Определение кислотности
Кислотность водного раствора обусловлена наличие в нем положительных водородных ионов Н+ и оценивается концентрацией в 1 литре раствора C(H+) (моль/л или г/л). В абсолютно чистой воде концентрации ионов Н+ и ОН– равны и раствор нейтрален. В кислых растворах преобладают ионы Н+, в щелочных – ионы ОН–, однако их произведение в любых условиях постоянно. Следовательно, увеличение концентрации одного типа ионов приводит к уменьшению концентрации другого типа в том же количестве. На практике степень кислотности (или щелочности) раствора выражается
водородным показателем рН (от латинского «пундус гидрогениум» — вес водорода), представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов рН = –lgC(H+). Эта величина может изменяться в небольших пределах – всего от –1 до 15 (а чаще – от 0 до 14). При этом изменению концентрации ионов Н+ в 10 раз соответствует изменение рН на одну единицу. Таким образом, концентрация водородных ионов в среде с рН = 5 в 10, 100 и 1000 раз выше, чем в среде с рН = 6, 7 и
8 соответственно.
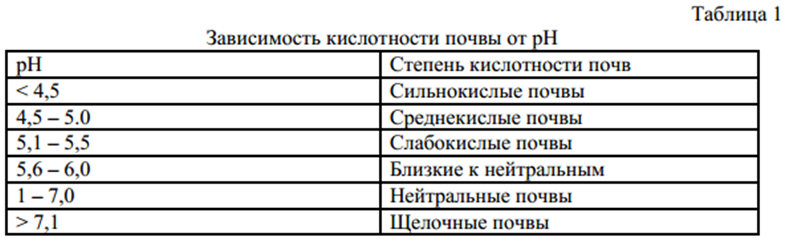
Кислыми называют растворы, в которых рН 7, и, чем ближе это значение к 14, тем раствор считается более щелочным. Установленная шкала кислотности идет от рН = 0 (крайне высокая кислотность) до рН = 14 (крайне высокая щелочность). Нейтральная среда имеет показатель ph, равный 7 (при комнатной температуре).
Показатель рН непосредственно влияет на нормальное протекание всех биохимических процессов у живых организмов. Очень важно, чтобы все процессы проходили при строго заданной кислотности. В частности, это необходимо для нормального функционирования биологических катализаторов – ферментов (при выходе за эти пределы их активность может резко снижаться). В клетках организма рН имеет значение около 7, во внеклеточной жидкости – 7,4. Наиболее чувствительны к изменению ph нервные окончания, которые находятся вне клеток. Кроме того, организм использует данное изменение ph в сигнальных целях: при механических или термических повреждениях тканей стенки клеток разрушаются и их содержимое попадает на нервные окончания.
Для определения степени кислотности используют специальные приборы — рН-метры, которые бывают весьма недешевы. Такие приборы измеряют электрический потенциал специального электрода (ЭДС), погруженного в раствор, и этот потенциал зависит от концентрации ионов водорода в растворе, и весьма вероятно измерить его с высокой точностью.
Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус.
Приборы для измерения водородного показателя (рН метры):
Как определить КИСЛОТНОСТЬ почвы самостоятельно? ОБЗОР!
Рассматриваем какие лучше приборы для измерения кислотности почвы, а также узнаем как определить кислотность почвы самостоятельно и по сорнякам. Отдельно расскажем как определить кислотность почвы в домашних условиях и с помощью народных средств.
ДОПОЛНЕНИЯ К СТАТЬЕ:
1. ПОЧВА ДЛЯ КОМНАТНЫХ РАСТЕНИЙ: ВИДЫ КОМПОНЕНТОВ И СЕКРЕТЫ!
2. НАРОДНЫЕ УДОБРЕНИЯ ДЛЯ КОМНАТНЫХ ЦВЕТОВ: 20 ЛУЧШИХ ДЛЯ ПОДКОРМКИ!
Содержание статьи:
Как определить кислотность почвы самостоятельно?
Кислотность почвы для растений играет важную роль и часто является определяющим фактором в успешном их развитии.
Показателем кислотности грунта служит значение PH (кислотно-щелочной баланс).
PH почвы имеет классифицированные числовые значения: РН = 7 – нейтральная почва, PH выше 7 (щелочная) и PH ниже 7 (кислая).
Для того чтобы максимально точно измерить кислотность грунта используют специальный прибор – измеритель PH почвы.
Для общего определения кислотности почвы применяют различные хитрые способы. В роли прибора для определения кислотности почвы часто выступают различные народные средства.
- Знание PH почвы позволяет создать оптимальные условия для развития растений (полив, освещенность, кислотность грунта).
При этом уровень PH одинаково важен для комнатных растений и для огородных культур.
- Для определения кислотности почвы с измерителя PH в ней делают небольшую ямку 7-10 см в глубину, в которую наливают дистиллированную воду (в крайнем случае, кипяченая дождевая или талая).
Дистиллированная вода имеет нейтральный уровень PH, что повышает точность полученных результатов.
- В ямке вода смешивается с грунтом и образуется жижа, в нее и вставляют щуп измерителя PH на одну минуту. После этого смотрят полученные данные.
- Если вы проводите измерения в открытом грунте, то для большей точности необходимо повторить опыт в нескольких точках сада, не менее 5-6 проб.
По результатам измерений кислотности грунта получаем средний уровень PH почвы. Если в некоторых участках уровень PH сильно отличается, то в первую очередь обрабатываем их.
ВАЖНО! Перед каждым измерением щуп прибора необходимо протирать тканью.
ВНИМАНИЕ: Некоторые модели PH-метров могут функционировать иначе. Поэтому, внимательно читайте инструкцию именно вашего тестера.
ПОЛЕЗНЫЕ СОВЕТЫ:
- Перед началом измерения кислотности почвы нужно проверить прибор на точность. Для этого измеритель PH почвы погружают в субстанцию с известным уровнем кислотности, например, торф.

- Не касайтесь голыми руками не только зонда измерителя, но и исследуемую часть грунта.
- Кислотность почвы – это не постоянная величина и со временем она может поменяться. Поэтому, лучше записать результаты, чтобы можно сравнить с разными периодами времени и участками сада/огорода/теплицы/горшка.
Прибор для определения кислотности почвы или ph метр
На сегодняшний день приборы для измерения кислотности почвы представлены механическими и электронными вариантами.
- Механические приборы для определения кислотности почвы отличаются невысокой ценой, автономностью и большей погрешностью, чем электронные модели.
- Электронные приборы для измерения кислотности почвы более быстро и точно измеряют ph грунта, просты в обращении, но стоят дороже.
- Некоторые бытовые измерители PH грунта показывают кислотность почвы не в виде цифр, а с помощью изменения цвета. Как правило, зеленый – нейтральный, желтый/оранжевый – кислый, а темно-зеленый – щелочной.

.
Один из видов измерителей ph почвы.
.
Измеритель кислотности почвы 3 в 1
Для бытового использования популярностью пользуется измеритель кислотности почвы 3 в 1. Такой прибор помимо определения кислотности грунта, еще может измерить уровень влажности почвы и освещенности.
Измеритель кислотности почвы 3 в 1 удобно иметь под рукой, чтобы провести комплексную проверку условий развития растений. Прибор измеряет влажность почвы и вам уже легче понять как часто и обильно надо поливать растения.
По отзывам многие цветоводы успешно применяют измеритель кислотности почвы 3 в 1 на садовом участке, теплице и в домашних условиях. По их мнению для общего анализа условий — это отличный прибор.
Некоторые модели способны работать без электричества и батареек.
.
Измеритель кислотности почвы 3 в 1: один из вариантов
.
Как проверить кислотность почвы в домашних условиях и на даче?В домашних условиях проверить кислотность почвы можно, но точность полученных результатов значительно уступает показаниям измерителя PH почвы.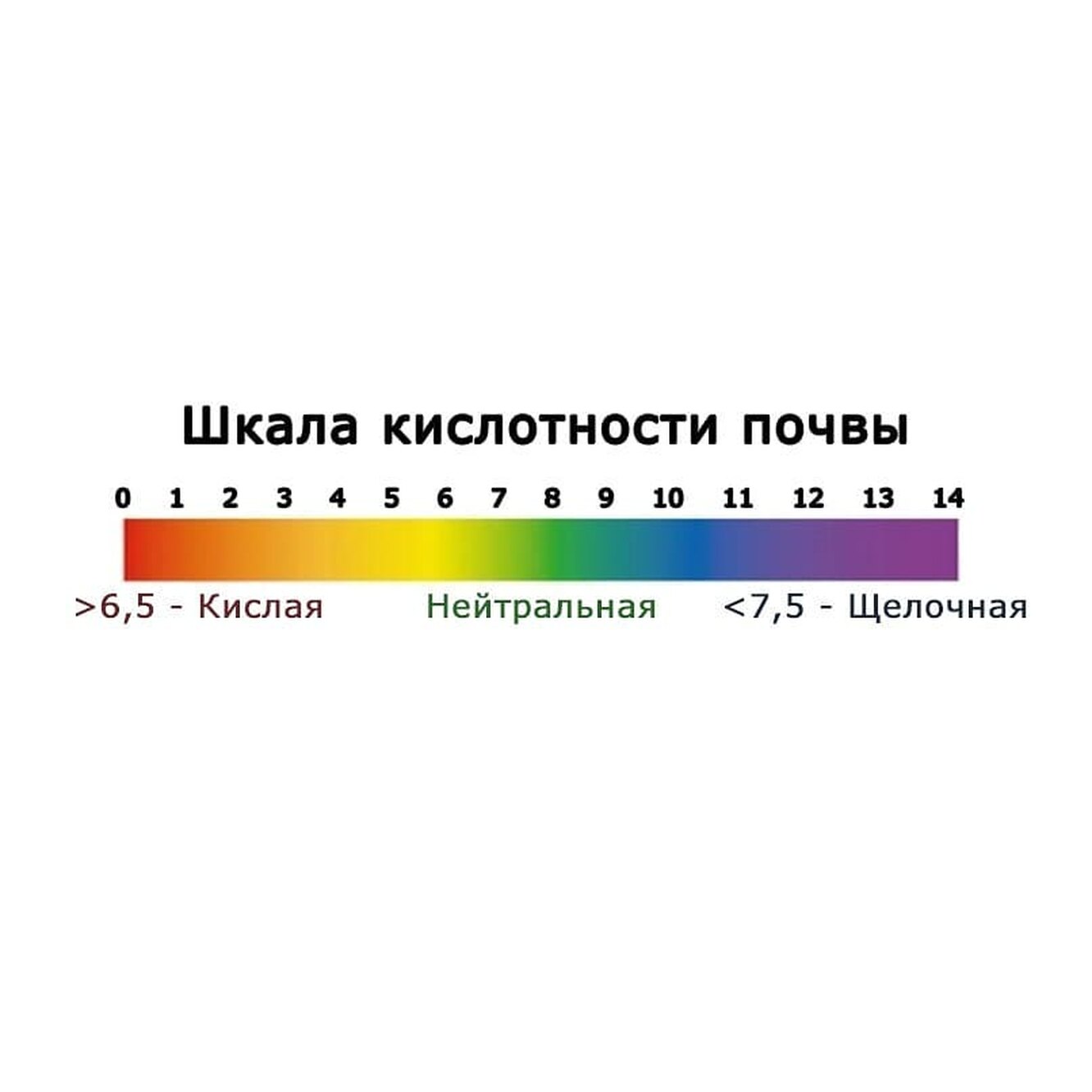
Эти методы подходят для получения общей картины, из серии «дешево и сердито».
Среди доступных для домашних условий способов выделяют: уксус, виноградный сок, капуста, пищевая сода, лакмусовая бумага и т.д.
УКСУС. На горсть земли капают чайную ложку столового уксуса и смотрят на результат. На земле появились пузырьки («закипела») – почва щелочная (в ней содержится кальций в нормальном количестве).
ВИНОГРАДНЫЙ СОК: Комок земли опускают в стакан виноградного сока. Если сок поменял цвет, а из комка выделяются пузырьки, то грунт – нейтральный.
ВИШНЯ, СМОРОДИНА: Листья вишни или смородины (5-7 штук) заливают кипятком, настаивают 15-20 минут. В настой кладут комок земли: если он посинел – кислая почва, позеленел – нейтральная или щелочная.
КАПУСТА: Один из самых противоречивых и популярных в интернете способов. По мнению специалистов, данный метод определяет только крайние значения: щелочной или кислый. С его помощью невозможно понять, какой у почвы уровень PH 4 или 8. Поэтому, способ нет смысла описывать.
С его помощью невозможно понять, какой у почвы уровень PH 4 или 8. Поэтому, способ нет смысла описывать.
СОДА: в небольшую емкость насыпаем землю и наливаем воду, чтобы образовалась кашица. В нее насыпаем пищевую соду: если зашипела – грунт кислотный.
Определение кислотности почвы лакмусовой бумагой:Кислотность почвы можно примерно определить с помощью лакмусовой бумаги. Один из вариантов мы опишем, чтоб его выполнить, необходим комплект, который продается в магазинах с химреактивами.
Влажный ком земли вместе с лакмусовой бумагой сжимают в руке: лакмус стал красного цвета – кислая почва, розового – среднекислая, желтого – слабокислая, зеленого – PH около 7.
.
Цветовая таблица кислотности почвы.
.
Как определить кислотность почвы самостоятельно по растениям?
РАСТЕНИЯ-ИНДИКАТОРЫ:
На садовом участке, даче или в полевых условиях можно определить кислотность почвы по сорнякам. По растениям-индикаторам можно определить примерный уровень кислотности почвы.
По растениям-индикаторам можно определить примерный уровень кислотности почвы.
Обратите внимание на произрастающие виды сорняков. Некоторые дикорастущие растения сигнализируют о кислотности или щелочности грунта.
КИСЛАЯ ПОЧВА: вероника полевая, зеленый мох, конский щавель, лютик ползучий, хвощ полевой, осока, фиалка трехцветная, иван-да-марья, подорожник большой.
СЛАБОКИСЛАЯ ПОЧВА: бодяк огородный, пырей ползучий, вьюнок полевой, мать-и-мачеха, клевер луговой, мокрица (звездчатка), крапива, ромашка непахучая, лебеда.
Как снизить кислотность почвы на огороде или даче?Удобным и доступным способом снизить кислотность почвы будет добавление древесной золы или угля, которые содержат много калия или извести.
- Особенно полезно вносить калийные удобрения осенью, в том числе и для успешной зимовки кустарников. Во время осенней перекопки в землю вносят золу или известь.
Таким образом, вы можете уменьшить кислотность почвы на садовом участке, огороде или даче, в том числе.
Как можно повысить кислотность почвы?
Снизить щелочность почвы можно с помощью внесения торфа, хвои или перегноя (подойдут перепревшие листья).
Опубликовано: Обновлено: 2016-09-19 Команда «Праздник цветов»
Как определить кислотность почвы в домашних условиях на даче или участке
У многих садоводов есть проблемы с урожаем. Они вовремя вносят в почву удобрения, пропалывают огород от сорной травы, поливают, разрыхляют землю, но растения все равно растут плохо. Огромное значение для правильного развития огородных культур имеет степень кислотности грунта. О том, как определить кислотность почвы в домашних условиях мы поговорим далее.
Кислотность почвы
Питательные микроэлементы, попадая в почву, после химических реакций превращаются в ионы, которые активно поглощаются растениями. Чем больше ионов водорода осталось после реакций, тем больше кислотность почвы. В кислой среде большинство садовых культур не могут свободно развиваться и питаться.
В кислой среде большинство садовых культур не могут свободно развиваться и питаться.
В кислом грунте прекрасно растворяются малорастворимые соли, повышается содержание металлов. Из-за этого растения отравляются, в них накапливаются вредные вещества, которые препятствуют поступлению полезных элементов.
Как определить кислотность в домашних условиях
Для обозначения меры активности водорода и степени кислотности, принято использовать значение рН.
рН 7.0 – это нейтральная среда в грунте. Этот показатель соответствует чистой воде. Если значение рН ниже 7.0, то почва становится кислой, выше – щелочной.
Кислотность зависит от природных условий и от результатов деятельности человека. Кислая среда характерна для регионов с влажным климатом, щелочная – для мест с сухой погодой.
Пожалуй, каждый садовод обеспокоен правильным развитием своих культур. Поэтому кислотность грунта можно определить самостоятельно.
Шкала pH почвыПри помощи специального прибора
Узнать кислотность с помощью специального прибора – самый простой способ. Сначала нужно в земле сделать углубление, предварительно очистив его от посторонних предметов (камни, ветки, трава). Затем налить туда чистой дистиллированной воды, так как только она обладает нейтральной средой.
Сначала нужно в земле сделать углубление, предварительно очистив его от посторонних предметов (камни, ветки, трава). Затем налить туда чистой дистиллированной воды, так как только она обладает нейтральной средой.
Как только вода вступит в реакцию с землей и станет грязной, следует опустить щуп измерителя в воду на 1 минуту. После этого на приборе отобразится значение кислотности.
Нельзя касаться руками ни щупа прибора, ни воды в ямке. Иначе результат будет недостоверным.
pH метр для почвыПо растениям на участке
На кислой почве хорошо растут огурцы, кабачки, помидоры, баклажаны, тыква, картофель, облепиха, смородина, крыжовник, лимонник, розы, герань, пионы, нарциссы, тюльпаны.
В грунте с нейтральной средой прекрасно себя чувствуют капуста, фасоль, горох, морковь, свекла, редька, сельдерей, петрушка, яблоня, груша, слива, вишня, малина, садовая земляника, георгины, ирисы.
К растениям, предпочитающие щелочную почву можно отнести: кизил, барбарис, боярышник, арнику, сирень, можжевельник, кедр, айва, багряник, абрикос, шелковицу, эдельвейс, лаванду.
В таких условиях не рекомендуется разделывать грядки. Садовым культурам здесь будет плохо.
Фасоль отлично растет на нейтральной почвеПо сорнякам
В кислой среде предпочитают расти: осока, иван-да-марья, папоротник, подорожник, конский щавель, хвощ полевой, багульник, мята полевая, вереск, василек, лапчатка, трехцветная фиалка, одуванчик, клевер, ромашка.
Нейтральная среда привлекает горицвет, осот, полевой вьюнок, крапиву, лебеду, красный клевер, пастушью сумку.
Если в огороде растет крапива, это значит, что почва содержит большое количество питательных органических элементов.
В щелочном грунте произрастают цикорий, молочай пятнистый, чабрец, шалфей, бадан, чертополох, горчица.
Молочай пятнистый предпочитает щелочную почвуПри помощи мела
Две полные столовые ложки земли с участка нужно положить в бутылку. Затем налить в нее пять столовых ложек теплой воды и чайную ложечку мела, предварительно растертого в порошок. На бутылку надеть резиновый напальчник, удалив из него воздух. После этого следует сильно ее потрясти.
На бутылку надеть резиновый напальчник, удалив из него воздух. После этого следует сильно ее потрясти.
Если напальчник выпрямится, это значит, что почва кислая. Если он надуется лишь наполовину – слабокислая. Если изменений не произойдет – нейтральная.
Определение кислотности при помощи мела: напальчник не надулся, значит почва нейтральнаяЛакмусовой бумагой
Определение кислотности с помощью индикаторных полосок является наиболее точным методом. Купить их можно в магазинах для огородников. Продаются они в виде набора из 50 – 100 полосок вместе с цветной шкалой значений рН.
Для проведения опыта, в емкость помещают землю и чистую воду в соотношении 1:4, после чего необходимо все хорошо перемешать.
После появления земляного осадка, в воду нужно на несколько секунд опустить лакмусовую бумагу. В течение одной минуты, на полоске должен проступить цвет, по которому можно легко определить уровень рН почвы.
Лакмусовый индикатор определения кислотности почвы – самый надежный и проверенный временем способКак уменьшить или увеличить кислотность на даче
Если замеры показали, что в грунте на даче преобладает слишком кислая среда, ее необходимо раскислить. Для этого существует несколько способов:
Для этого существует несколько способов:
- Известь, предварительно гашеную водой, вносят в почву из расчета на 1 сотку:
- сильнокислотный уровень рН – 50-75 кг;
- среднекислотный – 45-45 кг;
- слабокислотный – 25-35 кг.
- С помощью известняковой муки (другое название – доломитовая) можно не только снизить кислотность земли, но и насытить ее магнием, кальцием, а также другими микроэлементами. Но этот метод будет уступать по скорости гашеной извести.
Чем мельче доломитовая мука, тем быстрее будут проходить химические реакции в почве.
Рассчитать необходимое количество муки не сложно:
- сильнокислая среда – 500-600 грамм на 1м2;
- среднекислая – 450-500 грамм на 1м2;
- слабокислая – 350-450 грамм на 1м2.
- Веществами, содержащими кальций, тоже можно снизить уровень рН:
- Измельченный мел на 1м2 вносят в сильнокислую почву 300 грамм, среднекислую – 200 грамм, слабокислую – 100 грамм.

- Торфяной золой нужно удобрять грунт мерой, которая в 4 раза превышает норму внесения мела.
- Дровяная зола используется из расчет 100-200 грамм на 1м2.
- Самый удобный способ раскисления почвы – это покупка специальных средств для нормализации грунта.
В случае, если почва имеет щелочную среду, ее нужно подкислить:
- С помощью органики, такой как свежий навоз, листовой компост, верховой торф, мох-сфагнум, перепревшие опилки и хвоя. Эти вещества медленно закисляют землю, но действуют долгое время.
- Минеральные соединения помогут снизить щелочность среды быстрее, чем органические:
- Коллоидная сера существенно повышает кислотность. Ее нужно вносить под зиму на глубину 10-15 см. Результат появится примерно через год.
- Сульфат железа работает быстрее, для этого необходимо на 10м2 брать 0,5 кг вещества.
- Самый быстрый метод – это использование растворов кислот:
- 50 мл серной кислоты развести в 10 литрах воды.
 Этот объем рассчитан на 1м2 садового участка;
Этот объем рассчитан на 1м2 садового участка; - 1-2 столовые ложки лимонной кислоты смешать с 10 литрами воды.
Уровень кислотности почвы является важнейшим показателем роста и развития растений. Для абсолютного большинства садовых и плодово-ягодных культур наиболее благоприятна нейтральная среда. Добиться таких условий можно своевременно раскисляя или подкисляя грунт.
Определение кислотности почвы
Сегодня мы поговорим об одной важной проблеме, которая называется кислотность почвы и как ее определить. Вообще, кислотность почвы, ее определение, является достаточно большой проблемой для садоводов. Определением кислотности почвы, занимаются профессиональные биохимические лаборатории, которые не всегда доступны нашим садоводам-любителям, да и в общем-то, мне в том числе. Поэтому существует ряд бытовых способов обследования почвы и определения ее кислотности. Чаще всего, даются рекомендации по определению кислотности по растениям, которые произрастают на вашем участке, и в принципе, это имеет под собой некоторую основу. Но не все люди, умеют правильно определять эти растения, да и иногда, это действительно вызывает определенные трудности.
Поэтому существует ряд бытовых способов обследования почвы и определения ее кислотности. Чаще всего, даются рекомендации по определению кислотности по растениям, которые произрастают на вашем участке, и в принципе, это имеет под собой некоторую основу. Но не все люди, умеют правильно определять эти растения, да и иногда, это действительно вызывает определенные трудности.
При этом, существует иной способ, как определить кислотность в вашем саду. Вообще, почему это важно? Потому ,что большинство огородных растений, предпочитают нейтральную кислотность. Если кислотность слишком низкая или слишком высокая, то огородное растение, разве что, кроме щавеля, который предпочитает кислую почву, они начинают страдать от недостатка питания. В условиях не оптимальной кислотности почвы, растения не могут нормально всасывать макро-и микроэлементы и, соответственно, страдают от их недостатка.
Конечно, существуют растения, которые предпочитают щелочные почвы, например, люцерна, все знают, что она хорошо растет на меловых почвах. А такие растения, как голубика, рододендрон, верески, некоторые хвойные и лесные хвойные, не горные, они предпочитают чаще кислые почвы. Соответственно, каждому растению на одном и том же участке, необходимо создать определенные условия. Но прежде, надо определить, какая же кислотность.
А такие растения, как голубика, рододендрон, верески, некоторые хвойные и лесные хвойные, не горные, они предпочитают чаще кислые почвы. Соответственно, каждому растению на одном и том же участке, необходимо создать определенные условия. Но прежде, надо определить, какая же кислотность.
Вообще, сразу определимся с терминами, что кислотность бывает высокая, нейтральная и низкая. Что такое высокая кислотность? Высокая кислотность — это означает, что почвы щелочные. Кислотность измеряется по показателю pH, чем выше показатель pH, тем выше кислотность, тем более щелочная почва. Нейтральный показатель почвы равен 7. Кислые почвы — это то, что меньше семи, это низкая кислотность. А 7 — нейтральная.
Большинство огородных растений, как я уже сказал, предпочитают нейтральную реакцию почвы. Как- же нам, в домашних условиях, быстро и эффективно определить, какая у нас кислотность почвы? Дело в том, что в быту, мы постоянно сталкиваемся с таким интересным пигментом, который является одновременно индикатором на кислотность — это антоцианы. Антоцианы очень широко представлены, их можно найти в голубике, вишне, ежевике, черной смородине, в чернике, конечно- же, и в моей любимице-краснокочанной капусте. С помощью этих антоцианов, как вот здесь, видите, мы можем определить, какова же кислотность нашей почвы, да и в общем-то, кислотность любого раствора. Конечно, этот метод является достаточно грубым, он вам точно в цифрах не скажет, какая у вас почва, кислая, щелочная, именно в цифрах. Но в целом, охарактеризовать вашу почву, как избыточно кислую, нейтральную или излишне щелочную, этот метод вам вполне поможет.
Антоцианы очень широко представлены, их можно найти в голубике, вишне, ежевике, черной смородине, в чернике, конечно- же, и в моей любимице-краснокочанной капусте. С помощью этих антоцианов, как вот здесь, видите, мы можем определить, какова же кислотность нашей почвы, да и в общем-то, кислотность любого раствора. Конечно, этот метод является достаточно грубым, он вам точно в цифрах не скажет, какая у вас почва, кислая, щелочная, именно в цифрах. Но в целом, охарактеризовать вашу почву, как избыточно кислую, нейтральную или излишне щелочную, этот метод вам вполне поможет.
Среди всех источников антоцианов, которые нам доступны в быту, я выбрал именно краснокочанную капусту. Почему? Дело в том, что ягоды содержат достаточно много кислот, своих собственных кислот, которые в быту нейтрализовать достаточно сложно, и вот наличие этих кислот в ягодах, очень влияет на результаты нашего анализа. А капуста содержит минимальное количество кислот в своих листьях. На вкус, по крайней мере, это совершенно не ощущается, поэтому краснокочанная капуста, является наиболее оптимальным источником антоцианов для определения кислотности.
Что-же, я сделал? Я взял примерно сто грамм капусты краснокочанной, нашинковал ее довольно грубо, немножечко помял в руках, руки сразу прокрашиваются, делаются синими, залил примерно пол-литром воды и настоял в течение нескольких часов. В результате, у меня получился вот такой раствор. Этот раствор и является индикатором для нашей кислотности.
Давайте проведем небольшой эксперимент. Что это означает? Вот, передо мной, например, есть два раствора. Я не знаю, который из них щелочной, а которой из них кислый. Я всего лишь, намочу палочку стеклянную и опущу в стаканчик. Цвет сразу же поменялся. Чем более синий, а потом зеленый цвет становится, тем более щелочным раствором является испытуемый раствор. Все промоем, чтобы у нас не было каких-то влияний. Давайте предположим, что второй раствор, тоже я не знаю какой. Вот, исходный цвет, вот такой, кислая реакция антоцианов получается такого марганцовочного цвета, чем более он розовый, тем более кислая реакция нашего раствора.
Давайте теперь испытаем почвенные растворы. Вот здесь, я замочил три, сделал три почвенных раствора. Прежде, чем мы будем использовать, мы их немного отфильтруем. Значит, что я сделал: я взял примерно 100 миллилитров почвы и залил их стаканом воды до 250 мл, обыкновенной водопроводной водой и настаивал в течение нескольких часов, чтобы все почвенные растворимые вещества перешли в раствор. Что-же, можем взять любой из них прежде, чем залить туда наш индикатор. Мы немного почву профильтруем, чтобы у нас там ничего не было лишнего, какие-то взвеси нам не помешали. И добавим наш,видите — раствор достаточно щелочной. Могу вам сказать, что это был образец меловой почвы. Меловая почва содержит достаточно много карбонатов, и конечно, дает такую слабощелочную реакцию. Возьмем следующий раствор — это был обыкновенный торф для выращивания рассады. Что-же, реакция оптимальная, нейтральная. И последний образец почвы, это была почва, которая в магазине называлась «Для Азалий и Рододендронов», по идее, она должна иметь слабокислую реакцию, но мы сейчас это проверим. Такой достаточно грубый торф с кусочками. Да, действительно, почва достаточно кислая, находится где-то, вот в этой области, той, которая действительно оптимальна для Азалий,Рододендронов и Голубики. Таким образом, данный способ является хоть и грубым, но достаточно надежным в отношении того, чтобы определить, кислая, нейтральная или щелочная почва на вашем участке.
Такой достаточно грубый торф с кусочками. Да, действительно, почва достаточно кислая, находится где-то, вот в этой области, той, которая действительно оптимальна для Азалий,Рододендронов и Голубики. Таким образом, данный способ является хоть и грубым, но достаточно надежным в отношении того, чтобы определить, кислая, нейтральная или щелочная почва на вашем участке.
Как определить кислотность почвы: уровни кислотности почвы, способы
Оглавление:
В народе говорят: «Не жди урожая, коль земля худая». Действительно, от свойств грунта во многом зависит, будет ли успешным труд земледельца. Поэтому оценка потенциала почвы – всегда актуальный вопрос для садоводов и огородников. Один из важных показателей – уровень кислотности. В статье расскажем, как определить кислотность почвы, каким способом воспользоваться для анализа.
Кислотность почвы в разных регионах России
Кислотностью почвы называют её водородный показатель (уровень pH). Величина pH грунтов обычно колеблется в пределах от 3 до 8 водородных единиц, но на некоторых типах почв может выходить за эти пределы;
Величина pH грунтов обычно колеблется в пределах от 3 до 8 водородных единиц, но на некоторых типах почв может выходить за эти пределы;
| Тип почвы | Уровень pH | Реакция |
| Торфяно-болотная и болотно-подзолистая | 3,0-5 | От сильнокислой до среднекислой |
| Подзолистая, дерново-подзолистая, краснозём | 4,5-5,6 | От среднекислой до слабокислой |
| Серая лесная | 4,5-6,5 | От среднекислой до слабокислой, близкой к нейтральной |
| Мерзлотно-таёжная | 4,5-7,3 | От среднекислой до нейтральной |
| Чернозём, серозём, каштановая | 6,5-7,5 | Близкая к нейтральной |
| Карбонатная, солончак, солонец | 7,5-9,5 | От слабощелочной до сильнощелочной |
Более кислая реакция почвы связана с содержанием в ней угольной кислоты, алюминия, железа и марганца. Более щелочная – с высоким процентом щелочных солей. И сильнокислая, и сильнощелочная реакция грунта неблагоприятны для возделывания культурных растений. Кислые почвы содержат мало питательных веществ, органика в них не закрепляется. Щелочные также низкоплодородны, бесструктурны, обладают плохой водопроницаемостью.
Более щелочная – с высоким процентом щелочных солей. И сильнокислая, и сильнощелочная реакция грунта неблагоприятны для возделывания культурных растений. Кислые почвы содержат мало питательных веществ, органика в них не закрепляется. Щелочные также низкоплодородны, бесструктурны, обладают плохой водопроницаемостью.
На территории России преобладают кислые подзолистые и дерново-подзолистые почвы.
Влияние показателя кислотности почвы на развитие растений
Большинство культурных растений – нейтрофилы, то есть отдают предпочтение почвам с реакцией, близкой к нейтральной. Однако есть среди них и те, которым больше годятся кислые или слабощелочные грунты:
| Культура | Оптимальная кислотность почвы |
| Овощи: | |
| Капуста белокочанная | 6,5-7,5 |
| Томаты | 6,0-6,8 |
| Огурцы | 6,5-7,0 |
| Репчатый лук | 7,0-7,5 |
| Морковь | 7,0-7,5 |
| Баклажан | 6,5-7,0 |
| Картофель | 5,0-5,5 |
| Тыква | 5,5-6,5 |
| Свёкла | 6,5-7,5 |
| Плодовые деревья: | |
| Яблоня | 5,1-7,0 |
| Груша | 4,5-6,0 |
| Слива | 6,5-7,5 |
| Вишня | 6,5-7,0 |
| Айва | 6,5-8,0 |
| Персик | 6,5-7,0 |
| Абрикос | 6,5-8,2 |
| Кустарники: | |
| Крыжовник | 6,0-7,0 |
| Красная смородина | 6,0-6,5 |
| Чёрная смородина | 6,0-6,5 |
| Малина | 6,0-7,0 |
| Ежевика | 6,0-6,2 |
| Клюква | 3,5-5,0 |
| Голубика | 3,5-4,5 |
| Жимолость | 5,0-7,0 |
| Газонные травы: | |
| Мятлик луговой | 5,5-6,5 |
| Тимофеевка луговая | 5,0-5,5 |
| Клевер луговой | 6,0-7,0 |
| Овсяница красная | 6,0-6,5 |
Если кислотность грунта не соответствует оптимальным значениям, растение не может извлечь из почвенного раствора нужные ему питательные вещества. Корневая система страдает, угнетается рост растений, резко снижается урожайность, возрастает подверженность заболеваниям.
Корневая система страдает, угнетается рост растений, резко снижается урожайность, возрастает подверженность заболеваниям.
Для улучшения свойств проблемных почв в сельском хозяйстве принимаются меры химической мелиорации земель.
Определение кислотности почвы по дикорастущим растениям
Самый простой, «дедовский» способ приблизительно оценить уровень pH почвы – присмотреться к дикорастущим травам на участке. По своим предпочтениям они делятся на ацидофилов (любителей кислых грунтов), нейтрофилов (предпочитающих нейтральные) и базофилов (растущих на щелочных почвах).
| Растения-индикаторы | pH почвы |
| Предельные ацидофилы:
конский щавель, мхи, хвощ полевой, водяника, черника, марьянник луговой |
3,0-4,5 |
| Средние ацидофилы:
брусника, багульник, горец щавелелистный, мята, толокнянка, болотная золотничка, «кошачья лапка» |
4,5-6,0 |
| Слабые ацидофилы:
колокольчик широколистный, осока волосистая, купена, щитовник |
5,0-6,7 |
| Нейтрофилы:
мать-и-мачеха, тысячелистник, аптечная ромашка, луговой клевер, лесная земляника, лебеда, крапива, пастушья сумка, осот, сныть |
6,0-7,0 |
| Базофилы:
осока мохнатая, «гусиная лапка», полынь, вика, люцерна, аржанец луговой, костер безострый |
7,5-9,0 |
Совет #1.
Не нужно полагать индикаторами кислотности травы, встречающиеся на участке в малом количестве или единично. Их семена могли быть занесены случайно. Ориентироваться следует по преобладающим видам.
Изучение видового состава сорных трав поможет примерно определить кислотность почвы на участке.
Приборы для измерения кислотности почвы
Произрастающие травы дают лишь приблизительное представление о кислотности почвы. Во-первых, многие из них приспособлены к довольно широкому диапазону pH. Во-вторых, даже в пределах одного участка кислотность может сильно колебаться.
Для точных измерений имеет смысл приобрести pH-метр. Это приборы, состоящие из стержня-щупа и блока, выводящего результаты измерения на цифровое табло или шкалу. Щуп снизу прикрыт защитным колпачком, под которым расположена чувствительная электрозона. Недорогие и простые в эксплуатации pH-метры представлены в таблице:
| Торговое название | Преимущества | Недостатки |
| КС-300 | Долговечен, рабочий диапазон 3,5-9, точность 0,1, измеряет также температуру, освещённость и влажность грунта. |
Если батарейка подсела, даёт большую погрешность в измерениях. |
| Мегеон 35280
|
Лёгкий прочный корпус, возможность измерения влажности и освещённости грунта, не нуждается в смене батарей, дешёвый. | Небольшой диапазон показателей pH (3,5-8), работа от солнечных батарей не позволяет делать замеры в тени или защищённом грунте. |
| ZD-06
|
Измеряет влажность грунта, имеет длинный щуп (30 см), не нуждается в смене батарей, долговечен и прочен. | Малый рабочий диапазон (3-8), точность 0,3, солнечные батареи ограничивают возможности. У прибора высокая цена. |
Замеры кислотности следует производить регулярно. Внесение удобрений и другие агротехнические мероприятия могут влиять на pH. Чтобы измерение дало наиболее точный результат, при использовании pH-метра нужно придерживаться следующих правил:
- Производить замеры не ранее, чем через 2-3 дня после внесения удобрений.

- Поливать проверяемый участок водой.
- Хорошо уплотнять грунт вокруг щупа.
- Делать 2-3 замера, после чего вычислять среднее арифметическое.
- Стержень pH-метра необходимо содержать в чистоте, протирая его после использования чистой салфеткой.
Совет #2. При покупке pH-метра необходимо поинтересоваться, откалиброван ли он. Если нет, нужно дополнительно приобрести специальный буферный раствор и откалибровать прибор самостоятельно.
Определение кислотности почвы с помощью лакмусовой бумаги
Многие специализированные магазины, в том числе и в интернете, предлагают индикаторные лакмусовые полоски для замера кислотности почвы. Стоят они недорого, а пользоваться ими очень просто:
- Взять на пробу 1 столовую ложку грунта с глубины 25-30 см и 5 столовых ложек дистиллированной воды.
- Поместить грунт в марлю и опустить в воду на 15 минут.

- Опустить в раствор полоску на несколько секунд.
- Сравнить окраску полоски с индикаторной шкалой на упаковке. Диапазон измерений у лакмусовых полосок может быть разным: 1-14 или 4-8.
С помощью индикаторных полосок нельзя определить кислотность почвы с точностью до десятых долей.
Народные способы определения кислотности почвы
Есть несколько народных способов оценки кислотности почвы. Они не позволяют определить её точно, но общее представление о характере грунта дают. ».
Сода и уксус для измерения кислотности
Столовую ложку земли, взятой с глубины 25 см, поместить в чашку и полить уксусом. Есть смесь начала шипеть и пениться, реакция грунта щелочная. Если нет, нужно взять вторую пробу. Вторую пробу почвы полить раствором соды. Пузырьки и шипение указывают на кислую реакцию. Если и на этот раз никакой реакции не наблюдается, почва имеет нейтральный pH в районе 7.
Красная капуста для анализа
Листья краснокочанной капусты измельчить, залить водой и прокипятить до получения фиолетового отвара. В остуженный отвар поместить пробу грунта. Изменение окраски до синей или зелёной говорит о щелочной реакции почвы. Осветление раствора до розового – о кислой.
В остуженный отвар поместить пробу грунта. Изменение окраски до синей или зелёной говорит о щелочной реакции почвы. Осветление раствора до розового – о кислой.
Лист смородины и вишни
Несколько свежих листьев залить кипятком и настоять 15 минут. Остудить настой и поместить в него пробу грунта. Изменение окраски до красной указывает на кислую реакцию, до синей – на щелочную. Зеленоватый цвет раствора говорит о нейтральной среде.
Мел, свекла и виноградный сок
- Мел. В бутылку поместить пробу грунта, добавить немного тёплой воды и 1 чайную ложку истолчённого мела. Надеть на горлышко латексный напальчник, потрясти бутылку и оставить на несколько минут. Если напальчник начнёт постепенно надуваться, значит почва кислая.
- Свёкла. Этот способ основан на свойстве листьев свёклы менять окраску в зависимости от кислотности грунта. Если при выращивании этой культуры наблюдается постепенное покраснение листовых пластин, значит, земля имеет кислую реакцию.

- Виноградный сок. В 50 мл натурального сока поместить пробу грунта. Вспенивание раствора указывает на щелочную или нейтральную реакцию почвы. Отсутствие изменений – на кислую.
Чай «Каркаде» содержит антоцианы и может использоваться для определения pH аналогично отвару листа красной капусты.
Способы снижения кислотности почвы
Если на участке кислая почва, можно откорректировать её pH несколькими способами:
- Известкование. Самый распространённый метод. Для раскисления почвы при перекопке вносятся вещества, имеющие щелочную реакцию: известь-пушонка (50-150 г на 1 м2), доломитовая мука (300-600 г на 1 м2), мел (100-300 г на 1 м2).
- Использование удобрений. Раскисляют почву древесная зола (1-1,5 кг на 1 м2), сахарный дефекат (400-600 г на 1 м2), раскислитель «Известь-Гуми» с бором (200-300 г на 1 м2), костная мука (200 г на 1 м2). ».
- Использование сидератов.
 Хорошо уменьшает кислотность почвы посев фацелии, люпина, вики, люцерны, донника.
Хорошо уменьшает кислотность почвы посев фацелии, люпина, вики, люцерны, донника. - Использование дождевых червей. В процессе жизнедеятельности черви выделяют в грунт карбонат кальция, постепенно меняя кислую реакцию на нейтральную.
Способы повышения кислотности почвы
На сильнощелочных грунтах целесообразно подкислять почву следующими способами:
- Внесение удобрений. Закислению способствуют мочевина, сульфат аммония и аммиачная селитра.
- Поливы подкисленной водой. Для этого используют щавелевую или лимонную кислоту (2 столовые ложки на 10 л воды), а также 9%-ный уксус (100 г на 10 л воды).
- Внесение верхового торфа. Верховой торф, в отличие от низинного, имеет кислую реакцию. На 1 м2 вносится при перекопке 1,5 кг торфа.
Свежие опилки повышают кислотность почвы.
Агротехнические ошибки, влияющие на кислотность почвы
Ошибка №1. Бессистемное использование минеральных удобрений.
Минеральные удобрения, особенно при избыточном внесении, резко меняют показатели pH грунта. Использовать их нужно строго по инструкции, ориентируясь на тип почвы.
Ошибка №2. Несоблюдение режима поливов.
Неправильное орошение способно вызвать засаливание или заболачивание почвы, изменить её реакцию, снизив естественное плодородие.
Ошибка №3. Злоупотребление известью и золой.
Некоторые земледельцы используют эти средства везде, не проверяя предварительно уровень кислотности почвы. В результате почва ощелачивается и становится бесплодной.
Вопросы садоводов о кислотности почвы
Вопрос №1. Можно ли определить кислотность почвы по внешнему виду растений?
Очень ориентировочно. Например, если капуста на участке постоянно поражается килой, можно предположить, что грунт кислый. Однако такой способ нельзя считать информативным, так как угнетённый вид и заболевания растений могут вызываться и другими причинами.
Вопрос №2. Есть ли смысл в полной замене грунта на участке, если его кислотность не подходит для земледелия?
Смысл есть, но это мероприятие связано с большими затратами труда. Необходимо срезать верхний слой грунта не менее, чем на 15 см и уложить на это место новый. Лучшие варианты для замены – чернозёмы или лесные почвы. А вот землю с полей покупать не стоит – она бывает перенасыщена солями и заражена вредителями.
Вопрос №3. Влияют ли органические удобрения на кислотность почвы?
Перепревший навоз, компостированный торф и растительные остатки увеличивают содержание гумуса и кальциевых оснований, приближая реакцию почвы к нейтральной. Но для существенного изменения уровня pH требуется регулярное использование органики в больших количествах. Однократное внесение роли не сыграет. ».
Вопрос №4. Отличаются ли способы изменения кислотности почвы в теплице и открытом грунте?
Не отличаются. Однако в теплице необходимо ещё тщательней отслеживать динамику pH, поскольку в защищённом грунте кислотность подвержена большим колебаниям. Также важно следить за качеством поливной воды. Она не должна быть жёсткой – это вызывает ощелачивание почвы.
Однако в теплице необходимо ещё тщательней отслеживать динамику pH, поскольку в защищённом грунте кислотность подвержена большим колебаниям. Также важно следить за качеством поливной воды. Она не должна быть жёсткой – это вызывает ощелачивание почвы.
Кислотность почвы: самые распространенные способы определения
От состава почвы зависит полноценный рост многих растений и овощных культур. Среди всех параметров уровень кислотности почвы является наиболее важным.
От этого показателя зависит плодородие, количество собранного урожая.
Содержание:
Основные виды кислотности почв
Под кислотностью принято понимать наличие солей, кислот и обменных ионов в почве. Измеряется кислотность в двух показателях: абсолютной и потенциальной.
Абсолютная кислотность измеряется в рН. Это число обозначает соотношение ионов кальция к ионам водорода. Количество ионов кальция и ионов водорода в нейтральной среде одинаковое.
На кислых почвах ионов водорода больше, чем ионов кальция. В такой среде питательные вещества плохо усваиваются.
В такой среде питательные вещества плохо усваиваются.
При использовании калийных и минеральных удобрений снижается их эффективность. Если в почве ионов кальция больше, чем ионов водорода, то в почве содержится щелочь.
Чтобы показатель приблизился к нейтральному уровню, такую почву необходимо перемешать с кислым или нейтральным грунтом.
В зависимости от уровня рН показателя выделяют несколько видов кислотности:
- Сильнокислая земля – 4,1-4,5 рН
- Среднекислая почва – 4,6-5 рН
- Слабокислая земля – 5,1-5,5 рН
- Нейтральный грунт – 5,6-6,9 рН
- Щелочная почва – от 7 и более рН
На почвах средней кислотности произрастает малина и смородина. Картофель, помидоры, тыква хорошо растут на сильнокислой почве. Для выращивания кабачков, баклажанов, огурцов подойдет земля слабой кислотности.
Перец, капусту, свеклу, чеснок, клубнику можно выращивать на нейтральных или слабокислых почвах. Подсолнечник, сахарная свекла хорошо приживается на слабощелочных грунтах.
Почти все овощи желательно выращивать на слабокислых или кислых почвах. Бобовые культуры, в частности фасоль и бобы в основном выращивают на нейтральных почвах.
Для измерения потенциальной кислотности в раствор вводят дополнительные ионы, чтобы определить твердой фазы почвы и ее прогрессию. Если земля будет использоваться продолжительное время, то важным показателем является потенциальная кислотность.
От уровня и вида кислотности зависит качество почвы, а также пригодность для выращивания отдельных культур.
Способы определения кислотности
Уровень кислотности необходимо всегда контролировать. Кислотность почвы можно определить одним из трех способов:
- по сорнякам и растениям
- лакмусовой бумажкой
- специальным прибором
На почвах сильной кислотности можно заметить подорожник, хвощ, лютик, василек. На среднекислом грунте растет молочай, клевер.
Пырей, белый клевер, василек полевой, иван-да-марья можно встретить на слабокислых почвах.
 В нейтральной среде растет луговой клевер, цикорий, мохнатая осока. На щелочном грунте можно найти бузину сибирскую, вяз шершавый и др.
В нейтральной среде растет луговой клевер, цикорий, мохнатая осока. На щелочном грунте можно найти бузину сибирскую, вяз шершавый и др.
Другой способ определения кислотности с помощью лакмусовой бумажки. Ее можно приобрести в специальном магазине химреактивов. Также понадобится цветной индикатор, на котором имеется шкала рН.
На участке выкопать ямку и взять с глубины 20-25 см почву для образца. В глубокую емкость налить дистиллированную воду, всыпать землю и хорошо размешать. Оставить в таком состоянии на 10-15 минут, а затем опять перемешать.
Далее к верхнему слою грунта приложить лакмусовую бумагу или взять в руки размоченную землю и сжать бумажку. Через несколько минут лакмусовая бумага станет ярко-красного, желтого или зеленого цвета.
Если лакмус приобрел ярко-красный цвет, то это свидетельствует о высокой кислотности почвы. При окрашивании бумажки в желтый цвет почва слабокислая.
Зеленоватый цвет на лакмусовой бумаге указывает на нейтральный состав грунта. Если лакмусовая бумага окрасилась в ярко-зеленый цвет, то земля щелочная. Определить абсолютную кислотность почвы можно с помощью кислотомера.
Если лакмусовая бумага окрасилась в ярко-зеленый цвет, то земля щелочная. Определить абсолютную кислотность почвы можно с помощью кислотомера.
Существуют и другие методы определения уровня рН. Несколько листьев смородины залить стаканом горячей воды и оставить на 10 минут. Когда отвар остынет, всыпать немного земли. Если отвар стал красным, то грунт кислый.
Наличие зеленоватого оттенка свидетельствует о слабокислой почве. При нейтральном грунте отвар окрасится в синий цвет.
В домашних условиях можно использовать уксус для определения кислотности. Для этого необходимо взять горсть земли и добавить несколько капель уксуса. Если появились мелкие пузырьки, то земля нейтральная. Если пузырьков нет, то грунт кислый.
Если после проведения опыта на обнаружение кислотности почва кислая, то ее необходимо понизить. Для этого используют мел или известняк. Чтобы повысить уровень кислотности, землю следует удобрять перегноем хвоей.
Также участок можно залить раствором марганцовки. Определить кислотность почвы на дачном участке можно, воспользовавшись одним из вышеперечисленных советов.
Определить кислотность почвы на дачном участке можно, воспользовавшись одним из вышеперечисленных советов.
Видео о том, как определить кислотность почвы с помощью лакмуса:
как с этим бороться Как узнать повышенная кислотность или
Как понять, кислотность желудка повышена или понижена? Разберемся.
Для процесса пищеварения очень важно, чтобы желудочный сок обладал нормальным уровнем кислотности. Этот уровень определяется концентрацией соляной кислоты. В нашей статье узнаем, как определить кислотность желудка. Также выясним, какими бывают признаки повышенного или пониженного показателя.
Желудочный сок и его кислотность
Повышенная кислотность является избытком соляной кислоты, она может приводить к ослаблению оболочки, защищающей желудок. Повышенная кислотность крайне отрицательно влияет на его стенки. Такой процесс тесно взаимосвязан с рядом патологий и нежелательной симптоматики, к примеру, это ведет к таким недугам, как язва, кровотечения, гастрит и так далее.
Как определить кислотность желудка в домашних условиях, интересно многим.
Что касается пониженной кислотности, то она представляет собой дефицит соляной кислоты и ведет к неблагоприятным последствиям. При этой форме отклонения ухудшается антибактериальная деятельность кислоты, из-за чего происходит значительное нарушение кишечной флоры. В желудке находится среда, которая благоприятна для размножения болезнетворных бактерий, а, кроме того, грибов. Поэтому при попадании туда и размножаются бактерии Хеликобактер, из-за чего появляются различные заболевания, такие как эрозия, гастрит, полипоз и, что еще хуже — злокачественные опухоли.
Рассмотрим, как определить кислотность желудка самостоятельно.
Методы самостоятельного диагностирования
Сбои в работе пищеварительной системы при различных типах кислотности можно с легкостью перепутать с другими заболеваниями, если не проводить наблюдение за реакцией организма на те, или иные вкусовые предпочтения. Существуют всем известные тесты для определения кислотности желудка. Необходимо воспользоваться следующими видами продуктов:
Необходимо воспользоваться следующими видами продуктов:
- Тест с помощью лимона. Обычно людям, у которых повышенная кислотность, на вкус данный фрукт кажется очень кислым. Те, у кого она пониженная, с легкостью употребят мякоть или сок лимона, так как это не вызовет у них неприятных ощущений. Еще как проверить кислотность желудка?
- Тест с пищевой содой. Для проверки кислотности с помощью данного метода нужна 0,5 ч. л. соды, которую растворяют в воде и тщательно размешивают. Полученный напиток выпивают на голодный желудок и наблюдают за состоянием своего организма. Отсутствие отрыжки будет указывать на пониженный уровень.
- Тест с использованием пшенной каши с маслом. В том случае, если изжога появится от этого блюда, будет свидетельствовать о повышенном уровне. Как проверить кислотность желудка, знают не все.
- Тест с использованием яблочного сока. Для проверки следует выпить такой сок на голодный желудок. В случае наличия повышенной кислотности, возникнут неприятные, а, кроме того, болезненные ощущения в животе.
 В том случае, если эти ощущения будут отсутствовать, то это будет означать, что уровень кислотности в норме. Если же имеется желание употребить яблочный сок или другой кислый продукт, значит, она сильно понижена.
В том случае, если эти ощущения будут отсутствовать, то это будет означать, что уровень кислотности в норме. Если же имеется желание употребить яблочный сок или другой кислый продукт, значит, она сильно понижена.
Вот как определить кислотность желудка в домашних условиях.
Почему понижена кислотность и каковы для этого причины?
Пониженная кислотность выступает следствием определенных заболеваний, например, гастрита, гастродуоденита или рака желудка. Эти патологии тесно взаимосвязаны с нарушением работы желез, которые отвечают за наличие соляной кислоты. Как таковая пониженная кислотность служит довольно серьезным видом патологии, так как создает среду для распространения инфекций.
Должен знать каждый.
Почему повышается кислотность?
Основной причиной ее увеличения считается неправильный режим питания наряду с несоблюдением графика принятия продуктов. Употребление жирной и острой пищи наряду с копченостями, сладостями, алкоголем и кофе крайне отрицательно отражается на процессе пищеварения.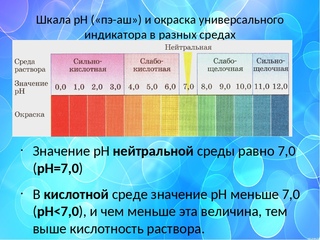
Помимо этого продолжительный прием некоторого вида медицинских препаратов способен повышать кислотность в желудке. К таким препаратам относят гормональные средства наряду с противовоспалительными нестероидными медикаментами. Курение тоже пагубно влияет на желудок и повышает его кислотность.
Признаки пониженной кислотности желудка
Наиболее характерными признаками пониженной кислотности являются следующие факторы:
Вторичными признаками пониженной кислотности желудка, которые появляются спустя некоторое время, в этом случае являются следующие симптомы:
- Наличие сухости кожи на руках, а, кроме того, на лице.
- Присутствие ломкости и расслаивания ногтей.
- Наличие ломкости и сухости волос.
- Возникновение сыпи и расширенной сосудистой сетки на лице.
- Общая слабость организма.
- Недостаток веса.
- Наличие быстрой утомляемости организма.
- Снижение гемоглобина даже при сбалансированном питании.
Рассмотрим ниже признаки повышенной кислотности желудка.
Симптоматика избытка кислоты
Это является проблемой с не менее отрицательными последствиями, чем в противоположном случае. У человека происходит раздражение стенки желудка из-за избытка кислотности, что приводит к появлению следующих симптомов:
- Появление изжоги после питания.
- Медный привкус во рту.
- Наличие отрыжки после пищи.
- Боль в желудке, которая имеет ноющий характер.
- Тяжесть со вздутием живота.
- Появление давящих ощущений в брюшной полости.
- Сбой процесса дефекации.
- Появление боли в желудке после лекарственных препаратов.
Вторичными признаками, которые могут возникнуть при отсутствии лечения, служат следующие симптомы:
- Снижение аппетита наряду с апатией.
- Частый дискомфорт в районе желудка.
- Частые приступы тошноты и рвоты.
- Присутствие бело-серого налета на языке.
Как правило, при отсутствии таких признаков кислотность находится в норме (нулевая кислотность желудка). Но, при наличии хотя бы некоторой симптоматики необходимо своевременно обратиться к специалисту в целях выявления вероятных проблем и последующей корректировки. Знать, как определить кислотность желудка, недостаточно. Далее выясним, какой должна быть диета.
Но, при наличии хотя бы некоторой симптоматики необходимо своевременно обратиться к специалисту в целях выявления вероятных проблем и последующей корректировки. Знать, как определить кислотность желудка, недостаточно. Далее выясним, какой должна быть диета.
Выбор диеты при высоком уровне кислоты в желудке
Любая диета при проблемах с кислотностью должна быть направлена на нормализацию уровня соляной кислоты и на создание благоприятных условий для нормального пищеварения. При высоком уровне кислоты необходимо отказываться от наваристых бульонов, а, кроме того, от острых закусок наряду с сырыми овощами и газированной водой. Из овощей разрешено употреблять в пищу отварной картофель, морковь или цветную капусту.
Рекомендуется также ограничить сладости и мучные изделия. Полезным при повышенной кислотности считают употребление каш, а также минеральной воды. Принимать продукты требуется в хорошо измельченном и отварном виде.
Пониженная кислотность и диета
При пониженной кислотности принципы диеты похожи, но стоит исключить жирную, перченую и соленую пищу. При нормализации самочувствия разрешается расширить рацион добавлением мясных бульонов, рыбных блюд и овощных. Оба варианта диеты исключают напитки, содержащие алкоголь. Следует с осторожностью относиться к различным специям, поэтому лучше их полностью убрать, так как они могут оказать сильное раздражающее воздействие на желудок и усилить нежелательные симптомы.
При нормализации самочувствия разрешается расширить рацион добавлением мясных бульонов, рыбных блюд и овощных. Оба варианта диеты исключают напитки, содержащие алкоголь. Следует с осторожностью относиться к различным специям, поэтому лучше их полностью убрать, так как они могут оказать сильное раздражающее воздействие на желудок и усилить нежелательные симптомы.
Способы определения кислотности желудка
Прежде всего, следует знать, что ее нормальный уровень должен составлять от 0 до 9 ммоль. К медицинским мероприятиям, помогающим в определении уровня кислотности, относятся следующие приемы:
Домашние способы понижения повышенной кислотности
Можно попытаться снизить кислотность с помощью диеты. Для этого прекращают употребление продуктов, вызывающих ее повышение, а именно речь идет о кофе, чае, газированных напитках, квашеных овощах, сладостях, бобовых, грибах, кисломолочных жирных продуктах и калорийных блюдах. Следует принимать больше продуктов, способствующих снижению кислотности, к которым относят нежирное молоко наряду с ряженкой, йогуртами, молочными кашами, творожно-фруктовыми запеканками, соками из моркови и свеклы.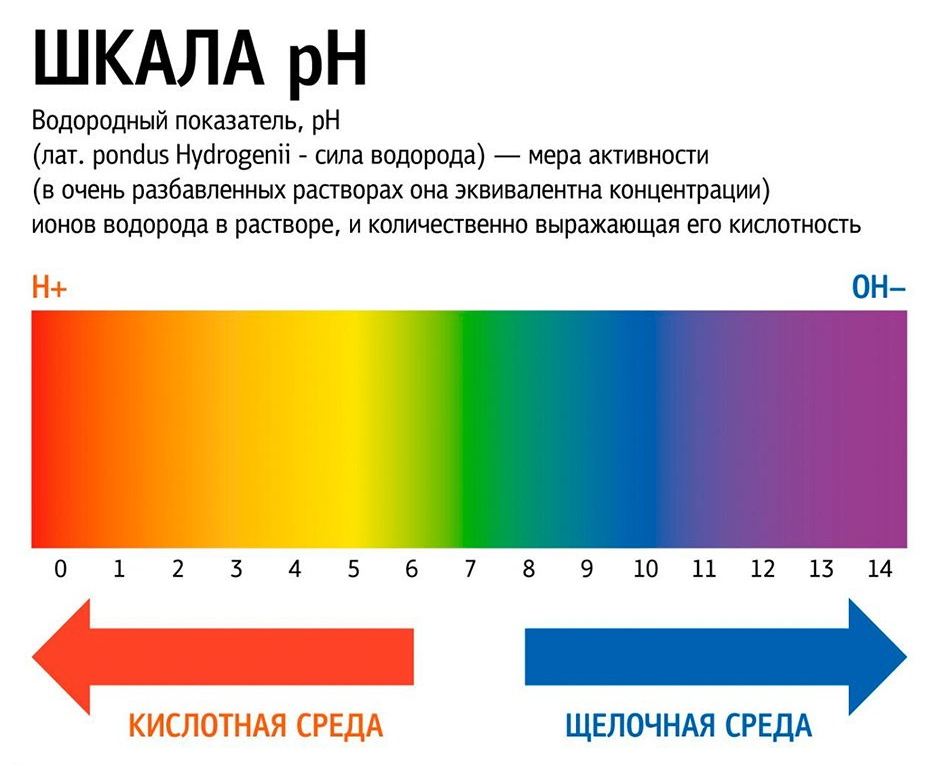 Также полезно будет употреблять мед и лечебную минеральную воду, но без газа.
Также полезно будет употреблять мед и лечебную минеральную воду, но без газа.
Для понижения кислотности можно пользоваться народными методами. Эффективным народным методом является употребление травяного чая, настоев или отваров, воздействие которых направлено на то, чтобы восстановить нормальную функцию нервной системы. Рекомендуют употреблять чай с мятой, добавляя в него пару капель имбирного сока с ложкой меда. Приготовленный по этому рецепту чай не только успокоит нервы, но и поможет процессу пищеварения.
Можно пить отвар, приготовленный из семечек льна, подойдет и настойка из семян укропа. Действие этих продуктов направлено на восстановление здоровой работы желудка. Число применений в день: два раза. Очень эффективным методом является прием таблеток активированного угля, который способен связывать лишнюю соляную кислоту.
Для устранения кислоты нужен металл. Хорошим для этого средством является кальций. Необходимо растолочь скорлупу от яиц, перемешать полученный порошок с витамином «D» или рыбьим жиром. Употреблять такое средство надо при кислом привкусе во рту.
Употреблять такое средство надо при кислом привкусе во рту.
Мы рассмотрели основные методы определения кислотности желудка.
Профилактика повышения кислотности
Если повышение уровня кислотности возникает лишь время от времени, то подобное состояние крайне редко приводит к серьезным последствиям. Но в том случае, если повышенный уровень наблюдается регулярно, то это может приводить к серьезным заболеваниям. В связи с этим очень важно соблюдать следующие меры профилактики:
- Правильно, а, кроме того, рационально питаться. Употреблять в пищу следует много продуктов, которые содержат клетчатку и белки с витаминами. Пищу рекомендуется принимать небольшими порциями, исключая жирные и острые продукты. Под особым запретом должны быть блюда из категории фаст-фуда.
- Не менее важно отказаться от курения, а, кроме того, употребления алкогольных напитков.
- Следует осуществлять регулярные обследования на присутствие хеликобактерной инфекции.
- Нужно стараться избегать стрессов и нервного перенапряжения.

- Осуществлять своевременное лечение патологий инфекционного генеза, так как они могут привести к развитию осложнений.
Заключение
Как определить кислотность желудка, теперь понятно. Но, несмотря ни на что, следует помнить, что в любом случае требуется обратиться за квалифицированной помощью к доктору. Ведь именно специалист с помощью предназначенной диагностики и клинических обследований поможет поставить верный диагноз, назначив адекватное лечение.
Кислотность желудка – показатель, характеризующий нормальное функционирование этого органа пищеварения. Определить кислотность желудка можно различными способами. Это и диагностические процедуры в лечебном учреждении, и подручные средства в домашних условиях. Выявится повышенная или пониженная кислотность, независимо от этого любое отклонение является патологией и нуждается в коррекции и лечении.
Общие сведения
Желудок является главным органом, участвующим в процессе пищеварения. Внутри него накапливается и расщепляется поступающая в организм пища. Нормальная ее переработка обеспечивается . Показателем того, что желудок работает в нормальном режиме, является уровень его кислотности. Под этим показателем понимается концентрация соляной кислоты в желудочном соке. Уровень его содержания постоянный и составляет 160 ммоль/л.
Нормальная ее переработка обеспечивается . Показателем того, что желудок работает в нормальном режиме, является уровень его кислотности. Под этим показателем понимается концентрация соляной кислоты в желудочном соке. Уровень его содержания постоянный и составляет 160 ммоль/л.
Если соотношение между щелочным компонентом и кислотой изменяется, то говорят о понижении или повышении кислотности. Когда концентрация завышена, кислотность повышается, и соответственно, снижение концентрации ниже нормы указывает на пониженную кислотность. Любой сдвиг приводит к сбою нормального функционирования ЖКТ и вызывает заболевания органов этой системы.
Инструментальные методы
В современной гастроэнтерологии применяются различные инструментальные методы определения кислотности желудка. Такая диагностика проводится с помощью;
- внутрижелудочной pH-метрии;
- фракционного зондирования;
- окрашивания стенок желудка;
- использования ионообменной смолы.
Внутрижелудочная pH-метрия или интрагастральная метрия считается самым информативным методом.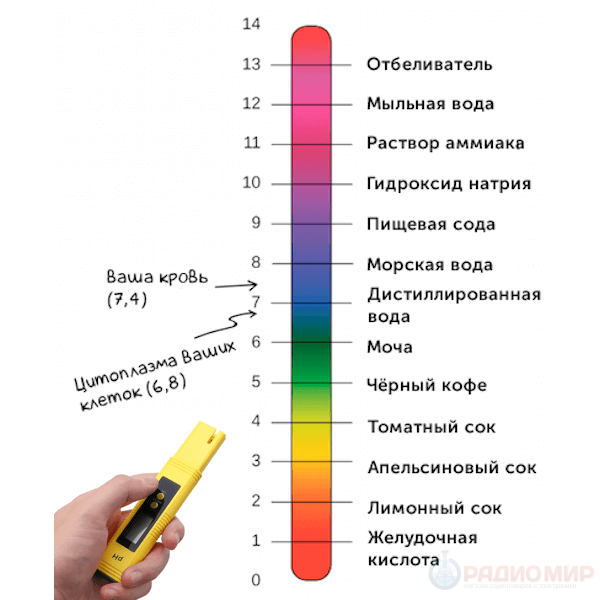 Процедура проводится с помощью ацидогастрометра. Этот прибор оснащен зондом и pH-датчиком. Эндоскоп вводится в желудок через рот и показатели сразу поступают на прикрепленный датчик.
Процедура проводится с помощью ацидогастрометра. Этот прибор оснащен зондом и pH-датчиком. Эндоскоп вводится в желудок через рот и показатели сразу поступают на прикрепленный датчик.
Фракционное зондирование поможет узнать кислотность желудка. Эта процедура предполагает отсасывание содержимого желудка через резиновую трубку. Полученный материал исследуется в лаборатории. Но необходимо иметь в виду, что результаты такого метода могут иметь погрешность, так как материал забирается из разных участков желудка и перемешивается в процессе отсасывания.
Известно, что исследуемый орган имеет 3 отдела, в каждом из которых кислотность различная. Определение кислотности с помощью окрашивания желудка заключается в эндоскопическом введении красителя в орган пищеварения. Оценка показателя осуществляется посредством визуального исследования стенок желудка по тому, как изменится цвет красителя.
Использование ионообменных смол считается самым простым способом определения кислотности желудочного сока, но вместе с тем и наименее информативным. В ходе процедуры пациенту внутрь вводится реактив с пигментом. В желудке происходит его высвобождение и поступление в желудочно-кишечный тракт. Затем он проникает в почки и выводится естественным путем через мочу. Заключение делают по цвету этой биологической жидкости.
В ходе процедуры пациенту внутрь вводится реактив с пигментом. В желудке происходит его высвобождение и поступление в желудочно-кишечный тракт. Затем он проникает в почки и выводится естественным путем через мочу. Заключение делают по цвету этой биологической жидкости.
Такой способ диагностики применяется, когда у пациента имеются противопоказания к зондированию.
Инструментальные методы отличаются наибольшей точностью
Определение показателя по симптомам
Повышенная выработка желудочной кислоты сопровождается возникновением определенных симптомов. Повышенную кислотность можно выявить по таким признакам, как:
- отрыжка и изжога;
- привкус кислоты во рту;
- тяжесть и боль в желудке;
- вздутие живота и нарушение стула.
Изжога возникает каждый раз после приема пищи. В положении лежа этот симптом усиливается. Подобное проявление обусловлено раздражением стенок желудка вырабатываемой в избытке соляной кислотой. Когда кислотность понижена, наблюдается нарушение процесса пищеварения, поступаемая пища плохо расщепляется, ухудшается усвоение витаминов и микроэлементов.
Снижение концентрации желудочного сока имеет аналогичные проявления, как и при ее повышении, с небольшой разницей. Признаками нехватки желудочного сока является отрыжка с тухлым запахом, постоянное урчание в желудке, снижение уровня гемоглобина. Если говорить об общей реакции организма, то снижается иммунитет, человек становится подверженным заражению различными вирусами и бактериями. Кроме того, пониженная секреция соляной кислоты в желудке может провоцировать рак этого органа.
О снижении кислотность желудка будут свидетельствовать такие дополнительные проявления, как:
- глистная инвазия;
- грибок ногтей;
- ломкость ногтей и волос;
- просвечивание сосудов на лице;
- присутствие в кале непереваренных остатков пищи;
- угревая сыпь на теле и лице.
Какие способы подходят для домашних условий
Несмотря на то что состояние кислотности желудка с достоверной точностью определяется лишь в медицинских условиях, можно самому в домашних условиях проверить этот показатель. Одним из таких методов является специальная тест-полоска. Ее действие основано на определении уровня PH. На лакмусовую полоску нанесен специальный индикатор, который вступает в химическую реакцию при контакте с кислотой.
Одним из таких методов является специальная тест-полоска. Ее действие основано на определении уровня PH. На лакмусовую полоску нанесен специальный индикатор, который вступает в химическую реакцию при контакте с кислотой.
Повышенная кислотность желудка всегда сопровождается приступами изжоги
Результат определяется по цвету полоски, он меняется. Если кислотность повышена, то индикатор становится красного цвета. При пониженном показателе лакмусовая полоска окрашивается в синий цвет. Рекомендуется проводить проверку натощак утром, между 9 и 11 часами. Для получения наиболее точных данных желательно повторить тест через несколько дней. Сопоставляя эти показатели можно получить более или менее достоверную информацию об интересующем вопросе.
Определить кислотность желудочного сока можно с помощью обычной соды. Для этого нужно выпить раствор соды: половину одной чайной ложки растворяют в стакане прохладной воды. Если после этого появилась отрыжка или обильное срыгивание воздухом, то принято считать, что кислотность повышена. Проверить pH желудка можно с помощью лимона. Достаточно отрезать тонкий ломтик цитрусового фрукта и съесть его.
Проверить pH желудка можно с помощью лимона. Достаточно отрезать тонкий ломтик цитрусового фрукта и съесть его.
Если почувствуется сильно кислый привкус, значит у человека повышенная кислотность. Если же показатель на самом деле понижен, то вкус лимона будет воспринят не кислым.
Обычный яблочный сок поможет ответить на вопрос об уровне кислотности желудка. Нужно выпить напиток натощак и проследить за собственной реакцией. При повышенном уровне pH в органе пищеварения, у человека начнутся болевые спазмы в животе, появится изжога и , во рту будет чувствоваться металлический вкус. При пониженной кислотности подобные симптомы отсутствуют.
Кислотно-щелочной баланс организма – важный показатель обмена веществ. При малейших нарушениях этого равновесия человек сталкивается с серьёзными патологиями желудочно-кишечного тракта. Но это вовсе не значит, что при малейшей симптоматике нужно бежать в поликлинику. Определить кислотность желудка самостоятельно можно при помощи простейших опытов или посредством специальных тестовых полосок.
Симптомы повышенной и пониженной кислотности
На 0,5% желудочный сок состоит из соляной кислоты, которая помогает в переваривании пищи, способствуя её постепенному перемещению в полость 12-перстной кишки. Кроме того, она осуществляет ряд прочих функций, не менее значимых для организма человека:
- Содействие процессу расщепления белка.
- Активизация пепсиногенов, которые обращаются в пепсины.
- Формирование субацидной среды.
- Противомикробное действие желудочного сока.
- Развитие панкреатической секреции.
От степени содержания кислоты напрямую зависит субацидность желудка. Она отличается своими определёнными нормами, аномалии которых способствуют появлению дискомфорта в организме.
Узнать кислотность желудка можно самостоятельно. К примеру, повышенный уровень определяют следующие признаки:
- Изжога.
- Острые болевые ощущения, сопровождающиеся жжением в области пищевода.
- Тяжесть в желудке.

- Отрыжка с характерным кисловатым запахом.
- Боль во время еды и между приёмами пищи.
- Красноватый цвет языка с белёсым налётом.
- Болезненное самочувствие.
- Рассеянность.
- Проблемы со сном.
Симптомы пониженной кислотности:
- Гнилостный запах из полости рта даже при отсутствии кариеса зубов или пародонтоза.
- Отрыжка.
- Плохое переваривание еды, сопровождающееся жидким стулом и в некоторых случаях запорами.
- Урчание, вздутие.
- Привкус железа во рту.
- Неважный аппетит или полное его отсутствие.
- Анемия.
- Тошнота.
- Понижение иммунитета.
- Присутствие непереваренных фрагментов пищи в кале.
- Расстройства психики.
Норма кислотности
Субацидность желудка – сосредоточение соляной кислоты, измеряемое рН-метрией. Когда у человека начинаются проблемы с перевариванием пищи, появляется болевой синдром в области желудка, тогда гастроэнтерологи назначают анализ желудочного сока и ФГСД. Всё это помогает определить, в каком состоянии находится слизистая, а также проверить кислотность желудочного секрета.
Всё это помогает определить, в каком состоянии находится слизистая, а также проверить кислотность желудочного секрета.
Для естественного пищеварения в желудке требуются специальные ферменты. Ключевым из них считается пепсин, образующийся лишь в кислой среде. Тем не менее, чтобы всё, что содержится в желудке переместилось в кишечник, нужна обязательная нейтрализация этой кислоты.
В организме всё взаимосвязано, и при малейших нарушениях желудочных процессов, как например при гастрите, происходит сбой всего пищеварительного функционала. А это уже чревато серьёзными осложнениями.
Нормы кислотности здоровой среды желудка выглядят следующим образом (значения указываются в ед. рН):
- Оптимальность – 1,5–2,0.
- Максимум – 0,86.
- Минимум – 8,3.
- Антрум – 1,3–7,4.
- Эпителиальный слой – 7,0.
- Нейтральное число – 7,0.
Если уровень последнего показателя превышает указанную цифру, то в организме доминирует щелочная среда.
Определение кислотности дома
Патологии, связанные с повышенной или пониженной кислотностью, выявляются в домашних условиях с помощью простых методов. Чтобы проверить эти показатели самостоятельно достаточно использовать доступные всем продукты.
Пищевая сода
Потребуется растворить ½ чайной ложечки в 200 мл воды и употребить натощак. Если после приёма появилась отрыжка, то это говорит о повышенной норме. Отсутствие такого симптома указывает на пониженный уровень.
Простейший домашний тест на кислотность, который также поможет понять, что происходит в желудке. В случае повышения нормы вкус цитруса ощущается чрезмерно кислым, а понижения – самым обычным, когда человек даже не сморщится.
Пшённая каша
Когда после употребления этого блюда появляется изжога, то субацидность превышает свои допустимые параметры.
Яблочный сок
Если выпить напиток утром до завтрака, то в случае повышенной концентрации кислоты появится жжение за грудиной посередине (в области пищевода) и металлический вкус во рту. Отсутствие симптоматики говорит о нормальных показателях. Если же после кислого сока хочется попить ещё что-то аналогичное, то это значит, что уровень концентрации низкий.
Отсутствие симптоматики говорит о нормальных показателях. Если же после кислого сока хочется попить ещё что-то аналогичное, то это значит, что уровень концентрации низкий.
Лакмусовые полоски
Этот вариант является самым точным показателем проверки кислотной среды желудка. Лакмус – природный краситель, добываемый из лишайника. Кусочек бумаги, пропитанный настоем, играет роль индикатора, который в условиях кислотной среды становится красным, а щелочной – синим.
Стоит отметить, что измерения лучше всего производить натощак с 10 до 12 ч. В этот временной период слюноотделение меньше, чем, например, вечером. За два часа до перекуса лакмусовую бумагу надо положить на поверхность языка и оставить на несколько мгновений. Узнать свои результаты можно при помощи приложенной цветовой шкалы.
Причины отклонения кислотности
Соляная кислота необходима для расщепления белка и переваривания пепсинов, активизации панкреатической секреции и борьбы с болезнетворными бактериями. Поэтому контролировать её концентрацию – занятие необходимое и важное. Только так её можно своевременно нормализовать, а значит избавить свой организм от таких серьёзных заболеваний, как гастрит, язва, и что ещё страшнее – рака желудка, кишечника или других отделов ЖКТ.
Поэтому контролировать её концентрацию – занятие необходимое и важное. Только так её можно своевременно нормализовать, а значит избавить свой организм от таких серьёзных заболеваний, как гастрит, язва, и что ещё страшнее – рака желудка, кишечника или других отделов ЖКТ.
Концентрация соляной кислоты изменяется в силу целого ряда причин. В их числе:
- стрессы;
- хеликобактерная инфекция;
- злоупотребление алкоголем;
- курение;
- переедания;
- применение сухой и тяжёлой пищи;
- жирные и острые блюда;
- перенапряжения;
- проблемы со сном;
- продолжительный приём лекарственных препаратов;
- авитаминоз;
- наследственные факторы.
В целом проверить концентрацию кислоты в организме – занятие несложное и сделать это возможно даже дома. Однако не стоит пренебрегать периодическими осмотрами у специалистов. При необходимости будут проведены исследования, включая гастроскопию и зондирование. Это поможет поставить правильный диагноз и назначить своевременное лечение гастроэнтерологической патологии. Не нужно также забывать, что разумное питание, избавление от вредных привычек и стрессов является залогом не только нормальных значений кислотности, но хорошего самочувствия и настроения.
Не нужно также забывать, что разумное питание, избавление от вредных привычек и стрессов является залогом не только нормальных значений кислотности, но хорошего самочувствия и настроения.
Гастрит − это воспаление слизистых оболочек органов желудочно-кишечного тракта, сопровождаемое нарушением уровня pH в организме. Значительное снижение или повышение кислотности негативно сказывается на работе органов пищеварения и организме, поэтому логичной мерой при появлении гастрита становится диагностика кислотности желудочного сока.
Главная составляющая желудочного сока − соляная кислота. Желудок обладает кислотной реакцией на приём пищи. Кислотная среда считается агрессивной для множества вредоносных бактерий, вирусов, с лёгкостью попадающих в пищу человека, вызывая отравление. Соляная кислота в норме нейтрализует их действие. Необходима для эффективного переваривания пищи.
Между приёмами еды в желудке скапливается некое количество желудочного сока. Когда человек ест, усиливается аппетит, содержание желудочного сока в организме в этот момент достигает полутора литров. Нормальным уровнем кислотности считается водородный показатель (pH) в диапазоне 1,5-2,5 единиц. Среда в органах пищеварения преимущественно кислая. Уровень pH ниже 7 единиц считают кислым, от 7 единиц и выше − щелочным.
Нормальным уровнем кислотности считается водородный показатель (pH) в диапазоне 1,5-2,5 единиц. Среда в органах пищеварения преимущественно кислая. Уровень pH ниже 7 единиц считают кислым, от 7 единиц и выше − щелочным.
Правильный процесс пищеварения обеспечивают ферменты, главным считается пепсин. Указанный фермент вырабатывается и действует, если кислотность желудка в норме. Малейший сбой в кислотности отражается на качестве пищеварения и обуславливает гастрит и прочие заболевания. Правило работает и в обратном направлении − гастрит обуславливает сбои в уровне pH.
Соляная кислота выделяется желудком и нейтрализуется в его антральном отделе для нормального рассасывания пищи в кишечнике. Когда развивается дисбаланс в продукции и нейтрализации соляной кислоты, появляется повышенная кислотность организма. Если излишняя выработка кислоты происходит продолжительное время, возникает её устойчивое повышение в желудке и двенадцатиперстной кишке.
Симптомы снижения кислотности нельзя оставлять без внимания, длительное раздражение слизистой оболочки желудка, особенно при наличии гастрита, чревато многими сопутствующими заболеваниями. Из-за патологии развивается множество расстройств органов пищеварения:
Из-за патологии развивается множество расстройств органов пищеварения:
- гастродуоденит;
- гастроэзофагеальная рефлюксная болезнь;
- гастриты различных видов.
Понять, что кислотность повышена, позволяют симптомы:
- изжога − яркий признак заболеваний органов ЖКТ, свидетельствует об этом в комплексе с прочими признаками;
- чувство жжения в районе груди и першение в горле;
- отрыжка с горьким привкусом;
- боль ноющая, приступообразная, свидетельствует о начальной стадии развития язв;
- боль под ребром с правой стороны.
При обнаружении ряда симптомов не откладывайте визит к врачу. Повышение уровня pH − опасная дисфункция органов ЖКТ, при длительном течении последствия необратимы.
Признаки пониженной кислотности желудка
Определить кислотность желудка, если она заметно снижена, возможно самостоятельно. Потом потребуется срочно обратиться к гастроэнтерологу для подтверждения диагноза. Врач диагностирует неполадки в органах ЖКТ и назначит правильное лечение. Пониженная кислотность не менее опасна, чем повышенная, обуславливает ряд характерных явлений.
Пониженная кислотность не менее опасна, чем повышенная, обуславливает ряд характерных явлений.
Основной признак сниженного уровня pH − неприятный запах изо рта, имеющий гнилостный привкус протухшего яйца. Полезные свойства соляной кислоты заключаются в том, что вещество обладает антисептическим, бактерицидным влиянием на патогенные микроорганизмы. Вредные бактерии попадают в организм, желудочный сок обрабатывает заражённую пищу, не допуская отравления продуктами жизнедеятельности. Если соляной кислоты недостаточно, защитные реакции снижаются. Подобным образом в кишечник попадают вирусы и бактерии, уничтожающие полезную микрофлору.
Частый спутник пониженной кислотности − запоры, сменяющиеся частыми поносами. Расстройство кишечника происходит из-за ослабевания защитных механизмов в желудке, важно стараться сохранять правильный баланс кислот в организме. Причина запоров − ухудшение моторной функции кишечника из-за нехватки кислоты. Нарушение нельзя исправить диетой или стимулирующими методами. Проявится лишь временный эффект, поскольку не устранена первопричина.
Проявится лишь временный эффект, поскольку не устранена первопричина.
Брожение в кишечнике вызывает дискомфорт, боль и метеоризм. Белки всасываются в кишечнике, в результате, происходит неполное их усвоение. В желудке собирается избыток продуктов распада, негативно действующих на организм, вызывая интоксикацию. Токсины способствуют снижению сопротивляемости организма к вирусным заболеваниям, падает иммунитет человека. В комплексе с указанными симптомами отмечаются грибковые поражения слизистых оболочек, кожи головы, ладоней и стоп.
Когда замедляется белковый обмен, снижение кислотности приводит к худшему усвоению витаминов и минералов. Авитаминоз чреват ломкостью и сухостью волос, кожи, ломкостью ногтей и другими внешними признаками. От дефицита витаминов страдают органы и системы. Авитаминоз сопровождает железодефицитная анемия. Вместе с атрофическим гастритом анемия считается признаком болезни Аддисон-Бирмера. сопровождает В12-дефицитная анемия.
Среди внешних симптомов пониженной кислотности − неприятности с кожными покровами. У человека на лице и теле наблюдается угревая сыпь, расширение капилляров на лице. В кале заметны непереваренные остатки пищи. После еды человека беспокоят изжога, вздутие и тяжесть в желудке.
У человека на лице и теле наблюдается угревая сыпь, расширение капилляров на лице. В кале заметны непереваренные остатки пищи. После еды человека беспокоят изжога, вздутие и тяжесть в желудке.
Как определяют кислотность желудка
Как определить кислотность при гастрите достоверно, знает врач-гастроэнтеролог. Называют косвенные признаки, по котором делаются выводы о снижении или повышении. Назовём перечень оправданных методов, устанавливающих кислотность с точностью до десятых. Среди упомянутых способов выделяют:
Лечение патологической кислотности
Если пониженная кислотность обнаружена у больного гастритом без наличия эрозивных повреждений слизистой оболочки, назначаются препараты:
- соляная кислота и медикаменты, стимулирующие её выработку;
- для восстановления нормальной ферментативной функции назначают заместительную терапию пепсидилом;
- в зависимости от симптомов обязательно применение лекарств с антацидным действием;
- если имеется заражение бактерией Хеликобактер пилори, применяется антибиотикотерапия.

При низком уровне pH народная медицина предлагает употреблять в пищу растения с горьким привкусом − перечную мяту, полынь или аир. Традиционный метод борьбы с болезнью − соблюдение принципов диетического питания. Больным гастритом рекомендуется отказаться от цельного молока, винограда, абрикосов, свежей выпечки, вызывающих бродильные процессы в кишечнике. Важно воздержание от жареного, острого, жирного, копчёного. Питаться нужно дробно, не допускать больших перерывов между едой.
Всех этих принципов необходимо придерживаться и при высоком уровне pH. Медикаментозно он лечится по такой схеме:
- назначение антисекреторных средств, снижающих выработку желудочного сока;
- применение антацидной терапии при сопутствующих симптомах гастрита;
- ингибиторы протонной помпы, нейтрализующие действие соляной кислоты.
Вовремя принятые меры обеспечат успешную нормализацию секреторной функции желудка, уберут неприятные симптомы. При наличии хронических заболеваний органов ЖКТ важно внимательно относиться к качеству и пользе пищи, своевременно обращаться за медицинской помощью при появлении первых признаков обострения.
Что такое кислотность, как узнать кислотность желудка, и для чего это нужно? Кислотность содержимого желудочно-кишечного тракта может значительно изменяться в зависимости от отдела кишечной трубки. Так, концентрация рН желудка низкая, и это необходимо для активизации желудочных ферментов и осуществления физиологичного пищеварения. Напротив, кислотность содержимого двенадцатиперстной и тощей кишки очень низкая, вплоть до щелочной среды, что также необходимо для активизации панкреатических ферментов и адекватного пищеварения. Однако существует немало заболеваний органов пищеварительной системы, как дисфункционального, так и органического характера, при которых развивается дисбаланс внутренней химической среды. Именно для определения конкретной патологии и дальнейшего эффективного лечения проводится исследование кислотности желудка.
Медицинская справка
Кислотность желудка, а точнее, желудочного сока – показатель, характеризующий концентрацию свободных ионов водорода и соляной кислоты в желудочном соке или в целом желудочного содержимого.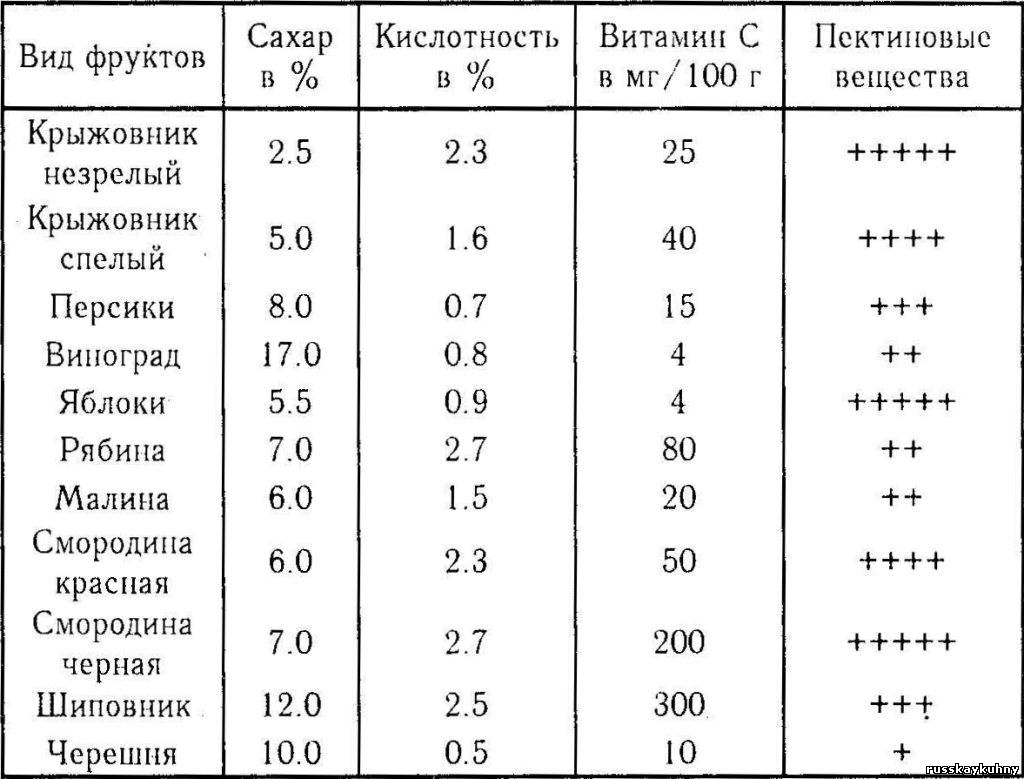 Измеряется данный показатель в рН, что является сокращением от латинского pondus Hydrogenii, а в переводе – вес водорода. В независимости от диагностического исследования или метода, главным показателем остаётся исследование уровня рН.
Измеряется данный показатель в рН, что является сокращением от латинского pondus Hydrogenii, а в переводе – вес водорода. В независимости от диагностического исследования или метода, главным показателем остаётся исследование уровня рН.
Чтобы не путаться в терминологии, следует запомнить простую схему: чем ниже рН – тем более повышенная кислотность желудка и наоборот, чем выше рН – тем ниже кислотность желудочного сока. Теперь Вы поймете, о чем будет идти речь.
Чтобы понять, как происходит образование соляной кислоты в желудке, и для чего она нужна, необходимо знать элементарные физиологические принципы функционирования данного органа. Всю площадь желудка можно условно разделить на две зоны.
- Верхняя зона, которая состоит из кардиального отдела, дна и тела желудка. Данная зона считается высококислотной, основная секреция соляной кислоты происходит именно в ней.
- Нижняя кислотно-нейтрализующая зона, в которой происходит выработка гидрокарбонатов. Гидрокарбонаты – вещества, понижающие кислотность желудочного содержимого и способствующие нейтрализации соляной кислоты.
Именно эти участки органа необходимо учитывать при проведении исследования кислотности желудка определёнными диагностическими методами. Таким образом, если зонд возьмёт содержимое желудка из антрального или пилорического отдела, то интерпретировать результат можно в качестве пониженной кислотности желудка. Чтобы результат был максимально достоверным, исследование кислотности необходимо проводить в двух отделах желудка.
Как определить кислотность желудка, не прибегая к лабораторным и инструментальным методам исследования? Уже перед началом диагностики специалиста могут насторожить некоторые симптомы и жалобы со стороны пациента, которые говорят в пользу того или иного заболевания.
Симптомы повышенной кислотности
Повышенную кислотность характеризует целый комплекс клинических проявлений. К основным из них можно отнести следующие признаки: изжога, отрыжка, вздутие, тяжесть в верхних отделах живота.
Симптомы пониженной кислотности
Повышение уровня рН может приводить к появлению эрозивного или атрофического гастрита, для которого характерны долгие и упорные боли со слабой интенсивностью.
Важно! Если Вы самостоятельно решили узнать рН желудка, не стоит полагаться на симптомы, лучше купить специальный диагностический препарат, который сможет провести приблизительную оценку кислотности содержимого желудка.
Существует целый ряд кислотозависимых заболеваний желудка. В большинстве своём они связаны с верхними отделами желудочно-кишечного тракта. Нарушение кислотопродукции или её нейтрализация в желудке приводит к повышению кислотности желудочного секрета и развитию дискинезии пищевода, желудка и двенадцатиперстной кишки. Дискинезия приводит к таким заболеваниям, как:
- Гастроэзофагеальная рефлюксная болезнь и эзофагит. Возникает из-за заброса желудочного сока в пищевод, что приводит к воспалению и изъязвлению нижней трети слизистой пищевода.
- Диспепсия верхних отделов ЖКТ. Агрессивная среда желудка с повышенной или, наоборот, пониженной кислотностью приводит к возникновению спазма гладкой мускулатуры органа.
- Гастрит и дуоденит. Повышенная или пониженная кислотность приводит к развитию химического раздражения слизистой верхних отделов пищеварительного тракта и его воспалению.
Методы диагностики
Как проверить кислотность желудка? Исследование секреторной активности и степени концентрации соляной кислоты позволяет не только определить или подтвердить кислотозависимое заболевание желудка и соседних отделов, но и определить степень выраженности дисфункциональных проявлений заболевания. Самые проверенные методы оценки химического состава содержимого желудочно-кишечного тракта представлены ниже.
Как узнать кислотность желудка в домашних условиях? Определить самостоятельно рН желудка можно при помощи специальных препаратов. Ионообменные смолы – самый простой в применении диагностический метод. Человек, у которого проводится исследование, выпивает специальный препарат (Ацидотест или Гастротест) в виде раствора. Данные препараты покупают в аптеке для того, чтобы самостоятельно провести простейшую рН-метрию. Попадая внутрь, раствор взаимодействует с кислотой, после чего высвобождается специальный краситель, который выводится вместе с мочой. По её цвету судят о состоянии кислотности желудка, например, если цвет не изменяется, то кислотность снижена.
Стоит отметить, что данный метод обладает низкой информативностью и редко используется в общей лечебной сети, а вот в качестве самостоятельного мониторинга применяется по желанию пациента.
Определение кислотности желудка эндоскопическим методом лучше всего проводить натощак, чтобы лучше визуализировать слизистую желудка и степень окраски индикатора.
В момент гастроскопии через гибкий эндоскоп в полость желудка вводится небольшое количество красящего вещества – индикатора. В зависимости от концентрации свободных ионов водорода в желудочном соке индикатор окрашивается с той или иной интенсивностью, что регистрирует врач – эндоскопист.
Зондирование относится к аспирационным методам исследования рН желудочного секрета. Такой метод позволяет после взятия желудочного содержимого провести тест с определенными реактивами в лабораторных условиях. Метод позволяет достаточно быстро оценить рН желудочного сока, однако сопряжен с некоторыми трудностями. Диагностическую картину искажают такие факторы, как:
- Усиленная секреция соляной кислоты в момент аспирации.
- Невозможность узнать точную зону взятия материала.
Метод, несомненно, более информативный и точный, в сравнении с применением ионообменных смол, однако для постановки клинического диагноза необходимо проведение дополнительных исследований. Данный анализ или тест часто применяется в амбулаторной практике, перед направлением пациента на стационарное лечение.
В отличие от теста после фракционного зондирования, рН-метрия обладает максимальной точностью и информативностью и позволяет узнать кислотность не только исследуемого органа, но и пищевода и даже дистальных отделов кишечника. Существует три разновидности рН-метрии. Отличаются они по длительности проведения диагностической процедуры:
- Суточная рН-метрия, при таком виде исследования человек целые сутки ходит со специальным зондом, связанным с ацидогастрометром. Внутрижелудочная суточная рН-метрия позволяет определить концентрацию соляной кислоты, а также оценить в динамике его секреторную активность.
- Кратковременная рН-метрия – исследование проводится аналогичным способом, однако длительность процедуры составляет не более 3 часов.
- Экспресс-рН-метрия. Экспресс-тест позволяет за 15-20 минут определить кислотность содержимого желудка, однако не отражает динамики кислотообразования.
5 ключевых факторов, влияющих на кислотность в органической химии
Пять ключевых факторов, влияющих на кислотность
Сегодня мы поговорим о том, что стоит за тенденциями кислотности для различных молекул, и обсудим наиболее важные факторы, определяющие эти значения.
Раньше я писал школьным тоном о том, что pKa является одним из самых важных показателей, которые вы можете изучить в органической химии, и незнание некоторых основных значений pKa перед экзаменом во многом похоже на то, чтобы подойти к покерному столу, не зная значения рук: вы потеряете рубашку.
Давайте быстро рассмотрим основы кислотности и основности. Вот сокращенная версия:
- Кислоты Бренстеда являются донорами протонов, кислоты Льюиса — акцепторами электронных пар . Обратное: основание Бренстеда = акцептор протона, основание Льюиса = донор электронной пары.
- Основание конъюгата — это то, что вы получаете при удалении протона (H +) из соединения. Например, HO — — сопряженная основа воды. O 2- является сопряженным основанием HO —.И наоборот, сопряженные кислоты — это то, что вы получаете, когда добавляете протон к соединению. Конъюгированная кислота воды H 3 O + .
- Быстрая проверка: кислотный или щелочной pH 1? pKa похож на pH в том смысле, что низкие (и даже отрицательные значения) обозначают сильные кислоты. Это потому, что pKa основывается на равновесии:
- Согласно этому все, что стабилизирует конъюгированное основание, увеличивает кислотность. Следовательно, pKa также является мерой того, насколько стабильно сопряженное основание.Другими словами, сильные кислоты имеют слабые сопряженные основания, и наоборот.
Разобравшись с этим, приступим.
Содержание
- Фактор 1 — начисление.
- Фактор № 2 — Роль атома
- Фактор № 3 — Резонанс
- Фактор № 4 — Индуктивные эффекты
- Фактор № 5 — Орбитали
1. Фактор № 1 — Заряд.
Удаление протона H + снижает формальный заряд атома или молекулы на одну единицу.Это, конечно, легче всего сделать, когда атом изначально несет заряд +1, и становится все труднее, когда общий заряд становится отрицательным. Тенденции кислотности отражают это:
Обратите внимание, что как только конъюгат основания (B-) становится отрицательным, второе депротонирование приводит к образованию дианиона (B 2-). Хотя это далеко не невозможно, образование дианиона может быть затруднено из-за накопления отрицательного заряда и соответствующего электронного отталкивания, которое возникает в результате.
2.Фактор №2 — роль атомаЭтот момент вызывает большую путаницу из-за наличия двух, казалось бы, противоречащих друг другу тенденций.
Вот первый момент: кислотность увеличивается по мере прохождения по строке в периодической таблице. В этом есть смысл, правда? Логично, что HF более электроотрицателен, чем h3O, Nh4 и Ch5, из-за большей электроотрицательности фтора по сравнению с кислородом, азотом и углеродом. Фтор, несущий отрицательный заряд, — это счастливый фтор.
Но вот, казалось бы, странная вещь.Сам по себе HF не является «сильной» кислотой, по крайней мере, не в том смысле, что он полностью ионизируется в воде. HF — более слабая кислота, чем HCl, HBr и HI. Что тут происходит?
Вы можете привести два аргумента в пользу этого. Первая причина связана с более короткой (и более прочной) связью H-F по сравнению с более крупными галогенидами водорода. Второй связан со стабильностью конъюгированного основания. Фторид-анион F (-) — крошечный и злобный зверь с наименьшим ионным радиусом среди любых других ионов, несущих единственный отрицательный заряд.Следовательно, его заряд распределен по меньшему объему, чем у более крупных галогенидов, что энергетически невыгодно: с одной стороны, F (-) требует сольватации, что приведет к более низкому члену энтропии в Δ G.
Обратите внимание, что эта тенденция также сохраняется для h3O и h3S, причем h3S примерно в 10 миллионов раз более кислый.
3. Фактор № 3 — РезонансОгромным стабилизирующим фактором для сопряженной базы является то, что отрицательный заряд может быть делокализован посредством резонанса.Классические примеры — фенол (C6H5OH), который примерно в миллион раз более кислый, чем вода, и уксусная кислота (pKa ~ 5).
Однако будьте осторожны — для π-системы недостаточно просто находиться рядом с протоном — электроны сопряженного основания должны находиться на орбитали, которая обеспечивает эффективное перекрытие (для подлого вопроса с подвохом в этом Вены, которые обычно блокируют выпуски Гарварда, смотрите здесь.)
4. Фактор № 4 — Индуктивные эффектыЭлектроотрицательные атомы могут притягивать к себе отрицательный заряд, что может привести к значительной стабилизации сопряженных оснований.Посмотрите на эти примеры:
Как и следовало ожидать, этот эффект будет связан с двумя основными факторами: 1) электроотрицательностью элемента (чем больше электроотрицательный, тем более кислотный) и расстоянием между электроотрицательным элементом и отрицательным зарядом. .
5. Фактор №5 — ОрбиталиИ снова кислотность хорошо соотносится со стабильностью конъюгированного основания. А стабильность сопряженного основания зависит от того, насколько хорошо оно может приспособиться к своей новообретенной паре электронов.В эффекте, похожем на электроотрицательность, чем больше s-характер на орбитали, тем ближе электроны будут к ядру и тем ниже их энергия (= стабильная!).
Посмотрите разницу между pKa ацетилена и алканов — 25! Это 10 в степени 25, как «в 100 раз больше числа Авогадро». Просто чтобы дать вам представление о масштабе. Это удивительная вещь в химии — диапазон и силы различных явлений внушает трепет.
На самом деле я нашел мнемонику, которая может помочь вам запомнить эти эффекты. Это приписывают доктору Кристине Пруис, старшему преподавателю Темпе Университета штата Аризона.
C harge
A tom
R esonance
D ipole I nduction
O rbitals
= .
Будьте осторожны с мнемоникой, но готово.
5.4: Факторы, определяющие кислотную силу
Периодические тенденции
Во-первых, мы сосредоточимся на отдельных атомах и подумаем о тенденциях, связанных с положением элемента в периодической таблице.Мы будем использовать в качестве наших первых моделей простые органические соединения этан, метиламин и метанол, но эти концепции в равной степени применимы и к более сложным биомолекулам, таким как боковые цепи аланина, лизина и серина.
Мы можем видеть четкую тенденцию кислотности, когда мы движемся слева направо по второй строке периодической таблицы от углерода к азоту и кислороду. Ключом к пониманию этой тенденции является рассмотрение гипотетического конъюгированного основания в каждом случае : чем стабильнее (слабее) конъюгированное основание, тем сильнее кислота .Посмотрите, где заканчивается отрицательный заряд в каждой сопряженной базе. В этил-анионе отрицательный заряд несет углерод, в то время как в анионе метиламина и анионе метоксида заряды расположены на азоте и кислороде соответственно. Вспомните периодическую тенденцию электроотрицательности: она также увеличивается по мере того, как мы движемся слева направо по строке, а это означает, что кислород является наиболее электроотрицательным из трех, а углерод — наименее. Чем более электроотрицателен атом, тем лучше он может нести отрицательный заряд. .Таким образом, метоксид-анион является наиболее стабильным (с наименьшей энергией, наименее основным) из трех сопряженных оснований, а этил-анион является наименее стабильным (с наибольшей энергией, наиболее основным).
Мы можем использовать тот же набор идей, чтобы объяснить разницу в основности между водой и аммиаком.
Изучая значения pK и для соответствующих конъюгированных кислот, мы знаем, что аммиак более щелочной, чем вода. Кислород, как более электроотрицательный элемент, более плотно связан со своей неподеленной парой, чем азот.Таким образом, неподеленная пара азота с большей вероятностью разорвется и образует новую связь с протоном — другими словами, она более проста. Еще раз, более реакционноспособное (более сильное) основание конъюгата означает менее реакционноспособное (более слабое) конъюгированное основание.
При движении по вертикали в пределах данного столбца периодической таблицы мы снова наблюдаем четкую периодическую тенденцию изменения кислотности. Лучше всего это иллюстрируется галогенидами: основность, как и электроотрицательность, увеличивается по мере продвижения вверх по столбцу.
И наоборот, кислотность в галогенкислотах увеличивается по мере того, как мы перемещаемся на вниз на колонки.
Чтобы понять эту тенденцию, мы еще раз рассмотрим устойчивость сопряженных оснований. Поскольку фтор является наиболее электроотрицательным элементом галогена, можно ожидать, что фторид также будет наименее основным ионом галогена. Но на самом деле это наименее стабильный, и самый базовый! Оказывается, что при вертикальном движении в периодической таблице размер атома превосходит его электроотрицательность в отношении основности. Атомный радиус йода примерно в два раза больше, чем у фтора, поэтому в ионе йода отрицательный заряд распространяется на значительно больший объем:
Это иллюстрирует фундаментальную концепцию органической химии, которая достаточно важна, чтобы выделить ее красным:
Электростатические заряды, положительные или отрицательные, более стабильны, когда они «растянуты», чем когда они ограничены одним атомом .
Мы увидим, как эта идея выражается снова и снова в ходе нашего исследования органической реакционной способности во многих различных контекстах. Пока это понятие применяется только к влиянию радиуса атома на стабильность аниона. Поскольку фторид является наименее стабильным (наиболее основным) из галогенидных конъюгированных оснований, HF является наименее кислой из галогенкислот, лишь немного сильнее, чем уксусная кислота. HI, с pK и около -9, является одной из самых сильных известных кислот.
Что еще более важно для изучения биологической органической химии, эта тенденция говорит нам о том, что тиолы более кислые, чем спирты.Например, pK a тиоловой группы в боковой цепи цистеина составляет приблизительно 8,3, в то время как pK a для гидроксила в боковой цепи серина составляет порядка 17.
Еще раз повторю: сила кислоты увеличивается по мере того, как мы перемещаемся вправо по строке периодической таблицы и по мере того, как мы движемся вниз по столбцу.
| Пример 7,6 |
|---|
Изобразите структуру основания конъюгата, которое образовалось бы, если бы указанное ниже соединение реагировало с 1 молярным эквивалентом гидроксида натрия: Решение |
Эффект резонанса
В предыдущем разделе мы сосредоточили наше внимание на периодических тенденциях — различиях в кислотности и основности между группами, в которых обменный протон был связан с разными элементами.Теперь пришло время подумать о том, как структура различных органических групп влияет на их относительную кислотность или основность, даже когда мы говорим об одном и том же элементе, действующем как донор / акцептор протонов. Первая модельная пара, которую мы рассмотрим, — это этанол и уксусная кислота, но сделанные нами выводы будут одинаково справедливы для всех групп спирта и карбоновых кислот.
Несмотря на то, что обе являются кислородными кислотами, значения pK a этанола и уксусной кислоты сильно различаются.Что делает карбоновую кислоту более кислой, чем спирт? Как и раньше, начнем с рассмотрения сопряженных оснований.
У обоих видов отрицательный заряд конъюгированного основания удерживается кислородом, поэтому периодические тенденции не могут быть вызваны. Однако для уксусной кислоты есть ключевое различие: можно нарисовать резонансный вклад, в котором отрицательный заряд локализован на втором кислороде группы. Две резонансные формы для сопряженного основания равны по энергии в соответствии с нашими «правилами резонанса».Как вы помните, это означает, что отрицательный заряд ацетат-иона не находится ни на одном, ни на другом кислороде: скорее, он распределяется между ними двумя. Химики используют термин «делокализация заряда» для описания этой ситуации. В этоксид-ионе, напротив, отрицательный заряд «заблокирован» на единственном кислороде — ему больше некуда деваться.
А теперь пора вспомнить утверждение из предыдущего раздела, которое было настолько важным, что оно было напечатано жирным шрифтом в отдельном абзаце — на самом деле, это настолько важно, что мы просто скажем это еще раз: «Электростатические заряды , будь то положительные или отрицательные, более стабильны, когда они «растянуты», чем когда они ограничены одним атомом.«Теперь мы видим эту концепцию в другом контексте, где заряд« распространяется »(другими словами, делокализуется) за счет резонанса , а не просто из-за размера задействованного атома.
Делокализация заряда за счет резонанса оказывает очень сильное влияние на реакционную способность органических молекул, достаточное для того, чтобы учесть разницу более чем в 12 pK a единиц между этанолом и уксусной кислотой (и помните, pK a — это логарифмическое выражение , поэтому мы говорим о разнице между константами кислотности двух молекул более чем на 10 12 ).Ацетат-ион намного более стабилен, чем этоксид-ион, все из-за эффектов резонансной делокализации.
Эффект резонанса также хорошо объясняет, почему атом азота является основным, когда он находится в амине, но , а не основным, когда он является частью амидной группы. Напомним, что в амиде существует значительный характер двойной связи углерод-азотной связи из-за второго резонансного фактора, в котором неподеленная пара азота является частью p-связи.
В то время как неподеленная электронная пара аминного азота «застревает» в одном месте, неподеленная пара на амидном азоте делокализована в результате резонанса.Обратите внимание, что в этом случае мы расширяем наше центральное утверждение, чтобы сказать, что плотность электронов — в форме неподеленной пары — стабилизируется за счет резонансной делокализации, даже если здесь нет отрицательного заряда. Вот еще один способ подумать об этом: неподеленная пара на амидном азоте недоступна для связывания с протоном — эти два электрона слишком «удобны», будучи частью делокализованной системы пи-связывания. Напротив, неподеленная пара на аминном азоте не является частью делокализованной p-системы и очень готова к образованию связи с любым кислотным протоном, который может находиться поблизости.
Часто требуется тщательное размышление, чтобы предсказать наиболее кислый протон в молекуле. Аскорбиновая кислота, также известная как витамин С, имеет pK — , равное 4,1.
В этой молекуле четыре гидроксильные группы — какая из них наиболее кислая? Если мы рассмотрим все четыре возможных сопряженных основания, мы обнаружим, что есть только одно, для которого мы можем делокализовать отрицательный заряд по двум атомам кислорода.
| Пример 7.7 |
|---|
Расположите перечисленные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Индуктивный эффект
Сравните значения pK a для уксусной кислоты и ее моно-, ди- и трихлорированных производных:
Присутствие хлоринов явно увеличивает кислотность группы карбоновой кислоты, но аргумент здесь не имеет отношения к резонансной делокализации, потому что для хлорированных молекул нельзя выделить дополнительные резонансные составляющие.Скорее, объяснение этого явления связано с так называемым индуктивным эффектом . Атом хлора более электроотрицателен, чем водород, и, таким образом, способен «индуцировать» или «притягивать» электронную плотность к себе, от карбоксилатной группы. Фактически, атомы хлора способствуют дальнейшему расширению электронной плотности сопряженного основания, что, как мы знаем, имеет стабилизирующий эффект. В этом контексте заместитель хлора называется электроноакцепторной группой .Обратите внимание, что эффект понижения pK a для каждого атома хлора, хотя и значительный, не так драматичен, как эффект делокализационного резонанса, проиллюстрированный разницей в значениях pK a между спиртом и карбоновой кислотой. В общем, резонансные эффекты более мощные, чем индуктивные эффекты .
Индуктивный электроноакцепторный эффект хлора осуществляется за счет ковалентных связей, и его влияние заметно уменьшается с расстоянием — таким образом, хлор на два атома углерода от группы карбоновой кислоты оказывает меньшее влияние по сравнению с хлором, находящимся на расстоянии одного атома углерода.
| Пример |
|---|
Расположите перечисленные ниже соединения от наиболее кислых до наименее кислых и объясните свои рассуждения. Решение |
Кислоты и основания
Кислоты, основания и шкала pHТермины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно.Кислые вещи кислые на вкус. Обычные или щелочные вещества имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания — едкие; оба могут вызвать серьезные повреждения кожи, похожие на ожог. Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислым или основным? Следующее уравнение — хорошее место для начала:
2 H 2 O & Равновесие; 1 H 3 O + + 1 OH —Начнем с двух молекул воды и переместим несколько атомов водорода.Одна молекула воды приобретает водород и, следовательно, принимает положительный заряд, в то время как другая молекула воды теряет атом водорода и, следовательно, становится отрицательно заряженной. H 3 O + называется ионом гидроксония, и он делает вещи кислыми. OH — называется гидроксил-ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; это нейтрально.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксоний и гидроксилы не сбалансированы.Если положительно заряженных гидроксониев больше, чем отрицательно заряженных гидроксилов, то вещество кислое. Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксониев, то вещество становится основным. pH фактически означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + как сокращение от H 3 O + , и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они действительно имеют в виду только H + и не H 3 O + .Следите за этим и попросите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония. Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 COOH. При растворении в воде он превращается в CH 3 COO — и H + . Ионы H + соединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым.Теперь давайте посмотрим на щелок, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, он диссоциирует на Na + и OH — . Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания такие противные? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы восстановить баланс, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы восстановить баланс.Это заставляет их очень быстро реагировать на все, с чем они контактируют. Когда положительные и отрицательные стороны равны, они нейтрализуют друг друга.
Что такое pH ?: pH — это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и является примерно отрицательным из десятичного логарифма молярной концентрации ионов водорода, поэтому pH = -log 10 [H + ]
Шкала pH — это показатель кислотности по 14-балльной шкале, где 7 — нейтральная средняя точка.pH представляет собой логарифмическую шкалу (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6. Вы можете купить электронные pH-метры или pH-индикатор. бумага от любой биологической или лабораторной компании-поставщика, которая может быть использована для точного измерения кислотного или основного качества веществ, которые вы хотите проверить. Попробуйте это моделирование, чтобы определить pH некоторых распространенных веществ.
Дополнительный мини-эксперимент : Сделайте свой собственный индикатор pH, используя сок красной капусты.Смешайте 2 стакана нарезанных листьев красной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными. Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость изменит цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капустного сока примерно к 1 столовой ложке исследуемого вещества.Какого цвета капустный сок превращается в кислоту, такую как белый уксус? Какого цвета капустный сок превращается в основу, такую как пищевая сода и водный раствор?
Проверьте pH различных веществ и создайте соответствующую цветовую шкалу pH. Сравните свои результаты с таблицей здесь.
Вы также можете сделать индикаторную бумагу, окунув полоски белого бумажного полотенца, кофейные фильтры или белый картон в капустный сок до пурпурного цвета. Когда фиолетовые полоски высохнут, используйте зубочистку, соломинку с содой или пипетку, чтобы нанести на полоски каплю тестового раствора.Как результаты соотносятся с вашей диаграммой pH?
ROCO Кислотно-Основное: наиболее кислотное H
Лучше всего работает методический подход. Проще говоря, вы должны сканировать молекулу на наличие кислотных функциональных групп, а затем ранжировать реакционную способность этих групп. Наиболее кислая функциональная группа обычно содержит наиболее кислый Н во всей молекуле.
«Сканирование и ранжирование» звучит просто, но скрывает несколько трудностей, которые подробно описаны ниже.
Сканировать молекулу на предмет известных кислотных функциональных групп
Кислые протоны обычно связаны с O или N. Поэтому первым шагом является поиск всех связей OH и NH.
Однако, когда вы обнаружите связи ОН и NH, вам нужно будет решить, следует ли объединить эти связанные атомы в функциональную группу с соседними атомами.
ЕДИНСТВЕННЫЙ удобный метод определения функциональной группы — это уже знать около .Например, если вы знаете, что ROH, RCO2H и RSO3H являются обычными кислотными функциональными группами, вам не составит труда найти кислотные группы в следующей молекуле (правильные группы отмечены красным).
Раздельная кислотность OH и NH
Значения pKa обычных кислот OH и NH охватывают широкий диапазон, и их диапазоны перекрываются. Ранжирование происходит быстрее, если вы ранжируете кислоты OH и NH по отдельности, а затем сравниваете лучших кандидатов в каждой категории.
Самый удобный метод ранжирования кислотных групп — это заранее знать их характерные значения pKa. Если вам известны эти значения для всех кислотных групп в вашей молекуле, то группа с наименьшим pKa содержит наиболее кислый H. Дело закрыто.
Если вы не помните значения pKa для всех кислотных групп, вы можете руководствоваться несколькими общими принципами.
# 1 Важность — положительно заряженные кислоты сильнее нейтральных кислот.Отрицательно заряженные кислоты редко бывают кислыми. Если вы сравните значения pKa обычных кислот OH, вы увидите, что кислоты ROh3 + (включая h4O + и R2OH +) значительно сильнее нейтральных кислот, таких как RCO2H, PhOH и ROH. Единственные нейтральные кислоты, которые сильнее, чем ROh3 +, — это h3SO4 и некоторые другие RSO3H.
Формальное правило заряда еще более строго применяется к NH кислотам. Разница в pKa между h4O + и h3O составляет 18 единиц, в то время как разница в pKa между Nh5 + и Nh4 составляет гигантские 26 единиц.
# 2 Важность — ищите активирующие группы, включая RSO2, RC = O и Ph. На следующей диаграмме показано, как каждая группа атомов активирует кислоту ОН (значения pKa варьируются от 16 до -2):
Ch4 считается группой зрителей , где бы он ни появлялся в этих молекулах. Он неполярен, не оказывает значительного индуктивного эффекта и не способен делокализовать заряд. Следовательно, можно заменить Ch4 другими группами зрителей (например, H и другими R), не сильно влияя на реактивность.
Следует сделать два дополнительных замечания относительно активации групп.
Во-первых, группы оказывают аналогичное действие на NH-кислоты (и активирующая последовательность одинакова: RSO2> RC = O> Ph). Как оказалось, вам нужно только изучить влияние Ph на NH + для этого курса:
Во-вторых, активирующие группы должны быть связаны непосредственно с группой ОН (или NH), чтобы активировать ее. Следующие соединения имеют аналогичные значения pKa, поскольку активирующие группы не связаны напрямую с ОН: Ch4C (= O) Ch3OH, PhCh3OH и Ch4Ch3OH.
# 3 Важность — при прочих равных, кислота OH более кислая, чем кислота NH. Этот принцип может быть очень полезным при правильном использовании. Меня беспокоит, что вы понимаете, что подразумевается под «все равны». Это означает, что O и N должны иметь одинаковый формальный заряд (элемент №1) и должны быть связаны с одной и той же активирующей группой (элемент №2). Однако различия в зрительских группах значения не имеют.
Некоторые допустимые сравнения включают:
# 4 Важность — в категории функциональной группы используйте эффекты заместителей для сравнения кислот. Электроотрицательные заместители обычно повышают кислотность функциональной группы за счет комбинации полевого и индуктивного эффектов. Эти эффекты усиливаются, когда 1) заместитель расположен ближе к кислотной группе и 2) имеется несколько заместителей. Учитывая эти принципы, мы ожидаем, что кислотность этих карбоновых кислот будет соответствовать следующей тенденции:
Задачи обзора
строится
Кислотность и щелочность
от Тима Лофтуса
Уровень кислотности в сточных водах указывает на ее коррозионные свойства и может играть ведущую роль в регулировании биологических процессов, а также в химические реакции (например, химическая коагуляция и флокуляция). Щелочность тоже влияет на свойства сточных вод, многие из которых также влияют на биологические процессы (например, нитрификацию) и химические реакции.
Хотя и кислотность, и щелочность связаны с pH , они не должны следует путать с pH, и эти термины не должны использоваться взаимозаменяемо. Кислотность — это мера способности раствора реагировать с сильным основанием (обычно натрием гидроксид, NaOH) до заданного значения pH. Это измерение основано на общая кислотная составляющая раствора (сильные и слабые кислоты, гидролизующие соли, и т.п.) Возможна очень кислая вода, но при умеренных значениях pH. Точно так же pH образца может быть очень низким, но иметь относительно низкую кислотность. Кислотность похожа на буфер в том смысле, что чем выше кислотность, тем больше нейтрализатор необходим, чтобы противодействовать этому.
Щелочность — это мера способности раствора реагировать с сильная кислота (обычно серная кислота h3SO4) до заданного pH. Щелочность раствора обычно состоит из карбоната, бикарбоната и гидроксидов.Как и в случае с кислотностью, чем выше щелочность, тем больше нейтрализующего агента. необходимо было противодействовать этому. В целом очистное сооружение и система его сбора лучше работает со сточными водами с более низкой кислотностью и более высокой щелочностью.
Согласно рекомендациям EPA по отбору и хранению образцов, образцы для обоих измерения кислотности и щелочности можно проводить в стеклянных или пластиковых бутылках и хранится при 4 градусах Цельсия до четырнадцати дней. Однако образец обработка, вероятно, играет гораздо более важную роль в сохранении целостности образца.Кислотность и щелочность сильно зависят от воздействия Атмосфера. Большая площадь поверхности или длительное время контакта с атмосферой, оба в контейнере для образца и во время анализа может растворять газы в образец или позволить растворенным газам, уже находящимся в образце, уйти, тем самым изменение размеров. При отборе проб на кислотность и щелочность лучше всего чтобы не оставлять свободного места в контейнере. Кроме того, не фильтруйте образец (который создает сильную турбулентность) или оставьте в открытом стакане на лабораторном столе на несколько часов.Вылейте аликвоту непосредственно перед анализом, чтобы свести к минимуму воздействие воздуха. Во время анализа сводите турбулентность перемешивания к минимуму. Эти меры особенно важно при определении низких уровней кислотности или щелочность.
Каждый анализ кислотности и щелочности состоит из простого титрования. Обычно кислотность определяется титрованием образца гидроксидом натрия. до pH 8,3 (часто называемой кислотностью фенолфталеина, этот термин восходит к ко времени перед электронными pH-метрами).Щелочность определяется титрованием. серной кислотой до pH 4,5. Хотя эти конечные значения pH являются обычными для ситуации со сточными водами, в зависимости от конкретного теста часто используются другие конечные точки или условия образца. Кроме того, поскольку кислотность и щелочность не анализируются для конкретных химикатов, а скорее представляют собой конкретные свойства раствора, его размеры приравниваются к эквивалентному количеству карбоната кальция. Это сделано для того, чтобы измерения разных образцов можно было сравнивать с каждым. Другие.Поэтому всегда сообщайте измерения кислотности и щелочности как ___ мг. CaCO3 / л до pH ___. Математические формулы для расчета кислотности и щелочность, а также описание некоторых случаев, когда образец предварительная обработка необходима, ее можно найти в Стандартных методах .
В заключение, тестирование кислотности и щелочности выполнить легко. И с тщательный отбор проб вы будете далеко на пути к точному мониторингу эффективность борьбы с коррозией бытовой воды в ваших районах, мониторинг часть процесса нитрификации в активном иле на вашем предприятии или даже устранение неполадок в процессе добавления химикатов для удаления фосфора в конечный сток.
Рекомендации в этой статье по анализу кислотности и щелочности: очень общий. Всегда проверяйте свои государственные и местные правила. Ты можешь иметь дополнительные требования для удовлетворения.
Если у вас есть вопросы, предложения или комментарии, обращайтесь в LPC. Председатель Пол Фитцгиббонс: (401) 222-6780 доб.118 ( [email protected] ) или Тим Лофтус по телефону (508) 949-3865 ( [email protected] ). Вы также можете посетить наш веб-сайт по адресу newea.org. Оказавшись на сайте, нажмите Lab Кнопка практики.
| Качество воды и pH часто упоминаются в одном предложении. PH — очень важный фактор, потому что определенные химические процессы могут происходить только тогда, когда вода имеет определенный pH. Например, реакции с хлором происходят только тогда, когда значение pH составляет от 6,5 до 8. pH является показателем кислотности вещества. Он определяется количеством свободных ионов водорода (H +) в веществе.
Методы определения pH Есть несколько различных методов измерения pH. Один из них — использовать кусок индикаторной бумаги pH. Когда бумага погружается в раствор, она меняет цвет. Каждый разный цвет указывает на разное значение pH.Этот метод не очень точен и не подходит для определения более точных значений pH. Вот почему сейчас доступны тестовые наборы, которые могут определять меньшие значения pH, такие как 3,5 или 8,5. pH-электродpH-электрод — это трубка, достаточно маленькая, чтобы помещать ее в сосуды для образцов.Он привязан к pH-метру с помощью кабеля. Внутри электрода находится жидкость особого типа; обычно это «3M Kalium Chlorine». Некоторые электроды содержат гель, который имеет те же свойства, что и жидкость 3M. В жидкости есть серебряные и платиновые провода. Система довольно хрупкая, поскольку содержит небольшую мембрану. Ионы H + и OH- войдут в электрод через эту мембрану. Ионы будут создавать слегка положительный заряд и слегка отрицательный заряд на каждом конце электрода.Потенциал зарядов определяет количество ионов H + и OH-, и когда это определено, pH будет отображаться в цифровом виде на pH-метре. Потенциал зависит от температуры раствора. Вот почему температура также отображается на pH-метре. Кислоты и основания Когда кислоты попадают в воду, ионы разделяются. Например, хлористый водород разделится на ионы водорода и хлора (HCL à H + + CL-). Здесь мы суммировали список продуктов и их pH:
|
Как кислотная и основная структура влияют на значения pH и pKa — стенограмма видео и урока
Resonance
Кислоты находятся в равновесии с их сопряженным основанием.Сила кислоты (pKa) зависит от стабильности основания. Когда протон покидает кислоту, он оставляет позади свои электроны. Они суперотрицательны, и на сопряженной основе есть большой отрицательный заряд.
Вы знаете, что если есть концентрированный отрицательный заряд, то база не очень устойчива. Однако если заряд можно распределить, то основание более стабильно, а значит, у нас более сильная кислота. Если в молекуле есть электроны, которые распределены более чем по одной связи, она имеет резонанс .
Итак, у кого, по вашему мнению, более низкий pKa: пропанол или пропановая кислота?
Если вы выбрали пропановую кислоту, вы правы! Когда пропановая кислота теряет протон, две молекулы кислорода разделяют отрицательный заряд, создавая резонанс и, следовательно, стабилизируя основание и создавая сильную кислоту. Когда пропанол теряет протон, резонанса нет.
Размер атома
Помните, более сильная кислота имеет более стабильное основание.Одна вещь, которая влияет на стабильность основания, — это размер иона. Ион большего размера лучше переносит отрицательный заряд. Представьте, что у заряда есть больше «места» для распространения.
К счастью, мы можем использовать периодические тренды, чтобы предсказать размер иона. Это означает, что мы можем предсказать более стабильное основание и, следовательно, более сильную кислоту. Размер иона увеличивается по мере продвижения сверху вниз по столбцу периодической таблицы. (Размер иона также увеличивается справа налево, но это не влияет на стабильность базы из-за электроотрицательности, о которой мы поговорим чуть позже).
Итак, у кого есть низший pka, соляная кислота (HCl) или бромистоводородная кислота (HBr)?
Если вы ответили на вопрос о бромистоводородной кислоте, то вы правы! Br- больше, чем Cl-. Это означает, что Br- более стабильное основание, поэтому HBr — более сильная кислота. PKa HBr составляет -9, а pKa HCl составляет -7.
Электроотрицательность
Помните, что электроотрицательность — это способность атома притягивать электроны.Электроотрицательность увеличивается по мере продвижения слева направо по строке периодической таблицы. Он также увеличивается по мере продвижения вверх по столбцу, но размер атома больше влияет на кислотность. Представьте себе это как бой. Электроотрицательность «выигрывает» по горизонтали в периодической таблице, в то время как размер атома «выигрывает» по вертикали.
Если атом очень электроотрицателен, он может вместить лишние электроны, которые остаются, когда кислота теряет протон. Поэтому база более устойчивая.
Итак, какая кислота HCl или h3S более сильная?
Если вы выбрали HCl, вы правы! Cl более электроотрицателен, чем S, поэтому он «счастливее», когда у него есть дополнительные электроны по сравнению с S. Итак, Cl- более стабильное основание, а HCl — более сильная кислота.
Индуктивный эффект
Знаете ли вы, что когда электроотрицательный атом присоединяется близко к кислому водороду, это может повлиять на pKa? Электроотрицательный атом забирает электронную плотность, помогая стабилизировать отрицательный заряд, который остается после удаления протона.Это означает, что основание будет более стабильным и приведет к более сильной кислоте.
Какая кислота сильнее: бромуксусная кислота или хлоруксусная кислота?
Если вы выбрали хлоруксусную кислоту, вы правы! Хлор более электроотрицателен, чем бром, поэтому он поглощает больше электронной плотности, стабилизируя сопряженное основание кислоты.
Чем ближе электроотрицательный атом к кислому водороду, тем больше он поглощает электронную плотность, что приводит к более сильной кислоте.
Краткое содержание урока
Молекулярную структуру можно использовать для прогнозирования кислотности соединения. pH раствора зависит от концентрации кислоты. pKa описывает, сколько кислотных ионов вещество будет производить в растворе, или, в нашем случае, указывает, сколько протонов диссоциирует с образованием ионов гидроксония. Чем ниже pKa, тем сильнее кислота. Несколько структурных элементов молекулы могут влиять на pKa, включая:
- Резонанс — Если в молекуле есть электроны, которые распределены более чем по одной связи (если молекула имеет резонанс), она будет иметь более низкую pKa по сравнению с молекулой, которая не.
- Размер атома — По мере того, как размер атома увеличивается вниз по столбцу в периодической таблице, кислотность увеличивается.
- Электроотрицательность — Способность атома притягивать электроны. По мере того как электроотрицательность атома увеличивается слева направо по строке, кислотность увеличивается.

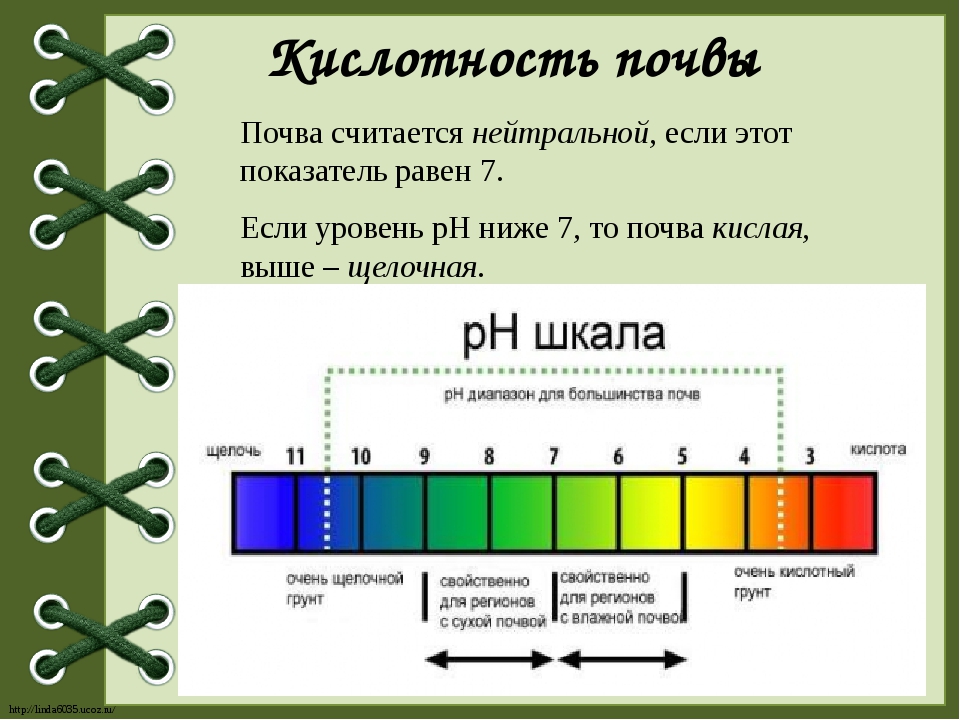


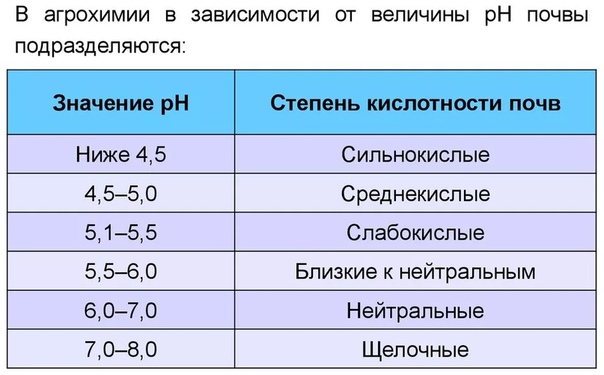
 Этот объем рассчитан на 1м2 садового участка;
Этот объем рассчитан на 1м2 садового участка;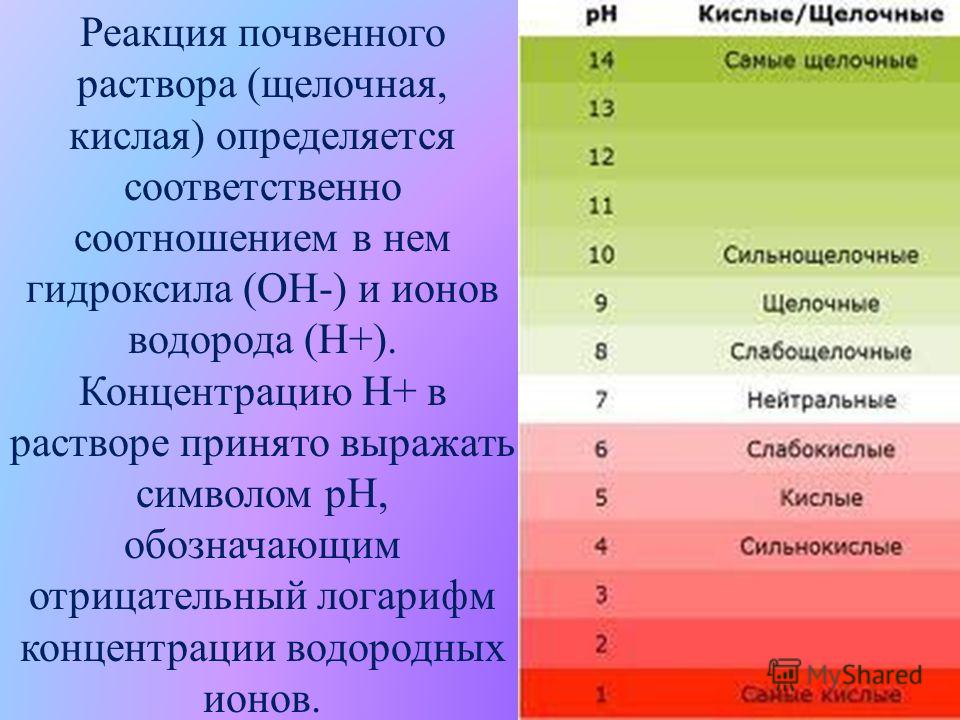 Не нужно полагать индикаторами кислотности травы, встречающиеся на участке в малом количестве или единично. Их семена могли быть занесены случайно. Ориентироваться следует по преобладающим видам.
Не нужно полагать индикаторами кислотности травы, встречающиеся на участке в малом количестве или единично. Их семена могли быть занесены случайно. Ориентироваться следует по преобладающим видам.
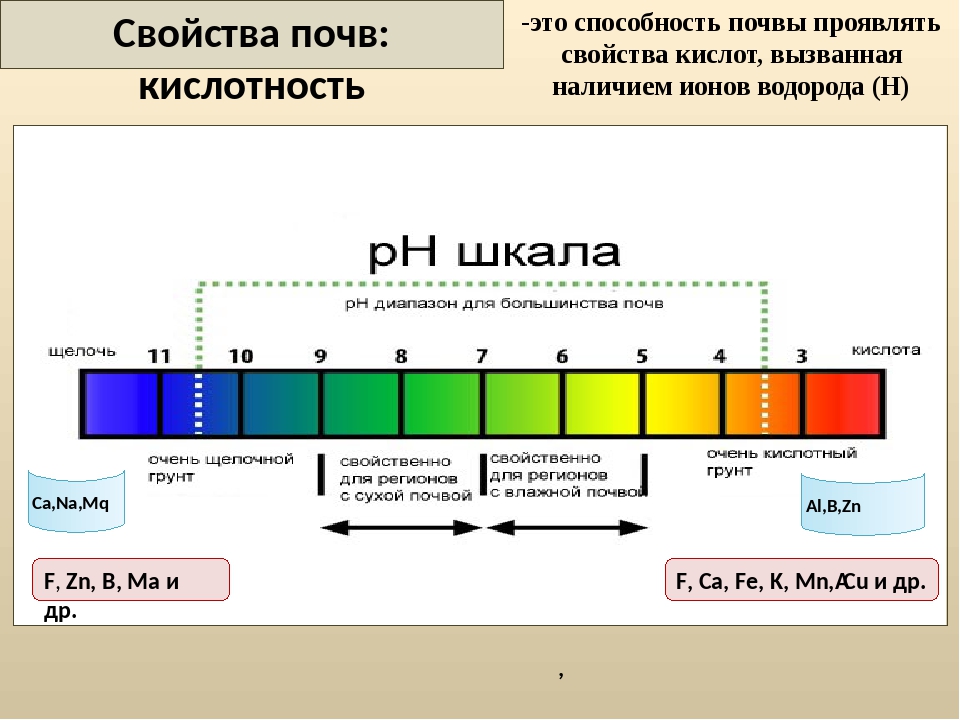

 Хорошо уменьшает кислотность почвы посев фацелии, люпина, вики, люцерны, донника.
Хорошо уменьшает кислотность почвы посев фацелии, люпина, вики, люцерны, донника. В том случае, если эти ощущения будут отсутствовать, то это будет означать, что уровень кислотности в норме. Если же имеется желание употребить яблочный сок или другой кислый продукт, значит, она сильно понижена.
В том случае, если эти ощущения будут отсутствовать, то это будет означать, что уровень кислотности в норме. Если же имеется желание употребить яблочный сок или другой кислый продукт, значит, она сильно понижена.