Гастрит, ассоциированный с Helicobacter pylori (гистологический профиль)
Метод определения- гистологическое исследование с окрашиванием гематоксилином-эозином;
- гистохимическое исследование с окрашиванием по Гимзе.
Исследуемый материал Смотрите в описании
Helicobacter pylori (H. pylori) – бактерия, обитающая в слизи, покрывающей слизистую оболочку желудка. Инфицирование человека H. pylori широко распространено. По оценкам эпидемиологов, присутствие этой бактерии в желудке можно обнаружить примерно у половины населения планеты, а в некоторых регионах у 80–100% популяции. Заражение обычно происходит в детстве и сохраняется пожизненно. В большинстве случаев наличие H. pylori не вызывает проблем, но у некоторых людей в ответ на инфекцию развивается локальное воспаление, которое проявляется как гастрит или дуоденит.
Примерно у 15% людей, инфицированных H. pylori, развивается язвенная болезнь желудка или двенадцатиперстной кишки. Реже хроническое воспаление, связанное с инфекцией H. pylori, приводит к атрофии слизистой оболочки (атрофическому гастриту) – состоянию, связанному с риском развития рака желудка. Вероятность развития таких угрожающих состояний зависит от штамма H. pylori и факторов его вирулентности, индивидуальных особенностей организма и характера реакций на присутствие H. pylori, влияния условий жизни, в частности, диеты. Данную инфекцию успешно элиминируют (эрадикация H. pylori), но это не исключает вероятность повторного инфицирования в будущем. Вопрос о необходимости эрадикации H. pylori решается индивидуально. Тактика врача во многом зависит от клинических проявлений инфекции и, что особенно важно, наличия патологических изменений в слизистой оболочке желудка и двенадцатиперстной кишки.
Существуют различные способы диагностики инфекции H. pylori и разные способы оценки состояния слизистой оболочки желудка.
Методы выявления инфекции H. pylori можно разделить на прямые и непрямые, инвазивные (требующие проведения биопсии) и неинвазивные.
Прямые – непосредственное микробиологическое выявление возбудителя в культуре (в рутинной практике не используется), выявление H. pylori и оценка степени обсемененности H. рylori в желудочной слизи при гистохимическом исследовании биопсийного материала (№516), выявление ДНК возбудителя в исследуемом материале методом ПЦР, выявление антигенов возбудителя в кале (№484). Непрямые – диагностика инфекции H. pylori по наличию специфических иммунных антител к этому возбудителю в крови (№№133, 176, 177, 258, 259), по продуктам метаболизма H. pylori в уреазном дыхательном тесте. Инвазивные – гистологическое (№511) и гистохимическое (№516) исследование. Неинвазивные – дыхательный тест на продукты метаболизма H. pylori*, анализ кала на антиген H. pylori (№484), анализ крови на антитела к H. pylori (№№133, 176, 177, 258, 259). Инвазивные – гистологическое исследование (№511).
Неинвазивные – например, анализ крови (профиль «Гастропанель», пепсиногены I/II с расчетом соотношения №2111).
Прямые – гистологическое исследование морфологии слизистой оболочки желудка в биопсийных препаратах (№511).
Непрямые – оценка состояния слизистой оболочки желудка по косвенным показателям, связанным с ее функциями (профиль «Гастропанель», пепсиногены с расчетом соотношения в тесте №2111).
Инвазивные – гистологическое исследование (№511).
Неинвазивные – например, анализ крови (профиль «Гастропанель», пепсиногены I/II с расчетом соотношения №2111).
Прямые – гистологическое исследование морфологии слизистой оболочки желудка в биопсийных препаратах (№511).
Непрямые – оценка состояния слизистой оболочки желудка по косвенным показателям, связанным с ее функциями (профиль «Гастропанель», пепсиногены с расчетом соотношения в тесте №2111).
В гистологической дифференциальной диагностике заболеваний слизистой оболочки желудка принято использовать новую международную морфологическую классификацию – OLGA (Operative Link for Gastritis Assessment) – оперативную систему оценки гастритов. Международной группой исследователей и экспертов предложена система стадийной оценки для описания желудочной патологии. Эта классификация позволяет оценивать хронические гастриты в зависимости от риска развития предопухолевых изменений и рака желудка. Согласно классификации OLGA гастриты подразделяются на 4 стадии (от 0 до IV) – по степени риска развития рака желудка, а также на 4 степени (от 0 до IV) – по степени выраженности воспалительных изменений и/или наличию инфильтратов. Данная классификация учитывает стадию гастрита в сочетании с Н.pylori-статусом, диагноз должен быть подтвержден общеклинической информацией (жалобы, анамнез, дополнительные исследования: КТ, МРТ, ПЭТ, УЗИ).
*Тест пока недоступен к заказу в ИНВИТРО; в настоящее время инициирован процесс регистрации в Министерстве Здравоохранения РФ.
Материал для исследования:
Биоптат/биоптаты слизистой оболочки желудка и двенадцатиперстной кишки, помещённые в специализированный гистологический контейнер/контейнеры с фиксирующим раствором (10% забуференным раствором формалина). Количество биоптатов определяет врач-эндоскопист. Если биоптаты взяты из нескольких анатомических локализаций, фиксация должна проводиться в разных контейнерах, которые должны быть соответствующим образом маркированы, с указанием локализации биоптата.
Новые европейские рекомендации по ведению пациентов с предраковыми изменениями в желудке
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Журнал «Медицинский совет» № 3, 2019
DOI: https://doi.org/10.21518/2079-701X-2019-3-44-47
В.В. Цуканов, д.м.н., профессор, заведующий клиническим отделением патологии пищеварительной систем, А.
Цель обзора: проанализировать современные аспекты тактики ведения пациентов с предраковыми изменениями в желудке, изложенные в новых европейских рекомендациях MAPS II.
Основные положения. Для квалифицированной диагностики предраковых изменений в желудке необходимо применение современных эндоскопических и морфологических методов. Своевременное выявление атрофии, метаплазии и дисплазии значительно повышает эффективность предупреждения рака желудка. Эрадикация инфекции Helicobacter pylori является важным принципом ведения больных с предраковыми изменениями в желудке.
Своевременное выявление атрофии, метаплазии и дисплазии значительно повышает эффективность предупреждения рака желудка. Эрадикация инфекции Helicobacter pylori является важным принципом ведения больных с предраковыми изменениями в желудке.
Заключение. В соответствии с европейскими рекомендациями, своевременная диагностика, адекватное лечение и последующее наблюдение пациентов с предраковыми изменениями желудка играют важную роль в профилактике рака желудка. Применение таких принципов в ежедневной клинической практике позволит стандартизировать подход к ведению пациентов с предопухолевой патологией.
New European guidelines for the management of patients with precancerous changes in the stomach
Vladislav V. Tsukanov, Dr. of Sci. (Med), Professor, Head of the Clinical Department of Pathology, Alexander V. Vasyutin, Cand. of Sci. (Med.), Senior Researcher at the Clinical Department of Pathology,
 Tonkih, Cand. of Sci. (Med.), Leading Researcher of the Clinical Department of Pathology, Olga V. Peretatko, Cand. of Sci. (Med.), Researcher of the Clinical Department of Pathology, Research Institute for Medical Problems in the North — Division of Federal Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS»
Tonkih, Cand. of Sci. (Med.), Leading Researcher of the Clinical Department of Pathology, Olga V. Peretatko, Cand. of Sci. (Med.), Researcher of the Clinical Department of Pathology, Research Institute for Medical Problems in the North — Division of Federal Research Center «Krasnoyarsk Scientific Center of the Siberian Branch of the RAS»Aim of the review: to analyze the current aspects of the management of patients with precancerous changes in the stomach, as outlined in the new MAPS II European recommendations.
Basic provisions. For qualified diagnosis of precancerous changes in the stomach it is necessary to use modern endoscopic and morphological methods. Timely detection of atrophy, metaplasia and dysplasia significantly increases the effectiveness of gastric cancer prevention. Eradication of Helicobacter pylori infection is an important principle in the management of patients with precancerous changes in the stomach.
Conclusion. According to European recommendations, timely diagnosis, adequate treatment and follow-up of patients with precancerous gastric changes play an important role in the prevention of stomach cancer. The application of such principles in daily clinical practice will allow standardization of the approach to the management of patients with pre-tumor pathology.
Рак желудка в настоящее время находится на четвертом месте в структуре онкологической заболеваемости во всем мире и является одной из ведущих причин смертности от онкологической патологии [1]. Считается, что выявление пациентов с предраковыми изменениями желудка и наблюдение за ними способствует ранней диагностике аденокарциномы и более эффективному лечению [2, 3]. В последнее время эта проблема становится чрезвычайно актуальной в связи с информацией о тенденции к увеличению заболеваемости раком желудка в США [4].
В 2019 г. были опубликованы вторые рекомендации по ведению пациентов с предраковыми состояниями и изменениями желудка (Management of epithelial precancerous conditions and lesions in the stomach – MAPS II) [5]. Следует отметить, что эти рекомендации были созданы тремя группами специалистов: Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (ESMHG) и Европейским обществом патологоанатомов (ESP), что особенно важно для комплексной диагностики патологии желудка.
Следует отметить, что эти рекомендации были созданы тремя группами специалистов: Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (ESMHG) и Европейским обществом патологоанатомов (ESP), что особенно важно для комплексной диагностики патологии желудка.
Положение 1 MAPS II. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией находятся в группе риска развития аденокарциномы желудка.
Это известное положение было подтверждено также 5-м Маастрихтским консенсусом в 2016 г. [6] и Киотским консенсусом по гастриту [7].
Положение 2 MAPS II. Гистологически подтвержденная кишечная метаплазия является наиболее надежным маркером атрофии слизистой оболочки желудка.
Хронический атрофический гастрит и кишечная метаплазия являются предраковыми изменениями, потому что они создают независимый риск развития аденокарциномы желудка [8].
Положение 4 MAPS II. При ведении пациентов с хроническим атрофическим гастритом и кишечной метаплазией развитие дисплазии высокой степени и инвазивный рак желудка должны быть определены как исходы, которые необходимо предотвратить.
Считается, что хронический атрофический гастрит и кишечная метаплазия являются предраковыми состояниями, поскольку они независимо создают риск развития рака желудка и представляют собой фон, на котором могут возникать дисплазия и аденокарцинома. Кишечная метаплазия считается ключевым биомаркером предраковых поражений и часто рассматривается в качестве «точки невозврата», после которой изменения слизистой желудка становятся необратимыми. Дисплазия слизистой оболочки представляет собой предпоследнюю стадию канцерогенеза рака желудка и гистологически определяется как однозначно опухолевый эпителий без признаков тканевой инвазии и, таким образом, является прямым предраковым поражением [9]. Правильная диагностика и стадирование дисплазии имеют решающее значение, потому что предопределяют риск злокачественного перерождения.
Положение 6 MAPS II. Эндоскопия высокой четкости с хромоэндоскопией лучше, чем только эндоскопия высокой четкости для диагностики предраковых состояний желудка и ранних опухолевых поражений.
В современном метаанализе, включающем 10 исследований, 699 пациентов и 902 поражения, объединенная чувствительность, специфичность и площадь под кривой хромоэндоскопии составляли 0,90 (95% доверительный интервал (ДИ) 0,87-0,92), 0,82 (95% ДИ 0,79–0,86) и 0,95 соответственно. Эти результаты были значительно лучше, чем у обычной эндоскопии [10]. Тем не менее хромоэндоскопия с красителем является сложным методом и значительно удлиняет процедуру исследования.
Положение 10 MAPS II. Системы для гистологического определения стадии гастрита (например, OLGA и OLGIM) могут использоваться для идентификации пациентов с поздними стадиями атрофического гастрита.
В 2008 г. международной группой гастроэнтерологов и морфологов была предложена новая система стадирования атрофического гастрита OLGA («Operative Link for Gastritis Assessment»). Эта система суммирует показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III, IV стадии выраженности атрофического гастрита по системе OLGA свидетельствует о высокой вероятности развития рака желудка [11]. На основании классификации OLGA была разработана модификация OLGIM, основанная на оценке кишечной метаплазии [12].
Эта система суммирует показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III, IV стадии выраженности атрофического гастрита по системе OLGA свидетельствует о высокой вероятности развития рака желудка [11]. На основании классификации OLGA была разработана модификация OLGIM, основанная на оценке кишечной метаплазии [12].
Положение 11 MAPS II. Низкие уровни пепсиногена I в сыворотке и/или низкое соотношение пепсиногенов I/II выявляют пациентов с продвинутыми стадиями атрофического гастрита, и для этих пациентов рекомендуется эндоскопия, особенно если серологический тест на H. pylori отрицательный.
Как было указано в MAPS I [13], низкий уровень пепсиногена I в сыворотке, низкое соотношение пепсиногена I/II или оба являются хорошими показателями атрофических изменений слизистой оболочки желудка. Работы, опубликованные после MAPS I, подтверждают, что уровни пепсиногенов являются предикторами атрофического гастрита и риска развития рака желудка. Метаанализ 2015 года по тестам на пепсиноген при раке желудка и атрофическом гастрите позволил получить высокую корреляцию между снижением уровня пепсиногена в сыворотке и атрофией. Суммарная чувствительность и суммарная специфичность диагностики рака желудка составили 0,69 (95% ДИ 0,60–0,76) и 0,73 (95% ДИ 0,62–0,82) соответственно. Соответствующие значения для диагностики атрофического гастрита были 0,69 (95% ДИ 0,55–0,80) и 0,88 (95% ДИ 0,77–0,94) соответственно. График Фагана показал, что использование уровней пепсиногена в сыворотке крови может улучшить частоту выявления рака желудка и атрофического гастрита [14].
Метаанализ 2015 года по тестам на пепсиноген при раке желудка и атрофическом гастрите позволил получить высокую корреляцию между снижением уровня пепсиногена в сыворотке и атрофией. Суммарная чувствительность и суммарная специфичность диагностики рака желудка составили 0,69 (95% ДИ 0,60–0,76) и 0,73 (95% ДИ 0,62–0,82) соответственно. Соответствующие значения для диагностики атрофического гастрита были 0,69 (95% ДИ 0,55–0,80) и 0,88 (95% ДИ 0,77–0,94) соответственно. График Фагана показал, что использование уровней пепсиногена в сыворотке крови может улучшить частоту выявления рака желудка и атрофического гастрита [14].
Положение 16 MAPS II. У пациентов с кишечной метаплазией в одиночной локализации, но с семейным анамнезом рака желудка или с неполной кишечной метаплазией, можно рекомендовать эндоскопическое наблюдение с хромоэндоскопией и биопсией через 3 года.
Недавнее исследование с последующим 16-летним наблюдением показало, что кишечная метаплазия неполного типа была ассоциирована с более высоким риском развития рака желудка, чем полный тип метаплазии (относительный риск (ОР) = 11,3; 95% ДИ 1,4-91,4) [15]. Эти результаты и данные других исследований показывают, что неполный тип кишечной метаплазии связан с риском прогрессирования заболевания, подобным тому, который приписывают обширной атрофии или семейной истории рака желудка. По этим причинам эта информация может иметь прогностическую ценность и важна для отбора пациентов для диспансерного наблюдения. Родственники первой степени молодых пациентов с раком желудка имеют более высокую частоту атрофического гастрита высокой стадии (стадия III/IV OLGA) и дисплазии, которые, по-видимому, связаны со штаммами H. pylori с высокой вирулентностью и провоспалительными генотипами хозяина, что приводит к повышенному риску развития рака желудка [16].
Эти результаты и данные других исследований показывают, что неполный тип кишечной метаплазии связан с риском прогрессирования заболевания, подобным тому, который приписывают обширной атрофии или семейной истории рака желудка. По этим причинам эта информация может иметь прогностическую ценность и важна для отбора пациентов для диспансерного наблюдения. Родственники первой степени молодых пациентов с раком желудка имеют более высокую частоту атрофического гастрита высокой стадии (стадия III/IV OLGA) и дисплазии, которые, по-видимому, связаны со штаммами H. pylori с высокой вирулентностью и провоспалительными генотипами хозяина, что приводит к повышенному риску развития рака желудка [16].
Положение 17 MAPS II. Пациенты с продвинутыми стадиями атрофического гастрита (тяжелые атрофические изменения или кишечная метаплазия как в антральном отделе, так и в теле желудка, OLGA/OLGIM III/IV) должны проходить высококачественную эндоскопию каждые 3 года.
В целом существует значительно более высокий риск прогрессирования рака у пациентов с дисплазией, кишечной метаплазией и/или атрофией стадии III/IV (OLGA/OLGIM). Поэтому авторы MAPS II рекомендуют эндоскопическое наблюдение за этими пациентами, в идеале с помощью высококачественной эндоскопии. Тем не менее риск рака желудка также увеличивается и у пациентов с менее выраженными стадиями преднеопластических изменений. Основываясь на экспертном мнении, авторы рекомендуют, что пациенты с кишечной метаплазией должны быть повторно осмотрены через 3 года [5].
Поэтому авторы MAPS II рекомендуют эндоскопическое наблюдение за этими пациентами, в идеале с помощью высококачественной эндоскопии. Тем не менее риск рака желудка также увеличивается и у пациентов с менее выраженными стадиями преднеопластических изменений. Основываясь на экспертном мнении, авторы рекомендуют, что пациенты с кишечной метаплазией должны быть повторно осмотрены через 3 года [5].
Положение 20 MAPS II. Эрадикация H. pylori лечит хронический неатрофический гастрит, может привести к регрессии атрофического гастрита и снижает риск рака желудка у пациентов с неатрофическим и атрофическим гастритом, и, следовательно, рекомендуется для пациентов с этими состояниями.
Положение 21 MAPS II. У пациентов с кишечной метаплазией эрадикация H. pylori, по-видимому, не дает обратного развития метаплазии, но уменьшает воспаление и атрофию. В этой связи эрадикация H. pylori у таких больных рекомендуется.
Два метаанализа, которые фокусировались на риске рака желудка после эрадикации H. pylori, показали, что эрадикация H. pylori значительно снижает риск рака желудка у пациентов с хроническим атрофическим или неатрофическим гастритом (ОР=0,64; 95% ДИ 0,48–0,85), но не у пациентов с кишечной метаплазией или дисплазией (ОР=0,88, 95% ДИ 0,59–1,31) [17, 18]. Тем не менее у пациентов с кишечной метаплазией эрадикация H. pylori оказывает благотворное гистологическое действие. В этой связи авторы MAPS II считают, что эрадикацию H. pylori также следует проводить и у пациентов с кишечной метаплазией [5]. Важно отметить, что инфекция H. pylori вызывает и другие заболевания желудка и ДПК, поэтому эрадикация рекомендована в большинстве случаев, помимо наличия предраковых состояний [6, 19].
pylori, показали, что эрадикация H. pylori значительно снижает риск рака желудка у пациентов с хроническим атрофическим или неатрофическим гастритом (ОР=0,64; 95% ДИ 0,48–0,85), но не у пациентов с кишечной метаплазией или дисплазией (ОР=0,88, 95% ДИ 0,59–1,31) [17, 18]. Тем не менее у пациентов с кишечной метаплазией эрадикация H. pylori оказывает благотворное гистологическое действие. В этой связи авторы MAPS II считают, что эрадикацию H. pylori также следует проводить и у пациентов с кишечной метаплазией [5]. Важно отметить, что инфекция H. pylori вызывает и другие заболевания желудка и ДПК, поэтому эрадикация рекомендована в большинстве случаев, помимо наличия предраковых состояний [6, 19].
Положение 22 MAPS II. Эрадикация H. pylori рекомендуется для пациентов с неоплазией желудка после эндоскопической терапии.
Двойное слепое плацебо-контролируемое клиническое исследование 2018 года, в котором участвовало 396 пациентов, убедительно показало, что эрадикация H. pylori снижает риск метахронного рака желудка почти до половины (7% против 13%; ОШ=0,5, 95% ДИ 0,26-0,94) [20].
pylori снижает риск метахронного рака желудка почти до половины (7% против 13%; ОШ=0,5, 95% ДИ 0,26-0,94) [20].
Положение 25 MAPS II. В регионах среднего и высокого риска рака желудка выявление и наблюдение пациентов с предраковыми состояниями желудка является экономически эффективным.
В заключение следует сказать несколько слов об эрадикации H. pylori. Маастрихт 5 [6] и ежегодное итоговое совещание EHMSG, состоявшееся в сентябре 2018 г. в г. Каунас (Литва), пришли к выводу, что преобладающим методом эрадикации H. pylori в настоящее время является четырехкомпонентная терапия [21]. Аналогичный взгляд отстаивают авторы российской части большого европейского наблюдательного исследования, посвященного определению эффективности эрадикации H. pylori [22]. Эта точка зрения в целом поддерживается рекомендациями Российской гастроэнтерологической ассоциации [23]. Оптимальным методом четырехкомпонентной терапии в России является схема: препарат висмута + ингибитор протонной помпы + кларитромицин + амоксициллин, назначаемая на 10—14 дней. Для повышения эффективности терапии первой линии целесообразно преимущественно применять эзомепразол или рабепразол [24].
Для повышения эффективности терапии первой линии целесообразно преимущественно применять эзомепразол или рабепразол [24].
Таким образом, в соответствии с европейскими рекомендациями MAPS II, своевременная диагностика, адекватное лечение и последующее наблюдение пациентов с предраковыми изменениями желудка играют важную роль во вторичной профилактике рака желудка. Применение таких принципов в ежедневной клинической практике позволит стандартизировать подход к ведению пациентов с предопухолевой патологией в России. Одним из оптимальных методов профилактики и лечения предраковых изменений в желудке является эрадикация H. pylori [25, 26].
Список литературы
- Rugge M., Genta R.M., Graham D.Y., Di Mario F., Vaz Coelho L.G., Kim N. et al. Chronicles of a cancer foretold: 35 years of gastric cancer risk assessment. Gut. 2016;65(5):721-725.
- Liu H., Li P.W., Yang W.Q., Mi H., Pan J.L., Huang Y.C. et al. Identification of non-invasive biomarkers for chronic atrophic gastritis from serum exosomal microRNAs.
 BMC Cancer. 2019;19(1):129.
BMC Cancer. 2019;19(1):129. - Цуканов В.В., Амельчугова О.С., Каспаров Э.В., Буторин Н.Н., Васютин А.В., Тонких Ю.Л., Третьякова О.В. Роль эрадикации Helicobacter pylori в профилактике рака желудка. Терапевт. арх. 2014;86(8):124-127.
- Wang Z., Graham D.Y., Khan A., Balakrishnan M., Abrams H.R., El-Serag H.B., Thrift A.P. Incidence of gastric cancer in the USA during 1999 to 2013: a 50-state analysis. Int J Epidemiol. 2018ю [Epub ahead of print]. https://doi.org/10.1093/ije/dyy055.
- Pimentel-Nunes Pю, Libânio Dю, Marcos-Pinto Rю, Areia Mю, Leja Mю, Esposito Gю et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopyю 2019;51(4):365-388.
- Malfertheiner P., Megraud F.
 , O’Morain C.A., Gisbert J.P., Kuipers E.J., Axon A.T. et al. Management of Helicobacter pylori infectionthe Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30.
, O’Morain C.A., Gisbert J.P., Kuipers E.J., Axon A.T. et al. Management of Helicobacter pylori infectionthe Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30. - Sugano K., Tack J., Kuipers E.J., Graham DY, El-Omar EM, Miura S et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-1367.
- Kapadia C.R. Gastric atrophy, metaplasia and dysplasia: a clinical perspective. J Clin Gastroenterol. 2003;36(5 Suppl):S29-S36.
- Correa P. Gastric cancer: overview. Gastroenterol Clin North Am. 2013;42(2):211-217.
- Zhao Z., Yin Z., Wang S., Wang J., Bai B., Qiu Z., Zhao Q. Meta-analysis: The diagnostic efficacy of chromoendoscopy for early gastric cancer and premalignant gastric lesions. J Gastroenterol Hepatol, 2016;31(9):1539-1545.
- Rugge M., Correa P., Di Mario F., El-Omar E., Fiocca R., Geboes K. et al. OLGA staging for gastritis: a tutorial. Dig Liver Dis, 2008, 40(8): 650-658.
- Capelle L.
 G., de Vries A.C., Haringsma J., Ter Borg F., de Vries R.A., Bruno M.J. et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis. Gastrointest Endosc. 2010;71(7):1150-1158.
G., de Vries A.C., Haringsma J., Ter Borg F., de Vries R.A., Bruno M.J. et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis. Gastrointest Endosc. 2010;71(7):1150-1158. - Dinis-Ribeiro M., Areia M., de Vries A.C., MarcosPinto R., Monteiro-Soares M., O’Connor A. et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy. 2012;44(1):74-94.
- Huang Y.K., Yu J.C., Kang W.M., Ma Z.Q., Ye X., Tian S.B., Yan C. Significance of Serum Pepsinogens as a Biomarker for Gastric Cancer and Atrophic Gastritis Screening: A Systematic Review and Meta-Analysis. PLoS One. 2015;10(11):e0142080.
- Mera R.M., Bravo L.E., Camargo M.C., Bravo J.C., Delgado A.
 G., Romero-Gallo J. et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018;67(7):1239-1246.
G., Romero-Gallo J. et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018;67(7):1239-1246. - Marcos-Pinto R., Dinis-Ribeiro M., Carneiro F., Wen X., Lopes C., Figueiredo C. et al. Firstdegree relatives of early-onset gastric cancer patients show a high risk for gastric cancer: phenotype and genotype profile. Virchows Arch.2013;463(3):391-399.
- Chen H.N., Wang Z., Li X., Zhou Z.G. Helicobacter pylori eradication cannot reduce the risk of gastric cancer in patients with intestinal metaplasia and dysplasia: evidence from a meta-analysis. Gastric Cancer. 2016;19(1):166-175.
- Rokkas T., Rokka A., Portincasa P. A systematic review and meta-analysis of the role of Helicobacter pylori eradication in preventing gastric cancer. Ann Gastroenterol. 2017;30(4):414-423.
- Tsukanov V.V., Kasparov E.V., Tonkikh J.L., Shtygasheva O.V., Butorin N.
 N., Amelchugova O.S. et al. Peptic Ulcer Disease and Helicobacter pylori Infection in Different Siberian Ethnicities. Helicobacter. 2017;22(1):e12322.
N., Amelchugova O.S. et al. Peptic Ulcer Disease and Helicobacter pylori Infection in Different Siberian Ethnicities. Helicobacter. 2017;22(1):e12322. - Choi I.J., Kook M.C., Kim Y.I., Cho S.J., Lee J.Y., Kim C.G., Park B., Nam B.H. Helicobacter pylori Therapy for the Prevention of Metachronous Gastric Cancer. N Engl J Med. 2018;378(12):1085-1095.
- O’Morain N.R., Dore M.P., O’Connor A.J.P., Gisbert J.P., O’Morain C.A. Treatment of Helicobacter pylori infection in 2018. Helicobacter. 2018;23(Suppl 1):e12519.
- Бордин Д.С., Эмбутниекс Ю.В., Вологжанина Л.Г., Ильчишина Т.А., Войнован И.Н., Сарсенбаева А.С. и др. Европейский регистр Helicobacter pylori (Hp-EuReg): как изменилась клиническая практика в России с 2013 по 2018 г. Терапевт. арх. 2019;91(2):8-24.
- Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А., Трухманов А.С., Баранская Е.К. и др. Клини ческие рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых.
 Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2018;1:55-70.
Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2018;1:55-70. - McNicholl A.G., Linares P.M., Nyssen O.P., Calvet X., Gisbert J.P. Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther. 2012;36(5):414-425.
- Graham D.Y. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits. Gastroenterology. 2015;148(4):719-731.
- McMahon B.J., Bruce M.G., Koch A., Goodman K.J., Tsukanov V., Mulvad G. et al. The diagnosis and treatment of Helicobacter pylori infection in Arctic regions with a high prevalence of infection: Expert Commentary. Epidemiol Infect. 2016;144(2):225-33.
Особенности течения хронического аутоиммунного гастрита и в сочетании с инфекцией H. Pylori
%PDF-1.4 % 1 0 obj > endobj 4 0 obj /Title >> endobj 2 0 obj > endobj 3 0 obj > stream
 Pylori
Pylori`. otu.j[m;PBI»uBy=UP3S%(T
Aaj鯷xcQOI~HL51Jt4QurSMɋv;LzThmF.oonQwus$:DvXC5ROQUa2gT]#oQ
otu.j[m;PBI»uBy=UP3S%(T
Aaj鯷xcQOI~HL51Jt4QurSMɋv;LzThmF.oonQwus$:DvXC5ROQUa2gT]#oQ
«Гастрит» – Яндекс.Кью
В конце 2019 г в мире начала распространяться инфекция, вызванная новым вирусом SARS-CoV-2. Заболевание, которое вызывает это вирус, названо COVID-19 .
Все больше людей сталкивается с этим вирусом, и все больше людей подозревает, что когда-то перенесли COVID-19 (например, во время зимнего отдыха в горах), не подозревая еще, что совсем скоро весь мир будет парализован пандемией, вызванной SARS-CoV-2.
В этой статье мы попробуем разобраться, как именно подтвердить или опровергнуть диагноз COVID-19, какие тесты бывают и кому они нужны.
Итак, глобально существует 2 вида тестов:
- Тесты для обнаружения самого вируса (точнее, РНК вируса). Они же ПЦР, они же «мазок из горла на вирус».
- Тесты для обнаружения антител (они же иммуноглобулины). Эти тесты глобально делятся на «более сложные» исследования, которые делаются в лаборатории (ИФА) и экспресс-тесты, которые можно сделать как в клиниках, так и дома.

Разберемся по порядку
1. Обнаружение РНК вируса в мазках (ПЦР)
Эти тесты актуальны, главным образом, для тех, кто болеет в данный момент. Если человек попал в больницу, то ему (скорее всего) сделают именно этот анализ. Для этого возьмут мазок из носоглотки ( глобально можно тестировать мазки из носа/зева/мокроту/смывы из носа/бонхоальвеолярный лаваж ).
Сам анализ занимает несколько часов, но с транспортировкой в лабораторию обычно занимает 1-2 дня. Его можно сдать во многих лабораториях, но пожалуйста не надо ехать в лабораторию, если у вас есть симптомы заболевания (кашель, потеря обоняния, слабость, повышенная температура тела).
Если вы заболели и хотите провести тестирование дома, оптимально заказать набор для самостоятельного взятия материала с доставкой на дом, чтобы минимизировать риск инфицирования других людей в клинике/лаборатории. В таком случае курьер подождет за дверью и заберет пакетик в пробиркой в лабораторию, ответ вы получите на почту.
Если заболевание протекает тяжело, у вас есть затрудненное дыхание, выраженная слабость и другие симптомы, которые заставляют вас обратиться к врачу, пожалуйста, не тратьте время на тестирование дома. При обращении в больницу с подозрением на COVID-19 тестирование должны провести непосредственно в больнице. Поэтому при тяжелом течении заболевания не раздумывайте о вариантах тестирования, а вызывайте скорую.
Интерпретация результата: положительный результат с очень высокой вероятностью подтверждает наличие вируса SARS-CoV-2 и (соответственно) COVID-19. Однако чувствительность теста далека от идеала, а потому отрицательный результат не позволяет нам исключить COVID-19.
Если у пациента есть симптомы, похожие на COVID-19, а результат ПЦР отрицательный, имеет смысл провести повторное тестирование через 24-48 часов. Это важно, тк до 30% пациентов, больных COVID-19, поучат отрицательный результат при первом ПЦР-тесте и положительный при последующем тестировании. Чем больше времени пройдет с момента начала заболевания, тем больше шансов, что результат теста окажется положительным .
Чем больше времени пройдет с момента начала заболевания, тем больше шансов, что результат теста окажется положительным .
2. Обнаружение антител (ИФА или экспресс-тесты)
Эти тесты не нужны (почти никогда) непосредственно в период заболевания (тогда, когда есть симптомы). Антитела (IgM и IgG) вырабатываются в организме человека в ответ на встречу с вирусом, их выработка занимает от нескольких дней до нескольких недель (сроки зависят от многих факторов, в том числе, особенности работы иммунной системы конкретного человека).
В среднем антитела появляются через 2 недели после начала заболевания (раньше искать антитела смысла нет). Другими словами, эти тесты помогут разобраться ретроспективно, болели ли вы COVID-19 ранее (если вы помните, что кашляли в феврале, например). Чувствительность и специфичность тестов для определения антител продолжает изучаться, для многих таких тестов предсказательная ценность слишком низка, чтобы они могли использоваться в клинической практике.
Мы пока не знаем точно, являются ли антитела (IgG) свидетельством наличия стойкого иммунитета к коронавирусу, поэтому выявление антител пока стоит интерпретировать как подтверждение перенесенной инфекции, а не как возможность нарушать режим самоизоляции. Вероятно, антитела обладают защитным эффектом, но пока этот вопрос остается открытым.
Если вы решили узнать, есть ли у вас антитела к коронавирусу, у вас есть 2 варианта
1) Обратиться в клинику/лабораторию/вызвать медицинскую сестру на дом и сдать кровь из вены (для исследования методом ИФА).
Кровь будет доставлена непосредственно в лабораторию, результат вы получите на почту. При такой схеме тестирования можно получить информацию не только о том, есть ли антитела, но и о том, в каком они количестве. Пока мы не знаем точно, как интерпретировать эту информацию, но есть предположения о том, что от количества антител в крови зависит то, будут ли они защищать в дальнейшем от нового инфицирования. Этот вопрос продолжает изучаться.
Этот вопрос продолжает изучаться.
2) Есть еще вариант экспресс-тестирования (капля крови/плазмы помещается на специальные картридж, и в течение нескольких минут появляется результат.
Это все похоже на проведение теста на беременность). Экспресс-тестирование можно пройти в клинике, но можно (что кажется более логичным) заказать такой же тест с доставкой на дом и сделать всю процедуру самостоятельно. Последний вариант подходит тем, кто хочет выяснить, была ли у них COVID-19 в прошлом, но не хочет выходить из дома и контактировать в другими людьми/медицинским персоналом.
Чувствительность и специфичность экспресс-тестов очень сильно отличается у разных производителей, поэтому очень важно изучить, какой именно тест вы собираетесь пройти. Некоторые экспресс — тесты получили регистрационное удостоверение росздравнадзора и могут полноправно применяться на территории РФ.
Интерпретация результатов
- Если у вас нет антител IgG/IgM: вы не сталкивались с SARS-CoV-2 (или заболели совсем недавно, и антитела еще не успели сформироваться).

- Если у вас есть антитела IgM: вы перенесли инфекцию COVID-19 совсем недавно (или как раз выздоравливаете в данный момент).
- Если у вас есть антитела IgG: вы переболели COVID-19 в прошлом. Скорее всего, это произошло более 2 недель назад, но точнее сказать, когда именно, не представляется возможным.
Если у вас есть антитела (вы переболели коронавирусом), вы можете стать донором и помочь в борьбе с инфекцией тяжелобольным людям. Этот способ лечения пока изучается, но вы уже сейчас можете сдать кровь, если у вас есть антитела.
🤒🧬 Хронический гастрит, лечение хронического гастрита
<div>
<div>
<div>Общая информация</div>
<div>Клиническая картина</div>
<div>Лечение</div>
</div>
<div>
<div>
<h4>Этиология</h4>
<p>Согласно Сиднейской классификации различают 3 типа гастритов, обозначаемых как гастрит А (аутоиммунный), гастрит-В (инфекционный), гастрит-С (химический или рефлюкс-гастрит) и особые формы хронического гастрита: радиационный, лимфоцитарный, гранулемотозный, эозинофильный и другие. </p>
</p>
<p><img title=»Гастрит» src=»assets/images/gastrit.jpg» alt=»Гастрит»>Воспаление слизистой оболочки желудка, вызванное инфекцией (гастрит В), составляет 90% среди всех форм гастритов. Приблизительно 5% страдают аутоиммунным гастритом (гастрит А) и 5% другими особыми формами гастрита (гастрит С, химический гастрит, например, вследствие заброса желчи, действие алкоголя, лекарств и т.д.).</p>
<p>Причиной наиболее частого варианта гастрита (тип В) является <span>геликобактер пилори</span> колонизирующий слизистую оболочку желудка. По эпидемиологическим данным в нашей стране инфицированы более 80% взрослого, населения.</p>
<h4>Топография</h4>
<p><span>Топография </span>поражения устанавливается при <a href=»[~1598~]»>гастроскопии</a>.</p>
<h4>Морфология</h4>
<p><span>Морфология </span>позволяет установить наличие воспаления и определить активность воспаления. </p>
</p>
<p>Заражение H.pylori приводит к появлению воспалительного инфильтрата в слизистой, а присутствие этого бактериального агента всегда сопровождается морфологическими признаками гастрита. Бактерия способна выделять белок, активирующий нейтрофилы и стимулирует экспрессию эпителиоцитами интерлейкина.</p>
</div>
<div>
<p>«Клинический» диагноз гастрита без морфологического исследования практически не имеет смысла. Жалобы, которые приписывают гастриту, на самом деле это <span>симптомы функциональной диспепсии</span> и не обусловлены теми морфологическими изменениями, которые составляют суть гастрита. Обнаруживаемая при гастроскопии гиперемия носит субъективный характер и лишь косвенно свидетельствует о наличии гастрита.</p>
<h4>Критерии функциональной диспепсии (Римские критерии 2):</h4>
<ul>
<li>боль и дискомфорт в эпигастрии – язвенно-подобный вариант;</li>
<li>дискомфорт и чувство переполнения в эпигастрии, ранее насыщение, вздутие живота и тошнота – дискинетический вариант;</li>
<li>промежуточное состояние – неспецифический вариант;</li>
</ul>
<p>По данным европейских авторов инфекция H. pylori обнаруживается у 30-70% случаев функциональной диспепсии. В зависимости от вирулентности H.pylori и генетических особенностей макроорганизма исход инфекции различен: у большинства инфицированных хронический гастрит протекает бессимптомно, у части (6%) развивается язвенная болезнь, у части приводит к развитию рака.</p>
pylori обнаруживается у 30-70% случаев функциональной диспепсии. В зависимости от вирулентности H.pylori и генетических особенностей макроорганизма исход инфекции различен: у большинства инфицированных хронический гастрит протекает бессимптомно, у части (6%) развивается язвенная болезнь, у части приводит к развитию рака.</p>
<p><span>В здоровой слизистой оболочке рак практически не возникает.</span></p>
<p>Оказалось, что<span> антральный гастрит</span> не предрасполагает к развитию кишечной метаплазии, дисплазии и раку. На фоне антрального гастрита и кислотной агрессии в 12-ти п.к. очаги метаплазии способны привести к образованию язвы ДПК.</p>
<p><span><span><img title=»Хронический гастрит — доктор» src=»assets/images/gastrit-1.JPG» alt=»Хронический гастрит — доктор»></span>Фундальный</span> или <span>мультифокальный гастрит</span> приводит к потере желудочных желез с замещением их фиброзной тканью или метаплазированным эпителием. Именной такой тип гастрита создает фон для карциномы кишечного типа. Диффузный пангастрит или гастрит тела желудка – формирует язву желудка. С годами гастрит становится атрофичным, и рассматривается как предопухолевое заболеваний желудка. Риск развития опухоли при атрофическом гастрите в 10 раз выше, чем в общей популяции. Наибольшую опасность представляет атрофический гастрит с пониженной кислотообразующей функцией желудка.</p>
<p>Один из главных признаков геликобактерного гастрита является <span>кишечная метаплазия.</span> Стандартом диагностики кишечной метаплазии является гистологическое исследование.</p>
<p>Имеются факты, что успешная эрадикация способна предотвращать прогрессирование атрофии и даже возможность обратного развития атрофии.</p>
<p>Сиднейская система предложила визуально-аналоговую шкалу для полуколичественного определения активности и выраженности гастрита, атрофии и кишечной метаплазии, степени колонизации H.pylori. К сожалению, на практике в подавляющем большинстве случаев диагноз базируется исключительно на эндоскопической картине, иногда дополненном быстрым уреазным тестом, и крайне редко выполняются гистологические исследования с оценкой топографии и распространенности поражения.</p>
<p><span>Морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей поэтому приходится прибегать к помощи гастропанели, способной определение уровня сывороточного пепсиногена 1 и пепсиногена П, определить уровень гастрина 1, позволяющих диагностировать атрофический гастрит с поражением тела желудка. Атрофический гастрит с поражением тела желудка в сочетании с сохранившейся слизистой оболочкой антрального отдела наиболее характерен для аутоиммунного атрофического гастрита.</span></p>
<h4>Диагностика геликобактерной инфекции</h4>
<ul>
<li>быстрый уреазный тест — 92%</li>
<li>Хелпил-тест — 85%</li>
<li>гистология тела желудка — 35%</li>
<li>гистология – антрум — 70%</li>
<li>ПЦР — 69%</li>
<li>бактериологический тест — 16%</li>
</ul>
</div>
<div>
<h4>Лечение хронического гастрита</h4>
<p><span>H.pylori</span> признан причинным фактором хронического гастрита и предрасполагающим фактором <a href=»[~424~]»>язвенной болезни</a>.</p>
<p>Современное <a href=»[~573~]»>лечение гастрита</a> – это этиологическая терапия, направленная на эрадикацию H.pylori. Инфицированы почти все, но кому необходима эрадикация?</p>
<p>Согласно Маастрихскому консенсус 2 лицам моложе 45 лет, без признаков тревоги (лихорадка, анемия, потеря вес, кровотечения) можно не проводить эндоскопию, а выявлять геликобактер дыхательным уреазным тестом или исследованием кала и слюны (тест на H/pl- неинвазивное тестирование) – и при позитивном результате провести эрадикацию, с последующим (через месяц) неинвазивным контролем.</p>
<p>При установленной функциональной диспепсии эрадикационная терапия не обязательна, но возможна.</p>
<p>Пациентам после 45 лет нужна эндоскопия.</p>
<p>Для пациентов с длительной антисекреторной терапией, не получавших антибактериальное лечение, используется стратегия «sеarch and treat» (выявляй и лечи).</p>
<h4>H.pylori-позитивные пациенты.</h4>
<table>
<tbody>
<tr>
<th><span>Эрадикационная терапия необходима</span></th>
<th><span>Эрадикационная терапия желательна</span></th>
</tr>
<tr>
<td>
<p>Язва ДПК и желудка (1)</p>
</td>
<td>
<p>Гастропатия на прием НПВС (2)</p>
</td>
</tr>
<tr>
<td>
<p>МАЛЬТОма желудка (2)</p>
</td>
<td>
<p>ГЭРБ (3)</p>
</td>
</tr>
<tr>
<td>
<p>Атрофический гастрит (метаплазия) (2)</p>
</td>
<td>
<p> </p>
</td>
</tr>
<tr>
<td>
<p>Оперированные по поводу рака желудка (3)</p>
</td>
<td>
<p> </p>
</td>
</tr>
<tr>
<td>
<p>Близкие родственники с раком желудка (3)</p>
</td>
<td>
<p> </p>
</td>
</tr>
<tr>
<td>
<p>Желание пациента (после консультации с врачом) (4)</p>
</td>
<td>
<p> </p>
</td>
</tr>
<tr>
<td>
<p>Синдром диспепсии («неустановленная»)</p>
</td>
<td>
<p>Функциональная диспепсия – потенциальные кандидаты (2)</p>
</td>
</tr>
</tbody>
</table>
<h4>Контроль эрадикации: уреазный дыхательный тест, ПЦР, иммуноферментный анализ (кал, слюна).</h4>
<table>
<tbody>
<tr>
<th colspan=»2″>Терапия первой линии <br>Тройная терапия (лечение 10-14 дней)</th>
</tr>
<tr>
<td>
<p>Омепрозол 20 мг 2 раза в день или</p>
<p>Лансопрозол 30 мг 2 раза в день или</p>
<p>Пантопрозол 40 мг 2 раза в день</p>
<p>+ кларитромицин 500мг 2 раза в день +</p>
<p>амоксициллин 1000 мг 2 раза в день</p>
<p>или</p>
<p>+ кларитромицин 500 мг 2 раза в день</p>
<p>+ метронидазол 500мг 2 раза в день</p>
</td>
<td>
<p> </p>
<p> </p>
<p>Ранитидин висмут цитрат 400 мг 2 раза в день</p>
<p>+ кларитромицин 500мг 2 раза в день +</p>
<p>амоксициллин 1000 мг 2 раза в день</p>
<p>или</p>
<p>+ кларитримицин 500 мг 2 раза в день + метронидазол 500 мг 2 раза в день</p>
</td>
</tr>
<tr>
<th colspan=»2″>Терапия второй линии <br>Квадротерапия (лечение 10-14 дней)</th>
</tr>
<tr>
<td colspan=»2″>
<p>Омепрозол 20 мг 2 раза в день или</p>
<p>Лансопрозол 30 мг 2 раза в день или</p>
<p>Пантопрозол 40 мг 2 раза в день +</p>
<p>Висмута субсалицилат/субцитрат 120 мг 4 раза в день</p>
<p>+ метронидазол 500 мг 3 раза в день</p>
<p>+ тетрациклин 500 мг 4 раза в день</p>
</td>
</tr>
</tbody>
</table>
<h4>Лечение хронического гастрита с синдромом диспепсии</h4>
<p><span>Синдром эпигастральной боли<span> – </span></span>хорошо отвечает на ингибирование соляной кислоты и применяют, как правило, ингибиторы протоновой помпы или блокаторы Н2-рецепторов гистамина, которые можно комбинировать с антацидами.</p>
<p><span>Синдром постпрандиальной диспепсии:</span> показано применение прокинетиков (митилиум, ганатон).</p>
<p>При эндоскопической картине выраженного эрозивного повреждения слизистой целесообразно назначение препаратов висмута (гастронорм или де-нол).</p>
</div>
</div>
</div>
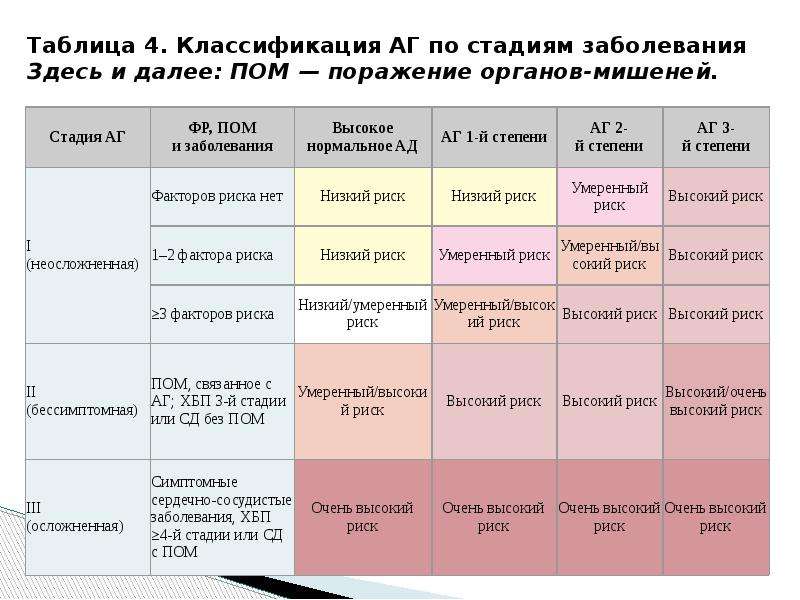
Стадия OLGA при гастрите
Rugge M и др. . (2007) Стадия гастрита в клинической практике: система стадирования OLGA. Кишечник 56 : 631–636
Используемые в настоящее время системы классификации гастрита не предоставляют немедленной прогностической и терапевтической информации, применяются непоследовательно и открыты для неправильного толкования.Международная группа гастроэнтерологов и патологов под названием Operative Link on Gastritis Assessment (OLGA) предложила альтернативную систему для определения стадии гастрита, которая объединяет полученную биопсией оценку атрофии и топографию атрофии.
Чтобы оценить полезность системы OLGA и проверить, правильно ли она классифицирует пациентов в соответствии с их риском развития рака желудка, Rugge и его коллеги включили 439 амбулаторных пациентов с диспепсией в проспективное перекрестное исследование.
Всем пациентам была выполнена эндоскопия со стандартизированной биопсией, и был определен их статус Helicobacter pylori . Оценка атрофии была присвоена образцам после гистологического анализа. Стадия гастрита определялась на основании топографической локализации гистологических изменений. Регистрировали наличие пептических язв или новообразований.
Все выявленные новообразования наблюдались у пациентов с гастритом III – IV стадии ( P <0.001), что согласуется с предполагаемой корреляцией между атрофией и раком. Аналогичным образом доброкачественные образования (например, язвы двенадцатиперстной кишки) наблюдались у пациентов с гастритом 0– II стадии ( P <0,001). Также была замечена корреляция между степенью гастрита и статусом H. pylori , что еще раз подтверждает ценность этой системы.
Авторы приходят к выводу, что их результаты подтверждают эффективность промежуточной системы OLGA, но предупреждают, что она должна быть дополнительно оценена в других эпидемиологических контекстах, прежде чем существующие системы будут заменены.
Об этой статье
Цитируйте эту статью
Стадийная система OLGA при гастрите. Нат Рев Гастроэнтерол Гепатол 4, 416 (2007). https://doi.org/10.1038/ncpgasthep0855
Ссылка для скачивания
Поделиться этой статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для совместного использованияК сожалению, в настоящее время ссылка для совместного использования отсутствует доступно для этой статьи.
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Классификация гастрита — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; Заместитель главного редактора: Аравинд Редди Котагади M.B.B.S [2]}}
Обзор
Обновленная Сиднейская система устанавливает классификацию и классификацию гастрита, что подчеркивает важность объединения топографической, морфологической и этиологической информации для постановки клинического диагноза.В клинической практике стадирование гастрита выполняется с использованием системы стадирования OLGA (Operative Link on Gastritis Assessment) для составления отчетов о гистологии желудка. Стадия гастрита сочетает в себе оценку атрофии, которая определяется биопсией, и топографию атрофии, которая определяется путем направленной биопсии.
Классификация
- Обновленная Сиднейская система устанавливает классификацию и классификацию гастрита, что подчеркивает важность объединения топографической, морфологической и этиологической информации для постановки клинического диагноза. [1]
- В клинической практике определение стадии гастрита выполняется с помощью системы стадирования OLGA (Operative Link on Gastritis Assessment) для составления отчетов о гистологии желудка. Стадия гастрита сочетает в себе оценку атрофии, которая определяется биопсией, и топографию атрофии, которая определяется путем направленной биопсии. [2] [3]
| Стадия гастрита в клинической практике: система стадирования OLGA | |||||
|---|---|---|---|---|---|
| Оценка атрофии | Корпус | ||||
| Без атрофии (Оценка: 0) | Легкая атрофия (Оценка: 1) | Средняя атрофия (Оценка: 2) | Тяжелая атрофия (Оценка: 3) | ||
А с.ш. т R U млн | Нет атрофии (Оценка: 0) (, включая угловую вырезку ) | ЭТАП 0 | ЭТАП I | ЭТАП II | ЭТАП II |
| Легкая атрофия (Оценка: 1) (, включая угловую инцизуру ) | ЭТАП I | ЭТАП I | ЭТАП II | ЭТАП III | |
| Умеренная атрофия (Оценка: 2) (, включая incisura angularis ) | ЭТАП II | ЭТАП II | ЭТАП III | ЭТАП IV | |
| Тяжелая атрофия (Оценка: 3) (, включая incisura angularis ) | ЭТАП III | ЭТАП III | ЭТАП IV | ЭТАП IV | |
Сиднейская система классификации хронического гастрита [1]
| Сиднейская система классификации хронического гастрита | ||
|---|---|---|
| Характеристика | Определение | Руководство по выставлению оценок |
| Хроническое воспаление |
| |
| Активность |
| |
| Атрофия |
|
|
| Helicobacter pylori |
| |
| Кишечная метаплазия |
| |
Ссылки
- ↑ 1.0 1,1 Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. (1996). «Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994». Am J Surg Pathol . 20 (10): 1161–81. PMID 8827022.
- ↑ Рагге М, Меггио А, Пеннелли Дж., Пишоли Ф., Джакомелли Л., Де Претис Дж. и другие. (2007). «Стадирование гастрита в клинической практике: система стадирования OLGA». Кишечник . 56 (5): 631–6. DOI: 10.1136 / gut.2006.106666. PMC 1942143. PMID 17142647.
- ↑ Рагге М, Корреа П, Ди Марио Ф, Эль-Омар Э, Фиокка Р, Гебоэс К; и другие. (2008). «Стадия OLGA при гастрите: учебное пособие». Dig Liver Dis . 40 (8): 650–8. DOI: 10.1016 / j.dld.2008.02.030. PMID 18424244.
Шаблон: WH Шаблон: WS
Значение систем стадирования OLGA и OLGIM в оценке риска рака желудка: систематический обзор и метаанализ
Ферлей Дж., Сурджоматарам И., Дикшит Р., Эзер С., Мазерс С., Ребело М., Паркин Д. М., Форман Д., Брей Ф. Заболеваемость и смертность от рака во всем мире: источники, методы и основные закономерности в GLOBOCAN 2012. Int J Cancer. 2015; 136 (5): E359–86.
Артикул PubMed CAS Google ученый
Карим-Кос HE, de Vries E, Soerjomataram I, Lemmens V, Siesling S, Coebergh JW. Последние тенденции рака в Европе: комбинированный подход к заболеваемости, выживаемости и смертности для 17 очагов рака с 1990-х годов.Eur J Cancer. 2008. 44 (10): 1345–89.
Артикул PubMed Google ученый
Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. Модель эпидемиологии рака желудка. Ланцет. 1975. 2 (7924): 58–60.
Артикул PubMed CAS Google ученый
Correa P, Piazuelo MB. Предраковый каскад желудка. J Dig Dis. 2012; 13 (1): 2–9.
Артикул PubMed PubMed Central Google ученый
Уэмура Н., Окамото С., Ямамото С., Мацумура Н., Ямагути С., Ямакидо М., Танияма К., Сасаки Н., Шлемпер Р.Дж. Инфекция Helicobacter pylori и развитие рака желудка. N Engl J Med. 2001. 345 (11): 784–9.
Артикул PubMed CAS Google ученый
Сиотани А., Харума К., Уэдо Н., Ииши Х., Исихара Р., Тацута М., Кумамото М., Накаэ Ю., Исигуро С., Грэм Д. Я. Гистологические маркеры риска раннего рака желудка без кардии.Картина экспрессии муцина и рака желудка. Арка Вирхова. 2006. 449 (6): 652–9.
Артикул PubMed Google ученый
Rugge M, Genta RM. Стадия и классификация хронического гастрита. Hum Pathol. 2005. 36 (3): 228–33.
Артикул PubMed Google ученый
Капелле Л.Г., де Фрис А.С., Харингсма Дж., Тер Борг Ф., де Фрис Р.А., Бруно М.Дж., ван Деккен Х., Мейер Дж., Ван Грикен Н.С., Кейперс Э.Дж.Определение стадии гастрита с помощью системы OLGA с использованием кишечной метаплазии в качестве точной альтернативы атрофическому гастриту. Gastrointest Endosc. 2010. 71 (7): 1150–8.
Артикул PubMed Google ученый
Rugge M, Correa P, Di Mario F, El-Omar E, Fiocca R, Geboes K, Genta RM, Graham DY, Hattori T, Malfertheiner P, Nakajima S, Sipponen P, Sung J, Weinstein W , Виет М. ОЛЬГА Стадия гастрита: учебное пособие. Dig Liver Dis.2008. 40 (8): 650–8.
Артикул PubMed CAS Google ученый
Rugge M, de Boni M, Pennelli G, de Bona M, Giacomelli L, Fassan M, Basso D, Plebani M, Graham DY. Гастрит OLGA-стадия и риск рака желудка: двенадцатилетнее клинико-патологическое исследование. Алимент Pharmacol Ther. 2010; 31: 1104–11.
PubMed CAS Google ученый
Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-Pinto R, Monteiro-Soares M, O’Connor A, Pereira C, Pimentel-Nunes P, Correia R, Ensari A, Dumonceau JM, Machado JC, Macedo G, Malfertheiner P, Matysiak-Budnik T, Megraud F, Miki K, O’Morain C, Peek RM, Ponchon T., Ristimaki A, Rembacken B, Carneiro F, Kuipers EJ, Европейское общество гастроинтестинальной эндоскопии; Европейская группа изучения хеликобактер; Европейское общество патологов; Sociedade Portuguesa de Endoscopia Digestiva.Ведение предраковых состояний и поражений желудка (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта (ESGE), Европейской группы изучения хеликобактер (EHSG), Европейского общества патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ). Эндоскопия. 2012. 44 (1): 74–94.
Артикул PubMed CAS Google ученый
De Re V, Orzes E, Canzonieri V, Maiero S, Fornasarig M, Alessandrini L, Cervo S, Steffan A, Zanette G, Mazzon C, De Paoli P, Cannizzaro R.Пепсиногены для различения пациентов с кишечной метаплазией желудка и инфекцией Helicobacter pylori среди групп риска по развитию рака желудка. Клин Транс Гастроэнтерол. 2016; 7 (7): e183.
Артикул PubMed PubMed Central Google ученый
Molaei M, Ehtiati A, Mashayekhi R, Rafizadeh M, Zojaji H, Mirsattari D, Kishani Farahani R. Атрофия желудка: использование системы стадирования OLGA на практике. Gastroenterol Hepatol Bed Bench.2016; 9 (1): 25–9.
PubMed PubMed Central Google ученый
Эль-Зимаити М.Х., Ридделл Р.Х., Абудайе С., Грэм Ю.Д. Точность диагностики атрофии желудка: сравнение OLGA с системой Бейлора. Lab Invest. 2009; 89: 128A.
Google ученый
Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, Moher D, Becker BJ, Sipe TA, Thacker SB.Метаанализ наблюдательных исследований в эпидемиологии: предложение для отчетности. Группа «Мета-анализ наблюдательных исследований в эпидемиологии» (MOOSE). ДЖАМА. 2000. 283 (15): 2008–12.
Артикул PubMed CAS Google ученый
Wells G, Shea B, O’Connell D, Peterson J, Welch V, Losos M, Tugwell P (2009) Шкала Нью Касла – Оттавы (NOS) для оценки качества нерандомизированных исследований мета- анализ. http: // www.ohri.ca/programs/clinical_epidemiology/oxford.asp. Доступно 5 апреля 2017 г.
Станг А. Критическая оценка шкалы Ньюкасла-Оттавы для оценки качества нерандомизированных исследований в метаанализах. Eur J Epidemiol. 2010. 25 (9): 603–5.
Артикул PubMed Google ученый
Азиз О., Константинидес В., Теккис П.П., Атанасиу Т., Пуркаястха С., Параскева П., Дарзи А.В., Хериот АГ. Лапароскопическая и открытая хирургия рака прямой кишки: метаанализ.Энн Сург Онкол. 2006. 13 (3): 413–24.
Артикул PubMed Google ученый
Хиггинс Дж. П., Томпсон С. Г.. Количественная оценка неоднородности в метаанализе. Stat Med. 2002. 21 (11): 1539–58.
Артикул PubMed Google ученый
DerSimonian R, Laird N. Мета-анализ в клинических испытаниях. Контрольные клинические испытания. 1986. 7 (3): 177–88.
Артикул PubMed CAS Google ученый
Сато К., Осава Х., Йошизава М., Накано Х., Хирасава Т., Кихира К., Сугано К. Оценка атрофического гастрита с использованием системы OLGA. Helicobacter. 2008. 13 (3): 225–9.
Артикул PubMed Google ученый
Чой И., Чо С., Кук М., Ким С., Ли Дж. Валидатон системы определения стадии гастрита OLGA для оценки риска рака желудка в регионе высокой распространенности: исследование случай-контроль. Helicobacter. 2012; 17: 76.
Артикул Google ученый
Cho SJ, Choi IJ, Kook MC, Nam BH, Kim CG, Lee JY, Ryu KW, Kim YW. Определение стадии рака кишечника и диффузного рака желудка с помощью систем стадирования OLGA и OLGIM. Алимент Pharmacol Ther. 2013. 38 (10): 1292–302.
Артикул PubMed Google ученый
Кодама М., Мураками К., Окимото Т., Абэ Х., Сато Р., Огава Р., Мизуками К., Сиота С., Накагава И., Сома В., Арита Т., Фудзиока Т. Гистологические характеристики слизистой оболочки желудка до заражения Helicobacter pylori может предсказать рак желудка.Сканд Дж Гастроэнтерол. 2013. 48 (11): 1249–56.
Артикул PubMed Google ученый
Цай Ю.К., Сяо У.Х., Ян HB, Ченг Х.С., Чанг В.Л., Лу СС, Шеу Б.С. Индекс гастрита с преобладанием тела может служить ранним маркером инфицированных Helicobacter pylori пациентов с риском рака желудка. Алимент Pharmacol Ther. 2013; 37 (10): 969–78.
Артикул PubMed Google ученый
Чжоу Й, Ли Х., Чжан Дж.Дж., Чен XY, Ге ЗЗ, Ли ХБ. Оперативное звено на стадии оценки гастрита является подходящим предиктором раннего рака желудка. Мир Дж. Гастроэнтерол. 2016; 22 (13): 3670–8.
Артикул PubMed PubMed Central Google ученый
Мики К. Скрининг рака желудка с помощью комбинированного анализа на сывороточные антитела IgG к Helicobacter pylori и уровни пепсиногена в сыворотке — «метод ABC». Proc Jpn Acad Ser B Phys Biol Sci.2011. 87 (7): 405–14.
Артикул PubMed PubMed Central Google ученый
Shin WG, Kim HU, Song HJ, et al. Стратегия эпиднадзора за атрофическим гастритом и кишечной метаплазией в стране с высокой распространенностью рака желудка. Dig Dis Sci. 2012. 57 (3): 746–52.
Артикул PubMed Google ученый
Китайское общество гастроэнтерологов.Китайский национальный консенсус по хроническому гастриту. Чин Дж Гастроэнтерол. 2017; 22 (11): 670–87.
Google ученый
Daugule I, Sudraba A, Chiu HM, Funka K, Ivanauskas A, Janciauskas D, Jonaitis L, Kiudelis G, Tolmanis I, Vanags A, Lin JT, Kupcinskas L, Leja M. Биомаркеры желудочной плазмы и оперативные данные ссылка для оценки гастрита стадия гастрита. Eur J Gastroenterol Hepatol. 2011; 23 (4): 302–7.
Артикул PubMed CAS Google ученый
Quach DT, Le HM, Nguyen OT, Nguyen TS, Uemura N. Тяжесть эндоскопической атрофии желудка может помочь спрогнозировать стадию гастрита при оценке гастрита. J Gastroenterol Hepatol. 2011; 26 (2): 281–5.
Артикул PubMed Google ученый
Исаев С., Лиепниеце-Кареле И., Янчаускас Д., Моисеев Г., Путниньш В., Функа К., Кикусте И., Ванагс А., Толманис И., Лея М. Постановка гастрита: соглашение между исследователями с применением систем OLGA и OLGIM.Арка Вирхова. 2014. 464 (4): 403–7.
Артикул PubMed Google ученый
Ниеминен А., Сиппонен П., Контто Дж., Пуолаккайнен П., Виртамо Дж., Коккола А. Системы стадирования OLGA и OLGIM у мужчин с атрофическим гастритом. United Eur Gastroenterol J. 2015; 3 (5): A296–7.
Google ученый
Rugge M, Fassan M, Pizzi M, Farinati F, Sturniolo GC, Plebani M, Graham DY.Оперативная ссылка на оценку гастрита и оперативная ссылка на оценку кишечной метаплазии. Мир Дж. Гастроэнтерол. 2011. 17 (41): 4596–601.
Артикул PubMed PubMed Central Google ученый
Поперечное исследование с участием эндоскопической группы населения Восточного Китая
Гистологическая стадия желудка (OLGA) играет важную роль в оценке атрофии желудка, симптома, указывающего на риск рака желудка (GC). Однако гастроскопия — это инвазивное обследование, которое имеет ограниченное применение в группах населения, проходящих физикальное обследование.Уровни сывороточного пепсиногена (PG) и гастина-17 (G-17) являются неинвазивными показателями, которые рекомендуются при скрининге на ГК. Мы стремимся изучить корреляцию между стадией PG / G-17 и OLGA, чтобы предоставить надежные индексы для скрининга GC. В исследование были включены 453 бессимптомных человека из Восточного Китая, прошедшие физическое обследование, которым затем была сделана эндоскопия, включая сбор образцов биопсии. Были выполнены анализы сыворотки на PG, G-17 и Helicobacter pylori (Hp) . Атрофия слизистой оболочки желудка оценивалась по шкале OLGA для каждого человека.Было включено 453 участника среднего возраста, 253 мужчины и 200 женщин. При бессимптомном физикальном обследовании уровни PGI, PGII и PGR в сыворотке снижались с увеличением баллов OLGA. PGI и PGR были обратно коррелированы с увеличением стадии OLGA как в Hp-положительных, так и в Hp-отрицательных группах. Уровни сывороточных PGI, PGII и G-17 в Hp-положительной группе были выше, чем в Hp-отрицательной группе; наоборот, уровни PGR были ниже. Кроме того, показатели OLGA увеличивались с возрастом в Hp-положительной группе.В заключение, существует значительная корреляция между стадией OLGA и сывороточным PG в популяциях из Восточного Китая, проходящих медицинское обследование. Сыворотка PG и G-17 в сочетании с тестом на Hp играет важную роль в оценке атрофии желудка.
1. Введение
Рак желудка (РЖ) является пятым по распространенности раком в мире.
Приблизительно 1 миллион новых случаев ГК диагностируется ежегодно, и почти 700 000 человек умирают от этого заболевания ежегодно, что составляет 10% всех смертей, связанных с раком в мире [1].Районы с самой высокой заболеваемостью ГК — Восточная Европа, Восточная Азия и части Центральной и Южной Америки, а самые низкие — в Южной Азии, Северной и Восточной Африке, Австралии и Северной Америке [2]. ГК — второй по распространенности рак в Китае после рака легких [3]. Ранний рак желудка имеет лучший прогноз: 5-летняя выживаемость составляет более 90%, в то время как 5-летняя выживаемость при распространенном раке желудка составляет менее 40%. Чтобы снизить частоту ГК, необходимы ранняя диагностика и активное вмешательство.
Среди всех возможных факторов риска инфекция Helicobacter pylori (Hp) является основным причинным фактором для GC. Под влиянием длительной инфекции Hp и других факторов слизистая оболочка желудка может подвергаться процессам атрофии, кишечной метаплазии (IM), дисплазии и, наконец, GC [4].
Международная группа исследователей атрофии предложила в 2005 году стандарт оценки воспаления, степени и объема атрофии слизистой оболочки желудка (т.е. стадии хронического гастрита OLGA), который связывает гистопатологию хронического гастрита с риском рака.Стадия OLGA способна ранжировать риск ГК путем сочетания степеней атрофии слизистой оболочки антрального отдела и слизистой оболочки тела. Испытания, проведенные в поперечных и когортных исследованиях, показали, что GC ассоциирован со стадиями III и IV OLGA, которые определены как стадии высокого риска [5, 6]. Тем не менее, эндоскопия — это инвазивное обследование, а стадия OLGA, требующая обширного отбора проб, находится под влиянием патологов, поэтому она не идеальна для клинической практики, особенно среди здоровых групп населения, проводящих медицинский осмотр. Следовательно, существует необходимость в скрининге на атрофию и высокий риск рака желудка с использованием неинвазивных методов в этих группах населения.
Общепринято, что уровни пепсиногена (PG) и гастина-17 (G-17) в сыворотке отражают функциональное и морфологическое состояние слизистой оболочки желудка. Уровни PG в сыворотке способствуют диагностике атрофического гастрита (AG) и могут применяться для скрининга GC с использованием индикаторов PGI и PGR, уровни которых связаны с AG и с GC, соответственно.
Таким образом, комбинация сывороточного PG и инфекции Hp была предложена в качестве прогностического маркера для пациентов с GC [7]. Предыдущие исследования установили корреляцию между уровнями PG в сыворотке и стадией OLGA [6, 8, 9], но в Восточном Китае было опубликовано мало исследований среди бессимптомных групп населения, проходящих физикальное обследование.Принято считать, что Hp является фактором высокого риска для GC, но сообщения о влиянии Hp на взаимосвязь между уровнями PG в сыворотке и стадией OLGA редки.
Это исследование направлено на оценку корреляции между сывороточной PG и стадией OLGA при оценке атрофии слизистой оболочки желудка у бессимптомной популяции, чтобы определить простой и эффективный метод скрининга для снижения смертности от GC.
2. Методы
2.1. Популяция исследования
Это перекрестное описательное исследование было проведено в больнице провинции Аньхой, больнице, входящей в состав AHMU (Медицинского университета Аньхой).Исследуемая популяция состояла из 453 бессимптомных индивидов из Восточного Китая, прошедших медицинское обследование, которым в период с 2015 по 2018 год была проведена эндоскопия с забором биоптатов. Тесты сыворотки на PG / G-17 и определение Hp выполнялись одновременно. Критерии исключения: пациенты, ранее перенесшие хирургические вмешательства на верхних отделах желудочно-кишечного тракта; пациенты, принимающие лекарства от болезней желудка, такие как ингибиторы протонной помпы (ИПП), за неделю до обследования; пациенты с серьезными поражениями важных органов; пациенты с аутоиммунными заболеваниями и пациенты с объемными поражениями, которые могут повлиять на анализ.Стоит отметить, что все участники не получали эрадикационную терапию Hp до физического обследования.
2.2. Эндоскопия и патология
Гастроскопическое обследование и забор патологической биопсии проводились опытными врачами, не имеющими отношения к серологическим данным субъектов. Образцы патологии были взяты по Сиднейской системе: два — из тела желудка; один из слизистой оболочки angularis incisura и два из слизистой оболочки антрального отдела. Все биопсии фиксировали в 10% формалине, заливали парафином, а затем делали срезы и окрашивали в лаборатории патологии.Каждая биопсия оценивалась двумя патологами в соответствии с системой классификации Сиднея [10], а затем оценивалась в сочетании с атрофией антрального отдела желудка и слизистой оболочки желудка.
2.3. Тест на пепсиноген в сыворотке и
H. Pylori StatusПриблизительно 5 мл венозной крови натощак собирали утром у каждого участника и хранили при 4 ° C в течение 24 часов. После центрифугирования образцов при 3000 об / мин в течение 10 минут сыворотку разделяли на аликвоты и замораживали при -20 ° C, затем перед анализом переводили на -70 ° C.Уровни сывороточного PGI, PGII и G-17 измеряли с помощью анализа ELISA (Biohit Co., Хельсинки, Финляндия) и рассчитывали PGR.
Каждый участник прошел дыхательный тест на 13 С-мочевину или 14 С-мочевину в тот же день, что и эндоскопия. Диагноз Hp-инфекции был поставлен на основании результатов дыхательного теста в сочетании с патологическим обследованием.
2.4. Статистический анализ
Когда данные показывали нормальное распределение, результаты были представлены в виде отклонения (SD).Аномально распределенные данные были выражены как. Статистический анализ проводился с использованием программы SPSS 22.0 (SPSS Inc., Чикаго, США). Значительные различия в возрасте и уровнях PG в сыворотке крови между разными группами оценивали с помощью дисперсионного анализа (ANOVA) и теста Шеффе. Различия в инфицировании Hp оценивали с помощью теста Пирсона.
Значение менее 0,05 считалось значимым.
3. Результаты
3.1. Характеристики участников
Всего в исследовании приняли участие 453 субъекта, и исходные характеристики участников представлены в таблице 1.Возрастной диапазон испытуемых составлял от 22 до 80 лет. Средний возраст включенных пациентов составлял годы, 47,7% составляли мужчины, а средний индекс массы тела (ИМТ) составлял. Частота инфицирования Hp составила 47,6%. Был один субъект с раком желудка, распределенным по OLGA 4 стадии. Уровни PGI у мужчин были выше, чем у женщин (Таблица 2).
| ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Согласно системе этапов OLGA, 176 (38,85%) испытуемых находились на этапе 0, 81 (17,88%) на этапе 1, 126 (27,81%) на этапе 2, 47 (10,38%) на этапе 3, и 23 (5,08%) на этапе 4 (таблица 3). Не было значительных различий в распространенности инфекции Hp среди субъектов с разными стадиями OLGA.История курения показала статистическую значимость на разных этапах (). По мере увеличения стадии OLGA уровни PGI, PGII и PGR в сыворотке значительно снижались (), в то время как между стадиями G-17 и OLGA не было обнаружено значимости.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Инфекция HP
По сравнению с Hp-отрицательной группой, сывороточные уровни PGI, PGII и G-17 были значительно повышены в Hp-положительной группе, в то время как уровни PGR были значительно снижены (Таблица 4).
| ||||||||||||||||||||||||||||||||||||
В Hp-положительной группе уровни PGI и PGR в сыворотке были явно снижены с повышенная стадия OLGA (, табл. 5). Такая же картина была обнаружена среди пациентов с отрицательным результатом исследования Hp (). Хотя уровни PGII постепенно снижались с увеличением стадии OLGA в Hp-положительной группе (), не было никакой разницы в отрицательной группе. Статистически значимой разницы в группе G-17 не было, как в Hp-положительных, так и в Hp-отрицательных группах.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| , по сравнению с различными ступенями OLGA в той же группе HP; # , по сравнению с различными ступенями OLGA в той же группе Hp; по сравнению с разными стадиями OLGA в той же группе Hp. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4. Распределение стадий OLGA по возрасту
Участники были разделены на возрастные группы 22–44, 45–50, 51–57 и 58–80 лет в зависимости от их количества и пола. Стадия OLGA увеличивалась с возрастом в Hp-положительной группе, хотя у субъектов не было симптомов (Таблица 6). Однако эта разница не была значимой в группе Hp-отрицательных пациентов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В таблице 7 показаны различные уровни PG в сыворотке для каждой возрастной группы. Частота инфицирования Hp не показала различий между четырьмя возрастными группами (). С возрастом уровни сывороточных PGI, PGII и G-17 увеличивались, в то время как PGR явно не пострадал.
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| , диапазон 45-50 по сравнению с диапазоном 51-57. | |||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
Существует значительная разница в выживаемости между теми, у кого диагностирован ранний и продвинутый GC [11]; Причина этого — отсутствие эффективных методов лечения расширенных ГК. AG и IM считаются предраковыми поражениями GC, а Hp — фактором высокого риска GC [12–14]. Сообщалось, что стадия высокого риска (определяемая как стадия III или IV системы стадий OLGA) тесно связана с возникновением GC [8, 12].Следовательно, выявление атрофии слизистой оболочки желудка и инфекции Hp в общей популяции имеет важное значение для ранней диагностики.
Наше исследование показывает, что сывороточный тест PG имеет такое же значение, что и стадия OLGA при оценке атрофии слизистой оболочки желудка при физикальном обследовании населения из Восточного Китая, особенно по параметрам PGI и PGR. После более чем 12-летнего наблюдения за 93 пациентами Rugge et al. пришли к выводу, что существует значимая обратная корреляция между стадией PGR и OLGA [15]. Диксон и др.и Wang et al. также наблюдали очевидную корреляцию между сывороточной PG и стадией OLGA в последние годы, что согласуется с нашими выводами [10, 16].
Hokkanen et al. сообщили, что пол был фактором, влияющим на сывороточные уровни PG [17]. Предыдущее популяционное исследование, проведенное в Северном Китае, показало, что у мужчин нормальные значения PGI выше, чем у женщин [17]. В настоящем исследовании уровни PGI у мужчин были явно выше, чем у женщин, что согласуется с результатами предыдущих исследований.Как и ожидалось, уровни PG и G17 в сыворотке значительно зависели от возраста. Недавнее исследование также показало, что уровни PGII увеличивались, а уровни PGR снижались с возрастом у здорового населения [18, 19]. Распространенность инфекции Hp не показала разницы между мужчинами и женщинами, как и ранее [20, 21].
Общеизвестно, что инфекция Hp влияет на уровни PG в сыворотке. Hp способен повышать уровень гастрина за счет стимуляции G-клеток в антральном отделе, что напрямую стимулирует синтез и секрецию PG во многих клетках, особенно PG II [22].В нашем исследовании сывороточные уровни PG в Hp-положительной группе значительно отличались по сравнению с Hp-отрицательной группой. Ohkusa et al. обнаружили, что инфекция Hp активирует уровень гастрина в сыворотке, подтверждая, что инфекция Hp может влиять на уровни PG в сыворотке [23].
Интересно, что инфекция Hp чаще встречалась у субъектов моложе 50 лет (диапазон 45–50), что сопровождалось стадией OLGA с более низким риском. Предыдущее исследование, проведенное Nam et al. в корейской популяции показали, что инфекция Hp наиболее часто встречается у людей в возрасте 40 лет и старше, и не было субъектов моложе 30 в стадии высокого риска [24].Таким образом, они пришли к выводу, что наиболее подходящим возрастом для эрадикации Hp может быть менее 30 лет, прежде чем стадия OLGA повысится. Кроме того, Nam et al. предположили, что ранняя эрадикация Hp может предотвратить большинство случаев рака желудка у пациентов со стадией OLGA с низким риском, и эндоскопическое обследование может не потребоваться.
Другое исследование, проведенное Rugge et al. предположили, что при обнаружении инфекции Hp требуется обязательная эрадикационная терапия. Их данные подтверждают мнение о том, что чем тяжелее заболевание желудка во время эрадикации Hp, тем менее обратимыми будут уже установленные поражения слизистой оболочки [24].Ликвидация до атрофии желудка дает наилучшую возможность минимизировать риск, но положительные эффекты лечения все еще существуют в пожилом возрасте и на поздних стадиях заболевания. Даже у пациентов с ГК эрадикация, по крайней мере, замедляет рецидив рака.
Наше исследование показывает, что инфекция Hp более распространена среди людей моложе 50 лет. Следовательно, в Китае необходимо проводить скрининг на Hp в возрасте менее 50 лет с целью ранней диагностики и эффективного лечения. При своевременном лечении на слизистой оболочке желудка можно предотвратить дальнейшее развитие предраковых поражений, таких как атрофия и ИМ, которые в конечном итоге приводят к ГК.Корреляция между стадией OLGA и возрастом также наблюдалась у Hp-положительных участников. В то время как уровни PGI снижались с возрастом, показатели OLGA были значительно выше в Hp-положительной группе, как и результаты других исследований [25–27]. Следовательно, пожилым людям может потребоваться регулярное эндоскопическое обследование.
Заболеваемость GC имеет очевидную семейную агрегацию и региональные различия. По сравнению с Южным Китаем заболеваемость ГК значительно выше в восточном и северо-западном Китае.Общими чертами этих регионов являются продолжительное употребление соленых продуктов, таких как мясо, соленая рыба, маринованные овощи и морепродукты. В настоящем исследовании распространенность стадий высокого риска высока, возможно, из-за пищевых привычек региона.
Текущее исследование имеет несколько ограничений. Во-первых, кросс-секционный характер исследования затрудняет вывод о развитии атрофии слизистой оболочки желудка и ИМ. Во-вторых, сывороточный PG зависит от многих факторов, таких как подавление кислоты желудочного сока в анамнезе или эрадикация Hp, что не принималось во внимание в нашем исследовании.В-третьих, поскольку настоящее исследование было основано на одной больнице, и наши испытуемые проживали в Восточном Китае, наши результаты могут не отражать все население Китая. Кроме того, размер изучаемой нами выборки ограничен, и в будущем было бы разумно проводить многоцентровые исследования по всему Китаю.
В заключение отметим, что значительная корреляция между PGI, PGR и стадией OLGA наблюдалась среди населения из Восточного Китая, проходящего медицинское обследование. Стадии PG и OLGA в сыворотке показали последовательную полезность при оценке атрофии слизистой оболочки желудка.Кроме того, в то время как ранняя эрадикация Hp может задержать развитие предраковых поражений желудка, скрининг Hp имеет большое значение для китайского населения, а наблюдение за ГК необходимо для пожилых людей. Чтобы лучше оценить риск ГК, мы рекомендуем комбинировать сывороточный PG со стадией OLGA при клинической оценке.
Доступность данных
Ретроспективные данные, использованные для подтверждения результатов этого исследования, включены в файл дополнительной информации.
Конфликт интересов
Мы заявляем об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Мы благодарны мисс Лю, которая собрала и провела анализ ретроспективных данных, и мисс Ся, которая напечатала рукопись. Мы также высоко ценим полезное обсуждение профессора Чжана. Эта работа была поддержана Anhui Science and Technology Office (номер гранта 1604a0802075).
Дополнительные материалы
Дополнительные материалы — это исходные данные рукописи, включая уровни PG и G17 в сыворотке крови, статус HP и историю курения и употребления алкоголя. (Дополнительные материалы)
Долгосрочное последующее исследование 7436 пациентов
Желудок
1627
Стадия гастрита OLGA для прогнозирования риска рака желудка: долгосрочное последующее исследование …
© 2018 Американский колледж гастроэнтерологии Американский журнал гастроэнтерологии
ing является надежным средством прогнозирования риска опухолевых поражений желудка,
, включая рак желудка. Среди H. pylori-положительных пациентов, даже у
пациентов со стадией OLGA низкого риска, персистирование инфекции
может способствовать неопластическому прогрессированию, что дополнительно подтверждает необходимость
как для ликвидации, так и для неинвазивной оценки ее успеха. —
сн.Среди пациентов с III / IV стадией OLGA ликвидация
инфекции H. pylori не обязательно снижает риск рака;
этим пациентам рекомендуется эндоскопия высокого разрешения, чтобы
снизить риск пропуска небольших неопластических очагов [40–44].
БЛАГОДАРНОСТИ
Авторы признательны г-же Сюзанне Риднер за подготовку и
за редактирование рукописи.
КОНФЛИКТЫ ИНТЕРЕСОВ
Гарант статьи: Massimo Rugge.
Особые вклады авторов: Концепция и дизайн исследования: MR;
сбор данных: MF, EV, IC; ES, FF; анализ и интерпретация
данных: MR, RMG, MZ, SG, PM; оформление рукописи: MR,
RMG; статистический анализ: SG, MZ; полученное финансирование: MR.
Финансовая поддержка: эта работа была частично поддержана грантом
Итальянской ассоциации онкологических исследований (региональный грант AIRC №
6421 для MR).
Потенциальные конкурирующие интересы: Нет
Основные моменты исследования
ЧТО ТАКОЕ ТЕКУЩИЕ ЗНАНИЯ
✓ Атрофия слизистой оболочки желудка — это поле раковой опухоли, в котором встречается
наибольшее количество раковых заболеваний желудка.
✓ Протоколы эндоскопического наблюдения при атрофическом гастрите
обсуждаются.
✓ Основываясь на расширении и топографии пластических изменений atrophic-meta
, гистологическая стадия гастрита является надежным предиктором риска рака желудка
.
ЧТО ЗДЕСЬ НОВОГО
✓ При определении стадии гастрита ассоциированный с атрофией риск рака желудка
классифицируется по различным классам.
✓ Стадия гастрита имеет решающее значение при разработке индивидуальных протоколов эндоскопического наблюдения
, направленных на вторичную профилактику рака желудка
.
СПИСОК ЛИТЕРАТУРЫ
1. Колкухун А., Арнольд М., Ферлей Дж. И др. Глобальные паттерны кардии и
заболеваемости раком желудка без кардии в 2012 году. Gut. 2015; 64: 1881–88.
2. Allemani C, Weir HK, Carreira H, et al. Глобальный эпиднадзор за раком
Выживаемость 1995-2009: анализ индивидуальных данных для 25 676 887 пациентов
из 279 популяционных регистров в 67 странах (CONCORD-2).
Ланцет. 2015; 385: 977–1010.
3.Корреа П. Э. Биологическая модель желудочного канцерогенеза. IARC Sci Publ.
2004; 157: 301–10.
4. Агреус Л., Койперс Э. Дж., Купчинскас Л. и др. Обоснование диагностики и
скрининга атрофического гастрита с использованием биомаркеров плазмы, специфичных для желудка.
Сканд Дж Гастроэнтерол. 2012; 47: 136–47.
5. Парк YH, Ким Н. Обзор атрофического гастрита и кишечной метаплазии
как предракового поражения рака желудка. J Cancer Prev. 2015; 20: 25–40.
6. Graham DY. Обновление Helicobacter pylori: рак желудка, надежная терапия,
и возможные преимущества. Гастроэнтерология. 2015; 148: 719–31.e3.
7. Lee YC, Chiang TH, Chou CK, et al. Связь между эрадикацией Helicobacter
pylori и заболеваемостью раком желудка: систематический обзор и метаанализ
. Гастроэнтерология. 2016; 150: 1113–24.e5.
8. Rugge M, Genta RM, Graham DY, et al. Хроники предсказанного рака:
35 лет оценки риска рака желудка.Кишечник. 2016; 65: 721–5.
9. Рагге М., Корреа П., Диксон М.Ф. и др. Дисплазия желудка: национальная классификация Padova inter-
. Am J Surg Pathol. 2000; 24: 167–76.
10. Рагге М., Кассаро М., Ди Марио Ф. и др. Долгосрочный исход
неинвазивной неоплазии желудка. Кишечник. 2003. 52: 1111–6.
11. Dinis-Ribeiro M, Areia M, de Vries AC, et al. Ведение предраковых состояний и поражений в желудке (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта
(ESGE), Европейской группы изучения кобактеров Heli-
(EHSG), Европейского общества патологов (ESP) и
Sociedade Portuguesa de Endoscopia Digestiva (SPED).Эндоскопия.
2012; 44: 74–94.
12. Sugano K, Tack J, Kuipers EJ, et al. Киотский глобальный консенсусный отчет по гастриту
Helicobacter pylori. Кишечник. 2015; 64: 1353–67.
13. Загари Р.М., Романо М., Оджетти В. и др. Руководство по лечению инфекции Helicobacter pylori
в Италии: Консенсус Рабочей группы III
Отчет, 2015 г. Dig Liver Dis. 2015; 47: 903–12.
14. Rugge M, de Boni M, Pennelli G, et al. Гастрит OLGA-стадия и риск рака желудка
: последующее двенадцатилетнее клинико-патологическое исследование.Aliment
Pharmacol er. 2010; 31: 1104–11.
15. Рагге М., Гента РМ. Стадия и классификация хронического гастрита. Hum
Pathol. 2005; 36: 228–33.
16. Rugge M, Pennelli G, Pilozzi E, et al. Гастрит: гистологический отчет. Dig
Liver Dis. 2011; 43 (Приложение 4): S373–84.
17. Rugge M, Meggio A, Pravadelli C et al. Стадия гастрита в эндоскопическом наблюдении
для вторичной профилактики рака желудка: 5-летнее проспективное исследование
с участием 1755 пациентов.Кишечник. 2018. https://doi.org/10.1136/
gutjnl-2017-314600
18. Месколи С., Галло Лопес А., Такса Рохас Л. и др. Стадия гастрита как клинический приоритет
. Eur J Gastroenterol Hepatol. 2018; 30: 125–9.
19. Capelle LG, de Vries AC, Haringsma J, et al. Определение стадии гастрита с помощью
системы OLGA с использованием кишечной метаплазии в качестве точной альтернативы
для атрофического гастрита. Gastrointest Endosc. 2010; 71: 1150–8.
20.Сато К., Осава Х., Йошизава М. и др. Оценка атрофического гастрита
по системе OLGA. Helicobacter. 2008; 13: 225–9.
21. Маркос-Пинто Р., Карнейро Ф., Динис-Рибейро М. и др. У родственников первой степени родства
пациентов с ранним началом рака желудка обнаруживается высокая распространенность поздних стадий OLGA / OLGIM и дисплазии даже в молодом возрасте
. Ali-
ment Pharmacol er. 2012; 35: 1451–9.
22. Cho SJ, Choi IJ, Kook MC, et al. Стадирование рака желудка
кишечного и диффузного типов с помощью систем стадирования OLGA и OLGIM.Aliment
Pharmacol er. 2013; 38: 1292–302.
23. Нам Дж. Х., Чой И. Дж., Кук М. С. и др. Распределение стадий OLGA и OLGIM
в зависимости от возраста и статуса Helicobacter pylori среди корейского населения.
Хеликобактер. 2014; 19: 81–9.
24. Bornschein J, Dingwerth A, Selgrad M, et al. Аденокарциномы в разных позициях на гастроэзофагеальном переходе обнаруживают четкую ассоциацию
с гастритом и предопухолевыми состояниями желудка.Eur J Gastroenterol
Hepatol. 2015; 27: 492–500.
25. Бен Слама С., Бен Гачем Д., Дауи А. и др. Helicobacter pylori
гастрит: оценка систем стадирования OLGA и OLGIM. Пан Афр Мед
Дж. 2016; 23:28.
26. Zhou Y, Li HY, Zhang JJ, et al. Оперативная ссылка на стадию оценки гастрита
является подходящим предиктором раннего рака желудка. Мир Дж. Гастроэнтерол.
2016; 22: 3670–8.
27. Ван X, Лу Б., Мэн Л. и др.Корреляция между гистологическим гастритом
, стадия — «OLGA / OLGIM», и тестом на пепсиноген в сыворотке при оценке атрофии желудка
/ кишечной метаплазии в Китае. Сканд Дж Гастроэнтерол. 2017; 52: 822–7.
28. Kim YI, Kook MC, Cho SJ et al. Влияние участка биопсии на обнаружение газа —
трех групп риска рака по стадиям OLGA и OLGIM. Helicobacter.
2017; 22. https://doi.org/10.1111/hel.12442.
29. Рагге М., Гента Р.М., Ди Марио Ф. и др.Рак желудка как предотвратимая болезнь
. Clin Gastroenterol Hepatol. 2017; 15: 1833–43.
30. den Hoed CM, Holster IL, Capelle LG, et al. Наблюдение за предраковыми
очагами у пациентов с риском прогрессирования рака желудка. Эндоскопия.
2013; 45: 249–56.
31. Рагге М., Корреа П., Ди Марио Ф. и др. ОЛЬГА Стадия гастрита: Туто-
риал. Dig Liver Dis. 2008. 40: 650–8.
Какова система классификации хронического гастрита?
Szabo IL, Cseko K, Czimmer J, Mozsik G.Диагностика гастрита — обзор от ранней патологической оценки до современного лечения. Мозик Г, изд. Текущие темы по гастриту — 2012 . Риека, Хорватия: In Tech; 2012. Глава 1. [Полный текст].
Уоррен Дж. Р., Маршалл Б. Неопознанные изогнутые бациллы на эпителии желудка при активном хроническом гастрите. Ланцет . 4 июня 1983 г., 1 (8336): 1273-5. [Медлайн].
Гао Л., Век Миннесота, Штегмайер С., Ротенбахер Д., Бреннер Х.Употребление алкоголя и хронический атрофический гастрит: популяционное исследование среди 9 444 пожилых людей из Германии. Инт Дж. Рак . 2009 15 декабря. 125 (12): 2918-22. [Медлайн].
Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996 20 октября (10): 1161-81. [Медлайн].
Сепульведа А.Р., Патил М.Практический подход к патологической диагностике гастрита. Arch Pathol Lab Med . 2008 октябрь 132 (10): 1586-93. [Медлайн].
Pounder RE, Ng D. Распространенность инфекции Helicobacter pylori в разных странах. Aliment Pharmacol Ther . 1995. 9 Suppl 2: 33-9. [Медлайн].
Johnson KS, Ottemann KM. Колонизация, локализация и воспаление: роль хемотаксиса H. pylori in vivo. Curr Opin Microbiol .2017 декабрь 1. 41: 51-7. [Медлайн].
Mommersteeg MC, Yu J, Peppelenbosch MP, Fuhler GM. Генетические факторы хозяина в канцерогенезе, индуцированном Helicobacter pylori: новые парадигмы. Biochim Biophys Acta . 2017 24 ноября 1869 (1): 42-52. [Медлайн].
Leker K, Lozano-Pope I, Bandyopadhyay K, Choudhury BP, Obonyo M. Сравнение липополисахаридного состава двух различных штаммов Helicobacter pylori. BMC Microbiol .2017 декабрь 4. 17 (1): 226. [Медлайн].
McColl KE. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med . 29 апреля 2010 г., 362 (17): 1597-604. [Медлайн].
Консенсусная конференция NIH. Helicobacter pylori при язвенной болезни. Группа разработки консенсуса NIH по Helicobacter pylori при язвенной болезни. ЯМА . 6 июля 1994 г. 272 (1): 65-9. [Медлайн].
Шиотани А., Нургалиева З. З., Ямаока Ю., Грэм Д. Я.Helicobacter pylori. Мед Клин Норт Ам . 2000 сентябрь 84 (5): 1125-36, viii. [Медлайн].
Ihan A, Pinchuk IV, Beswick EJ. Воспаление, иммунитет и вакцины от инфекции Helicobacter pylori. Хеликобактер . 2012 Сентябрь 17 (Дополнение 1): 16-21. [Медлайн]. [Полный текст].
Wilson KT, Crabtree JE. Иммунология Helicobacter pylori: понимание неудач иммунного ответа и перспективы исследований вакцин. Гастроэнтерология .2007 июл.133 (1): 288-308. [Медлайн].
Zalewska-Ziob M, Adamek B, Strzelczyk JK, et al. Экспрессия TNF-альфа в слизистой оболочке желудка людей, инфицированных различными вирулентными штаммами Helicobacter pylori. Медицинский научный мониторинг . 2009 июня, 15 (6): BR166-71. [Медлайн].
Adamsson J, Ottsjo LS, Lundin SB, Svennerholm AM, Raghavan S. Желудочная экспрессия IL-17A и IFNγ у лиц, инфицированных Helicobacter pylori, связана с симптомами. Цитокин . 2017 ноябрь 99: 30-4. [Медлайн].
Уоллес JL. Изъязвление желудка: критические события на границе нейтрофил-эндотелий. Может J Physiol Pharmacol . 1993, январь 71 (1): 98-102. [Медлайн].
Грэм Д. Ю., Опекун А., Лью Г. М., Эванс Д. Д. Младший, П. Д. Кляйн, Д. Г. Эванс. Устранение повышенного высвобождения гастрина, вызванного приемом пищи, у пациентов с язвой двенадцатиперстной кишки после устранения инфекции Helicobacter (Campylobacter) pylori. Ам Дж. Гастроэнтерол . 1990 апр. 85 (4): 394-8. [Медлайн].
Грэм Д. Ю., Гоу М. Ф., Лью Г. М., Гента Р. М., Рехфельд Дж. Ф. Инфекция Helicobacter pylori и повышенное выделение гастрина. Эффекты воспаления и обработки прогастрина. Сканд Дж. Гастроэнтерол . 1993 28 августа (8): 690-4. [Медлайн].
Салама Н.Р., Хартунг М.Л., Мюллер А. Жизнь в желудке человека: стратегии сохранения бактериального патогена Helicobacter pylori. Нат Рев Микробиол . 2013 июн.11 (6): 385-99. [Медлайн]. [Полный текст].
Gao L, Weck MN, Nieters A, Brenner H. Обратная связь между провоспалительным генетическим профилем и серопозитивностью Helicobacter pylori среди пациентов с хроническим атрофическим гастритом: усиленное устранение инфекции во время прогрессирования заболевания ?. Eur J Cancer . 2009 ноябрь 45 (16): 2860-6. [Медлайн].
Wang SY, Shen XY, Wu CY и др.Анализ профилей полногеномной экспрессии хронического атрофического гастрита, связанного с Helicobacter pylori, с генотипами IL-1B-31CC / -511TT. J Dig Dis . 2009 Май. 10 (2): 99-106. [Медлайн].
Paniagua GL, Monroy E, Rodriguez R, et al. Частота маркеров вирулентности vacA, cagA и babA2 в штаммах Helicobacter pylori, выделенных от мексиканских пациентов с хроническим гастритом. Анн Клин Микробиол Антимикроб . 2009 30 апр. 8:14. [Медлайн]. [Полный текст].
Антонио-Ринкон Ф, Лопес-Видаль Y, Кастильо-Рохас G и др. Остров патогенности генотипов cag, vacA и IS605 в мексиканских штаммах Helicobacter pylori, ассоциированных с пептическими язвами. Анн Клин Микробиол Антимикроб . 2011 13 мая, 10:18. [Медлайн]. [Полный текст].
Conteduca V, Sansonno D, Lauletta G, Russi S, Ingravallo G, Dammacco F. Инфекция H.pylori и рак желудка: современное состояние (обзор). Инт Дж. Онкол .2013 Январь 42 (1): 5-18. [Медлайн].
Уэмура Н., Окамото С., Ямамото С. и др. Инфекция Helicobacter pylori и развитие рака желудка. N Engl J Med . 2001 13 сентября. 345 (11): 784-9. [Медлайн].
Judaki A, Norozi S, Ahmadi MRH, Ghavam SM, Asadollahi K, Rahmani A. Расширение, опосредованное потоком, и толщина интимы сонной артерии у пациентов с хроническим гастритом, связанным с инфекцией Helicobacter pylori. Арк Гастроэнтерол .2017 декабрь 54 (4): 300-4. [Медлайн].
Чжао Б., Чжао Дж., Ченг В.Ф. и др. Эффективность эрадикационной терапии Helicobacter pylori при функциональной диспепсии: метаанализ рандомизированных контролируемых исследований с 12-месячным периодом наблюдения. Дж Клин Гастроэнтерол . 2014 Март 48 (3): 241-7. [Медлайн].
Delgado JS, Landa E, Ben-Dor D. Гранулематозный гастрит и инфекция Helicobacter pylori. Иср Мед Ассо Дж. . 2013 июн.15 (6): 317-8.[Медлайн].
Ueno M, Shimodate Y, Yamamoto S, Yamamoto H, Mizuno M. Рак желудка, связанный с рефрактерным цитомегаловирусным гастритом. Клин Дж. Гастроэнтерол . 2017 г. 10 (6): 498-502. [Медлайн].
Neumann WL, Coss E, Rugge M, Genta RM. Аутоиммунный атрофический гастрит — патогенез, патология и лечение. Нат Рев Гастроэнтерол Гепатол . 2013 Сентябрь 10 (9): 529-41. [Медлайн].
Hung OY, Maithel SK, Willingham FF, Farris AB 3rd, Kauh JS.Гипергастринемия, карциноидные опухоли желудка 1 типа: диагностика и лечение. Дж. Клин Онкол . 2011 1 сентября. 29 (25): e713-5. [Медлайн].
Гиллиган CJ, Lawton GP, Tang LH, West AB, Modlin IM. Карциноидные опухоли желудка: биология и терапия загадочного и спорного поражения. Ам Дж. Гастроэнтерол . 1995 Март 90 (3): 338-52. [Медлайн].
Conn DA. Обнаружение антител I и II типа к внутреннему фактору. Медицинская лаборатория . 1986, апрель, 43 (2): 148-51. [Медлайн].
Экторс Н.Л., Диксон М.Ф., Гебоес К.Дж., Рутгеертс П.Дж., Десмет В.Дж., Вантраппен Г.Р. Гранулематозный гастрит: морфологический и диагностический подход. Гистопатология . 23 июля 1993 г. (1): 55-61. [Медлайн].
Wu TT, Hamilton SR. Лимфоцитарный гастрит: связь с этиологией и топологией. Am J Surg Pathol . 1999 23 февраля (2): 153-8. [Медлайн].
Вольбер Р., Оуэн Д., ДельБуоно Л., Аппельман Х., Фриман Х.Лимфоцитарный гастрит у пациентов с глютеновой спруой или спруоподобным кишечным заболеванием. Гастроэнтерология . 1990 Февраль 98 (2): 310-5. [Медлайн].
Фили К.М., Хенеган Массачусетс, Стивенс FM, Маккарти CF. Лимфоцитарный гастрит и целиакия: данные о положительной связи. Дж. Клин Патол . 1998 Март 51 (3): 207-10. [Медлайн]. [Полный текст].
Haot J, Hamichi L, Wallez L, Mainguet P. Лимфоцитарный гастрит: недавно описанная сущность: ретроспективное эндоскопическое и гистологическое исследование. Кишечник . 1988 29 сентября (9): 1258-64. [Медлайн]. [Полный текст].
Lambert R, Andre C, Moulinier B, Bugnon B. Диффузный вариолиформный гастрит. Пищеварение . 1978. 17 (2): 159-67. [Медлайн].
Makinen JM, Niemela S, Kerola T, Lehtola J, Karttunen TJ. Разрастание эпителиальных клеток и атрофия желез при лимфоцитарном гастрите: эффект лечения H. pylori. Мир Дж. Гастроэнтерол . 2003 Декабрь 9 (12): 2706-10. [Медлайн].
Ruget O, Burtin P, Cerez H, Cales P, Boyer J. Хроническая диарея, связанная с атрофией ворсинок и лимфоцитарным гастритом, вызванным тиклопидином. Гастроэнтерол Clin Biol . 1992. 16 (3): 290. [Медлайн].
Шейх РА, Prindiville TP, Pecha RE, Ruebner BH. Необычные проявления эозинофильного гастроэнтерита: серия случаев и обзор литературы. Мир Дж. Гастроэнтерол . 2009 7 мая. 15 (17): 2156-61. [Медлайн].[Полный текст].
Продам A, Jensen TS. Острая язва желудка, вызванная радиацией. Acta Radiol Ther Phys Biol . 1966, 4 августа (4): 289-97. [Медлайн].
Flobert C, Cellier C, Landi B и др. [Тяжелый геморрагический гастрит лучевого происхождения]. Гастроэнтерол Clin Biol . 1998 22 февраля (2): 232-4. [Медлайн].
Quentin V, Dib N, Thouveny F, L’Hoste P, Croue A, Boyer J. Хронический ишемический гастрит: отчет о сложном диагнозе и обзор литературы. Эндоскопия . 2006 май. 38 (5): 529-32. [Медлайн].
Chambon JP, Bianchini A, Massouille D, Perot C, Lancelevee J, Zerbib P. Ишемический гастрит: редкое, но летальное последствие ишемического синдрома целиакии. Минерва Чир . 2012 Октябрь 67 (5): 421-8. [Медлайн].
Sipponen P, Maaroos HI. Хронический гастрит. Сканд Дж. Гастроэнтерол . 2015 июн. 50 (6): 657-67. [Медлайн].
Сингхал А.В., Сепульведа, АР.Гастрит Helicobacter heilmannii: тематическое исследование с обзором литературы. Am J Surg Pathol . 2005 29 ноября (11): 1537-9. [Медлайн].
Hasegawa Y, Goto A, Nishimura S, Sukawa Y, Fujii K, Suzuki K. Цитомегаловирусный гастрит после лечения ритуксимабом. Эндоскопия . 2009 июл.41 (S 02): E199. [Медлайн].
Genta RM. Дифференциальный диагноз реактивной гастропатии. Семин Диагноз Патол . 2005 22 ноября (4): 273-83.[Медлайн].
Шапиро Дж. Л., Гольдблюм Дж. Р., Петрас РЭ. Клинико-патологическое исследование 42 пациентов с гранулематозным гастритом. Неужели существует «идиопатический» гранулематозный гастрит? Am J Surg Pathol . 1996, 20 апреля (4): 462-70. [Медлайн].
Маенг Л., Ли А., Чой К., Кан К.С., Ким К.М. Гранулематозный гастрит: клинико-патологический анализ 18 случаев биопсии. Am J Surg Pathol . 2004 июл.28 (7): 941-5. [Медлайн].
Leung ST, Chandan VS, Murray JA, Wu TT.Коллагенозный гастрит: гистопатологические особенности и связь с другими желудочно-кишечными заболеваниями. Am J Surg Pathol . 2009 Май. 33 (5): 788-98. [Медлайн].
Габриэли Д., Чикконе Ф., Капанноло А. и др. Подтипы хронического гастрита у пациентов с глютеновой болезнью до и после безглютеновой диеты. United European Gastroenterol J . 2017 5 (6) октября: 805-10. [Медлайн].
Galiatsatos P, Gologan A, Lamoureux E.Аутичный энтероколит: факт или вымысел ?. Банка J Гастроэнтерол . 2009 23 февраля (2): 95-8. [Медлайн]. [Полный текст].
Rosenberg JJ. Helicobacter pylori. Педиатр Ред. . 2010, 31 февраля (2): 85–6; обсуждение 86. [Medline].
Everhart JE, Kruszon-Moran D, Perez-Perez GI, Tralka TS, McQuillan G. Распространенность серотипа и этнические различия в инфекции Helicobacter pylori среди взрослых в Соединенных Штатах. J Заразить Dis .2000 апр. 181 (4): 1359-63. [Медлайн].
Эверхарт Дж. Э. Последние события в эпидемиологии Helicobacter pylori. Гастроэнтерол Clin North Am . 2000 Сентябрь 29 (3): 559-78. [Медлайн].
Siao D, Somsouk M. Helicobacter pylori: обзор, основанный на фактах, с акцентом на иммигрантское население. J Gen Intern Med . 2014 29 марта (3): 520-8. [Медлайн]. [Полный текст].
Nabwera HM, Nguyen-Van-Tam JS, Logan RF, Logan RP.Распространенность инфекции Helicobacter pylori у кенийских школьников в возрасте 3-15 лет и факторы риска заражения. Eur J Gastroenterol Hepatol . 2000 Май. 12 (5): 483-7. [Медлайн].
Sathar MA, Gouws E, Simjee AE, Mayat AM. Сероэпидемиологическое исследование инфекции Helicobacter pylori у детей Южной Африки. Trans R Soc Trop Med Hyg . 1997 июль-авг. 91 (4): 393-5. [Медлайн].
Заякова А., Дауд Дж.Б., Айелло А.Е.Социально-экономические и расовые / этнические модели стойкого бремени инфекции среди взрослого населения США. J Gerontol A Biol Sci Med Sci . 2009 Февраль 64 (2): 272-9. [Медлайн]. [Полный текст].
Dattoli VC, Veiga RV, da Cunha SS, Pontes-de-Carvalho LC, Barreto ML, Alcantara-Neves NM. Распространенность серотипа и потенциальные факторы риска инфекции Helicobacter pylori у детей Бразилии. Хеликобактер . 2010 15 августа (4): 273-8. [Медлайн]. [Полный текст].
Цай С.Дж., Перри С., Санчес Л., Парсоннет Дж.Инфекция Helicobacter pylori у разных поколений латиноамериканцев в районе залива Сан-Франциско. Am J Epidemiol . 2005 15 августа. 162 (4): 351-7. [Медлайн].
Lin DB, Lin JB, Chen CY, Chen SC, Chen WK. Распространенность инфекции Helicobacter pylori среди школьников и учителей на Тайване. Хеликобактер . 2007 июн. 12 (3): 258-64. [Медлайн].
Rubio CA, Befritz R, Eriksson B, Christensson B, Duvander A, Larsson B.Топографическое распределение лимфоцитарного гастрита в образцах гастрэктомии. АПМИС . 1991 сентябрь 99 (9): 815-9. [Медлайн].
Jaskiewicz K, Price SK, Zak J, Louwrens HD. Лимфоцитарный гастрит при неязвенной диспепсии. Dig Dis Sci . 1991 августа, 36 (8): 1079-83. [Медлайн].
Tanih NF, Dube C, Green E, et al. Африканский взгляд на Helicobacter pylori: распространенность инфекции среди людей, лекарственная устойчивость и альтернативные подходы к лечению. Энн Троп Мед Паразитол . 2009 Апрель 103 (3): 189-204. [Медлайн].
Gao L, Weck MN, Raum E, Stegmaier C, Rothenbacher D., Brenner H. Sibship size, Инфекция Helicobacter pylori и хронический атрофический гастрит: популяционное исследование среди 9444 пожилых людей из Германии. Int J Epidemiol . 2010 Февраль 39 (1): 129-34. [Медлайн].
Boelaert K, Newby PR, Simmonds MJ, et al. Распространенность и относительный риск других аутоиммунных заболеваний у субъектов с аутоиммунным заболеванием щитовидной железы. Am J Med . 2010 февраль 123 (2): 183.e1-9. [Медлайн].
Laberge G, Mailloux CM, Gowan K, et al. Раннее начало заболевания и повышенный риск других аутоиммунных заболеваний при семейном генерализованном витилиго. Pigment Cell Res . 2005 18 августа (4): 300-5. [Медлайн].
де Вега Сантос Т., Замаррон Морено А., Паскуаль де Пабло Е., Лопес Лопес К. [Злокачественная анемия и первичный гиперпаратиреоз]. Рев Клин Эсп . 1995 Март.195 (3): 200-1. [Медлайн].
Асака М., Кимура Т., Кудо М. и др. Связь Helicobacter pylori с пепсиногенами сыворотки у бессимптомной популяции Японии. Гастроэнтерология . 1992 марта 102 (3): 760-6. [Медлайн].
Sugiyama T, Nishikawa K, Komatsu Y, et al. Приписываемый риск H. pylori при язвенной болезни: объясняет ли снижение распространенности инфекции среди населения в целом увеличение частоты язв, не связанных с H. pylori? Dig Dis Sci . 2001 Февраль 46 (2): 307-10. [Медлайн].
О’Донохо Дж. М., Салливан П. Б., Скотт Р., Роджерс Т., Брютон М. Дж., Барлтроп Д. Рецидивирующая боль в животе и Helicobacter pylori в выборке лондонских детей по месту жительства. Acta Paediatr . 1996 августа 85 (8): 961-4. [Медлайн].
Линдквист П., Асрат Д., Нильссон И. и др. Возраст на момент заражения инфекцией Helicobacter pylori: сравнение стран с высокой и низкой распространенностью. Scand J Infect Dis . 1996. 28 (2): 181-4. [Медлайн].
Gold BD, Colletti RB, Abbott M и др. Инфекция Helicobacter pylori у детей: рекомендации по диагностике и лечению. J Педиатр Gastroenterol Nutr . 2000 31 ноября (5): 490-7. [Медлайн].
Hall CA, Beebe RT. Раннее начало злокачественной анемии у двух братьев и сестер: генетический и аутоиммунный аспекты. Br J Haematol . 1973 25 декабря (6): 751-6. [Медлайн].
Аннибале Б., Ланер Э, Фаве Г.Д. Диагностика и лечение злокачественной анемии. Curr Gastroenterol Rep . 2011 Декабрь 13 (6): 518-24. [Медлайн].
Min KU, Metcalfe DD. Эозинофильный гастроэнтерит. Immunol Allergy Clin North Am . 1991. 11: 799-813.
Ndip RN, Malange AE, Akoachere JF, MacKay WG, Titanji VP, Weaver LT. Антигены Helicobacter pylori в фекалиях бессимптомных детей в медицинских округах Буэа и Лимбе Камеруна: пилотное исследование. Trop Med Int Health . 2004 Сентябрь 9 (9): 1036-40. [Медлайн].
Ван Ф., Мэн В., Ван Б., Цяо Л. Воспаление желудка, вызванное Helicobacter pylori, и рак желудка. Cancer Lett . 2014 10 апреля. 345 (2): 196-202. [Медлайн].
Iacopini F, Consolazio A, Bosco D, et al. Окислительное повреждение слизистой оболочки желудка при хроническом атрофическом и неатрофическом гастрите с положительным результатом Helicobacter pylori до и после ликвидации. Хеликобактер .2003. 8 (5): 503-12. [Медлайн].
Уоррен-младший. Патология желудка, связанная с Helicobacter pylori. Гастроэнтерол Clin North Am . 2000 Сентябрь 29 (3): 705-51. [Медлайн].
Macintyre G, Kooi C, Wong F, Anderson R. О цитопатологии мембран вируса гепатита мышей по данным полупроницаемого лекарственного средства, ингибирующего трансляцию. Adv Exp Med Biol . 1990. 276: 67-72. [Медлайн].
Ито М., Таката С., Тацугами М. и др.Клиническая профилактика рака желудка с помощью эрадикационной терапии Helicobacter pylori: систематический обзор. Дж Гастроэнтерол . 2009. 44 (5): 365-71. [Медлайн].
Fukase K, Kato M, Kikuchi S, et al. Влияние эрадикации Helicobacter pylori на частоту метахронной карциномы желудка после эндоскопической резекции раннего рака желудка: открытое рандомизированное контролируемое исследование. Ланцет . 2 августа 2008 г. 372 (9636): 392-7. [Медлайн].
Камада Т., Хата Дж., Сугиу К. и др.Клинические особенности рака желудка, обнаруженные после успешной ликвидации Helicobacter pylori: результаты 9-летнего проспективного исследования в Японии. Aliment Pharmacol Ther . 2005 г. 1. 21 (9): 1121-6. [Медлайн].
Ямамото К., Като М., Такахаши М. и др. Клинико-патологический анализ рака желудка на ранней стадии, обнаруженного после успешной ликвидации Helicobacter pylori. Хеликобактер . 2011 июн.16 (3): 210-6. [Медлайн].
Toh BH, van Driel IR, Gleeson PA.Злокачественная анемия. N Engl J Med . 1997 13 ноября. 337 (20): 1441-8. [Медлайн].
Сджоблом С.М., Сиппонен П., Ярвинен Х. Гастроскопическое наблюдение за пациентами с пернициозной анемией. Кишечник . 1993, январь, 34 (1): 28-32. [Медлайн]. [Полный текст].
Стабильный СП. Клиническая практика. Дефицит витамина B12. N Engl J Med . 2013, 10 января. 368 (2): 149-60. [Медлайн].
Arvanitakis C. Функциональные и морфологические аномалии слизистой оболочки тонкого кишечника при пернициозной анемии — проспективное исследование. Acta Hepatogastroenterol (Штутг) . 1978 25 августа (4): 313-8. [Медлайн].
Кумар Н. Неврологические аспекты дефицита кобаламина (B12). Handb Clin Neurol . 2014. 120: 915-26. [Медлайн].
Росс В.А., Гош С., Декович А.А., Лю С., Айерс Г.Д., Клири К.Р. Эндоскопическая биопсия, диагностика острой желудочно-кишечной реакции «трансплантат против хозяина»: биопсия ректосигмоида более чувствительна, чем биопсия верхних отделов желудочно-кишечного тракта. Ам Дж. Гастроэнтерол .2008 апр. 103 (4): 982-9. [Медлайн].
Тахара Т., Шибата Т., Накамура М. и др. Картина слизистой оболочки желудка с помощью эндоскопии с узкополосной увеличительной визуализацией четко различает гистологическую и серологическую тяжесть хронического гастрита. Гастроинтест Эндоск . 2009 Август 70 (2): 246-53. [Медлайн].
Anagnostopoulos GK, Ragunath K, Shonde A, Hawkey CJ, Yao K. Диагностика аутоиммунного гастрита с помощью эндоскопии с увеличением с высоким разрешением. Мир Дж. Гастроэнтерол . 2006 28 июля, 12 (28): 4586-7. [Медлайн].
Ford AC, Marwaha A, Lim A, Moayyedi P. Какова распространенность клинически значимых эндоскопических результатов у пациентов с диспепсией? Систематический обзор и метаанализ. Клин Гастроэнтерол Гепатол . 2010 Октябрь 8 (10): 830-7, 837.e1-2. [Медлайн].
Oh B, Kim BS, Kim JW и др. Влияние пробиотиков на микробиоту кишечника во время эрадикации Helicobacter pylori: рандомизированное контролируемое исследование. Хеликобактер . 2016, 21 июня (3): 165-74. [Медлайн].
Чакраварти К., Гаур С. Роль пробиотиков в профилактике инфекции Helicobacter pylori. Карр Фарм Биотехнология . 2019. 20 (2): 137-45. [Медлайн].
Rahmani A, Abangah G, Moradkhani A, Hafezi Ahmadi MR, Asadollahi K. Коэнзим Q10 в сочетании со схемами тройной терапии улучшает окислительный стресс и перекисное окисление липидов при хроническом гастрите, связанном с H.pylori. J Clin Pharmacol . 2015 Август 55 (8): 842-7. [Медлайн].
Грэм Д.Ю., Белсон Г., Абудайе С., Осато М.С., Доре депутат, Эль-Зимайти Х.М. Дважды в день (в середине дня и вечером) четырехкратная терапия инфекции H.pylori в США. Dig Liver Dis . 2004 июн. 36 (6): 384-7. [Медлайн].
Malfertheiner P, Megraud F, O’Morain C и др. Для Европейской исследовательской группы Helicobacter Pylori (EHPSG). Современные концепции управления инфекцией Helicobacter pylori — Консенсусный отчет Маастрихта 2-2000. Aliment Pharmacol Ther . 2002 16 февраля (2): 167-80. [Медлайн].
Chetty R, Роскелл, DE. Цитомегаловирусная инфекция желудочно-кишечного тракта. Дж. Клин Патол . 1994 ноябрь 47 (11): 968-72. [Медлайн]. [Полный текст].
Griffiths AP, Wyatt J, Jack AS, Dixon MF. Лимфоцитарный гастрит, аденокарцинома желудка и первичная лимфома желудка. Дж. Клин Патол . 1994 Декабрь 47 (12): 1123-4. [Медлайн]. [Полный текст].
Ingle SB, Петля CR, Дахуре S, Бхосале СС.Изолированная желудочная болезнь Крона. World J Clin Cases . 2013 16 мая. 1 (2): 71-3. [Медлайн]. [Полный текст].
Оберхубер Г., Хирш М., Штольте М. Высокая частота поражения верхних отделов желудочно-кишечного тракта при болезни Крона. Арка Вирхова . 1998, январь, 432 (1): 49-52. [Медлайн].
Школьник Л.Е., Шин Р.Д., Брабек Д.М., Ротман Р.Д. Симптоматический саркоидоз желудка у пациента с легочным саркоидозом в стадии ремиссии. BMJ Case Rep .2012 13 июля 2012: [Medline].
Weck MN, Gao L, Brenner H. Инфекция Helicobacter pylori и хронический атрофический гастрит: ассоциации в зависимости от тяжести заболевания. Эпидемиология . 2009 июл.20 (4): 569-74. [Медлайн].
[Рекомендации] Chey WD, Wong BC, Комитет параметров практики Американского колледжа гастроэнтерологии. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2007 августа 102 (8): 1808-25. [Медлайн]. [Полный текст].
Stent A, Every AL, Chionh YT, Ng GZ, Sutton P. Супероксиддисмутаза из Helicobacter pylori подавляет выработку провоспалительных цитокинов во время инфекции in vivo. Хеликобактер . 2018 23 февраля (1). [Медлайн].
Gao X, Zhang Y, Brenner H. Ассоциации инфекции Helicobacter pylori и хронического атрофического гастрита с ускоренным эпигенетическим старением у пожилых людей. Br J Рак . 2017 Октябрь 10, 117 (8): 1211-4. [Медлайн].
Эстевам РБ, Вуд да Силва, СМП, Вуд да Силва и др. Модуляция галектина-3 и галектина 9 в слизистой оболочке желудка пациентов с хроническим гастритом и положительной инфекцией Helicobacter pylori. Патол Рес Прак . 2017 Октябрь 213 (10): 1276-81. [Медлайн].
Определение стадии гастрита с помощью системы OLGA с использованием кишечной метаплазии в качестве точной альтернативы атрофическому гастриту
https: // doi.org / 10.1016 / j.gie.2009.12.029Получить права и контентПредпосылки
Система стадирования OLGA (оперативная ссылка на оценку гастрита) основана на степени тяжести атрофического гастрита (АГ). АГ остается сложным гистопатологическим диагнозом с низким соглашением между наблюдателями, тогда как кишечная метаплазия (IM) связана с высоким соглашением между наблюдателями.
Цель
Целью этого исследования было оценить, является ли система стадирования, основанная на IM, предпочтительнее для оценки риска рака желудка.
Дизайн и настройка
Проспективное многоцентровое исследование.
Пациенты
Всего 125 пациентов, которым ранее был поставлен диагноз ИМ желудка или дисплазия.
Вмешательства
Эндоскопия под наблюдением с забором обширных биоптатов.
Основные измерения результатов
Три патолога оценили образцы биопсии в соответствии с Сиднейской классификацией. Согласие между наблюдателями было проанализировано с помощью каппа-статистики. В OLGA AG было заменено на IM, создав OLGIM.
Результаты
Согласие между наблюдателями было справедливым для дисплазии (κ = 0,4), существенным для AG (κ = 0,6), почти идеальным для IM (κ = 0,9) и улучшенным для всех стадий OLGIM по сравнению с OLGA. В целом 84 (67%) и 79 (63%) пациентов были классифицированы как I-IV стадии согласно OLGA и OLGIM, соответственно. Из пациентов с дисплазией 5 (71%) и 6 (86%) сгруппировались в III-IV стадии OLGA и OLGIM, соответственно.
Ограничение
Проспективные исследования должны подтвердить корреляцию между риском рака желудка и стадиями OLGIM.
Заключение
Замена АГ на ИМ при стадировании гастрита значительно увеличивает согласие между наблюдателями. Корреляция с тяжестью гастрита остается не менее сильной.

.gif) BMC Cancer. 2019;19(1):129.
BMC Cancer. 2019;19(1):129. , O’Morain C.A., Gisbert J.P., Kuipers E.J., Axon A.T. et al. Management of Helicobacter pylori infectionthe Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30.
, O’Morain C.A., Gisbert J.P., Kuipers E.J., Axon A.T. et al. Management of Helicobacter pylori infectionthe Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6-30. G., de Vries A.C., Haringsma J., Ter Borg F., de Vries R.A., Bruno M.J. et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis. Gastrointest Endosc. 2010;71(7):1150-1158.
G., de Vries A.C., Haringsma J., Ter Borg F., de Vries R.A., Bruno M.J. et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis. Gastrointest Endosc. 2010;71(7):1150-1158. G., Romero-Gallo J. et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018;67(7):1239-1246.
G., Romero-Gallo J. et al. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018;67(7):1239-1246. N., Amelchugova O.S. et al. Peptic Ulcer Disease and Helicobacter pylori Infection in Different Siberian Ethnicities. Helicobacter. 2017;22(1):e12322.
N., Amelchugova O.S. et al. Peptic Ulcer Disease and Helicobacter pylori Infection in Different Siberian Ethnicities. Helicobacter. 2017;22(1):e12322. Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2018;1:55-70.
Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2018;1:55-70.