диагностика и лечение заболеваний, которые она вызывает, в клинике МЕДСИ в Санкт-Петербурге
Оглавление
Бактерия Helicobacter pylori относится к грамотрицательным спиралевидным микроорганизмам и обычно «поселяется» в антральной части желудка. Продукты ее жизнедеятельности способны вызывать развитие эрозивно-язвенных, воспалительных или атрофических процессов в слизистой оболочке желудка или двенадцатиперстной кишки и провоцируют такие заболевания, как язвенная болезнь, гастрит, дуоденит и рак.
По оценкам различных авторов, во всем мире инфицированность этим микроорганизмом достигает более 60 % (15-25 % в странах Европы и Северной Америки и более 90% в странах третьего мира). В России инфицированность взрослого населения колеблется от 65% (Санкт-Петербург) до 92% Москва, Красноярск). Считают, что Helicobacter pylori распространился из Восточной Африки около 58000 лет назад. В настоящее время в 27 регионах мира выявлено 370 штаммов Helicobacter pylori.
История
Первые сведения об данном микроорганизме даны немецкими учеными в 1875 г. (бактерия не росла на известных в то время искусственных питательных средах, и это случайное открытие было забыто). Потом имеются упоминания в работах 1886 года профессора Валерия Яворского из Ягеллонского университета (назвал обнаруженную им бактерию Vibrio rugula и был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка), в 1974 г. в работах профессора И. А. Морозова (обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию). Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом. Уоррену и Маршаллу удалось выделить, изолировать и культвировать этот микроорганизм из проб слизистой оболочки желудка человека.
Протекание болезни
После попадания в желудок H. pylori, двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка. Продукты гена СagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения их фенотипа клеток. Привлечённые воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Таким образом запускается механизм воспалительных и эрозивно-язвенных изменений в слизистой оболочке желудка и двенадцатиперстной кишки и программируемой клеточной гибели клеток эпителия желудка с запуском каскада изменений слизистой желудка (каскад Cоrrea) – нормальная слизистая – атрофия слизистой желудка – метаплазия – дисплазия – рак. Эксперты Всемирной Организации Здравоохранения признали микроорганизм Helicobacter pylori абсолютно доказанным канцерогеном 1 класса. В России ежегодно регистрируется более 37000 новых случаев рака желудка. Эта патология заняла четвертое место среди опухолевых заболеваний и второе место по структуре смертности от онкологической патологии.
Продукты гена СagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения их фенотипа клеток. Привлечённые воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Таким образом запускается механизм воспалительных и эрозивно-язвенных изменений в слизистой оболочке желудка и двенадцатиперстной кишки и программируемой клеточной гибели клеток эпителия желудка с запуском каскада изменений слизистой желудка (каскад Cоrrea) – нормальная слизистая – атрофия слизистой желудка – метаплазия – дисплазия – рак. Эксперты Всемирной Организации Здравоохранения признали микроорганизм Helicobacter pylori абсолютно доказанным канцерогеном 1 класса. В России ежегодно регистрируется более 37000 новых случаев рака желудка. Эта патология заняла четвертое место среди опухолевых заболеваний и второе место по структуре смертности от онкологической патологии.
Диагностика и лечение
По Киотскому консенсусу, консенсусу Маастрихт V, рекомендаций Российской гастроэнтерологической ассоциации рассмотрены вопросы диагностики и оптимизации эрадикационной терапии Нр.

Хеликобактер пилори: история открытия
В сказках бывают заколдованные предметы. Человек ходит вокруг них, но не может обнаружить. История открытия бактерии хеликобактер пилори напоминает такую сказку. В ней нет волшебства. Чтобы добраться до истины, потребовались разум, самоотверженность и упорство. И от этого история становится особенно захватывающей.
Таинственная спираль
Долгое время считалось, что среда желудка стерильна. Ведь в состав желудочного сока входит соляная кислота. Возможность существования бактерий в такой среде вызывала серьёзные сомнения. Поэтому изучению желудочной микрофлоры уделяли мало внимания.
Однако во все времена для учёных не существует мелочей. Несколько раз люди вплотную подходили к открытию бактерии. Более чем за век до Маршалла и Уоррена немецкие физиологи обнаружили неведомый ранее микроорганизм в слизистой оболочке желудка собак и человека. Что помешало открытию? Учёные так и не смогли вырастить колонию, пригодную для изучения. Микроорганизм не размножался на известных в тот момент питательных средах.
Более чем за век до Маршалла и Уоррена немецкие физиологи обнаружили неведомый ранее микроорганизм в слизистой оболочке желудка собак и человека. Что помешало открытию? Учёные так и не смогли вырастить колонию, пригодную для изучения. Микроорганизм не размножался на известных в тот момент питательных средах.
В 1886 году Валерий Яворский – профессор Ягеллонского университета в Кракове – обнаружил спиралевидную бактерию в промывных водах человеческого желудка. Профессор назвал её Vibrio rugula, составил подробное описание и даже выдвинул гипотезу о её влиянии на развитие желудочных заболеваний. Публикация вышла в свет в 1889 году. Однако в научных кругах версию Яворского оставили без внимания. Во-первых, за пределами Польши мало кто интересовался изданиями на польском языке. Во-вторых, сказалось убеждение: кислая среда стерильна.
В 1893 году подобное описание составил итальянский врач Джулио Бидзодзеро. Его работа также осталась без внимания.
В 1913 году датский микробиолог Йоханнес Фибигер обнаружил, что у крыс и мышей, употреблявших заражённую бактериями пищу, может развиваться рак желудка.
До 70-х годов ХХ века появлялись и другие исследования, авторы которых вплотную подошли к открытию хеликобактер пилори. Многим не хватило одного шага.
Терпение, труд и один счастливый случай
Во второй половине ХХ века арсенал диагностических методов существенно вырос. В частности, появились эндоскопические исследования, позволяющие взять фрагмент слизистой для исследования (биопсия). Ткани для исследования почти всегда брали у пациентов с язвенной болезнью и опухолями желудка, а иногда и при тяжёлых гастритах. Австралийский учёный Робин Уоррен обнаружил, что у большинства пациентов в биоптате (кусочек полученной при биопсии ткани для анализа) присутствует спиралевидная бактерия. Уоррен собрал большой материал, классифицировал образцы биоптата по патоморфологическим характеристикам, но работе не хватало клинического осмысления.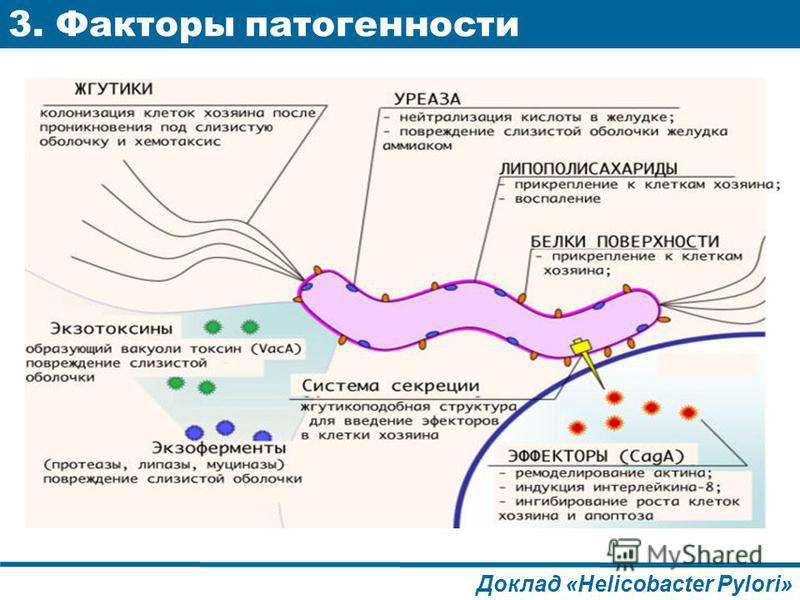
В этот период на работу в Королевский госпиталь города Перта устроился молодой учёный Барри Маршалл. Он мечтал стать кардиологом, но в 1981 году обстоятельства привели его в отделение гастроэнтерологии. Там и состоялось знакомство Робина Уоррена и Барри Маршалла. Уоррен оценил юного коллегу: тот был открыт новому, в то время как большинство врачей продолжало пренебрежительно относиться к роли желудочной микрофлоры. Вскоре Маршалл включился в работу. Учёные впервые смогли вырастить недооткрытый предшественниками микроорганизм на искусственных питательных средах. Помог случай. Результата обычно ждали по 48 часов. Но одну чашку Петри с культурой перед пасхальными каникулами забыли в инкубаторе. Рост бактерий обнаружился через 5 дней. Загадочной спирали просто требовалось больше времени.
Сперва бактерию назвали Campylobacter pylori, но в 1989 году анализ ДНК показал, что она не принадлежит к роду Campylobacter. Обитающая в желудке бактерия получила новое имя – Helicobacter pylori (хеликобактер пилори).
Требовалось экспериментальное подтверждение её влияния на возникновение гастрита и язвенной болезни. Медицинское сообщество считало теорию далёкой от истины, первые опыты на животных не дали убедительного результата, согласовать исследование с участием людей было трудно. Барри Маршалл решил поставить эксперимент на себе.
Жертвенник науки
В 1984 году Барри Маршалл добровольно выпил жидкость, содержащую бактериальную культуру. Вскоре после этого у учёного развился гастрит. Эндоскопическое исследование подтвердило наличие хеликобактер пилори. Маршалл ожидал такого результата, но впоследствии признался, что был застигнут врасплох тяжестью инфекции. Следующим этапом эксперимента стал двухнедельный курс лечения метронидазолом и солями висмута. После антибактериальной терапии симптомы заболевания исчезли, а эндоскопия показала отсутствие бактерий в желудке.
Отчаянный шаг Барри Маршалла привлёк внимание учёных всего мира. Медицинский исследовательский совет Австралии согласился финансировать дальнейшую работу. В Великобритании исследование повторил Мартин Скирроу. Вскоре выяснилось, что во многих случаях хеликобактер пилори является причиной гастрита, дуоденита, язв желудка и двенадцатиперстной кишки, некоторых видов опухолей желудка (в том числе рака). Подтвердилась эффективность антибиотиков в лечении вызванных бактерией гастрита и язвы.
В Великобритании исследование повторил Мартин Скирроу. Вскоре выяснилось, что во многих случаях хеликобактер пилори является причиной гастрита, дуоденита, язв желудка и двенадцатиперстной кишки, некоторых видов опухолей желудка (в том числе рака). Подтвердилась эффективность антибиотиков в лечении вызванных бактерией гастрита и язвы.
В 2005 году Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по физиологии и медицине.
Хеликобактер пилори: значение, обнаружение, лечение.
Хеликобактер пилори: значение, обнаружение, лечение.
11 Июля 2018
Бактерия Helicobacter pylori имеет общемировое значение, ею, в той или иной степени, инфицировано население всех стран мира, в том числе и Беларуси. По официальной медицинской статистике этот микроорганизм паразитирует в организме приблизительно у 80% всего взрослого населения. Хеликобактерная инфекция виновна почти в 90% хронических гастритов, зарегистрированных у пациентов лечебных учреждений Беларуси.
Давайте разберёмся поподробнее, что из себя представляет многоножка по имени — Helicobacter pylori, и почему вокруг неё столько шума.На сегодняшний день достоверно установлена связь Helicobacter pylori, обитающей в желудочно-кишечном тракте человека, с имеющимся у него хроническим гастритом, повышенным риском язвообразования и, что особенно страшно, развитием такого грозного заболевания, как рак желудка. Жизнедеятельность этого жгутикового микроорганизма наносит непоправимый вред органам пищеварения человека.
Хеликобактер пилори по праву можно назвать единственной в своем роде: только эта бактерия может существовать в агрессивной кислотной среде желудка. Благодаря наличию жгутиков, Хеликобактер пилори способна передвигаться и очень быстро и прочно внедряться в слизистую оболочку желудка. Кроме того, бактерия выделяет вокруг себя аммиак, который нейтрализует кислую среду желудка вокруг нее. Эти две особенности позволяют бактерии Хеликобактер пилори закрепляться на стенках желудка и паразитировать там многие годы. При этом продукты жизнедеятельности бактерии вызывают воспалительные процессы в слизистой желудка и двенадцатиперстной кишки, вследствие чего образуются эрозии и язвы и повышается риск развития злокачественных новообразований.
При этом продукты жизнедеятельности бактерии вызывают воспалительные процессы в слизистой желудка и двенадцатиперстной кишки, вследствие чего образуются эрозии и язвы и повышается риск развития злокачественных новообразований.
Всё вышенаписанное заставило медиков в обязательном порядке проводить тест на наличие Helicobacter pylori при любых хронических заболеваниях пищевода, желудка и 12-перстной кишки. И это особенно актуально при обнаружении язвы желудка или 12-перстной кишки! Если Хеликобактер пилори обнаружена, то проводится курс антибиотикотерапии для её устранения (эта процедура получила название – эрадикация Helicobacter pylori).
Так как же можно заподозрить присутствие Helicobacter pylori?
Обратите внимание на наличие у себя следующих симптомов:
- Частые запоры и поносы
- Изжога
- Тошнота
- Тяжесть и боль в животе
- Рвота
- Отрыжка
- Аллергия
- Плохая усваиваемость мясных продуктов
- Выпадение волос
- Неприятный привкус и запах изо рта (при отсутствии проблем с зубами)
- Грибковые заболевания ногтей и их чрезмерная ломкость
- Быстрое насыщение после еды
- Периодическая боль в желудке, прекращающаяся вскоре после приема пищи.

Если что-то подобное Вас беспокоит, то это повод обратиться к врачу для назначения исследования на наличие Helicobacter pylori. А если Вам уже был выставлен один из следующих диагнозов: гастроэзофагиальная рефлюксная болезнь, хронический гастрит, язва желудка или 12-перстной кишки, а тест на наличие Helicobacter pylori не был проведён, то его необходимо произвести незамедлительно. Без него применяемые методы лечения, скорее всего, окажутся неэффективны!Как можно обнаружить у человека Хеликобактер пилори?
Наиболее распространены и информативны следующие методы диагностики: морфологическое исследование биоптатов из желудка, полученных во время ФЭГДС. Это наиболее точный метод диагностики. Кроме того, он позволяет своевременно обнаружить другие заболевания желудка, а также оценить степень воспаления, атрофии и вероятности развития рака.
Помимо этого, широко применяются биохимические методы диагностики, основанные на анализе продуктов жизнедеятельности Хеликобактер пилори: уреазный тест с биоптатами (тоже выполняется при ФЭГД) и анализ выдыхаемого воздуха (аэротест, при котором в выдыхаемом воздухе определяется содержание 13С после принятия пациентом внутрь мочевины, предварительно меченной указанным изотопам).
Врач поможет Вам подобрать оптимальный метод диагностики Хеликобактер пилори и необходимый минимум дополнительных обследований. После обследования наступает ответственный этап лечебных мероприятий, которые должны быть подобраны индивидуально для Вашего организма, с учётом всех показаний и противопоказаний.
Не занимайтесь самолечением! Квалифицированная медицинская помощь – залог успеха в борьбе с любой болезнью!
Данную статью подготовил:
Врач-терапевт первой квалификационной категории Курапёнок Евгений Александрович.
Хеликобактер Пилори (Helicobacter pylori) в медицинском центре «Академия здоровья»
Стоимость услуги225р
Хеликобактер пилори – спиральные грам-отрицательные бактерии, которые были обнаружены на слизистой оболочке желудка более полувека назад, но они не вызывали особого интереса до начала 1980-х гг. , когда был разработан метод культивирования организмов из биопсийного материала слизистой оболочки.
В 1983 г. австралийский врач Барри Маршалл обнаружил, что H. pylori почти всегда присутствует в желудке пациентов, страдающих хроническим гастритом или язвой. Бактерии, сами по себе, язвы желудка или двенадцатиперстной кишки не вызывают, однако, провоцируют воспалительные процессы в желудке и ослабляют естественную защиту слизистой от воздействия кислотной среды желудка; при этом H. pylori стимулирует гиперсекрецию соляной кислоты, воздействуя на механизмы ее регуляции.
Если проводимая терапия приводит к снижению кислотности желудка, то язва может затянуться, но после прекращения лечения существует вероятность ее повторного возникновения. Длительные наблюдения показали, что у больных, не получавших лечение против H. pylori, язва рецидивирует через 2 года в 100 %, а у пролеченных пациентов возникает повторно (обычно вследствие реинфекции H. pylori) только в 5-10 %. Источником заражения H. pylori является инфицированный человек, кошки, свиньи, крупный рогатый скот и обезьяны (макака-резус). Чаще заражение происходит через загрязнённую фекалиями воду и пищу (овощи, при поливе которых использовалась загрязненная вода).
Объектом передачи инфекционного начала могут быть загрязнённые руки, слюна, капли слюны или мокроты при кашле. Исследования, проведенные медиками из США, показали, что H.pylori можно считать семейной инфекцией, и, если в семье выявлен носитель H.pylori, то вероятность остальных членов семьи оказаться инфицированными составляет 95%. Обнаружение хеликобактера методом ПЦР позволяет значительно быстрее установить диагноз, проводить контроль лечения. Материалом для исследования могут служить желудочные аспираты, кал, слюна.
, когда был разработан метод культивирования организмов из биопсийного материала слизистой оболочки.
В 1983 г. австралийский врач Барри Маршалл обнаружил, что H. pylori почти всегда присутствует в желудке пациентов, страдающих хроническим гастритом или язвой. Бактерии, сами по себе, язвы желудка или двенадцатиперстной кишки не вызывают, однако, провоцируют воспалительные процессы в желудке и ослабляют естественную защиту слизистой от воздействия кислотной среды желудка; при этом H. pylori стимулирует гиперсекрецию соляной кислоты, воздействуя на механизмы ее регуляции.
Если проводимая терапия приводит к снижению кислотности желудка, то язва может затянуться, но после прекращения лечения существует вероятность ее повторного возникновения. Длительные наблюдения показали, что у больных, не получавших лечение против H. pylori, язва рецидивирует через 2 года в 100 %, а у пролеченных пациентов возникает повторно (обычно вследствие реинфекции H. pylori) только в 5-10 %. Источником заражения H. pylori является инфицированный человек, кошки, свиньи, крупный рогатый скот и обезьяны (макака-резус). Чаще заражение происходит через загрязнённую фекалиями воду и пищу (овощи, при поливе которых использовалась загрязненная вода).
Объектом передачи инфекционного начала могут быть загрязнённые руки, слюна, капли слюны или мокроты при кашле. Исследования, проведенные медиками из США, показали, что H.pylori можно считать семейной инфекцией, и, если в семье выявлен носитель H.pylori, то вероятность остальных членов семьи оказаться инфицированными составляет 95%. Обнаружение хеликобактера методом ПЦР позволяет значительно быстрее установить диагноз, проводить контроль лечения. Материалом для исследования могут служить желудочные аспираты, кал, слюна.
Helicobacter pylori — симптомы и диагностика хеликобактер пилори.
Хеликобактер пилори — это спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки.
Заболевания желудочно-кишечного тракта (гастрит, гастродуоденит, язвенная болезнь 12-перстной кишки) занимают лидирующее место среди хронических заболеваний. Причиной этих заболеваний может стать стресс, курение, злоупотребление алкогольными напитками, наркомания, частый и необоснованный прием лекарств, генетическая предрасположенность, наследственность (близкие родственники с гастритом, язвенной болезнью, раком желудка). Но основным этиологическим фактором является инфекция Helicobacter pylori — одна из наиболее широко распространенных хронических инфекций человека.
В 1983 г. австралийские ученые Б. Маршалл и Р. Уоррен открыли, что этот микроб почти всегда присутствует у пациентов с язвой желудка и 12-перстной кишки.
Сейчас врачи считают, что Helicobacter pylori связан с большей частью случаев хронического гастрита, язвенной болезни желудка и 12-перстной кишки, злокачественными опухолями желудка, аденокарциномой и экстранодальной В-клеточной лимфомой.
В одних случаях эта бактерия вызывает воспаление слизистой оболочки и усиление выработки соляной кислоты, что позже может вызвать появление язвы, в других — развитие атрофии с риском дальнейшего формирования рака желудка.
Helicobacter pylori — микроорганизм, который поразил 60% населения Земли.
Как происходит заражение?
Инфекция Helicobacter pylori распространяется путем передачи от человека к человеку. Микроб является анаэробом, то есть погибает на воздухе, а передается в слюне и слизи.
Заражение желудка происходит внутри семьи или других тесно общающихся групп. И заражение происходит легко и просто:
- при пользовании общими предметами гигиены;
- при использовании одной и той же посуды;
- несоблюдение правил гигиены;
- скученности проживания.
Часто инфекция передается от матери к ребенку (через слюну, попавшую на соску, ложку и другие предметы). Заразиться инфекцией Helicobacter pylori можно даже при поцелуе.
Хеликобактерная инфекция — это семейная проблема. В 95% случаев заражение одного члена семьи ведет к инфицированию всей семьи.
Достаточно длительное время люди могут и не знать, что у них в организме есть эта бактерия. Когда у человека ослаблен иммунитет, бактерия начинает своё разрушительное действие. Человек может безрезультатно лечиться от других болезней, пока не узнает в чем дело.
Симптомы хеликобактер пилори
- изжога;
- запоры и поносы;
- тошнота, отрыжка, рвота;
- неприятный запах изо рта;
- аллергия;
- быстрое насыщение после еды;
- тяжесть в желудке и боль, которые прекращаются после приема пищи;
- грибковые заболевания ногтей и их чрезмерная ломкость;
- выпадение волос.
Диагностика хеликобактерной инфекции:
Самым распространенным методом диагностики хеликобактерной инфекции является дыхательный тест.
Хелик-тест — это неинвазивная диагностика инфекции Helicobacter pylori по составу выдыхаемого воздуха. Дыхательный тест Хелик предназначен для первичной диагностики Helicobacter pylori, а также для контроля хода антихеликобактерной терапии и проверки эффективности уже проведенной терапии.
Хелик — нагрузочный метод. Принцип его действия основан на биохимическом методе определения инфицированности бактерией Helicobacter pylori по её уреазной активности, а именно — по способности уреазы гидролизировать карбамид. Пациент принимает раствор карбамида и образующийся в ходе гидролиза газ поступает в воздух ротовой полости. В ходе тестирования сравниваются уровни содержания газа, образующегося в ходе гидролиза карбамида (нагрузки), с базальным, исходным уровнем содержания этого газа в полости рта пациента. Из всех возможных уреазопродуцентов только Helicobacter pylori проявляет столь высокую уреазную активность, вследствие которой карбамид гидролизируется исключительно быстро.
Дыхательный тест — это:
- тестирование без привлечения лаборатории;
- безопасный для детей и беременных метод, поскольку используется карбамид нормального изотопного состава;
- позволяет получить результат сразу по окончании обследования;
- позволяет проводить обследование «у постели больного» и сразу получить сведения о текущем состоянии пациента;
- с Хелик-тестом не требуется транспортировка дыхательных проб;
- результаты Хелик теста не зависят от возраста и физической активности пациента;
- реализован в компактных переносных тест-системах;
- тест-системы Хелик производят в России с 1997 г. и сертифицированы в РБ.
Как подготовиться к тестированию?
Для получения достоверных данных, пациент должен быть готов к обследованию, поэтому необходимо соблюсти следующие условия:
- обследование должно проводится утром натощак (последний прием пищи не позднее 22.00 накануне). Допускается употребление воды, но за час до обследования можно выпить не более 100 мл.
- нельзя принимать некоторые лекарственные препараты (антибиотики и антисекреторные средства в течение двух недель, противовоспалительные, антацидные препараты и анальгетики в течение пяти дней).
- нельзя принимать крепкие спиртные напитки в течение трех суток перед обследованием.
- нельзя принимать бобовые в течение суток перед обследованием.
- отказаться от жевательной резинки за три часа до обследования.
- не курить за три часа до обследования.
- обязательно почистить зубы и тщательно прополоскать рот.
Лечение хеликобактер пилори
Международное медицинское сообщество считает, что даже если в семье инфицированы не все, следует помнить, что Helicobacter pylori — это семейная проблема! Поэтому лечиться надо всей семье. Эти меры помогают избежать проблем и предотвратить такое грозное заболевание как рак желудка.
Полное уничтожение (эрадикация) Helicobacter pylori для позитивных больных рекомендовано в следующих случаях:
- MALT-лимфома, злокачественное новообразование;
- после резекции желудка по поводу рака;
- если ближайшие родственники больны раком;
- язва желудка и 12-перстной кишки;
- атрофический гастрит;
- иногда в связи с длительными расстройствами пищеварения для исключения других заболеваний.
Как питаться при хеликобактерной инфекции?
Диетическое питание следует согласовывать с личным врачом, но есть и общие рекомендации:
- отказ от жареных и жирных блюд;
- отказ от острых, соленых блюд, копчёностей;
- отказ от маринадов, специй и газированных напитков;
- отказ от алкоголя;
- пищу тщательно пережевывать, не употреблять слишком горячую и слишком холодную пищу;
- выпивать не менее двух литров за сутки;
- питание больного должно быть дробным, не допускающим чрезмерное растягивание желудка. Также питание должно быть регулярным — необходимо питаться в строго определенные часы, не допуская длительных интервалов между приемами пищи.
Как избежать развития хеликобактериоза?
- соблюдать правила личной гигиены;
- отказаться от вредных привычек;
- следовать принципам правильного питания;
- укреплять иммунитет.
Желаете узнать, имеется ли у Вас заболевание Helicobacter pylori? Медицинский центр «Грандмедика» при помощи дыхательного теста проводит диагностику данного недуга.
Почему Хеликобактер может вызывать болезни ЖКТ?
Хеликобактер пилори (Helicobacter pylori) – бактерия, с которой связывают возникновение некоторых болезней желудочно-кишечного тракта: язвенной болезни, рака желудка, хронического гастрита и дуоденита.1
Бактерия эта обнаруживается у 70-80 % жителей России.1 Однако не у каждого из тех, кто является носителем бактерии Хеликобактер пилори (Helicobacter pylori), развиваются симптомы болезней. Это связано с генетическими особенностями, от которых зависят защитные свойства слизистых оболочек. Есть результаты исследований, которые показывают: наличие нескольких штаммов Хеликобактер пилори (Helicobacter pylori) может вызывать более сильное воспаление слизистых оболочек и другие неблагоприятные изменения по сравнению с ситуацией, когда у больного обнаруживается лишь один штамм этой бактерии.2
Основной путь передачи хеликобактериоза – внутрисемейный. Заражение Хеликобактер пилори (Helicobacter pylori) происходит контактным путем, а также через еду и напитки.1
Почему хеликобактер вызывает воспаление?
В норме поверхность слизистой оболочки желудка защищена действием соляной кислоты. Это сильный химический агент, который уничтожает болезнетворные микробы. Хеликобактер пилори (Helicobacter pylori) выделяет специальное вещество – фермент уреазу. Она расщепляет желудочное содержимое, образуется аммиак, который и защищает эту бактерию от действия соляной кислоты. Бактерия разрушает защитный слой слизистой оболочки желудка и проникает на поверхность клеток, запуская процесс их повреждения и гибели. Хеликобактер пилори (Helicobacter pylori) способна существовать в желудке и двенадцатиперстной кишке в течение длительного времени, поддерживая воспаление и неприятные симптомы.2
Симптомы.
Проявления зависят от болезни, которая вызвана бактерией Хеликобактер пилори (Helicobacter pylori). Все связанные с этой бактерией симптомы являются неспецифическими, требуют консультации врача и дообследования.
Возможные проявления:
- Боль. Интенсивность и локализация боли зависят от болезни. При гастрите боль может быть связана с употреблением раздражающей пищи или алкоголя. При язвенной болезни могут возникать «голодные», в том числе ночные боли.3
- Диспепсия. Это комплекс разнообразных симптомов, который включает отрыжку, изжогу, тошноту и рвоту, чувство переполненности в животе, избыточное газообразование и нарушения стула.
- Другие симптомы. Иногда могут возникать и другие проявления: общая слабость, раздражительность, нарушения сна.4
Также существует вариант бессимптомного носительства хеликобактерной инфекции.8 В одном из исследований с участием жителей Москвы Хеликобактер пилори (Helicobacter pylori) был обнаружен в среднем у 88 % трудоспособных жителей: у 78 % молодых людей и у 97 % лиц в возрасте старше 61 года.8
Как определить наличие Хеликобактер пилори (Helicobacter pylori) в организме
Проведение эндоскопического исследования позволяет получить биоптат – кусочек слизистой, который затем рассматривают под микроскопом.2 Фиброгастродуоденоскопию также назначают, чтобы оценить состояние слизистой оболочки желудка и двенадцатиперстной кишки, обнаружить воспаление, язвы и другие дефекты.
Однако есть и неинвазивные тесты – анализы на Хеликобактер пилори (Helicobacter pylori), которые проводятся быстро и не требуют медицинского вмешательства:
- уреазный дыхательный тест,
- тест для определения H. pylori в кале,
- определение антител к H. pylori в крови.2
Лечение.
Схема лечения, помогающая устранению бактерии Хеликобактер пилори (Helicobacter pylori), называется эрадикационная терапия.6 Она может включать:
Примером препарата с действующим веществом висмута трикалия дицитрат может служить Улькавис®. Его фармацевтическая субстанция обладает направленной бактерицидной активностью против Хеликобактер пилори (Helicobacter pylori) и образует защитную пленку на поверхности эрозий и язвенных дефектов слизистой оболочки.6, 7 Улькавис® препятствует закреплению бактерий на поверхности слизистой и способствуют восстановлению ее поврежденных участков.6
лечение и анализы, симптомы, причины и диагностика в Москве (Красногорск, Истра, Митино, Строгино)
Геликобактер пилори: инфекция желудочно-кишечного тракта
Геликобактер пилори (Helicobacter pylori) является бактерией спиралевидной формы. Чаще всего она поражает двенадцатиперстную кишку и желудок, реже – другие отделы ЖКТ. Врачи утверждают, что приблизительно 70-90% населения мира инфицировано этой бактерией. При этом не у каждого встречаются симптомы дуоденита или гастрита, поэтому сделать гастроскопию или проходить лечение спешат не многие.
Особенности бактерии: в чем ее опасность?
Бактерия Helicobacter pylori невосприимчива к действию антибиотиков, поскольку она формирует биопленки. Эти биопленки также защищают ее от иммунной системы человека, в котором она живет. Такое высокое защитное свойство позволяет бактерии быть устойчивой к агрессивной кислой среде желудка.
Опасность инфекции заключается в том, что она становится причиной возникновения многих заболеваний. Гастриты, язвы двенадцатиперстной кишки и желудка, дуодениты, некоторые случаи рака желудка и лимфом – эти и другие заболевания часто возникают из-за наличия в организме человека коварной бактерии. Она поддерживает хронически протекающий воспалительный процесс в желудке и двенадцатиперстной кишке, а также формирует очаги метаплазии слизистой желудка.
Процесс пищеварения: нормальное протекание и пищеварение при инфицировании
Если желудочно-кишечный тракт не поражен Helicobacter pylori, процесс пищеварения происходит по обычной схеме. Желудок осуществляет химическую и механическую обработку пищи. Пищевая масса становится подходящей для дальнейшего переваривания.
Механическая обработка происходит за счет сокращений мышечных волокон, химическая – за счет воздействия ферментов и соляной кислоты. Последняя необходима также для регуляции двигательной желудочной активности и для расщепления молекул белка. Если в желудок попадают какие-либо бактерии, соляная кислота действует на них губительно.
При инфицировании Helicobacter pylori, которое происходит достаточно быстро, бактерия заселяет слизистую оболочку. Двигается бактерия благодаря жгутикам. При заселении Helicobacter pylori выделяет особые ферменты, которые расщепляют защитный слой слизи. Закрепившись на поверхности слизистой оболочки, бактерия выделяет уреазу – собственный продукт обмена.
Выделение уреазы увеличивает вокруг колонии Helicobacter pylori концентрацию аммиака. Как результат – желудочные клетки выделяют больше гастрина, который, в свою очередь, стимулирует повышение уровня пепсина и соляной кислоты. Для подтверждения того, что в организме человека вырабатывается уреаза, необязательно сделать гастроскопию – для этого проводится специальное исследование под названием уреазный дыхательный тест.
Воспаление и изъязвление желудка происходит также вследствие выделения бактериями разрушающих ферментов – какпротеаза, муциназа и липаза. Они разъедают слизистую желудка.
3 симптома геликобактерной инфекции
- Схваткообразные, колющие, давящие боли в области желудка. Как правило, боли имеют отношение к приему пищи.
- Тошнота, иногда доходящая до рвоты, потеря аппетита, слабость.
- Белый налет на языке, изо рта неприятный запах.
Диагностика Helicobacter pylori в Клинике Горбакова
Как думают многие, сделать гастроскопию для выявления Helicobacter pylori недостаточно. Существуют специальные методы диагностики, помогающие подтвердить наличие бактерии в организме:
- Неинвазивные методы (которые не требуют эндоскопии):
- дыхательный уреазный тест;
- анализ крови на выявление антител к Helicobacter pylori;
- анализ кала на определение бактерии.
- Инвазивные методы – это, прежде всего, биопсия. Во время эндоскопического исследования (можно сделать гастроскопию, ФЭГДС или ЭГДС) берут маленький кусочек ткани, который подвергают гистологическому исследованию и тестированию на наличие антигенов H.pylori и уреазы.
Диагностика может включать и гастродуоденоскопию, с помощью которой удается оценить степень воспаления и определить, есть ли сопутствующие гастроэзофагеальные и гастродуоденальные рефлюксы, эрозии, язвы и т.д. Все это в комплексе позволяет правильно подобрать лечение.
Эффективное лечение геликобактер пилори
Антигеликобактерная терапия оправдана в тех случаях, когда выявлено конкретное заболевание желудка, вызванное данной бактерией. Как уже упоминалось выше, не все 70-90% людей, в организме которых существует Helicobacter pylori, проходят лечение.
В Клинике профессора Горбакова врачи-гастроэнтерологи индивидуально подбирают лечение дуоденитов, рефлюксов, гастритов в зависимости от симптомов. Разрабатываются специальные схемы лечения с назначением антибактериальных препаратов. Длительность терапии также определяется в каждом конкретном случае.
В некоторых ситуациях может понадобиться консультация хирурга, но чаще всего терапия заключается в лечении рефлюкс-эзофагита, дуоденита, гастрита, дискинезии желчевыводящих путей и других заболеваний ЖКТ с назначением дополнительных препаратов и специальной диеты.
Хеликобактер пилори (Helicobacter pylori) является бактерией спиралевидной формы. Чаще всего она поражает двенадцатиперстную кишку и желудок, реже – другие отделы ЖКТ. Врачи утверждают, что приблизительно 70-90% населения мира инфицировано этой бактерией. При этом не у каждого встречаются симптомы дуоденита или гастрита, однако, необходимо регулярно делать гастроскопию или проходить уреазный тест на хеликобактер в целях ранней диагностики возможных обострений.
Симптомы Хеликобактер пилори
Опасность инфекции заключается в том, что она становится причиной возникновения многих заболеваний. Гастриты, язвы двенадцатиперстной кишки и желудка, дуодениты, некоторые случаи рака желудка и лимфом – эти и другие заболевания часто возникают из-за наличия в организме человека коварной бактерии. Она поддерживает хронически протекающий воспалительный процесс в желудке и двенадцатиперстной кишке, а также формирует очаги метаплазии слизистой желудка.
Бактерия Хеликобактер пилори в процессе своей жизнедеятельности формирует биопленки на поверхности слизистой желудка, что в ряде случаев делает ее невосприимчивой к действию антибиотиков, а также защищают ее от иммунной системы человека, в котором она живет. Такое высокое защитное свойство позволяет бактерии быть устойчивой к агрессивной кислой среде желудка.
Как протекает процесс пищеварения при инфицировании?
Если желудочно-кишечный тракт не поражен Helicobacter pylori, процесс пищеварения происходит по обычной схеме. Желудок осуществляет химическую и механическую обработку пищи. Пищевая масса становится подходящей для дальнейшего переваривания.
Механическая обработка происходит за счет сокращений мышечных волокон, химическая – за счет воздействия ферментов и соляной кислоты. Последняя необходима также для регуляции двигательной желудочной активности и для расщепления молекул белка. Если в желудок попадают какие-либо бактерии, соляная кислота действует на них губительно.
При инфицировании Helicobacter pylori, которое происходит достаточно быстро, бактерия заселяет слизистую оболочку. Двигается бактерия благодаря жгутикам. При заселении Helicobacter pylori выделяет особые ферменты, которые расщепляют защитный слой слизи. Закрепившись на поверхности слизистой оболочки, бактерия выделяет уреазу – собственный продукт обмена.
Выделение уреазы увеличивает вокруг колонии Helicobacter pylori концентрацию аммиака. Как результат – желудочные клетки выделяют больше гастрина, который, в свою очередь, стимулирует повышение уровня пепсина и соляной кислоты. Для подтверждения того, что в организме человека чрезмерно вырабатывается уреаза как следствие жизнедеятельности бактерии, проводится специальное исследование под названием уреазный дыхательный тест.
Воспаление и изъязвление желудка происходит также вследствие выделения бактериями разрушающих ферментов:
- протеазы;
- муциназы;
- липазы.
Они и разъедают слизистую желудка.
Симптомы развития инфекции хеликобактер:
- Схваткообразные, колющие, давящие боли в области желудка. Как правило, боли имеют отношение к приему пищи.
- Тошнота, иногда доходящая до рвоты, потеря аппетита, слабость.
- Белый налет на языке, неприятный запах изо рта.
Диагностика Хеликобактер пилори
Сделать гастроскопию для выявления Helicobacter pylori явно недостаточно. Существуют специальные методы диагностики, помогающие подтвердить наличие бактерии в организме:
- Неинвазивные методы (которые не требуют эндоскопии):
- Инвазивные методы – это, прежде всего, биопсия. Во время эндоскопического исследования (гастроскопия/ФЭГДС/ ЭГДС) берут маленький кусочек ткани, который подвергают гистологическому исследованию и тестированию на наличие антигенов H. pylori и уреазы.
Диагностика может включать и гастродуоденоскопию, с помощью которой удается оценить степень воспаления и определить, есть ли сопутствующие гастроэзофагеальные и гастродуоденальные рефлюксы, эрозии, язвы и другие заболевания. Все это в комплексе позволяет подобрать правильное лечение хеликобактер.
Лечение Хеликобактер пилори
Антихеликобактерная терапия оправдана в тех случаях, когда выявлено конкретное заболевание желудка, вызванное данной бактерией. Как уже упоминалось выше, не все 70-90% людей, в организме которых существует эта бактерия, проходят лечение от Хеликобактер пилори.
В Клинике профессора Горбакова врачи-гастроэнтерологи индивидуально подбирают схему лечения при дуоденитах, рефлюксах, гастритах в зависимости от симптомов. Разрабатываются специальные курсы с назначением антибактериальных препаратов. Длительность терапии также определяется индивидуально в каждом конкретном случае.
В некоторых ситуациях может понадобиться консультация других докторов, но чаще всего терапия заключается в лечении рефлюкс-эзофагита, дуоденита, гастрита, дискинезии желчевыводящих путей и других заболеваний желудочно-кишечного тракта с назначением дополнительных препаратов и специальной диеты.
бактерий Helicobacter Pylori | Michigan Medicine
Обзор темы
Helicobacter pylori — это тип бактерий, который является основной причиной язв желудка (желудка) и верхних отделов тонкой кишки (двенадцатиперстной кишки). Заражение H. pylori также может увеличить риск рака желудка.
Бактерии H. pylori могут вызывать язвы, разрастаясь в слизистой оболочке желудка, вызывая воспаление и вызывая более легкое повреждение желудочной и кишечной оболочки кислотой желудка.Но у большинства людей, инфицированных H. pylori , язвы не развиваются. Для формирования язвы может потребоваться дополнительный фактор, который не всегда можно идентифицировать. К таким факторам могут относиться:
- Использование определенных лекарств, таких как аспирин или другие нестероидные противовоспалительные препараты (НПВП).
- Чрезмерное употребление алкоголя.
- Прочие болезни.
H. pylori. бактерий можно уничтожить, принимая определенные антибиотики, специально предназначенные для этих бактерий.
Людям, переболевшим язвенной болезнью и инфицированным H. pylori , необходимо лечение, чтобы вылечить инфекцию, чтобы снизить риск возникновения новой язвенной болезни. Лечение комбинацией лекарств очень эффективно при лечении инфекции H. pylori . сноска 1 Иногда бактерий H. pylori устойчивы к определенным антибиотикам, которые могут удерживать лекарство от уничтожения бактерий.
Для некоторых людей, которые принимали лекарства для лечения H.pylori , может потребоваться повторный тест, чтобы убедиться, что инфекция излечена.
Ссылки
Цитаты
- Chey WD и др. (2007). Руководство Американского колледжа гастроэнтерологии по ведению инфекции Helicobacter pylori . Американский журнал гастроэнтерологии , 102 (8): 1808–1825.
Кредиты
Текущий по состоянию на: 15 апреля 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач внутренних болезней
Адам Хусни, доктор медицины, семейная медицина
По состоянию на 15 апреля 2020 г.
Chey WD, et al. (2007). Руководство Американского колледжа гастроэнтерологии по ведению инфекции Helicobacter pylori . Американский журнал гастроэнтерологии , 102 (8): 1808-1825.
Лечение инфекции Helicobacter pylori
BMJ. 2000, 1 января; 320 (7226): 31–34.
Регулярный осмотр
, терапевт a и профессор bВинк А де Бур
a Отделение внутренней медицины, Госпиталь Синт-Анна, Postbus 10, 5340 BE Oss, Нидерланды, b Отделение гастроэнтерологии и гепатологии, Академический медицинский центр, Амстердам, Нидерланды
Guido NJ Tytgat
a Отделение внутренней медицины, Госпиталь Синт-Анна, Postbus 10, 5340 BE Oss, Нидерланды, b Отделение гастроэнтерологии и гепатологии, Академический медицинский центр, Амстердам, Нидерланды
a Отделение внутренних болезней, Госпиталь Синт-Анна, Postbus 10, 5340 BE Oss, Нидерланды, b Отделение гастроэнтерологии и Гепатология, Академический медицинский центр, Амстердам, Нидерланды
Для корреспонденции: WA de Boer
This ar Этот элемент цитировался в других статьях PMC.Бактерия Helicobacter pylori может инфицировать желудок в детстве и вызывать хронический гастрит на протяжении всей жизни, который может привести к язвенной болезни. Вылечить инфекцию H pylori излечивает язвенную болезнь. 1 — 5 И поскольку повторное инфицирование у взрослых чрезвычайно редко, адекватное лечение позволяет навсегда излечить это бывшее хроническое рецидивирующее серьезное заболевание. Если язвы не рецидивируют, не происходит ни перфорации язвы, ни кровотечения; качество жизни повышается, уменьшается 7 больничных, меньше денег тратится на посещение врача и лекарства.
Необходимо учитывать устойчивость к антибиотикам при разработке лечения инфекции H pylori . 8 За последнее десятилетие было продвинуто множество различных методов лечения, и рекомендации быстро изменились. Большинство врачей сбились с пути, и сейчас используются самые разные методы лечения. 9 В этой статье мы попытаемся предоставить базовую структуру, на которой может быть основано лечение.
Сводные баллы
Терапевтическая цель состоит в том, чтобы вылечить инфекцию H. pylori у всех пациентов с язвой
Доступно несколько одинаково эффективных схем, но даже самые лучшие из них не работают у 5-20% пациентов
Устойчивость к антибиотикам обычно индуцируется после неудачи, и начальные схемы не должны ставить под угрозу будущие терапевтические возможности. кларитромицин с резервной схемой лечения на основе метронидазола, если резистентность не превышает 15%, и в этом случае порядок следует изменить на противоположный
Тройные схемы, сочетающие кларитромицин и метронидазол, не должны использоваться, поскольку не существует действительной эмпирической резервной схемы после неудачи
Методы
Эта статья основана на в основном на нашем опыте лечения инфекции H pylori .Мы основываем наши рекомендации на основных бактериологических принципах и на регулярно обновляемой внутренней компьютерной базе данных, которая содержит результаты всех опубликованных терапевтических исследований.
Кого следует лечить?
Лечение для искоренения H pylori у пациентов с доказанной язвой является экономически эффективным и приносит пользу пациенту и обществу. 10 Все пациенты с язвенными заболеваниями в анамнезе, которые часто используют кислотоподавляющие средства по требованию, поэтому нуждаются в выявлении и лечении. 3 Неясно, полезны ли антибиотики пациентам без язв. При диспепсии было предложено эмпирическое лечение антибиотиками, чтобы вылечить всех пациентов со «скрытой» язвой. 11 В группах населения с высокой частотой язвенной болезни может быть дешевле назначать антибиотики всем пациентам с диспепсией, положительным по H pylori , чем обследовать всех пациентов с диспепсией для выявления тех, у кого есть язвы.
Выбор режима
Выбор лечения на основе фактических данных невозможен, поскольку у нас нет крупных рандомизированных исследований, сравнивающих высокоэффективные схемы. 4 , 8 , 9 , 11 — 13 Двойное лечение ингибиторами протонной помпы теперь устарело из-за недостаточной эффективности. Несколько тройных или четверных терапий были достаточно изучены и, по-видимому, способны вылечить либо 80% (намерение лечить), либо 90% (согласно протоколу) пациентов. В таблице показаны применяемые в настоящее время методы лечения, но ни один из них не рассматривался в качестве окончательного варианта лечения. Метронидазол (или тинидазол) и кларитромицин — два ключевых антибиотика.Резистентность к антибиотикам против этих двух препаратов, первичная или индуцированная после лечения, имеет клиническое значение. 8
Двойное лечение
Двойное лечение, сочетающее ингибитор протонной помпы с амоксициллином или кларитромицином, было популярно несколько лет назад, поскольку их легко объяснить и они хорошо переносились. Теперь от них отказались, потому что они были не очень эффективны. Новый 14-дневный курс лечения ранитидином цитратом висмута плюс кларитромицин эффективен и имеет мало побочных эффектов.В рандомизированных исследованиях он превосходил другие двойные методы лечения. 14 — 16 Его легко взять и поэтому он привлекателен для общей практики.
Тройное лечение
Тройное лечение соединением висмута, тетрациклином (или амоксициллином) и метронидазолом дешево и хорошо изучено. 2 , 4 , 5 , 7 — 9 , 11 , 13 Это может вызвать побочные эффекты, но обычно они не являются серьезными и не приводят к несоблюдению требований испытания. 17 , 18 Он достигает высоких показателей излечения у чувствительных к метронидазолу штаммов через семь дней 2 , 8 , но требует 14 дней для уничтожения значительного процента устойчивых штаммов. 2 , 8 , 18 Этот режим широко используется на чувствительных к стоимости рынках, но даже в Соединенных Штатах он по-прежнему популярен. 19
Тройная терапия висмутом в основном превосходит семидневные тройные схемы с использованием ингибиторов протонной помпы; они сочетают омепразол, лансопразол или пантопразол с двумя антибиотиками.В большинстве исследований антибиотики используются два раза в день. Имеются данные о том, что оптимальная доза составляет 20 мг два раза в день для омепразола, 30 мг два раза в день для лансопразола, 20 и 40 мг два раза в день для пантопразола. 21 Подходящими антибиотиками являются метронидазол (или тинидазол), амоксициллин и кларитромицин. Несколько руководств рекомендуют тройные схемы лечения с применением ингибиторов протонной помпы в качестве лечения первой линии. 4 — 6 , 11 Ингибиторы протонной помпы чаще всего сочетаются с амоксициллином 1000 мг два раза в день и кларитромицином 500 мг два раза в день.Этот режим имеет меньше побочных эффектов, чем другие тройные режимы, 22 , но он лишь умеренно эффективен для штаммов, устойчивых к кларитромицину, и вторичная резистентность обычно индуцируется при неудаче лечения.
Ингибиторы протонной помпы иногда комбинируют с амоксициллином и метронидазолом два или три раза в день. Этот режим умеренно эффективен для штаммов, устойчивых к метронидазолу, в течение семи дней. 8 , 18 , 23 , 24 В районах с высокой распространенностью резистентности курс лечения следует увеличить до 10 или 14 дней. 18 Схемы, сочетающие ингибиторы протонной помпы с метронидазолом 400 или 500 мг и кларитромицином 250 мг или 500 мг два раза в день, менее эффективны у пациентов с первичной резистентностью к метронидазолу или кларитромицину. 22 , 24 , 25 Если лечение не дает результатов, схема может вызвать устойчивость к одному или обоим антибиотикам, используемым в этой схеме.
Разработана новая группа тройных схем, в которой ингибиторы протонной помпы заменяются цитратом висмута ранитидина.Они производят меньшее подавление кислоты, но обеспечивают дополнительное антимикробное действие висмута. У большинства пациентов с чувствительными штаммами замена ингибиторов протонной помпы на цитрат висмута ранитидина не повысит эффективность, но может предотвратить индукцию резистентности в случае неудачи лечения. Скорость излечения также может быть улучшена у пациентов с устойчивыми штаммами, хотя для подтверждения этого потребуется очень большое исследование. Пока что не было обнаружено клинически значимых различий в рандомизированных испытаниях, в которых напрямую сравнивались тройные схемы с ингибиторами протонной помпы и с ранитидином висмута цитратом.
Четырехкратное лечение
Добавление кислотоподавляющих средств увеличивает эффективность трехкратного лечения висмутом. 26 Четырехкратное лечение более эффективно с ингибиторами протонной помпы, чем с антагонистами рецептора гистамина-2 17 и когда включены тетрациклин и метронидазол. В мета-анализах четырехкратный режим имел самые высокие показатели излечения, 5 , 6 , 12 , но это также самый сложный режим с наибольшим количеством таблеток в день.Тем не менее, исследования показали хорошее соблюдение режима лечения и процент выбываний сравним с более легкой тройной терапией. 17 Семидневный курс, по-видимому, излечивает как чувствительные к метронидазолу, так и резистентные штаммы; чувствительные штаммы уничтожаются за четыре дня. 8 Высокая частота излечения на 4-й день показывает его эффективность и широкое терапевтическое окно.
Лечение второй линии
Ликвидация препарата более трудна при лечении второй линии, 27 и повторные схемы лечения, возможно, потребуется продлить.Некоторые бактерии можно легко убить (крутая кривая уничтожения), а другие бактерии убить труднее. Во время обработки субстраты с самой крутой кривой уничтожения исчезнут первыми. В случае неудачи лечения бактерии, которые являются наименее восприимчивыми, остаются. Бактерии этого «трудноубиваемого» субстрата затем увеличивают свое количество и снова заселяют желудок. Более того, такие оставшиеся штаммы также могли стать устойчивыми к одному или обоим ключевым антибиотикам. 28 По очевидным причинам пациенты, которые не соблюдают лечение, чрезмерно представлены среди тех, чье лечение не помогло.Эти факторы могут объяснить более низкие показатели излечения при повторном лечении. Некоторые авторы сообщают, что у некоторых пациентов инфекцию невозможно искоренить, 27 , но, по нашему опыту, это бывает редко.
Четырехместные схемы были предложены в качестве оптимального лечения второй линии. 11 Хотя они успешно использовались после неэффективности схем, содержащих кларитромицин, 29 — 32 результаты после схем, содержащих метронидазол, были неутешительными. 33 , 34 Большое количество «трудно убить» H pylori , которые также стали устойчивыми к метронидазолу, вызывает беспокойство. Это показывает, что идеального лечения второй линии пока не существует.
Логическая основа лечения
Если первоначальное лечение антибиотиками не дает результата, должна последовать еще одна попытка и, при необходимости, третья или четвертая, пока инфекция не будет излечена в 100% случаев. В идеале последующее лечение должно основываться на данных о восприимчивости, но эта информация часто недоступна.Ни один пациент с язвой не должен быть выписан до тех пор, пока не будет документально подтверждено эндоскопией, дыхательным тестом или шестимесячным контрольным серологическим исследованием, что H pylori устраняется. 35 Ни одна из схем в таблице не уступает и не превосходит другую. Даже самые лучшие схемы терпят неудачу в 5-20% случаев. Поэтому нам нужно сосредоточиться на том, что мы можем предложить тем, кто не излечился. Поскольку лечение для уничтожения H pylori увеличивается, количество неудач будет расти и приобретать все большее клиническое значение.Многие из этих пациентов будут направлены к специалистам.
Выбор лечения второй линии зависит от того, какое лечение использовалось изначально. Если использовалась схема на основе кларитромицина, впоследствии следует использовать схему на основе метронидазола, и наоборот (рис.). Кажется неразумным использовать один и тот же антибиотик дважды. Врачи должны выбрать набор из двух схем лечения, которые дополняют друг друга и которые при последовательном применении приблизятся к желаемому 100% излечению.
Общие принципы лечения для искоренения H. pylori
Не следует выбирать схему выбора, сочетающую кларитромицин и метронидазол.Хотя этот режим очень эффективен, неизлечимые пациенты будут иметь как минимум одиночную, а обычно двойную резистентность: 33 , 34 , 36 , 37 , и после этого не остается никакого логического эмпирического лечения. Это особенно важно в регионах с высокой распространенностью первичной резистентности к метронидазолу, где будет больше неудач лечения и, следовательно, больше двойной резистентности. 37 Двойное сопротивление может стать серьезной клинической проблемой. Таким образом, эндоскопия с посевом и тестом на чувствительность необходима после этих режимов у всех пациентов, особенно у пациентов с положительными результатами дыхательного теста, для выбора дальнейших вариантов.
Если вместо начального лечения используется метронидазол или кларитромицин в сочетании с другим антибиотиком, выбор лечения второй линии ясен с самого начала и не зависит от результатов посева. Таким образом, с этими схемами можно использовать более простой и дешевый график последующего наблюдения. 35 Посев и тестирование на чувствительность требуются только после неудачной второй попытки выбрать лечение третьей линии (рис.).
Будущие испытания необходимы для изучения последовательных комбинаций лечения.Авторы должны сосредоточиться на сообщении о чувствительности к противомикробным препаратам до и после лечения 8 , 28 и на поиске оптимального дополнительного «резервного» режима к их первоначальному лечению.
Рекомендации по лечению
Местная (географическая) распространенность устойчивости к противомикробным препаратам будет определять, лучше ли начинать с схемы на основе кларитромицина или схемы на основе метронидазола. 8 , 28 В настоящее время устойчивость к кларитромицину в большинстве популяций ниже 10%.Поэтому лечение обычно можно начинать с схемы, основанной на кларитромицине, с семидневным четырехкратным курсом (ингибитор протонной помпы, висмут, тетрациклин и метронидазол) в качестве лечения второй линии (рис.). В последующих попытках используются разные антибиотики, и два проспективных исследования показывают более 98% общего излечения при таком подходе. 31 , 32 Ранитидин цитрат висмута плюс кларитромицин используется для пациентов с аллергией на пенициллин. В первую очередь следует использовать схемы на основе метронидазола, если устойчивость к кларитромицину превышает 15%.Тройные схемы с использованием метронидазола менее эффективны для штаммов, устойчивых к первичному метронидазолу, 8 , 18 , 23 , 24 , но четырехкратная схема, похоже, работает хорошо. 8 , 26 Таким образом, его можно использовать почти во всех популяциях, и мы рекомендуем четырехкратный режим в качестве лечения первой линии, когда возникает проблема с устойчивостью к кларитромицину. Однако тройные схемы на основе метронидазола можно безопасно использовать в регионах с низкой распространенностью резистентности к метронидазолу.
Рекомендуемая стратегия лечения в регионах с низкой первичной распространенностью резистентности к кларитромицину
Схемы, содержащие как кларитромицин, так и метронидазол, не более эффективны, чем схемы с одним из этих антибиотиков. Из-за проблем с резистентностью мы предлагаем не использовать оба основных антибиотика вместе до тех пор, пока не будет доступен действующий эмпирический резервный режим.
В целом вероятность излечения может быть увеличена за счет увеличения продолжительности лечения.Хотя семидневное лечение является стандартным для тройных схем с ингибитором протонной помпы и ранитидином и цитратом висмута, вероятность успеха можно повысить, назначив 10-14-дневный курс пациентам, у которых ранее были неудачи или у которых последствия неудачи могли быть опасными для жизни — например, пациенты с осложнениями язвы, такими как кровотечение.
Таблица 1
Схемы лечения, которые неоднократно демонстрировали свою эффективность в искоренении H. pylori
| Продолжительность лечения (дни) | Компоненты лекарств | ||||
|---|---|---|---|---|---|
| Схемы на основе кларитромицина | |||||
| 14 | Ранитидин цитрат висмута 400 мг два раза в день | Кларитромицин 500 мг два раза в день | |||
| 7-10 | Ранитидин цитрат висмута 400 мг два раза в день | Амоксициллин | мг амоксициллин | мг два раза в день | |
| 7-10 | Ингибитор протонной помпы два раза в день | Амоксициллин 1000 мг два раза в день | Кларитромицин 500 мг два раза в день | ||
| Режимы на основе метронидазола42 | |||||
| 14 | Висмут со прием 4 раза в день | Тетрациклин 500 мг 4 раза в день | Метронидазол 400-500 мг 3-4 раза в день | ||
| 7-10 | Ингибитор протонной помпы два раза в день | Амоксициллин 500 мг 2- 3 раза в день | Метронидазол 400-500 мг 2-3 раза в день | ||
| 4-7 | Ингибитор протонной помпы 2 раза в день | Коллоидный субцитрат висмута 4 раза в день | Тетрациклин 500 мг 4 раза / день | Метронидазол 400-500 мг 3-4 раза в день | |
| Схемы на основе кларитромицина плюс метронидазол (или тинидазол) | |||||
| 7 | Ранитидин висмут цитрат 400 мг | дважды в день ежедневноМетронидазол 400-500 мг два раза в день | |||
| 7 | Ингибитор протонной помпы два раза в день | Кларитромицин 500 мг два раза в день | Метро нидазол 400-500 мг два раза в день | ||
Благодарности
Конкурирующие интересы: Оба автора получили финансирование для выступлений или исследовательских проектов от многих различных фармацевтических компаний, производящих некоторые из препаратов, упомянутых в этой статье.
Ссылки
1. Хопкинс Р.Дж., Жирарди Л.С., Терни Э.А. Связь между эрадикацией H. pylori и уменьшением рецидивов язвы двенадцатиперстной кишки и желудка: обзор. Гастроэнтерология. 1996; 110: 1244–1252. [PubMed] [Google Scholar] 2. Де Бур, WA, Tytgat GNJ. Лучшая терапия от инфекции Helicobacter pylori. Что должно определять наш выбор: эффективность или профиль побочных эффектов? Сканд Дж Гастроэнтерол. 1995; 30: 401–407. [PubMed] [Google Scholar] 3. Нил Г.А. Язвы выгорают или продолжают гореть? Ведение диатеза язвенной болезни двенадцатиперстной кишки в эпоху Helicobacter pylori.Am J Gastroenterol. 1997. 92: 387–392. [PubMed] [Google Scholar] 4. Penston JG. Обзорная статья: клинические аспекты эрадикационной терапии Helicobacter pylori при язвенной болезни. Алимент Pharmacol Ther. 1996; 10: 469–486. [PubMed] [Google Scholar] 5. Soll AH. Заявление о консенсусе. Медикаментозное лечение язвенной болезни. Практические рекомендации. ДЖАМА. 1996. 275: 622–629. [PubMed] [Google Scholar] 6. Ван дер Хюлст RWM, Раус EAJ, Koycu B, Keller JJ, Ten Kate FJW, Dankert J и др. После успешной ликвидации реинфекция Helicobacter pylori практически отсутствует.J Infect Dis. 1997; 176: 196–200. [PubMed] [Google Scholar] 7. Вильгельмсен И. Качество жизни и эрадикация Helicobacter pylori. Сканд Дж Гастроэнтерол. 1996; 31 (прил. 221): 18–20. [PubMed] [Google Scholar] 8. Де Бур, WA, Tytgat GNJ. Как лечить инфекцию H. pylori. Должны ли стратегии лечения основываться на тестировании чувствительности к бактериям? Личная точка зрения. Eur J Gastroenterol Hepatol. 1996. 8: 709–716. [PubMed] [Google Scholar] 9. Пенстон Дж. Г., Мистри КР. Ликвидация Helicobacter pylori в общей практике.Алимент Pharmacol Ther. 1996. 10: 139–145. [PubMed] [Google Scholar] 10. Боджер К., Дейли М.Дж., Хитли Р.В. Обзор клинической экономики: язвенная болезнь, ассоциированная с Helicobacter pylori. Алимент Pharmacol Ther. 1997. 11: 273–282. [PubMed] [Google Scholar] 11. Современные европейские концепции лечения инфекции Helicobacter pylori. отчет Маастрихтского консенсуса. Кишечник. 1997; 41: 8–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Ван дер Хюльст RWM, Келлер JJ, Раус EAJ, Tytgat GNJ. Лечение инфекции Helicobacter pylori у человека: обзор мировой литературы.Helicobacter. 1996; 1: 6–19. [PubMed] [Google Scholar] 13. Трейбер Г. Влияние дозировки препарата на эрадикацию Helicobacter pylori: анализ экономической эффективности. Am J Gastroenterol. 1996. 91: 246–257. [PubMed] [Google Scholar] 14. Kolkman JJ, Tan TG, Oudkerk Pool M, van Kleef WA, Geraedts AAM, Timmerman RJ, et al. Цитрат висмута ранитидина с кларитромицином по сравнению с омепразолом с амоксициллином в лечении инфекции Helicobacter pylori. Алимент Pharmacol Ther. 1997; 11: 1123–1129. [PubMed] [Google Scholar] 15.Pare P, Romaozinho J, Bardhan KD, French PC, Roberts PM. Цитрат висмута ранитидина более эффективен, чем омепразол, в эрадикации H.pylori при одновременном назначении с кларитромицином. Гастроэнтерология. 1997; 112: A251. [Google Scholar] 16. Мегро Ф., Пишаван Р., Палегри Д., Французский ПК, Робертс П. М.. Цитрат висмута ранитидина, назначаемый одновременно с кларитромицином, более эффективен в искоренении Helicobacter pylori, чем омепразол с кларитромицином. Кишечник. 1997; 41 (приложение 1): A92. [Google Scholar] 17.Чиба Н., Хант Р.Х. Висмут, метронидазол и тетрациклин и подавление кислоты в эрадикации H. pylori: метаанализ. Кишечник. 1996; 39 (приложение 2): A36 – A37. [Google Scholar] 18. Леранг Ф., Моум Б., Рагнхильдствейт Э., Хауг Дж. Б., Хауге Т., Толас П. и др. Сравнение тройной терапии на основе омепразола и тройной терапии на основе висмута для лечения инфекции Helicobacter pylori: проспективное рандомизированное последующее исследование через 1 год. Am J Gastroenterol. 1997. 92: 653–658. [PubMed] [Google Scholar] 19. Брейер Т., Гудман К.Дж., Малати Х.М., Судхоп Т., Грэм Д.Ю.Как практикующие врачи в США лечат желудочно-кишечные заболевания, связанные с Helicobacter pylori? Am J Gastroenterol. 1998. 93: 553–556. [PubMed] [Google Scholar] 20. Buda A, Dal BO N, Kusstatscher S, Grassi SA, Crestani B, Battaglia G, et al. Различные дозы лансопразола при эрадикационной терапии H.pylori: проспективное многоцентровое рандомизированное исследование, сравнивающее 30 мг 2 раза в день и 15 мг 2 раза в день. Кишечник. 1997; 41 (доп. 1): A92. [Google Scholar] 21. Lamouliatte H, de Mascarel A, Megraud F, Samoyeau R. Двойное слепое исследование, сравнивающее дозировку ИПП один раз в сутки и два раза в сутки для лечения H. pylori.Кишечник. 1997; 41 (приложение 1): A93. [Google Scholar] 22. Хуанг Дж. К., Уилкинсон Дж. М., Чиба Р. Х., Хант Р. Х. Однонедельный кларитромицин в дозе 500 мг два раза в день лучше, чем 250 мг два раза в день для искоренения инфекции H.pylori в сочетании с ингибитором протонной помпы и метронидазолом или амоксициллином: метаанализ. Кишечник. 1997; 41 (приложение 1): A90 – A91. [Google Scholar] 23. Thys JC, van Zwet AA, Thys WJ, van der Wouden EJ, Kooy A. Однонедельная тройная терапия омепразолом, амоксициллином и тинидазолом для инфекции Helicobacter pylori: значение устойчивости к имидазолу.Алимент Pharmacol Ther. 1997; 11: 305–309. [PubMed] [Google Scholar] 24. Мисевич Дж. Дж., Харрис А. В., Бардхан К. Д., Леви С., О’Морайн С., Купер Б. Т. и др. Однонедельная тройная терапия Helicobacter pylori: многоцентровое сравнительное исследование. Кишечник. 1997. 41: 735–739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Линд Т., Мегро Ф., Унге П., Байердорфер Э., О’Морайн С., Спиллер Р. и др. Исследование MACh3: роль омепразола в искоренении Helicobacter pylori с помощью тройной терапии в течение 1 недели. Гастроэнтерология. 1999; 116: 248–253.[PubMed] [Google Scholar] 26. Де Бур В.А., Дриссен WMM, Янс А.Р., Титгат GNJ. Влияние подавления кислоты на эффективность лечения Helicobacter pylori. Ланцет. 1995; 345: 817–820. [PubMed] [Google Scholar] 27. Бороды Т.Дж., Шортис Н.П. Лечение пациентов с неудачной эрадикацией — личное мнение. В: Hunt RH, Tytgat GNJ, редакторы. Helicobacter pylori: основные механизмы клинического лечения. Дордрехт: Kluwer Academic; 1996. С. 357–365. [Google Scholar] 28. Грэм Д.Ю., де Бур В.А., Титгат GNJ. Выбор лучшей антихеликобактерной терапии: эффект устойчивости к противомикробным препаратам.Am J Gastroenterol. 1996; 91: 1072–1076. [PubMed] [Google Scholar] 29. Де Костер Э., Де Реак, Йонас С., Денис П., Отеро Дж., Бусет М. и др. Французский тройной отлично работает в Брюсселе. Гастроэнтерология. 1997; 112: A99. [Google Scholar] 30. Ли Дж. М., Фэллон С., Бреслин Н. П., Гайд, округ Колумбия. Эрадикация H.pylori: четырехкратная терапия эффективна при неудачной тройной терапии. Гастроэнтерология. 1997; 112: A195. [Google Scholar] 31. Хуэлин Бенитес Дж., Хименес Перес М., Дуран Кампос А., Испания П., Контрерас Дж., Де ла Крус Ломбардо Дж. М. и др.Четырехкратная терапия омепразолом, тетрациклином, метронидазолом и висмутом в качестве второго варианта после неудачи первой эрадикационной терапии. Кишечник. 1998; 43 (приложение 2): A86. [Google Scholar] 32. Борда Ф., Мартинес А., Эчарри А., Хименес Дж., Родригес С., Хара С. и др. Результаты клинической практики четырехкратного лечения неэффективности эрадикации Helicobacter pylori с помощью ОСА-7. Кишечник. 1998; 43 (приложение 2): A81. [Google Scholar] 33. Годдард А.Ф., Логан Р.П., Атертон Дж. К., Хоуки Си Джей, Спиллер Р. Маастрихтский консенсусный отчет о схеме лечения инфекции H. pylori второй линии: как она работает на практике? Кишечник.1997; 41 (приложение 1): A96. [Google Scholar] 34. Peitz U, Nusch A, Sulliga M, Becker T, Stolte M, Borsch G. Лечение инфекции Helicobacter pylori второй линии. Кишечник. 1997; 41 (приложение 1): A104. [Google Scholar] 35. Кателарис PH, Джонс ДБ. Обследование на инфекцию Helicobacter pylori после лечения антибиотиками. Am J Gastroenterol. 1997. 92: 1245–1247. [PubMed] [Google Scholar] 36. Kist M, Strobel S, Folsch UR, Kirchner T, Hahn EG, von Kleist DH, et al. Проспективная оценка влияния первичной устойчивости к противомикробным препаратам на показатели излечения от инфекций Helicobacter pylori.Кишечник. 1997; 41 (приложение 1): A90. [Google Scholar] 37. Бакли MJM, Xia HX, Hyde DM, Keane CT, O’Morain CA. Резистентность к метронидазолу снижает эффективность тройной терапии и приводит к вторичной резистентности к кларитромицину. Dig Dis Sci. 1997. 42: 2111–2115. [PubMed] [Google Scholar]Что мне нужно знать об инфекциях Helicobacter pylori?
Обратите внимание: Эта информация была актуальной на момент публикации. Но медицинская информация постоянно меняется, и некоторая информация, приведенная здесь, может быть устаревшей.Для получения регулярно обновляемой информации по различным темам, связанным со здоровьем, посетите familydoctor.org, веб-сайт AAFP по обучению пациентов.
Информация от вашего семейного врача
Am Fam Physician. 2002, 1 апреля; 65 (7): 1339.
Что такое хеликобактер пилори?
Helicobacter pylori (скажем: hel-lick-o-back-ter pie-lor-ee) — это бактерии, которые могут жить в желудочной кислоте. У многих людей инфекция не вызывает никаких симптомов.У некоторых людей это может повредить слизистую оболочку желудка, что приведет к гастриту (воспалению) и язвам. Большинство пациентов с гастритом или язвой испытывают боль или жжение в верхней части живота (область над пупком). У некоторых людей инфекция H. pylori приводит к раку желудка.
Как диагностируется инфекция H. pylori?
Анализ крови — это простой способ узнать, есть ли у вас инфекция H. pylori. Вы также можете пройти тест на дыхание или стул на H. pylori. Чаще всего эти тесты используются после лечения, чтобы узнать, полностью ли прошла инфекция.
Почему я должен лечиться от инфекции H. pylori?
Если микробы H. pylori погибнут, можно вылечить язву желудка или гастрит. Многие люди принимают антациды или другие лекарства в течение длительного времени, прежде чем начнут лечить от инфекции H. pylori. После лечения от этой инфекции им не нужно принимать столько лекарства для желудка.
Если у вас гастрит, вызывающий боль, но у вас нет язвы, лечение инфекции H. pylori может не облегчить вашу боль.
Как лечится инфекция H. pylori?
Лечение включает комбинацию антибиотиков и кислотоснижающих препаратов. Вы должны принимать эти лекарства не менее 10–14 дней. Наиболее эффективные комбинации включают как минимум два антибиотика плюс кислотные редукторы. Лекарства, снижающие кислотность, облегчают боль и улучшают действие антибиотиков.
Как я могу помочь лечению?
Принимайте все прописанные лекарства. Ваше лечение может не сработать, если (1) бактерии сопротивляются антибиотикам или (2) вы не принимаете все лекарства.Очень важно принимать лекарства в течение 10–14 дней в соответствии с предписаниями врача. Первая попытка избавиться от инфекции H. pylori обычно бывает наиболее успешной, поэтому важно сделать это правильно.
Избегайте продуктов, которые могут увеличить кислотность желудка. Повышенная кислотность желудочного сока может помешать правильному действию ваших лекарств. Вы не должны принимать лекарства, повышающие кислотность желудочного сока, такие как аспирин, ибупрофен (торговая марка: Advil) или напроксен (торговая марка: Aleve). Держитесь подальше от сигарет, алкоголя, кофеина, острой пищи, кофе или чая (обычного или без кофеина).
Обратитесь к врачу. Обратитесь к врачу после того, как закончите прием лекарств. Вы можете пройти тест на дыхание или стул, чтобы убедиться, что инфекция исчезла.
Чтобы просмотреть статью полностью, войдите в систему или приобретите доступ.
Этот раздаточный материал предоставлен вам вашим семейным врачом и Американской академией семейных врачей. Другая информация, связанная со здоровьем, доступна на сайте AAFP по адресу http://familydoctor.org.
Эта информация представляет собой общий обзор и может не относиться ко всем.Поговорите со своим семейным врачом, чтобы узнать, применима ли эта информация к вам, и получить дополнительную информацию по этому вопросу.
Авторское право © 2002 Американской академией семейных врачей.
Этот контент принадлежит AAFP. Человек, просматривающий его в Интернете, может сделать одну распечатку материала и может использовать эту распечатку только в личных некоммерческих целях. Этот материал не может быть загружен, скопирован, распечатан, сохранен, передан или воспроизведен на любом носителе, известном сейчас или изобретенном позже, за исключением случаев, когда это разрешено в письменной форме AAFP.Контакт
[email protected] для вопросов об авторских правах и / или запросов на разрешение.
Инфекция Helicobacter pylori и кожные заболевания
Автор: д-р Юджин Тан, регистратор дерматологии, больница Вайкато, Гамильтон, Новая Зеландия, 2009 г.
Что такое хеликобактер пилори?
Helicobacter pylori ( H. pylori ) — это бактерии, обнаруженные в желудке, которые вызывают большинство случаев язвенной болезни. Около половины населения мира имеют бактерии, что делает их наиболее распространенной бактериальной инфекцией у людей [1].
Инфекция H. pylori чаще встречается в развивающихся странах. Риск заражения H. pylori связан с социально-экономическим статусом и плохими условиями жизни, такими как перенаселенность, отсутствие чистой проточной воды и большее количество братьев и сестер. В результате большинство детей в развивающихся странах инфицированы в возрасте до 10 лет.
В Новой Зеландии распространенность инфекции выше среди маори и полинезийцев. Исследования показывают, что около 5% европейских детей заражаются H.pylori к 20 годам, в отличие от 50% полинезийских детей [2].
Точный путь заражения остается неизвестным, но наиболее вероятной причиной является передача от человека к человеку через оральное / оральное или фекальное / оральное воздействие. Такие действия, как совместное использование еды, столовых приборов или несоблюдение гигиены туалета, могут привести к передаче H. pylori другому человеку.
Какие заболевания связаны с инфекцией
H. pylori ?H. pylori вызывает прямое заболевание желудка.Другие состояния, вероятно, связаны с иммунным ответом организма на бактерии.
- Хронический гастрит (воспаление слизистой оболочки желудка)
- Язвенная болезнь
- Рак желудка
- Некоторые виды лимфом (рак лимфоидной ткани)
Каковы симптомы инфекции H. pylori?
Большинство людей с инфекцией H. pylori не имеют никаких симптомов. Симптомы возникают, если заражение H. pylori вызывает язвенную болезнь желудка или гастрит.Эти симптомы могут быть неспецифическими и включать:
- Боль в животе (обычно в верхней части живота)
- Тошнота
- Рвота
- Вздутие живота
- Стул красного или смолистого цвета (указывает на кишечное кровотечение)
- Низкий показатель крови (анемия).
Как H. pylori повреждает желудок?
Повреждение слизистой оболочки желудка происходит из-за сложного взаимодействия бактерий и иммунного ответа хозяина. H.pylori выделяет несколько ферментов и микробных продуктов, которые непосредственно повреждают слизистую оболочку желудка. Иммунная система реагирует, вызывая бурную воспалительную реакцию в попытке уничтожить бактерии. В результате этой воспалительной реакции происходит непреднамеренное повреждение слизистой оболочки желудка.
Какие исследования проводятся на H. pylori?
Существует несколько тестов для обнаружения присутствия H. pylori в желудке:
- Анализ крови — выявляет специфические антитела против H.pylori бактерия.
- Дыхательный тест — включает в себя питье раствора карбамида, меченного углеродом. Этот раствор расщепляется на H. pylori, , а продукты его распада можно обнаружить в дыхании.
- Тест стула — выявляет белки H. pylori в фекалиях.
- Эндоскопическое обследование — включает использование оптических инструментов для визуального осмотра внутренних частей тела. Гибкая трубка вводится через рот в желудок и верхние отделы тонкой кишки.Небольшие образцы ткани могут быть взяты из стенки желудка, которые затем проверены на H. pylori .
Анализ крови и дыхательный тест часто являются первым подходом к тестированию на H. pylori . Эндоскопическая биопсия — относительно инвазивная процедура, которую часто проводят пациенты, которым требуется эндоскопия по другой причине.
Кого следует тестировать?
Американский колледж гастроэнтерологии рекомендует тестирование в следующих ситуациях [3]:
- Пациенты с активной язвенной болезнью
- Документально подтвержденная язвенная болезнь в анамнезе
- Лимфома желудочного солода (лимфоидной ткани, связанной со слизистой оболочкой)
- Пациенты, перенесшие резекцию рака желудка на ранней стадии.
Тестирование не рекомендуется людям с бессимптомным течением (без симптомов) или без язвенной болезни в анамнезе. Однако определенные группы населения, которые подвержены риску развития язвы или рака желудка, могут быть рассмотрены для бессимптомного тестирования.
Что такое лечение?
Лечение инфекции H. pylori включает прием нескольких лекарств в течение 7–14 дней («тройная терапия»), например, ингибитора протонной помпы (ингибитор секреции желудочной кислоты), такого как омепразол 40 мг один раз в день, амоксициллин 1 г два раза в день и кларитромицин 500 мг два раза в день.
Лечение излечивает до 90% людей.
Какая связь между H. pylori и кожными заболеваниями?
H. pylori были причастны к множеству заболеваний, не связанных с желудочно-кишечным трактом. Кожа является примером, и несколько исследований предположили связь со следующими состояниями [4,5]:
Влияет ли лечение H. pylori на кожные заболевания?
Несколько небольших исследований показали, что искоренение H.pylori имеет положительный результат при некоторых кожных заболеваниях, таких как крапивница, болезнь Бехчета, красный плоский лишай, атопический дерматит, болезнь Свита и системный склероз. Условия, которые могут не принести пользу, — это псориаз и розацеа.
Эти исследования не являются рандомизированными и включают небольшое количество пациентов, поэтому в настоящее время нельзя сделать окончательного вывода об искоренении H. pylori при кожных заболеваниях.
Каталожные номера
- Обложка TL, Blaser MJ.Helicobacter pylori в здоровье и болезни. Гастроэнтерология 2009; 136: 1863-73. Медлайн.
- Fraser A. Helicobacter pylori: историческая перспектива 1983–2003 гг. N Z Med J 2004; 117: 1194. U896. Полный текст.
- Chey WD, Вонг, Британская Колумбия. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol 2007; 102: 1808-25. Медлайн.
- Hernando-Harder AC, Booken N, Goerdt S. et al. Инфекция Helicobacter pylori и дерматологические заболевания.Eur J Dermatol 2009. Medline.
- Wedi B, Kapp A. Инфекция Helicobacter pylori при кожных заболеваниях: критическая оценка. Am J Clin Dermatol 2002; 3: 273-82. Медлайн.
В DermNet NZ
Другие веб-сайты
Книги о кожных заболеваниях
См. Книжный магазин DermNet NZ.
Новая биология для нового лечения рака желудка, индуцированного Helicobacter pylori — FullText — Заболевания пищеварения 2016, Vol. 34, № 5
Аннотация
Справочная информация: Helicobacter pylori — бактериальный канцероген, который, как предполагается, имеет самый высокий из известных уровней риска развития рака желудка, болезни, уносящей сотни тысяч жизней в год.Примерно 89% глобального бремени рака желудка и 5,5% злокачественных новообразований во всем мире связаны с воспалением и повреждением, вызванным H. pylori . Однако только у части колонизированных людей когда-либо развивается неоплазия, и риск заболевания связан с хорошо спланированными взаимодействиями между патогеном и хозяином, которые зависят от специфичных для штамма бактериальных факторов, генотипических особенностей хозяина и / или условий окружающей среды. Ключевые сообщения: Одной из детерминант вирулентности штамма H. pylori , которая увеличивает риск рака желудка, является остров патогенности cag , система секреции, которая вводит бактериальный онкопротеин CagA в клетки-хозяева.Полиморфизм хозяина в генах, регулирующих иммунитет и онкогенез, также повышает риск рака желудка в сочетании с компонентами, специфичными для штамма H. pylori . Кроме того, такие состояния, как дефицит железа и высокое потребление соли, могут влиять на фенотип H. pylori , что снижает порог заболевания. Выводы: Выделение медиаторов бактерий, хозяев и окружающей среды, которые увеличивают риск рака желудка, имеет глубокие последствия как для врачей, так и для биомедицинских исследователей, поскольку такие результаты будут сосредоточены не только на профилактических подходах, нацеленных на H.pylori -инфицированные человеческие популяции с повышенным риском рака желудка, но также предоставят механистические сведения о воспалительных карциномах, которые развиваются за пределами желудочной ниши.
© 2016 S. Karger AG, Базель
Введение
Helicobacter pylori — бактериальный канцероген, который, как установлено, имеет самый высокий из известных уровней риска развития рака желудка. По оценкам, при 1 миллионе новых случаев в год аденокарцинома желудка уносит более 700 000 жизней каждый год и составляет примерно 89% глобального бремени рака желудка и 5.5% всех злокачественных новообразований во всем мире связаны с воспалением и повреждением, вызванным H. pylori, [1].
Две гистологически различные формы аденокарциномы желудка были четко определены, диффузного типа и кишечного типа, обе из которых связаны с инфекцией H. pylori . Рак диффузного типа характеризуется широко распространенной инфильтрацией опухолевых клеток по всей слизистой оболочке желудка, в то время как рак кишечного типа прогрессирует через ряд четко определенных патологических этапов от нормальной слизистой оболочки желудка до поверхностного гастрита, хронического гастрита, атрофического гастрита, кишечной метаплазии и, наконец, дисплазия и аденокарцинома (рис.1) [2,3]. Хроническая инфекция H. pylori вызывает воспаление желудка и, таким образом, увеличивает риск прогрессирования через каждый из этих четко определенных этапов трансформации желудка, включая атрофический гастрит, кишечную метаплазию и дисплазию, которые считаются предшественниками развития аденокарциномы желудка ( рисунок 1). В отличие от гистологической стратификации рака желудка, в недавнем исследовании был проведен всесторонний молекулярный анализ случаев рака желудка с целью дальнейшей классификации рака желудка на подтипы, специфически связанные с различными клиническими исходами [4].В этой классификации выделено 4 подтипа, включая MSI, TP53 + , TP53 – и EMT [4]. MSI или микросателлитно-нестабильные опухоли показали лучший общий прогноз и самую низкую частоту рецидивов [4]. Классификация TP53 или опухолевого белка 53 на активный (TP53 + ) или неактивный (TP53 — ) давала промежуточный прогноз и частоту рецидивов, при этом неактивная форма давала худший прогноз, чем активная форма [4]. Наконец, классификация типа перехода от эпителия к мезенхиме показала наихудший прогноз и наивысшую частоту рецидивов [4].Эти новые молекулярные классификации рака желудка, вероятно, улучшат будущую практику скрининга.
Рис. 1
Гистологический каскад к аденокарциноме желудка кишечного типа, ассоциированной с инфекцией H. pylori .
Однако только у человек, колонизировавших H. pylori , когда-либо развивается неоплазия, и повышенный риск связан с различиями в штаммах бактерий, воспалительными реакциями, определяемыми генетическим разнообразием хозяина, и / или специфическими взаимодействиями между хозяином и микробными детерминантами [3 ].Эти наблюдения в сочетании с доказательствами того, что носительство определенных штаммов обратно пропорционально аденокарциноме пищевода и атопическим заболеваниям [3], подчеркивают важность выявления механизмов, которые регулируют взаимодействия H. pylori с его хозяином, которые способствуют канцерогенезу.
H. pylori Факторы вирулентности, влияющие на риск рака желудкаШтаммы H. pylori обладают высоким уровнем генетического разнообразия [5].Остров патогенности cag представляет собой штамм-специфический локус, который кодирует систему секреции типа IV (TFSS) [6], и штаммы cag + заметно увеличивают риск рака желудка по сравнению со штаммами cag – [ 7]. Продукт гена cagA (CagA) перемещается TFSS в эпителиальные клетки, подвергается фосфорилированию тирозина [8,9,10] и активирует эукариотическую фосфатазу (SHP-2), что приводит к клеточным ответам, которые могут снизить порог трансформации [8,9,10].Наша группа и другие продемонстрировали, что нефосфорилированный CagA также оказывает патологические эффекты, включая активацию β-катенина, нарушение апикально-соединительных комплексов и потерю клеточной полярности [11,12,13,14], изменения, которые играют важную роль. роль в канцерогенезе. В дополнение к CagA, cag TFSS доставляет пептидогликан в клетки-хозяева, где он распознается нуклеотид-связывающим доменом олигомеризации 1, внутрицитоплазматическим сенсором бактериальных пептидогликановых компонентов [15].Нарушение синтеза пептидогликана H. pylori ослабляет активацию β-катенина, аутофагию и развитие предраковых поражений в ответ на штаммы cag + [16].
VacA, токсин, секретируемый H. pylori , является еще одним микробным компонентом, связанным с развитием рака желудка [17]. Все штаммов H. pylori обладают vacA , но существуют значительные различия в последовательностях vacA , причем области наибольшего разнообразия локализованы в 5′-области гена, который кодирует сигнальную последовательность и аминоконцевую часть гена. секретируемый токсин (типы аллелей s1a, s1b, s1c или s2), промежуточная область (типы аллелей i1 или i2) и средняя область (типы аллелей m1 или m2).Штаммы, содержащие аллели типов s1, i1 и m1, тесно связаны с раком желудка [18], и в двух недавних исследованиях было определено, что генотипов vacA s1 и i1 являются лучшими маркерами кишечной метаплазии или рака желудка, чем генотипов cagA . [19,20].
Факторы хозяина и рак желудка
В нескольких исследованиях использовался генетический анализ высокого уровня для выявления факторов хозяина, связанных с инфекцией H. pylori и раком желудка. Недавнее исследование GWAS связывало полиморфизмы в локусе, кодирующем TLR, с присутствием H.pylori , хотя конкретная связь с раком желудка не была определена [21]. Другая группа использовала анализ MLST и SNP для оценки H. pylori и генетической изменчивости человека, соответственно, в 2 уникальных колумбийских популяциях с несопоставимыми рисками рака желудка, чтобы оценить коэволюционные отношения в контексте патогенных исходов [22]. Специфические взаимодействия между генетическими предками микробов и человека четко предсказывали риск заболевания, и всех людей, которые попадали в самый низкий дециль содержания африканских предков-хозяев, но которые были инфицированы вирусом H.pylori , имеющий> 19,8% африканского происхождения, имел предраковое поражение. Таким образом, взаимодействия между предками хозяина и патогена полностью объясняют различия в тяжести повреждения желудка в этих популяциях, что позволяет предположить, что ни человеческая, ни H. pylori генетическая вариация не обеспечивает восприимчивость к заболеванию изолированно, а только в контексте генетического несоответствия.
Специфические полиморфизмы провоспалительных цитокинов могут значительно увеличить риск рака желудка среди H.pylori -инфицированные [23,24]. Фактически, оценки отношения шансов для дистального рака желудка, вызванного генетическим полиморфизмом IL-1, IL-10 или TNF-альфа, дополнительно усиливаются у лиц, инфицированных штаммами cag + , по сравнению с общим числом H. pylori . -инфицированное население [25]. У лиц, инфицированных изолятами H. pylori , которые обладают аллелями типа s1 / m1 vacA , более вероятно развитие гипохлоргидрии — фенотипа, связанного с аллелями высокой экспрессии IL-1β и раком желудка.Комбинация генотипов хозяина высокого риска и связанных с раком аллелей vacA или генотипа cag аналогичным образом значительно увеличивает риск рака желудка, до 87 раз по сравнению с исходным уровнем [26]. Таким образом, оценка генетической изменчивости человека в сочетании с генетическим анализом заражения штаммов H. pylori может выявить колонизированных людей, которые имеют самый высокий риск рака желудка и могут быть оптимальными кандидатами для противомикробного вмешательства.
Еще одна многообещающая область исследований рака желудка — определение конкретных взаимодействий, которые происходят между H.pylori и стволовые клетки. Стволовые клетки имеют решающее значение для регуляции самообновляющегося эпителия желудка и поддержания гомеостаза, и данные, полученные на мышах и тканях человека, показали, что H. pylori может взаимодействовать с популяциями стволовых клеток [27]. Прослеживание клонов эпителия желудка in vivo продемонстрировало, что Lgr5 (Lgr5-богатые повторы, содержащие рецептор 5, связанный с G-белком), являются самообновляющимися, а мультипотентные стволовые клетки способны генерировать целую антральную железу желудка [28].В желудке человека инфекция H. pylori у пациентов с раком желудка приводит к увеличению популяции Lgr5-положительных эпителиальных клеток в антральном отделе по сравнению с неинфицированными людьми с раком [29]. Более того, у больных раком, инфицированных H. pylori , Lgr5-положительные клетки более восприимчивы к повреждению ДНК, чем Lgr5-отрицательные клетки [29]. Недавнее новое исследование с использованием 3D-конфокальной микроскопии продемонстрировало, что H. pylori может специфически взаимодействовать с предшественниками Lgr5 + и стволовыми клетками, что приводит к их функциональной активации [27].
Богатые лейцином повторы и иммуноглобулиноподобные домены 1 (Lrig1) — это трансмембранный белок, который маркирует отдельную популяцию покоящихся стволовых клеток и действует как опухолевый супрессор [30]. Lrig1 экспрессируется в эпителии желудка, и экспрессия Lrig1 увеличивается в эпителии желудка инфицированных H. pylori мышей по сравнению с неинфицированными, что позволяет предположить, что инфекция H. pylori также увеличивает популяцию стволовых клеток [31].
Клетки, происходящие из костного мозга (BMDC), представляют собой гетерогенную популяцию клеток, способных дифференцироваться в клетки различных линий.Исследования на мышах, инфицированных Helicobacter , показали, что BMDC являются домом и приживаются в местах хронического воспаления желудка, а также повторно заселяют стволовые клетки эндогенной ткани [32]. В воспаленном желудке BMDC дегенерируют в аденокарциному, что позволяет предположить, что эпителиальные карциномы желудка могут возникать из костного мозга [32].
Факторы риска, связанные с питанием
Риск рака желудка зависит не только от компонентов штамма H. pylori и генетики хозяина, но и от факторов окружающей среды, таких как диета.Диеты, богатые солеными, маринованными, копчеными или плохо консервированными продуктами, диеты с высоким содержанием мяса и диеты с низким содержанием фруктов и овощей, чаще всего связаны с повышенным риском развития рака желудка [33]. В контексте инфекции H. pylori высокое потребление соли с пищей и низкий уровень железа наиболее тесно связаны с повышенным риском рака желудка.
Высокое потребление соли с пищей связано с повышенным риском рака желудка, о чем сообщалось в многочисленных исследованиях [33], а также H.pylori в сочетании с диетой с высоким содержанием соли еще больше увеличивает риск рака. У монгольских песчанок сочетание инфекции H. pylori и диеты с высоким содержанием соли оказывает синергетическое действие на развитие предраковых поражений или рака желудка [34,35]. Механизмы, с помощью которых соль увеличивает риск развития рака желудка у людей, изучены не полностью; однако недавние данные показывают, что соль может модулировать экспрессию гена вирулентности у H. pylori .Экспрессия cagA значительно усиливается, когда определенные штаммы H. pylori культивируются в высоких концентрациях соли [36], а чувствительные к соли штаммы чаще содержат 2 копии мотива 5′-TAATGA, расположенные в пределах cagA . промотор [37].
Было обнаружено, что помимо соли, уровень железа в организме хозяина модулирует потенциал вирулентности H. pylori , а дефицит железа связан с повышенным риском рака желудка.Длительная колонизация H. pylori может еще больше усугубить дефицит железа из-за развития атрофии желудка, что приводит к снижению секреции кислоты, снижению уровня аскорбиновой кислоты и снижению абсорбции железа [38]. Наша группа продемонстрировала, что дефицит железа у инфицированных H. pylori людей ускоряет развитие канцерогенеза за счет увеличения потенциала вирулентности H. pylori [39]. Мы также провели механистические исследования, чтобы определить влияние дефицита железа в рационе на развитие H.pylori -индуцированный канцерогенез у песчанок [39]. Инфекция H. pylori значительно увеличивала частоту дисплазии и аденокарциномы желудка у песчанок, обедненных железом, по сравнению с песчанками, богатыми железом [39], но эти эффекты наблюдались только после заражения CagA-положительным H. pylori . Чтобы исследовать молекулярные механизмы, лежащие в основе этих изменений, сравнивали протеомы штаммов H. pylori , выращенных из песчанок, питавшихся обедненной железом диетой или диете с высоким содержанием железа.Белки, участвующие в функции cag TFSS, по-разному регулировались при сравнении штаммов H. pylori , выделенных из обедненных железом и богатых железом песчанок [39], и уровней фосфорилированного CagA (отражающего перемещенный CagA), число cag T4SS pili, и индукция провоспалительных цитокинов была значительно выше после совместного культивирования со штаммами, выделенными из обедненных железом песчанок, по сравнению со штаммами, выделенными из железистых песчанок [39].В совокупности эти данные демонстрируют, что истощение запасов железа в пище значительно увеличивает тяжесть воспаления желудка и ускоряет развитие болезни, вызванной H. pylori , за счет увеличения системы секреции cag .
Рекомендации по лечению
H. pyloriЦелью терапии против H. pylori является устранение микроорганизмов из желудка, а успешная ликвидация определяется как отрицательный тест на бактерию через ≥4 недели после завершения терапии.Схемы лечения должны быть простыми, хорошо переносимыми и экономичными. Существует несколько различных вариантов лечения инфекций H. pylori , и выбор конкретной терапии зависит от многих факторов, включая доступность лекарств, паттерны устойчивости к противомикробным препаратам штаммов H. pylori и стоимость. В настоящее время Американским колледжем гастроэнтерологии одобрены две терапии первой линии: тройная терапия с использованием ингибитора протонной помпы (ИПП) и двух антибиотиков или четырехкратная терапия, содержащая висмут [40].Тройная терапия состоит из ИПП плюс кларитромицин (500 мг) и амоксициллина (1 г) или метронидазола (500 мг), каждый из которых принимается дважды в день. Четырехкратная терапия на основе висмута состоит из приема ИПП два раза в день плюс висмут, метронидазол и тетрациклин в течение 10-14 дней. Однако эти методы лечения не могут уничтожить H. pylori у 20–25% пациентов, вероятно, из-за повышенной глобальной распространенности устойчивых к антибиотикам штаммов H. pylori (таблица 1) [41].
Таблица 1
H.pylori в Европе и США
Последовательная терапия в исходной формулировке состоит из ежедневного приема ингибитора протонной помпы плюс амоксициллина 1 г два раза в день в течение 5 дней с последующей терапией ИПП, кларитромицином 500 мг и тинидазолом 500 мг. каждый два раза в день в течение дополнительных 5 дней. В объединенном анализе 22 испытаний, в которых оценивали 2388 пациентов, показатели коллективной эрадикации составили 91,3 и 93,7% (намерение лечить и согласно протоколу, соответственно) [41]. Важное предостережение — важность нитроимидазола, используемого в этой схеме.У пациентов, получавших тинидазол (в настоящее время недоступный в США), частота эрадикации составила 97,4% по сравнению с 84,1% при замене метронидазола в схеме, что может отражать более длительный период полувыведения тинидазола [41]. Последовательная терапия напрямую сравнивалась со стандартной тройной терапией в нескольких рандомизированных исследованиях и позволила достичь более высоких показателей эрадикации без разницы в профилях побочных эффектов. Еще одним преимуществом последовательной терапии является ее способность достигать высоких показателей эрадикации устойчивых к кларитромицину H.pylori и левофлоксацин могут быть успешно включены в последовательную терапию (левофлоксацин заменяет кларитромицин) [42]. Однако географическое положение может повлиять на уровень искоренения. Недавнее исследование, проведенное в Латинской Америке, продемонстрировало, что последовательная терапия не превосходит стандартную тройную терапию, хотя метронидазол использовался вместо тинидазола, а характеристики чувствительности к антибиотикам инфекционных штаммов не анализировались [43]. Это исследование подняло вопросы относительно использования последовательной терапии в качестве терапии первой линии для H.pylori в США. Другие опасения включают тот факт, что эффективность последовательной терапии может быть снижена, когда метронидазол используется вместо тинидазола, и что последовательная терапия содержит амоксициллин в качестве основного компонента, что ограничивает его использование у пациентов с аллергией на пенициллин.
Другой потенциальной альтернативой рекомендованным в настоящее время терапии первой линии является сопутствующая терапия, сочетающая ИПП с кларитромицином, метронидазолом и амоксициллином [44].Хотя сообщалось, что уровень эрадикации при использовании сопутствующей терапии превышает 90%, рандомизированные испытания, оценивающие этот режим, показали, что он менее эффективен [43].
Последняя Маастрихтская конференция IV / Флорентийский консенсус рекомендовала следующую стратегию лечения H. pylori [45]. В регионах с низким уровнем устойчивости к кларитромицину H. pylori (<15%) в качестве лечения первой линии рекомендуются тройные схемы, содержащие ИПП-кларитромицин; Однако альтернативой является висмутсодержащая четверная терапия (рис.2). В регионах с высокой устойчивостью к кларитромицину в качестве эмпирического лечения первой линии рекомендуются висмутсодержащие четырехкомпонентные схемы. Если этот режим недоступен, рекомендуется последовательная терапия или четырехкратная терапия без висмута, такая как сопутствующая терапия (ИПП с кларитромицином, метронидазолом и амоксициллином). Поскольку показатели местной устойчивости к антибиотикам не всегда могут быть легко доступны, следует предполагать, что пациенты, недавно или неоднократно получавшие кларитромицин, обладают устойчивостью H.pylori (рис.2).
Рис. 2
Антимикробная терапия, рекомендованная для эрадикации H. pylori . * Или недавнее использование кларитромицина.
У пациентов, у которых не удалось добиться эрадикации с помощью схемы, содержащей ИПП-кларитромицин, рекомендуется либо четырехкратная терапия, содержащая висмут, либо трехкомпонентная терапия, содержащая левофлоксацин (ИПП, левофлоксацин, амоксициллин) (рис. 2). Тройная терапия, содержащая левофлоксацин, также рекомендуется в качестве терапии второй линии, если четырехкратная терапия висмутом или невисмутовая четырехкомпонентная терапия неэффективны в качестве терапии первой линии.В метаанализе, включавшем 4 рандомизированных исследования левофлоксацина в качестве компонента тройной терапии, сообщалось о более высоких показателях эрадикации по сравнению с 7-дневным курсом четырехкратной терапии на основе висмута, а также о меньшем количестве побочных эффектов [46]. Устойчивость к левофлоксацину является основным ограничивающим фактором, уровень резистентности которого превышает 16% в Восточной Азии, Канаде, некоторых регионах Европы и США [47, 48]. После неэффективности терапии второй линии лечение следует, если возможно, руководствоваться тестом на чувствительность к противомикробным препаратам.Любая из вышеперечисленных схем может быть рассмотрена для эрадикации второй линии, в зависимости от использованной терапии первой линии [45]. Одним из компонентов схем спасения является рифабутин, антибиотик, используемый для лечения микобактериальных инфекций. Скорость эрадикации обычно ниже по сравнению со схемами, в которых используется левофлоксацин, и побочные эффекты могут быть серьезными, включая миелосупрессию.
Показатели эрадикации в клинической практике часто составляют <90%, в первую очередь из-за различий в популяциях пациентов, генетического разнообразия инфицирования H.pylori и паттерны устойчивости к антибиотикам. Поэтому после вмешательства рекомендуется провести дыхательный тест на мочевину или анализ стула на антиген, чтобы подтвердить успешное излечение. Контрольное обследование следует проводить как минимум через 4 недели после завершения терапии.
Выводы
Рак желудка приводит к высокому числу связанных с раком смертей, и понимание факторов риска этого заболевания имеет первостепенное значение для выявления людей, у которых с наибольшей вероятностью разовьется злокачественная опухоль.Риск развития рака желудка зависит от множества факторов, включая штамм-специфические факторы вирулентности H. pylori , генотип хозяина и факторы окружающей среды, такие как диета. Взаимодействие между этими факторами влияет на результат долгосрочной колонизации H. pylori ; поэтому важно использовать результаты механистических исследований для выявления людей, которые подвергаются наибольшему риску развития рака желудка.
Благодарности
Грантовая поддержка: NIH CA-116087, DK-58404, DK-58587 и CA-77955.
Заявление о раскрытии информации
У автора нет конфликта интересов.
Список литературы
- de Martel C, Ferlay J, Franceschi S, Vignat J, Bray F, Forman D, Plummer M: Глобальное бремя рака, связанное с инфекциями, в 2008 г .: обзор и синтетический анализ.Ланцет Онкол 2012; 13: 607-615.
- Корреа П.: Канцерогенез желудка у человека: многоэтапный и многофакторный процесс — первая лекция Американского онкологического общества по эпидемиологии и профилактике рака. Cancer Res 1992; 52: 6735-6740.
- Polk DB, Peek RM Jr: Helicobacter pylori : рак желудка и не только.Нат Рев Рак 2010; 10: 403-414.
- Cristescu R, Lee J, Nebozhyn M, Kim KM, Ting JC, Wong SS, Liu J, Yue YG, Wang J, Yu K, Ye XS, Do IG, Liu S, Gong L, Fu J, Jin JG, Choi MG , Sohn TS, Lee JH, Bae JM, Kim ST, Park SH, Sohn I, Jung SH, Tan P, Chen R, Hardwick J, Kang WK, Ayers M, Hongyue D, Reinhard C, Loboda A, Kim S, Aggarwal A: Молекулярный анализ рака желудка определяет подтипы, связанные с различными клиническими исходами.Нат Мед 2015; 21: 449-456.
- Salama N, Guillemin K, McDaniel TK, Sherlock G, Tompkins L, Falkow S: микрочип полного генома выявляет генетическое разнообразие среди штаммов Helicobacter pylori . Proc Natl Acad Sci U S. A 2000; 97: 14668-14673.
- Censini S, Lange C, Xiang Z, Crabtree JE, Ghiara P, Borodovsky M, Rappuoli R, Covacci A: Cag, остров патогенности Helicobacter pylori , кодирует факторы вирулентности, специфичные для типа I.Proc Natl Acad Sci U S. A 1996; 93: 14648-14653.
- Crabtree JE, Wyatt JI, Sobala GM, Miller G, Tompkins DS, Primrose JN, Morgan AG: системные и гуморальные реакции слизистых оболочек на Helicobacter pylori при раке желудка. Gut 1993; 34: 1339-1343.
- Odenbreit S, Püls J, Sedlmaier B, Gerland E, Fischer W, Haas R: Транслокация Helicobacter pylori CagA в желудочные эпителиальные клетки путем секреции типа IV.Наука 2000; 287: 1497-1500.
- Backert S, Ziska E, Brinkmann V, Zimny-Arndt U, Fauconnier A, Jungblut PR, Naumann M, Meyer TF: Транслокация белка CagA Helicobacter pylori в эпителиальные клетки желудка с помощью аппарата секреции типа IV. Cell Microbiol 2000; 2: 155-164.
- Mueller D, Tegtmeyer N, Brandt S, Yamaoka Y, De Poire E, Sgouras D, Wessler S, Torres J, Smolka A, Backert S: киназы C-Src и c-Abl контролируют иерархическое фосфорилирование и функцию эффекторного белка CagA в Западно-азиатские штаммы Helicobacter pylori .Дж. Клин Инвест 2012; 122: 1553-1566.
- Amieva MR, Vogelmann R, Covacci A, Tompkins LS, Nelson WJ, Falkow S: Нарушение эпителиального апикально-соединительного комплекса Helicobacter pylori CagA. Наука 2003; 300: 1430-1434.
- Франко А.Т., Израиль Д.А., Вашингтон М.К., Кришна Ю., Фокс Дж. Г., Роджерс А. Б., Нейш А. С., Кольер-Хьямс Л., Перес-Перес Г. И., Хатакеяма М., Уайтхед Р., Гаус К., О’Брайен Д. П., Ромеро-Галло Дж., Peek RM Jr: Активация бета-катенина канцерогенными Helicobacter pylori .Proc Natl Acad Sci U S A 2005; 102: 10646-10651.
- Murata-Kamiya N, Kurashima Y, Teishikata Y, Yamahashi Y, Saito Y, Higashi H, Aburatani H, Akiyama T, Peek RM Jr, Azuma T, Hatakeyama M: Helicobacter pylori CagA взаимодействует с E-кадгерином и отменяет регуляцию бета-тестирования. Сигнал -катенин, который способствует кишечной трансдифференцировке в эпителиальных клетках желудка.Онкоген 2007; 26: 4617-4626.
- Saadat I, Higashi H, Obuse C, Umeda M, Murata-Kamiya N, Saito Y, Lu H, Ohnishi N, Azuma T, Suzuki A, Ohno S, Hatakeyama M: Helicobacter pylori CagA нацелена на киназу PAR1 / MARK, чтобы разрушить полярность эпителиальных клеток. Природа 2007; 447: 330-333.
- Виала Дж., Чапут С., Бонека И.Г., Кардона А., Жирардин С.Е., Моран А.П., Атман Р., Мемет С., Хуэрре М.Р., Койл А.Дж., ДиСтефано П.С., Сансонетти П.Дж., Лабинье А., Бертин Дж., Филпотт DJ, Ферреро Р.Л .: отвечает Nod1 к пептидогликану, доставляемому островом патогенности Helicobacter pylori cag .Нат Иммунол 2004; 5: 1166-1174.
- Суарес Дж., Ромеро-Галло Дж., Пиасуэло М.Б., Ван Дж., Майер Р.Дж., Форсберг Л.С., Азади П., Гомес М.А., Корреа П., Пик Р.М. Младший: Модификация пептидогликана Helicobacter pylori усиливает активацию Nod1 и способствует развитию рака желудка. Cancer Res 2015; 75: 1749-1759.
- Обложка TL, Blanke SR: Helicobacter pylori VacA, образец многофункциональности токсинов. Nat Rev Microbiol 2005; 3: 320-332.
- Rhead JL, Letley DP, Mohammadi M, Hussein N, Mohagheghi MA, Eshagh Hosseini M, Atherton JC: Новая вакуолизирующая детерминанта цитотоксина Helicobacter pylori , промежуточная область, связана с раком желудка.Гастроэнтерология 2007; 133: 926-936.
- Memon AA, Hussein NR, Miendje Deyi VY, Burette A, Atherton JC: Вакуолизирующие генотипы цитотоксинов являются сильными маркерами рака желудка и штаммов Helicobacter pylori , ассоциированных с язвой двенадцатиперстной кишки: подходящее исследование случай-контроль.J Clin Microbiol 2014; 52: 2984-2989.
- Winter JA, Letley DP, Cook KW, Rhead JL, Zaitoun AA, Ingram RJ, Amilon KR, Croxall NJ, Kaye PV, Robinson K, Atherton JC: роль вакуолизирующего цитотоксина VacA в колонизации и Helicobacter pylori — индуцированная метаплазия в желудке.Журнал Infect Dis 2014; 210: 954-963.
- Mayerle J, den Hoed CM, Schurmann C, Stolk L, Homuth G, Peters MJ, Capelle LG, Zimmermann K, Rivadeneira F, Gruska S, Völzke H, de Vries AC, Völker U, Teumer A, van Meurs JB, Steinmetz I , Nauck M, Ernst F, Weiss FU, Hofman A, Zenker M, Kroemer HK, Prokisch H, Uitterlinden AG, Lerch MM, Kuipers EJ: Идентификация генетических локусов, связанных с серологическим статусом Helicobacter pylori .JAMA 2013; 309: 1912-1920.
- Kodaman N, Pazos A, Schneider BG, Piazuelo MB, Mera R, Sobota RS, Sicinschi LA, Shaffer CL, Romero-Gallo J, de Sablet T, Harder RH, Bravo LE, Peek RM Jr, Wilson KT, Cover TL, Williams SM, Correa P: Human и Helicobacter pylori Коэволюция формирует риск желудочных заболеваний.Proc Natl Acad Sci U S A 2014; 111: 1455-1460.
- Эль-Омар Е.М., Кэррингтон М., Чоу У.Х., Макколл К.Э., Лещ Дж. Х., Янг Х.А., Эррера Дж., Лиссовска Дж., Юань С.К., Ротман Н., Ланьон Г., Мартин М., Фраумени Дж. Ф. младший, Рабкин К.С.: полиморфизмы, связанные с интерлейкином-1. с повышенным риском рака желудка.Природа 2000; 404: 398-402.
- Амиева М.Р., Эль-Омар Е.М.: Взаимодействие бактерий и хозяев при инфекции Helicobacter pylori . Гастроэнтерология 2008; 134: 306-323.
- Эль-Омар Е.М., Рабкин С.С., Гаммон, доктор медицины, Воган Т.Л., Риш HA, Шенберг Дж. Б., Стэнфорд Дж. Л., Мейн С. Т., Гёдерт Дж., Блот В. Дж., Фраумени Дж. Ф. младший, Чоу WH: Повышенный риск некардиального рака желудка, связанного с провоспалительным геном цитокина. полиморфизмы.Гастроэнтерология 2003; 124: 1193-1201.
- Фигейредо C, Machado JC, Pharoah P, Seruca R, Sousa S, Carvalho R, Capelinha AF, Quint W, Caldas C, van Doorn LJ, Carneiro F, Sobrinho-Simões M: Helicobacter pylori и генотипирование интерлейкина 1: возможность для выявления лиц с высоким риском рака желудка.J Natl Cancer Inst 2002; 94: 1680-1687.
- Sigal M, Rothenberg ME, Logan CY, Lee JY, Honaker RW, Cooper RL, Passarelli B, Camorlinga M, Bouley DM, Alvarez G, Nusse R, Torres J, Amieva MR: Helicobacter pylori активирует и расширяет Lgr5 (+) стволовые клетки путем прямой колонизации желудочных желез.Гастроэнтерология 2015; 148: 1392-1404.e21.
- Баркер Н., Хуч М., Куяла П., ван де Ветеринг М., Снапперт Х. Дж., Ван Эс Дж. Х., Сато Т., Штанге, Д. Э., Бегтель Х, ван ден Борн М., Даненберг Э, ван ден Бринк С., Корвинг Дж., Або А., Петерс PJ, Wright N, Poulsom R, Clevers H: Lgr5 (+ ve) стволовые клетки стимулируют самообновление в желудке и создают долгоживущие желудочные единицы in vitro.Cell Stem Cell 2010; 6: 25-36.
- Uehara T, Ma D, Yao Y, Lynch JP, Morales K, Ziober A, Feldman M, Ota H, Sepulveda AR: Инфекция H. pylori связана с повреждением ДНК Lgr5-положительных эпителиальных стволовых клеток в желудке пациентов при раке желудка. Dig Dis Sci 2013; 58: 140-149.
- Пауэлл А.Е., Ван И, Ли И, Пулин Э.Дж., Средство А.Л., Вашингтон М.К., Хиггинботам Дж.Н., Юххейм А., Прасад Н., Леви С.Е., Го И, Шир Й., Ароноу Б.Дж., Хейгис К.М., Франклин Д.Л., Коффи Р.Дж.: Кастрюля -ErbB негативный регулятор Lrig1 представляет собой маркер стволовых клеток кишечника, который действует как опухолевый супрессор.Cell 2012; 149: 146-158.
- Ното Дж. М., Хизанишвили Т., Чатурведи Р., Пиазуэло М. Б., Ромеро-Галло Дж., Дельгадо АГ, Хурана СС, Сьерра Дж. К., Кришна США, Суарес Дж., Пауэлл А. Э., Голденринг Дж. Р., Коффи Р. Дж., Ян В. В., Корреа П., Миллс Дж. К., Wilson KT, Peek RM Jr: Helicobacter pylori способствует экспрессии Krüppel-подобного фактора 5, медиатора канцерогенеза, in vitro и in vivo.PLoS One 2013; 8: e54344.
- Houghton J, Stoicov C, Nomura S, Rogers AB, Carlson J, Li H, Cai X, Fox JG, Goldenring JR, Wang TC: рак желудка, происходящий из клеток костного мозга. Наука 2004; 306: 1568-1571.
- Cover TL, Peek RM Jr: Диета, микробная вирулентность и Helicobacter pylori -индуцированный рак желудка.Кишечные микробы 2013; 4: 482-493.
- Като С., Цукамото Т., Мизошита Т., Танака Х., Кумагаи Т., Ота Х, Кацуяма Т., Асака М., Татемацу М.: Высокосолевые диеты дозозависимо способствуют химическому канцерогенезу желудочного сока у монгольских песчанок, инфицированных Helicobacter pylori , связанных со сдвигом. в продукции муцина от железистых к поверхностным слизистым клеткам.Int J Cancer 2006; 119: 1558-1566.
- Gaddy JA, Radin JN, Loh JT, Zhang F, Washington MK, Peek RM Jr, Algood HM, Cover TL: Высокое потребление соли с пищей усугубляет индуцированный Helicobacter pylori канцерогенез желудка. Infect Immun 2013; 81: 2258-2267.
- Loh JT, Torres VJ, Cover TL: Регулирование экспрессии Helicobacter pylori CagA в ответ на соль.Cancer Res 2007; 67: 4709-4715.
- Loh JT, Friedman DB, Piazuelo MB, Bravo LE, Wilson KT, Peek RM Jr, Correa P, Cover TL: Анализ промоторных элементов Helicobacter pylori cagA , необходимых для индуцированной солью усиления экспрессии CagA. Инфекция Иммун 2012; 80: 3094-3106.
- Ип Р., Лимбург П.Дж., Алквист Д.А., Карпентер Х.А., О’Нил А., Круз Д., Ститхэм С., Голд Б.Д., Гюнтер Э.В., Лукер А.С., Паркинсон А.Дж., Нобманн Э.Д., Петерсен К.М., Эллефсон М., Шварц С: широко распространенный оккультный желудочно-кишечный тракт. кровотечение у коренного населения Аляски с преобладающим дефицитом железа.Роль Helicobacter pylori гастрита. JAMA 1997; 277: 1135-1139.
- Noto JM, Gaddy JA, Lee JY, Piazuelo MB, Friedman DB, Colvin DC, Romero-Gallo J, Suarez G, Loh J, Slaughter JC, Tan S, Morgan DR, Wilson KT, Bravo LE, Correa P, Cover TL, Амиева М.Р., Пик Р.М. Младший: Дефицит железа ускоряет индуцированный Helicobacter pylori канцерогенез у грызунов и людей.Дж. Клин Инвест, 2013; 123: 479-492.
- Чей В.Д., Вонг Британская Колумбия; Комитет по параметрам практики Американского колледжа гастроэнтерологии: Руководство Американского колледжа гастроэнтерологии по ведению инфекции Helicobacter pylori . Am J Gastroenterol 2007; 102: 1808-1825.
- Вайра Д., Зулло А., Хассан С., Фиорини Дж., Вакил Н.: Последовательная терапия для ликвидации Helicobacter pylori : время пришло! Therap Adv Gastroenterol 2009; 2: 317-322.
- Romano M, Cuomo A, Gravina AG, Miranda A, Iovene MR, Tiso A, Sica M, Rocco A, Salerno R, Marmo R, Federico A, Nardone G: эмпирическая последовательная терапия с содержанием левофлоксацина и кларитромицином для Helicobacter pylori Искоренение : рандомизированное исследование.Кишечник 2010; 59: 1465-1470.
- Гринберг ER, Андерсон Г.Л., Морган Д.Р., Торрес Дж., Чей В.Д., Браво Л.Е., Домингес Р.Л., Ферречо С., Эрреро Р., Ласкано-Понсе ЕС, Меза-Монтенегро ММ, Пенья Р., Пенья Е.М., Салазар-Мартинес Е., Корреа П. , Martínez ME, Valdivieso M, Goodman GE, Crowley JJ, Baker LH: 14-дневная тройная, 5-дневная сопутствующая и 10-дневная последовательная терапия инфекции Helicobacter pylori в семи странах Латинской Америки: рандомизированное испытание.Ланцет 2011; 378: 507-514.
- Вакил Н., Меграуд Ф: Эрадикационная терапия для Helicobacter pylori . Гастроэнтерология 2007; 133: 985-1001.
- Малфертхайнер П., Меграуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т., Эль-Омар Е. М., Кейперс Э. Дж.; Европейская группа по изучению Helicobacter: управление инфекцией Helicobacter pylori — Маастрихтский IV / Флорентийский консенсусный отчет.Кишечник 2012; 61: 646-664.
- Саад Р.Дж., Шенфельд П., Ким Х.М., Чей В.Д.: Тройная терапия на основе левофлоксацина по сравнению с четырехкратной терапией на основе висмута для стойкой инфекции Helicobacter pylori : метаанализ. Am J Gastroenterol 2006; 101: 488-496.
- Мегро Ф., Коенен С., Верспортен А., Кист М., Лопес-Бреа М., Хиршль А. М., Андерсен Л. П., Гуссенс Х., Глупчински Ю. Участники исследовательской группы: Helicobacter pylori Устойчивость к антибиотикам в Европе и ее связь с потреблением антибиотиков.Кишечник 2013; 62: 34-42.
- Shiota S, Reddy R, Alsarraj A, El-Serag HB, Graham DY: Устойчивость к антибиотикам Helicobacter pylori среди мужчин-ветеранов Соединенных Штатов. Clin Gastroenterol Hepatol 2015; 13: 1616-1624.
Автор Контакты
Ричард М.Peek Jr.
Отделение гастроэнтерологии
Медицинский факультет Медицинского факультета Университета Вандербильта
2215B Garland Ave Suite 1030C, TN 37232 Нэшвилл (США)
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 22 июня 2016 г.
Дата выпуска: июнь 2016 г.
Количество страниц для печати: 7
Количество рисунков: 2
Количество столов: 1
ISSN: 0257-2753 (печатный)
eISSN: 1421-9875 (онлайн)
Для дополнительной информации: https: // www.karger.com/DDI
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Helicobacter pylori — Симптомы, причины, лечение
Лечение для H.pylori начинается с обращения за медицинской помощью к своему врачу. Чтобы определить, есть ли у вас H. pylori бактерии, ваш лечащий врач попросит вас пройти диагностические тесты.
Лечение антибиотиками при инфекции
H pyloriАнтибиотикотерапия — основа лечения. Важно точно соблюдать режим приема антибиотиков, чтобы избежать повторного заражения или рецидива.Чаще всего назначают два антибиотика в течение 14 дней. Повторное инфицирование после антибактериального лечения встречается редко.
Примеры лечения антибиотиками:
- Амоксициллин
- Кларитромицин (Биаксин)
- Метронидазол (Флагил)
- Тетрациклин
Другие лекарства для лечения
Инфекция H. pyloriЛекарства, такие как ингибиторы протонной помпы и антагонисты гистаминовых h3-рецепторов, которые уменьшают количество кислоты в желудке, также могут быть эффективными при лечении язвенной болезни, вызванной: H.pylori .
Ингибиторы протонной помпы, эффективные при лечении язвенной болезни, включают:
- Эзомепразол (нексиум)
- Лансопразол (Превацид)
- Омепразол (Прилосек)
- Пантопразол (Протоникс)
- Рабепразол (Ацифекс)
Антагонисты h3-рецепторов гистамина, которые эффективны при лечении язвенной болезни, включают:
- Циметидин (тагамет)
- Фамотидин (Пепцид)
- Низатидин (Аксид)
- Ранитидин (Зантак)
Если у вас диарея и рвота, восполнение запасов жидкости и электролитов также является составной частью успешного лечения.
Каковы возможные осложнения инфекции
Helicobacter pylori ?Оставлено без лечения, H. pylori бактерии могут вызвать кровоточащие язвы — серьезное и даже опасное для жизни осложнение. Вы можете минимизировать риск серьезных осложнений, следуя плану лечения, разработанному вами и вашим лечащим врачом специально для вас. Осложнения H.pylori к бактериям относятся:
- Воспаление слизистой оболочки желудка (гастрит)
- Прободная язва, которая может привести к кровотечению
- Злокачественная лимфома
- Рак желудка
- Язва желудка
Что такое H. pylori? Симптомы, причины, диагностика, лечение и профилактика
Рекомендуется посещать врача каждый раз, когда у вас возникают необычные боли в животе или жалобы, особенно если они постоянные или повторяющиеся.
Немедленно обратитесь к врачу, если у вас возникнут следующие симптомы:
- Сильная боль в животе или другая боль в животе
- Не проходит боль в животе или животе
- Затруднение при глотании
- Кровавый, черный или дегтеобразный стул
- Рвота с кровью или похожая на кофейную гущу
Сначала ваш врач, вероятно, проведет медицинский осмотр и спросит о вашей истории болезни.Затем они могут порекомендовать один или несколько из этих тестов для выявления бактерий.
Анализ крови Можно взять анализ крови для поиска антител H. pylori в вашем организме. Хотя анализы крови выполнить легко, они часто не так точны, как другие диагностические подходы. Дыхательный тест Дыхательный тест заключается в проглатывании таблетки, жидкости или пудинга, содержащих углерод. Если у вас инфекция H. pylori , ваш врач сможет обнаружить молекулы углерода, когда вы выдыхаете в мешок.Детям младшего возраста часто трудно провести дыхательные тесты, и вы не можете принимать определенные лекарства, такие как ингибиторы протонной помпы, антибиотики или пепто-бисмол (субсалицилат висмута), в течение недели или двух до сдачи теста. .
Анализ кала Образец кала может помочь врачам обнаружить белки, которые связаны с H. pylori . Перед прохождением этого теста вам необходимо прекратить прием таких лекарств, как ингибиторы протонной помпы, антибиотики или субсалицилат висмута. Верхняя эндоскопияВо время верхней эндоскопии ваш врач сначала даст вам легкое успокаивающее средство, а затем продет длинную трубку с крошечной камерой на конце вниз по горлу, мимо пищевода и в желудок. Это позволит вашему врачу заглянуть внутрь вашего пищеварительного тракта и при необходимости удалить небольшие кусочки ткани (известные как образцы биопсии).
Если образцы ткани удалены, их можно проанализировать на инфекцию H. pylori . Эндоскопия считается более инвазивной, чем другие методы, такие как анализ кала или дыхательный тест. Следует ли вам проходить обследование на H. pylori?В местах, где высок риск заражения H. pylori , врачи проверяют здоровых людей на наличие бактерий, даже если у них нет признаков или симптомов, что называется медицинским обследованием.

