| Бинавит | Р-р д/в/м введения: амп. 2 мл 5, 10 или 20 шт. рег. №: ЛП-000604 от 21.09.11 Дата перерегистрации: 12.07.18 | |||
| Бинавит форте | Таб. | |||
| Битригам | Р-р д/в/м введения: 2 мл амп. 5 или 10 шт. рег. №: ЛП-006421 от 24.08.20 | |||
| Витаксон | Р-р д/в/м введения: 2 мл амп. | |||
| Димексид | Гель д/наружн. прим. 25%: туба 30 г рег. №: ЛП-000501 от 01.03.11 Дата перерегистрации: 07.04.16 | |||
| Дифенин | Таб. | |||
| Дифенин | Таб. 117 мг: 10, 20, 30 или 50 шт. рег. №: ЛП-003509 от 16.03.16 | |||
| Дифенина таблетки | Таб. | |||
| Зептол | Таб. 200 мг: 100 шт. рег. №: П N011348/01 от 05.09.11 | |||
| Зептол | 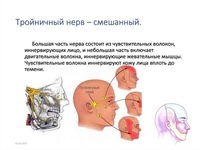 пролонгир. действия, покр. пленочной оболочкой, 200 мг: 30 шт. рег. №: П N011348/02
от 11.04.12 пролонгир. действия, покр. пленочной оболочкой, 200 мг: 30 шт. рег. №: П N011348/02
от 11.04.12Таб. пролонгир. действия, покр. пленочной оболочкой, 400 мг: 30 шт. рег. №: П N011348/02 от 11.04.12 | |||
| Карбамазепин | Таб. 200 мг: 10, 20 или 50 шт. рег. №: Р N002370/01 от 29.08.08 | |||
| Карбамазепин | Таб. | |||
| Карбамазепин | Таб. 200 мг: 10, 50 или 100 шт. рег. №: ЛС-001546 от 24.02.11 | |||
| Карбамазепин | Таб. | |||
| Карбамазепин | Таб. 200 мг: 20, 30, 40, 50 или 60 шт. рег. №: ЛП-004756 от 27.03.18 | |||
| Карбамазепин | Таб. | |||
| Карбамазепин | Таб. 200 мг: 50 или 100 шт. рег. №: Р N003681/01 от 05.06.09 | |||
| Карбамазепин Авексима | Таб. | |||
| Карбамазепин ретард-Акрихин | Таб. пролонгир. действия 200 мг: 10, 20, 30, 50 или 100 шт. рег. №: Р N003829/01 от 10.12.09 | |||
| Карбамазепин ретард-Акрихин | Таб. | |||
| Карбамазепин-Акрихин | Таб. 200 мг: 20, 50 или 100 шт. рег. №: Р N000852/01 от 07.09.07 | |||
| Карбамазепин-Ферейн | Таб. | |||
| Комбилипен® табс | Таб., покр. пленочной оболочкой, 100 мг+100 мг+2 мкг: 30 или 60 шт. рег. №: ЛС-002530 от 05.07.10 Дата перерегистрации: 26.12.18 | |||
| КомплигамВ® | Р-р д/в/м введения: амп. | |||
| Мильгамма® | Р-р д/в/м введения 100 мг+100 мг+1 мг+20 мг/2 мл: амп. 5, 10 или 25 шт. рег. №: П N012551/02 от 26.09.11 Дата перерегистрации: 29.06.20 | |||
| Мильгамма® Композитум | Таб. | |||
| Апо-Карбамазепин | Таб. 200 мг: фл. 100 или 500 шт. рег. №: П N011792/01 от 11.08.06 | |||
Дифенина таблетки 0. 117 г 117 г | Таб. 117 мг: 10, 20, 30 или 50 шт. рег. №: 74/331/63 от 12.04.74 | |||
| Дифенина таблетки 0.117 г | Таб. 117 мг: 10, 20, 30 или 50 шт. рег. №: 74/331/62 от 12.04.74 | |||
Дифенина таблетки 0. 117 г 117 г | Таб. 117 мг: 10, 20, 30 или 50 шт. рег. №: 74/331/63 от 12.04.74 | |||
| Дифенина таблетки 0.117 г | Таб. 117 мг: 10, 20, 30 или 50 шт. рег. №: 74/331/69 от 12.04.74 | |||
| Карбамазепин Никомед | Таб. 100 мг: 50 шт. рег. №: П N012662/01-2001 от 08.02.01 | |||
| Карбамазепин Никомед | Таб. 200 мг: 50 шт. рег. №: П N012662/01-2001 от 08.02.01 | |||
| Карбамазепин таблетки 0.2 г | Таб. 200 мг: 50 шт. рег. №: 98/365/4 от 17.12.98 | |||
| Карбамазепин таблетки 0.2 г | Таб. 200 мг: 50 шт. рег. №: 98/365/4 от 17.12.98 | |||
| Карбамазепин таблетки 0.2 г | Таб. 200 мг: 50 шт. рег. №: 98/365/4 от 17.12.98 | |||
| Карбамазепин таблетки 0.2 г | Таб. 200 мг: 50 шт. рег. №: 98/365/4 от 17.12.98 | |||
| Карбамазепин таблетки 0.2 г | Таб. 200 мг: 50 шт. рег. №: 98/365/4 от 17.12.98 | |||
| Карбамазепин-Тева | Таб. 200 мг: 20, 30, 50 или 100 шт. рег. №: П N014091/01-2002 от 06.06.02 | |||
| Мазепин | Таб. 200 мг: 50 или 100 шт. рег. №: Р N001134/01-2002 от 18.02.02 | |||
Невралгия тройничного нерва | Степанченко А.В.
МГМСУ им. Н.А. Семашко
Невралгия тройничного нерва (НТН) – хроническое рецидивирующее заболевание, протекающее с ремиссиями и обострениями различной продолжительности, отдельные приступы которых проявляются внезапной, интенсивной, стреляющей болью в зонах иннервации 3, 2 и, крайне редко, 1 ветвей тройничного нерва, с преобладанием в правой стороне лица. В европейской медицинской литературе первое описание этого заболевания принадлежит венецианскому врачу Масса (1550 г.), однако в самостоятельную нозологическую форму НТН выделил английский врач Джон Фотергилл (1781 г.) в своей монографии «Болезненные поражения лица». В Международной классификации болезней 10–го пересмотра (МКБ –10) в «поражения тройничного нерва» включаются «невралгия тройничного нерва (синдром пароксизмальной лицевой боли)», «атипичная лицевая боль», «другие поражения тройничного нерва» и «поражения тройничного нерва неуточненные». Международное общество головной боли (МОГБ) в разделе «краниальные невралгии, боли при поражении нервных стволов и деафферентационные боли» рассматривает «тригеминальную невралгию» как «идиопатическую» и «симптоматическую», а также «лицевые боли, не входящие в эту группу».
Взгляды на этиологию и патогенез НТН отличались значительным разнообразием. До начала XX века преобладало мнение о решающей роли в происхождении этого заболевания переохлаждения лица, местных хронических инфекций (зубо–челюстной системы, верхнечелюстных пазух), менингитов и арахноидитов основания мозга. Высказывались мнения о сдавлении периферических ветвей тройничного нерва в узких и длинных каналах лицевого скелета. В качестве причины НТН предполагали нарушения прикуса, необычно высокое стояние верхушки пирамиды височной кости, раздражающее корешок тройничного нерва, кальцификацию арахноидальных оболочек. В настоящее время общепринятой является точка зрения о решающей роли в происхождении НТН сдавления корешка пятого нерва в месте его входа в мозговой мост патологически извитым кровеносным сосудом (обычно передней верхней мозжечковой артерией), опухолями мосто–мозжечкового узла (акустической невриномой, арахноэндотелиомой) или бляшками рассеянного склероза. Полагают, что сдавление патологически извитым кровеносным сосудом встречается в 88%, опухолями мосто–мозжечкового угла в 6% и бляшками рассеянного склероза также в 6%. Патологический механизм возникновения боли наиболее убедительно объясняется теорией «воротного контроля» Мелзака и Уолла (1965 г.). При сдавлении корешка тройничного нерва в зоне его входа в мозговой мост патологически извитой верхней передней мозжечковой артерией (реже другим патологическим образованием) происходит поражение волокон глубокой чувствительности верхне– и нижнечелюстного подразделений из–за особенностей типичных анатомических соотношений чувствительных волокон в этом отделе системы тройничного нерва. В нормальных физиологических условиях стимуляция быстропроводящих нервных волокон глубокой чувствительности тормозит поток сигналов по волокнам поверхностной чувствительности, проводящей болевые сигналы. При нарушении целостности нервных волокон возникает контакт между волокнами глубокой и поверхностной системы, поэтому стимулы в норме вызывающие торможение болевых сигналов (движение нижней челюсти, глотание и др.), напротив, будут способствовать усилению болевого потока в чувствительных ядрах тройничного нерва ствола мозга и запускать типичный сигнал, субъективно ощущаемый в виде боли. Разумеется, в оформлении болевого ощущения при приступах невралгии тройничного нерва принимают участие и другие многообразные стволовые, подкорковые и корковые структуры, но вышеописанный механизм возникновения боли, по–видимому, является ведущим.
По данным многолетних наблюдений клиники нервных болезней стоматологического факультета Московского государственного медико–стоматологического университета, невралгией тройничного нерва женщины заболевают чаще мужчин в соотношении 3:1, правосторонняя локализация встречается в 70% , левосторонняя в 29%, а двусторонняя – в 1%. Средний возраст, поступающих больных НТН в клинику впервые составляет 55 лет, тогда как анамнестические данные свидетельствуют о начале заболевания на 8–10 лет раньше. Первый приступ боли без всякой видимой причины наступает в 34%, совпадает с лечением зубов в 27%, с отрицательными эмоциями – у 17%, у остальных началу заболевания сопутствуют самые различные факторы (внезапное переохлаждение лица, респираторная инфекция, локальные травмы и др.).
Только у 23% больных НТН дебютирует развернутым болевым синдромом, тогда как у остальных – ограниченными, локальными, малоинтенсивными, стреляющими, дергающими или прокалывающими болями в области альвеолярного отростка или медиальных отделах лица. Такие приступы боли возникали по несколько раз в день, без четкой связи с запускающими факторами или зонами. Разнообразные виды амбулаторной терапии (акупунктура, парантеральная витаминотерапия, физиотерапия), приводили к прекращению болевого синдрома в среднем на 18 месяцев. У некоторых пациентов регресс таких умеренных болевых проявлений происходил и без всякого лечения.
Развернутый типичный болевой пароксизм невралгии тройничного нерва достаточно характерен и состоит из нескольких ключевых симптомов:
1. Кратковременная, никогда не превышающая двух минут (в среднем 10 – 12 секунд) чрезвычайно интенсивная боль стреляющего характера, сравниваемая больными с ударом электрического тока.
2. Между отдельными приступами боли имеется «светлый промежуток», разной продолжительности, в зависимости от характера обострения.
3. Рисунок боли всегда имеет определенную протяженность в границах сегментарной иннервации тройничного нерва и существенно не изменяется при последующих обострениях.
4. Наличие пусковых зон – гиперчувствительных участков на коже лица (обычно в области носогубного треугольника) и в полости рта, слабое раздражение которых приводит к типичному болевому приступу.
5. Наличие запускающих факторов – действий или условий, при которых возникают типичные присупы боли при НТН. Чаще всего это умывание, жевание, глотание, разговор, иногда даже дуновение ветра.
6. Типичное болевое поведение. Как правило, во время приступа боли больные не плачут, не кричат, а замирают в одной позе, в которой их застает приступ и, стараясь не двигаться, пережидают болевой период. Иногда растирают зону боли или давят на нее.
7. Избегание раздражения пусковой зоны. Когда больного просят указать ее, он не доносит палец на несколько сантиметров до гиперчувствительного участка, опасаясь спровоцировать приступ боли, а когда врач пытается коснуться этого участка, непроизвольно отшатывается.
8. На высоте болевого приступа могут возникнуть подергивания лицевой мускулатуры, однако в последнее время, в связи с применением для лечения НТН противоэпилептическими препаратами, этот симптом встречается редко.
9. Отсутствие чувствительного дефицита в зоне боли. Исключение при этом составляют больные после хирургических методов лечения НТН.
Традиционно описываемая болезненность точек выхода ветвей тройничного нерва на лицо (супраорбитальная вырезка, подглазничное и подбородочное отверстие) существенного диагностического значения не имеют, а возникающий при этом болевой приступ связан со стимуляцией пусковых зон соответствующего участка лица.
Первый визит при дебюте НТН, как правило, происходит к стоматологу, так как гиперчувствительные зоны у подавляющего числа больных располагаются не только на лице, но и в полости рта. До конца XX века, когда стоматологи были в меньшей степени знакомы с этиологией НТН, на стороне болевых приступов нередко ошибочно удалялись здоровые зубы. Следует, впрочем, заметить, что удаление зубов производилось по настоятельному требованию самих больных, связанному с тем, что после очередного удаления зуба болевые пароксизмы на некоторое время прекращались. Такое явление можно объяснить с позиций теории «ворот боли», когда раздражение рецепторов глубокой чувствительности околозубных тканей приводит к выделению тормозных медиаторов в стволовом ядерном комплексе тройничного нерва и временному прекращению приступов невралгии.
В период ремиссий сохраняется фобический синдром, с формированием охранительного поведения, т.к. больные, опасаясь наступления рецидива заболевания, всегда едят на половине рта противоположной боли и укутывают голову даже в теплую погоду.
Стадия развернутых болевых приступов может продолжаться десятки лет с ремиссиями и обострениями, но со временем, в старческом возрасте типичные невралгические приступы боли приобретают невропатические черты в виде легких болей, уменьшения интенсивности острой боли возникновения тупой постоянной атипичной лицевой боли.
По–видимому, определенная стадийность в течении НТН объясняется особенностями поражения корешка тройничного нерва под влиянием сдавления патологическими образованиями мосто–мозжечкового угла.
Следует иметь в виду, что при стойком болевом синдроме, появлении симптомов неврологического дефицита как со стороны тройничного, так и других черепных нервов (особенно лицевого и слухового), следует проводить тщательное обследование структур задней черепной ямки (МРТ, слуховые вызванные потенциалы и др.) для выявления возможного объемного образования и неотложного нейрохирургического вмешательства.
В классификационных критериях МАИБ, МОГБ имеются описательные характеристики атипичных болевых синдромов лицевого нерва, близких по клиническим проявлениям НТН. Важнейшими среди них являются следующие:
Вторичной НТН при лицевой травме присуща хроническая, пульсирующая, жгучая боль с пароксизмальными усиливающимися приступами в зонах распределения конечных ветвей тройничного нерва. Болевой синдром отличается умеренностью, продолжительностью, со временем присоединяются незначительные трофические нарушения. Хронологически начало заболевания совпадает с травмой лица, реконструктивными операциями или затрудненным удалением зубов.
SUNCT – синдром (англ. аббревиатура слов – кратковременная, односторонняя, невралгоподобная боль с конъюнктивитом и слезотечением). Проявляется односторонними, длящимися десятки секунд, обычно дневными периорбитальными болями, сопровождающимися преходящим конъюнктивитом, слезотечением и потением лба. Неврологического дефицита нет.
Единственным эффективным препаратом для консервативного лечения НТН является карбамазепин (Тегретол и др.). Карбамазепин, синтезированный Шиндлером в 1957 г. и введенный в клиническую практику терапии НТН Блумом в 1963 г., представляет по своим химическим свойством призводное иминостильбена, способность которого уменьшать проницаемость мембран нейронов, участвующих в ноцицептивных реакциях, для натрия и обусловливает его противоболевое действие.
Тегретол оказывает противосудорожный и одновременно психотропный эффект. Его можно назначать как основное лечебное средство, так и в сочетании с другими противоэпилептическими препаратами. Психотропный эффект Тегретола способствует повышению коммуникабельности больных и их социальной реабилитации. При эссенцальной невралгии тройничного нерва Тегретол в большинстве случаев предупреждает появление пароксизмальных болей. Тегретол вызывает быстрое улучшение при психических и вегетативных симптомах.
Тегретол – противоэпилептический препарат, с периодом полураспада 20–40 часов (при повторных приемах и комбинированной терапии с другими противосудорожными препаратами он может снижаться до 8–12 часов), достаточно полно, но медленно и неравномерно всасывается из стандартных таблеток в верхнем и нижнем отделах кишечного тракта, с достижением максимального уровня содержания в сыворотке крови через 4 – 8 часов. Активное вещество карбамазепин соединяется с белками плазмы (около 75%), почти полностью метаболизируется в печени и переходит в активный метаболит – эпоксид, также обладающий противосудорожными свойствами.
Противопоказаниями к этому препарату являются заболевания костного мозга, предсердно–желудочковая блокада, гипонатриемия, комбинирование с ингибиторами моноаминооксидазы, препаратами лития, малые эпилептические припадки. Эффективность действия карбамазепина повышают дилтиазем, верапамил, никотинамид, эритромицин, а снижают вальпроаты, галоперидол, фенобарбитал. Препарат выпускается в виде таблеток 200 и 400 мг, таблеток с пролонгированным действием с разделительной бороздкой по 200 и 400 мг, разжевываемых таблеток по 100 мг и в виде сиропа (2%) (флаконы по 100 и 250 мл).
При НТН обычно назначается следующая схема лечения:
– два дня по 100 мг 3 раза в сутки (суточная доза 300 мг), – два дня по 200 мг 2 раза в сутки (суточная доза 400 мг), – два дня по 200 мг 3 раза в сутки (суточная доза 600 мг), – три дня по 200 мг 4 раза в сутки (суточная доза 800 мг).
При отсутствии противоболевого эффекта переходят к более высоким дозировкам – 1000 и 1200 мг в сутки, с распределением на 4–6 приемов. Рекомендуемая начальная доза для пациентов пожилого возраста составляет по 100 мг 2 раза/сут. При достижении достаточно выраженного результата следует остановиться на соответствующей суточной дозе в течение месяца и затем также медленно снизить эффективную дозу. Лечение карбамазепином на таком количестве необходимо продолжать без перерыва не менее, чем полгода, а затем перевести на поддерживающие дозы (200–400 мг в сутки в два приема). В последнее время карбамазепин (Тегретол) производится в сиропе, что хорошо переносится больными НТН.
Таблетки и сироп Тегретола следует принимать вместе с едой или после еды с небольшим количеством жидкости. Сироп следует взбалтывать до употребления. Разжевываемые таблетки следует принимать после еды с небольшим количеством жидкости. Таблетки с пролонгированным действием (или целиком или, если так выписано, только половину) проглатывать вместе с едой или после еды с небольшим количеством жидкости, не разжевывая их. Разжевываемые таблетки и сироп особенно годятся для пациентов, которые с трудом проглатывают таблетки. Благодаря медленному, контролированному высвобождению активного вещества из таблеток, имеющих бороздку для деления, суточную дозу можно, как правило, принимать в 2 приема. Перед началом лечения необходимо провести исследование функции печени и картины крови. Впоследствии анализ крови следует проводить в течение первого месяца лечения еженедельно, а затем ежемесячно. Контроль функции печени должен осуществляться периодически. Непрогрессирующая или устойчивая асимптоматическая лейкопения, которая часто наблюдается, в общем не требует отмены препарата. Однако лечение Тегретолом следует прекратить при появлении прогрессирующей лейкопении или лейкопении, сопровождающейся клиническими симптомами, такими как лихорадка или ангина. Препарат обладает хорошей переносимостью. В отдельных случаях, особенно в начале лечения, могут наблюдаться такие побочные действия, как потеря аппетита, сухость во рту, рвота, диарея, запор, головная боль, головокружение, сонливость, атаксия, нарушения аккомодации, диплопия, у пожилых людей может наблюдаться спутанность сознания и возбуждение. Эти побочные явления, как правило, исчезают через 7–14 дней сами собой или после временного уменьшения дозы Тегретола.
Менее эффективным препаратом, чем карбамазепин, но все же обладающим достаточно выраженнным противоболевым действием, является фенитоин. Фенитоин назначается 2–3 табл в сутки, противопоказания – нарушения функций печени и почек, кахексия, нарушения сердечного ритма, порфирия. Среди побочных реакций наиболее часто встречаются ажитация, вертиго, гиперплазия десен, контрактура Дипюитрена и др. Эффективность этого препарата повышают пропанолол, хлордиазепоксид, а снижают – стероиды, фолиевая кислота, галоперидол.
У ряда больных НТН противоболевое действие оказывают некоторые другие препараты, ряд убывающей эффективности которых представлен следующим образом – карбамазепин, фенитоин, клоназепам, вальпроевая кислота.
В период обострения НТН используется внутривенное (более эффективно капельное) введение натрия оксибутирата, по 5 мл 20 % раствора дважды в сутки (противопоказанием является гипокалемия), внутривенное струйное введение никотиновой кислоты 1%, начиная с 1 мл, с постепенным повышением до эффекта «воспламенения» (обычно 6–8 мл) и снижением к исходной дозе.
В период обострения применяется ультрафонофорез гидрокортизона, лазеропунктура на болевые точки, классическая акупунктура.
При сопутствующих спастических состояниях, сопровождающихся болевым синдромом при НТН, используются антиспастические препараты – миорелаксанты. Одним из представителей этой группы является тизанидин (Сирдалуд). Сирдалуд – миорелаксант центрального действия. Стимулируя пресинаптические a2–адренорецепторы, он приводит к угнетению полисинаптической передачи возбуждения в спинном мозге, вызывающей мышечный гипертонус. Препарат эффективен при болях умеренной или высокой интенсивности, особенно когда боль усиливается в течение ночи. Препарат характеризуется хорошей переносимостью. Доза подбирается индивидуально в течение 2–4 нед. и составляет 2–6 мг/сут.
При неэффективности консервативной терапии альтерантивым методов являются нейрохирургические методы лечения – ретрогассеральная терморизотомия, микроваскулярная декомпрессия тригеминального корешка и др
.
Симптомы и причины возникновения невралгии. Чем лечить невралгию.
Что такое невралгия?
Невралгиями называют поражения периферических нервов. Симптомы невралгии — приступы боли в зоне, так называемой иннервации, то есть в тех участках, где орган или ткань окружены нервами для связи с центральной нервной системой. Невралгия может возникнуть в любой части тела и имеет различные причины.
Причины возникновения невралгии
Среди наиболее частых причин невралгии – переохлаждение, инфекционные заболевания, тяжелое течение острых респираторных вирусных инфекций, травмы, воспаления и опухоли. Распространенными являются невралгия тройничного нерва и межреберная невралгия. При поражении тройничного нерва боль локализуется в области лица. Человек страдает от приступов, которые могут быть вызваны как легкими прикосновениями (например, к щеке или носу), так и холодной или горячей пищей, чисткой зубов, вспышкой света или громким звуком. Само поражение нерва вызвано, как правило, травмой лица, воспалительными процессами в пазухах носа или нелеченых зубах. Профилактика невралгии возможна лишь в тех случаях, когда речь идет о запущенных воспалительных процессах, так как на развитие опухолей или возникновение инфекционных заболеваний мы влиять не можем.
Невралгия тройничного нерва чаще всего возникает у женщин, причем в зрелом возрасте.
Причиной межреберной невралгии (торакалгии) обычно является остеохондроз позвоночника, преимущественно грудного отдела. Резкая боль в области ребер может возникать при глубоком вдохе, чихании или кашле. Кроме того, возможно развитие межреберной невралгии на фоне сердечно-сосудистых заболеваний, связанных с недостаточным притоком кислорода к нервам.
Уменьшить вероятность новых приступов невралгии помогает выполнение простых правил: нужно избегать стрессов, больше спать, соблюдать умеренность в употреблении алкоголя, ограничить физические нагрузки, а также своевременно лечить воспалительные и инфекционные заболевания.
Существуют и другие локализации невралгии: в бедре, крылонебном узле (вызывает боль в шее, небе, висках, глазах), в затылке (при этом боль распространяется в области глаз, затылка, висков, усиливается во время движений головой и может сопровождаться рвотой). Во всех случаях невралгия может быть вызвана как переохлаждением или травмой, так и быть следствием хронического заболевания. Симптомы такой болезни, как невралгия, требуют подтверждения у врача, так как могут «маскироваться» под другие заболевания.
Как и чем лечить невралгию, и возможно ли лечение невралгии в домашних условиях
Если невралгия связана с ранее возникшим заболеванием, его необходимо лечить, чтобы избежать дальнейшего поражения периферических нервов и начать восстановительные процессы.
В любом случае лечение невралгии предполагает прием препаратов, уменьшающих боль. При лечении невралгии назначают такие препараты:
- инъекции обезболивающих препаратов (местно)
- миорелаксанты (препараты для расслабления мышц)
- нестероидные противовоспалительные препараты
- гормональные препараты
- витамины группы В
Хороших результатов в лечении невралгий позволяет достичь физиотерапия, в том числе с использованием ультразвука, инфракрасных и ультрафиолетовых лучей, лазера, иглоукалывания и других методик. В крайних случаях применяют хирургическое лечение.
Витамины группы B при лечении невралгии
Витамины группы B принимают участие во многих метаболических процессах, в том числе, непосредственно затрагивающих нервную систему. Они отвечают за передачу нервных импульсов, обмен в тканях нервной системы, восстановление нервов после поражений или травм. Среди наиболее важных нейротропных витаминов — B1 и B6 (бенфотиамин и пиридоксин), содержащиеся в дозе по 100 мг в препарате Мильгамма® таблетки. Противовоспалительный, обезболивающий, восстановительный эффекты бенфотиамина и пиридоксина способствуют быстрому выздоровлению, значительно улучшают качество жизни благодаря эффективному воздействию на болевой синдром. Однако не следует лечить невралгии самостоятельно, полагаясь только на витамины. Прежде всего, нужна точная диагностика, которая поможет определить причину невралгии. Далее врач прописывает комплексное лечение, которое иногда может включать гормональные препараты при невралгии и другие медикаментозные средства, которые нельзя принимать без назначения специалистом. При этом применение препарата, содержащего витамины группы B – это действительно необходимость, если речь идет о лечении болевого синдрома, связанного с поражениями нервов.
Профилактика невралгии при хроническом течении заболевания
К сожалению, да, если не выявить причину поражения периферических нервов и не устранить ее. Если невралгия первичная, то есть, возникла в результате, например, переохлаждения или травмы, важно пройти полный курс лечения, чтобы не допустить развития хронического процесса. Боль при невралгиях может быть очень сильной, что значительно ухудшает качество жизни и снижает трудоспособность, поэтому полноценное лечение необходимо. Не стоит забывать и о том, что состояние нашей нервной системы зависит от уровня стресса, в котором находится организм, и боль иногда может усиливаться по психосоматическим причинам, то есть, буквально зависеть от наших мыслей.К сожалению, да, если не выявить причину поражения периферических нервов и не устранить ее. Если невралгия первичная, то есть, возникла в результате, например, переохлаждения или травмы, важно пройти полный курс лечения, чтобы не допустить развития хронического процесса. Боль при невралгиях может быть очень сильной, что значительно ухудшает качество жизни и снижает трудоспособность, поэтому полноценное лечение необходимо. Не стоит забывать и о том, что состояние нашей нервной системы зависит от уровня стресса, в котором находится организм, и боль иногда может усиливаться по психосоматическим причинам, то есть, буквально зависеть от наших мыслей.
Принципы лечения и ведения больных невралгией тройничного нерва
Л.С. Манвелов, В.М. Тюрников, А.В. Кадыков, НИИ неврологии РАМН, г. Москва, РФ
Невралгия тройничного нерва (НТН) — заболевание, проявляющееся резкой лицевой болью в зонах иннервации его ветвей. Болевые приступы часто провоцируются легким прикосновением к коже так называемых курковых зон: участков губ, крыльев носа, бровей. В то же время, сильное давление на эти зоны облегчает приступ.
Тактика ведения больных НТН должна предусматривать:
• диагностику заболевания, включающую общее клиническое, отоларингологическое, стоматологическое и инструментальное обследование;
• выявление этиологических факторов;
• консервативное лечение;
• хирургическое лечение.
Основными целями лечения НТН являются купирование болевого синдрома и предупреждение рецидивов заболевания.
Консервативное лечение подразумевает лекарственное лечение и физиотерапию.
Примерно в 90% случаев НТН эффективно применение противоэпилептических препаратов. Первым из них был применен фенитоин, однако с 1961 года до настоящего времени широко применяется более эффективное средство — карбамазепин, справедливо считающийся препаратом первого выбора для лечения больных с НТН. Начальная доза составляет 200–400 мг в сутки, постепенно ее увеличивают до прекращения боли, в среднем — до 800 мг в сутки в 4 приема, затем уменьшают до минимально эффективной дозы. При лечении карбамазепином в 70% случаев удается купировать болевой синдром.
Препаратами второго ряда являются фенитоин, баклофен, вальпроевая кислота, тизанидин, антидепрессанты.
Фенитоин при обострениях заболевания назначают в дозе 15 мг/кг внутривенно капельно в течение 2 часов однократно.
Баклофен принимают внутрь во время еды. Начальная доза — 5 мг 3 раза в сутки, последующее увеличение дозы — на 5 мг каждые 3 дня до достижения эффекта, но не более 20–25 мг 3 раза в сутки. Максимальная доза — 100 мг в сутки, назначаемая на короткое время в условиях стационара. Окончательная доза устанавливается так, чтобы при приеме препарата снижение мышечного тонуса не приводило к чрезмерной миастении и не ухудшало двигательные функции. При повышенной чувствительности начальная суточная доза баклофена — 6–10 мг с последующим медленным увеличением. Отменять препарат следует постепенно — в течение 1–2 недель.
Вальпроевая кислота назначается в качестве терапии взрослым в начальной дозе 3–15 мг в сутки в 2 приема независимо от приема пищи. При необходимости дозу препарата увеличивают на 5–10 мг/кг в неделю. Максимальная доза составляет 30 мг/кг в сутки или 3000 мг в сутки. При комбинированном лечении взрослым назначают 10–30 мг/кг в сутки с последующим повышением на 5–10 мг/кг в неделю. Если принимается решение о переходе на внутривенное введение препарата, его выполняют через 4–6 часа после перорального приема в дозе 0,5–1 мг/кг в час.
Тизанидин назначается внутрь. Режим дозирования устанавливают индивидуально. Начальная суточная доза составляет 6 мг (1 капсула). При необходимости суточную дозу можно постепенно увеличивать — на 6 мг (1 капсула) с интервалами 3–7 дней. Для большинства больных оптимальная доза препарата составляет 12 мг в сутки (2 капсулы). В редких случаях может потребоваться увеличение суточной дозы до 24 мг.
Амитриптилин рекомендуется принимать внутрь после еды. Начальная доза взрослым составляет 25–50 мг на ночь, затем дозу увеличивают в течение 5–6 дней до 150–300 мг в сутки в 3 приема. Большая часть дозы принимается на ночь. Если в течение 2 недель не наступает улучшение, суточную дозу увеличивают до 300 мг. Больным в пожилом возрасте при легких нарушениях препарат назначается в дозе 30–100 мг на ночь. После достижения терапевтического эффекта переходят на минимальные поддерживающие дозы — 25–50 мг в сутки. Амитриптилин вводят внутримышечно или внутривенно капельно в дозе 25–40 мг 4 раза в сутки, постепенно заменяя приемом внутрь. Длительность лечения составляет не более 8–10 месяцев [2, 3].
Показана витаминотерапия, в основном — применение витаминов группы В. Хорошо зарекомендовали себя комбинированные препараты.
Прием анальгетиков считается малоэффективным. К тому же, употребление больших доз этих препаратов, связанное с желанием быстро купировать приступ, может привести к появлению абузусной головной боли.
Из физиотерапевтических методов в острый период заболевания и во время приступа показано умеренное тепловое воздействие: лампа «Соллюкс», электрическая грелка, ультрафиолетовое облучение больной половины лица. Анальгезирующее и противовоспалительное действие оказывают широко применяющиеся диадинамические токи. На курс лечения назначают 6–10 процедур, которые проводят ежедневно. Рекомендуют 2–3 таких курса с перерывом в 1 неделю. Кроме того, эту процедуру в течение 2–3 минут проводят на области височной артерии и звездчатого узла. При упорной боли с помощью диадинамических и синусоидальных модулированных токов вводят прокаин, тетракаин, эпинефрин. Анестезирующий эффект при этом выражен больше, чем при использовании гальванического тока. При длительном упорном болевом синдроме, хроническом течении заболевания увеличивают время воздействия диадинамическими токами до 8–10 минут. На курс лечения назначают 10–18 процедур с 4-дневным перерывом после 10 сеансов.
При лицевой боли, связанной с шейным остеохондрозом, симпатико-радикулярным симптомокомплексом хороший эффект дает воздействие ультразвуком не только паравертебрально, но и на места выхода тройничного нерва по 2 минуты на каждую точку через день. В результате такого воздействия лицевая боль не возобновлялись в течение 1 года после лечения [4]. Противопоказаниями к лечению ультразвуком являются склонность к носовым кровотечениям, отслойка сетчатки глаза, острые воспалительные процессы в носовых пазухах, среднем ухе, нарушения мозгового кровообращения. В период лечения ультразвуком уменьшается не только болевой синдром, но и регионарные и общие вегетативно-сосудистые нарушения.
В подострый период при наличии триггерных зон применяется эндоназальный электрофорез 4% раствора прокаина и 2% раствора тиамина, продолжительность воздействия составляет от 10 до 30 минут. Кроме того, его можно осуществлять в виде полумаски и маски Бургонье (при двустороннем поражении нервов). Применяется также электрофорез дифенгидрамина, пахикарпина гидройодида, платифиллина на больную сторону лица. При артрозе височно-нижнечелюстного сустава проводят электрофорез метамизола натрия, гиалуронидазы; при ревматической этиологии заболевания — салицилатов; при малярийной — хинина; при обменных нарушениях — йода и прокаина.
Эффективно также применение электрического поля ультравысоких частот в олиготермической дозе.
При хронических формах НТН, шейном остеохондрозе с лицевой болью тригеминального характера назначают массаж лица по 6–7 минут ежедневно или через день. Положительное воздействие оказывают грязевые аппликации на воротниковую область при температуре 36–37°С по 10 минут. На курс назначают 10 процедур. Используют озокерит, парафин или торф. Успешно применяют бальнеотерапию: сульфидные, морские, радоновые ванны. Нельзя переоценить благотворное воздействие лечебной гимнастики. Санаторно-курортное лечение в санаториях для больных с заболеваниями периферической нервной системы рекомендуют в теплое время года при хроническом течении заболевания и редких приступах. Положительно влияет рефлексотерапия (иглоукалывание, прижигание, лазеротерапия).
Если консервативная терапия оказывается неэффективной или наблюдаются выраженные побочные действия лекарств — обсуждается необходимость хирургического вмешательства.
В 1884 году американский хирург Д.Э. Мирс при хронической НТН впервые произвел удаление его ганглия. В 1890 году английский хирург У. Рос и американский хирург Э. Эндерюс независимо друг от друга разработали специальный метод удаления гассерова узла, который вошел в практику нейрохирургов в конце XIX и начале XX вв. В настоящее время при НТН используются следующие способы оперативного вмешательства:
• микрохирургическая декомпрессия нерва на выходе из ствола мозга;
• частичная сенсорная ризотомия;
• периферическая блокада или перерезка нерва проксимальнее узла Гассера;
• нейроэктомия;
• криохирургические методы;
• диатермокоагуляция;
• высокочастотное излучение.
Наиболее распространенными современными эффективными методами хирургического лечения НТН являются микроваскулярная декомпрессия и пункционные деструктивные операции. Среди деструктивных операций, входящих в состав арсенала хирургических вмешательств при НТН, выделяют чрескожную высокочастотную селективную ризотомию (ЧВСР), баллонную микрокомпрессию и глицероловую ризотомию [8].
Наиболее распространенным деструктивным методом является ЧВСР, представляющая собой контролируемую термическую деструкцию гассерова узла, которая препятствует передаче сенсорных импульсов и развитию болевых пароксизмов. Локация электрода контролируется по отношению к порциям узла. Этот метод успешно применяется в ведущих клиниках, занимающихся проблемой боли [1, 6, 7].
Значительный опыт ЧВСР накоплен в Mayfield Clinik Chincinati (доктор медицины John Tew). В этой клинике с использованием данного метода прооперировано более 3 тысяч больных. Хорошие результаты были получены у 93% больных. Рецидивы боли в течение 15 лет наблюдались у 25% больных [7]. Рецидивы болезни в течение первых 5 лет отмечены у 15% больных, до 10 лет — у 7%, от 10 до 15 лет — у 3% больных. Отмечается прямая связь между выраженностью гипалгезии после чрескожной ризотомии, частотой рецидивов боли и дизестезий. При достижении легкой гипалгезии после операции и наблюдении в течение 3 лет частота рецидивов боли достигала 60%, при этом дизестезии наблюдаются у 7% больных. При достижении выраженной гипалгезии и наблюдении больных в течение 15 лет частота рецидивов боли составила 25%, вероятность дизестезий увеличилась до 15%. При получении полной аналгезии после чрескожной ризотомии и наблюдении больных в течение 15 лет частота рецидивов боли наблюдалась в 20% случаев, число дизестезий увеличилось до 36%. Таким образом, наиболее благоприятным является второй вариант — достижение выраженной гипалгезии.
К сожалению, в нейрохирургические отделения довольно часто попадают больные с запущенными формами НТН, в том числе после многочисленных деструктивных процедур. Несомненно, это ухудшает функциональный результат нейрохирургических вмешательств и в некоторых случаях требует сложных и более опасных операций на уровне центральной нервной системы [1, 5].
Преимущества ЧВСР: бескровность, быстрота и безопасность вмешательства, местная анестезия в качестве обезболивания и, наконец, высокий процент положительных результатов. ЧВСР гассерова узла при НТН и кластерной головной боли является высокоэффективным и безопасным методом хирургического вмешательства.
Обострения заболевания чаще всего бывают весной и осенью. При отсутствии рецидивов прогноз благоприятный.
Список литературы
Григорян Ю.А. Чрескожная высокочастотная, селективная ризотомия и микроваскулярная декомпрессия корешка тройничного нерва в лечении тригеминальной невропатии: Автореф. дис. … канд. мед. наук. – М., 1989. Кадыков А.С., Шахпаронова Н.В., Манвелов Л.С. Невралгия тройничного нерва. В кн.: Практическая неврология / Под ред. А.С. Кадыкова, Л.С. Манвелова, В.В. Шведкова. – М.: ГЭОТАР-Медиа, 2011. – С. 26–27. Лекарственные средства / Под ред. Р.У. Хабриева, А.Г. Чучалина. – М.: ГЭОТАР-Медиа, 2006. – 753 с. Стрелкова Н.И. Физические методы лечения в неврологии. – М.: Медицина, 1991. – С. 134–137. Оглезнев К.Я., Григорян Ю.А., Шестериков С.А. Патофизиологические механизмы возникновения и методы лечения лицевых болей. – Новосибирск: Наука, 1990. – 192 с. Broggi G., Franzini A., Lasio G. et al. Long time results of percutaneous retrogasserian Thermorhizotomy for essential trigeminal neuralgia consdarations in 1000 patients // Nerosurgery. – 1995. – Vol. 83. – P. 989–993. Taha J.M., Bumer U.R. A prospective 15-year follow up of 154 consecutive patients with trigeminal neuralgia treated by percutaneous stereotactic radiofre-quensy thermal rhizotomy // J. Neurosurgery. – 1995. – Vol. 83. – Р. 989–993. Wegel G., Kasey K. Strring Back Trigeminal neuralgia Association. 2000.Ранее статья была опубликована в РМЖ, 2014, №16
Таблетки, инъекции, мази при лицевом неврите
- Высокие результаты, отсутствие побочных эффектов
- Лечение без таблеток и операций
- Первичная консультация врача БЕСПЛАТНО
Записаться
Неврит лицевого нерва – это воспалительное заболевание, которое проявляется нарушением чувствительности, мышечных сокращений (двигательной активности) в области лица. Чтобы уменьшить эти симптомы врач назначает комплекс препаратов, включая противовоспалительные и мышечные средства.
Болевые проявления нетипичны для лицевого неврита, потому обезболивающие препараты (анальгетики, анестетики) при этом заболевании, как правило, не требуются.
- Нестероидные противовоспалительные препараты (НПВП) назначаются в виде таблеток или мазей. Уменьшают воспаление нерва, облегчают боль в области уха, лица. Уменьшают отечность мягких тканей, сдавление нерва.
- Стероидные (гормональные препараты) применяются в случаях, когда негормональные средства не дают достаточного противоотечного, противовоспалительного эффекта. Наряду со снятием воспаления улучшают прохождение нервных импульсов и иннервацию лицевых мышц, препятствуют развитию мышечных контрактур. Оказывают мощное действие, но показаны для однократного или редкого (ситуативного) применения из-за высокой вероятности побочных эффектов и привыкания. Обычно применяются в виде таблеток или инъекций.
- Мочегонные препараты назначаются, чтобы уменьшить отечность, вывести межклеточную жидкость из мышечных тканей и тем самым уменьшить давление на сдавленный нерв. Назначаются в виде таблеток.
- Спазмолитики уменьшают мышечное напряжение, облегчают спазмы, улучшают сократительную активность лицевых мышц, помогают восстановлению мимики. Уменьшают спазмы кровеносных сосудов, улучшают кровообращение, кровоснабжение и питание лицевого нерва, активизируют обменные процессы. Оказывают косвенное обезболивающее, противовоспалительное действие. Назначаются в виде таблеток.
- Нейротропные препараты улучшают проводимость нервных волокон, помогают устранить непроизвольные сокращения мимических мышц (тики), улучшают прохождение нервных команд к мышцам и сигналов от чувствительных рецепторов, оказывают укрепляющее действие на нервные ткани.
- Витамины В1, В6, В12 оказывают укрепляющее действие на нервную систему, в том числе лицевой нерв, улучшают работу нейронов, позитивно влияют на межнейронные связи. Назначаются в виде таблеток.
- Противовирусные препараты назначаются при инфекционных формах лицевого неврита, подавляют вирус герпеса. Назначаются в виде таблеток.
- Антихолинэстеразные препараты увеличивают концентрацию нейромедиатора ацетилхолина в межнейронных связях, благодаря этому улучшают прохождение нервных сигналов, иннервацию и работу лицевых мышц, слюнных, слезных желез.
Немедикаментозные средства
Методы восточной медицины, применяемые в клинике «Тибет», не уступают в эффективности фармацевтическим препаратам, но при этом не вызывают привыкания и не дают побочных эффектов.
- Иглоукалывание оказывает спазмолитическое, противоишемическое, антивоспалительное, обезболивающее действие. Уменьшает отечность, воспаление, снимает боль. Повышает выработку ацетилхолина, дофамина и других нейромедиаторов, улучшает проводимость нервных волокон и прохождение нервных сигналов.
С помощью акупунктуры врач устраняет перекос, парез, онемение лица, восстанавливает иннервацию мимических мышц, слюнных и слезных желез, нормализует чувствительность лица.
- Точечный массаж лица снимает мышечные спазмы, улучшает кровообращение, приток крови к лицевому нерву и его питание, устраняет застойные явления, скопление межклеточной жидкости и отечность мягких тканей, активизирует обменные процессы, стимулирует восстановительные, защитные механизмы, работу иммунной системы.
- Фитопрепараты тибетской медицины снимают воспаление, улучшают работу кровеносных сосудов, повышают эластичность и сократительную активность сосудистой стенки, позитивно влияют на нервную систему, помогают устранить последствия стрессов, повысить устойчивость к холоду, стрессовым нагрузкам. Повышают иммунитет, оказывают противовирусное и ангиопротекторное действие. Закрепляют результаты лечебных процедур.
Бесплатная консультация Опрос, осмотр, пульсовая диагностика от 30 минут
Диагностика УЗИ, МРТ, Лабораторные исследования (по назначению)
Лечение Индивидуальный
план
Кто занимается лечением
данного заболевания
Невралгия тройничного нерва — современные методы лечения
Лечение невралгии тройничного нерва обычно начинается с назначения медицинских препаратов, подавляющих боль и многим людям этого достаточно длительное время. Однако, со временем, у части пациентов развивается привыкание к медикаментам, что проявляется снижением их эффективности, вплоть до полной потери эффекта. Также нередки случаи развития существенных нежелательных побочных эффектов. Для подобных случаев существуют более радикальные методики лечения.
Если же причиной болей в лице являются другие заболевания, то также необходимо лечение, направленное на основную причину.
Общепринятым мировым подходом является начало лечения с медикаментозной терапии с последующим проведением (при необходимости) реконструктивных вмешательств (микрососудистой декомпрессии корешка тройничного нерва), а при невозможности ее проведения или же неэффективности выполняются деструктивные (разрушающие нерв) вмешательства.
Медицинские препаратыДля лечения тригеминальной невралгии тройничного нерва Вам могут назначить лекарства, которые уменьшают или прекращают передачу болезненных сигналов, посылаемых в Ваш мозгимпульсов.
- Антиконвульсанты. Обычно назначают карбамазепин (финлепсин), эффективность которого при лечении тригеминальной невралгии тройничного нерва подтверждена. Другой Другие антиконвульсанты, который которые может могут применяться при данном состоянии – — это окскарбазепин (Трилептал), ламотриджин (Ламиктал) и топироматы (Топиромакс). Также могут применяться препараты других групп, такие как клоназепам, габапентин, прегабалин. Если препараты, которые Вы принимаете теряют свою эффективность, может потребоваться корректировка дозы или смена препарата, которую необходимо производить под контролем лечащего врача. Побочные эффекты могут включать в себя головокружение, заторможенность, сонливость, двоение в глазах и тошноту. Во время приема препаратов следует воздержаться от управления автомобилем и работы с механизмами, которая требует повышенного внимания или травмоопасна.
- СпазмолитикиМышечные релаксанты. Препараты с мышечно-расслабляющим действием, такие как баклофен (Габлофен, Лиоресал) могут применяться самостоятельно или в комбинации с карбамазепином.
- Антидепрессанты. В многие протоколы лечения хронических болевых синдромов входят препарат группы антидепрессантов (Амитриптилин, Флуоксетин (Прозак), Пароксетин)), которые показали свою эффективность при правильном применении.
При невралгии тройничного нерва, цель хирурга – — прекратить сдавление и раздражение тройничного нерва прилежащим сосудом или же, в ряде случаев, разрушить его волокна, для прерывания прекращения патологического функционирования. Разрушение нерва приводит к онемению лица на стороне вмешательства, которое в зависимости от процедуры и особенностей заболевания, может сохраниться быть постояннопостоянным. После любого хирургического вмешательства боль может возобновиться спустя несколько месяцев или лет. Частота рецидивов зависит от типа невралгии и характера проведенного вмешательства.
Варианты хирургических операций при тригеминальной невралгии (оперативное лечение невралгии тройничного нерва) включают:Микрососудистая декомпрессия. «Золотой стандарт» хирургического лечения невралгии тройничного нерва. Эффективность вмешательства составляет 96-97,5%, что также делает ее одной из самых эффективных операций в плановой нейрохирургии. Операция относится к реконструктивному типу вмешательств, что означает максимальное сохранение анатомических структур и их нормальных функций.
Процедура заключается в отведении сосуда от тройничного нерва в зоне их контакта.
Во время операции хирург делает разрез позади уха на стороне боли. Затем через небольшое отверстие в черепе, хирург отводит все сосуды от нерва, которые находятся с ним в контакте и изолирует их друг от друга специальной прокладкой. Если нерв сдавливается веной, хирург может ее удалить. Также врач может пересечь часть волокон нерва (нейротомия) во время операции, в зависимости от особенностей анатомических взаимоотношений и характера сосудисто-нервного конфликта.
В подавляющем большинстве случаев микрососудистая декомпрессия приводит к полному прекращению боли или значительному ее уменьшению. Данное вмешательство, как и все хирургические операции несет определенные риски, которые включают малый в небольшом проценте случаев снижения снижение слуха, слабости слабость мышц лица, онемение лица, двоение в глазах и другие общехирургические осложнения. Более подробную информацию сообщит Ваш лечащий врач при личной беседе. Большинство пациентов после этой процедуры не имеют каких-либо стойких неврологических симптомов. Данная процедура имеет наименьший процент возобновления болей в долгосрочной перспективе, в сравнении с другими методиками лечения.
Деструктивные методики хирургического лечения невралгии тройничного нерваОстальные методики хирургического лечения являются деструктивными, то есть предполагают разрушение волокон тройничного нерва или иных структур, вовлеченных в процесс.
- Радиохирургия. При этой процедуре, производится сфокусированное радиационное воздействие на корешок тройничного нерва. Данная техника и спользует радиацию для того чтобы разрушить тройничный нерв и снизить или прекратить передачу по нему болевых импульсов. Эффект наступает постепенно, что может занимать несколько недель. После процедуры развивается онемение половины лица, которое сохраняется длительное время. В случае рецидива и возобновления боли процедуру повторяют.
Несомненный плюс процедуры – — это ее безболезненность и отсутствие необходимости в госпитализации и проведении хирургической операции. Среди минусов – — высокая стоимость, и тот факт, что она не устраняет причину заболевания – — сдавление корешка нерва. Деструктивный характер процедуры, в случае ее неэффективности, значительно снижает или сводит на нет эффективность возможного проведения микрососудистой декомпрессии. Иногда может происходить усиление болей на фоне онемения лица – — так называемая «болезненная анестезия» – — «anesthesia dolorosa»
Другие процедуры, которые могут применяться для лечения тригеминальной невралгии тройничного нерва, называются «ризотомия». При ризотомии, хирург проводит разрушение волокон нерва, что приводит к онемению лица.
Способы ризотомии включают:- Инъекции глицерола (Глицероловые блокады). Во время данной процедуры игла проводится через лицо к отверстию на в основании черепа, через которое затем игла вводится в тригеминальную цистерну, небольшую полость со спинномозговой жидкостью, которая окружает узел тройничного нерва —- место, где нерв делится на три ветви – — и часть его корешка. Затем доктор вводит небольшое количество стерильного глицерола, который повреждает тройничный нерв и прерывает проведение болевого импульса. Эта процедура обычно облегчает боль. Однако иногда боль, спустя некоторое время, возобновляется, а у многих пациентов сохраняется онемение лица или чувство покалывания.
- Баллонная компрессия. При баллонной компрессии, Ваш доктор вводит полую иглу через Ваше лицо в часть нерва, которая выходит на основании черепа. Затем он проводит через иглу тонкую гибкую трубку (катетер) с баллончиком на конце. Врач раздувает баллон с давлением, достаточным для повреждения тройничного нерва и блокировки болевых сигналов. Баллонная компрессия успешно облегчает боль у большинства пациентов, по крайней мере на какой-то период времени. Большинство пациентов после процедуры испытывают онемение лица, а у некоторых отмечается временная или постоянная слабость жевательных мышц.
- Радиочастотное температурное повреждение (деструкция). Процедура избирательно разрушает волокна нерва, связанные с болью. Методика проведения иглы к месту выхода нерва на основании черепа аналогична описанной выше. После расположения иглы через ее просвет проводится электрод, на который подается небольшой электрический ток. Во время процедуры Вас попросят сказать где и когда Вы почувствовали покалывание. Когда же нейрохирург определит часть нерва, вовлеченную в передачу болевых ощущений, электрод разогревается до тех пор, пока это не приводит к разрушению нервных волокон, что создает зону повреждения (деструкции). Если боль сохраняется, врач может создать дополнительные зоны деструкции. Радиочастотная термодеструкция обычно приводит к некоторому онемению лица после процедуры.
- Алкоголизация. Проведение блокады ветвей тройничного нерва в местах их выхода на лице с использованием раствора спирта, которые приводят к разрушению нервных волокон. Методика на сегодняшний день практически утратила свою актуальность ввиду низкой эффективности при таком процессе как лечение невралгии тройничного нерва и высокого процента рецидивов и осложнений. Проведение алкоголизации может иметь смысл, как крайней меры, при невозможности выполнения иных методик.
Очень небольшое количество клинических испытаний было проведено по изучению эффективности альтернативных методов лечения невралгии тройничного нерва, так что убедительных доказательств пользы их применения нет. Однако, некоторые пациенты отмечают улучшение состояния при использовании этих методик. Как правило эффект отмечается при сочетании с традиционными методами лечения.
Альтернативные методики лечения невралгии включают:
- акупунктуру
- витаминотерапию
- рефлексотерапию
- нутрициотерапию
- электростимуляцию нервов
При хронической боли, сопровождающей лечениеи в частности при невралгии тройничного нерва хорошо зарекомендовало себя включение в комплекс лечения психотерапевтических методик.
Всегда необходимо проконсультироваться с Вашим врачом до того, как прибегать к альтернативному лечению, так как в противном случае Вы может усугубить свое состояние.
Развернутую консультацию по поводу Вашего заболевания и ответы на все вопросы Вы можете получить в нашей клинике, которая уже более 20 лет специализируется на лечении такого рода заболеваний и имеет наибольший опыт в Украине
Задайте вопрос специалистам Клиники Субтенториальной нейрохирургии, заполнив поля ниже.
Невралгия тройничного нерва – причины и симптомы 😕 Как лечить невралгию тройничного нерва 👩⚕️
Анатомия и функции тройничного нерва
Тройничный нерв относится к классу смешанных, включающих как чувствительные, так и двигательные волокна. Это самый большой из 12 черепных нервов. Такое название нерва обусловлено наличием трех ветвей – глазничного, верхнечелюстного и нижнечелюстного нервов.
При поражении одной из ветвей тройничного нерва возникает расстройство чувствительности в области иннервации. При поражении корешка тройничного нерва расстройство чувствительности отмечается в областях иннервации всех трех ветвей.
Виды невралгии тройничного нерва
Различают два вида невралгии тройничного нерва:
- Идиопатическая (первичная) невралгия – возникает самостоятельно, без иных патологических процессов, которые могут сдавливать нерв.
- Симптоматическая (вторичная) – возникает в качестве следствия других патологий
Заболеваемость невралгией тройничного нерва
Согласно статистическим данным, заболеваемость поражениями тройничного нерва составляет 35-50 человек на 100 тысяч населения. У женщин патология встречается чаще, чем у мужчин. Преимущественно поражение носит правосторонний характер.
Причины невралгии тройничного нерва
Невралгия тройничного нерва возникает в силу разных причин, среди которых часто встречаются следующие:
- Компрессия (сдавливание) тройничного нерва сосудами или новообразованиями.
- Патологии нервной системы (рассеянный склероз, менингит).
- Нарушение прикуса.
- Воспалительные патологии носовых пазух.
- Травмы.
- Переохлаждение.
- Вирусные или бактериальные инфекции верхних дыхательных путей.
Поражение тройничного нерва после удаления зуба
Выделяют и невралгию тройничного нерва одонтогенного происхождения. В данном случае патология вызвана заболеваниями зубов, челюстей или ротовой полости. Иногда такие осложнения возникают после удаления зубов.
Заподозрить поражение лицевого нерва после удаления зуба можно в случае возникновения болевых ощущений в области глаз, височной зоны или носа. При этом триггером болевых ощущений выступают безобидные процедуры или явления, например, порыв ветра или чистка зубов.
Важно! Не бойтесь удалять зубы, когда это необходимо по медицинским показаниям. Поражение лицевого нерва при удалении зубов возникают крайне редко. А вот осложнения при отсутствии должного лечения зубов возникают намного чаще. Поэтому здесь важно довериться опытному врачу, с которым вероятность развития осложнений сводится к минимуму.
Выделяют две главные причины, по которым происходит поражение тройничного нерва на фоне удаления зуба:
- Диагностическая ошибка. Иногда невралгия настолько удачно маскируется под зубную боль, что врач ставит ошибочный диагноз. Вместо лечения невралгии тройничного нерва, больному лечат или удаляют зуб. При этом болевые ощущения усиливаются.
- Сложности в стоматологическом лечении. Иногда при лечении тяжелых стадий пульпита часто травмируется нерв, из-за чего возникают невралгические симптомы.
Осложнение после имплантации
Среди осложнений, встречающихся в имплантологической стоматологии, является и поражение тройничного нерва. При этом нервные волокна поражаются механически (в ходе проведение процедуры), в силу воспалительного процесса или на фоне инфекционного осложнения.
Поражение тройничного нерва при имплантации могут возникнуть на разных этапах процедуры, начиная с анестезии. Тщательная диагностика с применением компьютерной томографии, а также хирургические шаблоны позволят минимизировать риски осложнений в имплантологии.
Осложнения со стороны тройничного нерва возникают и при неправильно подобранном имплантате, когда возрастает риск травматизации нервных волокон. Усиленное давление на имплантат при установке также чревато поражением тройничного нерва.
Важно! Согласно статистическим данным, вероятность осложнений со стороны тройничного нерва при имплантации составляет меньше 3%. В Центре Израильской Стоматологии этот показатель еще меньше. В данном случае минимизировать вероятность осложнений позволяет опытная команда врачей и тщательная подготовка к процедуре имплантации. Поэтому нашим пациентам незачем беспокоится о последствиях.
Симптомы заболевания
К симптомам патологии относятся:
- Сильная боль в лице. Часто болевой синдром охватывает область верхней и нижней челюсти. Нередко такой характер боли приводит человека в заблуждение, маскируясь под зубную боль. Однако после лечения зубов боль не проходит.
- Мышечные спазмы лица и изменение чувствительности кожи. Из-за спазмов человек испытывает сложности в общении или жевании.
- Асимметрия лица. В частности, асимметричность четко просматривается при разговоре или улыбке.
- Болевые приступы стреляющего характера.
К сопутствующим симптомам невралгии тройничного нерва относится повышенное слюноотделение, бессонница, тревога, изменение вкусовых ощущений, местное или общее повышение температуры тела.
Диагностика
При подозрении на повреждение тройничного нерва пациенту проводят следующие диагностические мероприятия:
- Осмотр и сбор анамнеза.
- Магнитно-резонансная томография.
- Компьютерная томография.
В ходе диагностики врач выясняет и причину поражения тройничного нерва. Во многом от этого зависит выбранная тактика лечения пациента.
Как лечить невралгию тройничного нерва
Лечение данной патологии осуществляется консервативными и/или хирургическими методами. Предпочтение отдается консервативной терапии, а хирургия применяется в крайних случаях, когда медикаменты и немедикаментозные способы не приносят желаемого результата.
Схема лечения тройничного нерва подбирается с учетом диагностических параметров. Врачи также учитывают особенности здоровья и состояния пациента. Основная цель терапевтических мероприятий при данной патологии – устранение болевых ощущений и предупреждение рецидивов.
Консервативное лечение
Консервативная терапия невралгии сводится к приему медикаментов, а также к проведению физиотерапевтических процедур. Первые препараты при невралгии тройничного нерва стали применяться еще в начале прошлого века. Самым популярным был фенитоин. Однако с 60-х годов для этих целей стали использовать карбамазепин. При использовании данного препарата устранение болевого синдрома удается достичь в 70-75% случаев.
Лекарственная терапия
Сегодня при данной патологии применяются лекарства трех видов:
- Антиконвульсанты – лекарственные средства, устраняющие болевой синдром и притупляющие гиперчувствительность нервных волокон лица к раздражающим факторам. Антиконвульсанты применяются при эпилептических приступах для купирования мышечных судорог. Однако они эффективны и при невралгии.
- Спазмолитические препараты – лекарства, способствующие расслаблению гладкой мускулатуры. Таким образом, спазмолитики купируют вторичный болевой синдром.
- Нейропротекторы – лекарственные средства, обладающие защитным действием по отношении к нервным волокнам и клеткам.
Рассмотрим некоторые препараты для лечения невралгии тройничного нерва:
- Фенитоин. Сегодня этот препарат используют при обострениях. Назначают в виду внутривенных инъекций.
- Баклофен. Это лекарственное средство принадлежит к группе миорелаксантов.
- Препараты вальпроевой кислоты. Назначают как в таблетированном виде, так и в виде внутривенных инъекций.
- Тизанидин. Это миорелаксант центрального действия. При невралгии назначают внутрь.
- Витамины. При невралгии, как и других патологиях нервной системы назначают витамины группы В. Эти витамины принимают участие в обменных процессах нервных клеток, способствуя скорейшему восстановлению функций нервных клеток.
Как показывает практика, обезболивающие препараты при невралгии тройничного нерва малоэффективны. Прием анальгетиков при данной патологии нежелателен и по той причине, что у пациента на фоне их приема могут возникнуть абузусные головные боли. Связано это с ожидание пациента быстрого купирования боли, из-за чего возможен чрезмерный их прием. На фоне же передозировок нередко развиваются головные боли, которых называют абузусными.
Физиотерапевтические методы лечения невралгии тройничного нерва
Физиотерапия – дополняющий лечебный компонент, способствующий скорейшему восстановлению нервных волокон. При невралгических нарушениях часто применяются следующие физиотерапевтические методики:
- Магнитотерапия – методика, оказывающая стимулирующее действие на микроциркуляцию крови целевого участка. Кроме того, магнитное поле, создаваемое при магнитотерапии, оказывает обезболивающий и миорелаксирующий эффекты. Снимается мышечное напряжение, что улучшает и внешний вид лица.
- Ультравысокочастотная терапия (УВЧ) – процедура, активирующая нормальные реакции нейронов на внешние раздражители. Кроме того, УВЧ оказывает и нейропротекторный эффект. Установлено, что курсы УВЧ способствуют устранению воспалительного процесса и снижению болевого синдрома.
- Лазерная терапия – методика физиотерапевтического лечения, улучшающая микроциркуляцию, а также способствующая восстановлению нервных тканей. Кроме того, лазерное излучение определенной длины волны способствует устранению спазмов, болевого синдрома и воспалений.
- Диадинамические токи (ДДТ) – процедура, улучшающая циркуляцию крови в целевом участке. Также ДДТ улучшает лимфоток и местные защитные механизмы.
Хирургическое лечение
Если консервативная терапия малоэффективна, то с невралгией тройничного нерва справляются при помощи хирургии. Суть хирургического вмешательства состоит в устранении сдавливающей нерв структуры. Часто это сосуд, который оказывает компрессию. В иных случаях прибегают к удалению нерва, чтобы избавить пациента от болевого синдрома и воспалительного процесса.
Операции при невралгии тройничного нерва часто носят малоинвазивный характер. Это вмешательства через маленькие проколы. Такие операции не сопровождаются обильными потерями крови, и после них пациент намного быстрее восстанавливается. В некоторых случаях вместо «классической» хирургии также применяют стереотаксическую радиохирургию. В данном случае удаление целевых структур осуществляется пучком высокоэнергетических радиоволн.
Как лечить невралгию тройничного нерва в домашних условиях
Врачи крайне не рекомендуют заниматься самолечением. Так пациенты тратят драгоценное время. Часто за помощью обращаются уже с запущенными формами поражения тройничного нерва, что требует радикальных (хирургических) вмешательств.
Восстановление зубов при невралгии
Некоторым пациентам приходится сталкиваться с несколькими проблемами сразу. Например, восстановлением зубов на фоне невралгии. В данной ситуации важно разобраться в нюансах для понимания правильного алгоритма действий.
Лечебный процесс при поражении тройничного нерва – длительный. Пациенту предстоит поработать для полного восстановления. В частности, требования предъявляются и зубным протезам, если у пациента нет собственных зубов. Связано это с необходимостью поддерживать оптимальное состояние жевательного аппарата. Ведь при нарушении мимики (которой сопровождается невралгия) нарушается и процесс жевания. Зубной протез должен быть изготовлен из качественных высокопрочных материалов. Он не должен доставлять дискомфорта пациенту, например, выпадать изо рта.
Если же пациент столкнулся с необходимостью восстановления зубов на фоне невралгии, то при острой стадии заболевания от восстановительных работ следует отказаться минимум на 3 недели. Если за это время с проблемой удалось справиться, то можно обращаться к стоматологу с вопросом о восстановлении зубного ряда.
Что касается типов протезирования при невралгии, то по возможности пациенту рекомендуют имплантацию. Съемные протезы ввиду их размеров и особенностей ухода обладают рядом недостатков, по сравнению с несъемными.
Помните, что в любой ситуации благодаря современным достижениям в стоматологии, можно найти выход. Команда врачей Центра Израильской Стоматологии составит грамотную схему лечения, оптимальную для каждого пациента.
Список из 11 препаратов от невралгии тройничного нерва по сравнению
- Лечебные процедуры
- Боль
- Невралгия
- Невралгия тройничного нерва
Другие названия: Tic Doloureux; TN боль
Невралгия тройничного нерва — это чрезвычайно болезненное воспаление тройничного нерва, которое вызывает сильную боль в лице, похожую на молниеносную, и спазм лицевых мышц на пораженной стороне.
Эти болезненные приступы могут возникнуть после легкого прикосновения к различным участкам кожи лица по ходу этого черепного нерва.Специальные лекарства могут быть очень эффективными для снижения частоты приступов, но может потребоваться хирургическое вмешательство.
Лекарства, применяемые для лечения невралгии тройничного нерва
Следующий список лекарств так или иначе связаны с этим состоянием или используются для его лечения.
| Название препарата | Рейтинг | Отзывы | Деятельность & квест; | Rx / OTC | Беременность | CSA | Спирт |
|---|---|---|---|---|---|---|---|
| Просмотр информации о карбамазепине карбамазепин | 6.8 | 107 отзывов | Rx | D | N | Икс | |
Общее название: карбамазепин системный Бренды: Тегретол, Тегретол XR, Эпитол, Карбатрол …показать все Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении | |||||||
| Просмотр информации о габапентине габапентин Не по назначению | 8.0 | 33 отзыва | Rx | C | N | Икс | |
Общее название: габапентин системный Класс препарата: аналоги гамма-аминомасляной кислоты Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении Вне лейбла: Да | |||||||
| Просмотр информации о Тегретоле Тегретол | 6.8 | 37 Отзывов | Rx | D | N | Икс | |
Общее название: карбамазепин системный Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Назначение информации | |||||||
| Просмотреть информацию о топирамате топирамат Не по назначению | 6.0 | 13 отзывов | Rx | D | N | Икс | |
Общее название: топирамат системного действия Брендовое название: Топамакс Класс препарата: противосудорожные средства ингибитор карбоангидразы Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении Вне лейбла: Да | |||||||
| Просмотр информации об окскарбазепине окскарбазепин Не по назначению | 8.1 | 60 отзывов | Rx | C | N | Икс | |
Общее название: окскарбазепин системный Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении Вне лейбла: Да | |||||||
| Посмотреть информацию о баклофене баклофен Не по назначению | 6.6 | 11 отзывов | Rx | C | N | Икс | |
Общее название: баклофен системного действия Класс препарата: релаксанты скелетных мышц Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении Вне лейбла: Да | |||||||
| Посмотреть информацию о Topamax Топамакс Не по назначению | 6.0 | Отзывов: 9 | Rx | D | N | Икс | |
Общее название: топирамат системного действия Класс препарата: противосудорожные средства ингибитор карбоангидразы Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Назначение информации Вне лейбла: Да | |||||||
| Просмотр информации о Тегретол XR Тегретол XR | 8.5 | 10 отзывов | Rx | D | N | Икс | |
Общее название: карбамазепин системный Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты | |||||||
| Посмотреть информацию об Epitol Эпитол | 8.3 | 3 отзыва | Rx | D | N | Икс | |
Общее название: карбамазепин системный Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Назначение информации | |||||||
| Посмотреть информацию о Carbatrol Карбатрол | 8.7 | 3 отзыва | Rx | D | N | Икс | |
Общее название: карбамазепин системный Класс препарата: дибензазепиновые противосудорожные средства Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Назначение информации | |||||||
| Просмотр информации о фенитоине фенитоин Не по назначению | 8.0 | 4 отзыва | Rx | D | N | Икс | |
Общее название: фенитоин системный Класс препарата: гидантоиновые противосудорожные средства, антиаритмические средства I группы Потребителям: дозировка, взаимодействия, побочные эффекты Для профессионалов: Факты о наркотиках от А до Я, Монография AHFS DI, Информация о назначении Вне лейбла: Да | |||||||
Узнать больше о Невралгии тройничного нерва
IBM Watson Micromedex
Mayo Clinic Reference
Легенда
| Рейтинг | Для оценки пользователей спрашивали, насколько эффективным они нашли лекарство с учетом положительных / побочных эффектов и простоты использования (1 = неэффективно, 10 = наиболее эффективно). |
|---|---|
| Деятельность | Активность основана на недавней активности посетителей сайта по отношению к другим лекарствам в списке. |
| Rx | Только по рецепту. |
| ОТК | Без рецепта. |
| Rx / OTC | По рецепту или без рецепта. |
| Не по назначению | Это лекарство не может быть одобрено FDA для лечения этого состояния. |
| EUA | Разрешение на использование в чрезвычайных ситуациях (EUA) позволяет FDA разрешать использование неутвержденных медицинских продуктов или несанкционированного использования одобренных медицинских продуктов в объявленной чрезвычайной ситуации в области общественного здравоохранения, когда нет адекватных, одобренных и доступных альтернатив. |
| Категория беременности | |
|---|---|
| А | Адекватные и хорошо контролируемые исследования не смогли продемонстрировать риск для плода в первом триместре беременности (и нет доказательств риска в более поздних триместрах). |
| B | Исследования репродукции животных не смогли продемонстрировать риск для плода, и нет адекватных и хорошо контролируемых исследований у беременных женщин. |
| С | Исследования репродукции животных показали неблагоприятное воздействие на плод, и нет адекватных и хорошо контролируемых исследований на людях, но потенциальные преимущества могут потребовать применения у беременных женщин, несмотря на потенциальные риски. |
| D | Имеются положительные доказательства риска для плода человека, основанные на данных о побочных реакциях, полученных в результате исследований или маркетингового опыта или исследований на людях, но потенциальные преимущества могут потребовать применения у беременных женщин, несмотря на потенциальные риски. |
| X | Исследования на животных или людях продемонстрировали аномалии развития плода и / или есть положительные доказательства риска для плода у человека, основанные на данных о побочных реакциях из исследовательского или маркетингового опыта, и риски, связанные с применением у беременных женщин, явно перевешивают потенциальную пользу. |
| N | FDA не классифицировало препарат. |
| Закон о контролируемых веществах (CSA) Приложение | |
|---|---|
| M | Препарат имеет несколько графиков.График может зависеть от точной лекарственной формы или силы лекарства. |
| U | CSA Расписание неизвестно. |
| N | Не подпадает под действие Закона о контролируемых веществах. |
| 1 | Имеет высокий потенциал для злоупотреблений. В настоящее время не применяется в медицинских целях в США. Отсутствуют общепринятые правила безопасности для использования под медицинским наблюдением. |
| 2 | Имеет высокий потенциал для злоупотреблений.В настоящее время разрешено медицинское использование для лечения в Соединенных Штатах или в настоящее время принятое медицинское использование с серьезными ограничениями. Жестокое обращение может привести к серьезной психологической или физической зависимости. |
| 3 | Имеет меньшую вероятность злоупотребления, чем те, которые указаны в таблицах 1 и 2. В настоящее время разрешено медицинское использование для лечения в Соединенных Штатах. Злоупотребление может привести к умеренной или низкой физической зависимости или высокой психологической зависимости. |
| 4 | Имеет низкий потенциал злоупотребления по сравнению с теми, которые указаны в таблице 3.В настоящее время он широко используется в лечении в Соединенных Штатах. Жестокое обращение может привести к ограниченной физической или психологической зависимости по сравнению с теми, которые указаны в таблице 3. |
| 5 | Имеет низкий потенциал злоупотребления по сравнению с теми, которые указаны в таблице 4. В настоящее время разрешено медицинское использование для лечения в Соединенных Штатах. Жестокое обращение может привести к ограниченной физической или психологической зависимости по сравнению с теми, которые указаны в таблице 4. |
| Спирт | |
|---|---|
| X | Взаимодействует с алкоголем. |
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об ограничении ответственности в отношении медицинских услуг
«Молния» боли
Фарм США . 2017; 42 (1): 41-44.
РЕФЕРАТ: Невралгия тройничного нерва (НТГ) — это внезапно возникающая, кратковременная, но изнурительная нейропатическая боль, возникающая в результате сдавления пятого черепного нерва, вызванная повседневными действиями, такими как жевание и речь.Это хроническое заболевание чаще всего встречается у пожилых женщин, поражая до 27 на 100 000 человек во всем мире. Фармакологическое лечение первой линии для TGN представляет собой противосудорожное средство карбамазепин, с окскарбазепином, используемым по аналогичному механизму, но с более мягким профилем побочных эффектов. Лекарственные препараты второго ряда (баклофен, ламотриджин) считаются полезными вспомогательными средствами, а менее изученные лекарства или хирургическое вмешательство прибегают к помощи, если только стандартное лечение неэффективно или не переносится пациентом.
Невралгия тройничного нерва (TGN), или tic douloureux , представляет собой быстрое начало колющей, односторонней лицевой боли продолжительностью от секунд до минут, вызванное простыми действиями, такими как прием пищи, чистка зубов, разговор или воздействие порыв холодного воздуха.По оценкам, TGN поражает приблизительно от 12,6 до 27 человек на 100 000 человек во всем мире 1,2 и наиболее часто встречается у женщин в возрасте старше 50 лет. 3 В США распространенность TGN составляет 15,5 случаев на 100 000 человек. 4
Эта «молния» боли исходит от пятого черепного нерва, который имеет три отдела, обеспечивающих чувствительность различных участков лица. Офтальмологический нерв (V 1 ) поддерживает ощущения в глазах и лбу, верхнечелюстной нерв (V 2 ) в области щек и верхней губы, а нижнечелюстной нерв (V 3 ) иннервирует область челюсти, которая участвует в кусании, жевании и глотании.Боль TGN исходит из верхнечелюстного и нижнечелюстного отделов. TGN ассоциируется с более высоким уровнем депрессии, поскольку на качество жизни пациента может влиять хроническая боль, и могут потребоваться антидепрессанты. 5
Патогенез и диагностикаМеханизмы, участвующие в патогенезе TGN, до конца не изучены. Считается, что сдавление сосудов, обычно венозных или артериальных петель на входе тройничного нерва в мост, приводит к очаговой демиелинизации тройничного нерва. 6-8 TGN подразделяется на три категории: идиопатический не имеет четкой причины, классический вызван компрессией V черепного нерва и вторичный является результатом основного заболевания, такого как опухоль головного мозга или рассеянный склероз. 9 Клинические данные, анамнез и подробное обследование головы, шеи, зубов и челюсти остаются основными методами исключения других причин невропатической боли. Нейровизуализация с помощью МРТ используется в диагностике при подозрении на сдавление нерва или при необходимости хирургического вмешательства.Медикаментозная терапия остается основным методом лечения ТГН.
Медикаментозная терапия первого рядаКарбамазепин: На основании клинических исследований карбамазепин является признанным вариантом лечения первого ряда для TGN; это также единственный одобренный FDA препарат со специальными показаниями для TGN. 10-13 Обычная начальная доза карбамазепина составляет от 100 до 200 мг два раза в день при пероральном приеме, которая может быть увеличена по мере переносимости до поддерживающей дозы от 600 до 800 мг в день в разделенных дозах.Максимальная доза не должна превышать 1200 мг в день. Эти медленные титрования дозировки уменьшают эффекты центральной нервной системы (ЦНС), такие как сонливость, головокружение, атаксия и нистагм. Карбамазепин — это блокатор потенциал-управляемых натриевых каналов, который останавливает распространение потенциала действия, механизма лечения эпилепсии. Ингибирование этого «повторяющегося возбуждения» делает карбамазепин подходящим основным средством лечения ТГН. Карбамазепин также показан для лечения пациентов с биполярным расстройством, которые не могут переносить другие лекарства от мании, такие как литий или вальпроат. 10-13
Карбамазепин может изменять состояние костного мозга, приводя к уменьшению количества эритроцитов, лейкоцитов и тромбоцитов, состояние, известное как апластическая анемия . Таким образом, пациенты должны быть проинформированы о признаках и симптомах миелосупрессии, при этом обычные клинические анализы крови выполняются в течение первых 3 месяцев лечения, а частота определяется по результатам. 14 Карбамазепин стимулирует высвобождение антидиуретического гормона (АДГ), усиливая реабсорбцию воды и повышая вероятность гипонатриемии, что может иметь негативное влияние на пожилых пациентов, получающих лечение от ТГН.В этой популяции также могут наблюдаться изменения в минерализации костей, поскольку наблюдалось снижение уровня витамина D при хроническом введении карбамазепина. 15
Карбамазепин является хорошо известным индуктором CYP450 3A4, при этом сообщалось о значительных лекарственных взаимодействиях, таких как снижение эффективности варфарина или пероральных контрацептивов. 16 Более высокие уровни карбамазепина в сыворотке крови возникают, если препарат одновременно вводится с ингибиторами CYP450, включая макролидные антибиотики, вальпроат, азольные противогрибковые средства и грейпфрутовый сок.Эти эффекты, вместе взятые, могут быть проблематичными для врача, лечащего пожилого пациента, у которого частота TGN является самой высокой. 17
Карбамазепин противопоказан лицам из населения Восточной и Юго-Восточной Азии, у которых был положительный результат теста на аллель HLA-B * 15: 02. 18 Эти люди подвержены повышенному риску развития синдрома Стивенса-Джонсона (SJS) и токсического эпидермального некролиза (TEN). Хотя эта реакция маловероятна, она фатальна, и при появлении сыпи следует немедленно прекратить прием карбамазепина.
Окскарбазепин: Окскарбазепин является кето аналогом карбамазепина, пролекарства, превращенного в активный метаболит, 10-моногидроксипроизводное. Препарат начинают с пероральной дозы 600 мг в день, затем ее увеличивают на 300 мг до общей суточной дозы от 1200 до 1800 мг в день. Механизм действия такой же, как у карбамазепина, но окскарбазепин также снижает активность высоковольтных кальциевых каналов. Окскарбазепин имеет меньше побочных эффектов и лекарственных взаимодействий, чем карбамазепин, и является подходящей альтернативой для пациентов пожилого возраста с дисфункцией почек, печени и сердца.Поскольку окскарбазепин является аналогом карбамазепина, его также следует избегать у пациентов, экспрессирующих генетический аллель HLA-B * 15: 02 из-за редкой кожной реакции. 19,20
Таким образом, карбамазепин и окскарбазепин остаются золотым стандартом фармакотерапии TGN. Противосудорожные препараты следует тщательно титровать, часто отслеживая побочные эффекты и лекарственные взаимодействия. ТАБЛИЦА 1 обобщает карбамазепин и окскарбазепин как препараты первой линии для лечения ТГН.
Медикаментозная терапия второго рядаСледующие препараты предназначены для пациентов, которые не реагируют на карбамазепин и окскарбазепин или обеспокоены побочными эффектами или лекарственными взаимодействиями, поскольку они считаются вспомогательными для лечения TGN . Кроме того, имеется меньше исследований, подтверждающих их эффективность.
Ламотриджин: Ламотриджин — это противосудорожное средство, которое подавляет быстрое возбуждение нейронов и вызывает зависимую от напряжения и потребления блокаду натриевых (Na + ) каналов, стабилизируя мембраны нейронов.Также наблюдается снижение высвобождения глутамата, возбуждающего нейромедиатора. Для TGN ламотриджин обеспечивает эффективную дополнительную терапию. 21 Ламотриджин вводят перорально в суточной дозе 25 мг в течение первых 2 недель, а затем ее увеличивают до 50 мг в день в течение 3 и 4 недель, пока общая доза ламотриджина не достигнет 400 мг в день (в два приема). Пациентам, получающим параллельную терапию индукторами CYP3A4, следует начинать с ламотриджина в дозе 50 мг один раз в день, постепенно увеличивая дозу до 100 мг один раз в день на 3 неделе, 200 мг один раз в день на 5 неделе, 300 мг один раз в день на 6 неделе. и 400 мг один раз в день на 7 неделе.Пациентам, принимающим ингибитор CYP3A4, следует начинать с более низкой дозы (12,5-25 мг) через день и увеличивать ее на 25 мг каждые 2 недели, в общей сложности до 400 мг в день. Сообщалось о потенциально смертельных кожных реакциях при лечении ламотриджином, особенно в первые недели лечения, и пациентов следует проинструктировать о необходимости незамедлительно прекратить прием препарата при первых признаках сыпи. 22
Баклофен: Баклофен — это релаксант скелетных мышц, действующий как агонист гамма-аминомасляной кислоты типа B (GABA B ).Лечение баклофеном позволяет увеличить приток хлорид-ионов и закрыть пресинаптические кальциевые каналы, что снижает высвобождение возбуждающих передатчиков в ЦНС для уменьшения мышечных спазмов. Для купирования боли баклофен снижает содержание вещества P в спинном мозге. Начальная доза баклофена для ТГН составляет 15 мг в день перорально в три приема с постепенным титрованием до поддерживающей дозы от 50 до 60 мг в день. При ТГН баклофен снижает количество болезненных эпизодов и продлевает ремиссию. 23
Усиливая действие ГАМК, баклофен может вызывать сонливость и угнетение дыхания в случае передозировки. Прием препарата следует постепенно снижать, и не рекомендуется резкая отмена, поскольку могут возникнуть спастичность, галлюцинации и судороги. 24
ТАБЛИЦА 1 суммирует действия ламотриджина и баклофена в качестве лекарственной терапии второй линии для TGN.
Рефрактерная терапияГабапентин: Габапентин является аналогом ГАМК, который считается ценным для лечения невропатической боли. 25 Препарат модулирует высвобождение ГАМК без прямого рецепторного действия. В ЦНС габапентин связывает кальциевые каналы N-типа, что приводит к уменьшению поступления кальция в нейроны. Габапентин начинают перорально в дозе 300 мг в день для TGN и могут быть увеличены на 300 мг каждые 2–3 дня по мере переносимости. Максимальная суточная доза габапентина составляет 1800 мг. Наиболее частыми эффектами, связанными с габапентином, являются сонливость, головокружение, атаксия, головная боль и тремор. С этим аналогом ГАМК связаны минимальные лекарственные взаимодействия.
Ботулинический токсин типа А (Ботокс-А): Ботокс-А , по наблюдениям, является эффективным средством лечения нескольких неврологических патологий, включая головную боль. 26-28 Он предотвращает зависимое от кальция высвобождение ацетилхолина, вызывающее расслабление мышц. Хотя эффективность этого токсина в отношении TGN полностью не изучена, считается, что высвобождение ноцицептивных модулирующих пептидов ингибирует центральную и периферическую сенсибилизацию. 29
В нескольких клинических исследованиях стандартная доза Ботокса-А для лечения ТГН составляла от 25 до 100 ЕД, вводимых в триггерные зоны, с обезболиванием до 12 недель.Сообщенные побочные эффекты включали асимметрию лица и отек в месте инъекции, которые переносились пациентами с коротким периодом восстановления. 30-32 Потребуются дальнейшие исследования для установления долгосрочного клинического исхода ботокса-А при лечении TGN.
Другие агенты: Пациенты могут испытывать резкую боль или увеличенную продолжительность и интенсивность TGN, что требует использования сильнодействующих опиоидных анальгетиков, таких как морфин или оксикодон.Опасения, связанные с использованием агонистов мю-опиоидных рецепторов, по-прежнему вызывают сильнейший седативный эффект, зависимость и угнетение дыхания в случае передозировки. 33
Было обнаружено, что пимозид, блокатор дофамина, имеет некоторую пользу для TGN, который не реагирует на терапию первой линии карбамазепином. 34 Однако есть опасения по поводу экстрапирамидных эффектов и сердечных аритмий с этим антагонистом дофамина 2 (D 2 ), особенно у пожилых пациентов. 34 Таким образом, большинство клиницистов избегают приема пимозида при терапии TGN.
Лидокаин — блокатор натриевых каналов, который останавливает распространение потенциала действия в центральной и периферической нервной системе. Фармакокинетика этого анестетика ограничивает его использование, так как его короткий период полувыведения сокращает продолжительность обезболивания лидокаином до не более 24 часов при внутривенном введении для TGN. 35 Кроме того, более высокие дозы лидокаина могут снижать проводимость миокарда и вызывать тремор и ненормальные ощущения в конечностях. 35
Фосфенитоин является пролекарством противосудорожного фенитоина. Пациенты, которые стали невосприимчивыми к пероральным лекарствам и поступили в острый кризис TGN, могут испытывать облегчение боли в течение примерно 48 часов с помощью этого блокатора натриевых каналов, пока не будут рассмотрены другие фармакотерапевтические агенты или пока не будет обеспечено обезболивание перед хирургическим вмешательством. 36
Операция: Операция предназначена для пациентов, которые безуспешно пробовали как минимум три препарата или не переносят побочные эффекты или взаимодействия лекарств.Хирургическое вмешательство следует тщательно продумать, поскольку некоторые процедуры являются инвазивными, требуют анестезии и увеличивают вероятность инфекций. Наиболее часто используемые методы включают микрососудистую декомпрессию, ризотомию и радиохирургию гамма-ножом. 37
ЗаключениеФармакологическая терапия остается исходным лечением для пациентов с ТГН, а противосудорожный карбамазепин является общепринятой терапией первой линии. Препараты второго ряда добавляются, если пациент не может переносить побочные эффекты или лекарственные взаимодействия.Фармацевты играют уникальную роль в наблюдении за пациентом на предмет этих исходов. Клинические исследования расширили возможную роль других лекарств для лечения этой нейропатической боли, и эти механизмы должны быть дополнительно оценены как варианты лечения этой хронической боли в будущем.
СПИСОК ЛИТЕРАТУРЫ 1. Купман Дж. С., Дилеман Дж. П., Хюйген Ф. Дж. И др. Частота лицевых болей среди населения в целом. Боль . 2009; 147 (1-3): 122-127.
2. Холл GC, Кэрролл Д., МакКуэй HJ.Заболеваемость первичной медико-санитарной помощью и лечение четырех состояний с невропатической болью: описательное исследование, 2002-2005 гг. BMC Fam Pract . 2008; 9: 26.
3. Лю Л., Ван Х, Лю Н. и др. Остеопороз костей челюсти: фактор, коррелирующий с первичной невралгией тройничного нерва. Медицинский Научный Монит . 2014; 20: 1481-1485.
4. Шапарин Н., Гриценко К., Фернандес Гарсиа-Ровес Д. и др. Периферическая нейромодуляция для лечения рефрактерной невралгии тройничного нерва. Pain Res Manag. 2015; 20 (2): 63-66.
5. Hals EKB, Stubhaug A. Сопутствующие психические и соматические заболевания при хронических состояниях орофациальной боли: пациенты, страдающие болью, нуждаются в коллективном подходе с участием специалистов разных профессий. Scand J Pain . 2011; 2 (4): 153-154.
6. Jannetta PJ. Артериальная компрессия тройничного нерва на мосту у пациентов с невралгией тройничного нерва. Дж. Нейросург . 1967; 26 (1 доп.): 159-162.
7. Девор М., Амир Р., Раппапорт Ж. Патофизиология невралгии тройничного нерва: гипотеза воспламенения. Клин Дж. Боль .2002; 18: 4-13.
8. Девор М., Говрин-Липпманн Р., Раппапорт Ж. Механизм невралгии тройничного нерва: ультраструктурный анализ образцов корешка тройничного нерва, полученных во время операции по микрососудистой декомпрессии. Дж. Нейросург . 2002; 96: 532-543.
9. Cruccu G, Finnerup NB, Jensen TS, et al. Невралгия тройничного нерва: новая классификация и диагностическая классификация для практики и исследований. Неврология . 2016; 87 (2): 220-228.
10. Gronseth G, Cruccu G, Alksne J, et al. Параметр практики: диагностическая оценка и лечение невралгии тройничного нерва (обзор, основанный на фактах): отчет Подкомитета по стандартам качества Американской академии неврологии и Европейской федерации неврологических обществ. Неврология . 2008; 71: 1183-1190.
11. Кэмпбелл Ф.Г., Грэм Дж. Г., Зилха К.Дж. Клинические испытания карбазепина (тегретола) при невралгии тройничного нерва. J Neurol Neurosurg Psychiatry . 1966; 29: 265-267.
12. Роклифф Б.В., Дэвис Э. Последовательные контролируемые испытания карбамазепина при невралгии тройничного нерва. Arch Neurol . 1966; 15: 129-136.
13. Киллиан Дж. М., Фромм Г. Х. Карбамазепин в лечении невралгии. Использование побочных эффектов. Arch Neurol . 1968; 19: 129-136.
14. Соботка Ю.Л., Александр Б., Повар Б.Л. Обзор гематологических реакций карбамазепина и рекомендации по мониторингу. DICP . 1990; 24 (12): 1214-1219.
15. Минцер С., Боппана П., Тогури Дж. И др. Уровни витамина D и метаболизм костной ткани у пациентов с эпилепсией, принимающих карбамазепин или окскарбазепин . Эпилепсия. 2006; 47 (3): 510-515.
16. Perucca E. Клинически значимые лекарственные взаимодействия с противоэпилептическими препаратами. Br J Clin Pharmacol. 2006; 61 (3): 246-255.
17.Oomens MA, Forouzanfar T. Фармацевтическое лечение невралгии тройничного нерва у пожилых людей. Препараты старения . 2015; 32 (9): 717-726.
18. Locharernkul C, Shotelersuk V, Hirankarn N. Фармакогенетический скрининг тяжелых кожных аллергических реакций, вызванных карбамазепином. Дж. Clin Neurosci . 2011; 18 (10): 1289-1294.
19. Гулерия В.С., Шарда С., Рана Т., Суд А.К. Вызванный окскарбазепином токсический эпидермальный некролиз — сообщение о редком случае. Индийский J Pharmacol . 2015; 47 (4): 459-461.
20. Линь Л.С., Лай П.С., Ян С.Ф., Ян Р.С. Синдром Стивенса-Джонсона, индуцированный окскарбазепином: клинический случай. Kaohsiung J Med Sci . 2009; 25 (2): 82-86.
21. Zakrzewska JM, Chaudhry Z, Nurmikko TJ, et al. Ламотриджин (ламиктал) при рефрактерной невралгии тройничного нерва: результаты двойного слепого плацебо-контролируемого перекрестного исследования. Боль . 1997; 73 (2): 223-230.22. Wang XQ, Lv B, Wang HF и др. Тяжелая кожная побочная реакция, вызванная ламотриджином: обновленные данные за 1999-2014 гг. J Clin Neurosci. 2015; 22 (6): 1005-1011.
23. Фромм Г. Х., Терренс К. Ф., Чатта А. С.. Баклофен в лечении невралгии тройничного нерва: двойное слепое исследование и долгосрочное наблюдение. Энн Нейрол . 1984; 15 (3): 240-244.
24. Терренс К.Ф., Фромм Г.Х. Осложнения отмены баклофена. Arch Neurol. 1981; 38 (9): 588-589.
25. Zakrzewska JM. Медикаментозное лечение невропатических болей тройничного нерва. Эксперт Опин Фармакотер . 2010; 11 (8): 1239-1254.
26. Ney JP, Joseph KR.Неврологическое использование ботулинического нейротоксина типа А. Neuropsychiatr Dis Treat . 2007; 3 (6): 785-798.
27. Аврора С.К., Додик Д.В., Тюркель С.К. и др. OnabotulinumtoxinA для лечения хронической мигрени: результаты двойной слепой рандомизированной плацебо-контролируемой фазы исследования PREEMPT 1. Цефалгия . 2010; 30 (7): 793-803.
28. Динер Х.С., Додик Д.В., Аврора С.К. и др. OnabotulinumtoxinA для лечения хронической мигрени: результаты двойной слепой рандомизированной плацебо-контролируемой фазы исследования PREEMPT 2. Цефалгия . 2010; 30 (7): 804-814.
29. Wu C, Xie N, Lian Y, et al. Центральная антиноцицептивная активность периферически применяемого ботулотоксина типа А на модели невралгии тройничного нерва у лабораторных крыс. Springerplus . 2016; 5: 431.
30. Wu CJ, Lian YJ, Zheng YK, et al. Ботулинический токсин типа А для лечения невралгии тройничного нерва: результаты рандомизированного двойного слепого плацебо-контролируемого исследования. Цефалгия . 2012; 32 (6): 443-450.
31. Zhang H, Lian Y, Ma Y, et al.Две дозы ботулотоксина типа А для лечения невралгии тройничного нерва: наблюдение терапевтического эффекта в рандомизированном двойном слепом плацебо-контролируемом исследовании. J Головная боль . 2014; 15:65.
32. Шехата Х.С., Эль-Тамави М.С., Шалаби Н.М., Рамзи Г. Ботулинический токсин типа А: может ли он быть эффективным вариантом лечения трудноизлечимой невралгии тройничного нерва? J Головная боль . 2013; 14: 92.
33. Мендлик М.Т., Урицкий Т.Ю. Лечение невропатической боли. Варианты лечения Curr Neurol .2015; 17 (12): 50.
34. Lechin F, van der Dijs B, Lechin ME, et al. Терапия пимозидом при невралгии тройничного нерва. Arch Neurol . 1989; 46 (9): 960-963.
35. Chaudhry P, Friedman DI. Внутривенное лечение лидокаином при классической невралгии тройничного нерва с сопутствующей стойкой лицевой болью. Головная боль . 2014; 54 (8): 1376-1379.
36. Чеширский WP. Фосфенитоин: внутривенное средство для лечения острого криза невралгии тройничного нерва. J Устранение болевых симптомов .2001; 21 (6): 506-510.
37. Bajwa Z, Ho CC, Khan SA. Невралгия тройничного нерва. Дата обновления . www.uptodate.com/contents/trigeminal-neuralgia. По состоянию на 24 августа 2016 г.
Чтобы прокомментировать эту статью, обращайтесь по адресу [email protected].
Часто задаваемые вопросы о невралгии тройничного нерва | Отделение неврологической хирургии
Невралгия тройничного нерва, также называемая тик-дулурекс, представляет собой редкое неврологическое заболевание, которое вызывает внезапные, сильные, короткие, повторяющиеся колющие повторяющиеся эпизоды лицевой боли в одной или нескольких ветвях тройничного нерва.Обычно это вызвано сдавлением тройничного нерва артерией или веной, но также может присутствовать без видимой причины. Иногда его ошибочно принимают за стоматологическую проблему или проблему с челюстью или как психологическое расстройство. После правильного диагноза существует несколько вариантов медикаментозного и хирургического лечения, чтобы уменьшить или облегчить изнурительную боль, вызванную этим заболеванием. Пациентам с невралгией тройничного нерва уделяется первоочередное внимание при планировании обследования.
Какие существуют безоперационные методы лечения невралгии тройничного нерва?
Кто является кандидатом на операцию при невралгии тройничного нерва?
Какие виды операций по поводу невралгии тройничного нерва проводятся в UCSF?
· Микроваскулярная декомпрессия (MVD)
· Радиохирургия
· Радиочастотное поражение (также называемое радиочастотной ризотомией)
Проводятся ли в UCSF какие-либо исследования невралгии тройничного нерва?
Лечебная терапия невралгии тройничного нерва
Первая линия лечения пациентов с невралгией тройничного нерва — это всегда медикаменты.Даже малоинвазивная хирургия сопряжена с риском и должна рассматриваться как последнее средство.
Лекарства, наиболее часто используемые для лечения невралгии тройничного нерва, — это лекарства, которые изначально были разработаны для лечения эпилепсии. Однако было обнаружено, что этот класс лекарств достаточно эффективен при лечении нервной боли, включая TN, при постоянном приеме. Противосудорожным средством, наиболее часто назначаемым при TN, является карбамазепин (Тегретол®), который может обеспечить хотя бы частичное обезболивание от 80% до 90% пациентов.Другие противосудорожные средства, часто назначаемые при TN, включают фенитоин (Дилантин®), габапентин (Нейронтин®), ламотриджин (Ламиктал®), окскарбазепин (Трилептал®) и топирамат (Топамакс®). Также может быть назначен миорелаксант баклофен (Лиорезал®), отдельно или в комбинации с другими лекарствами.
Обычно наблюдаемые побочные эффекты лекарственной терапии TN включают головокружение, сонливость, забывчивость, неустойчивость и тошноту. Кроме того, карбамазепин и другие препараты, назначаемые для лечения TN, не всегда остаются эффективными с течением времени, требуя все более и более высоких доз или большего количества лекарств, принимаемых одновременно, а у некоторых пациентов наблюдаются достаточно серьезные побочные эффекты, чтобы потребовать отмены.
В UCSF пациентов могут обследовать опытные неврологи, специализирующиеся на оценке и лечении невралгии тройничного нерва. Чтобы запланировать обследование для подтверждения диагноза невралгии тройничного нерва и обсудить варианты лечения, свяжитесь с неврологической клиникой по телефону (415) 353-2273.
Хирургическое обследование при невралгии тройничного нерва
Хирургическая оценка невралгии тройничного нерва включает подтверждение диагноза невралгии тройничного нерва, просмотр магнитно-резонансной томографии головного мозга (МРТ) для исключения других поддающихся лечению причин боли в лице и оценку тяжести боли, общего состояния здоровья пациента и предпочтение пациентом целей лечения по сравнению с неприятием риска.
Операция при невралгии тройничного нерва предназначена для людей, которые все еще испытывают изнуряющую боль, несмотря на лучшее медицинское лечение. Операция по поводу невралгии тройничного нерва редко предлагается пациентам с болью в лице, не связанной с невралгией тройничного нерва, или с атипичной невралгией тройничного нерва; Операции по поводу этих состояний имеют гораздо более низкие показатели успеха и во многих случаях могут усилить боль и / или вызвать дополнительные проблемы со здоровьем.
Микрососудистая декомпрессия при невралгии тройничного нерва
Микроваскулярная декомпрессия (MVD), также известная как процедура Жаннетты, является наиболее распространенной хирургической процедурой для лечения невралгии тройничного нерва.Это открытый хирургический доступ, при котором за ухом делается небольшой разрез, в черепе просверливается небольшое отверстие и под микроскопом обнажается тройничный нерв. В большинстве случаев имеется кровеносный сосуд (обычно артерия, но иногда и вена), сдавливающий тройничный нерв. Отодвигая этот кровеносный сосуд от нерва и вставляя прокладку из тефлонового войлока, боль почти всегда уменьшается. Хотя МВД считается наиболее инвазивной операцией при ТН, это также лучшая процедура для устранения основной проблемы, которая обычно вызывает ТН: компрессии сосудов.MVD также вызывает наименьшее повреждение тройничного нерва и обеспечивает, в среднем, самые длительные периоды без боли и наилучшие шансы на постоянное прекращение приема лекарств. При использовании МВД в качестве самостоятельного лечения показатель долгосрочного успеха составляет около 80%. Процедура требует пребывания в больнице в среднем два дня и четырех-шести недель, чтобы вернуться к нормальной повседневной деятельности.
Каковы возможные побочные эффекты МВД?
MVD — это серьезная операция, включающая в себя процедуру трепанации черепа с вырезанием небольшого отверстия в черепе.Типичные хирургические риски для любой нейрохирургической процедуры с открытым черепом включают инфекцию, чрезмерное кровотечение, утечку спинномозговой жидкости и риски анестезии. Редкие неврологические травмы могут включать повреждение слуха, повреждение сосудов (инсульт) и, очень редко, смерть.
Будет ли у меня боль при пробуждении?
Поскольку МВД является серьезной операцией, пациенты после операции будут испытывать некоторую боль в разрезе и головную боль, но медсестры дадут вам лекарства, которые помогут вам контролировать эту боль.
Как долго мне нужно будет оставаться в больнице?
Пациенты обычно проводят две ночи в больнице перед выпиской.
Когда я могу вернуться к нормальной деятельности?
Боль и скованность в результате операции обычно проходят в течение недели, и вы можете вернуться к нормальной деятельности в своем собственном темпе. Однако вам следует избегать подъема тяжестей или напряжения в первые шесть недель после операции.
Будет ли операция полностью излечивающей?
Никто не может обещать, что любая операция по поводу невралгии тройничного нерва будет успешной для всех пациентов, и всегда есть шанс, что боль вернется позже; тем не менее, МВД — лучший шанс облегчить проблему, лежащую в основе боли при невралгии тройничного нерва.
Радиохирургия при невралгии тройничного нерва
Радиохирургическое лечение (гамма-нож) невралгии тройничного нерва является наименее инвазивным хирургическим методом. Фактически, это вообще не операция. Гамма-нож — это устройство, которое доставляет точные контролируемые лучи излучения к целям внутри черепа, включая мозг и связанные с ним нервы. При лечении невралгии тройничного нерва лучи излучения направляются на тройничный нерв, где они попадают в ствол мозга. Лечение гамма-ножом не направлено на первопричину невралгии тройничного нерва, а вместо этого повреждает тройничный нерв, чтобы остановить передачу болевых сигналов.Процедура не требует анестезии или требует небольшого количества анестезии и проводится в амбулаторных условиях. Эта процедура обеспечивает значительный контроль или уменьшение боли примерно у 80% пациентов, но реакция обычно медленнее, чем при других методах лечения. Пациенты могут ответить в течение 4-6 недель после лечения; однако некоторым пациентам для полного ответа требуется от 3 до 8 месяцев. Большинство пациентов продолжают принимать полные дозы лекарств в течение как минимум 3-6 месяцев после лечения, и мы обычно не начинаем снижать прием препаратов TN до тех пор, пока не будет достигнуто облегчение боли.
Каковы возможные побочные эффекты операции с использованием гамма-ножа?
Побочные эффекты могут включать покалывание или онемение лица (у 20–30% пациентов), но обычно они проявляются в легкой степени.
Будет ли у меня боль при пробуждении?
Пациентов не усыпляют для этой процедуры, так как она вызывает минимальную боль и дискомфорт. Лечение требует использования каркаса, который крепится к голове булавками. В течение 1-2 дней после лечения наблюдается умеренная боль в месте расположения булавки.
Как долго мне нужно будет оставаться в больнице?
Гамма-нож Лечение невралгии тройничного нерва является амбулаторной процедурой — вы сможете отправиться домой в день лечения.
Когда я могу вернуться к нормальной деятельности?
Пациенты обычно начинают возвращаться к нормальной деятельности в течение 48 часов, хотя это зависит от человека.
Будет ли операция полностью излечивающей?
Никто не может обещать, что любая операция по поводу невралгии тройничного нерва будет успешной для всех пациентов; Лечение гамма-ножом «перемешивает» болевые пути, но всегда есть шанс, что боль может повториться позже.
Радиочастотное поражение (RFL) при невралгии тройничного нерва
Радиочастотное поражение (также называемое радиочастотной ризотомией) является хорошим вариантом при сильной боли у пациентов с высоким риском, например, у пациентов с сопутствующим заболеванием, которое сделало бы открытое хирургическое вмешательство слишком опасным. Это также хороший вариант для пациентов с рассеянным склерозом (МС), у которых TN часто не вызвана сдавлением сосудов. Как и лечение гамма-ножом, радиочастотное поражение не лечит первопричину TN, а вместо этого повреждает тройничный нерв, чтобы остановить передачу болевых сигналов.В этой процедуре электрод, вводимый через щеку, используется для нагрева нерва и его избирательного повреждения, чтобы не дать болевым сигналам попасть в мозг. Лечение обеспечивает немедленное облегчение боли почти у 90% пациентов, но может вызывать большее онемение лица, чем другие процедуры, и имеет частоту рецидивов боли в 40% через 2–3 года после операции. При необходимости процедуру можно повторить.
Каковы возможные побочные эффекты радиочастотной ризотомии?
Хотя радиочастотная ризотомия менее инвазивна, менее рискованна и требует меньше времени в больнице, чем МВД, этот метод также имеет более высокую частоту рецидивов боли.Радиочастотная ризотомия также сопряжена с повышенным риском незначительного или тяжелого послеоперационного онемения, которое часто может быть постоянным. Эта процедура также сопряжена с редкими общими хирургическими рисками инфицирования и чрезмерного кровотечения, а также чрезмерного повреждения нервов, онемения роговицы, анестезии dolorosa и внутричерепного кровоизлияния.
Будет ли у меня боль при пробуждении?
Пациенты могут испытывать небольшую боль в щеке в месте введения иглы. Обычно это проходит в течение одной недели.
Как долго мне нужно будет оставаться в больнице?
Радиочастотная ризотомия по поводу TN — это амбулаторная процедура — вы сможете отправиться домой в день лечения.
Когда я могу вернуться к нормальной деятельности?
Пациенты обычно начинают возвращаться к нормальной деятельности в течение 48 часов, хотя это зависит от человека.
Будет ли операция полностью излечивающей?
Никто не может обещать, что любая операция по поводу TN будет успешной для всех пациентов; Радиочастотная ризотомия «перемешивает» болевые пути, но всегда есть шанс, что боль может повториться позже.
Подходы, Обзор противоэпилептических препаратов, Карбамазепиновая терапия
Автор
Manish K Singh, MD Ассистент-профессор кафедры неврологии, преподавательский факультет программы резидентуры по лечению боли и неврологии, Университетская больница Ганемана, Медицинский колледж Дрекселя; Медицинский директор, неврология и лечение боли, Институт нейробиологии Джерси
Маниш К Сингх, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской академии медицины боли, Американского общества головной боли, Американской ассоциации врачей индийского происхождения. , Американская медицинская ассоциация, Американское общество региональной анестезии и медицины боли
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Гордон Х. Кэмпбелл, MSN, FNP-BC Практикующая медсестра-невролог, Служба неврологии, Портлендский медицинский центр по делам ветеранов; Начальный факультет, клинический инструктор и приглашенный лектор, отделение семейного ухода, Школа медсестер Университета медицинских наук штата Орегон
Гордон Х. Кэмпбелл, MSN, FNP-BC является членом следующих медицинских обществ: Американская академия неврологии
Раскрытие информации: ничего расскрыть.
Сиддхарт Гаутам, врач-резидент MBBS , Институт неврологии Джерси
Раскрытие: Ничего не говорится.
Helmi L Lutsep, MD Профессор и заместитель председателя кафедры неврологии Медицинского факультета Орегонского университета здоровья и науки; Заместитель директора, Центр инсульта OHSU
Хелми Л. Луцеп, доктор медицины, является членом следующих медицинских обществ: Американская академия неврологии, Американская ассоциация инсульта.
Раскрытие информации: Medscape Neurology Редакционный консультативный совет: Комитет по рассмотрению инсульта, CREST2; Консультативный совет врачей Coherex Medical; Клиническое испытание национального лидера и руководящего комитета, Bristol Myers Squibb; Abbott Laboratories, консультативная группа.
Главный редактор
Роберт Эган, доктор медицины NW Нейроофтальмология
Роберт Эган, доктор медицины, является членом следующих медицинских обществ: Американская академия неврологии, Американская кардиологическая ассоциация, Североамериканское нейроофтальмологическое общество, Медицинская ассоциация Орегона
Раскрытие информации : Получил гонорары от Biogen Idec и Genentech за участие в консультативных советах.
Благодарности
Джейн В. Чан, доктор медицины Профессор неврологии / нейроофтальмологии, медицинский факультет, отделение неврологии, медицинский факультет Университета Невады
Джейн В. Чан, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской академии офтальмологии, Американской медицинской ассоциации, Североамериканского нейроофтальмологического общества и Phi Beta Kappa
.Раскрытие: Ничего не нужно раскрывать.
Джеймс Р. Коуч, доктор медицинских наук, FACP Профессор неврологии, Центр медицинских наук Университета Оклахомы
Раскрытие: Ничего не нужно раскрывать.
Теодор Дж. Гаэта, DO, MPH, FACEP Клинический адъюнкт-профессор, Департамент неотложной медицины, Медицинский колледж Weill Cornell; Заместитель председателя и директор программы резидентуры по неотложной медицине, Департамент неотложной медицины, Методистская больница Нью-Йорка; Научный руководитель, адъюнкт-профессор кафедры неотложной медицины, медицинский факультет Университета Святого Георгия
Теодор Дж. Гаэта, DO, MPH, FACEP является членом следующих медицинских обществ: Альянса клинического образования, Американского колледжа врачей неотложной помощи, руководителей отделов неотложной медицины, Совета директоров резидентур по неотложной медицине, Нью-Йоркской медицинской академии и Общество академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Дж. Стивен Хафф, доктор медицины Доцент кафедры неотложной медицины и неврологии, факультет неотложной медицины, Медицинский факультет Университета Вирджинии
Дж. Стивен Хафф, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американской академии неврологии, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Саймон К. Лоу, доктор медицины, фармацевт Доцент офтальмологии, Глазной институт Жюля Стейна, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена
Саймон К. Ло, доктор медицинских наук, фармацевт является членом следующих медицинских обществ: Американской академии офтальмологии, Американского общества глаукомы и Ассоциации исследований в области зрения и офтальмологии
Раскрытие: Ничего не нужно раскрывать.
Эндрю Лоутон, доктор медицины Медицинский директор нейроофтальмологической службы, отделение офтальмологии, Баптистский глазной центр, Баптистский медицинский медицинский центр
Эндрю Лоутон, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Медицинского общества Арканзаса и Южной медицинской ассоциации
Раскрытие: Ничего не нужно раскрывать.
Марк Э. Ленертс, доктор медицины, FAHS Штатный невролог, Mercy Medical Group; Адъюнкт-клинический профессор неврологии, кафедра неврологии, Калифорнийский университет, Дэвис, медицинский факультет
Марк Э. Ленертс, доктор медицины, FAHS является членом следующих медицинских обществ: Американской академии неврологии, Американского общества головной боли и Международного общества головной боли
Раскрытие: Ничего не нужно раскрывать.
Хорхе Э. Мендизабал, доктор медицины Консультант, неврология Корпус-Кристи
Хорхе Э. Мендизабал, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американского общества головной боли, Национальной ассоциации инсульта и Совета по инсульту Американской кардиологической ассоциации.
Раскрытие: Ничего не нужно раскрывать.
Hampton Roy Sr, MD Доцент кафедры офтальмологии Медицинского университета Арканзаса
Хэмптон Рой-старший, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Американского колледжа хирургов и Панамериканской ассоциации офтальмологов
Раскрытие: Ничего не нужно раскрывать.
Tom Scaletta, MD Заведующий отделением неотложной медицины, больница Эдварда; Бывший президент Американской академии экстренной медицины
Том Скалетта, доктор медицины, является членом следующих медицинских обществ: Американская академия неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Brian R Younge, MD Профессор офтальмологии, Медицинский факультет клиники Майо
Брайан Р. Юнг, доктор медицины, является членом следующих медицинских обществ: Американской медицинской ассоциации, Американского офтальмологического общества и Североамериканского нейроофтальмологического общества.
Раскрытие: Ничего не нужно раскрывать.
Невралгия тройничного нерва: основы практики, анатомия, анатомия
Автор
Manish K Singh, MD Ассистент-профессор кафедры неврологии, преподавательский факультет программы резидентуры по лечению боли и неврологии, Университетская больница Ганемана, Медицинский колледж Дрекселя; Медицинский директор, неврология и лечение боли, Институт нейробиологии Джерси
Маниш К Сингх, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской академии медицины боли, Американского общества головной боли, Американской ассоциации врачей индийского происхождения. , Американская медицинская ассоциация, Американское общество региональной анестезии и медицины боли
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Гордон Х. Кэмпбелл, MSN, FNP-BC Практикующая медсестра-невролог, Служба неврологии, Портлендский медицинский центр по делам ветеранов; Начальный факультет, клинический инструктор и приглашенный лектор, отделение семейного ухода, Школа медсестер Университета медицинских наук штата Орегон
Гордон Х. Кэмпбелл, MSN, FNP-BC является членом следующих медицинских обществ: Американская академия неврологии
Раскрытие информации: ничего расскрыть.
Сиддхарт Гаутам, врач-резидент MBBS , Институт неврологии Джерси
Раскрытие: Ничего не говорится.
Helmi L Lutsep, MD Профессор и заместитель председателя кафедры неврологии Медицинского факультета Орегонского университета здоровья и науки; Заместитель директора, Центр инсульта OHSU
Хелми Л. Луцеп, доктор медицины, является членом следующих медицинских обществ: Американская академия неврологии, Американская ассоциация инсульта.
Раскрытие информации: Medscape Neurology Редакционный консультативный совет: Комитет по рассмотрению инсульта, CREST2; Консультативный совет врачей Coherex Medical; Клиническое испытание национального лидера и руководящего комитета, Bristol Myers Squibb; Abbott Laboratories, консультативная группа.
Главный редактор
Роберт Эган, доктор медицины NW Нейроофтальмология
Роберт Эган, доктор медицины, является членом следующих медицинских обществ: Американская академия неврологии, Американская кардиологическая ассоциация, Североамериканское нейроофтальмологическое общество, Медицинская ассоциация Орегона
Раскрытие информации : Получил гонорары от Biogen Idec и Genentech за участие в консультативных советах.
Благодарности
Джейн В. Чан, доктор медицины Профессор неврологии / нейроофтальмологии, медицинский факультет, отделение неврологии, медицинский факультет Университета Невады
Джейн В. Чан, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской академии офтальмологии, Американской медицинской ассоциации, Североамериканского нейроофтальмологического общества и Phi Beta Kappa
.Раскрытие: Ничего не нужно раскрывать.
Джеймс Р. Коуч, доктор медицинских наук, FACP Профессор неврологии, Центр медицинских наук Университета Оклахомы
Раскрытие: Ничего не нужно раскрывать.
Теодор Дж. Гаэта, DO, MPH, FACEP Клинический адъюнкт-профессор, Департамент неотложной медицины, Медицинский колледж Weill Cornell; Заместитель председателя и директор программы резидентуры по неотложной медицине, Департамент неотложной медицины, Методистская больница Нью-Йорка; Научный руководитель, адъюнкт-профессор кафедры неотложной медицины, медицинский факультет Университета Святого Георгия
Теодор Дж. Гаэта, DO, MPH, FACEP является членом следующих медицинских обществ: Альянса клинического образования, Американского колледжа врачей неотложной помощи, руководителей отделов неотложной медицины, Совета директоров резидентур по неотложной медицине, Нью-Йоркской медицинской академии и Общество академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Дж. Стивен Хафф, доктор медицины Доцент кафедры неотложной медицины и неврологии, факультет неотложной медицины, Медицинский факультет Университета Вирджинии
Дж. Стивен Хафф, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американской академии неврологии, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Саймон К. Лоу, доктор медицины, фармацевт Доцент офтальмологии, Глазной институт Жюля Стейна, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена
Саймон К. Ло, доктор медицинских наук, фармацевт является членом следующих медицинских обществ: Американской академии офтальмологии, Американского общества глаукомы и Ассоциации исследований в области зрения и офтальмологии
Раскрытие: Ничего не нужно раскрывать.
Эндрю Лоутон, доктор медицины Медицинский директор нейроофтальмологической службы, отделение офтальмологии, Баптистский глазной центр, Баптистский медицинский медицинский центр
Эндрю Лоутон, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Медицинского общества Арканзаса и Южной медицинской ассоциации
Раскрытие: Ничего не нужно раскрывать.
Марк Э. Ленертс, доктор медицины, FAHS Штатный невролог, Mercy Medical Group; Адъюнкт-клинический профессор неврологии, кафедра неврологии, Калифорнийский университет, Дэвис, медицинский факультет
Марк Э. Ленертс, доктор медицины, FAHS является членом следующих медицинских обществ: Американской академии неврологии, Американского общества головной боли и Международного общества головной боли
Раскрытие: Ничего не нужно раскрывать.
Хорхе Э. Мендизабал, доктор медицины Консультант, неврология Корпус-Кристи
Хорхе Э. Мендизабал, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американского общества головной боли, Национальной ассоциации инсульта и Совета по инсульту Американской кардиологической ассоциации.
Раскрытие: Ничего не нужно раскрывать.
Hampton Roy Sr, MD Доцент кафедры офтальмологии Медицинского университета Арканзаса
Хэмптон Рой-старший, доктор медицины, является членом следующих медицинских обществ: Американской академии офтальмологии, Американского колледжа хирургов и Панамериканской ассоциации офтальмологов
Раскрытие: Ничего не нужно раскрывать.
Tom Scaletta, MD Заведующий отделением неотложной медицины, больница Эдварда; Бывший президент Американской академии экстренной медицины
Том Скалетта, доктор медицины, является членом следующих медицинских обществ: Американская академия неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Brian R Younge, MD Профессор офтальмологии, Медицинский факультет клиники Майо
Брайан Р. Юнг, доктор медицины, является членом следующих медицинских обществ: Американской медицинской ассоциации, Американского офтальмологического общества и Североамериканского нейроофтальмологического общества.
Раскрытие: Ничего не нужно раскрывать.
Реалистичный подход к лечению невралгии тройничного нерва
Боль при невралгии тройничного нерва остается сложной задачей. Натуральные соединения могут быть многообещающим средством для снятия боли. Это исследование было направлено на изучение эффектов аконитина на крысиной модели боли при невралгии тройничного нерва. У взрослых крыс линии Wistar Albino выполнено хроническое сужение подглазничного нерва. После развития невропатической боли крыс распределяли в одну из групп лечения: карбамазепин 40 или 80 мг / кг; аконитин 0.25, 0,50 или 0,75 мг / кг; или инъекция физиологического раствора (контрольная группа). Поведенческий тест с использованием нитей фон Фрея и тест вращающегося стержня проводился перед хирургической процедурой и на 24–29-й день после операции. После завершения тестов ипсилатеральный и контралатеральный спинной мозг собирали для вестерн-блоттинга для оценки экспрессии белка NR-1. Для статистического анализа выполняли дисперсионный анализ с последующим критерием Манна-Уитни. значения <0,05 считались значимыми. Аконитин значительно снижает механическую чувствительность дозозависимым образом.Значительное снижение моторной координации было отмечено для более высоких доз аконитина, что было аналогично дозам карбамазепина 40 и 80 мг / кг. Экспрессия NR-1 была снижена в ипсилатеральном спинном мозге, тогда как между группами не было отмечено значительных различий в экспрессии NR-1 в контралатеральном спинном мозге. Аконитин обладал значительным обезболивающим эффектом, который был аналогичен карбамазепину в зависимости от дозы. Аконитин может быть альтернативным фармакологическим средством для контроля боли при невралгии тройничного нерва.
1. Введение
Невралгия тройничного нерва (TN) — это нейропатическое болевое состояние, распространяющееся по одной или нескольким ветвям тройничного нерва [1]. TN определяется 3-ей Международной классификацией головных болей (ICHD-3) как «внезапные, повторяющиеся односторонние короткие удары током, похожие на колющие, или стреляющие боли, длящиеся от долей секунды до 2 минут» [2, 3]. Приступы могут возникать спонтанно или быть вызваны безобидными раздражителями, включая разговор, жевание, чистку зубов и прикосновения [4, 5].Однако между приступами бывают безболезненные периоды [6]. Согласно новой классификации Международной ассоциации по изучению боли TN была классифицирована как классическая, возникающая в результате нервно-сосудистого сдавления; идиопатический, когда этиологический фактор не очевиден; и вторичные, вызванные опухолями, инфекциями, рассеянным склерозом, травмами и др. [3, 7]. Уровень заболеваемости оценивается в 4–5 случаев на 100 000 человек, что чаще встречается у женщин, чем у мужчин, и у лиц старше 40 лет [4, 6].
Исследования показали, что лекарства эффективны у большинства пациентов, а фармакотерапия считается лечением первой линии при TN [4, 8–10]. Однако следует рассмотреть возможность хирургического лечения при наличии структурных поражений и в случаях, не поддающихся лечению. Обычные анальгетики и противовоспалительные препараты не облегчают боль TN, тогда как противоэпилептические средства обычно эффективны [11]. Карбамазепин признан препаратом первой линии для начального лечения TN во многих клинических руководствах [7, 12].Сообщалось, что карбамазепин обеспечивает 100% обезболивание у 70% пациентов [13]. Однако пациенты обычно испытывают побочные эффекты, включая сонливость, головокружение, запор, тошноту и атаксию. Менее распространенные, но более серьезные побочные эффекты включают сыпь, лейкопению, нарушение функции печени, апластическую анемию и гипонатриемию [3]. В литературе также упоминалось о многочисленных лекарственных взаимодействиях с карбамазепином [14]. Это предполагает необходимость оценки альтернативных фармакологических агентов с меньшими побочными эффектами, которые можно было бы безопасно использовать во всех группах пациентов при лечении TN.
Природные соединения могут иметь терапевтическое значение для облегчения невропатической боли. С давних времен препараты различных видов Aconitum L. (), принадлежащих к семейству Ranunculaceae, широко применялись в качестве лечебных средств в восточной медицине [15]. Aconitum видов насчитывает более 300 видов, которые естественным образом произрастают во всем мире [16]. Несколько типов алкалоидов были экстрагированы из разных видов Aconitum [17]. Аконитин, основной алкалоид Aconitum , и другие родственные алкалоиды использовались, в частности, в традиционной китайской медицине и аюрведической медицине для обезболивающих, противовоспалительных, противоревматических и неврологических показаний [15, 17]).Обезболивающие эффекты видов Aconitum были продемонстрированы на животных моделях воспалительной и невропатической боли [18]. Экстракт, полученный из видов Aconitum , применялся наружно для лечения TN, люмбаго, радикулита, артрита и подагры из-за его анестезирующих свойств [19].
Эффекты системного введения аконитина на TN остаются неизвестными. В этом исследовании мы исследовали влияние аконитина на TN в модели крыс с хроническим сужением (CCI) подглазничного нерва (ION).
2. Материалы и методы
2.1. Экспериментальные животные
Крысы, использованные в этом исследовании, были получены из лаборатории животных Кобая. Протокол исследования был одобрен этическим комитетом Лаборатории животных Кобая (номер разрешения: 234). Всего в настоящем исследовании использовались 72 крысы-самцы линии Wistar Albino со средним весом 180-200 гр. Животных содержали в стандартных пластиковых клетках в помещении с влажностью 40-45% и температурой 21-24 ° C с циклами свет / темнота 12/12 часов, с пищей и водой ad libitum.
2.2. Протокол эксперимента
Семьдесят две крысы массой 180-200 г были включены в исследование. На исходном уровне все крысы были проверены на координацию движений и подверглись поведенческому тестированию на тактильную аллодинию. Все крысы подверглись хроническому сужению подглазничного нерва. После травмы и развития нейропатической боли крысы были разделены на 6 групп (по 12 крыс в каждой). Две группы получали разные дозы карбамазепина (40 и 80 мг / кг) внутрибрюшинно, 3 группы получали разные дозы аконитина (0.25, 0,50 и 0,75 мг / кг) интраорально. Одна группа служила контролем и получала только физиологический раствор внутрибрюшинно. Порядок, в котором были протестированы эти шесть различных обработок, различается для разных животных; Дизайн с латинскими квадратами использовался, чтобы гарантировать, что каждый день проверяются все шесть процедур. Аконитин применяли в дозах 0,25, 0,50 и 0,75 мг / кг через желудочный зонд. В качестве препарата сравнения применяли карбамазепин в дозах 40 и 80 мг / кг внутрибрюшинно. Эти дозы были выбраны согласно Barros, Leite и Carroll et al.[20, 21]. Лекарства вводили в течение шести последовательных послеоперационных дней (то есть с 24-го по 29-й день) за 30 минут до начала поведенческого тестирования. Дозы определялись на основе доз, описанных в литературе [22]. После завершения тестов 36 крыс использовали для анализа вестерн-блоттингом, и спинной мозг собирали под общей анестезией.
2.3. Хирургический протокол
CCI-ION выполняли в соответствии с методом, описанным ранее [23].Вкратце, крыс анестезировали внутримышечным введением комбинации 1 мл кетамина (50 мг / мл) и 1 мл ксилазина (20 мг / мл). Разрез производился на стыке носовой кости и скуловой дуги. ИОН экспонировался путем тупого рассечения мышцы. После отделения ИОНа от прилегающих тканей были выполнены две перевязки нерва хромовым кетгутом. Разрез закрыли шелковыми швами.
2.4. Поведенческое тестирование
крыс тестировали в начале исследования и на 24-29 дни после операции.За день до операции, перед первым сеансом фактической стимуляции, крысам позволяли адаптироваться к клетке для наблюдения и к условиям тестирования в течение 3 часов. В течение этого периода экспериментатор медленно заходил в клетку, чтобы коснуться стенок клетки пластиковым стержнем, похожим на те, на которых закреплены нити фон Фрея. После того, как крысы приучали к достигающим движениям, начинали серию механических раздражений [24]. Анализы проводились через 30 минут после приема лекарств.Акклимация и тестирование проводились в затемненном помещении при освещении красной лампочкой мощностью 60 Вт, подвешенной на высоте 1 м над центром испытательной зоны, с фоновым шумом 45 дБ. Как описано ранее [25], механическую чувствительность проверяли путем приложения градуированных сил (0,015, 0,127, 0,217, 0,745 и 2,150 г) с нитями фон Фрея (Эстезиометр давления®, Стултинг, Чикаго, Иллинойс). Нити применялись на территории ИОН. Стимулы вводились односторонне до операции и двусторонне после операции, с возрастающей интенсивностью.Балльная оценка, основанная на ранее утвержденной шкале, была проведена для оценки реакции крыс на каждый стимул [25]. Оценка была следующей: нет ответа = 0; обнаружение = 1; обнаружение и изъятие = 2; обнаружение, отход и бегство или атакующие движения = 3; и то же самое, что и в ответе 3, но с расширенным ипсилатеральным уходом за лицом> 3 ударов = 4. Во время тестов фон Фрея животные были неподвижны.
2,5. Rotarod Test
Вращающийся стержень использовался для исследования влияния препаратов на координацию движений, как описано ранее [26].Скорость вращения стержня была откалибрована на 16 об / мин с максимальным временем, проведенным со стержнем, установленным на 180 с. Перед испытанием животных тренировали два или три раза в два отдельных дня для привыкания. Базальный ответ оценивали на 14-е сутки после операции.
2.6. Вестерн-блоттинг
После последнего поведенческого тестирования спинной мозг был удален под общим наркозом и разделен на ипсилатеральную и контралатеральную части. Образцы хранили при -80 ° C для вестерн-блоттинга.
В научных исследованиях было показано, что карбамазепин ингибирует увеличение внутриклеточного свободного кальция, индуцированное глицином и NMDA (N-метил-D-аспартат) в гранулярных клетках мозжечка крысы, и влияет на боль, блокируя высвобождение эндогенного глутамата. [27]. В настоящем исследовании оценивались значения NMDA. Эффекты ингибиторов переносчика глицина на экспрессию белка NR-1 исследовали, как описано ранее [28].
2.7. Статистическая оценка
Статистический анализ проводился с использованием GraphPad Prism (версия 6.0). Значения <0,05 считались значимыми:,,, и. Односторонний дисперсионный анализ, которому предшествовал тест Бонферрони (95% доверительный интервал), был проведен при сравнении трех или более групп. Для статистической оценки в поведенческом тесте и тесте с вращающимся стержнем каждый раз сравнивали внутри себя. Все результаты представляют собой статистическое среднее значение (SEM).
3. Результаты
3.1. Поведенческое тестирование
Значительное уменьшение механических стимулов с филаментами фон Фрея было обнаружено в ответах на ипсилатеральные и контралатеральные стимуляции, выполняемые при всех дозах аконитина и карбамазепина (рисунки 1 и 2).Антиаллодинический эффект был дозозависимым для групп как карбамазепина, так и аконитина. 80 мг карбамазепина и 0,75 мг аконитина имели наиболее значительный эффект среди групп.
3.2. Rotarod Test
Не было обнаружено значительного влияния группы аконитина 0,25 мг / кг на двигательные характеристики крыс по сравнению с контрольной группой. Однако аконитин, введенный в дозах 0,50 и 0,75 мг / кг, показал значительный антиаллодинический эффект на 20-й, 40-й, 60-й и 90-й минутах за счет значительного нарушения координации движений (рис. 3).Карбамазепин оказывал значительное влияние на координацию движений, как и аконитин во всех дозах.
3.3. Вестерн-блоттинг
Было продемонстрировано, что аконитин снижает экспрессию NR-1 в ипсилатеральном спинном мозге при всех дозах, но только 0,75 мг / кг аконитина оказалось статистически значимым (фиг. 4).
Однако был сделан вывод, что не было существенной разницы между группами в экспрессии NR-1 в контралатеральном спинном мозге (рис. 5).
4. Обсуждение
Среди различных состояний невропатической боли TN является наиболее часто встречающейся невралгической причиной лицевой боли [5]. Пациенты с лицевой болью часто консультируются со своим стоматологом и могут пройти дальнейшее стоматологическое обследование и лечение до направления к неврологу [29]. Диагноз TN по-прежнему основывается на клинических данных, истории болезни и обследовании из-за отсутствия объективных методов тестирования [30, 31]. Для TN характерны периоды частичной или полной ремиссии, а спонтанное выздоровление бывает редко [32].В настоящее время нет лекарства от TN, и лечение этого состояния остается проблемой, часто приводящей к неправильному диагнозу [31].
Боль, испытываемая при TN, значительно ухудшает качество жизни с субоптимальными исходами из-за неэффективности и плохой переносимости существующих медицинских методов лечения [33, 34]. Недавние клинические исследования показали, что пациенты имеют разные уровни депрессии и тревоги [35, 36]. Для достаточного обезболивания обычно требуются высокие дозы, и пациенты испытывают неприятные побочные эффекты и другие проблемы со здоровьем [2].
TN — это состояние хронической периферической нейропатической боли, и нейропатическая боль плохо поддается лечению обычными терапевтическими методами и стандартными дозами опиоидных анальгетиков [37, 38]. Противоэпилептические препараты используются для лечения боли TN из-за сходства между биохимическими и молекулярными механизмами, продемонстрированными на некоторых экспериментальных моделях эпилепсии и нейропатической боли [37]. В последние годы в лечении TN не было достигнуто большого прогресса. В настоящее время не существует специфического препарата для TN [33].Из обычно используемых противоэпилептических средств при TN карбамазепин является лекарственным средством первого выбора и оказывает существенное влияние на облегчение боли при TN [39]. Механизм действия карбамазепина заключается в блокаде потенциал-управляемых натриевых каналов частотно-зависимым образом, что приводит к стабилизации гипервозбужденных нервных мембран и ингибированию повторяющихся импульсов. Однако длительное лечение карбамазепином связано с серьезными побочными эффектами, вызывающими прерывание лечения или снижение дозировки [40].
Лекарственные растения веками использовались в традиционной медицине, и некоторые из этих растений обладают болеутоляющими свойствами. Эти растения могут стать альтернативным вариантом лечения боли [41]. Среди этих растений широко известны биологические свойства видов Aconitum [42]. Виды Aconitum использовались в качестве лечебных трав в традиционной восточной медицине из-за их противовоспалительного и обезболивающего действия. Фармакологические эффекты частично связаны с аконитином [42, 43].Аконитин, являющийся основным алкалоидом Aconitum , был известен как мощный нейротоксин, в то время как он также обеспечивает антиноцицепцию на моделях грызунов [44].
Влияние аконитина на TN оценивали на экспериментальной модели нейропатической боли (CCI of the ION) в настоящем исследовании. CCI ION был описан в 1994 году и использовался в качестве основного инструмента для исследования невропатической боли тройничного нерва [25, 45]. Эта модель боли имеет то преимущество, что вызывает чисто сенсорное повреждение нерва, ведущее к болезненным сенсорным нарушениям на территории ION.Животные, подвергнутые CCI-ION, демонстрируют поведенческие изменения, соответствующие клиническим симптомам повреждения тройничного нерва. Модель CCI-ION была выбрана, поскольку эта модель может точно отображать клиническую ситуацию TN боли [45]. Насколько известно авторам, настоящее исследование представляет собой первое исследование влияния аконитина на TN. Результаты ясно продемонстрировали, что аконитин может вызывать значительный антиаллодинический эффект на модели нейропатической боли CCI-ION у крыс.
Напряжение-зависимый натриевый канал известен как основная мишень для обезболивающих эффектов видов Aconitum [18].Аконитин действует, подавляя инактивацию потенциал-зависимых Na + каналов, связываясь с сайтом связывания нейротоксина 2 α -субъединицы белка канала [46]. Из-за длительной активации канала Na + клетки деполяризованы постоянным притоком Na + , что в конечном итоге приводит к неуравновешенности [47]. Это один из самых мощных модификаторов вольт-зависимого канала Na + [46]. Антиаллодинический эффект аконитина, продемонстрированный в этом исследовании, может быть результатом его действия на натриевые каналы нейронов спинного мозга.
Предыдущие экспериментальные исследования сообщили об антиноцицептивных эффектах аконитина и других родственных алкалоидов видов Aconitum в различных моделях боли. Сообщалось, что обработанный клубень Aconiti снимает невропатическую боль на модели хронического сужения у крыс [48]. Было обнаружено, что буллеаконитин А эффективен для лечения хронической боли, включая боль в спине и невропатическую боль, у пациентов с минимальными побочными эффектами [41]. Исследование серии случаев с участием 12 пациентов с постгерпетической невралгией показало улучшение уровня боли при применении препаратов Aconitum [49].Сообщается также, что он является многообещающим агентом при диабетической периферической нейропатической боли [50]. Лаппаконитин, другой алкалоид, экстрагированный из вида Aconitum , оказывал значительное облегчение боли на крысиной модели нейропатической боли, вызванной CCI седалищного нерва. Подавление ноцицептивного поведения было в основном основано на снижении экспрессии рецепторов P2X3 в нейронах DRG [51].
Аконитин не вызывал побочных эффектов, влияющих на болевой порог.Эти данные свидетельствуют о том, что лечение аконитином значительно ослабляет невропатическую боль в ответ на повреждение нерва. Кроме того, диапазон оценок ответа составлял 2-4 как при ипсилатеральной, так и при контралатеральной стимуляции с силой сцепления 0,745 и 2,150 г. С другой стороны, диапазон оценок ответа составлял 1-4 как для ипсилатеральной, так и для контралатеральной стимуляции с силой связи 0,015, 0,127 и 0,217 г. Введение аконитина в дозе 0,75 мг / кг заметно снизилось, особенно на 28 и 29 дни с 0.015 г прочность сцепления. Кроме того, введение аконитина в дозах 0,25, 0,50 и 0,75 мг / кг заметно снизилось на 26, 27, 28 и 29 дни с силой связи 2,150 г в обоих поведенческих тестах. В настоящем исследовании было определено, что оценка ответа увеличилась в течение 24-дневного послеоперационного периода. Однако, особенно в течение последних 4 дней, в контрольных группах повысились оценки ответов. При прочности связи 0,217 г введение карбамазепина в дозах 40 и 80 мг / кг заметно снизило оценку ответа между 26-м и 29-м днями.
Седативный эффект и ослабление координации движений — хорошо известные побочные эффекты противоэпилептических препаратов [37, 52]. Доза аконитина 0,25 мг / кг не влияла на координацию движений. Однако более высокие дозы аконитина (0,50 мг / кг и 0,75 мг / кг) привели к значительному снижению моторной координации, что было аналогично дозам карбамазепина 40 и 80 мг / кг (20, 40, 60 и 90). минут). Крысы были способны переносить дозы аконитина и оставаться на вращающемся стержне.
NR-1, глицин-связывающая субъединица возбуждающего рецептора NMDA, играет решающую роль в развитии нейропатической боли [28]. Однако в литературе обсуждается ограниченная информация о роли рецептора NMDA в антиаллодиническом эффекте аконитина. Значительное снижение NR-1 наблюдалось в ипсилатеральном спинном мозге при приеме 0,75 мг аконитина. Это новое открытие предполагает, что аконитин имеет решающее влияние на рецепторы NMDA.
Хотя настоящее исследование предоставило важную документацию по модели крысы после CCI-ION, эта модель имеет некоторые ограничения, требующие дальнейшего изучения.Крысы с CCI-ION демонстрируют связанные с болью поведенческие аномалии и механическую аллодинию [23, 25, 45]. Однако механизмы спонтанной хронической боли могут отличаться от экспериментальных моделей вызванной боли [53], что может не коррелировать с клиническими данными TN. В будущие исследования следует включить разработку различных экспериментальных моделей и изучение механизмов хронической боли.
5. Выводы
Наши экспериментальные результаты показывают, что аконитин значительно ослаблял боль TN, дозозависимо, в модели нейропатической боли CCI-ION у крыс.Эти обезболивающие, вероятно, были опосредованы механизмами рецепторов NMDA. Обезболивающий эффект был аналогичен карбамазепину. До сих пор карбамазепин был золотым стандартом для лечения боли TN, несмотря на серьезные побочные эффекты в долгосрочной перспективе. Аконитин, по-видимому, является многообещающим фармакологическим средством для контроля боли TN.
Доступность данных
Данные, использованные для подтверждения результатов этого исследования, включены в статью.
Конфликт интересов
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье.
Вклад авторов
E.K.A. и D.Ç. отвечали за концептуализацию; методология, М. и E.K.A. отвечали за методологию; M.I., Y.K., E.K.A. и D.Ç. отвечали за формальный анализ; M.I., E.K.A., Y.K. и D.Ç. несли ответственность за расследование; E.K.A. и D.Ç. отвечали за ресурсы; М.И. и E.K.A. отвечали за курирование данных; Y.K., E.K.A., D.Ç. и M.I. отвечали за подготовку первоначального проекта; Ю.К., E.K.A., D.Ç., M.I. и R.C. отвечали за просмотр и редактирование. Все авторы прочитали и согласились с опубликованной версией рукописи.
Благодарности
Это исследование было поддержано Научно-исследовательским проектом Университета Гази, грант №: 03 / 2017-23.
Ваше полное руководство по невралгии тройничного нерва; A. M. Kaufmann & M. Patel, CCND Winnipeg
Ваше полное руководство по невралгии тройничного нерва; А. М. Кауфманн и М. Патель, CCND ВиннипегЧасть вторая: Лечение невралгии тройничного нерва
II.Лекарства А. Введение Сегодня невралгия тройничного нерва обычно лечится препаратами, называемыми противосудорожными, в том числе карбамазепином. (Тегретол), фенитоин (Дилантин), оксикарбазепин (Трилептал) , и габапентин (Нейронтин). Фенитоин был впервые представлен в 1942 г. а в 1962 году карбамазепин стал наиболее распространенным использованный препарат. Баклофен (Лиорезал) может повысить эффективность этих препаратов. В последнее время широко используется нейронтин (габапентин). из-за меньшего количества побочных эффектов, хотя стоит дороже и несколько дешевле эффективен тогда Тегретол.Противосудорожные средства Считается, что уменьшает приступы TN за счет снижения гиперактивности тройничного нерва нервное ядро в стволе головного мозга. Лечение обычно начинают с одного препарата, например
как Тегретол или Нейронтин.
Дозу увеличивают по мере необходимости и переносимости. Если какой-либо отдельный препарат окажется неэффективным,
альтернативные препараты можно попробовать отдельно или в сочетании с другими препаратами. Медицинское
терапия изначально эффективна для большинства пациентов с ТН. К сожалению, около
половина пациентов, страдающих TN, в конечном итоге становятся недовольными медикаментозной терапией, потому что
неполного контроля боли или побочных эффектов, связанных с лекарствами, которые почти всегда
опытный.Затем рассматривается возможность хирургического лечения.
| Нервно-сосудистая система сдавление зоны входа корешка тройничного нерва приводит к гиперактивности ядра тройничного нерва. | Медицинский терапия направлена на снижение гиперактивности ядра тройничного нерва, тем самым уменьшая приступы боли TN. |
Практически все типовые Больные TN испытывают значительное облегчение боли при приеме карбамазепина. В начальная суточная доза низкая (от одной до двух таблеток в день), которую постепенно увеличивают. до тех пор, пока боль не исчезнет полностью или не возникнут побочные эффекты. Хорошее облегчение боль может быть достигнута при низких дозах, но обычная эффективная доза колеблется от От 600 до 1600 мг, разделенных на три или четыре приема в день. Даже более высокие дозы могут потребуются при сильных приступах боли.Как только облегчение боли было достигнута, та же доза обычно сохраняется в течение как минимум двух недель перед попыткой уменьшить до минимальной дозировки, обеспечивающей обезболивание. Как и все препараты TN, В периоды ремиссии можно постепенно снижать содержание тегретола.
Несколько дозозависимых часто наблюдаются побочные эффекты, включая сонливость, спутанность сознания, головокружение, нистагм (быстрые движения глаз), атаксия (снижение координации), диплопия (двоение в глазах), тошнота и анорексия (потеря аппетита).Если побочные эффекты тяжелая, суточная доза карбамазепина может быть уменьшена в течение 1-3 дней, прежде чем пытаясь снова увеличить суточную дозу.
Есть также редкие, но серьезные реакции на карбамазепин.
которые не зависят от дозы. К ним относятся аллергическая кожная сыпь, которая может образовывать
в любое время после начала приема лекарства. От двух до шести процентов больных, которые
принимать карбамазепин, развиваться заболевания крови, включая лейкопению или агранулоцитоз
(падение количества лейкоцитов) или апластическая анемия (когда костная
костный мозг перестает производить клетки крови).Другие редкие осложнения включают токсичность печени, водную интоксикацию (задержку воды), гипонатриемию (низкий уровень натрия в крови), застойные явления.
сердечная недостаточность, зрительные галлюцинации и расстройства вкуса или половой функции.
Из-за этих осложнений перед приемом карбамазепина обычно проводят анализы крови.
запускается и периодически повторяется. Прием карбамазепина
следует прекратить, если количество лейкоцитов станет аномально низким.
Следует немедленно уведомить врача и провести анализы крови, если
испытывает жар, боль в горле, стоматит (болезненное инфицирование ротовой полости),
легкие синяки или петехии (крошечные красные пятна на коже).
Оксикарбамазепин это новая форма Тегретола®, которая может иметь меньше побочных эффектов и рисков. токсичности, но необходимо принимать в более высоких дозах, чтобы обеспечить адекватный контроль боли.
С. Трилептал (оксикарбазепин)Трилептал, или оксикарбемазепин, представляет собой форму Тегретола®, которая получает все более широкое распространение назначают при различных состояниях. Недавно было обнаружено, что он эффективен для некоторых пациентов с невралгией тройничного нерва.Как и Тегретол®, это противосудорожное средство. препарата, но побочные эффекты менее выражены и возникают реже.
Доза обычно начинается с 300 мг. два раза в день и постепенно увеличивают для достижения контроля боли. Максимум доза составляет 2400-3000 мг в сутки. Общие побочные эффекты — тошнота, рвота, головокружение, утомляемость и тремор. Менее частые симптомы — сыпь, респираторные инфекции, двоение в глазах и изменение электролитов в крови. Если у вас была аллергия реакция на Тегретол® (карбемазепин), то не следует пробовать Трилептал.Как и в случае с другими противосудорожными препаратами, следует увеличивать и уменьшать дозу. быть постепенным.
Д. Фенитоин (дилантин)фенитоин снимает тиков боли более чем у половины пациентов с TN в дозах от 300 до 500 мг, разделенных на три приема в день. Фенитоин также может вводить внутривенно для лечения тяжелых обострений TN. Максимум доза зависит от серьезности побочных эффектов, которые испытывает Наркотик.Эти дозозависимые побочные эффекты включают нистагм (быстрые движения глаза), атаксия (снижение координации), дизартрия (затруднение речи), офтальмоплегия (паралич движений глаз), а также сонливость и психические расстройства. путаница. Другие эффекты лекарства могут включать гиперплазию десен. (увеличение десен во рту) и гипертрихоз (чрезмерный рост волос). Могут возникнуть редкие, но серьезные осложнения, включая аллергические высыпания на коже, печени. повреждения и нарушения со стороны крови.
E. Baclophen (Lioresal)
Баклофен не так эффективен, как карбамазепин или фенитоин, для TN, но может использоваться в сочетание с этими лекарствами. Начальная доза баклофена обычно составляет 5 мг два или три раза в день, можно постепенно увеличивать. Обычная дозировка для полного обезболивания принимают от 50 до 60 мг в день. Баклофен имеет короткая продолжительность функции, поэтому пациентам с тяжелым TN может потребоваться прием доз каждые 3-4 часа.
г. Наиболее частые побочные эффекты, связанные с баклофеном, включают сонливость, головокружение, тошнота и слабость в ногах. Частота возникновения этих побочных эффектов снижается, если начинать с низкой дозой баклофена, которую постепенно увеличивают. Однако примерно одна десятая часть больных не переносит баклофен. Редкое осложнение — сбивающее с толку состояние, которое появляется вскоре после начала приема баклофена, но быстро проходит при прекращении терапии. Не следует прекращать прием Баклофена сразу после длительное использование, потому что могут возникнуть галлюцинации или судороги.Если эти изъятия симптомы действительно возникают, обычно восстанавливают предыдущую дозу баклофена и затем постепенно снижается.
Габапентин Ф. (Нейронтин)
Габапентин является противоэпилептическим препаратом, структурно связанным с нейромедиатором ГАМК. Этот препарат почти так же эффективен, как карбамазепин. но вызывает меньше побочных эффектов. начальная доза обычно составляет 300 мг три раза в день, и ее увеличивают до максимальная доза.Наиболее частые побочные реакции включают сонливость (сонливость), атаксия (снижение координации), утомляемость и нистагм (быстрые движения глаз). Нет данных о взаимодействии с Тегретолом. или Дилантин, что позволяет использовать эти препараты в комбинации с нейронтином. Как и в случае со всеми этими препаратами, следует незамедлительно отменить прием. следует избегать, так как могут возникнуть тяжелые реакции отмены.
Следующий раздел >>
<< Вернуться к содержанию
Нажмите
здесь, чтобы вернуться на веб-сайт
Невралгия тройничного нерва
в Центре
заболеваний черепных нервов
А.М. Кауфманн и М. Патель
Центр заболеваний черепных нервов
Виннипег, Манитоба, Канада
© 2001
Подготовлено А. М. Кауфманн и М. Patel
© 2001 Центр заболеваний черепных нервов, Виннипег, Университет Манитобы, Центр медицинских наук. Информация, представленная на этом сайте, предназначена только в образовательных целях и не должны использоваться для диагностики или лечения заболевания. или беспорядок. Эта информация не предназначена для замены, дополнения или каким-либо образом квалифицировать услуги или советы, предоставленные квалифицированным специалистом в области здравоохранения.Пожалуйста, проконсультируйтесь с сертифицированным специалистом в области здравоохранения, прежде чем заполнять какую-либо форму. лечебного действия. Копирование в любой части или форме этого документа строго запрещено. запрещенный. Все права защищены. Для получения дополнительной информации ознакомьтесь с нашим заявлением об отказе от ответственности . Запросы, связанные с веб-сайтом, можно направлять по номеру Information Провайдер . .

 , покр. пленочной оболочкой, 200 мг+100 мг+0.2 мг: 10, 20 или 60 шт.
, покр. пленочной оболочкой, 200 мг+100 мг+0.2 мг: 10, 20 или 60 шт. 5 или 10 шт.
5 или 10 шт. 100 мг: 10 или 20 шт.
100 мг: 10 или 20 шт. 117 мг: 10 или 20 шт.
117 мг: 10 или 20 шт. 200 мг: 10, 20, 30, 40 или 50 шт.
200 мг: 10, 20, 30, 40 или 50 шт. 200 мг: 20, 30 или 50 шт.
200 мг: 20, 30 или 50 шт.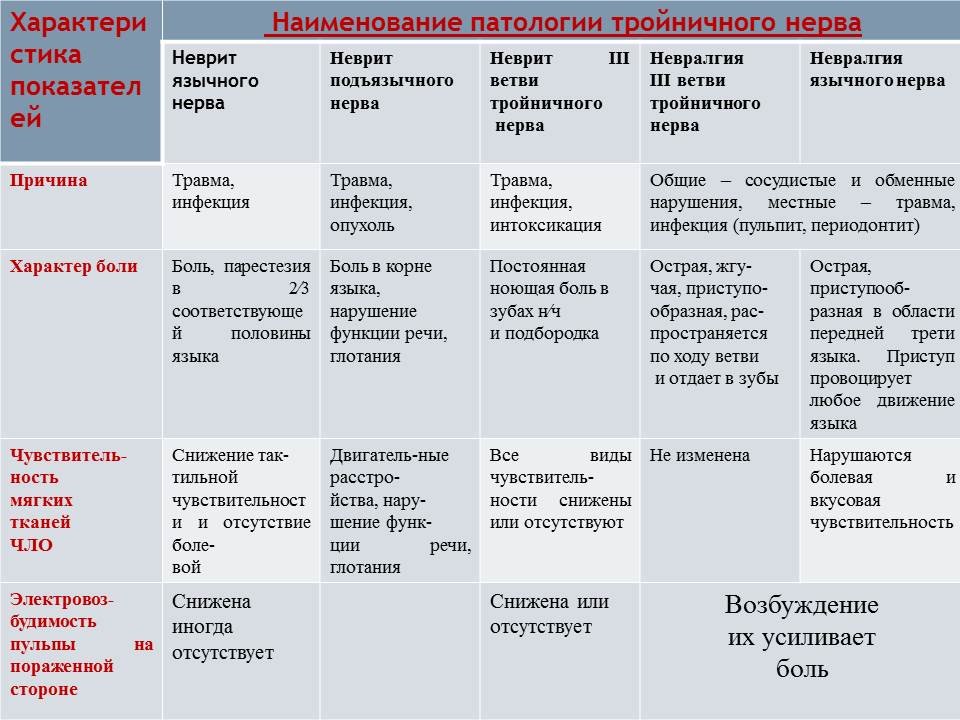 200 мг: 40 или 50 шт.
200 мг: 40 или 50 шт. 200 мг: 10, 20, 30, 40 или 50 шт.
200 мг: 10, 20, 30, 40 или 50 шт. пролонгир. действия 400 мг: 10, 20, 30, 50 или 100 шт.
пролонгир. действия 400 мг: 10, 20, 30, 50 или 100 шт. 200 мг: 20, 30, 50 или 100 шт.
200 мг: 20, 30, 50 или 100 шт. , покр. оболочкой, 100 мг+100 мг: 15, 30 или 60 шт.
, покр. оболочкой, 100 мг+100 мг: 15, 30 или 60 шт.