Аутоиммунные заболевания щитовидной железы и беременность | Фадеев
В последние годы вопроам функционирования щитовидной железы (ЩЖ) во время беременности, адаптации ее в условиях йодного дефицита было посвящено большое количество зарубежных и оте чественных публикций и исследований. В настоя щее время носительство беременными женщинами антител к ткани ЩЖ (АТ-ЩЖ) стало привлекать все большее внимание эндокринологов, акушеров- гинекологов и педиатров, поскольку многие иссле дования показали, что этот феномен ассоциирован с такими неблагоприятными осложнениями, как нарушение функции ЩЖ во время беременности и после родов, повышение риска невынашивания бе ременности, развития антифосфолипидного син дрома, а также, что наиболее важно, нарушения развития детей, рожденных этими женщинами. Ак туальной проблемой является решение вопроса о назначении индивидуальной йодной профилакти ки женщинам с АТ-ЩЖ. С одной стороны, про живая в йоддефицитном регионе, они имеют высо кий риск развиия йоддефицитной патологии, с другой, по мнению ряда исследователей, активное назначение препаратов йода на фоне носительства АТ-ЩЖ может спровоцировать прогрессирование аутоиммунной патологии ЩЖ.
- АТ-ЩЖ и нарушение функции ЩЖ во время беременности.
- Невынашивание беременности у женщин с АТ-ЩЖ.
- Аутоиммунные тиреопатии и развитие ново рожденных.
- Послеродовые аутоиммунные тиреопатии (ПАТ).
- Аутоиммунные тиреопатии и йодная профи лактика во время беременности.
- Скрининг аутоиммунных тиреопатий во вре мя беременности.
АТ-ЩЖ, как известно, могут обнаруживаться у абсолютно здоровых людей, при этом в 5-10 раз чаще у женщин, чем у мужчин. Среди женщин ре продуктивного возраста распространенность носи тельства классических АТ-ЩЖ (к тиреоглобулину- АТ-ТГ-и пероксидазе тироцитов -АТ-ТПО) дости гает 5-10% [10, 19]. Под носительством АТ-ЩЖ мы понимаем выявление последних на фоне нор мальной функции и структуры ЩЖ. У женщин старшей возрастной группы распространенность носительства АТ-ЩЖ может достигать 26% и более [64]. Как уже неоднократно отмечали [4], единст венным риском, который несет носительство АТ- ЩЖ вне беременности, является риск развития ги потиреоза.
Антитиреоидные антитела и нарушение функции 1ЦЖ во время беременности
По данным ряда популяционных исследований было показано, что 2,2-2,5% всех беременных мо гут иметь недиагностированный субклинический гипотиреоз, тогда как манифестный гипотиреоз встречается у 0,3% беременных [18, 30]. В работе К. Kamijo [28] распространенность транзиторного субклинического гипотиреоза среди 9453 беремен ных женщин в Японии составила 0,19%. Манифе стный гипотиреоз очень часто приводит к беспло дию, а если женщина с гипотиреозом беременеет, у нее имеется повышенный риск различных акушер ских осложнений (табл.
Гипотиреоз у беременной женщины, как будет показано ниже, может приводить к тяжелым пси хоневрологическим нарушениям у плода, в первую очередь на ранних сроках беременности, когда ЩЖ плода еще не функционирует [55]. Именно эти данные и легли в основу рекомендации о про ведении скринингового исследования функции ЩЖ на ранних сроках беременности. Наряду с этим было предложено исследование уровня АТ- ТПО. Что же послужило основанием для этого?
В 90-х годах было показано, что беременные женщины с высокими уровнями АТ-ТПО являют ся группой риска по развитию субклинического ги потиреоза [61]. В дальнейшем важным результатом исследования D. Glinoer и соавт. [17] стала возмож ность предсказать прогрессирование аутоиммун ных тиреопатий в сторону развития гипотиреоза на основании уровня ТТГ и АТ-ЩЖ в 1 триместре бе ременности. В работе D. Glinoer и соавт. [17] было
Таблица 1
Осложнения гипотиреоза (в %) при беременности [11, 40, 46]
Осложнение | Манифестный | Суб клинический |
гипотиреоз | гипотиреоз | |
Гипертензия, преэклампсия | 22 | 15 |
Отслойка плаценты | 5 | 0 |
Низкая масса тела плода | 16,6 | 8,7 |
Внутриутробная гибель | 6,6 | 1,7 |
Пороки развития | 3,3 | 0 |
Послеродовое кровотечение | 6,6 | 3,5 |
обследовано 1600 женщин; у 6,5% из них были вы явлены АТ-ТПО, при этом у 5,2% (л = 87) на фоне эутиреоза. При динамическом исследовании во время беременности функции ЩЖ у женщин с эу- тиреозом и повышенными уровнями АТ-ЩЖ вы яснилось, что к концу беременности у 40% из них уровень ТТГ превысил 3 мМЕ/л, а у 16% — 4 мМЕ/ л. Аналогичным образом в группе женщин с АТ- ЩЖ к концу беременности определялся более низ кий уровень свободного Т4, чем в контрольной группе.
При динамическом исследовании во время беременности функции ЩЖ у женщин с эу- тиреозом и повышенными уровнями АТ-ЩЖ вы яснилось, что к концу беременности у 40% из них уровень ТТГ превысил 3 мМЕ/л, а у 16% — 4 мМЕ/ л. Аналогичным образом в группе женщин с АТ- ЩЖ к концу беременности определялся более низ кий уровень свободного Т4, чем в контрольной группе.
По данным исследования, проведенного J. La zarus и соавт. [37], нарушение функции ЩЖ на ранних сроках беременности наблюдалось у 20,1% женщин с АТ-ТПО по сравнению с 6,8% женщин без АТ-ТПО. По данным R. Klein и соавт. [30], в 58% случаев субклинического и в 90% случаев ма нифестного гипотиреоза отмечались повышенные уровни АТ-ЩЖ по сравнению с 11% в контроль ной группе.
В дополнение к уже сказанному выше было по казано (табл. 2), что значительно более высокий риск развития субклинических нарушений функ ции ЩЖ имеют женщины с АТ-ЩЖ, чем женщи ны без АТ-ЩЖ. Так, в исследовании F. Mecacci и соавт. [45], в которое были включены женщины, имевшие в анамнезе привычное невынашивание, мертворождение или преэклампсию, было показа но, что значительно более высокий риск развития субклинических нарушений функций ЩЖ в этих группах имеют женщины с АТ-ЩЖ (53,8%), чем женщины без АТ-ЩЖ (16,2%).
С чем же связан повышенный риск развития ги потиреоза у женщин, которые до беременности бы ли лишь носительницами АТ-ЩЖ? По данным многочисленных исследований, во время беремен ности ЩЖ оказывается под воздействием ком плекса мощных стимулирующих физиологических факторов (хорионический гонадотропин, тирок- синсвязывающий глобулин, изменение плацентар ного метаболизма тиреоидных гормонов и др.) [2]. Биологический смысл такой гиперстимуляции ЩЖ, вероятно, состоит в том, что увеличение про дукции тиреоидных гормонов примерно на 30- 50%, которое происходит в норме, необходимо для адекватного развития плода, особенно на ранних
Табл и ца 2
Распространенность субклинического гипотиреоза у женщин с различными исходами беременности [45]
Носительст во АТ-ЩЖ | Невынаши вание | Мертворож дение | Преэклам псия | Всего |
АТ-ЩЖ | 7/Н (63,3) | 3/9 (33,3) | 4/6 (66,7) | 14/26 (53,8) |
АТ-ЩЖ от сутствуют | 3/18 (16,7) | 1/13 (7,7) | 3/12 (25,0) | 7/43 (16,2) |
Статистиче ская зна чимость различий | р < 0,02 | Нет | Нет | р < 0,02 |
Примечание. | ||||
сроках беременности, когда у него еще не функ ционирует ЩЖ.
Снижение функциональной активности ЩЖ во время беременности было хорошо продемонстри ровано при действии такого распространенного фактора окружающей среды, как дефицит йода. По данным D. Glinoer, у 1/3 обследованных беремен ных женщин, проживающих в Бельгии — регионе легкого йодного дефицита, развивается состояние относительной гипотироксинемии. По данным R. Ball и соавт. [8], у женщин, проживающих в йод дефицитной местности, во время беременности уровень свободного Т
Другими словами, на фоне действия мощных стимуляторов ЩЖ во время беременности к сни жению ее функциональной активности может при вести даже легкий дефицит йода. В случае пораже ния ЩЖ аутоиммунным процессом патогенез от носительной гипотироксинемии, вероятно, во многом схож: измененная железа оказывается не способной ответить адекватным секреторным отве том на гиперстимуляцию.
Тот факт, что при носительстве АТ-ЩЖ риск нарушения функции ЩЖ наиболее велик в 1 три местре (критический период для развития плода и период наибольшей стимуляции ЩЖ беремен ной), демонстрирует исследование К. Kamijo и со авт. [28]. У женщин с АТ-ТПО и АТ-ТГ (при от сутствии указаний в анамнезе на патологию ЩЖ) сниженный уровень свободного Т4 при повышен ном уровне ТТГ (11,7 + 6,3 мЕд/л) на ранних сро ках (8,5 ± 2,4 нед) возвращался без лечения к нор ме в сроки 17,9 ± 7,1 нед беременности.
Антитиреоидные антитела и невынашивание беременности
Результаты ряда исследований 90-х годов вы явили повышенную частоту самопроизвольных вы кидышей у женщин с АТ-ЩЖ при отсутствии на рушения функции ЩЖ. A. Stagnaro-Green и соавт. [61] были обследованы 552 женщины в I триместре беременности; у женщин с АТ-ЩЖ распростра ненность спонтанных абортов была значительно выше, чем у женщин без АТ-ЩЖ (17 и 8,4% соот ветственно). Эти данные были подтверждены D. Glinoer [16], который показал, что в группе жен щин с АТ-ЩЖ распространенность спонтанного прерывания беременности составила 13,3% случаев по сравнению с 3,3% случаев в контрольной группе.
Glinoer [16], который показал, что в группе жен щин с АТ-ЩЖ распространенность спонтанного прерывания беременности составила 13,3% случаев по сравнению с 3,3% случаев в контрольной группе.
Целью работы F. Mecacci и соавт. [45], которая уже упоминалась выше, стало изучение распро страненности АТ-ЩЖ у женщин, имевших в анам незе спонтанное прерывание беременности на ран них сроках (1-я группа), мертворождения (2-я группа) или преэклампсию (3-я группа), по срав нению с контрольной группой. АТ-ЩЖ обнаружи вались в 37,7% случаев (распределение по выше указанным подгруппам составило 37,9, 40,9 и 33,3% соответственно) по сравнению с 14,5% в контрольной группе; различие статистически зна чимо. Значимое различие в распространенности АТ-ТПО и АТ-ТГ отмечалось только в группе жен щин, имевших в анамнезе мертворождение. Кроме того, в исследуемой группе не было выявлено раз личий распространенности носительства антифос- фолипидных антител у женщин с АТ-ЩЖ (26,9%) и без АТ-ШЖ (34,9%).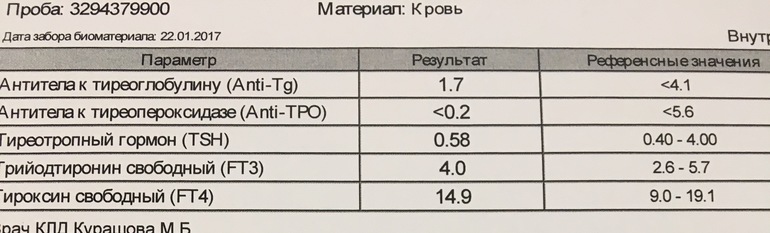 Авторами был сделан вывод о том, что АТ-ЩЖ являются самостоятельным фактором риска, который часто ассоциируется с акушерскими осложнениями.
Авторами был сделан вывод о том, что АТ-ЩЖ являются самостоятельным фактором риска, который часто ассоциируется с акушерскими осложнениями.
В исследовании R. Bakimer и соавт. [7] было по казано, что носительство АТ-ЩЖ не связано на прямую с носительством ряда известных органо неспецифических антител — антикардиолипино- вых, антинуклеарных и антифосфолипидных. По данным D. Pratt и соавт. [56], распространенность носительства АТ-ЩЖ у женщин с самопроизволь ными выкидышами была выше, чем частота выяв ления других органонеспецифических антител.
- D. Pratt и соавт. [56] обследовали группу жен щин, имеющих в анамнезе привычное невынаши вание беременности (3 и более самопроизвольных выкидыша на ранних сроках) в отсутствие наруше ния функции ЩЖ. АТ-ЩЖ выявлялись в 31% слу чаев по сравнению с 19% в контрольной группе. Выкидыши имели место у 62% женщин с АТ-ЩЖ и только у 14% женщин без АТ-ЩЖ. С. Kim и со авт. [29] показали, что носительство АТ-ЩЖ у женщин (без нарушения функции ЩЖ) с трубным бесплодием или с бесплодием с невыясненной причиной сочетается с неблагоприятным исходом беременности после искусственного оплодотворе ния.
 Уровни АТ-ЩЖ были значительно выше у женщин с произошедшим спонтанным выкиды шем, чем при благоприятном исходе беременно сти. Аналогичным образом S. Bussen и Т. Steck [10] выявили высокие уровни АТ-ЩЖ (36%) у женщин с привычным невынашиванием по сравнению с контрольной группой (9%).
Уровни АТ-ЩЖ были значительно выше у женщин с произошедшим спонтанным выкиды шем, чем при благоприятном исходе беременно сти. Аналогичным образом S. Bussen и Т. Steck [10] выявили высокие уровни АТ-ЩЖ (36%) у женщин с привычным невынашиванием по сравнению с контрольной группой (9%).
В других более крупных исследованиях было по казано, что наличие АТ-ЩЖ является маркером повышенного риска самопроизвольного выкиды ша в 22% случаев у женщин с АТ-ЩЖ по сравне нию с 5% в контрольной группе [39].
По данным R. Wilson и соавт. [65], уровень АТ- ТПО и их авидность (т. е. степень сродства антител к антигену) были значительно выше у беременных женщин, у которых впоследствии произошел вы кидыш по сравнению с группой женщин, имевших благоприятный исход беременностей, у которых уровень АТ-ТПО и их авидность уменьшались с увеличением срока беременности.
- W. Kutteh и соавт. [34] исследовали распростра ненность АТ-ТГ и АТ-ТПО в группах женщин с по вторными спонтанными выкидышами (1-я группа) и женщин, перенесших экстракорпоральное опло дотворение — ЭКО) (2-я группа), по сравнению с контролем (3-я группа) и показали, что антитела наиболее часто обнаруживались у женщин 1-й группы (22,5%; у 158 из 700) по сравнению с жен щинами, перенесшими ЭКО (19,2%; у 132 из 688), и женщинами контрольной группы (14,5%; у 29 из 200).
 В данном исследовании не удалось выявить большей распространенности АТ-ЩЖ у женщин, которым требовалось ЭКО, по сравнению с кон трольной группой. В исследовании A. Singh и со авт. [60] у беременных женщин после ЭКО АТ- ЩЖ были выявлены в 22% случаев, распростра ненность спонтанных выкидышей в группе жен щин с АТ-ЩЖ составила 32%, а у женщин без АТ- ЩЖ — 16%.
В данном исследовании не удалось выявить большей распространенности АТ-ЩЖ у женщин, которым требовалось ЭКО, по сравнению с кон трольной группой. В исследовании A. Singh и со авт. [60] у беременных женщин после ЭКО АТ- ЩЖ были выявлены в 22% случаев, распростра ненность спонтанных выкидышей в группе жен щин с АТ-ЩЖ составила 32%, а у женщин без АТ- ЩЖ — 16%.
Некоторыми авторами было предложено скри нинговое исследование АТ-ЩЖ в качестве раннего маркера риска неудач при имплантации и прогноза беременности после ЭКО. G. Sher и соавт. [59] предложили назначать пациенткам с АТ-ЩЖ, ко торым было предпринято ЭКО, инъекции имму ноглобулина G, но в связи с высокой распростра ненностью носительства этих антител и здоровыми женщинами оценка их клинической значимости у женщин с бесплодием и невынашиванием бере менности остается сложной. Таким образом, необ ходимость в столь агрессивной и дорогостоящей терапии у женшин после ЭКО с АТ-ЩЖ является весьма сомнительной.
Относительно возрастных особенностей этой проблемы было отмечено следующее [34]: женщи ны 31-35 лет с повторными выкидышами или ЭКО чаще имели АТ-ЩЖ по сравнению с женщи нами контрольной группы той же возрастной кате гории. У большинства пациенток с повторными выкидышами и после ЭКО отмечалось повышение уровня АТ-ЩЖ с возрастом вплоть до 31-35 лет, после чего наблюдалось понижение их уровня в группе 36-40 лет. U. Knudsen и соавт. [32] было по казано, что риск спонтанного прерывания бере менности значительно повышается с возрастом.
У большинства пациенток с повторными выкидышами и после ЭКО отмечалось повышение уровня АТ-ЩЖ с возрастом вплоть до 31-35 лет, после чего наблюдалось понижение их уровня в группе 36-40 лет. U. Knudsen и соавт. [32] было по казано, что риск спонтанного прерывания бере менности значительно повышается с возрастом.
Суммируя данные различных исследований (табл. 3) по проблеме взаимосвязи невынашивания беременности с носительством АТ-ЩЖ, можно сделать следующие выводы.
- Риск спонтанного прерывания беременности у женщин с АТ-ЩЖ превышает таковой у женшин без АТ-ЩЖ в 2-4 раза.
- Наиболее велик этот риск в 1 триместре бере менности.
- В дальнейшем у женщин, имеющих в анам незе привычное невынашивание (количество само произвольных выкидышей 3 и более), этот риск по вышается с увеличением срока беременности.
С другой стороны, существуют и иные точки зрения на эту проблему. Так, в исследовании М.
Таблица 3
Распространенность самопроизвольных выкидышей у женшин с антитиреоидными антителами
Распространенность самопроизвольных выкидышей, % | Источник | |
женщины с АТ-ЩЖ | контрольная группа | |
17 (108) | 8,4 (444) | A. |
13,3 (45) | 3,3 (603) | D. Glinoer [16] |
22 (730) | 5 (730) | В. Lejeune [39] |
62(13) | 14 (29) | D. Pratt [56] |
36 (22) | 9 (22) | S. Bussen [10] |
37,7 (69) | 14,5 (69) | F. Mecacci [45] |
33 (12) | 19 (42) | A. Muller [47] |
29,3 (74) | 39 (75) | M. Esplin [14] |
Примечание. В скобках — общее число женщин в груп пе.
Esplin и соавт. [14] АТ-ЩЖ были выявлены у 29,3% (из 74) небеременных женшин с анамнезом при вычного невынашивания и у 39% (из 75) здоровых женщин репродуктивного возраста. Таким обра зом, не было обнаружено взаимосвязи между нали чием АТ-ЩЖ и спонтанными выкидышами.
- A. Muller и соавт. [47] были обследованы 173 женщины, подвергшиеся ЭКО, без предшествую щих выкидышей в анамнезе; 54 (31%) из 173 жен щин забеременели. АТ-ЩЖ были исследованы до и во время беременности. Беременность наступила у 48% женщин с АТ-ЩЖ и у 28% женщин без АТ- ЩЖ, беременность закончилась выкидышем у 33 и 19% женщин соответственно. При определении уровня ТТГ не было выявлено значимой разницы у беременных женщин с АТ-ЩЖ и без них, а также у женщин с самопроизвольными выкидышами в обеих группах. Таким образом, авторами был сде лан вывод о том, что наличие АТ-ЩЖ, обнаружен ных до беременности, не повышает риска выкиды ша у женщин без невынашивания в анамнезе и не влияет на возможность наступления беременности у этих женщин. Несоответствие приведенных дан ных большинству других D. Glinoer [20] объясняет тем, что в исследование было включено мало жен щин с АТ-ЩЖ, а также тем, что принятый поро говый уровень для АТ-ЩЖ был ниже, чем в других исследованиях, и тем, что женщины, отобранные для процедуры искусственного оплодотворения, составляют особую популяцию с известно высокой распространенностью аутоиммунных тиреопатий.

Трудно предположить, что сами по себе АТ- ЩЖ могут играть какую-либо патогенетическую роль в патогенезе невынашивания беременности. Наиболее вероятно, что эти антитела являются маркером генерализованной иммунной дисфунк ции, которая и приводит к развитию спонтанного аборта.
В последнее время появилось несколько рабо чих гипотез по взаимосвязи носительства АТ-ЩЖ и повышенного риска спонтанных выкидышей [44]. Первая гипотеза предполагает, что женщины с высоким уровнем АТ-ЩЖ имеют легкую гипо функцию ЩЖ. Вторая теория рассматривает АТ- ЩЖ просто как маркеры предрасположенности к аутоиммунным заболеваниям, а не как непосредст венную причину невынашивания беременности. В качестве третьей гипотезы в некоторых работах бы ло сделано предположение о том, что АТ-ЩЖ слу жат маркерами нарушения функции Т-клеток. Не давно D. Glinoer [17] предложил еще одну рабочую гипотезу: аутоиммунные заболевания ЩЖ по тем или иным причинам приводят к тому, что женщи ны с АТ-ЩЖ беременеют в относительно более старшем возрасте, который сам по себе характери зуется большим риском невынашивания беремен ности. Несмотря на большое количество гипотез о взаимосвязи носительства АТ-ЩЖ и невынашива ния беременности, однозначных данных об этом до настоящего времени не получено.
Несмотря на большое количество гипотез о взаимосвязи носительства АТ-ЩЖ и невынашива ния беременности, однозначных данных об этом до настоящего времени не получено.
Аутоиммунные тиреопатии и перинатальное развитие
Как указывалось выше, носительство АТ-ЩЖ является фактором риска нарушения функции ЩЖ у беременных женщин. Учитывая кардиналь ное значение тиреоидных гормонов для развития нервной и других систем плода, весьма актуальным представляется исследование возможного влияния носительства АТ-ЩЖ на перинатальное развитие.
Как известно, уровень свободного Т4 плазмы на прямую коррелирует с уровнем интрацеребрально го Т4, от которого зависит адекватное развитие го ловного мозга в неонатальном периоде. При дефи ците тиреоидных гормонов у плода наблюдаются уменьшение массы головного мозга и содержания в нем ДНК, а также ряд гистологических изменений [22]. Тиреоидные гормоны регулируют экспрессию некоторых нейрональных генов, обеспечивающих развитие центральной нервной системы, и синтез ряда специфических белков. Относительно низкий уровень Т4 у беременной женщины на ранних сро ках может явиться серьезным фактором риска за медления психомоторного развития ребенка на 1-м году жизни и в дальнейшем.
Относительно низкий уровень Т4 у беременной женщины на ранних сро ках может явиться серьезным фактором риска за медления психомоторного развития ребенка на 1-м году жизни и в дальнейшем.
В 1991 г. была опубликована одна из первых ра бот, в которой проводилось обследование детей женщин, у которых во время беременности выяв лялась гипотироксинемия [43]. Было показано, что дети женшин с неадекватно леченным гипотирео зом имели значительно более низкие показатели умственного развития на 8-м месяце и 4-м году жизни по сравнению с контрольной группой. В возрасте 4 и 7 лет у 33-35% этих детей более низ кий IQ-индекс был отмечен в 2,3 раза чаще, чем в контрольной группе детей.
В проспективном исследовании J. Haddow и со авт. [21] при определении IQ-индекса у детей жен щин, не получавших лечение по поводу гипотире оза, было показано, что IQ у этих детей был на 7 пунктов ниже, чем в контрольной группе (100 и 107 соответственно). 19% детей основной и только 5% детей контрольной группы имели IQ ниже 86 бал лов. В отличие от этого показатели IQ были оди наковыми у детей женщин, получавших адекватное лечение тироксином, и детей контрольной группы. Заметим, что АТ-ЩЖ в этом исследовании опре делялись у 77% женщин с гипотиреозом.
В отличие от этого показатели IQ были оди наковыми у детей женщин, получавших адекватное лечение тироксином, и детей контрольной группы. Заметим, что АТ-ЩЖ в этом исследовании опре делялись у 77% женщин с гипотиреозом.
Если больший интерес в рамках обсуждаемой темы представяют собой результаты проспективно го исследования V. Pop и соавт. [53], в котором в течение 5 лет после родов наблюдались 293 женщи ны без нарушения функции ЩЖ с АТ-ТПО, выяв ленными на 32-й неделе беременности. Кроме то го, было обследовано 230 детей, рожденных этими женщинами. При сравнении интеллектуального развития детей от женщин с АТ-ТПО и большой группы детей от матерей без АТ-ЩЖ в первой группе было выявлено значительное снижение IQ — на 10,5 пунктов. Авторы сделали вывод о том, что дети от матерей, имевших повышенные уровни АТ-ТПО во время беременности, имеют повышен ный риск нарушения развития даже при нормаль ной функции ЩЖ у женщины. Возможным объяс нением этого может быть транзиторная гипотирок- синемия в начале беременности, которая не была зафиксирована в процессе исследования. В более позднем исследовании V. Pop и соавт. [54] было выявлено снижение показателей психомоторного развития детей от женщин с уровнем свободного Т4 ниже нормы или даже на ее нижней границе на ранних сроках беременности.
В более позднем исследовании V. Pop и соавт. [54] было выявлено снижение показателей психомоторного развития детей от женщин с уровнем свободного Т4 ниже нормы или даже на ее нижней границе на ранних сроках беременности.
Другим объяснением может быть влияние мате ринских АТ-ЩЖ, которые проникают через пла центу и воздействуют на ЩЖ плода. Так, при ис следовании пуповинной крови выявлено, что 40% новорожденных от женщин с АТ-ЩЖ имели по вышенные уровни АТ-ТПО при рождении, при этом была выявлена значимая корреляция между материнскими и неонатальными уровнями этих антител [16].
- J. Dussault и соавт. [12] посмотрели на проблему носительства АТ-ЩЖ у беременных женщин с дру гой стороны, обследовав матерей детей с выявлен ным транзиторным гипотиреозом. Оказалось, что распространенность носительства АТ-ТПО у этих женщин составила 77%. Таким образом, авторы сделали вывод о необходимости подозревать тран- зиторный гипотиреоз у новорожденных, если у ма тери во время беременности определялись АТ- ТПО.

По результатам исследования К. Bech и соавт. [9], материнские АТ-ЩЖ во время беременности и развитие в дальнейшем послеродового тиреоидита (ПТ) никак не отражаются на развитии ребенка или на функции его ЩЖ в неонатальном периоде. Тем не менее в данном исследовании показатели роста и массы тела в течение 1-го месяца жизни были ниже у новорожденных от женщин с АТ- ЩЖ, у которых в последующем развился ПТ. По мнению самих авторов, это могло быть связано с недостатком грудного молока у женщин этой груп пы. Это в свою очередь может быть связано с пря мым влиянием АТ-ЩЖ на молочные железы или быть опосредовано снижением функции ЩЖ ма тери. Нарушения функции ЩЖ в период исследо вания ни у одного из детей не выявлено.
Таким образом, если неблагоприятное влияние как манифестного, так и суб клинического гипоти реоза беременной на перинатальное развитие более или менее очевидно, влияние носительства АТ- ЩЖ при отсутствии нарушения функции ЩЖ ос тается невыясненным.
Послеродовые аутоиммунные тиреопатии
В послеродовом периоде у женщин- носителей АТ-ЩЖ могут развиваться различные нарушения функции ЩЖ, которые были объединены в общее понятие, получившее название послеродовой дис функции ЩЖ [49]. ПАТ включают в себя ПТ, по слеродовую болезнь Грейвса-Базедова — БГБ (диффузный токсический зоб) и значительно реже — вторичный гипотиреоз вследствие послеродово го некроза гипофиза или лимфоцитарного гипофи- зита. Поскольку иммунологические изменения по сле аборта подобны таковым в послеродовом пе риоде, то в некоторых случаях может иметь место и постабортная тиреоидная дисфункция [6].
ПАТ включают в себя ПТ, по слеродовую болезнь Грейвса-Базедова — БГБ (диффузный токсический зоб) и значительно реже — вторичный гипотиреоз вследствие послеродово го некроза гипофиза или лимфоцитарного гипофи- зита. Поскольку иммунологические изменения по сле аборта подобны таковым в послеродовом пе риоде, то в некоторых случаях может иметь место и постабортная тиреоидная дисфункция [6].
Первые случаи тиреотоксикоза после родов бы ли описаны С. Рапу [51] в 1786 г. у 6 пациенток, при этом наблюдались учащенные сердцебиения, припухлость в области шеи и протрузия глазных яблок. Таким образом, первые случаи БГБ (болез ни Парри), описанные в медицинской литературе, были случаями послеродовой манифестации забо левания [6]. Природа послеродовых нарушений функции ЩЖ оставалась невыясненной до 70-х го дов, когда появились сообщения из Японии и Ка нады о существовании послеродовых тиреопатий аутоиммунного генеза [38].
ПТ является разновидностью аутоиммунного тиреоидита (АНТ) и представляет собой транзитор- ную дисфункцию ЩЖ в послеродовом периоде. У женщин с АИТ, предшествующим беременности, после родов нередко происходит его прогрессиро вание [41].
У женщин с АИТ, предшествующим беременности, после родов нередко происходит его прогрессиро вание [41].
Распространенность ПТ в общей популяции со ставляет 5-9% среди всех беременностей [6, 36, 63]. В Уэльсе этот показатель достигает 17% [50].
Этиология ПТ, равно как и других аутоиммун ных тиреопатий, неизвестна, однако было установ лена тесная взаимосвязь возникновения ПТ и вы явления АТ-ЩЖ, наличия определенных HLA- маркеров и лимфоцитарной инфильтрации ЩЖ. Было показано, что послеродовая тиреоидная дис функция не связана с возрастом, количеством бе ременностей, частотой и длительностью лактации или семейным анамнезом других аутоимунных за болеваний.
В патогенезе ПТ важное значение имеет иммун ная реактивация или феномен «рикошета», кото рый заключается в резком увеличении активности иммунной системы после ее долгого физиологиче ского подавления во время беременности, что у предрасположенных лиц может приводить к разви тию многих аутоиммунных заболеваний.
В развитии ПТ изучается роль антигенов HLA- системы. Была показана ассоциация ПТ с гаплоти пами HLA-A26, BW46, BW67, Al, В8 при низкой распространенности гаплотипов HLA BW62 и CW7 [24]. Определенное влияние на продукцию АТ- ТПО могут оказывать гены, кодирующие DR4-aH- тиген.
- N. Amino и соавт. [5] впервые отметили взаимо связь развития ПТ с носительством АТ-ЩЖ. Зна чительное повышение уровня АТ-ТПО после родов является отражением усиления иммунного ответа вследствие общего повышения синтеза иммуногло булинов (общего IgG и подклассов IgG) [26]. Рас пределение подклассов IgG при ПТ характеризует ся преобладанием IgGl и IgG4 с незначительным повышением уровня IgG2 и IgG3 [25], хотя повы шение уровня IgG2 и IgG3 отмечалось у женщин с двухфазным нарушением функции ЩЖ, и повы шение IgG3 соответствовало тиреотоксической фазе.
Обнаружение АТ-ЩЖ во время беременности является прогностически важным, так как у 30- 50% женщин с АТ-ЩЖ развивается ПТ [36, 38, 57, 59]. Так, в одном из исследований ПТ не развился ни у одной из женщин контрольной группы без АТ-ЩЖ [57]. С другой стороны, по данным J. Ки- ijpens и соавт. [33], в 2/3 случаев при ПТ может об наруживаться повышенный уровень АТ-ТПО, а в 1/3 случаев ПТ АТ-ТПО не выявляются.
Так, в одном из исследований ПТ не развился ни у одной из женщин контрольной группы без АТ-ЩЖ [57]. С другой стороны, по данным J. Ки- ijpens и соавт. [33], в 2/3 случаев при ПТ может об наруживаться повышенный уровень АТ-ТПО, а в 1/3 случаев ПТ АТ-ТПО не выявляются.
По данным J. Kuijpens и соавт. [33], при обсле довании 291 женщины с АТ-ТПО отмечалось сни жение уровня этих антител в течение беременности и возвращение их к исходно высокому уровню в те чение 12 нед после родов. Независимыми фактора ми риска для развития ПТ являлись АТ-ТПО (от носительный риск 27,2), искусственное вскармли вание новорожденных (риск 11,1), курение (риск 3,1). Женщины, у которых развился ПТ, выкури вали большее число сигарет и в течение более дли тельного периода времени.
Для классического варианта ПТ характерно раз витие транзиторного тиреотоксикоза, как правило, через 8-12 нед после родов, за которым следует ги потиреоидная фаза (в среднем на 19-й неделе), а через 6-8 мес — восстановление эутиреоза. Очень редко гипотиреоз предшествует тиреотоксикозу.
Очень редко гипотиреоз предшествует тиреотоксикозу.
По мнению J. Lazarus [38], симптомы различных фаз ПТ могут появляться задолго до характерных лабораторных изменений. Клинически тиреоток сикоз обычно не тяжелый, так как речь идет о ти- реолитическом (деструктивном) тиреотоксикозе. Чаще более выраженными оказываются симптомы гипотиреоидной фазы, хотя они не отличаются особой специфичностью. Анализ клинических проявлений ПТ [36, 38] показал, что слабость и раздражительность были наиболее частыми сим птомами тиреотоксической фазы, в то время как слабость в сочетании со снижением памяти, сухо стью кожи и непереносимостью холода была харак терна для фазы гипотиреоза. Некоторые из этих симптомов чаще наблюдались в группе женщин с АТ-ЩЖ даже при отсутствии нарушения функции ЩЖ по сравнению с контрольной группой. В от ношении развития послеродовой депрессии было показано, что она может быть ассоциирована с но сительством АТ-ТПО независимо от наличия или отсутствия нарушения функции ЩЖ [38, 52].
Тем не менее изменения функции ЩЖ сопро вождаются клиническими проявлениями. Так, в нашей стране диагноз ПТ и его патогенетического аналога — молчащего (безболевого) тиреоидита — практически не ставят. К сожалению, часто прихо дится сталкиваться с поспешным установлением диагноза БГБ или стойкого гипотиреоза в ситуа ции, когда речь идет об одной из транзиторных фаз ПТ. Мягкий и прогностически благоприятный ха рактер нарушения функции ЩЖ обусловливает определенную сложность выявления каких-либо специфических симптомов среди многочисленных стресс-симптомов, возникающих на фоне измене ния условий жизни после родов.
Различные авторы подчеркивают, что в боль шинстве случаев через год после родов функции ЩЖ нормализуется, но в дальнейшем повышается риск развития стойкого гипотиреоза. По мнению Т. Nikolai и соавт. [48], до 12% женщин в послеро довом периоде имеют те или иные отклонения в состоянии ЩЖ, и лишь у половины из них функ ция ЩЖ нормализуется через 3 года после родов. По данным других исследований [6, 38], гипоти реоидная фаза ПТ может быть стойкой в 25-30% случаев в течение 3 лет после родов. У 50% жен щин, перенесших ПТ, через 7-9 лет развивается гипотиреоз. Отдаленный риск развития ПТ при следующей беременности для женщин с АТ-ТПО, у которых не было послеродовой тиреоидной дис функции, составляет только 5%. У женщин, пере несших ПТ, риск его развития при следующей бе ременности составит 70% [38].
По данным других исследований [6, 38], гипоти реоидная фаза ПТ может быть стойкой в 25-30% случаев в течение 3 лет после родов. У 50% жен щин, перенесших ПТ, через 7-9 лет развивается гипотиреоз. Отдаленный риск развития ПТ при следующей беременности для женщин с АТ-ТПО, у которых не было послеродовой тиреоидной дис функции, составляет только 5%. У женщин, пере несших ПТ, риск его развития при следующей бе ременности составит 70% [38].
При гормональном обследовании беременных женшин с АТ-ЩЖ, у которых в последующем раз вивался ПТ [9], было показано, что уровни ТТГ в течение беременности у них были значительно вы ше, чем в группе женщин без АТ-ЩЖ.
Учитывая деструктивный характер тиреотокси коза при ПТ, тиреостатики в тиреотоксическую фазу не назначают; если симптомы тиреотоксикоза значительно выражены, назначают р-адреноблока- торы. В гипотиреоидную фазу назначают замести тельную терапию левотироксином [63]. Примерно через год делается попытка отмены или значитель ного снижения дозы левотироксина, для того, что бы убедиться в транзиторном характере нарушения функции ЩЖ. В случае развития стойкого гипоти реоза назначают постоянную заместительную тера пию.
В случае развития стойкого гипоти реоза назначают постоянную заместительную тера пию.
При обнаружении в послеродовом периоде ти реотоксикоза необходимо иметь в виду, что речь может идти и о манифестации БГБ, которая с по вышенной частотой развивается в послеродовом периоде [6, 23]. Частота послеродовой БГБ состав ляет 0,54% в общей популяции, т. е. у 1 из 200 жен щин после родов может развиться иммуногенный тиреотоксикоз, несмотря на то что тиреотоксикоз может быть транзиторным у половины пациенток. По данным Н. Tada и соавт. [62], у 40% пациенток с БГБ, имевших одни и более родов, заболевание развилось именно в послеродовом периоде. Вопро сы диагностики и лечения БГБ у беременных, а также проблемы трансплацентарного переноса ти- реоидстимулирующих антител в этой работе мы на меренно не обсуждаем. Эта проблема уже неодно кратно подробно обсуждалась как в отечественной, так и в зарубежной литературе [3, 19, 42].
Аутоиммунные тиреопатии и йодная профилактика во время беременности
Проблема роли потребления йода в патогенезе аутоиммунных тиреопатий уже неоднократно обсу ждалась [1, 4]. В указанных обзорах приводится много аргументов в пользу того, что физиологиче ские дозы йода безопасны в плане индукции ауто иммунных тиреопатий. Значительно сложнее об стоит дело в ситуации, когда у беременной женщи ны, проживающей в йоддефицитном регионе, об наруживаются АТ-ЩЖ. С одной стороны, во время беременности повышается риск развития йоддефи- цитных заболеваний как для нее, так и для плода, с другой — АТ-ЩЖ, как было показано выше, явля ются самостоятельным фактором нарушения функции ЩЖ у беременной.
В указанных обзорах приводится много аргументов в пользу того, что физиологиче ские дозы йода безопасны в плане индукции ауто иммунных тиреопатий. Значительно сложнее об стоит дело в ситуации, когда у беременной женщи ны, проживающей в йоддефицитном регионе, об наруживаются АТ-ЩЖ. С одной стороны, во время беременности повышается риск развития йоддефи- цитных заболеваний как для нее, так и для плода, с другой — АТ-ЩЖ, как было показано выше, явля ются самостоятельным фактором нарушения функции ЩЖ у беременной.
О. Каетре и соавт. [27] проводили обследование беременных женщин с АТ-ТПО на предмет разви тия у них ПТ на фоне терапии левотироксином и йодидом калия в течение 40 нед после родов. Во время беременности у всех женщин отмечалось снижение уровня антител и его транзиторное по вышение в течение года после родов. Были созданы группы, получавшие лечение левотироксином (100 мкг/сут), йодидом калия (150 мкг/сут), и контроль ная группа без лечения. Изменения функции ШЖ были выявлены у всех женщин в послеродовом пе риоде. Было показано, что гормональные сдвиги были более значительными в группе, получавшей йод, чем в контрольной группе, что свидетельству ет о том, что у некоторых пациенток йод может скорее ухудшать, чем улучшать течение ПТ. Назна чение левотироксина закономерно предотвращало симптомы гипотиреоза при развитии гипотиреоид ной стадии ПТ, но не изменяло его течение. С дру гой стороны, многие авторы получили отрицатель ные результаты при попытках установить взаимо связь между потреблением йода и антителообразо- ванием [13, 31].
Было показано, что гормональные сдвиги были более значительными в группе, получавшей йод, чем в контрольной группе, что свидетельству ет о том, что у некоторых пациенток йод может скорее ухудшать, чем улучшать течение ПТ. Назна чение левотироксина закономерно предотвращало симптомы гипотиреоза при развитии гипотиреоид ной стадии ПТ, но не изменяло его течение. С дру гой стороны, многие авторы получили отрицатель ные результаты при попытках установить взаимо связь между потреблением йода и антителообразо- ванием [13, 31].
Сталкиваясь с проблемой назначения индиви дуальной йодной профилактики беременной жен щине, проживающей в йоддефицитном регионе (особенно, если речь идет о тяжелом или средней тяжести йодном дефиците), которая является но сителем АТ-ЩЖ, необходимо понимать, что речь идет о восполнении физиологической потребности в жизненно необходимом микроэлементе, дефицит которого, как показали многие исследования, гро зит развитием тяжелых нарушений у будущего ре бенка. Данные же о негативном влиянии повыше ния потребления йода в этой ситуации крайне про тиворечивы. Если одним серьезным аргументом является тот факт, что в большинстве стран на про тяжении многих десятилетий эффективно функ ционирует массовая йодная профилактика путем всеобщего йодирования соли, которая в контексте обсуждаемой проблемы имела лишь положитель ное влияние на здоровье популяции. Если вернуть ся к клинической практике, т. е. к отдельным па циенткам, проблему легко решает контроль функ ции ЩЖ во время беременности, который в случае носительства беременной АТ-ЩЖ, по современ ным представлениям, в любом случае необходим.
Данные же о негативном влиянии повыше ния потребления йода в этой ситуации крайне про тиворечивы. Если одним серьезным аргументом является тот факт, что в большинстве стран на про тяжении многих десятилетий эффективно функ ционирует массовая йодная профилактика путем всеобщего йодирования соли, которая в контексте обсуждаемой проблемы имела лишь положитель ное влияние на здоровье популяции. Если вернуть ся к клинической практике, т. е. к отдельным па циенткам, проблему легко решает контроль функ ции ЩЖ во время беременности, который в случае носительства беременной АТ-ЩЖ, по современ ным представлениям, в любом случае необходим.
Практические рекомендации
Обсуждая клинические рекомендации по диаг ностике и лечению аутоиммунных тиреопатий у бе ременных женщин, необходимо иметь в виду 2 ас пекта. Как будет показано ниже, многие современ ные исследователи рекомендуют проведение скри нинга нарушения функции ЩЖ у всех беременных женщин и более углубленное исследование в слу чае выявления каких-либо изменений, даже таких, как носительство АТ-ЩЖ. Совершенно очевидно, такого рода рекомендации на уровне национально го здравоохранения требуют больших капиталовло жений. При имеющейся в нашей стране кризисной ситуации эту проблему на фоне эпидемии туберку леза и ВИЧ-инфекции нельзя назвать первоочеред ной. Она не будет первоочередной и на фоне плохо налаженного скрининга врожденного гипотиреоза и фактически отсутствующей массовой йодной профилактики. Учитывая стоимость исследований ТТГ и АТ-ЩЖ, их проведение у всех беременных женщин вряд ли осуществимо и в странах с более развитой системой здравоохранения.
Совершенно очевидно, такого рода рекомендации на уровне национально го здравоохранения требуют больших капиталовло жений. При имеющейся в нашей стране кризисной ситуации эту проблему на фоне эпидемии туберку леза и ВИЧ-инфекции нельзя назвать первоочеред ной. Она не будет первоочередной и на фоне плохо налаженного скрининга врожденного гипотиреоза и фактически отсутствующей массовой йодной профилактики. Учитывая стоимость исследований ТТГ и АТ-ЩЖ, их проведение у всех беременных женщин вряд ли осуществимо и в странах с более развитой системой здравоохранения.
Если вернуться от социальных проблем к чисто медицинским, по современным представлениям, рекомендация по исследованию функции ЩЖ у женщины, планирующей беременность, особенно с заболеваниями ЩЖ в прошлом и отягощенным семейным анамнезом, не лишена оснований. В связи с этим хотелось бы заметить, что Американ ская тиреоидологическая ассоциация в своих по следних рекомендациях предлагает проведение скрининга нарушения функции ЩЖ у всего взрос лого населения, подразумевающего исследование уровня ТТГ начиная с 35-летнего возраста и далее каждые 5 лет [35]. Наиболее вероятно, что это по зволит многим страховым компаниям включать определение уровня ТТГ в программу рутинных исследований без специальных показаний к этому. Возвращаясь к беременным, Американская ассо циация клинических эндокринологов (ААСЕ) фор мулирует следующие показания к определению уровня ТТГ [15]: 1) у всех женщин, планирующих беременность, для исключения гипотиреоза или его коррекции до беременности; 2) рутинное опре деление уровня ТТГ на ранних сроках беременно сти целесообразно, но должно проводиться по на значению врача, после обсуждения с пациенткой; 3) у всех женщин с зобом, повышенными уровнями АТ-ЩЖ, с заболеваниями ЩЖ в семейном анам незе, при наличии других эндокринных аутоим мунных заболеваний или симптомов, позволяю щих заподозрить гипотиреоз.
Наиболее вероятно, что это по зволит многим страховым компаниям включать определение уровня ТТГ в программу рутинных исследований без специальных показаний к этому. Возвращаясь к беременным, Американская ассо циация клинических эндокринологов (ААСЕ) фор мулирует следующие показания к определению уровня ТТГ [15]: 1) у всех женщин, планирующих беременность, для исключения гипотиреоза или его коррекции до беременности; 2) рутинное опре деление уровня ТТГ на ранних сроках беременно сти целесообразно, но должно проводиться по на значению врача, после обсуждения с пациенткой; 3) у всех женщин с зобом, повышенными уровнями АТ-ЩЖ, с заболеваниями ЩЖ в семейном анам незе, при наличии других эндокринных аутоим мунных заболеваний или симптомов, позволяю щих заподозрить гипотиреоз.
В 1998 г. рядом исследователей был предложен так называемый скрининг гипотиреоза и аутоим мунных тиреопатий во время беременности. Один из его авторов D. Glinoer [19] следующим образом формулирует основания для такого скрининга.
- Гипотиреоз и аутоиммунные тиреопатии от носительно часто встречаются среди молодых жен щин.
- Субклинический гипотиреоз практически не имеет клинических проявлений.
- Повышенный риск акушерских осложнений при некомпенсированном гипотиреозе.
- Повышенный риск спонтанных абортов у женщин, имеющих высокие уровни АТ-ЩЖ.
- Повышенный риск прогрессирования гипо тиреоза во время беременности у женщин, имею щих высокие уровни АТ-ЩЖ.
- Повышенный риск развития послеродовых тиреопатий (50% женщин с АТ-ТПО имеют после родовые нарушения функции ЩЖ).
Скрининг базируется на определении уровня ТТГ и АТ-ЩЖ на ранних сроках беременности. Определение уровня ТТГ и АТ-ЩЖ необходимо проводить как можно раньше (предпочтительнее между 12-й и 20-й неделями беременности). Если по экономическим причинам определение и АТ- ТГ, и АТ-ТПО провести невозможно, то предпоч тение следует отдавать определению АТ-ТПО, так как АТ-ТГ относительно редко встречаются изоли рованно (см. рисунок).
рисунок).
Если уровень ТТГ превышает 4 мМЕ/л незави симо от наличия или отсутствия антител, у паци ентки с высокой вероятностью имеется гипотире-
Скрининг аутоиммунных тиреопатий и гипотиреоза при бере менности в модификации [19].
оз. В этой ситуации целесообразно исследование уровня свободного Т4. Этим женщинам показана терапия левотироксином на протяжении всей бе ременности и определение показателей, характери зующих функцию ЩЖ, в каждом триместре. Что касается женшин, имеющих АТ-ТПО, то решение о дальнейшей тактике принимается по результатам определения уровня ТТГ. Если уровень ТТГ со ставляет менее 2 мМЕ/л (чаще всего в этом случае определяется низкий уровень антител), лечение не показано, но уровень ТТГ целесообразно перепро верить в конце II триместра. Для женщин, имею щих АТ-ЩЖ и уровень ТТГ в нормальных преде лах, но составляющий 2-4 мМЕ/л (это нередко со четается с высокими уровнями антител), необходи мо рассматривать вопрос о назначении терапии ле вотироксином [19]. Как на это указывают сами ав торы приведенного алгоритма скрининга, послед ний еще не получил окончательного подтвержде ния клиническими испытаниями.
Как на это указывают сами ав торы приведенного алгоритма скрининга, послед ний еще не получил окончательного подтвержде ния клиническими испытаниями.
Из приведенных выше представлений законо мерно вытекают принципы лечения гипотиреоза во время беременности, которые мы формулируем, суммируя ряд широко принятых рекомендаций [15, 19, 35] и собственный клинический опыт.
- Систематический скрининг на гипотиреоз и аутоиммунные тиреопатии у всех беременных жен щин (вопрос остается открытым).
- Одинаковые подходы к лечению манифестно го и субклинического гипотиреоза.
- При гипотиреозе, впервые выявленном во время беременности, полная заместительная доза левотироксина назначается сразу, т. е. без посте пенного ее увеличения, принятого в обычной кли нической практике.
- Исследование уровня свободного Т4 и ТТГ должно проводиться каждые 8 нед.
- На протяжении беременности происходит по степенное и закономерное увеличение потребно сти в левотироксине; во второй половине беремен ности его доза, как правило, увеличивается на 30- 50%.

Если гипотиреоз был диагностирован у женщин до беременности и она уже получает левотироксин, начиная примерно со II триместра, заместительная доза, как правило, увеличится на 30-50%. Бере менные с гипотиреозом, который развился в исхо де АИТ, будут получать примерно 1,9 мкг/кг лево тироксина. Пациентки, у которых гипотиреоз развился в результате аблации ЩЖ (хирургической или радиоактивным йодом), будут получать не сколько большую дозу — около 2,3 мкг/кг. После беременности доза левотироксина должна быть уменьшена до исходной дозы, которую пациентка получала до беременности. Если вне беременности наиболее адекватным показателем, который используется для оценки компенсации гипотиреоза, является уровень ТТГ, который вплоть до подбора окончательной дозы исследуется с интервалом 1 раз в 3 мес, во время беременности не меньшее зна чение придается исследованию уровня свободного Т4. Это связано с тем, что уровень ТТГ изменяется в ту или иную сторону после коррекции заместительной терапии достаточно медленно. Во время беременности нужно более оперативно изменять дозу препарата.
Во время беременности нужно более оперативно изменять дозу препарата.
1. Герасимов Г. А., Петунина Н. А. // Пробл. эндокринол. -1993- № 3. — С. 52-54.
2. Мельниченко Г. А., Мурашко Л. Е., Клименченко Н. И., Малясова С. В. // Рус. мед. журн. — 1999. — Т. 7, № 3 (87). — С. 145-150.
3. Мельниченко Г. А., Лесникова С. В. // Consilium Medicum. 2000. — Т. 2, № 5. — С. 221-226.
4. Фадеев В. В., Мельниченко Г. А., Герасимов Г. А. // Пробл. эндокринол. — 2001. — Т. 47, № 4. — С. 7-13.
5. Amino N., Miyai К., Ohnishi Т. // J. Clin. Endocrinol. Metab. 1976. — Vol. 42. — P. 296-301.
Clin. Endocrinol. Metab. 1976. — Vol. 42. — P. 296-301.
6. Amino N., Tada H., Hidaka Y. // Thyroid. — 1999. — Vol. 9, N 7. — P. 705-713.
7. Bakimer R., Cohen J. R., Shoenfeld Y. // Immunol. Allergy Clin. N. Am. — 1994. — Vol. 14. — P. 701-723.
8. Ball R., Freedman D. B., Holmes J. C. et al. // Clin. Chem. — 1989. — Vol. 35, N 9. — P. 1891-1896.
9. Bech K., Hertel J., Rasmussen N. et al. // Acta Endocrinol. — 1991. — Vol. 125. — P. 146-149.
10. Bussen S., Steck T. // Hum. Reprod. — 1995. — Vol. 10, N 11. — P. 2938-2940.
11. Davis L. E., Leveno K. J., Cunningham F. G. I I Obstet. and Gynecol. — 1988. — Vol. 72, N 1. — P. 108-112.
Davis L. E., Leveno K. J., Cunningham F. G. I I Obstet. and Gynecol. — 1988. — Vol. 72, N 1. — P. 108-112.
12. Dussault J. H. // The Thyroid and Age / Eds A. Pinchera et al. — Stuttgart; New York, 1998. •
13. Eltom M., Karlsson F. A., Kamal A. M. et al. // J. Clin. Endo crinol. Metab. — 1985. — Vol. 6, N 6. — P. 1112-1117.
14. Esplin M. S., Branch D. W., Silver R., Stagnaro-Green A. I I Am. J. Obstet. Gynecol. — 1998. — Vol. 179, N 6. — P. 1583-1586.
15. Gharib H., Cobin R. H., Dickkey R. A. // Endocr. Pract. — 1999. — Vol. 5, N 6. — P. 367-368.
16. Glinoer D., Soto M. F., Bourdoux P. et al. // J. Clin. Endocri nol.Metab. — 1991. — Vol. 73, N 2. — P. 421-427.
Glinoer D., Soto M. F., Bourdoux P. et al. // J. Clin. Endocri nol.Metab. — 1991. — Vol. 73, N 2. — P. 421-427.
17. Glinoer D., Riahi M., Griien J. P., Kinthaert J. // Ibid. — 1994. Vol. 79. — P. 197-204.
18. Glinoer D., De Nayer P., Delange F. et al. // Ibid. — 1995. — Vol. 80. — P. 258-269.
19. Glinoer D. // Trends Endocrinol. Metab. — 1998. — Vol. 9, N 10. — P. 403-411.
20. Glinoer D. // Fertil. and Steril. — 1999. — Vol. 72, N 2. — P. 373-374.
21. Haddow J. E., Palomaki G. E., Allan W. C. et al. // N. Engl. J. Med. — 1999. — Vol. 341. — P. 549-555.
22. Hetzel B. S. // Ibid. — 1994. — Vol. 331, N 26. — P. 1770- 1771.
23. Hidaka Y., Tamaki H., Iwatani Y. et al. // Clin. Endocrinol. -1993- Vol. 41, N I. — P. 15-20.
24. Jansson R., Saefwenberg J., Dahlberg P. A. // J. Clin. Endocri nol.Metab. — 1985. — Vol. 60, N 1. — P. 168-173.
25. Jansson R., Thompson P. M., Clark F., McLachlan S. M. // Clin. Exp. Immunol. — 1986. — Vol. 63. — P. 80-86.
26. Jansson R., Karlsson F. A., Linde A., Sjoberg O. // Ibid. — 1987. — Vol. 70. — P. 68-73.
27. Kaempe O., Jansson R., Karlsson F. A. // J. Clin. Endocrinol. Metab. — 1990. — Vol. 70, N 4. — P. 1014-1018.
Kaempe O., Jansson R., Karlsson F. A. // J. Clin. Endocrinol. Metab. — 1990. — Vol. 70, N 4. — P. 1014-1018.
28. Kamijo K., Saito T, Sato M. et al. // Endocrinol. Jap. — 1990. -Vol. 37, N 3. — P 397-403.
29. Kim С. H., Chae H. D., Kang В. M., Chang Y. S. // Am. J. Reprod. Immunol. — 1998. — Vol. 40, N 1. — P. 2-8.
30. Klein R. Z., Haddow J. E., Faix J. D. et al. // Clin. Endocri nol. — 1991. — Vol. 35. — P. 41-46.
31. Knobel M., Medeiros-Neto G. // J. Endocrinol. Invest. — 1986. — Vol. 9, N 4. — P. 321-324.
32. Knudsen U. B., Hansen И, Juul S., Secher N. J. // Eur. J. Obstet. Gynecol. Reprod. Biol. — 1991. — Vol. 39. — P. 31-36.
J. // Eur. J. Obstet. Gynecol. Reprod. Biol. — 1991. — Vol. 39. — P. 31-36.
33. Kuijpens J. L., Pop И J., Vader H. L. et al. // Eur. J. Endocrinol. — 1998. — Vol. 139, N 1. — P. 36-43.
34. Kutteh W. H., Yetman D. L., Carr A. C. et al. // Fertil. and Steril. — 1999. — Vol. 71, N 5. — P. 843-848.
35. Ladenson P. W., Singer P. A., Ain К. B. et al. // Arch. Intern. Med. — 2000. — Vol. 160. — P. 1573-1575.
36. Lazarus J. H., Hall R., Othman S. et al. // Quart. J. Med. — 1996. — Vol. 89. — P. 429-435.
37. Lazarus J. H., Aloa A., Parkes A. B. et al. // 71-st Meeting of the American Thyroid Association. — 1998. — Abstr. 16.
— 1998. — Abstr. 16.
38. Lazarus J. H. // Thyroid. — 1999. — Vol. 9, N 7. — P. 685- 695.
39. Lejeune B., Grun J. P., de Nayer P. et al. // Br. J. Obstet. Gynaecol. — 1993. — Vol. 100, N 7. — P. 669-672.
40. Leung A. S., Millar L. K., Koonings P. P. et al. // Obstet. and Gynecol. — 1993. — Vol. 81, N 3. -P. 349-353.
41. Lobig H., Bohn W., Mau J., Schats H. // Autoimmune Thyroiditis / Eds W. Scherbaum et al. — Berlin, 1991. — P. 185- 193.
42. McKenzie J. M., Zakarija M. // Thyroid. — 1992. — Vol. 2. N 2. — P. 155-159.
43. Man E. B., Brown J. F, Serunian S. A. // Ann. Clin. Lab. Sci. 1991. — Vol. 21. — P. 227-239.
Man E. B., Brown J. F, Serunian S. A. // Ann. Clin. Lab. Sci. 1991. — Vol. 21. — P. 227-239.
44. Matalon S. T, Blank M., Ornoy A., Shoenfeld Y. // Am. J. Reprod. Immunol. — 2001. — Vol. 45. — P. 72-77.
45. Mecacci F, Paretti E., Cioni R. et al. // J. Reprod. Immunol. 2000. — Vol. 46. — P. 39-50.
46. Montoro M., Collea J. V., Frasier S. D., Mestman J. H. I I Ann. Intern. Med. — 1981. — Vol. 94, N I. — P. 31-34.
47. Muller A. F, Verhoeff A., Mantel M. J., Berghout A. I I Fertil and Steril. — 1999. — Vol. 71, N 1. — P. 30-34.
48. Nikolai T. F, Turney S. L., Roberts R. C. // Arch. Intern. Med. — 1987. — Vol. 147, N 2. — P. 221-224.
L., Roberts R. C. // Arch. Intern. Med. — 1987. — Vol. 147, N 2. — P. 221-224.
49. Orgiazzi J-, Madec A. M. // The Thyroid and Iodine / Eds J. Nauman et al. — Stuttgart, 1996. — P. 169-178.
50. Othman S., Philips D., Parkes A. B. et al. // Clin. Endocrinol. 1990. — Vol. 32. — P. 559-564.
51. Parry С. H. U Collection from the Unpublished Papers of the Late Caleb Hillier Parry. — London, 1825. — P. 111.
52. Pop V. J., de Rooy H. A., Vader H. L. et al. // Acta Endocrinol. — 1993. — Vol. 129, N 1. — P. 26-30.
53. Pop V. J., de Vries E., van Baar A. L. et al. // J. Clin. Endocrinol. Metab. — 1995. — Vol. 80. — P. 3561-3566.
L. et al. // J. Clin. Endocrinol. Metab. — 1995. — Vol. 80. — P. 3561-3566.
54. Pop V. J., Kuijpens J. L., van Baar A. L. et al. // Clin. Endocrinol. — 1999. — Vol. 50. -P. 149-155.
55. Porterfield S. P., Hendrich С. E. // Endocr. Rev. — 1993. — Vol. 14. — P. 94-106.
56. Pratt D. E., Kaberlein G., Dudkiewicz A. et al. // Fertil. and Steril. — 1993. — Vol. 60, N 6. — P. 1001-1005.
57. Rasmussen N. G., Hornnes P. J., Hoier-Madsen M. et al. // Acta Endocrinol. — 1990. — Vol. 123. — P. 395-401.
58. Roti E., Bianconi L., Gardini E. et al. // J. Endocrinol. Invest. 1991. — Vol. 14, N 8. — P. 669-674.
Invest. 1991. — Vol. 14, N 8. — P. 669-674.
59. Sher G., Maassarani G., Zouves C. et al. // Am. J. Reprod. Immunol. — 1998. — Vol. 39, N 4. — P. 223-225.
60. Singh A., Damas Z. N., Stone S. C., Asch R. H. // Fertil. and Steril. — 1995. — Vol. 63, N 2. — P. 277-281.
61. Stagnaro-Green A., Roman S. H., Cobin R. H. et al. // J. A. M. A. — 1990. — Vol. 264, N 11. — P. 1422-1425.
62. Tada H., Hidaka Y., Itoh E. et al. // Endocr. J. — 1994. — Vol. 41. — P. 325-327.
63. Thomas-Desrousseaux P. // Revue Fr. Gynecol. Obstet. — 1989. — Vol. 84, N 12. — P. 928-931.
928-931.
64. Vanderpump M. P., Tunbridge W. M., French J. M. et al. // Clin. Endocrinol. — 1995. — Vol. 43, N 1. — P. 55-68.
65. Wilson R., Ling H., MacLean M. A. et al. // Fertil. and Steril.
Аутоиммунный тиреоидит щитовидной железы — безопасное лечение в клинике «Гавриловой»
Медицинские способы лечения аутоиммунного тиреоидита
- заместительная гормональная терапия;
- операция или разрушение щитовидной железы радиоактивным йодом;
- восстановительное лечение компьютерной рефлекторной терапией.
Прием гормонов и операции не устраняют причину аутоиммунного тиреоидита
- Заместительная гормональная терапия (ЗГТ ) — то регулярный прием и замещение недостающих организму гормонов синтетическими аналогами.

ЗГТ не устраняет развитие аутоиммунного тиреоидита, а только снижает на какое-то время его проявления в анализах.
В результате такого «лечения» заболевание прогрессирует, требуются все большие дозы препаратов,
что вкупе с отсутствием выздоравления приводит к многочисленным побочным эффектам и нарушениям
пищеварительной, сердечно-сосудистой, нервной и репродуктивной системы человека.
Об опасности и терапевтической бесполезности ЗГТ подробно описано здесь.
Прежде чем принимать решение о «лечении» методом ЗГТ, мы рекомендуем Вам поискать реальные отзывы пациентов в интернете
или ознакомиться с отзывами наших пациентов, которые годами пытались вылечиться таким способом.
Мы не используем в нашей практике ЗГТ, а наоборот постепенно снимаем зависимость пациентов от приема синтетических гормонов.
- Операцию при аутоиммунном тиреоидите назначают в запущенных случаях, например при больших объемах щитовидной железы, или чтобы остановить избыточную выработку антител.

Т.е. вместо того, чтобы устранить причину заболевания — сбой в иммунной системе, щитовидную железу частично или полностью удаляют.
Как «безопасную» альтернативу, чтобы полностью остановить работу щитовидной железы без операции, предлагают ее облучить радиоактивным йодом.
Последний способ конечно безопаснее операции, но удаление или разрушение щитовидной железы любым способом не избавляет от причины заболевания.
Аутоиммунные процессы в организме никуда не исчезают.
И добавляется пожизненная ЗГТ, которая приводит к другим хроническим заболеваниям, вызванным приемом искуственных гормонов.
Об опасности хирургии или облучении радиоактивным йодом подробнее здесь (хирургия) и тут (радиоактивный йод) .
Не расстраивайтесь. Уже более 25 лет существует безопасное лечение аутоиммунного тиреоидита без гормонов и операций
С 1994 года мы развиваем безопасный способ лечения щитовидной железы.
Восстанавливаем её функцию, структуру и объем! Заболевание исчезает.
Восстановление обеспечивает авторский метод Гавриловой Н.А. — компьютерная рефлекторная терапия (КРТ).
Метод защищен 9-ю патентами Российской Федерации.
В отличие от заместительной гормональной терапии (ЗГТ), которая с помощью медикаментов только на время улучшает гормональные показатели в крови,
компьютерная рефлекторная терапия (КРТ) устраняет причину заболевания — сбой в иммунной системе, и восстанавливает собственный гормональный фон пациента.
При этом необходимости в операции, как правило, нет!
Показательный результат лечения методом КРТ одной из наших пациенток,
которая еще раз перепроверила результаты на гормоны в своей региональной клинике:
ФИО — Файзуллина Ирина Игоревна
Лабораторное исследование ДО лечения M20161216-0003 от 16. 12.2016 (кликнуть, чтобы смотреть)
12.2016 (кликнуть, чтобы смотреть)
Тиреотропный гормон (ТТГ) — 8,22 мкМЕ/мл
Лабораторное исследование ПОСЛЕ 1 курса КРТ M20170410-0039 от 10.04.2017 (кликнуть, чтобы смотреть)
Тиреотропный гормон (ТТГ) — 2,05 мкМЕ/мл
Тироксин свободный (Т4) — 1,05 нг/дл
Почему нормализуется собственный гормональный фон у наших пациентов?
Дело в том, что работа внутренних органов обеспечивается взаимодействием 3-х основных управляющих систем организма:
нервной, иммунной и эндокринной.
Именно от их синхронной работы зависит физическое состояние и здоровье человека.
Любое хроническое заболевание прогрессирует и организм не может с ним самостоятельно справиться только из-за сбоев этих регуляторных систем.
Компьютерная рефлекторная терапия оказывает модулирующее воздействие на иммунную систему и восстанавливает её.
Затем «перезагружает» работу всех систем организма в состояние активной борьбы с заболеваниями.
Методов воздействия на организм человека существует множество.
Но, только компьютерная рефлекторная терапия восстанавливает иммунную систему,
восстанавливает нейро-иммуно-эндокринную саморегуляцию организма.
Человек выздоравливает.
Особенность метода лечения заключается еще и в том, что врач воздействует на организм пациента не «вслепую», а с помощью автоматизированной компьютерной системы.
Медицинский адаптер системы, постоянно сканирует в процессе лечения
состояние акупунктурных точек, меридианных систем организма,
и автоматически дозирует лечебное воздействие по мощности и времени.
Компьютерная рефлекторная терапия внешне может напоминать акупунктуру, но ей не является, работает без использования игл и на других принципах.
КРТ, как и любой метод лечения, имеет свои противопоказания к применению:
онкологические заболевания и психические расстройства, наличие кардиостимулятора, мерцательная аритмия, инфаркт миокарда в остром периоде, ВИЧ-инфекция и врожденный гипотериоз.
Если у Вас отсутствуют противопоказания, то восстановить естественный гормональный баланс и избавиться от заболеваний щитовидной железы,
уже 25 лет является обычной практикой с помощью метода КРТ.
При желании Вы можете детальнее ознакомиться с биоэлектрофизическими основами лечебного воздействия рефлекторной терапии и конкретными примерами лечения.
Лечение аутоиммунного тиреоидита методом компьютерной рефлекторной терапии без побочных эффектов приводит к следующим результатам:
- рост узлов и кист приостанавливается, они постепенно уменьшаются в размерах и, чаще всего, полностью рассасываются;
- восстанавливаются объем функционирующей ткани и структура щитовидной железы;
- восстанавливается синтез собственных тиреоидных гормонов, что подтверждается данными УЗИ и нормализацией уровня гормонов щитовидной железы ТТГ и Т4;
- снижается активность аутоиммунных процессов в щитовидной железе, что подтверждается снижением титра антител АТ- ТПО, АТ- ТГ и АТ к рецепторам ТТГ;
- если пациент принимает гормонозамещающие препараты, удаётся уменьшить их дозировку и со временем полностью отменить;
- восстанавливается менструальный цикл;
- женщины могут реализовать детородную функцию без применения ЭКО и родить здорового ребенка с нормальным уровнем гормонов;
- кроме того, уменьшается биологический возраст пациента, укрепляется здоровье, снижается вес, уходят отеки.
 Именно поэтому в Клинике появились дополнительные процедуры и программы для естественного омоложения лица.
Именно поэтому в Клинике появились дополнительные процедуры и программы для естественного омоложения лица.
Информация на сайте не предназначена для самодиагностики и самолечения. Если нездоровится, не запускайте болезнь, обратитесь за квалифицированной медицинской помощью.
- Чтобы приехать на лечение в Клинику Гавриловой из другого города, не теряйте время, думая как всё это организовать, звоните 8-800-55-00-128 из России бесплатно, для звонка из других стран набирайте +7 846 374-07-08 или +7 927 725 -11-44 (WhatsApp, Viber, telegram). Помощник консультирующего врача оперативно ответит на ваши вопросы и поможет организовать поездку максимально комфортно.
- Чтобы записаться на прием к врачу обратитесь в регистратуру по телефону +7 (846) 374-07-08 , или через .
Далее приведены примеры выздоровления
изменения в современных лечебно-диагностических парадигмах
Проблема взаимосвязи аутоиммунной патологии щитовидной железы (ЩЖ) и нарушений репродуктивной функции в последние годы становится все более обсуждаемой. Клиническими и экспериментальными исследованиями показано, что нарушение функции ЩЖ приводит к тяжелым осложнениям беременности: самопроизвольному патологическому прерыванию беременности, мертворождению, невынашиванию беременности, аномалиям развития плода. Данная взаимосвязь подтверждена не только у женщин с тиреотоксикозом и гипотиреозом, но и у женщин с сохранной функцией ЩЖ, в сыворотке крови у которых выявлены высокие титры антител (АТ) к тиреопероксидазе (АТ-ТПО), тиреоглобулину (АТ-ТГ) и рецепторам тиреотропного гормона (АТ-рТТГ) [1].
Клиническими и экспериментальными исследованиями показано, что нарушение функции ЩЖ приводит к тяжелым осложнениям беременности: самопроизвольному патологическому прерыванию беременности, мертворождению, невынашиванию беременности, аномалиям развития плода. Данная взаимосвязь подтверждена не только у женщин с тиреотоксикозом и гипотиреозом, но и у женщин с сохранной функцией ЩЖ, в сыворотке крови у которых выявлены высокие титры антител (АТ) к тиреопероксидазе (АТ-ТПО), тиреоглобулину (АТ-ТГ) и рецепторам тиреотропного гормона (АТ-рТТГ) [1].
Распространенность первичного манифестного гипотиреоза среди беременных составляет 2%, субклинического — до 15% [2]. Гипотиреоз во время беременности наиболее опасен для развития плода и в первую очередь для его центральной нервной системы (ЦНС) [3]. Причем заболевание матери оказывает более неблагоприятное воздействие на формирование и функционирование центральных структур мозга плода, чем гипотиреоз, обусловленный нарушением закладки самой ЩЖ плода [4, 5]. Это объясняется тем, что в первую половину беременности (до 18—20 нед) ЩЖ плода практически не функционирует, миграция нейронов и другие важные ранние стадии внутриутробного развития мозга во многом зависят от поступления материнских гормонов ЩЖ матери.
Это объясняется тем, что в первую половину беременности (до 18—20 нед) ЩЖ плода практически не функционирует, миграция нейронов и другие важные ранние стадии внутриутробного развития мозга во многом зависят от поступления материнских гормонов ЩЖ матери.
В последние годы особое внимание уделяется вопросу взаимосвязи между носительством АТ к ЩЖ и репродуктивной функцией у женщин. Частота выявления тиреоидных АТ (АТ-ТПО, АТ-ТГ) у беременных по различным источникам составляет 10—20% [6]. Отмечено, что у женщин с повышенным уровнем тиреоидных АТ, даже при эутиреоидном состоянии, значительно выше частота осложнений беременности и родов. У 16% беременных с носительством АТ к ЩЖ и нормальным уровнем тиреотропного гормона (ТТГ) в I триместре в последующем отмечалось повышение ТТГ более 4 мЕд/л, а у 33—50% развивался послеродовый тиреоидит [7]. Рядом исследователей представлены доказательства негативного влияния субклинического изменения уровня ТТГ при наличии носительства АТ-ТПО на частоту развития акушерских осложнений — это повышение риска преждевременных родов и спонтанных патологических прерываний беременности, задержка внутриутробного развития плода, гестационная гипертензия и другая патология [8]. Ассоциацию между носительством АТ-ТПО и риском преждевременных родов (1,7-кратное повышение) удалось выявить по результатам двух проспективных популяционных исследований, включивших в целом 7585 беременных из двух голландских когорт [9].
Ассоциацию между носительством АТ-ТПО и риском преждевременных родов (1,7-кратное повышение) удалось выявить по результатам двух проспективных популяционных исследований, включивших в целом 7585 беременных из двух голландских когорт [9].
В последнее время в научном сообществе возникают спорные ситуации, связанные с интерпретацией лабораторных тестов для оценки функции ЩЖ во время беременности. Это прежде всего связано с тем, что во время беременности происходит изменение метаболизма тиреоидных гормонов и динамически меняющееся взаимодействие гипофизарно-тиреоидных систем матери и плода. Доступные в настоящее время иммунометрические методы определения тиреоидных гормонов по существу представляют собой приблизительные и оценочные тесты, не являются прямыми методами определения концентрации гормона и очень чувствительны к изменениям уровня связывающих белков. В связи с этим чрезвычайно актуальным является использование высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (ВЭЖХ-МС/МС) для разработки надежных и точных триместр-специфичных интервалов для тиреоидных гормонов во время беременности.
В данном обзоре мы представили современные принципы диагностики и лечебные подходы ведения беременности у женщин с аутоиммунной патологией ЩЖ.
По данным литературы известно, что аутоиммунные заболевания встречаются у 3—8% населения мира [10], развиваются до 10 раз чаще у женщин, чем у мужчин, и характеризуются длительным течением. Большой интерес в настоящее время уделяется диагностике и лечебной тактике при аутоиммунных заболеваниях ЩЖ, особенно у женщин, так как данная патология в последние десятилетия активно прогрессирует [11] и оказывает влияние на репродуктивный статус [12]. В настоящее время не существует единой точки зрения на роль АТ к ткани ЩЖ в генезе нарушения репродуктивной функции женщин. В общей популяции в среднем 10% беременных являются носительницами АТ-ТПО [13].
АИТ является HLA-ассоциированным заболеванием. При этом атрофическая и гипертрофическая формы АИТ связаны с разными гаплотипами. Однако пусковые процессы при хроническом АИТ до конца не ясны. В крови пациентов с АИТ, как правило, обнаруживают АТ к различным антигенам ЩЖ, наиболее часто определяются АТ-ТПО, АТ-ТГ, реже — блокирующие АТ-рТТГ. Кроме того, в начале заболевания могут транзиторно определяться и стимулирующие АТ-рТТГ. Тем не менее одним из спорных моментов в механизме развития АИТ является роль антитиреоидных АТ. В соответствии с данными исследователей, АТ-ТПО могут приводить к образованию иммунных комплексов, способствующих выделению биологически активных веществ, которые осуществляют деструктивные изменения в ЩЖ, снижая ее функцию [14]. Согласно мнению других авторов, АТ-ТПО — показатель деструктивных проявлений ЩЖ, а АТ-ТГ — результат компенсаторных механизмов организма, так как уровень этих АТ зависит от числа стимулированных рецепторов к тиреоидным гормонам [15].
В крови пациентов с АИТ, как правило, обнаруживают АТ к различным антигенам ЩЖ, наиболее часто определяются АТ-ТПО, АТ-ТГ, реже — блокирующие АТ-рТТГ. Кроме того, в начале заболевания могут транзиторно определяться и стимулирующие АТ-рТТГ. Тем не менее одним из спорных моментов в механизме развития АИТ является роль антитиреоидных АТ. В соответствии с данными исследователей, АТ-ТПО могут приводить к образованию иммунных комплексов, способствующих выделению биологически активных веществ, которые осуществляют деструктивные изменения в ЩЖ, снижая ее функцию [14]. Согласно мнению других авторов, АТ-ТПО — показатель деструктивных проявлений ЩЖ, а АТ-ТГ — результат компенсаторных механизмов организма, так как уровень этих АТ зависит от числа стимулированных рецепторов к тиреоидным гормонам [15].
На данный момент доказано, что частота встречаемости антитиреоидных АТ не совпадает с распространенностью как манифестного, так и субклинического гипотиреоза. Этот факт указывает на то, что АТ могут выявляться даже у лиц, не имеющих функциональных или структурных изменений ЩЖ [16]. По данным J. Hollowell и соавт. [17], у 12% обследованных пациентов без заболеваний ЩЖ обнаружены АТ-ТПО и у 10% — АТ-ТГ [17]. При этом некоторые исследователи считают выявление АТ-ТПО признаком возможного нарушения функции ЩЖ в будущем, и даже низкие титры этих АТ коррелируют с лимфоидной инфильтрацией ткани Щ.Ж. Зарубежные исследователи утверждают, что повышенный уровень AT-ТПО является статистически значимым признаком АИТ, и наличие тиреоид-специфических АТ в сыворотке крови (АТ-ТГ 1:100 и выше, АТ-ТПО 1:32 и выше) является показателем аутоиммунного поражения ЩЖ [17]. По данным исследовательской работы G. Karanikas и соавт. [19], повышенные титры АТ-ТПО коррелируют с высокой частотой продукции Т-клетками Тh/Тс1-цитокинов, отвечающих за поражение клеток ЩЖ.
По данным J. Hollowell и соавт. [17], у 12% обследованных пациентов без заболеваний ЩЖ обнаружены АТ-ТПО и у 10% — АТ-ТГ [17]. При этом некоторые исследователи считают выявление АТ-ТПО признаком возможного нарушения функции ЩЖ в будущем, и даже низкие титры этих АТ коррелируют с лимфоидной инфильтрацией ткани Щ.Ж. Зарубежные исследователи утверждают, что повышенный уровень AT-ТПО является статистически значимым признаком АИТ, и наличие тиреоид-специфических АТ в сыворотке крови (АТ-ТГ 1:100 и выше, АТ-ТПО 1:32 и выше) является показателем аутоиммунного поражения ЩЖ [17]. По данным исследовательской работы G. Karanikas и соавт. [19], повышенные титры АТ-ТПО коррелируют с высокой частотой продукции Т-клетками Тh/Тс1-цитокинов, отвечающих за поражение клеток ЩЖ.
Однако, несмотря на заметный интерес исследователей к данной патологии, единого мнения по поводу этиологии АИТ в настоящее время нет. Некоторые ученые предполагают генетическую предрасположенность в качестве главенствующей причины в развитии АИТ [20], в частности, при изучении генов системы HLA указывалось сочетание с генами HLA-B8, HLA-DR3, HLA-DR4 [21].
Выявлено также 5 новых вариаций генов TPO, ATXN2, BACh3, MAGI3 и KALRN, ассоциирующихся с носительством АТ-ТПО. Сочетание этих вариантов генов ассоциировалось с повышением риска развития гипотиреоза и понижением риска развития зоба. Вариации в генах MAGI3 и BACh3 связаны с повышенным риском развития гипертиреоза, а вариант MAGI3 также связан с повышенным риском развития гипотиреоза [22].
Отдельным пунктом для обсуждения является микрохимеризм (МХ) — присутствие в тканях и/или кровеносной системе «организма—хозяина» небольшого количества генетически отличных клеток, способных к длительному персистированию. Присутствие микрохимерных клеток в организме женщины является распространенным явлением и следствием нормально протекающей беременности. Отдаленные последствия этого феномена стали предметом пристального внимания сравнительно недавно. В настоящий момент МХ рассматривается как одна из перспективных теорий патогенеза аутоиммунных заболеваний.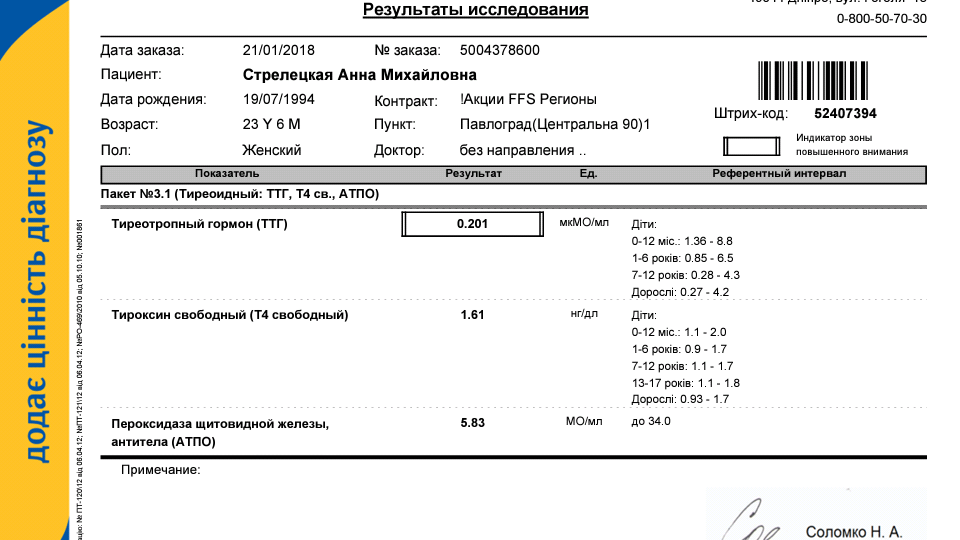 Данное явление ассоциировано с риском развития нарушения функции ЩЖ в результате ее аутоиммунного поражения, а также способно оказывать непосредственное влияние на течение последующих беременностей и реализацию аутоиммунных реакций. Фетальные и материнские микрохимерные клетки способны длительно сохраняться в организме и могут быть обнаружены в крови и тканях спустя десятилетия после завершения беременности [23—25]. МХ чаще определяется в ткани ЩЖ и периферической крови у пациенток с аутоиммунными тиреопатиями, чем у здоровых лиц [26]. Предполагается, что МХ способен провоцировать локальную иммунную реакцию против материнских антигенов в ткани железы, а также представлять собой мишень для иммунной системы матери. В пользу участия МХ в патогенезе аутоиммунных тиреопатий также свидетельствует распространенность подозреваемых генетических маркеров среди пар мать—ребенок с фетальным М.Х. Данный феномен рассматривается как одна из привлекательных гипотез генеза аутоиммунных тиреопатий, которая могла бы объяснить преобладание заболеваемости среди женщин репродуктивного возраста и частую манифестацию в послеродовом периоде.
Данное явление ассоциировано с риском развития нарушения функции ЩЖ в результате ее аутоиммунного поражения, а также способно оказывать непосредственное влияние на течение последующих беременностей и реализацию аутоиммунных реакций. Фетальные и материнские микрохимерные клетки способны длительно сохраняться в организме и могут быть обнаружены в крови и тканях спустя десятилетия после завершения беременности [23—25]. МХ чаще определяется в ткани ЩЖ и периферической крови у пациенток с аутоиммунными тиреопатиями, чем у здоровых лиц [26]. Предполагается, что МХ способен провоцировать локальную иммунную реакцию против материнских антигенов в ткани железы, а также представлять собой мишень для иммунной системы матери. В пользу участия МХ в патогенезе аутоиммунных тиреопатий также свидетельствует распространенность подозреваемых генетических маркеров среди пар мать—ребенок с фетальным М.Х. Данный феномен рассматривается как одна из привлекательных гипотез генеза аутоиммунных тиреопатий, которая могла бы объяснить преобладание заболеваемости среди женщин репродуктивного возраста и частую манифестацию в послеродовом периоде.
При наступлении беременности у женщин, являющихся носительницами АТ-ТПО без нарушения функции ЩЖ, повышается риск развития гипотиреоза и относительной гестационной гипотироксинемии, что может привести к ряду перинатальных и акушерских осложнений [27]. Патогенез этих нарушений на сегодняшний день остается невыясненным. Возможно, антитиреоидные АТ являются маркером генерализованной аутоиммунной дисфункции, в результате которой и происходит самопроизвольное патологическое прерывание беременности. Согласно данным литературы, у 30—50% носительниц АТ развиваются нарушения функции ЩЖ после родов. По данным разных авторов, дисфункция ЩЖ в послеродовом периоде может развиваться у женщин и в отсутствие АТ к Щ.Ж. Таким образом, четкие прогностические критерии развития нарушения функции ЩЖ как на фоне беременности, в послеродовом периоде, так и в течение жизни, отсутствуют.
Дисфункция ЩЖ может возникать в любом сроке беременности, при этом следует учитывать, что принципы диагностики и лечения заболеваний ЩЖ у беременных существенно отличаются от общепринятых. Существуют различные методы скрининга на дисфункцию ЩЖ: как простое обследование только беременных женщин из группы высокого риска, так и тотальный скрининг всех беременных женщин независимо от срока беременности. С одной стороны, учитывая распространенность и потенциальную опасность нарушений тиреоидного статуса во время беременности, ряд профессиональных ассоциаций и сообществ рекомендует проводить оценку функции ЩЖ у всех беременных и женщин, планирующих беременность. С другой стороны, исследователи из Американского колледжа акушерства и гинекологии еще в 2002 г. утверждали, что предложения в отношении проведения рутинного скрининга беременных являются преждевременными в отсутствие данных, показывающих улучшение результатов при назначении терапии левотироксином натрия [28]. Современные работы в этой области демонстрируют неоднозначные выводы. На сегодняшний день мы располагаем докладом Кокрейновской группы исследователей, опубликовавшей в 2015 г. анализ двух рандомизированных контролируемых исследований с участием 26 408 женщин (одно исследование включало 21 839 женщин и другое — 4562) [29]. Авторы сообщают, что универсальный скрининг на дисфункцию ЩЖ при беременности увеличил число женщин с диагнозом гипо- и гипертиреоз и, как следствие, увеличилось количество пациенток, получающих лечение по поводу этих состояний. Однако рутинный скрининг и последующее лечение не способствовали выявлению явных преимуществ или негативных реакций для женщин и/или их детей. Не изменились доля женщин с преэклампсией и преждевременными родами (по результатам исследования с участием 4562 женщин), число детей с инвалидностью (коэффициент интеллекта (IQ) менее 85 в возрасте 3 лет) — исследование с участием 794 детей, родившихся от матерей с гипотиреозом). Несмотря на то что исследования включали большую выборку, не установлено четких различий в исходах для матерей и их детей между рутинным скринингом и обследованием при обращении за медицинской помощью (выявлением случаев заболеваний) или полным отсутствием обследования.
Современные работы в этой области демонстрируют неоднозначные выводы. На сегодняшний день мы располагаем докладом Кокрейновской группы исследователей, опубликовавшей в 2015 г. анализ двух рандомизированных контролируемых исследований с участием 26 408 женщин (одно исследование включало 21 839 женщин и другое — 4562) [29]. Авторы сообщают, что универсальный скрининг на дисфункцию ЩЖ при беременности увеличил число женщин с диагнозом гипо- и гипертиреоз и, как следствие, увеличилось количество пациенток, получающих лечение по поводу этих состояний. Однако рутинный скрининг и последующее лечение не способствовали выявлению явных преимуществ или негативных реакций для женщин и/или их детей. Не изменились доля женщин с преэклампсией и преждевременными родами (по результатам исследования с участием 4562 женщин), число детей с инвалидностью (коэффициент интеллекта (IQ) менее 85 в возрасте 3 лет) — исследование с участием 794 детей, родившихся от матерей с гипотиреозом). Несмотря на то что исследования включали большую выборку, не установлено четких различий в исходах для матерей и их детей между рутинным скринингом и обследованием при обращении за медицинской помощью (выявлением случаев заболеваний) или полным отсутствием обследования. Таким образом, очевидно, что необходимы дополнительные исследования и доказательства для оценки потенциальных краткосрочных и долгосрочных преимуществ или недостатков различных методов скрининга.
Таким образом, очевидно, что необходимы дополнительные исследования и доказательства для оценки потенциальных краткосрочных и долгосрочных преимуществ или недостатков различных методов скрининга.
Важно уточнить, что обнаружение повышения уровня ТТГ не всегда является синонимом снижения концентрации свободного тироксина 4 (свT4). Чаще всего повышенный уровень ТТГ у беременной обнаруживается, когда содержание свT4 является нормальным — это расценивается как субклинический гипотиреоз. Наоборот, низкий уровень свT4 может быть выявлен на фоне нормального содержания ТТГ — подобная ситуация называется изолированной гипотироксинемией (ИГ). ИГ беременных встречается редко, в случае ее установления в I триместре может быть рекомендована терапия левотироксином натрия. Обоснованием для назначения терапии является доказанная ассоциация ИГ в начале беременности с нарушениями нервно-психического развития ребенка. Но в настоящий момент нет исследований, демонстрирующих клинически значимое улучшение нейрокогнитивных функций у детей, рожденных от матерей с ИГ, благодаря проводимому лечению. Терапия левотироксином натрия не рекомендуется при ИГ, выявленной во II и III триместрах беременности. Поскольку минимальный уровень свТ4 часто наблюдается и физиологически обусловлен в конце беременности, имеется высокий риск развития ятрогенного тиреотоксикоза в отсутствие доказательств потенциального положительного влияния терапии левотироксином натрия. Повышенное содержание тиреоидных гормонов во время беременности расценивается как физиологический процесс адаптации, но, согласно последним исследованиям, чрезмерно высокие концентрации свТ4 оказывают не менее негативное влияние на ЦНС ребенка, чем низкое его содержание: гипертироксинемия может способствовать снижению IQ ребенка и уменьшению объема серого вещества [30]. В этой связи необходимо очень взвешенно подходить к назначению левотироксина натрия и оценивать оправданность любых медицинских вмешательств во время беременности, принимая во внимание не только здоровье женщины, но и ребенка.
В виду того, что во время беременности происходит изменение активности ЩЖ и динамически меняется взаимодействие гипофизарно-тиреоидных систем матери и плода, точная оценка функции ЩЖ у матери остается сложной задачей по настоящее время. В научном сообществе ведется активная дискуссия и пока не достигнуто единое соглашение относительно значений «нормы» и соответственно тактики ведения. Принципиальным моментом дискуссий является вопрос определения диагностических референсных уровней и интерпретации результатов лабораторных тестов для оценки гормонального статуса во время беременности.
Уровень ТТГ первым реагирует на повышение активности ЩЖ во время беременности: происходит сдвиг уровня ТТГ вниз, при этом снижаются как нижний (примерно на 0,1—0,2 мЕд/л), так и верхний предел уровня материнского ТТГ (примерно на 0,5—1,0 мЕд/л) относительно стандартных границ ТТГ [31]. Наибольшее снижение уровня ТТГ в сыворотке наблюдается в течение I триместра (пик секреции ТТГ к 8-й неделе беременности) из-за непосредственной стимуляции плацентарным человеческим хорионическим гонадотропином (чХГ) рецептора ТТГ, тем самым напрямую увеличивается производство гормонов ЩЖ. В дальнейшем, по мере прогрессирования беременности, уровень ТТГ постепенно повышается и максимален в III триместре, но в целом остается ниже, чем у небеременных женщин [32]. Поскольку при многоплодной беременности концентрация чХГ выше, чем при одноплодной, то и снижение границ контрольного интервала для уровня ТТГ в данном случае значительнее [31].
За последние два десятилетия опубликован целый ряд рекомендаций и руководств, касающихся аспектов диагностики и лечения заболеваний ЩЖ во время беременности и послеродового периода. Экспертами Американской тиреоидологической ассоциации (АТА) принято, что референсные интервалы для уровня ТТГ во время беременности должны быть сужены за счет верхнего показателя, и с 2011 г. во многих странах мира и у нас использовались триместр-специфичные нормы уровня ТТГ. Отметим, что рекомендации АТА базировались на результатах 6 когортных исследований, проведенных в США и некоторых странах Европы, а также отдельно оговаривалось, что данные нормы предлагаются только для лабораторий, которые по каким-либо причинам не имеют собственных установленных норм. Рекомендуемые триместр-специфические референсные интервалы для ТТГ были следующими: I триместр 0,1—2,5 мЕд/л; II триместр 0,2—3 мЕд/л; III триместр 0,3—3 мЕд/л.
Европейские рекомендации по диагностике и лечению заболеваний ЩЖ во время беременности, вышедшие в 2012 г., демонстрируют согласие экспертного сообщества относительно снижения верхних границ триместр-специфических референсных диапазонов для уровня ТТГ у беременных [33]. Именно эти диапазоны используются по настоящее время отечественными клиницистами для оценки функции ЩЖ и как целевые при проведении беременным заместительной терапии при гипотиреозе. В 2017 г. вышли обновленные клинические рекомендации АТА, в которых подвергнуты пересмотру референсные значения ТТГ для беременных. Основанием для этого послужили скрининговые исследования последних лет, свидетельствующие, что для беременности в целом характерен относительно низкий уровень ТТГ практически у всех популяций, однако степень этого снижения значительно варьирует между различными расовыми и этническими группами. Необходимо также учитывать и различия в йодной обеспеченности. Исследования с участием беременных женщин в Азии, Индии и некоторых странах Европы продемонстрировали существенную географическую неоднородность в интенсивности падения уровня ТТГ в I триместре, выявив преобладание слабого снижения верхних значений [34—37]. Аналогичные данные получены по результатам исследований беременных в Корее — умеренное снижение ТТГ в I триместре на 0,5—1,0 мЕд/л [38]. Недавнее исследование, проведенное с участием 4800 беременных женщин в Китае, показало, что хотя сдвиг вниз в контрольном диапазоне ТТГ произошел на 7—12-й неделе, но верхний контрольный предел был несущественно снижен с 5,31 до 4,34 мЕд/л [35].
Большинством исследовательских групп признается ограниченная практическая значимость применяемых в настоящее время триместр-специфических диапазонов для ТТГ, поскольку они рассчитаны для популяций с адекватным потреблением йода, а в выборку включались женщины без носительства тиреоидных А.Т. Становится очевидной актуальность проведения национальных исследований с целью установления популяционных референсных значений тиреоидных гормонов, учитывая потребление йода, наличие АТ к ткани ЩЖ и, согласно некоторым исследованиям, индекса массы тела.
Таким образом, учитывая накопленные данные и последние рекомендации АТА, в настоящее время идеальным вариантом является использование интервалов «нормы» ТТГ для беременных, определенных для конкретного региона (страны) с учетом этнических и географических особенностей. К сожалению, в России в настоящее время нет данных национальных популяционных исследований уровня ТТГ и базирующихся на них клинических рекомендаций по диагностике и лечению заболеваний ЩЖ во время беременности. В такой ситуации в клинических рекомендациях АТА специалистам предлагается использовать в качестве верхнего контрольного значения «нормы» уровень ТТГ 4 мЕд/л, который для большинства лабораторных анализов представляет собой уменьшение верхнего популяционного значения ТТГ примерно на 0,5 мЕд/л.
Определение уровня Т4 во время беременностиСвободный Т4 — биологически активная часть общего Т4, составляющая всего около 0,03%, а основной объем гормона связан с белками сыворотки, в первую очередь с тироксинсвязывающим глобулином (ТСГ). Определение содержания свТ4 в преобладающем большинстве лабораторий осуществляется иммунометрическими методами, точность результатов которых зависит от множества факторов: разведения, температурного режима, буферного состава, аффинности АТ и прочее [39]. Доступные в настоящее время иммунометрические методы определения тиреоидных гормонов по существу являются приблизительными и оценочными тестами (не дают точного указания концентрации гормона) и очень чувствительны к изменениям уровня связывающих белков [40]. Определение содержания свТ4 во время беременности сопряжено с методическими сложностями, возникающими в результате происходящих в организме матери биохимических изменений [41]. Сыворотка беременных характеризуется более высокими концентрациями ТСГ, пик которого приходится примерно на 16-ю неделю беременности, неэстерифицированных жирных кислот и более низким уровнем альбумина по сравнению с показателями у небеременных женщин. Высокие концентрации ТСГ, как правило, приводят к более высоким значениям общего T4 и соответственно к закономерному, с методической точки зрения, занижению уровня свТ4 [42]. В итоге у клиницистов возникает необходимость дифференциальной диагностики истинной гипотироксинемии беременных, при которой необходимо назначение заместительной терапии левотироксином натрия, и методически обусловленного занижения уровня свТ4, не требующего никаких вмешательств. Поскольку во время беременности содержание свT4 в сыворотке крови подвергается значительным колебаниям, и имеет место широкая вариабельность между методиками измерения его уровня, интерпретация значений измерений свТ4 требует применения диапазонов, специфичных как для конкретного метода, так и для триместров.
Широко обсуждается возможность использования новой технологии ВЭЖХ-МС/МС для разработки надежных и доказанных триместр-специфичных интервалов для тиреоидных гормонов во время беременности. Появление и развитие технологии ВЭЖХ-МС/МС обеспечивает высокую производительность, практически 100% специфичность, необходимую чувствительность по сравнению с методами иммуноанализа [43, 44]. В настоящее время технология МС/МС получает широкое распространение для рутинной диагностики в эндокринологических лабораториях, и прежде всего для определения основного спектра стероидов, а также их многочисленных метаболитов.
Субклинический гипотиреоз (СГ) во время беременностиНаблюдательные исследования, охватывающие более чем три последних десятилетия, свидетельствуют, что СГ статистически значимо повышает акушерский риск, частоту развития осложнений течения беременности и неблагоприятных исходов для ребенка, в первую очередь для его ЦНС [45]. При этом доказательно не подтверждено, что лечение субклинического гипотиреоза во время беременности левотироксином натрия улучшает когнитивные функции у ребенка. Это продемонстрировано в исследовании CATS, в ходе которого проведен скрининг функции ЩЖ у 21 846 беременных женщин [46]. Совсем недавно проведенное в США проспективное 5-летнее исследование оценило результаты терапии субклинического гипотиреоза, выявленного впервые в I триместре беременности [47]. В общей сложности по итогам скрининга 97 288 беременных в исследование включено 677 женщин с СГ, определяемым как повышение уровня ТТГ более 4,0 мЕд/л при нормальном показателе концентрации свТ4. Анализ «контрольной» точки — показателя IQ у детей в возрасте 5 лет — не выявил преимуществ лечения субклинического гипотиреоза во время беременности: терапия левотироксином натрия не привела к клинически значимому улучшению познавательных функций у детей в возрасте до 5 лет. Равно как не выявлено преимуществ терапии левотироксином натрия в отношении течения беременности и снижения риска акушерских осложнений. Интерес представляют отдельные результаты исследования, например, динамическая оценка показателей тиреоидных гормонов в I триместре — отмечена тенденция снижения содержания свT4 только при достижении уровня ТТГ — 4,8 мЕд/л и более.
При выявлении СГ у пытающейся зачать естественным путем женщины в отсутствие АТ к ЩЖ может быть рекомендована терапия низкими дозами левотироксина натрия (25—50 мкг) во избежание прогрессирования гипотиреоза в случае наступления беременности.
При выявлении СГ у женщины, планирующей экстракорпоральное оплодотворение, рекомендуется назначение левотироксина натрия для достижения уровня ТТГ менее 2,5 мЕд/л. Нет достаточных доказательств того, что терапия левотироксином натрия улучшает успех беременности после вспомогательных репродуктивных технологий у женщин — носителей АТ-ТПО без снижения функции Щ.Ж. Вместе с тем назначение левотироксина натрия в данной ситуации может рассматриваться с учетом его потенциальных преимуществ по сравнению с его минимальным риском. В таких случаях 25—50 мкг левотироксина натрия является типичной начальной дозой.
Имеющиеся данные подтверждают преимущества максимально ранней инициализации терапии. Поэтому при впервые выявленном во время беременности манифестном гипотиреозе необходимо оперативно назначить левотироксин натрия. Расчет дозы препарата для старта лечения определяется как 2,3 мкг на 1 кг массы тела в сутки с первым контролем уровня ТТГ через 2 нед. В дальнейшем для коррекции терапии контрольные определения уровня ТТГ следует выполнять каждые 4 нед всю первую половину беременности (до 16—20 нед беременности) и, по крайней мере, однократно в период с 26-й по 32-ю неделю. Целью терапии гипотиреоза является поддержание уровня ТТГ в пределах триместр-специфических референсных интервалов (если они определены), а если это недоступно, то целесообразно поддерживать концентрацию ТТГ ниже 2,5 мЕд/л [31]. Не подтверждено, что достижение более низкого уровня ТТГ (менее 1,5 мЕд/л) ассоциировано с клинической выгодой подобной терапии [48]. Если женщина уже получает левотироксин натрия, его дозу необходимо увеличить на 30—50%.
При наличии повышенного риска развития гипотиреоза во время беременности рекомендуется только динамическое наблюдение, в частности, это относится к пациенткам с эутиреозом и носительством АТ к ткани ЩЖ или после хирургического лечения (резекции ЩЖ, гемитиреоидэктомии) или радиойодтерапии по поводу заболевания Щ.Ж. Опираясь на выводы, сделанные на основе исследований методов лечения гипотиреоза во время беременности, можно рекомендовать мониторинг уровня ТТГ у этих женщин каждые 4 недели в течение первой половины беременности, в дальнейшем достаточным считают контроль уровня ТТГ в сроке 26—32 недели беременности [31, 49]. Поскольку не доказано, что терапия левотироксином натрия позволяет снизить риск преждевременных родов и самопроизвольного патологического прерывания беременности у носителей АТ беременных без нарушений функции ЩЖ, профилактическое лечение препаратами левотироксина натрия у данной группы не проводится [31].
Женщинам, которые получали терапию левотироксином натрия до беременности, после родов следует снизить дозу препарата до исходной с контролем ТТГ через 6 нед. Если прием левотироксина натрия впервые начат во время беременности (особенно, когда доза препарата ≤50 мкг/сут), то после родов лечение следует отменить с контролем ТТГ также через 6 нед [31]. Современная клиническая практика в основном фокусируется на предотвращении негативных последствий низких концентраций гормонов ЩЖ во время беременности. Вместе с тем данные исследований последних лет показали, что как низкие, так и высокие концентрации тиреоидных гормонов оказывают негативное влияние на развитие мозга плода и его морфологическое строение, а также тесно связаны с нервно-психическими расстройствами у детей и подростков [30, 50, 51].
В 2016 г. опубликованы результаты проспективного когорного популяционного исследования, встроенного в исследование Generation R Study (Роттердам, Нидерланды), в котором изучали ассоциацию функции ЩЖ у матери с IQ ребенка (оценивали с помощью невербальных тестов интеллекта) и морфологией мозга (оценивали посредством магнитно-резонансной томографии, МРТ) [30].
Данные уровня IQ получены от 3839 детей, а МРТ головного мозга проведена у 646 детей. Концентрация свТ4 в сыворотке крови матери показала инвертированную U-образную связь с IQ и объемом серого вещества головного мозга у ребенка. В равной степени как для низких, так и для высоких концентраций свТ4 эта ассоциация соответствовала сокращению среднего уровня IQ на 1,4—3,8 балла. При этом уровень материнского ТТГ не ассоциировался со снижением уровня детского IQ или нарушениями морфологии мозга. Все ассоциации оставались сходными после исключения женщин с манифестным гипотиреозом и гипертиреозом. Установленная зависимость между уровнем свТ4 матери и объемом коры мозга ребенка позволяет предполагать, что терапия левотироксином натрия во время беременности, которая часто инициируется у женщин с субклиническим гипотиреозом, может быть сопряжена с потенциальным риском неблагоприятных результатов развития нервной системы ребенка, в случае, когда целью лечения является поддержание уровня свТ4 на верхней границе нормы.
Микронутриенты и аутоиммунный тиреоидитПредставляется целесообразным рассмотреть отдельно вопрос о назначении микронутриентов пациентам с АИТ. Йод в физиологической дозе (около 200 мкг/сут) не способен индуцировать развитие гипотиреоза и не оказывает отрицательного влияния на функцию ЩЖ при уже существующем гипотиреозе, вызванном АИТ. При наличии АТ к ЩЖ и в отсутствие снижения ее функции рекомендовано назначение препаратов йода на весь период беременности и лактации [52]. При назначении больным АИТ препаратов, содержащих йод в фармакологических дозах (более 1 мг/сут), следует помнить о возможном риске манифестации гипотиреоза (или повышении потребности в тиреоидных гормонах при субклиническом и манифестном гипотиреозе) и контролировать функцию ЩЖ. В настоящее время ведутся дискуссии о положительном влиянии селена, однако в соответствии с рекомендациями ATA 2017 г. назначение препаратов селена беременным с высокими титрами АТ-ТПО не рекомендуется [31]. Необходимы дальнейшие исследования по данной теме.
Актуальность проблемы диагностики и лечения гипотиреоза у женщин репродуктивного возраста определяется высокой частотой бесплодия, акушерских и перинатальных осложнений, поскольку важную роль играет сниженная функция щитовидной железы. У беременной женщины с гипотиреозом имеется повышенный риск развития акушерских осложнений: внутриутробной гибели плода, гипертензии, отслойки плаценты, перинатальных осложнений. Терапия тиреоидными гормонами значительно улучшает результат беременности. Гипотиреоз у беременных — это абсолютное показание к назначению заместительной терапии из расчетной дозы 2,3 мкг на 1 кг массы тела в сутки. Если женщина с компенсированным гипотиреозом планирует беременность, дозу левотироксина натрия необходимо увеличить сразу после ее наступления на 25—30%. В дальнейшем контроль адекватности терапии осуществляется по уровню тиреотропного гормона, который необходимо осуществлять каждые 6—8 нед.
Дискутабельной остается тактика ведения субклинического гипотиреоза и назначение заместительной терапии. Основываясь на мнении большинства экспертов, учитывая наличие доказанных потенциальных рисков для матери и плода, рекомендуется начинать заместительную терапию левотироксином натрия при субклиническом повышении уровня тиреотропного гормона на фоне наличия повышенного титра антител к щитовидной железе.
Согласно последним представлениям, верхние триместр-специфичные пороговые значения для тиреотропного гормона могут быть повышены и допустимо использовать уровень тиреотропного гормона — 4 мЕд/л.
Поскольку географические и этнические различия в популяции оказывают влияние на уровень тиреотропного гормона у беременных, это должно учитываться при разработке референсных интервалов наряду с уровнем потребления йода и носительством антител к ткани щитовидной железы с использованием метода высокоэффективной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией.
Источник финансирования. Поисково-аналитическая работа при подготовке рукописи проведена при финансовой поддержке гранта РНФ № 17−75−30035 «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация».
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Платонова Надежда Михайловна — https://orcid.org/0000-0001-6388-1544; eLibrary SPIN: 4053-3033
Маколина Наталья Павловна — https://orcid.org/0000-0003-3805-7574; eLibrary SPIN: 7210-9512
Рыбакова Анастасия Андреевна — e-mail: [email protected]; https://orcid.org/0000-0002-1248-9099; eLibrary SPIN: 8275-6161
Трошина Екатерина Анатольевна — https://orcid.org/0000-0002-8520-8702; eLibrary SPIN: 8821-8990
Автор, ответственный за переписку: Рыбакова Анастасия Андреевна — https://orcid.org/0000-0002-1248-9099;br />eLibrary SPIN: 8275-6161
Повышены антитела к тиреопероксидазе при беременности
Вопрос: «Здравствуйте, доктор! Ответьте, пожалуйста. Сейчас беременна на 19 неделе, у меня по щитовидке очень повышенны антитела к ТПО, остальное в норме. Диагноз поставили хронический аутоиммунный тиреоидит, сказали пить только йод при беременности и наблюдать за ТТГ и Т4. Наблюдаю за ними, все нормально. Скажите, а если, не дай бог, ТТГ или Т4 будет не в норме, тогда что? Что мне прописать должен эндокринолог? Я сейчас пью кардиомагнил для профилактики преэклампсии, в первую беременность потеряла ребенка из-за этого. Хороший это препарат? Пью с 12 недель. Спасибо.»
На ваши вопросы отвечает Игорь Иванович Гузов, акушер-гинеколог, к.м.н., основатель Центра иммунологии и репродукции.
Это нормальный подход эндокринологов. То есть, если повышены антитела к ТПО, а это антитела, которые встречаются, как правило, при любых формах хронического аутоиммунного тиреоидита (есть еще другие антитела, но они встречаются не у всех пациенток с аутоиммунным тиреоидитом, а антитела к ТПО у 99%), поэтому это нормальная диагностика хронического аутоиммунного тиреоидита.
И тактика врачей эндокринологов — это не назначать никакого лечения, если у вас в норме ТТГ, если у вас имеется нормальное состояние функции щитовидной железы, которые на научном языке называется эутиреозом.
Значит, что нужно делать, если у Вас будут идти какие-то отклонения? Если ТТГ начнет расти, а на современном этапе целевым значением цифры ТТГ является 2,5, тогда Вам назначат препарат L-тироксин. Он будет называться или L-тироксин, или Эутирокс — это просто разные названия одного и того же препарата. Он безопасен при беременности, потому что он не переходит через плаценту, и он необходим для компенсации вот этого субклинического гипотиреоза или гипотериоза (если ТТГ будет расти).
Хуже будет, если ТТГ будет падать, но если сейчас он у Вас хороший, то маловероятно, что разовьется какая-то проблемная ситуация, которая связана с гипертиреозом. Поэтому, если ТТГ будет падать, это, возможно, будет идти вопрос по поводу отмены препаратов йода или по поводу дополнительного обследования на антитела к рецепторам ТТГ. И есть существует лекарственная терапия, которая проводится очень осторожно, потому что она уже не безразличных для плода, но это к Вам не относится, потому что, скорее всего, всё будет хорошо.
Единственное, Вы должны помнить о том, что дисфункция щитовидной железы может оказывать неблагоприятное действие на плацентарную функцию, а плацента не очень хорошо действует на щитовидную железу. Поэтому основная задача — это контроль за функцией щитовидной железы в послеродовом периоде, потому что в послеродовом периоде те скрытые процессы, которые происходят в организме, в частности сам аутоиммунный процесс, может вызвать обострение. Важно здесь не пропустить резкого нарушения функций щитовидной железы, которые довольно-таки часто бывают во время беременности. Потому что, если щитовидная железа имеет вот эту проблему (хронический аутоиммунный тиреоидит), во время беременности редко бывает какое-то отклонение, но это всё может оказывать действие на организм уже в послеродовом периоде.
Поэтому в конце послеродового периода, где-нибудь через 6-8 недель беременности, обязательно нужно сдать анализ на ТТГ, антитела к ТПО, можно сделать УЗИ щитовидной железы, может быть сходить на консультацию к эндокринологу. И если есть малейшие какие-то отклонения, то обязательна консультация эндокринолога, и если всё хорошо, то повторить всё это через полгода после родов. То есть послеродовый период и первые полгода после родов являются двумя ключевыми факторами, когда мы должны всё это контролировать.
У Вас 19-20 недель беременности, поэтому Вам это не грозит, но, вообще говоря, эта ситуация — повышение антител к ТПО, то есть признаки хронического аутоиммунного тиреоидита и нормальные показатели ТТГ — это фактор риска невынашивания беременности на малых сроках. Вы это всё прошли, и к Вам это не относится, но если нас слушают сейчас другие пациентки с похожей ситуацией, которые готовятся к беременности, мы обычно все-таки даже при нормальном уровне ТТГ, если нет признаков гипотиреоза, назначаем очень небольшое количество L-тироксина, и потому что это резко — в 3 раза (!) – снижает риск невынашивания беременности на малых сроках.
Иногда врачи эндокринологи игнорируют эти назначения на эти назначения, но это назначения не эндокринолога, а врача акушера-гинеколога, которые связаны с нормальной функцией щитовидной железы, поэтому это важно.
Кардиомагнил — нормальный препарат, здесь просто слишком мало данных: насколько он необходим, с чем было связано назначение… В принципе, это абсолютно нормальная профилактика и безопасная для беременных.
Ведение
беременности является одним из основных направлений работы ЦИР. За развитием вашего малыша на протяжении всей беременности будет следить команда врачей-профессионалов. Для определения индивидуальной программы обследования и профилактики невынашивания беременности требуется консультация
врача акушера-гинеколога.
Аутоиммунный тиреоидит щитовидной железы (АИТ) — причины, симптомы, диагностика и лечение аутоиммунного тиреоидита
Аутоиммунный тиреоидит щитовидной железы (АИТ) – это заболевание хронической формы, при котором происходит постепенное разрушение клеток. Нарушается функционал щитовидной железы, так как на нее воздействуют аутоантитела. Поэтому болезнь определяют как аутоиммунную. Причины развития АИТ до конца не понятны, но специалисты нашли способ значительно замедлить развитие патологии. Давайте подробнее разберем, что это за болезнь, по какой причине развивается, какие симптомы имеет и как ее лечить.
Аутоиммунный тиреоидит щитовидной железы: что это, симптоматика, как лечить
АИТ часто называют болезнью Хашимото. Это имя ученого, который впервые смог описать патологию и выявить факторы, провоцирующие ее развитие. Это болезнь, при которой иммунная система человека начинает разрушать структуру щитовидной железы, уничтожая клетки.
Часто это приводит к гипотиреозу – определенному состоянию, при котором щитовидка перестает вырабатывать необходимое количество гормонов. Из-за этого могут страдать сердечно-сосудистая система, обменные процессы.
Воспаление тканей приобретает хроническую форму в результате аутоиммунных изменений. Полностью вылечить АИТ не получится, но врачи помогают устранить признаки, убрать последствия недостатка гормонов и защитить организм от поражений.
Классификация аутоиммунного заболевания
Аутоиммунный тиреоидит имеет несколько форм течения, вот основные:
- Хронический АИТ. Появляется из-за усиленного роста Т-лимфоцитов. На фоне данной аутоиммунной патологии развивается гипотиреоз. Наиболее частая форма заболевания.
- Послеродовой тиреоидит. Тоже встречается очень часто, появляется из-за изменения строения организма женщины в период беременности и скачков гормонов. Достаточно просто восстановиться, функция железы стабилизируется.
- Безболевая форма. Самый непредсказуемый тип, сложно понять ход течения, сложно заметить гормональные нарушения на первом этапе. Для выявления рекомендуется проходить периодически комплексное обследование.
- Цитокин-индуцированный тиреоидит. Возникает из-за приема фармакологических препаратов при поражении печени, нарушениях в крови. Процесс лечения продолжительный и сложный.
Современные методы диагностики позволяют в точности определить форму недуга, уровень гормонов и состояние щитовидной железы. После этого доктор назначает лечение в зависимости от формы. В большинстве случаев АИТ можно вылечить весьма успешно. От него невозможно избавиться полностью, но предотвратить дальнейшее развитие легко. Главное – своевременно обращаться к специалистам за помощью.
Симптомы аутоиммунного тиреоидита
Особенность болезни в том, что симптомы изменяются в зависимости от количества гормона определенного типа. Заболевание вообще может проходить без каких-либо симптомов, не вызывать боли и неприятных ощущений. Иногда обнаруживается случайно, во время обследования или плановой сдачи анализов. Но определенная симптоматика зачастую присутствует. Симптомы аутоиммунного тиреоидита таковы:
- возникает вялость организма, дополняется апатией и депрессивным состоянием;
- вес может резко набираться или, наоборот, беспричинно снижаться;
- выпадают волосы;
- кожа становится сухой;
- регулярно возникает першение в горле;
- изменяется голос, становится сиплым, огрубевшим;
- ухудшается память;
- щитовидная железа увеличивается в размерах;
- возникают проблемы в работе сердца;
- сердцебиение становится учащенным, развивается тахикардия;
- появляется тремор конечностей;
- возникает раздражительность, сильная усталость, от которой невозможно избавиться даже после продолжительного сна;
- регулярно меняется настроение.
Если Вы страдаете подобными симптомами, стоит обратиться в медицинский центр и пройти диагностику. Все это может указывать на наличие аутоиммунного недуга. Чем раньше принять меры по восстановлению гормональной системы, тем лучше будет результат.
У вас появились симптомы аутоиммунного тиреоидита?
Точно диагностировать заболевание может только врач. Не откладывайте консультацию — позвоните по телефону +7 (495) 775-73-60Причины аутоиммунного тиреоидита
Окончательно причины возникновения аутоиммунного тиреоидита специалисты не могут определить. Гормональная система человека до конца не изучена, поэтому аутоиммунные недуги лечатся достаточно сложно. Но доктора выделяют провоцирующие факторы, которые способствуют развитию тиреоидита:
- воспалительные процессы в щитовидной ткани;
- наличие хронических инфекций во всем организме;
- неконтролируемый прием различных лекарственных препаратов;
- употребление большого количества йода в любой форме;
- регулярные стрессы;
- облучение;
- ОРВИ, состояние гриппа;
- беременность и роды, при которых вероятность развития тиреоидита щитовидной железы увеличивается на 20%;
- генетический фактор.
Именно генетические изменения и предрасположенность считаются главной причиной развития данного заболевания. Мнения врачей в этом вопросе расходятся. Проблема в том, что определить какую-либо из причин, явно провоцирующую нарушения в щитовидной ткани, не получается. Поэтому предрасположенность определяют как основной фактор. Если в семье есть родственники, страдающие заболеваниями щитовидной железы, стоит особое внимание уделить этому вопросу.
Диагностика заболевания
Для устранения последствий болезни и предотвращения ее дальнейшего развития следует выбрать эффективный курс укрепления здоровья при аутоиммунном заболевании. Важно провести детальный анализ щитовидной железы. Это позволит в точности определить, каким гормонам следует уделить внимание и как контролировать состояние пациента.
Как правило, диагноз ставится на основании клинических проявлений, выявления патологий щитовидной ткани и ряда анализов. Анализы позволяют определить форму аутоиммунного заболевания, степень развития патологии. После получения результатов специалист назначает лечение, выбирая наиболее оптимальные методы воздействия.
Какие анализы нужны, чтобы определить АИТ: исследование аутоиммунного заболевания
В первую очередь выполняется анализ крови. Именно такой способ диагностики позволяет определить гормоны, их количество и любые изменения. Помимо анализов крови есть и другие способы определения АИТ:
Когда все анализы будут готовы, доктор может назначить лечение. Кроме этого, специалист должен изучить семейный анамнез. Если у родственников есть проблемы с щитовидной железой, врач обязательно должен знать об этом.
Врачи, способствующие лечению аутоиммунного тиреоидита
При симптомах или подозрении на аутоиммунный тиреоидит следует сразу обратиться к специалисту. Чем раньше получится остановить развитие патологии, тем выше вероятность сохранить здоровье. Ведь гормоны влияют на деятельность всего организма. Но не все знают, какой врач лечит АИТ.
Щитовидная железа является аутоиммунным органом. По гормонам специализируется эндокринолог. Именно он проведет ряд исследований, поможет определить, каким гормонам не место в организме, а какие, наоборот, нуждаются в дополнительной стимуляции. Могут потребоваться услуги иммунолога, специалиста по УЗИ и других докторов. Записывайтесь на прием к врачу в нашей клинике в удобное для Вас время.
Лечение аутоиммунного тиреоидита
Лечение аутоиммунного тиреоидита довольно продолжительное. Самое неприятное – доктора не вылечат недуг на 100%, нет особой терапии заболевания. Те, кто обещает навсегда устранить подобное заболевание, мягко говоря, врут. Однако успешная терапия позволяет стабилизировать состояние пациента, контролировать тиреоидит щитовидной железы. Лечение происходит таким образом:
- Если заболевание находится в состоянии гиперфункции, применяется метод устранения признаков недуга. Доктора препятствуют возникновению сердечных заболеваний, используя бета-блокаторы.
- При развитии гипотиреоза применяются синтетические заменители гормональных компонентов. «Искусственными» гормонами возможно контролировать выработку настоящих в щитовидной железе. Постепенно количество уменьшают, пока не будет преодолен гипотиреоз. Прививку ставят регулярно, гормональный курс нельзя прерывать без указания специалиста.
- Еще один способ контролировать аутоиммунную систему – использование иммуномодулирующей коррекции. Используются специальные прививки, позволяющие укреплять иммунитет. Обязательно пациентам с диагнозом АИТ нужно регулярно делать прививку от гриппа и других заболеваний, создающих опасность для иммунитета.
- Используются нестероидные противовоспалительные компоненты. Они могут быть в виде таблеток, или доктор ставит прививку.
- Если развивается подострый тиреоидит, АИТ такой формы лечат с помощью глюкокортикоидов.
- Иногда происходит разрастание ткани щитовидной железы. Это может повлечь за собой развитие онкологического заболевания. В таком случае врачи рекомендуют провести операцию по удалению железы. Происходит это нечасто, но все же приходится делать операции.
Если обнаружены признаки нарушения работы щитовидной железы, следует сразу обращаться к специалистам. Сдаются анализы, проводится диагностика, доктор смотрит на состояние крови и выбирает путь устранения недуга. При лечении возможны изменения в организме, так как процесс связан с гормонами. Но комплексный подход к своему здоровью помогает укрепить организм и прожить долгую жизнь.
Существуют ли народные способы лечения: как устраняют заболевание гомеопаты
Справиться с заболеванием с помощью народной медицины невозможно. Однако гомеопаты предлагают полное выздоровление, предупреждая, что результат может быть неудовлетворенным.
Действительно, есть препараты народной медицины, влияющие положительно на щитовидную железу. Но они не заменят полноценное лечение. Все равно нужно делать прививки от гриппа, применять гормональные средства. Противопоказаний у народной медицины очень много, использовать такие продукты разрешается только под контролем доктора. Не нужно шутить с аутоиммунной системой. Рекомендуется избавляться от гриппа и других недугов, провоцирующих АИТ.
Показания
Показания для проведения комплексных мер восстановления аутоиммунной системы таковы:
- железа увеличивается в размерах;
- негативные гормональные анализы;
- плохие показатели крови;
- подтвержден диагноз гипотиреоза;
- пациент сделал прививки, но симптоматика не уходит.
Первым признаком, указывающим на проблемы, является смена настроения, изменение веса, повышенная раздражительность. Если Вы себя не узнаете, возможно, проблема в здоровье. Наша клиника всегда для Вас открыта.
Противопоказания
Противопоказания для устранения аутоиммунной патологии таковы:
- доктора сделали прививку, которая не сочетается с курсом восстановления, нужно подождать некоторое время;
- разрастание щитовидной ткани происходит очень быстро, требуется операция;
- во время анализа стало ясно, что организм не воспринимает гормональную терапию или другие методы воздействия.
Также есть ряд ограничений по употреблению пищи и других компонентов. Железе для нормального функционирования не нужно более 150 мкг йода, стоит ограничивать продукты, содержащие этот компонент. Также не разрешается делать контурную пластику. Более детально обо всех ограничениях расскажет доктор.
Подготовка к лечению: какие цены, условия
Аутоиммунный недуг нужно устранять, не давать ему развиваться. Многие пациенты заранее хотят узнать, как проходит подготовка к лечению, какие цены на услуги.
Вам потребуется сдать кровь, пройти детальный анализ организма, чтобы доктор изучил состояние пациента и смог назначить курс восстановления. Цены на лечение тиреоидита представлены на сайте, также Вы можете позвонить и подробнее узнать, как подготовиться к посещению специалиста.
Преимущества лечения в нашей клинике
Мы предлагаем восстановить щитовидную железу в АО «Медицина» (клиника академика Ройтберга). Процесс лечения в нашей клинике эффективный, у нас работают опытные доктора, используется современное оборудование для выявления проблем и их устранения. Преимущества нашего центра таковы:
- Мы всегда для Вас открыты. Медицинский центр работает в праздники, выходные. Вы можете позвонить в удобное время и записаться на прием.
- Есть своя скорая помощь. Вам не придется долго ждать машину, если состояние здоровья критическое. Вызывайте нашу скорую помощь, машины оснащены всем необходимым оборудованием.
- Удобные комфортные палаты. Вы будете чувствовать себя практически как дома, наши палаты помогают восстановиться как можно скорее за счет удобства и спокойствия. Задача центра – создать благоприятную атмосферу для восстановления.
- Высококлассные специалисты. Врачи помогут лечению аутоиммунного тиреоидита, они имеют большой опыт работы в данной области. Все доктора регулярно проходят обучение, консультируются с зарубежными коллегами.
- Вежливый персонал. Вам не придется стоять в очередях, к Вам будет приставлен помощник, сопровождающий по отделениям. Доктор всегда на связи, курирует Вас лично.
Позвоните нам и узнайте стоимость, а также другую информацию о предоставлении услуг. Консультанты подробно ответят на Ваши вопросы. Выбирайте качественную медицину.
Лабораторная диагностика заболеваний щитовидной железы
РЕФЕРЕНТНЫЕ ПРЕДЕЛЫ ТТГ И ТИРЕОИДНЫХ
ГОРМОНОВ В ЗАВИСИМОСТИ ОТ ВОЗРАСТА И СРОКА
БЕРЕМЕННОСТИ (95% ДОВЕРИТЕЛЬНЫЙ ИНТЕРВАЛ)
|
Возраст |
ТТГ (мкМЕ/мл) |
Т4 общий (нмоль/л) |
Т4 свободн. (пмоль/л) |
Т3 общий (нмоль/л) |
Т3 свободн. (пмоль/л) |
|
Новорожденные |
11,6 – 35,9 |
105 — 290 |
21 — 49 |
0,84 – 3,63 |
|
|
Дети в возрасте: 2 суток 3 суток 1 неделя 2 недели 3 недели 1 месяц 6 месяцев 1 год 5 лет 10 лет 15 лет |
8,3 – 19,8 1,0 – 10,9 1,2 – 5,8
0,7 – 6,4 0,7 – 6,4 0,7 – 6,4 0,7 – 6,4 0,7 – 6,4 |
83 – 303 110 – 285 93 – 247 88 – 225 94 – 259 112 – 243 103 – 210 92 – 189 89 – 173 71 – 145 64 — 149 |
21 – 38 19 – 37 18 – 35 18 – 35 17 – 33 16 – 33 15 – 29 14 – 23 13 – 23 12 – 22 12 — 23 |
1,95 – 3,63 0,81 – 3,39 0,65 – 1,90 0,59 – 1,84 0,77 – 2,15 1,10 – 3,10 1,43 – 3,17 1,75 – 3,50 1,80 – 3,10 1,70 – 3,10 1,50 – 2,80 |
|
|
Взрослые: до 60 лет старше 60 лет |
0,3 – 4,0 0,5 – 7,8 |
50 – 150 65 — 135 |
10 – 25 10 — 18 |
1,0 — 3,0 0,62 – 2,79 |
3,0 – 7,0 |
|
Беременные: 1 триместр 2 триместр 3 триместр |
0,3 – 4,5 0,5 – 4,6 0,8 – 5,2 |
79 — 227 |
9 – 26 6 – 21 6 — 21 |
1,79 – 3,80 |
3,2 – 5,9 3,0 — 5,2 3,0 – 5,2 |
ПРИМЕЧАНИЕ: Коэффициент пересчета ТТГ: 1 мкМЕ/мл = 1 мЕ/л.
Нормы могут изменяться при использовании различных стандартных коммерческих наборов.
КАК ПРАВИЛЬНО ПОДГОТОВИТЬСЯ К ИССЛЕДОВАНИЮ ФУНКИОНАЛЬНОЙ АКТИВНОСТИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ В КЛИНИКО – ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ
1) Исследование производится утром натощак – между последним приемом пищи и взятием крови должно пройти не менее 8 – 12 часов. Вечером предшествующего дня рекомендуется необильный ужин. Желательно за 1 – 2 дня до обследования исключить из рациона жирное, жареное и алкоголь. Если накануне состоялось застолье или было посещение бани или сауны – необходимо перенести лабораторное исследование на 1-2 дня. За 1 час до взятия крови необходимо воздержаться от курения.
2) Не следует сдавать кровь после рентгенологических исследований, физиотерапевтических процедур.
3) Необходимо исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Перед процедурой следует отдохнуть 10 – 15 минут и успокоиться.
4) Необходимо помнить, что результат исследования может быть искажен действием принимаемых лекарственных препаратов или продуктами их метаболизма. Назначение и отмена любого лекарственного препарата сопровождается изменением лабораторных показателей. Поэтому перед сдачей анализа следует проконсультироваться у врача о возможности ограничения приема лекарственных препаратов для подготовки к исследованию. Рекомендуется отказаться от приема лекарственных препаратов перед сдачей крови на исследование, то есть забор крови производится до приема лекарственных препаратов.
5) Учитывая суточные ритмы изменения показателей крови повторные исследования целесообразно проводить в одно и то же время.
6) В разных лабораториях могут применяться разные методы исследования и единицы измерения. Чтобы оценка результатов обследования была корректной и была приемлемость результатов, желательно проводить исследования в одной и той же лаборатории, в одно и то же время.
Исследование на тиреоидные гормоны. За 2 – 3 дня до проведения исследования исключается прием йодсодержащих препаратов, за 1 месяц – тиреоидных гормонов (чтобы получить истинные базальные уровни), если нет специальных указаний врача- эндокринолога. Однако, если целью исследования является контроль за дозой препаратов тиреоидных гормонов, забор крови производится на фоне приема обычной дозы. Следует иметь ввиду, что прием левотироксина вызывает транзиторное значимо повышенное содержание общего и свободного тироксина в крови примерно в течение 9 часов (на 15 – 20 %).
Исследование на тиреоглобулин целесообразно проводить спустя как минимум 6 недель после тиреоэктомии, либо проведенного лечения. Если назначены такие диагностические процедуры, как биопсия или сканирование ЩЖ, то исследование уровня ТГ в крови нужно строго проводить до процедур. Поскольку больные после радикального лечения дифференцированного рака ЩЖ получают высокие дозы тиреоидных гормонов (для подавления секреции ТТГ), на фоне которого также снижается уровень ТГ, его концентрацию следует определять через 2 – 3 недели после отмены супрессивной терапии тиреоидными гормонами.
ТИРЕОТРОПНЫЙ ГОРМОН (ТТГ, ТИРЕОТРОПИН)
ТТГ – опорный критерий лабораторной оценки функции ЩЖ. Именно с него следует начинать диагностику при подозрении на отклонения в гормональной активности ЩЖ. ТТГ – гликопротеидный гормон, который вырабатывается в передней доле гипофиза и стимулирующий синтез и йодирование тиреоглобулина, образование и секрецию тиреоидных гормонов. Гипофизарная секреция ТТГ очень чувствительна к изменениям концентрации Т3 и Т4 в сыворотке крови. Снижение или повышение этой концентрации на 15-20 % приводит к реципроктным сдвигам в секреции ТТГ (принцип обратной связи).
Существование зависимости образования и секреции ТТГ от действия лекарственных препаратов, суточного ритма изменения уровня ТТГ, состояния стресса и наличия у пациента соматических заболеваний должно учитываться при интерпретации результатов исследования.
Период биологической полужизни ТТГ – 15 — 20 минут.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ ТТГ: диагностика нарушений функции ЩЖ, различные виды гипотиреоза, гипертиреоз, задержка умственного и полового развития у детей, сердечные аритмии, миопатия, депрессия, алопеция, бесплодие, аменорея, гиперпролактинемия, импотенция и снижение либидо.
-наблюдение за состоянием пациентов на фоне заместительной гормональной терапии: секреция ТТГ подавляется во время стандартной терапии или в течение послеоперационной заместительной терапии.
Нормальные или повышенные уровни ТТГ свидетельствуют о неадекватной дозе препарата, неверно проводимой гормональной терапии или наличии антител к антигенам ЩЖ. В ходе заместительной терапии при гипотиреозе оптимальный уровень ТТГ находиться в пределах нижних значений референтных величин. В ходе заместительной терапии кровь на исследование ТТГ необходимо забирать через 24 часа после последнего приема лекарственного препарата.
·скрининг врожденного гипотиреоза: На 5-е сутки жизни ребенка проводят определение уровня ТТГ в сыворотке крови или пятне крови на фильтровальной бумаге. Если уровень ТТГ превышает 20 мМЕ/л, необходимо провести повторный анализ нового образца крови. При концентрации ТТГ в диапазоне от 50 до 100 мМЕ/л существует высокая вероятность наличия заболевания. Концентрации выше 100 мМЕ/л являются типичным для врожденного гипотиреоза.
ФИЗИОЛОГИЧЕСКИЕ СОСТОЯНИЯ, ПРИВОДЯЩИЕ К ИЗМЕНЕНИЮ УРОВНЯ ТТГ В КРОВИ
У здоровых новорожденных при рождении отмечается резкий подъем уровня ТТГ в крови, снижающийся до базального уровня к концу первой недели жизни.
У женщин концентрация ТТГ в крови выше, чем у мужчин примерно на 20 %. С возрастом концентрация ТТГ незначительно повышается, уменьшается количество выбросов гормона в ночное время. У пожилых людей часто наблюдаются пониженные уровни ТТГ и в этих случаях необходимо принимать во внимание низкую чувствительность к стимуляции.
Концентрация ТТГ увеличивается во время беременности (оральные контрацептивы и менструальный цикл не влияют на динамику гормона)
Для ТТГ характерны суточные колебания секреции: наивысших величин ТТГ в крови достигает к 24 – 4 часам ночи, в утренние часы наибольший уровень в крови определяется в 6 – 8 часов. Минимальные значения ТТГ определяются в 15 – 18 часов вечера. Нормальный ритм секреции ТТГ секреции нарушается при бодрствовании ночью. На уровне ТТГ не сказывается интервал после приема левотироксина. Рекомендуется повторное проведение анализа, если полученные результаты не соответствуют клинической картине и параметрам других исследований.
У женщин среднего возраста и старых мужчин максимальный пик ТТГ в сыворотке крови приходиться на декабрь.
При климаксе может наблюдаться повышение содержания ТТГ при интактной ЩЖ.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ ТТГ В КРОВИ
|
ПОВЫШЕНИЕ УРОВНЯ ТТГ |
СНИЖЕНИЕ УРОВНЯ ТТГ |
|
Гемодиализ. Гестоз (преэклампсия). Контакт со свинцом. Некомпенсированная первичная надпочечниковая недостаточность. Подострый тиреоидит (фаза выздоровления). После тяжелых физических нагрузок. Избыточная секреция ТТГ при аденомах гипофиза (тиротропинома): тиреотоксикоз центрального генеза. Прекращение курения. Секреция ТТГ аденомами гипофиза не всегда является автономной, а подвержена частичной регуляции по типу обратной связи. При назначении таким больным тиреостатических препаратов (метилтиоурацил, мерказолил и другие) и снижения у них под влиянием лечения уровня тиреоидных гормонов в крови наблюдается дальнейшее повышение содержания ТТГ в сыворотке крови. Первичный гипотиреоз. Синдром нерегулируемой секреции ТТГ. Синдром резистентности к тиреоидным гормонам. Тиреоидит Хашимото с клиническим и субклиническим гипотиреозом. Тяжелые соматические и психические заболевания. Упражнения на велоэргометре. Холецистэктомия. Эктопическая секреция ТТГ (опухоли легкого, молочной железы). Секрецию ТТГ стимулируют низкая температура и пониженное АД. |
Акромегалия. Вторичная аменорея. Гипертиреоз беременных и послеродовой некроз гипофиза. Гипофизарным нанизмом. Голодание. Диффузный и узловой токсический зоб. Замедленное половое развитие. Курение. Неврогенная анорексия. Общие заболевания в пожилом возрасте. Психологический стресс. Синдром Клайнфельтера. Синдром Кушинга. Субклинический тиротоксикоз. Т3-токсикоз. Тепловой стресс. Травма гипофиза. Транзиторный тиротоксикоз при аутоиммунном тиреоидите. ТТГ-независимый тиротоксикоз. Угнетающее действие СТГ на синтез и высвобождение ТТГ. Хроническая почечная недостаточность. Цирроз печени. Экзогенная терапия гормонами ЩЖ. Эндогенные депрессии. Эндокринная офтальмопатия.
|
КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ТТГ
· У пролеченных гипертиреоидных больных ТТГ может оставаться низким в течение 4-6 недель после достижения эутиреоидного состояния.
· У беременных и женщин, принимающих контрацептивы, нормальный уровень ТТТ и повышенные уровни Т3 и Т4 имеют место при эутиреозе.
· Отсутствие первичного заболевания ЩЖ можно констатировать у любого пациента, имеющего нормальный ТТГ и Т4 в сочетании с изолированным отклонением (в любую сторону) Т3.
· У тяжелых больных при нормальной концентрации Т4 и Т3 продукция ТТГ может нарушаться.
· Секреция ТТГ подавляется при лечении с применением тироксина и в постоперационной заместительной терапии. Нормальные или повышенные уровни ТТГ в этих случаях свидетельствуют о малой дозе препарата, периферической резистентности к тиреоидным гормонам или наличии антител к гормонам ЩЖ.
· В ходе заместительной терапии при гипотиреозе оптимальный уровень ТТГ должен находиться ниже значений референтных величин.
ОСНОВНЫЕ КРИТЕРИИ ДИФФЕРЕНЦИАЛЬНОГО ДИАГНОЗА СУБКЛИНИЧЕСКОГО ГИПОТИРЕОЗА
|
Основные состояния, сопровождающиеся подъемом уровня ТТГ |
|
* Вторичный и третичный гипотиреоз сопровождается в 25% случаев небольшим повышением уровня ТТГ со сниженной биологической активностью при значительном снижении Т4 . |
|
* При синдроме резистентности к тиреоидным гормонам выявляется незначительное увеличение уровня ТТГ при повышенном содержании тиреоидных гормонов в крови. |
|
* Некомпенсированная первичная надпочечниковая недостаточность иногда сопровождается повышением уровня ТТГ, который нормализуется при назначении глюкокортикостероидов. |
|
* При ТТГ- продуцирующей аденоме гипофиза определяется повышенный уровень ТТГ и тиреоидных гормонов. |
|
* Хроническая почечная недостаточность может сопровождаться повышением ТТГ как из-за задержки выведения йода (истинный гипотиреоз), так из-за применения препаратов, повышающих уровень ТТГ в крови и накопления метаболитов. |
|
* При обострении психических заболеваний у каждого четвертого пациента может быть транзиторное повышение уровня ТТГ, связанное с активацией гипоталамо-гипофизарно-тиреоидной системы. |
|
* Влияние антидофаминовых препаратов (метоклопрамида и сульпирида), амиодарона. |
|
* Синдром нетиреоидных заболеваний. |
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА УРОВЕНЬ ТТГ В КРОВИ
|
ЗАВЫШЕНИЕ РЕЗУЛЬТАТА |
ЗАНИЖЕНИЕ РЕЗУЛЬТАТА |
|
АМИОДАРОН (ЭУТИРЕОИДНЫЕ И ГИПОТИРЕОИДНЫЕ БОЛЬНЫЕ) БЕТА-АДРЕНОБЛОКАТОРЫ (АТЕНОЛОЛ, МЕТОПРОЛОЛ, ПРОПРАНОЛОЛ) ГАЛОПЕРИДОЛ ЙОДИДЫ КАЛЬЦИТОНИН (МИАКАЛЬЦИК) КЛОМИФЕН ЛИТИЙ ЛОВАСТАТИН (МЕВАКОР) МЕТИМИЗОЛ (МЕРКАЗОЛИЛ) МОРФИЙ НЕЙРОЛЕПТИКИ (ФЕНОТИАЗИНЫ, АМИНОГЛЮТЕТИМИД) ПАРЛОДЕЛ (БРОМКРИПТИН) ПРЕДНИЗОН ПРОТИВОРВОТНЫЕ СРЕДСТВА (МОТИЛИУМ, МЕТОКЛОПРАМИД, ДОМПЕРИДОН) ПРОТИВОСУДОРОЖНЫЕ ПРЕПАРАТЫ (БЕНЗЕРАЗИД, ФЕНИТОИН, ВАЛЬПРОЕВАЯ КИСЛОТА) РЕНТГЕНОКОНТРАСТНЫЕ СРЕДСТВА РИФАМПИЦИН СУЛЬФАТ ЖЕЛЕЗА (ГЕМОФЕР, ФЕРРОГРАДУМЕНТ) СУЛЬПИРИД (ЭГЛОНИЛ) ФЛУНАРИЗИН ХЛОРПРОМАЗИН (АМИНАЗИН) ЭРИТРОЗИН
|
АМИОДАРОН (ГИПЕРТИРЕОИДНЫЕ БОЛЬНЫЕ) АНАБОЛИЧЕСКИЕ СТЕРОИДЫ АНТАГОНИСТЫ ДОФАМИНОВЫХ РЕЦЕПТОРОВ АСПИРИН БЕТА-АДРЕНОМИМЕТИКИ (ДОБУТАМИН, ДОПЕКСАМИН) ВЕРАПАМИЛ (ИЗОПТИН, ФИНОПТИН) ГЕПАРИН ДИНАЗОЛ ДОПАМИН ИНТЕРФЕРОН-2 КАРБАМАЗЕПИН (ФИНЛЕПСИН, ТЕГРЕТОЛ) КАРБОНАТ ЛИТИЯ (СЕДАЛИТ) КЛОФИБРАТ (МИСКЛЕРОН) КОРТИЗОЛ (УГНЕТАЕТ СЕКРЕЦИЮ ТТГ) КОРТИКОСТЕРОИДЫ ЛЕВОДОПА (ДОПАКИН, НАКОМ, МАДОПАР) ЛЕВОТИРОКСИН (ЭУТИРОКС) МЕТЭРГОЛИН НИФЕДИПИН (АДАЛАТ, КОРДИПИН, КОРИНФАР) ОКТРЕОТИД (САНДОСТАТИН) ПИРИДОКСИН (ВИТАМИН В6) СОМАТОСТАТИН СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛАКТИНЕМИИ (ПЕРИБЕДИЛ, ТРИЙОДТИРОНИН ФЕНТОЛАМИН ЦИМЕТИДИН (ГИСТОДИЛ) ЦИПРОГЕПТАДИН (ПЕРИТОЛ) ЦИТОСТАТИК |
ТИРОКСИН ( Т4 )
Тироксин – тиреоидный гормон, биосинтез которого происходит в фолликулярных клетках ЩЖ под контролем ТТГ. Основная фракция органического йода в крови находится в форме Т4. Около 70 % Т4 связано с тироксинсвязывающим глобулином (ТС), 20 % — с тироксинсвязывающим преальбумином (ТСПА) и 10 % — с альбумином. Только 0,02 – 0,05 % Т4 циркулирует в крови в несвязанном с белками состоянии — свободная фракция Т4. Концентрация Т4 в сыворотке зависит не только от скорости секреции, но и от изменения связывающей способности белков. Свободный Т4 составляет 0,02 – 0,04 % общего тироксина.
Период биологической полужизни Т4 – 6 суток.
ФИЗИОЛОГИЧЕСКИЕ СОСТОЯНИЯ, ПРИВОДЯЩИЕ К ИЗМЕНЕНИЮ УРОВНЯ Т4 В КРОВИ
У здоровых новорожденных концентрация свободного и общего Т4 выше, чем у взрослых.
Уровень гормона у мужчин и женщин остается относительно постоянным в течение всей жизни, снижаясь только после 40 лет.
Во время беременности концентрация тироксина нарастает, достигая максимальных величин в 3 триместре.
В течение дня максимальная концентрация тироксина определяется с 8 до 12 часов, минимальная – с 23 до 3 часов. В течение года максимальные величины Т4 наблюдаются в период между сентябрем и февралем, минимальные в летнее время.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ Т4 В КРОВИ
Гемолиз, многократное оттаивание и замораживание сыворотки могут привести к снижению результатов Т4. Высокие концентрации билирубина в сыворотке способствуют завышению результатов. Наличие консерванта ЭДТА дает ложнозавышенные результаты для свободного Т4. Голодание, плохое питание с низким содержанием белка, контакт со свинцом, тяжелые мышечные упражнения и тренировки, чрезмерное физическое усилие, различные виды стрессов, потери веса у женщин при ожирении, хирургические операции, гемодиализ могут способствовать снижению показателей общего и свободного Т4. Гиперемия, ожирение, прерывание приема героина (вследствие увеличения транспортных белков) вызывают увеличение Т4, героин снижает свободный Т4 в сыворотке крови. Курение вызывает как снижение, так и завышение результатов исследования на тироксин. Наложение жгута при взятии крови с работой и без «работы рукой» вызывает увеличение общего и свободного Т4.
Уровни Т4 в крови из пупочной вены ниже у недоношенных младенцев по сравнению с доношенными и положительно коррелируют с весом при рождении доношенных детей. Высокие величины Т4 у новорожденных вызваны повышенным ТСГ, свободный Т4 близок к уровню у взрослых. Величины резко повышаются в первые часы после рождения и постепенно снижаются к 5 годам. У мужчин происходит снижение в период полового созревания, у женщин этого не наблюдается.
Концентрация свободного Т4, как правило, остается в пределах нормы при тяжелых заболеваниях, не связанных со ЩЖ (концентрация общего Т4 может быть пониженной).
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ ОБЩЕГО Т4
|
ПОВЫШЕНИЕ УРОВНЯ ОБЩЕГО Т4 |
СНИЖЕНИЕ УРОВНЯ ОБЩЕГО Т4 |
|
ВИЧ – инфекция. Острый гепатит (4 недели) и подострый гепатит. Гипертиреоидизм, состояния с повышением ТСГ (беременность, генетическое повышение, острая перемежающая порфирия, первичный билиарный цирроз). Гиперэстрогения (повышение содержания общего Т4 за счет увеличения ТСГ, при этом уровень свободного Т4 остается нормальным). Диффузный токсический зоб. Ожирение. Острые психические расстройства. Острый тиреоидит (отдельные случаи). Послеродовая дисфункция ЩЖ. Синдром резистентности к тиреоидным гормонам. Тиреотропинома. Токсическая аденома. Тиреоидиты. ТТГ – независимый тиреотоксикоз. Хориокарцинома |
Вторичный гипотиреоз (синдром Шихана, воспалительные процессы в области гипофиза). Гипотиреоидизм, состояния со снижением ТСГ (нефротический синдром, хронические заболевания печени, потеря белка через ЖКТ, нарушения питания, генетическое снижение ТСГ). Пангипопитуитаризм. Первичный гипотиреоз (врожденный и приобретенный: эндемический зоб, АИТ, неопластические процессы в ЩЖ). Третичный гипотиреоз (черепно-мозговые травмы, воспалительные процессы в области гипоталамуса).
|
КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ Т4
· изолированное повышение общего Т4 на фоне нормальных значений ТТГ и Т3 может быть редкой находкой. Это, по-видимому, пациент с нормальной тиреоидной функцией, но врожденной избыточной печеночной продукцией белков-переносчиков тиреоидных гормонов.
· при «изолированном» Т3-гипертиреозе уровень свободного и общего Т4 – в пределах нормы.
· на начальной стадии гипотиреоза уровень свободного Т3 понижается раньше, чем общий Т4. Диагноз подтверждается в случае повышения ТТГ или чрезмерного ответа на ТРГ-стимуляцию.
· нормальный уровень Т4 не является гарантией нормальной тиреоидной функции. Т4 в пределах нормы может быть при эндемическом зобе, супрессивной или заместительной терапии, при скрытой форме гипертиреоза или скрытой форме гипотиреоза.
· при гипотиреозе тироксин способствует нормализации ТТГ и Т4.Повышенные концентрации общего и свободного Т4 и концентрация ТТГ в районе нижнего предела нормы наблюдается при подборе адекватной заместительной терапии.
· во время тиреостатической терапии уровень Т4 в районе верхнего предела нормы свидетельствует об адекватном выборе поддерживающей дозы.
· повышенный уровень свободного Т4 не всегда свидетельствует о нарушении функции ЩЖ. Это может быть следствием приема некоторых лекарственных препаратов или тяжелых общих заболеваний.
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА УРОВЕНЬ ОБЩЕГО Т4 В КРОВИ
|
ЗАВЫШЕНИЕ РЕЗУЛЬТАТА |
ЗАНИЖЕНИЕ РЕЗУЛЬТАТА |
|
АМИОДАРОН (В НАЧАЛЕ ЛЕЧЕНИЯ И ПРИ ДЛИТЕЛЬНОМ ЛЕЧЕНИИ) АМФЕТАМИНЫ ГЕРОИН ДЕКСТРО-ТИРОКСИН ДИНОПРОСТ ТРОМЕТАИН ИНСУЛИН ЛЕВАТЕРЕНОЛ ЛЕВОДОПА (ДОПАКИН, НАКОМ, МАДОПАР, СИНЕМЕТ) ОПИАТЫ (МЕТАДОН) ПЕРОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ ПРЕПАРАТЫ ГОРМОНОВ ЩЖ ПРОПИЛТИОУРАЦИЛ ПРОПРАНОЛОЛ (АНАПРИЛИН) ПРОСТАГЛАНДИН РЕНГЕНОКОНТРАСТНЫЕ ЙОДСОДЕРЖАЩИЕ ПРЕПАРАТЫ (ИОПАНОЕВАЯ КИСЛОТА, ИПОДАТ, ТИРОПАНОЕВАЯ КИСЛОТА) ТАМОКСИФЕН ТИРЕОЛИБЕРИН ТИРЕОТРОПИН ФЕНОТИАЗИН ФЛУОРОУРАЦИЛ (ФТОРФЕНАЗИН) ХОЛЕЦИСТОГРАФИЧЕСКИЕ В-ВА ЭСТРОГЕНЫ СИНТЕТИЧЕСКИЕ (МЕСТРАНОЛ, СТИЛЬБЕСТРОЛ) ЭФИР (ПРИ ГЛУБОКОМ НАРКОЗЕ) |
АМИНОГЛЮТЕМИД (СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ) АМИОДАРОН (КОРДАРОН) АНДРОГЕНЫ (СТАНОЗОЛОЛ, НАНДРОНОЛОЛ), ТЕСТОСТЕРОНОН АНТИКОНВУЛЬСАНТЫ (ВАЛЬПРОЕВАЯ КИСЛОТА, ФЕНИТОИН, ФЕНОБАРБИТАЛ, КАРБАМАЗЕПИН) АСПАРАГИНАЗА АСПИРИН АТЕНОЛОЛ БАРБИТУРАТЫ ГИПОЛИПИДЕМИЧЕСКИЕ СРЕДСТВА (ЛОВАСТАТИН, КЛОФИБРАТ, ХОЛЕСТИРАМИН) ДАНАЗОЛ ДИАЗЕПАМ (ВАЛИУМ, РЕЛАНИУМ, СИБАЗОН) ИЗОТРЕТИОНИН (РОАККУТАН) КОРТИЗОЛ КОРТИКОСТЕРОИДЫ (КОРТИЗОН, ДЕКСАМЕТАЗОН) КОРТИКОТРОПИН ЛИТИЙ МЕТАМИЗОЛ (АНАЛЬГИН) НПВС (ДИКЛОФЕНАК, ФЕНИЛБУТАЗОН) ОКСИФЕНБУТАЗОН (ТАНДЕРИЛ) ПЕНИЦИЛЛИН ПРЕПАРАТЫ СУЛЬФОНИЛМОЧЕВИНЫ (ГЛИБЕНКЛАМИД, ДИАБЕТОН, ТОЛБУТАМИД, ХЛОРПРОПАМИД) ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ (ИНТРАКОНАЗОЛ, КЕТОКОНАЗОЛ) ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА (АМИНОСАЛИЦИЛОВАЯ КИСЛОТА, ЭТИОНАМИД) РЕЗЕРПИН РИФАМПИН СОМАТОТРОПИН СУЛЬФАНИЛАМИДЫ (КО-ТРИМОКСАЗОЛ) ТРИЙОДТИРОНИН ФУРОСЕМИД (ПРИЕМ В БОЛЬШИХ ДОЗАХ) ЦИТОСТАТИКИ |
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА УРОВЕНЬ СВОБОДНОГО Т4
|
ЗАВЫШЕНИЕ РЕЗУЛЬТАТА |
ЗАНИЖЕНИЕ РЕЗУЛЬТАТА |
|
АМИОДАРОН АСПИРИН ВАЛЬПРОЕВАЯ КИСЛОТА ГЕПАРИН ДАНАЗОЛ ДИФЛЮНИСАЛ ИОПАНОЕВАЯ КИСЛОТА ЛЕВОТИРОКСИН МЕКЛОФЕНАМИНОВАЯ КИСЛОТА ПРОПИЛТИОУРАЦИЛ ПРОПРАНОЛОЛ РАДИОГРАФИЧЕСКИЕ ПРЕПАРАТЫ |
АНТИКОНВУЛЬСАНТЫ (ФЕНИТОИН, КАРБАМАЗЕПИН) – ПРИ ДЛИТЕЛЬНОМ ЛЕЧЕНИИ И БЕРЕМЕННЫХ ЖЕНЩИН С ЭПИЛЕПСИЕЙ МЕТАДОН |
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ СВОБОДНОГО Т4
|
ПОВЫШЕНИЕ УРОВНЯ СВОБОДНОГО Т4 |
СНИЖЕНИЕ УРОВНЯ СВОБОДНОГО Т4 |
|
Гипертиреоидизм. Гипотиреодизм, леченный тироксином. Заболевания, связанные с повышением свободных жирных кислот. Послеродовая дисфункция ЩЖ. Синдром резистентности к тиреоидным гормонам. Состояния, при которых снижается уровень или связывающая способность ТСГ. Тиреоидиты. Тиреотоксическая аденома. Токсический зоб. ТТГ-независимый тиреотоксикоз. Хронические заболевания печени.
|
Вторичный гипотиреоз (синдром Шихана, воспалительные заболевания в области гипофиза, тиреотропинома). Диета с низким содержанием белка и значительная недостача йода. Колебания уровней свободного Т4 могут наблюдаться у эутиреоидных пациентов при острых или хронических нетиреоидных болезнях Контакт со свинцом. Первичный гипотиреоз, не леченный тироксином (врожденный и приобретенный: эндемический зоб, АИТ, новообразования в ЩЖ, обширная резекция ЩЖ). Поздняя беременность. Резкое снижение массы тела у женщин с ожирением. Третичный гипотиреоз (ЧМТ, воспалительные процессы в области гипоталамуса). Хирургические вмешательства. |
ТРИЙОДТИРОНИН ( Т3 )
Трийодтиронин – тиреоидный гормон, на 58% состоящий из йода. Часть сывороточного Т3 образуется путем ферментативного дейодирования Т4 в периферических тканях, и только небольшое количество образуется прямым синтезом в ЩЖ.. Менее, чем 0,5 % Т3, циркулирующего в сыворотке, находится в свободной форме и биологически активна. Оставшийся Т3 находится в обратимой связи с сывороточными белками: ТСГ, ТСПА и альбумином. Афинность Т3 к сывороточным белкам в 10 раз ниже, чем Т4. В связи с этим уровень свободного Т3 не имеет такого большого диагностического значения, как уровень свободного Т4. По меньшей мере 80 % циркулирующего Т3 получено в результате монодейодизации Т4в периферических тканях. Т3 в 4 – 5 раз более активен в биологических системах, чем Т4. Хотя минимальные сывороточные концентрации Т3 в 100 раз ниже, чем концентрация Т4, большинство иммуноанализов имеют незначительную перекрестную реактивность с Т4. Так как уровни Т3 быстро меняются под влиянием стресса или других нетиреоидных факторов, измерение Т3 не является лучшим общим тестом определения тиреоидного статуса. Свободный Т3 составляет около 0,2 – 0,5 % общего Т3.
Период биологической полужизни Т3 составляет — 24 часа.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ Т3
· дифференциальная диагностика заболеваний ЩЖ,
· контрольное исследование при изолированном Т3-токсикозе,
· начальная стадия гиперфункции ЩЖ, в частности автономных клеток,
· острый гипертиреоз после подавляющей терапии тироксином,
· рецидив гипертиреоза.
· для исключения передозировки лекарственных препаратов необходимо проводить контроль уровня Т3, который должен находиться в пределах нормы.
ФИЗИОЛОГИЧЕСКИЕ СОСТОЯНИЯ, ПРИВОДЯЩИЕ К ИЗМЕНЕНИЮ УРОВНЯ Т3 В КРОВИ
Концентрация Т3 в сыворотке крови новорожденных составляет 1/3 от его уровня, наблюдаемого у взрослых, но уже в течение 1 – 2 суток увеличивается до концентрации, выявляемой у взрослых. В раннем детском возрасте концентрация Т3 несколько уменьшается, а в подростковом возрасте (к 11 – 15 годам) вновь достигает уровня взрослого человека. После 65 лет наблюдается более значительное снижение уровня Т3 по сравнению с Т4. У женщин отмечаются более низкие концентрации Т3 , чем у мужчин, в среднем на 5 – 10 %.
Во время беременности (особенно в 3 триместре) концентрация Т3 в крови возрастает в 1,5 раза. После родов уровень гормона нормализуется в течение 1 недели.
Для показателей Т3 характерны сезонные колебания: максимальный уровень приходится на период с сентября по февраль, минимальный – на летний период.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ Т3 В КРОВИ
|
ПОВЫШЕНИЕ РЕЗУЛЬТАТА |
СНИЖЕНИЕ РЕЗУЛЬТАТА |
|
Большая высота над уровнем моря. Героинмания. Нарастание веса тела. Прерывание приема героина. При дефиците йода происходит компенсаторное повышение уровней общего и свободного Т3. При наложении жгута с целью взятия крови на 3 мин. без «работы рукой» возможно увеличение Т3 примерно на 10 %. Физические упражнения. |
Гемодиализ. Гипертермия. Голодание. Недоношенные новорожденные. Низкокалорийная диета. Острые заболевания. Плазмоферез. Плохое питание с низким содержанием белков. После абортов. Потеря веса. Тяжелые соматические заболевания. Тяжелые физические нагрузки у женщин. Электроконвульсивная терапия. |
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ ОБЩЕГО Т3
|
ПОВЫШЕНИЕ РЕЗУЛЬТАТА |
СНИЖЕНИЕ РЕЗУЛЬТАТА |
|
Гипертиреоз. Йоддефицитный зоб. Леченный гипертиреоидизм. Начальная нетиреоидная недостаточность. Состояния с повышенным ТСГ. Т3-тиреотоксикоз.
|
Гипотиреоз (при раннем или легком первичном гипотиреоидизме Т4 снижается больше, чем Т3 – высокое соотношение Т3/Т4). Некомпенсированная первичная надпочечниковая недостаточность. Острые и подострые нетиреоидные заболевания. Первичный, вторичный и третичный гипотиреоз. Период выздоровления после тяжелых заболеваний. Синдром эутиреоидного больного. Состояния с пониженным ТСГ. Тяжелая нетиреоидная патология, включая соматические и психические заболевания. Хронические заболевания печени. |
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА УРОВЕНЬ ОБЩЕГО Т3
|
ЗАВЫШЕНИЕ РЕЗУЛЬТАТА |
ЗАНИЖЕНИЕ РЕЗУЛЬТАТА |
|
АМИОДАРОН (КОРДАРОН) АНДРОГЕНЫ АСПАРАГИНАЗА ГЕРОИН ДЕКСТРОТИРОКСИН ДИНОПРОСТ ТРОМЕТАИН (ЭНЗАПРОСТ) ИЗОТРЕТИОНИН (РОАККУТАН) ЙОДИДЫ ЛИТИЙ МЕТАДОН (ДОЛОФИН, ФИСЕПТОН) ПЕРОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ ПРОПИЛТИОУРАЦИЛ ПРОПРАНОЛОЛ (АНАПРИЛИН) ПРОТИВОСУДОРОЖНЫЕ СРЕДСТВА САЛИЦИЛАТЫ ТЕРБУТАЛИН ХОЛЕЦИСТОГРАФИЧЕСКИЕ В – ВА ЦИМЕТИДИН (ГИСТОДИЛ) ЭСТРОГЕНЫ |
ДЕКСАМЕТАЗОН (СЫВОРОТОЧНАЯ КОНЦЕНТРАЦИЯ МОЖЕТ УМЕНЬШАТЬСЯ НА 20 – 40 %) |
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ СВОБОДНОГО Т3
|
ПОВЫШЕНИЕ УРОВНЯ СВОБОДНОГО Т3 |
СНИЖЕНИЕ УРОВНЯ СВОБОДНОГО Т3 |
|
Гипертиреоидизм. Т3-токсикоз. Синдром периферического сопротивления сосудов. |
Гипотиреоидизм. Третий триместр беременности. При нетиреоидных заболеваниях низкий уровень свободного Т3 является неспецифической находкой. |
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА УРОВЕНЬ СВОБОДНОГО Т3
|
ЗАВЫШЕНИЕ РЕЗУЛЬТАТА |
ЗАНИЖЕНИЕ РЕЗУЛЬТАТА |
|
ДЕКСТРОТИРОКСИН ФЕНОПРОФЕН (НАЛФОН) |
АМИОДАРОН (КОРДАРОН) ВАЛЬПРОЕВАЯ КИСЛОТА (КОНВУЛЕКС, ЭНКОРАТ, ДЕПАКИН) НЕОМИЦИН (КОЛИМИЦИН) НИАЦИН ПРАЗОЗИН ПРОБУКОЛ ПРОПРАНОЛОЛ (АНАПРИЛИН, ОБЗИДАН) ТИРОКСИН ФЕНИТОИН (ДИФЕНИН) ХОЛЕЦИСТОГРАФИЧЕСКИЕ ПРЕПАРАТЫ (ИОПАНОЕВАЯ КИСЛОТА, ИПОДАТ) |
КЛИНИКО-ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ Т3
· при дефиците йода наблюдается компенсаторное повышение общего и свободного Т3. Таким образом, организм приспосабливается к недостатку «сырья». Обеспечение достаточным количеством йода влечет за собой нормализацию Т3. Никакого лечения эти лица не требуют. Неверная трактовка повышенного уровня Т3 как Т3-токсикоза, невзирая на нормальный ТТГ и иногда даже сниженный Т4, может привести к необоснованному назначения тиреостатиков, что является грубой ошибкой.
· при гипотиреозе уровни общего и свободного Т3 могут длительное время находиться в районе нижнего предела нормы, так как повышенное периферическое превращение Т4 в Т3 компенсирует снижение Т3 .
· нормальный уровень Т3 может быть при скрытых функциональных дефектах тиреоидной функции, при гипотиреозе, компенсированном превращении Т4 в Т3.
· во время лечения зоба или послеоперационной заместительной терапии тироксином уровни ТТГ и Т3 измеряют для предупреждения дозировки.
· при лечении гипотиреоза тироксином повышение Т3 значительно меньше по сравнению с Т4. При введении больших доз тироксина ТТГ подавляется до нерегистрируемых значений. Для исключения передозировки лекарственных препаратов проводят анализ уровня Т3, который должен находиться в пределах нормы.
· в начале курса тиреостатической терапии уровень Т3 может возрастать в результате процессов компенсации.
· определение уровня Т3 в сыворотке имеет низкую чувствительность и специфичность при гипотиреозе, так как активизация конверсии Т4 в Т3 поддерживает уровень Т3 в пределах нормы до развития тяжелого гипотиреоза. Пациенты с НТЗ или в состоянии энергетического голода имеют низкие показатели с Т3 и о Т3. Уровень Т3 следует определять в сочетании с свободным Т4 при диагностике сложных и необычных проявлений гипертиреоза или некоторых редких состояний. Высокий уровень Т3 является частым и ранним признаком рецидива болезни Грейвса. Высокий или нормальный уровень Т3 встречается при гипертиреозе у пациентов с НТЗ на фоне снижения содержания ТТГ (менее 0,01 мМЕ/л). Высокий или нормальный уровень Т3 встречается при кордарониндуцированном гипертиреозе.
АЛГОРИТМ ЛАБОРАТОРНОЙ ОЦЕНКИ ФУНКЦИИ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
|
ТТГ повышен, свободный Т4 повышен или в норме, свободный Т3 понижен или в норме.
|
* Прием амиодарона, йодсодержащих рентгеноконтрастных средств, больших доз пропранолола. * Тяжелая нетиреоидная патология, включая соматические и психические заболевания. * Некомпенсированная первичная надпочечниковая недостаточность. * Период выздоровления. |
|
ТТГ повышен, свободный Т4 повышен или в норме, клинический эутиреоз. |
* Тотальная резистентность к тиреоидным гормонам.
|
|
ТТГ повышен, свободный Т4 в норме
|
* Недавно проведенная коррекция гормонами ЩЖ. * Недостаточная терапия гормонами ЩЖ., пациенты не предъявляют жалоб. |
|
ТТГ понижен, свободный Т4 повышен, свободный Т3 понижен. |
* Артифициальный тиреотоксикоз вследствие самоназначения Т4. |
|
ТТГ понижен, свободный Т4 в норме. |
* Избыточная терапия гормонами ЩЖ. * Прием препаратов, содержащих Т3. |
|
ТТГ в норме, свободный Т4 и Т3 понижены. |
* Прием больших доз салицилатов.
|
|
ТТГ повышен, свободный Т4 повышен, клинический тиреотоксикоз. |
* ТТГ – секретирующие опухоли. |
|
ТТГ в норме, повышение уровня общего Т4 при нормальном уровне св. Т4. |
* Семейная дисальбуминемическая гипертироксинемия.
|
|
ТТГ повышен, свободный и общий Т4 снижены, общий и свободный Т3 снижены. |
* Хронические заболевания печени: хронический гепатит, цирроз печени. |
|
Аномальные концентрации общегоТ4 и общегоТ3 |
* Чаще всего являются результатом нарушений со стороны связывающего белка, а не результатом тиреоидной дисфункции. При изменении уровня ТСГ расчетные показатели свободногоТ4 более надежны, чем содержание общегоТ4. При расхождении показателей свободных гормонов следует определить общийТ4 и общийТ3. |
ИСТОЧНИКИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОРГАНИЧЕСКИХ
КОНТРТИРЕОИДНЫХ СРЕДСТВ
|
Химическое название |
Источники |
Механизм действия |
|
Тиоцианаты и изотиоцианаты |
Растения семейства крестоцветных, курение |
Ингибирование йодконцентрирующих механизмов |
|
Гойтрин |
Желтая репа |
Препятствие органификации йодида и образованию активных тиреоидных гормонов в ЩЖ (активность гойтрина составляет 133% активности пропилтиоурацила). |
|
Цианогенные гликозиды |
Маниок, маис, сладкий картофель, побеги бамбука |
Превращаются в организме в изотиоцианаты |
|
Дисульфиды |
Лук, чеснок |
Тиомочевиноподобное антитиреоидное действие |
|
Флавоноиды |
Просо, сорго, бобы, земляные орехи |
Ингибирование ТПО и дейодиназ йодтиронинов – торможение периферического метаболизма тиреоидных гормонов. |
|
Фенолы (резорцин) |
Питьевая вода, угольная пыль, сигаретный дым |
Торможение органификации йода в ЩЖ и ингибирование ТПО |
|
Полициклические ароматические углеводороды |
Пищевые продукты, питьевая вода, грунтовые воды |
Ускорение метаболизма Т4 за счет активации печеночной УДФ-глюкуронилтрансферазы и образования глюкуронида Т4 |
|
Эфиры фталевой кислоты |
Изделия из пластмассы, некоторые виды рыб |
Ингибирование ТПО и включения йода в тиреоидные гормоны |
|
Полихлорированные и полибромированные бифенилы |
Пресноводная рыба |
Развитие АИТ |
|
ДДТ |
Питьевая вода, продукты питания |
Гиперплазия фолликулярного эпителия, ускорение метаболизма тиреоидных гормонов, повышение активности микросомальных ферментов |
|
Высокий уровень или дефицит лития, селена |
|
Могут блокировать протеолиз коллоида и выход ТГ из фолликулов, поступление йода в ЩЖ, связь тиреоидных гормонов с белками сыворотки, ускорять процесс их дейодирования. |
ВИДЫ СИНДРОМА НЕТИРЕОИДНЫХ ЗАБОЛЕВАНИЙ,
ИХ ЗНАЧЕНИЕ И МЕХАНИЗМЫ РАЗВИТИЯ
|
Варианты синдрома нетиреоидных заболеваний (СНТЗ) |
|
Низкий уровень Т3 |
|
Снижение уровня Т3 наблюдается у 70% пациентов стационаров при системных заболеваниях при нормальной функции ЩЖ. Общий Т3 ниже нормы на 60%, свободный Т3 – на 40%.Уровень Т4 – нормальный. Вариант СНТЗ связан с нарушением превращения Т4 в Т3вследствие снижения активности 5-монодейодиназы. Данное состояние также характерно для голодания и представляет собой адаптивную реакцию организма, связанную со снижением основного обмена. |
|
Низкий уровень Т3 и Т4 |
|
Одновременное снижение уровня Т3 и Т4 часто встречается у пациентов палат интенсивной терапии. При этом низкий уровень общего Т4 – неблагоприятный прогностический признак. Данный вариант СНТЗ связан с присутствием в крови ингибитора связывания тиреоидных гормонов и увеличением метаболического клиренса Т4. |
|
Высокий уровень Т4 |
|
Повышение уровня сывороточного Т4 и реверсивного Т3 наблюдается при острой порфирии, хроническом гепатите, первичном билиарном циррозе. При этом уровень общего Т3 и свободного Т4 – в пределах нормы, уровень свободного Т3 – на нижней границе нормы или снижен. |
ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ, ВЛИЯЮЩИЕ
НА ЭФФЕКТИВНОСТЬ ТЕРАПИИ ТИРОКСИНОМ
|
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ |
ЛЕКАРСТВЕННОЕ ВЕЩЕСТВО |
|
|
Одновременное использование может потребовать увеличение дозы L-тироксина |
||
|
Лекарственные средства, блокирующие рецепторы, как истинных катехоламинов, так и образующихся из тироксина псевдомедиаторов. |
Пропранолол (анаприлин, обзидан) |
|
|
Лекарственные средства, снижающие абсорбцию L-тироксина. |
Холестирамин (квестран) Гидроокись алюминия Сульфат железа (гемофер) Сукральфат (вентер) Колестипол Карбонат кальция |
|
|
Лекарственные средства, ускоряющие метаболизм Л-тироксина в печени |
Фенобарбитал Фенитоин (дифенин) Карбамазепин (финлепсин) Рифампицин |
|
|
Одновременное использование может потребовать уменьшение дозы L-тироксина |
||
|
Лекарственные средства, уменьшающие уровень тироксинсвязывающего глобулина в сыворотке крови |
Андрогены Анаболические стероиды Глюкокортикостероиды |
|
КЛИНИЧЕСКИЕ СИТУАЦИИ, ИЗМЕНЯЮЩИЕ
ПОТРЕБНОСТЬ В ТИРОКСИНЕ
|
ПОВЫШЕНИЕ ПОТРЕБНОСТИ В ТИРОКСИНЕ |
|
* Снижение абсорбции Т4 в кишечнике: заболевания слизистой тонкого кишечника (спру и т.п.), поносы при диабете, цирроз печени, после операции еюно-еюнального шунтирования или резекции тонкой кишки, беременность. * Препараты, увеличивающие выведение неметаболизированного Т4: рифампицин, карбамазепин, фенитоин. * Прием препаратов, снижающих абсорбцию тироксина: холестирамин, гидроокись алюминия, сульфат железа, карбонат кальция, сукральфат, колестипол. * Препараты, блокирующие конверсию Т4 в Т3: амиодарон (кордарон), дефицит селена. |
|
СНИЖЕНИЕ ПОТРЕБНОСТИ В ТИРОКСИНЕ |
|
* Старение (возраст более 65 лет). * Ожирение. |
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА
ФУНКЦИЮ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
|
ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ |
ВЛИЯНИЕ НА ЩИТОВИДНУЮ ЖЕЛЕЗУ |
|
Йодсодержащие препараты и рентгеноконтрастные вещества |
Индуцирование гипотиреоза за счет ингибирования синтеза и секреции гормонов ЩЖ – снижение уровня Т4 и повышение содержания ТТГ. Снижение скорости образования Т3 из Т4. (Иногда препараты, содержащие йод, могут вызывать феномен «йод-Базедов») |
|
Препараты лития |
Подавляют секрецию Т4 и Т3 и снижают превращение Т4 в Т3, подавляют протеолиз тиреоглобулина. |
|
Сульфаниламиды (в том числе препараты, используемые для лечения СД) |
Оказывают слабое супрессивное влияние на ЩЖ, тормозят синтез и секрецию тиреоидных гормонов (оказывают структурные и функциональные нарушения ЩЖ). |
|
Дофамин |
Подавляет секрецию ТТГ. |
|
Тестостерон, метилтестостерон, нандролон |
Уменьшение содержания в сыворотке ТСГ и концентрации общего Т4 и стимулирование синтеза ТТГ. |
|
Фенитоин, Фенобарбитал, Карбамазепин
|
Усиливают катаболизм Т4 ферментными системами печени (при длительном применении требуется контроль функции щитовидной железы). При длительном лечении фенитоином уровень свободного Т4 и ТТГ могут оказаться аналогичными таковым при вторичном гипотиреозе. |
|
Оральные контрацептивы |
Могут вызвать значительное повышение общего Т4, но не свободного Т4. |
|
Салицилаты |
Блокируют захват йода ЩЖ, повышают свободный Т4 за счет снижения связывания Т4 с ТСГ. |
|
Бутадион |
Влияет на синтез гормонов ЩЖ, снижая уровень общего и свободного Т4. |
|
Глюкокортикоиды (при кратковременном приеме в больших дозах и при длительной терапии в средних дозах) |
Снижают превращение Т4 в Т3 за счет увеличения конценрации неактивного реверсивного Т3, ингибируют секрецию тиреоидных гормонов и ТТГ и уменьшают его выделение на ТРГ. |
|
Бета-блокаторы |
Замедляют конверсию Т4 в Т3 и понижают уровень Т3. |
|
Фуросемид (в больших дозах) |
Вызывает падение общего и свободного Т4 с последующим повышением ТТГ. |
|
Гепарин |
Подавляет поглощение Т4 клетками. При проведении гепаринотерапии может быть выявлен неадекватно высокий уровень свободного Т4. |
|
Амиодарон |
Эффекты разнонаправленные, в зависимости от исходного обеспечения йодом и состояния ЩЖ. * Амиодарониндуцированный гипотиреоз наиболее часто наблюдается в йоддостаточных регионах. Патогенез: Амиодарон ингибируя ТТГ-зависимую продукцию цАМФ, снижает синтез тиреоидных гормонов и йодный метаболизм; ингибирует 5-дейодиназу – селенопротеина, обеспечивающего превращение Т4 в Т3 и реверсионный Т3, что приводит к снижению экстра- и интратиреоидного содержания Т3. * Амиодарониндуцированный тиреотоксикоз наиболее часто встречается в йоддефицитных или районах умеренного йодного дефицита. Патогенез: йод, высвобождаемый из амиодарона, приводит к повышению синтеза тиреоидных гормонов в существующих зонах автономии в ЩЖ. Также возможно развитие деструктивных процессов в ЩЖ, причиной которых стало действие самого амиодарона.
|
ПАЦИЕНТЫ, ПРИНИМАЮЩИЕ АМИОДАРОН (КОРДАРОН)
До лечения необходимо исследование базального уровня ТТГ и анти-ТПО. Содержание свободногоТ4 и свободногоТ3 проверяют, если изменен уровень ТТГ. Повышение уровня анти-ТПО является фактором риска тиреоидной дисфункции на фоне терапии кордароном.
В течение первых 6 месяцев после начала терапии уровень ТТГ может не соответствовать уровню периферических тиреоидных гормонов (высокий уровень ТТГ / высокий уровень свободногоТ4 / низкий уровень свободногоТ3). При сохранении эутиреоза показатель ТТГ со временем обычно нормализуется.
Длительное наблюдение. Уровень ТТГ в ходе терапии кордароном следует определять каждые 6 месяцев. Именно уровень ТТГ в таких условиях является надежным показателем тиреоидного статуса.
Прием амиодарона вначале вызывает изменения уровня ТТГ в сторону повышения. За этим следует динамика уровней реверсивного Т3, Т4 и Т3.Прогрессивное снижение уровня Т3 отражает нарушение периферического превращения Т4 в Т3.Увеличение содержания общего и свободного Т4 может быть связано со стимулирующим эффектом ТТГ и/или со снижением клиренса Т4.
ПАЦИЕНТЫ С НЕТИРЕОИДНЫМИ
ЗАБОЛЕВАНИЯМИ (НТЗ)
Острые и хронические НТЗ оказывают сложное влияние на результаты тиреоидных тестов. Тестирование по возможности следует отложить до выздоровления, за исключением случаев отягощенного анамнеза или появления симптомов дисфункции ЩЖ. У тяжелобольных, а также при интенсивном медикаментозном лечении результаты некоторых тиреоидных тестов не поддаются интерпретации.
Сочетанное определение уровня ТТГ и Т4 позволяет наиболее надежно дифференцировать истинную первичную тиреоидную патологию (совпадение изменений уровня Т4 и ТТГ) и транзиторные сдвиги, вызванные самими НТЗ (расхождение изменений уровня Т4 и ТТГ).
Патологический уровень свободного Т4 у пациентов с тяжелыми соматическими болезнями не доказывает наличия тиреоидной патологии. В случае патологического уровня свободного Т4 необходимо исследовать содержание общего Т4.Если оба показателя (свободный Т4 и общий Т4) однонаправлено выходят за пределы нормы, тиреоидная патология возможна. Если же показатели свободного Т4 и общего Т4 расходятся, то это, скорее всего, обусловлено не тиреоидной дисфункцией, а соматическим заболеванием, приемом медикаментов. При выявлении патологического уровня общего Т4 необходимо соотнести данный результат с тяжестью соматического заболевания. Низкий уровень общего Т4 типичен лишь для тяжело- и агонирующих больных. Низкий уровень общего Т4 у пациентов вне реанимационного отделения позволяет предполагать гипотиреоз. Повышенный уровень общего Т3 и свободного Т3 является надежным показателем гипертиреоза при соматических заболеваниях, но нормальный или низкий уровень Т3 не исключает гипертиреоз.
Определение уровня ТТГ у больных с НТЗ. Определение уровня ТТГ и Т4 (свободного Т4 и общего Т4) – наиболее эффективная комбинация для выявления тиреоидной дисфункции больных с соматической патологией. В таких случаях следует расширить референтные интервалы ТТГ до 0,05-10,0 мМЕ/л. Уровень ТТГ может транзиторно снижаться до субнормальных величин в острой фазе болезни и повышаться в фазе выздоровления.
ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ЩИТОВИДНОЙ
ЖЕЛЕЗЫ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Изменение функционирования ЩЖ у женщин происходит уже с первых недель беременности. На нее воздействует множество факторов, большая часть которых прямо или косвенно стимулирует ЩЖ женщины. Преимущественно это происходит в первой половине беременности.
Тиреотропный гормон. Буквально с первых недель беременности под влиянием хорионического гонадотропина (ХГ), обладающего структурной гомологией с ТТГ, стимулируется продукция тиреоидных гормонов ЩЖ. В связи с этим по механизму обратной связи подавляется продукция ТТГ, уровень которого на протяжении первой половины беременности оказывается сниженным примерно у 20% беременных. При многоплодной беременности, когда уровень ХГ достигает очень высоких значений, уровень ТТГ в первой половине беременности оказывается значительно снижен, а порой подавлен, практически у всех женщин. Наиболее низкие показатели уровня ТТГ в среднем приходятся на 10 – 12 неделю беременности. Тем не менее, в отдельных случаях он может оставаться нескольким сниженным вплоть до поздних сроков беременности.
Тиреоидные гормоны. Определение уровня общих тиреоидных гормонов во время беременности не информативно, поскольку он всегда будет повышен (в целом продукция тиреоидных гормонов во время беременности в норме увеличивается на 30 – 50%). Уровень свободного Т4 в первом триместре беременности, как правило, высоконормален, но примерно у 10% с подавленным уровнем ТТГ превышает верхнюю границу нормы. По мере увеличения сроков беременности уровень свободного Т4 будет постепенно снижаться и к концу беременности очень часто оказывается низконормальным. У части пациенток, даже не имеющих патологии ЩЖ и получающих индивидуальную йодную профилактику, на поздних сроках беременности может обнаруживаться пограничное снижение уровня свободного Т4 в сочетании с нормальным уровнем ТТГ. Уровень свободного Т3, как правило, меняется однонаправлено с уровнем свободного Т4, но повышенным оказывается реже.
Общие принципы диагностики заболеваний ЩЖ во время беременности.
* Необходимо сочетанное определение ТТГ и свободного Т4.
* Определение уровня общего Т4 и Т3 во время беременности малоинформативно.
* Уровень ТТГ в первой половине беременности в норме понижен у 20-30% женщин.
* Уровни общих Т4 и Т3 в норме всегда повышены (примерно в 1,5 раза).
* Уровень свободного Т4 в первом триместре несколько повышен примерно у 2% беременных и у 10% женщин с подавленным ТТГ.
* На поздних сроках беременности в норме часто определяется низконормальный или даже погранично сниженный уровень свободного Т4 при нормальном уровне ТТГ.
ТИРЕОГЛОБУЛИН (ТГ)
Тиреоглобулин – гликопротеин, содержащий йод. ТГ является основным компонентом коллоида фолликулов щитовидной железы и выполняет функцию накопления тиреоидных гормонов. На поверхности ТГ происходит синтез тиреоидных гормонов. Секреция ТГ контролируется ТТГ.
Период биологической полужизни ТГ в плазме крови — 4 суток.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ ТГ В КРОВИ
Повышение содержания в крови ТГ отражает нарушение целостности гематофолликулярного барьера и наблюдается при заболеваниях, протекающих с нарушением структуры железы либо сопровождающихся дефицитом йода. Выход ТГ в кровоток увеличивается при стимуляции и структурных поражениях ЩЖ. Определение ТГ не имеет смысла в ближайшие 2 – 3 недели после пункционной биопсии, так как уровень ТГ может быть повышен из-за пассивного выхода коллоида в кровь при травматизации железы. Уровень ТГ повышается в ближайшие сроки после операций на ЩЖ. Потребление большого количества йода с пищей подавляет выход тиреоидных гормонов из ЩЖ, сдвигая равновесие между образованием и распадом ТГ в сторону его образования и накопления в коллоиде. Уровень ТГ может быть повышен при ДТЗ, подостром тиреоидите, увеличении ЩЖ под действием ТТГ, в некоторых случаях доброкачественной аденомы ЩЖ.
Присутствие антител к ТГ может быть причиной ложноотрицательных результатов, поэтому параллельно с ТГ желательно определять антитела к ТГ.
У больных недифференцированным раком ЩЖ концентрация ТГ в крови увеличивается редко. При дифференцированных опухолях с низкой функциональной активностью уровень ТГ повышается в меньшей степени, чем в опухолях с высокой функциональной активностью. Повышение уровня ТГ установлено при высокодифференцированном раке ЩЖ. Большое диагностическое значение имеет определение уровня ТГ для выявления метастазов карциномы ЩЖ и динамического контроля за состоянием больных на фоне лечения фолликулярной карциномы. Также установлено, что метастазы рака ЩЖ имеют способность синтезировать ТГ.
Снижение после перенесенной хирургической операции или лучевой терапии уровня ТГ в крови исключает наличие метастазов. Напротив, нарастание уровня ТГ может служить признаком генерализованного процесса.
Поскольку больные после радикального лечения дифференцированного рака ЩЖ получают высокие дозы тиреоидных гормонов ( для подавления секреции ТТГ ), на фоне которого также снижается уровень ТГ, его концентрацию следует определять через 2 – 3 недели после отмены супрессивной терапии тиреоидными гормонами.
В педиатрической эндокринологии определение ТГ имеет большое значение при ведении детей с врожденным гипотиреозом для подбора дозы заместительной гормональной терапии. При аплазии ЩЖ, когда ТГ в крови не определяется, показана максимальная дозировка, тогда как при других вариантах обнаружение и увеличение концентрации ТГ позволяет предполагать обратимое течение болезни, в связи с чем дозировка гормона может быть уменьшена.
ФИЗИОЛОГИЧЕСКИЕ СОСТОЯНИЯ, ПРИВОДЯЩИЕ К ИЗМЕНЕНИЮ УРОВНЯ ТГ В КРОВИ
Значения ТГ у новорожденных повышены и значительно снижаются в течение первых 2 лет жизни.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ ТГ
— карцинома ЩЖ (за исключением медуллярного рака),
— раннее выявление рецидивов и метастазов высокодифференцированного рака ЩЖ у оперированных больных,
— оценка эффективности радийодтерапии метастазов рака ЩЖ (по убыли его содержания в крови до нормальных значений),
— метастазы в легких неясного происхождения,
— метастазы в костях неясного происхождения, патологическая ломкость костей,
— определение ТГ нельзя проводить с целью дифференциальной диагностики доброкачественных и злокачественных опухолей ЩЖ.
КОНЦЕНТРАЦИЯ ТГ У ЗДОРОВЫХ ЛИЦ И ПРИ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ ЩЖ
Здоровые лица 1,5 – 50нг/мл
Рак щитовидной железы:
До операции 125,9 +8,5 нг/мл
После операции без метастазов и рецидивов 6,9+1,8 нг/мл
Метастазы и рецидивы высокодифференцированного 609,3 + 46,7 нг/мл
рака ЩЖ у оперированных больных
Доброкачественные опухоли (до операции) 35,2 + 16,9 нг/мл
Тиреотоксикоз (тяжелая форма) 329,2 + 72,5 нг/мл
АНТИТЕЛА К ТИРЕОГЛОБУЛИНУ ( АНТИ – ТГ )
Щитовидная железа, содержащая специфические антигены, может приводить иммунную систему организма в состояние аутоагрессии. Одним из таких антигенов является тиреоглобулин. Повреждение ЩЖ при аутоиммунных или неопластических заболеваниях может вызвать попадание ТГ в кровеносное русло, что, в свою очередь, ведет к активации иммунного ответа и синтезу специфических антител. Концентрация анти-ТГ изменяется в широком диапазоне и зависит от заболевания. Поэтому определение концентрации анти-ТГ может быть использовано для диагностики и мониторинга лечения заболеваний ЩЖ.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ АНТИ-ТГ В КРОВИ
Анти-ТГ являются важным параметром для выявления аутоиммунных заболеваний ЩЖ и их тщательно измеряют во время наблюдения за ходом болезни. Повышение уровня анти-ТГ определяется при тиреоидите Хашимото (больше 85 % случаев), болезни Грейвса (больше 30 % случаев), рака ЩЖ(45 %случаев), идиопатической микседеме (больше 95 % случаев), пернициозной анемии (50 % случаев, низкие титры), СКВ (около 20 % случаев), подостром тиреоидите де Кервена( низкие титры), гипотиреозе (около 40 % случаев), ДТЗ (около 25 % случаев), слабоположительный результат может быть получен при нетоксическом зобе.
Эстроген-прогестероновая терапия с целью контрацепции увеличивает титр антител к тиреоглобулину и пероксидазе. У женщин с АИТ при приеме данных препаратов титр антител значительно выше, чем у лиц с АИТ, не принимающих эти лекарственные препараты.
Повышенный титр анти-ТГ может быть получен у больных с неэндокринными заболеваниями при приеме препаратов, влияющих на характер иммунного ответа.
У больных тиреоидитом Хашимото титр анти-ТГ в процессе лечения, как правило, снижается, но могут встречаться больные, у которых анти-ТГ могут персистировать или обнаруживаться волнообразно с периодом около 2 – 3 лет. Титр анти-ТГ у беременных женщин с болезнью Грейвса или Хашимото снижается прогрессивно в течение беременности и кратковременно возрастает после родов, достигая пика через 3 – 4 месяца. Нормальный титр анти-ТГ не исключает тиреоидита Хашимото. Тест определения микросомальных антител более чувствителен по отношению к тиреоидиту Хашимото, чем тест анти-ТГ, особенно у пациентов моложе 20 лет.
Определение анти-ТГ дает возможность прогнозировать нарушение функции ЩЖ у больных с другими аутоиммунными эндокринными заболеваниями и у членов семей с наследственными органоспецифическими аутоиммунными заболеваниями. Слабо положительные результаты обычно обнаруживаются при других аутоиммунных расстройствах и хромосомных нарушениях таких, как синдром Турнера и синдром Дауна.
Положительные результаты у некоторых больных гипертиреоидизмом позволяют думать о сочетании с тиреоидитом. Использование анти-ТГ для выявления аутоиммунных заболеваний ЩЖ особенно оправдано в йоддефицитных районах.
У детей, рожденных от матерей с высокими титрами анти-ТГ, в течение жизни могут развиваться аутоиммунные тиреоидные заболевания, что требует отнести таких детей к группе риска.
Около 5 — 10 % практически здоровых людей могут иметь низкий титр анти-ТГ без симптомов болезни, чаще у женщин и пожилых людей, что связано, вероятно, с выявлением лиц, имеющих субклинические формы аутоиммунного тиреоидита.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ АНТИ-ТГ: — новорожденные: высокий титр анти-ТГ у матерей, — хронический тиреоидит Хашимото, — дифференциальная диагностика гипотиреоза, — диффузный токсический зоб (болезнь Грейвса), — послеоперационное ведение больных высокодифференцированным раком ЩЖ в комплексе с ТГ, — в йоддефицитных районах оценка уровня анти-ТГ в сыворотке способствует диагностике аутоиммунной тиреоидной патологии у пациентов с узловым зобом.
РЕФЕРЕНТНЫЕ ПРЕДЕЛЫ – 0 – 100 мЕ/мл
АНТИТЕЛА К ТИРЕОИДНОЙ ПЕРОКСИДАЗЕ
(АНТИ – ТПО)
Тест анти-ТПО используется для верификации аутоиммунных тиреопатий. Обладая способностью связываться с комплементом, анти-ТПО принимают прямое участие в аутоагрессии, то есть являются показателем агрессии иммунной системы по отношению к собственному организму. Тиреоидная пероксидаза обеспечивает образование активной формы йода, который способен включаться в процесс йодификации тиреоглобулина, то есть играет ключевую роль в процессе синтеза тиреоидных гормонов. Антитела к ферменту блокируют его активность, вследствие чего снижается секреция тиреоидных гормонов, в основном тироксина. Анти-ТПО – наиболее чувствительный тест для обнаружения аутоиммунных заболеваний ЩЖ. Обычно их появление является первым сдвигом, который наблюдается в ходе развития гипотиреоза вследствие тиреоидита Хашимото.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ АНТИ-ТПО
Аутоиммунные заболевания ЩЖ являются основным фактором, лежащим в основе гипотиреоза и гипертиреоза, и развиваются у генетически предрасположенных лиц. Таким образом, измерение циркулирующих анти-ТПО является маркером генетической предрасположенности. Наличие анти-ТПО и повышенный уровень ТТГ позволяет прогнозировать развитие гипотиреоза в будущем.
Высокая концентрация анти-ТПО наблюдается при тиреоидите Хашимото (чувствительность 90–100 %)и болезни Грейвса (чувствительность 85 %). Уровень анти-ТПО повышается в 40 – 60 % при ДТЗ, но в меньшем титре, чем при активной стадии тиреоидита Хашимото.
Обнаружение анти-ТПО во время беременности говорит о риске развития у матери послеродового тиреоидита и возможном влиянии на развитие ребенка.
В низких концентрациях анти-ТПО могут встречаться у 5 – 10 % здорового населения и у пациентов с заболеваниями, не связанными со ЩЖ, например, при воспалительных ревматических заболеваниях.
Титр анти-ТПО увеличивается при лечении эстроген-прогестероновыми препаратами и приеме препаратов, влияющих на характер иммунного ответа.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ АНТИ-ТПО
— аутоиммунный тиреоидит,
— прогноз риска гипотиреоза при изолированном повышении уровня ТТГ,
— прогноз послеродового тиреоидита у женщин из групп высокого риска,
— офтальмопатия: увеличение окологлазных тканей (подозрение на «эутиреоидную болезнь Грейвса»).
— новорожденные: гипертиреоз и высокий уровень анти-ТПО или болезнь Грейвса у матери,
— фактор риска тиреоидной дисфункции при терапии интерфероном, интерлейкином-2, препаратами лития, кордароном,
— фактор риска невынашивания беременности и неудачи при оплодотворении.
РЕФЕРЕНСНЫЕ ПРЕДЕЛЫ – 0 – 30 мЕ/мл.
АНТИТЕЛА К МИКРОСОМАЛЬНОЙ ФРАКЦИИ
(АНТИ-МФ)
Аутоантитела к микросомальной фракции выявляются при всех видах аутоиммунных заболеваний ЩЖ, однако, могут обнаруживаться и у здоровых людей. Анти-МФ являются цитотоксичным фактором, непосредственно вызывающим повреждение тиреоидных клеток. Микросомальный антиген является липопротеидом, из которого состоят мембраны пузырьков, содержащие тиреоглобулин. Аутоиммунный тиреоидит – заболевание, которое характеризуется образованием антител к различным компонентам ЩЖ с развитием ее лимфоидной инфильтрации и разрастанием фиброзной ткани. Анти-МФ способны разрушать ЩЖ и снижать ее функциональную активность.
ЗАБОЛЕВАНИЯ И СОСТОЯНИЯ, ПРИ КОТОРЫХ ВОЗМОЖНЫ ИЗМЕНЕНИЯ УРОВНЯ АНТИ-МФ
Наиболее высокие уровни анти-МФ обнаруживаются у пациентов с АИТ Хашимото( у 95 % больных), идиопатической мексидемой, на последней стадии хронического атрофического тиреоидита, особенно у пожилых женщин, довольно часто встречаются у пациентов с выявленной нелеченной формой болезни Грейвса. Анти-МФ определяются у 85 % больных ДТЗ, что указывает на его аутоиммунный генез. Анти-МФ иногда выявляются при раке ЩЖ. Повышенные уровни анти-МФ в ходе 1 триместра беременности указывают на определенную степень риска послеродового тиреоидита.
ПОКАЗАНИЯ К ОПРЕДЕЛЕНИЮ АНТИ-МФ
— тиреоидит Хашимото,
— аутоиммунный характер заболеваний ЩЖ,
— прогноз послеродового тиреоидита у женщин из групп высокого риска,
— высокая степень риска возникновения тиреоидита при наследственной предрасположенности к данному заболеванию, при других формах аутоиммунных процессов (сахарный диабет 1 типа, болезнь Аддисона, пернициозная анемия).
АНТИТЕЛА КРЕЦЕПТОРАМ ТТГ (TTT—RP)
Рецепторы тиреотропного гормона — мембранные структуры тиреоцитов (и, возможно, клеток других органов и тканей). ТТГ-RP являются регуляторными белками, интегрированными в мембране тиреоидной клетки и влияющими как на синтез и секрецию ТГ, так и на клеточный рост. Они специфически связывают ТТГ гипофиза и обеспечивают реализацию его биологического действия. Причиной развития диффузного токсического зоба (болезнь Грейвса) считается появление в крови больных особых иммуноглобулинов — аутоантител, специфически конкурирующих с ТТГ за связывание с рецепторами тиреоцитов и способных оказывать на щитовидную железу стимулирующее влияние, аналогичное ТТГ. Выявление высокого уровня аутоантител к ТТГ-рецепторам в крови больных с болезнью Грейвса является прогностическим предвестником рецидива заболевания (чувствительность 85 % и специфичность 80 %). Фетоплацентарный перенос этих антител является одной из причин врожденного гипертиреоза у новорожденных, если мать страдает болезнью Грейвса. Для получения доказательства об обратимом характере заболевания необходим лабораторный мониторинг, направленный на установление элиминации антител к ТТГ-RP из организма ребенка. Исчезновение антител у ребенка после медикаментозного достижения эутиреоза и устранения зоба служит основанием для решения вопроса о прекращении лекарственной терапии.
Аутоантитела к ТТГ-рецепторам в повышенных количествах могут быть обнаружены у больных с зобом Хашимото, при подостром АИТ. Уровень аутоантител прогрессивно снижается при медикаментозном лечении этих заболеваний или после тиреоидэктомии, что может быть использовано для контроля за эффективностью проводимого лечения.
ПОКАЗАНИЯ К НАЗНАЧЕНИЮ:
|
АБСОЛЮТНЫЕ |
ОТНОСИТЕЛЬНЫЕ |
|
· Дифференциальный диагноз послеродового тиреоидита и БГ при послеродовом тиреотоксикозе. · Прогноз риска фетального/неонатального тиреотоксикоза у женщин с предшествовавшей радиоаблацией ЩЖ по поводу БГ или на фоне текущей терапии тионамидами. |
· Диагностика эутиреоидной офтальмопатии Грейвса. · Расчёт длительности терапии и риска рецидива у пациентов, получающих терапию по поводу БГ (особенно у детей).
|
РЕФЕРЕНСНЫЕ ПРЕДЕЛЫ: Уровень аутоантител к ТТГ-рецепторам в сыворотке в норме составляет до 11 ЕД/л.
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.
АТ ТПО сильно повышен: что это значит, причины отклонений и лечение. Антитела к тиреопероксидазе
Аутоиммунные заболевания щитовидной железы встречаются преимущественно у детей и женщин. На фоне такого недуга иммунитет неправильно реагирует на клетки собственного организма и начинает активно с ним бороться. Подобное состояние может быть опасным во время беременности. Что делать, если АТ к ТПО сильно повышен? Что это значит, чем грозит и какие лечебные меры необходимо предпринять? Когда удается заподозрить патологию и кто обычно ей больше всего подвержен? Ответы на все эти вопросы будут приведены ниже.
Медицинское описание АТ к ТПО
АТ к ТПО представляет собой белок иммунной системы. Определение наличия этого компонента в крови отражает, насколько защитные функции агрессивны по отношению к собственным клеткам в организме. Антитела, как известно, служат основой для иммунной системы человека. Благодаря им могут распознаваться и уничтожаться опасные вредоносные клетки, попадающие в организм из внешней среды. Правда, зачастую они вдруг начинают бороться с родными клетками, так как принимают их за своего врага. Симптомы и причины Базедовой болезни также будут описаны.
Если уровень антител к тиреопероксидазе (АТ к ТПО) значительно повышен, это означает лишь одно – у иммунитета человека происходит некорректная реакция на собственные клетки. В такой ситуации гарантировано развитие патологии, которая влечет за собой опасность в нарушении работы различных органов и систем, что в свою очередь способна приводить к развитию серьезных заболеваний. Причинами повышения выработки антител, как правило, служат нарушения в щитовидной железе, из-за которых происходит проникновение тиреопероксидазы в состав крови из этого органа.
Итак, АТ к ТПО сильно повышен, что это значит? Разберемся.
Тиреоидная пероксидаза необходима организму для производства синтеза йода, который в свою очередь требуется для продуцирования гормонов Т3 и Т4. При возрастании уровня антител синтез йода сильно понижается, а значит это прямым образом оказывает воздействие на процесс выработки гормонов щитовидной железой. При недостаточном количестве таких ферментов происходит развитие патологий ЖКТ, сердечно-сосудистой, нервной и даже дыхательной системы.
Если АТ к ТПО повышен, последствия могут быть очень серьезными.
Нормы содержания белка АТ к ТПО в организме человека
У здоровых людей в возрастной категории до пятидесяти лет норма таких гормонов в крови должна быть ниже значения 5,6 мМЕ/мл. Для тех, кому уже за пятьдесят, этот показатель обычно может повышаться. Данное значение объема рассматриваемого белка достаточно стабильно и совершенно не зависит от пола пациента. Следует сказать, что с ростом антител к ТПО, как правило, сталкиваются около семи процентов населения планеты. АТ к ТПО сильно повышен, что это значит? Об этом далее.
Не лишним будет отметить, что непосредственно само отклонение данного показателя чаще всего наблюдается среди женщин. Установление уровня антител к тиреопероксидазе имеет особое значение в период беременности. Заметный рост показателей сообщает о больших рисках, связанных с вынашиванием плода, или рождением ребенка с возможными врожденными отклонениями. У женщин, которые вынашивают плод, уровень антител в норме должен быть не более 2,6 мМЕ/мл.
Когда следует сдавать анализы на определение уровня антител к тиреопероксидазе?
Проведение анализа крови на данные антитела не считается обязательным для всех категорий пациентов. Такое исследование может понадобиться в следующих ситуациях:
- при беременности;
- при увеличении щитовидной железы;
- в случае подозрения на гипотиреоз;
- риск аутоиммунных заболеваний;
- подозрение на тиреотоксикоз.
Самое важное значение этот анализ, конечно, имеет при беременности. По его результатам врачи-специалисты способны предвидеть риск проявления повышенных антител к тиреопероксидазе и тиреоидита у женщин в послеродовом периоде. В том случае, если объем гормона АТ к ТПО повышен, опасность приобрести патологию увеличивается в два раза по сравнению с нормальными анализами.
Кроме того, этот анализ может понадобиться перед проведением медикаментозной терапии с помощью некоторых лекарственных средств, имеющих негативные эффекты при значительном уровне антител. Необходимо также отметить, что у некоторых пациентов объем АТ может быть повышен даже при отсутствии каких-либо патологий. Также уровень гормона возрастает на фоне прочих аутоиммунных заболеваний, которые не связаны с работой щитовидной железы.
АТ к ТПО повышен — причины
Высокий показатель антител, превышающий норму, как правило, наблюдается при следующих заболеваниях:
- различные вирусные заболевания;
- почечная хроническая недостаточность;
- тиреоидит;
- Базедова болезнь;
- травмы щитовидной железы;
- аутоиммунные заболевания наследственного характера;
- сахарный диабет;
- ревматизм.
Также повышенные антитела к ТПО бывают в том случае, если незадолго до сдачи анализов больному провели лучевую терапию в области головы и шеи. Следует сказать, что анализ на эти антитела не используется в рамках меры для контроля проводимой терапии. Обследование необходимо только для того, чтобы определить имеется ли в наличии патология или нет.
Опасность возрастания уровня антител
Повышенный уровень антител к тиреопероксидазе обосновано считается крайне серьезным отклонением, свидетельствующем о некорректном функционировании иммунной системы. В результате подобного сбоя имеется риск развития недостатка гормонов щитовидной железы, которые являются весьма важными для здоровья нашего организма. Они осуществляют регулировку работы различных органов и тканей, а на фоне их дефицита появляется угроза появления серьезных заболеваний.
Повышенный показатель антител способен приводить к возникновению следующего ряда заболеваний:
- Появление гипертиреоза. Симптомы данной патологии выражаются в резкой потере веса, усталости, раздражительности, учащенном пульсе, выпадении волос, зобе, отдышке, сбое менструального цикла и плохом сне.
- Развитие гипотиреоза. Основными жалобами больных при этой болезни выступают непереносимость низких температур, нарушения работы в желудке и кишечнике, плохое состояние волос и ногтей, избыточный вес.
В том случае, если АТ к ТПО повышен и признаки обнаружены в период беременности, то возникает значительный риск выкидыша или рождения малыша со всевозможными патологиями. Женщины, имеющие повышенный объем антител к тиреопероксидазе, зачастую могут сталкиваться с такой проблемой, как гормональный сбой. Его появление может обернуться большими проблемами со здоровьем женских половых органов.
Лечение при повышенном уровне антител к тиреопероксидазе
Симптомы и причины Базедовой болезни интересуют многих.
Проведение терапии отклонений в объеме АТ ТПО, как правило, заключается в ликвидации аутоиммунных заболеваний, которые приводят к данной патологии. В целях определения точного диагноза докторам необходимо изучить историю болезни пациента, провести различные дополнительные процедуры диагностического характера, а также осуществить подробный анализ крови.
Если обнаружены повышенные антитела к ТПО, то требуется лечение базовых патологий:
- Послеродовой тиреоидит. Зачастую данное заболевание проходит практически без каких-либо симптомов. Молодые женщины сталкиваются с ним, как правило, в первые годы после рождения малыша. Самыми частыми жалобами пациенток становятся усталость, повышенная раздражительность, учащенное сердцебиение, дрожь в руках и ногах. Как и в случае с аутоиммунным типом болезни, здесь требуется симптоматическое лечение. Таблица антител к тиреопероксидазе представлена ниже.
- Базедова болезнь. Эта патология проявляется в слабости, треморе конечностей, формировании токсического зоба, высоком артериальном давлении, повышенном потоотделении и сопровождается аритмией. Правда, такое заболевание достаточно успешно лечится, особенно на своих первых стадиях. В роли медикаментозных методов наиболее часто назначают такие препараты, как «Пропицил» и «Тиамазол». Указанные средства осуществляют блокировку щитовидных функций. Кроме того, пациентам могут назначать радиотерапию щитовидной железы.
- Симптомы аутоиммунного тиреоидита. Эта патология обладает такими симптомами, как снижение концентрации внимания и работоспособности, тремор, резкое повышение веса, сухость кожных покровов и волос, потливость, аритмия. Общая терапия недуга сводится к облегчению основной симптоматики. На данный момент не существует специальных препаратов для проведения лечения этого заболевания. Важно отметить, что обнаружение в составе крови антител не считается однозначным поводом для определения точного диагноза. Нередки случаи, когда подобное отклонение наблюдается и среди абсолютно здоровых людей. Если у пациента показатель ТТГ в норме – это говорит о том, что нет никакого заболевания.
Повышенные антитела к тиреопероксидазе обнаруживаются часто.
Таким образом, всем женщинам рекомендуется регулярный контроль функций щитовидной железы. Кроме того, пациентам может быть назначена заместительная терапия. В случаях сбоя нормальной деятельности сердечной мышцы будет необходимо употребление соответствующих препаратов. Также обязательной считается и витаминная терапия и соблюдение стандартных рекомендаций по здоровому образу жизни. На фоне нарушений функциональности щитовидной железы гормональная терапия вполне может стать пожизненной мерой.
Мы рассмотрели антитела к тиреопероксидазе, что это такое, теперь понятно.
Дополнительная врачебная и народная помощь
Ни в коем случае нельзя недооценивать значение щитовидной железы. И в том случае, если в ее рабочих функциях происходят сбои, требуется незамедлительно обращаться к врачам. Как правило, это относится к ситуациям, когда наблюдается значительно превышенный титр антител к такому ферменту, как пероксидаза. Лечение данного типа нарушения осуществляется посредством использования медикаментозных средств. Доктор, как правило, назначает заместительную гормонотерапию в индивидуальном порядке.
В рамках развития аутоиммунного тиреоидита обычно нельзя исключать возникновение гипотиреоза. Приходится применять лекарственные препараты до тех пор, пока не становится понятно, какой из них подходит больше всего.
Обычным пациентам, ровно, как и беременным, врачи прописывают тиреоидные средства, к примеру, «L-тироксин». От больных требуется регулярная сдача крови. Это делается для того, чтобы доктор сумел лучше рассмотреть общую клиническую картину и определить, успешно ли проходит лечение.
Медикаменты
На фоне такого лечения терапию осуществляют при помощи следующих средств:
- нестероидные средства противовоспалительного характера;
- глюкокортикоиды, например, «Преднизолон».
Для некоторых больных необходимо хирургическое вмешательство, и показания к операции могут быть следующие;
- болезнь Грейвса;
- узловой токсический зоб;
- йодиндуцированный тиреотоксикоз.
В целях общего укрепления всего организма пациентам рекомендуют принимать витамины и адаптогены. Впоследствии доктора назначают препараты, которые придется употреблять в течение всей жизни.
Полезной в лечении окажется и народная медицина, когда уровень антител к тиреопероксидазе станет повышаться. Как правило, в течение трех – четырех месяцев пациент пьет чай, к примеру, из чистотела, ромашки или корня солодки, а по завершении срока ему будет желательно перейти на другие средства.
Если АТ к ТПО повышен, лечение должно быть комплексным и своевременным.
Фитосборы можно готовить себе самостоятельно. В качестве примера подойдет настойка хурмы, которая поможет нормализовать показатели гормона. Порядок действий такой:
- выжать из плода сок;
- смешать двести миллиграммов полученного вещества с парой капель спирта;
- настоять средство в течение двух дней;
- выпивать одну столовую ложку полученного настоя до еды три раза в день.
Особые указания
Но как бы ни была хороша и полезна народная медицина, необходимо учитывать, что на фоне сильно запущенных форм болезни, когда АТ к ТПО сильно повышен (что это значит, мы пояснили выше), уже никакие травы и фитосборы ситуацию исправить не смогут. Поэтому, чтобы состояние пациента не усугублялось еще больше, необходимо заниматься регулярной профилактикой. Кроме того, важно строго соблюдать и выполнять все врачебные предписания. Любые признаки, которые демонстрируют и намекают на неполадки в правильном функционировании щитовидной железы, должны стать сигналом и побуждением к тому, чтобы в срочном порядке пройти необходимое обследование для установления причин нарушений.
Выводы
В том случае, если человек сдал анализ на антитела к тиреопероксидазе, и необходимая норма оказалась превышенной, ни в коем случае не стоит мгновенно впадать в панику. Малые отклонения в значениях вполне вероятны даже среди здоровых людей. Если у вас все же обнаружены некоторые незначительные отклонения, вы сможете привести свои анализы в норму и без употребления дополнительных лекарственных средств. Для этого необходимо будет просто пересмотреть рацион своего питания, и отказаться от всевозможных вредных привычек, предварительно избавившись от лишнего веса. Большинство врачей советуют полностью отказаться от регулярного ношения колье и цепочек на шее, так как некоторые металлы способны отрицательно повлиять на работу щитовидной железы.
Тиреоидит: комплексный подход — Американский семейный врач
1. Пирс EN, Фарвелл AP, Браверман Л.Е. Тиреоидит [опубликованное исправление опубликовано в N Engl J Med. 2003; 349 (6): 620]. N Engl J Med . 2003; 348 (26): 2646–2655 ….
2. Харджай К.Дж., Licata AA. Влияние амиодарона на функцию щитовидной железы. Энн Интерн Мед. . 1997. 126 (1): 63–73.
3. Гори Ф., Польдер КД, Пинтер-Браун LC, и другие.Тиреотоксикоз после терапии денилейкином дифтитоксом у больных грибовидным микозом. Дж. Клин Эндокринол Метаб . 2006. 91 (6): 2205–2208.
4. Deutsch M, Дуракис С, Манезис Е.К., и другие. Нарушения щитовидной железы при хроническом вирусном гепатите и их связь с терапией интерфероном альфа. Гепатология . 1997. 26 (1): 206–210.
5. Schwartzentruber DJ, Белый DE, Цвейг MH, Weintraub BD, Розенберг С.А.Дисфункция щитовидной железы, связанная с иммунотерапией больных раком. Рак . 1991. 68 (11): 2384–2390.
6. Маннавола Д., Коко П, Vannucchi G, и другие. Новый селективный ингибитор тирозинкиназы, сунитиниб, вызывает преходящий гипотиреоз, блокируя захват йода. Дж. Клин Эндокринол Метаб . 2007. 92 (9): 3531–3534.
7. Myers DH, Картер Р.А., Бернс BH, Армонд А, Хуссейн С.Б., Ченгапа ВК.Проспективное исследование влияния лития на функцию щитовидной железы и преобладание антитиреоидных антител. Психол Мед . 1985. 15 (1): 55–61.
8. Перрилд Х, Hegedüs L, Бааструп ПК, Кайзер Л, Кастберг С. Функция щитовидной железы и размер щитовидной железы, определяемый ультразвуком у пациентов, длительно получающих лечение литием. Am J Psychiatry . 1990. 147 (11): 1518–1521.
9. Биндра А, Браунштейн Г.Д.Тиреоидит. Am Fam Врач . 2006. 73 (10): 1769–1776.
10. Menconi F, Хашам А, Томер Ю. Экологические триггеры тиреоидита: гепатит С и интерферон-α. Дж Эндокринол Инвест . 2011. 34 (1): 78–84.
11. Badenhoop K, Boehm BO. Генетическая предрасположенность и иммунологический синапс при диабете 1 типа и аутоиммунных заболеваниях щитовидной железы. Exp Clin Endocrinol Diabetes . 2004. 112 (8): 407–415.
12. Финк Х., Хинтце Г. Аутоиммунный тиреоидит (тиреоидит Хашимото): современная диагностика и терапия [на немецком языке]. Мед Клин (Мюнхен) . 2010. 105 (7): 485–493.
13. Vanderpump MP, Танбридж WM, Французский JM, и другие. Распространенность заболеваний щитовидной железы в сообществе: двадцатилетний период наблюдения Whickham Survey. Клин Эндокринол (Oxf) . 1995. 43 (1): 55–68.
14. Гарбер-младший, Кобин РХ, Гариб Х, и другие.Клинические рекомендации по лечению гипотиреоза у взрослых: при поддержке Американской ассоциации клинических эндокринологов и Американской тироидной ассоциации [опубликованные поправки опубликованы в Endocr Pract. 2013; 19 (1): 175]. Endocr Pract . 2012. 18 (6): 988–1028.
15. Дэниэлс Г.Х. Рекомендации Американской тироидной ассоциации и Американской ассоциации клинических эндокринологов по гипертиреозу и другим причинам тиреотоксикоза: оценка. Endocr Pract . 2011. 17 (3): 325–333.
16. Roti E, Уберти Эд. Послеродовой тиреоидит — обновленная клиническая информация. Eur J Эндокринол . 2002. 146 (3): 275–279.
17. Стагнаро-Грин А. Клинический обзор 152: послеродовой тиреоидит. Дж. Клин Эндокринол Метаб . 2002. 87 (9): 4042–4047.
18. Азизи Ф, Амузегар А. Лечение гипертиреоза во время беременности и кормления грудью. Eur J Эндокринол .2011. 164 (6): 871–876.
19. Певица П.А. Тиреоидит. Острый, подострый и хронический. Med Clin North Am . 1991. 75 (1): 61–77.
20. Фатоуречи В., Анишевский JP, Фатоуречи Г.З., Аткинсон Э.Дж., Jacobsen SJ. Клинические особенности и исходы подострого тиреоидита в когорте заболеваемости: округ Олмстед, штат Миннесота, исследование. Дж. Клин Эндокринол Метаб . 2003. 88 (5): 2100–2105.
21. Нишихара Э, Охе Х, Амино N, и другие.Клиническая характеристика 852 больных подострым тиреоидитом до лечения. Intern Med . 2008. 47 (8): 725–729.
22. Hamaguchi E, Нисимура Y, Канеко С, Такамура Т. Подострый тиреоидит развился у однояйцевых близнецов с разницей в два года. Endocr J . 2005. 52 (5): 559–562.
23. Kramer AB, Роозендал С, Dullaart RP. Семейное возникновение подострого тиреоидита, связанного с лейкоцитарным антигеном человека-B35. Щитовидная железа . 2004. 14 (7): 544–547.
24. Нюлассы С, Гнилица П, Бук М, Гуман М, Hirschová V, Стефанович Я. Подострый (де Кервен) тиреоидит: связь с антигеном HLA-Bw35 и аномалиями системы комплемента, иммуноглобулинов и других белков сыворотки. Дж. Клин Эндокринол Метаб . 1977. 45 (2): 270–274.
25. Вольпе Р. Ведение подострого тиреоидита (болезни ДеКервена). Щитовидная железа .1993. 3 (3): 253–255.
26. Мияучи А. Щитовидная железа: новый алгоритм лечения острого гнойного тиреоидита? Нат Рев Эндокринол . 2010. 6 (8): 424–426.
Тест на антитела к пероксидазе щитовидной железы: что это такое?
Что такое тест на антитела к пероксидазе щитовидной железы? Диагностирует ли он заболевание щитовидной железы?
Ответ Тодда Б. Ниппольдта, доктора медициныПероксидаза щитовидной железы (ТПО) — это фермент, обычно обнаруживаемый в щитовидной железе. TPO играет важную роль в производстве гормонов щитовидной железы.Тест TPO обнаруживает в крови антитела против TPO . Если у вас диагностировано заболевание щитовидной железы, ваш врач может предложить тест на антитела TPO и другие тесты на щитовидную железу, чтобы найти причину.
Наличие в крови антител TPO позволяет предположить, что причиной заболевания щитовидной железы является аутоиммунное заболевание, такое как болезнь Хашимото или болезнь Грейвса. При аутоиммунных заболеваниях ваша иммунная система вырабатывает антитела, которые по ошибке атакуют нормальные ткани.Антитела, которые атакуют щитовидную железу, вызывают отек, редко болезненность и снижение функции щитовидной железы.
Ваш врач может также назначить тест на антитела TPO , если вы беременны и страдаете аутоиммунным заболеванием, затрагивающим щитовидную железу, например, болезнью Хашимото или болезнью Грейвса.
Некоторые люди с антителами TPO могут не иметь заболевания щитовидной железы. Но наличие антител TPO может увеличить риск будущих заболеваний щитовидной железы.
11 августа 2020 г. Показать ссылки- Функциональные тесты щитовидной железы. Американская тироидная ассоциация. https://www.thyroid.org/thyroid-function-tests/. По состоянию на 5 августа 2020 г., .
- Обзор функции щитовидной железы. Руководство Merck Professional Version. https://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/thyroid-disorders/overview-of-thyroid-function?query=overview функция щитовидной железы. По состоянию на 5 августа 2020 г., .
- Послеродовой тиреоидит. Американская тироидная ассоциация.http://www.thyroid.org/postpartum-thyroiditis/. По состоянию на 5 августа 2020 г., .
- Jameson JL, et al., Eds. Физиология и тестирование щитовидной железы. В: Принципы внутренней медицины Харрисона. 20-е изд. Компании Макгроу-Хилл; 2018. https://accessmedicine.mhmedical.com. По состоянию на 5 августа 2020 г., .
- Laposata M. Эндокринная система. В: Лабораторная медицина Лапосаты: Диагностика заболеваний в клинической лаборатории. 3-е изд. Компании Макгроу-Хилл; 2019. https: // accessmedicine.mhmedical.com. По состоянию на 5 августа 2020 г., .
- AskMayoExpert. Тесты щитовидной железы. Клиника Майо; 2020.
.
Антитела к щитовидной железе | Лабораторные тесты онлайн
Источники
A.D.A.M. Медицинская энциклопедия. Венепункция. Обновлено 26 апреля 2019 г. Проверено 3 августа 2021 г. https://medlineplus.gov/ency/article/003517.htm
А.D.A.M. Медицинская энциклопедия. Тест TSI. Обновлено 26 января 2020 г. Проверено 18 августа 20/21. https://medlineplus.gov/ency/article/003685.htm
A.D.A.M. Медицинская энциклопедия. Антитела к тироидной пероксидазе. Обновлено 26 января 2020 г. Проверено 2 августа 2021 г. https://medlineplus.gov/ency/article/003556.htm
A.D.A.M. Медицинская энциклопедия. Антитело. Обновлено 13 августа 2020 г. Проверено 2 августа 2021 г. https://medlineplus.gov/ency/article/002223.htm
A.D.A.M. Медицинская энциклопедия.Тест антитироглобулиновых антител. Обновлено 26 января 2021 г. По состоянию на 2 августа 2021 г. https://medlineplus.gov/ency/article/003557.htm
Американский совет по внутренней медицине. Референсные диапазоны лабораторных испытаний ABIM. Обновлено в июле 2021 г. По состоянию на 11 августа 2021 г. https://www.abim.org/Media/bfijryql/laboratory-reference-ranges.pdf
Американское общество клинической онкологии. Справочник по раку щитовидной железы. Обновлено в январе 2021 г. По состоянию на 29 июля 2021 г. https://www.cancer.net/cancer-types/thyroid-cancer
Американская тироидная ассоциация.Функциональные тесты щитовидной железы. Дата неизвестна. По состоянию на 26 июля 2021 г. https://www.thyroid.org/thyroid-function-tests/
Американская тироидная ассоциация. Гипертиреоз. Дата неизвестна. По состоянию на 24 августа 2021 г. https://www.thyroid.org/hyperthyroidism/
Американская тироидная ассоциация. Гипотиреоз. Дата неизвестна. По состоянию на 24 августа 2021 г. https://www.thyroid.org/hypothyroidism/
Американская тироидная ассоциация. Зоб. Дата неизвестна. По состоянию на 24 августа 2021 г. https://www.thyroid.org / goiter /
ARUP Консультации. Аутоиммунный тиреоидит. Обновлено в феврале 2021 г. По состоянию на 24 августа 2021 г. https://arupconsult.com/content/thyroiditis-autoimmune
Columbia Surgery. Наборы для тестирования щитовидной железы в домашних условиях: что мы знаем… и чего не знаем: интервью с доктором Хесу Лоу. Веб-сайт Columbia Surgery. Дата неизвестна. По состоянию на 18 июня 2021 г. https://columbiasurgery.org/news/home-thyroid-testing-kits-what-we-knowand-what-we-dont
Дэвис TF. Патогенез тиреоидита Хашимото (хронический аутоиммунный тиреоидит).В: Росс Д.С., изд. Своевременно. Обновлено 3 января 2020 г. Проверено 2 августа 2021 г. https://www.uptodate.com/contents/pathogenesis-of-hashimotos-thyroiditis-chronic-autoimmune-thyroiditis
Дэвис TF. Патогенез болезни Грейвса (хронический аутоиммунный тиреоидит). В: Росс Д.С., изд. Своевременно. Обновлено 15 марта 2021 г. По состоянию на 2 августа 2021 г. https://www.uptodate.com/contents/pathogenesis-of-graves-disease
Elhomsy G, Griffing GT. Антитиреоидные антитела. Старос Е.Б., изд. Обновлено 24 декабря 2014 г.По состоянию на 1 августа 2021 г. https://emedicine.medscape.com/article/2086819-overview#a4
Fröhlich E, Wahl R. Аутоиммунитет щитовидной железы: роль антител к щитовидной железе при заболеваниях щитовидной железы и экстратироидных заболеваниях. Фронт Иммунол . 2017; 8: 521. Опубликовано 9 мая 2017 г. doi: 10.3389 / fimmu.2017.00521
Hershman JM. Тиреоидит Хашимото. Руководство Merck Professional Edition. Обновлено в сентябре 2020 г. По состоянию на 1 августа 2021 г. https://www.merckmanuals.com/professional/endocrine-and-metabolic-disorders/thyroid-disorders/hashimoto-thyroiditis
Hershman JM.Обзор функции щитовидной железы. Руководство Merck Professional Edition. Обновлено в сентябре 2020 г. По состоянию на 1 августа 2021 г. https://www.merckmanuals.com/en-ca/professional/endocrine-and-metabolic-disorders/thyroid-disorders/overview-of-thyroid-function
MedlinePlus: Национальная медицинская библиотека. Болезнь Грейвса. Обновлено 18 августа 2020 г. По состоянию на 16 августа 2021 г. https://medlineplus.gov/genetics/condition/graves-disease
MedlinePlus: Национальная медицинская библиотека. Тиреоидит Хашимото.Обновлено 18 августа 2020 г. По состоянию на 1 августа 2021 г. https://medlineplus.gov/genetics/condition/hashimoto-thyroiditis/
MedlinePlus: Национальная медицинская библиотека. Ген ТПО. Обновлено 18 августа 2020 г. По состоянию на 1 августа 2021 г. https://medlineplus.gov/genetics/gene/tpo/
MedlinePlus: Национальная медицинская библиотека. Антитела к щитовидной железе. Обновлено 15 декабря 2020 г. По состоянию на 11 августа 2021 г. https://medlineplus.gov/lab-tests/thyroid-antibodies/
Минсер DL, Ишварлал, Дж.Тиреоидит Хашимото. В: StatPearls. Обновлено 10 августа 2020 г. Проверено 1 августа 2021 г. https://www.ncbi.nlm.nih.gov/books/NBK459262/
Национальный институт сердца, легких и крови. Анализы крови. Дата публикации неизвестна. По состоянию на 5 августа 2021 г. https://www.nhlbi.nih.gov/health-topics/blood-tests
Национальный институт диабета, болезней органов пищеварения и почек. Гипертиреоз (сверхактивная щитовидная железа). Обновлено в августе 2016 г. По состоянию на 24 августа 2021 г. https://www.niddk.nih.gov/health-information/endocrine-diseases/hyperthyroidism
Национальный институт диабета, болезней органов пищеварения и почек.Гипотиреоз (пониженная активность щитовидной железы). Обновлено в марте 2021 г. По состоянию на 1 августа 2021 г.
https://www.niddk.nih.gov/health-information/endocrine-diseases/hypothyroidism
Росс Д.С. Центральный гипотиреоз. В: Купер Д.С., изд. Своевременно. Обновлено 18 ноября 2019 г. По состоянию на 1 августа 2021 г. https://www.uptodate.com/contents/central-hypothyroidism
Росс Д.С. Лабораторная оценка функции щитовидной железы. В: Купер Д.С., изд. Своевременно. Обновлено 11 декабря 2019 г. Проверено 1 августа 2021 г.https://www.uptodate.com/contents/laboratory-assessment-of-thyroid-function
Росс Д.С. Заболевания, вызывающие гипотиреоз. В: Купер Д.С., изд. Своевременно. Обновлено 12 марта 2021 г. По состоянию на 1 августа 2021 г. https://www.uptodate.com/contents/disorders-that-cause-hypothyroidism
Антитело к тиреоглобулину — обзор
Клиническое применение
ТГ-антитела в основном используются для подтверждения диагностического подозрения на тиреоидит Хашимото и обычно запрашиваются вместе с антителами к ТПО.Антитела к ТГ встречаются реже и имеют более низкий титр, чем антитела к ТПО. Учитывая, что у большинства пациентов с тиреоидитом Хашимото есть антитела к ТПО и / или ТГ, отрицательный результат на антитела практически исключает диагноз тиреоидита, поэтому тест имеет высокую прогностическую ценность отрицательного результата.
Напротив, наличие положительных антител не является диагностическим признаком тиреоидита Хашимото, потому что антитела к Tg обнаруживаются при многих других состояниях. Они присутствуют примерно в 50% случаев болезни Грейвса, 20% случаев нетоксичного зоба и рака щитовидной железы, а также у нормальных людей, особенно у пожилых женщин.Антитела к ТГ также обнаруживаются при аутоиммунных заболеваниях, не связанных с щитовидной железой, таких как синдром Шегрена, миастения, целиакия и диабет 1 типа [9]. Это открытие свидетельствует о том, что аутоиммунитет щитовидной железы более распространен, чем настоящий тиреоидит Хашимото. Титр антител к ТГ обычно не коррелирует со степенью дисфункции щитовидной железы.
Вторым показанием к измерению антител к ТГ является оценка риска развития аутоиммунного тиреоидита. 20-летнее исследование на уровне сообщества в Англии показало, что наличие антител к щитовидной железе является основным фактором риска для выявления лиц, подверженных риску тиреоидита [10].То же исследование показало, что антитела к ТГ также полезны при оценке риска развития послеродового тиреоидита.
Еще одно важное применение антител к ТГ — наблюдение за пациентами с дифференцированным раком щитовидной железы. После тиреоидэктомии и удаления радиоактивного йода пациентам следует измерить уровень ТГ в сыворотке. Учитывая, что Tg является тканеспецифическим белком, экспрессирующимся почти исключительно в клетках щитовидной железы, повышенные концентрации Tg во время наблюдения указывают на рецидив опухоли или метастазирование.В этом случае присутствие антител к ТГ может вызывать ложно низкие значения ТГ [11]. В настоящее время многие центры автоматически измеряют антитела к ТГ, когда они запрашиваются у пациента с раком щитовидной железы.
Антитела к ТГ, как и антитела к ТПО и рецепторам ТТГ, падают и исчезают после удаления и абляции щитовидной железы [12]. Такое поведение может указывать на то, что основными продуцентами антител были В-лимфоциты, расположенные в щитовидной железе, или что для их производства требуется постоянство ТГ в организме, или что высвобождение большого количества антигенов во время операции вызвало апоптоз аутореактивные лимфоциты, специфичные для щитовидной железы.
Отчет о случае тироид-ассоциированной орбитопатии с повышенным уровнем антител к ТПО | BMC Endocrine Disorders
Yoshihara A, Yoshimura Noh J, Nakachi A, et al. Тяжелая тирео-ассоциированная орбитопатия при тиреоидите Хашимото. Отчет о 2 случаях. Endocr J. 2011; 58: 343–8 ..
CAS Статья Google ученый
Cyranska-Chyrek E, Olejarz M, Szczepanek-Parulska E, Stajgis P, Pioch A, Ruchala M. Тяжелая односторонняя орбитопатия у пациента с тиреоидитом Хашимото — отчет о клиническом случае.BMC Ophthalmol. 2019; 19 (1): 9. https://doi.org/10.1186/s12886-018-1018-5 ..
Статья PubMed PubMed Central Google ученый
Haugen BR. Лекарства, подавляющие ТТГ или вызывающие центральный гипотиреоз. Передовой опыт и исследования . Clin Endocrinol Metab. 2009. 23 (6): 793–800. https://doi.org/10.1016/j.beem.2009.08.003 ..
CAS Статья Google ученый
Moncef B, Anne LV. Орбитопатия dysthyroïdienne. (П. Шансон и П. Бугнер, ред.). Méd Clin Endocrinol Diab. 2018; 92: 73–8 Получено с https://www.sfdiabete.org/sites/www.sfdiabete.org/files/article/2018_jndes_mced_92_bd.pdf ..
Google ученый
Менгисту М., Лукес Ю.Г., Надь Э.В., Берч Х.В., Карр Ф.Э., Лахири С. и др. Экспрессия гена рецептора ТТГ в ретроокулярных фибробластах. J Endocrinol Investig. 1994. 17 (6): 437–41..
CAS Статья Google ученый
Paschke R, Metcalfe A, Alcalde L, Vassart G, Weetman A, Ludgate M. Наличие нефункциональных транскриптов вариантов рецепторов тиреотропина в ретроокулярных и других тканях. J Clin Endocrinol Metab. 1994. 79 (5): 1234–8.
CAS PubMed Google ученый
Айер С., Бан Р. Иммунопатогенез офтальмопатии Грейвса: роль рецептора ТТГ.Лучшая практика Res Clin Endocrinol Metab. 2012; 26 (3): 281–9.
CAS Статья Google ученый
Шан С.Дж., Дуглас Р.С. Патофизиология заболеваний щитовидной железы глаз. J Neuroophthalmol. 2014. 34 (2): 177–85.
Артикул Google ученый
Lahooti H, Parmar KR, Wall JR. Патогенез тироид-ассоциированной офтальмопатии: играет ли роль аутоиммунитет против кальсеквестрина и коллагена XIII? Clin Ophthalmol.2010; 4: 417–25.
PubMed PubMed Central Google ученый
Kahaly GJ, Diana T, Glang J, Kanitz M, Pitz S, Konig J. Антитела, стимулирующие тиреоид, широко распространены при тиреоидите Хашимото и связанной с ним орбитопатии. J Clin Endocrinol Metab. 2016; 101 (5): 1998–2004.
CAS Статья Google ученый
Бозкурт Северная Каролина, Карбек Б., Уджан Б., Сахин М., Чакал Е., Озбек М. и др.Связь между серьезностью дефицита витамина D и тиреоидитом Хашимото. Endocr Pract. 2013. 19 (3): 479–84.
Артикул Google ученый
Ким Д. Низкий уровень витамина D связан с гипотиреозным тиреоидитом Хашимото. Гормоны (Афины). 2016; 15 (3): 385–93.
Google ученый
Мансурния Н., Мансурния М.А., Саиди С., Дехан Дж. Связь между уровнями 25OHD в сыворотке и тиреоидитом Хашимото при гипотиреозе.J Endocrinol Investig. 2014. 37 (5): 473–6.
CAS Статья Google ученый
Lahooti H, Edirimanne S, Walsh JP, Delbridge L, Hibbert EJ, Wall JR. Однонуклеотидный полиморфизм 1623 a / G (rs180195) в промоторе гена тиреоглобулина связан с аутоиммунным заболеванием щитовидной железы, но не с офтальмопатией щитовидной железы. Clin Ophthalmol. 2017; 11: 1337–45.
CAS Статья Google ученый
Бодду Н., Джумани М., Вадхва В., Баджадж Г., Фаас Ф. Не всякая орбитопатия — это могила: обсуждение случаев и обзор литературы. Фронт-эндокринол (Лозанна). 2017; 8: 184.
Артикул Google ученый
Макнаб А.А., МакКелви П. Офтальмологические заболевания, связанные с IgG4. Часть II: клинические аспекты. Офтальмологический Plast Reconstr Surg. 2015; 31 (3): 167–78.
Артикул Google ученый
Ручала М., Щепанек Э., Пущевич М., Сосновский П., Совинский Ю. Не место для захоронения. Am J Med. 2011. 124 (3): 210–4.
Артикул Google ученый
Kahaly GJ. Визуализация при тироид-ассоциированной орбитопатии. Eur J Endocrinol. 2001. 145 (2): 107–18.
CAS Статья Google ученый
Tjiang H, Lahooti H, McCorquodale T, Parmar KR, Wall JR.У пациентов с тиреоидитом Хашимото часто встречаются аномалии глаз и век. Щитовидная железа. 2010. 20 (3): 287–90.
Артикул Google ученый
Кан Э., Кан Э.К., Эцемис Дж., Чолак Р. Наличие тироид-ассоциированной офтальмопатии при тиреоидите Хашимото. Int J Ophthalmol. 2014. 7 (4): 644–7.
PubMed PubMed Central Google ученый
Grzesiuk W, Szydlarska D, Pragacz A, Bar-Andziak E.Орбитопатия, связанная с щитовидной железой, у пациентов с тиреоидитом Хашимото: клинический случай. Pol Arch Med Wewn. 2008. 118 (5): 318–21.
PubMed Google ученый
Кирмизибекмез Х., Есилтепе Мутлу РГ. Атипичное проявление болезни Хашимото у подростка: офтальмопатия, связанная с щитовидной железой. J Clin Res Pediatr Endocrinol. 2014; 6 (4): 262–5.
Артикул Google ученый
Verma R, Gupta M, Mehta VK. Орбитопатия, связанная с щитовидной железой. BMJ Case Rep.2013; 2013: bcr2013009920.
PubMed PubMed Central Google ученый
Ручала М., Савицка-Гутай Н. Достижения в фармакологическом лечении орбитопатии Грейвса. Эксперт Rev Clin Pharmacol. 2016; 9 (7): 981–9.
CAS Статья Google ученый
Барталена Л., Балдески Л., Боборидис К., Экштейн А., Кахали Г.Дж., Маркоччи С. и др.Руководство Европейской ассоциации щитовидной железы / Европейской группы по орбитопатии Грейвса 2016 г. по лечению орбитопатии Грейвса. Eur Thyroid J. 2016; 5 (1): 9–26.
CAS Статья Google ученый
Zang S, Ponto KA, Kahaly GJ. Клинический обзор: внутривенные глюкокортикоиды при орбитопатии Грейвса: эффективность и заболеваемость. J Clin Endocrinol Metab. 2011. 96 (2): 320–32.
CAS Статья Google ученый
Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly G.J, Marcocci C, Perros P, Salvi M, Wiersinga W., M: Европейская ассоциация щитовидной железы / Европейская группа по орбитопатии Грейвса 2016 г. ‘Орбитопатия. Eur Thyroid J. 2016; 5: 9–26.
CAS Статья Google ученый
Drutel A, Archambeaud F, Caron P. Селен и щитовидная железа: еще одна хорошая новость для врачей. Clin Endocrinol.2013. 78 (2): 155–64.
CAS Статья Google ученый
Fröhlich E, Wahl R. Аутоиммунитет щитовидной железы: роль антител к щитовидной железе при заболеваниях щитовидной железы и вне щитовидной железы. Фронт Иммунол. 2017; 8: 521. https://doi.org/10.3389/fimmu.2017.00521.
CAS Статья PubMed PubMed Central Google ученый
Обзор теста на антитела к тироидной пероксидазе
Пероксидаза щитовидной железы (ТПО) — это фермент, вырабатываемый вашей щитовидной железой, железой в форме бабочки, расположенной в передней части шеи.Щитовидная железа использует ТПО вместе с йодом для выработки гормонов щитовидной железы трийодтиронина (Т3) и тироксина (Т4). Вместе эти гормоны регулируют температуру тела, частоту сердечных сокращений и обмен веществ. Они также способствуют росту, развитию и созреванию мозга и нервной системы.
Томас Барвик / Getty ImagesАнтитела служат определенной цели в вашем теле; они защищают от бактерий, вирусов и токсинов. У человека со здоровой функционирующей иммунной системой организм рассматривает ТПО как важный фермент, вырабатывающий гормоны.Однако у людей с аутоиммунным заболеванием в организме могут образовываться белки, называемые антителами, которые атакуют здоровые ткани и органы, включая щитовидную железу.
Если у вас аутоиммунное заболевание щитовидной железы, уровень антител к ТПО в крови может увеличиваться, и его можно определить с помощью простого анализа крови. Для определения причины и постановки диагноза может потребоваться дальнейшее обследование.
Назначение
Тест на антитела к ТПО проводится для диагностики тиреоидита Хашимото.Симптомы, которые могут указывать на тиреоидит Хашимото, включают:
- Усталость
- Нарушения менструального цикла
- Сухая кожа
- Хрупкие ногти
- Запор
- Непереносимость холода
- Мышечные боли
- Депрессия
- Мозговой туман
Кроме того, ваш лечащий врач может назначить другие тесты щитовидной железы в сочетании с тестом на антитела к ТПО, которые могут включать антитела к тиреоглобулину, тиреотропный гормон (ТТГ), свободный гормон Т4 и гормон Т3.
Риски и противопоказания
Тест на антитела к ТПО считается безопасным, и риски, связанные с ним, незначительны. Если у вас уже брали кровь из руки, этот тест будет аналогичным. Вены различаются от человека к человеку. В некоторых случаях у медсестры или техника могут возникнуть проблемы с поиском вены, и, возможно, потребуется ввести иглу более одного раза для сбора крови. Это может вызвать легкую боль.
Кроме того, вы можете испытать синяк или покалывание при введении иглы — синяк можно облегчить или свести к минимуму, если удерживать повязку на месте в течение того времени, которое врач рекомендует после взятия крови.Дискомфорт должен исчезнуть через день-два. В редких случаях вена может набухать и вызывать состояние, известное как флебит, которое часто лечится с помощью теплых компрессов в течение дня.
Иногда при анализе крови люди могут чувствовать слабость или головокружение. Если это относится к вам, обязательно сообщите об этом специалисту, чтобы вы могли посидеть в кресле в течение нескольких минут, прежде чем вставать. Вы также можете пройти тест в положении лежа.
Перед испытанием
Поскольку тест на антитела к ТПО можно проводить вместе с другими тестами на щитовидную железу, ваш лечащий врач может попросить вас прекратить прием лекарств, которые могут повлиять на уровень вашей щитовидной железы.Сюда могут входить препараты для заместительной терапии щитовидной железы, стероиды, некоторые сердечные препараты и другие.
Обязательно сообщите своему врачу о любых лекарствах, травах и добавках (в том числе безрецептурных), которые вы принимаете.
Ваш лечащий врач предоставит вам конкретные инструкции по сдаче этого анализа крови. Вас могут попросить воздержаться от еды и питья в течение нескольких часов перед сдачей крови; часто это удобнее всего делать накануне обследования.
В день теста вы сможете носить обычную одежду. Но чтобы специалисту было легче получить доступ к вашим венам, вы можете подумать о том, чтобы надеть рубашку с закатанными рукавами. Кроме того, не забудьте взять с собой свою страховую карту и документ, удостоверяющий личность, чтобы медицинское учреждение могло выставить счет вашей страховой компании.
Помните, что компенсация за тестирование варьируется в зависимости от страховой компании, поэтому вам может потребоваться поговорить со своим оператором связи, чтобы определить, нужно ли вам предварительное одобрение при проведении теста на антитела к TPO.
Во время теста
Обычно лаборант просит вас сесть в кресло, а одна рука лежит перед вами. Затем лаборант наложит на эту руку эластичную ленту, чтобы на короткое время ограничить кровоток и определить местонахождение вены. После этого продезинфицируют участок тампоном со спиртом или тампоном.
После дезинфекции этой области они вставят иглу в вашу руку и присоединят трубку для сбора крови у основания шприца.Когда будет набрано достаточно крови для анализа, лаборант снимет эластичную ленту, вытащит иглу и наложит повязку на место прокола. Обычно такой анализ крови занимает всего несколько минут.
После испытания
После теста ваш лечащий врач при необходимости предоставит вам конкретные инструкции по дальнейшим действиям. Например, если перед тестом вам пришлось голодать или пропустить прием лекарств, ваш лечащий врач сообщит вам, можно ли возобновить прием пищи и рецепт.
Если не указано иное, вам следует вернуться к своей обычной деятельности. Как правило, результаты анализов приходят через пару дней.
Интерпретация результатов
Если в вашей крови не обнаружены антитела, это считается нормальным отрицательным результатом. Если ваш тест положительный, то есть антитела присутствовали в вашей крови, это может указывать на аутоиммунное заболевание, влияющее на вашу щитовидную железу. Если тест отрицательный, вероятность того, что у вас болезнь Хашимото, ниже.
Сам по себе тест на антитела к ТПО имеет ограниченную диагностическую ценность. Это связано с тем, что 8% мужчин и 14,6% женщин будут иметь положительный результат теста на антитела к ТПО, даже если у них нормально функционирующие щитовидные железы.
Только при сравнении антител к ТПО с другими тестами на щитовидную железу, особенно с ТТГ, поставщик медицинских услуг может поставить более точный диагноз. Даже в этом случае, если заболевание носит субклинический характер (без явных симптомов) или ТТГ находится на грани нормы, некоторые эксперты не рекомендуют проводить тестирование на антитела к ТПО.Это может заставить вас поверить в то, что у вас аутоиммунное заболевание щитовидной железы, когда вы этого не сделаете, и отвлечет вас от истинной причины ваших симптомов.
Скорее всего, ваш лечащий врач будет рассматривать ваши тесты как часть более широкой картины, которая включает в себя другие результаты лабораторных исследований щитовидной железы, ваши симптомы и вашу историю болезни.
Слово Verywell
Если вы получили положительный результат теста на антитела к ТПО, вашей первой реакцией может быть легкое нервозность.Но помните, что у вас может быть положительный результат теста по нескольким причинам, и вам доступно множество вариантов лечения. Чтобы расслабиться, убедитесь, что у вас есть медицинский работник, которому вы доверяете. Надежный поставщик может ответить на любые вопросы и проблемы, чтобы вместе вы оба могли принять наилучшее решение для своего здоровья.
Дисфункция щитовидной железы у пациентов с сахарным диабетом 1 типа
Продольное исследование
Abstract
ЦЕЛЬ — Поперечные исследования показали, что риск дисфункции щитовидной железы у пациентов с диабетом 1 типа в два-три раза выше, чем в общей популяции.Однако продольные исследования для определения естественного течения дисфункции щитовидной железы у пациентов с диабетом 1 типа отсутствуют.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ — Мы проанализировали частоту нарушения функции щитовидной железы с течением времени в когорте из 58 пациентов (26 мужчин и 32 женщины), включенных в исследование по контролю диабета и его осложнений в Научном центре здравоохранения Университета Теннесси в 1983 г. и перспективно отслеживается в течение 18 лет. Пациентам ежегодно проводились измерения функциональных тестов щитовидной железы (тиреотропный гормон [ТТГ], тироксин и трийодтиронин), а с 4-летними интервалами — антитела к тироидной пероксидазе (ТПО).
РЕЗУЛЬТАТЫ — У 18 пациентов был гипотиреоз, а у 1 пациента — преходящий гипертиреоз. У двух субъектов развился гипотиреоз за 7 и 18 лет до развития диабета, и они были исключены из анализа. Средний возраст диагноза составлял 19 ± 2 года для диабета 1 типа и 29 ± 3 года для гипотиреоза. Гипотиреоз чаще встречался у женщин (41%), чем у мужчин (19%), и у пациентов с положительными антителами к ТПО. Пациентов с положительным результатом на ТРО было 17 лет.Вероятность развития гипотиреоза в 91 раз выше, чем у пациентов с отрицательным ТПО (95% ДИ 3,89–82,54). Не было различий в ИМТ, липидном профиле и HbA 1c между пациентами с дисфункцией щитовидной железы и без нее.
ВЫВОДЫ —Это продолжительное исследование подтверждает связь между аутоиммунной дисфункцией щитовидной железы и диабетом 1 типа. Наши результаты показывают, что все пациенты с диабетом 1 типа должны проходить ежегодный скрининг по измерению ТТГ в сыворотке для выявления бессимптомной дисфункции щитовидной железы, особенно у пациентов с положительными антителами к ТПО.
Заболевания щитовидной железы широко распространены среди населения в целом (1). Поперечные исследования показали, что 7,5% женщин и 2,8% мужчин всех возрастов в Уикхэме, Великобритания, имели аномальные уровни тиреотропного гормона (ТТГ) в сыворотке крови (2). Недавно в исследовании распространенности заболеваний щитовидной железы в Колорадо сообщается, что среди 25 682 субъектов, посещающих ярмарку здоровья в масштабе штата, у 11,7% субъектов наблюдалась аномальная концентрация ТТГ в сыворотке крови (3). Первичный гипотиреоз (ТТГ> 5,1 мЕд / л) выявлен у 9.5% и гипертиреоз у 2,1% пациентов, большинство из которых протекали бессимптомно (3). Распространенность дисфункции щитовидной железы увеличивается с возрастом и у пациентов с антителами к щитовидной железе (4–8). В 20-летнем последующем исследовании когорты Wickham (2) среднегодовая частота спонтанного гипотиреоза увеличилась с 4 до 27% у женщин с положительными антителами к щитовидной железе. Недавно было проведено Третье национальное обследование здоровья и питания (NHANES III), проведенное среди 17 353 человек в возрасте ≥12 лет, представляющих географическое и этническое распределение U.В популяции S. сообщалось о распространенности гипотиреоза у 4,6% (0,3% клинических и 4,3% субклинических) и гипертиреоза у 1,3% (0,5% клинических и 0,7% субклинических) (9).
Аутоиммунные заболевания щитовидной железы являются наиболее распространенными иммунологическими заболеваниями у пациентов с диабетом 1 типа (10–13). Поперечные исследования показали распространенность гипотиреоза у 12–24% женщин и ∼6% мужчин с диабетом 1 типа, а также у 3–6% пациентов с диабетом 2 типа (11–14). Гипертиреоз встречается у 1-2% пациентов с диабетом (11,15).Распространенность положительных антител к тироидной пероксидазе (ТПО) (ранее называвшихся антимикросомными антителами к щитовидной железе) сообщалось примерно у 80% пациентов с диабетом 1 типа и повышенным уровнем ТТГ и от 10 до 20% у лиц с диабетом с нормальным уровнем ТТГ. (15–18). У большинства пациентов заболевание субклиническое, и развитие диабета обычно предшествует диагностике гипотиреоза (15). Из-за повышенной распространенности дисфункции щитовидной железы у пациентов с диабетом 1 типа рекомендуется регулярный скрининг ТТГ (10).Однако отсутствуют долгосрочные проспективные исследования по оценке частоты и естественного течения заболеваний щитовидной железы у пациентов с диабетом 1 типа. Поэтому мы оценили статус щитовидной железы и наличие антител к ТПО у 58 пациентов с диабетом 1 типа, включенных в исследование по контролю и осложнениям диабета (DCCT), и проспективно наблюдали за ними в течение последних 18 лет.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ
DCCT было многоцентровым рандомизированным клиническим исследованием, разработанным для определения того, повлияет ли режим интенсивного лечения на появление или прогрессирование микрососудистых осложнений у пациентов с диабетом 1 типа (19).Всего в 29 клинических центрах был набран 1441 пациент, срок наблюдения составил 6,5 ± 1,6 года. Основными критериями отбора были инсулиновая зависимость, о чем свидетельствует недостаточная секреция С-пептида; возрастной диапазон 13–39 лет; и отсутствие гипертонии, гиперхолестеринемии и тяжелых осложнений диабета или заболеваний. Подробное описание критериев отбора и процедур рандомизации субъектов, поступающих в DCCT, было описано в другом месте (20). После завершения этого знакового исследования все пациенты были включены в исследование «Эпидемиология вмешательств и осложнений диабета» (EDIC) и продолжали проходить ежегодное наблюдение (21).В Центре медицинских наук Университета Теннесси в Мемфисе в 1983 г. в DCCT были включены в общей сложности 58 пациентов с диабетом 1 типа, за которыми они проспективно наблюдались в течение последних 18 лет. Помимо мониторинга гликемического контроля и осложнений диабета, все пациенты ежегодно проходили тесты функции щитовидной железы (ТТГ, тироксин [T 4 ] и трийодтиронин [T 3 ]). Присутствие ТПО определяли с 4-летними интервалами в замороженной сыворотке (хранящейся при -70 ° C) 54 пациентов.Институциональный наблюдательный совет Центра медицинских наук Университета Теннесси в Мемфисе одобрил это исследование.
По результатам тестов функции щитовидной железы пациенты были разделены на четыре группы: 1 ) нормальные, когда общий или свободный T 4 и ТТГ были в пределах нормы; 2 ) гипотиреоз, когда общий T 4 был <60 нмоль / л и ТТГ> 5,0 мЕд / л; 3 ) субклинический гипотиреоз, когда общий или свободный T 4 был в пределах нормы, но ТТГ был> 5.0 мЕд / л; и 4 ) гипертиреоз, когда уровень сывороточного ТТГ был снижен и составлял <0,03 мЕд / л. Чтобы определить, подвержены ли пациенты с диабетом 1 типа более высокому риску развития дисфункции щитовидной железы, чем население в целом, результаты сравнивали с распространенностью дисфункции щитовидной железы и наличием антител к ТПО, о которых недавно сообщалось в NHANES III (9). Это исследование было разработано с целью дать национальные нормативные оценки состояния здоровья и питания гражданского неинституционализированного населения США, проведенное с 1988 по 1994 год с использованием стратифицированного многоступенчатого вероятностного плана.NHANES III измерял ТТГ в сыворотке, общий Т 4 в сыворотке и антитела к ТПО у 17 353 человек в возрасте ≥12 лет, которые представляли географическое и этническое население США (9).
Анализы.
Количественные уровни антител к ТПО измеряли на анализаторе DPC Immulite (Diagnostic Product Corporation, Лос-Анджелес), который использует твердофазную двухсайтовую последовательную иммунометрическую методологию. Антитела ТПО ранее назывались антимикросомными антителами, потому что антитела связываются с микросомальной частью клеток щитовидной железы.Чувствительность анализов составляла 3 МЕ / мл для антител к ТПО и 0,002 мЕ / мл для анализа ТТГ третьего поколения. Концентрации ТТГ в сыворотке, Т 4 и Т 3 были измерены в клинических лабораториях Общего клинического исследовательского центра или в эндокринологических лабораториях Университета Теннесси, Мемфис. Нормальные диапазоны были <32 МЕ / мл для антител к ТПО и 0,4–4,0 мЕд / мл для ТТГ. Анализы общего Т 4 и Т 3 в сыворотке выполнялись в соответствии с рекомендациями производителей и соответствовали техническим требованиям.Для контроля качества были проанализированы три уровня контролей при каждом запуске для каждого анализа и всех значений.
Статистический анализ.
StatView версии 5.0 (Институт SAS, Кэри, Северная Каролина) использовался для сравнения демографических и клинических характеристик пациентов с гипотиреозом и пациентов без него. Непрерывные переменные сравнивались с помощью теста Стьюдента t и категориальных переменных с помощью χ 2 критериев независимости. Данные выражены в виде средних значений ± SE.
Система SAS для Windows версии 8.1 (Институт SAS) был использован для проведения логистической регрессии и анализа пропорциональных рисков Кокса на подгруппе из 54 из 58 пациентов, у которых было выявлено отсутствие гипотиреоза в начале диабета 1 типа. Оба анализа были сосредоточены на оценке возникновения гипотиреоза в зависимости от возраста начала диабета, пола и наличия или отсутствия TPO. Во всех случаях критерий статистической значимости был установлен на уровне 0,05 перед тестированием.
РЕЗУЛЬТАТЫ
В исследование DCCT из нашего учреждения было включено 58 пациентов, 26 мужчин и 32 женщины (Таблица 1).Средний возраст постановки диагноза диабета составлял 19 ± 2 года (диапазон 2–37). У 19 (33%) пациентов была дисфункция щитовидной железы. Восемнадцать пациентов со средним возрастом на момент постановки диагноза 29 ± 3 года (диапазон 11–48) имели первичный гипотиреоз. У двух субъектов развился гипотиреоз за 7 и 18 лет до развития диабета, и они были исключены из статистического анализа. У остальных пациентов среднее время между диагностированием диабета и гипотиреоза составило 13 ± 3 года (диапазон 4–32). Не было различий в ИМТ, липидном профиле и HbA 1c при постановке диагноза или во время наблюдения между пациентами с гипотиреозом и без него.
Наличие антител к ТПО было связано с повышенным риском гипотиреоза (рис. 1). В общей сложности 18 (33%) пациентов имели положительные антитела к ТПО (8 мужчин и 10 женщин). Гипотиреоз чаще всего встречался у женщин с положительными (83%) по сравнению с отрицательными (12%) антителами к ТПО ( P <0,001). Точно так же частота гипотиреоза была выше у мужчин с положительными (51%), чем с отрицательными (3%) антителами к ТПО ( P <0,001). Большинство субъектов с положительными антителами к ТПО (17 из 18) дали положительный результат в начале исследования и оставались положительными на протяжении всего периода исследования.У одного пациента с исходным отрицательным титром ТПО через 12 лет наблюдения развились низкие титры ТПО. Мы не наблюдали статистически значимых различий в значениях ТТГ при диагностике гипотиреоза между пациентами с положительными (8 ± 1 мЕд / л) и отрицательными (9 ± 3 мЕд / л) антителами.
Средний возраст начала гипотиреоза составлял 38 ± 4 года для ТПО-отрицательных субъектов и 33 ± 3 года для ТПО-положительных субъектов ( P = NS), а средний возраст начала диабета составлял 17 ± 1 год. для отрицательных TPO и 18 ± 2 лет для положительных TPO ( P = NS).Логистическая регрессия гипотиреоза (положительный или отрицательный) по возрасту в начале, полу и статусу TPO (положительный или отрицательный) была значимой (отношение правдоподобия χ 2 = 17,33, P = 0,0005). Хотя возраст начала диабета ( P = 0,68) и пол ( P = 0,45) не оказались статистически значимыми предикторами гипотиреоза в многофакторной модели, они были сохранены в модели для получения отношения шансов для статуса TPO. , что было значимым ( P = 0.0002) с поправкой на их эффекты. У пациентов с положительным результатом на ТПО вероятность развития гипотиреоза в 17,91 раза выше, чем у пациентов с отрицательным результатом на ТПО (95% ДИ 3,89–82,54), с учетом возраста начала диабета и пола.
Анализ пропорциональных рисков Кокса для прогнозирования развития гипотиреоза в зависимости от возраста начала, пола и статуса TPO подтвердил результаты логистической регрессии (отношение правдоподобия χ 2 = 15,88, df = 3, P = 0,001). С поправкой на влияние пола и возраста на начало диабета, статус TPO был значимым детерминантом гипотиреоза ( P = 0.001). Скорректированное отношение рисков для статуса TPO, равное 8,99 (95% ДИ 2,35–34,36), указывает на то, что пациенты с положительным результатом TPO с гораздо большей вероятностью разовьются гипотиреозом в следующем временном интервале, чем пациенты с отрицательным результатом на TPO с аналогичным временем, прошедшим с момента начала заболевания. диабет.
У большинства пациентов развился субклинический гипотиреоз. За исключением трех пациентов, которые жаловались на усталость, у большинства пациентов не было симптомов на момент постановки диагноза гипотиреоз, и ни у одного из них не развился клинически значимый гипотиреоз в течение периода исследования.Средняя концентрация ТТГ при диагностике гипотиреоза составляла 8 ± 1 мЕд / л (диапазон 5,3–12,2). Средний уровень ТТГ в группе эутиреоидов при включении в исследование составлял 1,9 ± 0,2 мЕд / л и оставался на том же уровне в течение периода исследования. За исключением одного пациента, который не лечился, все субъекты с гипотиреозом получали терапию левотироксином в средней суточной дозе 128 мкг. Средний уровень ТТГ во время заместительной терапии составил 2,2 ± 0,2 мЕд / л.
У одного пациента с положительными антителами к ТПО был преходящий бессимптомный период подавления ТТГ (0.03 мЕд / л) на четвертый год наблюдения. Его уровень ТТГ в сыворотке спонтанно вернулся к нормальному значению в следующем году и после этого оставался в пределах нормы. По-видимому, не было сопутствующего заболевания или стресса во время подавленного уровня ТТГ.
ВЫВОДЫ
Это долгосрочное и проспективное исследование предоставляет окончательные доказательства связи между аутоиммунным гипотиреозом и диабетом 1 типа. Заболеваемость гипотиреозом была выше у женщин, особенно с положительными антителами к ТПО.С поправкой на влияние пола и возраста на начало диабета, статус TPO был значимым детерминантом гипотиреоза ( P = 0,0013). С учетом возраста начала диабета и пола у пациентов с положительным результатом на ТПО вероятность развития гипотиреоза в 17,91 раза выше, чем у пациентов с отрицательным результатом на ТПО (95% ДИ 3,89–82,54).
Связь между диабетом и заболеванием щитовидной железы была признана давно, хотя сообщаемая распространенность дисфункции щитовидной железы в популяциях с диабетом широко варьируется между исследованиями (10–18).Поперечные исследования показали распространенность гипотиреоза у 12–24% женщин и ∼6% мужчин с диабетом 1 типа, а также у 3–6% пациентов с диабетом 2 типа (11–13). Точно так же мы наблюдали более высокий уровень дисфункции щитовидной железы, чем в общей популяции. Недавно NHANES III сообщил о распространенности гипотиреоза у 4,6% (0,3% клинических и 4,3% субклинических) и гипертиреоза у 1,3% (0,5% клинических и 0,7% субклинических) и о преобладании положительных антител к ТПО в 13% случаев.С. популяция (9). В соответствии с этими сообщениями, мы наблюдали более высокую распространенность дисфункции щитовидной железы при диабете 1 типа, чем в общей популяции, особенно у пациентов с положительными антителами к ТПО. Распространенность гипотиреоза была достоверно связана с положительными антителами к ТПО (OR 8,4, 95% CI 5,8–12,1). Среди субъектов с положительными антителами к ТПО и гипотиреозом во время последующего наблюдения 95% дали положительный результат в начале исследования и оставались положительными на протяжении всего периода наблюдения.В этом исследовании было обнаружено, что использование TPO для прогнозирования гипотиреоза имеет положительную прогностическую ценность 67% и отрицательную прогностическую ценность 90%. Несмотря на связь между положительными антителами к ТПО щитовидной железы и последующим развитием гипотиреоза, ежегодное измерение ТТГ в сыворотке крови является предпочтительным скрининговым тестом для выявления бессимптомной дисфункции щитовидной железы. Если бы мы использовали антитела к ТПО в качестве единственного диагностического инструмента в текущем исследовании, то мы бы пропустили 28% случаев субклинического гипотиреоза.
Скрининг населения на дисфункцию щитовидной железы может предотвратить развитие явной дисфункции щитовидной железы и может позволить раннее лечение гиперлипидемии (6,22), профилактику связанных сердечно-сосудистых осложнений (23) и метаболических нарушений костей (24). Американский колледж врачей недавно опубликовал руководство по скринингу на заболевания щитовидной железы с помощью чувствительного теста на ТТГ в учреждениях первичной медико-санитарной помощи (25). В этих рекомендациях указывается, что скрининг женщин младше 50 лет и мужчин не оправдан из-за низкой частоты дисфункции щитовидной железы.Наши результаты и предыдущие исследования (4,10–15) показывают, что эти рекомендации не применимы к пациентам с диабетом 1 типа, поскольку по сравнению с населением в целом у пациентов с диабетом дисфункция щитовидной железы развивается в более раннем возрасте. Кроме того, наши результаты показывают, что необходимо долгосрочное наблюдение, поскольку начало диабета обычно предшествует диагностике дисфункции щитовидной железы примерно на десять лет.
В настоящем исследовании мы наблюдали более низкую распространенность гипертиреоза, чем сообщалось ранее (11,12).Распространенность гипертиреоза, включая субклинический гипертиреоз, составляет 1,7% у пациентов с диабетом 1 типа и 0,3% у пациентов с диабетом 2 типа (15). Причина отсутствия случаев гипертиреоза в нашем исследовании не известна, но может относиться к относительно небольшому количеству субъектов и / или к более определенной популяции пациентов с диабетом 1 типа, включенных в это исследование.
Таким образом, наше долгосрочное проспективное исследование подтверждает связь между аутоиммунным гипотиреозом и диабетом 1 типа и предполагает, что все пациенты с диабетом 1 типа, особенно с положительными антителами к ТПО, должны проходить ежегодный скрининг путем измерения уровня ТТГ в сыворотке для выявления бессимптомной активности щитовидной железы. дисфункция.
Рис. 1—Анализ пропорциональных рисков Кокса для прогнозирования развития гипотиреоза с учетом возраста начала, пола и статуса TPO.
Таблица 1—Клинические характеристики пациентов с диабетом 1 типа с гипотиреозом и без него
Благодарности
Это исследование было поддержано грантами Национальных институтов здравоохранения (NOIDK-62203, DK-30625 и USPHS-RR00211) и неограниченным грантом от Knoll Pharmaceuticals.
Авторы благодарят Джона Крислера за помощь в проведении иммуноанализа и Dr.Джозефу Н. Фишеру за критический обзор рукописи.
Эта работа была представлена в виде тезисов на заседании эндокринного общества 2001 г., Денвер, Колорадо.
Сноски
Адрес для переписки и перепечатки Гильермо Умпьеррес, доктор медицины, доцент медицины, акушерства и гинекологии, Университет Теннесси. Центр медицинских наук, 951 Court Ave., комната 335M, Мемфис, TN 38163. Электронная почта: gumpierrez {at} utmem.edu.
Поступила в печать 26 августа 2002 г. и принята в доработке 23 декабря 2002 г.
В таблице в другом месте этого выпуска показаны общепринятые и Système International (SI) единицы и коэффициенты пересчета для многих веществ.
- УХОД ЗА ДИАБЕТОМ
Ссылки
- ↵
Ван С., Крапо Л.М.: Эпидемиология заболевания щитовидной железы и значение для скрининга. Endocrinol Metab Clin North Am 26: 189–218, 1997
- ↵
Tunbridge WM, Evered DC, Hall R, Appleton D, Brewis M, Clark F, Evans JG, Young E, Bird T, Smith PA: The спектр заболеваний щитовидной железы в сообществе: исследование Whickham.Clin Endocrinol (Oxf) 7: 481–493, 1977
- ↵
Canaris GJ, Manowitz NR, Mayor G, Ridgway EC: Исследование распространенности заболеваний щитовидной железы в Колорадо. Arch Intern Med 160: 526–534, 2000
- ↵
Eggertsen R, Petersen K, Lundberg PA, Nystrom E, Lindstedt G. Предел обнаружения. BMJ 297: 1586–1592, 1988
Купер Д.С.: Субклиническое заболевание щитовидной железы: взгляд клинициста.Ann Intern Med 129: 135–138, 1998
- ↵
Sawin CT, Chopra D, Azizi F, Mannix JE, Bacharach P: Старение щитовидной железы: повышенная распространенность повышенных уровней тиреотропина в сыворотке крови у пожилых людей. JAMA 242: 247–250, 1979
Вандерпамп М.П., Танбридж В.М., Френч Дж.М., Эпплтон Д., Бейтс Д., Кларк Ф., Гримли Эванс Дж., Хасан Д.М., Роджерс Х., Танбридж Ф. и др. заболеваний щитовидной железы в сообществе: двадцатилетний период наблюдения Whickham Survey.Clin Endocrinol (Oxf) 43: 55–68, 1995
- ↵
Parle JV, Franklyn JA, Cross KW, Jones SC, Sheppard MC: Распространенность и последующее наблюдение аномальных концентраций тиреотрофина (ТТГ) у пожилых людей в Объединенное королевство. Clin Endocrinol (Oxf) 34: 77–83, 1991
- ↵
Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, Braverman LE: сывороточный ТТГ, Т4 и антитела к щитовидной железе в Население США (1988–1994 гг.): Национальное обследование здоровья и питания (NHANES III).J Clin Endocrinolo Metab 87: 489–499, 2002
- ↵
Riley WJ, Maclaren NK, Lezotte DC, Spillar RP, Rosenbloom AL: Аутоиммунитет щитовидной железы при инсулинозависимом сахарном диабете: случай для рутинного скрининга. J Pediatr 99: 350–354, 1981
- ↵
Perros P, McCrimmon RJ, Shaw G, Frier BM: Частота дисфункции щитовидной железы у пациентов с диабетом: значение ежегодного скрининга. Diabet Med 12: 622–627, 1995
- ↵
Gray RS, Irvine WJ, Clarke BF: Скрининг дисфункции щитовидной железы у диабетиков (Letter).BMJ 2: 1439, 1979
- ↵
Feely J, Isles TE: Скрининг дисфункции щитовидной железы у диабетиков (Letter). BMJ 1: 1678, 1979
- ↵
Duckworth WC, Badlissi J, Kitabchi AE: Функция щитовидной железы при диабете. В Щитовидная железа . Vanmiddleworth L, Ed. Чикаго, Медицинский ежегодник, 1986, стр. 247–261
- ↵
Mouradian M, Abourizk N: Сахарный диабет и заболевания щитовидной железы. Diabetes Care 6: 512–520, 1983
Nerup J, Binder C: аутоиммунитет щитовидной железы, желудка и надпочечников при сахарном диабете.Acta Endocrinol 72: 279–286, 1973
Nabarro JD, Mustaffa BE, Morris DV, Walport MJ, Kurtz AB: Инсулино-дефицитный диабет: контрастирует с другими эндокринными дефицитами. Diabetologia 16: 5–12, 1979
- ↵
Radetti G, Paganini C, Gentili L, Bernasconi S, Betterle C, Borkenstein M, Cvijovic K, Kadrnka-Lovrencic M, Krzisnik C et al: Krzisnik C et al: Частота тиреоидита Хашимото у детей с сахарным диабетом 1 типа. Acta Diabetol 32: 121–124, 1995
- ↵
Исследовательская группа DCCT: Исследование контроля и осложнений диабета (DCCT): дизайн и методологические соображения для этапа осуществимости.Diabetes 35: 530–545, 1986
- ↵
Исследовательская группа DCCT: Исследование контроля диабета и его осложнений (DCCT): обновленная информация. Диабет 13: 427–433, 1990
- ↵
Исследовательская группа по эпидемиологии вмешательств и осложнений диабета (EDIC): Эпидемиология вмешательств и осложнений диабета (EDIC): дизайн, реализация и предварительные результаты долгосрочного исследования план группы исследований по борьбе с диабетом и его осложнениям. Diabetes Care 22: 99–111, 1999
- ↵
Geul KW, van Sluisveld IL, Grobbee DE, Docter R, de Bruyn AM, Hooykaas H, van der Merwe JP, van Hemert AM, Krenning EP, Hennemann G , et al: Важность микросомальных антител щитовидной железы в развитии повышенного уровня ТТГ в сыворотке у женщин среднего возраста: связь с липидами сыворотки.Clin Endocrinol (Oxf) 39: 275–280, 1993
- ↵
Hak AE, Pols HA, Visser TJ, Drexhage HA, Hofman A, Witteman JC: Субклинический гипотиреоз является независимым фактором риска атеросклероза и миокарда. пожилые женщины: Роттердамское исследование. Ann Intern Med 132: 270–278, 2000
- ↵
Greenspan SL, Greenspan FS: Влияние гормона щитовидной железы на целостность скелета.

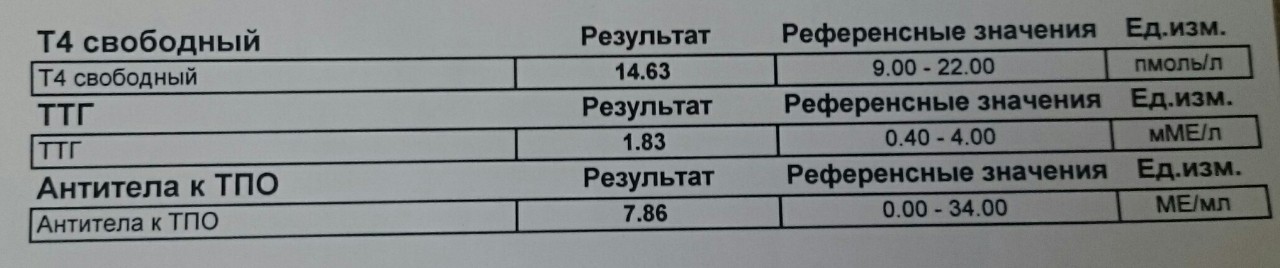 В скобках — процент.
В скобках — процент. Уровни АТ-ЩЖ были значительно выше у женщин с произошедшим спонтанным выкиды шем, чем при благоприятном исходе беременно сти. Аналогичным образом S. Bussen и Т. Steck [10] выявили высокие уровни АТ-ЩЖ (36%) у женщин с привычным невынашиванием по сравнению с контрольной группой (9%).
Уровни АТ-ЩЖ были значительно выше у женщин с произошедшим спонтанным выкиды шем, чем при благоприятном исходе беременно сти. Аналогичным образом S. Bussen и Т. Steck [10] выявили высокие уровни АТ-ЩЖ (36%) у женщин с привычным невынашиванием по сравнению с контрольной группой (9%). В данном исследовании не удалось выявить большей распространенности АТ-ЩЖ у женщин, которым требовалось ЭКО, по сравнению с кон трольной группой. В исследовании A. Singh и со авт. [60] у беременных женщин после ЭКО АТ- ЩЖ были выявлены в 22% случаев, распростра ненность спонтанных выкидышей в группе жен щин с АТ-ЩЖ составила 32%, а у женщин без АТ- ЩЖ — 16%.
В данном исследовании не удалось выявить большей распространенности АТ-ЩЖ у женщин, которым требовалось ЭКО, по сравнению с кон трольной группой. В исследовании A. Singh и со авт. [60] у беременных женщин после ЭКО АТ- ЩЖ были выявлены в 22% случаев, распростра ненность спонтанных выкидышей в группе жен щин с АТ-ЩЖ составила 32%, а у женщин без АТ- ЩЖ — 16%.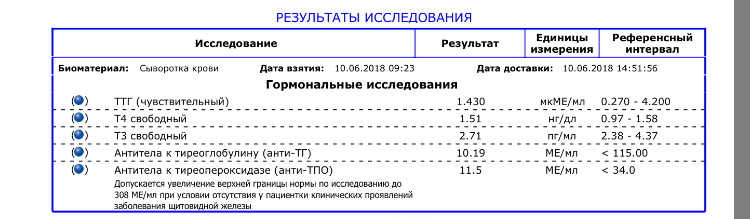 Stagnaro-Green [61]
Stagnaro-Green [61]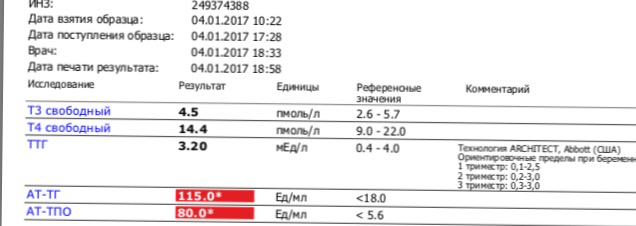


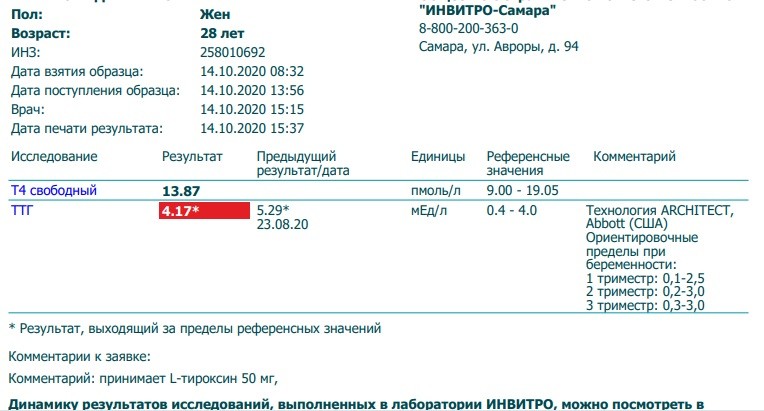

 Именно поэтому в Клинике появились дополнительные процедуры и программы для естественного омоложения лица.
Именно поэтому в Клинике появились дополнительные процедуры и программы для естественного омоложения лица.