Clostridium botulinum — Википедия
| Clostridium botulinum | |||
|---|---|---|---|
 Clostridium botulinum, окраска генцианом фиолетовым | |||
промежуточные ранги
| |||
Clostridium botulinum (van Ermengem 1896) Bergey et al. 1923 | |||
| |||
Clostridium botulinum (лат.) (ботулина) — анаэробная грамположительная бактерия рода клостридий[1], возбудитель ботулизма — тяжёлой пищевой интоксикации, вызываемой ботулиническим токсином и характеризуемой поражением нервной системы.
Впервые эти бактерии выявил в 1895 году бельгийский микробиолог Эмиль ван Эрменгем, ученик Роберта Коха. Однако первые упоминания о вызываемом ими ботулизме относятся ещё к 1793 году, когда в Германии после употребления в пищу копчёной кровяной колбасы заболели 13 человек, 6 из которых скончались. Аналогичные пищевые отравления колбасой с гибелью большого числа людей наблюдались в Германии во время войны с Наполеоном в 1795–1813 годах. Тогда считалось, что эта смертность связана с отсутствием гигиены питания в деревнях в связи с войной
Первым учёным, который занялся сбором статистики по случаям подобных отравлений и их симптомов, был Генрих Фердинанд Аутенрит из Тюбингенского университета. Опубликованный им в газете в 1817 году список симптомов включал желудочно-кишечные нарушения, двоение в глазах и расширение зрачка. Также Аутенрит обнаружил связь между силой действия яда и степенью прожарки колбасы.
Одним из медиков, представивших профессору описания случаев отравления, был врач и литератор Юстинус Кернер. В дальнейшем Кернер значительную часть своей жизни посвятил изучению ботулинического токсина и считается крестным отцом его исследований. Проводя испытания на животных и на самом себе, он пытался выделить из колбасы неизвестный токсин, который сам называл «колбасный яд», «жирный яд» или «жировая кислота». Результаты этих исследований были опубликованы им в 1822 году в монографии, описывавшей 155 случаев отравления у человека и эксперименты на животных, в соответствии с которыми делался вывод о том, что действие токсина заключается в нарушении передачи импульса в волокнах периферической и автономной нервных систем. Кернер также предположил биологическое происхождение данного яда на основании сходства действия токсина с действием атропина и змеиного яда.
В дальнейшем заболевание, возникающее в результате отравления описанным им токсином получило название «ботулизм» от лат. botulus, что означает «колбаса».
C. botulinum обитает в почве. Заболеваемость ботулизмом повсеместна. Наиболее распространены бактерии типа A и B. В природных условиях бактерии колонизируют ил на дне водоёмов, инфицируют рыб. При пересыхании водоёмов рост C. botulinum стимулируется. Таким образом, естественный резервуар для этих бактерий — почва и различные животные. Тёплый климат создаёт условия для длительного сохранения спор в почве, а также для прорастания и размножения вегетативных форм.
Попадание в человеческий организм как вегетативных форм C. botulinum, так и спор обычно не вызывает заболевания, так как для продуцирования токсина нужны строго анаэробные условия. Исключения составляют раневой ботулизм (развивается при загрязнении почвой раны, в которой создаются условия, необходимые для прорастания попавших из почвы C. botulinum и последующего токсинообразования), а также ботулизм новорождённых до 6 месяцев, в кишечнике которых также возможно размножение C. botulinum и токсинообразование из-за особенностей кишечной микрофлоры.
Возбудители ботулизма имеют форму палочек длиной 3-9 мкм, шириной 0,6-1 мк с закругленными концами. Палочки образуют субтерминально расположенные споры и имеют вид теннисной ракетки. Капсулы не образуют. Подвижны в результате перитрихиально расположенных жгутиков. Грамположительны.
Строгий анаэроб, срок культивирования 48–72 ч. На мясо-пептонном бульоне — помутнение среды с газообразованием, характерный запах прогорклого масла. На кровяном МПА — колонии крупные с корневидными отростками и зоной гемолиза. Оптимальная кислотность для роста 7,3–7,6 (для прорастания спор 6,0–7,2).
Вид C. botulinum образует экзотоксины, различающиеся по антигенным свойствам и по этому признаку подразделяются на серотипы. Ботулотоксины всех типов обладают сходной биологической активностью, являясь вариантами одного нейротоксина. Кроме нейротоксического действия, ботулотоксин обладает лейкотоксической, гемолитической и лецитиназной активностью.
Ботулотоксин[править | править код]
Известны 7 антигенных вариантов ботулотоксина: A, B, C (подтипы C1 и C2), D, E, F, G. Токсинообразование типов C, D, E закодировано в геноме конвертируемых бактериофагов и проявляется при интеграции профага в бактериальную хромосому; у остальных типов генетический контроль осуществляет непосредственно хромосома клетки.
Заболевания человека вызывают ботулотоксины типов A, B, E, а также F. В организме человека C. botulinum размножаются слабо и не продуцируют токсина за редким исключением. Ботулотоксин накапливается в пищевых продуктах, инфицированных спорами
Токсин представляет собой полипептидную цепь с одной или несколькими внутримолекулярными связями, его молекулярная масса равна 150 000, он относится к бинарным токсинам.
Ботулотоксины всех типов продуцируются в виде токсичных белковых комплексов, состоящих из нейротоксина и нетоксичного белка. Белок является стабилизатором токсина, защищает его от разрушающего действия протеолитических ферментов и HCl.
Ботулотоксин в виде высокомолекулярного комплекса малотоксичен и является прототоксином. В результате мягкого протеолиза, осуществляемого у большинства типов токсина собственными эндогенными протеазами, а у типа E экзогенными протеазами (например трипсином), прототоксин распадается на 2 субкомпонента: L-лёгкий и H-тяжёлый. Между ними сохраняется дисульфидная связь. L-суб-компонент соответствует фрагменту A (активатор) и оказывает токсическое действие на клетку-мишень (мотонейрон). H-субкомпонент соответствует фрагменту В (акцептор) и осуществляет прикрепление к рецептору клетки-мишени.
Применение ботулотоксина[править | править код]
Ботулинический нейротоксин типа A-гемагглютинин комплекс используется в современной косметологии под торговыми названиями «Ботокс», «Диспорт», «Релатокс» и «Лантокс».
Попав вместе с пищей в желудочно-кишечный тракт, ботулотоксин прикрепляется к клеткам эпителия кишечника и путём пиноцитоза попадает в лимфатические сосуды, затем в кровь и далее проходит гематоэнцефалический барьер. В организме он распадается на 2 субкомпонента: L-лёгкий и Н-тяжёлый. Н-субкомпонент связывается с ганглиозидами пресинаптической мембраны мотонейронов. L-субкомпонент, действуя как эндопротеаза, блокирует секрецию ацетилхолина, тем самым прерываются нервные импульсы, идущие от мотонейрона к мышце, что приводит к развитию вялых параличей. Ботулотоксин поражает мотонейроны спинальных моторных центров, продолговатого мозга и периферической нервной системы.
В результате опытов, проведённых в различных условиях, выявлено, что ботулотоксин приводит к угнетению как спонтанного, так и вызванного возбуждением выброса нейромедиаторов в нервных окончаниях. При этом чувствительность рецепторов к ацетилхолину не изменяется, процессы синтеза и хранения нейромедиаторов не страдают. В результате экспериментов установлено, что в среднем для блокирования одного синапса достаточно 10 молекул ботулотоксина. Также отмечается, что более высокая нервная активность ускоряет возникновение синаптического блока. Предполагается, что поражающее действие токсина обусловлено поражением Ca² (кальциевых потенциал-зависимых ионных каналов) зависимого механизма экзоцитоза в пресинаптической мембране. В настоящее время это поражение считается необратимым, а восстановление двигательной активности происходит за счёт образования новых синаптических связей
C. botulinum является сапронозом и вегетирует в почве, часто обнаруживается в кишечнике лошадей и других животных, реже встречается в кишечнике человека. Из почвы или испражнений споры возбудителя попадают на различные объекты и могут загрязнять пищевые продукты. В анаэробных условиях споры прорастают, вегетативные клетки продуцируют ботулотоксин. Чаще всего заболевание возникает при употреблении в пищу консервированных продуктов домашнего приготовления, что связано с их недостаточной стерилизацией.
Инкубационный период при ботулизме колеблется от нескольких часов до 2—5 дней (редко до 10 дней). В первые сутки отмечается тошнота, рвота, диарея. Далее преобладают нейросимптомы, связанные с поражением бульбарных нервных центров: нарушение аккомодации, двоение в глазах, затрудненное глотание, афония. При тяжёлых формах ботулизма смерть наступает от паралича дыхания, иногда от внезапной остановки сердца.
Классический способ — биологическая проба на мышах. Для опытов подбирают партию из 5 мышей. Первую заражают только исследуемым материалом, остальных — исследуемым материалом с введением 2 мл 200 МЕ антитоксической сыворотки типов A, B, C и E. При наличии в материале токсина выживает животное, получившее антитоксическую сыворотку, нейтрализовавшую токсин соответствующего типа. Для идентификации токсинов также используют РПГА с антительным диагностикумом (эритроциты, сенсибилизированные антитоксинами соответствующих типов). Серологических исследований не проводят, так как заболевание не сопровождается выработкой выраженных титров антител, что связано с незначительной дозой токсина, вызвавшей поражение.
Поскольку основной причиной возникновения заболевания является употребление различных продуктов домашнего приготовления (консервированные, маринованные, копчёные, вяленые (рыба, мясо) и др.), то в профилактике ботулизма большое значение имеет разъяснительная работа с населением. Знание оптимальных условий прорастания спор, токсинообразования, устойчивости к термическому воздействию спор позволяет определить адекватные технологические условия обработки пищевых продуктов, исключающие накопление ботулинического токсина.
Опасны не только герметично закрытые консервы, но и те продукты, в кишечнике, тканях мышц которых также созданы анаэробные условия. C. botulinum погибают в очень кислой среде, но создать такие условия в пищевых продуктах нельзя (невкусно). C. botulinum — анаэроб, то есть не размножается в присутствии кислорода, поэтому консервы, пригот
Clostridium difficile — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 января 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 января 2018; проверки требуют 5 правок.| Clostridium difficile | |||
|---|---|---|---|
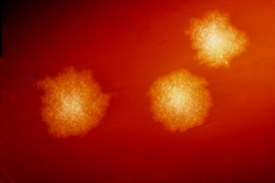 | |||
промежуточные ранги
| |||
Clostridium difficile | |||
Clostridium difficile (лат.) — вид анаэробных грамположительных бактерий рода клостридий.
C. difficile является главным возбудителем псевдомембранозного колита[1], тяжёлого инфекционного заболевания прямой кишки, часто возникает в случае уничтожения флоры кишечника из-за использования антибиотиков.
В случае возникновения, заболевание лечат антибиотиками, такими как метронидазол, при полном устранении всех других антибиотиков. Бактерия подразделяется на шесть штаммов. Пять из которых содержат патогенные подвиды.[2]C. difficile спорулирующая бактерия, поэтому псевдомембранозный колит может легко возобновиться после курса антибиотиков. Клостридиум диффициле также резистентный к таким антибиотикам как эритромицин, хлорамфеникол и тетрациклин из-за транспозонов в геноме бактерии.[2] Симптомы заболевания могут варьироваться от легкой диареи и болей в животе до опасных для жизни воспалительных процессов, перфорации кишечника, а в тяжелых случаях — сепсиса и смерти. Эти симптомы вызваны двумя сильными цитотоксинами, TcdA и TcdB. Бактерия прикрепляется к эпителию кишечника и начинает производить эти токсины. Токсины проходят в клетки эпителия и в цитозоле клетки инактивируют небольшие GTP-молекулы, такие как Rho, Rac и Cdc42. Токсины TcdA и TcdB вызывают распад цитоскелета и гибель клеток..[2] Данные токсины находятся на особом патогенном локусе в геноме бактерии. Этот локус также содержит дополнительные гены для производства этих токсинов.
Было показано, что ректальное введение больным людям фекалий, взятых от здоровых доноров, вылечивает системную инфекцию Clostridium difficile[3][4].При применении фекальной трансплантации микробиоты, 90% трансплантаций прошли успешно без серьезных побочных эффектов[5]
- ↑ Pseudomembranous Colitis (неопр.). eMedicine. WebMD (1 июля 2005). Дата обращения 11 января 2007. Архивировано 26 июня 2013 года.
- ↑ 1 2 3 Mónica Oleastro, Adriano O. Henriques, Mónica Serrano, Aristides L. Mendes, Joana Isidro. Overview of Clostridium difficile Infection: Life Cycle, Epidemiology, Antimicrobial Resistance and Treatment (англ.) // Clostridium Difficile — A Comprehensive Overview. — 2017-09-27. — DOI:10.5772/intechopen.69053.
- ↑ Джонатан Эйзен. Знакомьтесь, ваши микробы (неопр.). TED Talks (07.2012).
- ↑ Clostridium difficile colitis -Treatment — Stool transplant (неопр.). Wikipedia.
- ↑ Michael H. Woodworth, Cynthia Carpentieri, Kaitlin L. Sitchenko, Colleen S. Kraft. Challenges in fecal donor selection and screening for fecal microbiota transplantation: A review // Gut Microbes. — 2017-01-27. — Т. 8, вып. 3. — С. 225–237. — ISSN 1949-0976. — DOI:10.1080/19490976.2017.1286006.
Clostridium perfringens — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 апреля 2016; проверки требуют 11 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 апреля 2016; проверки требуют 11 правок.| Clostridium perfringens | |||
|---|---|---|---|
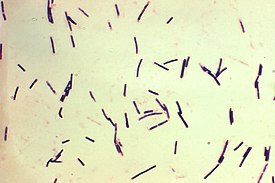 Clostridium perfringens, окраска по методу Грама | |||
промежуточные ранги
| |||
Clostridium perfringens (Veillon and Zuber 1898) Hauduroy et al. 1937 | |||
Clostridium perfringens (лат.) — вид грамположительных, облигатно (строго) анаэробных (за исключением C. perfringens типа A) спорообразующих бактерий рода клостридий. Возбудитель пищевых токсикоинфекций человека, один из возбудителей газовой гангрены. Является санитарно-показательным организмом. Открыта в 1892 году Уэлчем и Нетталом.
Морфология[править | править код]
Крупные (0,8—1,5 × 4—8 мкм) полиморфные палочковидные грамположительные бактерии. Споры овальные, расположены центрально либо субтерминально. Неподвижны, в организме человека образуют капсулу. Образуют стабильные L-формы, способные расти на поверхности стекла[1].
Культуральные свойства[править | править код]
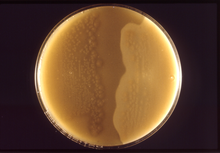 Зоны преципитации вокруг колоний C. perfringens на желточном агаре
Зоны преципитации вокруг колоний C. perfringens на желточном агареХемоорганогетеротроф, облигатный анаэроб. Растёт на простых питательных средах в анаэробных условиях. На агаризованных средах образуются круглые колонии 1—2 мм в диаметре с гладким или зубчатым краем. Колонии, выросшие в толще агара, имеют чечевицеобразную форму. В жидкой среде — помутнение с дальнейшим просветлением среды и образованием беловатого хлопьевидного осадка. На среде Китт-Тароцци — помутнение с обильным газообразованием. На кровяном агаре образуются круглые гладкие сероватые колонии, постепенно зеленеющие и окружённые зоной гемолиза β-типа. На желточном агаре ввиду образования лецитиназы образуются зоны преципитации. Сбраживают с активным газообразованием глюкозу, лактозу, мальтозу и сахарозу. Образует масляную кислоту в ходе ацетобутиратного брожения, способен восстанавливать нитраты[2].
Геном[править | править код]
В 1989 году было проведено физическое картирование генома C.perfringens с использованием метода пульс-электрофореза[3], в 2001 году была определена нуклеотидная последовательность всего генома C.perfringens штамма 13, этот геном представлен одной кольцевой двуцепочечной молекулой ДНК размером 3031430 п.н. Доля пар Г+Ц составляет 28,6%. Количество открытых рамок считывания составляет 2660. Также имеется плазмида pCP13 размером 54310 п.н., которая содержит 63 открытые рамки считывания[4]. Геном C.perfringens ATCC13124 представлен кольцевой двуцепочечной молекулой ДНК размером 3256683 п.н. и содержит 3015 генов, из них 2899 кодируют белки. Доля пар Г+Ц составляет 28,37%[5]. У C. perfringens штамма E88 геном размером 2799250 п.н. и содержит 2372 открытых рамок считывания[6]. Охарактеризованы гены энтеротоксинов C. perfringens[7], гены токсинообразования могут находиться как на хромосоме, так и на плазмидах[8] и являются транспозибельными элементами[9].
C. perfringens является возбудителем пищевых токсикоинфекций человека и одним из возбудителей газовой гангрены. Синтезируют протеиназы, лецитиназу, коллагеназу, гиалуронидазу и другие ферменты агрессивности. Продуцируют также токсины[10][11][12]. α-токсин является фосфолипазой С, обладающей гемолитическими свойствами[13], ε-токсин является белком размером 300 аминокислот, образующий поры в мембранах эпителиоцитов кишечника человека и вызывающий выход ионов K+ и воды из клетки, LD50 для мышей составляет 0,1 мкг на кг веса[14].
Столбнячная палочка — Википедия
| Столбнячная палочка | |||
|---|---|---|---|
 Clostridium tetani, видны споры | |||
промежуточные ранги
| |||
Clostridium tetani | |||
Столбня́чная па́лочка[1] (лат. Clostridium tetani) — грамположительная спорообразующая облигатно анаэробная бактерия рода клостридий, возбудитель столбняка. Открыта в 1883 г. русским хирургом Нестором Монастырским (1847—1888) и в 1884 г. немецким медиком Артуром Николайером (нем. Arthur Nicolaier, 1862—1942), выделена в чистую культуру в 1889 г. японским бактериологом Китасато Сибасабуро (яп. 北里 柴三郎, 1852—1931). Токсин отнесён ко II группе патогенности.
Морфология[править | править код]
Крупная (3—12 × 0,3—0,6 мкм), подвижная (жгутики расположены перетрихиально) палочковидная бактерия. Образует овальные эндоспоры, превышающие диаметр клетки в 2—3 раза, расположенные терминально (характерная морфология типа «барабанных палочек»).
Культуральные свойства[править | править код]
Хемоорганогетеротроф, облигатный анаэроб. Для культивирования на питательных средах необходимо обеспечивать анаэробные условия, а также очистить исследуемый материал от неспорообразующих анаэробов (применяется метод Дригальского). На плотных питательных средах образуют мелкие прозрачные колонии с неправильными краями, через некоторое время приобретают стеклянный блеск. В жидких питательных средах растёт медленно, наблюдается слабое помутнение и лёгкий слой пылевидного осадка на стенках пробирки. При уколе в толщу плотной питательной среды образует мелкие колонии, похожие на кусочки ваты. Разжижает желатин с газообразованием, не образует индола, быстро восстанавливает нитраты в нитриты[2]. Не ферментирует углеводов, обладает фибринолитической активностью.
Антигенные свойства[править | править код]
Обладает групповым специфическим O-антигеном и типоспецифическим H-антигеном. По особенностям строения H-антигена выделяют 10 сероваров C. tetani.
В естественных условиях столбняком болеют лошади и мелкий рогатый скот. Многие животные являются носителями возбудителя столбняка.
Из экспериментальных животных к бациллам столбняка восприимчивы белые мыши, морские свинки, крысы, кролики, хомяки.
Столбняк у животных протекает при явлениях спастических сокращений поперечнополосатой мускулатуры и поражения пирамидальных клеток передних рогов спинного мозга. Первоначально вовлекаются конечности, а затем туловище (восходящий столбняк). Токсин, полученный из фильтрата бульонной культуры, в дозе 0,000005 мл убивает белую мышь весом 20 г. Вызывает столбняк у человека, также патогенен для животных.
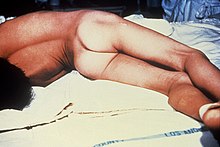 Характерные генерализованные судороги, наблюдаемые при столбняке
Характерные генерализованные судороги, наблюдаемые при столбнякеИсточником заболевания являются животные и человек, которые выделяют клостридий с испражнениями в почву. Споры обнаруживаются в почве 50—80 % исследованных проб, в некоторых почвах (особенно унавоженных) — 100 %.
Clostridium tetani вырабатывает тетаноспазмин, обладающий нейротоксическими свойствами и тетанолизин, обладающий гемолитическими свойствами. Тетаноспазмин действует на периферическую нервную систему и вызывает тонические сокращения поперечнополосатой мускулатуры. Тетанолизин вызывает лизис эритроцитов. Тетаноспазмин нейтрализуется противостолбнячной сывороткой, неустойчив при нагревании, в щелочной среде и под действием солнечных лучей. Не всасывается в пищеварительной системе, относительно безопасен при пероральном приёме. Механизм передачи — контактный. Около 2/3 заболеваний приходится на лиц, занятых в хозяйстве. Больше 50 % из них заболевает в результате ранений лопатой, гвоздём или стерней во время работы на огороде, поле. Патология также характерна как сопутствующая при огнестрельной ране в ходе вооружённых конфликтов.
Вегетативные формы возбудителя столбняка гибнут при температуре 60—70°C в течение 30 минут и быстро обезвреживаются при применении всех применяемых дезсредств, однако споры обладают большей устойчивостью и выдерживают кипячение 10—90 минут (а споры некоторых штаммов 1—3 часа), 5%-ный раствор фенола вызывает их гибель через 8—10 часов, а 1%-ный раствор формалина — 6 часов. Действие прямого солнечного света споры выдерживают 3—5 суток.
Применение в медицине и экспериментальной биологии[править | править код]
Концентраты из культуральных сред и очищенные токсины столбнячной палочки применяется в экспериментальной биологии для изучения функционирования моторных нейронов.
Изучается возможность применения генетически измененных (не производящих токсины) штаммов столбнячной палочки в онкологии для борьбы с плотными новообразованиями, трудно поддающиеся всем известным методам лечения. Считается, что в тканях таких новообразований вследствие их недостаточного снабжения кислородом создаются благоприятные условия для размножения столбнячной палочки, которую можно модифицировать таким образом, чтобы она стала продуцентом цитотоксических метаболитов и разрушала опухоль изнутри.
микробиология, вид бактерий, заболевание, диагноз и лечение
Кто такие клостридии? Это микроорганизмы, образующие споры, развивающиеся при полном неимении кислорода. Питаются они мертвой органикой. Интересная особенность — способны превращать неорганические вещества в органические. В этой статье мы подробно остановимся на бактерии Клостридии перфрингенс. Рассмотрим ее особенности в рамках микробиологии, заболевания, что она вызывает, симптоматику поражения, методики диагностики и терапии.
Кто такие клостридии?
Клостридия перфрингенс — один из представителей микроорганизмов-клостридий. Основное место их проживания — вода и почва. Многие из данных микроорганизмов являются болезнетворными для человека — вызывают ботулизм, газовую гангрену, столбняк, несколько видов колитов.
Если бактерия попадает в неблагоприятные для себя условия, то она преобразуется в спору. В такой форме ей удается выжить и при содержании кислорода в воздухе, и в пыли, на поверхностях предметах, на живых существах.
Чем опасно проникновение клостридии в человеческий организм? Бактерия способна разрушать его ткани, что может привести к тяжелым последствиям и даже летальному исходу. Также ряд ученых считает, что именно клостридии оказывают определенное влияние на психику человека. Есть предположение, что данные бактерии вызывают развитие аутизма. В защиту этой точки зрения говорит то, что излечение организма от клостридий ведет за собой исчезновение симптомов психического расстройства.
Самые известные клостридии в микробиологии:
- Clostridium perfringens — возбудитель пищевых отравлений (в частности, диареи).
- Clostridium difficile — начинает активно развиваться в кишечном тракте при любых проблемах с его микрофлорой (особенно на фоне приема препаратов-антибиотиков), в норме всегда сдержится небольшим процентом в кале человека.
Переходим к следующей теме.
В кале обнаружены клостридии — это опасно?
Как мы уже упомянули, Clostridium difficile может содержаться в каловых массах здорового человека. Это наблюдается у 3% абсолютно здоровых людей, у 15-20% пациентов больниц, клиник.
Однако тут важно количество содержащихся клостридий. Оно не должно превышать нормы — 105 кое/г. Усиленное размножение, развитие клостридий вызывает проблемы с микрофлорой кишечника. Для человека это опасно тем, что в процессе своей жизнедеятельности Clostridium difficile начинает вырабатывать сильнодействующий токсин, который отравляет организм хозяина. Следствие — диарея и более серьезные заболевания, патологии.
Не нужно бояться последствий в случае, если в результатах анализа кала доля клостридий обнаружена в пределах нормы, а вы не диагностируете у себя настораживающих симптомов — болей в животе, рвоты, тошноты, поноса. Главное для вас — заботиться о здоровом состоянии своей кишечной микрофлоры.
Clostridium perfringens — что это?
Возбудитель Clostridium perfringens — еще один вид клостридий. Для него также характерна выработка опасного для организма человека сильнодействующего яда. Что примечательно, токсин сохраняет свои свойства даже при нагревании его до 100° по Цельсию.
Чем опасны для нас клостридии перфрингенс? Воздействие их токсинов на организм человека может привести к тяжелому пищевому отравлению, гастроэнтериту, газовой гангрене.
Как и предыдущий вид, Clostridium perfringens в пределах нормы будет обитать в кишечнике 1/3 здоровых людей. Микробиологи расценивают ее как условно-патогенную микрофлору, санитарно-показательный микроорганизм.
Факты о бактерии
Давайте поближе познакомимся с клостридией перфрингенс:
- Бактерия была открыта сравнительно давно — в 1892 году.
- Относится к грамположительным (по Граму имеет сине-фиолетовую прочную окраску).
- Спорообразующий анаэробный организм, как и иные виды клостридий.
- Свое название Clostridium perfringens получила от слова «веретено». Это связано с особенностью образования ее спор. Бактерия начинает раздуваться по центру, образуя собой форму, чем-то напоминающую в микроскопе веретено.
- В состоянии споры хорошо переносит даже кипячение. Плохо поддается губительному воздействию антибиотиков.
- Бактерии клостридии перфрингенс разделяются между собой на 6 серотипов. Основой для градации выступает антигенное свойство токсинов, ими вырабатываемых. Отсюда разные виды Clostridium perfringens обозначают латинскими символами с А по F.
- Для каждого типа бактерии характерно свое патогенное воздействие — некротическое, энтеротоксическое, гемотоксическое, нейротоксическое и проч.
- Для человеческого организма наиболее опасны типы бактерии А и С. Первый вид поражает пищеварительный тракт, а второй может привести к прогрессии некротического энтерита.
- Клостридия перфрингенс — условно патогенная палочка. Ее длина — 4-8 мкм. Толщина микроорганизма — всего 0,8-1,5 мкм. Отличает ее небольшая выпуклость посередине тельца.
- Размножается спорами. Самые идеальные условия — локация, где происходит интенсивное газообразование (анаэробная среда).
- В среднем 1 г почвы будет содержать сотню представителей Clostridium perfringens! Также в больших количествах их можно найти в уличной пыли, сточных водах, фекалиях.
- Наблюдается клостридия перфрингенс у животных, домашних и диких, у человека.
Биологические свойства бактерии
Clostridium perfringens устойчивы к нагреванию, к охлаждению (сохраняют свои биологические свойства даже после длительного пребывания в морозильной камере). Также им нипочем и следующие воздействия:
- ультрафиолет;
- радиоактивное облучение;
- воздействие щелочи и кислоты;
- обработка дезинфицирующим препаратом и проч.
Споры микроорганизма, попав на продукт питания, практически мгновенно прорастают. Они могут инфицировать мясо, рыбу, молочную продукцию и проч. Употреблять инфицированную бактерией пищу, когда она не прошла должную по длительности термическую обработку, очень опасно. Попав с продуктами питания в кишечник, микроорганизм начинает усиленно размножаться, отравляя человека токсинами — продуктами своей жизнедеятельности.
Чем опасно заражение бактерией?
Патогенез клостридии перфрингенс начинается с активного всасывания кишечников этих ядов. В частности, некротоксина, энтеротоксина. Более всего они губительны для капилляров слизистой оболочки тонкого кишечника. Попав в кровь человека, яды Clostridium perfringens оказывают на организм токсическое и некротическое воздействие.
Таким образом, продукты жизнедеятельности бактерии могут привести даже к летальному исходу. У больных, скончавшихся от поражения микроорганизмом, были обнаружены глубокие некрозы, множественные внутренние кровоизлияния, отечность, гиперемия.

Заболевания, вызываемые микроорганизмом
Воздействие клостридии перфрингенс — заболевания, которые вызывает бактерия:
- Группа диарейных патологий, чьи симптомы порой опасно схожи с обычным пищевым отравлением.
- Некротический энтерит.
- Колит псевдомембранозный.
Особенно опасно поражение организма бактерией серотипа F. Именно она вызывает энтерит некротический. Его итог — омертвение внутренних тканей тонкой кишки. Вероятность летального исхода такого заболевания очень высока — 30 % случаев.
Клиническая картина, симптомы поражения
Болезнь (клостридия перфрингенс тут выступает возбудителем) начинает давать о себе знать спустя 6-24 часа после употребления инфицированной продукции. Чаще всего в роли последней выступают колбасные, молочные изделия.
У больного отмечается:
- сильная тошнота;
- рвота;
- повышение температуры тела до 38-39° по Цельсию;
- признаки интоксикации организма — вялость, слабость, апатия, потеря аппетита, беспокойство;
- расстройство функций желудочно-кишечного тракта.
Если заболевание развивается в тяжелой форме, по пмногим признакам оно будет напоминать гастроэнтероколит инфекционный:
- частая рвота с кровяными прожилками;
- пенистый водянистый жидкий стул, чья частота порой доходит до 15-20 раз в сутки;
- примеси крови в кале.
Особенность поражения Clostridium perfringens в том, что заболевание очень быстро прогрессирует. Всегда сопровождается резким ухудшением общего самочувствия — обезвоживание, сильная слабость, острые боли в области желудка, вздутие живота, увеличение в размерах селезенки и печени, снижение кровяного давления. Если больному вовремя не оказать квалифицированную медицинскую помощь, то не исключен летальный исход.
Симптомы поражения у детей
Детский организм на поражение его Clostridium perfringens может отреагировать таким образом:
- частый жидкий стул;
- боли в животе, спазмы в области брюшины;
- примеси слизи в кале.
Данные симптомы могут самостоятельно исчезнуть через 2-3 дня. Через 4-5 дней, как правило, у ребенка нормализируется стул. Перед нами тут будет легкая форма клостридиоза. Однако ребенок не застрахован и от тяжелой формы болезни. Чаще всего она отмечается у маленьких пациентов с длительным дисбактериозом — детей, которые долгое время принимали антибактериальные лекарства.
Поражение раны серотипом А
Серотип А Clostridium perfringens может попасть в организм не только с пищей в желудочно-кишечную систему, но и на раневую поверхность. Более всего здесь уязвимы раны, не прошедшие хирургическую первичную обработку, некротические участки, ткани, не получающие достаточного кровотока.
Следствием будет газовая (анаэробная) гангрена. Она ведет за собой быстропрогрессирующий некроз тканей, отеки, газообразование, тяжелую интоксикацию организма.
Диагностика клостридиоза
Даже неспециалист заметит, что поражение Clostridium perfringens схоже по симптоматике со многими иными кишечными инфекциями и заболеваниями. Поэтому для постановки диагноза «клостридиоз» прежде всего требуется лабораторное исследование кала пациента. Цель мероприятия — обнаружение в массе энтеротоксина (яда, выделяемого бактерией).
Чаще всего в рамках такой диагности используются известные методы ВИЭФ и РИГА.
Лечение клостридиоза
Лечение (клостридия перфрингенс — возбудитель данного типа клостридиоза) назначается только доктором. Главное его направление — медикаментозное. Преимущественно, это прием антибиотиков и антибактериальных препаратов:
- «Фуразолидон».
- «Тетрациклин».
- «Мономицин».
- «Азитромицин».
- «Гентамицин».
- «Метронидазол».
- «Цепорин».
Дозировка, схема приема зависит от возраста, индивидуальных особенностей организма.
Данное лечение будет сопровождаться симптоматической и антиинтоксиционной терапией. Для скорейшего восстановления иммунитета больные обращаются и к народной медицине — употреблению травяных настоев.
Профилактика данной формы клостридиоза будет состоять в простом следовании правилам личной гигиены, санитарной обработки и хранения продукции — и каждым из нас, и работниками пищеблоков, продуктовых магазинов в особенности. Надо также помнить, что детский организм менее устойчив к Clostridium perfringens. Поэтому контроль за питанием детей должен быть наиболее строгим.
Клостридии
СТАЙЛАБ предлагает комплексные тест-системы для анализа клостридий в пищевых продуктах и продовольственном сырье методом ПЦР.
Клостридии – это анаэробные спорообразующие грамположительные бактерии. Они способны жить и размножаться только в отсутствие кислорода. Некоторые из этих бактерий входят в состав нормальной микрофлоры кишечника человека и животных, другие обитают в почве. Клостридии используются для производства спиртов и органических кислот.
Среди патогенных клостридий – возбудители таких заболеваний, как газовая гангрена, столбняк, ботулизм, псевдомембранозные колиты, некротические энтериты. Белковые токсины клостридий – ботулотоксины, тетаноспазмин (тетанотоксин, столбнячный токсин) и ε-токсин относятся к сильнейшим ядам органического происхождения, известным в настоящее время. В пищевых продуктах чаще всего встречаются два представителя клостридий: Clostridium botulinum и Clostridium perfringens.
Clostridium botulinum – это подвижная палочковидная бактерия, обитающая в иле и почве, иногда в организмах рыб. Она не размножается в присутствии кислорода. Однако бескислородная среда консервированных продуктов позволяет Clostridium botulinum размножаться и вырабатывать ботулотоксины. Эти яды разрушаются при кипячении в течение получаса и в щелочной среде (например, в растворе пищевой соды) в течение 1 часа, но проявляют устойчивость к желудочному соку. Наиболее токсичный из ботулотоксинов – ботулотоксин А. Его молекула имеет два связанных между собой домена. После попадания в организм одна часть молекулы превращается в канал в мембране нервной клетки. Вторая часть молекулы отделяется от первой и проникает в клетку по этому каналу, где необратимо препятствует выделению нейромедиатора ацетилхолина. Это приводит к нарушению нервной и нервно-мышечной передаче сигнала и, как следствие, расслаблению мышц. Пострадавшие умирают от остановки дыхания. Скрытый период отравления, во время которого не проявляются никакие его симптомы, зависит от дозы токсина и составляет от нескольких часов до нескольких суток. Отравление ботулотоксином не всегда приводит к смерти, однако противоядия против этого яда не существует. Лечением является симптоматическая и поддерживающая терапия в условиях больницы.
Clostridium botulinum попадает в продукты при нарушении правил их переработки, чаще всего, с землей. Заражены ей могут быть колбасные изделия, консервы из мяса, рыбы, овощей и грибов. Кроме того, иногда эта бактерия встречается в меде. Clostridium botulinum может выжить в пищеварительной системе маленьких детей (до 1 года). В этом случае она становится причиной детского ботулизма. Скрытый период заболевания длится несколько недель, после чего наступает отравление ботулотоксином. У взрослых людей со сниженным иммунитетом, после операций на брюшной полости и с некоторыми другими состояниями также может встречаться такой тип ботулизма.
Ботулизм может возникать не только у людей, но и у животных, зачастую приводя к их гибели. Помимо употребления продуктов, зараженных Clostridium botulinum, отравление ботулотоксином может наступать в результате попадания этого вещества на слизистые оболочки, роговицу глаз, в раны, а также при его вдыхании.
Ботулотоксин А используют в медицине и косметологии в качестве миорелаксанта.
Clostridium perfringens патогенна для человека и животных и является возбудителем пищевых токсикоинфекций, некротических энтеритов, а также газовой гангрены. Эти бактерии обитают в почве и воде, в том числе, в сточных водах. Они способны выживать в кишечнике человека и животных, и их присутствие не всегда приводит к заболеваниям. Clostridium perfringens типа А, в отличие от других бактерий этого вида, относительно устойчива к воздействию кислорода.
Clostridium perfringens выделяет множество ядов с некротическим и гемолитическим (вызывает разрушение клеток крови) действием. Наиболее токсичным из них является выделяемый сероварами B и D ε-токсин (эпсилон-токсин), образующий в клетках каналы, по которым из них выходят ионы калия. Это приводит к отеку различных органов, в том числе, мозга и нарушению их работы. Clostridium perfringens серовара A вызывают относительно легкие пищевые токсикоинфекции.
Clostridium perfringens нередко встречается в сыром мясе животных и птицы и консервах из него. С загрязненной водой эта бактерия может попадать в овощи и фрукты.
В Российской Федерации и странах Таможенного Союза содержание клостридий в пищевых продуктах регламентировано Техническим Регламентом Таможенного Союза ТР ТС 021/2011 «О безопасности пищевой продукции», ТР ТС 034/2013 «О безопасности мяса и мясной продукции» и другими законодательными документами. С актуальной информацией можно ознакомиться на сайте compact24.com
Микробиологические методы анализа клостридий и других анаэробов довольно трудоемки: в присутствии кислорода эти организмы не размножаются, потому необходимо создать им бескислородные условия. Для этого используют различные подходы: культивирование в жидких средах в специальных высоких пробирках или посев внутрь столбика агара, замена воздуха в пробирке углекислым газом, добавка в среды веществ, поглощающих кислород, запаивание пробирок, культивирование под вазелиновым маслом и др. После выделения культуры микроорганизма необходимо определить его биологическими методами, оценив биохимические свойства бактерий или иным методом. Определение ДНК с помощью ПЦР является самым точным способом определения микроорганизма.
Литература
- О.К. Поздеев. Медицинская микробиология. Москва, ГЭОТАР-МЕД, 2001.
- Clostridium botulinum. International Program on Chemical Safety. Poisons Information Monograph 858 Bacteria. World Health Organization.
- Shukla, HD; Sharma, SK. Clostridium botulinum: a bug with beauty and weapon. Crit Rev Microbiol 31 (1): 11–8. 2005
- Knapp O, Maier E, Benz R, Geny B, Popoff MR. Identification of the channel-forming domain of Clostridium perfringens Epsilon-toxin (ETX). Biochim Biophys Acta. 2009 Dec;1788(12):2584-93.
- Epsilon Toxin of Clostridium perfringens. The Center for Food Security and Public Health. Iowa State University. 2004.
возбудители газовой гангрены. Пути передачи. Clostridium perfringens, novyi, septicum. Таксономия. Микробиология. Фото
Клостридии — возбудители газовой гангрены. Пути передачи. Clostridium perfringens, novyi, septicum. Таксономия. Микробиология. ФотоГазовая гангрена (газовая флегмона) — это чрезвычайно тяжелый инфекционный процесс, развивающийся при инфицировании ран анаэробными патогенными бактериями рода Clostridium. Заболевание сопровождается тяжелой интоксикацией, быстро прогрессирующим омертвением (некрозом) тканей, отеком и газообразованием.
Клостридии обитают в земле, их много в уличной пыли. Предрасположены к заболеванию травмированные люди с обширными участками размозжения мышечной ткани, где резко снижено кровоснабжение и образуется множество «карманов». Бактерии размножаются только в среде, где отсутствует кислород. При попадании в кислородную среду микроорганизмы образуют споры и в таком состоянии сохраняются многие десятилетия. Они обитают в кишечнике человека и травоядных животных, с калом попадают в грунт, и далее с уличной пылью распространяются по объектам внешней среды. При благоприятных условиях клостридии активизируются и начинают интенсивно размножаться. Из множества видов клостридий, в основном, только 7 вызывают газовую гангрену. 70-80% всех заболеваний приходится на Clostridium perfringens. Основной метод лечения заболевания — хирургический. Производятся вскрытие раны лампасными разрезами. При прогрессировании заболевания конечность ампутируется.
Рис. 1. На фото газовая гангрена нижней конечности.
Эпидемиология
На сегодняшний день описано около 80 видов бактерий рода Clostridium. Причиной газовой гангрены у человека являются лишь патогенные виды клостридий: Clostridium perfringens (70 — 80% всех случаев заболевания), Clostridium novi и Clostridium septicum. Описаны также другие виды патогенных бактерий рода Clostridium, но они встречаются значительно реже. Все микроорганизмы являются облигатными анаэробами — растут и размножаются в условиях отсутствия доступа кислорода.
При неблагоприятных условиях бактерии образуют споры. В таком состоянии они могут пребывать значительное количество времени. Споры устойчивы к солнечному свету, высушиванию и высокой температуре. Рост и развитие клостридий происходит только в анаэробных условиях. Восприимчивы к заболеванию человек и все виды животных.
Источники инфекции
Клостридии постоянно присутствуют в почве, кишечнике человека и травоядных животных, в ряде случаев при плохой гигиене бактерии можно обнаружить на кожных покровах.
Пути передачи
Газовая гангрена развивается при инфицировании клостридиями обширных размозженных ран (огнестрельных, рвано-ушибленных), чаще нижних конечностей и туловища, ранениях толстого кишечника. Бактерии проникают в поврежденные ткани с землей, пылью, через обрывки одежды, осколки снарядов, при оперативных вмешательствах, инъекциях лекарственных препаратов, внебольничных абортах. При шахтных и транспортных травмах ранения чаще возникают в области ягодиц и бедер. Подвержены заболеванию лица, травмированные крупным рогатым скотом, свиньями, овцами и козами. Раны при этом загрязняются навозом животных. В некоторых случаях заболевание развивается при небольших, но загрязненных порезах. Заболевание развивается быстро. Первые его признаки появляются уже с первых суток травмирования.
Рис. 2. 90% всех случаев заболевания газовой гангреной приходится на Clostridium perfringens.
к содержанию ↑Клостридии
Клостридии — факультативные анаэробы (бактерии растут и размножаются при отсутствии доступа кислорода). Являются сапрофитами. Освобождают природу от мертвого органического материала через процессы брожения и гниения. Они присутствуют в кишечнике животных и человека, где питаются органическими остатками, но не инвазируют (проникают) в живые здоровые ткани.
Клостридии — это бактерии палочковидной формы (бациллы), продуцирующие целый ряд токсинов и ферментов, образующие при неблагоприятных условиях споры. Патогенные формы возбудителей вызывают такие грозные заболевания, как столбняк, ботулизм и газовую гангрену. Они вырабатывают самые сильные из известных ядов — тетаноспазмин (Clostridium tetani), ботулотоксин (Clostridium botulinum) и а-токсин (Clostridium perfringens).
Основными возбудителями газовой гангрены являются Clostridium perfringens (70 — 80% случаев), Clostridium novyi (20 — 43%) и Clostridium septicum (5 — 18%). Значительно реже встречаются такие виды клостридий, как Clostridium histolyticum, Clostridium sordellii, Clostridium difficile, Clostridium fallax и др.
Газовая гангрена практически всегда является смешанной инфекцией. Часто при инфицировании к клостридиям присоединяются аэробные микроорганизмы: стрептококки, стафилококки, кишечная палочка, протей и др.
Таксономия клостридий
Возбудители газовой гангрены относятся к семейству Bacillaceae, роду Clostridium. К роду Clostridium относятся многочисленные (около 80) видов клостридий.
Морфология
Возбудитель газовой гангрены — грамположительная палочка. Бактерии обычно подвижны, имеют капсулу. некоторые виды клостридий лишены капсулы, но имеют жгутики. Самая большая по размеру из всех клостридий является С. novyi. Все остальные бактерии значительно меньших размеров.
Рис. 3. Возбудители газовой гангрены Clostridium perfringens (мазок чистой культуры) под микроскопом.
Спорообразование клостридий
Клостридии при неблагоприятных условиях образуют споры, расположенные центрально или субтерминально. При центральном расположении спор палочка становится похожей на веретено (closter — веретено).
Споры клостридий устойчивы к высушиванию, высокой температуре и солнечному свету. Они способны выживать в солевых растворах, переносить длительное кипячение, промораживание, ультрафиолетовое облучение, радиацию и вакуум. Споры проявляют устойчивость к целому ряду токсических и дезинфицирующих веществ.
В спорообразном состоянии бактерии могут находиться сотни лет. При благоприятных условиях внешней среды споры прорастают. Процесс прорастания длится 4 — 5 часов.
Рис. 4. Споры Clostridium perfringens.
Рис. 5. На фото спора клостридии. В ее сердцевине находится покоящаяся вегетативная клетка.
Рис. 6. Деление вегетативной клетки после прорастания споры.
Биохимические свойства и токсины клостридий
Возбудители газовой гангрены ферментируют углеводы с образованием газа и кислоты, образуют сложные экзотоксины — 12 ферментов (токсинов) и энтеротоксин, вызывающий воспаление кишечника. Бактерии делятся на шесть сероваров (А, В, С, D, E, F), каждый из которых имеет свои некротические характеристики. Серовар А является основным возбудителем газовой гангрены. Он формирует до 90% всех случаев заболевания. Основные мишени для токсинов являются мембраны клеток. Ферменты способствуют их расщеплению с последующим за этим отеком и аутолизом (саморастворением).
Бактерии типов А и С выделяют энтеротоксины, являющихся причиной пищевых токсикоинфекций и некротического энтерита.
к содержанию ↑Clostridium perfringens — основной возбудитель газовой гангрены
Газовую гангрену, пищевые токсикоинфекции и некротический энтерит у человека и животных вызывают Clostridium perfringens типов А, С и D. Аналогичные заболевания, но только у животных вызывают Clostridium perfringens типов В, С, D и Е.
Возбудитель впервые был открыт Уэлчем и Нетталом в 1892 году.
Морфология Clostridium perfringens
Бактерии имеют вид палочек с закругленными концами. Они крупные, имеют размер 3-9 × 0,9-1,2 мкм. Неподвижные. Располагаются поодиночке. Выделенные из чистых культур клостридии имеют капсулу. Окрашиваются по Граму в фиолетовый цвет. Старые культуры утрачивают эту способность. Образуют споры, сохраняющие в окружающей среде многие десятилетия.
Рис. 7. Мазок из чистой культуры Clostridium perfringens (фото слева). Спора бактерии (фото справа).
Рис. 8. На фото бактерии клостридий перфингенс и споры.
Культивирование Clostridium perfringens
Clostridium perfringens являются строгими облигатными анаэробами, хемоорганогетеротрофами. Растут на простых питательных средах — сахарно-кровяном агаре и среде Китта-Тароцци. Рост бактерий сопровождается газообразованием и снижением рН в кислую сторону.
- На сахарно-кровяном агаре бактерии образуют гладкие, блестящие, округлой формы (S-колонии), либо колонии сероватого цвета, плоские, шероховатые с зазубренными краями (R-колонии). Вокруг колоний образуется зона гемолиза. При контакте с воздухом колонии приобретают зеленоватую окраску. Колонии в толще агара приобретают чечевицеобразную форму.
- При росте в жидких средах (среда Китта-Тароцци) образуется помутнение с интенсивным газообразованием. В последующем среда просветляется и на дно выпадает беловатого цвета пластиноподобный осадок.
- При росте на желчном агаре образуются зоны преципитации.
- При росте на молоке уже через 4 часа отмечается его интенсивное сворачивание, а сгусток из-за газообразования приобретает дырчатую структуру и часто подпрыгивает вверх. Подобная реакция используется в лабораториях для проведения экспресс-диагностики.
- При росте на мясном бульоне бактерии образуют уксусную и масляную кислоты, а также большое количество таких газов, как H2S, NH3 и CО.
Рис. 9. Колонии Clostridium perfringens на кровяном агаре.
Рис. 10. C. perfringens идентифицируют по характерной «двойной зоне» гемолиза.
Биохимические свойства клостридий
Мощная ферментативная активность бактерий послужила присуждению им эпитета perfringens, что обозначает разламывающий, прорывающий. Благодаря интенсивному газообразованию происходит отек поврежденных тканей и разрывы питательных сред. Clostridium perfringens вырабатывают огромное число сахаролитических ферментов, сбраживающих глюкозу, лактозу, мальтозу и сахарозу с последующим образованием кислоты и газа. Они интенсивно створаживают молоко с последующим образованием губчатого крупноячеистого сгустка («штормовая реакция»).
Бактерии разлагают желатин, яичный белок, свернувшуюся сыворотку и коллаген. Не разлагает казеин.
В ходе ацетобутиратного брожения Clostridium perfringens синтезируют масляную кислоту, восстанавливают нитраты в нитриты, образуют лецитиназу.
Рис. 11. Определение лецитиназной активности. Вокруг колоний отчетливо видны зоны мутного ореола, состоящие из преципитированных липидов.
Рис. 12. В левой пробирке культура Clostridium perfringens на сахарном агаре. В результате интенсивного газообразования в гелиевоподобной среде образовались зоны разрывов.
Токсинообразование
Бактерии Clostridium perfringens по спектру продуцируемых ими токсинов (ферментов) подразделяются на типы A, B, C, и Е. Газовая гангрена и пищевые токсикоинфекции чаще связаны с типом А, некротизирующий энтероколит — с типом С. Понятие «токсин» объединяет около 12 идентифицированных сегодня токсинов (ферментов) и энтеротоксин. Выброс ферментов в области поврежденных тканей приводит к расщеплению сложных веществ и нарушению клеточной проницаемости, в результате чего клетки отекают и расплавляются.
Основные экзотоксины клостридий
- а-токсин (фосфолипаза С). Более интенсивно продуцируется клостридиями типа А. Является основным и самым мощным токсином. Фермент гидролизирует (расщепляет) фосфолипиды клеточных мембран, что приводит к разрушению (лизису) клеток. Оказывает дерматонекротическое и летальное действие, является главным фактором внутритканевой инвазии и внутрисосудистого гемолиза — символа смертельной клостридиальной токсинемии. Обладает лецитиназной активностью.
- b-токсин (цитотоксин). В основном, продуцируется клостридиями типов В и С. Оказывает дерматонекротическое и летальное действие, не вызывает гемолиз. Является причиной развития некротического энтерита.
- Тета-токсин. Обладает гемолитическим и дерматонекротическим действием. Чувствителен к кислороду. Имеет схожесть с О-стрептолизином стрептококков.
- v-токсин (протеиназы). Нарушают реакции белкового синтеза путем расщепления нуклеиновых кислот.
- р-токсин (коллагеназа и желатиназа). Продуцируется клостридиями типов А, С и Е, а также некоторыми штаммами бактерий типа D. Ферменты расщепляют желатин и коллагеновые волокна соединительной ткани. Оказывают некротизирующее и летальное действие.
- Мю-токсин (гиалуронидаза). Является фактором проникновения клостридий. Ферменты расщепляют кислые мукополисахариды и гиалуроновую кислоту.
- Ню-токсин (ДНК-за). Разрушает клеточную ДНК.
- q-гемолизин. При участии комплемента разрушает мембраны эритроцитов.
- Фибринолизин. Растворяет волокна фибрина.
- Гемагглютинин. При его участии происходит реакция агглютинации эритроцитов.
- у-токсин (протеиназа). По своему действию напоминает фибринолизин. Не расщепляет нативный (природный) коллаген, но разрушает азоколл (денатурированный коллаген), казеин и желатин.
- Дельта -токсин (эластаза). Является протеолитическим ферментом. Расщепляет белки и пептиды.
- Сигма-токсин. Продуцируют клостридии типа В и С. Оказывает летальное действие, проявляет гемолитическую активность.
- Омега-токсин. Продуцируется, в основном, клостридиями типа С. Оказывает дерматонекротическое и летальное действие.
- Эпсилон -токсин. Продуцируется клостридиями типовВ и D, l-токсин — клостридиями типа Е. Проявляют летальное и дерматонекротизирующее действие.
- у- и n-токсины. Биохимическая природа этих токсинов остается неизвестной.
- р-токсин. Является фактором проницаемости тканей.
Энтеротоксин возбудителя газовой гангрены
Энтеротоксин продуцируют клостридии типов А и С.
- Энтеротоксин Clostridium perfringens штамма А представляет собой термолабильный белок, выделяющийся в тонком кишечнике в процессе образования спор. При его воздействии капилляры расширяются, повышается их проницаемость, усиливается секреция воды, ионов натрия и хлора, повреждаются мембраны энтероцитов.
- Энтеропатогенность Clostridium perfringens типа С связана с b-токсином. Заболевание протекает по типу некротизирующего энтерита.
Рис. 13. При неблагоприятных условиях некоторые бактерии образуют споры. Они помогают выжить микроорганизму в неблагоприятных условиях много десятилетий. На фото споры бактерий рода Clostridium.
к содержанию ↑Clostridium novyi
Clostridium novyi являются одним из основных возбудителей газовой гангрены. В годы Великой Отечественной войны причиной газовой гангрены в 42% случаев были бактерии этого вида. Впервые выделили возбудитель и дали ему название Clostridium oedematiens Э. Сэген и М. В. Вейнберг в 1891 году. Позже более полно этот вид клостридий был описан американским бактериологом Ф. Нови, чьим именем в дальнейшем стали называть этот вид бактерий.
Морфология Clostridium novyi
Клостридии представляют собой палочки, крупные, иногда слегка изогнутые, размером 4 — 22 х 1,4 — 2 мкм, подвижные, имеют до 25 жгутиков, располагаются часто цепочками. Возбудитель, как и все клостридии, являются облигатными анаэробами. Капсулу не образуют. Окрашиваются по Граму в фиолетовый цвет (грамположительные). Старые культуры утрачивают эту способность. Образуют овальной формы споры, располагающиеся центрально и субтерминально.
Рис. 14. Clostridium novyi. Крупные палочки, располагаются одиночно или цепочками.
Культивирование
Clostridium novyi являются строгими анаэробами. Высокочувствительны к кислороду. Растут на простых средах: углеводных, казеиновых и мясопептонных.
- При росте на плотных средах через 48 часов образуются полупрозрачные, сочные колонии сероватого цвета. Края неровные. Поверхность зернистая. Клостридии типов А, В и С иногда образуют дочерние колонии. Колонии окружены зоной гемолиза. Клостридии типа D эритроциты не разрушают.
В глубине агара колонии напоминают комочки ваты или снежные хлопья, часто окрашенные в коричневый или желтый цвет.
- При росте на жидких средах образуется газ и помутнение питательной среды, на дно выпадает осадок. рН сдвигается в кислую сторону за счет образования H2S и органических кислот.
Антигенная структура
Clostridium novyi идентифицируются по выявлению соматических антигенов. Существует 4 серовара, различные по антигенным характеристикам и синтезируемых токсинов — серовары А, В, С и D.
Биохимические свойства
Серовары типов А, В и С ферментируют фруктозу, глюкозу и мальтозу, серовары типа D ферментируют только глюкозу. Серовары типов А, С и D разлагают глицерин. Все штаммы свертывают молоко и разлагают желатин. Клостридии типа D образуют сероводород и индол, остальные типы бактерий — нет.
Токсины Clostridium novyi
Clostridium novyi продуцируют такой фермент патогенности, как фосфолипазу (а-токсин), а также b, у, сигма, е и n — токсины, обладающие некротическим, гемолитическим и летальным действиями. Нарушая проницаемость сосудов, они приводят к развитию желеобразного отека.
Рис. 15. На фото газовая гангрена.
к содержанию ↑Clostridium septicum
Clostridium septicum впервые были описаны в 1877 году Л. Пастером. Эти бактерии являются условно-патогенными. В обычных условиях они пребывают в кишечнике человека и не вызывают заболевание. В случае дефектов кишечника, например при колоректальном раке, инфекция повреждает кишечник и с кровью (гематогенным путем) распространяется по организму. В отличие от Clostridium perfringens газовая гангрена может возникнуть без предварительных травм и повреждений. Инфекция чаще встречается у людей с травмами и ожогами кожи, после хирургических вмешательств и септических абортах, заболеваниях периферических сосудов, сахарном диабете, раке толстой кишки.
Заболевание развивается быстро. До 80% взрослых погибает в течение первых 2-х суток. Выживаемость повышается у лиц без сопутствующих заболеваниях нижних конечностей.
Clostridium septicum поражают как человека, так и домашних животных: крупный и мелкий рогатый скот.
Морфология
Clostridium septicum представляет собой бактерию палочковидной формы. с размерами 3 — 4 х 1,1 — 1,6 мкм. В культурах иногда образуются нитевидные формы бактерий, имеющие в длину до 50 мкм в длину. Подвижны (имеют жгутики). Капсулу не образуют. Грамположительны. Со временем клостридии теряют эту особенность. Являются строгими анаэробами.
Clostridium septicum образуют споры. Споры чаще всего располагаются субтерминально, реже — центрально.
Рис. 16. Clostridium septicum под микроскопом.
Культуральные свойства
Clostridium septicum хорошо растут на казеиновых и мясных средах с добавлением глюкозы.
- На поверхности глюкозокровяного агара бактерии образуют полупрозрачные колонии, блестящие, состоящие из переплетающихся нитей с зоной гемолиза по периферии.
- При росте на 2% агаре колонии имеет вид дисков.
- При росте на агаре Цейсслера по истечении 48 часов образуется сплошной нежный налет с зоной гемолиза по периферии.
- При росте в 1% сахарном агаре колонии образуются в глубине. У них уплотненный центр, от периферии отходят переплетающиеся нити.
- При росте на мясопептонном бульоне образуется равномерное помутнение. Далее отмечается выпадение рыхлого осадка и газообразование.
- При росте на среде Китта-Тароцци бактерии растут с интенсивным газообразованием.
Рис. 17. При росте в 1% сахарном агаре колонии образуются в глубине. У них уплотненный центр, от периферии отходят переплетающиеся нити.
Антигенная структура
Clostridium septicum имеют Н и О антигены. По антигенам Н определяется 6 сероваров: А, В, С, D, E и F.
Биохимические свойства
Clostridium septicum синтезируют ряд ферментов. Они живут на различных органических субстратах, в том числе содержащих сахара и аминокислоты с выделением углекислого газа и молекулярного водорода.
Бактерии ферментируют некоторые углеводы: глюкозу, мальтозу и лактозу с образованием газа и кислоты. Нитраты переводят в нитриты. Расщепляют белки с выделением аммиака и сероводорода. Молоко под действием бактерий свертывается медленно. Не разлагают сахарозу, глицерин и маннит. Не образуют индол.
Токсины
Clostridium septicum выделяют 4 экзотоксина: а, р, у и s. обладающие некротическим, гемолитическим и летальным действиями.
Рис. 18. Рост Clostridium septicum на питательных средах.
Что такое газовая гангрена
ПОНРАВИЛАСЬ СТАТЬЯ?
Подпишитесь на нашу рассылку!
Статьи раздела «Газовая гангрена»