Немногочисленные очаги глиоза — Вопрос невропатологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.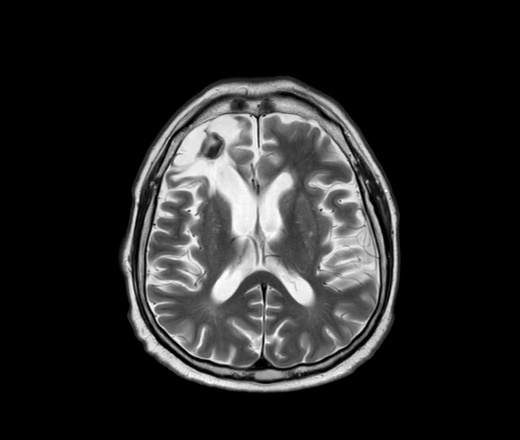
Мы отвечаем на 97.48% вопросов.
Оставайтесь с нами и будьте здоровы!
Единичный супратенториальный очаг глиоза сосудистого генеза
Вконтакте
Google+
Одноклассники
Здравствуйте, в этой статье мы постараемся ответить на вопрос: «Единичный супратенториальный очаг глиоза сосудистого генеза». Также Вы можете бесплатно проконсультироваться у юристов онлайн прямо на сайте.
Характерной чертой пациентов, у которых диагностирован глиоз, в частности на последних этапах болезни, будет наличие неврологической симптоматики и дисбаланс в центральной нервной системе. Она не даст обнаружить локализацию сбоев без осуществления инструментального обследования.
Головная боль, головокружение и нарушение памяти – частые признаки глиоза головного мозга
Обратить на себя внимание должны следующие признаки нездоровья:
- Интенсивные головные боли, которые носят постоянный характер и плохо купируются спазмолитиками;
- Скачки и падения артериального давления;
- Перманентное головокружение, снижение работоспособности;
- Возникновение проблем со слухом и зрением;
- Нарушения памяти и внимания;
- Расстройство двигательных функций.

Величина поражения может быть разной. При расчете этого показателя учитывают соотношение доли разросшейся глии к клеткам ЦНС в единице объема. Если развивается глиоз головного мозга, прогноз зависит от степени разрастания участков поражения. Этот патологический процесс может вызвать серьезные нарушения функций мозга. Вылечить его невозможно.
При этом первые признаки и симптомы глиоза часто имеют смазанную картину и маскируются симптоматикой основного заболевания: так при возникновении глиоза сосудистого генезиса, заболевший в первую очередь обращает внимание на повышение артериального давления и возникновение частых головных болей.
Виды возникновения и развития глиоза
Клинические признаки нейроглиоза зависят от основного заболевания, явившегося причиной его развития. Единичные очаги небольшого размера не дают специфической симптоматики и обнаруживаются при проведении МРТ по поводу другого заболевания.
Нервная система – основа полноценной жизни и осуществления рефлекторной деятельности человека. При ее поражении нарушаются все важнейшие функции: питание, дыхание, сердцебиение, ходьба, навыки поддерживания равновесия. Если же в область повреждения включается головной мозг, человек полностью может утратить способность к формированию речи, чтению, письму и осмысленной деятельности.
Среди взрослого населения глиоз головного мозга может развиться на фоне прогрессирования основного заболевания, вредных привычек, неправильного образа жизни и питания.
Единичные супратенториальные очаги глиоза головного мозга сосудистого генеза – возникают вследствие родовой травмы или естественных процессов старения.
Это компенсаторный процесс, обеспечивающий продолжение нормального функционирования ЦНС при гибели нейронов. При небольших размерах очаг глиоза не проявляется клинически и обнаруживается только во время обследования по поводу других патологий.
Дальнейшее усугубление патологии тканей мозга и ее проявление зависит от места локализации очаговых изменений: так при поражении правой части лобной доли больших полушарий у пациента отмечается повышенное нервное возбуждение, он становится агрессивным и невосприимчивым к поступающей речевой информации.
Заболевания головного мозга наиболее опасны, так как способны навредить всем органам и системам организма, отключить многие функции нервной системы и сделать из человека инвалида.
Подобный патологический процесс чаще всего определяется случайно при проведении обследования, потому как клинические проявления произошедших изменений в организме могут отсутствовать. Именно эти изменения и становятся причиной появления таких старческих проблем, как ухудшение координации движений, памяти и замедленности реакций.
Глиоз белого вещества головного мозга – что это?
Врожденные патологии, приводящие к развитию глиоза связаны с нарушением жирового обмена. Диагностировать их можно при проведении исследования амниотической жидкости во втором триместре беременности. При подтверждении диагноза беременность рекомендуют прервать, поскольку лечения таких болезней не существует.
Степень поражения головного мозга определяется количеством очагов поражения, в зависимости от этого, врачи диагностируют вид заболевания.
Разбираясь в этиологии глиоза, медики уверены, что непосредственное влияние на его возникновение оказывают:
- Алкоголь. При умеренном употреблении спиртных напитков повышается кровообращение. Но когда дозы оказываются большими, нарушаются нейронные связи.
- Наркотики. Их употребление приводит к отмиранию мозговых тканей и воспалению сосудов. Обследовав пациентов, которые вынуждены были использовать наркотические вещества по медицинским показаниям, было выявлено развитие глиоза.
Заболевание такой формы характеризуется большими очагами глиозных разрастаний, что делает функционирование нервной системы практически невозможным.
Последствия глиоза в первую очередь связаны с локализацией катализатора, вызвавшего патологические изменения. Томография – исследования головного мозга с помощью КТ и МРТ являются общепризнанными эталонами обследования.
Глии не выполняют в полном объеме обменные процессы в тканях головного мозга, поэтому происходит развитие патологии глиоз с его клиническими проявлениями.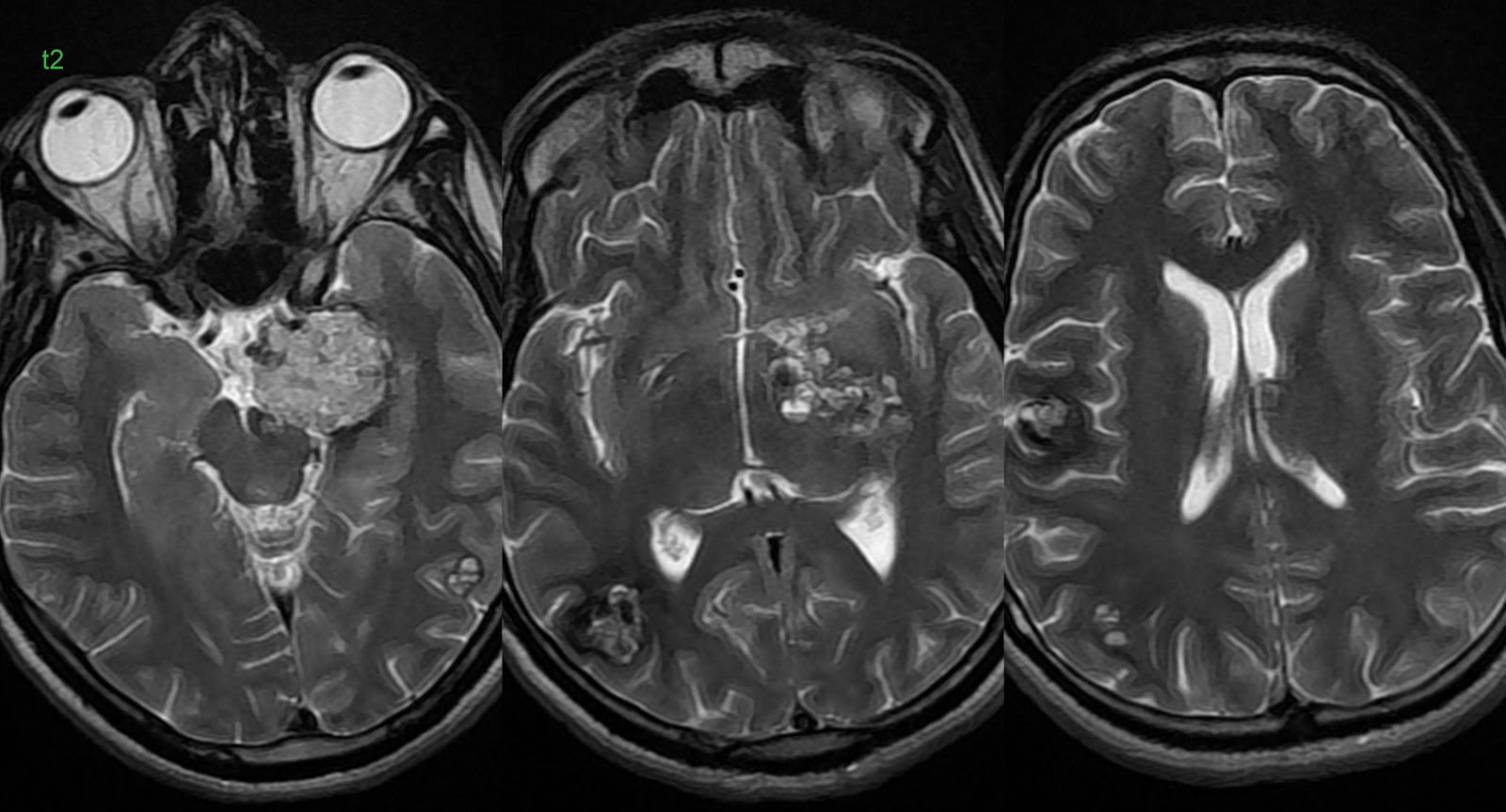
Он является физиологическим и всегда сопровождает естественное старение организма. Однако, в некоторых случаях, значительное разрастание глиальных клеток приобретает масштабный характер. Как следствие работоспособность головного мозга снижается, что приводит к нарушению обменных процессов организма.
После гибели нейронов на их место приходят глии, которые и являются живыми клетками мозга, и знают функциональные обязанности нейронов, но в полной мере выполнить данные функции они не могут.
Он является физиологическим и всегда сопровождает естественное старение организма. Однако, в некоторых случаях, значительное разрастание глиальных клеток приобретает масштабный характер. Как следствие работоспособность головного мозга снижается, что приводит к нарушению обменных процессов организма.
Из каких клеток построена нервная система? В нее входят не только нейроны (нейроциты), но и другие элементы. Каждый из них имеет свое предназначение, например, нейроглия отвечает за метаболизм в других клетках и защищает нейроны.
Критическим возрастом для возникновения глиоза считается период 15—40 лет, причем чаще всего ему подвержены пациенты, у которых в результате основного заболевания развивается церебральный отек и образование очагов поражения с выходом плазматического компонента крови в белое вещество головного мозга.
Очаги глиоза в головном мозге при МРТ — что это такое, при каких заболеваниях видны образования в белом веществе?
Периваскулярное расположение очагов (сосудистый глиоз) – наиболее распространенный тип течения. Отличается наличием разрастаний глии вдоль атеросклеротически пораженных сосудов. Диагностируется как микроангиопатия с наличием единичных или множественных очагов глиоза.
Благодаря современным методам исследования появилась возможность диагностировать самые мелкие очаги поражения и точно измерить размер новообразований, поэтому среди специалистов появилось такое понятие, как величина глиоза, которая равна увеличению клеток нейроглий по отношению к количеству здоровых функционирующих нейронов в 1 единице объема.
Глиоз сосудистого генеза считается процессом замены деформированных либо утраченных нейронов из-за разнообразных поражений тканей ЦНС на клетки глии (нейроглии). Сосудистый генез патологий головного мозга сейчас можно встретить довольно часто. К недугу относятся инсульты и разные сбои в кровотоке мозга. Данное явление зачастую становится фактором необратимых осложнений и небезопасных повреждений.
Глиоз головного мозга: причины, симптомы, лечение и прогноз
Причины некроза ткани, которые повлекли излишнее размножение нейроглии и формирование рубцов, бывают такие:
- Туберозный и рассеянный склероз.
- Воспаления, которые сопряжены с нейроинфекцией.
- Кислородное голодание мозга.
- Травмы черепно-мозгового характера.
- Повреждения при родах.
- Продолжительное повышение АД и гипертонический криз.
- Энцефалопатия.
- Ранее проведенные оперативные вмешательства.
Одним из заболеваний мозга является глиоз.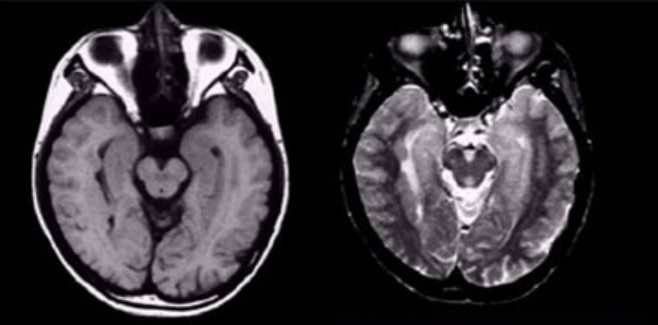 Этот термин обозначает процесс замещения отмерших нервных клеток специальными глиальными клетками. Они защищают нервную систему, помогают нейронам в передаче импульсов и в образовании новых связей.
Этот термин обозначает процесс замещения отмерших нервных клеток специальными глиальными клетками. Они защищают нервную систему, помогают нейронам в передаче импульсов и в образовании новых связей.
Такое разрастание глиозной ткани происходит на фоне разрушения собственных нейронов, из этого следует, что чем больше количество этих нервных клеток разрушено, тем обширнее будет очаг глиоза.
До того момента, пока в структуре клеток не происходит патологических процессов изменения, количество в мозге глии, не влияет на работоспособность всех мозговых функций.
Глиоз клеток мозга — это защита организма на повреждение волокон нервной системы. Когда происходит разрушение и гибель нейронов, клетки глии занимают их место и полностью стараются заменить нейроны по всем их функциям.
Все чаще, при определении этиологии заболевания, медики указывают на прямое воздействие двух факторов:
- Влияние алкоголя – умеренные дозы спиртного приводят к улучшению кровообращения и обмена веществ мозга.
 Но чрезмерное употребление выпивки наносит критический урон нейронным связям.
Но чрезмерное употребление выпивки наносит критический урон нейронным связям. - Влияние наркотиков на развитие глиоза – последние исследования позволяют сделать вывод – прием наркотических препаратов приводит к атрофии тканей мозга, некрозам и воспалению сосудов.
Практически у всех пациентов, принимавших наркотики, даже в медицинских целях, наблюдается начальная степень глиоза.
Глиоз головного мозга и его суть заключаются в том, что в области пассивных нейронов, погибших вследствие какой-либо определенной причины, начинают разрастаться клетки нейроглии.
Желательно употребляйте продукты, не подвергшиеся термообработке. Для приготовления используйте щадящие способы – тушите, варите, готовьте на гриле или в пароварке.
Единичные патологические очаги глиальных разрастаний могут являться случайной находкой при проведении диагностического обследования.
Если неврологическая проблема имеет место, проявления глиоза могут быть следующие:
- Головная боль.
 Болевые ощущения могут быть различной степени выраженности, продолжительности: от умеренной постоянной, до нестерпимой, мигренозной.
Болевые ощущения могут быть различной степени выраженности, продолжительности: от умеренной постоянной, до нестерпимой, мигренозной. - Головокружение.
- Ухудшение памяти, внимания.
- Лабильность настроения.
- Шаткость походки, неустойчивость при ходьбе.
- Забывчивость.
- Шум в голове.
- Неустойчивость артериального давления (характерно для глиоза сосудистого генеза).
- Судорожные приступы.
- Бессонница.
- Паретические расстройства, парестезии (ощущение «ползания мурашек»).
- Ухудшение работы зрительных анализаторов: слуха или зрения.
- Повышенная утомляемость, слабость, проявления общей астенизации организма.
- Нарушения речи, дизартрия.
Очаги разрушения нейронов ухудшают функциональность всей ЦНС. Лечить данную патологию не имеет смысла, потому что погибшие нейроны не поддаются восстановлению, а удалять количество глии нельзя, так как они служат замещением разрушенных клеток нейронов и замещают их по мере своей возможности.
Глиальные клетки разрастаются вследствие защитной реакции организма, пытающегося восполнить недостающие нейроны. В результате, на месте некротических явлений и повреждений мягких тканей мозга, разрастается своеобразный «шрам» или рубец.
Нервные ткани, кроме сети нейронов, состоят из глий, капилляров, эпидермальных единиц и стволовых клеток. При этом глии образуют основу и поддерживают форму структурных образований.
Неврологи уверены в том, что глиозные изменения не являются заболеванием, а это всего лишь последствия некоторых патологических изменений в головном мозге. Разрастание глиальных клеток происходит, как защита организма и реакция на гибель нейронов, которые необходимо заменить.
Цитрусовые освобождают организм от жидкости
При развитии патологических процессов, вызывающих гибель большого участка нервной ткани, глиоциты замещают отмершие импульсные клетки, хотя генерировать и проводить нервные импульсы они не могут. Благодаря этому распространение патологического процесса замедляется, а обмен веществ пораженного участка сохраняется в полном объеме.
Очаги глиоза сосудистого генеза вызывают сбои активности мозга и атрофические изменения тканей. Единичные супратенториальные очаги не способны провоцировать признаки заболевания и выявлятся случайно в процессе диагностики.
Известно, что у здорового человека нейроглия занимает около 40% всей нервной ткани, однако, из-за длительного пагубного влияния различных неблагоприятных факторов происходит ее патологическое разрастание или глиоз. Эта аномалия ЦНС на начальной стадии не имеет ярко выраженной клинической картины, но со временем усугубляясь, способна привести к плачевным последствиям.
На начальном этапе развития глиоз никак себя не проявляет, при этом о наличии небольших или микроскопических очагов поражения пациент может узнать только на плановом МРТ исследовании, которое позволяет обследовать содержимое не только черепной коробки, но и нервную ткань всей ЦНС.
Также подозрение на некоторые неврологические проблемы, связанные с недостаточным функционированием ЦНС, часто обнаруживаются на приеме врача-невролога, который перед постановкой предварительного диагноза, должен оценить работу нервно-мышечного аппарата и других структур, отвечающих за кровоснабжение мозговых тканей.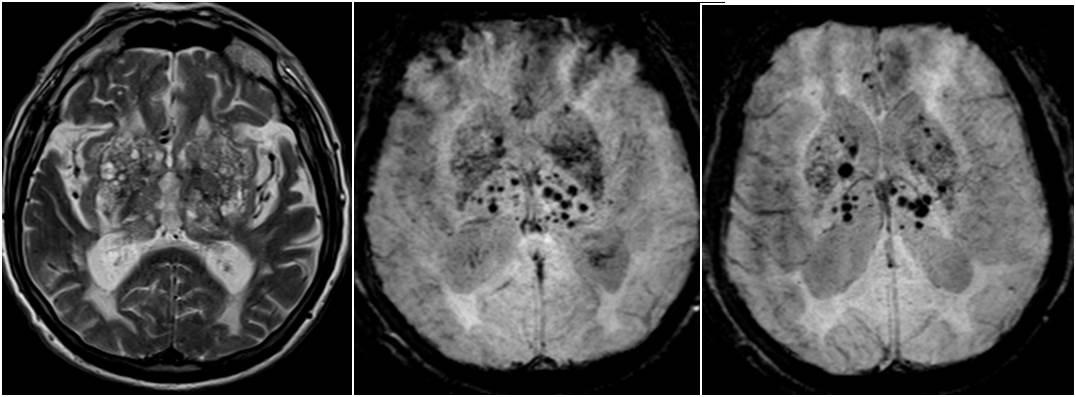
Головной мозг человека состоит из серого и белого вещества, которые, в свою очередь, включают нейроны, функциональные отростки, глиальные ткани, участки эпителия и кровеносные сосуды, обеспечивающие нервные ткани кислородом и другими питательными веществами.
При этом функциональной единицей ЦНС является нейрон, особенностью которого является способность к возбуждению или возникновению электрического импульса, который посредством отростков главной клетки передается соседним нейронам. Затем, переработанная информация, при помощи миелиновых волокон белого вещества поступает к нижележащим нервным центрам, откуда направляется в функциональные органы и другие системы жизнеобеспечения человека.
Разрушение одного из звеньев этой цепи ведет к частичному нарушению передачи импульса или к полному его исчезновению и, соответственно, к дисфункции органа, к которому он был направлен. Также вследствие разрастания глиозных очагов происходит смещение нейронов коры и разрыв образованных ими связей, что приводит к дисфункции того участка головного мозга, к которому они принадлежали.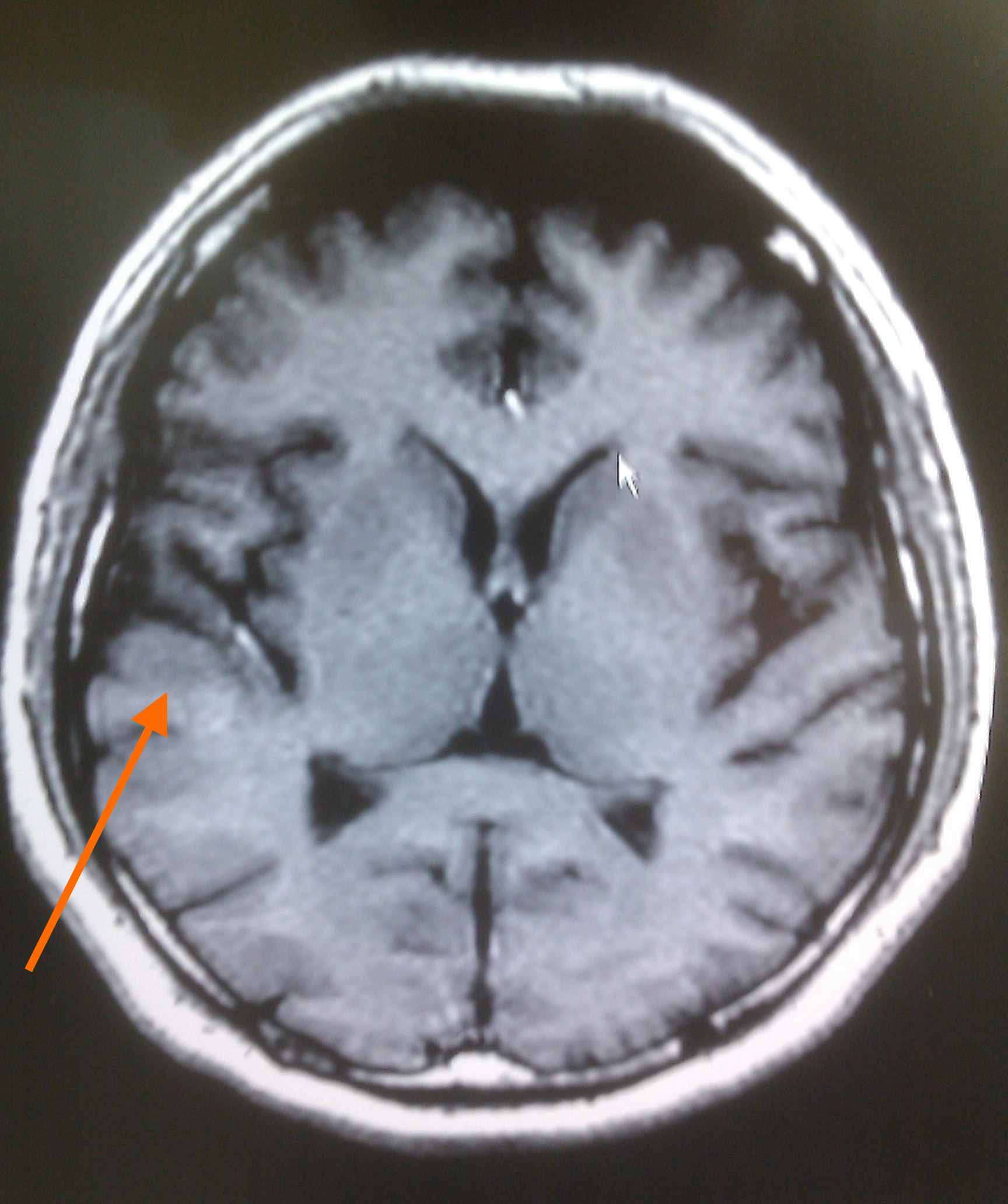
Специалисты выделяют несколько видов глиоза в зависимости от концентрации и места расположения очага поражения:
Хотя процесс такого замещения сравнивают с регенерацией кожи, эти элементы не способны полноценно восстановить поврежденное гибелью нейроцитов строение мозга. Глиальные клетки не компенсируют нервную проводимость в полной мере. Они построены иначе и изначально имеют другое назначение. Болезни головного мозга всегда носят довольно серьёзный характер. Безусловно, любые неполадки в организме требуют внимания, но в случае с головным мозгом даже самая небольшая проблема должна быть внимательно рассмотрена.
Глиоз головного мозга: симптомы, терапия
В статье рассмотрим признаки глиоза головного мозга.
В процессе функционирования нейронов по всему человеческому организму передаются различные нервные импульсы. Некоторые факторы способствуют мгновенному разрушению нервных клеток, на фоне чего они замещаются глиальными элементами. В медицине такое состояние называют глиозом головного мозга. Подобное физиологическое явление служит естественным процессом во время старения организма. Но бывает так, что микропроцессы обмена в значительной степени нарушаются вследствие снижения мозговой работоспособности. Такой сбой может происходить в том случае, если очаги глиоза в белом веществе значительно разрастаются, приобретая масштабный характер. О том, что такое глиоз, каковы его признаки и как проходит лечение, расскажем в нашей статье.
Подобное физиологическое явление служит естественным процессом во время старения организма. Но бывает так, что микропроцессы обмена в значительной степени нарушаются вследствие снижения мозговой работоспособности. Такой сбой может происходить в том случае, если очаги глиоза в белом веществе значительно разрастаются, приобретая масштабный характер. О том, что такое глиоз, каковы его признаки и как проходит лечение, расскажем в нашей статье.
Основная информация о патологии
Специалисты в сфере неврологии полагают, что подобное отклонение в клетках мозга нельзя классифицировать в качестве отдельного заболевания, так как данная патология, скорее всего, является следствием других нарушений в человеческом организме. До тех пор, пока изменение клеточного состава мозга не становится аномальным, на работоспособность нервных клеток глии никак не влияют, а скорее, даже наоборот. Они могут оказывать защитное воздействие, предупреждая различные травмы и попадание инфекций в пораженные участки мозга.
Замещая районы погибших нейронов, глии выполняют функцию прежней структуры и снабжают обменные процессы мозговых тканей. Но положительный эффект, связанный с образованием глий, происходит только до наступления определенного состояния. Непосредственно после его достижения любые изменения переходят в разряд патологии, что со временем может проявляться в виде тех или иных клинических проявлений. Теперь разберемся, какие причины вызывают глиоз головного мозга.
Основные причины развития глиоза
Провоцировать гибель нервных тканей, а, следовательно, и глиоз мозга могут самые разные факторы. Приведем наиболее распространенные из них:
- Наличие генетической или наследственной патологии.
- Развитие туберкулезного склероза.
- Появление хронической патологии кровообращения в мозге.
- Появление травм черепа и мозга.
- Воспаления, которые провоцируются нейронной инфекцией.
- Наличие продолжительно прогрессирующей гипертензии.
- Появление травм при рождении.

- Понижение содержания сахара.
- Влияние оперативных воздействий на головной мозг.
На фоне родовой травмы, которая сопровождается асфиксией, может происходить гибель клеточных нейронов. Данная патология в первые несколько месяцев никоим образом не сказывается на детском развитии. Регресс, как правило, возникает после шестого месяца, что выражается в форме психических и физических нарушений в развитии. Факторами, непосредственно влияющими на очаги глиоза в головном мозге, являются следующие причины:
- Употребление алкоголя. В том случае, если употреблять алкогольные напитки в умеренном количестве, то это будет способствовать повышению кровообращения. Но увеличение дозы спиртного может спровоцировать нарушение нейронных связей.
- Прием наркотиков. Абсолютно любой вид наркотических препаратов может повлечь за собой воспаление сосудов с очаговым отмиранием мозговых тканей.
Формы патологии и степени ее развития
Начальная стадия образования глиоза головного мозга обычно носит бессимптомный характер. Клиническое проявление нарушений врачи, как правило, обнаруживают на фоне последующего патологического распространения глиозного очага. В ходе некротических процессов на месте отмерших клеток нейронов, которые образуют очаги глиоза, в мозге освобождаются большие участки. Формы глиоза мозга напрямую зависят от разных признаков, характера и локализации его положения:
Клиническое проявление нарушений врачи, как правило, обнаруживают на фоне последующего патологического распространения глиозного очага. В ходе некротических процессов на месте отмерших клеток нейронов, которые образуют очаги глиоза, в мозге освобождаются большие участки. Формы глиоза мозга напрямую зависят от разных признаков, характера и локализации его положения:
- Единичный глиоз головного мозга. Этот супратенториальный тип нарушения появляется в результате старения организма или во время получения родовой травмы новорожденным. Подобное отклонение никак не проявляется и является не опасным для человека.
- Множественный глиоз головного мозга может возникать при нарушении мозгового кровообращения. Данное состояние может выступать проявлением неврологической патологии.
- Перивентрикулярные проявления поражают участки желудочков мозга. В результате могут формироваться изменения кистозного и глиозного характера.
- Анизомофорные проявления могут быть выявлены в любой части мозга.
 Они служат следствием хаотичного разрастания глиального волокна.
Они служат следствием хаотичного разрастания глиального волокна. - Периваскулярные нарушения заявляют о себе тем, что происходит опутывание поврежденных сосудов посредством глиозных клеток, что является признаком рассеянного склероза.
- Субкортикальные очаги глиоза в белом веществе головного мозга диагностируют под корой.
- Диффузные поражения образуют множественные очаги глиоза мозга, которые способны впоследствии распространяться на спинной мозг.
- Краевой вид может поражать поверхность мозга.
Далее выясним, каким образом может проявляться эта патология.
Симптоматика патологии и ее последствия
Единичные появления глиоза головного мозга обычно не выдают себя. Обнаруживают такие очаги случайным образом во время магнитно-резонансного обследования. Однако в том случае, если вовремя не обнаружить патологию, глиоз будет размножаться, формируя новые островки атрофического изменения. Следующие симптомы нарушения в состоянии организма должны непременно насторожить человека:
- Наблюдение резких и частых перепадов артериального давления.

- Наличие постоянных интенсивных головных болей, которые не купируются спазмолитиками.
- Наблюдение снижения работоспособности с появлением периодических головокружений.
- Утрата концентрации и внимания наряду с провалами в памяти.
- Значительное снижение слуховой, а, кроме того, зрительной функции.
- Нарушение в работе двигательной системы.
Необходимо отметить, что проявление заболевания с интенсивностью его симптоматики напрямую зависит от того, на каком именно участке сформировались очаги глиоза в головном мозге:
- Супратенториальная форма наиболее часто может выражаться расстройством зрения.
- Глиоз в белом веществе головного мозга зачастую является следствием черепной травмы и оперативного вмешательства в этот орган. Проявиться данное нарушение может в форме головокружений, а, кроме того, в виде судорожного состояния мозга.
- Частые, а вместе с тем сильные боли в голове могут являться следствием травмы височной доли.
 Кроме того, такие головные боли могут повлечь за собой глиоз сосудистого генеза, который будет провоцировать постоянные скачки давления.
Кроме того, такие головные боли могут повлечь за собой глиоз сосудистого генеза, который будет провоцировать постоянные скачки давления. - При отсутствии каких-либо других заболеваний, которые стимулируют размножение глии, появление глиоза может рассматриваться в качестве первичной патологии. Такие изменения считаются возрастными и появляются на фоне естественного старения.
Опасность развития глиоза
Расположение катализатора, который вызывает патологические нарушения, влияет в первую очередь на последствия глиоза вещества головного мозга. Скачки давления наряду с гипертензией, энцефалитами, рассеянным склерозом и травмами черепа могут приводить к последующему образованию глий.
Продолжительность жизни людей, страдающих подобными изменениями, в первую очередь зависит от степени повреждений систем и органов, которые наиболее важны для жизни. Благоприятность прогноза данного заболевания зависит от своевременного диагностирования нарушений, а, кроме того, от адекватности лечения.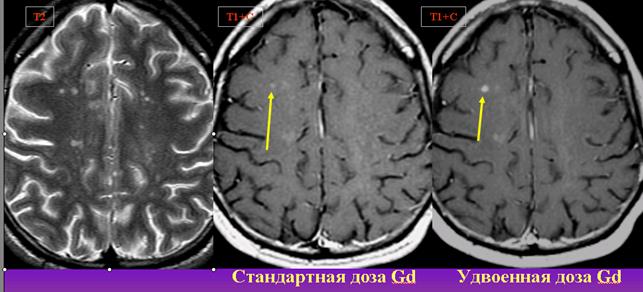 Далее разберемся, какие меры в наши дни предпринимаются для лечения глиоза мозга.
Далее разберемся, какие меры в наши дни предпринимаются для лечения глиоза мозга.
Диагностика и последствия глиоза
Анализы мочи и крови не дают точной информации для диагноза, поэтому обследование проводят при помощи магнитно-резонансной и компьютерной томографии (МРТ и КТ), также эффективна ангиография. Детей обследуют посредством нейросонографии.
МРТ поможет выявить следующие отклонения:
- очаги глиоза, их количество, размер и локализацию;
- на каком уровне поражены мозговые структуры;
- в каком состоянии находятся окружающие структуры.
Также на основании этой процедуры высока вероятность определения причины патологии, что позволит в будущем успешно побороть болезнь.
Очаг на МРТ определяют из соотношений внеклеточной и внутриклеточной жидкости в имеющемся образовании.
Существует несколько критериев, которые характеризуют полученное изображение и дают информацию о природе очага:
- Имеет значение интенсивность изображения — чаще всего наблюдают гиперинтенсивные и изоинтенсивные сигналы.

- Характер изображения также оценивают — бывает гетерогенная или гомогенная структура.
Глиоз головного мозга и его лечение
В случае возникновения подозрительной симптоматики глупо надеяться на то, что запустившийся процесс не будет прогрессировать без необходимого лечения, оставаясь на своем прежнем уровне. Даже наиболее безобидное нарушение в состоянии, которое свойственно для глиоза сосудистого генеза, может давать различные осложнения, начиная от полной утраты речевой функции, заканчивая параличом конечностей, расстройством интеллектуального и механического характера наряду с деменцией.
Жить с подобными симптомами можно, но все эти проявления будут создавать дискомфорт пациенту, являясь одновременно весьма опасными для его жизни. В наиболее тяжелых случаях, например, при неправильном лечении или вообще на фоне полного отсутствия терапии возможен летальный исход. В связи с этим лечение такого заболевания следует начинать сразу после того, как оно будет обнаружено. На МРТ очаги глиоза головного мозга очень хорошо просматриваются.
На МРТ очаги глиоза головного мозга очень хорошо просматриваются.
Эффективных терапевтических способов для борьбы с этой патологией на сегодняшний день еще не разработано. Прежде всего, лечить необходимо основное заболевание, спровоцировавшее этот патологический алгоритм. Такие меры помогут предотвратить последующее формирование вторичного очага и приостановят развитие и еще большее усугубление заболевания.
Одним из самых важных критериев в рамках предупреждения дальнейшего развития болезни является рацион. Прежде всего, необходимо исключить жирную пищу, так как именно она может положительно влиять на прогрессирование, а, кроме того, на усугубление глиоза вещества головного мозга. Больше всего этот фактор будет сказываться в том случае, если у пациента присутствует врожденное нарушение в жировом обмене. Непосредственно после рекомендаций специалиста допустимо использование ноотропных лекарств наряду с вазоактивными и метаболическими средствами. Но надо сказать, что представленная терапия является неспецифичной. В том случае, если не устранить факторы, которые спровоцировали развитие патологического нарушения, терапия окажется бесполезной.
В том случае, если не устранить факторы, которые спровоцировали развитие патологического нарушения, терапия окажется бесполезной.
Как еще можно лечить очаги глиоза в белом веществе головного мозга?
Обращение к традиционной медицине
Многие люди могут жить годами, не зная об этом заболевании. А запускать глиозные нарушения мозга не рекомендуется. Чем дольше пациенты тянут с лечением, тем сложнее будет справиться в будущем с последствиями болезни. Препаратов, которые бы устраняли глиальные образования, не существует, так как глиозные нарушения не классифицируются в качестве самостоятельного заболевания. Для того чтобы улучшить самочувствие пациента, традиционная медицина обращается к трем следующим направлениям лечения:
- Проведение профилактики. Организм взрослого человека на раннем этапе болезни может справиться с негативными изменениями самостоятельно. Специалисты рекомендуют пациентам полностью бросить вредные привычки, изменив режим питания. Также очень важно придерживаться здорового образа жизни.

- Использование медикаментов. Врачи назначают необходимое лечение того заболевания, которое спровоцировало глиоз сосудистого генеза головного мозга. В случае появления поражений назначаются средства, которые восстанавливают и укрепляют стенки артерий. Также применяют препараты, которые повышают мозговую активность посредством улучшения проводимости нервного волокна.
- Проведение хирургического лечения. В том случае, если у пациента выявляют отклонения в работе внутренних органов наряду с судорожными и эпилептическими припадками, то целесообразным считается назначение нейрохирургического вмешательства.
Лечение глиоза головного мозга этим не ограничивается.
Обращение к народным способам терапии
Сколько бы лекарственных средств не назначали больному, а дополнительное поддержание организма посредством применения народных средств поспособствует улучшению общего состояния.
- На начальном этапе при наличии немногочисленных поражений очагов прекрасно поддерживают организм человека травы, которые способствуют стабилизации системы кровоснабжения и повышают обмен веществ.

- При развитии у пациента ожирения рекомендуется диета, основанная на сыроедении, также требуются разгрузочные дни с периодическим голоданием. Это поспособствует общему очищению организма от различных веществ, которые нарушают его здоровое функционирование.
- Прием настоек и различных отваров, действие которых направляется на борьбу с симптоматикой заболевания. В аптеке можно покупать уже готовые сборы, которые являются сбалансированными для лечения.
Необходимо подчеркнуть, что лечение с помощью народных методик может оказаться действенным лишь в качестве дополнения к традиционной терапии, которая должна назначаться специалистами. Продолжительный эффект от применения лекарственных средств и лечения с помощью народных методов не будет достигнут до тех пор, пока не устранится причина глиального образования. Далее выясним, какие меры профилактики помогут людям избежать развития данного заболевания.
Сколько живут взрослые с глиозом головного мозга? Это частый вопрос. Об этом далее.
Об этом далее.
Проведение профилактики
Для того чтобы суметь предотвратить прогрессирование глиального образования и исключить возникновение этой болезни, необходимо следовать некоторым правилам профилактики, приведем основные из них:
- Каждому человеку требуется качественный отдых наряду со свежим воздухом и полноценным сном. Если придерживаться правильного дневного распорядка, человеку удастся сохранить нервную систему в здоровом состоянии.
- Занятие посильными физическими нагрузками также поспособствует общему укреплению нервной системы. Чтобы организм был выносливым, а вместе с тем и сильным, вовсе не обязательно посвящать спортивным занятиям очень много времени. Достаточно будет просто уделять немного времени определенному комплексу упражнений каждый день.
- Питание организма. Стоит в полной мере отказаться от вредных животных жиров. Продукты, которые жизненно необходимо включить в свой рацион в рамках профилактики различных нарушений, – это, прежде всего, злаки наряду с овощами, фруктами и мясом нежирных сортов.
 Во время приготовления пищи лучше всего использовать технику тушения или приготовления продуктов в пароварке.
Во время приготовления пищи лучше всего использовать технику тушения или приготовления продуктов в пароварке. - Очень важно полностью отказаться от вредных привычек.
Представленные выше профилактические мероприятия являются полезными для всех людей, они позволят в значительной степени ограничить возможность развития такого нежелательного недуга, как глиоз мозга. Помимо этого, они могут помочь замедлить прогрессирование уже имеющегося заболевания.
Прогноз жизни с глиозом головного мозга
Стоит отметить, что последствия роста количества глиозных клеток напрямую зависят от расположения катализатора, спровоцировавшего эту патологию. Прогнозирование на полноценную жизнь зависит от степени повреждений жизненно важных систем и органов. Чем раньше выявить изменения и провести качественное лечение, тем благоприятнее окажется прогноз для пациента.
ГЛИОЗ ГОЛОВНОГО МОЗГА НА МРТ | Все о КТ и МРТ
В ходе МРТ головного мозга врачи могут выявить такое заболевание, как глиоз. Что же это такое, каковы признаки глиоза на томографии и как с этим жить — мы поговорим в этой статье. Глиоз головного мозга представляет собой вторичное заболевание, появляющееся по причине возникновения определенных расстройств на клеточном уровне ЦНС. Болезнь носит хронический характер. Максимальным положительным эффектом лечения можно считать стабилизацию состояния без дальнейшего прогрессирования.
Что же это такое, каковы признаки глиоза на томографии и как с этим жить — мы поговорим в этой статье. Глиоз головного мозга представляет собой вторичное заболевание, появляющееся по причине возникновения определенных расстройств на клеточном уровне ЦНС. Болезнь носит хронический характер. Максимальным положительным эффектом лечения можно считать стабилизацию состояния без дальнейшего прогрессирования.
КЛИНИЧЕСКАЯ КАРТИНА ПОЯВЛЕНИЯ ГЛИОЗА
Человеческий мозг состоит из следующих клеточных образований: эпендимальный слой, нейроны (нейроцит, нерв и его волокно, неврон), нейроглиальные клетки. Главными веществами головного мозга являются нейроны, распространяющие импульсы по всей нервной системе. Нейронные процессы, включая гибель этих клеток, протекают малозаметно для человека. Достаточно важную функцию выполняют и нейроглии, отвечающие за метаболические процессы, выполнение секреторной, трофической функции. Здоровый мозг содержит глиальные клетки в большом количестве (около 40% от общей мозга) при сохранении всех нейронов. Они защищают мозг от возможных травм, клеточных повреждений и инфекций. Если же по причине заболевания или травмы происходит отмирание нейронов, их место занимают глии. Процесс замены нейронов нейроглиальными клетками (своеобразным клеем мозга) называется глиозом головного мозга. Иными словами, глиальные клетки реагируют на возникшее повреждение клеток ЦНС, занимая позицию отмерших нейронов, и тем самым способствуют восстановлению обменных процессов в мозговой ткани. Они не способны осуществлять нейрорегуляторные функции, как это делают нейроны, а потому такое перераспределение клеток в головном мозге считается патологическим состоянием.
Они защищают мозг от возможных травм, клеточных повреждений и инфекций. Если же по причине заболевания или травмы происходит отмирание нейронов, их место занимают глии. Процесс замены нейронов нейроглиальными клетками (своеобразным клеем мозга) называется глиозом головного мозга. Иными словами, глиальные клетки реагируют на возникшее повреждение клеток ЦНС, занимая позицию отмерших нейронов, и тем самым способствуют восстановлению обменных процессов в мозговой ткани. Они не способны осуществлять нейрорегуляторные функции, как это делают нейроны, а потому такое перераспределение клеток в головном мозге считается патологическим состоянием.
Ограниченные участки головного мозга, где произошло поражение нейронов, именуются очагами. Это своеобразные пустоты заполняются глиозными образованиями. Развитие болезней клеточного генеза приводит к увеличению массы глии относительной общего количества мозговой ткани. Проблема эта достаточно серьезная, но до определенной стадии человек и врачи вообще могут не замечать появления очагов. Если же имеет место повышенние содержания глиозных тканей в головном мозге, можно говорить о прогрессирующем характере болезни. Клинические тесты, направленные на изучение истинных причин развития глиозных нарушений, проводятся медиками регулярно. Есть мнение, что глиоз — это некое состояние мозговых тканей, возникающее под действием множества факторов, носящих чисто наследственный характер. Последние исследования в той области выявили некоторую зависимость образования участков поражения от возраста больного. Единичные очаги глиоза могут формироваться в любом возрасте, но преимущественно данные процессы происходят у пожилых людей, поэтому выдвинуто предположение, что глиоз — это естественный дегенеративный процесс, говорящий о старении мозговых клеток. Однако полностью патогенез этого явление не изучен.
Если же имеет место повышенние содержания глиозных тканей в головном мозге, можно говорить о прогрессирующем характере болезни. Клинические тесты, направленные на изучение истинных причин развития глиозных нарушений, проводятся медиками регулярно. Есть мнение, что глиоз — это некое состояние мозговых тканей, возникающее под действием множества факторов, носящих чисто наследственный характер. Последние исследования в той области выявили некоторую зависимость образования участков поражения от возраста больного. Единичные очаги глиоза могут формироваться в любом возрасте, но преимущественно данные процессы происходят у пожилых людей, поэтому выдвинуто предположение, что глиоз — это естественный дегенеративный процесс, говорящий о старении мозговых клеток. Однако полностью патогенез этого явление не изучен.
Классификация глиозной ткани осуществляется с учетом концентрации участков поражения и формы очагов патологии.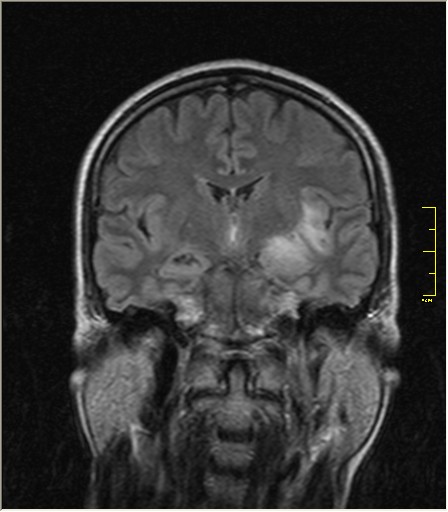 Выделяют следующие формы глиозов головного мозга:
Выделяют следующие формы глиозов головного мозга:
- Аморфный тип. Отличается беспорядочным разрастанием очагов глиоза в головном мозге с преобладанием клеточной структуры.
- Волокнистый тип. Образование имеет, преимущественно, волокнистую структуру.
- Периваскулярный глиоз. Характеризуется концентрацией глий вокруг склерозированных кровеносных сосудов. Одной из причин глиоза сосудистого можно назвать демиелинизирующие заболевания, например — рассеянный склероз.
- Диффузный тип. Охарактеризован отсутствием очагов поражения. Возникает у пациента в головном, либо спинном мозге. Причина — диффузные поражения нервной системы, например, ишемическая болезнь.
- Субэпендимальный вид. Характеризуется сосредоточением очагов глиоза в субэпендемии.
- Краевой глиоз. Характеризуется концентрацией очагов поражения сразу под оболочкой.

- Очаговый вид. Области повреждения нервных тканей четко очерчены. Возникает по причине протекания воспалительного заболевания, приведшего к отмиранию нейронов.
Важным параметром глиальных образований является размер. Чем больше область разрастания образования, чем менее четко она локализована, тем сильнее возможны поражения нервной системы.
СИМПТОМЫ ГЛИОЗАГлиоз головного мозга сопровождается проявлением различных симптомов, поскольку он может быть локализован в различных долях мозгового вещества. В их число входит головные боли, гипертония, нарушенная координация, дезориентация в пространстве, уменьшение остроты зрения, слуха, потеря памяти, человеку тяжело концентрировать внимание. Множественные очаги глиоза приводят к распространению следующих симптомов:
- снижение уровня зрения и слуха;
- проблемы с вниманием на фоне первичной потери памяти;
- нарушения психического поведения;
- перепады артериального давления;
- проблемы с речью и координацией;
- бывает возникает временный паралич.

Степень хорошего самочувствия пациента при ярковыраженном глиозе зависит от локации и геометрии очагов. Крупный очаг глиоза может вызвать судорожные припадки и эпилепсию. В остальном симптомы не специфичны, а потому определить проблему сразу получается далеко не у всех медицинских работников. Поставить правильный диагноз поможет только процедура МРТ головного мозга.
СИМПТОМЫ ГЛИОЗА У НОВОРОЖДЕННЫХГлиоз головного мозга может носить врожденный характер. У новорожденных малышей он проявляется немного иначе, чем у взрослых. Нервные ткани гибнут по причине врожденных заболеваний центральной нервной системы. Затем на их месте появляются глии. Данное заболевание проявляется следующими симптомами:
- снижение активности головного мозга;
- заторможенность и неспособность младенца фокусироваться и концентрировать внимание;
- признаки гидроцефалии;
- слабый тонус конечностей.

Проблема отмирания нервных клеток и последующий глиоз белого вещества может возникать вследствие различных болезней:
- демилиезация и рассеянный склероз;
- нарушенный жировой обмен;
- воспалительные заболевания оболочки мозга, включая менингит, энцефалит и туберкулез;
- последствия ЧМТ, отечное состояние мозга;
- ОНМК, инсульт, ишемия;
- частые гипогликемии;
- наследственные факторы;
- дефицит железа в крови.
Помимо заболеваний, названных выше, глиоз головного мозга провоцируется неправильным образом жизни и вредными привычками. В старшем возрасте этот процесс может говорить о возрастной дегенерации мозгового вещества.
РОЛЬ НАСЛЕДСТВЕННОСТИ ПРИ ГЛИОЗЕСейчас врачи медицинских центров СПб глиоз головного мозга могут предвидеть на генном уровне, поскольку он появляется под влиянием мутирующего гена, отвечающего за синтез гексозоаминидаза. Это фермент, обеспечивающий выработку ганглиозидов, а они уже провоцируют дисфункцию нервных тканей. При условии, что мутирующий ген присутствует и у отца, и у матери, риск возникновения у общего ребенка глиоза головного мозга составляет 25%. Имея такой риск, родителям необходимо получить консультацию генетика при планировании беременности. Также при наличии глиоза головного мозга у одного из детей значительно повышается вероятность проявления заболевания и у следующих общих детей пары. В данном случае достоверные прогнозы развития патологий может дать только квалифицированный врач.
ДИАГНОСТИКА ГЛИОЗА НА МРТ
Выявляется глиоз на МРТ головного мозга. Магнитно-резонансная томография проводится с использованием специального устройства – томографа. Обследуемый помещается в открытую или закрытую камеру аппарата, где под действием магнитных волн исследуется состояние долей мозга и сосудистого русла. На полученных МРТ снимках врачи четко увидят даже самы маленькие очаги поражения, источник возникновения глиальных клеток, степень распространенности патологии, смогут оценить нарушения в системе сосудов. Помимо МРТ могут проводиться некоторые клинические анализы: анализ крови на содержание железа,генетический анализ крови родителей.
Однако информативность их имеет вторичный характер. Скорее они направлены не на выявление глиоза, а на контроль лечения основной болезни, ставшей толчком его развития. Основным методом диагностики, дающим обширную картину состояния головного мозга, все же является МРТ головы. Для детей помимо МРТ допускается проведение нейросонографии, также отображающей обширную картину мест скопления клеток глий, а для младенцев до года результативным также является УЗИ. МРТ показывает следующие клинические проявления глиоза головного мозга:
- геометрию и количество локальных скоплений клеток, замещающих нервную ткань;
- степень поражения вещества головного мозга глиальными очагами;
- состояние близко расположенных тканей и сосудов.
МРТ также позволяет определить причины поражения глиозом головного мозга — болезни, ведущие к структурным изменениям мозговых тканей. Результаты МРТ головы позволяют не просто оценить масштаб аномалии, причины и распространение глиоза, но также составить план лечения пациента. На МРТ снимках хорошо прослеживаются места разрастания клеток глии, замещающих нервную ткань, включая единичные очаги. Последствия некомпенсированного глиоза могут быть очень серьезными. У некоторых пациентов при обширном прогрессировании наблюдаются такие симптомы, как паралич, сильные непроходящие боли в голове, постоянное головокружение, нарушение способности координировать собственную двигательную деятельность, шаткость в походке, плохая моторика рук и признаки слабоумия. Потому важно проводить диагностическую профилактику заболеваний головы. Для это людям после 50 лет врачи медицинских центров СПб настоятельно рекомендует делать профилактическое МРТ головного мозга один раз в год.
ПРОФИЛАКТИКА ГЛИОЗАМетодик полного излечения глиоза головного мозга пока не разработано. Но врачами проводится успешная терапия, которая тормозит распространение патологических процессов. Основная задача этой терапии – лечении заболеваний, ставших причиной глиоза головного мозга. Ключевыми факторами, влияющими на появление множественных очагов глиоза, стоит назвать и такие проблемы, как высокий холестерин, декомпенсированный диабет, гипертония, мерцательная аритмия. Значительно улучшить качество жизни и предотвратить возникновение проблем с разрастанием глиальных клеток поможет правильное питание. Главным условием правильного питания для мозга является ограничение потребления жиров, провоцирующих заболевание.
Излечить глиоз головного мозга невозможно, но болезнь можно предупредить или же остановить ее дальнейшее развитие. Для этого следует выполнять следующие меры профилактики: Правильное питание с максимальным отказом от жирной пищи, как уже упоминалось выше. В данном случае нарушение жирового обмена провоцирует распространение глий. Следует оставить в рационе то количество жиров, которое необходимо для нормальной жизнедеятельности организма.
Здоровый образ жизни. Регулярная физическая активность с приемлемым уровнем нагрузки будет способствовать улучшению все систем организма. Важно не перегружать организм, а просто обеспечить активный образ жизни на свежем воздухе. Постоянные обследования с рекомендуемой частотой. Сюда входит не только МРТ диагностика раз в год пациентам старше 50 лет, но систематический контроль артериального давления, холестерина, глюкозы в крови. Также при появлении симптоматики необходимо посещать невролога и по рекомендации устранять все выявленные проблемы, препятствующие нормальной работе организма.
В некоторых случаях профилактика заболеваний обеспечивается за счет лечения терапевтическими методами в стационарных или амбулаторных условиях, например, сезонные курсы витаминных капельниц или периодические поездки для санаторно-курортного лечения. Важно, начиная с 45 лет, проходить ежегодное полное обследование и выявить все существующие проблемы с головным мозгом до назначения различных терапевтических препаратов. Нельзя применять методы самолечения, поскольку болезнь может приобрести более сложный характер под действием такого лечения. По рекомендации специалиста-невролога можно и нужно лечить первоисточники глиоза головного мозга с помощью лекарственных средств и капельниц, укрепляющих сосуды и улучшающих витаминизацию и кровобращение.
ЛЕЧЕНИЕ ГЛИОЗА
Как уже было сказано, очаги поражения нейронов возникают в головном мозге разными путями. В основном причинами являются патологические воспалительные и демиелинизирующие изменения в головном мозге. Глиозные процессы не поддаются полноценному лечению, обратная замена глиозной ткани нейронами невозможна. Также глии не могут выполнять функции нейронов, но они очень важны для нормального течения обменных процессов. Потому проблема редко решается хирургическим путем. Глиозная ткань, которая замещает собой мертвые нейроны, не удаляется без острой необходимости. Но можно устранить причины и некоторые последствия основного заболевания, что позволит улучшить состояние пациента.
При хроническом процессе в нервной ткани специалистами назначается терапевтическое лечение в амбулаторных условиях. Подбираются лекарственные препараты, оказывающие положительное влияние на кровообращение и артериальное давление, системы сосудистого расширения, а также витаминные комплексы. Под действием препаратов замедляется или полностью останавливается развитие глиоза белого вещества. Большое значение имеет соблюдение рекомендаций медицинских специалистов относительно образа жизни и питания. Следует как можно больше времени проводить на свежем воздухе, начинать свой день с легкой зарядки и неплотного завтрака. Острое состояние требует госпитализации пациента. Как правило, для острого сосудистого и иного вида глиоза характерны потери сознания, резкие боли, судорожные припадки, нарастающая дисфункция внутренних органов. Лечение в этом случае допускает хирургическое удаление. Осуществляется шунтирование с последующим удалением образования клеток глии и отводом ликвора, если это необходимо.
Мрт Голова Единичные Очаги
Глиоз — это итог восстановительных процессов нервной системы , суть которых заключается в заполнении свободного пространства, появившегося после гибели нейронов, глией — опорной тканью ЦНС. Они относятся к верхним отделам мозга в отличие от субтенториальных, включающих мозжечок и мозговой ствол. Расположенная над намётом затылочная доля страдает чаще всего при ушибах головы, родовых травмах из-за того, что со всех сторон окружена несжимаемой при ударе жидкостью ликворных пространств. В этой доле чаще всего возникают не связанные с травмами разрастания глии, имеющие сосудистый генез. Клиническая картина заболевания коррелирует с числом погибших нейронов и размером очага.
Что такое супратенториальный очаг глиоза сосудистого генеза?
Заболеваний, вызванные нарушением кровообращения в головном мозге, к сожалению, довольно много и проявляются они крайне разнообразно. Наиболее легкие из них выражаются только головной болью и некоторыми неврозоподобными нарушениями, и бывает так, что лишь этими симптомами болезнь и ограничивается. Но в тяжелых случаях необходимо лечение и весьма длительное. Здесь следует уточнить: сосудистый генез — это указание на происхождении недуга, а не сама болезнь. Говоря о заболеваниях головного мозга сосудистого генеза имеют в виду изменения, связанные с нарушением кровообращения — в венулах, артериях, венах и так далее. ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Поражения головного мозга на МРТЕдиничные очаги демиелинизации в лобных долях
Каждая часть головного мозга выполняет определенные функции — регулирует речь, мышление, равновесие, внимание, контролирует работу внутренних органов. В мозге хранится и обрабатывается невероятное количество информации; вместе с этим в нем протекает множество процессов, обеспечивающих человеку нормальную жизнедеятельность. Функционирование всей этой сложно устроенной системы напрямую зависит от кровоснабжения. Даже небольшое повреждение сосудов ведет к серьезным последствиям.
Темы, связанные напрямую с заболеваниями головного мозга, являются серьезнейшими медицинскими вопросами. В частности, это касается нарушения кровообращения в системе сосудов головного и спинного мозга.
Форум Здоровье. Создать тему Разделы. Болит голова. По МРТ:Единичные точечные неспецифические очаги ВсемСкажу автор темы. Самое страшное, что таблетки не помогают.
Очаги на мрт
Это заболевание головного мозга может присутствовать при разных болезнях в различной стадии. Чаще всего микроангиопатию приравнивают к осложнению сахарного диабета, нарушению циркуляции крови нижней части конечностей или патологии в мозге. Микроангипатия головного мозга с наличием очагов глиоза — что это такое? Микроангиопатия — это заболевание, характеризующееся патологическим состоянием маленьких капилляров. При микроангиопатии поражаются капилляры и части стенок сосудов, что приводит к развитию множества других заболеваний диабет, опухоли, инфекции и т.
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Что чувствует человек во время МРТ — 5 факторовЛечение очагов в головном мозге
Множество неприятных симптомов, связанных с болью в области головы, берут свое начало от патологических очагов головного мозга, которые появились там в результате различных заболеваний. Хотя эти очаги имеют разное происхождение — это может быть, как опухолевое новообразование, киста головного мозга , кровоизлияние, паразитарное или дегенеративное расстройство по типу болезни Альцгеймера, все они будут выявляться на МРТ в виде патологического образования. Каждый очаг, благодаря МРТ, можно интерпретировать и выявить причинно-следственную связь его появления, а, следовательно, поставить диагноз и начать необходимое лечение. Среди диагностических средств, при патологических образованиях головного мозга МРТ пользуется наибольшим доверием среди врачей и пациентов. Этот точный и чувствительный исследовательский метод позволяет определить патологическое состояние на самых ранних стадиях. Магнитно-резонансная томография позволяет получать объемные изображения интересующих мозговых структур. Помимо прочего, МРТ является одним из самых безопасных методов, который не влечет за собой пагубного воздействия излучением и нарушения мозговых покровов и структурных элементов мозга. МРТ позволяет осуществить комплексное сканирование головного мозга. Магнитно-резонансный томограф создает послойные изображения мозга — томограммы, показывая каждый структурный элемент до мельчайших подробностей.
Единичные очаги сосудистого генеза
Демиелинизирующее заболевание головного мозга — это патология, характеризующееся повреждением оболочки нервных волокон и нарушением их проводимости. Нервные волокна — это длинные отростки нейронов, покрытых миелиновой оболочкой, имеющую липидную основу. В процессе демиелинизации происходит разрушение этих оболочек либо центральной нервной системы, либо периферической. На месте разрушенного миелина разрастается фиброзная ткань, которая не способна проводить нервные импульсы. Демиелинизация головного мозга характеризуется появлением очагов поражения, имеющих округлую или овальную форму.
В базальных субкортикальных отделах белого вещества левой лобной доли определяется единичный очаг гиперинтенсивный на Т2 ВИ и FLAIR ИП с четкими контурами, диаметром до 3 мм, без перифокальных изменений. Желудочковая система не деформирована, не расширена.
Очаги сосудистого генеза на мрт
Заболевания головного мозга наиболее опасны, так как способны навредить всем органам и системам организма, отключить многие функции нервной системы и сделать из человека инвалида. Глиоз белого вещества головного мозга — болезнь очень серьезная и требующая немедленного лечения. В головном мозге человека по каким-либо причинам может начаться гибель нервных клеток. Спровоцировать это способны некоторые болезни и состояния. Начинается заболевание с единичного участка такого поражения, постепенно эта площадь разрастается, на месте погибших нейронов образуются глии — рубцевидные ткани, которые защищают орган от различных инфекций и травм.
ВИДЕО ПО ТЕМЕ: «Дифференциальная диагностика очаговых и объемных изменений головного мозга»Еще совсем недавно единственным способом увидеть патологические изменения, очаги в головном мозге можно было только с помощью рентгеновского обследования. Порой и этот метод не давал точных результатов, и хирурги уже во время операции встречались с последствиями травмы или болезни. Расшифровка — это ряд снимков, число их не менее 6. Получается поэтапный ряд снимков во всю толщину мозга начиная с его поверхности. Так можно увидеть последствия травмы или болезни, объем и месторасположения. Для специалиста — это ценная информация, логически выстроенная цепочка. Также в МРТ изображение может быть и объемным.
единичные и множественные очаги, признаки и прогноз жизни
Заболевания головного мозга наиболее опасны, так как способны навредить всем органам и системам организма, отключить многие функции нервной системы и сделать из человека инвалида. Глиоз белого вещества головного мозга – болезнь очень серьезная и требующая немедленного лечения.
Глиоз белого вещества головного мозга – что это?
В головном мозге человека по каким-либо причинам может начаться гибель нервных клеток. Спровоцировать это способны некоторые болезни и состояния.
Начинается заболевание с единичного участка такого поражения, постепенно эта площадь разрастается, на месте погибших нейронов образуются глии – рубцевидные ткани, которые защищают орган от различных инфекций и травм. Большие скопления глий образуют глиоз.
Задача глиозных клеток состоит в защите головного мозга. Образовываясь на месте поражения тканей органа, глии защищают разрушенный участок, обволакивая его. Если гибель нейронов происходит в большом количестве, глии покрывают объемные участки головного мозга, то нервная система перестает нормально функционировать.
Степень поражения головного мозга определяется количеством очагов поражения, в зависимости от этого, врачи диагностируют вид заболевания.
Глиоз бывает нескольких видов, обусловленных местом локализации и степенью разрастания глиозных клеток.
Виды
- Анизоморфный глиоз диагностируется в том случае, если волокна клеток расположены хаотично.
- Волокнистый вид данного заболевания определяется по более выраженному формированию глиальных клеток, чем клеточное составляющее.
- Диффузный тип болезни означает, что зона поражения головного мозга очень большая.
- Изоморфный вид этого заболевания встречается у пациентов в том случае, когда глиальные волокна размещены относительно правильно.
- Маргинальный глиоз обусловлен разрастанием глиальных клеток только в подоболочечных областях головного мозга.
- Периваскулярный тип такой болезни возникает при атеросклерозе сосудов головного мозга. Глиальные волокна образовываются, окружая пораженные сосуды.
- Субэпендимальный вид означает, что зона роста глий располагается под эпиндимой.
Заболеваний, вызывающих глиоз белого вещества головного мозга, огромное количество. Даже самые банальные недуги, встречающиеся довольно часто, могут выступить провокатором этой болезни.
Здесь вы можете подробно прочитать о глиозных изменениях головного мозга.
Очаги глиоза
Очаги глиоза могут быть различны по количеству и площади. Такое разрастание глиозной ткани происходит на фоне разрушения собственных нейронов, из этого следует, что чем больше количество этих нервных клеток разрушено, тем обширнее будет очаг глиоза.
Болезни, провоцирующие глиоз:
- Эпилепсия.
- Гипертония, продолжающаяся длительный период.
- Рассеянный склероз.
- Гипогликемия.
- Ишемический инсульт.
- Низкое содержание кислорода в крови.
- Слабое кровообращение.
- Энцефалиты.
- Анемия.
- Травмы и отеки головного мозга.
Глиоз может возникнуть и по другим причинам, не касающимся конкретных заболеваний.
Причины:
- Наследственный фактор.
- Травмы при родах.
- Пожилой возраст.
- Чрезмерное употребление жирной еды.
Прогноз лечения и жизни пациента полностью зависит от распространенности процесса глиоза, чем запущеннее процесс, тем сложнее терапия и продолжительнее восстановление больного.
Единичные
Единичные очаги глиоза могут возникнуть у многих. Обычно это означает, что пациент страдает гипертонией. При постоянно повышенном давлении, спустя некоторое время, как правило, возникает гипертензивная энцефалопатия, что приводит к единичным очагам глиоза.
Важно вовремя обратиться в медицинское учреждение, чтобы остановить процесс гибели нейронов, иначе площадь поражения и количество очагов могут сильно увеличиться. Проблема состоит в том, что повернуть этот процесс вспять уже невозможно, нервные клетки погибают уже безвозвратно, и, главное, не допустить их дальнейшего разрушения.
Глиоз зачастую вызывает болезни нервной системы, которые полностью излечить нельзя, но современная медицина способна остановить прогрессирование таких заболеваний, а значит и развитие самого глиоза.
Множественные
Множественные очаги глиоза головного мозга обычно встречаются при диффузном типе этой болезни. Заболевание такой формы характеризуется большими очагами глиозных разрастаний, что делает функционирование нервной системы практически невозможным.
Если при единичных очагах поражений, симптоматика данной болезни выражена слабо или может вовсе отсутствовать, то при множественных очагах симптомы довольно серьезные и тяжелые.
Следует отметить, что глиоз головного мозга может появиться на фоне старения организма, когда нейроны в мозгу отмирают. Такая ситуация вполне естественна с помощью медикаментозных средств, возможно частично восстановить функции нервной системы пожилого человека.
Признаки глиоза
Довольно часто, пациент узнает о наличии единичного очага глиоза в своем головном мозге, случайно, на плановом осмотре. При этом человека ничего не беспокоит. Такая ситуация требует особого внимания.
Пациента необходимо тщательно обследовать и выявить причину, по которой образовался очаг, то есть болезнь, спровоцировавшую разрастание глиозных волокон. В случае с множественными очагами глий, дело обстоит иначе, без неприятных симптомов не обойтись.
Симптомы:
- Постоянные головные боли.
- Скачки артериального давления.
- Головокружения.
- Нарушение интеллектуальной деятельности.
- Потеря или нарушение координации.
- Изменение речевых функций.
- Парезы и параличи.
- Нарушение слуха и зрения.
- Изменения в психической сфере.
- Деменции.
Чем больше площадь поражения мозга, тем более выражены симптомы этого заболевания.
Опасен ли глиоз
Глиоз белого вещества головного мозга, очень опасная болезнь, требующая особого внимания. Даже если очаг поражения мозга глиозными клетками небольшой и единичный, нельзя оставлять его без внимания, так как каждый отдел этого органа человека, отвечает за определенные функции.
Любые нарушения в таком отделе, негативно сказываются на работе всей системы жизнедеятельности.
В случае множественных очагов поражения, работа нервной системы нарушается полностью, страдает функционирование всех отделов мозга, приводя человека к полной беспомощности.
К чему приводит болезнь:
- Сильные скачки артериального давления.
- Энцефалиты головного мозга.
- Рассеянный склероз.
- Нарушение кровообращения во всех органах.
- Полное повреждение ЦНС.
При первых симптомах данного заболевания , необходимо обратиться к врачу и исследовать головной мозг для выявления таких нарушений. Существуют методики, позволяющие снизить прогрессию глиоза.
Для новорожденных детей, такой диагноз, как глиоз – это практически приговор. В результате генетических мутаций, у плода, в возрасте 5 месяцев, начинают происходить патологические процессы в головном мозге, что приводит к тяжелому глиозу. Малыши, страдающие этим недугом, редко доживают до возраста 4 лет, хотя в первые месяцы их жизни все кажется благополучно, и болезнь не дает о себе знать.
Диагностика и МРТ
Диагностика глиоза головного мозга основывается на данных КТ и МРТ:
- Магнитно-резонансная томография, является приоритетным методом для выявления таких отклонений. Помощью этого метода, специалист увидит очаги глиоза в мозге, выяснит степень распространенности и определит точную причину возникновения болезни.
- Компьютерная томография тоже может быть использована в качестве способа диагностики глиоза белого вещества головного мозга, но данный метод не дает такой точной клинической картины, как МРТ, а кроме того КТ способно облучать рентгеновскими лучами, что сказывается на общем здоровье не лучшим образом.
Иногда, для развернутой картины болезни необходимо провести дополнительное обследование, в виде анализов и других манипуляций. Всегда, после диагностирования глиоза, возникает необходимость в лечении заболевания, спровоцировавшего гибель нейронов.
Результаты МРТ
Сегодня МРТ считается самым популярным методом исследований многих заболеваний:
- В случае глиоза, обычно в заключении МРТ может быть написано – «картина очага глиоза в левой (правой) лобной доли».
- Если очаги множественные, то данная методика выявит все места их локализации и масштабы гибели нейронов.
- Также магнитно-резонансный томограф определит причину возникновения таких очагов.
- Если виновником отмирания нервных клеток стало заболевание сосудистого характера, то в заключении МРТ будет написано – «картина единичного (множественных) очагов глиоза в белом веществе головного мозга – вероятно, сосудистого генеза». Подробнее о сосудистом генезе головного мозга и что это такое читайте в нашей аналогичной статье.
- Кроме того, специалист может выявить дополнительные отклонения в головном мозге, в виде гидроцефалии, гематом и других болезней.
Лечение
В данное время не существует эффективных методов лечения глиоза головного мозга. Эта болезнь не является самостоятельной, а возникает как следствие развития другого недуга. Необходимо точно диагностировать причину гибели нервных клеток, и лечить именно ее.
В случае если причина не установлена или проигнорирована, глиозные волокна будут разрастаться настолько же, насколько будет поражаться головной мозг. Такое состояние считается тяжелым, и изменить ситуацию не сможет ничего.
При возникновении этой болезни у людей пожилого возраста, необходимо принимать меры профилактики, чтобы затормозить этот патологический процесс. Немаловажно своевременно снижать артериальное давление, чтобы очаги глиоза не разрастались.
Препараты:
- Лекарственные средства для улучшения деятельности головного мозга.
- Препараты, улучшающие кровообращение в головном мозге.
- Медикаменты для улучшения функционирования мозга.
- Витамины, в частности, группы В.
Излечив причину возникновения глиоза, отпадает необходимость терапии, направленной на торможение гибели нейронов.
Последствия и прогноз жизни
Глиоз головного мозга нельзя назвать незначительной патологией. Такая ситуация требует немедленной медицинской помощи. Прогноз для таких больных будет полностью зависеть от степени распространенности глиозного процесса и заболеваний, вызвавших его. Зачастую достаточно пройти курс терапии у невролога, и болезнь отступит. Иногда лечение может занять годы, и улучшений не наступит.
К сожалению, новорожденные дети, страдают от этого недуга гораздо сильнее взрослых. Гибель нервных клеток у младенцев быстро прогрессирует, приводя к смерти ребенка. На плановых обследованиях беременных женщин, с помощью УЗИ диагностики можно выявить глиозные изменения в головном мозге плода. В этом случае ставится вопрос о прерывании беременности.
Профилактика
Для того чтобы исключить появление глиоза или затормозить процесс отмирания нервных клеток, в первую очередь необходим:
- Спорт — хорошо укрепляет нервную систему человека, а значит, служит методом профилактики глиоза. Достаточно выполнять небольшой комплекс упражнений каждый день, и организм станет сильнее и выносливее.
- Хороший отдых и сон положительно влияют на нервную систему.
- Нужно наладить распорядок своего дня, чтобы нервы оставались крепкими, и заболевания этой сферы не возникали.
- Наладить питание, полностью исключив из своего рациона жиры животного происхождения.Ожирение провоцирует гибель нейронов и, как следствие, замену их на глиозные клетки. Меню такого больного должно состоять из полезных блюд.
Необходимые продукты:
- Злаковые.
- Фрукты.
- Овощи в любом виде.
- Нежирные сорта мяса.
Жарка продуктов недопустима, все блюда нужно готовить на пару или варить. Каждый человек должен сам заботиться о своем здоровье, чтобы не допустить болезни.
Такие методы профилактики будут полезны для любого человека и обезопасят от проявлений такого опасного недуга, как глиоз белого вещества головного мозга.
21.09.2016Что такое очаги в белом веществе головного мозга человека
Очаги в белом веществе головного мозга – это зоны поражения мозговой ткани, сопровождающиеся нарушением психических и неврологических функций высшей нервной деятельности. Очаговые области вызываются инфекциями, атрофией, нарушением кровоснабжения и травмами. Чаще всего зоны поражения вызываются воспалительными заболеваниями. Однако области изменений могут иметь и дистрофическую природу. Это наблюдается преимущественно по мере старения человека.
Очаговые изменения белового вещества головного мозга бывают локальными, одноочаговыми, и диффузными, то есть умеренно поражается все белое вещество. Клиническая картина определяется локализацией органических изменений и их степенью. Единичный очаг в белом веществе может и не повлиять на расстройство функций, однако массовое поражение нейронов вызывает нарушение работы нервных центров.
Симптомы
Набор симптомов зависит от расположения очагов и глубины поражения мозговой ткани. Симптомы:
- Болевой синдром. Характеризуется хроническими головными болями. Неприятные ощущения усиливаются по мере углубления патологического процесса.
- Быстрая утомляемость и истощение психических процессов. Ухудшается концентрация внимания, уменьшается объем оперативной и долговременной памяти. С трудом осваивается новый материал.
- Уплощение эмоций. Чувства теряют остроту. Больные безучастны к миру, теряют к нему интерес. Прежние источники удовольствия уже не приносят радости и желание ими заниматься.
- Нарушение сна.
- В лобных долях очаги глиоза нарушают контроль за собственным поведением больного. При глубоких нарушениях может утратиться понятие о социальных нормах. Поведение становится вызывающим, необычным и странным.
- Эпилептические проявления. Чаще это малые судорожные припадки. Непроизвольно сокращаются отдельные группы мышц без угрозы для жизни.
Глиоз белого вещества может проявится у детей как врожденная патология. Очаги вызывают дисфункцию центральной нервной системы: нарушается рефлекторная деятельность, ухудшается зрение и слух. Дети медленно развиваются: поздно становятся на ноги и начинают говорить.
Причины
Зоны поражения в белом веществе вызываются такими заболеваниями и состояниями:
- Группа сосудистых заболеваний: атеросклероз, амилоидная ангиопатия, диабетическая микроангиопатия, гипергомоцистеинемия.
- Воспалительные заболевания: менингит, энцефалит, рассеянный склероз, системная красная волчанка, болезнь Шегрена.
- Инфекции: болезнь Лайма, СПИД и ВИЧ, мультифокальная лейкоэнцефалопатия.
- Отравление веществами и тяжелыми металлами: угарный газ, свинец, ртуть.
- Дефицит витаминов, особенно витаминов группы B.
- Черепно-мозговые травмы: ушиб, сотрясение.
- Острая и хроническая лучевая болезнь.
- Врожденные патологии центральной нервной системы.
- Острое нарушение мозгового кровообращения: ишемический и геморрагический инсульт, инфаркт мозга.
Группы риска
В группы риска входят люди, подвержены таким факторам:
- Артериальная гипертензия. У них повышается риск развития сосудистых очагов в белом веществе.
- Неправильное питание. Люди переедающие, избыточно употребляющие лишние углеводы. У них нарушается обмен веществ, вследствие чего на внутренних стенках сосудов откладываются жировые бляшки.
- Очаги демиелинизации в белом веществе появляются у пожилых людей.
- Курение и алкоголь.
- Сахарный диабет.
- Малоподвижный образ жизни.
- Генетическая предрасположенность к сосудистым заболеваниям и опухолям.
- Постоянный тяжелый физический труд.
- Отсутствие занятий интеллектуальным трудом.
- Проживание в условиях загрязнения воздуха.
Лечение и диагностика
Основной способ найти множественные очаги – визуализировать мозговое вещество на магнитно-резонансной томографии. На послойных
изображениях наблюдаются пятна и точечные изменения тканей. На МРТ видно не только очаги. Этим методом также выявляется причина поражения:
- Единичный очаг в правой лобной доли. Изменение указывает на хроническую гипертензию или перенесенный гипертонический криз.
- Диффузные очаги по всей коре появляются при нарушении кровоснабжения вследствие атеросклероза сосудов головного мозга или.
- Очаги демиелинизации теменных долей. Говорит о нарушении поступления крови через позвоночные артерии.
- Массовые очаговые изменения в белом веществе больших полушарий. Такая картина появляется вследствие атрофии коры, которая формируется в старости, от болезни Альцгеймера или болезни Пика.
- Гиперинтенсивные очаги в белом веществе головного мозга появляются вследствие острого нарушения кровоснабжения.
- Мелкие очаги глиоза наблюдаются при эпилепсии.
- В белом веществе лобных долей единичные субкортикальные очаги преимущественно формируются после инфаркта и размягчения мозговой ткани.
- Единичный очаг глиоза правой лобной доли проявляется чаще всего как признак старения мозга у пожилых людей.
Магнитно-резонансная томография также проводится для спинного мозга, в частности для шейного и грудного его отдела.
Смежные методы исследования:
Вызванные зрительные и слуховые потенциалы. Проверяется способность затылочной и височной области генерировать электрические сигналы.
Люмбальная пункция. Исследуются изменения в цереброспинальной жидкости. Отклонение от нормы указывает на органические изменения или воспалительные процессы в ликворопроводящих путях.
Показана консультация у невролога и психиатра. Первый изучает работу сухожильных рефлексов, координацию, движения глаз, мышечную силу и синхронность мышц-разгибателей и сгибателей. Психиатр исследует психическую сферу больного: восприятие, когнитивные способности.
Очаги в белом веществе лечатся несколькими ветвями: этиотропной, патогенетической и симптоматической терапией.
Этиотропная терапия направлена устранение причины заболевания. Например, если вазогенные очаги белового вещества головного мозга вызваны артериальной гипертензией, пациенту назначается антигипертензивная терапия: набор препаратов, направленных на понижение давления. Например, мочегонные, блокаторы кальциевых каналов, бета-адреноблокаторы.
Патогенетическая терапия направлена на восстановление нормальных процессов в головном мозгу и устранение патологический явлений. Назначаются препараты, улучшающие кровоснабжение мозга, улучшающие реологические свойства крови, понижающие потребность мозговой ткани к кислороду. Применяются витамины. Для восстановления работы нервной системы необходимо принимать витамины группы B.
Симптоматическое лечение устраняет симптомы. Например, при судорогах назначаются противоэпилептические препараты, устраняющие очаги возбуждения. При пониженном настроении и отсутствии мотивации больному дают антидепрессанты. Если очаги в белом веществе сопровождаются тревожным расстройством, пациенту назначаются анксиолитики и успокаивающие. При ухудшении когнитивных способностей показан курс ноотропных средств – веществ, улучшающих метаболизм нейронов.
Не нашли подходящий ответ?
Найдите врача и задайте ему вопрос!
Смотрите также:
Глиоз — обзор | ScienceDirect Topics
Gliomatosis cerebri
Gliomatosis cerebri — это биологически агрессивный, редкий глиальный неопластический процесс с отличительной чертой обширного диспергирования опухолевых клеток минимум в трех долях головного мозга, который заметно сохраняет основную цитоархитектуру мозга, включая тела нейрональных клеток и структуры аксонов . Инвазивный паттерн может имитировать субпиальное распространение, нейрональный сателлитоз, периваскулярную локализацию на инфильтрирующих краях опухоли олигодендроглиом и глиобластом (вторичные структуры Шерера) или более аморфный диффузный паттерн дисперсии в астроцитомах низкой степени злокачественности.Несмотря на обширное поражение мозга опухолевыми клетками, дискретных масс, которые можно обнаружить с помощью нейровизуализации высокого разрешения, нет. Присутствие инфильтрирующих опухолевых клеток обычно связано с общим увеличением объема, с переменным массовым эффектом, вовлеченных областей мозга с минимальными изменениями гиподенсии или изоденсии при Т2-взвешенной МРТ и гиперинтенсивностью при МРТ FLAIR. Наиболее часто поражаются полушария головного мозга, за которыми следуют средний мозг, таламус и базальные ганглии; и, в меньшей степени, мозжечок и ствол мозга.Гипоталамус, зрительные нервы и хиазм, а также спинной мозг, по-видимому, вовлечены менее чем в 10% зарегистрированных случаев. Хотя возраст широко варьируется от неонатального периода до 9-го десятилетия, средний возраст постановки диагноза у детей составляет 12 лет, а пик заболеваемости приходится на период между 4-м и 5-м десятилетием жизни у взрослых (Fuller & Kros 2007).
Фенотипические признаки глиальных опухолевых клеток обычно являются астроцитарными, хотя в меньшем количестве случаев вовлекаются клетки либо с олигодендроглиальными признаками (Balko et al 1992; Pal et al 2008), либо со смесью глиальных фенотипов.Опухолевые клетки обычно выглядят как маленькие глиальные клетки с удлиненными веретенообразными ядрами, которые имеют переменный плеоморфизм и гиперхромазию. Некроз и микрососудистая гиперплазия всегда отсутствуют, что соответствует морфометрическим характеристикам, которые больше соответствуют глиомам низкой степени злокачественности. Количественное исследование сосудов, которое продемонстрировало нормальные иммуногистохимические профили микрососудов в областях мозга, пораженных глиоматозом, также подтвердило, что ангиогенез полностью отсутствует в этих поражениях (Bernsen et al 2005).Митотические индексы сильно различаются (MIB ≤1–30), но обычно низкие. Однако сообщалось о случаях, когда опухолевые клетки демонстрируют более выраженную клеточную анаплазию (Vates et al, 2003), а церебральный глиоматоз со временем может развиваться в фенотипы более высокой степени с появлением или без появления отдаленных дискретных поражений (Kong et al 2008; Inoue et al 2008).
Иммунореактивность к S100, GFAP и MAP2 присутствует, но в большинстве случаев варьирует, как и в случае инфильтрирующих глиом низкой степени злокачественности (Fuller & Kros 2007; Romeike & Mawrin 2009).Хотя окончательный молекулярный анализ глиоматоза головного мозга проблематичен из-за диффузной дисперсии опухолевых клеток с низкой плотностью в небольших биоптатах, эти неопластические клетки, по-видимому, являются клональными и имеют молекулярные поражения, общие с диффузно инфильтрирующими глиомами низкой степени злокачественности (Romeike & Mawrin 2008 г.). Неопластические клетки глиоматоза головного мозга экспрессируют биомаркеры, которые связаны с подвижностью во всех степенях инфильтрации глиом, CD44 (рецептор гиалуроновой кислоты) и матриксные металлопептидазы (Kunishio et al 2003; Mawrin et al 2005).Однако два исследования выявили ключевые различия между инфильтрирующими глиомами низкой степени злокачественности и глиоматозом головного мозга. Одно исследование глиоматоза головного мозга у 29-летнего мужчины продемонстрировало преобладающую экспрессию мРНК FGFR1 (β-тип) в биоптатах с обычно низкосортными опухолевыми клетками (Yamada et al 2001). Экспрессия FGFR1 чаще встречается в злокачественных глиомах. Эта аберрантная экспрессия в gliomatosis cerebri может отражать высоко мигрирующие нейральные стволовые клетки / ранние клетки-предшественники с аберрантным пролиферативным фенотипом.Во время развития транслокация срединной радиальной глии и формирование мозолистого тела требует передачи сигналов FGFR1 (Smith et al, 2006), а передача сигналов FGFR1 увеличивает пролиферацию и ингибирует спонтанную дифференцировку нейральных стволовых клеток взрослых посредством активации MAPK и Erk1 / 2 (Ma et al. 2009 г.). Обильная иммунореактивность с нестином в GFAP-отрицательных опухолевых клетках gliomatosis cerebri также согласуется с гипотезой происхождения мигрирующих нервных стволовых / ранних клеток-предшественников (Hilbig et al 2006).Более недавнее исследование четырех случаев первичного церебрального глиоматоза (Kong et al 2008) продемонстрировало повышенную, но вариабельную экспрессию связанных со стволовыми клетками биомаркеров Sox2 и Mushahi-1. В отличие от глиобластомы в этих популяциях клеток не было значительной экспрессии CD133.
FLAIR-изображение 46-летнего мужчины с небольшими глиотическими очагами в подкорке …
Контекст 1
… 3. T1 / SE-изображение с усилением гадолиния того же пациента, показанное на рисунке 1, подтверждает отсутствие усиления, соответствующего неактивным очагам демиелинизации при РС. …
Контекст 2
… РС и его животная модель (экспериментальный аутоиммунный энцефаломиелит). В качестве антагониста провоспалительного действия TNF-α антитела против TNF-α первоначально рассматривались как возможное средство лечения демиелинизирующих заболеваний. Однако несколько исследований показали, что терапия анти-TNF-α ухудшала клиническое течение рассеянного склероза. Эти сообщения предполагают возможность развития рассеянного склероза или неврита зрительного нерва у пациентов с аутоиммунными заболеваниями, такими как ревматоидный артрит и CD, на лечении анти-TNF-α.Эта взаимосвязь не была хорошо установлена, и нет общего согласия относительно причинной связи между терапией анти-TNF-α и началом рассеянного склероза у пациентов с ВЗК. Принимая во внимание эти предыдущие наблюдения, предполагается, что лечение анти-TNF-α в некоторых случаях приводит к обострению ранее существовавшей скрытой демиелинизации. Основываясь на этой гипотезе, мы стремились оценить неврологический статус пациентов с CD до начала анти-TNF-терапии, чтобы избежать возможных осложнений у пациентов с латентными демиелинизирующими заболеваниями.Целью этого наблюдательного одноцентрового исследования было задокументировать неврологический статус пациентов с БК, особенно признаки демиелинизирующего заболевания, такие как очаговые поражения белого вещества центральной нервной системы Т2 на МРТ. В это исследование были включены в общей сложности 70 пациентов с БК, которые еще не прошли терапию анти-TNF-α. Критерии включения были:. История КД более 1 года. . Пациентам с умеренной или тяжелой БК показана терапия анти-TNF-α из-за неэффективности или непереносимости предыдущего лечения азатиоприном, кортикостероидами или обоими.Критериями исключения были:. Предыдущее лечение анти-TNF-α агентами в анамнезе пациента. . Серьезное неврологическое заболевание в анамнезе пациента. Пациенты были обследованы неврологом-неврологом для выявления возможных признаков демиелинизирующего заболевания. Им сделали МРТ головного мозга (нативные последовательности T1, T2 и FLAIR). Исследование МРТ было проанализировано независимым исследователем. И невролог, и радиолог были ослеплены относительно результатов друг друга. Результаты сравнивали с ожидаемой заболеваемостью в общей популяции с использованием распределения Пуассона.Протокол исследования был одобрен местным этическим комитетом. В общей сложности 70 пациентов с CD (27 женщин, 43 мужчин, средний возраст 36 лет, диапазон 18–66 лет) были обследованы до начала анти-TNF-терапии. Общая частота выявления патологий (при неврологическом осмотре или МРТ) составила 67%. У 37 пациентов (53%) при неврологическом обследовании наблюдались отклонения от нормы. Наиболее частыми обнаружениями были флексия брюшной стенки или ног, нарушение чувствительности к вибрации и легкий гемипарез.Нарушения на МРТ выявлены у 26 пациентов (37%). Большинство этих патологий представляли собой неспецифические спорадические поражения белого вещества или легкую атрофию. Рис. 1. В одном случае мы обнаружили невриному слухового нерва как случайную находку. В семи случаях эти аномалии МРТ (перивентрикулярные поражения) вызывали подозрение на демиелинизацию. Рисунки 2 и 3. У этих пациентов не было симптомов. У пяти из этих пациентов при неврологическом обследовании были выявлены отклонения от нормы. Всем семи пациентам с отклонениями в результатах МРТ было проведено исследование спинномозговой жидкости…
Региональная нейродегенерация и глиоз усугубляются легкой травмой головного мозга, повторяющейся с 24-часовым интервалом
Abstract
Большинство ежегодно возникающих черепно-мозговых травм классифицируются как «легкие». Лица, занимающиеся видами деятельности с высоким риском, могут перенести множественные легкие формы ЧМТ. Мы оценили острые физиологические и гистопатологические последствия легкой ЧМТ на мышиной модели, сравнивая фиктивную травму, однократное воздействие или 5 ударов с интервалом между травмами 24 или 48 часов.Одиночный закрытый удар черепа привел к двустороннему глиозу в гиппокампе и энторинальной коре, что было пропорционально глубине удара. Удар по средней линии на глубине чуть выше порога, вызывающего преходящее бессознательное состояние, приводил к случайным повреждениям аксонов и дегенерированию нейронов, сопровождаемых астроглиозом в энторинальной коре и мозжечке. Легкая ЧМТ, повторяемая каждые 24 часа, привела к двусторонним геморрагическим поражениям в энторинальной коре, а также к значительному увеличению нейродегенерации и активации микроглии, несмотря на уменьшение продолжительности апноэ и бессознательного состояния с последующими воздействиями.Астроглиоз и диффузно распределенное повреждение аксонов также наблюдались с двух сторон в мозжечке и стволе мозга. Когда интервал между легкой ЧМТ был увеличен до 48 часов, патологические последствия были сопоставимы с одиночной ЧМТ. В совокупности эти данные предполагают, что у мышей мозг остается подверженным повышенному риску повреждения в течение 24 часов после легкой ЧМТ, несмотря на снижение острых физиологических реакций на последующие легкие воздействия.
Ключевые слова: Астроцитоз, Аксональная травма, Мозжечок, Сотрясение мозга, Энторинальная кора, Потеря сознания, Микроглиоз, Черепно-мозговая травма
ВВЕДЕНИЕ
Примерно 1.От 7 до 3,8 миллиона человек в Соединенных Штатах ежегодно получают черепно-мозговую травму (ЧМТ) (1, 2), причем подавляющее большинство из них относятся к категории «легких» и возникают во время занятий спортом (1, 3). Легкая ЧМТ вызывается травматическим или биомеханическим воздействием, которое приводит к изменению функции мозга без невропатологических осложнений, которые можно наблюдать с помощью стандартных методов визуализации (4–6). Легкая ЧМТ проявляется множеством признаков и симптомов. К ним могут относиться такие симптомы, как головокружение, головная боль и / или тошнота, и такие признаки, как потеря сознания, потеря памяти, возбуждение и / или двигательный дефицит (4–6).Для многих пациентов отдых с течением времени помогает облегчить симптомы легкой травмы головы в течение нескольких часов или нескольких дней. Однако у 10–15% людей симптомы сохраняются намного дольше (6).
Особое внимание при связанной со спортом ЧМТ уделялось облегчению симптомов до того, как спортсмен должен вернуться в игру. Тем не менее, неясно, стихают ли клеточные реакции в мозге в это время или мозг остается в состоянии повышенной уязвимости к последующей травме. Затем люди возвращаются к игре с более высоким риском развития другой легкой ЧМТ, особенно в высококонтактных видах спорта, таких как бокс и футбол (4–6).Кроме того, неврологические и патофизиологические последствия дополнительных ЧМТ могут быть более серьезными, чем последствия, вызванные первой ЧМТ, если мозг не полностью восстановился.
Животные модели — важные инструменты для выяснения молекулярных событий, вызванных легкой ЧМТ, исследования клеточной основы постоянной уязвимости и корреляции патологии мозга с нейроповеденческой дисфункцией. Модели позволяют осуществлять контролируемое, воспроизводимое воздействие и позволяют систематически изменять экспериментальные параметры для изучения эффектов повторной ЧМТ легкой степени тяжести.Исследование ЧМТ основано на различных хорошо зарекомендовавших себя моделях на животных, включая снижение веса (7, 8), травму, вызванную перкуссией жидкости (9, 10), ускорение удара (11, 12) и контролируемое корковое воздействие (13). Эти модели использовались для описания паттернов глиоза, повреждения аксонов и / или гибели нейронов, а также нарушений памяти и координации движений после единичного повреждения «от умеренного до тяжелого». Многие из этих моделей были модифицированы для изучения легкой ЧМТ и последствий повторных травм (14–20).
Чтобы создать модель легкой ЧМТ, подходящую для исследования повторных травм головы, мы выбрали закрытую модель черепа, как и многие лаборатории (14, 17, 21–26), чтобы повысить легкость повторных травм. наносить и создавать более размытую картину травмы, передавая силу оскорбления через большую часть мозга. Мы использовали фиксацию головы, чтобы свести к минимуму вариабельность из-за движения головы. Удар выполнялся гибким наконечником, чтобы минимизировать перелом черепа, как описано в предыдущих публикациях (17, 18, 27).В то время как во многих повторяющихся исследованиях легкой ЧМТ использовалось латеральное воздействие (15, 21, 24, 28–30), мы выбрали удар по средней линии (14, 16, 22) с целью получения двустороннего повреждения для усиления распределенного характера патологического переделки. Затем мы охарактеризовали гистологические и физиологические реакции на одиночную ЧМТ легкой степени в зависимости от тяжести травмы и сравнили реакцию однократной ЧМТ легкой степени на легкую ЧМТ, повторяемую с 24-часовым или 48-часовым интервалом. Мы подтверждаем, что повреждение аксонов и астроглиоз являются особенностями одиночной легкой закрытой травмы головы (CHI), но демонстрируют повышенную уязвимость мозга к легкой ЧМТ, повторяющейся с 24-часовым интервалом, что приводит к более обширной нейродегенерации и нейровоспалению, включая повреждение внутри энторинальная кора, мозжечок и ствол мозга.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Самцы мышей C57Bl / 6 в возрасте от двух до трех месяцев были приобретены в Jackson Laboratories (Bar Harbor, ME) для всех экспериментов. По прибытии мышей помещали в группу при контролируемом цикле свет: темнота 14:10 и давали пищу и воду ad libitum. Животноводство и все хирургические процедуры были одобрены Комитетом по институциональному уходу и использованию животных Университета Кентукки и следовали федеральным руководящим принципам, установленным Институтом ресурсов лабораторных животных (U.S.) и Комитет по уходу и использованию лабораторных животных.
Закрытая травма головы
После индукции анестезии в камере с использованием 3% изофлуорана / 3% кислорода в течение 1-2 минут мышей переводили в стереотаксический каркас с неразрывными ушными чашками Zygomar (Kopf, Instruments, Tujunga, CA) где анестезия поддерживалась с использованием 2,5% изофлуорана / 2,5% кислорода, подаваемого через носовой конус. Хирургический участок кожи головы очищали раствором бетадина. После введения 0.2 мл 1: 200 000 адреналина и 0,5% бупивакаина (Henry Schein Animal Health, Дублин, Огайо) в стерильном физиологическом растворе для местного обезболивания, резецировали кожу головы. Затем мыши получили легкую закрытую травму головы (CHI) с использованием пневматически управляемого кортикального ударного устройства (TBI-0310 Impactor, Precision Systems and Instrumentation, Fairfax Station, VA) с изготовленным на заказ гибким силиконовым наконечником диаметром 5 мм с твердость 55 по Шору А. Кончик был выровнен по средней линии шва между швами Bregma и лямбда.Устройство было запрограммировано на удар на заданной глубине (0,5–3,0 мм) со скоростью 3,5 м / сек с временем задержки 500 мс. Мыши с ложными травмами получили анестезию и подверглись той же хирургической процедуре, не получив удара. Общая продолжительность анестезии для всех животных контролировалась и составляла 10 минут.
Для наиболее точной оценки потери сознания из-за травмы по сравнению с анестезией, мышей сразу же после удара удаляли из стереотаксического устройства и помещали на грелку на спину.Оценивали продолжительность апноэ и время спонтанного перехода в положение лежа (выпрямляющий рефлекс). После восстановления мышей ненадолго повторно анестезировали, чтобы зашить скальп, и возвращали к грелке для восстановления. Мышам подкожно вводили 1 мл стерильного физиологического раствора для увеличения гидратации, способствуя нормальной реакции на еду после травмы и поддержанию здорового веса. При повторных имитационных травмах и травмах ВМС швы снимали, кожу головы резецировали, а затем выполняли вышеуказанные травмы и процедуры оценки.
Для первоначальной характеристики глубины воздействия на гистологические и физиологические реакции производился однократный удар с заданной глубиной 0,5 мм, 1,0 мм, 1,5 мм, 2,0 мм, 2,5 мм или 3,0 мм (n = 2–3 / удар глубина). Данные апноэ и выпрямляющего рефлекса анализировали отдельно с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Неймана-Кейлса с использованием программного обеспечения Graph Pad Prism 6 (La Jolla, CA). Мышей из этих групп умерщвляли через 48 часов после травмы для анализа астроцитоза и дегенерации нейронов.
Для повторных экспериментов с CHI мышей случайным образом разделили на 3 основные группы: 2,0 мм повторные CHI; 2,0 мм одинарный ЧИ; и фиктивный ЧИ (). Группа повторных ОМС получила 5 ударов либо с 24-часовым интервалом между травмами (rCHI-24h; n = 9), либо с 48-часовым интервалом (rCHI-48h; n = 8). Эти интервалы были выбраны на основе нескольких исследований, которые предполагают, что интервал уязвимости для повторной легкой ЧМТ у грызунов может составлять от 24 до 48 часов (18, 21, 22, 26, 28, 30). На основании предыдущих исследований повторной ЧМТ легкой степени тяжести использовалось пять воздействий (22, 23, 26).Мышей rCHI умерщвляли через 24 часа после их последнего удара, чтобы оценить острые последствия повторных CHI с различными интервалами между травмами. Единственная группа ОМС была разделена на 3 подгруппы, чтобы сопоставить время выживания групп rCHI относительно первой и последней травм: 24 часа (одиночные 24 часа; n = 6), 5 дней (одиночные 5 дней; n = 5) и 9. дней (одиночные 9 дней; n = 5). Ложные контрольные мыши для групп rCHI-24h (n = 4) и rCHI-48h (n = 3) были объединены для анализа (n = 7), за исключением дополнительной фигуры 1.Одна мышь, отнесенная к группе rCHI-24h, и одна мышь, отнесенная к группе rCHI-48h, умерла до получения 5 CHI. Таким образом, окончательный размер группы составлял 8 для rCHI-24h и 7 для rCHI-48h. Данные апноэ и выпрямляющего рефлекса анализировали с помощью многократных измерений одностороннего дисперсионного анализа (группа травмы х количество CHI) с последующими апостериорными тестами Неймана-Кеулса с использованием программного обеспечения Graph Pad Prism 6.
Дизайн эксперимента с повторной закрытой травмой головы (РЧИ). Синие стрелки указывают день ОМС. Зеленые кресты указывают на смерть.
Обработка тканей
Мышей умерщвляли внутрибрюшинной инъекцией Fatal Plus (130 мг / кг, Henry-Schein Animal Health) перед транскардиальной перфузией холодным гепаринизированным стерильным физиологическим раствором с последующим введением 10% нейтрального забуференного формалина (Fisher Scientific, Атланта, Джорджия) .Мышей обезглавливали и головы помещали в формалин на 24 часа. Затем мозг извлекали из черепа и оставляли на дополнительные 24 часа для постфиксации. По истечении этого периода мозг помещали в 30% сахарозу в 1X трис-буферном физиологическом растворе (TBS) на 24-48 часов для криозащиты ткани. Ткань замораживали в изопентане от -25 до -35 ° C, а затем разрезали на коронковые срезы толщиной 40 мкм с помощью скользящего микротома (Dolby-Jamison, Pottstown, PA). Срезы тканей хранили при -20 ° C в криопротекторном средстве (30% глицерин, 30% этиленгликоль в 1X TBS).
Гистология
Для начальной оценки потери клеток серию из 9 срезов, расположенных с интервалами 400 мкм, окрашивали по Нисслю 2,5% Cresyl Violet. Дегенерирующие нейроны исследовали с помощью Fluoro-Jade C (FJC), как описано ранее (50). Для каждого животного были отобраны 4 среза с интервалом 400 мкм в пределах каудального гиппокампа и энторинальной коры (от -2,2 до -3,4 мм Bregma) и от 6 до 8 срезов с интервалами 200 мкм в мозжечке и стволе мозга. Срезы первоначально обрабатывали диаминобензидином ([DAB], Vector Laboratories, Burlingame, CA) в течение 5 минут, промывали в ddH 2 O и наносили на предметные стекла.Обработка DAB использовалась для подавления эндогенных пероксидаз, устранения любой неспецифической флуоресценции, которая может возникнуть при кровотечении. Ткань обезвоживали, помещая слайды в более теплый (45 ° C) на 30 минут, а затем оставляя их при комнатной температуре на ночь. На следующий день слайды последовательно погружали в 1% NaOH в 80% этаноле, 70% этаноле и ddH 2 O перед тем, как поместить в 0,06% раствор перманганата калия на 10 минут. Ткань промывали ddH 2 0 перед инкубацией в 0.0001% раствор FJC (Millipore, Temecula, CA) в 0,1% уксусной кислоте в течение 10 минут. Ткань промывали ddH 2 O, сушили на воздухе, закрывали Cytoseal 60 (Thermo Scientific, Hanover Park, IL) и защищали от света.
Иммуногистохимия
Свободно плавающие срезы ткани использовали для иммуногистохимического анализа. Чтобы пометить ткань для накопления белка-предшественника амилоида (cAPP) и гиперфосфорилированного тау (PHF-1), извлечение антигена выполняли с использованием 10 мМ лимонной кислоты на водяной бане при 65 ° C в течение 15 минут.Затем ткани давали остыть при комнатной температуре в течение 20 минут перед промывкой 1XTBS. Для всех тканей, чтобы погасить эндогенные пероксиды, ткань обрабатывали 3% H 2 O 2 в 50/50 метаноле / ddH 2 O в течение 30 минут, покачивая при комнатной температуре. Затем ткань промывали и блокировали в течение 1 часа 5% нормальной лошадиной сывороткой в 1XTBS / 0,1% Triton X-100 перед инкубацией с первичным антителом в течение ночи при 4 ° C. Были использованы следующие антитела: белок-предшественник амилоида (cAPP, поликлональный кролик, 1: 2000; Invitrogen / Life Technologies, Карлсбад, Калифорния), антитела против тау-белка pSer396 / 404 (PHF-1, моноклональный мышиный, 1: 500, Peter Davies, The Feinstein Institute for Medical Research, Great Neck, NY), антиглиальный фибриллярный кислотный белок ([GFAP], мышиный моноклональный, 1: 3000; Sigma-Aldrich, St.Луис, Миссури), антиионизированная кальций-связывающая адаптерная молекула-1 ([Iba-1], поликлональная кроличья, 1: 1000; Вако, Ричмонд, Вирджиния) и анти-MHC II (IA / IE, моноклональная крыса, 1 : 1000; eBiosciences, Сан-Диего, Калифорния). На следующий день срезы ткани, меченные анти-GFAP, -cAPP и -PHF-1, инкубировали в соответствующей конъюгированной с биотином вторичной обмотке в течение 1 часа. Ткань промывали перед инкубацией в комплексе авидин-биотин (Vector Laboratories) в течение 1 часа, а затем обрабатывали DAB в соответствии с указаниями производителя. Меченые Iba-1 и I-A / I-E ткани инкубировали с соответствующими вторичными антителами, конъюгированными с Alexa-488 и Cy-3 соответственно.
Количественная оценка гистологии и иммуногистохимии
Срезы, окрашенные FJC, просматривали при 40-кратном увеличении с использованием микроскопа Olympus AX80 с фильтром TRITC. FJC-положительные клетки двусторонней энторинальной коры подсчитывались человеком, не знающим условий повреждения. Для статистического анализа подсчеты суммировали для каждого животного. Качественно исследовали срезы мозжечка и ствола мозга, помеченные FJC. cAPP-положительные аксоны в 4 срезах / животное с интервалом 200 мкм (~ уровень Bregma -2.2–3,4) просматривали в ярком поле с помощью микроскопа Olympus AX80 с линзой 40x. Набухания аксонов и луковицы подсчитывались ослепленным исследователем. Для статистического анализа подсчеты суммировали для каждого животного.
ИммунореактивностьGFAP наблюдали с помощью микроскопа Olympus BX51 (20x) с автоматическим столиком ASI XY. 24-битные RGB-изображения энторинальной коры и гиппокампа были получены с помощью 12-битной камеры Q Imaging. Откалиброванный модуль Stage-Pro программы Image Pro Plus (Media Cybernetics, MD) использовался для сборки изображений в монтаж.Энторинальную кору анализировали в 4 срезах / животное, взятых с интервалом 200 мкм (Bregma от -2,8 до -3,4 мм). Астроцитоз в гиппокампе анализировали в 3 срезах / животное, взятых с интервалом 200 мкм (Bregma от -2,8 до -3,2 мм). Для количественной оценки иммунореактивности GFAP область интереса была очерчена с использованием анатомических особенностей, как описано в «Мозг мыши в стереотаксических координатах», 4 th Edition (Paxinos & Franklin). Гиппокамп очерчивали вдоль дорсального края по альвеусу гиппокампа, а затем над таламусом на вентральной стороне гиппокампа.Чтобы очертить энторинальную кору, в качестве отправной точки использовали ринальную щель. Линия была проведена вентрально по периферии энторинальной коры примерно в 1,5 мм от ринальной щели. Оттуда линия была продлена горизонтально до бокового желудочка, а затем продолжилась дорсально вдоль края бокового желудочка до горизонтальной ринальной щели. Линия продолжалась горизонтально до ринальной щели, чтобы соединиться с исходной точкой. Диапазон был установлен от 0 до 210 для каждого цвета, а минимальная площадь была установлена на уровне 5 пикселей для захвата меченных анти-GFAP астроцитов и устранения фонового шума.Количество иммунореактивных астроцитов GFAP определяли количественно и определяли среднюю интегральную оптическую плотность (IOD) путем деления общего IOD на количество астроцитов в данной области интереса. Более высокая ИОД соответствовала большей иммунореактивности GFAP. Собранные данные были усреднены для каждой области (энторинальной коры, гиппокампа) для каждого животного для статистического анализа. В мозжечке и стволе мозга иммунореактивность GFAP оценивали качественно в серии от 6 до 8 срезов, выбранных с интервалом 200 мкм.
ИммунореактивностьIba-1 наблюдали с использованием фильтра FITC на микроскопе Olympus BX51 (20x) с автоматическим столиком ASI XY, и получали и монтировали 8-битные изображения с серой шкалой, как описано ранее. Процент иммунореактивности Iba-1 в энторинальной коре и гиппокампе анализировали, сначала устанавливая диапазон отображения от 0 до 255, чтобы очертить гиппокамп или энторинальную кору, как описано ранее. Затем слепой исследователь выбрал диапазон, в котором была выбрана иммунореактивная микроглия для каждого мозаичного изображения.Процент общей площади, которая содержала меченную Iba-1 микроглией, измеряли и усредняли для энторинальной коры на 8 снимках на животное и для гиппокампа на 6 снимках на животное. Ткань, меченная Iba-1, была помечена I-A / I-E (MHC Class II). Иммуномечение I-A / I-E оценивалось качественно.
Односторонний дисперсионный анализ с последующими апостериорными тестами Неймана-Кейлса, где это необходимо, выполняли с использованием программного обеспечения Graph Pad Prism 6 для определения статистической значимости среди групп для каждого маркера в каждой области.
РЕЗУЛЬТАТЫ
Определение глубины удара
Первоначальная когорта мышей была подвергнута CHI разной глубины воздействия, чтобы охарактеризовать модель CHI и определить параметры повреждения, которые привели к легкой ЧМТ по оценке дегенерации нейронов, глиоза, и острые физиологические реакции после контузии. Установленная глубина удара по средней линии шва черепа мыши 0,5 мм, 1,0 мм и 1,5 мм не продлила подавление рефлекса выпрямления после удара (), но вызвала постепенное увеличение апноэ с увеличением тяжести травмы () по сравнению с одной анестезией. у мнимых контрольных животных.Мыши, получившие травму с предписанной глубиной 2,0 мм, имели значительно увеличенное подавление рефлекса выпрямления (p <0,05) и продолжительность апноэ (p <0,05) по сравнению с мышами фиктивной контрольной группы и мышами, получавшими CHI при всех других меньших глубинах удара. Глубина удара 2,0 мм не привела к перелому черепа. Напротив, удар глубиной 2,5 мм и 3,0 мм приводил к переломам черепа или длительному апноэ, что приводило к гибели 6 из 10 протестированных животных.
Острые физиологические и гистопатологические последствия однократного удара в зависимости от глубины.( A, B ) Рефлекс выпрямления ( A ) и апноэ ( B ). * означает p <0,05 по сравнению со всеми другими группами. Столбцы представляют собой среднее значение ± стандартная ошибка. ( C – O ) Окрашивание фторо-нефритом C (FJC) после имитации ( C ), 1,0 мм- ( G ), 2,0 мм- ( K ) и 3,0 мм- (O ) глубины воздействия. FJC-положительные клетки были очевидны в зубчатой извилине через 48 часов после воздействия на глубину 3,0 мм. Глиальный фибриллярный кислотный белок (GFAP), меченный астроцитами в гиппокампе и энторинальной коре после имитации ( D, E, F ), 1.Глубина удара 0 мм ( H, I, J ), 2,0 мм ( L – N ) и 3,0 мм ( P – R ). Легкий астроцитоз был очевиден в каудальном гиппокампе и энторинальной коре после 2,0-мм удара. Удар 3,0 мм усиливал астроцитоз всего гиппокампа и моторной коры. Масштабные линейки: C, D, G, H, K, L, O, P , 500 мкм; D, O, P вставки, 100 мкм; E, F, I, J, M, N, Q, R, 1 мм.
Через 48 часов после CHI, FJC-положительные клетки наблюдались только в 3.Группа удара 0 мм в зубчатой извилине (), предполагая, что одиночный ВМС глубиной менее 3,0 мм не вызывал заметной нейродегенерации в головном мозге через 48 часов после удара. Иммуногистохимия GFAP использовалась для визуализации астроглиальных изменений во всем головном мозге. Глубина удара 0,5 мм (данные не показаны), 1,0 мм (), 1,5 мм (данные не показаны) и 2,0 мм () вызвали лишь небольшое увеличение иммунореактивности GFAP в гиппокампе и энторинальной коре. Напротив, гиппокампальный и кортикальный глиоз были более очевидными после CHI через 2 балла.Глубина удара 5 мм (данные не показаны) или 3,0 мм (), особенно в зубчатой извилине и воротах, где также происходила дегенерация нейронов. Основываясь на первоначальной характеристике глубины удара в диапазоне от 0,5 до 3,0 мм, глубина 2,0 мм была выбрана для последующих экспериментов по оценке повторных ОМС на основе наличия острых физиологических реакций (повышенный рефлекс выпрямления и время апноэ) и умеренный глиоз, указывающий на тканевых ответов в отсутствие заметной гибели нейронов. Мозжечок и ствол мозга этой когорты животных не были доступны для оценки.
Снижение острых физиологических реакций при повторном ОЧИ
Чтобы оценить влияние повторного ОМС на острые физиологические реакции и определить, зависят ли апноэ и выпрямляющий рефлекс от интервала между травмами, реакции сравнивались у мышей, получавших имитацию, rCHI-24h и rCHI. -48ч групп.
Время, необходимое для того, чтобы вызвать ответный рефлекс выпрямления, зависело как от группы травмы (p <0,0005), так и от количества CHI (p <0,0001) со значительным взаимодействием между этими факторами (p <0.05) (). Подавление рефлекса выпрямления в обеих группах rCHI было значительно более длительным, чем в группе имитации (p <0,001 для rCHI-24h; p <0,005 для rCHI-48h). С течением времени возврат рефлекторного ответа выпрямления в группе rCHI-24h был значительно более задержанным по сравнению с группой rCHI-48h (p <0,05). Апостериорное тестирование не выявило значительной разницы в рефлексе выпрямления между двумя группами rCHI для любого конкретного CHI (с первого по пятый). В группе rCHI-24h подавление выпрямляющего рефлекса значительно продлилось после первого и второго CHI (p <0.05 против фиктивного). Подавление рефлексов было значительно снижено после четвертого и пятого воздействия по сравнению с реакцией группы rCHI-24h на первоначальное воздействие. Группа rCHI-48h также показала значительное увеличение времени восстановления выпрямляющего рефлекса после первого CHI, но не после последующего CHI.
( A, B ) Рефлекс выпрямления ( A ) и апноэ ( B ) после имитации травмы, повторной закрытой травмы головы с интервалом в 24 часа (rCHI-24h) и повторной закрытой травмы головы через 48 часов. часовые интервалы (рЧИ-48ч).$ означает p <0,05 по сравнению с фиктивным. % указывает на p <0,05 по сравнению с rCHI-48h. # означает p <0,05 по сравнению с CHI 1 той же группы. Столбцы, среднее ± SE.
Продолжительность апноэ варьировала в зависимости от травмы (p <0,0001) и количества CHI (p <0,005) со значительным взаимодействием между этими факторами (p <0,05) (). Обе группы rCHI-24h и rCHI-48h имели значительное апноэ после первого удара по сравнению с фиктивной группой (p <0,0001 и p <0,001, соответственно), но продолжительность апноэ значительно уменьшилась, когда второе воздействие было передано 48 часов, в отличие от Через 24 часа после первого (p <0.05). Обе группы с повторной ЧМТ легкой степени продемонстрировали тенденцию к более короткому апноэ с последовательными воздействиями. По сравнению с апноэ после первого удара, апноэ значительно уменьшилось после третьего, четвертого и пятого ударов для группы rCHI-24h и второго, четвертого и пятого воздействий для группы rCHI-48h, что свидетельствует о действующем компенсаторном механизме. с множественными легкими ЧМТ.
Легкая ЧМТ, повторяющаяся с 24-часовыми, но не 48-часовыми интервалами, обостряет острую смерть нейронов в энторинальной коре
Несколько гистологических оценок были использованы для оценки воздействия повторного ВМС на мозг и того, повлиял ли временной интервал между воздействиями на эти реакции .Окрашивание по Нисслю не выявило каких-либо явных патологических изменений через 1, 5 или 9 дней после однократного CHI (). Однако у 5 из 8 мышей в группе rCHI-24h наблюдались геморрагические поражения энторинальной коры через 24 часа после пятого сотрясения мозга (). Частота геморрагических поражений снизилась до 1 из 7 в группе rCHI-48h, и повреждения были меньше по сравнению с теми, которые наблюдались у мышей, травмированных с 24-часовым интервалом ().
Дегенерация нейронов энторинальной коры после однократной и многократной закрытой травмы головы (ЧИ).( A, C, E ) Окрашивание по Нисслю мышей, получавших один CHI с 24-часовой смертью (Single 24h; A ), 5 CHI повторяли с 24-часовым интервалом между травмами (rCHI-24h; C ), и повторение 5 CHI с 48-часовым интервалом между травмами (rCHI-48h; E ). Окрашивание по Нисслю показывает геморрагические поражения в энторинальной коре головного мозга группы rCHI-24h. ( B, D, F ) Окрашивание фтор-нефритом C (FJC) в энторинальной коре мышей в группе Single 24h ( B ), rCHI-24h ( D ) и rCHI-48h ( F ).указывает p <0,05 по сравнению с однократным 9 дней.
В энторинальной коре однократное воздействие на 2,0 мм привело к появлению небольшого количества FJC-положительных клеток через 24 часа после травмы (), что указывает на дегенерацию нейронов; однако количество дегенерирующих нейронов существенно не отличалось от фиктивного (). В группе rCHI-24h, FJC-положительные клетки были расположены вокруг области кровоизлияния (), а также в энторинальной коре в срезах ткани, которые не содержали поражения. Легкая ЧМТ, повторяемая с 24-часовым интервалом, но не с 48-часовым интервалом, привела к значительному увеличению количества FJC-положительных клеток в энторинальной коре головного мозга по сравнению сфиктивная травма (p <0,05) (). Ни однократный, ни повторный CHI на глубине удара 2,0 мм не приводил к окрашиванию FJC в гиппокампе.
В мозжечке качественная оценка окрашивания FJC выявила небольшое количество двусторонней дегенерации нейронов в клетке Пуркинье и молекулярных слоях наиболее дистальной части боковой листовой оболочки мозжечка через 24 часа после однократного CHI (), который в основном ограничивался нейронами. процесс окрашивания в молекулярном слое через 9 дней после однократного CHI (не показано).Напротив, сома дегенерирующих нейронов редко метилась у мышей, получавших rCHI с 24-часовыми интервалами. С интервалом между повреждениями 48 часов у некоторых мышей rCHI было обнаружено FJC-мечение небольшого количества нейронов и отростков в латеральной листовой оболочке мозжечка, аналогичное тому, которое наблюдалось в группах с одиночным CHI.
Дегенерация нейронов мозжечка и ствола мозга после однократной и многократной закрытой травмы головы (ЧИ). ( A, B ) Окрашивание фтор-нефритом C (FJC) у мышей, убитых через 24 часа после однократного CHI (Single 24h), показало дегенерирующие нейроны в слое клеток Пуркинье (PC) и некоторое повреждение аксонов в белом веществе (WM) тракт мозжечка ( A ) с очень незначительным повреждением ствола мозга ( B ).указывает на дегенерирующие нейроны; ML = молекулярный слой; GC = слой зернистых клеток; масштабная линейка = 100 мкм.
Легкая ЧМТ вызывает повреждение аксонов
Хотя окрашивание FJC не выявило заметного повреждения аксонов в коре, белом веществе головного мозга или гиппокампе, оно предоставило четкие доказательства повреждения аксонов в мозжечке и стволе мозга через 24 часа после повторной легкой ЧМТ. Легкое повреждение аксонов наблюдалось в боковых трактах белого вещества мозжечка (), но не в стволе головного мозга () при одиночном ВГС.Поражение аксонов было более обширным и более диффузно распределенным в группе rCHI-24h, с повреждением аксонов в боковых () и центральных трактах белого вещества мозжечка, и было рассеяно по стволу мозга с наибольшей концентрацией вентролатерально (). Повторный ВМС с 48-часовым интервалом привел к тому же распределению аксональных повреждений, что и с 24-часовым интервалом, но степень аксонального повреждения оказалась меньше ().
В головном мозге повреждение аксонов было обнаружено по накоплению cAPP в отростках аксонов и небольших луковицах в энторинальной коре через 24 часа после однократного CHI ().Количество cAPP-положительных аксонов / луковиц уменьшалось с увеличением продолжительности жизни (5 дней, 9 дней), что указывает на острую, но не затяжную волну аксонального повреждения (). Когда CHI повторяли с 24-часовыми интервалами, количество меченых аксонов увеличивалось по сравнению с одним CHI, но это не было статистически значимым (). Частота повреждения аксонов также была сходной между группой rCHI-24h (5 из 8 с> 1 опухолью / срез) и единственной 24-часовой группой (3 из 6). Несмотря на это сходство, луковицы, меченные cAPP, оказались намного больше в группе rCHI-24h (), чем в группах с одиночным CHI ().Кроме того, в группе rCHI-24h скопления луковиц были расположены рядом с внешней капсулой (), тогда как повреждение аксонов в единственной 24-часовой группе было более центрально расположено в пределах энторинальной коры. Когда CHI повторяли с 48-часовыми интервалами, у нескольких мышей наблюдались повреждения аксонов (2 из 7). Хотя среднее количество аксонов, меченных cAPP, было таким же, как в единственной 24-часовой группе, это было связано с одним животным с необычно большим количеством опухолей.
Аксональная травма после повторной закрытой черепно-мозговой травмы (ЧИ).указывает аксоны, меченные cAPP; * обозначает внешнюю капсулу; + указывает на ринальную щель; шкала = 250 мкм. ( G ) Количество иммуномеченных набуханий аксонов существенно не различалось в разных группах. Столбцы представляют собой среднее значение ± стандартная ошибка.
Астроцитоз усугубляется повторным ОЗИ с 24-часовыми, но не 48-часовыми интервалами
GFAP-положительные астроциты присутствовали в энторинальной коре головного мозга ложно травмированных животных, но их клеточные тела и отростки не выглядели раздутыми ().Вскоре после однократного CHI некоторые астроциты в небольшой области энторинальной коры казались более опухшими по сравнению с таковыми у фиктивных мышей. Хотя количество GFAP-положительных астроцитов через 24 часа не увеличилось по сравнению с мнимой травмой, их количество постепенно увеличивалось в течение 9 дней после однократной легкой ЧМТ (p <0,05 по сравнению с 24-часовым CHI;). Одиночная ЧМТ легкой степени также привела к замедленному увеличению интенсивности иммунореактивности GFAP на астроцит через 9 дней после травмы (p <0,05 по сравнению с фиктивным) (). Когда CHI повторяли с 24-часовыми интервалами, астроциты по всей энторинальной области коры казались реактивными с набухшими клеточными телами и отростками ().Количество GFAP-позитивных астроцитов в энторинальной коре было значительно увеличено у мышей rCHI-24h по сравнению с мышами, оцененными через 24 часа после однократного CHI (p <0,05) (), и, по-видимому, увеличилось по сравнению с группой выживания с одиночным CHI 5d. , хотя это не достигло статистической значимости. Интенсивность иммунореактивности GFAP в расчете на один астроцит также была увеличена в энторинальной коре головного мозга группы rCHI-24h по сравнению с группами одиночного CHI и ложным повреждением (p <0,05) (). Когда интервал между травмами был увеличен до 48 часов, региональная степень реактивного астроцитоза была аналогична той, которая наблюдалась через 9 дней после однократного CHI, но некоторые клеточные тела и отростки выглядели опухшими, как в группе rCHI-24h ().Число GFAP-положительных астроцитов в энторинальной коре в группе rCHI-48h увеличилось по сравнению с 24 часами после однократного CHI, но не отличалось от 9 дней после однократного CHI (). Иммунореактивность GFAP для данного астроцита в группе rCHI-48h не изменилась по сравнению с фиктивным и одиночным CHI, предполагая, что более длительный интервал между повреждениями может защитить от кумулятивных воздействий (). Эти данные указывают на аддитивный эффект CHI, повторяемый с 24-часовым, но не 48-часовым интервалом, на астроглиоз в энторинальной коре головного мозга.
Астроцитоз энторинальной коры и гиппокампа после имитационных и повторных закрытых травм головы (ЧИ). ( A – F ) Иммуногистохимическое мечение глиального фибриллярно-кислого белка (GFAP) после имитации ( A, D ), повторение 5 CHI с 24-часовыми интервалами (rCHI-24h; B, E ) или 48- часовые интервалы (rCHI-48h, C, F ). Масштабные линейки: A – C , 500 мкм; D – F , 250 мкм. ( G, H ) Иммунореактивные астроциты подсчитывали в энторинальной коре (репрезентативная область интереса, обведена черным) ( G ) и гиппокампе ( H ).Средняя интегральная оптическая плотность GFAP на астроцит была определена количественно в энторинальной коре ( G ) и гиппокампе ( H ). Столбцы представляют собой среднее значение ± стандартная ошибка. * означает p <0,05 по сравнению со всеми другими группами. $ означает p <0,05 по сравнению с фиктивным. ! указывает p <0,05 по сравнению с однократным 24 ч. # означает p <0,05 по сравнению с одиночным 5d и одиночным 9d.
В гиппокампе как количество, так и иммунореактивность GFAP на астроцит были выше через 24 часа после однократного CHI, чем через 5 дней и 9 дней, что соответствует острому переходному глиозу ().Однако реакция через 24 часа после однократного CHI была эквивалентна фиктивной, что указывает на возможный глиоз, вызванный анестезией, у мышей с фиктивными повреждениями, которые получили 5 воздействий анестезии. Ранее сообщалось об усилении астроцитоза гиппокампа при повторной анестезии (22), но на степень астроцитоза, вызванного анестезией, не влиял интервал между приступами анестезии (дополнительный рис. 1). Легкая ЧМТ, повторенная с 24-часовым интервалом, не привела к большему количеству GFAP-положительных астроцитов по сравнению с фиктивным или одиночным CHI ().Иммунореактивность GFAP в расчете на один астроцит была значительно увеличена в группе rCHI-24h по сравнению с фиктивной, но не в единственной 24-часовой группе (). Когда CHI повторялся с 48-часовыми интервалами между травмами, астроциты выглядели менее опухшими, чем в группе rCHI-24h, и ни количество GFAP-положительных астроцитов, ни экспрессия GFAP на астроцит не были значительно различаются по сравнению с фиктивным или одиночным 24-часовым периодом. группа ().
Качественный анализ астроцитоза в мозжечке и стволе мозга выявил закономерности среди групп повреждений, аналогичные описанным для энторинальной коры.Одиночный CHI индуцировал умеренный глиоз в молекулярном слое наиболее дистальной части латеральной листовой пластинки мозжечка в областях, подобных тем, которые демонстрируют дегенерацию нейронов с FJC. В стволе мозга была отмечена очень низкая реактивность астроцитов. При повторении с 24-часовыми интервалами 5 CHI вызывали повышенный ответ астроцитов с обеих сторон в мозжечке, особенно в боковых слоях (2). Отростки астроцитов, распространяющиеся через молекулярный слой, стали утолщенными, а клеточные тела в гранулярном клеточном слое гипертрофировались ().Повторные CHI с 24-часовыми интервалами также привели к усилению иммуноокрашивания GFAP в сером и белом веществе ствола мозга (). Когда интервал был увеличен до 48 часов, 5 CHI вызывал более умеренный астроцитарный ответ в боковом мозжечке () и стволе мозга () по сравнению с группой rCHI-24h.
Астроцитоз мозжечка и ствола мозга после повторной закрытой черепно-мозговой травмы. Иммуногистохимическое мечение глиального фибриллярного кислого белка (GFAP) после фиктивного CHI указывает на исходный уровень иммуноокрашивания в слое клеток Пуркинье мозжечка ( A, D ) и в стволе мозга ( G, J ).Когда 5 CHI были повторены с 24-часовыми интервалами (rCHI-24h), реактивный астроцитоз наблюдался по всему мозжечку с наибольшей гипертрофией, происходящей в молекулярном и гранулярном слоях латеральной листовой оболочки мозжечка ( B, E ). После 5 CHI, повторенных с 48-часовыми интервалами (rCHI-48h), реактивный астроцитоз не был таким сильным и был сосредоточен в боковых слоях мозжечка ( C, F ). Астроглиоз был более выражен в стволе мозга после rCHI с 24-часовыми интервалами ( H, K ), чем с 48-часовыми интервалами ( I, L ).Масштабные линейки: A – C, G – I, J – L , 500 мкм; D – F : 250 мкм.
Микроглия активируется CHI, повторяется через 24 часа, но не через 48 часов
У здоровой мыши Iba-1 в основном мечен маленькими однородными телами клеток микроглии и очень тонкими отростками. Микроглиоз наблюдался в виде морфологических изменений меченных Iba-1 клеток, таких как набухание тел клеток и увеличение Iba-1-положительных отростков. Микроглиоз, измеренный с помощью процента площади, занятой иммуномечением Iba-1, не увеличивался через 24 часа, 5 дней или 9 дней после однократного CHI по сравнению с фиктивным повреждением энторинальной коры или гиппокампа (2).Однако после проведения rCHI с 24-часовыми интервалами тела микроглиальных клеток и отростки в энторинальной коре выглядели опухшими (). Процент площади микроглии, меченной Iba-1, был увеличен в энторинальной коре (p <0,0001 по сравнению со всеми другими группами) (), но не в гиппокампе (p> 0,05). rCHI, повторяемый с 48-часовыми интервалами, не вызывал значительного микроглиоза () в энторинальной коре или гиппокампе по сравнению с фиктивным повреждением или одиночным CHI (p> 0,05;).
Микроглиоз после повторных закрытых травм головы (рЧИ).( A – D ) Иммуногистохимическое мечение ионизированной кальций-связывающей адаптерной молекулы 1 (Iba-1) после 5 CHI, повторяемых с 24-часовыми интервалами (rCHI-24h; A, C ) и 48-часовыми интервалами (rCHI- 48h; B, D ). ( E ) Процент площади иммунного мечения Iba-1 определяли количественно в энторинальной коре и гиппокампе. Столбцы представляют собой среднее значение ± стандартная ошибка. * означает p <0,05 по сравнению со всеми другими группами. ( F – I ) Проникающие макрофаги, меченные I-A / I-E в геморрагическом поражении ( F, G ), не метятся совместно с микроглией, экспрессирующей Iba-1 ( H, I ).Масштабные линейки: A, B, F – I , 500 мкм; C, D , 250 мкм.
IA / IE (MHC II) использовался в качестве маркера активированной микроглии (31), но мягкий CHI не индуцировал микроглиальную экспрессию MHC II после повреждения, о чем свидетельствует отсутствие коэкспрессии с Iba-1 () . Вместо этого в областях кровотечения I-A / I-E, по-видимому, маркируют макрофаги, которые проникли в мозг из-за разрушения гематоэнцефалического барьера (). Клетки, меченные I / A-I / E, также выстилали желудочки во всех группах (данные не показаны).
Повторный CHI не вызывает острого гиперфосфорилирования тау
Иммуногистохимия с PHF-1 не выявила качественного увеличения гиперфосфорилированного тау в коре или гиппокампе в любой группе травм по сравнению с фиктивным контролем (данные не показаны).
ОБСУЖДЕНИЕ
Многие легкие ЧМТ, возникающие каждый год, можно отнести к таким занятиям, как бокс и футбол, где повышен риск повторных сотрясений мозга. В этом исследовании мы разработали модель легкой ЧМТ на мышах, используя мягкое воздействие средней линии на закрытый череп.Эта модель вызвала повреждение в первую очередь энторинальной коры и мозжечка с дополнительной патологией в стволе мозга с повторяющимися ударами. Варьируя запрограммированную глубину удара, глубина удара 2,0 мм была выбрана в качестве оптимальной тяжести травмы, вызывающей острые физиологические последствия и легкий глиоз без перелома черепа или явной гибели кортикальных или гиппокампальных клеток. Это типично для человеческого состояния, при котором после удара может произойти потеря сознания, но визуальный анализ мозга обычно ничем не примечателен.Затем мы продемонстрировали, что 5 легких ЧМТ с 24-часовыми или 48-часовыми интервалами между травмами привели к подавлению апноэ и выпрямляющего рефлекса, которые уменьшались при последовательных воздействиях. Несмотря на уменьшение ответа, 5 CHI, повторенные с 24-часовым интервалом между повреждениями, усилили глиоз и увеличили дегенерацию нейронов и повреждение аксонов по сравнению с одним CHI. Когда интервал между травмами между множественными травмами головы был увеличен с 24 часов до 48 часов, полученные в результате гистопатологические последствия были аналогичны одиночному CHI.
Временная потеря сознания продолжительностью до 30 минут возникает у людей при легкой ЧМТ (32). У мышей рефлекс выпрямления используется более 50 лет, чтобы указать на потерю сознания (33). В то время как меньшая глубина удара не приводила к значительному изменению рефлекса выпрямления, одиночный ВМС глубиной 2,0 мм приводил к потере сознания примерно на 10 минут, в пределах диапазона, представляющего легкую ЧМТ на моделях грызунов (20). Хотя это подавление рефлексов длится дольше, чем в некоторых предыдущих отчетах (от 2 до 5 минут), в большинстве этих исследований для оценки сознания использовался ответ на защемление пальца / хвоста или другой болезненный стимул (15, 27, 30), что может привести к более быстрое возвращение отзывчивости (34).Хотя анестезия подавляет рефлекс выпрямления, мы поддерживали постоянную продолжительность ингаляционной анестезии на протяжении каждой операции.
Продолжительность апноэ постепенно увеличивалась в зависимости от глубины удара. Хотя апноэ не является типичным признаком легкой ЧМТ у людей, реакции апноэ являются обычным явлением в моделях легкой ЧМТ у грызунов, использующих срединное воздействие на череп (12, 22, 35), и значительно дольше, чем реакции апноэ, сообщаемые при боковом повреждении (15). , 30). В то время как боковой удар может направлять деформацию ткани по средней линии, а также вниз через более глубокие структуры мозга, удар по средней линии, вероятно, направляет деформацию ткани в сторону ствола мозга, временно воздействуя на нейроны, участвующие в дыхании (36).В средних моделях более тяжелой ЧМТ животным требуется интубация для облегчения дыхательной деятельности (12). Хотя трудно отделить потенциальные эффекты апноэ от последствий механического повреждения, кратковременное апноэ в нашей модели вряд ли внесет значительный вклад в патологические изменения. Повторное апноэ во время обструктивного апноэ во сне было связано с нарушением функции памяти у людей и животных, но только в тяжелых случаях, включая до 100 эпизодов апноэ каждую ночь, причем каждый эпизод длился от секунд до минут (37).
Во время серии из 5 сотрясений, потеря сознания и апноэ уменьшились с последующим ОМС до почти фиктивного контрольного уровня. Уменьшение рефлекса выпрямления и апноэ происходило более быстрыми темпами, когда интервал между травмами был увеличен с 24 часов до 48 часов, что позволяет предположить, что адаптивный или защитный механизм был инициирован через 48 часов, но не через 24 часа после CHI. Наши результаты подтверждают исследование Mouzon et al, в котором продолжительность апноэ уменьшалась при повторной средней ЧМТ легкой степени у мышей (22), но они контрастируют с другими исследованиями, демонстрирующими увеличенную или устойчивую продолжительность апноэ или восстановительные рефлекторные реакции при повторных легких ЧМТ (14, 15, 22, 30, 38).Различия в ударном устройстве, характеристиках ударного наконечника, тяжести травмы, месте травмы или анестезии могут способствовать этим несопоставимым наблюдениям. Необходимы дальнейшие исследования, чтобы понять эволюцию и основные механизмы подавления восстановительного рефлекса и ответов апноэ при повторной легкой ЧМТ, но наши данные поднимают интересный вопрос о том, адаптируются ли люди к повторным сотрясениям с точки зрения их острых физиологических реакций. То есть, в ответ на эквивалентное сотрясение мозга, будут ли у таких спортсменов, как боксеры, получившие много ударов по голове в течение своей карьеры, симптомы, отличные от симптомов людей, не имевших ранее сотрясений мозга? Если симптоматика уменьшается при множественных сотрясениях мозга, серьезность и возможные последствия любой данной травмы головы могут быть недооценены.
Исторически модели легкой ЧМТ вызывали некоторую степень дегенерации нейронов, которая наблюдается сразу после травмы (20), что указывает на временную волну гибели клеток (35). С растущим интересом к повторным сотрясениям, параметры травмы были изменены, чтобы уменьшить или исключить гибель клеток как признак однократной (26, 29) или повторной легкой ЧМТ (26, 28, 39). Однако во многих из этих исследований для оценки гибели клеток использовались относительно нечувствительные меры, такие как окрашивание по Нисслю. В нашей модели после сингла 2.0 мм средней линии CHI, явной потери клеток не наблюдалось при окрашивании по Нисслю, но небольшое количество острой дегенерации нейронов в энторинальной коре и слое клеток Пуркинье мозжечка было обнаружено с помощью FJC. Когда CHI повторяли с 24-часовым интервалом между повреждениями, количество тел нейронов, меченных FJC, увеличивалось, и в энторинальной коре развивалось геморрагическое поражение. Сообщалось об усилении потери клеток, истончении коры или развитии поражения при повторной по сравнению с одиночной ЧМТ (15, 22, 29), но эти наблюдения были качественными или полуколичественными и не использовали нейрон-специфические маркеры для острой дегенерации.Longhi и др. Отметили, что острая корковая нейродегенерация была качественно эквивалентна после одного и двух CHI с 3-дневным интервалом (27). Мы исследовали более короткие интервалы и предоставили количественные данные, чтобы продемонстрировать, что увеличение интервала между травмами с 24 часов до 48 часов предотвращает обострение гибели нейронов в энторинальной коре, указывая на то, что первоначальная клеточная дисфункция была обратимой в течение 48 часов после травмы. Насколько нам известно, это первый отчет, в котором количественно оценивается влияние повторяющейся легкой ЧМТ и вариаций временного интервала на накопление дегенерирующих нейронов.Следовательно, мы предлагаем модель, в которой множественные повреждения могут преобразовать сублетальное повреждение нейронов в дегенерацию нейронов, что является важной платформой для исследования уязвимости нейронов и аксонов к легкой ЧМТ. Интересно, что повышенная острая гибель клеток не наблюдалась в мозжечке, что может указывать на уникальные механизмы повреждения или на ускоренную дегенерацию, которая не была зафиксирована с помощью окрашивания FJC. Для понимания степени гибели нейронов в энторинальной коре и мозжечке необходима дальнейшая оценка долговременного повреждения нейронов, включая стереологическое количество клеток.
Аксональное повреждение является частым признаком легкой диффузной ЧМТ, которая обычно усугубляется повторными травмами (16, 18, 29, 30, 38). В настоящем исследовании одиночный ВМС вызывал легкое повреждение аксонов в энторинальной коре и мозжечке, распределение, уникальное для других моделей легкой ЧМТ, которые чаще всего сообщают о повреждении подкорковых путей белого вещества (18, 27, 29, 30, 35). Непонятно, почему удар по средней линии не привел к повреждению аксонов подкоркового белого вещества, обнаруженному с помощью иммуноокрашивания APP или окрашивания FJC, но в будущих исследованиях будут использоваться альтернативные методы обнаружения, такие как окрашивание серебром, которое может быть более чувствительным, или обнаруживать альтернативные фенотипы повреждения аксонов ( 28).ЧМТ, повторенная с 24-часовым интервалом, не приводила к значительному увеличению количества APP-положительных аксонов в энторинальной коре, но набухание аксонов выглядело больше, что может указывать на функциональное различие. Хотя сообщалось, что размер набухания аксонов коррелирует со временем выживания (40), более крупные набухания в группе rCHI-24h нельзя приписывать исключительно более длительному выживанию, потому что эквивалентные набухания не наблюдались в группах одиночных CHI с одинаковым временем выживания. Напротив, rCHI с интервалом в 24 часа приводила к заметному усилению повреждения аксонов мозжечка и появлению диффузного повреждения аксонов в стволе мозга.О развитии аксонального повреждения после повторной, но не однократной ЧМТ легкой степени сообщалось в стволе мозга (16, 22) и таламусе (29) в других моделях средней линии ВМС, и это может указывать на то, что одна ЧМТ легкой степени вызывает дисфункцию аксонов, которая перерастает только в APP- положительная патология при повторной травме. Когда легкая ЧМТ повторялась с 48-часовыми интервалами между травмами, повреждение аксонов в энторинальной коре было таким же, как у мышей, обследованных через 9 дней после однократного ВМС, а дегенерирующие аксоны в мозжечке и стволе мозга наблюдались реже, чем в рИГН. -24ч группа.Эти данные предполагают, что более длительные интервалы между легкой ЧМТ защищают от обострения аксонального повреждения, как было показано Povlishock et al (16). В совокупности наши данные подтверждают гипотезу о том, что повторные легкие ЧМТ в течение определенного периода времени могут вызвать и / или ускорить повреждение аксонов.
В то время как клеточные механизмы временной уязвимости нейронов к повторной легкой ЧМТ недостаточно изучены, динамические изменения проницаемости клеточной мембраны, высвобождения глутамата, регуляции кальция и функции митохондрий могут играть роль.Снижение метаболизма глюкозы в головном мозге также считается основной причиной уязвимости ко второй ЧМТ (41). Взаимодействие между нейронами и реактивной глией после травмы еще больше затрудняет идентификацию причинных клеточных механизмов.
При травматическом событии астроциты становятся реактивными и запускают защитные механизмы восстановления, чтобы ограничить повреждение ткани, восстанавливая любой разрыв гематоэнцефалического барьера (42) и способствуя синаптогенезу (43). Единичный CHI размером 2,0 мм или меньше приводил к очень легкому прогрессирующему астроглиозу, как и в других моделях одиночного CHI на грызунах (22, 44).Когда легкая ЧМТ повторялась с 24-часовыми интервалами между травмами, астроцитоз усиливался в энторинальной коре, мозжечке и стволе мозга, подтверждая предыдущие сообщения об увеличении астроглиоза при повторной по сравнению с одиночной легкой ЧМТ (21, 22). Однако остается неясным, является ли обострение астроцитоза нейропротективным или пагубным для окружающих нейронов. Астроциты ответственны за обратный захват глутамата из синаптической щели, но после ушиба транспортеры глутамата подавляются, что усиливает эксайтотоксичность в синаптической щели (45).В будущих исследованиях будет изучена стойкость глиального ответа после повторного CHI и его связь с начальным и продолжающимся повреждением нейронов.
Подобно астроцитозу, микроглиальная реактивность была отмечена у грызунов после однократной и повторной легкой ЧМТ, прежде всего в коре головного мозга ниже места удара, мозолистом теле и гиппокампе сразу после травмы (15, 22, 28) и в течение длительного периода после травмы. как 2 месяца (15) и 12 месяцев (46). В этом исследовании реактивность микроглии не была очевидна в течение 9-дневного периода после однократного CHI или сразу после rCHI с 48-часовым интервалом; однако rCHI с интервалом в 24 часа значительно увеличивал микроглиоз энторинальной коры.Напротив, Mouzon et al продемонстрировали, что 5 легких ЧМТ с 48-часовыми интервалами увеличивали микроглиоз в коре и мозолистом теле в течение 24 часов после окончательного повреждения (22), но парадигма травмы, используемая Mouzon et al., Вызывала микроглиоз после однократного легкого повреждения. ЧМТ, тогда как наша модель вызывала микроглиоз только с повторяющимися сотрясениями мозга, что позволяет предположить, что наш единственный ВМС может представлять собой более легкую начальную травму. Активация микроглии наблюдалась в энторинальной коре в сочетании с повреждением аксонов и дегенерацией нейронов.После активации микроглия высвобождает множество цитокинов и хемокинов, которые сигнализируют о начале воспалительного каскада. В зависимости от уровней этих различных сигнальных молекул после травмы в микроглии могут развиваться фенотипы, способствующие либо гибели клеток, либо восстановлению тканей (47). Необходимы дальнейшие исследования экспрессии цитокинов / хемокинов в микроглии между повторными повреждениями и хронически после повторных травм с легкой степенью тяжести, чтобы понять, помогает ли микроглия или противодействует восстановлению нейронов после повторных травматических повреждений.
Сочетание нейроглиальных ответов в гиппокампе, энторинальной коре, мозжечке и стволе мозга в нашей модели CHI является отличительным; Большинство моделей умеренной ЧМТ вызывают повреждение клеток сенсорной и моторной коры вблизи места удара, мозолистого тела и / или гиппокампа. Энторинальная кора вместе с гиппокампом участвует в цепи памяти. Было показано, что двусторонние электролитические поражения энторинальной коры вызывают дефицит памяти и обучения (48).Таким образом, в нашей модели повторной легкой ЧМТ двусторонняя нейродегенерация энторинальной коры в сочетании с глиозом гиппокампа может облегчить исследование посттравматического дефицита памяти. Двустороннее повреждение мозжечка и аксонов ствола мозга может иметь функциональные последствия для сложной координации движений и баланса. Таким образом, будущая работа должна определить, приводит ли повторный ОМС с этой моделью к поведенческой дисфункции. Настоящее исследование ограничивалось оценкой острых физиологических и гистопатологических изменений.Поскольку повторная ЧМТ легкой степени считается фактором риска или причиной нейродегенеративных заболеваний, таких как болезнь Альцгеймера и хроническая травматическая энцефалопатия (49), важно изучить долгосрочные гистологические последствия повторной ЧМТ легкой степени на этой модели.
В заключение, по сравнению с одной легкой ЧМТ, легкая ЧМТ, повторяемая с 24-часовым интервалом, приводила к большей дегенерации нейронов, повреждению аксонов, астроглиозу и микроглиозу во всех каудальных областях мозга мыши.Эти повышенные тканевые реакции не были просто следствием большего количества ударов, потому что 5 сотрясений, вызванных с 48-часовыми интервалами, не увеличивали гибель нейронов или глиоз по сравнению с единичным повреждением. Необходимы дополнительные исследования для выявления клеточных и молекулярных факторов, влияющих на временную уязвимость к повторной легкой ЧМТ. Усиленные невропатологические изменения, связанные с повторными травмами головы, были очевидны, несмотря на снижение острых физиологических реакций на последовательные воздействия.Эти данные подтверждают необходимость дополнения симптоматического анализа легкой ЧМТ оценкой патологии головного мозга с использованием изображений, биомаркеров или других технологий.
Поведенческие нарушения, ранний глиоз, дисмиелинизация и синаптическая дисфункция на мышиной модели муколипидоза IV | Acta Neuropathologica Communications
Бах Г., Вебб М.Б., Баргал Р., Зейглер М., Экштейн Дж .: Частота муколипидоза типа IV в еврейской популяции ашкенази и идентификация 3 новых мутаций MCOLN1. Хум Мутат 2005, 26 (6): 591. 10.1002 / humu.9385
Артикул PubMed Google ученый
Altarescu G, Sun M, Moore DF, Smith JA, Wiggs EA, Solomon BI, Patronas NJ, Frei KP, Gupta S, Kaneski CR, Quarrell OW, Slaugenhaupt SA, Goldin E, Schiffmann R: The neurogenetics муколипидоза IV типа. Неврология 2002, 59 (3): 306–313. 10.1212 / WNL.59.3.306
CAS Статья PubMed Google ученый
Smith JA, Chan CC, Goldin E, Schiffmann R: Неинвазивная диагностика и офтальмологические особенности муколипидоза типа IV. Офтальмология 2002, 109 (3): 588–594. 10.1016 / S0161-6420 (01) 00968-X
Артикул PubMed Google ученый
Вакабаяши К., Густафсон А.М., Сидранский Э., Голдин Е.: Муколипидоз типа IV: обновленная информация. Mol Genet Metab 2011, 104 (3): 206–213. DOI: 10.1016 / j.ymgme.2011.06.006
CAS Статья PubMed PubMed Central Google ученый
Амир Н., Злотогора Дж., Бах Г.: Муколипидоз IV типа: клинический спектр и естественное течение. Педиатрия 1987, 79 (6): 953–959.
CAS PubMed Google ученый
Schiffmann R, Mayfield J, Swift C, Nestrasil I: Количественная нейровизуализация при муколипидозе IV типа. Mol Genet Metab 2014, 111 (2): 147–151. DOI: 10.1016 / j.ymgme.2013.11.007
CAS Статья PubMed Google ученый
Бонавита С., Вирта А., Джеффрис Н., Голдин Е., Тедески Г., Шиффманн Р.: Диффузное нейроаксональное вовлечение в муколипидоз IV по данным протонной магнитно-резонансной спектроскопической визуализации. J Child Neurol 2003, 18 (7): 443–449. 10.1177 / 08830738030180070701
Артикул PubMed Google ученый
Frei KP PN, Crutchfield KE, Altarescu G, Schiffmann R: Муколипидоз IV типа: характерные результаты МРТ. Неврология 1998, 51: 565–569.(1998) Муколипидоз IV типа: характерные данные МРТ. Неврология 51: 565–569 10.1212 / WNL.51.2.565
Статья PubMed Google ученый
Folkerth RDAJ, Lomakina I, Skutelsky E, Raghavan SS, Kolodny EH: Муколипидоз IV: морфология и гистохимия вскрытия. J Neuropathol Exp Neurol 1995, 54 (2): 154–164. 10.1097 / 00005072-199503000-00002
CAS Статья PubMed Google ученый
Теллез-Нагель ИРИ, Ивамото Т., Джонсон А.Б., Нортон В.Т., Нитовски Х .: Муколипидоз IV. Клинические, ультраструктурные, гистохимические и химические исследования случая, включая биопсию головного мозга. Arch Neurol Дек. 1976 г., 33 (12): 828–835. 10.1001 / archneur.1976.00500120032005
CAS Статья Google ученый
Dong XP, Cheng X, Mills E, Delling M, Wang F, Kurz T, Xu H: Связанный с муколипидозом белок TRPML1 типа IV представляет собой эндолизосомный канал высвобождения железа. Nature 2008, 455 (7215): 992–996. DOI: 10.1038 / nature07311
CAS Статья PubMed PubMed Central Google ученый
Dong XP, Wang X, Shen D, Chen S, Liu M, Wang Y, Mills E, Cheng X, Delling M, Xu H: активирующие мутации канала TRPML1, выявленные мутагенезом при сканировании пролина. J Biol Chem 2009, 284 (46): 32040–32052. DOI: 10.1074 / jbc.M109.037184
CAS Статья PubMed PubMed Central Google ученый
Xu H, Delling M, Li L, Dong X, Clapham DE: Активирующая мутация в потенциальном канале транзиторного рецептора муколипина приводит к потере меланоцитов у мышей varitint-waddler. Proc Natl Acad Sci U S A 2007, 104 (46): 18321–18326. DOI: 10.1073 / pnas.070
04
CAS Статья PubMed PubMed Central Google ученый
Киселев К., Чен Дж., Рбаиби Ю., Обердик Д., Тьон-Кон-Санг С., Щейников Н., Муаллем С., Сойомбо А. TRP-ML1 представляет собой лизосомный моновалентный катионный канал, который подвергается протеолитическому расщеплению. J Biol Chem 2005, 280 (52): 43218-43223. 10.1074 / jbc.M508210200
CAS Статья PubMed Google ученый
LaPlante JM, Ye CP, Quinn SJ, Goldin E, Brown EM, Slaugenhaupt SA, Vassilev PM: Функциональные связи между муколипин-1 и Ca2 + -зависимым переносом мембран при муколипидозе IV. Biochem Biophys Res Commun 2004, 322 (4): 1384–1391. 10.1016 / j.bbrc.2004.08.045
CAS Статья PubMed Google ученый
Manzoni M, Monti E, Bresciani R, Bozzato A, Barlati S, Bassi MT, Borsani G: Сверхэкспрессия белков муколипина дикого типа и мутантных белков муколипина в клетках млекопитающих: влияние на организацию позднего эндоцитарного компартмента. FEBS Lett 2004, 567 (2–3): 219–224. 10.1016 / j.febslet.2004.04.080
CAS Статья PubMed Google ученый
Treusch S, Knuth S, Slaugenhaupt SA, Goldin E, Grant BD, Fares H: Функциональный ортолог Caenorhabditis elegans человеческого белка h-муколипина-1 необходим для биогенеза лизосом. Proc Natl Acad Sci U S A 2004, 101 (13): 4483–4488. 10.1073 / pnas.0400709101
CAS Статья PubMed PubMed Central Google ученый
Chen CS, Bach G, Pagano RE: Аномальный транспорт по лизосомному пути при муколипидозе, заболевании типа IV. Proc Natl Acad Sci U S. A 1998, 95 (11): 6373–6378. 10.1073 / пнас.95.11.6373
CAS Статья PubMed PubMed Central Google ученый
Pryor PR, Reimann F, Gribble FM, Luzio JP: Муколипин-1 — это лизосомальный мембранный белок, необходимый для внутриклеточного движения лактозилцерамида. Трафик 2006, 7 (10): 1388–1398. 10.1111 / j.1600-0854.2006.00475.x
CAS Статья PubMed Google ученый
Piper RC, Luzio JP: CUP: образцы кальция для лизосомного биогенеза. Trends Cell Biol 2004, 14 (9): 471–473. 10.1016 / j.tcb.2004.07.010
CAS Статья PubMed Google ученый
Венкатачалам К., Лонг А.А., Эльзэссер Р., Николаева Д., Броди К., Монтелл С. Моторный дефицит в модели муколипидоза IV типа на дрозофиле из-за дефектного клиренса апоптотических клеток. Cell 2008, 135 (5): 838–851. DOI: 10.1016 / j.cell.2008.09.041
CAS Статья PubMed PubMed Central Google ученый
Vergarajauregui S, Connelly PS, Daniels MP, Puertollano R: Аутофагическая дисфункция у пациентов с муколипидозом IV типа. Hum Mol Genet 2008, 17 (17): 2723–2737. DOI: 10.1093 / hmg / ddn174
CAS Статья PubMed PubMed Central Google ученый
LaPlante JM, Sun M, Falardeau J, Dai D, Brown EM, Slaugenhaupt SA, Vassilev PM: Лизосомный экзоцитоз нарушается при муколипидозе IV типа. Mol Genet Metab 2006, 89 (4): 339–348. 10.1016 / j.ymgme.2006.05.016
CAS Статья PubMed Google ученый
Lima WC, Leuba F, Soldati T, Cosson P: Муколипин контролирует экзоцитоз лизосом в диктиостелии. J Cell Sci 2012, 125 (Pt 9): 2315–2322. DOI: 10.1242 / jcs.100362
CAS Статья PubMed Google ученый
Venugopal B, Browning MF, Curcio-Morelli C, Varro A, Michaud N, Nanthakumar N, Walkley SU, Pickel J, Slaugenhaupt SA: Неврологические, желудочные и офтальмологические патологии на мышиной модели муколипидоза типа IV. . Am J Hum Genet 2007, 81 (5): 1070–1083. DOI: 10.1086 / 521954
CAS Статья PubMed PubMed Central Google ученый
Micsenyi MC, Dobrenis K, Stephney G, Pickel J, Vanier MT, Slaugenhaupt SA, Walkley SU: Невропатология мышиной нокаута Mcoln1 (- / -) модели муколипидоза типа IV. J Neuropathol Exp Neurol 2009, 68 (2): 125–135. DOI: 10.1097 / NEN.0b013e3181942cf0
CAS Статья PubMed PubMed Central Google ученый
Библия E, Гупта П., Хофманн С.Л., Купер Дж. Д.: Региональная и клеточная невропатология в мышиной модели с нулевым мутантом пальмитоил-протеина тиоэстеразы-1 инфантильного нейронального цероид липофусциноза. Neurobiol Dis. 2004, 16 (2): 346–359. DOI: 10.1016 / j.nbd.2004.02.010
CAS Статья PubMed Google ученый
Kuchibhotla KV, Goldman ST, Lattarulo CR, Wu HY, Hyman BT, Bacskai BJ: бляшки Abeta приводят к аберрантной регуляции гомеостаза кальция in vivo, что приводит к структурным и функциональным нарушениям нейронных сетей. Нейрон 2008, 59 (2): 214–225. DOI: 10.1016 / j.neuron.2008.06.008
CAS Статья PubMed PubMed Central Google ученый
Рудинский Н., Хоукс Дж.М., Бетенский Р.А., Егучи М., Ямагути С., Спирс-Джонс Т.Л., Хайман Б.Т.: На мышиной модели болезни Альцгеймера слаженные реакции дуги, основанные на опыте, нарушены. Nat Neurosci 2012, 15 (10): 1422–1429. DOI: 10.1038 / nn.3199
CAS Статья PubMed PubMed Central Google ученый
Datta S, Satten GA: тесты суммы рангов для кластеризованных данных. J Am Stat Assoc 2005, 100: 908–915. 10.1198 / 016214504000001583
CAS Статья Google ученый
Kelleher RJ 3rd, Govindarajan A, Jung HY, Kang H, Tonegawa S: Контроль трансляции с помощью передачи сигналов MAPK в долговременной синаптической пластичности и памяти. Cell 2004, 116 (3): 467–479. 10.1016 / S0092-8674 (04) 00115-1
CAS Статья PubMed Google ученый
DiFiglia M, Sapp E, Chase K, Schwarz C, Meloni A, Young C, Martin E, Vonsattel JP, Carraway R, Reeves SA, Boyce FM, Aronin N: Хантингтин — это цитоплазматический белок, связанный с пузырьками в мозге человека и крысы. нейроны. Нейрон 1995, 14 (5): 1075–1081. 10.1016 / 0896-6273 (95)
CAS Статья PubMed Google ученый
Копейкина К.Дж., Карлсон Г.А., Питстик Р., Людвигсон А.Е., Петерс А., Любке Дж. И., Коффи Р.М., Фрош М.П., Хайман Б.Т., Спирс-Джонс Т.Л.: Накопление тау-белка вызывает дефицит митохондриального распределения в нейронах в модели мыши таупатии и головного мозга человека с болезнью Альцгеймера. Am J Pathol 2011, 179 (4): 2071–2082. DOI: 10.1016 / j.ajpath.2011.07.004
CAS Статья PubMed PubMed Central Google ученый
Мори С., Леблон CP: Идентификация микроглии в световой и электронной микроскопии. J Comp Neurol 1969, 135 (1): 57–80. DOI: 10.1002 / cne.
0104CAS Статья PubMed Google ученый
Нагаи Т., Ямада С., Томинага Т., Итикава М., Мияваки А. Расширенный динамический диапазон флуоресцентных индикаторов для Ca (2+) за счет циркулярно переставленных желтых флуоресцентных белков. Proc Natl Acad Sci U S A 2004, 101 (29): 10554–10559. DOI: 10.1073 / pnas.0400417101
CAS Статья PubMed PubMed Central Google ученый
Block ML, Zecca L, Hong JS: Опосредованная микроглией нейротоксичность: раскрытие молекулярных механизмов. Nat Rev Neurosci 2007, 8 (1): 57–69. DOI: 10.1038 / nrn2038
CAS Статья PubMed Google ученый
Chitayat D, Meunier CM, Hodgkinson KA, Silver K, Flanders M, Anderson IJ, Little JM, Whiteman DA, Carpenter S: Тип муколипидоза IV: клинические проявления и естественное течение. Am J Med Genet 1991, 41 (3): 313–318. 10.1002 / ajmg.1320410310
CAS Статья PubMed Google ученый
Килар С., Мэддокс Л., Библия Е, Понтикис С.С., Маколей С.Л., Гриффи М.А., Вонг М., Сэндс М.С., Купер Дж. Д.: Последовательная потеря нейронов в таламусе и коре головного мозга на мышиной модели инфантильного нейронального цероид липофусциноза. Neurobiol Dis. 2007, 25 (1): 150–162. DOI: 10.1016 / j.nbd.2006.09.001
CAS Статья PubMed Google ученый
Pontikis CC, Cella CV, Parihar N, Lim MJ, Chakrabarti S, Mitchison HM, Mobley WC, Rezaie P, Pearce DA, Cooper JD: Поздняя нейродегенерация в Cln3 — / — мышиной модели ювенильных нейронов Цероидному липофусцинозу предшествует глиальная активация низкого уровня. Brain Res 2004, 1023 (2): 231–242. DOI: 10.1016 / j.brainres.2004.07
CAS Статья PubMed Google ученый
Pontikis CC, Cotman SL, MacDonald ME, Cooper JD: Потеря таламокортикальных нейронов и локализованный астроцитоз в модели болезни Баттена у мышей Cln3Deltaex7 / 8. Neurobiol Dis. 2005, 20 (3): 823–836. DOI: 10.1016 / j.nbd.2005.05.018
CAS Статья PubMed Google ученый
фон Шанц С., Килар С., Хансен С. Н., Понтикис С. К., Александр Н. А., Копра О., Яланко А., Купер Д. Д.: Прогрессирующая потеря таламокортикальных нейронов у мышей с дефицитом Cln5: различные эффекты в финском варианте позднего инфантильного NCL. Neurobiol Dis. 2009, 34 (2): 308–319. 10.1016 / j.nbd.2009.02.001
CAS Статья PubMed PubMed Central Google ученый
Kuronen M, Lehesjoki AE, Jalanko A, Cooper JD, Kopra O: Селективные пространственно-временные паттерны глиальной активации и потери нейронов в сенсорных таламокортикальных путях нейрональных мышей с цероидным липофусцинозом. Neurobiol Dis. 2012, 47 (3): 444–457. DOI: 10.1016 / j.nbd.2012.04.018
CAS Статья PubMed Google ученый
Schmiedt ML, Blom T, Kopra O, Wong A, von Schantz-Fant C, Ikonen E, Kuronen M, Jauhiainen M, Cooper JD, Jalanko A: Дефицит Cln5 у мышей приводит к активации микроглии, дефектный миелинизация и изменение липидного обмена. Neurobiol Dis. 2012, 46 (1): 19–29. DOI: 10.1016 / j.nbd.2011.12.009
CAS Статья PubMed Google ученый
Wilkinson FL, Holley RJ, Langford-Smith KJ, Badrinath S, Liao A, Langford-Smith A, Cooper JD, Jones SA, Wraith JE, Wynn RF, Merry CL, Bigger BW: Невропатология на моделях мышей мукополисахаридоза типа I, IIIA и IIIB. PLoS One 2012, 7 (4): e35787. DOI: 10.1371 / journal.pone.0035787
CAS Статья PubMed PubMed Central Google ученый
Pressey SN, Smith DA, Wong AM, Platt FM, Cooper JD: Ранняя активация глии, синаптические изменения и аксональная патология в таламокортикальной системе мышей Niemann-Pick типа C1. Neurobiol Dis. 2012, 45 (3): 1086–1100. DOI: 10.1016 / j.nbd.2011.12.027
CAS Статья PubMed PubMed Central Google ученый
Kollmann K, Damme M, Markmann S, Morelle W, Schweizer M, Hermans-Borgmeyer I, Rochert AK, Pohl S, Lubke T, Michalski JC, Kakela R, Walkley SU, Braulke T: причины дисфункции лизосом нейродегенерация у мышей с муколипидозом II. Мозг: J Neurol 2012, 135 (Pt 9): 2661–2675. DOI: 10.1093 / brain / aws209
CAS Статья Google ученый
Киселев К., Коллетти Г.А., Тервиллигер А., Кетчум К., Лайонс К.В., Куинн Дж., Муаллем S: TRPML: переносчики металлов в лизосомах, необходимые для выживания клеток? Cell Calcium 2011, 50 (3): 288–294. DOI: 10.1016 / j.ceca.2011.04.009
CAS Статья PubMed PubMed Central Google ученый
Коллетти Г.А., Киселев К: Трпмл1. Adv Exp Med Biol 2011, 704: 209–219. DOI: 10.1007 / 978–94–007–0265–3_11
CAS Статья PubMed Google ученый
Чжун Y, Чжоу LJ, Ren WJ, Xin WJ, Li YY, Zhang T, Liu XG: Направление синаптической пластичности, опосредованной C-волокнами в спинном спинном роге, определяется киназами семейства Src в микроглии. : роль фактора некроза опухоли альфа. Brain Behav Immun 2010, 24 (6): 874–880.DOI: 10.1016 / j.bbi.2010.01.007
CAS Статья PubMed Google ученый
Сами М, Ван Х, Чжан Х, Гошка А, Ли Х, Ченг Х, Грегг Э, Азар М, Чжо Й, Гаррити АГ, Гао Q, Слаугенхаупт С., Пикель Дж., Золов С.Н., Вайсман Л.С. , Lenk GM, Titus S, Bryant-Genevier M, Southall N, Juan M, Ferrer M, Xu H: канал TRP в лизосоме регулирует фагоцитоз крупных частиц посредством очагового экзоцитоза. Dev Cell 2013, 26 (5): 511–524.DOI: 10.1016 / j.devcel.2013.08.003
CAS Статья PubMed PubMed Central Google ученый
Фолкерт RD: Аномалии развития белого вещества при лизосомных болезнях накопления. J Neuropathol Exp Neurol 1999, 58 (9): 887–902. 10.1097 / 00005072-199
0-00001CAS Статья PubMed Google ученый
Определение влияния старения, времени восстановления и лечения мемантином после инсульта на отсроченный таламический глиоз после кортикального инфаркта
В этом исследовании мы изучили влияние старения и отсроченного лечения мемантином на таламический глиоз на модели инсульта у мышей. вторичная травма.Используя эту модельную систему, мы сделали следующие новые открытия. Во-первых, мы показали, что реакция глиоза в таламусе состоит из значительного увеличения популяции клеток микроглии / макрофагов, что частично связано с инвазией периферических моноцитов. Во-вторых, мы показали, что ответ таламического глиоза ослаблен у старых мышей. В-третьих, мы продемонстрировали, что астроглиоз ипсилатерального таламуса является длительным (возможно, постоянным) и в конечном итоге развивает характеристики, похожие на глиальный шрам.В-четвертых, постинсультное лечение блокатором рецепторов NMDA, мемантином, ослабляет глиоз в таламусе. Мы подробно остановимся на этих новых выводах ниже.
Ответ глиоза в таламусе заключается в значительном увеличении популяции клеток микроглии / макрофагов, что отчасти связано с инвазией периферических моноцитов.
Хорошо известно, что повреждение ЦНС запускает внутренние программы для микроглии. как первая иммунная клетка в головном мозге. В этом процессе активированная микроглия играет решающую роль в распознавании нейровоспаления и высвобождении хемокинов и цитокинов (провоспалительных и противовоспалительных), которые распространяются из поврежденной области в защищенную, но активную область мозга 45,46 .Большой объем доказательств того, как фенотипы микроглии изменяются при ишемическом повреждении, объясняет региональное разнообразие и способы поляризации микроглии от M0 до M1 или M2 в моделях нейродегенеративных заболеваний в ответ на тяжесть и типы повреждений 47,48 . Во время фазы острого инсульта ишемический стресс вызывает апоптоз и некроз микроглии в центральной и полутеневой областях, что приводит к снижению количества микроглиальных клеток 26,27 . Впоследствии популяция микроглиальных клеток может возвращаться за счет пролиферации оставшихся MG или миграции MG из близлежащих регионов 49,50,51 .Кроме того, CCR2 + периферические моноциты могут проникать в область повреждения и затем дифференцироваться в макрофаги или микроглиеподобные клетки 34,52,53 . На дифференциацию макрофагов влияет местная среда, а также тип и время повреждения 54 . В настоящее время неизвестно, вторгаются ли периферические моноциты или вносят вклад в популяцию микроглии / макрофагов при вторичном повреждении.
Мы использовали комбинацию иммуноокрашивания, проточной цитометрии и мышей-репортеров CCR2 для изучения временного и клеточного происхождения глиоза в таламусе после инсульта.Подобно тому, что показали другие, кортикальный инфаркт индуцировал замедленный и прогрессирующий микроглиоз (клетки IBA-1 + ) в ядрах VPM / PoM ипсилатерального таламуса 30,55 . Используя проточную цитометрию, мы обнаружили, что доля и абсолютное количество CD45 в / CD11b + MG были значительно увеличены в таламусе PSD 14. Клетки CD45 int / CD11b + отражают общую популяцию MG, а не просто активированный MG (т.е.ИБА-1 + ячеек). Четырехкратное увеличение общего MG в ипсилатеральном таламусе (по сравнению с фиктивным) указывает на существенное расширение этой популяции, превышающее уровни до травмы. Для сравнения, абсолютное количество и доля CD45 int / CD11b + MG в коре головного мозга при PSD 14 были аналогичны фиктивным контролям. Причина этой разницы между корой и таламусом не была определена, но могла отражать менее обширное (или полное отсутствие) начальное истощение MG после таламического повреждения или другой временной ход истощения / репопуляции MG.Кроме того, пропорциональное значение MG в образце коры головного мозга отражает эффект разведения за счет увеличения периферических миелоидных клеток и лимфоцитов. Таким образом, чтобы более конкретно оценить регион и специфический для повреждения потенциал инвазии периферических моноцитов, мы выполнили pdMCAO на репортерных мышах CCR2. Эти мыши экспрессируют RFP в моноцитах, экспрессирующих CCR2, и клетках моноцитарного происхождения (например, в макрофагах, происходящих из моноцитов), но не в резидентных CCR2-отрицательных макрофагах. Как и ожидалось, кора головного мозга продемонстрировала присутствие RFP + моноцитов / макрофагов при PSD 14.Интересно, что ипсилатеральный таламус также продемонстрировал значительное увеличение клеток RFP + , что указывает на то, что периферические моноциты действительно вторгаются в таламус после вторичного повреждения. Насколько нам известно, это первое сообщение об инфильтрации периферических моноцитов как части механизма вторичного повреждения. При первичном инсульте циркулирующие моноциты CCR2 + , как было показано, рекрутируются в ишемические области из лептоменингов, окружающих паренхиму головного мозга, а затем вдоль проникающих артериол 34 .Однако, учитывая большее расстояние таламуса от лептоменингов, приток моноцитов из кровотока может быть более вероятным в этой области мозга. Тем не менее, независимо от того, как в конечном итоге поступают моноциты, эти данные предполагают, что периферические моноциты могут вносить вклад в увеличение популяции IBA-1 + MG / макрофагов при вторичном повреждении таламуса. Необходимы дальнейшие исследования для определения сигнальных механизмов и пути проникновения рекрутированных периферических моноцитов, динамики инфильтрации моноцитов и роли этой полученной из моноцитов популяции в механизме вторичного повреждения или репарации.
Ответ таламического глиоза ослаблен у старых мышей
Риск ишемического инсульта значительно увеличивается с возрастом, показывая удвоение частоты инсульта на каждое десятилетие после 55 лет 56 . Следовательно, чтобы увеличить трансляционную ценность этих исследований, мы выполнили подгруппу исследований на старых мышах (18–22 месяца). Этот возрастной диапазон у мышей примерно соответствует возрасту человека в 6-7-м десятилетии жизни 57,58 .
Старение связано с рядом патологических изменений MG и астроцитов, двух типов глиальных клеток, которые играют важную роль как в поддержке мозга, так и в ответе на травмы. 59,60 .Большая часть возрастного увеличения нейровоспаления было связано с изменениями в микроглии, которые проявляют как морфологические, так и молекулярные изменения, соответствующие усиленному воспалительному профилю 60 . Эти «примированные» фенотипы MG в старом мозге демонстрируют повышенную экспрессию генов презентации антигена и рецепторов антигена и демонстрируют усиленный воспалительный ответ на иммунные стимулы. 61 . Астроциты также демонстрируют возрастное нарушение опорной функции и повышенную чувствительность к травмам.Старые астроциты продуцируют меньшее количество трофических факторов, таких как VEGF и Wnt3, обнаруживают сниженное поглощение и клиренс глутамата и вносят вклад в ускоренное образование глиальных рубцов 59 . В целом, старение приводит к тому, что в мозговой среде снижается функция глиальной поддержки и усиливается реакция на воспалительные стимулы. Однако доказательства того, как старение влияет на реакцию MG и астроцитов при вторичном повреждении, в настоящее время отсутствуют.
Мы показали, что у старых мышей, несмотря на образование классического глиального рубца в коре головного мозга, после инсульта наблюдалось уменьшение астроглиоза и микроглиоза в таламусе.Учитывая повышенную воспалительную реакцию в старом мозге, этот результат противоречил нашему первоначальному прогнозу. Однако возможное объяснение пониженной реакции глиоза может включать возрастное старение клеток, поскольку некоторые сообщения показали старение и гипоактивацию MG при старении 60,62,63 . Кроме того, MG в пожилой ЦНС, как сообщается, имеет пониженный потенциал к репликации из-за укорочения теломер и демонстрирует пониженную пролиферацию после травмы. 63,64 .Комбинация пониженной активации и уменьшенной пролиферации может объяснить уменьшение популяции IBA-1 + в ипсилатеральном таламусе и уменьшение источника воспалительной стимуляции астроцитов. Насколько нам известно, наше исследование представляет собой первый отчет о том, как старение влияет на патологию вторичного таламического повреждения.
Астроглиоз в ипсилатеральном таламусе является длительным (возможно, постоянным) и, в конечном итоге, развивает характеристики, похожие на глиальный шрам впервые проявляется между PSD 3 и 7.Астроглиоз в таламусе отличался от астроглиоза в области первичного коркового повреждения тем, что глиальный рубец не образовывался вокруг повреждения в течение первых двух или даже шести недель. Однако через два года после травмы в ипсилатеральном таламусе развился плотный кластер клеток с высоким содержанием GFAP
+ . Этот кластер продемонстрировал плотное сеткообразное расположение активированных астроцитов, характерное для глиального рубца 65 . На контралатеральном таламусе заметно отсутствовал глиоз, что подтверждает причинную роль первичного инсульта в стойком глиозе ипсилатерального таламуса.В то время как в старом мозге действительно наблюдалось усиление астроглиоза в различных областях мозга (особенно в волокнистых путях), он демонстрировал двустороннее распределение.Образование глиального рубца является обычным явлением при первичном инсульте, а также при некоторых других типах тяжелых повреждений ЦНС 65,66,67,68 . Глиальный рубец состоит в основном из гипертрофических астроцитов, для которых характерно повышение уровня GFAP 65 . Рубец обычно образуется на границе между некротическими и здоровыми тканями и, по-видимому, поддерживает механизмы восстановления тканей в ЦНС. 69,70 .Однако то, как рубец препятствует или поддерживает отрастание аксонов, все еще горячо оспаривается 69 . Причина или цель образования глиальных рубцов в таламусе вызывает недоумение. На формирование рубца в этой области уходит много месяцев (а возможно, и лет); таким образом, цель кажется несовместимой с защитным барьером для поддержки ремонта. Учитывая, что рубец был обнаружен у мышей через два года после инсульта, возможно, что медленное развитие рубца могло быть связано с изменением окружающей среды в стареющем мозге.Учитывая сообщаемую роль JAK-STAT3 в развитии рубцов в поврежденной ишемией коре головного мозга и поврежденном спинном мозге, было бы интересно определить, связано ли отсроченное образование рубца также с замедленной индукцией пути STAT3 71,72,73,74 . В свете длительного времени, в течение которого развивается это вторичное повреждение, будет важно оценить возможность либо уменьшения (т.е. терапевтического), либо ухудшения (например, экологического стресса и т. Д.) Вторичного повреждения в значительно более поздние моменты времени.
В результате появления новых технологий, таких как всестороннее секвенирование одноклеточной РНК и крупномасштабный анализ транскриптомов, мы стали лучше понимать явную гетерогенность астроцитов в ЦНС. Эта неоднородность, обусловленная физиологическими и патологическими состояниями, а также старением, объясняет специализированные функции этих клеток в различных областях мозга, цепях и сетях 75,76 . Таким образом, каждый тип астроцитов может играть уникальную роль в восприятии разнообразных клеточных сигналов и реагировании на них, происходящих на разных этапах воспалительных реакций.Образование глиального рубца является примером специализированной функции астроцитов в контексте инсульта. Хорошо известно, что глиальный рубец, образующийся вокруг области инфаркта, способствует подавлению распространения воспаления на близлежащие здоровые ткани, выработке нейротрофических факторов при восстановлении / ремоделировании и формировании каркаса для облегчения роста аксонов. 77,78 . Однако, как отмечалось выше, повреждение ипсилатерального таламуса показало широкую активацию астроцитов, но не свидетельствовало о формировании глиального рубца — даже через шесть недель после инсульта.Причина разной картины глиоза может отражать разные типы повреждений (ишемические или эксайтотоксические), а также разные подтипы глиальных клеток в соответствующих регионах. Недавнее исследование с использованием scRNAseq выявило семь различных типов астроцитов с регионально-специфическим распределением в головном мозге 75 . Авторы обнаружили, что два основных подтипа популяций астроцитов (астроциты конечного мозга) распределены в коре головного мозга, полосатом теле, миндалевидном теле и гиппокампе. Однако они показали, что эти подтипы отсутствуют в таламусе и среднем мозге, что подчеркивает гетерогенность астроцитов в коре и таламусе.
Постинсультное лечение блокатором рецепторов NMDA, мемантином, ослабляет глиоз в таламусе
Таламус играет важную роль в головном мозге и служит важным промежуточным звеном между различными областями мозга (например, корой и стволом мозга). Однако в результате высокой связности этого мозгового центра таламус также уязвим для вторичных повреждений из нескольких областей мозга. Отдаленное вторичное таламическое повреждение наблюдалось на моделях инсульта у грызунов, а также при патологии инсульта у человека.Кроме того, таламическая дисфункция связана с ухудшением исхода и восстановлением после инсульта. 7,9,79 . Важно отметить, что развитие и прогрессирование этого вторичного повреждения, по-видимому, можно изменить в экспериментальных моделях. Ранее мы показали, что повреждение таламуса (потеря нейронов и глиоз) может быть уменьшено с помощью гипотермии после инсульта 23 , в то время как другие показали аналогичную пользу с низким содержанием кислорода после кондиционирования 41 . В другом направлении, другие показали, что потеря нейронов может быть увеличена за 4 недели посттравматического хронического стресса 24 .С клинической точки зрения, медленное развитие и изменяемый характер вторичного повреждения обнадеживают, поскольку это означает, что этот тип травмы поддается отсроченному терапевтическому вмешательству.
Мемантин является антагонистом рецепторов NMDA, который, как было ранее продемонстрировано, снижает первичный инфаркт в экспериментальных моделях как постоянного, так и преходящего инсульта. 42,43,44 . Этот препарат в настоящее время также используется в клинических условиях для лечения симптомов болезни Альцгеймера. 80 .Хотя механизм вторичного повреждения полностью не выяснен, похоже, что опосредованная глутаматом эксайтотоксичность играет ключевую причинную роль 81 . Может ли постинсультное лечение мемантином уменьшить вторичное повреждение таламуса и глиоз, ранее не изучалось.
Наши исследования показали, что лечение мемантином через 4 и 24 часа после инсульта приводит к уменьшению глиоза в ипсилатеральном таламусе. И астроглиоз, и микроглиоз были значительно уменьшены у мышей, получавших мемантин.Первичный кортикальный инфаркт на расстоянии + 1 мм от брегмы (содержащий область коры с большей частью таламокортикальных выступов) выглядел несколько уменьшенным, но не достиг статистической значимости. Отдельная когорта, исследованная при PSD 3, показала аналогичную тенденцию при лечении мемантином. Высокая вариабельность ответа мемантина может указывать на то, что он эффективен для уменьшения первичного повреждения, но дозировка или время могут быть неоптимальными. Учитывая потенциал того, что мемантин уменьшал первичное повреждение в наших исследованиях, мы не можем окончательно сделать вывод, было ли значительное уменьшение таламического глиоза результатом уменьшения первичного коркового повреждения или специфического нарушения прогрессирования вторичного повреждения.Для разделения этих двух возможностей потребуются будущие исследования. Однако, независимо от вышеупомянутого различия, обнадеживает тот факт, что мемантин, введенный через четыре часа после инсульта, был эффективен в уменьшении таламического глиоза.
Ограничения
Наши исследования проводились исключительно на самцах мышей. Однако было показано, что существуют половые различия в ответах микроглии и астроцитов на ишемическое повреждение, как в воспалительной реакции, так и в выживаемости клеток после ишемического стресса 82,83,84 .Потребуются дальнейшие исследования, чтобы определить, как на вторичное таламическое повреждение влияют половые гормоны или генетический пол.
Резюме
Вторичное повреждение может быть вызвано в дистальных отделах мозга посредством соединения нейрональных путей с первичными участками ишемического повреждения. Таким образом, релейные центры, такие как таламус, могут быть особенно уязвимы для этого типа травм. Мы обнаружили, что кортикальный инсульт вызывает прогрессирующий и продолжительный глиоз, связанный с вторичным повреждением ипсилатерального таламуса.Это таламическое повреждение характеризуется начальным глиозом, за которым следует потеря нейронов в ядрах VPN и PoM. В течение нескольких месяцев глиоз в таламусе в конечном итоге приобретает характеристики глиального рубца. У старых мышей (постаревших на момент инсульта) глиоз в таламусе ослаблен. Мы также впервые показали, что периферические моноциты проникают в поврежденный таламус и, следовательно, могут способствовать увеличению популяции активированных микроглии / макрофагов при вторичном повреждении.Наконец, мы показали, что лечение после инсульта антагонистом рецептора NMDA приводит к уменьшению глиоза в таламусе. Эти результаты обеспечивают важную основу для будущих исследований молекулярных механизмов повреждения таламуса и стратегий, направленных на уменьшение вторичного повреждения головного мозга после инсульта.
Гиперинтенсивность белого вещества на МРТ
Размещено: 26 мая 2017 г.Последнее обновление: 2 октября 2020 г.
Время на чтение: 5 минут.Гиперинтенсивность белого вещества (WMH) — это поражения в головном мозге, которые проявляются как области повышенной яркости при визуализации с помощью Т2-взвешенной магнитно-резонансной томографии (МРТ).
WMH также называют Leukoaraiosis и часто обнаруживаются при КТ или МРТ у пожилых пациентов. Преобладает мнение, что эта интенсивность является маркером сосудистого заболевания мелких сосудов и в клинической практике свидетельствует о когнитивной и эмоциональной дисфункции, особенно у стареющего населения.
Первое открытие WMH было сделано в конце 1980-х годов Хачински и его коллегами. Они описали WMH как неоднородное низкое затухание в перивентрикулярном и глубоком белом веществе.
НА ЧТО ВЗГЛЯД НА МРТ?
Поскольку МРТ обладают большей чувствительностью к незначительным изменениям содержания воды в мозге, они лучше визуализируют ГМГ. Эти области являются гиперинтенсивными на последовательностях T2-взвешенных (T2) и инверсионных восстановительных (FLAIR) МРТ, и теперь по общему мнению, они называются «гиперинтенсивностью белого вещества» (WMH) или «подкорковой гиперинтенсивностью», где также вовлечено глубокое серое вещество.
Перивентрикулярная гиперинтенсивность белого вещества на МРТ T2-снимке
ЧТО ТАКОЕ НЕЙРОПАТОЛОГИЯ ВМГ?
WMH связаны с факторами риска сосудов, такими как диабет, курение и гипертония, и, следовательно, WMH считаются частью болезни мелких сосудов.
Некоторые потенциальные невропатологические ассоциации:
- Демиелинизация и потеря аксонов
- Уменьшение плотности глии и атрофия
- Истончение коркового вещества и церебральная атрофия
- Активация эндотелия и иммунитета
- Ишемическое повреждение
- Гипоксия и гипоперфузия
WMH, как известно, исчезают, поскольку они не всегда означают постоянную потерю глии или аксонов; вместо этого тонкие сдвиги в содержании воды.
КАКОВО КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ВМГ?
До относительно недавнего времени WMH обычно отклонялись как неизбежные последствия «нормального» пожилого возраста. Это явно не так. Хотя WMH становится все более распространенным явлением с возрастом, их распространенность сильно варьируется.
Имеются убедительные доказательства того, что WMH являются клинически важными маркерами повышенного риска инсульта, деменции, смерти, депрессии, нарушения походки и подвижности, как в поперечных, так и в продольных исследованиях.Они связаны с повреждением головного мозга, таким как глобальная атрофия и другими особенностями повреждения мелких сосудов головного мозга, с очаговым прогрессирующим видимым повреждением головного мозга, являются маркерами основного невидимого диффузного повреждения мозга и предсказывают рост инфаркта и худший исход после инсульта большой артерии. Их можно рассматривать как нейровизуализационный маркер слабости мозга . (Wardlaw et al., 2015)
Обзор Debette и Markus был направлен на обзор доказательств связи между WMH и риском когнитивных нарушений, деменции, смерти и инсульта.
WMH И ИНСУЛЬТ
Гиперинтенсивность белого вещества является предиктором сосудистых заболеваний, для которых возраст и высокое кровяное давление являются основными факторами риска.
Обзор показал, что WMH в значительной степени связаны с повышенным риском инсульта. Даже с поправкой на факторы риска сосудистых заболеваний, такие как возраст и высокое кровяное давление, эта связь все еще была значительной.
WMH И КОГНИТИВНОЕ НАРУШЕНИЕ
Гиперинтенсивность белого вещества также связана как с нарушением подвижности, так и с пониженным когнитивным функционированием.
В частности, WMH могут влиять на память, бдительность и исполнительное функционирование, в зависимости от его локализации и серьезности.
Перивентрикулярные WMH могут влиять на когнитивные функции, в то время как подкорковые WMH нарушают определенные двигательные функции в зависимости от местоположения.
WMH’S AND DEMENTIA
Хотя WMH связаны с более быстрым снижением глобальной когнитивной деятельности, а также исполнительной функции и скорости обработки информации, мнение относительно их связи с деменцией отсутствует.
WMH имеют высокую связь с сосудистой деменцией , но их роль в деменции Альцгеймера неясна.
По словам Дебетт и Маркуса —
Наличие гиперинтенсивности белого вещества может увеличить риск того, что у человека разовьется легкое когнитивное нарушение или снизятся результаты когнитивных тестов, но этого может быть недостаточно для облегчения перехода от легкого когнитивного нарушения к слабоумию, последнее в значительной степени обусловлено нейродегенеративными факторами. поражения.Исключением могут быть редкие случаи чистой сосудистой деменции, когда диффузная гиперинтенсивность белого вещества может иметь значение также на более поздних стадиях когнитивного снижения и конверсии.
ЗДОРОВЬЕ И СМЕРТНОСТЬ
По-видимому, существует значительная связь между ЗМЗ и смертностью как в общей популяции, так и в группах высокого риска, например, с инсультом и депрессией в анамнезе.
Исследование Rotterdam and the Framingham Offspring Study показало связь между WMH и смертностью независимо от событий сосудистого риска и факторов риска.Связь особенно сильна со смертностью от сердечно-сосудистых заболеваний.
Следовательно,WMH могут быть маркером диффузного поражения сосудов, включая периферические и коронарные артерии, повышая риск сердечно-сосудистой смертности.
ТЯЖЕЛАЯ И РЕЗИСТЕНТНАЯ ДЕПРЕССИЯ WMH
Гиперинтенсивность глубокого белого вещества (DWMH) связана с более тяжелой (меланхолической) И устойчивой формой депрессии [Khalaf A et al., 2015], и у пациента более высокая вероятность появления с когнитивной дисфункцией, замедлением психомоторного развития и апатией.[Подробнее о меланхолической депрессии и ассоциации гомосексуальных мужчин и женщин со структурной меланхолией)
Они также тесно связаны с депрессией с поздним началом, а их прогрессирование связано с худшими исходами гериатрической депрессии. [Taylor W et al., 2003]
Накопление WMH происходит в течение значительно более коротких интервалов (например, 12 недель), чем было показано ранее. Кроме того, эти изменения по-разному распределяются среди тех пациентов, которые в конечном итоге классифицируются как пациенты, не получающие денежные переводы, что указывает на то, что взаимосвязь между накоплением WMH и поздней депрессией (LLD) имеет важное значение даже во время коротких курсов лечения антидепрессантами. [Khalaf A et al., 2015]
Этот «Сосудистая депрессия» рассматривается как подтип депрессии позднего возраста, характеризующийся отчетливыми клиническими проявлениями и связью с цереброваскулярным повреждением.
Женщина, 49 лет, с устойчивой депрессией и смешанными чертами лица. Тестирование лобной доли показало исполнительную дисфункцию. Необходимые стратегии аугментации для достижения ремиссии
Женщина 54 лет с устойчивой депрессией, когнитивными нарушениями и соматической симптоматикой
Рентгенологический отчет для вышеуказанных состояний пациента —
Лейкоареоз от умеренной до тяжелой степени с разбросанными участками гиперинтенсивности Т2, включая подкорковое белое вещество, правую и левую лучевую коронку лобно-теменных и, в меньшей степени, височных долей.Область старого коркового повреждения, вовлекающая левую вентральную лобную часть и очень небольшая область, вовлекающая вентральную левую височную долю с некоторым окружающим глиозом, что очень наводит на мысль о предыдущей травме.
БОЛЬШОЕ ИЗОБРАЖЕНИЕ
Присутствие WMH значительно увеличивает риск инсульта, деменции и смерти. WMH’S в значительной степени связаны с устойчивой депрессией.
Обнаружение WMH с помощью диагностической визуализации головного мозга дает врачам возможность скрининга других сосудистых факторов риска и проактивного их лечения.
У них есть важные клинические ассоциации и ассоциации с факторами риска, и их нельзя просто игнорировать как неизбежные «тихие» последствия старения мозга.
Хотите узнать больше? Мы рассмотрели нейропсихиатрические аспекты рассеянного склероза, аутоиммунного заболевания, характеризующегося значительным поражением белого вещества.
ВИКТОРИНА
Поражения головного мозга: симптомы, причины, лечение
Обзор
Что такое поражения головного мозга?
Поражения головного мозга — это повреждение любой части мозга.Повреждения могут быть вызваны болезнью, травмой или врожденным дефектом. Иногда поражения появляются в определенной области мозга. В других случаях поражения присутствуют в значительной части ткани головного мозга. Поначалу поражения головного мозга могут не вызывать никаких симптомов. По мере того, как со временем поражения ухудшаются, симптомы становятся более заметными.
Как работает мозг?
Мозг контролирует мысли, память, речь, движения конечностей и функции органов. Мозг состоит из множества частей, и каждая из них играет определенную роль в человеческом теле.
Мозг состоит из четырех долей:
Лобная доля — самая большая из четырех долей, отвечает за двигательные навыки организма, такие как произвольные движения, речь, интеллектуальные и поведенческие функции. Эта область контролирует память, интеллект, концентрацию, вспыльчивость и личность.
Височные доли — расположены на каждой стороне мозга на уровне ушей, важны для слуха, памяти и речи.
Теменная доля — в центре мозга, где принимается и интерпретируется сенсорная информация, такая как тепло, давление и боль.
Затылочная доля — находится в задней части мозга, в первую очередь отвечает за зрение.
Симптомы и причины
Что вызывает поражение головного мозга?
Поражения головного мозга могут быть вызваны множеством различных триггеров. Следующие факторы повышают риск поражения головного мозга человека:
- Старение
- Семейный анамнез поражений головного мозга. Риск увеличивается, если кто-то из членов семьи болел этим заболеванием.
- Сосудистые заболевания , такие как инсульт, высокое кровяное давление и аневризмы церебральных артерий
- Травма головного мозга , которая может вызвать внутреннее кровотечение. Если не исправить, это может привести к смерти.
- Инфекции , вредные микробы или бактерии в головном мозге. Они могут вызывать такие заболевания, как менингит и энцефалит (оба типа отека (воспаления) мозга).
- Опухоли , которые либо начинаются в головном мозге (первичные опухоли), либо перемещаются туда (метастатические) через кровеносные или лимфатические сосуды
- Аутоиммунные заболевания , такие как волчанка и рассеянный склероз.Это происходит, когда антитела организма начинают атаковать собственные ткани организма, такие как ткани мозга.
- Бляшки или избыточное накопление аномального белка в тканях головного мозга или в кровеносных сосудах, замедляющих приток крови к мозгу, как это наблюдается в закупоренных артериях. Болезнь Альцгеймера, заболевание, которое влияет на память, мышление и поведение человека, развивается из-за бляшек в тканях мозга. Рассеянный склероз также может вызывать образование бляшек в головном мозге, вторичное по отношению к поврежденной ткани.
- Воздействие радиации или определенных химических веществ , которые увеличивают вероятность опухолей и поражений головного мозга
- Токсины , такие как чрезмерное количество алкоголя или сигаретного дыма в организме. К другим токсичным веществам относятся повышенные уровни аммиака и мочевины в организме из-за проблем с почками (могут влиять на функцию мозга, но могут не проявлять отдельных поражений мозга).
- Плохое питание , особенно употребление продуктов с избытком жиров и холестерина
Какие заболевания вызывают поражение головного мозга?
- Инсульт , повреждение сосудов или нарушение кровоснабжения головного мозга , возможно, является основной причиной поражений головного мозга.
- Рассеянный склероз или MS , — это заболевание, при котором поражения головного мозга локализуются в нескольких участках мозга. У людей, страдающих рассеянным склерозом, есть серьезные проблемы с двигательными и сенсорными функциями.
- Волчанка , аутоиммунное заболевание, поражающее почти все системы организма, от кожи до сердца, печени, мышц и мозга. Поражения головного мозга обычно являются симптомом этого заболевания.
- Опухоли также являются причиной поражений головного мозга и аномального роста клеток головного мозга.
Каковы симптомы поражения головного мозга?
Симптомы поражения головного мозга различаются в зависимости от типа поражения, его степени и места обнаружения. Все люди разные, и симптомы могут отличаться в отдельных случаях. Однако многие поражения могут быть в областях мозга, которые не вызывают симптомов.
Типичные симптомы могут включать:
- Головные боли обычно являются первым симптомом поражения головного мозга. Боль появляется внезапно и со временем усиливается.Лекарства, отпускаемые без рецепта, обычно не облегчают боль.
- Тошнота и возможная рвота
- Нарушение движений, если поражение затрагивает часть мозга, отвечающую за моторику
- Недостаток концентрации, неспособность быстро принимать решения и возбуждение
- Задержка речи, нечеткое зрение и нарушение слуха
- Непроизвольные движения частей тела, которые в тяжелых случаях могут прогрессировать до судорог
Следующие симптомы характерны для поражений лобной доли:
- Отсутствие обоняния, обычно ограниченное одной ноздрей
- Нарушение речи
- Потеря двигательной активности с одной или обеих сторон тела
- Поведенческие изменения
Следующие симптомы характерны для поражения височной доли:
- Изменение поведения и эмоций
- Нарушение обоняния, вкуса и слуха
- Языковые и речевые расстройства
- Проблемы с полем зрения
- Забывчивость и неспособность сосредоточиться
Следующие симптомы характерны для поражения теменной доли:
- Потеря ощущения прикосновения
- Астереогнозис, или неспособность идентифицировать вещи, помещенные в руку
- Ослабление языкового развития
Следующие симптомы характерны для поражений затылочной доли:
Диагностика и тесты
Как диагностируются поражения головного мозга?
Если симптомы указывают на то, что человек может страдать от поражений головного мозга, важно записаться на прием к врачу.Врач поможет поставить диагноз и предложить варианты лечения для каждого пациента в зависимости от степени заболевания.
Врач задаст вопросы о симптомах и истории болезни пациента, а затем проведет физический осмотр.
Чтобы определить место поражения, врач может дотронуться до кожи пациента горячими, холодными или вибрирующими предметами, а также ущипнуть пациента, чтобы проверить чувство боли. Врач также может порекомендовать дополнительные тесты для дальнейшей оценки состояния.
Какие тесты диагностируют поражения головного мозга?
После медицинского осмотра врач может также порекомендовать пациенту назначить диагностическое обследование, такое как компьютерная томография, компьютерная томография или компьютерная томография, магнитно-резонансная томография или МРТ. Эти тесты помогут врачу точно определить местоположение поражения, а также помогут оценить степень повреждения головного мозга, вызванного поражением.
Компьютерная томография (компьютерная томография или компьютерная томография) — это диагностическое изображение, используемое для оценки костей, крови и тканей мозга.Иногда в вену пациента вводят лекарство, чтобы выделить структуры мозга. Компьютерная томография использует радиацию.
Магнитно-резонансная томография (МРТ) — это диагностический тест, который позволяет получать трехмерные или трехмерные изображения внутренней части тела с использованием магнитных полей и компьютерных технологий. Он показывает детали мозговой ткани, а также ствол мозга и мозжечок (задний мозг) лучше, чем компьютерная томография. МРТ головного мозга может помочь определить, есть ли признаки предшествующих мини-инсультов.Также можно вводить лекарство (контраст), чтобы помочь структурам с высокой освещенностью.
Ведение и лечение
Как лечат поражения головного мозга?
Лечение варьируется в каждом отдельном случае в зависимости от типа поражения, его местоположения и причины. Важно, чтобы врач провел тщательное обследование, чтобы разработать соответствующий план лечения.
Варианты лечения зависят от типа поражения и тяжести симптомов.


 Но чрезмерное употребление выпивки наносит критический урон нейронным связям.
Но чрезмерное употребление выпивки наносит критический урон нейронным связям. Болевые ощущения могут быть различной степени выраженности, продолжительности: от умеренной постоянной, до нестерпимой, мигренозной.
Болевые ощущения могут быть различной степени выраженности, продолжительности: от умеренной постоянной, до нестерпимой, мигренозной.
.jpg) Они служат следствием хаотичного разрастания глиального волокна.
Они служат следствием хаотичного разрастания глиального волокна.
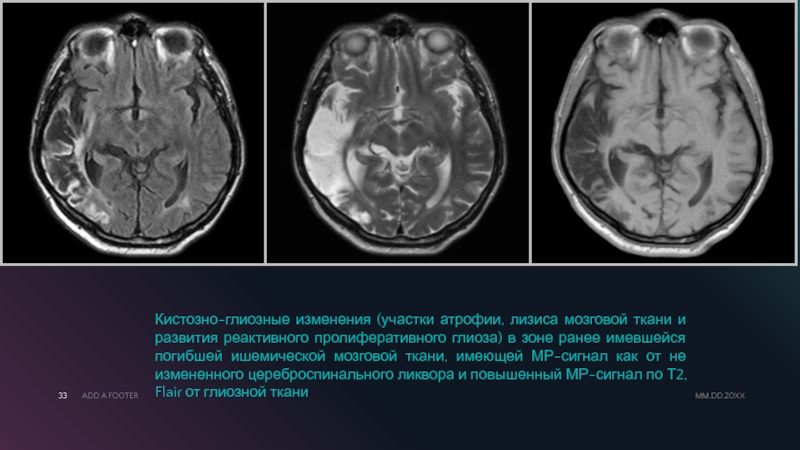 Кроме того, такие головные боли могут повлечь за собой глиоз сосудистого генеза, который будет провоцировать постоянные скачки давления.
Кроме того, такие головные боли могут повлечь за собой глиоз сосудистого генеза, который будет провоцировать постоянные скачки давления.
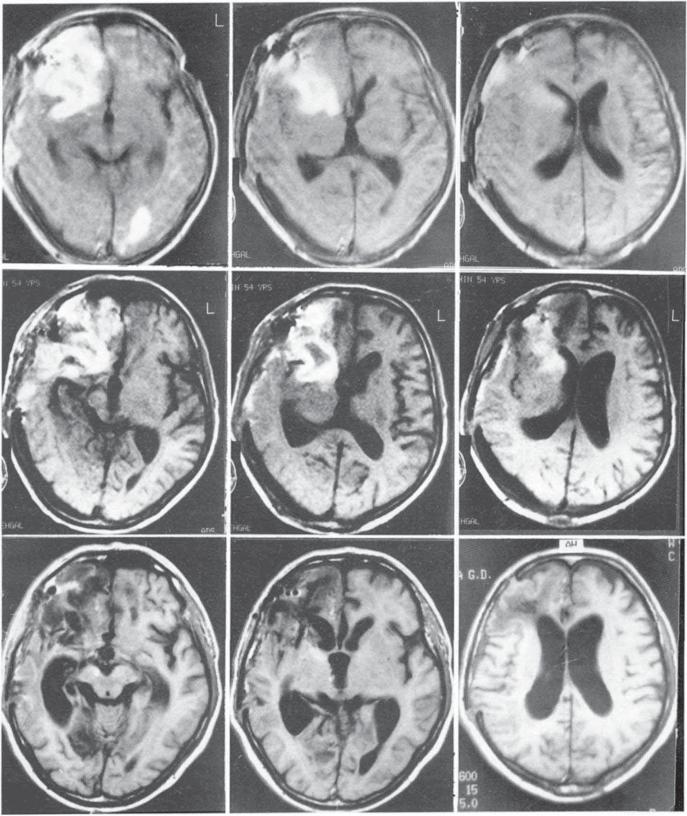

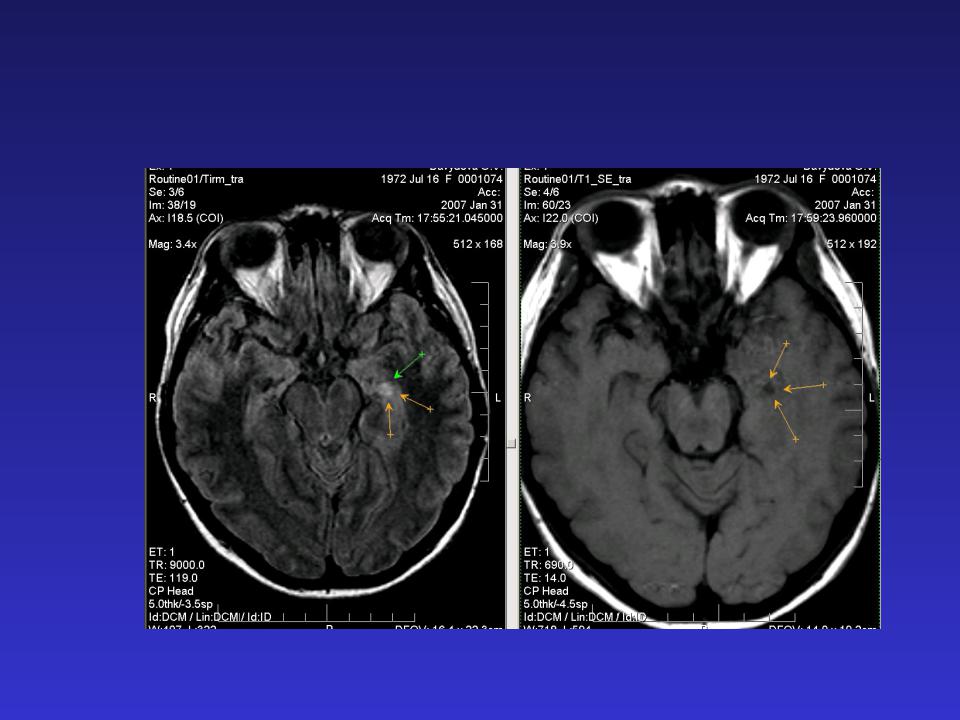 Во время приготовления пищи лучше всего использовать технику тушения или приготовления продуктов в пароварке.
Во время приготовления пищи лучше всего использовать технику тушения или приготовления продуктов в пароварке.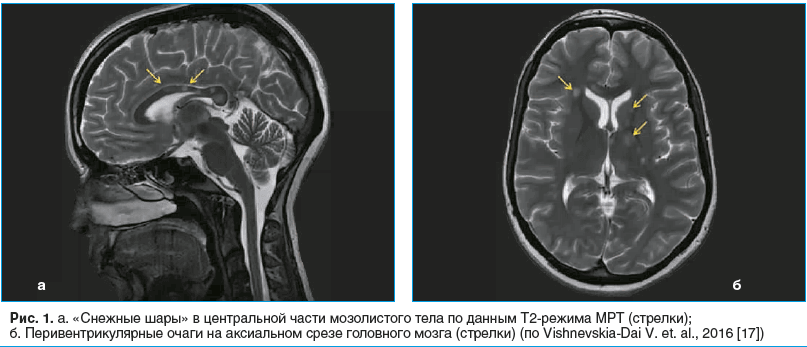
2008/23/01-03.jpg)
