Повышен общий иммуноглобулин Е в крови. Что делать?
Иммуноглобулин E (IgE) – это антитело, которое вырабатывается иммунной системой организма в ответ на предполагаемую угрозу. Это один из пяти классов иммуноглобулинов (A, G, M, D и E) и обычно присутствует в крови в очень небольших количествах. Он вырабатываются специфическими иммунными клетками, называемыми плазматическими клетками.
Физиологическая роль IgE недостаточно хорошо охарактеризована, хотя считается, что он участвует в защите от паразитов, особенно гельминтов.
При каких заболеваниях повышается общий иммуноглобулин Е?
Повышенные концентрации IgE обычно рассматриваются в контексте аллергического заболевания. Однако увеличение количества циркулирующего IgE также можно обнаружить при различных других заболеваниях, включая:
- первичные иммунодефициты,
- инфекции,
- воспалительные заболевания,
- злокачественные новообразования.
IgE может быть повышен при паразитарных инфекциях, поэтому общий тест на IgE иногда используется в качестве скринингового теста, если подозревается паразитарная инфекция.
Для пациентов с установленным диагнозом аллергического заболевания измерение общего IgE необходимо для выявления кандидатов на терапию омализумабом (анти-IgE) и для определения правильной дозировки.
При каких симптомах необходимо измерять общий иммуноглобулин в крови?
Общий тест на IgE может быть назначен, когда у человека наблюдаются периодические или постоянные симптомы, которые могут быть вызваны аллергической реакцией, особенно когда потенциальный аллерген неизвестен. Симптомы могут включать симптомы, предполагающие поражение кожи, органов дыхания и / или пищеварения, такие как:
- Периодический или постоянный зуд
- Крапивница
- Зуд глаз
- Экзема
- Тошнота, рвота, постоянный понос
- Чихание, заложенность носа и насморк
- Симптомы астмы: одышка, хрипы, кашель, стеснение в груди
Общий иммуноглобулин Е и аллергия
Иммуноглобулин Е связан с аллергическими реакциями, включая астму. При аллергии человек реагирует на одно или несколько веществ в окружающей среде, называемых аллергенами, которые обычно не вызывают реакции у других людей. Аллергия может развиваться на пыльцу растений, арахис, яйца, клубника, пчелиный яд и сотни других потенциальных веществ.
При аллергии человек реагирует на одно или несколько веществ в окружающей среде, называемых аллергенами, которые обычно не вызывают реакции у других людей. Аллергия может развиваться на пыльцу растений, арахис, яйца, клубника, пчелиный яд и сотни других потенциальных веществ.
Каждый раз, когда человек с аллергией подвергается воздействию определенного аллергена (-ов) после первоначального воздействия, IgE быстро продуцируется, увеличиваясь до уровней, которые вызывают аллергическую реакцию. Степень тяжести реакции и симптомов, связанных с каждым эпизодом, может варьироваться от локального покраснения и зуда кожи, респираторного дистресса, рвоты и диареи, а в некоторых случаях до угрожающей жизни анафилаксии.
Измерения общего IgE имеют ограниченную полезность для диагностической оценки пациентов с подозрением на аллергическое заболевание, за исключением аллергического бронхолегочного аспергиллеза (AБЛA). AБЛА является реакцией гиперчувствительности к грибам Aspergillus, которая чаще всего встречается у пациентов с астмой или муковисцидозом.
Повышенный уровень общего IgE указывает на наличие аллергического процесса, но не указывает, на что у человека аллергия. В целом, чем в большей степени у человека проявляется аллергия, тем выше может быть общий уровень IgE.
Нормальная концентрация общего IgE не исключает возможности аллергического заболевания. У пациентов с высоким индексом подозрений на аллергическое заболевание может потребоваться тестирование на аллерген-специфические IgE.
Синдром гипериммуноглобилинемии Е
Нечасто может быть назначен тест на IgE, чтобы помочь диагностировать очень редкое наследственное заболевание, называемое синдромом гипериммуноглобулина Е (синдром Джоба).
Что можно сделать, чтобы снизить уровень IgE?
Ограничение контакта с аллергенами может помочь снизить уровень общего иммуноглобулина Е, а также лечение неаллергических состояний, которые могут вызвать его повышение, например, инфекции или глистная инвазия.
Кроме того, при высоких уровнях общего иммуноглобулина Е назначаются биологические препараты, такие как Омализумаб. Омализумаб является гуманизированным моноклональным антителом, полученным из рекомбинантной ДНК, которое селективно связывается с человеческим иммуноглобулином Е (IgЕ). Омализумаб связывается с IgE и предупреждает его связывание с FCεRI-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
Омализумаб связывается с IgE и предупреждает его связывание с FCεRI-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
Общий и специфический IgE. Болезни и состояния, сопровождающиеся изменением содержания общего IgE Показания к назначению, правила подготовки к сдаче исследования, расшифровка результатов анализа и показатели нормы.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
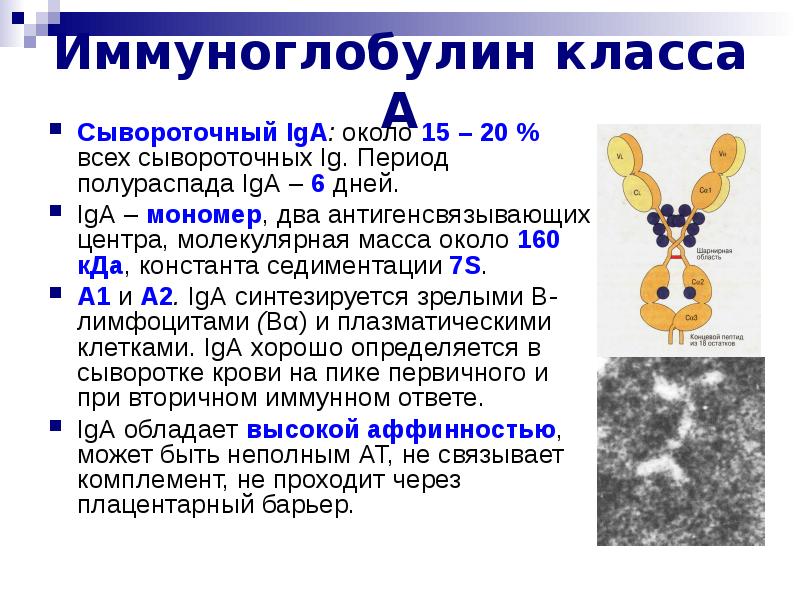
Иммуноглобулин Е (IgE) — класс иммуноглобулинов, обнаруживаемый в норме в незначительных количествах в сыворотке крови и секретах. Впервые IgE был изолирован в 1960-х годах из сывороток больных атопией и множественной миеломой.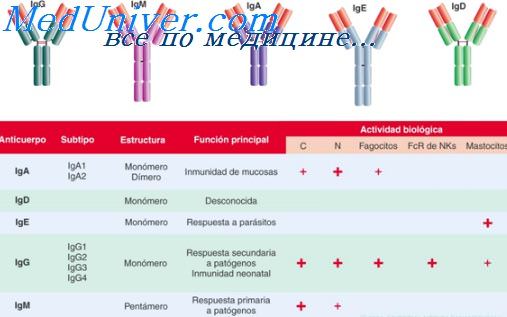
В норме IgE составляет менее 0,001% от всех иммуноглобулинов сыворотки крови (см. табл.1).
Таблица 1: Содержание IgE в сыворотке крови здоровых людей
| Возрастные группы | IgE (кЕ/л) |
|---|---|
| До 1 года | 0 — 15 |
| 1 год-6 лет | 0 — 60 |
| 6 -10 лет | 0 — 90 |
| 10 -16 лет | 0 — 200 |
| Взрослые | 0 — 100 |
Структура IgE подобна структуре других иммуноглобулинов и состоит из двух тяжёлых и двух лёгких полипептидных цепей.
Дегрануляция тучных клеток и базофилов происходит, когда две связанные с мембраной клеток молекулы IgE соединяются с антигеном, что, в свою очередь, «включает» последовательные события, ведущие к выбросу медиаторов воспаления.
 В табл. 2 перечислены основные болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови.
В табл. 2 перечислены основные болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови.Таблица 2: Болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови
| Болезни и состояния | Возможные причины |
| I. Повышенное содержание IgE | |
|---|---|
|
Аллергические болезни, обусловленные IgE антителами: а) Атопические болезни · Аллергический ринит · Атопическая бронхиальная астма · Атопический дерматит · Аллергическая гастроэнтеропатия б) Анафилактические болезни · Системная анафилаксия · Крапивница — ангионевротический отек |
Множественные аллергены: · пыльцевые · пылевые · эпидермальные · пищевые · лекарственные препараты · химические вещества · металлы · чужеродный белок |
| Аллергический бронхопульмональный аспергиллез | Неизвестны |
| Гельминтозы | IgE антитела, связанные с защитным иммунитетом |
| Гипер-IgE синдром (синдром Джоба) | Дефект Т-супрессоров |
| Селективный IgA дефицит | Дефект Т-супрессоров |
| Синдром Вискотт-Олдриджа | Неизвестны |
| Тимусная аплазия (синдром Ди-Джорджи) | Неизвестны |
| IgE — миелома | Неоплазия IgE-продуцирующих плазматических клеток |
| Реакция «трансплантат против хозяина» | Дефект Т-супрессоров |
II. Сниженное содержание общего IgE Сниженное содержание общего IgE
|
|
| Атаксия — телеангиэктазия | Дефекты Т-клеток |
Ниже приведены в качестве примеров диапазоны содержания общего IgE сыворотки крови (у взрослых) при некоторых патологических состояниях (табл. 3). Однако, несмотря на первоначально кажущуюся простоту использования определения общего и специфического IgE для диагностики, существуют некоторые сложности в интерпретации результатов. Их перечень приведён ниже.
Таблица 3: Значения общего IgE при некоторых патологических состояниях
| Патологические состояния | Содержание IgE (кЕ/л) |
|---|---|
| Аллергический ринит | 120 — 1000 кЕ/л |
| Атопическая бронхиальная астма | 120 — 1200 кЕ/л |
| Атопический дерматит | 80 — 14000 кЕ/л |
|
Аллергический бронхолегочный аспергиллез: — ремиссия — обострение |
80 — 1000 кЕ/л 1000 — 8000 кЕ/л |
| Гипер — IgE синдром | 1000 — 14000 кЕ/л |
| IgE — миелома | 15000 кЕ/л и выше |
Особенности интерпретации и диагностические ограничения общего IgE
- Примерно 30% больных атопическими заболеваниями имеют уровень общего IgE в пределах значений нормы.

- Некоторые больные бронхиальной астмой могут иметь повышенную чувствительность только к одному аллергену (антигену), в результате чего общий IgE может быть в пределах нормы, в то время как кожная проба и специфический IgE будут положительными.
- Концентрация общего IgE в сыворотке крови также повышается при неатопических состояниях (особенно при глистной инвазии, некоторых формах иммунодефицитов и бронхопульмональном аспергиллезе) с последующей нормализацией после соответствующего лечения.
- Хроническая рецидивирующая крапивница и ангионевротический отёк не являются обязательными показаниями для определения общего IgE, так как обычно имеют неиммунную природу.
- Границы нормы, определённые для европейцев, не могут быть применены для представителей зон, эндемичных по гельминтозам.
Особенности интерпретации и диагностические ограничения специфического IgE
- Доступность определения специфического IgE не должна преувеличивать его диагностическую роль в обследовании больных с аллергией.

- Обнаружение аллергенспецифического IgE (к какому-либо аллергену или антигену) не доказывает, что именно этот аллерген ответственен за клиническую симптоматику; окончательное заключение и интерпретация лабораторных данных должны быть сделаны только после сопоставления с клинической картиной и данными развёрнутого аллергологического анамнеза.
- Отсутствие специфического IgE в сыворотке периферической крови не исключает возможности участия IgE-зависимого механизма, так как местный синтез IgE и сенсибилизация тучных клеток может происходить и в отсутствие специфического IgE в кровотоке (например, аллергический ринит).
- Антитела других классов, специфичные для данного аллергена, особенно класса IgG (IgG4), могут быть причиной ложноотрицательных результатов.
- Исключительно высокие концентрации общего IgE, например, у отдельных больных атопическим дерматитом, могут за счёт неспецифического связывания с аллергеном давать ложноположительные результаты.

- Идентичные результаты для разных аллергенов не означают их одинакового клинического значения, так как способность к связыванию с IgE у разных аллергенов может быть различной.
Таблица 4: Показания и противопоказания к определению специфического IgE
| Показания | |
|---|---|
| 1 | Дифференциальная диагностика между IgE-зависимым и не-IgE-зависимым механизмами аллергических реакций |
| 2 |
Больные, у которых невозможно выявить аллерген анамнестически, при помощи дневника и т. д. д.
|
| 3 | Больные с недостаточным эффектом специфической гипосенсибилизации, назначенной по результатам кожных проб |
| 4 | Дермографизм и распространённый дерматит |
| 5 | Больные детского и пожилого возраста с гипореактивностью кожи |
| 6 | Гиперреактивность кожи |
| 7 | Больные, которым невозможно отменить симптоматическую терапию препаратами, влияющими на результаты кожных проб |
| 8 | Отрицательное отношение больного к кожным пробам |
| 9 | В анамнезе системные аллергические реакции на кожные пробы |
| 10 | Несоответствие результатов кожных проб данным анамнеза и клинической картине |
| 11 | IgE-зависимая пищевая аллергия |
| 12 | Необходимость количественной оценки чувствительности и специфичности аллергена |
| 13 | Общий IgE сыворотки крови более 100 кЕ/л |
| Обследование нецелесообразно: | |
| 1 | При атопических заболеваниях в случаях удовлетворительных результатов специфической терапии по данным кожных проб |
| 2 | У больных с не-IgE-зависимым механизмом аллергических реакции |
Ссылки по теме: Иммуноглобулин Е, IgE общий (аллергодиагностика), панели аллергенов.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Иммуноглобулин E (IgE) общий – что это за анализ и для чего он делается?
Иммуноглобулины, или специфические белковые антитела – это «стражи» нашей иммунной системы. Когда в организм проникает аллерген или другой чужеродный биоматериал, они реагируют первыми. Все иммуноглобулины делятся на 5 классов. Конкретно IgЕ отвечает за самую часто встречающуюся аллергическую реакцию – ту, которая проявляется немедленно. Кроме этого, он участвует в создании иммунитета против таких видов гельминтов, как: токсоплазмы, нематоды, аскариды, трихинеллы, описторхи.
Соответственно, повышение или понижение иммуноглобулина Е может говорить либо об аллергической реакции в организме, либо об инфицировании гельминтами. Назначают исследование тогда, когда есть необходимость в дифференцированной диагностике этих заболеваний. Направление может выписать терапевт (ребенку – педиатр), а также аллерголог, гастроэнтеролог, пульмонолог, гематолог или ревматолог. Чаще всего анализ на IgЕ назначают, если у пациента есть подозрение на:
Назначают исследование тогда, когда есть необходимость в дифференцированной диагностике этих заболеваний. Направление может выписать терапевт (ребенку – педиатр), а также аллерголог, гастроэнтеролог, пульмонолог, гематолог или ревматолог. Чаще всего анализ на IgЕ назначают, если у пациента есть подозрение на:
- аллергическую бронхиальную астму;
- аллергический ринит;
- атопический дерматит;
- экзему;
- поллиноз;
- аллергию на пищу или лекарства;
- глистную инвазию.
Исследование позволяет точно определить причину заболевания и в дальнейшем бороться уже с его причиной.
Также анализ крови на IgЕ назначают детям, родители которых страдали какой-либо аллергией. По статистике, у ¾ таких детей показатели также будут повышены.
В ряде случаев у ребенка показатели иммуноглобулина Е повышены, но родители аллергиями не страдали. В этом случае ребенок попадает в группу риска. С высокой вероятностью в ближайшие два года у него разовьется аллергия.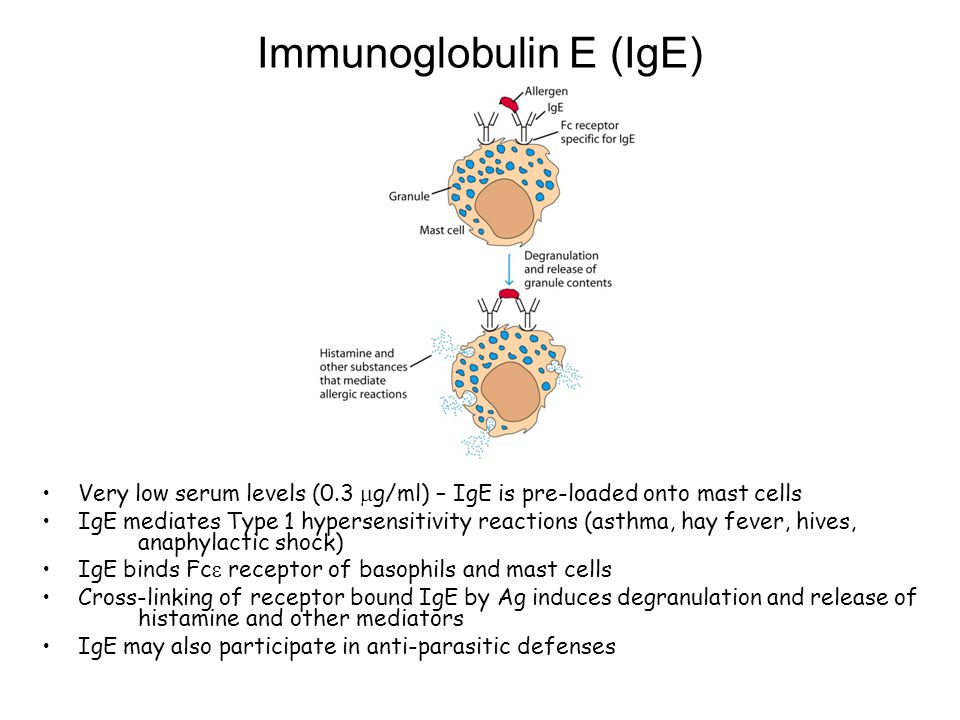
Для исследования берут кровь из вены. Какой-либо специфической подготовки к этому исследованию не требуется, нужно лишь соблюдать общие правила подготовки к забору анализов.
Исследование позволяет установить аллергическую природу ряда заболеваний, однако конкретный аллерген выявить таким способом невозможно. Для этого необходимо проводить дополнительные тесты.
Кроме перечисленных выше заболеваний, причинами повышения IgE могут быть также: отек Квинке, анафилактический шок,
крапивница, астматический бронхит, паразитарные инфекции, синдром Стивенса — Джонсона, синдром Лайелла и некоторые другие заболевания.
В ряде случаев IgE может быть понижен. Возможные причины этого: гипогамма-глобулинемия, атаксия-телеангиэктазия,
иммунодефициты.
Резюме: IgE отвечает за развитие аллергической реакции. Анализ назначают при подозрении на аллергическую природу заболевания. Повышенные показатели иммуноглобулина Е чаще всего говорят о наличии аллергии.
Анализ на общий иммуноглобулин (IgE)
Общий иммуноглобулин Е (IgE)
Иммуноглобулины класса Е – это антитела, которые принимают участие в развитии аллергической реакции. Повышение уровня содержания иммуноглобулина наблюдается при астме, а также сенной лихорадке, других аллергических проявлениях. Часто причиной повышенного иммуноглобулина является воздействие паразитов (трематодозы, нематодозы, эхинококкоз и другие).
Хемилюминесцентный анализ позволяет установить общий уровень иммуноглобулина Е.
Материал необходимый для анализа: сыворотка крови
Подготовка
В течение 4 часов стоит воздержаться от приема пищи. Накануне, а также в день взятия пробы исключите физическую нагрузку. В этот же период времени нельзя употреблять алкоголь и курить. Можно пить воду без газа.
Можно пить воду без газа.
Показания к назначению
-
диагностика и определение эффективности терапии атопических болезней, гельминтозов;
-
диагностика синдрома гипер IgE;
-
оценка возможности развития атопического заболевания;
-
глубокие ожоги;
-
угнетение иммунной системы, в том числе при СПИДе;
-
злокачественные новообразования в дыхательной системе, желудочно-кишечном тракте/
Интерпретация результатов
Определяется общий уровень иммуноглобулина, что помогает уточнить диагноз и предпринять меры для исправления ситуации. Выявляется степень реактивности:
-
Класс 0 (0,1-0,34 kU/L) – очень низкая
-
Класс I (0,35-0,69 kU/L) – низкая
-
Класс II (0,7-3,49 kU/L) – умеренная
-
Класс III (3,5-17,49 kU/L) – высокая
-
Класс IV (17,5-52,49 kU/L) – очень высокая
-
Класс V (52,5- 99,99 kU/L) – сверхвысокая
-
Класс VI (более 100) – исключительно высокая
Повышенный уровень иммуноглобулина класса Е является показателем ряда заболеваний и нарушения жизнедеятельности, в том числе, при приеме лекарственных препаратов. Высокий уровень так же может говорить о врожденных заболеваниях. Интерпретация результатов проводится только врачом.
Высокий уровень так же может говорить о врожденных заболеваниях. Интерпретация результатов проводится только врачом.
Уважаемые пациенты!
Обращаем Ваше внимание, что стоимость визита к врачу не всегда совпадает с указанной ценой приёма.
Окончательная стоимость приема может включать стоимость дополнительных услуг.
Необходимость оказания таких услуг определяется врачом в зависимости от медицинских показаний непосредственно во время приёма.
Общий IgЕ (Общий иммуноглобулин E)
Синонимы: определение общего IgЕ, иммуноглобулин Е, иммуноглобулин Е общий, иммуноглобулин класса Е, IgЕ, IgG total, Immunoglobulin E.
Связанные тесты: аллергоскрининг: ингаляционная, пищевая, ингаляционно-пищевая, педиатрическая панели, общий анализ крови.
Исследование позволит вашему врачу:Определение общего IgЕ проводится для выявления аллергии. Также этот показатель используется как дополнительный метод для дифференцировки атопических заболеваний с аллергическим компонентом среди множества патологий, клинически проявляющихся как астма, частые заболевания дыхательных путей, хронический ринит, дерматит, хроническая диарея и другие.
- Дифференцировать аллергические заболевания среди множества патологий, клинически проявляющихся как астма, частые заболевания дыхательных путей, хронические риниты, дерматиты;
- Диагностировать аллергические заболевания;
- Оценить эффективность лечения аллергии;
- Оценить риск развития аллергический реакций у детей;
- Диагностировать иммунопатологические состояния.
- Пищевой аллергии;
- Лекарственной аллергии;
- Аллергии на пыльцу растений;
- Аскаридозе;
- Нематодозе кишечника;
- Эхинококкозе;
- Амебиозе;
- Анкилостомозе;
- Бронхиальной астме;
- Рините;
- Синусите;
- Дерматите;
- Крапивнице;
- Отеке Квинке;
- Высоком уровне эозинофилов;
- Аллергическом бронхолегочном аспергиллезе;
- IgE-миеломе;
- Синдроме Ди Джоржи;
- Узелковом периартрите;
- Синдроме Вискотта-Олдрича;
- Синдроме Джоба-Бакли;
- Синдроме Неймана.
Метод:
Иммуноферментный анализ (ИФА).
Чувствительность:
Не менее 2,5 МЕ/мл.
Материал для исследования:
Сыворотка крови.
Подготовка к исследованиюПоследний прием пищи за 3-4 часа перед сдачей анализа;
Исключить курение за 3 часа до сдачи анализа;
Исключить физическое и эмоциональное напряжение за 30 минут до сдачи анализа.
Особые условия:
Предварительная запись не требуется.
Формат выдачи результата:
Количество IgE общего в 1 мл сыворотки крови (МЕ/мл).
Норма общего IgE:
Дети до года: 3,5 – 4 МЕ/мл;
Дети 1 – 15 лет: не более 50 МЕ/мл;
Дети от 15 лет и взрослые: не более 100 МЕ/мл;
У курящих людей показатели завышены.
Интерпретация результатов:
Для взрослых:
IgE ≤ 25МЕ/мл – атопические заболевания маловероятны;
IgE = 25-100 МЕ/мл – атопические заболевания нельзя исключать;
IgE ˃ 100 МЕ/мл – атопические заболевания весьма вероятны.
Повышенный уровень IgE может свидетельствовать о:
- Аллергических заболеваниях;
- Бронхиальной астме;
- Бронхоспазме;
- Экземе;
- Крапивнице;
- Отеке Квинке;
- Воспалительных заболеваниях кожи;
- Гельминтозе;
- Кандидомикозе;
- Хронической диарее;
- Болезнях иммунной системы;
- Гипер-IgEобщий синдроме;
- Лимфосаркоме.
Пониженный уровень может свидетельствовать о:
- Прогрессирующих опухолях;
- Некоторых разновидностях агаммаглобулинемии.
Комментарий:
Диагноз ставит лечащий врач на основании клинических данных и результатов лабораторных исследований.
Медицинский центр Аллергоцентр — Иммуноглобулин Е повышен – почему?
Иммуноглобулины — это определенная группа глобулярных белков, которые образуются в организме в ответ на антигенную нагрузку. Существуют пять типов таких белков — это иммуноглобулины: A, D, E, G и М.Каждый вид иммуноглобулинов отвечает за свое звено иммунитета.
Так иммуноглобулин Е (IgE) относится к классу антител, которые отвечают за аллергическую реакцию немедленного типа, являющейся достаточно частым вариантом аллергических реакций. Также IgE принимает участие в комплексном противогельминтном иммунитете, что обусловлено наличием связывания между IgE и антигеном гельминтов.
Для исследования иммуноглобулина Е используется венозная кровь, взятая натощак. Кровь для исследования можно сдавать в любой стадии заболевания.
Нормы иммуноглобулина Е изменяются с возрастом:
1-3 мес — 0-2кЕ/л
3-6 мес — 3-10 кЕ/л
1 год — 8-20 кЕ/л
5 лет — 10-50 кЕ/л
15лет — 16-60 кЕ/л
взрослые — 20-100 кЕ/л
Превышение этих показателей имеют большее диагностическое значение в детском возрасте.
Влиять на результаты анализов могут прием алкоголя, курение, тяжелые психические и физические нагрузки, а также менструальный цикл у женщин.
Повышение иммуноглобулина Е выявляется при аллергических состояниях к нескольким аллергенам, глистных инвазиях, аспергиллезе, инфекционном мононуклеозе, алкогольном циррозе печени. Также повышение иммуноглобулина Е может появляться при таких заболеваниях как: целиакия, изолированный дефицит IgA, болезнь Кавасаки, узелковый периартериит, лекарственный интерстициальный нефрит, синдром гиперпродукции IgE. недостаточность клеточного иммунитета и другие.
Поэтому определить причину повышения иммуноглобулина Е может только врач-специалист. При выявлении очень высокого уровня IgE прежде всего, обычно, исключают гельминтозы: так например при аскаридозах количество IgE превышает норму в 15-20 раз.
В аллергологии по степени повышения данного показателя судят о гиперчувствительности к большому количеству аллергенов. стадии и выраженности аллергических заболеваний, а также дифференциальной диагностики между атопическими и неатопическими состояниями.
При установленной аллергической природе повышения IgE назначается аллергологическая диагностика и определение специфических IgE к конкретному аллергену. Это позволяет быстро определиться со специфическим противоаллергическим лечением, назначение которого лучше доверить хорошему аллергологу.
Другие статьи:
Аллерген-специфическая иммунотерапия
Часто болеющие дети и аллергия
Как не допустить превращения аллергии в астму — эксперт
07:4523.09.2019
(обновлено: 10:46 23.09.2019)
403620
СИМФЕРОПОЛЬ, 23 сен — РИА Новости Крым. Неконтролируемый прием антибиотиков и пыльца растений может стать причиной возникновения и развития аллергии у человека. Об этом в эфире радио «Спутник в Крыму» рассказала врач аллерголог-иммунолог Людмила Соколова.
Аллерген атакует: в Крыму дорожники борются с амброзией»Стало больше аллергиков. Аллергическую реакцию может вызвать то, что мы едим, носим, чем дышим, различные факторы, которые не зависят от нас — изменения организма. Один из факторов риска развития аллергических реакций – неконтролируемый прием антибиотиков, которые уничтожают микрофлору, меняется иммунный ответ», — предупредила она.За нейтрализацию веществ, способных вызвать аллергическую реакцию, в организме человека отвечает иммуноглобулин Е, уточняет Соколова. Его повышенный уровень свидетельствует о предрасположенности человека к аллергическим реакциям. Провести такой анализ можно в любой лаборатории, для этого нужно лишь сдать кровь.
«Иммуноглобулин — то, как организм отвечает на разные чужеродные антигены. Иммуноглобулин Е — это неадекватный ответ на какой-то антиген. Он может быть либо нормальным, либо повышенным. Его числовое значение не имеет принципиальной роли. Если есть предрасположенность, то у таких людей шансы «приобрести» аллергию выше. Как правило, у таких людей аллергия поливалентная, то есть, смешанная, может быть и на лекарства, и сезонная, и так далее»,- пояснила эксперт.
Аллергии, по ее словам, в большей степени подвержены молодые люди. Если аллергию не лечить, она может прогрессировать и постепенно перерасти в бронхиальную астму.
«Если с аллергией ничего не делать, у людей с предрасположенностью спектр аллергенов, как правило, расширяется. Например, могла быть только пищевая, а потом присоединилась сезонная аллергия. Сезонная аллергия проявляется риноконъюктивитом и приступами удушья. Опасность в том, что это может перерасти в бронхиальную астму. По статистике, от 40 до 60% больных с аллергическим ринитом заканчивают бронхиальной астмой», — отмечает она.Полностью избавиться от аллергии нельзя, утверждает эксперт. Однако болезнь, по ее словам, можно контролировать: симптоматически лечить аллергические насморки, конъюнктивиты и астму антигистаминными препаратами. Или использовать «специфическую терапию».
Как спастись от сезонной аллергии: советы медика»Идея этой терапии в том, что мы сначала определяем, есть ли у человека высокий уровень иммуноглобулина Е, потом вне сезона, в отсутствии приема человеком противоаллергических препаратов, делаем ему кожные пробы с «актуальными» аллергенами. Определяем конкретный аллерген, и, начиная с низких доз и концентрации, его вводим. При таком введении вместо иммуноглобулина вырабатываются антитела, которые блокируют попадающий аллерген, не вызывая симптомов. Считается, что у 80- 85% пациентов такой метод дает длительную ремиссию — порядка пяти лет», — уточняет Соколова.Такой метод, по ее словам, разрешен детям с 6 лет, однако противопоказан больным, ранее пережившим анафилактический шок. В период сезонной аллергии эксперт советует соблюдать ряд правил, которые позволят минимизировать вредное воздействие.
«Нужно уменьшать контакт с аллергеном, по возможности, не выезжать в те места, где, например, много амброзии, особенно в ветреную погоду. Убрать из рациона подсолнечник – он может давать перекрестную аллергию с амброзией. Увлажнять нос физрастворами или суспензиями, чтобы уменьшить контакт с аллергеном. В плане лекарственных препаратов лучше обратиться к врачу», — заключила она.
Синдром гипер-IgE | Фонд иммунодефицита
Синдром гипер-IgE (HIES) — редкое заболевание первичного иммунодефицита, характеризующееся экземой, рецидивирующими стафилококковыми кожными абсцессами, рецидивирующими легочными инфекциями, эозинофилией (высокое количество эозинофилов в крови) и высоким уровнем IgE в сыворотке крови. Большинство случаев HIES являются спорадическими, но сообщалось о некоторых семейных случаях HIES с аутосомно-доминантным (AD) или аутосомно-рецессивным (AR) типом наследования.
Определение синдрома гипер-IgE
HIES — это редкий первичный иммунодефицит, характеризующийся рецидивирующей экземой, кожными абсцессами, легочными инфекциями, эозинофилией и высоким уровнем IgE в сыворотке крови. Описаны две формы HIES, включая аутосомно-доминантную (AD, или тип 1) и аутосомно-рецессивную (AR, или тип 2) форму. Эти две формы имеют общие клинические и лабораторные особенности, включая экзему, рецидивирующие инфекции, кожные абсцессы, высокий уровень IgE и повышенное количество эозинофилов.Однако они также имеют отчетливые клинические проявления, течение и исходы.
История синдрома гипер-IgE
HIES впервые был описан Дэвисом и его коллегами как «синдром Джоба» в 1966 году у двух девочек с множеством эпизодов пневмонии, экземоподобной сыпью и периодически возникающими кожными фурункулами, примечательными отсутствием окружающего тепла, покраснения или нежности (так называемые « холодные абсцессы »). В 1972 году этот синдром был уточнен и прояснен Бакли и его коллегами, которые отметили аналогичные инфекционные проблемы у двух мальчиков, у которых также был характерный внешний вид лица и чрезвычайно высокий уровень IgE.После этого отчета у двух девочек из первоначального отчета был обнаружен повышенный уровень IgE, что свидетельствует о том, что синдром Джоба и синдром Бакли представляют одно и то же состояние. В 2007 году было обнаружено, что гетерозиготная мутация в гене, кодирующем фактор транскрипции STAT3, лежит в основе большинства случаев БА (тип 1) -HIES. В 2009 году было обнаружено, что мутации и делеции в гене DOCK8 лежат в основе большинства случаев AR (тип 2) -HIES.
Клиническая картина синдрома гипер-IgE
AD-HIES, связанный с гетерозиготными мутациями в транскрипционном факторе STAT3, является наиболее распространенной формой HIES в U.S. Обычно проявляется респираторными инфекциями и кожными проявлениями, включая сыпь у новорожденных, экзему, рецидивирующие кожные абсцессы и инфекции уха, носовых пазух и легких, приводящие к образованию полостей в легких (пневматоцеле). Другие частые проявления дефицита STAT3 включают кожно-слизистый кандидоз (грибок кандида на слизистых оболочках и / или коже), обычно проявляющийся в виде молочницы, вагинального кандидоза или кандидоза ногтей (онихомикоз). Дополнительные данные включают аномалии соединительной ткани и скелета, такие как типичный внешний вид лица, характерный для пациентов с этим синдромом, гиперрастяжимость их суставов, сохранность молочных зубов и рецидивирующие переломы костей, вторичные даже при минимальной травме.
AR-HIES с дефицитом DOCK8 особенно распространен в регионах мира с высокими показателями кровного родства (смешанные браки между близкими родственниками), где его частота может превышать AD-HIES. AR-HIES также проявляется при экземе, кожных абсцессах, рецидивирующих респираторных инфекциях, кандидозе и других грибковых инфекциях. Однако пациенты с AR-HIES отличаются от пациентов с AD-HIES наличием тяжелых рецидивирующих вирусных инфекций, вызванных патогенами, такими как Herpes simplex , Herpes zoster и Molluscum contagiosum .Они также подвержены аллергическим и аутоиммунным проявлениям, включая пищевую аллергию, гемолитическую анемию (из-за разрушения эритроцитов антителами) и васкулит (воспаление внутри кровеносных сосудов). Пациенты с AR-HIES также имеют высокую частоту неврологических осложнений, включая энцефалит (воспаление головного мозга) и сосудистые поражения головного мозга. Механизмы этих осложнений могут включать вирусные инфекции центральной нервной системы и аутоиммунитет. Наконец, в отличие от своих аналогов AD-HIES, пациенты с AR-HIES не проявляют патологий соединительной ткани или скелета.
Кожа, пораженная синдромом гипер-IgE
Сыпь у новорожденных или экзема часто являются первым проявлением AD-HIES. Гнойничковые и экземоподобные высыпания обычно появляются в течение первого месяца жизни, сначала поражая лицо и кожу головы. Кожные абсцессы — классическая находка при этом заболевании, вызванная особой восприимчивостью к инфекциям, вызываемым Staphylococcus aureus . Степень воспалительных симптомов, таких как болезненность и тепло, часто бывает весьма различной. Термин «холодные абсцессы» применяется к тем поражениям, у которых отсутствуют внешние признаки воспаления, несмотря на наличие гноя.Возникновение и тяжесть этих абсцессов значительно уменьшаются при профилактической терапии антибиотиками против Staphylococcus aureus .
Пациенты с дефицитом DOCK8 также имеют тяжелые экземоподобные высыпания, начинающиеся в раннем возрасте, хотя и не обязательно в период новорожденности. Они также страдают рецидивирующими кожными абсцессами, обычно связанными с инфекцией Staphylococcus aureus . Тяжелые рецидивирующие или стойкие кожные вирусные инфекции, вызванные Herpes simplex , Herpes zoster и Molluscum contagiosum , также могут быть признаком дефицита DOCK8.Эти инфекции могут быть хроническими и часто трудно поддаются лечению.
Инфекции кожи и ногтей, вызванные кандидозом, являются общими для AD- и AR-HIES.
Легкие, пораженные синдромом гипер-IgE
Рецидивирующие бактериальные пневмонии часто встречаются у пациентов с AD-HIES. Пневмонии обычно начинаются в детстве, и наиболее частыми изолятами бактерий являются Staphylococcus aureus , Streptococcus pneumoniae и Haemophilus influenzae .Также распространены грибковые инфекции легких, особенно Aspergillus fumigatus. Подобно появлению холодных кожных абсцессов, эти пневмонии могут проявляться меньшим количеством симптомов, чем можно было бы ожидать у человека с неповрежденным иммунитетом. Это относительное отсутствие симптомов и последующая задержка клинических проявлений могут способствовать развитию заболевания и значительному повреждению тканей до выявления и начала соответствующей терапии. Однако тяжесть повреждения легочной ткани и последующее появление хронического заболевания легких выше у пациентов с AD-HIES по сравнению с пациентами с AR-HIES.Разрушение тканей, вызванное инфекцией, у людей с AD-HIES может вызвать образование пневматоцеле (большие полости в легких), что является отличительной чертой AD-HIES с мутациями STAT3.
Рецидивирующие легочные инфекции, вызванные как грамположительными, так и отрицательными бактериями, обычны у пациентов с AR-HIES с дефицитом DOCK8, а также могут привести к хроническому заболеванию легких с повреждением дыхательных путей (бронхоэктазы) и тканей легких.
Скелетные и соединительные ткани, пораженные синдромом гипер-IgE
Вовлечение как соединительной, так и скелетной тканей является важной особенностью AD-HIES с мутациями STAT3.Для этого заболевания типичны асимметричный внешний вид лица с выступающим лбом и подбородком, глубоко посаженные глаза, широкий нос, утолщенная кожа лица и высокое изогнутое небо. Эти особенности развиваются в детстве и становятся более устойчивыми к подростковому возрасту. У пациентов с AD-HIES наблюдается повышенная растяжимость суставов. У них часто возникают переломы костей из-за, казалось бы, незначительной травмы, и плотность костной ткани может снижаться. Сколиоз является обычным явлением и обычно возникает в подростковом или более позднем возрасте.Сращенные кости черепа (краниосиностоз) и лишние или аномально сформированные ребра или позвонки также чаще встречаются у пациентов с AD-HIES, чем в общей популяции. Ни одна из этих аномалий скелета не наблюдается у пациентов с дефицитом DOCK8.
Зубы, пораженные синдромом гипер-IgE
Аномалии, влияющие на зубной ряд, — еще одна общая черта AD-HIES с мутациями STAT3. Сохранение молочных (или молочных) зубов даже после прорезывания постоянных зубов — постоянный вывод.Снижение резорбции корней молочных зубов приводит к невозможности выпадения молочных зубов, что, в свою очередь, предотвращает соответствующее прорезывание постоянных зубов. Эта аномалия выявляется на панорамных рентгеновских снимках в виде двойных рядов ретенционных молочных зубов, перекрывающих постоянные. Хирургическое удаление ретенционных молочных зубов необходимо для здорового зубного ряда при этом заболевании. У детей, которым удалили ретинированные молочные зубы, постоянные зубы прорезывались нормально. В отличие от пациентов с AD-HIES, пациенты с AR-HIES из-за дефицита DOCK8 не проявляют аномалий зубных рядов.
Другие клинические результаты синдрома гипер-IgE
Абсцессы глубоких тканей часто встречаются у пациентов с AD-HIES, чаще всего вызванные стафилококковыми инфекциями.
Пациенты с AD- и AR-HIES имеют повышенный риск злокачественных новообразований, особенно лимфом. Другие виды рака, описанные при дефиците STAT3, включают лейкоз и рак вульвы, печени и легких. Пациенты с дефицитом DOCK8 предрасположены к плоскоклеточной карциноме, вызванной вирусом папилломы, и лимфомам.Аутоиммунные заболевания также связаны с обоими типами HIES, но чаще всего это наблюдается при дефиците DOCK8.
Пациенты с дефицитом DOCK8 имеют больше симптоматических неврологических заболеваний, чем пациенты с дефицитом STAT3. Неврологические проявления могут варьироваться от ограниченного поражения, такого как паралич лицевого нерва, до более серьезных проявлений, таких как гемиплегия (парализована одна сторона тела) и энцефалит. Причины неврологических осложнений не ясны, но причиной могут быть грибковые, вирусные агенты и васкулит.Поражение центральной нервной системы является причиной значительного числа смертельных исходов при этом заболевании.
Лабораторные данные о синдроме гипер-IgE
Дефицит как STAT3, так и DOCK8 влияет на иммунную систему и приводит к иммунологическим нарушениям. Повышенные сывороточные концентрации IgE и количество эозинофилов присутствуют при обеих формах заболевания. Общее количество лейкоцитов обычно высокое у пациентов с мутациями AD-HIES и STAT3, но может не увеличиваться должным образом во время острой инфекции.Сообщалось о нейтропении (низкое количество лейкоцитов в крови, называемых нейтрофилами), но она встречается редко. Сывороточные IgG, IgA и IgM обычно нормальны, хотя некоторые люди с AD-HIES имеют дефицит одного или нескольких из этих подтипов иммуноглобулинов.
Пациенты с AR-HIES и дефицитом DOCK8 обычно обнаруживают очень высокое количество эозинофилов в периферической крови при очень низком количестве Т-клеток. Они проявляют низкий уровень IgM в сыворотке и не могут поддерживать специфические реакции антител при вакцинации.
Диагностика синдрома гипер-IgE
Диагноз HIES может быть поставлен на основании комбинации клинических и лабораторных данных для обоих типов HIES. Повышенный уровень сывороточного IgE — практически универсальная находка у этих пациентов. Однако одного этого недостаточно для постановки диагноза, поскольку пациенты с другими состояниями, такими как тяжелая экзема, могут иметь уровни IgE в диапазоне HIES. Определенные особенности, такие как образование пневматоцеле в контексте других результатов HIES, решительно подтверждают диагноз HIES типа 1.
Система оценки HIES была ранее разработана в Национальных институтах здравоохранения (NIH), которая может помочь в диагностике HIES типа 1. В этой системе пациенты оцениваются на предмет наличия и тяжести следующих клинических и лабораторных признаков: сыпь у новорожденных, экзема, кожные абсцессы, рецидивирующие инфекции верхних дыхательных путей, пневмония, изменения легких (полости), кандидоз, другие тяжелые инфекции, смертельные инфекции, характерный внешний вид лица, увеличенная ширина носа, высокое нёбо, сохранение первичных зубных рядов, чрезмерная растяжимость суставов, переломы с незначительной травмой, сколиоз, анатомические аномалии средней линии, лимфома, высокий уровень IgE в сыворотке и эозинофилия.Оценка коррелирует с тяжестью заболевания (от 0 до 15 баллов без поражения, от 16 до 39, возможно, пораженных, от 40 до 59, вероятно, пораженных, и 60 или более окончательно пораженных). Система подсчета очков — особенно полезный инструмент для диагностики AD-HIES, но в меньшей степени для AR-HIES. Окончательный диагноз может быть установлен с помощью генетического анализа генов STAT3 и / или DOCK8.
Снижение сывороточных концентраций IgM и количества Т-лимфоцитов периферической крови является важным лабораторным признаком дефицита DOCK8.Отсутствие белка DOCK8 в клетках крови встречается более чем у 95% пациентов с дефицитом DOCK8 и как таковое может быть полезно для подтверждения диагноза у подозреваемых пациентов, но не для его исключения, если экспрессия белка DOCK8 в норме. У последних диагноз должен быть установлен методами секвенирования ДНК.
Наследование синдрома гипер-IgE
Аутосомно-доминантный HIES (с мутациями STAT3) — AD-HIES встречается как у мужчин, так и у женщин всех этнических групп с очевидной одинаковой частотой.В семьях, где имеется более одного больного человека, передача заболевания согласуется с аутосомно-доминантным наследованием. У большинства пациентов заболевание возникает спорадически. Мутации STAT3 вызывают большинство, если не все, случаев аутосомно-доминантного HIES. Мутационный анализ гена STAT3 позволит поставить точный диагноз и провести генетическое консультирование.
Аутосомно-рецессивный HIES (дефицит DOCK8) — Большинство, но не все пациенты с AR-HIES происходят из кровных семей. Делеции и мутации в гене DOCK8 на хромосоме 9 составляют большинство случаев, хотя некоторые пациенты с AR-HIES имеют нормальный ген DOCK8.Мутационный анализ гена DOCK8 важен для диагностики и генетического консультирования.
Лечение синдрома гипер-IgE
Терапия HIES остается в основном поддерживающей. Антибиотикопрофилактика триметоприм-сульфометоксазолом часто используется в качестве профилактики рецидивирующих респираторных инфекций. Лечение этих инфекций, если они возникают, следует начинать незамедлительно. Учитывая, что пациенты с HIES страдают от значительной экземы и кожных инфекций и что поврежденная кожа представляет собой портал для проникновения патогенов, вызывающих глубоко укоренившиеся инфекции, уход за кожей и быстрое лечение кожных инфекций является важным компонентом ведения HIES.При тяжелой экземе местные увлажняющие кремы и ограниченное использование местных стероидов могут помочь добиться заживления. Антисептические обработки кожи значительно снижают бактериальную нагрузку на кожу, не приводя к появлению устойчивых к антибиотикам бактерий.
Кожные абсцессы могут потребовать разреза и дренирования, но в значительной степени их можно предотвратить с помощью профилактических пероральных антибиотиков. Роль профилактических антибиотиков тщательно не исследовалась, но существует общий консенсус в пользу использования антибиотиков против Staphylococcus aureus в обеих группах HIES.Абсцессы легких и других глубоких тканей могут потребовать дренирования или резекции. После разрешения острой пневмонии легочные кисты или полости образуют места для колонизации Pseudomonas aeruginosa , Aspergillus и другими видами грибов. Эти суперинфекции могут быть трудным аспектом HIES. Возможные стратегии лечения включают непрерывное лечение противогрибковыми препаратами и / или антибиотиками в аэрозольной форме.
Кандидоз ногтей, рта или влагалища при HIES редко распространяется на более глубокие ткани и хорошо поддается пероральным противогрибковым препаратам.Хотя чрезмерное использование антибиотиков и противогрибковых средств в целом не рекомендуется для «нормальных» пациентов из-за опасений по поводу отбора резистентных организмов, недостаточное использование антибиотиков у пациентов с HIES подвергает эту группу риску инфекций, которые изнуряют и опасны.
Замечательной особенностью HIES является то, насколько хорошо пациенты могут себя чувствовать (и выглядеть), когда у них есть инфекция. Например, даже при наличии доказательств серьезной инфекции при физикальном обследовании и рентгеновском подтверждении пневмонии, пациент с HIES может отрицать тошноту и может не видеть необходимости в инвазивном диагностическом тестировании или длительной терапии.Более того, врачи, не знакомые с HIES, не решаются поверить в то, что пациенты, которые не выглядят очень больными и выглядят примерно так же, как обычно, могут действительно быть очень больными.
Слабый ответ антител на вакцинацию при AD- и AR-HIES поддерживает использование заместительной иммуноглобулиновой терапии у этих пациентов. Однако роль гамма-интерферона, фактора, стимулирующего колонии гранулоцитов, или других иммуномодуляторов в HIES не доказана. Трансплантация костного мозга является лечебным средством от AR-HIES с дефицитом DOCK8 и рекомендуется с учетом тяжести заболевания и пожизненного риска развития фатальных осложнений, включая инфекции, аутоиммунные заболевания и злокачественные новообразования.Напротив, пациенты с AD-HIES обычно хорошо переносят интенсивную терапию и поддерживающую терапию, и им не рекомендуется трансплантация костного мозга.
Ожидания для пациентов с синдромом гипер-IgE
Пациентам с обоими типами HIES требуется постоянная бдительность в отношении инфекций и развития хронических заболеваний легких. С ранней диагностикой и лечением инфекций у большинства пациентов с AD-HIES все хорошо. Более тяжелый характер AR-HIES должен побуждать к раннему рассмотрению возможности трансплантации костного мозга, которая является лечебной.Генетическое консультирование рекомендуется семьям с детьми HIES и особенно важно для тех семей, где присутствует кровное родство.
Выдержка из Справочника IDF для пациентов и семей по первичным иммунодефицитным заболеваниям ПЯТОЕ ИЗДАНИЕ . Авторское право 2013 г. Фондом иммунодефицита, США. Эта страница содержит общую медицинскую информацию, которую нельзя безопасно применить к любому отдельному случаю. Медицинские знания и практика могут быстро меняться. Таким образом, эту страницу не следует использовать как замену профессиональной медицинской консультации.
Общий IgE | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
(© 1995–2016). Иммуноглобулин Е (IgE), сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8159. Дата обращения 06.04.16.
Durani, Y. (сентябрь 2014 г., обзор). Иммуноглобулин E. KidsHealth от Nemours. [Он-лайн информация]. Доступно в Интернете по адресу http: // kidshealth.org / en / Родители / test-иммуноглобулин-e.html. Дата обращения 06.04.16.
Моррис, М. (обновлено 25 марта 2016 г.). Астма. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/296301-overview. Дата обращения 06.04.16.
Шварц Р. и Тарлоу М. (обновлено 31 августа 2015 г.). Дерматологические проявления синдрома работы. Наркотики и болезни, помогающие избежать болезней [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/1050852-overview.Дата обращения 06.04.16.
Delgado, J. et. al. (Обновлено за апрель 2016 г.). Нарушения иммуноглобулинов. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу https://arupconsult.com/content/immunoglobulin-disorders?tab=tab_item-0. Дата обращения 06.04.16.
(обновлено 1 июля 2015 г.). Синдром гипериммуноглобулина Е (HIES) или синдром Джобса. Национальный институт аллергии и инфекционных заболеваний [Он-лайн информация]. Доступно в Интернете по адресу http://www.niaid.nih.gov/topics/jobssyndrome/Pages/default.aspx. Дата обращения 06.04.16.
Источники, использованные в предыдущих обзорах
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник Мосби по диагностике и лабораторным испытаниям, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 581-584.
Даллер Дж. (Обновлено 1 августа 2011 г.). Синдром гипериммуноглобулина Е. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001311.htm. По состоянию на январь 2012 г.
Персонал клиники Мэйо (28 июля 2011 г.).Первичный иммунодефицит. Клиника Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayoclinic.com/health/primary-immunodeficiency/DS01006. По состоянию на январь 2012 г.
Jyonouchi, H. (Обновлено 2 августа 2011 г.). Синдром гипериммуноглобулинемии E (Иова). Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/886988-overview#showall. По состоянию на январь 2012 г.
(© 1995-2012). Идентификатор теста: ИГЭ иммуноглобулин Е (IgE), сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация].Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8159. По состоянию на январь 2012 г.
Hill, H. и Wittwer, C. (обновлено в апреле 2011 г.). Нейтрофильные расстройства. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/NeutrophilDisorders.html?client_ID=LTD. По состоянию на январь 2012 г.
Delgado, J. et. al. (Обновлено в январе 2011 г.). Нарушения иммуноглобулинов. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http: //www.arupconsult.ru / Topics / ImmunoglobulinDisorders.html? client_ID = LTD # tabs = 0. По состоянию на январь 2012 г.
Dowshen, S. (обзор, февраль 2011 г.). Анализ крови: иммуноглобулин Е (IgE). KidsHealth от Nemours [Он-лайн информация]. Доступно в Интернете по адресу http://kidshealth.org/parent/system/medical/test_immunoglobulin_e.html. По состоянию на январь 2012 г.
Лоури, Ф. (18 ноября 2010 г.). Возрастные уровни IgE в США растут. Медицинские новости Medscape от: Ежегодного научного собрания Американского колледжа аллергии, астмы и иммунологии (ACAAI) 2010 [онлайн-информация].Доступно в Интернете по адресу http://www.medscape.com/viewarticle/732797. По состоянию на январь 2012 г.
(обновлено в августе 2011 г.). Раздаточный материал по здоровью: атопический дерматит. Национальный институт артрита, скелетно-мышечных и кожных заболеваний [он-лайн информация]. Доступно в Интернете по адресу http://www.niams.nih.gov/Health_Info/Atopic_Dermatitis/default.asp. По состоянию на январь 2012 г.
Heimall, J. et. al. (Обновлено 4 августа 2010 г.). Синдром работы. Справочник по Medscape [Он-лайн информация]. Доступно на сайте http: // emedicine.medscape.com/article/1547969-overview. По состоянию на январь 2012 г.
Влияние высоких уровней иммуноглобулина Е в сыворотке на риск атеросклероза у людей
Резюме
Предпосылки
Эпидемиологические исследования показывают, что уровни иммуноглобулина Е (IgE) были выше у субъектов с острыми коронарными событиями. Однако неизвестно, является ли повышенный уровень IgE маркером будущих коронарных заболеваний и может ли он рассматриваться как фактор риска ишемической болезни сердца.
Цель
Наша цель состояла в том, чтобы исследовать взаимосвязь между уровнями IgE и некоторыми атеросклеротическими маркерами у пациентов без известного атеросклеротического заболевания.
Методы
Были включены пятьдесят пациентов (средний возраст 40,96 ± 10,8 лет) с высокими уровнями сывороточного IgE из-за различных состояний, у которых не было признаков атеросклеротического заболевания, и 30 здоровых контрольных субъектов (средний возраст 47 ± 8,27 года). В исследовании. Маркеры атеросклеротического заболевания, включая молекулы адгезии, такие как молекула адгезии сосудистых клеток-1, молекула межклеточной адгезии-1, провоспалительные цитокины, такие как интерлейкин-6, эндотелин-1, и системные воспалительные маркеры, такие как С-реактивный белок высокой чувствительности, были определены с помощью ферментно-связанного иммуноферментный анализ (ИФА).Эндотелиальные функции коронарных артерий определялись путем измерения резерва коронарного кровотока (CFR) и толщины интима-медиа сонной артерии с помощью трансторакальной допплерэхокардиографии.
Результаты
CFR была значительно ниже в группе пациентов по сравнению с контрольной группой ( p <0,001; 95% доверительный интервал, от -0,79 до -0,20), в то время как толщина каротидной среды не различалась между двумя группами. Между двумя группами не было различий в результатах теста ELISA.
Заключение
Наши результаты показали, что CFR как ранний маркер эндотелиальной дисфункции был значительно ниже у пациентов с высоким уровнем IgE. Это открытие, по-видимому, подтверждает роль IgE в сосудистой патологии атеросклероза.
Ключевые слова: Атеросклероз, толщина интима-медиа сонных артерий, резерв коронарного кровотока, иммунглобулин E
ВВЕДЕНИЕ
Иммуноглобулин E (IgE) является самым низким из 5 изотипов человеческих иммуноглобулинов, IgE, IgM (IgG, IgDA, IgM). ) в крови и имеет самый короткий период полураспада среди них [1,2].Он в первую очередь обеспечивает защитный иммунитет против гельминтов-паразитов, но также может реагировать на инородные вещества даже в небольших количествах и признан «стражником ворот». При некоторых условиях IgE достигает патологического уровня. Заболевания, вызывающие повышение уровня сывороточного IgE, включают атопические заболевания (астма, аллергический ринит, атопический дерматит, крапивница), паразитарные заболевания, кожные заболевания, опухолевые заболевания и иммунодефицит [3]. Состояниями, связанными с необычно высокими концентрациями IgE в сыворотке (> 1000 МЕ / мл), являются аллергический бронхолегочный аспергиллез, аллергический грибковый синусит, атопический дерматит, вирусная инфекция иммунодефицита человека, синдром гипер-IgE, миелома IgE, лимфома, системный паразитоз и туберкулез [4].
Некоторые эпидемиологические исследования показали, что уровни IgE были выше у субъектов с сердечно-сосудистыми заболеваниями, в частности, у пациентов с нестабильной стенокардией и острыми коронарными заболеваниями [5]. Но пока неясно, является ли повышенный уровень IgE маркером будущих коронарных заболеваний и может ли он рассматриваться как фактор риска ишемической болезни сердца. Недавнее молекулярное исследование Wang et al. [6] внесли большую ясность в связь между высоким уровнем IgE и атеросклерозом, показав, что IgE играет важную роль в патогенезе атеросклероза.Однако клинические доказательства, демонстрирующие, что высокий уровень IgE может быть фактором риска атеросклеротического исхода, по-прежнему необходимы.
Наша цель состояла в том, чтобы исследовать взаимосвязь между высокими уровнями сывороточного IgE и некоторыми ранними маркерами атеросклероза у пациентов без известных атеросклеротических заболеваний и факторов риска.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовательские группы
Пациенты были случайным образом отобраны среди амбулаторных пациентов, направленных в нашу аллергологическую клинику с различными симптомами, у которых было обнаружено высокий (> 100 МЕ / мл) или очень высокий уровень сывороточного IgE (≥1000 МЕ / мл ).В исследование были включены пятьдесят пациентов (средний возраст 40,96 ± 10,8 года; 22 женщины), у которых не было признаков атеросклеротического заболевания, и 30 здоровых контрольных субъектов (средний возраст 47 ± 8,27 года; 11 женщин). Аллергический ринит, ядовитая и пищевая аллергия диагностировались по клиническим симптомам, кожным прик-тестам и уровням аллерген-специфического IgE. Кожные уколы были проведены для Dermatophagoides farinea , Dermatophagoides pteronyssinus , пыльцы трав, пыльцы сорняков, пыльцы деревьев, Pariteria judaica , Artemisia vulgaris , Aspergillus Furnigatus , ALK alternata, Дания (Дания). .Уровни аллерген-специфического IgE для D. farinea , D. pteronyssinus , пыльцы травы, пыльцы сорняков, пыльцы деревьев, Pariteria judaica измеряли с помощью ImmunoCAP (Thermo Fisher Scientific Inc., Phadia AB, Упсала, Швеция).
Кожные пробы считались положительными при появлении волдырей со средним диаметром 3 мм или больше [7]. Для иммунного КАП положительный результат был определен как значение ≥0,35 кЕд / л [8].
Лекарственная аллергия была диагностирована с помощью кожных проб и пероральных контрольных проб с коммерческими препаратами в соответствии с рекомендациями Европейской сети по лекарственной аллергии [9].
Критерии исключения
Пациенты с анамнезом артериальной гипертензии, сахарным диабетом, дислипидемией, курением, диагнозом ишемической болезни сердца и астмы были исключены из исследования.
Измерение общего IgE, молекул адгезии, провоспалительных цитокинов и hsCRP
Образцы крови были получены путем пункции локтевой вены. Сыворотку отделяли центрифугированием и хранили при -80 ° С. Концентрации общего IgE в сыворотке крови (Siemens, Мюнхен, Германия), молекулы межклеточной адгезии-1 (ICAM-1; Diaclone SAS, Besancon Cedex, Франция), молекулы адгезии сосудистых клеток-1 (VCAM-1; Diaclone SAS, Besancon Cedex, Франция). ), IL-6 (Diaclone SAS, Besancon Cedex, Франция), эндотелин-1 (Biomedica Medizinprodukte GmbH & Co KG, Вена, Австрия) и hsCRP (DRG international Inc., Springfield Township, NJ, USA) определяли с помощью иммуноферментного анализа.
Измерения коронарного кровотока
Регистрации коронарного резерва кровотока (CFR) выполнялись с помощью эхокардиографического устройства Vivid 7 (General Electrics, Horten, Норвегия) с использованием широкополосного датчика средней частоты (от 3 до 8 МГц). Запись CFR проводилась в левой передней нисходящей коронарной артерии (LAD) с помощью трансторакальной допплеровской эхокардиографии. Акустическое окно располагалось рядом со среднеключичной линией в четвертом и пятом межреберных промежутках в левом боковом положении декубита.Левый желудочек был визуализирован в поперечном сечении по длинной оси, а ультразвуковой луч был наклонен в сторону. Коронарная кровь в средней и дистальной части ПМЖВ была идентифицирована с помощью цветного доплеровского картирования потока с оптимальным диапазоном скорости (от +12 до +15 см / с). Затем объем образца (шириной 1,5 или 2,0 мм) помещался на цветовой сигнал в LAD. Переменные скорости LAD были измерены с использованием анализа быстрого преобразования Фурье. После исходных записей кровотока дипиридамол (0,56 мг / кг) вводился в течение 4-минутного периода.Дополнительная инфузия дипиридамола (0,28 мг / кг в течение 2-минутного периода) применялась, когда частота сердечных сокращений не превышала исходный уровень на 10%. Через две минуты после окончания инфузии были записаны гиперемированные спектральные профили в ПМЖВ. Все изображения были записаны для анализа воспроизведения и позже были измерены в автономном режиме. Средняя пиковая диастолическая скорость (APDV) и средняя средняя диастолическая скорость были измерены на исходном уровне и в условиях гиперемии. CFR определяли как отношение APDV при гиперемии к APDV на исходном уровне.
Измерение толщины интима-медиа сонных артерий
Сонные артерии оценивали с помощью эхокардиографического устройства Vivid 7 с использованием линейного зонда 10 МГц. Полученные изображения были записаны для анализа воспроизведения, а затем были измерены в автономном режиме. Общая сонная артерия, луковица сонной артерии, а также внутренняя и внешняя сонные артерии визуализировались с обеих сторон. Толщину интима-медиа (ТИМ) сонных артерий измеряли в дистальной части общей сонной артерии на уровне 15-20 мм проксимальнее луковицы сонной артерии.Две яркие эхогенные линии на стенке артерии были идентифицированы как интима и медиа. Было проведено по три измерения с каждой стороны тела; отдельные средние были рассчитаны и записаны как правая и левая IMT.
Статистический анализ
Данные представлены как среднее ± стандартная ошибка. Статистическая значимость данных была проанализирована с помощью SPSS ver. 17 (SPSS Inc., Чикаго, Иллинойс, США). Тест Колмогорова-Смирнова использовался для оценки нормального распределения данных. Различия между пациентами и контрольными субъектами были проанализированы статистически с использованием независимого образца t -тест.Значения CFR пациентов и контрольной группы были показаны с помощью метода распределения. Статистическая значимость была приемлемой на уровне p ≤ 0,05.
Исследование было одобрено этическим комитетом Стамбульского медицинского факультета, и информированное согласие было получено от всех участников (номер одобрения: 29449).
РЕЗУЛЬТАТЫ
Характеристики пациентов
Тридцать четыре пациента страдали атопическим заболеванием, в то время как у остальных 16 пациентов атопия не была обнаружена.Распределение атопических заболеваний было следующим; аллергический ринит (n = 16), пищевая аллергия (n = 7), лекарственная аллергия (n = 5), аллергический ринит и сопутствующая пищевая аллергия (n = 4), аллергия на яд (n = 2) ().
Таблица 1
Демографические и клинические особенности пациентов
Серологическое исследование
Уровни общего IgE находились в широком диапазоне в группе пациентов (диапазон 117–7200 МЕ / мл; медиана 8610 МЕ / мл) в то время как в контрольной группе он был в близких пределах (диапазон, 5.29–100 МЕ / мл; медиана 29,7 МЕ / мл). Средний уровень общего IgE у пациентов с атопией составлял 1209 ± 1031 МЕ / мл, в то время как у пациентов без атопии он составлял 828 ± 757 МЕ / мл, что указывает на отсутствие статистически значимой разницы ( p = 0,194) (). Не было различий между группами пациентов и контрольной группой в отношении уровней VCAM-1, ICAM-1, эндотелина-1 и IL-6, хотя вчСРБ был выше у контрольных субъектов ().
Таблица 2
Сравнение индивидуальных параметров пациента и контрольной группы
CFR и измерения ТИМ сонной артерии
CFR была значительно ниже в группе пациентов по сравнению с контрольной группой ( p <0.001; 95% доверительный интервал, от -0,79 до -0,20), в то время как толщина каротидной среды не различалась между двумя группами ().
Значения коронарного резерва кровотока (CRF) пациента и контрольных групп. Пациенты, р = -0,026391; элементы управления, r = 0,246059.
Не было значительной корреляции между значениями CFR и различными уровнями общего IgE, вчСРБ и других маркеров воспаления.
ОБСУЖДЕНИЕ
В этом исследовании было обнаружено, что CFR пациентов с неизвестным атеросклеротическим заболеванием, но с высокими уровнями IgE из-за атопических или неизвестных причин, были значительно ниже по сравнению с пациентами с нормальным уровнем IgE.Это открытие подтверждает гипотезу о связи между IgE и атеросклерозом.
Оценка CFR представляет собой надежный и воспроизводимый маркер функции микрососудов коронарных артерий, однако IMT сонных артерий служит общим показателем степени тяжести атеросклероза [10,11]. Данные, демонстрирующие связь между стенозом коронарной артерии и CFR, выросли [12,13]. Согласно этим исследованиям, CFR считается чувствительным маркером для идентификации пациентов с анатомическим заболеванием высокого риска с помощью компьютерной томографической ангиографии.Многие исследования продемонстрировали, что даже у пациентов без обструктивной болезни коронарных артерий (ИБС) CFR снижается у пациентов со многими состояниями, такими как гипертония, диабет, метаболический синдром, курение, дислипидемия, хроническое заболевание почек и системное воспаление по сравнению со здоровыми добровольцами ( средний CFR в этих исследованиях составляет 3,8.) [14]. Эти, а также другие исследования предполагают, что коронарная микрососудистая дисфункция предшествует ограничивающему поток атеросклеротическим бляшкам эпикардиальных коронарных артерий у пациентов с факторами риска.Снижение CFR (<2,0), связанное с кумулятивными факторами риска коронарных артерий, наблюдалось почти у 50% когорты пациентов с подозрением на ИБС и без признаков ишемии. Недавние исследования, в том числе крупные ретроспективные исследования, последовательно демонстрируют, что CFR является важным прогностическим маркером у пациентов с известной и подозреваемой ИБС [15,16]. Пациенты с низким риском, классифицированные по сохраненной CFR (≥2,0), связаны с низким риском сердечной смерти (0,2% в год). Напротив, пациенты из группы высокого риска стратифицированы по очень низкой CFR (CFR <1.5) относятся к группе высокого риска сердечной смерти (11% в год). ТИМО общих сонных артерий является общим показателем тяжести атеросклероза, а повышенное ТИМ связано с генерализованным атеросклерозом. Ряд исследований продемонстрировали связь ТИМ сонных артерий и статус коронарного атеросклероза [17,18]. Было обнаружено, что у пациентов без клинического атеросклеротического заболевания факторы риска сердечно-сосудистых заболеваний связаны с нарушением опосредованной кровотоком дилатации, CFR и увеличением IMT [18].Однако значения IMT в группе пациентов не отличались от контрольных субъектов в другом исследовании [19].
Criqui et al. [20] впервые исследовали взаимосвязь между общим IgE и сердечно-сосудистыми заболеваниями. Они обнаружили, что средний уровень общего сывороточного IgE увеличился в 1,2 раза у мужчин с перенесенным острым инфарктом миокарда (ОИМ) в анамнезе. Последующие исследования, включая большие и малые серии, продемонстрировали, что различные подгруппы ишемической болезни сердца, особенно у мужчин, неизменно связаны с высокими уровнями сывороточного IgE [21].Соответственно, была выдвинута гипотеза о том, что IgE может играть роль в развитии ишемической болезни сердца. Также обсуждается высокий уровень IgE как возможный биомаркер ишемической болезни сердца. Вопрос о том, является ли повышенный уровень IgE причиной или результатом атеросклеротической болезни сердца, все еще остается предметом споров, поскольку есть данные, поддерживающие обе стороны. Szczeklik et al. [22] оценили концентрацию общих сывороточных IgE у 100 пациентов с недавно перенесенным ОИМ. Средние значения общего IgE неуклонно увеличивались после эпизода ишемии, достигая статистически значимого изменения на 3-й день и достигая пика на 7-й день.Концентрация IgE снизилась на 14 день и вернулась к исходному уровню через 3 недели. Коркмаз и др. [23] также оценили уровни сывороточного IgE у 156 пациентов с ишемической болезнью сердца. Они сообщили, что общие сывороточные уровни IgE были значительно выше у пациентов с ОИМ и нестабильной стенокардией. Szczeklik et al. [24] исследовали уровень общего сывороточного IgE у 386 пациентов с ОИМ на момент поступления в коронарное отделение и разделили пациентов на наличие (n = 55) или отсутствие (n = 331) внезапной остановки сердца.Они обнаружили, что сывороточные уровни общего IgE были значительно выше в первой группе. Edston и van Hage-Hamsten [25] изучили 29 случаев внезапной смерти из-за тромбоза коронарной артерии. Они сообщили, что у этих пациентов концентрация общего сывороточного IgE была почти вдвое выше, а уровень общего сывороточного IgE повышался значительно чаще.
Все эти исследования показывают, что уровни IgE повышаются как иммунный ответ при острых коронарных событиях. Однако другие исследования предполагают, что сам IgE может быть фактором риска ишемической болезни сердца.Langer et al. [26] измерили уровни IgE у 621 человека, за которыми наблюдали в среднем в течение 9 лет. Было обнаружено, что уровни общих сывороточных IgE были значительно выше у мужчин, перенесших ишемическую болезнь сердца, а также у тех, кто перенес нефатальный ОИМ. Однако эта тенденция не была подтверждена у женщин, у которых уровни общих сывороточных IgE незначительно отличались от мужских. В другом исследовании Kovanen et al. [27] оценили связь между уровнем общего сывороточного IgE и ишемической болезнью сердца у мужчин с дислипидемией, участвовавших в Хельсинкском исследовании сердца, наблюдая за ними в течение 5 лет.Они показали, что базальные уровни IgE были значительно выше у тех, кто испытал летальный или нефатальный ОИМ. Недавнее молекулярное и клиническое исследование, оценивающее патогенез атеросклероза, дополнительно прояснило вопросы, связанные с взаимосвязью между IgE и атеросклерозом [18]. Было обнаружено, что концентрация общего сывороточного IgE была почти на 60% выше у пациентов с диагнозом ИБС, чем у пациентов без ИБС, и была даже выше у пациентов с более тяжелой ИБС, такой как ОИМ, чем у пациентов с нестабильной и стабильной стенокардией.В молекулярной части исследования было показано, что IgE и субъединица FcεR1 FcεR1α присутствуют в атеросклеротических поражениях человека, особенно в областях, богатых макрофагами. У мышей отсутствие FcεR1α уменьшало воспаление и апоптоз в атеросклеротических бляшках и уменьшало бремя болезни. В культивируемых макрофагах присутствие TLR4 необходимо для активности FcεR1. IgE стимулировал взаимодействие между FcεR1 и TLR4, которое вызывало апоптоз макрофагов [6]. Обобщая результаты этих исследований, которые продемонстрировали проатерогенные, протромботические и антифибринолитические эффекты IgE, высокий уровень IgE может быть фактором риска ишемической болезни сердца [28].
Данные, полученные в исследованиях на людях и животных, которые показали повышенный уровень IgE как фактор риска ишемической болезни сердца, были ограничены только поликлональным IgE. Связь между аллерген-специфическим IgE и ишемической болезнью сердца еще не показана. В крупном и перспективном исследовании Linneberg et al. [29] наблюдали за 18 841 человеком, получавшим подкожную аллерген-специфическую иммунотерапию (SCIT), а также за 428 484 пациентами, получавшими обычное лечение аллергии (например, назальные стероиды или пероральные антигистаминные препараты) в течение 10 лет.По сравнению с традиционным лечением аллергии пациенты, получавшие SCIT, имели в целом более низкий риск смертности и ОИМ. Это исследование показало, что иммунотерапия аллергеном, которая, как известно, изменяет течение заболевания, а также иммунный ответ, также может снизить риск ишемической болезни сердца.
У здоровых субъектов и пациентов с атеросклерозом были исследованы некоторые белковые маркеры сосудистого воспаления в качестве неинвазивного индикатора атеросклероза. Наиболее изученным биомаркером воспаления при сердечно-сосудистых заболеваниях является вчСРБ [30].ВчСРБ был предложен в качестве сильного биохимического маркера в дополнение к другим традиционным факторам риска, таким как дислипидемия, гипертония, ожирение и курение [31]. Однако другие исследования показали, что вчСРБ не играет прямой роли в атерогенезе. Например, измерения вчСРБ у женщин и мужчин (старше 55 лет) в Роттердамском исследовании не внесли никакого вклада в дополнение к традиционным факторам риска [32]. Удивительно, но в нашем исследовании hsCRP был выше у контрольных субъектов.Это открытие можно объяснить тем фактом, что пациенты лечились различными лекарствами, включая антигистаминные препараты, назальные стероиды или монтелукаст, прежде чем их направили в нашу клинику, которые могли уменьшить воспаление.
Было обнаружено, что некоторые другие воспалительные маркеры, такие как VCAM-1, ICAM-1 и IL-6, связаны с атеросклерозом. Ридкер и др. [33] указали, что концентрация растворимого ICAM-1 в плазме повышается за много лет до первого инфаркта миокарда. Однако только несколько проспективных исследований оценили, является ли растворимый VCAM-1 также маркером повышенного сердечно-сосудистого риска [34].
В этом текущем исследовании не было обнаружено, что ни один из воспалительных маркеров не различается между пациентами и контрольными субъектами, хотя значения CFR предполагают атеросклеротическую тенденцию в группе пациентов. Объяснение этого открытия может заключаться в том, что это исследование было проведено на очень ранней стадии возможного будущего атеросклероза.
В заключение, результаты этого исследования, кажется, подтверждают мнение о том, что высокий уровень общего IgE может быть фактором риска развития атеросклероза.В будущих исследованиях следует выяснить, могут ли вмешательства по снижению уровня IgE, такие как лечение анти-IgE, предотвратить атеросклероз.
IgE-связанные хронические заболевания и лечение на основе анти-IgE
IgE — это иммуноглобулин, который играет центральную роль в острых аллергических реакциях и хронических воспалительных аллергических заболеваниях. Разработка препарата, нейтрализующего это антитело, представляет собой прорыв в лечении воспалительных патологий с вероятной аллергической подоплекой. Этот обзор посвящен хроническим заболеваниям, связанным с IgE, таким как аллергическая астма и хроническая крапивница (CU), а также роли моноклональных антител против IgE, омализумаба, в их лечении.Мы также оцениваем использование омализумаба не по назначению при других патологиях, связанных с IgE, и сообщаем о последних результатах, касающихся этого препарата и других новых родственных ему препаратов. На сегодняшний день омализумаб был одобрен только для лечения тяжелой аллергической астмы и лечения хронической крапивницы без ответа. При аллергической астме омализумаб продемонстрировал свою эффективность в снижении дозы ингаляционных кортикостероидов, необходимых пациентам, уменьшении количества обострений астмы и ограничении влияния на ремоделирование дыхательных путей.При КЯ лечение омализумабом быстро улучшает симптомы и в некоторых случаях приводит к полной ремиссии заболевания. При системном мастоцитозе омализумаб также улучшает симптомы, и обсуждается его профилактическое использование для предотвращения анафилактических реакций. При других патологиях, таких как атопический дерматит, пищевая аллергия, аллергический ринит, полипоз носа и кератоконъюнктивит, омализумаб значительно улучшает клинические проявления. Омализумаб действует двумя путями: секвестрируя свободный IgE и ускоряя диссоциацию комплекса рецептора I IgE-Fc ε .
1. Введение
IgE обладает уникальными свойствами среди изотипов иммуноглобулинов и играет центральную роль в патофизиологии острых аллергических реакций и хронических воспалительных аллергических заболеваний. У генетически предрасположенных людей воздействие специфических аллергенов приводит к увеличению специфического IgE, который может связываться с эффекторными клетками через высокоаффинный рецептор, известный как Fc ε RI, экспрессируемый в тучных клетках и базофилах [1].
IgE очень недолговечен в плазме (около 1 дня), но связанный с рецептором IgE может оставаться прикрепленным к клеткам в тканях в течение недель или месяцев.Более того, связывание IgE с Fc ε RI увеличивает выживаемость клеток и активацию рецепторов [2, 3], а при контакте со специфическим аллергеном вызывает высвобождение фармакологически активных медиаторов, хранящихся в гранулах тучных клеток (MC) и базофилов крови (BS ), что приводит к клиническим проявлениям гиперчувствительности 1 типа. При гиперчувствительности 1 типа в начальной фазе антиген (аллерген) презентируется антигенспецифическим клеткам CD4 + Th3, которые стимулируют выработку B-клетками антител IgE, которые также являются антиген-специфическими.Во время сенсибилизации антитела IgE связываются с Fc ε RI на поверхности MC ткани и BS крови. Последующее воздействие того же аллергена перекрестно связывает связанный IgE на сенсибилизированных клетках, что приводит к дегрануляции и секреции предварительно сформированных фармакологически активных медиаторов, таких как гистамин. Все это происходит как немедленная реакция, которая начинается в считанные секунды. Поздняя реакция, вызванная индуцированным синтезом и высвобождением лейкотриенов, хемокинов и цитокинов активированными тучными клетками, позволяет рекрутировать другие лейкоциты, эозинофилы, базофилы и лимфоциты Th3 в место воспаления.Аллергическая реакция включает такие симптомы, как кашель, бронхоспазм, хрипы, диарея и крапивница, вызванные этим процессом [1, 4].
IgE-опосредованные хронические заболевания классически лечат антигистаминными препаратами, кортикоидами и другими противовоспалительными препаратами, но некоторые пациенты не реагируют на эти методы лечения. Открытие и характеристика путей, которые управляют различными фенотипами астмы, и наше растущее понимание патофизиологии хронической крапивницы (ХК) открыли новые возможности для их лечения.Нацеливание на IgE с помощью биологических препаратов проводится при лечении более тяжелых случаев этих патологий.
Применение омализумаба (OmAb), препарата против IgE, одобрено при тяжелой аллергической астме, не контролируемой традиционным лечением, и в КН [5, 6]. Известно, что IgE участвует в других патологиях, и по этой причине омализумаб в настоящее время оценивается при таких состояниях, как аллергический ринит, атопический дерматит, пищевая аллергия, мастоцитоз и эозинофильные желудочно-кишечные заболевания [7].
В настоящее время наиболее интересной особенностью омализумаба является его эффективность в условиях, при которых ранее не сообщалось об успешном лечении [5]. Возможно, неожиданно, в некоторых сообщениях отмечена полезная роль препарата при состояниях, которые, по-видимому, не опосредованы IgE [8]. Если эта эффективность будет продемонстрирована, использование этого биологического препарата может быть расширено до лечения других заболеваний.
В последние годы был разработан ряд других препаратов против IgE. Они будут обсуждаться в этом обзоре, но никоим образом не ясно, будут ли они в конечном итоге использоваться на людях.
2. Хронические заболевания, связанные с IgE
2.1. Астма
2.1.1. Клинические проявления и эпидемиология
Астма — хроническое воспалительное заболевание дыхательных путей, характеризующееся перемежающимися симптомами со стороны грудной клетки, различной обструкцией дыхательных путей и гиперреактивностью бронхов. В последние годы произошел сдвиг в представлении об астме, которая больше не рассматривается как отдельное заболевание, а как хроническое состояние с заметной клинической неоднородностью во времени [9]. Сегодня астма считается сложным синдромом с разными фенотипами, которые имеют сходные клинические проявления, но, вероятно, имеют разную этиологию.Обстоятельства, при которых появляются симптомы, важны, потому что они могут объяснить, связано ли состояние с воздействием холодного воздуха, пыльцой или другими раздражителями. Симптомы астмы возникают приступообразно; то есть пациент долгое время здоров, хотя в тяжелых случаях клинические проявления сохраняются. В этот патогенетический процесс вовлечены различные клетки и медиаторы воспаления, что частично обусловлено генетическими факторами [10]. В настоящее время около 300 миллионов человек во всем мире страдают астмой.В детстве это заболевание чаще встречается у мужчин, но в период полового созревания оба пола поражаются в равной степени, а во взрослом возрасте оно чаще встречается у женщин. Смертность составляет около 180 000 смертей ежегодно [11].
Классически астму подразделяют на внешние и внутренние фенотипы. Внешняя астма характеризуется повышенной чувствительностью к чужеродным молекулам (веществам, белкам) и всегда связана с аллергией. Внутренняя астма охватывает все случаи астмы, не связанные с аллергией, такие как астма, вызванная инфекциями носовых пазух, хроническим синуситом, полипами носа, острым бронхитом, простудой, стрессом или физическими упражнениями.Попытки понять сложность проявления астмы и появление биологических агентов привели к возобновлению интереса к идентификации клинически значимых фенотипов. В настоящее время исследования фенотипов астмы развиваются, и все большее внимание уделяется их генетической основе и соответствующим биомаркерам; но вместо того, чтобы создавать постоянно расширяющийся список конкретных фенотипов, будущие исследования, вероятно, будут сосредоточены на выделении клинически значимых. Выявление фенотипов астмы было дополнительно уточнено изучением эндотипов, которое предоставило информацию о патофизиологических механизмах, присутствующих в различных фенотипах [9, 12].
2.1.2. Патофизиология
Астма в основном рассматривалась как Th3-опосредованный процесс, тесно связанный с атопией и эозинофильным воспалением. Однако в значительной части случаев астмы не наблюдается увеличения цитокинов Th3 [13]. Не-Th3-опосредованная астма не так хорошо изучена, как Th3-опосредованная астма. В этом обзоре мы сосредоточимся на Th3-опосредованной астме, при которой роль IgE хорошо известна.
Исследования фенотипа выявили фенотип аллергической Th3-астмы с ранним началом (обычно в период предподросткового возраста) и несколько фенотипов, связанных с Th3 с поздним началом (часто в возрасте 20 лет или позже).Клинический фенотип астмы, вызванной физической нагрузкой (ИФА), также, вероятно, имеет компонент Th3, учитывая его профиль, связанный с эозинофилами и тучными клетками [14].
Аллергическая Th3-астма с ранним началом является наиболее изученным фенотипом, составляющим 50% пациентов с астмой, и связана с другими аллергическими заболеваниями, такими как аллергический ринит и атопический дерматит. Нарушения, которые он вызывает, варьируются от легких до тяжелых [15]. Этот фенотип связан с увеличением общего и специфического IgE [16].По-видимому, существует генетический компонент астмы с ранним началом, о чем свидетельствует семейный анамнез астмы в этой группе [17]. При аллергической астме аллерген может непосредственно активировать сторожевые дендритные клетки (ДК), присутствующие в эпителии дыхательных путей [18, 19] (рис. 1). Однако бактериальные эпитопы или другие повреждения, вызванные вирусом или загрязнителями, могут действовать как инициаторы, поскольку они могут активировать эпителиальные клетки дыхательных путей. Эти клетки секретируют несколько цитокинов, таких как стромальный лимфопоэтин тимуса (TSLP), IL25 и IL33, которые могут напрямую активировать DC [20–22], и хемокины, такие как хемоаттрактантный белок-1 моноцитов (MCP1 / также называемый CCL2) и воспалительный белок макрофагов. -3 (MIP3a / также называемый CCL20), которые рекрутируют базофилы (BS).Это также вызывает увеличение количества тучных клеток (MC) в этой области [23], но неясно, связано ли это с привлечением предшественников MC, в основном фактором стволовых клеток (SCF), или с пролиферацией резидентных MC. Затем DC мигрируют во вторичные иммунные органы и через главный комплекс гистосовместимости класса II (MHCII) и OXO40L активируют транскрипцию GATA3 наивными Т-клетками. Полученные клетки Th3 будут способствовать переключению B-клеток с IgG на IgE. В зародышевых центрах цитокины IL4 и IL13, секретируемые Th3-клетками, заставляют B-клетки IgE + превращаться в плазматические клетки IgE и секретировать растворимый IgE против аллергенов.Растворимый IgE вместе с клетками Th3 возвращается в легочную ткань [24]. Эти IgE связываются с Fc и RI на поверхности клеток MC и BS. Комплекс IgE-аллерген способствует дегрануляции MC и BS предварительно сформированных медиаторов (гистамин, триптаза и т. Д.) И секреции de novo растворимых компонентов, включая лейкотриены, простагландины и другие цитокины Th3, которые способствуют длительному воспалению и рекрутменту большего количества иммунных клеток [25, 26]. Цитокин IL9, секретируемый Th3-клетками, вносит свой вклад в эту активацию MC и BS [27].
Секреция IL4 клетками Th3 способствует экспрессии ICAM-1 и VCAM-1 на поверхности кровеносных сосудов [28], что позволяет эозинофилам прикрепляться и рекрутироваться под действием хемокинов, привлекающих эозинофилы. Клетки MC, BS и Th3, такие как IL5, эотаксин 1 и эотаксин 2, или RANTES, которые также увеличивают рекрутирование и пролиферацию BS и MC [29, 30]. Все эти цитокины и растворимые молекулы, секретируемые Т-клетками, MC, BS и эозинофилами, вызывают воспаление, увеличение слизи, продуцируемой бокаловидными клетками, и бронхоспазм, характерный для острого обострения.Однако, если эта ситуация сохраняется, эти вещества вызывают необратимое повреждение эпителия и приводят к структурным изменениям, известным как ремоделирование дыхательных путей. Это ремоделирование дыхательных путей характеризуется субэпителиальным фиброзом из-за увеличения эпителиально-мезенхимальной трофической единицы и отложения коллагена, характеризующегося инфильтрацией эозинофилов и тучных клеток, а также гипертрофией гладких мышц, что приводит к хроническому сужению бронхов и снижению реакции дыхательных путей на бронходилататоры [31 ] (Фигура 1).
Поздняя форма Th3-астмы характеризуется выраженной эозинофилией, меньшей атопией и повторяющимися обострениями.Считается, что эта форма астмы не связана с триггерами аллергии. Семейный анамнез этой астмы также наблюдается реже, а генетика этого фенотипа специально не изучалась. Отсутствие клинической аллергии в этом фенотипе предполагает, что процесс Th3 отличается и, вероятно, более сложен, чем фенотип с ранним началом аллергии [13]. Респираторное заболевание, обостренное аспирином (AERD), является субфенотипом стойкой эозинофильной астмы и широко считается эндотипом.Он представляет собой тип начинающейся у взрослых астмы с высокой эозинофильностью с воспалением тканей носа и бронхов и не-IgE-опосредованной реакцией на аспирин или другие ингибиторы циклооксигеназы-1. Патофизиология AERD характеризуется повышенной продукцией цистеиниллейкотриенов [32].
Кроме того, многочисленные факторы окружающей среды, такие как курение, гормональные изменения, инфекции и ожирение, являются сопутствующими и мешающими факторами, которые могут изменять фенотип астмы и влиять на лежащий в основе иммуновоспалительный процесс.
2.2. Хроническая крапивница
2.2.1. Клинические проявления, классификация и эпидемиология
Крапивница характеризуется зудящими волдырями, которые быстро развиваются с центральным отеком и окружающей областью эритемы. Размер волдырей варьируется, и поражения длятся от одного до 24 часов. Заболевание может сопровождаться ангионевротическим отеком, определяемым как отек кожи или слизистых оболочек, который обычно не вызывает зуда, но является болезненным и длится от одного до трех дней [6]. Крапивница может быть разделена на две группы на основе ее клинических проявлений: острая форма, которая длится менее шести недель и часто является аллергической, и хроническая спонтанная крапивница (CSU), также известная как хроническая спонтанная / идиопатическая крапивница, которая проявляется ежедневно. или почти ежедневные волдыри в течение более шести недель.Это состояние поражает 0,1–0,8% населения [33, 34]. Он включает субпопуляцию пациентов с положительной аутоиммунной серологией (до 30%) в отношении рецептора IgE, IgE и антитиреоидных антител [35]. Устойчивость и тяжесть симптомов коррелируют с положительной аутоиммунной серологией, более интенсивным воспалением при биопсии кожи и устойчивостью к антигистаминным препаратам [36]. Третья общая форма заболевания известна как индуцибельная крапивница (физическая, холодовая, холинергическая крапивница или дерматографизм), но здесь мы не будем рассматривать ее.
2.2.2. Патофизиология
Хроническая спонтанная крапивница может возникать в результате высвобождения биоактивных медиаторов тучными клетками и базофилами. Однако механизм дегрануляции тучных клеток у пациентов с крапивницей остается неясным. В настоящее время мы знаем, что здесь задействованы иммунологические и неиммунологические факторы. Ключевую роль в патогенезе CSU играют вазоактивные медиаторы, высвобождаемые тучными клетками дермы. Гистамин является наиболее заметным из этих медиаторов, хотя есть и другие, такие как эйкозаноиды, цитокины и протеазы.Гистамин действует на рецепторы h2 (85%) и на h3 (15%) в коже. Связывание гистамина с рецепторами h2 вызывает зуд, расширение сосудов и отек [37]. Механизмы, кроме высвобождения гистамина, которые участвуют в CSU, включают аутоиммунитет и нарушения в передаче сигналов базофилов и базопению [37].
С точки зрения патофизиологии были определены три категории CSU (Рисунок 2).
( 1) Аллергический . В этом случае аллерген действует, стимулируя выработку IgE, который связывается с Fc ε RI, что приводит к дегрануляции тучных клеток и базофилов.
( 2) Аутоиммунные . На аутоиммунную этиологию указывают несколько данных. Аутологичная внутрикожная инъекция сывороток пациентов с CSU вызывает реакции волдыря и обострения [38]. Более того, анализ сывороток больных крапивницей выявляет аутоантитела IgG к альфа-субъединице Fc ε RI или к самому IgE [39]. Аутоантитела IgG против IgE или рецептора высокого сродства IgE вырабатываются почти у половины пациентов с CSU. Сшивание аутоантител с альфа-субъединицей Fc и RI вызывает дегрануляцию тучных клеток и базофилов крови, за которой следует высвобождение гистамина [40].IgG 1 и IgG 3 являются основными подклассами аутоантител против Fc ε RI, обнаруженными в CSU [41]. Была продемонстрирована роль комплемента, поскольку присутствие C5a увеличивает гистамин, высвобождаемый аутоантителами против Fc ε RI в нормальных тучных клетках человека и базофилах in vitro [42].
Кроме того, в CSU часто повышается небольшой процент базофилов крови, аутоантител, высвобождающих гистамин, и аллелей HLA-DR, которые обычно связаны с аутоиммунными заболеваниями [43].
( 3) Неиммунологические . Механизмы не зависят от IgE и Fc ε RI. В эту группу входят индуцибельная крапивница и крапивница, вызванная приемом лекарств. Более того, другие пациенты с CSU без аутоиммунитета или повышенного уровня сывороточного IgE также могут быть включены: в этих случаях триггер неизвестен, но он может включать изменения в других неизвестных молекулярных механизмах.
3. Лечение на основе анти-IgE
С момента идентификации IgE в качестве основных стимулов в воспалительном каскаде, разработка агентов, нацеленных на IgE, стала успешной.Среди них биологический омализумаб против IgE оказался одним из самых успешных.
3.1. Препарат против IgE Омализумаб: механизм действия
Омализумаб (OmAb) представляет собой рекомбинантное гуманизированное моноклональное антитело, которое было разработано для связывания с IgE на участке Fc (константный фрагмент), локус С-эпсилон 3, в том же домене, где связывается IgE. к Fc ε RI [44, 45]. Этот препарат был синтезирован с целью изолирования свободного IgE и уменьшения аллергического воспаления [5]. Препарат вводится подкожно и всасывается медленно.Пик концентрации в сыворотке крови достигается через 7-8 дней [5], и он выводится через ретикулоэндотелиальную систему, имея период полураспада около 26 дней.
В течение длительного времени считалось, что OmAb действует на свободный IgE (механизм () на рисунке 3) и может отменять связывание IgE с Fc ε RI + или Fc ε RII + (CD23) клетки, B-клетки, дендритные клетки (DC), эозинофилы (Eo) и моноциты. Интересно, что в последние годы было показано, что действие препарата идет дальше, отделяя связанный IgE от комплекса IgE-Fc ε RI (механизм () на рисунке 3) [46, 47].Таким образом, в диапазоне физиологических концентраций OmAb может ускорять диссоциацию предварительно сформированного комплекса IgE-Fc ε RI на поверхности тучных клеток и базофилов в дополнение к его способности нейтрализовать свободный IgE, что приводит к нарушению IgE. -воспалительный сигнальный каскад [47]. Более того, плотность экспрессии Fc ε RI на базофилах, тучных и дендритных клетках заметно падает у пациентов, получающих лечение анти-IgE в течение первой недели применения OmAb [8].Это может быть связано с тем, что IgE стабилизирует рецептор на поверхности клетки и предотвращает его интернализацию; таким образом, снижение уровня иммуноглобулина приводит к снижению экспрессии рецепторов [48–50]. Все эти события делают эти клетки невосприимчивыми к запуску IgE и уменьшают такие симптомы, как воспаление, отек и зуд. Наконец, это приводит к уменьшению количества MC / BS. Интересно, что снижение экспрессии Fc и RI также было продемонстрировано в дендритных клетках [51].
Аналогичным образом, в качестве дополнительного механизма было предложено, что комплексы OmAb-IgE могут связываться с антигенами и действовать как конкурентные ингибиторы (механизм (), описанный на рисунке 3) [52].
Также было опубликовано, что OmAb может нацеливаться на мембранный IgE (mIgE) в B-клетках IgE + , снижая экспрессию IL4R и синтез IgE и уменьшая количество этих клеток, возможно, вызывая анергию B-клеток [53] (механизм () описан на рисунке 3). Сообщалось также, что OmAb вызывает апоптоз эозинофилов [54], открытие, которое согласуется с падением эозинофилии в крови, обнаруженным у пациентов с астмой после введения OmAb [55]. Однако неясно, связано ли это с прямым действием OmAb или вызвано снижением IgE или сниженной секрецией цитокинов Т-клетками.
Подводя итог, OmAb может действовать через несколько механизмов, которые, по-видимому, влияют не только на события, запускаемые IgE, но также на жизнеспособность различных клеток, вовлеченных в эти патологии. Это приводит к быстрому и длительному уменьшению симптоматики.
3.2. Омализумаб при астме
В то время как в большинстве случаев астма контролируется противовоспалительными и бронхолитическими препаратами независимо от фенотипа, меньшая часть пациентов, около 10%, плохо реагирует. Таким образом, определение «тяжелой» астмы применяется к пациентам, симптомы или обострения которых требуют применения высоких доз ингаляционных кортикостероидов плюс второй контролер, или чье заболевание сохраняется, несмотря на лечение [56, 57].Понимание физиопатологии астмы позволило разработать методы лечения этих устойчивых случаев, основанные на моноклональных антителах против IgE, таких как OmAb.
Во многих клинических исследованиях сообщалось об эффективности OmAb, а использование этого препарата подробно рассмотрено в литературе. Среди самых крупных исследований было систематическое исследование, проведенное в 2006 году, в котором анализировалась его эффективность при аллергической астме на основе данных, полученных из 14 исследований, в которых участвовало в общей сложности 3143 пациента. Результаты показали, что терапия ингаляционными кортикостероидами, которая является основой терапии астмы, была снижена более чем на 50% у значительного числа пациентов после лечения OmAb, а некоторые пациенты смогли полностью прекратить терапию ингаляционными кортикостероидами [58].Другие клинические испытания, проведенные в последние годы, подтвердили, что лечение OmAb улучшает симптомы и снижает частоту обострений астмы и потребность в высоких дозах ингаляционных кортикостероидов [8].
В нескольких реальных исследованиях использование омализумаба было связано с отсутствием обострений и улучшением качества жизни, что отражается в уменьшении количества госпитализаций и обращений за неотложной помощью [8].
В попытке выяснить механизм действия препарата было проведено другое плацебо-контролируемое исследование с участием 41 взрослого пациента с тяжелой, неатопической рефрактерной астмой.Интересно, что OmAb негативно регулирует экспрессию Fc и RI на базофилах и плазматических дендритных клетках и увеличивает объем форсированного выдоха в первую минуту (ОФВ1) по сравнению с исходным уровнем через 16 недель у пациентов с тяжелой неатопической астмой, как это происходит при тяжелой атопической астме [ 59]. Это открытие указывает на возможную роль IgE при неатопической астме.
Стандартная продолжительность лечения OmAb на сегодняшний день не установлена. Последующее исследование показало, что после шести лет лечения OmAb у большинства пациентов наблюдалась легкая и стабильная астма в последующие три года после прекращения лечения [60].Было высказано предположение, что стойкость эффектов OmAb может быть связана с его способностью сокращать ремоделирование дыхательных путей у пациентов с астмой. Фактически, было обнаружено, что OmAb значительно уменьшал площадь стенки дыхательных путей, процент площади стенки и площадь просвета правых апикальных сегментов бронхов, в то время как при традиционной терапии изменений не наблюдалось [61]. После одного года лечения OmAb было зарегистрировано значительное среднее снижение эозинофильной инфильтрации, а также уменьшение ретикулярной основной мембраны в биоптатах бронхов пациентов с тяжелой персистирующей аллергической астмой.Эти данные показывают, что OmAb могут изменять течение заболевания из-за их возможного влияния, ограничивающего ремоделирование дыхательных путей.
3.3. Омализумаб при хронической крапивнице
В настоящее время доступно несколько вариантов лечения хронической крапивницы. Практические меры включают избегание отягчающих факторов, таких как лекарства (нестероидные противовоспалительные препараты, НПВП), алкоголь, стресс, а также местное тепло и трение. В настоящее время в руководстве рекомендуется поэтапный подход, который включает неседативные антигистаминные препараты в качестве первой линии лечения или комбинации с пероральными кортикостероидами.Контроль часто оказывается недостаточным, и дополнительные методы лечения включают антагонисты лейкотриенов или циклоспорин, а недавно добавляли OmAb, если симптомы сохраняются [6].
Использование OmAb при крапивнице было сосредоточено в основном на CSU с аутоиммунной формой [62]. Влияние OmAb на CSU с ангионевротическим отеком или без него было продемонстрировано в нескольких двойных слепых рандомизированных плацебо-контролируемых исследованиях с участием почти 1200 пациентов с относительно небольшим количеством побочных эффектов [63–66]. Хотя доза OmAb для CSU установлена на уровне 300 мг каждые 4 недели, доза 150 мг каждые 4 недели также дает эффект у некоторых пациентов, а в других случаях дозу необходимо увеличивать до 300 мг каждые две недели.В некоторых случаях признаки и симптомы крапивницы исчезают через несколько дней лечения, что является более быстрым эффектом, чем при астме, при которой улучшение начинается не ранее чем через неделю [62]. Эти данные позволили предположить другой механизм действия OmAb, помимо его способности связывать свободный IgE. Снижение уровней свободного IgE может снижать уровни плотности экспрессии рецепторов IgE на поверхности тучных клеток в долгосрочной перспективе, но это, по-видимому, не отвечает за быстрое улучшение клинических симптомов; Более вероятной причиной является способность OmAb диссоциировать предварительно связанный IgE от Fc Ɛ RI [46, 47].Тем не менее, до сих пор неясно, как OmAb работает в CSU: кроме того, тот факт, что OmAb не эффективен у всех пациентов, предполагает участие механизмов / проводящих путей в CSU, кроме каскада IgE.
Интересно, что OmAb, как сообщается, также эффективен при лечении других форм крапивницы: холодовой крапивницы, солнечной крапивницы, холинергической крапивницы, замедленного давления и симптоматической крапивницы, хотя роль IgE в этих состояниях крапивницы неизвестна [67–20]. 71].
3.4. Использование омализумаба при других заболеваниях не по назначению
3.4.1. Системный мастоцитоз, синдром гипериммуноглобулина Е и эозинофильный гастроэнтерит
Мастоцитоз — это гетерогенное заболевание, которое возникает в результате аномальной пролиферации и накопления тучных клеток в одном или нескольких органах. Когда эта инфильтрация распространяется на внекожные органы, такие как костный мозг, печень, селезенку и желудочно-кишечный тракт, несмотря на кожную инфильтрацию, диагностируется системный мастоцитоз.Считается, что повышенная локальная концентрация растворимых факторов роста тучных клеток в очагах поражения стимулирует пролиферацию тучных клеток. Нарушенный апоптоз тучных клеток и интерлейкин-6 также были вовлечены, о чем свидетельствует активация BCL-2 и высокие уровни IL6 в ткани. У большинства пациентов с системной формой присутствует активирующая точечная мутация в гене c-kit в кодоне 816 (D816V), которая, как полагают, вносит вклад в аномальную пролиферацию тучных клеток и увеличивает выживаемость тучных клеток [72]. Сообщается, что OmAb безопасен и эффективен для предотвращения рецидивирующей анафилаксии [73].Поскольку OmAb снижает экспрессию Fc ε RI на циркулирующих базофилах и тучных клетках, он, по-видимому, снижает их активность и, таким образом, снижает их потенциальную реактивность [74, 75]. Любопытно, что нет доказательств способности OmAb уменьшать количество тучных клеток, потому что уровни триптазы в сыворотке у некоторых пациентов с мастоцитозом не меняются в течение периода ответа [76]. В другом исследовании уровень триптазы в сыворотке крови снижался во время терапии OmAb у двух пациентов с мастоцитозом, но оставался неизменным у двух других [77].Механизмы, лежащие в основе симптоматического улучшения у пациентов с системным мастоцитозом, получавших OmAb, до сих пор полностью не изучены.
Синдром гипериммуноглобулина E (HIES) — это гетерогенная группа иммунных расстройств, характеризующихся очень высокими уровнями сывороточного IgE, дерматитом и рецидивирующими кожными и легочными инфекциями. Существует две формы HIES: доминантная форма, вызванная мутациями в STAT3, и рецессивная форма, генетическая причина которой неясна. Эти синдромы имеют разные проявления, течение и исходы, но оба представляют собой явное повышение уровня IgE.Исследования сообщают о клинических улучшениях у пациентов с высокими уровнями IgE в сыворотке крови и тяжелой атопической экземой, а также у пациентов с некоторыми другими симптомами после лечения OmAb [78, 79].
Эозинофильный гастроэнтерит характеризуется пятнистой или диффузной эозинофильной инфильтрацией любой части желудочно-кишечного тракта. Лечение анти-IgE с помощью OmAb связано с падением количества эозинофилов периферической крови на 35–45% и снижением эозинофилов двенадцатиперстной и антральной частей. Он эффективно блокирует связывание CD23-опосредованного аллергена с B-клетками [80].
3.4.2. Аллергический ринит, полипоз носа и респираторные заболевания, связанные с IgE
Между астмой и аллергическим ринитом существует тесная взаимосвязь. По этой причине ожидалось, что OmAb будет эффективным при лечении сопутствующего ринита у пациентов с астмой. Действительно, в одном испытании отношение шансов для положительного эффекта при рините составляло 3,56, что указывает на то, что вероятность улучшения была в три с половиной раза выше у субъектов, получавших OmAb [81]. В двойном слепом рандомизированном исследовании 2002 года комбинированная терапия OmAb со специфической иммунотерапией (SIT) для березы и пыльцы уменьшала нагрузку симптомов в течение двух сезонов пыльцы на 48% по сравнению с одной SIT [82].
При полипозе носа результаты использования OmAb менее очевидны, поскольку это состояние проявляется у неаллергических пациентов. Примечательно, что высокие уровни IgE в полипах связаны с энтеротоксином Staphylococcus aureus , действующим как суперантиген, а не атопией. Интересно, что IgE-антитела против энтеротоксина S. aureus были обнаружены в значительно более высокой концентрации у пациентов с тяжелой астмой по сравнению с контрольной группой, что свидетельствует о взаимосвязи между этими антителами и тяжестью астмы [83].В этом контексте несколько исследований с OmAb также продемонстрировали клиническую эффективность при лечении полипов носа с сопутствующей астмой [84, 85].
Омализумаб также продемонстрировал свою клиническую значимость у пациентов с аллергическим бронхолегочным аспергиллезом (ABPA), аллергической реакцией на Aspergillus , характеризующейся высоким уровнем IgE, который обычно возникает в сочетании с муковисцидозом (CF) [86, 87]. В нескольких сериях случаев также сообщалось об успешном применении OmAb у пациентов с ABPA без МВ [88, 89].
3.4.3. Атопический дерматит и буллезный пемфигоид
Атопический дерматит (БА) — одно из наиболее частых хронических воспалительных заболеваний кожи, связанных с повышенным уровнем сывороточного IgE. Острые поражения кожи при БА характеризуются интенсивным зудом, эритематозными папулами, связанными с эпидермальным межклеточным отеком, а также увеличением количества клеток Лангерганса, воспалительных дендритных эпидермальных клеток, макрофагов, эозинофилов и активированных CD4-положительных клеток Th3. Результаты использования OmAb для лечения атопического дерматита противоречивы: в нескольких отчетах о случаях исследования анти-IgE терапии у пациентов с БА было обнаружено улучшение симптомов [90, 91], но в других сообщается об отрицательных ответах у пациентов с тяжелой формой БА, получавших четырехкомпонентную терапию. месячный курс OmAb [92] или положительный ответ только у 6 из 11 пациентов [78].Для подтверждения эффективности OmAb при БА необходимы более рандомизированные контролируемые испытания, включая контрольную группу плацебо.
Буллезный пемфигоид (БП) — приобретенное аутоиммунное заболевание, проявляющееся субэпидермальными волдырями, эозинофилией и сильным зудом. Он характеризуется наличием аутоантител против буллезного пемфигоидного антигена 230 кДа в базальных кератиноцитах и коллагена 180 кДа типа XVII в зоне базальной мембраны, лежащей между эпидермисом и дермой. IgE-специфические антитела против коллагена типа XVII были обнаружены в сыворотках и образцах биопсии у большинства пациентов с БП, и было показано, что эти аутоантитела IgE являются патогенными.Клинические испытания OmAb показали эффективность в нескольких случаях [93, 94].
3.4.4. Пищевая аллергия и анафилаксия, связанная с пищевыми продуктами
OmAb вызывал значительное увеличение пороговой дозы для перорального приема пищи с арахисом, вызывающим аллергические симптомы [95]. OmAb также был полезен при введении пероральной иммунотерапии (OIT) пациентам с пищевой аллергией. В пилотном исследовании с участием детей с клиническими реакциями на коровье молоко лечение OmAb в сочетании с десенсибилизацией орального молока позволило быстро увеличить дозу молока у большинства пациентов.[96]. Сообщалось также, что OmAb эффективен при переносимости различных пищевых аллергий во время протокола OIT у 25 пациентов [97]. Таким образом, OmAb в сочетании с оральной десенсибилизацией имеет потенциальную ценность для лечения пищевой аллергии.
3.4.5. Атопический кератоконъюнктивит
Атопический кератоконъюнктивит — это тяжелое глазное заболевание роговицы, сопровождающееся реакциями гиперчувствительности немедленного или замедленного действия, которое может приводить к потере остроты зрения и слепоте. В открытом исследовании у шести пациентов, получавших OmAb, наблюдалось улучшение глазных симптомов [98].
3.5. Другие виды терапии на основе анти-IgE
3.5.1. C
ε mX Моноклональные антителаМембранно-связанный IgE (mIgE) является частью IgE-BCR и необходим для генерации изотип-специфичных ответов IgE. На В-клетках mIgE + связанная с мембраной ε -цепь существует преимущественно в длинной изоформе, таким образом обеспечивая привлекательный сайт для иммунологического нацеливания на клетки mIgE + . C ε mX-специфические антитела оказались потенциально полезными для нацеливания на клетки mIgE + с целью контроля продукции IgE [99].Это были основы для производства квилизумаба, гуманизированного моноклонального антитела IgG1, которое связывается с первичным сегментом M1, присутствующим только на mIgE, но не на растворимом IgE в сыворотке. В исследованиях фазы I и II квилизумаб снижал общий сывороточный IgE примерно на 25%. Это снижение сохранялось в течение как минимум шести месяцев после последней дозы, в отличие от OmAb, который необходимо вводить каждые 2–4 недели для поддержания пониженных уровней IgE [100]. К сожалению, у взрослых с неконтролируемой аллергической астмой 36-недельное лечение квилизумабом не оказало клинически значимого влияния на частоту обострений, функцию легких или качество жизни [101].Его использование у пациентов с рефрактерной CSU также не привело к клинически значимому улучшению, хотя оно снизило средний уровень сывороточного IgE примерно на 30% [102].
3.5.2. Лигелизумаб
Лигелизумаб (QGE031) представляет собой гуманизированное моноклональное антитело IgG1, которое с более высоким сродством связывается с доменом C-эпсилон 3 IgE. Разработанный для достижения большего подавления IgE, чем OmAb, он может преодолеть некоторые ограничения, связанные с дозированием OmAb, и достичь лучших клинических результатов. Данные доклинических экспериментов и двух рандомизированных двойных слепых плацебо-контролируемых клинических испытаний фазы I показали, что QGE031 превосходит OmAb в подавлении свободного IgE и поверхностной экспрессии базофилов Fc , RI и IgE.Эти эффекты позволили практически полностью подавить кожный укол-ответ на аллерген, который был лучше по степени и продолжительности по сравнению со случаем с OmAb [103].
3.5.3. Биспецифические антитела и сконструированные анкириновые повторяющиеся белки (DARPins)
Некоторые исследования показали, что использование биспецифических антител, которые перекрестно связывают Fc ε RI и низкоаффинный рецептор IgG (Fc γ RIIb) на тучных клетках и базофилах ингибирует аллерген-индуцированную дегрануляцию клеток [104, 105].
DARPin — это белки, полученные с помощью генной инженерии, которые обычно демонстрируют высокоспецифичное связывание с целевым белком с высоким сродством. В одном исследовании сообщалось о специфическом анти-IgE DARPin (DE53-Fc), слитом с Fc-частью человеческого IgG1, который ингибировал индуцированную аллергеном активацию базофилов в образцах различных доноров через Fc γ RIIb [106]. Со своей стороны, DARPin E2_79 способен блокировать взаимодействия IgE: Fc ε RI и активно стимулирует диссоциацию предварительно сформированных комплексов лиганд-рецептор [107].
Биспецифические антитела и DARPin представляют собой многообещающие лекарственные препараты-кандидаты для лечения заболеваний, связанных с IgE, но их потенциал для использования у людей еще не подтвержден.
3.5.4. IgE-R419N-Fc3-4
Структурные исследования OmAb облегчили создание мутанта IgE-Fc3-4 (IgE-R419N-Fc3-4), устойчивого к нейтрализации OmAb, но способного связывать Fc ε RI и Fc ε RII. Мутант IgE-R419N-Fc3-4 в комбинации с OmAb может эффективно обменивать связанный с клеткой IgE на IgE-R419N-Fc3-4, и эта обработка двойным ингибитором блокирует активацию базофилов сильнее, чем любой из ингибиторов по отдельности.Этот подход, включающий одновременное истощение антиген-специфических IgE при взаимодействии рецепторов Fc ε RI и Fc ε RII с вариантом IgE, можно использовать для дальнейшего тестирования роли IgE-зависимых регуляторных путей во время лечения анти-IgE и может предоставить многообещающий путь для улучшения существующих методов лечения анти-IgE [108].
4. Заключение
Лучшее понимание фенотипов и эндотипов астмы и хронической крапивницы позволит нам выбирать лечение на основе вероятности ответа, тем самым улучшая контроль и качество жизни этих пациентов.Количество биологических методов лечения этих заболеваний продолжает расти.
Таргетинг на IgE оказался успешным подходом к IgE-связанным заболеваниям с плохой реакцией на традиционные методы лечения. Хотя показания для OmAb в настоящее время ограничены аллергической астмой и CSU, его потенциал в лечении других сопутствующих аллергических заболеваний становится все более очевидным. Фактически, использование OmAb не по назначению показало многообещающие результаты при различных заболеваниях, в которых IgE играет ограниченную или неподтвержденную роль.Знание механизма действия OmAb может помочь выяснить взаимосвязь между всеми факторами, взаимодействующими с IgE-опосредованными патологиями, и может пролить свет на некоторые другие, не опосредованные IgE.
Таким образом, необходимы дополнительные исследования, чтобы раскрыть молекулярную информацию об этих патологиях и механизме действия биологических препаратов против IgE, таких как OmAb, а также для проверки эффективности новых лекарственных средств, нацеленных на IgE, у людей.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов относительно публикации данной статьи.
Благодарности
Эта работа была поддержана Fondo de Investigaciones Sanitarias, Ministerio de Economía y Competitividad (грант PI120032).
Иммуноглобулин E (IgE) и аллергическая астма
Астму можно охарактеризовать как аллергическую или неаллергическую. Аллергическая (внешняя) астма связана с иммуноглобулином E (IgE) — антителом, вырабатываемым иммунной системой, в данном случае в ответ на обычно безвредное вещество. Напротив, эпизоды неаллергической (внутренней) астмы обычно не вызываются воздействием вещества и не связаны с IgE.Взаимодействие с другими людьми
Учитывая роль IgE в некоторых случаях астмы, лечение может включать лечение анти-IgE для снижения количества этого антитела и его эффектов. Анализ крови для проверки уровня может помочь определить, может ли это быть полезным в вашем случае.
Филипп Рой / Getty ImagesРоль IgE
IgE естественным образом вырабатывается лимфоцитами B-клеток, типом иммунных лейкоцитов. Это антитело обычно активирует физические реакции, помогая вашему телу бороться с инфекциями.Взаимодействие с другими людьми
Для некоторых людей воздействие аллергенов — безвредных, неинфекционных веществ (например, пыли или пыльцы) — также может вызвать выработку и высвобождение IgE организмом.
В этих ситуациях антитела IgE связываются с аллергеном и вызывают воспалительную реакцию, которая может проявляться такими симптомами аллергии, как кожная сыпь, чихание и опухшие губы. Когда это приводит к астме, это считается аллергическим типом.
Общие аллергены включают:
Когда ваше тело высвобождает IgE, следует каскад иммунных ответов, некоторые из которых опосредуются другими иммунными клетками в организме.Считается, что IgE связывается и активирует несколько типов иммунных клеток, таких как:
Когда IgE связывается с любой из этих клеток, это может чрезмерно стимулировать вашу иммунную систему. Кроме того, ваши капилляры расширяются и становятся более протекающими, что усиливает воспаление, позволяя иммунным клеткам сгруппироваться вокруг аллергена.
Симптомы, вызванные избытком IgE
Когда у вас аллергическая астма, ваши бронхи (дыхательные пути) могут сужаться и воспаляться из-за прилива иммунных клеток, что быстро обостряет симптомы астмы.
Воспалительные клетки не только препятствуют прохождению воздуха через дыхательные пути, но и могут внезапно возникать спазмы дыхательных путей, затрудняя прохождение воздуха, когда вы пытаетесь дышать.
Повышенный уровень IgE может способствовать появлению таких симптомов астмы, как:
- Свистящее дыхание
- Плотность груди
- Одышка
- Рецидивирующий кашель
Симптомы обычно легкие, но они могут быть довольно серьезными и вызывать серьезные последствия, такие как опасный для жизни респираторный кризис.
Диагноз
Если у вас еще не было официального диагноза астмы, ваш врач рассмотрит ваши конкретные симптомы. Те, которые предполагают аллергическую причину вашей астмы, включают зуд в глазах, тошноту, чихание, кашель и заложенность носа.
Иногда набор симптомов может указывать на аллергическую астму, когда симптомы, как правило, возникают в связи с воздействием аллергена. Тестирование на аллергию может помочь определить, что может вызывать ваше заболевание.
Тестирование IgE
Если есть подозрение, что у вас аллергическая астма, врач может проверить уровень IgE, чтобы поставить диагноз и составить план лечения.Ваш врач рассмотрит ваши результаты в контексте ваших симптомов и других диагностических мер.
Уровень антител может варьироваться, а уровень IgE может быть нормальным, даже если у вас аллергическая астма. Высокий уровень IgE не может подтвердить диагноз астмы. Высокий уровень IgE может только указывать на то, что у вас может быть какое-то аллергическое заболевание.
Иммунные расстройства и инфекции, вызванные паразитами, также связаны с высоким уровнем IgE. Например:
- Синдром Черджа-Стросса, разновидность васкулита (воспаление кровеносных сосудов)
- Аллергический бронхолегочный аспергиллез, гиперчувствительность к почвенному грибку, известному как Aspergillus fumigatus
Дети, страдающие астмой, чаще имеют повышенный уровень IgE, чем взрослые, страдающие астмой.Астма, которая впервые начинается в зрелом возрасте, называемая астмой у взрослых, с большей вероятностью будет внутренней неаллергической астмой.
Повышенный уровень IgE подтверждает диагноз аллергической астмы, но не указывает на то, что может быть триггером (ами) ваших приступов.
Лечение
Существует ряд методов лечения аллергической астмы, в том числе по возможности избегать аллергенов, вызывающих астму. Однако не всегда удается избежать аллергенов, особенно если они широко распространены в окружающей среде.
Ингаляторы, содержащие иммунодепрессанты или бронходилататоры, обычно используются для лечения аллергической астмы.
Лечение анти-IgE — еще один подход, который можно использовать вместе с бронходилататорами. Ваш уровень IgE может помочь вашему врачу определить, может ли вам помочь лечение, снижающее IgE. Но высокий уровень не является требованием для лечения анти-IgE.
Ваш врач может рассмотреть это, если ваша астма не проходит или у вас есть побочные эффекты от вашего лечения.Снижение уровня IgE, если он повышен, является более целенаправленным методом предотвращения симптомов аллергической астмы, чем иммуносупрессия стероидами, которые долгое время были способом лечения астмы путем уменьшения воспаления.
Xolair (омализумаб) — это лекарство против IgE, одобренное Управлением по контролю за продуктами и лекарствами США (FDA) для лечения аллергической астмы у взрослых и детей старше 6 лет. Он связывается с антителами IgE, чтобы уменьшить их действие и помочь предотвращать (но не лечить) приступы аллергической астмы.
Показания к применению Xolair включают:
- Тяжелая или стойкая астма, неадекватно контролируемая с помощью ингаляционных кортикостероидов и положительного кожного теста или положительного теста на аллергию крови
- Хроническая кожная сыпь, недостаточно контролируемая антигистаминными препаратами
Xolair вводится каждые две-четыре недели в виде подкожной (подкожной) инъекции, которую вводит поставщик медицинских услуг. Побочные эффекты могут включать реакции в месте инъекции, инфекции, головные боли и боль в горле.Взаимодействие с другими людьми
Слово Verywell
Аллергическая астма вызвана чрезмерной реакцией на один или несколько конкретных аллергенов, и вы, вероятно, будете испытывать симптомы каждый раз, когда сталкиваетесь с ними. Высокий уровень IgE может подтвердить диагноз аллергической астмы, а лекарства против IgE могут помочь контролировать ваши симптомы.
Если вы уже находитесь на плане лечения аллергической астмы без надлежащего контроля над ней, поговорите со своим врачом о ваших стойких симптомах.Возможно, вам будет полезно пересмотреть свой подход к лечению.
Высокий, низкий и нормальный уровни (Ig) антител
Этот тест проверяет количество определенных антител, называемых иммуноглобулинами, в вашем организме.
Антитела — это белки, которые ваши иммунные клетки вырабатывают для борьбы с бактериями, вирусами и другими вредными захватчиками. Тест на иммуноглобулин может показать, есть ли проблемы с вашей иммунной системой.
Некоторые условия заставляют ваше тело вырабатывать слишком много или слишком мало иммуноглобулинов.
Слишком мало иммуноглобулинов в крови увеличивает вероятность заражения. Их слишком много может означать, что у вас аллергия или сверхактивная иммунная система.
Типы иммуноглобулинов
Ваше тело вырабатывает несколько различных типов иммуноглобулиновых антител, включая следующие:
Иммуноглобулин A: IgA-антитела обнаруживаются в слизистых оболочках легких, пазух, желудка и кишечника. Они также находятся в жидкостях, производимых этими мембранами, таких как слюна и слезы, а также в крови.
Иммуноглобулин G: IgG — наиболее распространенный тип антител в крови и других жидкостях организма. Эти антитела защищают вас от инфекции, «запоминая», с какими микробами вы сталкивались раньше.
Если эти микробы вернутся, ваша иммунная система знает, как атаковать их. Ваш врач может проверить наличие IgG, чтобы выяснить, инфицированы ли вы определенными видами бактерий или вирусов.
Иммуноглобулин M: Ваш организм вырабатывает антитела IgM, когда вы впервые заражаетесь новыми бактериями или другими микробами.
Они — первая линия защиты вашего организма от инфекций. Когда ваше тело чувствует захватчика, ваш уровень IgM на короткое время повышается. Затем он начнет падать по мере того, как ваш уровень IgG начнет расти, чтобы защитить вас в долгосрочной перспективе.
Иммуноглобулин E: Ваш организм вырабатывает антитела IgE, когда он чрезмерно реагирует на вещества, которые не являются вредными, такими как пыльца или перхоть домашних животных. Ваш врач, скорее всего, измерит ваш уровень IgE, если у вас будет анализ крови для проверки на аллергию.
Зачем вам может понадобиться этот тест
Ваш врач может назначить тест на иммуноглобулин, если у вас много инфекций, особенно инфекций носовых пазух, легких, желудка или кишечника.
Они также могут заказать тест, если у вас есть:
Как проводится тест
Врачи часто измеряют IgA, IgG и IgM вместе, чтобы получить снимок вашей иммунной функции. Лаборант обычно берет образец крови, вводя иглу в вену на руке. Кровь собирается в пробирку или пузырек.
Другой способ сделать этот тест — взять образец так называемой спинномозговой жидкости (CSF).
ЦСЖ окружает головной и спинной мозг. Врач возьмет образец этой жидкости с помощью люмбальной пункции (часто называемой «спинномозговой пункцией»).
Для этого вы обращаетесь в поликлинику или больницу. Техник сделает вам укол в спину, чтобы обезболить.
Скорее всего, вы будете лежать на боку, подтянув колени к груди, или сядете на стол.Техник вводит полую иглу между двумя позвонками в нижней части позвоночника и удаляет небольшое количество жидкости, чтобы ее можно было проверить.
Что означают мои результаты?
Образец будет отправлен в лабораторию для тестирования. Это может занять несколько дней.
В зависимости от ваших результатов врачу может потребоваться провести другие тесты, например:
Если у вас высокий уровень иммуноглобулина, это может быть вызвано:
Низкий уровень иммуноглобулинов означает, что ваша иммунная система не работает должным образом. ну как надо.Это может быть вызвано следующими причинами:
Тот факт, что у вас высокий или низкий уровень иммуноглобулина, не означает, что у вас есть одно из этих состояний.
Тесты для каждого человека могут отличаться в зависимости от метода, который лаборатория использует для проверки результатов. Поговорите со своим врачом о результатах анализов и узнайте, что вам делать дальше.
IgE в клинической аллергии и диагностике аллергии
Обновлено: июль 2015 г.
Сообщение: май 2003 г.,
Обновил:
Джей Портной, Мэриленд
Профессор педиатрии
Медицинский факультет Университета Миссури и Канзас-Сити
Директор отдела аллергии, астмы и иммунологии
Детская больница и клиники милосердия
Канзас-Сити, Миссури, США
Введение
В 1919 году врач наблюдал после переливания крови случай преходящей астмы, вызванной аллергией на перхоть лошади.Это было первое указание на наличие в крови фактора, способного опосредовать аллергическую реакцию. В 1921 году Prausnitz & Küstner выполнили пассивный перенос этого вещества, чтобы искусственно вызвать положительный кожный тест. После этого начались поиски реагина, но до 1960-х годов считалось, что реагиновая активность не является одним неделимым молекулярным видом, а присутствует в аллергических сыворотках в форме лабильных комплексов. Это радикально отличалось от иммунных антител, которые были известны в то время.
Новый иммуноглобулин
В 1966-67 гг. Группа Ishizaka в Денвере, штат Колорадо, США, сообщила о применении антисыворотки, которая могла препятствовать реагиновой активности. Этот фактор, предположительно представляющий новый иммуноглобулин, был условно назван yE-глобулином. Несмотря на многочисленные попытки, группе не удалось очистить yE-глобулин, который, как теперь известно, присутствует в сыворотке крови в крайне низких концентрациях.
Независимо от этой работы Беннич и Йоханссон в 1965 году открыли новый класс иммуноглобулинов, условно названный IgND.Был обнаружен атипичный миеломный белок, обладающий известными физико-химическими свойствами реагина. Было показано, что PK-реакцию можно блокировать дозозависимым образом с помощью изолированных IgND или Fc-фрагментов белка ND. Используя радиоиммуноанализ, нормальный аналог можно было обнаружить в сыворотке здоровых людей, и было обнаружено, что пациенты с аллергической астмой имели в среднем в шесть раз более высокую концентрацию IgND, чем нормальные люди или пациенты с неаллергической астмой. Был разработан новый радиоиммуноанализ, радиоаллергосорбентный тест (RAST), способный выявлять аллерген-специфические антитела IgND к аллергену, и их присутствие в сыворотке крови коррелирует с результатами кожных тестов.
Реагенты были обменены между лабораториями в США и Швеции в 1967 году. Было обнаружено, что антисыворотка к yE-глобулину реагировала с изолированным белком ND, и что очищенный белок ND мог блокировать реакцию анти-yE-глобулина в биологической тестовой системе. на реактивную активность. В Справочном центре ВОЗ по иммуноглобулинам в Лозанне, Швейцария, в феврале 1968 года исследователи из двух групп встретились, и было решено, что имеющиеся данные об уникальной структуре, антигенных свойствах и биологической активности IgND, подкрепленные данными по yE-глобулину, позволит объявить новый иммуноглобулин, который получил название IgE.
IgE — полезная или патологическая молекула?
На основании наблюдения, что аллергические реакции обычно поражают кожу, кишечник и дыхательные пути, основные места паразитарной инвазии, считается, что IgE возник как защитный механизм против паразитарного заражения. Гельминты стимулируют интенсивную выработку IgE, в том числе паразитарно-специфических антител IgE. Однако другая гипотеза полезной функции антител IgE заключается в том, что они играют ключевую роль в очень раннем распознавании чужеродного материала («функция привратника») или в общем потенцировании ответа иммунной системы за счет улучшенной презентации антигена.Фактически, аллергия, вызванная IgE, может оказывать благотворное влияние на хозяина; Типичные аллергические реакции выделения слизи, чихания, зуда, кашля, сужения бронхов, слезоотделения, воспаления, рвоты и диареи — все это механизмы, которые изгоняют аллергенные белки из организма.
Роль IgE в аллергическом воспалении
Сенсибилизация
Иммунный ответ при аллергии начинается с сенсибилизации. Когда, например, вдыхают клещи домашней пыли или аллергены пыльцы, антигенпредставляющие клетки в эпителиальной выстилке дыхательных путей легких и носа интернализуются, обрабатывают и затем экспрессируют эти аллергены на своей клеточной поверхности.Затем аллергены передаются другим клеткам, участвующим в иммунном ответе, особенно Т-лимфоцитам. В результате ряда специфических клеточных взаимодействий В-лимфоциты трансформируются в секреторные клетки антител — плазматические клетки. При аллергическом ответе плазматическая клетка продуцирует IgE-антитела, которые, подобно антителам других изотипов иммуноглобулинов, способны связывать специфический аллерген через его Fab-часть. Различные аллергены стимулируют выработку соответствующих аллергенспецифических антител IgE.После образования и высвобождения в кровоток IgE связывается через свою Fc-часть с высокоаффинными рецепторами на тучных клетках, оставляя свой аллергенспецифический рецепторный сайт доступным для будущего взаимодействия с аллергеном. Другие клетки, которые, как известно, экспрессируют высокоаффинные рецепторы IgE, включают базофилы, клетки Лангерганса и активированные моноциты. Производство аллергенспецифических IgE-антител завершает иммунный ответ, известный как сенсибилизация.
Повторное воздействие аллергена
При повторном воздействии связывание аллергена с IgE регулирует иммунную систему, чтобы инициировать более агрессивную и быструю реакцию памяти.Перекрестное связывание достаточного количества антител IgE, связанных с тучными клетками / базофилами, аллергеном запускает процесс внутриклеточной передачи сигналов, который приводит к дегрануляции клеток с высвобождением медиаторов воспаления. Тучные клетки пытаются поддерживать фиксированное количество незанятых высокоаффинных рецепторов IgE на своей клеточной поверхности. Антитела IgE связываются с этими рецепторными участками, ожидая встречи со своим специфическим аллергеном. Чтобы поддерживать постоянным количество незанятых участков рецептора IgE, тучная клетка регулирует экспрессию рецептора IgE, вероятно, в ответ на уровни циркулирующего IgE.
Ранние и поздние фазовые реакции
Ответ иммунной системы на воздействие аллергена можно разделить на две фазы. Первый — немедленная гиперчувствительность или реакция ранней фазы, которая возникает в течение 15 минут после воздействия аллергена. Вторая, или поздняя фаза, реакция возникает через 4-6 часов после исчезновения симптомов первой фазы и может длиться несколько дней или даже недель. Во время ранней фазы реакции химические медиаторы, выделяемые тучными клетками, включая гистамин, простагландины, лейкотриены и тромбоксан, вызывают местные тканевые реакции, характерные для аллергической реакции.Например, в дыхательных путях к ним относятся чихание, отек и секреция слизи с расширением сосудов в носу, что приводит к заложенности носа, и бронхоспазм в легких, что приводит к хрипу. Во время реакции в поздней фазе в легких клеточная инфильтрация, отложение фибрина и разрушение тканей в результате стойкой аллергической реакции приводят к повышенной реактивности бронхов, отеку и дальнейшему привлечению воспалительных клеток. Эти наблюдения предполагают, что IgE играет важную роль в ответе иммунной системы на аллергены в силу своей способности запускать высвобождение медиатора тучных клеток, что приводит непосредственно к реакциям как ранней, так и поздней фазы.
Чтобы посмотреть видео об аллергической реакции, опосредованной IgE, щелкните здесь.
IgE и номенклатура аллергических заболеваний
Понимание иммунологических механизмов, лежащих в основе аллергического заболевания, привело к пересмотренной номенклатуре, которая связывает клинические симптомы с инициирующим иммунологическим механизмом. Суть этой новой номенклатуры можно найти в нескольких языковых переводах на веб-сайте Европейской академии аллергологии и клинической иммунологии.Чтобы просмотреть полный документ, щелкните здесь.
Аллергия определяется как «реакция гиперчувствительности, опосредованная иммунологическими механизмами», которая может быть опосредована антителами или клетками. В большинстве случаев антитело, обычно ответственное за аллергическую реакцию, относится к изотипу IgE, и людей можно отнести к страдающим IgE-опосредованным аллергическим заболеванием, например, IgE-опосредованной астмой. Атопия — это личная или семейная склонность к выработке антител IgE в ответ на низкие дозы аллергенов, обычно белков, и, как следствие, к развитию типичных симптомов астмы, риноконъюнктивита или аллергического кожного заболевания.То, что обычно известно как «атопическая экзема / дерматит», — это не одно, отдельное заболевание, а скорее совокупность нескольких заболеваний с определенными общими клиническими характеристиками, и был предложен термин «синдром атопической экземы / дерматита». Подгруппа, связанная с аллергической астмой и риноконъюнктивитом, IgE-ассоциированная подгруппа AEDS, может быть соответственно названа атопическим дерматитом / атопической экземой.
Клинические и лабораторные тесты для обнаружения аллергенспецифических антител IgE
Кожные тесты на аллергию
Кожные пробы укола можно использовать для определения специфической сенсибилизации IgE.Кожа маркируется для тестирования с помощью панели соответствующих аллергенов для пациента, выбранных на основе истории болезни и знания аллергенов, обычно встречающихся в данной местности. Положительные и отрицательные тесты сравнения с использованием гистамина и физиологического раствора также должны быть выполнены, чтобы доказать, что кожа способна демонстрировать положительную реакцию, и предотвратить интерпретацию ложноположительных результатов, возникающих в результате дерматографизма.
Для проведения кожной пробы укола можно использовать различные методы.В одном методе капля раствора аллергена помещается на кожу в каждой отметке, и используется свежая тонкая стерильная игла или ланцет, чтобы аккуратно проколоть кожу через каждую каплю, вводя небольшой объем раствора аллергена в дерму. В другом методе используется пластиковое колющее устройство, которое доставляет на кожу определенное количество аллергена. Их можно объединить в несколько уколов, чтобы можно было проводить несколько тестов одновременно. Через 10-15 минут результаты интерпретируются со ссылкой на контрольные тесты.При отсутствии реакции волдыря на отрицательный контроль наличие волдыря на месте кожного укола аллергеном диаметром 3 мм или более указывает на присутствие антител IgE, специфичных к этому аллергену. При интерпретации в сочетании с историей болезни результаты кожного укола могут подтвердить диагноз IgE-опосредованного заболевания и идентифицировать причинные аллергены. Кожные прик-тесты особенно надежны для ингаляционных аллергенов. Однако различия в реакции между тестами и тестировщиками ограничивают его использование опытным персоналом.Чтобы посмотреть видео демонстрацию кожного укола, щелкните здесь.
Тесты in vitro на специфические антитела IgE.Открытие IgE позволило разработать иммуноанализы на IgE и IgE-антитела, что сделало возможным прямое и объективное измерение степени и специфичности иммунного ответа. Иммуноанализы, такие как RAST (радиоаллергосорбентный анализ), FAST (флуоресцентный аллергосорбентный тест) и ELISA (иммуноферментный иммуноферментный анализ), были разработаны с использованием различных систем обнаружения.Для каждого анализа аллергены связываются с бумажными дисками или полиуретановыми крышками (ImmunoCAP) и инкубируются с сывороткой человека. Связывание IgE, специфичного к аллергенам, обнаруживают с помощью ферментно-связанного антитела против человеческого IgE, что приводит либо к колориметрическому, либо к флуоресцентному продукту, который можно измерить. Существует хорошая корреляция между результатами сывороточных тестов на антитела IgE, положительными кожными и провокационными тестами, а также симптомами аллергии. Положительные результаты in vitro на конкретный аллерген демонстрируют сенсибилизацию IgE, но не являются доказательством того, что аллерген является причиной клинических симптомов.
Измерение аллергенспецифических антител IgE в сыворотке имеет диагностическое значение, аналогичное показателям кожных проб, но имеет гораздо более высокую воспроизводимость и не зависит от текущих симптомов или лечения, например, антигистаминных препаратов или противовоспалительной терапии. В некоторых случаях, особенно у лиц с пищевой аллергией, где в редких случаях даже кожный укол с небольшим количеством аллергена может вызвать анафилактическую реакцию, тесты in vitro с использованием образцов крови являются безопасным методом для определения уровней специфических антител IgE.Тесты in vitro также предпочтительны для людей с широко распространенной экземой, что исключает кожные уколы.
Приблизительно 500 различных аллергенов теперь доступны для диагностики аллергии in vitro. В дополнение к классической пыльце, перхоти и пищевым аллергенам доступны лекарства, профессиональные химические вещества и рекомбинантные аллергены. Общедоступность хорошо стандартизированных тестов на аллергию in vitro значительно повысила качество диагностики аллергии.
Идентификация повышенного общего IgE в отличие от специфического IgE в сыворотке, секрете или на поверхности клеток не имеет большого диагностического значения.Причина в том, что митогенные факторы вирусов (например, цитомегаловирус — CMV), бактерий (например, Staphylococcus ), гельминтов (например, Ascaris, Schistosoma ) и адъювантных факторов загрязнения воздуха (например, сигаретный дым и выхлопные газы дизельных двигателей) ) стимулируют выработку молекул IgE, не вызывая аллерген-специфической IgE-сенсибилизации. Однако выработка IgE-антител немного увеличит общий уровень IgE, и, таким образом, повышенный общий IgE в пуповинной крови является высокочувствительным, но низкой специфичностью предиктором аллергии.С другой стороны, очень низкий общий IgE указывает на низкую вероятность специфической сенсибилизации IgE.
Радиоаллергосорбентные пробы (РАСТ)
Открытие IgE позволило разработать иммуноанализы на IgE и IgE-антитела, что сделало возможным прямое и объективное измерение степени и специфичности иммунного ответа. В RAST аллергены связаны с бумажными дисками или полиуретановыми колпачками (CAP — RAST) и вступают в реакцию с сывороткой человека. Связывание IgE, специфичного к этому аллергену, выявляют с помощью ферментно-связанного антитела против человеческого IgE в колориметрической реакции.Результаты тестирования RAST показывают очень хорошую корреляцию между наличием антител IgE в сыворотке и положительными кожными и провокационными тестами, а также симптомами аллергии. Положительные результаты RAST на конкретный аллерген демонстрируют специфическую сенсибилизацию IgE, но не доказывают, что аллерген является причиной клинических симптомов.
Измерение аллергенспецифических антител IgE в сыворотке имеет диагностическое значение, аналогичное показателям кожных проб, но имеет гораздо более высокую воспроизводимость и не зависит от текущих симптомов или лечения, например, антигистаминных препаратов или противовоспалительной терапии.В некоторых случаях, особенно у лиц с пищевой аллергией, где в редких случаях даже кожный укол с небольшим количеством аллергена может вызвать анафилактическую реакцию, RAST с использованием образцов крови является безопасным методом для определения уровней специфических антител IgE. RAST также является предпочтительным тестом для людей с широко распространенной экземой, что исключает кожные уколы.
Приблизительно 500 различных аллергенов теперь доступны для диагностики аллергии на основе RAST. В дополнение к классической пыльце, перхоти и пищевым аллергенам доступны лекарства, профессиональные химические вещества и рекомбинантные аллергены.Общедоступность хорошо стандартизированных тестов на аллергию in vitro значительно повысила качество диагностики аллергии.
Измерение общего IgE, а не антител IgE, в сыворотке, секрете или на поверхности клеток не имеет большого диагностического значения. Причина в том, что митогенные факторы вирусов (например, цитомегаловирус — CMV), бактерий (например, Staphylococcus ), гельминтов (например, аскарида , Schistosoma ) и адъювантные факторы загрязнения воздуха (например, сигаретный дым и выхлопные газы дизельных двигателей) ) стимулируют выработку молекул IgE, не вызывая аллерген-специфической IgE-сенсибилизации.Однако выработка IgE-антител немного увеличит общий уровень IgE, и, таким образом, повышенный общий IgE в пуповинной крови является высокочувствительным, но низкой специфичностью предиктором аллергии.
Роль атопии в развитии аллергической болезни
Лица с семейным анамнезом атопии имеют повышенный риск развития сенсибилизации IgE, и атопическая конституция также является основным фактором риска развития аллергических заболеваний, таких как аллергическая астма, ринит или атопический дерматит / атопическая экзема.Вклад генетических факторов в развитие сенсибилизации IgE и семейный анамнез IgE-опосредованного заболевания составляет 70-80%. Риск развития аллергического заболевания в конкретном органе связан с семейным анамнезом заболевания этого органа.
Ранние признаки аллергического заболевания, особенно атопического дерматита / атопической экземы, и наличие антител IgE, специфичных к ингаляционным аллергенам, являются важными факторами риска более поздней респираторной аллергии. IgE-антитела в сыворотке крови младенца к основным пищевым белкам, e.g., куриное яйцо, может быть признаком «атопического марша» (атопический дерматит / атопическая экзема с последующим аллергическим ринитом и / или астмой).
Можно ли предотвратить сенсибилизацию IgE?
Механизмы первичной сенсибилизации до сих пор практически неизвестны. Избегание контакта с аллергеном лишь частично помогло предотвратить IgE-сенсибилизацию. Избегать его сложно, и он может серьезно ограничить образ жизни, польза невелика, а долгосрочные эффекты сомнительны.До недавнего времени было рекомендовано, чтобы младенцы с высоким риском аллергии могли получить пользу, избегая домашних животных и пылевых клещей в течение первого года жизни, но новые исследования показывают, что у некоторых людей контакт с пушистыми животными (но не с пылевыми клещами или тараканами) может привести к иммунологической толерантности, а не к иммунологической сенсибилизации. Аналогичное открытие было недавно обнаружено для раннего введения арахиса как способа предотвращения сенсибилизации к арахису у младенцев из группы риска.
Некоторые ранние респираторные инфекции, e.g., бронхиолит, вызванный коклюшем и респираторно-синцитиальным вирусом (RSV), а также некоторые формы гастроэнтерита могут усиливать IgE-сенсибилизацию и, таким образом, усиливать аллергические заболевания, хотя относительное отсутствие раннего воздействия микробов (как желудочно-кишечного, так и респираторного) может также способствовать развитию аллергические заболевания. Предотвратить сенсибилизацию IgE можно в производственной среде путем устранения сенсибилизирующих агентов на рабочем месте или принятия мер по предотвращению воздействия на сотрудников.Было показано, что курение является фактором риска развития антител IgE к профессиональным агентам и оказывает адъювантное действие с раздражающими газами, такими как озон и сера. Таким образом, помимо других преимуществ для здоровья, политика отказа от курения на рабочем месте может сыграть роль в предотвращении сенсибилизации к IgE.
Сводка
Существуют довольно хорошие сведения о различных стадиях аллергической реакции, но, несмотря на имеющиеся знания, распространенность аллергических заболеваний все еще увеличивается.В некоторых регионах промышленно развитого мира поражено до 50% населения. Необходимо приложить больше усилий для понимания аллергической сенсибилизации и способов ее предотвращения. Выявление патологической роли IgE и последующее высвобождение медиаторов воспаления и цитокинов позволило врачам лечить аллергические симптомы с учетом основных иммунологических механизмов. Новая фармакотерапия в виде гуманизированных моноклональных антител против IgE, предназначенных для устранения IgE, может сыграть важную роль в лечении людей, сенсибилизированных к IgE.