Как измерить базальную температуру, чтобы определить овуляцию? Практический гайд
Проверено экспертом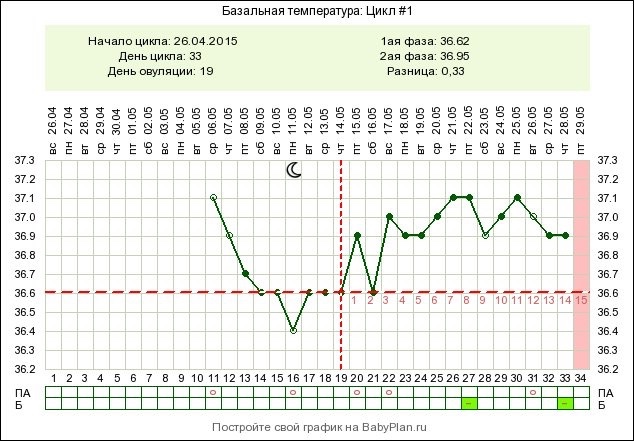 Расскажем, как правильно это делать, чтобы забеременеть быстрее.
Расскажем, как правильно это делать, чтобы забеременеть быстрее.Базальная температура в течение дня
Изменение БТ на протяжении дня
Некоторых женщин интересует, как меняется базальная температура в течении дня. Отметим, что под этим показателем понимают такую температуру, которая обнаруживается в состоянии покоя. В таких условиях она является самой низкой. Их можно обеспечить, если человек спал на протяжении не меньше восьми часов, причем сон был полноценным и не прерывался, он находится в полностью расслабленном состоянии. Необходимо, чтобы на протяжении не меньше восьми часов не было коитуса и перед измерением женщина не вставала.
Измерение базальной температуры в течение дня
Известно, что ее рекомендовано измерять только в утреннее время. Только тогда параметры БТ являются наиболее информативными. Базальная температура днем не имеет диагностического значения.
Измерение базальной температуры в течении дня для определения беременности и начала овуляции не дает никаких диагностических данных, следовательно, оно неинформативно или малоинформативно.
Базальная температура в середине дня повышается. Это объясняется активностью человека. А вот если человек расслаблен, то удается достичь наиболее правдоподобных диагностических значений. Температура резко изменяется и может повышаться во время приема еды, выполнения тяжелой физической работы. Даже употребление алкоголя и большинства лекарственных медикаментов приводит к тому, что у человека существенно нарушаются процессы термогенеза, и БТ в прямой кишке значительно отличается от той, что была утром.
Значительное количество женщин интересует, какая базальная температура в течение дня и не меняется ли она к вечеру.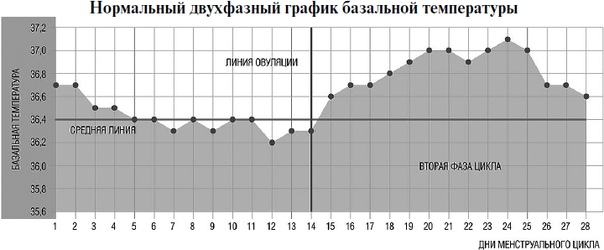
Какая должна быть базальная температура вечером?
Вечернее измерение базальной температуры при обычном ритме женщины не допускается, потому что и в этом случае она будет далекой от реальной. Измерение базальной температуры вечером допустимо лишь в том случае, если женщина в силу образа работы ведет ночной образ жизни. Тогда вечером ее измерять можно лишь в том случае, если перед процедурой был полноценный сон продолжительностью не меньше пяти часов. Это очень важно для того, чтобы можно было добиться высокой точности результатов.
Базальная температура за два дня до менструации должна понижаться. Если измерять ее на протяжении дня, то невозможно будет увидеть динамику таких изменений и узнать, наступило ли оплодотворение.
Чего нельзя делать при измерении? При получении показателей категорически не допускается:
- вставать с постели до того, как термометр будет вставлен в прямой кишечник и получены результаты;
- двигаться в постели и совершать резкие движения;
- принимать накануне лекарственные препараты, которые могут существенно нарушить нормальные параметры базальной температуры;
- употреблять крепкие алкогольные напитки накануне замера;
- менять градусник;
- изменять места введения термометра с целью получения данных о базальной температуре;
- держать измерительный прибор меньше чем пять минут;
- разговаривать во время процедуры.

Соблюдение всех правил измерения позволит получить достоверные данные. А по ним можно будет составить точный график, показывающий динамику всех процессов в женском организме.
Видео
Базальная температура
Акушерство и гинекология Базальная температураИзмерение базальной температуры является самым простым и дешевым из известных методов определения овуляции и планирования беременности.
Что означает базальная температура
Базальная температура, это температура тела человека, находящегося в покое при условии полного расслабления. Такие условия возникают тогда, когда человек длительное время лежит, не испытывает мышечного и психического напряжения, а последний прием пищи осуществлялся как минимум 8 часов назад. Как правило это наблюдается сразу после сна, до подъема с постели и открытия глаз. Базальная температура тела – это минимально необходимая температура для поддержания жизнедеятельности.
Когда температура тела может повышаться
Все знают, что температура тела поднимается при простуде и инфекционных заболеваниях. Однако в течение дня температура может повышаться и у здорового человека. При выполнении физической нагрузки, при стрессах, прием пищи, лекарств и алкоголя у человека меняется термогенез. Даже для того, чтобы сидеть на стуле, читать или смотреть телевизон необходимы минимальные мышечные усилия. Эти усилия повышают частоту сердечных сокращений и незначительно увеличивают обмен веществ, что вызывает подъем температуры на десятые доли градусов.
У женщин, помимо этих общих факторов воздействия на температуру тела, есть еще очень важные факторы – изменения уровня гормонов в течение менструального цикла.
Как гормоны влияют на базальную температуру
Известно, что женский половой гормон прогестерон вызывает повышение температуры тела. Прогестерон вырабатывается желтым телом, которое образуется из фолликула в результате выхода яйцеклетки.
О чем свидетельствует подъем базальной температуры
Подъем базальной температуры отражает повышение уровня прогестерона в крови женщины. Повышается уровень прогестерона при овуляции. Следовательно подъем базальной температуры является показателем состоявшейся овуляции. Овуляция – самый важный процесс во всем репродуктивном здоровье женщины. Именно во время овуляции яйцеклетка способна к оплодотворению. Как только произошло это событие, яйцеклетка сохраняет способность быть оплодотворенной в течение 24 часов. Учитывая, что время жизни сперматозоидов составляет максимум 72 часа, половой контакт для удачного оплодотворения должен произойти не ранее, чем за 3 дня до ожидаемой овуляции. Зная точное время овуляции,можно значительно повысить шансы забеременеть или наоборот, рассчитать безопасные для половых контактов дни, когда вероятность забеременеть будет минимальна. Многие пары испытывают проблемы с зачатием или подвергаются риску нежелательной беременности именно из-за незнания таких простых вещей.
Именно во время овуляции яйцеклетка способна к оплодотворению. Как только произошло это событие, яйцеклетка сохраняет способность быть оплодотворенной в течение 24 часов. Учитывая, что время жизни сперматозоидов составляет максимум 72 часа, половой контакт для удачного оплодотворения должен произойти не ранее, чем за 3 дня до ожидаемой овуляции. Зная точное время овуляции,можно значительно повысить шансы забеременеть или наоборот, рассчитать безопасные для половых контактов дни, когда вероятность забеременеть будет минимальна. Многие пары испытывают проблемы с зачатием или подвергаются риску нежелательной беременности именно из-за незнания таких простых вещей.
Преимущества и недостатки метода измерения базальной температуры
Основным преимуществом методики является ее простота, доступность и бесплатное осуществление. Все, что нужно, это педантичность в измерениях. Все, что понадобится –ручка, лист бумаги и термометр. Для сравнения, процедура фолликулометрии – контроль созревания фолликула и визуализация овуляции при помощи УЗИ стоит от 500-600 гривен и требует времени на посещение врача. Недостатком метода измерения базальной температуры является то, что признаки овуляции – косвенные. Температура может повышаться и от других причин, например при простудных заболеваниях. Для избежания такого риска проводят измерения на протяжении 3 месяцев, что требует сильной мотивации со стороны женщины. Кроме этого, хотя овуляция и является необходимым условием оплодотворения, все же это условие не явлеется единственным. Например при состоявшейся овуляции и непроходимости маточных труб или изменениях в полости матки беременность все равно не наступит.
Недостатком метода измерения базальной температуры является то, что признаки овуляции – косвенные. Температура может повышаться и от других причин, например при простудных заболеваниях. Для избежания такого риска проводят измерения на протяжении 3 месяцев, что требует сильной мотивации со стороны женщины. Кроме этого, хотя овуляция и является необходимым условием оплодотворения, все же это условие не явлеется единственным. Например при состоявшейся овуляции и непроходимости маточных труб или изменениях в полости матки беременность все равно не наступит.
Как правильно измерять базальную температуру
Базальная температура измеряется лежа в постели сразу после сна, желательно с закрытыми глазами. Термометр помещается в прямую кишку на несколько минут. Результаты измерения записываются в сетку, где по горизонтали отмечаются дни, а по вертикали температура. Последний прием пищи должен быть не позднее, чем за 8 часов до измерения. Начинают измерения с первого дня месячных. Продолжают на протяжении 3 менструальных циклов. Анализ графика очень простой: замечают повышение температуры на более, чем 0.4 градуса. Если в течение 3 циклов эти повышения совпадают по дням цикла, делается вывод о том, что овуляция происходит. Если температура не меняется – овуляции не происходит. При нарушениях менструального цикла анализировать график базальной температуры сложнее и лучше обратиться к врачу.
Продолжают на протяжении 3 менструальных циклов. Анализ графика очень простой: замечают повышение температуры на более, чем 0.4 градуса. Если в течение 3 циклов эти повышения совпадают по дням цикла, делается вывод о том, что овуляция происходит. Если температура не меняется – овуляции не происходит. При нарушениях менструального цикла анализировать график базальной температуры сложнее и лучше обратиться к врачу.
Почему базальную температуру измеряют именно в прямой кишке?
Температура тела человека имеет разные значения в различных частях. Существуют зоны, где температура меняется очень быстро и является нестабильной – например конечности. Более стабильные зоны – подмышечные впадины. Однако на температуру в них влияет плотность примыкания термометра к коже, а следовательно этот показатель будет нестабильным от измерения к измерению. Определение температуры во рту более точно, но и на нее влияет дыхание и выделение слюны. Температура в прямой кишке достаточно стабильна и мало подвержена влияниям извне, так как к стенке прямой кишки примыкает венозной сплетение, поддерживающее постоянную температуру. Именно стабильность и является главным критерием выбора прямой кишки как места, где измеряется базальная температура.
Является ли измерение базальной температуры достаточным критерием
Повышение базальной температуры, хотя и является признаком овуляции, все же не является абсолютным критерием способности забеременеть у женщины. Помимо наличия овуляции необходимо убедиться в проходимости маточных труб путем соногистеросальпингографии (гидроэхотубации). Очень удобно сочетать эти два метода женщинам, у которых нет возможности посещать врача несколько раз для контроля овуляции при помощи УЗИ. В таком случае за одно посещение делается проверка проходимости маточных труб, а затем амбулаторно в течение 3 месяцев женщина может самостоятельно определить, есть ли у нее овуляция. Сопоставление данных, полученных при УЗИ и при измерении базальной температуры дает полную ясность относительно способности забеременеть. Естественно, что все эти усилия нужно прилагать лишь тогда, когда в течение года интенсивной половой жизни без предохранения беременность не наступает.
Можно ли мерить базальную температуру вечером или днем?
Нормативный показатель температуры человеческого тела – 36,6°С, но если копнуть глубже, то это не совсем та цифра. В течение суток она колеблется, так как в организме каждую минуту происходит энергетический обмен. Одни белки, жиры и углеводы распадаются, а другие образовываются. Эти процессы обусловлены выделением тепловой энергии, которая концентрируется в межклеточном веществе и клетках тела.
Больше всего таких процессов происходит в печени, поэтому этот орган самый горячий 38°С. Температура в прямой кишке и ротовой полости варьирует от 37,3 до 37,6°С, а кожные покровы в этот же момент гораздо прохладнее: 36,6 в подмышечной зоне и примерно 28°С в области пятки.
Для чего нужно измерять БТ?
Базальная температура демонстрирует величину нагрева человеческого организма только внутренними органами. Без учета тепла, которое вырабатывают мышцы при работе нижних, верхних конечностей и туловища. Попросту говоря, базальная температура – это температура тела, зафиксированная сразу после пробуждения только головного мозга, а не всего организма в целом. Мерить ее нужно сразу после сна, лежа в постели еще с закрытыми глазами.
Базальную температуру можно измерять для того чтобы:
- Определить овуляцию и благоприятные дни для зачатия ребенка;
- Определить дни, в которые можно не предохраняться во время секса;
- Диагностировать беременность на ранней стадии;
- Оценить гормональное состояние женщины.
На сегодня это наиболее эффективный, доступный и дешевый метод определения гормонального дисбаланса и овуляции. Для ранней диагностики беременности он не слишком подходит, только если у женщины здоровый организм и стабильный менструальный цикл.
Правила измерения
Базальная температура тела измеряется каждое утро в одно и то же время (± 30 мин.), не поднимаясь с постели и при помощи обычного ртутного градусника;
- Сон до момента измерения должен длиться не менее 4-6 часов;
- Градусник вводят в ректальное отверстие (прямую кишку), можно вводить во влагалище или в рот. Наиболее точные показания будут, если вводить градусник в ректальное отверстие. В ротовой полости температурный показатель всего на 0,25-0,5°С выше, чем в подмышечной ямке. Данный способ используют при диагностике заболеваний щитовидной железы;
- Время измерения – 7-10 минут. Нельзя измерять температуру каждый день разными способами. Если взялись мерить во влагалище, значит, на протяжении всего времени нужно мерить только там. Под мышкой БТ не измеряется. Нельзя менять градусники;
- Для достоверности показателей желательно отказаться от курения, приема алкогольных напитков, избегать стрессов. Не точные показания могут быть вызваны бессонницей, оральными контрацептивами, снотворным, разными заболеваниями (воспалениями), частыми перелетами или переездами, половым актом за несколько часов до пробуждения, перееданиями на ночь;
- Чтобы старания не оказались тщетными, не забывайте класть вечером сбитый градусник рядом с постелью, так чтобы легко можно было дотянуться рукой;
- Показатели за 3-4 цикла измерений заносятся в график, который потом необходимо предъявить врачу. График представляет собой две оси координат: температура и день месяца. Для определения беременности достаточно информации за несколько дней.
БТ в разное время суток
Базальная температура с каждым дополнительным часом сна увеличивается, поэтому ее следует измерять в одинаковое время и желательно до 8-ми часов утра. В течение дня температура тела и внутренних органов человека постоянно меняется и это нормально. Она зависит от физической нагрузки, приема пищи, испытанных эмоциональных напряжений, одежды и других факторов внешней среды.
Найти днем оптимальное время для измерения практически не возможно. Если вечером и утром биологическая активность организма умеренная, то днем она может приближаться к максимальному значению.
БТ вечером всегда выше утренних показаний, измерять ее в это время суток не рекомендуется. Но если вы бодрствуете ночью, то можно измерять БТ днем после сна длительностью не меньше 5 часов.
Базальная температура, зафиксированная утром спросонок, может отличаться от температуры вечером на один градус. Для медицинского анализа это вполне большое расхождение. Именно утренняя величина – норма, от которой отталкиваются женщины и лечащие их врачи.
Диагностика беременности
Вести график базальной температуры можно начинать еще при планировании беременности и заканчивать наблюдения после первого триместра. Он дает относительно достоверную информацию о работе яичников, состоянии маточного эпителия. Работу данных органов контролируют гормоны прогестерон и эстроген, периодически увеличиваясь и уменьшаясь в определенные дни.
Часто «метод градусника» повергается критике: не соблюдение правил измерения приводят к смазанным результатам и запутывают женщину при анализе. Безусловно, медицинское обследование гораздо надежнее, но нет ничего плохого в самостоятельных наблюдениях за состоянием собственного здоровья во время беременности. Вреда от дополнительных мер предосторожности не возникнет, если не избегать обязательного медицинского сопровождения.
Из-за вечернего упадка сил базальная температура при беременности может опускаться на 0,1-0,2°С. Температуру днем не учитывают, от различной степени активности организма она склонна к понижению и повышению каждый час.
Как меняется температура в течение цикла
Менструальный цикл состоит из двух фаз. В зависимости от фазы колеблется базальная температура. В первой фазе цикла свое влияние оказывает эстроген, а после овуляции (вторая фаза) начинает действовать прогестерон. В период менструации температура всегда повышенная (37°С). По окончанию месячных снижается до 36,2 — 36,7°С. Овуляция проходит со скачком до 36,9-37,2°С на протяжении трех дней, поэтому ее легко можно вычислить и узнать дату выхода яйцеклетки в следующем месяце. Вторая фаза цикла обусловлена повышенной температурой, а за неделю до очередных месячных происходит понижение до прежнего значения – 36,2-36,7. Если БТ продолжает держаться на уровне 37°, то гормон прогестерон начал подготавливать матку к приему оплодотворенной яйцеклетке. Это первый признак беременности до задержки.
Однако нужно учитывать, что помимо беременности, повышенную БТ в конце второй фазы могут вызывать инфекционные гинекологические заболевания, физические нагрузки и некоторые лекарства. Повышенный показатель сохраняется на протяжении почти всей беременности.
Существует мнение, что перед выкидышем или замиранием плода происходит понижение. Воспринимать данную информацию всерьез не нужно. Однократное снижение может быть связано с общим состоянием организма либо погрешностью измерения при беременности. Но если наблюдается стойкое снижение, то можно перестраховаться и обратиться к врачу. Повышение до 37,8°С и выше также может быть тревожным сигналом организма о протекании процессов воспаления во время беременности.
Базальная температура: измеряем правильно
Значения базальной температуры помогают отследить овуляцию — момент выхода яйцеклетки. Дни овуляции (так называют несколько суток до, день овуляции и сутки после) являются самыми благоприятными для зачатия. Такая информация актуальна и для планирующих беременность женщин, и для тех, кто пока решил с этим повременить. Как же правильно мерить базальную температуру?
В течение всего цикла базальная температура меняется. Весь период цикла делится на две фазы: фолликулярную и лютеиновую. Фолликулярная фаза длится от первого дня менструации до овуляции: в этот период происходит рост фолликула, из которого потом выйдет яйцеклетка. Базальная температура в данное время не превышает 37°С, а в момент овуляции опускается еще ниже. После овуляции наступает лютеиновая фаза: на месте вышедшей яйцеклетки возникает желтое тело, продуцирующее прогестерон и эстроген на случай, если беременность произойдет. Базальная температура при этом держится на отметке 37°С и за несколько дней до менструации начинает снижаться. Если этого не происходит, наступила беременность.
Что нужно знать для верного измерения базальной температуры?
- Базальную температуру измеряют по утрам, примерно в одно и то же время. По сути это температура тела в период абсолютного покоя. Поэтому измерение следует проводить сразу после пробуждения, не вставая с кровати, после 2-3 часов непрерывного сна.
- Базальную температуру можно измерять не только в прямой кишке. Это самый распространенный вариант, но есть еще оральный и влагалищный способ. Важно использовать один и тот же термометр постоянно, независимо от того, каким образом вы будете измерять температуру.
- График необходимо составлять на протяжении нескольких месяцев (5-6). В течение этого времени следует записывать температуру каждый день.
- На базальную температуру влияют многие факторы. Значения могут подскочить на фоне простуды, воспалительных заболеваний органов малого таза, после употребления алкоголя, если вы спали менее 2 часов. Это не значит, что нужно отказываться от ведения наблюдений: такие дни просто следует отмечать особо.
- Базальная температура резко повышается при внематочной беременности — до 37,5°С и выше. Если вы заметили подозрительные симптомы, самочувствие ухудшилось, следует немедленно обратиться к врачу.
- Фиксировать данные можно с помощью специальных мобильных приложений. Таким образом легче отследить динамику, сохранить и сравнить данные за несколько месяцев.
График базальной температуры не является надежным способом контрацепции. Несмотря на то, что с его помощью можно определить дату овуляции, полагаться только на эти сведения опасно. Особенно это касается женщин, которые недавно родили ребенка, кормят грудью, перестали принимать оральные контрацептивы, вступили в период предменопаузы. Если вы решили пока повременить с беременностью, проконсультируйтесь со своим гинекологом о более надежных способах предохранения.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Читайте также
повышение и понижение в 1 и 2 фазах
Как меняется базальная температура в течение цикла? Почему на протяжении дня происходят колебания БТ? В каких случаях повышается базальная температура? В этой статье вы найдёте ответы на эти и другие важные вопросы.
Измерение базальной температуры – самый простой способ высчитать оптимальные дни для зачатия ребенка. Измерения на протяжении цикла помогут определить уровень выработки гормонов, отследить процесс созревания яйцеклетки. С помощью данного метода можно узнать о беременности на ранних сроках.
Базальная температура меняется по дням цикла, поэтому необходимо делать измерения каждый день в одно и то же время и записывать данные в график. При этом важно знать, какой должна быть базальная температура в начале и в средине цикла и какие показания считаются оптимальными в последней фазе.
Норма БТ является относительной величиной. Показатели меняются в зависимости от индивидуальных особенностей организма.
Если даже во время всего цикла наблюдалась норма, то стоит учитывать, что базальная температура играет опосредованную роль: важными являются не показатели, а разница температуры между двумя фазами цикла. В норме она должна составлять не меньше 0.4°С.
Как меняется базальная температура в течение дня
В течение дня базальная температура меняется, причем разница в значениях может быть существенной. Базальная температура днём, как правило, выше, чем утром. Дневные измерения могут достигать возможного максимума. Днём в организме проходят основные процессы, наступает активная фаза, во время которой задействованы все органы.
Утром и вечером активность организма низкая, поэтому многие считают, что показания БТ в эти периоды должны быть одинаковыми. На самом деле это не так. Утренние показания и вечерние разнятся в пределах одного градуса. Для графика БТ такая разница является существенной. Почему базальная температура вечером, когда организм находится в состоянии покоя, выше, чем утром? В вечернее время биологические процессы в организме начинают замедляться, тогда как утром они ещё не запустились. Из-за этого появляется температурная разница, хотя кажется, что показания утром и вечером в состоянии покоя должны быть идентичны.
БТ – температура покоя, поэтому измерять её для графика нужно утром, после шестичасового непрерывного сна. Именно на утренние показания ориентируются врачи.
Базальная температура в первой фазе цикла
В первой фазе цикла средняя базальная температура равна 36,6, норма в этот период колеблется в пределах 36,7 – 36,8. Начать измерять БТ можно в любой день цикла. Однако для создания точного графика требуется, чтобы базальная температура была измерена в самом начале цикла, то есть, в первый день менструации. В первой фазе могут наблюдаться скачки базальной температуры. Скачки бывают трёх видов:
- Ступенчатые. Резкое изменение температуры в сторону повышения. Высокая температура наблюдается на протяжении трёх дней, а затем вновь происходит скачок.
- Постепенные. Каждый день температура увеличивается на 0,1 градус.
- Подъём с возвратом. Сначала наблюдается повышение температуры, на следующей день она опускается ниже разделительной линии, после чего вновь поднимается.
Высокая базальная температура в первой фазе цикла
В первой фазе цикла может наблюдаться повышенная базальная температура. Если все измерения были проведены корректно, то это является сигналом для обращения к врачу. В организме могут проходить воспалительные процессы.
Почему в первой фазе появляется высокая базальная температура, если со здоровьем всё нормально? Причины высокой температуры в этот период могут быть разными. Чаще всего повышение наблюдается после стрессовых ситуаций, приёма алкоголя, бессонной ночи. Также при утренних измерениях можно наблюдать высокую температуру, если поздно ночью был половой контакт. Если ваш сон длился меньше шести часов, то, скорее всего, на градуснике вы увидите «необычную» температуру. Чтобы исключить показания, полученные в нестандартных ситуациях, в графике необходимо соединить пунктиром только корректные температурные данные. Также важно отметить возможную причину повышения БТ.
Низкая базальная температура в первой фазе цикла
В первой фазе низкая БТ является нормой. Перед овуляционным подъёмом часто наблюдается снижение температуры на 0,1 – 0,2 градуса. Если цикл длится 28 дней, то в первой фазе БТ начинает постепенно увеличиваться. На 12-ый день можно наблюдать резкий скачок температуры вниз. Это – естественный процесс, который называется предовулярное западание. Если низкая базальная температура держится весь цикл, то необходимо обратиться к врачу. Во второй фазе крайне важно, чтобы БТ поднялась.
Базальная температура во второй фазе цикла
Вторая фаза цикла – это период после выхода яйцеклетки из фолликула. Во второй фазе базальная температура должна быть в среднем равна 37 градусам, однако норма может быть и выше, ведь показания ещё зависят и от способа измерения. Какая базальная температура считается нормальной во второй половине цикла? В пределах нормы считается БТ от 37,2 до 37,3, однако в некоторых случаях могут быть незначительные поправки с учётом индивидуальных особенностей организма. Если во второй фазе базальная температура по соотношению с температурой первой фазы не поднимается, то стоит записаться на приём к гинекологу. Это может свидетельствовать о нарушениях в работе половых органов.
Если во второй фазе наблюдается резкий скачок базальной температуры, то это должно насторожить вас. Когда базальная температура во второй фазе нехарактерно скачет, это может указывать на недостаток эстрогенов либо же на воспаление придатков. При скачках дату овуляции определить будет сложно.
Во второй фазе цикла базальная температура является индикатором проблем. Если в конце цикла ваша базальная температура не совпадает с нормой, то это может указывать на патологии репродуктивной системы.
Высокая базальная температура во второй фазе цикла
Если во второй фазе наблюдается повышенная базальная температура, то это сигнал к походу к гинекологу. По БТ второго цикла определяются как проблемы со здоровьем (киста, воспаление), так и беременность. О беременности свидетельствует высокая БТ, которая держится больше двух недель. При беременности высокая температура сопровождается задержкой месячных. В любом случае нужно обратиться к врачу, так как измерения могут быть ошибочными, особенно если вы составляете график впервые.
Низкая базальная температура во второй фазе цикла
Почему во второй фазе наблюдается низкая базальная температура? Если в этот период средняя температура не доходит до 36,8 градусов, то это свидетельствует о различных проблемах. Низкая БТ второй фазы наблюдается при:
- недостаточности жёлтого тела;
- эстроген-прогестероновой недостаточности.
Если во второй фазе цикла происходит западение базальной температуры, то есть, её резкое снижение, это – признак беременности. Имплантационное западение наблюдается лишь один день: БТ снижается до уровня средней линии.
Когда повышается базальная температура
Повышение базальной температуры: что это означает? Почему базальная температура повышается в различные периоды? Давайте разбираться. Повышение БТ чаще всего является признаком наступившей беременности. Определить, что в вашем теле зарождается новая жизнь можно, если:
- высокая БТ держится на три дня больше фазы жёлтого тела;
- если повышение наблюдается больше 18 дней подряд;
- если в двухфазовом графике происходит третий скачок температур.
Нормально протекающая беременность сопровождается высокой БТ (37,1 – 37,3) в период от зачатия до 20 недель. После четырёх месяцев температура постепенно снижается, необходимость измерений пропадает.
Высокая БТ не всегда свидетельствует о том, что зачатие состоялось. В каких ещё случаях обычно повышается базальная температура? Причины, из-за которых состоялось повышение базальной температуры в двухфазовом цикле, могут крыться в физиологических особенностях организма. Нехарактерное повышение температуры наблюдается при патологиях половых органов.
Высокая базальная температура, а тест отрицательный
Нередко бывают ситуации, когда базальная температура повышена, а тест при этом отрицательный. Сказать наступила ли беременность в этом случае может только врач. Иногда тесты подводят и не определяют беременность на ранних сроках. Однако проблема несоответствия БТ и результатов теста может заключаться не в тесте: повышенная температура может сигнализировать о заболеваниях. Своевременное обращение к врачу поможет решить проблему со здоровьем (если она действительно есть), что ускорит долгожданную беременность.
Оцените материал:
спасибо, ваш голос принят
Что такое базальная температура и как её измерять
Что такое базальная температура
Базальной называют температуру, которая измеряется в прямой кишке, во рту или влагалище. Но это понятие — не про место измерения.
Греческое слово basis означает «основа», «база». Соответственно, базальная температура — «базовая». Она представляет собой температуру тела в состоянии полнейшего покоя.
У каждого человека своя базальная температура. Как правило, она колеблется от 36,1 °C до 36,6 °C.
Базальную температуру можно поймать утром, сразу после сна, но строго до того, как вы подниметесь с постели: от любой физической активности тело разогревается, поэтому измерения окажутся неверными.
Сейчас читают 🔥
Зачем надо измерять базальную температуру
Базальная температура тесно связана с гормонами. В зависимости от гормонального фона она может немного снижаться или, напротив, расти. Эти изменения отслеживают, ежедневно используя термометр и фиксируя полученные значения на графике. Получается примерно такая картинка:
Иллюстрация: Tatata / Wikimedia CommonsКлючевое влияние на изменения базальной температуры оказывает женский гормон эстроген, поэтому получившийся график наиболее информативен для женщин. У мужчин колебания будут не такими выраженными.
График базальной температуры считается одним из методов естественного планирования семьи. Он подходит тем парам, которые не форсируют события, но в целом не против завести детей. Способ довольно ненадёжный. Например, у некоторых женщин овуляция не сопровождается резким повышением температуры. Или этот показатель растёт, но из‑за ОРВИ. Стресс, недосып и другие факторы тоже играют роль в колебаниях базальной температуры.
Но если об этих факторах знать и вносить в чертёж пометки, риск ошибок можно свести к минимуму. Просто фиксируйте изменения месяц за месяцем — и в конце концов обнаружите закономерности, которые позволят вам разобраться в тонкостях лично вашего менструального цикла. Вот что можно сделать с помощью графика.
Наглядно увидеть, как развивается месячный цикл
В первой половине цикла базальная температура колеблется примерно от 36,1 °C до 36,4 °C и день ото дня меняется плавно, снижаясь или повышаясь буквально на 0,1 °C.
Определить овуляцию
Во время овуляции яйцеклетка выходит из яичника и отправляется в матку. Пара дней до и после этого события считаются самым «плодородным» периодом месячного цикла. Замечено, что непосредственно перед выходом яйцеклетки базальный показатель резко падает, а когда она направляется в путешествие по маточной трубе — поднимается, вплоть до 37 °C.
Если вы хотите завести ребёнка, стоит заняться незащищённым сексом сразу после того, как вы увидели на графике провал и следующий за ним стремительный рост.
Высчитать «безопасные» в плане возможного зачатия дни
Если вы надеетесь избежать беременности, незащищённый секс запрещён с начала менструального цикла и до 3–4 дней после «овуляционного» повышения базальной температуры.
Если вы не готовы к беременности, выбирайте более надёжный метод контрацепции — презервативы или назначенные вашим гинекологом противозачаточные средства.
Предсказать, когда наступят месячные
Это случится вскоре после того, как температура начнёт снижаться до стандартных для первой половины цикла значений.
Обнаружить беременность
Если «овуляционное» повышение температуры не снижается в течение 18 дней, скорее всего, вы беременны .
Как измерять базальную температуру
Прежде всего, вам понадобится термометр. Подойдёт обычный ртутный или электронный, но лучше всё же купить базальный: такие гаджеты более точны и удобнее для использования в прямой кишке или во влагалище. Термометр надо подготовить заранее, положив с вечера на тумбочку возле кровати.
Вот несколько важных правил измерения:
- Определяйте температуру в одном и том же месте. Выбирайте любую локацию: рот, анус, влагалище. И в дальнейшем не меняйте её.
- Старайтесь измерять температуру в одно время. Поблажка — максимум полчаса‑час. Например, если вы начали делать это в 8 утра, термометр не должен использоваться раньше 7 часов и позже 9. Если соблюсти время не удалось, сделайте на графике пометку — результат может быть не совсем достоверен.
- Высыпайтесь. Для точного результата вы должны проспать не менее 3 часов до начала измерения.
- Пользуйтесь термометром строго до того, как поднялись с постели. Если вы измеряете в 8, но сегодня проснулись в 6, потому что захотелось в туалет, сначала узнайте температуру. Так результаты будут более достоверными.
- Меряйте температуру исключительно лёжа. Именно поэтому важно, чтобы термометр находился на прикроватной тумбочке — вы должны легко дотягиваться до него рукой.
- Записывайте температуру сразу после измерения — чтобы не забыть и не запутаться в примерно одинаковых значениях.
- Стройте график на миллиметровой бумаге. Обязательно отмечайте любые события, которые могли повлиять на точность измерений. Например, поздний отход ко сну, бессонница, секс, простуда, приём алкоголя, смена часовых поясов, стресс и другие факторы. Такие пометки помогут объяснить возможные необычные колебания.
- Составляйте график хотя бы три месяца подряд, чтобы отследить в нём закономерности.
Читайте также 🤰🌡🤱
Как работает Bt?
Как работает Bt ?
Bt необходимо съесть, чтобы вызвать смертность. бат токсины растворяются в кишечнике насекомых с высоким pH и становятся активными. Токсины затем атакуйте клетки кишечника насекомого, пробивая отверстия в подкладке. Споры Bt выходят из кишечника и прорастают в насекомых. вызывая смерть в течение пары дней.
Хотя токсин не убивает насекомое сразу, обработанные части растения не будут повреждены, потому что насекомое перестает питаться в течение нескольких часов. Споры Bt не передаются другим насекомым и не вызывают вспышки болезней сами по себе.
1. Насекомое поедает Bt кристаллов и споры. 2. Токсин связывается со специфическими рецепторами кишечника и насекомых. перестает есть. 3. Кристаллы вызывают разрушение стенки кишечника, в результате чего возникают споры. и нормальные кишечные бактерии попадают в организм. 4. Насекомое погибает по мере размножения спор и кишечных бактерий в тело. |
Bt Действие очень специфическое. Различные сорта из Bt специфичны для различных рецепторов в стенке кишечника насекомых. Bt токсичность зависит от распознавания рецепторов, повреждения кишечника токсином происходит при связывании с рецептором. Каждый вид насекомых обладает различные типы рецепторов, которые будут соответствовать только определенным токсиновым белкам, как замок на ключ.
Именно из-за этого фермеры должны быть осторожны. для сопоставления целевых видов вредителей с конкретным токсиновым белком Bt что характерно для этого насекомого. Это также помогает полезным насекомым потому что они обычно не пострадают от штамма Bt .
Изменения в развитии и экспрессии генов CYP6AE14, CYP6B2 и CYP9A12
Abstract
Культуры Bt способны продуцировать Cry-белки, которые изначально присутствовали в бактериях Bacillus thuringiensis .Хотя Bt-кукуруза очень эффективна против кукурузных мотыльков, испанские посевы также поражаются ушным червем H. armigera , который менее восприимчив к Bt-кукурузе. В этой низкой восприимчивости к токсину могут быть задействованы многие механизмы, включая метаболическую устойчивость насекомых к токсинам, обусловленную монооксигеназами цитохрома P450. В данной статье исследуется реакция личинок H. armigera последней стадии возраста на питание с использованием Bt и не Bt листьев кукурузы в процессе развития личинок и на экспрессию генов трех цитохромов P450: CYP6AE14, CYP6B2 и CYP9A12.Личинки, питавшиеся сублетальными количествами токсина Bt, показали снижение потребления пищи и снижение роста и веса, что препятствовало достижению большинством из них критического веса и окукливанию; Кроме того, после однодневного кормления Bt-диетой у личинок наблюдалось небольшое увеличение ювенильного гормона II в гемолимпе. Личинки, получавшие диету без Bt, показали наивысшую экспрессию CYP6AE14, CYP6B2 и CYP9A12 через день после кормления диетой без Bt, а всего через два дня экспрессия резко снизилась, что, вероятно, связано с программой развития последнего возраста. .Более того, хотя ответ генов P450 на аллелохимические вещества растений и ксенобиотики в целом был связан со сверхэкспрессией у резистентных насекомых или индукцией генов во время кормления, экспрессия трех изученных генов подавлялась у личинок, питавшихся насекомыми. Bt токсин. Неожиданный ингибирующий эффект токсина Cry1Ab в генах P450 личинок H. armigera следует тщательно изучить, чтобы определить, связана ли эта реакция как-то с низкой восприимчивостью вида к токсину Bt.
Образец цитирования: Muñoz P, López C, Moralejo M, Pérez-Hedo M, Eizaguirre M (2014) Реакция последней инстанции Helicoverpa armígera Личинок на проглатывание токсина Bt: изменения в развитии и CYP6AE214 и CYP6AE214, CYP6AE214 и CYP6AE214 Экспрессия гена. PLoS ONE 9 (6): e99229. https://doi.org/10.1371/journal.pone.0099229
Редактор: Марио Соберон, Институт биотехнологии, Национальный автономный университет Мексики, Мексика
Получено: 5 декабря 2013 г .; Принята к печати: 13 мая 2014 г .; Опубликовано: 9 июня 2014 г.
Авторские права: © 2014 Muíoz et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана грантом Испанского агентства НИОКР (Comisión Interministerial de Ciencia y Tecnología) в рамках проекта AGL2011-23996. Спонсор не принимал участия в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Культуры Bt способны продуцировать Cry-белки, которые изначально присутствовали в бактериях Bacillus thuringiensis . Испания — европейская страна с наибольшим количеством гектаров, засеянных кукурузой Bt, 25,3% от общего количества 97 346 гектаров, отведенных под кукурузу, и эта площадь увеличивается с момента внедрения кукурузы Bt в 1998 году [1].Единственный посев Bt — это MON 810, который экспрессирует белок типа Cry1Ab, который высокоэффективен против кукурузных мотыльков Ostrinia nubilalis [2] и Sesamia nonagrioides [3]. Посевы кукурузы в Испании подвергаются нападению со стороны этих двух кукурузных мотыльков и других личинок чешуекрылых, которые менее восприимчивы к токсину Bt: питателя листьев Mythimna unipuncta и кукурузного червя Helicoverpa armigera [4]. Перес-Хедо и др. [4] предположили, что в низкой чувствительности этих двух чешуекрылых могут быть задействованы множественные механизмы, включая высокую скорость выведения токсина внутри перитрофической мембраны.Выведение токсина внутри перитрофической мембраны может происходить из-за быстрого выведения, как это происходит у личинок M. unipuncta [5], или из-за высокой скорости разложения внутри этого пространства. Недавно Gonzalez-Cabrera и др. [6] указали, что низкие уровни протеолитических ферментов, участвующих в активации Cry-токсина, могут быть еще одной причиной низкой чувствительности M. unipuncta к Bt-токсину.
Насекомые обладают тремя ферментными системами, обеспечивающими метаболическую устойчивость к токсинам: эстеразами, монооксигеназами цитохрома P450 и глутатион-S-трансферазами [7].P450 представляют собой мультигенное суперсемейство ферментов, которые обнаруживаются в путях биосинтеза экдистероидов и ювенильных гормонов [8], и могут быть самым мощным механизмом детоксикации, доступным для насекомых при воздействии чужеродного агента [9]. Несколько авторов опубликовали прекрасные обзоры роли этих ферментов у насекомых [9], [10], [8], включая рост, развитие, питание, устойчивость к пестицидам и толерантность к токсинам растений [11] — [12]. Когда устойчивость к инсектицидам опосредуется монооксигеназами, это обычно происходит из-за повышенной детоксикации или снижения активации ксенобиотиков [11] из-за сверхэкспрессии или индукции генов P450 [13] — [16].Ответ насекомых на аллелохимические вещества растений и другие ксенобиотики также опосредуется монооксигеназами [17] — [20].
У гусениц-фитофагов высокая экспрессия гена Р450 также связана с периодами активного питания [10], [8], [21]. Однако гусеницы не питаются непрерывно в течение каждого личиночного возраста, но демонстрируют разные фазы, которые могут быть связаны с подъемом и падением экспрессии P450 во время стадии, о которой сообщил Агосин [9]. Более того, личинки последней стадии подвергаются фагопериоду, который длится несколько дней, за которым следует фаза прекращения питания и массовая очистка кишечника от материала [22].Прекращение кормления из-за достижения критического веса [23] совпадает с изменением программы развития, характеризующейся отключением всех тел и секрецией ювенильного гормона (ЮГ), что приводит к высвобождению проторацикотропного гормона. активация переднегрудных желез с последующим окукливанием насекомого.
Недавние исследования показали, что H. armigera выработала полевую устойчивость к токсину Cry1Ac в Китае [24] и к фенвалерату хлопка в Австралии [25].Кроме того, Zhou et al [26] сообщили о сверхэкспрессии нескольких генов P450 из H. armigera в ответ на ксенобиотики.
Таким образом, учитывая возможность развития устойчивости H. armigera к токсину Cry1Ab кукурузы в полевых условиях, мы решили проанализировать реакцию личинок на прием сублетальных количеств токсина Bt в отношении пищевого поведения, уровня JH и экспрессия нескольких генов P450, идентифицированных как монооксигеназы, отвечающие на ксенобиотики.
Материалы и методы
Насекомые
Личинки H. armigera были первоначально собраны с разрешения владельца (Josep Piqué) на коммерческом поле кукурузы, не относящейся к Bt, в Лериде, Испания (координаты GPS 41 ° 46’55.48»N, 0 ° 31’39.3»E. ) и обновляется каждый сезон. Личинки выращивались на полуискусственной диете [27]. Взрослым особям давали раствор сахара (10%), поддерживали температуру 21 ° C и высокую влажность (> 60%) при фотопериоде свет: темнота 16: 8 ч.
Влияние токсина Bt на развитие личинок
Отобрали гусениц 6-го возраста после линьки (L 6 0), которым был предоставлен полуискусственный рацион, содержащий 9% лиофилизированной кукурузы без Bt (без Bt диеты) или Bt (Bt диета) листьев кукурузы и 3% кукурузной муки. (все проценты относятся к влажной диете) [28].Каждый день до появления куколок или гибели личинок (по 24 личинки в каждом типе рациона) помещали в чистый ящик и взвешивали личинок, проглоченную пищу и образовавшуюся мочу. Усвоение проглоченной пищи (усвояемость) и способность превращать проглоченную и переваренную пищу в рост оценивали с помощью ковариационного анализа [29]. Усвоение пищи было исследовано путем корректировки количества продуцируемой муки с потреблением пищи как ковариантой. Способность превращать съеденную пищу в рост исследовали путем вычитания веса фрэйса из веса съеденной пищи и использования результата в качестве ковариаты для увеличения веса личинок [30].Кроме того, потребление пищи личинками, получавшими Bt-диету или не-Bt-диету для всех возрастов, сравнивали с потреблением пищи личинкой, получавшей Bt-диету в течение трех дней, а затем с диетой без Bt для остальной части возраст.
Регистрировали также продолжительность возрастов и вес куколок. Односторонний дисперсионный анализ ANOVA был использован для анализа влияния Bt и не Bt диеты на вес куколки с помощью статистического пакета JMP [31]. В случаях значимых различий использовался t-критерий Стьюдента для наименьших различий.Смертность и окукливание были проанализированы с использованием нормального приближения биномиального теста.
Коллекция Гемолимфа
Гемолимфа была извлечена из восьми живых личинок, питавшихся диетой Bt, и восьми личинок, получавших диету без Bt, в первый и третий день шестого возраста (L 6 d1, L 6 d3) путем разрезания ложной ножки с микроножницами и сбор 40 мкл от каждой личинки в градуированной стеклянной микропипетке.
Количественное определение JH II
Гемолимфу собирали во флакон с метанолом / изооктаном (1: 1, объем: объем) и метопреном в качестве внутреннего стандарта (5 нг).Раствор гемолимфы в растворителе встряхивали в течение 20 с и оставляли при комнатной температуре на 30 мин. Затем весь образец центрифугировали при 8500 x g в течение 15 минут и изооктановую фазу переносили в новый стеклянный флакон. Оставшуюся фазу метанола снова встряхивали, центрифугировали при 10000 × g в течение 30 мин и объединяли с изооктановой фазой в том же сосуде. Экстракты сушили в токе азота и хранили при -80 ° C. Экстракты разбавляли 100 мкл смеси метанол / вода (80:20, об. / Об.) Для немедленного анализа [32].JH II, преобладающий гормон в H. armigera [33], был измерен. Калибровочные кривые по пяти точкам в качестве стандарта были получены с метанолом и добавлением экстракта холостого образца, не содержащего JHII, для покрытия диапазона в обоих случаях от 1 до 100 нг / мл, с 18 нг / мл метопрена в качестве внутреннего стандарта. Для получения холостых экстрактов, свободных от JHII, личинок L6d1 декапитировали и через пять дней после декапитации экстрагировали гемолимфу [3]. В качестве инструментальных параметров использовались Acquity UPLC, соединенный с QqQ-MS TQD (Waters, Milford, MA), то есть трехквадрупольный масс-спектрометр с использованием интерфейсов ESI, APCI и APPI, и система работала под Masslynx 4.1 программное обеспечение. Хроматографическое разделение проводили при 28 ° C в изократическом режиме с использованием метанола (Waters) (80 + 20, об.: Об.) В качестве подвижной фазы. Объем инъекции составлял 15 мкл в частичную петлю с переполнением иглы. Используемая колонка представляла собой 100 мм × 2,1 мм внутренний диаметр, 1,7 мкм, Acquity UPLC BEH C18 (Waters) при скорости потока 400 мкл / мин. Требовалось полное разделение на 7 минут.
Экстракция ткани
Средние кишки, ткани с наивысшей экспрессией P450 [8], были выделены из L 6 личинок, которых кормили один (L 6 d1) и три (L 6 d3) дней на Bt-диете или без Bt-диеты, и от личинок, которых кормили в течение трех дней на диете Bt и один (L 6 d4) или три (L 6 d6) дней на диете без Bt, немедленно замораживали в жидкости N 2 и хранили при -80 ° С.
Выделение РНК и синтез кДНК
Суммарную РНК выделяли из пяти средних кишок, объединенных вместе с использованием TRIzol (INvitrogen, CA, USA), в соответствии с инструкциями производителя. РНК определяли количественно, и ее качество оценивали с помощью электрофореза в агарозном геле и измерения оптической плотности при λ260 / λ280 нм с помощью спектрофотометра Nanodrop ND-1000. Тотальную РНК обрабатывали набором Turbo DNA-free DNase (Applied Biosystems) в соответствии с протоколом производителя, чтобы удалить любые следы геномной ДНК.
кДНК первой цепи синтезировали из 2 мкг тотальной РНК со случайными гексамерными праймерами (50 нг / мкл) и дНТФ при 65 ° C в течение 5 мин, затем путем обратной транскрипции в реакциях объемом 20 мкл с использованием первой цепи SuperScript III. Набор для системы синтеза (Invitrogen, Карлсбад, Калифорния, США) в соответствии с рекомендованным протоколом. Для синтеза кДНК использовали три независимых препарата РНК, представляющих три биологических повтора для каждой обработки.
Наборы праймеров, использованные в этом исследовании, перечислены в таблице 1.Были выбраны три праймера из двух разных семейств с разным ответом на аллелохимические вещества [26]. Два из протестированных праймеров были идентичны описанным Zhou et al [26], другой праймер был переработан с использованием программного обеспечения Genomics для экспрессии. Специфичность амплификации полимеразной цепной реакции (ПЦР) проверяли анализом кривой плавления и секвенированием продуктов ПЦР.
КДНКиспользовали в последующих реакциях ПЦР, проводимых в Eppendorf Mastercycler DNA Engine Thermal Cycler PCR (Eppendorf AG, Гамбург, Германия).Реакционные смеси по 25 мкл содержали 2,5 мкл 10x буфера, 1 мкл 200 мкМ смеси dNTP, 1 мкл 10 мкМ каждого праймера (Таблица 1), 1 ЕД полимеразы Taq (BIOTOOLS, Мадрид, Испания) и 2 мкл раствора кДНК. За начальной стадией денатурирования в течение 1 мин при 94 ° C следовали 20 циклов по 20 с при 60 ° C с изменением на -0,5 ° C за цикл и 1 мин при 72 ° C; затем 30 циклов по 1 мин при 94 ° C, 1 мин при 50 ° C и 1 мин при 72 ° C; реакция завершалась через 5 мин при 72 ° C. Продукты ПЦР разделяли электрофорезом в 2% агарозном геле.
Секвенирование
продуктов ПЦР очищали и экстрагировали с помощью набора для очистки QIAquick PCR (QIAGEN, Дюссельдорф, Германия), а затем секвенировали с помощью набора для секвенирования BigDye Terminator v3.1 (Applied Biosystems, Foster City, CA, USA) и капиллярного электрофореза ABI-3130. система. Гомологии последовательностей были подтверждены поиском нуклеотидов BLAST.
Количественный анализ экспрессии гена цитохрома p450
Уровень экспрессии цитохромов P450 в тканях средней кишки был проанализирован с помощью количественной ПЦР в реальном времени (q-PCR) в соответствии с рекомендациями MIQE [34].
q-PCR проводили с использованием системы CFX 96 и IQ SYBR Green Supermix (Bio-Rad Laboratories, 2000 Alfred Nobel Drive, Hercules, CA 94547, США). EF-1α использовали в качестве эталонного гена для нормализации уровней экспрессии целевого гена среди образцов. q-ПЦР для каждого образца кДНК и контроля без матрицы выполняли, по крайней мере, в трех повторностях. Наборы праймеров, использованные в этом исследовании, перечислены в таблице 1.
Специфичность амплификации ПЦР проверяли анализом кривой плавления (Bio-Rad CFX Manager 3.0) и путем секвенирования продуктов ПЦР. q-ПЦР проводили в 25 мкл реакционной смеси, содержащей 22 мкл раствора RealMasterMix / SYBR, по 0,5 мкл каждого из прямого и обратного праймеров (10 мкМ) и 2 мкл матрицы кДНК, используя следующие параметры цикла: 95 ° C в течение 5 мин, затем 45 циклов: 95 ° C в течение 30 секунд, 55–60 ° C в течение 30 секунд и 68 ° C в течение 40 секунд. Кривые плавления ампликонов измеряли путем непрерывного считывания флуоресценции при повышении температуры с 58 до 95 ° C с шагом 0,5 ° C в течение 10 с. Для каждого гена было выполнено серийное разведение от 10 до 1000 раз каждой матрицы кДНК, чтобы оценить эффективность ПЦР.Относительные уровни экспрессии генов-мишеней рассчитывали с использованием программного обеспечения Bio-Rad CFX Manager. Значения представляют собой среднее значение различных повторов ± стандартная ошибка. Эффективности амплификации сравнивали путем нанесения на график значений ΔCt различных комбинаций праймеров серийных разведений против журнала исходных концентраций матрицы с использованием программного обеспечения CFX96. Значения Ct приводили к стандартным кривым и нормализовали по уровням EF-1α.
Преобразованные данные (sqrt (x + 0.5)) были проанализированы с помощью двухфакторного дисперсионного анализа. Результаты были выражены как среднее соотношение экспрессии (± SE) 1-дневного, 3-дневного, 4-дневного и 6-дневного личинок L 6 , получавших Bt и не-Bt диету.
Результаты
Влияние токсина Bt на пищевое поведение и развитие личинок
Пищевое поведение личинок, получавших не-Bt диету, показанную на Рисунке 1, имело три разных периода. В первый период, с L 6 d1 по L 6 d3, личинки питались активно, потребляя большее количество корма, чем количество произведенного франа.Во второй период, с L 6 d4 до L 6 d5, количество съеденной пищи и произведенного фрикаделька было примерно одинаковым. В третьем периоде количество продуцируемой муки было намного больше, чем количество съеденной пищи, что сигнализировало о периоде очищения, который закончился окукливанием личинок.
Рисунок 1. Кормление, среднесуточное значение (± стандартная ошибка) съеденного корма (г) и продуцируемого фосса (г) личинок L 6 из Helicoverpa armigera , получавших Bt или не Bt диету.
На вставке сравнивается ежедневный прием пищи личинок, которых кормили в течение всего последнего возраста на диете Bt или без Bt, с принятой пищей личинок, которых кормили на диете Bt в течение трех дней, а затем на диете без Bt для остальная часть возраста. Стрелка на вставке указывает день перехода лавы с Bt-диеты на не-Bt-диету.
https://doi.org/10.1371/journal.pone.0099229.g001
Пищевое поведение личинок, получавших корм Bt, было совершенно другим (рис. 1).Потребление корма было выше, чем количество продуцируемого до двенадцатого дня возраста, за исключением девятого дня, и резких изменений в поведении не наблюдалось. Личинки ели меньше, чем личинки, питавшиеся без Bt-диеты, но питавшиеся в течение более длительного периода. Первые куколки появились на день позже, чем личинки, питавшиеся без Bt-диеты (таблица 2), и большинство личинок погибло, не окуклившись. Личинки, которых кормили в течение трех дней на диете Bt, а затем на диете без Bt в течение оставшейся части возраста, демонстрировали резкое увеличение потребления пищи сразу после изменения рациона с последующим снижением активности кормления аналогично, но трех дней позже, чем личинки питались диетой, не содержащей Bt (вставка на рис. 1).
Таблица 2. Накопленное окукливание (%) и смертность (%) личинок Helicoverpa armigera , питавшихся не-Bt и Bt-диетой в течение всего последнего личиночного возраста или в течение трех дней с Bt-диетой, а затем с не-Bt-диетой. диета в течение остального возраста (Bt3d-nonBt).
https://doi.org/10.1371/journal.pone.0099229.t002
Окукливание и смертность значительно различались у личинок, получавших Bt-диету и не-Bt (Z = -2,85, P = 0,002), а также у личинок, получавших Bt-диету. три дня на диете Bt, а затем на диете без Bt (Z = 2.31, P = 0,001). Личинки, получавшие не-Bt диету, начинали окукливаться на шестой день и заканчивали к десятому дню возраста L 6 (таблица 2). Окукливание происходило в среднем за 7,7 дня, тогда как у личинок, питавшихся диетой Bt, окукливание происходило в среднем за 8,8 дня. Вес куколок от личинок, питавшихся диетой Bt, был разным (в среднем 0,17 г), куколок от личинок, питавшихся диетой без Bt (0,32 г), и куколок от личинок, которых кормили 3 дня диетой Bt и затем на диете без Bt (0.29 г) (F = 107,32; df = 2,66; P = 0,001).
Усвоение пищи, исследованное путем корректировки количества фрэйса, производимого при приеме пищи в качестве ковариаты, зависело от типа диеты (F = 5,21; df = 1,253; P = 0,002). Двустороннее (диета и день) взаимодействие не было значимым (F = 0,76; df = 6, 253; P = 0,60). Влияние диеты на прибавку в весе значимо зависело от дня выведения личинок последнего возраста (F = 25,5; df = 6, 253; P> 0,001) (рисунок 2), когда вычитание потребления пищи за вычетом фекалий использовалось в качестве ковариант ( F = 10.07; df = 1,253; P> 0,001). Эффективность преобразования переваренной пищи в течение первых двух дней последнего возраста была значительно выше для личинок, получавших не-Bt-диету, чем для личинок, получавших Bt-диету. Эффективность снизилась на третий день, будучи аналогичной для личинок, получавших Bt и не Bt диету. На четвертый и пятый дни последнего возраста он был выше у личинок, питавшихся диетой Bt, и в остальные дни возраста он был аналогичен для личинок, питавшихся обеими диетами.Резкое изменение способности превращения переваренной пищи у личинок, питавшихся не-Bt диетой, на 4 и 5 дни последнего возраста указывает на то, что процесс очистки, ведущий к окукливанию, уже начался.
Рис. 2. Способность превращать переваренную пищу в рост: соотношение между прибавкой в весе личинок и вычитанием веса полученной муки из веса пищи, съеденной в течение последнего возраста личинок Helicoverpa armigera , питавшихся диетой с Bt и не -Bt уходит.
Столбцы показывают наименее значимые различия (P <0,05) для каждого среднего в ANCOVA увеличения веса, когда ковариантой является «потребление пищи-фекалии».
https://doi.org/10.1371/journal.pone.0099229.g002
Эти результаты указывают на то, что на скорость роста личинок последнего возраста влиял еще один фактор, помимо потребления пищи или продуцируемой муки. Различия между скоростью роста личинок, получавших Bt-диету и не-Bt-диету, в первые два дня возраста, вероятно, связаны с более низким потреблением пищи вместе с токсическим действием токсина Bt.
Влияние проглатывания токсина Bt на уровень JH II в гемолимфе
На рис. 3 показана концентрация JHII в гемолимфе первого и третьего дня шестого возраста (L 6 d1 и L 6 d3, соответственно) личинок, получавших Bt и не Bt диету. Концентрация JH II в гемолимфе была выше у личинок, питавшихся диетой Bt в течение одного дня, чем у личинок, получавших диету без Bt (F = 6,62; df = 1,14; P = 0,02), но двумя днями позже. не было различий в концентрации JHII в зависимости от типа принятой диеты (F = 0.06; df = 1,15; P = 0,81).
Рисунок 3. Влияние токсина Bt в рационе на концентрацию JHII в гемолимфе личинок Helicoverpa armigera .
Личинок кормили на листьях, отличных от Bt или Bt, в течение одного (L 6 d1) или трех (L 6 d3) дней. Звездочка над столбцами указывает на различия между обработками, а столбцы указывают на SE.
https://doi.org/10.1371/journal.pone.0099229.g003
Количественный анализ экспрессии гена цитохрома p450
КДНКамплифицировали с помощью ПЦР со специфическими праймерами и разделяли электрофорезом.Ожидаемый размер был обнаружен для каждого цитохрома (рис. 4) и подтвержден секвенированием.
Рисунок 4. Фрагменты кДНК, полученные из тканей средней кишки личинок Helicoverpa armigera .
Были получены специфические продукты для фактора удлинения EF-1α (279 пар оснований), CYP6AE14 (241 пар оснований), CYP6B2 (140 пар оснований) и CYP9A12 (233 пар оснований).
https://doi.org/10.1371/journal.pone.0099229.g004
Результаты количественной q-ПЦР показали, что на экспрессию цитохромов CYP6AE14, CYP6B2 и CYP9A12 по-разному влияли диета и дни кормления (рис. ).
Рисунок 5. Относительная нормализованная экспрессия генов CYP6AE14, CYP9A12 и CYP6B2 в L 6 личинок Helicoverpa armigera , получавших A) в течение одного (1 дня) или трех (3 дней) дней на диете без Bt или Bt. и B) в течение трех дней на диете Bt (день 3), а затем в течение одного (4 дня) или трех (6 дней) дней на диете без Bt (Bt 3d-non Bt).
Значения представляют собой среднее значение по крайней мере трех повторов ± стандартная ошибка.
https://doi.org/10.1371/journal.pone.0099229.g005
Хотя три сравниваемых гена принадлежали к двум разным семействам, CYP 6 и CYP 9, реакция на диету без Bt (рис. 5A) была одинаковой для всех трех. Наибольшая экспрессия произошла через день после кормления, а экспрессия резко снизилась на 3-й день, что свидетельствует о более высокой активности кормления в течение первых нескольких дней возраста.
Реакция на токсин Bt была совершенно иной. Те, кто питался диетой Bt, почти полностью подавляли экспрессию гена, а экспрессия генов CYP6AE14, CYP6B2 и CYP9A12 у личинок, получавших диету Bt, составляла 4.В 4, 125 и 25 раз ниже, чем у личинок, получавших один день на диете без Bt. Экспрессия трех генов у личинок, получавших Bt-диету, увеличилась через два дня, но незначительно, и была выше, чем у личинок, получавших не-Bt-диету, только для гена CYP6AE14 (фиг. 5A). Когда личинки изменили тип диеты через три дня после кормления диетой Bt (фиг. 5B), экспрессия генов CYP6AE14 и CYP6B2 оставалась низкой у личинок, получавших диету Bt.Только ответ гена CYP9A12 увеличился после перехода на диету без Bt в одном из выполненных повторений, показывая двойное (образец x повторение) взаимодействие (F = 21,43; df = 2,17; P <0,001).
Обсуждение
Развитие последней стадии H. armigera шло по схеме, описанной Nijhout и Williams [22]. Личинки увеличивали свой вес, чтобы достичь критического веса через три дня после линьки до возраста. Затем они резко снизили вес из-за очистки, что привело к окукливанию.Достижение критического веса совпадает с изменением программы развития, характеризующейся отключением всех тел и секрецией JH, что приводит к окукливанию насекомого [23].
Однако личинки H. armigera , питавшиеся сублетальными количествами токсина Bt, показали снижение потребления пищи и снижение роста и веса, что не позволило большинству из них достичь критического веса и окукливаться. Это сокращение потребления пищи, которое происходит у других гусениц в ответ на сублетальные количества пестицидов [35], с последующим увеличением потребления пищи, которое имело место в ответ на переход от Bt к диете без Bt, совпадает с поведение, описанное Слански и Скрибером [36].Эти авторы указали, что такое поведение может быть адаптивной реакцией на средство, сдерживающее кормление, при котором уменьшенное потребление позволяет личинкам не перегружать их детоксикационную и выделительную систему, тем самым избегая смерти от токсичности или голода до смены пищи. Такое пищевое поведение также может быть следствием метаболического вмешательства токсина в рост личинки. Оба эти явления могут возникать в ответе личинок H. armigera на прием токсина Bt.
Три гена P450 изучены в местной популяции H.armigera принадлежали к семействам CYP 6 и 9. Некоторые из них, такие как CYP 6B2, специфичны для личинок [11]. Семейство CYP 6 является одним из наиболее изученных семейств монооксигеназ насекомых в отношении устойчивости к инсектицидам и аллелохимических реакций растений [37], [19]. Монооксигеназы CYP 9 менее изучены, но также в отношении ответа на аллелохимические вещества растений, а иногда и ответа на ксенобиотики [18].
Личинки, получавшие диету без Bt, показали наивысшую экспрессию CYP6AE14, CYP6B2 и CYP9A12 через день после кормления диетой без Bt, а всего через два дня экспрессия резко снизилась.Это снижение, вероятно, связано с программой развития последнего возраста, которая предполагает резкое сокращение кормления после достижения критического веса. Это изменение, связанное с подавлением JH и активацией проторацикотропного гормона, могло быть следствием подавления или активации гена P450, поскольку известно, что некоторые гены P450 участвуют в синтезе и метаболизме гормона [10], [38]. Интересно, что прием токсина Bt привел к подавлению трех протестированных генов P450, что указывает на то, что ответ не был специфичным для гена или семейства, и вызвал небольшое увеличение титра JH в гемолимфе, как было обнаружено в тесте S. .nonagrioides личинок, питавшихся сублетальным количеством токсина Bt [3], или Chilo suppressalis , питавшихся имидаклопридом [39]. Когда личинки были переведены с диеты Bt на диету без Bt, у них восстановилась активность питания, но экспрессия генов не улучшилась. Следовательно, подавление экспрессии гена может быть связано не только со снижением активности питания [10], [8], [21], но и с действием токсина Bt.
Ответ генов P450 на аллелохимические вещества растений и ксенобиотики в целом связан со сверхэкспрессией генов устойчивости насекомых к инсектицидам или индукцией генов во время кормления [14], [17], [19], [40].Подавление экспрессии генов, хотя и происходит в некоторых случаях [26], мало изучено. Что касается устойчивости насекомых к инсектицидам, реакция некоторых ингибиторов P450 была изучена с точки зрения синергистов инсектицидов [41], [14].
Результаты настоящего исследования подтверждают гипотезу о том, что кормление диетой Bt вызывает подавление экспрессии P450, затем снижает активность кормления, а затем экспрессия немного увеличивается, а также активность кормления, поэтому рост более ограничен и замедлен. .Мао и др. [42] продемонстрировали, что личинки H. armigera , скармливаемые трансгенным растениям хлопка, экспрессирующим dsCYP6AE14, показали сниженный уровень экспрессии CYP6AE14 и резко замедленный рост, поэтому эффект, достигнутый при подавлении гена растениями dsRNA, был в некоторой степени аналогичным. эффекту подавления гена токсином Bt. Следует отметить, что реакция генов P450 насекомых на прием Bt изучена очень мало [43].
H.Личинки armigera выработали устойчивость ко многим инсектицидам [25] и к токсину Cry1Ac в Bt-хлопке в поле в Китае [24], и, как сообщается, в Европе они устойчивы к Bt-кукурузе [4]. Неожиданный супрессивный эффект токсина Cry1Ab в генах P450 семейств CYP6 и CYP9 личинок H. armigera заслуживает дальнейшего изучения, чтобы определить, аналогична ли реакция на другие токсины Cry, имеет ли подавляющий эффект токсин может действовать как синергист для других ксенобиотиков или других токсинов Cry, как штаммы H.armigera , устойчивый к инсектицидам, реагирует на токсины Bt, и связана ли эта реакция каким-либо образом с низкой толерантностью вида к токсину Bt.
Благодарности
Авторы благодарят Джоан Сафон, Аврору Рибес, доктора Джемму Фарре, доктора Ариадну Перемарти, доктора Джину Санахуджа, Дра Роми Пена, Дэвида Альмузара, Еву Пуиг и Изабель Санчес за их техническую помощь.
Вклад авторов
Задумал и спроектировал эксперименты: ME MPH CL.Проведены эксперименты: КЛ ПМ ММ. Проанализированы данные: PM CL MM MPH ME. Написал статью: ME CL. Критически рассмотренная статья: PM CL MM MPH ME.
Ссылки
- 1. MARM (2011) Ministerio de Medio Ambiente Medio Rural y Marino. Доступно на: www.marm.es/estadistica (по состоянию на 13 ноября 2011 г.).
- 2. Барри Б.Д., Дарра Л.Л., Хакла Д.Л., Антонио А.К., Смит Г.С. и др. (2000) Эффективность трансгенных гибридов кукурузы в Миссури для борьбы с насекомыми и урожайности.J Econ Entomol 93: 993–999.
- 3. Pérez-Hedo M, Albajes R, Eizaguirre M (2011a) Изменение гормонального баланса у личинок кукурузного мотылька Sesamia nonagrioides из-за приема белка Bacillus thuringiensis . J Econ Entomol 104: 853–861.
- 4. Перес-Хедо М., Лопес С., Альбахес Р., Эйсагирре М. (2012) Низкая восприимчивость нецелевых вредителей чешуекрылых кукурузы к белку Bt Cry1Ab. Bull Entomol Research 102: 737–743.
- 5.Перес-Хедо М., Рейтер Д., Лопес С., Эйсагирре М. (2013) Обработка токсина кукурузы Bt в кишечнике гусениц Mythimna unipuncta . Entomol Exp Appl 148: 56–64.
- 6. Гонсалес-Кабрера Дж., Гарсия М., Эрнандес-Креспо П., Фаринос Г. П., Ортего Ф. и др. (2013) Устойчивость к Bt кукурузе у Mythimna unipuncta (Lepidoptera: Noctuidae) опосредуется изменением активации белка Cry1Ab. Биохимия насекомых, биол 43: 635–643.
- 7. Даутерман В.К. (1981) В: Керкут Г.А., Гилберт Л.И., редакторы.Комплексная физиология, биохимия и фармакология насекомых. Vol. 12. Нью-Йорк: Pergamon Press. С. 713–730.
- 8. Feyereisen R (1999) Ферменты насекомых P450. Анну Преподобный Энтомол 44: 507–33.
- 9. Агосин М. (1985) Роль микросомального окисления в деградации инсектицидов. В кн .: Керкут Г.А., Гилберт Л.И., ред. Комплексная физиология, биохимия и фармакология насекомых. Vol. 12. Нью-Йорк: Pergamon Press. С. 647–712.
- 10. Ходжсон Э. (1985) Microsomal Mono-Oxigenasas, стр.225-321: В кн .: Керкут Г.А., Гилберт Л.И., ред. Комплексная физиология, биохимия и фармакология насекомых. Vol. 4. Pergamon Press; 1985. С. 225–319.
- 11. Скотт Дж. Г., Лю На, Вэнь З. (1998) Цитохромы насекомых P450: разнообразие, устойчивость к инсектицидам и толерантность к токсинам растений. Comp Biochem Physiol C 121: 147–155.
- 12. Скотт Дж. Г. (1999) Цитохромы P450 и устойчивость к инсектицидам. Биохимия насекомых, биол 29: 757–777.
- 13. Баутиста МАМ, Танака Т., Мията Т. (2007) Идентификация перметрин-индуцибельных цитохромов P450 из ромбовидной моли, Plutella xylostella (L.) и возможность участия в устойчивости к перметрину. Pestic Biochem Physiol 87: 85–93.
- 14. Брун-Барале А., Хема О, Мартин Т., Сурапорн С., Аудант П. и др. (2010) Множественные гены P450 сверхэкспрессируются в дельтаметрин-резистентных штаммах Helicoverpa armigera . Pest Manag Sci 66: 900–909.
- 15. Джонс С.М., Дэниэлс М., Эндрюс М., Слейтер Р., Линд Р.Дж. и др. (2011) Возрастная экспрессия монооксигеназы P450 (CYP6CM1) коррелирует с устойчивостью к неоникотиноидам у Bemisia tabaci .Pestic Biochem Physiol 101: 53–58.
- 16. Карункер И., Бентинг Дж., Люке Б., Понге Т., Науэн Р. и др. (2008) Сверхэкспрессия цитохрома P450 CYP6CM1 связана с высокой устойчивостью к имидаклоприду в биотипах B и Q Bemisia tabaci (Hemiptera: Aleyrodidae) Insect Biochem Mol Biol. 38: 634–644.
- 17. Снайдер MJ, Стивенс JL, Андерсен JF, Feyereisen R (1995) Экспрессия генов цитохрома P450 семейства CYP4 в средней кишке и жировом теле табака Hornworm Manduca sexta .Arch Biochem Biophys 321: 13–20.
- 18. Стивенс JL, Снайдер MJ, Koener JF, Feyereisen R (2000) Индуцируемые P450 семейства CYP9 из средней кишки личинки Manduca sexta . Биохимия насекомых, биол 30: 559–568.
- 19. Schuler MA (2011) P450 во взаимодействии растений и насекомых. Biochim et Biophys Acta 1814: 36–45.
- 20. Rupasinghe SG, Wen Z, Chiu T.L, Schuler MA (2007) Helicoverpa zea CYP6B8 и CYP321A1: различные молекулярные решения проблемы метаболизма токсинов растений и инсектицидов.Protein Eng Des Sel 20: 615–624
- 21. Чжан X, Юань Д., Дин Л., Ли П, Ли Ф и др. (2013) Экспрессия цитохрома P450 CYP6B6 на разных стадиях развития насекомого Helicoverpa armigera (Lepidoptera: Noctuidae). Eur J Entomol 110: 39–45.
- 22. Nijhout HF, Williams MC (1974) Контроль линьки и метаморфоза у табачного рогатого червя, Manduca sexta (L.): рост личинки последнего возраста и решение окукливать J Exp Biol.61: 493–501.
- 23. Nijhout HF, Williams MC (1974) Контроль линьки и метаморфоза у табачного рогатого червя, Manduca sexta (L.): прекращение секреции ювенильного гормона как триггер для окукливания. J Exp Biol 61: 493–501.
- 24. Чжан Х., Инь В., Чжао Дж., Цзинь Л., Ян Ю. и др. (2011) Раннее предупреждение об устойчивости хлопковых совок, связанной с интенсивными посадками Bt-хлопка в Китае. PLoS One 6 (8): e22874
- 25. Jouβen N, Agnolet S, Lorenz S, Schöne SE, Ellinger R и др.(2012) Устойчивость австралийской Helicoverpa armigera к фенвалерату обусловлена химерным ферментом P450 CYP337B3. Proc Natl Acad Sci U S A 109: 15206–15211.
- 26. Чжоу X, Шэн Ц., Ли М., Вана Х, Лю Д. и др. (2010) Ответы экспрессии девяти генов цитохрома P450 на ксенобиотики в хлопковой совке Helicoverpa armigera . Pestic Biochem Physiol 97: 209–213.
- 27. Eizaguirre M, Albajes R (1992) Индукция диапаузы у стебля кукурузного мотылька, Sesamia nonagrioides (Lepidoptera, Noctuidae).Энтомол Gen 17: 277–283.
- 28. Перес-Хедо М., Маркес Т., Лопес С., Эйсагирре М. (2011b) Определение токсина Cry1Ab в личинках Helicoverpa armigera , которых кормили на диете, содержащей лиофилизированные листья Bt. IOBC / WPRS Bull 73: 75–81.
- 29. Мартинес С.С., Эмден HFV (1999) Сублетальные концентрации азадирахтина влияют на потребление пищи, эффективность преобразования и пищевое поведение Spodoptera littoralis (Lepidoptera: Noctuidae). Bull Entomol Res 89: 65–71.
- 30. Statgraphics (1997) Statgraphics плюс версия 3.0 Manugistics, Rockwille MD.
- 31. JMP 8.0 (2008) SAS Institute Inc., Кэри, Северная Каролина, США.
- 32. Vilaró F, Pérez-Hedo M, Eras J, Canela R, Eizaguirre M (2012) UHPLC-MS Анализ ювенильного гормона II у средиземноморского кукурузного мотылька ( Sesamia nonagrioides ) гемолимфы с использованием различных методов ионизации J Agric Food Chem. 60: 3020–3025.
- 33. Fan Y, Rafaeli A, Gileadi C, Applebaum SW (1999) Индукция ювенильным гормоном феромонной железы PBAN-реактивности у самок Helicoverpa armigera .Биохимия насекомых Molec Biol 29: 635–641.
- 34. Бастин С.А., Бенес В., Гарсон Дж. А., Хеллеманс Дж., Хаггетт Дж. И др. (2009) Рекомендации MIQE: минимум информации для публикации количественных экспериментов ПЦР в реальном времени. Clin Chem 55: 611–622.
- 35. Бернад Л., Лагадич Л. (1993) Сублетальные эффекты диетического цифлутрина на показатели питания и активность гидролазы кишечника у личинок листовой черви египетского хлопка, Spodoptera littoralis . Pestic Biochem Physiol 46: 171–180.
- 36. Slansky FJ, Scriber JM (1985) Потребление и использование пищевых продуктов. В кн .: Керкут Г.А., Гилберт Л.И., ред. Комплексная физиология, биохимия и фармакология насекомых. Vol. 4. Нью-Йорк: Pergamon Press. С. 87–163.
- 37. Baek JH, Clark JM, Lee SH (2010) Сравнение перекрестных деформаций индуцированной циперметрином транскрипции цитохрома P450 в различных условиях индукции у алмазной моли. Pestic Biochem Physiol 96: 43–50.
- 38. Скотт Дж. Г., Вен З (2001) Цитохромы P450 насекомых: верхушка айсберга.Pest Manag Sci 57: 958–987.
- 39. Yu YS, Xue S, Wu JC, Wang F (2007) Изменения уровней ювенильного гормона и гормона линьки у личинок и взрослых самок Chilo suppresalis (Lepidoptera: Pyralidae) после нанесения имидаклоприда на рис. J Econ Entomol 100: 1088–1193.
- 40. Чжао Г., Чжао С., Гао Р., Ван Р., Чжан Т. и др. (2011) Профили транскрипции восьми цитохромов P450, потенциально участвующих в метаболизме ксенобиотиков у тутового шелкопряда, Bombyx mori .Пестик Биохим Физиол 100: 25–255.
- 41. Berge J-B, Feyereisen R, Amichot M (1998) Монооксигеназы цитохрома P450 и устойчивость к инсектицидам у насекомых. Philos Trans R Soc Lond B Biol Sci 353: 1701–1705.
- 42. Mao YB, Tao XY, Xue XY, Wang LJ, Chen XY (2011) Растения хлопка, экспрессирующие двухцепочечную РНК CYP6AE14, проявляют повышенную устойчивость к совкам. Transgenic Res 20: 665–673.
- 43. Munster M, Préfontaine G, Meunier L, Elias M, Mazza A и др.(2007) Измененная экспрессия гена в Choristoneura fumiferana и Manduca sexta в ответ на сублетальную интоксикацию токсином Bacillus thuringiensis Cry1Ab. Насекомое Mol Biol 16: 25–35.
Bt Технология защиты от насекомых | ISAAA.org
Вы когда-нибудь видели лист, съеденный вредителями растений? А как насчет целого урожая, уничтоженного насекомыми? Вредители растений доставляют массу проблем как фермерам, так и домашним садоводам.Из-за этого у них было очень мало возможностей, кроме как постоянно опрыскивать свои растения пестицидами. К сожалению, некоторые из этих пестицидов представляют опасность для здоровья людей, подвергающихся их воздействию.
Именно по этой причине ученые постоянно ищут альтернативные способы борьбы с вредителями растений.
Bt означает Bacillus thuringiensis (Bt), обычную почвенную бактерию, названную так потому, что она была впервые выделена в регионе Тюрингия в Германии.
Bt производит белок, который парализует личинок некоторых вредных насекомых, в том числе хлопковых совок и азиатских и европейских кукурузных мотыльков, которые являются обычными вредителями растений, чьи инвазии оказывают разрушительное воздействие на важные сельскохозяйственные культуры.
Принцип действияПри попадании в организм личинки насекомого-мишени белок Bt активируется в щелочной среде кишечника и прокалывает средний кишечник, в результате чего насекомое не может есть.Насекомое погибает в течение нескольких дней.
Именно из-за его способности продуцировать инсектицидный белок проводится большое количество исследований, направленных на использование агрономической ценности этого организма. На сегодняшний день идентифицировано более 200 типов белков Bt с различной степенью токсичности для некоторых насекомых.
Ранее Bt TechnologyBt легко культивируется путем ферментации. Таким образом, за последние 50 лет Bt использовался фермерами во всем мире в качестве инсектицида.Органическое сельское хозяйство, в частности, выиграло от инсектицида Bt, поскольку это один из очень немногих пестицидов, разрешенных органическими стандартами. Инсектицид применяется либо в виде спрея, либо в виде грунта. Он бывает как в гранулах, так и в жидком виде.
Эффективность обоих применений весьма ограничена, поскольку организмы-мишени часто не контактируют с инсектицидом, поскольку они находятся на нижней стороне листьев или уже проникли в растение. Ученые работают над преодолением этой проблемы с помощью современных биотехнологий.
Современные технологии Bt Ученые взяли ген Bt, ответственный за производство инсектицидного белка из бактерии, и включили его в геном растений. Таким образом, у этих растений есть встроенный механизм защиты от целевых вредителей. Белок, производимый растениями, не смывается и не разрушается солнечным светом. Таким образом, растение круглосуточно защищено от совки или кукурузного мотылька независимо от ситуации.
Воздействие на здоровье человека
Итак, насколько безопасен белок Bt для нецелевых организмов? Специфичность Bt по отношению к целевым насекомым является одной из характеристик, которые делают его идеальным методом биологической борьбы с вредителями. Фактически, различные штаммы Bt обладают специфической токсичностью для определенных насекомых-мишеней. Специфичность основана на том факте, что токсичность белка Bt опосредована рецептором.Это означает, что для того, чтобы насекомое могло быть поражено белком Bt, у него должны быть определенные рецепторные участки в кишечнике, где эти белки могут связываться. К счастью, у людей и большинства полезных насекомых этих рецепторов нет.
Перед тем, как Bt-культуры поступят на рынок, они должны пройти очень строгие нормативные тесты, в том числе на токсичность и аллергенность.
Агентство по охране окружающей среды США (US-EPA) уже провело токсикологические оценки, и белки Bt уже были протестированы даже в относительно более высоких дозах.По данным Extension Toxicology Network (Extoxnet), информационного проекта по пестицидам, осуществляемого несколькими университетами США, «никаких жалоб не поступало после того, как 18 человек употребляли один грамм коммерческого препарата Bt ежедневно в течение пяти дней через день. Люди, которые ели один грамм в день в течение трех дней подряд, не были отравлены или инфицированы ». Кроме того, было показано, что белок быстро разлагается в желудочной жидкости человека in vitro (Extoxnet, 1996).
Воздействие на окружающую среду
Почвенные экосистемы и подземные воды
Белок Bt умеренно устойчив в почве и классифицируется как неподвижный, поскольку он не перемещается и не вымывается из грунтовых вод.Он не особенно устойчив в кислых почвенных условиях и при воздействии солнечного света быстро разрушается из-за ультрафиолетового излучения.
Независимые эксперты провели исследования для изучения воздействия культур Bt на почвенные организмы и другие виды насекомых, которые считаются полезными в сельском хозяйстве. Не было обнаружено никаких неблагоприятных воздействий на нецелевые почвенные организмы, даже когда эти организмы подвергались воздействию Bt в количествах, намного превышающих то, что на самом деле происходило бы в естественных условиях выращивания сельскохозяйственных культур.Аналогичным образом, исследование, проведенное Агентством по охране окружающей среды США, не выявило изменений в микробиоте почвы на полях с растительным материалом Bt или обычным растительным материалом (Donegan, et al., 1995) или между полями с культурами Bt и не-Bt (Donegan, et al. др., 1996).
Животные и насекомые
В ходе испытаний, проведенных на собаках, морских свинках, крысах, рыбах, лягушках, саламандрах и даже птицах, было обнаружено, что белок Bt не оказывает вредного воздействия. Также следует отметить, что не было обнаружено токсического воздействия на полезных или хищных насекомых, таких как медоносные пчелы и божьи коровки (Extoxnet, 1996).
В 1999 г. сообщалось, что пыльца Bt-кукурузы оказывала негативное воздействие на личинок бабочки монарх. В этом отчете были высказаны опасения и вопросы о рисках, связанных с Bt-культурами для нецелевых организмов. Однако недавние исследования показывают, что кукуруза Bt представляет «незначительную» угрозу для бабочек-монархов в полевых условиях. В результате совместных исследований ученых из США и Канады была получена информация для разработки официальной оценки риска воздействия кукурузы Bt на популяции бабочек-монархов.Они пришли к выводу, что у большинства коммерческих гибридов экспрессия Bt в пыльце низка, а лабораторные и полевые исследования не показывают острых токсических эффектов при любой плотности пыльцы, которая может встречаться в полевых условиях.
Преимущества культур BtУлучшенная борьба с вредителями. Защищенные от насекомых культуры Bt обеспечивают фермерам сезонную защиту от нескольких вредных насекомых-вредителей, а также сокращают или устраняют необходимость в аэрозольных инсектицидах.Это исключает потерю урожая, которая является следствием неоптимальной борьбы с вредителями с помощью применяемых на ферме инсектицидов, и дает фермеру больше времени для выполнения других обязанностей по управлению фермой.
Сокращение использования инсектицидов. Исследование, проведенное Министерством сельского хозяйства США, показало, что 8,2 миллиона фунтов активных ингредиентов пестицидов были уничтожены фермерами, которые посадили Bt-культуры в 1998 году. О значительном сокращении также сообщалось в Китае и Аргентине, где использование Bt-хлопка привело к Сокращение использования пестицидов на 60-70%.
Увеличение чистой прибыли. Более низкие производственные затраты часто способствуют более высокой чистой прибыли по сравнению с традиционными культурами. Фермеры Bt-хлопка в США заработали дополнительные 99 миллионов долларов в результате снижения затрат на пестициды и / или повышения урожайности. Точно так же фермеры, выращивающие Bt-хлопок в Аргентине, сообщили, что Bt-хлопок принес в среднем дополнительную прибыль в размере 65,05 долларов США / га.
Улучшение условий для нецелевых организмов. Поскольку Bt-культуры способны защищаться от вредителей, использование химических инсектицидов значительно сокращается, тем самым способствуя размножению полезных организмов.Эти полезные организмы могут помочь контролировать других вторичных вредителей, что часто может стать проблемой, когда популяции хищников и паразитов сокращаются с помощью обычных инсектицидов широкого спектра действия.
Меньше микотоксинов в кукурузе. Помимо того, что они эффективны против насекомых-вредителей, Bt-культуры имеют более низкую заболеваемость условно-патогенными микроорганизмами, такими как гриб Fusarium. Этот гриб производит микотоксины, которые могут быть смертельными для домашнего скота, а также вызывать рак у людей.
Управление устойчивостью к насекомым
Поскольку культуры Bt способны к продолжительной сезонной экспрессии белка Bt, необходимо принять меры предосторожности, чтобы избежать развития устойчивости насекомых. В США, например, EPA обычно требует «буферной зоны» или структурированного убежища для культур, не содержащих Bt, которые высаживаются в непосредственной близости от культур Bt. Считается, что борьба с устойчивостью насекомых (IRM) является ключом к устойчивому использованию инсектицида как в генетически модифицированных культурах, так и в составах микробных спреев Bt.
Текущее состояние Bt TechnologyПо состоянию на конец 2018 года около 23,7 миллиона гектаров земли были засеяны культурами, содержащими ген Bt. В следующей таблице показаны страны, которые коммерциализировали Bt-культуры (с одиночными и сложенными генами) и его продукты с 1996 по 2019 год.
| Bt урожай | Страна |
| Хлопок | Аргентина, Австралия, Бразилия, Буркина-Фасо, Канада, Китай, Колумбия, Коста-Рика, ЭСватини, Эфиопия, Европейский союз, Индия, Япония, Малайзия, Мексика, Мьянма, Новая Зеландия, Нигерия, Пакистан, Парагвай, Филиппины, Сингапур, Юг Африка, Южная Корея, Судан, Тайвань, США |
| Воровка | Нигерия |
| Баклажаны | Бангладеш |
| кукуруза | Аргентина, Австралия, Бразилия, Канада, Чили, Китай, Колумбия, Египет, ЕС, Гондурас, Индонезия, Япония, Малайзия, Мексика, Новая Зеландия, Нигерия, Пакистан, Панама, Парагвай, Филиппины, Российская Федерация, Сингапур, Южная Африка, Южная Корея, Швейцария, Тайвань, Таиланд, Турция, США, Уругвай, Вьетнам, Замбия |
| Тополь | Китай |
| Картофель | Австралия, Канада, Япония, Мексика, Новая Зеландия, Филиппины, Российская Федерация, Южная Корея, США |
| Рис | Китай, Иран, США |
| Соя | Аргентина, Австралия, Бразилия, Канада, Китай, Колумбия, ЕС, Индия, Индонезия, Иран, Япония, Малайзия, Мексика, Новая Зеландия, Парагвай, Филиппины, Российская Федерация, Сингапур, Южная Африка, Южная Корея, Тайвань, Таиланд, Турция , США, Уругвай, Вьетнам |
| Сахарный тростник | Бразилия, Канада, США |
| Помидор | Канада, США |
Источник: База данных одобрений GM ISAAA.http://www.isaaa.org/gmapprovaldatabase/.
За первые 22 года коммерциализации (1996-2016 гг.) Выгоды от выращивания устойчивых к насекомым культур оцениваются в 97,4 млрд долларов США, что составляет 52,3% от мировой стоимости биотехнологических культур, составляющей 186,1 млрд долларов США; и только на 2016 год — 9,73 млрд долларов США, что составляет 53,4% мировой стоимости биотехнологических культур, составляющей 18,2 млрд долларов США.
Заключение Зерновые культурыBt — это дополнение к нашему арсеналу ГМО-продуктов против вредителей растений.С ростом населения и сокращением пахотных земель необходимо использовать все возможности с минимальными компромиссами, чтобы производить больше урожая. При использовании наряду с надлежащими методами ведения сельского хозяйства технология защиты от насекомых Bt может принести множество преимуществ как сельскохозяйственным культурам, так и фермерам, и потребителям.
Список литературы- 2004. Основная биобезопасность. Стратегии сельского хозяйства и биотехнологии, Inc.
- Донеган, К.К., С.Дж. Палм, В.Дж. Fieland, L.A. Porteous, L.M. Ganio, D.L. Schaller, L.Q. Букао, Р.Дж. Зайдлер. 1995. Изменения в уровнях, видах и отпечатках ДНК почвенных микроорганизмов, ассоциированных с хлопком, экспрессирующих Bacillus thuringiensis var. курстаки эндотоксин. Прикладная экология почвы 2: 111-124.
- Донеган, К.К., Д.Л. Шаллер, Дж. Стоун, Л.М. Ганио, Дж. Рид, П. Хэмм и Р.Дж. Зайдлер. 1996. Микробные популяции, разнообразие видов грибов и уровни патогенов растений на полевых участках растений картофеля, экспрессирующих Bacillus thuringiensis var.tenebrionis Эндотоксин. Трансгенные исследования 5: 25-35.
- Совет по биотехнологической информации. 2001. Bt-белок в почве. http://www.whybiotech.com/pdf/Bt_Protein_in_Soil.pdf
- Агентство по охране окружающей среды. 1999. Позиционный документ Агентства по охране окружающей среды и Министерства сельского хозяйства США по управлению устойчивостью насекомых к Bt-культурам. http://www.epa.gov/pesticides/biopesticides/otherdocs/bt_position_paper_618.htm
- Расширение сети токсикологии. 1996 г.Профиль информации о пестицидах, Bacillus thuringiensis .
- Sears, M., R. Hellmich, S. Stanley-Horn, K. Onerhauser, J. Pleasants, H. Mattila, B. Siegfried, G. Dively. 2001. Воздействие пыльцы Bt кукурузы на популяции бабочек-монархов: оценка риска. PNAS 98 (21): 11937-11942.
- ISAAA. 2018. Глобальный статус коммерциализированных биотехнологических / ГМ-культур: 2018. Краткий обзор ISAAA № 54. ISAAA: Итака, штат Нью-Йорк.
- Брукс, Г.и П. Барфут. 2018. ГМ-культуры: глобальное социально-экономическое и экологическое воздействие 1996-2016 гг. PG Economics Ltd, Великобритания. С. 1-204.
* Обновлено в марте 2020 г.
Next Pocket K: маркировка продуктов GM
Влияние генетически модифицированного риса T2A-1 на здоровье желудочно-кишечного тракта крыс после 90-дневного приема добавок
Мендельсон, М., Коу, Дж., Вайтузис, З. и Мэтьюз, К. Безопасны ли культуры Bt? Nat Biotechnol 21, 1003–1009 (2003).
CAS PubMed Google Scholar
Бец, Ф.С., Хаммонд, Б. Г. и Фукс, Р. Л. Безопасность и преимущества растений, защищенных Bacillus thuringiensis, для борьбы с насекомыми-вредителями. Regul Toxicol Pharmacol 32, 156–173 (2000).
CAS PubMed Google Scholar
Усда. Служба инспекции здоровья растений, ветеринарные службы, & lt; www.aphis.usda.gov/animal_health/vet_biologics.> (2007).
Кеннеди, Г. Г. Интеграция устойчивых к насекомым генетически модифицированных культур в программы IPM.Интеграция устойчивых к насекомым генетически модифицированных культур в программы IPM, 1–26 (2008).
Джеймс К. Глобальный статус коммерциализированных биотехнологических / ГМ-культур: 2009 г. Краткий обзор ISAAA 41 (2009).
Ye, R. et al. Создание трансгенного риса, устойчивого к насекомым, с эндоспермом, свободным от Cry1C *. Pest Manag Sci 65, 1015–1020 (2009).
CAS PubMed Google Scholar
Сигель, Дж. П. Безопасность инсектицидов на основе Bacillus thuringiensis для млекопитающих.J Invertebr Pathol 77, 13–21 (2001).
CAS PubMed Google Scholar
МакКлинток, Дж. Т., Шаффер, К. Р. и Сджоблад, Р. Д. Сравнительный обзор токсичности пестицидов на основе Bacillus thuringiensis для млекопитающих. Наука о пестицидах 45, 95–105 (1995).
CAS Google Scholar
Kroghsbo, S. et al. Иммунотоксикологические исследования генетически модифицированного риса, экспрессирующего лектин PHA-E или токсин Bt, на крысах Wistar.Токсикология 245, 24–34 (2008).
CAS PubMed Google Scholar
Schroder, M. et al. 90-дневное исследование безопасности генетически модифицированного риса, экспрессирующего белок Cry1Ab (токсин Bacillus thuringiensis), на крысах Wistar. Food Chem Toxicol 45, 339–349 (2007).
CAS PubMed Google Scholar
Васкес-Падрон, Р. И. и др. Протоксин Cry1Ac из Bacillus thuringiensis sp.kurstaki HD73 связывается с поверхностными белками тонкого кишечника мыши. Biochem Biophys Res Commun 271, 54–58 (2000).
CAS PubMed Google Scholar
Sagstad, A. et al. Оценка биомаркеров стресса и иммунного ответа у атлантического лосося Salmo salar L., получавшего различные уровни генетически модифицированной кукурузы (Bt-кукурузы), по сравнению с его почти изогенной родительской линией и коммерческой кукурузой супрекса. J. Fish Dis 30, 201–212 (2007).
CAS PubMed Google Scholar
Новерр, М. К. и Хаффнагл, Г. Б. Регулирует ли микробиота иммунные реакции вне кишечника? Trends Microbiol 12, 562–568 (2004).
CAS PubMed Google Scholar
Einspanier, R. et al. Отслеживание остаточных рекомбинантных молекул корма во время пищеварения и бактериального разнообразия рубца у крупного рогатого скота, получавшего трансгенную кукурузу.Eur Food Res Technol 218, 269–273 (2004).
CAS Google Scholar
Лапарра, Дж. М. и Санс, Ю. Взаимодействие кишечной микробиоты с функциональными пищевыми компонентами и нутрицевтиками. Pharmacol Res 61, 219–225 (2010).
CAS PubMed Google Scholar
Nissen, L., Chingwaru, W., Sgorbati, B., Biavati, B. & Cencic, A. Способствующая здоровью кишечника активность новых предполагаемых пробиотических / защитных Lactobacillus spp.штаммы: функциональное исследование на модели клеток тонкого кишечника. Int J Food Microbiol 135, 288–294 (2009).
CAS PubMed Google Scholar
Tudisco, R. et al. Генетически модифицированная соя в кормлении кроликов: обнаружение фрагментов ДНК и оценка метаболических эффектов с помощью ферментативного анализа. НАУКА О ЖИВОТНЫХ — ГЛАЗГО ТОГДА PENICUIK 82, 193 (2006).
CAS Google Scholar
Чжоу, Дж.и другие. Метаболический профиль трансгенного риса с генами cryIAc и sck: оценка нежелательных эффектов на метаболическом уровне с использованием GC-FID и GC-MS. J Chromatogr B Analyt Technol Biomed Life Sci 877, 725–732 (2009).
CAS PubMed Google Scholar
Heritage, J. Трансгены для чая? Trends Biotechnol 23, 17–21 (2005).
CAS PubMed Google Scholar
Heritage, J.Судьба трансгенов в кишечнике человека. Nat Biotechnol 22, 170–172 (2004).
CAS PubMed Google Scholar
Тони М.А. и др. Оценка безопасности кукурузы Bt 176 в питании бройлеров: деградация ДНК кукурузы и ее метаболическая судьба. Arch Tierernahr 57, 235–252 (2003).
CAS PubMed Central PubMed Google Scholar
Рейтер, Т., Олрих, К., Берк А. и Флаховски Г. Исследования генетически модифицированной кукурузы (Bt-кукурузы) в питании свиней: химический состав и оценка питательности. Arch Tierernahr 56, 23–31 (2002).
CAS PubMed Google Scholar
Netherwood, T. et al. Оценка выживаемости ДНК трансгенных растений в желудочно-кишечном тракте человека. Nat Biotechnol 22, 204–209 (2004).
CAS PubMed Google Scholar
van den Eede, G.и другие. Значение переноса генов для безопасности пищевых продуктов и кормов, полученных из генетически модифицированных (ГМ) растений. Food Chem Toxicol 42, 1127–1156 (2004).
CAS PubMed Google Scholar
Келли, Б. Г., Весперманн, А. и Болтон, Д. Дж. События передачи генов и их возникновение в выбранных средах. Food Chem Toxicol 47, 978–983 (2009).
CAS PubMed Google Scholar
Койпер, Х.А., Клетер, Г. А., Нотеборн, Х. П. и Кок, Э. Дж. Оценка проблем безопасности пищевых продуктов, связанных с генетически модифицированными пищевыми продуктами. Завод J 27, 503–528 (2001).
CAS PubMed Google Scholar
Poulsen, M. et al. 90-дневное исследование безопасности на крысах линии Вистар, получавших генетически модифицированный рис, экспрессирующий лектин подснежника Galanthus nivalis (GNA). Food Chem Toxicol 45, 350–363 (2007).
CAS PubMed Google Scholar
Поульсен, М.и другие. Тестирование безопасности ГМ-риса, экспрессирующего лектин PHA-E, с использованием нового дизайна тестов на животных. Food Chem Toxicol 45, 364–377 (2007).
CAS PubMed Google Scholar
Гварнер Ф. и Малагелада Дж. Р. Флора кишечника в здоровье и болезнях. Ланцет 361, 512–519 (2003).
PubMed Google Scholar
Коэн, М., Чен, М., Бентур, Дж. С., Хеонг, К. Л. и Е, Г.в интеграции устойчивых к насекомым генетически модифицированных культур в рамках программ IPM Vol. 5, Progress in Biological Control (eds Jörg, Anthony M., & George G.) Ch. 8, 223–248 (Springer, Нидерланды, 2008).
Google Scholar
Xu, W. et al. Оценка безопасности гибридного белка Cry1Ab / Ac. Food Chem Toxicol 47, 1459–1465 (2009).
CAS PubMed Google Scholar
Трабальца-Маринуччи, М.и другие. Трехлетнее продольное исследование влияния диеты, содержащей генетически модифицированную кукурузу Bt176, на состояние здоровья и продуктивность овец. Животноводство 113, 178–190 (2008).
Google Scholar
Song, W. B. et al. Растворимая молекула межклеточной адгезии-1, D-лактат и диаминоксидаза у пациентов с воспалительным заболеванием кишечника. World J Gastroenterol 15, 3916–3919 (2009).
CAS PubMed Central PubMed Google Scholar
Патури, Г., Филлипс, М., Джонс, М. и Кайласапати, К. Иммуностимулирующие эффекты Lactobacillus acidophilus LAFTI L10 и Lactobacillus paracasei LAFTI L26 у мышей. Int J Food Microbiol 115, 115–118 (2007).
CAS PubMed Google Scholar
Rizzi, A. et al. Стабильность и деградация пищевой ДНК в желудочно-кишечном тракте млекопитающих: последствия для горизонтального переноса генов и биобезопасности ГМО. Crit Rev Food Sci Nutr 52, 142–161 (2012).
CAS PubMed Google Scholar
Лу, Б. Р. и Янг, К. Поток генов от генетически модифицированного риса к его диким родственникам: оценка потенциальных экологических последствий. Biotechnol Adv 27, 1083–1091 (2009).
CAS PubMed Google Scholar
Килич А. и Акай М. Т. Исследование трех поколений генетически модифицированной кукурузы Bt на крысах: биохимическое и гистопатологическое исследование.Food Chem Toxicol 46, 1164–1170 (2008).
CAS PubMed Google Scholar
Сералини, Г. Э., Селлиер, Д. и де Вендомойс, Дж. С. Новый анализ исследования кормления крыс генетически модифицированной кукурузой выявил признаки гепаторенальной токсичности. Arch Environ Contam Toxicol 52, 596–602 (2007).
CAS PubMed Google Scholar
Хупер, Л. В. Вклад бактерий в развитие кишечника млекопитающих.Trends Microbiol 12, 129–134 (2004).
CAS PubMed Google Scholar
Сартор Р. Б. Влияние микробов при воспалительных заболеваниях кишечника. Гастроэнтерология 134, 577–594 (2008).
CAS PubMed Google Scholar
Стробер В., Фасс И. и Маннон П. Фундаментальные основы воспалительного заболевания кишечника. Дж. Клин Инвест 117, 514–521 (2007).
CAS PubMed Central PubMed Google Scholar
Надаль, И., Донат, Э., Рибес-Конинккс, С., Калабуиг, М., и Санц, Ю. Дисбаланс в составе микробиоты двенадцатиперстной кишки у детей с глютеновой болезнью. J Med Microbiol 56, 1669–1674 (2007).
CAS PubMed Google Scholar
Laukoetter, M. G., Bruewer, M. & Nusrat, A. Регулирование кишечного эпителиального барьера апикальным соединительным комплексом. Curr Opin Gastroenterol 22, 85–89 (2006).
PubMed Google Scholar
Цукита, С., Фурузе, М. и Ито, М. Многофункциональные нити в плотных соединениях. Nat Rev Mol Cell Biol 2, 285–293 (2001).
CAS PubMed Google Scholar
Грошвиц, К. Р. и Хоган, С. П. Функция кишечного барьера: молекулярная регуляция и патогенез заболевания. J Allergy Clin Immunol 124, 3–20; викторина 21–22 (2009).
CAS PubMed Central PubMed Google Scholar
Холлингворт, Р.M. et al. Безопасность генетически модифицированных пищевых продуктов, произведенных с помощью биотехнологии. Toxicol Sci 71, 2–8 (2003).
PubMed Google Scholar
Реста-Ленерт, С. и Барретт, К. Э. Живые пробиотики защищают эпителиальные клетки кишечника от воздействия инфекции энтероинвазивной кишечной палочкой (EIEC). Gut 52, 988–997 (2003).
CAS PubMed Central PubMed Google Scholar
Арриета, М.С., Мэдсен, К., Дойл, Дж. И Меддингс, Дж. Снижение проницаемости тонкого кишечника ослабляет колит у мышей с дефицитом гена IL10. Gut 58, 41–48 (2009).
CAS PubMed Google Scholar
Delroisse, J. M. et al. Количественное определение Bifidobacterium spp. и Lactobacillus spp. в образцах фекалий крыс методом ПЦР в реальном времени. Microbiol Res 163, 663–670 (2008).
CAS PubMed Google Scholar
Ринттила, Т., Кассинен, А., Малинен, Э., Крогиус, Л. и Палва, А. Разработка обширного набора праймеров, нацеленных на 16S рДНК, для количественного определения патогенных и местных бактерий в образцах фекалий с помощью ПЦР в реальном времени. J Appl Microbiol 97, 1166–1177 (2004).
CAS PubMed Google Scholar
de Araujo, J. C. & Schneider, R. P. DGGE с геномной ДНК: подходит для обнаружения численно важных организмов, но не для идентификации наиболее распространенных организмов.Water Res 42, 5002–5010 (2008).
CAS PubMed Google Scholar
Cani, P. D. et al. Изменения микробиоты кишечника контролируют воспаление у мышей с ожирением с помощью механизма, включающего улучшение проницаемости кишечника под действием GLP-2. Gut 58, 1091–1103 (2009).
CAS PubMed Central PubMed Google Scholar
Beards, E., Tuohy, K. & Gibson, G.Бактериальные, SCFA и газовые профили ряда пищевых ингредиентов после ферментации in vitro микробиотой толстой кишки человека. Анаэроба 16, 420–425 (2010).
CAS PubMed Google Scholar
Zhao, G., Liu, J. F., Nyman, M. & Jonsson, J. A. Определение короткоцепочечных жирных кислот в сыворотке с помощью жидкостной мембранной экстракции на основе полых волокон в сочетании с газовой хроматографией. J Chromatogr B Analyt Technol Biomed Life Sci 846, 202–208 (2007).
CAS PubMed Google Scholar
Лю Р. и Сюй Г. Влияние резистентного крахмала на пренеопластические аберрантные очаги крипт толстой кишки у крыс. Food Chem Toxicol 46, 2672–2679 (2008).
CAS PubMed Google Scholar
Yao, Y. M. et al. Роль кишечной эндотоксемии и бактериальной транслокации у крыс после термической травмы: эффекты избирательной дезактивации пищеварительного тракта.Бернс 21, 580–585 (1995).
CAS PubMed Google Scholar
Границы | Оценка питания диетических белков Bt и Cp4EPSPS на биохимические изменения сыворотки крови кроликов на разных стадиях развития
Введение
В связи с недавним увеличением населения мира в сочетании с ростом доходов возникла необходимость в улучшении производства продуктов питания. Для борьбы с растущим спросом на продукты питания к 2050 году необходимо увеличить мировое сельскохозяйственное производство на 60% по сравнению с предыдущими годами (1).Появление биотехнологии растений в начале 1980-х годов в настоящее время быстро прогрессирует (2). Были успешно выведены различные сорта растений с улучшенными характеристиками, такими как устойчивость к насекомым, устойчивость к гербицидам и улучшенные питательные свойства. В последнее время существует более 200 различных трансгенных культур с разными характеристиками, одобренных для употребления в разных странах (3). Генетически модифицированные (ГМ) растения с геном « Bt », экспрессирующим инсектицидный белок, представляют собой улучшенную технологию для устойчивого растениеводства.Однако общественность выражает озабоченность по поводу безопасности пищевых продуктов этих ГМ-культур в отношении потребления людьми и производства продуктов животного происхождения, таких как мясо, молоко и яйца, от домашнего скота, выращиваемого на этих ГМ-культурах (4). ГМ-растительные продукты все чаще становятся частью пищевой цепи человека. Несмотря на это, исследований по кормлению, оценивающих влияние ГМ-культур на здоровье человека и животных, сравнительно меньше (5). Вопрос использования кормовых ингредиентов, полученных из ГМ-культур, в животноводстве вызывает серьезные споры.В прошлом были опубликованы многочисленные отчеты по этой теме, в которых заявлялось об отсутствии вредного воздействия на здоровье животных и человека (6), однако существуют и противоположные мнения, которые документально подтверждены экспериментально (7–10). Исследования по безопасности пищевых продуктов также ограничиваются некоторыми продуктами и, как правило, не хлопком. Например, большинство более ранних экспериментов проводилось на ГМ-растениях, таких как марихуана, кукуруза и соя (11–14). Исследования ГМ-хлопка с точки зрения оценки риска пока недостаточны для доказательства его безопасности (15, 16).Таким образом, требуется час для создания всеобъемлющей базы данных по оценке диетического риска для тематических исследований ГМ-хлопка с различными животными (дикие, жвачные и животные с однокамерным желудком) (17).
Биохимический профиль сыворотки отражает нутритивный, физиологический и патологический статус человека (18–20). Биохимические параметры взаимосвязаны с различными функциями и изменениями организма. Любое нарушение биохимических показателей сыворотки может в конечном итоге привести к структурным и физиологическим аномалиям (21).С помощью анализа биохимических параметров сыворотки можно легко определить функцию жизненно важных органов, таких как печень, почки, сердце и поджелудочная железа. Биохимическое исследование сыворотки, как правило, позволяет проводить клинические исследования различных компонентов тела животных. Это особенно важно для кроликов, поскольку они демонстрируют сложные клинические признаки, которые часто скрывают болезненные состояния (22).
Принимая во внимание значение биохимических компонентов у животных, было обнаружено, что диетические ингредиенты оказывают значительное влияние на серологические исследования (23).При изучении и оценке физиологии и питания животных лабораторные тесты могут применяться для исследования модельных животных. Информация о влиянии кормления диетическими белками Bt и Cp4epsps на биохимический профиль сыворотки скудна, особенно в случае кроликов. Таким образом, это исследование было проведено для оценки включения в рацион трансгенных семян хлопчатника, экспрессирующих белки Bt и Cp4epsps , на серологию растущих кроликов.
Материалы и методы
Область исследования
Настоящие исследования были проведены в Национальном центре передового опыта в области молекулярной биологии (CEMB), Университет Пенджаба, Лахор, Пакистан. Изучено влияние тройных генов хлопка на различные биохимические показатели подопытных животных.
Тестируемое вещество
Тестируемое вещество представляет собой зрелые семена хлопка ( Gossypium hirsutum) сорта (VH-289), генетически модифицированные бинарными генами устойчивости к насекомым ( Cry 1Ac и Cry 2A ) и геном устойчивости к гербициду глифосата ( EPSPS) .Семена ГМ-хлопка были предоставлены хранилищем в CEMB, Университет Пенджаба, Лахор, Пакистан.
Состав рациона
Рацион для контрольных и подопытных животных был составлен в соответствии с оптимизированной процедурой CEMB. Испытуемые вещества (семена хлопка) измельчали с помощью механического измельчителя после удаления ворса с хлопковой коробочки. Семена дополнительно измельчали, чтобы удалить оставшийся пух или нити крошечных хлопковых волокон. Затем семена лущили и полировали для выделения мягкого и съедобного белка.Затем очищенные семена тщательно перемешивали с другими типами кормовых ингредиентов с помощью механического миксера, чтобы сделать его пригодным для животных. Были составлены четыре различных экспериментальных рациона, содержащие различные уровни хлопковой муки вместо пшеничных субпродуктов при уровнях включения в рацион 0 (контроль), 20, 30 и 40% (Таблица 1).
Таблица 1 . Составы экспериментальных диет.
Композиционный анализ
Пищевые компоненты как контрольного, так и экспериментального рациона были проанализированы в соответствии со стандартной процедурой, описанной AOAC (24).Были оценены основные составы, такие как сухое вещество, влага, сырой белок, сырая клетчатка, эфирный экстракт, нейтральное детергентное волокно, кислотное детергентное волокно и гемицеллюлоза. Также измерялось общее энергетическое содержание каждого рациона (таблица 2). Все диетические ингредиенты были тщательно перемешаны перед анализом состава. Определение сухого вещества осуществлялось путем сушки образцов при 70 ° C в течение 24 ч с помощью конвекционной печи Memmert. Влажность рассчитывалась по формуле:% влажности = (100–% СВ).Для определения общего содержания азота использовали макро-метод Кьельдаля. Затем определенное содержание азота переводили в неочищенный белок путем умножения на коэффициент 6,25. Сырая клетчатка оценивалась как фракция, остающаяся после разложения стандартным раствором серной кислоты (H 2 SO 4 ) и гидроксида натрия (NaOH) в контролируемых условиях. Определение золы было достигнуто путем озоления образцов при высокой температуре около 550 ° C в печи в течение около 4 часов.Для определения эфирного экстракта использовали метод экстракции Сокслета. Формула:% NFE =% DM — (% CP +% CF +% EE +% золы) применялась для расчета безазотного экстракта. Автоматизированная система определения волокон (FIBER TECH M System; Tecator, Швеция) использовалась для определения как нейтрального детергентного волокна (NDF), так и кислотного детергентного волокна (ADF), как описано Van Soest et al. (25). Гемицеллюлозу рассчитывали по формуле; (% NDF–% ADF). Для расчета энергосодержания использовался калориметр адиабатической бомбы.
Таблица 2 . Композиционный анализ экспериментальных диет.
Экспериментальные животные и управление ими
«Всего сорок восемь» новозеландских белых самцов и самок (24 пары) кроликов массой в среднем 570,50 ± 0,50 г были приобретены на рынке животных Толлинтон в Лахоре, Пакистан. Сразу после приема всем животным вводили антистрессовый препарат (Symostress-, код продукта: SSA100 г), смешанный с чистой питьевой водой, в течение не менее 3 дней.Животным позволяли акклиматизироваться к окружающей среде в течение первых 7 дней, прежде чем им было назначено соответствующее лечение. Всех животных содержали при температуре 22 ± 3 ° C (комнатная температура) в течение 12 часов (цикл свет / темнота) и влажности (45–60%).
Методика эксперимента
После семи дней адаптации к окружающей среде кроликов сбалансировали по весу и случайным образом распределили по четырем диетическим лечебным группам, а именно: G1, G2, G3 и G4 по 6 пар в группе (самцы и самки в отдельных клетках) для 6-месячного кормления. испытание.Кролики в группе G1 выращивались на обычном рационе без ГМ хлопчатника. Кролики в G2, G3 и G4 выращивались на диете, содержащей 20, 30 и 40% трансгенных семян хлопка, соответственно. Каждому животному ежедневно давали сто пятьдесят граммов (150 г) экспериментальной диеты, чтобы обеспечить кормление ad-libitum . Чистая вода была доступна на протяжении всего экспериментального периода.
Расход корма и живая масса
За всеми животными ежедневно наблюдали на предмет аномалий и смертности.Массу тела каждого животного измеряли перед введением дозы, и эта практика обычно выполнялась еженедельно в течение всего периода исследования. Потребление корма для животных в каждой группе определяли ежедневно, вычисляя разницу между суточным количеством подаваемого корма и остатком корма. Однако для понимания данные о потреблении корма, представленные на Рисунке 1, были суммированы на еженедельной основе.
Рисунок 1 . Среднее потребление корма самцами и самками кроликов. G1 представляют контрольную группу.G2, G3 и G4 представляют собой диету с содержанием 20, 30 и 40% ГМО-хлопка.
Суточное потребление корма (г) = (Количество подаваемого корма − Количество оставшегося корма).
Сбор крови и биохимия сыворотки
Образцы крови были взяты из ушной вены каждого животного с помощью стерилизованного одноразового шприца и иглы. Чтобы свести к минимуму стандартную ошибку в значениях, животных не кормили в течение 12 ч (12 ч) перед забором крови. Три миллилитра образца крови отбирали в промаркированные стерильные пробирки-сепараторы сыворотки через определенные интервалы времени 0, 45, 90, 135 и 180 дней исследования.Сыворотку отделяли центрифугированием при 3000 об / мин при 4 ° C в течение 10 мин и немедленно хранили при -20 ° C до использования. Измеряемые биохимические параметры включают ферменты сыворотки, электролиты сыворотки, глюкозу, общий холестерин, общий белок сыворотки и билирубин. Среди сывороточных ферментов изучались аспартатаминотрансфераза (AST), щелочная фосфатаза (ALP), аланинаминотрансфераза (ALT), креатинин и мочевина (BUN). Для электролитов сыворотки измеряли уровни натрия [Na], калия [K], кальция [Ca] и хлорида [Cl].Все параметры оценивали в автоматическом биохимическом анализаторе (Accurex — Sphera Automated Clinical Chemistry Analyzer Италия) с использованием коммерческих наборов в соответствии с инструкциями производителя.
Статистический анализ
Данные по композиционному анализу, потреблению корма и еженедельной массе тела были подвергнуты одностороннему дисперсионному анализу (ANOVA). Наблюдения за биохимическими параметрами сыворотки крови были проанализированы с использованием двухфакторного дисперсионного анализа (2-way ANOVA). Учитывались диета, период отбора проб и их взаимодействие.Данные для кроликов-самцов и самок были проанализированы отдельно, и результаты были представлены в виде среднего значения ± стандартная ошибка (x ± SEM). Среднее значение всех обработок сравнивали с использованием «теста множественного сравнения Тьюки», когда это было целесообразно для определения любых значимых различий. P <0,05 считались значимыми. Весь анализ был выполнен с использованием (программное обеспечение Graph Pad Prism для Windows версии 7).
Биоэтика
Все экспериментальные процедуры были одобрены этическим комитетом Национального центра передового опыта в области молекулярной биологии (CEMB) Пенджабского университета в Лахоре, Пакистан.
Результаты
Композиционный анализ
Примерные составы контрольных и экспериментальных деистов перечислены в таблице 2. Хотя есть небольшие различия в расчетных средних значениях некоторых из ближайших компонентов, между контрольной и экспериментальной диетами, однако такие различия не являются статистически значимыми ( P > 0,05).
Собственная масса и расход корма
С течением времени масса тела каждого животного во всех четырех группах увеличивается.Статистических различий в массе тела как в контрольной, так и в экспериментальной группах не наблюдалось (рис. 2). Потребление корма было сопоставимым между четырьмя экспериментальными группами на протяжении всего исследования (Рисунок 1).
Рисунок 2 . Средняя недельная масса тела кроликов мужского и женского пола на протяжении фазы роста. G1 представляют контрольную группу. G2, G3 и G4 представляют собой диету с содержанием 20, 30 и 40% ГМО-хлопка.
Биохимические изменения сыворотки и активность ферментов
Реакция и активность сывороточных ферментов, таких как аминотрансфераза (ALT), аспартаттрансаминаза (AST), щелочная фосфатаза (ALP), креатинин и мочевина BUN, у растущих кроликов в отношении диетического лечения суммированы в таблицах 3, 4.Биохимические показатели во всех четырех группах кроликов-самцов и самок после 180-дневного эксперимента по кормлению незначительно ( p > 0,05) не повлияли на диетическое лечение. Уровень мочевины BUN в сыворотке кроликов-самцов, получавших рацион, содержащий 40% ГМ-семян хлопчатника, был значительно выше ( P <0,05) через 135 дней по сравнению с контрольными кроликами и кроликами-самками. Однако в следующие 45 дней такого роста не наблюдалось. Также было зарегистрировано очевидное повышение уровня мочевины BUN в сыворотке кроликов, получавших диету, содержащую 20 и 30% ГМ диеты, но такое увеличение статистически не отличалось от такового в контрольных группах.
Таблица 3 . Влияние пищевых белков Bt и CP4EPSPS на биохимический ответ сыворотки и активность ферментов самцов кроликов.
Таблица 4 . Влияние пищевых белков Bt и CP4EPSPS на биохимический ответ сыворотки и активность ферментов самок кроликов.
Электролиты сыворотки
Изучена реакция на различные сывороточные электролиты, такие как Na, K, Ca и Cl, у самцов и самок кроликов после кормления четырьмя различными типами рационов в течение 180 дней.Таблицы 5, 6 суммировали проанализированные значения во всех группах как среднее ± SEM. Базальный уровень сывороточного натрия был статистически одинаковым во всех группах и не изменялся в ходе исследования. Точно так же исходные уровни калия и кальция в сыворотке крови были сопоставимы в четырех экспериментальных группах. Также оценивали реакцию сывороточного Cl на диетическое лечение, и все значения оставались неизменными в контрольной, а также в обработанных группах кроликов.
Таблица 5 .Влияние диетических белков Bt и CP4EPSPS на электролит сыворотки самцов кроликов.
Таблица 6 . Влияние диетических белков Bt и CP4EPSPS на электролит сыворотки самок кроликов.
Общий холестерин и глюкоза сыворотки
На рис. 3 представлено влияние кормления ГМ хлопчатника на общий холестерин и глюкозу в сыворотке крови каждого кролика после 180-дневного приема добавок. Начальные уровни общего холестерина в сыворотке крови во всех четырех группах кроликов-самцов статистически не различались ( p > 0.05) друг от друга. Однако через 45 дней употребления ГМ-семян хлопчатника наблюдалось значительное повышение ( P <0,01) уровней общего холестерина G3 в сыворотке по сравнению с другими группами.
Рисунок 3 . Изменения уровней общего холестерина и глюкозы в сыворотке крови в четырех экспериментальных группах кроликов-самцов и самок. группа. Контрольная группа G1, G2, G3 и G4 представляют 20, 30 и 40% ГМ-семян хлопка соответственно. Двусторонний дисперсионный анализ показал значительные различия между группами, периодами выборки и их взаимодействием ( P <0.05). Post-hoc множественных сравнений дополнительно выявили существенные различия между конкретными группами лечения и контрольными группами.
Уровень общего холестерина G2 в сыворотке крови также оказался значительно выше ( P <0,01), чем уровень общего холестерина G1 и G2 на 45-й день исследования. Уровни общего холестерина в сыворотке как в G1, так и в G4 оставались значительно ниже по сравнению с уровнями G2 и G3 с 45 дней до конца исследования. Базальный уровень общего холестерина в сыворотке крови самок кроликов G3 был значительно выше ( P <0.05), чем в остальных группах. Значительное увеличение общего холестерина сыворотки было зарегистрировано во всех группах кроликов-самок, за исключением контрольных групп, на 45 и 90 дни исследования. Уровень холестерина в G3 и G4 также был значительно выше по сравнению с G2 через 45 дней. Значения общего холестерина в сыворотке крови кроликов-самок G1 и G2 были аналогичными через 135 и 180 дней, но значительно ниже, чем у кроликов G3 и G4. Уровни холестерина в G4 также были значительно ниже по сравнению с G3 через 180 дней.Точно так же не было обнаружено значительных различий ( P <0,05) в исходных уровнях сывороточной глюкозы во всех группах самцов и самок кроликов. Уровни оставались такими же у кроликов-самцов всех групп до тех пор, пока через 180 дней уровень в G4 не был значительно ниже по сравнению с G1 и G3. Подобная тенденция, по-видимому, наблюдается у кроликов-самок во всех группах. Уровни глюкозы у самок кроликов G3 через 135 дней были значительно ниже по сравнению с таковыми у G2 и G4.Через 135 дней уровни во всех группах были статистически одинаковыми, за исключением G4, который значительно выше ( P <0,05), чем в G3.
Белки сыворотки
Ответ общего белка сыворотки и общего билирубина у растущих самцов и самок кроликов, получавших разные уровни диетической ГМ-хлопковой муки, представлен на рисунке 4. Не было значительных различий ( P > 0,05) в базовых уровнях общего сывороточного уровня. белки всех групп.Эти уровни оставались неизменными на протяжении всего исследования. Начальные и конечные значения общего билирубина сыворотки во всех группах также были равны. Несмотря на то, что были некоторые различия в рассчитанных средних значениях, эти различия не были статистически значимыми ( P > 0,05).
Рисунок 4 . Изменения уровней общего белка сыворотки и общего билирубина в четырех экспериментальных группах кроликов-самцов и самок. группа. Контрольная группа G1, G2, G3 и G4 представляют 20, 30 и 40% ГМ-семян хлопка соответственно.Двусторонний дисперсионный анализ показал незначительные различия между группами, периодами выборки и их взаимодействием ( P > 0,05).
Обсуждение
Генетически модифицированные (ГМ) культуры обладают огромным потенциалом в растениеводстве, однако их безопасность в качестве пищевых продуктов и кормов остается спорной. Постоянно возникали различные противоречивые отчеты и противоречивые мнения относительно потенциальных рисков ГМ-культур для здоровья людей и животных. Тем не менее, очень мало известно о достоверности различных тестов по оценке безопасности, проведенных для этих культур (3).По-прежнему предлагалось интенсивное тестирование трансгенных культур на животных моделях вместе с оценкой производительности и токсикологии на предмет существенной эквивалентности (26, 27). Хотя семена хлопка не потребляются человеком напрямую, а являются их побочными продуктами, но все же сельскохозяйственные животные потребляют значительные количества растительного материала, и у домашнего скота есть значительные шансы потреблять значительное количество трансгенной ДНК и белка, что может привести к изменению их гематологических и биохимических показателей профиль (28).Таким образом, это исследование было проведено для оценки влияния кормления трансгенных семян хлопчатника, экспрессирующих белки Bt и Cp4epsps , на биохимический профиль сыворотки кроликов.
Принцип существенной эквивалентности недавно был рассмотрен как средство оценки безопасности пищевых продуктов в соответствии с международным стандартом трансгенных культур (29–32). На основе этого принципа оценка питательных компонентов между ГМ-культурой и их не-ГМ-аналогом является важным фактором для оценки безопасности ГМ-пищевых продуктов / кормов (33).В настоящем исследовании потребление трансгенных семян хлопка с пищей оценивалось по реакции питания кроликов. Перед кормлением кроликов анализировали основные компоненты питания контрольного и экспериментального рационов. Статистических различий в составе питательных веществ между контрольным и экспериментальным рационами не наблюдалось. Результат этого исследования показал, что включение до 40% семян трансгенного хлопка не приводит к значительным изменениям химического состава рационов.Трипати и его коллеги сообщили, что интеграция Bt-генов , экспрессирующих белки, устойчивые к насекомым ( Cry1Ac, Cry2Ab, Cry2Ab2 ) или белок Cp4 epsps , не может изменить химический состав семян хлопка (28). Исследования также показали, что химический состав растений хлопка, которые были генетически модифицированы для экспрессии различных типов генов, таких как ген Cry1Ac, Cry2Ab и Cp4 epsps , или комбинации генов Cry1Ac и Cry2Ab ; Гены Cry1Ac и Cp4 epsps оказались идентичными (34).
На потребление корма и среднюю еженедельную массу тела животных во всех четырех группах диетическое лечение не повлияло. Результат этого исследования показал, что скармливание трансгенным семенам хлопка даже при 40% -ном уровне включения не имело пагубного влияния на рост и развитие животных. Результат этого исследования соответствует предыдущим выводам, указывающим на незначительные различия в массе тела кроликов, когда 30% семян хлопка Bt были включены в их рационы (17).Таким образом, наш вывод согласуется с рекомендациями предыдущих исследователей о том, что добавление ГМ-хлопка в рацион животных безопасно, поскольку присутствие трансгенов в геноме хлопка не объясняет значительных изменений в его питательных компонентах (26, 27, 35–37). . Аналогичные результаты наблюдались также при воздействии на сома и северного бобуайтского перепела бат, хлопковой муки (38–40). Более того, исследования показали, что потребление корма и масса тела лактирующих коров голштинской породы существенно не изменились, когда их кормили рационом, содержащим цельные ГМ-семена хлопчатника (34).
В сывороточной энзимологии концентрация ферментов используется для диагностики поражения сердца, печени и почек, обеспечивая ценную информацию об их состоянии повреждения (41). Ферменты сыворотки, такие как аминотрансферазы, представляют собой внутриклеточные ферменты, которые обычно находятся в низком уровне в плазме и контролируют высвобождение клеточного содержимого во время нормального обновления клеток (42). В многочисленных исследованиях сообщалось, что более высокий уровень АЛТ и АСТ в основном вызван инфекциями печени, приводящими к обширной гибели клеток, а также тяжелым вирусным гепатитом или токсическим поражением печени (42).В этом исследовании были оценены средние значения всех тестируемых сывороточных ферментов как самцов, так и самок кроликов, и результаты показали, что не было значительных различий в LFT для каждой группы, и все значения были в пределах нормального контрольного диапазона, указанного для кроликов (43 ). Результаты активности ферментов сыворотки, полученные в этом исследовании, ясно показали, что воздействие на кроликов диетических ГМ-семян хлопка в течение 180 дней не оказывает неблагоприятного воздействия на функции их жизненно важных органов, таких как печень, почки и сердце.Эти результаты согласуются с отчетом Yonemochi et al. (44), которые не обнаружили пагубного влияния ГМ кукурузы на уровни лактатдегидрогеназы в сыворотке молочных коров. Аналогичные результаты были также получены Tudisco et al. (45), что ГМ-соя не влияла на несколько специфических ферментов в сыворотке, сердце, скелетных мышцах, печени и почках экспериментальных животных. Напротив, Сингх и его коллеги сообщили о снижении уровня АЛТ в сыворотке буйволов, выращенных на ГМ-хлопчатнике (46). Однако авторы пришли к выводу, что не было обнаружено опасного для здоровья воздействия на буйволов, что подтверждается гематологическими показателями.
Электролиты сыворотки, такие как Na, K, Ca и Cl, являются второстепенными пищевыми веществами, на которые, как сообщается, меньше всего влияют изменения в составе рациона. Тем не менее нельзя игнорировать их большое клиническое значение (47). Более того, они играли значительную роль в большинстве повседневных функций организма, таких как нервная проводимость, сокращение сердца и скелетных мышц, кислотно-щелочной баланс, регулирование осмотического давления, всасывание моносахаридов и аминокислот (48–50). Результаты исследования сывороточных электролитов, представленные в этом исследовании, соответствуют отчетам, и все значения находятся в пределах стандартного референсного диапазона, сообщенного Джонсом (43).Результаты, полученные в этом исследовании, показали, что потребление ГМ-диеты не повлияло на баланс электролитов. Аналогичные выводы были сделаны Zhou et al. (51), когда крыс Sprague-Dawley кормили трансгенным рисом с высоким содержанием амилозы на протяжении до трех поколений. Результаты этого исследования подтверждаются данными Прасада (52), который кормил кроликов диетой с высоким содержанием холестерина в течение 6 месяцев. Однако, напротив (42), сообщалось о значительных изменениях уровней электролитов в сыворотке крови кроликов после 6-недельного употребления фумонизина с пищей.
Холестерин — это основной тип стерола, биосинтезируемый всеми клетками животных, как важный структурный компонент мембран всех клеток животных и предшественник стероидных гормонов, витамина D и желчных кислот (53). Холестерин — это не просто отходы метаболизма, он действует как важный клеточный защитный барьер от обезвоживания и инфекций (54). Точно так же глюкоза является основным источником энергии не только для эритроцитов, но также действует как незаменимый краткосрочный источник энергии для многих других тканей. E.g., центральная нервная система (55). Хотя значимые различия между группами были рассчитаны в уровне общего холестерина и глюкозы в сыворотке у некоторых экспериментальных кроликов-самцов и самок после 180-дневного испытания кормления ГМ-семенами хлопчатника. Однако эти различия не были биологически значимыми, поскольку все различия находились в пределах сообщенных нормальных физиологических эталонных значений кроликов (43). Таким образом, результат этого эксперимента предполагает, что наблюдаемые различия не могут быть отнесены на счет воздействия на животное ГМ-семян хлопчатника, а могут быть результатом некоторых других физиологических факторов, специфичных для отдельных животных.Этот результат подтверждает вывод (17), который обнаружил незначительные различия в уровнях общего холестерина и глюкозы в сыворотке крови, когда кроликов кормили семенами ГМ хлопчатника и свежими листьями в течение 90 дней. Аналогичным образом (33) сообщили о незначительных различиях в уровнях общего холестерина и глюкозы в сыворотке, когда устойчивые к глифосату трансгенные бобы сои GTS40-3-2 скармливались крысам в течение 195 дней. Также сообщалось о незначительных различиях в уровнях триглицеридов и общего холестерина, когда крысам скармливали ГМ и обычный рис в течение 90-дневного исследования (56).
Исследования показали, что на различные типы пищевых белков, такие как общий белок, альбумин, глобулин и общий билирубин, обычно влияет общее потребление белка (57, 58). Начальные и конечные значения всех типов белков, изученных в этих экспериментах, статистически не различались. Незначительные различия, зарегистрированные для общих белков сыворотки и билирубина в этом исследовании, являются показателем того, что пищевые белки epsps и Bt не оказывают отрицательного влияния на метаболизм белков у экспериментальных животных, поскольку синтез сывороточного белка в основном связан с с количеством доступного белка в рационе (59).На основании полученных результатов также была выявлена питательная ценность пищевых белков. Результаты этого исследования согласуются с отчетом Rahman et al. и Юань и др. (17, 33).
Заключение
Никаких побочных эффектов не наблюдалось на биохимические показатели сыворотки крови кроликов после кормления рационом, содержащим различные уровни (20, 30 и 40%) генетически модифицированных семян хлопка, несущих гены Bt и EPSPS , в течение 180 дней. Таким образом, результаты этого исследования позволяют предположить, что муку из семян ГМ-хлопка можно безопасно использовать в качестве кормового ингредиента, как и другие обычные кормовые продукты.
Вклад авторов
Концепция и дизайн эксперимента были инициированы И.С. IS, AS и TH: Подготовка оборудования и материалов; IS и AR: Обзор литературы; IS и QA: сбор и анализ данных; IS, AS и QA: Подготовка основной рукописи; QA и AR: критический обзор рукописи; IS, AS, QA, AR и TH: утверждение окончательной версии рукописи. Рукопись была прочитана всеми авторами и одобрена к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана Национальным центром передового опыта в области молекулярной биологии Университета Пенджаба.
Список литературы
1. Организация Объединенных Наций. World Population Prospects The 2012 Revision, Vol. I. Исчерпывающие таблицы . Департамент по экономическим и социальным вопросам, Организация Объединенных Наций, Нью-Йорк, штат Нью-Йорк. Том I: ST / ESA / SER.A / 336. (2013).
2. Мо X, Тан З., Сюй М., Ян Х. Оценка безопасности для здоровья риса, генетически модифицированного обоими генами Bt и EPSPS, с использованием модели мыши ( Mus musculus ). J Anim Plant Sci . (2015) 25 : 80–90.
Google Scholar
3. Ибрагим М.А., Окаша Э.Ф. Влияние генетически модифицированной кукурузы на слизистую тощей кишки взрослого самца крысы-альбиноса. Exper Toxicol Pathol. (2016) 68 : 579–88. DOI: 10.1016 / j.etp.2016.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Ян Л., Сунь И., Хао Ю., Ван Ю. Эффекты трансгенных листьев тополя с бинарными генами устойчивости к насекомым, используемых в качестве корма для кроликов. Всемирная наука о кроликах . (2013) 21 : 257–61. DOI: 10.4995 / wrs.2013.1188
CrossRef Полный текст | Google Scholar
5. Snell C, Bernheim A, Bergé J-B, Kuntz M, Pascal G, Paris A, et al. Оценка воздействия рациона ГМ-растений на здоровье в долгосрочных испытаниях кормления животных с участием нескольких поколений: обзор литературы. Food Chem Toxicol. (2012) 50 : 1134–48. DOI: 10.1016 / j.fct.2011.11.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Reichert M, Kozaczynski W, Karpinska TA, Bocian Ł, Jasik A, Kycko A, et al. Гистопатология внутренних органов сельскохозяйственных животных, получавших генетически модифицированную кукурузу и соевый шрот. Bull Vet Inst Pulawy (2012) 56 : 617–22. DOI: 10.2478 / v10213-012-0109-y
CrossRef Полный текст | Google Scholar
7. Séralini G-E, Cellier, D, de Vendomois JS. Новый анализ исследования кормления крыс генетически модифицированной кукурузой выявил признаки гепаторенальной токсичности. Arch Environ Contam Toxicol .(2007) 52 : 596–602. DOI: 10.1007 / s00244-006-0149-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Куликов А. Генетически модифицированные организмы и риски их интродукции. Российская физиология растений J . (2005) 52 : 99–111. DOI: 10.1007 / s11183-005-0015-8
CrossRef Полный текст | Google Scholar
9. Абдо Э., Барбэри О., Шалтут О. Химический анализ Bt-кукурузы «Mon-810: Ajeeb-YG®» и ее аналога, не содержащего Bt кукурузы «Ajeeb.” IOSR J Appl Chem. (2013) 4 : 55–60. DOI: 10.9790 / 5736-0415560
CrossRef Полный текст | Google Scholar
10. Тышко Н.В., Аксюк И.Н., Тутельян В.А. Оценка безопасности генетически модифицированных организмов растительного происхождения в Российской Федерации. Биотехнология J . (2007) 2 : 826–32. DOI: 10.1002 / biot.200700020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Марвье М. Экология трансгенных культур. Генно-инженерные растения могут создавать проблемы с сорняками и влиять на нецелевые организмы, но измерить риск сложно. Am Sci . (2001) 89 : 160–7. DOI: 10.1511 / 2001.18.728
CrossRef Полный текст | Google Scholar
12. Shelton AM, Zhao J-Z, Roush RT. Экономические, экологические, продовольственные и социальные последствия внедрения трансгенных растений Bt. Ann Rev Entomol. (2002) 47 845–81. DOI: 10.1146 / annurev.ento.47.0.145309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Коннер А.Дж., Глэр Т.Р., Нап. JP. Выпуск в окружающую среду генетически модифицированных культур. Plant J. (2003) 33 : 19–46. DOI: 10.1046 / j.0960-7412.2002.001607.x
CrossRef Полный текст | Google Scholar
15. Мага-а-Гомес Х.А., Кальдерон-де-ла-Барка AM. Оценка риска генетически модифицированных культур для питания и здоровья. Nutri Ред. . (2009) 67 : 1–16. DOI: 10.1111 / j.1753-4887.2008.00130.x
CrossRef Полный текст | Google Scholar
17. Рахман М., Заман М., Шахин Т., Ирем С., Зафар Ю. Безопасное использование генов Cry в генетически модифицированных культурах. Энвирон Хем Летт . (2015) 13 : 239–49. DOI: 10.1007 / s10311-015-0508-4
CrossRef Полный текст | Google Scholar
18. Аль-Фартоси К.Г., Талиб Ю., Али С. Сравнительное исследование некоторых биохимических параметров сыворотки крови крупного рогатого скота и овец болот на юге Ирака. AL-Qadisiya J Vet Med Sci. (2010) 9 : 79–84.
Google Scholar
19. Сриджая С., Арчана Д., Санти К. Биохимические изменения в сыворотке экспериментальных животных, обработанных корневищем аира аира. Шпилька. Этно Мед . (2017) 11 : 216–20. DOI: 10.1080 / 09735070.2017.1353109
CrossRef Полный текст | Google Scholar
20. Панда С, Бабу Л.К., Панда АК. Влияние диетических добавок ферментированного рыбного силоса на биохимические показатели сыворотки крови японских перепелов-бройлеров (Coturnix coturnix japonica). Вет. Мир . (2017) 10 : 380. DOI: 10.14202 / vetworld.2017.380-385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Мамун М., Хасан М., Шайкат А., Ислам С., Хок М., Уддин М. и др. Биохимический анализ крови местного крупного рогатого скота в холмистой местности Бангладеш. Bangl J Vet Med . (2014) 11 : 51–6. DOI: 10.3329 / bjvm.v11i1.16513
CrossRef Полный текст
22. Молина Е., Гонсалес-Редондо П., Морено-Рохас Р., Монтеро-Кинтеро К., Чиринос-Кинтеро Н., Санчес-Урданета А. Оценка гематологических, биохимических и гистопатологических параметров сыворотки крови растущих кроликов, которых кормили Amaranthus dubius 26. J Anim Physiol Anim Nutrit. (2017) 102 : e525–33. DOI: 10.1111 / jpn.12791
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Ewuola EO, Egbunike GN. Гематологический и сывороточный биохимический ответ растущих кроликов, получавших фумонизин B 1. Afr. J. Biotechnol . (2008) 7 : 4304–9. DOI: 10.4314 / ajb.v7i23.59575
CrossRef Полный текст | Google Scholar
24. Химики А.А. Официальные методы анализа .Vol. I, 15-е издание, Арлингтон, Вирджиния: AOAC (1990). п. 69–84.
25. Ван Сост П.В., Робертсон Дж., Льюис Б. Методы получения пищевых волокон, нейтральных детергентных волокон и некрахмальных полисахаридов в отношении питания животных. J Молочные науки . (1991) 74 : 3583–97. DOI: 10.3168 / jds.S0022-0302 (91) 78551-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Александр Т.В., Рейтер Т., Олрих К., Шарма Р., Окин Е.К., Диксон В.Т. и др. Обзор обнаружения и судьбы новых молекул растений, полученных с помощью биотехнологии в животноводстве. Anim Feed Sci Technol. (2007) 133 : 31–62. DOI: 10.1016 / j.anifeedsci.2006.08.003
CrossRef Полный текст | Google Scholar
27. Трабальца-Маринуччи М., Брэнди Дж., Рондини С., Авеллини Л., Джаммарини С., Костарелли С. и др. Трехлетнее продольное исследование влияния диеты, содержащей генетически модифицированную кукурузу Bt176, на состояние здоровья и продуктивность овец. Наука о животноводстве . (2008) 113 : 178–90. DOI: 10.1016 / j.livsci.2007.03.009
CrossRef Полный текст | Google Scholar
28. Трипати М., Мондал Д., Сомванши Р., Карим С. Гематология, биохимия крови и гистопатология тканей ягнят, содержащихся на диетах, содержащих белок, контролирующий насекомых (Cry1Ac) в семенах Bt-хлопка. J Anim Physiol Anim Nutrit. (2011) 95 : 545–55. DOI: 10.1111 / j.1439-0396.2010.01081.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Junhua H, Yuexin Y, Shurong C, Zhu W., Xiaoli Y, Guodong W. и др.Сравнение питательного состава исходного риса и риса, генетически модифицированного ингибитором трипсина вигнового гороха в Китае. J Food Compos Anal. (2005) 18 : 297–302. DOI: 10.1016 / j.jfca.2004.11.001
CrossRef Полный текст | Google Scholar
30. Хе XY, Тан MZ, Луо YB, Ли X, Cao SS, Yu JJ, et al. 90-дневное токсикологическое исследование трансгенного зерна кукурузы, богатого лизином (Y642), на крысах Sprague-Dawley. Food Chem Toxicol. (2009) 47 : 425–32.DOI: 10.1016 / j.fct.2008.11.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Чжоу XH, Dong Y, Xiao X, Wang Y, Xu Y, Xu B, et al. 90-дневное токсикологическое исследование трансгенного зерна риса с высоким содержанием амилозы на крысах Sprague-Dawley. Food Chem Toxicol. (2011) 49 : 3112–8. DOI: 10.1016 / j.fct.2011.09.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Ван Э. Х., Ю З., Ху Дж., Сюй HB. Влияние 90-дневного кормления трансгенным рисом Bt TT51 на репродуктивную систему самцов крыс. Food Chem Toxicol. (2013) 62 : 390–6. DOI: 10.1016 / j.fct.2013.08.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Юань Дж., Тан З., Чжао Дж., Ши З., Ван Дж. Токсикологическая оценка хронического скармливания глифосат-устойчивой трансгенной соевой муки GTS40-3-2 крысам. Эмир Дж. Продовольствие и сельское хозяйство . (2017) 29 : 856–62. DOI: 10.9755 / ejfa.2017.v29.i11.1495
CrossRef Полный текст | Google Scholar
34.Кастильо А., Галлардо М., Масиэль М., Джордано Дж., Конти Дж., Гаджотти М. и др. Влияние кормления рационами генетически модифицированного цельного хлопка на лактирующих коров голштинской породы. J Молочные науки . (2004) 87 : 1778–85. DOI: 10.3168 / jds.S0022-0302 (04) 73333-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Гамильтон К.А., Пила П.Д., Бриз М., Олсон Т., Ли М., Робинсон Е. и др. Хлопок Bollgard II: анализ состава и исследования питания семян хлопчатника, защищенного от насекомых (Gossypium hirsutum L.) продуцируя белки Cry1Ac и Cry2Ab2. J Agric Food Chem. (2004) 52 : 6969–76. DOI: 10.1021 / jf030727h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Флачовски Г., Бёме Х. Предложения по оценке питательности кормов из генетически модифицированных растений. J Anim Feed Sci. (2005) 14 : 49. DOI: 10.22358 / jafs / 70354/2005
CrossRef Полный текст | Google Scholar
37. Flachowsky G, Aulrich K, Böhme H, Halle I.Исследования кормов из генетически модифицированных растений (GMP) — вклад в оценку питательности и безопасности. Anim Feed Sci Technol. (2007) 133 : 2–30. DOI: 10.1016 / j.anifeedsci.2006.08.002
CrossRef Полный текст | Google Scholar
39. Галлахер С., Граймс Дж., Биверс Дж. Белок 2 для защиты от насекомых в хлопковой муке: исследование диетической токсичности с участием северного бобуайта . Отчет № Отчет Monsanto № MSL-1678. Компания «Монсанто», Сент-Луис.(2000).
40. Ли М., Робинсон Э. Оценка хлопковой муки, полученной из защищенных от насекомых хлопковых линий 15813 и 15985, в качестве кормового ингредиента для сома . Отчет № MSL-16179, Национальный центр теплой воды Трад Кокран (испытательный центр) Государственный университет Миссисипи, Стоунвилл, штат Миссисипи. (2000) 38776-0197.
41. Сушильная машина RL. Обзор физиологической химии. Arch. Междунар. Мед . (1962) 109 : 632. DOI: 10.1001 / archinte.1962.03620170130024
CrossRef Полный текст | Google Scholar
42.Gbore FA, Akele O. Показатели роста, гематология и биохимия сыворотки кролика-самки (Oryctolagus cuniculus), получавшего диетический фумонизин. Ветеринарный архив . (2010) 80 : 431–43.
Google Scholar
44. Ёнемочи К., Икеда Т., Харада С., Кусама Т., Ханадзуми М. Влияние трансгенной кукурузы (CBH 351, названной Starlink) на состояние здоровья дойных коров и перенос белка Cry9C и гена cry9C в молоко, кровь, печень и мышца. Anim Sci J . (2003) 74 : 81–8.DOI: 10.1046 / j.1344-3941.2003.00090.x
CrossRef Полный текст | Google Scholar
45. Тудиско Р., Ломбарди П., Бовера Ф., Кутриньелли М., Мастеллоне В., Терци В. и др. Генетически модифицированная соя в кормлении кроликов: обнаружение фрагментов ДНК и оценка метаболических эффектов с помощью ферментативного анализа. Anim Sci. (2006) 82 : 193–9. DOI: 10.1079 / ASC200530
CrossRef Полный текст | Google Scholar
46. Сингх М., Тивари Д., Кумар А., Кумар М.Р.Влияние кормления трансгенными семенами хлопчатника по сравнению с нетрансгенными семенами хлопчатника на гематобиохимические составляющие у кормящих буйволов породы Мурра. Азиатский Austr J Anim Sci. (2003) 16 : 1732–7. DOI: 10.5713 / ajas.2003.1732
CrossRef Полный текст | Google Scholar
47. Мураками А., Овьедо-Рондон Э., Мартинс Э., Перейра М., Скапинелло С. Потребность в натрии и хлоридах растущих цыплят-бройлеров (возрастом от 21 до 42 дней), получающих кукурузо-соевые бобы. Poultry Sci. (2001) 80 : 289–94. DOI: 10.1093 / пс / 80.3.289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Ахмад Т., Муштак Т., Хан М., Бабар М., Юсуф М., Хасан З. и др. Влияние различного баланса электролитов в рационе на продуктивность бройлеров в условиях тропического лета. J Anim Physiol Anim Nutrit. (2009) 93 : 613–21. DOI: 10.1111 / j.1439-0396.2008.00840.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Овьедо-Рондон Э., Мураками А., Фурлан А., Морейра И., Макари М. Потребность молодых цыплят-бройлеров в содержании натрия и хлоридов, получавших кукурузно-соевые бобы (в возрасте от одного дня до двадцати одного дня). Наука о птицеводстве . (2001) 80 : 592–8. DOI: 10,1093 / пс / 80.5.592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Муштак М., Паша Т. Электролиты, баланс электролитов в рационе и соли у бройлеров: обновленный обзор кислотно-щелочного баланса, характеристик крови и туши. World’s Poultry Sci J. (2013) 69 : 833–52. DOI: 10.1017 / S00439330846
CrossRef Полный текст | Google Scholar
51. Чжоу XH, Dong Y, Zhao YS, Xiao X, Wang Y, He YQ и др. Исследование репродукции трех поколений на крысах Sprague-Dawley, потребляющих трансгенный рис с высоким содержанием амилозы. Food Chem Toxicol. (2014) 74 : 20–7. DOI: 10.1016 / j.fct.2014.08.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Прасад К. Биохимические изменения в сыворотке крови кроликов на регулярной диете с комплексом льняного лигнана и без него после диеты с высоким содержанием холестерина. Int J Angiol. (2008) 17 : 27–32. DOI: 10.1055 / с-0031-1278276
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Ханукоглу И. Стероидогенные ферменты: структура, функция и роль в регуляции биосинтеза стероидных гормонов. J. Ster Biochem Mol Biol. (1992) 43 : 779–804. DOI: 10.1016 / 0960-0760 (92) -5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Джереми Э. Сердечно-сосудистая эффективность против недостаточности питания. Международный фонд здоровья и питания в Сан-Диего. J Ветеринарный акушер . (2010) 858 : 2488–533.
56. Юань Ю, Сюй В., Хэ Х, Лю Х., Цао С., Ци Х и др. Влияние генетически модифицированного риса T2A-1 на здоровье желудочно-кишечного тракта крыс после 90-дневного приема добавок. Научная репутация . (2013) 3 : 1962.DOI: 10.1038 / srep01962
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Бирт Д., Шульдт Г. Влияние источника и уровня белка, скармливаемого сирийским хомячкам, на рост, использование белка и отдельные белки крови. Lab Anim Sci. (1982) 32 : 357–62.
PubMed Аннотация | Google Scholar
58. Онифаде А., Теви О. Альтернативные источники тропической энергии в рационах кроликов: показатели роста, усвояемость рациона и состав крови. World Rabbit Sci. (2010) 1 : 17–24. DOI: 10.4995 / wrs.1993.191
CrossRef Полный текст | Google Scholar
59. Iyayi E, Tewe O. Уровни общего белка, мочевины и креатинина в сыворотке как показатели качества кормов из маниоки для свиней. Trop Vet. (1998) 16 : 59–67.
Bacillus thuringiensis (Bt) Общий информационный бюллетень
Что такое
Bacillus thuringiensis (Bt) ?Bt — это микроб, который в природе встречается в почве.Вырабатывает токсичные белки неполовозрелым насекомым (личинкам). Есть много типов Bt . Каждая цель разные группы насекомых. Целевые насекомые включают жуков, комаров, черных мухи, гусеницы и бабочки.
При использовании пестицидов Bt рутинные испытания необходимы, чтобы убедиться, что нежелательные токсинов и микробов нет. Bt был зарегистрирован для использования в пестициды Агентством по охране окружающей среды США (EPA) с 1961 года.
Какие продукты содержат
Bacillus thuringiensis (Bt) ?В настоящее время штаммов Bt обнаружены в более чем 180 зарегистрированных пестицидных продуктах. Bt Продукция используется для выращивания сельскохозяйственных культур и декоративных растений. растения. Другие используются в зданиях и вокруг них, в водной среде и в воздухе. Эти продукты обычно спреи, дусты, гранулы и пеллеты. Некоторые из этих продуктов одобрены для использования в органическом сельском хозяйстве.
Некоторые сельскохозяйственные культуры вырабатывают токсин Bt .Эти защитные средства, содержащиеся в растениях, включают кукурузу, хлопок, и соя.
Всегда следуйте инструкциям на этикетке и принимайте меры, чтобы избежать воздействия. Если произойдет какое-либо воздействие, обязательно следуйте Первому Внимательно следуйте инструкциям на этикетке продукта. Для получения дополнительных рекомендаций по лечению обращайтесь в Центр борьбы с отравлениями по адресу: 1-800-222-1222. Если вы хотите обсудить проблему с пестицидами, позвоните по телефону 1-800-858-7378.
Как работает
Bacillus thuringiensis (Bt) ?Bt производит токсины, которые поражают личинок насекомых при употреблении в пищу.В их кишках токсины активированы. Активированный токсин разрушает их кишечник, и насекомые умирают от инфекции и голода. Смерть может наступить в течение нескольких часов или недель.
Различные типы Bt создают токсины, которые можно только активировать личинками насекомых-мишеней. Напротив, когда люди едят то же самое токсины, токсины не активируются и никакого вреда не возникает.
Каждый тип токсина Bt очень специфичен для целевого насекомого.Например, «курстаки» нацелены на гусениц. В Тип «isrealensis» поражает неполовозрелых мух и комаров. Прямая токсичность для нецелевых насекомых практически отсутствует. наблюдаемый.
Как я могу подвергнуться воздействию
Bacillus thuringiensis (Bt) ?Люди чаще всего подвергаются воздействию Bt через свой рацион, в очень низких концентрациях. Воздействие может также произойти, если вы вдохнете его или попадете на кожу или в глаза. Например, это может произойти при нанесении спрея или пыли в ветреную погоду.Вы можете также подвергаться воздействию после использования продукта, если вы не моете руки перед едой или курение. Поскольку Bt обычно встречается в почвах, воздействие не связано с пестицидами. также возможны.
Домашние животные могут подвергаться воздействию этого продукта в обработанных ваннах для птиц или в фонтанчиках с водой. Вы можете ограничить свое воздействие и снизить риск, тщательно следуя инструкциям на этикетке.
Каковы некоторые признаки и симптомы кратковременного воздействия
Bacillus thuringiensis (Bt) ?Bt имеет низкую токсичность для людей и других млекопитающих.В нескольких исследованиях не было обнаружено никаких доказательств болезни или инфекции, поскольку в результате воздействия. Однако некоторые продукты с содержанием Bt вызывают раздражение глаз и кожи. В одном исследовании крысы дышали в очень высоких дозах концентрированного Bt . У некоторых были насморк, хрустящие глаза и мурашки по коже. Другие были менее активны или похудел.
В другом исследовании люди были опрошены до и после применения бат с воздуха. Большинство людей не пострадали.Однако некоторые люди с сенной лихорадкой сообщали об определенных симптомах. К ним относятся проблемы со сном и концентрация, расстройство желудка и раздражение носа / горла. Сезонные факторы, такие как пыльца, могли способствовать некоторые эффекты.
Ученые также оценили, может ли Bt вызывать аллергические реакции. Исследователи обнаружили, что сельскохозяйственные рабочие подвергаются воздействию от одного до четырех месяцев не испытывали никаких проблем с дыхательными путями, носом или кожей. Однако дальнейшее разоблачение показали доказательства иммунного ответа и возможность развития кожной аллергии.
Что происходит с
Bacillus thuringiensis (Bt) , когда он попадает в организм?При употреблении в пищу Bt остается в кишечнике. Он не размножается, и токсин расщепляется, как и другие белки в организме. рацион питания. Bt покидает организм в течение 2–3 дней.
При вдохе Bt может перемещаться в легкие, кровь, лимфу и почки. Затем Bt подвергается атаке иммунной системы. Уровни Bt быстро уменьшаются через день после воздействия.
Может ли
Bacillus thuringiensis (Bt) способствовать развитию рака?Не было обнаружено данных о канцерогенном действии Bt на человека. Однако в одном исследовании на животных крыс кормили очень высоким дозы Bt на 2 года. Признаков рака не наблюдалось.
Кто-нибудь изучал нераковые эффекты длительного воздействия
Bacillus thuringiensis (Bt) ?В двухлетнем исследовании крысам давали высокие дозы Bt ежедневно.Самки крыс имели меньшую массу тела. Однако никаких свидетельств была обнаружена инфекция.
Bt активируется только в щелочной среде кишечника насекомых, по сравнению с кислой средой человека. желудки. В желудке человека легко переваривается. Таким образом, после длительного соблюдения диеты побочных эффектов не ожидается. воздействие Bt , независимо от того, распыляются ли его белки на растения или выращиваются в тканях растений.
Дети более чувствительны к
Bacillus thuringiensis (Bt) , чем взрослые?Дети могут быть особенно чувствительны к пестицидам по сравнению со взрослыми.Однако в настоящее время нет данных, показывающих что у детей повышена чувствительность именно к Bt .
Что происходит с
Bacillus thuringiensis (Bt) в окружающей среде?Токсины, создаваемые Bt , быстро расщепляются под действием солнечного света и в кислой почве. Другие микробы в почве также могут его разрушить. Bt плохо выщелачивается пачкаться. Обычно он остается в верхних слоях почвы на несколько дюймов. Bt остается бездействующим в большинстве естественных почвенных условий.Однако было некоторое воспроизведение в почвах, богатых питательными веществами. На поверхности почвы спящие клетки Bt живут всего несколько дней. Однако под поверхностью почвы они могут длиться месяцами или годами. В Период полураспада в неблагоприятной почве составляет около 4 месяцев. Bt токсинов сильно расщепляются Быстрее. В одном исследовании 12% оставались после 15 дней.
В воде Bt плохо воспроизводятся. Исследование обнаружило в воздухе Bt, токсинов были быстро разрушены солнечным светом.Сорок один процент (41%) токсина осталось через 24 часа. На поверхности растений солнечный свет разрушает бат ; в Период полувыведения Bt токсинов составляет 1-4 дня.
Может ли
Bacillus thuringiensis (Bt) влиять на птиц, рыб или других диких животных?Bt практически не токсичен и не патогенен для птиц, рыб и креветок. Никаких побочных эффектов или инфекции обнаружено не было. крысам давали большие дозы двух различных штаммов Bt .Нет никаких доказательств того, что Bt может вызвать вспышку заболевания среди дикие животные.
Прямая токсичность для нецелевых насекомых и других беспозвоночных с панцирем практически отсутствует. Bt не похоже чтобы навредить дождевым червям. Однако штамм aizawai очень токсичен для пчел. Другие штаммы обладают минимальной токсичностью для пчелы.
Водяные блохи, подвергшиеся воздействию штаммов kurstaki и israelensis , показали умеренную токсичность.Штаммы aizawai высокоэффективны. токсичен для водяных блох. Однако данные свидетельствуют о том, что токсичность для этих нецелевых объектов может быть связана с примесями из производство бат .
Цитируйте как: Perez, J .; Bond, C .; Buhl, K .; Stone, D. 2015. Bacillus thuringiensis (Bt) Общий информационный бюллетень ; Национальный информационный центр по пестицидам, Консультационные службы Университета штата Орегон. http://npic.orst.edu/factsheets/btgen.html.
BT показывает, как Великобритания адаптировалась за 100 дней изоляции
Примечания для редакторов
Исследование было проведено организацией Opinion Matters посредством онлайн-опроса, в ходе которого была опрошена репрезентативная на национальном уровне выборка из 2 000 взрослых (старше 16 лет).
Пожалуйста, смотрите ниже ряд инициатив, реализованных BT и EE за это время:
Поддержка NHS
- BT Mobile и EE Mobile бесплатно оценили сайты NHS & GOV и предоставили бесплатный доступ к NHS 111
- Более 260 000 сотрудников NHS получили предложение EE & BT безлимитных мобильных данных, а EE пожертвовала 8000 аккумуляторов для NHS
- BT передала в дар больницам радионяни, чтобы помочь медицинскому персоналу общаться с пациентами и минимизировать распространение инфекции
- Клиенты BT Sport пожертвовали NHS на общую сумму 1 млн фунтов стерлингов посредством приостановленных платежей по подписке
- BT ответила на более чем 100 индивидуальных запросов о помощи в различных департаментах центрального правительства, причем половина из них поступила от NHS
- BT было поручено как можно быстрее подключить новые полевые госпитали Nightingale по всей стране.Всего за 48 часов после того, как нас попросили помочь выстоять больницу Nightingale в лондонском ExCel, мы установили 1000 IP-телефонов, и для этого требовалось высокоскоростное соединение
- BT помогает ряду органов NHS через свою платформу Smart Messaging передавать сообщения пациентам и напоминания о встрече, связанные с COVID-19
- BT сотрудничает с UHB для предоставления удаленной диагностики пациентам
Поддержка клиентов и коллег
- BT исключила из плана плату за звонки на стационарные телефоны в размере 5 фунтов стерлингов и повысила уровень абонентов с ограниченным широкополосным доступом до безлимитных
- EE предлагал безлимитные звонки и данные для наиболее уязвимых, а также кредиты на роуминг для клиентов за рубежом
- EE и BT Mobile сняли плату за передачу данных для веб-сайтов, поддерживающих жертв преступлений / домашнего насилия
- BT предоставила почти 10 000 наших коллег по обслуживанию клиентов из контактных центров наших потребительских брендов (BT, EE и Plusnet) технологии и безопасность, необходимые для работы из дома
Поддержка нуждающихся
- BT подарила 1000 устройств нуждающимся через DevicesDotNow,
- BT работала с Элли Голдинг, TAP Music и Crisis, чтобы предоставить бездомным 400 телефонов с предоплатой кредита
- BT продолжила финансирование 73 спонсируемых онлайн-центров, чтобы они могли оказывать поддержку в области цифровых навыков уязвимым людям Проект
- BT Lifelines, который позволяет родственникам видеть и разговаривать со своими близкими, находящимися на лечении в отделениях интенсивной терапии, с помощью планшета, в настоящее время доставил более 1000 таблеток в более чем 150 мест, было сделано более 15000 звонков, включая трогательное предложение
- BT предоставила Службе общественного здравоохранения Англии доступ к нашим 500 Street Hubs (ранее — киоскам InLink), чтобы они могли использовать цифровые экраны для распространения общедоступных информационных сообщений по всей стране
- BT поддерживал беспрецедентный объем звонков, поступающих в наши центры обработки вызовов 999, несмотря на наличие специального номера 111 Covid-19.Чтобы представить это в контексте, на пике спроса у BT были объемы, которые обычно наблюдаются в канун Нового года (традиционно самый загруженный день в году)
- BT запустила пробный проект Call Center Companions по борьбе с одиночеством в домах престарелых, дав коллегам из центра обслуживания время позвонить в местные дома престарелых.
- BT предоставит нуждающимся семьям шестимесячный бесплатный доступ к крупнейшей в Великобритании сети Wi-Fi, которая охватывает 5,5 миллионов точек доступа Wi-Fi по всей стране.
Поддержка технических навыков
- ITV запустила свою кампанию с BT, Beyond Limits: Top Tips on Tech, чтобы помочь людям оставаться на связи с помощью лучших советов, таких как Клэр Болдинг, Райлан Кларк-Нил и Ферн Коттон
- С 2014 года программа BT’s Work Ready также помогла более 3300 молодым людям в возрасте от 18 до 24 лет, которые в настоящее время не учатся, не работают или не учатся, приобрести новые навыки и опыт работы и подготовить их к трудоустройству или повышению квалификации
- Программа BT Barefoot достигла более двух.8 миллионов учеников в начальных школах Великобритании с 2014 года. Страница «Learn at Home» выросла на 1100% после выпуска двенадцати новых ресурсов Barefoot с 52 тыс. Просмотров новых игр
- Программа BT «Навыки для завтрашнего дня» призвана расширить возможности 10 миллионов человек, дав им навыки, необходимые для процветания в цифровом мире. Skills for Tomorrow — это портфель программ и инициатив. Портал оказывает огромную поддержку семьям, родителям и детям, включая обучающие интерактивные игры и миссии, предназначенные для детей младшего возраста
О компании BT
BT Group — ведущий телекоммуникационный и сетевой провайдер Великобритании, а также ведущий поставщик глобальных коммуникационных услуг и решений, обслуживающий клиентов в 180 странах.Его основная деятельность в Великобритании включает предоставление фиксированной голосовой связи, мобильной связи, широкополосного доступа и телевидения (включая спорт), а также предоставление ряда продуктов и услуг по конвергентным фиксированным и мобильным сетям для потребителей, предприятий и клиентов государственного сектора. Своим глобальным клиентам BT предоставляет управляемые услуги, услуги безопасности, а также услуги сетевой и ИТ-инфраструктуры для поддержки их операций по всему миру. BT состоит из трех клиентских подразделений: потребительского, корпоративного и глобального. Его дочерняя компания Openreach, находящаяся в полной собственности, предоставляет услуги доступа к сети более чем 650 поставщикам услуг связи, которые продают услуги телефонной связи, широкополосного доступа и Ethernet для домов и предприятий по всей Великобритании.
За год, закончившийся 31 марта 2020 года, заявленная выручка BT Group составила 22 905 млн фунтов стерлингов, а заявленная прибыль до налогообложения — 2 353 млн фунтов стерлингов.
British Telecommunications plc (BT) является 100% дочерней компанией BT Group plc и охватывает практически все предприятия и активы BT Group. BT Group plc котируется на Лондонской фондовой бирже.
Для получения дополнительной информации посетите www.btplc.com
.
