О дисбактериозе рассказывает педиатр «ЕвроМед клиники»
Дисбактериоз — история о плохих и хороших бактериях
Дисбактериоз — одна из наиболее часто обсуждаемых проблем со здоровьем, особенно, среди детей. Педиатр «ЕвроМед клиники»Елена Сергеевна Кочеткова рассказывает нашим читателям, что известно о дисбактериозе в свете современных знаний.
Дисбактериоз – микроэкологические нарушения в желудочно-кишечном тракте. Это клиническая совокупность нарушений в макроорганизме (то есть в человеке), вызванные изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз определяется, по сути, по результату анализа — посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела.Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить. Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
Что же делает микрофлора в нашем теле?
- противостоит болезнетворным бактериям и сдерживает рост условно-патогенных бактерий
- участвует в синтезе и всасывании многих витаминов
- разрушает и выводит токсины
- вырабатывает вещества, участвующие в обмене холестерина, жирных кислот, липопротеидов, оксалатов, стероидных гормонов
- участвует в формировании как местного, так и системного иммунитета.

- участвует в переваривании многих пищевых ингредиентов
- питает, поддерживает работу клеток кишечной стенки
Это далеко не все, только основные направления работы нашей микрофлоры. Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идет на поддержание нашей микрофлоры.
Симптомы
Как проявляется дисбиоз хорошо известно всем:
- диспептический синдром: поносы, запоры, метеоризм, повышенное газообразование, отрыжка, боли в животе
- аллергические реакции: кожные высыпания, бронхиальная астма, насморк, непереносимость некоторых пищевых продуктов
- частые простудные заболевания, как правило, протекающие длительно и волнообразно
- синдром мальабсорбции — нарушение всасывания, как следствие: гиповитаминоз, анемия, неврологические расстройства, задержка роста и развития
- хроническая интоксикация, как следствие: недомогание, плохой аппетит, головные боли, субфебрильная температура
Хотя, как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов, индивидуальных для каждого человека.
- наличие у мамы любых инфекций: хронических урогенитальных и других, даже вне обострения, острых (ОРЗ и др.), прием лекарств, нерациональное питание
- роды путем кесарева сечения
- позднее (не в родовом зале) прикладывание к груди. Млечные ходы молочной железы заселены лакто- и бифидобактериями, даже если новорожденный высосет 3–5 мл молозива он получит первой «хорошую» семейную микрофлору, а не больничную, вероятнее всего, вредную
- гипоксия нервной системы любой степени тяжести
- долгое нахождение в родильном доме
- раздельное нахождение мамы и младенца в роддоме
- искусственное вскармливание
- применение антибиотиков и некоторых других лекарств
- раннее введение прикормов и прекращение грудного вскармливания
- нерациональное питание
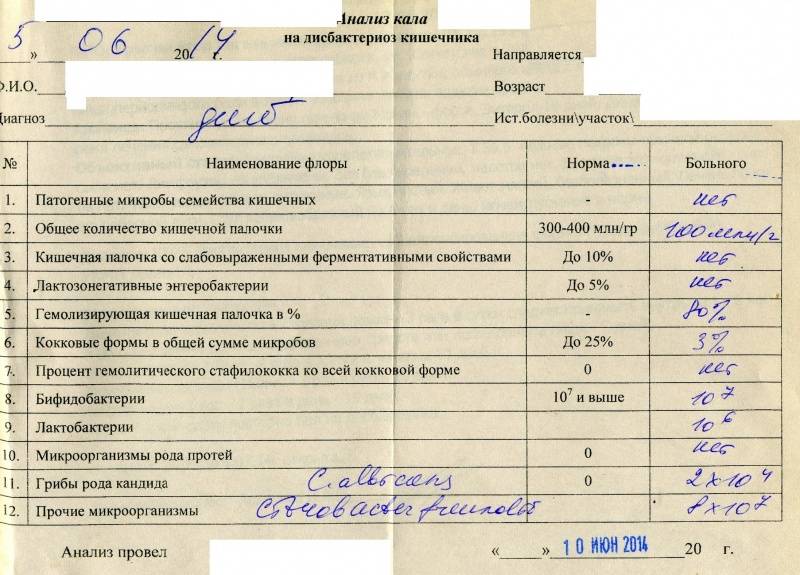
Какие анализы можно сдать для выявления дисбиоза:
- Кал на дисбиоз.
 До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий. - Копрограмма – показывает нарушения характера пищеварения: своевременно ли и в достаточном ли количестве выделяется желчь и секрет поджелудочной железы.
- Газо-жидкостная хроматография и молекулярно-генетическое исследование фекалий показывают истинное состояние микрофлоры, ее полный количественный и качественный состав (в том числе тонко-кишечный и тот, который невозможно вырастить вне человека), энтеротип человека. Проводится в нескольких НИИ в мире, в широком применении будет только в ближайшие 5–10 лет.

Можем ли мы как то повлиять на количество и качество микробиоты? Даже учитывая, что мы, на сегодняшний день, не знаем большинства «наших» бактерий, но все же можем многое сделать, особенно, для младенца. У всех детей первого полугодия 98-99 % микрофлоры — это бифидо- и лактобактерии, значит, надо обеспечить их достаточное количество и качество их жизнедеятельности. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактазной недостаточности в кишечнике неблагоприятная среда, а бифидо- и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Кстати тут сразу встает вопрос: когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная организация здравоохранения), но решение принимается в каждом случае индивидуально!
Получается, мы живем в океане микробов, и только так мы можем жить.Если мы хотим жить долго и здорово, мы должны заботиться о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
🧬 Анализ на «дисбактериоз»: пожалуйста, хватит
Прилетели как-то на Землю инопланетяне. Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины. Ну, а глобальное потепление — из-за рубля: у всех жителей Бирюлево в карманах оказалась эта валюта. Улетели инопланетяне к себе домой и по результатам исследования напечатали своими зелеными щупальцами десять кандидатских диссертаций.
Вот как-то так и проводится «анализ на дисбактериоз». Поговорим об этом диагнозе с гастроэнтерологом GMS Clinic Головенко Алексеем.
Что не так с этим исследованием? Его же так часто назначают врачи!
- Давайте оговоримся: его назначают врачи только в странах бывшего СССР. За пределами этих государств простой посев стула для выявления дисбаланса микрофлоры не выполняется. Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике.
- В нашем желудочно-кишечном тракте обитает не менее 1000 (тысячи!) видов бактерий, а число всех выявленных видов составляет 2172.

- Бактерии, обнаруживаемые в стуле (который формируется в толстой кишке) — это совсем не те же бактерии, что обитают в ротовой полости или тонкой кишке. Кроме того, бактерии в стуле (то есть в просвете кишки) — это совсем не бактерии, обитающие в слизи, защищающей кишечную стенку. Вообще, через наш пищеварительный тракт «пролетает» безумное количество чужеродных бактерий, грибов и вирусов. К счастью, большая их часть не могут подобраться к кишечной стенке: обитающая там пристеночная микрофлора конкурирует с «пришельцами». Мы называем это явление колонизационной резистентностью, и именно ему мы обязаны тем, что первая же проглоченная со стаканом московской воды условно-патогенная бактерия не вызывает у нас понос.

- Состав и соотношение кишечных бактерий у каждого человека свои. Изучив (не посевом кала, конечно, а сложнейшими генетическими методами) состав бактерий в стуле, можно, например, угадать принадлежит ли образец жителю Нью-Йорка или побережья Амазонки. Ну, или в каком регионе отдельной страны (например, Дании). проживает человек, отправивший на анализ свои фекалии. В общем, истинный состав кишечной микрофлоры — наши «отпечатки пальцев», и предполагать некую общую норму, а уж тем более судить о «нормальности» флоры всего по 20 видам из 1000 — смешно.
- То, будут ли размножаться бактерии на питательной среде, зависит не только от того, какие бактерии в стуле живут, но и от того, как стул собрали (с унитаза, со стерильной бумаги), как хранили (в холодильнике, у батареи, у окна), как быстро доставили в лабораторию. Много ли людей, которым рекомендовали анализ на дисбактериоз читали вот эту инструкцию, согласно которой кал нужно собрать в стерильную посуду, поместить в холодильник и нести в лабораторию не в руках, а в термосе с кубиком льда? Впрочем, даже при совершении этих действий результат анализа на дисбактериоз интерпретировать нормальный врач не может.
 А значит, не должен и пытаться это сделать.
А значит, не должен и пытаться это сделать.
В питательной среде появились колонии бактерий. К счастью для нас, действительно опасная Сальмонелла растет в питательной среде. Большая часть кишечных бактерий, увы, нет.
Так что, нет такого понятия — «дисбактериоз»?
Конечно, есть. Например, псевдомембранозный колит — тяжелое воспаление толстой кишки после антибиотика — самый настоящий дисбактериоз: погибли конкуренты, и поэтому размножается Clostridium difficile. Только для того, чтобы это лечить, совершенно не нужно констатировать очевидное — состав бактерий в кишке изменился. Достаточно подтвердить инфекцию (выявить токсины C.difficile) и назначить лечение.
Кишечная микрофлора, вне сомнения, влияет на все процессы в нашем организме. Пересадив стул от мыши с ожирением мышке с нормальным весом, у последней мы вызываем ожирение. Состав кишечных бактерий принципиально разный у людей с тревожностью и депрессией. Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Состав бактерий можно и нужно изучать. Этому посвящено амбициозное международное исследование Human Microbiome Project с бюджетом $115 млн. Естественно, никакие «посевы стула» при этом не используются. Для анализа микробных «джунглей» кишечника используются методы метагеномики. Они позволяют описать, сколько уникальных последовательностей ДНК присутствует у конкретного человека, какие группы бактерий преобладают, а какие отсутствуют. К слову, когда такие технологии (например, секвенирование 16S-рРНК появились, выяснилось, что 75% видов, обнаруживаемых при генетическом анализе того же кала, вообще не известны науке.
Стоп. То есть делать посев стула вообще нет смысла?
Я этого не говорил. Мы обязательно выполняем посев стула, если хотим выявить рост по-настоящему вредных бактерий. Например, у человека с кровавой диареей мы пытаемся найти Сальмонеллу или Шигеллу, Кампилобактерию или особую разновидность кишечной палочки. Здесь посев кала жизненно необходим, ведь так мы сможем назначить лечение антибиотиком — убить конкретного возбудителя.
Грамотный врач выполняет диагностический тест только тогда, когда его результат может изменить лечение. Если и при «дефиците» лактобактерий, и при «избытке» кишечной палочки будет назначено одно и то же лекарство или диета, анализ является пустой тратой денег.
Полноценное исследование собственной микрофлоры уже можно сделать на коммерческой основе в США и Европе. Стоит «удовольствие» около 100 евро, и в результате генетического анализа микрофлоры вы получите заключение (например, вот такое) о преобладающих в вашем пищеварительном тракте бактериях. Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
пока у нас НЕТ способа, избирательно менять состав кишечных бактерий.
Предположим, мы однозначно установили, что у человека имеется дефицит какой-то конкретной микроорганизмы (например, лактобактерий). Мы можем:
- Дать пробиотик (то есть конкретную живую бактерию) и надеяться, что она останется жить в кишечнике.
- Дать пребиотик (то есть «корм» для бактерии) и надеяться, что это усилит рост именно нужной нам бактерии.
- Дать антибиотик (яд для бактерии) и надеяться, что погибнет именно чрезмерно размножившаяся бактерия.
- Пересадить человеку чужую микрофлору — сделать трансплантацию фекальной микробиоты (ввести разбавленный стул здорового человека больному человеку).
Очевидно, избирательным действием можно считать только назначение пробиотика. Максимальная доза лучшего коммерческого пробиотика — это 10 млрд. жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
Ну, а главное: одно дело — теория и лабораторные исследования, другое дело — клинические испытания (то есть изучение эффекта препаратов у людей). Разберем три типовых для России ситуации, когда человеку предлагают сдать «анализ кала на дисбактериоз»:
Колики у новорожденного
Мама жалуется, что ребенок много плачет. К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
Чаще бывает не так. Выполняется анализ кала на дисбактериоз, там, естественно (норма-то взята с «потолка»), обнаруживаются «отклонения». Назначается пробиотик. И часто ведь помогает: еще бы, ведь частота колик неумолимо снижается с возрастом ребенка. При этом уверенности в том, что пробиотики вообще эффективны при коликах, у нас нет. Многочисленные мета-анализы, посвященные лечению и профилактике этого состояния, не смогли однозначно подтвердить эффективность пробиотиков. Возможно, какое-то полезное действие оказывает пробиотик Lactobacillus reuteri. Вот только для того, чтобы назначить этот препарат, анализ кала на «дисбактериоз» нам совершенно не нужен.
Атопический дерматит у ребенка
Все уверены, что проблемы с кожей — от «живота». Будь это так, наверное, атопический дерматит прекрасно лечился бы пробиотиками. Но этот подход не слишком эффективен. Последний мета-анализ свидетельствует: применение пробиотиков (главным образом, Lactobacillus rhamnosus GG) несколько уменьшает выраженность экземы, но эффект этот весьма символический, а дополнительная терапия пробиотиком не позволяет сократить частоту применения местных стероидов, которые (вместе с увлажнением кожи) остаются основой лечения атопического дерматита. И вновь: назначить этот пробиотик мы можем вне зависимости от «результатов» «анализа на дисбактериоз».
Вздутие и спазмы в животе у взрослого
Вздутие живота чаще всего является проявлением избыточного бактериального роста в тонкой кишке (СИБРа), при котором помогает не пробиотик, а антибиотик, например, рифаксимин. Это состояние диагностируется при помощи специального дыхательного теста. Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Так нужно хоть в какой-то ситуации сдавать «кал на дисбактериоз»?
Нет. Никогда. Ни при каких обстоятельствах. Мы не лечим вздутие живота, изучая линии на ладони. Мы не лечим сыпь, глядя в хрустальный шар. Мы не делаем бессмысленный анализ на дисбактериоз, чтобы назначить лечение.
Мы ждем, когда доказательная медицина предложит нам эффективные препараты и практические способы понять, что не так с нашими бактериями.
Жду вместе с вами!
Источник: deti.mail.ru
Сдать анализ кала на дисбактериоз кишечника
Метод определения Бактериологический, бактериоскопический
Исследуемый материал Кал
Доступен выезд на дом
Синонимы: Дисбиоз кишечника; Анализ кала на дисбактериоз.
Intestinal dysbiosis; Intestinal disbios; Intestinal dysbacteriosis.
Краткое описание исследования «Дисбактериоз кишечника»
В медицинских офисах Москвы и Московской области приём биоматериала для выполнения теста № 456 производится 7 дней в неделю с ограничениями по времени взятия. Интересующую информацию уточняйте у администраторов медицинских офисов.
Интересующую информацию уточняйте у администраторов медицинских офисов.
Дисбактериоз (в англоязычной литературе используют термин Intestinal bacterial overgrowth, реже – disbios) острое или хроническое нарушение нормальной микрофлоры кишечника.
В содержимом тощей кишки здоровых людей может находиться до 105 бактерий в 1 мл кишечного содержимого. Основными являются молочнокислые палочки, стафилококки и стрептококки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 108, в первую очередь за счёт энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. В толстой кишке преобладают анаэробы (бактероиды, клостридии, лактобациллы). Этот симбиоз бактерий у здорового человека (и у млекопитающих!) выполняет многие полезные функции: противодействует чужеродным патогенным микробам и вирусам, помогает пищеварению, синтезирует витамины группы В.
Соотношение количества различных микроорганизмов достаточно постоянно. Но вследствии ослабления иммунитета, нерациональной терапии антибиотиками, лучевой и химиотерапии, врождённых дефектов ферментов баланс нарушается. Могут исчезнуть некоторые представители нормальной микрофлоры (бифидобактерии, молочнокислые и кишечные палочки) и появиться грибки рода кандида, стафилококки, протей, синегнойная палочка. Возникает клинический синдром, для которого характерны понос, стеаторея, снижение веса и анемия. При резком ослаблении защитных сил, иммунитета может развиться генерализованная форма эндогенной инфекции вплоть до сепсиса.
Но вследствии ослабления иммунитета, нерациональной терапии антибиотиками, лучевой и химиотерапии, врождённых дефектов ферментов баланс нарушается. Могут исчезнуть некоторые представители нормальной микрофлоры (бифидобактерии, молочнокислые и кишечные палочки) и появиться грибки рода кандида, стафилококки, протей, синегнойная палочка. Возникает клинический синдром, для которого характерны понос, стеаторея, снижение веса и анемия. При резком ослаблении защитных сил, иммунитета может развиться генерализованная форма эндогенной инфекции вплоть до сепсиса.
С какой целью проводят исследование на дисбактериоз кишечника
Исследование микрофлоры кишечника применяют для определения характера нарушения биоценоза кишечника.
Выявляемые микроорганизмы и возбудители в исследовании «Дисбактериоз кишечника»
Выделяемые микроорганизмы и возбудители:
- полезные бактерии кишечника – лактобактерии, бифидобактерии, кишечные палочки с типичными свойствами, а также со сниженными ферментативными и гемолитическими признаками;
- условно-патогенные бактерии – энтеробактерии, неферментирующие бактерии, стафилококки, энтерококки, анаэробные бактерии (клостридии, без идентификации до вида), грибы;
- патогенные – сальмонеллы, шигеллы.

Пищевая аллергия или атопический дерматит? аллергия у грудничков
Меню раздела
Записаться на прием
14.06.2019
Как понять, откуда у грудничка сыпь? Врач-педиатр Галина Михайловна Циж поможет разбираться в теме пищевой аллергии и атопического дерматита у грудничков.В последние 30 лет заболеваемость атопическим дерматитом (экземой) у детей существенно возросла.
 Вероятность развития этого заболевания у ребенка, если больны оба родителя, составляет 81%; 59%, если болен только один из родителей, а другой имеет аллергическую патологию дыхательных путей, и 56%, если болен только один из родителей. Не лучше обстоит дело и с аллергическими реакциями.
Вероятность развития этого заболевания у ребенка, если больны оба родителя, составляет 81%; 59%, если болен только один из родителей, а другой имеет аллергическую патологию дыхательных путей, и 56%, если болен только один из родителей. Не лучше обстоит дело и с аллергическими реакциями.– Бывает так, что врач при сыпи у младенца рекомендует сдать анализ кала. Имеет ли это смысл?
– Нет. Уже доказано, что не существует такого понятия, как дисбактериоз. Очень сложно для каждого ребенка определить его личный состав микрофлоры, а также всей его семьи. Это все очень индивидуально.
– Как понять, когда у младенца появилась сыпь, следствием чего она явилась?
– Самое главное определить, в чем причина. Есть пищевая аллергия, а есть атопический дерматит. Это абсолютно разные заболевания.
– Давайте коснемся основных понятий.
– При пищевой аллергии высыпания появляются сразу после того, как ребенок что-то скушал.
 И следом за отменой определенного продукта (аллергена) эти высыпания сразу же проходят. Никаких кожных изменений после этого не происходит. Сыпь исчезла, и мы о ней забыли.
И следом за отменой определенного продукта (аллергена) эти высыпания сразу же проходят. Никаких кожных изменений после этого не происходит. Сыпь исчезла, и мы о ней забыли.– А если это, к примеру, курица? Не может же человек всю жизнь без нее обходиться.
– Просто введение курицы в качестве прикорма в таком случае нужно отложить. Хотя бы дать ребенку отдохнуть на 2 месяца от этого продукта. А уже через 2 месяца снова попробовать дать его малышу. Если все нормально, то продолжаем вводить ее в качестве прикорма. И даже при пищевой аллергии необязательно назначение антигистаминных препаратов. Достаточно просто исключить из рациона аллерген. Антигистамины предназначены для того, чтобы избавиться от зуда, как самого неприятного симптома.
Атопический дерматит – это не последствия аллергии, он не имеет с ней никакой связи. Атопический дерматит – наследственное заболевание, хроническое воспаление кожи, характерным признаком которого является зуд. Это обязательный признак.
Аллергеном чаще всего выступает какой-то пищевой продукт, но необязательно. Это наследственная предрасположенность. Чаще всего у 50% атопиков этим же заболеванием страдает мама, папа, кто-то из дедушек или бабушек. Лечение таких детей достаточно серьезное и скрупулезное, нужно выявлять аллергены, подбирать диеты, правильный уход за кожей. Все это должно работать на благо ребенка именно в комплексе. Потому что даже воздух и температурный режим имеют значение. Очень часто атопический дерматит появляется именно зимой, когда включается отопление.
– В этом виноваты сухой воздух и шерстяная одежда?
– Да. Атопический дерматит – очень широкое понятие. И причинных факторов у него очень много. Сложно сказать, что именно дает толчок началу заболевания. Доказано лишь, что это наследственный недуг. Многие очень часто путают аллергию и атопический дерматит. Даже доктора часто ошибаются, ставя ребенку диагноз «атопический дерматит». Как только мама корректирует диету, все проходит, у ребенка нет никаких высыпаний.
 В таком случае речь шла именно об аллергической реакции, которая исчезла и может больше не вернуться. А атопический дерматит – это тяжелое комплексное заболевание на всю жизнь.
В таком случае речь шла именно об аллергической реакции, которая исчезла и может больше не вернуться. А атопический дерматит – это тяжелое комплексное заболевание на всю жизнь. – Это имунное нарушение?
– Да.
– Как выявить атопический дерматит у 3-месячного ребенка, у которого постоянно есть какие-то высыпания?
– Достаточно легко. Обычно у младенца есть серьезные поражения кожи, которые благодаря обычному эмоленту не проходят. Иногда приходится назначать и гормональные препараты, чтобы убрать острое воспаление кожи, а потом уже назначать какие-то увлажняющие кремы для постоянного использования.
– Эмоленты – это не просто увлажняющие средства?
– Нет, это специальные препараты, которые продаются только в аптеке. Они проникают в более глубокие слои кожи и хорошо увлажняют не только ее верхние, но и глубокие слои.
– А при атопическом дерматите всегда есть период лечения гормональной мазью?
– Иногда да.
 К сожалению, есть такое понятие у родителей, как «гормонофобия». Мамы и папы очень боятся назначения детям гормональных препаратов. Но если начать применять его не вовремя, это значительно ухудшает состояние кожи. И лечить ее после этого гораздо сложнее. Однако в любом случае назначить такое лекарство может только врач. Ни в коем случае не нужно лечить своего ребенка гормональной мазью по совету подруги.
К сожалению, есть такое понятие у родителей, как «гормонофобия». Мамы и папы очень боятся назначения детям гормональных препаратов. Но если начать применять его не вовремя, это значительно ухудшает состояние кожи. И лечить ее после этого гораздо сложнее. Однако в любом случае назначить такое лекарство может только врач. Ни в коем случае не нужно лечить своего ребенка гормональной мазью по совету подруги.– Вы имеете в виду Адвантал или Элидел?
– Адвантал – не гормональная мазь. Это промикролинус. То есть противовоспалительный препарат.
– Его тоже можно применять?
– Да. Но его опять же может назначить только доктор. Эмолент вы можете купить и попробовать применить сами. Но более серьезные препараты – только по назначению врача. Нужно знать, что некоторые гормональные средства при длительном применении могут вызывать атрофию кожи.
– Не привыкание, а атрофию?
– Верно.
– Многие родители путаются в этих понятиях.

– Гормональные препараты не могут вызвать привыкания, потому что их никогда не назначают на длительный срок. В основном не более 5 дней. А потом уже идет поддерживающая терапия, чтобы восстановить кожный покров. А еще в этот период назначаются антигистаминные препараты, чтобы облегчить состояние ребенка и снять зуд.
– А что делать в такой ситуации? Пришла мама на прием с маленьким ребенком. Мама сама аллергик. И у ребенка такая же картина. И вот мама исключила из своего меню аллергены. А у ребенка атопический дерматит все равно остался. Есть ли смысл обследоваться у иммунолога?
– До года такие обследования не имеют смысла, потому что у детей еще нестабильный иммунитет. Сейчас очень популярен метод исследования иммуноплотинга. Я говорю о педиатрической панели, метод исследования иммуноглобулинов, которые отвечают за аллергию. Его назначают детям в первую очередь. Высокий уровень иммуноглобулина как раз говорит о том, что у ребенка есть аллергия.
 Но до года эти анализы не имеют смысла.
Но до года эти анализы не имеют смысла.Помимо педиатра такого ребенка обязательно должен осмотреть дерматолог, чтобы исключить кожные заболевания. Даже у младенце бывают инфекционные кожные недуги, схожие с проявлениями атопического дерматита. Например, чесотка. Потом – к аллергологу, чтобы он собрал семейный анамнез и помог выявить аллерген, назначил правильное лечение. Маме нужно вести пищевой дневник, записывать все новые продукты, вводимые в прикорм. Их нужно давать строго с утра, чтобы аллерген, если он есть в пище, к обеду проявился.
– То есть до года мы идем только к этим специалистам, а к иммунологу имеет смысл вести ребенка только после года?
– Сейчас есть такое понятие, как аллерголог-иммунолог. Я бы рекомендовала после года обращаться именно к нему.
| 14.06.2019 | Алеся Денисова |
Дисбактериоз: причины, симптомы, диагностика, лечение
Опубликовано: 25.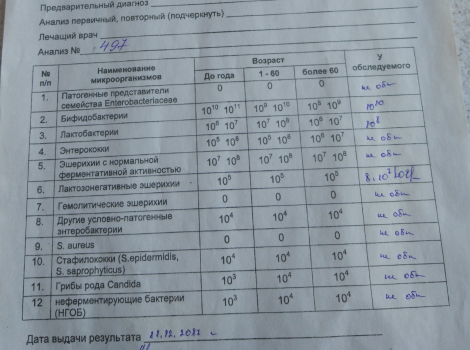 08.2021 12:53:00 Обновлено: 31.08.2021 Просмотров: 3888
08.2021 12:53:00 Обновлено: 31.08.2021 Просмотров: 3888
Дисбактериоз – качественное и количественное изменение микрофлоры в организме на любом его участке, включая кожные покровы, кишечник, полость рта, влагалище и другие области, населяемые микроорганизмами. Патология встречается при многих заболеваниях, длительном или неконтролируемом употреблении антибиотиков и иммунодепрессантов, развивается под влиянием вредных факторов окружающей среды.
Состояние опасно сопутствующим снижением иммунитета, нарушением барьерной функции кожи и слизистых оболочек, через которые патогенная флора проникает во внутренние органы.
Диагноз «дисбактериоз» отсутствует в международной классификации болезней и выставляется докторами исключительно Российской Федерации и стран СНГ. Дисбактериоз — это не заболевание, а синдром, функциональное расстройство, сопровождаемое нарушением баланса микрофлоры. Самая распространенная форма патологии – дисбактериоз кишечника.
Самая распространенная форма патологии – дисбактериоз кишечника.
Роль микробиоты в организме
Микробиота – это экосистема, внутри которой уживаются более семи тысяч видов микроорганизмов, включая бактерии, вирусы, бактериофаги, простейшие, археи и грибы. Они живут на кожных покровах, слизистых оболочках, в пищеварительном тракте и играют важную роль в поддержании иммунитета.
Кишечное сообщество находится в симбиозе с организмом хозяина и выполняет множество функций:- участвует в пищеварении, способствуя переработке пищи и лучшему усвоению питательных веществ;
- стимулирует рост клеток кишечной стенки – энтероцитов;
- поддерживает иммунитет в активном состоянии;
- не допускает роста опасных микроорганизмов, способных вызвать воспаление и инфекционный процесс;
- контролирует метаболические процессы, энергетический и жировой обмены;
- синтезирует биологически активные вещества, участвующие в гормональной и нейрорегуляции.

При снижении количества полезных микроорганизмов, таких как бифидо- и лактобактерии, кишечная палочка и других, занимаемые ими ранее участки активно заселяют патогенные бактерии – преимущественно пептококки, грибы рода Кандида, стафилококки и клостридии.
Причины дисбиоза
Дисбактериоз никогда не возникает первично, он развивается вследствие дисфункции органов и систем либо под действием медикаментов и химических веществ, отрицательно влияющих на микроорганизмы.
Предрасполагают к нарушению микрофлоры следующие факторы:
- острый и хронический стресс;
- чрезмерная физическая нагрузка;
- неблагоприятные экологические условия, вредные производственные факторы;
- генетическая предрасположенность;
- иммунодефицитные состояния;
- беременность и гормональный дисбаланс, например, гиперандрогения у женщин;
- нарушение биоритмов, акклиматизация;
- активный прием антибиотиков, цитостатиков, сульфаниламидов, заместительная гормональная терапия;
- травмы и воспалительные заболевания, сопровождающиеся активацией иммунитета.

Одна из причин кожного дисбактериоза – чрезмерная гигиена, применение агрессивных уходовых средств, смывающих защитный водно-жировой слой с эпителия.
Микробиота кишечника страдает в следующих случаях:- присутствие в пище разного рода химических добавок – солей натрия и сернистой кислоты, наночастиц металлов и антибиотиков;
- голодание либо резкое изменение рациона, обилие в нем животных жиров и белков, сахара, крахмала, недостаток клетчатки, витаминов и минеральных веществ;
- инфекционные процессы, глистная инвазия в кишечнике;
- снижение пищеварительной функции внутренних органов при панкреатите, гепатите, гастрите и других заболеваниях;
- нарушение моторики кишечника;
- хирургические вмешательства на органах ЖКТ.
Классификация дисбактериоза
Самой распространенной формой патологии считается кишечный дисбактериоз.
К внекишечным формам можно отнести дисбиоз:
- кожи;
- половых органов;
- мочевыделительных путей;
- ротовой полости;
- органов дыхания.

Также, в зависимости от длительности процесса и выраженности симптомов, выделяют острый и хронический дисбактериоз.
Степень тяжести определяется количеством и составом бактерий в процессе лабораторной диагностики:- I степень — недостаток представителей нормальной микрофлоры;
- II степень — преобладание условно-патогенных микроорганизмов;
- III степень — присоединение патогенной флоры.
Кишечный дисбактериоз протекает в три стадии:
- Латентный дисбиоз. Клинические проявления патологии отсутствуют. Нарушение микрофлоры выявляется только по результатам анализов.
- Локальная или местная форма дисбиоза. Сопровождается симптоматикой колита или энтероколита.
- Стадия развития осложнений. Появляются признаки инсулинорезистентности, нейровегетативных нарушений, хронического колита, дерматита и вагинита.
Симптомы нарушенной микрофлоры
Проявления дисбактериоза зависят от локализации пораженной микробиоты. Для кишечной формы патологии характерны следующие симптомы:
Для кишечной формы патологии характерны следующие симптомы:- Диспепсический синдром – расстройство стула, иногда с чередованием запора и диареи, метеоризм, вздутие живота, отрыжка и неприятный привкус во рту, урчание в кишечнике.
- Повышенная чувствительность к определенной пище, в особенности к злакам и молочным продуктам, а также аллергическая реакция на переносимые ранее продукты. Наиболее часто встречается при дисбактериозе у детей. Проявления могут быть различными: крапивница, кожный зуд, приступы удушья, ангионевротический отек, жидкий пенящийся стул, резкая боль в животе, тошнота вплоть до рвоты, понижение артериального давления.
- Синдром мальабсорбции – нарушение всасывания питательных веществ проявляется их недостаточностью в организме. Развивается симптоматика белково-энергетической недостаточности, гиповитаминозов, преимущественно витаминов группы В, анемии, нарушения ионного баланса, дефицита кальция.
- Интоксикационный синдром.
 Характерны слабость, снижение аппетита, повышение температуры тела, головная боль.
Характерны слабость, снижение аппетита, повышение температуры тела, головная боль. - Частые ОРЗ, ОРВИ, обострения герпетической инфекции, грибковые заболевания вследствие снижения иммунитета.
Проявления дисбактериоза кишечника у взрослых зависят от пола пациента. У женщин болезненные ощущения в животе усиливаются перед менструацией. Наблюдается повышенная активность сальных желез, на лице и на теле появляются высыпания. Слизистая оболочка влагалища раздражается, больную беспокоит зуд и жжение вульвы. Кожа становится сухой, дряблой и шелушится. Дисбактериоз кишечника у мужчин сопровождается ухудшением потенции, проблемами с мочеиспусканием.
По мере прогрессирования дисбактериоза присоединяются и симптомы осложнений.
При нейропсихическом расстройстве появляются слабость, апатия, тревожность, пониженное настроение, снижение концентрации внимания и стрессоустойчивости, навязчивые мысли, судороги.
Для инсулинорезистентности характерны прибавка в весе, высокая концентрация глюкозы и липидов крови, ощущение тяжести в правом подреберье. При генерализованной воспалительной или аутоиммунной реакции возможно появление боли в суставах, сыпи на коже, примеси слизи либо крови в испражнениях, повышения температуры тела, озноба, быстрой утомляемости.
При генерализованной воспалительной или аутоиммунной реакции возможно появление боли в суставах, сыпи на коже, примеси слизи либо крови в испражнениях, повышения температуры тела, озноба, быстрой утомляемости.
Для кожного дисбиоза характерны сыпь на теле, дряблость, краснота, зуд, сухость либо избыточная жирность кожных покровов. При дисбактериозе влагалища проявляются молочница – творожистые выделения белого цвета, жжение и зуд в области наружных половых органов. При дисбалансе флоры ротовой полости прогрессируют стоматит, пародонтоз и кариес, ощущаются неприятный привкус и запах изо рта, появляется белый налет на языке.
Осложнения дисбиоза
Дисбиоз — синдром, способствующий развитию многих болезней. Научно подтверждена его связь со следующими патологиями:- нейропсихические расстройства: депрессия, болезнь Альцгеймера, рассеянный склероз, шизофрения, аутизм, болезнь Паркинсона;
- инсулинорезистентность, дислипидемия, ожирение, сахарный диабет 2 типа, артериальная гипертензия, жировой гепатоз печени;
- аутоиммунные патологии: сахарный диабет I типа, ревматоидный артрит, системная красная волчанка, первичный склерозирующий холангит;
- аллергические заболевания: бронхиальная астма, атопический дерматит, аллергия на пищевые продукты;
- системные воспаления: болезнь Крона, неспецифический язвенный колит, синдром раздраженного кишечника, целиакия и колоректальный рак;
- заражение венерическими заболеваниями, в том числе ВИЧ-инфекцией;
- при генитальном дисбактериозе во время беременности – преждевременные роды;
- сердечно-сосудистые заболевания вследствие активации патогенных бактерий пародонта, способствующих атеросклеротическим процессам и развитию ИБС;
- аденокарцинома и плоскоклеточный рак пищевода при дисбактериозе полости рта.

Диагностика дисбактериоза
Диагноз ставится на основании жалоб больного, характерной симптоматики и данных осмотра. Для определения тяжести процесса и подбора тактики лечения проводятся лабораторные и инструментальные исследования:- Общий клинический анализ крови. Обращают внимание на признаки анемии, уровень лейкоцитов в крови и их распределение по видам.
- Биохимический анализ крови. Выполняется для определения степени выраженности интоксикации и нарушения обмена веществ вследствие их неправильного всасывания в кишечнике.
- Общий анализ кала. Оценка физических и химических свойств кала, а также разнообразных компонентов и включений различного происхождения – копрограмма.
- Анализ кала на дисбактериоз. Бактериологический посев – это биологическое исследование испражнений с целью определения состава и количества микроорганизмов, обитающих в пищеварительном тракте человека. Также проводится биохимический анализ кала на предмет маркеров дисбиоза, таких как метаболиты летучих жирных кислот, производимых микроорганизмами.

- УЗИ брюшной полости. Визуальная оценка состояния органов пищеварения.
- Определение чувствительности патогенной флоры к бактериофагам. Проводится преимущественно детям перед назначением соответствующего лечения.
Лечение дисбактериоза
Важную роль в нормализации микрофлоры и работы органов пищеварения играет пересмотр рациона, режима питания. Таким больным рекомендован стол №4. Диета при дисбактериозе предполагает отказ от:- острой и жареной пищи, копченых деликатесов;
- продуктов, насыщенных сахарами;
- быстроусвояемых углеводов;
- яблок, бананов, винограда;
- а также ограничение молочных продуктов.
Полезными для микрофлоры считаются продукты, обогащенные клетчаткой – цельнозерновая выпечка, крупы, за исключением белого риса, овощи, листовая зелень и сушеные фрукты. Рекомендована также кисломолочная продукция, содержащая пребиотики и стимулирующая рост полезной микрофлоры.
- Противомикробных средств синтетического происхождения – кишечных антисептиков.
- Пробиотиков. Это готовые лакто-бифидопробиотики в дозах свыше 109 в одной капсуле.
- Пребиотиков. Представляют собой вещества, способствующие росту и размножению полезной флоры.
- Синбиотиков. Комплексные препараты, содержащие как сами микроорганизмы, так и необходимые для их развития компоненты.
- Бактериофагов. Эффективны для борьбы с инфекцией при второй степени дисбаланса микрофлоры. Метод лечения чаще используют при дисбактериозе у грудничка, когда противопоказано применение антибиотиков.
- Иммуномодуляторов. Применяются для восстановления иммунитета.
- Антибиотиков. Назначаются при распространенной форме дисбактериоза – в случае выраженных симптомов интоксикации, продолжительной диареи, тяжелого иммунодефицита и лабораторно-подтвержденного дисбиоза третьей степени.

Также применяются средства патогенетической терапии для восстановления моторики кишечника, уменьшения воспаления и восстановления ферментной активности органов пищеварения. Для облегчения проявлений диареи, боли в животе, метеоризма назначаются препараты симптоматической терапии.
Профилактика
Профилактика дисбактериоза включает сбалансированное питание, активный образ жизни, минимизацию стрессов и факторов, способных спровоцировать кишечное расстройство и дисбаланс микрофлоры.Для предотвращения нарушения микрофлоры у новорожденных рекомендуется отдавать предпочтение естественному родоразрешению и грудному вскармливанию.
Дисбактериоз у детей: лечим правильно!
На следующей стадии дисбактериоза, когда в микрофлоре уже появляются патогенные бактерии, проявлений значительно больше. Они могут быть похожи на симптомы различных заболеваний.
У грудных детей наблюдаются срыгивания, рвота, вздутие живота, через 1,5-2 часа после еды малыш беспокоится, притягивает ножки к животу, у него нарушается сон, он плохо прибавляет в весе.
У детей постарше могут наблюдаться признаки гастрита (воспаления желудка). После приема пищи появляется чувство распирания или боли в животе; снижается, а иногда и совсем пропадает аппетит; часто случается изжога, может появиться отрыжка, тошнота и даже рвота; периодически болит верхняя часть живота; постоянны усиленное газообразование и запоры.
Дисбактериоз может проявляться симптомами энтерита (воспаления тонкого кишечника), а именно частыми поносами, вздутием живота, метеоризмом, болями в животе. Ребенок становится раздражительным, но в то же время слабым, вялым, он быстро устает, жалуется на головную боль. Стул при этом жидкий, может быть пенистым, с кислым запахом, со слизью и зеленью.
В некоторых случаях дисбактериоз имеет все признаки энтероколита. Ребенок плохо растет, но зато энергично прибавляет в весе, жалуется на схваткообразные боли в животе, у него скопление газов, которые отходят с большим трудом, стул неустойчив: у одних детей частые поносы, у других — запоры.
Ребенок плохо растет, но зато энергично прибавляет в весе, жалуется на схваткообразные боли в животе, у него скопление газов, которые отходят с большим трудом, стул неустойчив: у одних детей частые поносы, у других — запоры.
Дети теряют интерес к пище, даже самые любимые в прошлом продукты им уже не по вкусу. Поскольку нарушаются всасывательные функции кишечника, наблюдается симптом проскальзывания пищи (только поел и уже просится на горшок), появляются сбои в обменных процессах. Дети вялы, им явно не хватает витаминов и минеральных веществ.
Порой дисбактериоз своими симптомами напоминает колит (воспаление толстого кишечника). У ребенка неустойчивый стул: то поносы, то запоры. Практически всегда присутствует синдром неполного опорожнения кишечника: после туалета малыш беспокоен, нервничает, не может объяснить, что его тревожит. Язык обложен налетом, скапливаются газы.
Лечение стафилококка у грудных детей, как лечить стафилококк у ребенка
Лечение стафилококка у детей
Стафилококковая инфекция представляет собой бактериальное заболевание, которое характеризуется распространением гнойного процесса в тканях и органах, поражаемых микроорганизмами. Среди прочих инфекций такая патология встречается наиболее часто. Объясняется это тем, что бактерии стафилококки чрезвычайно распространены в природе и способны вызывать десятки различных заболеваний, которые могут представлять серьезную опасность для новорожденного или грудного ребенка.
Опасные виды стафилококков
Стафилококки — это целый род микробов. На сегодняшний день насчитывают 27 видов, но только 3 из них представляют опасность для человека и могут спровоцировать ту или иную болезнь. Среди них: сапрофитный, эпидермальный и золотистый стафилококки. Серьезную опасность для новорожденных представляет последний вид микроба, который в процессе своей жизнедеятельности выделяет сильнейший токсин эксфолиатин.
Причины стафилококковой инфекции
Источником инфекции может стать больной человек или бактерионоситель. Для ребенка она опасна при условии пониженного иммунитета, т.к. в норме существуют бактерии, которые способны сдерживать стафилококк, не давая ему развиваться. Как только такой баланс нарушается, бактерия начинает размножаться, приводя к серьезным проблемам со здоровьем. Инфицирование может произойти контактным путем (простые прикосновения, кормление грудью), пищевым (через еду или нестерильную посуду) или воздушно-капельным (например, в больнице или роддоме).
Заболевания, вызываемые стафилококком
Стафилококк у грудных детей может вызывать как легкие, так и тяжелые формы различных заболеваний. Среди самых серьезных последствий – пневмония и сепсис. Кроме этого бактерия способна спровоцировать развитие следующих болезней:
- органы дыхания: ринит, тонзиллит, фарингит, бронхит, трахеит, плеврит;
- кости и суставы: артрит, остеомиелит;
- ЦНС: абсцесс мозга, менингит;
- мочевыводящие пути: очаговый нефрит, пиелонефрит, пиелит, цистит;
- сердечно-сосудистая система: флебит, перикардит, эндокардит;
- кожа: пиодермия, карбункулы, фурункулы, фолликулиты;
- ЖКТ: дисбактериоз и др.
Симптомы инфекции
Проявления стафилококковой инфекции разнообразны и зависят от заболевания, вызванного микробом. Среди общих симптомов можно выделить субфебрильную или высокую температуру, понос, рвоту, появление воспалений на коже, напоминающих ожоги. При наличии подобных признаков стоит немедленно обратиться в больницу для проведения тестов на наличие стафилококков в организме.
Лечение стафилококковой инфекции
Лечение стафилококка у детей – достаточно трудная задача, к которой нужно подходить комплексно. Среди основных методов выделяют следующие.
Прием лекарственных препаратов. Такое лечение стафилококка у грудных детей заключается в использовании антибиотиков и других противомикробных препаратов (например, препараты бактериофагов, активные в отношении бактерий рода стафилококк: Бактериофаг стафилококковый, Пиобакетриофаг поливалентный очищенный, Секстафаг®, Интести-бактериофаг, Пиобактериофаг комплексный). Препараты бактериофагов назначаются врачом после предварительного определения фагочувствительности.
Прием витаминов и растительных препаратов. Такое лечение назначается с целью укрепления иммунитета, что помогает в борьбе с инфекцией, а также снижает риск возникновения рецидивов.
Хирургические методы. К такому виду лечения прибегают в случае серьезных гнойных форм инфекции для удаления абсцессов и фурункулов.
Переливание крови. Лечить стафилококк можно и таким методом. Во время процедуры забранная из вены ребенка кровь вводится обратно внутримышечно, что помогает стимулировать иммунитет.
Не пытайтесь самостоятельно вылечить стафилококк. Обязательно обратитесь к врачу!
Уточнить все возникшие вопросы о бактериофагах Вы можете, задав вопрос нашему специалисту на сайте.
Связь между грибковым и бактериальным дисбиозом у младенцев и детским атопическим хрипом в непромышленных условиях
https://doi.org/10.1016/j.jaci.2017.08.041Получить права и контентОбщие сведения
Астма — наиболее распространенное хроническое заболевание детского возраста . Недавно мы определили критическое окно в начале жизни мышей и канадских младенцев, в течение которого микробные изменения кишечника (дисбиоз) влияют на развитие астмы. Учитывая географические различия в микробиоте кишечника человека во всем мире, мы изучили влияние микробного дисбиоза кишечника на атопическое дыхание у населения, живущего в разных условиях развивающегося мира.
Цель
Мы стремились определить, связаны ли микробные изменения в раннем младенчестве с развитием атопического хрипа в непромышленных условиях.
Методы
Мы провели исследование случай-контроль, вложенное в когорту новорожденных из сельских районов Эквадора, в котором мы идентифицировали 27 детей с атопическим хрипом и 70 здоровых контрольных субъектов в возрасте 5 лет. Мы проанализировали микробиоту кишечника бактерий и эукариот в образцах стула, собранных в возрасте 3 месяцев, с использованием секвенирования 16S и 18S.Бактериальные метагеномы были предсказаны на основе данных 16S рРНК с использованием филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний и классифицированы по функциям с помощью Киотской энциклопедии генов и онтологии геномов. Концентрации фекальных короткоцепочечных жирных кислот определяли с помощью газовой хроматографии.
Результаты
Как ранее наблюдалось у канадских младенцев, микробный дисбиоз в возрасте 3 месяцев был связан с более поздним развитием атопического хрипа. Однако дисбактериоз у эквадорских младенцев затрагивал разные бактериальные таксоны, был более выраженным, а также затрагивал несколько грибковых таксонов.Прогнозируемый метагеномный анализ подчеркнул значительные связанные с дисбиозом различия в генах, участвующих в метаболизме углеводов и таурина. Уровни ацетата и капроата короткоцепочечных жирных кислот в кале были снижены и увеличены, соответственно, в 3-месячных образцах стула детей, у которых развился атопический хрип.
Выводы
Наши результаты подтверждают важность грибковой и бактериальной микробиоты в течение первых 100 дней жизни для развития атопического хрипа и обеспечивают дополнительную поддержку для рассмотрения модуляции микробиома кишечника в качестве стратегии первичной профилактики астмы.
Ключевые слова
Астма
атопия
свистящее дыхание
микробиом кишечника
микобиом
короткоцепочечные жирные кислоты
непромышленные условия
Используемые сокращения
AW5000e, канадский пациент с инфузией MaAsLinМногопараметрическая ассоциация с линейными моделями
MEDМинимальная энтропийная декомпозиция
OTUОперативная таксономическая единица
PICRUStФилогенетическое исследование сообществ путем реконструкции ненаблюдаемых состояний
SCFA жирных кислот статей с короткой цепью 9000 © 2017 Авторы.Опубликовано Elsevier Inc. от имени Американской академии аллергии, астмы и иммунологии.Рекомендуемые статьи
Ссылки на статьи
Колики у младенцев представляют воспаление и дисбактериоз кишечника
Младенческие колики представляют собой воспаление и дисбактериоз кишечника | Практика центр передового опыта социальные-linkedinicon-social-twitter Мы обнаружили, что вы используете блокировщик рекламы.
PracticeUpdate бесплатен для конечных пользователей, но мы полагаемся на рекламу для финансирования нашего сайта. Пожалуйста, подумайте о поддержке PracticeUpdate, добавив нас в белый список в вашем блокировщике рекламы.
Войти на практикуОбновить
Только зарегистрированные пользователи имеют полный доступ к контенту PracticeUpdate.
Дополнительная информация
Заявления о раскрытии информации доступны в профилях авторов:
Дополнительная литература
признакам
Неблагоприятный детский опыт и обращение за медицинской помощью детей в отделения неотложной детской помощи
J Педиатр · 8 октября 2021 г.
обновлено
история недели
Безопасность и эффективность вакцины AZD1222
Н.Англ. J. Med · 07 октября 2021 г.
обновлено
история недели
Эффективность вакцин Moderna, Pfizer-BioNTech и Janssen в предотвращении госпитализаций COVID-19 у взрослых
MMWR Morb.Смертный. Wkly. Rep. · 07 октября 2021 г.
обновлено
признакам
Медицинский каннабис и каннабиноиды от хронической боли
BMJ · 06 октября 2021 г.
признакам
Шагов в день и универсальная смертность у взрослых среднего возраста
JAMA Netw Open · 06 октября 2021 г.
обновлено
признакам
Осложнения при сахарном диабете 2 типа в молодости
Н.Англ. J. Med · 05 октября 2021 г.
обновлено
признакам
Терапия полипиллами с асприном и без него для профилактики сердечно-сосудистых заболеваний
Ланцет · 05 октября 2021 г.
обновлено
признакам
Влияние экранного времени на восстановление после сотрясения мозга
JAMA Педиатр · 4 октября 2021 г.
обновлено
признакам
Результаты применения агонистов рецепторов GLP-1 у пациентов с сахарным диабетом 2 типа
Ланцет Диабет Эндокринол · 30 сентября 2021 г.
обновлено
признакам
6-месячное наблюдение за детьми с MIS
Педиатрия · 30 сентября 2021 г.
обновлено
история недели
Рекомендации по усилению иммунного ответа на вакцину против COVID-19
Ланцет · 30 сентября 2021 г.
Первичная помощь Гастроэнтерология Первичная помощь Гастроэнтерология
Младенческая колика представляет воспаление и дисбактериоз кишечника
Микробиота желудочно-кишечного тракта представляет собой сложную и динамичную экосистему, состоящую из нескольких сотен различных микробов, в основном бактерий (1011–12 бактерий / г содержимого толстой кишки, что составляет 60% от общей массы фекалий; Eckburg et al. al., 2005; О’Хара и Шанахан, 2006 г.). Общее количество бактерий в 10 раз превышает количество клеток человека, а коллекция микробного генома (микробиома) содержит в 100 раз больше генов, чем геном человека (Vael and Desager, 2009). Микробиота кишечника влияет на рост и дифференцировку эпителиальных клеток кишечника и играет основные питательные, метаболические, иммунологические и защитные функции (O’Hara and Shanahan, 2006). Его дерегуляция участвует в патогенезе иммунологических, сердечно-сосудистых и метаболических заболеваний (Hammer, 2011; Maslowski and MacKay, 2011; Harris et al., 2012). Исследование состава микробиоты началось в 1900 году (Tissier, 1900) и проводилось методами культивирования с недавнего появления методов, основанных на последовательностях ДНК, которые, благодаря их способности идентифицировать большое количество видов, которые нельзя культивировать, стали позволили провести более полную и быструю оценку экосистемы желудочно-кишечного тракта (Palmer et al., 2007; Adlerberth and Wold, 2009). На основе гена, кодирующего рибосомную РНК 16S, в дистальном отделе кишечника человека было обнаружено более 7000 различных филотипов (Vael and Desager, 2009) с высокой межиндивидуальной и возрастной вариабельностью, но принадлежащих к ограниченному числу широких таксономических групп. подразделения (в основном анаэробы Bacteroides, Eubacterium, Clostridium; Hayashi et al., 2002; Экбург и др., 2005; Zoetendal et al., 2008). В недавнем исследовании Arumugam et al. (2011), объединив фекальные метагеномы людей из разных стран, определили три разных энтеротипа (с преобладанием видов Bacteroides, Prevotella и Ruminococcus, соответственно), которые не зависят от страны или континента, и показали, что вариации кишечной микробиоты стратифицированы, не непрерывно, что указывает на существование ограниченного числа хорошо сбалансированных симбиотических состояний между хозяином и микробом.Эти энтеротипы, по-видимому, не различаются по функциональному разнообразию и, по-видимому, не коррелируют с национальностью, полом, возрастом или индексом массы тела; в то же время они кажутся характерными и достаточно стабильными у индивидуумов, так что они могут восстанавливаться после возмущений. Состав и концентрация кишечной микробиоты физиологически различаются по всему желудочно-кишечному тракту (возрастающий градиент от желудка к толстой кишке и характерное распределение микрофлоры в кишечнике) и на этапах жизни, от бесплодия новорожденного до чрезвычайно изменчивой и плотной колонизации кишечника взрослого человека. влияние различных внутренних и внешних факторов, связанных с хозяином (Mackie et al., 1999; Palmer et al., 2007).
Дисбиоз материнской и неонатальной микробиоты, связанный с гестационным сахарным диабетом
Введение
В человеческом теле обитают многочисленные микробы, которые образуют стабильные симбиотические отношения с хозяином и необходимы для здоровья человека. Длинный список болезней связан с дисбалансом микробиоты человека1. В последние годы большое внимание уделяется микробиоте во время беременности и в раннем периоде жизни, поскольку они очень важны для репродуктивного здоровья.2 Например, существует сильная корреляция между микробиотой влагалища матери и преждевременными родами. 3 Кроме того, микробиота матери и новорожденного может повлиять на раннее развитие новорожденных 4 и может вызвать долгосрочные физиологические последствия в будущем 5. Следует приложить усилия, чтобы понять влияние состояния здоровья матери во время беременности на исходную микробиоту новорожденных и материнский вклад.
Сахарный диабет беременных (ГСД) — это заболевание аномальной толерантности к глюкозе, которое впервые возникает и распознается во время беременности.Пероральный тест на толерантность к глюкозе (OGTT), проводимый между 24 и 28 неделями, является золотым стандартом для диагностики этого заболевания.6 GDM распространен во всем мире, а его распространенность в некоторых странах или регионах даже превышает 20% .7 Более серьезно, заболеваемость ГСД продолжает расти, что представляет большую угрозу для здоровья матери и новорожденного. Это было связано с рядом неблагоприятных исходов, включая гестационную гипертензию, сердечно-сосудистые заболевания и преэклампсию у беременных 8, а также макросомию плода, респираторный дистресс-синдром и диабет 2 типа у потомства.9 Более того, диабетический статус матери может вызвать дисбактериоз микробиоты в меконии новорожденных.10 Учитывая, что меконий обычно выводится и собирается через несколько часов после родов, микробы могут накапливаться и воспроизводиться в течение этого периода, микробиота мекония предположительно является результатом послеродовой сбор.11 Однако такие типы образцов, как глоточные аспираты, которые располагаются глубоко в теле новорожденного и могут быть собраны сразу же при рождении, являются идеальным материалом для изучения воздействия GDM на исходную микробиоту.
В этом исследовании мы выполнили ген 16S рРНК и метагеномное секвенирование образцов, собранных из нескольких участков тела 486 беременных китайских женщин и новорожденных в течение нескольких секунд после родов. Наличие или отсутствие GDM было включено для определения вариаций материнской и неонатальной микробиоты, соответствующих состоянию здоровья беременных женщин, а также для иллюстрации основных микробных различий в раннем возрасте и их влияния на результаты для здоровья.
Материалы и методы
Набор субъектов
Беременных женщин и новорожденных набирали в больнице общего профиля авиации Пекина и Народной больнице Вэньчжоу.Беременные женщины с ГСД (ГСД +) были диагностированы врачами-специалистами по результатам ОГТТ и были отобраны в качестве клинической группы. Контрольной группой служили здоровые беременные женщины (GDM-), у которых в анамнезе не было других заболеваний, особенно пародонтита, диабета 2 типа и бактериального вагиноза.
Отбор проб
Операции по отбору проб выполнялись обученными профессионалами в строгих асептических условиях и по единому протоколу. Амниотическая жидкость (5–10 мл на образец) была собрана во время родов.Примерно 0,5–1 мл слюны новорожденного и 2–3 мл глоточного аспирата были взяты стерильными пипетками в течение 60 с после родов до того, как пуповина была разрезана. Примерно 1 г мекония брали стерильной пластиковой ложкой в течение 24 часов, как только у новорожденных появились первые кишечные выделения. Большинство неонатальных образцов было собрано у новорожденных после кесарева сечения. Образцы свежей слюны, стула и вагинального секрета были взяты у беременных за 1-2 дня до родов. Влагалищные образцы были взяты из заднего свода под прямой визуализацией с использованием трех мазков.Все образцы помещали в стерильные пробирки или флаконы, сразу же замораживали после сбора при –20 ° C, а затем транспортировали в лабораторию и хранили при –80 ° C до полной экстракции ДНК для последующего секвенирования.
Препарат ДНК
На строго контролируемом, отдельном и стерильном рабочем месте приблизительно 0,2 мл слюны, глоточного аспирата и амниотической жидкости смешивали с равными объемами PBS и буфера AL Qiagen путем импульсного встряхивания в течение 30 секунд. Тотальную ДНК экстрагировали в трех экземплярах из суспензии каждого типа образцов с использованием мини-набора QIAamp DNA Mini Kit (Qiagen, Valencia, CA).Образцы фекалий (~ 200 мг) ресуспендировали в буфере ASL Qiagen и гомогенизировали в течение 2 минут. Тотальную фекальную ДНК экстрагировали из супернатанта с использованием мини-набора QIAamp DNA Stool (Qiagen). Два вагинальных мазка интенсивно встряхивали в 0,5 мл PBS и 0,5 мл буфера Qiagen’s AL в течение 2 минут для ресуспендирования и лизиса микробных клеток. Полученный лизат обрабатывали с использованием мини-набора QIAamp DNA (Qiagen). Выделенную ДНК элюировали 50 мкл дистиллированной воды. Качество ДНК и концентрацию каждого образца измеряли электрофорезом в агарозном геле и Qubit 3.0 (Life Technologies, Waltham, MA) и до последующей обработки.
Высокопроизводительное секвенирование
Для каждого образца мы амплифицировали вариабельные области 3 и 4 (V3-V4) гена 16S рРНК с использованием модифицированных праймеров 341F и 805R. Очищенные положительные ампликоны с различными индексными последовательностями объединяли в эквимолярных количествах и затем секвенировали на платформе HiSeq2500 (Illumina, San Diego, CA) с реагентами v2 и картриджем 2 × 250 п.н. Метагеномная ДНК 50 образцов мекония (~ 0.5 мкг на образец) был разрезан на фрагменты размером ~ 300 п.н. с использованием сфокусированного ультразвукового устройства (Covaris, Woburn, MA). Библиотеки секвенирования были сконструированы из разрезанных фрагментов с использованием TruSeq Sample Preparation Kit v2 (Illumina). Длина вставки и целостность библиотек оценивали с помощью анализатора фрагментов (Advanced Analytical Technologies) перед секвенированием парных концов (PE) (2 × 125 п.н.) на платформе HiSeq2500.
Анализ последовательности 16S рРНК
Необработанные данные секвенирования последовательностей гена 16S рРНК были качественно отфильтрованы и проанализированы с использованием QIIME V.1.8.0.12 Оперативные таксономические единицы (OTU) были классифицированы таксономически с использованием эталонной базы данных гена 16S рРНК Greengenes.13 Таксономический состав микробных сообществ был визуализирован с помощью Calypso.14 Кластеризация сообществ измерялась невзвешенным расстоянием UniFrac на основе нормализованной таблицы OTU. Вместе с набором данных о микробиоте кожи новорожденных, полученным в результате недавнего исследования, с помощью пакета R ecodist было рассчитано различие Брея-Кертиса между различными типами образцов.Наборы микробных данных взрослого человека, включая 121 переднюю ноздрю, 312 слизистой оболочки рта, 73 образца средней части влагалища, 102 слюны и 55 образцов стула, были загружены из проекта Human Microbiome Project (HMP). Кластерный анализ структуры бактериального сообщества проводился на уровне родов.
Дискриминантный анализ частичных наименьших квадратов и линейный дискриминантный анализ
Дискриминантный анализ частичных наименьших квадратов (PLS-DA) и линейный дискриминантный анализ (LDA) использовались для выявления таксономических и функциональных изменений материнской и неонатальной микробиоты в ответ на GDM.16 17 PLS-DA был выполнен с использованием пакета R mixOmics (http://www.mixOmics.org). Дискриминационная способность каждого таксона оценивалась количественно с помощью переменной важности для параметров проекции (VIP). Оценки VIP использовались для ранжирования способности разных таксонов различать разные группы. Таксон с оценкой VIP> 1,0 считался важным для дискриминации. Категории KEGG с общей относительной численностью во всех пробах <1% были удалены. Величина эффекта была определена как значимая (p <0.05), различающиеся между группами, были оценены LDA для выявления дискриминационной ортологии (KO) KEGG с использованием онлайн-приложения Galaxy (https://huttenhower.sph.harvard.edu/galaxy). Только функциональные категории с логарифмической оценкой LDA> 2,0 рассматривались как дифференциальные сигнатуры, которые лучше различают группы GDM + и GDM-.
Анализ соответствия и совместной встречаемости
Обогащение OTU было рассчитано для каждого типа образца путем сравнения среднего и медианного относительного содержания между группами GDM + и GDM-.Для сетевого анализа совместной встречаемости бактериальные корреляции в материнских и неонатальных образцах с и без GDM были рассчитаны соответственно на основе относительной численности каждого рода с использованием SparCC со 100 бутстрапами для оценки значения p.18 Значения корреляции со значением p <0,05 были сохранены. Сети совместной встречаемости материнской микробиоты полости рта, кишечника и влагалища были визуализированы с помощью igraph (http://igraph.org). Близость и собственный вектор узлов были рассчитаны для измерения центральности узлов в каждой сети.Согласованность бактериальных корреляций между материнской и неонатальной микробиотой, связанной с GDM, была сделана путем подсчета одинаковых бактериальных корреляций в разных типах образцов и визуализирована с помощью OmicCircos19.
Реконструкция метаболических путей
KO-функциональное профилирование микробиоты мекония новорожденных было выполнено с использованием сборок, полученных на основе данных полногеномного секвенирования (WGS). Показания низкого качества сначала были вырезаны из необработанных данных секвенирования с помощью Trimmomatic.Было собрано 20 высококачественных считываний de novo в контиги с использованием metaSPAdes и metaSort с параметрами по умолчанию.21 22 Затем мы выполнили прогнозирование генов с помощью PROKKA V.1.11 для этих каркасов, 23 и предсказанные белки были назначены на KO с использованием Сервер автоматических аннотаций KEGG.24 Обрезанные высококачественные чтения, расположенные на заданных каркасах, были подсчитаны для расчета численности нокаутов в каждом образце с использованием выравнивателя Берроуза-Уиллера (BWA) 25. Матрицу нормализовали путем деления абсолютного количества каждого функционального гена. по общему количеству считываний, присвоенных функциональным генам в каждом образце.Анализ под наблюдением был проведен с использованием LDA для выявления микробных функциональных путей, которые по-разному экспрессировались в микробиоте кишечника новорожденных, рожденных женщинами с различным статусом уровня глюкозы.
Анализ вирома и подвидов
После удаления последовательностей ДНК человека были измерены таксономия и численность вируса и бактериофага в микробиоте неонатального мекония путем сопоставления показаний секвенирования WGS с пользовательской базой данных. Эта база данных была построена путем объединения геномных последовательностей вирусов и фагов из NCBI и PhAnToMe после удаления дубликатов, как описано в нашем предыдущем исследовании.26 считываний BLASTX для этой базы данных с порогом E -значение <10 −5 с использованием DIAMOND.27 Был вычислен самый низкий общий предок всех таксонов в собранных совпадениях BLAST и использован для определения таксономического происхождения. Альфа-разнообразие вирусных и фаговых сообществ было рассчитано с использованием веганского (https://cran.r-project.org/web/packages/vegan). Для профилирования видов бактерий на уровне штаммов на основе данных метагеномного секвенирования геномы 35 Escherichia и 69 Lactobacillus , выделенных из полости рта, кишечника или влагалища человека, были получены из HMP и были взяты в качестве эталонов.Считывания WGS каждого образца мекония были сопоставлены с этими эталонными геномами с помощью BWA.
Результаты
Мы включили 140 новорожденных и 346 беременных женщин и взяли 1062 пробы, включая слюну, глоточный аспират, меконий и околоплодные воды новорожденных, а также слюну, фекалии и вагинальные выделения беременных женщин (онлайн-дополнительная таблица S1) . Подавляющее большинство неонатальных проб, особенно амниотической жидкости, было собрано при кесаревом сечении (76 кесарева сечения против 17 вагинальных родов), чтобы избежать возможного заражения влагалищной флорой.Для каждого образца были секвенированы области 16S рРНК V3-V4, и 233 образца не смогли получить данные и были удалены из следующих анализов.
Секвенирование гена 16S рРНК подходящих 248 неонатальных (64 амниотической жидкости, 20 оральных, 81 глоточных и 83 мекониевых) и 581 материнских (175 оральных, 147 кишечных и 259 вагинальных) образцов дало 309 миллионов считываний PE (2 × 250 п.н. ), с ~ 373 241 чтением на выборку. Каждая пара считываний PE была объединена в одну последовательность путем перекрытия. Совпадения составляли 25–75 п.н. для каждого образца (онлайн-дополнительная фигура S1A), и более 80% считываний PE были успешно объединены в длинные последовательности в 94.3% выборок (дополнительный рисунок S1B онлайн). Кроме того, согласно оценке охвата и кривой разрежения Good (дополнительный рисунок S1C, D), количество последовательностей может хорошо отражать микробное разнообразие каждого сообщества. При выборе различных методов для классификации OTU было небольшое расхождение (онлайн-дополнительный рисунок S1E). Все неонатальные образцы и половина материнских образцов (n = 289), собранные во время родов, были использованы для изучения возможного микробного сдвига нескольких участков тела, страдающих от GDM (онлайн-дополнительная таблица S2).Оставшаяся половина материнских образцов (95 оральных, 98 кишечных и 99 вагинальных) использовалась в качестве наборов данных для валидации. Подмножество образцов мекония было выбрано случайным образом для метагеномного секвенирования, и 48 из 50 образцов (24 для GDM + и 24 для GDM-) были успешно секвенированы, что дало более 1,5 миллиардов считываний PE (2 × 125 п.н.).
Измененная материнская микробиота в нескольких участках тела в GDM
Чтобы выяснить, может ли материнская микробиота зависеть от уровня глюкозы, мы сначала исследовали микробный сдвиг беременных женщин, которым был поставлен диагноз GDM.Соотношения общих или уникальных OTU в образцах ротовой, кишечной и вагинальной ротовой полости матери были оценены, чтобы определить, оказывает ли GDM аналогичное влияние на разные участки тела. Мы обнаружили, что пациенты с GDM (GDM +) имели больше OTU как минимум в двух участках тела, чем беременные женщины без GDM (GDM-), при этом примерно 57,6% OTU появлялись только в одном участке тела GDM- по сравнению с 47,0% в GDM + ( рисунок 1А). Кроме того, мы рассчитали расстояния Брея-Кертиса с использованием нормализованной численности OTU. Расстояния между образцами любых двух участков тела были значительно меньше в GDM +, чем в GDM- (p <0.05, тест Манна-Уитни) (рис. 1В). Эти результаты показывают, что микробный сдвиг в материнской микробиоте различных участков тела может быть связан с ГСД во время беременности.
Рисунок 1Микробные вариации беременных женщин, страдающих гестационным сахарным диабетом (ГСД). (A) Доли общих операционных таксономических единиц (OTU) среди материнской микробиоты полости рта, кишечника и влагалища. Общая ОТЕ означает, что определенная ОТЕ была обнаружена в двух или трех участках тела. (B) Различия бактериального сообщества между любыми двумя участками тела в материнских образцах.Расстояния Брея-Кертиса были независимо рассчитаны для групп GDM + и GDM-. VS представляет собой против. Статистическая значимость определялась с помощью теста Манна-Уитни. (C – E) Относительное количество типов бактерий в микробиоте полости рта, кишечника и влагалища беременных женщин. (F – H) Бактериальные роды со значительными (критерий Манна-Уитни с поправкой на частоту ложных открытий (FDR); * p <0,1) различиями между группами GDM + и GDM-. Обилие рода в каждой выборке было нормализовано до 100 000 прочтений. (I – K) Корреляция между значимыми различиями между бактериями и значениями перорального теста на толерантность к глюкозе (OGTT).Метки 0 час, 1 час и 2 часа под прямоугольными диаграммами представляют моменты времени тестирования OGTT. Пара прямоугольников указывает бактериальные соотношения, соответствующие уровням глюкозы в крови ниже (левое поле) или выше (правое поле) пороговых значений (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT). Значимое различие (критерий Манна-Уитни, p <0,05) обозначается символом красного цвета, а символ ns синим цветом обозначает несущественное различие (критерий Манна-Уитни, p ≥ 0,05).
Чтобы дополнительно продемонстрировать эти вариации, соответствующие GDM в разных участках тела, мы сравнили численность бактерий между группами на уровне филума.Наибольшие изменения произошли в полости рта: больше протеобактерий (p <0,05, тест Манна-Уитни с коррекцией частоты ложных обнаружений (FDR) с использованием метода Бенджамини-Хохберга), но меньше Firmicutes (p <0,01), обнаруженных в GDM + (рисунок 1C). ). Не было показано никаких явных различий ни в кишечной, ни в вагинальной микробиоте (рис. 1D, E). Затем был проведен PLS-DA для улучшения разрешения флоры GDM. От семи до девяти родов со значением VIP> 1 были обнаружены из трех участков тела (онлайн-дополнительный рисунок S2A – F).Для подтверждения микробных вариаций, соответствующих GDM, были использованы 95 образцов перорального, 98 кишечных и 99 вагинальных образцов, взятых у второй когорты беременных женщин. Около 77,8% (7 из 9), 88,9% (8 из 9) и 71,4% (5 из 7) родов VIP, идентифицированных в наборах данных первой партии, можно было проверить во второй партии, и большинство из них показали последовательное обогащение или истощение в двух когортах (рисунок 1F – H и дополнительный онлайн рисунок S2G – I). Для дальнейшего изучения взаимосвязи между этими родами и GDM мы связали их численность с результатами OGTT.Пороговые значения (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT) основаны на диагностических критериях, рекомендованных Международной ассоциацией групп по изучению диабета и беременности в 2011 году. Как показано на рисунке 1I – K, относительная численность этих бактерий сильно коррелировала со значениями OGTT (p <0,05, тест Манна-Уитни).
Микробиота новорожденных, матери которых страдали ГСД, значительно отличается от таковой в контрольной группе
Чтобы изучить возможные эффекты ГСД на микробиоту новорожденных, мы затем исследовали состав сообщества и структуру новорожденных.В анализе основных координат (PCoA) невзвешенных расстояний UniFrac образцы были сгруппированы в основном по участкам тела, с отдельными материнскими оральными, кишечными и вагинальными кластерами, а также кластерами неонатальной глотки, мекония и околоплодных вод (рисунок 2A). Узловая кластеризация тела наблюдалась в образцах новорожденных из разных участков тела, хотя разделение было не таким заметным, как у матери. Кроме того, мы рассчитали расстояние Брея-Кертиса внутри или между участками тела, чтобы количественно оценить сходство сообщества одного и того же типа образца.Расстояния между сообществами в образцах, полученных с одного и того же участка тела, как и ожидалось, были меньше, чем между разными участками тела (рис. 2В), что дополнительно подтвердило результаты кластеризации с помощью PCoA. Мы рассчитали расстояния Брея-Кертиса между неонатальными и материнскими образцами. В результате, за исключением нескольких необычных образцов родившихся через естественные родовые пути младенцев, которые, очевидно, происходили из вагинального сообщества матери, способ родоразрешения оказал лишь очень незначительное влияние на микробиоту новорожденных (рис. 2С).Более того, неонатальная микробиота демонстрирует более высокое альфа-разнообразие, чем микробиота влагалища (рисунок 2D). Видовое богатство образцов глотки и околоплодных вод было даже сопоставимо с материнскими оральными и кишечными сообществами, микробное разнообразие которых было довольно высоким (дополнительный рисунок S3 онлайн). Неонатальная микробиота каждого участка тела имела уникальную структуру сообщества (рисунок 2E). Напротив, материнские сообщества этих трех участков тела показали типичную структуру микробиоты взрослого человека (дополнительный рисунок S4 онлайн).
Рисунок 2Колонизация и специфичность участка тела неонатальной микробиоты при рождении. (A) Анализ основных координат (PCoA) невзвешенных расстояний UniFrac для образцов ротовой полости, кишечника и влагалища матери, а также амниотической жидкости новорожденных, образцов ротовой полости, глотки и мекония. Эллипсы представляют 95% доверительный интервал. (B) Различия бактериального сообщества внутри и между участками тела. Метки Phar, Inte, Amni и Vagi обозначают микробиоту глотки, кишечника, околоплодных вод и влагалища соответственно.Приведено среднее расстояние Брея-Кертиса для каждой группы парных сравнений. Красные и синие тени обозначают наименьшее и наибольшее значения в каждом столбце соответственно. (C) Влияние способов доставки на неонатальные бактериальные сообщества. Три края треугольника представляют материнскую микробиоту ротовой полости (коричневый), кишечника (желтый) и влагалища (зеленый). Каждая полая точка представляет собой неонатальный образец, а расстояние по вертикали до трех краев треугольника указывает среднее расстояние Брея-Кертиса между этим образцом и материнскими образцами.Точки ближе к краям означают, что такие неонатальные образцы более похожи по бактериальному сообществу на указанную материнскую микробиоту. (D) Альфа-разнообразие неонатальной и материнской микробиоты. Скрипка с прямоугольной диаграммой показывает медианное значение и IQR индексов разнообразия типа сэмпла, а ширина скрипки представляет собой распределение плотности индексов. (E) Таксономическое профилирование микробиоты глотки, кишечника и околоплодных вод новорожденных. Средняя относительная численность каждой таксономической категории представлена толщиной ветви.Каждый узел филогенетического дерева представляет один таксон микробов.
Учитывая, что неонатальная микробиота могла быть установлена при рождении, мы задались вопросом, будет ли такое микробное сообщество формироваться состоянием здоровья беременных женщин во время беременности. Соответственно, расстояния Брея-Кертиса были рассчитаны с использованием количества OTU микробиома из образцов околоплодных вод, глотки и мекония для оценки воздействия GDM на микробиоту новорожденных. Мы обнаружили, что расстояния между тремя типами выборок в GDM + были значительно меньше, чем в GDM- (p <0.001, тест Манна-Уитни) (рис. 3A), из которого следует, что GDM может влиять на микробиоту новорожденных и, следовательно, приводить к однородности сообщества по множеству типов образцов. Эта тенденция к изменению расстояния между сообществами соответствовала той, которая наблюдалась в микробиоте полости рта, кишечника и влагалища матери (рис. 1B). PCoA продемонстрировал минимальные различия между состоянием здоровья и болезнью околоплодных вод (Adonis p <0,001, R 2 = 0,069), глоточный (Adonis p <0.001, R 2 = 0,050) и меконий (Адонис p <0,05, R 2 = 0,026) микробиота (рисунок 3B – D). Образцы были сгруппированы преимущественно по ассоциациям GDM + и GDM-. Эти результаты показывают, что микробный состав и различия как у матери, так и у новорожденного могут быть обусловлены состоянием здоровья беременной женщины. Воздействие ГСД на микробы во время беременности может вертикально передаваться ребенку во время беременности.
Рисунок 3Микробиота новорожденных, связанная с гестационным сахарным диабетом (ГСД).(A) Бактериальные различия между микробиотой новорожденных. Расстояния Брея-Кертиса были рассчитаны для образцов GDM + и GDM- независимо. Статистическая значимость определялась с помощью теста Манна-Уитни. (B – D) Анализ основных координат (PCoA) невзвешенных расстояний UniFrac для околоплодных вод, глоточной и мекониевой микробиоты. Эллипсы представляют 95% доверительный интервал. (E – G) Наиболее многочисленные роды со значительным различием между группами GDM + и GDM−. Обилие рода в каждой выборке было нормализовано до 100 000 прочтений.Тест Манна-Уитни с поправкой на частоту ложных открытий (FDR): нет. * р <0,1; * р <0,05; ** р <0,01; *** р <0,001. Пара таксонов была выделена темным цветом, поскольку их относительная численность была наибольшей среди значительно обогащенных и истощенных родов GDM + в каждом типе образцов. (H – J) Корреляция между существенно различающимися бактериями микробиоты новорожденных и значениями перорального теста на толерантность к глюкозе (OGTT). Метки 0 час, 1 час и 2 часа представляют три момента времени тестирования OGTT.Пара прямоугольников показывает соотношение бактерий, соответствующее уровням глюкозы в крови ниже (левое поле) или выше (правое поле) пороговых значений (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT). Тест Манна-Уитни; * р <0,05; ** р <0,01; *** p <0,001; нс p≥0,05.
Обилие бактерий между группами GDM + и GDM- было дополнительно сравнено на уровне рода, чтобы прояснить локальные вариации тела, связанные с GDM в микробиоте новорожденных. Как показано на рис. 3E – G, образцы околоплодных вод имели больше родов со значительными межгрупповыми различиями, чем образцы глотки или мекония (p <0.1, тест Манна-Уитни с поправкой на FDR) в 30 самых распространенных родах, что указывает на большую микробную дифференциацию в околоплодных водах (рис. 3B – D). Чтобы изучить корреляцию между дискриминирующими бактериями и GDM, мы выбрали наиболее распространенные обогащенные или истощенные роды и рассчитали корреляцию их численности с соответствующими материнскими значениями OGTT. В результате сильная корреляция наблюдалась в нескольких группах (рисунок 3H – J и дополнительный рисунок S5 в Интернете). Мы также выполнили анализ PLS-DA в неонатальных образцах, чтобы определить дифференциальные сигнатуры между группами здоровья и заболевания (дополнительный рисунок S6 онлайн).Роды VIP, такие как Prevotella , Streptococcus , Bacteroides и Lactobacillus , преобладали в нескольких типах образцов материнской и неонатальной микробиоты, что отражает их возможное значение для ответа GDM на разных поколениях и участках тела.
Согласованность микробных вариаций между матерями и новорожденными, страдающими GDM
Учитывая, что как материнский, так и неонатальный микробиомы нескольких участков тела были заметно изменены с GDM, мы попытались изучить соответствие микробных вариаций между матерями и новорожденными.Сначала мы подсчитали количество OTU, обогащенных или истощенных у новорожденных с GDM, а затем сосредоточились на тех, которые были общими в материнских выборках. OTU, которая была обогащена (или истощена) материнской и неонатальной микробиотой GDM +, была определена как изменяющаяся по одной и той же тенденции. Напротив, OTU, которая была обогащена микробиотой новорожденных, но обеднена материнской микробиотой GDM +, была определена как противоположная тенденция, и наоборот. Соответственно, были подсчитаны таксономия и количество OTU, изменяющихся по одной и той же тенденции в материнской и неонатальной микробиоте, и было обнаружено, что большое количество OTU с высоким содержанием варьирует с той же тенденцией.Наиболее заметное соответствие микробной изменчивости было показано между околоплодными водами и микробиотой ротовой полости матери (рисунок 4A, B и дополнительный рисунок S7 онлайн), в котором большинство наиболее распространенных OTU варьировались с одной и той же тенденцией. Кроме того, было обнаружено, что около 100 OTU различаются с одинаковой тенденцией в одном типе выборки матери и трех типах неонатальной выборки. Prevotella , Streptococcus и Bacteroides были наиболее распространенными таксонами, показывающими соответствие микробных вариаций между матерями и новорожденными (дополнительные рисунки S8 – S11 в Интернете).Вместе с Lactobacillus и Faecalibacterium (рисунок 4C – E) эти бактерии соответствовали общим родам VIP для материнских и неонатальных типов образцов (дополнительные рисунки S2 и S6 онлайн), что также отражает их важность для ответа на GDM. Эти наблюдения доказали, что, несмотря на локальные вариации в организме, GDM может иметь сходные эффекты как на материнскую, так и на неонатальную микробиоту.
Рисунок 4Сходные микробные сдвиги между материнской и неонатальной микробиотой, связанные с гестационным сахарным диабетом (GDM).Обилие операционных таксономических единиц (OTU) в каждой выборке было нормализовано до 100 000 считываний. (A) Соответствие вариаций OTU между околоплодными водами и микробиотой полости рта матери. Средняя относительная численность 100 самых распространенных OTU сравнивалась между группами GDM + и GDM-. Сплошные точки представляют собой OTU микробиоты околоплодных вод, а полые точки представляют микробиоту полости рта матери. Красные точки обозначают OTU, изменяющиеся по одной и той же тенденции, а синие точки обозначают противоположную тенденцию. (B) Совокупное количество OTU, изменяющихся в соответствии с одной или противоположной тенденцией.p <0,001, t-критерий. (C – E) Наиболее распространенные таксоны, показывающие соответствие микробной изменчивости между матерями и новорожденными. Каждая цветная полоса указывает частоту OTU определенного рода. Полоса красного цвета представляет переменную важность для проекционного (VIP) рода, связанного с GDM, который является общим для материнских и неонатальных типов выборок.
Чтобы исследовать соответствие микробной совместимости между матерями и новорожденными, мы затем вычислили корреляции между бактериальными родами в материнских и неонатальных образцах с и без GDM.Приблизительно 47–62 родов (узлов) и 60–134 соединений (ребер) сохранялись при различных пороговых значениях корреляции (0,4–0,5) (онлайн-дополнительный рисунок S12A, B) в сетях совместной встречаемости материнских оральных, кишечных и микробиота влагалища. При сравнении сетей GDM + с сетями GDM− их компоненты и топографии были весьма различны, и наиболее заметное различие происходит из-за связей родов VIP с другими бактериями (рис. 5A – C). Чтобы количественно оценить такую разницу, мы подсчитали количество ребер и центральность узлов в материнских микробных сетях с различным статусом GDM.Несмотря на наличие нескольких перекрывающихся ребер, десятки ребер были специфичными для GDM + или GDM- (рисунок 5D), а близость и собственный вектор общих узлов между GDM + и GDM- также сильно различались (рисунок 5E и дополнительный рисунок S12C онлайн). Более того, внутригрупповые различия всегда были очевидны в каждом интервале значений корреляции (онлайн-дополнительная цифра S12D – F). Что касается новорожденных, бактериальные корреляции также были различны между GDM + и GDM- (рисунок 5F, G и дополнительный рисунок S12G онлайн).Например, в микробиоте глотки около 69,2% корреляций со значением корреляции> 0,4 существовали только в GDM +, в то время как ~ 18,7% присутствовали только в GDM- (рисунок 5F). Аналогичные результаты наблюдались и для мекония: 76,9% и 15,3% уникальных корреляций присутствовали в GDM + и GDM-, соответственно (рисунок 5G). Примечательно, что бактериальные корреляции между образцами матери и новорожденного, ассоциированными с GDM, были высоко сохранены (рисунок 5H и дополнительный рисунок S12H онлайн). Около 88,8% всех бактериальных связей имели одинаковую тенденцию к совместному возникновению между поколениями, а 69.1% были обнаружены только в GDM +, но не в GDM-. Среди них положительная корреляция между Neisseria и Haemophilus и отрицательная корреляция между Lactobacillus и несколькими VIP-бактериями (включая Porphyromonas и Bacteroides ) присутствовали почти на всех сайтах тела матери и новорожденного12 ). Кроме того, соединения, содержащие Blautia , Coprococcus , Roseburia и Sutterella , показали высокую частоту совместной встречаемости в нескольких типах образцов, что указывает на их универсальную принадлежность к микробиоте, связанной с GDM.Согласно этим результатам, можно предположить, что постоянство микробной изменчивости у матерей и новорожденных, страдающих от GDM, произошло в изобилии бактерий и в их взаимодействиях.
Рисунок 5Сеть сопутствующих бактерий и соответствие между материнской и неонатальной микробиотой, связанной с гестационным сахарным диабетом (GDM). (A – C) Сети совместного присутствия материнской микробиоты полости рта, кишечника и влагалища GDM + (левая панель) и GDM- (правая панель). Сеть совместной встречаемости была выведена для каждого типа материнской выборки путем попарной корреляции относительной численности (нормированной на 100 000) для всех родов.Каждый узел в сети указывает на род бактерий. Размер узла представляет собой среднюю относительную численность одного рода в каждом типе материнской выборки. Узлы зеленого цвета показывают переменную важность для родов проекций (VIP), связанных с GDM. Сохраняются только бактериальные связи (края), превышающие пороговые значения (значения корреляции> 0,4, 0,45 и 0,5 в трех сетях соответственно). Ширина края представляет собой значение корреляции, поддерживающее это соединение. Цвет краев показывает положительную (красный) и отрицательную (синий) корреляцию соответственно.(D, E) Расхождения в бактериальных сетях совместного возникновения между материнским GDM + и GDM-. Подсчитывалось количество уникальных и общих ребер, а также центральности (ранг близости) и расхождения узлов в сетях совместного появления GDM + и GDM-, соответственно. (F – G) Расхождения в бактериальных корреляциях между неонатальной микробиотой GDM + и GDM-. Каждая ячейка показывает количество одинаковых пар бактериальных корреляций, имевших место как в GDM +, так и в GDM-, при этом изменения цвета представляют слабую (серый) или сильную (синий и красный) корреляции, соответственно.(H) Соответствие бактериальных корреляций между материнской и неонатальной микробиотой, связанной с GDM. Соответствие было выведено путем подсчета одинаковых бактериальных корреляций (пороговое значение> 0,4) для разных типов образцов. Каждая точка внешнего цикла представляет собой одно соединение двух коррелированных бактерий (по крайней мере, одна принадлежит к роду VIP). Красная кривая (встречается только в GDM +) и серая (встречается как в GDM +, так и в GDM-) обозначает одну и ту же тенденцию совместного возникновения такой связи между материнской и неонатальной микробиотой, а кривая синего цвета обозначает противоположную тенденцию.
Измененный микробный метаболизм и повышенная вирусная нагрузка в GDM + меконий
Микробиота кишечника новорожденных важна для метаболизма и иммунитета развивающихся младенцев и взрослых.28–30 Поэтому мы попытались оценить потенциальные риски микробного перехода на новорожденных, профилируя микробиота мекония, и, таким образом, для секвенирования WGS была выбрана подгруппа проб мекония. Было успешно секвенировано 48 образцов, что дало более 375 Гб данных секвенирования WGS.Метагеномное таксономическое профилирование данных секвенирования образцов мекония WGS было выполнено с использованием MetaPhlAn.31 По сравнению с таксономическими профилями мекония на основе 16S рРНК, метагеномное секвенирование генерирует довольно похожую структуру бактериального сообщества (дополнительный рисунок S13 онлайн). Мы искали метаболические различия между кишечной микробиотой новорожденных, рожденных женщинами с ГСД и без. В результате меньшие индексы Pielou для КО были показаны в группе GDM + (рис. 6A), что означает, что микробиота новорожденных в этой группе имела более низкую равномерность, чем в группе GDM-.LDA использовалась для выявления межгрупповых различий в KOs, и большое количество KOs было истощено в GDM +, что указывает на снижение метаболических возможностей по сравнению с микробиотой кишечника новорожденных, рожденных женщинами без GDM (рисунок 6B и дополнительная таблица S3 онлайн). Отсутствие таких метаболических путей может отрицательно влиять на усвоение пищи или определенную метаболическую способность новорожденных.
Рисунок 6Микробные и функциональные изменения микробиоты мекония, связанные с гестационным сахарным диабетом (GDM).(A) Равномерность ортологии KEGG (KO). (B) Количество обогащенных КО. (C, D) Распределение вирусного богатства и равномерности. (E, F) Относительная численность вируса герпеса и поксвируса. Обилие вирусов в каждом образце было нормализовано до 100 000 считываний. (G, H) Распространенность мастаденовируса и папилломавируса в меконии. (I, J) Значительная дифференциация штаммов Escherichia и Lactobacillus между GDM + и GDM-. Геномы штаммов Escherichia и Lactobacillus , выделенных из ротовой полости, кишечника или влагалища человека, были загружены из Human Microbiome Project (HMP) и взяты в качестве ссылок.Считывания секвенирования были сопоставлены с этими ссылками, и численность штаммов в каждом образце была нормализована до 100 000 считываний.
Мы также сравнили данные WGS с известными вирусными геномами, чтобы выявить возможные изменения в вироме мекония. Хотя более высокое богатство (количество наблюдаемых видов вирусов) эукариотических вирусов в меконии GDM + было незначительным (рисунок 6C), как вирусная однородность (индекс Пиелу в каждом образце), так и индексы альфа-разнообразия были значительно ниже, чем у GDM- ( р <0.05, тест Манна-Уитни) (рисунок 6D и дополнительный онлайн рисунок S14A – D). Напротив, не было очевидных межгрупповых различий в альфа-разнообразии бактериофагов (онлайн-рисунок S14E – H). Дальнейшее исследование оценило относительное количество распознаваемых вирусных таксонов и выявило четыре типа вирусов, которые варьировались в зависимости от состояния здоровья беременных женщин, включая герпесвирус, поксвирус, мастаденовирус и папилломавирус. Среди них герпесвирус и поксвирус были более распространены в группе GDM + (рис. 6E, F), а также более распространены мастаденовирус и папилломавирус в образцах этой группы (рис. 6G, H).Эти данные свидетельствуют о том, что беременные женщины, страдающие ГСД, увеличивают распространенность вирусов в кишечной микробиоте новорожденных и могут привести к появлению населения, очень уязвимого к воздействию этих вирусов.
Наконец, чтобы исследовать внутривидовое разнообразие некоторых неонатальных кишечных бактерий, мы сопоставили данные WGS-секвенирования образцов мекония с доступными в настоящее время эталонными геномами Escherichia и Lactobacillus , которые включают геномы 35 Escherichia и 69 выделенных Lactobacillus из полости рта, кишечника и влагалища человека, извлеченных из HMP (рис. 6I, J).Учитывались только однозначно картированные чтения этих геномов. Большое количество считываний может быть отнесено к геномам эталонных штаммов, выделенных не только из влагалища, но и из ротовой полости и кишечника человека, что дополнительно подтвердило наблюдение о том, что неонатальная микробиота происходит не только из влагалища. Кроме того, мы наблюдали, что и Escherichia , и Lactobacillus показали различия в уровне штаммов между новорожденными, родившимися от матерей с GDM и без него. Примечательно, что штаммов Lactobacillus iners были значительно более многочисленны в GDM + (p <0.05, тест Манна-Уитни с поправкой FDR) (рисунок 6J). Эти данные продемонстрировали, что Lactobacillus spp и их подвиды у новорожденных могут быть сформированы статусом GDM их матерей.
Обсуждение
Большинство неонатальных образцов в нашем исследовании было собрано в течение нескольких секунд после доставки кесарева сечения, что позволило нам исключить возможность микробного воздействия и колонизации in vitro . Микробы, присутствующие в этих образцах, указывают на формирование микробиоты плода, в отличие от обнаружения микробов в меконии, которое, как сомневается, было результатом послеродового приобретения.11 Секвенирование гена 16S рРНК выявило бактериальные сигналы от каждого участка тела новорожденного, а некоторые участки тела (например, микробиота глотки и околоплодных вод) даже имеют относительно высокое видовое богатство. В сочетании с заметной разницей в таксономическом составе и структуре сообществ неонатальной и материнской микробиоты эти результаты показывают, что не все микробные нуклеиновые кислоты, обнаруженные в амниотической жидкости и образцах новорожденных, являются контаминантами от матери, как предполагалось ранее.32 Кроме того, как показано в анализе несходства PCoA и Брея-Кертиса, очень ясно, что неонатальные образцы были сгруппированы в соответствии с типами образцов. Наблюдаемой кластеризации различных типов образцов не наблюдалось бы, если бы их микробы возникли в результате потенциального материнского заражения или загрязнения реагентами. Более того, живые бактерии были успешно культивированы из околоплодных вод беременных женщин как с GDM +, так и с GDM- (данные не показаны). Несмотря на то, что в одном обзоре использовались стерильные мыши в качестве примера, чтобы отвергнуть гипотезу микробной колонизации в утробе матери, 11 мы предполагаем, что причиной могут быть различия в клеточных структурах плаценты и продолжительности беременности между мышами и людьми.Два слоя синцитиотрофобластов и один полный слой цитотрофобластов в плаценте мыши создают сильные барьеры для предотвращения вертикальной передачи микробов от матери к потомству 33, а короткий срок беременности (19–21 день) также снижает вероятность попадания бактерий в матку мыши. Напротив, у людей в плаценте есть только один слой синцитиотрофобластов, и более длительная беременность дает бактериям больше шансов проникнуть в матку. Таксономическое профилирование как 16S рРНК, так и метагеномное секвенирование показали, что Enterobacteriaceae и Escherichia являются наиболее распространенными таксонами в образцах мекония.Это согласуется с предыдущими исследованиями микробиоты плаценты34 или мекония.15 Эти результаты предполагают, что Escherichia преобладают в утробе матери и в раннем детстве.
В сочетании с результатами предыдущих исследований 10 35 мы считаем, что GDM может влиять на микробиоту как беременных женщин, так и новорожденных во многих частях тела во время беременности. Хотя OGTT был принят в качестве золотого стандарта для диагностики GDM, для мониторинга необходим анализ крови, и его проводят только между 24 и 28 неделями беременности.6 Существует сильная корреляция между несколькими дискриминационными бактериями и значениями OGTT. Например, в материнской микробиоте, оральные соотношения Neisseria / Leptotrichia положительно коррелировали со значениями глюкозы в крови, особенно с концентрациями глюкозы в крови натощак, которые отражают суточную секреторную способность базального инсулина. Низкое кишечное соотношение Faecalibacterium / Fusobacterium соответствовало высоким значениям глюкозы в крови, где корреляция была очень значимой между соотношением бактерий и 2-часовыми уровнями глюкозы в крови, что отражает способность к регуляции и восстановлению после приема сахара.Кроме того, высокие вагинальные соотношения Prevotella / Aerococcus также коррелировали с высокими значениями глюкозы в крови, в частности, с 1- и 2-часовыми значениями OGTT. Хотя образцы матери, собранные до OGTT, необходимы, это может обеспечить многообещающий подход к разработке биомаркеров GDM, особенно для микробов полости рта, которые очень удобны для отбора образцов и имеют самые большие микробные вариации, связанные с GDM.
Как в материнской, так и в неонатальной микробиоте, микробные вариации имели тенденцию сходиться по участкам тела в GDM +, которые демонстрировали более сходную структуру сообщества, чем в GDM-.Микробы, различающиеся по одной и той же тенденции между материнской и неонатальной микробиотой, также наблюдались в нашем исследовании, что выявило межпоколенческую согласованность микробных вариаций, связанных с GDM. Эти результаты предполагают, что GDM может оказывать одинаковое влияние на микробиоту в разных поколениях и на разных участках тела. Такие микробные изменения, вероятно, увеличивают риск гестационных осложнений или нежелательных исходов. Более низкая равномерность, но большее истощение КО, а также более высокая численность или распространенность некоторых эукариотических вирусов могут привести к снижению метаболических возможностей и большему воздействию вирусов на новорожденных с ГСД, чем без него.Кроме того, считается, что L. iners более способствует возникновению аномальной микробиоты, которая может привести к неблагоприятным последствиям для здоровья.36 37 L. iners имеет наименьший размер генома среди лактобацилл и не имеет генов, необходимых для синтеза аминокислоты de novo ,38 Относительно высокое соотношение этого штамма может снизить эффективность метаболизма микробных аминокислот в пищеварительном тракте новорожденных.
Здесь мы описываем влияние состояния здоровья матери на вертикальную передачу микробов и колонизацию в раннем возрасте.Связь между микробным дисбактериозом в раннем возрасте и большим количеством заболеваний может указывать на долгосрочное влияние исходной микробиоты на здоровье человека39–41. Наше исследование сосредоточено на контакте с микробами и их колонизации в раннем возрасте, а также на форме микробов. неонатальный микробиом. Эти наблюдения будут способствовать лучшему пониманию происхождения микробиоты человека и вертикальной передачи микробов от матери к младенцу. Это исследование проливает свет на другую форму наследования и подчеркивает важность понимания формирования микробиома в раннем возрасте, что предлагает многообещающий подход к модуляции начальной микробной колонизации и взаимодействия посредством вмешательства матери для снижения риска неблагоприятных последствий для здоровья.
Кишечный дисбактериоз и экспрессия калпротектина у недоношенных детей.
AbstractПредпосылки
Недоношенные дети часто развивают кишечный дисбактериоз с преобладанием гаммапротеобактерий, что связано с неблагоприятными клиническими исходами. Мы исследовали взаимосвязь между увеличением фекальных гаммапротеобактерий и воспалением слизистых оболочек, измеренную с помощью фекального кальпротектина (ФК).Методы
Образцы стула были взяты у младенцев с очень низкой массой тела при рождении (ОНМТ) в послеродовом возрасте ≤2, 3 и 4 недели.Микробиом фекалий исследовали с использованием амплификации с помощью полимеразной цепной реакции области V4 рибосомной РНК 16S, а FC измеряли с помощью иммуноферментного анализа.Результаты
Мы включили 45 детей с ОНМТ (срок беременности 27,9 ± 2,2 недели, масса тела при рождении 1126 ± 208 г) и получили образцы стула через 9,9 ± 3, 20,7 ± 4,1 и 29,4 ± 4,9 дней. FC положительно коррелировал с родом Klebsiella (r = 0,207, p = 0,034) и его доминирующим вариантом последовательности ампликона (r = 0,290, p = 0,003), но не с относительной численностью общих Gammaproteobacteria.Клебсиелла колонизировала кишечник по двум разным схемам: некоторые младенцы начали с низкой численностью клебсиелл и со временем приобрели эти бактерии, тогда как другие начали с очень высокой численностью клебсиелл.Заключение
У недоношенных новорожденных FC коррелировал с относительной численностью определенного патобионта, Klebsiella, а не с численностью класса Gammaproteobacteria. Эти результаты указывают на необходимость определения дисбактериоза на родовых или более высоких уровнях разрешения.Многие научные публикации, созданные UC, находятся в свободном доступе на этом сайте из-за политики открытого доступа UC.Сообщите нам, насколько этот доступ важен для вас.
Основное содержаниеЗагрузить PDF для просмотраПросмотреть больше
Больше информации Меньше информации
Закрывать
Введите пароль, чтобы открыть этот PDF-файл:
Отмена Ok
Подготовка документа к печати…
Отмена
Пробиотики значительно улучшают микробиом кишечника у младенцев, находящихся на грудном вскармливании
С Марком Андервудом, MD, и комментариями Кэролайн Аповиан, MD
Младенцы на грудном вскармливании, которые получали 3-недельный курс пробиотиков в течение первого месяца жизни, имели устойчивые улучшения в микробиоме кишечника, 1 , согласно результатам, опубликованным в журнале, mSphere .
«Мы наблюдали за младенцами в северной Калифорнии на протяжении многих лет, и сначала были очень удивлены, увидев большое количество ошибок, таких как E. coli , и небольшое количество ошибок, таких как бифидобактерии , в стуле младенцев, которые были родились вагинально, никогда не получали антибиотиков и находились на грудном вскармливании. Казалось бы, это идеальная популяция с низким уровнем риска, — сказал Марк Андервуд, доктор медицинских наук, заведующий отделением неонатологии и профессор педиатрии Калифорнийского университета в Дэвисе. — Вместо этого в кишечнике этих младенцев преобладали потенциальные патогены, и поэтому мы думаем , подвержены риску заболеваний, связанных с дисбактериозом, по мере взросления.” 2
Более пристальный взгляд на результаты исследования
Чтобы устранить этот долгосрочный риск повышенного риска хронических заболеваний, исследователи изучили, возможно ли коренным образом изменить состав микробиоты у младенцев.
Младенцы в тестовой группе получили Bifidobacterium longum subsp. infantis ( B. infantis ) с 7 по 21 день. По сравнению с контрольной группой, у них было значительно больше популяции Bifidobacteriaceae и в четыре раза более низкие уровни фекального эндотоксина в стуле, при этом положительный эффект сохранялся через 30 дней после лечения. . 1
Грудное молоко было собрано постнатально на 21 день, и образцы кала младенцев были проанализированы на исходном уровне (день 6) и снова после завершения приема добавок на 29 день. Оба образца были проанализированы на наличие основных питательных веществ, которые не усваиваются организмом. младенец. 1 Исследователи считают, что эти важные питательные вещества могут быть полезны в качестве биомаркеров в будущих исследованиях. 1
Опытная группа, получившая пробиотик B.infantis в раннем возрасте, имел более низкий уровень pH в стуле, увеличение количества здоровых бактерий на 80% и снижение количества потенциальных патогенов на 80%. 1
«Мы выбрали этот организм не потому, что он хорошо растет, или потому, что его легко производить, или потому, что вы можете добавить его в пищевой продукт, но из-за его генетической способности расти и доминировать в кишечном тракте, а также из-за животных исследования, которые показывают, что это организм, который уменьшает воспаление кишечника и снижает проницаемость или неплотность кишечника.Так что для нас действительно захватывающе видеть эти убедительные результаты, полученные в результате более чем десятилетних исследований », — сказал д-р Андервуд.
«В предыдущих исследованиях они давали пробиотик, и они обнаружили небольшое количество этого пробиотика в кале», — сказал доктор Андервуд EndocrineWeb . «В этом случае мы стали свидетелями действительно глубокой реструктуризации этого сообщества, где в нем доминировал организм, который мы давали. И что было действительно поразительно, чего мы не видели в других исследованиях раньше, так это то, что это доминирование здорового или комменсального организма сохранялось в течение целого месяца после того, как мы прекратили давать пробиотический организм.”
Преимущества увеличения микрофлоры у детей, находящихся на грудном вскармливании
«Антибиотики, кесарево сечение, кормление смесью, гигиена и другие вещи изменили микробиоту в нашем кишечнике, особенно у детей и младенцев, — сказал д-р Андервуд. — Я думаю, что доказательства того, что существует связь, стали довольно убедительными. между изменениями микробиоты кишечника в самом начале жизни и более поздним риском различных хронических заболеваний ».
Большая часть исследований на сегодняшний день подчеркивает важность микробиома кишечника и его здоровья.Но у тучных и худых взрослых «кажется, есть различия в микробиомах кишечника, которые коррелируют с болезнями и здоровьем», — сказала Кэролайн Аповиан, доктор медицины, FACP, FACN, профессор медицины и педиатрии Медицинской школы Бостонского университета и директор отдела питания и веса. Центр управления в Бостонском медицинском центре в Бостоне, штат Массачусетс.
«Это исследование показывает, что можно изменить микробиом младенца с помощью определенного пробиотика, связанного со здоровьем, и что это изменение сохраняется по крайней мере через месяц после периода кормления», -Аповиан сказал EndocrineWeb : «На данный момент актуальность для детей и взрослых является предварительной, и необходимо провести дополнительные исследования. Однако это шаг в направлении демонстрации того, что кормление грудных детей может иметь значение для здоровья микробиома кишечника в будущем ».
Будущие исследования помогут определить долгосрочное влияние первых пробиотиков на хронические заболевания. Доктор Андервуд отметил, что детские колики — одно из многих состояний, связанных с дисбактериозом. 1
«Мы определенно заинтересованы в изучении детей, находящихся на искусственном вскармливании», — сказал Андервуд, и дальнейшие исследования покажут, приведет ли более здоровый микробиом к снижению риска хронических заболеваний у этих детей с течением времени.Это еще предстоит выяснить, но это, безусловно, захватывающая идея », — сказал он.
Это исследование финансировалось Evolve Biosystems, Inc., Дэвис, Калифорния.
Обновлено: 21.09.21
Микробиом, связанный с гипертиреоидными заболеваниями, раком и др.
Плохой рост у младенцев с МВ, связанный с дисбалансом микробиоты кишечника, в исследовании
Дисбаланс микробов, населяющих кишечник младенцев с муковисцидозом (МВ), влияет на их рост в течение всего периода жизни. первый год жизни.
Это открытие было подробно описано в исследовании «Дисбактериоз кала у младенцев с муковисцидозом связан с ранним нарушением линейного роста», опубликованном в журнале Nature Medicine .
Большинство младенцев с МВ имеют низкий линейный рост (длину тела к возрасту) в течение первых 12 месяцев жизни, что также влияет на развитие их легких. Предыдущие исследования обнаружили связь между более слабым линейным ростом у этих младенцев и ухудшением дыхательной функции и выживаемостью в долгосрочной перспективе.
По оценкам, 85% младенцев с МВ также имеют внешнесекреторную недостаточность поджелудочной железы — дефицит ферментов поджелудочной железы, необходимых для правильного переваривания пищи. Эта недостаточность является причиной воспаления желудочно-кишечного тракта, проблем с пищеварением и плохого усвоения питательных веществ, что может привести к плохому увеличению веса.
Эти желудочно-кишечные симптомы могут также способствовать так называемому дисбактериозу кишечника — дисбалансу популяций микробов, естественным образом присутствующих в кишечнике.Популяции кишечных микробов (также называемые микробиотой) играют ключевую роль в росте тела, собирая питательные вещества в кишечнике, регулируя метаболизм хозяина и производя вещества, которые влияют на уровень гормона роста.
Исследователи из Вашингтонского университета использовали образцы фекалий младенцев с МВ, чтобы исследовать возможную связь между их кишечной микробиотой и линейным ростом в возрасте от 3 до 12 месяцев.
В исследование были включены 207 младенцев с МВ с низкой или нормальной длиной тела и 25 здоровых младенцев соответствующего возраста, служивших в качестве контроля.У всех младенцев, начиная с 3-месячного возраста, были взяты образцы, чтобы определить, «выглядит ли развитие микробиоты схожей по траектории».
Результаты показали, что младенцы с МВ в возрасте 4 месяцев имели меньшее разнообразие видов бактерий в образцах фекалий в целом, чем здоровые младенцы. Это бактериальное разнообразие улучшилось у детей с МВ в течение первого года жизни, но в меньшей степени, чем было очевидно в контрольной группе.
В тот же период было обнаружено, что пропорции между различными группами бактерий у младенцев с МВ были разными по сравнению со здоровыми младенцами.В частности, относительная численность Proteobacteria была выше у младенцев с МВ, а относительная численность Bacteroidetes была ниже. Предыдущие исследования показали, что мальабсорбция жира и воспаление связаны с обогащением фекалий Proteobacteria и истощением Bacteroidetes .
Доля групп бактерий, обнаруженных в образцах, также значительно различалась между младенцами с МВ с низким линейным ростом (более короткая длина) и младенцами с МВ с нормальным линейным ростом в возрасте 12 месяцев.В частности, младенцы с МВ меньшего роста имели более выраженный дисбактериоз (дисбаланс в популяциях кишечных микробов).
Затем исследователи использовали математическую модель, чтобы установить связь между возрастом младенца и его фекальной микробиотой. Используя этот метод, они увидели, что у младенцев с МВ в целом созревание фекальной микробиоты было отложено по сравнению с контрольной группой. Задержки созревания были особенно выражены у младенцев с МВ меньшего роста в возрасте 12 месяцев по сравнению с младенцами с этим заболеванием, но нормальной длины тела для этого возраста.
«Таким образом, низкая длина была связана с задержкой развития фекальной микробиоты у младенцев с МВ», — пишут исследователи.
Команда также обнаружила, что у младенцев с МВ меньше видов бактерий, участвующих в производстве короткоцепочечных жирных кислот (SCFA) — молекул, которые, как известно, модулируют рост костей и тела.
«Эти результаты предполагают, что продукция SCFA кишечной микробиотой младенцев с CF может быть снижена по сравнению с таковой у младенцев без CF», — писали исследователи, предполагая, что «фекальный дисбиоз может способствовать недостаточному достижению длины, изменяя продукцию SCFA.”
Эта работа предполагает, что «терапии, направленные на устранение раннего фекального дисбиоза, демонстрируемого здесь у младенцев с МВ, восполняющие SCFAs или регулирующие их выработку (например, с помощью пребиотиков, как подтверждено недавним исследованием), могут улучшить ранний рост, GI [желудочно-кишечного тракта] функции и долгосрочные исходы МВ », — заключили исследователи.



 До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем. Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.



 А значит, не должен и пытаться это сделать.
А значит, не должен и пытаться это сделать.

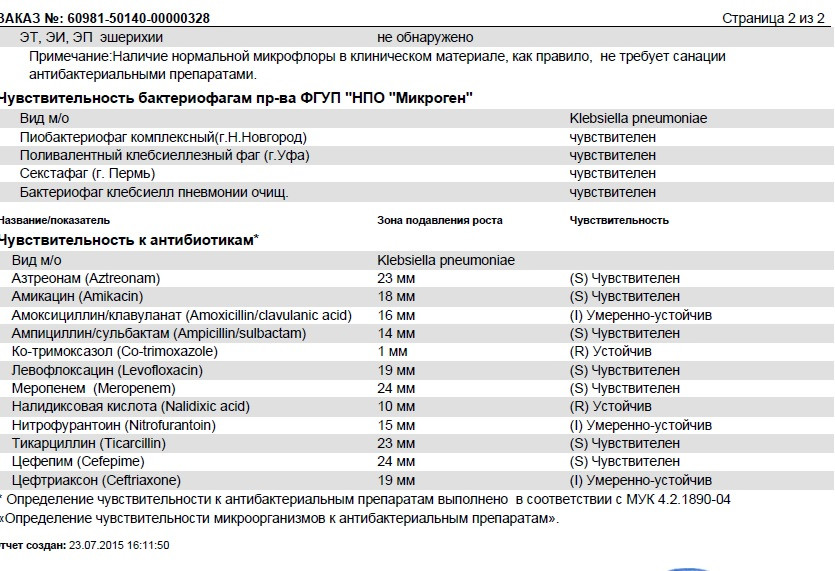

 Характерны слабость, снижение аппетита, повышение температуры тела, головная боль.
Характерны слабость, снижение аппетита, повышение температуры тела, головная боль.

