Как правильно подготовиться к сдаче анализа кала?
07 ноября 2013
СтатьиАнализ кала на дисбактериоз.
Подготовка:
- перед сбором анализа за три дня нельзя принимать активированный уголь, сорбент, антибиотики, антисептики, биопрепараты, молочно-кислые продукты питания типа «Бифидок» и т. д.,
- заранее необходимо подготоаить горшок: тщательно вымыть с мылом, обработать кипятком, остудить. Материал собирают из трех разных мест в стерильную баночку специальной лапаточкой, которую Вам выдадут в медицинском центре «Здоровье семьи»,
- отбор производят (без клизмы) утром в день сдачи анализа, заполняя объем посуды на 2/3. При длительных запорах отбор можно произвести накануне вечером.

Анализ кала на яйца глист.
- собрать кал сразу после испражнения,
- доставить в лабораторию в течение двух часов.
Анализ кала на цисты лямблий.
- собрать кал сразу после испражнения,
- доставить в лабораторию в течение двух часов в теплом виде,
Анализ кала на состав (копрограмма).
- собрать кал сразу после испражнения,
- собирать с наиболее патологически измененных участков кала (слизь, не переваренные частички пищи и т.д.),
- доставить в лабораторию в течение двух часов.
Анализ кала на скрытую кровь.
Подготовка:
- перед сбором анализа за три дня исключить из рациона мясо, рыбу, печень, препараты железа,
- собрать кал сразу после испражнения,
- доставить в лабораторию в течение двух часов.
Поделиться в соц.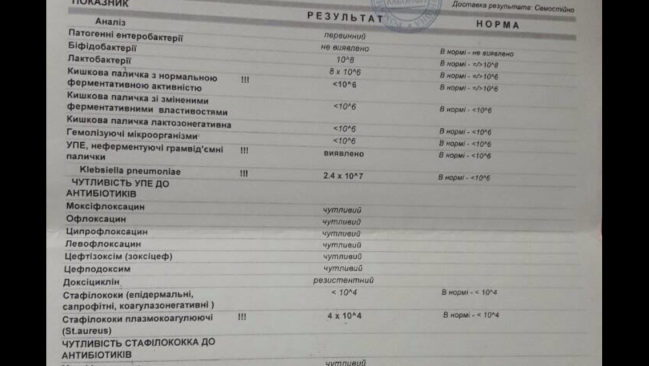 сетях
сетях
Другие статьи по теме
Анализ кала на дисбактериоз | Медицинский центр «Президент-Мед»
В кишечнике любого человека находятся бактерии, они перерабатывают пищу и помогают нашему организму усваивать питательные вещества. Когда таких микроорганизмов мало развиваются нарушения, приводящие к расстройству пищеварения.
Исследовать состав кишечной микрофлоры помогает анализ кала на дисбактериоз, он позволяет определить наличие бифидобактерий, а также лактобактерий (полезные бактерии), выявить энтеробактерии, энтерококки, бактероиды и другие патогенные микроорганизмы.
Анализ кала на дисбактериоз может назначаться пациентам всех возрастов, поскольку этот диагноз бывает даже у самых маленьких пациентов. Показан данный анализ и после применения антибиотиков, так как они пагубно влияют на микрофлору кишечника.
Что такое дисбактериоз, чем он опасен
Дисбактериоз – состояние, при котором в микрофлоре кишечника диагностируется преобладание патогенных и условно-патогенных микроорганизмов над полезными бактериями.
Различают несколько стадий развития дисбактериоза:
1-ая стадия – патогенные бактерии имеются в кишечнике, но плохая микрофлора развивается не стремительно. Неприятные симптомы на этом этапе могут не проявляться.
2-ая стадия – полезных микроорганизмов мало, вредные бактерии активно развиваются. У пациента может быть понос, метеоризм.
3-я стадия – не обнаруживается полезная микрофлора. Развивается воспаление стенок кишечника, появляются хронические запоры или диарея, симптоматика болезненная.
4-ая стадия – патогенные организмы активны, они прогрессируют и истощают организм. Длительное преобладание вредной микрофлоры кишечника приводит к авитаминозу, анемии и другим неприятным состояниям.
Быстрое восстановление работы ЖКТ возможно только на ранних стадиях, запущенные же варианты тяжело лечатся, они могут стать катализатором для развития онкологических и других опасных недугов. Именно поэтому важно своевременно выявить дисбактериоз.
Именно поэтому важно своевременно выявить дисбактериоз.
Признаки дисбактериоза
Особое проявление симптоматики дисбактериоза наблюдается в младенческом и детском возрасте. У взрослых пациентов симптомы также прослеживаются, но из-за постоянной загруженности, как правило, на недомогание вовремя никто внимания не обращает.
Симптомы дисбактериоза:
- Постоянная тошнота.
- Чрезмерное выделение слюны.
- Отсутствие аппетита.
- Неприятный запах изо рта.
- Повышенное газообразование.
- Диарея или запор.
- Во рту привкус металла.
- Боль в животе.
- Аллергическая реакция.
- Ухудшение состояния ногтей, кожи, а также волос.
- Частые простудные заболевания.
У взрослых больных появляются признаки интоксикации организма, могут ощущаться головные боли. При дисбактериозе повышается утомляемость, наблюдается постоянное состояние слабости.
Если человека мучают выше приведенные симптомы, врач в обязательном порядке назначит исследование кала на дисбактериоз.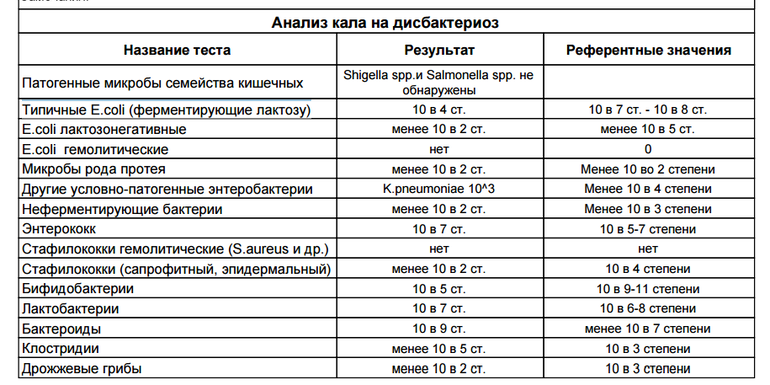 Сдавать анализ можно и в профилактических целях, чтобы предупредить развитие болезней ЖКТ.
Сдавать анализ можно и в профилактических целях, чтобы предупредить развитие болезней ЖКТ.
Правила сбора анализа кала
Чтобы результаты анализа кала на дисбактериоз были достоверными, нужно заранее подготовиться и правильно собрать исследуемый материал. Примерно за четыре дня до сдачи кала перестают принимать медикаментозные средства, которые могут воздействовать на состав микрофлоры. Если необходима терапия антибиотиками, тогда пройти исследование рекомендуют до приема лекарств и после их отмены.
Перед сбором материала для диагностики дисбактериоза нельзя применять клизму, а за три дня до анализа следует перестать использовать свечи. Придется также посидеть несколько дней на диете, из рациона нужно исключить продукты, оказывающие воздействие на микрофлору: острые и кислые блюда, жирное мясо, а также алкогольные напитки.
Собирать анализ необходимо только в стерильную тару, поэтому утку или другую емкость нужно продезинфицировать. Удобнее всего кал транспортировать в специальном калоприемнике (продают в аптеке), он стерильный и не требует обработки.
Чтобы сдать анализ кала на дисбактериоз в Видном и в Москве (метро Коломенская и ВДНХ) обращайтесь в медцентры Президент-Мед
Автор: Лаврова Нина Авенировна
Заместитель генерального директора по медицинской части
Окончила Ярославский государственный медицинский институт по специальности «Лечебное дело»
Медицинский опыт работы — 25 лет
Записаться к врачу
ОТЗЫВЫ КЛИЕНТОВ
Елена
От души и с добрым чувством, выражаю благодарность ЧУДО-ВРАЧУ Семенову Артему Юрьевичу, за неоценимый вклад в возвращении красоты моих ножек! Даже и не думала, что можно буквально стереть с них (ножек) «карту мира», которая злостно ограничивала выбор моего гардероба, не заикаюсь уже об отсутствии эстетики. .. Что и говорить, склеротерапия — великая вещь в волшебных руках…[…]
.. Что и говорить, склеротерапия — великая вещь в волшебных руках…[…]Евгения
Хочу от всего сердца поблагодарить и выразить чувство глубочайшего уважения уникальному доктору Артему Юрьевичу Семенову за выполненную в марте 2014 года лазерную операцию с минифлебэктомией на обеих ножках. Варикозная болезнь у меня проявилась после рождения детей в 30 лет. А в последний год тяжесть и боли в ногах, особенно в жаркое время года, стали просто нестерпимыми….[…]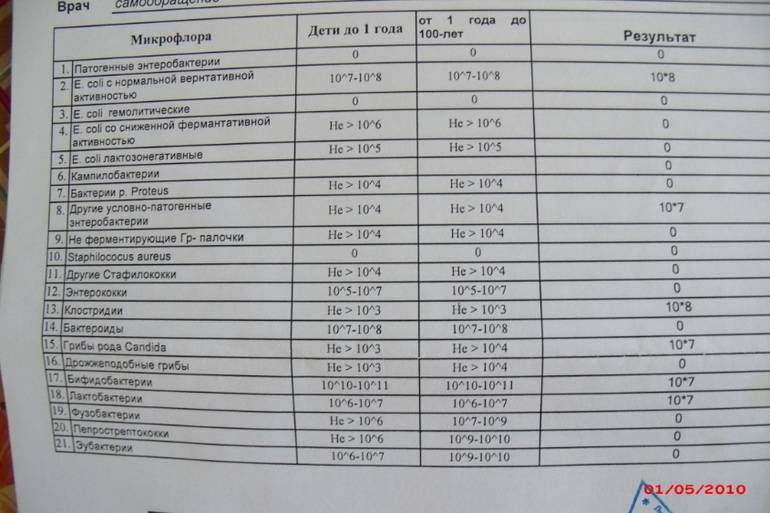 Клиника платная, но деньги не дерут! Профессионализм на высшем уровне, а цены ниже чем во многих псевдоклиниках. Девушка на телефоне очень приятная и уважительно относится к клиентам, старается помочь и выгодно для…[…]
Клиника платная, но деньги не дерут! Профессионализм на высшем уровне, а цены ниже чем во многих псевдоклиниках. Девушка на телефоне очень приятная и уважительно относится к клиентам, старается помочь и выгодно для…[…]Мария
Хочу поблагодарить врача-онколога Яннау Ирину Николаевну. Очень внимательный и душевный доктор, настоящий профессионал, выслушала все жалобы и страхи по поводу обнаруженного уплотнения в молочной железе. Уже после разговора с врачом почувствовала облегчение. При повторном приеме Ирина Николаевна очень подробно объяснила результаты анализов, УЗИ, назначила лечение. Я себя…[…] ..[…]
..[…]Наталья
Прекрасный молодой доктор,внимательный прислушивается к жалобам больных, лечил ногу после неудавшейся операции у флеболога Семенова А. Ю.[…]Матвеева Ольга
Хочу выразить свою благодарность Семенову Артему Юрьевичу за блестяще проведенную лазерную облитерацию большой подкожной вены в октябре 2015 года. Не было никаких сомнений в выборе врача и клиники. До этого, восемь лет назад Артем Юрьевич провел блестящую склеротерапию на вене. Вы -профессионал, знающий свое дело, о таких людях говорят : «на своем месте». Внимательный….[…]Валентина
Хочу выразить свою благодарность Семенов Артему Игоревичу за блестяще проведенную лазерную облитерацию по технологии Biolitec на обеих голенях . Выбирая клинику я сомневалась и очень боялась так как 10 лет назад мне делали операцию и я помнила насколько это было болезненно и как тяжело я проходила реабилитационный период. А здесь все так быстро и совершенно…[…]
А здесь все так быстро и совершенно…[…]Елена
Хочу всем женщинам на свете порекомендовать высококвалифицированного специалиста, мастера своего дела Артема Юрьевича Семенова. У него просто золотые руки! Я делала склеротерапию обеих ног, после двух лечебных процедур ножки мои наконец то стали без сосудистых «звездочек». Очень рада что обратилась именно к этому врачу. Искренне желаю — здоровья, благополучия, успехов во всем…[…]Наталья
Замечательный доктор Семенов А.Ю. помог с проблемой расширенных вен. Делала у него ЭВЛА в мае 2016г. Все прошло очень хорошо. Профессионально, качественно, безболезненно, с добрым веселым общением. Приехала из Воронежа просто по отзывам других людей в инете. Боялась, вдруг отзывы липовые!! Но теперь сама пишу хвалебную оду. Все получилось. Всем страждущим по вопросам…[…]Галина
Артем Юрьевич спасибо Вам большое за Ваши золотые ручки. Артем Юрьевич делал мне склеротерапию обеих конечностей в 2015 году, в этом году была на профилактике. Очень благодарна, ножками можно любоваться. И мои друзья и знакомые лечились у него, очень благодарны. Спасибо Вам. Рекомендую !!!!![…]
Артем Юрьевич делал мне склеротерапию обеих конечностей в 2015 году, в этом году была на профилактике. Очень благодарна, ножками можно любоваться. И мои друзья и знакомые лечились у него, очень благодарны. Спасибо Вам. Рекомендую !!!!![…]Сергей Бусурин
Четыре года страдал варикозном. Были сильные боли. Большое спасибо Алексею Михайловичу, замечательно провел операцию. Доктор от Бога.[…]Наталья
Выражаю большую благодарность Бадмаеве Тамаре Борисовна! Помогла в лечение, отличный врач![…]Валерия
Много лет лечилась, обошла много врачей, но никак не удавалось найти подходящее лечение. Эти бесконечные неудобства в жизни стали ее неотъемлемой частью, я уже свыклась с таким состоянием. Так вышло,что привела сына на консультацию в связи с подростковыми угрями и Тамара Борисовна сразу заметила и мою проблему. Таким образом она помогла и сыну, и нашла источник моей.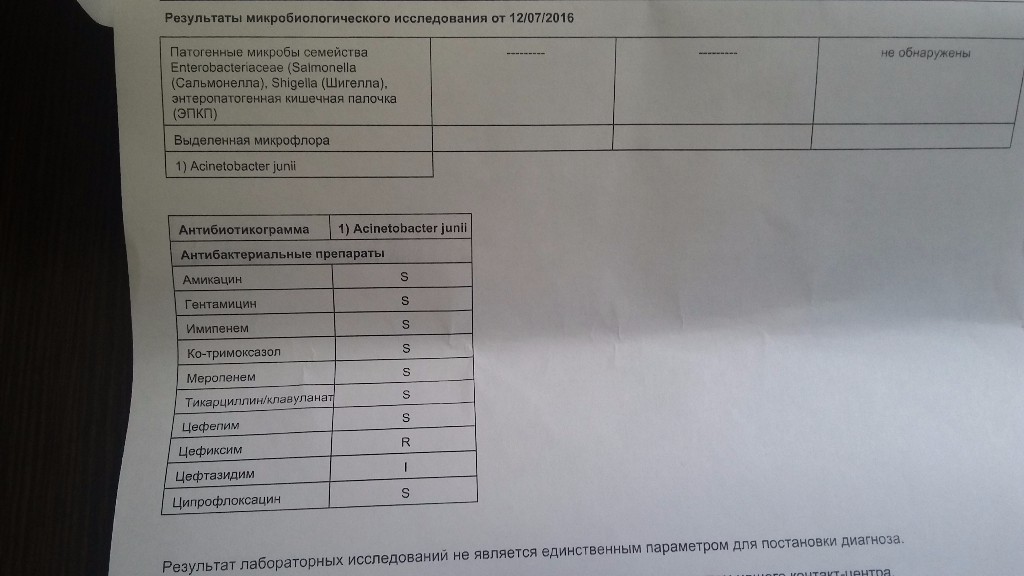 ..[…]
..[…]Наталья
Хочу выразить благодарность врачу Озеровой М.С. В городскую поликлинику к кардиологу не попасть, долго собиралась и пошла в платную клинику. Очень боялась, что сейчас назначат кучу анализов, кучу лекарств выпишут, но была приятно удивлена. Врач провела осмотр, сделала ЭКГ, назначила только необходимые анализы. Очень благодарна Марии Сергеевне за чуткое, внимательное отношение…[…]Анастасия
Спасибо огромнейшее за Вашу работу! Все четко, ясно, понятно и быстро! Без лишних разговоров «о судьбе отечества». Просто невероятно позитивные эмоции после общения![…]Инна
Прекрасный врач, имеет огромный опыт, может правильно поставить диагноз, все объяснить клиенту. К каждому находит свой подход.[…]Анна
Хочется сказать слава благодарности доктору Колонтарову А.Я. Ходила в поликлинику, сдавала несколько раз анализы и особо мне помочь не смогли. Пришла на приём к врачу по рекомендации знакомой, и правда такого врача можно советовать всем! Грамотный, опытный, помог мне. Назначил анализы, выявил причину и лечение подобрал индивидуально, т к не все препараты мне можно пить….[…]
Ходила в поликлинику, сдавала несколько раз анализы и особо мне помочь не смогли. Пришла на приём к врачу по рекомендации знакомой, и правда такого врача можно советовать всем! Грамотный, опытный, помог мне. Назначил анализы, выявил причину и лечение подобрал индивидуально, т к не все препараты мне можно пить….[…]Марина Степановна
Мария Сергеевна, профессионал своего дела. Большое ей спасибо! Пришла с высоким давлением, головной болью, провели полное обследование, назначили лечение. В поликлинике не дождёшься на записи к врачи, а про ЭКГ вообще нечего говорить. А в мед центре сразу сделали ЭКГ, УЗИ сердца, взяли анализы. Я теперь буду наблюдаться только тут. Давно не встречала такого специалиста![…]Ольга
Спасибо Юлие Владимировне! Врач очень опытная, внимательная, а самое главное ее очень любят дети! Приходилось уже несколько раз с ребёнком обращаться и всегда каждый приём на высоте. Как хорошо, когда есть такие хорошие врачи[…]
Как хорошо, когда есть такие хорошие врачи[…]Наталья
Спасибо от меня и всей моей семьи за профессионализм, поддержку, чуткое и внимательное отношение. Это – огромное счастье, что такие компетентные, умелые и талантливые, неравнодушные люди работают именно там, где они больше всего нужны. Ваши терпение, отзывчивость, чуткость, понимание, забота, доброжелательное и внимательное отношение, лечат и успокаивают. Желаю крепкого…[…]Дмитрий
Хочу сказать огромное спасибо доктору Колонтарову Аркадию Яковлевичу за высочайший профессионализм и врачебную проницательность.Только после лечения у Аркадия Яковлевича появились ощутимые улучшения!Очень рекомендую этого доктора.[…]Дмитрий
Низкий поклон, Аркадий Яковлевич! Несколько лет назад Вы диагностировали мне варикоцеле и сделали операцию. Сегодня я отмечаю первый месяц со дня рождения сына.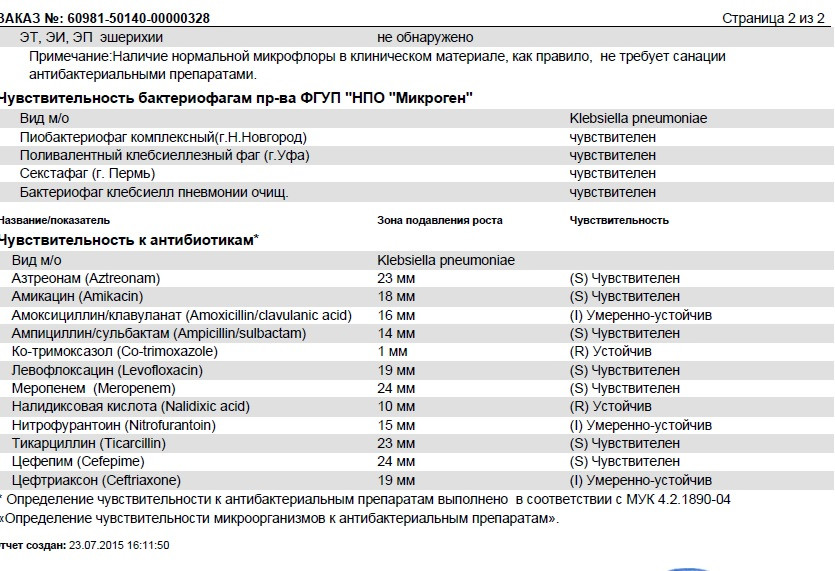 Спасибо за Ваш профессионализм, чуткость и позитив![…]
Спасибо за Ваш профессионализм, чуткость и позитив![…]Дмитрий
Низкий поклон, Аркадий Яковлевич! Несколько лет назад Вы диагностировали мне варикоцеле и сделали операцию. Сегодня я отмечаю первый месяц со дня рождения сына. Спасибо за Ваш профессионализм, чуткость и позитив![…]ТАТЬЯНА
Замчательный доктор! Был варикоз на левой ноге.Убрали все лазером.Сечас ничего не заметно.После операции год наблюдали. Очень благодарна!!![…]Ольга
Была на приёме у маммолога Яннау Ирины Николаевны. В середине приёма врач удалилась на 20 мин. ссылаясь на то, что ей самой нужно посетить врача, у которой заканчивается рабочий день. Врач осмотрела, дала рекомендации. Вопрос почему за первичный приём пришлось платить на 20% больше оплаты оговоренной с администратором, остался загадкой. Задав данный вопрос, обрушился…[…]Щетининой О. Н.
Н.
Ирина
Хочу рассказать свою историю. В 2015 году обращалась к доктору Семенову Артему Юрьевичу по поводу лечения варикозного расширения вен. Доктро провел обследование и предложил операцию по новой методике с использованием лазера. Я пребывала в нерешительности и думах в течение нескольких лет. А зря, болезнь прогрессировала. И вот наконец вчера 10 апреля 2019 года решилась на…[…]Светлана
Хочу выразить огромную благодарность Чулак Ольге Александровне, за внимательность, инд. подход к пациенту, а так же профессионализм, доброжелательность и заботу! А ТАк же клинику Президент-мед и всему персоналу на ресепшн. Ольга Александровна- вы лучшая :)[…]Светлана
Хочу выразить огромную благодарность Чулак Ольге Александровне, за внимательность, инд.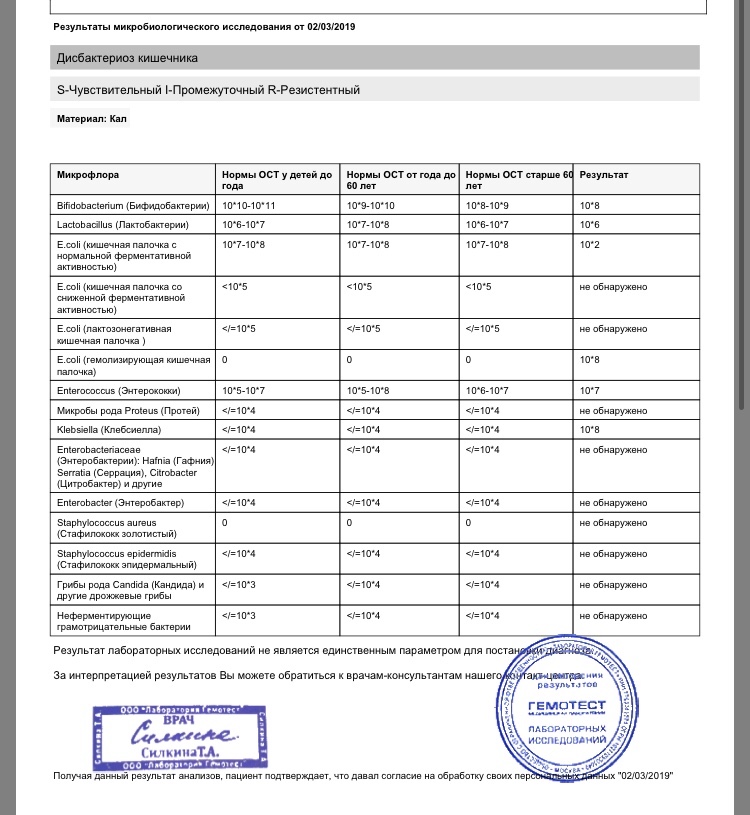 подход к пациенту, а так же профессионализм, доброжелательность и заботу! А ТАк же клинику Президент-мед и всему персоналу на ресепшн. Ольга Александровна- вы лучшая :)[…]
подход к пациенту, а так же профессионализм, доброжелательность и заботу! А ТАк же клинику Президент-мед и всему персоналу на ресепшн. Ольга Александровна- вы лучшая :)[…]Татьяна
Роман Евгеньевич хороший,грамотный специалист.Я разбираюсь в медицине и могу полностью доверять доктору.Спасибо.[…]Наталья Ивановна
Была на приеме у доктора для получения справки на права. Внимательно провел осмотр с использованием всей офтальмологической аппаратуры. Очень серьезный молодой человек. Никаких лишних разговоров. Но работу свою знает на отлично. По сравнению с предыдущими осмотрами окулистов для получения справки, которые были чисто формальным осмотром, здесь я получила полноценный осмотр и…[…]Марат Кудайкулов
Нас несет поток бесконечных событий, заданий, аттестаций… Цейтнот – естественное для нас состояние… И среди этого вечного движения островок простой человеческой доброты – Аркадий Яковлевич Колонтаров! После знакомства с ним автоматически попадаешь в некую систему абсолютной защищенности. Через некоторое время понимаешь – эта защищённость из нашего детства… Это когда медсестра…[…]
Через некоторое время понимаешь – эта защищённость из нашего детства… Это когда медсестра…[…]Татьяна
От души хочу поблагодарить флеболога Семенова А.Ю. На первичном приеме Артем Юрьевич сделал УЗИ, показал и прокомментировал состояние моих вен, затем на схеме нарисовал и объяснил суть операции лазерной коагуляции вен. Доктор очень доброжелательный и внимательный. Операцию я перенесла легко, в тот же день была уже дома. Много лет (больше 10) мучилась с тяжестью и болями в…[…]наталья
Долго собиралась с духом на проведение процедуры гастроскопии и, как оказалось, совершенно зря. При первом общении с доктором сразу попадаешь в атмосферу спокойствия и доброжелательности. это достаточно неприятное исследование Владимир Израилевич сделал очень нежно и безболезненно. Огромное ему спасибо. Руки у него просто золотые. Теперь на контрольную гастроскопию через 6…[…]Киселева Елена
Хочу выразить свою благодарность Медицинскому Инновационному Флебологическому Центру, в лице Семенова Артема Юрьевича и его команды профессионалов! Мой путь в вашу клинику и профессиональные руки был целых 5 лет, за это время я перенесла 3 тромбоза на одной ноге, имея при этом сопутствующую болезнь, т. к. Бронхиальная астма, с аллергическим компонентом, непереносимость всех…[…]
к. Бронхиальная астма, с аллергическим компонентом, непереносимость всех…[…]Светлана
Выражаю благодарность Роману Евгеньевичу Бачурину. Доктор провел УЗИ брюшной полости на высшем уровне, проконсультировал по всем беспокоившим меня вопросам, показал на мониторе проблемные области и порекомендовал дальнейшие действия. Осталась очень довольна и отношением врача, и его работой. При необходимости буду вновь к нему обращаться.[…]Екатерина
Добрый день, хочу выразить свое восхищение Екатериной Викторовной, врач высшей категории, с первой секунды располагает пациента, чувствуется высокий профессионализм, очень доброжелательная, внимательная, реально всегда на связи со своими пациентами, что очень важно, так как в наше время мало кто может брать на себя ответственность. Всем советую![…]Максим Ерохин
Выражаю огромную признательность коллективу клиники «Президент-Мед».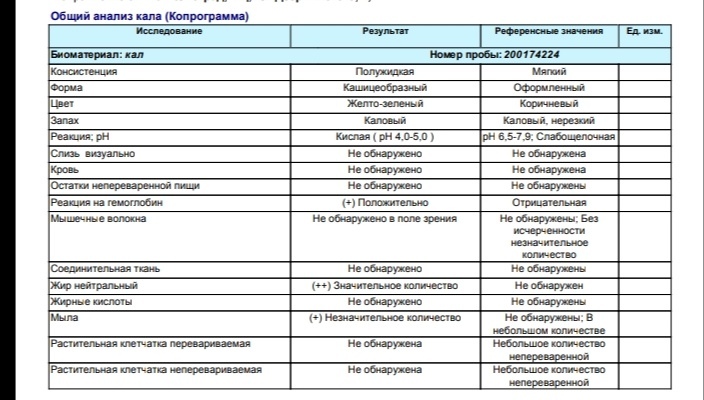 В особенности хирургу-флебологу Семенову Артёму Юрьевичу за высокий профессионализм, преданность своему делу, чуткое и внимательное отношение к пациентам. Буду рекомендовать Вашу клинику своим знакомым. Спасибо![…]
В особенности хирургу-флебологу Семенову Артёму Юрьевичу за высокий профессионализм, преданность своему делу, чуткое и внимательное отношение к пациентам. Буду рекомендовать Вашу клинику своим знакомым. Спасибо![…]Алла
Вырожаю сердечную ость Артему[…]Алла Саблина
Вырожаю сердечную благодарность Артему Семеновичу за его золотые руки! У меня был не легкий случай. Никто не брался,чтобЫ гарантировать хороший исход. Артем Семенрвич не только взялся,но и результат просто превосходный. Реабилитация прошла успешно. Доктор с большой буквы,по другому не скажешь!!!![…]Наталья
Добрый день! Обычно ходила к врачам по рекомендациям моих друзей -врачей , моего папы-хирурга.. В этот раз решила помониторить сама и положиться на интуицию.. И она меня не подвела. Благодарю от чистого сердца Семенова Артема Юрьевича и моего оперирующего доктора Федорова Дмитрия Анатольевича за высокий профессионализм, чуткое отношение к пациенту и тонкое чувство юмора! И.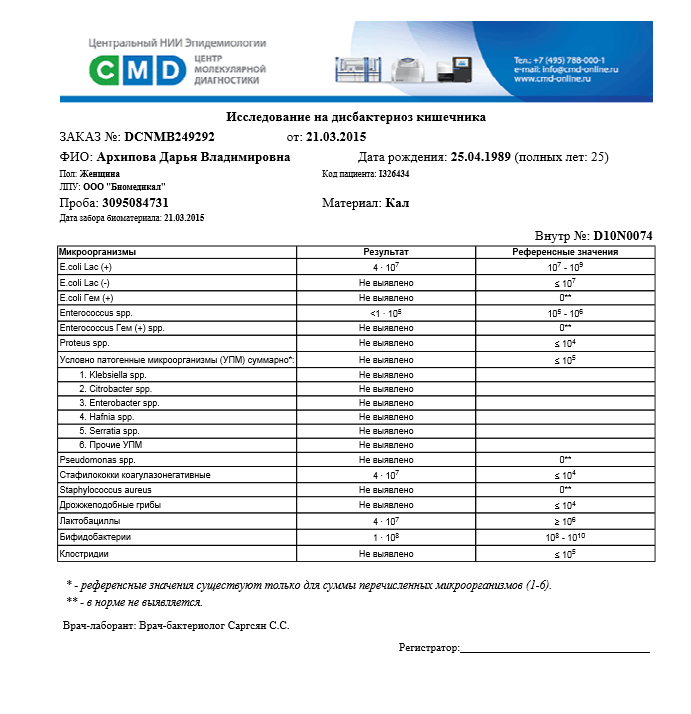 ..[…]
..[…]Дисбактериоз с определением чувствительности к антибиотикам и бактериофагам
Количественный метод бактериологического исследования микрофлоры кишечника на специальных обогащенных питательных средах с целью выявления дисбиотических состояний у взрослых. Исследование на определение чувствительности к антибиотикам ставится диско-диффузионным методом с учетом рекомендаций по антибиотикорезистентности. Исследование на определение чувствительности к бактериофагам может быть выполнено в случае, если к обнаруженному возбудителю существует бактериофаг.
В каких случаях обычно назначают посев на дисбактериоз?
Посев на дисбактериоз проводится с целью выявления нарушений баланса микрофлоры кишечника, основывается на определении количественного состава основных бактерий, населяющих кишечник. Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Дисбактериоз (нарушение баланса нормальной флоры кишечника) у взрослых и у детей может быть связано с нарушением работы печени, желчевыводящих путей, желудка, поджелудочной железы.
Признаки дисбактериоза могут сопровождать следующие состояния:
- паразитарные инвазии, в том числе лямблиоз;
- хронические инфекции, например, носительство стафилококка;
- аллергии;
- гиповитаминоз;
- сахарный диабет;
- после приема антибиотиков.
Дисбактериоз кишечника может проявляться запором, диареей, метеоризмом, болями и другими расстройствами.
Что именно определяется в процессе анализа?
Исследование позволят выявить и определить количество как нормальной микрофлоры, так и условно- патогенных микроорганизмов.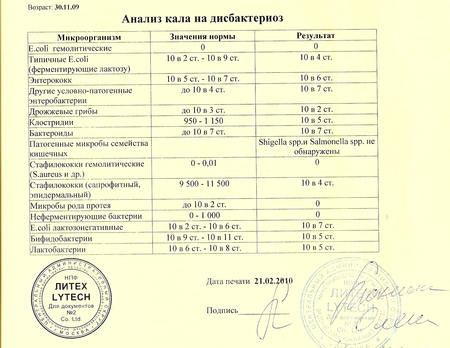 Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Что означают результаты теста?
Анализ позволит выявить изменения биоценоза кишечника и определить степень их выраженности. При выявлении патогенных бактерий или условно-патогенных микроорганизмов в значимом количестве проводится тестирование их на чувствительность к действию антибиотиков и бактериофагов.
Обычный срок выполнения теста:
до 7-8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Исследование нельзя проводить на фоне приема антибактериальных препаратов. После окончания лечения должно пройти не менее 2-ух недель.
Подготовка к исследованию кала | Лорак
Правила сбора кала для исследования микрофлоры кишечника (дисбактериоз)
Общие требования:
Использование только одноразовых контейнеров, выдаваемых в лаборатории. Контейнер стерилен, не требует предварительной обработки и полностью готов к использованию.
Собирать кал следует утром – после естественной дефекации. Подготовка пробы заранее не допускается. Замораживание или хранение пробы в холодильнике не допускается.
Все обследуемые пациенты за 1-3 дня до взятия пробы должны находиться на диете, исключающей прием продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, а так же алкоголь и бактерийные препараты (содержащие бифидобактерии, лактобактерии, кишечные палочки).
Проведение исследования и сбора материала до начала лечения антибиотиками, антисептиками, противогрибковыми препаратами или не ранее, чем через 2-3 недели после окончания курса лечения.
Что обязательно следует сделать:
Тщательный туалет наружных половых органов и области заднего прохода.
Предварительно помочиться.
Не рекомендуется собирать кал из унитаза.
Дефекацию производить в сухую, чистую емкость – судно или «ночную вазу». Предварительно необходимо хорошо промыть с мылом и губкой, многократно ополаскивать водопроводной водой, а потом обдать кипятком и остудить. Обработка судна синтетическими моющими средствами не допустима.
Перенести пробу кала специальной ложечкой, вмонтированной в крышку стерильного контейнера, в количестве не более 1/3 от объема контейнера. Тщательно закрыть крышку.
Нельзя допускать:
Нельзя проводить исследование кала раньше, чем через 2 дня после клизмы, рентгенологического исследования желудка и кишечника, колоноскопии.
Все обследуемые пациенты за 1-3 дня до взятия пробы должны находиться на диете, исключающей прием продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, а так же алкоголь и бактерийные препараты (содержащие бифидобактерии, лактобактерии, кишечные палочки).
Накануне исследования нельзя принимать лекарственные препараты, в том числе: слабительные; активированный уголь; препараты железа, меди, висмута; использовать ректальные свечи на жировой основе.
Не допускать попадания в образец мочи или воды.
Проводить исследование кала у женщин во время менструации.
Несоблюдение правил сбора, сроков и режима хранения проб, полученных для исследований, приводит к отрицательному результату.
Исследование на энтеробиоз
При самостоятельном заборе процедура проводится утром сразу после подъема с постели до проведения гигиенических процедур, мочеиспускания и дефекации. Ватной палочкой круговыми движениями забирается материал с перианальных складок, после чего палочку помещают в специальную пробирку. Материал доставляется в лабораторию в день сбора материала.
Анализкала на копрограмму
Специальной подготовки не требуется.
При диагностике некоторых заболеваний врачом может назначаться специальная диета на несколько дней.
За 3-4 дня до исследования отменить прием слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей. Также за несколько дней до обследования необходимо исключить прием препаратов железа, висмута.
Недопустимо направлять кал на исследование в спичечных или картонных коробках, так как при этом меняются форма и консистенция кала и искажаются результаты анализа.
Необходимо использовать одноразовые пластиковые контейнеры.
Анализ кала на скрытую кровь
В течение 3-4 суток до сбора анализа необходимо исключить из питания мясо (печень, говядину, баранину), некоторые овощи (огурцы, дыню, цветную капусту, редис, хрен, турнепс, капусту брокколи, болгарский перец, шпинат, яблоки, фасоль).
Также в этот срок исключить избыточные количества витамина С (не более 250 мг в день), как в виде препаратов, так и в составе пищевых продуктов (цитрусовые фрукты и соки), и препараты железа.
В течение 7 дней перед анализом необходимо прекратить прием аспирина и нестероидных противовоспалительных препаратов (диклофенак, вольтарен, мовалис и др.), а также исключаются алкогольные напитки.
Анализ не сдается во время менструаций.
Стул должен быть получен без применения клизм и слабительных.
ПРАВИЛА СБОРА КАЛА ПРИ ИССЛЕДОВАНИИ МИКРОФЛОРЫ КИШЕЧНИКА (ДИСБАКТЕРИОЗ)
ПРАВИЛА СБОРА КАЛА ПРИ ИССЛЕДОВАНИИ
МИКРОФЛОРЫ КИШЕЧНИКА (ДИСБАКТЕРИОЗ)
Все обследуемые пациенты за 1-3 дня до взятия пробы должны находиться на диете, исключающей прием продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, а так же алкоголь, антибиотики и бактерийные препараты (содержащие бифидобактерии, лактобактерии, кишечные палочки и т.д.).
Материалом служит кал после естественной дефекации, который собирают в чистый одноразовый контейнер с завинчивающейся крышкой и ложечкой.
Все обследуемые пациенты за 1-3 дня до взятия пробы должны находиться на диете, исключающей прием продуктов, усиливающих процессы брожения в кишечнике и молочно-кислые продукты, а так же алкоголь, антибиотики и бактерийные препараты (содержащие бифидобактерии, лактобактерии, кишечные палочки и т.д.).
Материалом служит кал после естественной дефекации, который собирают в чистый одноразовый контейнер с завинчивающейся крышкой и ложечкой.
Не рекомендуется собирать кал из унитаза.
Собирают кал на чистую поверхность, в качестве которой может быть использован чистый новый лист (пакет) из полиэтилена или бумаги (этот способ является предпочтительным).
При использовании судна, его предварительно хорошо промывают с мылом и губкой, ополаскивают многократно водопроводной водой, а потом обдают кипятком и остужают.
Кал берут преимущественно из средней порции специальной ложечкой, вмонтированной в крышку стерильного контейнера, в количестве не более 1/3 от объема контейнера. Не наполняйте контейнер доверху. Тщательно закройте крышку.
Материал необходимо доставить в лабораторию не позднее, чем через 2 часа с момента забора. При необходимости время доставки может быть увеличено до 3 часов, условия хранения материала — 4 градуса С.
Для правильной оценки результатов рекомендуется проведение 2-3-кратных исследований с интервалом 1-2 дня.
ПРАВИЛА СБОРА МОЧИ ДЛЯ ЖЕНЩИН
Перед сбором мочи подготовьте 6-10 чистых ватных шариков, сосуд с теплым мыльным раствором (пользуйтесь обычным туалетным мылом), сосуд с теплой кипяченой водой и контейнер для сбора мочи (крышку контейнера приоткройте так, чтобы ее можно было снять одной рукой).
Вымойте руки с мылом.
Удобно расположитесь на унитазе и разведите колени как можно шире.
Вымойте область наружных половых органов, последовательно меняя 4 ватных шарика, смоченных в мыльном растворе. Каждым шариком необходимо провести по направлению от лобка к заднему проходу только один раз, стараясь проникать во все складки.
Промойте намыленный участок с помощью двух и более ватных шариков, смоченных в теплой кипяченой воде. Каждым шариком необходимо провести по направлению от лобка к заднему проходу только один раз, стараясь проникать во все складки.
Во избежание попадания в мочу выделений из влагалища, во время сбора мочи женщинам, живущим половой жизнью, рекомендуется ввести во влагалище тампон.
Снимите крышку с контейнера и возьмите его в руку, стараясь не касаться краев. Приготовьтесь собрать мочу.
Удерживая половые губы разведенными, выпустите немного мочи в унитаз, приостановите мочеиспускание, а затем, подставив контейнер под струю мочи, наполните его до половины объема. Постарайтесь не прикасаться контейнером к телу.
Тщательно закройте контейнер крышкой.
Мочу доставить в лабораторию в течение 2 часов. Если немедленный посев невозможен, то ее следует хранить в холодильнике до 18 часов.
ПРАВИЛА СБОРА МОЧИ ДЛЯ МУЖЧИН
1. Вымойте руки с мылом.
2. Отведите назад крайнюю плоть (если она не обрезана), головку полового члена вымойте с мылом теплой кипяченой водой, просушите с помощью чистой салфетки.
3. Подготовьте контейнер, приоткрыв крышку контейнера так, чтобы ее можно было снять одной рукой. Не дотрагивайтесь руками до внутренних стенок контейнера и крышки.
Выпустите небольшое количество мочи в унитаз. Приостановите мочеиспускание.
4. Удерживая крайнюю плоть в отведенном положении, направьте струю мочи в контейнер и наполните его до половины объема, при этом старайтесь не касаться краев контейнера.
5. Тщательно закройте контейнер крышкой.
6. Мочу доставить в лабораторию в течение 2 часов. Если немедленный посев невозможен, то ее следует хранить в холодильнике до 18 часов.
РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ К УЗИ
ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
1. Исследование проводится натощак (отказ от приема пищи за 6-8 часов до исследования). Перед исследованием не рекомендуется пить и курить.
2. За 2-3 дня до исследования желательно ограничить прием продуктов, вызывающих метеоризм (цельное молоко, черный хлеб, капусту, другие свежие овощи и фрукты, соки, сладкое).
3. Для уменьшения метеоризма рекомендуется принимать эспумизан в день перед исследованием по 2 капс.3 раза в день и 2 капс утром в день исследования или активированный уголь по 2 таб.3 раза в день.
РЕКОМЕНДАЦИИ ПО ПОДГОТОВКЕ К УЗИ
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ ТРАНСАБДОМИНАЛЬНЫМ ДАТЧИКОМ
1. Исследование проводится с наполенным мочевым пузырем.
2. Для наполнения мочевого пузыря за час до исследования необходимо выпить 1,5 л. жидкости (минеральная или питьевая вода без газа).
Сдать анализ на дисбактериоз у грудничка в СПб
Родители грудных детей часто встречаются с диагнозом «дисбактериоз кишечника». Что же означает диагноз «дисбактериоз», и какие анализы могут его выявить?
Дисбактериоз кишечника – это нарушение равновесного состояния кишечной микрофлоры. Считается, что при этом полезные бактерии, способствующие пищеварению, погибают, а патогенные (болезнетворные) размножаются. При этом дисбактериоз не является болезнью (этот диагноз отсутствует и в международных, и в отечественных классификациях болезней). Скорее, это состояние, которое может являться следствием некоторых заболеваний (энтериты, колиты), приема антибиотиков. У грудных детей с неустоявшейся кишечной микрофлорой симптомы дисбактериоза могут также возникать при смене питания, введения новых продуктов в рацион малыша или матери (при грудном вскармливании).
Как выявить дисбактериоз
Обычно для того, чтобы определить состояние кишечной микрофлоры, берут анализ на дисбактериоз у грудничка. Он делается не меньше недели и включает в себя копрограмму (анализ непереваренных остатков) и бактериальный посев, выявляющий патогенную и нормальную микрофлору. Также применяется ПЦР-диагностика, исследование продуктов обмена веществ бактерий и метод хромато-масс-спектрометрии. При этом все эти методы обладают погрешностью, ведь точно определить состав кишечной микрофлоры можно, только взяв пробу непосредственно из тонкого кишечника.
Как правильно собрать биоматериал для анализа на дисбактериоз у детей
Для этого анализа необходимо собрать кал ребенка. Объем пробы не менее 10-15 мл, моча в кал попасть не должна. Кал должен быть свежим: его необходимо сдать в лабораторию в течение 2-3 часов после дефекации. При этом опорожнение кишечника должно быть естественным, его нельзя стимулировать специальными средствами.
Чтобы результаты анализа на дисбактериоз у грудничка не исказились, необходимо соблюдать следующие требования:
- сдавать анализ на дисбактериоз у детей через 2-3 недели после отмены антибиотиков, а также пробиотиков и пребиотиков;
- после отмены других лекарственных препаратов должна пройти 1 неделя;
- несколько дней перед сбором кала не вводить в рацион ребенка новых продуктов, если ребенок на искусственном вскармливании – не менять смесь.
- не применять ректальные препараты.
При соблюдении этих правил анализ на дисбактериоз у грудничка будет наиболее информативным.
Что покажет анализ на дисбактериоз у детей
Исследование кала покажет соотношение разных штаммов бактерий нормальной микрофлоры кишечника, а также наличие патогенных бактерий (сальмонеллы, грибы рода Кандида, клостридии и др.). При выявлении этих микроорганизмов нужно будет начать лечение.
Если в результате анализа кала на дисбактериоз у детей будет выявлено нарушение баланса кишечной микрофлоры, задача врача – избрать правильную тактику для устранения симптомов этого состояния. Обычно лечение начинается с устранения причины дисбактериоза, далее назначается симптоматическая терапия.
В сети клиник «Медицентр» Вы можете сдать анализ на дисбактериоз у своего ребенка, результат вы получите в течение нескольких дней.
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Как собрать анализы — Вирилис
Во избежание получения некорректных результатов настоятельно рекомендуется сдавать общий анализ мочи и пробу мочи по Ничипорснко в разные дни!
Инструкции по сбору мочи:
Сбор мочи для общего анализа
Сбор суточной мочи
Сбор суточной мочи для биохимических анализов
Сбор разовой порции мочи с консервантом
Сбор материала для выполнения посева мочи
Сбор материала для выполнения посева мочи (контейнер СКК) для женщин
Сбор материала для выполнения посева мочи (контейнер СКК) для мужчин
Сбор мочи на амилазу
Сбор мочи на исследование «Катехоламины в моче»
Сбор мочи на исследование «Метаболиты катехоламинов и серотонина, метанефрин и нормстанефрин»
Сбор мочи на исследование «Антиген рака мочевого пузыря в моче»
Сбор мочи на исследование по определению В2 микроглобулина
Сбор мочи на исследование по определению психоактивных и наркотических веществ
Инструкции по сбору кала:
Сбор кала
Сбор кала на дисбактериоз
Сбор кала на посев
Сбор кала для исследования на содержание углеводов
Сбор кала на антигенные тесты
Сбор кала при исследовании на скрытую кровь
Сбор кала для исследования кальпротектина
Инструкции по сбору других биоматериалов:
Сбор материала на энтеробиоз
Сбор грудного молока на посев
Сбор мокроты
Сбор волос и ногтей
Сбор материала на исследование эякулята
Сбор материала (Гастропанель)
Инструкция по подготовке к глюкозотолерантному тесту
Памятка по подготовке к взятию мазков
Инструкция по сбору мочи для общего анализа в контейнер с консервантом
Подготовка к исследованию
- В медицинском центре получите контейнер с крышкой и встроенным переходником, а также пробирку с консервантом
- Накануне сдачи анализа рекомендуется не употреблять овощи и фрукты, которые могут изменить цвет мочи (свекла, морковь и пр.), не принимать диуретики
- Перед сбором мочи необходимо произвести тщательный гигиенический туалет половых органов. Женщинам не рекомендуется сдавать анализ мочи во время менструации
Важно!!! Во избежание получения некорректных результатов настоятельно рекомендуется сдавать общий анализ мочи и пробу мочи по Ничипорснко в разные дни! При использовании для данных исследований одной и той же порции мочи в результате неравномерного перемешивания, а также влияния внешних факторов результаты анализов могут быть противоречивыми, что ведёт к затруднению их интерпретации лечащим врачом. Не сдается в один день с биохимией мочи (суточная моча).
Порядок сбора материала
- Для правильного проведения исследования при первом утреннем мочеиспускании небольшое количество мочи (первые 1-2 сек.) выпустить в унитаз, а затем, не прерывая мочеиспускания, подставить контейнер для сбора мочи и собрать в него мочу, приблизительно 2/3 объема контейнера
- Сразу после сбора мочи плотно закройте контейнер завинчивающейся крышкой. Насадите пробирку вниз резиновой пробкой в углубление на крышке контейнера, при этом пробирка начнёт наполняться мочой
- После того как моча прекратит поступать в пробирку, снимите пробирку с пробойника (рис. 1 и 2)
- Несколько раз переверните пробирку для лучшего смешивания мочи с консервантом (рис. 3)
- Доставить пробирку с мочой в течение 24 часов в медицинский центр (по графику приёма биоматериала)
- До доставки в медицинский офис мочу следует сохранять в прохладном, защищённом от света месте, но не в холодильнике
Инструкция по сбору суточной мочи
ВАЖНО!!! Для корректного сбора суточной мочи необходимо зафиксировать время начала и время окончания сбора, а также итоговый объем собранного биоматериала.
Сбор мочи должен окончиться в то же самое время следующего дня. Например, если вы начали собирать мочу в 8 утра, то также в 8 утра следующего дня вы должны опорожнить мочевой пузырь в промежуточный контейнер и добавить последнюю порцию к общему объему.
Данные по времени сбора и объему мочи необходимо перенести на транспортный контейнер (СКК) перед отправкой в лабораторию:
Дата: «___» ________ 20___г. Время: ____:____ начала сбора мочи
Дата: «___» ________ 20___г. Время: ____:____ окончания сбора мочи
Диурез (объем собранной мочи) __________ мл
Для сбора суточной мочи вам понадобятся:
- Емкость для хранения — чистая сухая емкость объемом 3-5 литров. Используется как емкость для хранения мочи в течение всего периода сбора
- Емкость промежуточного сбора мочи — чистый сухой контейнер объемом не менее 0,5 литра. Необходима для сбора мочи и переливания в основную емкость для хранения. Также используется для переливания из большой емкости в транспортный контейнер при окончании сбора
- Транспортный контейнер — стерильный контейнер с крышкой (СКК). Предназначен для транспортировки мочи в лабораторию (необходим только на последнем этапе сбора)
- Флакон с консервантом — концентрированная соляная кислота. Для обеспечения сохранности биоматериала (добавляется сразу в первую порцию мочи, перелитой в большую емкость)
Инструкция по сбору суточной мочи
- Утром после пробуждения опорожните мочевой пузырь (эта порция мочи выливается в унитаз). Вся последующая моча собирается для исследования по схеме, описанной ниже
- Перелейте первую порцию мочи в емкость для сбора. Отметьте дату и время начала сбора мочи. Сбор мочи должен окончиться в то же время следующего дня. Следующие мочеиспускания производите в контейнер для промежуточного сбора
- Аккуратно, соблюдая меры предосторожности, добавьте консервант к первой порции мочи, влитой в емкость для сбора. Внимание! Флакон содержит соляную кислоту (HCl) 25%. Открывать с осторожностью. Избегать разбрызгивания! Беречь от детей! Не допускать нагревания флакона! При попадании на кожу или слизистые смыть большим количеством воды или слабым раствором пищевой соды. При необходимости обратиться к врачу
- Закройте емкость для сбора мочи плотно крышкой, перемешайте содержимое, покачивая ёмкость, и поставьте её в холодное тёмное место. Не замораживать! Используя промежуточный контейнер, собирайте в течение суток всю мочу (также и во время дефекации) в большую ёмкость, хранящуюся в период сбора в холодильнике.
Плотно закрывайте ёмкость для сбора и перемешивайте содержимое каждый раз. Последнее мочеиспускание в промежуточный контейнер должно быть через 24 часа от отмеченного накануне времени. Например, если вы начали собирать мочу в 8 утра, то также в 8 утра следующего дня вы должны опорожнить мочевой пузырь в промежуточный контейнер и добавить последнюю порцию к общему объёму - После завершения сбора измерьте точно объём собранной мочи. Запишите измеренный объём в бланк для сбора в графу «Диурез»
- Тщательно перемешайте всю собранную мочу. Для этого плотно закрыв ёмкость, переверните её 2-3 раза «на крышку». Отлейте часть содержимого в промежуточный контейнер
- Наполните транспортный контейнер СКК порцией собранной мочи не менее, чем на две трети
- На этикетке транспортного контейнера СКК укажите ФИО пациента, время сбора и общий объём выделенной за период сбора мочи в миллилитрах. Транспортный контейнер с порцией собранной мочи сразу доставьте в медицинский центр. Все используемые в процессе сбора предметы можно утилизировать в бытовом мусоре
Инструкция по сбору суточной мочи для биохимических анализов
Важно!!! Не сдается в один день с ОАМ, анализом мочи на Нечипоренко
Подготовка к исследованию:
- Необходимо исключить диуретики, предварительно проконсультировавшись с лечащим врачом
- Накануне исследования и при его проведении необходимо исключить эмоциональные стрессы и физические нагрузки (спортивные тренировки), приём алкоголя
- За 3 дня, по возможности, следует отменить прием лекарственных препаратов. За сутки до сбора мочи нельзя употреблять в пищу продукты, способные ее окрасить (например, свеклу, морковь и т.п.). Также не следует есть острую пищу
Подготовка к исследованию:
- Необходимо заранее приобрести стерильный контейнер (СКК)
- Утром после пробуждения опорожните мочевой пузырь (эта порция мочи выливается в унитаз)
- Все последующие порции мочи, выделенные в течение последующих 24 часов собираются в одну емкость, которая хранится в холодильнике (+2 — +8°С) в течение всего времени сбора (это необходимое условие, так как при комнатной температуре существенно снижается содержание глюкозы)
- После завершения сбора мочи содержимое емкости нужно точно измерить, обязательно перемешать и сразу же отлить в стерильный контейнер (100-200 мл)
- На контейнере нужно указать суточный объем мочи (диурез) в миллилитрах, например: «Диурез 1250 мл», также написать рост и вес пациента
Инструкция по сбору разовой порции мочи с консервантом
Для исследований: катехоламины (адреналин, норадреналин, дофамин) в моче (разовая порция).
Для сбора мочи вам понадобится
- Емкость для сбора мочи — чистый сухой контейнер объемом не менее 0,5л. Необходима для сбора разовой порции мочи и переливания в емкость для транспортировки
- Транспортный контейнер — стерильный контейнер с крышкой (СКК). Предназначен для транспортировки мочи в лабораторию
- Флакон с консервантом — концентрированная соляная кислота HCl. Для обеспечения сохранности биоматериала (добавляется сразу в собранную порцию мочи)
Порядок сбора материала
- Соберите всю мочу в процессе разового мочеиспускания в емкость для сбора мочи
- Соблюдая меры предосторожности, добавьте консервант к собранной моче, перемешайте содержимое, аккуратно покачивая контейнер. Внимание! Флакон содержит соляную кислоту HCl 25%. Открывать с осторожностью. Беречь от разбрызгивания! Беречь от детей! Не допускать нагревания флакона! При попадании на кожу и слизистые смыть большим количеством воды или слабым раствором пищевой соды. При необходимости обратиться к врачу
- Наполните транспортный контейнер СКК порцией собранной мочи с консервантом
- На этикетке транспортного контейнера СКК укажите ФИО пациента, время сбора и объем разовой порции мочи. Транспортный контейнер с порцией собранной мочи с консервантом сразу доставьте в медицинский центр. Все используемые в процессе сбора предметы можно утилизировать в бытовом мусоре
Инструкция по сбору материала для выполнения посева мочи (с определением чувствительности к антибиотикам). Контейнер СКУТ
Подготовка к исследованию
Важно!!! Мочу для исследования следует собирать до начала антибактериальной терапии или спустя 12-14 дней после её окончания
До сбора мочи обязательно проводится гигиеническая процедура
Порядок сбора материала
- Открутить крышку и извлечь аппликатор с тампоном
- Опустить губчатый тампон в образец мочи на 5 секунд, пока губка полностью не пропитается мочой (вар.1) или непосредственно помочиться на тампон (вар.2)
- Вернуть аппликатор с тампоном в пробирку и плотно ее закрыть
- Произвести маркировку пробы на этикетке, находящейся на пробирке
- Материал хранить при комнатной температуре
Важно!!! Непосредственно в пробирку не мочиться! Губку, находящуюся в пробирке, не отжимать!
Инструкция по сбору материала для выполнения посева мочи (для женщин). Контейнер СКК
Подготовка к исследованию
Важно!!! Мочу для исследования следует собирать до начала антибактериальной терапии или спустя 10-14 дней после её окончания.
- Необходимо приобрести стерильный контейнер с крышкой
- Перед сбором мочи подготовьте 8-10 чистых ватных шариков, сосуд с теплым мыльным раствором (пользуйтесь обычным туалетным мылом), сосуд с теплой кипяченой водой и контейнер для сбора мочи (крышку контейнера приоткройте так, чтобы её можно было снять одной рукой)
- Вымойте руки с мылом
- Удобно расположитесь на унитазе и разведите колени как можно шире
- Пальцами одной руки разведите половые губы и удерживайте их в этом положении во время всего подмывания
- Вымойте область наружных половых органов, последовательно меняя 4-6 ватных шарика, смоченных в мыльном растворе. Каждым шариком необходимо проводить по направлению от лобка к заднему проходу только один раз, стараясь проникать во все складки
- Промойте намыленный участок с помощью двух и более ватных шариков, смоченных в теплой кипяченой воде. Каждым шариком необходимо проводить по направлению от лобка к заднему проходу только один раз, стараясь проникать во все складки
Порядок сбора материала
- Снимите крышку с контейнера и возьмите его в руку, стараясь не касаться краев
- Удерживая половые губы разведенными, выпустите немного мочи, приостановите мочеиспускание, а затем, подставив под струю мочи контейнер, наполните его до половины объема. Постарайтесь не касаться контейнером тела
- Тщательно закройте контейнер крышкой, укажите Ф.И.О., дату рождения, дату и время сбора мочи и доставьте в медицинский центр в тот же день. Если не удается доставить анализ в лабораторию в течение 2 часов после мочеиспускания, то его следует хранить при температуре +2…+8°С (в холодильнике, но не замораживать!). С момента сбора до начала исследования не должно пройти более 24 часов
Инструкция по сбору материала для выполнения посева мочи (для мужчин). Контейнер СКК
Подготовка к исследованию
Важно!!! Мочу для исследования следует собирать до начала антибактериальной терапии или спустя 10-14 дней после её окончания.
- Необходимо приобрести стерильный контейнер с крышкой
- Вымойте руки с мылом
- Перед сбором мочи приоткройте крышку контейнера так, чтобы ее можно было снять одной рукой
- Отведите назад крайнюю плоть (если она не обрезана), головку полового члена тщательно вымойте с мылом теплой кипяченой водой, просушите с помощью чистой салфетки
Порядок сбора материала
- Удерживая крайнюю плоть в отведенном положении, подставив под струю мочи контейнер, и не касаясь его краев, наполните на половину объема
- Тщательно закройте контейнер крышкой и доставьте в лабораторию в течение 1-2 часов. При невозможности быстрой доставки мочи в лабораторию, поместите её в холодильник (+4…+8°С). С момента сбора анализа до начала исследования хранение не более 24 часов
- На контейнере укажите Ф.И.О., дату рождения, дату и время сбора мочи
Инструкция по сбору мочи на амилазу
- Отметить время первого произвольного мочеиспускания (эту порцию мочи удаляют)
- В течение последующих часов (возможное время сбора мочи от 1 до 24 часов) вся моча собирается в емкость
- По окончании времени сбора мочу обязательно перемешивают, после чего сразу же отливают в контейнер около 5 мл
- На исследование в лабораторию необходимо доставить именно контейнер для мочи. На направительном бланке нужно указать точный объем мочи (диурез) в миллилитрах и период сбора (часов). Например: «Диурез (мл) — 200; время сбора — 2ч».
Инструкция но подготовке к исследованию «Катехоламины в моче»
- Перед плановым сбором мочи для определения катехоламинов, в течение 3-х дней нельзя применять препараты, содержащие раувольфию, теофиллин, нитроглицерин, кофеин, этанол, по-возможности не принимать другие лекарственные средства, а также пищевые продукты, содержание серотонин (шоколад, сыры и другие молочные продукты, бананы), не употреблять алкоголь
- Избегать физической нагрузки, стрессов, курения, болевых воздействий
Инструкция по подготовке к исследованию «Метаболиты катехоламинов и серотонина; метанефрин и нормстанефрин»
Для исключения ложноположительных результатов, целесообразно за 48 часов до сбора мочи исключить из диеты бананы, ананасы, томаты, яйца, шоколад, сыр, а также пищевые продукты, содержащие ванилин (кондитерские изделия). Необходимо максимально ограничить прием продуктов, содержащих кофеин и другие стимуляторы (чай, кофе, какао, кока-кола). По возможности, после консультации с направляющим врачом, исключить прием лекарственных препаратов за 1 -2 дня до исследования, кроме применяемых по жизненным показаниям.
Инструкция по сбору мочи на исследование «Антиген рака мочевого пузыря в моче»
- Необходимо заранее приобрести стерильный контейнер (СКК)
- Воздержаться от мочеиспускания в течение 3-х часов
- Собрать среднюю порцию мочи, находившуюся в мочевом пузыре не менее 3-х часов в стерильный контейнер (СКК)
- Образец мочи необходимо доставить в медицинский центр в день сбора биоматериала
Инструкция по сбору мочи на исследования по определению В2-микроглобулина
- Опорожнить мочевой пузырь
- Выпить большой полный стакан воды (250 мл)
- В пределах 1 часа после этого необходимо собрать мочу в контейнер (не менее 5 мл) и доставить в лабораторию
Инструкция по сбору мочи на исследования по определению психоактивных и наркотических веществ
Подготовка к исследованию
В медицинском центре получите контейнер СКК (стерильный контейнер с крышкой, 30 мл).
Порядок сбора материала
- Моча должна быть собрана в чистый, не использованный прежде контейнер (примеси моющих и дезинфицирующих средств могут искажать результат)
- Внимание! Немедленно после сбора моча должна быть помещена в контейнер с красной крышкой (СКК), предотвращающей испарение и окисление. Контейнер для сбора мочи следует заполнить полностью для предотвращения испарения под крышкой
- Доставить контейнер в лабораторию в течение дня. Если нет возможности сразу доставить мочу в медицинский центр, то контейнер с мочой следует хранить в холодильнике при +2…+8°С, не более 24 часов
Инструкция по сбору кала
Подготовка к исследованию
- Рекомендована отмена лекарственных препаратов (все слабительные, ваго- и симпатикотропные средства, каолин, сульфат бария, препараты висмута, железа, ректальные свечи на жировой основе, ферменты и другие препараты, влияющие на процессы переваривания и всасывания)
- Нельзя проводить копрологические исследования после клизмы
- После рентгенологического исследования желудка и кишечника проведение анализа кала показано не ранее, чем через двое суток
- Целесообразно применение следующей диеты: молоко, молочные продукты, каши, картофельное пюре, белый хлеб с маслом, 1-2 яйца всмятку, немного свежих фруктов. Такую пищу дают в течение 4-5 дней, кал исследуют на 3-5 сутки (при условии самостоятельного опорожнения кишечника)
- Кал собирается после самопроизвольной дефекации в одноразовый пластиковый контейнер с герметичной крышкой и ложечкой-шпателем для отбора пробы. Следует избегать примеси к калу мочи и отделяемого половых органов. Контейнер необходимо доставить в лабораторию в день сбора материала, до отправки хранить в холодильнике (+4…+8°С)
- При исследовании на скрытую кровь все обследуемые пациенты за 3 дня до взятия пробы должны придерживаться диеты, исключающей прием продуктов, содержащих железо (мясо, рыба, помидоры, болгарский перец, яблоки, все зеленые овощи, печень, икра, гранаты, гречка и т.д.). Также необходимо исключить прием железосодержащих лекарственных средств. Употребление этих продуктов может дать ложноположительный результат (для теста на скрытую кровь в кале количественным иммунохимическим методом специальная диета не требуется). При кровотечении из десен в течение всего периода подготовки к исследованию пациент не должен чистить зубы щеткой. Рекомендуется только полоскание полости рта
- Обращаем внимание на необходимость приобретения стерильного контейнера с завинчивающейся крышкой и ложечкой
Порядок сбора материала
- Кал собирается в количестве не более 1/3 объёма контейнера
- На контейнере необходимо указать вашу фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком
- Материал должен быть доставлен в лабораторию в день сбора. Во время сбора избегать примесей мочи, отделяемого половых органов. До отправки материал должен храниться в холодильнике при +4…+8°С.
Инструкция по сбору кала на дисбактериоз
Подготовка к исследованию
- Материал (кал) собирается до начала антибактериальной терапии, или же не ранее, чем через 12-14 дней после последнего приема препарата
- За 3 — 4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла, прекратить введение ректальных свечей. Кал, полученный после клизмы, а также после приема бария (при рентгеновском обследовании) для исследования не используется
- До сбора анализа помочитесь в унитаз
Порядок сбора материала
- Путём естественной дефекации в подкладное судно соберите испражнения (следить, чтобы не попала моча). Подкладное судно предварительно обрабатывается любым дезинфицирующим средством, тщательно промывается проточной водой несколько раз и ополаскивается кипятком
- Кал собирается в чистый, одноразовый контейнер с завинчивающейся крышкой и ложечкой или аналогичный контейнер, приобретенный заказчиком через аптечную сеть, в количестве не более 1/3 объёма контейнера. Материал доставляется в медицинский центр в течение 3 часов с момента сбора анализа. Желательно в течение указанного времени материал хранить в холодильнике
- На контейнере необходимо указать вашу фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком. В направительном бланке обязательно должен быть указан диагноз и дата начала заболевания, сведения о приёме антибиотиков. При взятии материала необходимо соблюдать стерильность
Условия, соблюдение которых обязательно:
- не допускается замораживание
- не допускается длительное хранение (более 5-6 часов)
- не допускается неплотно закрытый контейнер
- не подлежит исследованию биоматериал, собранный накануне
Инструкция по сбору кала на посев
Важно!!! Необходимо приобрести стерильную пробирку с питательной средой для взятия биоматериала.
Подготовка к исследованию
- Материал (кал) собирается до начала антибактериальной терапии, или же не ранее, чем через 12-14 дней после последнего приема препаратов
- За 3-4 дня отменить прием слабительных, касторовое и вазелиновое масло, ректальные свечи, использование клизм
- Для исследований использовать только свежевыделенный кал
Подготовка к взятию материала
- Открыть стерильную упаковку и извлечь комплект «пробирка + аппликатор»
- Извлечь аппликатор из его собственной упаковки и произвести взятие материала (см. ниже)
- Открутить крышку пробирки, вставить аппликатор и переломить его в точке, отмеченной цветом. Ненужную часть аппликатора утилизировать
- Закрутить крышку пробирки (аппликатор при этом надежно закрепится в крышке)
- Написать данные пациента на этикетке
Порядок сбора материала
- Произвести дефекацию на чистый лист бумаги или полиэтилен
- Для сбора материала погрузить тампон, входящий в состав транспортной среды, в кал поочередно в нескольких местах, чтобы остались следы кала. Обязательно погрузить в места со слизью, гноем и т.д. Кусочки кала помещать в пробирку не надо. Хранить в холодильнике, доставить в день взятия
Инструкция но сбору кала для исследования на содержание углеводов
- Материалом служит кал после естественной дефекации, который собирают в чистый одноразовый контейнер с завинчивающейся крышкой и ложечкой
- Не рекомендуется собирать кал из унитаза
- Собирают кал на чистую поверхность, в качестве которой может быть использован чистый новый лист (пакет) из полиэтилена, недопустимо собирать кал с тканевой поверхности или памперса
- При использовании судна, его предварительно хорошо промывают с мылом и губкой, ополаскивают многократно водопроводной водой, а потом обдают кипятком и остужают
- Кал берут преимущественно из средней порции специальной ложечкой, вмонтированной в крышку стерильного контейнера, в количестве не более 1/3 от объема контейнера. Не наполняйте контейнер доверху. Тщательно закройте крышку
- Образец кала доставляется в медицинский центр в течение 4-х часов от момента сбора
Важно!!! Количество материала — не менее объема чайной ложки!
При проведении исследования пациент должен получать обычное количество молочных продуктов (лактозы) в питании, иначе результат теста может оказаться ложноотрицательным.
Инструкция по сбору кала на антигенные тесты
Подготовка к исследованию
- Материал (кал) собирается до начала антибактериальной терапии, или же не ранее, чем через 12-14 дней после последнего приема препарата
- За 3-4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла, прекратить введение ректальных свечей. Кал, полученный после клизмы, а также после приёма бария (при рентгеновском обследовании) для исследования не используется
- необходимо ограничить прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий)
- До сбора анализа помочитесь в унитаз
Порядок сбора материала
- Путём естественной дефекации в подкладное судно соберите испражнения (следить, чтобы не попала моча). Подкладное судно предварительно обрабатывается любым дезинфицирующим средством, тщательно промывается проточной водой несколько раз и ополаскивается кипятком
- Кал собирается в чистый, одноразовый контейнер с завинчивающейся крышкой и ложечкой или аналогичный контейнер, приобретенный заказчиком через аптечную сеть, в количестве не более 1/3 объёма контейнера
- Исследование должно проводиться по возможности сразу после сбора образцов. Перед проведением тестирования образцы могут храниться в холодильнике при температуре 2-4°С в течение 1-2 дней. Допускается однократное замораживание при -20°С, если предполагается более длительное хранение
- На контейнере необходимо указать вашу фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком. В направительном бланке обязательно должен быть указан диагноз и дата начала заболевания, сведения о приёме антибиотиков. При взятии материала необходимо соблюдать стерильность
Условия, соблюдение которых обязательно: не допускается неплотно закрытый контейнер.
Инструкция по сбору кала при исследовании на скрытую кровь
Подготовка к сбору
- Все обследуемые пациенты за 3 дня до взятия пробы должны придерживаться диеты, исключающей прием продуктов, содержащих железо (мясо, рыба, помидоры, болгарский перец, яблоки, все зеленые овощи, печень, икра, гранаты, гречка и т.д.). Также необходимо исключить прием железосодержащих лекарственных средств. Употребление этих продуктов может дать ложноположительный результат (для теста на скрытую кровь в кале количественным иммунохимическим методом специальная диета не требуется)
- При кровоточивости десен в течение всего периода подготовки к исследованию пациент не должен чистить зубы щеткой. Рекомендуется только полоскание полости рта (для теста на скрытую кровь в кале количественным иммунохимическим методом выполнение этого условия не требуется)
- Необходимо приобрести стерильный контейнер
- В случае применения препаратов, повышающих риск кровотечений (например, нестероидные противовоспалительные препараты) следует обсудить порядок проведения исследования с лечащим врачом
- Исследование не следует проводить в течение 2 недель после проведения инструментальных исследований желудочно-кишечного тракта или медицинских процедур, которые могут вызвать механические повреждения слизистой (например, колоноскопия, ректороманоскопия, очищение кишечника с помощью клизм и пр.)
Порядок сбора материала
- Стул должен быть без клизмы и слабительных средств
- Не рекомендуется собирать кал из унитаза
- Собирают кал на чистую поверхность, в качестве которой может быть использован сухой чистый лист бумаги, полиэтилен, или клеенка
- Помещают пробу в контейнер для кала в количестве не более 1/3 объёма контейнера. Доставить в медицинский центр в день сбора пробы (или не позднее 12-часового периода после дефекации)
- До транспортировки в пункт приёма материал должен храниться в холодильнике при +2…+8°С
Инструкция по сбору материала для исследования кальпротектина
- Специальной подготовки не требуется
- Биоматериал для исследования собирается в стерильный контейнер. После дефекации необходимо отобрать пробу кала в количестве 5-10 граммов (одна чайная ложка, но не более 1/3 объёма контейнера) и закрыть крышкой
- Во время сбора избегать примесей мочи, отделяемого половых органов
- На контейнере необходимо указать вашу фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком
- Биоматериал должен быть доставлен в медицинский офис в день сбора. До доставки в медицинский центр хранить строго при температуре +2…+8°С
Инструкция по сбору материала на энтеробиоз
Подготовка к исследованию
Взятие материала должно производиться утром до дефекации и проведения туалета половых органов.
Порядок сбора материала
- Утром, в положении лежа на боку, ноги согнуты в коленях и прижаты к животу, ватной палочкой, смоченной в глицерине, сделать соскоб с поверхности прианальных складок
- Палочку поместить в пластиковую пробирку и плотно закрыть крышкой
- Материал необходимо доставить в медицинский офис в день взятия анализа. До отправки в лабораторию материал должен храниться в холодильнике при температуре +4…+8°С
Инструкция по сбору грудного молока на посев
Подготовка к исследованию
Перед сцеживанием молока тщательно вымойте руки и молочные железы с мылом, обработайте соски и околососковую область ватными тампонами, смоченными 70% спиртом (каждая железа обрабатывается отдельным тампоном).
Порядок сбора материала
- Сцедите первые 5-10 мл в отдельную посуду (т.к. эта порция молока не пригодна для исследования), последующие 4-5 мл сцедите в стерильный контейнер с красной крышкой, старайтесь при этом не касаться краев контейнера телом
- Молоко из каждой железы собирайте в отдельный контейнер. После сцеживания аккуратно закройте крышку, стараясь не дотрагиваться краев контейнера руками
- Промаркируйте каждый контейнер, указав Вашу фамилию, инициалы, дату рождения, на каждом контейнере необходимо указать: «правая молочная железа» или «левая молочная железа»
- Молоко до отправки в лабораторию должно храниться в холодильнике
- С момента сбора до начала исследования не должно пройти более 24 ч
Важно!!! Сбор материала должен осуществляться до антибактериальной терапии или же через 12-14 дней после последнего приема препарата!
Инструкция по сбору мокроты
Подготовка к исследованию
- Исследованию подлежит утренняя мокрота, выделяющаяся во время приступа кашля
- Перед откашливанием необходимо почистить зубы и прополоскать рот кипяченой водой с целью механического удаления остатков пищи, опущенного эпителия и микрофлоры ротовой полости. Следите за тем, чтобы в контейнер не попала слюна и носоглоточная слизь (особенно при насморке!)
Порядок сбора материала
- Выделившуюся мокроту собирают в стерильный контейнер с красной крышкой
- Тщательно закройте контейнер крышкой и храните в холодильнике при температуре +2…+8°С не более 24 часов (с момента сбора до начала исследования)
- На контейнере необходимо указать Вашу фамилию, инициалы, дату рождения, дачу и время сбора
- Доставить в любой медицинский центр
Важно!!! Мокроту для микробиологического исследования следует брать до начала антибактериальной терапии или же через 12-14 дней после последнего приема
Инструкция по сбору волос и ногтей
Подготовка волос
- Волосы должны быть чистыми и сухие
- Не допускается перед анализом нанесение на волосы средств по уходу и укладке
- Химическая завивка без окраски и обесцвечивание волос не препятствуют анализу
- Проводить анализ окрашенных волос рекомендуется через 2 месяца после процедуры их окрашивания
- Рекомендуется прекратить использование лечебных шампуней, средств против перхоти, муссов, лечебных бальзамов и гелей за 2 недели до сдачи волос на анализ
- Вели Вы применяете препараты типа «Антиседин», то их использование необходимо прекратить за 3 месяца до анализа
- Перед процедурой срезания волос тщательно вымыть руки. Не рекомендуется использовать перчатки из латекса
- Инструмент для срезания волос (ножницы или бритва) должен иметь очищенные режущие поверхности
Порядок сбора волос
- Волосы необходимо аккуратно отстричь (нс выдергивать!) в непосредственной близости от корней в четырех-пяти местах на затылке ближе к области шеи
- Желательно оставить длину отстриженных волос 3 — 5 см от корней, а лишнее обрезать
- Срезанные волосы собрать в пучок толщиной 2 — 3 мм и поместить во внутренний маленький конверт. В зоне конверта, где расположен корневой конец пряди сделать надпись «корень»
- Если волосы очень короткие, то их необходимо состричь в количестве, способном заполнить чайную ложку
- При отсутствии волос на голове, их можно компенсировать с любой другой части тела, сделав соответствующую пометку в бланке заказа
Правила сбора ногтей
Важно!!! Ногти рекомендуется собирать для анализа только в том случае, если отобрать волосы для анализа принципиально невозможно.
- Ногти должны быть чистыми и сухими
- Не допускается нанесение лака для ногтей и иных средств по уходу за 1 неделю до сдачи анализа. Также нельзя перед процедурой обрабатывать ногти металлической пилочкой
- Перед процедурой тщательно вымыть руки. Не рекомендуется использовать перчатки
- Инструмент для срезания ногтей (ножницы или бритва) должен иметь чистые режущие поверхности
Порядок сбора ногтей
- Ногти необходимо срезать со всех пальцев обеих рук или ног, указав соответствующий источник на бланке заказа. Длина срезаемых ногтей должна быть не менее 2-х мм
- Срезанные ногти помещают во внутренний маленький конверт
- Внутренний маленький конверт вместе с собранным материалом (волосы или ногти) и заполненный бланк заказа необходимо поместить в большой конверт. На большом конверте необходимо указать свою Ф.И.О., дату рождения и пол
Важно!!! В бланке заказа необходимо обязательно заполнить все пункты. Если Вы скрыли факт окрашивания, обесцвечивания, химической завивки волос или факт применения средств по уходу за волосами, то результат исследования будет выдан в искаженном виде. В этом случае лаборатория не несет ответственности за достоверность выдаваемого результата.
Инструкция по сбору материала на исследовании эякулята
Подготовка к исследованию
Важно!!! Биоматериал сдастся после полового воздержания, не менее 48 часового и не более 7-дневного. В период подготовки к анализу нельзя принимать алкоголь, лекарственные препараты, посещать баню или сауну, подвергаться воздействию УВЧ. При повторном исследовании желательно устанавливать одинаковые периоды воздержания для адекватной оценки полученного результата.
Важно!!! Поскольку проведение исследования «Спермограмма» должно начинаться не позднее 1 часа после получения биоматериала, приём производится только в тех медицинских центрах, где проводится данная услуга
Важно!!! По требованиям Всемирной Организации Здравоохранения MAR-тест без спермограммы не проводится, тест выполняется одновременно с анализом эякулята.
Порядок сбора материала
- Эякулят получают путём мастурбации. Собирают в специальный контейнер, который предварительно необходимо получить в медицинском офисе. Нельзя использовать презерватив для сбора спермы (вещества, используемые при производстве презервативов, могут влиять на степень подвижности сперматозоидов)
- На контейнере необходимо указать фамилию, дату и точное время получения эякулята
- Во время транспортировки сперму сохранять при температуре +27…+37°С
- Если мастурбация не завершилась семяизвержением, необходимо сразу помочиться и доставить на анализ всю полученную мочу
Инструкция по сбору материала (Гастропанель)
Подготовка к исследованию
- Взятие крови производится утром в период с 8 до 11 часов, строго натощак (не менее 8 часов и не более 14 часов голода, питье — вода, в обычном режиме), накануне избегать пищевых перегрузок
- Следует воздержаться от чрезмерных физических нагрузок, приема алкоголя, пищевых перегрузок в течение 24 ч до взятия крови. Не курить 4 часа до исследования
- Проведение стимуляционной пробы связано с приемом внутрь белкового коктейля, содержащего сою, молочные продукты, яйца, шоколад. Белковая стимуляция противопоказана пациентам, имеющим в анамнезе аллергическую реакцию на сою, молочные продукты, яйца, шоколад
- Допустимо проводить исследование на фоне приёма обычных для пациента предписанных врачом лекарств, за исключением препаратов, которые могут влиять на секрецию желудочного сока:
- За 1 неделю до проведения исследования (после консультации с врачом) воздержаться от приёма медикаментов, угнетающих секрецию кислоты в желудке, например: ранитидин, фамотидин, низатидии (и препараты-синонимы), ингибиторы протонной помпы (лансопразол, омепразол, пантопразол, эзомепразол, рабепразол и др.)
- За 1 день до проведения исследования воздержаться от приёма медикаментов, нейтрализующих соляную кислоту желудка: антацидов (гевискон, молочко магния, рении и г.п.) и препаратов, направленные на защиту слизистой (алсукрал, андапсин и т.п.)
- Необходимо проконсультироваться с врачом относительно возможности временной отмены соответствующих препаратов. При невозможности отмены препаратов следует указать применяемые препараты в направлении на исследование
- При проведении Гастропанели без стимуляционной пробы проводится однократное взятие крови натощак
- При проведении варианта Гастропанели со стимуляционной пробой первое взятие крови из вены производится у пациента натощак. Затем пациент должен выпить белковый напиток-стимулятор секреции гастрина-17 с высоким содержанием белка. Через 20 минут после приёма белкового напитка берут вторую пробу венозной крови
Важно!!! Несоблюдение требований приводит к некорректным результатам исследования.
Инструкция по подготовке к глюкозотолерантному тесту (ГТТ, ГТТС, ГТБ)
- Тест проводится строго по назначению врача
- Глюкозотолерантный тест не выполняется детям до 14 лет
- Исследование проводится натощак (не менее 12, но не более 16 часов голодания). Для беременных — не менее 8 часов. Воду пить можно
- При беременности обычный рекомендуемый срок проведения глюкозотолерантного теста — 24-28 недель. Тест может быть назначен врачом и соответственно проведен и на более ранних сроках беременности (до 24 недель). Беременным со сроком более 28 недель тест с нагрузкой глюкозой не выполняется, хотя в исключительных случаях врач может назначить проведение теста и на сроке 28-32 недели. На сроке беременности более 32 недель глюкозотолерантный тест не назначается и не проводится, поскольку это может быть опасно для плода
- Глюкозотолерантный тест не проводится в следующих ситуациях:
- при раннем токсикозе беременности (рвота, тошнота)
- при необходимости соблюдения строгого постельного режима (тест не проводится до момента расширения двигательного режима)
- на фоне острого воспалительного или инфекционного заболевания
- при обострении хронического панкреатита или наличии демпинг-синдрома (синдром резецированного желудка)
- В течение трех дней перед проведением исследования необходимо придерживаться обычного питания, без ограничения углеводов. Последний прием пищи также должен содержать обычное количество углеводов. Пить воду не запрещается
- За 3 дня до проведения исследования необходимо воздержаться от приёма лекарственных препаратов, применение которых, может влиять на результат исследования (салицилаты, оральные контрацептивы, тиазиды, кортикостероиды, диуретики, глюкокортикоиды и др.)
- Беременным пациенткам лекарственные средства, влияющие на уровень глюкозы крови (поливитамины и препараты железа, содержащие углеводы, глюкокортикоиды, β-адреноблокаторы, β-адреномиметики), по возможности, следует принимать после окончания теста.
ВНИМАНИЕ!!! Отмена лекарственных препаратов производится только после предварительной консультации пациента с врачом! - Накануне за 24 часа до исследования противопоказано употребление алкоголя
- Во время проведения 2-часового исследования исключается курение, приём пищи и любых жидкостей (допускается небольшое количество воды в случае сильной жажды)
- В день проведения исследования необходимо соблюдать умеренную физическую активность (без нагрузок), но не постельный режим
Памятка пациенту по подготовке к взятию мазков
Перед взятием мазков необходимо
- За 1-2 суток перед визитом к врачу для сдачи мазков воздержаться от половых контактов
- По согласованию с лечащим врачом за 10-14 дней до взятия биоматериала необходимо прекратить прием лекарственных препаратов и лечебные процедуры
- Мазки на инфекции и посевы желательно сдавать не ранее, чем через 3 недели после приема антибиотиков
Для женщин: взятие биоматериала производится после менструации не ранее, чем на 4-5 день цикла, если другие сроки не назначены врачом. Желательно не принимать ванну накануне взятия биоматериала. За 1-2 суток перед визитом к врачу для сдачи мазков воздержаться от половых контактов. В течение 24 часов запрещены спринцевания, влагалищные души, тампоны, свечи и другие местные препараты (в том числе контрацептивы). Допускается только наружный туалет половых органов. Исключить проведение накануне УЗИ, кольпоскопии.
Для мужчин: pа 1-2 суток перед визитом к врачу для сдачи мазков воздержаться от половых контактов. Не использовать антисептики накануне взятия биоматериала. Не мочиться в течение 1,5-2 часов до процедуры.
Как я должен собирать и хранить образец кала (кала)?
Вам следует:
- Соберите образец фекалий (стула) в полностью чистый (стерильный) контейнер
- храните контейнер в холодильнике в герметичном пластиковом пакете, если вы не можете сразу сдать его
Сбор пробы стула
Ваш терапевт или другой медицинский работник, например медсестра, должны объяснить, как собирать образец. Его следует собрать в чистый сухой контейнер с завинчивающейся крышкой.
Ваш врач или сотрудник больницы даст вам пластиковый контейнер (для образцов), хотя вы можете использовать любой чистый контейнер, если вы можете его запечатать.
Старайтесь не собирать мочу (мочу) или воду из унитаза вместе с фекалиями, но не беспокойтесь, если вы это сделаете. Если вам нужно в туалет, сделайте это, прежде чем собирать фекалии.
Для сбора пробы:
- Наклейте на чистый контейнер с завинчивающейся крышкой свое имя, дату рождения и дату
- поместите в унитаз что-нибудь, чтобы собрать какашку, например горшок или пустой пластиковый контейнер для еды, или расстелите чистую газету или полиэтиленовую пленку по краю унитаза
- убедитесь, что фекалии не касаются внутренней части унитаза
- используйте ложку или лопатку из комплекта для сбора фекалий, затем закрутите крышку.
- , если вам дали контейнер, постарайтесь заполнить его примерно на треть — это примерно размер грецкого ореха, если вы используете свой собственный контейнер
- поместите все, что вы использовали для сбора фекалий, в полиэтиленовый пакет, завяжите его и положите в мусорное ведро
- тщательно вымыть руки теплой проточной водой с мылом
Следуйте любым другим инструкциям, которые дал вам врач.
Хранение образца стула
Образец фекалий должен быть свежим — в противном случае бактерии в нем могут размножаться. Это означает, что уровни бактерий в образце стула не будут такими же, как уровни бактерий в вашей пищеварительной системе. Если уровни бактерий не совпадают, результаты теста могут быть неточными.
Ваш образец следует сдать как можно скорее, так как иногда его невозможно проанализировать после охлаждения — ваш врач скажет вам, если это так.
Если вы не можете сразу сдать образец, узнайте, как долго его можно хранить в холодильнике. Ваш терапевт или медицинский работник, запросивший тест, сможет вам сказать. Если вы можете хранить его в холодильнике, сначала поместите контейнер в герметичный пластиковый пакет.
Для чего используются образцы стула?
Ваш терапевт или другой медицинский работник может попросить вас сдать образец стула, чтобы помочь им диагностировать или исключить конкретное состояние здоровья.
Poo содержит бактерии и другие вещества, попадающие в пищеварительную систему.
Проверяя уровни этих веществ и бактерий в фекалиях, можно понять, что происходит в вашей пищеварительной системе.
Например, образец можно протестировать для диагностики:
Узнайте больше об операциях, тестах и процедурах.
Дополнительная информация
Последняя проверка страницы: 27 августа 2019 г.
Срок следующего рассмотрения: 27 августа 2022 г.
границ | Современные методы отбора проб кишечной микробиоты: потребность в более точных устройствах
Введение
У людей имеется сложная кишечная микробиота, состав которой варьируется в разных частях желудочно-кишечного тракта (ЖКТ) (Zoetendal et al., 2012). Сообщалось, что количество некультивируемых видов в микробиоте кишечника достигло 1952 года (Almeida et al., 2019). Считается, что физиологические изменения в различных областях тонкой и толстой кишки, включая химические и пищевые градиенты и изолированную иммунную активность хозяина, влияют на состав бактериальных сообществ (Donaldson et al., 2016). Микробиота кишечника играет важную роль во внутренней среде человека. Он развивается вместе с хозяином и выполняет важные физиологические функции для хозяина, такие как предотвращение заражения различными патогенами; содействие созреванию иммунной системы; участие в регуляции иммунного ответа, всасывания пищи и метаболизма; и продвижение противораковых функций (Foster et al., 2017; Ким и др., 2017; Macpherson et al., 2017; Ли и др., 2019). Колонизация микробиоты новорожденных начинается с в утробе матери с (Dunn et al., 2017). Как способ родоразрешения, так и прекращение грудного вскармливания считаются важными для сборки микробиоты кишечника взрослого человека. Микробный состав резко меняется в течение 1-го года жизни (La Rosa et al., 2014; Bäckhed et al., 2015).
Микробиота кишечника постепенно меняется со временем, и были обнаружены различия между молодыми и пожилыми людьми (O’Toole and Jeffery, 2015).Микробиота кишечника различается у разных людей из-за многих факторов, таких как гены и диета. Исследования показали, что диета с высоким содержанием углеводов и клетчатки может увеличить численность и разнообразие кишечных микроорганизмов, особенно у лиц с пониженным микробным разнообразием (Tap et al., 2015; Sheflin et al., 2017). Низкоуглеводные диеты могут значительно снизить количество бактерий, продуцирующих масляную кислоту (таких как Roseburia и Bifidobacterium ), тем самым снижая выработку масляной кислоты и уменьшая защитный эффект на кишечник (Duncan et al., 2007; Russell et al., 2011). Незрелая кишечная микробиота считается одной из причин недоедания, а олигосахариды грудного молока могут уменьшить недоедание, регулируя микробиом (Blanton et al., 2016; Charbonneau et al., 2016). Более того, возникновение многих заболеваний, таких как инфекция Clostridium difficile , воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), также связано с изменением микробиоты кишечника. Длительный прием большого количества антибиотиков широкого спектра действия может привести к дисбактериозу, например C.difficile (Stanley and Burns, 2010). По сравнению с контрольной группой, исследования кишечной микрофлоры у пациентов с ВЗК постоянно показывают изменения в составе микрофлоры и снижение общего биоразнообразия, например, увеличение факультативных анаэробов и уменьшение облигатных анаэробов (Shim, 2013; Lloyd-Price et al. , 2019). Считается, что возникновение СРК связано с микробным воздействием на коммуникацию между кишечником и мозгом (Eisenstein, 2016).
Поскольку существует множество ассоциаций между микробиотой кишечника и здоровьем человека, особенно важно проанализировать взаимосвязь между изменениями микробиоты кишечника и возникновением, прогрессированием и прогнозом заболевания.В прошлом анализ микробиома кишечника зависел от изоляции и культур, но сложность культивирования анаэробных бактерий, которых много в кишечнике, серьезно влияла на точность анализа. В последние годы развитие секвенирования следующего поколения (NGS), которое может точно анализировать микробные компоненты без посева, привлекло внимание в исследованиях кишечного микробиома. Однако очень важно собрать соответствующие образцы кишечной микробиоты для NGS.Современные методы отбора проб для получения образцов фекалий, биопсии слизистой оболочки и кишечной аспирации, все из которых могут иметь некоторые дефекты, не могут точно отражать состав кишечного микробиома (таблица 1). В этом обзоре мы обобщаем текущие методы сбора микробиоты кишечника и их возможные недостатки, чтобы изучить трудности, которые необходимо преодолеть при использовании технологий сбора микробиоты кишечника.
Таблица 1 . Сравнение различных методов отбора проб для анализа кишечной микробиоты.
Обзор
Образцы фекалий
Из прагматических соображений образцы фекалий часто используются в качестве заместителей микробиоты кишечника. Образцы фекалий собираются естественным путем, неинвазивно и могут быть взяты повторно, поэтому они являются источником образцов для большинства исследований кишечной микробиоты. Однако становится все более очевидным, что могут быть значительные различия в микробном составе между слизистой оболочкой и фекалиями (Zoetendal et al., 2002; Carroll et al., 2010).Фекалии считались заменителями содержимого просвета желудочно-кишечного тракта, но их компоненты неуверенно отражают прямое взаимодействие со слизистой оболочкой. В недавних исследованиях было продемонстрировано, что микробиота, связанная с фекалиями и слизистыми оболочками, представляет собой две отдельные микробные ниши (Rangel et al., 2015; Ringel et al., 2015; Tap et al., 2017). Образцы фекалий не могут быть индикаторами состава и метагеномной функции ассоциированной со слизистой оболочкой микробиоты, распределенной по множеству участков кишечника (Zmora et al., 2018).Таким образом, оценка микробиоты кишечника с фекалиями является необъективной. Более того, фекальная микробиота неравномерно распределена в фекалиях и имеет собственную биоструктуру (Swidsinski et al., 2008). Wu et al. сообщили, что 35% таксонов с низкой численностью, которые составляют 0,2–0,4% от общего микробиома в одной повторности, не были обнаружены во втором образце фекалий (Wu et al., 2010). Внутрииндивидуальные вариации обнаруженных бактерий были значительно уменьшены в большинстве исследований, в которых образцы кала или мазки гомогенизировались и игнорировалась их структура (Hsieh et al., 2016). В случае подвыборки фекалий результаты микробных таксонов, обнаруженных с помощью кПЦР, сильно различались (Gorzelak et al., 2015).
Кроме того, при определенных условиях свежие образцы стула нельзя анализировать немедленно, и их необходимо хранить некоторое время. Фекальные материалы, мгновенно замораживаемые при -80 ° C, которые могут поддерживать микробную целостность без консервантов, широко считаются золотым стандартом для профилирования кишечной микробиоты. Этот подход сохраняет микробные компоненты, аналогичные тем, которые содержатся в свежих образцах, и воздерживается от потенциального воздействия консервантов (Fouhy et al., 2015). Для крупномасштабных популяционных исследований важны соответствующие методы для соблюдения пациентом режима лечения и сбора оптимальных образцов. Иногда идеальные условия для немедленного хранения образцов при -80 ° C не могут быть выполнены. Следовательно, необходимо учитывать допустимые методы сбора данных, чтобы минимизировать систематическую ошибку, которая может быть внесена на этапах предварительной обработки (Flores et al., 2015). Jocelyn M et al. сообщили, что хранение и транспортировка образцов при 4 ° C может минимизировать изменения микробного состава, если хранение при сверхнизких температурах недоступно (Choo et al., 2015).
Существуют и другие методы хранения с консервантами или без них, которые используются для получения микробиомного состава, аналогичного составу свежих образцов. В качестве безаддитивных методов образцы фекалий, хранящиеся при комнатной температуре в течение 24 часов, −20 ° C в течение 1 недели и в пробирках Эппендорфа при комнатной температуре в течение 3 дней, не оказывали значительного влияния на профили фекального микробиома (Carroll et al., 2012; Tedjo et al. др., 2015). Кроме того, карты анализа кала на скрытую кровь, карты FTA (Whatman) и набор OMNIgene Gut (DNA Genotek) также оказались эффективными для образцов, хранящихся в течение нескольких дней при комнатной температуре (Dominianni et al., 2014; Song et al., 2016; Vogtmann et al., 2017). Для использования консервантов для стабильного хранения образцов кала рекомендуется рекомендовать 95% этанол и RNAlater (Flores et al., 2015; Song et al., 2016; Vogtmann et al., 2017; Wang et al., 2018). Условия хранения могут значительно изменить характеристики микробного сообщества. В отсутствие условий сверхнизких температур хранение и транспортировка указанными выше методами может минимизировать изменения микробного состава. Выбор методов сбора и хранения должен основываться на цели, объеме и условиях исследования.
Вкратце, недостатки использования образцов фекалий в качестве замены кишечной микробиоты можно резюмировать в следующих аспектах. Во-первых, нельзя исключить возможность неполного разделения каловых бактерий и кишечной флоры. Физиологические вариации, содержащие градиенты химических и питательных веществ, а также разделение иммунной активности хозяина, различаются по длине тонкой и толстой кишки, и все они, как известно, влияют на микробный состав. В тонком кишечнике преобладают семейства Lactobacillaceae и Enterobacteriaceae , тогда как в толстой кишке преобладают семейства Prevotellaceae, Bacteroidaceae, Rikenellaceae, Ruminococcaceae и Lachnospiraceae (Donaldson et al., 2016). Таким образом, изучение кишечной флоры с фекальными бактериями не является исчерпывающим. Во-вторых, гомогенизация перед сбором образцов фекалий нарушает биоструктуру фекалий, и, если не гомогенизация, репрезентативность образцов может быть недостаточной. Swidsinski et al. использовали пластиковую трубочку для питья, чтобы пробить стул, чтобы получить фекальные цилиндры, которые успешно сохраняли биоструктуру фекальной микробиоты и продемонстрировали, что фекальная микробиота высоко структурирована (Swidsinski et al., 2008). Однако в другом исследовании сообщается, что гомогенизация может значительно снизить внутрииндивидуальные различия в обнаружении каждого компонента фекальной микробиоты (Hsieh et al., 2016). Это приводит к спорам о том, какой метод следует использовать. Наконец, в большинстве случаев нереально сразу проанализировать свежие образцы. Затем необходимо учитывать влияние метода хранения, который может вызвать деградацию микробной ДНК, чрезмерный рост и гибель некоторых видов, на компоненты образца фекалий.
Эндоскопические образцы
По сравнению с использованием образцов фекалий для анализа состава микробиоты желудочно-кишечного тракта, было проведено несколько исследований по сбору образцов тканей и содержимого просвета для оценки микробиоты в различных микробных нишах во время эндоскопических процедур.Более полную информацию о микробиоме кишечника можно получить с помощью инструментов (таких как щипцы для биопсии и щетки для просвета) с помощью эндоскопии. Есть несколько общих недостатков методов отбора проб. Во-первых, эндоскопия инвазивна и вредна для пациентов. Во-вторых, во многих исследованиях сообщается, что влияние подготовки кишечника на микрофлору кишечника неизбежно. Затем, когда инструменты для отбора проб проходят через эндоскопический канал, они могут быть загрязнены содержимым, существующим в канале. Наконец, из-за сложной структуры эндоскопия ограничивается дистальным отделом тонкой кишки.В настоящее время существует несколько методов получения образцов микробиоты кишечника с помощью эндоскопии.
Биопсия
Нижний отдел желудочно-кишечного тракта млекопитающих содержит разнообразные среды обитания микробов вдоль тонкой кишки, слепой и толстой кишки. Эндоскопическая биопсия дает возможность исследовать состав микробиоты слизистой оболочки в различных анатомических участках желудочно-кишечного тракта. Считается, что микробиота слизистой оболочки важна для хозяина, потому что она находится в контакте с лимфоидной тканью, связанной с кишечником (Heinsen et al., 2015).
Для подготовки кишечника обычно требуется некоторое количество слабительных, таких как полиэтиленгликоль (ПЭГ) или сульфат, чтобы вывести большую часть пищеварительного тракта из желудочно-кишечного тракта. Для надлежащей подготовки кишечника необходимо, чтобы кал был прозрачной жидкостью без каких-либо твердых частиц. Однако у мышей с осмотической диареей, вызванной водным раствором ПЭГ, эпителий кишечника, слизистая оболочка и среда кишечника хозяина были разрушены за короткий период времени, а микробиота кишечника все еще значительно изменялась в течение длительного периода времени.Изменения в микробиоте кишечника в основном заключались в том, что альфа-разнообразие значительно уменьшилось, и оно все еще было значительно ниже исходного уровня через 2 недели после диареи, и его было трудно полностью восстановить. Более того, некоторые бактерии с высокой численностью исчезли (например, семейство S24-7) и были заменены другими таксонами с низкой численностью (Tropini et al., 2018). Предыдущее исследование продемонстрировало, что подготовка кишечника с помощью ПЭГ может привести к значительным морфологическим изменениям в толстой кишке, включая потерю эпителиальных клеток и поверхностной слизи (Bucher et al., 2006). Shobar et al. сообщили, что на разнообразие и состав микробиомов просвета и слизистых оболочек влияет подготовка кишечника (Shobar et al., 2016). Также было обнаружено, что промывание перед колоноскопией вызывает 31-кратное снижение общей микробной нагрузки и потерю специфичности микробиоты у 22% участников (Jalanka et al., 2015).
В дополнение к эффектам, вызванным подготовкой кишечника, биопсия слизистой оболочки, выполняемая во время стандартных эндоскопических процедур, может быть загрязнена люминальной жидкостью ЖКТ в эндоскопическом канале.Чтобы свести к минимуму контаминацию во время отбора образцов микробиоты, связанной со слизистой оболочкой, было разработано устройство для асептической биопсии Брисбена (BABD), которое состоит из стерильных щипцов, покрытых оболочкой и закрытых заглушкой на концах. Биопсии, полученные с помощью стандартных щипцов, имеют большее разнообразие микробиоты, связанной со слизистой оболочкой, чем образцы, собранные с помощью BABD (Shanahan et al., 2016). Даже в этом случае загрязнение может произойти до отбора проб. Когда эндоскопическая трубка попадает в место отбора пробы изо рта или ануса, бактерии, находящиеся в местах, не относящихся к отбору проб, неизбежно попадают в место отбора проб.Более того, эндоскоп не может охватить все сегменты всего кишечника, такие как дистальный отдел тонкой кишки, поэтому биопсийные участки ограничены. Современные мультиомные технологии требуют различных исходных материалов, включая ДНК, РНК и белки, и биопсия может не дать достаточно материала, чтобы удовлетворить потребности этих технологий. По этой причине Watt et al. продемонстрировали, что лаваж толстой кишки предлагает тип образца, аналогичный таковому при биопсии, и генерирует значительно более высокий уровень ДНК, чем при биопсии, со средним выходом ДНК 48.5 и 1,95 мкг для лаважа толстой кишки и биопсии соответственно (Watt et al., 2016).
Биопсия слизистой оболочки охватывает только небольшую площадь поверхности и может привести к отклонению выборки и недоступности редких таксонов, если микробная популяция распределяется неравномерно. Биопсия слизистой оболочки часто содержит большое количество загрязненной ДНК хозяина, что затрудняет метагеномный и другие молекулярные анализы (Huse et al., 2014).
Из-за влияния подготовки кишечника и загрязнения во время процедуры, инвазии, ограничения мест отбора проб, риска кровотечения и инфекции и непригодности для здоровых людей биопсия, хотя и считается золотым стандартом для сбора микробиоты слизистых оболочек. , не подходит для будущего анализа кишечной микробиоты.
Чистка просвета
В 1979 году Уимберли и его коллеги впервые применили технику защищенной кисти для образцов (PSB) для сбора инфекционных образцов из нижних дыхательных путей с помощью волоконно-оптического бронхоскопа (Wimberley et al., 1979). Эти образцы кистей нелегко контаминировать нормальной флорой верхних дыхательных путей, что имеет большее значение для диагностики инфекции нижних дыхательных путей. В последние годы Lavelle et al. продвигаемые и проверенные методы повторной оценки пространственной изменчивости микробной популяции толстой кишки путем сочетания биопсии слизистой оболочки с методом PSB, который используется для отбора проб микробиоты, связанной с просветом (Lavelle et al., 2013). PSB представляет собой стерильную одноразовую щеточку для интродьюсера с дистальной заглушкой наверху, которая герметично закрывается кожухом при введении и втягивании через колоноскопический канал. В отличие от биопсии, чистка слизистой оболочки может снизить риски, связанные с биопсией слизистой оболочки (кровотечение и инфекция), и предоставить более репрезентативный образец поверхности слизистой оболочки, а кистевой забор показал относительно большое соотношение бактериальной ДНК к ДНК хозяина (Huse et al. , 2014). Хотя сообщалось, что альфа-разнообразие образцов, собранных с помощью BABD и метода PSB, одинаково на уровне филума, метод PSB обеспечивает образцы с более высокой долей бактериальной гДНК (Shanahan et al., 2016). Другое исследование, однако, показало, что существуют пространственные различия между микробиотой просвета и слизистой оболочки (Lavelle et al., 2015). Поскольку отбор проб с использованием технологии PSB зависит от эндоскопии, этот метод имеет те же недостатки, что и биопсия, такие как влияние подготовки кишечника, неизбежное заражение и инвазия.
Микродиссекция лазерного захвата
Лазерная микродиссекция (LCM) была разработана для преодоления недостатков методов микродиссекции тканей. LCM избирательно приклеивает интересующие материалы к тонкой прозрачной пленке на срезе ткани с помощью импульса инфракрасного лазера (Emmert-Buck et al., 1996). Затем тонкую пленку с полученной тканью удаляют со среза и обрабатывают непосредственно ДНК, РНК или ферментным буфером. Следовательно, эта способность избирательно переносить небольшую фокальную область ткани или кластеров клеток на пленку может быть использована для получения слоев слизистого геля на поверхности образцов биопсии кишечника. Прежде чем образцы LCM можно будет проанализировать, замороженные образцы биопсии необходимо разрезать на 10-микронные срезы, а затем поместить на предметные стекла, свободные от нуклеаз и нуклеиновых кислот, и высушить на воздухе в течение ночи.Чтобы с высокой точностью улавливать микробы между складками толстой кишки мышей, Nava et al. использовали LCM, чтобы обнаружить, что микробы в межслойной области значительно отличаются от микробов в центральном просвете (Nava et al., 2011). Хотя максимальный размер области между складками составляет ~ 100 мкм, высокое разрешение LCM ~ 5 мкм позволяет легко и точно отобрать образцы. Дифференциация между просветом и слизистой оболочкой была очевидна при использовании LCM для взятия образцов слоя слизистого геля из быстро замороженных биоптатов (Lavelle et al., 2015). Обнаруживаемая бактериальная нагрузка у пациентов с ЯК, измеренная с помощью целевых LCM и количественной ПЦР, была ниже, чем у контрольной группы (Rowan et al., 2010). Таким образом, LCM обеспечивает простой, точный и эффективный метод получения бактерий в области слизистой оболочки для анализа взаимодействий микробиоты, связанных со слизистой оболочкой хозяина. LCM может быть подходящим для точной медицины, но утомительная процедура ограничивает его использование в крупномасштабных исследованиях. То, что ограничивает точность LCM, может заключаться в том, что источником образца является биопсия, которая имеет свои недостатки, в основном деградацию нуклеиновых кислот, например.ж., РНК и недостаточное количество образца.
Образцы аспирированной кишечной жидкости
Для аспирации незагрязненной кишечной жидкости Шайнер изобрел капсулу из нержавеющей стали, снабженную колпачком на ее дистальном конце и полым соединением на проксимальном конце (SHINER, 1963). Проксимальный конец капсулы через трубку соединен с источником отрицательного давления. При достижении места отбора проб всасывание с отрицательным давлением приводит к открытию пробоотборного канала капсулы, и окружающая жидкость попадает в камеру капсулы.После аспирации капсула снова закрывается, и собранные образцы изолируются от внешней жидкости. Преимущество этого устройства заключается в том, что отобранные образцы не загрязняются содержимым желудочно-кишечного тракта в местах, где отбор образцов не производится. Из-за сложной конструкции этот метод не получил широкого распространения. После этого прогресс в получении жидкости желудочно-кишечного тракта заключался в разработке специально изготовленной двухпросветной трубки с множеством аспирационных портов в разных местах и наполненным ртутью мешком на ее дистальном конце (Kalser et al., 1966). Субъекты проглатывали трубку, а затем аспираты отсасывали стерильным шприцем, когда порты находились в правильном положении (75 см дистальнее связки Трейца для аспиратов тощей кишки и 75 см проксимальнее илеоцекального клапана для аспиратов подвздошной кишки). Белов и др. аспирировали кишечную жидкость через назоеюнальные трубки, обычно вводимые для энтерального питания (Belov et al., 1999). Однако вязкая кишечная жидкость и закупорка трубок усложняли процедуру сбора и делали ее трудоемкой.
В настоящее время для получения кишечной жидкости наиболее часто используется эндоскопическая аспирация. Обычно предполагается, что аспирация и посев жидкости тонкого кишечника являются золотым стандартом для диагностики избыточного бактериального роста в тонком кишечнике, который определяется как ≥ 10 5 колониеобразующих единиц на миллилитр (КОЕ / мл) при посеве аспирированного жидкость (Khoshini et al., 2008; Grace et al., 2013; Erdogan et al., 2015). Недавнее исследование, основанное на культуре аспирата двенадцатиперстной кишки, продемонстрировало, что SIBO связан с чрезмерным ростом анаэробов и что микробный состав тонкой кишки у пациентов с симптомами значительно изменился, что несовместимо с результатами аспирационной культуры (Saffouri et al., 2019).
Рабочий канал эндоскопа легко загрязняется содержимым полости рта и желудочно-кишечного тракта. Резину покрывали дистальный конец катетера, чтобы заблокировать инфильтрацию кишечной жидкости (Uno et al., 1998). Вдохновленный предыдущими исследованиями, Quintanilha et al. использовали мембрану из микрофильмов для защиты дистального конца во избежание внутреннего загрязнения (Quintanilha et al., 2007). Поскольку эндоскопическая биопсия агрессивна для здоровых людей, альтернативным вариантом стало отсасывание кишечной жидкости.Тем не менее, отсасывание кишечной жидкости иногда занимает много времени, что увеличивает время эндоскопии и иногда оказывается неудачным из-за разреженности кишечной жидкости (Riordan et al., 1995). Хотя в предыдущих исследованиях были приложены большие усилия для минимизации сопутствующего загрязнения во время всасывания кишечной жидкости, врожденные дефекты при отборе эндоскопических образцов неизбежны, как упоминалось выше. Более того, неопределенность мест отбора проб также создает проблемы для получения надежных проб.
Образцы из хирургии
Когда при эндоскопии трудно достичь дистального отдела подвздошной кишки, хирургическое вмешательство дает нам возможность взять образец из дистального отдела подвздошной кишки.Методы получения кишечной флоры во время операции включают прямую пункционную аспирацию или биопсию образцов слизистой оболочки (Bentley et al., 1972; Corrodi et al., 1978; Thadepalli et al., 1979; Lavelle et al., 2015). Поскольку хирургический отбор образцов не подвержен загрязнению, теоретически образцы, полученные с помощью этого метода, лучше всего представляют микробиоту кишечника. Однако реальность такова, что перед операцией необходимо провести несколько подготовительных мероприятий. Эти препараты могут включать голодание, механическое очищение кишечника и прием антибиотиков, все из которых могут нарушить микробиоту (Antonopoulos et al., 2009; Убеда и Памер, 2012; Феррер и др., 2014; Зарринпар и др., 2014; Яланка и др., 2015). В этом контексте Thadepalli et al. брали двенадцатиперстную, тощую и подвздошную жидкость у пациентов с травмой живота, требующей экстренной лапаротомии с помощью пункционной аспирации для исследования микробиоты тонкой кишки. Ни один из пациентов не проходил плановую предоперационную подготовку; Следовательно, эти образцы, полученные без вмешательства предоперационной подготовки, были в идеальном состоянии. Кроме того, отбор проб во время операции также может обойти проблему недоступности тонкого кишечника за счет использования модельных систем in vivo (Booijink et al., 2007). Пациенты, перенесшие илеостомию, могут использоваться в качестве модели in vivo и обеспечивать сток из илеостомы для получения микробиоты кишечника (Go et al., 1988; Ala Aldeen and Barer, 1989). Zoetendal et al. продемонстрировали, что общие микробные компоненты в образцах, выделенных илеостомами (люди без толстой кишки), также могут быть обнаружены в тонком кишечнике здоровых субъектов с помощью филогенетических анализов микрочипов (Zoetendal et al., 2012). По сравнению с микробиотой толстой кишки микробиота в стоках подвздошной кишки относительно нестабильна и менее сложна и состоит из различных доминирующих филотипов (Booijink et al., 2010). Более того, модели in vivo также можно использовать для изучения влияния диеты на кишечную флору. Йонссон и др. исследовали влияние потребления клетчатки на сегментированные нитчатые бактерии, собирая образцы илеостомы человека (Jonsson, 2013). В дополнение к указанным выше методам Haysahi et al. получили образцы кишечного содержимого при аутопсии и продемонстрировали градиентное распределение количества ОТЕ от проксимального до дистального конца кишечника (Hayashi et al., 2005). Хотя модель in vivo обеспечивает удобство отбора проб в любое время, сама операция приводит к значительным изменениям в составе кишечной микробиоты, которые сохраняются в течение длительного времени (Guyton and Alverdy, 2017). Илеостомия изменяет анатомическую структуру кишечника, что может необратимо повлиять на состав микробиоты кишечника. Таким образом, неясно, подходят ли результаты исследования, основанные на эффлюенте илеостомии, для людей с нормальным анатомическим строением.Поскольку операция является инвазивной, получение образца у здоровых людей кажется невозможным. Очевидно, что хирургическое применение операции и вскрытия ограничено. Хирургия не способствует всестороннему анализу взаимосвязи между бактериальной флорой и заболеваниями в разных популяциях.
Импульсные устройства для отбора проб
Недостатки вышеупомянутых методов кажутся непреодолимыми, и исследователи прилагают усилия для разработки новых устройств для отбора проб. На сегодняшний день для наблюдения за кишечником и доставки лекарств использовалось множество глотательных устройств.Из-за неинвазивных характеристик устройств для проглатывания все чаще рассматривается их использование для сбора кишечного содержимого. Основываясь на технологии микроэлектромеханических систем (MEMS), Cui et al. изобрел проглатывающуюся капсулу, которая может доставлять лекарства и собирать кишечную жидкость (Cui et al., 2008). Характеристики расположения желудочно-кишечного тракта, беспроводная связь и большой размер образца дают капсуле возможность автоматически собирать кишечную жидкость. Однако недостатком этого устройства является то, что собранный образец легко загрязняется находящейся ниже по потоку жидкостью.В последние годы NIZO разработала интеллектуальную капсулу для отбора проб микробиома из тонкого кишечника, объединив систему IntelliCap ® и гаситель. Система IntelliCap ® представляет собой проглатывающуюся капсулу, которая содержит датчики pH и температуры, коммуникационные блоки, микрокомпьютеры, двигатели и батареи. Тушитель — это емкость, помещенная в капсулу для качественного и количественного сохранения микробиоты. Капсулы можно расположить путем измерения значительных изменений pH в желудочно-кишечном тракте (Koziolek et al., 2015). Когда проглоченная капсула достигает обозначенной области тонкой кишки, можно начинать аспирацию кишечной жидкости. Аспирированная кишечная жидкость может быть собрана после выхода капсулы из организма. Недавно Rezaei Nejad et al. также сообщил о таблетке для аспирации жидкости из тонкого кишечника, напечатанной на 3D-принтере (Rezaei Nejad et al., 2019). Эта таблетка содержит полупроницаемую мембрану для разделения спиральных каналов и солевой камеры. Более высокое осмотическое давление на стороне соляной камеры заставляет жидкость в спиральных каналах течь в камеру через полупроницаемую мембрану.Затем кишечная жидкость может быть аспирирована через входные отверстия, соединенные со спиральными каналами. Внешняя оболочка кишечной капсулы обеспечивает начало сбора в тонком кишечнике. По сравнению с капсулой NIZO, стоимость этой безбатарейной таблетки наверняка будет намного ниже. Однако проблема сохранения образцов после сбора, по-видимому, не решена, что может привести к загрязнению образцов кишечной жидкостью из мест, где они не собирались.
Наша настоящая работа сосредоточена на отборе образцов кишечной жидкости малоинвазивными методами.Мы также исследовали недорогое и удобное капсульное устройство «Аспирация микробиома кишечника» (IMBA), которое предназначено для автономного сбора образцов кишечной жидкости. Без использования дорогостоящих технологий микроэлектромеханических систем, IMBA использует технологию контролируемого высвобождения, оснащенную новым механизмом отбора проб для достижения точного и регионального отбора проб в кишечнике. Более того, форма капсул улучшает комплаентность пациента, а условия отбора проб, близкие к физиологическому состоянию (нет необходимости в подготовке кишечника), обеспечивают более высокую точность.Ключ к этой технологии — как точно определить местонахождение и собрать кишечную жидкость.
Инструменты, связанные с биологией
В дополнение к составу и разнообразию микробиоты кишечника, их пространственная организация также отражает отношения хозяина и микробиоты. Чтобы получить полную структуру кишечника и его содержимого, Johansson et al. улучшили гистологические препараты, которые успешно сохранили кишечную слизь и локализовали бактерии с флуоресценцией in situ гибридизации (FISH) (Johansson and Hansson, 2012).Используя технологию FISH, местоположение интересующих бактерий, помеченных флуоресцентным ДНК-зондом, можно наблюдать под флуоресцентным микроскопом. Однако из-за трудностей при отборе проб, этических проблем и огромных индивидуальных различий в микробном составе исследования и манипуляции с микробными сообществами кишечника человека in situ ограничены. В качестве альтернативы широко используется трансплантация кишечной микробиоты человека стерильным мышам (Goodman et al., 2011; McNulty et al., 2013). Чтобы изучить пространственную организацию микробиоты кишечника человека, Earle et al. разработали новый подход, который визуализирует бактерии у мышей-гнотобиотов, колонизированных человеческой микробиотой, с помощью FISH (Earle et al., 2015). Они инокулировали флуоресцентный зонд, соответствующий интересующим бактериям, в фиксированные поперечные срезы кишечника мыши. Однако одно поле зрения в разрезе не может отображать весь кишечник. Чтобы решить эту проблему, было разработано программное обеспечение Bacspace, которое сшивает перекрывающиеся изображения нескольких полей зрения в непрерывное изображение, которое представляет весь кишечник, позволяет отличать эпителиальные клетки хозяина от бактерий и измерять расстояние между бактериальными клетками и между бактериальными клетками и эпителием.Используя Bacspace, они выявили гомологичную кластеризацию в пределах Bacteroidales или Firmicutes , которые объединяют Bacteroidales , которые исключают Firmicutes и наоборот. Более того, применение FISH в сочетании с методами анализа спектральной визуализации раскрыло пространственную организацию мышей-гнотобиотов, колонизированных 15-членной микробиотой кишечника человека (Welch et al., 2017). В толстой кишке есть две густо колонизированные области: одна прилегает к слизистой оболочке, а другая граничит с частицами пищи в просвете.Небольшие различия в составе микробиоты в этих двух регионах позволяют предположить, что просвет и слизистую оболочку не следует определять как стратифицированные компартменты. Из-за различий в плотности микробов между тонкой и толстой кишкой на порядки количество микробов в поперечном сечении тонкой кишки в 10–1 миллион раз меньше, чем в толстой кишке. То есть, по сравнению с 1000 бактериями на поле зрения в толстой кишке, в тонком кишечнике почти нет бактерий.Из-за более высокой микробной плотности гистологический метод больше подходит для толстой кишки. Неправильная подготовка образца также может привести к потере содержимого кишечника на участках. По сравнению с другими методами метод внедрения Technovit h8100 может успешно сохранять трехмерную структуру кишечника и совместим с FISH и другими методами маркировки для визуализации микробных клеток в кишечнике мышей вместе со слизью и фекальными гранулами (Hasegawa et al. ., 2017). Эти методы визуализации могут одновременно обнаруживать некоторые культивируемые микробы с помощью флуоресцентных зондов, которые требуют предварительного проектирования, но они не могут иметь дело со сложными и разнообразными микробиомами. Для беспристрастного анализа сложной микробной биогеографии кишечника с высоким таксономическим разрешением Ravi et al. разработали выборку метагеномного графика путем секвенирования, который может анализировать пространственное расположение различных микробов без предварительного уточнения (Sheth et al., 2019). Они обнаружили, что сильная связь между Bacteroides во всех полостях кишечника и локальными областями бактериальной филогении и агрегации была связана с нарушением питания.Хотя установление микробиоты кишечника человека у мышей, свободных от микробов, дает нам решение проблемы отбора проб из кишечника человека, нельзя игнорировать влияние разницы в генном фоне на состав микробиоты (Wos-Oxley et al. ., 2012). В то же время на формирование микрофлоры кишечника человека у стерильных мышей также повлияет операция бактериальной трансплантации. Есть несколько моментов, на которые следует обратить внимание при оральном введении желудочного зонда.Из-за присутствия анаэробных бактерий во флоре человека их необходимо быстро ввести в пищеварительный тракт. Большой объем введения будет способствовать распространению и колонизации кишечного микробного сообщества мышей и защищать микробиоту от кишечных ферментов и изменений pH, а некоторые диеты для грызунов могут также стимулировать или подавлять рост некоторых бактерий (Rodriguez-Palacios et al., 2019) По сравнению с контрольной группой, мыши без микробов имеют значительно более длительное время прохождения через кишечник вместе с более низкими уровнями SCFAs, которые образуются в результате ферментации неперевариваемых углеводов комменсальными бактериями и могут способствовать опорожнению кишечника (Vincent et al., 2018). Колонизация различных линий у стерильных мышей может влиять на перистальтику кишечника, влияя на уровень SCFA, что приводит к разному количеству фекальных гранул в толстой кишке. Следовательно, соотношение между бактериями и фекальными гранулами в отделе толстой кишки может немного отличаться.
Перспектива
Несмотря на значительные усилия исследователей по получению точных образцов, недостатки существующих методов отбора проб непреодолимы. Получение точных результатов из неточных образцов будет затруднительно.Фекалии стали источником образцов для большинства исследований бактериальной флоры из-за их удобства и неинвазивного характера, но даже содержание микробиоты в нижних отделах пищеварительного тракта, которое ближе всего к фекалиям, значительно отличается от такового в фекалиях (Zmora et al. , 2018). Большинство остальных методов отбора проб являются инвазивными и не подходят для здоровых людей. Вопросы, которые необходимо решить в будущих методах отбора проб, должны включать снижение инвазивности, отбор проб без перекрестного загрязнения в фиксированных точках и минимизацию нарушений нормальной физиологии кишечника.
Точность образцов оказывает заметное влияние на ценность исследований микробиоты кишечника; поэтому необходимы более точные методы отбора проб для обеспечения надежности исследования. Конструкция будущих оптимальных устройств для сбора кишечной микробиоты должна соответствовать следующим требованиям. Во-первых, устройства могут эффективно собирать кишечное содержимое в фиксированной точке и предотвращать перекрестное загрязнение образцов. Во-вторых, размер устройств должен быть небольшим, чтобы обеспечить беспрепятственный проход через привратник и илеоцекальный клапан.Кроме того, устройство имеет простую конструкцию и удобство в эксплуатации, а процесс отбора проб вызывает меньше психологического давления и дискомфорта. Материал, используемый в производственном оборудовании, должен быть нетоксичным, безвредным, нетератогенным и неканцерогенным. Более того, стоимость устройств также является ключевым фактором при проведении крупных когортных исследований. Наконец, учитывая, что подготовка кишечника оказывает большее влияние на состав микробиоты кишечника, новые технологии лучше всего устраняют эту процедуру. Ввиду недостатков существующих методов отбора проб, разработка более точных методов отбора проб имеет решающее значение для будущих исследований микробиоты кишечника.Для удовлетворения этих требований разработка глотательных устройств представляется наиболее целесообразным методом. В будущем небольшие автономные устройства для отбора проб позволят исследователям и клиницистам изучать кишечную флору со специфичностью, локализацией и чувствительностью. С другой стороны, пространственная структура кишечной флоры также является важным компонентом изучения взаимодействия между флорой и хозяином. По этическим причинам нецелесообразно собирать образцы, содержащие информацию о позиционных отношениях между микробами и кишечником.В качестве альтернативы установление микробиоты кишечника человека у мышей-гнотобиотов также дает нам решение трудностей отбора проб. Хотя флуоресцентная визуализация не может изучать сложные микробиомы, применение объективной пространственной макрогеномики у мышей-гнотобиотов значительно продвинет наше понимание пространственной организации кишечной микробиоты.
Авторские взносы
QT, GJ, GW, BW и HC разработали исследование. QT, GJ, GW, TL и XL собрали и проанализировали соответствующую информацию.QT, GJ, GW и HC написали статью. Все авторы принимали участие в окончательном утверждении статьи.
Финансирование
Это исследование было поддержано грантами (81570478, 81741075) Национального фонда естественных наук Китая, грантом (17JCYBJC24900) Фонда естественных наук Тяньцзиня и грантом (2019M651049) Фонда постдокторской науки Китая.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Алмейда А., Митчелл А. Л., Боланд М., Форстер С. К., Глор Г. Б., Тарковска А. и др. (2019). Новый геномный план микробиоты кишечника человека. Природа 568, 499–504. DOI: 10.1038 / s41586-019-0965-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Антонопулос, Д. А., Хьюз, С. М., Моррисон, Х. Г., Шмидт, Т. М., Согин, М. Л., и Янг, В. Б. (2009). Воспроизводимая динамика сообщества микробиоты желудочно-кишечного тракта после воздействия антибиотиков. Заражение. Иммун. 77, 2367–2375. DOI: 10.1128 / IAI.01520-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bäckhed, F., Roswall, J., Peng, Y., Feng, Q., Jia, H., Kovatcheva-Datchary, P., et al. (2015). Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин 17, 690–703. DOI: 10.1016 / j.chom.2015.04.004
CrossRef Полный текст | Google Scholar
Белов Л., Мехер-Хомджи В., Путасвами В. и Миллер Р. (1999). Вестерн-блот-анализ желчи или кишечной жидкости пациентов с септическим шоком или синдромом системной воспалительной реакции с использованием антител к TNF-альфа, IL-1 альфа и IL-1 бета. Immunol. Cell Biol. 77, 34–40. DOI: 10.1046 / j.1440-1711.1999.00796.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бентли Д. У., Николс Р. Л., Кондон Р. Э. и Горбач С. Л. (1972). Микрофлора подвздошной и внутрибрюшной толстой кишки человека: результаты прямой пункционной аспирации во время операции и оценка методики. J. Lab. Clin. Med. 79, 421–429.
PubMed Аннотация | Google Scholar
Блэнтон, Л. В., Шарбонно, М. Р., Салих, Т., Баррат, М. Дж., Венкатеш, С., Илкавея, О., и др. (2016). Кишечные бактерии, предотвращающие нарушение роста, передаваемое микробиотой от недоедающих детей. Наука 80: 351. DOI: 10.1126 / science.aad3311
CrossRef Полный текст | Google Scholar
Booijink, C. C. G. M., Эль-Айди, С., Раджилич-Стоянович, М., Heilig, H.G.H.J., Troost, F.J., Smidt, H., et al. (2010). В микробиоте подвздошной кишки человека обнаружены высокие временные и межиндивидуальные вариации. Environ. Microbiol. 12, 3213–3227. DOI: 10.1111 / j.1462-2920.2010.02294.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Booijink, C. C. G. M., Zoetendal, E. G., Kleerebezem, M., and de Vos, W. M. (2007). Сообщества микробов в тонком кишечнике человека: сочетание разнообразия с метагеномикой. Future Microbiol. 2, 285–295. DOI: 10.2217 / 17460913.2.3.285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bucher, P., Gervaz, P., Egger, J.F., Soravia, C., and Morel, P. (2006). Морфологические изменения, связанные с механической подготовкой кишечника перед плановой колоректальной операцией: рандомизированное исследование. Dis. Двоеточие. Прямая кишка. 49, 109–112. DOI: 10.1007 / s10350-005-0215-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэрролл, И.М., Чанг, Ю.-Х., Парк, Дж., Сартор, Р. Б., и Рингель, Ю. (2010). Микробиота кишечника, связанная с просветом и слизистыми оболочками, у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Gut Pathog. 2:19. DOI: 10.1186 / 1757-4749-2-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэрролл И. М., Рингель-Кулька Т., Сиддл Дж. П., Клаенхаммер Т. Р. и Рингель Ю. (2012). Характеристика фекальной микробиоты с помощью высокопроизводительного секвенирования показывает стабильное микробное сообщество во время хранения. PLoS ONE 7: e46953. DOI: 10.1371 / journal.pone.0046953
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарбонно, М. Р., О’Доннелл, Д., Блэнтон, Л. В., Тоттен, С. М., Дэвис, Дж. К. С., Баррат, М. Дж. И др. (2016). Сиалированные олигосахариды молока способствуют росту, зависящему от микробиоты, в моделях недоедания младенцев. Ячейка 164, 859–871. DOI: 10.1016 / j.cell.2016.01.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корроди, П., Уайдман, П. А., Саттер, В. Л., Дреник, Э. Дж., Пассаро, Э., и Финеголд, С. М. (1978). Бактериальная флора тонкой кишки до и после процедуры шунтирования при патологическом ожирении. J. Infect. Дис. 137, 1–6. DOI: 10.1093 / infdis / 137.1.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Дж., Чжэн, X., Хоу, В., Чжуан, Ю., Пи, X. и Ян, Дж. (2008). Изучение дистанционно управляемой системы доставки и отбора проб желудочно-кишечного тракта. Телемед.J. E. Health. 14, 715–719. DOI: 10.1089 / tmj.2007.0118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дункан, С. Х., Беленгер, А., Холтроп, Г., Джонстон, А. М., Флинт, Х. Дж., И Лобли, Г. Э. (2007). Снижение потребления углеводов с пищей у людей с ожирением приводит к снижению концентрации бутирата и бутират-продуцирующих бактерий в фекалиях. Заявл. Environ. Microbiol. 73, 1073–1078. DOI: 10.1128 / AEM.02340-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Данн, А.Б., Джордан, С., Бейкер, Б. Дж., И Карлсон, Н. С. (2017). Материнский микробиом младенца: соображения для родов и родов. MCN. Являюсь. J. Matern. Детские медсестры. 42, 318–325. DOI: 10.1097 / NMC.0000000000000373
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрл, К. А., Биллингс, Г., Сигал, М., Лихтман, Дж. С., Ханссон, Г. К., Элиас, Дж. Э. и др. (2015). Количественная визуализация пространственной организации кишечной микробиоты. Клеточный микроб-хозяин 18, 478–488.DOI: 10.1016 / j.chom.2015.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эммерт-Бак, М. Р., Боннер, Р. Ф., Смит, П. Д., Чуаки, Р. Ф., Чжуан, З., Гольдштейн, С. Р. и др. (1996). Лазерная микродиссекция. Наука 274, 998–1001. DOI: 10.1126 / science.274.5289.998
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрдоган А., Рао С. С., Галли Д., Джейкобс К., Ли Ю. Ю. и Баджер К. (2015).Избыточный бактериальный рост в тонком кишечнике: дуоденальная аспирация против дыхательного теста на глюкозу. Нейрогастроэнтерол. Мотил. 27, 481–489. DOI: 10.1111 / nmo.12516
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррер М., Мартинс душ Сантуш, В. А. П., Отт, С. Дж., И Мойя, А. (2014). Нарушение микробиоты кишечника во время терапии антибиотиками: многомерный подход. Кишечные микробы 5, 64–70. DOI: 10.4161 / gmic.27128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Флорес, Р., Shi, J., Yu, G., Ma, B., Ravel, J., Goedert, J. J., et al. (2015). Среда для сбора и эффекты замедленного замораживания на микробный состав человеческого стула. Микробиом 3:33. DOI: 10.1186 / s40168-015-0092-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фостер, К. Р., Шлютер, Дж., Койт, К. З., и Ракофф-Нахум, С. (2017). Эволюция микробиома хозяина как экосистемы на привязи. Природа 548, 43–51. DOI: 10.1038 / природа23292
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фухи, Ф., Дин, Дж., Ри, М. К., О’Салливан, О., Росс, Р. П., О’Каллаган, Г. и др. (2015). Воздействие замораживания на фекальную микробиоту, определенное с помощью секвенирования MiSeq и исследований на основе культур. PLoS ONE 10: e0119355. DOI: 10.1371 / journal.pone.0119355
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, П. М., ван Дийен-Виссер, М. П., Дэвис, Б. И., Ленс, Дж., И Бромбахер, П. Дж. (1988). Микробная флора и метаболизм желчных кислот у пациентов с подвздошным резервуаром. Сканд. J. Gastroenterol. 23, 229–36.
PubMed Аннотация | Google Scholar
Гудман А. Л., Каллстром Г., Фейт Дж. Дж., Рейес А., Мур А., Дантас Г. и др. (2011). Обширные персональные коллекции культур микробиоты кишечника человека, охарактеризованные и обработанные на мышах-гнотобиотах. Proc. Natl. Акад. Sci. США. 108, 6252–6257. DOI: 10.1073 / pnas.1102938108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Горжелак, М.А., Гилл, С. К., Тасним, Н., Ахмади-Ванд, З., Джей, М., и Гибсон, Д. Л. (2015). Методы улучшения данных микробиома кишечника человека за счет уменьшения вариабельности за счет обработки образцов и хранения стула. PLoS ONE 10: e0134802. DOI: 10.1371 / journal.pone.0134802
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грейс, Э., Шоу, К., Уилан, К., Андреев, Х. Дж. Н. (2013). Обзорная статья: избыточный бактериальный рост в тонком кишечнике — распространенность, клинические особенности, текущие и разрабатываемые диагностические тесты и лечение. Алимент. Pharmacol. Ther. 38, 674–688. DOI: 10.1111 / apt.12456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хасегава Ю., Марк Уэлч, Дж. Л., Россетти, Б. Дж., И Бориси, Г. Г. (2017). Сохранение трехмерной пространственной структуры микробиома кишечника. PLoS ONE 12: e188257. DOI: 10.1371 / journal.pone.0188257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаяси, Х., Такахаши, Р., Ниси, Т., Сакамото, М., Бенно, Ю. (2005). Молекулярный анализ микробиоты толстой кишки человека тощей, подвздошной, слепой и ректо-сигмоидальной кишки с использованием библиотек генов 16S рРНК и полиморфизма длин концевых рестрикционных фрагментов. J. Med. Microbiol. 54, 1093–1101. DOI: 10.1099 / jmm.0.45935-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heinsen, F.-A., Knecht, H., Neulinger, S.C., Schmitz, R.A., Knecht, C., Kühbacher, T., et al. (2015). Динамические изменения микробиоты просвета и слизистой оболочки кишечника во время и после антибактериальной терапии паромомицином. Кишечные микробы 6, 243–254. DOI: 10.1080 / 194.2015.1062959
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hsieh, Y.-H., Peterson, C.M., Raggio, A., Keenan, M.J., Martin, R.J., Ravussin, E., et al. (2016). Влияние различных методов обработки фекалий на оценку бактериального разнообразия в кишечнике человека. Фронт. Microbiol. 7: 1643. DOI: 10.3389 / fmicb.2016.01643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Huse, S.М., Янг, В. Б., Моррисон, Х. Г., Антонопулос, Д. А., Квон, Дж., Далал, С. и др. (2014). Сравнение методов взятия пробы кистью и биопсии подвздошной кишки для оценки микробиоты слизистой оболочки людей. Микробиом 2: 5. DOI: 10.1186 / 2049-2618-2-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jalanka, J., Salonen, A., Salojärvi, J., Ritari, J., Immonen, O., Marciani, L., et al. (2015). Влияние очищения кишечника на микробиоту кишечника. Кишечник 64, 1562–1568. DOI: 10.1136 / gutjnl-2014-307240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йоханссон, М. Е. В., и Ханссон, Г. К. (2012). Сохранение слизи в гистологических срезах, иммуноокрашивание муцинов в фиксированной ткани и локализация бактерий с помощью FISH. Methods Mol. Биол. 842, 229–235. DOI: 10.1007 / 978-1-61779-513-8_13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кальзер, М.H., Cohen, R., Arteaga, I., Yawn, E., Mayoral, L., Hoffert, W., et al. (1966). Нормальная вирусная и бактериальная флора тонкого и толстого кишечника человека. N. Engl. J. Med. 274, 558–63. DOI: 10.1056 / NEJM196603102741006
CrossRef Полный текст | Google Scholar
Хошини Р., Дай С. К., Лескано С. и Пиментел М. (2008). Систематический обзор диагностических тестов избыточного бактериального роста в тонком кишечнике. Dig. Дис. Sci. 53, 1443–1454. DOI: 10.1007 / s10620-007-0065-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, С., Ковингтон А. и Памер Э. Г. (2017). Микробиота кишечника: антибиотики, резистентность к колонизации и кишечные патогены. Immunol. Ред. 279, 90–105. DOI: 10.1111 / imr.12563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Козиолек, М., Гримм, М., Беккер, Д., Иорданов, В., Зоу, Х., Шимицу, Дж. И др. (2015). Исследование профилей pH и температуры в желудочно-кишечном тракте голодных людей с использованием системы intellicap ® . Дж.Pharm. Sci. 104, 2855–2863. DOI: 10.1002 / jps.24274
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ла Роса, П. С., Уорнер, Б. Б., Чжоу, Ю., Вайншток, Г. М., Содергрен, Э., Холл-Мур, К. М. и др. (2014). Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc. Natl. Акад. Sci. США. 111, 12522–12527. DOI: 10.1073 / pnas.1409497111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лавель, А., Леннон, Г., Дочерти, Н., Балф, А., Малкахи, Х.Э., Доэрти, Г. и др. (2013). Зависимые от глубины различия в структуре сообщества микробиоты толстой кишки человека в состоянии здоровья. PLoS ONE 8: e78835. DOI: 10.1371 / journal.pone.0078835
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лавель А., Леннон Г., О’Салливан О., Дочерти Н., Балф А., Магуайр А. и др. (2015). Пространственная изменчивость микробиоты толстой кишки у пациентов с язвенным колитом и контрольных добровольцев. Кишечник 64, 1553–1561. DOI: 10.1136 / gutjnl-2014-307873
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Тиноко Р., Эльмен Л., Сегота И., Сиань Ю., Фудзита Ю. и др. (2019). Зависящий от микробиоты кишечника противоопухолевый иммунитет ограничивает рост меланомы у мышей Rnf5 — / -. Nat. Commun. 10: 1492. DOI: 10.1038 / s41467-019-09525-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ллойд-Прайс, Дж., Арзе, К., Анантакришнан, А.Н., Ширмер М., Авила-Пачеко Дж., Пун Т. В. и др. (2019). Многокомпонентность микробной экосистемы кишечника при воспалительных заболеваниях кишечника. Природа 569, 655–662. DOI: 10.1038 / s41586-019-1237-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макферсон, А. Дж., Де Агуэро, М. Г., и Ганал-Вонарбург, С. К. (2017). Как питание и материнская микробиота формируют иммунную систему новорожденного. Nat. Rev. Immunol. 17, 508–517. DOI: 10.1038 / шт.2017,58
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакНалти, Н. П., Ву, М., Эриксон, А. Р., Пэн, К., Эриксон, Б. К., Мартенс, Е. С. и др. (2013). Влияние диеты на использование ресурсов модельной кишечной микробиотой человека, содержащей Bacteroides cellulosilyticus Wh3, симбионт с обширным гликобиомом. PLoS Biol. 11: e1637. DOI: 10.1371 / journal.pbio.1001637
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нава, Г.М., Фридрихсен, Х. Дж., И Стаппенбек, Т. С. (2011). Пространственная организация кишечной микробиоты восходящей ободочной кишки мышей. ISME J. 5, 627–638. DOI: 10.1038 / ismej.2010.161
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Quintanilha, A.G., Zilberstein, B., Santos, M.A.A., Pajecki, D., Hourneaux Moura, E.G., Alves, P.R.A. и др. (2007). Новый метод отбора проб для исследования микробиоты кишечника. World J. Gastroenterol. 13, 3990–3995.DOI: 10.3748 / wjg.v13.i29.3990
CrossRef Полный текст | Google Scholar
Ранжел И., Сундин Дж., Фуэнтес С., Репсилбер Д., де Вос В. М. и Брюммер Р. Дж. (2015). Взаимосвязь между микробиотой, связанной с фекалиями и слизистыми оболочками, у пациентов с синдромом раздраженного кишечника и здоровых субъектов. Алимент. Pharmacol. Ther. 42, 1211–1221. DOI: 10.1111 / apt.13399
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Резаи Неджад, Х., Oliveira, B.C.M, Sadeqi, A., Dehkharghani, A., Kondova, I., Langermans, J.A.M, et al. (2019). Незаменимая осмотическая таблетка для отбора проб кишечного микробиома in vivo . Adv. Intell. Syst. 1: 1
CrossRef Полный текст | Google Scholar
Рингель Ю., Махаршак Н., Рингель-Кулька Т., Вольбер Э. А., Сартор Р. Б. и Кэрролл И. М. (2015). Высокопроизводительное секвенирование выявляет различные микробные популяции в нишах слизистой оболочки и просвета у здоровых людей. Кишечные микробы 6, 173–181. DOI: 10.1080 / 194.2015.1044711
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Риордан, С. М., Макивер, К. Дж., Данкомб, В. М., и Болин, Т. Д. (1995). Бактериологический анализ биоптатов слизистой оболочки для выявления избыточного бактериального роста в тонкой кишке. Сканд. J. Gastroenterol. 30, 681–685. DOI: 10.3109 / 003655295013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родригес-Паласиос, А., Хоретоненко, М.В., Илич, С. (2019). Институциональные протоколы для перорального введения (зонд) химических веществ и микроскопических микробных сообществ мышам: аналитический консенсус. Exp. Биол. Med. 244, 459–470. DOI: 10.1177 / 1535370219838203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роуэн, Ф., Дочерти, Н. Г., Мерфи, М., Мерфи, Т. Б., Коффи, Дж. К., и О’Коннелл, П. Р. (2010). Бактериальная колонизация слизистого геля крипт толстой кишки и активность заболевания при язвенном колите. Ann. Surg. 252, 869–874. DOI: 10.1097 / SLA.0b013e3181fdc54c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рассел В. Р., Грац С. В., Дункан С. Х., Холтроп Г., Инс Дж., Скобби Л. и др. (2011). Диеты для похудения с высоким содержанием белка и низким содержанием углеводов способствуют формированию профиля метаболитов, который может быть вредным для здоровья толстой кишки. Am. J. Clin. Nutr. 93, 1062–1072. DOI: 10.3945 / ajcn.110.002188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саффури, Г.Б., Шилдс-Катлер, Р. Р., Чен, Дж., Янг, Ю., Лекац, Х. Р., Хейл, В. Л. и др. (2019). Микробный дисбактериоз тонкого кишечника лежит в основе симптомов, связанных с функциональными желудочно-кишечными расстройствами. Nat. Commun. 10: 2012. DOI: 10.1038 / s41467-019-09964-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шанахан, Э. Р., Чжун, Л., Талли, Н. Дж., Моррисон, М., Хольтманн, Г. (2016). Характеристика микробиоты, связанной со слизистой оболочкой желудочно-кишечного тракта: новый метод предотвращения перекрестного загрязнения во время эндоскопических процедур. Алимент. Pharmacol. Ther. 43, 1186–1196. DOI: 10.1111 / apt.13622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шефлин, А. М., Борресен, Э. К., Кирквуд, Дж. С., Бут, К. М., Уитни, А. К., Лу, С. и др. (2017). Пищевые добавки с рисовыми отрубями или темно-синей фасолью изменяют метаболизм кишечных бактерий у выживших после колоректального рака. Мол. Nutr. Food Res. 61: 905. DOI: 10.1002 / mnfr.201500905
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шет, Р.У., Ли, М., Цзян, В., Симс, П. А., Леонг, К. В. и Ван, Х. Х. (2019). Пространственная метагеномная характеристика микробной биогеографии кишечника. Nat. Biotechnol. 37, 877–883. DOI: 10.1038 / s41587-019-0183-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шобар, Р. М., Велинени, С., Кешаварзян, А., Суонсон, Г., ДеМео, М. Т., Мелсон, Дж. Э. и др. (2016). Воздействие подготовки кишечника на показатели, связанные с микробиотой, различается для здоровья и воспалительного заболевания кишечника, а также для отделов микробиоты слизистой и просвета. Clin. Пер. Гастроэнтерол. 7: e143. DOI: 10.1038 / ctg.2015.54
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сонг, С. Дж., Амир, А., Меткалф, Дж. Л., Амато, К. Р., Сюй, З. З., Хамфри, Г. и др. (2016). Способы консервации отличаются стабильностью фекального микробиома. мСистемы 1, 1–12. DOI: 10.1128 / mSystems.00021-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Свидсински, А., Ленинг-Бауке, В., Верстрален, Х., Osowska, S., and Doerffel, Y. (2008). Биоструктура фекальной микробиоты здоровых людей и пациентов с хронической идиопатической диареей. Гастроэнтерология 135, 568–579. DOI: 10.1053 / j.gastro.2008.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tap, J., Derrien, M., Törnblom, H., Brazeilles, R., Cools-Portier, S., Dor, é, J., et al. (2017). Идентификация сигнатуры кишечной микробиоты, связанной с тяжестью синдрома раздраженного кишечника. Гастроэнтерология 152, 111–123.e8. DOI: 10.1053 / j.gastro.2016.09.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tap, J., Furet, J.-P., Bensaada, M., Philippe, C., Roth, H., Rabot, S., et al. (2015). Богатство кишечной микробиоты способствует ее стабильности при повышенном потреблении пищевых волокон у здоровых взрослых. Environ. Microbiol. 17, 4954–4964. DOI: 10.1111 / 1462-2920.13006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Теджо, Д.И., Йонкерс, Д. М. А. Э., Савелкул, П. Х., Маскли, А. А., ван Бест, Н., Пиерик, М. Дж. И др. (2015). Влияние отбора и хранения образцов на состав фекальной микробиоты у здоровых и больных людей. PLoS ONE 10: e0126685. DOI: 10.1371 / journal.pone.0126685
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тадепалли, Х., Лу, М. А., Бах, В. Т., Мацуи, Т. К., и Мандал, А. К. (1979). Микрофлора тонкого кишечника человека. Am. Дж.Surg. 138, 845–850. DOI: 10.1016 / 0002-9610 (79)
-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тропини К., Мосс, Э. Л., Меррилл, Б. Д., Нг, К. М., Хиггинботтом, С. К., Казавант, Э. П. и др. (2018). Преходящее осмотическое нарушение вызывает долговременные изменения микробиоты кишечника. Cell 173, 1742–1754.e17. DOI: 10.1016 / j.cell.2018.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уно, Ю., Мунаката, А., и Охтомо Ю. (1998). Прощание с бактериемией, вызванной эндоскопической инъекцией — эффективность нового инъекционного катетера с закрытым кончиком. Гастроинтест. Endosc. 47, 523–525.
PubMed Аннотация | Google Scholar
Винсент, А. Д., Ван, X. Y., Парсонс, С. П., Хан, В. И., и Хейзинга, Дж. Д. (2018). Аномальная абсорбционная моторная активность толстой кишки у стерильных мышей устраняется бутиратом, эффект, возможно, опосредован серотонином слизистой оболочки. Am. J. Physiol. 315, G896 – G907.DOI: 10.1152 / ajpgi.00237.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vogtmann, E., Chen, J., Kibriya, M. G., Chen, Y., Islam, T., Eunes, M., et al. (2017). Сравнение методов сбора фекалий для исследований микробиоты в Бангладеш. Заявл. Environ. Microbiol. 83:17. DOI: 10.1128 / AEM.00361-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, Z., Zolnik, C.P., Qiu, Y., Usyk, M., Wang, T., Strickler, H.D., et al. (2018). Сравнение методов сбора фекалий для исследований микробиома и метаболомики. Фронт. Клетка. Заразить. Microbiol. 8: 301. DOI: 10.3389 / fcimb.2018.00301
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ватт, Э., Геммелл, М. Р., Берри, С., Глер, М., Фаркухарсон, Ф., Луи, П. и др. (2016). Расширение анализа микробиома слизистой оболочки толстой кишки — оценка лаважа толстой кишки в качестве заместителя для эндоскопической биопсии толстой кишки. Микробиом 4:61.DOI: 10.1186 / s40168-016-0207-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэлч, Дж. Л. М., Хасегава, Ю., МакНалти, Н. П., Гордон, Дж. И., и Бориси, Г. Г. (2017). Пространственная организация модели микробиоты кишечника человека, состоящей из 15 человек, созданная у мышей-гнотобиотов. Proc. Natl. Акад. Sci. США. 114, E9105 – E9114. DOI: 10.1073 / pnas.1711596114
CrossRef Полный текст | Google Scholar
Уимберли Н., Фалинг Л. Дж. И Бартлетт Дж.Г. (1979). Метод волоконно-оптической бронхоскопии для получения незагрязненного секрета из нижних дыхательных путей для бактериального посева. Am. Преподобный Респир. Дис. 119, 337–343. DOI: 10.1164 / arrd.1979.119.3.337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wos-Oxley, M. L., Bleich, A., Oxley, A. P. A., Kahl, S., Janus, L.M., Smoczek, A., et al. (2012). Сравнительная оценка создания микробного сообщества кишечника человека на моделях грызунов. Кишечные микробы 3, 1–16.DOI: 10.4161 / gmic.19934
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, G. D., Lewis, J. D., Hoffmann, C., Chen, Y.-Y., Knight, R., Bittinger, K., et al. (2010). Методы отбора проб и пиросеквенирования для характеристики бактериальных сообществ в кишечнике человека с использованием тегов последовательности 16S. BMC Microbiol. 10: 206. DOI: 10.1186 / 1471-2180-10-206
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zarrinpar, A., Chaix, A., Yooseph, S., и Панда, С. (2014). Рацион и режим кормления влияют на суточную динамику микробиома кишечника. Cell Metab. 20, 1006–1017. DOI: 10.1016 / j.cmet.2014.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zmora, N., Zilberman-Schapira, G., Suez, J., Mor, U., Dori-Bachash, M., Bashiardes, S., et al. (2018). Персонализированная устойчивость к колонизации слизистой оболочки кишечника эмпирическими пробиотиками связана с уникальными особенностями хозяина и микробиома. Cell 174, 1388–1405.e21. DOI: 10.1016 / j.cell.2018.08.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зоетендал, Э. Г., Раес, Дж., Ван ден Богерт, Б., Арумугам, М., Буйжинк, К. К. Г. М., Трост, Ф. Дж. И др. (2012). Микробиота тонкого кишечника человека определяется быстрым поглощением и преобразованием простых углеводов. ISME J. 6, 1415–1426. DOI: 10.1038 / ismej.2011.212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зоетендаль, Э.Г., фон Райт, А., Вильппонен-Салмела, Т., Бен-Амор, К., Аккерманс, А. Д. Л., и де Вос, В. М. (2002). Бактерии, связанные со слизистой оболочкой желудочно-кишечного тракта человека, равномерно распределены по толстой кишке и отличаются от сообщества, выделенного из фекалий. Заявл. Environ. Microbiol. 68, 3401–3407. DOI: 10.1128 / aem.68.7.3401-3407.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тестирование стула в NHS: все, что вам нужно знать (2021)
Не так давно единственная причина, по которой вы должны пройти анализ стула, заключалась в том, что ваш врач хотел исключить серьезные заболевания, такие как рак или воспалительное заболевание кишечника, или вы только что вернулись из Борнео со случаем паразитарно-индуцированного заболевания. понос.
Сегодня тесты стула могут сделать гораздо больше. Хотя их до сих пор используют для выявления серьезных заболеваний и инфекций, огромные скачки в технологиях и микробиологии открыли целый новый мир: тестирование здоровья кишечника. Читайте дальше, чтобы узнать, что различные типы анализов стула могут сделать для вас и вашего кишечника.
Вернуться к началу
Содержание
Как долго длится анализ кала в системе здравоохранения?
Сколько времени нужно, чтобы получить результаты теста стула NHS?
Сколько времени длится анализ стула у Healthpath?
Сколько времени нужно, чтобы получить результаты теста стула Healthpath?
Что показывает образец стула NHS?
Что показывает тест стула Healthpath?
Почему я должен сдавать анализ стула у Healthpath?
Вам нужен анализ стула или анализ стула?
Заключение
Сколько времени занимает анализ образца стула в системе здравоохранения?
Тест стула NHS включает два элемента: сбор образца самостоятельно при дефекации и анализ образца, который обычно проводится в лаборатории.
Медицинский работник объяснит вам, как собирать образец. Обычно вы получаете чистый сухой контейнер с завинчивающейся крышкой для хранения стула и пластиковый контейнер для его «ловли». Вы должны стараться не допускать попадания в образец мочи.
Очевидно, что этот процесс довольно быстрый. Затем вам нужно будет вернуть образец в приемный врач или в больницу, а затем дождаться результатов.
К началу
Сколько времени нужно, чтобы получить результаты анализа стула NHS?
Сколько времени длится анализ стула NHS, полностью зависит от вашего индивидуального случая, например от того, на что вас проверяет врач или где проводится анализ образца (на месте или отправляется в лабораторию).Есть так много переменных, что нет стандартного ответа.
Если вы хотите знать, сколько времени потребуется, чтобы получить результаты анализа стула NHS, лучше всего спросить своего врача или члена персонала в хирургии или больнице, где вы проходили анализ.
К началу
Сколько времени длится анализ стула Healthpath?
Вы готовите тест стула Healthpath так же, как вы готовите тест для NHS: вносите депозит и собираете образец стула в небольшой контейнер.Единственное отличие состоит в том, что вместо того, чтобы отнести его к терапевту или в больницу, вы упаковываете его в стерильный контейнер, входящий в комплект для тестирования, и отправляете его в нашу лабораторию для оценки.
Все, что вам нужно для этого процесса, входит в комплект, который мы вам отправляем.
Вернуться к началу
Сколько времени нужно, чтобы получить результаты анализа стула Healthpath?
Анализ стула Healthpath занимает 14 рабочих дней. Это покрывает:
- время доставки образца в нашу лабораторию по почте
- время, необходимое ученым и техническим специалистам для анализа пробы с использованием новейших технологий
- Время, которое наши специалисты по функциональной медицине и дипломированные диетологи тратят на преобразование данных результатов теста в значимую информацию, которую вы можете использовать для улучшения здоровья кишечника
Вернуться к началу
Что показывает образец стула NHS?
NHS использует тесты стула для выявления или оценки огромного количества состояний, которые мы не можем здесь полностью описать.
Вот некоторые из наиболее распространенных:
- Рак толстой кишки
- воспалительное заболевание кишечника (например, язвенный колит и болезнь Крона)
- острая инфекция патогенными бактериями
К наиболее распространенным патогенным бактериям относятся:
- Сальмонелла, часто обнаруживаемая в сырых яйцах (даже в неповрежденных, продезинфицированных яйцах) и сырой домашней птице
- Shigella, из зараженных продуктов питания и воды
- Campylobacter, полученный из сырой или недоваренной птицы: наиболее частая причина бактериальной диареи в Великобритании
- Escherichia coli 0157: H7 (другие штаммы E.coli считаются «нормальными») содержатся в сырой или недоваренной говядине
- других включают Staphylococcus aureus, Clostridium difficile и штаммы Yersinia и Vibrio .
Вернуться к началу
Что показывает анализ стула Healthpath?
Тест стула Healthpath отличается от теста кала NHS.
Тесты кала Healthpath — это комплексные тесты кала.
Комплексные тесты стула не только позволяют выявить широкий спектр микробов в кишечнике: бактерии, дрожжи, археи, паразиты и даже черви, но также и функциональные маркеры, такие как:
Вернуться к началу
Почему я должен сдавать анализ стула Healthpath?
Если вы хотите получить представление об общем состоянии вашего кишечника или узнать, почему вы страдаете от неприятных кишечных симптомов, вам может быть полезно пройти один из наших тестов стула.Вместе информация о типах и уровнях микробов в кишечнике вместе с функциональными маркерами может помочь вам понять, что происходит в кишечнике.
Ваш кишечник делает гораздо больше, чем просто переваривает пищу.
Он играет роль в создании ваших нейротрансмиттеров (химических веществ, контролирующих ваше настроение), он влияет на ваши гормоны и, помимо прочего, содержит до 80% вашей иммунной системы.
Поскольку в вашем кишечнике происходит так много всего, что влияет на остальную часть вашего тела, дисбаланс в кишечнике может вызвать проблемы практически в любой области вашего здоровья.Некоторые из наиболее распространенных заболеваний тесно связаны с дисбактериозом кишечника (дисбаланс триллионов бактерий и других микробов в кишечнике).
Сюда входят:
Беспокойство
Дисбактериоз кишечника связан с тревогой: исследования показали, что, изменяя микробиом кишечника, мы можем улучшить симптомы тревоги (Источник: NCBI).
Депрессия
Определенные виды бактерий связаны с депрессией (Источник: PUBMED NCBI).
Экзема
Микробы кишечника помогают регулировать иммунную систему.При экземе иммунная система начинает атаковать кожу с высоким уровнем одного конкретного микроба: золотистого стафилококка, который вызывает вспышки экземы (Источник: PUBMED NCBI).
Розацеа
Люди с СИБР (чрезмерный рост бактерий в тонком кишечнике) часто страдают розацеа. Одно исследование даже показало, что лечение СИБР помогло избавиться от розацеа (Источник: PUBMED NCBI)
Псориаз
Многие кишечные заболевания связаны с псориазом (Источник: PUBMED NCBI).
Дерматит
Интересно, что удаление глютена из рациона может помочь облегчить симптомы герпетиформного дерматита, как показали это и другие исследования (Источник: NCBI).
Болезнь сердца
Многие исследования показали, что оздоровление кишечника может предотвратить или даже вылечить сердечные заболевания (Источник: PUBMED NCBI).
Болезнь Альцгеймера
Дисбактериоз кишечника вызывает воспаление, которое связывают с болезнью Альцгеймера (Источник: NCBI).
Болезнь Паркинсона
Огромное количество исследований связывает дисбактериоз и болезнь Паркинсона. В настоящее время ученые изучают новые методы лечения, воздействующие на микробиом кишечника (Источник: PUBMED NCBI).
Аутоиммунные болезни
Ваш микробиом кишечника и ваша иммунная система настолько связаны, что их трудно отделить друг от друга. Подавляющее большинство клеток, составляющих вашу иммунную систему, находится в кишечнике (Источник: PUBMED NCBI).
Мигрень
Люди с дисбактериозом кишечника чаще страдают мигренью (Источник: PUBMED NCBI).
Аллергия
Аллергия — это способ вашего тела избавиться от чего-то, что он считает захватчиком: пыльцы, молочных продуктов или чего-то еще.Уровни дисбактериоза среди населения в целом выросли вместе с увеличением количества аллергий (Источник: PUBMED NCBI).
Астма
Было обнаружено, что некоторые бактерии помогают или препятствуют ответам иммунной системы у людей с астмой (Источник: PUBMED NCBI).
Рак
Ученые обнаружили, что опухоли «общаются» с микробиомом кишечника и наоборот (Источник: NCBI).
Синдром хронической усталости
Пациенты с синдромом хронической усталости почувствовали повышение уровня энергии после изменений в микробиоме кишечника (Источник: NCBI).
Ожирение
Было показано, что восстановление микробного баланса у людей с ожирением помогает им похудеть (Источник: PUBMED NCBI).
Сахарный диабет 2 типа
Дисбаланс кишечного микробиома играет важную роль в прогрессировании диабета 2 типа (Источник: PUBMED NCBI).
Артроз
Остеоартрит — это воспалительное заболевание. Дисбаланс кишечного микробиома вызывает воспаление, которое в случае остеоартрита может возникать в суставах (Источник: NCBI).
Неалкогольная жировая болезнь печени
Неалкогольная жировая болезнь печени часто возникает одновременно с ожирением. Ученые начинают находить ответы в микробиомах нашего кишечника (Источник: NCBI).
Вернуться к началу
Вам нужен анализ стула или анализ стула?
Суть в том (извините за каламбур), что существует два основных типа тестов стула. Типы анализов стула, которые вы проходите через NHS, сильно отличаются от анализов стула, которые мы предлагаем в Healthpath.Тесты NHS ищут доказательства инфекции или заболевания.
Наши тесты стула ищут и анализируют гораздо более широкий спектр маркеров. Мы не врачи, поэтому не можем диагностировать никакие заболевания. Вместо этого мы ищем полную картину здоровья вашего кишечника, чтобы помочь вам понять, почему вы можете страдать от неприятных симптомов, и улучшить ваше самочувствие.
Вернуться к началу
Ключевые выносы
- Если врач попросил вас сделать анализ стула, вероятно, он ищет доказательства инфекции или заболевания.
- Если вы не знаете, что делать, вам следует посоветоваться с ними или с персоналом в вашей клинике или больнице.
- В настоящее время NHS не предлагает тесты стула, которые мы используем в Healthpath .
- Мы используем комплексное исследование стула: анализ здоровья кишечника. Мы не ищем болезнь или инфекцию: это может сделать только ваш врач.
- Наши тесты стула рассматривают широкий спектр маркеров: типы и уровни бактерий, дрожжей и паразитов, а также свидетельства воспаления и плохого пищеварения, чтобы вы могли увидеть, где находится ваше здоровье: кишечник.
Вернуться к началу
Автор
Александра Фалконер MA (Dist) DipCNM mBANT — сертифицированный диетолог, специализирующийся на СРК и связанных с ним состояниях. Выпускница Брайтонского колледжа натуропатической медицины, она стремится бороться с первопричинами хронических заболеваний и предоставлять функциональную медицину всем, кто в ней нуждается.
До своей естественной оздоровительной карьеры Алекс была журналистом и копирайтером. Она продолжает писать для журналов и медиа-агентств и теперь объединяет свои две великие страсти — писательство и здоровье — создавая контент, который дает людям возможность отстаивать свое право на здоровое тело и разум.
Призыв к более точным устройствам
Front Cell Infect Microbiol. 2020; 10: 151.
, 1, 2, † , 1, 2, † , 2, † , 1, 2 , 1 , 1, 2, * и 1, 2, *Qiang Tang
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
2 Тяньцзиньский институт болезней органов пищеварения, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, КитайГэ Цзинь
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
2 Тяньцзиньский институт по заболеваниям пищеварительной системы, больница общего профиля, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
Gang Wang
2 Тяньцзиньский институт болезней пищеварения, больница общего профиля, Тяньцзиньский медицинский университет, Ti Аньцзинь, Китай
Tianyu Liu
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
2 Тяньцзиньский институт болезней органов пищеварения, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
Сян Лю
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
Бангмао Ван
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет,
, Китай2 Тяньцзиньский институт болезней органов пищеварения, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
Хайлун Цао
1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
32 Тяньцзиньский институт болезней органов пищеварения, больница общего профиля, T Ияньцзиньский медицинский университет, Тяньцзинь, Китай1 Отделение гастроэнтерологии и гепатологии, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
2 Тяньцзиньский институт болезней органов пищеварения, Общая больница, Тяньцзиньский медицинский университет, Тяньцзинь, Китай
Отредактировал: Венкатакришна Рао Джала, Университет Луисвилля, США
Рецензент: Гьянендра Пракаш Дубей, Институт Пастера, Франция; Кун Чжан, Университет Содружества Вирджинии, США
Эта статья была отправлена в Microbiome in Health and Disease, раздел журнала Frontiers in Cellular and Infection Microbiology
† Эти авторы внесли равный вклад в эту работу
Получено 26 августа 2019 г. ; Принята в печать 23 марта 2020 г.
Авторские права © 2020 Тан, Цзинь, Ван, Лю, Лю, Ван и Цао.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY). Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя (ов) и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.Abstract
Развитие технологии секвенирования нового поколения позволило исследователям изучить и понять микробиом кишечника с более широкой и глубокой перспективы. Однако результаты различных исследований микробиоты кишечника сильно различаются даже при одном и том же заболевании, что затрудняет проведение клинической диагностики и лечения. Идеальный метод отбора проб должен быть неинвазивным, включать небольшое перекрестное загрязнение или подготовку кишечника и собирать микробиоту кишечника в разных местах.В настоящее время технологии секвенирования обычно основаны на образцах, взятых из фекалий, биопсии слизистой оболочки, кишечной жидкости и т. Д. Однако разные части желудочно-кишечного тракта обладают различными физиологическими характеристиками, которые важны для определенных видов живой микробиоты. Более того, существующие методы отбора проб в некоторой степени несовершенны. Например, образцы фекалий — это всего лишь косвенный показатель микробиоты кишечника, в то время как биопсии инвазивны для пациентов и не подходят для здорового контроля. В этом обзоре мы суммируем существующие методы отбора проб, их преимущества и недостатки.Также упоминаются новые технологии отбора проб, такие как устройство для асептической биопсии Брисбена и интеллектуальная капсула, которые вдохновят на разработку будущих методов точного описания микробиома кишечника.
Ключевые слова: микробиота кишечника, методы отбора проб, фекалии, биопсия, аспират
Введение
У людей сложная кишечная микробиота, состав которой варьируется в разных регионах желудочно-кишечного тракта (Zoetendal et al., 2012). Сообщалось, что количество некультивируемых видов в кишечной микробиоте достигло 1952 г. (Almeida et al., 2019). Считается, что физиологические изменения в различных областях тонкой и толстой кишки, включая химические и пищевые градиенты и изолированную иммунную активность хозяина, влияют на состав бактериальных сообществ (Donaldson et al., 2016). Микробиота кишечника играет важную роль во внутренней среде человека. Он развивается вместе с хозяином и выполняет важные физиологические функции для хозяина, такие как предотвращение заражения различными патогенами; содействие созреванию иммунной системы; участие в регуляции иммунного ответа, всасывания пищи и метаболизма; и продвижение противораковых функций (Foster et al., 2017; Ким и др., 2017; Macpherson et al., 2017; Ли и др., 2019). Колонизация микробиоты новорожденных начинается in utero (Dunn et al., 2017). Как способ родоразрешения, так и прекращение грудного вскармливания считаются важными для сборки микробиоты кишечника взрослого человека. Микробный состав резко меняется в течение 1-го года жизни (La Rosa et al., 2014; Bäckhed et al., 2015).
Микробиота кишечника постепенно изменяется со временем, и были обнаружены различия между молодыми и пожилыми людьми (O’Toole and Jeffery, 2015).Микробиота кишечника различается у разных людей из-за многих факторов, таких как гены и диета. Исследования показали, что диета с высоким содержанием углеводов и клетчатки может увеличить численность и разнообразие кишечных микроорганизмов, особенно у лиц с пониженным микробным разнообразием (Tap et al., 2015; Sheflin et al., 2017). Низкоуглеводные диеты могут значительно снизить количество бактерий, продуцирующих масляную кислоту (таких как Roseburia и Bifidobacterium ), тем самым снижая выработку масляной кислоты и уменьшая защитное действие на кишечник (Duncan et al., 2007; Russell et al., 2011). Незрелая кишечная микробиота считается одной из причин недоедания, а олигосахариды грудного молока могут уменьшить недоедание, регулируя микробиом (Blanton et al., 2016; Charbonneau et al., 2016). Более того, возникновение многих заболеваний, таких как инфекция Clostridium difficile , воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), также связано с изменением микробиоты кишечника. Длительный прием большого количества антибиотиков широкого спектра действия может привести к дисбактериозу, например, C.difficile (Stanley and Burns, 2010). По сравнению с контрольной группой, исследования кишечной микрофлоры у пациентов с ВЗК постоянно показывают изменения в составе микрофлоры и снижение общего биоразнообразия, например, увеличение факультативных анаэробов и уменьшение облигатных анаэробов (Shim, 2013; Lloyd-Price et al. , 2019). Считается, что возникновение СРК связано с микробным воздействием на коммуникацию между кишечником и мозгом (Eisenstein, 2016).
Поскольку существует множество взаимосвязей между микробиотой кишечника и здоровьем человека, особенно важно проанализировать взаимосвязь между изменениями микробиоты кишечника и возникновением, прогрессированием и прогнозом заболевания.В прошлом анализ микробиома кишечника зависел от изоляции и культур, но сложность культивирования анаэробных бактерий, которых много в кишечнике, серьезно влияла на точность анализа. В последние годы развитие секвенирования следующего поколения (NGS), которое может точно анализировать микробные компоненты без посева, привлекло внимание в исследованиях кишечного микробиома. Однако очень важно собрать соответствующие образцы кишечной микробиоты для NGS.Современные методы отбора проб для получения образцов фекалий, биопсии слизистой оболочки и кишечной аспирации, все из которых могут иметь некоторые дефекты, не могут точно отражать состав кишечного микробиома (). В этом обзоре мы обобщаем текущие методы сбора микробиоты кишечника и их возможные недостатки, чтобы изучить трудности, которые необходимо преодолеть при использовании технологий сбора микробиоты кишечника.
Таблица 1
Сравнение различных методов отбора проб для анализа кишечной микробиоты.
Обзор
Образцы фекалий
Из прагматических соображений образцы фекалий часто используются в качестве заместителей микробиоты кишечника. Образцы фекалий собираются естественным путем, неинвазивно и могут быть взяты повторно, поэтому они являются источником образцов для большинства исследований кишечной микробиоты. Однако становится все более очевидным, что могут быть значительные различия в микробном составе между слизистой оболочкой и фекалиями (Zoetendal et al., 2002; Carroll et al., 2010). Фекалии считались заменителями содержимого просвета желудочно-кишечного тракта, но их компоненты неуверенно отражают прямое взаимодействие со слизистой оболочкой.В недавних исследованиях было продемонстрировано, что микробиота, связанная с фекалиями и слизистыми оболочками, представляет собой две отдельные микробные ниши (Rangel et al., 2015; Ringel et al., 2015; Tap et al., 2017). Образцы фекалий не могут быть индикаторами состава и метагеномной функции ассоциированной со слизистой оболочкой микробиоты, распределенной по множеству участков кишечника (Zmora et al., 2018). Таким образом, оценка микробиоты кишечника с фекалиями является необъективной. Более того, фекальная микробиота неравномерно распределена в фекалиях и имеет свою собственную биоструктуру (Swidsinski et al., 2008). Wu et al. сообщили, что 35% таксонов с низкой численностью, которые составляют 0,2–0,4% от общего микробиома в одной повторности, не были обнаружены во втором образце фекалий (Wu et al., 2010). Внутрииндивидуальные вариации обнаруженных бактерий были значительно сокращены в большинстве исследований, в которых образцы фекалий или мазки гомогенизировались и игнорировалась их структура (Hsieh et al., 2016). В случае подвыборки фекалий результаты микробных таксонов, обнаруженных с помощью кПЦР, сильно варьировались (Gorzelak et al., 2015).
Кроме того, при определенных условиях свежие образцы стула нельзя анализировать немедленно, и их необходимо хранить некоторое время. Фекальные материалы, мгновенно замораживаемые при -80 ° C, которые могут поддерживать микробную целостность без консервантов, широко считаются золотым стандартом для профилирования кишечной микробиоты. Этот подход сохраняет микробные компоненты, аналогичные тем, которые содержатся в свежих образцах, и воздерживается от потенциального воздействия консервантов (Fouhy et al., 2015). Для крупномасштабных популяционных исследований важны соответствующие методы для соблюдения пациентом режима лечения и сбора оптимальных образцов.Иногда идеальные условия для немедленного хранения образцов при -80 ° C не могут быть выполнены. Следовательно, необходимо учитывать допустимые методы сбора данных, чтобы минимизировать систематическую ошибку, которая может быть внесена на этапах предварительной обработки (Flores et al., 2015). Jocelyn M et al. сообщили, что хранение и транспортировка образцов при 4 ° C может минимизировать изменения микробного состава, если хранение при сверхнизких температурах недоступно (Choo et al., 2015).
Существуют и другие методы хранения с консервантами или без них, которые используются для получения микробиомного состава, аналогичного составу свежих образцов.В качестве безаддитивных методов образцы фекалий, хранящиеся при комнатной температуре в течение 24 часов, −20 ° C в течение 1 недели и в пробирках Эппендорфа при комнатной температуре в течение 3 дней, не оказывали значительного влияния на профили фекального микробиома (Carroll et al., 2012; Tedjo et al. др., 2015). Кроме того, карты анализа кала на скрытую кровь, карты FTA (Whatman) и набор OMNIgene Gut (DNA Genotek) также оказались эффективными для образцов, хранящихся в течение нескольких дней при комнатной температуре (Dominianni et al., 2014; Song et al. ., 2016; Vogtmann et al., 2017). Для использования консервантов для стабильного хранения образцов кала рекомендуется рекомендовать 95% этанол и RNAlater (Flores et al., 2015; Song et al., 2016; Vogtmann et al., 2017; Wang et al., 2018). Условия хранения могут значительно изменить характеристики микробного сообщества. В отсутствие условий сверхнизких температур хранение и транспортировка указанными выше методами может минимизировать изменения микробного состава. Выбор методов сбора и хранения должен основываться на цели, объеме и условиях исследования.
Вкратце, недостатки использования образцов кала в качестве замены кишечной микробиоты можно резюмировать в следующих аспектах. Во-первых, нельзя исключить возможность неполного разделения каловых бактерий и кишечной флоры. Физиологические вариации, содержащие градиенты химических и питательных веществ, а также разделение иммунной активности хозяина, различаются по длине тонкой и толстой кишки, и все они, как известно, влияют на микробный состав. В тонком кишечнике преобладают семейства Lactobacillaceae и Enterobacteriaceae , тогда как в толстой кишке доминируют семейства Prevotellaceae, Bacteroidaceae, Rikenellaceae, Ruminococcaceae и Lachnospiraceae (Dachnospiraceae et al., 2016). Таким образом, изучение кишечной флоры с фекальными бактериями не является исчерпывающим. Во-вторых, гомогенизация перед сбором образцов фекалий нарушает биоструктуру фекалий, и, если не гомогенизация, репрезентативность образцов может быть недостаточной. Swidsinski et al. использовали пластиковую трубочку для питья, чтобы пробить стул, чтобы получить фекальные цилиндры, которые успешно сохраняли биоструктуру фекальной микробиоты и продемонстрировали, что фекальная микробиота высоко структурирована (Swidsinski et al., 2008). Однако в другом исследовании сообщается, что гомогенизация может значительно снизить внутрииндивидуальные различия в обнаружении каждого компонента фекальной микробиоты (Hsieh et al., 2016). Это приводит к спорам о том, какой метод следует использовать. Наконец, в большинстве случаев нереально сразу проанализировать свежие образцы. Затем необходимо учитывать влияние метода хранения, который может вызвать деградацию микробной ДНК, чрезмерный рост и гибель некоторых видов, на компоненты образца фекалий.
Образцы из эндоскопии
По сравнению с использованием образцов кала для анализа состава микробиоты желудочно-кишечного тракта, было проведено несколько исследований по сбору образцов тканей и содержимого просвета для оценки микробиоты в различных микробных нишах во время эндоскопических процедур.Более полную информацию о микробиоме кишечника можно получить с помощью инструментов (таких как щипцы для биопсии и щетки для просвета) с помощью эндоскопии. Есть несколько общих недостатков методов отбора проб. Во-первых, эндоскопия инвазивна и вредна для пациентов. Во-вторых, во многих исследованиях сообщается, что влияние подготовки кишечника на микрофлору кишечника неизбежно. Затем, когда инструменты для отбора проб проходят через эндоскопический канал, они могут быть загрязнены содержимым, существующим в канале. Наконец, из-за сложной структуры эндоскопия ограничивается дистальным отделом тонкой кишки.В настоящее время существует несколько методов получения образцов микробиоты кишечника с помощью эндоскопии.
Биопсия
Нижний отдел желудочно-кишечного тракта млекопитающих содержит разнообразные среды обитания микробов вдоль тонкой кишки, слепой и толстой кишки. Эндоскопическая биопсия дает возможность исследовать состав микробиоты слизистой оболочки в различных анатомических участках желудочно-кишечного тракта. Считается, что микробиота слизистой оболочки важна для хозяина, потому что она находится в контакте с лимфоидной тканью, связанной с кишечником (Heinsen et al., 2015).
Для подготовки кишечника обычно требуется некоторое количество слабительных, таких как полиэтиленгликоль (ПЭГ) или сульфат, чтобы вывести большую часть пищеварительного тракта из желудочно-кишечного тракта. Для надлежащей подготовки кишечника необходимо, чтобы кал был прозрачной жидкостью без каких-либо твердых частиц. Однако у мышей с осмотической диареей, вызванной водным раствором ПЭГ, эпителий кишечника, слизистая оболочка и среда кишечника хозяина были разрушены за короткий период времени, а микробиота кишечника все еще значительно изменялась в течение длительного периода времени.Изменения в микробиоте кишечника в основном заключались в том, что альфа-разнообразие значительно уменьшилось, и оно все еще было значительно ниже исходного уровня через 2 недели после диареи, и его было трудно полностью восстановить. Более того, некоторые бактерии с высокой численностью исчезли (например, семейство S24-7) и были заменены другими таксонами с низкой численностью (Tropini et al., 2018). Предыдущее исследование продемонстрировало, что подготовка кишечника с помощью ПЭГ может привести к значительным морфологическим изменениям в толстой кишке, включая потерю эпителиальных клеток и поверхностной слизи (Bucher et al., 2006). Shobar et al. сообщили, что на разнообразие и состав микробиомов просвета и слизистых оболочек влияет подготовка кишечника (Shobar et al., 2016). Также было обнаружено, что промывание перед колоноскопией вызывает 31-кратное снижение общей микробной нагрузки и потерю специфичности микробиоты у 22% участников (Jalanka et al., 2015).
В дополнение к эффектам, вызванным подготовкой кишечника, биопсия слизистой оболочки, выполняемая во время стандартных эндоскопических процедур, может быть загрязнена люминальной жидкостью желудочно-кишечного тракта в эндоскопическом канале.Чтобы свести к минимуму контаминацию во время отбора образцов микробиоты, связанной со слизистой оболочкой, было разработано устройство для асептической биопсии Брисбена (BABD), которое состоит из стерильных щипцов, покрытых оболочкой и закрытых заглушкой на концах. Биопсии, полученные с помощью стандартных щипцов, имеют большее разнообразие микробиоты, связанной со слизистой оболочкой, чем образцы, собранные с помощью BABD (Shanahan et al., 2016). Даже в этом случае загрязнение может произойти до отбора проб. Когда эндоскопическая трубка попадает в место отбора пробы изо рта или ануса, бактерии, находящиеся в местах, не относящихся к отбору проб, неизбежно попадают в место отбора проб.Более того, эндоскоп не может охватить все сегменты всего кишечника, такие как дистальный отдел тонкой кишки, поэтому биопсийные участки ограничены. Современные мультиомные технологии требуют различных исходных материалов, включая ДНК, РНК и белки, и биопсия может не дать достаточно материала, чтобы удовлетворить потребности этих технологий. По этой причине Watt et al. продемонстрировали, что лаваж толстой кишки предлагает тип образца, аналогичный таковому при биопсии, и генерирует значительно более высокий уровень ДНК, чем при биопсии, со средним выходом ДНК 48.5 и 1,95 мкг для лаважа толстой кишки и биопсии соответственно (Watt et al., 2016).
Биопсия слизистой оболочки охватывает только небольшую площадь поверхности и может привести к отклонению выборки и недоступности редких таксонов, если микробная популяция распределяется неравномерно. Биопсия слизистой оболочки часто содержит большое количество загрязненной ДНК хозяина, что затрудняет метагеномный и другие молекулярные анализы (Huse et al., 2014).
Из-за влияния подготовки кишечника и загрязнения во время процедуры, инвазии, ограничения мест отбора проб, риска кровотечения и инфекции и ее непригодности для здоровых людей, биопсия, хотя и считается золотым стандартом для сбора слизистой оболочки микробиота, не подходит для будущего анализа кишечной микробиоты.
Чистка просвета
В 1979 году Уимберли и его коллеги впервые применили технику защищенной кисти для образцов (PSB) для сбора инфекционных образцов из нижних дыхательных путей с помощью волоконно-оптического бронхоскопа (Wimberley et al., 1979). Эти образцы кистей нелегко контаминировать нормальной флорой верхних дыхательных путей, что имеет большее значение для диагностики инфекции нижних дыхательных путей. В последние годы Lavelle et al. продвигаемые и проверенные методы повторной оценки пространственной изменчивости микробной популяции толстой кишки путем сочетания биопсии слизистой оболочки с методом PSB, который используется для отбора проб микробиоты, связанной с просветом (Lavelle et al., 2013). PSB представляет собой стерильную одноразовую щеточку для интродьюсера с дистальной заглушкой наверху, которая герметично закрывается кожухом при введении и втягивании через колоноскопический канал. В отличие от биопсии, чистка слизистой оболочки может снизить риски, связанные с биопсией слизистой оболочки (кровотечение и инфекция), и предоставить более репрезентативный образец поверхности слизистой оболочки, а кистевой забор показал относительно большое соотношение бактериальной ДНК к ДНК хозяина (Huse et al. , 2014). Хотя сообщалось, что альфа-разнообразие образцов, собранных с помощью BABD и метода PSB, одинаково на уровне филума, метод PSB обеспечивает образцы с более высокой долей бактериальной гДНК (Shanahan et al., 2016). Другое исследование, однако, показало, что существуют пространственные различия между микробиотой просвета и слизистой оболочки (Lavelle et al., 2015). Поскольку отбор проб с использованием технологии PSB зависит от эндоскопии, этот метод имеет те же недостатки, что и биопсия, такие как влияние подготовки кишечника, неизбежное заражение и инвазия.
Лазерная микродиссекция
Лазерная микродиссекция (LCM) была разработана для преодоления недостатков методов микродиссекции тканей. LCM избирательно приклеивает интересующие материалы к тонкой прозрачной пленке на срезе ткани с помощью импульса инфракрасного лазера (Emmert-Buck et al., 1996). Затем тонкую пленку с полученной тканью удаляют со среза и обрабатывают непосредственно ДНК, РНК или ферментным буфером. Следовательно, эта способность избирательно переносить небольшую фокальную область ткани или кластеров клеток на пленку может быть использована для получения слоев слизистого геля на поверхности образцов биопсии кишечника. Прежде чем образцы LCM можно будет проанализировать, замороженные образцы биопсии необходимо разрезать на 10-микронные срезы, а затем поместить на предметные стекла, свободные от нуклеаз и нуклеиновых кислот, и высушить на воздухе в течение ночи.Чтобы с высокой точностью улавливать микробы между складками толстой кишки мышей, Nava et al. использовали LCM, чтобы обнаружить, что микробы в межслойной области значительно отличаются от микробов в центральном просвете (Nava et al., 2011). Хотя максимальный размер области между складками составляет ~ 100 мкм, высокое разрешение LCM ~ 5 мкм позволяет легко и точно отобрать образцы. Дифференциация между просветом и слизистой оболочкой была очевидна при использовании LCM для взятия образцов слоя слизистого геля из быстро замороженных биоптатов (Lavelle et al., 2015). Обнаруживаемая бактериальная нагрузка у пациентов с ЯК, измеренная с помощью целевых LCM и количественной ПЦР, была ниже, чем у контрольной группы (Rowan et al., 2010). Таким образом, LCM обеспечивает простой, точный и эффективный метод получения бактерий в области слизистой оболочки для анализа взаимодействий микробиоты, связанных со слизистой оболочкой хозяина. LCM может быть подходящим для точной медицины, но утомительная процедура ограничивает его использование в крупномасштабных исследованиях. То, что ограничивает точность LCM, может заключаться в том, что источником образца является биопсия, которая имеет свои недостатки, в основном деградацию нуклеиновых кислот, например.ж., РНК и недостаточное количество образца.
Образцы аспирированной кишечной жидкости
Для аспирации незагрязненной кишечной жидкости Шайнер изобрел капсулу из нержавеющей стали, снабженную колпачком на дистальном конце и полым соединением на проксимальном конце (SHINER, 1963). Проксимальный конец капсулы через трубку соединен с источником отрицательного давления. При достижении места отбора проб всасывание с отрицательным давлением приводит к открытию пробоотборного канала капсулы, и окружающая жидкость попадает в камеру капсулы.После аспирации капсула снова закрывается, и собранные образцы изолируются от внешней жидкости. Преимущество этого устройства заключается в том, что отобранные образцы не загрязняются содержимым желудочно-кишечного тракта в местах, где отбор образцов не производится. Из-за сложной конструкции этот метод не получил широкого распространения. После этого прогресс в получении жидкости желудочно-кишечного тракта заключался в разработке специально изготовленной двухпросветной трубки с множеством аспирационных портов в разных местах и наполненным ртутью мешком на ее дистальном конце (Kalser et al., 1966). Субъекты проглатывали трубку, а затем аспираты отсасывали стерильным шприцем, когда порты находились в правильном положении (75 см дистальнее связки Трейца для аспиратов тощей кишки и 75 см проксимальнее илеоцекального клапана для аспиратов подвздошной кишки). Белов и др. аспирировали кишечную жидкость через назоеюнальные трубки, обычно вводимые для энтерального питания (Belov et al., 1999). Однако вязкая кишечная жидкость и закупорка трубок усложняли процедуру сбора и делали ее трудоемкой.
В настоящее время для получения кишечной жидкости наиболее часто используется эндоскопическая аспирация. Обычно предполагается, что аспирация и посев жидкости тонкого кишечника являются золотым стандартом для диагностики избыточного бактериального роста в тонком кишечнике, который определяется как ≥ 10 5 колониеобразующих единиц на миллилитр (КОЕ / мл) при посеве аспирированного жидкость (Khoshini et al., 2008; Grace et al., 2013; Erdogan et al., 2015). Недавнее исследование, основанное на культуре аспирата двенадцатиперстной кишки, продемонстрировало, что SIBO связан с чрезмерным ростом анаэробов и что микробный состав тонкой кишки у пациентов с симптомами значительно изменился, что несовместимо с результатами аспирационной культуры (Saffouri et al., 2019).
Рабочий канал эндоскопа легко загрязняется содержимым полости рта и желудочно-кишечного тракта. Резину покрывали дистальный конец катетера, чтобы заблокировать инфильтрацию кишечной жидкости (Uno et al., 1998). Вдохновленный предыдущими исследованиями, Quintanilha et al. использовали мембрану из микрофильмов для защиты дистального конца во избежание внутреннего загрязнения (Quintanilha et al., 2007). Поскольку эндоскопическая биопсия агрессивна для здоровых людей, альтернативным вариантом стало отсасывание кишечной жидкости.Тем не менее, отсасывание кишечной жидкости иногда занимает много времени, что увеличивает время эндоскопии и иногда оказывается неудачным из-за разреженности кишечной жидкости (Riordan et al., 1995). Хотя в предыдущих исследованиях были приложены большие усилия для минимизации сопутствующего загрязнения во время всасывания кишечной жидкости, врожденные дефекты при отборе эндоскопических образцов неизбежны, как упоминалось выше. Более того, неопределенность мест отбора проб также создает проблемы для получения надежных проб.
Образцы из хирургии
Когда при эндоскопии трудно добраться до дистального отдела подвздошной кишки, хирургия дает нам возможность взять образец из дистального отдела подвздошной кишки.Методы получения кишечной флоры во время операции включают прямую пункционную аспирацию или биопсию образцов слизистой оболочки (Bentley et al., 1972; Corrodi et al., 1978; Thadepalli et al., 1979; Lavelle et al., 2015). Поскольку хирургический отбор образцов не подвержен загрязнению, теоретически образцы, полученные с помощью этого метода, лучше всего представляют микробиоту кишечника. Однако реальность такова, что перед операцией необходимо провести несколько подготовительных мероприятий. Эти препараты могут включать голодание, механическое очищение кишечника и прием антибиотиков, все из которых могут нарушить микробиоту (Antonopoulos et al., 2009; Убеда и Памер, 2012; Феррер и др., 2014; Зарринпар и др., 2014; Яланка и др., 2015). В этом контексте Thadepalli et al. брали двенадцатиперстную, тощую и подвздошную жидкость у пациентов с травмой живота, требующей экстренной лапаротомии с помощью пункционной аспирации для исследования микробиоты тонкой кишки. Ни один из пациентов не проходил плановую предоперационную подготовку; Следовательно, эти образцы, полученные без вмешательства предоперационной подготовки, были в идеальном состоянии. Кроме того, отбор проб во время операции также может обойти проблему недоступности тонкого кишечника за счет использования модельных систем in vivo (Booijink et al., 2007). Пациенты, перенесшие илеостомию, могут использоваться в качестве модели in vivo и обеспечивать сток из илеостомы для получения микробиоты кишечника (Go et al., 1988; Ala Aldeen and Barer, 1989). Zoetendal et al. продемонстрировали, что общие микробные компоненты в образцах, выделенных илеостомами (люди без толстой кишки), также могут быть обнаружены в тонком кишечнике здоровых субъектов с помощью филогенетических анализов микрочипов (Zoetendal et al., 2012). По сравнению с микробиотой толстой кишки микробиота в стоках подвздошной кишки относительно нестабильна и менее сложна и состоит из различных доминирующих филотипов (Booijink et al., 2010). Более того, модели in vivo также можно использовать для изучения влияния диеты на кишечную флору. Йонссон и др. исследовали влияние потребления клетчатки на сегментированные нитчатые бактерии, собирая образцы илеостомы человека (Jonsson, 2013). В дополнение к указанным выше методам Haysahi et al. получили образцы кишечного содержимого при аутопсии и продемонстрировали градиентное распределение количества ОТЕ от проксимального до дистального конца кишечника (Hayashi et al., 2005). Хотя модель in vivo обеспечивает удобство отбора проб в любое время, сама операция приводит к значительным изменениям в составе кишечной микробиоты, которые сохраняются в течение длительного времени (Guyton and Alverdy, 2017). Илеостомия изменяет анатомическую структуру кишечника, что может необратимо повлиять на состав микробиоты кишечника. Таким образом, неясно, подходят ли результаты исследования, основанные на эффлюенте илеостомии, для людей с нормальным анатомическим строением.Поскольку операция является инвазивной, получение образца у здоровых людей кажется невозможным. Очевидно, что хирургическое применение операции и вскрытия ограничено. Хирургия не способствует всестороннему анализу взаимосвязи между бактериальной флорой и заболеваниями в разных популяциях.
Заменяемые устройства для отбора проб
Недостатки вышеупомянутых методов кажутся непреодолимыми, и исследователи прилагают усилия для разработки новых устройств для отбора проб. На сегодняшний день для наблюдения за кишечником и доставки лекарств использовалось множество глотательных устройств.Из-за неинвазивных характеристик устройств для проглатывания все чаще рассматривается их использование для сбора кишечного содержимого. Основываясь на технологии микроэлектромеханических систем (MEMS), Cui et al. изобрел проглатывающуюся капсулу, которая может доставлять лекарства и собирать кишечную жидкость (Cui et al., 2008). Характеристики расположения желудочно-кишечного тракта, беспроводная связь и большой размер образца дают капсуле возможность автоматически собирать кишечную жидкость. Однако недостатком этого устройства является то, что собранный образец легко загрязняется находящейся ниже по потоку жидкостью.В последние годы NIZO разработала интеллектуальную капсулу для отбора проб микробиома из тонкого кишечника, объединив систему IntelliCap® и гаситель. Система IntelliCap® представляет собой проглатывающуюся капсулу, которая содержит датчики pH и температуры, коммуникационные блоки, микрокомпьютеры, двигатели и батареи. Тушитель — это емкость, помещенная в капсулу для качественного и количественного сохранения микробиоты. Капсулы можно расположить путем измерения значительных изменений pH в желудочно-кишечном тракте (Koziolek et al., 2015). Когда проглоченная капсула достигает обозначенной области тонкой кишки, можно начинать аспирацию кишечной жидкости. Аспирированная кишечная жидкость может быть собрана после выхода капсулы из организма. Недавно Rezaei Nejad et al. также сообщил о таблетке для аспирации жидкости из тонкого кишечника, напечатанной на 3D-принтере (Rezaei Nejad et al., 2019). Эта таблетка содержит полупроницаемую мембрану для разделения спиральных каналов и солевой камеры. Более высокое осмотическое давление на стороне соляной камеры заставляет жидкость в спиральных каналах течь в камеру через полупроницаемую мембрану.Затем кишечная жидкость может быть аспирирована через входные отверстия, соединенные со спиральными каналами. Внешняя оболочка кишечной капсулы обеспечивает начало сбора в тонком кишечнике. По сравнению с капсулой NIZO, стоимость этой безбатарейной таблетки наверняка будет намного ниже. Однако проблема сохранения образцов после сбора, по-видимому, не решена, что может привести к загрязнению образцов кишечной жидкостью из мест, где они не собирались.
Наша настоящая работа сосредоточена на отборе образцов кишечной жидкости малоинвазивными методами.Мы также исследовали недорогое и удобное капсульное устройство «Аспирация микробиома кишечника» (IMBA), которое предназначено для автономного сбора образцов кишечной жидкости. Без использования дорогостоящих технологий микроэлектромеханических систем, IMBA использует технологию контролируемого высвобождения, оснащенную новым механизмом отбора проб для достижения точного и регионального отбора проб в кишечнике. Более того, форма капсул улучшает комплаентность пациента, а условия отбора проб, близкие к физиологическому состоянию (нет необходимости в подготовке кишечника), обеспечивают более высокую точность.Ключ к этой технологии — как точно определить местонахождение и собрать кишечную жидкость.
Инструменты, связанные с биологией
В дополнение к составу и разнообразию кишечной микробиоты их пространственная организация также отражает взаимосвязь между хозяином и микробиотой. Чтобы получить полную структуру кишечника и его содержимого, Johansson et al. улучшили гистологические препараты, которые успешно сохранили кишечную слизь и локализовали бактерии с помощью флуоресценции in situ гибридизации (FISH) (Johansson and Hansson, 2012).Используя технологию FISH, местоположение интересующих бактерий, помеченных флуоресцентным ДНК-зондом, можно наблюдать под флуоресцентным микроскопом. Однако из-за трудностей при отборе проб, этических проблем и огромных индивидуальных различий в микробном составе исследования и манипуляции с сообществами кишечных микробов человека in situ ограничены. В качестве альтернативы широко используется трансплантация кишечной микробиоты человека стерильным мышам (Goodman et al., 2011; McNulty et al., 2013). Чтобы изучить пространственную организацию микробиоты кишечника человека, Earle et al. разработали новый подход, который визуализирует бактерии у мышей-гнотобиотов, колонизированных человеческой микробиотой, с помощью FISH (Earle et al., 2015). Они инокулировали флуоресцентный зонд, соответствующий интересующим бактериям, в фиксированные поперечные срезы кишечника мыши. Однако одно поле зрения в разрезе не может отображать весь кишечник. Чтобы решить эту проблему, было разработано программное обеспечение Bacspace, которое сшивает перекрывающиеся изображения нескольких полей зрения в непрерывное изображение, которое представляет весь кишечник, позволяет отличать эпителиальные клетки хозяина от бактерий и измерять расстояние между бактериальными клетками и между бактериальными клетками и эпителием.Используя Bacspace, они выявили гомологичную кластеризацию в пределах Bacteroidales или Firmicutes , которые объединяют Bacteroidales , которые исключают Firmicutes и наоборот. Более того, применение FISH в сочетании с методами анализа спектральной визуализации раскрыло пространственную организацию мышей-гнотобиотов, колонизированных 15-членной микробиотой кишечника человека (Welch et al., 2017). В толстой кишке есть две густо колонизированные области: одна прилегает к слизистой оболочке, а другая граничит с частицами пищи в просвете.Небольшие различия в составе микробиоты в этих двух регионах позволяют предположить, что просвет и слизистую оболочку не следует определять как стратифицированные компартменты. Из-за различий в плотности микробов между тонкой и толстой кишкой на порядки количество микробов в поперечном сечении тонкой кишки в 10–1 миллион раз меньше, чем в толстой кишке. То есть, по сравнению с 1000 бактериями на поле зрения в толстой кишке, в тонком кишечнике почти нет бактерий.Из-за более высокой микробной плотности гистологический метод больше подходит для толстой кишки. Неправильная подготовка образца также может привести к потере содержимого кишечника на участках. По сравнению с другими методами метод внедрения Technovit h8100 может успешно сохранять трехмерную структуру кишечника и совместим с FISH и другими методами маркировки для визуализации микробных клеток в кишечнике мышей вместе со слизью и фекальными гранулами (Hasegawa et al. ., 2017). Эти методы визуализации могут одновременно обнаруживать некоторые культивируемые микробы с помощью флуоресцентных зондов, которые требуют предварительного проектирования, но они не могут иметь дело со сложными и разнообразными микробиомами. Для беспристрастного анализа сложной микробной биогеографии кишечника с высоким таксономическим разрешением Ravi et al. разработали выборку метагеномного графика путем секвенирования, который может анализировать пространственное расположение различных микробов без предварительного уточнения (Sheth et al., 2019). Они обнаружили, что сильная связь между Bacteroides во всех полостях кишечника и локальными областями бактериальной филогении и агрегации была связана с нарушением питания.Хотя установление микробиоты кишечника человека у мышей, свободных от микробов, дает нам решение проблемы отбора проб из кишечника человека, нельзя игнорировать влияние разницы в генном фоне на состав микробиоты (Wos-Oxley et al. ., 2012). В то же время на формирование микрофлоры кишечника человека у стерильных мышей также повлияет операция бактериальной трансплантации. Есть несколько моментов, на которые следует обратить внимание при оральном введении желудочного зонда.Из-за присутствия анаэробных бактерий во флоре человека их необходимо быстро ввести в пищеварительный тракт. Большой объем введения будет способствовать распространению и колонизации кишечного микробного сообщества мышей и защищать микробиоту от кишечных ферментов и изменений pH, а некоторые диеты для грызунов могут также стимулировать или подавлять рост некоторых бактерий (Rodriguez-Palacios et al., 2019) По сравнению с контрольной группой, мыши без микробов имеют значительно более длительное время прохождения через кишечник вместе с более низкими уровнями SCFAs, которые образуются в результате ферментации неперевариваемых углеводов комменсальными бактериями и могут способствовать опорожнению кишечника (Vincent et al., 2018). Колонизация различных линий у стерильных мышей может влиять на перистальтику кишечника, влияя на уровень SCFA, что приводит к разному количеству фекальных гранул в толстой кишке. Следовательно, соотношение между бактериями и фекальными гранулами в отделе толстой кишки может немного отличаться.
Перспектива
Несмотря на значительные усилия исследователей по получению точных образцов, недостатки существующих методов отбора проб непреодолимы. Получение точных результатов из неточных образцов будет затруднительно.Фекалии стали источником образцов для большинства исследований бактериальной флоры из-за их удобства и неинвазивного характера, но даже содержание микробиоты в нижних отделах пищеварительного тракта, которое ближе всего к фекалиям, значительно отличается от такового в фекалиях (Zmora et al. , 2018). Большинство остальных методов отбора проб являются инвазивными и не подходят для здоровых людей. Вопросы, которые необходимо решить в будущих методах отбора проб, должны включать снижение инвазивности, отбор проб без перекрестного загрязнения в фиксированных точках и минимизацию нарушений нормальной физиологии кишечника.
Точность образцов оказывает заметное влияние на ценность исследований микробиоты кишечника; поэтому необходимы более точные методы отбора проб для обеспечения надежности исследования. Конструкция будущих оптимальных устройств для сбора кишечной микробиоты должна соответствовать следующим требованиям. Во-первых, устройства могут эффективно собирать кишечное содержимое в фиксированной точке и предотвращать перекрестное загрязнение образцов. Во-вторых, размер устройств должен быть небольшим, чтобы обеспечить беспрепятственный проход через привратник и илеоцекальный клапан.Кроме того, устройство имеет простую конструкцию и удобство в эксплуатации, а процесс отбора проб вызывает меньше психологического давления и дискомфорта. Материал, используемый в производственном оборудовании, должен быть нетоксичным, безвредным, нетератогенным и неканцерогенным. Более того, стоимость устройств также является ключевым фактором при проведении крупных когортных исследований. Наконец, учитывая, что подготовка кишечника оказывает большее влияние на состав микробиоты кишечника, новые технологии лучше всего устраняют эту процедуру. Ввиду недостатков существующих методов отбора проб, разработка более точных методов отбора проб имеет решающее значение для будущих исследований микробиоты кишечника.Для удовлетворения этих требований разработка глотательных устройств представляется наиболее целесообразным методом. В будущем небольшие автономные устройства для отбора проб позволят исследователям и клиницистам изучать кишечную флору со специфичностью, локализацией и чувствительностью. С другой стороны, пространственная структура кишечной флоры также является важным компонентом изучения взаимодействия между флорой и хозяином. По этическим причинам нецелесообразно собирать образцы, содержащие информацию о позиционных отношениях между микробами и кишечником.В качестве альтернативы установление микробиоты кишечника человека у мышей-гнотобиотов также дает нам решение трудностей отбора проб. Хотя флуоресцентная визуализация не может изучать сложные микробиомы, применение объективной пространственной макрогеномики у мышей-гнотобиотов значительно продвинет наше понимание пространственной организации кишечной микробиоты.
Вклад авторов
QT, GJ, GW, BW и HC разработали исследование. QT, GJ, GW, TL и XL собрали и проанализировали соответствующую информацию.QT, GJ, GW и HC написали статью. Все авторы принимали участие в окончательном утверждении статьи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноски
Финансирование. Это исследование было поддержано грантами (81570478, 81741075) Национального фонда естественных наук Китая, грантом (17JCYBJC24900) Фонда естественных наук Тяньцзиня и грантом (2019M651049) Фонда постдокторской науки Китая.
Ссылки
- Ала Алдин Д. А., Барер М. Р. (1989). Рост бактерий и выработка токсинов в стоках илеостомии. J. Med. Microbiol. 28, 287–290. 10.1099 / 00222615-28-4-287 [PubMed] [CrossRef] [Google Scholar]
- Алмейда А., Митчелл А. Л., Боланд М., Форстер С. С., Глор Г. Б., Тарковска А. и др. . (2019). Новый геномный план микробиоты кишечника человека. Природа 568, 499–504. 10.1038 / s41586-019-0965-1 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Антонопулос Д.А., Хьюз С. М., Моррисон Х. Г., Шмидт Т. М., Согин М. Л., Янг В. Б. (2009). Воспроизводимая динамика сообщества микробиоты желудочно-кишечного тракта после воздействия антибиотиков. Заразить. Иммун. 77, 2367–2375. 10.1128 / IAI.01520-08 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Bäckhed F., Roswall J., Peng Y., Feng Q., Jia H., Kovatcheva-Datchary P., и другие. (2015). Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин 17, 690–703.10.1016 / j.chom.2015.04.004 [PubMed] [CrossRef] [Google Scholar]
- Белов Л., Мехер-Хомджи В., Путасвами В., Миллер Р. (1999). Вестерн-блот-анализ желчи или кишечной жидкости пациентов с септическим шоком или синдромом системной воспалительной реакции с использованием антител к TNF-альфа, IL-1 альфа и IL-1 бета. Иммунол. Cell Biol. 77, 34–40. 10.1046 / j.1440-1711.1999.00796.x [PubMed] [CrossRef] [Google Scholar]
- Бентли Д. У., Николс Р. Л., Кондон Р. Э., Горбач С. Л. (1972). Микрофлора подвздошной и внутрибрюшной толстой кишки человека: результаты прямой пункционной аспирации во время операции и оценка методики.J. Lab. Clin. Med. 79, 421–429. [PubMed] [Google Scholar]
- Блэнтон Л. В., Шарбонно М. Р., Салих Т., Барратт М. Дж., Венкатеш С., Илкавея О. и др. (2016). Кишечные бактерии, предотвращающие нарушение роста, передаваемое микробиотой от недоедающих детей. Наука 80: 351 10.1126 / science.aad3311 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Booijink C. C. G. M., Эль-Айди С., Раджилич-Стоянович М., Хейлиг Х. Г. Х. Дж., Троост Ф. Дж., Смидт Х. и др. . (2010). В микробиоте подвздошной кишки человека обнаружены высокие временные и межиндивидуальные вариации.Environ. Microbiol. 12, 3213–3227. 10.1111 / j.1462-2920.2010.02294.x [PubMed] [CrossRef] [Google Scholar]
- Booijink C. C. G. M., Zoetendal E. G., Kleerebezem M., de Vos W. M. (2007). Сообщества микробов в тонком кишечнике человека: сочетание разнообразия с метагеномикой. Future Microbiol. 2, 285–295. 10.2217 / 17460913.2.3.285 [PubMed] [CrossRef] [Google Scholar]
- Бухер П., Герваз П., Эггер Дж. Ф., Соравиа К., Морел П. (2006). Морфологические изменения, связанные с механической подготовкой кишечника перед плановой колоректальной операцией: рандомизированное исследование.Дис. Двоеточие. Прямая кишка. 49, 109–112. 10.1007 / s10350-005-0215-5 [PubMed] [CrossRef] [Google Scholar]
- Кэрролл И. М., Чанг И.-Х., Пак Дж., Сартор Р. Б., Рингель Ю. (2010). Микробиота кишечника, связанная с просветом и слизистыми оболочками, у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Gut Pathog. 2:19. 10.1186 / 1757-4749-2-19 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Кэрролл И. М., Рингель-Кулька Т., Сиддл Дж. П., Кленхаммер Т. Р., Рингель Ю. (2012). Характеристика фекальной микробиоты с помощью высокопроизводительного секвенирования показывает стабильное микробное сообщество во время хранения.PLoS ONE 7: e46953. 10.1371 / journal.pone.0046953 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шарбонно М. Р., О’Доннелл Д., Блантон Л. В., Тоттен С. М., Дэвис Дж. К. С., Баррат М. Дж. И др. . (2016). Сиалированные олигосахариды молока способствуют росту, зависящему от микробиоты, в моделях недоедания младенцев. Клетка 164, 859–871. 10.1016 / j.cell.2016.01.024 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Чу Дж. М., Леонг Л. Э. X., Роджерс Г. Б. (2015). Условия хранения образцов существенно влияют на профили фекального микробиома.Sci. Rep. 5, 1–10. 10.1038 / srep16350 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Корроди П., Уайдман П. А., Саттер В. Л., Дреник Э. Дж., Пассаро Э., Файнголд С. М. (1978). Бактериальная флора тонкой кишки до и после процедуры шунтирования при патологическом ожирении. J. Infect. Дис. 137, 1–6. 10.1093 / infdis / 137.1.1 [PubMed] [CrossRef] [Google Scholar]
- Цуй Дж., Чжэн X., Хоу В., Чжуан Ю., Пи X., Ян Дж. (2008). Изучение дистанционно управляемой системы доставки и отбора проб желудочно-кишечного тракта.Телемед. J. E. Health. 14, 715–719. 10.1089 / tmj.2007.0118 [PubMed] [CrossRef] [Google Scholar]
- Доминианни К., Ву Дж., Хейс Р. Б., Ан Дж. (2014). Сравнение методов сбора биопробы фекального микробиома. BMC Microbiol. 14, 1–6. 10.1186 / 1471-2180-14-103 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Дональдсон Г. П., Ли С. М., Мазманян С. К. (2016). Биогеография кишечника бактериальной микробиоты. Nat. Rev. Microbiol. 14, 20–32. 10.1038 / nrmicro3552 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Duncan S.Х., Беленгер А., Холтроп Г., Джонстон А. М., Флинт Х. Дж., Лобли Г. Э. (2007). Снижение потребления углеводов с пищей у людей с ожирением приводит к снижению концентрации бутирата и бутират-продуцирующих бактерий в фекалиях. Прил. Environ. Microbiol. 73, 1073–1078. 10.1128 / AEM.02340-06 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Данн А. Б., Джордан С., Бейкер Б. Дж., Карлсон Н. С. (2017). Материнский микробиом младенца: соображения для родов и родов. MCN. Являюсь. J. Matern.Детские медсестры. 42, 318–325. 10.1097 / NMC.0000000000000373 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Эрл К. А., Биллингс Г., Сигал М., Лихтман Дж. С., Ханссон Г. К., Элиас Дж. Э. и др. . (2015). Количественная визуализация пространственной организации кишечной микробиоты. Клеточный микроб-хозяин 18, 478–488. 10.1016 / j.chom.2015.09.002 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Eisenstein M. (2016). Микробиом: широкополосный бактериальный. Природа 533, S104 – S106. 10.1038 / 533S104a [PubMed] [CrossRef] [Google Scholar]
- Эммерт-Бак М.Р., Боннер Р. Ф., Смит П. Д., Чуаки Р. Ф., Чжуанг З., Голдштейн С. Р. и др. . (1996). Лазерная микродиссекция. Наука 274, 998–1001. 10.1126 / science.274.5289.998 [PubMed] [CrossRef] [Google Scholar]
- Эрдоган А., Рао С. С., Галли Д., Джейкобс К., Ли Ю. Ю., Баджер К. (2015). Избыточный бактериальный рост в тонком кишечнике: дуоденальная аспирация против дыхательного теста на глюкозу. Нейрогастроэнтерол. Мотил. 27, 481–489. 10.1111 / nmo.12516 [PubMed] [CrossRef] [Google Scholar]
- Феррер М., Мартинс душ Сантуш В. А. П., Отт С. Дж., Моя А. (2014). Нарушение микробиоты кишечника во время терапии антибиотиками: многомерный подход. Кишечные микробы 5, 64–70. 10.4161 / gmic.27128 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Флорес Р., Ши Дж., Ю. Г., Ма Б., Равель Дж., Гёдерт Дж. Дж. И др. . (2015). Среда для сбора и эффекты замедленного замораживания на микробный состав человеческого стула. Микробиом 3:33. 10.1186 / s40168-015-0092-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Foster K.Р., Шлютер Дж., Койт К. З., Ракофф-Нахум С. (2017). Эволюция микробиома хозяина как экосистемы на привязи. Природа 548, 43–51. 10.1038 / nature23292 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Фухи Ф., Дин Дж., Ри М. К., О’Салливан О., Росс Р. П., О’Каллаган Г. и др. . (2015). Воздействие замораживания на фекальную микробиоту, определенное с помощью секвенирования MiSeq и исследований на основе культур. PLoS ONE 10: e0119355. 10.1371 / journal.pone.0119355 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Go P.М., ван Дайен-Виссер М. П., Дэвис Б. И., Ленс Дж., Бромбахер П. Дж. (1988). Микробная флора и метаболизм желчных кислот у пациентов с подвздошным резервуаром. Сканд. J. Gastroenterol. 23, 229–36. [PubMed] [Google Scholar]
- Гудман А. Л., Каллстром Г., Фейт Дж. Дж., Рейес А., Мур А., Дантас Г. и др. . (2011). Обширные персональные коллекции культур микробиоты кишечника человека, охарактеризованные и обработанные на мышах-гнотобиотах. Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 108, 6252–6257. 10.1073 / pnas.1102938108 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Gorzelak M.А., Гилл С. К., Тасним Н., Ахмади-Ванд З., Джей М., Гибсон Д. Л. (2015). Методы улучшения данных микробиома кишечника человека за счет уменьшения вариабельности за счет обработки образцов и хранения стула. PLoS ONE 10: e0134802. 10.1371 / journal.pone.0134802 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Грейс Э., Шоу К., Уилан К., Андреев Х. Дж. Н. (2013). Обзорная статья: избыточный бактериальный рост в тонком кишечнике — распространенность, клинические особенности, текущие и разрабатываемые диагностические тесты и лечение.Алимент. Pharmacol. Ther. 38, 674–688. 10.1111 / apt.12456 [PubMed] [CrossRef] [Google Scholar]
- Гайтон К., Алверди Дж. К. (2017). Микробиота кишечника и желудочно-кишечная хирургия. Nat. Преподобный Гастроэнтерол. Гепатол. 14, 43–54. 10.1038 / nrgastro.2016.139 [PubMed] [CrossRef] [Google Scholar]
- Хасегава Ю., Марк Велч Дж. Л., Россетти Б. Дж., Бориси Г. Г. (2017). Сохранение трехмерной пространственной структуры микробиома кишечника. PLoS ONE 12: e188257. 10.1371 / journal.pone.0188257 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хаяси Х., Такахаши Р., Ниси Т., Сакамото М., Бенно Ю. (2005). Молекулярный анализ микробиоты толстой кишки человека тощей, подвздошной, слепой и ректо-сигмоидальной кишки с использованием библиотек генов 16S рРНК и полиморфизма длин концевых рестрикционных фрагментов. J. Med. Microbiol. 54, 1093–1101. 10.1099 / jmm.0.45935-0 [PubMed] [CrossRef] [Google Scholar]
- Heinsen F.-A., Knecht H., Neulinger S.C., Schmitz R.A., Knecht C., Kühbacher T., et al. . (2015). Динамические изменения микробиоты просвета и слизистой оболочки кишечника во время и после антибактериальной терапии паромомицином.Кишечные микробы 6, 243–254. 10.1080 / 194.2015.1062959 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Се Й.-Х., Петерсон С. М., Рэджио А., Кинан М. Дж., Мартин Р. Дж., Равуссин Э. и др. . (2016). Влияние различных методов обработки фекалий на оценку бактериального разнообразия в кишечнике человека. Фронт. Microbiol. 7: 1643. 10.3389 / fmicb.2016.01643 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Хьюз С. М., Янг В. Б., Моррисон Х. Г., Антонопулос Д.А., Квон Дж., Далал С. и др. . (2014). Сравнение методов взятия пробы кистью и биопсии подвздошной кишки для оценки микробиоты слизистой оболочки людей. Микробиом 2: 5. 10.1186 / 2049-2618-2-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Jalanka J., Salonen A., Salojärvi J., Ritari J., Immonen O., Marciani L., и другие. . (2015). Влияние очищения кишечника на микробиоту кишечника. Кишечник 64, 1562–1568. 10.1136 / gutjnl-2014-307240 [PubMed] [CrossRef] [Google Scholar]
- Йоханссон М.Э. В., Ханссон Г. К. (2012). Сохранение слизи в гистологических срезах, иммуноокрашивание муцинов в фиксированной ткани и локализация бактерий с помощью FISH. Методы Мол. Биол. 842, 229–235. 10.1007 / 978-1-61779-513-8_13 [PubMed] [CrossRef] [Google Scholar]
- Йонссон Х. (2013). Сегментированные нитчатые бактерии в образцах илеостомы человека после приема большого количества клетчатки. FEMS Microbiol. Lett. 342, 24–29. 10.1111 / 1574-6968.12103 [PubMed] [CrossRef] [Google Scholar]
- Калсер М. Х., Коэн Р., Arteaga I., Yawn E., Mayoral L., Hoffert W. и др. (1966). Нормальная вирусная и бактериальная флора тонкого и толстого кишечника человека. N. Engl. J. Med. 274, 558–63. 10.1056 / NEJM196603102741006 [PubMed] [CrossRef] [Google Scholar]
- Хошини Р., Дай С. К., Лескано С., Пиментел М. (2008). Систематический обзор диагностических тестов избыточного бактериального роста в тонком кишечнике. Копать землю. Дис. Sci. 53, 1443–1454. 10.1007 / s10620-007-0065-1 [PubMed] [CrossRef] [Google Scholar]
- Ким С., Ковингтон А., Памер Э. Г. (2017). Микробиота кишечника: антибиотики, резистентность к колонизации и кишечные патогены. Иммунол. Ред. 279, 90–105. 10.1111 / imr.12563 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Козиолек М., Гримм М., Беккер Д., Иорданов В., Цзоу Х., Симидзу Дж. И др. . (2015). Исследование профилей pH и температуры в желудочно-кишечном тракте голодных людей с использованием системы intellicap®. J. Pharm. Sci. 104, 2855–2863. 10.1002 / jps.24274 [PubMed] [CrossRef] [Google Scholar]
- La Rosa P.С., Уорнер Б. Б., Чжоу Ю., Вайншток Г. М., Содергрен Э., Холл-Мур К. М. и др. . (2014). Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 111, 12522–12527. 10.1073 / pnas.1409497111 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lavelle A., Lennon G., Docherty N., Balfe A., Mulcahy H. E., Doherty G., et al. . (2013). Зависимые от глубины различия в структуре сообщества микробиоты толстой кишки человека в состоянии здоровья. PLoS ONE 8: e78835.10.1371 / journal.pone.0078835 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Лавель А., Леннон Г., О’Салливан О., Дочерти Н., Балф А., Магуайр А., и другие. . (2015). Пространственная изменчивость микробиоты толстой кишки у пациентов с язвенным колитом и контрольных добровольцев. Кишечник 64, 1553–1561. 10.1136 / gutjnl-2014-307873 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Li Y., Tinoco R., Elmén L., Segota I., Xian Y., Fujita Y., et al. . . (2019). Зависящий от микробиоты кишечника противоопухолевый иммунитет ограничивает рост меланомы у мышей Rnf5 — / -.Nat. Commun. 10: 1492. 10.1038 / s41467-019-09525-y [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Lloyd-Price J., Arze C., Ananthakrishnan AN, Schirmer M., Avila-Pacheco J., Poon TW, et al. . (2019). Многокомпонентность микробной экосистемы кишечника при воспалительных заболеваниях кишечника. Природа 569, 655–662. 10.1038 / s41586-019-1237-9 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Макферсон А. Дж., Де Агуэро М. Г., Ганал-Вонарбург С. К. (2017). Как питание и материнская микробиота формируют иммунную систему новорожденного.Nat. Rev. Immunol. 17, 508–517. 10.1038 / nri.2017.58 [PubMed] [CrossRef] [Google Scholar]
- МакНалти Н. П., Ву М., Эриксон А. Р., Пан К., Эриксон Б. К., Мартенс Э. К. и др. . (2013). Влияние диеты на использование ресурсов модельной кишечной микробиотой человека, содержащей Bacteroides cellulosilyticus Wh3, симбионт с обширным гликобиомом. PLoS Biol. 11: e1637. 10.1371 / journal.pbio.1001637 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Nava G. M., Friedrichsen H.Дж., Стаппенбек Т. С. (2011). Пространственная организация кишечной микробиоты восходящей ободочной кишки мышей. ISME J. 5, 627–638. 10.1038 / ismej.2010.161 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- О’Тул П. В., Джеффри И. Б. (2015). Микробиота кишечника и старение. Наука 350, 1214–1215. 10.1126 / science.aac8469 [PubMed] [CrossRef] [Google Scholar]
- Кинтанилья А. Г., Зильберштейн Б., Сантос М. А., Паецки Д., Хорно Моура Э. Г., Алвес П. Р. А. и др. (2007). Новый метод отбора проб для исследования микробиоты кишечника.Мир J. Gastroenterol. 13, 3990–3995. 10.3748 / wjg.v13.i29.3990 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Ранжел И., Сундин Дж., Фуэнтес С., Репсилбер Д., де Вос В.М., Брюммер Р.Дж. (2015 г. ). Взаимосвязь между микробиотой, связанной с фекалиями и слизистыми оболочками, у пациентов с синдромом раздраженного кишечника и здоровых субъектов. Алимент. Pharmacol. Ther. 42, 1211–1221. 10.1111 / apt.13399 [PubMed] [CrossRef] [Google Scholar]
- Резаи Неджад Х., Оливейра Б. К. М., Садеки А., Деххаргани А., Кондова И., Лангерманс Дж. А. М. и др. (2019). Незаменимая осмотическая таблетка для взятия проб in vivo кишечного микробиома. Adv. Intell. Syst. 1: 1
- 3 10.1002 / aisy.201
- 3 [CrossRef] [Google Scholar]
- Рингель Ю., Махаршак Н., Рингель-Кулька Т., Вольбер Э. А., Сартор Р. Б., Кэрролл И. М. (2015). Высокопроизводительное секвенирование выявляет различные микробные популяции в нишах слизистой оболочки и просвета у здоровых людей. Кишечные микробы 6, 173–181. 10.1080 / 194.2015.1044711 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Риордан С. М., Макивер К. Дж., Данкомб В. М., Болин Т. Д. (1995). Бактериологический анализ биоптатов слизистой оболочки для выявления избыточного бактериального роста в тонкой кишке. Сканд. J. Gastroenterol. 30, 681–685. 10.3109 / 003655295013 [PubMed] [CrossRef] [Google Scholar]
- Родригес-Паласиос А., Хоретоненко М. В., Илич С. (2019). Институциональные протоколы для перорального введения (зонд) химических веществ и микроскопических микробных сообществ мышам: аналитический консенсус.Exp. Биол. Med. 244, 459–470. 10.1177 / 1535370219838203 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Роуэн Ф., Дочерти Н. Г., Мерфи М., Мерфи Т. Б., Коффи Дж. С., О’Коннелл П. Р. (2010). Бактериальная колонизация слизистого геля крипт толстой кишки и активность заболевания при язвенном колите. Аня. Surg. 252, 869–874. 10.1097 / SLA.0b013e3181fdc54c [PubMed] [CrossRef] [Google Scholar]
- Рассел В. Р., Грац С. В., Дункан С. Х., Холтроп Г., Инс Дж., Скобби Л. и др. . (2011).Диеты для похудения с высоким содержанием белка и низким содержанием углеводов способствуют формированию профиля метаболитов, который может быть вредным для здоровья толстой кишки. Являюсь. J. Clin. Nutr. 93, 1062–1072. 10.3945 / ajcn.110.002188 [PubMed] [CrossRef] [Google Scholar]
- Саффури Г. Б., Шилдс-Катлер Р. Р., Чен Дж., Ян Й., Лекац Х. Р., Хейл В. Л. и др. . (2019). Микробный дисбактериоз тонкого кишечника лежит в основе симптомов, связанных с функциональными желудочно-кишечными расстройствами. Nat. Commun. 10: 2012. 10.1038 / s41467-019-09964-7 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shanahan E.Р., Чжун Л., Талли Н. Дж., Моррисон М., Холтманн Г. (2016). Характеристика микробиоты, связанной со слизистой оболочкой желудочно-кишечного тракта: новый метод предотвращения перекрестного загрязнения во время эндоскопических процедур. Алимент. Pharmacol. Ther. 43, 1186–1196. 10.1111 / apt.13622 [PubMed] [CrossRef] [Google Scholar]
- Шефлин А. М., Борресен Э. К., Кирквуд Дж. С., Бут К. М., Уитни А. К., Лу С. и др. . (2017). Пищевые добавки с рисовыми отрубями или темно-синей фасолью изменяют метаболизм кишечных бактерий у выживших после колоректального рака.Мол. Nutr. Food Res. 61: 905. 10.1002 / mnfr.201500905 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шет Р. У., Ли М., Цзян В., Симс П. А., Леонг К. В., Ван Х. Х. (2019). Пространственная метагеномная характеристика микробной биогеографии кишечника. Nat. Biotechnol. 37, 877–883. 10.1038 / s41587-019-0183-2 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Шим Дж. О. (2013). Микробиота кишечника при воспалительном заболевании кишечника. Педиатр. Гастроэнтерол. Гепатол. Nutr. 16, 17–21.10.5223 / pghn.2013.16.1.17 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- ШИНЕР М. (1963). Капсула для получения стерильных проб желудочно-кишечных жидкостей. Ланцет 1, 532–533. 10.1016 / s0140-6736 (63) -x [PubMed] [CrossRef] [Google Scholar]
-x [PubMed] [CrossRef] [Google Scholar]
Заполнение пробела между сбором, транспортировкой и хранением микробиоты кишечника человека
Устройство для сбора образцов и условия, манипуляции с донором, температура хранения образца, буфер для стабилизации состава для нуклеиновых кислот и время между сбором образца и лабораторным анализом являются основными переменными, которые могут повлиять на неправильный расчет микробных популяций, присутствующих в образце стула.Что наиболее важно, ожидается, что сохранение анаэробных условий с момента отбора пробы окажет положительное влияние на восстановление облигатных анэробных бактерий или бактерий EOS.
GutAlive поставляется в виде набора, содержащего все необходимые компоненты для облегчения процесса сбора стула (рис.). Примечательно, что использование GutAlive позволяет в течение 24–48 часов отбирать образцы фекалий и доставлять их в лабораторию при комнатной температуре без значительного снижения жизнеспособности бактерий.Это значительное улучшение для целей нормализации в крупных исследованиях, включающих отбор проб в разных географических точках, поскольку жизнеспособность выборки гарантируется для стандартных услуг, предлагаемых многими курьерскими компаниями. Ожидается, что стабильность при комнатной температуре (RT) улучшит и улучшит текущие протоколы, используемые для FMT / aFMT, которые на сегодняшний день отражают отсутствие консенсуса и иногда включают замораживание образца в домашних морозильных камерах 4 , 5 . Для лучшего понимания улучшений, предлагаемых GutAlive, все результаты, представленные в этой работе, сравниваются с обычным устройством, широко используемым для отбора проб стула.
Жизнеспособность и разнообразие фекальной микробиоты
Поскольку GutAlive показал свою эффективность для обработки облигатных анаэробных бактерий / бактерий EOS, мы исследовали, может ли это устройство поддерживать жизнеспособность микробиоты в процессе отбора и доставки образцов, первых двух этапов большинства исследований микробиома. .
Чтобы проанализировать различия в жизнеспособности популяций фекальных микробов на протяжении всей процедуры транспортировки / доставки, были взяты одни и те же образцы фекалий как в обычных устройствах для отбора проб стула, так и в GutAlive.Образцы выдерживали при комнатной температуре или 4 ° C в течение 5 и 24 часов, при этом 5 часов считались нулевым временем анализа. После этих периодов оба устройства были открыты в анаэробной рабочей станции, и были сделаны серийные разведения на разбавителе максимального восстановления и нанесены на поверхность 4 различных предварительно восстановленных сред GAMc, mBHI, mBHIb и ABMb: (рис.). Устройство GutAlive смогло предотвратить потерю культурного разнообразия бактерий, наблюдаемое в традиционных контейнерах, даже через 24 часа, сохраняя индекс разнообразия около 2.5–3,8 в зависимости от рассматриваемой питательной среды. Напротив, обычное устройство для сбора стула показало заметно более низкие значения индекса бактериального разнообразия (1,3–2,8 через 24 ч; рис.).
Эффект от использования GutAlive для сбора и отбора проб стула при извлечении культивируемых бактерий с использованием четырех различных сред через 5 и 24 часа с момента отбора проб. Результаты сравниваются с использованием обычных устройств для отбора проб стула, и разнообразие выражается как богатство видов Маргалефа.
Уменьшение бактериального разнообразия при использовании обычного устройства для сбора стула можно коррелировать с присутствием кислорода, который убивает облигатные анаэробы, в то же время способствуя выживанию факультативных анаэробных / аэротолерантных микроорганизмов. Токсичность кислорода для доминирующих микробных популяций широко изучалась в последние годы. В этом отношении Альбенберг и его коллеги продемонстрировали, что градиентное распределение членов микробиоты коррелирует с перфузией кислорода из тканей кишечника в просвет, и показали более высокую распространенность устойчивых к кислороду видов протеобактерий и актинобактерий, связанных со слизистой оболочкой прямой кишки 10 .Точно так же количество аэротолерантных микроорганизмов увеличивалось во время воспаления кишечника из-за более высокого присутствия окислительных метаболитов и кислорода в высокогидратированных фекалиях при диарее 11 . Примечательно, что воспалительное заболевание кишечника (ВЗК) характеризуется характерным дисбиозом микробиоты, при котором облигатные анаэробы чрезвычайно редки, способствуя увеличению факультативных анаэробов, например уменьшение F. prausnitzii и увеличение Escherichia coli из-за более высокого присутствия кислорода 12 .
В качестве доказательства концепции мы провели секвенирование 16S рДНК всех колоний, выделенных из образцов фекалий трех здоровых доноров, с использованием как устройств для сбора стула, так и секвенирования дифференциальных и общих колоний. В этом случае мы идентифицировали в общей сложности 150 колоний, растущих в среде ABMb из трех образцов фекалий. Различия в колониях были связаны с двумя разными устройствами для сбора, а также с индивидуумами (дополнительный файл 1 , колонии, дающие одинаковую последовательность, не показаны).Разнообразие микробов, основанное на данных секвенирования рДНК 16S, было заметно выше при использовании устройства GutAlive по сравнению с разнообразием, полученным с помощью обычного устройства для сбора стула (рис.). Примечательно, что GutAlive смог сохранить жизнеспособность фекальных видов EOS, таких как Akkermansia muciniphila , F. prausnitzii и возможного нового члена отряда Clostridiales , среди других облигатных анаэробов, которые были потеряны при обычном сборе стула. устройство (доп.Файл 1 ). Примечательно, что изолят F. prausnitzii , выделенный с помощью GutAlive (MT126), сгруппирован с подмножеством других геномов того же вида в однородную группу, которая может представлять отдельный вид с учетом значений гибридизации ДНК-ДНК in silico (> 70 %), полученных из геномных последовательностей (Прилож. рис. 1 , Прилож. файл 2 ). GutAlive позволил культивировать новый изолят (MT139), который в соответствии с разведением, в котором он появился, обозначал распространенный изолят, который, кроме того, является потенциальным продуцентом масляной кислоты (рис., Прил. Файл 3 ). Это также продемонстрировало важность индивидуального подхода к терапии на основе микробиоты, поскольку этот новый изолят Clostridiales , который таксономически близок к семейству Ruminococcaceae , был идентифицирован только в образце фекалий одного донора, S5.
( A ) Диаграммы Венна, показывающие различные виды бактерий, выделенных в BHI с добавлением дефибринированной крови лошади после 24 часов отбора проб. Показаны результаты от 3 доноров (S1, S2 и S5) с разными микробиотами.Пересечение обозначает общие изоляты, идентифицируемые с обоими устройствами. ( B ) Консенсусное дерево NJ начальной загрузки, выведенное из 5000 реплик с использованием данных гена 16S рРНК из 42 ближайших совпадений с изолятом MT139. Получено из базы данных GenBank. Показаны только три самых близких совпадения, а остальные ветви, соответствующие другим тридцати девяти последовательностям, свернуты. Рядом с ветками показана поддержка Bootstrap. ( C ) Значения гибридизации ДНК-ДНК in silico бактерий, наиболее близких к изоляту МТ139.
Охлаждение, замораживание или даже доставка образцов стула при комнатной температуре — это разные подходы, применяемые для сохранения ДНК для дальнейшего выделения и последующего анализа 13 . Чтобы проверить влияние температуры на жизнеспособность бактерий, мы сначала протестировали транспорт при 4 ° C или комнатной температуре. Температура не повлияла на микробное разнообразие, рассчитанное по различиям морфологии колоний, полученным после отбора проб, поэтому мы оставили наиболее удобный и экономичный вариант — RT.Как правило, мы можем утверждать, что жизнеспособность и разнообразие фекалий остаются неизменными после 24 часов отбора проб и сохраняют RT при использовании GutAlive, поскольку EOS и даже новые анаэробные таксоны культивируются после этого периода. Мы осознаем, что представленные здесь результаты ограничиваются бактериями, выделенными в неселективной и богатой среде. Можно выделить большее количество кишечных бактерий, комбинируя GutAlive с культуромическим подходом 14 .
Жизнеспособность фекальной микробиоты является ключевым фактором для разработки продуктов на основе микробиоты, таких как FMT, aFMT и консорциумы на основе персонализированной фекальной микробиоты.Поколение продуктов на основе микробиоты, основанных на жизнеспособной микробиоте, позволит разработать целое новое поколение персонализированных методов лечения, чтобы изменить микробиом человека в сторону здоровых форм. Более того, поскольку исследования пробиотиков следующего поколения в настоящее время продвигаются, определенные и персонализированные консорциумы могут быть выделены и распространены индивидуально. Сохранение жизнеспособности микробов и нормализация процесса отбора и доставки проб имеют решающее значение для всего микробиома. 1 .Для этого фекальную микробиоту необходимо поддерживать неизменной и репрезентативной для исходных микробных популяций, укрываемых хозяином.
Субпопуляция микроорганизмов, рассматриваемая в рамках нашего подхода, представляет собой вид F. prausnitzii , один из основных продуцентов бутирата в толстой кишке и микроорганизм EOS 15 , 16 . Наиболее важно, что снижение относительной численности этой бактерии связано с дисбактериозом, связанным с диабетом 2 типа, воспалительным заболеванием кишечника или другими хроническими воспалительными состояниями 16 — 20 .Недавние исследования подтверждают противовоспалительный механизм действия F. prausnitzii за счет секреции различных молекул 20 — 22 . Очень интересно, что продуценты бутирата, по-видимому, зависят от хозяина, поэтому сохранение его биоразнообразия за счет предотвращения токсического действия кислорода во время отбора проб позволит предусмотреть разработку персонализированных пробиотиков следующего поколения в случае необходимости в будущем.
GutAlive также полезен для гетерологичного FMT, который в последние годы успешно использовался для уничтожения патогена человека с множественной лекарственной устойчивостью Clostridium difficile , одновременно восстанавливая здоровый микробиом.FMT отражает как выдающиеся применения FMT, так и актуальность использования полной микробиоты для достижения терапевтического эффекта 23 . Использование таких устройств, как GutAlive, позволит нормализовать процесс сбора и доставки образцов для обеспечения жизнеспособности микробов, позволяя хранить аликвоты здоровых конфигураций микробиоты. Хранение здоровой жизнеспособной микробиоты откроет новые возможности для использования в персонализированной терапии восстановления микробиома, когда человек страдает болезнью или проходит обширное лечение (например,г. длительное введение антибиотиков или химиотерапия), которые разрушают микробиоту. Персонализированные биотерапевтические приложения включают aFMT и составы персонализированной смеси пробиотиков, разработанные специально не только для человека, но и для конкретного изменения, связанного с микробиотой 24 .
Недавнее исследование показало выдающиеся результаты в отношении восстановления микробиома с использованием aFMT после обширного лечения антибиотиками 4 . Богатство микробиоты, измеренное как индекс альфа-разнообразия, было аналогично контролю через восемь дней на модели животных и сразу через один день в группе добровольцев после aFMT.Интересно, что та же работа показала, что многовидовой пробиотический продукт был менее эффективным с точки зрения восстановления микробиоты, как следует из индекса альфа-разнообразия. Хотя замораживание образцов стула (при -20 ° C или -80 ° C) сразу после сбора, по-прежнему считается золотым стандартом сбора кала для исследований микробиоты, особенно если рассматривается метагеномный подход, наша технология позволит стандартизировать сбор и транспортировка образцов, предоставленных тысячами разных людей, поскольку температура во время этих двух процессов мало влияет на жизнеспособность основных облигатных анаэробных бактерий, присутствующих в образцах.Следует проявлять осторожность в том смысле, что наш подход отражает реальную процедуру, в которой пользователь отбирает образец фекалий дома, будучи ответственным за доставку образца курьером обратно в нашу лабораторию. Для этого мы оценили среднее время в 5 ч и, что считается исходным. Поскольку микробиота не тестировалась на жизнеспособность в нулевой момент времени (сразу после осаждения), мы можем утверждать, что GutAlive лучше, чем обычный контейнер для стула, но мы не можем строго сказать, что GutAlive поддерживает все анаэробные бактерии в образце, поскольку некоторые микроорганизмы могут быть потеряны во время транспортировки простого в лабораторию.
Анализ микробиома и, что более важно, методы лечения восстановления микробиома требуют стандартизации протоколов и материалов, в том числе устройств для отбора проб фекалий, которые обеспечивают жизнеспособность фекальной микробиоты при сборе, транспортировке и хранении до любого анализа или лечения. Однако текущие и прошлые международные инициативы были сосредоточены на стандартизации протоколов анализа и обработки последовательностей ДНК, тогда как протоколам сбора, транспортировки и хранения образцов уделялось мало внимания 25 , 26 .
GI-MAP | GI Microbial Assay Plus
ПАТОГЕНОВ
GI-MAP® включает патогены (бактериальные, паразитарные и вирусные), обычно вызывающие кишечный гастроэнтерит. Важно отметить, что не у всех людей с положительными результатами на патогены проявляются симптомы. Многие факторы, в том числе здоровье человека, преходящий характер некоторых патогенов, а также наличие и проявление факторов вирулентности, — все это способствует появлению симптомов у человека.
Токсины представляют собой фактор вирулентности, продуцируемый определенными патогенами. Поскольку GI-MAP — это тест на основе ДНК, результаты отражают уровни патогенных штаммов, несущих гены токсинов, а не уровни каких-либо токсинов, которые могут быть продуцированы.
БАКТЕРИАЛЬНЫЕ ПАТОГЕНЫ
- Campylobacter
- C. difficile Токсин A
- С.difficile Токсин B
- Энтерогеморрагический E. coli
- E. coli O157
- Энтероинвазивный E. coli / Shigella
- Энтеротоксигенный E. coli LT / ST
- Шига-подобный токсин E. coli stx1
- Шига-подобный токсин E. coli stx2
- Сальмонелла
- Виброхолера
- Yersinia enterocolitica
ПАРАЗИТНЫЕ ПАТОГЕНЫ
- Криптоспоридиум
- Entamoeba histolytica
- Лямблии
ПАТОГЕНОВ ВИРУСА
- Адреновирус 40/41
- Норовирус GI
- Норовирус GII
Недавние исследования показали, что почти 50% населения мира могут быть носителями H. pylori . И, хотя многие носители протекают бессимптомно, известно, что H. pylori является причиной язв, хронического гастрита и рака желудка.
Кроме того, на ранних этапах колонизации пациенты могут испытывать гипохлоргидрию с последующим переходом в гиперацидурию. Со временем могут колонизировать еще штаммов H. pylori , в том числе с факторами вирулентности и повышенным потенциалом заболевания.
Х. пилори
- H. pylori
- Фактор вирулентности, babA
- Фактор вирулентности, cabA
- Фактор вирулентности, cabPAI
- Фактор вирулентности, dupA
- Фактор вирулентности, лед A
- Фактор вирулентности, opiA
- Фактор вирулентности, vacA
НОРМАЛЬНЫЕ / КОММЕНТАЛЬНЫЕ БАКТЕРИИ
Триллионы микроорганизмов населяют кишечник человека и составляют сложную экосистему, играющую важную роль в здоровье человека.Комменсальные бактерии извлекают питательные вещества и энергию из нашего рациона, поддерживают функцию кишечного барьера, производят витамины (биотин и витамин К) и защищают от колонизации потенциальными патогенами.
ОБЩИЕ БАКТЕРИИ
- Аккермансия Муцинофилия
- Bacteroides fragilis
- Bifidobacterium spp.
- Clostridia (класс)
- Enterobacter spp.
- Enterococcus spp.
- Escherichia spp.
- Faecalbacterium prausnitzii
- Lactobacillus spp.
БАКТЕРИАЛЬНАЯ ФИЛА
- Бактероиды
- Firmicutes
- Соотношение Firmicutes / Bacteroidetes
ОПОРТУНИСТИЧЕСКИЕ / МИКРОБЫ ПЕРЕРОСТА
Многие бактерии, измеренные с помощью GI-MAP, считаются условно-патогенными микроорганизмами, поскольку они вызывают заболевание только у некоторых людей, особенно у людей с ослабленным иммунитетом.Многие люди контактируют с условно-патогенными бактериями и не испытывают никаких симптомов. Большинство источников считают, что эти микробы присутствуют в стуле нормально. Однако они могут вызывать гастроэнтерит и воспаление в высокой степени у уязвимых пациентов. Симптомы могут включать диарею, жидкий стул, боль в животе или даже запор.
Чрезмерный рост и чрезмерная колонизация условно-патогенными бактериями может произойти, когда комменсальные бактерии нарушены неправильным питанием, использованием антибиотиков, паразитарной инфекцией или ослабленной иммунной системой.При наличии кишечной проницаемости (см. Зонулин) эти микробы могут покинуть просвет кишечника и инфицировать внекишечные участки.
ДОПОЛНИТЕЛЬНЫЕ ДИСБИОТИЧЕСКИЕ БАКТЕРИИ / БАКТЕРИИ ПЕРЕГРУЗКИ
- Enterococcus faecalis
- Enterococcus faecium
- Methanobacteriaceae (семейство)
- Morganella morganii
- Pseudomonas spp.
- Синегнойная палочка
- Staphylococcus spp.
- Стафилококк aureus
- Streptococcus spp.
ПОТЕНЦИАЛЬНЫЕ АУТОИММУННЫЕ ТРИГГЕРЫ
- Citrobacter spp.
- Citrobacter freundii
- Fusobacterium spp.
- Klebsiella spp.
- Klebsiella pneumoniae
- Mycobacterium avium
- Prevotella copri
- Proteus spp.
- Протей мирабилис
ГРИБЫ / ДРОЖЖИ
Грибковые организмы обычно встречаются в пищеварительном тракте человека, но чрезмерный рост грибков может вызвать заболевание у восприимчивых людей.В теле может локализоваться рост грибков. Например, Candida spp. может быть высоко в толстой кишке, но нормально в тонкой кишке, и наоборот. У пациента с подозрением на грибковый рост могут потребоваться дополнительные тесты, чтобы понять полную картину грибкового разрастания. Иногда используются мочевой D-арабинит или антитела к Candida .
ГРИБЫ / ДРОЖЖИ
- Candida albicans
- Candida spp.
- Geotricum spp.
- Microsporidia spp.
- Rhodoturula spp.
ВИРУСЫ
Копировать?
ОПОРТУНИСТИЧЕСКИЕ ВИРУСЫ
- ЦМВ-цитомегаловирус
- EBV-вирус Эпштейна-бара
ПАРАЗИТЫ
Паразит — это организм, который живет и питается организмом хозяина за счет хозяина.Тесты GI-MAP на патогенных паразитов и простейших (некоторые из которых не являются патогенными) , наиболее часто встречающиеся в желудочно-кишечном тракте. Источники заражения должны быть идентифицированы и устранены, чтобы предотвратить повторное заражение.
ПРОТОЗОА
- Blastocystis hominis
- Chilomastix mesnelli
- Cyclospora cayetanenensis
- Dientamoeba fragilis
- Эндолимакс нана
- Entamoeba coli
- Pentatrichomonas hominis
ЧЕРВЫ
- Ancyclostroma duodenale
- Аскарида поясничная
- Некатор американский
- Trichuris trichiura
- Taenia solium / saginada
МАРКЕРЫ ЗДОРОВЬЯ КИШЕЧНИКА
Копировать?
GI МАРКЕРЫ
- β-глюкуронидаза
- Скрытая кровь — FIT
Гены устойчивости к антибиотикам
GI-MAP включает результаты обнаружения генов устойчивости к антибиотикам в микробиоме.Если присутствует ген устойчивости к антибиотикам, то этот класс антибиотиков считается ПОЛОЖИТЕЛЬНЫМ для устойчивости к антибиотикам. Положительный результат на наличие генов устойчивости к данному антибиотику указывает на то, что антибиотик не является идеальным выбором для протокола антибиотиков.
Гены устойчивости к антибиотикам применимы ко всем микроорганизмам, обнаруженным в образце фекалий. Поскольку микробы могут быстро обмениваться ДНК при стрессе, наличие устойчивости к антибиотикам в любом организме является достаточной причиной, чтобы избегать этого класса лекарств.
Фенотипы | ХЕЛОБАКТЕР
- Амоксициллен
- Кларитромицин
- Фторхинолины
- Тетрациклин
Генотипы | УНИВЕРСАЛЬНЫЕ ГЕНЫ УСТОЙЧИВОСТИ К МИКРОБИОТА
- β-лактамаза
- Фторхинолоны
- Макролиды
- Ванкомицин
ГЕНЫ УНИВЕРСАЛЬНОЙ УСТОЙЧИВОСТИ К МИКРОБИОТА
- β-лактамаза
- Фторхинолоны
- Макролиды
- Ванкомицин
Тесты стула (для родителей) — Nemours Kidshealth
О тестах стула
Стул (или фекалии) обычно считается ничем иным, как отходами — чем-то, что нужно быстро смыть.Но дефекация может дать врачам ценную информацию о том, что не так, когда у ребенка проблемы с желудком, кишечником или другой частью желудочно-кишечной системы.
Врач может назначить сбор стула для проверки на различные возможные состояния, в том числе:
- аллергия или воспаление в организме, например, часть оценки аллергии на молочный белок у младенцев
- инфекция, вызванная некоторыми типами бактерий, вирусов или паразитов, которые вторгаются в желудочно-кишечный тракт
- проблемы с пищеварением, такие как нарушение всасывания некоторых сахаров, жиров или питательных веществ
- желудочно-кишечное кровотечение
Самая распространенная причина для анализа стула — определить, могут ли бактерии или паразиты инфицировать кишечник.Многие микроскопические организмы, живущие в кишечнике, необходимы для нормального пищеварения. Однако, если кишечник заражен вредными бактериями или паразитами, это может вызвать проблемы, такие как определенные виды кровавой диареи, а анализ стула может помочь найти причину.
Образцы стула также иногда анализируются на предмет того, что они содержат; например, проверка содержания жира. В норме жир полностью всасывается из кишечника, а стул практически не содержит жира. Однако при некоторых типах расстройств пищеварения жир всасывается не полностью и остается в стуле.
Стр. 1
Сбор образцов стула
В отличие от большинства других лабораторных тестов, стул иногда собирает семья ребенка дома, а не медицинский работник. Вот несколько советов по сбору образца стула:
- Собирать стул может быть грязно, поэтому не забудьте надеть латексные перчатки и после этого хорошо вымыть руки и руки ребенка.
- Многие дети, страдающие диареей, особенно маленькие, не всегда могут заранее сообщить родителям о приближении дефекации.Иногда для сбора образца стула используют пластиковую крышку в форме шляпы. Это устройство для улавливания можно быстро разместить над унитазом или задним концом вашего ребенка, чтобы собрать образец. Использование улавливающего устройства может предотвратить загрязнение стула водой и грязью. Если моча загрязняет образец стула, необходимо будет взять еще один образец. Кроме того, если вы не можете собрать образец стула до того, как он коснется внутренней части унитаза, его необходимо будет повторить. Ловля испражнений из туалета не дает лаборатории для анализа чистый образец.
- Другой способ взятия пробы стула — это свободно накинуть полиэтиленовую пленку на край унитаза под сиденьем. Затем поместите образец стула в чистый герметичный контейнер, прежде чем отправлять его в лабораторию. Пластиковую пленку также можно использовать, чтобы выстелить подгузник младенца или малыша, который еще не пользуется туалетом.
Стул следует собирать в чистые сухие пластиковые банки с завинчивающейся крышкой. Вы можете получить их у врача, в больничных лабораториях или аптеках, хотя подойдет любой чистый герметичный контейнер.Для достижения наилучших результатов стул следует немедленно доставить в лабораторию.
Если образец стула будет исследован на наличие инфекции, и невозможно сразу доставить образец в лабораторию, стул следует охладить, а затем доставить в лабораторию для посева как можно скорее после сбора. Когда образец поступает в лабораторию, он либо исследуется и сразу же культивируется, либо помещается в специальную жидкую среду, которая пытается сохранить потенциальные бактерии или паразиты.
Врач или больничная лаборатория обычно предоставляют письменные инструкции о том, как успешно собрать образец кала; Если письменных инструкций нет, запишите, как собирать образец и что делать после того, как вы его взяли.
Если у вас возникнут вопросы по сбору пробы, обязательно задавайте их. Врач или лаборатория также сообщат вам, нужен ли свежий образец стула для конкретного теста и нужно ли его сразу же доставить в лабораторию.
В большинстве случаев болезнетворные бактерии или паразиты можно идентифицировать по одному образцу стула. Однако иногда необходимо взять до трех образцов из разных дефекаций. Врач сообщит вам, если это так.
Стр. 2
Исследование образца стула
Как правило, результаты анализов стула обычно сообщаются в течение 3–4 дней, хотя для завершения анализа на паразитов часто требуется больше времени.
Исследование стула на наличие крови
Ваш врач иногда проверяет стул на наличие крови, что может быть вызвано определенными видами инфекционной диареи, кровотечением из желудочно-кишечного тракта и другими состояниями.Однако в большинстве случаев прожилки крови в стуле у грудных детей или малышей появляются из-за небольшого разрыва прямой кишки, называемого трещиной, который возникает из-за натуживания твердого стула (это довольно часто встречается у младенцев и детей с постоянными запорами). .
Анализ крови в стуле часто выполняется с помощью быстрого теста в офисе, который может немедленно предоставить результаты. Сначала на карточку размазывают стул, затем на карточку наносят несколько капель проявляющего раствора. Мгновенное изменение цвета показывает, что в стуле присутствует кровь.Иногда кал отправляют в лабораторию для анализа крови, и результат сообщается в течение нескольких часов.
Культивирование стула
Стул можно культивировать на болезнетворные бактерии. Образец стула помещается в инкубатор на срок от 48 до 72 часов, и все болезнетворные бактерии идентифицируются и выделяются. Помните, что не все бактерии в стуле вызывают проблемы; Фактически, около половины стула составляют бактерии, большинство из которых живут там нормально и необходимы для пищеварения.При посеве стула лаборанты больше всего озабочены выявлением бактерий, вызывающих заболевание.
Для посева кала в лаборатории потребуется свежий или охлажденный образец стула. Лучшие образцы — жидкий свежий стул; хорошо сформированный стул редко бывает положительным на болезнетворные бактерии. Иногда для посева собирают более одного стула.
Мазки из прямой кишки ребенка также могут быть проверены на вирусы. Хотя это обычно не делается, иногда это может дать подсказку об определенных заболеваниях, особенно у новорожденных или очень больных детей.Выращивание вирусных культур может занять неделю или больше, в зависимости от вируса.
Тестирование стула на яйцеклетки и паразиты
Стул можно проверить на наличие паразитов и яйцеклеток (паразитическая стадия яйца), если у ребенка длительная диарея или другие кишечные симптомы. Иногда врач собирает два или более образцов кала для успешного выявления паразитов. Если при исследовании мазка стула под микроскопом обнаруживаются паразиты или их яйца, ребенок лечится от паразитарной инвазии.Врач может дать вам специальные контейнеры для сбора, содержащие химические консерванты от паразитов.
.
