Диффузная фиброзно-кистозная мастопатия (ДФК) — лечение в клинике СОЮЗ
Диагностика
Основные методы диагностики мастопатии – маммография и УЗИ. Реже применяют МРТ – это исследование самое чувствительное, но его цена выше. К тому же, во многих клиниках нет оборудования для проведения МРТ и врачей, которые умеют интерпретировать полученные данные.
Маммография (рентген) – используется для скрининга рака и выявления мастопатии после 40 лет. Метод недорогой, поэтому имеет широкое распространение. Но у него есть недостатки: 15% случаев мастопатии остаются невыявленными, в 10% случаях устанавливается ошибочный диагноз. К тому же, рентгенологическое исследование ассоциировано с лучевой нагрузкой на организм – облучается не только молочная железа, но и легкие, сердце, органы средостения. У женщин до 40 лет точность исследования ещё ниже, а до 30 лет оно минимально информативно.
УЗИ – основной метод диагностики мастопатии у женщин до 40 лет, с развитым железистым компонентом груди, а также у беременных и кормящих.
-
допплеровское картирование;
-
энергетическое допплеровское картирование;
-
ультразвуковая эластография (компрессионная и сдвиговой волной).
Современные варианты УЗИ позволяют провести дифференциальную диагностику между диффузными и очаговыми изменениями, кистозными и плотными образованиями.
МРТ с контрастированием – самое чувствительное, но недостаточно специфичное исследование. Оно применяется как уточняющий метод. Особую ценность МРТ имеет в диагностике мастопатии у молодых женщин, при установленных имплантах груди, наличии выделений из сосков, высокой плотности молочной железы.
Биопсия – при мастопатии требуется редко. Помогает исключить злокачественные опухоли и определить показания к лечению мастопатия. Самое точное исследование – cоrе-биопсия (введение в опухоль толстой иглы, внутри которой после извлечения остается столбик ткани).
Помогает исключить злокачественные опухоли и определить показания к лечению мастопатия. Самое точное исследование – cоrе-биопсия (введение в опухоль толстой иглы, внутри которой после извлечения остается столбик ткани).
В чем проявляется нехватка женских гормонов
Стоит ли говорить, что гормоны играют огромную роль в нашем организме. Любые отклонения могут вызвать различные заболевания, рассказывает Sympaty.net.
Поэтому важно знать свой гормональный фон и, если есть необходимость, вовремя проводить лечение по восстановлению гормонального баланса.
Нехватка женских гормонов: симптомы
Даже не сдавая анализы, можно обнаружить нехватку гормонов. Для этого необходимо знать, какие симптомы вызывает нехватка того или иного гормона. Поговорим об этом подробнее.
Эстрадиол — главный женский половой гормон, входит в группу эстрогенов. Его нехватка может вызвать следующие симптомы: быстрая утомляемость, депрессия, отсутствие или снижение сексуального желания, сбои менструального цикла, трудности с зачатием или вынашиванием ребенка.
Также при сильной нехватке эстрогенов может обнаружиться остеопороз и бесплодие, развиться ожирение, появиться опухоль молочных желез или матки.
Причиной нехватки женского гормона эстрадиола чаще всего бывает нарушение функций яичников, а также прием неправильно подобранных оральных контрацептивов.
Пролактин вырабатывается гипофизом, а во время беременности — в эндометрии. Этот гормон ответственен за половое созревание, выработку прогестерона, состояние молочных желез, лактацию.
Пониженный уровень образования пролактина — явление достаточно редкое и связано, прежде всего, с нарушением в работе гипофиза. Чаще встречается увеличение выработки, а не нехватка женского гормона пролактина.
Симптомы следующие: нарушение менструального цикла, отсутствие овуляции, разного рода выделения из молочных желез, рост волос на лице и спине, проблемная кожа, склонная к угревой сыпи. С наступлением беременности, начиная приблизительно с восьмой недели, выработка пролактина также увеличивается, но это считается абсолютной нормой.
Прогестерон часто называют гормоном беременности, потому что именно он несет ответственность за образование желтого тела и играет значимую роль в течение беременности, особенно в первом триместре. Нехватка женских гормонов вообще и в частности прогестерона ведет к нарушению менструального цикла.
Симптомы пониженного уровня прогестерона: скудные и нерегулярные менструации, угревая сыпь, раздражительность, депрессивность, угроза выкидыша во время беременности.
Нехватка прогестерона может привести к аменорее, неврозу, депрессии, хроническим воспалительным заболеваниям женских половых органов, выкидышу.
Кроме этого, если у вас нехватка женских гормонов, симптомы могут быть следующие: сильное потоотделение, частые запоры, бессонница, нервные срывы, беспричинное появление растяжек на теле, приливы, выпадение волос, сухость кожи, сухость слизистых оболочек глаз и половых органов и другие.
Нехватка женских гормонов. Что делать?
Несмотря на то, что определить нехватку гормонов можно по симптомам, все же невозможно угадать, какого конкретно гормона не хватает и насколько его содержание далеко от нормы.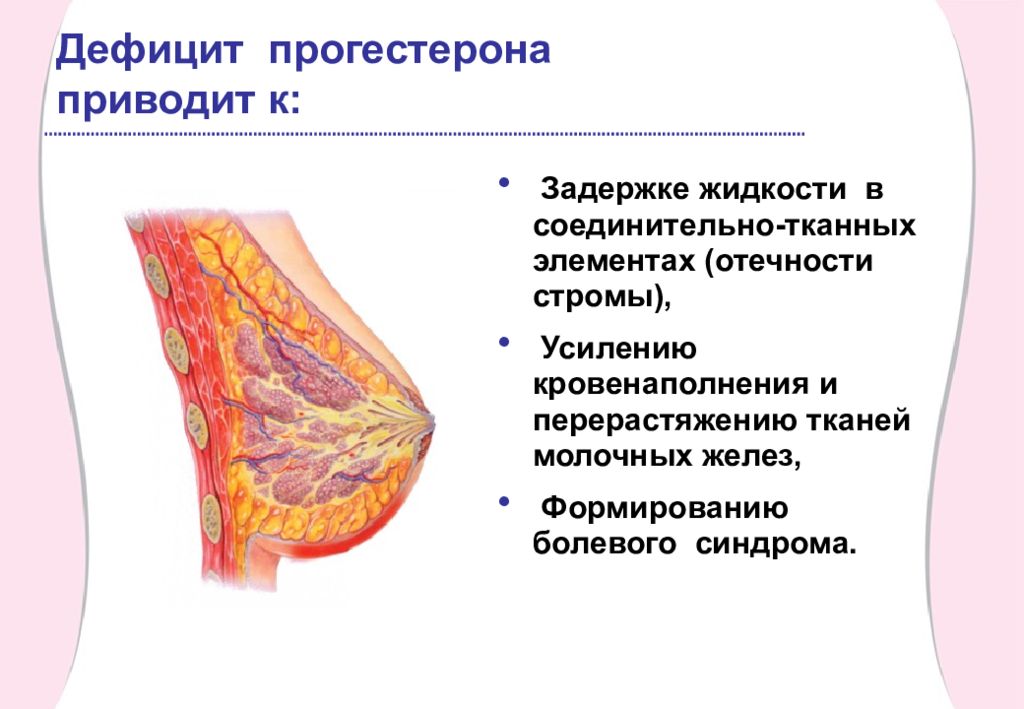 А иногда и повышение уровня гормонов может выражаться в подобных симптомах.
А иногда и повышение уровня гормонов может выражаться в подобных симптомах.
По этой причине стоит рассказать об общих рекомендациях по нормализации гормонального фона.
- Необходимо правильно, сбалансированно и разнообразно питаться. В меню обязательно должны быть включены следующие продукты: фрукты и овощи, мясо и рыба, достаточное количество жидкости, в том числе натуральных соков.
- Нужно научиться владеть собой в стрессовых ситуациях и по возможности избегать их.
- Минимизировать симптомы нехватки женских гормонов помогут занятия спортом, фитнесом, танцами.
- Если у ваc нехватка женских гормонов, имеет смысл отказаться от курения, алкоголя, уменьшить потребление кофе.
- Необходимо выделять достаточное количество времени для сна и отдыха.
- Скрупулезно выбирать оральные контрацептивы. Лучше всего, если по этому вопросу вас проконсультирует гинеколог.
Нехватка женских гормонов, как и их избыток, в первую очередь отражается на работе репродуктивной системы, то есть на способности зачать и выносить ребенка.
Поэтому не игнорируйте эти симптомы, заботьтесь о своем здоровье.
Оставить комментарий Читать комментарииКоррекция гормональных нарушений
Нарушение баланса гормонов в организме женщины провоцирует целый ряд гинекологических заболеваний и нарушений функций организма, и влияет на эмоционально и физическое самочувствие. Норма – это когда в организме женщины гармонично функционируют одновременно женские и мужские гормоны. Но временами может наблюдаться сбой в работе половых гормонов.Если в организме женщины нарушение гормонального фона, то в первую очередь об этом свидетельствуют нарушения менструального цикла. Это может проявляться в болезненных менструациях, кратковременных, небольшим количеством выделений или чрезмерное их обилие, также менструации могут отсутствовать вовсе.
Определяя, действительно ли есть нарушения, стоит обратить внимание на регулярность менструального цикла, его продолжительность, и на то, как чувствует себя женщина на протяжении менструации, до и после.

О нарушении гормональной функции могут говорить такие симптомы как резкие перемены артериального давления, особо усиленная болезненность менструаций, частые резко возникающие головокружения, заметная отечность, вздутие живота, общее состояние слабости и разбитости.
Внешний вид. Внешне гормональные нарушения у женщин также проявляются. Следует обратить внимание на такой фактор как изменения в весе. Период, когда вы набирали или сбрасывали вес, возможно, был связан со стрессами либо какими-то заболеваниями? Примите во внимание, что избыток жировой ткани влияет на снижение функции яичников, такое же влияние имеет и дефицит в весе. Внимательно посмотрите на свою кожу. Наличие угревой сыпи, повышенной сальности, вероятнее всего, могут указывать на дисфункцию яичников, которая сопровождается чрезмерным выделением мужских гормонов.
Беременность. Очень часто препятствием для беременности могут быть гормональные нарушения. Причиной этого является недостаток гормона прогестерона, который принимает участие в процессах возникновения и развития беременности. Не просто так прогестерон считают гормоном материнства. Именно из-за его нехватки у женщины невозможно забеременеть, или же оплодотворенная яйцеклетка не может удержаться в матке больше двух-трех дней. Характерно то, что нехватка этого гормона может не влиять на менструальный цикл, он может быть нормальным.
Молочные железы. Специалисты считают, что молочные железы – это мишень для женских половых гормонов. Норма, когда грудь не имеет никаких патологических уплотнений. Из сосков не должны выделяться никакие жидкости в период менструации. В это время она может быть чувствительной и набухать, но не должна болеть. Если грудь болит, значит в организме не достаточно гормона прогестерона.
Если грудь болит, значит в организме не достаточно гормона прогестерона.
Климактерический синдром. Период климакса также может сопровождаться гормональными нарушениями. Во время возрастной перестройки в организме постепенно прекращается созревание фолликулов и процесса овуляции. В то же время выделение гормонов в организме не прерывается даже после того, как менструации прекращаются.
В случае отсутствия гормональных нарушений климакс протекает без сопровождения болезненных проявлений и без каких-либо осложнений. Однако, если присутствуют гормональные нарушения, то период климакса сопровождает так называемый климактерический синдром, который проявляется бессонницей, приливами, нервозностью, раздражительностью, повышенным артериальным давлением, депрессивным состоянием. В некоторых случаях это состояние может усугубляться болями в суставах, что имеет название эндокринный артрит, и может болеть сердце.
Причины гормональных нарушений
В первую очередь, это может быть обусловлено наследственностью, генетической предрасположенностью. В таких случаях приходится приложить немало усилий, чтобы повернуть процесс нарушений вспять.
В таких случаях приходится приложить немало усилий, чтобы повернуть процесс нарушений вспять.
Еще одна причина – это переживания и стресс. Влияние центральной нервной системы напрямую распространяется на эндокринную?которая несет ответственность за гормональную выработку. И если возрастает нагрузка на нервную систему, то это чревато гормональными нарушениями. Соответственно, в первую очередь это наносит урон репродуктивной функции, процессу созревания фолликул, что является подготовкой к беременности. Женский организм так устроен, что в случае каких-либо нарушений первое, что выходит из строя – это яичники.
Снижение иммунитета влияет на гормональный фон. Если у маленьких девочек детство было болезненным, в частности частым были такие гости как ангина и ОРЗ, то это негативно отражается на гормональной сфере в старшем возрасте. Иммунитет, который постоянно «подбивается» стрессами, болезнями, неправильным питанием, переутомлением, паразитами, сразу же дает сбой именно в репродуктивной системе женщины.
Большое влияние на гормональную сферу имеют перенесенные инфекции, включая инфекции, полученные половым путем. Если в организме женщины присутствуют паразиты, то это так же отражается на иммунной защите негативно, кроме того, паразиты выделяют большое количество токсинов, которые вредят всему организму, включая репродуктивную систему.
Негативное влияние имеют так же любые хирургические вмешательства в брюшной полости и при операциях на области женских половых органах. Особенно важно помнить, что самой распространенной причиной женских нарушений гормонального фона, которые ведут к бесплодию – это аборты, которые часто сопровождаются выскабливанием матки.
Как гормоны влияют на кожу: сухость, морщины, прыщи :: Здоровье :: РБК Стиль
«Нормальная» — эпитет, который мы часто слышим в контексте разговоров о коже. Но с медицинской точки зрения стандартного нормального состояния у нашей кожи нет и не может быть. С возрастом она меняется и проходит через различные состояния. Гормоны — важнейший фактор, оказывающий влияние на кожу в каждый период жизни. Их воздействие определяет реакцию кожи на внешние и внутренние сигналы. Разбираемся, как это работает.
Маргарита Гехт,
ведущий врач-дерматолог фонда «Дети-бабочки»
Что такое гормоны
Гормоны — это химические посредники-помощники, которые вырабатываются в яичниках, надпочечниках, щитовидной железе, гипофизе и эпифизе. Каждый гормон выполняет свою роль. Они являются «дирижерами» работы внутренних органов, влияя как на самочувствие, так и на внешний вид кожи.
На состоянии кожи сказывается деятельность следующих гормонов.
Эстрогены
Считаются «женскими» гормонами. Они помогают коже и волосам оставаться молодыми.
Эстрогены влияют на толщину и влажность кожи, отвечают за образование морщин. Они увеличивают содержание гликозаминогликанов, например, гиалуроновой кислоты, поддерживающих баланс жидкости и структурную целостность кожных покровов. Эти гормоны также отвечают за выработку коллагена, который поддерживает толщину эпидермиса и позволяет коже оставаться плотной, гладкой и увлажненной.
От колебаний эстрогенов также зависит состояние придатков кожи — волос и ногтей. Например, усиленный рост волос, так радующий многих беременных женщин, объясняется повышением уровня эстрогенов, а резко падающий послеродовой и даже менопаузальный уровень эстрогенов вызывает истончение и выпадение волос. Иногда это приводит к клинически значимому — телогеновому — выпадению волос.
Андрогены
Эти гормоны обычно ассоциируются с мужчинами, но они также есть и у женщин, поэтому эффект от изменения уровня андрогенов испытывают оба пола. Например, из-за повышенного уровня андрогенов у женщин может наблюдаться облысение.
С возрастом, в том числе и после менопаузы, соотношение эстроген-андроген в организме становится несбалансированным, что также приводит к изменениям состояния кожи и волос.
Тестостерон — главный представитель этой группы гормонов, увеличивающий продукцию сальных желез в порах кожи.
Результаты работы тестостерона:
- более грубые волосы;
- более плотная, пористая и жирная кожа;
- более позднее начало проявления признаков старения кожи;
- акне.
Более высокий уровень тестостерона у женщин часто является причиной появления нежелательных волос на лице. В возрасте 15-35 лет, когда андрогены, и, в частности, тестостерон, активно участвуют в производстве кожного сала, женщины также могут испытывать повышенную жирность кожи или явления возрастного акне.
Прогестерон
Этот гормон является посредником в работе других гормонов и помогает регулировать уровень тестостерона и эстрогена.
Прогестерон влияет на кожу в нескольких направлениях:
- контролирует уровень других гормонов;
- уменьшает уровень кортизола и других гормонов стресса, в результате чего действует успокаивающе на нервную систему.
- способствует здоровому сну, что положительно сказывается на состоянии кожи.
Тиреоидный гормон
Щитовидная железа — это маленькая железа в форме бабочки, расположенная прямо над голосовым аппаратом. Она вырабатывает тиреотропный гормон, который влияет на обмен веществ, уровень увлажненности кожи, менструальные циклы, вес и уровень холестерина.
В норме выработка этого гормона должна быть сбалансированной. При его переизбытке кожа может стать красной, воспаленной, приобрести повышенную влажность. При недостатке — сухой, грубой, шершавой и воспаленной вследствие сухости и уменьшения потоотделения.
Дисфункция щитовидной железы также может привести к истончению и выпадению волос.
Кортизол
Вы замечали, как кожа выходит из строя после нескольких бессонных ночей? За это отвечает кортизол, известный как гормон стресса.
Надпочечники вырабатывают кортизол рефлекторно, чтобы помочь организму справиться со стрессом. Однако если высокий уровень кортизола сохраняется в организме в течение длительного времени, на коже появляются акне, красные пятна. Она приобретает неоднородные оттенок и текстуру.
Мелатонин
Мелатонин вырабатывается в эпифизе в темноте, поэтому его еще называют «гормоном ночи».
Это мощный антиоксидант нейтрализует повреждения, вызванные в организме свободными радикалами за сутки, и обращает вспять признаки старения.
Основные состояния кожи при гормональных изменениях
Акне
Корни этого проблемного кожного состояния уходят в сальные железы. С момента начала полового созревания они вырабатывают и выделяют повышенное количество кожного сала, или себума. Наибольшее количество кожного сала выделяется между 15-35 годами.
Сальные железы, как и многие функциональные компоненты кожи, имеют рецепторы, восприимчивые к половым гормонам. Наиболее сильно они «страдают» от тестостерона из группы андрогенов. Андрогены увеличивают выработку себума в период полового созревания у обоих полов. Чем больше андрогенов связывается с рецепторами на поверхности сальных желез, тем больше кожного сала вырабатывается. В результате соединения сала с отшелушенными клетками в поре кожи образуется комплекс, вызывающий ее закупорку. Закупоренная пора не дает избытку кожного сала выйти на поверхность, в результате чего и образуется акне.
У женщин появление акне также часто связано с фазой менструального цикла и, соответственно, интенсивностью выработки кожного сала. Гормональные изменения, вызванные менструацией, часто приводят к увеличению количества воспалительных элементов на коже лица и тела за десять дней до «критических дней».
Кроме того, акне чаще страдают женщины с более высоким уровнем андрогенов. Он также провоцирует избыточный рост волос на лице, выпадение волос по женскому типу, нерегулярный менструальный цикл.
Не все женские акне могут быть обусловлены менструальным циклом. Их также провоцируют приступы стресса, когда на работе сальных желез сказывается кортизол.
Пигментация
Пигментация кожи знакома многим беременным. На всем протяжении беременности для организма характерен высокий уровень эстрогена. Он делает кожу более чувствительной к солнцу, в результате чего на ней появляется темные пятна — мелазма.
Сухость кожи и шелушения
Снижения уровня эстрогенов приводит к тому, что кожа становится более сухой и зудящей. Этот процесс наблюдается у пациентов с сухой кожей в целом, а также у больных экземой во время обострения заболевания.
Второй гормональной причиной появления внезапной сухости кожи может стать снижение уровня тиреотропного гормона щитовидной железы.
Является ли гормонозаместительная терапия решением
Итак, в течение всей жизни уровень гормонов в организме может резко меняться, что сказывается на состоянии кожи на протяжении каждой гормональной фазы. Логичным решением этой проблемы может показаться гормонозаместительная терапия. Однако действительно ли этот инструмент способен эффективно «подкрутить» уровень тех или иных гормонов до оптимального и сохранить молодость и красоту кожи?
Гормонозаместительная терапия сегодня — относительно новая область в уходе за кожей. Из-за отсутствия широких исследований и побочных эффектов она еще не стала эффективным и доступным решением кожных проблем. Тем не менее, исследования подтвердили повышение эластичности кожи, ее влажности и толщины у женщин, использовавших местную или пероральную заместительную гормональную терапию (ЗГТ). Так, в составе комбинированных противозачаточных таблеток синтетический эстроген присутствует в дозах, подавляющих овуляцию. Если овуляция не происходит, то яичниковые андрогены не производятся, а, значит, уменьшается выработка кожного себума и соответственно количество акне на коже.
Как ухаживать за кожей при гормональном дисбалансе без применения гормональных средств
Ухудшение состояния кожи в период менопаузы
Сегодня доступно множество «негормональных» вариантов ухода, позволяющих сделать сухую, зудящую и истонченную кожу более гладкой и свежей. Так, в период менопаузы, когда снижается уровень эстрогенов, а вместе с ней замедляется и выработка коллагена, важно использовать средства с ингредиентами, которые стимулируют выработку коллагена в коже. К ним относятся:
- ретиноиды, включая ретинол, которые являются частью семейства витамина А;
- витамин С, который также стимулирует выработку коллагена, осветляет кожу и выравнивает ее тон;
- пептиды и гиалуроновая кислота, которые увеличивают выработку эластина, коллагена, эффективно наполняя и укрепляя сухую кожу.
Акне
Чтобы контролировать воспаления и держать акне под контролем, используйте средства с противовоспалительными ингредиентами — экстрактом овса, белого и зеленого чая, конского каштана, лакрицы, бисаболола, гинкго билоба, салициловой и гликолевой кислотами, ниацинамидом.
Предварительно мягко очищайте кожу средствами, не содержащими ПАВ (содиум лаурил сульфат и его производные).
Сухость и шелушение
При сухости, которая развивается вследствие дефицита тиреотропного гормона, эстрогена и прогестерона, кожа нуждается в незаменимых жирных кислотах, фитостеролах, церамидах и керамидах. Они защищают кожу от окислительного повреждения, вызывающего шелушение.
Здоровье и безопасность
Многие «эксперты» по здоровью обещают провести «гормональную перезагрузку» организма и улучшить состояние кожи за счет диеты или БАДов. Чаще всего такие «специалисты» не имеют к медицине никакого отношения. Не стоит верить их обещаниям и приобретать «волшебные» мази и таблетки, а при описанных выше проблемных состояниях кожи следует обратиться к дерматологу или эндокринологу.
Лютеиновая недостаточность — обзор
Дефект лютеиновой фазы
Дефект лютеиновой фазы (LPD) или иногда его называют неадекватная лютеиновая фаза определяется как секреторное созревание, которое происходит по крайней мере на 2 дня раньше, чем ожидаемое хронологическое датирование в двух, предпочтительно последовательном, циклы. 17 В последнее десятилетие биопсия эндометрия как инструмент определения адекватности лютеиновой фазы подверглась критике. Те, кто возражает против его включения в исследование бесплодной пары, предлагают несколько причин его кончины.Во-первых, датировка эндометрия может варьироваться от цикла к циклу. Дэвис и др. исследовали последовательные биопсии у пяти менструирующих женщин с доказанной фертильностью. 18 Если для определения ДПЗ запаздывать в зрелости эндометрия на 2 дня или больше, частота однократных и последовательных несинфазных биопсий эндометрия составила 51,4% и 26,7% соответственно. При использовании 3-дневного или большего журнала для определения LPD частота единичных и последовательных биопсий вне фазы составила 41,4% и 6,6% соответственно. Таким образом, авторы продемонстрировали изменчивость датирования эндометрия от цикла к циклу.Кроме того, поскольку очень высокая частота ДПЗ была обнаружена у известных фертильных женщин, авторы подвергли сомнению стандартные критерии определения ДПЗ. 18
Вторая проблема использования LPD в качестве диагностического инструмента при оценке бесплодия связана с вариабельностью между и внутри наблюдателей, наблюдаемой при датировании эндометрия. В одном исследовании пять наблюдателей дважды проанализировали биопсию эндометрия у 25 женщин. В общей сложности 65% и 27% расхождений, соответственно, объяснялись вариабельностью между и внутри наблюдателей. 19 В исследовании, в котором оценивали 774 биопсии эндометрия, выполненных по поводу бесплодия, Davidson et al. обнаружили отставание лютеиновой фазы более чем на 2 дня в 19% биопсий, но ДПЗ был диагностирован только в 5,7%. 20 Авторы пришли к выводу, что большую часть случаев ДПЗ можно предсказать только случайно. Дагган и др. назначил 78 биопсий эндометрия группе из четырех патологов. 17 Каждый патологоанатом прочитал биопсию дважды: один раз в «обычной практике» и второй раз после изучения документа, определяющего гистологические критерии.При первоначальном рассмотрении 68% биопсий были датированы в пределах 1 дня друг от друга, а 77% были датированы в пределах 2 дней, без каких-либо улучшений при повторном рассмотрении. 17 В хорошо выполненном исследовании Murray et al. получили доступ к воспроизводимости гистологического датирования эндометрия в течение менструального цикла у фертильных женщин с фазой цикла, подтвержденной измерениями эстрадиола и прогестерона в сыворотке. Для биопсий средней и поздней лютеиновой фазы согласие между группой патологов составило 79% для нормальных и 81% для биопсий, отсроченных в соответствии с системой баллов с использованием 32 гистологических критериев. 21 Таким образом, даже в наиболее благоприятных исследованиях вариабельность между наблюдателями превышает 20%, что ставит под сомнение точность диагноза LPD.
Третья проблема касается распространенности LPD у бесплодных женщин по сравнению с контрольной группой. В хорошо спланированном и хорошо выполненном исследовании Национальной сети кооперативной репродуктивной медицины Coutifaris et al. оценили 619 средне- и поздних биопсий лютеиновой кислоты от фертильных женщин и женщин от бесплодных пар. 22 Не было различий в процентном соотношении биопсий, не совпадающих по фазе, с использованием 2-х, 3-х и 4-х дневных не совпадающих по фазе биопсий средней и поздней лютеиновой биопсии.Датирование лютеиновой фазы основывалось на выбросе ЛГ в моче. Например, биопсия, определенная на 3 или более дней вне фазы с использованием биопсии в дни цикла 22 и 23, составила 49,4% у фертильных женщин и 43,2% у женщин с бесплодием ( p = 0,33), соответственно. Фактически, процент несинфазных биопсий был выше среди фертильных женщин для каждого из используемых определений несинфазности и для обоих периодов времени биопсии. Авторы пришли к выводу, что «гистологическое датирование эндометрия не делает различий между женщинами в фертильных и бесплодных парах и не должно использоваться в рутинной оценке бесплодия. 22
Следовательно, Комитет по практике Американского общества репродуктивной медицины (ASRM) пришел к выводу, что «гистологическое датирование эндометрия не является допустимым диагностическим методом, потому что ему недостает точности и точности, а также потому, что тест не может отличить фертильных женщин от бесплодных. . Поэтому биопсия эндометрия больше не рекомендуется для оценки овуляции или лютеиновой функции у бесплодных женщин и должна быть ограничена теми, у кого специфическая патология эндометрия (например,g., новообразование, хронический эндометрит) сильно подозревается ». 23
Наконец, в заключении комитета, озаглавленном «Текущая клиническая не значимость дефицита лютеиновой фазы: мнение комитета», Практический комитет ASRM далее заявил, что «в настоящее время не существует воспроизводимого, патофизиологически значимого и клинически практического стандарта для диагностики. LPD и отличить фертильных женщин от бесплодных ». 24 Заключение заключения: «Хотя прогестерон важен для процесса имплантации и раннего эмбрионального развития, LPD как независимая сущность, вызывающая бесплодие, не доказана.” 24
Введение прогестерона матери на ранних сроках беременности изменяет функцию гипофиза и яичек и стероидный профиль у плодов мужского пола
Ho, S.-M. et al. Факторы окружающей среды, эпигенетика и происхождение репродуктивных нарушений, связанных с развитием. Репродукция. Toxicol. 68 , 85–104 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Schug, T. T., Janesick, A., Blumberg, B. & Heindel, J. J. Химические вещества, нарушающие эндокринную систему, и восприимчивость к болезням. J. Steroid Biochem. Мол. Биол. 127 , 204–215 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Diamanti-Kandarakis, E. et al. Химические вещества, нарушающие работу эндокринной системы: научное заявление эндокринного общества. Endocr. Ред. 30 , 293–342 (2009).
CAS PubMed PubMed Central Статья Google Scholar
Рид К. Э. и Фентон С. Э. Воздействие диэтилстильбестрола на чувствительных этапах жизни: наследие наследственных последствий для здоровья. Врожденные дефекты Res. (Часть C) 99 , 134–146 (2013).
CAS Статья Google Scholar
Гал, И., Кирман, Б. и Стерн, Дж.Гормональные тесты на беременность и врожденные пороки развития. Nature 216 , 83–83 (1967).
ADS CAS PubMed Статья PubMed Central Google Scholar
Olszynko-Gryn, J., Bjørvik, E., Weßel, M., Jülich, S. & Jean, C. Исторический аргумент в пользу несостоятельности регулирования в случае тестов Primodos и других гормонов на беременность. Репродукция. Биомед. Soc. Интернет: 6 , 34–44 (2018).
PubMed PubMed Central Статья Google Scholar
Heneghan, C. et al. Устные гормональные тесты на беременность и риски врожденных пороков развития: систематический обзор и метаанализ. F1000Res 7 , 1725 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Hogg, K. et al. Повышенная выработка текальных андрогенов пренатально запрограммирована в модели синдрома поликистозных яичников у овец. Эндокринология 153 , 450–461 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Падманабхан В. и Вейга-Лопес А. Овцы модели фенотипа синдрома поликистозных яичников. Мол. Клетка. Эндокринол. 373 , 8–20 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Abbott, D. H. et al. Нечеловеческие модели синдрома поликистозных яичников приматов. Мол. Клетка. Эндокринол. 373 , 21–28 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Барнс, Р. Б., Розенфилд, Р. Л. и Эрманн, Д. А. Гиперандрогинизм яичников в результате врожденных нарушений вирилизации надпочечников: данные о перинатальной маскулинизации нейроэндокринной функции у женщин. J. Clin. Эндокринол. Метаб. 79 , 1328 (1994).
CAS PubMed Google Scholar
Hogg, K., Wood, C., McNeilly, A. S. & Duncan, W. C. Эффект внутриутробного программирования повышенных материнских андрогенов и прямого вмешательства плода на печень и метаболическую функцию у взрослых овец. PLoS ONE 6 , e24877 (2011).
ADS CAS PubMed PubMed Central Статья Google Scholar
Siemienowicz, K. J. et al. Воздействие андрогенов на плод является определяющим фактором метаболического здоровья взрослых мужчин. Sci. Отчетность 9 , 20195–20217 (2019).
ADS CAS PubMed PubMed Central Статья Google Scholar
Dalziel, S. R. et al. Факторы риска сердечно-сосудистых заболеваний после антенатального приема бетаметазона: 30-летнее наблюдение в ходе рандомизированного контролируемого исследования. Ланцет 365 , 1856–1862 (2005).
CAS PubMed Статья Google Scholar
Браун, Т., Чаллис, Дж. Р., Ньюнхэм, Дж. П. и Слобода, Д. М. Воздействие глюкокортикоидов в раннем возрасте: гипоталамо-гипофизарно-надпочечниковая ось, функция плаценты и долгосрочный риск заболевания. Endocr. Ред. 34 , 885–916 (2013).
CAS PubMed Статья Google Scholar
Уоттерс, М., Нобл, М., Чайлд, Т. и Нельсон, С. Сравнение коротких и длительных добавок прогестерона для поддержки лютеиновой фазы в свежих циклах ЭКО: систематический обзор и метаанализ. Репродукция. Биомед. Интернет: 40 , 143–150 (2019).
PubMed Статья CAS PubMed Central Google Scholar
Вахаби, Х. А., Файед, А. А., Эсмаил, С. А. и Бахкали, К. Х. Прогестоген для лечения угрозы выкидыша. Кокрановская база данных Syst. Ред. 8 , CD005943 (2018).
PubMed PubMed Central Google Scholar
Coomarasamy, A. et al. Рандомизированное исследование прогестерона у женщин с кровотечением на ранних сроках беременности. N. Engl. J. Med. 380 , 1815–1824 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Фаулер, П. А. и О’Шонесси, П. Дж. Принцип Златовласки и андрогены развития у мужчин, что такое «в самый раз» ?. Эндокринология 154 , 1669–1671 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Bellingham, M. et al. Влияние воздействия химических веществ окружающей среды во время беременности на развитие мужской и женской репродуктивной системы. Репродукция. Внутренний. Anim. 47 (Дополнение 4), 15–22 (2012).
PubMed Статья Google Scholar
Ямазаки, Х. и Шимада, Т. Прогестерон и гидроксилирование тестостерона цитохромами P450 2C19, 2C9 и 3A4 в микросомах печени человека. Arch. Биохим. Биофиз. 346 , 161–169 (1997).
CAS PubMed Статья Google Scholar
Куинни, С.К., Бенджамин, Т., Чжэн, X. и Патил, А.С. Характеристика метаболизма прогестерона, опосредованного CYP3A у матери и плода. Fetal Pediatr. Патол. 36 , 400–411 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Мюррей, М. CYP2J2 — регуляция, функция и полиморфизм. Препарат. Метаб. Ред. 48 , 351–368 (2016).
CAS PubMed Статья Google Scholar
Джаррар, Ю. Б. и Ли, С.-Дж. Молекулярная функциональность генетических полиморфизмов цитохрома P450 4 (CYP4) и их клиническое значение. Внутр. J. Mol. Sci. 20 , 4274 (2019).
CAS PubMed Central Статья PubMed Google Scholar
Брукс, А. Н., Макнейли, А. С. и Томас, Г. Б. Роль гонадолиберина в онтогенезе и регуляции гипоталамо-гипофизарно-гонадной оси плода у овец. J. Reprod. Fertil. Дополнение 49 , 163–175 (1995).
CAS PubMed Google Scholar
Голуб М.С., Кауфман Ф. Л., Кэмпбелл М. А., Ли, Л.-Х. И Дональд, Дж. М. «Натуральный» прогестерон: информация о влиянии на плод. Врожденные дефекты Res. (Часть B) 77 , 455–470 (2006).
CAS Статья Google Scholar
Вигод, С. Н., Страсбург, К., Даскалакис, З. Дж. И Блумберже, Д. М. Систематический обзор дефицита ингибиторов гамма-аминомасляной кислоты на протяжении репродуктивного жизненного цикла. Arch. Womens Ment. Здравоохранение 17 , 87–95 (2014).
PubMed Статья Google Scholar
Wagner, C. K., Nakayama, A. Y. & De Vries, G. J. Потенциальная роль материнского прогестерона в половой дифференциации мозга. Эндокринология 139 , 3658–3661 (1998).
CAS PubMed Статья Google Scholar
Никол, М. Б., Херст, Дж. Дж., Уокер, Д. и Торберн, Г. Д. Эффект изменения концентрации прогестерона в плазме матери на поведенческое состояние плода на поздних сроках беременности. J. Endocrinol. 152 , 379–386 (1997).
CAS PubMed Статья Google Scholar
Кроссли, К. Дж., Никол, М. Б., Херст, Дж. Дж., Уокер, Д. У. и Торберн, Г. Д. Подавление возбуждения прогестероном у плодов овцы. Репродукция. Fertil. Dev. 9 , 767–773 (1997).
CAS PubMed Статья PubMed Central Google Scholar
Хаверфилд, Дж. Т., Хэм, С., Браун, К. А., Симпсон, Э. Р. и Мичем, С. Дж. Выявление роли ароматазы в здоровых и больных семенниках. Сперматогенез 1 , 240–249 (2011).
PubMed PubMed Central Статья Google Scholar
Boukari, K. et al. Яички плода человека: источник эстрогена и мишень действия эстрогена. Гм. Репрод. 22 , 1885–1892 (2007).
CAS PubMed Статья PubMed Central Google Scholar
Brem, A. S., Matheson, K. L., Barnes, J. L. & Morris, D. J. 11-дегидрокортикостерон, метаболит глюкокортикоидов, ингибирует действие альдостерона в мочевом пузыре жаб. Am. J. Physiol. 261 , F873 – F879 (1991).
CAS PubMed PubMed Central Google Scholar
Muto, S., Nemoto, J., Ebata, S., Kawakami, K. & Asano, Y. Кортикостерон и 11-дегидрокортикостерон стимулируют экспрессию гена Na, K-АТФазы в гладкомышечных клетках сосудов. Kidney Int. 54 , 492–508 (1998).
CAS PubMed Статья PubMed Central Google Scholar
Johnston, Z. C. et al. Надпочечники человеческого плода вырабатывают кортизол, но не обнаруживают альдостерона на протяжении второго триместра. BMC Med. 16 , 23–16 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Шеппард, К. Э. и Аутелитано, Д. Дж. 11-Бета-гидроксистероид дегидрогеназа 1 превращает 11-дегидрокортикостерон в транскрипционно активный глюкокортикоид в сердце новорожденных крыс. Эндокринология 143 , 198–204 (2002).
CAS PubMed Статья PubMed Central Google Scholar
Harno, E. et al. 11-Дегидрокортикостерон вызывает метаболический синдром, который предотвращается, когда 11β-HSD1 нокаутируется в печени самцов мышей. Эндокринология 154 , 3599–3609 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Маккартни, Дж., Ричардс, Э. М., Вуд, К. Э. и Келлер-Вуд, М. Эффекты минералокортикоидов в легких плода овцы на поздних сроках беременности. Physiol. Отчет 2 , e12066 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Azibani, F. et al. Альдостерон подавляет программу развития плода и увеличивает гипертрофию сердца мышей с гипертонической болезнью. PLoS ONE 7 , e38197 (2012).
ADS CAS PubMed PubMed Central Статья Google Scholar
Davidovitch, M. et al. Лечение бесплодия во время беременности и риск расстройства аутистического спектра у детей. Прог.Neuropsychopharmacol. Биол. Психиатрия 86 , 175–179 (2018).
PubMed Статья PubMed Central Google Scholar
Baron-Cohen, S. et al. Повышенная стероидогенная активность плода при аутизме. Мол. Психиатрия 20 , 369–376 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Connolly, F. et al. Избыток андрогенов в матке влияет на развитие семенников плода. Эндокринология 154 , 1921–1933 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Recabarren, S.E. et al. Пренатальный избыток тестостерона снижает количество и подвижность сперматозоидов. Эндокрионология 149 , 6444–6448 (2008).
CAS Статья Google Scholar
Шарп Р. М., Маккиннелл К., Кивлин С. и Фишер Дж. С. Пролиферация и функциональное созревание клеток Сертоли и их значение для нарушений функции яичек в зрелом возрасте. Репродукция 125 , 769–784 (2003).
CAS PubMed Статья PubMed Central Google Scholar
Meroni, S. B. et al. Молекулярные механизмы и сигнальные пути, участвующие в пролиферации клеток Сертоли. Фронт. Эндокринол. 10 , 224 (2019).
Артикул Google Scholar
Аса, С. Л., Ковач, К. и Сингер, В. Аденогипофиз плода человека: морфологический и функциональный анализ in vitro. Нейроэндокринология 53 , 562–572 (1991).
CAS PubMed Статья PubMed Central Google Scholar
Gromoll, J., Eiholzer, U., Nieschlag, E. & Simoni, M. Мужской гипогонадизм, вызванный гомозиготной делецией экзона 10 рецептора лютеинизирующего гормона (LH): дифференциальное действие хорионического гонадотропина человека и LH. J. Clin. Эндокринол. Метаб. 85 , 2281–2286 (2000).
CAS PubMed Статья PubMed Central Google Scholar
Валлийский М., Сузуки Х. и Ямада Г. Окно программирования маскулинизации. Endocr. Dev. 27 , 17–27 (2014).
PubMed Статья PubMed Central Google Scholar
Carmichael, S. L. et al. Материнское потребление прогестина и риск гипоспадии. Arch. Педиатр. Adolesc. Med. 159 , 957–962 (2005).
PubMed Статья PubMed Central Google Scholar
Coomarasamy, A. et al. Рандомизированное исследование прогестерона у женщин с повторяющимися выкидышами. N. Engl. J. Med. 373 , 2141–2148 (2015).
CAS PubMed Статья Google Scholar
Pointis, G., Latreille, M. T., Richard, M. O., D’Athis, P. & Cedard, L. Влияние материнского прогестерона на тестостерон плода у мышей. Biol. Новорожденный 45 , 203–208 (1984).
CAS PubMed Статья Google Scholar
Pointis, G., Latreille, M. T., Richard, M. O., D’Athis, P. D. & Cedard, L. Влияние естественного лечения прогестероном во время беременности на тестостерон плода и половое поведение потомства мужского пола у мышей. Dev. Pharmacol. Ther. 10 , 385–392 (1987).
CAS PubMed Статья Google Scholar
Фаркухарсон, Р. Г. и Клоппер, А. И. Концентрации прогестерона в крови матери и плода. BJOG 91 , 133–137 (1984).
CAS Статья Google Scholar
O’Shaughnessy, P.J. et al. Альтернативное (бэкдор) производство андрогенов и маскулинизация у плода человека. PLoS Biol 17 , e3000002 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Варн, Г. Л., Файман, К., Рейес, Ф. И. и Уинтер, Дж. С. Исследования полового развития человека. V. Концентрации тестостерона, 17-гидроксипрогестерона и прогестерона в околоплодных водах человека на протяжении всей беременности. J. Clin. Эндокринол. Метаб. 44 , 934–938 (1977).
CAS PubMed Статья Google Scholar
Ramaswamy, S. et al. Программирование развития синдрома поликистозных яичников (СПКЯ): пренатальные андрогены устанавливают соотношение α / β клеток островков поджелудочной железы и последующую секрецию инсулина. Sci. Отчет 6 , 27408 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Connolly, F. et al. Местные эффекты диатермии яичников на модели синдрома поликистозных яичников у овец. PLoS ONE 9 , e111280 (2014).
ADS PubMed PubMed Central Статья CAS Google Scholar
Гиффорд, Р. М. et al. Положительная адаптация функции оси HPA у женщин в течение 44 недель военной подготовки в пехоте. Психонейроэндокринология 111 , 104432 (2019).
Артикул CAS Google Scholar
Дисфория, индуцированная прогестином (прогестероноподобные гормоны) (депрессивное настроение, раздражительность, беспокойство) — полный текст
Часто женщинам назначают заместительную гормональную терапию (ЗГТ) в перименопаузе или менопаузе.
Заместительная гормональная терапия включает эстроген и прогестерон. Эстрогеновый компонент ЗГТ помогает облегчить симптомы и благотворно влияет на сердце и кости, но эстроген также увеличивает риск рака матки. Прогестероновый компонент ЗГТ (прогестин) предотвращает повышенный риск рака матки.
Имеются данные о том, что некоторые женщины испытывают неприятные симптомы настроения (такие как раздражительность, депрессивное настроение и беспокойство) при приеме заместительной гормональной терапии (ЗГТ) при одновременном приеме прогестинового / прогестеронового компонента ЗГТ.
Это исследование разработано для оценки способности прогестинов вызывать симптомы плохого настроения у женщин. Исследователи намереваются сделать это, сравнив эффекты медроксипрогестерона ацетата (Провера) и неактивной сахарной таблетки плацебо. Настроение пациентов будет контролироваться на основе их ответов на анкеты, заполненные в поликлинике и дома.
Это исследование попытается ответить на следующие вопросы:
- Связаны ли прогестины с изменениями настроения во время заместительной гормональной терапии?
- Если прогестины связаны с нарушением настроения, то не потому ли, что они блокируют полезные эффекты эстрогена?
В литературе есть данные о том, что некоторые женщины испытывают симптомы дисфории при приеме заместительной гормональной терапии (ЗГТ) и что это нарушение настроения связано с прогестиновым компонентом ЗГТ.Большая часть этих свидетельств анекдотична. Хотя некоторые авторы пытались изучить эту предполагаемую проблему более систематическим образом, не существует контролируемых исследований, которые пытались бы определить механизм, посредством которого происходит нарушение настроения. Побочные эффекты прогестинов могут быть опосредованы непосредственно через рецепторы прогестерона или андрогенов. С другой стороны, эффекты прогестинов могут быть следствием антиэстрогенных эффектов прогестерона. Эта последняя возможность частично подтверждается нашими наблюдениями в предыдущих исследованиях благотворного воздействия эстрадиола на настроение и возможного ускорения расстройства настроения после острой отмены эстрогена.Наконец, несмотря на распространенное мнение о том, что прогестерон вызывает расстройства настроения, нельзя исключать эффект плацебо, поскольку женщины, принимающие ЗГТ, знают, когда они получают прогестиновый компонент режима. Поэтому вопросы нашего исследования заключаются в следующем: 1) Связаны ли прогестины с изменениями настроения во время ЗГТ, и 2) Если прогестины связаны с нарушением настроения, это потому, что они блокируют благотворные эффекты эстрогена?
Эффект омализумаба при аутоиммунном прогестероновом дерматите, резистентном к двусторонней овариэктомии: клинический случай | Аллергия, астма и клиническая иммунология
Случай Дилемма № 1: Рефрактерная АПД после двусторонней офариэктомии
В нашем случае пациентка решила продолжить двустороннюю овариэктомию после трех лет неразрешенных симптомов, несмотря на различные методы лечения.Двусторонняя овариэктомия по поводу неизлечимого APD использовалась 19 раз и оказалась успешной во всех описанных случаях [1, 10, 11, 12, 13, 14]. Однако в нашем случае у пациента продолжались эпизоды обострения генерализованной крапивницы и периферического отека. Эти симптомы соответствовали тому, что она испытывала до двусторонней овариэктомии. Дифференциальный диагноз также может включать хроническую спонтанную крапивницу и ангионевротический отек после овариэктомии. Хотя она не проходила повторное тестирование с использованием кожной пробы с медроксипрогестероном после ее процедуры, первоначальный диагноз АДФ был основан на положительном кожном тесте и сильных клинических характеристиках, соответствующих этому диагнозу.Кроме того, вторичное обследование на крапивницу также дало отрицательные результаты, исключая дополнительные воспалительные, васкулитные, ревматологические, эндокринные и иммунологические состояния. Поэтому мы считаем маловероятным, что основная этиология ее симптомов изменится после операции, и предполагаем, что надпочечники являются источником выработки прогестерона после овариэктомии. Насколько нам известно, это первый случай, когда процедура двусторонней овариэктомии могла не устранить симптомы APD. Тем не менее, одной из потенциальных предвзятостей публикации действительно может быть отсутствие отчетов о случаях, не отвечающих на запросы.
Через три месяца после двусторонней овариэктомии она обратилась в нашу эндокринную клинику для первичной консультации по поводу синдрома Кушинга при лечении преднизоном в дозе 50 мг в день. В поисках преднизоносохраняющего лечения ее APD мы начали терапию моноклональными антителами Омализумаб (Xolair). Антитела IgE связываются с областью FcεRI на поверхности высокоаффинных рецепторов IgE, обеспечивая большую стабилизацию рецепторов. Перекрестное связывание IgE или стимуляция высокоаффинного рецептора IgE на тучных клетках приводит к высвобождению медиаторов тучных клеток, включая гистамин.Омализумаб работает за счет уменьшения количества свободных антител IgE в кровотоке, что приводит к подавлению регуляции высокоаффинных рецепторов IgE на тучных клетках, тем самым подавляя высвобождение медиаторов тучных клеток [15,16,17]. Подкожные инъекции 300 мг омализумаба позволили пациенту устранить потребность в ежедневном пероральном приеме преднизона в течение шести месяцев с медленным снижением. Что наиболее важно, ее вспышки ADP разрешились. Это согласуется с двумя другими сообщениями о случаях, которые показали улучшение симптомов APD на фоне приема омализумаба [18, 19].Насколько нам известно, это третий случай, когда Омализумаб использовался для лечения APD. Мы продолжаем попытки снизить дозу и частоту приема омализумаба, чего она до сих пор не переносила.
Случай Дилемма № 2: Осложнения ранней менопаузы, вторичные по отношению к процедуре двусторонней офариэктомии
После двусторонней овариэктомии, а также хронического приема преднизона у нашей пациентки был риск симптоматической ранней менопаузы и преждевременного остеопороза. Поскольку в прошлом она не реагировала на десенсибилизацию прогестероном, нельзя было рассматривать типичную заместительную гормональную терапию, состоящую из эстрогена и прогестерона.Кроме того, ее матка оставалась на месте, поэтому лечение беспрепятственным эстрогеном могло бы подвергнуть ее риску гиперплазии эндометрия и последующего злокачественного новообразования [20]. Оглядываясь назад, можно сказать, что рассмотрение гистерэктомии в дополнение к двусторонней овариэктомии свело бы на нет потребность в прогестероне и допустило бы монотерапию эстрадиолом. В будущем можно рассмотреть возможность гистерэктомии. К сожалению, монотерапия эстрадиолом у нашего пациента не была возможна. В результате мы начали назначать пациенту комбинацию конъюгированных эстрогенов с базедоксифеном.Несколько крупных исследований фазы 3 показали, что эта комбинация эффективна для уменьшения вазомоторных симптомов менопаузы, а также для поддержания здоровья костей и снижения риска гиперплазии эндометрия у женщин в постменопаузе в возрасте от 40 до 65 лет с интактной маткой [21, 22,23]. Начало этого лечения привело к немедленному облегчению вазомоторных симптомов.
Случай Дилемма № 3: Последствия длительного приема высоких доз перорального преднизона
Наш пациент спорадически принимал преднизон с 2008 года.После двусторонней овариэктомии в июне 2018 года она принимала преднизон 50 мг в день в течение трех месяцев до нашей первичной консультации. Несмотря на улучшение симптомов APD, длительное использование глюкокортикоидов имеет множество возможных побочных эффектов, включая снижение костной массы, миопатию, гипергликемию, синдром Кушинга и ятрогенную недостаточность надпочечников [24]. Фактически, наш пациент страдал от большинства этих осложнений.
Как и ожидалось, у нее развились важные кушингоидные черты, включая значительное увеличение веса на 70 фунтов за четыре года, депрессию, истощение проксимальных мышц, лунное лицо, легкие синяки и дорс-ключичное ожирение.Она восстановила мышечную массу и потеряла 35 фунтов после отмены преднизона с разрешением кушингоидных особенностей (рис. 2 — правая панель).
Постоянное употребление нашей пациенткой глюкокортикоидов в сочетании с двусторонней овариэктомией подвергает ее значительному риску снижения костной массы и раннего развития остеопороза. В августе 2018 г. ее минеральная плотность кости показала остеопению поясничного отдела позвоночника (T-оценка поясничного отдела позвоночника: -1,1, Z-оценка поясничного отдела позвоночника: -2,0, T-оценка шейки бедра: -0,8, Z-оценка шейки бедра: — 1.1, T-показатель общего тазобедренного сустава: — 0,5 и Z-показатель общего тазобедренного сустава: — 0,9), и ей начали принимать добавки кальция, витамина D, а также конъюгированных эстрогенов с базедоксифеном.
Кроме того, было постулировано, что у нее был эпизод индуцированной преднизоном надпочечниковой недостаточности после быстрого снижения ежедневного перорального приема преднизона, что привело к эпизоду сильной атипичной боли в груди, мышечным болям и тошноте. Наряду с этими симптомами, ее уровень кортизола AM натощак составлял 86 ммоль / л (135–537 ммоль / л) примерно через 48 часов после отмены преднизона.Из-за ятрогенного подавления надпочечников снижение дозы стероидов происходило очень медленно в течение 6 месяцев. С этого времени пациент не принимает стероиды и не имеет симптомов, уровень кортизола находится в пределах физиологического диапазона.
На протяжении многих лет терапии глюкокортикоидами у нее начали развиваться диффузные неопределенные боли в костях и артралгии, которые сохраняются по сей день. Было заказано несколько методов визуализации, которые не выявили аномалий костей. Сообщалось о боли в мышцах и суставах при применении конъюгированных эстрогенов с базедоксифеном [25], однако временное прекращение приема конъюгированных эстрогенов с базедоксифеном не улучшило симптомов.Ее иммунолог также исключил сывороточную болезнь Омализумаба и другие возможные ревматологические состояния. Причина симптомов остается неубедительной, но они улучшаются с помощью физиотерапии.
Аутоиммунный прогестероновый дерматит | SpringerLink
Джонс В.Н., Гордон В.Х. Аутоиммунная экзема, вызванная прогестероном. Эндогенная гиперчувствительность к прогестерону. Arch Dermatol. 1969; 99: 57–9.
PubMed Статья CAS Google Scholar
Moghadam BK, Hersini S, Barker BF. Аутоиммунный прогестероновый дерматит и стоматит. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998. 85: 537–41.
PubMed Статья CAS Google Scholar
Stephens CJ, Wojnarowska FT, Wilkinson JD. Аутоиммунный прогестероновый дерматит, реагирующий на тамоксифен. Br J Dermatol. 1989; 121: 135–7.
PubMed Статья CAS Google Scholar
Стоун Дж., Даунхэм Т. Аутоиммунный прогестероновый дерматит. Int J Dermatol. 1981; 20: 50–1.
PubMed Статья CAS Google Scholar
Wilkinson SM, Beck MH, Kingston TP. Крапивница, вызванная прогестероном, может ли она быть аутоиммунной? Br J Dermatol. 1995; 133: 792–4.
PubMed Статья CAS Google Scholar
Войнаровска Ф., Гривз М.В., Пичи Р.Д., Друри П.Л., Бессер Г.М.Многоформная эритема, индуцированная прогестероном. JR Soc Med. 1985; 78: 407–8.
PubMed CAS Google Scholar
Yee KC, Cunliffe WJ. Крапивница, вызванная прогестероном: ответ на бусерелин. Br J Dermatol. 1994; 130: 121–3.
PubMed Статья CAS Google Scholar
Mayou SC, Charles-Holmes R, Kenney A, Black MM. Предменструальная крапивница, которую лечили с помощью двусторонней овариэктомии и гистерэктомии.Clin Exp Dermatol. 1988. 13: 114–6.
PubMed Статья CAS Google Scholar
Мельцер Л. Повышенная чувствительность к гонадным гормонам. Саут Мед Дж. 1963; 56: 538–42.
PubMed Статья CAS Google Scholar
Shelley WB, Shelley ED, Talanin NY, Santoso-Pham J. Эстрогеновый дерматит. J Am Acad Dermatol. 1995; 32: 25–31.
PubMed Статья CAS Google Scholar
Wahlen T. Эндокринная аллергия; исследование в 35 случаях с предменструальными симптомами аллергического типа. Acta Obstet Gynecol Scand. 1955; 34: 161–70.
PubMed Статья CAS Google Scholar
Зондек Б., Бромберг Ю.М. Эндокринная аллергия; клинические реакции на аллергию на эндогенные гормоны и их лечение. J Obstet Gynaecol Br Emp. 1947; 54: 1–19.
PubMed Статья CAS Google Scholar
Филипс EW. Клинические доказательства чувствительности к гонадотропинам у женщин с аллергией. Ann Intern Med. 1949; 30: 364–73.
PubMed Статья CAS Google Scholar
Geber H. Einege Daten zur Pathologie der Urticaria menstruationalis. Дермат З. 1921; 32: 143.
Артикул Google Scholar
Гербер. Десенсибилизация при лечении менструальной интоксикации и других аллергических симптомов.Br J Dermatol. 1930; 51: 265–8.
Артикул Google Scholar
Веннер MM, Stachenfeld NS. Артериальное давление и регулирование воды: понимание эффектов половых гормонов внутри и между мужчинами и женщинами. J Physiol. 2012; 590: 5949–61.
PubMed Статья CAS Google Scholar
Sacco S, Ricci S, Degan D, Carolei A. Мигрень у женщин: роль гормонов и их влияние на сосудистые заболевания.J Головная боль Боль. 2012; 13: 177–89.
PubMed Статья CAS Google Scholar
van Wingen GA, Ossewaarde L, Backstrom T, Hermans EJ, Fernandez G. Гормональная регуляция контура эмоций у людей. Неврология. 2011; 191: 38–45.
PubMed Статья Google Scholar
Плацентарные гормоны C. В: Williams Obstetrics, редактор: FG Cunningham, 22-е изд, издательство McGraw Hill; 2005 г.стр: 75-91.
Пиявка Ш.Х., Кумар П. Циклическая крапивница. Энн Аллергия. 1981; 46: 201–3.
PubMed CAS Google Scholar
Муди Б.Р., Шаттен С. Аутоиммунный прогестероновый дерматит: начало у женщин, ранее не подвергавшихся воздействию экзогенного прогестерона. Саут Мед Дж. 1997; 90: 845–6.
PubMed Статья CAS Google Scholar
Rodenas JM, Herranz MT, Tercedor J. Аутоиммунный прогестероновый дерматит: лечение овариэктомией. Br J Dermatol. 1998. 139: 508–11.
PubMed Статья CAS Google Scholar
Schoenmakers A, Vermorken A, Degreef H, Dooms-Goossens A. Аллергия на кортикостероиды или стероиды? Контактный дерматит. 1992; 26: 159–62.
PubMed Статья CAS Google Scholar
Фарах Ф.С., Шбаклу З. Аутоиммунная прогестероновая крапивница. J Allergy Clin Immunol. 1971; 48: 257–61.
PubMed Статья CAS Google Scholar
Чавла С.В., Куирк С., Сондхаймер С.Дж., Джеймс В.Д. Аутоиммунный прогестероновый дерматит. Arch Dermatol. 2009; 145: 341–2.
PubMed Статья Google Scholar
Бирман С.М. Аутоиммунный прогестероновый дерматит беременных.Arch Dermatol. 1973; 107: 896–901.
PubMed Статья CAS Google Scholar
Миура Т., Мацуда М., Янбе Х., Сугияма С. Два случая аутоиммунного прогестеронового дерматита. Иммуногистохимические и серологические исследования. Acta Derm Venereol. 1989; 69: 308–10.
PubMed CAS Google Scholar
Shelley WB, Preucel RW, Spoont SS. Аутоиммунный прогестероновый дерматит.Лечение овариэктомией. ДЖАМА. 1964; 190: 35–8.
PubMed Статья CAS Google Scholar
Георгоурас К. Аутоиммунный прогестероновый дерматит. Australas J Dermatol. 1981; 22: 109–12.
PubMed Статья CAS Google Scholar
Харт Р. Аутоиммунный прогестероновый дерматит. Arch Dermatol. 1977; 113: 426–30.
PubMed Статья CAS Google Scholar
Катаяма И., Нисиока К. Аутоиммунный прогестероновый дерматит со стойкой аменореей. Br J Dermatol. 1985; 112: 487–91.
PubMed Статья CAS Google Scholar
Слейтер Дж. Э., Калинер М. Влияние половых гормонов на высвобождение базофильного гистамина при рецидивирующей идиопатической анафилаксии. J Allergy Clin Immunol. 1987. 80: 285–90.
PubMed Статья CAS Google Scholar
Халеви С., Коэн А.Д., Луненфельд Э., Гроссман Н. Аутоиммунный прогестероновый дерматит, проявляющийся в виде кольцевой эритемы центрифугирования: подтверждение чувствительности к прогестерону высвобождением гамма-интерферона in vitro. J Am Acad Dermatol. 2002; 47: 311–3.
PubMed Google Scholar
Mittman RJ, Bernstein DI, Steinberg DR, Enrione M, Bernstein IL. Прогестерон-чувствительная крапивница и эозинофилия. J Allergy Clin Immunol. 1989; 84: 304–10.
PubMed Статья CAS Google Scholar
Spellberg B. Кожная цитадель: целостный взгляд на кожу и иммунитет. Life Sci. 2000; 67: 477–502.
PubMed Статья CAS Google Scholar
Миллер Дж.Б. Облегчение предменструальных симптомов, дисменореи и непереносимости противозачаточных таблеток. Предварительный отчет. J Med Assoc State Ala.1974; 44: 57–60.
PubMed CAS Google Scholar
Jenkins J, Geng A, Robinson-Bostom L. Аутоиммунный прогестероновый дерматит, связанный с лечением бесплодия. J Am Acad Dermatol. 2008. 58: 353–5.
PubMed Статья Google Scholar
Bandino JP, Thoppil J, Kennedy JS, Hivnor CM. Ятрогенный аутоиммунный прогестероновый дерматит, вызванный 17альфа-гидроксипрогестерона капроатом для профилактики преждевременных родов.Кутис. 2011; 88: 241–3.
PubMed Google Scholar
Кадиан С., О’Брайен С. Классификация предменструальных расстройств, предложенная Международным обществом предменструальных расстройств. Менопауза Int. 2012; 18: 43–7.
PubMed Статья Google Scholar
Ицексон А., Лазаров А., Кордова М., Зейтуне М., Абрахам Д., Сейдман Д.С. Предменструальный синдром и сопутствующие кожные заболевания, связанные с повышенной чувствительностью к женским половым гормонам.J Reprod Med. 2004; 49: 195–9.
PubMed Google Scholar
Мабрей С.Р., Бурдитт М.Л., Мартин Т.Л., Джейнс С.Р., Хейс-младший. Лечение общих гинеколого-эндокринологических симптомов методами лечения аллергии. Obstet Gynecol. 1982; 59: 560–4.
PubMed CAS Google Scholar
Bernstein IL, Bernstein DI, Lummus ZL, Bernstein JA. Случай анафилаксии, вызванной прогестероном, циклической крапивницы / ангионевротического отека и аутоиммунного дерматита.J Womens Health (Larchmt). 2011; 20: 643–8.
Артикул Google Scholar
Meggs WJ, Pescovitz OH, Metcalfe D, Loriaux DL, Cutler Jr G, Kaliner M. Чувствительность к прогестерону как причина рецидивирующей анафилаксии. N Engl J Med. 1984; 311: 1236–8.
PubMed Статья CAS Google Scholar
Slater JE, Raphael G, Cutler Jr GB, Loriaux DL, Meggs WJ, Kaliner M.Рецидивирующая анафилаксия у менструирующих женщин: лечение агонистом рилизинг-гормона лютеинизирующего гормона — предварительное сообщение. Obstet Gynecol. 1987. 70: 542–6.
PubMed CAS Google Scholar
• Прието-Гарсия А., Слоан Д.Е., Гарджуло А.Р., Фельдвег А.М., Кастельс М. Аутоиммунный прогестероновый дерматит: клиническая картина и лечение с помощью десенсибилизации прогестероном для успешного экстракорпорального оплодотворения. Fertil Steril.2011; 95: 1121 e9–13. Это первое свидетельство успешной десенсибилизации к прогестерону у пациенток с APD, требующих ЭКО, завершившейся успешной беременностью.
Артикул Google Scholar
• Ицексон А.М., Сориано Д., Золти М., Сайдман Д.С., Карп Х.Дж. Интрадермальная десенсибилизация половыми гормонами для облегчения предменструальных симптомов может улучшить акушерский исход у женщин с повторной потерей беременности.Гинекол Эндокринол. 2013; 29: 169–72. Похоже, что успешная десенсибилизация прогестероном у пациентов с APD помогает при стойком предменструальном синдроме.
PubMed Статья Google Scholar
Bork K, Fischer B, Dewald G. Рецидивирующие эпизоды кожного ангионевротического отека и сильные приступы боли в животе, вызванные оральными контрацептивами или заместительной гормональной терапией. Am J Med. 2003. 114: 294–8.
PubMed Статья CAS Google Scholar
Баптистский AP, Болдуин JL. Аутоиммунный прогестероновый дерматит у пациента с эндометриозом: история болезни и обзор литературы. Clin Mol Allergy. 2004; 2: 10.
PubMed Статья Google Scholar
Cocuroccia B, Gisondi P, Gubinelli E, Girolomoni G. Аутоиммунный прогестероновый дерматит. Гинекол Эндокринол. 2006; 22: 54–6.
PubMed Статья CAS Google Scholar
Винтцен М., Гур-ван Эгмонд МБ, Ноз KC. Аутоиммунный прогестероновый дерматит с пурпурой и петехиями. Clin Exp Dermatol. 2004; 29: 316.
PubMed Статья CAS Google Scholar
•• Снайдер Дж. Л., Кришнасвами Г. Аутоиммунный прогестероновый дерматит и его проявления как анафилаксия: отчет о болезни и обзор литературы. Ann Allergy Asthma Immunol. 2003; 90: 469–77. Это одно из первых исследований, описывающих связь между APD и анафилаксией.
PubMed Статья Google Scholar
Васконселос К., Ксавье П., Виейра А.П., Мартинью М., Родригес Дж., Бодас А. и др. Аутоиммунная прогестероновая крапивница. Гинекол Эндокринол. 2000; 14: 245–7.
PubMed Статья CAS Google Scholar
Herzberg AJ, Strohmeyer CR, Cirillo-Hyland VA. Аутоиммунный прогестероновый дерматит.J Am Acad Dermatol. 1995; 32: 333–8.
PubMed Статья CAS Google Scholar
Стивенс CJ, черный MM. Перименструальные высыпания: аутоиммунный прогестероновый дерматит. Semin Dermatol. 1989; 8: 26–9.
PubMed CAS Google Scholar
Brestel EP, Thrush LB. Лечение глюкокортикостероид-зависимой хронической крапивницы станозололом.J Allergy Clin Immunol. 1988. 82: 265–9.
PubMed Статья CAS Google Scholar
Teelucksingh S, Edwards CR. Аутоиммунный прогестероновый дерматит. J Intern Med. 1990; 227: 143–4.
PubMed Статья CAS Google Scholar
Ziel HK, Finkle WD. Повышенный риск рака эндометрия среди пользователей конъюгированных эстрогенов. N Engl J Med.1975; 293: 1167–70.
PubMed Статья CAS Google Scholar
Matta WH, Shaw RW, Hesp R, Katz D. Гипогонадизм, вызванный аналогами агонистов гормона высвобождения лютеинизирующего гормона: влияние на плотность костей у женщин в пременопаузе. Br Med J (Clin Res Ed). 1987. 294: 1523–4.
Артикул CAS Google Scholar
Дефицит лютеинизирующего гормона: основы практики, история вопроса, патофизиология
Автор
Дженнифер Л. Итон, доктор медицинских наук, MSCI, FACOG Доцент кафедры акушерства и гинекологии, отделение репродуктивной эндокринологии и бесплодия Медицинской школы Университета Дьюка; Медицинский директор, вспомогательные репродуктивные технологии, директор программы донорства ооцитов, Центр фертильности Дьюка
Дженнифер Л. Итон, доктор медицинских наук, MSCI, FACOG является членом следующих медицинских обществ: Американского конгресса акушеров и гинекологов, Американской медицинской ассоциации, Американского общества поддержки Репродуктивная медицина, Эндокринное общество, Общество вспомогательных репродуктивных технологий, Общество репродуктивной эндокринологии и бесплодия, Общество репродуктивных исследований, Общество репродуктивных хирургов
Раскрытие: нечего раскрывать.
Соавтор (ы)
Николь М. Баркер, DO Врач репродуктивной эндокринологии и бесплодия, Сиэтл Репродуктивная медицина
Николь М. Баркер, DO является членом следующих медицинских обществ: Американского колледжа акушеров и гинекологов, Американского общества репродуктивной медицины
Раскрытие информации: Нечего раскрывать.
Ребекка Флайкт, доктор медицины Ассоциированный персонал, репродуктивная эндокринология и бесплодие, Кливлендская клиника
Раскрытие информации: раскрытие информации отсутствует.
Аллен Дональд Сефтел, доктор медицины Профессор урологии, Университет медицины и стоматологии Нью-Джерси — Медицинская школа Роберта Вуда Джонсона; Заведующий отделением урологии, директор Урологической ординатуры, Госпиталь Университета Купера
Аллен Дональд Сефтел, доктор медицины, является членом следующих медицинских обществ: Американская урологическая ассоциация
Раскрытие информации: Получил гонорар от Lilly за консультацию; Получен гонорар от компании abbott за консультацию; Получено консультационное вознаграждение от вспомогательного учреждения за консультацию; Получено консультационное вознаграждение от агента за консультацию; Получал гонорары от урологического журнала за членство в совете директоров; Получил гонорар от эндо за консультацию.
William W Hurd, MD, MSc, MPH Профессор и директор, Отдел репродуктивной эндокринологии и бесплодия, Отделение акушерства и гинекологии, Медицинский центр Университета Дьюка
William W Hurd, MD, MSc, MPH является членом следующих медицинские общества: Американский колледж хирургов, Американское гинекологическое и акушерское общество, AAGL, Общество репродуктивных хирургов, Alpha Omega Alpha, Американский колледж акушеров и гинекологов, Американская медицинская ассоциация, Американское общество репродуктивной медицины, Общество репродуктивных исследований
Раскрытие: Нечего раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Главный редактор
Ричард Скотт Люциди, доктор медицины, FACOG Адъюнкт-профессор репродуктивной эндокринологии и бесплодия, кафедра акушерства и гинекологии, Медицинский факультет Университета Содружества Вирджинии
Ричард Скотт Люциди, доктор медицины, FACOG является членом следующих медицинских обществ: Американский колледж акушеров и гинекологов, Американское общество репродуктивной медицины
Раскрытие информации: нечего раскрывать.
Благодарности
МРТ аденомы гипофиза любезно предоставлена Кристин Блэкхэм, доктором медицины, Медицинский центр клинических случаев при университетской клинике, отделение радиологии
У вас дефицит щитовидной железы или низкий прогестерон?
Низкий уровень прогестерона часто ошибочно принимают за недостаточность щитовидной железыСимптомы дефицита прогестерона и гипотиреоза могут быть очень похожими.В период пременопаузы мы знаем, что ее выработка эстрогена была достаточной (если у вас менструация, у вас достаточно эстрогена). Поскольку у нее все еще были регулярные месячные, ее врач, как и многие другие, не чувствовал необходимости проверять ее уровень прогестерона. Он предположил, что, несмотря на нормальные уровни Т3 и Т4, ее утомляемость и низкая базальная температура указывают на гипотиреоз. Он не знал, что прогестерон является анаболическим (сжигает жир) и термогенным (повышает температуру), поэтому его дефицит вызывает увеличение веса и низкую температуру.Он просто не рассматривал возможность дефицита прогестерона.
Тем не менее, гормон щитовидной железы является основным для всех биологических функций, и иногда необходимы добавки как для щитовидной железы, так и для прогестерона, поскольку каждый из них оказывает стимулирующее действие на другое.
Без адекватной щитовидной железы мы становимся вялыми, неуклюжими, холодными, анемичными, подвержены инфекциям, сердечным заболеваниям, головным болям, раку и многим другим заболеваниям и, кажется, преждевременно стареем…. Пища плохо усваивается, поэтому даже при кажущейся адекватной диете наблюдается «внутреннее недоедание».Нерегулярные периоды, часто приводящие к ненужной гистерэктомии, являются частыми проявлениями гипотиреоза; и заболевание груди — еще одно классическое проявление.
Эстроген (который мы можем попытаться сбалансировать с дополнительным прогестероном) подавляет высвобождение гормона щитовидной железы из железы, тогда как адекватное количество гормона щитовидной железы, с другой стороны, увеличивает естественную выработку прогестерона и снижает эстроген. Это позволяет легко увидеть, как гормон щитовидной железы и прогестерон могут дополнять друг друга.Он даже сделал интересное наблюдение: поскольку эстроген и кортизон ослабляют кровеносные сосуды, прогестерон (наряду с добавками для щитовидной железы) является хорошим способом предотвратить легкие синяки.
Преобладание эстрогена заставляет печень вырабатывать высокие уровни белка, называемого «тироид-связывающий глобулин», который, как следует из названия, связывает тироидный гормон и снижает количество тироидного гормона, которое может ассимилироваться и использоваться клетками.
Дефицит прогестерона, вызывающий угнетение фермента тироидпероксидазы (ТПО).
Пероксидаза щитовидной железы — это фермент щитовидной железы; и это один из ферментов, которые вы используете для производства Т4 и Т3. Итак, если у вас недостаточно активности этого фермента, то со временем вы просто не сможете вырабатывать достаточно T4 и T3. В какой-то момент вы начнете страдать от таких симптомов низкой щитовидной железы, как:
- Усталость
- Прибавка в весе
- Выпадение волос на коже головы или брови
- Высокий холестерин
- Бесплодие
- Мозговой туман
- Депрессия
- Запор
- Боль в суставах и мышцах
Как прогестерон играет в этом сценарии? Как правило, прогестерон активирует функцию TPO.
Вот что обычно происходит (здесь немного физиологии):
Во второй половине менструального цикла, когда у нее происходит овуляция, наблюдается выброс прогестерона.
- Этот всплеск прогестерона вызывает всплеск активности ТПО, так что вы производите больше Т4 и Т3.
- Вот почему у женщины во время овуляции повышается температура тела из-за выброса прогестерона.
- Этот прогестерон влияет на ТПО в щитовидной железе, что в конечном итоге увеличивает скорость ее метаболизма и повышает температуру.
Что ж, когда у вас недостаточно прогестерона, это довольно просто … активность ТПО снижается, и, следовательно, количество вырабатываемых вами Т4 и Т3 снижается.
Вот главное, что я хочу, чтобы вы знали обо всем этом:
Когда у женщины недостаточно прогестерона, у нее могут быть симптомы, связанные с дефицитом прогестерона, но дефицит прогестерона никогда не может привести к тому, что лабораторные показатели щитовидной железы будут выглядеть «ненормальными».”Вот почему часто женщина обращается к врачу и страдает такими симптомами низкой щитовидной железы, как депрессия, выпадение волос, увеличение веса, высокий уровень холестерина, бесплодие, запоры, туман в мозгу…
Врач проведет какие-то анализы крови на щитовидную железу (обычно крайне недостаточные, такие как только ТТГ и Т4). Врач говорит: «Для меня это нормально». А если у вас низкий уровень прогестерона как скрытая причина симптомов низкого уровня щитовидной железы … лабораторные анализы не так много могут выявить результаты лабораторных исследований.Почему?
Потому что, когда женщина не производит достаточного количества прогестерона для своих нужд, это не обязательно может отражаться на аномальном уровне Т4, Т3 или ТТГ, который ниже или выше лабораторного диапазона анализа крови. Вот почему низкий уровень прогестерона определенно является скрытой причиной, потому что врач, с которым вы работаете, должен уметь распознавать симптомы прогестерона и симптомы низкой активности щитовидной железы.
Каковы типичные симптомы низкого прогестерона?Многие из них связаны с менструальным циклом и беременностью, так что вот они:
- нерегулярные менструальные циклы и периоды
- менструальные спазмы.задержка воды до начала менструации.
- Обильное менструальное кровотечение
- мигрени во второй половине менструального цикла
- Выкидыш на ранних сроках
- бесплодие
- нежность груди
Если у вас есть три или четыре из этих симптомов… И… и у вас также есть симптомы низкой активности щитовидной железы, то низкий уровень прогестерона, влияющий на пероксидазу щитовидной железы в вашей щитовидной железе, может быть для вас ОГРОМНЫМ фактором.
Что вы делаете с этой проблемой прогестерона и щитовидной железы?
Если вы хотите свести к минимуму, у вас могут быть симптомы низкой щитовидной железы и симптомы низкого прогестерона, которые в конечном итоге вызваны нестабильным уровнем сахара в крови.Уровень сахара в крови должен быть очень устойчивым… НЕ повышаться и не понижаться… пиковым и пониженным.
Это немного выходит за рамки того, о чем мы хотим поговорить сегодня, но вот вывод:
Синтетические прогестины не усиливают функцию гормонов щитовидной железы; фактически, они усугубляют проблему. Они захватывают рецепторы прогестерона и мешают нормальному функционированию настоящего прогестерона.
.