Карбоната кальция порошок – инструкция по применению, показания, дозы
 Карбоната кальция порошок – лекарственное средство с антацидным, противоязвенным и восполняющим дефицит кальция действием.
Карбоната кальция порошок – лекарственное средство с антацидным, противоязвенным и восполняющим дефицит кальция действием.
Форма выпуска и состав
Форма выпуска – субстанция-порошок (в пакетах полиэтиленовых по 18 кг, в мешке бумажном 1 пакет).
Активное вещество: кальция карбонат – порошок белого цвета без вкуса и запаха, практически нерастворимый в воде. Содержание кальция – 40%.
Показания к применению
Показания к применению порошка Карбоната кальция:
- Гиперацидный гастрит – острый и хронический в период обострения;
- Изжога;
- Острый дуоденит;
- Эрозии слизистой оболочки желудочно-кишечного тракта;
- Язвенная болезнь желудка и двенадцатиперстной кишки – период обострения;
- Рефлюкс-эзофагит;
- Остеопороз – лечение и профилактика;
- Повышенная потребность в кальции у детей в период интенсивного роста и женщин в период беременности и грудного вскармливания;
- Гипокальциемия – при гипопаратиреозе, почечной остеодистрофии, повышенном выведении или пониженном всасывании кальция, при длительном лечении глюкокортикоидами;
- Рахит и кариес у детей – лечение и профилактика;
- Остеомаляция;
- Тетания;
- Аллергические реакции – в качестве вспомогательного лечебного средства.
Противопоказания
Противопоказания к применению порошка Карбоната кальция:
- Гиперкальциемия – при гиперпаратиреоидизме, передозировке витамина D, костных метастазах;
- Гиперкальциурия;
- Хроническая почечная недостаточность;
- Нефроуролитиаз;
- Тромбоз;
- Выраженный атеросклероз;
- Фенилкетонурия;
- Саркоидоз;
- Множественная миелома;
- Гиперчувствительность.
Способ применения и дозировка
Препарат принимают внутрь по 0,25-1 г 2-3 раза в сутки.
Для профилактики остеопороза суточная доза составляет 0,6-1,2 г.
Детям для профилактики и лечения рахита и кариеса назначают 300-600 мг кальция карбоната в сутки.
Побочные действия
Побочные действия порошка Карбоната кальция:
- Реакции гиперчувствительности;
- Диспепсические расстройства – тошнота, боль в области желудка, метеоризм, нарушение характера стула;
- Усиление секреторной деятельности желудка вторичного характера;
- Гиперкальциемия – при приеме более 2 г кальция в день.
Особые указания
Во время длительного лечения следует контролировать уровень кальция в моче и показатели функции почек.
В больших дозах препарат может вызвать развитие алкалоза, гиперкальциемию или молочно-щелочной синдром, особенно при соблюдении молочной диеты.
Аналоги
Кальций в качестве активного действующего вещества входит в большинство комплексов минералов и витаминно-минеральных препаратов.
Сроки и условия хранения
Порошок Кальция карбоната следует хранить в сухом месте, недоступном для детей.
Срок годности – 5 лет.
Карбонат кальция порошок, таблетки – инструкция по применению

Фармакологическое действие
Карбонат кальция ослабляет повреждающее действие кислоты соляной на слизистые желудка и пищевода.
Также кальций участвует в образовании костной ткани, свертывании крови, поддерживает стабильную деятельность сердца, осуществляет передачу нервных импульсов.
Еще один препарат с антацидным действием — кальция карбонат магния карбонат, который подавляет разрушающее действие соляной кислоты, уменьшает расщепление белков желудочным соком. Действие препарата не провоцирует повышенное выделение соляной кислоты, не изменяет кислотнощелочное равновесие. Магний, участвующий в комплексе, активизирует обменные процессы, оказывает антиаритимическое, спазмолитическое, антиагрегантное действие, регулирует синтез белка, кислот нуклеиновых, отвечает за процессы хранения, переноса и утилизации энергии.
Форма выпуска
Выпускают таблетки и порошок карбоната кальция.
Показания к применению
Карбонат кальция назначают при расстройствах пищеварения, рефлюксэзофагите, дискомфорте и болях в эпигастрии, метеоризме, в состояниях, сопровождающихся повышенной кислотностью, для профилактики остеопороза, кариеса и рахита у детей.
Кальция карбонат магния карбонат также применяют в состояниях, характеризующихся повышенной кислотностью сока желудочного, назначают при дефиците магния, который проявляется нарушениями сна, утомляемостью, мышечными спазмами, миалгией. Эффективен комплекс при интенсивных занятиях спортом, во время быстрого роста детей, для профилактики нефроуролитиаза оксалатного.
Способ применения
 Карбонат кальция в порошке взрослым для нейтрализации соляной кислоты назначают в дозировке 0,5-1гр. Для профилактики остеопороза назначают 0,6-1,2гр в сутки.
Карбонат кальция в порошке взрослым для нейтрализации соляной кислоты назначают в дозировке 0,5-1гр. Для профилактики остеопороза назначают 0,6-1,2гр в сутки.
Детям для лечения кариеса и рахита назначают по 300-600мг в сутки.
Разовая доза комплекса кальция с магнием — 500 мг.
Детям после 12л и взрослым дают две таблетки, если появятся симптомы заболеваний или после еды (если надо, каждые два часа). Больше 12 таблеток в сутки принимать нельзя.
Таблетку не глотают, а рассасывают.
Побочные действия
Карбонат кальция при длительном применении из-за накопления щелочных веществ может вызвать алкалоз (увеличение уровня pH в тканях и крови).
Применение Кальция карбонат магния карбонат может вызвать изменение консистенции стула.
Прием повышенных доз препарата может привести к повышенному выделению сока желудочного. Длительное применение повышенных доз препарата может вызвать гиперкальциемию, которая проходит после окончания терапии.
Если препарат принимает пациент с нарушенной функцией почек, может развиться гипермагниемия.
Противопоказания к применению
Порошок карбоната кальция противопоказан при тромбозе, атеросклерозе тяжелом, гиперкальциемии, повышенной чувствительности к препарату.
Кальций с магнием нельзя принимать при фенилкетонурии, тяжелых нарушениях почечной функции, гиперкальциемии, повышенной чувствительности к средству, детям до 12л.
Во время беременности препараты принимать можно, но после консультации с наблюдающим гинекологом.
Карбонат кальция — Википедия. Что такое Карбонат кальция
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3{\displaystyle {\mathsf {CaCO_{3}}}}. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
 Таблетки из карбоната кальция
Таблетки из карбоната кальцияОчищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
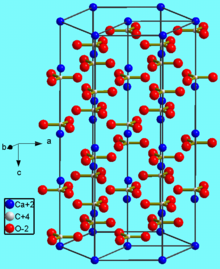
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит). Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[2]:
- CaO+h3O⟶Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}}}
- Ca(OH)2+CO2⟶CaCO3+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}+H_{2}O}}}
Химические свойства
При нагревании до 900−1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3⟶CaO+CO2↑{\displaystyle {\mathsf {CaCO_{3}\longrightarrow CaO+CO_{2}\uparrow }}}.
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3+CO2+h3O⟶Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow Ca(HCO_{3})_{2}}}}.
Благодаря именно этой реакции образуются сталактиты, сталагмиты и прочие красивые природные формы и образуются карстовые пещеры.
При обжиге с температурой около 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3+4C⟶CaC2+3CO↑{\displaystyle {\mathsf {CaCO_{3}+4C\longrightarrow CaC_{2}+3CO\uparrow }}}.
Примечания
Ссылки
Карбонат кальция: свойства и все характеристики
Характеристики и физические свойства карбоната кальция
Практически не растворяется в воде.
Рис. 1. Карбонат кальция. Внешний вид.
Основные характеристики карбоната кальция приведены в таблице ниже:
|
Молекулярная формула |
CaCO3 |
|
Молярная масса, г/моль |
100 |
|
Плотность, г/см3 |
2,74 – 2,83 |
|
Температура плавления, oС |
825 |
|
Температура разложения, oС |
900 – 1000 |
|
Растворимость в воде (25oС), г/100 мл |
0,0015 |
Получение карбоната кальция
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
CaO + H2O = Ca(OH)2;
Ca(OH)2 + CO2 = CaCO3↓.
Химические свойства карбоната кальция
Карбонат кальция — это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная H2CO3). В водном растворе он гидролизуется. Гидролиз протекает по аниону. Наличие анионов OH— свидетельствует о щелочном характере среды.
CaCO3↔ Ca2+ +CO32-;
Ca2+ +CO32- + HOH ↔ HCO3— + Ca2+ + OH—;
CaCO3 + HOH ↔ Ca(HCO3)2 + Ca(OH)2↓.
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот:
CaCO3 + 2HClconc = CaCl2 + CO2↑ + H2O.
Он способен реагировать с щелочами в водных растворах:
CaCO3 + 2NaOHaq = Na2CO3 + Ca(OH)2↓.
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды:
CaCO3 + 2NH4Clcon = CaCl2 + 2NH3↑ + CO2↑ + H2O.
При нагревании данная соль разлагается:
CaCO3 = CaO + CO2↑ (t,oС = 900 — 1000).
Пропускание диоксида углерода через раствор карбоната кальция приводит к образованию кислой соли – гидрокарбоната кальция:
CaCO3 + CO2 + H2O ↔Ca(HCO3)2.
Применение карбоната кальция
Карбонат кальция нашел широкое применение в различных отраслях промышленности. Так, например, его используют в пищевой (добавка Е710 – белый краситель) и бумажной промышленности, при производстве полимеров, лакокрасочных материалов, бытовой химии и т.д.
Примеры решения задач
Карбонат кальция — Википедия
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3{\displaystyle {\mathsf {CaCO_{3}}}}. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Таблетки из карбоната кальцияОчищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — ещё один из основных потребителей карбоната кальция. Шпаклёвки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно — щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит). Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[2]:
- CaO+h3O⟶Ca(OH)2{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}}}
- Ca(OH)2+CO2⟶CaCO3+h3O{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}+H_{2}O}}}
Химические свойства
При нагревании до 900−1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3⟶CaO+CO2↑{\displaystyle {\mathsf {CaCO_{3}\longrightarrow CaO+CO_{2}\uparrow }}}.
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3+CO2+h3O⟶Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow Ca(HCO_{3})_{2}}}}.
Благодаря именно этой реакции образуются сталактиты, сталагмиты и прочие красивые природные формы и образуются карстовые пещеры.
При обжиге с температурой около 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3+4C⟶CaC2+3CO↑{\displaystyle {\mathsf {CaCO_{3}+4C\longrightarrow CaC_{2}+3CO\uparrow }}}.
Примечания
Ссылки
Польза и вред карбоната кальция

Пищевая добавка карбонат кальция обозначается как Е 170 и в природе встречается в виде привычного мела. Вещество относится к неорганическим пигментам и используется в пищевой промышленности, медицине, строительстве, других отраслях.
Карбонат кальция не растворяется в воде и спирте, обладает свойствами разрыхлителя, антиокислителя, красителя. В материале разберем, какую пользу несет вещество и ознакомимся с оптимальными дозировками, чтобы исключить опасные побочные эффекты.
Состав пищевой добавки Е 170

Химическая формула добавки Е 170 — CaCO3. Очищенный мел поступает в продажу в форме белого порошка мелкой фракции. Источником карбоната служит мрамор. Также соль угольной кислоты присутствует в панцирях ракообразных и моллюсков.
Где добывают карбонат кальция?
Для изготовления промышленной добавки Е 170 берут природное сырье, которое содержится в минералах: ватерите, арагоните, кальците. Источником углекислого кальция также служат мрамор, известняк, мел. Сырье перерабатывают и очищают от примесей перед продажей. Наиболее ценен карбонат кальция, полученный из мрамора.

Ведущие производители добавки — 10 европейских компаний, включая Omya (Швейцария) и Imerys (Франция). С начала XXI века заводы по переработке углекислого кальция действуют в Китае. Свои меловые месторождения есть и в России. Карбонаты добывают в Белгородской и Воронежской областях. Промышленным производством занимаются предприятия АО «Мелстром», ООО «Воронежглавмел» и ОАО «Клинцевский силикатный завод».
Краситель Е170 (карбонат кальция) — вреден или нет?
Потребляемый в разумных дозировках карбонат кальция вред организму не наносит. По этой причине пищевой краситель разрешен к применению в России. При превышении суточной нормы вещество может вызвать отравление, симптомами которого становятся:
- тошнота и рвота;
- дискомфорт в желудке;
- метеоризм;
- нарушение координации движений.
Избежать этих неприятных последствий помогает соблюдение дозировки.
В сутки медики рекомендуют применять взрослому человеку не более 1,2–1,5 г карбоната кальция.
Применение карбоната кальция в промышленности
Углекислый кальций используется сразу в нескольких отраслях промышленности.
- Производство средств гигиены — вещество добавляют в зубную пасту.
- Бумажное производство — кальцием отбеливают бумагу и наполняют картон.
- Стекольная промышленность — карбонаты входят в состав стекла.
- Производство бытовой химии — компонент кремов для обуви, чистящих средств.
- Производство сантехники — карбонат кальция используется в изготовлении фарфора и фаянса, а также керамической плитки.
- Лакокрасочное производство — в лаки и краски вещество добавляют в качестве красителя.
- Строительство — карбонаты входят в состав герметиков, шпаклевки.

Кроме того, вещество используется при производстве очистных сооружений и фильтров, а также в сельском хозяйстве — для восстановления кислотности грунта.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.

Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.
КАЛЬЦИЯ КАРБОНАТ — косметические свойства, описание, применение в косметике
Традиционное название
Латинское название
Название по INCI
КАЛЬЦИЯ КАРБОНАТ
Стабилизаторы кислотности (PH)
Пигменты
красители
Абразивы скрабы
Наполнители (в т.ч. минеральные)
Общая опасность0
Канцерогенность0
Опасность при беременности0
Алергенность, Иммунотоксичность0
Ограничение в использовании0
CALCIUM CARBONATE, PRECIPITATED
CALCIUM CARBONATE
CALCIUM CARBONATE
SLAKER REJECTS
CALCIUM SALT CARBONIC ACID
CARBONIC ACID CALCIUM SALT (1:1)
CARBONIC ACID, CALCIUM SALT
HEAVY CALCIUM CARBONATE
PRECIPITATED CALCIUM CARBONATE
PRECIPITATED CHALK
AEROMATT
AGRICULTURAL LIMESTONE
AGSTONE
CI 77220
TRAVERTINE
Абсолютно безопасный компонент при использовании по назначению.
Белый кристаллический порошок без запаха и вкуса. Очищенный, химически осажденный мел — основной абразивно-полирующих компонент зубных паст, порошков. В зависимости от степени дисперсности делят на четыре типа: сверхтонкий, тонкий, средний, грубый. Для зубных паст используют мел средней дисперсности. Неорганический пигмент, абразив, буферный агент, наполнитель, замутнитель. Как хороший абсорбент используется в сухих дезодорантах, депиляториях, пудре, гигиеническом тальке. В соответствии с законодательством ЕС 1223/2009 и ТР ТС 009/2011 как белый пигмент разрешен к использованию без ограничений. Зарегистрирован в качестве пищевой добавки Е170.
Abrasive; Buffering Agent; Bulking Agent; Opacifying Agent; Oral Care Agent




