сравнение рисков и побочных эффектов / Клиника офтальмологии доктора Шиловой corporate blog / Habr
Механическое устройство, выстреливающее или медленно двигающее лезвием для срезания верхней части роговицы глаза
Начнём с истории, чтобы было понятно, как эволюционировали методы, а потом перейдём к рискам и побочным эффектам современных операций.
Итак, доктор Снеллен, который изобрёл таблицу проверки зрения, выдвинул теорию о том, что можно «поцарапать» глаз так, что кривизна роговицы изменится. Случилось это в 1869 году (в этом же году появилась таблица Менделеева и докопали Суэцкий канал), поэтому «царапать» тогда могли только металлическим скальпелем. Офтальмологии как отдельной науки официально не было, и занимались ей обычные хирурги — те же самые, которые бодро отпиливали руки и ноги при возникновении инфекции.
К глазам они приступать поначалу не решались: пациент вроде жив, шевелится и не кричит, значит, трогать его пока нет достаточных оснований. Поэтому первая операция по коррекции зрения была проведена доктором Лансом в Голландии только через 30 лет, в 1898 году.
Следующим отличившимся персонажем стал выдающийся советский хирург академик Святослав Николаевич Фёдоров, который предложил очень своеобразный метод: точечно нагревать роговицу глаза до тех пор, пока она не деформируется. Но вместе с японским офтальмологом Сато они быстро перешли к надрезам. Сато резал изнутри и тем самым создавал много осложнений, а Фёдоров делал насечки алмазным ножом снаружи. Эти самые надрезы фактически и положили начало современным лазерным операциям.
Скальпель
Надо сказать, что офтальмология как отдельная специальность появилась в Германии в середине девятнадцатого века (1857 г.), когда родилось немецкое общество офтальмологов. В США, например, до 50-х годов двадцатого века это называлось «секция офтальмологии» и находилось в департаменте общей хирургии.
С. Н. Фёдоров из СССР, Сато из Японии и Роуси из США в 80-х годах пришли к похожим выводам. Сначала они нагревали роговицу до нужной стадии деформации и смотрели, что будет с оптикой пациента. Роговица пациента остывала, он успокаивался, видел хорошо, но через некоторое время эффект пропадал. Поэтому ветка была признана неудачной, и хирурги взялись за разрезы. Точнее, настоящий толчок появился тогда, когда они стали делать насечки на роговице. Идея была Сато, но у него результаты были прогнозируемо плохими.
Сато поначалу делал насечки изнутри наверх, то есть получал доступ к внутренней (нижней) части роговицы глаза и резал через эндотелий — нижний слой роговицы. Эндотелий предсказуемо не регенерировал, роговицы мутнели. Потом в результате опытов быстро появилась методика насечек на поверхности через эпителий и боуменову мембрану прямо в строму. В 1972 году академик С. Н. Фёдоров опубликовал системный научный труд, где описал методику операции и механику различных разрезов. До этого момента в сфере царила случайность — каждый делал, полагаясь только на свой небогатый опыт и не очень-то понимая архитектуру глаза. Диагностика — вручную, глубина реза — интуитивно, количество насечек — в зависимости от размера пальцев доктора. С. Н. Фёдоров назвал операцию радиальной кератотомией. Она приобрела популярность в СССР и США, а также в Латинской Америке. Скоро появилась версия Линдстрома — так называемая мини-РКТ, чуть менее инвазивная.
В СССР начали делать её массово, в Колумбии и США — тоже. В Западной Европе почти не было последователей из-за консерватизма.
Технология нанесения самих насечек менялась незначительно: теория С. Н. Фёдорова прекрасно работала, разве что инструменты стали чуть точнее — металлические скальпели заменили на алмазные.
Через 10 лет набрался клинический опыт. И вышло первое десятилетнее исследование по РКТ Джорджа Ворринга Третьего — ему удалось показать, что РКТ хорошо работает, но происходит гиперметропизация: люди становятся со временем более дальнозоркими. И именно в СССР хирурги получили огромный опыт лечения таких осложнений, поскольку они очень часто встречались (благодаря массовости операций — их сделали больше миллиона).
Эксимерный лазер
Потом появился первый инфракрасный эксимерный лазер. Считается, что его впервые использовал Стив Торкель, который придумал, как использовать промышленный лазер в медицине. За счёт того, что все изменения рефракции делались на тот момент резом, он решил просто заменить металлический скальпель на алмазный, а алмазный на ещё более точный — лазерный. Да-да, это тогда делалось вручную лазерным станком, по сути.
Начали испытывать — получилось, что лазер на специальных направляющих позволяет добиться куда большей точности, чем ручной рез. И началась эпоха автоматизации операций рефракционной хирургии.
Проблемы были в том, что эксимерные лазеры грели роговицу, и она просто зарастала в местах разрезов. Радиальная коррекция работает так, что вы ослабляете механику роговицы, надрезая, выпаривая или изымая оттуда часть коллагеновых волокон. Затем она проседает посредине и смыкается. Тогда шли с середины «звёздочкой», роговица становилась более плоской. Есть разные методики — мы застали с докоррекциями лазером больных на «всего 16 разрезов», а есть те, у которых 32 разреза. В МНТК тогда создали фактически конвейер, где люди двигались по кругу, и каждый хирург делал единственный этап операции.
Доктор Маргуерит Макдональд первой сделала в 1985-м операцию, названную фоторефрактивной кератэктомией (ФРК). Лазер она решила использовать, скорее, как шлифовальный инструмент (по методике Сринивазана и Бренена, описанной в 1983-м, но не опробованной). На операции пациенту «сточили» часть роговицы. В центре роговицы выпарили много ткани, дальше к краям — чуть меньше. Получалось, что линза, которая образовывается роговицей, меняла ее оптические свойства.
Принцип ФРК
Проблемы на тот момент были в том, что рабочая зона лазера выбиралась около 4 миллиметров — дальше к краям не ходили. А зрачок здорового человека раскрывается в темноте иногда до 6–8 миллиметров, то есть прямо напротив зрачка оказывалось кольцо, образованное резом. Отсюда — сильные гало-эффекты, то есть очень интересное изображение любых источников света ночью. В общем, пациенты ночью оказывались если не беспомощными, то близкими к этому состоянию: свет едущей навстречу машины лишал их способности ориентироваться.
В 90-х начали производить лазеры массово, а потом довольно быстро расширили рабочую область. С тех пор ФРК не особо сильно поменялась — сегодня эта методика ещё жива (почему — ниже), но выполняется более современными устройствами и широкими зонами абляции, менее травматично. Но если вы решитесь на эту операцию — помните, что боуменову мембрану она просто уничтожает. Но, надо признать, в некоторых случаях это вполне допустимая потеря.
LASIK
Примерно одновременно с ФРК появилась идея не выпаривать «шлифовкой» линзу на поверхности глаза, а снимать верхний слой роговицы, вырезать под ним полость, а потом пришивать верхний слой обратно. Собственно, поначалу доктор Зейлер из Берлина, работавший с помутнениями и поверхностными рубцами, придумал операцию ФТК с помощью эксимерного лазера (дедушка-гуру офтальмологии Тео Зейлер, кстати, до сих пор лечит в Цюрихе, у него своя клиника). Исходя из его практических разработок и теории Хоссе Барракера из 50-х, доктор Иоаннис Полликарис с теплого острова Крит придумал практическое воплощение этого метода.
Но вернёмся к Полликарису, очаровательному доктору Барракеру и тихому и спокойному Лучио Буратто (он тоже уже дедушка-гуру, живущий в своё удовольствие в Милане и «работающий» на полную катушку). Они все мучились от того, что такой хороший метод даёт не очень точную коррекцию — разброс у среднего хирурга составлял плюс-минус три диоптрии (поэтому применяли его только для пациентов с реально сильной близорукостью). Используя методику Хосе Барракера, Иоаннис Полликарис и Лучио Буратто поняли, что эксимерный лазер позволяет шлифовать роговицу точнее, чем срезать её лезвием.
Как в комментарии отметил stAndrew: «Мне флэп резали ножом. Это скорее очень неприятно психологически, когда тебе на глаз кладут шайбочку, которая жужжит и режет зеницу ока по живому. Сейчас флэп делают фемтосекундным лазером.»
Кстати, эта «шайбочка» есть на картинке вверху поста.
Так появилась процедура LASIK (это аббревиатура: К — это кератомлилёз, остальные буквы — laser assisted, то есть «при поддержке лазера»). Полликарис привнёс в операцию наиболее прогрессивную часть — он оставлял «ножку» или «петлю» для «шапочки», то есть позволял относительно ровно накладывать её обратно, и чтобы ей было за что держаться. Кстати, говоря о смещении флэпа при LASIK и femtoLASIK, стоит помнить, как раз про эту главную проблему. Срезаемая «крышка» держится именно на лоскуте шириной около 20-40 градусов, и сверху покрывается эпителием. И то, что она стоит на месте, а не «отскакивает», обеспечивает именно эпителий. И больше ничего. Поэтому при травмах глаза она может «откинуться».
В 1992 году LASIK был введён как массовая операция.
LASIK
FemtoLASIK и FLEX
Хирургам хотелось от лазера большей точности реза и меньшего нагрева тканей. То есть куда большей частоты при куда меньшей энергии импульса. Когда появились первые фемтосекундные лазеры (современные дают импульс в десятки тысяч раз короче, чем первое поколение), сразу начался ажиотаж вокруг них.
И не зря. Поначалу был разработан FemtoLASIK — всё тот же самый старый добрый метод очаровательного и гениального Барракера, но уже с куда большей точностью и без особых сюрпризов. Это была прекрасная операция, и она работала как часы. Собственно, и сейчас работает.
С помощью фемтосекундного лазера делается разрез по горизонтали (то, что раньше делали укладывающейся на глаз шайбочкой с двигающимся стальным лезвием), затем пациент переносится под эксимерный лазер, внутри стромы роговицы выпаривается линза, а сверху кладётся то, что отрезали вначале.
Как работает лазер, я уже писала вот здесь.
Но лазер позволял сделать то, что не получалось раньше, а именно, не «пробивая» поверхность роговицы глаза, резать внутри, формируя рез, который вообще может не касаться поверхности. Так появился FLEX — по сути, он не лучше и не хуже femtoLASIK, поскольку там всё равно есть флэп — «лоскут на ножке». Но FLEX делался уже одним лазером, а не двумя, поэтому операция происходила значительно быстрее, да и запаха «паленой роговицы», такого типичного для эксимера, не было. И рез по линзе был криволинейным, что на 2006 год было прорывом. Правда, из-за высокой точности реза (точнее, малой толщины) иногда оставались спайки, которые надо было аккуратно разделять. Тогдашние лазеры только-только обеспечивали нужную частоту, и поэтому кроме спаек могли появиться мостики в результате неточного попадания фокуса (из-за микрокапель жира, например, на поверхности глаза), их тоже надо было разделять шпателем.
Поскольку мы живём в мире патентов, конкуренты Zeiss (производителя лазеров) начали срочно придумывать свои аналоги. Очень хорошей эволюционной веткой была история с superLASIK, который делался по специальной wavefront-карте глаза. Все искажения измеряются и передаются в прошивку, которая выстраивает индивидуальный профиль.
Минус в том, что часть искажений даёт роговица (её можно корректировать), а часть — хрусталик. С ним сложнее — он растёт всю жизнь, и все преимущества операции могут нивелироваться через 5 или 10 лет. В современных операциях используется принцип асферической линзы на роговице — она делается так, чтобы максимально хорошо «показывать» через сколько угодно лет. Современные оптимизированные профили для сферических аберраций (а именно они больше всего создают проблем вроде «плохо вижу ночью») дают результаты лучше или на уровне с лазерами, которые не имеют асферических профилей, зато решают вопрос по индивидуальным профилям. Если у вас цейсовский лазер MEL-90 или «VISX STAR S4» от АМО, то они позволяют и то и другое. В конце операции почти нет разницы.
Отсюда и мифы про «3000 отдельных линз в роговице» и так далее. Цейс обновил математику на новом поколении своих лазеров, и теперь догнать его крайне сложно — по уже как минимум двухлетним клиническим исследованиям его стандартные асферические профили качественнее или не хуже, чем специально спроектированные под конкретную операцию на других лазерах. Теперь уже последние догоняют, поскольку нужна более сложная подготовка пациента, чтобы добиться того же результата.
Следующий этап работы с механикой роговицы — FLEX. Это всё тот же старый добрый кератомилёз, только на другом уровне точности. Потом для FLEX стали делать разрез не во всю дугу, а вполовину, а потом профессор Вальтер Секундо и Маркус Блум решили попробовать вырезать линзу внутри целиком и достать её через небольшой разрез.
SMILE
Так FLEX проэволюционировал до SMILE — это тоже аббревиатура, означает «малоинвазивное извлечение лентикулы». То есть вырезание линзы внутри глаза с последующим её доставанием.
Как именно это происходит, можно посмотреть вот тут (меня несколько раз просили предупреждать, поэтому лучше, наверное, не смотреть ссылку за едой, хотя ничего страшного там на самом деле нет).
В 2007-м мой был сделан первый SMILE, тогда ещё с двумя разрезами по 5 миллиметров — предполагалось, что второй нужен для того, чтобы при промывании полости лентикулы в строме жидкость могла свободно выйти. Два по 5 — это 10, а не 20, как делалось для FLEX или femtoLASIK, а значит, сохранялось куда больше нервов внутри глаза и куда меньше травмировалась боуменова мембрана.
Довольно быстро удалось уменьшить разрезы до 2,5 миллиметров. А затем Рупал Ша из Индии доказала, что достаточно всего одного. Сегодня большая часть опытных хирургов работает от 2 до 3 миллиметров (но большая часть российских хирургов — от 3 до 4,5 мм).
ICL
Если FemtoLASIK и SMILE отлично решают задачи близорукости, то с дальнозоркостью или более сложными эффектами не так просто. Но имея возможность вырезать лентикулу внутри глаза, можно использовать не только эффект схлопывания стромы и формирования новой формы линзы. Можно вставлять в эту полость что-то новое и интересное. Тот же самый неутомимый советский хирург академик С. Н. Фёдоров придумал операцию (в будущем её назвали ICL — имплантируемая контактная линза). Он вставлял линзы или в заднюю камеру глаза, или перед хрусталиком — благо операции по имплантации хрусталика тогда уже были хорошо освоенными. Но у академика С. Н. Фёдорова не было современных материалов, поэтому каждый четвёртый пациент получал неприятный побочный эффект: за счёт ухудшения питания собственного хрусталика начиналось его помутнение.
В США был создан новый сополимер — отчасти силикон, отчасти свинья. Точнее, там использовался свиной коллаген. От 25% побочных катаракт удалось уйти до 3%. Операция стала массовой, и началась масса веток улучшения. Целые десятки моделей появлялись и исчезали из-за осложнений. С тех лет компании-производители пару раз поменяли название, но 90% рынка — всё та же «наполовину свинка». Хотя, конечно, линзы теперь делают гибкими, чтобы вводить их через небольшой разрез.
На сегодня стабильная операция такого рода разработана Яном Ворстом из Голландии — у него линза с «клешнями», она зацепляется за радужку и держится в передней камере. Профессор Секундо, кстати, специально ездил к Яну Ворсту в Голландию для обучения и понимания технологии изготовления на фабрику Ophtech, которой сейчас руководит Ворст-младший.
Что делают сегодня в России и в мире
В Германии, ситуация 5 лет назад была следующая:
- ФРК для редких показаний и для городов, где нет отдельной офтальмологии («Как у нас шутят, операция ФРК очень простая, её может освоить при должной ассистенции даже кошка», — рассказывает профессор Секундо).
- LASIK для тех, у кого нет денег на femtoLASIK.
- FemtoLASIK и его производные для стандартных случаев.
- SMILE для тех, кто готов уменьшать риски за дополнительную плату (как VIP-операция у опытных хирургов).
За следующие 2 года SMILE стал делаться примерно так же часто, как femtoLASIK.
На текущий момент ситуация несколько изменилась. Дело в том, что из-за увеличения частоты лазера и улучшения энергетических параметров точность SMILE стала существенно выше, и 2–3 года назад сравнялась с femtoLASIK на коррекциях от –2 (на меньших femtoLASIK точнее, а ФРК идеальна по точности для –1). Остался вопрос высокой цены, и тут мало что изменится из-за того, что только Цейс умеет пока делать необходимую оптику. Одно включение лазера для операции SMILE для одного глаза стоит 300 евро.
Сейчас в Германии в той же сети произошло вот что:
- ФРК держится в районе 7–10% (тонкая роговица, ряд сложных случаев, малые коррекции около –1 диоптрии, плюс реклама «никто вас даже не тронет», огромная клиническая практика).
- Обычный LASIK даже пациенты считают почти что за варварство, и его уже нет.
- Затем по популярности идёт femtoLASIK с аналогами, примерно 10% операций.
- FLEX — единицы в год, поскольку это уже ненужный эволюционный этап.
- И затем — SMILE, его примерно 80%.
FemtoLASIK, скорее всего, снизится до 5–7%, как и ФРК. У него есть два плюса: во-первых, меньше эвакуируемой ткани по сравнению со SMILE при малой коррекции, ведь лентикула должна иметь ну хотя бы 30 микронов, чтобы за неё ухватиться. Во-вторых, после него быстрее появляется резкое зрение — это день-два, а не 4 дня, а то и неделя. Для некоторых это важно.
В России ситуация чуть похуже: LASIK ещё делают из-за низких цен (оборудование для этой операции стоит от 50 до 80 тысяч евро, а операционная с фемтолазером VisuMax Carl Zeiss — полмиллиона евро). SMILE довольно мало распространён. Проблема в высокой цене и, как следствие, малом опыте хирургов — например, некоторые коллеги имеют на всех своих хирургов больше 20 тысяч операций FemtoLASIK, но единицы или десятки — SMILE. Проблема в том, что, как было в одном немецком заголовке, «В рефракционной хирургии снова нужен хирург». То есть надо делать что-то руками, а кадры, которых готовили для LASIKа, ничего руками не делают. Отсюда вопрос квалификации. И недоучек — много где по миру репутацию SMILE несколько портили хирурги, которые не очень-то хорошо умели работать мануально. Поэтому если вас отговаривают от этого метода в клинике — лучше послушаться, скорее всего, они не хотят рисковать, зная своего хирурга. Многие хирурги боятся нового, ибо боятся осложнений. Это нормальное человеческое свойство: все оставить, как было раньше.
Кстати, LASIK ещё долго будет жить у нас на рынке хотя бы по той причине, что старые лазеры из Европы уезжают не только в страны третьего мира, но и в Россию, и «оседают» в клиниках-лоукостерах.
— Я уже давно сделал femtoLASIK, FLEX, superLASIK или ФРК… не надо было?
Если вы делали ФРК по цене, а не по показаниям, у вас нет боуменовой мембраны, и это действительно было не лучшей идеей. Тем не менее пока у вас нет проблем с внутриглазным давлением, риски очень низки. ФРК — хорошая операция с 20-летней историей, и сделана она была точно качественно. Потому что там очень-очень-очень сложно ошибиться в момент самой операции.
Если вы делали femtoLASIK или его аналоги, прошло несколько лет и проблем нет — поздравляю, скорее всего, проблем уже и не будет — риск на следующие лет 20 только около 1–2%.
Если вы собираетесь делать коррекцию и выбираете между SMILE и femtoLASIK не из-за финансовой составляющей, то SMILE чуть лучше. Однако сейчас в России если вы собрались делать femtoLASIK — знайте, что здравомыслящий хирург сможет сделать эту операцию с минимумом рисков, сама технология отработана, специалисты в мире её отлично знают, цены в целом земные. Я несколько лет назад лично сделала лазерную коррекцию и своей маме, и дочери, да и многие мои коллеги делали лазерную коррекцию себе и своим близким.
И есть SMILE. Это снижение вероятности побочных эффектов, грубо говоря, с 2-5% до 0,5%. Причём как естественно обратимых, так и необратимых. Минимально травмируется боуменова мембрана, сохраняется много нервов, которые при других методах коррекции были бы уничтожены. Но это дороже, и требуются навыки хирурга. Если вы доверяете врачу и готовы заплатить за снижение риска необратимых осложнений — выбор достаточно очевиден.
В следующем посте будут ответы на все оставшиеся ваши вопросы, подробно про ход операции, защиту лазера от разного рода ЧП, случаи прерывания операции и рассказ про устройство глаза на микроуровне, чтобы было понятно, как идут регенеративные процессы. Чуть позже я ещё расскажу про мировые и российские клиники, на которые стоит обратить внимание.
Лазер или скальпель: преимущества лазерной хирургии
Аннотация
Говоря о СО2 лазере, необходимо отметить его общепризнанную эффективность в хирургии мягких тканей. Луч этого лазера с длиной волны 10 600 нм наиболее тропен к молекулам воды (Н2О). Исходя из того, что мягкие ткани человека на 60–80 % состоят из воды, поглощение излучения СО2 лазера в них происходит наиболее выраженно и эффективно, обуславливая эффект абляции, иными словами, эффект «лазерного скальпеля». Абляция мягких тканей – необходимое и клинически значимое условие для выполнения различных видов хирургии.
Универсальность методики «лазерного скальпеля»
Многопрофильность нашего операционного отделения позволяет использовать данную методику – методику «лазерного скальпеля» – в хирургии, гинекологии, пластической хирургии, урологии.
Выделим особенности и преимущества взаимодействия «лазерного скальпеля» с биологическими тканями:
- нет прямого контакта с тканью, а значит, нет опасности инфицирования. Луч не может являться переносчиком вирусов и бактерий (в том числе ВИЧ, вирусных гепатитов В и С). Разрез, выполненный лазером, является стерильным при любых условиях;
- стерилизация ткани в операционном поле, подвергшейся обработке лазерным излучением, и возможность работать с инфицированными участками тканей. Эта возможность представляется поистине грандиозной для хирургов;
- возможность одноэтапного удаления инфицированной дермальной кисты с наложением первичного шва при условии отсутствия кровопотери и опасения раневой гематомы;
- коагулирующее действие излучения, позволяющее получить практически бескровные разрезы. Удобство и скорость работы. Бескровность – это то состояние, которое позволяет хирургу комфортно работать там, где это необходимо. Из личного опыта: исправление врожденных и приобретенных деформаций губ качественно и симметрично можно выполнить только лазерным лучом;
- минимальное термическое воздействие на окружающие ткани и известный биостимулирующий эффект лазера обуславливают быструю заживляемость раны и ощутимое сокращение послеоперационного периода.
Благодаря инновационным возможностям современных СО2 лазеров, а именно модулируемым формам лазерного импульса, независимой регулировке глубины абляции, мощности и длины импульса, стало возможным сделать лазерные операции максимально эффективными и физиологичными при работе с различными типами тканей и показаний.
Важно понимать, что от компетентности специалиста зависит безопасность пациента, поэтому обучение врачей технологии работы с лазером – необходимое условие применения лазерных технологий в медицинской практике.
Являясь хирургом классической школы, я имел неоднозначное отношение к лазерному лучу. За время профессионального роста мне приходилось работать с несколькими лазерными системами, однако началом своего осознанного подхода к лазерной хирургии могу считать момент внедрения в клиническую практику нашего Центра СО2 лазерной системы SmartXide2 компании DEKA. Выбор данной системы был обусловлен ее многофункциональностью для разных направлений медицины и наличием в ней ряда инновационных возможностей, напрямую влияющих на повышение эффективности и индивидуализацию подходов в хирургической практике:
- модулируемые формы лазерного импульса Pulse Shape Design и возможность их выбора и изменения,
- ступенчатая регулировка глубины абляции, так называемые стеки,
- независимая друг от друга настройка параметров лазерного излучения: мощность, длина импульса, расстояние между точками, форма импульсов, стеки, геометрия сканируемой площади, порядок сканирования.
Первое использование СО2 лазера в моей практике – удаление доброкачественных образований кожи. Использование лазерной системы дало неоспоримые преимущества, среди которых простота и скорость процесса, четкая визуализация края образования, возможность работать на любом участке тела, включая слизистые и подвижную часть века, эстетичность результата, быстрое заживление.
Недостатком лазерного воздействия можно считать затруднение при взятии биопсии.
Таким образом, лазерное воздействие можно считать наиболее приемлемым способом удаления доброкачественных образований.
Применение лазера SmartХide2 DOT для удаления подкожных образований, таких как атерома, фиброма и т. д., также является эффективным. Лазерный луч позволяет выполнять прецизионное рассечение слоев кожи. Оболочки кисты хорошо визуализированы. Данный метод незаменим при наличии перифокального воспаления и повышенной кровоточивости из-за полнокровия тканей. Во всех перечисленных случаях образование удавалось удалить полностью, послеоперационная рана отмечалась сухостью, отсутствием кровотечения, включая капиллярное. Раны во всех случаях ушивались без дренирования. Назначалась антибиотикотерапия. На контрольных осмотрах была отмечена положительная динамика, заживление ран первичным натяжением.
Клинические примеры
Клинический случай 1
Пациентка, 32 года. Предложена трансконъюнктивальная билатеральная блефаропластика с применением лазера. Через нижний свод конъюнктивального мешка осуществлен доступ к параорбитальной клетчатке (SP 3 W), избытки подвергнуты абляции (SP 6 W). Рана ушита одиночными швами Vicryl 6.0. В послеоперационном периоде отмечены отеки и синяки в меньшей степени по сравнению с классической методикой. Риски электротравмы глаза отсутствовали, так как электрокоагулятор не использовался.
Минусы: необходимость использования одноразовых конъюнктивальных экранов, что в свою очередь усиливает явления послеоперационного конъюнктивита.
Выводы: методика значительно облегчает работу хирурга, обеспечивает меньшую травматизацию тканей при операции. При одномоментном лазерном фракционном воздействии на кожу периорбитальной области (псевдоблефаропластике) данный метод незаменим.
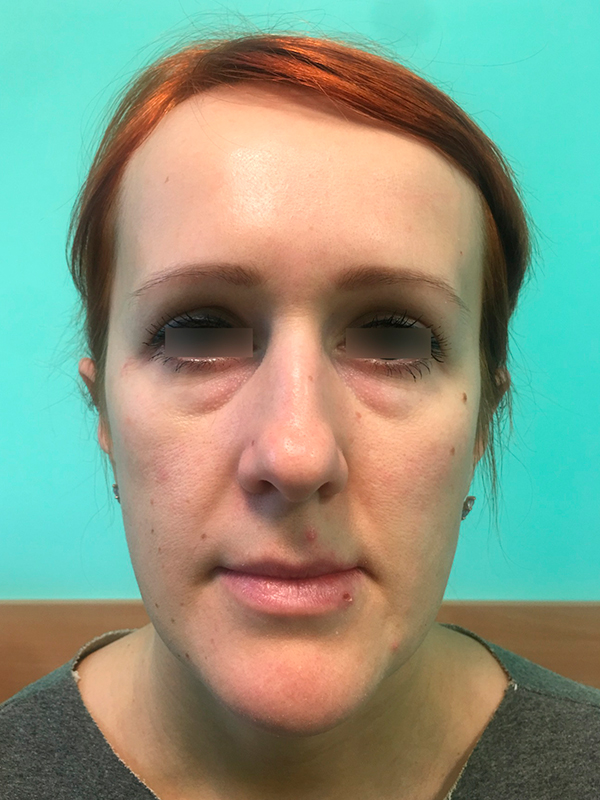 Рис. 1 а. Фото до проведения операции
Рис. 1 а. Фото до проведения операции  Рис. 1 б. Фото на 6-й день после проведения операции.
Рис. 1 б. Фото на 6-й день после проведения операции.Клинический случай 2
Пациент, 23 года. Посттравматическая деформация губы. Предпринята попытка симметризации губ. В условиях операционной с электрокоагулятором по разметке было проведено моделирование верхней губы. Операция длилась 20 минут, стабильный гемостаз – +40 минут. Результат: пациент удовлетворен на 80 %. После анализа результата пациенту была предложена коррекция губы лазером SmartХide2. В режиме Smart Pulse 6W с помощью насадки 7” была выполнена абляция избыточной и рубцовой ткани верхней губы. Швы наложены Vicryl Rapide 5.0. Пациенту рекомендован уход за раной до исчезновения отека (до 14 дней). Через два месяца после операции результат удовлетворительный на 100 % для пациента и хирурга.
Минусы лазерного метода коррекции: не выявлены.
Выводы: на данном этапе считаю коррекцию деформаций губ СО2 лазером лучшим методом из возможных.
Клинический случай 3
Пациентка, 44 года. Предложена пластика верхних век. Было выполнено иссечение избытка кожи верхнего века. Абляция участка круговой мышцы глаза, ее рассечение и удаление избытков параорбитальной клетчатки. Преимущества применения лазера – в скорости операции и чистоте раны.
Минусы: в связи с большим размером манипул лазера нужны идеально выверенные и точные движения хирурга для получения ровного операционного края.
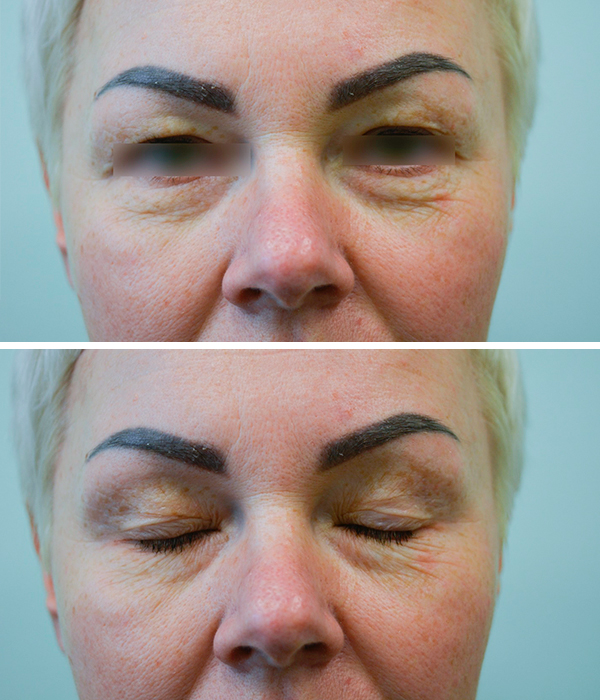 Рис. 2 а. Фото пациентки до операции
Рис. 2 а. Фото пациентки до операции 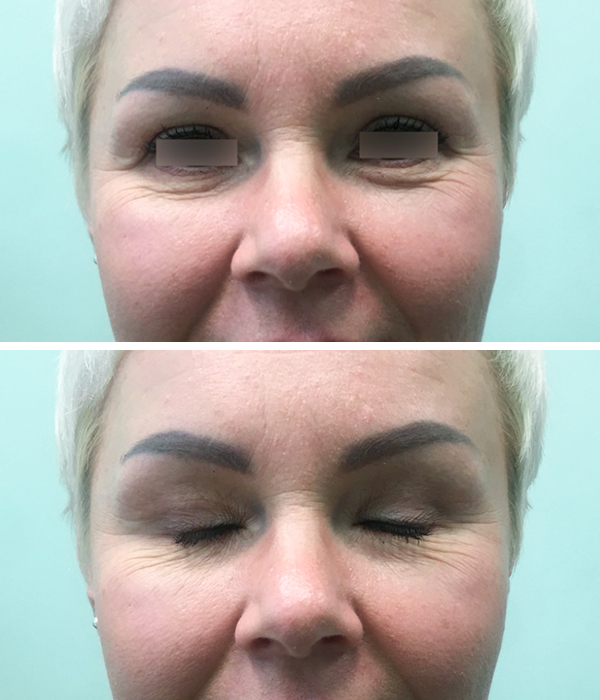 Рис. 2 б. Фото пациентки через 4 месяца после проведения операции
Рис. 2 б. Фото пациентки через 4 месяца после проведения операцииЗаключение
Показанные клинические случаи и результаты лазерной хирургии посредством системы SmartXide2 продемонстрировали ощутимое сравнительное преимущество данного метода над классическим хирургическим методом за счет лучшей эстетичности, сокращения времени реабилитации, меньшей травматизации тканей, отличной заживляемости раны и, как следствие, высокого процента удовлетворенности процедурой доктора и пациента.
Таким образом, считаю клинически целесообразным и экономически оправданным внедрение в медицинскую практику рассмотренной лазерной технологии. Уверен, что динамичное развитие лазерных технологий уже определило большое будущее за лазерной хирургией.
полная операция с комментариями (не для слабонервных) / Клиника офтальмологии доктора Шиловой corporate blog / Habr
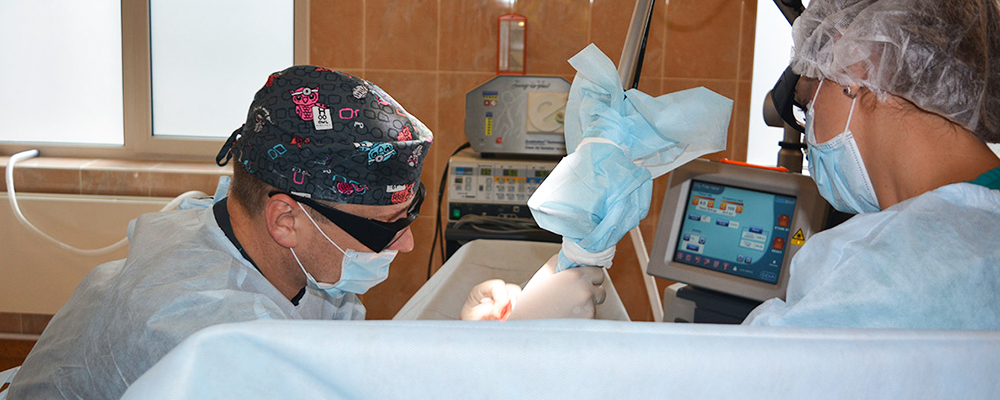
Сейчас я буду показывать то, что обычно врачи никогда не показывают пациентам. Точнее, показывается это всё в виде красивого рендера, из которого никак не следует, что прямо в вашей роговице будет пару минут торчать железка. К счастью, вы этого не почувствуете из-за обезболивающей премедикации, не узнаете и не запомните, потому что железка будет не в фокусе.
Введение шпателя для рассекания оставшихся тканевых мостков в разрез роговицы после лазерной обработки, но до извлечения лентикулы
Поехали. Итак, смотрите видео, а я покажу стопкадры с комментариями. Это реальная операция на пациенте в немецкой клинике, запись сделана на устройство вроде «чёрного ящика» аппарата VisuMAX. В данном случае пациент дал согласие на использование записи для учебных целей, обычно доступ к таким записям строжайше ограничен.
Сначала коротко повторим прошлый пост про то, почему вообще надо вырезать вот такую линзу внутри глаза, а потом её доставать:
Если очень коротко, операции прошлых поколений формировали вот такую неприятную «крышку», которая при заживлении держалась на одном лоскуте. Снимается «крышка»-флэп, выпаривается линза, «крышка» кладётся обратно.
Инвазивность высокая, «крышка» не приживается полностью никогда (при травмах и физических нагрузках иногда отрывается с крайне неприятными последствиями), для разрезов используется очень много тепла, проходящего внутрь тканей глаза, сильно повреждается боуменова мембрана как резом, так и тепловыми фронтами.
Идея следующего поколения — вырезать линзу прямо внутри роговицы, а потом доставать её через тоненький разрез без вот этой «крышки». Эффект возможен, поскольку лазеры позволяют фокусироваться внутри ткани, а не на её поверхности. То есть можно выполнять разрез вот по такой схеме:
Теперь смотрим рендер операции:
Сначала нижняя поверхность линзы внутри роговицы, потом верхняя, потом небольшой разрез сбоку — и вынимаем линзу пинцетом.
Это то, что покажет вам любая клиника, чтобы вы не пугались. Реальная операция выглядит вот так (теперь телеметрия):
Сначала пациента просят смотреть на мигающую зелёную лампу. Лампа не просто горит, а именно мигает затем, чтобы человек ловил её в фокус достаточно часто. Глаз делает невероятное количество микродвижений-саккад в секунду, но именно такой темп позволяет хирургу чуть позже произвести правильный захват глаза.
Вот здесь видно тампон в расфокусе (на видео он движется с левой стороны глаза) — это хирург ещё раз протирает поверхность, чтобы застраховаться от микросгустков жира, плавающих по ней. Вторая цель этого касания — проверить, как прошла премедикация. Пациент должен ответить, почувствовал ли он что-то. Почувствовать он ничего не должен, нервы уже отключены тетракаином.
Вот захват приближается к глазу, это хорошо заметно по появлению ближе к зоне резкости радужки:
Выполняется центровка и фиксация пневмозахвата. Сам момент захвата можно увидеть по лёгкому вращению глаза, и этот эффект очень важно контролировать при коррекции астигматизма, ведь поворот на 30 градусов сводит на нет всю операцию для случая астигматизма. Поэтому хирург корректирует центровку.
После успешного захвата мы переключаем диапазон наблюдения из видимого в инфракрасный, чтобы контролировать процесс и не слепить пациента:
Медленно расширяющееся кольцо от краёв глаза к центру — это миллионы микроимпульсов фемтолазера, которые формируют рез по верхней поверхности линзы-лентикулы внутри роговицы. Поверхность роговицы не прорезается. Напомню, главный эффект — испарение нескольких клеток внутри слоя роговицы, а затем освобождение относительно большого количества газа, мягко раздвигающего ткани.
Нижняя поверхность линзы закончена:
Второй круг, который расширяется от центра глаза к краям — это верхняя поверхность линзы, которая также режется внутри слоя роговицы, без прямого «пробивания» поверхности:
Примерно на 01:02 происходит формирование разреза через поверхность роговицы к вырезанной линзе-лентикуле, но на видео это крайне сложно разглядеть. Через этот разрез линза будет доставаться.
Теперь переключение вида (и конец видео с лазера) — пациент из-под управления ЧПУ отдаётся под руки хирурга (фактически он перемещается под аппаратом из-под лазера ближе к рукам врача). Первый шаг — смочить глаз:
Переключение объектива микроскопа, фиксация глаза, чтобы он не дёргался, пинцетом. Это защип, но пациент его не чувствует (из-за обезболивания) и даже не видит пинцет толком (точнее, видит руку хирурга над своей головой):
Разрез для извлечения лентикулы аккуратно разделяется инструментом — шпателем:
Вот это очень интересное место, первым маленьким шпателем выполняется разделение сначала верхнего края линзы и окружающих тканей, а потом нижнего края линзы (на кадре ниже):
Шпатель движется малозаметными рывками — это сопротивление микроспаек, возникающих из-за дискретной структуры разреза, кое-где отдельные волокна не «разлеплены», и их нужно раздвигать. Просто так дёрнуть лентикулу за край нельзя, она может зацепиться, поэтому всегда делается полный проход шпателем по поверхности, чтобы в полость между верхним краем линзы и роговицей и нижним краем линзы и роговицей вошёл воздух. Самая страшная часть выглядит так:
Рука хирурга при этом лежит локтем на специальном упоре, а запястьем упирается на лоб пациента. Шпатель сконструирован так, что даже если хирурга толкнуть (несильно) или пациента отвлечь громким хлопком, то глаз не будет повреждён. Однако все подобные факторы должны строго исключаться.
Итак, линза разделена и готова для извлечения изнутри роговицы. Хирург берёт пинцет и цепляет лентикулу:
Всё. Можно на этом и закончить, но нужно ещё промыть глаз. Вот тут видно, как работает подача жидкости:
Следующая стадия — подача физраствора прямо внутрь образовавшейся полости внутри роговицы:
Как видно дальше, он позже вытечет через тот же разрез, через который была удалена лентикула. Ранее делался второй разрез напротив первого (на другом полюсе глаза), чтобы удалять эту жидкость, но выяснилось, что необходимости в этом нет. Тем более, чем меньше разрез, тем лучше.
Разглаживание во избежание микроскладок:
Затем — снятие фиксирующих плёнок и финал. Можно моргнуть пару раз. Пациент отдыхает несколько секунд, а затем медленно встаёт и идёт в коридор. В каждой клинике в конце коридора висят часы для контроля. Дальше — диалог, чтобы успокоить волнующегося пациента:
— Который час вон там?
— Шесть минут двенадцатого.
— А вы раньше с такого расстояния часы бы различили?
— Ой. Точно.
— Ну вот, всё в порядке.
Пациент успокаивается и отправляется отдыхать. Через 2-3 часа глаз уже ничего не чувствует. Нельзя читать, писать, использовать телефон или планшет-ноутбук день-другой, чтобы способствовать быстрому заживанию (ведь чтение — это «джоггинг» для глаз, потом нельзя в жёсткую сауну или бассейн две недели (пока полностью не заживёт разрез для удаления лентикулы, чтобы не попала инфекция). И всё.
Надеюсь, вы ещё не убежали в ужасе, когда увидели шпатель. Несмотря на пугающее, отмечу, что это одна из самых простых операций. Собирание глаза по кусочкам после ДТП с выниманием осколков стекла и другими побочными прелестями на несколько часов либо точнейшая мануальная работа микроскальпелем куда сложнее и напряжённее.
На вопросы, как именно работает пневмозахват, как удаётся точно вырезать линзу нужной формы и диаметра, что происходит с тканями роговицы на границе реза, и почему вообще такие сложности с вырезанием линзы внутри глаза (и почему это безопаснее всего). Плюс то, как готовится операционная, как хирург успокаивает пациента, как выполняется премедикация, какая есть защита от непредвиденных ситуаций (перебоев питания, проезжающего мимо грузовика) и так далее я отвечу следующим большим постом. И про обещанное сравнение линз и операций тоже позже. Всё это — отдельные темы для обсуждения, и про них чуть позже, увы, много писать не выходит. В первом посте в обсуждении многие темы поверхностно затронуты.
Оборудование операционной для коррекции зрения
Это фотоэкскурсия, дальше будет 70 фотографий из двух операционных блоков для лазерной коррекции зрения.
Разные варианты векорасширителей:
Упаковка с одноразовым лезвием, которое заправляется в микрокератом для формирования клапана в роговице при механических (не лазерных) операциях:
А вот головка микрокератома, куда лезвие вставляется:
Вот такой наборчик «аксессуаров» для рабочей части — он многоразовый:
Моторчик для приведения в движение головки с лезвием:
А это консоль с индикатором параметров работы:
А теперь сравним с инструментами для SMILE. Вот так выглядит одноразовая упаковка с конусом, там же — вакуумная трубка для отвода газа:
Шпатель для сепарации в масштабе:
Самый первый шпатель сделал доктор Блум, который вместе с Вальтером Секундо изобрёл технологию. Сегодня им не пользуются, потому что он был островатый, так как тогда резали на других частотах, не было современных лазеров. Сейчас рез куда чище, и уже есть порядка 10 различных модификаций инструментов. Самый популярный — по Чансу (это таиландский хирург, который делает дикое количество операций, 8 или 10 тысяч один за год, у него клиника «конвейерного» типа в Бангкоке). Есть интересные российские, в частности, шпатель Костина из Екатеринбурга. Огромной разницы между ними нет. Вальтер пользуется вот таким как на фото, это его авторская модель именно под его руку. Напомню, вот так это выглядит (на фото ниже во время операции шпатель Чансу):
Микрогубки из гидрофильного материала, которые кого-то напугали во втором посте (это не лезвия):
То, что пациент забирает домой после коррекции:
Вот так выглядит одноразовый скальпель для роговицы, который практически не нужен (его функции выполняет лазер):
Для пациента начинается всё после коридора с вот такой койки. Здесь пациент немного лежит до коррекции (чтобы успокоить моторику) и отдыхает пару часов после.
На стене две кнопки: вызов сестры и SOS. SOS включает тревогу по всем помещениям, кроме других операционных.
На стене картинки для разглядывания:
Есть видеокамера наблюдения за состоянием пациента в палате. Изображение транслируется на пост медицинской сестры, чтобы мы всегда знали, что происходит с пациентом. Особенно она нужна для тех длинных операций, после которых пациент просыпается после наркоза не совсем в нормальном состоянии сознания.
Первая операционная с эксимерным лазером:
Кушетка (точнее, операционный стол, он же — смарт-кровать):
Эксимерный лазер:
Он же «лицом» к пациенту (эта часть располагается под микроскопом):
Вот так лазер виден хирургу:
В этот микроскоп ведётся наблюдение. Данные также выводятся для ассистента на экран на стене операционной.
Под рукой у врача — кнопка остановки лазера:
Это ключ на старт и заранее пересчитанный профиль для операции:
Виброзащита:
Педаль управления лазером (во время операции она находится под ногой врача):
Вакуумный отсос для удаления избытка влаги и жировых выделений желёз:
Рукоятка управления эксимерным лазером:
Диоптриметр для оценки калибровки лазера (лазер выжигает специальные тестовые калибровочные линзы различных диоптрий).
Вот такие карты, на них лазер прожигает линзы разной диоптрийности:
Положенные предупреждения:
Карточка с лицензией (на фемтосекундном лазере лицензия уже полностью цифровая):
Угадайте, кто под ней:
Клавиатура почти обычная, но с трекпадом — нужна для работы с интерфейсом. До самой работы лазера это Windows-программа, дальше — прошивка лазера.
Тестирование:
Вот здесь видна разметка для прицеливания:
Активируется нажатием клавиши слева вверху у джойстика. Она позиционируются на роговицу пациента во время операции — она же «мигающая красная точка» (интенсивность её можно менять) во время операции эксимерлазерной коррекции:
В левом ряду три кнопки. Левая верхняя включает красную линию, которая проецируется на лицо пациента для укладки в строго продольном положении без бокового смещения. На боковой стороне головного конца имеется метка для позиционирования на уровне глаз. Таким образом происходит точная укладка головы по оси X-Y. Вакуумная подушка достаточно жёстко фиксирует голову в выбранном положении. С левого на правый глаз положение меняется нажатием кнопки ассистентом на ложе кровати. Далее хирург приступает к центровке глаза под микроскопом.
Левая нижняя кнопка управления захватом изображения радужки — кнопка управления ирис-регистратора (контролирует положение X-Y). Левая средняя — кнопка управления циклоторсией (ротацией глазного яблока вокруг своей оси при изменении пациентом положения с вертикального на горизонтальное).
Справа кнопки регуляции освещённости операционного поля — прямого и бокового освещения. Часто хирург почти полностью выключает освещение операционного поля, так как камера слежения за индивидуальной картой радужки работает в инфракрасном диапазоне и «рисунок» радужки и зрачок в темноте определяются прибором быстрее.
Вот основное положение стола во время операции:
Он подстраивается по высоте и другим параметрам:
Экран на лазере совершенно обычный:
Эксимерные лазеры крайне чувствительны к перепадам температур и влажности в операционной. Также никаких эфирных и спиртовых растворов в эксимерлазерной операционной не должно быть. Положен постоянный контроль термометрами и гигрометрами.
Карточка лицензии:
Газовые баллоны для лазера:
Средство рауш-наркоза Сервисный набор инструментов. Всё в лазере крепится по месту использования, например, снизу есть отвёртка на держателе, которая нужна для болтов на нижней панели:
Экран для ассистента:
Всё, с эксимерным пока закончили. Переходим в следующую операционную, где стоит фемтолазер VisuMax. Он используется для формирования флэпа при femtoLASIK (затем пациент переходит в описанную выше операционную под эксимер), для лазерной коррекции FLEX и SMILE (тогда никуда перемещаться не надо — всё делается под одним лазером), а также для любых роговичных рассечений, например, для внутрироговичных колец при кератоконусе). В случае общего производителя фемтолазерной и эксимерлазерной установки в некоторых случаях используют одну кровать под два прибора, тогда её перемещают в процессе выполнения разных этапов.
Итак, вот это VisuMax:
Лазер создан впечатлять видом — эргономику Цейс заказывал в дизайн-бюро Mercedes (у этого лазера и дизайн, и стоимость — как у Maybach, там не только сделали очень удобным управление, но и поработали с внешним видом). Это мотивировалось очень просто: если пациент чувствует, что садится в «Майбах», то он как-то более спокоен, чем при посадке в нечто из фильмов про «Чужого».
Эргономика действительно замечательная, всё под рукой (точнее, руками):
Клавиатура тут почти не нужна, экраны сенсорные:
Педаль чуть другая. С момента её нажатия лицензия на конкретную операцию считается использованной:
Посадка вот такая:
Обратите внимание, насколько всё под руками.
Что касается человеческого фактора — для успешной хирургии есть пара важных моментов:
- Хирург должен иметь стереоскопическое, т. е. объёмное зрение, так как здесь важно видеть трёхмерно — рез криволинейный, имеет глубину.
- Нужно ориентироваться ещё на звук и световую индикацию — каждый режим работы лазера и каждая ситуация имеют свою индикацию.
- Это тот тип хирургии, когда в момент операции хирург остаётся один на один с пациентом — в этот момент только он контролирует его поведение
Далее — о программном обеспечении. Интерфейсы у VisuMax чуть поновее, чем на эксимере, но всё так же на «банкоматной» Windows.
Во время настройки на экране слева отображается показывается анимация того, как будут размещаться резы в роговице и их геометрия.
Лазер страхует от ошибок: если что-то в совокупности параметров выпадает за best practice, выдаются предупреждения. И да, конечно, последние 100 операций пишутся на «чёрный ящик» со всей телеметрией и видео.
А вот конус, который приходит вместе с лицензией (это сменная часть, прилегающая к глазу):
Вот так он встаёт на глаз во время операции (кстати, это мягкая игрушка, которую мы даём пациенту в руку, чтобы отвлечь моторику):
Вот здесь конус располагается на лазере:
Пока всё. В первом посте можно прочитать про то, как на физическом уровне работает фемтосекундный лазер ReLEx SMILE и как делается рез внутри роговицы, во втором — посмотреть на телеметрию реальной операции, в третьем — какие бывают операции, в четвёртом — разные вопросы про виброзащиту, что будет если тряхнуть головой и так далее, в пятом конкретно FAQ про ReLEx SMILE в России, и в шестом про побочные эффекты и диагностику. Это седьмой, надеюсь, теперь у вас есть целостное представление о том, как это всё выглядит. Дальше мы поговорим про другие методы коррекции (в частности, про интраокулярные линзы), сравнение контактных линз и коррекции, а чуть позже я расскажу про другие заболевания глаза.
Лазеры — зрению
Сергей Вартапетов, Иван Щербаков
«Природа» №6, 2016
 Сергей Каренович Вартапетов — кандидат физико-математических наук, директор Центра физического приборостроения ИОФ РАН. Область научных интересов — газовые и твердотельные лазеры, лазерные технологические системы, медицинские лазерные системы. |
 Иван Александрович Щербаков — академик, академик-секретарь Отделения физических наук РАН, профессор, доктор физико-математических наук, директор ИОФ РАН, заведующий кафедрой лазерной физики Московского физико-технического института. Награжден золотой медалью имени А. М. Прохорова РАН (2013). Занимается лазерной физикой, спектроскопией, нелинейной и квантовой оптикой, медицинскими лазерами. |
Первой отраслью медицины, в которой нашли применение лазеры, стала офтальмология. Глаз, будучи оптической системой, оказался идеальным объектом для бесконтактного воздействия лазерного луча. Лазерная микрохирургия глаза имеет целый ряд преимуществ по сравнению с традиционными механическими манипуляциями: отсутствие прямого контакта инструмента с тканью, стерильность в ходе самой операции и стерилизующее воздействие лазерного излучения на ткани; выполнение хирургических процедур внутри глаза без его вскрытия; возможность доставки излучения внутрь глаза с помощью волоконно-оптических систем; избирательное действие и точная дозировка воздействия на ткани — от коагуляции тканей до их абляции и разреза.
В офтальмологии эпоха лазерных операций отсчитывается от 1968 г., когда аргоновый лазер с длиной волны 531 нм был использован для коагуляции отслоившейся сетчатки. «Приваривание» сетчатки и в настоящее время — один из самых отработанных и широко практикуемых методов лазерного вмешательства. Впоследствии аргоновый лазер был заменен на более современный — с диодной накачкой. Другое заболевание глаза, при котором активно используется излучение лазера, — глаукома, характеризующаяся накоплением жидкости в глазу. Лазер играет роль своеобразной иглы, обеспечивая создание каналов для оттока жидкости. Но самое широкое применение лазерная микрохирургия нашла в коррекции рефракции. Оптическая сила глаза как линзы (т.е. величина, обратная фокусному расстоянию) в основном (более чем на 70%) определяется кривизной роговицы. Следовательно, изменяя форму последней, можно влиять на рефрактивные характеристики зрения. Об использовании лазеров для этой цели мы и расскажем подробнее.
Средства и методы
Оптимален для абляции роговицы, как было установлено в работе [1], эксимерный ArF-лазер с длиной волны 193 нм. Тут необходимо сделать небольшое отступление и напомнить, что эксимерные лазеры — это газовые лазеры, излучение которых возбуждается электрическим разрядом или электронным пучком. Идея о возможности генерации молекулярными соединениями, существующими только в возбужденном состоянии (что и определило название лазера — excited dimer, сокращенно excimer), была впервые высказана и реализована в 1971 г. группой ученых из Физического института имени П. Н. Лебедева, возглавляемой Н. Г. Басовым. А первый коммерческий эксимерный лазер был создан в СССР в 1984 г. под руководством А. М. Прохорова в Центре физического приборостроения Института общей физики.

Эксимерные лазеры генерируют излучение в УФ-области спектра (193–350 нм) и имеют чрезвычайно высокий коэффициент усиления, что делает их не совсем классическими: излучение формируется в оптическом резонаторе за счет всего нескольких проходов. Это, в свою очередь, приводит к генерации коротких импульсов (их характерная длительность ≈10–20 нс, что соответствует трем-четырем проходам по резонатору длиной ~100 см), а также к тому, что излучение не имеет классической модовой структуры. Форма выходного пучка эксимерных лазеров, как правило, прямоугольная, а пространственное распределение интенсивности в пучке неоднородное. Эти «недостатки» эксимерного лазера с лихвой компенсируются тем, что только эксимерные лазеры позволяют генерировать мощное излучение в УФ-области спектра.
Коротковолновое излучение ArF-лазера с энергией кванта 6,4 эВ, воздействуя на роговицу, приводит (при минимальном термическом воздействии!) к прямой фотодиссоциации роговичной ткани с образованием микро- и нанометровых фрагментов. Эти фрагменты аблируют (т.е. испараются) с поверхности с очень высокими, практически сверхзвуковыми, скоростями.
Луч эксимерного ArF-лазера действует на роговицу поистине ювелирно: глубина поглощения излучения составляет ≈0,2 мкм при плотности энергии в импульсе 160 мДж/см2. Процесс фотоабляции носит пороговый характер — фотодиссоциация роговицы начинается только после превышения энергетического порога (~40 мДж/см2).
Технология коррекции зрения основана на профилировании наружной поверхности роговицы. Если ткань удаляется в центральной зоне, роговица становится более плоской, что исправляет близорукость. Если же испарить периферическую часть роговицы, то ее центр получится более «крутым», что позволяет корригировать дальнозоркость. Дозированное удаление в разных меридианах роговицы дает возможность избавиться от астигматизма.
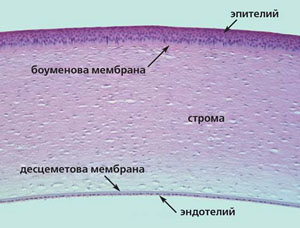

Роговица имеет толщину около 600 мкм и состоит из пяти слоев: наружного (эпителия), боуменовой мембраны, стромы, десцеметовой мембраны и внутреннего (эндотелия). Основной объем, около 500 мкм, приходится на строму (рис. 1).
При лазерной коррекции удаляется часть стромы в оптической зоне глаза, т.е. в той части, с которой свет попадает в зрачок и формирует изображение на сетчатке. В общем случае толщина испаренного слоя роговицы h для достижения рефракционного эффекта δD (в диоптриях D) связана с диаметром оптической зоны OZ следующим соотношением: h (мкм) = [(δD)/3]×OZ2 (мм). Так, для оптической зоны 6 мм нужно удалить 12 мкм роговицы при коррекции зрения на одну диоптрию. Вообще операция по лечению регулярной рефракционной патологии считается успешной, если некорригированная острота зрения после нее не хуже или выше дооперационной максимально корригированной остроты зрения. Иными словами, если пациент в очках имел остроту зрения 1,0, то после операции она без очков должна быть 1,0 или выше. Напомним, что острота зрения 1 соответствует возможности глаза различать объекты с угловым расстоянием между ними в одну угловую минуту.
Современная коррекция зрения методом лазерной абляции роговицы реализована несколькими способами. Основные методики — это фоторефрактивная кератэктомия (ФРК), трансэпителиальная ФРК, лазерный кератомилез in situ (ЛАCИК/LASIK — Laser-Assisted in SItu Keratomileusis), Фемто-ЛАCИК.
Смысл ФРК заключается в испарении склеры в оптической зоне для изменения ее кривизны и, соответственно, оптических свойств. При этом эпителий удаляется либо механическим способом, либо непосредственно лазером (трансэпителиальная ФРК).
По технологии ЛАСИК эпителий вместе со слоем стромы общей толщиной 120–160 мкм удаляется лишь временно, а лазер воздействует непосредственно на строму роговицы. Операция состоит из двух этапов. На первом этапе создается роговичный клапан (лоскут) (строма + эпителий) с характерным диаметром 10 мм и толщиной 120 мкм. Клапан создается либо механическим инструментом (микрокератомами различной конструкции с применением электрического или пневматического привода), либо по новой технологии с использованием фемтосекундного лазера (Фемто-ЛАСИК). Далее получившийся лоскут специальным инструментом отделяется от основной части роговицы так, чтобы он не закрывал оптическую зону. На втором этапе операции роговица пациента подвергается воздействию эксимерного лазера, с помощью которого формируется требуемая кривизна поверхности, после чего роговичный клапан возвращается на место. Поскольку в данном случае нет необходимости удалять внешний слой эпителия, реабилитация после лазерной операции существенно ускоряется.
Формирование роговичного лоскута с помощью фемтосекундного лазера предпочтительнее, поскольку воздействие на роговицу происходит на заданной глубине, а все слои роговицы, включая эпителий, вне зоны фокусировки лазерного излучения остаются незатронутыми. Толщина лоскута здесь получается более равномерной, чем при обычном ЛАСИКе, поверхность раздела более гладкой, а сам лоскут может быть сделан тоньше 90 мкм, что существенно при проведении операций пациентам с тонкой роговицей.
Первые коммерческие эксимерные офтальмохирургические установки использовали лазеры с большой энергией в импульсе (200–400 мДж) и с пучками, характерные размеры которых равны диаметру области обработки оптической зоны роговицы (≤9 мм). Профиль интенсивности на роговице глаза формировался профилированными вращающимися или сменными диафрагмами. В первой такой российской установке [2] была воплощена оригинальная оптическая схема с применением гауссова гомогенизатора пучков (об этом подробнее будет сказано ниже). Такой метод формирования обеспечивал совершенно гладкую послеоперационную поверхность роговицы. Однако технические возможности при работе с широкоапертурными пучками существенно ограничены при коррекции дальнозоркости и астигматизма. Позже было предложено формировать произвольную послеоперационную поверхность с помощью сканируемого по поверхности роговицы лазерного пучка малого диаметра (размер лазерного пятна 0,7–1,2 мм). Такая технология известна как «летающее пятно» (flying spot). При каждом импульсе ArF-лазера абляции подвергается малый (менее 1 мкм в толщину и менее 1 мм в диаметре) слой роговицы, что позволяет с большой точностью сформировать рассчитанную послеоперационную поверхность.
Самый современный тип лазерных офтальмохирургических операций — персонализированная коррекция зрения. Отличие ее от прежних методик состоит в том, что исправляются не только сфероастигматические отклонения от нормы, но и нерегулярные, уникальные для данного пациента рефракционные дефекты, которые не могут быть скорректированы подбором очков. Персонализированная коррекция осуществляется на основе данных кератометрии (измерения формы роговицы) и аберрометрии (измерения аберраций всего оптического тракта глаза). Из-за того что при таких операциях приходится наносить на роговицу более мелкие элементы рельефа, потребовался новый уровень точности и стабильности лазерной коррекции формы роговицы. В частности, необходимым элементом стала система слежения за движением глаза в ходе операции, вносящая соответствующие поправки в режиме реального времени. Ключевым параметром системы слежения служит ее латентный период — время от момента смещения глаза до учета этого смещения в ходе операции.
Человеческий глаз — очень динамичная структура, в которой протекает множество процессов различных пространственных и временных масштабов. Например, движения глаза в ходе операции должны рассматриваться во временном масштабе миллисекунд, тогда как послеоперационные адаптационные процессы могут занимать несколько месяцев. Каждый из этих процессов может оказать решающее влияние на качество послеоперационного зрения и потому должен быть учтен при проектировании офтальмохирургического оборудования. И разумеется, столь точные глазные операции невозможны без исчерпывающей исходной информации и контроля за результатами, для чего существует целый арсенал диагностических средств, которого мы коснемся вкратце.
От начальных условий до проверки решения
Основные методы диагностики и послеоперационного контроля включают следующие процедуры.
Определение субъективной рефракции (ручной подбор очков) позволяет установить параметры коррекции регулярных искажений рефракции.
Кератотопография (кератометрия) выдает базовые выходные данные по форме (карте высот) наружной поверхности роговицы глаза, на основе которой рассчитывается кривизна поверхности в каждой точке роговицы. Современные приборы для кератометрии основаны на анализе искажения отраженных от роговицы спроецированных на нее концентрических кругов. Таким образом, рефракционные свойства глубоких отделов глаза кератометрия никак не отражает.
Аберрометрия дает информацию об аберрациях, вызываемых не только дефектами роговицы, но и всем оптическим трактом глаза. Для измерения этих аберраций в точке пересечения оптической оси глаза и сетчатки формируется малоразмерный инфракрасный источник света, получаемый направлением узкого луча вдоль оптической оси глаза. Выходящий при этом из зрачка глаза волновой фронт (в виде разложения по полиномам Цернике [3]) и представляет собой искомые данные аберрометра. Если глаз, сфокусированный на бесконечно удаленный объект, покидает плоский волновой фронт, то в этом идеальном случае никакой оперативной коррекции не нужно.
Таким образом, аберрометрия дает не геометрические, а оптические данные, причем характеризующие не только роговицу, но и весь оптический тракт глаза в целом. Правда, область определения ее данных не выходит за пределы зрачка на момент измерения, тогда как данные кератометрии не имеют такого ограничения.
Успех операции — высокое качество послеоперационного зрения — зависит от многих факторов. Недостаточный учет даже одного из них может резко снизить качество жизни после операции. Перечислим важнейшие.
Ограниченность толщины роговицы. Средняя толщина роговицы составляет 550 мкм, но может варьироваться в зависимости от расы, национальности, пола, возраста и т. д. В отличие от большинства тканей организма, роговица не регенерируется и потому является невосполнимым ресурсом. Слишком тонкая (менее 250–300 мкм) остаточная роговица может выпячиваться под воздействием внутриглазного давления. Поэтому при коррекции рефракционных аномалий высоких степеней следует планировать меры по экономии испаряемой роговицы.
ЛАСИК-клапан и ФРК-эпителизация. Эпителиально-роговичный лоскут (клапан), возвращаемый на место после операции ЛАСИК, и регенерация эпителия после ФРК-операций оказывают сглаживающее влияние на послеоперационную поверхность, что, с одной стороны, восстанавливает гладкость обработанной роговицы, но с другой — снижает точность формирования мелких деталей на роговице, уменьшая эффективность коррекции нерегулярных аномалий рефракции.
Конечность размера лазерного пятна. Из-за этого желаемая послеоперационная форма роговицы не может быть реализована с абсолютной точностью. Но уменьшение диаметра пятна вызывает увеличение числа импульсов лазера (обратно пропорционально квадрату диаметра пятна), необходимых для операции, и удлинение самой операции, что нежелательно по клиническим соображениям.
Интраоперационная температура роговицы. Перегрев роговицы в ходе операции может вести к ухудшению ее оптических характеристик.
Позиционирование операции относительно оптической оси глаза, торсионная ориентация. Центр зоны операции должен совпадать с оптической осью глаза, а горизонтальная ось операции — с таковой в момент диагностических измерений. Это особенно важно при персонализированных операциях, в которых профиль абляции включает элементы небольшого размера.
Подвижность и нестабильная выраженность анатомических структур глаза. Геометрическая привязка (как сдвиговая, так и торсионная) производится по анатомическим структурам глаза — лимбу (границе между радужной оболочкой и склерой) и радужке. Вид лимба может зависеть от условий освещения, радужка может неодинаково и нерегулярно сокращаться во время диагностических измерений и в ходе операции.
Стабильность энергии лазерного импульса. Чем выше стабильность энергии лазерных импульсов, тем выше вероятность достижения заданных послеоперационных значений остроты зрения.
Соотношение размеров зрачка глаза и зоны абляции. Если зона абляции существенно меньше зрачка, качество зрения может резко снизиться. Особенно эта проблема актуальна для вечернего и ночного зрения, т.е. в условиях, когда зрачок расширен.
Качество переходной зоны. Такая зона — плавный переходный участок между частью поверхности роговицы, форму которой планируется изменить, и периферической зоной, которая не подвергается воздействию лазера. Эта зона должна обеспечивать, помимо математической гладкости, отсутствие высоких значений первых и вторых пространственных производных профиля абляции в пределах всей области действия лазера. Наличие резких изломов и врезов приведет к нестабильным результатам операции, так как будет вызывать физиологическое сглаживание профиля абляции, которое при ЛАСИК-операциях происходит за счет действия клапана, а при ФРК — за счет избыточного наращивания роговичного эпителия.
Возможность внезапного прерывания операции. В случае резких изменений самочувствия пациента операция должна быть остановлена. Это редкое, но не исключительное событие. Поэтому важно производить абляцию в такой последовательности, чтобы в случае прерывания операции пациент не остался с роговицей, имеющей неправильную форму, что затруднило бы завершение оперативного лечения.
Работают эксимерные лазеры
Уже спустя несколько лет после предложения американских ученых использовать эксимерный лазер для коррекции зрения [1], в 1987–1988 гг., в Германии, США и Советском Союзе (в Межотраслевом научно-техническом комплексе «Микрохирургия глаза» — МНТК МГ) были проведены первые клинические фоторефрактивные операции.
В МНТК МГ в 1986 г. была создана не имеющая аналогов в мире эксимер-лазерная офтальмологическая установка «Профиль» с уникальной системой формирования гауссова профиля излучения. Гауссов профиль сначала формировался за счет прохождения излучения через кювету, образованную плоским и сферическими окнами и наполненную поглощающим газом. Впоследствии газовая кювета была заменена оптическим гомогенизатором на основе шероховатой кварцевой пластины. При гауссовом профиле интенсивности излучения, воздействующего на глаз, автоматически формировалась параболическая форма роговицы, что в оптике соответствует безаберрационой оптической поверхности. Данный принцип лег в основу первой отечественной коммерческой системы «Профиль-500» (рис. 2), разработанной в 1995 г. совместно Центром физического приборостроения Института общей физики РАН (ЦФП ИОФ РАН), носящего в настоящее время имя академика А. М. Прохорова, и Межотраслевым научно-техническим комплексом «Микрохирургия глаза», носящим ныне имя академика С. Н. Федорова.

Именно Святослав Николаевич Федоров и Александр Михайлович Прохоров были инициаторами разработки и производства в России коммерческих систем для рефракционной хирургии. В последующем оба коллектива вместе создали для такой хирургии несколько поколений эксимерных лазерных систем, которые были уже основаны на принципе «летающего пятна». В системе последнего поколения «Микроскан Визум» (рис. 3) обеспечен учет всех 10 перечисленных выше факторов, влияющих на качество проводимых операций.
Основные особенности системы «Микроскан Визум», которые определяют предсказуемость проведения операций и высокое качество послеоперационной остроты зрения в дневное и ночное время, состоят в следующем.


Обеспечена высокая частота повторения импульсов. Используется эксимерный лазер собственной разработки, излучающий импульсы с частотой повторения 500 Гц, что гарантирует малое время операции (5 с на 1 D).
Выбран оптимальный размер лазерного пятна. При математическом моделировании и в клинической практике были опробованы размеры лазерного пятна от 0,7 до 1,14 мм. Было установлено, что пятно размером 0,9 мм оказывается достаточно малым для качественного выполнения как стандартных, так и персонализированных операций. Если уменьшить данный параметр, это удлинит операцию, но существенно не повлияет на клинические результаты.
Оптимизирована форма профиля энергии в лазерном пятне. В силу особенности пространственной формы исходного импульса во всех зарубежных коммерческих системах излучение эксимерного лазера преобразуется системой гомогенизации и формируется гауссов профиль для сканирующего лазерного пучка. Наши исследования, однако, показали, что в сканирующих системах эффективнее работает пучок с практически плоским распределением интенсивности. Размер шероховатостей на роговице для «плоского» пучка получается в 2,3 раза меньше, чем для гауссова.
Реализована высокая стабильность энергии лазерных импульсов. Для предсказуемости и повторяемости результатов операции среднеквадратичное отклонение энергии в лазерных импульсах должно быть как можно меньше. Кратковременная нестабильность средней энергии лазерного излучения эксимерного лазера, характеризующая точность проводимой коррекции, у нас не превышает 1% (среднеквадратичное отклонение), что соответствует ошибке 0,1 D при коррекции 10,0 D.
Разработана скоростная система слежения за положением глаза. Как уже говорилось, глаз в ходе операции не может быть жестко фиксирован и потому непрерывно совершает быстрые неконтролируемые движения, как поступательные (амплитудой до нескольких миллиметров), так и торсионные (вращение глаза вокруг его оптической оси, амплитуда до десятков градусов). Эти движения требуют непрерывного автоматизированного отслеживания и внесения соответствующих поправок в ход операции, т.е. работы автоматической системы слежения. В установке «Микроскан Визум» реализована такая система, которая может отслеживать положение глаза по привязке либо к зрачку, либо к радужной оболочке или к лимбу (границе между радужной оболочкой и склерой). Латентное время системы слежения составляет менее 1 мкс.
Исключен перегрев роговицы. В ходе операции небольшая часть энергии лазерных импульсов переходит в тепло, что может вызвать патологические процессы (ожог, клеточные мутации). В установке реализован такой алгоритм сканирования лазерного пучка, при котором каждый следующий импульс направляется на роговицу на возможно большем расстоянии от предыдущего, что позволяет избежать накопления тепла и повышения температуры роговицы. Измеренное максимальное повышение температуры роговицы на частоте импульсов 500 Гц не превышает 4°C (до температуры менее 35°C). Его можно считать физиологически безвредным.
В итоге установка демонстрирует отличные клинические результаты по различным типам операций. Вмешательства всех типов, описанных в данной работе, широко применяются в клинической практике. Всего на эксимер-лазерных установках серии «Микроскан» за 20 лет эксплуатации выполнено более 500 тысяч операций. Среднее отклонение достигнутых послеоперационных результатов от планируемых значений в диапазоне от −1,0 до −8,0 D не превышает 0,25 D.
Подключаются фемтосекундные
По мере развития лазерной техники исследователи разрабатывали методы укорочения длительности лазерных импульсов. Прогресс в увеличении мощности лазера был достигнут в основном за счет сокращения длительности импульсов, а не увеличения самой энергии. Первые лазеры генерировали импульсы миллисекундного диапазона, а сейчас идет речь уже об импульсах длительностью в аттосекунды (10−18 с), что приближается к одному периоду колебаний световой волны! Даже незначительная энергия генерации, но сосредоточенная в столь коротком временном интервале, дает высокую интенсивность излучения. Так, в рассматриваемом здесь медицинском применении используется фемтосекундный лазер с энергией в импульсе около 2 мкДж при длительности около 200 фс, что при фокусировке излучения в пятно характерного диаметра около 2 мкм приводит к значению пиковой лазерной мощности более чем 1014 Вт/см2. Вообще, в настоящее время достаточно широкий класс фемтосекундных лазеров, твердотельных или волоконных, генерирует импульсы с энергией от единиц до сотен микроджоулей длительностью от единиц до сотен фемтосекунд. На их базе созданы уникальные системы с последующим усилением импульсов до интенсивности петаваттного уровня.
Первые эксперименты, в которых вещество обрабатывалось излучением фемтосекундных лазеров [4], показали практически полное отсутствие зоны теплового воздействия. В связи с этим такие лазеры могут быть эффективно использованы для прецизионной трехмерной обработки прозрачных материалов в микрометровых масштабах. Высокие интенсивности фемтосекундных импульсов приводят к сильному нелинейному многофотонному поглощению даже в материалах, прозрачных для используемых длин волн. В идеальном случае сфокусированный фемтосекундный импульс создает в объеме сферическую модификацию с диаметром в несколько микрометров (типично менее 2 мкм).
Такие особенности воздействия фемтосекундных импульсов, как возможность обработки внутриобъемных локальных областей без влияния на окружающие зоны, высокая степень локализации микромодификации и отсутствие зоны теплового воздействия, становятся определяющими при их использовании в медицине, в частности в офтальмологии. Применение в офтальмологии фемтосекундных лазеров расширяется стремительно. Основой технологии служит внутристромальная обработка роговицы, когда лазерный пучок остро фокусируется во внутренние слои роговицы и производится локальное их рассечение.
При этом возможны два подхода:
- использование лазера с относительной большой энергией в импульсе (более 1 мкДж) и относительно низкой частотой повторения (30–200 кГц), условно этот режим обозначается μJ/kHz;
- использование лазера с малой энергией в импульсе (менее 1 мкДж) и высокой частотой повторения (более 500 кГц) — так называемый режим nJ/MHz.
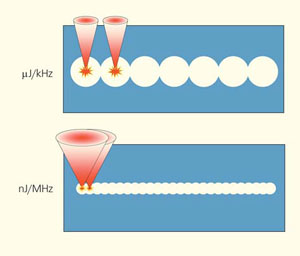

В зависимости от выбранного вида лазера и типа воздействия (нДж или мкДж) для реализации режима резания (расслоения) роговицы необходимы разные алгоритмы перемещения лазерного фокального пятна во внутренних слоях роговицы. В силу специфики физических процессов, имеющих место при различных лазерных параметрах, результаты обработки сильно зависят как от пространственного расположения, так и от последовательности воздействия (кумулятивный эффект) на данную область биоматериала. На рис. 4 схематично проиллюстрированы варианты такого взаимодействия и различия получаемых результатов — более узкий разрез и более гладкая конфигурация краев в случае nJ/MHz-режима с малым пятном фокусировки.
В настоящий момент фемтосекундные лазеры используются для большого количества операций различного типа (рис. 5).
Прежде всего это уже упоминавшаяся операция Фемто-ЛАСИК (рис. 5,а), в которой роговичный лоскут формируется как раз с помощью фемтосекундного лазера. Данный лоскут содержит в себе эпителий, который не подвергается воздействию лазера (уже эксимерного), что улучшает прогнозируемость результатов и послеоперационное восстановление.

Фемтосекундные лазеры незаменимы для формирования роговичных карманов (рис. 5,б) и роговичных тоннелей (рис. 5,в) в строме роговицы. При таком заболевании, как кератоконус, происходит истончение роговицы, уменьшение ее механической прочности, что, в свою очередь, приводит к существенной потере остроты зрения, вплоть до полной слепоты. Один из способов усиления механических свойств роговицы — введение внутрь нее специального укрепляющего раствора. Для этого с помощью фемтосекундного лазера в строме роговицы создается карман, в который раствор и вводится (такая операция называется «кросслинкинг»). Другой вариант: вне оптической зоны глаза создается роговичный тоннель, куда вставляются пластиковые укрепляющие кольца. Фемтосекундный лазер также используется для создания внутри стромы, на глубине около 300 мкм, небольших разрезов, ослабляющих механические характеристики роговицы в определенных направлениях, что приводит к механической релаксации и корректировке астигматизма глаза (рис. 5,г).
В принципе, с помощью только фемтосекундного лазера можно выполнять и полную коррекцию рефракции. При этом лазером в строме роговицы формируется лентикула с известной кривизной поверхностей, которая в дальнейшем извлекается через надрез в роговице. А для исправления астигматизма (или для доступа в переднюю камеру глаза) производятся проникающие и послабляющие надрезы роговицы. В данном случае лазер используется в качестве прецизионного хирургического ножа. При надрезе внутреннее давление глаза немного раскрывает края разреза, меняя таким образом кривизну роговицы в направлении, перпендикулярном ему.
Одна из самых распространенных операций в офтальмологии — замена хрусталика при катаракте. Излучение фемтосекундного лазера способно как разрушить помутневшее ядро хрусталика, так и осуществить капсулорексис, т.е. прецизионное вскрытие капсулы хрусталика для дальнейшего извлечения его ядра через получившееся окно, а также последующей надежной фиксации искусственного хрусталика в капсульном мешке.
С помощью фемтосекундного лазера производятся также операции по кератопластике (рис. 5,д). Для пересадки роговицы требуется, чтобы донорский материал и пациент были прооперированы на одной фемтосекундной лазерной системе, поскольку существуют высокие требования к форме и размерам донорского роговичного лоскута и роговичного ложа у пациента. Хирург с помощью фемтосекундного лазера вырезает в донорском материале требуемый лоскут, затем повторяет ту же операцию на пациенте, формируя роговичное ложе, помещает лоскут в ложе и наконец сшивает их. Поскольку формы донорского лоскута и ложа на глазу пациента повторены с высокой геометрической точностью, заживление происходит существенно быстрее, чем при механическом выкраивании лоскута и ложа.

Единственная в России фемтосекундная лазерная система «Фемто Визум» (рис. 6) разработана в ЦФП ИОФ РАН при поддержке Федерального агентства по науке и инновациям. В качестве режима воздействия мы выбрали вариант nJ/MHz. В установке используется объектив, который обеспечивает фокусировку излучения в двухмикрометровое пятно в толще роговицы. Поле зрения объектива дает возможность углового сканирования лазерного пучка по кадру размером не менее 200 мкм. Источником излучения служит фемтосекундный волоконный лазер FL300 собственной разработки. При частоте лазерных импульсов 1 МГц энергия в импульсе доходит до 2 мкДж, что позволяет реализовать nJ/MHz-режим при двукратном запасе по энергии в импульсе. Длительность импульса генерации лазера FL-300 менее 300 фс, длина волны генерации — 1040 нм.
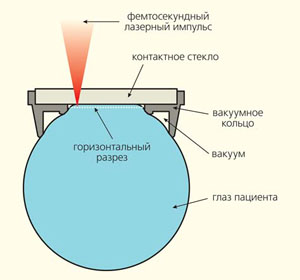

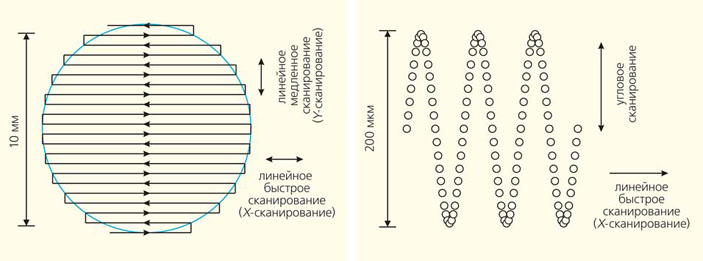
Принцип проведения операции с использованием фемтосекундного лазера поясняется на рис. 7. Плоское (или вогнутое) стекло прижимается к глазу с помощью вакуумной присоски, которая жестко связана с офтальмологическим фемтосекундным лазером. После фиксации глаза луч, сфокусированный в строму роговицы, сканируется по специальному алгоритму, который задается типом проводимой операции. В случае Фемто-ЛАСИК фокальное пятно действует на глубине около 100 мкм по площади диаметром около 9 мм. Внутри рабочего поля объектива системы (200 мкм) пучок лазера перемещается высокоскоростным резонансным сканером по одной координате Y, а все поле операции (диаметром до 10 мм) покрывается участками по 200 мкм за счет X—Y-растрового передвижения объектива с помощью пьезоподвижек (рис. 8). При этом расстояние между соседними пятнами (от каждого лазерного импульса) составляет менее 5 мкм.
Ключевые преимущества применения фемтосекундной лазерной системы «Фемто Визум» в офтальмологии — воспроизводимость и точность операций (толщина клапана, глубина надрезов, размер и форма трансплантата при кератопластике), малое время проведения операций (<15 c для клапана диаметром 9,5 мм при операции ЛАСИК), широкий спектр возможных операций (Фемто-ЛАСИК, роговичный карман, кератопластика, роговичные тоннели, дуговые послабляющие надрезы).
В сочетании с «Микроскан Визум» система «Фемто Визум» образует лазерный офтальмологический комплекс, который позволяет решать широкий спектр задач по коррекции зрения и ряду микрохирургических операций. В настоящее время эти системы успешно применяются во многих клиниках России. И этим мы во многом обязаны Александру Михайловичу Прохорову, который был не только одним из создателей лазерной техники, но и «вечным двигателем» ее продвижения в жизнь.
Литература
1. Trokel S., Shrinivasan R., Braren B. A. Excimer laser surgery of cornea // Am. J. Ophthalmol. 1983. V. 96. P. 710–715.
2. Atejev V. V., Bukreyev V. S., Vartapetov S. K. et al. Excimer laser system «Profile-500» // ALT’98 Selected papers on novel laser methods in medicine and biology, SPIE. 1999. V. 3829. Paper 3829–19. P. 124–127.
3. Борн М., Вольф Э. Основы оптики. М., 1973.
4. Srinivasan R., Sutcliff E., Braren B. Ablation and etching of polymethylmethacrylate by very short (160 fs) ultraviolet (308 nm) laser pulses // Appl. Phys. Lett. 1987. V. 51. P. 1285–1287.
У таких молекул есть только «притягивающее» (связывающее) возбужденное состояние и «отталкивающее» (несвязывающее) основное. В возбужденном состоянии (например, вызванном электрическим разрядом) молекулы (димеры) образовываться могут, причем автоматически с инверсной населенностью уровней, но, когда лишняя энергия «сброшена» в виде спонтанного или вынужденного излучения, основное состояние не способно удержать атомы вместе и происходит очень быстрый (в течение пикосекунд) распад.
Lin J. T., LaserSight Inc. Ophthalmic surgery method using noncontact scanning laser / US Patent 5520679.
❶ Что такое лазерная хирургия 🚩 применение лазеров в хирургии 🚩 Виды медицины
В основе лазерной хирургии лежит использование усовершенствованных технологий. Они представляют собой устройства, содержащие газовую среду (углекислый газ, ксенон или аргон), и восстанавливающие мощные световые лучи.
Существует два вида лазеров. Низкочастотные лазеры применяются в терапии и служат для лечения многих заболеваний, начиная от герпеса и заканчивая устранением раковых клеток. Свое наибольшее распространение высокочастотные лазеры нашли в операциях по коррекции зрения и удаления рубцов. 
Лазерная хирургия является практически бескровной (лазер прижигает поверхность сосудов) и не оставляет после себя рубцов и шрамов. Заживление ран после нее происходит за счет регенерации нормальной структуры кожного покрова. Сами раны продолжительное время остаются стерильными, а развитие воспалительного процесса сводится к минимуму.
Самыми первыми «клиентами» лазерной хирургии были операции по лечению аномалий глаз (дальнозоркости, близорукости, астигматизма и других патологий). Ткани глаза являются идеальными поверхностями, на которых можно сфокусировать лучи лазера.
Сами операции не считаются сложными. Последние модели лазеров обеспечивают безболезненность работы, возможность ее проведения на обоих глазах за один день и кратковременный реабилитационный период.
При помощи лазерной хирургии также можно устранить и многие другие заболевания, среди которых хочется отметить: злокачественные образования кожи, некоторые злокачественные болезни красной каймы губ или слизистой оболочки полости рта, ЛОР-заболевания, сосудистые, гнойно-воспалительные болезни кожи и подкожно-жировой клетчатки, а также нарушения женской половой сферы.
Лазерная хирургия активно применяется в косметологии и пластической хирургии. Она дает возможности устранить множество проблем, еще недавно казавшихся неразрешимыми, корректировать почти любые недостатки своего тела. К таким процедурам относят лазерную эпиляцию, удаление татуировок, пигментных пятен, бородавок, подкожных сосудов, родинок, послеоперационных рубцов, папиллом, растяжек, хирургию вросшего ногтя и лазерную шлифовку кожи.
В зависимости от вида операции применяются один или более видов лазерных лучей. Подбирается индивидуальная программа, которая может составлять один или несколько сеансов. Обычно при проведении лазерной хирургии необходимости в анестезии нет.
На протяжении некоторого времени после завершения работы на коже остается ровный розовый участок. Его следует защищать от воздействия ультрафиолетовых лучей. В противном случае может возникнуть процесс пигментации кожи.
Лазерная хирургия стала настоящим прорывом в лечении варикозного расширения век и настоящим помощником флебологам. Для этого используется эндовазальный метод с применением высокоэнергетических лазеров. Такие операции характеризуются безболезненностью, высокой эффективностью и легким течением послеоперационного периода.
цены на операцию ППЛК, консультация офтальмолога в клинике «Эксимер»
Лазерная коагуляция сетчатки применяется при периферических и центральных дистрофиях сетчатки, сосудистых поражениях, при некоторых видах опухолей. Также лазерная коагуляция сетчатки предотвращает развитие дистрофий и препятствует отслоению сетчатки, эффективна как профилактика прогрессирования изменений на глазном дне.
Данный вид лечения является единственным и безальтернативным при изменениях на сетчатке глаза, «решетчатой» дегенерации сетчатки, дистрофии («след улитки»), при сосудистых заболеваниях глаз, например, диабетические изменения на сетчатке, связанные с сахарным диабетом, тромбозе центральной вены сетчатки, ангиоматозе, возрастной макулодистрофии, сосудистой патологии вен (ДРП, тромбоз).
Лазерная коагуляция сетчатки — амбулаторная процедура. В ходе лечения применяется местная капельная анестезия. Она легко переносится пациентами разного возраста и не оказывает нагрузку на сердце, сосуды и другие органы. Лазерная коагуляция сетчатки занимает около 15-20 минут. После небольшого отдыха и осмотра врача пациент возвращается домой, продолжая вести свой обычный образ жизни.
Принцип лечения при помощи лазерной коагуляции основан на том, что лазерное воздействие ведет к резкому повышению температуры, что вызывает коагуляцию (свертывание) ткани. Благодаря этому операция проходит бескровно. Лазер обладает очень высокой точностью и используется для создания сращений между сетчаткой и сосудистой оболочкой глаза. В ходе проведения лазерной коагуляции на глаз пациента ставится специальная линза. Она позволяет излучению полностью проникнуть внутрь глаза. Хирург имеет возможность контролировать ход операции через микроскоп.
Преимущества лазерной коагуляции
- Укрепление сетчатки при помощи лазера позволяет избежать вскрытия глазного яблока и происходит бесконтактно, что исключает возможность инфицирования.
- Благодаря особенностям лазерного лечения вмешательство проходит бескровно.
- Такое лечение не требует общей анестезии, а значит, организм избегает лишнего стресса.
- Лазерное лечение проходит в режиме «одного дня», восстановительного периода как такового нет.
Периферическая профилактическая лазерная коагуляция сетчатки
Периферическая профилактическая лазерная коагуляция сетчатки – это процедура укрепления периферической зоны сетчатки, направленная на профилактику возникновения отслоения сетчатки. Дистрофия сетчатки часто приводит к микроразрывам в этих зонах и появлению отслоения сетчатки, которая плохо поддается лечению и может привести к необратимой потере зрения. ППЛК позволяет предупредить отслоение сетчатки, таким образом сохранить зрение.

В основе метода периферической профилактической лазерной коагуляции лежит обработка лазером истонченных участков сетчатки. При помощи излучения лазера выполняется так называемое «припаривание» сетчатки в слабых местах, и вокруг разрывов образуются спайки сетчатки с подлежащими тканями.
Основной целью ППЛК является именно профилактика – снижение риска возникновения осложнений, а не улучшение зрения. Каким именно будет зрение после операции, во многом зависит от того, имеются ли сопутствующие заболевания глаз, влияющие на возможность хорошо видеть.
ППЛК улучшает кровоснабжение, увеличивает скорость кровотока, улучшает питание пораженной области сетчатки, препятствует проникновению жидкости под сетчатку и, как следствие, ее отслаиванию.
Данная процедура выполняется за 1 сеанс, без госпитализации и в режиме «одного дня», под местной капельной анестезией. В этот же день пациент возвращается домой, продолжая вести привычный для себя образ жизни.
Показания для проведения ППЛК
Как показывает статистика офтальмохирургов, перед проведением лазерной коррекции зрения около 60% пациентов нуждаются в укреплении сетчатки. Метод ППЛК применяется в медицине уже более 40 лет и в настоящее время офтальмологи не представляют, как можно обойтись без этого уникального способа.
Периферическая дистрофия сетчатки – одна из основных причин отказа беременным женщинам в естественных родах и рекомендации кесарева сечения. При средней и высокой степенях близорукости сетчатка истончается и растягивается. В связи с этим увеличивается риск разрыва и отслоения сетчатки во время родов.
Однако, сейчас эта проблема решается с помощью укрепления сетчатки до родов методом ППЛК. После проведения такой процедуры сетчатка укрепляется, предохраняется ее растяжение и отслоение. Вовремя выполненная процедура ППЛК дает женщинам с проблемной сетчаткой возможность самостоятельного радоразрешения. Врачи рекомендуют проведение периферической профилактической лазерной коагуляции до 35-й недели беременности.
