Из чего состоит кровь?
Кровь состоит на 60 % из плазмы. Это желтовато-белая жидкость, которая в свою очередь состоит в основном из воды, а также различных белков, солей, микроэлементов и витаминов. Около 40 % кровь состоит из клеток [клетка], которые называют кровяными тельцами или кровяными клетками. Существует три вида клеток крови, которые находятся в ней в разном количестве и выполняют разные задачи:
- красные кровяные тельца (эритроциты)
- белые кровяные тельца (лейкоциты)
- кровяные пластинки (тромбоциты)
Эритроциты (красные кровяные тельца)
Больше всего в крови человека находится эритроцитов, которые также называют красными кровяными тельцами или красными клетками крови. Они составляют 99 % из всех клеток крови. В одном микролитре крови (то есть в одной милионной части литра) находится от 4 до 6 миллионов эритроцитов.
Самая важная задача эритроцитов – переносить по кровеносным сосудам жизненно необходимый кислород (который поступает в лёгкие) к органам и тканям тела.
Если количества эритроцитов в крови не достаточно, или если в эритроцитах мало гемоглобина и поэтому они не могут полностью выполнять свою работу, то речь идёт об анемии, или о малокровии. У „малокровных“ людей часто очень бледная кожа. Так как их организм не получает достаточное количество кислорода, то у них также появляются такие симптомы как утомляемость, слабость, одышка, снижение работоспособности, головная боль или боли в спине.
Главным в оценке работы эритроцитов является в первую очередь не их количество в крови, а их объём, так называемый гематокрит (сокращение в анализах Ht), и уровень гемоглобина (сокращение в анализах Hb). Для детей страше грудного возраста нормальным считается уровень гемоглобина в пределах от 10 до 16 г/дл, норма гематокрита – в пределах между 30 и 49 % (детали см. в таблице) [KUL2002].
Если эти показатели значительно ниже нормы и одновременно у ребёнка появляются симптомы анемии [анемия], например, из-за лейкоза, или после химиотерапии [химиотерапия], то может потребоваться переливание (трансфузия) эритроцитарного концентрата (эритроцитарной массы, сокращённо „эрмасса“), чтобы стабилизировать состояние ребёнка.
Возраст ребёнка | Гемоглобин(Hb) уровень в г/дл | Гематокрит (Hk) показатель в % |
|---|---|---|
1 год | 10.1 — 13.0 | 30 — 38 |
2 – 6 лет | 11.0 — 13.8 | 32 — 40 |
6 – 12 лет | 11. | 32 — 43 |
12 – 18 лет женщины | 12.1 — 15.1 | 35 — 44 |
12 – 18 лет мужчины | 35 — 49 |
Лейкоциты (белые клетки крови)
Белые кровяные тельца или белые клетки крови, которые также называют лейкоцитами, составляют вместе с тромбоцитами у здоровых людей лишь 1 % всех клеток крови. Нормальным считается уровень от 5.000 до 8.000 лейкоцитов в микролитре крови.
Нормальным считается уровень от 5.000 до 8.000 лейкоцитов в микролитре крови.
Лейкоциты отвечают за имунную защиту организма. Они распознают „чужаков“, например, бактерии, вирусы или грибы, и обезвреживают их. Если есть инфекция, количество лейкоцитов может сильно вырасти за короткое время. Благодаря этому организм быстро начинает бороться с возбудителями болезни.
Лейкоциты делят на разные группы в зависимости от их внешнего вида, от места, в котором они выросли, и от того, как именно они работают. Самую большую группу (от 60 до 70 %) составляют так называемые гранулоциты; от 20 до 30 % — лимфоциты и от 2 до 6 % — моноциты („клетки-пожиратели“).
Эти три вида клеток по-разному борются с возбудителями болезней, одновременно дополняя работу друг друга. Только благодаря тому, что они работают согласованно, организм обеспечивается оптимальной защитой от инфекций. Если количество белых клеток крови снижается, или они не могут работать нормально, например, при лейкозе, то защита организма от „чужаков“ (бактерий, вирусов, грибов) больше не может быть эффективной.
Общее количество лейкоцитов измеряется в анализе крови [анализ крови]. Характеристики различных типов белых кровяных клеток и их процентуальное соотношение могут исследоваться в так называемом дифференциальном анализе крови (лейкоцитарная формула).
Гранулоциты
Гранулоциты отвечают прежде всего за защиту организма от бактерий [бактерии]. Также они защищают от вирусов, грибов и паразитов (например, глистов). А называются они так потому, что в их клеточой жидкости есть зёрнышки (гранулы). В том месте, где появляется инфекция, они моментально накапливаются в большом количестве и становятся „первым эшелоном“, который отражает атаку возбудителей болезни.
Гранулоциты являются так называемыми фагоцитами. Они захватывают проникшего в организм противника и перевариваюи его (фагоцитоз). Таким же образом они очищают организм от мёртвых клеток. Кроме того, гранулоциты отвечают за работу с аллергическими и воспалительными реакциями, и с образованием гноя.
Уровень гранулоцитов в крови имеет в лечении онкологических болезней очень важное значение. Если во время лечения их количество становится меньше, чем 500 — 1.000 в 1 микролитре крови, то, как правило, очень сильно возрастает опасность инфекционных заражений даже от таких возбудителей, которые обычно вообще не опасны для здорового человека.
Лимфоциты
Лимфоциты – это белые клетки крови, 70 % которых находится в тканях лимфатической системы. К таким тканям относятся, например, лимфатические узлы, селезёнка, глоточные миндалины (гланды) и вилочковая железа.
Группы лимфоузлов находятся под челюстями, в подмышечных впадинах, на затылке, в области паха и в нижней части живота. Селезёнка – это орган, который находится слева в верхней части живота под рёбрами; вилочковая железа – небольшой орган за грудиной. Кроме того, лимфоциты находятся в лимфе. Лимфа – это бесцветная водянистая жидкость в лимфатических сосудах. Она, как и кровь, охватывает своей разветвлённой весь организм
Она, как и кровь, охватывает своей разветвлённой весь организм
Лимфоциты играют главную защитную роль в иммунной системе, так как они способны целенаправленно распознавать и уничтожать возбудителей болезней. Например, они играют важную роль при вирусной инфекции. Лимфоциты „организовывают“ работу гранулоцитов, производя в организме так называемые антитела. Атитела – это маленькие белковые молекулы, которые прицепляются к возбудителям болезни и таким образом помечают их как „врагов“ для фагоцитов.
Лимфоциты распознают и уничтожают клетки организма, поражённые вирусом, а также раковые клетки, и запоминают тех возбудителей болезни, с которыми они уже контактировали. Специалисты различают Т-лимфоциты и В-лимфоциты, которые отличаются по своим иммунологическим характеристикам, а также выделяют некоторые другие, более редкие подгруппы лимфоцитов.
Моноциты
Моноциты – это клетки крови, которые уходят в ткани и там начинают работать как „крупные фагоциты“ (макрофаги), поглощая возбудителей болезней, инородные тела и умершие клетки, и зачищая от них организм. Кроме того часть поглощённых и переваренных организмов они презентируют на своей поверхности и таким образом активируют лимфоциты на иммунную защиту.
Кроме того часть поглощённых и переваренных организмов они презентируют на своей поверхности и таким образом активируют лимфоциты на иммунную защиту.
Тромбоциты (кровяные пластинки)
Кровяные пластинки, которые также называют тромбоциты, отвечают главным образом за остановку кровотечений. Если происходит повреждение стенок кровеносных сосудов, то они в самое кратчайшее время закупоривают повреждённое место и таким образом кровотечение останавливается.
Слишком низкий уровень тромбоцитов (встречается, например, у больных лейкозом) проявляется в носовых кровотечениях или кровоточивости дёсен, а также в мелких кровоизлияниях на коже. Даже после самого незначительного ушиба могут появляться синяки, а также кровоизлияния во внутренних органах.
Количество тромбоцитов в крови также может падать из-за химиотерапии. Благодаря переливанию (трансфузия) кровяных пластинок (тромбоконцентрата), как правило, удаётся поддерживать приемлемый уровень тромбоцитов. 12/л (10 в ст. 12/л), г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
12/л (10 в ст. 12/л), г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь и лекарственные препараты (по согласованию с врачом) за сутки до сдачи крови.
- Не принимать пищу в течение 8 часов перед исследованием, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общий анализ крови, как правило, включает в себя от 8 до 30 пунктов: подсчет количества эритроцитов, лейкоцитов, тромбоцитов в 1 микролитре или литре крови, а также ряд других показателей, описывающих форму, объем и другие характеристики этих клеток.
Обычно в дополнение к этому назначается лейкоцитарная формула (процентное соотношение различных форм лейкоцитов) и подсчет скорости оседания эритроцитов (СОЭ).
Основные показатели, которые входят в общий анализ крови:
- количество лейкоцитов (white blood cells, WBC),
- количество эритроцитов (red blood cells, RBC),
- уровень гемоглобина (hemoglobin content, Hb),
- гематокрит (рematocrit, Hct),
- средний объем эритроцита (MCV),
- среднее содержание гемоглобина в эритроците (MCH),
- средняя концентрация гемоглобина в эритроцитах (MCHC),
- тромбоциты (platelet count, PC).
Кровь состоит из клеток (форменных элементов) и жидкой части – плазмы. Эти клетки – эритроциты, лейкоциты и тромбоциты – образуются и созревают в костном мозге и должны попадать в системный кровоток по мере необходимости.
При изучении мазка крови под микроскопом капля крови помещается на стекло, размазывается шпателем, а затем окрашивается специальным красителем и высушивается.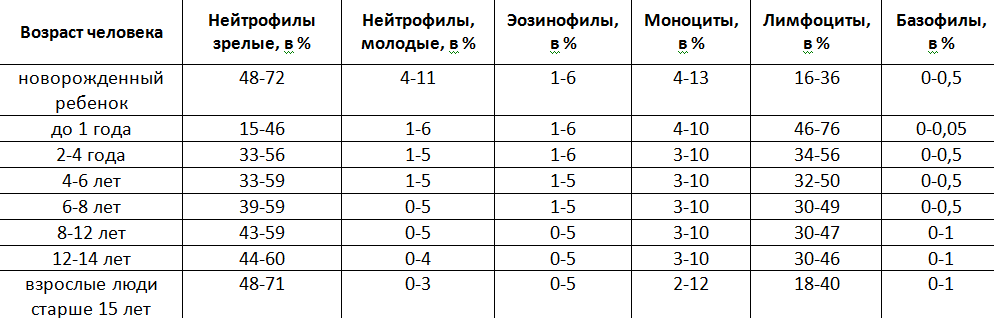 После этого врач лаборатории может детально рассмотреть ее под микроскопом.
После этого врач лаборатории может детально рассмотреть ее под микроскопом.
Отношение объема форменных элементов к плазме называется гематокритом. Изменение этого показателя характеризует степень «разжижения» или «сгущения» крови.
Лейкоциты
Лейкоциты – клетки, помогающие организму бороться с инфекцией. Они способны определять чужеродные агенты (бактерии, вирусы) в организме и уничтожать их.
Выделяют 5 различных видов лейкоцитов: эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты. Подсчет количества лейкоцитов, входящий в общий анализ крови, позволяет узнать суммарное количество всех типов клеток, лейкоцитарная формула – каждого типа в отдельности.
Общее количество лейкоцитов, как правило, повышено при остром инфекционном процессе, вызванном бактериями. Если лейкоцитов слишком мало, то организм становится более подверженным различным инфекциям.
Эритроциты
Эритроциты – клетки, имеющие форму бублика с более тонкой частью в центре вместо дырки.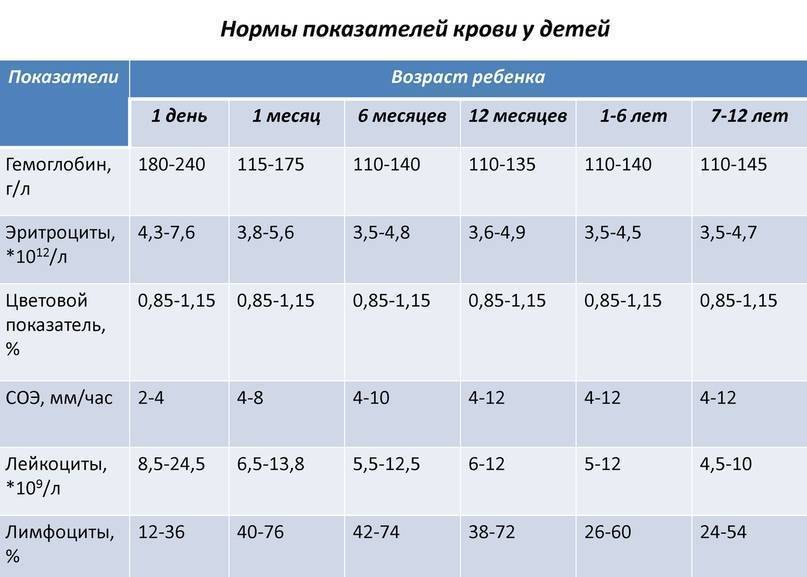 В их составе есть гемоглобин – белок, содержащий железо, который обладает способностью переносить кислород от легких к тканям и органам, а углекислый газ – от тканей и органов к легким, из которых он выдыхается. Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12- или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
В их составе есть гемоглобин – белок, содержащий железо, который обладает способностью переносить кислород от легких к тканям и органам, а углекислый газ – от тканей и органов к легким, из которых он выдыхается. Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12- или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Тромбоциты
Тромбоциты – клетки, играющие значительную роль в свертывании крови. Если у человека снижено количество тромбоцитов, риск кровотечения и образования синяков у него повышен.
Для чего используется исследование?
Данный тест применяют для общей оценки состояния здоровья, диагностики анемии, инфекций и множества других заболеваний. Фактически это совокупность анализов, оценивающих различные показатели крови.
Фактически это совокупность анализов, оценивающих различные показатели крови.
- Подсчет количества лейкоцитов определяет количество лейкоцитов в единице крови (литре или микролитре). Его повышение или понижение может иметь значение в диагностике инфекций или, например, заболеваний костного мозга.
- Соответственно, количество эритроцитов в единице крови (литре или микролитре) определяет подсчет количества эритроцитов. Он необходим для диагностики анемии или полицитемии и дифференциальной диагностики различных типов анемий.
- Уровень гемоглобина важен для оценки тяжести анемии или полицитемии и для контроля за эффективностью терапии этих состояний.
- Гематокрит – процентное соотношение клеток крови (форменных элементов) к жидкой ее части. Используется в комплексной оценке анемий и полицитемий, для принятия решения о переливании крови и оценки результатов этой процедуры.
-
Подсчет количества тромбоцитов определяет количество тромбоцитов в единице крови (литре или микролитре).
 Используется для выявления нарушений свертывания или заболеваний костного мозга.
Используется для выявления нарушений свертывания или заболеваний костного мозга. - Средний объем эритроцита (MCV) – усредненный показатель, отражающий размер эритроцитов. Он необходим для дифференциальной диагностики различных типов анемий. Так, при B12-дефицитной анемии размер эритроцитов увеличивается, при железодефицитной – уменьшается.
- Среднее содержание гемоглобина в эритроците (MCH) – показатель того, сколько гемоглобина в среднем содержится в одном эритроците. При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
- Средняя концентрация гемоглобина в эритроците (MCHC) отражает насыщение эритроцита гемоглобином. Это более чувствительный параметр для определения нарушений образования гемоглобина, чем MCH, так как он не зависит от среднего объема эритроцита.
-
Распределение эритроцитов по объему (RDW) – показатель, определяющий степень различия эритроцитов по размеру.
 Имеет значение в диагностике анемий.
Имеет значение в диагностике анемий. - Средний объем тромбоцита (MPV) – характеристика тромбоцитов, которая может косвенно свидетельствовать об их повышенной активности или о наличии чрезмерного количества молодых тромбоцитов.
Когда назначается исследование?
Общий анализ крови – самый распространенный лабораторный анализ, используемый для оценки общего состояния здоровья. Он выполняется при плановых медицинских осмотрах, при подготовке к оперативному вмешательству, входит в медкомиссию при устройстве на работу.
Если человек жалуется на утомляемость, слабость или у него есть признаки инфекционного заболевания, воспаления, повышенная температура тела, то, как правило, назначается общий анализ крови.
Значительное повышение количества лейкоцитов обычно подтверждает воспаление. Снижение эритроцитов и гемоглобина говорит об анемии и требует дополнительных обследований для уточнения ее причины.
Множество различных патологических состояний могут приводить к изменениям количества основных клеточных популяций в крови. 12/л
12/л
RDW-SD (распределение эритроцитов по объёму, стандартное отклонение): 37 — 54.
RDW-CV (распределение эритроцитов по объёму, коэффициент вариации): 11,5 — 14,5.
Гемоглобин
| Пол | Возраст |
Референсные значения |
| Женский | Меньше 2 недель | 60 — 134 г/л |
| 2 недели – 2 месяца | 60 — 124 г/л | |
| 2 месяца – 1 год | 60 — 110 г/л | |
| 1-2 года | 60 — 110 г/л | |
| 2-3 года | 60 — 111 г/л | |
| 3-4 года | 60 — 112 г/л | |
| 4-5 лет | 60 — 114 г/л | |
| 5-6 лет | 60 — 113 г/л | |
| 6-7 лет | 60 — 115 г/л | |
| 7-8 лет | 60 — 116 г/л | |
| 8-9 лет | 60 — 115 г/л | |
| 9-10 лет | 60 — 118 г/л | |
| 10-11 лет | 60 — 114 г/л | |
| 11-12 лет | 60 — 118 г/л | |
| 12-13 лет | 60 — 117 г/л | |
| 13-14 лет | 60 — 121 г/л | |
| 14-15 лет | 60 — 120 г/л | |
| 15-18 лет | 60 — 120 г/л | |
| 18-45 лет | 60 — 117 г/л | |
| 45-65 лет | 60 — 117 г/л | |
| Больше 65 лет | 60 — 117 г/л | |
| Мужской | Меньше 2 недель | 60 — 134 г/л |
| 2 недели – 2 месяца | 60 — 124 г/л | |
| 2 месяца – 1 год | 60 — 110 г/л | |
| 1-2 года | 60 — 110 г/л | |
| 2-3 года | 60 — 111 г/л | |
| 3-4 года | 60 — 112 г/л | |
| 4-5 лет | 60 — 114 г/л | |
| 5-6 лет | 60 — 113 г/л | |
| 6-7 лет | 60 — 115 г/л | |
| 7-8 лет | 60 — 116 г/л | |
| 8-9 лет | 60 — 115 г/л | |
| 9-10 лет | 60 — 118 г/л | |
| 10-11 лет | 60 — 114 г/л | |
| 11-12 лет | 60 — 118 г/л | |
| 12-13 лет | 60 — 117 г/л | |
| 13-14 лет | 60 — 121 г/л | |
| 14-15 лет | 60 — 120 г/л | |
| 15-18 лет | 60 — 130 г/л | |
| 18-45 лет | 60 — 132 г/л | |
| 45-65 лет | 60 — 131 г/л | |
| Больше 65 лет | 60 — 126 г/л |
Гематокрит
| Пол | Возраст | Референсные значения |
| Меньше 1 года | 33 — 41 % | |
| 1-3 года | 32 — 40 % | |
| 3-6 лет | 32 — 42 % | |
| 6-9 лет | 33 — 41 % | |
| 9-12 лет | 34 — 43 % | |
| Женский | 12-15 лет | 34 — 44 % |
| 15-18 лет | 34 — 44 % | |
| 18-45 лет | 35 — 45 % | |
| 45-65 лет | 35 — 47 % | |
| Больше 65 лет | 35 — 47 % | |
| Мужской | 12-15 лет | 35 — 45 % |
| 15-18 лет | 37 — 48 % | |
| 18-45 лет | 39 — 49 % | |
| 45-65 лет | 39 — 50 % | |
| Больше 65 лет | 39 — 50 % |
Снижение показателей отмечается при железо-, B12-дефицитной и других анемиях, острых и хронических кровотечениях.
Повышение – при истинной полицитемии, обезвоживании, кислородном голодании.
Средний объем эритроцита (MCV)
| Пол | Возраст | Референсные значения |
| Меньше 1 года | 71 — 112 фл | |
| 1-5 лет | 73 — 85 фл | |
| 5-10 лет | 75 — 87 фл | |
| 10-12 лет | 76 — 94 фл | |
| Женский | 12-15 лет | 73 — 95 фл |
| 15-18 лет | 78 — 98 фл | |
| 18-45 лет | 81 — 100 фл | |
| 45-65 лет | 81 — 101 фл | |
| Больше 65 лет | 81 — 102 фл | |
| Мужской | 12-15 лет | 77 — 94 фл |
| 15-18 лет | 79 — 95 фл | |
| 18-45 лет | 80 — 99 фл | |
| 45-65 лет | 81 — 101 фл | |
| Больше 65 лет | 81 — 102 фл |
Среднее содержание гемоглобина в эритроците (MCH)
| Возраст | Референсные значения |
| Меньше 1 года | 31 — 37 пг |
| 1-3 года | 24 — 33 пг |
| 3-12 лет | 25 — 33 пг |
| 13-19 лет | 26 — 32 пг |
| Больше 19 лет | 27 — 31 пг |
Повышение показателя отмечается при B12- и фолиеводефицитной анемии.
Снижение – при железодефицитной анемии и талассемии.
Средняя концентрация гемоглобина в эритроците (MCHC)
| Возраст | Референсные значения |
| Меньше 1 года | 290 — 370 г/л |
| 1-3 года | 280 — 380 г/л |
| 3-12 лет | 280 — 360 г/л |
| 13-19 лет | 330 — 340 г/л |
| Больше 19 лет | 300 — 380 г/л |
Понижение показателя отмечается при анемии.
Повышение – при наследственном сфероцитозе.
Тромбоциты
| Возраст | Референсные значения |
| Меньше 10 дней | 99 — 421 *10^9/л |
| 10 дней – 1 месяц | 150 — 400 *10^9/л |
| 1-6 месяцев | 180 — 400 *10^9/л |
| 6 месяцев – 1 год | 160 — 390 *10^9/л |
| 1-5 лет | 150 — 400 *10^9/л |
| 5-10 лет | 180 — 450 *10^9/л |
| 10-15 лет | 150 — 450 *10^9/л |
| Больше 15 лет | 180 — 320 *10^9/л |
Понижение – при иммунной тромбоцитопенической пурпуре, онкологических заболеваниях костного мозга, сепсисе. Повышение показателя отмечается при истинной полицитемии, онкологических заболеваниях, туберкулезе, удалении селезенки.
Что может влиять на результат?
На различные показатели могут оказывать влияние, соответственно, разные факторы: беременность, курение, прием некоторых лекарств, интенсивная физическая нагрузка.
Также рекомендуется
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
- Ретикулоциты
Кто назначает исследование?
Терапевт, хирург, инфекционист, гематолог, нефролог.
Показатели клинического анализа крови
Анализ крови – привычная медицинская процедура. Первый раз мы проходим ее еще в раннем детстве. При этом сама суть и значение этого вида диагностики для обывателя достаточно абстрактны. В этой статье мы расскажем о том, зачем берут анализ крови, какие показатели определяют, а также о чем говорят те или иные результаты.
Любые отклонения, происходящие в нашем организме, отражаются на биологических жидкостях – слюне, моче, крови. При этом ряд заболеваний на ранних стадиях протекает бессимптомно. Больной может не замечать начинающихся изменений. А вот кровь «чувствует», ее биохимические показатели реагируют на заболевание одними из первых. Таким образом, вовремя сдав общий анализ, можно заблаговременно выявить отклонения в организме и начать правильное лечение.
Общий анализ крови с исследованием лейкоцитарной формулы включает в себя следующие основные показатели: гемоглобин, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула (нейрофилы, эозинофилы, базофилы, лимфоциты и моноцициты), СОЭ.
Чуть подробнее расскажем о каждом из них.
СОЭ
Скорость оседания эритроцитов является одним из наиболее популярных лабораторных тестов. Повышенная скорость оседания свидетельствует о наличие хронического или острого воспалительного процесса. СОЭ может повышаться при беременности, инфекционном заболевании, воспалительном процессе, анемии, образовании опухоли и др.
Лейкоциты
Лейкоциты – это белые кровяные тельца. Основная их функция заключается в защите организма от микробов и чужеродных веществ. Высокое количество лейкоцитов (лейкоцитоз) наблюдается при инфекционных заболеваниях и воспалениях различной локализации. При этом повышение лейкоциты не всегда свидетельствует о болезни – при беременности, после физической нагрузки или пережитого стресса их количество также возрастает.
Состояние организма, когда наблюдается пониженное содержание лейкоцитов в крови, называется лейкопенией. Причиной этого могут быть онкологические, аутоиммунные, некоторые инфекционные заболевания, патология костного мозга, прием медицинских препаратов и др.
Лейкоцитарная формула
При общем анализе крови оценивается не только уровень лейкоцитов вообще, но и процентное соотношение количества различных видов: нейтрофилов, лимфоцитов, эозинофилов, базофилов и моноцитов. Все типы лейкоцитов выполняют разные функции, в связи с этим, по изменениям пропорций их содержания в крови врач может определить характер патологического процесса в организме больного человека.
Эритроциты
Главная функция эритроцитов – транспортировка и отдача кислорода тканям и органам.
Повышение количества эритроцитов наблюдается при патологии костного мозга, обезвоживании, почечных заболеваниях, нехватке кислорода в организме из-за легочных болезней, сердечно-сосудистых патологий или курения, снижение – при анемии вследствие потери крови, недостатке железа и витаминов.
Гемоглобин
Гемоглобин – белок, содержащийся в эритроцитах. Его главная функция заключается в том, чтобы связываться с кислородом и переносить его к тканям, а также в выведении углекислого газа из организма. Обычно, пониженный уровень гемоглобина в крови, можно предположить по внешним признакам и симптомам – бледность, головокружение, сухая кожа, быстрая утомляемость. Такое состояние часто называют «малокровием» или анемией.
Повышение уровня гемоглобина встречается реже и может быть связано со «сгущением» крови (обезвоживание), эритроцитозами, при физиологических состояниях (у жителей высокогорных районов, летчиков, альпинистов, после повышенной физической нагрузки, длительного стресса).
Тромбоциты
Эти маленькие безъядерные клетки играют главную роль в свёртывании крови. Когда происходит кровотечение, они, соединяясь друг с другом, формируют сгусток, который закупоривает поврежденную стенку сосуда. Состояние, при котором снижены тромбоциты, сопровождается нарушением системы свертывания крови и ломкостью капилляров. Не меньшую опасность представляет увеличение их количества, приводящее к тромбообразованию в сосудах. Нарушение нормы содержания тромбоцитов может быть вызвано многими опасными заболеваниями, поэтому очень важно вовремя провести анализ крови.
Помните, даже при отсутствии ощутимых симптомов заболевания, врачи рекомендуют сдавать кровь на общий анализ не реже раза в год.
Общий анализ крови (без лейкоцитарной формулы и СОЭ): исследования в лаборатории KDLmed
Общий анализ крови – набор тестов, направленных на определение количества различных клеток крови, их параметров (размера и др.12/л (10 в ст. 12/л), г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь и лекарственные препараты (по согласованию с врачом) за сутки до сдачи крови.
- Не принимать пищу в течение 8 часов перед исследованием, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общий анализ крови, как правило, включает в себя от 8 до 30 пунктов: подсчет количества эритроцитов, лейкоцитов, тромбоцитов в 1 микролитре или литре крови, а также ряд других показателей, описывающих форму, объем и другие характеристики этих клеток.
Обычно в дополнение к этому назначается лейкоцитарная формула (процентное соотношение различных форм лейкоцитов) и подсчет скорости оседания эритроцитов (СОЭ).
Основные показатели, которые входят в общий анализ крови:
- количество лейкоцитов (white blood cells, WBC),
- количество эритроцитов (red blood cells, RBC),
- уровень гемоглобина (hemoglobin content, Hb),
- гематокрит (рematocrit, Hct),
- средний объем эритроцита (MCV),
- среднее содержание гемоглобина в эритроците (MCH),
- средняя концентрация гемоглобина в эритроцитах (MCHC),
- тромбоциты (platelet count, PC).
Кровь состоит из клеток (форменных элементов) и жидкой части – плазмы. Эти клетки – эритроциты, лейкоциты и тромбоциты – образуются и созревают в костном мозге и должны попадать в системный кровоток по мере необходимости.
При изучении мазка крови под микроскопом капля крови помещается на стекло, размазывается шпателем, а затем окрашивается специальным красителем и высушивается. После этого врач лаборатории может детально рассмотреть ее под микроскопом.
Отношение объема форменных элементов к плазме называется гематокритом. Изменение этого показателя характеризует степень «разжижения» или «сгущения» крови.
Лейкоциты
Лейкоциты – клетки, помогающие организму бороться с инфекцией. Они способны определять чужеродные агенты (бактерии, вирусы) в организме и уничтожать их.
Выделяют 5 различных видов лейкоцитов: эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты. Подсчет количества лейкоцитов, входящий в общий анализ крови, позволяет узнать суммарное количество всех типов клеток, лейкоцитарная формула – каждого типа в отдельности.
Общее количество лейкоцитов, как правило, повышено при остром инфекционном процессе, вызванном бактериями. Если лейкоцитов слишком мало, то организм становится более подверженным различным инфекциям.
Эритроциты
Эритроциты – клетки, имеющие форму бублика с более тонкой частью в центре вместо дырки. В их составе есть гемоглобин – белок, содержащий железо, который обладает способностью переносить кислород от легких к тканям и органам, а углекислый газ – от тканей и органов к легким, из которых он выдыхается. Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12— или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Тромбоциты
Тромбоциты – клетки, играющие значительную роль в свертывании крови. Если у человека снижено количество тромбоцитов, риск кровотечения и образования синяков у него повышен.
Для чего используется исследование?
Данный тест применяют для общей оценки состояния здоровья, диагностики анемии, инфекций и множества других заболеваний. Фактически это совокупность анализов, оценивающих различные показатели крови.
- Подсчет количества лейкоцитов определяет количество лейкоцитов в единице крови (литре или микролитре). Его повышение или понижение может иметь значение в диагностике инфекций или, например, заболеваний костного мозга.
- Соответственно, количество эритроцитов в единице крови (литре или микролитре) определяет подсчет количества эритроцитов. Он необходим для диагностики анемии или полицитемии и дифференциальной диагностики различных типов анемий.
- Уровень гемоглобина важен для оценки тяжести анемии или полицитемии и для контроля за эффективностью терапии этих состояний.
- Гематокрит – процентное соотношение клеток крови (форменных элементов) к жидкой ее части. Используется в комплексной оценке анемий и полицитемий, для принятия решения о переливании крови и оценки результатов этой процедуры.
- Подсчет количества тромбоцитов определяет количество тромбоцитов в единице крови (литре или микролитре). Используется для выявления нарушений свертывания или заболеваний костного мозга.
- Средний объем эритроцита (MCV) – усредненный показатель, отражающий размер эритроцитов. Он необходим для дифференциальной диагностики различных типов анемий. Так, при B12-дефицитной анемии размер эритроцитов увеличивается, при железодефицитной – уменьшается.
- Среднее содержание гемоглобина в эритроците (MCH) – показатель того, сколько гемоглобина в среднем содержится в одном эритроците. При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
- Средняя концентрация гемоглобина в эритроците (MCHC) отражает насыщение эритроцита гемоглобином. Это более чувствительный параметр для определения нарушений образования гемоглобина, чем MCH, так как он не зависит от среднего объема эритроцита.
- Распределение эритроцитов по объему (RDW) – показатель, определяющий степень различия эритроцитов по размеру. Имеет значение в диагностике анемий.
- Средний объем тромбоцита (MPV) – характеристика тромбоцитов, которая может косвенно свидетельствовать об их повышенной активности или о наличии чрезмерного количества молодых тромбоцитов.
Когда назначается исследование?
Общий анализ крови – самый распространенный лабораторный анализ, используемый для оценки общего состояния здоровья. Он выполняется при плановых медицинских осмотрах, при подготовке к оперативному вмешательству, входит в медкомиссию при устройстве на работу.
Если человек жалуется на утомляемость, слабость или у него есть признаки инфекционного заболевания, воспаления, повышенная температура тела, то, как правило, назначается общий анализ крови.
Значительное повышение количества лейкоцитов обычно подтверждает воспаление. Снижение эритроцитов и гемоглобина говорит об анемии и требует дополнительных обследований для уточнения ее причины.
Множество различных патологических состояний могут приводить к изменениям количества основных клеточных популяций в крови. Общий анализ крови назначается для контроля за эффективностью лечения анемии или инфекционного заболевания, а также для оценки негативного влияния на клетки крови некоторых лекарств.12/л
RDW-SD (распределение эритроцитов по объёму, стандартное отклонение): 37 — 54.
RDW-CV (распределение эритроцитов по объёму, коэффициент вариации): 11,5 — 14,5.
Гемоглобин
Возраст | Референсные значения | ||
Меньше 2 недель | 134 — 198 г/л | ||
2 недели – 2 месяца | 124 — 166 г/л | ||
2-12 месяцев | 110 — 131 г/л | ||
1-2 года | 110 — 132 г/л | ||
2-3 года | 111 — 133 г/л | ||
3-4 года | 112 — 134 г/л | ||
4-5 лет | 114 — 134 г/л | ||
5-6 лет | 113 — 135 г/л | ||
6-7 лет | 115 — 135 г/л | ||
7-8 лет | 116 — 138 г/л | ||
8-9 лет | 115 — 137 г/л | ||
9-10 лет | 118 — 138 г/л | ||
10-11 лет | 114 — 140 г/л | ||
11-12 лет | 118 — 142 г/л | ||
12-13 лет | 117 — 143 г/л | ||
13-14 лет | 121 — 145 г/л | ||
14-15 лет | 120 — 144 г/л | ||
15-16 лет | 130 — 168 г/л | ||
16-17 лет | 130 — 168 г/л | ||
17-18 лет | 120 — 148 г/л | ||
18-45 лет
| Мужской | 132 — 173 г/л | |
| Женский | 117 — 155 г/л | ||
45-65 лет
| Мужской | 131 — 172 г/л | |
| Женский | 117 — 160 г/л | ||
Больше 65 лет
| Мужской | 126 — 174 г/л | |
| Женский | 117 — 161 г/л | ||
Гематокрит
Пол | Возраст | Референсные значения |
Меньше 1 года | 33 — 41 % | |
1-3 года | 32 — 40 % | |
3-6 лет | 32 — 42 % | |
6-9 лет | 33 — 41 % | |
9-12 лет | 34 — 43 % | |
Женский | 12-15 лет | 34 — 44 % |
15-18 лет | 34 — 44 % | |
18-45 лет | 35 — 45 % | |
45-65 лет | 35 — 47 % | |
Больше 65 лет | 35 — 47 % | |
Мужской | 12-15 лет | 35 — 45 % |
15-18 лет | 37 — 48 % | |
18-45 лет | 39 — 49 % | |
45-65 лет | 39 — 50 % | |
Больше 65 лет | 39 — 50 % |
Снижение показателей отмечается при железо-, B12-дефицитной и других анемиях, острых и хронических кровотечениях.
Повышение – при истинной полицитемии, обезвоживании, кислородном голодании.
Средний объем эритроцита (MCV)
Пол | Возраст | Референсные значения |
| Меньше 1 года | 71 — 112 фл |
1-5 лет | 73 — 85 фл | |
5-10 лет | 75 — 87 фл | |
10-12 лет | 76 — 94 фл | |
Женский | 12-15 лет | 73 — 95 фл |
15-18 лет | 78 — 98 фл | |
18-45 лет | 81 — 100 фл | |
45-65 лет | 81 — 101 фл | |
Больше 65 лет | 81 — 102 фл | |
Мужской | 12-15 лет | 77 — 94 фл |
15-18 лет | 79 — 95 фл | |
18-45 лет | 80 — 99 фл | |
45-65 лет | 81 — 101 фл | |
Больше 65 лет | 81 — 102 фл |
Среднее содержание гемоглобина в эритроците (MCH)
Возраст | Референсные значения |
Меньше 1 года | 31 — 37 пг |
1-3 года | 24 — 33 пг |
3-12 лет | 25 — 33 пг |
13-19 лет | 26 — 32 пг |
Больше 19 лет | 27 — 31 пг |
Повышение показателя отмечается при B12— и фолиеводефицитной анемии.
Снижение – при железодефицитной анемии и талассемии.
Средняя концентрация гемоглобина в эритроците (MCHC)
Возраст | Референсные значения |
Меньше 1 года | 290 — 370 г/л |
1-3 года | 280 — 380 г/л |
3-12 лет | 280 — 360 г/л |
13-19 лет | 330 — 340 г/л |
Больше 19 лет | 300 — 380 г/л |
Понижение показателя отмечается при анемии.9/л
Понижение – при иммунной тромбоцитопенической пурпуре, онкологических заболеваниях костного мозга, сепсисе. Повышение показателя отмечается при истинной полицитемии, онкологических заболеваниях, туберкулезе, удалении селезенки.
Что может влиять на результат?
На различные показатели могут оказывать влияние, соответственно, разные факторы: беременность, курение, прием некоторых лекарств, интенсивная физическая нагрузка.
Также рекомендуется
Кто назначает исследование?
Терапевт, хирург, инфекционист, гематолог, нефролог.
ИСПОЛЬЗОВАНИЕ МЕТОДА ПРОТОЧНОЙ ЦИТОМЕТРИИ ДЛЯ КОНТРОЛЯ СОДЕРЖАНИЯ ОСТАТОЧНЫХ ЛЕЙКОЦИТОВ В ПЛАЗМЕ КРОВИ | Козырева
Введение
Потребление донорской крови и ее компонентов про — должает увеличиваться, что неизбежно ведет к росту посттрансфузионных осложнений. Развитие высокотехнологичной медицинской помощи обуславливает повышение требований к качеству компонентов крови. Предупреждение большинства нежелательных трансфузионных последствий заключается в повышении качества трансфузионных сред [1]. Иммунологическая и инфекционная безопасность компонентов крови является основным критерием качества трансфузионной терапии. Лейкоциты, их фрагменты и продуцируемые ими цитокины обуславливают посттрансфузионные осложнения. Переливание реципиенту свободных от лейкоцитов продуктов крови предотвращает HLA- аллоиммунизацию, фебрильную посттрансфузионную реакцию, реакцию «трансплантат против хозяина», острое трансфузионное поражение легких, передачу цитомегаловирусной инфекции, вируса Эпштейна — Барр, вируса Т-клеточного лейкоза человека, резко снижает вероятность передачи гепатотропных вирусов, иммуномодуляцию и передачу прионов (возбудителя болезни Крейтцфельдта — Якоба) [2].
В соответствии с техническим регламентом, утвержденным постановлением правительства от 26 января 2010 года № 29 [3], определены приемлемые характеристики качества различных трансфузионных сред: в эритроцитсодержащих компонентах, полученных методом афереза, должно содержаться не более 1х106 лейкоцитов в одной дозе, для концентрата тромбоцитов — не более 0,05х109 лейкоцитов в одной дозе, для плазмы — не более 0,1х109 лейкоцитов в литре. В соответствии с требованиями Совета Европы [4] компонент крови для трансфузии после удаления лейкоцитов должен содержать менее 1х106 клеток для профилактики посттрансфузионных реакций, обусловленных «остаточными лейкоцитами» [5]. Фильтрация компонентов крови необходима, что, в свою очередь, стимулирует разработку методов валидации контроля остаточных лейкоцитов. Согласно требованиям стандарта качества [5], концентрации лейкоцитов должны находиться в области значений, которые могут быть определены только на приборах с высокой разрешающей способностью. Гемоцитометрия Nageotte была первым практическим методом для подсчета остаточных клеток в компонентах крови и считалась подходящей для рутинного контроля качества [6—8]. Описанный в 1990-х годах данный способ определения с использованием метода световой микроскопии и гемоцитометра большого объема (счетной камеры Nageotte) не позволяет провести экспертную оценку качества фильтрации в силу недостаточной чувствительности метода и характеризуется высокой вариабельностью получаемых результатов [6—8]. Метод Nageotte слишком трудоемкий и неуместен в качестве метода выбора, когда нужно тестировать большое количество образцов [9].
Для преодоления этих трудностей были разработаны альтернативные методы подсчета: автоматизированный объемный капиллярный цитометр [10], проточные цитометрические методы [11, 12] и методы полимеразной цепной реакции [13]. В нескольких исследованиях [10, 14, 15] сравнили количество лейкоцитов, подсчитанных автоматическими методами, с результатами подсчета лейкоцитов, полученными с помощью гемоцитометрии Nageotte. Использование многократных разбавлений показало, что точность ге- моцитометра Nageotte была низкой при малых концентрациях остаточных клеток, а результаты были ниже по сравнению с результатами, полученными с помощью автоматизированных методов [6, 16]. Большое количество исследований посвящено сравнению гемоцитометрии Nageotte с различными автоматизированными методами подсчета, основанными на технологии проточной цитометрии [17]. Использование гематологических анализаторов для подсчета остаточных лейкоцитов крайне ограничено в связи с недостаточной чувствительностью анализа и отсутствием контрольных материалов. А.И. Костин и соавт. [1] отмечают при подсчете лейкоцитов в эритроцитсодержащих компонентах сходство результатов подсчета лейкоцитов до фильтрации обоими методами и допускают возможность использования обычного гематологического анализатора, прошедшего процедуру валидации, при необходимости определения количества лейкоцитов в эритроцитсодержащих компонентах, не подвергавшихся лейкоредукции. Авторы [1] отмечают, что количество остаточных лейкоцитов было выше рекомендованного экспертами Совета Европы [4].
Целью данного исследования была сравнительная характеристика использования проточного цитометра и гематологического анализатора для контроля содержания остаточных лейкоцитов в плазме крови.
Материалы и методы
В качестве анализируемой трансфузионной среды была выбрана плазма крови. Выбор плазмы крови в качестве анализируемой трансфузионной среды был обусловлен тем, что плазма крови — один из самых широко востребованных компонентов крови, при этом стандарты качества в отношении «остаточных лейкоцитов» для плазмы стали применяться относительно недавно по сравнению с эритроцитсодержащими компонентами крови и концентратами тромбоцитов [18].
Для исследования использован 191 образец донорской плазмы крови, произведенный в ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России, г. Новосибирск.
Для подсчета «остаточных лейкоцитов» в плазме кро — ви на проточном цитометре Navios Beckman Coulter (США) использовали набор реагентов Beckman Coulter LeukoSure (США). Образец плазмы крови лизиро- вали и проводили через процедуру повышения проницаемости мембран с использованием оригинального лизирующего реагента LeukoSure, Beckman Coulter (США). При помощи РНКазы удаляли РНК, и красящий реагент, содержащий йодид пропидия, связывался только с ДНК. Ядросодержащие клетки в образце флуоресцировали с интенсивностью пропорциональной содержанию ДНК. Зрелые эритроциты и тромбоциты, не содержащие ДНК, не связывают краситель. Непосредственно перед анализом добавляли 100 мкл гомогенизированных флуоросфер LeukoSure, осторожно перемешивали, пробирки загружали в карусель для автоматического анализа. Для анализа использовалось фиксированное количество — 10 000 клеток: после того как на проточном цитометре проанализировали 10 000 клеток, протокол измерения останавливали. В регион обнаружения были включены только неповрежденные лейкоциты. При помощи проточного цитометра Navios Beckman Coulter измеряли флуоресценцию каждой помеченной клетки. Так как зрелые тромбоциты и «красные клетки» крови не содержат
ДНК, то помеченные клетки представляли собой лейкоцитарный компонент образца.
Процедура лизиса и окрашивания, настройка проточного цитометра и создание протоколов измерения проходили согласно инструкции производителя к комплекту реагентов. Линейность измерения лейкоцитов, заявленная производителем, определена диапазоном от 0 до 400 клеток в 1 мкл образца. Контроль качества измерений содержания лейкоцитов в плазме крови проводили с использованием двух уровней контрольных материалов, Leuko-Trol Platelet Control Cells Low/ High Beckman Coulter в каждой аналитической серии. Контрольные материалы для оценки качества измерения остаточных лейкоцитов соответствовали следующим диапазонам измерений: 0,5-4,5 клетки в 1 мкл и 14,5-25,5 клетки в 1 мкл соответственно.
В этих же образцах плазмы крови содержание лейкоцитов определяли при помощи автоматического гематологического анализатора Sysmex XT-4000i (Япония) согласно стандартному протоколу работы на автоматическом гематологическом анализаторе. В данном гематологическом анализаторе для подсчета количества лейкоцитов используется также принцип флуоресцентной проточной цитометрии. Проба направляется в проточную кювету. Образец подсвечивается лучом полупроводникового лазера, который может разделять клетки посредством трех различных сигналов: прямо рассеянный свет (прямое рассеяние/FSC), боковой рассеянный свет (боковое рассеяние/SSC), боковой флуоресцентный свет (боковая флуоресценция/SFL). Интенсивность прямого рассеяния указывает на объем клетки. Боковое рассеяние предоставляет информацию о содержимом клетки: о ядре и гранулах. Боковая флуоресценция указывает на количество ДНК и РНК в клетке. Клетки со схожими физико-химическими свойствами формируют кластер на графическом изображении, известном как диаграмма рассеивания.
Линейность измерения содержания лейкоцитов в режиме анализа биологической жидкости, заявленная производителем, определена в диапазоне 0,05х103 до 10,000х103 клеток в 1 мкл образца. В связи с тем что нет коммерческих контрольных материалов, разработанных для контроля остаточных лейкоцитов и аттестованных для автоматического гематологического анализатора Sysmex XT-400, контроль качества измерений содержания лейкоцитов в образцах плазмы крови проводили с использованием трех уровней контрольных материалов: Liquichek Hematology Control (X) Levels 1, 2 and 3 Bio-Rad. Контрольные материалы для оценки качества измерения остаточных лейкоцитов соответствовали следующим диапазонам измерений: (3,0- 4,6)х103 клеток в 1 мкл, (6,3-8,3)х103 клеток в 1 мкл и (16,7-20,9)х103 клеток в 1 мкл соответственно.
Статистическая обработка результатов произведена с использованием статистических критериев в программе Statistica 6.0. Полученные результаты измерения количества остаточных лейкоцитов методом проточной цитометрии проверены на нормальность распределения при помощи метода Колмогорова — Смирнова. Результаты представлены в виде медианы, межквартильного интервала (25 и 75 % квартили).
Результаты
Количество лейкоцитов в анализируемых образцах плазмы, определенных при помощи проточного цитометра и гематологического анализатора, представлено в таблице 1.
Обращала на себя внимание неоднородность распределения количества остаточных лейкоцитов в различных образцах донорской плазмы (рис. 1). 98,95 % анализируемых образцов донорской плазмы имели количество остаточных лейкоцитов менее 100 кл/мкл. 2 образца донорской плазмы содержали лейкоциты 140 и 217 кл/мкл соответственно. Большая часть (83 %) анализируемых образцов плазмы имела количество остаточных лейкоцитов меньше либо равное 15 кл/мкл, из них 20 % имело нулевое содержание остаточных лейкоцитов, определенное методом проточной цитометрии.
Количество лейкоцитов 0,05х103 кл/мкл соответствовало нижней границе линейности измерения анализатора в режиме биологической жидкости. Соответственно результаты измерения количества лейкоцитов, находящиеся ниже предела линейности (85 % образцов), не могли быть оценены достоверно.
При оценке остаточного количества лейкоцитов повышенного внимания заслуживали образцы с малым количеством лейкоцитов, поскольку в связи с повышающимися требованиями к компонентам крови приоритет должен быть отдан использованию образцов с наименьшим содержанием остаточных лейкоцитов.
Имелась значимая корреляция (r = 0,96718, p = 0,95) между количеством остаточных лейкоцитов, определенных при помощи проточного цитометра, и количеством лейкоцитов, определенных при помощи гематологического анализатора (рис. 2).
Таблица 1. Количество остаточных лейкоцитов в плазме донорской крови, определенное при помощи проточного цитометра и автоматического гематологического анализатора
Table 1. Use of a flow cytometer and a hematology analyzer for counting residual leucocytes in donor plasma
Проточный цитометр, количество лейкоцитов, кл/мкл Flow cytometer, WBC cells/μΙ | Гематологический анализатор, количество лейкоцитов, кл/мкл Hematology analyzer, WBC cells/μΙ |
|---|---|
2,000 (1,00;5,00) | 10,000 (0,00;10,00) |
Рисунок 1. Содержание остаточных лейкоцитов в плазме донорской крови, определенное при помощи проточного цитометра
Figure 1. Residual leucocytes content in donor plasma determined by a flow cytometer
Рисунок 2. Корреляция значений количества лейкоцитов, измеренных при помощи проточного цитометра и гематологического анализатора (г = 0,96718, p = 0,95)
Figure 2. Correlation between WBC estimated by a flow cytometer and a hematology analyser (r = 0,96718, p = 0,95)
Обсуждение
Развитие технологий афереза позволяет производить плазму, практически не содержащую клеток крови, что, в свою очередь, требует наличия простого, объективного и точного метода подсчета остаточных клеток крови. В данном исследовании сравнили использование автоматического гематологического анализатора Sysmex XT-4000i и проточной цитометрии (Navios) с коммерческим набором для подсчета остаточных лейкоцитов в плазме крови. В отсутствие метода «золотого стандарта», учитывая, что не проводили эксперименты по разбавлению, основной целью было выяснить соответствие между этими методами и преимущества использования в реальных условиях работы лаборатории.
Обнаружена сильная корреляция значений количества лейкоцитов, измеренных при помощи проточного цитометра Navios и гематологического анализатора Sysmex XT-400 (г=0,96718, p=0,95), что свидетельствует о хорошей сопоставимости методов и, вероятно, возможной взаимозаменяемости в условиях работы лаборатории.
Согласно анализу на гематологическом анализаторе, все компоненты донорской плазмы соответствовали техническому регламенту, но пороговые значения прибора не позволяли точно оценить низкие значения концентраций клеток после лейкоредукции.
Лейкоциты в плазме крови способны к активации во время хранения и секреции цитокинов и факторов роста, что, в свою очередь, может вызвать трансфузионные реакции у реципиента [19, 20]. Относительно большое количество остаточных лейкоцитов (до 100 кл в мкл) допускается согласно техническому регламенту [3], но адаптации Европейского совета [4] рекомендуют использовать продукты плазмы с наименее возможным содержанием остаточных клеток. С учетом того, что отдается предпочтение использованию образцов с минимальным содержанием остаточных клеток, предпочтительнее использовать проточную цитометрию с коммерческим набором реагентов для подсчета остаточных лейкоцитов в продуктах крови. Кроме того, наличие аттестованных контрольных материалов с диапазонами значений низких концентраций лейкоцитов свидетельствует в пользу выбора метода проточной цитометрии для рутинной оценки количества остаточных клеток в продуктах крови, так как позволяет сделать выводы о воспроизводимости и правильности проводимых измерений. К недостаткам данного метода можно отнести высокую стоимость по сравнению с использованием гематологического анализатора и наличие технической подготовки оператора прибора при настраивании протоколов. Оба метода не являются трудоемкими и могут использоваться для большого потока исследований.
Таким образом, для полноценного удаления лейкоцитов из трансфузионных сред с целью снижения риска трансфузионных осложнений необходим правильный контроль качества компонентов крови в отношении количества остаточных лейкоцитов. Результаты настоящего исследования показали, что подсчет остаточных лейкоцитов плазмы крови для проверки на соответствие техническому регламенту возможен как при использовании технологии проточной цитометрии, так и при использовании автоматического гематологического анализатора. Применение метода проточной цитометрии позволяет с высокой точностью производить подсчет остаточных лейкоцитов в компонентах крови за счет улавливания наименьших значений. Использование проточного цитометра с коммерческим анализом набора лучше подходит для образцов с минимальным количеством клеток до 15 клеток в мкл по сравнению с использованием гематологического анализатора.
Значительная вариабельность содержания остаточных лейкоцитов в образцах плазмы крови свидетельствует о целесообразности проверки содержания лейкоцитов во всех компонентах крови.
1. Костин А.И., Майорова О.А., Ложкин А.В. и др. К вопросу о контроле качества эритроцитсодержащих компонентов крови, обедненных лейкоцитами. Трансфузиология. 2011; 12(2): 12–33.
2. Максимов В.А. Инфекционная безопасность донорской крови и ее компонентов. Санэпидемконтроль. Охрана труда. 2009; 3.
3. Постановление Правительства РФ от 26 января 2010 г. № 29 «Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии» (с изменениями и дополнениями).
4. Council of Europe Publishing. Strasbourg, France. Guide to the preparation use and quality assurance of blood components, 7th edition. 2001. 127–32.
5. Зарубин М.В., Саратова О.Е., Веревкина Л.Н., Жибурт Е.Б. Стратификация плазмы по содержанию лейкоцитов. Актуальные вопросы трансфузиологии и клинической медицины. 2015; 1: 67–70.
6. Dzik S., Moroff G., Dumont L. A multicenter study evaluating three methods for counting residual WBCs in WBC-reduced blood components: Nageotte haemocytometry, flow cytometry, and microfluorimetry. Transfusion. 2000; 40: 513–20.
7. Van Der Meer P.F., Gratama J.W., Van Delden C.J., et al. Comparison of five platforms for enumeration of residual leucocytes in leucoreduced blood components. Br J Haematol. 2001; 115: 953–62.
8. Dzik W.H., Ragosta A., Cusack W.F. Flow-cytometric method for counting very low numbers of leukocytes in platelet products. Vox Sang. 1990; 59: 153–9.
9. Palmer D.S., Birch P., O’Toole J., et al. Flow cytometric determination of residual white blood cell levels in preserved samples from leukoreduced blood products. Transfusion. 2008; 48(1): 118–28.
10. Adams M.R., Johnson D.K., Busch M.P., et al. Automated volumetric capillary cytometry for counting white cells in white cell-reduced plateletpheresis components. Transfusion. 1997; 37: 29–37.
11. Wenz B., Burns E.R., Lee V., Miller W.K. A rare-event analysis model for quantifying white cells in white cell-depleted blood. Transfusion. 1991; 31: 156–9.
12. Barclay R., Walker B., Allan R., et al. Flow cytometric determination of residual leucocytes in filter-depleted blood products: an evaluation of Becton-Dickinson’s Leuco COUNT system. Transfus Sci. 1998; 19: 399–403.
13. Lee T.H., Stromberg R.R, Heitman J., et al. Quantification of residual white cells in filtered blood components by polymerase chain reaction amplification of HLA DQ-A DNA. Transfusion 1994; 34: 986–94.
14. Dumont L.J., Dumont D.F. Enhanced flow cytometric method for counting very low numbers of white cells in platelet products. Cytometry. 1996; 26: 311–6.
15. Dzik W.H., Rebulla P. Multicenter evaluation of methods for counting residual white cells in leukocyte-depleted red blood cells. Vox Sang. 1994; 66: 25–32.
16. van der Meer P.F., Gratama J.W., van Delden C.J., et al. Comparison of five platforms for enumeration of residual leucocytes in leucoreduced blood components. Br. J. Haematol. 2001; 115: 953–62.
17. Kyriakou E., Nearchakos N., Bonovas S. Comparison between Nageotte and flow cytometric counting of residual leucocytes in freshly prepared leucocytereduced red blood cell components. Transfus Apher Sci. 2018. DOI: 10.1016/j. transci.2018.06.002 [Epub ahead of print]
18. Masse M. Universal leukoreduction of cellular and plasma components: process control and performance of the leukoreduction process. Tranfus Clin Biol. 2001; 8: 297–302.
19. Muylle L. The role of cytokines in blood transfusion reactions. Blood Rev. 1995; 9: 77–83.
20. Sedlmayr P., Blaschitz A., Wilders-Truschnig M., et al. Platelets contain interleukin-1 alpha and beta which are detectable on the cell surface after activation. Scand J Immunol. 1995; 42: 209–14.
Клинический анализ крови (норма и отклонения) у детей и взрослых — Мир здоровья
Начнем с того: «Как и когда сдавать анализ крови?»
Вот некоторые правила сдачи крови:
- Для данного обследования используют капиллярную кровь, которую берут из пальца. Реже, по указаниям доктора,могут использовать кровь из вены.
- Анализ осуществляют утром. Пациенту запрещено употреблять пищу, воду за 4 ч. до взятия образца klinicheskii_analiz_kroviкрови.
- Основные медицинские принадлежности, которые применяют для взятия крови – скарификатор, вата, спирт.
Правила сбора крови в мед. учреждениях:
- Палец, из которого планируют взятие крови, обрабатывают спиртом. Для лучшего забора крови полезно предварительно растереть палец, чтобы обеспечить к нему лучший приток крови.
- Скарификатором производят прокалывание кожного покрова на пальце.
- Сбор крови осуществляется посредством мелкой пипетки. Образец помещают в стерильный сосуд-трубочку.
Расшифровка основных показателей общего (клинического) анализа крови
Каждый в своей жизни проходил через такую безболезненную процедуру, как сдача крови из пальца. Но для большинства полученный результат остается лишь набором цифр, записанном на бумаге. Разъяснения указанного анализа даст возможность каждому пациенту сориентироваться в отклонениях, что выявлены в крови, причинах что их обусловили.
Гемоглобин
Данный компонент крови представляет собою белок, при помощи которого кислород поступает во все внутренние органы/системы. Количество указаного компонента исчисляется в граммах, что в 1 литре крови.
Норма гемоглобина в крови у детей и взрослых.
Этот показатель будет зависеть от возраста пациента, его пола:
- В 1-й день после рождения: от 180 до 240.
- На первом месяце жизни: 115-175.
- В первые полгода: не выше 140, не ниже 110.
- До 1 года: от 110 до135.
- От 1 до 6 лет: не выше 140, не ниже 110.
- В возрастном промежутке 7-12 лет: не выше 145.
- В интервале 13-15 лет: 115-150.
- С 16 лет (мужчины): от 130 до 160.
- После 16 лет (женщины): от 120 до 140.
Повышение гемоглобина:
- Диагностировании порока сердца.
- Болезнях почек.
- Сердечной/легочной недостаточности.
- Наличии у пациента патологий, связанных с кроветворением. Понижение гемоглобина:
- Дефицита витаминов/железа.
- Значительной потери крови.
- Рака крови.
- Анемии.
- Жесткой диеты, что привела к истощ
Эритроциты
Внутри рассматриваемых компонентов содержится гемоглобин. Основное назначение эритроцитов — перенос кислорода к внутренним органам. Зачастую в таблице вместо единицы измерения эритроцитов можно видеть аббревиатуру RBC.
Норма содержания эритроцитов в крови у детей и взрослых.
Приведенный показатель необходимо множить на 1012. Полученный результат будет равен числу эритроцитов, что присутствуют в 1 л. крови:
- У новорожденных в 1-й день жизни: не менее 4,3, не более 7,6.
- У грудничков до месяца этот показатель снижается: 3,8-5,6.
- 1-6 месяцев: от 3,5 до 4,8.
- До 1 года: не выше 4,9, не ниже 3,6.
- От 1 до 6 лет: от 3,5 до 4,5.
- В возрастном интервале 7-12 лет нижняя граница допустимой нормы увеличивается до 4,7.
- В подростковом периоде (до 15-летнего рубежа): 3,6-5,1.
- С16-летнего возраста (мужчины): не выше 5,1, не ниже 4.
- С 16 лет (женщины): от 3,7 до 4,7.
Причины повышенного и пониженного уровня эритроцитов у детей и взрослых.
Факторы, что провоцируют повышение/понижение численности эритроцитов в крови аналогичны тем, что вызывают повышение/понижение гемоглобина.
Ширина распределения эритроцитов в общем анализе крови.
Указанный параметр напрямую зависит от размеров эритроцитов: при выявлении большого количества различных по размеру эритроцитов во взятом образце крови можно говорить о высокой ширине распределения эритроцитов.
Норма ширины распределения эритроцитов в крови у детей и взрослых.
Данный показатель является идентичным для детей, взрослых, и может варьироваться от 11,5 до 14,5%.
Причины повышенного и пониженного уровня ширины распределения эритроцитов у детей и взрослых.
Отклонение от нормы рассматриваемого показателя может возникнуть на фоне неправильного питания, анемии, обезвоживания организма.
Средний объем эритроцитов в общем анализе крови.
Этот параметр крови способствует получению информации о размерах эритроцитов. Измеряется в фемтолитрах/микрометрах в кубе. Рассчитывают данный объем по несложной формуле, для которой нужно знать процент гематокрита, количество эритроцитов.
Ширина распределения эритроцитов – норма у детей и взрослых.
Независимо от возраста, пола пациента,в норме рассматриваемый параметр крови (MCV) должен быть не выше 95 фл, не ниже 80 фл.
Причины повышенных и пониженных показателей ширины распределения эритроцитов.
Понижение — зачастуют возникает вследствие недостатка железа.
Увеличение показателя MCV свидетельствует о дефиците некоторых микроэлементов.
Среднее содержание гемоглобина в эритроците
Полученный показатель (MCH) отображает количество гемоглобина, что содержится внутри 1-го эритроцита. Рассчитывается по определенной формуле, для которой нужно знать количество гемоглобина+эритроцитов. Измеряют указаный параметр в пикограммах. Норма MCH одинакова для мужчин, женщин, детей: 24-33 пг.
Понижение — зачастую возникает вследствие железодефицитной анемии.
Увеличение показателя MCH является результатом дефицита фолиевой кислоты/витамина В12.
Средняя концентрация гемоглобина в эритроците
Рассматриваемый параметр (MCHC) получают путем математических исчислений, в которых используют гемоглобин+гематокрит. Единицей измерения являются %. Норма содержания гемоглобина в эритроците варьируется в пределах 30-38%.
Снижение, причины:
- Болезни крови.
- Дефицит железа.
Вероятность повышения рассматриваемого показателя небольшая.
Скорость оседания эритроцитов в общем анализе крови (СОЭ)
Этот показатель (СОЭ) получают путем отстаивания взятого образца крови. Определяется количеством, формой эритроцитов, измеряется в мм/ч. На рассматриваемый процесс также оказывает влияние количество белков в плазме.
Норма скорости оседания эритроцитов в крови у детей и взрослых.
Этот параметр не претерпевает особых изменений с возрастом, однако различия присутствуют:
- 1-й день жизни: 2-4.
- У малышей до месяца: от 4 до 8.
- В период до 6 мес. норма СОЭ составляет 4-10.
- От 1 до 12 лет: не выше 12, не ниже 4.
- От 13 до 15 лет нижняя граница нормы увеличивается до 15.
- С 16 лет (мужчины): 1-10.
- С 16 лет (женщины): 2-15.
Причины повышенной и пониженной скорости оседания эритроцитов (CОЭ) у детей и взрослых.
Повышение, причины:
- Инфицирование организма.
- Беременность.
- Рак.
- Анемия.
Снижение СОЭ — результат заболеваний крови.
Лейкоциты
Это живые клетки организма, что продуцируются в лимфоузлах, костном мозге, выполняют контролирующую функцию. Разновидностей рассматриваемых компонентов крови несколько: нейтрофилы, моноциты, эозинофилы, лимфоциты, базофилы.
Норма лейкоцитов дети (взрослые):
Полученный результат будет соответствовать процентному соотношению лейкоцитов, что в норме присутствуют в 1 л крови:
- В 1-й день жизни: от 8,5 до 24,5.
- У малышей до 1 мес.: от 6,6 до 13,8.
- В первые полгода норма не должна превышать 12,5, не может быть меньшей 5,5.
- В возрастном интервале от 1 мес. до 1 года: от 6 до 12% на литр крови.
- От 1 до 6 лет: не выше 12, не ниже 5.
- В возрасте 7-12 лет: от 4,4 до 10.
- В подростковом периоде (после 15-летнего рубежа): не выше 9,5, не ниже 4,4.
- С 16 лет (мужчины/женщины): от 4 до 9.
Повышение от нормы:
- Воспалительные явления в организме. Сюда относят послеоперационный период, ЛОР-заболевания, болезни нижних дыхательных путей, повреждение кожных покровов врезультате травмирования/ожога. При онкозаболеваниях общее тестирование крови также будет показывать завышенный уровень лейкоцитов.
- Беременность.
- Менструация.
- Вакцинация.
Снижение лейкоцитов:
- Дефицит витамина В12.
- Болезни крови.
- Определенная группа инфекционных болезней: малярия, вирусный гепатит, брюшной тиф.
- Влияние радиации.
- Системная красная волчанка.
- Прием некоторых препаратов.
- Состояния, при которых возникает иммунодефицит.
Тромбоциты в общем анализе крови
Это мелкие безъядерные клетки, внутри которых содержатся микроэлементы, что обеспечивают свертываемость крови.
Норма тромбоцитов в крови дети (взрослые):
Приведенный показатель необходимо множить на 109.. Полученный результат будет соответствовать количеству клеток, что в норме присутствуют в 1 л крови:
- 1-й день после рождения: 180-490.
- У детишек от 1 мес. до 1 года: не выше 400, не ниже 180.
- От 1 до 6 лет: 160-390.
- В возрастном интервале 7-12 лет: не выше 380, не ниже 160.
- В подростковом периоде (до 15 лет включительно): от 160 до 360.
- С 16 лет (мужчины/женщины): от 180 до 320.
Причины повышенного и пониженного уровня тромбоцитов у детей и взрослых.
Повышение тромбоцитов, причины:
- Воспалительные реакции (в т.ч. послеоперационный период).
- Онкозаболевания.
- Значительные кровопотери.
- Болезни крови.
Снижение тромбоцитов, причины:
- Дефекты в работе костного мозга.
- Цирроз печени.
- Переливание крови.
- Нарушения, связанные с функционированием иммунной системы.
- Болезни крови.
Гематокрит
Посредством данного параметра сопоставляют объем эритроцитов с объемом крови. Единицей измерения гематокрита являются проценты.
Гематокрит, норма, дети (взрослые)
С возрастом указанный параметр претерпевает определенных изменений:
- В 1-й день после рождения:40-66 %.
- У детишек до месяца: от 34 до 55%.
- У грудничков в возрастном интервале 1-6 мес: 32-43%.
- От1 до 9 лет: 34-41%.
- С 9 до 15 лет: 34-45 %.
- С 16 лет (женщины): не выше 45%, не ниже 35%.
- С 16 лет (мужчины): 39-49%.
Гематокрит, повышение:
- Сердечной/легочной недостаточности.
- Обезвоживании.
- Некоторых болезнях крови.
Гематокрит, снижение:
- III-IV тримеестр беременности.
- Анемия.
- Почечная недостаточность.
Гранулоциты
Указанный параметр крови представлен несколькими группами клеток: базофилами, нейтрофилами, эозинофилами. Эти тельца-гранулы – незаменимые учасники в борьбе с инфекциями, микробами.
Норма гранулоцитов:
Абсолютный показатель. В таблицах результатов анализов крови будет обозначаться как GRA#. В этом контексте норма гранулоцитов может варьироваться от 1,2 до 6,8 *109 клеток на 1 литр.
Процентное соотношение гранулоцитов к лейкоцитам. Имеет обозначение GRA %. Норма не должна быть больше 72%, меньше 47%.
Причины повышения гранулоцитов:
- При воспалительных явлениях в организме происходит повышение гранулоцитов в крови.
Причины снижения гранулоцитов:
- Сбои в работе костного мозга, что связаны с продуцированием клеток крови.
- У пациента диагностируется системная красная волчанка.
- Прием некоторых медицинских препаратов.
Моноциты
Важные составляющие иммуной системы. В их обязанности входит распознание опасных для организма микроорганизмов, борьба с воспалительными очагами. Их количество ограничено.
Норма моноцитов в крови у детей и взрослых.
Приведенный показатель (MON%) отображает процент содержания моноцитов в общем количестве лейкоцитов:
- Малыши до 1 года включительно:2-12%.
- От 1 до 15 лет: не выше 10%, не ниже 2%.
- С 16 лет (женщины/мужчины): от 2 до 9%.
Причины повышения и понижения моноцитов в крови у детей и взрослых.
Повышение:
- Заболевания крови.
- Недуги системного характера.
- Инфицирование организма вследствие воздействия грибков, вирусов, паразитов.
- Отравление химикатами.
Понижение:
- Роды.
- Послеоперационная реабилитация.
- Прием противоопухолевых препаратов.
- Воспалительно-гнойные явления.
Нейтрофилы
Указанные клетки помогают организму справиться с инфекциями, ликвидировать собственные вымершие микрочастицы. По своему строению подразделяют на две группы: зрелые, незрелые.
Норма нейтрофилов в крови у детей и взрослых.
Рассматриваемый показатель отображает процент содержания палочкоядерных, сегментноядерных нейтровилов в общем количестве лейкоцитов. Рассмотрим норму палочкоядерных в крови у детей, взрослых:
- В 1-й день после рождения:1-17 %.
- У детишек от1 мес. до 1 года: от 0,5 до 4%.
- Возрастная группа 1-12 лет: 0,5-5%.
- С 13 до 15 лет: не выше 6%, не ниже 0,5.
- С 16 лет (женщины/мужчины): 1-6%.
Показатели нормы сегментоядерных в крови:
- У новорожденных в 1-3 день жизни: не выше 75-80%, не ниже 45%.
- Умалышей от1 мес. до 1 года: от 15 до 45%.
- Возрастная группа 1-6 лет: 25-60%.
- С 7 до 12 лет: не выше 66%, не ниже 34%.
- В подростковом периоде (до 15 лет включительно.): 40-65%.
- 16 лет (женщины/мужчины): 47-72%.
Увеличение численности нейтрофилов:
- Инфицирование организма.
- Онкозаболевания.
- Вакцинация.
- Воспалительные явления.
Снижение нейтрофилов:
- Лечения, направленого на ликвидацию онкозаболеваний: химиотерапия, прием медикаментов. Прием иных препаратов, что угнетают защитные возможности организма.
- Погрешностей в работе костного мозга.
- Облучения.
- «Детских» инфекционных заболеваний (краснуха, корь и т.д.).
- Переизбытка гормонов, что продуцируются щитовидной железой.
Эозинофилы
Очередные представители лейкоцитов. Именно эти клетки активно борются с раковыми клетками, благоприятствуют очищению организма от токсинов, паразитов.
Норма эозинофилов в крови у детей и взрослых.
Приведенный показатель отображает процент содержания эозинофилов в общем количестве лейкоцитов:
- В 1-й день жизни малыша: 0,5-6%.
- В возрастном промежутке 1 мес.-12 лет: не выше 7%, не ниже 0,5%.
- Возрастная группа13-15 лет: не выше 6%, не ниже 0,5%.
- С 16 лет (женщины/мужчины): от 0 до 5%.
Причины повышения и понижения эозинофилов у детей и взрослых.
Увеличение эозинофилов:
- Патологий кроветворной системы.
- Онкозаболеваний.
- Аллергических состояний.
- Паразитарных инвазий.
Снижение эозинофилов:
- Родами.
- Инфицированием организма (в т.ч. послеоперационный период).
- Отравлением химикатами.
Базофилы
При тестировании кровиуказанные клетки могут быть не выявлены: самые немногочисленные элементы имунной системы. Состоят из микрочастиц, что провоцируют возникновение воспалительных явлений в тканях.
Норма базофилов в крови у детей и взрослых.
Отображает процент содержания эозинофилов в общем количестве лейкоцитов. Для детей любого возраста, пациентов мужского/женского пола количество эозинофилов должно составлять 0-1%.
Повышение базофилов:
- Аллергических состояниях.
- Недостатке гормонов: погрешности в работе щитовидной железы, прием гормональных средств.
- Ветрянной оспе.
- Патологиях лимфосистемы.
Снижение базофилов:
- Беременностью/овуляцией.
- Увеличением численности гормонов.
- Стрессом.
Все нормы общего анализа крови детей и взрослых в таблицах
Таблица 1: Нормы клинического анализа крови детей разных возрастов
Таблица 2: Нормы общего анализа крови взрослых (мужчин и женщин)
Таблица 3: Нормальные показатели крови в сравнении у небеременных и беременных женщин в 1 триместре
Таблица 4: Нормы общего анализа крови беременных женщин в 3 триместре беременности
Навигация по записям
Последнее обновление: 21.03.2020
Назад
6 возможных причин низкого уровня лейкоцитов
Белые кровяные тельца, также называемые лейкоцитами, борются с инфекцией. Они перемещаются по вашему телу в вашей крови, ища захватчиков. И ваше тело постоянно производит свежие запасы.
Ваш врач измеряет количество этих клеток, отправляя часть вашей крови в лабораторию для проведения общего анализа крови или общего анализа крови. Количество лейкоцитов — это одно из значений, которое вы получите после этого теста. Он может указывать на диагноз или подтверждать его, а также показывать, работает лечение или нет.
Чаще всего о низком уровне лейкоцитов беспокоиться не о чем.
Что такое «низкий»?
Количество белых кровяных телец (лейкоцитов) варьируется, но нормальный диапазон обычно составляет от 4000 до 11000 на микролитр крови.
Анализ крови, который показывает количество лейкоцитов менее 4000 на микролитр (некоторые лаборатории говорят, что менее 4500), может означать, что ваше тело не может бороться с инфекцией должным образом. Низкое количество иногда называют лейкопенией.
Причины
Ваш врач проведет медицинский осмотр и рассмотрит симптомы, которые у вас есть, а также ваши прошлые медицинские проблемы, чтобы выяснить, что стоит за вашим результатом.
Проблемы с костным мозгом: Губчатый центр ваших костей, называемый костным мозгом, производит клетки крови. Низкое количество лейкоцитов часто связано с проблемами костного мозга. Находиться рядом с определенными химическими веществами, такими как бензол и пестициды, а также с некоторыми видами рака и лечения рака, включая химиотерапию и облучение, может повредить способность вашего костного мозга вырабатывать лейкоциты.
Аутоиммунные заболевания: Некоторые аутоиммунные заболевания, такие как волчанка и ревматоидный артрит, заставляют ваше тело атаковать и разрушать собственные лейкоциты.
Инфекция: Вирусы могут поражать ваш костный мозг и на какое-то время вызывать снижение уровня лейкоцитов. Тяжелые инфекции, такие как инфекции крови, могут привести к тому, что ваш организм использует лейкоциты быстрее, чем он может их вырабатывать. ВИЧ убивает определенный вид белых кровяных телец.
Лекарства: Некоторые лекарства, включая антибиотики, могут разрушать лейкоциты.
Питание: Плохое питание или низкий уровень определенных витаминов, таких как фолиевая кислота и B12, могут повлиять на то, как ваше тело вырабатывает лейкоциты.Злоупотребление алкоголем может сказаться на питательных веществах в вашем организме, а также на количестве лейкоцитов.
Проблемы с селезенкой: Селезенка также производит лейкоциты. Инфекции, сгустки крови и другие проблемы могут привести к опуханию и неправильной работе. Это снизит количество лейкоцитов.
Последующие тесты
Если нет четкой причины для низкого количества лейкоцитов, ваш врач, вероятно, захочет сделать тест еще раз или провести дифференциал или «различие» вместе с общим анализом крови.
Этот другой тест дает гораздо больше деталей.Существуют нормальные диапазоны для каждого из пяти типов лейкоцитов, и некоторые проблемы затрагивают только один тип. Результаты сравнения могут помочь вашему врачу сузить круг вопросов.
Много раз повторный тест покажет, что количество лейкоцитов в норме.
Ваш врач может назначить дополнительные анализы в зависимости от имеющихся у вас симптомов. Например, вас могут проверить на стрептококковое горло или моно. Другие анализы крови позволяют выявить вирусную инфекцию, воспаление или аллергию. Врач может взять образец вашего костного мозга, чтобы убедиться, что он здоров.
Что будет дальше?
Когда у вас очень низкий уровень лейкоцитов, вам может потребоваться принять меры, чтобы избежать инфекции.
Ваш врач может попросить вас посетить гематолога. Это специалист, прошедший дополнительную подготовку по диагностике и лечению проблем со счетом крови.
Если количество лейкоцитов остается низким или продолжает снижаться, обратитесь к врачу, чтобы выяснить, почему это происходит. Правильное лечение должно помочь нормализовать количество лейкоцитов.
Симптомы, причины, диагностика, лечение и профилактика
Обзор
Что такое пиоспермия?
Пиоспермия (также называемая лейкоцитоспермией) — это состояние, при котором в сперме содержится необычно высокое количество лейкоцитов — более 1 миллиона лейкоцитов на 1 миллилитр спермы.
Поскольку лейкоциты могут ослабить сперму, пиоспермия может повредить ее генетический материал. Лейкоциты выделяют мощные вещества, называемые активными формами кислорода (АФК), которые уничтожают организмы, вызывающие инфекции. Но АФК также может влиять на здоровые ткани, включая сперму. АФК разрушают мембрану сперматозоидов, нарушают движение сперматозоидов и повреждают ДНК сперматозоидов.
Насколько распространена пиоспермия?
Менее 5% мужчин с проблемами фертильности имеют диагноз пиоспермии.
Симптомы и причины
Что вызывает пиоспермию?
Пиоспермия может быть вызвана множеством разных причин, в том числе:
- Заражение.
- Воспаление (отек).
- Аутоиммунные состояния (организм атакует сам себя).
- Стриктура уретры (сужение трубки, по которой проходит моча).
- Генитальные инфекции, такие как герпес, гонорея или хламидиоз.
- Варикоцеле (вены, идущие от яичка, расширены или расширены).
- Системное заболевание (по всему телу).
- Редкая эякуляция.
- Употребление табака, марихуаны и алкоголя.
Инфекции мочеполовой системы — одна из потенциальных причин пиоспермии. Обычные организмы включают E. coli, Mycoplasma, Ureaplasma и Chlamydia . В то время как у большинства людей с инфекцией мочеполовой системы есть симптомы, до 10% молодых людей не имеют симптомов или имеют лишь легкие симптомы.
Поскольку некоторые генитальные инфекции могут передаваться половым путем и обычно успешно поддаются лечению, всем мужчинам с диагнозом пиоспермия следует сдавать анализы мочи для поиска организмов, вызывающих инфекцию в мочеполовых путях.
Инфекции женских половых путей могут вызвать серьезные и необратимые проблемы с фертильностью. Поэтому, даже если риск заражения очень низок, мужчинам следует носить презерватив во время полового акта до тех пор, пока анализ мочи не покажет отсутствие инфекции. В случаях, когда тесты выявляют инфекционный организм, супруга или партнер также должны пройти обследование и лечение.
Ведение и лечение
Как лечится пиоспермия?
Удаление лейкоцитов из спермы может улучшить функцию сперматозоидов и повысить частоту наступления беременности.Поскольку антибиотики могут помочь в лечении пиоспермии, мужчины могут получить рецепт на антибиотики и пройти весь курс, даже если в моче не обнаружены микроорганизмы. В редких случаях может быть взят посев спермы.
Нестероидные противовоспалительные препараты (НПВП) также назначаются пациентам с пиоспермией, они также могут улучшить количество сперматозоидов. Пиоспермия также может вылечиться сама по себе.
Есть и другие вещи, которые мужчины могут сделать, чтобы попытаться удалить избыток лейкоцитов из спермы, в том числе:
- Прекращение употребления любых табачных изделий.
- Избегайте употребления слишком большого количества алкоголя.
- Прекращение употребления марихуаны.
- Более частая эякуляция.
Использование антиоксидантных пищевых добавок может снизить выработку спермы и уменьшить влияние лейкоцитов в сперме. Мужчины, пытающиеся забеременеть и страдающие пиоспермией, должны рассмотреть возможность приема антиоксидантных пищевых добавок, включая витамин E, витамин C, коэнзим убихинол-10 (CoQ10), глутатион и другие.
Пиоспермия также лечится путем коррекции аномалий мочеполовой системы, которые могут вызвать инфекцию или воспаление.Методы коррекции включают варикоцелэктомию, операцию по исправлению варикоцеле, которая может улучшить производство спермы и уменьшить количество лейкоцитов в сперме. Другие патологии, которые можно лечить, включают обструкцию предстательной железы с инфекцией и уретральные клапаны.
Последующая деятельность
В качестве последующего наблюдения рекомендуется еще один анализ спермы через три месяца после окончания приема антибиотиков. Если пиоспермия не была успешно вылечена, другие меры включают посев спермы, тестирование на антиспермальные антитела, рентген мочеполовых путей и / или анализ потока мочи.Во многих случаях ваш врач порекомендует лечение в течение 30 дней безрецептурными НПВП.
Биологическое значение лейкоцитов в семенной жидкости
Задача: Проанализировать имеющиеся данные о биологическом значении лейкоцитов (WBC) в сперме пациентов с бесплодием.
Ресурсы данных: Была проанализирована соответствующая литература.
Результаты: Невозможно надежно идентифицировать лейкоциты с помощью обычных методов окрашивания спермы. Пероксидазного метода достаточно для количественного определения гранулоцитов, но иммуноцитология является золотым стандартом для выявления всех популяций лейкоцитов в сперме. Гранулоциты являются наиболее распространенным типом лейкоцитов в сперме (от 50% до 60%), за ними следуют макрофаги (от 20% до 30%) и Т-лимфоциты (от 2% до 5%).Распространенность лейкоцитоспермии (> 10 (6) лейкоцитов / мл спермы) среди пациентов с мужским бесплодием составляет примерно от 10% до 20%. Существуют разногласия по поводу значения лейкоцитов в сперме. В то время как некоторые авторы не наблюдали повреждения сперматозоидов при лейкоцитоспермии, другие нашли доказательства того, что лейкоциты являются значимыми кофакторами мужского бесплодия: [1] количество лейкоцитов в семенах было выше у пациентов с бесплодием, чем у фертильных мужчин; [2] лейкоцитоспермия была связана с уменьшением количества сперматозоидов и нарушением подвижности сперматозоидов; [3] WBC повреждали функцию сперматозоидов и проникновение в яйцеклетку хомячка in vitro и были важными прогностическими факторами неудачи ЭКО-ЭТ.Из-за отсутствия клинических симптомов происхождение лейкоцитов трудно определить. Обычно большинство лейкоцитов происходит из придатка яичка, потому что у мужчин, подвергшихся вазэктомии, в сперме обнаруживается очень мало лейкоцитов. С другой стороны, образцы лейкоцитоспермии показывают низкий уровень лимонной кислоты, что указывает на бессимптомный простатит как источник лейкоцитов в сперме. Удивительно, но примерно 80% лейкоцитоспермических проб являются микробиологически отрицательными. В некоторых случаях Chlamydia trachomatis могла вызвать стойкую воспалительную реакцию, приводящую к лейкоцитоспермии.Повреждение сперматозоидов лейкоцитами может быть опосредовано активными формами кислорода, протеазами и цитокинами. Кроме того, воспаление половых путей способствует образованию антител к сперматозоидам. Поскольку семенная плазма обладает сильными противовоспалительными свойствами и поскольку при простатите и семенном везикулите существует только короткий контакт между спермой и лейкоцитами, воспаления придатка яичка и яичка, вероятно, будут иметь наибольшее влияние на сперму.
Выводы: Существует множество доказательств того, что лейкоциты могут влиять на функцию сперматозоидов.Необходимы дальнейшие исследования для определения кофакторов, которые увеличивают или уменьшают риск повреждения сперматозоидов лейкоцитами.
общего и дифференциального подсчета лейкоцитов и их связи с уровнями циркулирующего интерлейкина-6 у пожилых женщин, проживающих в общинах | Журналы геронтологии: серия A
«> Методы
«> Измерение уровня IL-6, общего и дифференциального подсчета лейкоцитов
IL-6 измеряли в двух экземплярах с помощью твердофазного иммуноферментного анализа из замороженной сыворотки с помощью коммерческого набора (High-Sensitivity Quantikine Kit, R&D Systems, Миннеаполис, Миннесота), и в анализе использовали среднее из двух измерений (8 ). Общее и дифференциальное количество лейкоцитов получали с помощью счетчика Коултера в хорошо стандартизированной коммерческой лаборатории.
«> Результаты
Средний возраст участников исследования составлял 77,4 года со стандартным отклонением 7,8 года. 72% участников исследования были белыми, а 28% — нет. Их статус курения был разделен на категории: никогда не курили (53%), бывшие курильщики (36%) и нынешние курильщики (11%). В таблице 1 приведены средние, медианные и процентильные значения всех количеств лейкоцитов и уровней IL-6 для исследуемой популяции.
Потенциальное влияние возраста, расы и статуса курения на уровни IL-6 и количество лейкоцитов оценивали с помощью двумерного регрессионного анализа (таблица 2). Как и ожидалось, уровни IL-6 были значительно связаны с возрастом и статусом курения, но не с расой. Медианные уровни IL-6 увеличивались на 13% в возрасте 10 лет, на 23% у бывших курильщиков по сравнению с никогда не курившими и на 61% у нынешних курильщиков по сравнению с никогда не курившими. Среднее количество лейкоцитов было значительно ниже среди участников, которые не были белыми, и выше среди курильщиков, но они не сильно различались с возрастом.Что касается дифференциального подсчета лейкоцитов, количество нейтрофилов и лимфоцитов было значительно выше среди курильщиков. Все, кроме лимфоцитов и эозинофилов, были значительно ниже у участников, которые не были белыми. Только количество лимфоцитов было обратно пропорционально возрасту.
Затем оценивали взаимосвязь между количеством лейкоцитов и уровнями IL-6. Сначала средние значения были сопоставлены со стандартными отклонениями общего количества лейкоцитов и каждым дифференциальным подсчетом по квартилям уровня IL-6. Мы обнаружили ступенчатое увеличение общего количества лейкоцитов, нейтрофилов, моноцитов и эозинофилов в квартилях IL-6 (таблица 3).По квартилям IL-6 различия в общем количестве лейкоцитов, нейтрофилов, моноцитов (все p <0,001) и количестве эозинофилов ( p = 0,02) были очень значимыми. Статистически значимых различий в количестве лимфоцитов или базофилов не отмечено (таблица 3).
Анализ множественной линейной регрессии проводился с использованием log IL-6 в качестве показателя результата и различных количеств лейкоцитов (общее количество лейкоцитов в единицах 1000 / мм 3 и дифференциальное количество в единицах 1 / мм 3 ) в качестве предикторов ( отдельные модели, каждая с поправкой на возраст, расу и статус курения, а также без поправки на них).Общие лейкоциты, нейтрофилы, моноциты и эозинофилы показали значительную грубую и скорректированную связь с уровнями IL-6 (таблица 4). Эти результаты показывают, например, увеличение среднего уровня IL-6 на 13% (грубый) или 12% (скорректированный) на каждые 1000 / мм 3 увеличения общего количества лейкоцитов. Кроме того, эти результаты также предполагают, что оцениваемые смешивающие факторы оказали минимальное влияние на выявленные ассоциации уровней IL-6 с общим и специфическим дифференциальным количеством лейкоцитов. Количество лимфоцитов и базофилов не имело значительной связи с уровнями IL-6 (таблица 4).
Кроме того, с использованием скорректированной модели многомерной регрессии, прогнозируемые уровни IL-6 были рассчитаны на основе медианы и 1 или 2 стандартных отклонений общего и дифференциального количества лейкоцитов для участников в возрасте 78 лет (средний возраст исследуемой популяции). ), а не белых, а нынешних курильщиков. Как показано в таблице 5, подсчет общего количества лейкоцитов, нейтрофилов, моноцитов и эозинофилов на 1 или 2 стандартных отклонения выше их медианы, но не лимфоцитов или базофилов, предсказывает значительно более высокие уровни IL-6.Вместе эти результаты показывают, что подсчет общего количества лейкоцитов, нейтрофилов, моноцитов и эозинофилов позволяет прогнозировать уровни IL-6 (таблицы 4 и 5), подтверждая ассоциации общего и специфического дифференциального количества лейкоцитов с уровнями циркулирующего IL-6. На рисунке 1 показаны ассоциации общего количества лейкоцитов с log IL-6 (рисунок 1A, частный коэффициент корреляции [ r ] = 0,31, p <0,001) и нейтрофилов с log IL-6 (рисунок 1B, r ). = 0,34, p <0,001) с поправкой на возраст, расу и статус курения.Сглаженные наблюдаемые и подогнанные тренды в значительной степени перекрываются, что указывает на хорошее соответствие модели. Сходные ассоциации наблюдались между количеством моноцитов и эозинофилов и log IL-6 (данные не показаны).
Количество лейкоцитов Всего лейкоцитов, 10 3 / мм 3 4,43 6,3 7,5 9,8 Нейтрофилы, 1 / мм 3 3991 (1406) 2045 2916 3818 67304 9030 1 9030 1 / мм 3 1839 (617) 905 1400 1788 2188 2949 Моноциты, 1 / мм 3 9030 426 550 805 Эозинофилы, 1 / мм 3 148 (108) 38 77 117 195 1 / мм 3 49 (29) 10 28 42 61 111 IL-6, пг / мл 90 305 3.05 (2,29) 0,96 1,55 2,33 3,61 9,35
| Переменная исследования . | Среднее ( SD ) . | 5% . | 25% . | Медиана . | 75% . | 95% . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество лейкоцитов | ||||||||||||
| Всего лейкоцитов, 10 3 / мм 3 | 6.48 (1,74) | 4 | 5,3 | 6,3 | 7,5 | 9,8 | ||||||
| Нейтрофилы, 1 / мм 3 | 3991 (1406) | 2045 | 29305 | 6716 | ||||||||
| Лимфоциты, 1 / мм 3 | 1839 (617) | 905 | 1400 | 1788 | 2188 | 2949 | ||||||
9019 9019 9019| 9019 | 9019 | (182) | 186 | 318 | 426 | 550 | 805 | | ||||
| Эозинофилы, 1 / мм 3 | 148 (108) | 38 117304 | 38 117304 | 77 352 | ||||||||
| Базофилы 1 / мм 3 | 49 (29) | 10 | 28 | 42 | 61 | 111 | ||||||
| ИЛ-6, пг / мл | 3.05 (2,29) | 0,96 | 1,55 | 2,33 | 3,61 | 9,35 | ||||||
, медиана и процентили общего и дифференциального количества лейкоцитов и уровней IL-6.
| Исследуемая переменная . | Среднее ( SD ) . | 5% . | 25% . | Медиана . | 75% . | 95% . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество лейкоцитов | ||||||||||||||||
| Всего лейкоцитов, 10 3 / мм 3 | 4,4 6,3 | 7,5 | 9,8 | |||||||||||||
| Нейтрофилы, 1 / мм 3 | 3991 (1406) | 2045 | 2916 | 3818 | 4811 | 6716 | 1 | 6716 3 | 1839 (617) | 905 | 1400 | 1788 | 2188 | 2949 | ||
| Моноциты, 1 / мм 3 | 450 (182) | 450 (182) | 550 | 805 | ||||||||||||
| Эозинофилы, 1 / мм 3 | 148 (108) | 38 | 9030 5 77117 | 195 | 352 | |||||||||||
| Базофилы 1 / мм 3 | 49 (29) | 10 | 28 | 42 | 61 | |||||||||||
| 111 90-305 IL | ||||||||||||||||
| 3.05 (2,29) | 0,96 | 1,55 | 2,33 | 3,61 | 9,35 | |||||||||||
| Переменная исследования . | Среднее ( SD ) . | 5% . | 25% . | Медиана . | 75% . | 95% . | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество лейкоцитов | ||||||||||||
| Всего лейкоцитов, 10 3 / мм 3 | 6.48 (1,74) | 4 | 5,3 | 6,3 | 7,5 | 9,8 | ||||||
| Нейтрофилы, 1 / мм 3 | 3991 (1406) | 2045 | 29305 | 6716 | ||||||||
| Лимфоциты, 1 / мм 3 | 1839 (617) | 905 | 1400 | 1788 | 2188 | 2949 | ||||||
9019 9019 9019| 9019 | 9019 | (182) | 186 | 318 | 426 | 550 | 805 | | ||||
| Эозинофилы, 1 / мм 3 | 148 (108) | 38 117304 | 38 117304 | 77 352 | ||||||||
| Базофилы 1 / мм 3 | 49 (29) | 10 | 28 | 42 | 61 | 111 | ||||||
| ИЛ-6, пг / мл | 3.05 (2,29) | 0,96 | 1,55 | 2,33 | 3,61 | 9,35 | ||||||
Влияние возраста, расы и статуса курения на уровни IL-6, общее количество лейкоцитов и дифференциальное количество, как показано с помощью коэффициентов регрессии (95% доверительный интервал).
| . | Возраст (× 10 лет) . | . | Цветное против белого . | . | Бывшие курильщики и не курили . | . | Текущие курильщики и не курили . | . | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | |||||
| ИЛ-6 (пг / мл) † | 1,13 * | (1,05, 1,21) | 1,08 | (0,97, 1,21) | 1,23 * | (1,11, 1,38) | *(1,37, 1,91) | |||||
| Всего лейкоцитов (10 3 / мм 3 ) | -0,02 | (-0,19, 0,16) | -0,74 * | (-1,04, -0,4 ) | 0,32 * | (0,03, 0.61) | 1,07 * | (0,62, 1,51) | ||||
| Нейтрофилы (1 / мм 3 ) | 55,18 | (-86,24, 196,6) | -750,73 * | , 5 | 368,82 * | (137,39, 600,25) | 833,75 * | (478,77, 1188,73) | ||||
| Лимфоциты (1 / мм 3 ) | 9030,245 -77,70304102,49 | (-5,06, 210,05) | -67.48 | (-172,56, 37,61) | 187,94 * | (26,76, 349,12) | ||||||
| Моноциты (1 / мм 3 ) | 3,16 | (-15,88,21, | * 9030,2) | (-98,1, -34,31) | 16,07 | (-15,08, 47,23) | 39,52 | (-8,27, 87,32) | ||||
| Эозинофилы (1 / мм 3 ) † | 0,98 ( 0,90, 1,06) | 0,88 | (0,77, 1,00) | 1.01 | (0,88, 1,14) | 0,97 | (0,80, 1,19) | |||||
| Базофилы (1 / мм 3 ) † | 1,01 | (0,94, 1,08) | (9030 0,7) , 0,94) | 1,04 | (0,92, 1,17) | 1,15 | (0,96, 1,39) | |||||
| . | Возраст (× 10 лет) . | . | Цветное против белого . | . | Бывшие курильщики и не курили . | . | Текущие курильщики и не курили . | . | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | |||||
| ИЛ-6 (пг / мл) † | 1,13 * | (1,05, 1,21) | 1,08 | (0,97, 1,21) | 1,23 * | (1,11, 1,38) | *(1,37, 1,91) | |||||
| Всего лейкоцитов (10 3 / мм 3 ) | -0,02 | (-0,19, 0,16) | -0,74 * | (-1,04, -0,4 ) | 0,32 * | (0,03, 0.61) | 1,07 * | (0,62, 1,51) | ||||
| Нейтрофилы (1 / мм 3 ) | 55,18 | (-86,24, 196,6) | -750,73 * | , 5 | 368,82 * | (137,39, 600,25) | 833,75 * | (478,77, 1188,73) | ||||
| Лимфоциты (1 / мм 3 ) | 9030,245 -77,70304102,49 | (-5,06, 210,05) | -67.48 | (-172,56, 37,61) | 187,94 * | (26,76, 349,12) | ||||||
| Моноциты (1 / мм 3 ) | 3,16 | (-15,88,21, | * 9030,2) | (-98,1, -34,31) | 16,07 | (-15,08, 47,23) | 39,52 | (-8,27, 87,32) | ||||
| Эозинофилы (1 / мм 3 ) † | 0,98 ( 0,90, 1,06) | 0,88 | (0,77, 1,00) | 1.01 | (0,88, 1,14) | 0,97 | (0,80, 1,19) | |||||
| Базофилы (1 / мм 3 ) † | 1,01 | (0,94, 1,08) | (9030 0,7) , 0,94) | 1,04 | (0,92, 1,17) | 1,15 | (0,96, 1,39) | |||||
Влияние возраста, расы и курения на уровни IL-6, общее количество лейкоцитов, и дифференциальные подсчеты, как показано коэффициентами регрессии (95% ДИ).
| . | Возраст (× 10 лет) . | . | Цветное против белого . | . | Бывшие курильщики и не курили . | . | Текущие курильщики и не курили . | . | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | |||||
| ИЛ-6 (пг / мл) † | 1,13 * | (1,05, 1,21) | 1,08 | (0,97, 1,21) | 1,23 * | (1,11, 1,38) | *(1,37, 1,91) | |||||
| Всего лейкоцитов (10 3 / мм 3 ) | -0.02 | (-0,19, 0,16) | -0,74 * | (-1,04, -0,44) | 0,32 * | (0,03, 0,61) | 1,07 * | (0,62, 1,51) | ||||
| 55,18 | (-86,24, 196,6) | -750,73 * | (-987,60, 513,85) | 368,82 * | (137,39, 600,25) | *478,77, 1188,73) | ||||||
| Лимфоциты (1 / мм 3 ) | −77.46 * | (-141,70, -13,24) | 102,49 | (-5,06, 210,05) | -67,48 | (-172,56, 37,61) | 187,94 * | (26,76, 349,1299) | ||||
| 3,16 | (-15,88, 22,2) | -66,21 * | (-98,1, -34,31) | 16,07 | (-15,08, 47,23) | 39,52 | -8,27, 87,32) | |||||
| Эозинофилы (1 / мм 3 ) † | 0.98 | (0,90, 1,06) | 0,88 | (0,77, 1,00) | 1,01 | (0,88, 1,14) | 0,97 | (0,80, 1,19) | ||||
| базофилы (1/1/1 / ) † | 1,01 | (0,94, 1,08) | 0,83 * | (0,73, 0,94) | 1,04 | (0,92, 1,17) | 1,15 | (0,96, 1,39) | . | Возраст (× 10 лет) . | . | Цветное против белого . | . | Бывшие курильщики и не курили . | . | Текущие курильщики и не курили . | . |
| Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | |||||
| ИЛ-6 (пг / мл) † | 1,13 * | (1,05, 1,21) | 1,08 | (0,97, 1,21) | 1,23 * | (1,11, 1,38) | *(1,37, 1,91) | |||||
| Всего лейкоцитов (10 3 / мм 3 ) | -0.02 | (-0,19, 0,16) | -0,74 * | (-1,04, -0,44) | 0,32 * | (0,03, 0,61) | 1,07 * | (0,62, 1,51) | ||||
| 55,18 | (-86,24, 196,6) | -750,73 * | (-987,60, 513,85) | 368,82 * | (137,39, 600,25) | *478,77, 1188,73) | ||||||
| Лимфоциты (1 / мм 3 ) | −77.46 * | (-141,70, -13,24) | 102,49 | (-5,06, 210,05) | -67,48 | (-172,56, 37,61) | 187,94 * | (26,76, 349,1299) | ||||
| 3,16 | (-15,88, 22,2) | -66,21 * | (-98,1, -34,31) | 16,07 | (-15,08, 47,23) | 39,52 | -8,27, 87,32) | |||||
| Эозинофилы (1 / мм 3 ) † | 0.98 | (0,90, 1,06) | 0,88 | (0,77, 1,00) | 1,01 | (0,88, 1,14) | 0,97 | (0,80, 1,19) | ||||
| базофилы (1/1/1 / ) † | 1,01 | (0,94, 1,08) | 0,83 * | (0,73, 0,94) | 1,04 | (0,92, 1,17) | 1,15 | (0,96, 1,39) | ||||
| Квартили по IL-6 (диапазон в пг / мл) . | 0% –25% (0–1,6) . | 26% –50% (1,6–2,3) . | 51% –75% (2,3–3,6) . | 76% –100% (3,6–10,1) . | p Значение * . | ||||
|---|---|---|---|---|---|---|---|---|---|
| Всего лейкоцитов, 10 3 / мм 3 | 5,67 (1,43) | 6,44 (1,57) | 6.56 (1,80) | 7,24 (1,79) | <0,001 | ||||
| Нейтрофилы, 1 / мм 3 | 3373,97 (1141,16) | 3850,27 (1256,57) | <.001 | ||||||
| Лимфоциты, 1 / мм 3 | 1734,44 (557,29) | 1941,79 (639,82) | 1809,80 (579,82) | 1871,95 Моноциты, 1 / мм 3 | 381.07 (161,69) | 454,70 (169,92) | 460,86 (182,98) | 503,18 (193,95) | <0,001 |
| Эозинофилы, 1 / мм 3 14305 | 3 14305 )155,08 (125,17) | 159,72 (114,09) | 0,02 | ||||||
| Базофилы, 1 / мм 3 | 45,60 (26,59) | 53,38 (31,82) 45305 | 27304 (30.12).30 |
| Квартили по IL-6 (диапазон в пг / мл) . | 0% –25% (0–1,6) . | 26% –50% (1,6–2,3) . | 51% –75% (2,3–3,6) . | 76% –100% (3,6–10,1) . | p Значение * . |
|---|---|---|---|---|---|
| Всего лейкоцитов, 10 3 / мм 3 | 5,67 (1,43) | 6,44 (1.57) | 6,56 (1,80) | 7,24 (1,79) | <0,001 |
| Нейтрофилы, 1 / мм 3 | 3373,97 (1141,16) | 9085,15 3850,27 (1256,562)4654,80 (1514,68) | <0,001 | ||
| Лимфоциты, 1 / мм 3 | 1734,44 (557,29) | 1941,79 (639,82) | 1809,80 (579,82) | 1809,80 (579,65 | |
| Моноциты, 1 / мм 3 | 381.07 (161,69) | 454,70 (169,92) | 460,86 (182,98) | 503,18 (193,95) | <0,001 |
| Эозинофилы, 1 / мм 3 14305 | 3 14305 )155,08 (125,17) | 159,72 (114,09) | 0,02 | ||
| Базофилы, 1 / мм 3 | 45,60 (26,59) | 53,38 (31,82) 45305 | 27304 (30.12).30 |
( SD ) общего и дифференциального подсчета лейкоцитов в квартилях IL-6.
| Квартили по IL-6 (диапазон в пг / мл) . | 0% –25% (0–1,6) . | 26% –50% (1,6–2,3) . | 51% –75% (2,3–3,6) . | 76% –100% (3,6–10,1) . | p Значение * . | |
|---|---|---|---|---|---|---|
| Всего лейкоцитов, 10 3 / мм 3 | 5.67 (1,43) | 6,44 (1,57) | 6,56 (1,80) | 7,24 (1,79) | <0,001 | |
| Нейтрофилы, 1 / мм 3 | 3373.97 ( | 1256) | ) | 4085,15 (1362,22) | 4654,80 (1514,68) | <0,001 |
| Лимфоциты, 1 / мм 3 | 1734,44 (557,29) | 1941,82,72 | 1871,65 (669.94) | ,21 | ||
| Моноциты, 1 / мм 3 | 381,07 (161,69) | 454,70 (169,92) | 460,86 (182,98) | 503,18 (19002,98) | 503,18 (19002,93) | |
| Эозинофилы, 1 / мм 3 | 134,45 (93,30) | 142,63 (95,67) | 155,08 (125,17) | 159,72 (114,09) | 0,02 | |
| / базо | 45,60 (26.59) | 53,38 (31,82) | 45,54 (27,08) | 50,40 (30,12) | ,30 |
| Квартили IL-6 (диапазон в пг / мл) . | 0% –25% (0–1,6) . | 26% –50% (1,6–2,3) . | 51% –75% (2,3–3,6) . | 76% –100% (3,6–10,1) . | p Значение * . | |
|---|---|---|---|---|---|---|
| Всего лейкоцитов, 10 3 / мм 3 | 5.67 (1,43) | 6,44 (1,57) | 6,56 (1,80) | 7,24 (1,79) | <0,001 | |
| Нейтрофилы, 1 / мм 3 | 3373.97 ( | 1256) | ) | 4085,15 (1362,22) | 4654,80 (1514,68) | <0,001 |
| Лимфоциты, 1 / мм 3 | 1734,44 (557,29) | 1941,82,72 | 1871,65 (669.94) | ,21 | ||
| Моноциты, 1 / мм 3 | 381,07 (161,69) | 454,70 (169,92) | 460,86 (182,98) | 503,18 (19002,98) | 503,18 (19002,93) | |
| Эозинофилы, 1 / мм 3 | 134,45 (93,30) | 142,63 (95,67) | 155,08 (125,17) | 159,72 (114,09) | 0,02 | |
| / базо | 45,60 (26.59) | 53,38 (31,82) | 45,54 (27,08) | 50,40 (30,12) | .30 |
(95% ДИ) общего и дифференциального подсчета лейкоцитов с уровнями IL-6.
| . | Неочищенное . | . | Скорректировано * . | . | ||||
|---|---|---|---|---|---|---|---|---|
| Коэффициент . | 95% ДИ . | Коэффициент . | 95% ДИ . | |||||
| Всего лейкоцитов | 1,13 † | (1,10, 1,16) | 1,12 † | (1,09, 1,16) | ||||
| Нейтрофилы | 1,17 † | † | † | † | (1,13, 1,21) | |||
| Лимфоциты | 1,01 | (0,99, 1,01) | 1.00 | (0,99, 1,01) | ||||
| Моноциты | 1,08 † | (1,05, 1,11) | 1,08 † | (1,05, 1,11) | ||||
| Эозинофилы | † 1 0304 | ) | 1,07 † | (1,02, 1,12) | ||||
| Базофилы | 1,09 | (0,92, 1,30) | 1,07 | (0,90, 1,27) | 45
| |||

 1 — 14.7
1 — 14.7 Используется для выявления нарушений свертывания или заболеваний костного мозга.
Используется для выявления нарушений свертывания или заболеваний костного мозга. Имеет значение в диагностике анемий.
Имеет значение в диагностике анемий.