Почему не наступает беременность
Пашкина Наталья Валентиновна
Заведующая отделением вспомогательных репродуктивных технологий — врач-акушер-гинеколог
Одной из причин не наступления беременности является отсутствие овуляции.
Как правило этому способствуют эндокринные заболевания, такие как:
- гипогонадотропный гипогонадизм (недосточная выработка головным мозгом гормонов, регулирующих работу яичников),
- синдром поликистозных яичников,
- повышение гормона пролактина в крови (гипепролактинемия),
- заболевания щитовидной железы (гипотиреоз),
- нарушение функции надпочечников, недостаточность яичников.
У пациентов могут присутствовать следующие жалобы:
- нерегулярный менструальный цикл,
- редкие менструации,
- может быть даже отсутствие менструации,
-
проблемы с весом: как дефицит веса, так и избыток массы тела.

Возможны также другие жалобы: повышенный рост волос, акне и другие.
Как узнать есть у Вас овуляция или нет
Методов определение овуляции несколько. Самый простой способ определения овуляции в домашних условиях – купить в магазине тесты на овуляцию. Эти тесты похожи на тесты для диагностики беременности.
Как они действуют
Перед овуляцией происходит повышение в крови лютеинизирующего гормона ЛГ, который появляется в моче. Тест на овуляцию как раз и улавливает появление ЛГ в моче.
Какие тесты использовать
На рынке их много, призводители Канада, Китай, Германия и другие (Ovuplan, Clearble, Frautes и и др.)
Обязательно читайте инструкцию! Как правило, все тесты надежны и информативны.
В какой период лучше делать тесты
Тесты как правило необходимо делать с 12 дня цикла, если у Вас 28-дневный цикл. Если у вас цикл короткий (21-26 дней) – с 8 дня.
Если цикл длинный (30-34 дня), то скорее всего овуляция у Вас поздняя и может приходится на 17-21 день и даже позже. Тогда тесты необходимо делать с 14-16 дня.
Причём лучше делать тестирование 2 раза в день – утром и вечером, чтобы не пропустить пик ЛГ (у некоторых он бывает короткий).
Как расшифровать показатели теста
Если у вас 2 полоски, значит тест отицательный и овуляции нет.
В случае появления второй полоски, но она не такая яркая, как первая, то тест тоже отрицательный. В этом случае необходимо продолжать делать тесты до тех пор пока две полоски не будут одинаково окрашены.
Как только цвет полосок станет одинаковым или приближенным по цвету – УРА, тест положительный!
В ближайшие сутки, двое у Вас произойдет овуляция. Занимаемся сексом, получаем удовольствие и визуализируем как в нас зарождается новая жизнь. И все получится! Всем удачи и успехов!
Бывают ли тесты ложно отрицательные или ложно положительные.

К сожалению – да. Поэтому овуляцию отслеживать нужно несколькими методами.
Ультразвуковой мониторинге овуляции
Это метод достаточно эффективный и наглядный.
Коротко о физиологии. На 10—12 день менструального цикла (стандартного менструального цикла продолжительностью 28-30 дней) в яичнике появляется доминантный фолликул — это самый крупный Фолликул в котором будет созревать яйцеклетка. Фолликул растет примерно 2 мм в сутки, овуляция может наступить при размере фолликула 17-25 мм. Фолликул выделяет очень важный гормон, который называется – эстрадиол. В матке, под воздействием эстрадиола растет эндометрий (это внутренняя оболочка матки, где происходят процессы прикрепления эмбриона) . Эндометрий сразу после менструации равен примерно 5 мм, по мере роста фолликула (увеличения концентрации эстрадиола) толщина эндометрия увеличивается с 5 мм до 8-12 мм- эта стадия называется фазой пролиферации. Если овуляция состоялась, то фолликул превращается в «желтое тело», и «желтое тело» начинает вырабатывать прогестерон.
Эти изменения, которые происходят с фолликулом и эндометрием мы с Вами и сможем увидеть на УЗИ!
Если Вы придете на 12 день цикла, я в яичнике увижу крупный фолликул, размером 10-12 мм — это отлично! Далее через 2-3 дня мы с Вами посмотрим его рост и рост эндометрия, помним о том, что скорость роста фолликула и эндометрия примерно 2 мм в сутки. Сделав УЗИ на 14-15 день мы увидим, что фолликул, который вчера был 17-20 мм исчез. Значит произошла овуляция.
Увидим жидкость за маткой, которая тоже говорит о том, что фолликул лопнул. Далее сделав УЗИ на 17- 19-21 день цикла мы констатируем, что на месте лопнувшего фолликула сформировалось желтое тело и произошли характерные изменения в эндометрии. А если Вы, еще в это время делали тесты на овуляцию и если Вы еще сдадите кровь на определение количества гормона прогестерона, мы с наибольшей вероятностью решим, что у Вас была овуляция. Значит нам нужно искать другую причину отсутствия беременности.
Значит нам нужно искать другую причину отсутствия беременности.
Очень важно делать УЗИ мониторинг вместе с выполнением тестов.
Ультразвуковая картина, если овуляции нет
Важно делать ультразвуковой мониторинг не один месяц, а лучше 2-3. Вообще у здоровой женщины могут быть 1-2 раза в год циклы без овуляции. С возрастом к 40 годам количество ановуляторных циклов увеличивается и это норма.
Ранее я рассказывала что мы видим по УЗИ, если все проходит правильно. А теперь поговорим о том, что не так …
-
Мы можем зафиксировать, что доминантный фолликул есть, нормально растет, но на определенном этапе его рост останавливается, не достигнув 17-20 мм. И дальше он начинает уменьшатся(регрессировать). Это нарушение овуляции по типу атрезии фолликула.

- Доминантный фолликул растет, достигает размеров овуляторного, но овуляции не происходит и он продолжает расти дальше, выделяя эстрогены, воздействуя на эндометрий. Так как не формируется «желтое тело», в матке сохраняется стадия пролиферации. И длительная стимуляция эндометрия эстрогенами может приводить к формированию полипов в матке. Это нарушение овуляции по типу персистенции фолликула. Часто такой фолликул мы видим в следующем цикле. И очень часто формируется фолликулярная киста размером от 3 до 8 см. Это пугает моих пациенток. Но, как правило такие кисты проходят через 1-2 месяца. Если мы хотим ускорить этот процесс, то гинекологи назначают противозачаточные таблетки.
-
И последний вариант, доминантный фолликул вырос до овуляторного, но овуляции не произошло, происходит преждевременная лютеинизация, медленное, постепенное сморщивание фолликула. Основная причина гормональные дисфункции: повышение пролактина, тиреотропного гормона, андрогенов.

ЭХОГРАФИЧЕСКИЕ КРИТЕРИИ НАРУШЕНИЙ ОВАРИАЛЬНОГО ЦИКЛА
Высокая частота расстройств менструальной функции, которые в структуре гинекологической патологии составляют 60–70%, обусловливает
К нарушениям овариального цикла относятся синдром поликистоза яичников (СПКЯ), синдром истощения яичников (СИЯ), отсутствие доминантного фолликула, синдром лютеинизации неовулировавшего фолликула (LUF-синдром), недостаточность лютеиновой фазы (НЛФ) менструального цикла, мультифолликулярные яичники, синдром гиперстимуляции яичников.
СПКЯ — это патология структуры и функции яичников, основными проявлениями которой являются хроническая ановуляция и гиперандрогения. Частота СПКЯ составляет около 30% среди пациенток гинекологов-эндокринологов, а в структуре эндокринного бесплодия достигает 75%. СИЯ характеризуется вторичной аменореей с вегетативно-сосудистыми нарушениями у женщин в среднем в возрасте до 38 лет с ранее нормальной менструальной и генеративной функцией. Частота СИЯ в популяции составляет 1,5%, а в структуре вторичной аменореи — до 10% (Жмакин К.Н., 1980; Манухин И.Б. и соавт., 2003).
В диагностике нарушений овариального цикла значительную роль играет ультразвуковое исследование (УЗИ) с допплерометрическим картированием.
Для оценки морфофункционального состояния яичников УЗИ начинают с определения их величины. В репродуктивный период размеры яичников варьируют в зависимости от фазы менструального цикла, однако максимальная длина в норме не превышает 40 мм, ширина — 30 мм, толщина — 25 мм. При этом объем составляет не более 9–10 см3. Допустимая разница между объемами правого и левого яичников достигает в среднем 9–9,5% (Йен С.С.К., Джаффе Р.Б., 1998).
При этом объем составляет не более 9–10 см3. Допустимая разница между объемами правого и левого яичников достигает в среднем 9–9,5% (Йен С.С.К., Джаффе Р.Б., 1998).
Эхографическое сканирование яичников позволяет наиболее точно и неинвазивно оценить динамику развития фолликулярного аппарата, определить момент овуляции, стадии формирования желтого тела.
Так, в раннюю фолликулярную фазу (3–5-й день менструального цикла) при трансвагинальном УЗИ визуализируется в среднем 5 фолликулов диаметром от 2 до 5 мм. Рост фолликулов до такого размера мало зависит от уровня гонадотропных гормонов, в связи с чем данная эхографическая картина в норме отмечается на протяжении всего менструального цикла у пациенток, принимающих гормональные контрацептивы. С 5-го дня цикла активный рост фолликулов происходит под влиянием гонадотропинов. С этого же времени развивается доминантный фолликул. Однако его достоверное определение при УЗИ возможно не ранее 8–12-го дня цикла, когда диаметр фолликула достигает 14 мм и более. Как правило, к периоду овуляции, увеличиваясь на 2–3 мм в день, размер доминантного фолликула составляет 18–24 мм (Митьков В.В., Медведев М.В., 1997).
Как правило, к периоду овуляции, увеличиваясь на 2–3 мм в день, размер доминантного фолликула составляет 18–24 мм (Митьков В.В., Медведев М.В., 1997).
Появление совокупности вышеперечисленных признаков связывают с выбросом лютеинизирующего гормона (ЛГ), что свидетельствует о возможности наступления овуляции. Вместе с тем наличие данных эхографических признаков не позволяет точно предсказать время овуляции, а лишь свидетельствует о ее приближении и вероятном наступлении в течение 24 ч.
Ультразвуковая картина произошедшей овуляции достаточно четко определяется по наличию свободной жидкости в позадиматочном пространстве. Одновременно отмечается исчезновение доминантного фолликула и визуализация на его месте геморрагического тела в виде гетерогенного образования с нечетким, неровным контуром, из которого в последующем формируется желтое тело. Эхографическая картина желтого тела отличается большим разнообразием: от анэхогенного до гиперэхогенного, нередко с причудливой формой содержимого.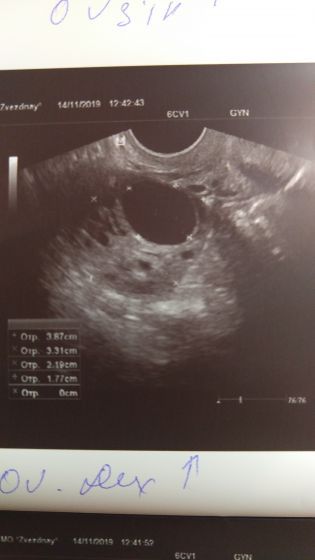 Всевозможные варианты изображений отражают многочисленные процессы, происходящие в желтом теле, такие как кровотечение, образование кровяного сгустка, ретракцию и реабсорбцию жидкой части крови. В связи с этим нередко желтое тело имитирует эктопическую беременность, опухоли яичников и другую патологию (Митьков В.В., Медведев М.В., 1997; Назаренко Т.А. и соавт., 2000). На сегодняшний день цветное допплеровское картирование облегчает визуализацию желтого тела по наличию яркого цветового ореола вокруг образования.
Всевозможные варианты изображений отражают многочисленные процессы, происходящие в желтом теле, такие как кровотечение, образование кровяного сгустка, ретракцию и реабсорбцию жидкой части крови. В связи с этим нередко желтое тело имитирует эктопическую беременность, опухоли яичников и другую патологию (Митьков В.В., Медведев М.В., 1997; Назаренко Т.А. и соавт., 2000). На сегодняшний день цветное допплеровское картирование облегчает визуализацию желтого тела по наличию яркого цветового ореола вокруг образования.
В целом ультразвуковая эхография позволяет в динамике оценить морфологические изменения овулирующего яичника. Однако для полноценного анализа его функционального состояния необходимо исследование яичникового кровотока с помощью цветовой и импульсной допплерографии, так как адекватный уровень артериальной перфузии обеспечивает необходимые условия для роста, созревания фолликула и адекватного синтеза половых гормонов.
Изменения, происходящие в овулирующем яичнике, прямо коррелируют с динамикой внутрияичникового кровотока в течение всех фаз менструального цикла.
В норме перифолликулярный кровоток начи-
нает регистрироваться в фолликулах диаметром более 10 мм с 8–10-го дня 28-дневного менструального цикла. Динамика изменений допплерометрических показателей в данных сосудах может служить критерием для оценки роста, созревания фолликула и его овуляции. К примеру, пульсационный индекс (ПИ) и индекс резистентности (ИР) перифолликулярных артерий овулирующего яичника постепенно снижаются с 1,59 и 0,55 в фазу ранней пролиферации до 1,18 и 0,48 в преовуляторный период. При этом максимальная скорость кровотока (МСК) значительно возрастает приблизительно за 29 ч до разрыва фолликула с 13–14 см/с до 20–25 см/с. Выраженные изменения перифолликулярного кровотока связаны с пиком ЛГ и свидетельствуют о зрелости фолликула и приближении овуляции.
Далее, в течение 4–5 дней после овуляции (период расцвета желтого тела), высокая МСК и самый низкий ИР (0,44) сохраняются. Однако к концу менструального цикла сосудистая резистентность внутригонадного кровотока постепенно возрастает и возвращается к уровню ранней пролиферативной фазы. Об этом свидетельствует повышение ИР в среднем до 0,50.
Об этом свидетельствует повышение ИР в среднем до 0,50.
В сосудах пассивного яичника происходят прямо противоположные изменения. На фоне постоянно высоких индексов сосудистого сопротивления (ИР = 0,57–0,58) МСК постепенно снижается с 11,3 см/с в позднюю пролиферативную фазу до 6,3 см/с в первые дни после овуляции (Зыкин Б.И., Медведев М.В., 2000; Федорова Е.В., Липман А.Д., 2003; Подзолкова Н.М., Глазкова О.Л., 2004).
Следует отметить, что в последние годы с развитием методов вспомогательных репродуктивных технологий исследователями предпринята попытка оценить функциональную зрелость фолликула перед введением разрешающей дозы хорионического гонадотропина (ХГ) у пациенток с бесплодием, исходя из гемодинамических показателей перифолликулярного кровотока. Так, несмотря на установленную прямую корреляцию между размером фолликула и МСК, не выявлено взаимосвязи между скоростью перифолликулярного кровотока и частотой наступления беременности. Также не подтвердилось прогностическое значение показателей перифолликулярной гемодинамики для оценки зрелости яйцеклетки. Однако для определения времени введения разрешающей дозы ХГ исследователи предложили использовать индекс перифолликулярной васкуляризации (общее число фолликулов/число фолликулов с перифолликулярным кровотоком), который коррелировал с количеством аспирированных яйцеклеток (Федорова Е.В., Липман А.Д., 2003).
Однако для определения времени введения разрешающей дозы ХГ исследователи предложили использовать индекс перифолликулярной васкуляризации (общее число фолликулов/число фолликулов с перифолликулярным кровотоком), который коррелировал с количеством аспирированных яйцеклеток (Федорова Е.В., Липман А.Д., 2003).
Вместе с тем доказана прямая зависимость максимальной скорости перифолликулярного кровотока как косвенного показателя степени зрелости яйцеклетки с частотой успешного развития беременности. МСК более 10 см/с достоверно увеличивала качество полученных эмбрионов и их имплантацию. Во многочисленных исследованиях также подтверждены высокое качество и хорошая способность к оплодотворению яйцеклеток, полученных из обильно васкуляризированных фолликулов.
Таким образом, допплерометрическое исследование перифолликулярного кровотока позволяет оценить качество созревающих яйцеклеток, провести их селекцию и оптимизировать время введения разрешающей дозы ХГ, что в свою очередь достоверно повышает частоту наступления беременности (Зыкин Б. И., Медведев М.В., 2000; Подзолкова Н.М., Глазкова О.Л., 2004).
И., Медведев М.В., 2000; Подзолкова Н.М., Глазкова О.Л., 2004).
Нарушения овариального цикла, характеризующиеся отсутствием доминантного фолликула, диагностируются при проведении динамического УЗИ в течение первой фазы менструального цикла. На эхограммах в структуре яичников, как правило, визуализируются преантральные фолликулы диаметром не более 5 мм. В ходе обследования размеры фолликулов не изменяются или увеличиваются незначительно, до 8–10 мм в диаметре. Однако при этом отсутствует доминантный фолликул. При допплерометрическом исследовании не отмечают гемодинамических изменений интраовариального кровотока, характерных для нормального менструального цикла. Данная ультразвуковая картина свойственна в случае гипогонадотропной аменореи, СПКЯ, ановуляции по типу атрезии фолликулов и других патологических состояний, а также гормональной контрацепции (Митьков В.В., Медведев М.В., 1997).
LUF-синдром. Факт персистенции доминантного фолликула устанавливается на основании данных динамического УЗИ в течение периовуляторного периода менструального цикла. Данный синдром характеризуется прогрессивным ростом доминантного фолликула до состояния преовуляторного с дальнейшим сохранением таких размеров и формы до конца второй фазы цикла. При этом лютеинизация неовулировавшего фолликула проявляется утолщением и повышением эхогенности его стенки на фоне циклических изменений толщины и эхогенности эндометрия, характерных для двухфазного цикла.
Данный синдром характеризуется прогрессивным ростом доминантного фолликула до состояния преовуляторного с дальнейшим сохранением таких размеров и формы до конца второй фазы цикла. При этом лютеинизация неовулировавшего фолликула проявляется утолщением и повышением эхогенности его стенки на фоне циклических изменений толщины и эхогенности эндометрия, характерных для двухфазного цикла.
При допплерометрическом исследовании у пациенток с LUF-синдромом регистрируют бедный сосудистый рисунок вокруг фолликула наряду с отсутствием динамических изменений интраовариального кровотока в периовуляторный период. При этом высокий ИР (более 0,50) и низкая скорость перифолликулярного кровотока во вторую фазу соответствуют показателям ранней фолликулярной фазы менструального цикла.
Основными ультразвуковыми признаками НЛФ следует считать отсутствие характерного гетерогенного изображения внутренней структуры желтого тела и истончение стенки. Однако ряд исследователей предлагают использовать уменьшение толщины эндометрия во вторую фазу цикла в качестве единственного надежного критерия диагностики НЛФ в В-режиме.
Допплерометрическое картирование дает возможность на ранней стадии диагностировать данную патологию по наличию единичных сосудистых сигналов в стенке структуры и отсутствию визуализации непрерывного цветового кольца, характерного в норме для активно функционирующего желтого тела. При НЛФ регистрируют высокий ИР (более 0,50) и низкую максимальную скорость (до 13 см/с) интраовариального кровотока, причем степень изменения показателей коррелирует со снижением уровня содержания прогестерона в крови. При этом отсутствуют различия между гемодинамическими показателями в сосудах доминантного и контралатерального яичников, тогда как в норме во все фазы цикла в активном яичнике ИР всегда ниже (Зыкин Б.И., Медведев М.В., 2000; Манухин И.Б. и соавт., 2003; Федорова Е.В., Липман А.Д., 2003).
СИЯ характеризуется уменьшением размеров матки и яичников. У большинства пациенток отсутствует изображение фолликулярного аппарата. При цветном допплеровском картировании внутрияичниковый кровоток не визуализируется либо выявляются единичные цветовые сигналы с низкой скоростью кровотока и ИР более 0,60.
Традиционно критериями ультразвуковой диагностики СПКЯ считают двустороннее увеличение размеров и объема (более 12 см3) яичников, а также визуализацию в паренхиме при сканировании вдоль длинной оси более 10 эхонегативных включений диаметром от 2 до 8 мм. Строму при СПКЯ описывают как утолщенную с повышенной эхогенностью. В зависимости от характера локализации фолликулов выделяют периферический (субкапсулярный) и генерализованный (диффузный) тип СПКЯ.
В клинической практике при СПКЯ достаточно часто величина яичников не отличается от нормальной или даже меньше нормы. Поэтому данный эхографический критерий нельзя считать высокоспецифичным для диагностики СПКЯ. Равным образом, оценка другого дополнительного признака — утолщения и повышения эхогенности стромы — носит субъективный характер. По всей видимости, измерение объема стромы яичника при трехмерном сканировании может позволить более точно оценить строение измененной гонады.
Следует отметить, что при динамическом УЗИ в течение менструального цикла в поликистозных яичниках не визуализируются доминантный фолликул и желтое тело. При цветовом допплеровском картировании выявляют богатый интраовариальный кровоток уже на 3–5-й день менструального цикла, тогда как в норме до 8–10-го дня сосуды стромы не визуализируются.
При цветовом допплеровском картировании выявляют богатый интраовариальный кровоток уже на 3–5-й день менструального цикла, тогда как в норме до 8–10-го дня сосуды стромы не визуализируются.
При импульсной допплерометрии регистрируют высокий ИР (более 0,54), не изменяющийся в течение всего менструального цикла. При этом отмечают более высокие показатели сосудистой резистентности интраовариальной гемодинамики при периферическом расположении фолликулов по сравнению с диффузным. По данным некоторых исследований, при СПКЯ в начале фолликулярной фазы (16,89±2,36) МСК достоверно выше нормы (8,74±0,68), что можно использовать в качестве дополнительного критерия ультразвуковой диагностики СПКЯ (Митьков В.В., Медведев М.В., 1997; Федорова Е.В., Липман А.Д., 2003; Подзолкова Н.М., Глазкова О.Л., 2004).
По данным допплерометрического исследования кровотока в маточных артериях при СПКЯ по сравнению с физиологическим менструальным циклом ПИ повышается, причем возрастание данного показателя в этих сосудах прямо коррелирует с уровнем андростендиона в крови.
Следует отметить, что степень выраженности всех вышеописанных гемодинамических изменений при СПКЯ определяется уровнем тонической гиперсекреции ЛГ и соответствующим изменением соотношения ЛГ/ФСГ (фолликулостимулирующего гормона). Поэтому чем выше показатели сосудистой резистентности интраовариального и маточного кровотока у пациенток со СПКЯ, тем более выражены эндокринные расстройства и тяжелее степень нарушений менструального цикла.
Эхографическая картина мультифолликулярных яичников характеризуется наличием множественных (обычно более 10) эхонегативных включений диаметром 5–10 мм в нормальных или несколько увеличенных в размерах яичниках. Как правило, при динамическом наблюдении в течение нескольких менструальных циклов отмечается нормализация эхографической картины. Чаще всего мультифолликулярная трансформация визуализируется в пубертатный период, в случае гормональной контрацепции, нестойкой ановуляции, хронических воспалительных заболеваний и других состояний. При этом отсутствуют клинические и лабораторные признаки СПКЯ.
При синдроме гиперстимуляции яичников с помощью допплерометрического исследования обнаруживают снижение показателей сосудистой резистентности и повышение максимальной систолической скорости кровотока в маточных и яичниковых артериях (Митьков В.В., Медведев М.В., 1997; Зыкин Б.И., Медведев М.В., 2000; Федорова Е.В., Липман А.Д., 2003).
Приведенные данные свидетельствуют о высокой информативности УЗИ, особенно с применением допплерометрического картирования, в диагностике нарушений овариального цикла, что позволяет широко использовать данный метод для исследования причин бесплодия и контроля его лечения.
ЛИТЕРАТУРА
- Жмакин К.Н. (1980) Гинекологическая эндокринология. Медицина, М., 528 с.
- Зыкин Б.И., Медведев М.В. (2000) Допплерография в гинекологии. Реальное время, М., с. 35–55, 93–98.
- Йен С.С.К., Джаффе Р.Б. (1998) Репродуктивная эндокринология (Пер. с англ.). Медицина, М., Т. 1, 704 с.; Т. 2, 432 с.
- Манухин И.Б., Тумилович Л.Г.
 , Геворкян М.А. (2003) Клинические лекции по гинекологической эндокринологии. МИА, М., 247 с.
, Геворкян М.А. (2003) Клинические лекции по гинекологической эндокринологии. МИА, М., 247 с. - Митьков В.В., Медведев М.В. (1997) Клиническое руководство по ультразвуковой диагностике. Видар, М., Т. 2, с.76–83, 132–146.
- Назаренко Т.А., Дуринян Э.Р., Зыряева Н.А. (2000) Эндокринное бесплодие у женщин. Диагностика и лечение. НЦАГиП РАМН, М., 80 с.
- Подзолкова Н.М., Глазкова О.Л. (2004) Исследование гормонального статуса женщины в практике гинеколога. МЕДпресс-информ, М., 80 с.
- Федорова Е.В., Липман А.Д. (2003) Применение цветового допплеровского картирования и допплерометрии в гинекологии. Видар, М., с. 22–28, 60–70.
- Чайка В.К., Акимов И.К., Попова М.В. (2004) Эпидемиология и структура бесплодного брака в Украине. Новости медицины и фармации в Украине, 9(149): 16.
Адрес для переписки:
Шевчик Елена Евгеньевна
03115, Киев, просп. Победы, 119
Научный центр радиационной медицины АМН Украины, поликлиника радиационного регистра, отделение диагностики
Шевчик Олена Євгеніївна, Кокоткова Т Ф
Резюме.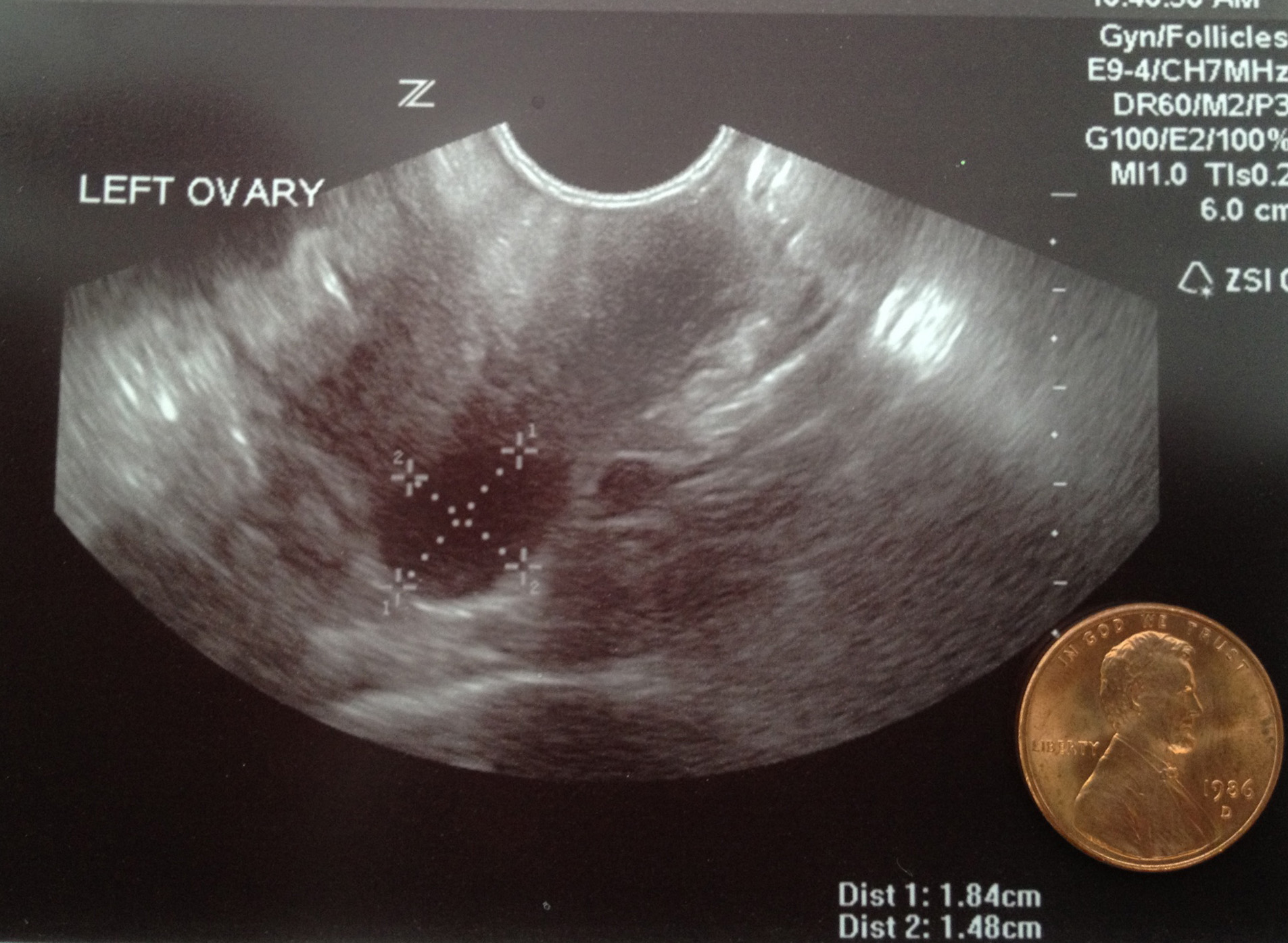 Наведені можливості ультразвукового методу дослідження з використанням допплєрівського картування в діагностиці порушень оваріального циклу. Наведені дані епідеміології безплідніх шлюбів. Показана висока інформативність ультразвукового дослідження в діагностиці причин безпліддя.
Наведені можливості ультразвукового методу дослідження з використанням допплєрівського картування в діагностиці порушень оваріального циклу. Наведені дані епідеміології безплідніх шлюбів. Показана висока інформативність ультразвукового дослідження в діагностиці причин безпліддя.
Ключові слова:безпліддя, порушення оваріального циклу, ультразвукове дослідження, допплєрівське картування
Вопрос задает – Екатерина, 33, Санкт-Петербург по теме: ЭКО
Добрый день! Я хотела бы услышать мнения специалистов по своей ситуации. Мне 33 года. Месячные начались в 12 лет, цикл был регулярный 35 дней. В 21 год была замершая беременность, причины не выявлены. после нее назначили на 6 месяцев противозачаточные таблетки. Когда я закончила их принимать, мой цикл прежним не стал. И до недавнего времени колебался от 23 до 31 дня. К гинекологам регулярно ходила на прием, но всегда мне говорили что эти колебания в пределах нормы. Детей у меня нет, мы с мужем как раз планировали. В мае 2015 произошел сильный сбой цикла – 1 цикл 37 дней, следующий 11 дней. Обратилась к гинекологу, сдала анализы на 2 д.ц: АТ-ТПО, ТТГ, Т4св,Т3 св — в норме ЛГ — 7,03 при норме 2,12-10,89 Пролактин – 323,61 при норме 71-568 ФСГ – 12,71 при норме 3,85-8,78 Эстрадиол – 426,7 при норме 99-118,33 АМГ – 0,1 при норме 1,0 – 10,6 На 20 д.ц.: Пролактин – 241,17 при норме 71-568 Тестостерон св. – 2,168 при норме 0,0- 4,1 ДГЭФ-сульфат – 1,51 при норме 0,23-2,66 Прогестерон – анализы не отдали на руки, но сказали что низкий. По результатам УЗИ единичные фолликулы и киста желтого тела. Эндометрий соответствует дню цикла. Провели УЗГСС – трубы проходимы. Поставили диагноз: нарушение менструального цикла, ановуляция, киста желтого тела правого яичника, снижение овариального резерва. Назначение: Утрожестан 200 с 14 д.ц. по 25 д.ц. на 3 цикла, ангиовит, фолибер по 1 т.в день. Цикл в котором я обследовалась продлился 39 дней. Дальше на утрожестане 27,35,29 дней. Цикл после отмены утрожестана 19 дней. В нем я пришла к врачу на прием 28.09.2015. На 15 д.ц. анализы: ФСГ – 2,02 при норме 1,79 – 5,12 АМГ – 0,1 при норме 1,0 – 10,6 УЗИ на 15 д.ц. – матка 47х36х40мм, ширина передней стенки 12 мм, задней – 13 мм, миометрий однородный, эндометрий 8,1 мм, эхоструктура одноролная. Подость матки не расширена, не деформирована. Шейка матки 36 мм, эхоструктура однородная, эндоцервикс – 5 мм\норма 5-8мм\ Цервикальный канал не расширен. Параметральные венозные сплетения не расширены. Яичники: Правый – 27х16х20мм объем 4,3 см3 Фолликулы 1 шт. 7 мм Левый – 18х13х15мм объем 1,7 см3 Фолликулы 3 шт.5-4-3мм Свободная жидкость в малом тазу – нет Заключение: истощение фолликулярного аппарата. Врач назначил схему стимуляции яичников со 2 д.ц.: Менопур 75, с 3 д.ц 150 С 6 дня стимуляции добавили Пурегон 300. 6 день – 100, 7 день – 50, 8 день -50. УЗИ контроль показал на 3 день цикла (2 день стимуляции) в правом яичнике 4 фолликула 1-2-1-1 мм, в левом 2 фолликулы 2-1 мм. На 5 день цикла (4 стимуляции) в правом 1 фолликул 2 мм, в левом 1 фол. 5 мм. Эндометрий 7 мм. На 7 день цикла (6 стимуляции) правый яичник пустой, левый 1 фол. 4 мм. Эндометрий 5 мм. На 10 д.ц правый яичник пустой, в левом 1 фол. 5,3, эндометрий 5,2 С протокола сняли с 10 дня цикла, назначили до 13д.ц. менопур 35, пурегон 25. Так же на 10 д.ц. назначили сдать Эстрадиол, т.к. плохо рос эндометрий. Результат 73,6 при норме 99-118,33. По итогу врач сказал, что у меня ранний климакс и остался один вариант – ЭКО с донорской яйцеклеткой. При этом нужно сделать это до конца года, иначе матка атрофируется и я не смогу выносить никакую беременность. Протокол закончился 14 октября. У меня во время уколов начался плохой сон из-за потливости и продолжается до сих пор. Есть приливы жара, но до протокола такого не было. Мои вопросы: 1. Действительно ли в моем случае только Д,Я? 2. Действительно ли так мало времени на принятие этого решения? Мы с мужем пока совсем не хотим рассматривать этот вариант. 3. Какие виды лечения истощенных яичников существуют? 4. Действительно ли это ранний климакс? ( наследственности подобной у меня нет) И что со всем этим делать дальше?
Оценка функционального резерва яичников
Что такое овариальный резерв яичников?
Если Вы когда-нибудь были на приеме у врача репродуктолога, то наверняка слышали это словосочетание, в оптимистичной интонации: «ну, резерв яичников у Вас вполне перспективный» или же с негативным оттенком: «низковат резерв яичников»…
Овариальный резерв или функциональный резерв яичников — так можно назвать предполагаемое количество яйцеклеток в яичниках женщины, которые могут в перспективе дать беременность.
Этот потенциал закладывается в яичниках девочки еще в утробе матери, после ее рождения в яичниках остается около 400 000 клеток. В дальнейшем же нас ждет печальная участь, в отличие от мужского репродуктивного резерва, который периодически обновляется всю жизнь, наш, женский запас в течение жизни только тратится, без возможности восстановления. Ежемесячно мы теряем не менее 20 клеток, независимо от образа жизни, наличия или отсутствия беременностей, приема контрацептивов и проч.
Таким образом, с возрастом в норме у всех женщин снижается количество клеток, способных дать беременность.
Кроме того, в течение жизни яичники подвергаются негативному воздействию множества факторов, которые снижают качество этих клеток (воспалительные реакции, новообразования, воздействие различных токсичных веществ и проч.). Оперативные вмешательства на яичниках (удаление кист яичников, резекция яичников и т. п.) может преждевременно уменьшить фолликулярный резерв до 0 у молодых женщин.
Как узнать, каков Ваш функциональный резерв яичников?
При помощи УЗИ органов малого таза
УЗИ органов малого таза делают на 5-7 день цикла. С его помощью можно посчитать количество антральных фолликулов — пузырьков, в которых созревают яйцеклетки.
Возраст женщины — самый важный независимый прогностический фактор, влияющий на фолликулярный запас, а следовательно — на вероятность достижения беременности и эффективность лечения бесплодия.
У женщин в возрасте 35-38 и старше 40 лет по сравнению с 25-летними способность к зачатию снижается до 50 %, 25 % и менее 5 % соответственно. Но изменения фолликулярного резерва у всех женщин индивидуальны. У кого-то уже к 30 годам в яичниках не остается фолликулов, содержащих клетки (это называется преждевременным истощением яичников), а у кого-то после 40 лет сохраняется достаточный фолликулярный запас.
Биологический репродуктивный возраст женщины отражает количество фолликулов размером менее 10 мм при УЗИ, проведенном на 5-7 день менструального цикла. У женщин в активном репродуктивном возрасте (до 35 лет) должно быть не менее 5-6 фолликулов в одном срезе в каждом яичнике по результатам УЗИ.
Менее 8 антральных фолликулов в яичниках — это уже снижение фолликулярного резерва, по которому можно предполагать слабый ответ на стимуляцию овуляции и необходимость повышения дозы препаратов в программе ЭКО.
При наличии менее 5 фолликулов в обоих яичников прогноз адекватного ответа на стимуляцию овуляции очень сомнителен.
При помощи анализа крови на гормоны
Кроме УЗИ фолликулярный резерв яичников может помочь определить анализ крови на гормоны. В первую очередь исследуют уровень ФСГ — фолликулостимулирующего гормона гипофиза. Он вырабатывается в специальной железе, которая находится в головном мозге — гипофизе и стимулирует рост фолликулов в яичниках. Если в яичниках достаточного количества фолликулов нет и они не реагируют на его «требования» адекватным ответом, гормон повышается, чтобы заставить яичники работать.
Уровень ФСГ исследуется на 2-5 день менструального цикла. Повышение концентрации гормона выше 10-12 МЕ/л говорит о снижении фолликулярного резерва яичников.
Другие гормоны, показывающие уровень фолликулярного резерва — это АМГ (антимюллеров гормон) и ингибин В. Они вырабатываются в ткани яичников. Концентрация ингибина В менее 45 пг/мл сопровождается уменьшением количества яйцеклеток.
Уровень АМГ наиболее точный прогностический фактор исхода лечения, низким считается его показатель менее 1 нг/л. Но для получения достоверной оценки фолликулярного резерва яичников нужно учитывать в целом все показатели — малое число антральных фолликулов на узи, высокие концентрации ФСГ, низкие уровни АМГ и ингибина В.
Многие пациентки, получив результаты обследования на гормоны, задают вопрос: Как повысить уровень АМГ? Можно ли снизить уровень ФСГ?
Изменить уровень этих гормонов в крови можно. Для этого существует так называемая заместительная гормональная терапия, например, можно пропить курс гормональных препаратов, которые «обманут» гипофиз и он уменьшит выработку ФСГ, т. к. будет получать сигнал о мнимой активности яичников. Но, к сожалению, как я уже говорила выше, восстановить таким образом фолликулярный резерв яичников не удастся.
Снижение уровня ФСГ не улучшит результативность ЭКО и не повысит вероятность получения беременности, поэтому делать этого перед ЭКО не нужно.
Что же делать, если по результатам обследования констатировано снижение фолликулярного резерва яичников?
В этом случае для достижеия беременности необходимо обратиться к врачу репродуктологу. Получить беременность у женщин позднего репродуктивного возраста или со сниженным фолликулярным резервом можно с помощью лечения методом ЭКО.
При выборе клиники ЭКО при этом факторе бесплодия очень важно обратить внимание на качество эмбриологической службы, ведь от ее работы зависит львиная доля успеха.
Также важным является такой, казалось бы, на первый взгляд не слишком существенный момент, как режим работы клиники. Если у Вас снижен фолликулярный запас, оптимально выбрать для лечения клинику, работающую без выходных. Именно такой режим позволяет производить своевременный забор клеток, даже если их мало, всего 1-2, без риска допустить их овуляцию.
Также сейчас широко применяются новые эффективные методики получения большего количества ооцитов в циклах ЭКО у пациенток с низким фолликулярным резервом. Например, так называемая «двойная стимуляция» яичников, суть которой заключается в том, что в течение одного цикла ЭКО собирается двойной «урожай» клеток. Повышение количества клеток увеличивает шансы на наступление беременности, ведь так получается большее количество эмбрионов, из которых можно с большей вероятностью выбрать перспективные эмбрионы на перенос.
Имеет ли значение особенность проведения программы ЭКО?
Безусловно. Схема стимуляции яичников подбирается врачом индивидуально в каждом конкретном случае, с учетом возраста женщины, ее веса, гормонального фона, результатов УЗИ, предыдущих протоколов ЭКО. Если за плечами у пациентки со сниженным фолликулярным резервом уже были неэффективные протоколы ЭКО, например такие, при которых не было получено яйцеклеток при пункции яичников, врач использует альтернативные подходы, чтобы изменить ситуацию.
Например, есть теория, что у пациенток со сниженным фолликулярным резервом в программе ЭКО можно использовать специальную технику пункции фолликулов, с промыванием содержимого фолликулов специальным раствором, что якобы повышает вероятность получения ооцитов. Правда исследования, которые проводились у таких пациенток, не подтвердили, что пункция, проведенная таким образом, способствует увеличению общего числа полученных яйцеклеток и повышению частоты наступления беременности, а методика при этом существенно удлиняет время процедуры и требует большей дозы анестетиков во время операции, поэтому целесообразность ее спорна (данные исследования 2010 г.).
Истощение фолликулярного резерва у женщин до 40 лет называется преждевременной недостаточностью яичников или, в прежней классификации болезней — синдром истощения яичников.
Яичники перестают продуцировать женские гормоны — эстрогены, что сопровождается нарушениями работы всего организма — повышение артериального давления, учащенное сердцебиение, появлении симптомов «приливов», жара, повышенной потливости, сухости кожи, ломкости волос, плаксивости и раздражительности, снижения либидо, сухости влагалища и как следствие — болезненности при половых контактах, нарушении мочеиспускания (учащенное мочеиспускание, недержание мочи при напряжении) и проч. Конечно же при этом страдает и репродуктивная функция — при синдроме преждевременного истощения яичников яйцеклеток, пригодных для оплодотворения практически не остается.
Преждевременное истощение яичников часто носит наследственный характер (у 25 % матерей женщин с такими проблемами менопауза также наступила до 40 лет)
Другие причины истощения яичников — воздействие на яичники повреждающих факторов, от аутоиммунных до внешних, например, интоксикации, радиации или воспалительного процесса. Также такая проблема может возникнуть у женщин с резким снижением массы тела из-за неправильного питания (анорексии).
Диагностировать преждевременную недостаточность яичников у женщин младше 40 лет кроме указанных выше жалоб помогает УЗИ, на котором определяется уменьшение размеров матки, истончение слизистой оболочки матки (эндометрия), уменьшение яичников, а также отсутствие в них фолликулов.
При исследовании гормонального профиля выявляется существенное повышение фолликулостимулирующего гормона, уменьшения эстрадиола, выраженное снижение АМГ и ингибина В.
Восстановление репродуктивной функции у женщин с преждевременной недостаточностью яичников перспективно только в случаях, когда она вызвана интоксикаций или нарушением веса вследствие анорексии — устранение повреждающего фактора в этой ситуации может помочь яичникам вновь заработать.
В большинстве же случаев единственный способ забеременеть при такой проблеме — это ЭКО с использованием донорских ооцитов.
Если у молодых девушек (20-25 лет) поздно начинается и долго устанавливается менструальный цикл, можно предположить риск возникновения преждевременной недостаточности яичников в будущем, особенно, если у мамы девушки отмечалась ранняя менопауза. В этом случае нужно обратиться к врачу репродуктологу — его своевременное вмешательство может помочь решить проблему бесплодия до ее возникновения.
Например, на сегодняшний день существует возможность сохранить яйцеклетки при повышенном риске их преждевременной утраты с помощью программы криоконсервации (заморозки) ооцитов, которая позволяет хранить их в течение десятков лет без повреждения их структуры, а при планировании беременности — безопасно разморозить, оплодотворить спермой партнера и получить эмбрионы, которые после переноса в подготовленную полость матки помогут обрести паре долгожданного здорового малыша.
Ультразвуковая оценка фолликулярного резерва яичников
Відповідно до Закону України «Про захист населення від інфекційних хвороб», приймаючи до уваги офіційні рекомендації ВООЗ та МОЗ, медичним центром «Юнімед» затверджено план протиепідемічної готовності та тимчасово (на час дії встановленого в Україні карантину) запроваджено особливі Правила внутрішнього розпорядку, які, серед іншого, передбачають наступні заходи та обмеження щодо надання медичних послуг:1. Перебувати на території медичного центру пацієнти/відвідувачі можуть виключно у захисних медичних масках та бахілах (МЦ «Юнімед» забезпечує зазначеними засобами захисту кожного пацієнта/відвідувача на безоплатній основі).
2. Перед входом до медичного центру пацієнти/відвідувачі зобов’язані здійснити дезінфікуючу обробку рук спиртовмісними дезінфікуючими засобами (засоби дезінфекції надаються пацієнтам/відвідувачам МЦ «Юнімед» на безоплатній основі).
3. При наявності ознак хвороби (нежить, кашель, чхання, сльозотеча тощо) у пацієнта/відвідувача, персонал медичного центру має право здійснити вимірювання температури тіла безконтактними інфрачервоними термометрами.
4. Супровід пацієнта безпосередньо до приміщень медичного центру здійснюється іншими особами лише у виключних випадках, коли пацієнт не може самостійно пересуватись та/або пройти діагностику (малолітні/неповнолітні особи, пацієнти у супроводі співробітників реанімації тощо).
5. Персонал медичного центру має право відмовити у доступі до приміщень центру та подальшому веденні пацієнта у випадках, коли на вимогу співробітника медичного центру пацієнт/відвідувач відмовляється дотримуватись заходів, передбачених Правилами внутрішнього розпорядку та/або у разі виявлення підвищеної температури тіла пацієнта/відвідувача більше 37 градусів.
6. Наполегливо рекомендуємо пацієнтам після проходження діагностичної процедури очікувати висновки за межами території медичного центру або використовувати для отримання результатів електронний сервіс «MedOffice» (medoffice.zp.ua).
Невиконання вказаних положень Правил загрожуватиме життю і здоров’ю населення, а отже буде причиною відмови від ведення пацієнта згідно ст. ст. 11, 29 ЗУ «Про захист населення від інфекційних хвороб» та ст. 34 Закону України «Основи законодавства України про охорону здоров’я».
УЗИ в Новосибирске по доступной цене
Когда семейная пара сталкивается с проблемой бесплодия, врач в рамках лечения и диагностики назначает целую череду исследований, среди которых присутствует и мониторинг фолликулогенеза.
Сегодня существует множество способов определения наступления овуляции. Мониторинг фолликулогенеза помогает определить не только момент зачатия, но и выявить проблемы, препятствующие оплодотворению яйцеклетки.
Как проходит созревание фолликул?
С началом менструального цикла в организме женщины изменяется гормональный фон, повышается уровень ФСЛ, что способствует формированию фолликул. Небольшая полость, наполненная жидкостью, необходима яйцеклетки для созревания. При нормальной степени развития, фолликул лопается и из него выходит яйцеклетка.
С самого рождения в организме женщины все фолликулы являются примордиальными, имея размер от 0,03 мм — до 0,05 мм. В этот период мониторинг фолликулогенеза ничего не покажет, настолько фолликулы еще малы. Их рост начинается в период полового созревания.
Каждый менструальный цикл, который в среднем длится 28 дней, дает начало росту нескольким фолликулам. Только лишь один, доминантный, доходит до процесса овуляции и закладывает жизнь.
Именно нарушение в росте и созревание фолликул является одной из основных причин бесплодия.
Что дает это исследование?
Каждый день в женском организме созревает более 50 фолликулов, предназначенных для созревания яйцеклетки. Это сложный длительный процесс, который предшествует овуляции. Часть фолликулов естественным образом отмирает (около 99%), и лишь маленькая часть начинает созревать.
Фаза созревания и развития фоликул длится около трех месяцев и проведение УЗИ фолликулогенеза позволяет специалисту определить наиболее благоприятный для зачатия период.
Это исследование позволяет врачу определять, как проходит овуляция, наступает ли она вообще. Кроме того именно фолликулометрия помогает гинекологу увидеть нарушение роста фолликул, узнать причины бесплодия, чтобы выработать правильную стратегию лечения.
Наблюдая за процессом роста и созревания фолликулов внутри яичников, специалист может выявить причину нарушения в слизистой матки, в самих яичниках, определить способность матки принимать в данный период яйцеклетку для оплодотворения.
Такое УЗИ позволяет при планировании беременности определить наиболее благоприятные дни для зачатия.
Итак, основной целью исследования фолликулогенеза является:
- определение функционального расстройства работы яичников;
- оценка роста и развития фолликул;
- выяснение причин нарушений менструального цикла;
- определение готовности к зачатию;
- осуществление контроля над ЭКО;
- определение состояния организма во время гормональной терапии;
- оценка общего репродуктивного состояния женщины;
- выработка стратегии лечения при выявлении патологии.
Когда делать фолликулогенез?
Многих женщин, планирующих беременность, интересует вопрос, на какой день цикла делать фолликулогенез.
Первое ультразвуковое исследование целесообразно проводить на 8-10 день с начала цикла. Отсчет начала цикла считается с первого дня последней менструации.
Если же цикл не регулярный, имеет более длинную продолжительность, то УЗИ назначается через 3-4 дня после окончания менструации.
В некоторых случаях гинеколог может рекомендовать проводить УЗИ за 5 дней до ожидаемой овуляции. В каждом случае врач индивидуально назначает количество исследований, но обычно это 2-3 визита в кабинет УЗИ.
Как проводится УЗИ фолликулогенеза?
Мониторинг назначается не только при выявлении проблем с зачатием, но и для определения общего репродуктивного состояния организма. Проводя исследование, гинеколог может видеть картину изменений, происходящих в матке и яичниках на протяжении всего менструального цикла.
Как делается фолликулогенез и насколько эффективно такое исследование?
Для проведения обследования не требуется предварительная подготовка. Подобно другим ультразвуковым исследованиям репродуктивных органов, УЗИ проводится с использованием вагинального датчика.
Это абсолютно безболезненная процедура, которая длится не более 20-30 минут. Но для эффективного исследования, необходимо прийти на прием к врачу полным мочевым пузырем, с задержкой мочи на 2-4 часа. Рекомендуется выпить не менее 1-1,5 литра чистой негазированной воды за час до назначенной процедуры.
Если вам необходимо сделать фоллликулогенез в Новосибирске по доступной цене, вы можете взять направление у своего лечащего врача и записаться на УЗИ в клинику «Инфо-Медика».
В ходе проведения УЗИ гинеколог исследует женские репродуктивные органы, определяя размер и состояние фолликул, необходимых для созревания яйцеклетки.
Современная аппаратура УЗИ позволяет оценить причины возможного нарушения в созревании.
На успешную овуляцию будут указывать следующие моменты:
- определение зрелого фолликула перед наступлением овуляции;
- уменьшение или полное исчезновение доминантного фолликула;
- наличие желтого тела вместо зрелого фолликула.
Но следует отметить, что УЗИ фолликулогенеза – это не одиночный анализ, который может дать 100% гарантию наступления овуляции.
Это исследование назначается в совокупности с другими анализами. Анализ каждого случая требует подробного и тщательного изучения. При выявлении патологии, нарушении развития и созреваний фолликул, врач назначит лечение, стимулирующее овуляцию и восстанавливающее гормональный фон.
Для того чтобы узнать сколько стоит сделать фолликулогенез в Новосибирске и записаться на прием позвоните по телефону (383) 22 00 904. В нашей клинике работают лучшие специалисты по репродуктивному здоровью.
Современная аппаратура, высокая квалификация врачей и грамотный подход к лечению позволит выявить проблемы бесплодия и найти правильные пути решения.
| 296. | УЛЬТРАЗВУКОВЫЕ ИССЛЕДОВАНИЯ | |||
| 297. | А04.21.001.001 | 70001 | УЗИ щитовидной железы | 1000 |
| 298. | А04.20.002 | 70002 | УЗИ молочных желёз | 1000 |
| 299. | А04.16.001 | 70003 | УЗИ органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезёнка) | 1300 |
| 300. | А04.16.001 | 70004 | Комплексное УЗИ органов брюшной полости и забрюшинного простр-ва. | 2100 |
| 301. | А04.14.002.001 | 70005 | УЗИ желчного пузыря с определением функции | 1100 |
| 302. | А04.30.003 | 70006 | УЗИ забрюшинного пространства (почки, надпочечники, мочевой пузырь) | 1000 |
| 303. | А04.28.002.001 | 70006.1 | УЗИ почек | 800 |
| 304. | А04.22.002 | 70007 | УЗИ надпочечников | 550 |
| 305. | А04.28.002.003 | 70008 | УЗИ мочевого пузыря | 800 |
| 306. | А04.28.002.005 | 70009 | УЗИ мочевого пузыря с определением остаточной мочи | 900 |
| 307. | А04.21.001 | 70010 | ТРУЗИ (трансректальное ультразвуковое исследование предстательной железы) | 1100 |
| 308. | А04.21.001.001 | 70011 | ТРУЗИ (трансректальное ультразвуковое исследование предстательной железы)+мочевой пузырь | 1400 |
| 309. | А04.21.001.001 | 70012 | ТРУЗИ (трансректальное ультразвуковое исследование предстательной железы)+мочевой пузырь с определением остаточной мочи | 1600 |
| 310. | А04.21.001 | 70013 | УЗИ предстательной железы трансабдоминальное | 1000 |
| 311. | А04.21.001 | 70014 | УЗИ предстательной железы и мочевого пузыря (трансабдоминальное) | 1400 |
| 312. | А04.21.001.001 | 70015 | УЗИ мужского комплекса (ТРУЗИ предстательной железы, семенные пузырьки, мочевой пузырь, придатки, яички) | 2500 |
| 313. | А04.28.003 | 70016 | УЗИ мошонки | 900 |
| 314. | А04.06.002 | 70017 | УЗИ мягких тканей, л/узлов | 900 |
| 315. | А04.07.002 | 70018 | УЗИ слюнных желез | 900 |
| 316. | А04.20.001 | 70019 | УЗИ органов малого таза гинекологическое (трансабдоминальное) | 1100 |
| 317. | А04.20.001.001 | 70020 | УЗИ органов малого таза гинекологическое (трансвагинально, с использованием влагалищного датчика и транабдоминально) | 1300 |
| 318. | А04.20.001.001 | 70020.1 | УЗИ органов малого таза гинекологическое повторно в течение 1 мес. (трансвагинально, с использованием влагалищного датчика и транабдоминально) | 1100 |
| 319. | А04.20.001.001 | 70020.2 | УЗИ органов малого таза гинекологическое повторно в течение 3-х мес. (трансвагинально, с использованием влагалищного датчика и трансабдоминально) | 1200 |
| 320. | А04.30.001.001 | 70021 | УЗИ раннего срока беременности (до 12 недель) | 1400 |
| 321. | А04.20.003 | 70022 | Фолликулогенез — 1й раз с 5 по 8 дня м/цикла | 800 |
| 322. | А04.20.003 | 70022.1 | Фолликулогенез — 2й раз с 11 по 13 день м/цикла | 600 |
| 323. | А04.20.003 | 70022.2 | Фолликулогенез — 3й раз с 17 по 21 день м/цикла | 600 |
| 324. | А04.26.002 | 70024 | УЗИ глазных яблок | 1000 |
Яйцеклетка не созревает: почему и что делать
Зачатие происходит только в том случае, если яйцеклетка созрела и вышла из фолликула в брюшную полость. Этот процесс называется овуляцией, и обычно он приходится на середину цикла. Но в организме иногда бывают сбои, которые негативно отражаются на фертильности. Почему не созревает яйцеклетка, поможет установить высококвалифицированный гинеколог. Нарушения могут затрагивать различные звенья фолликулогенеза. И только грамотный подход к диагностике, проводимой на современном оборудовании, позволит разобраться в истинных причинах и механизмах ановуляции.
Как созревает яйцеклетка
Овуляция – это эндокринно-опосредованный процесс разрыва фолликула, который происходит примерно через 35-40 часов после подъема уровня лютеинизирующего гормона (ЛГ). Яйцеклетка должна выйти в брюшную полость и затем попасть в маточную трубу.
Подъем уровня лютеинизирующего гормона инициирует окончательное созревание женской половой клетки, которая будет готова к встрече со сперматозоидом. Одновременно с этим под влиянием ЛГ активируется синтез простагландинов. Эти вещества способствуют отделению яйценосного бугорка от стенки фолликула, а также способствуют растворению мембраны фолликула и ее разрыву. Если этого не происходит, то развивается синдром пустого фолликула. В этом случае при проведении ЭКО после пункции фолликула не удается получить яйцеклетку.
В норме яичник в фазе овуляции должен сблизиться с фимбриями маточной трубы, чтобы ооцит с легкостью туда мог попасть. Этот процесс могут нарушить спайки и рубцы, кисты, эндометриоидные очаги вследствие механического давления или посредством нарушения моторики маточной трубы.
Таким образом, процесс созревания фолликулов очень сложный. И только его грамотное моделирование, учитывающее физиологические особенности, может привести к желаемым результатам в рамках лечения эндокринного бесплодия.
Персонифицированный подход к каждой женщине центра репродуктивного здоровья «СМ-Клиника» позволяет добиваться наилучших терапевтических результатов. Врачи разбираются в каждом случае до мельчайших подробностей, отвечают на вопрос, может ли яйцеклетка не созреть, и выявляют факторы, которые этому способствуют, чтобы провести коррекцию имеющихся нарушений.
Как может повести себя фолликул
Созревание фолликула происходит в первой фазе менструального цикла. В норме этот процесс завершается овуляцией, при этом эндометрий становится достаточно толстым, чтобы в последующем быть в состоянии принять оплодотворенную яйцеклетку (после процесса секреторной трансформации).
Однако процесс фолликулогенеза может нарушиться. Основные варианты нарушения:
- Отсутствие овуляции – фолликул так и не разрывается, что выявляется на УЗИ в виде синдрома неовулировавшего фолликула. Если размеры этого образования превышают 21 мм в диаметре, то это расценивается как фолликулярная киста.
- Запоздалая овуляция – выход яйцеклетки происходит позже, чем в норме.
- Преждевременная овуляция – яйцеклетка выходит раньше, чем успевает подготовиться эндометрий.
Во всех случаях нарушается репродуктивная функция женщины, и может развиваться эндокринное бесплодие.
Причины, по которым не созревает яйцеклетка
Основными причинами нарушенной овуляции являются эндокринные факторы – недостаточная активность щитовидной железы или гипофиза, который вырабатывает тропные гормоны, стимулирующие яичник. Также яйцеклетка не созревает правильно при повышенном уровне мужских половых гормонов или пролактина. Зачастую подобные эндокринные расстройства можно заподозрить по нарушению менструального цикла. У женщин месячные приходят нерегулярно, могут быть скудными или обильными.
Процесс выхода яйцеклетки из фолликула могут нарушать некоторые лекарственные препараты, которые отодвигают наступление овуляции или вовсе блокируют ее.
Естественные физиологические причины
Как ни странно это звучит, но даже в норме допускается отсутствие овуляции. В течение года может быть 2-3 менструальных цикла, которые не сопровождаются созреванием яйцеклетки и ее выходом из фолликула. Стоит отметить, что такое состояние является вариантом нормы только в том случае, если ановуляторные циклы не следуют один за другим.
Достаточно часто несозревание фолликула могут спровоцировать следующие состояния:
- жаркий климат;
- авиаперелет;
- психо-эмоциональные переживания;
- снижение массы тела.
Патологии в органах малого таза
Основными патологиями в органах малого таза, при которых не созревает яйцеклетка, являются следующие:
- спаечная болезнь;
- поликистоз яичников;
- эндометриоз;
- преждевременная недостаточность яичников;
- яичниковые кисты;
- воспалительные процессы.
Симптомы и диагностика
По клиническим симптомам бывает трудно догадаться, что яйцеклетка не созревает. Обычно подобные расстройства устанавливаются с помощью ультразвуковой оценки состояния эндометрия и яичников. На 8-9-й день менструального цикла в норме должен определяться доминантный фолликул, который увеличивается каждый день на 2-3 мм. Накануне овуляции его размер должен достигать 18-22 мм. Гранулезные клетки такого фолликула вырабатывают половые гормоны, преобладающим из которых в первую фазу цикла является эстрадиол. Он вызывает пролиферацию эндометрия, в результате чего слизистая утолщается и имеет типичную трехслойную структуру. Ближе к овуляции начинается рост желез – секреторная трансформация эндометрия, которая хорошо определяется с помощью ультразвука.
Заподозрить нарушенное созревание яйцеклетки помогают следующие симптомы:
-
недостаточная толщина эндометрия; отсутствие трехслойной структуры и предовуляторных изменений; отсутствие доминантного фолликула или его малые размеры накануне овуляции.
Дополнительно для оценки фолликулогенеза может определяться концентрация в крови эстрадиола и лютеинизирующего гормона.
Когда необходима стимуляция овуляции
Стимуляция овуляции – это медикаментозное моделирование фолликулогенеза и проведение соответствующей подготовки эндометрия. Такое лечение показано тогда, когда овуляция не происходит или запаздывает. Достаточно часто синдром неовулировавшего фолликула подразумевает индукцию с помощью инъекций ХГЧ. Могут применяться и другие препараты (рекомбинантный лютеинизирующий гормон, антагонисты гонадолиберинов и т.д.). Оптимальный препарат гинеколог подбирает индивидуально каждой женщине после детального обследования.
После индукции овуляции пара должна совершить половой акт через 24-36 часов. Если уровень ЛГ в сыворотке крови уже повышен, то интимная близость должна состояться в день введения индуцирующего препарата.
Поле стимуляции овуляции гинеколог подбирает прогестероновый препарат для поддержания второй фазы менструального цикла. Это позволит подготовить эндометрий (вызвать секреторную трансформацию) для возможной имплантации оплодотворенной яйцеклетки.
Преимущества лечения в Центре репродуктивного здоровья «СМ-Клиника»
В многопрофильном холдинге центр репродуктивного здоровья «СМ-Клиника» прием ведут не только гинекологи, но и врачи других специальностей, задача которых «настроить» организм женщины на правильное функционирование и успешную реализацию репродуктивной функции. Диагностика выполняется с использованием оборудования экспертного класса, которое позволяет выявить даже незначительные отклонения в функциональном состоянии органов. В собственной лаборатории проводится оценка различных показателей, которые отражают состояние и функционирование репродуктивной системы.
Центр репродуктивного здоровья «СМ-Клиника» — это центр, в котором квалифицированные специалисты помогут оценить вашу фертильность и в случае имеющихся нарушений подберут наиболее оптимальный способ коррекции.
Рост и развитие фолликулов | GLOWM
Фолликулогенез — это процесс, при котором рекрутированный примордиальный фолликул растет и развивается в специализированный графиевый фолликул, способный либо овулировать свою яйцеклетку в яйцевод в середине цикла для оплодотворения, либо умереть от атрезии. У женщин этот процесс длится долго, требуется почти 1 год для роста примордиального фолликула и его развития до стадии овуляции. В ходе фолликулогенеза рост достигается за счет пролиферации клеток и образования фолликулярной жидкости, тогда как развитие включает цитодифференцировку всех клеток и тканей в фолликуле.Только несколько фолликулов в яичниках человека выживают, чтобы завершить процесс цитодифференцировки, причем 99,9% из них умирают в результате запрограммированного механизма гибели клеток, называемого апоптозом.
Механизмы, регулирующие рост и развитие фолликулов, находятся под контролем изменяющихся концентраций лигандов (, т.е. гормонов и факторов роста). На эндокринном уровне фолликулогенез регулируется каскадным механизмом центральной нервной системы, передней доли гипофиза и яичников. Специализированные нейроны гипоталамуса секретируют импульсы гонадотропин-рилизинг-гормона (ГнРГ) в портальные кровеносные сосуды, которые действуют на гонадотрофов, вызывая пульсирующее высвобождение фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), которые действуют на фолликулярные клетки яичников. для контроля фолликулогенеза.Хотя ГнРГ, ФСГ и ЛГ критически важны в регуляции фолликулогенеза, гормоны и факторы роста, которые сами являются продуктами фолликула, могут действовать локально, модулируя (усиливая или ослабляя) действие ФСГ и ЛГ. Это аутокринная / паракринная система развивающихся фолликулов. Считается, что эта местная регуляторная система играет важную роль в сложных механизмах, управляющих временем фолликулогенеза и становится ли фолликул доминирующим или атретическим.
Хронология
Шаги и время фолликулогенеза человека показаны на рис.2. У женщин фолликулогенез — длительный процесс. 1,2,3 В каждом менструальном цикле доминирующий фолликул, который овулирует свою яйцеклетку, происходит из примордиального фолликула, который был задействован для инициирования роста почти на год раньше (рис. 2). В широком смысле существует два типа фолликулов (рис. 2): преантральных (первичных, первичных, вторичных [класс 1], третичных [класс 2]) и антральных (граафовых, малых [класс 3, 4]. , 5], средний [6 класс], большой [7 класс], преовуляторный [8 класс]).Развитие преантральных и антральных фолликулов не зависит от гонадотропина и зависит от гонадотропина соответственно.
Рис. 2. Хронология фолликулогенеза в яичниках человека. Обратите внимание на временную шкалу на периферии. Преантральный период: Требуется 300 дней, чтобы рекрутированный примордиал вырастал и развился до стадии класса 2/3 (0,4 мм) или стадии кавитации (ранний антральный отдел). Атрезия может возникать в преантральных фолликулах 1, 2 и 3 класса. Антральный период: Фолликулу класса 4 (1-2 мм), если он выбран, требуется около 50 дней для роста и развития до преовуляторной стадии.Доминирующий фолликул цикла, по-видимому, выбран из когорты фолликулов класса 5, и ему требуется около 20 дней для развития до стадии овуляции. Атрезия часто встречается в антральном периоде. gc — количество гранулезных клеток; d, дни. (Из Gougeon A: Динамика роста фолликулов у человека: Модель на основе предварительных результатов. Hum Reprod 1:81, 1986.) |
Скорость развития преантральных фолликулов низкая, требуется около 300 дней. для рекрутированного примордиального фолликула для завершения всего преантрального периода (рис.2). Длительное время удвоения (около 10 дней) клеток гранулезы отвечает за медленную скорость роста. После образования антрального отдела в фолликуле 3 класса (диаметром около 0,4 мм) скорость роста увеличивается (рис. 2). Промежуток времени между формированием антрального отдела и развитием 20-миллиметрового преовуляторного фолликула составляет около 50 дней (рис. 2). Доминантный фолликул, по-видимому, выбран из когорты фолликулов класса 5 в конце лютеиновой фазы менструального цикла. 1,2,3,4 Для роста доминантного фолликула и его развития до преовуляторной стадии требуется от 15 до 20 дней (рис.2). Атрезия может возникать во всех фолликулах (преантральном и антральном) после стадии фолликула класса 1 или вторичной; однако наибольшая частота встречаемости наблюдается в антральных фолликулах диаметром более 2 мм (, т.е. класса 5, 6 и 7) (рис. 2).
Процесс
Фолликулогенез происходит в коре яичника (рис. 3). Фолликулы в коре головного мозга представлены в широком диапазоне размеров, представляющих различные стадии фолликулогенеза. Целью фолликулогенеза является создание единственного доминантного фолликула из пула растущих фолликулов.В этот процесс вовлечены четыре основных регуляторных события: рекрутирование, преантральное развитие фолликула, отбор и атрезия.
Рис. 3. Микрофотография яичника взрослого примата. Фолликулярные и лютеиновые единицы видны в коре головного мозга, а крупные кровеносные сосуды и нервы — в продолговатом мозге. se, серозный или поверхностный эпителий; ta, tunica albuginea; pf — первичный фолликул; sf, вторичный фолликул; tf, третичный фолликул; gf, графиевый фолликул. (From Bloom W, Fawcett DW: A Textbook of Histology. Филадельфия: У. Б. Сондерс, 1975.) |
ИСКОННЫЙ ФОЛЛИКЛ.
Все примордиальные фолликулы состоят из небольшого первичного ооцита (около 25 мкм в диаметре), задержанного на стадии диплотены (или диктиата) мейоза, одного слоя уплощенных (плоских) клеток гранулезы и базальной пластинки (рис. ). Средний диаметр примордиального фолликула человека составляет 29 мкм. 5 Благодаря базальной пластинке гранулеза и ооцит существуют в микроокружении, в котором не происходит прямого контакта с другими клетками.Примордиальные фолликулы не имеют самостоятельного кровоснабжения. 6 Следовательно, примордиальные фолликулы имеют ограниченный доступ к эндокринной системе.
Рис. 4. Электронная микрофотография примордиального фолликула человека показывает уплощенные клетки гранулезы (GC), ооцит с его зародышевым пузырьком (GV) или ядром, тельце Balbiani (BB), со всеми собранными органеллами ооцита. у одного полюса GV и базальной пластинки (BL). (Из Эриксона GF: Яичник: Основные принципы и концепции.В Felig P, Baxter JD, Frohman L (eds): Endocrinology and Metabolism. Нью-Йорк: Макгроу-Хилл, 1995.) |
Набор.
Первым важным событием в фолликулогенезе является набор. Вербовка — это процесс, при котором арестованный примордиальный фолликул запускается, чтобы возобновить развитие и войти в пул растущих фолликулов. Все примордиальные фолликулы (ооциты), присутствующие в яичниках человека, образуются у плода между шестым и девятым месяцем беременности.Поскольку весь запас ооцитов в примордиальных фолликулах находится в профазе мейоза, ни один из них не способен к митотическому делению. Все ооциты (примордиальные фолликулы), способные участвовать в воспроизводстве в течение жизни женщины, присутствуют в яичниках при рождении (рис. 5). Общее количество примордиальных фолликулов в яичниках в любой момент времени называется резервом яичников (OR). 7 Процесс набора начинается вскоре после образования примордиальных фолликулов у плода, 8 и продолжается на протяжении всей жизни женщины до тех пор, пока пул примордиальных фолликулов не истощится в период менопаузы (рис.5). При старении наблюдается двухэкспоненциальное уменьшение OR 7 , 9 , 10 (рис. 6). Число примордиальных фолликулов неуклонно падает на протяжении более трех десятилетий, но когда OR достигает критического числа около 25000 в возрасте 37,5 ± 1,2 года, скорость потери примордиальных фолликулов увеличивается примерно в два раза (рис. 6). Это изменение OR связано с возрастным снижением плодовитости, что, возможно, является причиной возрастного увеличения ФСГ у женщин после 36 лет. 7
Рис. 5. Возрастные изменения количества примордиальных фолликулов (ооцитов) в яичниках человека. Левая панель: Количество яиц уменьшается от 6 месяцев беременности до 50 лет. (От Baker TG: Радиочувствительность ооцитов млекопитающих с особым упором на самку человека. Am J Obstet Gynecol 110: 746, 1971.) Правая панель: Микрофотографии, иллюстрирующие возрастное уменьшение примордиальных фолликулов ( стрелки ) у человека. яичники.(Из Эриксона GF: Анализ развития фолликулов и созревания яйцеклетки. Semin Reprod Endocrinol 4: 233, 1986.) |
Рис. 6. Связанное с возрастом уменьшение количества примордиальных фолликулов (PF) внутри оба яичника человека от рождения до менопаузы. В результате набора численность PF постепенно уменьшается с примерно 1 000 000 при рождении до примерно 24 000 в 37 лет. К 37 годам скорость набора увеличивается примерно вдвое, а количество PF снижается примерно до 1000 через 51 год ( i.е. — средний возраст начала менопаузы) (от Faddy MJ, Gosden RG, Gougeon A et al: Ускоренное исчезновение фолликулов яичников в среднем возрасте: значение для прогнозирования менопаузы. Hum Reprod 7: 1342, 1992.) |
Механизм.
Первый видимый признак (рис. 7) рекрутирования примордиального фолликула — это то, что некоторые клетки гранулезы начинают изменяться от плоской до кубовидной. 5 Первая кубовидная клетка видна, когда первичный фолликул содержит 8 клеток гранулезы, и процесс завершается, когда число гранулез достигает 19 (рис.8). За изменением формы следует начало, хотя и медленное, синтеза ДНК и митоза в клетках гранулезы. 8 Изменение формы и приобретение митотического потенциала в клетках гранулезы являются отличительными признаками набора. Такие наблюдения предполагают, что механизмы, управляющие рекрутированием, могут включать регуляторный ответ на уровне гранулезных клеток. Рекрутмент не зависит от гипофиза и, вероятно, контролируется аутокринными / паракринными механизмами. Неизвестно, вызывает ли это стимулятор или потеря ингибитора; однако примордиальные фолликулы подвергаются быстрому рекрутированию при удалении из яичника и культивировании in vitro. 11 Эти наблюдения подтверждают идею ингибитора.
Рис. 7. Микрофотография нерастущего примордиального и вновь набранного (растущего) фолликула в яичнике человека. Обратите внимание на кубовидные клетки гранулезы ( наконечников стрелок ) во вновь набранном примордиальном фолликуле. |
Рис. 8. Связь между количеством гранулез в наибольшем поперечном сечении фолликула и распределением уплощенных и кубовидных клеток.(Из Gougeon A, Chainy GBN: Морфометрические исследования маленьких фолликулов в яичниках женщин в разном возрасте. J Reprod Fertil 81: 433, 1987.) |
Для объяснения механизма рекрутирования было выдвинуто несколько различных гипотез. Во-первых, этот процесс, по-видимому, происходит в примордиальных фолликулах, ближайших к мозговому веществу, где видны кровеносные сосуды. Это подтверждает гипотезу о том, что воздействие питательных веществ или переносимых с кровью регуляторных молекул может играть роль в контроле рекрутирования.Во-вторых, был предложен механизм внутренних часов ооцитов для контроля рекрутирования. 12 В этой гипотезе часы связаны со временем, когда ооцит инициирует мейоз у эмбриона. Примечательно, что набор можно модулировать. 8 У грызунов скорость пополнения может быть снижена путем удаления вилочковой железы новорожденного, голодания или обработки экзогенными опиоидными пептидами. Это важные наблюдения, потому что они утверждают, что пути передачи сигналов лиганд-рецептор могут регулировать рекрутирование.Понимание регуляторных механизмов, лежащих в основе рекрутирования, остается важной задачей репродуктивной биологии.
ПРЕАНТРАЛЬНАЯ ФОЛЛИКЛА.
Ранние стадии фолликулогенеза можно разделить на три класса в зависимости от количества слоев клеток гранулезы, развития ткани теки и экспрессии небольшой полости или антрального отдела. Классы — первичные, вторичные и ранние третичные фолликулы (рис. 9). По мере увеличения морфологической сложности в фолликуле происходят важные клеточные и физиологические изменения, которые делают его способным реагировать на гонадотропины.В следующих разделах исследуются структурные и функциональные изменения, сопровождающие рост и развитие преантральных фолликулов.
Рис. 9. Диаграмма, показывающая размер и гистологическую организацию ранних развивающихся фолликулов человека во время гонадотропин-независимого периода фолликулогенеза. (Эриксон GF: Яичник: основные принципы и концепции. In Felig P, Baxter JD, Frohman L (eds): Endocrinology and Metabolism. New York: McGraw-Hill, 1995.) |
Первичный фолликул.
Первичный фолликул состоит из одной или нескольких кубовидных гранулезных клеток, расположенных в одном слое, окружающем ооцит (рис. 10). Одновременно с изменением формы и митотической активностью, которые сопровождают рекрутинг (рис. 7 и 10), клетки кубовидной гранулезы начинают экспрессировать рецепторы ФСГ. 13 , 14 Механизм, лежащий в основе этого критического события в фолликулогенезе, остается неясным, но есть доказательства у грызунов 15 , что активин, полученный из гранулезы, может играть важную роль в экспрессии рецептора ФСГ с помощью аутокринных / паракринных механизмов. (Рис.11). Хотя клетки гранулезы экспрессируют рецепторы ФСГ на этой очень ранней стадии фолликулогенеза, считается, что физиологические уровни ФСГ в плазме во время нормального менструального цикла не влияют на реакции гранулезы, поскольку первичные фолликулы не имеют независимой сосудистой системы. Тем не менее, из-за наличия поблизости кровеносных сосудов (рис. 10), ФСГ-индуцированные изменения функции первичных фолликулов могут происходить в ответ на аномально высокие уровни ФСГ в плазме, такие как те, которые возникают во время индукции овуляции или старения.
Рис. 10. Рисунок развивающегося первичного фолликула, встроенного в соединительную ткань или строму коры яичника. Ядрышко и мейотические хромосомы очевидны в ядре ооцита. Митохондрии агрегированы на одном полюсе ядра ооцита (, т. Е. тельца Балбинни). Всего видно 19 кубовидных гранулезных клеток, одна из которых дает начало второму слою клеток (From Bloom W, Fawcett DW: A Textbook of Histology. Philadelphia: WB Saunders, 1975.) |
Рис. 11. Схема предлагаемого механизма аутокринного контроля экспрессии рецепторов фолликулостимулирующего гормона в гранулезных клетках преантральных фолликулов (Из Эриксона GF: Диссоциация эндокринной и гаметогенной функции яичников. Lobo R (ed): Perimenopause. New York: Springer-Verlag, 1997.) |
Начиная примерно с момента набора, ооцит начинает расти и дифференцироваться.Этот период отмечен прогрессивным увеличением уровня синтеза РНК ооцитов. 16 В это время включен ряд важных генов ооцитов. Например, гены, кодирующие белки zona pellucida (ZP) (, т.е. ZP-1, ZP-2 и ZP-3), транскрибируются и транслируются. 17 Секретируемые белки ZP начинают полимеризоваться вблизи поверхности ооцита, образуя оболочку внеклеточного матрикса (пеллюцидную оболочку), которая в конечном итоге инкапсулирует яйцеклетку. Важность блестящей оболочки подчеркивается тем фактом, что углеводная часть ZP-3 представляет собой видоспецифичную молекулу, связывающую сперматозоиды. 18 Он отвечает за инициирование акросомной реакции в конденсированных сперматозоидах. 19
Во время развития первичного фолликула клетки гранулезы отправляют процессы через слой зоны, где они образуют щелевые соединения с клеточной мембраной ооцита или оолемме (Рис. 12). Щелевые соединения — это межклеточные каналы, состоящие из белков, называемых коннексинами. 20 , 21 Существует по крайней мере 13 членов семейства коннексинов, которые напрямую связывают соседние клетки, обеспечивая диффузию ионов, метаболитов и других низкомолекулярных сигнальных молекул, таких как цАМФ и кальций. 20 , 21 Коннексин 37 (C × 37) представляет собой коннексин, полученный из ооцитов, который образует щелевые контакты между ооцитом и окружающими клетками гранулезы. 22 Данные, полученные на мышах с дефицитом C × 37, приписывают C × 37 обязательную роль в фолликулогенезе, овуляции и фертильности. 22 Большие щелевые соединения также присутствуют между самими клетками гранулезы (Рис. 12). C × 43 является основным белком щелевого соединения, экспрессируемым в клетках гранулезы. 23 Как следствие щелевых контактов первичный фолликул становится метаболически и электрически связанной единицей.Эта связь между гранулезой и ооцитом сохраняется на протяжении всего фолликулогенеза и отвечает за синхронное проявление важных активностей (положительных и отрицательных).
Рис. 12. Электронная микрофотография гранулезных клеток короны радиата ооцита в преантральном фолликуле. Отростки гранулезных клеток, пересекающие блестящую оболочку (ZP), образуют небольшие щелевые соединения ( стрелок, ) с плазматической мембраной ооцита. Между ячейками corona radiata видны более крупные щелевые соединения ( стрелки ).(Гилула Н.Б., Эпштейн М.Л., Бирс WH: Межклеточная коммуникация и овуляция: исследование комплекса кумулюс-ооцит. J Cell Biol 78:58, 1978, воспроизведено с разрешения Rockefeller University Press.) |
Вторичный фолликул.
Вторичный фолликул — это преантральный фолликул с 2-10 слоями кубовидных или низко столбчатых клеток, которые образуют многослойный эпителий (рис. 13). Как видно на рисунке 10, переход от первичного ко вторичному фолликулу включает приобретение второго слоя клеток гранулезы.Этот переход осуществляется продолжающимся делением клеток гранулезы. Механизмы, регулирующие митоз гранулезы, плохо изучены. Однако захватывающие исследования на грызунах предоставили убедительные доказательства участия производного ооцитами фактора роста, называемого фактором дифференцировки роста-9 (GDF-9). GDF-9 является новым членом суперсемейства трансформирующего фактора роста-β (TGF-β). 24 GDF-9 сильно экспрессируется в яичнике; локализуется только в ооцитах рекрутированных фолликулов. 25 У мышей с дефицитом GDF-9 рост и развитие фолликулов останавливаются на начальной стадии; следовательно, доминантные фолликулы не образуются, и самки бесплодны. 26 Соответственно, GDF-9 является обязательным для фолликулогенеза после первичной стадии, предположительно потому, что он является обязательным митогеном для клеток гранулезы. Фундаментальная концепция, вытекающая из этой работы, заключается в том, что ооцит играет ключевую роль в регуляции фолликулогенеза благодаря своей способности продуцировать новые регуляторные лиганды ( e.г. GDF-9), которые имеют решающее значение для фолликулогенеза.
Рис. 13. Типичный здоровый вторичный фолликул содержит полностью выросший ооцит, окруженный блестящей оболочкой, пять-восемь слоев гранулезных клеток, базальную пластинку и развивающуюся ткань теки с многочисленными кровеносными сосудами. (From Bloom W. , Fawcett DW: A Учебник гистологии. Philadelphia: WB Saunders, 1975, с разрешения Arnold Ltd.) |
Одним из наиболее важных изменений, которые происходят в развитии вторичного фолликула, является приобретение слой тека.Эта ткань, которая состоит из слоя стромоподобных клеток вокруг базальной пластинки, впоследствии дифференцируется на внутреннюю и внешнюю теку (рис. 13). Развитие Theca сопровождается новообразованием множества мелких сосудов, предположительно за счет ангиогенеза (Fig. 13). Это критическое событие, потому что кровь циркулирует вокруг фолликула, доставляя питательные вещества и гормоны (, например, ФСГ, ЛГ) во вторичный фолликул, а также отходы и секреторные продукты. В связи с этим некоторые стромальные клетки внутреннего слоя экспрессируют рецепторы ЛГ. 27 Эти клетки впоследствии дифференцируются в стероидогенные клетки, называемые интерстициальными клетками теки (ТИК), наиболее вероятно в ответ на плазменный ЛГ, доставляемый сосудистой системой теки. 27 Все клетки гранулезы вторичных фолликулов экспрессируют рецепторы ФСГ. 13 Кажется вероятным, что диффузия плазменного FSH во вторичный фолликул может вызвать FSH-зависимые гранулезные ответы. Внешний слой клеток стромы впоследствии дифференцируется в клетки гладкой мускулатуры, называемые внешней текой.Эти гладкомышечные клетки иннервируются вегетативной нервной системой. 27
Во вторичном фолликуле ооцит завершает свой рост. Когда диаметр фолликула составляет около 200 мкм, ооцит достигает максимального размера и больше не растет, несмотря на то, что человеческий фолликул увеличивается в диаметре до 2 см и более (рис. 14). У грызунов хорошо известно, что клетки гранулезы играют обязательную роль в росте и дифференцировке ооцита. 28 , 29 Важным событием дифференциации, которое происходит, когда ооцит завершает свой рост, является приобретение способности возобновлять мейоз. 30 Ооциты обычно не возобновляют мейоз во время фолликулогенеза, и должен действовать механизм, ингибирующий этот процесс (, т.е. разрушение зародышевых пузырьков [GVBD]) и возобновление мейоза. Основной механизм торможения остается неизвестным; однако есть данные, подтверждающие концепцию, что цАМФ, происходящий из гранулезы, может играть важную роль в ингибировании возобновления мейоза. 30 По такому механизму ФСГ индуцирует цАМФ в клетках гранулезы, который диффундирует в ооцит через щелевое соединение C × 37, где он продолжает ингибировать GVBD (рис.15).
Рис. 14. Диаграмма, показывающая соотношение между размером ооцита и размером фолликулов в яичнике младенца человека (из Мандл AM, Zuckerman S: Рост ооцита и фолликула у взрослой крысы .J Endocrinol 8: 126, 1952, воспроизведено с разрешения Общества эндокринологов.) |
Рис. 15. Схема гипотетического механизма ингибирования циклическим АМФ (цАМФ) разрушения зародышевых пузырьков ( ГВБД) или возобновление меоизиса.Передача сигнала рецептора фолликулостимулирующего гормона (ФСГ) в клетках гранулезы приводит к увеличению продукции цАМФ. ЦАМФ может диффундировать через щелевые соединения гранулоза-ооцит коннексин-37 (C × 37), где он накапливается на высоких уровнях в ооплазме, чтобы ингибировать распад (BD) зародышевых пузырьков (GV) (, т.е. , подавляет возобновление мейоза или GVBD). |
Третичный фолликул.
Когда преантральный фолликул завершает вторичную стадию развития, он содержит пять различных структурных единиц: полностью выросший ооцит, окруженный блестящей оболочкой, от шести до девяти слоев клеток гранулезы, базальную пластинку, внутреннюю и внешнюю теки. (Рис.13). Первым признаком начала развития третичного фолликула является появление полости в клетках гранулезы. 31 В ответ на внутренний стимул на одном полюсе ооцита начинает формироваться полость. Этот процесс, называемый кавитацией или началом образования антрального отдела, характеризуется накоплением жидкости между клетками гранулезы, что со временем приводит к образованию внутренней полости (рис. 16). По завершении кавитации устанавливается основной план графического фолликула, и все различные типы клеток занимают свои надлежащие места в ожидании стимулов, которые будут перемещать их по путям дифференцировки и пролиферации (рис.16). Основываясь на данных по фолликулам полиоцитов, механизм спецификации кавитации, вероятно, строго регулируется (Рис. 17).
Рис. 16. Микрофотография раннего третичного фолликула (диаметром 0,4 мм) при кавитации ранней стадии антрального отдела. ZP, zona pellucida; GC — клетки гранулезы; BL — базальная пластинка; TI, theca interna; TE, theca externa; наконечников стрел, митозов гранулезы. (Из Bloom W., Fawcett DW: A Textbook of Histology. Philadelphia: WB Saunders, 1975, с разрешения Arnold Ltd.) |
Рис. 17. Микрофотография полиовулярного фолликула на ранней третичной стадии показывает места кавитации или раннего образования антрального отдела ( чистых пространств ) непосредственно над ооцитами ( звездочка ). Это событие, которое находится под внутриовариальным контролем, по-видимому, возникает особым синхронизированным образом и устанавливает полярность фолликула. (Из Zamboni L: Comparative studies on ultra-structure of the mammaterial oocytes. In Biggers JD and Schultz AW (eds) : Оогенезис. Балтимор: University Park Press, 19972.) |
Что контролирует кавитацию или раннее образование антрального отдела? Хорошо известно, что кавитация возникает у гипофизэктомированных животных, демонстрируя, что гормоны гипофиза, такие как ФСГ, не требуются для этого морфогенетического события. 32 С этой концепцией согласуется наблюдение, что кавитация возникает у мышей с дефицитом ФСГ-β. 33 , 34 Кажется разумным сделать вывод, что кавитация контролируется аутокринными / паракринными механизмами.В кавитацию вовлечены два фактора роста, экспрессируемые в самом фолликуле: активин и лиганд KIT. Обработка культивированных клеток гранулезы активином вызывает морфогенетические изменения, которые приводят к образованию гистологической единицы с антральной полостью. 35 Блокирование действия лиганда KIT в яичнике предотвращает образование антральных фолликулов; следовательно, овуляции нет, и самка бесплодна. 36 В этом отношении данные подтверждают концепцию, что щелевые соединения ооцитов также важны для кавитации.Щелевые соединения — это межклеточные каналы, состоящие из белков, называемых коннексинами. 20 , 21 Существует по крайней мере 13 членов семейства коннексинов, которые напрямую связывают соседние клетки, обеспечивая диффузию ионов, метаболитов и других низкомолекулярных сигнальных молекул, таких как цАМФ. 20 , 21 C × 37, по-видимому, является производным ооцита коннексином, который образует щелевые соединения между ооцитом и окружающими клетками гранулезы. Данные, полученные на мышах с дефицитом C × 37, приписывают C × 37 обязательную роль в формировании графических фолликулов, овуляции и фертильности. 22 В совокупности все эти данные свидетельствуют о том, что активин, полученный из фолликулов, KIT и C × 37 участвуют в аутокринных / паракринных механизмах, контролирующих кавитацию.
ГРАФИАНСКИЙ ФОЛЛИКЛ.
Графический фолликул можно определить структурно как гетерогенное семейство относительно больших фолликулов (от 0,4 до 23 мм), характеризующихся полостью или антральным отделом, содержащим жидкость, называемую фолликулярной жидкостью или ликворными фолликулами. Характерной структурной единицей всех графиевых фолликулов является антральный отдел.По этой причине термин антральный фолликул правильно используется как синоним графического фолликула. Фолликулярная жидкость — это среда, в которой находятся клетки гранулезы и ооцит, и через которую регуляторные молекулы должны проходить на своем пути в это микросреду и из нее. 37 Удивительно, но мы почти ничего не знаем о физиологическом значении антрального отдела и фолликулярной жидкости в фолликулогенезе. Понятно, что развитие фолликулов и овуляция происходят у птиц и земноводных, несмотря на отсутствие антрального отдела и фолликулярной жидкости.Тем не менее его присутствие у всех видов млекопитающих свидетельствует о его физиологическом значении.
Структура.
Графический фолликул представляет собой трехмерную структуру с центральным антральным отделом, окруженным множеством различных типов клеток (рис. 18). В граафовом фолликуле есть шесть различных гистологических компонентов, включая внешнюю, внутреннюю, базальную пластинки, клетки гранулезы, ооцит и фолликулярную жидкость (рис. 18). Графический фолликул не меняет своей морфологической сложности по мере роста.Все графиевые фолликулы имеют одинаковую базовую архитектуру; Несмотря на то, что размер графических фолликулов резко изменился, их внешний вид остается более или менее неизменным.
Рис. 18. Схема архитектуры типичного графического фолликула класса 5. (Из Эриксона GF: Яичник: Основные принципы и концепции. In Felig P, Baxter JD, Broadus AE, Froman LA, (eds) : Эндокринология и метаболизм. 3-е изд. Нью-Йорк: McGraw-Hill, 1987.) |
Наружная тека (рис.19) характеризуется наличием гладкомышечных клеток, 38 , 39 , которые иннервируются вегетативными нервами. 27 Хотя физиологическое значение наружной теки остается неясным, есть свидетельства того, что она сокращается во время овуляции и атрезии. 40 , 41 Изменения сократительной активности внешней теки могут быть вовлечены в атрезию и овуляцию; однако это не было строго доказано. Желтое тело сохраняет внешнюю теку на протяжении всей своей жизни, 42 , но значение при лютеинизации и лютеолизе неизвестно.
Рис. 19. Чертеж стенки графического фолликула. (Из Bloom W., Fawcett DW: A Textbook of Histology. Philadelphia: WB Saunders, 1975.) |
Theca interna is состоит из дифференцированных TIC, расположенных в матрице рыхлой соединительной ткани и кровеносных сосудов (рис. 19). Во всех граафовых фолликулах ЛГ является ключевым регулирующим гормоном функции TIC, и было установлено его значение в регулировании продукции андрогенов TIC in vivo и in vitro . 27 Начиная с самых ранних стадий развития графических фолликулов, TIC выражают свое дифференцированное состояние в виде андрогенов (, т.е. клеток, продуцирующих андростендион). 27 Внутренняя тека обильно васкуляризована и служит для доставки гормонов (, например, ФСГ, ЛГ), молекул питательных веществ, витаминов и кофакторов, необходимых для роста и дифференцировки ооцитов и клеток гранулезы.
Нам мало известно о регуляторных элементах, контролирующих сосудистую сеть теки.Функциональная связь между сосудистой сетью и развитием граафовых фолликулов подтверждается свидетельством 43 , что все граафовые фолликулы обезьян экспрессируют высокие уровни рецепторов ФСГ и ЛГ независимо от размера, но когда вводится 125 I-хорионический гонадотропин человека (ХГЧ). Системно только доминирующий граафовый фолликул, по-видимому, способен накапливать 125 I-ХГЧ в внутренней теке. Эти результаты предполагают, что доминирующий графиевый фолликул выражает повышенную васкуляризацию, которая играет важную роль в его выбранном созревании.В связи с этим интенсивно исследуются фактор роста эндотелия сосудов из фолликулов 44 , 45 и другие ангиогенные факторы, такие как эндотелин 46 .
Компартменты теки (, т.е. theca externa и interna) выражают свои дифференцированные функции в начале развития графического фолликула (при кавитации) и, по-видимому, конститутивно выражают зрелый фенотип на протяжении всей жизни и смерти графического фолликула.В широком смысле, существует мало или совсем нет доказательств того, что серьезные изменения происходят в слоях теки на различных стадиях развития графиевых фолликулов, помимо тех, которые связаны с сосудистой и пролиферативной активностью. Это может означать, что именно клетки гранулезы (и, возможно, ооцит) являются вариабельными и, следовательно, ответственными за разнообразие графических фолликулов.
В граафовом фолликуле гранулезные клетки и ооцит существуют как масса точно сформированных и точно расположенных клеток (рис.18). Пространственное изменение создает по крайней мере четыре различных слоя или домена гранулезных клеток: самый внешний домен — это гранулезная мембрана, самый внутренний домен — периантраль, промежуточный домен — кучевой оофорус, а домен, прилегающий к ооциту, — это лучшая корона ( Рис.20). Характерным гистологическим свойством мембранного домена является то, что он состоит из псевдостратифицированного эпителия высоких столбчатых гранулезных клеток, все из которых прикреплены к базальной пластинке.
Рис. 20. Схема структурной и функциональной неоднородности клеток гранулезы в здоровом фолликуле графита. Относительное положение гранулезной клетки в клеточной массе определяет ее способность к пролиферации и дифференцировке. (Из Эриксона GF: Графиевый фолликул: функциональное определение. В Adashi EY (ed): Овуляция: эволюция научных и клинических концепций. New York : Springer-Verlag, 2000.) |
Дифференцировку гранулезной клетки можно проследить по ее положению в клеточной массе (рис.20). Например, клетки в домене мембраны прекращают пролиферировать раньше, чем в центральном домене. 47 , 48 Способность клеток гранулезы во внутренних доменах продолжать делиться на протяжении всего развития графиевых фолликулов, предполагает, что они могут быть клетками-предшественниками. Прекращение митоза в домене мембраны характеризуется прогрессирующим выражением явной дифференцировки, при которой они принимают функциональный фенотип полностью дифференцированных клеток. Этот процесс требует временной и координированной экспрессии генов, которые составляют основу цитодифференцировки гранулезы.Механизмы, с помощью которых это происходит, включают лиганд-зависимые сигнальные пути, которые связаны с активацией и ингибированием определенных генов. Например, нормальная дифференцировка клеток гранулезной мембраны требует активации специфических генов, в том числе генов ароматазы цитохрома P450 (P450 arom ) 49 и рецептора LH, 50 и ингибирования структурных генов в пути апоптоза. . Напротив, клетки гранулезы в периантральном, кучевом и лучистом доменах пролиферируют, но они не могут экспрессировать гены, участвующие в терминальной дифференцировке (рис.20).
Что контролирует неоднородность гранулезы? Все клетки гранулезы в здоровом фолликуле графита экспрессируют рецептор ФСГ, 13 , 51 , 52 , и было показано, что мышиные гранулезные клетки в мембранных и кучевых доменах продуцируют цАМФ в ответ на стимуляцию ФСГ. . 53 Эти наблюдения подтверждают, что пост-цАМФ регуляторные события участвуют в аспектах гетерогенности гранулезы. Идея о том, что ооцит играет ключевую роль в возникновении различных паттернов цитодифференцировки гранулезы во время развития графиевых фолликулов, подтверждается исследованиями на грызунах. 54 Между ооцитом и клетками гранулезы происходит диалог, который оказывает большое влияние на фолликулогенез. В развивающихся граафовых фолликулах мышей дифференцированный паттерн пролиферации и дифференцировки между гранулезой в мембранных и кумулюсных доменах находится под контролем секретируемых морфогенов ооцитов. 54 Новый член семейства TGF-β, GDF-9, был обнаружен у мышей. 24 , 25 Окончательное доказательство того, что GDF-9 является обязательным для фолликулогенеза, было получено в исследованиях на мышах с дефицитом GDF-9. 26 У этих животных отсутствие GDF-9 приводило к остановке роста и развития фолликулов на начальной стадии, и самки бесплодны. Эти данные подтверждают идею о том, что GDF-9, секретируемый яйцеклеткой, является обязательным для развития графиевых фолликулов, цитодифференцировки и пролиферации гранулезных клеток, а также для женской фертильности. Клиническая значимость этой новой концепции демонстрируется наличием мРНК GDF-9 в яичниках человека. 25 Текущие проблемы состоят в выяснении механизмов, контролирующих экспрессию GDF-9, и в идентификации клеток-мишеней для GDF-9 и биологических процессов, которые регулирует GDF-9.Представление о том, что факторы роста, полученные из ооцитов, контролируют фолликулогенез и фертильность, может иметь важные последствия для физиологии и патофизиологии человека.
Классификация.
Все графиевые фолликулы можно условно разделить на две группы: здоровые и атретические (рис. 21). Основное различие между этими двумя группами заключается в том, происходит ли апоптоз в клетках гранулезы. Развитие графиевого фолликула (здорового или атретичного) со временем прогрессирует.Это означает, что вариабельность или гетерогенность являются нормальным следствием фолликулогенеза. Здоровый графиевый фолликул со временем становится все более дифференцированным, пока не достигнет преовуляторной стадии (рис. 22). Время этого процесса (рис. 2) у женщин составляет около 2 месяцев. 3 Когда это происходит, существует временной и пространственный паттерн экспрессии большого количества генов. В здоровых фолликулах эти гены управляют цитодифференцировкой, пролиферацией и образованием фолликулярной жидкости.В атретических фолликулах зависящие от времени изменения экспрессии генов вызывают прекращение митоза и экспрессию апоптоза (, т.е. атрезия фолликула). Во время атрезии ооциты и клетки гранулезы становятся обязанными экспрессировать гены, которые приводят к апоптозу. 55 В здоровых и атретичных графиевых фолликулах механизмы контроля включают лиганд-зависимые сигнальные пути, которые ингибируют или стимулируют экспрессию дифференцировки и апоптоза (рис. 22). Понимание молекулярных механизмов и клеточных последствий сигнальных путей лиганд-рецептор, которые контролируют судьбу граафовых фолликулов, является основной целью репродуктивных исследований.
Рис. 21. Два основных класса графиевых фолликулов: здоровые и атретические. Каждый из них претерпевает регулируемый курс прогрессивных изменений, которые приводят к овуляции или апоптозу. (Из Эриксона GF: Графический фолликул: функциональное определение. В Adashi EY (ed): Овуляция: эволюция научных и клинических концепций. Нью-Йорк: Springer- Verlag, 2000.) |
Рис. 22. Схема жизненного цикла графиевых фолликулов в яичниках человека.(Из Эриксона Г.Ф.: Графический фолликул: функциональное определение. В Adashi EY (ed): Овуляция: эволюция научных и клинических концепций. Нью-Йорк: Springer-Verlag, 2000.) |
Процесс образования граафового фолликула рост и развитие можно условно разделить на несколько стадий в зависимости от размера фолликула (рис. 2 и 22). Для клиницистов и исследователей удобно и важно определять физиологические функции различных типов или классов фолликулов в течение всего цикла.У здорового графического фолликула человека есть предназначение завершить переход от малого (от 1 до 6 мм), среднего (от 7 до 11 мм) и большого (от 12 до 17 мм) до полностью дифференцированного преовуляторного состояния (от 18 до 23 мм). . Атретическому графовому фолликулу предназначено завершить переход от малой к средней стадии (от 1 до 10 мм), но он, по-видимому, неспособен вырасти до больших размеров в нормальных физиологических условиях. 56 Поскольку процесс развития графиевых фолликулов является асинхронным, он в любой момент времени производит большую гетерогенную популяцию графических фолликулов в яичниках (рис.3). Каждый из этих морфологически различных графиевых фолликулов представляет собой динамическую структуру, претерпевающую поток или прогрессию изменений в развитии на пути к тому, чтобы стать более дифференцированным или более атретичным (Рис. 22). Следует иметь в виду, что это приводит к наличию крайне неоднородного пула графиевых фолликулов. Это неоднородность, из-за которой трудно прийти к простому функциональному определению графического фолликула.
Размер графического фолликула в значительной степени определяется размером антрального отдела, который определяется объемом фолликулярной жидкости, который определяется биодоступностью ФСГ в жидкости. 57 ФСГ является обязательным для развития графиевых фолликулов, и никакой другой лиганд сам по себе не обладает способностью индуцировать образование фолликулярной жидкости. В отсутствие ФСГ фолликулярная жидкость не образуется, и графитовые фолликулы не развиваются. Разрастание клеток фолликула также способствует росту графиевых фолликулов; В здоровых фолликулах клетки гранулезы и тека сильно разрастаются (в 100 раз), при этом антральный отдел заполняется фолликулярной жидкостью (рис.23). Эти события (, т. Е. повышенное накопление фолликулярной жидкости и пролиферация клеток) ответственны за огромный рост здоровых графиевых фолликулов. 3 , 58 Напротив, именно прекращение митоза и образование фолликулярной жидкости определяет размер атретического графинового фолликула.
Рис. 23. Изменения количества гранулезных клеток и объема фолликулярной жидкости в граафовых фолликулах человека на протяжении фолликулогенеза.Доминирующий фолликул во время овуляции имеет диаметр около 25 мм и содержит около 50 миллионов клеток гранулезы и 7 мл фолликулярной жидкости (из McNatty KP: Гормональные корреляты развития фолликулов в яичнике человека. Aust J Biol Sci 34: 249, 1981. ) |
Выбор доминантного фолликула.
В каждом менструальном цикле яичники обычно производят единственный доминантный фолликул, который участвует в единственной овуляции. Морфометрический анализ нормальных яичников человека (рис.2 и 3) указывает на то, что доминантный фолликул, который будет овулировать в последующем цикле, выбран из когорты здоровых фолликулов класса 5 размером 4,7 ± 0,7 мм в диаметре в конце лютеиновой фазы менструального цикла. 1,2,3, 59 Во время отбора фолликул каждой когорты содержит полностью выросший ооцит, около 1 миллиона клеток гранулезы, внутреннюю теку, содержащую несколько слоев ТИК, и внешнюю теку, состоящую из гладкомышечных клеток ( Рис.3 и 23).
Характерной чертой доминантного фолликула является высокая скорость митоза в клетках гранулезы.Данные свидетельствуют о том, что вскоре после средней лютеиновой фазы скорость митоза гранулезы резко (примерно в два раза) увеличивается в клетках гранулезы во всех когортных фолликулах. 2 , 56 , 60 Это говорит о том, что лютеолиз может сопровождаться всплеском митоза в гранулезе когорты фолликулов класса 5. Первым признаком того, что был выбран один фолликул, по-видимому, является то, что клетки гранулезы в выбранном фолликуле продолжают делиться с относительно быстрой скоростью, в то время как пролиферация в гранулезе фолликулов другой когорты замедляется.Поскольку это различие становится очевидным в конце лютеиновой фазы, утверждалось, что отбор происходит на поздней лютеиновой фазе менструального цикла. Вследствие увеличения митоза доминантный фолликул продолжает быстро расти 3 , 4 во время фолликулярной фазы, достигая 6,9 ± 0,5 мм в дни с 1 по 5, 13,7 ± 1,2 мм в дни с 6 по 10 и 18,8 ± 0,5 мм на 11-14 дни. И наоборот, рост в фолликулах когорты происходит медленнее, и со временем атрезия становится все более очевидной в фолликулах недоминирующей когорты, предположительно из-за экспрессии специфических генов в апоптотическом пути. 56 Атретический фолликул редко достигает в диаметре более 10 мм, независимо от стадии цикла. 4 , 56 , 60
Процесс.
Имеются убедительные доказательства лабораторных животных 61 и экспериментов на приматах 62 , что для достижения доминирования фолликула необходимо добиться вторичного повышения уровня ФСГ в плазме. Как показано на Рисунке 24, вторичный подъем ФСГ у женщин начинается за несколько дней до того, как уровни прогестерона упадут до базальных уровней в конце лютеиновой фазы, а уровни ФСГ остаются повышенными в течение первой недели фолликулярной фазы цикла. 63 Эксперименты на обезьянах продемонстрировали, что доминантный фолликул подвергается атрезии, если вторичное повышение уровня ФСГ предотвращается обработкой экзогенным эстрадиолом. 64 Важной концепцией репродуктивной биологии является то, что повышение биоактивного ФСГ является обязательным для отбора фолликулов и фертильности. 33 , 65 Похоже, что снижение продукции эстрадиола желтым телом является основной причиной вторичного повышения уровня ФСГ 66 , а не падения ингибина А, производного от желтого тела (рис.24).
Рис. 24. Лютеино-фолликулярный переход у женщин. Данные представляют собой средние значения (± SEM) для суточных уровней ингибина A, ингибина B, ФСГ, эстрадиола и прогестерона при лютеин-фолликулярном переходе у женщин с нормальным циклом ( n = 5). Данные сосредоточены на дне менструации в цикле 2. (Из Welt CK, Martin KA, Taylor AE et al: Частотная модуляция фолликулостимулирующего гормона (ФСГ) во время лютеин-фолликулярного перехода: Доказательства контроля ФСГ ингибина В в нормальные женщины.J Clin Endocrinol Metab 82: 2645, 1997, с разрешения Общества эндокринологов.) |
Как происходит вторичный рост выбора контроля ФСГ? Результаты исследований фолликулярной жидкости человека подтверждают вывод о том, что повышение уровня ФСГ в плазме приводит к прогрессивному накоплению относительно высоких концентраций ФСГ в микроокружении одного фолликула в когорте; этому фолликулу суждено стать доминирующим (рис. 25). При развитии здоровых (доминантных) фолликулов (фолликулы классов 5-8) средняя концентрация ФСГ в фолликулярной жидкости увеличивается примерно с 1.От 3 мМЕ / мл (около 58 нг / мл) до около 3,2 мМЕ / мл (около 143 нг / мл) через фолликулярную фазу. 4 , 67 Напротив, 4 , 67 уровни ФСГ низкие или неопределяемые в микросреде недоминирующих когортных фолликулов (рис. 25).
Рис. 25. Иллюстрация концепции, согласно которой доминантный фолликул содержит относительно высокие уровни фолликулостимулирующего гормона (ФСГ) в фолликулярной жидкости, тогда как уровни ФСГ низкие или неопределяемые в когортных фолликулах, предназначенных для атрезии. A. В доминантных фолликулах ФСГ в фолликулярной жидкости индуцирует активность P450 arom , которая метаболизирует андрогенный субстрат до эстрадиола (E 2 ). В таких фолликулах E 2 и андростендион (A 4 ) накапливаются в фолликулярной жидкости в очень высоких концентрациях. B. В недоминантных фолликулах низкие уровни ФСГ приводят к недостатку гранулезных клеток (GC) и низким концентрациям эстрадиола, несмотря на высокие уровни A 4 .(Из Erickson GF, Yen SSC: Новые данные о фолликулярных клетках в поликистозных яичниках: предлагаемый механизм возникновения кистозных фолликулов. Semin Reprod Endocrinol 2: 231, 1984.) |
Поступление ФСГ в фолликулярную жидкость на Считается, что кавитация обеспечивает индукционный стимул, который запускает процесс роста и развития графитовых фолликулов. На клеточном уровне именно рецептор ФСГ на клетке гранулезы является основным игроком в этом процессе. Когда соответствующий высокий порог ФСГ достигается в одном графовом фолликуле, он становится доминирующим. 31 Напротив, маленькие графиевые фолликулы в когорте с подпороговыми уровнями ФСГ становятся недоминантными (рис. 22 и 25). Механизм, с помощью которого один маленький графовый фолликул в когорте способен концентрировать высокие уровни ФСГ в своем микроокружении, остается одной из загадок физиологии яичников. Важным моментом является то, что эстрадиол, продуцируемый доминантным фолликулом, ингибирует вторичный рост ФСГ по механизму отрицательной обратной связи (рис. 24 и 26). Считается, что это обеспечивает подпороговый уровень ФСГ в фолликулах недоминантной когорты, что затем приводит к атрезии.Митоз в клетках гранулезы фолликулов атретической когорты можно стимулировать путем лечения менопаузальным гонадотропином человека (чМГ) на ранней фолликулярной фазе. 59 Если уровни ФСГ повышены до пороговых уровней в микросреде, то недоминантные фолликулы могут быть спасены от атрезии. Этот феномен может иметь значение для способа, которым экзогенный ФСГ или чМГ запускает образование множественных доминантных фолликулов у женщин, подвергающихся индукции овуляции.
Рис.26. Диаграмма, иллюстрирующая важные последствия повышения уровня фолликулостимулирующего гормона (ФСГ) в ранней фолликулярной фазе менструального цикла человека на рост и развитие доминирующего фолликула. |
Что такое фолликул и сколько фолликулов вам нужно?
Возможно, вы никогда раньше не слышали о фолликулах яичников и не ожидали, что они будут иметь такое значение для вас и вашей фертильности. Тем не менее, фолликулов , возможно, являются одной из самых неотъемлемых частей репродуктивной системы женщины, а , сколько у вас фолликулов , часто является прямым способом определения вероятности вашего зачатия естественным путем или метода вспомогательного лечения бесплодия, такого как ЭКО. подойдет вам.
Фолликулы и фертильность неразрывно связаны, и, когда вы начинаете свой путь к лечению вспомогательной бесплодия, может быть полезно понять, что такое фолликулы и какую роль они играют в этом процессе. В этой статье мы объясним , что такое фолликул , сколько яиц в фолликуле, размер фолликула, необходимый для ЭКО, как можно контролировать фолликулы на яичниках с помощью ультразвука и гормонов, и какие у вас есть варианты во время ЭКО яйцеклеток в фолликулах не обнаружено .
Что такое фолликул?
Фолликулы представляют собой небольшие мешочки с жидкостью, находящиеся на внешнем слое яичников, которые содержат незрелые яйца (ооциты). Когда приходит время и фолликул достигает нужного размера, он разрывается и выпускает созревшую яйцеклетку, готовую к оплодотворению. Распространенное заблуждение состоит в том, что каждый фолликул выпускает несколько яйцеклеток. Однако на вопрос , сколько яиц находится в фолликуле , ответ таков: всего одно.
Это научный процесс овуляции, который обычно происходит у большинства женщин ежемесячно в период между половым созреванием и менопаузой.Несколько фолликулов начнут развиваться с каждым циклом, но обычно только один из них высвобождает ооцит. Фолликулы, не выделяющие яйцеклетку, распадаются. Этот процесс известен как атрезия и может произойти на любой стадии развития фолликула.
Сколько фолликулов должно быть в яичнике?
Трудно сказать , сколько фолликулов должно быть в яичнике , поскольку фактически невозможно подсчитать, сколько фолликулов в яичниках у любой женщины.Пока фолликул не начинает развиваться, он известен как примордиальный фолликул. Эти примордиальные фолликулы микроскопические, их размер составляет всего 25 микрометров (0,025 миллиметра). Они слишком малы, чтобы их можно было увидеть невооруженным глазом, и их нельзя обнаружить с помощью УЗИ или любого другого теста.
Однако, как только гормональные сигналы запускают развитие фолликулов, и они начинают созревать и расти, они становятся известными как антральные фолликулы и имеют размер до 10 мм. Затем они видны на УЗИ и могут быть подсчитаны.Это не показывает общее количество фолликулов в яичниках женщины, но просто указание количества видимых антральных фолликулов может помочь определить состояние резервов яичников женщины (количество оставшихся яйцеклеток).
Фолликулы и фертильность
Ультразвуковое исследование антрального фолликула (AFC) может быть выполнено на начальных этапах исследования фертильности, чтобы помочь вам решить, может ли вспомогательное лечение бесплодия, такое как ЭКО, быть подходящим вариантом для вас.
Рост и развитие фолликулов также тщательно контролируются во время лечения бесплодия. В IVI проводится серия из 3 или 4 ультразвуковых сканирований, а также измеряется количество эстрадиола в крови, чтобы проверить, что во время лечения наблюдается нормальный рост и развитие фолликулов.
Эстрадиол — это тип эстрогена, который является основным половым гормоном у женщин и секретируется фолликулами яичников. По мере того, как фолликулы растут и развиваются каждый месяц, они производят эстрадиол, поэтому анализ крови для проверки уровня эстрадиола важен для измерения не только количества вырабатываемых фолликулов и яиц, но и того, насколько они здоровы.
Размер фолликула, необходимый для ЭКО
В качестве подготовки к лечению ЭКО может быть рекомендована стимуляция яичников. Это состоит из введения ежедневных инъекций, которые заставляют яичники вместо производства одной яйцеклетки, что они делают естественным образом каждый месяц, производить больше ооцитов, чтобы можно было получить большее количество эмбрионов. Производство большего количества доступных яиц, конечно, может увеличить шансы на успех лечения.
Однако наиболее важным является качество разрабатываемых яиц, поэтому в IVI мы также будем контролировать размер и состояние фолликула для достижения оптимальных результатов. Когда фолликулы достигают адекватного размера (обычно около 18–25 мм) и мы считаем, что имеется подходящее количество ооцитов, мы планируем пункцию фолликулов через 36 часов после введения инъекции гормона ХГЧ. Это заставляет ооциты созревать таким же образом, как и в естественном цикле.
Что произойдет, если при ЭКО в фолликулах нет яйцеклеток?
В IVI мы делаем все возможное, чтобы способствовать успешному и здоровому росту ваших фолликулов и стимулировать увеличение яйцеклетки, чтобы дать лечению ЭКО оптимальные шансы на успех.
В редких случаях пункция фолликула может привести к тому, что яйцеклетки не будут извлечены из фолликулов. Даже если фолликулы могут быть здоровыми и расти, это не обязательно означает, что они будут производить яйцеклетку.Если в фолликулах нет яйцеклеток, лечение ЭКО не может быть завершено в этом случае. Это не означает, что последующее лечение не будет успешным, поскольку реакция фолликулов варьируется, а на рост яйцеклеток может влиять множество факторов. Существует также возможность использовать донора яйцеклеток, если вы не можете зачать ребенка, используя собственные яйцеклетки.
Что произойдет, если фолликулов слишком много?
При стимуляции яичников возможно развитие синдрома гиперстимуляции яичников (СГЯ).Это когда ваши яичники чрезмерно стимулируются и производят слишком много фолликулов и зрелых яиц. Большое количество фолликулов в яичниках может привести к осложнениям со здоровьем, и с СГЯ нужно бороться с осторожностью.
Если вам меньше 30 лет, вы страдаете синдромом поликистозных яичников (СПКЯ) или ранее страдали СГЯ, то вы можете подвергаться большему риску. Во время вашего первоначального тестирования и процесса скрининга мы учтем эти факторы и сможем определить, есть ли у вас риск развития СГЯ, и предпримем необходимые шаги, чтобы свести к минимуму это во время цикла лечения.
Мы также внимательно следим за ростом вашего фолликула на протяжении всего лечения и сможем сразу определить, разовьется ли СГЯ. В большинстве случаев это не должно повлиять на ваше лечение бесплодия, которое должно продолжаться в соответствии с планом.
Важны ли фолликулы для лечения ВМИ?
IUI (внутриматочная инсеминация) — один из самых простых способов лечения бесплодия. Сперма мужчины готовится в лаборатории, а затем помещается непосредственно в матку женщины, что увеличивает шансы того, что сперма достигнет яйцеклетки и оплодотворяет ее.ВМИ может быть очень успешным методом лечения пар с низкой подвижностью сперматозоидов или трудностями с овуляцией, а также для пар с неустановленными причинами недостаточной фертильности.
Как обсуждалось ранее, чем больше количество фолликулов, вырабатывающих здоровые яйцеклетки, тем выше шансы на успешное естественное или вспомогательное зачатие. Это означает, что здоровье и рост фолликулов важны для лечения ВМИ. Таким образом, существует возможность облегчить процесс ВМИ с помощью стимуляции яичников, как при ЭКО.
Какова вероятность успеха ВМИ с одним фолликулом?В среднем за цикл образуется от десяти до двенадцати фолликулов, но это может варьироваться от человека к человеку и зависит от множества факторов, таких как возраст, история болезни и ваша индивидуальная реакция на стимуляцию яичников.
Хотя наличие большого количества фолликулов идеально для лечения бесплодия, это не обязательно означает, что меньшее количество фолликулов повлияет на ваши шансы на успех. Больше всего имеет значение качество произведенных яиц, а не их количество.Таким образом, возможно успешное лечение бесплодия, даже если вы произведете всего несколько фолликулов или даже один здоровый зрелый фолликул, который высвобождает жизнеспособную яйцеклетку.
Помните, что для рождения ребенка требуется всего одна яйцеклетка, а для образования здоровой яйцеклетки нужен только один фолликул. Следовательно, в зависимости от каждого случая может быть очень хороший показатель успешности ВМИ даже с одним фолликулом .
ПодробнееIVI предлагает наилучших возможных методов уже более 28 лет, с момента своего основания в 1990 году, и с помощью группы родилось более 160 000 детей.Располагая более чем 70 клиниками в 13 разных странах, IVI является пионером в области репродуктивной медицины и находится на переднем крае развития и продвижения медицины в этой области.
Чтобы получить дополнительную информацию или поговорить с кем-нибудь о наших вспомогательных методах лечения бесплодия, вы можете позвонить или использовать онлайн-контактную форму, и специалист IVI свяжется с вами, чтобы поговорить с вами без каких-либо обязательств.
Запросить дополнительную информацию, без обязательств
Время введения ФСГ для стимуляции яичников у женщин с нормоовуляцией: сравнение начала краткосрочного лечения в начале или в середине фолликулярной фазы | Репродукция человека
Аннотация
СПРАВОЧНАЯ ИНФОРМАЦИЯ: У женщин с нормальным овуляторным бесплодием, подвергающихся умеренной стимуляции яичников после ЭКО, режим стимуляции ФСГ должен быть тщательно отрегулирован, чтобы контролировать количество задействованных фолликулов и предотвратить многоплодную беременность.Целью этого проспективного исследования было оценить влияние времени введения ФСГ (фиксированная доза и продолжительность) на количество крупных фолликулов. МЕТОДЫ. Женщины были проспективно рандомизированы с помощью запечатанных конвертов для ежедневного получения 112,5 МЕ рекомбинантного ФСГ (рФСГ) либо со дня цикла (CD) 2–6 (Группа A), либо с CD 7–11 (Группа B). Гормональные измерения и ультразвуковое исследование фолликулов проводились на CD 2, 7 и 12. РЕЗУЛЬТАТЫ: На CD 12 скорость развития ровно двух фолликулов диаметром ≥14 мм была значительно ниже в группе A, чем в группе B (4% женщин по сравнению с 42%, P = 0.002). Хотя образец концентрации эстрадиола в сыворотке (E 2 ) в группе A демонстрировал плато от CD 7, частота отмены при чрезмерной стимуляции (более трех фолликулов диаметром ≥14 мм) была значительно увеличена ( P = 0,009). ВЫВОДЫ: Предотвращение закрытия окна ФСГ при средней и поздней фолликулярной фазе введение ФСГ лучше выполняет задачу получения ограниченного количества крупных фолликулов, чем превышение порога ФСГ при раннем введении.
ВведениеКонтроль количества растущих фолликулов является одним из ключевых вопросов стимуляции яичников у женщин, которые не переходят к ЭКО в качестве терапии первой линии, потому что количество фолликулов в день введения ХГЧ является основным определяющим фактором как частоты наступления беременности, так и риска. осложнений. Действительно, у женщин с нормоовуляторным циклом, подвергающихся внутриматочной инсеминации (ВМИ) по поводу необъяснимого или умеренного мужского бесплодия, частота наступления беременности значительно повышается, когда стимуляция ФСГ приводит к более чем одному доминантному фолликулу.Между тем одновременно возрастает риск многоплодной беременности и синдрома гиперстимуляции яичников (СГЯ) (Stone et al ., 1999; Guzick et al ., 1999; Dickey et al ., 2001). Таким образом, обычно считается, что увеличение вероятности беременности не должно перевешивать риск многоплодных родов. Однако до сих пор нет определенного консенсуса относительно наиболее подходящего количества и размера фолликулов для набора в таких ситуациях. Когда применяется стратегия щадящей стимуляции, в настоящее время рекомендуется воздержаться от введения ХГЧ, если присутствует более трех крупных фолликулов (Fauser et al ., 2005). Однако запуск овуляции ровно с двумя большими фолликулами может быть более актуальным для одновременного увеличения успешности и предотвращения многоплодной беременности высокого порядка. Что касается размеров фолликулов, несколько исследований продемонстрировали, что риск многоплодной беременности высокого порядка лучше связан с количеством фолликулов диаметром ≥10 мм, чем с количеством крупных фолликулов во время введения ХГЧ. Однако разные пороговые значения, например более 3, 6 или 7 фолликулов диаметром ≥10 мм (Gleicher et al ., 2000; Tur et al ., 2001; Dickey et al. ., 2005), были предложены для приостановки введения ХГЧ. Следовательно, хотя фолликулы диаметром менее 14 мм в день введения ХГЧ вряд ли приведут к овуляции, определяемой по коллапсу фолликулов при ультразвуковом исследовании (Silverberg et al ., 1991), и приведут к беременности (Richmond et al. ., 2005), при введении ХГЧ следует учитывать наличие фолликулов среднего размера (10–13 мм).Соответственно, цель стимуляции яичников, ведущая к развитию двух фолликулов диаметром ≥14 мм с ограниченным количеством фолликулов диаметром ≥10 мм, может быть подходящим вариантом для оптимальной частоты наступления беременности с ограниченным риском многоплодных родов высокого порядка. у нормоовуляторных женщин.
На сегодняшний день не существует четких рекомендаций относительно управления стимуляцией ФСГ у нормоовуляторных женщин для достижения этой цели. В клинической практике введение ФСГ обычно начинают с ранней фолликулярной фазы, при этом начальная доза рассчитывается с учетом возраста, ИМТ и предыдущей реакции яичников в анамнезе.Последующие корректировки дозы ФСГ выполняются в соответствии с ответом яичников, чтобы модулировать количество растущих фолликулов. Суточные дозы ФСГ от 75 до 150 МЕ в настоящее время используются в программах стимуляции яичников для ВМИ. У нормоовуляторных женщин было показано (Sengoku et al ., 1999), что протокол повышения низких доз (начальная доза 75 МЕ в день с увеличением дозы на 37,5 МЕ каждые 7 дней при отсутствии набора фолликул) в среднем приводит к образованию двух крупных и двух фолликулов среднего размера.Тем не менее около 50% циклов были монофолликулярными для больших фолликулов. По сравнению с обычным протоколом (начальная доза 150 МЕ увеличивалась на 75 МЕ каждые 5 дней) среднее количество фолликулов большого и среднего размера составляло около четырех и трех соответственно, а скорость развития монофолликулов была снижена до 25%. Следовательно, промежуточная начальная доза 112,5 МЕ может лучше соответствовать цели высокой скорости развития бифолликулов для больших фолликулов и ограниченного числа растущих фолликулов.
Продолжительность и время введения ФСГ — другие важные инструменты для определения количества растущих фолликулов. Во время лютео-фолликулярного перехода нормального цикла повышение сывороточного ФСГ сверх определенного порога инициирует рекрутирование нескольких фолликулов. Впоследствии закрытие окна ФСГ из средней фолликулярной фазы отвечает за выбор одного доминантного фолликула. Эти две концепции — «порог ФСГ» и «окно ФСГ» применялись к ановуляторным женщинам для индукции овуляции с помощью двух разных протоколов, а именно «повышающего» и «понижающего» режима введения ФСГ (Homburg and Howles, 1999). .Основным преимуществом поэтапного режима является более короткая продолжительность введения ФСГ, но его безопасность в отношении скорости мультифолликулярного развития по сравнению с поэтапным протоколом кажется ниже (Christin-Maitre et al ., 2003). Некоторые данные свидетельствуют о том, что у женщин с нормоовуляцией продолжительность и время, а не доза введения ФСГ участвуют в регуляции количества растущих фолликулов во время стимуляции яичников. Действительно, как раннее введение ФСГ в начале фолликулярной фазы (Hohmann et al ., 2001), а длительное введение ФСГ в позднюю фолликулярную фазу (Lolis et al ., 1995; Hughes et al ., 1998), как оказалось, увеличивало процент циклов с более чем одним доминантным фолликулом. Более того, сообщалось, что продолжительность, а не величина введения ФСГ влияет на развитие фолликулов (Schipper et al ., 1998a). Действительно, кратковременное повышение уровней ФСГ, вызванное однократной инъекцией высокой дозы ФСГ в ранней фолликулярной фазе, не нарушало процессов отбора и доминирования, тогда как умеренное, но стойкое повышение уровней ФСГ при использовании того же разделения доз при ежедневной инъекции для Через 5 дней от средней до поздней фолликулярной фазы индуцировался продолжающийся рост множества фолликулов.Однако краткосрочное лечение от ранней до средней фолликулярной фазы для превышения порога ФСГ с последующим прекращением введения ФСГ со средней до поздней фолликулярной фазы, чтобы закрыть окно ФСГ, могло бы быть альтернативным подходом к имитации нормального физиологические изменения и получение ограниченного количества растущих фолликулов.
Это проспективное рандомизированное исследование было проведено среди женщин с нормоовуляцией для оценки влияния времени введения ФСГ на итоговое количество фолликулов диаметром ≥14 мм и ≥10 мм.Сравнение проводилось между женщинами, получавшими в течение 5 дней ежедневную дозу 112,5 МЕ рекомбинантного ФСГ (рФСГ), инициированную либо с ранней, либо со средней фолликулярной фазы.
Материалы и методы СубъектыС мая 2000 г. по ноябрь 2002 г. бесплодные женщины с овуляторным циклом были включены в это исследование, одобренное комитетом по обзору. Критериями включения были: возраст ≤38 лет, ИМТ ≤27, продолжительность цикла 27–32 дня, уровень лютеинового прогестерона в плазме ≥5 нг / мл, нормальный базальный уровень ФСГ (≤13 МЕ / л) и нормальное количество антральных фолликулов (6 < AFC <24 фолликулов для обоих яичников) на УЗИ.Критериями исключения были предыдущие операции на яичниках, эндометриоз яичников, эндокринные и системные нарушения (например, сахарный диабет, заболевания печени, почек или сердечно-сосудистой системы). Для участия в этом исследовании принимали участие женщины с необъяснимым бесплодием или нуждающиеся в ВМИ по поводу шейного или умеренного мужского бесплодия. Включенные пациенты дали письменное информированное согласие.
ПротоколПациенты были проспективно рандомизированы с помощью запечатанных непрозрачных конвертов для ежедневного приема s.c. инъекции 112,5 МЕ рФСГ (Gonal F®; Сероно, Булонь, Франция) либо со дня цикла (CD) 2–6 (Группа A), либо с CD 7–11 (Группа B). Последовательность случайного распределения была сгенерирована из таблицы случайных чисел и была скрыта от врача, который включал и рандомизировал пациентов. Это исследование не было слепым.
Забор крови для определения гормонального фона и ультразвуковой оценки развития фолликулов проводился на CD 2, 7 и 12 в обеих группах. Согласно данным, полученным на CD 12, на предполагаемый день введения ХГЧ была запрограммирована еще одна оценка развития фолликулов.В план исследования не было включено дополнительное введение экзогенного ФСГ между введением CD 12 и ХГЧ. Однако несколько пациентов, которым требовалась поддержка гонадотропином для поддержания секреции эстрадиола (E 2 ) или роста фолликулов на CD 12, действительно получали дополнительный ФСГ, чтобы избежать отмены цикла.
Когда хотя бы один фолликул достиг 17 мм в диаметре, вводили 5000 МЕ ХГЧ с мочой (Gonadotrophines chorioniques Endo®; Органон, Пюто, Франция). Лютеиновая поддержка не выполнялась.Когда присутствовало более трех фолликулов диаметром ≥14 мм, введение ХГЧ было приостановлено, и пациенты были проинформированы об отказе от полового акта или защищенном половом акте.
Гормональные измеренияГормональные измерения проводили с использованием имеющихся в продаже хемилюминесцентных иммуноанализаторов с автоматическим иммуноанализатором Elecsys (ECLIA; Roche Diagnosis, Мейлан, Франция). Чувствительность анализа составила 0,1 МЕ / л для ФСГ и ЛГ.Коэффициенты вариации внутри анализа и между анализами находились в пределах 3 и 6% и в пределах 3 и 4%, соответственно, для ФСГ и ЛГ. Чувствительность анализа составляла 5 пг / мл и 0,03 нг / мл для E 2 и прогестерона соответственно. Коэффициенты вариации внутри анализа и между анализами составляли 5 и 10%, соответственно, для E 2 и 3 и 5%, соответственно, для прогестерона. Ингибин (INH) A и B измеряли в замороженных образцах сыворотки, как описано ранее (Lahlou et al ., 1999) с использованием реагентов Oxford BioInnovation, распространяемых DSL-France (Cergy-Pontoise, Франция). В анализе INH A точность внутри анализа составляла 5,4 и 3,2% при концентрациях 14 и 48 пг / мл соответственно, чувствительность составляла 1 пг / мл. В анализе INH B точность внутри анализа составляла 7,4 и 4,2% при концентрациях 44 и 225 пг / мл соответственно; чувствительность составила 6 пг / мл.
УЗИ влагалищаУльтразвуковые исследования были выполнены с помощью вагинального датчика с частотой 6 МГц и устройства Toshiba SSA-340.Диаметр фолликула рассчитывали как средний диаметр, измеренный в 2D. В этом исследовании рассматривались только фолликулы диаметром> 4 мм.
Оценка размера выборкиЭто исследование было технико-экономическим обоснованием. Поскольку до сих пор доступно очень мало данных относительно эффектов краткосрочного лечения ФСГ у женщин с нормоовуляцией, и отсутствуют данные для режима суточной дозы 112,5 МЕ, первичная конечная точка не была определена. Однако размер выборки из 25 человек в группе может показать около 40% вариаций в скорости развития фолликулов.Это соответствует результатам, полученным в предыдущих опубликованных исследованиях, цитируемых в Introduction .
Статистический анализРезультаты выражены как среднее ± стандартное отклонение. Статистический анализ выполнялся с помощью программы StatView 4.5 (Abacus Concepts, Беркли, Калифорния, США). Номинальные или непрерывные переменные были проанализированы с помощью хи-квадрат или критерия Стьюдента t или дисперсионного анализа для повторных измерений, если это необходимо. Значение P <0.05 считали статистически значимым.
Результаты Исходные характеристикиИз 52 рандомизированных нормоовуляторных женщин 48 начали стимуляцию ФСГ и завершили цикл исследования до CD 12 в соответствии с протоколом (рис. 1). Обе группы были похожи (таблица I) в отношении возраста, ИМТ, продолжительности цикла, овариального резерва, оцениваемого по уровням CD 3 ФСГ и E 2 в плазме, а также по фактору бесплодия.
Рисунок 1.
Блок-схема пациентов на протяжении всего исследования.
Рис. 1.
Блок-схема пациентов на протяжении всего исследования.
Таблица I.Характеристики пациентов, которые получали ежедневные инъекции 112,5 МЕ рекомбинантного ФСГ со 2-го по 6-й день цикла (группа A) или с 7-го по 11-й день (группа B)
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Возраст (лет) | 30,8 ± 3,8 | 30,5 ± 3,4 | NS |
| ИМТ (кг / м 2 ) | 21,4 ± 2,8 | 21,1 ± 2,2 | NS |
| Длина цикла (дни) | 28 ± 1,2 | 28 ± 1,2 | NS |
| CD 3 FSH (МЕ / л) | 8.2 ± 2,1 | 7,2 ± 2,7 | NS |
| CD 3 E 2 (пг / мл) | 41 ± 12 | 34 ± 17 | NS |
| CD 20 прогестерон (нг / мл) ) | 13,3 ± 4,5 | 15,9 ± 7 | NS |
| Фактор бесплодия | NS | ||
| Бесплодие необъяснимое | 17 | 14 | |
| 14 | |||
| мужской фактор средней степени тяжести 4 | 6 | ||
| Цервикальный фактор | 3 | 4 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Возраст (лет) | 30,8 ± 3,8 | 30,5 ± 3,4 | NS |
| ИМТ (кг / м 2 ) | 21,4 ± 2,8 | 21,1 ± 2,2 | NS |
| Длина цикла (дни) | 28 ± 1,2 | 28 ± 1.2 | NS |
| CD 3 FSH (МЕ / л) | 8,2 ± 2,1 | 7,2 ± 2,7 | NS |
| CD 3 E 2 (пг / мл) | 41 ± 12 | 34 ± 17 | NS |
| CD 20 прогестерон (нг / мл) | 13,3 ± 4,5 | 15,9 ± 7 | NS |
| Фактор бесплодия | NS | ||
| UD бесплодие | 17 | 14 | |
| Средний мужской фактор | 4 | 6 | |
| Цервикальный фактор | 3 | 4 |
Характеристики пациентов, которым ежедневно вводили 112,5 МЕ рекомбинантного ФСГ со 2-го по 6-й день цикла (группа A) или с 7-го по 11-й дни (группа B)
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Возраст (лет) | 30,8 ± 3,8 | 30,5 ± 3,4 | NS |
| ИМТ (кг / м 2 ) | 21.4 ± 2,8 | 21,1 ± 2,2 | NS |
| Длина цикла (дни) | 28 ± 1,2 | 28 ± 1,2 | NS |
| CD 3 FSH (МЕ / л) | 8,2 ± 2,1 | 7,2 ± 2,7 | NS |
| CD 3 E 2 (пг / мл) | 41 ± 12 | 34 ± 17 | NS |
| CD 20 прогестерон (нг / мл) | 13,3 ± 4,5 | 15,9 ± 7 | NS |
| Фактор бесплодия | NS | ||
| Бесплодие без объяснения причин | 17 | 14 | |
| Умеренный мужской фактор | 6 | ||
| Цервикальный фактор | 3 | 4 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Возраст (лет) | 30,8 ± 3,8 | 30,5 ± 3,4 | NS |
| ИМТ (кг / м 2 ) | 21,4 ± 2,8 | 21,1 ± 2,2 | NS |
| Длина цикла (дни) | 28 ± 1,2 | 28 ± 1.2 | NS |
| CD 3 FSH (МЕ / л) | 8,2 ± 2,1 | 7,2 ± 2,7 | NS |
| CD 3 E 2 (пг / мл) | 41 ± 12 | 34 ± 17 | NS |
| CD 20 прогестерон (нг / мл) | 13,3 ± 4,5 | 15,9 ± 7 | NS |
| Фактор бесплодия | NS | ||
| Ued бесплодие | 17 | 14 | |
| Умеренный мужской фактор | 4 | 6 | |
| Цервикальный фактор | 3 | 4 |
После введения ФСГ с CD 2 на CD 6 в группе A количество фолликулов ≥10 мм и толщина эндометрия, оцененные на CD 7, были значительно выше, чем в группе B.Однако на CD 12 после аналогичного введения ФСГ с CD 7 на CD 11 в группе B это различие больше не было значимым между двумя группами (таблица II).
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| CD 2 | |||
| Фолликулы <10 мм | 8.2 ± 4,2 | 7,6 ± 2,8 | NS |
| Толщина эндометрия (мм) | 4 ± 1,5 | 4,8 ± 2 | NS |
| CD 7 | |||
| Фолликулы ≥10 мм | 3,8 ± 2,9 | 0,9 ± 0,8 | 0,0001 |
| Фолликулы <10 мм | 7,2 ± 5 | 9,15 ± 5 | NS |
| Толщина эндометрия (мм) | 7.5 ± 1,5 | 4,5 ± 1,6 | 0,0001 |
| CD 12 | |||
| Фолликулы ≥14 мм | 2,6 ± 2,7 | 1,5 ± 0,7 | NS |
| Фолликулы 10 –13 мм | 2,1 ± 2 | 2 ± 2 | NS |
| Фолликулы <10 мм | 6,8 ± 4,1 | 5,9 ± 3,8 | NS |
| Толщина эндометрия (мм) | 8.8 ± 2 | 8,6 ± 1,8 | NS |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| CD 2 | |||
| Фолликулы <10 мм | 8,2 ± 4,2 | 7,6 ± 2,8 | NS |
| Толщина эндометрия (мм) | 4 ± 1.5 | 4,8 ± 2 | NS |
| CD 7 | |||
| Фолликулы ≥10 мм | 3,8 ± 2,9 | 0,9 ± 0,8 | 0,0001 |
| Фолликулы <10 мм | 7,2 ± 5 | 9,15 ± 5 | NS |
| Толщина эндометрия (мм) | 7,5 ± 1,5 | 4,5 ± 1,6 | 0,0001 |
| CD 12 | |||
| Фолликулы ≥14 мм | 2.6 ± 2,7 | 1,5 ± 0,7 | NS |
| Фолликулы 10–13 мм | 2,1 ± 2 | 2 ± 2 | NS |
| Фолликулы <10 мм | 6,8 ± 4,1 | 5,9 ± 3,8 | NS |
| Толщина эндометрия (мм) | 8,8 ± 2 | 8,6 ± 1,8 | NS |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| CD 2 | |||
| Фолликулы <10 мм | 8,2 ± 4,2 | 7,6 ± 2,8 | NS |
| Толщина эндометрия (мм) | 4 ± 1,5 | 4,8 ± 2 | NS |
| CD 7 | |||
| Фолликулы ≥10 мм | 3.8 ± 2,9 | 0,9 ± 0,8 | 0,0001 |
| Фолликулы <10 мм | 7,2 ± 5 | 9,15 ± 5 | NS |
| Толщина эндометрия (мм) | 7,5 ± 1,5 | 4,5 ± 1,6 | 0,0001 |
| CD 12 | |||
| Фолликулы ≥14 мм | 2,6 ± 2,7 | 1,5 ± 0,7 | NS |
| Фолликулы 10–13 мм | 2.1 ± 2 | 2 ± 2 | NS |
| Фолликулы <10 мм | 6,8 ± 4,1 | 5,9 ± 3,8 | NS |
| Толщина эндометрия (мм) | 8,8 ± 2 | 8,6 ± 1,8 | NS |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| CD 2 | |||
| Фолликулы <10 мм | 8,2 ± 4,2 | 7,6 ± 2,8 | NS |
| Толщина эндометрия (мм) | 4 ± 1,5 | 4,8 ± 2 | NS |
| CD 7 | |||
| Фолликулы ≥10 мм | 3,8 ± 2,9 | 0,9 ± 0.8 | 0,0001 |
| Фолликулы <10 мм | 7,2 ± 5 | 9,15 ± 5 | NS |
| Толщина эндометрия (мм) | 7,5 ± 1,5 | 4,5 ± 1,6 | 0,0001 |
| CD 12 | |||
| Фолликулы ≥14 мм | 2,6 ± 2,7 | 1,5 ± 0,7 | NS |
| Фолликулы 10–13 мм | 2.1 ± 2 | 2 ± 2 | NS |
| Фолликулы <10 мм | 6,8 ± 4,1 | 5,9 ± 3,8 | NS |
| Толщина эндометрия (мм) | 8,8 ± 2 | 8,6 ± 1,8 | NS |
Тем не менее, скорость развития ровно двух крупных фолликулов была значительно выше ( P = 0,002) в группе B (42% женщин), чем в группе A (4%). Если скорость развития двух или трех крупных фолликулов была сгруппирована в один класс, разница между группами оставалась значимой ( P = 0.04). Однако распределение фолликулов диаметром ≥10 мм было одинаковым в обеих группах (Таблица III).
Таблица III.Фолликулярная когорта на CD 12
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Фолликулы ≥14 мм | (Отсутствуют 3) | (Отсутствуют 1) | P = 0.002 |
| Один | 9 | 11 | |
| Два | 1 | 10 | |
| Три | 6 | 2 | |
| Четыре или более | 0 | ||
| Фолликулы ≥10 мм | NS | ||
| Три или меньше | 13 | 13 | |
| От четырех до шести | 5 | 8 | |
| Семь или более | 6 | 3 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Фолликулы ≥14 мм | (Отсутствуют 3) | (Отсутствуют 1) | P = 0,002 |
| Один | 9 | 11 | |
| Два | 110 | ||
| Три | 6 | 2 | |
| Четыре или более | 5 | 0 | |
| Фолликулы ≥10 мм | 9097 | ||
| Три или меньше | 13 | 13 | |
| От четырех до шести | 5 | 8 | |
| Семь или более | 6 | 3 |
Фолликулярная когорта на CD 12
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Фолликулы ≥14 мм | (Отсутствуют 3) | (Отсутствуют 1) | P = 0,002 |
| Один | 9 | 11 | |
| Два | 110 | ||
| Три | 6 | 2 | |
| Четыре или более | 5 | 0 | |
| Фолликулы ≥10 мм | 9097 | ||
| Три или меньше | 13 | 13 | |
| От четырех до шести | 5 | 8 | |
| Семь или более | 6 | 3 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Фолликулы ≥14 мм | (Отсутствуют 3) | (Отсутствуют 1) | P = 0,002 |
| Один | 9 | 11 | |
| Два | 110 | ||
| Три | 6 | 2 | |
| Четыре или более | 5 | 0 | |
| Фолликулы ≥10 мм | 9097 | ||
| Три или меньше | 13 | 13 | |
| От четырех до шести | 5 | 8 | |
| Семь или более | 6 | 3 |
Было нет значимой связи между количеством фолликулов ≥14 мм или ≥10 мм в диаметре на CD 12 и базальные уровни ФСГ или INH B в плазме на CD 2.
Концентрация гормонов в сывороткеПаттерны концентрации гормонов в плазме сильно различались между группами (рис. 2). Значения E 2 и INH A увеличивались во время ранней фолликулярной фазы и имели тенденцию к выходу на плато между CD 7 и CD 12 в группе A, тогда как они резко увеличивались во время поздней фолликулярной фазы в группе B. Введение ФСГ в группе A предотвращало снижение Уровни ФСГ на 7-й день, тогда как значения ФСГ снизились со 2-го по 7-й день в группе B.Введение ФСГ в позднюю фолликулярную фазу в группе В привело к более высоким уровням ФСГ в группе В, чем в группе А, на 12 день ( P < 0,009). Значения INH B увеличились на CD 7 и снизились на CD 12 в группе A, тогда как они резко увеличились во время поздней фолликулярной фазы после введения ФСГ в группе B.
Рис. 2.
Концентрации эстрадиола (E 2 ), ингибина (INH) A, FSH и INH B в сыворотке на 2, 7 и 12 дни цикла в группе A (–– • ––) и группе B (–– ○ -).Результаты представлены со средним доверительным интервалом ± 95%. Дисперсионный анализ для повторных измерений показал значительные различия между группами лечения: P <0,001 для E 2 , P = 0,009 для INH A, P <0,001 для FSH и P = 0,02 для INH B.
Рисунок 2.
Концентрации эстрадиола (E 2 ), ингибина (INH) A, FSH и INH B в сыворотке на 2, 7 и 12 дни цикла в группе A (–– • ––) и группе B (–– ○ -).Результаты представлены со средним доверительным интервалом ± 95%. Дисперсионный анализ для повторных измерений показал значимые различия между группами лечения: P <0,001 для E 2 , P = 0,009 для INH A, P <0,001 для FSH и P = 0,02 для INH B.
Паттерны ответа яичников в группе АФолликулярные и гормональные реакции на введение ФСГ были довольно неоднородными в группе А.Две подгруппы были охарактеризованы в соответствии с наличием (подгруппа A1, n = 10) или отсутствием (подгруппа A2, n = 14) по крайней мере одного фолликула диаметром ≥14 мм на CD 7, с ведущим средним значением фолликула. размер 15,3 ± 1,6 мм и 11,7 ± 1,6 мм соответственно. Как показано на рисунке 3, две подгруппы различались по CD 2 только по уровням ФСГ, которые были значительно ниже в подгруппе A1, чем в подгруппе A2 (7,8 ± 1,4 против 10,8 ± 4,1 ЕД / л, P = 0,04), тогда как среднее значение количество фолликулов <10 мм в диаметре не различалось между подгруппами.Ранний ответ на ФСГ привел к более раннему мониторингу ответа яичников, первоначально запланированного на D12, у всех пациенток из подгруппы A1 (средний день контроля 9,4 ± 0,7) и у 9 из 14 пациентов из подгруппы A2 (средний день контроля 11,5 ± 0,8). В то время среднее количество фолликулов диаметром ≥14 мм было значительно выше в подгруппе A1, чем в подгруппе A2 (4,5 ± 3,1 против 1,2 ± 1,1, P = 0,001), а также среднее количество фолликулов ≥10 мм в диаметре (7,1 ± 4,5 против 1,8 ± 1,9, P = 0.001). С 7 дня до оценки ответа яичников рост ведущего фолликула был значительно выше в подгруппе A1, чем в подгруппе A2 (2 ± 0,5 против 0,9 ± 0,6 мм в день, P < 0,0001).
Рисунок 3.
Различные модели сывороточных концентраций E 2 и ФСГ и развития фолликулов в группе А в зависимости от типа ответа яичников. Подгруппы A1 (–– • ––) и A2 (–– ○ -) характеризовались наличием или отсутствием хотя бы одного фолликула диаметром ≥14 мм на 7 день цикла соответственно.Результаты представлены со средним доверительным интервалом ± 95%. * = значения из подгрупп A1 и A2 значительно различаются, P <0,05.
Рисунок 3.
Различные модели сывороточных концентраций E 2 и ФСГ и развития фолликулов в группе А в зависимости от типа ответа яичников. Подгруппы A1 (–– • ––) и A2 (–– ○ -) характеризовались наличием или отсутствием хотя бы одного фолликула диаметром ≥14 мм на 7 день цикла соответственно. Результаты представлены со средним доверительным интервалом ± 95%.* = значения из подгрупп A1 и A2 значительно различаются, P <0,05.
Результат циклаВосемь циклов в группе A были отменены из-за чрезмерного ответа (более 3 фолликулов диаметром ≥14 мм) и только один в группе B ( P = 0,009). Четыре пациента из подгруппы A2 получили дополнительное введение ФСГ для поддержания роста фолликулов от CD 12 до введения ХГЧ и ни одного пациента из группы B. В день введения ХГЧ (Таблица IV) концентрации E 2 в плазме были значительно выше в группе B, чем в группе А, тогда как среднее количество фолликулов диаметром ≥14 мм не различается между группами.Однако скорость развития ровно двух крупных фолликулов была значительно выше в группе B. Концентрации стероидов в плазме во время лютеиновой фазы были одинаковыми между группами. Только одна беременность была получена в группе A, а частота наступления беременности в группе B составила 21% за начатый цикл. Было пять одноплодных беременностей и одна двойная беременность (группа B), в результате чего родилось семь здоровых детей.
Таблица IV.Результат стимуляции яичников
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Отмена (% за начатый цикл) | 8 (33,3) | 1 (4,2) | 0,009 |
| В день ХГЧ | |||
| ХГЧ день 900 | 12,4 ± 3,5 | 12 ± 1,1 | NS |
| E 2 (пг / мл) | 312 ± 186 | 489 ± 136 | 0.006 |
| Фолликулы> 14 мм | 1,6 ± 0,9 | 1,7 ± 0,8 | NS |
| Один | 11 | 10 | |
| Два | 1 | 9 | 0,05 900 |
| Три | 5 | 4 | |
| Фолликулы 10-13 мм | 1,1 ± 1,6 | 1,9 ± 2 | NS |
| Толщина эндометрия (мм) | 9.1 ± 2,3 | 9,1 ± 2 | NS |
| Лютеиновая фаза | |||
| E 2 (пг / мл) | 217 ± 152 | 452 ± 448 | NS |
| Прогестерон (нг / мл) | 16,4 ± 12,9 | 18,6 ± 6,7 | NS |
| Беременности (% за начатый цикл) | 1 (4,2) | 5 (20,8) | 0,08 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . |
|---|---|---|---|
| Отмена (% за начатый цикл) | 8 (33,3) | 1 (4,2) | 0,009 |
| В день ХГЧ | |||
| ХГЧ день 900 | 12,4 ± 3,5 | 12 ± 1,1 | NS |
| E 2 (пг / мл) | 312 ± 186 | 489 ± 136 | 0.006 |
| Фолликулы> 14 мм | 1,6 ± 0,9 | 1,7 ± 0,8 | NS |
| Один | 11 | 10 | |
| Два | 1 | 9 | 0,05 900 |
| Три | 5 | 4 | |
| Фолликулы 10-13 мм | 1,1 ± 1,6 | 1,9 ± 2 | NS |
| Толщина эндометрия (мм) | 9.1 ± 2,3 | 9,1 ± 2 | NS |
| Лютеиновая фаза | |||
| E 2 (пг / мл) | 217 ± 152 | 452 ± 448 | NS |
| Прогестерон (нг / мл) | 16,4 ± 12,9 | 18,6 ± 6,7 | NS |
| Беременности (% за начатый цикл) | 1 (4,2) | 5 (20,8) | 0,08 |
Результат стимуляции яичников
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . | ||
|---|---|---|---|---|---|
| Отмена (% за начатый цикл) | 8 (33,3) | 1 (4,2) | 0,009 | ||
| В день ХГЧ | |||||
| ХГЧ день 900 | 12.4 ± 3,5 | 12 ± 1,1 | NS | ||
| E 2 (пг / мл) | 312 ± 186 | 489 ± 136 | 0,006 | ||
| Фолликулы> 14 мм | 1,6 ± 0,9 | 1,7 ± 0,8 | NS | ||
| Один | 11 | 10 | |||
| Два | 1 | 9 | 0,05 | ||
| Три | 5 | 4 | 4 | ||
| Фолликулы 10–13 мм | 1.1 ± 1,6 | 1,9 ± 2 | NS | ||
| Толщина эндометрия (мм) | 9,1 ± 2,3 | 9,1 ± 2 | NS | ||
| Лютеиновая фаза | |||||
| E 2 (пг / мл) | 217 ± 152 | 452 ± 448 | NS | ||
| Прогестерон (нг / мл) | 16,4 ± 12,9 | 18,6 ± 6,7 | NS | ||
| Беременности ( % за запущенный цикл) | 1 (4.2) | 5 (20,8) | 0,08 |
| . | Группа A ( n = 24) . | Группа B ( n = 24) . | п. . | ||
|---|---|---|---|---|---|
| Отмена (% за начатый цикл) | 8 (33,3) | 1 (4,2) | 0,009 | ||
| В день ХГЧ | |||||
| ХГЧ день 900 | 12.4 ± 3,5 | 12 ± 1,1 | NS | ||
| E 2 (пг / мл) | 312 ± 186 | 489 ± 136 | 0,006 | ||
| Фолликулы> 14 мм | 1,6 ± 0,9 | 1,7 ± 0,8 | NS | ||
| Один | 11 | 10 | |||
| Два | 1 | 9 | 0,05 | ||
| Три | 5 | 4 | 4 | ||
| Фолликулы 10–13 мм | 1.1 ± 1,6 | 1,9 ± 2 | NS | ||
| Толщина эндометрия (мм) | 9,1 ± 2,3 | 9,1 ± 2 | NS | ||
| Лютеиновая фаза | |||||
| E 2 (пг / мл) | 217 ± 152 | 452 ± 448 | NS | ||
| Прогестерон (нг / мл) | 16,4 ± 12,9 | 18,6 ± 6,7 | NS | ||
| Беременности ( % за запущенный цикл) | 1 (4.2) | 5 (20,8) | 0,08 |
Эти данные показывают, что время введения ФСГ имеет решающее значение для контроля количества рекрутированных фолликулов после стимуляции яичников у нормоовуляторных пациентов. Руководства, разработанные при ановуляторном бесплодии, рекомендуют скорректированную начальную дозу и поэтапное введение ФСГ (Homburg and Howles, 1999). В отличие от пациентов с нормоовуляцией, до сих пор не опубликовано никаких рекомендаций по управлению стимуляцией яичников, когда введение экзогенного ФСГ мешает динамике эндогенного ФСГ, необходимой для отбора фолликулов.Обычно используется корректировка дозы ФСГ, тогда как изменение времени введения ФСГ для корректировки количества фолликулов выполняется редко. Однако превышение порога ФСГ или предотвращение закрытия окна ФСГ может по-разному повлиять на количество растущих фолликулов. Принимая во внимание, что ежедневное введение 75 МЕ ФСГ с CD 7 отменяет процесс отбора одного доминантного фолликула в небольшой части циклов (Balasch et al ., 1994), начало введения рано на CD 5 или 3 (Hohmann et al ., 2001) или продление введения в поздней фолликулярной фазе (Lolis et al ., 1995; Hughes et al ., 1998) постоянно увеличивает скорость мультифолликулярного развития. Однако в этих исследованиях время, продолжительность и доза введения ФСГ связаны и варьируются вместе. Напротив, сравнение эффектов однократной высокой дозы ФСГ в ранней фолликулярной фазе и такого же количества, разделенного на 5-дневное введение в поздней фолликулярной фазе (Schipper et al ., 1998a) привели к предположению, что продолжительность и время, а не доза введения ФСГ участвуют в контроле количества растущих фолликулов во время стимуляции яичников. Таким образом, наши данные, полученные в ходе циклов с фиксированной дозой и продолжительностью ФСГ, согласуются с концепцией, согласно которой изменение только времени введения ФСГ фактически влияет на количество задействованных фолликулов. Цель получить ограниченное количество крупных фолликулов была более успешно достигнута у пациентов, которым поддерживали ФСГ в поздней фолликулярной фазе, чем у пациентов, получавших ФСГ только в ранней фолликулярной фазе.Таким образом, это исследование предполагает, что больше внимания следует уделять корректировке времени введения экзогенного ФСГ у нормоовуляторных пациентов.
Хотя добавление ФСГ, ограниченное ранней фолликулярной фазой, близко имитирует физиологическое повышение уровней ФСГ, наблюдаемое в нормоовуляторных циклах, этот режим введения ФСГ был связан с высоким риском мультифолликулярного рекрутирования, хотя реакция яичников была довольно неоднородной. Действительно, примерно у половины пациенток наблюдалась ранняя и чрезмерная реакция яичников.Низкие базальные уровни ФСГ, наблюдаемые у этих пациенток, могут отражать высокую чувствительность яичников к ФСГ (Schipper et al ., 1998b). Таким образом, можно предположить, что суточная доза ФСГ, используемая в нашем исследовании, была слишком высокой, и что этим пациентам следует использовать более низкие начальные дозы (Papageorgiou et al ., 2004). Другая половина пациентов демонстрировала начальный фолликулярный ответ, соответствующий цели мягкой стимуляции, за которой следовало плато или снижение секреции E 2 , сопровождающееся медленным ростом фолликулов в поздней фолликулярной фазе.Таким образом, прекращение введения ФСГ в сочетании с вызванной эстрогеном отрицательной обратной связью по секреции эндогенного гонадотропина, по-видимому, пагубно сказывается на созревании фолликулов до тех пор, пока ведущий фолликул не достигает полного доминирования. Хотя это исследование не предназначалось из-за размера выборки для оценки частоты беременностей, заметное сокращение числа беременностей в этой группе показывает, что режим введения ФСГ, ограниченный ранней фолликулярной фазой, неадекватен для нормоовуляторных женщин и предполагает, что добавление ФСГ требуется в поздней фолликулярной фазе.
Введение ФСГ от средней до поздней фолликулярной фазы привело к более однородному ответу яичников с высокой долей пациентов, которые достигли цели только для двух фолликулов диаметром ≥14 мм. Кроме того, этот режим позднего введения ФСГ был связан с ограниченным количеством фолликулов диаметром ≥10 мм. Эти данные имеют клиническое значение, поскольку риск многоплодной беременности высокого порядка связан с количеством фолликулов диаметром ≥10 мм в день введения ХГЧ у пациенток моложе 32 лет (Tur et al ., 2001) или 38 лет (Dickey et al ., 2005). Прекращение приема ХГЧ при наличии более трех (Tur et al ., 2005) или шести (Dickey et al ., 2005) фолликулов диаметром ≥10 мм может значительно снизить количество многоплодных беременностей высокого порядка, при этом только небольшое снижение общей частоты наступления беременности. Однако вопрос о вкладе фолликулов среднего размера в частоту наступления беременности все еще остается предметом дискуссий. Действительно, в серии циклов зачатия, проведенных у пациентов с пониженной регуляцией агониста ГнРГ, не наблюдалось многоплодной беременности при наличии только одного фолликула диаметром ≥14 мм и не наблюдалось многоплодных беременностей высокого порядка, когда размер третичного фолликула составлял <14 мм. мм в диаметре (Richmond et al ., 2005). Тем не менее, авторы постулировали, но не смогли доказать, что беременность происходит от самых крупных фолликулов. Более того, для схем стимуляции без агониста ГнРГ нельзя исключить возможность достижения фолликулами 10–13 мм овуляции после введения ХГЧ после спонтанного выброса ЛГ.
Эти данные предполагают, что идеальный режим введения ФСГ нормоовуляторным женщинам мог бы сочетать добавление ФСГ из средней фолликулярной фазы с последующим снижением доз ФСГ, когда два фолликула достигли 14 мм в диаметре, чтобы уменьшить количество фолликулов среднего размера. как ранее было показано у ановуляторных пациентов (Hugues et al ., 1996). Альтернативой уменьшению поступления ФСГ может быть своевременное введение антагониста ГнРГ для уменьшения эндогенной секреции ФСГ. Использование антагониста GnRH одновременно с ежедневным введением низких доз ФСГ оказалось эффективным и безопасным для предотвращения многоплодной беременности (Ragni et al ., 2004). Хотя полезность мягкой стимуляции яичников подвергалась сомнению по сравнению с естественными циклами для ВМИ (Goverde et al ., 2005; Van Rumste et al ., 2006), мы действительно считаем, что будущие усовершенствования схемы введения ФСГ могут улучшить частоту наступления беременности и минимизировать риск многоплодной беременности, как это было продемонстрировано за последнее десятилетие для ановуляторного бесплодия.
В заключение, наше исследование показывает, что своевременное введение ФСГ нормоовуляторным женщинам является важным фактором в адаптации количества крупных преовуляторных фолликулов. Начало введения ФСГ из средней фолликулярной фазы с использованием постоянной дозы в течение фиксированного периода времени лучше достигает цели получения двух больших фолликулов (диаметром ≥14 мм), чем раннее введение.Эти результаты предполагают, что предотвращение закрытия окна ФСГ более эффективно, чем превышение порога ФСГ в создании легкой гиперстимуляции у нормоовуляторных пациентов. Однако необходимы другие исследования для сравнения эффективности и безопасности режима поздней фолликулярной фазы с таковыми при наиболее часто используемом введении ФСГ на протяжении всей фолликулярной фазы.
БлагодарностиЭта работа была поддержана для гормонального измерения INH B и INH A Институтом эндокринных исследований и метаболизма, Париж (Франция).
Список литературы ,,,,,.Низкие дозы чистого фолликулостимулирующего гормона для стимуляции яичников в циклах внутриматочного осеменения
,Hum Reprod
,1994
, vol.9
(стр.1863
—1866
),.Группа по изучению рекомбинантного ФСГ
Сравнительное рандомизированное многоцентровое исследование, сравнивающее протоколы повышения и снижения при синдроме поликистозных яичников
,Hum Reprod
,2003
, vol.18
(стр.1626
—1631
),,,,,.Связь количества фолликулов, уровней эстрадиола с множественной имплантацией в 3608 циклах внутриматочной инсеминации
,Fertil Steril
,2001
, vol.75
(стр.69
—78
),,,,,.Факторы риска многоплодной беременности и многоплодных родов после контролируемой гиперстимуляции яичников: результаты 4062 циклов внутриматочной инсеминации
,Fertil Steril
,2005
, vol.83
(стр.671
—683
),,.Многоплодные роды в результате стимуляции яичников для лечения бесплодия
,Ланцет
,2005
, vol.365
(стр.1807
—1816
),,,,.Снижение риска многоплодной беременности высокого порядка после стимуляции яичников гонадотропинами
,N Engl J Med
,2000
, vol.343
(стр.2
—7
),,,,,.Дальнейшее рассмотрение естественных или умеренных циклов гиперстимуляции для лечения внутриматочной инсеминации: влияние на частоту наступления беременности и многоплодной беременности
,Hum Reprod
,2005
, vol.20
(стр.3141
—3146
),,,,,,,,, и др.Эффективность суперовуляции и внутриматочной инсеминации при лечении бесплодия. Национальная кооперативная сеть репродуктивной медицины
,N Engl J Med
,1999
, vol.340
(стр.177
—183
),,,,.Низкие дозы экзогенного ФСГ, инициированные во время ранней, легкой или поздней фолликулярной фазы, могут вызывать развитие множественных доминантных фолликулов
,Hum Reprod
,2001
, vol.16
(стр.846
—854
),.Терапия низкими дозами ФСГ при ановуляторном бесплодии, связанном с синдромом поликистозных яичников: обоснование, результаты, размышления и уточнения
,Hum Reprod Update
,1999
, vol.5
(стр.493
—499
),,.Рандомизированное контролируемое исследование трех протоколов низких доз гонадотропинов при необъяснимом бесплодии
,Hum Reprod
,1998
, vol.6
(стр.1527
—1531
),,,,,.Последовательный повышающий и понижающий режим дозирования: альтернативный метод индукции овуляции фолликулостимулирующим гормоном при синдроме поликистозных яичников
,Hum Reprod
,1996
, vol.11
(стр.2581
—2584
),,,,,.Главный ингибитор фолликулостимулирующего гормона при лютеин-фолликулярном переходе: ингибин A, эстрадиол или ингибин B?
,Hum Reprod
,1999
, т.14
(стр.1190
—1193
),,.Пороговый уровень фолликулостимулирующего гормона для созревания фолликулов в суперовулированных циклах
,Fertil Steril
,1995
, vol.63
(стр.1272
—1277
),,,,,,,.Лечение низкими дозами рекомбинантного ФСГ может уменьшить многоплодие, вызванное контролируемой гиперстимуляцией яичников и внутриматочной инсеминацией
,BJOG
,2004
, vol.111
(стр.1277
—1282
),,,,,,.Антагонисты ГнРГ и мягкая стимуляция яичников при внутриматочной инсеминации: рандомизированное исследование, сравнивающее различные дозировки гонадотропина
,Hum Reprod
,2004
, vol.19
(стр.54
—58
),,,,.Диаметр фолликулов в циклах зачатия с многоплодной беременностью и без нее после индукции стимулированной овуляции
,Hum Reprod
,2005
, vol.20
(стр.756
—760
),,.Концепция порога / окна фолликулостимулирующего гормона (ФСГ), исследованная с помощью различных вмешательств с экзогенным ФСГ во время фолликулярной фазы нормального менструального цикла: продолжительность, а не величина увеличения ФСГ влияет на развитие фолликулов
,J Clin Endocrinol Metab
,1998а
, т.83
(стр.1292
—1298
),,.Отсутствие корреляции между максимальной концентрацией фолликулостимулирующего гормона в сыворотке крови в ранней фолликулярной фазе и характеристиками менструального цикла у женщин в возрасте до 35 лет
,Hum Reprod
,1998b
, vol.13
(стр.1442
—1448
),,,,,,,,.Клиническая эффективность введения низких доз фолликулостимулирующего гормона для лечения бесплодия необъяснимого характера
,Hum Reprod
,1999
, vol.14
(стр.349
—353
),,,,,.Размер фолликулов во время введения хорионического гонадотропина человека позволяет прогнозировать исход овуляции в менопаузальных циклах, стимулированных гонадотропинами в период менопаузы.
,Fertil Steril
,1991
, vol.56
(стр.296
—300
),,,,.Детерминанты исхода внутриматочной инсеминации: анализ результатов 9963 последовательных циклов
,Am J Obstet Gynecol
,1999
, vol.180
(стр.1522
—1534
),,,,,.Факторы риска множественной имплантации высокого порядка после стимуляции яичников гонадотропинами: данные большой серии из 1878 последовательных беременностей в одном центре
,Hum Reprod
,2001
, vol.16
(стр.2124
—2129
),,,,,.Использование модели прогнозирования для множественной имплантации высокого порядка после стимуляции яичников гонадотропинами
,Fertil Steril
,2005
, vol.83
(стр.116
—121
),,,,.Является ли контролируемая стимуляция яичников при внутриутробном оплодотворении приемлемой терапией для пар с необъяснимым невынашиванием зачатия в перспективе многоплодной беременности?
,Hum Reprod
,2006
, т.21
(стр.701
—704
)© Автор 2006. Опубликовано Oxford University Press от имени Европейского общества репродукции человека и эмбриологии.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Правосторонняя овуляция благоприятствует беременности больше, чем левосторонняя овуляция | Репродукция человека
9″> Введение Обычно предполагается, что овуляция каждого из двух яичников происходит примерно одинаковое количество раз. Различные исследования показали, что правосторонняя овуляция происходит с той же частотой, что и левосторонняя овуляция (Balasch et al ., 1994, 81/156 природных циклов, 52%; Fukuda et al. ., 1996, 210/410, 51%), или что правый яичник имеет тенденцию к большей овуляции, чем левый (Potashnik et al ., 1987, 62/97, 64%; Check и др., ., 1991, 312/572, 54,5%). Как было предложено в недавнем обзоре (Baker and Spears, 1999), похоже, нет никаких данных, подтверждающих предпочтение левого яичника. Однако вышеупомянутые исследования были основаны на относительно небольшом количестве, и вопрос о том, существует ли истинное предпочтение правому яичнику, все еще остается нерешенным.
Хотя характер овуляции в последующих циклах был предметом ряда исследований, окончательных данных о том, происходит ли овуляция с чередующихся сторон (т. Е. С противоположной стороны), пока нет: Dukelow, 1977; Hodgen, 1982; Marinho et al. . , 1982; Gougeon and Lefevre, 1984), с той же стороны (т. Е. Ипсилатерально: Werlin et al ., 1986) или случайным образом (Clark et al ., 1978; Check et al ., 1991) . Однако было замечено, что в циклах с продолжительностью фолликулярной фазы <14 дней овуляция имела тенденцию происходить контралатерально, тогда как в циклах с более длинной фолликулярной фазой овуляция имела тенденцию происходить случайным образом (Wallach et al ., 1973; Fukuda et al ., 1996). Наблюдалась значительно более длительная фолликулярная фаза ипсилатеральной овуляции по сравнению с контралатеральной овуляцией (Potashnik et al ., 1987; Fukuda et al ., 1996). Кроме того, ранее было показано, что вероятность беременности ооцитов от контралатеральной овуляции увеличивается по сравнению с таковыми от ипсилатеральной овуляции (Fukuda et al ., 1996, 1998, 1999). Однако неизвестно, различается ли потенциал фертильности ооцитов правого и левого яичников.В этом исследовании к этим вопросам подходили с использованием относительно большой популяции, состоящей из двух отдельных групп фертильных и бесплодных женщин, последняя группа проходила лечение с помощью внутриматочной инсеминации (ВМИ) или экстракорпорального оплодотворения (ЭКО). Кроме того, продолжительность фолликулярной фазы, результаты лечения и, в некоторых случаях, гормональные профили фолликулярной жидкости и сыворотки в середине лютеиновой фазы у бесплодных женщин, перенесших ЭКО или ВМИ, также оценивались в отношении правостороннего и левостороннего овуляция.
4″> Сторона овуляции и длина фолликулярной фазы у бесплодных женщин
Обычно предполагается, что овуляция каждого из двух яичников происходит примерно одинаковое количество раз. Различные исследования показали, что правосторонняя овуляция происходит с той же частотой, что и левосторонняя овуляция (Balasch et al ., 1994, 81/156 природных циклов, 52%; Fukuda et al. ., 1996, 210/410, 51%), или что правый яичник имеет тенденцию к большей овуляции, чем левый (Potashnik et al ., 1987, 62/97, 64%; Check и др., ., 1991, 312/572, 54,5%). Как было предложено в недавнем обзоре (Baker and Spears, 1999), похоже, нет никаких данных, подтверждающих предпочтение левого яичника. Однако вышеупомянутые исследования были основаны на относительно небольшом количестве, и вопрос о том, существует ли истинное предпочтение правому яичнику, все еще остается нерешенным.
Хотя характер овуляции в последующих циклах был предметом ряда исследований, окончательных данных о том, происходит ли овуляция с чередующихся сторон (т. Е. С противоположной стороны), пока нет: Dukelow, 1977; Hodgen, 1982; Marinho et al. . , 1982; Gougeon and Lefevre, 1984), с той же стороны (т. Е. Ипсилатерально: Werlin et al ., 1986) или случайным образом (Clark et al ., 1978; Check et al ., 1991) . Однако было замечено, что в циклах с продолжительностью фолликулярной фазы <14 дней овуляция имела тенденцию происходить контралатерально, тогда как в циклах с более длинной фолликулярной фазой овуляция имела тенденцию происходить случайным образом (Wallach et al ., 1973; Fukuda et al ., 1996). Наблюдалась значительно более длительная фолликулярная фаза ипсилатеральной овуляции по сравнению с контралатеральной овуляцией (Potashnik et al ., 1987; Fukuda et al ., 1996). Кроме того, ранее было показано, что вероятность беременности ооцитов от контралатеральной овуляции увеличивается по сравнению с таковыми от ипсилатеральной овуляции (Fukuda et al ., 1996, 1998, 1999). Однако неизвестно, различается ли потенциал фертильности ооцитов правого и левого яичников.В этом исследовании к этим вопросам подходили с использованием относительно большой популяции, состоящей из двух отдельных групп фертильных и бесплодных женщин, последняя группа проходила лечение с помощью внутриматочной инсеминации (ВМИ) или экстракорпорального оплодотворения (ЭКО). Кроме того, продолжительность фолликулярной фазы, результаты лечения и, в некоторых случаях, гормональные профили фолликулярной жидкости и сыворотки в середине лютеиновой фазы у бесплодных женщин, перенесших ЭКО или ВМИ, также оценивались в отношении правостороннего и левостороннего овуляция.
Наблюдения проводились в период с июня 1990 г. по декабрь 1999 г. Развитие фолликулов и овуляция оценивались в общей сложности по 1033 естественным циклам у 258 женщин (возраст 31,2 ± 4,7 года, среднее ± стандартное отклонение, диапазон 22–45), проходящих лечение от бесплодия.Причины бесплодия: мужской фактор — 205 пар; неизвестно, 53 пары. Двести восемнадцать женщин прошли 727 циклов ВМИ и 92 женщины прошли 306 циклов ЭКО; 52 женщины прошли циклы как ВМИ, так и ЭКО. Среднее количество изученных циклов у каждого пациента составляло 4,0 (диапазон 1–10). Ни одна из женщин не получала экзогенных гонадотропинов или цитрата кломифена для стимуляции яичников. За развитием фолликулов ежедневно следили с помощью трансвагинального ультразвукового исследования [сканер SSA-250A Toshiba (Токио, Япония) с 5.Выпуклый вагинальный зонд 0 МГц или сканер Sonovista CS или EX Mochida (Токио, Япония) с механическим секторным вагинальным зондом 5,0, 6,0 или 7,5 МГц] с момента измерения диаметра фолликула 14 мм до образования желтого тела или извлечения ооцитов. Овуляция была предсказана по выбросу лютеинизирующего гормона в моче (L-check ® ; Нипро, Осака, Япония или Gold Sign LH ® ; Моринага, Токио, Япония). Циклы, в которых развивались два или более преовуляторных фолликула, были исключены из этого исследования.Во время каждого цикла определяли сторону, на которой развивался доминантный фолликул. День 1 был определен как первый день менструации. Продолжительность фолликулярной фазы определялась как день разрыва фолликула или извлечения ооцитов (например, если разрыв фолликула подтверждался на 14-й день, продолжительность фолликулярной фазы составляла 14 дней).
8″> Измерение стероидных гормонов в фолликулярной жидкости, полученной при извлечении ооцитов, и в сыворотке, полученной в середине лютеиновой фазы от бесплодных женщин
Чтобы оценить состояние здоровья доминантного фолликула, контролировали гормональные профили фолликулярной жидкости, полученные при извлечении ооцитов, как описано ранее (Yding Andersen, 1993, 1995; Fukuda et al ., 1995). Подмножество образцов фолликулярной жидкости было отобрано случайным образом, чтобы образцы из правостороннего и левого циклов овуляции были представлены в равной степени. Были измерены концентрации эстрадиола, прогестерона, тестостерона и андростендиона и рассчитаны соотношения эстрадиол / тестостерон, эстрадиол / андростендион и эстрадиол / тестостерон + андростендион при правосторонней и левосторонней овуляции. Более того, сыворотка в середине лютеиновой фазы (+7 дней, 7 дней после извлечения ооцитов или разрыва фолликула) была собрана у подгруппы бесплодных женщин, у которых наблюдалась как минимум одна правосторонняя и одна левосторонняя овуляция, а также стероидный гормон. концентрации были измерены с использованием автоматизированной системы хемилюминесценции (ACS) для эстрадиола, прогестерона и тестостерона и радиоиммуноанализа для андростендиона.Образцы фолликулярной жидкости и среднего лютеина не были получены от одной и той же подгруппы женщин. Дисперсия внутри анализа составляла ≤5%, а дисперсия между исследованиями составляла ≤6%. Часть материала из настоящего исследования была использована в предыдущем исследовании (410 естественных циклов у 123 бесплодных женщин, Fukuda et al ., 1996), поскольку протокол процедуры и причины бесплодия не изменились на протяжении всего этого исследования.
3″> Статистический анализ Статистическая оценка проводилась с использованием критерия Стьюдента t , критерия χ 2 или точного критерия Фишера.При сравнении показателей беременности использовались отношение шансов и 95% доверительный интервал (ДИ). Различия считались достоверными при P <0,05. Результаты представлены как среднее ± стандартное отклонение.
6″> Сторона овуляции и длина фолликулярной фазы у бесплодных женщин Овуляция из правого яичника произошла в 578 из 1033 циклов (55,9%; достоверно отличается от 50%, P = 0,01). Исключая беременные циклы, правосторонняя овуляция произошла в 505 из 920 небеременных циклов (54.9%; значительно отличается от 50%, P = 0,04). Продолжительность фолликулярной фазы была одинаковой независимо от того, развился ли доминантный фолликул в правом или левом яичнике, составляя 15,5 ± 2,9 дня для правосторонней овуляции и 15,3 ± 2,9 дня для левосторонней овуляции (Таблица I).
1″> Профили стероидных гормонов в фолликулярной жидкости и средней лютеиновой сыворотке у женщин с бесплодием
Концентрации эстрадиола, прогестерона, тестостерона и андростендиона в фолликулярной жидкости, полученные при извлечении ооцитов, и соотношения эстрадиол / тестостерон, эстрадиол / андростендион и эстрадиол / тестостерон + андростендион в правой и левой таблицах показаны в таблице овуляции. .Хотя правосторонняя овуляция показала более высокие концентрации эстрадиола, тестостерона и андростендиона в фолликулярной жидкости по сравнению с левосторонней овуляцией, а концентрации прогестерона и эстрадиола / тестостерона, эстрадиола / андростендиона и эстрадиола / тестостерона + андростендиона, по-видимому, были снижены по сравнению с соотношением эстрадиола / тестостерона + андростендиона. для левосторонней овуляции достоверных различий между правосторонней и левосторонней овуляцией не было.
Средние лютеиновые (+7 дней) концентрации эстрадиола и тестостерона в сыворотке крови при правосторонней овуляции были значительно выше, чем при левосторонней овуляции ( P = 0.03, P = 0,04 соответственно). Однако концентрации прогестерона и андростендиона были одинаковыми при правосторонней и левосторонней овуляции, как показано в таблице VI.
7″> Обсуждение
Статистическая оценка проводилась с использованием критерия Стьюдента t , критерия χ 2 или точного критерия Фишера.При сравнении показателей беременности использовались отношение шансов и 95% доверительный интервал (ДИ). Различия считались достоверными при P <0,05. Результаты представлены как среднее ± стандартное отклонение.
6″> Сторона овуляции и длина фолликулярной фазы у бесплодных женщин Овуляция из правого яичника произошла в 578 из 1033 циклов (55,9%; достоверно отличается от 50%, P = 0,01). Исключая беременные циклы, правосторонняя овуляция произошла в 505 из 920 небеременных циклов (54.9%; значительно отличается от 50%, P = 0,04). Продолжительность фолликулярной фазы была одинаковой независимо от того, развился ли доминантный фолликул в правом или левом яичнике, составляя 15,5 ± 2,9 дня для правосторонней овуляции и 15,3 ± 2,9 дня для левосторонней овуляции (Таблица I).
1″> Профили стероидных гормонов в фолликулярной жидкости и средней лютеиновой сыворотке у женщин с бесплодием
Овуляция из правого яичника произошла в 578 из 1033 циклов (55,9%; достоверно отличается от 50%, P = 0,01). Исключая беременные циклы, правосторонняя овуляция произошла в 505 из 920 небеременных циклов (54.9%; значительно отличается от 50%, P = 0,04). Продолжительность фолликулярной фазы была одинаковой независимо от того, развился ли доминантный фолликул в правом или левом яичнике, составляя 15,5 ± 2,9 дня для правосторонней овуляции и 15,3 ± 2,9 дня для левосторонней овуляции (Таблица I).
Концентрации эстрадиола, прогестерона, тестостерона и андростендиона в фолликулярной жидкости, полученные при извлечении ооцитов, и соотношения эстрадиол / тестостерон, эстрадиол / андростендион и эстрадиол / тестостерон + андростендион в правой и левой таблицах показаны в таблице овуляции. .Хотя правосторонняя овуляция показала более высокие концентрации эстрадиола, тестостерона и андростендиона в фолликулярной жидкости по сравнению с левосторонней овуляцией, а концентрации прогестерона и эстрадиола / тестостерона, эстрадиола / андростендиона и эстрадиола / тестостерона + андростендиона, по-видимому, были снижены по сравнению с соотношением эстрадиола / тестостерона + андростендиона. для левосторонней овуляции достоверных различий между правосторонней и левосторонней овуляцией не было.
Средние лютеиновые (+7 дней) концентрации эстрадиола и тестостерона в сыворотке крови при правосторонней овуляции были значительно выше, чем при левосторонней овуляции ( P = 0.03, P = 0,04 соответственно). Однако концентрации прогестерона и андростендиона были одинаковыми при правосторонней и левосторонней овуляции, как показано в таблице VI.
Это исследование, основанное на 2659 естественных менструальных циклах, показывает, что доминирующий фолликул чаще развивается в правом яичнике, чем в левом.В среднем 11 из 20 циклов овуляции (55%) происходят из правого яичника. Более того, это исследование демонстрирует, что вероятность беременности ооцитов из правого яичника, вероятно, выше, чем у ооцитов, полученных из левого яичника. Скорость имплантации преэмбрионов, происходящих из ооцитов правого яичника, по-видимому, выше по сравнению с таковыми из левого яичника, хотя частота преэмбрионального образования выше в ооцитах левого яичника. Гормональные профили подмножества образцов сыворотки, собранных в середине лютеиновой фазы, показали повышенные концентрации эстрадиола и тестостерона в результате правосторонней овуляции по сравнению с левосторонней овуляцией.
Самое крупное предыдущее исследование включало в общей сложности 572 естественных цикла и обнаружило частоту правосторонней овуляции 54,5% (Check et al., 1991), что почти идентично найденному нами (54,8%). В это исследование были включены только бесплодные женщины, тогда как в наше исследование были включены как фертильные, так и бесплодные. Однако мы не смогли продемонстрировать никакой разницы между фертильной и бесплодной группами. Асинхронность между активностью двух яичников не уникальна для людей.У ряда других видов обнаруживаются различия в активности двух яичников, некоторые даже более выраженные, чем у людей. У птиц активен только левый яичник, тогда как правый яичник остается в состоянии покоя, что также наблюдается у китов и шиншилл. Если левый яичник у птиц удаляется или становится функционально нарушенным, правый яичник разовьется в активную гонаду. Преобладание овуляции из правого яичника также наблюдалось у коровы, хотя известно, что анатомия отличается от анатомии человека (Nation et al ., 1999). Механизм, с помощью которого эти два яичника различаются по своей активности, насколько нам известно, неизвестен ни для других видов, ни для человека.
Предполагая, что оба яичника испытывают одинаковый эндокринный контроль гормонов гипофиза, интересно отметить, что концентрация эстрадиола и тестостерона в сыворотке крови из средней лютеиновой фазы через 7 дней после овуляции или извлечения ооцитов выше, когда овуляция происходит в период овуляции. правый яичник по сравнению с левым. Это может указывать на то, что механизм, который способствует установлению беременности из ооцитов, происходящих из правого яичника, связан с анатомической асимметрией.Васкуляризация может быть различной, и может иметь значение развитие других органов, таких как почки и надпочечники. Чтобы оценить, отличается ли васкуляризация, мы в настоящее время проводим ультразвуковые измерения с цветным допплером. Однако это не исключает возможности того, что ооциты, происходящие из правого яичника, по какой-то неизвестной причине обладают внутренне повышенным потенциалом беременности, вызывающим наблюдаемые эффекты.
Отношение беременностей от правосторонней овуляции к общему количеству беременностей было очень схожим для каждой группы пациенток: ЭКО, 62.5%; IUI, 65,1%; фертильные женщины — 63,4%, что позволяет предположить, что этот механизм не связан с общим потенциалом фертильности женщин. Ранее было продемонстрировано, что контрлатеральная овуляция в последующих циклах усиливает беременность в естественных циклах (Fukuda et al ., 1996, 1999, 2000) и в циклах, стимулированных цитратом кломифена (Fukuda et al ., 1998, 1999, 2000). . Если доминирующий фолликул развивается в яичнике, противоположном тому месту, где произошла овуляция в предыдущем цикле, фолликулярная жидкость содержит более благоприятное соотношение андрогенов и эстрогенов, и ооцит более склонен к оплодотворению и преэмбриональному развитию in vitro по сравнению с двух последовательных циклов овуляции из одного яичника.Однако предэмбриональное развитие при правосторонней овуляции ниже, чем при левосторонней, что позволяет предположить, что механизм, который увеличивает потенциал фертильности ооцитов из правого яичника, отличается от механизма контрлатеральной овуляции. В настоящее время мы проводим исследования, в которых отслеживается потенциал фертильности ооцитов с учетом овуляции из правого / левого яичника и латеральности в течение двух последовательных менструальных циклов.
В заключение, овуляция из правого яичника происходит чаще, чем из левого.Кроме того, ооциты правого яичника чаще вызывают беременность, чем ооциты левого яичника. Эта картина идентична в группе фертильных и бесплодных женщин. Основной механизм неизвестен, но может быть связан с повышенной выработкой эстрадиола и тестостерона желтым телом правого яичника.
Таблица I.Число правосторонних (R) и левосторонних (L) овуляции различной длины фолликулярной фазы в 1033 естественных циклах 258 бесплодных женщин
| Продолжительность фолликулярной фазы (дни) . | R . | л . | Итого . | R / R + L (%) . | R / R + L (совокупно) . |
|---|---|---|---|---|---|
| a Значения представляют собой средние значения ± стандартное отклонение и существенно не отличаются. | |||||
| Значения в скобках — это проценты. | |||||
| 9 | 1 | 3 | 4 | 1/4 (25) | 1/4 (25) |
| 10 | 5 | 7 | 12 | 5 / 12 (42) | 6/16 (38) |
| 11 | 24 | 12 | 36 | 24/36 (66) | 30/52 (58) |
| 12 | 46 | 43 | 89 | 46/89 (52) | 76/141 (54) |
| 13 | 74 | 67 | 141 | 74/141 (52) | 150/282 ( 53) |
| 14 | 99 | 66 | 165 | 99/165 (60) | 249/447 (56) |
| 15 | 73 | 65 | 138 | 73 / 138 (53) | 322/585 (55) |
| 1 6 | 70 | 65 | 135 | 70/135 (52) | 392/720 (54) |
| 17 | 60 | 36 | 96 | 60/96 (63) | 452/816 (55) |
| 18 | 44 | 32 | 76 | 44/76 (58) | 496/892 (56) |
| 19 | 23 | 22 | 45 | 23/45 (51) | 519/937 (55) |
| 20 | 24 | 15 | 39 | 24/39 (62) | 543/976 (56) |
| 21 | 13 | 7 | 20 | 13/20 (65) | 556/996 (56) |
| 22 | 10 | 5 | 15 | 10/15 (67) | 566/1011 (56) |
| 23 | 4 | 0 | 4 | 4/4 (100) | 570/1015 (56) |
| 24 | 2 | 5 | 7 | 2/7 (29) | 572/1022 (56) |
| 25 | 6 | 5 | 11 | 6/11 (55) | 578/1033 (56) |
| Всего | 578 | 455 | 1033 | 578/1033 ( 56) | |
| 15.5 ± 2,9 a | 15,3 ± 2,9 a | 15,4 ± 2,9 a | |||
| Длина фолликулярной фазы (дни) . | R . | л . | Итого . | R / R + L (%) . | R / R + L (совокупно) . |
|---|---|---|---|---|---|
| a Значения представляют собой средние значения ± стандартное отклонение и существенно не отличаются. | |||||
| Значения в скобках — это проценты. | |||||
| 9 | 1 | 3 | 4 | 1/4 (25) | 1/4 (25) |
| 10 | 5 | 7 | 12 | 5 / 12 (42) | 6/16 (38) |
| 11 | 24 | 12 | 36 | 24/36 (66) | 30/52 (58) |
| 12 | 46 | 43 | 89 | 46/89 (52) | 76/141 (54) |
| 13 | 74 | 67 | 141 | 74/141 (52) | 150/282 ( 53) |
| 14 | 99 | 66 | 165 | 99/165 (60) | 249/447 (56) |
| 15 | 73 | 65 | 138 | 73 / 138 (53) | 322/585 (55) |
| 1 6 | 70 | 65 | 135 | 70/135 (52) | 392/720 (54) |
| 17 | 60 | 36 | 96 | 60/96 (63) | 452/816 (55) |
| 18 | 44 | 32 | 76 | 44/76 (58) | 496/892 (56) |
| 19 | 23 | 22 | 45 | 23/45 (51) | 519/937 (55) |
| 20 | 24 | 15 | 39 | 24/39 (62) | 543/976 (56) |
| 21 | 13 | 7 | 20 | 13/20 (65) | 556/996 (56) |
| 22 | 10 | 5 | 15 | 10/15 (67) | 566/1011 (56) |
| 23 | 4 | 0 | 4 | 4/4 (100) | 570/1015 (56) |
| 24 | 2 | 5 | 7 | 2/7 (29) | 572/1022 (56) |
| 25 | 6 | 5 | 11 | 6/11 (55) | 578/1033 (56) |
| Всего | 578 | 455 | 1033 | 578/1033 ( 56) | |
| 15.5 ± 2,9 a | 15,3 ± 2,9 a | 15,4 ± 2,9 a | |||
Правосторонняя (R) и левосторонняя (L) овуляция количество различной длины фолликулярной фазы в 1033 естественных циклах 258 бесплодных женщин
| Продолжительность фолликулярной фазы (дни) . | R . | л . | Итого . | R / R + L (%) . | R / R + L (совокупно) . |
|---|---|---|---|---|---|
| a Значения представляют собой средние значения ± стандартное отклонение и существенно не отличаются. | |||||
| Значения в скобках — это проценты. | |||||
| 9 | 1 | 3 | 4 | 1/4 (25) | 1/4 (25) |
| 10 | 5 | 7 | 12 | 5 / 12 (42) | 6/16 (38) |
| 11 | 24 | 12 | 36 | 24/36 (66) | 30/52 (58) |
| 12 | 46 | 43 | 89 | 46/89 (52) | 76/141 (54) |
| 13 | 74 | 67 | 141 | 74/141 (52) | 150/282 ( 53) |
| 14 | 99 | 66 | 165 | 99/165 (60) | 249/447 (56) |
| 15 | 73 | 65 | 138 | 73 / 138 (53) | 322/585 (55) |
| 1 6 | 70 | 65 | 135 | 70/135 (52) | 392/720 (54) |
| 17 | 60 | 36 | 96 | 60/96 (63) | 452/816 (55) |
| 18 | 44 | 32 | 76 | 44/76 (58) | 496/892 (56) |
| 19 | 23 | 22 | 45 | 23/45 (51) | 519/937 (55) |
| 20 | 24 | 15 | 39 | 24/39 (62) | 543/976 (56) |
| 21 | 13 | 7 | 20 | 13/20 (65) | 556/996 (56) |
| 22 | 10 | 5 | 15 | 10/15 (67) | 566/1011 (56) |
| 23 | 4 | 0 | 4 | 4/4 (100) | 570/1015 (56) |
| 24 | 2 | 5 | 7 | 2/7 (29) | 572/1022 (56) |
| 25 | 6 | 5 | 11 | 6/11 (55) | 578/1033 (56) |
| Всего | 578 | 455 | 1033 | 578/1033 ( 56) | |
| 15.5 ± 2,9 a | 15,3 ± 2,9 a | 15,4 ± 2,9 a | |||
| Длина фолликулярной фазы (дни) . | R . | л . | Итого . | R / R + L (%) . | R / R + L (совокупно) . |
|---|---|---|---|---|---|
| a Значения представляют собой средние значения ± стандартное отклонение и существенно не отличаются. | |||||
| Значения в скобках — это проценты. | |||||
| 9 | 1 | 3 | 4 | 1/4 (25) | 1/4 (25) |
| 10 | 5 | 7 | 12 | 5 / 12 (42) | 6/16 (38) |
| 11 | 24 | 12 | 36 | 24/36 (66) | 30/52 (58) |
| 12 | 46 | 43 | 89 | 46/89 (52) | 76/141 (54) |
| 13 | 74 | 67 | 141 | 74/141 (52) | 150/282 ( 53) |
| 14 | 99 | 66 | 165 | 99/165 (60) | 249/447 (56) |
| 15 | 73 | 65 | 138 | 73 / 138 (53) | 322/585 (55) |
| 1 6 | 70 | 65 | 135 | 70/135 (52) | 392/720 (54) |
| 17 | 60 | 36 | 96 | 60/96 (63) | 452/816 (55) |
| 18 | 44 | 32 | 76 | 44/76 (58) | 496/892 (56) |
| 19 | 23 | 22 | 45 | 23/45 (51) | 519/937 (55) |
| 20 | 24 | 15 | 39 | 24/39 (62) | 543/976 (56) |
| 21 | 13 | 7 | 20 | 13/20 (65) | 556/996 (56) |
| 22 | 10 | 5 | 15 | 10/15 (67) | 566/1011 (56) |
| 23 | 4 | 0 | 4 | 4/4 (100) | 570/1015 (56) |
| 24 | 2 | 5 | 7 | 2/7 (29) | 572/1022 (56) |
| 25 | 6 | 5 | 11 | 6/11 (55) | 578/1033 (56) |
| Всего | 578 | 455 | 1033 | 578/1033 ( 56) | |
| 15.5 ± 2,9 a | 15,3 ± 2,9 a | 15,4 ± 2,9 a | |||
Результат ЭКО 306 естественных циклов 92 бесплодных женщин с правосторонней овуляцией (R) и левосторонней овуляцией (L)
| . | R . | л . |
|---|---|---|
| a Значительно отличается, P = 0.03. | ||
| Скорость извлечения ооцитов (%) | 145/173 (84) | 107/133 (80) |
| Скорость оплодотворения (%) | 104/145 (72) | 82 / 107 (77) |
| Скорость расщепления (%) | 75/104 (72) | 70/82 (85) |
| Скорость преэмбрионального образования (%) | 75/145 a (52) | 70/107 a (65) |
| Частота беременностей / цикл (%) | 15/173 (9) | 9/133 (7) |
| Частота имплантации (%) ) | 15/75 (20) | 9/70 (13) |
| . | R . | л . |
|---|---|---|
| a Значительно отличается, P = 0,03. | ||
| Скорость извлечения ооцитов (%) | 145/173 (84) | 107/133 (80) |
| Уровень оплодотворения (%) | 104/145 (72) | 82/107 (77) |
| Скорость расщепления (%) | 75/104 (72) | 70/82 (85) |
| Скорость преэмбрионального образования (%) | 75/145 a ( 52) | 70/107 a (65) |
| Частота беременностей / цикл (%) | 15/173 (9) | 9/133 (7) |
| Частота имплантации (%) | 15/75 (20) | 9/70 (13) |
Результат ЭКО 306 естественных циклов 92 бесплодных женщин с правосторонней овуляцией (R) и левосторонней овуляцией (L)
| . | R . | л . |
|---|---|---|
| a Значительно отличается, P = 0,03. | ||
| Скорость извлечения ооцитов (%) | 145/173 (84) | 107/133 (80) |
| Уровень оплодотворения (%) | 104/145 (72) | 82/107 (77) |
| Скорость расщепления (%) | 75/104 (72) | 70/82 (85) |
| Скорость преэмбрионального образования (%) | 75/145 a ( 52) | 70/107 a (65) |
| Частота беременностей / цикл (%) | 15/173 (9) | 9/133 (7) |
| Частота имплантации (%) | 15/75 (20) | 9/70 (13) |
| . | R . | л . |
|---|---|---|
| a Значительно отличается, P = 0,03. | ||
| Скорость извлечения ооцитов (%) | 145/173 (84) | 107/133 (80) |
| Скорость оплодотворения (%) | 104/145 (72) | 82/107 (77) |
| Скорость расщепления (%) | 75/104 (72) | 70/82 (85) |
| Скорость преэмбрионального образования (%) | 75/145 a ( 52) | 70/107 a (65) |
| Частота беременностей / цикл (%) | 15/173 (9) | 9/133 (7) |
| Частота имплантации (%) | 15/75 (20) | 9/70 (13) |
Исход беременности ВМИ и ЭКО при различной продолжительности фолликулярной фазы при правосторонней овуляции (R) и левосторонней овуляции (L) у бесплодных женщин
| Продолжительность фолликулярной фазы (дни) . | IUI . | ЭКО . | ВМИ + ЭКО . | |||||
|---|---|---|---|---|---|---|---|---|
| . | R . | л . | R . | л . | R . | л . | ||
| 9 | 1 | 1 | ||||||
| 10 | ||||||||
| 2 | ||||||||
| 12 | 6 | 2 | 1 | 2 | 7 | |||
| 13 | 5 | 1 | 6 900 | 2 | ||||
| 14 | 6 | 7 | 5 | 2 | 11 | 9 | ||
| 15 | 9 | 5 | 1 | 2 | 7 | |||
| 16 | 10 | 5 | 2 900 27 | 1 | 12 | 6 | ||
| 17 | 9 | 1 | 9 | 1 | ||||
| 18 | 3 | 3 | 2 | 3 | ||||
| 19 | 2 | 2 | 2 | 2 | ||||
| 20 | 2 | 2 | 2 | 2 | 1 | 1 | ||
| 22 | 3 | 3 | ||||||
| 23 | 2 | 2 | 2 | |||||
| 24 | 2 | 9097 12 | ||||||
| 25 | 4 | 4 | ||||||
| Всего | 58 | 31 | 9 | 9 | 40 | |||
| 58/405 | 31/322 | 15/173 | 9/133 | 73/578 | 40/455 | |||
| (14%) | (10 %) | (9%) | (7%) | (13%) | (9%) | |||
| Продолжительность фолликулярной фазы (дни) . | IUI . | ЭКО . | ВМИ + ЭКО . | |||||
|---|---|---|---|---|---|---|---|---|
| . | R . | л . | R . | л . | R . | л . | ||
| 9 | 1 | 1 | ||||||
| 10 | ||||||||
| 2 | ||||||||
| 12 | 6 | 2 | 1 | 2 | 7 | |||
| 13 | 5 | 1 | 6 900 | 2 | ||||
| 14 | 6 | 7 | 5 | 2 | 11 | 9 | ||
| 15 | 9 | 5 | 1 | 2 | 7 | |||
| 16 | 10 | 5 | 2 900 27 | 1 | 12 | 6 | ||
| 17 | 9 | 1 | 9 | 1 | ||||
| 18 | 3 | 3 | 2 | 3 | ||||
| 19 | 2 | 2 | 2 | 2 | ||||
| 20 | 2 | 2 | 2 | 2 | 1 | 1 | ||
| 22 | 3 | 3 | ||||||
| 23 | 2 | 2 | 2 | |||||
| 24 | 2 | 9097 12 | ||||||
| 25 | 4 | 4 | ||||||
| Всего | 58 | 31 | 9 | 9 | 40 | |||
| 58/405 | 31/322 | 15/173 | 9/133 | 73/578 | 40/455 | |||
| (14%) | (10 %) | (9%) | (7%) | (13%) | (9%) | |||
Исход беременности ВМИ и ЭКО при различной продолжительности фолликулярной фазы при правосторонней овуляции (R) и левосторонней овуляции (L) у бесплодных женщин
| Продолжительность фолликулярной фазы (дни) . | IUI . | ЭКО . | ВМИ + ЭКО . | |||||
|---|---|---|---|---|---|---|---|---|
| . | R . | л . | R . | л . | R . | л . | ||
| 9 | 1 | 1 | ||||||
| 10 | ||||||||
| 2 | ||||||||
| 12 | 6 | 2 | 1 | 2 | 7 | |||
| 13 | 5 | 1 | 6 900 | 2 | ||||
| 14 | 6 | 7 | 5 | 2 | 11 | 9 | ||
| 15 | 9 | 5 | 1 | 2 | 7 | |||
| 16 | 10 | 5 | 2 900 27 | 1 | 12 | 6 | ||
| 17 | 9 | 1 | 9 | 1 | ||||
| 18 | 3 | 3 | 2 | 3 | ||||
| 19 | 2 | 2 | 2 | 2 | ||||
| 20 | 2 | 2 | 2 | 2 | 1 | 1 | ||
| 22 | 3 | 3 | ||||||
| 23 | 2 | 2 | 2 | |||||
| 24 | 2 | 9097 12 | ||||||
| 25 | 4 | 4 | ||||||
| Всего | 58 | 31 | 9 | 9 | 40 | |||
| 58/405 | 31/322 | 15/173 | 9/133 | 73/578 | 40/455 | |||
| (14%) | (10 %) | (9%) | (7%) | (13%) | (9%) | |||
| Продолжительность фолликулярной фазы (дни) . | IUI . | ЭКО . | ВМИ + ЭКО . | |||||
|---|---|---|---|---|---|---|---|---|
| . | R . | л . | R . | л . | R . | л . | ||
| 9 | 1 | 1 | ||||||
| 10 | ||||||||
| 2 | ||||||||
| 12 | 6 | 2 | 1 | 2 | 7 | |||
| 13 | 5 | 1 | 6 900 | 2 | ||||
| 14 | 6 | 7 | 5 | 2 | 11 | 9 | ||
| 15 | 9 | 5 | 1 | 2 | 7 | |||
| 16 | 10 | 5 | 2 900 27 | 1 | 12 | 6 | ||
| 17 | 9 | 1 | 9 | 1 | ||||
| 18 | 3 | 3 | 2 | 3 | ||||
| 19 | 2 | 2 | 2 | 2 | ||||
| 20 | 2 | 2 | 2 | 2 | 1 | 1 | ||
| 22 | 3 | 3 | ||||||
| 23 | 2 | 2 | 2 | |||||
| 24 | 2 | 9097 12 | ||||||
| 25 | 4 | 4 | ||||||
| Всего | 58 | 31 | 9 | 9 | 40 | |||
| 58/405 | 31/322 | 15/173 | 9/133 | 73/578 | 40/455 | |||
| (14%) | (10 %) | (9%) | (7%) | (13%) | (9%) | |||
Число беременных и небеременных циклов от правосторонней овуляции (R) и левосторонней овуляции (L) у бесплодных и фертильных женщин
| . | Беременные циклы . | Циклы для небеременных . | Отношение шансов (95% ДИ) . | P значение . |
|---|---|---|---|---|
| Значения в скобках — это проценты. | ||||
| Бесплодие | ||||
| R | 73 (64.6) | 505 (54,9) | 1,50 (1,00–2,25) | 0,0497 |
| L | 40 (35,4) | 415 (45,1) | ||
| Фертильный | Фертильный | |||
| R | 361 (63,4) | 578 (54,7) | 1,44 (1,28–1,62) | 0,0006 |
| L | 208 (36,6) | 479 9097 (45,3) | 479 (45,3) | |
| Бесплодие + Фертильность | ||||
| R | 434 (63.6) | 1083 (54,8) | 1,44 (1,32–1,57) | <0,0001 |
| L | 248 (36,4) | 894 (45,2) | ||
| Беременные циклы . | Циклы для небеременных . | Отношение шансов (95% ДИ) . | P значение . | |
|---|---|---|---|---|
| Значения в скобках — это проценты. | ||||
| Бесплодие | ||||
| R | 73 (64,6) | 505 (54,9) | 1,50 (1,00–2,25) | |
| 0,0497 | 40 (35,4)415 (45,1) | |||
| Плодородный | ||||
| R | 361 (63.4) | 578 (54,7) | 1,44 (1,28–1,62) | 0,0006 |
| L | 208 (36,6) | 479 (45,3) | ||
| Бесплодие + Фертильность | ||||
| R | 434 (63,6) | 1083 (54,8) | 1,44 (1,32–1,57) | <0,0001 |
| L | 248 (36,4) | (45971 89971) .2)|||
Число беременных и небеременных циклов от правосторонней овуляции (R) и левосторонней овуляции (L) у бесплодных и фертильных женщин
| . | Беременные циклы . | Циклы для небеременных . | Отношение шансов (95% ДИ) . | P значение . |
|---|---|---|---|---|
| Значения в скобках — это проценты. | ||||
| Бесплодие | ||||
| R | 73 (64,6) | 505 (54,9) | 1,50 (1,00–2,25) | |
| 0,0497 | 40 (35,4)415 (45,1) | |||
| Плодородный | ||||
| R | 361 (63.4) | 578 (54,7) | 1,44 (1,28–1,62) | 0,0006 |
| L | 208 (36,6) | 479 (45,3) | ||
| Бесплодие + Фертильность | ||||
| R | 434 (63,6) | 1083 (54,8) | 1,44 (1,32–1,57) | <0,0001 |
| L | 248 (36,4) | (45971 89971) .2)|||
| . | Беременные циклы . | Циклы для небеременных . | Отношение шансов (95% ДИ) . | P значение . |
|---|---|---|---|---|
| Значения в скобках — это проценты. | ||||
| Бесплодие | ||||
| R | 73 (64.6) | 505 (54,9) | 1,50 (1,00–2,25) | 0,0497 |
| L | 40 (35,4) | 415 (45,1) | ||
| Фертильный | Фертильный | |||
| R | 361 (63,4) | 578 (54,7) | 1,44 (1,28–1,62) | 0,0006 |
| L | 208 (36,6) | 479 9097 (45,3) | 479 (45,3) | |
| Бесплодие + Фертильность | ||||
| R | 434 (63.6) | 1083 (54,8) | 1,44 (1,32–1,57) | <0,0001 |
| L | 248 (36,4) | 894 (45,2) | ||
Фолликулярная жидкость эстрадиол (E2), прогестерон (P), тестостерон (T) и андростендион (A), а также соотношения E2 / T, E2 / A и E2 / T + A при правосторонней овуляции ( R) и левосторонняя овуляция (L) бесплодных женщин, перенесших ЭКО
| Эстрадиол нмоль / л . | Прогестерон мкмоль / л . | Тестостерон нмоль / л . | Андростендион нмоль / л . | E2 / T . | E2 / A . | E2 / T + A . |
|---|---|---|---|---|---|---|
| Значения являются средними ± стандартное отклонение. | ||||||
| R | ||||||
| 6064 ± 3113 | 32 ± 16 | 84 ± 66 | 175 ± 93 | 86 ± 26 | 16 | 25 ± 10 |
| ( n = 16) | ( n = 15) | ( n = 17) | ( n = 13) | ( n = 16) | ( n = 13) | ( n = 13) |
| L | ||||||
| 4868 ± 1550 | 41 ± 13 | 56 ± 26 | 152 ± 100 | 93 ± 25 | 42 ± 22 | 28 ± 11 |
| ( n = 16) | ( n = 16) | ( n = 16) 9 0027 | ( n = 16) | ( n = 16) | ( n = 15) | ( n = 15) |
| эстрадиол нмоль / л . | Прогестерон мкмоль / л . | Тестостерон нмоль / л . | Андростендион нмоль / л . | E2 / T . | E2 / A . | E2 / T + A . |
|---|---|---|---|---|---|---|
| Значения являются средними ± стандартное отклонение. | ||||||
| R | ||||||
| 6064 ± 3113 | 32 ± 16 | 84 ± 66 | 175 ± 93 | 86 ± 26 | 16 | 25 ± 10 |
| ( n = 16) | ( n = 15) | ( n = 17) | ( n = 13) | ( n = 16) | ( n = 13) | ( n = 13) |
| L | ||||||
| 4868 ± 1550 | 41 ± 13 | 56 ± 26 | 152 ± 100 | 93 ± 25 | 42 ± 22 | 28 ± 11 |
| ( n = 16) | ( n = 16) | ( n = 16) 9 0027 | ( n = 16) | ( n = 16) | ( n = 15) | ( n = 15) |
Фолликулярная жидкость эстрадиол (E2), прогестерон (P), тестостерон (T) и андростендион (A), а также соотношения E2 / T, E2 / A и E2 / T + A при правосторонней овуляции (R) и левой -сторонняя овуляция (L) бесплодных женщин, перенесших ЭКО
| Эстрадиол нмоль / л . | Прогестерон мкмоль / л . | Тестостерон нмоль / л . | Андростендион нмоль / л . | E2 / T . | E2 / A . | E2 / T + A . |
|---|---|---|---|---|---|---|
| Значения являются средними ± стандартное отклонение. | ||||||
| R | ||||||
| 6064 ± 3113 | 32 ± 16 | 84 ± 66 | 175 ± 93 | 86 ± 26 | 16 | 25 ± 10 |
| ( n = 16) | ( n = 15) | ( n = 17) | ( n = 13) | ( n = 16) | ( n = 13) | ( n = 13) |
| L | ||||||
| 4868 ± 1550 | 41 ± 13 | 56 ± 26 | 152 ± 100 | 93 ± 25 | 42 ± 22 | 28 ± 11 |
| ( n = 16) | ( n = 16) | ( n = 16) 9 0027 | ( n = 16) | ( n = 16) | ( n = 15) | ( n = 15) |
| эстрадиол нмоль / л . | Прогестерон мкмоль / л . | Тестостерон нмоль / л . | Андростендион нмоль / л . | E2 / T . | E2 / A . | E2 / T + A . |
|---|---|---|---|---|---|---|
| Значения являются средними ± стандартное отклонение. | ||||||
| R | ||||||
| 6064 ± 3113 | 32 ± 16 | 84 ± 66 | 175 ± 93 | 86 ± 26 | 16 | 25 ± 10 |
| ( n = 16) | ( n = 15) | ( n = 17) | ( n = 13) | ( n = 16) | ( n = 13) | ( n = 13) |
| L | ||||||
| 4868 ± 1550 | 41 ± 13 | 56 ± 26 | 152 ± 100 | 93 ± 25 | 42 ± 22 | 28 ± 11 |
| ( n = 16) | ( n = 16) | ( n = 16) 9 0027 | ( n = 16) | ( n = 16) | ( n = 15) | ( n = 15) |
Средне-лютеиновая (+7 дней) сыворотка эстрадиола, прогестерона, тестостерона и андростендиона после правосторонней овуляции (R) и левосторонней овуляции (L) бесплодных женщин, получавших ВМИ или ЭКО
| Эстрадиол пмоль / л . | Прогестерон нмоль / л . | Тестостерон пмоль / л . | Андростендион нмоль / л . | |
|---|---|---|---|---|
| a, b Значения с одинаковым надстрочным индексом существенно различались ( P = 0.03, P = 0,04 соответственно). | ||||
| Значения являются средними ± стандартное отклонение. | ||||
| R | ||||
| 624 ± 235 a | 72,8 ± 26,7 | 951 ± 527 b | 7,25 ± 2,29 | |
| 7,25 ± 2,29 | ||||
| ( 144) | ( n = 144) | ( n = 123) | ( n = 123) | |
| L | ||||
| 558 ± 184 a | 72.8 ± 28,3 | 798 ± 364 b | 7,39 ± 2,43 | |
| ( n = 94) | ( n = 92) | ( n = 82) | ( n = 81) | |
| Эстрадиол пмоль / л . | Прогестерон нмоль / л . | Тестостерон пмоль / л . | Андростендион нмоль / л . | |
|---|---|---|---|---|
| a, b Значения с одинаковым надстрочным индексом существенно различались ( P = 0.03, P = 0,04 соответственно). | ||||
| Значения являются средними ± стандартное отклонение. | ||||
| R | ||||
| 624 ± 235 a | 72,8 ± 26,7 | 951 ± 527 b | 7,25 ± 2,29 | |
| 7,25 ± 2,29 | ||||
| ( 144) | ( n = 144) | ( n = 123) | ( n = 123) | |
| L | ||||
| 558 ± 184 a | 72.8 ± 28,3 | 798 ± 364 b | 7,39 ± 2,43 | |
| ( n = 94) | ( n = 92) | ( n = 82) | ( n = 81) | |
Средне-лютеиновая (+7 дней) сыворотка эстрадиола, прогестерона, тестостерона и андростендиона после правосторонней овуляции (R) и левосторонней овуляции (L) бесплодных женщин, получавших ВМИ или ЭКО
| Эстрадиол пмоль / л . | Прогестерон нмоль / л . | Тестостерон пмоль / л . | Андростендион нмоль / л . | ||
|---|---|---|---|---|---|
| a, b Значения с одинаковым надстрочным индексом значительно различались ( P = 0,03, P = 0,04 соответственно). | |||||
| Значения являются средними ± стандартное отклонение. | |||||
| R | |||||
| 624 ± 235 а | 72.8 ± 26,7 | 951 ± 527 b | 7,25 ± 2,29 | ||
| ( n = 144) | ( n = 144) | ( n = 123) | ( n = 123) | ||
| L | |||||
| 558 ± 184 a | 72,8 ± 28,3 | 798 ± 364 b | 7,39 ± 2,43 | ||
| ( | = 94) | ( n = 92) | ( n = 82) | ( n = 81) | |
| Эстрадиол пмоль / л . | Прогестерон нмоль / л . | Тестостерон пмоль / л . | Андростендион нмоль / л . | |
|---|---|---|---|---|
| a, b Значения с одинаковым надстрочным индексом значительно различались ( P = 0,03, P = 0,04 соответственно). | ||||
| Значения являются средними ± стандартное отклонение. | ||||
| R | ||||
| 624 ± 235 а | 72.8 ± 26,7 | 951 ± 527 b | 7,25 ± 2,29 | |
| ( n = 144) | ( n = 144) | ( n = 123) | ( n = 123) | |
| L | ||||
| 558 ± 184 a | 72,8 ± 28,3 | 798 ± 364 b | 7,39 ± 2,43 | |
| ( | = 94) | ( n = 92) | ( n = 82) | ( n = 81) |
Ссылки
Бейкер, С.Дж. И Спирс, Н. (
1999
) Роль внутриовариальных взаимодействий в регуляции доминирования фолликулов.Hum. Репрод. Обновление
,5
,153
–165.Balasch, J., Penarrubia, J., Marquez, M. et al. . (
1994
) Овуляция и рак яичников.Gynecol. Эндокринол.
,8
,51
–54.Check, J.H., Dietterich, C. and Houck, M.A.(
1991
) Выбор доминирующего фолликула на ипсилатеральном яичнике в сравнении с контрлатеральным яичником в следующем цикле.Акушерство. Гинеколь.
,77
,247
–249.Кларк, Дж. Р., Диршке, Д. Дж. и Вольф, Р. (
1978
) Гормональная регуляция фолликулогенеза яичников у макак-резусов: I. Концентрация лютеинизирующего гормона и прогестерона в сыворотке крови во время лапароскопии и паттерны развития фолликулов во время последовательных менструальных циклов.Biol. Репрод.
,17
,779
–783.Dukelow, W.R. (
1977
) Характеристики овуляторного цикла Macaca fasicularis .J. Med. Primatol.
,6
,33
–42.Foulot, H., Ranoux, C., Dubuisson, J. B. et al. . (
1989
) Оплодотворение in vitro без стимуляции яичников: упрощенный протокол, применяемый в 80 циклах.Fertil. Стерил.
,52
,617
–621.Фукуда, М., Фукуда, К., Идинг Андерсен, К. и Бысков, А.Г. (
1995
) Здоровые и атретичные фолликулы: вагинозонографическое обнаружение и профили гормонов фолликулярной жидкости.Hum. Репрод.
,10
,1633
–1637.Фукуда, М., Фукуда, К., Идинг Андерсен, К. и Бысков, А.Г. (
1996
) Контралатеральный отбор доминантного фолликула способствует преэмбриональному развитию.Hum. Репрод.
,11
,1958
–1962.Fukuda, M., Fukuda, K., Yding Andersen, C. и Byskov, A.G. (
1998
) Контралатеральная овуляция сокращает длину фолликулярной фазы и способствует преэмбриональному развитию во время стимуляции яичников цитратом кломифена.Hum. Репрод.
,13
,1590
–1594.Fukuda, M., Fukuda, K., Yding Andersen, C. и Byskov, A.G. (
1999
) Ановуляция в яичнике во время двух менструальных циклов увеличивает потенциал беременности ооцитов, созревших в этом яичнике в течение следующего третьего цикла.Hum. Репрод.
,14
,96
–100.Фукуда, М., Фукуда, К., Йдинг Андерсен, К. и Бысков, А.Г. (
2000
) Способствует ли ановуляция, вызванная пероральными контрацептивами, беременности во время следующих двух менструальных циклов?Fertil. Стерил.
,73
,742
–747.Gougeon, A. and Lefevre, B. (
1984
) Гистологические данные о чередовании овуляции у женщин.J. Reprod. Fertil.
,70
,7
–13.Hodgen, G.D. (
1982
) Доминантный фолликул яичника.Fertil. Стерил.
,38
,281
–300.Мариньо А.О., Саллам Х.Н., Гессенс Л. и др. (
1982
) Сторона овуляции и возникновение mittelschmerz в спонтанных и индуцированных циклах яичников.Br. Med. J.
,284
,632
.Nation, D.P., Burke, C.R., Rhodes, F.M. et al. (
1999
) На распределение доминирующих фолликулов между яичниками влияет расположение желтого тела при беременности.Anim. Репрод. Sci.
,16
,69
–76.Поташник Г., Инслер В. и Мейзнер И. (
1987
) Частота, последовательность и сторона овуляции у нормально менструирующих женщин.Br. Med. J.
,294
,219
.Wallach, E.E., Virutamasen, P. and Wright, K.H. (
1973
) Характеристики менструального цикла и стороны овуляции у макаки резус.Fertil. Стерил.
,24
,715
–721.Werlin, L.B., Weckstein, L., Weathersbee, P.S. и др. . (
1986
) Ультразвук: метод, используемый для определения стороны овуляции.Fertil. Стерил.
,46
,814
–817.Yding Andersen, C. (
1993
) Характеристики фолликулярной жидкости человека, связанные с успешным зачатием после оплодотворения in vitro .J. Clin. Эндокринол. Метаб.
,77
,1227
–1234.Yding Andersen, C. (
1995
) Регулирование выработки андрогенов яичниками: ключевой параметр успеха во время стимуляции?Hum. Репрод.
,10
,2227
–2232.© Европейское общество репродукции человека и эмбриологии
Синдром поликистозных яичников (СПКЯ) | Центр репродуктивной медицины и репродуктивной медицины
Что такое СПКЯ?
По оценкам, от четырех до шести процентов женщин детородного возраста страдают синдромом поликистозных яичников (СПКЯ). Это самая распространенная эндокринопатия у женщин.
Если женщина обладает двумя из трех следующих характеристик, у нее может быть синдром поликистозных яичников:
- Свидетельства овуляции или нерегулярного менструального цикла.
- Клинические или биохимические доказательства гиперандрогенемии означают, что имеются данные о повышенном производстве мужских гормонов. Это измеряется анализом крови, который измеряет уровень тестостерона. Еще одним признаком является гирсутизм или проблемы с ростом волос, то есть аномальный рост волос в гормонально зависимых областях, включая верхнюю губу, подбородок, лицо, грудь и нижнюю часть живота. Это может быть от очень легкой до очень тяжелой степени.
- При трансвагинальном УЗИ органов малого таза изображение поликистозных яичников выглядит как крошечные кистообразные образования.Это яйца или фолликулы, окаймляющие яичники, которые начинают расти, а затем останавливаются на небольшом размере фолликула примерно 2-10 мм. Этот вид очень характерен и может быть использован для постановки диагноза.
- Следует отметить, что при постановке диагноза СПКЯ необходимо исключить другие заболевания, которые присутствуют, например, СПКЯ. Перед постановкой диагноза СПКЯ необходимо исключить следующие гормональные состояния: заболевание щитовидной железы, опухоли яичников и / или надпочечников, дефицит ферментов надпочечников и аномалии пролактина.
Это состояние может быть связано с множеством различных симптомов, в том числе:
- Высокий уровень мужских гормонов, также называемых андрогенами. Это может вызвать чрезмерное оволосение на лице и теле или гирсутизм
- Нерегулярный или отсутствующий менструальный цикл
- Может иметь или не иметь много мелких кист в яичниках, как видно на УЗИ
- Невозможность забеременеть
- Акне, жирная кожа
- Увеличение веса или ожирение, обычно избыточный вес приходится на талию
- Трудности похудения
- Сахарный диабет 2 типа
- Высокий холестерин, высокий уровень триглицеридов
- Высокое кровяное давление
- Пятна утолщенной темно-коричневой или черной кожи на шее, руках, груди или бедрах (черный акантоз)
- Апноэ во сне — чрезмерный храп и прерывистое дыхание во время сна
- Важной причиной для распознавания СПКЯ является то, что он может подвергнуть человека риску возникновения медицинских проблем типа синдрома инсулинорезистентности.У вас может развиться высокий риск диабета 2 типа, высокого уровня холестерина, высокого уровня триглицеридов и высокого кровяного давления. Женщина также может быть подвержена риску рака эндометрия или аномального роста слизистой оболочки матки. Вот почему важно, чтобы люди с СПКЯ получали медицинское лечение и устраняли их нерегулярные циклы.
Точная причина СПКЯ неизвестна. У СПКЯ есть наследственный компонент, что означает, что у женщин с этим заболеванием часто есть мать или сестра с СПКЯ.Вероятность заражения СПКЯ составляет пятьдесят процентов, если у вашей матери есть это заболевание. Многие женщины с СПКЯ имеют проблемы с весом, поэтому исследователи изучают взаимосвязь между СПКЯ и способностью организма вырабатывать инсулин. Инсулин — это гормон, регулирующий превращение сахара, крахмала и другой пищи в энергию для использования или хранения в организме. Женщины с СПКЯ вырабатывают слишком много инсулина, заставляя яичники реагировать и вырабатывать слишком много мужских гормонов. Инсулин также нарушает процесс созревания яичников и выделения яйцеклеток, создавая нерегулярные циклы.Нарушение нормального функционирования яичников при СПКЯ может привести к появлению прыщей, чрезмерному росту волос, увеличению веса и проблемам с овуляцией.
Какие тесты используются для диагностики СПКЯ?Для диагностики СПКЯ будут проводиться различные тесты. Ваш врач изучит историю болезни, проведет физический осмотр и проверит ваш уровень гормонов. Это может включать анализ уровней гормонов щитовидной железы, гипофиза и надпочечников. Вы можете проверить метаболизм глюкозы и уровень риска диабета, что делается с помощью двухчасового перорального теста на толерантность к глюкозе и введения инсулина натощак.
Ультразвуковое исследование влагалища может быть выполнено для проверки яичников на кистозный вид и для оценки слизистой оболочки матки (или эндометрия).
Почему у женщин с СПКЯ проблемы с менструальным циклом?Каждый месяц в яичниках женщины созревает скопление нескольких яйцеклеток, но обычно только одна становится зрелой или доминирующей. У женщин с СПКЯ яичник не получает правильных сигналов от гипофиза для выработки гормонов, необходимых для полного созревания любой из яйцеклеток.Некоторые исследователи считают, что это связано с высоким уровнем инсулина, который прерывает нормальные сигналы для роста яиц. Фолликулы, содержащие яйца, начинают расти, но не получают правильных сигналов. Фолликулы перестают расти или останавливаются и становятся атретичными, оставаясь небольшими кистозными областями, видимыми на УЗИ. Поскольку яйцеклетка не созревает и не выделяется, овуляция не происходит, и гормон прогестерон не производится. Без прогестерона менструальный цикл женщины нерегулярный или отсутствует. Небольшие задержанные или атретические фолликулы вырабатывают мужские гормоны, которые способствуют развитию симптомов СПКЯ.
Как лечится СПКЯ?Нет лекарства от СПКЯ, поэтому нужно управлять им, чтобы предотвратить проблемы. Лечение основано на каждом индивидуальном случае. Ниже приведены описания методов лечения СПКЯ. Лечение СПКЯ основано на целях пациента.
- Образ жизни: Это самый важный фактор для долгосрочного здоровья. Упражнение — ключ к успеху. Женщинам с СПКЯ необходимо выполнять больше обычных рутинных или ареобических упражнений.Институт медицины рекомендует ежедневно выполнять 1 час ареобических упражнений. Необязательно делать это за один раз. Его можно разбить на два тридцатиминутных режима каждый день, но упражнения — это ключевой момент. Кроме того, диета важна для изменения образа жизни.
- Здоровый вес: Женщины, которые поддерживают нормальный вес, могут помочь справиться с СПКЯ. Поскольку ожирение является обычным явлением, здоровое питание и физическая активность помогают поддерживать здоровый вес.
Еще вопросы о СПКЯ?
Запишитесь на прием к специалисту по фертильности Вашингтонского университета!
Запишитесь на прием онлайн или позвоните нам по телефону 314-286-2497
Значение мониторинга при лечении бесплодия
Для многих пар, которые проводят лечение бесплодия, особенно внутриматочное оплодотворение (ВМИ) или экстракорпоральное оплодотворение (ЭКО), обычным ритуалом становятся посещения для утреннего наблюдения во время цикла лечения.Целью этих, иногда частых приемов является внесение необходимых промежуточных корректировок в ваш протокол лечения и определение наилучшего времени для овуляции или извлечения яйцеклеток путем мониторинга уровня эстрогена и размера фолликула. Это помогает нам достичь наилучшего результата для вас, избегая при этом возможных осложнений.
МОНИТОРИНГ ПЕРЕД ЗАПУСКОМ ЦИКЛАНа вашем пути к фертильности с Shady Grove Fertility есть общие начальные шаги — первичная консультация с врачом, встреча с медсестрой-клиницистом, первичный анализ крови на третий день, УЗИ, HSG и анализ спермы.Некоторые из этих тестов могли быть сделаны до посещения врача Shady Grove Fertility и могут быть включены без повторения.
После того, как ваш врач принял решение о плане лечения, начинается новый протокол. Этот визит очень важен, потому что он предоставляет вашему врачу базовые показатели уровня гормонов, а также возможность осмотреть матку и яичники с помощью ультразвука.
«Ультразвук дает нам представление о форме и мускулатуре матки, позволяет увидеть, есть ли какие-либо кисты, а также визуализировать слизистую оболочку матки», — объясняет д-р.Лорна Тиммрек из офиса Shady Grove Fertility в Колумбии. «Кроме того, яйцеклетки должны быть« незрелыми », а фолликулы — в« состоянии покоя »».
Типичный исходный уровень гормонов в крови до начала приема лекарств для ВМИ и ЭКО должен составлять:
- Эстроген — <50 пг / мл
- ХГЧ — <1 мМЕ / мл
- Прогестерон — <1 нг / мл
После того, как ваш врач изучит результаты анализа крови и УЗИ, вам позвонят из вашего медсестра, обычно во второй половине дня, чтобы подтвердить протокол приема лекарств и записаться на следующий контрольный прием.
СКОЛЬКО НУЖЕН МОНИТОРИНГ?Это вопрос, который обычно задают пациенты, когда начинают свой протокол лечения. Поскольку цикл лечения каждого пациента подбирается индивидуально для каждого пациента, необходим и объем мониторинга. Пациенту, принимающему пероральные препараты для стимуляции овуляции, такие как цитрат кломифена (кломид или серофен), с циклом ВМИ может потребоваться всего 2-3 сеанса мониторинга, тогда как женщинам, принимающим инъекционные препараты в сочетании с ВМИ или ЭКО, может потребоваться осмотр. до семи раз в двухнедельный период.
«Количество случаев, когда мы приводим пациента для наблюдения, коррелирует с силой лекарства в их протоколе лечения», — сказал д-р Роберт Стилман. «Пациентам, которые принимают препараты для стимуляции слабой силы, такие как Кломид, возможно, нужно будет реже наблюдать. Напротив, пациенты, принимающие более сильные инъекционные препараты, должны находиться под более пристальным наблюдением, чтобы вносить коррективы в количество принимаемых лекарств для обеспечения безопасности и эффективности ».
ЧТО ОЗНАЧАЕТ ВСЕ ЭТО МОНИТОРИНГ?По мере продвижения цикла лечения многие пациенты задаются вопросом, каким должен быть идеальный размер фолликула и надлежащая толщина слизистой оболочки матки, прежде чем запускать IUI или извлечение яйцеклетки.При каждом посещении наши врачи ищут баланс между уровнем гормонов и реакцией яичников. А поскольку гормон эстроген является основным фактором как увеличения размера фолликула, так и наращивания слизистой оболочки матки, ключевым фактором является постоянный рост уровня гормона на протяжении всего цикла.
«Я всегда говорю пациентам:« Не нужно слишком много хорошего », — поясняет доктор Стиллман. «Мы следим за тем, чтобы фолликулы и слизистая оболочка матки росли с соответствующей скоростью. Поэтому, если мы видим пациента со слишком высокой реакцией на лекарство, мы скорректируем его, чтобы немного замедлить его, в то время как мы увеличим дозу лекарства для пациента, который может реагировать более медленными темпами.”
При первом наблюдении яичники пациента должны быть неактивными или «в состоянии покоя», что означает, что ни один из фолликулов не начал созревать. По мере введения лекарства фолликулы начинают расти, примерно на 2 мм в день на более поздних этапах стимуляции. Повышение уровня эстрогена в крови является гормональным свидетельством созревания фолликулов в яичниках.
«Скорость роста фолликулов зависит от фазы цикла стимуляции», — пояснил д-р.Тиммрек. «На раннем этапе рост фолликулов может быть минимальным, но как только фолликул (ы) перейдет в« активный »рост, они могут увеличиваться на 1-3 мм в день».
Количество образующихся фолликулов также зависит от варианта лечения. Для женщин, которые используют цикл ВМИ, врачи будут стараться поддерживать меньшее количество фолликулов, чтобы избежать риска многоплодной беременности, в то время как в более контролируемом цикле ЭКО женщина может производить большее количество фолликулов, потому что мы можем ограничить количество фолликулов. эмбрионы переносятся позже на «задний конец».”
«Ожидаемое количество фолликулов зависит от многих факторов, в первую очередь от возраста и общего овариального резерва», — сказал д-р Тиммрек. «Определение« хорошего »количества фолликулов варьируется от пациента к пациенту и основывается на их индивидуальном протоколе лечения и типе стимуляции, которой они подвергаются».
По мере роста фолликула яйцеклетка внутри начинает созревать. Многие пациенты спрашивают, «каков идеальный размер фолликула», чтобы вызвать овуляцию.
Доктор Тиммрек предлагает: «Зрелость яйцеклетки в фолликуле частично отражается размером фолликула; в среднем идеальный размер фолликулов составляет от 18 до 20 миллиметров или больше, в зависимости от типа используемых лекарств.”
Повышающийся уровень эстрогена также отвечает за формирование слизистой оболочки матки. Оптимальное измерение толщины для имплантации оплодотворенной яйцеклетки составляет более 7 мм и предпочтительно более 8 мм, независимо от типа лечения, которому подвергаются.
«Помимо толщины, мы ищем так называемый« узор из трех линий », — говорит д-р Тиммрек. «Это должно быть похоже на красивое перышко. Вот как мы называем красивую подкладку в середине цикла, которая должным образом насыщена эстрогеном.”
Когда размер свинцового фолликула (ов) достигает примерно 20 мм, эстроген повышается, а слизистая оболочка матки представляет собой утолщенный «узор пера» в цикле приема лекарств, пора вводить ХГЧ или, для некоторых пациентов, проходящих ЭКО, Люпрон . ХГЧ (или лупрон) вызывает заключительные важные фазы созревания яйцеклетки в фолликуле, а также овуляцию для цикла ВМИ или для планирования правильного времени для извлечения яйцеклетки в цикле ЭКО. Именно в это время фолликул, эстроген, который он производит, и отвечающая на него слизистая оболочка матки должны работать вместе, чтобы создать наилучшую среду для введения оплодотворенной яйцеклетки.
«Часто проверяя важные переменные в цикле лечения бесплодия во время этих мониторинговых посещений, мы можем предоставить пациентке наилучшие шансы на достижение своих целей успешного зачатия здоровой беременности и, в конечном итоге, родов здорового ребенка, будь то с помощью ВМИ или ЭКО », — поясняет доктор Стиллман.
Недоминантные мелкие фолликулы являются многообещающим источником зрелых ооцитов в модифицированном естественном цикле экстракорпорального оплодотворения и переноса эмбрионов
Цель
Определить, обеспечивает ли извлечение ооцитов из недоминантных малых фолликулов зрелые ооциты и увеличение числа живорождений при ЭКО естественного цикла и переносе эмбрионов ( ЭКО-ЭТ).
Дизайн
Ретроспективное когортное исследование.
Учреждение
Частная практика вспомогательных репродуктивных технологий.
Пациенты
Семьсот семьдесят одна бесплодная женщина, перенесшая ЭКО естественного цикла в период с 2011 по 2013 год.
Вмешательства
Всплеск ЛГ был вызван назальным бусерелином, когда размер доминантного фолликула достиг 16–18 мм во время нестимулированных циклов, и как можно больше ооцитов было извлечено из недоминантных мелких фолликулов (диаметром 3–10 мм) после извлечения из большого (доминантного) фолликула.Эмбрионы подвергали криоконсервации после получения бластоцист хорошего качества, а затем переносили (по одной на цикл) во время последующих циклов.
Основные показатели результата
Число зрелых ооцитов (метафаза II) и результирующих живорождений, полученных в результате извлечения ооцитов из начального цикла лечения.
Результат (ы)
Среди 771 женщины пункция недоминирующего малого фолликула дала 902 ооцита в метафазе II и 78 родившихся живыми, тогда как пункция большого доминантного фолликула дала 466 ооцитов в метафазе II и 90 живорожденных.

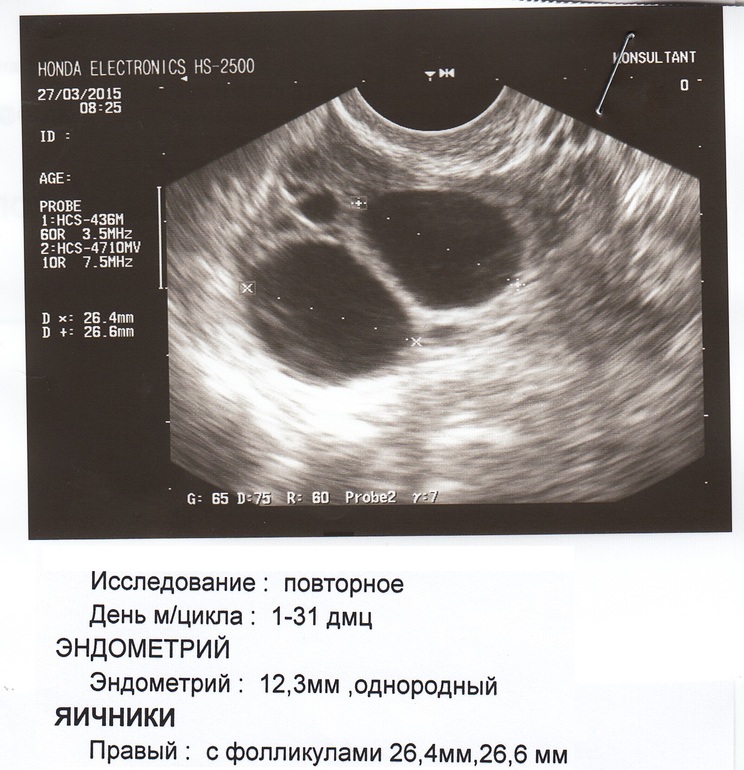
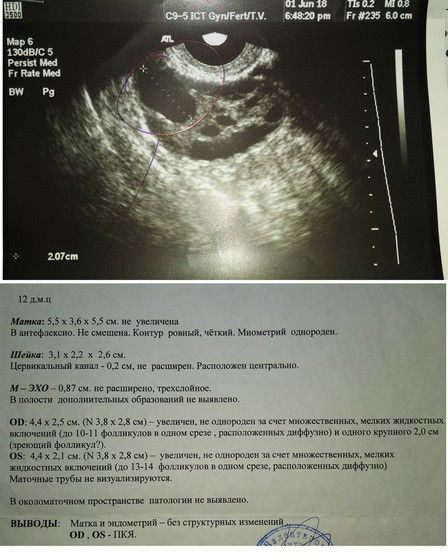

 , Геворкян М.А. (2003) Клинические лекции по гинекологической эндокринологии. МИА, М., 247 с.
, Геворкян М.А. (2003) Клинические лекции по гинекологической эндокринологии. МИА, М., 247 с.