Определение резус – принадлежности
Возьмите центрифужную пробирку
Закапайте 1 каплю УРА (универсального реагента) на дно пробирки пастеровской пипеткой
Добавьте 1 каплю исследуемых эритроцитов пастеровской пипеткой
Перемешайте обе капли так, чтобы они распределились по стенкам пробирки
Засеките время
Через 3 мин. добавьте 2-3 мл 0,9% натрия хлорида (до бледно-розового цвета)
Дважды аккуратно, не взбалтывая, переверните пробирку вверх дном, предварительно закрыв ее пробкой
Сразу же прочитайте результат в проходящем свете
Оценка результата:
Если произошла реакция агглютинации, резус-фактор положительный; если реакция не произошла – отрицательный.
Приложение № 8
Проба на совместимость по резус-фактору
— технически проводится так же, как определение резус-фактора.
Потребуется:
Две капли сыворотки реципиента
Одна капля эритроцитов донора
Одна капля 33% р-ра полиглюкина
Оценка результата:
Если через 5 мин. агглютинация не произошла, результат отрицательный.
Кровь донора совместима Кровь донора несовместима
с кровью больного с кровью больного
Приложение № 7
ПРОБА НА СОВМЕСТИМОСТЬ ПО ГРУППАМ КРОВИ ПО СИСТЕМЕ АВ0
Проба на совместимость по группам крови производится в течение 5 мин., на плоскости, при комнатной температуре, т.е. в условиях, при которых антитела (альфа и бета) наиболее активны.
Техника:
На тарелочке (пластинке) надписать фамилию, инициалы и группу крови больного, фамилию, инициалы, группу крови донора и номер флакона с кровью. На тарелочку накапать 2-3 капли сыворотки больного и туда же добавить маленькую каплю крови донора так, чтобы соотношение крови и сыворотки было примерно 1:10.
Кровь размешать с сывороткой, тарелочку слегка покачать, затем на 1-2 мин. оставить в покое и снова периодически покачивать, одновременно наблюдая за ходом реакции в течение 5 мин. Результат читать через 5 минут.
Оценка результата:
Если в смеси сыворотки больного и крови донора наступает агглютинация эритроцитов, значит, кровь больного несовместима с кровью донора и не должна быть перелита. Если смесь крови донора и сыворотки больного по истечении 5 мин. остается гомогенно красной, значит, кровь донора совместима с кровью больного по системе АВ0.


Кровь донора совместима Кровь донора несовместима
с кровью больного с кровью больного
Приложение № 9
БИОЛОГИЧЕСКАЯ ПРОБА (ПРОБА ЭПИКЕРА)
Струйно перелить 10-15 мл. крови, после чего сделать интервал- паузу в течение 5 мин., при этом наблюдать за состоянием больного. При отсутствии явлений несовместимости (учащенного пульса, дыхания, появления одышки, затрудненного дыхания, гиперемии лица и т.д.) ввести вновь 15 мл. крови и в течение 5 мин. снова наблюдать за больным. Такую процедуру произвести 3 раза. Отсутствие реакции у больного после трехкратной проверки дает право врачу продолжить переливание данной крови.
Приложение № 10
Значение и способы определения индивидуальной совместимости (ав0) и резус-совместимости. Биологическая совместимость. Обязанности врача, переливающего кровь.
Пробы на индивидуальную совместимость крови донора и реципиента.
При проведении проб на индивидуальную совместимость выявляют, есть ли в плазме (сыворотке) реципиента антитела, направленные против эритроцитов донора, способные вызвать агглютинацию эритроцитов в сосудистом русле реципиента с последующим их гемолизом. Поскольку антитела, содержащиеся в плазме донорской крови, при переливании разводятся значительно большим объемом крови реципиента со снижением их титра, — обратные взаимоотношения (т.е. донорских антител к антигенам эритроцитов реципиента) в трансфузиологии не имеют клинического значения.
Проба на совместимость крови донора и реципиента на плоскости при комнатной температуре.
На белую пластинку со смачивающейся поверхностью наносят большую каплю (2-3 капли, взятые пипеткой) сыворотки или плазмы реципиента.
Добавляют к ней в 10 раз меньшую каплю крови донора.
Кровь донора смешивают с плазмой (сывороткой) реципиента, а пластинку покачивают в течение 1-2 минут. Затем оставляя ее в покое на 1-2 минуты.
Через 5 минут после начала реакции (после смешивания капель крови и плазмы) учитывают реакцию после добавления к смеси реагентов (крови и плазмы) капли физраствора.
Трактовка результатов.
На пластинке моделируется то, что может произойти в сосудистом русле реципиента. Если образуются хлопья агглютинатов, а смесь крови донора и плазмы (сыворотки) реципиента светлеет, — кровь этого донора этому реципиенту переливать нельзя, т.к. в плазме реципиента содержатся антитела против антигенов эритроцитов донорской крови. Если же смесь крови и плазмы остается красного цвета и агглютинаты не определяются,- это свидетельствует об отсутствии полных антител в плазме у реципиента, способных вызвать иммунное склеивание эритроцитов донорской крови. Следовательно, такую кровь этому, конкретному, донору, с плазмой которого мы манипулировали, — можно перелить.
Проба на совместимость крови донора и реципиента с 33% раствором полиглюкина (проба на резус-совместимость).
В пробирку помещают большую каплю плазмы (сыворотки) реципиента (2-4 капли, взятые пипеткой).
Добавляют маленькую каплю крови донора (соотношение объемов крови и плазмы 1:10)
К полученной смеси реагентов добавляют каплю 33% раствора полиглюкина.
Содержимое пробирки тщательно перемешивают, пробирку наклоняют, чтобы содержимое растеклось по ее стенкам, и медленно поворачивают вокруг вертикальной оси в течение 5 минут, обеспечивая наиболее полный контакт элементов содержимого пробирки друг с другом.
По истечении 5 минут в пробирку доливают 3-4 мл изотонического раствора хлорида натрия, а содержимое перемешивают, не взбалтывая.
Учитывают результаты, рассматривая содержимое пробирки невооруженным глазом или под лупой с 2-5–кратным увеличением.
Трактовка результатов.
При появлении хлопьев агглютинатов и осветлении жидкости в пробирке кровь донора несовместима с кровью этого реципиента. Если же жидкость в пробирке равномерно окрашена в красный цвет, а агглютинаты не выявляются, — можно сделать вывод об отсутствии в плазме у реципиента неполных антител против антигенов донорских эритроцитов, и, следовательно, кровь этого донора может быть перелита этому реципиенту.
Проба на совместимость с применением 10% раствора желатина (проба на резус-совместимость).
В пробирку помещают 1 каплю отмытых эритроцитов донора.
Добавляют к эритроцитам донора 2 капли подогретого 10% раствора желатина 2 капли сыворотки реципиента.
Тщательно перемешивают содержимое пробирки.
Помещают пробирку на 10 минут на водяную баню при температуре 46-48 градусов.
По истечении указанного времени добавляют в пробирку 5-8 мл изотонического раствора хлорида натрия и перемешивают содержимое пробирки переворачиванием (не взбалтывая).
Учитывают результаты невооруженным глазом или под лупой с 2-5- кратным увеличением.
Трактовка результатов.
Если реакция положительная, т.е. отмечается появление агглютинатов на фоне обесцвеченной жидкости, — эта донорская кровь данному реципиенту не может быть перелита. Если же жидкость в пробирке равномерно окрашена и хлопья агглютинатов не выявляются, — кровь донора совместима с кровью реципиента и может быть ему перелита.
Непрямая проба Кумбса.
При проведении этой пробы (очень высокочувствительной) эритроциты донора отмывают 8-10-кратным объемом изотонического солевого раствора, после чего центрифугируют, и в реакции используют эритроциты из осадка, т.е. эритроциты должны быть максимально освобождены от присутствия других клеточных элементов и плазмы.
Одну маленькую каплю (0,01 мл) отмытых эритроцитов донора помещают в пробирку.
Добавляют 3 капли сыворотки реципиента и тщательно перемешивают содержимое пробирки.
Пробирку помешают в термостат при температуре 37 градусов на 45 минут.
По истечении указанного времени инкубации в пробирку наливают 8-10-кратный объем изотонического солевого раствора (хлорида натрия) и перемешивают содержимое пробирки.
Центрифугируют пробирку до осаждения эритроцитов.
Процедуру отмывания повторяют 3-4 раза, каждый раз тщательно удаляя надосадочную жидкость.
К отмытым эритроцитам добавляют 4-5 капель изотонического раствора хлорида натрия для получения взвеси эритроцитов.
Одну каплю взвеси эритроцитов помещают на пластинку с белой смачивающейся поверхностью.
К взвеси эритроцитов на плоскости добавляют 1-2 капли антиглобулиновой сыворотки и перемешивают стеклянной палочкой.
Пластинку периодически покачивают в течение 10 минут.
Учитывают результат невооруженным глазом или под лупой с 2-5-кратным увеличением.
Трактовка результатов.
Если после добавления антиглобулиновой сыворотки к донорским эритроцитам, инкубированным с сывороткой реципиента, образуются агглютинаты с осветлением жидкости, — в крови реципиента имеются неполные антитела против резус-антигена или других изоантигенов эритроцитов донора, и поэтому такому реципиенту эта донорская кровь не может быть перелита. Если же агглютинации нет,- кровь данного донора совместима с кровью данного реципиента, и следовательно, — может быть ему перелита.
Ошибки при проведении проб на групповую, резус-принадлежность и индивидуальную совместимость.
В большинстве случаев ошибки и затруднения при проведении иммуносерологических исследований связаны с нарушением техники их проведения. Реже в качестве причин ошибочных заключений могут встречаться индивидуальные особенности исследуемой крови.
Во всех случаях получения сомнительных результатов необходимо повторить исследование с использованием реагентов других серий при точном соблюдении правил проведения пробы. При повторном получении сомнительных результатов образец крови следует послать на исследование в специализированную лабораторию.
Наиболее типичные причины ошибок и затруднений при проведении иммуносерологических исследований.
Использование некачественных реагентов (с истекшим сроком годности, помутневших, частично высохших и т.д.)
Нарушение температурных режимов проведения реакций. При проведении определения групповой принадлежности крови по системе АВО температура окружающей среды должна быть в пределах от 15 до 25 градусов Цельсия. При более низкой температуре возможно развитие неспецифической агглютинации, обусловленной холодовыми агглютининами, а при высокой температуре агглютинины альфа и бета снижают свою активность.
Нарушение правильных соотношений реагирующих сред. При проведении пробы с сыворотками (в случаях определения групповой принадлежности по системе АВО) отношение объемов крови и сыворотки должно быть 1:10, а при использовании моноклональных антител и проб с коллоидами (при определении резус-принадлежности) — 2-3:10. В противном случае агглютинация может оказаться незамеченной (из-за экранирования агглютинатов неагглютинированными эритроцитами или из-за малого количества агглютинатов).
Нарушение временных режимов проведения проб. Начало агглютинации (особенно при проведении проб с моноклональными антителами) бывает заметным в первые секунды от момента смешивания реагирующих сред, однако учет реакции должен проводиться в строго определенное время, т.к. иногда встречаются разновидности антигенов, обладающие слабой агглютинабельностью и дающие позднюю реакцию (разновидности агглютиногена А, реже — В).
Игнорирование необходимости проведения контрольных исследований (например, с сывороткой АВ(IV) группы при определении групповой принадлежности со стандартными геагглютинирующими сыворотками или проб с коллоидами при определении резус-принадлежности).
Повышенная агглютинабельность эритроцитов — может наблюдаться при тяжелых гнойных заболеваниях, ожогах, циррозах печени, аутоиммунных и гематологических заболеваниях.
Снижение агглютинабельности эритроцитов — нередко встречается при лейкозах.
Кровяной химеризм — очень редко встречающееся явление, имеющее место у разнояйцовых близнецов, при пересадке донорского костного мозга или после переливаний (вынужденных) иногруппной, но совместимой крови в больших объемах.
Предупреждение ошибочных результатов исследований заключается в строгом следовании существующим правилам определения групповой и резус-принадлежности, проб на совместимость с обязательным учетом характера заболевания и общего состояния реципиента.
Биологическая проба.
Биологическая проба проводится в обязательном порядке при переливаниях донорской крови, эритроцитсодержащих сред, плазмы, концентратов лейкоцитов, независимо от объема и скорости гемотрансфузии.
Биологическая проба проводится непосредственно перед трансфузией и заключается в 3-кратном переливании по 10-15 мл трансфузионной среды струйно или с максимальной скоростью (2-3 мл в мин.) с интервалами в 5 минут, во время которых осуществляют инфузию солевых растворов во избежание тромбирования иглы. Если во время проведения биологической пробы появляется хотя бы один из симптомов, свидетельствующих о несовместимости трансфузионной среды, ее переливание прекращают и проводят соответствующие мероприятия. К таким симптомам относятся озноб, боли в пояснице и внизу живота, чувство стеснения и боли в груди, тошнота, рвота, тахикардия, снижение артериального давления. Во время операции под общим обезболиванием признаками несовместимости могут быть усиление кровоточивости тканей, снижение артериального давления, увеличение тахикардии, выделение мочи, окрашенной в красный или бурый цвет (в случаях катетеризации мочевого пузыря).
Переливание крови. Показания и противопоказания к переливанию крови. Современные правила переливания крови по группам системы АВ0 и системы резус. Способы и техника переливания крови.
Показания к переливанию крови определялись известными механизмами её действия:
Заместительным.
Гемостатическим.
Иммуностимулирующим.
Дезинтоксикационным.
Используемым для парэнтерального питания.
Однако, как показал накопленный опыт, столь широкое использование гемотрансфузий далеко не всегда оказывалось эффективным, больше того, нередко оказывалось опасным: больной получал с кровью помимо эритроцитов нежизнеспособные лейкоциты, тромбоциты, белки, антигены и антитела.
Повторные переливания крови приводили к аллоиммунизации больных.
В настоящее время основным показанием к переливанию крови является острая массивная кровопотеря не менее 25 – 30 % ОЦК со снижением гемоглобина ниже 70 – 80 г / л, гематокрита – ниже 25 % и возникновением циркуляторных нарушений.
Кроме того, переливание крови показано при шоке и терминальных состояниях, в- редких случаях при обменных переливаниях при гемолитической болезни новорождённых, при операциях, сопровождающихся массивной кровопотерей.
Во всех других случаях следует использовать фракции крови или кровезаменители.
Противопоказания к гемотрансфузии.
Абсолютных противопоказаний к переливанию нет.
Относительные противопоказания:
Острое нарушение мозгового кровообращения.
Недостаточность кровообращения II ст. – III ст.
Гипертоническая болезнь III ст.
Печеночная и почечная недостаточность.
Активный (диссеминированный) туберкулёз лёгких.
Тяжёлая бронхиальная астма.
Аллергические заболевания.
Правила переливания крови.
В настоящее время переливание крови и её компонентов допускается только одноимённой группы и Rh – принадлежности.
В исключительных случаях (по жизненным показаниям) при отсутствии одногруппной крови или её компонентов допускается переливание эритромассы О(I) группы,Rh – отрицательной, но не более 500 мл (за исключением детей!).
При отсутствии одногруппной плазмы реципиенту может быть перелита плазма группы АВ(IV).
Врач, производящий переливание крови или её эритромассы, обязан:
Перед каждым переливанием определить группу крови и Rh – принадлежность реципиента.
Убедившись в пригодности донорской крови, и, заполнив систему, определить группу крови и Rh- принадлежность донора, согласовать с этикеткой на гемоконе.
Поставить пробу на индивидуальную совместимость крови реципиента и донора.
Поставить пробу на резус – совместимость.
Провести пробу на биологическую совместимость.
Остаток крови (10 – 15мл) в гемоконе после гемотрансфузии хранят в холодильнике 48 часов.
В течение 3 х часов после окончания гемотрансфузии у больного измеряют температуру, пульс и АД. На следующее утро производится анализ крови и мочи.
Каждое переливание крови, её фракций, а также кровезаменителей записывается в трансфузионный лист, который находится в истории болезни больного.
Способы и техника переливания крови:
Прямое переливание. Кровь переливается с помощью аппарата непосредственно из вены донора в вену реципиента без использования консерванта.
Из – за опасности инфицирования донора в настоящее время не используется.
Непрямое переливание. Донорская кровь консервируется в гемокон, или ампулу и хранится в холодильнике при t 0 + 4 0 С.
При необходимости используется для переливания без специального подогрева. Непрямое переливание крови и её фракций используется очень широко.
Реинфузия крови: переливание крови больного, излившейся в серозные полости (брюшную, плевральную), при закрытой травме или во время операции. Кровь забирается с помощью специального аппарата или, при отсутствии такого, в экстренных случаях, фильтруется через 8 слоёв марли, добавляется консервант и сразу переливается внутривенно.
Метод очень эффективен.
Противопоказания: повреждение полых органов, нахождение крови в серозной полости более 12 часов, гемолиз крови.
Аутотрансфузия крови. Используется в плановой хирургии, когда за несколько дней до операции у больного берут из вены 400 – 500 мл крови, добавляют консервант, после чего гемокон хранят в холодильнике, а во время операции переливают больному его собственную кровь.
Метод очень перспективен.
Противопоказание: исходная анемия у больного.
Обменные переливания крови – частичное или полное удаление крови из кровяного русла с одновременным возмещением таким же количеством донорской крови.
Показания: гемолитическая желтуха новорождённых, гемотрансфузионный шок, тяжёлые отравления. При этом удаляется и одновременно инфузируется кровь со скоростью 1000 мл за 15 – 20 минут.
Обменные переливания используются редко.
Способы введения крови:
В настоящее время преимущественно используется внутривенное переливание крови.
После постановки проб на совместимость кровь переливают чаще всего в кубитальную вену путём её пункции, реже – через специальную канюлю, поставленную в вену. При необходимости переливание больших обьёмов трансфузионных сред используют постоянный катетер, который ставится в центральную вену (чаще в подключичную).
Обычно используется капельное переливание со скоростью 40 – 60 капель в минуту.
При необходимости срочного замещения ОЦК может использоваться внутривенное струйное переливание крови.
Внутриартериальное нагнетание крови.
Показания: шок III – IV ст., терминальные состояния.
Кровь нагнетается в периферическую артерию, которая предварительно обнажается, под давлением 200 — 220 мм рт. ст. со скоростью 200 мл за 1,5 – 2 минуты. Вводимая под давлением кровь, раздражает ангиорецепторы и обеспечивает восстановление венечного кровотока.
Внутриартериальное, внутрисердечное нагнетание крови проводится очень редко, только в реанимационной практике и во время операций на грудной клетке.
Внутрикостное переливание крови.
В настоящее время практически не используется. Применялось при обширных ожогах, когда периферические вены были недоступны. Переливание проводится в грудину, подвздошную, пяточную кости со скоростью от 5 до 30 капель в минуту.
Помимо осложнений, связанных непосредственно с гемотрансфузией, возможно развитие остеомиелита.
Гемотрансфузионные осложнения, их профилактика, диагностика, принципы лечения. Профилактика гепатита, ВИЧ — инфекции.
Оценка совместимости крови донора и реципиента
Для выявления совместимости крови по системе АВО Оттенберг ввел правило, согласно которому агглютинируются эритроциты переливаемой крови, а не крови больного. В соответствии с этим правилом возможно переливание разногруппной крови, а представители группы АВ (IV) являются универсальными реципиентами,
Но современными исследованиями установлено, что правило Оттенберга применимо лишь при переливании до 0,5 литра донорской крови.
Что касается резус-совместимости, то, как уже было сказано, резус-положительным пациентам принципиально можно переливать резус-отрицательную кровь. Но в связи с современными достижениями иммунологии и клинической практики в современной хирургии действует правило, согласно которому можно переливать только одногруппную и однорезусную кровь, за исключением экстренных случаев. Переливание иногруппной крови у детей запрещено вообще.
Пробы на индивидуальную совместимость
Пробы на индивидуальную совместимость проводятся в процессе подготовки к гемотрансфузии. Ставят две реакции: пробу на индивидуальную совместимость по системе АВО и по резус-фактору. Предварительно для постановки реакций у реципиента из вены берут кровь, которую разделяют сгусток и сыворотку (отстаиванием или центрифугированием).
а) Проба на индивидуальную совместимость по системе АВО
На белую поверхность (тарелку, пластинку) наносят крупную каплю {0,1 мл) сыворотки крови реципиента и маленькую капельку (0,01 мл) крови донора из флакона и смешивают их между собой, периодически покачивая тарелку (пластинку). Реакция проводится при температуре 15 — 25°С, результаты оценивают через 5 минут: отсутствие агглютинации эритроцитов донора свидетельствует о совместимости крови донора и реципиента по системе АВО. Появление агглютинации указывает на их несовместимость — такую кровь данному больному переливать нельзя.
б) Проба на индивидуальную совместимость по резус-фактору
После того как установлена совместимость крови донора и реципиента по системе АВО, необходимо установить совместимость в отношении резус-фактора. Проба на совместимость по резус-фактору может быть проведена в одном из двух вариантов:
— проба с использованием 33% полиглюкина;
— проба с использованием 10% желатина.
В клинической практике наибольшее распространение получила проба с полиглюкином. Проба с использованием 33% полиглюкина Реакция проводится в центрифужной пробирке без подогрева в течение 5 минут. На дно пробирки вносят 2 капли сыворотки реципиента, 1 каплю донорской крови и 1 каплю 33% раствора полиглюкина. После этого содержимое перемешивают, наклоняя пробирку и вращая ее вокруг оси, распределяя содержимое по стенкам ровным слоем.
Пробирку вращают в течение 5 минут, после чего добавляют 3-4 мл физиологического раствора и аккуратно перемешивают, 2-3 раза наклоняя пробирку до горизонтальной плоскости (не взбалтывая!). После этого оценивают результат: наличие агглютинации эритроцитов свидетельствует о несовместимости крови донора и реципиента по резус-фактору, такую кровь переливать нельзя. Равномерное окрашивание содержимого в пробирке, отсутствие реакции агглютинации указывает на совместимость крови донора и реципиента по резус-фактору.
Проба с использованием 10% желатина
На дно пробирки помещают 1 каплю эритроцитов донора, предварительно отмытых десятикратным объемом физиологического раствора, затем добавляют 2 капли подогретого до разжижения 10% раствора желатина и 2 капли сыворотки реципиента.
Содержимое пробирки перемешивают и помещают в водяную баню при температуре 46 — 48° С на 10 минут. После этого в пробирку добавляют б — 8 мл физиологического раствора, перемешивают содержимое, переворачивая пробирку 1-2 раза, и оценивают результат: наличие агглютинации эритроцитов свидетельствует о несовместимости крови донора и реципиента, ее переливание недопустимо.
Если содержимое пробирки остается равномерно окрашенным и в ней не наблюдается реакция агглютинации, кровь донора совместима с кровью реципиента по резус-фактору.
Методика проб на совместимость крови при переливании
До проведения гемотрансфузии следует установить группу крови (ГК) реципиента, донора и провести ряд проб на индивидуальную совместимость. Рассмотрим каждую из этих проб подробнее.
Определение ГК донора и реципиента
Вначале медицинский работник проводит определение ГК пациента по антигенам группы AB0. Самыми распространенными являются два метода – определение ГК при помощи стандартных изогемагглютинирующих сывороток и с использованием цоликлонов.

Методика проведения проб с использованием стандартных сывороток и планшеток
При использовании изогемагглютинирующих сывороток применяются стандартные сыворотки и специальные белые гладкие эмалированные тарелки со смачиваемой структурой, размеченные по 4 группам соответственно.
Порядок действий врача следующий:
- Врач указывает на тарелке ФИО пациента.
- Капает по 1 капле сывороток 0, А и В, причем используется 2 серии сывороток (получается 6 капель).
- Берет кровь у реципиента (капиллярную или венозную).
- Полученную каплю крови помещает в центр тарелки и смешивает отдельно с каждым образцом сыворотки (причем объем сыворотки нужно брать в 10 раз больше, чем объем капли крови).
- Перемешивает каждую пару сыворотка-кровь отдельной палочкой. Агглютинация начинается через 10-30 сек.
- В капли, где наблюдается агглютинация, добавляет по 1 капле физраствора и оценивает результаты.
Четвертая сыворотка (АВ) используется только если агглютинировали три предыдущие сыворотки для проверки результата. Отсутствие агглютинации со стандартной сывороткой означает отсутствие соответствующего агглютинина на эритроците. То есть, например, кровь группы 0(I) не будет агглютинировать ни с одной из используемых сывороток.

Цоликлоны, использующиеся при определении групп крови
Также возможны постановки проб с цоликлонами (анти-А и анти-Б). Процедура определения ГК будет похожа на описанную выше.
Отсутствие агглютинации с цоликлоном будет также означать отсутствие однобуквенного агглютинина на эритроците. Так, кровь III группы будет давать агглютинацию только с анти-В цоликлоном.
При проверке резус-фактора в медицине применяется так называемый ускоренный метод со стандартным универсальным реагентом .
Для этого в цетрифужную пробирку объемом не более 10 мл капают 1 каплю реагента (универсальной антирезусной сыворотки четвертой группы, с 33% декстраном — полимерным углеводом) и капают туда 1 каплю крови пациента. Затем круговым движением смешивают и разносят смесь по стенкам пробирки, затем ждут 3 минуты. На следующем этапе добавляют в емкость 2-3 мл физраствора и переворачивают емкость 2-3 раза, избегая взбалтывания. При наличии видимых лепестков агглютинации делают вывод о том, что резус-фактор положительный.

Кровь донора обязательно маркируется
Группа крови донора обычно определяется заранее, и на пакете с кровью должна быть нанесена соответствующая маркировка. Так, II группа обозначается синим, III – красным, а IV имеет желтую полоску.
Перед переливанием нужно визуально оценить ее качество: кровь, подходящая для переливания сверху желтоватая (слой плазмы), а внизу — темно – красная, собственно осадок из эритроцитов.
Однако, если в пакете видны сгустки, хлопья или пленки, а так же если плазма розовая (признак гемолиза), то такую кровь нельзя использовать.
Контрольное установление группы крови донора проводят после полного размораживания пакета. Каплю для анализа берут не из основного, а из маленького дополнительного отсека пакета. Методика определения аналогична таковым при определении у реципиента.
Результаты контрольного определения должны совпасть с информацией на флаконе. После успешного контрольного определения, приступают к выполнению проб на совместимость.
Пробы на индивидуальную совместимость
Пробы на индивидуальную совместимость проводятся по двум системам: по системе АВ0, а также по резус-фактору донора и рецепиента.
По системе АВ0

Центрифуга, которая используется для определения групп крови
При проведении пробы на индивидуальную совместимость по системе AB0 (также известной как холодовая проба) :
- Берут 3-5 мл свежей крови реципиента, центрифугируют ее
- забирают каплю получившейся сыворотки.
- Затем капля наносится на белую тарелку рядом с небольшой каплей крови донора, капли смешиваются
- Спустя 5-10 секунд оценивается, изменился раствор или нет.
- Если «слипания» красных клеток крови не произошло, то можно переходить к проведению пробы на установление индивидуальной совместимости по резус-фактору.
По резус-фактору
Известно два общепринятых способа определить совместимость по резус-фактору.
Первый подразумевает использование центрифуги. Для этого в пробирку для центрифугирования помещают 2 капли сыворотки пациента, 1 каплю крови из флакона, 1 каплю 33% декстрана и центрифугируют 5 минут. После этого к смеси добавляют 3-4 мл физраствора и оценивают результаты. При отсутствии агглютинации можно перейти к пробе на биологическую совместимость.
Второй метод (так называемая тепловая проба) заключается в следующем. В колбочку помещается 1 капля крови донора, 2 капли теплого 10% раствора желатина и пара капель сыворотки реципиента. Смесь инкубируют в течение 10 минут на водяной бане, где поддерживается температура +46-+48 градусов, а затем также вносят 5 мл физиологического изотонического раствора. Оценка результатов проводится аналогично пробе с центрифугой.
Проба на биологическую совместимость

Перед процедурой переливания крови необходимо провести биологическую пробу
Проба на биологическую совместимость, по сути — это первый этап непосредственно гемотрансфузии и проводится исключительно врачом. Врач, проводящий пробу, выполняет следующие действия:
- подсоединяет капельную систему и вводит первые 15-20 мл донорской крови струйно;
- останавливает трансфузию;
- ждет 3-5 минут, наблюдая за пациентом. Насторожить должны появление тахикардии, затруднения дыхания, болей в пояснице, озноба или жара.
- если все протекает благополучно, пробу считают положительной и выполняют дальнейшую трансфузию
Таким образом, если все пробы на совместимость прошли благополучно, можно проводить переливание крови. Правильная скорость переливания составляет 50-70 капель в минуту.
Конечно, существуют не только группы, описанные в системах AB0 и резус-фактора, так как всего на сегодняшний день описано 250 групп крови. Однако, проведение описанных выше проб на совместимость позволяет выявить несовместимость и по большинству других агглютининов и агглютиногенов, что в итоге делает гемотрансфузиологические мероприятия относительно безопасной процедурой при правильной подготовке.
Из видео вы узнаете как происходит процедура определения совместимости групп крови по резус-фактору:
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
9. Определение резус-принадлежности и проведение пробы на резус-совместимость.
Способы определения Rh0(D) в клинической практике
В клинических условиях (в приёмном покое, хирургическом отделении, операционной), где нет специального лабораторного оборудования, используют экспресс-методы определения Rho(D) (D-фактора).
Экспресс-метод определения стандартным универсальным реагентом в пробирке без подогрева
Для исследования можно использовать свежую несвернувшуюся кровь, взятую из пальца (или вены) непосредственно перед исследованием, или консервированную кровь без предварительной обработки, а также эритроциты из пробирки после формирования сгустка и отстаивания сыворотки.
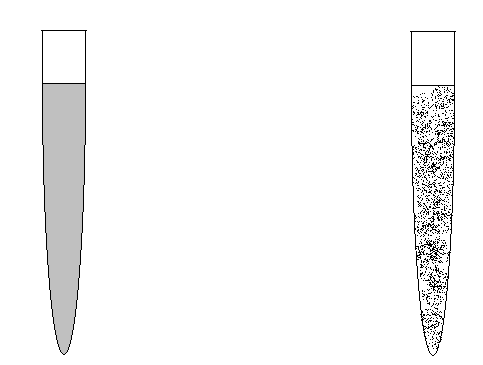
Методика проведения реакции. Исследование проводят в центрифужных пробирках объёмом не менее 10 мл. На дно пробирки вносят одну каплю стандартного универсального реагента, представляющего собой антирезусную сыворотку группы АВ(IV), разведённую 33% раствором декстрана (ср. мол. масса 50 000-70 000). Затем в неё добавляют одну каплю исследуемой крови (или эритроцитов). Круго- вым вращением пробирки содержимое размазывают по её внутренней поверхности таким образом, чтобы содержимое растеклось по стенкам. Это значительно ускоряет агглютинацию и делает её крупнолепестковой. Агглютинация на стенках пробирки наступает, как правило, в течение первой минуты, но для образования устойчивого комплекса антиген-антитело и чёткой агглютинации наблюдать следует не менее 3 мин. Затем для исключения неспецифической агрегации эритроцитов в пробирку добавляют 2-3 мл физиологического
раствора и перемешивают путём одно-двукратного перевертывания пробирки (без взбалтывания!).
Трактовка результатов. Наличие агглютинации (крупные хлопья на фоне просветлённой жидкости) указывает на резус-положительную принадлежность исследуемой крови. Отсутствие агглютинации (в пробирке гомогенно окрашенная розовая жидкость) свидетельствует о резус-отрицательной принадлежности исследуемой крови.
Лабораторные способы определения резус-фактора
Для определения резус-принадлежности крови больного в условиях лаборатории применяют четыре основных метода.
Метод агглютинации в солевой среде
Используют специальные сыворотки, содержащие полные антитела анти-резус. Эритроциты в виде 2% взвеси в изотоническом ра- створе хлорида натрия соединяют в пробирках с антирезусной сывороткой. Пробирки помещают на 1 ч в термостат при температуре 37 ?С, после чего осадок эритроцитов на дне пробирки рассматривают с помощью лупы и по его форме учитывают результат. При положительном результате (Rh+) осадок имеет характерный рисунок в виде нитей или зернистости. При отрицательном (Rh—) осадок размещается равномерным слоем и имеет вид правильно очерченного круга.
Метод агглютинации в присутствии желатина
B две пробирки помещают по 0,02-0,03 мл осадка исследуемых эритроцитов. Затем в первую пробирку добавляют 2 капли (0,1 мл) 10% раствора желатина и 2 капли (0,1 мл) анти-резусной сыворотки, во вторую (контрольную) пробирку — 2 капли (0,1 мл) 10% раствора желатина и 2 капли (0,1 мл) физиологического раствора.
Содержимое осторожно перемешивают. Затем пробирки инкубируют в термостате при температуре 45-48 ?С в течение 30 мин, после чего добавляют 5-8 мл физиологического раствора и переворачивают пробирки 1-2 раза для перемешивания.
Результат учитывают, просматривая пробирки на свет невоору- жённым глазом или через лупу. Eсли эритроциты резус-положи- тельны, произойдёт их агглютинация. Отсутствие агглютинации свидетельствует о том, что испытуемая кровь резус-отрицательная. B контрольной пробирке агглютинация эритроцитов должна отсутствовать.
Непрямой антиглобулиновыи тест (реакция Кумбса)
Эта реакция наиболее чувствительна для выявления неполных антител к ауто- и изоантигенам эритроцитов. К ней, как правило, прибегают при возникновении трудностей в определении резус-при- надлежности крови, связанных с нечёткими результатами, полученными при других методах исследования. Реакция основана на использовании антиглобулиновой сыворотки.
При обработке резус-положительных эритроцитов неполными антителами анти-Rh наступает их обволакивание, сенсибилизация по отношению к антиглобулиновой сыворотке, которая агглютинирует сенсибилизированные эритроциты, поскольку имеет антитела к глобулинам.
В пробирку вносят антирезусную сыворотку и отмытые физиологическим раствором эритроциты, помещают на 1 ч в термостат при температуре 37 ?С, после чего эритроциты тщательно отмывают. Последующий этап реакции проводят на плоскости. Каплю взвеси эритроцитов смешивают с равным количеством антиглобулиновой сыворотки и учитывают результат. Наличие агглютинации — показатель того, что исследуемый образец крови резус-положительный. Если агглютинация отсутствует, то испытуемая кровь резус-отрицательная.
Реакция с анти-D-моноклональными антителами
На планшете смешивают большую каплю (0,1 мл) анти-D-монокло- нальных антител и маленькую каплю (0,01 мл) исследуемой крови.
За реакцией наблюдают в течение 3 мин. При смешивании анти- D-MKA с образцами резус-положительных эритроцитов отмечают быстро наступающую лепестковую агглютинацию. Если кровь резусотрицательная, агглютинация отсутствует.
Проба на резус-совместимость
Последовательность выполнения:
1) капнуть на дно пробирки 2 капли сыворотки крови больного, 1 каплю крови донора, 1 каплю 33% раствора полиглюкина;
2) перемешать содержимое пробирки (не взбалтывая), наклонив пробирку таким образом, чтобы содержимое растекалось по ее стенкам;
3) долить через 5 мин в пробирку 2-3 мл физиологического раствора;
4) перемешать, не взбалтывая, путем дву-, трехкратного поворачивания пробирки;
5) читать результат в проходящем свете;
6) считать кровь несовместимой при наличии агглютинации на фоне просветленной жидкости;
7) считать кровь совместимой при равномерном окрашивании жидкости без признаков агглютинации;
8) произвести дезинфекцию отработанного материала.
Значение и способы определения индивидуальной совместимости (ав0) и резус-совместимости. Биологическая совместимость. Обязанности врача, переливающего кровь.
Пробы на индивидуальную совместимость крови донора и реципиента.
При проведении проб на индивидуальную совместимость выявляют, есть ли в плазме (сыворотке) реципиента антитела, направленные против эритроцитов донора, способные вызвать агглютинацию эритроцитов в сосудистом русле реципиента с последующим их гемолизом. Поскольку антитела, содержащиеся в плазме донорской крови, при переливании разводятся значительно большим объемом крови реципиента со снижением их титра, — обратные взаимоотношения (т.е. донорских антител к антигенам эритроцитов реципиента) в трансфузиологии не имеют клинического значения.
Проба на совместимость крови донора и реципиента на плоскости при комнатной температуре.
На белую пластинку со смачивающейся поверхностью наносят большую каплю (2-3 капли, взятые пипеткой) сыворотки или плазмы реципиента.
Добавляют к ней в 10 раз меньшую каплю крови донора.
Кровь донора смешивают с плазмой (сывороткой) реципиента, а пластинку покачивают в течение 1-2 минут. Затем оставляя ее в покое на 1-2 минуты.
Через 5 минут после начала реакции (после смешивания капель крови и плазмы) учитывают реакцию после добавления к смеси реагентов (крови и плазмы) капли физраствора.
Трактовка результатов.
На пластинке моделируется то, что может произойти в сосудистом русле реципиента. Если образуются хлопья агглютинатов, а смесь крови донора и плазмы (сыворотки) реципиента светлеет, — кровь этого донора этому реципиенту переливать нельзя, т.к. в плазме реципиента содержатся антитела против антигенов эритроцитов донорской крови. Если же смесь крови и плазмы остается красного цвета и агглютинаты не определяются,- это свидетельствует об отсутствии полных антител в плазме у реципиента, способных вызвать иммунное склеивание эритроцитов донорской крови. Следовательно, такую кровь этому, конкретному, донору, с плазмой которого мы манипулировали, — можно перелить.
Проба на совместимость крови донора и реципиента с 33% раствором полиглюкина (проба на резус-совместимость).
В пробирку помещают большую каплю плазмы (сыворотки) реципиента (2-4 капли, взятые пипеткой).
Добавляют маленькую каплю крови донора (соотношение объемов крови и плазмы 1:10)
К полученной смеси реагентов добавляют каплю 33% раствора полиглюкина.
Содержимое пробирки тщательно перемешивают, пробирку наклоняют, чтобы содержимое растеклось по ее стенкам, и медленно поворачивают вокруг вертикальной оси в течение 5 минут, обеспечивая наиболее полный контакт элементов содержимого пробирки друг с другом.
По истечении 5 минут в пробирку доливают 3-4 мл изотонического раствора хлорида натрия, а содержимое перемешивают, не взбалтывая.
Учитывают результаты, рассматривая содержимое пробирки невооруженным глазом или под лупой с 2-5–кратным увеличением.
Трактовка результатов.
При появлении хлопьев агглютинатов и осветлении жидкости в пробирке кровь донора несовместима с кровью этого реципиента. Если же жидкость в пробирке равномерно окрашена в красный цвет, а агглютинаты не выявляются, — можно сделать вывод об отсутствии в плазме у реципиента неполных антител против антигенов донорских эритроцитов, и, следовательно, кровь этого донора может быть перелита этому реципиенту.
Проба на совместимость с применением 10% раствора желатина (проба на резус-совместимость).
В пробирку помещают 1 каплю отмытых эритроцитов донора.
Добавляют к эритроцитам донора 2 капли подогретого 10% раствора желатина 2 капли сыворотки реципиента.
Тщательно перемешивают содержимое пробирки.
Помещают пробирку на 10 минут на водяную баню при температуре 46-48 градусов.
По истечении указанного времени добавляют в пробирку 5-8 мл изотонического раствора хлорида натрия и перемешивают содержимое пробирки переворачиванием (не взбалтывая).
Учитывают результаты невооруженным глазом или под лупой с 2-5- кратным увеличением.
Трактовка результатов.
Если реакция положительная, т.е. отмечается появление агглютинатов на фоне обесцвеченной жидкости, — эта донорская кровь данному реципиенту не может быть перелита. Если же жидкость в пробирке равномерно окрашена и хлопья агглютинатов не выявляются, — кровь донора совместима с кровью реципиента и может быть ему перелита.
Непрямая проба Кумбса.
При проведении этой пробы (очень высокочувствительной) эритроциты донора отмывают 8-10-кратным объемом изотонического солевого раствора, после чего центрифугируют, и в реакции используют эритроциты из осадка, т.е. эритроциты должны быть максимально освобождены от присутствия других клеточных элементов и плазмы.
Одну маленькую каплю (0,01 мл) отмытых эритроцитов донора помещают в пробирку.
Добавляют 3 капли сыворотки реципиента и тщательно перемешивают содержимое пробирки.
Пробирку помешают в термостат при температуре 37 градусов на 45 минут.
По истечении указанного времени инкубации в пробирку наливают 8-10-кратный объем изотонического солевого раствора (хлорида натрия) и перемешивают содержимое пробирки.
Центрифугируют пробирку до осаждения эритроцитов.
Процедуру отмывания повторяют 3-4 раза, каждый раз тщательно удаляя надосадочную жидкость.
К отмытым эритроцитам добавляют 4-5 капель изотонического раствора хлорида натрия для получения взвеси эритроцитов.
Одну каплю взвеси эритроцитов помещают на пластинку с белой смачивающейся поверхностью.
К взвеси эритроцитов на плоскости добавляют 1-2 капли антиглобулиновой сыворотки и перемешивают стеклянной палочкой.
Пластинку периодически покачивают в течение 10 минут.
Учитывают результат невооруженным глазом или под лупой с 2-5-кратным увеличением.
Трактовка результатов.
Если после добавления антиглобулиновой сыворотки к донорским эритроцитам, инкубированным с сывороткой реципиента, образуются агглютинаты с осветлением жидкости, — в крови реципиента имеются неполные антитела против резус-антигена или других изоантигенов эритроцитов донора, и поэтому такому реципиенту эта донорская кровь не может быть перелита. Если же агглютинации нет,- кровь данного донора совместима с кровью данного реципиента, и следовательно, — может быть ему перелита.
Ошибки при проведении проб на групповую, резус-принадлежность и индивидуальную совместимость.
В большинстве случаев ошибки и затруднения при проведении иммуносерологических исследований связаны с нарушением техники их проведения. Реже в качестве причин ошибочных заключений могут встречаться индивидуальные особенности исследуемой крови.
Во всех случаях получения сомнительных результатов необходимо повторить исследование с использованием реагентов других серий при точном соблюдении правил проведения пробы. При повторном получении сомнительных результатов образец крови следует послать на исследование в специализированную лабораторию.
Наиболее типичные причины ошибок и затруднений при проведении иммуносерологических исследований.
Использование некачественных реагентов (с истекшим сроком годности, помутневших, частично высохших и т.д.)
Нарушение температурных режимов проведения реакций. При проведении определения групповой принадлежности крови по системе АВО температура окружающей среды должна быть в пределах от 15 до 25 градусов Цельсия. При более низкой температуре возможно развитие неспецифической агглютинации, обусловленной холодовыми агглютининами, а при высокой температуре агглютинины альфа и бета снижают свою активность.
Нарушение правильных соотношений реагирующих сред. При проведении пробы с сыворотками (в случаях определения групповой принадлежности по системе АВО) отношение объемов крови и сыворотки должно быть 1:10, а при использовании моноклональных антител и проб с коллоидами (при определении резус-принадлежности) — 2-3:10. В противном случае агглютинация может оказаться незамеченной (из-за экранирования агглютинатов неагглютинированными эритроцитами или из-за малого количества агглютинатов).
Нарушение временных режимов проведения проб. Начало агглютинации (особенно при проведении проб с моноклональными антителами) бывает заметным в первые секунды от момента смешивания реагирующих сред, однако учет реакции должен проводиться в строго определенное время, т.к. иногда встречаются разновидности антигенов, обладающие слабой агглютинабельностью и дающие позднюю реакцию (разновидности агглютиногена А, реже — В).
Игнорирование необходимости проведения контрольных исследований (например, с сывороткой АВ(IV) группы при определении групповой принадлежности со стандартными геагглютинирующими сыворотками или проб с коллоидами при определении резус-принадлежности).
Повышенная агглютинабельность эритроцитов — может наблюдаться при тяжелых гнойных заболеваниях, ожогах, циррозах печени, аутоиммунных и гематологических заболеваниях.
Снижение агглютинабельности эритроцитов — нередко встречается при лейкозах.
Кровяной химеризм — очень редко встречающееся явление, имеющее место у разнояйцовых близнецов, при пересадке донорского костного мозга или после переливаний (вынужденных) иногруппной, но совместимой крови в больших объемах.
Предупреждение ошибочных результатов исследований заключается в строгом следовании существующим правилам определения групповой и резус-принадлежности, проб на совместимость с обязательным учетом характера заболевания и общего состояния реципиента.
Биологическая проба.
Биологическая проба проводится в обязательном порядке при переливаниях донорской крови, эритроцитсодержащих сред, плазмы, концентратов лейкоцитов, независимо от объема и скорости гемотрансфузии.
Биологическая проба проводится непосредственно перед трансфузией и заключается в 3-кратном переливании по 10-15 мл трансфузионной среды струйно или с максимальной скоростью (2-3 мл в мин.) с интервалами в 5 минут, во время которых осуществляют инфузию солевых растворов во избежание тромбирования иглы. Если во время проведения биологической пробы появляется хотя бы один из симптомов, свидетельствующих о несовместимости трансфузионной среды, ее переливание прекращают и проводят соответствующие мероприятия. К таким симптомам относятся озноб, боли в пояснице и внизу живота, чувство стеснения и боли в груди, тошнота, рвота, тахикардия, снижение артериального давления. Во время операции под общим обезболиванием признаками несовместимости могут быть усиление кровоточивости тканей, снижение артериального давления, увеличение тахикардии, выделение мочи, окрашенной в красный или бурый цвет (в случаях катетеризации мочевого пузыря).
Переливание крови. Показания и противопоказания к переливанию крови. Современные правила переливания крови по группам системы АВ0 и системы резус. Способы и техника переливания крови.
Показания к переливанию крови определялись известными механизмами её действия:
Заместительным.
Гемостатическим.
Иммуностимулирующим.
Дезинтоксикационным.
Используемым для парэнтерального питания.
Однако, как показал накопленный опыт, столь широкое использование гемотрансфузий далеко не всегда оказывалось эффективным, больше того, нередко оказывалось опасным: больной получал с кровью помимо эритроцитов нежизнеспособные лейкоциты, тромбоциты, белки, антигены и антитела.
Повторные переливания крови приводили к аллоиммунизации больных.
В настоящее время основным показанием к переливанию крови является острая массивная кровопотеря не менее 25 – 30 % ОЦК со снижением гемоглобина ниже 70 – 80 г / л, гематокрита – ниже 25 % и возникновением циркуляторных нарушений.
Кроме того, переливание крови показано при шоке и терминальных состояниях, в- редких случаях при обменных переливаниях при гемолитической болезни новорождённых, при операциях, сопровождающихся массивной кровопотерей.
Во всех других случаях следует использовать фракции крови или кровезаменители.
Противопоказания к гемотрансфузии.
Абсолютных противопоказаний к переливанию нет.
Относительные противопоказания:
Острое нарушение мозгового кровообращения.
Недостаточность кровообращения II ст. – III ст.
Гипертоническая болезнь III ст.
Печеночная и почечная недостаточность.
Активный (диссеминированный) туберкулёз лёгких.
Тяжёлая бронхиальная астма.
Аллергические заболевания.
Правила переливания крови.
В настоящее время переливание крови и её компонентов допускается только одноимённой группы и Rh – принадлежности.
В исключительных случаях (по жизненным показаниям) при отсутствии одногруппной крови или её компонентов допускается переливание эритромассы О(I) группы,Rh – отрицательной, но не более 500 мл (за исключением детей!).
При отсутствии одногруппной плазмы реципиенту может быть перелита плазма группы АВ(IV).
Врач, производящий переливание крови или её эритромассы, обязан:
Перед каждым переливанием определить группу крови и Rh – принадлежность реципиента.
Убедившись в пригодности донорской крови, и, заполнив систему, определить группу крови и Rh- принадлежность донора, согласовать с этикеткой на гемоконе.
Поставить пробу на индивидуальную совместимость крови реципиента и донора.
Поставить пробу на резус – совместимость.
Провести пробу на биологическую совместимость.
Остаток крови (10 – 15мл) в гемоконе после гемотрансфузии хранят в холодильнике 48 часов.
В течение 3 х часов после окончания гемотрансфузии у больного измеряют температуру, пульс и АД. На следующее утро производится анализ крови и мочи.
Каждое переливание крови, её фракций, а также кровезаменителей записывается в трансфузионный лист, который находится в истории болезни больного.
Способы и техника переливания крови:
Прямое переливание. Кровь переливается с помощью аппарата непосредственно из вены донора в вену реципиента без использования консерванта.
Из – за опасности инфицирования донора в настоящее время не используется.
Непрямое переливание. Донорская кровь консервируется в гемокон, или ампулу и хранится в холодильнике при t 0 + 4 0 С.
При необходимости используется для переливания без специального подогрева. Непрямое переливание крови и её фракций используется очень широко.
Реинфузия крови: переливание крови больного, излившейся в серозные полости (брюшную, плевральную), при закрытой травме или во время операции. Кровь забирается с помощью специального аппарата или, при отсутствии такого, в экстренных случаях, фильтруется через 8 слоёв марли, добавляется консервант и сразу переливается внутривенно.
Метод очень эффективен.
Противопоказания: повреждение полых органов, нахождение крови в серозной полости более 12 часов, гемолиз крови.
Аутотрансфузия крови. Используется в плановой хирургии, когда за несколько дней до операции у больного берут из вены 400 – 500 мл крови, добавляют консервант, после чего гемокон хранят в холодильнике, а во время операции переливают больному его собственную кровь.
Метод очень перспективен.
Противопоказание: исходная анемия у больного.
Обменные переливания крови – частичное или полное удаление крови из кровяного русла с одновременным возмещением таким же количеством донорской крови.
Показания: гемолитическая желтуха новорождённых, гемотрансфузионный шок, тяжёлые отравления. При этом удаляется и одновременно инфузируется кровь со скоростью 1000 мл за 15 – 20 минут.
Обменные переливания используются редко.
Способы введения крови:
В настоящее время преимущественно используется внутривенное переливание крови.
После постановки проб на совместимость кровь переливают чаще всего в кубитальную вену путём её пункции, реже – через специальную канюлю, поставленную в вену. При необходимости переливание больших обьёмов трансфузионных сред используют постоянный катетер, который ставится в центральную вену (чаще в подключичную).
Обычно используется капельное переливание со скоростью 40 – 60 капель в минуту.
При необходимости срочного замещения ОЦК может использоваться внутривенное струйное переливание крови.
Внутриартериальное нагнетание крови.
Показания: шок III – IV ст., терминальные состояния.
Кровь нагнетается в периферическую артерию, которая предварительно обнажается, под давлением 200 — 220 мм рт. ст. со скоростью 200 мл за 1,5 – 2 минуты. Вводимая под давлением кровь, раздражает ангиорецепторы и обеспечивает восстановление венечного кровотока.
Внутриартериальное, внутрисердечное нагнетание крови проводится очень редко, только в реанимационной практике и во время операций на грудной клетке.
Внутрикостное переливание крови.
В настоящее время практически не используется. Применялось при обширных ожогах, когда периферические вены были недоступны. Переливание проводится в грудину, подвздошную, пяточную кости со скоростью от 5 до 30 капель в минуту.
Помимо осложнений, связанных непосредственно с гемотрансфузией, возможно развитие остеомиелита.
Гемотрансфузионные осложнения, их профилактика, диагностика, принципы лечения. Профилактика гепатита, ВИЧ — инфекции.
48. Проба на совместимость по резус-фактору
Оснащение: кровь донора, сыворотка реципиента, 33% раствор полиглюкина, центрифужная пробирка, физиологический раствор натрия хлорида, пипетки.
Последовательность действий:
а) Из вены реципиента взять 3-5 мл крови, центрифугировать.
б) На дно центрифужной пробирки разными пипетками нанести 2 капли сыворотки больного, 1 каплю донорской крови и 1 каплю 33% раствора полиглюкина.
в) Содержимое перемешать, наклонив пробирку почти до горизонтального положения и медленно вращать вокруг оси, распределив содержимое по стенкам ровным слоем.
г) Процедуру продолжать в течение 5 минут.
д) Через 5 минут добавить 3-4 мл физиологического раствора хлорида натрия.
е) Содержимое перемешивать, 2-3 раза наклоняя пробирку до горизонтальной плоскости (не взбалтывать!).
Трактовка результатов:
Отсутствие агглютинации, равномерное окрашивание содержимого пробирки свидетельствуют о резус-совместимости крови донора и реципиента; наличие агглютинации — о несовместимости крови донора и реципиента по резус-фактору
После проведения первой пробы необходимо провести пробу на совместимость по Rh-фактору. Для этого существует 2 доступных метода — реакция в сывороточной среде и в желатине.
Первый метод: на чашку Петри наносят 1—2 капли сыворотки больного и маленькую каплю донорской крови, после чего ее на 10 минут ставят в водяную баню (+46~+48 °С). Наличие агглютинации свидетельствует о несовместимости.
Второй метод: на дно пробирки помещают маленькую каплю донорской крови, добавляют 2 капли подогретого 10 % раствора желатина и 2 капли сыворотки крови больного. Через 10 минут инкубирования в водяной бане при. температуре +46—+48 °С в пробирку добавляют 5 мл подогретого изотонического раствора хлорида натрия. ‘Наличие агглютинации свидетельствует о несовместимости крови донора и реципиента.
Следует отметить, что изоиммунные антитела и антитела других систем выявляются теми же методами, что и антитела анти-Rh, а некоторые — как антитела системы АВО. Поэтому несовместимость крови донора по этим антителам может быть выявлена при выполнении указанных проб на совместимость.
49. Значение резус-фактора при переливании крови
В норме в крови как резус-положительных, так и резус-отрицательных людей антирезусных антител нет. Причины их появления в сыворотке резус-отрицательных людей следующие:
• резус-конфликт при беременности;
• переливание резус-положительной крови;
• искусственная иммунизация добровольных доноров.
Резус-конфликт
Система резус-фактора играет большую роль в акушерстве и гинекологии. Во время беременности резус-отрицательной женщины резус-положительным плодом может происходить иммунизация беременной и образование у неё антител анти-D, которые из её крови проникают через плацентарный барьер, попадают в кровоток плода и повреждают его резус-положительные эритроциты и органы кроветворения. Возникает резус-конфликт. Указанные изменения ведут
к развитию гемолитической болезни, имеющей симптомы различной степени выраженности: от анемии, выраженной желтухи и отёка плода до нарушения беременности и мертворождения.
Первая беременность, как правило, заканчивается рождением здорового ребёнка, происходит только сенсибилизация матери к антигену D. В последующем, если снова развивается резус-положитель- ный плод, тяжесть проявления и последствий резус-конфликта нарастает. Иногда серьёзные последствия могут наступить и при первой беременности, в то время как в других случаях выраженность резусконфликта при второй, третьей беременностях может быть весьма умеренной. Степень выраженности осложнений зависит в первую очередь от титра антирезусных антител в сыворотке беременной. В связи с этим все резус-отрицательные беременные состоят на диспансерном учёте, у них регулярно контролируют содержание антител анти-D и в зависимости от полученных данных предпринимают соответствующее лечение, а иногда и искусственно прерывают беременность.
Переливание резус-несовместимой крови
Аналогичен механизм патологических изменений при переливании резус-несовместимой крови. Первое переливание резус-положи- тельной крови резус-отрицательному несенсибилизированному больному может не сопровождаться явлениями несовместимости, но обязательно приведёт к образованию антирезусных антител (сенсибилизации). При последующих трансфузиях этому больному резусположительной крови возникает несовместимость по Rh-фактору. Развитие резус-несовместимости опасно и при переливании резусположительной крови резус-отрицательной женщине, сенсибилизированной к резус-фактору во время беременности.
Искусственная иммунизация добровольных доноров
Процедуру проводят для получения антирезусной сыворотки и приготовления различных реагентов.
