Антигены системы Rh (C, E, c, e), Kell – фенотипирование
Исследование включает в себя определение наличия на исследуемых эритроцитах наиболее клинически значимых антигенов системы Rh (C, E, c, e) и Kell (K).
Синонимы русские
Анализ крови на фенотип, риск гемотрансфузионных осложнений, анализ крови на эритроцитарные антигены.
Синонимы английские
Antigens of Rh (C ,E, c, e) system, Kell – phenotyping.
Метод исследования
Реакция агглютинации.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
На поверхности красных кровяных телец-эритроцитов находится более 250 антигенов, которые разделяются на 29 генетических систем.
Резус-фактор (Rh) – одна из систем групп крови, считается наиболее важной после самой известной системы — ABO. Основным антигеном системы Rh считается антиген — D (именно по его наличию или отсутствию выставляется «положительный или отрицательный резус-фактор»), однако выделяют также антигены С и с и E и e. Два гена: RHD и RHCE кодируют Rh-белки, первый кодирует D-антиген, а второй кодирует CE антигены в различных комбинациях (ce, cE, Ce, CE).
Е и е антигены кодируются аллелями гена RHCE и являются кодоминантными. Во всех популяциях е встречается чаще, чем Е (примерно 30% белого населения имеют Е и 98% имеют е-антигены). Е имеет более сильные иммуногенные свойства, чем е. В редких случаях может быть наследование инактивированных или частично неактивных генов RHCE, которые не кодируют
Система Kell также является одной из наиболее важных групп крови в транфузиологии и в акушерской практике. Антитела Kell считаются значительно иммуногенными. Система группы крови Kell содержит 35 антигенов, из которых K/k (KEL1/KEL2), Kpa/Kpb (KEL3/KEL4), Jsa/Jsb (KEL5/KEL6) являются наиболее важными.
Исследование системы Rh (С, Е, с, е) и Kell успешно проводится методами реакции с моноклональными антителами и гель-фильтрацией. В первом методе используются специальные моноклональные смеси, предназначенные только для прямого тестирования и не используются в антиглобулиновом тесте. Rh-типирование также выполняется с использованием гель-фильтрации. Антисыворотка распределяется равномерно по всем частицам гелем. Антиген-положительные эритроциты реагируют с антисывороткой, при этом агглютинины связываются и не могут высвободиться из геля при центрифугировании.
Когда назначается исследование?
- Обследования перед планирующимися гемотрансфузиями в целях снижения частоты трансфузионных реакций.
- Дополнительные обследования во время беременности в целях оценки статуса по системе Rh и Kell.

- Обследование всех доноров крови в соответствии с приказом МЗ РФ № 183н от 02.04.2013 г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
Что означают результаты?
Референсные значения: «отрицательно» для всех компонентов исследования.
Система Rh имеет пять разновидностей антигенов: C, D, E, c, e. Наиболее иммуногенным является антиген D. Иммуногенность других антигенов системы «резус» существенно ниже и убывает в следующем ряду: с > Е > С > е. Фактор Kell (K) стоит на втором месте после фактора D в шкале трансфузионно опасных антигенов эритроцитов.
Наличие или отсутствие определенных белков на мембране эритроцитов (фенотип антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни. Люди, у которых отсутствует какой-либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются
Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются
Сдать анализ на антинуклеарный фактор (АНФ, HEp-2, титры)
Метод определения
Непрямая иммунофлюоресценция на клетках перевиваемой клеточной линии НЕр-2 с определением основных типов свечения ядра.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияAntinuclear Antibodies; ANA, Hep-2 Substrate; ANA-Hep2; Fluorescent AntiNuclear Antibody detection; FANA.
Краткое описание определяемого вещества Антинуклеарный фактор
При системной красной волчанке (СКВ) и других системных ревматических заболеваниях иммунный ответ направлен против нуклеопротеиновых антигенов, т.е. комплексов нуклеиновых кислот и белков. Такие эндогенные нуклеопротеиновые аутоантигены могут образовываться в ходе процесса апоптоза эпителиальных клеток (каскад генетически запрограммированных реакций, приводящих к удалению поврежденной или дефектной клетки) и напоминают чужеродные вирусные частицы.
В настоящее время описаны около 200 разновидностей антител к нуклеопротеинам и рибонуклеиновым кислотам, которые получили название антинуклеарные антитела. При аутоиммунных заболеваниях аутоантитела к ядерным антигенам не обладают прямым цитотоксическим действием на клетки человека, однако иммунные комплексы способны запускать иммунологическое воспаление, особенно в местах, где сосуды особенно тонки, в том числе в почках, коже, центральной нервной системе, синовиальной оболочке суставов, плевре.
С какой целью определяют Антинуклеарный фактор
Исследование антинуклеарного фактора (АНФ) представляет собой основной метод выявления антинуклеарных антител, позволяя выявлять аутоантитела к нуклеиновым кислотам (дсДНК, осДНК, РНК), рибонуклеопротеинам, а также большинству конформационных и нерастворимых антигенов.
Антинуклеарные антитела в данном методе обнаруживают благодаря их связыванию с внутриклеточными антигенами перевиваемой линии клеток эпителия человека (HEp-2). Ядро и цитоплазма клеток НЕр-2 содержит все антигены, характерные для человеческой клетки, что позволяет выявлять в одном тесте все основные антинуклеарные антитела. Метод непрямой иммунофлюоресценции на клеточной линии НЕр2 рекомендован в качестве золотого стандарта выявления антинуклеарных антител ведущими экспертами, включая европейские (EASI group 2010) и американские группы экспертов (ACR ANA Task force 2008). В силу многообразия антигенов антинуклеарных антител не все они могут быть очищены или синтезированы для использования в автоматизированных иммуноферментных тестах по выявлению антинуклеарных антител (таком как №125 Антинуклеарные антитела, скрининг ИФА). В свою очередь, легко растворимые компоненты ядра клетки могут утрачиваться из ядер клеток при фиксации препарата для проведения исследований АНФ методом непрямой иммунофлюоресценции (№1267).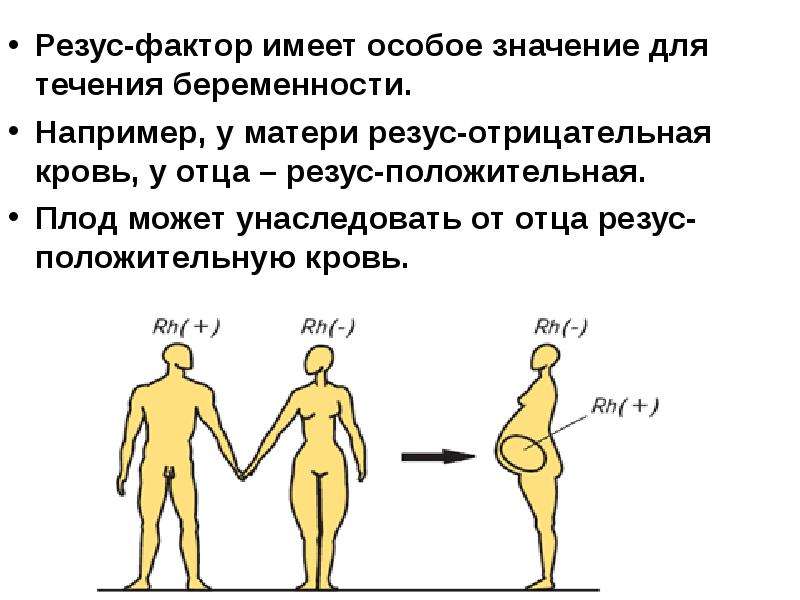
Поэтому использование ИФА-методов (антитела к экстрагируемым антигенам — ЭНА, антинуклеарные антитела, ИФА — АНА № 125) в комплексе с выявлением антинуклеарного фактора на клетках линии НЕр2 методом непрямой иммунофлюоресценции (АНФ №1267) позволяет избежать ложно-отрицательных результатов тестирования при системных ревматических заболеваниях.
При каких патологиях может быть обнаружен Антинуклеарный фактор в крови
Позитивность по АНФ на клеточной линии НЕр-2 отмечается при системной красной волчанке (СКВ), системных ревматических заболеваниях и многих аутоиммунных заболеваниях, что делает его универсальным тестом в обследовании больных с аутоиммунной патологией. Положительный результат АНФ отмечается более чем у 90% больных с диффузными болезнями соединительной ткани, такими как системная красная волчанка и кожные формы этого заболевания, склеродермия и ее разновидности, смешанное заболевание соединительной ткани, синдром Шегрена. Выявление АНФ имеет большое значение в диагностике ювенильного ревматоидного артрита и аутоиммунных заболеваний печени. Представители этого семейства аутоантител могут быть обнаружены при множестве других аутоиммунных (тиреоидит, диабет), инфекционных (вирусный гепатит), воспалительных и онкологических заболеваний. Встречаемость АНФ достигает 1-3% у клинически здоровых людей и несколько возрастает у лиц старше 65 лет. Лица с высокими титрами АНФ имеют повышенный риск развития аутоиммунных заболеваний.
Представители этого семейства аутоантител могут быть обнаружены при множестве других аутоиммунных (тиреоидит, диабет), инфекционных (вирусный гепатит), воспалительных и онкологических заболеваний. Встречаемость АНФ достигает 1-3% у клинически здоровых людей и несколько возрастает у лиц старше 65 лет. Лица с высокими титрами АНФ имеют повышенный риск развития аутоиммунных заболеваний.
что это такое, чем отличается положительный от отрицательного?
Международное сообщество трансфузиологов выделяет 29 систем групп крови. Все знают о системе AB0, которая включает 4 основные группы крови. Некоторые люди, являющиеся донорами, могли слышать и о системе Kell, которая влияет на возможность донорства или запрет на него. Еще одной распространенной системой является резус-фактор. Что это и почему резус-фактор важен во время гемотрансфузии и в период гестации?
Что это такое?
Что из себя представляет резус-фактор? Это целый комплекс антигенов, которые в разной комбинации могут содержаться или отсутствовать на мембране красных кровяных телец. Система антигенов резус-фактора включает в себя 54 белка, которые находятся на эритроцитах, однако наиболее значимы в гематологии и трансфузиологии только 6 из них.
Система антигенов резус-фактора включает в себя 54 белка, которые находятся на эритроцитах, однако наиболее значимы в гематологии и трансфузиологии только 6 из них.
Кто открыл систему Rh? В конце 30-хх гг. ХХ в. был опубликован доклад, в котором ученые описывали агглютинацию при переливании крови. Сыворотка из крови пациентки вступила в реакцию склеивания с 80% образцов эритроцитов, причем от группы крови по системе АВ0 это не зависело.
В следующем году был опубликован еще один доклад о похожих результатах. В исследовании использовалась сыворотка, где содержались эритроциты макаки-резуса, и она взаимодействовала с 85% красных клеток человека. Чтобы обозначить, что данная сыворотка готовилась из крови обезьяны, антиген, вызвавший склеивание, назвали «резусом» по виду животного, с тех пор название прижилось в научной литературе. Так открыли Rh, и связывают открытие с именами ученых Карла Ландштейнера и Александра Винера.
Положительный и отрицательный резусы
Многие после анализа на группу крови видели в своих справках кроме номера группы еще одну отметку— Rh+ или Rh-. Что значат эти символы? Они говорят о положительном или отрицательном резус-факторе.
Что значат эти символы? Они говорят о положительном или отрицательном резус-факторе.
Чем они отличаются и от чего зависят значения? Для определения положительного или отрицательного фактора имеет значение только один из 54 белков — антиген D. Если он присутствует на мембране эритроцитов, то кровь считается +, если же его нет — то -.
Какой будет Rh у ребенка, определяется правилами наследования. Отрицательный — рецессивный признак и проявляется у ребенка, только если он гомозиготный. Положительный — доминантный признак, и у человека будет присутствовать антиген D, даже если он гетерозиготен по этому признаку, что объясняет, почему у людей чаще всего встречается резус-фактор +.
Соотношение людей с Rh+ и Rh- зависит от народности. Больше всего людей с отрицательной кровью среди басков, народности в Пиренейских горах — 30%. Это представляет интерес для ученых, учитывая, что баски уникальны не только своей кровью, но и языком, который не родственен ни одному из существующих или вымерших языков мира. У европейцев носителей Rh+ 85%, а Rh- 15%. Среди азиатов и представителей негроидной разы распространенность отрицательного резус-фактора — менее 5%.
У европейцев носителей Rh+ 85%, а Rh- 15%. Среди азиатов и представителей негроидной разы распространенность отрицательного резус-фактора — менее 5%.
Как определяют резус человека? Капли крови смешивают со специальной сывороткой. Если произошла агглютинация и обнаружены разрушившиеся эритроциты, значит резус-фактор крови положительный. Если же агглютинации не происходит, то итог — отрицательный резус-фактор. Как происходит определение, можно посмотреть на видео ниже.
Понятие резус-конфликта: что это означает?
Смешение крови с разными Rh дает реакцию склеивания эритроцитов. Что же происходит, если резус-отрицательная мать носит в себе Rh+ эмбриона?
Что же происходит, если резус-отрицательная мать носит в себе Rh+ эмбриона?
Резус-конфликт — реакция иммунитета Rh- матери на эритроцитарные антигены плода, которая призвана защитить ее организм. В материнской крови начинают вырабатываться специальные антирезусные антитела, направленные на уничтожение белка D. Они просачиваются сквозь гемоплацентарный барьер в кровоток эмбриона и вызывают гемолиз эритроцитов, которые распадаются в кровяном русле ребенка с выбросом гемоглобина — так развивается гемолитическая желтуха новорожденных.
Несмотря на то, что отрицательная кровь не такая уж редкость — она встречается у 1-2 человек из десяти, резус-конфликт происходит намного реже. Этому есть объяснение: при гестации материнская и детская кровь не соприкасается между собой, поэтому защитные антитела не продуцируются. В первую гестацию практически не случается резус-конфликта.
Опасность возрастает, когда во время родового процесса кровь роженицы и малыша смешивается и иммунная система начинает вырабатывать агглютинины. Если следующий ребенок будет тоже иметь Rh+, то без принятия дополнительных мер образуется резус-конфликт. Также риск появления антител повышается после трубной гестации, искусственного и самопроизвольного абортов.
Если следующий ребенок будет тоже иметь Rh+, то без принятия дополнительных мер образуется резус-конфликт. Также риск появления антител повышается после трубной гестации, искусственного и самопроизвольного абортов.
Влияние отрицательного резус-фактора на беременность
Резус-конфликт вызывает патологии у плода. Гемолитическая болезнь новорожденных — состояние, при котором эритроциты массово распадаются из-за агглютинации агглютининов — материнских антител и агглютиногенов — антигенов резус-фактора.
ГБН вызывает следующие симптомы:
- гипертрофия органов;
- повышенное количество ретикулоцитов — предшественников эритроцитов;
- эритробластоз — пролиферация эритроцитов вне костного мозга;
- гемолитическая желтуха вследствие увеличения содержания билирубина.
В самых тяжелых случаях у эмбриона возникают водянка и отечный синдром, что вызывает внутриутробную смерть или гибель сразу после рождения. Кроме того, резус-конфликт нередко вызывает внутреннее кровотечение, отслаивание плаценты, гипоксию эмбриона.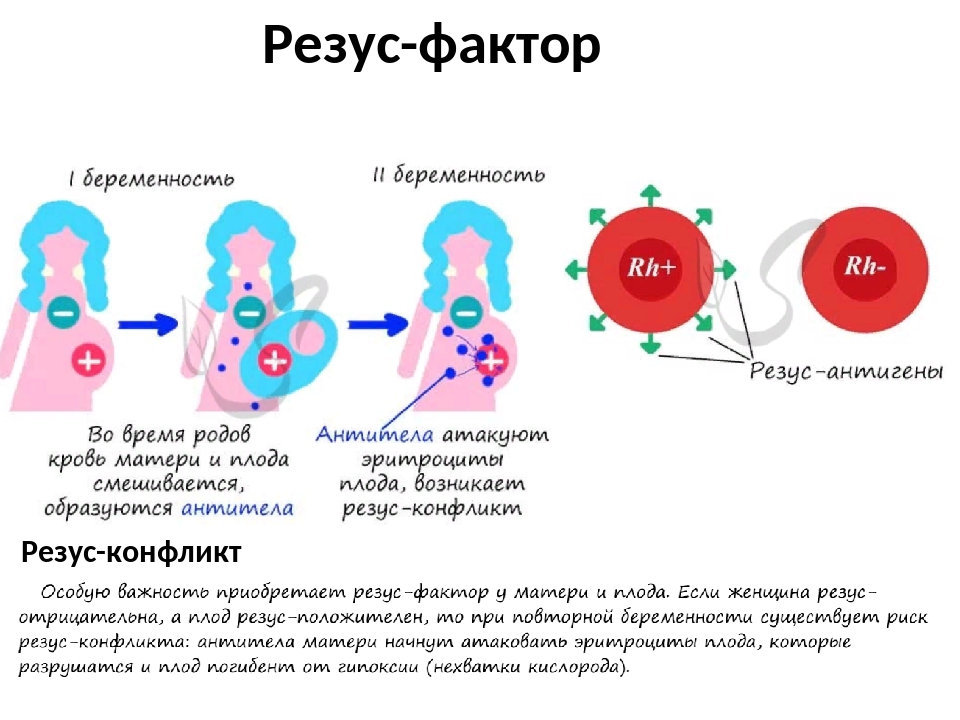 На начальных этапах гестации может случиться выкидыш, рожденный ребенок будет иметь физические и психические отклонения.
На начальных этапах гестации может случиться выкидыш, рожденный ребенок будет иметь физические и психические отклонения.
Случается ли конфликт, если у матери Rh+, а у ребенка Rh-? В таком случае о течении гестации можно не беспокоиться, никаких угроз здоровью матери или плода не появится.
Влияние резус-фактора на здоровье человека
Слова «положительный» и «отрицательный» не означают, что один резус хуже, чем другой. Учеными не обнаружено взаимосвязи отрицательного резус-фактора крови с какими-либо недугами. Rh- — особенность человека, точно такая же, как группа крови или цвет радужной оболочки глаза. Нельзя сказать, какой Rh самый лучший, так же, как нельзя сказать какая группа АВ0 самая лучшая, ведь отличия в присутствии белка D на мембране кровяных клеток не оказывают влияния на здоровье.
Однако у отрицательного резус-фактора есть свои особенности. 10 лет назад были опубликованы результаты исследования того, как паразитический протист токсоплазма влияет на людей с разным резус-фактором. Обнаружилось, что у людей с Rh- протист ухудшает скорость реакции, например, они в 6 раз чаще попадают в ДТП, чем люди с Rh+, которые тоже заражены протистом. Считается, что антиген D помогает справиться с влиянием токсоплазмы.
Обнаружилось, что у людей с Rh- протист ухудшает скорость реакции, например, они в 6 раз чаще попадают в ДТП, чем люди с Rh+, которые тоже заражены протистом. Считается, что антиген D помогает справиться с влиянием токсоплазмы.
Профилактика резус-конфликт при планировании беременности
Можно ли избежать резус-конфликта? В современной медицине существуют способы, которые помогают избежать возникновения патологий при второй гестации. После первых родов женщине в течение 72 часов вводят препарат, содержащий антирезусный иммуноглобулин (подробнее в статье: инъекции иммуноглобулина после родов). Он предотвращает выработку антигенов, а значит во время второй беременности конфликта не возникнет.
Такую же сыворотку надо вкалывать после искусственного прерывания беременности и выкидыша — в тех случаях, когда кровь матери и плода могла соприкоснуться друг с другом. Если аборт неизбежен, его лучше делать до 7 недели, до этого момента антигены не вырабатываются.
При гестации за женщиной пристально наблюдают врачи. При необходимости назначают дополнительные УЗИ, которые помогут выявить увеличение органов плода на ранних этапах. Несколько раз за период вынашивания делают пробу для контроля титра антител. До 32 недели анализ берут 1 раз в месяц, с 32 до 36 — дважды, а начиная с 36 недели пробу делают еженедельно.
При необходимости назначают дополнительные УЗИ, которые помогут выявить увеличение органов плода на ранних этапах. Несколько раз за период вынашивания делают пробу для контроля титра антител. До 32 недели анализ берут 1 раз в месяц, с 32 до 36 — дважды, а начиная с 36 недели пробу делают еженедельно.
Что делать, если при гестации повышены титры антител? В этих случаях врачи выбирают один из способов лечения. Десенсибилирующая терапия направлена на подавление аллергического ответа на чужие агглютинины. Также применяется введение антирезус-глобулина.
Значение резус-фактора при переливании крови
До обнаружения различных групп крови и резус-факторов конфликты при гемотрансфузии происходили нередко. Что чувствовал пациент при трансфузии ему неподходящей крови?
Сначала затруднялось дыхание, за грудиной появлялись спазмы. Затем резко падало давление, во всем теле возникал жар. Пациента мучила сильнейшая головная боль, возникали тошнота и рвота. Из-за повреждения почечной ткани и спастического сокращения почечных сосудов возникал ацидоз, менялся водноэлектролитический баланс, повышалось содержание азота в крови. Смерть наступала к концу первых суток. Причиной тому было стремительное слипание и распад эритроцитов. Такое состояние называется посттрансфузионным шоком.
Смерть наступала к концу первых суток. Причиной тому было стремительное слипание и распад эритроцитов. Такое состояние называется посттрансфузионным шоком.
В современной медицине трансфузию проводят только в случае полного совпадения факторов крови. При этом важна не только группа по системе АВ0, но и значение Rh и показатель Kell.
Гемотрансфузия осложняется тем, что некоторые пациенты обладают чрезвычайно редкими комбинациями антигенов, которые входят в состав резус-фактора. Например, люди с RhNULL вырабатывают антитела к распространенному антигену Rh39, который присутствует у подавляющего большинства независимо от резус-принадлежности.
Переливание крови таким пациентам приводит к посттрансфузионному шоку из-за выработки антител. Из-за того, что такой фенотип встречается очень редко, в банке крови может просто не оказаться нужного материала. Для решения данной проблемы трансфузиологи всего мира поддерживают донорство крови.
Врач акушер-гинеколог, репродуктолог, консультант по грудному вскармливанию, окончила ЧГУ им. Ульянова со специализацией гинекология, маммология Подробнее »Поделитесь с друьями!
Антитела — Википедия Wiki Русский 2022
Антитела́, иммуноглобулины — крупные глобулярные белки плазмы крови, выделяющиеся плазматическими клетками иммунной системы и предназначенные для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознаёт уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определённый его участок, эпитоп. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, такие как система комплемента и фагоциты, чтобы уничтожить чужеродные клетки или вирусные частицы. Антитела — важнейший компонент гуморального специфического иммунитета.
Схема взаимодействия антигена и антителаАнтитела (иммуноглобулины) образуют белковое суперсемейство. Они имеют Y-образную форму, на двух концах молекулы располагаются два одинаковых сайта связывания антигенов, а третий конец бывает одного из нескольких видов, в зависимости от него антитела относят к тому или иному классу. В состав одного антитела в большинстве случаев входят две тяжёлые цепи и две лёгкие цепи. У млекопитающих существует пять типов тяжёлых цепей — α, γ, δ, ε и μ, которым соответствуют пять изотипов[en] (классов) антител — IgA, IgG, IgD, IgE и IgM[1]. Антитела каждого изотипа отличаются от других функциями и особенностями структуры. Колоссальная вариабельность антител обеспечивается перестройками локусов, кодирующих тяжёлые и лёгкие цепи, в ходе V(D)J-рекомбинации.
Образование антител, распознающих нормальные белки организма (аутоантител), составляет основу развития аутоиммунных заболеваний, например, системной красной волчанки, ревматоидного артрита и других. Полное или частичное отсутствие антител приводит к развитию иммунодефицитных состояний.
Строение
Иммуноглобулиновые домены формируют две тяжёлые цепи (красная и синяя цепи) и две лёгкие цепи (жёлтая и зелёная цепи). В состав иммуноглобулинового домена входит от 7 (константные домены) до 9 (вариабельные домены) β-листовМолекулы иммуноглобулинов (антител) имеют форму буквы «Y» и состоят из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, соединенных вместе дисульфидными связями. Полипептидные цепи на «верхних» концах «буквы Y» завершаются аминогруппами и являются антигенсвязывающими участками, «ножка» — карбоксильными группами[2].
Известны растворимые и мембранные формы антител. Мембранные антитела встречаются у B-лимфоцитов и называются B-клеточными рецепторами. Растворимые антитела по строению практически идентичны мембранным, различия касаются лишь C-концевой (константной) части. Молекула мономерного иммуноглобулина имеет молекулярную массу 150—170 кДа и состоит из четырёх полипептидных цепей: двух лёгких, или L-цепей (англ. Lite) (масса 50—60 кДа), и двух тяжёлых, или H-цепей (англ. Heavy) (масса 100—120 кДа), которые располагаются симметрично и соединены дисульфидными связями. H- и L-цепи соединены единственной дисульфидной связью, расположенной недалеко от C-конца лёгкой цепи, остальные дисульфидные связи скрепляют H-цепи. В состав лёгких цепей входит два гомологичных сегмента (домена), а в состав тяжёлых — 4—5 доменов. Домены состоят из приблизительно 110 аминокислотных остатков (а. о.) и имеют сходную пространственную структуру, которая стабилизирована одной дисульфидной связью, однако их функции различаются[3]. Эти домены относятся к так называемым иммуноглобулиновым доменам, содержащим характерный структурный мотив[en], известный как иммуноглобулиновая укладка, представленная двумя β-слоями, которые взаимодействуют друг с другом с помощью дисульфидных связей и электростатических взаимодействий, формируя нечто наподобие сэндвича[4]. Домены взаимодействуют друг с другом посредством гидрофобных взаимодействий[5].
Строение мономерного антитела. 1 — фрагмент Fab, 2 — фрагмент Fc, 3 — тяжёлые цепи, 4 — лёгкие цепи, 5 — антигенсвязывающие участки, 6 — шарнирные участкиN-концы всех цепей участвуют в распознавании антигена, то есть образуют два одинаковых сайта связывания антигена. Ключевую роль в процессе распознавания антигена играет соответствие структур антигена (точнее, части молекулы антигена — эпитопа) и антигенраспознающего участка антитела, или паратопа по принципу «ключ-замок». Специфичность иммуноглобулинов определяется аминокислотной последовательностью антигенраспознающих доменов, которые называют вариабельными, или V-доменами (их также называют FV-участками). Антигенсвязывающий участок формируется V-доменами тяжёлых и лёгких цепей (VH— и VL-домены соответственно). Его формируют вариабельные петли β-листов, три из которых относятся к VL-доменам, а оставшиеся три — к VH-доменам. Эти петли иногда называют участками, определяющими комплементарность[en] (англ. complementarity-determining regions, CDRs)[6]. CDRs также известны как гипервариабельные участки. В молекуле иммуноглобулина обычно имеется 3 гипервариабельных участка, положение которых в цепи может быть различным. Кроме того, в состав каждого V-домена входит 4 участка относительно постоянного состава (каркасные участки)[7]. Сверхвысокая вариабельность CDRs обеспечивает огромное разнообразие иммуноглобулинов[8].
Остальные домены молекулы иммуноглобулина имеют фиксированную структуру, поэтому их называют константными, или C-доменами. L-цепь содержит один C-домен (обозначается CL), а H-цепь — 3 или 4 домена, которые обозначаются CH1, CH2, CH3, CH4. C-домены не участвуют в распознавании антигенов и необходимы для взаимодействия с рецепторами иммунных клеток, активации системы комплемента и других эффекторных функций[3].
Доля гипервариабельных положений в V-доменах по сравнению с относительно инвариантными невелико и составляет 15—20 % от всех аминокислотных остатков. Кроме того, в эволюции позвоночных животных V-домены оказались более консервативными, чем константные домены, причём их консервативность связана с константными участками. Так, гомология VL-доменов между тигровой и галапагосской акулами составляет около 75 %, а между человеком и собакой — около 50 %[9].
Антитело называют моноспецифичным[en], если оно может распознавать только один антиген или эпитоп, и биспецифичным, если оно связывается с двумя разными антигенами или двумя разными эпитопами в составе одного антигена[10]. Некоторые антитела называют поливалентными, или неспецифичными, если они распознают несколько антигенов[11].
Под действием протеаз молекулы иммуноглобулинов расщепляются на фрагменты, которые имеют специальные названия. Так, папаин расщепляет молекулу иммуноглобулина на три фрагмента: два фрагмента Fab (от англ. Fragment antigen binding) и один фрагмент Fc (от англ. Fragment cristallizable). В состав фрагментов Fab входят V-домены, а также CL— и CH1-домены, а Fc содержит остальные C-домены и соединяющие их дисульфидные связи. Пепсин разрезает молекулу иммуноглобулина немного иначе и даёт двухвалентный антигенсвязывающий F(ab’)2-фрагмент и укороченный Fc’-фрагмент[12].
В области C-доменов находится большая часть участков, взаимодействующих с рецепторами клеток, такими как Fc-рецепторы. Так, в домене Сγ2 расположены участки связывания с компонентом комплемента С4b, а также с рецепторами FcγRI и FcγRII. В домене Сγ3 локализован участок связывания с FcγRIII. Продолжительность пребывания антитела в кровотоке зависит от особенностей строения домена CH2[8]. Между доменами СН1 и СН2 располагается участок, различный по протяжённости в Н-цепях разных изотипов и не входящий в состав доменов. В связи высоким содержанием пролина этот участок обладает высокой гибкостью, поэтому его также называют шарнирным участком. Именно в нём располагаются сайты расщепления иммуноглобулинов протеазами[13].
Молекулы антител подвергаются гликозилированию, то есть являются гликопротеинами. L-цепи лишены стабильных участков гликозилирования, а в Н-цепях они представлены во всех доменах, кроме вариабельного (больше всего их находится в СН2-домене). Сайтов N-гликозилирования в составе антител больше, чем сайтов O-гликозилирования. Углеводная составляющая антител не влияет на их специфичность, однако гликозилирование необходимо для стабилизации функционально важных характеристик молекулы, обеспечивает взаимодействие с лектинами, определяет особенности катаболизма и биологические свойства антител. Углеводные фрагменты в составе антител чаще всего имеют основу из остатков маннозы и хитобиозы[14].
Классы
Тяжёлые и лёгкие цепи существуют в нескольких вариантах, отличающихся структурой и функциями, в связи с чем антитела делят на классы, или изотипы. Выделяют два типа L цепей (κ и λ) и пять изотипов H-цепей (μ, γ, α, δ и ε). В состав одной молекулы иммуноглобулина могут входить только H-цепи одного вида. У млекопитающих существует пять основных типов антител: IgM, IgG, IgA, IgD и IgE (латинские буквы в названиях классов антител соответствуют греческим в обозначении изотипов Н-цепей). Иммуноглобулины классов IgG и IgA разделяют на подклассы (субтипы), также в зависимости от особенностей Н-цепей. Иммуноглобулины всех классов могут принадлежать к К- и L-типам в зависимости от присутствия в их составе L-цепей κ- или λ-типов соответственно[15]. Разные изотипы H-цепей имеют отличающееся количество C-доменов: γ-, α- и δ-цепи имеют по 3 C-домена, а в состав μ- и ε-цепей входит по 4 C-домена[8]. Классы антител также различаются степенью гликозилирования, в частности, наименее гликозилированы антитела класса IgG[14].
Основные свойства классов антител перечислены в таблице ниже[15].
| Свойство | IgM | IgG | IgA | IgD | IgE |
|---|---|---|---|---|---|
| Молекулярная масса, кДа | 950 | 150; субтип IgG3 — 165 | 150; димер — 300 | 185 | 190 |
| Количество мономеров | 5 | 1 | 1 или 2 | 1 | 1 |
| Валентность | 5 | 2 | 2 или 4 | 2 | 2 |
| Изотип H-цепи | μ | γ | α | δ | ε |
| Количество C-доменов в H-цепи | 4 | 3 | 3 | 3 | 4 |
| Количество дисульфидных связей между H-цепями | 4 | 3—12 | 4 или 5 | 1 | 3 |
| Содержание в сыворотке, мг/мл | 1,5 | 13—14 | 3,5 | 0,03 | 0,00002—0,0005 |
| Время полужизни, сут | 5—10 | 23 (IgG3 — 7) | 6 | 3 | 2 |
| Клетки, связывающие антитело через Fc-рецепторы | — | Макрофаги, моноциты, нейтрофилы | Макрофаги, моноциты, нейтрофилы (слабо) | — | Тучные клетки, базофилы |
| Функции | Мембранный рецептор, первичный иммунный ответ | Вторичный иммунный ответ, защита от бактерий и вирусов | Преобладают в секретах слизистых оболочек | Мембранный рецептор | Реагины, защита от паразитов |
Помимо перечисленных выше классов антител млекопитающих, у некоторых позвоночных животных имеются другие классы антител. Например, у костных рыб имеется особый класс антител IgT/Z, а у амфибий, рептилий и птиц имеются иммуноглобулины Y (IgY), которые состоят из двух тяжёлых и двух лёгких цепей и в больших количествах накапливаются в яичном желтке[16]. У хрящевых рыб и млекопитающих семейства верблюдовых имеются антитела из тяжёлых цепей, лишённые лёгких цепей. Считается, что антитела из тяжёлых цепей хрящевых рыб и верблюдовых — результат конвергентной эволюции, и они появились в связи с функциональными особенностями. Около 50 % антител верблюдов и близких видов составляют типичные для млекопитающих антитела из четырёх цепей. Существуют ли животные, обладающие только антителами из тяжёлых цепей, неизвестно[17].
Функции
К основным функциям антител в иммунной системе можно отнести:
- нейтрализацию[en], в ходе которой нейтрализующие антитела блокируют часть поверхности бактериальной клетки или вириона и делают их неактивными;
- агглютинацию, при которой антитела «склеивают» чужеродные клетки в комки, которые уничтожаются путём фагоцитоза;
- преципитацию, в ходе которой антитела собирают растворимые в плазме крови антигены в скопления, выпадающие в осадок, подвергающийся фагоцитозу;
- активацию комплемента, при которой антитела присоединяются к поверхности патогенной клетки, благодаря чему её могут атаковать компоненты системы комплемента, вызвать её лизис и запустить воспаление[18].
Антитела, которые связываются с поверхностью чужеродной клетки, активируют первый компонент каскада комплемента с помощью своих Fc-участков; такой способ активации комплемента получил название классического пути активации комплемента[19]. В результате клетка, покрытая антителами, может погибнуть двумя способами. Во-первых, связывание антител и компонентов комплемента с поверхностью клетки помечает её как мишень для уничтожения фагоцитами, которые привлекаются к клетке некоторыми компонентами каскада комплемента. Во-вторых, компоненты комплемента формируют мембраноатакующий комплекс на поверхности клетки, который вызывает её гибель в результате лизиса[20].
Механизм зависимой от антител клеточной цитотоксичностиЧтобы противодействовать размножению внеклеточных патогенов, антитела «склеивают» патогенные клетки вместе, вызывая их агглютинацию[21]. Поскольку минимальная валентность (то есть число одновременно связанных антигенов) антитела равна двум, оно может связать две молекулы антигена, расположенные на разных клетках, и тем самым соединить их. Покрывая поверхность патогена, антитела привлекают к нему эффекторные иммунные клетки с помощью Fc-участков. Клетки, которые распознают Fc-участки антител, имеют специальные Fc-рецепторы (FcR), которые могут связываться с Fc-участками IgA, IgG и IgE. Связывание Fc-рецептора клетки с антителом активирует её, что у фагоцитов проявляется в запуске фагоцитоза, у тучных клеток и нейтрофилов — дегрануляции[en], натуральных киллеров — высвобождении цитокинов и цитотоксических молекул, что в конце концов приводит к уничтожению микроорганизма. Активация натуральных киллеров антителами запускает механизм, известный как зависимая от антител клеточная цитотоксичность[en] (англ. antibody-dependent cell-mediated cytotoxicity, ADCC). Этот механизм может объяснить эффективность моноклональных антител в лечении рака. Поскольку Fc-рецепторы специфичны только к антителам определённого изотипа, иммунная система обладает достаточной гибкостью, чтобы запускать определённый вид иммунного ответа на данного патогена[22].
У человека и высших приматов в плазме крови постоянно присутствуют так называемые натуральные антитела[en], которые образуются без предшествующей инфекции, вакцинации или иного воздействия. Благодаря этим антителам система комплемента может запускать лизис клеток микроорганизмов и вирионов оболочечных вирусов без предшествующей активации адаптивного иммунитета. Многие натуральные антитела специфичны к дисахариду галактозе-α(1,3)-галактозе (α-Gal), который является концевым сахаром гликозилированных белков поверхности клетки. Выработка этих антител запускается в ответ на синтез α-Gal симбиотическими кишечными бактериями[23]. Отторжение ксенотрансплантата отчасти можно объяснить действием натуральных антител реципиента, атакующих α-Gal в составе белков трансплантата[24].
Активированные B-клетки претерпевают дифференцировку в плазматические клетки, способные секретировать антитела, или B-клетки памяти, которые сохраняются в организме в течение долгого времени и хранят память об антигенах, с которыми организм ранее сталкивался[18]. В пренетальном и неонатальном периодах антитела поступают в организм младенца от матери. Начало выработки собственных антител различается в разных классах антител и обычно происходит в течение первых лет жизни[19].
Помимо перечисленных выше функций в иммунной системе, антитела могут выполнять и другие, неканонические роли. У некоторых антител композиция аминокислотных остатков в сайте связывания антигена очень близка к таковой в активном центре некоторых ферментов, поэтому антитела могут катализировать некоторые химические реакции. Антитела, обладающие каталитической активностью, называют абзимами. Показано, что синтез антител с различной каталитической активностью начинается при иммунизации промежуточными соединениями соответствующих реакций. Однако по каталитической активности абзимы сильно уступают «истинным» ферментам. У человека как в норме, так и при патологии нередко детектируются антитела с протеолитической активностью, которые расщепляют молекулы, специфичные для патогенов. Протеолитические антитела относятся к классам IgG, IgA и IgM. Некоторые антитела классов IgM и IgG могут убивать клетки микрорганизмов в одиночку без участия других эффекторных механизмов, однако механизм их действия известен лишь в нескольких случаях. В частности, показано, что инактивирующие моноклональные антитела IgM и IgG вызывают изменения экспрессии генов и метаболизма у патогенного гриба Cryptococcus neoformans при связывании с поверхностью его клеток. Связывание антител с поверхностью болезнетворной бактерии Borrelia burgdorferi[en] вызывает формирование пор и гибель клетки в результате осмотического шока[en]. Иногда разные антитела инактивируют патогена за счёт синергического действия без участия дополнительных эффекторных путей. Особые неканонические функции описаны у антител класса IgA. Так, они могут опосредовать трансэпителиальный транспорт бактерий в кишечнике у мышей и регулировать проникновение бактериальных метаболитов в клетки хозяина. Кроме того, антитела могут работать как шапероны и переносчики разнообразных соединений и в здоровом организме[25].
Разнообразие
Практически все микроорганизмы могут вызывать иммунный ответ. Для успешного распознавания и уничтожения патогенов необходимо большое разнообразие антител, распознающих разные антигены[26]. По некоторым оценкам, в организме человека образуется 10 млрд различных антител, каждое из которых распознаёт уникальный эпитоп[27]. Хотя в каждой особи образуется огромное количество антител, количество генов, которые их кодируют, ограничено размером генома. Существует несколько механизмов, которые дают возможность позвоночным животным получать огромное число различных антител с относительно небольшого количества генов[28].
Вариабельность доменов
Участки, кодирующие компоненты антител, у человека располагаются на нескольких хромосомах. На хромосоме 14 собраны гены, кодирующие варианты тяжёлой цепи, лёгкие цепи κ и λ закодированы на хромосомах 22 и 2. Вариабельные домены, образованные участками как лёгкой, так и тяжёлой цепей, отличаются между антителами, образованными разными плазматическими клетками. Различия между вариабельными доменами затрагивают три петли, известные как гипервариабельные участки (HV-1, HV-2 and HV-3) или участки, определяющие комплементарность (CDR1, CDR2 и CDR3). Локус тяжёлых цепей кодирует 65 вариабельных доменов с разными CDRs. Комбинация каждого из этих вариантов в пределах линейно расположенных генов, кодирующих другие домены тяжёлой цепи, обеспечивает огромное разнообразие антител. Эта комбинация происходит в результате V(D)J-рекомбинации, механизм которой описан ниже[29].
V(D)J-рекомбинация
Упрощённая схема V(D)J-рекомбинацииВ ходе процесса V(D)J-рекомбинации формируется уникальный участок ДНК, кодирующий вариабельный домен. Вариабельный участок тяжёлой или лёгкой цепи кодируется локусом, разбитым на несколько фрагментов — субгенов, которые обозначаются V (от англ. variable), D (от англ. diversity) и J (от англ. joining)[28]. Субгены V, D и J кодируют вариабельный участок тяжёлой цепи, в то время как вариабельный участок лёгкой цепи кодируют субгены V и J. Каждый субген представлен несколькими вариантами, тандемно расположенными друг за другом на хромосоме. В костном мозге при созревании B-клетки в её локусах, кодирующих вариабельные домены, происходят перестройки, в результате которых в составе локуса остаётся по одному варианту субгенов V, D и J, а остальные варианты навсегда удаляются из генома. Поскольку каждый субген присутствует в нескольких вариантах, их комбинации будут давать антитела с разной специфичностью к антигенам. Важную роль в V(D)J-рекомбинации играют белки RAG[en], которые вносят разрывы в определённые участки, и в их отсутствие V(D)J-рекомбинация невозможна[30]. После того, как в ходе созревания в геноме B-клетки для тяжёлой и лёгкой цепей появился один функциональный ген, кодирующий вариабельный домен, остальные локусы, кодирующие вариабельные домены, перестают экспрессироваться (аллельное исключение), так что каждая B-клетка может производить антитела только с одним вариабельным доменом[22][31].
Соматическая гипермутация
После активации антигеном B-клетки начинают интенсивно пролиферировать. Параллельно частым делениям в локусах, кодирующих гипервариабельные домены тяжёлой и лёгкой цепей, наблюдается повышенная частота точечных мутаций. Этот процесс называется соматической гипермутацией. Соматическая гипермутация происходит с частотой примерно в один мутировавший нуклеотид вариабельного домена на клеточное деление[32]. В результате этого процесса дочерние клетки, появляющиеся в результате деления, будут продуцировать антитела с немного отличающимися вариабельными доменами. Таким образом, соматическая гипермутация служит ещё одним механизмом повышения разнообразия антител и оказывает влияние на сродство антител к антигену[33]. Некоторые мутации понижают сродство антитела к некоторому антигену, а другие, напротив, повышают[34]. Те B-клетки, которые экспрессируют антитела с высоким сродством к антигену, в ходе взаимодействия с другими клетками получают сильные сигналы, способствующие выживанию, и не подвергаются апоптозу. По этой причине B-клетки, кодирующие антитела с высоким сродством к антигену, будут иметь конкурентное преимущество перед B-клетками, кодирующими антитела с меньшим сродством, и сродство к антигену с каждым делением B-клеток будет повышаться. Постепенное повышение сродства к антигену и отбор B-клеток с лучшим сродством происходит при участии T-хелперов уже после V(D)J-рекомбинации[35].
Переключение классов
Механизм переключения классов антителПереключение классов антител происходит после активации B-клетки и позволяет ей производить антитела разных классов (IgA, IgE или IgG)[30]. Различия между антителами разных классов связаны с C-доменами тяжёлой цепи. Сначала наивные B-клетки[en] производят только поверхностные иммуноглобулины IgM или IgD с одинаковой антигенной специфичностью. Поскольку каждый изотип связан со специфической функцией, после активации плазматическая клетка должна производить антитела IgG, IgA или IgE, чтобы эффективно противодействовать патогену. Благодаря переключению классов разные дочерние клетки, происходящие от одной и той же B-клетки, могут производить антитела разных изотипов. В ходе переключения классов изменения происходят лишь в C-доменах тяжёлой цепи. Поэтому потомки одной B-клетки могут производить антитела разных классов, но с одинаковой антигенной специфичностью. Переключение классов происходит под действием некоторых цитокинов[36].
В ходе переключения классов происходят перестройки в локусе, кодирующем тяжёлые цепи. Для прохождения процесса необходимы консервативные нуклеотидные мотивы, известные как S-участки (от англ. switch), которые находятся выше каждого локуса, кодирующего тяжёлые цепи (исключение составляют лишь δ-типы). Далее специальные ферменты вносят два разрыва в ДНК по двум S-участкам[37][38]. В результате фрагмент между двумя разрывами удаляется, двуцепочечный разрыв в константном участке репарируется с помощью негомологичного соединения концов[39].
Образование и секреция
Антитела выделяет особая разновидность B-клеток — плазматические клетки. Как и большинство секретируемых белков, тяжёлые и лёгкие цепи иммуноглобулинов синтезируются рибосомами, находящимися на шероховатом эндоплазматическом ретикулуме (ЭПР). В ходе синтеза образующаяся полипептидная цепь поступает в люмен ЭПР, где подвергается гликозилированию. Правильная укладка тяжёлых цепей и связывание с лёгкими цепями с образованием антитела регулируются шаперонами ЭПР, такими как кальнексин[en] и BiP[en]. Они связываются с новосинтезированными иммуноглобулиновыми полипептидами и защищают их от разрушения, пока они принимают правильную структуру. Также в люмене ЭПР происходит сборка антитела за счёт образования дисульфидных связей между тяжёлыми и лёгкими цепями. После сборки молекулы антител освобождаются от шаперонов и поступают в аппарат Гольджи, где их углеводные остатки подвергаются дополнительному процессингу. Везикулы, содержащие зрелые антитела, отпочковываются от аппарата Гольджи и сливаются с клеточной мембраной, после чего мембранные формы антител остаются заякоренными в мембране клетки, а свободные антитела выходят в межклеточное пространство[40].
По мере созревания B-клеток в костном мозге экспрессия иммуноглобулинов претерпевает ряд изменений. Самые ранние клетки B-клеточного ряда, пре-B-клетки, синтезируют только мембранные формы тяжёлых цепей класса μ. Эти цепи формируют комплекс с белками, которые называют суррогатными лёгкими цепями, и формируют пре-B-клеточный рецептор, небольшая доля которого экспонируется на поверхности B-клетки. Незрелые и зрелые B-клетки синтезируют лёгкие цепи классов κ и λ, которые, соединяясь с тяжёлыми цепями класса μ, образуют антитела IgM. Зрелые B-клетки экспрессируют мембранные формы IgM и IgD, которые служат рецепторами, распознающими антигены и запускающими активацию B-клетки. Пре-B-клеточные рецепторы и B-клеточные рецепторы нековалентно связаны с интегринами, сигнальные функции которых необходимы для экспрессии поверхностных форм IgM и IgD[41].
Когда B-клетки активируются антигенами и другими стимулами, они превращаются в плазматические клетки, секретирующие антитела. При переходе к плазматическим клеткам доля секретируемых иммуноглобулинов по сравнению с мембранными резко возрастает. Кроме того, в это же время переходит переключение классов антител, и клетка перестаёт синтезировать IgM и IgD, но начинает выделять IgA, IgE или IgG[42].
Эволюция
Адаптивный иммунитет и антитела в ходе эволюции появились у позвоночных животных примерно 500 миллионов лет назад[43]. Наиболее древними классами антител, вероятно, являются IgM и IgD, причём антитела IgD, которые есть практически у всех позвоночных, даже у хрящевых рыб, считают древнейшим классом антител (антитела IgD хрящевых рыб иногда обозначают IgW; W соответствует греческой букве ω). Однако есть и позвоночные, утратившие IgD, например, птицы и несколько видов млекопитающих. В то же время типичные для млекопитающих классы IgA, IgE и IgG есть не у всех групп позвоночных. В частности, у костных рыб отсутствуют IgA, IgE и IgD, однако имеется дополнительный класс антител IgT (или IgZ), который отсутствует у других позвоночных. Антитела IgT (T соответствует греческой букве τ), вероятно, защищают слизистые оболочки рыб[44]. Необычные классы антител есть и у других позвоночных, например, антитела из тяжёлых цепей у хрящевых рыб и верблюдовых, а также IgY амфибий, рептилий и птиц[16][17].
Предсказание структуры и компьютерный дизайн антител
Для использования антител в медицине и биотехнологиях необходимо знать их структуру с высоким разрешением. Информация о структуре антител широко используется в белковой инженерии антител, модификации их способности к связыванию антигенов и идентификации эпитопов отдельных антител. Одним из методов, широко использующихся для определения структур антител, является рентгеноструктурный анализ, однако кристаллизация антител — это очень долгий и трудоёмкий процесс, поэтому широко распространено предсказание структур антител с помощью вычислительных методов. Однако предсказание не даёт точных сведений о структуре. Компьютерное моделирование структур вариабельных доменов можно производить с помощью программ Web Antibody Modeling (WAM)[45] и Prediction of Immunoglobulin Structure (PIGS)[46]. Предсказание структуры вариабельных доменов также можно производить с помощью сервиса Rosetta, в котором с помощью специальных методов в ходе предсказания минимизируется протяжённость петель, соответствующих CDR, оптимизируется положение лёгких и тяжёлых цепей относительно друг друга и строятся модели, предсказывающие докинг антител с их уникальными антигенами[47]. Существует несколько программ, осуществляющих компьютерный дизайн антител на основании результатов биоинформатического изучения CDR[48][49][50].
Один из наиболее эффективных методов идентификации пептидов и белков, включая антитела, — жидкостная хроматография, связанная с тандемной масс-спектрометрией[51]. Высокопроизводительные методы секвенирования аминокислотных последовательностей[en] антител требуют специальных вычислительных подходов для анализа данных, в том числе для секвенирования de novo[en] из данных масс-спектрометрии[52], а также подходов к поиску по базам данных, содержащих белковые последовательности[53][54]. Особое значение для секвенирования аминокислот имеет метод дробовика, покрытие[en] которого увеличено посредством фрагментации методами CID/HCD/ETD[55]. Существуют методы определения аминокислотных последовательностей, для которых необходимы последовательности похожих белков[56] или известная последовательность генома[57]. Современные методы секвенирования могут производить сборку белковых последовательностей с высокой точностью, сочетая секвенирование пептидов de novo, интенсивность и позиционные доверительные оценки, полученные с помощью поиска гомологов по базам данных[58].
Применение в медицине
Диагностика
Выявление и определение концентрации специфических антител в крови является довольно распространённым методом медицинской диагностики[59]. Например, наличие в организме вируса Эпштейна — Барр или бактерии Borrelia burgdorferi, вызывающей болезнь Лайма, определяется по титру антител против них. Если соответствующие антитела выявить не удалось, то пациент или никогда не сталкивался с этими патогенами, или сталкивался очень давно, и плазматические клетки, продуцирующие антитела против них, уже исчезли[60].
В клинической иммунологии профиль антител пациента характеризуют, определяя концентрации антител разных классов с помощью нефелометрии[61]. Повышение содержания антител некоторых классов может быть полезным для выявления причин повреждений печени, когда установить точный диагноз не удаётся. Так, повышенное содержание IgA свидетельствует об алкогольном циррозе печени, повышение уровня IgM говорит в пользу вирусных гепатитов и первичного цирроза печени, а уровень IgG повышается при вирусных гепатитах, аутоиммунных заболеваниях и циррозе[62].
Развитие аутоиммунных заболеваний связано с образованием антител, распознающих эпитопы самого организма (аутоантител). Их можно выявить с помощью анализа крови. Антитела, действующие против поверхностных антигенов эритроцитов, вызывают гемолитическую анемию и могут быть выявлены с помощью реакции Кумбса. Реакцию Кумбса также проводят при скрининге антител при переливании крови и у беременных женщин[63].
Принцип взаимодействия антигенов и антител используют методы иммунодиагностики, такие как иммуноферментный анализ, иммунофлуоресцентный анализ, вестерн-блот, иммунодиффузия[en], иммуноэлектрофорез и магнитный иммуноанализ. Мечение антител радиоактивным изотопом фтора 18F позволяет их использовать для визуализации раковых опухолей с помощью позитронно-эмиссионной томографии[64].
Лечение заболеваний
Моноклональные антитела применяют для лечения ревматоидного артрита[65], рассеянного склероза[66], псориаза[67] и многих видов рака, среди которых неходжкинские лимфомы[68], рак толстой кишки, головы и шеи, молочной железы[69].
Многие иммунодефициты, такие как болезнь Брутона и гипогаммаглобулинемия[en], связаны с полным или частичным отсутствием антител[70]. Пациентам, страдающим от этих заболеваний, с помощью искусственного введения антител обеспечивают пассивный иммунитет[en][71].
Пренатальная терапия
У человека на эритроцитах присутствует антиген, известный как резус-фактор (Rh). В ходе родов или осложнений при беременности кровь плода может попасть в кровоток матери, и если у ребёнка резус-фактор положительный, а у матери отрицательный, то в организме матери вырабатываются антитела против резус-фактора. При последующих беременностях резус-положительным плодом они могут атаковать его, приводя к гемолитической желтухе новорождённых[72]. Чтобы предотвратить возникновение резус-конфликта, резус-отрицательным женщинам, беременным резус-положительным плодом, искусственно вводят антитела к резус-фактору (Rho(D)-иммуноглобулин[en]). Введение Rho(D)-иммуноглобулина необходимо произвести до того, как резус-фактор плода активирует B-клетки матери и запустит адаптивный иммунный ответ и образование B-клеток памяти[73].
Применение в научных исследованиях
Схема эксперимента по получению моноклональных антител с заданной специфичностью[74][75]Антитела, специфические к заданному антигену, можно получить, введя антиген в млекопитающее (мышь, крысу, кролика, козу, овцу, лошадь) и затем выделив из него большое количество антител. Кровь, выделенная из иммунизированного животного, содержит поликлональные антитела, то есть несколько разных антител, специфичных к одному и тому же антигену. Поликлональные антитела можно также получить, впрыснув антиген в яичный желток развивающегося куриного яйца[76]. Чтобы получить антитела, распознающие строго определённый эпитоп в составе антигена, плазматические клетки, выделяющие антитела к антигену, выделяют из животного и иммортализируют[en], сливая их с раковыми клетками. Клетки, полученные при слиянии плазматических клеток с раковыми, называют гибридомами, и они постоянно выделяют нужные антитела, размножаясь в культуре клеток. Из одиночных гибридом получают идентичные антитела, называемые моноклональными[77]. Поликлональные и моноклональные антитела часто очищают с помощью белка A/G[en] или аффинной хроматографии[78].
Очищенные антитела нашли множество применений в исследовательском процессе. Антитела ко многим антигенам можно купить у коммерческих компаний. В исследованиях антитела чаще всего используют для определения локализации клеточных и внеклеточных белков. Их также применяют в проточной цитометрии для разделения клеток по тому, какие белки они экспрессируют[79]. Антитела используют для отделения белков и связанных с ними молекул от остального содержимого клеточного лизата посредством иммунопреципитации[80], для идентификации белков, разделённых гель-электрофорезом, с помощью вестерн-блота[81]. Антитела составляют основу иммунофлуоресценции и иммуногистохимии, с помощью которых изучается экспрессия и локализация интересующих белков в клетках и тканях[79][82]. Антитела можно использовать для детекции и оценки концентрации белков, в частности, с помощью иммуноферментного анализа и метода ELISpot[83][84].
Несмотря на многочисленные применения, работа с антителами довольно трудоёмка, поскольку на результат эксперимента влияют множество факторов, которые необходимо контролировать, в частности, влияющие на степень сродства антитела к антигену pH, растворитель, состояние ткани и другие. Предпринималось множество попыток улучшить способ валидации антител исследователями[85][86]. Исследователи, работающие с антителами, должны тщательно записывать условия экспериментов, чтобы они могли быть воспроизведены другими учёными[87].
Миметики антител
Пример миметика антитела — искусственный пептид группы DARPinМиметиками антител[en] называют органические соединения, которые, как и антитела, могут специфически связывать антигены. Как правило, миметики антител представляют собой искусственные пептиды массой от 3 до 20 кДа. Иногда в роли миметиков антител выступают нуклеиновые кислоты и малые молекулы, однако ими не могут быть искусственные антитела, фрагменты антител или их ковалентно связанные комбинации. В отличие от антител, их миметики обычно обладают лучшей растворимостью, лучше проникают в ткань и обладают большей стабильностью по отношению к температуре и действию ферментов, кроме того, они дешевле настоящих антител. Некоторые миметики антител, такие как Affimer[en] и DARPin[en], зарегистрированы для использования в исследовательских, терапевтических и диагностических целях[88].
История изучения
Китасато СибасабуроТермин «антитело» (нем. Antikörper) впервые встречается в трудах Пауля Эрлиха. В частности, термин «Antikörper» можно найти в заключении его статьи «Экспериментальное изучение иммунитета», которая вышла в октябре 1891 года. В этой работе утверждается, что «если две субстанции вызывают выделение двух разных Antikörper, то они тоже различны». Тем не менее поначалу термин «Antikörper» не закрепился, и для обозначения антител было предложено несколько других терминов: Immunkörper, Amboceptor, Zwischenkörper, substance sensibilisatrice, copula, Desmon, philocytase, fixateur и Immunisin[89].
Изучение антител началось в 1890 году, когда Китасато Сибасабуро и Эмиль Адольф фон Беринг описали действие антител против дифтерии и столбнячного токсина[90]. Сибасабуро развил теорию гуморального иммунитета и предположил, что в сыворотке крови имеется некий медиатор, способный взаимодействовать с чужеродными антигенами[91]. На основе идей Сибасабуро Пауль Эрлих в 1897 году выдвинул теорию боковых цепей[en], объясняющую принципы взаимодействия антител и антигенов. Он предположил, что рецепторы («боковые цепи») на поверхности клеток могут специфично взаимодействовать с токсинами по принципу «ключ-замок», и взаимодействие рецептора с токсином запускает выработку антител[92]. Другие исследователи предположили, что антитела свободно перемещаются по кровотоку. В 1904 году Алмрот Райт предположил, что антитела покрывают поверхность бактериальных клеток, направляя их на фагоцитоз и разрушение; этот процесс сейчас известен как опсонизация[93].
В 1920-х годах Майкл Гейдельберг[en] и Освальд Эвери смогли пронаблюдать, что антигены могут уходить в осадок под действием антител, и показали, что антитела имеют белковую природу[94]. Биохимические особенности взаимодействия антитела и антигена были детально изучены в конце 1930-х годов Джоном Марраком[en][95]. В 1937 году иммуноглобулины как разновидность белков выявлены с помощью гель-электрофореза во фракциях γ- и β-глобулинов[en] сыворотки крови[90]. В 1940-х годах Лайнус Полинг подтвердил гипотезу Эрлиха относительно взаимодействия антигенов и антител по принципу «ключ-замок» и показал, что взаимодействие антитела и антигена в большей степени зависит от пространственной конфигурации антигена, чем от его химического состава[96]. В 1948 году Астрид Фагреус показала, что антитела выделяют плазматические клетки — разновидность B-лимфоцитов[97].
В дальнейшем исследования были сконцентрированы на изучении структуры антител. В начале 1960-х годов Джералд Эдельман и Джозеф Галли описали лёгкую цепь антител[98] и показали, что именно лёгкая цепь является белком Бенс-Джонса, который был описан Генри Бенс Джонсом[en] в 1845 году[99]. В дальнейшем Эдельман показал, что антитела состоят из двух тяжёлых и двух лёгких цепей, скреплённых дисульфидными связями. Примерно в то же время Родни Портер описал Fab- и Fc-участки в составе молекул IgG[100]. Вместе эти исследователи описали структуру и полную аминокислотную последовательность IgG, за что в 1972 году были удостоены Нобелевской премии по физиологии и медицине[100]. Фрагмент Fv был очищен и описан Дэвидом Гиволом[101]. Ранние исследования антител были сконцентрированы на IgG и IgM, и новые изотипы иммуноглобулинов были идентифицированы в 1960-х годах. Томас Томаши описал секретируемые антитела IgA[102], Дэвид Роув и Джон Фей открыли IgD[103], а Кимисиге Исизака[en] и Теруко Исизака[en] открыли IgE и установили, что именно эти антитела задействованы в развитии аллергических реакций[104]. В 1976 году Судзуми Тонегава начал серию экспериментов показал, что гены, кодирующие антитела, претерпевают перестройки, за счёт которых создаётся огромное разнообразие антител[105]. В 1987 году Тонегава получил Нобелевскую премию по физиологии и медицине за открытие механизмов разнообразия антител[106].
В 1970-х годах в результате изучения гомогенных опухолевых антигенов была разработана гибридомная технология, благодаря которой стало возможным получать моноклональные антитела с заданной специфичностью[3].
См. также
Примечания
- ↑ Ройт и др., 2000.
- ↑ Ройт и др., 2000, Иммуноглобулины — особое семейство белков.
- ↑ 1 2 3 Ярилин, 2010, с. 232.
- ↑ Barclay A. N. Membrane proteins with immunoglobulin-like domains—a master superfamily of interaction molecules. (англ.) // Seminars In Immunology. — 2003. — August (vol. 15, no. 4). — P. 215—223. — doi:10.1016/s1044-5323(03)00047-2. — PMID 14690046. [исправить]
- ↑ Ярилин, 2010, с. 235.
- ↑ Al-Lazikani B., Lesk A. M., Chothia C. Standard conformations for the canonical structures of immunoglobulins. (англ.) // Journal Of Molecular Biology. — 1997. — 7 November (vol. 273, no. 4). — P. 927—948. — doi:10.1006/jmbi.1997.1354. — PMID 9367782. [исправить]
- ↑ Ярилин, 2010, с. 238.
- ↑ 1 2 3 Ярилин, 2010, с. 239.
- ↑ Галактионов, 2004, с. 61.
- ↑ Spiess C., Zhai Q., Carter P. J. Alternative molecular formats and therapeutic applications for bispecific antibodies. (англ.) // Molecular Immunology. — 2015. — October (vol. 67, no. 2 Pt A). — P. 95—106. — doi:10.1016/j.molimm.2015.01.003. — PMID 25637431. [исправить]
- ↑ Farlex dictionary > polyvalent. Citing: The American Heritage Medical Dictionary. 2004 (неопр.).
- ↑ Ярилин, 2010, с. 232—233.
- ↑ Ярилин, 2010, с. 239—240.
- ↑ 1 2 Ярилин, 2010, с. 240.
- ↑ 1 2 Ярилин, 2010, с. 234—235.
- ↑ 1 2 Lanzarini N. M., Bentes G. A., Volotão E. M., Pinto M. A. Use of chicken immunoglobulin Y in general virology. (англ.) // Journal Of Immunoassay & Immunochemistry. — 2018. — Vol. 39, no. 3. — P. 235—248. — doi:10.1080/15321819.2018.1500375. — PMID 30044696. [исправить]
- ↑ 1 2 Nanobodies (неопр.). Nanobody.org.
- ↑ 1 2 Borghesi L., Milcarek C. From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion. (англ.) // Immunologic Research. — 2006. — Vol. 36, no. 1-3. — P. 27—32. — doi:10.1385/IR:36:1:27. — PMID 17337763. [исправить]
- ↑ 1 2 Ravetch J. V., Bolland S. IgG Fc receptors. (англ.) // Annual Review Of Immunology. — 2001. — Vol. 19. — P. 275—290. — doi:10.1146/annurev.immunol.19.1.275. — PMID 11244038. [исправить]
- ↑ Rus H., Cudrici C., Niculescu F. The role of the complement system in innate immunity. (англ.) // Immunologic Research. — 2005. — Vol. 33, no. 2. — P. 103—112. — doi:10.1385/IR:33:2:103. — PMID 16234578. [исправить]
- ↑ Pier G. B., Lyczak J. B., Wetzler L. M. Immunology, Infection, and Immunity. — ASM Press (англ.) (рус., 2004. — ISBN 978-1-55581-246-1.
- ↑ 1 2 Murphy, Weaver, 2017, p. 399—445.
- ↑ Racaniello, Vincent. Natural antibody protects against viral infection (неопр.). Virology Blog (6 октября 2009). Дата обращения: 22 января 2010. Архивировано 20 февраля 2010 года.
- ↑ Milland J., Sandrin M. S. ABO blood group and related antigens, natural antibodies and transplantation. (англ.) // Tissue Antigens. — 2006. — December (vol. 68, no. 6). — P. 459—466. — doi:10.1111/j.1399-0039.2006.00721.x. — PMID 17176435. [исправить]
- ↑ Dimitrov J. D., Lacroix-Desmazes S. Noncanonical Functions of Antibodies. (англ.) // Trends In Immunology. — 2020. — 6 April. — doi:10.1016/j.it.2020.03.006. — PMID 32273170. [исправить]
- ↑ Mian I. S., Bradwell A. R., Olson A. J. Structure, function and properties of antibody binding sites. (англ.) // Journal Of Molecular Biology. — 1991. — 5 January (vol. 217, no. 1). — P. 133—151. — doi:10.1016/0022-2836(91)90617-f. — PMID 1988675. [исправить]
- ↑ Fanning L. J., Connor A. M., Wu G. E. Development of the immunoglobulin repertoire. (англ.) // Clinical Immunology And Immunopathology. — 1996. — April (vol. 79, no. 1). — P. 1—14. — doi:10.1006/clin.1996.0044. — PMID 8612345. [исправить]
- ↑ 1 2 Nemazee D. Receptor editing in lymphocyte development and central tolerance. (англ.) // Nature Reviews. Immunology. — 2006. — October (vol. 6, no. 10). — P. 728—740. — doi:10.1038/nri1939. — PMID 16998507. [исправить]
- ↑ Peter Parham. The Immune System. — 2nd ed.. — New York: Garland Science, 2005. — P. 47—62.
- ↑ 1 2 Market E., Papavasiliou F. N. V(D)J recombination and the evolution of the adaptive immune system. (англ.) // PLoS Biology. — 2003. — October (vol. 1, no. 1). — P. 16—16. — doi:10.1371/journal.pbio.0000016. — PMID 14551913. [исправить]
- ↑ Bergman Y., Cedar H. A stepwise epigenetic process controls immunoglobulin allelic exclusion. (англ.) // Nature Reviews. Immunology. — 2004. — October (vol. 4, no. 10). — P. 753—761. — doi:10.1038/nri1458. — PMID 15459667. [исправить]
- ↑ Diaz M., Casali P. Somatic immunoglobulin hypermutation. (англ.) // Current Opinion In Immunology. — 2002. — April (vol. 14, no. 2). — P. 235—240. — doi:10.1016/s0952-7915(02)00327-8. — PMID 11869898. [исправить]
- ↑ Honjo T., Habu S. Origin of immune diversity: genetic variation and selection. (англ.) // Annual Review Of Biochemistry. — 1985. — Vol. 54. — P. 803—830. — doi:10.1146/annurev.bi.54.070185.004103. — PMID 3927822. [исправить]
- ↑ Or-Guil M., Wittenbrink N., Weiser A. A., Schuchhardt J. Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation. (англ.) // Immunological Reviews. — 2007. — April (vol. 216). — P. 130—141. — doi:10.1111/j.1600-065X.2007.00507.x. — PMID 17367339. [исправить]
- ↑ Neuberger M. S., Ehrenstein M. R., Rada C., Sale J., Batista F. D., Williams G., Milstein C. Memory in the B-cell compartment: antibody affinity maturation. (англ.) // Philosophical Transactions Of The Royal Society Of London. Series B, Biological Sciences. — 2000. — 29 March (vol. 355, no. 1395). — P. 357—360. — doi:10.1098/rstb.2000.0573. — PMID 10794054. [исправить]
- ↑ Stavnezer J., Amemiya C. T. Evolution of isotype switching. (англ.) // Seminars In Immunology. — 2004. — August (vol. 16, no. 4). — P. 257—275. — doi:10.1016/j.smim.2004.08.005. — PMID 15522624. [исправить]
- ↑ Durandy A. Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation. (англ.) // European Journal Of Immunology. — 2003. — August (vol. 33, no. 8). — P. 2069—2073. — doi:10.1002/eji.200324133. — PMID 12884279. [исправить]
- ↑ Casali P., Zan H. Class switching and Myc translocation: how does DNA break? (англ.) // Nature Immunology. — 2004. — November (vol. 5, no. 11). — P. 1101—1103. — doi:10.1038/ni1104-1101. — PMID 15496946. [исправить]
- ↑ Lieber M. R., Yu K., Raghavan S. C. Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations. (англ.) // DNA Repair. — 2006. — 8 September (vol. 5, no. 9-10). — P. 1234—1245. — doi:10.1016/j.dnarep.2006.05.013. — PMID 16793349. [исправить]
- ↑ Abbas, Lichtman, Pillai, 2015, p. 97.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 97—98.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 98.
- ↑ Schroeder Jr. H. W. The evolution and development of the antibody repertoire. (англ.) // Frontiers In Immunology. — 2015. — Vol. 6. — P. 33—33. — doi:10.3389/fimmu.2015.00033. — PMID 25699050. [исправить]
- ↑ Fillatreau S., Six A., Magadan S., Castro R., Sunyer J. O., Boudinot P. The astonishing diversity of Ig classes and B cell repertoires in teleost fish. (англ.) // Frontiers In Immunology. — 2013. — Vol. 4. — P. 28—28. — doi:10.3389/fimmu.2013.00028. — PMID 23408183. [исправить]
- ↑ Web Antibody Modeling (WAM) (неопр.) (17 июля 2011).
- ↑ Marcatili P., Rosi A., Tramontano A. PIGS: automatic prediction of antibody structures. (англ.) // Bioinformatics. — 2008. — 1 September (vol. 24, no. 17). — P. 1953—1954. — doi:10.1093/bioinformatics/btn341. — PMID 18641403. [исправить]
- ↑ Weitzner B. D., Jeliazkov J. R., Lyskov S., Marze N., Kuroda D., Frick R., Adolf-Bryfogle J., Biswas N., Dunbrack Jr. R. L., Gray J. J. Modeling and docking of antibody structures with Rosetta. (англ.) // Nature Protocols. — 2017. — February (vol. 12, no. 2). — P. 401—416. — doi:10.1038/nprot.2016.180. — PMID 28125104. [исправить]
- ↑ Adolf-Bryfogle J., Kalyuzhniy O., Kubitz M., Weitzner B. D., Hu X., Adachi Y., Schief W. R., Dunbrack Jr. R. L. RosettaAntibodyDesign (RAbD): A general framework for computational antibody design. (англ.) // PLoS Computational Biology. — 2018. — April (vol. 14, no. 4). — P. e1006112—1006112. — doi:10.1371/journal.pcbi.1006112. — PMID 29702641. [исправить]
- ↑ Lapidoth G. D., Baran D., Pszolla G. M., Norn C., Alon A., Tyka M. D., Fleishman S. J. AbDesign: An algorithm for combinatorial backbone design guided by natural conformations and sequences. (англ.) // Proteins. — 2015. — August (vol. 83, no. 8). — P. 1385—1406. — doi:10.1002/prot.24779. — PMID 25670500. [исправить]
- ↑ Li T., Pantazes R. J., Maranas C. D. OptMAVEn—a new framework for the de novo design of antibody variable region models targeting specific antigen epitopes. (англ.) // PloS One. — 2014. — Vol. 9, no. 8. — P. e105954—105954. — doi:10.1371/journal.pone.0105954. — PMID 25153121. [исправить]
- ↑ Pham V., Henzel W. J., Arnott D., Hymowitz S., Sandoval W. N., Truong B. T., Lowman H., Lill J. R. De novo proteomic sequencing of a monoclonal antibody raised against OX40 ligand. (англ.) // Analytical Biochemistry. — 2006. — 1 May (vol. 352, no. 1). — P. 77—86. — doi:10.1016/j.ab.2006.02.001. — PMID 16545334. [исправить]
- ↑ Ma B., Zhang K., Hendrie C., Liang C., Li M., Doherty-Kirby A., Lajoie G. PEAKS: powerful software for peptide de novo sequencing by tandem mass spectrometry. (англ.) // Rapid Communications In Mass Spectrometry : RCM. — 2003. — Vol. 17, no. 20. — P. 2337—2342. — doi:10.1002/rcm.1196. — PMID 14558135. [исправить]
- ↑ Zhang J., Xin L., Shan B., Chen W., Xie M., Yuen D., Zhang W., Zhang Z., Lajoie G. A., Ma B. PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification. (англ.) // Molecular & Cellular Proteomics : MCP. — 2012. — April (vol. 11, no. 4). — P. 111—010587. — doi:10.1074/mcp.M111.010587. — PMID 22186715. [исправить]
- ↑ Perkins D. N., Pappin D. J., Creasy D. M., Cottrell J. S. Probability-based protein identification by searching sequence databases using mass spectrometry data. (англ.) // Electrophoresis. — 1999. — December (vol. 20, no. 18). — P. 3551—3567. — doi:10.1002/(SICI)1522-2683(19991201)20:18<3551::AID-ELPS3551>3.0.CO;2-2. — PMID 10612281. [исправить]
- ↑ Bandeira N., Tang H., Bafna V., Pevzner P. Shotgun protein sequencing by tandem mass spectra assembly. (англ.) // Analytical Chemistry. — 2004. — 15 December (vol. 76, no. 24). — P. 7221—7233. — doi:10.1021/ac0489162. — PMID 15595863. [исправить]
- ↑ Liu X., Han Y., Yuen D., Ma B. Automated protein (re)sequencing with MS/MS and a homologous database yields almost full coverage and accuracy. (англ.) // Bioinformatics. — 2009. — 1 September (vol. 25, no. 17). — P. 2174—2180. — doi:10.1093/bioinformatics/btp366. — PMID 19535534. [исправить]
- ↑ Castellana N. E., Pham V., Arnott D., Lill J. R., Bafna V. Template proteogenomics: sequencing whole proteins using an imperfect database. (англ.) // Molecular & Cellular Proteomics : MCP. — 2010. — June (vol. 9, no. 6). — P. 1260—1270. — doi:10.1074/mcp.M900504-MCP200. — PMID 20164058. [исправить]
- ↑ Tran N. H., Rahman M. Z., He L., Xin L., Shan B., Li M. Complete De Novo Assembly of Monoclonal Antibody Sequences. (англ.) // Scientific Reports. — 2016. — 26 August (vol. 6). — P. 31730—31730. — doi:10.1038/srep31730. — PMID 27562653. [исправить]
- ↑ Animated depictions of how antibodies are used in ELISA assays (неопр.) (недоступная ссылка). Cellular Technology Ltd.—Europe. Дата обращения: 17 апреля 2020. Архивировано 18 ноября 2010 года.
- ↑ Animated depictions of how antibodies are used in ELISPOT assays (неопр.) (недоступная ссылка). Cellular Technology Ltd.—Europe. Дата обращения: 17 апреля 2020. Архивировано 18 ноября 2010 года.
- ↑ Stern P. Current possibilities of turbidimetry and nephelometry // Klin Biochem Metab. — 2006. — Vol. 14, № 3. — P. 146—151.
- ↑ Rhoades R. A., Pflanzer R. G. Human Physiology. — 5th. — Thomson Learning (англ.) (рус., 2002. — С. 584. — ISBN 978-0-534-42174-8.
- ↑ Dean, Laura. Chapter 4: Hemolytic disease of the newborn // Blood Groups and Red Cell Antigens. — NCBI Bethesda (MD): National Library of Medicine (US), 2005.
- ↑ Rodriguez E. A., Wang Y., Crisp J. L., Vera D. R., Tsien R. Y., Ting R. New Dioxaborolane Chemistry Enables (18)F-Positron-Emitting, Fluorescent (18)F-Multimodality Biomolecule Generation from the Solid Phase. (англ.) // Bioconjugate Chemistry. — 2016. — 18 May (vol. 27, no. 5). — P. 1390—1399. — doi:10.1021/acs.bioconjchem.6b00164. — PMID 27064381. [исправить]
- ↑ Feldmann M., Maini R. N. Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned? (англ.) // Annual Review Of Immunology. — 2001. — Vol. 19. — P. 163—196. — doi:10.1146/annurev.immunol.19.1.163. — PMID 11244034. [исправить]
- ↑ Doggrell S. A. Is natalizumab a breakthrough in the treatment of multiple sclerosis? (англ.) // Expert Opinion On Pharmacotherapy. — 2003. — June (vol. 4, no. 6). — P. 999—1001. — doi:10.1517/14656566.4.6.999. — PMID 12783595. [исправить]
- ↑ Krueger G. G., Langley R. G., Leonardi C., Yeilding N., Guzzo C., Wang Y., Dooley L. T., Lebwohl M., CNTO 1275 Psoriasis Study Group. A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis. (англ.) // The New England Journal Of Medicine. — 2007. — 8 February (vol. 356, no. 6). — P. 580—592. — doi:10.1056/NEJMoa062382. — PMID 17287478. [исправить]
- ↑ Plosker G. L., Figgitt D. P. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukaemia. (англ.) // Drugs. — 2003. — Vol. 63, no. 8. — P. 803—843. — doi:10.2165/00003495-200363080-00005. — PMID 12662126. [исправить]
- ↑ Vogel C. L., Cobleigh M. A., Tripathy D., Gutheil J. C., Harris L. N., Fehrenbacher L., Slamon D. J., Murphy M., Novotny W. F., Burchmore M., Shak S., Stewart S. J. First-line Herceptin monotherapy in metastatic breast cancer. (англ.) // Oncology. — 2001. — Vol. 61 Suppl 2. — P. 37—42. — doi:10.1159/000055400. — PMID 11694786. [исправить]
- ↑ LeBien T. W. Fates of human B-cell precursors. (англ.) // Blood. — 2000. — 1 July (vol. 96, no. 1). — P. 9—23. — PMID 10891425. [исправить]
- ↑ Ghaffer A. Immunization (неопр.). Immunology — Chapter 14. University of South Carolina School of Medicine (26 марта 2006). Дата обращения: 6 июня 2007. Архивировано 18 октября 2010 года.
- ↑ Urbaniak S. J., Greiss M. A. RhD haemolytic disease of the fetus and the newborn. (англ.) // Blood Reviews. — 2000. — March (vol. 14, no. 1). — P. 44—61. — doi:10.1054/blre.1999.0123. — PMID 10805260. [исправить]
- ↑ Fung Kee Fung K., Eason E., Crane J., Armson A., De La Ronde S., Farine D., Keenan-Lindsay L., Leduc L., Reid G. J., Aerde J. V., Wilson R. D., Davies G., Désilets V. A., Summers A., Wyatt P., Young D. C., Maternal-Fetal Medicine Committee, Genetics Committee. Prevention of Rh alloimmunization. (англ.) // Journal Of Obstetrics And Gynaecology Canada : JOGC = Journal D’obstetrique Et Gynecologie Du Canada : JOGC. — 2003. — September (vol. 25, no. 9). — P. 765—773. — doi:10.1016/s1701-2163(16)31006-4. — PMID 12970812. [исправить]
- ↑ Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies (неопр.). home.ccr.cancer.gov. Дата обращения: 2 апреля 2018.
- ↑ Gelboin H. V., Krausz K. W., Gonzalez F. J., Yang T. J. Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery. (англ.) // Trends In Pharmacological Sciences. — 1999. — November (vol. 20, no. 11). — P. 432—438. — doi:10.1016/s0165-6147(99)01382-6. — PMID 10542439. [исправить]
- ↑ Tini M., Jewell U. R., Camenisch G., Chilov D., Gassmann M. Generation and application of chicken egg-yolk antibodies. (англ.) // Comparative Biochemistry And Physiology. Part A, Molecular & Integrative Physiology. — 2002. — March (vol. 131, no. 3). — P. 569—574. — doi:10.1016/s1095-6433(01)00508-6. — PMID 11867282. [исправить]
- ↑ Cole S. P., Campling B. G., Atlaw T., Kozbor D., Roder J. C. Human monoclonal antibodies. (англ.) // Molecular And Cellular Biochemistry. — 1984. — June (vol. 62, no. 2). — P. 109—120. — doi:10.1007/bf00223301. — PMID 6087121. [исправить]
- ↑ Kabir S. Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis. (англ.) // Immunological Investigations. — 2002. — August (vol. 31, no. 3-4). — P. 263—278. — doi:10.1081/imm-120016245. — PMID 12472184. [исправить]
- ↑ 1 2 Brehm-Stecher B. F., Johnson E. A. Single-cell microbiology: tools, technologies, and applications. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 2004. — September (vol. 68, no. 3). — P. 538—559. — doi:10.1128/MMBR.68.3.538-559.2004. — PMID 15353569. [исправить]
- ↑ Williams N. E. Immunoprecipitation procedures. (англ.) // Methods In Cell Biology. — 2000. — Vol. 62. — P. 449—453. — PMID 10503210. [исправить]
- ↑ Kurien B. T., Scofield R. H. Western blotting. (англ.) // Methods (San Diego, Calif.). — 2006. — April (vol. 38, no. 4). — P. 283—293. — doi:10.1016/j.ymeth.2005.11.007. — PMID 16483794. [исправить]
- ↑ Scanziani E. Immunohistochemical staining of fixed tissues. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 1998. — Vol. 104. — P. 133—140. — doi:10.1385/0-89603-525-5:133. — PMID 9711649. [исправить]
- ↑ Reen D. J. Enzyme-linked immunosorbent assay (ELISA). (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 1994. — Vol. 32. — P. 461—466. — doi:10.1385/0-89603-268-X:461. — PMID 7951745. [исправить]
- ↑ Kalyuzhny A. E. Chemistry and biology of the ELISPOT assay. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 2005. — Vol. 302. — P. 15—31. — doi:10.1385/1-59259-903-6:015. — PMID 15937343. [исправить]
- ↑ Saper C. B. An open letter to our readers on the use of antibodies. (англ.) // The Journal Of Comparative Neurology. — 2005. — 26 December (vol. 493, no. 4). — P. 477—478. — doi:10.1002/cne.20839. — PMID 16304632. [исправить]
- ↑ NOT-OD-16-011: Implementing Rigor and Transparency in NIH & AHRQ Research Grant Applications (неопр.). grants.nih.gov.
- ↑ Vasilevsky N. A., Brush M. H., Paddock H., Ponting L., Tripathy S. J., Larocca G. M., Haendel M. A. On the reproducibility of science: unique identification of research resources in the biomedical literature. (англ.) // PeerJ. — 2013. — Vol. 1. — P. e148—148. — doi:10.7717/peerj.148. — PMID 24032093. [исправить]
- ↑ Gebauer M., Skerra A. Engineered protein scaffolds as next-generation antibody therapeutics. (англ.) // Current Opinion In Chemical Biology. — 2009. — June (vol. 13, no. 3). — P. 245—255. — doi:10.1016/j.cbpa.2009.04.627. — PMID 19501012. [исправить]
- ↑ Lindenmann J. Origin of the terms ‘antibody’ and ‘antigen’. (англ.) // Scandinavian Journal Of Immunology. — 1984. — April (vol. 19, no. 4). — P. 281—285. — doi:10.1111/j.1365-3083.1984.tb00931.x. — PMID 6374880. [исправить]
- ↑ 1 2 Ярилин, 2010, с. 231.
- ↑ A G N. The Late Baron Shibasaburo Kitasato. (англ.) // Canadian Medical Association Journal. — 1931. — August (vol. 25, no. 2). — P. 206—206. — PMID 20318414. [исправить]
- ↑ Winau F., Westphal O., Winau R. Paul Ehrlich—in search of the magic bullet. (англ.) // Microbes And Infection. — 2004. — July (vol. 6, no. 8). — P. 786—789. — doi:10.1016/j.micinf.2004.04.003. — PMID 15207826. [исправить]
- ↑ Silverstein A. M. Cellular versus humoral immunology: a century-long dispute. (англ.) // Nature Immunology. — 2003. — May (vol. 4, no. 5). — P. 425—428. — doi:10.1038/ni0503-425. — PMID 12719732. [исправить]
- ↑ Van Epps H. L. Michael Heidelberger and the demystification of antibodies. (англ.) // The Journal Of Experimental Medicine. — 2006. — 23 January (vol. 203, no. 1). — P. 5—5. — doi:10.1084/jem.2031fta. — PMID 16523537. [исправить]
- ↑ Marrack JR. Chemistry of antigens and antibodies. — 2nd edition. — London: His Majesty’s Stationery Office, 1938.
- ↑ The Linus Pauling Papers: How Antibodies and Enzymes Work (неопр.). Дата обращения: 5 июня 2007. Архивировано 5 декабря 2010 года.
- ↑ Silverstein A. M. Labeled antigens and antibodies: the evolution of magic markers and magic bullets. (англ.) // Nature Immunology. — 2004. — December (vol. 5, no. 12). — P. 1211—1217. — doi:10.1038/ni1140. — PMID 15549122. [исправить]
- ↑ EDELMAN GM, GALLY JA. The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins. (англ.) // The Journal Of Experimental Medicine. — 1962. — 1 August (vol. 116). — P. 207—227. — doi:10.1084/jem.116.2.207. — PMID 13889153. [исправить]
- ↑ Stevens F. J., Solomon A., Schiffer M. Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology. (англ.) // Biochemistry. — 1991. — 16 July (vol. 30, no. 28). — P. 6803—6805. — doi:10.1021/bi00242a001. — PMID 2069946. [исправить]
- ↑ 1 2 Raju T. N. The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85). (англ.) // Lancet (London, England). — 1999. — 18 September (vol. 354, no. 9183). — P. 1040—1040. — doi:10.1016/s0140-6736(05)76658-7. — PMID 10501404. [исправить]
- ↑ Hochman J., Inbar D., Givol D. An active antibody fragment (Fv) composed of the variable portions of heavy and light chains. (англ.) // Biochemistry. — 1973. — 13 March (vol. 12, no. 6). — P. 1130—1135. — doi:10.1021/bi00730a018. — PMID 4569769. [исправить]
- ↑ Tomasi T. B. The discovery of secretory IgA and the mucosal immune system. (англ.) // Immunology Today. — 1992. — October (vol. 13, no. 10). — P. 416—418. — doi:10.1016/0167-5699(92)90093-M. — PMID 1343085. [исправить]
- ↑ Preud’homme J. L., Petit I., Barra A., Morel F., Lecron J. C., Lelièvre E. Structural and functional properties of membrane and secreted IgD. (англ.) // Molecular Immunology. — 2000. — October (vol. 37, no. 15). — P. 871—887. — doi:10.1016/s0161-5890(01)00006-2. — PMID 11282392. [исправить]
- ↑ Johansson S. G. The discovery of immunoglobulin E. (англ.) // Allergy And Asthma Proceedings. — 2006. — March (vol. 27, no. 2 Suppl 1). — P. 3—6. — PMID 16722325. [исправить]
- ↑ Hozumi N., Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1976. — October (vol. 73, no. 10). — P. 3628—3632. — doi:10.1073/pnas.73.10.3628. — PMID 824647. [исправить]
- ↑ The MIT 150: 150 Ideas, Inventions, and Innovators that Helped Shape Our World (неопр.). The Boston Globe (15 мая 2011). Дата обращения: 8 августа 2011.
Литература
- Галактионов В. Г. Иммунология. — М.: Издат. центр «Академия», 2004. — 528 с. — ISBN 5-7695-1260-1.
- Ярилин А. А. Иммунология. — М.: ГЭОТАР-Медиа, 2010. — 752 с. — ISBN 978-5-9704-1319-7.
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology. — Garland Science, 2017. — ISBN 978-0-8153-4505-3.
- Ройт, А. Гл. 6. Антитела и клеточные рецепторы для них // Иммунология / А. Ройт, Дж. Бростофф, Д. Мейл. — 5-е изд. — М. : Мир, 2000. — 592 с. с. : ил. — 7000 экз. — ББК 28.073. — УДК 57.083.3(G). — ISBN 5-03-003305-X.
Ссылки
Генетики опровергли популярные теории о том, что влияет на пол ребенка
Мальчик или девочка? Какие факторы влияют на пол новорожденного? Новое исследование ученых из Каролинского института (Швеция) показывает: гены родителей, как это ни парадоксально, не играют никакой роли. Пол ребенка обусловлен случайностью, а не генами.
На вопрос, как формируется пол ребенка, наука отвечает однозначно: все зависит от того, наследует ли он от своего отца хромосому X или Y. Но вот что определяет, какая хромосома станет преобладающей во время зачатия? Что влияет на вероятность зачатия мальчика или девочки?
До последнего времени считалось, что предрасположенность к рождению сына или дочери зашифрована в наших генах: у мужчин, в семье которых больше сестер, выше шансы стать отцами девочек, а те, у кого были братья, чаще зачинают мальчиков.
Ученые под руководством Ральфа Халкола решили проверить эту теорию. Они проанализировали данные всех детей, родившихся в Швеции с 1932 года, а это информация о более чем 3,54 миллионов родителей и их 4,75 миллионов детей.
Исследовательская группа проверила, было ли у потомков этих людей такое же соотношение полов, как у их братьев и сестер.
Как ни парадоксально, но теория не получила подтверждения. «Мы не обнаружили существенного генетического влияния на соотношение полов потомства», — сообщается в журнале Proceedings of the Royal Society B.
Ученые также не нашли доказательств связи между полом первого и второго ребенка. То есть если в семье уже есть девочка, вероятность того, что второй ребенок будет мальчик, не увеличивается. И наоборот.
Ученые усомнились и в других расхожих теориях, в частности, в том, что у состоятельных родителей больше шансов на рождение мальчиков, а у более привлекательных людей чаще рождаются девочки. Также считалось, что на момент зачатия важен и уровень гормонов у родителей. «Наши результаты исключают все это и предполагают переосмысление теории соотношения полов», — говорит Брендан Цитч, соавтор работы.
И все-таки остается одна загадка, пишет Spiegel: во всем мире рождается больше мальчиков, чем девочек. При случайном распределении полов число должно быть одинаковым.
ALUMNI-MGIMO / PUBLIC BLOG / Бомбейский феномен: пятая группа крови
Кто же не знает, что у людей существуют четыре основные группы крови. Первая, вторая и третья встречаются довольно часто, четвёртая распространена не столь широко. Эта классификация основана на содержании в крови так называемых агглютиногенов — антигенов, ответственных за образование антител.
Группу крови чаще всего определяет наследственность, например если у родителей вторая и третья группы, у ребёнка может быть любая из четырёх, в случае, когда у отца и матери первая группа, у их детей также будет первая, а если, скажем, у родителей четвёртая и первая, у чада будет либо вторая, либо третья.
Однако, в некоторых случаях дети рождаются с группой крови, которой по правилам наследования у них быть не может — это явление называется бомбейский феномен, или бомбейская кровь.
В пределах систем групп крови ABO/Резус, которые используются для классификации большинства типов крови, существует несколько редких типов крови. Самый редкий – AB-, этот тип крови наблюдается менее чем у одного процента населения земли. Типы B- и O- также очень редкие, на каждый из них приходится менее 5% населения земли. Однако помимо этих двух основных есть более 30 общепризнанных систем определения группы крови, включающих множество редких типов, некоторые из которых наблюдаются совсем у небольшой группы людей.
Тип крови определяется по наличию в крови определенных антигенов. Антигены A и B очень распространены, что облегчает классификацию людей в зависимости от того какой антиген у них присутствует, тогда как у людей с типом крови O нет ни того ни другого антигена. Положительный или отрицательный знак после группы означает наличие или отсутствие резус-фактора. В то же время, помимо антигенов A и B возможно присутствие и других антигенов, и эти антигены могут вступать в реакцию с кровью определенных доноров. Например, у кого-то может быть группа крови A+, и при этом в крови отсутствует другой антиген, что говорит о вероятности неблагоприятной реакции с донорской кровью группы A+, содержащей этот антиген.
В бомбейской крови нет антигенов A и B, поэтому её часто путают с первой группой, однако нет в ней и антигена H, что может стать проблемой, например, при определении отцовства — ведь у ребёнка в крови не присутствуют ни одного антигена, которые есть у его из родителей.
Редкая группа крови не доставляет её обладателю никаких проблем, кроме одной — если ему вдруг понадобится переливание крови, то использовать можно только такую же бомбейскую, причём эту кровь можно переливать человеку с любой группой без каких-либо последствий.
Первые сведения об этом явлении появились в 1952 году, когда индийский врач Вхенд, проводя анализы крови в семье пациентов, получил неожиданный результат: у отца была 1 группа крови, у матери II, а у сына — III. Он описал этот случай в крупнейшем медицинском журнале «Ланцет». Впоследствии некоторые врачи сталкивались с подобными случаями, но объяснить их не могли. И только в конце XX столетия ответ был найден: оказалось, что в подобных случаях организм одною из родителей мимикрирует (подделывается) под 1 группу крови, в то время как на самом деле имеет другую, в формировании группы крови участвуют два гена: один определяет группу крови, второй кодирует выработку фермента, который позволяет реализоваться этой группе. У большинства людей эта схема работает, но в редких случаях второй ген отсутствует, стало быть, и фермента нет. Тогда наблюдается такая картина: человек имеет, например. III группу крови, но реализоваться она не может, и анализ выявляет II. Ребенку же такой родитель передает свои гены — отсюда и появляется у ребенка «необъяснимая» группа крови. Носителей такой мимикрии немного — менее 1% населения Земли.
Бомбейский феномен был открыт в Индии, где «особенной» кровью обладают, согласно статистике, 0,01% населения, в Европе бомбейская кровь встречается ещё реже — примерно у 0,0001% жителей.
А теперь еще немного подробнее :
Генов, отвечающих за группу крови, бывает три вида – А, В, и 0 (три аллеля).
Каждый человек имеет два гена группы крови – один, полученный от матери (А, В, или 0), и второй, полученный от отца (А, В, или 0).
Возможно 6 комбинаций:
| гены | группа |
| 00 | 1 |
| 0А | 2 |
| АА | |
| 0В | 3 |
| ВВ | |
| АВ | 4 |
Как это работает (с точки зрения биохимии клетки)
На поверхности наших эритроцитов имеются углеводы – «антигены Н», они же «антигены 0». (На поверхности эритроцитов имеются гликопротеины, обладающие антигенными свойствами. Они называются агглютиногены.)
Ген А кодирует фермент, который превращает часть антигенов Н в антигены А. (Ген А кодирует специфическую гликозилтрансферазу, которая присоединяет остаток N-ацетил-D-галактозамина к агглютиногену, при этом получается агглютиноген А).
Ген В кодирует фермент, который превращает часть антигенов Н в антигены В. (Ген В кодирует специфическую гликозилтрансферазу, которая присоединяет остаток D-галактозы к агглютиногену, при этом получается агглютиноген В).
Ген 0 не кодирует никакого фермента.
В зависимости от генотипа, углеводная растительность на поверхности эритроцитов будет выглядеть так:
| гены | специфические антигены на поверхности эритроцитов | группа крови | буквенное обозначение группы |
| 00 | — | 1 | 0 |
| А0 | А | 2 | А |
| АА | |||
| В0 | В | 3 | В |
| ВВ | |||
| АВ | А и В | 4 | АВ |
Скрестим для примера родителей с 1 и 4 группами и посмотрим, почему у них не может быть ребёнка с 1 группой.
| Родитель 00 (1 группа) | Родитель АВ (4 группа) | |
| А | В | |
| 0 | А0 (2 группа) | В0 (3 группа) |
(Потому что ребенок с 1 группой (00) должен получить по 0 от каждого родителя, но у родителя с 4 группой крови (АВ) нет 0.)
Бомбейский феномен
Возникает в том случае, если у человека на эритроцитах не образуется «исходного» антигена Н. В таком случае человек не будет иметь ни антигенов А, ни антигенов В даже при наличии необходимых ферментов. Ну, придут великие и могучие ферменты превращать Н в А… опа! а превращать-то нечего, аша нету!
Исходный антиген Н кодируется геном, который немудрёно обозначается Н.
Н – ген, кодирующий антиген Н
h – рецессивный ген, антиген Н не образуется
Пример: человек с генотипом АА должен иметь 2 группу крови. Но если он будет ААhh, то группа крови у него будет первая, потому что антиген А не из чего сделать.
Впервые эта мутация была обнаружена в Бомбее, осюда и название. В Индии она встречается у одного человека из 10 000, на Тайване – у одного из 8 000. В Европе hh встречается очень редко – у одного человека из двухсот тысяч (0,0005%).
Пример работы бомбейского феномена №1: если один родитель имеет первую группу крови, а другой – вторую, то ребенок не может иметь четвёртую группу, потому что ни у одного из родителей нет необходимого для 4 группы гена В.
| Родитель 00 (1 группа) | Родитель А0 (2 группа) | |
| А | 0 | |
| 0 | А0 (2 группа) | 00 (1 группа) |
| Родитель 00 (1 группа) | Родитель АА (2 группа) |
| А | |
| 0 | А0 (2 группа) |
А теперь бомбейский феномен:
| Родитель BBhh (1 группа) | Родитель ААHH (2 группа) |
| АH | |
| Bh | ABHh (4 группа) |
Фокус в том, что первый родитель, несмотря на свои гены ВВ, не имеет антигенов В, потому что их не из чего делать. Поэтому, не смотря на генетическую третью группу, с точки зрения переливания крови группа у него первая.
Пример работы бомбейского феномена №2. Если оба родителя имеют 4 группу, то у них не может получиться ребенок 1 группы.
| Родитель АВ (4 группа) | Родитель АВ (4 группа) | |
| А | В | |
| А | АА (2 группа) | АВ (4 группа) |
| В | АВ (4 группа) | ВВ (3 группа) |
А теперь бомбейский феномен
| Родитель АВHh (4 группа) | Родитель ABHh (4 группа) | |||
| АH | Ah | BH | Bh | |
| AH | AAHH (2 группа) | AAHh (2 группа) | ABHH (4 группа) | ABHh (4 группа) |
| Ah | AAHH (2 группа) | АAhh (1 группа) | ABHh (4 группа) | АBhh (1 группа) |
| BH | АBHH (4 группа) | ABHh (4 группа) | BBHH (3 группа) | BBHh (3 группа) |
| Bh | ABHh (4 группа) | ABhh (1 группа) | АBHh (4 группа) | BBhh (1 группа) |
Как видим, при бомбейском феномене у родителей с 4 группой всё-таки может получиться ребенок с первой группой.
Цис-положение А и В
У человека с 4 группой крови во время кроссинговера может произойти ошибка (хромосомная мутация), когда в одной хромосоме окажутся оба гена – и А, и В, а в другой хромосоме не будет ничего. Соответственно, и гаметы у такого АВ получатся странные: в одной будет АВ, а в другой – ничего.
| Что могут предложить другие родители | Родитель-мутант | |
| АВ | — | |
| 0 | АВ0 (4 группа) | 0- (1 группа) |
| А | ААВ (4 группа) | А- (2 группа) |
| В | АВВ (4 группа) | В- (3 группа) |
Конечно же, хромосомы, содержащие АВ, и хромосомы, не содержащие совсем ничего, будут выбраковываться естественным отбором, т.к. они будут с трудом конъюгировать с нормальными, немутантными хромосомами. Кроме того, у детей ААВ и АВВ может наблюдаться генный дисбаланс (нарушение жизнеспособности, гибель зародыша). Вероятность встретить мутацию цис-АВ оценивается примерно в 0,001% (0,012% цис-АВ относительно всех АВ).
Пример цис-АВ. Если один родитель имеет 4 группу, а другой первую, то у них не могут получиться дети ни 1, ни 4 группы.
| Родитель 00 (1 группа) | Родитель АВ (4 группа) | |
| А | В | |
| 0 | А0 (2 группа) | В0 (3 группа) |
А теперь мутация:
| Родитель 00 (1 группа) | Родитель-мутант АВ (4 группа) | |||
| АВ | — | А | В | |
| 0 | АВ0 (4 группа) | 0- (1 группа) | А0 (2 группа) | В0 (3 группа) |
Вероятность рождения детей, заштрихованных серым, конечно же, меньше – 0,001%, как и договаривались, а остальные 99,999% приходятся на 2 и 3 группы. Но всё-таки эти доли процента «следует учитывать при генетическом консультировании и судебно-медицинской экспертизе».
Как живут с необычной кровью?
Обыденная жизнь человека с уникальной кровью не отличается от остальных её классификаций, за исключением нескольких факторов:
· серьёзной проблемой является переливание, можно использовать лишь такую же кровь для этих целей, при этом она является универсальным донором и подходит всем;
· невозможность установить отцовство, если так произошло, что сделать ДНК необходимо, оно не даст результатов, так как у ребёнка отсутствуют антигены, которые есть у его родителей.
Интересный факт! В США, штат Массачусетс живёт семья, где двое детей имеют бомбейский феномен, только при этом ещё и А-Н тип, такая кровь диагностирована единожды в Чехии в 1961. Быть донорами друг для друга они не могут, так как у них разный резус-фактор, а переливание любой иной группы, естественно, невозможно. Старший ребёнок достиг совершеннолетия и стал донором сам для себя на крайний случай, такая участь ждёт его младшую сестру, когда ей исполнится 18 лет
источники
http://www.factroom.ru/facts/54527,
http://www.vitaminov.net/rus-catalog_zabolevaniy-896802656-0-23906.html
http://ru.wikipedia.org/wiki/%D0%93%D1%80%D1%83%D0%BF%D0%BF%D1%8B_%D0%BA%D1%80%D0%BE%D0%B2%D0%B8_%D1%87%D0%B5%D0%BB%D0%BE%D0%B2%D0%B5%D0%BA%D0%B0
http://bio-faq.ru/zzz/zzz014.html
https://testdnk.pro/informacia/bombejskij-fenomen.html
И еще что нибудь интересного по медицинской тематике : вот тут я подробно рассказывал о переливании крови. а вот Чума в Европе. А может кто то интересуется Хиджама — это имеет отношение к медицине ? (Впечатлительным не входить !) или например Наркотики в медицине прошлого и всем известные Символы медицины
Читать полностью
Антинуклеарный фактор. Анализы. Полный справочник
Читайте также
Фактор веры
Фактор веры Основываясь на своей практике, я могу сказать, что веру, а для многих людей это означает «религиозные верования», нельзя отделять от процесса лечения, как это принято считать в традиционной медицине. Вера является стержнем жизни пациентов и потенциальным
Фактор времени
Фактор времени Начиная с конца 1980-х годов Мерцених участвовал в проведении исследований, имевших конкретную цель, — проверить, имеют ли карты мозга временные критерии и можно ли манипулировать их границами и функционированием, «играя» с регулированием времени
Ревматоидный фактор
Ревматоидный фактор Ревматоидный фактор определяется у больных ревматоидным артритом, а также у больных с другими формами воспалительной патологии.В норме ревматоидный фактор в крови обычными методами не обнаруживается.Причины изменения нормальных
Антинуклеарный фактор
Антинуклеарный фактор Показания к назначению анализа: для диагностики аутоиммунных заболеваний, при определении совместно с антителами к ДНК является диагностическим критерием системной красной волчанки.Норма: отрицательно.Причины изменения нормальных
Фактор стройности
Фактор стройности Причины тучности, или «почему я полная»? Чрезмерное наполнение желудка вредно для здоровья. Корнелий Цельс Иногда кажется, что первоначальной причиной ожирения является не переедание, но оно скорее следствие особенностей типа мышления,
Фактор холестерина
Фактор холестерина В одном из первых наиболее крупных массовых исследований – проект семи стран – было обследовано 12 000 мужчин в 18 различных группах. В течение 10-летнего периода наблюдения были выявлены отличия в развитии сердечно-сосудистых заболеваний. Мужчины из
Эмоциональный фактор
Эмоциональный фактор Смирение тела, языка и души, бескорыстная милостыня, забота о чужих делах, как о своих, – вот предел возвышенного поведения. «Чжуд-Ши», тантра Объяснений С позиций тибетской медицины долголетие и здоровье невозможны без повседневного
Голодание как дисциплинирующий фактор
Голодание как дисциплинирующий фактор Как говорит доктор У. Готшелл, «в голодании нет ничего нового. У древних оно признавалось как прекрасный метод достижения и поддержания лучшей умственной и физической активности. Два величайших греческих философа и учителя Сократ и
Великий фактор времени
Великий фактор времени Первое, что выясняет реаниматолог, приступая к лечению кровопотери,— сколько времени продолжалось кровотечение? Прежде всего от этого будут зависеть лечение и исход. Вновь — в который уж раз! — мы сталкиваемся с влиянием фактора времени —
Пищевой фактор 7: что пить?
Пищевой фактор 7: что пить? Я пью только свежие овощные и фруктовые соки из органически выращенных растений. Однако с источниками воды проблем все больше и больше. До того как человечество достигло такой высокой плотности населения, которую мы наблюдаем сейчас, особенно в
Фактор возраста
Фактор возраста Исследования мускульной силы у лиц разного возраста показывают, что уже у двадцатилетних пациентов фиксируются признаки умеренного или ярко выраженного ослабления поясничных мышц при разгибании. Если не уделить этому внимания в молодости, с возрастом
Еда – как психологический фактор
Еда – как психологический фактор Заедание чувств и эмоцийПоглощение пищи с целью облегчить сложное эмоциональное состояние – одна из самых распространенных вредных привычек. Некоторые закусывают неудачи и разочарования, другие съедают что-нибудь вкусненькое, чтобы
Резус-фактор
Резус-фактор 729. Проблема совместимости по резус-фактору.В крови большинства людей положительный резус-фактор, у меньшинства — отрицательный. Проблемы не возникает, если у мужа, и у жены либо положительный, либо отрицательный резус-фактор, или если у жены положительный, а
Эмоциональный фактор
Эмоциональный фактор Считается, что беременные женщины часто становятся куда более эмоциональны, чем обычно: склонны взорваться без повода или всплакнуть без особой на то причины. Такой факт действительно имеет место. Особенно в первом триместре. Бороться с этим
Фактор друзей
Фактор друзей Ты по-прежнему многое узнаешь о ценностях от взрослых, присутствующих в твоей жизни, но, как мы говорили в начале этой книги, времена меняются! Став подростком, ты обращаешь больше внимания на своих друзей и других подростков, ценности которых могут
Введение Anti-D во время беременности для предотвращения резус-аллоиммунизации
Фон: У женщины могут развиться резус-отрицательные антитела во время первой беременности, когда ее плод является резус-положительным. Чаще всего антитела вырабатываются после 28 недели беременности.
Цели: Целью этого обзора было оценить влияние антенатального введения анти-D иммуноглобулина на 28 неделе беременности и более на частоту аллоиммунизации RhD при назначении резус-отрицательным матерям без анти-D антител.
Стратегия поиска: Мы провели поиск в регистре исследований Кокрановской группы по беременности и родам, в Кокрановском регистре контролируемых исследований и в библиографиях. Дата последнего поиска: декабрь 1998 г.
Критерий выбора: Рандомизированные испытания с участием резус-отрицательных женщин без анти-D-антител, получавших анти-D после 28 недель беременности, по сравнению с отсутствием лечения или плацебо.
Сбор и анализ данных: Данные были извлечены одним рецензентом и введены дважды.
Основные результаты: В двух подходящих испытаниях, в которых приняли участие более 4500 женщин, сравнивали профилактику анти-D с отсутствием лечения. Хотя данные свидетельствуют о том, что когда женщины получают анти-D на 28 и 34 неделе беременности, снижается частота иммунизации во время беременности (0R O.44, 95% ДИ 0,18-1,12), после рождения ребенка с положительным резус-положением (ОШ 0,44, 95% ДИ 0,18-1,12) и в течение 12 месяцев после рождения ребенка с положительным резус-положением (ОШ 0,44, 95% ДИ 0,19- 1.01), ни одно из этих различий не было статистически значимым. В испытании, в котором использовалась большая доза анти-D (100 мкг; 500 МЕ), было явное снижение частоты иммунизации через 2-12 месяцев после рождения у женщин, получавших анти-D на 28 и 34 неделях ( OR 0,22 95% ДИ 0,05-0,88). Нет данных о риске аллоиммунизации RhD при последующей беременности.Различий в частоте возникновения желтухи новорожденных не наблюдалось.
Выводы рецензента: Риск аллоиммунизации RhD во время или сразу после первой беременности составляет около 1,5%. Введение 100 мкг (500 МЕ) анти-D на 28 неделе и 34 неделе беременности женщинам во время их первой беременности может снизить этот риск примерно до 0,2% без каких-либо побочных эффектов на сегодняшний день. Хотя такая политика вряд ли принесет пользу или улучшит исход при нынешней беременности, меньшее количество женщин будет иметь антитела к резус-D при следующей беременности.Принятие такой политики потребует учета затрат на профилактику по сравнению с расходами на уход за женщинами, которые становятся сенсибилизированными, и их пораженными младенцами, а также с учетом местных запасов анти-D-гаммаглобулина.
Deutsches Primatenzentrum: Rhesus factor
Название указывает на то, что эта характеристика человеческой крови происходит из результатов экспериментов на животных с обезьянами: резус-фактор происходит от макаки-резуса (Macaca mulatta) .У этих обезьян тоже есть фактор, и название связано с использованием красных кровяных телец из крови макак-резусов для получения первой тестовой сыворотки. Сыворотка — это водянистое вещество, которое отделяется от свернувшейся крови. Примерно в 1940 году австриец Карл Ландштайнер и его коллега Александр Винер хотели выяснить, почему самая важная система группы крови человека «AB0», которая была обнаружена ранее, иногда имела шоковые эффекты, а в некоторых случаях — смертельные последствия после переливания крови.Они хотели выяснить, почему в иммунной системе некоторых людей после переливания крови возникают аллергические реакции.
Для этого они взяли кровь у макак-резусов, очень похожих на людей, и тем самым «вакцинировали» морских свинок. Грызуны вырабатывали защитное вещество от инородного вещества в крови. Из крови морской свинки исследователи снова получили сыворотку, которую они добавили к сотне образцов крови человека, каждый от другого донора. Результаты: около 85 образцов слиплись, 15 остались нетронутыми.Был открыт резус-фактор, который стал второй по важности системой группы крови для человека.
Резус-фактор может быть вредным (даже фатальным) для человека в двух различных ситуациях: при переливании крови и при беременности. Поверхностные белки на оболочке красных кровяных телец (эритроцитов), которые у некоторых людей есть, а у других нет, ответственны за резус-фактор: положительный («Rh +») с белками, отрицательный («Rh-») — без него. Около 15 процентов всех европейцев не имеют этого фактора в крови.Поверхностные белки гарантируют, что кровь резус-положительных людей рассматривается как инородные тела во время переноса крови из иммунной системы резус-отрицательного человека для образования антител против нее. Повторное переливание крови может вызвать опасную для жизни реакцию иммунной системы реципиента.
Rh Несовместимость: фон, патофизиология, эпидемиология
Автор
Леон Салем, MD, MS Заместитель лечащего врача, Kaiser Permanente, Южная Калифорния
Леон Салем, MD, MS является членом следующих медицинских обществ: Американский колледж врачей скорой помощи
Раскрытие информации: не раскрывать.
Соавтор (ы)
Карен Р. Сингер, PA-C Ассистент врача, отделение педиатрии, Медицинский центр Фаунтин-Вэлли, Медицинская группа педиатрической помощи Южных округов, Фаунтин-Вэлли и Лонг-Бич, Калифорния
Карен Р. Сингер, Пенсильвания-К, является членом следующие медицинские общества: Американская Академия Помощников Врачей
Раскрытие: Ничего не раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу.для: Medscape.
Джон Дж. Пирс-младший, доктор медицины Доцент кафедры акушерства / гинекологии и внутренней медицины, Медицинский колледж Вирджинии при Университете Содружества Вирджинии
Джон Дж. Пирс-младший, доктор медицины является членом следующих медицинских обществ: Американский колледж акушеров и гинекологов, Ассоциация профессоров гинекологии и акушерства, Христианские медицинские и стоматологические ассоциации, Медицинское общество Вирджинии, Общество лапароэндоскопических хирургов
Раскрытие: Ничего не раскрывать.
Главный редактор
Брюс М Ло, доктор медицинских наук, магистр делового администрирования, CPE, RDMS, FACEP, FAAEM, FACHE Начальник отделения неотложной медицины, больница общего профиля Сентара Норфолк; Врач-врач центра трансфера Sentara; Профессор и помощник директора программы, Основной академический факультет, Департамент неотложной медицины, Медицинская школа Восточной Вирджинии; Член правления Американской академии экстренной медицины
Брюс М. Ло, доктор медицины, магистр делового администрирования, CPE, RDMS, FACEP, FAAEM, FACHE является членом следующих медицинских обществ: Американской академии экстренной медицины, Американской ассоциации руководителей врачей, Американского колледжа врачей неотложной помощи, Американский колледж руководителей здравоохранения, Американский институт ультразвука в медицине, Ассоциация медсестер скорой помощи, Медицинское общество Вирджинии, Норфолкская медицинская академия, Общество академической неотложной медицины
Раскрытие: нечего раскрывать.
Дополнительные участники
Ассаад Дж. Саях, доктор медицины, FACEP Президент и главный исполнительный директор, Кембриджский альянс здравоохранения
Ассаад Дж. Саях, доктор медицины, FACEP является членом следующих медицинских обществ: Американский колледж врачей скорой помощи, Медицинское общество Массачусетса
Раскрытие информации: Нечего раскрывать.
Глобальное распределение группы крови Даффи
Cutbush, M. & Mollison, P.L. Система групп крови Даффи. Наследственность 4 , 383–389 (1950).
CAS Статья PubMed Google ученый
Муран, А. Э. Кровные родства: группы крови и антропология (Оксфордский университет, 1983).
Хэмблин, М. Т., Томпсон, Э. Э. и Ди Риенцо, А. Комплексные признаки естественного отбора в локусе группы крови Даффи. Am. J. Hum. Genet. 70 , 369–383 (2002).
Артикул PubMed Google ученый
Картер Р. Рассуждения о происхождении малярии Plasmodium vivax . Trends Parasitol. 19 , 214–219 (2003).
Артикул PubMed Google ученый
Розенберг, Р. Plasmodium vivax в Африке: спрятан у всех на виду? Trends Parasitol. 23 , 193–196 (2007).
Артикул PubMed Google ученый
Кляйн, Х. Г. и Ансти, Д. Дж. (Ред.) Переливание крови Моллисона в клинической медицине (Blackwell Publishing, 2005).
Муран, А. Э. и Доманевска-Собчак, К. Использование в антропологии групп крови и других генетических признаков. J. Afr. Hist. 3 , 291–296 (1962).
Артикул Google ученый
Миллер, Л.Х., Мейсон, С. Дж., Клайд, Д. Ф. и МакГиннисс, М. Х. Фактор устойчивости к плазмодию Plasmodium vivax в черных тонах. Генотип группы крови Даффи, FyFy. N. Engl. J. Med. 295 , 302–304 (1976).
CAS Статья PubMed Google ученый
Barnwell, J. W., Nichols, M. E. & Rubinstein, P. In vitro оценка роли группы крови Даффи в инвазии эритроцитов с помощью Plasmodium vivax . J. Exp. Med. 169 , 1795–1802 (1989).
CAS Статья PubMed Google ученый
Wertheimer, S.P. & Barnwell, J. W. Plasmodium vivax Взаимодействие с гликопротеином группы крови Даффи человека: идентификация белка, подобного рецептору паразита. Exp. Паразитол. 69 , 340–350 (1989).
CAS Статья PubMed Google ученый
Миллер Л.Х., Мейсон, С. Дж., Дворжак, Дж. А., Макгиннисс, М. Х. и Ротман, И. К. Рецепторы эритроцитов для ( Plasmodium knowlesi ) малярии: детерминанты группы крови Даффи. Наука 189 , 561–563 (1975).
ADS CAS Статья PubMed Google ученый
Барбер, М. А. и Комп, У. Х. У. Сезонная и региональная заболеваемость видами малярийных паразитов. Представитель общественного здравоохранения (1896–1970) 44 , 2048–2057 (1929).
Артикул Google ученый
Райан, Дж. Р. и др. Доказательства передачи Plasmodium vivax среди населения, отрицательного по антигену Даффи, в Западной Кении. Am. J. Hum. Genet. 75 , 575–581 (2006).
CAS Google ученый
Cavasini, C.E. et al. Plasmodium vivax Инфекция среди антиген-отрицательных людей Даффи из бразильского региона Амазонки: исключение? Пер.R. Soc. Троп. Med. Hyg. 101 , 1042–1044 (2007).
Артикул PubMed Google ученый
Ménard, D. et al. Plasmodium vivax Клиническая малярия обычно наблюдается у Даффи-отрицательных малагасийских людей. Proc. Natl Acad. Sci. США 107 , 5967–5971 (2010).
ADS Статья PubMed Google ученый
Галински, М.R. & Barnwell, J. W. Plasmodium vivax : кого это волнует? Малар. J. 7 , S9 (2008).
Артикул PubMed PubMed Central Google ученый
Guerra, C.A. et al. Международные пределы и популяция риска передачи Plasmodium vivax в 2009 г. PLoS Negl. Троп. Дис. 4 , e774 (2010).
Артикул PubMed PubMed Central Google ученый
Ансти, Д.J. Связь между группами крови и заболеванием. Кровь 115 , 4635–4643 (2010).
CAS Статья PubMed Google ученый
Хорн, К. и Вулли, И. Дж. Проливая свет на DARC: роль антигена / рецептора Даффи для хемокинов в воспалении, инфекции и злокачественных новообразованиях. Inflamm. Res. 58 , 431–435 (2009).
CAS Статья PubMed Google ученый
Уолли, Н.M. et al. Рецептор антигена Даффи для варианта нулевого промотора хемокинов не влияет на приобретение ВИЧ-1 или прогрессирование заболевания. Клеточный микроб-хозяин 5 , 408–410; ответ автора 418–409 (2009).
CAS Статья PubMed PubMed Central Google ученый
He, W. et al. Рецептор антигена Даффи для хемокинов опосредует транс-инфекцию ВИЧ-1 от эритроцитов к клеткам-мишеням и влияет на восприимчивость к ВИЧ / СПИДу. Клеточный микроб-хозяин 4 , 52–62 (2008).
CAS Статья PubMed PubMed Central Google ученый
Донахью, Р. П., Биас, В. Б., Ренвик, Дж. Х. и МакКусик, В. А. Вероятное отнесение локуса группы крови Даффи к хромосоме 1 у человека. Proc. Natl Acad. Sci. США 61 , 949–955 (1968).
ADS CAS Статья PubMed Google ученый
Ланги, Д.М. Младший и Бордин, Дж. О. Группа крови Даффи и малярия. Гематология 11 , 389–398 (2006).
CAS Статья PubMed Google ученый
Циммерман П. А. в книге « Инфекционные заболевания и эволюция возбудителя-хозяина» (изд. Дронамраджу, К. Р.) 141–172 (Кембриджский университет, 2004).
Zimmerman, P.A. et al. Появление FY * A null в Plasmodium vivax — эндемичном регионе Папуа-Новой Гвинеи. Proc. Natl Acad. Sci. USA 96 , 13973–13977 (1999).
ADS CAS Статья PubMed Google ученый
Sellami, M.H. et al. Генотипирование системы групп крови Даффи у городского населения Туниса. Ann. Гм. Биол. 35 , 406–415 (2008).
CAS Статья PubMed Google ученый
Ольссон, М.L. et al. Фенотип Fy (x) связан с миссенс-мутацией в аллеле Fy (b), предсказывающем Arg89Cys в гликопротеине Даффи. руб. J. Haematol. 103 , 1184–1191 (1998).
CAS Статья PubMed Google ученый
Кавалли-Сфорца Л. Л., Меноцци П. и Пьяцца А. История и география генов человека (Принстонский университет, 1994).
Диггл, П.Дж. И Рибейро, П. Дж. Мл. Геостатистика на основе моделей (Springer, 2007).
Хамблин М. Т. и Ди Риенцо А. Обнаружение признаков естественного отбора у людей: данные по локусу группы крови Даффи. Am. J. Hum. Genet. 66 , 1669–1679 (2000).
CAS Статья PubMed PubMed Central Google ученый
Bicheron, P. et al. GLOBCOVER: Описание продуктов и отчет о проверке (MEDIAS, 2008).
Хогг Р. В. и Крейг А. Введение в математическую статистику (Pearson Education, 2005).
Hay, S. I. et al. Карта мира по малярии: Plasmodium falciparum, эндемичность в 2007 г. PLoS Med. 6 , e1000048 (2009).
Артикул PubMed PubMed Central Google ученый
Tournamille, C. et al. Последовательность, эволюция и лиганд-связывающие свойства антигена / рецептора Даффи млекопитающих для хемокинов. Иммуногенетика 55 , 682–694 (2004).
CAS Статья PubMed Google ученый
Картер Р. и Мендис К. Н. Эволюционные и исторические аспекты бремени малярии. Clin. Microbiol. Ред. 15 , 564–594 (2002).
Артикул PubMed PubMed Central Google ученый
Ливингстон, Ф.B. Группы крови Даффи, малярия vivax и отбор малярии в человеческих популяциях: обзор. Гум. Биол. 56 , 413–425 (1984).
CAS PubMed Google ученый
Лысенко, А. Ю., Семашко, И. Н. в Итоги науки: Медицинская география (ред. Лебедев А. В.) 25–146 (Академия наук, 1968).
Piel, F. B. et al. Глобальное распространение гена серповидных клеток и географическое подтверждение гипотезы малярии. Nat. Commun. 1 , 104 (2010).
Артикул PubMed PubMed Central Google ученый
Чоун, Б., Льюис, М. и Кайта, Х. Система групп крови Даффи у кавказцев — свидетельство нового аллеля. Am. J. Hum. Genet. 17 , 384–389 (1965).
CAS PubMed PubMed Central Google ученый
Цена, р.N. et al. Малярия Vivax: запущенная и небезопасная. Am. J. Hum. Genet. 77 , 79–87 (2007).
Google ученый
Бэрд, Дж. К. Тяжелая и смертельная форма малярии vivax бросает вызов догме «доброкачественной третичной малярии». Ann. Троп. Педиатр. 29 , 251–252 (2009).
Артикул PubMed Google ученый
Каллтон, Р.L. et al. Не удалось обнаружить Plasmodium vivax в Западной и Центральной Африке с помощью ПЦР-типирования. Malaria J. 7 , 174 (2008).
Артикул Google ученый
Culleton, R. et al. Доказательства передачи Plasmodium vivax в Республике Конго, Западная Центральная Африка. J. Infect. Дис. 200 , 1465–1469 (2009).
CAS Статья PubMed Google ученый
Смит, Д.Л., Маккензи, Ф. Э., Сноу, Р. В. и Хей, С. И. Возвращение к основному репродуктивному числу при малярии и его последствиям для борьбы с малярией. PLoS Biol. 5 , e42 (2007).
Артикул PubMed PubMed Central Google ученый
Guerra, C. et al. Создание глобальной базы данных о распространенности малярийных паразитов для проекта «Атлас малярии». Malaria J. 6 , 17 (2007).
Артикул Google ученый
Hay, S. I. и Snow, R. W. Проект «Атлас малярии»: разработка глобальных карт риска малярии. PLoS Med. 3 , e473 (2006).
Артикул PubMed PubMed Central Google ученый
Мурант А.Э., Копеч А.С. и Доманевска-Собчак К. Распределение групп крови человека и других полиморфизмов (Оксфордский университет, 1976).
Дигл, П. Дж., Таун, Дж. А. и Мойид, Р. А. Геостатистика на основе моделей. J. R. Stat. Soc. Сер. C Прил. Стат. 47 , 299–326 (1998).
MathSciNet Статья Google ученый
Гетинг, П. У., Патил, А. П. и Хей, С. И. Количественная оценка совокупной неопределенности в Plasmodium falciparum распространенности малярии и группах риска с помощью эффективного пространственно-временного геостатистического совместного моделирования. PLoS Comput. Биол. 6 , e1000724 (2010).
ADS MathSciNet Статья PubMed PubMed Central Google ученый
Харди, Г. Х. Менделирующие пропорции в смешанной популяции. Наука 28 , 49–50 (1908).
ADS CAS Статья PubMed Google ученый
Weinberg, W. Über den nachweis der vererbung beim menschen. Jahresh. Wuertt. Верх. Фатерл. Naturkd. 64 , 369–382 (1908).
Google ученый
Вирус Зика
Признаки и симптомы
Инкубационный период (время от воздействия до появления симптомов) болезни, вызванной вирусом Зика, оценивается в 3 — 14 дней. У большинства людей, инфицированных вирусом Зика, симптомы отсутствуют. Симптомы обычно легкие, включая лихорадку, сыпь, конъюнктивит, боль в мышцах и суставах, недомогание и головную боль, и обычно длятся 2 — 7 дней.
Осложнения болезни, вызванной вирусом Зика
Инфекция, вызванная вирусом Зика, во время беременности является причиной микроцефалии и других врожденных аномалий у развивающегося плода и новорожденного. Инфекция Зика во время беременности также приводит к осложнениям беременности, таким как потеря плода, мертворождение и преждевременные роды.
Инфекция, вызванная вирусом Зика, также вызывает синдром Гийена-Барре, невропатию и миелит, особенно у взрослых и детей старшего возраста.
Продолжаются исследования по изучению воздействия инфекции вирусом Зика на исходы беременности, стратегии профилактики и контроля, а также воздействия инфекции на другие неврологические расстройства у детей и взрослых.
Передача
Вирус Зика в основном передается через укус инфицированного комара из рода Aedes , в основном Aedes aegypti , в тропических и субтропических регионах. Комары Aedes обычно кусаются в течение дня, пик наступает рано утром и поздно днем / вечером. Это тот же комар, который переносит лихорадку денге, чикунгунью и желтую лихорадку.
Вирус Зика также передается от матери к плоду во время беременности, при половом контакте, переливании крови и продуктов крови и трансплантации органов.
Диагноз
Заражение вирусом Зика можно заподозрить на основании симптомов людей, проживающих или посещающих районы с передачей вируса Зика и / или комаров-переносчиков Aedes . Диагноз вирусной инфекции Зика может быть подтвержден только лабораторными исследованиями крови или других биологических жидкостей, таких как моча или сперма.
Лечение
Не существует лечения от вирусной инфекции Зика или связанных с ней заболеваний.
Симптомы заражения вирусом Зика обычно легкие.Людям с такими симптомами, как лихорадка, сыпь или артралгия, следует много отдыхать, пить жидкости и лечить боль и жар общими лекарствами. Если симптомы ухудшаются, им следует обратиться за медицинской помощью и советом.
Беременным женщинам, проживающим в районах передачи вируса Зика или у которых развиваются симптомы вирусной инфекции Зика, следует обратиться за медицинской помощью для лабораторных исследований и другой клинической помощи.
Профилактика
Укусы комаров
Защита от укусов комаров в дневное время и ранним вечером является ключевой мерой для предотвращения заражения вирусом Зика.Особое внимание следует уделять профилактике укусов комаров среди беременных женщин, женщин репродуктивного возраста и маленьких детей.
Меры индивидуальной защиты включают ношение одежды (желательно светлого цвета), закрывающей как можно большую часть тела; использование физических барьеров, таких как оконные сетки и закрытые двери и окна; и нанесение репеллента от насекомых на кожу или одежду, содержащего ДЭТА, IR3535 или икаридин, в соответствии с инструкциями на этикетке продукта.
Маленькие дети и беременные женщины должны спать под москитной сеткой, если спят днем или ранним вечером.Путешественникам и лицам, живущим в пострадавших районах, следует соблюдать основные меры предосторожности, описанные выше, чтобы защитить себя от укусов комаров.
Комары Aedes размножаются в небольших скоплениях воды вокруг домов, школ и рабочих мест. Важно ликвидировать эти места размножения комаров, в том числе: накрывать емкости для хранения воды, удалять стоячую воду из цветочных горшков, а также убирать мусор и использованные шины. Инициативы сообществ имеют важное значение для поддержки программ местного самоуправления и общественного здравоохранения по сокращению мест размножения комаров.Органы здравоохранения могут также рекомендовать использование ларвицидов и инсектицидов для сокращения популяций комаров и распространения болезней.
Вакцины для профилактики или лечения вирусной инфекции Зика пока нет. Разработка вакцины против вируса Зика остается активной областью исследований.
Передача во время беременности
Вирус Зика может передаваться от матери к плоду во время беременности, что приводит к микроцефалии (размер головы меньше нормального) и другим врожденным порокам развития ребенка, которые вместе именуются врожденным синдромом Зика.
Микроцефалия вызывается аномальным развитием головного мозга или потерей мозговой ткани. Результаты у детей различаются в зависимости от степени повреждения головного мозга.
Синдром врожденного Зика включает другие пороки развития, включая контрактуры конечностей, высокий мышечный тонус, аномалии глаз и потерю слуха. Риск врожденных пороков развития после инфицирования во время беременности остается неизвестным; По оценкам, у 5–15% младенцев, рожденных от женщин, инфицированных вирусом Зика во время беременности, имеются признаки осложнений, связанных с вирусом Зика.Врожденные пороки развития возникают как после симптоматической, так и бессимптомной инфекции.
Передача половым путем
Вирус Зика может передаваться половым путем. Это вызывает озабоченность из-за связи между вирусной инфекцией Зика и неблагоприятными исходами беременности и плода.
В регионах с активной передачей вируса Зика все люди, инфицированные вирусом Зика, и их сексуальные партнеры (особенно беременные женщины) должны получать информацию о рисках передачи вируса Зика половым путем.
ВОЗ рекомендует правильно консультировать сексуально активных мужчин и женщин и предлагать полный спектр методов контрацепции, чтобы иметь возможность сделать осознанный выбор в отношении того, забеременеть ли и когда, чтобы предотвратить возможные неблагоприятные исходы для беременности и плода.
Женщины, имевшие незащищенный половой контакт и не желающие забеременеть из-за опасений по поводу заражения вирусом Зика, должны иметь свободный доступ к службам экстренной контрацепции и консультированию. Беременным женщинам следует практиковать более безопасный секс (включая правильное и постоянное использование презервативов) или воздерживаться от половой жизни, по крайней мере, на протяжении всей беременности.
Для регионов, где нет активной передачи вируса Зика, ВОЗ рекомендует практиковать более безопасный секс или воздержание в течение шести месяцев для мужчин и двух месяцев для женщин, которые возвращаются из районов активной передачи вируса Зика, чтобы предотвратить заражение их половых партнеров. Сексуальные партнеры беременных женщин, проживающие в районах, где происходит местная передача вируса Зика, или возвращающиеся из них, должны практиковать более безопасный секс или воздерживаться от половой жизни на протяжении всей беременности.
Ответные меры ВОЗ
ВОЗ поддерживает страны в борьбе с болезнью, вызванной вирусом Зика, путем принятия мер, изложенных в Программе стратегических ответных действий по вирусу Зика :
- Расширение исследований в области профилактики, надзора и борьбы с инфекцией, вызванной вирусом Зика, и связанными с ней осложнениями.
- Разработка, укрепление и внедрение интегрированных систем эпиднадзора за вирусной инфекцией Зика и связанными с ней осложнениями.
- Укрепление потенциала лабораторий по тестированию на вирусную инфекцию Зика во всем мире.
- Поддержка глобальных усилий по реализации и мониторингу стратегий борьбы с переносчиками, направленных на сокращение популяций комаров Aedes .
- Усиление ухода и поддержки пострадавших детей и семей, пострадавших от осложнений инфекции Зика.
Alles wat je will weten over de rhesusfactor
What is een rhesusfactor?
De rhesusfactor wordt gevormd door een verzameling van zogenoemde rhesus-eiwitten die voor kunnen komen op het membersraan van de rode bloedcellen. Dit worden ook wel antigenen genoemd. Er zijn meer dan 40 typen rhesus-eiwitten bekend, maar de meest voorkomende является резусом типа D.
Een bepaalde rhesusfactor erf je van je ouders. Eén kopie van de rhesusfactor-genen van je moeder en en én kopie van je vader bepalen dus welke rhesusfactor jij krijgt.
Ongeveer 85 procent van de mensen heeft de rhesusfactor en is rhesus (D) -позитив. Bij ongeveer 15 procent van de mensen ontbreekt de rhesusfactor, je bent dan rhesus (D) -negatief.
Rhesusfactor en zwangerschap
Als een rhesus (D) -negatieve zwangere vrouw een rhesus (D) -positief kind verwacht, kan deze rhesus (D) -factor van het kind aanleiding zijn tot het vormen de moederoffen de moederoffen de moederoffen de moederoffen. Tijdens de zwangerschap, maar vooral tijdens de geboorte kunnen rode bloedcellen van het kind in de bloedbaan van de moeder terechtkomen.Omdat het lichaam van de moeder deze rhesus (D) -positieve rode bloedcellen als vreemd herkent, maakt het rhesus (D) -antistoffen aan. Dit gebeurt meestal pas na de bevalling. Daarom — это де-канс о проблемах bij het eerste kind klein.
Tijdens een zwangerschap geeft de moeder via de placenta antistoffen aan haar ongeboren kind. Op die manier krijgt het kind de eerste afweer tegen allerlei ziekten via de moeder. Wanneer de moeder tijdens een vorige zwangerschap rhesus (D) -antistoffen heeft aangemaakt, blijven deze in haar bloed aanwezig en kunnen ze bij een volgende zwangerschap via de placenta in de bloedsomloop van hen hen (kind on kgeb).Hierdoor kunnen дан проблема ontstaan wanneer zij een rhesus (D) -позитивный вид verwacht. Deze antistoffen van de moeder breken de rode bloedcellen van het kind af en zo krijgt het bloedarmoede.
Rhesusziekte
Wanneer de rode bloedcellen van het (ongeboren) kind afgebroken word kan het ernstig ziek worden, soms zo ernstig dat zelfs een bloedtransfusie in de baarmoeder nodig is. Ook na de geboorte kan de baby ziek worden door de afbraakproducten van het bloed. De baby ziet dan erg geel.Dit noemen we rhesusziekte. Het is dan belangrijk om deze afbraakproducten uit het bloed te verwijderen. Dit kan door het kind te behandelen met UV-licht (eigenlijk een soort zonnebank). In ernstige gevallen moet al het bloed vervangen worden door middel van een zogenaamde wisseltransfusie.
Gelukkig kan rhesusziekte worden voorkomen. Hiervoor krijgen rhesus (D) -negatieve vrouwen tijdens de 30ste week van de zwangerschap en na de geboorte, als het kind rhesus (D) -positief blijkt te zijn, de rhesusprik.
De rhesusprik
De rhesusprik wordt gemaakt uit menselijk Plasma. Het плазма — это доноры afkomstig van vrijwillige, niet-betaalde, Nederlandse. De rhesusprik bevat antistoffen die de rhesus (D) -positieve rode bloedcellen van het kind, die mogelijk in de bloedbaan van de moeder zijn gekomen, opruimen. Hierdoor heeft het lichaam van de moeder geen tijd om de rode bloedcellen van haar kind als lichaamsvreemd te herkennen. Daarom maakt ze geen antistoffen aan en wordt de rhesusziekte voorkomen.Dankzij de huidige methodden om rhesusziekte te voorkomen en te behandelen is de ziekte nog maar zelden dodelijk voor het kind.
Rhesusfactor en bloedtransfusie
Wanneer iemand met rhesus (D) -negatief bloed een bloedtransfusie krijgt met rhesus (D) -positief bloed, maakt zijn immuunsysteem antistoffan de van de l’iędzat is an anti-spyen de van de l’a. Hierdoor wordt het nieuwe bloed afgebroken en ontstaat een transfusiereactie.
Iemand met rhesus (D) -positief bloed kan zonder problem rhesus (D) -negatief bloed krijgen.Het immuunsysteem reageert immers niet op de afwezigheid van het D-antigeen.
Rh Болезнь | Сидарс-Синай
Не то, что вы ищете?Что такое резус-инфекция?
Резус возникает при беременности. Это происходит, когда резус-фактор у мамы и кровь ребенка не совпадает. Это также может произойти, если у мамы и ребенка разная кровь. типы.
Что вызывает резус-инфекцию?
У каждого человека есть группа крови (O, A, B или AB).У всех тоже есть резус-фактор (положительный или отрицательный).
Резус-фактор — это белок, покрывающий эритроциты. Если резус-фактор белок есть на клетках, человек резус-положительный. Если нет белка резус-фактора, у человека отрицательный резус-фактор.
Ребенок может иметь группу крови и резус-фактор одного из родителей или комбинацию оба родителя.
Может быть проблема, когда Rh отрицательная мать родила ребенка от резус-положительного отца.Если резус-фактор ребенка положительный, как и у их отца, это может быть проблемой, если красные кровяные тельца ребенка пересекаются к резус-отрицательная мать. Когда это происходит, мама становится чувствительной к резус-положительному положительному результату. кровь.
Это часто случается при рождении, когда плацента отрывается. Но это также может произойти в любое время, когда кровь мамы и ребенка клетки перемешиваются. Это может произойти во время выкидыша или падения.Это также может произойти во время пренатальный тест. Они могут включать амниоцентез или биопсию ворсин хориона. Эти тесты используйте иглу, чтобы взять образец ткани. Они могут вызвать кровотечение.
Иммунная система мамы с отрицательным резус-фактором считает резус-положительные эритроциты ребенка чужеродными. Ваша иммунная система отвечает к создание антител для борьбы с этими чужеродными клетками и их уничтожения. Ваша иммунная система хранит эти антитела на случай, если эти чужеродные клетки вернутся снова.Это может случиться в будущем беременность. Теперь вы чувствительны к резусу.
Резус-сенсибилизация обычно не является проблемой при первой беременности. Большинство проблем возникает в будущая беременность еще одним резус-положительным ребенком. Во время этой беременности ваши антитела через плаценту, чтобы бороться с резус-положительными клетками в организме ребенка. Как антитела разрушить клетки, ваш ребенок заболеет. У вашего ребенка может быть желтуха, сердечная недостаточность и увеличенные органы.
Кто подвержен риску резус-инфекции?
Женщины с отрицательным резус-фактором и беременные ребенком, у отца которого положительный резус-фактор подвержены риску этого состояния. Ваш риск намного выше, если вы уже были беременны. Обычно риск возникновения резус-инфекции во время первой беременности отсутствует, если только вы не были сенсибилизирован до беременности.
Каковы симптомы резус-инфекции?
У матери нет признаков резус-инфекции.Но у вашего ребенка могут быть проблемы, если вы разовьетесь антитела.
Симптомы могут проявляться немного по-разному в зависимости от беременности и каждого ребенка. Во время беременности симптомы может включать:
- Желтая окраска околоплодных вод. Этот цвет может быть из-за билирубина. Этот это вещество, которое выделяется при разрушении клеток крови.
- У вашего ребенка может быть большая печень, селезенка или сердце.Также может быть лишняя жидкость в желудке, легких или легких ребенка. скальп. Это признаки водянки плода. Это состояние вызывает сильный отек. (отек).
Резус-болезнь может вызвать проблемы у новорожденного. Состояние, вызванное резус-инфекцией у младенцев называется гемолитической болезнью новорожденных (ГБН). Ваш ребенок может иметь следующие симптомы:
- Желтая окраска кожи и белков глаз (желтуха)
- Бледное от анемии
- Учащение пульса (тахикардия)
- Учащенное дыхание (тахипноэ)
- Недостаток энергии
- Отек под кожей
- Большой живот
Симптомы резус-инфекции могут выглядеть как симптомы других заболеваний.Смотрите ваше здравоохранение провайдер для диагностики.
Как диагностируется резус-фактор?
Ваш лечащий врач может подозревать резус-инфекцию, если в прошлой беременности у вас был резус-положительный ребенок. Ваше здоровье Поставщик спросит вас об истории вашего здоровья. Ваш провайдер также предоставит вам ан экзамен.
Для проверки на резус-фактор могут потребоваться следующие анализы:
- Анализы крови.Эти проверяют на Rh положительные антитела в крови.
- УЗИ. Этот тест может показать увеличенные органы или скопление жидкости у ребенка.
- Амниоцентез. Этот тест проверяет количество билирубина в околоплодных водах. В В этом тесте игла вводится в брюшную стенку и стенку матки. Это проходит в амниотический мешок. Игла берет образец околоплодных вод.
- Чрескожный забор пуповинной крови или забор крови плода.В этом тесте образец крови берется из пуповины вашего ребенка. Лечащий врач вашего ребенка проверит кровь на антитела, билирубин и анемию.
Как лечится резус-инфекция?
Лечение будет зависеть от вашей беременности и общего состояния здоровья. Это также будет зависеть от насколько тяжелое состояние.
Переливание внутриматочной крови
Этот тест устанавливает красные кровяные тельца в кровообращение вашего ребенка.В этом тесте через матку вводится игла. Он попадает в брюшную полость вашего ребенка и попадает в вену пуповины. Ваш ребенок может потребоваться успокаивающее средство, чтобы не двигаться. Возможно, вам понадобится более одного переливание.
Ранняя доставка
Если ваш ребенок осложнения, возможно, вашему ребенку придется родиться раньше срока.Ваш лечащий врач может вызвать роды, как только у вашего ребенка созреют легкие.
Какие возможные осложнения резус-фактора?
Осложнения резус-инфекции у вашего ребенка могут включать:
- Анемия. В некоторых случаях анемия бывает тяжелой. Селезенка и печень вашего ребенка могут быть увеличены.
- Желтуха
- Hydrops fetalis.Это условие происходит, когда органы вашего ребенка не могут справиться с анемией. Сердце твоего ребенка начнет терпеть неудачу. Это вызовет скопление большого количества жидкости в коже ребенка. ткани и органы. Младенцы с этим заболеванием рискуют родиться мертворожденным.
После рождения у вашего ребенка может быть:
- Тяжелая желтуха. Печень вашего ребенка не справляется с большим количеством билирубина.Итак, печень вашего ребенка становится слишком большой. Ваш у ребенка все еще будет анемия.
- Kernicterus. Это условие является самая тяжелая форма излишка билирубина. Это связано с накоплением билирубина в вашем мозг ребенка. Это может вызвать судороги, повреждение мозга и глухоту. Это может даже вызвать смерть.
Можно ли предотвратить резус-инфекцию?
Резус-болезнь можно предотвратить.Почти все женщины будут сдавать анализ крови, чтобы узнать группа крови на ранних сроках беременности.
Если у вас отрицательный резус-фактор и вы не прошли сенсибилизацию, вы получите лекарство под названием Rh. иммуноглобулин (RhoGAM). Это лекарство может помешать вашим антителам реагировать на ваши резус-положительные клетки ребенка. Вы получите RhoGAM примерно на 28 неделе беременности. Вы можете получить это раньше, если у вас есть вагинальное кровотечение, травма или амниоцентез до 28 недель.
Если у вашего ребенка резус-положительный результат, вы получите вторую дозу лекарства в течение 72 часов. родов. Если у вашего ребенка отрицательный резус-фактор, вам не понадобится вторая доза.
Когда мне следует позвонить своему врачу?
Позвоните своему врачу, если у вас отрицательный резус-фактор и у вас вагинальное кровотечение или травма. во время беременности. Ваш лечащий врач может дать вам RhoGAM.
Основные сведения о резус-инфекции
- Резус-болезнь возникает при беременности. Это происходит, когда резус-фактор у мамы и кровь ребенка не совпадает.
- Если резус-отрицательная мать была сенсибилизирована к резус-положительной крови, ее иммунная система вырабатывает антитела, чтобы атаковать ее ребенка.
- Когда антитела попадают в кровоток, они атакуют эритроциты, вызывая их разрушение.Этот может привести к проблемам.
- Это состояние можно предотвратить. Женщины с отрицательным резус-фактором и не были сенсибилизированы можно получить лекарство. Это лекарство может помешать вашим антителам реагировать на ваши резус-положительные клетки ребенка.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что говорит ваш поставщик ты.
- При посещении запишите имя новый диагноз и любые новые лекарства, методы лечения или тесты. Также запишите любые новые инструкции, которые дает вам ваш провайдер.
- Знайте, почему новое лекарство или лечение прописан и как это вам поможет.Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если у вас назначена повторная встреча, запишите дату, время и цель для этого визит.
- Знайте, как вы можете связаться со своим поставщиком медицинских услуг, если у вас возникнут вопросы.
Медицинский обозреватель: Ирина Бурд к.м.н.
Медицинский обозреватель: Донна Фриборн, доктор философии, CNM FNP
Медицинский обозреватель: Хизер Тревино
© 2000-2021 Компания StayWell, LLC.

