перекись магния — Magnesium peroxide
 | |
| имена | |
|---|---|
| название IUPAC перекись магния | |
| Другие имена Диоксид магния, bioxide магния, ООН 1476 | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChemSpider | |
| ИКГВ InfoCard | 100.034.928 |
| Номер EC | 238-438-1 |
| |
| свойства | |
| MgO , 2 | |
| Молярная масса | 56,3038 г / моль |
| Внешность | Белый или не совсем белый порошок |
| плотность | 3 г / см 3 |
| Температура плавления | 223 ° С (433 ° F, 496 К) |
| Точка кипения | 350 ° С (662 ° F, 623 К) (разлагается) |
| нерастворимый | |
| Состав | |
| Cubic, CP12 | |
| Па 3 , № 205 | |
| Фармакология | |
| A02AA03 ( ВОЗ ) A06AD03 ( ВОЗ ) | |
| опасности | |
| Основные опасности | Окисление ( O ) |
| R-фразы (устаревшее) | R8 |
| S-фразы | S17 , S36 |
| NFPA 704 |  |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
  Y Y N N | |
| ссылки Infobox | |
Пероксид магния (MgO , 2 ) не имеет запаха мелкий порошок пероксида с белого до грязно-белого цвета. Это похоже на пероксид кальция , поскольку магния пероксид также выпускает кислород за счет разрушения с регулируемой скоростью с водой. Коммерчески, пероксид магния часто существует в виде соединения перекиси магния и гидроксида магния .
Состав
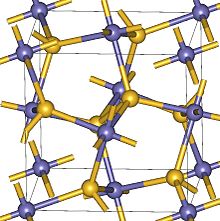
O 2 , аналогично N 2 , обладает способностью связываться либо бок о или с торца. Структура MgO 2 была рассчитана в качестве треугольной формы с O 2 связывающей молекулы боковой на магний. Это устройство является результатом Mg + донорной заряд к кислороду и создание Mg 2+ O 2 2- . Связь между к О 2 и атома магния имеет приблизительную энергию диссоциации 90 кДж моль -1 .
В твердом состоянии, MgO , 2 имеют кубическую кристаллическую структуру пирит-типа с 6-координатой Mg 2+ и ионами O 2 2- перекисных группами, в соответствии с экспериментальными данными и эволюционного предсказанием кристаллической структуры, причем последнее предсказание фазового перехода при давление 53 ГПа до тетрагональной структурой с 8-координату Mg
Синтез
MgO , 2 может быть получен путем смешивания MgO с перекисью водорода , чтобы создать пероксид магния и воду. Это, представляющее собой экзотермическая реакция должна быть охлаждена и выдерживают около 30-40 градусов по Цельсию. Важно также , чтобы удалить как можно больше железа из реакционной среды , как это возможно благодаря способности утюга катализировать разложение пероксида. Добавление стабилизаторов кислорода , такие как силикат натрия , также может быть использовано , чтобы помочь предотвратить преждевременное разложение пероксида. Независимо от того , хороший выход из этой реакции составляет лишь около 35%.
- MgO,+ЧАС2О2⟶MgO,2+ЧАС2О{\ Displaystyle {\ се {MgO + Н2О2 -> мгО2 + H 2 O}}}
Высокие выходы дополнительно осложняется тем , что MgO ,
Приложения
Пероксид магния является стабильным кислородом высвобождая соединение, которое используется в сельскохозяйственных и экологических отраслях промышленности. Он используется для снижения уровней загрязнения в подземных водах . Перекись магния используется в биоремедиации загрязненных почв и может улучшить качество почвы для растений роста и обмена веществ . Он также используется в аквакультуре промышленности для биоремедиации.
Для целей санитарии пероксид магния часто используются в качестве источника кислорода для аэробных организмов в обработке и удалении биологических отходов. Поскольку пробой углеводородов в почве, как правило , быстрее в аэробных условиях, MgO ,
При определенных обстоятельствах MgO 2 также было показано, ингибируют рост бактерий. В частности, рост сульфатредуцирующих бактерий может быть ингибирован в среде , содержащей пероксид магния. В то время как кислород медленно диссоциирует, он предположил , что она может затем действовать , чтобы вытеснить сульфат , который обычно действует в качестве терминального акцептора электронов в их цепи переноса электронов.
токсичность
Перекись магния является раздражителем , который может вызвать покраснение, зуд, отек, и может обжечь кожу и глаза при контакте. Вдыхание может также вызвать раздражение легких, носа и горла, а также вызывает кашель. Длительное воздействие может привести к повреждению легких, одышка, и ужесточение груди. Проглатывание MgO 2 может вызвать многочисленные неблагоприятные эффекты , включая: вздутие живота, отрыжка, боли в животе, раздражение во рту и горле, тошнота, рвота и понос.
Экологически, пероксид магния не является естественным соединением и не известно, сохраняются в окружающей среде в течение длительного времени, в своем полном состоянии, или биоаккумулироваться. Естественная деградация MgO
Общие реакции окружающей среды
Магний существует в верхних слоях атмосферы в различных молекулярных формах. Из — за его способности реагировать с кислородом и общей простой углерод-кислород соединения магния могут существовать в окисленных соединений , включая MgO 2 , OMgO 2 , MgO , и O 2 MgO 2 .
- MgCO 3 + O → MgO 2 + СО 2
- OMgO 2 + O → MgO 2 + O 2
- MgO + O 3 → MgO 2 + O 2
- MgO , 2 + O 2 → O 2 MgO 2
- MgO , 2 + O → MgO + O 2
При контакте с водой разлагается по реакции:
- MgO , 2 + 2 Н 2 O → Mg (OH) 2 + Н 2 О 2
- 2 Н 2 O 2 → 2 Н 2 O + O 2
Рекомендации
Оксид магния — Википедия
Материал из Википедии — свободной энциклопедии
Окси́д ма́гния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
- MgO+2HCl→MgCl2+h3O{\displaystyle {\mathsf {MgO+2HCl\rightarrow MgCl_{2}+H_{2}O}}}
- MgO+h3O→Mg(OH)2{\displaystyle {\mathsf {MgO+H_{2}O\rightarrow Mg(OH)_{2}}}}
Оксид магния получают обжигом минералов магнезита и доломита.
- CaCO3∗MgCO3→MgO+CaO+2CO2{\displaystyle {\mathsf {CaCO_{3}*MgCO_{3}\rightarrow MgO+CaO+2CO_{2}}}}
- MgCO3→MgO+CO2{\displaystyle {\mathsf {MgCO_{3}\rightarrow MgO+CO_{2}}}}
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
- Кнунянц И. Л. и др. т.2 Даффа-Меди // Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
МАГНИЯ ПЕРЕКИСЬ — это… Что такое МАГНИЯ ПЕРЕКИСЬ?
- МАГНИЯ ПЕРЕКИСЬ
- МАГНИЯ ПЕРЕКИСЬ ( Маgnesii рeroxydum ). Смесь магния окиси (85 %) с магния перекисью (15 %). Синонимы: Магния пергидроль, Маgnеsium реrохуdatum, Маgnium реrохуdatum. Белый порошок без запаха практически нерастворим в воде, растворим в разведенных минеральных кислотах с выделением перекиси водорода. Применяют при диспепсии, брожении в желудке и кишечнике, поносе. Эффект частично связан с действием магния окиси, частично — с образованием перекиси водорода при растворении препарата в кислом содержимом желудка. Назначают по 0,25 — 0,5 г 3 — 4 раза в день перед едой или после еды. Форма выпуска: порошок. Хранение: в хорошо укупоренной таре в защищенном от света месте. Rр.: Маgnеsii реrохуdi 0,25 (0,5) D.t.d. N. 12 S. По 1 порошку 3 раза в день
Словарь медицинских препаратов. 2005.
- Magnesii oxydum
- Magnesii peroxydum
Смотреть что такое «МАГНИЯ ПЕРЕКИСЬ» в других словарях:
Магния карбонат основной — Магния карбонат (Magnesii carbonas) Химическое соединение ИЮПАК Карбонат магния Брутто формула MgCO … Википедия
ПЕРЕКИСЬ ВОДОРОДА — (Hydrogenium hy peroxy datum, Hydrogenium peroxy datum), h302, сиропообразная жидкость, прозрачная, в тонких слоях бесцветная, в толстых голубого цвета, в 1х/2 раза тяжелее воды, металлического острого вкуса, растворяется в любых отношениях в… … Большая медицинская энциклопедия
Пероксид магния — Общие Систематическое наименование Пероксид магния Традиционные названия Перекись магния Химическая формула MgO2 Физические свойства Состояние ( … Википедия
Magnesii peroxydum — МАГНИЯ ПЕРЕКИСЬ ( Маgnesii рeroxydum ). Смесь магния окиси (85 %) с магния перекисью (15 %). Синонимы: Магния пергидроль, Маgnеsium реrохуdatum, Маgnium реrохуdatum. Белый порошок без запаха практически нерастворим в воде, растворим в разведенных … Словарь медицинских препаратов
Кислотный рикошет — Различные антацидные препараты Антациды (от греч. ἀντἰ против, лат. acidus кислый) лекарственные препараты, предназначенные для лечения кислотозависимых заболеваний желудочно кишечного тракта посредством нейтрализации соляной кислоты, входящей … Википедия
Маалукол — «Алмагель», «Алтацид», «Алюмаг», «Гастрацид», «Маалокс», «Маалукол», «Палмагель» Состав Алгелдрат антацид и адсорбент Магния гидроксид антацид Классификация Фарм. группа Антациды и адсорбен … Википедия
Палмагель — «Алмагель», «Алтацид», «Алюмаг», «Гастрацид», «Маалокс», «Маалукол», «Палмагель» Состав Алгелдрат антацид и адсорбент Магния гидроксид антацид Классификация Фарм. группа Антациды и адсорбен … Википедия
Магний — I Магний (Magnesium, Mg) химический элемент главной подгруппы II группы периодической системы Д.И. Менделеева, один из важнейших биоэлементов, необходимый для нормального функционирования организма. Содержание М. в крови является информативным… … Медицинская энциклопедия
Пероксид водорода — Пероксид водорода … Википедия
Серебро химический элемент — (Argentum, argent, Silber), хим. знак Ag. С. принадлежит к числу металлов, известных человеку еще в глубокой древности. В природе оно встречается как в самородном состоянии, так и в виде соединений с другими телами (с серой, напр. Ag 2S… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Магний пероксид — Справочник химика 21
Для получения пероксида магния в стакан с 35 мл 30 %-го раствора пероксида водорода внесите, постепенно перемешивая механической мешалкой, 10 г MgO, следя за тем, чтобы температура смеси не превышала 30 °С (охлаждение). После внесения всей навески оксида магния смесь перемешивайте еще в течение 1,5—2 ч. Образовавшийся осадок отфильтруйте, отожмите и высушите тонким слоем при 50—60°С. Выход пероксида магния составляет около 85 %. [c.108]Воспламеняющиеся реактивы — пероксиды натрия, калия, лития, магния, стронция, бария, цинка, а также пероксид водорода, азотная кислота и ее соли, соли кислот азотистой, хлористой, хлорноватой, йодной, йодноватой, хлорная кислота и ее соли, соли надборной, надсерной и марганцевой кислот, хромовый ангидрид и соли хромовых кислот. Все эти соединения негорючи, но, разлагаясь, они выделяют кислород, способствующий горению других веществ, а следовательно, интенсивному развитию пожара. Не менее важной особенностью этих веществ является их способность не только воспламеняться, но и взрываться в смеси с другими веществами. [c.38]
Суспензионная полимеризация стирола протекает в водной среде в присутствии инициаторов полимеризации, растворимых в мономере и нерастворимых в воде. Поэтому, реакция осуш е-ствляется как бы в объеме маленького блока (капли). Инициаторами реакции являются органические перекиси пероксид бензоила, трет-бутилпербензоат и др. Для повышения устойчивости суспензии стирола в воду добавляют стабилизаторы, например, гидроксид магния, поливиниловый спирт и др. Полученный ПС легко отделяется от водной фазы и осаждается на дне реактора. [c.395]
Получение марганца алюмотермией. В фарфоровый тигель возьмите 10 г пиролюзита и прокалите его при температуре 800 С в течение 1 ч. Полученный продукт охладите и перемешайте в ступке с 3 частями порошкообразного алюминия. Смесь поместите в фарфоровый тигель, уплотните ее, вставьте посредине магниевую ленту, зачищенную наждачной бумагой, и сверху насыпьте 10 частей зажигательной смеси. Зажигательную смесь приготовьте, осторожно свешивая в стакане 10 частей пероксида бария с 1 частью магния (или алюминия). Тигель закройте асбестовой крышкой с отверстием для магниевой ленты, поставьте на песочную баню (опыт проводите в вытяжном шкафу), погрузив стенки тигля в песок на /з глубины. Затем длинной лучинкой подожгите магниевую ленту (опыт проводите в присутствии преподавателя). Наблюдайте бурную реакцию восстановления марганца алюминием. После охлаждения тигель разбейте и выньте королек металла. [c.120]
Сильнодействующие окислители (хлорат магния, пероксид водорода и др.) должны храниться изолированно от других химических веществ и реактивов. [c.41]
Оксид магния MgO расходуется для производства цемента и огнеупорного кирпича, в резиновой промышленности в качестве белого наполнителя и вулканизатора карбоксилсодержащих каучуков. При повышенной кислотности желудочного сока, изжоге, отравлении кислотами MgO принимают внутрь. Пероксид магния MgOj используется как дезинфицирующее средство при расстройствах желудка, а в текстильной промышленности под названием н о в о з о н служит для отбеливания тканей. [c.405]
Реактивы и оборудование. Кусочек хорошо очищенной магниевой ленты длиной 8—10 см. Порощок магния. Пероксид бария. Алюминий в крупинках. Порошкообразный оксид железа. Графитовый тигель (около 100 мл). Глубокий поднос с песком. Щипцы. Пробирка с отрезанным дном (или отрезок широкой трубки). [c.43]
После сушки над сульфатом магния пероксид можно непосредственно использовать для инициирования радикальных реакций. [c.411]
Магний, как уже отмечалось, проявляет некоторое сходство о литием. Для Mg и Ы характерны нестабильность пероксидов, легкость получе иия нитридов, образование кристаллогидратов хорошо растворимых солей. Катионы Ы+ и M.g одинаково ведут себя во многих аналитических реакциях. 6 сходстве свойств соединений магния и лития свидетельствует зависимость, приведенная на рис. 3.7. Как следует из рис. 3.7, для каждого однотипного соединения [c.321]
Пероксид магния MgOj — белый порошок, плохо растворимый в воде. На воздухе в отсутствие влаги выдерживает нагревание без заметного разложения до 120 °С. В присутствии влаги медленно выделяет кислород. [c.108]
Приборы и реактивы. Прибор для получения сероводорода. Стакан. Тигель № 1. Фарфоровая чашечка (с1 = 3.— 4 см). Железная полоска. Цинк (гранулированный порошок). Натрий. Церий или мишметалл. Диоксид марганца. Мод кристаллический. Магний лента. Пероксид бария. Сульфат натрня. Сульфит натрия. Нитрит калия. Сульфид железа. Нитрат меди Си(Ы0з)2-ЗН20, Висмутат натрня. Дихромат аммоиия. Пероксодисульфат калия или аммония. Спирт этиловый. Растворы сероводородная вода хлорная вода бромная вода йодная вода крахмала фенолфталеина щавелевой кислоты (0,5 н,) серной кислоты (2 и. 4 и, плотность 1,84 г/см ) хлороводородной кислоты (2 н. плотность 1,19 г/см ) азотной кислоты (0,2 н. 2 н.) уксусной кислоты (2 и.) гидроксида натрня или калия (2 и.) аммиака (2 н. 25%) сульфата марганца (0,5 и.) сульфата меди (0,5 н,) сульфита натрня (0,5 н,) хлорида олова (11) (0,5 и,) дихромата калия (0,5 н.) перманганата калия (0,5 н,) нитрата ртути (II) (0,5 н,) нитрата серебра (0,1 н.) формальдегида (10%-ный) пероксида водорода (3%-ный) иодида калия (0,5 н.) сульфата цинка (0,5 и.) хлорида железа (111) (0,5 и.) гексацнано-феррата (III) калия (0,5 н.) соли ттана (IV) (0,5 и.) сульфида натрия нли аммония (0,5 и,) гидроксида натрия (2 н,). [c.94]
Наряду с обычными оксидами щелочноземельные металлы в отличие от бериллия и магния образуют пероксиды [c.484]
Объясните, почему подкисленный бесцветный раствор Т С14 становится фиолетовым после добавления металлического магния II снова обесцвечивается после добавления пероксида водорода Напишите уравнения этих реакций. [c.318]
Колебательные спектры (главным образом ИК-) известны для достаточно широкого круга соединений элементов главной и побочной подгрупп 1-1У фупп Периодической таблицы, а именно для Л-, N3-, К-солей гидропероксидов для магний-, цинк-, кадмий-, ртутьсодержащих пероксидов для пероксидных соединений алюминия,таллия и таллия, а также для органических пероксидов элементов IV группы — кремния, германия, олова, свинца и титана (литературу см. в [23], а также в 138-141]). В табл. 2.54 приведены частоты наиболее характерных поглощений некоторых элементоорганических пероксидных соединений. [c.160]
Примеч. Катион меди(П) в П5 — хлорид меди(П). Приготовление зажигательного состава для Оп. 7 пероксид бария (тв, порошок, 0,90 г) + магний (тв, порошок, 0,10 г), смешать встряхиванием в склянке/(осторожно не растирать ). Зажигательный состав поместить компактно в углубление уплотненной реакционной смеси, туда же поместить отрезок магниевой ленты. Для приготовления зажигательного состава можно использовать вместо пероксида бария —
Магний — Википедия
| Магний | |
|---|---|
| ← Натрий | Алюминий → | |
| лёгкий, ковкий, серебристо-белый металл | |
 | |
| Название, символ, номер | Магний / Magnesium (Mg), 12 |
| Атомная масса (молярная масса) | [24,304; 24,307][комм 1][1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 |
| Радиус атома | 160 пм |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность | 1,31 (шкала Полинга) |
| Электродный потенциал | −2,37 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
| Плотность (при н. у.) | 1,738[2] г/см³ |
| Температура плавления | 650 °C (923 K)[2] |
| Температура кипения | 1090 °C (1363 K)[2] |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 131,8 кДж/моль |
| Молярная теплоёмкость | 24,90[3] Дж/(K·моль) |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=0,32029 нм, c=0,52000 нм |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Номер CAS | 7439-95-4 |
 | |
 Металлический магний
Металлический магнийМа́гний — элемент второй группы (по старой классификации — главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета.
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари назвали её «горькой солью», а также «английской» или «эпсомской солью». Минерал эпсомит представляет собой кристаллогидрат сульфата магния и имеет химическую формулу MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт выделил из белой магнезии восстановлением углём неизвестный металл, названный им австрием. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом[4].
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах. В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.
Природный магний состоит из смеси 3 стабильных изотопов 24Mg, 25Mg и 26Mg с молярной концентрацией в смеси 78,6 %, 10,1 % и 11,3 % соответственно.
Все остальные 19 изотопов нестабильны, самый долгоживущий из них 28Mg с периодом полураспада 20,915 часов.
Кларк магния — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
- морская вода — (0,12—0,13 %),
- карналлит — MgCl2 • KCl • 6H2O (8,7 %),
- бишофит — MgCl2 • 6H2O (11,9 %),
- кизерит — MgSO4 • H2O (17,6 %),
- эпсомит — MgSO4 • 7H2O (9,9 %),
- каинит — KCl • MgSO4 • 3H2O (9,8 %),
- магнезит — MgCO3 (28,7 %),
- доломит — CaCO3·MgCO3 (13,1 %),
- брусит — Mg(OH)2 (41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь)[5][6], а затем в лавах в Южном Гиссаре (Таджикистан)[7].
Природные источники магния[править | править код]
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая[8][9].
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
- MgCl2→Mg+Cl2{\displaystyle {\mathsf {MgCl_{2}\rightarrow Mg+Cl_{2}}}}
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
- MgO+C→Mg+CO{\displaystyle {\mathsf {MgO+C\rightarrow Mg+CO}}}
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
- CaCO3⋅MgCO3→CaO+MgO+2CO2{\displaystyle {\mathsf {CaCO_{3}\cdot MgCO_{3}\rightarrow CaO+MgO+2CO_{2}}}}
Затем сильный нагрев с кремнием:
- 2MgO+CaO+Si→CaSiO3+2Mg{\displaystyle {\mathsf {2MgO+CaO+Si\rightarrow CaSiO_{3}+2Mg}}}
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта довольно прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Скорость воспламенения магния намного выше скорости одёргивания руки, поэтому при поджоге магния человек не успевает одёрнуть руку и получает ожог. На горящий магний желательно смотреть только через темные очки или стекло, так как в противном случае есть риск получить световой ожог сетчатки и на время ослепнуть.
Плотность магния при 20 °C — 1,738 г/см³, температура плавления 650 °C, температура кипения 1090 °C[2], теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Фазовый переход в сверхпроводящее состояние[править | править код]
При температуре Тс= 0,0005 К магний (Mg) переходит в сверхпроводящее состояние.
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и света:
- 2Mg+O2→2MgO+1203{\displaystyle {\mathsf {2Mg+O_{2}\rightarrow 2MgO+1203}}} кДж
- 3Mg+N2→Mg3N2{\displaystyle {\mathsf {3Mg+N_{2}\rightarrow Mg_{3}N_{2}}}}
Магний хорошо горит даже в углекислом газе:
- 2Mg+CO2→2MgO+C{\displaystyle {\mathsf {2Mg+CO_{2}\rightarrow 2MgO+C}}}
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
- Mg+h3O→MgO+h3+75 kcal{\displaystyle {\mathsf {Mg+H_{2}O\rightarrow MgO+H_{2}+75\ kcal}}}
Возможна также реакция:
- Mg+2h3O→Mg(OH)2+h3↑+80,52 kcal{\displaystyle {\mathsf {Mg+2H_{2}O\rightarrow Mg(OH)_{2}+H_{2}\uparrow +80,52\ kcal}}}
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
- Mg+2HCl→MgCl2+h3↑{\displaystyle {\mathsf {Mg+2HCl\rightarrow MgCl_{2}+H_{2}\uparrow }}}
Смесь порошка магния со взрывом реагирует с сильными окислителями, например с сухим перманганатом калия.
Также следует упомянуть реактивы Гриньяра, то есть алкил- или арилмагнийгалогениды:
- RHal+Mg→(C2H5)2ORMgHal{\displaystyle {\mathsf {RHal+Mg{\xrightarrow[{}]{(C_{2}H_{5})_{2}O}}RMgHal}}}
Где Hal = I, Br, реже Cl.
Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида
- TiCl4+2Mg→Ti+2MgCl2{\displaystyle {\mathsf {TiCl_{4}+2Mg\rightarrow Ti+2MgCl_{2}}}}
- UF4+2Mg→U+2MgF2{\displaystyle {\mathsf {UF_{4}+2Mg\rightarrow U+2MgF_{2}}}}
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет. Со второй половины XX века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита — ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы[править | править код]
Сплавы на основе магния являются важным конструкционным материалом в космической, авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Из магниевого сплава изготавливались картеры двигателей бензопилы «Дружба» и автомобиля «Запорожец», ряда других машин. Сейчас из этого сплава производятся легкосплавные колёсные диски.
Химические источники тока[править | править код]
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства энергоёмких резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высокой ЭДС.
Соединения[править | править код]
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его компактного хранения и получения.
Огнеупорные материалы[править | править код]
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с применением магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело[править | править код]
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Медицина[править | править код]
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяются в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния). В то же время, использование солей магния в кардиологии при нормальном уровне ионов магния в крови является недостаточно обоснованным[10].
Фотография[править | править код]
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы[править | править код]
Магниево-серные батареи являются одними из самых перспективных, теоретически превосходя ёмкость ионно-литиевых, однако пока эта технология находится на стадии лабораторных исследований в силу непреодолимости некоторых технических препятствий[11].
Производство в России сосредоточено на двух предприятиях: г. Соликамск (СМЗ) и г. Березники (АВИСМА). Общая производительность составляет, примерно, 35 тыс. тонн в год.[12]
Цены на магний в слитках в 2006 году составили в среднем 3 долл./кг. В 2012 году цены на магний составляли порядка 2,8—2,9 долл./кг.
Токсикология[править | править код]
Соединения магния малотоксичны (за исключением солей таких ядовитых кислот, как синильная, азотистоводородная,
Перхлорат магния — Википедия
Материал из Википедии — свободной энциклопедии
| Перхлорат магния | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | перхлорат магния |
| Хим. формула | Mg(ClO4)2 |
| Молярная масса | 223,2 г/моль |
| Плотность | 2,60 г/см³ |
| Температура | |
| • разложения | 251 °C[1] |
| Энтальпия | |
| • образования | 568,90 кДж/моль |
| Растворимость | |
| • в воде | 47,80; 49,9025; 52,150 г/100 мл |
| Рег. номер CAS | 10034-81-8 |
| PubChem | 24840 |
| Рег. номер EINECS | 233-108-3 |
| SMILES | |
| InChI | |
| RTECS | SC8925000 |
| ChemSpider | 23223 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Перхлора́т ма́гния (торговое название — ангидро́н) — Mg(ClO4)2, магний хлорнокислый, магниевая соль хлорной кислоты.
Представляет собой белый порошок или белую пористую массу, очень энергично поглощает влагу (до 60 % от своей массы) с образованием кристаллогидрата.
Сильный окислитель, при смешивании с органическими веществами образует взрывчатые смеси чувствительные к удару.
Применяется для глубокой осушки неокисляющихся газов.
Перхлорат магния и другие перхлораты обнаружены на Марсе спектральным методом[2].
Получают взаимодействием гидроксида магния с хлорной кислотой:
- Mg(OH)2+2HClO4⟶Mg(ClO4)2+2h3O⋅{\displaystyle {\ce {Mg(OH)2 + 2HClO4 -> Mg(ClO4)2 + 2h3O.}}}
Образует кристаллогидрат состава Mg(ClO4)2⋅2h3O{\displaystyle {\ce {Mg(ClO4)2.2h3O}}}.
Разлагается при нагреве свыше 251 °C[1].
При растворении в воде выделяется много тепла, поэтому при растворении воду берут с избытком.
Хорошо растворяется во многих полярных растворителях.
Применяется для глубокой осушки негорючих газов, при малой влажности осушаемого газа не расплывается, а постепенно затвердевает, при этом возможно блокирование газового потока в осушителе.
При насыщении влагой просто перестаёт поглощать влагу не расплываясь, в отличие от пентоксида фосфора Р2О5, который может превратиться в жидкий раствор ортофосфорной кислоты. При высокой влажности газа и высоких расходах пентоксид фосфора может оказаться предпочтительнее, так вначале поглощения влаги он превращается в резиноподобную массу и не блокирует прохождение газа через осушитель[5].
Давление насыщенного водяного пара над безводным перхлоратом магния при 20 °C составляет 70 мПа, для сравнения, давление насыщенного водяного пара над безводным пентоксидом фосфора 3 мПа при той же температуре. Давление насыщенного водяного пара над кристаллогидратом перхлората магния составляет 300 мПа при 20 °C.
Регенерация насыщенного влагой перхлората магния производят в вакууме при 220 °C.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ 1 2 Eintrag zu Magnesiumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018.
- ↑ Chojnacki, Matt; Massé, Marion; Hanley, Jennifer; James J. Wray; McEwen, Alfred S.; Murchie, Scott L.; Wilhelm, Mary Beth; Ojha, Lujendra. Spectral evidence for hydrated salts in recurring slope lineae on Mars (англ.) // Nature Geoscience : journal. — 2015. — Vol. 8, no. 11. — P. 829—832. — ISSN 1752-0908. — doi:10.1038/ngeo2546.
- ↑ Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12-18, doi:10.1016/S1074-9098(02)00294-0.
- ↑ Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286—297, doi:10.1021/ja01655a004.
- ↑ Чупин В. В. Методика анализа высоких концентраций сернистых компонентов в газе (неопр.) (12 октября 2009).
Карбид магния — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 сентября 2015; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 сентября 2015; проверки требует 1 правка.Карбид магния — бинарное неорганическое соединение магния и углерода с формулой MgС2. Известен также карбид магния с формулой Mg2C.[1]
- MgF2+CaC2 →τoC MgC2+CaF2{\displaystyle {\mathsf {MgF_{2}+CaC_{2}\ {\xrightarrow {\tau ^{o}C}}\ MgC_{2}+CaF_{2}}}}
- Mg+h3C2 →500oC MgC2+h3{\displaystyle {\mathsf {Mg+H_{2}C_{2}\ {\xrightarrow {500^{o}C}}\ MgC_{2}+H_{2}}}}
- Восстанавливая пентан порошком магния при 650 °C, можно получить более сложный карбид Mg2C3{\displaystyle {\ce {Mg2C3}}}.
Карбид магния образует кристаллы тетрагональной сингонии, параметры ячейки a = 0,555 нм, c = 0,503 нм, Z = 4.[источник не указан 2117 дней]
- При нагревании разлагается с образованием промежуточного карбида Mg2С3:
- MgC2 →−C570−610oC Mg2C3 →700oC Mg+C{\displaystyle {\mathsf {MgC_{2}\ {\xrightarrow[{-C}]{570-610^{o}C}}\ Mg_{2}C_{3}\ {\xrightarrow {700^{o}C}}\ Mg+C}}}
- Взаимодействует с водой:
- MgC2+2 h3O → Mg(OH)2+h3C2{\displaystyle {\mathsf {MgC_{2}+2\ H_{2}O\ {\xrightarrow {\ }}\ Mg(OH)_{2}+H_{2}C_{2}}}}
- ↑ Synthesis of Mg2C: A Magnesium Methanide — Wiley Online Library
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
