аспекты формирования болевого синдрома, хирургическое лечение с использованием микрокраниотомии
%PDF-1.3 % 1 0 obj > endobj 5 0 obj /Title >> endobj 2 0 obj > endobj 3 0 obj > stream

Профилактика и лечение осложнений со стороны нижнечелюстного нерва в дентальной имплантологии
Дентальные имплантаты решают массу проблем при сложном протезировании, когда имеются трудности восстановления приемлемой функции. При установке имплантатов в нижней челюсти возникает значительный риск повреждения какой-либо из периферических ветвей (нижнего альвеолярного, подбородочного, язычного нерва) нижнечелюстной части тройничного нерва.
Хотя нарушение чувствительности является известным и ожидаемым риском некоторых стоматологических (терапевтических и хирургических) вмешательств, несмотря на оказание самой качественной помощи наиболее квалифицированными специалистами, неврологические осложнения в настоящее время являются второй по частоте причиной возбуждения исков против стоматологов в Соединенных Штатах.
Нарушение чувствительности структур полости рта имеет большое значение с психологической и функциональной точек зрения. Анестезия, болезненность или гиперчувствительность могут появляться в области губ, щек, зубов, десен или языка.
Повреждения нерва не всегда разрешаются самостоятельно. Однако, у некоторых пациентов их можно успешно лечить с помощью использования микрохирургических методик, при условии выполнения их вовремя. У других пациентов симптомы повреждения нерва могут быть эффективно устранены, при применении адекватной нехирургической терапии.
Повреждения нижнего альвеолярного, подбородочного или язычного нервов появляются в результате компрессии, размозжения, растяжения, частичного или полного разрыва. В имплантологической практике разрыв нерва может произойти при проведении разреза слизистой или при сверлении кости для подготовки остеотомического отверстия с целью введения имплантата.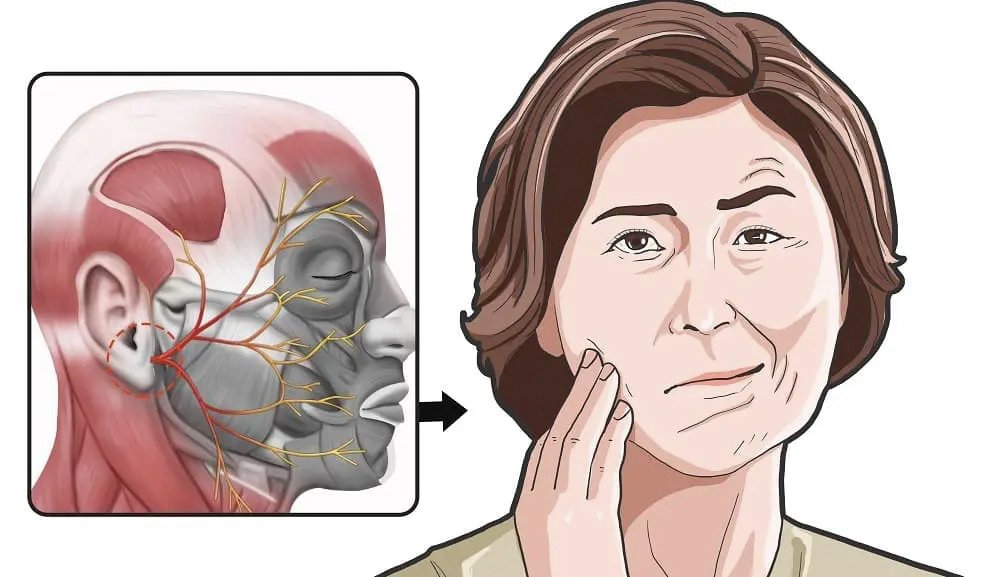
Тщательное планирование и квалифицированное выполнение манипуляций минимизируют риск повреждения нерва. Панорамные и периапикальные ренгенограммы, дополненные сканированием (при наличии показаний), позволяют определить высоту альвеолярного отростка над нервом, медиальнолатеральную и вертикальную локализацию канала нижнечелюстного нерва и подбородочного отверстия. Аккуратное проведение разрезов мягких тканей помогает избежать прямого контакта с подбородочным и язычным нервом, а нежная ретракция лоскута минимизирует непрямое растягивание нерва.
При отсутствии достаточной высоты альвеолярного отростка для установки имплантата без риска повреждения канала нижнечелюстного нерва, показана латерализация нижнечелюстного нерва. Имплантаты можно установить во время выполнения этой операции (рис. 1-3).
Рисунок 1. Репозиция нерва. Нижний альвеолярный нерв препятствует адекватной установке имплантата.
Рисунок 2. Трансоральная репозиция нерва и его латеральная ретракция.
Рисунок 3. Имплантаты установлены в желаемом положении и на необходимой глубине, произведена репозиция нерва.
Seddon описал три типа повреждения нерва: невропраксия, аксонотмезис и нейротмезис. Такая классификация основана на связи между патофизиологией повреждения нерва, способностью нерва к регенерации и клинической симптоматикой, которая формирует основу для определения прогноза спонтанного восстановления чувствительности, показаний и сроков хирургического вмешательства или другой терапии.
Невропраксия является доброкачественным состоянием. Существует временное нарушение чувствительности, но нет анатомического повреждения нерва. Возможно спонтанное восстановление чувствительности в течение 4 недель.
Аксонотмезис представляет собой более серьезное состояние, при котором имеется частичное анатомическое нарушение целостности нерва и неполная дегенерация нерва дистальнее повреждения. Первоначальные симптомы восстановления чувствительности не появляются раньше, чем через 6-8 недель после повреждения. Восстановление может быть неполным (гипоестезия) и часто сопровождается болезненными ощущениями (дисестезия).
Невротмезис — это полное пересечение нерва или другое полное нарушение его целостности с тотальной дегенерацией участка нерва дистальнее повреждения. Имеется небольшая надежда или даже нет никакой надежды на спонтанное восстановление. Если у пациента сохраняется полная анестезия в течение 3 месяцев после повреждения, чувствительность редко восстанавливается в значительной степени.
Документация факта повреждения нерва необходима для оценки дефицита чувствительности, решения о целесообразности и сроков проведения операции или другого вида лечения, а также из юридических соображений.
В анамнезе необходимо отметить причину проведения операции, дату повреждения и симптомы изменения чувствительности (если таковые имеются).
Проводится исследование с целью оценки выраженности нарушения чувствительности, для чего используют нейросенсорные тесты (реакция на раздражающие стимулы, статичное электричество, виталометр и др.). Повторная оценка проводится через каждые 4 недели до того момента, как чувствительность станет приемлемой или не возникнет необходимость в проведении другого хирургического вмешательства.
Показания к проведению хирургического вмешательства с целью устранения последствий повреждения нерва основываются на собственном опыте автора, включающем наблюдение за более чем 1000 пациентов и выполнение 375 микрохирургических вмешательств с целью устранения повреждений нерва, 21 из которых возникло в результате установки дентальных имплантатов в период с 1987 по 1996 год. Мнение автора относительно показаний к проведению оперативных вмешательств разделяют многие специалисты в области микрохирургии.
- Открытое (визуализируемое) повреждение нерва должно быть устранено как можно раньше. Такие повреждения обычно встречаются во время операций с целью установки имплантатов.
- Закрытые (не визуализируемые) повреждения необходимо устранять в следующем порядке:
- Анестезия, продолжающаяся более 3 месяцев, устраняется ушиванием или трансплантацией нерва.
- Дисестезия, неприемлемая для пациента и продолжающаяся более 4 месяцев, устраняется при открытой ревизии нерва путем его внешней декомпрессии, внутреннего невролиза, иссечения невромы, ушивания и трансплантации нерва.

- Тяжелая гипоестезия, неприемлемая для пациента и продолжающаяся более 4 месяцев, может быть устранена посредством удаления или частичного вывинчивания имплантата, а также с помощью открытой ревизии нерва и выполнения описанных выше манипуляций.
- В общем, пациенты, у которых нормальная чувствительность не восстанавливается чере 4 недели после операции, должны быть направлены к специалисту в области микрохирургии, который сможет наблюдать пациента и вовремя изменять план лечения, по необходимости.
В общем, удаление имплантата не способствует устранению повреждения нерва при раннем лечении повреждения нерва. Повреждение нерва чаще происходит при проведении разреза, ретракции лоскута или во время подготовки остеотомического отверстия. Компрессия нерва имплантатом, если только не слишком выраженная, редко приводит к постоянной травме нерва.
Дисестезия средней степени или синдром продолжительного (более 1 года) болезненного повреждения нерва иногда успешно устраняются с помощью проведения нехирургических методов лечения. Антиневралгические лекарственные средства (карбемазепин, фенитоин, клоназепам, баколофен) или антидепрессанты (амитриптилин, нотриптилин, имипрамин), местные аппликации (капсаицин) или составляющие местных анестетиков (микселитин), принимаемые перорально, помогают пациентам с тяжелой дисестезией, которым хирургическое лечение не показано или не помогло. Другие методы терапии (например, акупунктура, чрезкожная электрическая стимуляция нервной деятельности, психологическая или психиатрическая терапия, физиотерапия) могут играть определенную роль в лечении болезненных проявлений повреждения нерва.
Антиневралгические лекарственные средства (карбемазепин, фенитоин, клоназепам, баколофен) или антидепрессанты (амитриптилин, нотриптилин, имипрамин), местные аппликации (капсаицин) или составляющие местных анестетиков (микселитин), принимаемые перорально, помогают пациентам с тяжелой дисестезией, которым хирургическое лечение не показано или не помогло. Другие методы терапии (например, акупунктура, чрезкожная электрическая стимуляция нервной деятельности, психологическая или психиатрическая терапия, физиотерапия) могут играть определенную роль в лечении болезненных проявлений повреждения нерва.
Прогноз относительно улучшения или восстановления чувствительности после микрохирургии зависит от возраста пациента, технических навыков хирурга, продолжительности периода между фактом повреждения и оперативным вмешательством, направленным на устранение его последствий.
Из опыта автора, у 80-90% пациентов, страдающих невротмезисом (чаще выражается анестезией), прооперированных в период до 6 месяцев после повреждения, удавалось улучшить или восстановить чувствительность. Вмешательства, выполненные позже чем через 6 месяцев после травмы, приводили к улучшению у меньшего количества пациентов. При выполнении операций через 1 год после факта повреждения и позже приводили к улучшению состояния менее 10% пациентов. Больные, подвергшиеся хирургическому вмешательству с целью устранения дисестезии через 9 месяцев, достигали улучшения в 70% случаев, с ухудшением результатов при увеличении срока до операции.
Вмешательства, выполненные позже чем через 6 месяцев после травмы, приводили к улучшению у меньшего количества пациентов. При выполнении операций через 1 год после факта повреждения и позже приводили к улучшению состояния менее 10% пациентов. Больные, подвергшиеся хирургическому вмешательству с целью устранения дисестезии через 9 месяцев, достигали улучшения в 70% случаев, с ухудшением результатов при увеличении срока до операции.
Повреждение ветвей нижнечелюстного участка тройничного нерва является известным и ожидаемым риском при установке дентальных имплантатов. О подобном риске необходимо сообщать пациенту при получении его/ее информированного согласия. Знания нормальной анатомии и аккуратное выполнение манипуляций позволяют минимизировать риск возникновения осложнений.
Повреждения нервов, вызывающие неприемлемые изменения чувствительности, должны быть тщательно исследованы. Показания к проведению микрохирургического вмешательства разработаны. При выполнении операций вовремя квалифицированным специалистом в области микрохирургии удается достичь хороших результатов. Некоторым пациентам, показано проведение нехирургических методов терапии либо в дополнение к хирургическому лечению, либо в качестве основного лечения, когда пациент по каким-либо причинам не может являться кандидатом для выполнения микронейрохирургической операции.
Некоторым пациентам, показано проведение нехирургических методов терапии либо в дополнение к хирургическому лечению, либо в качестве основного лечения, когда пациент по каким-либо причинам не может являться кандидатом для выполнения микронейрохирургической операции.
Невропраксия — травма нерва, вызывающая паралич (без дегенерации нерва) с последующим полным восстановлением функций.
Аксонотмезис — перерыв аксона с последующим полным перерождением периферических отделов без нарушения опорных структур нерва.
Невротмезис — полный анатомический разрыв нерва.
Невралгия (Неврит):Причины,Симптомы,Лечение | doc.ua
Причины
Причины заболевания разные. Оно может развиться вследствие переохлаждения, травмы, заболеваний нервной системы. К нему может привести наличие инфекций и бактерий в организме, негативное действие медицинских препаратов, тяжелых металлов. Также болезнь развивается вследствие проблем с позвоночником и сердечнососудистой системой.
Симптомы
Выше уже говорилось, что главным симптомом невралгии является приступообразная боль. Иногда вместе с болью наблюдается покраснение, слезотечение, судороги. Часто боль приобретает постоянный характер, и тогда от нее удается избавиться только с помощью обезболивающих препаратов.
Виды невралгии
Различают несколько видов заболевания, которые зависят от того, какой вид нерва поражен.
Невралгия тройничного нерва
В этом состоянии больной ощущает резкую боль, которая может внезапно пронзить челюсть. Ощущения напоминают удар током. Боль распространяется на всю нижнюю часть лица и может достигать глаз. По-другому это состояние называют «невралгия лицевого нерва».
В большинстве случаев причиной является давление артерии. Оно возникает по двум причинам. Первая – повреждение лицевых ветвей нерва. Пациент жалуется на ноющие боли, у него немеет одна часть лица, другая становится более чувствительной. Вторая – повреждение мозговых центров нерва. В этом случае боль стреляющая, внезапно возникающая. Чувствительность кожи значительно снижается.
В этом случае боль стреляющая, внезапно возникающая. Чувствительность кожи значительно снижается.
Чаще всего от подобных поражений страдают женщины после 40 лет, реже – их ровесники-мужчины. Однако заболевание может постичь и маленьких детей.
Межреберная невралгия
Это состояние вызвано различными заболеваниями – перенесенными простудами, травмами, инфекциями, болезнями легких и плевры и т.д. Пациент ощущает опоясывающую боль в груди, чаще – с одной стороны. Боль усиливается при кашле, чихании, движении туловищем. На фоне этого теряется чувствительность.
Причинами развития этого вида заболевания называют травмы, остеохондроз, патологии легких, плевры, сердца. Также состояние может возникнуть вследствие наличия опухолей, повышенного мышечного тонуса.
Довольно часто на подобную проблему жалуются беременные во второй половине срока. В этом время растущая матка сдавливает грудную клетку, межреберное пространство деформируется, и происходит ущемление нервов. Виноват может быть и остеохондроз.
Виноват может быть и остеохондроз.
Невралгия седалищного нерва
Боль при этом состоянии охватывает довольно большую площадь тела. Отчасти это связано с тем, что седалищный нерв – самый крупный в теле человека. Он начинается в поясничном отделе, уходит в ногу и заканчивается в пальцах ступни.
Боль может быть разной. Это и жжение, и «мурашки» по телу, и онемение, и стреляющая боль. Довольно часто больной испытывает сразу несколько проявлений заболевания.
Причины проблемы могут быть самыми разными: травмы, чрезмерные нагрузки, артриты, диабет, запоры, сидячий образ жизни, дегенерация позвоночных дисков.
Невралгия затылочного нерва
Для этого состояния характерна головная боль. Она возникает в области затылка, часто отдает в глаза и переходит в переднюю часть головы. Боль – пульсирующая, жгучая, преимущественно односторонняя. Часто она появляется при повороте головы, и сопровождается тошнотой, рвотой, слезотечением.
Как и в предыдущих случаях, проблему вызывают травмы, инфекции, остеохондроз, поражения позвоночных дисков, а также подагра, остеоартрит. Также в зоне риска люди с сахарным диабетом, новообразованиями в затылочном отделе хребта, воспаленными сосудами.
Также в зоне риска люди с сахарным диабетом, новообразованиями в затылочном отделе хребта, воспаленными сосудами.
Поражение грудной клетки
В этом случае наблюдается острая боль по всему стволу нерва и его окончаний. Это происходит из-за сдавливания нерва или его раздражения. Болевые ощущения появляются после травм груди, вследствие аллергических реакций, нарушениях в работе центральной нервной системы, из-за инфекций. Причиной также является сниженный иммунитет, заболевания позвоночника, нагрузки на спинные мышцы. К заболеванию приводит злоупотребление алкоголем, нехватка витаминов группы В, болезни сердца.
Данный вид заболевания проявляется невыносимой болью в межреберье, которая усиливается при чихании, кашле, резком движении. Иногда состояние сопровождается утратой чувствительности кожи. Болезненные ощущения зачастую распространяются в область сердечной мышцы и лопатки, что в некоторых случаях воспринимается как сердечная болезнь.
Спина
Пораженный нерв в этом случае дает о себе знать тупой или острой болью. Она бывает периодической, сопровождается повышенным потоотделением, мышечной дрожью, покраснением или бледностью кожи. Заболевание начинается с мышечных спазмов, ощутимых при неловком движении, а также повышенных физических нагрузках, при принятии телом неудобной позы. Возникает боль после переохлаждения, пребывания на сквозняке, стрессовых ситуаций, травм спины. При этом появляется перенапряжение и спазм мышц спины, а нервные окончания раздражаются, возникает отек, в результате чего и образуется болевой синдром.
Она бывает периодической, сопровождается повышенным потоотделением, мышечной дрожью, покраснением или бледностью кожи. Заболевание начинается с мышечных спазмов, ощутимых при неловком движении, а также повышенных физических нагрузках, при принятии телом неудобной позы. Возникает боль после переохлаждения, пребывания на сквозняке, стрессовых ситуаций, травм спины. При этом появляется перенапряжение и спазм мышц спины, а нервные окончания раздражаются, возникает отек, в результате чего и образуется болевой синдром.
При боли спазм мышц усиливается, нервные скопления в области хребта защемляются, боль становится сильнее.
Наиболее опасны поражения в области поясницы, поскольку под угрозой находится седалищный нерв.
Невралгия языкоглоточного нерва
Довольно редкая форма заболевания. Она развивается в 30-40 летнем возрасте, чаще ею страдают женщины. Пациенты жалуются на приступообразные боли в корне языка или миндалины, которые отдают в горло, ухо, небо, нижнюю челюсть, боковую поверхность шеи.
Часто состояние сопровождается обильным слюноотделением, кашлем, покраснением лица, синкопальными состояниями с пониженным давлением. Пульс и мышцы слабеют, возможен обморок.
Боли – пароксизмальные, разной силы – от единичных слабых до прострелов. Приступ длится около двух минут. Иногда пациенты обнаруживают источник боли. При нажатии на эту зону начинается новый приступ. Его также может спровоцировать глотание слюны или пищи, разговор, горькая пища. Заболевание обостряется осенью-зимой. Существует и период ремиссии, когда больной чувствует себя нормально.
Эту форму заболевания вызывают проблемы в лор-органах, онкологические заболевания, аневризма сонной артерии и др.
Иногда тройничная невралгия схожа по своей симптоматике с данной формой заболевания, однако встречается первая намного чаще.
Постгерпетическая невралгия
Этот вид заболевания ведет к утрате пациентом трудоспособности. Болевые ощущения возникают после перенесенного опоясывающего лишая и именно в тех местах, где были высыпания. Появляются симптомы после того, как исчезают проявления лишая.
Появляются симптомы после того, как исчезают проявления лишая.
Заболевание характеризуется острой, пульсирующей, режущей болью. Иногда она настолько сильна, что требуется госпитализация. Между приступами ощущаются зуд и покалывание. Болевые ощущения зачастую возникают после желания человека почесать зудящие места. Поверхность кожи онемевает, присутствует обостренная реакция на внешние раздражители в местах поражения – прикосновение одежды, рук, изменения температуры.
Заболевание, в редких случаях, у пожилых пациентов может закончиться параличом и слабостью мышц.
Диагностика
Диагностируется заболевание достаточно просто во время осмотра. В случае необходимости врач-невролог может назначить электронейрографию. Если происходит масштабное воздействие на нервные структуры, что наблюдается при грыже, опухолях, протрузии межпозвонкового диска, то назначают магнитно-резонансную томографию.
Лечение
Как уже говорилось выше, патология может быть первичной и вторичной.
При вторичной форме упор делается на лечение основного заболевания. Терапия при первичных формах включает инъекции обезболивающих, прием витаминов группы В, местно назначают апикаин. Показаны и физиотерапевтические процедуры.
Для лечения заболевания применяют лазерный луч, иглоукалывание, импульсные токи, магнитные и электромагнитные поля, ультразвук, инфракрасное и ультрафиолетовое излучения. Если вышеописанные консервативные методы оказываются бессильны, проблему решают путем хирургического вмешательства.
Не стоит заниматься самолечением – это лишь усугубит болезнь.
Профилактика
- необходимо избегать сквозняков;
- употребление алкоголя, экстремальные виды спорта, нездоровый образ жизни приводят к травмам. Отсутствие вредных привычек и умеренные физические нагрузки помогут сохранить здоровье;
- нужно вовремя лечить болезни, при наличии хронических патологий (сахарный диабет, патологии сердца и сосудов) проходить периодический осмотр у врача;
- необходимо правильное питание, насыщенное витаминами и минералами.

К какому врачу идти при поражении тройничного нерва на DocDoc.ru
Неврологи Москвы — последние отзывы
Моя основная проблема остеохондроз. Был у разных неврологов, но сегодня кажется нашел своего доктора. Очень доброжелательна, профессиональна. Обследоваться приду на следующей неделе.
Николай, 18 ноября 2021
К неврологу Глинской меня записала моя подруга, она у нее лечилась и была очень довольна. И мне доктор помогла. Врач она отзывчивый и внимательный, долго со мной беседовала, выясняя характер и локализацию боли, осмотрела больное место бережно, но внимательно. Проблема выявлена лечение назначено, и оно мне уже начало помогать. Я довольна, в свою очередь тоже ее рекомендую.
И мне доктор помогла. Врач она отзывчивый и внимательный, долго со мной беседовала, выясняя характер и локализацию боли, осмотрела больное место бережно, но внимательно. Проблема выявлена лечение назначено, и оно мне уже начало помогать. Я довольна, в свою очередь тоже ее рекомендую.
Фарида, 17 ноября 2021
Рекомендую и буду рекомендовать этого великолепного специалиста. Индивидуальный подход в работе врача однозначно есть. Всегда следит за моими показателями, комплексно воздействует на очаг боли, а не просто старается избавиться от боли. Назначения недорогие, но очень толковые. Ничуть не жалею о сделанном выборе в пользу этого врача.
Назначения недорогие, но очень толковые. Ничуть не жалею о сделанном выборе в пользу этого врача.
Настя, 16 ноября 2021
Я очень переживала, что врач окажется неквалифицированный, но он оказался на высшем уровне. Кристина Сергеевна доброжелательный и внимательный доктор. Выслушала, не перебивала, обо всём подробно расспросила и всё чётко объяснила. Качественно выявила проблему. Подтвердила диагноз и мои какие-то сомнения. Врач назначил анализы и обследования. Через две недели пойду на повторный прием для назначения дальнейшего лечения. При необходимости буду рекомендовать этого специалиста знакомым.
При необходимости буду рекомендовать этого специалиста знакомым.
Ксения, 15 ноября 2021
Мне все понравилось. На приеме Наталья Александровна назначила лечение, сейчас прохожу. Планирую повторный прием через месяц. Пока непонятно помогает или нет, должно пройти время.
Кристина, 15 ноября 2021
Хороший, доброжелательный доктор. Помог решить мою проблему. Александр Ильич все доступно объяснил и ответил на все интересующие меня вопросы. Прием длился полчаса. Обратилась бы к данному специалисту повторно, при необходимости.
Помог решить мою проблему. Александр Ильич все доступно объяснил и ответил на все интересующие меня вопросы. Прием длился полчаса. Обратилась бы к данному специалисту повторно, при необходимости.
Анна, 06 ноября 2021
Прием прошел отлично все супер. Дмитрий Николаевич хороший врач. Мне все понравилось, все, что было нужно доктор назначил. Врач внимательный и компетентный, все было четко, вопросов у меня не осталось. Времени на приеме мне было уделено достаточно. Сто процентов буду рекомендовать специалиста своим знакомым.
Евгений, 05 ноября 2021
Андрей
Все хорошо. Все понравилось. Могу выделить профессиональный качества. В решении моего вопроса, Марина Юрьевна мне помогла. По времени достаточно внимания уделила. Хотел записаться к другому доктору, а в сервисе порекомендовали Носову Марину Юрьевну, так как тот врач был занят.
Все понравилось. Могу выделить профессиональный качества. В решении моего вопроса, Марина Юрьевна мне помогла. По времени достаточно внимания уделила. Хотел записаться к другому доктору, а в сервисе порекомендовали Носову Марину Юрьевну, так как тот врач был занят.
Андрей, 04 ноября 2021
Эмма Арамовна толковый специалист. Общается хорошо и по-человечески отнеслась к моему вопросу. На приёме мне было комфортно и приятно. Не знаю по поводу компетентности назначенный капельниц и лекарств. Но качество меня полностью устроило.
Павел, 03 ноября 2021
Все прошло отлично. Меня отлично проконсультировал врач. Я осталась довольна. Юлия Дмитриевна выслушала меня, достаточно времени уделила. При необходимости, я обращусь к ней повторно.
Меня отлично проконсультировал врач. Я осталась довольна. Юлия Дмитриевна выслушала меня, достаточно времени уделила. При необходимости, я обращусь к ней повторно.
Макка, 15 октября 2021
Показать 10 отзывов из 16212Невралгия тройничного нерва — симптомы, лечение, причины болезни, первые признаки
Описание
Невралгия тройничного нерва – патология, сопровождающаяся сильными стреляющими или жгучими болями, распространяющимися на всю половину лица или ее часть. Симптом имеет пароксизмальный характер, в подавляющем большинстве случаев выявляется только с одной стороны. Нарушения чувствительности отсутствуют. Наблюдается хроническое течение с чередованием периодов ремиссий и обострений. Частые мучительные приступы снижают трудоспособность и качество жизни, становятся причиной неврозов и депрессий. Лечение консервативное, при неэффективности терапии проводятся хирургические вмешательства.
Лечение консервативное, при неэффективности терапии проводятся хирургические вмешательства.
Невралгия тройничного (тригеминального) нерва является достаточно распространенным заболеванием, встречается у 30-50 пациентов на 100 тыс. населения. Заболеваемость составляет 2-4 человека на 100 тыс. Наиболее уязвимой категорией являются женщины постклимактерического возраста. Правая сторона лица страдает чаще левой. Двустороннее поражение выявляется у 3% больных. При продолжительном течении частота двусторонней невралгии увеличивается.
Причины
Невралгия тройничного нерва относится к числу полиэтиологических состояний. Известно более 50 причин развития, 95% из которых представляют собой сдавление нервного ствола и его ветвей различного генеза. При центральной форме патологии страдает Гассеров узел, расположенный в области пирамиды височной кости. При периферической форме поражаются ветви тройничного нерва. К числу провоцирующих факторов относятся:
- Болезни сосудов.
 При центральном варианте корешок сдавливается извитым или расширенным сосудом в области задней черепной ямки. Данный тип поражения наблюдается при аневризмах, артериальной гипертензии, церебральном атеросклерозе.
При центральном варианте корешок сдавливается извитым или расширенным сосудом в области задней черепной ямки. Данный тип поражения наблюдается при аневризмах, артериальной гипертензии, церебральном атеросклерозе. - Объемные образования. Центральную невралгию провоцируют эпидермоиды, неоплазии гипофиза, средней и задней черепной ямки. Возможно как непосредственное сдавление корешка опухолью, так и изменение расположения сосудов вследствие ее роста с последующей компрессией нерва артериальным стволом. Периферическая невралгия развивается при новообразованиях мягких тканей и костей лицевого скелета.
- Изменения твердых структур. Причиной центрального сдавления становится деформация костей при черепно-мозговых травмах. Периферическая компрессия возникает вследствие оссификации подглазничного отверстия или нижнечелюстного канала на фоне хронических отитов и гайморитов, стоматологических патологий: нарушений прикуса, деформаций зубного ряда, неправильно подобранных протезов.

В число других причин центральной невралгии входят острые нарушения мозгового кровообращения, воспалительные заболевания ЦНС (энцефалит, арахноидит), эндогенные интоксикации при обменных и эндокринных патологиях, отравления мышьяком, медью и свинцом. Провоцирующими факторами считаются период менопаузы, вирусные инфекции (ОРВИ, грипп) и хронический тонзиллит.
Особым вариантом является центральная тригеминальная невралгия, возникающая у пациентов с рассеянным склерозом. Она протекает более мягко, вызывается демиелинизацией нисходящего тракта и чувствительного корешка. Периферическая разновидность болезни развивается на фоне опоясывающего лишая, хронических инфекционных поражений полости рта: гингивита, стоматита, периодонтита.
Патогенез
Механизм формирования тригеминальной невралгии связывают с патологическими изменениями оболочки тройничного нерва. Из-за нарушений ее строения в нервном стволе формируется участок патологического гипервозбуждения. Большое количество импульсов с периферии поступает в центральные структуры, где также образуется фокус избыточного возбуждения, обуславливающий появление болевых ощущений.
Симптомы
Фото: mediso31.ru
Общая клиническая картина и особенности болевого синдрома при центральной и периферической невралгии практически идентичны. Болезненные ощущения чаще возникают в зоне иннервации 2 и 3 ветвей тройничного нерва, проходят от боковой поверхности к центру. При вовлечении 1 ветви локализуются в области надбровья, 2 ветви – в зоне скуловой дуги, 3 ветви – по ходу нижней челюсти. Поражение ствола характеризуется распространением болезненности на всю половину лица.
Первый пароксизм субъективно воспринимается настолько неожиданным, шокирующим и тяжело переносимым, что остается в памяти больных даже через много лет после манифестации заболевания. Реже в дебюте наблюдаются неопределенные неприятные ощущения «наэлектризованности» и зубная боль, которая вынуждает пациентов обращаться к стоматологу, иногда приводит к необоснованному удалению зубов и проведению ненужных процедур.
В последующем пароксизмы также развиваются внезапно. Могут быть спонтанными, но чаще провоцируются напряжением лицевых мышц при еде и разговоре, внешними воздействиями при бритье, умывании, контакте с холодным уличным воздухом и пр. Представляют собой серию крайне острых болевых импульсов.
Представляют собой серию крайне острых болевых импульсов.
Пациенты с невралгией тройничного нерва описывают свои ощущения, как «прохождение электрического тока», «разряд», «прострел». В момент появления боли человек застывает на месте, не говорят и не двигается, чтобы не вызвать усиления мучительных ощущений. Некоторые больные начинают глубоко дышать, растирают или сдавливают зону поражения, причмокивают или делают жевательные движения.
Продолжительность приступа невралгии тройничного нерва колеблется от нескольких секунд до 1-2 минут. В фазе обострения пароксизмы могут многократно повторяться в течение суток. В межприступном периоде неприятные ощущения полностью исчезают. В отдельных случаях отмечаются постоянные ломящие, давящие или колющие боли. В фазе ремиссии симптоматика отсутствует. Со временем «светлые промежутки» укорачиваются, течение болезни становится персистирующим.
Из-за возможного возникновения боли при нагрузке на жевательную и мимическую мускулатуру пациенты привыкают жевать на здоровой стороне, стараются исключить из рациона жесткие продукты, осторожно открывают рот, смеются и разговаривают. При длительном течении мышцы пораженной стороны несколько атрофируются. На здоровой стороне, напротив, возникают уплотнения, обусловленные постоянной перегрузкой и гипертрофией мускулатуры.
При длительном течении мышцы пораженной стороны несколько атрофируются. На здоровой стороне, напротив, возникают уплотнения, обусловленные постоянной перегрузкой и гипертрофией мускулатуры.
На фоне нарушений нервной регуляции кожа половины лица становится сухой. Могут появляться участки гиперпигментации, себорейная экзема. Иногда на больной стороне выпадают ресницы. При общей клинической картине существует ряд деталей, которые помогают различить невралгию тройничного нерва центрального и периферического генеза.
Центральная невралгия
У пациентов с данной формой болезни пароксизмам нередко предшествует вегетативная аура в виде слезотечения или локального повышения температуры кожи. У некоторых больных о приближении приступа свидетельствуют парестезии: покалывание, зуд или ощущение ползания мурашек. Вегетативные проявления сохраняются во время болевых импульсов. Наблюдаются обильное водянистое отделяемое из носа, слезотечение, покраснение лица, усиленное выделение слюны, реже – сухость ротовой полости. Возможны гиперкинезы в виде подергивания мышц глаза, подбородка и пр.
Возможны гиперкинезы в виде подергивания мышц глаза, подбородка и пр.
У большинства пациентов при осмотре больной стороны обнаруживаются триггерные точки – участки, при воздействии на которые возникает приступ. На коже они расположены в проекции губ, крыльев носа, подбородка и бровей, редко – в зоне слухового прохода. На слизистой полости рта их локализация более разнообразна – провоцировать пароксизмы может раздражение неба, альвеолярных отростков нижней или верхней челюсти и др.
Кроме того, у больных обнаруживаются точки Валле – болезненные участки в местах выхода ветвей тригеминального нерва. Возможным вариантом центральной невралгии является двухстороннее поражение. Клинические проявления те же, что при односторонних процессах. Болезненные ощущения могут появляться сначала на одной, а потом на другой половине лица, реже отмечаются с двух сторон одновременно.
Периферическая невралгия
Вегетативная аура отсутствует. Во время пароксизма вегетативные симптомы выражены не так ярко, как при центральном варианте поражения. Триггерные точки выявляются менее чем у половины больных (при центральной невралгии – у 84%). Показательны результаты диагностической блокады. После введения местного анестетика в зону появления боли приступы прекращаются на 1-2 часа, реже – на более длительный срок.
Осложнения
Наряду с вышеуказанными изменениями мышц (атрофией на больной и гипертрофией на здоровой стороне), поражением кожи и ее придатков, при длительном течении не исключено формирование сенсорного дефицита. Частые приступы существенно ухудшают качество жизни, приводят к развитию психоэмоциональных нарушений. Возможны ипохондрия, депрессивное расстройство, неврастения.
При триггерных точках на небе, языке и деснах больные не могут принимать пищу, выполнять основные гигиенические процедуры, нормально разговаривать. Наличие зон с таким расположением в сочетании с интенсивными болями приводит к отказу от еды, потере веса, астении, возникновению тяжелых депрессий, иногда – с суицидальными попытками.
Диагностика
Фото: oncc.ru
Определение характера патологии осуществляется врачом-неврологом, в большинстве случаев не представляет затруднений. На невралгию тройничного нерва указывают типичный характер приступов, наличие триггерных зон. Для уточнения причины заболевания назначают следующие процедуры:
- КТ черепа. Методика применяется для оценки расположения и размеров различных костных структур. Информативна при обнаружении сужений каналов и отверстий, на фоне которых возникает компрессия нерва.
- МРТ головного мозга. Позволяет выявлять этиофакторы центральной невралгии: новообразования, кисты, признаки рассеянного склероза.
- Магнитно-резонансная ангиография. Рекомендована для уточнения особенностей сосудов в зоне сдавления. Прицельное определение аневризм и других локальных поражений возможно только при достаточном размере измененного участка артерии.
В рамках дифференциальной диагностики исключают другие прозопалгии: ганглионит крылонебного, полулунного, ушного и цилиарного узла, невралгии ушно-височного, языкоглоточного и носоресничного нерва, иные расстройства. Кроме того, невралгию тройничного нерва различают с приступами пароксизмальной гемикрании и пучковой головной боли.
Иногда требуется дифференцировка с психогенными лицевыми болями. При подозрении на развитие риногенных, одонтогенных или офтальмогенных болей показаны соответственно консультации отоларинголога, стоматолога или офтальмолога.
Лечение
Фото: tbn-tv.com
Консервативная терапия
Основным методом лечения является терапия антиконвульсантами. Препараты данной группы предназначены для устранения эпилептических приступов, однако обладают высокой эффективностью и при невралгии тригеминального нерва. Лекарства хорошо устраняют болевой синдром. Могут применяться не только с лечебными, но и с диагностическими целями. В сложных случаях пациентам назначают прием противосудорожного средства в течение суток. Если боли купируются – это позволяет исключить другие болевые синдромы лица.
Лечение невралгии тройничного нерва начинают с минимальной дозы. В последующем дозировку постепенно увеличивают до тех пор, пока не удается добиться устойчивого клинического эффекта. Продолжительность курса составляет несколько месяцев. Отмену также производят постепенно, понемногу снижая дозу медикамента. Для повышения результативности терапии применяют следующие методы:
- Потенцирующие действие антиконвульсантов. Спазмолитики назначают для устранения боли, антигистаминные средства – для уменьшения отечности, корректоры микроциркуляции – для улучшения питания нерва.
- Лечебные блокады. Местные анестетики или их смесь с глюкокортикоидами вводят в курковые зоны, избегая попадания непосредственно в нерв. Целью процедуры является инфильтрация окружающих тканей. Методика позволяет быстро купировать болевой синдром.
- Физиопроцедуры. В остром периоде используют УВЧ, УФО, электрофорез с новокаином, платифиллином или димедролом, фонофорез анальгина, ультразвук. При особенно интенсивных болях рекомендуют синусоидальные модулированные токи, диадинамоэлектрофорез со специальной смесью препаратов. Хороший эффект отмечается при применении диадинамических токов.
Хирургическое лечение
При обнаружении объемного образования в полости черепа может потребоваться операция по его удалению. В остальных случаях хирургические вмешательства показаны при неэффективности консервативной терапии. В настоящее время предпочтение отдается малоинвазивным современным методам:
- Микрохирургическая декомпрессия. Сдавление устраняют через небольшое трепанационное отверстие за ухом. Из-за высоких рисков способ с осторожностью используют у пожилых больных и пациентов с тяжелой сопутствующей патологией.
- Стереотаксическая радиохирургия. Сенсорный корешок тригеминального нерва разрушают с помощью направленного гамма-излучения. Недостатком методики является онемение участков лица.
- Чрескожная радиочастотная деструкция. Плюсом метода считается отсутствие разрезов, минусом – достаточно высокая вероятность развития рецидивов.
Прогноз и профилактика
Исход зависит от причины возникновения невралгии, продолжительности болезни, наличия сопутствующих патологий. При раннем начале лечения невралгии тройничного нерва у больных молодого возраста нередко удается добиться хорошего эффекта с помощью консервативных методов. Вероятность рецидивирования после операций составляет около 10%.
В рамках первичной профилактики необходимо своевременно лечить атеросклероз, гипертоническую болезнь, воспалительные стоматологические и отоларингологические заболевания. Вторичные превентивные меры заключаются в соблюдении рекомендаций врача, исключении факторов, провоцирующих новые пароксизмы, профилактическом приеме противосудорожных средств при развитии острых инфекций (гриппа, ОРВИ).
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.ПОИСК ЛЕЧЕНИЯ ПО ВСЕМУ МИРУ ВМЕСТЕ С YELLMEDОставить заявку
Источники
- Невралгия тройничного нерва. Учебное пособие/ Гайворонская Т.В. и др. – 2012.
- Невралгия тройничного нерва/ Афанасьева Е.В. – 2008.
- Неврология/ Пирадов В.А., Максимова М.Ю. – 2015.
- Тригеминальная невралгия: патогенетические и клинические особенности, методы патогенетически обоснованного лечения. Лекция/ Тюрников М.В., Грачев Ю.В.// Патогенез – 2013 – Т.11, №4.
Ваши комментарии о симптомах и лечении
Поражение нерва во время имплантации: диагностика, лечение, профилактика
Повреждение ветвей тройничного нерва (например, нижнего альвеолярного, языкового, подбородочного или подглазничного) является потенциальным осложнением, которое может развиться в ходе выполнения процедуры дентальной имплантации.
Непосредственно поражение нервного волокна может быть спровоцировано травмой, воспалением или результатом действия инфекционного фактора. Чаще всего ветви тройничного нерва поражаются во время манипуляций анестезии, сепарации лоскута, забора костного аугментата, остеотомии и непосредственно установки титановой внутрикостной опоры. Поскольку восстановление пораженных нервных волокон является довольно проблематичным, лучшая тактика лечения подобных осложнений – это профилактика. Поэтом врачу крайне важно понимать особенности гистологии и анатомии нервов челюстно-лицевой области, и быть информированным о симптомах, которые чаще всего сопровождают их поражения. Также клиницист должен учитывать аспекты дифференциальной диагностики, чтобы правильно установить причину развития тех или иных симптомов, основываясь на которых в дальнейшем ему придется проводить соответствующее лечение. Варианты лечения поражений ветвей тройничных нервов включают применение различных фармакологических препаратов, мониторинг с физиотерапией, или даже удаление проблемного дентального имплантата.
В данной статье мы обсудим подходы к лечению стоматологических пациентов с поражением нервов челюстно-лицевой области ассоциированных с процедурой дентальной имплантации, а также основные аспекты этиологии и патогенеза подобных патологий в целом.
Анатомия и гистология тройничного нерва
Тройничный нерв представляет собой пятую и наибольшую пару черепных нервов, которая состоит из следующих ветвей: очного нерва (V1), верхнечелюстного нерва (V2) и нижнечелюстного нерва (V3). Нижнечелюстной нерв является самой большой ветвью и иннервирует нижнюю губу, область подбородка, зубы, смежные мягкие ткани, нижнюю челюсть и часть наружного уха. Двигательные волокна нижнечелюстного нерва не поддаются повреждению во время процедуры имплантации, поскольку они отходят от основной ветви V3 еще до выхода из подбородочного отверстия. Основной структурной единицей нерва является нервное волокно. В структуре V3 преобладают миелинизированные нервные волокна. Каждый аксон и шванновская клетка покрыты соединительной тканью, которая называется эндоневрием. Группы нервных волокон формируют пучки, которые окружены эпиневрием. Поражение любой части нервного пучка может привести к нейросенсорным нарушениям. Тройничный нерв состоит с 7000-12000 аксонов, а количество пучков варьирует в разных участках челюстно-лицевой области. Нижний альвеолярный нерв (НАН) является полипучковым (состоит больше чем из 10 пучков), в то время как язычный нерв включает лишь несколько аналогичных нервных структур. Поскольку НАН характеризуется большим количеством нервных пучков его регенераторные способности также значительно выше по сравнению с язычным нервом.
Типы нервных поражений
Поражения тройничного нерва могут быть спровоцированы компрессией, растяжением, полным или же частичным нарушением целостности нервного волокна. Повреждения могут привести к нейросенсорным изменениям в отношении чувствительности прикосновения, давления, температуры и боли. Подобные патологии заметно влияют на комфорт и возможность пациента нормально разговаривать, кушать, целоваться, бриться, наносить макияж, чистить зубы и пить. Кроме того, нейросенсорные нарушения также влияют на возможность пациента нормально взаимодействовать в социуме. Признаки данных патологий могут быть идентифицированы непосредственно во время проведения хирургического вмешательства (при наличие болевого симптома), так и в процессе длительного мониторинга за состоянием пациента. Для описания травматических поражений аксонов разной степени сложности используют следующие термины
— нейропраксия – поражение при котором сохраняется целостность нервного волокна, а механизм травмы связан с растяжением или воздействием по типу тупой травмы; чувствительность, как правило, нормализируется на протяжении нескольких дней или недель.
— аксонотмезис – поражение нерва, при котором развиваются процессы его дегенерации и регенерации, однако сам аксон при этом не теряет своей целостности, и чувствительность нормализируется на протяжении 2-4 месяцев; однако чувствительность после восстановления может быть несколько меньше, чем до вмешательства, а в отдельных клинических случаях характеризуется сопровождающей дизестезией.
— нейротмезис – поражение нерва, при котором отмечается нарушение его целостности, а прогноз восстановления нормальной чувствительности является неблагоприятным.
Международная ассоциация по изучению боли стандартизировала номенклатуру, касающуюся травматических поражений нервов. В частности, было изменено определение термина парестезия, которое раньше использовалось для обозначения потери чувствительности. Актуальная терминология предусматривает следующие определения:
— парестезия – изменение чувствительности без сопутствующих неприятных ощущений;
— дизестезия – изменение чувствительности, которое сопровождается неприятными ощущениями;
— анестезия – потеря чувствительности.
Для описания изменений нейросенсорных функций также используются такие термины, как аллодиния (возникновение боли на раздражители, которые в норме болевых ощущений не провоцируют), каузалгия (наличие персистирующей жгучей боли), гипостезия (снижение чувствительности на действие раздражителей), гиперестезия (повышение чувствительности на действие раздражителей).
Когда нервы растягиваются или сжимаются, периневрий защищает пучки от повреждения. Однако удлинение нерва более чем на 30% может спровоцировать его структурное поражение. При полном нарушении целостности нерва отмечается развитие симптомов анестезии и снижение определенных сенсорных функций. При частичном нарушении целостности нервного волокна могут наблюдаться различные симптомы поражения, включающие дизестезию. Следует отметить, что наличие персистирующей боли после оперативного вмешательства не является критерием для определения потенциальной возможности потенциального полного восстановления функции пораженного волокна.
После повреждения периферического нерва начинает развиваться валлеровская дегенерация, которая продолжается на протяжении нескольких недель и даже месяцев. Дистальнее места травматического пересечения развивается некроз аксонов. Дегенерация в подобных случаях является прогрессирующей и необратимой и длиться на протяжении до 18 месяцев. На возможность заживления пораженной области нерва влияют такие факторы как общее состояние здоровья пациента, возраст и тип поражения. Ключевым моментом в процессе восстановления нерва после поражения является формирование рубцовой ткани в области эндоневральных тубул.
Оценка травматических поражений тройничного нерва
Чаще всего в ходе установки дентальных имплантатов поражается НАН. Признаки поражения нижнего альвеолярного нерва включаются анестезию, парестезию или дизестезию в области кожи, нижней губы, щеки и десен до участка второго моляра. Пациенты же с повреждением язычного нерва характеризуются неконтролируемым слюноотделением, надкусыванием языка, ощущением изжоги, потерей вкуса, изменениями речи и функции глотания, онемением слизистой и языка. Как в ходе операции, так и после нее все потенциальные симптомы нарушения нейросенсорных функций должны быть задокументированы. Области измененной чувствительности картируют (как по локализации, так и по площади пораженного участка). Таким образом, удается проводить мониторинг за изменением всех параметров в будущем, и определить нуждается ли пациент в микрохирургическом вмешательстве или нет. Для идентификации и определения степени нарушений используют как объективные, так и субъективные диагностические тесты, которые условно делятся на механоцептивные (реакция на механические раздражители и компрессию) и ноцицептивные (ощущение боли).
Механоцептивные тесты включают статическое касание мягкой щеточкой, двухточечное распознавание и определение направления движения кисти. Ощущение укола иглой и распознавание термических раздражителей относят к ноцицептивным диагностическим процедурам. Для сравнения показателей всегда диагностируют не только область поражения, но и симметрический участок, таким образом, точно идентифицируя факт и степень нейросенсорных нарушений. При жалобах пациента на потерю вкуса для диагностики используют ватный тампон, смоченный солью или сахаром.
Распространенность травматических поражений нервов
После имплантации постоянное нарушение чувствительности в области губы вследствие травматического поражений нервных волокон отмечается в 0-36% клинических случаев. Однако эти данные можно считать несколько устаревшими, и не соответствующими подходам современной имплантологической практики. Ведь раньше в ходе операции хирурги-стоматологи использовали чаще вестибулярные разрезы, из-за которых и развивалось нарушение чувствительности. На сегодняшний день в процессе установки дентальных имплантатов выполняют срединные разрезы слизистой по вершине резидуального гребня, а всю процедуру предварительно планируют, учитывая данные, полученные после компьютерно-томографического исследования. Таким образом, можно предположить, что распространенность поражений нервных волокон в результате имплантации значительно меньше 36%.
Dannan и коллеги сообщили, что частота поражения нервов при имплантации достигает 2,95% (5 из 169 пролеченных пациентов) в случаях временных нейросенсорных изменений, и 1,7% в случаях, необратимых имплантат-ассоциированных нейропатий. В другом исследовании было указано, что частота поражений нервов после проведения хирургических вмешательств в челюстно-лицевой области достигает 2,69% (42 из 1559 пациентов), при этом процент необратимых нейросенсорных нарушений составляет еще меньше, но точное число таковых не было указано в исследовании. По мнению автора, однако, даже такие показатели имплантат-ассоциированных поражений нервных структур являются слишком высокими для клинической практики. Транзиторное нарушение чувствительности губы часто может быть связано с отеком, который наблюдается на протяжении первых двух недель после хирургического вмешательства.
Травматическое поражение язычного нерва в ходе выполнения хирургических манипуляций
Язычный нерв в области моляров нижней челюсти проходит в мягких тканях с язычной стороны челюсти. Иногда нерв находиться корональнее поверхности костной ткани и плотно прилегает к кортикальной костной пластинке с язычной стороны. Поэтому в данной области нужно очень аккуратно проводить какие-либо хирургические вмешательства. После удаления третьих моляров нижней челюсти поражения язычного нерва отмечаются в 0,5-2,1% клинических случаев. Травматические же нарушения язычного нерва в ходе дентальной имплантации – явление не распространенное и регистрируется достаточно редко. Для профилактики подобных осложнений при установке дентальных имплантатов следует придерживаться следующих правил: можно выполнять лишь внутрибороздковые разрезы без послабляющих разрезов и сепарации лоскута с язычной стороны; в ходе сепарации лоскута нужно избегать его перерастягивания и придерживаться безопасного расстояния при выполнении остеотомии. 90% всех регистрируемых случаев нейросенсорных изменений, связанных поражениями язычного нерва, разрешаются на протяжении 8-10 недель после оперативного вмешательства.
Предоперационное планирование: профилактика травматических поражений нервов
Для профилактики большинства осложнений, связанных с установкой дентальных имплантатов, необходимо обеспечить тщательное планирование оперативного вмешательства. Использование возможностей компьютерной томографии и хирургических шаблонов позволяет избежать непредвиденных исходов ятрогенного вмешательства. При установке дентального имплантата между апикальной его частью и корональной частью канала нижнечелюстного нерва должно быть оставлено минимум 2 мм толщины костной ткани. Кроме того, важно придерживаться установленной длины остеотомии и четко следовать протоколу препарирования костной ткани. Наличие 2 мм толщины костной ткани также позволяет избежать чрезмерной костной компрессии в области нерва после установки титановой внутрикостной опоры (фото 1 — 2).
Фото 1. Имплантат был установлен в области 30 зуба. После того, как действие анестезии закончилось, пациент начал жаловаться на наличие парастезии в области правой губы и подбородка. На рентгенограмме, сделанной сразу после имплантации, признаков пенетрации имплантата в канал нижнечелюстного нерва не видно.
Фото 2. Установка имплантата была проведена 10 лет назад, и за этом время пациент смог адаптироваться к изменениям чувствительности. На КЛКТ-снимке видно, что имплантат в области 30 зуба намного ближе к каналу нерва, чем казалось раньше.
При необходимости с целью обеспечения безопасности вмешательства могут быть использованы короткие дентальные имплантаты. Врачу также важно быть ознакомленным с абсолютной длиной всех сверл, которые используются в ходе манипуляции, поскольку неучет данных параметров может спровоцировать чрезмерное углубление более чем на 0,4-1,5 мм относительно выбранной безопасной границы. Для контроля углубления в костную ткань рекомендуется также использовать специальные стопперы. Тем не менее, врач должен понимать, что ни толщина, ни плотность костной ткани над областью нерва не обеспечивают безопасность его состояния в ходе выполнения процедуры остеотомии, поэтому приложение слишком больших усилий и давлений в процессе препарирования костной ткани строго воспрещается. Наконец, следует отметить, что до 50% судебных исков, связанных с повреждением нерва после имплантации, спровоцированы отсутствием информированного согласия со стороны пациента, которое врач должен получить до операции. Неплохо также провести оценку нейросенсорных параметров пациента до вмешательства, чтобы сравнить их с теми данными, которые будут получены после имплантации.
Местная анестезия: потенциальная причина повреждения нерва
Травматические поражения нижнечелюстного и язычного нервов могут возникнуть в процессе выполнения анестезии по причине травмы иглой, гематомы и воздействия составляющих анестезирующего раствора. Механизмы подобных поражений до сих пор достаточно неизученные. В одном ретроспективном исследовании было указано, что частота поражения нервов в ходе выполнения анестезии составляет от 1 / 26 762 до 1/160 571 6 случаев, тогда как Haas и Lennon прогнозировали частоту развития подобных осложнений на уровне 1/785 000. Другие данные свидетельствуют о том, что распространенность кратковременных транзиторных поражений нижнечелюстного и язычного нервов в результате проведения анестезии составляет от 0,15% до 0,54%. Тогда как случаи развития постоянных изменений чувствительности той же этиологии встречаются довольно редко, с распространённостью в 0,0001-0,01%. После выполнения нижнечелюстной анестезии у 3-7% пациентов отмечаются ощущения по типу электрического воздействия, которые со временем саморазрешаются. Однако, когда клиницист отметил, что пациент слишком резко среагировал на введение иглы, последнюю нужно немного вывести и репозиционировать. Методов для лечения или профилактики нервных осложнений, связанных с выполнением процедуры анестезии до сих пор не разработано. От 70% до 89% случаев нейросенсорных поражений, связанных с анестезией, развиваются в области язычного нерва. Такая тенденция может быть объяснена тем, что язычный нерв состоит лишь из нескольких пучков, в то время как нижний альвеолярный из огромного их количества, что, в свою очередь, повышает его потенциал к регенерации. С геометрической точки зрения все объясняется гораздо проще: размер иглы составляет в среднем 0,45 мм, в то время как диаметр язычного нерва – 1,86 мм, а диаметр нижнего альвеолярного нерва – 3 мм.
Ассоциированная с анестезией нефропатия чаще всего развивается после обезболивания 4% растворами артикаина или пилокарпина. По отношению к лидокаину, пилокарпин и артикаин вызывают в 7,3 и 3,6 раза больше нейросенсорных нарушений. Garisto и коллеги сообщили, что в 4 из 9 исследований, частота осложнений при введении 4% растворов прилокаина или артикаина была выше, чем при инъекции анестетиков с более низкой концентрацией. По мнению авторов, выполнение местной анестезии данным препаратами следует избегать, дабы снизить частоту ассоциированных нейропатий после ятрогенных вмешательств. Однако, по мнению Malamed, случаи, при которых арктикаин продемонстрировал большую связь с нейропатиями, чем лидокаин, являются эпизодическими, и не имеют под собой достаточной доказательной аргументации. Аналогичным образом, в 2013 году после обширного обзора литературы Toma и коллеги пришли к выводу, что исследования, предполагающие высшую нейротоксичность артикаина, являются по своему дизайну ретроспективными, данные представленные в них характеризуются высоким риском наличия ошибок, и полученные результаты не следует расценивать как достаточные доказательства. Авторы пришли к выводу, что непосредственная травма нервного волокна является преобладающей причиной развития нейросенсорных нарушений, и последние мало связаны с химической токсичностью используемых анестетиков. В целом в литературе имеются разногласия по этому вопросу; поэтому клиницисты должны принимать решения в отношении использования более высоких концентраций анестетиков на основе условий каждого отдельного клинического случая, интерпретируя при этом уже предварительно полученную информацию и учитывая рекомендации производителей лекарственных средств.
Процедура остеотомии при имплантации
Процедуру остеотомии следует проводить посредством хорошо заточенных сверл и при обильной ирригации. Гипотетически, перегрев области вмешательства при остеотомии может спровоцировать травматическое поражение нерва. Размер некротизирования кости, вызванного перегревом, прямо пропорционален температуре препарирования в условиях которой проводилось ятрогенное вмешательство.
Eriksson и Albrektsson резюмировали, что выполнение остеотомии при температуре в 47ºС в течение 1 минуты может спровоцировать последующую резорбцию костной ткани. В случаях прогрессивной резорбции, учитывая смещение позиции подбородочного отверстия, проводить транскретальный разрез противопоказано, вместо этого он должен быть смещен в лингвальную сторону. При установке имплантатов кпереди от подбородочного отверстия следует тщательно провести анализ КТ-снимков, которые могут помочь обнаружить наличие петли подбородочного нерва.
Процедуры сепарации лоскута
Как правило, сепарация лоскута не провоцирует каких-либо нейросенсорных нарушений, однако врачу все равно следует уделять огромное внимание при выполнении данного ятрогенного вмешательства в подбородочной области. Врач четко должен понимать, где подбородочный нерв выходит из подбородочного отверстия, дабы при сепарации лоскута не спровоцировать повреждения нервного волокна.
Экстракция зубов
Перед экстракцией моляров и премоляров на нижней челюсти для последующей установки дентальных имплантатов, следует тщательно изучить соотношении положения их корней относительно хода нижнего альвеолярного и подбородочного нервов. Также следует очень аккуратно проводить кюретаж лунок после резекции, поскольку периапикальные поражения часто могут находиться вблизи нервных структур (фото 3 — 4).
Фото 3. Пациент обратился за помощью по поводу боли в области 31 зуба. На рентгенограмме визуализированы признаки острого апикального пародонтита.
Фото 4. Результаты КЛКТ-диагностики указывают на то, что патологический очаг находиться вблизи канала нерва. Зуб был аккуратно удален с последующим осторожным кюретажем области дефекта.
Фармакологическая терапия невропатий, ассоциированных с установкой дентальных имплантатов
Однозначного мнения относительно того, какие препараты лучше использовать при диагностике травматических поражений нервов челюстно-лицевой области нет. Некоторые авторы отдают предпочтение кортикостероидам и нестероидным противоспалительным препаратам (НПЗП). При этом стоит помнить, что использование различных фармакологических средств актуально лишь при сохранении целостности нервного волокна в целом. В случаях нарушения чувствительности после инъекции пациенту можно вести дексаметазон 4 г/мл прямо в область повреждения, и через 3 дня повысить дозу стероидов. При сдавливании нерва или травмы волокна в ходе хирургического вмешательства вводят 1-2 мл дексаметазона внутривенно, после чего на протяжении 6 дней назначают дексаметазон перорально (4 мг, 2 таблетки после еды – три дня, потом 1 таблетку после еды – еще три дня). При нарушении целостности нерва стероиды могут назначить на период от 5 до 7 дней. Нарушение чувствительности могут помочь купировать 800 мг ибупрофена, которые следует принимать трижды на день на протяжении 3 недель. Если нейропатия развилась после удаления имплантата пациентам можно назначать также 800 мг ибупрофена трижды на день и с такой же частотой 500 мг амоксицилина на протяжении 5-7 дней. Параллельно с этим назначают 50 г преднизолона, снижая дозу на 10 мг каждый день (на протяжении 5 дней). Посттравматическую нейропатию можно попробовать купировать низкими дозами антидепрессантов и противоэпилептических препаратов.
В сочетании с фармацевтическим подходом, Renton и Yilma рекомендуют проводить для пациентов с хронической нейропатией также физиотерапевтические вмешательства. Цель подобного алгоритма лечения состоит в том, чтобы снизить чувство дискомфорта у пациента, и помочь ему избавиться от боли. Bagheri and Meyer вообще ставят под сомнение эффективность кортикостероидов при лечении травматических поражений нижнего альвеолярного нерва, поскольку плотность костной ткани формирующей канал нерва настолько высока, что медикаментам попросту невозможно достичь их пространства. На данное время, пока что не получено результатов клинических исследований, которые подтверждают целесообразность и успешность использовать кортикостероиды или НПЗП при травматических нейропатиях, ассоциированных с процедурой установки дентальных имплантатов.
Когда направлять пациента к микрохирургу
Универсальных рекомендаций относительно того, когда нужно направлять пациентов с травматическими нейропатиями тройничного нерва к микрохирургу пока что не разработано. Одни авторы утверждают, что пациента следует направить к специалисту сразу же после того, как он отметил нарушения чувствительности после проведения процедуры имплантации. Другие же исследователи рекомендуют проводить направление к микрохирургу через 2, 3, 4 или даже 6 месяцев мониторинга, если на протяжении таковых наблюдались признаки травматической нейропатии. Ziccardi and Zuniga рекомендуют проводить микрохирургическое вмешательство на протяжении до 1 года после проведения процедуры имплантации, поскольку через год после вмешательства эффективность микрохирургической коррекции заметно снижается. При констатации факта травматической нейропатии после имплантации врач должен установить, нуждается ли пациент в направлении к микрохирургу, или можно ли улучшить ситуацию с использованием различных фармакологических препаратов.
Иногда эксплантация, или незначительное «вывинчивание» имплантата из кости может способствовать разрешению симптомов травматического нарушения сенсорной функции. Результаты отдельных исследований указывают на то, что целесообразность направления к микрохирургу аргументирована лишь констатацией факта полного нарушения целостности нерва. Когда же врач уверен, что он не нарушал целостности костного канала нерва, то нарушение чувствительности может быть вызвано компрессией нервного волокна или же воспалительным эффектом. В таких случаях может помочь и фармакологический подход к лечению. Между тем, врач должен понимать, что даже если он не перфорировал основной нервный канал, часто у нерва имеются дополнительные ветви, предсказать ход которых довольно сложно. Последнее является возможным только при тщательном анализе данных, полученных после КЛКТ-сканирования, ведь двухмерные рентгенограммы провоцируют суперимпозицию отдельных анатомических структур, следовательно, прогноз возможного травматического поражения нервов с их помощью является неэффективным (фото 1-2).
В случаях ощущения дискомфорта после установки имплантата, если можно подтвердить, что интраоссальная опора не находиться вблизи канала нерва, алгоритмы лечения являются вариативными. Bagheri и Meyer предлагают проводить мониторинг на протяжении 3-4 месяцев, чтобы увидеть наблюдаются ли улучшения показателей чувствительности, перед тем как направить пациента к микрохирургу. Также авторы утверждают, что при слишком близкой позиции имплантата к нерву, уровень компрессии последнего можно уменьшить незначительным реверсивным движением имплантата. Другие исследователи предлагают эксплантировать интраоссальную конструкцию на протяжении 36 часов и сразу же назначать стероидные препараты, если после оперативного вмешательства у пациента отмечаются признаки нейросенсорных нарушений.
Khawaja and Renton описали четыре клинических случая развития симптомов нарушения чувствительности после установки дентальных имплантатов, при которых интраоссальная конструкция не находилась вблизи нерва. Однако, при эксплантации симптомы нейросенсорных нарушений разрешились у двух из четырех пациентов достаточно быстро. Интересно, что позитивная динамика наблюдалась у пациентов, которым удаление имплантатов проводили на протяжении 18 и 36 часов, а резидуальные симптомы отмечались у пациентов, эксплантация которым проводилась через 3 и 4 дня после оперативного вмешательства.
Renton, Dawood и коллеги предполагают, что период мониторинга за пациентами с подобными симптомами не должен превышать 3 месяцев, поскольку по истечении данного срока риск развития нейронных изменений превышает уровень потенциальной успешности микрохирургического вмешательства. Ziccardi и Steinberg в своей обзорной статье рекомендуют проводить начальный мониторинг на протяжении 1 месяца, и, если симптоматика улучшается – продолжать наблюдаться за пациентом. Если же симптоматика не улучшается или же усугубляется, необходимо направить больного к микрохирургу. Результаты исследований указывают на то, что пациенты, прооперированные по причине нейросенсорных нарушений через 6-8 месяцев после имплантации, характеризуются таким же уровнем успешности, как и пациенты, прооперированы в более короткий период после ятрогенного вмешательства. По мнению авторов, более ранее вмешательство возможно и является более эффективным, однако доказательных данных для подтверждения этого предположения пока что нет. Кроме того, выполнение микрохирургической операции в случаях лишь незначительных нейросенсорных изменений не показано, поскольку риск от самого вмешательства в таких случаях превышает прогнозированный уровень успешности. Существует также принцип 12-недельного ожидания – в среднем именно столько времени надо врачу, чтобы определиться в необходимости направления пациента на микрохирургическую операцию.
Логично, что в случаях наличия у пациентов острой боли ждать 12 недель необязательно. Перед аргументацией тех или иных подходов к лечению врач должен объективно сопоставить данные рентгенологического контроля и клинические симптомы, после чего учесть все возможны медико-правовые аспекты нарушений.
Хирургическое восстановления поврежденного тройничного нерва
Существуют конкретные причины, которые аргументируют необходимость микрохирургического восстановления повреждённого тройничного нерва, и контрактные факторы, которые определяют прогноз данной манипуляции. Ziccardi и Zuniga сформулировали следующий список причин, которые обосновывают направление пациента к микрохирургу: нарушение чувствительности, которое персистирует на протяжении более чем 3 месяцев и нарушает нормальную жизненную активность пациента, подтверждение факта пересечения нерва, отсутствие улучшений признаков гипостезии, развитие болевых ощущений после имплантации. После выполнения микрохирургической коррекции на успешность таковой влияет ряд факторов: время ожидания после имплантации, тип и объем поражения, степень васкуляризации области поражения, опыт хирурга, метод забора и подготовки трансплантата, наличие натяжения в области восстановления, возраст и общее состояние здоровья пациента.
По сути, микрохирургическое восстановление ветвей язычного и нижнего альвеолярного нервов возможно. Однако уровень успешности подобных манипуляций является весьма вариативным – в среднем исследователи указывают лишь на 50-59,4% эффективность такого лечения, и лишь в двух исследованиях результаты вмешательства достигали уровней 81,7% и 63,1%. Во всех проведённых исследованиях число субъектов является довольно незначительным, поэтому сравнивать конечные результаты таковых методологически невозможно. Тем не менее, 50-60% пациентов после микрохирургической коррекции демонстрируют признаки улучшения неврологических нарушений. Ziccardi and Zuniga предупреждают, что пациенты с тяжелыми нейросенсорными поражениями должны быть проинформированы о том, что полноценная их реабилитация фактически является невозможной. Также многие исследователи указывают на то, что эффективность микрохирургических процедур в случаях терапии анестезии, дизестезии и спонтанных болевых ощущений является преувеличенной. Если резюмировать, то микрохирургическая коррекция может помочь отдельными пациентам, но уровень прогнозированности результатов подобного лечения является неоднозначным. Таким образом, лучшая терапия нейросенсорных нарушений, связанных с имплантацией – это их профилактика.
Заключение
В клинической практике часто встречается дилемма: если имплантат успешно остеоинтегрирован, но вызывает умеренную парестезию без боли, что с ним делать? Ведь эксплантация не всегда может способствовать разрешению симптомов, а ретенция имплантата в кости при фактическом поражение нерва может спровоцировать развитие невромы. Последняя формируется в результате чрезмерного заживления области поврежденного нерва и гиперплазии смежных тканей, и очень часто требует последующего хирургического удаления. Решение о выборе возможного метода лечения должно приниматься вместе с пациентом после тщательной дискуссии всех возможных вариантов, и перед началом реабилитации пациент официально должен подтвердить свое согласие посредством заполнения специальной письменной формы.
Авторы:
Gary Greenstein, DDS, MS
Joseph R. Carpentieri, DDS
John Cavallaro, DDS
Источник статьи: https://stomatologclub.ru/stati/implantologiya-14/porazhenie-nerva-vo-vremya-implantacii-diagnostika-lechenie-profilaktika-2895/
Невралгия тройничного нерва, боль в лице, состояния
Обзор
Что такое тройничный нерв?
Тройничный нерв — это часть нервной системы, отвечающая за передачу ощущений боли, прикосновения и температуры от вашего лица к вашему мозгу. Это большой нерв, состоящий из трех частей, который обеспечивает ощущения. Одна часть, называемая нижнечелюстным нервом, задействует двигательную функцию, которая помогает вам жевать и глотать.
Функция
Для чего нужен тройничный нерв?
Тройничный нерв в первую очередь помогает вам чувствовать (сенсорное), хотя ветвь нижнечелюстного нерва выполняет как сенсорные, так и моторные функции.Тройничный нерв помогает при:
- Прикус, жевание и глотание.
- Ощущения лица и кожи головы.
Анатомия
Где тройничный нерв?
Тройничный нерв, также называемый черепным нервом V (римская цифра пять), является пятым из 12 черепных нервов.
У вас два тройничных нерва, по одному с каждой стороны вашего тела. Они начинаются в вашем мозгу и перемещаются по вашей голове.
Какова анатомия тройничного нерва?
Подобно дереву, простирающемуся от мозга к лицу, тройничные нервы имеют корни и ветви:
- Тройничный нерв начинается в четырех ядрах — или скоплениях тел нервных клеток — в вашем мозгу.Три из этих ядер контролируют работу ваших чувств. Четвертый контролирует двигательную функцию (или ваше движение).
- Эти три сенсорных ядра сливаются в один сенсорный корень возле моста, который является самой большой центральной частью вашего ствола мозга.
- Этот сенсорный корень становится ганглием тройничного нерва, покидая ствол мозга с каждой стороны. (Ганглии — это совокупность нервов вне нервной системы.) Каждый тройничный ганглий расположен рядом с вашим виском сбоку от головы, перед вашим ухом.
- Ганглий тройничного нерва разделяется на три ветви тройничного нерва. Эти ветви проходят вдоль каждой стороны вашей головы к разным частям вашего лица.
Какие ветви тройничного нерва?
У тройничного нерва есть три ветви, которые выполняют разные функции:
- Офтальмологический: Эта ветвь посылает нервные импульсы от верхней части вашего лица и кожи головы к вашему мозгу. Офтальмологические относится к глазам. Офтальмологический нерв относится к вашим глазам, верхним векам и лбу.
- Maxillary: Эта нервная ветвь отвечает за ощущения в средней части лица. Под верхней челюстью понимается верхняя челюсть. Верхнечелюстные нервы доходят до щек, носа, нижних век, верхней губы и десен.
- Нижняя челюсть: Нижнечелюстная ветвь (нижняя челюсть) помогает ощущать нижнюю часть лица, такую как челюсти, нижняя губа и десна. Эти нервы также выполняют двигательную функцию. Они помогают кусать, жевать и глотать.
Состояния и расстройства
Какие состояния и нарушения влияют на тройничный нерв?
Травмы и травмы могут повлиять на тройничный нерв.Несчастные случаи, опухоли и повреждения в результате стоматологических процедур или лицевой хирургии могут вызвать ушибы или порезать нервы.
Повреждение тройничного нерва может затронуть небольшую область, например часть десны, или большую область, например одну сторону лица. Травма может вызвать проблемы с жеванием и речью. Степень зависит от того, где происходит повреждение нерва.
У вас может продолжаться онемение или боль в лице в области, обслуживаемой нервом. Эти симптомы представляют собой невропатию тройничного нерва.
Поврежденный тройничный нерв часто со временем восстанавливает свою функцию.В редких случаях требуется хирургическое вмешательство, чтобы восстановить поврежденные нервы. Некоторым людям требуется трансплантат нерва, чтобы заменить поврежденный нерв здоровым.
Что такое невралгия тройничного нерва?
Невралгия тройничного нерва — это тип нейропатии тройничного нерва, вызванной повреждением нерва. Состояние вызывает внезапную сильную лицевую боль на одной стороне лица. Боль может ощущаться как удар электрическим током. Приблизительно у 150 000 человек ежегодно развивается невралгия тройничного нерва. Его еще называют tic douloureux.
Что вызывает невралгию тройничного нерва?
Причины невралгии тройничного нерва включают:
- Первичная невралгия тройничного нерва возникает, когда артерия или вена обвивают тройничный нерв и вызывают раздражение.
- Вторичная невралгия тройничного нерва возникает, когда опухоль, киста или травма лица оказывают давление на тройничный нерв. Рассеянный склероз также вызывает форму вторичной невралгии тройничного нерва.
Каковы признаки невралгии тройничного нерва?
Невралгия тройничного нерва обычно поражает только одну сторону лица. У некоторых людей подергивания (тики) лица появляются после того, как боль утихает.
Медицинские работники классифицируют болевые симптомы по типам:
- Тип 1 (TN1) вызывает резкую, шоковую лицевую боль, которая приходит и уходит.Ваше лицо может пульсировать. Боль может длиться от нескольких секунд до пары минут. Эти колющие боли могут повторяться в течение дня и ночи. Со временем боль может усиливаться и длиться дольше. Часто кратковременные боли вызываются такими действиями, как жевание, разговор или прикосновение к лицу.
- Тип 2 (TN2) вызывает постоянное (хроническое) жжение или боль. У вас также может быть колющая боль, но она менее сильная, чем у 1-го типа.
Как диагностируются проблемы тройничного нерва?
Проблемы с тройничным нервом сложно диагностировать, потому что не существует специального теста для оценки состояния этих нервов.Кроме того, другие состояния, такие как кластерные головные боли, заболевания височно-нижнечелюстного сустава и инфекции носовых пазух, могут вызывать лицевую боль и аналогичные симптомы.
Ваш лечащий врач может полагаться на симптомы и физическое обследование, чтобы поставить диагноз. Вы также можете пройти МРТ, компьютерную томографию или рентген. Эти тесты могут показать, давит ли киста, опухоль или артерия на тройничный нерв.
Забота
Как защитить тройничный нерв?
Эти изменения в образе жизни могут сохранить здоровье нервной системы:
Когда звонить врачу
Вы должны позвонить своему врачу, если у вас возникли проблемы:
- Подергивания (тики) лица.
- Сильная лицевая боль.
- Потеря чувствительности лица или кожи головы.
Записка из клиники Кливленда
Тройничный нерв играет важную роль, помогая лицу чувствовать боль, прикосновение, тепло или холод. Нижнечелюстные ветви тройничного нерва помогают кусать, жевать и глотать. В некоторых случаях онемение или другие признаки невропатии тройничного нерва возникают в результате несчастного случая, стоматологической процедуры или лицевой хирургии. Невралгия тройничного нерва может вызвать колющую, шоковую лицевую боль или постоянное ощущение жжения.Поговорите со своим врачом о том, как облегчить эти состояния тройничного нерва.
Восстановление тройничного нерва: обзор — Джонс — 2010 — Австралийский стоматологический журнал
Введение
Эта статья представляет собой введение в принципы восстановления нервов, связанные с тройничным нервом. Обсуждаются анатомия, механизмы повреждения его ветвей, механизмы заживления и проблемы, с которыми сталкивается хирург при попытке восстановить ветви этого нерва путем первичного, отсроченного первичного восстановления или пересадки нерва.В следующих статьях будет обсуждаться восстановление нижних зубных и язычных нервов.
Хирургия нервов челюстно-лицевой области в основном ограничивается тройничным и лицевым нервами и их ветвями. Тройничный нерв и его ветви могут быть повреждены в результате переломов лицевого скелета, во время резекции опухоли или установки имплантата, но чаще всего в результате удаления зубов, особенно третьего моляра нижней челюсти.
В прошлом это повреждение считалось частью заболеваемости, связанной с этими процедурами, но было опубликовано много статей, в которых сообщалось об успешном восстановлении или трансплантации этих нервов для восстановления функции. 1-10
Анатомия
Тройничный нерв возникает из более крупного чувствительного корешка и меньшего моторного корешка на вентральной поверхности моста. Моторный корешок находится ниже сенсорного корня и проходит латерально по глубокой поверхности тройничного ганглия, чтобы войти в третий отдел нижней челюсти и оттуда к жевательным мышцам, в то время как сенсорные волокна составляют тройничный ганглий и распространяются от этого ганглия в различные места. .
Первый отдел, офтальмологический отдел, проходит спереди в пределах боковой стенки кавернозного синуса до медиальной части верхней глазничной щели и в орбиту почти сразу же разделяется на носоциллярную, лобную надглазничную и надхлеарную ветви и слезную ветвь.
Второй отдел, верхнечелюстной отдел, проходит вниз и вперед и входит в верхнюю часть крылонебно-небной ямки через ротундемное отверстие, а затем в орбиту через нижнюю глазничную щель и выходит наружу через подглазничное отверстие для снабжения передней части лица. и нос.Задняя, средняя и передняя верхняя альвеолярные ветви подглазничного нерва входят в верхнечелюстную альвеолу сверху для питания верхнечелюстных зубов.
Третий отдел, нижнечелюстной отдел, проходит через овальное отверстие в подвисочную ямку, язычный нерв отделяется от нижнечелюстного отдела рядом с основанием черепа сразу после выхода из овального отверстия. Он расположен кпереди и медиальнее нижнего альвеолярного нерва и спускается между латеральной и медиальной крыловидными мышцами.На нижнем конце латеральной крыловидной мышцы она принимает волокна барабанной хорды и, следовательно, волокна вкуса. Затем нерв следует по боковой поверхности медиальной крыловидной мышцы. На верхнем конце подъязычно-подъязычной мышцы она резко изгибается медиально над этой мышцей и входит в рот. В этот момент он выпускает волокна в поднижнечелюстной ганглий, а затем переходит в язык. Здесь он уязвим для удаления третьих коренных зубов, и именно в этой области требуется ремонт при необходимости.
Нижний альвеолярный нерв огибает нижнюю границу латеральной крыловидной мышцы, а затем резко поворачивает латерально, достигая внутренней поверхности нижней челюсти и в теле нижней челюсти через нижнечелюстное отверстие, проходя латерально внутри нижнечелюстного канала и выходит через нижнечелюстной канал. подбородочное отверстие. Однако, прежде чем покинуть нижнюю челюсть, она петляет спереди, а затем сверху и сзади в области премоляров. Таким образом, две уязвимые области этого нерва находятся на участке третьего моляра, поскольку он проходит латерально в нижней челюсти и в области премоляра, где он петляет, прежде чем покинуть нижнюю челюсть через подбородочное отверстие.Каждое отделение снабжает часть лица, и в сочетании три ветви обеспечивают чувствительность большей части лица, за исключением мягких тканей вокруг угла нижней челюсти, которые снабжены ветвями верхних шейных нервов. 11
Гистологически клеточное тело спинномозгового нерва располагается в спинном мозге или ганглии заднего корешка, а аксоны проходят в сенсорные рецепторы. Тело клетки тройничного нерва находится в ганглии тройничного нерва, а аксоны выходят на сенсорные рецепторы, которые включают пульпы зубов, надкостницу челюстей, слизистую оболочку рта, височно-нижнечелюстной сустав (ВНЧС) и кожу лица.Стимуляция от этих органов чувств синапса в ганглии тройничного нерва передается на каудальное ядро в продолговатом мозге, мосту и верхних шейных сегментах спинного мозга, а затем на кору после перехода в центральном тройничном тракте.
Эти аксоны и их шванновские клетки покрыты тонким эндоневрием, группы которых соединяются вместе, образуя пучки. Пучки, в свою очередь, поддерживаются периневрием, который разделяет их на функциональные единицы.Эпиневрий — это соединительнотканная оболочка, окружающая периневрий и образующая нервный ствол. Мезоневрий окружает всю структуру и содержит кровеносные сосуды, обеспечивающие питание каркаса. 12
Повреждение нерва
Повреждение тройничного нерва может быть разной степени и может быть простым ушибом или ушибом до полного пересечения. Обычно ветви тройничного нерва повреждаются в результате травмы и, в частности, при удалении зубов, чаще всего третьего моляра нижней челюсти.
По словам Тэя и Зуниги, 13 к другим частым причинам относятся инъекции местного анестетика, ортогнатическая хирургия и установка дентальных имплантатов. Далее эти авторы заявили, что 60% повреждений нижнего зубного нерва были вызваны удалением зубов и что нижний зубной нерв был наиболее частой поврежденной ветвью, за которой следует язычный нерв. Погрель, 14 в исследовании на трупе, пришел к выводу, что другие причины могут включать травмы лезвия скальпеля, рассечения, раздавливания и растяжения.
Были предложены различные классификации повреждений нервов, но наиболее часто используемая была предложена Седдоном. 15 Он классифицировал повреждение нерва на три основные категории: (1) нейропраксия, которая возникает из-за местного блока проводимости со снижением аксональной проводимости или локализованного повреждения в результате непрямого давления, т. Е. Ретракции во время операции или отека. после операции. Эта травма быстро проходит после снятия давления или отека; (2) аксонотмезис, который возникает в результате полного разрушения аксональной проводимости и дегенерации дистальных сегментов без нарушения опорных структур.Сильное втягивание или сжатие может привести к этому типу травмы. Восстановление зависит от расстояния между местом реиннервации и повреждением нерва; (3) нейротмезис возникает в результате полного нарушения аксональной проводимости, а также опорных структур нерва. Этот тип повреждения можно подразделить на (а) эпиневральное нарушение и (б) периневральное нарушение.
Rood 16 далее уточнил эту классификацию до:
| 1. | Нейропраксия | 1 класс | Функциональный кондукторный блок |
| Ишемия или отек | |||
| 2 класс | Демиелинизация без потери аксона | ||
| 2. | Axonotmesis | 1 класс | Дегенерация аксона wallerian |
| 2 класс | Дегенерация аксона эндоневральная | ||
| 3. | Нейротмезис | 1 класс | Периневральный разрыв |
| 2 класс | Периневральная и эпиневральная |
Sunderland 17 рассматривал повреждения нервов и подразделял их на пять отдельных заголовков в зависимости от степени тяжести, которые могут рассматриваться под следующими заголовками: (1) блокада проводимости; (2) перерезка аксона с интактным эндоневрием; (3) рассечение аксонов нервных волокон и оболочки внутри неповрежденного периневрия; (4) рассечение пучков, непрерывность нервного ствола поддерживается эпиневральными тканями; (5) перерезка всего нервного ствола.
Теория боли ворот может дать ответ на некоторые проблемы, связанные с повреждением и восстановлением нервов. Входные данные от органов чувств лица подвергаются различным сознательным и подсознательным стимулам, которые могут изменять этот сенсорный вход. Каудальное ядро действует как «ворота» для сенсорной информации от тройничного нерва, и, если входной сигнал является болью, он может быть изменен внутри каудального ядра с помощью тормозных или стимулирующих воздействий и, таким образом, изменить ощущения, достигающие коры.Эта теория боли ворот, описанная Мелзаком и Уоллом 18 , частично объясняет клинические наблюдения боли при большинстве травм и заболеваний.
Боль передается немиелинизированными волокнами и прикосновением. Температура и проприоцепция передаются миелинизированными волокнами. Миелинизированные волокна действуют как противовес боли и тормозят «ворота», в то время как немиелинизированные волокна — нет. Немиелинизированные волокна более примитивны, менее активны, более устойчивы к травмам и легче регенерируются.Более быстрые миелинизированные волокна эволюционировали позже, и из-за своей сложности менее восстанавливаются и умирают в результате травм. Эти два влияния обычно остаются в равновесии, но это может измениться из-за травмы, болезни или других факторов. В случае боли, связанной с опоясывающим герпесом, вирус поражает миелинизированные волокна, которые изменяют баланс в «воротах» в мосту, и поэтому активность немиелинизированных волокон выше, а также усиливается боль.
Следовательно, если тройничный нерв поврежден после удаления третьего моляра и произошел полный разрыв нерва, т.е.Например, при невротмезисе (по Седдону) или травме пятого уровня (по Сандерленду) вся проводимость прекращается, в мозг не поступает сенсорная информация, и в этой области ощущается анестезия. Затем происходит регенерация проксимального конца, которая длится максимум около трех месяцев 19 , но дистальный конец подвержен валлеровской дегенерации и отмирает. Пролиферирующие аксоны пытаются преодолеть разрыв, и если они обнаруживают, что периневральная трубка растет вниз, постепенно начинает функционировать.
Однако это не обычная ситуация, и многие факторы могут повлиять на проблему, как указано Вольфордом и Стевао. 10 Часто неврома образуется в промежутке между двумя концами нерва, что является неудачной попыткой восстановления; регенерирующие аксоны проксимального конца не могут найти периневральную трубку для роста вниз, и поэтому на проксимальном конце растет увеличение. Неврома состоит из плотной фиброзной ткани, перемешанной с нервными пучками, которые часто болезненны из-за разрастания более примитивных немиелинизированных болевых волокон. Миелинизированные волокна более сложные, медленнее восстанавливаются и требуют больше питательных веществ и кислорода для синтеза миелина, что может затем привести к дисбалансу волокон, поднимающихся к воротам.
Если, однако, повреждение не является полным перерезанием нерва, более примитивные и, следовательно, более выносливые немиелинизированные волокна восстанавливаются в большем количестве, в то время как миелинизированные волокна отмирают и может развиться неврома. Однако чаще, когда область заживает, образуется бессосудистая рубцовая ткань, которая еще больше способствует потере миелинизированных волокон по тем же причинам, которые упоминались выше. Следовательно, этот дисбаланс приводит к усилению боли от частично резецированного нерва.Из-за частичного повреждения тела клеток тройничного ганглия не погибают, а остаются в виде поврежденных клеток и вырабатывают медиаторы боли, которые могут увеличивать уровень боли. Эта деафферентационная нейропатия не поддается лечению периферическими хирургическими вмешательствами, такими как резекция невромы и восстановление отсроченным первичным анастомозом или пересадкой нерва, но вместо этого более поддается лечению препаратами центрального действия, такими как Тегретол. Немиелинизированная или С-волокнистая неврома и деафферентационная нейропатия являются двумя наиболее частыми реакциями нерва на повреждение и могут вызывать у пациента длительную боль. 20
Это не всегда так, и некоторые нервные повреждения восстанавливаются спонтанно нейропраксией, а другие требуют восстановления или трансплантации аксонотмезиса и нейротмезиса для восстановления функции. Следовательно, основными причинами хирургического вмешательства являются: (1) травма, которая вызывает дефект или повреждение, которое не восстанавливается спонтанно; и (2) потеря функции, приводящая к анестезии, парестезии или дизестезии, которые нельзя исправить другими способами.
Нейросенсорное тестирование
Документирование повреждения сенсорного нерва важно для определения характера проблемы и типа травмы. Первым шагом является получение основной жалобы пациента, будь то потеря чувствительности, боль или какое-либо другое ненормальное ощущение или функциональное нарушение. 21 При сборе анамнеза важно определить характер травмы, дату происшествия и развитие симптомов.Возврат чувствительности в течение первых четырех недель указывает на нейропраксию и предполагает отличный прогноз, в то время как позднее начало восстановления функции указывает на более серьезное повреждение, такое как аксонотмезис, и, если ощущения не возвращаются к трем месяцам, невротмезис следует считать.
Цель нейросенсорного тестирования — определить схему сенсорного дефицита, количественно оценить величину и характер дефицита и записать его для объективного сравнения с течением времени.Врач должен искать объективные признаки повреждения, такие как отек, эритема, изъязвление или признаки гиперактивности симпатической нервной системы, такие как побледнение, покраснение и изменения температуры или потоотделение по анатомическому расположению нерва. При пальпации непосредственно над доступной частью поврежденного нерва, например, лингвальной стороной нижней челюсти, или в вестибюле щеки в области подбородочного нерва, или по коже лица, снабжаемой подглазничным нервом, может быть выявлен металлический признак или покалывание. над распределением нерва.Это также может вызвать болезненное ощущение, указывающее на возможное образование невромы, особенно на лингвальной стороне нижней челюсти с язычным нервом. Если боль соответствует анатомическому паттерну, можно заподозрить непрекращающуюся невриму, а если есть боль без облучения, можно заподозрить нейротмезис и формирование невриномы. Рентгенограммы и особенно компьютерная томография могут указывать на инородные тела, такие как винты, имплантаты или другие аллопластические материалы, которые могут вызывать проблему. Кроме того, тонкие срезы КТ или МРТ могут дополнительно определить проблему.
Нейросенсорное тестирование предназначено для максимально объективной оценки характера проблемы и стандартизации тестов для наблюдения за пациентом с течением времени и определения улучшения или изменения. Различные тесты позволят определить, какие волокна восстанавливаются. Как упоминалось выше, мы имеем дело с двумя основными волокнами, а именно с миелинизированными и немиелинизированными волокнами. Более примитивные или немиелинизированные, медленно действующие волокна являются болевыми волокнами и восстанавливаются быстрее, чем миелинизированные.Общие тесты включают легкое прикосновение, направленное касание кистью, двухточечную дискриминацию, изменение температуры и укол булавкой. Первое возвращающееся ощущение — это боль, которую можно определить с помощью укола булавкой; другие — медленнее и определяют более тонкие точки восстановления по мере восстановления миелинизированных волокон. Фотографии или диаграммы помогут документировать травму и ее восстановление. 22 В исследовательской лаборатории можно использовать более точные и сложные тесты (соматосенсорные вызванные потенциалы), но простого тестирования будет достаточно, чтобы определить природу проблемы, зафиксировать восстановление функции и контролировать восстановление после операции (рис. 1).
Нейросенсорное тестирование, запись и запись данных. (3+ полное ощущение; 3– без ощущения.)
Сроки ремонта
Раннее обследование и восстановление двигательных нервов, таких как лицевой нерв, дает наилучший результат. Функция торцевой пластины двигателя легко теряется и имеет решающее значение для восстановления. Однако сенсорная функция и сенсорные рецепторы не так важны.В прошлом было принято ждать и смотреть, что произойдет после повреждения отделов тройничного нерва. Alling 23 поставил под сомнение концепцию раннего восстановления язычных и нижних альвеолярных нервов, когда он сообщил о ретроспективном исследовании, проведенном с участием 103 членов Американской ассоциации челюстно-лицевых хирургов (AAOMS). Он обнаружил, что повреждение язычного нерва произошло в 0,06% случаев, а нижнего альвеолярного нерва — в 0,43% случаев.Он также сообщил, что некоторые из них представляют собой постоянную проблему. Однако Погрель, 24 в главе Осложнения челюстно-лицевой хирургии , указал, что большинство авторов признают, что существует приблизительно от 0,6% до 5% случаев сенсорного повреждения тройничного нерва после операции на третьем моляре, но большинство из них выздоравливают. согласно Аллингу. 23 Хиллеруп и Штольце 25 обнаружили, что большинство повреждений язычного нерва были закрытыми, не были известны оператору, и поэтому природа травмы была неизвестна.Они также рекомендовали период наблюдения и записи в течение трех месяцев до вмешательства. Поскольку большинство повреждений ветвей тройничного нерва закрыты, и оператор не уверен в характере травмы, целесообразно провести период наблюдения и записи перед хирургическим вмешательством. Следовательно, было бы логично восстановить нерв как можно раньше, когда стало ясно, что он не будет восстанавливаться. Обычно считается, что 3–6 месяцев — оптимальное время между травмой и попыткой восстановления.Эта концепция также поддерживалась многими другими авторами. 6, 9, 10, 19-25
Теоретически лучшее время для восстановления нерва — это время, когда регенерация наиболее активна. Holmes and Young 27 сообщают, что пролиферативная способность шванновских клеток достигает пика через 2–3 недели после травмы и, как говорят, снижается примерно через три месяца. В сочетании с этим ощущается, что сжатие дистальных периневральных трубок, которое увеличивается со временем после травмы, имеет большое влияние на способность продвигающихся аксонов расти вниз по дистальным канальцам.Следовательно, очень важно рассмотреть возможность операции в это время, то есть примерно через три месяца после травмы, если вы хотите зафиксировать эту активность. 10
Согласно Donoff, 28 , если спонтанное выздоровление не произошло в течение шести месяцев, оно вряд ли произойдет, и поэтому операция должна быть проведена в это время или раньше, что обеспечит максимальную способность восстановления шванновских клеток, а также позволит оператору время оценить травму и дать возможность спонтанно выздороветь.
Wolford и Stevao 10 показали, что раннее восстановление также позволяет избежать многих проблем, связанных с дегенерацией Валлера, которая включает атрофию и фиброз дистальной части нерва. Эта атрофия и усадка создают множество проблем несоответствия, которые становятся очевидными при попытке восстановить нерв, особенно если требуется трансплантат и время опаздывает. Они также заявляют, что если травма — это, прежде всего, травматическая неврома, время восстановления не так важно, так как это мало повлияет на конечный результат.
Согласно Сандерленду, 29 полного восстановления после восстановления нерва не произойдет, и оно будет меньше, если потребуется трансплантат. Таким образом, очевидно, что лучшее время для восстановления нерва — это момент повреждения, но это часто нецелесообразно из-за доступа, необходимого для восстановления нерва, и необходимости информированного согласия. Кроме того, поскольку многие из этих поражений закрыты, оператор не знает о проблеме до завершения операции.
Робинсон и др. , , 9, предложили полезные алгоритмы лечения травм нижних альвеолярных и язычных нервов. Эти алгоритмы предлагают схему управления повреждениями нервов.
Принципы восстановления нервов
Принято 30 , что периневральная пластика дает наилучшие шансы на успех. Однако не всегда возможно выполнить периневральную пластику, поэтому ее будет достаточно. 4 Хотя периневральная пластика предлагает лучшее анатомическое восстановление нерва, на нее следует смотреть с некоторой долей реальности.
Нижний альвеолярный нерв представляет собой сосудисто-нервный пучок, который находится внутри нижней челюсти и имеет множество пучков, которые различаются по размеру и количеству. Согласно Svane, 31 на участке третьего моляра может быть до 18 или более пучков. Следовательно, нецелесообразно сшивать каждую периневральную трубку вместе, поскольку каждый шов вызывает воспалительную реакцию и вызывает реакцию фиброзной ткани, которая снижает вероятность выздоровления за счет ингибирования роста аксонов.Поэтому разумно провести эпиневральную пластику. Согласно Wolford и Stevao, периневральная пластика 10 также вызывает больше травм, рассекая каждый отдельный пучок и сшивая их вместе. Они заявляют, что ветви тройничного нерва являются полифацикулярными, то есть множественными пучками разного размера и не сгруппированы, и поэтому техника эпиневрального шва является наиболее подходящим методом восстановления в этой группе.
Согласно O’Brien and Morrison, 32 нет убедительных доказательств того, что периневральная пластика значительно лучше, чем эпиневральная пластика, если увеличение используется, поскольку увеличение позволит более точно совместить пучки с пластикой.
Hausaman 30 рекомендовал, чтобы анастамоз без натяжения также был важен для функционального восстановления. Миямото 33 обнаружил, что напряжение при восстановлении более 23 граммов будет ингибировать рост аксонов, поскольку образовавшаяся в нервной структуре щель будет слишком большой, чтобы аксоны могли расти вниз по дистальным трубкам. Hausaman 30, 34 также заявил, что если нервы не могут быть соединены вместе пассивным способом без напряжения, то следует рассмотреть возможность трансплантации нервов.
На результаты восстановления нервов влияет множество факторов. Их можно рассматривать под разными заголовками. Согласно Wolford и Stevao, 10 факторы, влияющие на успех процедуры, многочисленны и включают: (1) время между травмой и восстановлением; (2) тип и степень травмы; (3) сосудистость участка; (4) ориентация нерва и трансплантата; (5) требуемая длина трансплантата; (6) качество ремонта; (7) напряжение ремонта; (8) подготовка трансплантата; и (9) возраст и общее состояние здоровья пациента.Эти факторы можно разделить на факторы, внешние по отношению к нерву, и факторы, локальные по отношению к нерву.
Факторы, внешние по отношению к нерву, включают тип и степень повреждения, количество ушибов, синяков и кровоснабжения окружающих тканей, возраст пациента и наличие или отсутствие инфекции. Из этих факторов наиболее важными являются возраст и общее состояние здоровья, и во всех зарегистрированных случаях наилучшие результаты наблюдаются у детей. 35
Факторы, локальные для нерва, включают факторы, расположенные проксимальнее повреждения, в месте повреждения, факторы, расположенные дистальнее повреждения, время восстановления, технику и качество восстановления, а также натяжение в месте наложения анастамоза.
Факторы, проксимальные к травме, относятся к валлеровской дегенерации, которая обычно относится к дистальному сегменту, но дегенерация также будет происходить вдоль проксимального конца, обычно до первого узла Ранвье. При тяжелой травме это повреждение можно увидеть проксимальнее ганглия. 36 Таким образом, в тяжелых случаях может быть повреждение проксимальной культи, которое не зависит от хирурга, даже если будет выполнено тщательное восстановление.
Уровень травмы напрямую влияет на результат регенерации.В целом, чем проксимальнее травма, тем быстрее будет начальная реакция, но конечный результат может быть хуже из-за большего расстояния, на которое аксоны должны пройти к месту назначения, и более высокой частоты перекрестного перехода пучка. Кроме того, существует большая вероятность коллапса дистальных пучков до того, как аксоны достигнут своего конечного пункта назначения. Это, вероятно, не так важно для тройничного нерва, поскольку задействованные расстояния относительно короткие. Также существует возможность коллапса органа-мишени, например.g., мышечное истощение, хотя это менее вероятно для периферических сенсорных нервов, чем для двигательных нервов. Следовательно, повреждение подбородочного нерва будет иметь больше шансов на выздоровление и за более короткое время, чем повреждение на участке третьего моляра. Кроме того, чем проксимальнее травма, тем труднее ее исправить из-за проблем с доступом. Это особенно верно в отношении нижнего альвеолярного нерва, который должен быть удален из его положения в теле нижней челюсти. К язычному нерву также трудно подойти из-за его заднего положения во рту и необходимости втягивания языка во время восстановления, что часто бывает затруднительно.
Тип нерва также имеет значение, потому что чистый моторный или чисто сенсорный нерв восстанавливается быстрее, чем смешанный нерв. Тройничный нерв является смешанным, поскольку он обеспечивает ощущение лица, а также двигательную функцию жевательных мышц, а в случае язычного нерва — вкус и стимул для поднижнечелюстной слюнной железы.
Характер и степень травмы также влияют на выздоровление, и чем обширнее травма, тем меньше шансов на выздоровление.Связанное с этим повреждение ткани также будет играть роль из-за нарушения кровоснабжения, некроза ткани, инфекции и возможного образования рубцовой ткани.
Факторы дистальнее травмы также важны и снова связаны с дегенерацией Валлера. Обычно дистальные канальцы теряют 70% своего первоначального диаметра в течение нескольких недель после травмы. 31 Однако они сохранят свою способность увеличиваться, когда аксоны входят в канальцы. Относительные размеры проксимальных и дистальных канальцев будут влиять на восстановление, а также на ориентацию пучков. 10 Использование увеличения, таким образом, поможет в этом выравнивании. Этот фактор усадки добавляет дополнительные доказательства раннего восстановления, когда проксимальные и дистальные канальцы более правильно выровнены.
Рекомендации по пересадке нервов
Нервные трансплантаты необходимы при нарушении целостности нерва и во время восстановления. После препарирования проксимальной и дистальной культи два конца невозможно соединить без натяжения, и в этом случае потребуется трансплантат, чтобы закрыть разрыв.Два наиболее распространенных нерва, используемых для трансплантации тройничного нерва, — это икроножный нерв в ноге и большой ушной нерв в области шеи. Для пересадки можно использовать и другие нервы, но они наиболее удобны. У каждого нерва есть своя собственная проблема с точки зрения осложнений, связанных с операцией, поскольку у пациента будет потеря чувствительности на латеральном аспекте стопы, если используется икроножный нерв, и на ухе и на боковой поверхности, если больше. ушной нерв. Пациенту требуется информированное обсуждение связанных с этим проблем, чтобы он мог принять решение о том, какое место донора трансплантата им выбрать.Miloro и Stoner 36 субъективно оценили результаты после извлечения икроножного нерва и обнаружили, что большинство пациентов переносят извлечение икроножного нерва без значительной заболеваемости донорским участком.
Донорский нерв и поврежденный нерв должны приблизительно соответствовать друг другу по диаметру, размеру пучка и количеству, чтобы трансплантат был успешным. Средний диаметр нижнего альвеолярного нерва составляет 2,4 мм 30, 38 и язычного нерва 3,2 мм. 39 Большой ушной нерв — 1.Диаметр 5 мм, а диаметр икроножного нерва 2,0 мм, что меньше диаметра нижнего альвеолярного нерва. Svane 30 также указывал на размер и количество пучков в нижнем альвеолярном нерве, и в некоторых случаях было до 18 пучков на участке третьего моляра, уменьшаясь до 12 в подбородочном отверстии. Размер и количество пучков в икроножном и большом ушном нерве намного меньше: 8–9 пучков 40 в большом ушном нерве и 12 39 в икроножном нерве.Язычный нерв имеет примерно 15–18 пучков 41 на участке третьего моляра, уменьшаясь до 9, когда он входит в язык. Следовательно, существует значительное несоответствие между диаметром восстанавливаемых нервов и предлагаемыми трансплантатами, включая количество пучков. Однако это можно преодолеть с помощью нескольких параллельных трансплантатов кабеля, и таким образом можно более полно использовать пучковые узоры. 10
Длина трансплантата иногда может быть проблемой, поскольку максимальная длина, которую можно получить от большого ушного нерва, составляет примерно 2–4 см, а длина икроножного нерва — 20–30 см.Кроме того, нижние альвеолярные и язычные нервы имеют полифацикулярный рисунок, а пучки различаются по размеру и форме. 30, 41 В икроножном нерве пучковый рисунок более однороден, но меньше по количеству. 30 Большой ушной нерв имеет полифасцикулярный рисунок и, следовательно, более точно приближает нижние альвеолярные и язычные нервы, особенно если для восстановления используются параллельные тросовые трансплантаты. 10
Форма поперечного сечения икроножного нерва снова немного отличается от формы нижнего альвеолярного и язычного нервов.Эти нервы округлые, а икроножный нерв более уплощенный. Большой ушной нерв имеет округлую форму и, следовательно, более совместим с нижними альвеолярными и язычными нервами. Площадь поперечного сечения нижнего альвеолярного нерва 30 и язычного нерва 41 намного больше, чем икроножного нерва.
Все эти параметры указывают на несоответствие между различными нервными трансплантатами, которые часто используются для трансплантации, и, возможно, повлияют на результат восстановления.
Пересадка нервов другими материалами
Для пересадки нерва использовались альтернативные каналы. К ним относятся трансплантаты аутологичных вен 42 и использование различных аллотрансплантатов, таких как Gore-tex (WL Gore & Associates Inc, Flagstaff, AZ, USA) 43 и полигликолевая кислота (PGA), например Neurotube (Neurogen LLC, Белоруссия). Эйр, Мэриленд, США). 10 Использование задней лицевой вены или длинной подкожной вены на ноге также использовалось для трансплантации. 42 Хотя внутри длинной подкожной вены есть клапаны, которые задерживают проникновение аксонов, этот трансплантат можно вывернуть наизнанку при использовании, чтобы преодолеть эти клапаны внутри трансплантата, а также использовать эффекты факторов роста нервов, которые считаются находящимися в адвентиции. 43 Pogrel 41 сообщил о хороших успехах при использовании трансплантатов вены, особенно для нижнего альвеолярного нерва, где нерв защищен нижней челюстью.
Внутренняя сила вены имеет значение, и возможное коллапс канала и, следовательно, изгиб, может привести к ингибированию продвижения аксонов.Успех трансплантатов вены для язычного нерва не так хорош, как для нижнего альвеолярного нерва, поскольку язычный нерв подвержен движению, а трансплантаты любой длины считаются изогнутыми и, следовательно, нежизнеспособными. Каналы аллотрансплантата, по-видимому, решают эту проблему, поскольку присущая им жесткость лучше, но отчеты показывают, что трансплантаты Gore-Tex не были особенно успешными. 44 Однако, согласно Wolford и Stevao, 10 резорбируемые каналы оказались эффективными в предварительных исследованиях.Кроме того, эти каналы могут быть заполнены факторами роста нервов, аналогично рассасывающимся каналам. Эти каналы также можно использовать для защиты нервного трансплантата, как и вены, и это поможет избежать возможного коллапса.
Сводка
Техники восстановления и пересадки нервов стали доступны уже давно. Успех методов зависит от точной оценки проблемы, раннего и точного ремонта и использования соответствующих методов, чтобы у пациента были наилучшие шансы на выздоровление.В настоящее время ведутся споры о сроках ремонта, но сейчас принято считать, что чем раньше ремонт, тем лучше результат. Таким образом, первичное восстановление нерва во время травмы будет иметь больше шансов на выздоровление, чем отсроченное восстановление через несколько месяцев. Однако мы не часто можем позволить себе роскошь первичного ремонта, поэтому очень важны оценка и оценка проблемы, а задержка в ремонте сводится к минимуму.
При трансплантации нервов возникают проблемы, особенно с донорскими нервами, доступными для трансплантации.Как уже отмечалось, существуют различные несоответствия, которые необходимо учитывать, если будут использоваться аутологичные трансплантаты. Запасные могут предложить путь вперед; трансплантаты вен использовались с некоторым успехом, но есть проблема с коллапсом из-за недостаточной прочности. Постоянные и рассасывающиеся каналы были опробованы с рассасывающимися материалами и имели некоторый успех.
Ваше полное руководство по невралгии тройничного нерва; A. M. Kaufmann & M. Patel, CCND Winnipeg
Ваше полное руководство по невралгии тройничного нерва; А.М. Кауфманн и М. Патель, CCND Виннипег Часть Первый: характеристики и причины невралгии тройничного нерва III. Типы невралгии тройничного нерва и их причины A. Введение
Мы определяем семь форм TN: типичные
TN, атипичный TN, pre-TN,
связанная с рассеянным склерозом TN, вторичная
TN, посттравматическая TN (невропатия тройничного нерва),
и провалился TN. Эти формы TN должны
отличать от идиопатического (атипичного)
лицевая боль, а также другие нарушения
вызывая кранио-лицевую боль.
Б. Типичная невралгия тройничного нерва ( Tic Douloureux )
Это является наиболее распространенной формой TN, которая ранее называлась классической , Идиопатический и эссенциальный TN . Почти все случаи типичного TN вызваны кровеносными сосудами, сдавливающими корешок тройничного нерва когда он входит в ствол мозга. Это нервно-сосудистая или микрососудистая компрессия в зоне входа корешка тройничного нерва могут быть артерии вен, большие или маленькие, которые могут просто касаться тройничного нерва или вдавить его.В людях без TN кровеносные сосуды обычно не контактируют с тройничным нервом корневая зона входа.
| дюйм у людей без TN обычно нет сдавления сосудов тройничного нерва нервный корешок. | ||||
| В у большинства страдающих типичной невралгией тройничного нерва сосуды сдавливают тройничный нервный корешок. | ||||
Пульсация сосудов тройничного нерва
корень не повреждают нерв заметно. Однако раздражение от повторяющихся пульсаций
может привести к изменениям функции нервов и доставке аномальных сигналов к
ядро тройничного нерва. Считается, что со временем это вызывает гиперактивность.
ядра тройничного нерва, что приводит к возникновению боли TN.
| Поколение боли TN считается результатом периферической патологии (т.е. нервно-сосудистая система компрессия) и центральной патофизиологии (т. е. гиперактивность тройничного нервное ядро). |
Верхняя мозжечковая артерия — самый
часто отвечает за нервно-сосудистую компрессию корешка тройничного нерва,
хотя другие артерии или вены могут быть виновными сосудами. TN можно вылечить
с помощью операции, которая эффективно снимает нервно-сосудистую компрессию при
корешок тройничного нерва. Эта операция называется микрососудистой.
декомпрессии и описана в части .
Второй: лечение невралгии тройничного нерва .
C. Нетипичный Невралгия тройничного нерва
Атипичная ТН характеризуется односторонним, выраженная постоянная и сильная ноющая, раздражающая или жгучая боль, наложенная на в остальном типичные симптомы TN. Это следует отличать от случаев типичного TN, которые развивают незначительную ноющую или жгучую боль в пораженном отделе тройничного нерва.
Сдавление сосудов, как описано выше в типичном Считается, что TN является причиной многих случаев атипичной TN.Некоторые считают нетипичным TN возникает из-за сдавления сосудов в определенной части тройничного нерва. нерв ( portio minor ), в то время как другие предполагают, что атипичный TN представляет собой более тяжелую форму или прогрессирование типичного TN.
Нетипичный Боль TN можно хотя бы частично уменьшить с помощью лекарств. используется для типичного TN, такого как карбамазепин (Тегретол). Операция МВД является излечивающей для многих пациентов с атипичными TN, но не так надежно, как у тех, у кого типовой TN.Также важно Обратите внимание, что процедуры ризотомии могут быть эффективными при лечении атипичного TN, но более вероятно, что они будут осложнены раздражающим или даже болезненное онемение (то есть боль от деафферентации).
Д. Невралгия пре-тройничного нерва
дней за годы до первого приступа боли TN, некоторые пациенты испытывают странные ощущения в распределениях тройничного нерва, которым суждено стать затронутым TN. Эти странные ощущения боли (например, зубная боль) или дискомфорта (например, «булавки и иглы », парастезия), могут быть симптомами пред-тройничной невралгии.Pre-TN наиболее эффективно лечится медикаментозной терапией используется для типичного TN. Когда первая атака истинного TN, это очень отличается от симптомов до TN.
E. Невралгия тройничного нерва, связанная с рассеянным склерозом
симптомы и характеристики TN, связанной с рассеянным склерозом (МС), идентичны тем, для типичного TN. От двух до четырех процентов пациентов с TN имеют признаки рассеянного склероза и около 1% пациентов страдающие рассеянным склерозом развивают TN.Те, у кого TN, связанная с РС, склонны быть моложе, когда они испытывают первый приступ боли, и боль прогрессирует за более короткий промежуток времени, чем у пациентов с типичным TN. Более того, двусторонний TN чаще встречается у людей с рассеянным склерозом.
MS включает образование демиелинизирующих бляшек внутри головной мозг. Когда эти участки травмы затрагивают тройничный нервная система, возможно развитие TN. Связанная с РС TN лечится теми же препаратами используется для типичного TN (см. Лекарства).Тройничный ризотомии используются, когда лекарства не помогают контролировать боль. У некоторых людей с РС и ТН нервно-сосудистая компрессия корешка тройничного нерва может быть редкой причиной и демонстрироваться с помощью специальных МРТ или КТ. В таких случаях проводится микрососудистая декомпрессия. Для лечения TN, связанной с рассеянным склерозом, может быть рассмотрено хирургическое вмешательство.
Ф. Вторичная или опухолевая невралгия тройничного нерва
Тригеминал
невралгия боль, вызванная поражением, например опухолью, называется вторичной
невралгия тройничного нерва.Опухоль, которая сильно сжимает или деформирует тройничный нерв.
нерв может вызвать онемение лица, слабость жевательных мышц и / или постоянное
ноющая боль (также см. Нейропатия тройничного нерва
или посттравматическая невралгия тройничного нерва). Лекарства
Обычно помогает контролировать вторичную боль TN при первой попытке, хотя часто становится.
Хирургическое удаление опухоли обычно облегчает боль и снижает функцию тройничного нерва.
может вернуться. На момент операции после удаления опухоли тройничный
нерв также может быть сдавлен артерией или веной, что вызывает
типичные особенности TN.Затем этот сосуд необходимо отвести от нерва с помощью
методы микроваскулярной декомпрессии для лечения ТН.
В этих Изображения МРТ, опухоль, ответственная за сдавливание тройничного нерва выделен красным. | ||
г.Тройничный
Невропатия или посттравматическая невралгия тройничного нерва
Травма к тройничному нерву может вызвать эту сильную боль состояние. Невропатия тройничного нерва или посттравматическая TN могут развиться после черепно-лицевая травма (например, в результате автомобильной аварии), травма зубов, травма носовых пазух (например, после процедур Колдуэлл-Люка), но чаще всего после деструктивных процедуры (ризотомии), используемые для лечения TN: после травмы TN онемение может стать связано с неприятными ощущениями. или боль, иногда называемая фантомом боль или деафферентация боль .Эти болевые состояния вызваны: непоправимое повреждение тройничного нерва и вторичная гиперактивность ядро тройничного нерва.
боль при нейропатии тройничного нерва или посттравматической TN обычно постоянная, ноющая или жжение, но может усугубиться воздействием таких факторов, как ветер и холод. Такая деафферентационная боль может начаться сразу же или через несколько дней или лет после травмы. к тройничному нерву. В самой крайней форме, называется анестезия. dolorosa наблюдается постоянная сильная боль в местах полного онемения.
К сожалению, лечение посттравматической ТН часто оказывается неэффективным и болезненным. нельзя контролировать с помощью лекарств. Там Есть несколько сообщений об обезболивании, связанном с использованием тройничного нерва. процедуры стимуляции. Более инвазивные процедуры, такие как обработка поверхности мозга (предмоторная коры головного мозга) или сфокусированные повреждения ствола головного мозга (трактотомия) тоже пробовали.
H. «Неудачная» невралгия тройничного нерва
Нет все случаи TN можно эффективно контролировать с помощью какой-либо одной формы лекарств или хирургические вмешательства.Когда лекарства перестали быть эффективными, хирургические вмешательства Если после операции боль повторяется или не проходит, можно попробовать лекарства. снова и затем может работать более эффективно. необходимы вмешательства. К сожалению, у очень небольшой части больных все лекарства, микрососудистые процедуры декомпрессии и деструктивной ризотомии оказались неэффективными в контроле боли TN. Это состояние называется «не удалось». невралгия тройничного нерва.Такие люди также часто страдают дополнительным поражением тройничного нерва. невропатия или посттравматическая ТН в результате деструктивных вмешательств они прошли. поверхности мозга (домоторная стимуляция коры), контролируемое поражение ствол головного мозга (трактотомия) или стимуляция тройничного нерва или гассерион ганглии (стимуляция тройничного нерва).
Подготовил А. М. Кауфманн и М.Пател
© 2001 Центр заболеваний черепных нервов, Виннипег, Университет Манитобы, Центр медицинских наук. Информация, представленная на этом сайте, предназначена только в образовательных целях и не должны использоваться для диагностики или лечения заболевания. или беспорядок. Эта информация не предназначена для замены, дополнения или каким-либо образом квалифицировать услуги или советы, предоставленные квалифицированным специалистом в области здравоохранения. Пожалуйста, проконсультируйтесь с сертифицированным специалистом в области здравоохранения, прежде чем заполнять какую-либо форму. лечебного действия.Копирование в любой части или форме этого документа строго запрещено. запрещенный. Все права защищены. Для получения дополнительной информации прочтите наш отказ от ответственности . Запросы, связанные с веб-сайтом, можно направлять по номеру Information Провайдер .
Невралгия тройничного нерва: что нужно знать
Если вы когда-либо испытывали нервную боль, вы знаете, насколько она может быть изнурительной. Невралгия тройничного нерва — это тип нервной боли, которая поражает лицо, обычно в области челюсти или щеки. Боль может быть острой или ощущаться как жжение.Оно может быть настолько серьезным, что вам трудно есть или пить.
Большинство обострений начинается с покалывания или онемения лица, а боль может приходить и уходить. Во время обострения приступы боли учащаются и почти никогда не прекращаются. Интенсивность боли может сделать вашу повседневную деятельность невыносимой, но само состояние не опасно для жизни.
Что вызывает невралгию тройничного нерва?
Наиболее частой причиной невралгии тройничного нерва является давление кровеносного сосуда на тройничный нерв.Редкие причины включают рассеянный склероз или опухоли. Это нервное заболевание чаще всего встречается у людей старше 50 лет и чаще встречается у женщин, чем у мужчин.
Каковы симптомы невралгии тройничного нерва?
Есть несколько симптомов:
- Боль в щеке или челюсти — обычно приходит и уходит, в основном односторонняя.
- Отсутствие боли между обострениями.
- Боль, похожая на поражение электрическим током или колоть.
- Боль, вызванная прикосновением, едой, чисткой зубов или другими факторами, например ветром.
- Тревога от мысли о возвращении боли.
Как диагностируется невралгия тройничного нерва?
Невралгия тройничного нерва может быть диагностирована вашим лечащим врачом на основе вашего описания боли. Этот диагноз основан на трех различных факторах:
- Тип боли: Боль, связанная с невралгией тройничного нерва, внезапная, шоковая и непродолжительная.
- Местонахождение боли: боль в основном в челюсти или щеке.
- Причины боли: обычно возникает после раздражения щек такими вещами, как еда, разговор или чистка зубов.
При необходимости провайдер может заказать дополнительные тесты. К ним относятся неврологическое обследование или МРТ.
Ваша лицевая боль может быть вызвана рядом различных состояний, поэтому важен точный диагноз.
Как лечится невралгия тройничного нерва?
Невралгия тройничного нерва лечится по-разному в зависимости от случая. Лечение обычно начинается с приема лекарств, которые помогают избавиться от нервной боли. Если лекарства не работают, а боль не проходит, возможно хирургическое вмешательство.Хирургические варианты лечения невралгии тройничного нерва включают следующие процедуры:
- Переместите или удалите кровеносные сосуды, которые контактируют с корешком тройничного нерва, чтобы предотвратить его неправильную работу.
- Используйте излучение для повреждения тройничного нерва и уменьшения или устранения боли.
- Используйте малоинвазивные инъекции, чтобы повредить тройничный нерв и заблокировать болевые сигналы.
- Избирательное разрушение нервных волокон, вызывающих боль.
Можно ли предотвратить невралгию тройничного нерва?
К сожалению, предотвратить невралгию тройничного нерва невозможно.Если какие-то действия вызывают у вас боль больше, чем другие, по возможности их следует избегать.
Хотя это состояние не смертельно, оно может нарушить вашу жизнь. Поговорите со своим лечащим врачом о боли при невралгии тройничного нерва. Ваш врач может определить для вас лучший метод обезболивания.
Пятый черепной нерв при головной боли | Журнал головной боли и боли
(2018) Комитет по классификации головной боли Международного общества головной боли (IHS) Международная классификация заболеваний головной боли, 3-е издание.Cephalalgia 38 (1): 1–211
Ray BS, Wolff HG (1940) Экспериментальные исследования головной боли: чувствительные к боли структуры головы и их значение при головной боли. Arch Surg 41 (4): 813–856
Статья Google ученый
Silberstein SD, Lipton RB, Dalessio DJ (2001) Головная боль Вольфа и другие головные боли: Oxford University Press
Google ученый
Fontaine D, Almairac F, Santucci S, Fernandez C, Dallel R, Pallud J et al (2018) Дуральные и пиальные структуры, чувствительные к боли у людей: новые данные от трепанации черепа в сознании. Мозг 141 (4): 1040–1048
PubMed Статья Google ученый
Эдвинссон Л. (2011) Отслеживание нейронных связей с болевыми путями, имеющими отношение к первичным головным болям. Цефалгия 31 (6): 737–747
PubMed Статья Google ученый
Stovner LJ, Nichols E, Steiner TJ, Abd-Allah F, Abdelalim A, Al-Raddadi RM et al (2018) Глобальное, региональное и национальное бремя мигрени и головной боли напряжения, 1990–2016: систематический анализ для исследование глобального бремени болезней, 2016. Lancet Neurology 17 (11): 954–976
Статья Google ученый
(2018) Глобальное, региональное и национальное бремя мигрени и головной боли напряжения, 1990–2016 гг .: систематический анализ для исследования глобального бремени болезней 2016 г.Lancet Neurology 17 (11): 954–976
James SL, Abate D, Abate KH, Abay SM, Abbafati C, Abbasi N et al (2018) Глобальная, региональная и национальная заболеваемость, распространенность и годы прожили с инвалидностью из-за 354 заболеваний и травм в 195 странах и территориях, 1990–2017 гг .: систематический анализ глобального бремени болезней, исследование 2017 г. Lancet 392 (10159): 1789–1858
Article Google ученый
Linde M, Gustavsson A, Stovner LJ, Steiner TJ, Barré J, Katsarava Z et al (2012) Стоимость головных болей в Европе: проект Eurolight.Eur J Neurol 19 (5): 703–711
CAS PubMed Статья Google ученый
Фейгин В.Л., и др. (2020) Глобальное бремя неврологических расстройств: преобразование доказательств в политику Lancet Neurol 19 (3): 255-265
Финнеруп Н.Б., Николайсен Л., Йенсен Т.С. (2012) Пренебрегаем ли мы реорганизацией позвоночника после повреждения нервов? Боль 153 (2): 269–272
PubMed Статья Google ученый
Frederiksen SD, Haanes KA, Warfvinge K, Edvinsson L (2019) Периваскулярные нейротрансмиттеры: регуляция мозгового кровотока и роль в первичных головных болях. J Cereb Blood Flow Metab 39 (4): 610–632
CAS PubMed Статья Google ученый
Эдвинссон Л., Краузе Д. Церебральный кровоток и метаболизм (2002). Филадельфия: Липпинкотт Уильямс и Уилкинс 17 (521): 8
Google ученый
Эдвинссон Л. (2017) Тригемино-сосудистый путь: роль рецепторов CGRP и CGRP при мигрени. Головная боль 57 (Дополнение 2): 47–55
PubMed Статья Google ученый
Нозеда Р., Бурштейн Р. (2013) Патофизиология мигрени: анатомия тройнично-сосудистого пути и связанные с ней неврологические симптомы, распространяющаяся кортикальная депрессия, сенсибилизация и модуляция боли. Pain 154: S44 – S53
CAS PubMed Статья Google ученый
Eftekhari S, Salvatore CA, Johansson S, Chen TB, Zeng Z, Edvinsson L (2015) Локализация CGRP, рецептора CGRP, PACAP и глутамата в ганглии тройничного нерва Связь с гематоэнцефалическим барьером. Brain Res 1600: 93–109
CAS PubMed Статья Google ученый
Месслингер К., Руссо А.Ф. (2019) Текущее понимание структуры и функции тройничного ганглия при головной боли. Цефалгия 39 (13): 1661–1674
PubMed Статья Google ученый
Thalakoti S, Patil VV, Damodaram S, Vause CV, Langford LE, Freeman SE et al (2007) Передача сигналов нейронов и глии в тройничном ганглии: последствия для патологии мигрени. Головная боль 47 (7): 1008–1023
PubMed PubMed Central Статья Google ученый
Franceschini A, Vilotti S, Ferrari MD, van den Maagdenberg AM, Nistri A, Fabbretti E (2013) Уровни TNFα и экспрессия макрофагов отражают воспалительный потенциал ганглиев тройничного нерва на мышиной модели семейной гемиплегической мигрени.PLoS One 8 (1): e52394 https://doi.org/10.1371/journal.pone.0052394
Harriott AM, Gold MS (2009) Вклад первичных афферентных каналов в невропатическую боль. Представитель Curr Pain Headache 13 (3): 197–207
PubMed PubMed Central Статья Google ученый
Биста П., Венди Л. (2019) Имлах. «Патологические механизмы и терапевтические цели при невропатической боли тройничного нерва». Лекарства 6 (3): 91
Pennisi E, Cruccu G, Manfredi M, Palladini G (1991) Гистометрическое исследование миелинизированных волокон в тройничном нерве человека. J Neurol Sci 105 (1): 22–28
CAS PubMed Статья Google ученый
Джей Г.В., Баркин Р.Л. (2017) Первичные головные боли — часть 2: головная боль напряжения и головная боль при чрезмерном употреблении лекарств. Dis Mon 63 (12): 342–367
PubMed Статья Google ученый
Бендцен Л. (2003) Центральная и периферическая сенсибилизация при головной боли напряжения. Представитель Curr Pain Headache 7 (6): 460–465
PubMed Статья Google ученый
Fumal A, Schoenen J (2008) Головная боль напряжения: текущие исследования и клиническое ведение. Ланцетная неврология. 7 (1): 70–83
CAS PubMed Статья Google ученый
Rusu MC, Cretoiu D, Vrapciu AD, Hostiuc S, Dermengiu D, Manoiu VS et al (2016) Телоциты тройничного ганглия взрослого человека.Cell Biol Toxicol 32 (3): 199–207
PubMed Статья Google ученый
Де Лука С., Коланджело А.М., Альбергина Л., Папа М. (2018) Нейроиммунный гемостаз: гомеостаз и заболевания центральной нервной системы. Front Cell Neurosci 12: 459
PubMed PubMed Central Статья CAS Google ученый
Messlinger K (2018) Большое наводнение CGRP — источники, поглотители и участки сигналов в тригеминоваскулярной системе.J Головная боль 19 (1): 22
PubMed PubMed Central Статья CAS Google ученый
Эдвинссон Л., Хаанес К.А., Варфвинге К., Краузе Д.Н. (2018) CGRP как цель новых методов лечения мигрени — успешный перевод из стационара в клинику. Nat Rev Neurol 14 (6): 338–350
CAS PubMed Статья Google ученый
Lundblad C, Haanes KA, Grande G, Edvinsson L (2015) Экспериментальное воспаление после применения твердой мозговой оболочки полного адъюванта Фрейнда или воспалительного супа не изменяет микрососудистый ход мозга и тройничного нерва.J Головная боль 16:91
PubMed PubMed Central Статья CAS Google ученый
De Luca C, Savarese L, Colangelo AM, Bianco MR, Cirillo G, Alberghina L et al (2016) Астроциты и опосредованный микроглией иммунный ответ при дезадаптивной пластичности по-разному модулируется NGF в вентральном роге спинной мозг после повреждения периферического нерва. Cell Mol Neurobiol 36 (1): 37–46
PubMed Статья CAS Google ученый
Cirillo G, Colangelo AM, Berbenni M, Ippolito VM, De Luca C, Verdesca F et al (2015) Пуринергическая модуляция дезадаптивной пластичности спинномозговой нейроглии после повреждения периферического нерва. Мол нейробиол 52 (3): 1440–1457
CAS PubMed Статья Google ученый
Папа М., Де Лука С., Петта Ф, Альбергина Л., Чирилло Г. (2014) Взаимодействие астроцитов и нейронов в неадаптивной пластичности. Neurosci Biobehav Rev 42: 35–54
CAS PubMed Статья Google ученый
Virtuoso A, Herrera-Rincon C, Papa M, Panetsos F (2019) Зависимость нейропротезной стимуляции от сенсорной модальности нейронов тройничного нерва после повреждения нерва. Значение в дизайне будущих сенсорных нейропротезов для правильного восприятия и модуляции невропатической боли. Front Neurosci 13: 389
PubMed PubMed Central Статья Google ученый
Такеда М., Такахаши М., Насу М., Мацумото С. (2011) Периферическое воспаление подавляет внутренние выпрямляющие калиевые токи сателлитных глиальных клеток в ганглиях тройничного нерва.Боль 152 (9): 2147–2156
CAS PubMed Статья Google ученый
Lai TH, Protsenko E, Cheng YC, Loggia ML, Coppola G, Chen WT (2015) Нейропластичность при распространенных формах хронических головных болей. Neural Plast 2015: 205985
PubMed PubMed Central Статья CAS Google ученый
Кавагути А., Сато М., Кимура М., Ичинохе Т., Тазаки М., Шибукава Ю. (2015) Экспрессия и функция пуринергических рецепторов P2Y12 в нейронах тройничного ганглия крыс.Neurosci Res 98: 17–27
CAS PubMed Статья Google ученый
Goto T, Oh SB, Takeda M, Shinoda M, Sato T, Gunjikake KK et al (2016) Последние достижения в фундаментальных исследованиях тройничного ганглия. J Physiol Sci 66 (5): 381–386
PubMed Статья Google ученый
Хаанес К.А., Эдвинссон Л. (2014) Экспрессия и характеристика пуринергических рецепторов в потенциале средней менингеальной артерии крысы при мигрени.PLoS One 9 (9): e108782
PubMed PubMed Central Статья CAS Google ученый
Haanes KA, Labastida-Ramírez A, Blixt FW, Rubio-Beltrán E, Dirven CM, Danser AH et al (2019) Исследование пуринергических рецепторов в качестве потенциальных целей против мигрени с использованием установленных доклинических моделей мигрени. Цефалгия 39 (11): 1421–1434
PubMed Статья Google ученый
Гейтс П. (2006) Актуальный диагноз Дууса в неврологии: анатомия, физиология, признаки, симптомы — М. Бэр и М. Фрочер. Int Med J 36 (9): 557
Статья Google ученый
Toshida H, Suto C (2018) Модель кролика с преганглионарной парасимпатической денервацией для исследований иннервации. Роговица 37 (Дополнение 1): S106 – Ss12
PubMed Статья Google ученый
Morgan C, DeGroat WC, Jannetta PJ (1987) Симпатическая иннервация роговицы из верхнего шейного ганглия. Исследование HRP на кошке. J Auton Nerv Syst 20 (2): 179–183
CAS PubMed Статья Google ученый
Suzuki N, Hardebo JE, Owman C (1989) Коллатерали тригеминальных волокон, хранящие вещество P и связанный с геном кальцитонина пептид, ассоциируются с ганглиозными клетками, содержащими холинацетилтрансферазу и вазоактивный кишечный полипептид в сфенопалатиновом ганглии крысы.Рефлекс аксонов, модулирующий активность парасимпатических ганглиев? Неврология 30 (3): 595–604
CAS PubMed Статья Google ученый
Ларриер Д., Ли А. (2003) Анатомия головной и лицевой боли. Otolaryngol Clin N Am 36 (6): 1041–1053 v
Статья Google ученый
Goadsby PJ, Holland PR, Martins-Oliveira M, Hoffmann J, Schankin C, Akerman S (2017) Патофизиология мигрени: нарушение сенсорной обработки.Physiol Rev 97 (2): 553–622
PubMed PubMed Central Статья Google ученый
Liu-Chen LY, Han DH, Moskowitz MA (1983) Пиа паутина содержит вещество P, происходящее из нейронов тройничного нерва. Неврология 9 (4): 803–808
CAS PubMed Статья Google ученый
Лю-Чен LY, Mayberg MR, Moskowitz MA (1983) Иммуногистохимическое доказательство тригеминоваскулярного пути, содержащего вещество P, к пиальным артериям у кошек.Brain Res 268 (1): 162–166
CAS PubMed Статья Google ученый
Mayberg MR, Zervas NT, Moskowitz MA (1984) Проекции тройничного нерва на супратенториальные пиальные и твердые кровеносные сосуды у кошек, продемонстрированные гистохимическим анализом пероксидазы хрена. J Comp Neurol 223 (1): 46–56
CAS PubMed Статья Google ученый
Penfield W, McNAUGHTON F (1940) Дуральная головная боль и иннервация твердой мозговой оболочки.Arch Neurol Psychiatr 44 (1): 43–75
Статья Google ученый
Анастаси Г., Капитани С., Карнацца М., Чинти С., Кремона О., Де Каро Р. и др. (2010) Trattato di anatomia umana
Google ученый
Burchiel KJ (2003) Новая классификация лицевой боли. Нейрохирургия 53 (5): 1164–1167
PubMed Статья Google ученый
Donnet A, Simon E, Cuny E, Demarquay G, Ducros A, De Gaalon S et al (2017) Французские рекомендации по диагностике и лечению классической невралгии тройничного нерва (Французское общество головной боли и Французское нейрохирургическое общество). Rev Neurol (Париж) 173 (3): 131–151
CAS Статья Google ученый
Brazis PW, Masdeu JC (2011) Локализация в клинической неврологии (шестое изд.), Филадельфия: Lippincott Williams & Wilkins
Piovesan EJ, Kowacs PA, Oshinsky ML (2003) Конвергенция цервикальных и тройничных сенсорных афферентов. Представитель Curr Pain Headache 7 (5): 377–383
PubMed Статья Google ученый
Haines DE, Mihailoff GA (2017) Фундаментальная нейробиология для базовых и клинических приложений Электронная книга: Elsevier Health Sciences
Google ученый
Fisch A (2012) Нейроанатомия: нарисуйте, чтобы узнать: OUP USA
Google ученый
Rusu MC (2004) Ядро тройничного нерва позвоночника — соображения по структуре хвостового ядра. Folia Morphol (Warsz) 63 (3): 325–328
Google ученый
Pradier B, McCormick SJ, Tsuda AC, Chen RW, Atkinson AL, Westrick MR et al (2019) Свойства нейронов в поверхностных пластинках хвостового ядра тройничного нерва. Physiol Rep 7 (12): e14112
PubMed PubMed Central Статья CAS Google ученый
Noseda R, Jakubowski M, Kainz V, Borsook D, Burstein R (2011) Кортикальные проекции функционально идентифицированных тригеминоваскулярных нейронов таламуса: последствия для мигрени и связанных с ней симптомов. J Neurosci 31 (40): 14204–14217
CAS PubMed PubMed Central Статья Google ученый
Малик А., Штрассман Р.М., Бурштейн Р. (2000) Нейроны тригеминогипоталамического и ретикулогипоталамического трактов в верхнем шейном отделе спинного мозга и хвостовом мозговом веществе крысы.J Neurophysiol 84 (4): 2078–2112
CAS PubMed Статья Google ученый
Алмейда Т.Ф., Ройзенблатт С., Туфик С. (2004) Афферентные болевые пути: нейроанатомический обзор. Brain Res 1000 (1-2): 40–56
CAS PubMed Статья Google ученый
Патель Н.М., Дас Дж. М. (2019) Нейроанатомия, ядро спинного мозга. StatPearls Publishing, StatPearls
Google ученый
Kocorowski LH, Helmstetter FJ (2001) Пептид, связанный с геном кальцитонина, высвобождаемый в миндалевидном теле, участвует в формировании условного рефлекса слухового страха Павлова. Neurobiol Learn Mem 75 (2): 149–163
CAS PubMed Статья Google ученый
Palmiter RD (2018) Парабрахиальное ядро: нейроны CGRP действуют как общая тревога. Trends Neurosci 41 (5): 280–293
CAS PubMed PubMed Central Статья Google ученый
Han JS, Li W, Neugebauer V (2005) Критическая роль рецепторов пептида 1, связанных с геном кальцитонина, в миндалине в синаптической пластичности и болевом поведении. J Neurosci 25 (46): 10717–10728
CAS PubMed PubMed Central Статья Google ученый
Shinohara K, Watabe AM, Nagase M, Okutsu Y, Takahashi Y, Kurihara H et al (2017) Важная роль эндогенного пептида, связанного с геном кальцитонина, в связанной с болью пластичности в центральной миндалине.Eur J Neurosci 46 (6): 2149–2160
PubMed PubMed Central Статья Google ученый
Missig G, Mei L, Vizzard MA, Braas KM, Waschek JA, Ressler KJ et al (2017) Активация полипептида, активирующего аденилатциклазу парабрахиального гипофиза, киназного сигнала, регулируемого эндосомными внеклеточными сигналами миндалины, регулирует эмоциональный компонент боль. Биологическая психиатрия 81 (8): 671–682
CAS PubMed Статья Google ученый
Sohn JH, Choi HC, Kim CH (2013) Различия между эпизодическими и хроническими головными болями напряжения в ноцицептивно-специфических проводящих путях тройничного нерва. Цефалгия 33 (5): 330–339
PubMed Статья Google ученый
Шварц Б.С., Стюарт В.Ф., Саймон Д., Липтон Р.Б. (1998) Эпидемиология головной боли напряжения. Джама 279 (5): 381–383
CAS PubMed Статья Google ученый
Бендцен Л. (2000) Центральная сенсибилизация при головной боли напряжения — возможные патофизиологические механизмы. Цефалгия 20 (5): 486–508
CAS PubMed Статья Google ученый
May A, Burstein R (2019) Гипоталамическая регуляция головной боли и мигрени. Цефалгия 39 (13): 1710–1719
PubMed PubMed Central Статья Google ученый
Goadsby PJ (2009) Сосудистая теория мигрени — отличная история, опровергнутая фактами. Brain 132 (Pt 1): 6–7
PubMed Статья Google ученый
Amin FM, Asghar MS, Hougaard A, Hansen AE, Larsen VA, de Koning PJ et al (2013) Магнитно-резонансная ангиография внутричерепных и экстракраниальных артерий у пациентов со спонтанной мигренью без ауры: поперечное исследование . Lancet Neurology 12 (5): 454–461
PubMed Статья Google ученый
Charles A (2013) Вазодилатация как причина мигренозной головной боли вне поля зрения. Lancet Neurology 12 (5): 419–420
PubMed Статья Google ученый
Goadsby P, Edvinsson L, Ekman R (1988) Высвобождение вазоактивных пептидов во внемозговом кровообращении у людей и кошек во время активации тройнично-сосудистой системы. Ann Neurol 23 (2): 193–196
CAS PubMed Статья Google ученый
Tuka B, Helyes Z, Markovics A, Bagoly T, Németh J, Márk L et al (2012) Периферийные и центральные изменения аденилатциклазы гипофиза, активирующие полипептидоподобную иммунореактивность у крыс в ответ на активацию тройнично-сосудистой системы. Пептиды 33 (2): 307–316
CAS PubMed Статья Google ученый
Lassen L, Haderslev P, Jacobsen V, Iversen HK, Sperling B, Olesen J (2002) CGRP может играть причинную роль в мигрени.Цефалгия 22 (1): 54–61
CAS PubMed Статья Google ученый
Олесен Дж., Бурштейн Р., Ашина М., Тфельт-Хансен П. (2009) Происхождение боли при мигрени: доказательства периферической сенсибилизации. Lancet Neurology 8 (7): 679–690
PubMed Статья Google ученый
Hou M, Uddman R, Tajti J, Kanje M, Edvinsson L (2002) Иммунореактивность рецептора капсаицина в ганглии тройничного нерва человека.Neurosci Lett 330 (3): 223–226
CAS PubMed Статья Google ученый
Benemei S, Fusi C, Trevisan G, Geppetti P (2014) Канал TRPA1 в механизме и лечении мигрени. Br J Pharmacol 171 (10): 2552–2567
CAS PubMed PubMed Central Статья Google ученый
Dussor G, Cao YQ (2016) TRPM8 и мигрень. Головная боль 56 (9): 1406–1417
PubMed PubMed Central Статья Google ученый
Vigano A, Manica A, Di Piero V, Leonardi M (2019) Движение на север вызвало у нас мигрень? Эволюционный подход к пониманию широтных различий в эпидемиологии мигрени. Головная боль 59 (4): 632–634
PubMed PubMed Central Статья Google ученый
Малик А., Бурштейн Р. (2000) Периферическая и центральная сенсибилизация во время мигрени. Funct Neurol 15: 28–35
PubMed Google ученый
Аврора С.К., Брин М.Ф. (2017) Хроническая мигрень: обновленная информация о физиологии, визуализации и механизме действия двух доступных фармакологических методов лечения. Головная боль 57 (1): 109–125
PubMed Статья Google ученый
Московиц М.А. (2008) Определение пути к открытиям от рабочего места до постели больного: тройнично-сосудистая система и сенсибилизация. Головная боль 48 (5): 688–690
PubMed Статья Google ученый
Burstein R, Jakubowski M, Garcia-Nicas E, Kainz V, Bajwa Z, Hargreaves R et al (2010) Таламическая сенсибилизация превращает локализованную боль в широко распространенную аллодинию. Энн Нейрол 68 (1): 81–91
PubMed PubMed Central Статья Google ученый
Cernuda-Morollón E, Larrosa D, Ramón C, Vega J, Martínez-Camblor P, Pascual J (2013) Интерктальное повышение уровней CGRP в периферической крови как биомаркер хронической мигрени.Неврология 81 (14): 1191–1196
PubMed Статья CAS Google ученый
Эдвинссон Л., Хаанес К.А., Варфвиндж К. (2019) Участвует ли воспаление в возникновении мигрени? Nat Rev Neurol 15 (8): 483–490
PubMed Статья Google ученый
Гоудсби П., Эдвинссон Л., Экман Р. (1990) Высвобождение вазоактивного пептида во внемозговом кровообращении человека во время мигрени.Ann Neurology 28 (2): 183–187
CAS Статья Google ученый
Lukács M, Haanes KA, Majláth Z, Tajti J, Vécsei L, Warfvinge K et al (2015) Дуральное введение воспалительного супа или полного адъюванта Фрейнда вызывает активацию и воспалительную реакцию в ганглии тройничного нерва крысы. J Головная боль 16 (1): 79
PubMed Central Статья CAS Google ученый
Fernandez-de-las-Penas C, Cuadrado ML, Arendt-Nielsen L, Simons DG, Pareja JA (2007) Миофасциальные триггерные точки и сенсибилизация: обновленная модель боли при головной боли напряжения. Цефалгия 27 (5): 383–393
CAS PubMed Статья Google ученый
Groves PM, Thompson RF (1970) Привыкание: теория двойного процесса. Psychol Rev 77 (5): 419–450
CAS PubMed Статья Google ученый
Coppola G, Di Lorenzo C, Schoenen J, Pierelli F (2013) Привыкание и сенсибилизация при первичных головных болях. J Головная боль 14:65
PubMed PubMed Central Статья Google ученый
Perrotta A, Serrao M, Sandrini G, Bogdanova D, Tassorelli C, Bartolo M et al (2008) Снижение привыкания к тройничным рефлексам у пациентов с эпизодической кластерной головной болью во время кластерного периода. Цефалгия 28 (9): 950–959
CAS PubMed Статья Google ученый
Ли Дж., Лин Р.Л., Гарсия Р.Г., Ким Дж., Ким Х, Лоджия М.Л. и др. (2017) Снижение привыкания к островку, связанное с усилением входного сигнала тройничного ствола мозга при мигрени. Цефалгия 37 (11): 1026–1038
PubMed Статья Google ученый
Динер Х.С., Додик Д., Эверс С., Холле Д., Дженсен Р. Х., Липтон Р. Б. и др. (2019) Патофизиология, профилактика и лечение головной боли при чрезмерном использовании лекарств. Lancet Neurology 18 (9): 891–902
PubMed Статья Google ученый
Diener HC, Holle D, Solbach K, Gaul C (2016) Головная боль от чрезмерного употребления лекарств: факторы риска, патофизиология и лечение. Nat Rev Neurol 12 (10): 575–583
PubMed Статья Google ученый
Supornsilpchai W, le Grand SM, Srikiatkhachorn A (2010) Сверхвозбудимость коры и механизм головной боли при чрезмерном употреблении лекарств. Цефалгия 30 (9): 1101–1109
PubMed Статья Google ученый
Okada-Ogawa A, Porreca F, Meng ID (2009) Устойчивая морфин-индуцированная сенсибилизация и потеря диффузного вредного ингибирующего контроля в нейронах твердой мозговой оболочки спинного мозга. J Neurosci 29 (50): 15828–15835
CAS PubMed PubMed Central Статья Google ученый
Srikiatkhachorn A, Anthony M (1996) Серотонин тромбоцитов у пациентов с головной болью, вызванной обезболивающими. Цефалгия 16 (6): 423–426
CAS PubMed Статья Google ученый
Coppola G, Currà A, Di Lorenzo C, Parisi V, Gorini M, Sava SL et al (2010) Аномальные корковые ответы на соматосенсорную стимуляцию при головной боли при чрезмерном употреблении лекарств. BMC Neurol 10 (1): 126
PubMed PubMed Central Статья Google ученый
Viganò A, Torrieri MC, Toscano M, Puledda F, Petolicchio B, D’Elia TS et al (2018) Нейрофизиологические корреляты клинического улучшения после блокады большого затылочного нерва (GON) при хронической мигрени: актуальность для хронической мигрени патофизиология мигрени.J Головная боль 19 (1): 73
PubMed PubMed Central Статья Google ученый
Wei DY-T, Ong JJY, Goadsby PJ (2018) Обзор вегетативных цефалгий тройничного нерва: нозологическая эволюция, диагностика и лечение. Ann Indian Acad Neurol 21 (Дополнение 1): S39
PubMed PubMed Central Google ученый
Tuka B, Szabó N, Tóth E, Kincses ZT, Párdutz Á, Szok D et al (2016) Выпуск PACAP-38 у пациентов с эпизодической кластерной головной болью — исследовательское исследование.J Головная боль 17 (1): 69
PubMed PubMed Central Статья CAS Google ученый
Goadsby PJ, Edvinsson L (1994) Человеческие доказательства in vivo активации тригемино-сосудистой системы в кластерных изменениях нейропептидов головной боли и эффекты терапии острых приступов. Brain 117 (3): 427–434
PubMed Статья Google ученый
Goadsby PJ, Dodick DW, Leone M, Bardos JN, Oakes TM, Millen BA et al (2019) Испытание галканезумаба для профилактики эпизодической кластерной головной боли.N Engl J Med 381 (2): 132–141
CAS Статья PubMed Google ученый
Миллер С., Синклер А.Дж., Дэвис Б., Матару М. (2016) Нейростимуляция в лечении первичных головных болей. Pract Neurol 16 (5): 362–375
PubMed PubMed Central Статья Google ученый
May A, Schwedt TJ, Magis D, Pozo-Rosich P, Evers S, Wang S-J (2018) Кластерная головная боль.Nat Reviews Dis Prime 4: 18006
Статья Google ученый
Akerman S, Holland PR, Summ O, Lasalandra MP, Goadsby PJ (2012) Трансляционная модель in vivo вегетативной цефалгии тройничного нерва: терапевтическая характеристика. Brain 135 (12): 3664–3675
PubMed Статья Google ученый
Schoenen J, Jensen RH, Lanteri-Minet M, Láinez MJ, Gaul C, Goodman AM et al (2013) Стимуляция сфенопалатинового ганглия (SPG) для лечения кластерной головной боли.Путь CH-1: рандомизированное фиктивно-контролируемое исследование. Цефалгия 33 (10): 816–830
PubMed PubMed Central Статья Google ученый
Cohen A (2017) SUN: кратковременные односторонние приступы невралгической головной боли. Головная боль 57 (6): 1010–1020
PubMed Статья Google ученый
Pedersen JL, Barloese M, Jensen RH (2013) Нейростимуляция при кластерной головной боли: обзор текущего прогресса.Цефалгия 33 (14): 1179–1193
PubMed Статья Google ученый
Snoer A, Lund N, Beske R, Hagedorn A, Jensen RH, Barloese M (2018) Кластерная головная боль вне фазы боли: проспективное исследование 500 приступов. Неврология 91 (9): e822 – ee31
PubMed Статья Google ученый
Merskey HE (1986) Классификация хронической боли: описание синдромов хронической боли и определения терминов, связанных с болью.Боль 3: S1-226
Maarbjerg S, Di Stefano G, Bendtsen L, Cruccu G (2017) Невралгия тройничного нерва — диагностика и лечение. Цефалгия 37 (7): 648–657
PubMed Статья Google ученый
Evers S (2017) Лицевая боль: перекрывающиеся синдромы. Цефалгия 37 (7): 705–713
PubMed Статья Google ученый
Хуанг С., Амасанти М., Ловелл Б., Янг Т. (2017) Рецидивирующая болезненная офтальмоплегическая нейропатия.Pract Neurol 17 (4): 318–320
PubMed Статья Google ученый
Evans RW, Pareja JA (2009) Мнение эксперта. Надглазничная невралгия. Головная боль 49 (2): 278–281
PubMed Статья Google ученый
Pareja JA, Lopez-Ruiz P, Mayo D, Villar-Quiles RN, Carcamo A, Gutierrez-Viedma A et al (2017) Супратрохлеарная невралгия: серия проспективных случаев с участием 15 пациентов.Головная боль 57 (9): 1433–1442
PubMed Статья Google ученый
Pareja JA, Cuadrado ML (2013) Слезная невралгия: пока отсутствует черепная невралгия. Цефалгия 33 (14): 1198–1202
PubMed Статья Google ученый
Tran TM, McClelland CM, Lee MS (2019) Диагностика и лечение трохлеодинии, трохлеита и блокированной головной боли.Передний Neurol 10: 361
PubMed PubMed Central Статья Google ученый
Pareja JA, Cuadrado ML, Porta-Etessam J, Fernandez-de-las-Penas C, Gili P, Caminero AB et al (2010) Идиопатическая офтальмодиния и идиопатическая риналгия: два топографических синдрома лицевой боли. Головная боль 50 (8): 1286–1295
PubMed Статья Google ученый
Разек А.А., Кастильо М. (2009) Визуализация поражений кавернозного синуса.AJNR Am J Neuroradiol 30 (3): 444–452
PubMed Статья Google ученый
Caldarelli C, Benech R, Iaquinta C (2016) Синдром верхней глазничной щели при боковом переломе орбитальной стенки: обновление управления и классификации. Craniomaxillofac Trauma Reconstr 9 (4): 277–283
PubMed PubMed Central Статья Google ученый
Bendtsen L, Zakrzewska JM, Abbott J, Braschinsky M, Di Stefano G, Donnet A et al (2019) Руководство Европейской академии неврологии по невралгии тройничного нерва.Eur J Neurol 26 (6): 831–849
CAS PubMed Статья Google ученый
Maarbjerg S, Gozalov A, Olesen J, Bendtsen L (2014) Невралгия тройничного нерва — проспективное систематическое исследование клинических характеристик у 158 пациентов. Головная боль 54 (10): 1574–1582
PubMed Статья Google ученый
Maarbjerg S, Wolfram F, Gozalov A, Olesen J, Bendtsen L (2015) Значение нейроваскулярного контакта при классической невралгии тройничного нерва.Brain 138 (2): 311–319
PubMed Статья Google ученый
Оберманн М., Родригес-Раеке Р., Наегель С., Холле Д., Мюллер Д., Юн М.-С. и др. (2013) Уменьшение объема серого вещества отражает хроническую боль при невралгии тройничного нерва. Нейроизображение 74: 352–358
PubMed Статья Google ученый
Тянь Т., Го Л., Сюй Дж., Чжан С., Ши Дж., Лю С. и др. (2016) Пластичность белого вещества мозга и функциональная реорганизация, лежащая в основе центрального патогенеза невралгии тройничного нерва.Научный представитель 6: 36030
CAS PubMed PubMed Central Статья Google ученый
Leal PRL, Barbier C, Hermier M, Souza MA, Cristino-Filho G, Sindou M (2014) Атрофические изменения тройничного нерва у пациентов с невралгией тройничного нерва из-за нервно-сосудистой компрессии и их связь с серьезностью компрессия и клинические исходы. J Neurosurg 120 (6): 1484–1495
PubMed Статья Google ученый
Benoliel R, Gaul C (2017) Постоянная идиопатическая лицевая боль. Цефалгия 37 (7): 680–691
PubMed Статья Google ученый
Forssell H, Tenovuo O, Silvoniemi P, Jaaskelainen SK (2007) Различия и сходства между атипичной лицевой болью и невропатической болью тройничного нерва. Неврология 69 (14): 1451–1459
PubMed Статья Google ученый
Lang E, Kaltenhauser M, Seidler S, Mattenklodt P, Neundorfer B (2005) Устойчивая идиопатическая лицевая боль существует независимо от соматосенсорного воздействия из болезненной области: результаты количественных сенсорных функций и соматотопии первичной соматосенсорной коры. Боль 118 (1-2): 80–91
PubMed Статья Google ученый
Du B, Xu J, Hu J, Zhong X, Liang J, Lei P et al (2019) Клиническое исследование интра-нейроэндоскопической техники для лечения подострой хронической и хронической субдуральной гематомы перегородки.Передний Neurol 10: 1408
PubMed Статья Google ученый
Моаззам А.А., Хабибиан М. (2012) Пациенты, обращающиеся к стоматологам с орофациальной болью, вызванной внутричерепными опухолями: обзор литературы. Oral Surg Oral Med Oral Pathol Oral Radiol 114 (6): 749–755
PubMed Статья Google ученый
List T, Leijon G, Svensson P (2008) Соматосенсорные аномалии при атипичной одонталгии: исследование случай-контроль.Боль 139 (2): 333–341
PubMed Статья Google ученый
Классер Г.Д., Грушка М., Су Н. (2016) Синдром жжения рта. Oral Maxillofac Surg Clin North Am 28 (3): 381–396
PubMed PubMed Central Статья Google ученый
Campbell WW Jr (1986) Синдром онемения щеки: признак инфраорбитальной невропатии. Неврология. 36 (3): 421–423
PubMed Статья Google ученый
Lopez Mesonero L, Pedraza Hueso MI, Herrero Velazquez S, Guerrero Peral AL (2014) Инфраорбитальная невралгия: возможность диагностики у пациентов с болью в скуловой дуге. Неврология 29 (6): 381–382
CAS PubMed Статья Google ученый
Okholm C, Frendo M, Kiss K, von Buchwald C (2018) Онемение щеки, вызванное инвазией периневральной опухоли подглазничного нерва: обзор 3 диагностически сложных случаев.Am J Case Rep 19: 296–300
PubMed PubMed Central Статья Google ученый
Цезарик М., Заворео И., Задро-Матовина Л., Папик М., Бейсик К.В. (2016) Эффекты дисфункции тройничного нерва при различных типах головных болей. Coll Antropol 40 (3): 183–188
PubMed Google ученый
Goadsby PJ (2019) Первичные головные боли: пять новых вещей.Neurol Clin Pract 9 (3): 233–240
PubMed PubMed Central Статья Google ученый
Энтони А.Б., Маццола А.Дж., Дхаливал Г.С., Хантер К.В. (2019) Нейростимуляция для лечения хронической головной и лицевой боли: обзор литературы. Врач боли 22 (5): 447–477
PubMed Google ученый
Hascalovici JR, Robbins MS (2017) Блокады периферических нервов для лечения головной боли у пожилых людей: ретроспективное исследование.Головная боль 57 (1): 80–86
PubMed Статья Google ученый
Coculescu EC, Radu A, Coculescu BI (2014) Синдром жжения во рту: обзор диагностики и лечения. J Med Life 7 (4): 512–515
CAS PubMed PubMed Central Google ученый
Aryeh HB, Gottlieb I, Ish-Shalom S, David A, Szargel H, Laufer D (1996) Устные жалобы, связанные с менопаузой.Maturitas 24 (3): 185–189
PubMed Статья Google ученый
Klasser GD, Fischer DJ, Epstein JB (2008) Синдром жжения рта: распознавание, понимание и управление. Oral Maxillofac Surg Clin North Am 20 (2): 255–271 vii
PubMed Статья Google ученый
Лаурия Г., Майорана А., Боргна М., Ломбарди Р., Пенза П., Падовани А. и др. (2005) Сенсорная нейропатия мелких волокон тройничного нерва вызывает синдром жжения во рту.Боль. 115 (3): 332–337
PubMed Статья Google ученый
Jaaskelainen SK, Woda A (2017) Синдром жжения рта. Цефалгия 37 (7): 627–647
PubMed Статья Google ученый
Heckmann SM, Kirchner E, Grushka M, Wichmann MG, Hummel T (2012) Двойное слепое исследование клоназепама у пациентов с синдромом жжения во рту. Ларингоскоп 122 (4): 813–816
CAS PubMed Статья Google ученый
Cui Y, Xu H, Chen F, Liu J, Jiang L, Zhou Y et al (2016) Оценка эффективности клоназепама для ремиссии симптомов при синдроме жжения во рту: метаанализ. Устное сообщение 22 (6): 503–511
CAS PubMed Статья Google ученый
Баскаран Р.К., Кришнамурти С.М. (2006) Синдром онемения подбородка — отражение системной злокачественности. Мир J Surg Oncol 4:52
PubMed PubMed Central Статья Google ученый
Murphy MK, MacBarb RF, Wong ME, Athanasiou KA (2013) Расстройства височно-нижнечелюстного сустава: обзор этиологии, клинического ведения и стратегий тканевой инженерии. Int J Oral Maxillofac Implants 28 (6): e393 – e414
PubMed PubMed Central Статья Google ученый
Пихут М., Шута М., Ферендюк Э., Зенчак-Вецкевич Д. (2014) Дифференциальная диагностика боли при невралгии тройничного нерва и дисфункции височно-нижнечелюстного сустава.Biomed Res Int 2014: 563786
CAS PubMed PubMed Central Google ученый
Хаанес К.А., Эдвинссон Л. (2019) Патофизиологические механизмы мигрени и определение новых терапевтических целей. Препараты для ЦНС 33 (6): 525–537
CAS PubMed Статья Google ученый
Kröger IL, May A (2014) Центральные эффекты ацетилсалициловой кислоты на тригеминально-ноцицептивные стимулы.J Головная боль Боль. 15 (1): 59
PubMed PubMed Central Статья CAS Google ученый
Khoury CK, Couch JR (2010) Фиксированная комбинация суматриптан – напроксен для лечения острой мигрени: критическая оценка. Препарат Des Dev Ther 4: 9
CAS Статья Google ученый
Baraldi C, Pellesi L, Guerzoni S, Cainazzo MM, Pini LA (2017) Терапевтические подходы к пароксизмальной гемикрании, континуальной гемикрании и краткосрочным односторонним приступам невралгической головной боли: критическая оценка.J Головная боль 18 (1): 71
PubMed PubMed Central Статья CAS Google ученый
Sjaastad O (2006) Хроническая пароксизмальная гемикрания: от основного пациента к болезни. Представитель Curr Pain Headache 10 (4): 295–301
PubMed Статья Google ученый
Neeb L, Hellen P, Boehnke C, Hoffmann J, Schuh-Hofer S, Dirnagl U et al (2011) IL-1β стимулирует COX-2-зависимый синтез PGE2 и высвобождение CGRP в клетках тройничных ганглиев крыс.PLoS One 6 (3): e17360
CAS PubMed PubMed Central Статья Google ученый
Summ O, Evers S (2013) Механизм действия индометацина при головных болях, чувствительных к индометацину. Представитель Curr Pain Headache 17 (4): 327
PubMed Статья Google ученый
Summ O, Andreou AP, Akerman S, Goadsby PJ (2010) Потенциальный нитрергический механизм действия индометацина, но не других ингибиторов ЦОГ: актуальность для чувствительных к индометацину головных болей.J Головная боль Боль 11 (6): 477–483
CAS PubMed PubMed Central Статья Google ученый
VanderPluym J (2015) Головные боли, реагирующие на индометацин. Curr Neurol Neurosci Rep 15 (2): 516
PubMed Статья CAS Google ученый
Akerman S, Holland PR, Summ O, Lasalandra MP, Goadsby PJ (2012) Трансляционная модель in vivo вегетативных цефалгий тройничного нерва: терапевтическая характеристика.Brain 135 (Pt 12): 3664–3675
PubMed Статья Google ученый
Эдвинссон Л., Вильялон С.М., МаассенВанДенБринк А. (2012) Основные механизмы мигрени и ее острое лечение. Pharmacol Ther 136 (3): 319–333
CAS PubMed Статья Google ученый
Edvinsson JCA, Warfvinge K, Krause DN, Blixt FW, Sheykhzade M, Edvinsson L et al (2019) C-волокна могут модулировать соседние адельта-волокна посредством передачи сигналов аксон-аксон CGRP в узлах Ранвье в тройничном нерве. система.J Головная боль 20 (1): 105
PubMed PubMed Central Статья CAS Google ученый
Arvieu L, Mauborgne A, Bourgoin S, Oliver C, Feltz P, Hamon M. et al (1996) Суматриптан подавляет высвобождение CGRP и вещества P из спинного мозга крысы. Нейроотчет 7 (12): 1973–1976
CAS PubMed Статья Google ученый
Silberstein SD, McCrory DC (2003) Эрготамин и дигидроэрготамин: история, фармакология и эффективность.Головная боль 43 (2): 144–166
PubMed Статья Google ученый
Rubio-Beltrán E, Labastida-Ramírez A, Villalón CM, MaassenVanDenBrink A (2018) Является ли селективный агонизм рецептора 5-HT1F сущностью отдельно от триптанов в противомигреневой терапии? Pharmacol Ther 186: 88–97
PubMed Статья CAS Google ученый
Kröger IL, May A (2015) Нарушение тригемино-кортикальной связи, вызванное триптаном.Неврология 84 (21): 2124–2131
PubMed Статья CAS Google ученый
Burish MJ, Rozen TD (2019) Вегетативные цефалгии тройничного нерва. Neurol Clin 37 (4): 847–869
PubMed Статья Google ученый
Мур Д. и др. (2019) «Систематический обзор спасательных обезболивающих стратегий при острых обострениях первичной невралгии тройничного нерва». Кирилл 123.2: e385-e396
Vila-Pueyo M (2018) Целевые 5-HT 1F терапии мигрени. Нейротерапия 15 (2): 291–303
CAS PubMed PubMed Central Статья Google ученый
Лабастида-Рамирес А., Рубио-Бельтран Э., Хаанес К.А. и др. (2020) Ласмидитан подавляет высвобождение пептидов, связанных с геном кальцитонина, в тройнично-сосудистой системе грызунов. Боль. 161 (5): 1092–1099 https://doi.org/10.1097/j.pain.0000000000001801
Curto M, Cipolla F, Cisale GY, Capi M, Spuntarelli V, Guglielmetti M et al (2020) Профилирование лазмидитана как варианта лечения мигрени. Экспертное мнение Pharmacother 21 (2): 147-153.
Walker CS, Raddant AC, Woolley MJ, Russo AF, Hay DL (2018) Антагонистическая активность олцегепанта в отношении рецепторов CGRP зависит от измеренного сигнального пути. Цефалгия 38 (3): 437–451
PubMed Статья Google ученый
Scott LJ (2020) Ubrogepant: First Approval. Drugs 80 (3): 323-328.)
Dach F, Éckeli ÁL, Ferreira KS, Speciali JG (2015) Нервная блокада для лечения головных болей и черепных невралгий — практический подход. Головная боль 55: 59–71
PubMed Статья Google ученый
Bussone G, Rapoport A (2010) Острое и профилактическое лечение кластерной головной боли и других вегетативных цефалгий тройничного нерва.Справочник Clin Neurol 97: 431–442
Статья Google ученый
Jürgens TP (2014) Therapie des trigeminoautonomen Kopfschmerzes. Bundesgesundheitsblatt-Gesundheitsforschung-Gesundheitsschutz. 57 (8): 983–995
PubMed Статья Google ученый
Оберманн М. (2010) Варианты лечения невралгии тройничного нерва. Ther Adv Neurol Disord 3 (2): 107–115
CAS PubMed PubMed Central Статья Google ученый
Linde M, Mulleners WM, Chronicle EP, McCrory DC (2013) Противоэпилептические средства, кроме габапентина, прегабалина, топирамата и вальпроата, для профилактики эпизодической мигрени у взрослых. Кокрановская база данных Syst Rev 6: CD010608.
Сузуки-Муромото С., Косаки Р., Косаки К., Кубота М. (2020) Семейная гемиплегическая мигрень с мутацией PRRT2: фенотипические вариации и эффективность карбамазепина. Мозг и развитие 42 (3): 293–297
PubMed Статья Google ученый
Парих С.К., Зильберштейн С.Д. (2019) Текущее состояние противоэпилептических препаратов как профилактической терапии мигрени. Варианты лечения Curr Neurol 21 (4): 16
PubMed Статья Google ученый
Barbanti P, Egeo G, Mitsikostas DD (2019) Лечение мигрени, направленное на тройничный нерв: 60% — магическое число? Головная боль 59 (9): 1659–1661
PubMed Статья Google ученый
Дин М., Корренти Э., Камм К., Келдерман Т., Папетти Л., Рубио-Бельтран Э. и др. (2017) Блокирование CGRP у пациентов с мигренью — обзор плюсов и минусов. J Головная боль 18 (1): 96
Статья CAS Google ученый
Melo-Carrillo A, Strassman AM, Nir RR, Schain AJ, Noseda R, Stratton J et al (2017) Fremanezumab — гуманизированное моноклональное антитело против CGRP — ингибирует тонко миелинизированные (Aδ), но не немиелинизированные ( В) менингеальные ноцицепторы.J Neurosci 37 (44): 10587–10596
CAS PubMed PubMed Central Статья Google ученый
Yuan H, Lauritsen CG, Kaiser EA, Silberstein SD (2017) Моноклональные антитела CGRP для мигрени: обоснование и прогресс. BioDrugs 31 (6): 487–501
CAS PubMed Статья Google ученый
Noseda R, Schain AJ, Melo-Carrillo A, Tien J, Stratton J, Mai F et al (2020) Фриманезумаб с флуоресцентной меткой распространяется на сенсорные и вегетативные ганглии и твердую мозговую оболочку, но не в мозг крысы с бескомпромиссным гематоэнцефалическим барьером.Цефалгия 40 (3): 229–240
PubMed Статья Google ученый
Чарльз А. (2018) Патофизиология мигрени: значение для клинического ведения. Lancet Neurol 17 (2): 174–182
CAS PubMed PubMed Central Статья Google ученый
Эдвинссон Л. (2015) Антагонисты рецептора CGRP и антитела против CGRP и его рецептора при лечении мигрени.Br J Clin Pharmacol 80 (2): 193–199
CAS PubMed PubMed Central Статья Google ученый
Sacco S, Bendtsen L, Ashina M, Reuter U, Terwindt G, Mitsikostas DD et al (2019) Руководство Европейской федерации головной боли по использованию моноклональных антител, действующих на пептид, связанный с геном кальцитонина, или его рецептор при мигрени профилактика. J Головная боль Боль. 20 (1): 6
PubMed PubMed Central Статья Google ученый
Melo-Carrillo A, Noseda R, Nir R-R, Schain AJ, Stratton J, Strassman AM et al (2017) Селективное ингибирование тригеминоваскулярных нейронов фреманезумабом: гуманизированное моноклональное антитело против CGRP. J Neurosci 37 (30): 7149–7163
CAS PubMed PubMed Central Статья Google ученый
Goadsby P, Edvinsson L (1996) Изменения нейропептидов в случае хронической пароксизмальной гемикрании — свидетельство тригемино-парасимпатической активации.Цефалгия 16 (6): 448–450
CAS PubMed Статья Google ученый
Lai KL, Niddam D, Fuh JL, Chen SP, Wang YF, Chen WT et al (2017) Сравнение флунаризина и топирамата для профилактики хронической мигрени: рандомизированное исследование. Acta Neurol Scand 135 (4): 476–483
CAS PubMed Статья Google ученый
Silberstein S, Holland S, Freitag F, Dodick DW, Argoff C, Ashman E (2012) Обновление рекомендаций на основе фактических данных: фармакологическое лечение для профилактики эпизодической мигрени у взрослых: отчет Американского подкомитета по стандартам качества Академия неврологии и Американское общество головной боли.Неврология 78 (17): 1337–1345
CAS PubMed PubMed Central Статья Google ученый
Pringsheim T, Davenport W, Mackie G, Worthington I, Aubé M, Christie SN et al (2012) Руководство Канадского общества по профилактике мигрени. Can J Neurol Sci 39 (2 Suppl 2): S1 – S59
PubMed Google ученый
Guardiani E, Sadoughi B, Blitzer A, Sirois D (2014) Новая парадигма лечения невралгии тройничного нерва с использованием ботулинического токсина типа a.Ларингоскоп 124 (2): 413–417
CAS PubMed Статья Google ученый
Lampl C, Rudolph M, Bräutigam E (2018) OnabotulinumtoxinA в лечении рефрактерной хронической кластерной головной боли. J Головная боль, боль 19 (1): 45
PubMed PubMed Central Статья CAS Google ученый
Do T, Hvedstrup J, Schytz H (2018) Ботулинический токсин: обзор механизма действия при мигрени.Acta Neurol Scand 137 (5): 442–451
CAS PubMed Статья Google ученый
Эдвинссон Дж., Варфвиндж К., Эдвинссон Л. (2015) Модуляция медиаторов воспаления в ганглии тройничного нерва с помощью нейротоксина ботулина типа a: исследование органной культуры. J Головная боль 16: 555
PubMed Статья CAS Google ученый
Gooriah R, Ahmed F (2015) OnabotulinumtoxinA для хронической мигрени: критическая оценка.Therap Clin Risk Manage 11: 1003
CAS Google ученый
Gazerani P, Pedersen NS, Staahl C, Drewes AM, Arendt-Nielsen L (2009) Подкожный ботулинический токсин типа a снижает вызванную капсаицином боль в тройничном нерве и вазомоторные реакции в коже человека. Боль 141 (1-2): 60–69
CAS PubMed Статья Google ученый
Вигано А., Тоскано М., Пуледда Ф, Ди Пьеро В. (2019) Лечение хронической мигрени с помощью нейромодуляции: роль нейрофизиологических аномалий и дезадаптивной пластичности.Front Pharmacol 10:32. https://doi.org/10.3389/fphar.2019.00032
Hawkins JL, Cornelison LE, Blankenship BA, Durham PL (2017) Стимуляция блуждающего нерва подавляет ноцицепцию тройничного нерва в модели эпизодической мигрени на грызунах. Pain Rep 2 (6): e628 https://doi.org/10.1097/PR9.0000000000000628
Галл С., Динер Х., Сольбах К., Сильвер Н., Штрауб А., Магис Д. и др. (2014) EHMTI-0364. Неинвазивная стимуляция блуждающего нерва с использованием gammacore® для профилактики и лечения хронической кластерной головной боли: отчет рандомизированной фазы исследования preva.J Headache Pain 15 (1)
Silberstein SD, Da Silva AN, Calhoun AH, Grosberg BM, Lipton RB, Cady RK, Goadsby PJ, Simmons K, Mullin C, Saper JR, Liebler EJ (2014) Non -инвазивная стимуляция блуждающего нерва для профилактики хронической мигрени в проспективном рандомизированном пилотном исследовании с фиктивным контролем (исследование EVENT): отчет о двойной слепой фазе. Headache 54: 1426
Magis D, Schoenen J (2012) Достижения и проблемы нейростимуляции при головных болях.Lancet Neurology 11 (8): 708–719
PubMed Статья Google ученый
Li Y, Yang L, Ni J, Dou Z (2019) Микроваскулярная декомпрессия и радиочастота для лечения невралгии тройничного нерва: метаанализ. J Pain Res 12: 1937
PubMed PubMed Central Статья Google ученый
Блюменфельд А., Ашкенази А., Напчан У., Бендер С.Д., Кляйн BC, Берлинер Р. и др. (2013) Консенсусные рекомендации экспертов по эффективности блокады периферических нервов при головных болях — повествовательный обзор.Головная боль 53 (3): 437–446
PubMed Статья Google ученый
Perloff MD, Chung JS (2018) Неотложная медицинская блокада периферических нервов при рефрактерной невралгии тройничного нерва. Am J Emerg Med 36 (11): 2058–2060
PubMed Статья Google ученый
Verlinde M, Hollmann MW, Stevens MF, Hermanns H, Werdehausen R, Lirk P (2016) Нейротоксичность, вызванная местными анестетиками.Int J Mol Sci 17 (3): 339
PubMed PubMed Central Статья CAS Google ученый
Dach F, Eckeli AL, Ferreira Kdos S, Speciali JG (2015) Нервная блокада для лечения головных болей и черепных невралгий — практический подход. Головная боль 55 (Дополнение 1): 59–71
PubMed Статья Google ученый
Мэтью Н.Т., Кайласам Дж., Мидорс Л. (2008) Ботулинический токсин типа А для лечения числовой головной боли: четыре тематических исследования.Головная боль 48 (3): 442–447
PubMed Статья Google ученый
Christopher Duma, MD, FACS: нейрохирург
Если вы избегали стоматолога, несмотря на хроническую зубную боль, возможно, вы захотите пересмотреть свое решение. Хотя кариес или абсцесс могут быть первопричиной зубной и челюстной боли, эти симптомы также относятся к более серьезному нервному заболеванию, известному как невралгия тройничного нерва.
Опытный нейрохирург, Кристофер Дума, доктор медицины, FACS, рекомендует пройти стоматологическое обследование на предмет появления зубной боли в самом начале.Если у вас стабильное здоровье полости рта, вам может потребоваться повторное обследование у доктора Дума для выявления невралгии тройничного нерва.
Связь между невралгией тройничного нерва и зубной болью
Невралгия тройничного нерва — это хроническое болевое состояние, которое возникает в результате дисфункции нервной системы, в частности тройничного нерва. Этот нерв обеспечивает ощущения на вашем лице и посылает сигналы в ваш мозг, которые помогают вам распознавать прикосновения, изменения температуры и тому подобное.
Дисфункция тройничного нерва обычно возникает из-за ненужного давления на нерв со стороны окружающих кровеносных сосудов.Когда нерв раздражен, вы можете испытывать приступы боли в любом месте лица, которые на ранних стадиях обычно непродолжительны.
Люди часто описывают боль при невралгии тройничного нерва как шоковую или дрожащую. Вы можете испытывать этот тип боли в зубах и челюсти, но это состояние также может посылать волны боли через щеки, губы и десны. Боль может ощущаться только в одной стороне лица или в обеих одновременно.
У многих с невралгией тройничного нерва состояние со временем ухудшается, и даже малейшее прикосновение может вызвать мучительные приступы боли.Чистка зубов и даже вытирание лишних ресниц может вызвать приступы боли, достаточно сильные, чтобы физически ограничить вас на несколько недель или месяцев.
Факторы риска невралгии тройничного нерва
Вы можете подвергаться повышенному риску невралгии тройничного нерва с возрастом, особенно после 50. У вас также может быть больше шансов заболеть этим заболеванием, если у вас есть сопутствующие заболевания, такие как рассеянный склероз, которые вызывают повреждение ваших нервов.
Когда ваша лицевая боль настолько сильна, что начинает влиять на качество вашей жизни, д-р.Duma может предоставить диагностическое неврологическое обследование для подтверждения невралгии тройничного нерва. Он также составляет план лечения, который направлен как на облегчение существующей боли, так и на предотвращение новых приступов боли.
Облегчение зубной боли с помощью лечения невралгии тройничного нерва
Когда ваша боль при невралгии тройничного нерва не подходит для приема лекарств, вы можете найти облегчение с помощью минимально инвазивных хирургических процедур, которые доктор Дума предлагает в своем офисе в Ньюпорт-Бич, Калифорния.
Два доступных и эффективных метода лечения невралгии тройничного нерва включают:
Стереотаксическая радиохирургия Gamma Knife®
Гамма-нож — это инновационная технология, которая позволяет Dr.Duma — это возможность снизить давление на тройничный нерв, чтобы помешать передаче сигналов боли в мозг. Технология использует пучки гамма-излучения для удаления опухолей или повреждений, которые давят на нерв и вызывают приступы боли без разрезов.
Хирургия микрососудистой декомпрессии
Микроваскулярная декомпрессия — это хирургическая процедура, направленная на удаление кровеносных сосудов, сдавливающих тройничный нерв. Через небольшой разрез на затылке доктор В.Дума может удалить необходимые кровеносные сосуды и поместить мягкую подушечку, чтобы смягчить нервы.
Если вам нужно пройти диагностическое обследование по поводу необъяснимой зубной или лицевой боли, позвоните в офис Christopher Duma, MD, FACS или запросите встречу через систему онлайн-бронирования сегодня.
Невралгия тройничного нерва | Неврология
Диагноз невралгии тройничного нерва (TN) во многом зависит от описания пациентом патогномоничных болевых приступов. 1 Следовательно, необходимо однозначное определение характерных особенностей TN.Диагностические критерии должны включать варианты клинического фенотипа и этиологию TN. Однако существующие критерии страдают терминологическими несоответствиями, которые ставят под угрозу общение между пациентами, врачами и исследователями (приложение e-1 на веб-сайте Neurology ® по адресу Neurology.org). Два недавно опубликованных диагностических руководства непреднамеренно усложнили классификацию TN. 2,3
Хотя TN является прототипом нейропатической боли, типичная TN не соответствует системе оценок для диагностики нейропатической боли.Для точного диагноза система оценок требует объективных признаков или тестов, которые выявляют основное поражение или заболевание нервной системы. 2 Это требование подходит для вторичных форм TN, но не может применяться к классической TN, наиболее распространенной форме невралгии. 4,5 Напротив, последнее издание Международной классификации головных болей (ICHD) больше не перечисляет симптоматическую или вторичную TN в качестве диагностической категории, 3 , оставляя широко используемое обозначение TN, которое вызвано основным неврологическим заболеванием. болезнь без определенных критериев.Признавая эти недостатки, мы разработали новую классификацию TN, которая соответствует потребностям клинической практики и исследований, соответствует системе оценки невропатической боли и соответствует общей нозологии неврологических расстройств. Рекомендации по лечению выходят за рамки данной статьи, но мы ожидаем, что они станут более конкретными после широкого использования предложенной классификации.
СИСТЕМА ДИАГНОСТИКИ ДЛЯ TN
Возможна TN.
Минимальные требования для возможного TN — это распределение боли на лицевой или внутриротовой территории тройничного нерва и приступообразный характер боли (рисунок 1).Обследующий врач должен убедиться, что боль не распространяется на заднюю треть волосистой части головы, заднюю часть уха или угол нижней челюсти, поскольку эти территории иннервируются шейными нервами (рис. 2). Территория нижнечелюстного отдела тройничного нерва достигает черепа; Следовательно, пациент с ТН нижней челюсти тройничного нерва может описывать боль как в нижней губе, так и в виске. Если невралгия затрагивает 2 отдела тройничного нерва, они должны быть смежными; Чаще всего встречается сочетание верхнечелюстного и нижнечелюстного отделов.TN в офтальмологическом отделе или на языке обычно считается показателем TN, вторичным по отношению к серьезному неврологическому заболеванию. Однако эта интерпретация не была изучена должным образом. 4,5 Также важно отметить, что как пораженный отдел тройничного нерва, так и сторона лица могут изменяться с течением болезни. 6, -, 8
Рис. 1 Новая система классификации и диагностики невралгии тройничного нерва (TN)a TN обычно является односторонним заболеванием.У некоторых пациентов TN на обеих сторонах лица развивается в течение болезни, например, при рассеянном склерозе, но они практически никогда не проявляют одновременной двусторонней боли. b Боль строго соответствует распределению ветвей тройничного нерва. Он не распространяется на заднюю треть черепа, заднюю часть наружного уха или угол нижней челюсти (рис. 2). c Приступообразная боль — основная жалоба, но она может сопровождаться постоянной болью. d Триггерные маневры включают безобидные механические раздражители, движения лица или рта или сложные действия, такие как бритье или нанесение макияжа. Ограниченные триггерные зоны и обычная комбинация с резкими мышечными сокращениями (тиками) помогают отличить триггерный TN от аллодинии при других состояниях нейропатической боли. Экзаменатор может проверить маневры спускового крючка. e MRI легко идентифицирует основные неврологические заболевания, такие как опухоли мозжечкового угла или рассеянный склероз.Другие исследования могут включать нейрофизиологическую регистрацию рефлексов тройничного нерва и вызванных потенциалов тройничного нерва, которые становятся необходимыми у пациентов, которые не могут пройти МРТ. f Современные методы МРТ позволяют продемонстрировать сдавление сосудов нервной системы с морфологическими изменениями корешка тройничного нерва.
Рисунок 2 Иннервационные зоны тройничного нерваЛицевая и внутриротовая зоны иннервации 3-х ветвей тройничного нерва (офтальмологической, верхней и нижней).Белые участки иннервируются шейными нервами. Светло-серые участки на задней части языка и в горле иннервируются языкоглоточным нервом.
Боль, квалифицируемая как возможная TN, должна иметь пароксизмальный характер. Внезапное начало и прекращение каждого пароксизма безошибочно, в то время как фактическое описание пароксизмов может варьироваться. Типичные характеристики включают понятия кратковременных, внезапных, колющих, похожих на электрический ток и сильных болевых приступов. 9 Пароксизмы могут длиться до 2 минут, но их продолжительность обычно ограничивается несколькими секундами.Частота приступов боли может составлять от 1 до более 50 в день. 10,11 Опровергая более ранние предположения, 7 недавнее исследование с участием 200 пациентов с классической TN не нашло доказательств, подтверждающих увеличение частоты или продолжительности болевых пароксизмов с продолжительностью заболевания. 12 В отличие от других форм нейропатической боли, TN переходит в периоды полной ремиссии почти у 63% пациентов. 11 Эти периоды могут длиться от недель до лет. 11,13
Болезненные симптомы, связанные с TN, практически всегда односторонние.Двусторонний TN очень редок, за исключением TN, вызванного рассеянным склерозом (MS). Редкие сообщения о двусторонней классической ТН отражают последовательные эпизоды односторонней боли с переключением стороны лица, а не боль, возникающую одновременно с обеих сторон. 14,15 Мета-анализ не выявил сообщений о действительно двустороннем TN у 234 пациентов с классическим TN. 4 Мы рассмотрели исследования РС, ассоциированного с ТН, и выявили 5 отчетов, описывающих 24 из 252 пациентов (~ 10%) с двусторонним ТН. 16, -, 20
Предыдущие определения TN подчеркивали стереотипный характер боли. Однако стереотипия — не уникальная черта TN. Равномерный характер боли возникает при других состояниях невропатической и ненейропатической боли и не должен считаться определяющим диагностическим критерием. Кроме того, TN нередко изменяет свои сенсорные качества в течение болезни. 6, -, 8
Клинически установлено TN.
Хотя болевые пароксизмы могут возникать спонтанно, пациенты с исключительно спонтанными приступами практически неизвестны.В нескольких исследованиях, в которых изучались триггерные стимулы или маневры при классической TN, вызванная боль наблюдалась у 99% пациентов. 11,21, -, 23 Таким образом, мы предлагаем, чтобы вызванная боль квалифицировалась как критерий, подтверждающий диагноз клинически установленного TN (рисунок 1). Редкие пациенты без триггерных приступов останутся на уровне возможного TN.
Боль, вызванная раздражителем, является одним из наиболее ярких признаков TN, имеющим высокую диагностическую ценность. 24 У большинства пациентов боль вызывается безобидными механическими раздражителями в области тройничного нерва, включая ротовую полость.Тонкость маневров спускового крючка — еще один уникальный признак TN. Стимулом может быть просто легкое прикосновение или дуновение воздуха. Более сложные маневры включают как тактильные раздражители, так и движения лица, например, бритье, нанесение макияжа, чистку зубов, прием пищи или питье. Одного движения, например, улыбки или разговора, может быть достаточно, чтобы спровоцировать приступ боли. Местоположение вызванной боли может отличаться от места стимуляции, и боль может ощущаться как излучающая. Пациент обычно сообщает о боли, вызванной раздражителем.Он также может быть проверен исследователем, который должен обратить внимание на типичный тик, непроизвольное движение лица в ответ на боль.
Триггерные болевые пароксизмы TN напоминают аллодинию при других состояниях нейропатической боли, но есть важные различия. Термин аллодиния первоначально был придуман для описания патологической болезненной реакции на нежное поглаживание кожи при постгерпетической невралгии. 25 TN также часто вызывается обычно безболезненными механическими раздражителями или комбинацией внешних раздражителей и орофациальных движений.Но в отличие от аллодинии триггерные зоны и болевые ощущения могут быть диссоциированы, что было интерпретировано как признак перекрестного возбуждения между соматосенсорными афферентами. 26,27 Рефрактерный период в несколько секунд или минут, в течение которого второй болевой пароксизм не может быть спровоцирован, является еще одной специфической особенностью TN; рефрактерные периоды не возникают ни при каких формах механической аллодинии. 28 Триггерные зоны TN чаще всего находятся в центральной части лица, вокруг носа и рта, например, в носогубной складке, и у большинства пациентов триггерные зоны небольшие, даже пунктированные. 29 Эти фенотипические различия четко определяют боль, вызванную триггером TN. Поскольку спровоцированные болевые пароксизмы являются таким уникальным соматосенсорным феноменом, они свидетельствуют о вероятной нейропатической боли (рис. 1).
Немногие авторы предполагают, что сенсорный дефицит выявляется при прикроватном осмотре пациентов с классической TN, 11 и отсутствие сенсорной недостаточности является одним из критериев диагностики классической TN в Международной классификации расстройств головной боли – 3-бета. 2 Однако тонкие сенсорные аномалии часто обнаруживаются при количественном сенсорном тестировании. 21,30 Клинические нарушения дискриминирующих сенсорных функций очень подозрительны в отношении TN, вызванной основным основным заболеванием. Они произошли у 25 из 67 пациентов (37%) с TN, вторичным по отношению к опухолям или MS. 4 Следовательно, если сенсорные дефициты обнаруживаются во время обычного клинического обследования, они всегда должны сопровождаться дополнительными исследованиями в предположении вторичного TN.Важно отметить, что обратный вывод неверен: отсутствие сенсорного дефицита не исключает вторичного TN.
Клинически установленный диагноз TN должен стимулировать начало лечения и позволить включить пациента в клиническое исследование. Дополнительная информация об основной этиологии и определенные доказательства нейропатической боли могут быть предпочтительны для патофизиологических исследований.
Подтверждает ли ответ на лечение диагноз TN?
Блокаторы частотно-зависимых натриевых каналов, которые увеличивают рефрактерный период потенциалов действия, в настоящее время являются наиболее эффективным средством лечения TN. 31,32 Карбамазепин и окскарбазепин, препараты первой линии, рекомендованные во многих клинических руководствах, уменьшают боль примерно у 90% пациентов. 4,5 Положительный ответ на эти препараты, возможно, как однократное применение небольшой дозы, таким образом, можно рассматривать как оперантный критерий TN. Однако не существует стандартизированных критериев или общепринятых правил для определения удовлетворительного обезболивания (например, полное или частичное подавление болевых пароксизмов). Кроме того, было бы невозможно применить критерий, связанный с лечением, к тем пациентам, которые не переносят побочные эффекты карбамазепина или окскарбазепина.Поэтому мы решили не включать ответ на лечение в качестве диагностического критерия TN.
Этиологически установленная TN.
Этот уровень диагностической достоверности, основанный на идентификации причины TN, соответствует 2 категориям: классическая и вторичная TN определяются первопричиной. Оба диагностических объекта квалифицируются как определенная невропатическая боль. 2 Однако у относительно небольшой части пациентов с клинически установленным ТН даже самые продвинутые диагностические исследования не могут выявить причину. 33, -, 35 Это состояние классифицируется как идиопатическая TN (рисунок 1).
Классический TN.
Классическая TN определяется как особая категория TN, при которой МРТ демонстрирует сдавление сосудов с морфологическими изменениями корешка тройничного нерва (рис. 3). Из-за своей чувствительности к обнаружению патологических процессов, затрагивающих ствол мозга и черепные нервы, проходящие через основание черепа, МРТ широко рассматривается как метод выбора для исследования тройничного нерва и корешка.МРТ может выявить нервно-сосудистый контакт корешка тройничного нерва, но частота контакта кровеносного сосуда с бессимптомным корешком тройничного нерва предостерегает от использования одного контакта в качестве диагностического критерия. В недавнем метаанализе 9 высококачественных слепых и контролируемых исследований нервно-сосудистый контакт был обнаружен в 471 из 531 симптоматических нервов (89%) и 244 из 681 бессимптомных нервов (36%), что указывает на высокую чувствительность, но низкую специфичность. 35 Некоторые авторы вместо этого подчеркнули важность физического воздействия кровеносного сосуда на нерв. 36,37 Дислокация или атрофия нерва повысили специфичность до 97%. Эти результаты подтвердили два проспективных исследования. 38,39 Местоположение нервно-сосудистого контакта также имеет значение. Сдавление корешка тройничного нерва при его входе в ствол мозга увеличило специфичность и положительную прогностическую ценность до 100% с высокой согласованностью между наблюдателями. 35 Степень морфологических изменений корня имеет терапевтическое значение. Долгосрочный результат после хирургической ревизии простого нейроваскулярного контакта является неопределенным по сравнению с декомпрессией вывихнутых, деформированных или уплощенных нервных корешков. 37,40,41 Уплощение и атрофия, по-видимому, являются особенно чувствительными признаками клинически значимого сжатия. 36,41 Усовершенствованные методы МРТ дополнительно позволяют визуализировать структурные изменения в корне, которые сильно указывают на физические изменения и обеспечивают высокую прогностическую ценность для облегчения боли после декомпрессии. 38 Однако важно признать, что все процитированные исследования основывались на клиническом диагнозе TN до МРТ. МРТ является ценным диагностическим инструментом, только если ему предшествует оценка симптомов и признаков, указывающих на вероятную TN.
Рисунок 3 Нейроваскулярная компрессия корешка тройничного нерва3D-конструктивное вмешательство в устойчивом состоянии МРТ показывает аксиальные срезы на уровне входа корешка тройничного нерва в мост. (A) Двусторонний нервно-сосудистый контакт без морфологических изменений корня у пациента с невралгией тройничного нерва левого отдела (TN). Нерв (длинные стрелки) и кровеносный сосуд (короткие стрелки) кажутся гипоинтенсивными, окруженными гиперинтенсивным СМЖ. Контакт виден в зоне входа корня, а также в середине цистернального сегмента.(B, C) Морфологические изменения, выходящие за рамки простого нейроваскулярного контакта корешка тройничного нерва, совместимы с диагнозом классической TN. (B) Атрофия корня у пациента с правым ТН. (C) Вдавление и вывих корня у пациента с правой TN (короткая стрелка).
Надежное обнаружение сосудисто-нервного сдавления требует использования специальных методов визуализации с 3D-реконструкцией. Несколько методов улучшают изображение корешка тройничного нерва и прилегающих кровеносных сосудов в задней ямке.Типичные парадигмы визуализации включают последовательности для трехмерной Т2-взвешенной МРТ, например, управляемое равновесие или конструктивное вмешательство в устойчивом состоянии, для подробного исследования сегментов цистернального и кавернозного нерва (рис. 3), трехмерную времяпролетную магнитно-резонансную ангиографию для визуализации. артерий и 3D T1-взвешенная МРТ с гадолинием или фазоконтрастная МРТ для визуализации вен. 33,38,42 Тензорная диффузионная визуализация (DTI) и волоконная трактография выявляют аномалии корешка тройничного нерва, которые нормализуются после декомпрессии или радиохирургии. 43,44 DTI может стать важным диагностическим тестом для TN в ближайшем будущем. Однако до сих пор было проведено слишком мало исследований с достаточной строгостью, чтобы вывести диагностические критерии с чувствительностью / специфичностью. Большинство исследований включали только групповой анализ, а некоторые дали противоречивые результаты. В ожидании дополнительной оценки эти инструменты визуализации могут в будущем позволить прогнозировать исход нейрохирургического лечения. 44
Вторичный TN.
Диагностика вторичной ТН основана на выявлении основного неврологического заболевания, вызывающего невралгию.Опухоль мостомозжечкового угла или МС вызывает ТН у 15% пациентов. 4,5 Опухоли, ведущие к TN, в основном доброкачественные и обычно сдавливают корень возле входа в мост. Компрессия вызывает очаговую демиелинизацию и, как полагают, вызывает пароксизмальные эктопические выделения. Злокачественные опухоли чаще проникают в нерв и приводят к дегенерации аксонов. Если злокачественные опухоли вызывают боль тройничного нерва, она обычно не похожа на приступы боли, возникающие при TN. TN встречается у 2–5% пациентов с МС; наоборот, МС выявляется у 2–14% пациентов с ТН. 45,46 Развитие пароксизмов боли по-разному объяснялось наличием демиелинизирующих бляшек в мосту или повышенной восприимчивостью корешка тройничного нерва к нервно-сосудистому сдавлению. 46, -, 50
Хотя МРТ является наиболее полезным исследованием для поиска основной этиологии, в некоторых случаях визуализация невозможна, например, у пациентов с металлическими имплантатами, такими как кардиостимуляторы. Регистрация тройничных рефлексов — признанная альтернативная оценка функции тройничного нерва. 51 Рефлексы могут быть вызваны всеми ветвями тройничного нерва. Рефлекторные аномалии достигают чувствительности 94% и специфичности 87% для выявления вторичного TN, что сравнимо с диагностической точностью МРТ. 4,5 Регистрация тройничного рефлекса особенно полезна в редких случаях TN, вторичной по отношению к невропатии (приложение e-2). В TN изучались различные вызванные потенциалы после электрических или тепловых раздражителей. В отличие от тройничных рефлексов, вызванные потенциалы могут быть изменены даже при идиопатическом или классическом ТН: мы обнаружили их аномальные у 103 из 209 пациентов, что дает чувствительность 50% (приложение e-2).Однако их специфичность в выявлении вторичного TN (64%) невысока. 5,52,53
TN с постоянной болью.
Некоторые пациенты с TN испытывают боль между приступами. Эта боль бывает постоянной или почти непрерывной и качественно отличается от приступообразной боли. Это не связано ни с какой другой причиной лицевой боли. Общие описания включают тупость, жжение или покалывание. Его распределение совпадает с распределением приступообразной боли, а колебания интенсивности, а также периоды ремиссии и рецидива параллельны таковым при приступообразной боли, что свидетельствует о тесной взаимосвязи между ними. 11,54,55 Он известен под несколькими обозначениями, включая атипичный TN и TN типа 2 (приложение e-1), но мы предпочитаем термин TN с постоянной болью, потому что он напрямую подчеркивает определяющую особенность, прост в общении , и наименее подвержен неверному толкованию.
Иногда пациенты с тяжелой формой TN могут описывать свои пароксизмы как постоянную боль, поэтому дифференцировать точные характеристики их боли становится трудно. Если движение является одним из факторов, провоцирующих боль, боль можно подавить, если пациенты будут полностью неподвижны в течение нескольких минут, что позволяет лучше различать особенности боли, которые соответствуют определяющим критериям TN. 56
Постоянная боль не имеет отношения к этиологии. Встречается при идиопатической, классической или вторичной ТН. Неясно, является ли постоянная боль результатом прогрессирующего повреждения корня или вторичного центрального механизма. 53,55 Некоторые авторы предположили, что постоянная боль связана с худшим исходом после хирургического вмешательства, 6,37,57,58 , но этот вывод является спорным. 41 Однако есть убедительные доказательства того, что постоянная и приступообразная боль может уменьшаться независимо после микроваскулярной декомпрессии, предполагая, что механизмы, ответственные за 2 компонента боли, различны. 8,36,58
ОБСУЖДЕНИЕ
Мы разработали новое определение и диагностическую классификацию TN (таблица), которая объединяет оценку диагностической достоверности на основе критериев, эквивалентных критериям, применяемым для невропатической боли в целом. 2 Дополнительная оценка диагностической достоверности будет полезна при принятии решения о лечении. Диагностические требования для идиопатической, классической и вторичной TN основаны на тщательном анализе клинических и этиологических особенностей TN.
ТаблицаОпределение и классификация невралгии тройничного нерва (TN)
Даже после МРТ или другого исследования этиология TN остается неясной (идиопатической) примерно у 11% пациентов. 33, -, 35 Классическая TN, вызванная сосудисто-нервным сдавлением, является наиболее частой формой TN с установленной этиологией. Морфологические изменения, указывающие на компрессию, а не на простой сосудистый контакт корня тройничного нерва, заметно повышают специфичность диагноза. Терапевтическая значимость этих более строгих критериев подтверждается улучшенными результатами микрососудистой хирургии у пациентов с явными признаками морфологических изменений корня. 35 МРТ — метод выбора для выявления компрессии тройничного нерва. Трехмерные реконструкции очерчивают анатомическую обстановку с высоким уровнем чувствительности и специфичности, что помогает избежать ненужного исследования задней черепной ямки. Примерно у 15% пациентов с TN МРТ выявляет серьезное неврологическое заболевание, такое как доброкачественная опухоль или рассеянный склероз. 4 Вторичная ТН — хорошо зарекомендовавший себя термин для обозначения этих проявлений невралгии, и его следует сохранить.
Систему диагностики невропатической боли трудно применять при TN, потому что она подчеркивает ценность патологических данных, которые отсутствуют при идиопатической TN.Однако описание пациентом триггерных зон или демонстрация триггерных маневров при физикальном обследовании достаточно специфичны, чтобы клинически установить TN и диагностировать вероятную невропатическую боль. Дополнительные исследования, в первую очередь МРТ, которые выявляют этиологию классической или вторичной ТН, удовлетворяют требованиям для диагностики определенной нейропатической боли. 2
В обследовании и лечении TN регулярно участвуют врачи в различных областях медицины, включая неврологию, нейрорадиологию, нейрохирургию, стоматологию, челюстно-лицевую хирургию и специалистов по медицине боли.Система классификации TN должна учитывать общие дифференциальные диагнозы в этих дисциплинах. Вероятность того, что пациентам с классической TN, боль которых недостаточно купируется лекарствами, или пациентам с вторичной TN потребуется инвазивное лечение, подчеркивает важность диагностической достоверности. ICHD не различает уровни доказательности и в своем последнем издании 3 отклоняет широко принятую диагностическую метку вторичного TN. Вместо этого ICHD-3 одобряет болезненную невропатию тройничного нерва в качестве диагностической метки для TN, которая вызвана основным неврологическим заболеванием.

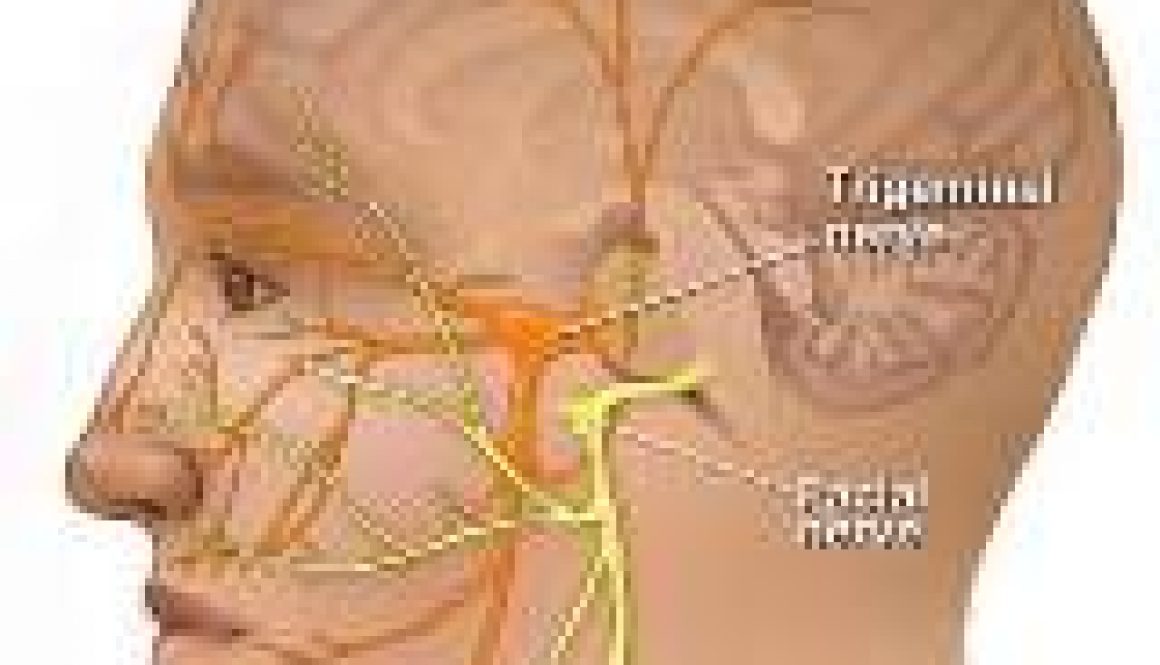

 При центральном варианте корешок сдавливается извитым или расширенным сосудом в области задней черепной ямки. Данный тип поражения наблюдается при аневризмах, артериальной гипертензии, церебральном атеросклерозе.
При центральном варианте корешок сдавливается извитым или расширенным сосудом в области задней черепной ямки. Данный тип поражения наблюдается при аневризмах, артериальной гипертензии, церебральном атеросклерозе.