«Обследование беременных на 17-оксипрогестерон (17-ОП)» – Яндекс.Кью
Обследование беременных на 17-оксипрогестерон (17-ОП) среди беременных женщин продолжается, мои коллеги эндокринологи уже не раз писали об этом, напишу и я, потому как проблема не решается.
Беременную женщину, показатели ее гормонов нельзя сравнивать с небеременными женщинами. Во время беременности все несколько иначе и появляются другие нормы.
17-ОН-прогестерон синтезируется в очень небольших количествах яичниками во время ранней фолликулиновой фазы, именно поэтому анализ крови на 17-ОН-прогестерон сдают строго на 3-5 день менструального цикла вне беременности.
После овуляции, когда в яичнике образуется желтое тело, это желтое тело начинает вырабатывать 17-оксипрогестерон и соответственно его концентрация выше.
Если беременности не наступает, функция желтого тела угасает и вместе с ним уменьшается уровень 17-ОН-прогестерона.
Если беременность все же наступила, она поддерживает желтое тело, которое продолжает секретировать 17-оксипрогестерон, затем его вырабатывает плод, плацента и продолжают вырабатывать в небольших количествах ваши яичники и надпочечники.
Почему-то, зачем-то, некоторые врачи, которые не разбираются в этих вопросах, проводят беременным женщинам исследование уровня 17-ОП и если находят повышенный результат (а как вы уже поняли, он будет повышен у любой беременной женщины), назначают гормональные препараты (Метипред, преднизолон, кортеф и пр.). Это грубейшая ошибка и прямое вредительство, высокие дозы этих гормонов могут быть опасны для ребенка.
У меня была пациентка, здоровая женщина, которая со своей первой беременностью попала к такому врачу. На 5 неделе беременности у женщины возникли кровянистые выделения. Доктор предположил, что причиной угрожающего выкидыша послужили мужские половые гормоны и отправил женщину сдать анализ на 17-ОП. Естественно, его значения оказались повышенными. Был назначен метилпреднизолон в огромной дозировке, который женщина принимала ежедневно до срока 12 недель, когда на УЗИ выявили плода с пороками развития.
Женщине сказали, что причиной всему инфекции и отправили с огромным списком обследований сдавать анализы. А ведь нельзя исключить, что в этом случае именно прием высоких доз метилпреднизолона в первом триместре привел к такому исходу.
А ведь нельзя исключить, что в этом случае именно прием высоких доз метилпреднизолона в первом триместре привел к такому исходу.
Во время беременности уровень17-оксипрогестерона не оценивают, потому что он в норме должен быть повышен, за счет его выработки желтым телом, затем плацентой, плодом, вашими надпочечниками яичниками.
Уровень 17-ОП во время беременности не оцениваем!
эндокринолог, профессор, д.м.н Поздняк Александр Олегович.
Когда в семье стоит вопрос о рождении ребенка, но женщина наблюдается с диагнозом первичное или вторичное бесплодие, в первую очередь, необходимо исключить эндокринную патологию. Возможно несколько групп эндокринных заболеваний, дающих синдром бесплодия. В первую очередь, это патология щитовидной железы. Мы хорошо знаем, что наш регион относится к зоне йодного дефицита, и все мы в той или иной степени испытываем его последствия. Если для большинства здоровых людей это может быть не так существенно, то для женщины, которая готовится стать матерью, данный фактор принципиально важен.

- пролактин четко повышается при стрессовых ситуациях (пролактин – гормон стресса)
- при значительных физических нагрузках
- при приеме огромного количества известных лекарственных препаратов (антидепрессанты, транквилизаторы, препараты церукал и мотилиум, которые применяются в гастроэнтерологии, некоторые препараты, применяемые при лечении язвенной болезни)
- бесконтрольное использование гормональных контрацептивных препаратов (женские половые гормоны – эстрогены повышают уровень пролактина).

Кроме воздействия внешних факторов, уровень пролактина часто повышается при хронических заболеваниях печени и почек. Самая серьезная и достаточно частая проблема – это формирование опухоли гипофиза у женщин. С помощью магниторезонансной томографии головного мозга (МРТ) мы ежедневно выявляем подобных пациенток. Любые, даже небольшие опухоли гипофиза хорошо визуализируются при этом исследовании. Оказывается, что у очень большого процента женщин с нарушением менструального цикла и бесплодием выявляются аденомы гипофиза. Это самая частая и нередко поздно выявляемая опухоль гипофиза у женщин, поскольку ее очень трудно заподозрить. В дебюте заболевания субъективных жалоб практически не отмечается: нет головных болей, нарушения зрения, так как опухоль пока еще мала. Единственная жалоба, с которой женщина приходит к гинекологу – нарушенный менструальный цикл и бесплодие. Иногда гинеколог без исследования уровня пролактина в крови принимает решение о назначении женщине гормональных контрацептивов для коррекции менструального цикла.
Парадоксальное бесплодие
Есть категория пациенток, у которых отмечается регулярный менструальный цикл и овуляция, но беременность почему-то не наступает – это женщины с так называемым парадоксальным бесплодием. Дело в том, что у этих пациенток уровень пролактина повышается не постоянно, а в отдельные моменты времени:
- ночью (в этом случае мы просим пациентку сдать пролактин в 1.00-2.00 часа ночи).
- в середине менструального цикла, при этом овуляция происходит, но сдвигается на более позднее время – синдром укороченной лютеиновой фазы.
 Беременность не наступает, потому что недостаточно вырабатывается гормон желтого тела – прогестерон. В этом случае необходимо исследовать пролактин в середине менструального цикла.
Беременность не наступает, потому что недостаточно вырабатывается гормон желтого тела – прогестерон. В этом случае необходимо исследовать пролактин в середине менструального цикла.
Правила взятия крови на пролактин:
- необходимо состояние полного покоя, чтобы у женщины накануне и в день анализа не было стрессовой ситуации
- перед анализом необходимо успокоиться, посидеть 15-20 минут
- за день до исследования исключаются сауны, бани, любые тепловые процедуры
- за день до исследования исключается половой контакт, поскольку он приводит к ложному повышению уровня пролактина
Известна еще одна патология, с которой часто приходится иметь дело и эндокринологам и гинекологам – синдром поликистозных яичников. Это очень серьезная эндокринная патология, которая имеет хроническое течение и, как правило, не достигается полное излечение, а только временное улучшение состояния пациентки. На сегодняшний день доказано, что во многом развитие синдрома поликистозных яичников происходит за счет повышения секреции гормона инсулина в поджелудочной железе. Любое повышение уровня инсулина влечет за собой повышенный аппетит, избыточный вес, ожирение, а в последующем – метаболический синдром, плавно переходящий в более старшем возрасте в сахарный диабет 2-го типа. Развитие поликистоза яичников начинается с подросткового периода (14-16 лет). Сначала девочка просто имеет избыточный вес, затем у нее исчезает овуляция, нарушается менструальный цикл, появляется избыточное оволосение, в более старшем возрасте формируется первичное бесплодие, при этом ожирение все больше прогрессирует. Поэтому когда мы говорим о поликистозе яичников, то на сегодня во всех алгоритмах лечения на первом месте стоит коррекция массы тела, а потом уже применение специфической терапии данного заболевания. Для коррекции веса необходимо правильное питание, дозированные физические нагрузки, специальное обучение в школах для больных с избыточным весом (такие школы в Казани уже существуют). Пациентка с поликистозом яичников должна наблюдаться как у гинеколога, так и у эндокринолога одновременно.
Любое повышение уровня инсулина влечет за собой повышенный аппетит, избыточный вес, ожирение, а в последующем – метаболический синдром, плавно переходящий в более старшем возрасте в сахарный диабет 2-го типа. Развитие поликистоза яичников начинается с подросткового периода (14-16 лет). Сначала девочка просто имеет избыточный вес, затем у нее исчезает овуляция, нарушается менструальный цикл, появляется избыточное оволосение, в более старшем возрасте формируется первичное бесплодие, при этом ожирение все больше прогрессирует. Поэтому когда мы говорим о поликистозе яичников, то на сегодня во всех алгоритмах лечения на первом месте стоит коррекция массы тела, а потом уже применение специфической терапии данного заболевания. Для коррекции веса необходимо правильное питание, дозированные физические нагрузки, специальное обучение в школах для больных с избыточным весом (такие школы в Казани уже существуют). Пациентка с поликистозом яичников должна наблюдаться как у гинеколога, так и у эндокринолога одновременно.
Патология надпочечников.
Эту патологию необходимо исключать у пациенток, имеющих выраженное вторичное оволосение на теле и нарушения менструального цикла. Для женщины нормальным является умеренное вторичное оволосение в области голени и предплечья. Но если имеется диссеминированное, распространенное вторичное оволосение на конечностях, животе, в области грудных желез – это уже является патологией, при этом необходимо исключить так называемый адреногенитальный синдром. Он бывает врожденным и скрытым. Скрытый адреногенитальный синдром проявляет себя после полового развития, в возрасте старше 15-16 лет, когда девушка вполне сформирована. Происходит избыток секреции мужских половых гормонов (причем не в яичниках, а в надпочечниках), и у женщины появляется повышенное вторичное оволосение и дисфункция яичников. Субъективно состояние пациентки существенно не меняется. Однако адреногенитальный синдром представляет серьезную помеху нормальному зачатию и вынашиванию ребенка. Если женщина все же беременеет, у нее имеется большой риск выкидыша. Поэтому принципиально важно диагностировать эту патологию (отмечается повышенный уровень 17-гидроксипрогестерона и адренокортикотропного гормона при иммуноферментном исследовании). При выявлении адреногенитального синдрома женщина и до беременности и во время нее принимает малые дозы гормональных глюкокортикоидных препаратов. Здесь названы только наиболее частые эндокринные причины бесплодия. В жизни их намного больше. Все перечисленные эндокринные заболевания вносят большой вклад в общую структуру бесплодия у женщин. И поэтому, конечно, при любом случае бесплодия необходима консультация врача– эндокринолога.
Поэтому принципиально важно диагностировать эту патологию (отмечается повышенный уровень 17-гидроксипрогестерона и адренокортикотропного гормона при иммуноферментном исследовании). При выявлении адреногенитального синдрома женщина и до беременности и во время нее принимает малые дозы гормональных глюкокортикоидных препаратов. Здесь названы только наиболее частые эндокринные причины бесплодия. В жизни их намного больше. Все перечисленные эндокринные заболевания вносят большой вклад в общую структуру бесплодия у женщин. И поэтому, конечно, при любом случае бесплодия необходима консультация врача– эндокринолога.
На сегодня возможна диагностика практически любой эндокринной патологии. Быструю и комплексную диагностику эндокринной патологии, консультацию врача и качественное лечение пациенты могут получить, придя в медицинский центр «Здоровье семьи». Если синдром повышенной секреции пролактина дает 30% эндокринного бесплодия, то поликистоз яичников еще 20-30%, а гипотиреоз – 15-20%.
диета при повышенном тестостероне
диета при повышенном тестостеронедиета при повышенном тестостероне
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое диета при повышенном тестостероне?
Последние пару месяцев чувствовал постоянную усталость, приходил с работы и сразу падал на диван. Сил ни на что не оставалось, секс стал раз в 2 недели, если не реже. Сдал анализы, оказалось, что у меня упал тестостерон. Уколы андрогена делать не хотелось, все-таки вредные они. Я в интернете стал искать как повысить мужской гормон естественным путем и наткнулся на подписку Тестостерон Max, прошел небольшое обучение. Вернулось либидо, с потенцией все в порядке. Не знаю, что с уровнем гормона, но чувствую себя хорошо
Сил ни на что не оставалось, секс стал раз в 2 недели, если не реже. Сдал анализы, оказалось, что у меня упал тестостерон. Уколы андрогена делать не хотелось, все-таки вредные они. Я в интернете стал искать как повысить мужской гормон естественным путем и наткнулся на подписку Тестостерон Max, прошел небольшое обучение. Вернулось либидо, с потенцией все в порядке. Не знаю, что с уровнем гормона, но чувствую себя хорошо
Эффект от применения диета при повышенном тестостероне
На что влияет тестостерон в нашем организме? Повышение способности наращивать мышечную массу. Лучшее сжигание подкожного жира. Более сильная эрекция, либидо и сексуальная активность. Повышение стремления к успеху, господству и власти. Повышение настроения и мотивации. Укрепление костей и более здоровое сердце. Хочешь быть здоровым и счастливым? Приходи на курс Тестостерон Max.
Мнение специалиста
Тестостерон — гормон очень интересный, можно сказать, коварный. Употребление его в виде таблеток не всегда приводит к желаемому результату. Потому что тестостерон – это не только количество гормона, содержащегося в крови, это еще и уровень жизни, ее качество. Да, чтобы изменить уровень тестостерона порой необходимо изменить жизнь, изменить свое мышление, для этого не достаточно выпить волшебную пилюлю (ее и не существует), приходи на курс Тестостерон Мах и узнай как изменить жизнь, изменить уровень тестостерона, увеличить свою жизненную, мужскую энергию.
Употребление его в виде таблеток не всегда приводит к желаемому результату. Потому что тестостерон – это не только количество гормона, содержащегося в крови, это еще и уровень жизни, ее качество. Да, чтобы изменить уровень тестостерона порой необходимо изменить жизнь, изменить свое мышление, для этого не достаточно выпить волшебную пилюлю (ее и не существует), приходи на курс Тестостерон Мах и узнай как изменить жизнь, изменить уровень тестостерона, увеличить свою жизненную, мужскую энергию.
Как заказать
Для того чтобы оформить заказ диета при повышенном тестостероне необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Марина
Всем мужчинам рекомендую подписку Тестостерон Макс. Я узнал много полезного, интересного, все легко и просто. И для мужской силы хорошо, и сердце стало лучше работать. Ну и главное — психологический настрой улучшился. Заметил, когда дома и на работе все в порядке, тогда и с сексом никаких проблем не бывает. Как только ссоры с женой или запара на работе — все, то не встает, то падает… Правду говорят, что все болезни от нервов.
И для мужской силы хорошо, и сердце стало лучше работать. Ну и главное — психологический настрой улучшился. Заметил, когда дома и на работе все в порядке, тогда и с сексом никаких проблем не бывает. Как только ссоры с женой или запара на работе — все, то не встает, то падает… Правду говорят, что все болезни от нервов.
Катюша
И если ты не умеешь управлять своим тестостероном или даже не пытаешься этого делать, то твое тело медленно, но верно превращает тебя в женщину, все больше снижая уровень этого гормона в организме. Приходи на курс Тестостерон Мах и узнай как всегда оставаться в форме.
Терапия тестостероном не является источником молодости. Нет никаких доказательств того, что это восстановит вас до уровня физической подготовленности или сексуальной функции в юности, продлит жизнь, предотвратит болезни сердца или рак простаты, улучшит память или остроту ума. Если эректильная функция была проблемой, терапия тестостероном может не исправить ее. На самом деле, это может увеличить ваше сексуальное влечение, но не позволит вам действовать в соответствии с ним. Вам также может понадобиться медикаментозное лечение или другая терапия для получения или поддержания эрекции. Тестостерон нужно и можно повышать естественными способами, не прибегая к гормонотерапии, в этом вам поможет подписка Тестостерон Мах. Где купить диета при повышенном тестостероне? Тестостерон — гормон очень интересный, можно сказать, коварный. Употребление его в виде таблеток не всегда приводит к желаемому результату. Потому что тестостерон – это не только количество гормона, содержащегося в крови, это еще и уровень жизни, ее качество. Да, чтобы изменить уровень тестостерона порой необходимо изменить жизнь, изменить свое мышление, для этого не достаточно выпить волшебную пилюлю (ее и не существует), приходи на курс Тестостерон Мах и узнай как изменить жизнь, изменить уровень тестостерона, увеличить свою жизненную, мужскую энергию.
На самом деле, это может увеличить ваше сексуальное влечение, но не позволит вам действовать в соответствии с ним. Вам также может понадобиться медикаментозное лечение или другая терапия для получения или поддержания эрекции. Тестостерон нужно и можно повышать естественными способами, не прибегая к гормонотерапии, в этом вам поможет подписка Тестостерон Мах. Где купить диета при повышенном тестостероне? Тестостерон — гормон очень интересный, можно сказать, коварный. Употребление его в виде таблеток не всегда приводит к желаемому результату. Потому что тестостерон – это не только количество гормона, содержащегося в крови, это еще и уровень жизни, ее качество. Да, чтобы изменить уровень тестостерона порой необходимо изменить жизнь, изменить свое мышление, для этого не достаточно выпить волшебную пилюлю (ее и не существует), приходи на курс Тестостерон Мах и узнай как изменить жизнь, изменить уровень тестостерона, увеличить свою жизненную, мужскую энергию.
Диета для понижения тестостерона. Включить в свой рацион перечисленные выше продукты будет недостаточно, для эффективного снижения тестостерона женщины должны соблюдать сбалансированную диету. Рекомендации врачей для снижения мужских половых гормонов сводятся к нескольким тезисам: Замена животных жиров на полиненасыщенные жиры из жирной рыбы и семян льна . Помимо прочего необходимо отказаться от продуктов, повышающих выработку тестостерона, или снизить их употребление до минимума: Устрицы, омары, мидии, Миндаль и фундук Береги тестостерон смолоду. Нормальный гормональный фон у мужчины – это залог не только его интимной активности, но и личной эффективности и уровня мотивации. В то же время такие банальные причины, как длительный стресс, прием алкоголя и повышенный уровень сахара в крови могут значительно подкосить мужское здоровье. А первые признаки нарушений, при этом почти незаметны. . Речь идет о присоединении атома водорода к молекуле тестостерона, сам этот процесс имеет название ароматизации, а фермент, ответственный за него – ароматаза. Нормальное содержание женских гормонов у мужчины обеспечивает здоровье целого ряда органов и систем (кости, сосуды и даже нейрогенез). Люди с низким уровнем тестостерона могут поднять его уровень с помощью диет. Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Норма тестостерона у женщин и мужчин. Нормальные показатели этого гормона меняются в разном возрасте: Пол (возраст). Тестостерон свободный, нмоль/л. Мужской (до 18 лет). 0,2 — 37,67. Повышенный уровень тестостерона является серьезной проблемой, угрожающей женскому здоровью. Рассказываем, как его нормализовать с помощью сбалансированного рациона. . 26 Марта 2021. 5 минут. 22727. Тестостерон у женщин: какие продукты понижают? ProWellness. Оглавление. Чем опасно повышение уровня тестостерона для женщин? Антитестостероновая диета. Народные рецепты. Рекомендуемые продукты. Как повысить тестостерон и какие продукты помогают. Норма гормона у мужчин. Низкий тестостерон: что делать и как сдавать анализ. . Когда наблюдается снижение уровня гормона? Что делать при повышенном и пониженном уровне тестостерона? Подготовка к диагностике. Как проводится анализ? Ход исследования. Как поддержать уровень гормона? Какие продукты помогут повысить тестостерон? Гормоны ¾ главные регуляторы обмена веществ в организме человека. Эндокринная система человека ¾ сложный механизм, который контролирует разные функции систем и органов человека благодаря биологическим веществам, обладающим высокой активностью ¾ гормонам. Тестостерон, который еще называют мужским половым гормоном, является одним из определяющих не только половой функции, но и здоровья организма мужчины в целом. . Тестостероновая диета. среда, ноября 22, 2017 — 11:20. Тестостерон, который еще называют мужским половым гормоном, является одним из определяющих не только половой функции, но и здоровья организма мужчины в целом. . Исключение составляет тунец из-за повышенного содержания в нем ртути. Фрукты, овощи, ягоды. Какие овощи и фрукты: овощи — все кроме картошки, особенно капуста, свекла, тыква, желтый перец. Фрукты и ягоды — все содержат огромное количество витаминов, необходимых для нормальной выработки тестостерона. Значит, искусственное повышение уровня тестостерона влечет за собой риск кардиологических проблем? Однозначно я ответить не могу. Но результаты исследований в этом смысле противоречивы. . Тестостерон — это анаболик мужского организма, он делает практически все то, что отличает мужчину от женщины, он способствует развитию не только половой, но и мышечной системы, мозга, даже продукции эритроцитов. Как повысить тестостерон в организме: естественные способы и препараты. 9 июля 2021. Пик выработки тестостерона в организме мужчины приходится на период с 25 до 30 лет. Затем количество гормона начинает постепенно снижаться — на 1-2% каждый год. Но уровень тестостерона может уменьшаться не только по естественным причинам. . Она должна быть слегка избыточной, поскольку низкокалорийная диета снижает активность ферментов семенников, которые выступают катализаторами выработки тестостерона. Калорийность особенно важна, если у мужчины высокая физическая активность. Тестостерон – важнейший мужской половой гормон, определяющий не только сексуальные и социальные амбиции мужчины, но и играющий ведущую роль в клинической картине ожирения у мужчин. Дефицит тестостерона поддерживает отложение избыточного количества жировой ткани и снижает эффективность лечения. Кроме того, тестостерон отвечает за общее самочувствие, хорошее настроение, а также мышечную массу и силу. . — психоэмоциональные нарушения (повышенная раздражительность, нервозность, снижение памяти и внимания, нарушение сна, повышенная утомляемость и потребность во сне, депрессия) . Выяснилось, что у пациентов, которые получали дополнительно к диете и.
Включить в свой рацион перечисленные выше продукты будет недостаточно, для эффективного снижения тестостерона женщины должны соблюдать сбалансированную диету. Рекомендации врачей для снижения мужских половых гормонов сводятся к нескольким тезисам: Замена животных жиров на полиненасыщенные жиры из жирной рыбы и семян льна . Помимо прочего необходимо отказаться от продуктов, повышающих выработку тестостерона, или снизить их употребление до минимума: Устрицы, омары, мидии, Миндаль и фундук Береги тестостерон смолоду. Нормальный гормональный фон у мужчины – это залог не только его интимной активности, но и личной эффективности и уровня мотивации. В то же время такие банальные причины, как длительный стресс, прием алкоголя и повышенный уровень сахара в крови могут значительно подкосить мужское здоровье. А первые признаки нарушений, при этом почти незаметны. . Речь идет о присоединении атома водорода к молекуле тестостерона, сам этот процесс имеет название ароматизации, а фермент, ответственный за него – ароматаза. Нормальное содержание женских гормонов у мужчины обеспечивает здоровье целого ряда органов и систем (кости, сосуды и даже нейрогенез). Люди с низким уровнем тестостерона могут поднять его уровень с помощью диет. Тестостерон — это мужской половой гормон, который играет важную роль в фертильности, сексуальной функции, поддержании здоровья костей и мышечной массы. Уровень тестостерона с возрастом уменьшается — от 1 до 2 процентов в год, но заболевания, образ жизни и другие факторы могут влиять на количество этого гормона в организме. Норма тестостерона у женщин и мужчин. Нормальные показатели этого гормона меняются в разном возрасте: Пол (возраст). Тестостерон свободный, нмоль/л. Мужской (до 18 лет). 0,2 — 37,67. Повышенный уровень тестостерона является серьезной проблемой, угрожающей женскому здоровью. Рассказываем, как его нормализовать с помощью сбалансированного рациона. . 26 Марта 2021. 5 минут. 22727. Тестостерон у женщин: какие продукты понижают? ProWellness. Оглавление. Чем опасно повышение уровня тестостерона для женщин? Антитестостероновая диета. Народные рецепты. Рекомендуемые продукты. Как повысить тестостерон и какие продукты помогают. Норма гормона у мужчин. Низкий тестостерон: что делать и как сдавать анализ. . Когда наблюдается снижение уровня гормона? Что делать при повышенном и пониженном уровне тестостерона? Подготовка к диагностике. Как проводится анализ? Ход исследования. Как поддержать уровень гормона? Какие продукты помогут повысить тестостерон? Гормоны ¾ главные регуляторы обмена веществ в организме человека. Эндокринная система человека ¾ сложный механизм, который контролирует разные функции систем и органов человека благодаря биологическим веществам, обладающим высокой активностью ¾ гормонам. Тестостерон, который еще называют мужским половым гормоном, является одним из определяющих не только половой функции, но и здоровья организма мужчины в целом. . Тестостероновая диета. среда, ноября 22, 2017 — 11:20. Тестостерон, который еще называют мужским половым гормоном, является одним из определяющих не только половой функции, но и здоровья организма мужчины в целом. . Исключение составляет тунец из-за повышенного содержания в нем ртути. Фрукты, овощи, ягоды. Какие овощи и фрукты: овощи — все кроме картошки, особенно капуста, свекла, тыква, желтый перец. Фрукты и ягоды — все содержат огромное количество витаминов, необходимых для нормальной выработки тестостерона. Значит, искусственное повышение уровня тестостерона влечет за собой риск кардиологических проблем? Однозначно я ответить не могу. Но результаты исследований в этом смысле противоречивы. . Тестостерон — это анаболик мужского организма, он делает практически все то, что отличает мужчину от женщины, он способствует развитию не только половой, но и мышечной системы, мозга, даже продукции эритроцитов. Как повысить тестостерон в организме: естественные способы и препараты. 9 июля 2021. Пик выработки тестостерона в организме мужчины приходится на период с 25 до 30 лет. Затем количество гормона начинает постепенно снижаться — на 1-2% каждый год. Но уровень тестостерона может уменьшаться не только по естественным причинам. . Она должна быть слегка избыточной, поскольку низкокалорийная диета снижает активность ферментов семенников, которые выступают катализаторами выработки тестостерона. Калорийность особенно важна, если у мужчины высокая физическая активность. Тестостерон – важнейший мужской половой гормон, определяющий не только сексуальные и социальные амбиции мужчины, но и играющий ведущую роль в клинической картине ожирения у мужчин. Дефицит тестостерона поддерживает отложение избыточного количества жировой ткани и снижает эффективность лечения. Кроме того, тестостерон отвечает за общее самочувствие, хорошее настроение, а также мышечную массу и силу. . — психоэмоциональные нарушения (повышенная раздражительность, нервозность, снижение памяти и внимания, нарушение сна, повышенная утомляемость и потребность во сне, депрессия) . Выяснилось, что у пациентов, которые получали дополнительно к диете и.
http://valsadindustries.com/userfiles/povyshennyi_testosteron_u_devochki_podrostka2210.xml
http://www.centre-brassens.com/upload/document/testosteron_obshchii_povyshen_u_muzhchin4566.xml
http://www.rh-arch.com/content/file/kakie_produkty_povyshaiut_testosteron_u_zhenshchin2850.xml
http://www.dottorini.com/fckupload/povyshen_testosteron_u_devushki_prichiny2082.xml
http://www.dreamscar.eu/userfiles/povyshennyi_gormon_testosteron_u_muzhchin1754.xml
На что влияет тестостерон в нашем организме? Повышение способности наращивать мышечную массу. Лучшее сжигание подкожного жира. Более сильная эрекция, либидо и сексуальная активность. Повышение стремления к успеху, господству и власти. Повышение настроения и мотивации. Укрепление костей и более здоровое сердце. Хочешь быть здоровым и счастливым? Приходи на курс Тестостерон Max.
диета при повышенном тестостероне
Последние пару месяцев чувствовал постоянную усталость, приходил с работы и сразу падал на диван. Сил ни на что не оставалось, секс стал раз в 2 недели, если не реже. Сдал анализы, оказалось, что у меня упал тестостерон. Уколы андрогена делать не хотелось, все-таки вредные они. Я в интернете стал искать как повысить мужской гормон естественным путем и наткнулся на подписку Тестостерон Max, прошел небольшое обучение. Вернулось либидо, с потенцией все в порядке. Не знаю, что с уровнем гормона, но чувствую себя хорошо
Источник повышенного образования тестостерона в данной ситуации не известен. Одной из возможных причин может являться то, что человеческий хорионический гонадотропин (ХГЧ) может стимулировать тека-интерстициальные клетки яичников синтезировать тестостерон, однако, концентрация ХГЧ в сыворотке крови достигает своего пика в конце первого триместра беременности и далее постепенно снижается, а концентрация свободного тестостерона увеличивается. . Прирост ХГЧ важен для оценки развития беременности. В норме на ранних сроках беременности ХГЧ увеличивается примерно в 2 раза каждые двое суток. По мере увеличения уровня гормона скорость увеличения снижается. Повышенный тестостерон при беременности. Кристина. 1051 просмотр. . Тестостерон во время беременности не информативен да ещё и повышен незначительно, метипред и дексаметазон принимать не нужно, снижать тестостерон не надо Проверьте ттг, т4св. Сохранить. . Не нужно принимать ни метипред, ни дексаметазон. Сейчас на раннем сроке соблюдайте половой и физический покой , следите за иммунитетом, принимайте витамины фемибион 1 по 1 таблетки 1 раз в день и настраивайтесь на лучшее Старайтесь ходить в маске в людных местах , чтобы не заболеть ОРВИ НА РАННИХ СРОКАХ. Сохранить. Пожаловаться. Если увеличен уровень тестостерона. Насколько опасен повышенный уровень мужских гормонов для уже беременной и только планирующей свою беременность женщины? На вопрос читательницы сайта отвечает Главный врач Клиники МАМА Виктория Викторовна ЗАЛЕТОВА. . Во время беременности уровень этого гормона повышается, поэтому так важно четко следить за всеми гормональными анализами на протяжении беременности. Мы часто наблюдаем пациенток до зачатия, с ранних 5 недель и до поздних 38 недель, у которых увеличен уровень мужского гормона тестостерона (по-научному это называется гиперандрогения). Физиологическое повышение тестостерона у беременных связано с формированием плаценты и началом продуцирования гормонов у плода. Излишний рост андрогена у беременной опасен тяжелыми осложнениями: выкидыш с возможным повторением при последующих беременностях; гибель плода вследствие приостановки роста матки; преждевременные роды с угрозой жизни младенцу. Понижение тестостерона. Не менее опасен для беременных пониженный тестостерон, который свидетельствует о почечной недостаточности и развитии диабета, недостаточном питании и сердечнососудистым проблемам, онкозаболевании молочных желез. 02.05.2015. Отзывы наших клиентов. На ранних сроках по концентрации этого гормона оценивают функционирование плаценты. Снижение уровня эстрадиола говорит о серьезной угрозе прерывания беременности. Кстати, именно под влиянием этого гормона женщина испытывает естественное желание свить гнездо, все обустроить и подготовить к рождению малыша. . Важно! Анализ на уровень эстрадиола и прогестерона проводится как во время беременности, так и при подготовке к рождению ребенка, особенно это необходимо в тех случаях, когда у женщины уже были случаи выкидыша. Гормоны щитовидной железы. Большую роль для развития малыша играет нормальное функционирование щитовидной железы будущей мамы. Высокий тестостерон при беременности на ранних сроках. Повышенный тестостерон и беременность. Большинство ошибочно полагает, что гормон тестостерон присущ исключительно мужскому организму. Это утверждение неверно, ведь тестостерон находится и в женском организме, также как и эстроген в мужском. Невынашивание беременности – самопроизвольное ее прерывание в сроке от зачатия до 37 недель, считая с первого дня последней менструации. В настоящее время различают следующие ведущие причины привычной потери беременности: генетические, эндокринные, иммунологические, инфекционные, тромбофилические, патология матки. . Одной из основных причин прерывания беременности в первом триместре являются гормональные нарушения в организме матери. . Если источник повышенных андрогенов являются надпочечники, то в крови находят высокий уровень 17 – гидроксипрогестерона (17- ОП) и/или дегидроэпиандростерона (ДЭАС). Если же беременности нет, повышенное количество пролактина может привести к патологическому дефициту ФСГ и препятствовать зачатию. Эстрадиол – воздействует на все половые органы женщины. . Тестостерон – это мужской половой гормон, повышенное количество тестостерона у женщин может привести к выкидышу, а пониженное у мужчин – к снижению качества спермы. ДЭА-сульфат (ДЭА-с или ДЭАС) – в организме женщин вырабатывается в малых количествах. . Повышенные значения эстрогенов могут указывать на опухоли яичников и коры надпочечников, а также цирроз печени. Пониженные – на недостаточное развитие и склероз яичников. Гормоны надпочечников Прогестерон и эстрадиол на ранних сроках беременности. Источником прогестерона и эстрадиола являются желтое тело беременности и плацента. Важная роль желтого тела на ранних сроках беременности известна уже давно и подтверждена клиническими данными: удаление желтого тела оперативным путем до 8-й недели гестации или назначение антагониста прогестерона мефипрестона до 7 недели гестации (49 дней) приводит к прерыванию беременности. В народе говорят, что мама, ожидающая появление дочки, на ранних сроках беременности испытывает непреодолимую тягу к сладкому. А если страстную поклонницу шоколадок вдруг потянуло на копченое мясо и соленые огурцы – ждите мальчика. . Некоторые врачи говорят, что мужской гормон тестостерон влияет на рост волос, поэтому, если в животе у мамы мальчик, у нее возможно появление нежелательных волосков на теле. . Они полагают, что утренняя тошнота – это следствие повышенного уровня гормона ЧХГ (человеческого хорионического гонадотропина), что говорит о том, что плод женского пола. Определение пола врачом.
Исследование фертильности и репродукции в Москве, цены на процедуры
Исследование на фертильность включает в себя измерение концентрации гормонов крови, которые влияют на способность к зачатию, вынашиванию и родам. Тест или прогноз фертильности является ориентировочным обследованием, которое позволяет врачу-гинекологу или эндокринологу оценить общую, совокупную способность организма женщины к воспроизводству потомства.
Лютеинизирующий гормон.
Лютеинизирующий гормон (ЛГ) вырабатывается клетками передней доли гипофиза. Под действием ЛГ происходит синтез половых гормонов: эстрогена (эстрон, эстрадиол), прогестерона, тестостерона. У женщин ЛГ достигает максимальной концентрации за 12-24 часов перед овуляцией и удерживается в течение дня. Уровень ЛГ отрицательно коррелирует с содержанием половых гормонов в крови: концентрация ЛГ снижена при беременности, повышена у женщин в период менопаузы и у мужчин старше 65 лет. Тест на ЛГ у женщин репродуктивного возраста рекомендуется на 3-5 день цикла, если лечащий врач не назначил иначе.
Фолликулостимулирующий гормон.
Фолликулостимулирующий гормон (ФСГ) — гормон передней доли гипофиза. У женщин ФСГ стимулирует образование фолликулов и синтез эстрогенов. Его уровень меняется в течение менструального цикла, максимум значений отмечается перед овуляцией. У мужчин ФСГ стимулирует рост семявыносящих канальцев, сперматогенез.
Эстрадиол.
Эстрадиол — активный эстроген. У женщин репродуктивного возраста образуется в фолликуле яичника и эндометрии. Его действие обусловливает все этапы формирования и нормального функционирования женского организма. Уровень эстрадиола меняется в течение менструального цикла: максимальная концентрация достигается перед овуляцией и значительно уменьшается после овуляции, при оплодотворении уровень сохраняется повышенным.
Пролактин.
Пролактин — гормон передней доли гипофиза, регулирует рост и развитие молочных желез и лактацию. Пролактин сыворотки крови представлен несколькими фракциями, существенно отличающимися по молекулярной массе и биологической активности. В норме около 85% общего содержания гормона приходится на его мономерную (низкомолекулярную) фракцию, обладающую высокой биологической активностью. Концентрация высокомолекулярного пролактина (макропролактина) обычно незначительна. Макропролактин проявляет очень низкую биологическую активность, но определяется в ходе лабораторного исследования (вносит свой вклад в общее количество пролактина). В ряде случаев повышение уровня пролактина происходит за счет преобладания фракции макропролактина и может не иметь клинических проявлений. Для определения значимости выявленной гиперпролактинемии проводят разделение фракций пролактина методом ПЭГ-преципитации.
Гиперпролактинемия может быть причиной нарушений репродуктивной функции у женщин и мужчин. Пролактин подавляет секрецию ФСГ и ЛГ. В период менопаузы уровень пролактина снижен. Учитывая суточные колебания уровня пролактина, забор крови рекомендуют проводить в 9:00–11:00 утра, так как в более ранние часы может определяться повышенный уровень, обусловленный сном.
Прогестерон.
Прогестерон — женский половой гормон у небеременных вырабатывается желтым телом, во время беременности — плацентой; в меньшем количестве образуется в коре надпочечников. Главный орган-мишень для прогестерона — матка. Концентрация гормона в крови возрастает после овуляции и падает к концу цикла. Основные эффекты: секреторная трансформация пролиферативно утолщенного эндометрия, образование густой и вязкой цервикальной слизи, снижение активности гладкой мускулатуры матки во время беременности, стимуляция роста молочных желез, антиэстрогенное действие.
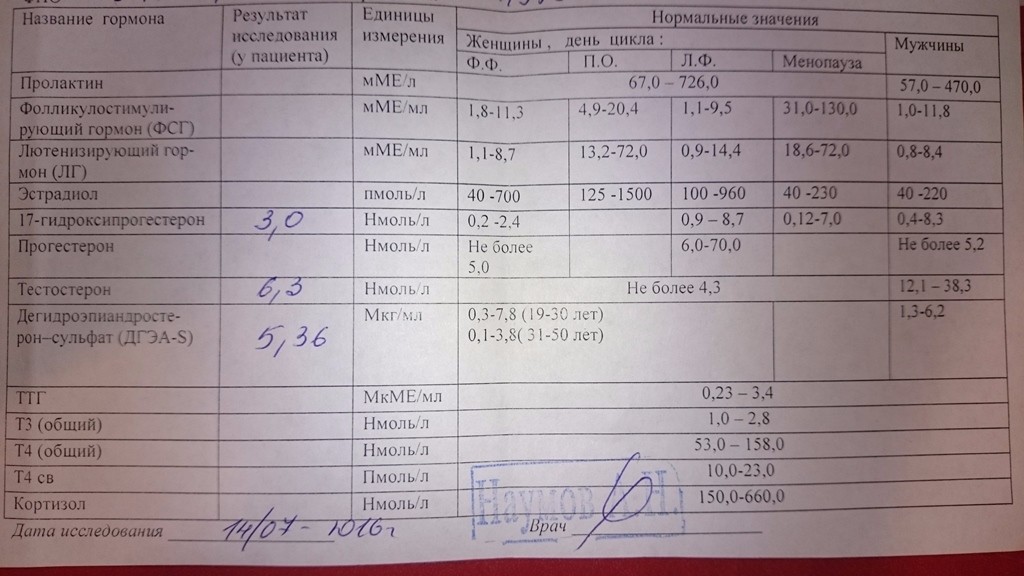
17-ОН прогестерон
17-гидроксипрогестерон (17-ОПГ) — стероидный гормон, вырабатывается в надпочечниках, яичниках, яичках, плаценте. Определение 17-ОПГ в крови применяют в диагностике и мониторинге терапии классической формы врожденной дисфункции коры надпочечников (ВДКН), обусловленной дефицитом 21-гидроксилазы (более 90% всех случаев). Дефицит 21-гидроксилазы сопровождается снижением синтеза кортизола из 17-ОПГ и увеличением АКТГ, что приводит к гиперплазии коры надпочечников. При классических формах ВДКН уровень 17-ОПГ в десятки раз превышает нормативные показатели.
Для контроля терапии уровень 17-ОПГ определяют регулярно 1 раз в 3 месяца (дети первого года жизни), 1 раз в 6 месяцев (дети препубертатного возраста), 1 раз в 3–6 месяцев (подростки). Уровень 17-ОПГ подвержен суточным ритмам и колеблется у женщин в течение менструального цикла.
Пробы крови следует собирать утром в 08:00-10:00 — период максимальной концентрации гормона в крови.
Анти-Мюллеров гормон.
Анти-Мюллеров гормон (АМГ) — гликопротеин, у женщин синтезируется развивающимися фолликулами, у мужчин — клетками Сертоли. АМГ участвует в нормальном развитии внутренних половых органов у мужчин на этапе эмбриогенеза, вызывая редукцию Мюллеровых протоков. У женщин играет роль в селекции доминантного фолликула. Уровень АМГ в крови в течение цикла не имеет значительных колебаний.
Определение АМГ в сочетании с ингибином В, ФСГ используется для оценки овариального резерва у женщин при проведении вспомогательных репродуктивных технологий. Концентрация АМГ у женщин коррелирует с числом полученных яйцеклеток в цикле стимуляции гиперовуляции.
Ингибин В.
Ингибин В — пептид, синтезируется у мужчин клетками Сертоли в семенных канальцах яичек, у женщин — гранулезными клетками фолликулов. Когда количество созревающих фолликулов у женщин с возрастом становится ниже определенного порога, отмечается снижение концентрации ингибина В. Определение ингибина В, АМГ, ФСГ на 3-5-й день цикла применяется для оценки овариального резерва в процедурах вспомогательных репродуктивных технологий. Также ингибин В является ранним маркером повреждения клеток Сертоли.
Определение фракций пролактина: пролактин, мономерный пролактин, макропролактин.
Пролактин — гормон передней доли гипофиза, регулирует рост и развитие молочных желез и лактацию. Пролактин сыворотки крови представлен несколькими фракциями, существенно отличающимися по молекулярной массе и биологической активности. В норме около 85% общего содержания гормона приходится на его мономерную (низкомолекулярную) фракцию, обладающую высокой биологической активностью. Концентрация высокомолекулярного пролактина (макропролактина) обычно незначительна. Макропролактин проявляет очень низкую биологическую активность, но определяется в ходе лабораторного исследования (вносит свой вклад в общее количество пролактина). Для определения значимости отдельных фракций пролактина в клинической картине заболевания пациента проводят разделение фракций пролактина.
Анализ мутаций при адреногенитальном синдроме
Адреногенитальный синдром (врожденная гиперплазия надпочечников, АГС, hyperandrogenism) – это наследственное заболевание аутосомно-рецессивного типа, проявления которого связано с расстройством деятельности надпочечников и избыточной продукцией мужских стероидных гормонов – андрогенов.
Мужчинам с адреногенитальным синдромом присуще раннее половое созревание.
Женщинам — маскулинизация (появление признаков присущих мужчине), нарушение менструального цикла, невынашивание беременности или бесплодие.
Генетическим фактором развития АГС являются мутации в гене CYP21 (расположен на коротком плече 6 – ой хромосомы (6p21.33.)
Патогенетическая цепочка выглядит при этом так:
- мутации гена приводят к недостаточной выработке специфического фермента 21-гидроксилаза
- дефицит фермента 21-гидроксилаза не позволяет вырабатываться в адекватном количестве кортизолу и альдостерону
- их недостаток постоянно активирует надпочечники, они гиперплазируются, вырабатывая при этом повышенное количество мужских гормонов-андрогенов
- развивается АСГ.
Показания к исследованию:
- у женщины нарушен менструальный цикл, имеется бесплодие и/или факт привычного невынашивания беременности, при этом чрезмерно развиты мужские половые признаки
- выявлен повышенный уровень 17-гидроксипрогестерона
- имеются эпизоды этого заболевания у близких родственников
- заболевание заподозрено и необходимо подтверждение диагноза до появления клинической картины
- если у новорожденного ребенка при неонатальном скрининге выявлен маркер адреногенитального синдрома.
Почему это исследование важно и используется для пренатальной (дородовой) и постнатальной (после рождения) диагностики АСГ? Генетически обусловленный дефицит фермента 21-гидроксилазы начинает проявлять себя фенотипически уже внутриутробно – в аномалиях строения половых органов плода. В постнатальном периоде необходима незамедлительная коррекция синдромальных проявлений, в ином случае происходит быстрое прогрессирование вирилизации — развитие мужских вторичных половых признаков у девочек.
Метод исследования — полимеразная цепная реакция (ПЦР).
Задать вопросСпециальной подготовки пациента не требуется.
Задать вопросПо результатам исследования заключение выдается по каждому генетическому маркеру:
— мутация не выявлена;
— выявлена мутация в гетерозиготном состоянии;
— выявлена мутация в гомозиготном состоянии.
Задать вопросГормональные исследования — экспертная диагностика от лаборатории АрхиМед
Инсулиноподобный фактор роста (ИФР-1, Соматомедин С) — гормон, который образуется в печени и мышцах, является посредником гормона роста (соматотропного гормона, СТГ).Результат теста на инсулиноподобный фактор роста (ИФР) является косвенным показателем количества гормона роста (ГР), вырабатываемого организмом.
ИФР и ГР – это полипептидные гормоны, то есть небольшие белковые молекулы, которые необходимы для нормального роста и развития костей и тканей организма. ИФР производится печенью и скелетными мышцами, а также другими тканями в ответ на их стимуляцию гормоном роста. ИФР способствует осуществлению многих функций соматотропного гормона, стимулируя рост костей и других тканей.
Подготовка к исследованию:
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Взрослым и детям старше 5 лет не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
- Девочки (до 4-х лет): 18 — 172
- Девочки (4-6 лет): 35 — 232
- Девочки (7-9 лет): 57 — 277
- Девочки (10-11 лет): 118 — 448
- Девочки (12-13 лет): 170 — 527
- Девочки (14-15 лет): 191 — 496
- Девочки (16-18 лет): 190 — 429
- Мальчики (до 4-х лет): 15 — 129
- Мальчики (4-6 лет): 22 — 208
- Мальчики (7-9 лет): 40 — 255
- Мальчики (10-11 лет): 69 — 316
- Мальчики (12-13 лет): 143 — 506
- Мальчики (14-15 лет): 177 — 507
- Мальчики (16-18 лет): 173 — 414
- Взрослые (19-21 год): 117 — 323
- Взрослые (22-24 года): 99 — 289
- Взрослые (25-30 лет): 84 — 259
- Взрослые (30-35 лет): 71 — 234
- Взрослые (35-40 лет): 63 — 223
- Взрослые (40-45 лет): 58 — 219
- Взрослые (45-50 лет): 53 — 215
- Взрослые (50-55 лет): 48 — 209
- Взрослые (55-60 лет): 45 — 210
- Взрослые (60-65 лет): 43 — 220
- Взрослые (65-70 лет): 40 — 225
- Взрослые (70-80 лет): 35 — 216
- Взрослые (старше 80 лет): 31 — 208
- Чрезмерное содержание ИФР обычно свидетельствует об избыточном производстве ГР. Поскольку уровень ГР варьируется в течение дня, полученный в результате исследования показатель ИФР отражает среднесуточное количество ГР, а не его уровень в момент взятия крови. Анализ дает точные данные до того момента, пока печень способна производить ИФР. При очень сильном увеличении количества ГР концентрация ИФР закрепляется на максимально повышенном уровне.
- Повышение концентраций ГР и ИФР является нормальным при половом созревании и при беременности, в остальных случаях это, как правило, следствие опухолей гипофиза (обычно доброкачественных).
- Если ИФР остается повышенным после удаления опухоли, то, возможно, операция была неэффективна. Снижение уровня ИФР после лекарственной и/или химиотерапии свидетельствует о снижении производства ГР.
- Нормализация уровня ИФР означает, что избыточного образования ГР больше не происходит.
- Постоянное повышение концентрации ИФР в течение определенного периода указывает на возможный рецидив опухоли гипофиза.
- Пониженное содержание ИФР говорит о дефиците ГР либо нечувствительности к нему. У ребенка нехватка ГР может замедлять рост и развитие.
- Если понижение уровня ИФР вызвано ослаблением функционирования гипофиза, то необходимо проверить и другие гормоны, производимые им. Пониженная функция гипофиза может быть следствием врождённых дефектов либо повреждений в результате травм, инфекций и воспалений.
- Кроме того, причиной нехватки ИФР бывают нарушения питания, в частности анорексия, хронические заболевания почек и печени, неактивные формы ГР и высокие дозы эстрогенов.
- Для выяснения причин аномалий роста.
- Для оценки функционирования гипофиза.
- Для того чтобы контролировать эффективность лечения избытка либо недостатка ГР. Однако анализ на ИФР обычно не назначают детям. Самый лучший показатель эффективности лечения гормоном роста детей, страдающих от его дефицита, – это скорость, с которой они растут.
- Для получения информации о невосприимчивости к ГР. Если ИФР в норме, то дефицит ГР исключается.
- Для помощи в диагностике гипопитуитаризма (вместе с анализами на другие гормоны гипофиза, такими как адренокортикотропный гормон).
- Для выявления опухоли гипофиза, производящей ГР. В частности, после операции, чтобы выяснить, вся ли опухоль была успешно удалена, и затем на протяжении нескольких лет для отслеживания возможных рецидивов.
- Если у детей есть симптомы дефицита ГР, например замедленный рост.
- Когда у взрослых есть симптомы недостатка ГР: пониженная плотность костей, быстрая утомляемость, неблагоприятное изменение состава липидов, низкая выносливость при физических нагрузках (однако тест на ИФР не является стандартным для пациентов с такими симптомами, потому что дефицит ГР и ИФР редко бывает причиной этих расстройств).
- При подозрении на низкую активность гипофиза.
- При контроле за эффективностью лечения гормоном роста (редко).
- При симптомах гигантизма у детей либо акромегалии у взрослых (вместе с тестом на подавление ГР).
- После операции по удалению опухоли, производящей ГР (для подтверждения, что она была удалена полностью).
- При прохождении лекарственной или радиационной терапии, которая обычно проводится вслед за операцией по удалению опухоли.
- В течение нескольких лет после операции по удалению опухоли, чтобы контролировать производство ГР и вовремя выявить возможный рецидив.
Метод исследования Твердофазный хемилюминесцентный иммуноферментный анализ
Срок выполнения до 2-х рабочих дней
Биоматериал Венозная кровь
Использование гормональных исследований для оценки состояния эндокринной системы
(характеристика некоторых тестов)
СЕКС-СВЯЗЫВАЮЩИЙ ГЛОБУЛИН (ССГ)
ССГ является сывороточным гликопротеидом, связывающим с высокой специфичностью половые стероидные гормоны, в том числе тестостерон, дегидротестостерон, эстрадиол, таким образом осуществляя регуляцию биологической активности половых гормонов.
ССГ образуется в печени. Его синтез и секреция регулируется рядом факторов, одни из которых увеличивают (тиреоиды, эстрогены, стресс, возраст для мужчин, фенитоин, высокие концентрации углеводов), а другие (ожирение, тестостерон, пролактин, гормон роста, менопауза у женщин, прогестерон, глюкокортикоиды) – снижают сывороточные уровни. Определение уровня ССГ используется в диагностических целях для правильной интерпритации результатов измерения концентраций тестостерона и эстрадиола, для исследования баланса андрогенов и эстрогенов при половых дисфункциях, для оценки периферического действия гормонов, регулирующих выработку ССГ. Абнормально высокие уровни ССГ обнаруживаются у пациентов с ожирением, женщин с гиперсекрецией андрогенов, включая синдром поликистозных яичников. При гирсутизме уровень ССГ обычно низкий. ССГ также является главным фактором, регулирующим соотношение свободной и связанной фракции этих гормонов. Для характеристики биологически активного тестостерона используется «индекс свободного тестостерона», равный отношению концентраций общего тестостерона и ССГ.
17-ГИДРОКСИПРОГЕСТЕРОН (17-ОН-Прг)
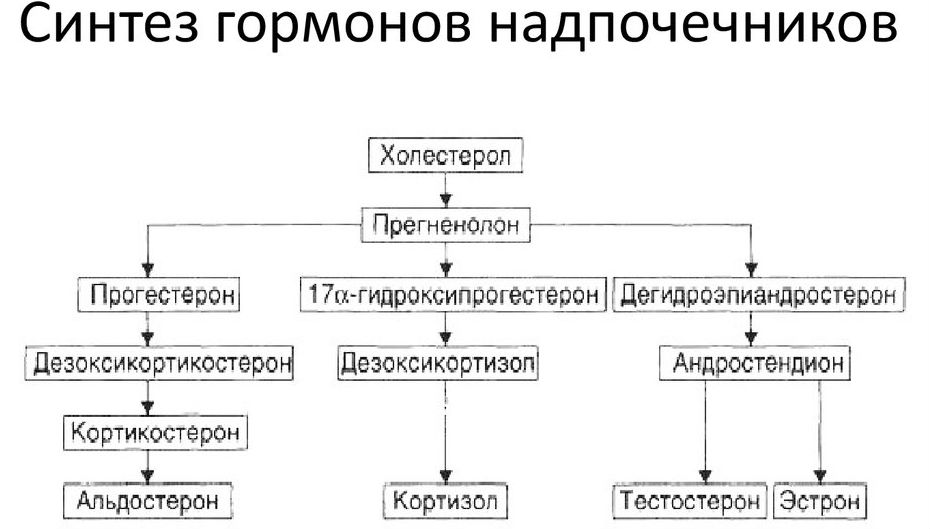
Промежуточный стероид в биосинтезе глюкокортикоидов, андрогенов и эстрогенов. Секретируется корой надпочечников, яичниками и семенниками, циркулирует в крови как в свободном, так и в связанном с белками состоянии.
17-ОН-Прг выработавается в небольших количествах яичниками во время фолликулярной фазы, затем его концентрация возрастает в лютеиновой фазе и остается постоянной в течении этой фазы. Если оплодотворения не происходит, уровень 17-ОН-Прг уменьшается и, наоборот, при имплантации оплодотворенной яйцеклетки желтое тело продолжает секретировать 17-ОН-ПРГ.
Измерение концентрации циркулирующего 17-ОН-Прг – стандартная процедура для клинической оценки дефицита 21β-гидроксилазы, как наиболее распространенной причины врожденной гиперплазии надпочечников. Дефицит 21β-гидроксилазы – наследственное аутосомно-рецессивное заболевание, которое встречается с частотой 1:500 – 1:5000 у новорожденных. Из-за понижения активности 21β-гидроксилазы 17-ОН-Прг не может эффективно превращаться в кортизол и, вместо этого, накапливается в больших количествах и шунтируется в цикл биосинтеза андрогенов. 21β-гидроксилаза требуется также для синтеза альдостерона, и примерно 50% пациентов с дефицитом 21β-гидроксилазы страдают от потенциально смертельной потери солей. Из-за относительно большой частоты встречаемости этого заболевания и его потенциальной тяжести в некоторых географических районах введена программа скрининга крови новорожденных на 17-ОН-Прг. Очевидно, что повышенные уровни 17-ОН-Прг наблюдаются фактически во всех случаях «классического» дефицита 21β-гидроксилазы, 11β-гидроксилазы, и мониторинг уровня 17-ОН-Прг необходим при заместительной стероидной терапии. Кроме того, определение уровня 17-ОН-Прг в ответ на парентеральное введение синтетического АКТГ проводят для подтверждения диагноза «частичного» дефицита 21β-гидроксилазы, как возможной причины женского гирсутизма и бесплодия. Пониженный уровень гормона выявляется у мужчин при болезни Аддисона.
ДЕГИДРОЭПИАНДРОСТЕРОНА-СУЛЬФАТ (DHEA-S)
DHEA-S является невирилизирующим андрогеном, не связанным с половой зрелостью, который синтезируется надпочечниками и относится к группе 17-кетостероидов. DHEA-S образуется из сульфата холестерола. Основное количество DHEA-S катаболизируется организмом и только 10% его выделяется с мочой. Ежесуточно в кровяное русло выделяется 10-20 мг. DHEA-S в среднем 35-70 моль у мужчин и 12-35 моль у женщин.
Секреция DHEA-S не имеет циркадного ритма, для этого стероида нет также специфических стеродсвязывающих сывороточных белков, поэтому концентрация DHEA-S не зависит от изменения содержания этих белков в сыворотке крови. Однако DHEA-S способен связываться с альбумином сыворотки крови человека.
Кроме DHEA-сульфата, в циркулирующей крови присутствует дегидроэпиандростерон (DHEA), который образуется частично в коре надпочечников и в половых железах со скоростью, составляющей 1/4 и 1/2 от скорости секреции DHEA-S у мужчин и женщин соответственно. Поскольку метаболический клиренс DHEA очень быстр, его концентрация в циркулирующей крови приблизительно в 300 раз ниже уровня DHEA-сульфата.
Из-за высокой концентрации DHEA-S в крови, длительного периода полураспада и высокой стабильности, а также того факта, что его источником, в основном являются надпочечники, DHEA-S является отличным индикатором андрогенной секреции.
Повышенный уровень тестостерона у женщин может иметь надпочечниковое или овариальное происхождение. Результаты определения DHEA-S позволяет выявить причину гиперандрогении. Если у женщин повышен уровень тестостерона, то с помощью определения концентрации DHEA-S можно установить связанно ли это с болезнью надпочечников или с заболеванием яичников. Уровни DHEA-S увеличиваются только при заболеваниях надпочечников, например, опухолях, вырабатывающих андрогены, гиперплазии надпочечников, синдроме Кушинга гипоталамо-гипофизарного происхождения с дефицитом 21-гидроксилазы или 11-бета-гидроксилазы.
Низкие уровни гормона характерны для гипофункции надпочечников.
Показания:
- опухоли надпочечников
- дифференциальная диагностика заболеваний яичников
- остеопороз
- задержка полового созревания
- гирсутизм у женщин (при нормальной концентрации DHEA-S гирсутизм не связан с нарушением функции надпочечников)
КАЛЬЦИТОНИН
Кальцитонин первично синтезируется в парафомикулярных С-клетках щитовидной железы как препрогормон с молекулярной массой 17 кДа. После отщепления короткого N-концевого сигнального пептидa кальцитонин находится в секреторных гранулах. Период полураспада гормона — 12 минут. Основная функция кальuитонина — уменьшение концентрации кальция в плазме. Показано, что увеличение уровня внеклеточного кальция стимулирует секрецию кальцитонина. Очевидно, кальцитонин действует, ингибируя активность остеокластов, в результате чего уменьшается мобилизация кальция из кости. Этот эффект более нагляден в условиях, связанных с высоким уровнем ремоделирования кости, например, болезни Педжета, с введением экзогенного кальцитонина.
Интерференция – Повышает концентрацию введение кальция, адреналин, эстрогены, глюкагон, пентагастрин, синкалиц (холецистокинин), пероральные контрацептивы.
Диагностическая информация — Определение кальцитонина имеет исключительное значение для диагностики медуллярного рака щитовидной железы. Обычно повышение в сыворотке крови как базального, так и стимулированного уровня кальцитонина при провокационном тесте с внутривенным введением кальция, служит основным диагностическим критерием медуллярной карциномы щитовидной железы даже при отсутствии данных радиоизотопной диагностики и коррелирует со стадией заболевания и величиной опухоли. Стойкое повышение содержания кальцитонина после удаления опухоли у больных с медуллярным раком щитовидной железы может указывать на нерадикальность операции или на наличие отдаленных метастазов. Быстрый подъем уровня кальцитонина после операции свидетельствует о рецидиве заболевания. Определение кальцитонина применимо в качестве скринингового теста у членов семьи больных этим видом рака (20% случаев этой формы рака имеют семейный характер).
Повышение концентрации наблюдается также при следующих заболеваниях: Медуллярный рак щитовидной железы; гиперплазия С-клеток; некоторые случаи рака легких, грудной железы или поджелудочной железы; синдром Золлингера-Эллисона; пернициозная анемия; хроническая почечная недостаточность; псевдогипопаратироидизм, опухоли клеток системы APUD; карциноидный синдром; алкогольный цирроз; пациенты с панкреатитом и тироидитом.
Повышение может наблюдаться при беременности и доброкачественных заболеваниях легких. Кальцитонин может также вырабатываться многими раковыми опухолями, особенно имеющими нейpо-эндокринную природу.
СОМАТОТРОПНЫЙ ГОРМОН
Соматотропный гормон (СТГ) – мономерный белок с молекулярной массой 21500 D, обладает наибольшей ростовой и анаболической активностью. Исследования показали, что как в гипофизе, так и в плазме крови СТГ может находиться и в обычной форме, и в форме, имеющей большую молекулярную массу, и не являющуюся классическим прогормоном.
СТГ принимает участие в регуляции многих видов обмена веществ, но основное его действие направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием организма. Под влиянием СТГ усиливается синтез белка в костях, хрящах, мышцах, печени и других внутренних органах, увеличиваются общее количество РНК, синтез ДНК и общее число клеток, повышается активность орнитиндекарбоксилазы, которая контролирует синтез провитаминов. Секреция СТГ гипофизом изменяется в зависимости от состояния организма. Поэтому СТГ не только стимулирует, но также координирует обменные процессы в зависимости от меняющихся поребностей организма.
Диагностическое значение. Избыточная секреция СТГ у детей и подростков обычно приводит к развитию гигантизма. В некоторых случаях гиперсекреции СТГ в детском возрасте при открытых зонах роста развивается акромегалия, а не гигантизм, что связано с гиперфункцией гипофиза. повышение концентрации СТГ отмечается также при гиперпитуитаризме, эктопической продукции СТГ (опухоли желудка, легкого), нарушении питания, почечной недостаточности, стрессе, физической нагрузке, длительном голодании.
Снижение содержания соматотропина происходит при гипофизарном нанизме, гипопитуитаризме, гиперкортицизме. Недостаточность секреции СТГ у плода не ведет к задержке роста: длина и масса тела такого плода при рождении не отличается от таковых у здорового новорожденного. Наследственный пангипопитуитаризм часто проявляется не только недостаточностью секреции СТГ, но и нарушением функции одного или нескольких тропных гормонов гипофиза: ГТГ, ТТГ и АКТГ. Первый тип наследственной изолированной недостаточности секреции СТГ встречается чаще и, как правило, сочетается с инсулиновой недостаточностью и продолжительной гипергликемией, наблюдаемой у больных после парентерального введения инсулина. Второй тип изолированной недостаточности секреции СТГ характеризуется повышенным содержанием инсулина в сыворотке крови.
Нередко встречается функциональная недостаточность СТГ (психосоциальный нанизм), когда задерживается рост ребенка при изменении условий жизни (помещение в детский дом, интернат и тд). При возвращении ребенка в домашнюю обстановку восстанавливается секреция СТГ и наблюдается скачок роста.
Неинвазивный анализ беременности — анализы Arbor
17-гидроксипрогестерон (17-HO-P) — стероидный гормон из группы андрогенов, обнаруженный у млекопитающих, рептилий, птиц и других позвоночных. Впервые он был выделен из надпочечников крупного рогатого скота Пфиффнером и Норт в компании Parke, Davis and Company в Детройте, штат Мичиган, в 1940 г. 1 . Надпочечники, яичники, семенники и плацента производят 17-гидроксипрогестерон. 17-HO-P увеличивается в третьем триместре беременности.
Путь биосинтеза стероидов
17-HO-P является эндогенным прогестагеном, а также химическим промежуточным продуктом в биосинтезе других стероидных гормонов, включая кортикостероиды, андрогены и эстрогены. Он образуется из прогестерона через 17-гидроксилазу, фермент P450c17, и из 17-гидроксипрегненолона через 3β-гидроксистероиддегидрогеназу 2 / Δ5-4-изомеразу.Затем он гидроксилируется в положениях 11 и 21 с образованием кортизола.
Дефицит 11- или 21-гидроксилазы приводит к снижению синтеза кортизола, и теряется обратное ингибирование секреции адренокортикотропного гормона (АКТГ). Последующее повышенное выделение АКТГ гипофизом увеличит выработку 17-HO-P. Дефицит либо 17-альфа-гидроксилазы (которая позволяет синтезировать 17-HO-P из прогестерона), либо 3β-гидроксистероиддегидрогеназы типа 2 (которая способствует развитию 17-HO-P из 17-гидроксипрегненолона) может привести к низким уровням 17-HO-P с возможным соответствующим увеличением прогестерона или прегненолона.Нормальный уровень 17-HO-P у детей составляет 3-90 нг / дл. Нормальные уровни у женщин до овуляции составляют 20-100 нг / дл и 100-500 нг / дл во время лютеиновой фазы 2,3 .
Врожденная гиперплазия надпочечников (ВГК) вызывается наследственными дефектами биосинтеза стероидов. Возникающий в результате гормональный дисбаланс, снижение уровня глюкокортикоидов и минералокортикоидов, а также повышенное содержание 17-HO-P и андрогенов могут привести к опасной для жизни солевой недостаточности у новорожденных и изменить развитие первичных и вторичных половых признаков у пораженных младенцев, детей и детей. взрослых, что приводит к неоднозначному гендерному назначению и бесплодию.
Наши наборы 17-гидроксипрогестерона для ИФА с 1 и 5 чашками, K053-h2 и K053-H5, позволяют проводить простое, чувствительное и быстрое определение 17-HO-P в моче, экстрагированной сыворотке, плазме, образцах кала или средства массовой информации. Результаты достигаются за 90 минут при чувствительности до 20 пг / мл. Все реагенты стабильны при 4 ° C и поставляются в жидкой форме.
Типичная стандартная кривая 17-гидроксипрогестерона
- Pfiffner JJ и North, «17-ß-гидроксипрогестерон» 1940, J.Biol.Chem. 132: 459-460.
- Abbassi-Ghanavati M, Greer LG, Cunningham «Беременность и лабораторные исследования: справочная таблица для врачей». 2009 Obstet Gynecol. 114: 1326-1331.
- Кратц А., Ферраро М., Слюсс П.М., Левандровски К.Б., «Исторические справки о еженедельных клинико-патологических упражнениях Массачусетса». Лабораторные эталонные значения ». 2004, N. Engl. J. Med. 351: 1548-1563.
СВЯЗАННЫЕ ТОВАРЫ
Наборы для ИФА прогестерона, K025-H
Наборы EIA для кортизола, K003-H
Наборы для ИФА кортикостерона, K014-H
Наборы CLIA для кортизона, K017-C
Наборы EIA для 17-бета-эстрадиола, K030-H
Наборы Estrone EIA, K031-H
Комплекты PGFM EIA, K022-H
Наборы для определения креатинина в моче, K002-H
Наборы тестостерона EIA, K032-H
17-гидроксипрогестерон — обзор | Темы ScienceDirect
2 Стероиды
Охарактеризовав изменения в паттернах концентраций гормонов гипофиза в плазме во время этих предположительно овуляторных циклов, мы обратились к рассмотрению паттернов вариаций концентраций некоторых гонадных стероидных гормонов в плазме.Результаты, полученные при ежедневном измерении прогестерона в плазме у 10 субъектов с постпиковым интервалом 13 дней или более, усреднялись с использованием дня пика ЛГ в качестве контрольной точки (рис. 12). Начиная с измеримых, хотя и низких значений в фолликулярной фазе, средние концентрации начали расти одновременно с пиком ЛГ, затем постепенно увеличивались до пика на 8-й день и, наконец, постепенно снижались до, но не совсем до концентраций, наблюдаемых в начале фолликулярной фазы. .
РИС.12. Средние (жирная линия) и 95% доверительные интервалы средних (заштрихованная область) дневных концентраций прогестерона в плазме в течение 10 предположительно овуляторных циклов с интервалами 13 дней или более от пика ЛГ до начала менструации. Циклы были синхронизированы в день пика ЛГ.
Концентрации прогестерона в плазме не измерялись в каждом образце из 16 предположительно овуляторных циклов. Для некоторых циклов были доступны только измерения концентраций в пулах, сделанные для образцов в дни с 5 по 9 до и с 5 по 7 после пика ЛГ.Таким образом, чтобы применить общий стандарт для сравнения значений во всех циклах, были рассчитаны средние значения для концентраций на 5, 6, 7, 8 и 9 дни до и на 5, 6 и 7 дни после пиков ЛГ в циклах, где они измерялись ежедневно. В каждом цикле наблюдалось значительное увеличение концентрации прогестерона при сравнении значений до и после пика ЛГ. В 15 из 16 случаев совокупные значения на 5-7 дни превышали 5 нг / мл. В 16-м цикле прогестерон в плазме повышался несколько более постепенно, так что значение 5 нг / мл не было обнаружено до 8-го дня после пика, когда концентрация была 13.3 нг / мл. Таким образом, концентрация прогестерона в плазме выше 5 нг / мл наблюдалась в каждом цикле через 5-8 дней после пика ЛГ.
Хотя концентрации прогестерона в плазме начали медленно расти в день пика ЛГ, среднее повышение уровней прогестерона произошло, когда концентрации ФСГ и ЛГ в плазме падали, причем вершина кривой прогестерона совпадала с надиром лютеина ФСГ. Это временное соотношение продемонстрировало, что увеличение биосинтеза прогестерона не зависело от увеличения секреции гипофизом ФСГ и ЛГ во время лютеиновой фазы, и предполагало возможность того, что снижение лютеиновой фазы как ФСГ, так и ЛГ могло быть результатом увеличения секреции стероидов яичниками.
Ожидалось, что повышение концентрации прогестерона в плазме отразится на повышении базальной температуры тела (M. E. Davis и Fugo, 1948; Israel and Schneller, 1950). Это предположение было подтверждено исследованием фиг. 13, на которой были нанесены средние суточные базальные температуры тела со средними концентрациями прогестерона в плазме. Хотя средняя температура постепенно повышалась, это повышение не было значительным по сравнению с преовуляторными средствами до 4 дней после пика ЛГ. Средняя концентрация прогестерона в плазме в то время была около 2.5 нг / мл, что свидетельствует о том, что концентрации, превышающие это значение, всегда могут приводить к повышению БТ. Средняя базальная температура тела оставалась повышенной по сравнению со средней температурой фолликулярной фазы в течение 9 дней.
РИС. 13. Средняя (жирная линия) дневная базальная температура тела (BBT) и средняя (жирная линия) дневная концентрация прогестерона в плазме в течение 16 предположительно овуляторных циклов, синхронизированных в день пика середины цикла ЛГ. Заштрихованные области представляют собой 95% доверительный интервал средних значений.
Значительное увеличение концентрации прогестерона в плазме после пика ЛГ было еще одним предположительным доказательством наступления овуляции. Повышенная экскреция прегнандиола с мочой, который, как считается, в основном происходит из прогестерона, рассматривается как отличительный признак овуляторного цикла и адекватности функции желтого тела со времен классического исследования Веннинга и Брауна в 1937 году.
В то время как развитие и функция тела luteum обычно связан с овуляцией, определяемой как созревание, за которым следует разрыв фолликула с выдавливанием яйцеклетки, эти два процесса могут быть диссоциированы.Это будет трудно определить, зависит ли оценка наступления овуляции либо от функции желтого тела и секреции прогестерона, либо от характера гонадотропинов. Следовательно, прямой индекс созревания фолликулов был бы полезен с целью изучения процессов отдельно. Паттерны изменения концентраций ФСГ и ЛГ до и включая преовуляторный пик могут быть необходимы для овуляции и согласуются с ней, но не обеспечивают убедительных доказательств, подтверждающих это событие.
Ранее мы сообщали (Strott et al., 1970), что уровень 17-гидроксипрогестерона в плазме, секретируемый яичниками, значительно увеличивается до и одновременно с пиком ЛГ во время предположительно овуляторных циклов. Кроме того, мы предположили, что это увеличение можно рассматривать как меру созревания фолликулов (Strott et al., 1970). Чтобы более полно охарактеризовать характер изменения концентраций 17-гидроксипрогестерона, этот стероид измеряли либо ежедневно в течение цикла, либо в ограниченном количестве отдельных образцов, либо в пулах в соответствующие дни до и после пика ЛГ.Результаты таких исследований у восьми женщин из серии из 16 с предположительно овуляторными циклами показаны на рис. 14. Средние значения начали расти во второй половине фолликулярной фазы, достигли пика, совпадающего с пиком ЛГ, снизились в течение нескольких дней. сразу после пика, и снова поднялся перед резким падением как раз перед началом менструации. Этот образец изменения аналогичен наблюдаемому Фотерби, который измерил прегнантриол в моче, который, как считается, является производным 17-гидроксипрогестерона (Fotherby, 1962).Кривая концентрации 17-гидроксипрогестерона в плазме аналогична кривой для эстрогенов плазмы (Abraham, 1969; Baird and Guevara, 1969; Korenman et al., 1969).
РИС. 14. Среднесуточные концентрации 17-гидроксипрогестерона в плазме (сплошная линия) в течение 8 и средние дневные концентрации прогестерона в плазме (пунктирная линия) в течение 10 предположительно овуляторных циклов, синхронизированных в день пика среднего цикла ЛГ. Область под кривой прогестерона заштрихована для контраста.
На рис.15 показаны кривые средних концентраций 17-гидроксипрогестерона, прогестерона, ФСГ и ЛГ и BBT, все с центром в день пика ЛГ. Подробное изучение этой составной фигуры желательно для того, чтобы можно было оценить совпадающие во времени особенности.
РИС. 15. Среднесуточная базальная температура тела (ВВТ) (верхняя часть), дневная концентрация 17-гидроксипрогестерона и прогестерона в плазме (средняя) и среднесуточная концентрация ЛГ и ФСГ (нижняя) в течение 16 предположительно овуляторных циклов, синхронизированных в день середины цикла ЛГ. пик.
Гормональные изменения во время спонтанных овуляторных циклов, по-видимому, начинались с повышения плазменных концентраций ФСГ и ЛГ в конце лютеиновой фазы, до начала менструации, знаменующей окончание предыдущего менструального цикла. После первоначального повышения, совпадающего с увеличением концентрации 17-гидроксипрогестерона в плазме, уровни ФСГ снизились, в то время как уровни ЛГ продолжали прогрессивно увеличиваться. Средние концентрации 17-гидроксипрогестерона в плазме начали расти до и достигли пика, совпадающего с пиками ЛГ и ФСГ, но затем временно снизились.
Одновременно с пиком ЛГ концентрация прогестерона в плазме начала расти. Это увеличение было связано с началом повышения базальной температуры тела, которая достигла плато перед максимальным повышением концентрации прогестерона в плазме. Временное снижение концентрации 17-гидроксипрогестерона в плазме, происходящее сразу после пика ЛГ, сопровождалось вторичным повышением, которое по существу совпадало с максимальными концентрациями прогестерона в плазме. После пика ЛГ повышенные значения 17-гидроксипрогестерона и прогестерона совпадали с продолжающейся тенденцией к снижению средних значений ФСГ и ЛГ.Надир для средних концентраций ФСГ, по-видимому, соответствовал фастигию средних концентраций прогестерона. Наконец, ранний подъем, по-видимому, начался во время снижения концентраций 17-гидроксипрогестерона и прогестерона ближе к концу лютеиновой фазы.
Таким образом, к характеристикам, описанным для гонадотропинов, мы теперь добавляем функции, описывающие вариации концентраций 17-гидроксипрогестерона и прогестерона в плазме во время предположительно овуляторных циклов.
- 1.
Для 17-гидроксипрогестерона
- a.
Рост концентраций во второй половине фолликулярной фазы, когда концентрации ЛГ увеличиваются, достигая пика, совпадающего с пиком ЛГ, за которым следует
- b.
Резкий спад, за которым, в свою очередь, следует
- c.
Вторичный подъем, совпадающий с максимальным средним уровнем прогестерона, происходящий, несмотря на снижение концентраций ФСГ и ЛГ.
Эти модели вариаций, которые мы описали для концентраций 17-гидроксипрогестерона в плазме, аналогичны другим, описанным для эстрогенов плазмы во время предположительно овуляторных циклов (Abraham, 1969; Baird and Guevara, 1969; Korenman et al. ., 1969).
- 2.
Для прогестерона
- а.
Повышение начинается, совпадая с пиком ЛГ, когда пробы отбираются с 24-часовыми интервалами, и продолжается, несмотря на прогрессирующее снижение средних значений ФСГ и ЛГ в плазме до
- b.
Fasttigium в течение 6-8 дней после пика ЛГ, совпадающего с временем максимального снижения средних концентраций ФСГ, и с продолжающимся снижением средних концентраций ЛГ с последующим
- c.
Постепенное снижение к уровням фолликулярной фазы, когда концентрации ФСГ и ЛГ в плазме начинают расти.
Положение ACOG о 17p гидроксипрогестерона капроате
Вашингтон, округ Колумбия —Кристофер М.Зан, доктор медицины, вице-президент по практической деятельности Американского колледжа акушеров и гинекологов (ACOG), опубликовал следующее заявление относительно результатов рандомизированного двойного слепого плацебо-исследования PROLONG (роль прогестина в оптимизации неонатальной беременности). контролируемое клиническое исследование по оценке 17-гидроксипрогестерона капроата (17p):
«Клиническое руководство ACOG« Прогнозирование и профилактика преждевременных родов »содержит важную информацию для акушеров-гинекологов, ухаживающих за пациентами с риском преждевременных родов, включая факторы риска, методы скрининга и данные о лечебных вмешательствах.Изучив результаты исследования PROLONG, ACOG считает, что его текущие рекомендации останутся в силе.
«При рассмотрении предложения 17p женщинам с риском повторных преждевременных родов следует принимать во внимание совокупность доказательств в отношении приема прогестерона, ценности и предпочтения беременной женщины, доступные ресурсы и условия, в которых будет проводиться вмешательство. Дополнительная информация из запланированного метаанализа и вторичного анализа должна быть оценена, чтобы оценить влияние этого вмешательства на женщин с риском повторных преждевременных родов в Соединенных Штатах.
«ACOG признает, что клиническое испытание PROLONG, оценивающее 17p у пациентов с анамнезом спонтанных одноплодных преждевременных родов в анамнезе, не продемонстрировало статистической разницы в первичных исходах преждевременных родов менее 35 0/7 недель гестации и неонатального композитного индекса. . Точно так же частота преждевременных родов менее 37 и менее 32 недель не различалась. Других различий в перинатальных или материнских исходах обнаружено не было. ACOG также понимает, что авторы предполагают, что исследование было недостаточно мощным для оценки эффективности лечения и что из-за предыдущих рекомендаций по лечению могла иметь место непреднамеренная систематическая ошибка отбора.
«Рекомендации ACOG основаны на обзоре лучшей доступной литературы. Таким образом, мы продолжим следить за этой темой, оценивать дополнительную литературу и любые дальнейшие опубликованные анализы и при необходимости рассматривать результаты в соответствующих клинических руководствах.
«Хорошо известно, что у недоношенных младенцев повышается риск неблагоприятных исходов, включая смерть, и что этот риск уменьшается с увеличением срока беременности. Фактически, преждевременные роды являются основной причиной неонатальной смертности в США.Предотвращение преждевременных родов может повысить шансы детей на здоровую жизнь.
«ACOG по-прежнему привержен обеспечению акушеров-гинекологов и других медицинских работников женского пола научно обоснованными рекомендациями, которые помогут обеспечить здоровье и благополучие женщин и их семей».
Американский колледж акушеров и гинекологов (ACOG) является ведущей в стране группой врачей, оказывающих медицинскую помощь женщинам. Как частная, добровольная, некоммерческая членская организация, насчитывающая более 58000 членов, ACOG решительно выступает за качественное медицинское обслуживание женщин, поддерживает самые высокие стандарты клинической практики и непрерывного образования своих членов, способствует обучению пациентов и повышает осведомленность своих членов и общественность меняющихся проблем, стоящих перед женским здоровьем. www.acog.org
Препараты, принимаемые во время беременности, могут повышать риск рака у взрослых детей матери
Воздействие в утробе матери препарата, используемого для предотвращения выкидыша, спустя десятилетия, по всей видимости, повышает риск рака у потомства, особенно колоректального рака и рака простаты, как выяснили исследователи. Они представят результаты своего нового исследования во вторник на ежегодном собрании эндокринологического общества ENDO 2021.
Некоторые взрослые дети женщин, которые получали препарат гидроксипрогестерона капроат (OHPC или 17-OHPC) во время беременности в 1950-х и 1960-х годах, в настоящее время имеют более чем в два раза больше шансов заболеть раком, сказала ведущий исследователь исследования, Кейтлин Мерфи, доктор философии. .D., M.P.H., доцент Юго-западного медицинского центра Техасского университета в Далласе, штат Техас.
OHPC — синтетический гормон прогестагена, который впервые появился на рынке в середине 1950-х годов (как Делалутин в США) для лечения беременных женщин с рецидивирующим или угрожающим выкидышем. Он по-прежнему доступен в Соединенных Штатах для беременных женщин (под торговым названием Makena) для предотвращения преждевременных родов.
«Существуют убедительные доказательства того, что некоторые синтетические гормоны вызывают нарушение эндокринной системы на раннем этапе развития плода, что может привести к раку у потомства в более позднем возрасте», — сказал Мерфи.
В качестве примера она привела синтетический эстроген диэтилстильбестрол (DES), который принимали некоторые беременные женщины в 1970-х годах, и который годы спустя было обнаружено, что он увеличивает риск некоторых видов рака у взрослых дочерей этих женщин.
«Заболеваемость некоторыми видами рака, такими как рак прямой кишки, увеличивается у взрослых моложе 50 лет, и мы задались вопросом, могут ли эндокринные нарушения в утробе матери — в утробе — частично способствовать этому увеличению», — сказала она.
Мерфи и ее коллеги исследовали влияние воздействия OHPC на риск рака среди взрослых потомков матерей, которые использовали OHPC во время беременности с ними, по сравнению с потомками, матери которых не использовали.Все матери участвовали в исследованиях здоровья и развития детей — группе, которая в период с июня 1959 по июнь 1967 года получала дородовую помощь в рамках плана здравоохранения Kaiser Foundation в Окленде, штат Калифорния. Исследователи использовали Калифорнийский реестр рака для выявления рака, диагностированного у взрослых детей. до 2018 года.
Из более чем 18 751 живорожденного 954 диагноза рака были поставлены детям в возрасте от 18 до 58 лет, как выяснили исследователи. В общей сложности 181 женщина получила OHPC во время беременности.У детей, которых они родили, рак выявлялся во взрослом возрасте более чем в два раза чаще, чем у необлученных потомков. По словам Мерфи, большинство этих видов рака — 65 процентов — встречается у людей моложе 50 лет.
Кроме того, по словам Мерфи, у потомков, подвергшихся воздействию OHPC, частота рака прямой и толстой кишки была почти в пять раз выше, а у потомков, не подвергавшихся воздействию, и почти в четыре раза выше, чем у потомков, не подвергавшихся воздействию. По ее словам, частота рака груди и рака шейки матки также была повышена у подвергшихся воздействию потомства, но не так резко.
«Наши результаты показывают, что многие системы органов чувствительны к эндокринным нарушениям на раннем этапе развития, что может увеличить риск рака спустя десятилетия», — сказал Мерфи. «Осторожность при использовании OHPC и других эндокринно-активных фармацевтических препаратов на ранних сроках беременности является оправданной».
В октябре 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США предложило изъять OHPC с рынка, поскольку постмаркетинговые исследования не подтвердили клинических преимуществ.
О эндокринном обществе
Эндокринологи занимаются решением самых насущных проблем со здоровьем нашего времени, от диабета и ожирения до бесплодия, здоровья костей и гормональных онкологических заболеваний.Эндокринологическое общество — старейшая и крупнейшая в мире организация ученых, занимающихся исследованиями гормонов, и врачей, которые заботятся о людях с гормональными заболеваниями.
Общество насчитывает более 18 000 членов, включая ученых, врачей, преподавателей, медсестер и студентов из 122 стран. Чтобы узнать больше об Обществе и области эндокринологии, посетите наш сайт www.endocrine.org. Следуйте за нами в Twitter на @TheEndoSociety и @EndoMedia.
Влияние однократных и многократных курсов пренатальных кортикостероидов на уровни 17-гидроксипрогестерона: значение для неонатального скрининга врожденной гиперплазии надпочечников
Speiser PW, White PC 2003 Врожденная гиперплазия надпочечников. N Engl J Med 349 : 776–788
CAS Статья Google ученый
Pang S, Hotchkiss J, Drash AL, Levine LS, New MI 1977 Микрофильтрационный бумажный метод для радиоиммуноанализа 17 альфа-гидроксипрогестерона: его применение для быстрого скрининга врожденной гиперплазии надпочечников. J Clin Endocrinol Metab 45 : 1003–1008
CAS Статья Google ученый
Pang SY, Wallace MA, Hofman L, Thuline HC, Dorche C, Lyon IC, Dobbins RH, Kling S, Fujieda K, Suwa S. 1988 Мировой опыт скрининга новорожденных на классическую врожденную гиперплазию надпочечников, вызванную 21-гидроксилазой дефицит. Педиатрия 81 : 866–874
CAS PubMed Google ученый
Pang S, Shook MK 1997 Текущее состояние неонатального скрининга на врожденную гиперплазию надпочечников. Curr Opin Pediatr 9 : 419–423
CAS Статья Google ученый
Cartigny-Maciejewski M, Guilley N, Vanderbecken S, Gonde S, Stuckens C, Ponte C, Weill J, Farriaux JP, Paux E 1999 [Неонатальный скрининг врожденной гиперплазии надпочечников из-за дефицита 21-гидроксилазы: опыт Lille 1980–1996]. Arch Pediatr 6 : 151–158
CAS Статья Google ученый
Döerr HG, Sippell WG, Versmold HT, Bidlingmaier F, Knorr D 1988 Минералокортикоиды, глюкокортикоиды и прогестины в плазме у недоношенных детей: продольное исследование в течение первой недели жизни. Pediatr Res 23 : 525–529
Артикул Google ученый
Аллен Д.Б., Фаррелл П.М. 1996 Скрининг новорожденных: принципы и практика. Adv Pediatr 43 : 231–270
CAS PubMed Google ученый
al Saedi S, Dean H, Dent W, Stockl E, Cronin C 1996 Скрининг на врожденную гиперплазию надпочечников: скрининговый тест Delfia завышает уровень 17-гидроксипрогестерона в сыворотке недоношенных детей. Педиатрия 97 : 100–102
CAS PubMed Google ученый
Lee MM, Rajagopalan L, Berg GJ, Moshang T. Jr 1989 Концентрации надпочечников в сыворотке крови у недоношенных детей. J Clin Endocrinol Metab 69 : 1133–1136
CAS Статья Google ученый
Nordenstrom A, Wedell A, Hagenfeldt L, Marcus C, Larsson A 2001 Неонатальный скрининг на врожденную гиперплазию надпочечников: уровни 17-гидроксипрогестерона и генотипы CYP21 у недоношенных детей. Педиатрия 108 : E68
CAS Статья Google ученый
Линдер Н., Давидович Н., Коган А., Барзилай А., Куинт Дж., Мазкерет Р., Сак Дж. 1999 Продольные измерения 17альфа-гидроксипрогестерона у недоношенных детей в течение первых трех месяцев жизни. Arch Dis Child Fetal Neonatal Ed 81 : F175 – F178
CAS Статья Google ученый
Pass KA, Lane PA, Fernhof PM, Hinton CF, Panny SR, Park JS, Pelias MZ, Rhead WJ, Ross SI, Wethers DL, Elsas LJ 2nd, for CORN. Руководство по системе скрининга новорожденных США, 2000 г. II: наблюдение за детьми, диагностика, ведение и оценка заявления Совета региональных сетей генетических служб (CORN). J Педиатр 137 : S1 – S46
CAS Статья Google ученый
Liggins GC, Howie RN 1972 Контролируемое испытание дородового лечения глюкокортикоидами для профилактики респираторного дистресс-синдрома у недоношенных детей. Педиатрия 50 : 515–525
CAS Google ученый
1994 Влияние кортикостероидов на созревание плода на перинатальные исходы. Заявление о согласии NIH 12 : 1–24
2001 Антенатальные кортикостероиды: повторный курс: повторные курсы — Заявление конференции по развитию консенсуса Национального института здравоохранения, 17–18 августа 2000 г. Obstet Gynecol 98 : 144 –150
Вальфиш А., Халлак М., Мазор М. 2001 Несколько курсов дородовых стероидов: риски и преимущества. Obstet Gynecol 98 : 491–497
CAS PubMed Google ученый
Wijnberger LD, Mostert JM, van Dam KI, Mol BW, Brouwers H, Visser GH 2002 Сравнение однократной и многократной антенатальной кортикостероидной терапии для предотвращения неонатальной смерти и заболеваемости недоношенных детей. Early Hum Dev 67 : 29–36
CAS Статья Google ученый
Дэвид М., Форест М.Г. 1984 Пренатальное лечение врожденной гиперплазии надпочечников, возникшей в результате дефицита 21-гидроксилазы. J Педиатр 105 : 799–803
CAS Статья Google ученый
Панг С.Ю., Поллак М.С., Маршалл Р.Н., Иммкен Л. 1990 Пренатальное лечение врожденной гиперплазии надпочечников из-за дефицита 21-гидроксилазы. N Engl J Med 322 : 111–115
CAS Статья Google ученый
Forest MG, Morel Y, David M 1998 Пренатальное лечение врожденной гиперплазии надпочечников. Trends Endocrinol Metab 9 : 284–289
CAS Статья Google ученый
New MI, Carlson A, Obeid J, Marshall I, Cabrera MS, Goseco A, Lin-Su K, Putnam AS, Wei JQ, Wilson RC 2001 Пренатальная диагностика врожденной гиперплазии надпочечников при 532 беременностях. J Clin Endocrinol Metab 86 : 5651–5657
CAS Статья Google ученый
Совместная рабочая группа LWPES / ESPE CAH. Согласованное заявление 2002 года о дефиците 21-гидроксилазы от Общества педиатрической эндокринологии им. Лоусона Уилкинса и Европейского общества детской эндокринологии. J Clin Endocrinol Metab 87 : 4048–4053
Лерой Б., Лефорт Ф. 1971 [Вес и размер новорожденных при рождении]. Ред. Fr Gynecol Obstet 66 : 391–396
CAS PubMed Google ученый
King JL, Naber JM, Hopkin RJ, Repaske DR, Bailey L, Leslie ND 2001 Антенатальные кортикостероиды и скрининг новорожденных на врожденную гиперплазию надпочечников. Arch Pediatr Adolesc Med 155 : 1038–1042
CAS Статья Google ученый
Баллард П.Л., Глюкман П.Д., Лиггинс Г.К., Каплан С.Л., Грумбах М.М. 1980 Уровни стероидов и гормона роста у недоношенных детей после пренатальной терапии бетаметазоном для предотвращения респираторного дистресс-синдрома. Pediatr Res 14 : 122–127
CAS Статья Google ученый
Кари М.А., Райвио К.О., Стенман У.Х., Воутилайнен Р. 1996 Сывороточный кортизол, дегидроэпиандростерон сульфат и стероидсвязывающие глобулины у недоношенных новорожденных: влияние гестационного возраста и терапии дексаметазоном. Pediatr Res 40 : 319–324
CAS Статья Google ученый
Nomura S 1997 Стероидогенез незрелых надпочечников у недоношенных детей. Early Hum Dev 49 : 225–233
CAS Статья Google ученый
Мерфи Дж. Ф., Джойс Б. Г., Дайас Дж, Хьюз И. А. 1983 Концентрации 17-гидроксипрогестерона в плазме у больных новорожденных. Arch Dis Child 58 : 532–534
CAS Статья Google ученый
Larsson A, Hagenfeldt L, von Dobeln U, Curstedt T., Gustafsson J, Svensson E 1988 Неонатальный скрининг на врожденную гиперплазию надпочечников с использованием анализа 17-гидроксипрогестерона в пятнах крови на фильтровальной бумаге. Horm Res 30 : 235–240
CAS Статья Google ученый
Симозава К., Мацумото М., Окада К., Мурата М., Цучия Ю., Китагава Т. 1988 Анализ концентрации альфа-гидроксипрогестерона 17 в пятнах крови у новорожденных. Horm Res 30 : 246–251
CAS Статья Google ученый
Knudtzon J, Markestad T, Aakvaag A, Bergsjo P 1991 Повышенный уровень 17-гидроксипрогестерона у недоношенных детей. Acta Paediatr Scand 80 : 96–97
CAS Статья Google ученый
Lange-Kubini K, Zachmann M, Kempken B, Torresani T 1996 15 Бета-гидроксилированные стероиды могут вводить в заблуждение с диагностической точки зрения при подтверждении врожденной гиперплазии надпочечников, подозреваемой в программе скрининга новорожденных. Eur J Pediatr 155 : 928–931
CAS Статья Google ученый
Bolt RJ, van Weissenbruch MM, Popp-Snijders C, Sweep CG, Lafeber HN, Delemarre-van de Waal HA 2002 Рост плода и функция коры надпочечников у недоношенных детей. J Clin Endocrinol Metab 87 : 1194–1199
CAS Статья Google ученый
Allen DB, Hoffman GL, Fitzpatrick P, Laessig R, Maby S, Slyper A 1997 Повышение точности скрининга новорожденных на врожденную гиперплазию надпочечников с использованием критериев с поправкой на вес для уровней 17-гидроксипрогестерона. J Педиатр 130 : 128–133
CAS Статья Google ученый
Террелл Б.Л., Беренбаум С.А., Мантер-Капанке В., Симманк Дж., Корман К., Прентис Л., Гонсалес Дж., Ганн С. 1998 Результаты проверки 1.9 миллионов новорожденных из Техаса с врожденной гиперплазией надпочечников с дефицитом 21-гидроксилазы. Педиатрия 101 : 583–590
Статья Google ученый
Окубо С., Шимозава К., Мацумото М., Китагава Т. 1992 Анализ концентрации 17 альфа-гидроксипрогестерона в пятнах крови у недоношенных детей — предложение по пороговым значениям при скрининге на врожденную гиперплазию надпочечников. Acta Paediatr Jpn 34 : 126–133
CAS Статья Google ученый
Gudmundsson K, Majzoub JA, Bradwin G, Mandel S, Rifai N 1999 Вирилизирующий дефицит 21-гидроксилазы: время скрининга новорожденных и подтверждающих тестов могут иметь решающее значение. J Pediatr Endocrinol Metab 12 : 895–901
CAS Статья Google ученый
Гидроксипрогестерон (путь введения) Описание и торговые марки
Описание и торговые марки
Информация о лекарствах предоставлена: IBM Micromedex
Описание
Инъекции гидроксипрогестерона капроата — это искусственный гормон прогестина. Он используется беременными женщинами, чтобы снизить риск преждевременных родов (преждевременные роды или роды на сроке менее 37 недель беременности).Это лекарство назначают только беременным женщинам, которые беременны одним ребенком и у которых в прошлом были преждевременные роды.
Это лекарство может вводить только ваш врач или под его непосредственным наблюдением.
Получите самую свежую информацию о здоровье от экспертов клиники Мэйо.
Зарегистрируйтесь бесплатно и будьте в курсе научных достижений, советов по здоровью и актуальных тем, касающихся здоровья, таких как COVID-19, а также опыта в области управления здоровьем.
Узнайте больше об использовании данных Mayo Clinic.Чтобы предоставить вам наиболее актуальную и полезную информацию и понять, какие информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с другая имеющаяся у нас информация о вас.Если вы пациент клиники Мэйо, это может включать защищенную медицинскую информацию. Если мы объединим эту информацию с вашими защищенными информация о здоровье, мы будем рассматривать всю эту информацию как защищенную информацию и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о политика конфиденциальности. Вы можете отказаться от рассылки по электронной почте в любое время, нажав на ссылку для отказа от подписки в электронном письме.
Подписывайся!
Спасибо за подписку
Наш электронный информационный бюллетень Housecall будет держать вас в курсе самой последней информации о здоровье.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить
Последнее обновление частей этого документа: фев.01, 2021
Авторские права © IBM Watson Health, 2021 г. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях.
.
Препарат для снижения преждевременных родов, связанных с повышенным риском рака у потомства
Сильвер Спринг, Мэриленд — В октябре Центр оценки и исследований лекарственных средств (CDER) FDA предложил изъять для инъекций гидроксипрогестерона капроата, продаваемый как Makena, из продажи , поскольку необходимое постмаркетинговое исследование не подтвердило клиническую пользу.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США пришло к выводу, что имеющиеся доказательства не подтверждают эффективность Makena при разрешенном использовании. Теперь новое исследование ставит под сомнение, идут ли проблемы дальше этого, обнаруживая связь между использованием гидроксипрогестерона капроата для снижения риска преждевременных родов (т.е. родов до 37 недель) у женщин, у которых ранее были спонтанные преждевременные роды, и повышенным риском рака у потомства.
В рамках ускоренного утверждения препарата в 2011 году производитель был обязан провести клинические испытания, чтобы продемонстрировать клиническую пользу новорожденным.«Препарат, предотвращающий преждевременные роды, полезен, если он в конечном итоге улучшает здоровье младенцев», — отмечает FDA. «Требуемое подтверждающее исследование не показало, что Makena эффективна для улучшения здоровья детей, рожденных женщинами с необъяснимыми преждевременными родами в анамнезе. Мы также определили, что имеющиеся данные не показывают, что Makena снижает риск преждевременных родов ».
Исследователи из Центра медицинских наук Техасского университета в Хьюстоне внимательно изучили 17-гидроксипрогестерона капроат (17-OHPC), синтетический прогестоген, который часто использовался женщинами в 1950-х и 1960-х годах и до сих пор прописывается женщинам для помощи. предотвратить преждевременные роды. Исследование , опубликованное в Американском журнале акушерства и гинекологии , сообщает, что прогестерон способствует росту матки во время беременности и предотвращает ранние схватки, которые могут привести к выкидышу у женщины.
«У детей, родившихся от женщин, которые принимали препарат во время беременности, заболеваемость раком в два раза выше по сравнению с детьми, рожденными женщинами, которые не принимали этот препарат», — пояснила Кейтлин С. Мерфи, доктор философии, магистр здравоохранения, ведущий автор. исследования и доцент кафедры укрепления здоровья и поведенческих наук в Школе общественного здравоохранения UTHealth в Хьюстоне.«Мы видели такие виды рака, как колоректальный рак, рак поджелудочной железы, рак щитовидной железы и многие другие, у людей, родившихся в 1960-х годах и позже, и никто точно не знает почему».
Чтобы прийти к такому выводу, исследователи проанализировали данные Плана здравоохранения Kaiser Foundation о женщинах, получавших дородовую помощь в период с июня 1959 по июнь 1967 года, и Калифорнийского онкологического реестра, который отслеживал рак у потомства до 2019 года.
С более чем 18 751 живорождений, исследование выявило 1008 диагнозов рака у детей в возрасте от 0 до 58 лет.Из них 234 потомства подверглись воздействию 17-OHPC во время беременности, по словам авторов, которые рассказали: «У потомков, подвергшихся воздействию в утробе матери, рак выявлялся во взрослом возрасте более чем в два раза чаще, чем у детей, не подвергавшихся воздействию этого препарата — 65% случаев рака. произошел у взрослых моложе 50 лет ».
«Наши результаты показывают, что прием этого препарата во время беременности может нарушить раннее развитие, что может увеличить риск рака спустя десятилетия», — добавил доктор Мерфи. «С этим лекарством мы наблюдаем эффекты синтетического гормона.То, что произошло с нами в утробе матери, или воздействие в утробе матери, является важным фактором риска развития рака через много десятилетий после нашего рождения ».
Исследователи сообщили, что воздействие в первом триместре было связано с повышенным риском любого рака (скорректированное отношение рисков [aHR] 2,57, 95% ДИ 1,59, 4,15), и риск увеличивался с количеством инъекций (1-2 инъекции: aHR 1,80, 95% ДИ 1,12,2,90; ≥3 инъекций: aHR 3,07, 95% ДИ 1,34, 7,05). «Воздействие во втором или третьем триместре представляло дополнительный риск для мужчин (aHR 2.59, 95% ДИ 1,07, 6,28), но не потомство женского пола (aHR 0,30, 0,04, 1,11) », — отметили они.
Следующие виды рака были выше у потомков, впервые подвергшихся воздействию 17-OHPC в первом триместре, по сравнению с потомством, которое не подвергалось воздействию:
• Колоректальный рак (aHR 5,51, 95% ДИ 1,73, 17,59)
• Рак простаты (aHR 5,10 , 95% ДИ 1,24, 21,00)
• Рак головного мозга у детей (aHR 34,72, 95% ДИ 7,29, 164,33)
«Осторожность при использовании 17-OHPC на ранних сроках беременности является оправданной, учитывая возможную связь с раком у потомства», — говорят авторы.


 Беременность не наступает, потому что недостаточно вырабатывается гормон желтого тела – прогестерон. В этом случае необходимо исследовать пролактин в середине менструального цикла.
Беременность не наступает, потому что недостаточно вырабатывается гормон желтого тела – прогестерон. В этом случае необходимо исследовать пролактин в середине менструального цикла.