Фолликулометрия в Москве | Центр медицины плода на Чистых Прудах
Фолликулометрия — это наблюдение в динамике за изменениями в органах женской репродуктивной системы в течение всего менструального цикла.
Диагностика (фолликулометрия) позволяет определить:
- Был данный цикл овуляторным или нет
- В какой день ментсруального цикла овуляция имела место
Также проводится наблюдение за созреванием и ростом эндометрия, то есть функциональной слизистой оболочки матки.
Данное исследование представляет собой ультразвуковой мониторинг, позволяющим следить за развитием и созреванием фолликула с начала и до завершения менструального цикла. На сегодняшний день подобное исследование считается одним из самых точных методов, позволяющих определить дни овуляции и, соответственно, время возможного оплодотворения яйцеклетки.
Первым днем менструального цикла принято считать первый день начала менструации.
Для чего проводится фолликулометрия?
Фолликулометрия дает возможность определить наличия овуляции, а также ее точные сроки. Это крайне важно для женщин, у которых нерегулярный менструальный цикл, и для диагностики ранней и поздней овуляции
Это крайне важно для женщин, у которых нерегулярный менструальный цикл, и для диагностики ранней и поздней овуляции
Кроме того, данное исследование используется для выяснения причины нарушения нормального функционирования репродуктивной системы и сбоя менструального цикла, а так же как влияют лекарственные гормональные средства на работу яичников.
Кроме того, данное исследование используется для выяснения причины нарушения нормального функционирования репродуктивной системы и сбоя менструального цикла, а так же как влияют лекарственные гормональные средства на работу яичников.
УЗИ-мониторинг фолликулов
Мониторинг фолликулогенеза
— это, как минимум трехкратное выполнение УЗИ в определенные дни менструальног цикла.
Мониторинг фолликулов: когда делать?
Женский менструальный цикл длится
в среднем 28-30 дней.
Первое УЗИ фолликулогенеза, если у женщины нормальный регулярный цикл,
рекомендовано проводить на 5-11 день.
Самыми оптимальными для исследования днями являются 5 — 8 день менструального
цикла.
Когда цикл нерегулярный, первый мониторинг фолликулогенеза обычно начинают через
3-5 дней по окончании менструации.
При этом проводится также исследование и фолликулов, и эндометрия, чтобы более
точно определить, какие факторы провоцируют нарушение фолликулогенеза.
Мониторинг помогает поставить правильный диагноз и в дальнейшем назначить
действенное лечение.
Количество УЗИ при нерегулярном менструальном цикле для каждой пациентки
индивидуально.
В редких случаях доминантных фолликулов может быть два или больше.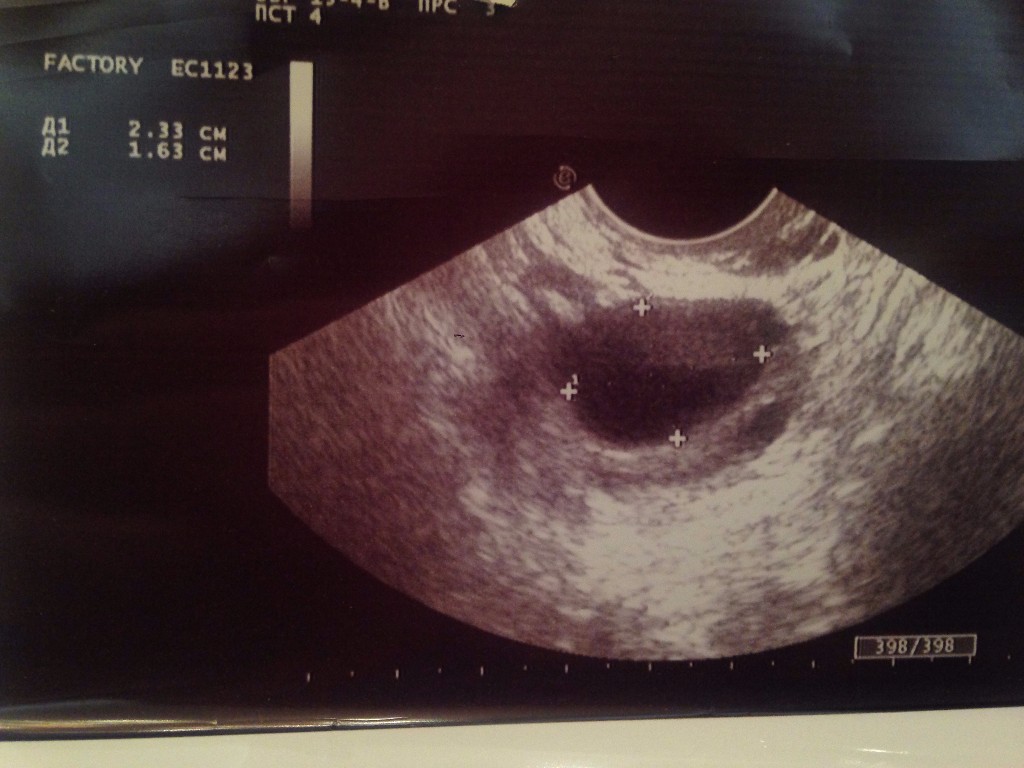 С каждым
С каждым
днем фолликул увеличивается в размерах, в день овуляции он может достигать 18-25 мм
в диаметре. При ультразвуковом исследовании обращается внимание не только на
фолликулогенез, но и на эндометрий.
Когда происходит овуляция, толщина эндометрия, имеющего трехслойную структуру,
достигает 10-12 мм. Затем в организме выделяется лютеинизирующий гормон,
способствующий овуляции. При этом незначительное количество фолликулярной
жидкости изливается в брюшную полость.
Во время УЗИ фолликулогенеза на то, что овуляция произошла, указывают следующие
признаки:
• наличие зрелого фолликула накануне овуляции;
• исчезновение или постепенное уменьшение доминантного фолликула, разрушение
его стенок;
• после нормальной овуляции в дугласовом пространстве брюшной полости
появляется свободная жидкость;

Нужно отметить, что иногда даже визуализация зрелого фолликула и наличие вместо
него желтого тела спустя неделю не дает стопроцентной гарантии, что овуляция прошла
полноценно. Так же, как и единичное УЗИ фолликулогенеза, на котором не было видно
доминантного фолликула либо желтого тела. Каждый из подобных случаев требует
более тщательных и регулярных наблюдений.
Виды нарушений фолликулогенеза
К сожалению, часто фолликулогенез проходит неправильно, что сказывается на
здоровье женщины и на способности зачать ребенка.
УЗИ фолликулогенеза может дать следующую информацию, подтверждающую
нарушение фолликулогенеза:
• регрессия (атрезия) фолликула. Доминантный фолликул визуализировался,
развивался, а затем резко остановился в развитии и начал уменьшаться, в результате
чего овуляция не произошла;
• персистенция фолликула — нарушение фолликулогенеза, для которого характерным
является отсутствие разрыва фолликула и, соответственно, выхода яйцеклетки.
такой патологии фолликул может существовать на протяжении всего цикла, а также
после менструации;
• фолликулярная киста. Доминантный фолликул дорастает до нужных размеров, но
его разрыв не происходит. Впоследствии в нем накапливается фолликулярная жидкость
и образуется киста;
• лютеинизация фолликула. Это нарушение фолликулогенеза, при котором желтое
тело образовывается на фоне отсутствия разрыва фолликула. Причиной может быть
преждевременное повышение гормонов, влияющих на овуляцию, или патология
структуры яичников;
• отсутствие развития фолликулов — случай, когда отсутствует развитие доминантного
фолликула, из-за чего овуляция невозможна.
Что покажет мониторинг фолликулов?
Ультразвуковой мониторинг — наблюдения
с помощью УЗИ за тем, как происходят
изменения в матке и яичниках на
протяжении менструального цикла.
На 8-10 день регулярного менструального
цикла на экране аппарата УЗИ виден один
доминантный фолликул, достигший в
диаметре 12-15 мм на фоне остальных,
значительно меньших фолликулов.
УЗИ органов малого таза у женщин — Здоровье нации
УЗИ внутренних женских органов- это метод, с помощью которого возможно диагностировать патологию органов, входящих в состав женской репродуктивной системы. Диагностическая ценность этого метода очень высока, чему существенно способствовало внедрение трансвагинального УЗИ.
Показания:
-подозрения на новообразования органов малого таза
-нарушения менструального цикла
-воспалительные процессы (параметрит, эндометрит, вульвагинит, сальпингоофарит и т. п)
п)
-беременность, скрининговый контроль беременности
-контроль расположения ВМС (спирали) в матке
Как проходит исследование:
УЗИ женских органов возможна через переднюю брюшную стенку- трансабдоминальным датчиком и через влагалище- трансвагинальным датчиком.
Для УЗИ через брюшную стенку трансабдоминальным датчиком, пациентка должна быть с наполненным мочевым пузырем. Необходимо освободить нижнюю часть живота, лечь на спину. На датчик наносится гель, после чего изображение выводится на монитор.
При выполнении ультразвукового исследования вагинальным датчиком, женщину просят опорожнить мочевой пузырь, снять нижнее белье, обеспечивая доступ к наружным половым органам. На датчик надевается презерватив и вводится во влагалище.
Что визуализирует УЗИ в гинекологии?
С помощью УЗИ можно видеть состояние матки, толщину её стенки, наличие диффузных или локальных утолщений, или наоборот истончения стенки; определяются возможные индивидуальные особенности строения матки или отклонения развития (например, маленькие размеры матки). Также важно, что показывает УЗИ и состояние придатков матки. Яичники оцениваются по наличию в них созревающих фолликулов, их размерам, соответствию менструальному циклу, по возможному наличию кист, по появлению жёлтого тела после выхода фолликула. Так же ультразвуковая диагностика позволяет выяснить вопрос о наличии или отсутствии внематочной беременности.
Также важно, что показывает УЗИ и состояние придатков матки. Яичники оцениваются по наличию в них созревающих фолликулов, их размерам, соответствию менструальному циклу, по возможному наличию кист, по появлению жёлтого тела после выхода фолликула. Так же ультразвуковая диагностика позволяет выяснить вопрос о наличии или отсутствии внематочной беременности.
Фолликулометрия
На вопрос, когда лучше делать УЗИ органов малого таза, ответ неоднозначен. Так как гинекологическое УЗИ предназначено в основном для определения состояния репродуктивной функции женщины, необходимо его проводить согласованно с менструальным циклом для того, чтобы оценить, на какой день цикла происходят те или иные изменения и сравнить их с нормами. Такое исследование называется фолликулометрией. Проходят ультразвуковое исследование в фолликулиновую половину овариального цикла в фазу пролиферации эндометрия, спустя примерно неделю после начала менструации. В это время в одном из яичников уже появляется доминантный фолликул, и он отличается от других по размерам, что и фиксируется датчиком УЗИ аппарата. Размеры доминантного фолликула учитываются: он не должен превышать 9 мм в это время. Спустя трое-четверо суток снова проводится ультразвуковое исследование. Фолликул в это время достигает уже около 15 мм в диаметре.
Размеры доминантного фолликула учитываются: он не должен превышать 9 мм в это время. Спустя трое-четверо суток снова проводится ультразвуковое исследование. Фолликул в это время достигает уже около 15 мм в диаметре.
Также фолликулометрия проводится спустя 2 недели после начала менструации (12 – 16 дней) для оценки состояния фолликула, а также определить готовность эндометрия к имплантации зиготы. Фолликул должен достигать к концу фолликулиновой фазы овариального цикла размеров около 20 – 24 мм, а эндометрий должен иметь размеры около 9 – 12 мм, его структура должна быть слоистой на УЗИ (три слоя). После этого ультразвуковая фолликулометрия проводится каждые сутки, пока не наступит овуляция. При овуляции обнаруживают разорвавшийся фолликул, полость, свободная жидкость.
Спустя три недели после начала менструального цикла оценивается состояние жёлтого тела, его развитие соответственно течению цикла. Оно имеет неровные очертания и располагается на месте бывшего доминантного фолликула. Также на УЗИ оценивается состояние эндометрия: его толщина (12 – 13 мм), отсутствие слоистости.
Также на УЗИ оценивается состояние эндометрия: его толщина (12 – 13 мм), отсутствие слоистости.
Что может показать УЗИ ?
-миому матки
-патологию маточных труб
-кисты яичников
— объемные образования малого таза
-патологию полости матки
-патологию шейки матки
Когда следует проходить УЗИ?
УЗИ внутренних женских органов необходимо делать не реже одного раза в год, а в случае наличия различной патологии значительно чаще. Так как назначают УЗИ такого рода, в основном, для диагностики воспалительных и опухолевых заболеваний, то его рекомендуется согласовывать с менструальным циклом для того, чтобы изменения матки и её придатков не наслаивались на патологические изменения или наоборот их не имитировали. В большинстве случаев, женский цикл в первую половину лучше подходит для оценки состояния матки и яичников: слизистая оболочка матки (эндометрий) ещё не гипертрофирован, в яичнике развивается фолликул. Поэтому миомы, полипы, эндометрит легче диагностировать правильно, когда на них не наслаивается слизистая оболочка. Кроме того, фолликул яичника не разорван, нет свободной жидкости, которые можно ошибочно принять за патологический процесс.
Поэтому миомы, полипы, эндометрит легче диагностировать правильно, когда на них не наслаивается слизистая оболочка. Кроме того, фолликул яичника не разорван, нет свободной жидкости, которые можно ошибочно принять за патологический процесс.
СЛЕДУЕТ ПОМНИТЬ, что после прекращения менструаций (у женщин в менопаузе) УЗИ ОМТ следует выполнять ежегодно. Следование этой простой рекомендации позволяет вовремя выявить предопухолевые заболевания матки и придатков и провести их эффективное лечение.
УЗИ органов малого таза – важный диагностический метод, который позволяет выявлять на ранних этапах заболевания женской половой системы, что важно для сохранения как репродуктивной функции, так и здоровья в целом.
В Медицинском центре «Здоровье нации» вы также можете сделать следующие виды УЗИ:
УЗИ щитовидной железы
УЗИ сосудов головного мозга
УЗИ почек и мочевого пузыря
УЗИ органов брюшной полости
УЗИ вен и артерий конечностей
УЗИ сердца
УЗИ молочных желез
ВОЗМОЖНОСТИ ТРАНСВАГИНАЛЬНОЙ УЛЬТРАСОНОГРАФИИ В ДИАГНОСТИКЕ БЕСПЛОДИЯ
Целью работы было изучение эхографических признаков первичного или вторичного бесплодия у женщин в двумерном, цветном, энергетическом и импульсноволновом режимах при использовании трансвагинального доступа. Материалы и методы. Трансвагинальная эхография (ТВЭ) проведена 54 женщинам в возрасте от 23 до 38 лет (в среднем 26±3 года) с первичным и вторичным бесплодием. Критерием бесплодия считалось: невозможность зачатия в течение 12 месяцев при регулярной половой жизни без применения методов контрацепции. УЗИ поводилось трехкратно в 6-8-й, 12-14-й 18-21-й день менструального цикла. В двумерном режиме оценивались размеры матки и яичников, количество и размеры зреющего фолликула, толщину эндометрия, степень васкуляризации доминантного фолликула, желтого тела, периэндометриальной зоны, индекс резистентности (ИР) кровотока. Результаты и обсуждение. У 3 больных с классической формой склерополикистоза яичников (СПЯ) при ТВЭ четко визуализировалась гиперэхогенная белочная оболочка толщиной 2-3 мм, множественные (более 15) атрезированные фолликулы, размерами 3-8 мм, располагающиеся по периферии стромы увеличенных яичников. В 2 случаях отмечался генерализованный (ИР был больше 0,7), в одном случае – периферический кистозный тип поликистоза яичников.
Материалы и методы. Трансвагинальная эхография (ТВЭ) проведена 54 женщинам в возрасте от 23 до 38 лет (в среднем 26±3 года) с первичным и вторичным бесплодием. Критерием бесплодия считалось: невозможность зачатия в течение 12 месяцев при регулярной половой жизни без применения методов контрацепции. УЗИ поводилось трехкратно в 6-8-й, 12-14-й 18-21-й день менструального цикла. В двумерном режиме оценивались размеры матки и яичников, количество и размеры зреющего фолликула, толщину эндометрия, степень васкуляризации доминантного фолликула, желтого тела, периэндометриальной зоны, индекс резистентности (ИР) кровотока. Результаты и обсуждение. У 3 больных с классической формой склерополикистоза яичников (СПЯ) при ТВЭ четко визуализировалась гиперэхогенная белочная оболочка толщиной 2-3 мм, множественные (более 15) атрезированные фолликулы, размерами 3-8 мм, располагающиеся по периферии стромы увеличенных яичников. В 2 случаях отмечался генерализованный (ИР был больше 0,7), в одном случае – периферический кистозный тип поликистоза яичников. Среди пациенток с синдромом мультифолликулярных яичников при ТВЭ капсула яичников визуализировалась в виде тонкой гиперэхогенной структуры, фолликулы имели более тонкую стенку. Уже при первом исследовании отмечалась разнокалибрность фолликулов размерами от 4 до 9 мм. Доминантный фолликул определялся в 6 случаев из 7, признаки ожидаемой овуляции в виде яйценосного бугорка и локального удвоения стенки регистрировались только у 2, однако, при цветном допплеровском картировании (ЦДК) определялась слабая васкуляризация стенки этих фолликулов, ИР составлял 0,56 и 0,58 (у здоровых женщин ИР колебался от 0,47 до 0,51).
У пациенток с синдромом лютеинизации неовулировавшего фолликула (ЛНФ) отмечались циклические изменения в виде образования доминантного фолликула, яйценосного бугорка или локального удвоения стенки. В 12 случаях отмечалось небольшое усиление васкуляризации стенки этого фолликула. У 6 пациенток васкуляризация паренхимы и фолликула практически не изменялась. В период ожидаемой овуляции и после нее диаметр преовуляторного фолликула не менялся, при некоторой деформации его контура.
Среди пациенток с синдромом мультифолликулярных яичников при ТВЭ капсула яичников визуализировалась в виде тонкой гиперэхогенной структуры, фолликулы имели более тонкую стенку. Уже при первом исследовании отмечалась разнокалибрность фолликулов размерами от 4 до 9 мм. Доминантный фолликул определялся в 6 случаев из 7, признаки ожидаемой овуляции в виде яйценосного бугорка и локального удвоения стенки регистрировались только у 2, однако, при цветном допплеровском картировании (ЦДК) определялась слабая васкуляризация стенки этих фолликулов, ИР составлял 0,56 и 0,58 (у здоровых женщин ИР колебался от 0,47 до 0,51).
У пациенток с синдромом лютеинизации неовулировавшего фолликула (ЛНФ) отмечались циклические изменения в виде образования доминантного фолликула, яйценосного бугорка или локального удвоения стенки. В 12 случаях отмечалось небольшое усиление васкуляризации стенки этого фолликула. У 6 пациенток васкуляризация паренхимы и фолликула практически не изменялась. В период ожидаемой овуляции и после нее диаметр преовуляторного фолликула не менялся, при некоторой деформации его контура. ИР колебался в пределах 0,49-0,55, в секреторной фазе фолликул персистировал. У всех пациенток определялась нормальная морфологическая структура эндометрия.
У пациенток с недостаточностью лютеиновой фазы (НЛФ) васкуляризация желтого тела в виде венчика была значительно ниже, чем в контрольной группе, а ИР достоверно ниже. Для этой группы пациенток характерно некоторое отставание развития толщигны М-эха. При ЦДК у женщин с НЛФ вокруг эндометрия в лютеиновую фазу цветовые эхосигналы почти не определялись. Резистентность кровотоку на стенке фолликула перед овуляцией снижалась и колебалась в пределах 0,39-0,48. Выводы. Таким образом, трансвагинальная эхография в комбинации с допплеровскими методами способна в большинстве случаев определить функциональное состояние эндометрия и яичников в различные периоды цикла, тем самым качественно улучшить диагностику различных видов эндокринного бесплодия.
ИР колебался в пределах 0,49-0,55, в секреторной фазе фолликул персистировал. У всех пациенток определялась нормальная морфологическая структура эндометрия.
У пациенток с недостаточностью лютеиновой фазы (НЛФ) васкуляризация желтого тела в виде венчика была значительно ниже, чем в контрольной группе, а ИР достоверно ниже. Для этой группы пациенток характерно некоторое отставание развития толщигны М-эха. При ЦДК у женщин с НЛФ вокруг эндометрия в лютеиновую фазу цветовые эхосигналы почти не определялись. Резистентность кровотоку на стенке фолликула перед овуляцией снижалась и колебалась в пределах 0,39-0,48. Выводы. Таким образом, трансвагинальная эхография в комбинации с допплеровскими методами способна в большинстве случаев определить функциональное состояние эндометрия и яичников в различные периоды цикла, тем самым качественно улучшить диагностику различных видов эндокринного бесплодия.
🧬 ВелЭКОлепный ответ
Первому человеку, который рожден благодаря методу ЭКО, сейчас уже 38 лет. Жительница Великобритании Луиза Браун была «зачата в пробирке», и ее жизнь ничем не отличается от нашей с вами. А это значит, что многие бесплодные пары, доверившись врачам-репродуктологам, могут стать счастливыми родителями абсолютно здоровых малышей, отмечает кандидат медицинских наук, медицинский директор GMS ЭКО, акушер-гинеколог, репродуктолог, эндокринолог Анна Морозова.
Жительница Великобритании Луиза Браун была «зачата в пробирке», и ее жизнь ничем не отличается от нашей с вами. А это значит, что многие бесплодные пары, доверившись врачам-репродуктологам, могут стать счастливыми родителями абсолютно здоровых малышей, отмечает кандидат медицинских наук, медицинский директор GMS ЭКО, акушер-гинеколог, репродуктолог, эндокринолог Анна Морозова.
Кто обращается к репродуктологам?
Среднестатистический портрет пациентки любых клиник — это женщина в возрасте 35-42 лет, которой в силу тех или иных причин не удалось зачать ребенка естественным путем.
Индивидуальный подход к каждой будущей маме — то, что в первую очередь обеспечивает успех экстракорпорального оплодотворения. Именно он повышает положительную результативность.
Современные методы ЭКО включают в первую очередь предимплантационную диагностику, в ходе которой у эмбрионов выявляется патология. Таким образом, мы, во-первых, не переносим патологические эмбрионы в полость матки, и, во-вторых, уменьшаем количество «пустых» переносов — когда беременность точно не наступит.
К нам обращаются пары, у которых изначально есть патология хромосом. И они хотят, чтобы у них родились здоровые дети. Диагностика позволяет работать с их клетками, определять хромосомный набор будущих малышей и отбраковывать некачественный материал. И тем самым мы даем возможность родителям иметь здоровое поколение.
Из каких этапов состоит ЭКО?
Стоит разделить подготовку к экстракорпоральному оплодотворению и непосредственно проведение процедуры, которая осуществляется в амбулаторных условиях и длится не более 15 минут. Подготовка к ЭКО делится на три стадии:
- инвазивное исследование, которое обычно занимает одну неделю;
- стимуляция работы яичников;
- пункция.
В норме у женщины растет один фолликул в яичнике. Достигая доминантного размера, он лопается, яйцеклетка выходит из яичника, попадает в маточную трубу, где и встречается со сперматозоидом. Ура, все прошло хорошо — наступает беременность, эмбрион формируется и опускается в полость матки.
У многих женщин в цикле растет один фолликул. Наша задача — получить в ходе подготовки к ЭКО не один, а хотя бы 7-10 фолликулов. Для этого необходимо работу яичников «подстегнуть» с помощью медикаментов. У пациентки вырастают те самые 7-10 фолликулов, и задача медиков — не допустить, чтобы они самостоятельно лопались. И здесь наступает третий этап — пункция, в ходе которой у женщины и забираются фолликулы для дальнейшего оплодотворения.
Не каждый фолликул содержит яйцеклетку, и не каждая яйцеклетка, которую мы получаем, бывает качественной, и не все эмбрионы дорастают до нужной нам стадии, и не всегда беременность наступает с первого раза. Именно ввиду этих «не» врачи и стимулируют выработку женским организмом дополнительных фолликулов и выращивают несколько эмбрионов, с которыми повторяют протокол — а именно так называется последовательность процедур, начиная с момента медикаментозной терапии и заканчивая переносом эмбриона в полость матки.
Если пара приходит на прием и мы понимаем, что, как я обычно говорю, случилась любовь между врачом и пациентом, то сдавать анализы можно буквально на следующий день. С их результатами все в порядке? В таком случае в ближайший первый день менструального цикла мы можем начинать работать с нашей пациенткой. В течение 14 дней происходит стимуляция и пункция, в следующие 2 недели осуществляется оплодотворение яйцеклетки и перенос эмбриона. И через две недели мы уже получаем ответ: случилась беременность или нет. Это происходит за один менструальный цикл, 28-30 дней.
Какие есть противопоказания и мифы, связанные с искусственным оплодотворением?
На сегодняшний день единственным противопоказанием для проведения процедуры ЭКО, как говорится в приказе Минздрава N 107-н, остаются онкологические заболевания. Тем не менее, и здесь есть исключения. Если онколог считает, что стимуляция работы яичников и в целом процедура ЭКО конкретной пациентке не противопоказана, репродуктологи могут спокойно работать с этой, надеемся, будущей мамой.
Как известно, в результате химиотерапии убиваются различные клетки, и клетки яичников также не минуют печальной участи. Поэтому очень часто онкобольные женщины сначала приходят к нам на консультацию, мы, с разрешения онколога, работаем с их яичниками, стимулируем, пунктируем, получаем эмбрионы, замораживаем их, отпускаем людей на лечение ракового заболевания и возвращаемся к ЭКО после выздоровления. Что важно отметить: Всемирная организация здравоохранения доказала, что дети, которые рождаются после ЭКО, абсолютно не отличаются от малышей, которых зачали естественным способом, и процедура ЭКО не провоцирует развитие онкологических заболеваний.
По сути единственными противопоказаниями к проведению ЭКО остаются психическое заболевание и поздний репродуктивный возраст женщины. Да, существует такая проблема, как раннее истощение фолликулярного запаса. Но следует понимать: даже если я на приеме говорю женщине, что у нее не осталось собственных яйцеклеток, это еще не значит, что мы поставили крест на ее беременности. Активно развивается такое направление, как использование донорских клеток. Мы можем использовать яйцеклетки другой женщины с тем, чтобы оплодотворить их спермой супруга. Затем эмбрион подсаживается нашей пациентке. Она вынашивает малыша, и осознание того, что генетически это не ее малыш, быстро стирается. Ребенок становится действительно родным.
Активно развивается такое направление, как использование донорских клеток. Мы можем использовать яйцеклетки другой женщины с тем, чтобы оплодотворить их спермой супруга. Затем эмбрион подсаживается нашей пациентке. Она вынашивает малыша, и осознание того, что генетически это не ее малыш, быстро стирается. Ребенок становится действительно родным.
И еще один, пожалуй, важнейший момент. По статистике, каждая пятая пара страдает бесплодием. И порой причина не в женских яйцеклетках.
Проблема мужского бесплодия может заключаться в неподвижности сперматозоидов. Им бывает достаточно тяжело «добежать» до яйцеклетки даже в колбе. Поэтому, если такие особенности выявляются именно у мужчины, эмбриолог дополняет ЭКО процедурой ИКСИ: после надреза цитоплазмы сперматозоид подсаживают непосредственно в яйцеклетку. Что также увеличивает шансы на успех.
Какова статистика положительных результатов?
Чем моложе женщина, тем больше процент вероятной беременности. Как показывает практика, у пациенток в возрасте 25-30 лет успешными становятся более половины попыток. У женщин в возрасте 30-35 лет беременность наступает в 30-40% случаев (речь об одной попытке ЭКО). После 37 лет шансы резко падают с 30% до 10%. И, наконец, процент наступления беременности у женщин после 40 лет — это 1-2%. Конечно, следует всегда быть морально готовой к тому, что с первого раза может «не получиться». Есть примеры, когда женщины беременели с 10 или 11‑й попытки. В целом же мировая статистика говорит о том, что стать мамой у пациентки получается с пятого раза.
Как показывает практика, у пациенток в возрасте 25-30 лет успешными становятся более половины попыток. У женщин в возрасте 30-35 лет беременность наступает в 30-40% случаев (речь об одной попытке ЭКО). После 37 лет шансы резко падают с 30% до 10%. И, наконец, процент наступления беременности у женщин после 40 лет — это 1-2%. Конечно, следует всегда быть морально готовой к тому, что с первого раза может «не получиться». Есть примеры, когда женщины беременели с 10 или 11‑й попытки. В целом же мировая статистика говорит о том, что стать мамой у пациентки получается с пятого раза.
Сделать УЗИ в Москве платно в клинике ДНК-Центр
Ультразвуковая диагностика занимает одно из ведущих мест в современной медицине. Этому способствует ряд факторов: это прежде всего достоверность получаемых результатов, неинвазивность, доступность и относительная простота процедуры. УЗИ можно повторять неоднократно, не причиняя вред организму пациента. Метод Ультразвуковой диагностики не требует особой подготовки к процедуре.
С появлением комплексного УЗИ в медицине открылись новые возможности для диагностирования значительного числа заболеваний. Ультразвуковая диагностика используется в обнаружении и исследовании различных опухолей, камней, кист внутренних органов, сосудистых аномалий.
Преимущество ультразвуковой диагностики в абсолютной безвредности для пациента. Комплексное УЗИ не оказывает никаких вредных воздействий на организм обследуемого, так как не несет лучевой нагрузки. Доступность Ультразвукового исследования позволяет считать этот метод ведущим в акушерстве и гинекологии, особенно при выявлении патологий плода, а также в исследовании ряда гинекологических заболеваний матери. С помощью ультразвука проводится диагностика заболеваний женской мочеполовой системы. При проведении гинекологического УЗИ определяется строение матки и яичника. В первую фазу менструального цикла проведение УЗИ — обследования рекомендуется на 5-6 день менструального цикла.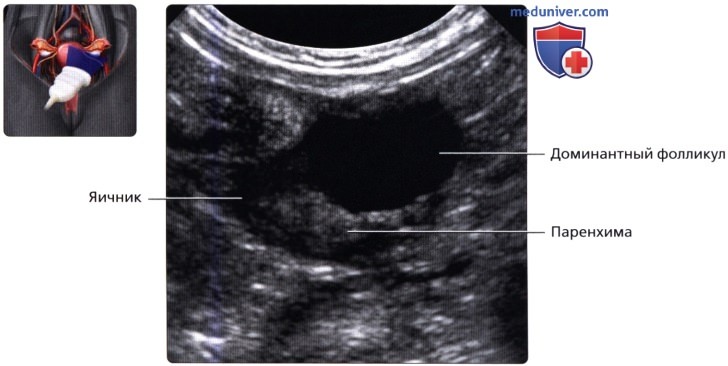 При обследовании матки оценивается ее наличие и расположение в малом тазу, размеры, структура миометрии, наличие расширенных сосудов в толще миометрии, оценивают объемные образования матки (миоматозные и аденомиозные узлы, липомы). Указываются их локализация, размеры и форма. Контуры, эхогенность, звукопроводимость, а также внутренняя структура этих образований.
При обследовании матки оценивается ее наличие и расположение в малом тазу, размеры, структура миометрии, наличие расширенных сосудов в толще миометрии, оценивают объемные образования матки (миоматозные и аденомиозные узлы, липомы). Указываются их локализация, размеры и форма. Контуры, эхогенность, звукопроводимость, а также внутренняя структура этих образований.
Кроме того при ультразвуковом исследовании оценивается состояние эндометрия и полость матки. При описании М-Эхо указывается толщина, однородность, наличие каких-либо патологических структур (синехии, полипы).
Для исследования функционального состояния яичников проводится УЗИ – мониторинг, т.е динамика созревания яйцеклетки. УЗИ проводится на 8-10 день менструального цикла, когда происходит выбор доминантного фолликула, в середине менструального цикла (14-16 день), с целью оценки размера доминантного фолликула (норма 18-24 мм) и во вторую фазу (22-24 день), когда на месте доминантного фолликула видно кистозное образование (желтое тело), наличие которого свидетельствует о произошедшей овуляции. Одновременно исследуется эндометрий.
Одновременно исследуется эндометрий.
В акушерской практике ультразвук позволяет следить за внутриутробным развитием плода, что является очень важным моментом во время беременности. Специалисты рекомендуют беременным женщинам обязательно проходить УЗИ. Широко применяется ультразвук для выявления различных заболеваний у детей, начиная с первых дней жизни ребенка.
Также ультразвук применяется в урологической практике, поскольку позволяет диагностировать многие урологические заболевания: опухоли предстательной железы, хронические простатит, заболевания почек (аномалии развития, наличие камней и т.д.), заболевания мочевого пузыря и органов мошонки. Высокоточная диагностика позволяет быстро и качественно диагностировать патологию молочных и щитовидных желез.
В нашем центре Вы можете провести широкий спектр ультразвуковых исследований на современной цифровой ультразвуковой аппаратуре. С прайс-листом, действующим в настоящее время в нашем центре, Вы можете ознакомиться в разделе «цены».
Взаимосвязь между размером доминирующего фолликула, вагинальным электрическим сопротивлением, концентрацией эстрадиола и прогестерона в сыворотке крови и сексуальной восприимчивостью во время фолликулярной фазы верблюда верблюда (Camelus dromedarius)
Тринадцать дромадеров были использованы для изучения взаимосвязи между размером доминантного фолликула, вагинальным электрическим сопротивлением (VER), сексуальной восприимчивостью и концентрацией эстрадиола-17β (E2) и прогестерона (P4) в сыворотке на протяжении фолликулярной фазы.Ежедневно животные испытывали поддразнивание с вазэктомией верблюда, трансректальное ультразвуковое исследование яичников, измерение VER и сбор крови для сыворотки E2 и P4. Результаты не выявили значимых различий между средними значениями VER у животных с фолликулом размером 5-10 мм (группа I, n = 11), 11-15 мм (группа II, n = 12) и 16-20 мм (группа III, n = 13).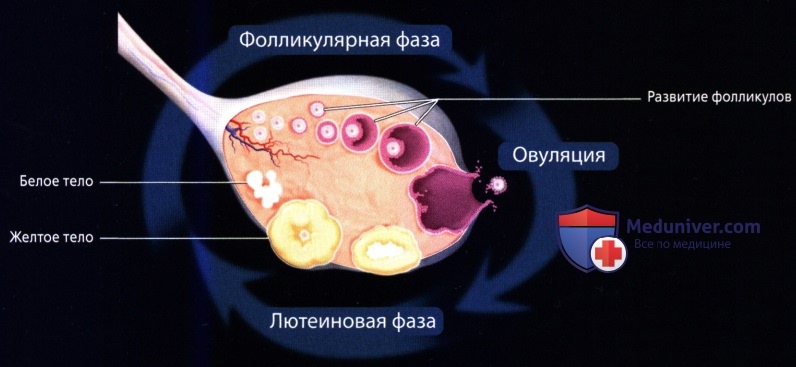 VER не коррелировал с размером фолликула. Концентрации Е2 у животных II групп (60,14 пг / мл) и III (66,14 пг / мл).52 пг / мл) были значительно (P <0,05) выше, чем у животных в группе I (48,31 пг / мл). E2 положительно коррелировал (r = 0,50; P <0,05) с общим размером фолликулов. Концентрация P4 была достоверно (P <0,05) ниже у животных группы II, чем у животных групп I и III. Концентрация P4 в сыворотке обратно коррелировала (r = -0,40; P <0,05) с общим размером фолликулов. Полная сексуальная восприимчивость была отмечена у 63,64%, 16,67% и 76,92% животных в группах I, II и III соответственно.В III группе подтверждена достоверная (P <0,05) полная сексуальная восприимчивость. Однако 23,08% животных были не полностью восприимчивы. В заключение, импедометрические характеристики слизистой оболочки влагалища не были надежным методом для прогнозирования доминирующего размера фолликулов во время фолликулярной фазы у верблюдов-верблюдов.
VER не коррелировал с размером фолликула. Концентрации Е2 у животных II групп (60,14 пг / мл) и III (66,14 пг / мл).52 пг / мл) были значительно (P <0,05) выше, чем у животных в группе I (48,31 пг / мл). E2 положительно коррелировал (r = 0,50; P <0,05) с общим размером фолликулов. Концентрация P4 была достоверно (P <0,05) ниже у животных группы II, чем у животных групп I и III. Концентрация P4 в сыворотке обратно коррелировала (r = -0,40; P <0,05) с общим размером фолликулов. Полная сексуальная восприимчивость была отмечена у 63,64%, 16,67% и 76,92% животных в группах I, II и III соответственно.В III группе подтверждена достоверная (P <0,05) полная сексуальная восприимчивость. Однако 23,08% животных были не полностью восприимчивы. В заключение, импедометрические характеристики слизистой оболочки влагалища не были надежным методом для прогнозирования доминирующего размера фолликулов во время фолликулярной фазы у верблюдов-верблюдов.
Ключевые слова: Дромадер; Фолликул; Эстрадиол-17β; Прогестерон; Вагинальное электрическое сопротивление.
Развитие доминантных фолликулов и продолжительность овариального цикла у послеродовых молочных коров
Восстановление активности яичников после нормальных отелов было изучено на 18 лактирующих коровах фризской породы. Поскольку у 17 коров первая послеродовая овуляция произошла без выявления явного эстрального поведения, полученные циклы были названы «циклами яичников». Средняя (+/- стандартное отклонение) продолжительность цикла яичников составляла 21,0 +/- 8,7 дня.Продолжительность циклов обычно была нормальной (18-24 дня) или длинной (больше или равной 25 дням), когда овуляторные доминантные фолликулы были идентифицированы до 10 дня после родов; они были постоянно короткими (9-13 дней), когда доминантные фолликулы идентифицировали после 20-го дня послеродовой овуляции. Когда такие фолликулы были обнаружены между 10 и 20 днями послеродового периода, выявлялись длинные, нормальные и короткие циклы яичников. Количество волн роста фолликулов с ассоциированными доминантными фолликулами, наблюдаемых во время овариальных циклов, как правило, связано с продолжительностью цикла; короткие циклы имели 1 доминантный фолликул, нормальные циклы преимущественно 2, а длинные циклы в основном 3 доминантных фолликула. Средняя (+/- s.d.) продолжительность 13 изученных циклов эстра составила 23,1 +/- 2,1 дня. Из этих циклов в 7 было 3 и 6 — 2 доминантных фолликула. Эстральные циклы с 3 доминирующими фолликулами имели среднюю (+/- s.d.) продолжительность 24,0 +/- 1,2 дня, а соответствующие доминантные неовуляторные фолликулы достигли максимальных размеров на 8 и 18 дни соответственно; Эстровые циклы с 2 доминантными фолликулами длились 22,2 +/- 2,6 дня, а доминантный неовуляторный фолликул достиг максимального размера к 8-му дню. Развитие фолликулов яичников в течение первых 45 дней беременности характеризовалось ростом и регрессом следующих друг за другом доминантных фолликулов. фолликулы продолжительностью 10-12 дней каждый.Эти результаты показывают, что первый овариальный цикл был преимущественно коротким, когда овуляторный доминантный фолликул был впервые обнаружен после 20-го дня после родов.
Средняя (+/- s.d.) продолжительность 13 изученных циклов эстра составила 23,1 +/- 2,1 дня. Из этих циклов в 7 было 3 и 6 — 2 доминантных фолликула. Эстральные циклы с 3 доминирующими фолликулами имели среднюю (+/- s.d.) продолжительность 24,0 +/- 1,2 дня, а соответствующие доминантные неовуляторные фолликулы достигли максимальных размеров на 8 и 18 дни соответственно; Эстровые циклы с 2 доминантными фолликулами длились 22,2 +/- 2,6 дня, а доминантный неовуляторный фолликул достиг максимального размера к 8-му дню. Развитие фолликулов яичников в течение первых 45 дней беременности характеризовалось ростом и регрессом следующих друг за другом доминантных фолликулов. фолликулы продолжительностью 10-12 дней каждый.Эти результаты показывают, что первый овариальный цикл был преимущественно коротким, когда овуляторный доминантный фолликул был впервые обнаружен после 20-го дня после родов.
Оборот доминантных фолликулов у крупного рогатого скота с разным репродуктивным состоянием
Целью данного исследования было сравнение концентраций прогестерона (P4) в плазме у нелактирующих повторнородящих коров голштинской породы (n = 24), которым вводили 2 типа интравагинальных имплантатов, содержащих 1,0 или 1,9 г P4 либо при первом использовании, либо во время повторного использования имплантатов после дезинфекции имплантата в автоклаве или химической дезинфекции. В полностью рандомизированном дизайне с факторной компоновкой 2 × 3 и 2 повторами каждая корова подвергалась 2 из 6 обработок. Два источника P4 [контролируемое внутреннее высвобождение лекарства (1,9 г P4) из Zoetis (Сан-Паулу, Бразилия) и Sincrogest (1,0 г P4) из Ourofino (Кравиньюс, Бразилия)] и 3 типа обработки, новые (N) , повторно использованные после автоклава (RA) и повторно использованные после химической дезинфекции (RC). После индукции лютеолиза, чтобы избежать эндогенного циркулирующего P4, коровы были рандомизированы в 1 из 6 обработок (1.9 г N, 1,9 г RA, 1,9 г RC, 1,0 г N, 1,0 г RA и 1,0 г RC). Коровам вводили имплантаты в течение 8 дней, и в течение этого периода образцы крови собирали через 0, 2, 12, 24, 48, 72, 96, 120, 144, 168 и 192 часа. Статистический анализ выполняли с использованием Proc-Mixed, и среднее значение ± стандартная ошибка средних концентраций P4 рассчитывали с использованием процедур Proc-Means SAS 9.4 (SAS Institute Inc., Кэри, Северная Каролина). Никакого взаимодействия между обработками не наблюдалось.
В полностью рандомизированном дизайне с факторной компоновкой 2 × 3 и 2 повторами каждая корова подвергалась 2 из 6 обработок. Два источника P4 [контролируемое внутреннее высвобождение лекарства (1,9 г P4) из Zoetis (Сан-Паулу, Бразилия) и Sincrogest (1,0 г P4) из Ourofino (Кравиньюс, Бразилия)] и 3 типа обработки, новые (N) , повторно использованные после автоклава (RA) и повторно использованные после химической дезинфекции (RC). После индукции лютеолиза, чтобы избежать эндогенного циркулирующего P4, коровы были рандомизированы в 1 из 6 обработок (1.9 г N, 1,9 г RA, 1,9 г RC, 1,0 г N, 1,0 г RA и 1,0 г RC). Коровам вводили имплантаты в течение 8 дней, и в течение этого периода образцы крови собирали через 0, 2, 12, 24, 48, 72, 96, 120, 144, 168 и 192 часа. Статистический анализ выполняли с использованием Proc-Mixed, и среднее значение ± стандартная ошибка средних концентраций P4 рассчитывали с использованием процедур Proc-Means SAS 9.4 (SAS Institute Inc., Кэри, Северная Каролина). Никакого взаимодействия между обработками не наблюдалось. При сравнении типов имплантатов средние концентрации P4 во время лечения были выше для 1 пациента.9 г, чем 1,0 г (1,46 против 1,14 ± 0,04 нг / мл). При сравнении типов обработки средние концентрации P4 не различались между автоклавированными и новыми вставками (1,46 против 1,37 ± 0,05 нг / мл; соответственно), но оба были выше, чем у химически продезинфицированных имплантатов (1,09 ± 0,04 нг / мл). В пределах 1,9 г вставок P4 концентрации P4 из автоклавированных имплантатов были выше, чем у новых имплантатов, которые были выше, чем у химически продезинфицированных (1,67 ± 0,06 против 1,49 ± 0,07 против 1,21 ± 0,05 нг / мл; соответственно). Для имплантатов P4 весом 1,0 г, концентрации P4 из автоклавированных не отличались от новых, но оба были выше, чем после химической дезинфекции (1.20 ± 0,08 против 1,24 ± 0,06 против 0,97 ± 0,05 нг / мл; соответственно). Таким образом, средняя концентрация P4 в плазме у нелактирующих коров голштинской породы была больше для 1,9 г, чем для 1,0 г P4, и независимо от типа имплантата процесс автоклавирования обеспечивал большее количество циркулирующего P4 по сравнению с химической дезинфекцией и аналогичные или более высокие концентрации P4 по сравнению с новый имплант.
При сравнении типов имплантатов средние концентрации P4 во время лечения были выше для 1 пациента.9 г, чем 1,0 г (1,46 против 1,14 ± 0,04 нг / мл). При сравнении типов обработки средние концентрации P4 не различались между автоклавированными и новыми вставками (1,46 против 1,37 ± 0,05 нг / мл; соответственно), но оба были выше, чем у химически продезинфицированных имплантатов (1,09 ± 0,04 нг / мл). В пределах 1,9 г вставок P4 концентрации P4 из автоклавированных имплантатов были выше, чем у новых имплантатов, которые были выше, чем у химически продезинфицированных (1,67 ± 0,06 против 1,49 ± 0,07 против 1,21 ± 0,05 нг / мл; соответственно). Для имплантатов P4 весом 1,0 г, концентрации P4 из автоклавированных не отличались от новых, но оба были выше, чем после химической дезинфекции (1.20 ± 0,08 против 1,24 ± 0,06 против 0,97 ± 0,05 нг / мл; соответственно). Таким образом, средняя концентрация P4 в плазме у нелактирующих коров голштинской породы была больше для 1,9 г, чем для 1,0 г P4, и независимо от типа имплантата процесс автоклавирования обеспечивал большее количество циркулирующего P4 по сравнению с химической дезинфекцией и аналогичные или более высокие концентрации P4 по сравнению с новый имплант.
Дифференциация доминантных и подчиненных фолликулов у крупного рогатого скота1 | Биология размножения
Абстрактные
Выбор доминантного фолликула, способного к овуляции, из когорты фолликулов аналогичного размера является критическим переходом в развитии фолликулов.Механизмы, которые регулируют отбор определенного для определенного вида числа доминантных фолликулов для овуляции, недостаточно изучены. Крупный рогатый скот представляет собой очень полезную животную модель для исследований отбора и доминирования фолликулов. Во время эстрального цикла крупного рогатого скота происходят две или три последовательных волны развития фолликулов, каждая из которых дает доминантный фолликул, способный к овуляции, если происходит регресс лютеиновой кислоты. Фолликулы достаточно велики, чтобы можно было анализировать несколько конечных точек в пределах одного фолликула, а развитие и регресс фолликулов можно отслеживать с помощью ультразвуковой визуализации.Характеристики рекрутированных и выбранных фолликулов, полученные в разное время во время первой фолликулярной волны, были определены в некоторых исследованиях, тогда как в других исследованиях сравнивали доминирующие и подчиненные фолликулы во время отбора. По мере рекрутирования фолликулов мРНК ароматазы P450 увеличивается. К моменту морфологического отбора доминирующий фолликул имеет гораздо более высокие концентрации эстрадиола в фолликулярной жидкости, а его гранулезные клетки производят больше эстрадиола in vitro, чем клетки подчиненных фолликулов.Вскоре после отбора в доминантных фолликулах наблюдается более высокий уровень мРНК рецепторов гонадотропина и стероидогенных ферментов. Была выдвинута гипотеза, что клетки гранулезы выбранного фолликула приобретают рецепторы ЛГ (LHr), что позволяет им усиливать ароматизацию в ответ на ЛГ, а также ФСГ. Однако, по всей видимости, ЛГ не стимулирует выработку эстрадиола клетками гранулезы крупного рогатого скота, и роль приобретения LHr еще предстоит определить. Недавние данные свидетельствуют о ключевой роли изменений во внутрифолликулярной системе инсулиноподобного фактора роста (IGF) в выборе доминирующего фолликула.Когда фолликулярная жидкость была взята in vivo перед морфологическим отбором, самая низкая концентрация IGF-связывающего белка-4 (IGFBP-4) была более предсказуемой для будущего доминирования, чем размер или концентрация эстрадиола. В соответствии с этим открытием, доминантные фолликулы приобретают ФСГ-индуцированную активность протеазы IGFBP-4. Таким образом, снижение IGFBP-4, которое сделает больше IGF доступным для взаимодействия с его рецепторами и синергетического действия с ФСГ, способствуя росту и ароматизации фолликулов, по-видимому, является критическим детерминантом отбора фолликулов для доминирования.
Введение
Во время репродуктивного цикла млекопитающих выбирается видоспецифичное количество фолликулов для завершения дифференцировки и овуляции. Выбранные фолликулы претерпевают дифференцированные изменения, которые позволяют им секретировать уровни эстрадиола, которые вызывают преовуляторный выброс ЛГ / ФСГ и изменения, которые позволяют им реагировать на выброс ЛГ / ФСГ. После набора группы фолликулов у крупных млекопитающих, таких как крупный рогатый скот, лошади и приматы, один фолликул выбирается для доминирования и продолжает расти, в то время как рост других (подчиненных фолликулов) замедляется.Несмотря на критическую важность выбора доминирующего фолликула для функции яичников и фертильности, почему один фолликул выбирается из группы похожих фолликулов, все еще остается загадкой. Крупный рогатый скот представляет собой отличную модель для изучения этих событий, потому что две или три волны развития фолликулов происходят последовательно в течение эстрального цикла крупного рогатого скота (см. Обзор в [1]). Каждая волна состоит из одновременного набора от трех до шести фолликулов, которые вырастают более 4–5 мм в диаметре. В течение нескольких дней после инициирования волны один фолликул выбирается в качестве доминирующего фолликула.Доминантный фолликул продолжает расти и дифференцироваться, тогда как его сестринские подчиненные фолликулы плато в росте, а затем регрессируют. Доминирующий фолликул первой волны в двухволновых циклах и первой и второй волн в трехволновых циклах регрессирует. Доминантный фолликул последней (второй или третьей) волны реагирует на снижение циркулирующего прогестерона при лютеолизе и последующее увеличение частоты пульса ЛГ с дальнейшими изменениями, которые позволяют ему секретировать достаточное количество эстрадиола, чтобы вызвать выброс ЛГ / ФСГ и овуляцию. в ответ на этот всплеск.Однако доминирующий фолликул любой фолликулярной волны, включая первую, может овулировать, если соответствующие эндокринные условия обеспечиваются индукцией лютеолиза (путем инъекции простагландина F 2α ) во время его доминирования. Первая волна цикла особенно полезна для экспериментальных целей, потому что она начинается в предсказуемое время, в отсутствие предыдущего доминантного фолликула (который только что овулировал).
В этой рукописи содержится обзор современной литературы по отбору фолликулов.Наиболее очевидным признаком того, что фолликул был выбран в качестве доминирующего, является значительная разница в размере по сравнению с самым большим подчиненным фолликулом. Эта разница в диаметре фолликулов, иногда называемая «отклонением фолликула» [2], является следствием повышенной скорости роста доминирующего фолликула по сравнению с подчиненными фолликулами. Вероятно, что отбор доминантного фолликула — это прогрессивный процесс, и что начальные этапы отбора происходят до того, как появится ощутимая разница в размере.Следовательно, на основе имеющихся знаний трудно определить, когда происходит отбор. Для целей этого обзора отбор будет означать морфологический отбор, обнаружение очевидной разницы в диаметре между двумя самыми большими фолликулами волны. Один из подходов к вопросу о механизмах отбора фолликулов заключается в сравнении характеристик фолликулов когорты перед отбором с характеристиками выбранных явно доминантных фолликулов. Другой подход — сравнить характеристики доминирующих и подчиненных фолликулов от одних и тех же животных в определенные периоды фолликулярной волны.Результаты исследований, в которых использовались эти подходы, будут рассмотрены ниже. Эти стратегии сравнения, хотя и не оптимальны, помогли выявить ключевые различия между доминантными и подчиненными фолликулами. Кроме того, теперь можно брать образцы фолликулярной жидкости in vivo из фолликулов когорты, чтобы определить характеристики, которые предшествуют морфологическому отбору и, следовательно, являются его предикторами.
Рекрутмент фолликулярных волн
Очевидно, что фолликулярные волны инициируются повышением циркулирующего ФСГ.У крупного рогатого скота и других видов фолликулярным волнам предшествует или сопровождается небольшим повышением ФСГ, и если это повышение ингибируется или задерживается, фолликулярная волна подавляется или задерживается (см. Обзор в [3]). Экзогенный ФСГ привлекает большее, чем обычно, количество фолликулов для роста более 5 мм в диаметре и, в протоколах суперовуляции, увеличивает количество фолликулов, доступных для овуляции. Эти эффекты ФСГ, по крайней мере, до некоторой степени зависят от дозы, поскольку лечение небольшими количествами экзогенного ФСГ может привести к образованию кодоминантных фолликулов [4, 5].Что не так хорошо понятно, так это то, как только один доминантный фолликул выбирается из когорты, набранной небольшим повышением ФСГ.
Выбор фолликулов для доминирования
Продукция эстрадиола является критической характеристикой фолликулов, выбранных для доминирования
Определяющей характеристикой доминантного фолликула, по-видимому, является его большая способность вырабатывать эстрадиол. Как показано в Таблице 1, концентрации эстрадиола в фолликулярной жидкости были намного выше в доминантных фолликулах, выделенных на 5-й день эстрального цикла, чем в рекрутированных фолликулах на 3-й день, тогда как подчиненные фолликулы на 5-й день имели концентрации, аналогичные рекрутированным фолликулам на 3-й день [ 3, 6].Совсем недавно доминантные и подчиненные фолликулы сравнивали в определенное время относительно появления морфологически доминантного фолликула. Как только было обнаружено, что доминантный фолликул лишь немного больше самого большого подчиненного фолликула, он имеет более высокие концентрации эстрадиола в фолликулярной жидкости [7–9], а его гранулезные клетки секретируют больше эстрадиола in vitro [8]. Похоже, что доминирующий фолликул является источником более высоких циркулирующих концентраций эстрадиола и андрогенов, обнаруживаемых в периферическом (полая вена) кровообращении во время первой фолликулярной волны цикла, поскольку концентрации эстрадиола, андростендиона и тестостерона повышаются в утробе матери. яичниковая вена, дренирующая яичник, несущий доминантный фолликул, но не в противоположную маточно-яичниковую вену [10].Секреция эстрадиола и, возможно, андрогена доминантным фолликулом связана с прекращением роста ФСГ и с поддержанием ФСГ на базальном уровне, соответственно [10–12]. Хотя есть доказательства того, что циркулирующий ингибин также регулирует ФСГ во время ранней лютеиновой фазы [13], его роль в контроле интервала между последовательными повышениями ФСГ не ясна, поскольку тесты на димерный ингибин только недавно стали доступны для жвачных [14].
Таблица 1Концентрации эстрадиола в фолликулах, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. а
| . | Эстрадиол фолликулярной жидкости (нг / мл ± SEM) . | ||
|---|---|---|---|
| День эстрального цикла . | Рекрутированные фолликулы . | Доминантные фолликулы . | Подчиненные фолликулы . |
| День 3 | 58 ± 14 | — | — |
| День 5 | — | 990 ± 30 | 60 ± 40 |
| День 7 | — | 201 ± 73 | 3 ± 1 |
| День 8 | — | 74 ± 9 | — |
| День 11 | — | 9 ± 5 | — |
| . | Эстрадиол фолликулярной жидкости (нг / мл ± SEM) . | ||
|---|---|---|---|
| День эстрального цикла . | Рекрутированные фолликулы . | Доминантные фолликулы . | Подчиненные фолликулы . |
| День 3 | 58 ± 14 | — | — |
| День 5 | — | 990 ± 30 | 60 ± 40 |
| День 7 | — | 201 ± 73 | 3 ± 1 |
| День 8 | — | 74 ± 9 | — |
| День 11 | — | 9 ± 5 | — |
Концентрации эстрадиол в фолликулах, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. а
| . | Эстрадиол фолликулярной жидкости (нг / мл ± SEM) . | ||
|---|---|---|---|
| День эстрального цикла . | Рекрутированные фолликулы . | Доминантные фолликулы . | Подчиненные фолликулы . |
| День 3 | 58 ± 14 | — | — |
| День 5 | — | 990 ± 30 | 60 ± 40 |
| День 7 | — | 201 ± 73 | 3 ± 1 |
| День 8 | — | 74 ± 9 | — |
| День 11 | — | 9 ± 5 | — |
| . | Эстрадиол фолликулярной жидкости (нг / мл ± SEM) . | ||
|---|---|---|---|
| День эстрального цикла . | Рекрутированные фолликулы . | Доминантные фолликулы . | Подчиненные фолликулы . |
| День 3 | 58 ± 14 | — | — |
| День 5 | — | 990 ± 30 | 60 ± 40 |
| День 7 | — | 201 ± 73 | 3 ± 1 |
| День 8 | — | 74 ± 9 | — |
| День 11 | — | 9 ± 5 | — |
Что отличает будущий доминантный фолликул, который позволяет ему более активно или раньше, чем подчиненные, реагировать на небольшое повышение уровня ФСГ, которое инициирует волну развития фолликулов? Доминантный фолликул может иметь уникальное положение, благодаря немного большему размеру или лучшему кровоснабжению, чтобы реагировать на повышение уровня ФСГ и увеличивать секрецию эстрадиола.Тщательные ультразвуковые исследования показали, что в начале фолликулярной волны будущий доминантный фолликул в среднем немного больше, чем другие в когорте [15, 16]. Однако разница в размерах невелика и не всегда позволяет предсказать будущее доминирование, что предполагает, что внутрифолликулярные механизмы в доминантном фолликуле позволяют ему усиливать эффекты ФСГ и, таким образом, гораздо более устойчиво, чем подчиненные фолликулы, реагировать на повышение циркулирующего ФСГ. . Характеристики доминантного фолликула, который может поддерживать его большую способность к продукции эстрадиола, были изучены путем сравнения рекрутированных фолликулов до морфологического отбора с доминантными фолликулами, полученными после отбора, или путем сравнения доминантных и подчиненных фолликулов в определенные моменты времени вскоре после морфологического отбора.Эти исследования рассматриваются в следующих разделах.
Характеристики рекрутированных и выбранных фолликулов
Ряд характеристик рекрутированных и выбранных фолликулов был исследован биологами-репродуктологами из Университета Миссури и представлен в серии статей (обзор см. В [17]). Фолликулы получали каждые 2 дня в течение первых 10 дней эстрального цикла крупного рогатого скота, и мРНК на стероидогенные ферменты и рецепторы гонадотропина исследовали гибридизацией in situ.Эти исследования позволили сравнить набранные фолликулы (дни 0–2 волны) и выбранные фолликулы (дни 4–10), но не сравнивали доминантные и подчиненные фолликулы. Как и ожидалось, выбранные фолликулы имели значительно более высокие концентрации эстрадиола в фолликулярной жидкости, чем задействованные или регрессирующие фолликулы (Таблица 2). В клетках гранулезы уровни мРНК ароматазы P450 (ароматазы), которая превращает андрогены в эстрадиол, увеличиваются между 0 и 2 днями после инициирования волны, тогда как в клетках theca мРНК 17α-гидроксилазы P450 (17α-OH), которая преобразует превращение прогестинов в андрогены, повышенное между 2 и 4 днями, одновременно с более высоким уровнем эстрадиола в выбранных фолликулах на 4 день, чем в рекрутированных фолликулах в дни 0–2 (таблицы 2 и 3 [18]).Также наблюдались изменения мРНК ферментов, участвующих в биосинтезе прогестина. Уровни мРНК фермента расщепления боковой цепи P450 (P450 scc ) были выше в клетках гранулезы выбранных (доминантных) фолликулов, полученных на 4-й день волны, чем в рекрутированных фолликулах, полученных до отбора (Таблица 3 [18]). Экспрессия мРНК для рецептора LH (LHr) была выше в клетках теки и гранулезы выбранных фолликулов на 4-й день волны, чем в рекрутированных фолликулах на 0–2 дни (таблица 4 [19]).
Таблица 2Характеристики фолликулов, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. a
| День волны . | Кол-во животных . | Кол-во фолликулов . | Диаметр фолликула (мм) . | Состояние здоровья . | Эстрадиол-17β (нг / мл) . |
|---|---|---|---|---|---|
| 0 | 3 | 8 | 5.3 ± 0,4 | Все здоровы | 13 ± 3 |
| 2 | 4 | 12 | 6,7 ± 0,5 | Все здоровы | 39 ± 14 |
| 4 | 4 | 4 | 10,8 ± 0,8 | Все здоровы | 189 ± 65 б |
| 6 | 5 | 5 | 12,9 ± 0,6 | Все здоровы | 51 ± 18 |
| 8 | 4 | 4 | 11.1 ± 1,0 | 3 здоровых, 1 чердак | 24 ± 15 |
| 10 | 3 | 3 | 11,7 ± 0,3 | Все чердаки | 9 ± 5 |
| День волна . | Кол-во животных . | Кол-во фолликулов . | Диаметр фолликула (мм) . | Состояние здоровья . | Эстрадиол-17β (нг / мл) . |
|---|---|---|---|---|---|
| 0 | 3 | 8 | 5,3 ± 0,4 | Все здоровы | 13 ± 3 |
| 2 | 4 | 12 | 6,7 ± 0,5 | Все здоровы | 39 ± 14 |
| 4 | 4 | 4 | 10,8 ± 0,8 | Все в порядке | 189 ± 65 b |
| 6 | 5 | 5 | 12.9 ± 0,6 | Все здоровые | 51 ± 18 |
| 8 | 4 | 4 | 11,1 ± 1,0 | 3 здоровых, 1 атретический | 24 ± 15 |
| 10 | 3 | 3 | 11,7 ± 0,3 | Весь атретический | 9 ± 5 |
Характеристики фолликулов, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. a
| День волны . | Кол-во животных . | Кол-во фолликулов . | Диаметр фолликула (мм) . | Состояние здоровья . | Эстрадиол-17β (нг / мл) . |
|---|---|---|---|---|---|
| 0 | 3 | 8 | 5,3 ± 0,4 | Все здоровы | 13 ± 3 |
| 2 | 4 | 12 | 6,7 ± 0,5 | Все здоровы | 39 ± 14 |
| 4 | 4 | 4 | 10.8 ± 0,8 | Все здоровы | 189 ± 65 б |
| 6 | 5 | 5 | 12,9 ± 0,6 | Все здоровы | 51 ± 18 |
| 8 | 4 | 4 | 11,1 ± 1,0 | 3 здоровых, 1 чердак | 24 ± 15 |
| 10 | 3 | 3 | 11,7 ± 0,3 | Все чердаки | 9 ± 5 |
| День волны . | Кол-во животных . | Кол-во фолликулов . | Диаметр фолликула (мм) . | Состояние здоровья . | Эстрадиол-17β (нг / мл) . |
|---|---|---|---|---|---|
| 0 | 3 | 8 | 5,3 ± 0,4 | Все здоровы | 13 ± 3 |
| 2 | 4 | 12 | 6,7 ± 0,5 | Все здоровы | 39 ± 14 |
| 4 | 4 | 4 | 10.8 ± 0,8 | Все здоровы | 189 ± 65 б |
| 6 | 5 | 5 | 12,9 ± 0,6 | Все здоровы | 51 ± 18 |
| 8 | 4 | 4 | 11,1 ± 1,0 | 3 здоровых, 1 чердак | 24 ± 15 |
| 10 | 3 | 3 | 11,7 ± 0,3 | Все чердаки | 9 ± 5 |
Экспрессия мРНК стероидогенных ферментов в фолликулах, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. a
| День волны . | P450 SCC . | 17α-OH Тека . | Ароматаза Гранулоза . | |
|---|---|---|---|---|
| Тека . | Гранулоза . | |||
| 0 | 35 ± 8 | 24 ± 7 | 8 ± 3 | 4 ± 1 |
| 2 | 29 ± 4 | 34 ± 10 | 20 ± 5 | 24 ± 5 b |
| 4 | 53 ± 14 | 63 ± 13 b | 59 ± 13 b | 53 ± 13 b |
| 6 | 7 ± 3 б | 12 ± 5 | 7 ± 2 | 51 ± 9 б |
| 8 | 5 ± 1 б | 2 ± 1 | 13 ± 6 | 8 ± 5 |
| 10 | 6 ± 2 b | 0 | 0 | 0 |
| День волны . | P450 SCC . | 17α-OH Тека . | Ароматаза Гранулоза . | |
|---|---|---|---|---|
| Тека . | Гранулоза . | |||
| 0 | 35 ± 8 | 24 ± 7 | 8 ± 3 | 4 ± 1 |
| 2 | 29 ± 4 | 34 ± 10 | 20 ± 5 | 24 ± 5 b |
| 4 | 53 ± 14 | 63 ± 13 b | 59 ± 13 b | 53 ± 13 b |
| 6 | 7 ± 3 б | 12 ± 5 | 7 ± 2 | 51 ± 9 б |
| 8 | 5 ± 1 б | 2 ± 1 | 13 ± 6 | 8 ± 5 |
| 10 | 6 ± 2 b | 0 | 0 | 0 |
Экспрессия мРНК стероидогенных ферментов в фолликулах, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. a
| День волны . | P450 SCC . | 17α-OH Тека . | Ароматаза Гранулоза . | |
|---|---|---|---|---|
| Тека . | Гранулоза . | |||
| 0 | 35 ± 8 | 24 ± 7 | 8 ± 3 | 4 ± 1 |
| 2 | 29 ± 4 | 34 ± 10 | 20 ± 5 | 24 ± 5 b |
| 4 | 53 ± 14 | 63 ± 13 b | 59 ± 13 b | 53 ± 13 b |
| 6 | 7 ± 3 б | 12 ± 5 | 7 ± 2 | 51 ± 9 б |
| 8 | 5 ± 1 б | 2 ± 1 | 13 ± 6 | 8 ± 5 |
| 10 | 6 ± 2 b | 0 | 0 | 0 |
| День волны . | P450 SCC . | 17α-OH Тека . | Ароматаза Гранулоза . | |
|---|---|---|---|---|
| Тека . | Гранулоза . | |||
| 0 | 35 ± 8 | 24 ± 7 | 8 ± 3 | 4 ± 1 |
| 2 | 29 ± 4 | 34 ± 10 | 20 ± 5 | 24 ± 5 b |
| 4 | 53 ± 14 | 63 ± 13 b | 59 ± 13 b | 53 ± 13 b |
| 6 | 7 ± 3 б | 12 ± 5 | 7 ± 2 | 51 ± 9 б |
| 8 | 5 ± 1 б | 2 ± 1 | 13 ± 6 | 8 ± 5 |
| 10 | 6 ± 2 b | 0 | 0 | 0 |
мРНК рецепторов гонадотропина в фолликулах, собранных во время первой фолликулярной волны полового цикла крупного рогатого скота. a
| День волны . | л / ч . | FSHr Гранулоза . | |
|---|---|---|---|
| Тека . | Гранулоза . | ||
| 0 | 15 ± 7 | 0 | 15 ± 5 |
| 2 | 13 ± 6 | 0 | 25 ± 4 |
| 4 | 59 ± 10 б | 26 ± 10 b | 31 ± 11 |
| 6 | 21 ± 10 | 24 ± 8 b | 14 ± 4 |
| 8 | 28 ± 10 | 9 ± 7 | 12 ± 6 |
| 10 | 10 ± 7 | 0 | 6 ± 3 |
| День волны . | л / ч . | FSHr Гранулоза . | |
|---|---|---|---|
| Тека . | Гранулоза . | ||
| 0 | 15 ± 7 | 0 | 15 ± 5 |
| 2 | 13 ± 6 | 0 | 25 ± 4 |
| 4 | 59 ± 10 б | 26 ± 10 b | 31 ± 11 |
| 6 | 21 ± 10 | 24 ± 8 b | 14 ± 4 |
| 8 | 28 ± 10 | 9 ± 7 | 12 ± 6 |
| 10 | 10 ± 7 | 0 | 6 ± 3 |
Экспрессия мРНК рецепторов гонадотропина в фолликулах, собранных во время первой фолликулярной волны течки крупного рогатого скота цикл. a
| День волны . | л / ч . | FSHr Гранулоза . | |
|---|---|---|---|
| Тека . | Гранулоза . | ||
| 0 | 15 ± 7 | 0 | 15 ± 5 |
| 2 | 13 ± 6 | 0 | 25 ± 4 |
| 4 | 59 ± 10 б | 26 ± 10 b | 31 ± 11 |
| 6 | 21 ± 10 | 24 ± 8 b | 14 ± 4 |
| 8 | 28 ± 10 | 9 ± 7 | 12 ± 6 |
| 10 | 10 ± 7 | 0 | 6 ± 3 |
| День волны . | л / ч . | FSHr Гранулоза . | |
|---|---|---|---|
| Тека . | Гранулоза . | ||
| 0 | 15 ± 7 | 0 | 15 ± 5 |
| 2 | 13 ± 6 | 0 | 25 ± 4 |
| 4 | 59 ± 10 б | 26 ± 10 b | 31 ± 11 |
| 6 | 21 ± 10 | 24 ± 8 b | 14 ± 4 |
| 8 | 28 ± 10 | 9 ± 7 | 12 ± 6 |
| 10 | 10 ± 7 | 0 | 6 ± 3 |
Во второй серии экспериментов группа из Миссури выделяла фолликулы каждые 12 часов в течение первых 4 дней. первой фолликулярной волны, чтобы получить больше информации об изменениях, конкретно связанных с выбором доминирующего фолликула.Экспрессия мРНК для рецептора ФСГ (ФСГ) в клетках гранулезы и для LHr в клетках теки была выше в доминантных фолликулах по сравнению с рекрутированными фолликулами ко второму дню волны [20]. Информационная РНК для LHr не была обнаружена в клетках гранулезы в течение первых 24 часов волны, но ее экспрессия была обнаружена в одном фолликуле на телку примерно во время отбора (36-60 часов волны) [20]. Кроме того, мРНК для 3β-гидроксистероиддегидрогеназы (3β-HSD) увеличивалась в тека-клетках рекрутированных фолликулов к 1-му дню волны по сравнению с 0-м днем.5 и позже в клетках гранулезы отобранных по сравнению с рекрутированными фолликулами к 1,5–2 дням [21]. Информационная РНК для стероидогенного острого регуляторного белка (StAR) не была обнаружена в клетках гранулезы, но была повышена в клетках теки выбранных по сравнению с рекрутированными фолликулами ко второму дню волны [22].
В совокупности эти интересные и всесторонние исследования показывают, что на ранней стадии развития фолликулов мРНК ароматазы увеличивается в рекрутированных фолликулах и что после отбора в доминантных фолликулах повышается уровень мРНК рецепторов гонадотропина и ферментов, участвующих в выработке андрогенов и прогестинов. синтез (17α-OH, P450 scc , 3β-HSD и StAR), чем рекрутированные фолликулы.Была выдвинута гипотеза, что доминантный фолликул выбран, потому что он приобретает LHr на своих клетках гранулезы и что это позволяет клеткам синтезировать эстрадиол в ответ на LH, а также на FSH (обзор в [2, 3]). Открытия группы из Миссури подтверждают идею о том, что приобретение LHr на гранулезных клетках может быть критическим компонентом отбора для доминирования.
Характеристики доминантных и подчиненных фолликулов
Наша лаборатория применила другой подход и сравнила характеристики доминантных и подчиненных фолликулов во время морфологического отбора доминантного фолликула.Доминантный и два самых больших подчиненных фолликула были получены на 2 и 3 дни первой фолликулярной волны цикла, и уровни мРНК стероидогенных ферментов и рецепторов гонадотропина исследовали гибридизацией in situ. Мы были особенно заинтересованы в сравнении мРНК рецепторов гонадотропина в доминантных и подчиненных фолликулах, чтобы проверить гипотезу о том, что приобретение LHr на клетках гранулезы связано с выбором доминантного фолликула. Вопреки этой гипотезе мРНК для LHr не была обнаружена в клетках гранулезы ни доминантных, ни подчиненных фолликулов, хотя она легко обнаруживалась в клетках теки тех же фолликулов (Таблица 5 [8]).В этих экспериментах единственная разница, обнаруженная между доминирующими и подчиненными фолликулами на 2-й день фолликулярной волны, заключалась в том, что доминирующие фолликулы имели гораздо более высокие концентрации эстрадиола в их фолликулярной жидкости, а их клетки гранулезы секретировали значительно больше эстрадиола в культуре. К 3 дню волны наблюдались дополнительные различия; по сравнению с доминантным фолликулом подчиненные фолликулы имели более низкие уровни мРНК для LHr и 17α-OH в клетках теки и для FSHr и ароматазы в клетках гранулезы (Таблица 5).
Таблица 5Характеристики доминирующего фолликула по сравнению с самым большим подчиненным фолликулом на 2-й и 3-й день первой фолликулярной волны полового цикла крупного рогатого скота. a
| Характеристики фолликулов . | День 2 волны . | День 3 волны . | ||
|---|---|---|---|---|
| Доминантный . | Подчиненный . | Доминантный . | Подчиненный . | |
| Диаметр фолликула (мм) | 8,0 ± 0 c | 7,0 ± 0 d | 9,7 ± 0,3 b | 6,7 ± 0,3 d |
| Стероиды фолликулярной жидкости (нг / мл) | ||||
| Эстрадиол | 606 ± 194 b | 140 ± 40 c | 865 ± 101 b | 9,8 ± 4.4 d |
| Андростендион | 116 ± 22 b, c | 148 ± 12 b | 87 ± 11 b, c | 36 ± 19 c |
| Стероид секреция стенкой фолликула (нг / мг ткани) | ||||
| Эстрадиол | 22,6 ± 3,0 c | 7,5 ± 1,5 d | 29,3 ± 3,5 b | 1,5 ± 0,4 e |
| Андростендион | 9.8 ± 7,0 | 14,6 ± 1,6 | 9,1 ± 3,5 | 8,2 ± 1,8 |
| мРНК (условные единицы) | ||||
| Рецептор ФСГ (гранулезный) | 58 ± 2 c | 53 ± 5 c | 84 ± 1 b | 42 ± 13 c |
| Рецептор LH (theca) | 55 ± 3 f | 50 ± 2 f | 64 ± 2 f | 23 ± 7 г |
| LH рецептор (гранулезный) | ND | ND | ND | ND |
| Ароматаза (гранулезная) | 67 ± 3 f | 46 ± 9 f | 70 ± 10 f | 2 ± 0.2g |
| 17α-гидроксилаза (theca) | 51 ± 1 б, в | 52 ± 1 б, в | 64 ± 4 б | 35 ± 8 в |
| Характеристики фолликулов . | День 2 волны . | День 3 волны . | ||
|---|---|---|---|---|
| Доминантный . | Подчиненный . | Доминантный . | Подчиненный . | |
| Диаметр фолликула (мм) | 8,0 ± 0 c | 7,0 ± 0 d | 9,7 ± 0,3 b | 6,7 ± 0,3 d |
| Стероиды фолликулярной жидкости (нг / мл) | ||||
| Эстрадиол | 606 ± 194 b | 140 ± 40 c | 865 ± 101 b | 9.8 ± 4,4 d |
| Андростендион | 116 ± 22 б, в | 148 ± 12 б | 87 ± 11 б, в | 36 ± 19 в |
| Секреция стероидов стенкой фолликула (нг / мг ткани) | ||||
| Эстрадиол | 22,6 ± 3,0 c | 7,5 ± 1,5 d | 29,3 ± 3,5 b | 1,5 ± 0,4 e |
| Андростендион | 9.8 ± 7,0 | 14,6 ± 1,6 | 9,1 ± 3,5 | 8,2 ± 1,8 |
| мРНК (условные единицы) | ||||
| Рецептор ФСГ (гранулезный) | 58 ± 2 c | 53 ± 5 c | 84 ± 1 b | 42 ± 13 c |
| Рецептор LH (theca) | 55 ± 3 f | 50 ± 2 f | 64 ± 2 f | 23 ± 7 г |
| LH рецептор (гранулезный) | ND | ND | ND | ND |
| Ароматаза (гранулезная) | 67 ± 3 f | 46 ± 9 f | 70 ± 10 f | 2 ± 0.2g |
| 17α-гидроксилаза (theca) | 51 ± 1 б, в | 52 ± 1 б, в | 64 ± 4 б | 35 ± 8 в |
Характеристики доминирующего фолликула по сравнению с самым большим подчиненным фолликулом на 2-й и 3-й день первой фолликулярной волны полового цикла крупного рогатого скота. a
| Характеристики фолликулов . | День 2 волны . | День 3 волны . | ||
|---|---|---|---|---|
| Доминантный . | Подчиненный . | Доминантный . | Подчиненный . | |
| Диаметр фолликула (мм) | 8,0 ± 0 c | 7,0 ± 0 d | 9,7 ± 0,3 b | 6,7 ± 0,3 d |
| Стероиды фолликулярной жидкости (нг / мл) | ||||
| Эстрадиол | 606 ± 194 b | 140 ± 40 c | 865 ± 101 b | 9.8 ± 4,4 d |
| Андростендион | 116 ± 22 б, в | 148 ± 12 б | 87 ± 11 б, в | 36 ± 19 в |
| Секреция стероидов стенкой фолликула (нг / мг ткани) | ||||
| Эстрадиол | 22,6 ± 3,0 c | 7,5 ± 1,5 d | 29,3 ± 3,5 b | 1,5 ± 0,4 e |
| Андростендион | 9.8 ± 7,0 | 14,6 ± 1,6 | 9,1 ± 3,5 | 8,2 ± 1,8 |
| мРНК (условные единицы) | ||||
| Рецептор ФСГ (гранулезный) | 58 ± 2 c | 53 ± 5 c | 84 ± 1 b | 42 ± 13 c |
| Рецептор LH (theca) | 55 ± 3 f | 50 ± 2 f | 64 ± 2 f | 23 ± 7 г |
| LH рецептор (гранулезный) | ND | ND | ND | ND |
| Ароматаза (гранулезная) | 67 ± 3 f | 46 ± 9 f | 70 ± 10 f | 2 ± 0.2g |
| 17α-гидроксилаза (theca) | 51 ± 1 б, в | 52 ± 1 б, в | 64 ± 4 б | 35 ± 8 в |
| Характеристики фолликулов . | День 2 волны . | День 3 волны . | ||
|---|---|---|---|---|
| Доминантный . | Подчиненный . | Доминантный . | Подчиненный . | |
| Диаметр фолликула (мм) | 8,0 ± 0 c | 7,0 ± 0 d | 9,7 ± 0,3 b | 6,7 ± 0,3 d |
| Стероиды фолликулярной жидкости (нг / мл) | ||||
| Эстрадиол | 606 ± 194 b | 140 ± 40 c | 865 ± 101 b | 9.8 ± 4,4 d |
| Андростендион | 116 ± 22 б, в | 148 ± 12 б | 87 ± 11 б, в | 36 ± 19 в |
| Секреция стероидов стенкой фолликула (нг / мг ткани) | ||||
| Эстрадиол | 22,6 ± 3,0 c | 7,5 ± 1,5 d | 29,3 ± 3,5 b | 1,5 ± 0,4 e |
| Андростендион | 9.8 ± 7,0 | 14,6 ± 1,6 | 9,1 ± 3,5 | 8,2 ± 1,8 |
| мРНК (условные единицы) | ||||
| Рецептор ФСГ (гранулезный) | 58 ± 2 c | 53 ± 5 c | 84 ± 1 b | 42 ± 13 c |
| Рецептор LH (theca) | 55 ± 3 f | 50 ± 2 f | 64 ± 2 f | 23 ± 7 г |
| LH рецептор (гранулезный) | ND | ND | ND | ND |
| Ароматаза (гранулезная) | 67 ± 3 f | 46 ± 9 f | 70 ± 10 f | 2 ± 0.2g |
| 17α-гидроксилаза (theca) | 51 ± 1 б, в | 52 ± 1 б, в | 64 ± 4 б | 35 ± 8 в |
Таким образом, при непосредственном сравнении доминирующих и подчиненных фолликулов, очень близко ко времени отбора (то есть ко 2-му дню фолликулярной волны), единственная отмеченная разница, помимо небольшой разницы в диаметре фолликулов, заключалась в способности фолликулов производить эстрадиол.Эти данные предполагают, что приобретение LHr клетками гранулезы не является ключевым компонентом отбора фолликулов, поскольку оно, по-видимому, происходит после, а не до того, как произошел отбор. Аналогичным образом Bodensteiner et al. [7] сообщили, что повышенному содержанию эстрадиола в фолликулярной жидкости предшествовало увеличение количества рецепторов гонадотропина, обнаруженное с помощью радиоорецепторного анализа. Неясно, почему клетки гранулезы вырабатывают LHr. Была выдвинута гипотеза, что это позволяет клеткам гранулезы увеличивать ароматазу в ответ как на ФСГ, так и на ЛГ или позволяет им переходить от зависимости от ФСГ к ЛГ, и что это увеличивает или, по крайней мере, поддерживает их способность производить больше эстрадиола, чем подчиненные. фолликулы.Однако нет опубликованных сообщений о стимуляции ЛГ продукции эстрадиола клетками гранулезы крупного рогатого скота. Мы культивировали клетки гранулезы крупного рогатого скота, полученные из преовуляторных фолликулов до выброса ЛГ, с очень широким диапазоном доз ЛГ (0,008–256 нг / мл) и не наблюдали стимулирующих эффектов на ароматизацию андрогена в эстрадиол, хотя высокие дозы ЛГ, моделирующий выброс ЛГ, подавляет выработку эстрадиола ([23]; неопубликованные данные). Напротив, секреция прогестерона клетками гранулезы из доминантных фолликулов крупного рогатого скота может легко стимулироваться ЛГ [23].С другой стороны, ЛГ действительно стимулирует ароматизацию клетками гранулезы из преовуляторных фолликулов человека и крысы [24, 25]. Однако у этих видов желтые тела синтезируют эстрадиол, что затрудняет определение без обширных исследований зависимости реакции от дозы, является ли производство эстрадиола просто лютеинизацией клеток гранулезы in vitro в ответ на высокие дозы ЛГ. Другая возможность заключается в том, что LHr развивается на клетках гранулезы доминантных фолликулов, чтобы подготовить их к дальнейшей дифференцировке в ответ на выброс ЛГ, а не для увеличения или поддержания их способности секретировать эстрадиол.Необходимы дальнейшие исследования, чтобы определить назначение LHr на клетки гранулезы и определить, существуют ли важные межвидовые различия.
В то же время экспериментальные данные, полученные из исследований на приматах [26] и овцах [27], подтверждают гипотезу о том, что ЛГ имеет решающее значение для выживания доминантного фолликула после снижения циркулирующего ФСГ. Как ЛГ поддерживает жизнеспособность фолликулов и способность секретировать эстрадиол, не так ясно. Есть как минимум два потенциальных механизма, которые не обязательно должны быть взаимоисключающими.Тека-клетки могут быть основной мишенью для ЛГ в этот период развития фолликулов, и поддержание секреции текальных андрогенов может быть ограничивающим фактором для продукции эстрадиола после установления доминирования. Имеются данные о том, что продукция прогестерона клетками гранулезы увеличивает продукцию андрогена текальными клетками за счет увеличения количества доступного предшественника [28], поэтому ЛГ может увеличивать продукцию прогестина клетками гранулезы доминантного фолликула и, таким образом, косвенно увеличивать продукцию эстрадиола.
Потенциальная роль системы инсулиноподобных факторов роста в выборе доминантного фолликула
Обсуждаемые выше данные свидетельствуют о том, что некоторые изменения в доминантном фолликуле, помимо приобретения LHr клетками гранулезы, стимулируют его большую способность к секреции эстрадиола и позволяют ему опережать подчиненные фолликулы. Как только это произойдет, доминантный фолликул сможет проявлять доминирование посредством отрицательной обратной связи по циркулирующим уровням ФСГ, но он также должен разработать механизмы, которые позволят ему продолжать выживать в условиях более низкого уровня ФСГ.Появляется все больше свидетельств того, что система инсулиноподобного фактора роста (IGF) может играть решающую роль в выборе доминирующего фолликула. Считается, что IGF играют важную роль в росте фолликулов, стимулируя пролиферацию клеток гранулезы и взаимодействуя с гонадотропинами, способствуя дифференцировке клеток фолликула [29, 30]. Нацеленная делеция гена IGF-I у мышей приводит к развитию фенотипа яичников, характеризующегося неспособностью фолликулов к овуляции, показывая, что IGF абсолютно необходим для нормального развития фолликулов [31].Система IGF имеет ряд компонентов, включая два лиганда (IGF-I и IGF-II), два рецептора (тип 1 и тип 2) и шесть различных IGF-связывающих белков (IGFBP-1, -2, -3, -4, -5 и -6) (обзор в [29, 30, 32, 33]). Действия IGF осуществляются в основном через рецепторы типа 1, но связывание IGF с их рецепторами может модулироваться IGFBP. Хотя как стимулирующие, так и ингибирующие эффекты IGFBP на действие IGF были описаны в различных тканях-мишенях [32, 34], похоже, существует консенсус в отношении того, что IGFBP ингибируют индуцированный гонадотропином рост и дифференцировку фолликулов [29, 30, 33] ].Таким образом, изменения внутрифолликулярных уровней IGFBP могут приводить к изменениям биодоступности IGF и, следовательно, к усилению или понижению регуляции действия гонадотропинов на клетки фолликула.
Большинство компонентов системы IGF были идентифицированы в яичнике крупного рогатого скота. Информационные РНК для IGF-I и -II были локализованы в клетках гранулезы и теки, соответственно, малых антральных, подчиненных и доминантных фолликулов Yuan et al. [35], тогда как Armstrong et al. [36] не обнаружили мРНК для IGF-I в клетках теки или гранулезы.IGF-I связывается как с гранулезными, так и с тека-клетками [37, 38] и стимулирует пролиферацию in vitro клеток гранулезы из малых антральных фолликулов [37, 39] и продукцию эстрадиола in vitro клетками гранулезы из больших антральных фолликулов [37]. Хотя экспрессия мРНК для IGF увеличивается в доминантных фолликулах, внутрифолликулярные концентрации IGF не коррелируют с концентрациями эстрадиола в фолликулярной жидкости [38, 40-43], что позволяет предположить, что фактическая биодоступность IGF на фолликулярном уровне с большей вероятностью определяется уровнями IGFBP, а не экспрессией гена IGF в тканях яичников.Фолликулярная жидкость крупного рогатого скота содержит IGFBP-2, -3, -4 и -5 [38, 43], а мРНК IGFBP-2 и IGFBP-4 локализованы в гранулезных и тека-клетках соответственно [35, 44]. Хотя IGFBP-3 является преобладающим видом в крови и фолликулярной жидкости [45], у большинства исследованных видов IGFBP-3 практически не экспрессируется в тканях яичников. Таким образом, внутрифолликулярные колебания уровней IGFBP-3, вероятно, являются отражением изменений проницаемости сосудов, сопровождающих развитие фолликулов. Более интересны внутрифолликулярные уровни низкомолекулярных (MW; <40 кДа) IGFBP (IGFBP-2, -4 и -5), поскольку они, по-видимому, регулируются с точки зрения развития и гормонально.Действительно, концентрации IGFBP с низкой молекулярной массой в фолликулярной жидкости были выше в подчиненных / атретических фолликулах по сравнению с эстроген-активными / доминантными фолликулами [38, 40, 43, 46].
Концентрация низкомолекулярных IGFBP в бычьих фолликулах может контролироваться уровнем экспрессии генов в тканях яичников, скоростью деградации за счет местной протеолитической активности или сочетанием обоих факторов. IGFBP-2 и -4, по-видимому, являются основными связывающими белками, продуцируемыми в фолликулах овцы и крупного рогатого скота [35, 44, 47].В фолликулах крупного рогатого скота экспрессия мРНК IGFBP-2 была локализована путем гибридизации in situ с клетками гранулезы антральных фолликулов малого и среднего размера, но отсутствовала в здоровых, крупных (> 8 мм) или доминантных фолликулах. Дальнейшие доказательства в поддержку гормональной регуляции IGFBP-2 на уровне экспрессии мРНК были предоставлены открытием, что FSH ингибировал экспрессию мРНК IGFBP-2 в культивируемых клетках гранулезы, полученных из фолликулов крупного рогатого скота [44]. В том же исследовании мРНК IGFBP-4 была локализована в ткани теки здоровых антральных фолликулов, независимо от класса размера, и стимулировалась ЛГ в первичных культурах клеток теки, полученных из фолликулов среднего размера.Эти данные предполагают, что внутрифолликулярный IGFBP-4 регулируется на уровне деградации, и действительно, наша лаборатория сообщила об увеличении активности протеазы IGFBP-4 в фолликулярной жидкости доминантных фолликулов по сравнению с подчиненными коровьими фолликулами [48]. Кроме того, мы недавно разработали и проверили модель индукции развития кодоминантных фолликулов у крупного рогатого скота путем инъекции малых доз рекомбинантного бычьего ФСГ (рбФСГ) в течение ожидаемого времени отбора доминантных фолликулов [5]. Интересно отметить, что размер (по оценке ультразвукового исследования) и концентрации эстрадиола и протеолитическая активность IGFBP-4 в фолликулярной жидкости были одинаковыми для двух кодоминантных фолликулов животных, получавших rbFSH (Таблица 6).Диаметр фолликула и протеолитическая активность IGFBP-4 также были такими же, как у единственного доминантного фолликула контрольных телок, и больше, чем у самого большого подчиненного фолликула контрольных телок.
Таблица 6Характеристики одиночных доминантных (DF) и наибольших подчиненных (SF) или кодоминантных (co-DF) фолликулов, полученных от контрольных или обработанных rbFSH телок. а
| . | Управление . | рубФШ . | ||
|---|---|---|---|---|
| Характеристики фолликулов . | DF . | SF . | co-DF1 . | co-DF2 . |
| Диаметр фолликула (мм) | 12,1 ± 0,5 b | 8,1 ± 0,3 c | 11,0 ± 0,3 b | 10,2 ± 0,4 b, c |
| Фолликулярный жидкость | ||||
| Эстрадиол (нг / мл) | 384 ± 74 b | 8.2 ± 7,6 e | 122 ± 38 c | 83 ± 13 c, d |
| Деградация IGFBP-4 (%) | 85 ± 6 b | 21 ± 4 d | 77 ± 8 b | 78 ± 6 b |
| . | Управление . | рубФШ . | ||
|---|---|---|---|---|
| Характеристики фолликулов . | DF . | SF . | co-DF1 . | co-DF2 . |
| Диаметр фолликула (мм) | 12,1 ± 0,5 b | 8,1 ± 0,3 c | 11,0 ± 0,3 b | 10,2 ± 0,4 b, c |
| Фолликулярный жидкость | ||||
| Эстрадиол (нг / мл) | 384 ± 74 b | 8.2 ± 7,6 e | 122 ± 38 c | 83 ± 13 c, d |
| Деградация IGFBP-4 (%) | 85 ± 6 b | 21 ± 4 d | 77 ± 8 b | 78 ± 6 b |
Характеристики одиночных доминантных (DF) и наибольших подчиненных (SF) или кодоминантных (co-DF) фолликулов, полученных от контрольных или Телки, получавшие rbFSH. а
| . | Управление . | рубФШ . | ||
|---|---|---|---|---|
| Характеристики фолликулов . | DF . | SF . | co-DF1 . | co-DF2 . |
| Диаметр фолликула (мм) | 12,1 ± 0,5 b | 8,1 ± 0,3 c | 11,0 ± 0,3 b | 10.2 ± 0,4 b, c |
| Фолликулярная жидкость | ||||
| Эстрадиол (нг / мл) | 384 ± 74 b | 8,2 ± 7,6 e | 122 ± 38 c | 83 ± 13 c, d |
| Деградация IGFBP-4 (%) | 85 ± 6 b | 21 ± 4 d | 77 ± 8 b | 78 ± 6 б |
| . | Управление . | рубФШ . | ||
|---|---|---|---|---|
| Характеристики фолликулов . | DF . | SF . | co-DF1 . | co-DF2 . |
| Диаметр фолликула (мм) | 12,1 ± 0,5 b | 8,1 ± 0,3 c | 11,0 ± 0,3 b | 10.2 ± 0,4 b, c |
| Фолликулярная жидкость | ||||
| Эстрадиол (нг / мл) | 384 ± 74 b | 8,2 ± 7,6 e | 122 ± 38 c | 83 ± 13 c, d |
| Деградация IGFBP-4 (%) | 85 ± 6 b | 21 ± 4 d | 77 ± 8 b | 78 ± 6 b |
Стоит подчеркнуть, что все ранее упомянутые исследования оценивали участие системы IGF в развитии фолликулов крупного рогатого скота в фолликулах, полученных сразу после морфологического отбора, или в фолликулах. чья стадия развития не определена (убойные яичники).Чтобы определить, являются ли наблюдаемые различия важными компонентами приобретения доминирования, необходимы исследования, посвященные роли системы IGF в критические моменты отбора фолликулов. В связи с этим Mihm et al. [16] недавно использовали этот подход и сообщили, что при отборе фолликулярной жидкости in vivo на 1,5-й день первой фолликулярной волны (3-й день цикла) фолликул с самой низкой концентрацией IGFBP-4 всегда становился доминирующим фолликулом (Таблица 7). Напротив, концентрации других IGFBP с низкой молекулярной массой (IGFBP-2 и -5) не были предсказуемыми для будущего доминирования, а концентрация IGFBP-4 была более предсказуемой, чем эстрадиол фолликулярной жидкости или диаметр фолликула на этой ранней стадии фолликулярной волны.Возникает соблазн предположить, что более низкие концентрации IGFBP-4, наблюдаемые в доминантном фолликуле до морфологического отбора, являются результатом повышенных уровней протеолиза IGFBP-4 в будущем доминантном фолликуле, и что эти различия, за счет увеличения биодоступного IGF, опосредуют большую способность доминирующего фолликула производить эстрадиол. Необходимы дальнейшие исследования для проверки этой гипотезы, которая представлена на Рисунке 1.
Таблица 7Надежность прогнозирования будущего доминирования фолликулов на основе характеристик фолликулов на 3-й день полового цикла крупного рогатого скота.
| Характеристики фолликулов . | Доля когорт . | |||
|---|---|---|---|---|
| Наибольшее . | Средний . | Наименее . | Не определено . | |
| Диаметр | 3/9 | 2/9 | 0/9 | 4/9 |
| Эстрадиол | 7/9 a | 1/9 b | 0/9 b | 1/9 |
| IGF-связывающие белки | ||||
| BP-3 | 2/8 | 4/8 | 2/8 | |
| BP-2 | 2/8 | 2/8 | 4/8 | |
| BP-5 | 2/8 | 1/8 | 5/8 | |
| BP-4 | 0 / 7 a | 0/7 a | 7/7 b | |
| Характеристики фолликулов . | Доля когорт . | |||
|---|---|---|---|---|
| Наибольшее . | Средний . | Наименее . | Не определено . | |
| Диаметр | 3/9 | 2/9 | 0/9 | 4/9 |
| Эстрадиол | 7/9 a | 1/9 b | 0/9 b | 1/9 |
| IGF-связывающие белки | ||||
| BP-3 | 2/8 | 4/8 | 2/8 | |
| BP-2 | 2/8 | 2/8 | 4/8 | |
| BP-5 | 2/8 | 1/8 | 5/8 | |
| BP-4 | 0 / 7 a | 0/7 a | 7/7 b | |
Надежность прогнозирования будущего доминирования фолликулов на основе характеристик фолликулов на 3-й день полового цикла крупного рогатого скота.
| Характеристики фолликулов . | Доля когорт . | |||
|---|---|---|---|---|
| Наибольшее . | Средний . | Наименее . | Не определено . | |
| Диаметр | 3/9 | 2/9 | 0/9 | 4/9 |
| Эстрадиол | 7/9 a | 1/9 b | 0/9 b | 1/9 |
| IGF-связывающие белки | ||||
| BP-3 | 2/8 | 4/8 | 2/8 | |
| BP-2 | 2/8 | 2/8 | 4/8 | |
| BP-5 | 2/8 | 1/8 | 5/8 | |
| BP-4 | 0 / 7 a | 0/7 a | 7/7 b | |
| Характеристики фолликулов . | Доля когорт . | |||
|---|---|---|---|---|
| Наибольшее . | Средний . | Наименее . | Не определено . | |
| Диаметр | 3/9 | 2/9 | 0/9 | 4/9 |
| Эстрадиол | 7/9 a | 1/9 b | 0/9 b | 1/9 |
| IGF-связывающие белки | ||||
| BP-3 | 2/8 | 4/8 | 2/8 | |
| BP-2 | 2/8 | 2/8 | 4/8 | |
| BP-5 | 2/8 | 1/8 | 5/8 | |
| BP-4 | 0 / 7 a | 0/7 a | 7/7 b | |
Рис.1
Предполагаемая последовательность событий при выборе доминирующего фолликула у крупного рогатого скота. Эта модель предполагает, что критическим событием функционального отбора является индукция ФСГ протеазы для IGFBP-4 в одном фолликуле когорты и что функциональный отбор быстро сопровождается морфологическим отбором и дальнейшей дифференцировкой доминантного фолликула
Рис.
Предполагаемая последовательность событий при выборе доминирующего фолликула у крупного рогатого скота. Эта модель предполагает, что критическим событием функционального отбора является индукция ФСГ протеазы для IGFBP-4 в одном фолликуле когорты и что функциональный отбор быстро сопровождается морфологическим отбором и дальнейшей дифференцировкой доминантного фолликула
Дифференциация доминантного фолликула. Фолликулы
Доминантные фолликулы продолжают дифференцироваться после отбора.Интересно, что фолликулы, отобранные во время лютеиновой фазы, демонстрируют подавление эстрадиол-продуцирующей способности, о чем свидетельствует прогрессивное снижение эстрадиола в фолликулярной жидкости вскоре после морфологического отбора (Таблицы 1 и 2). Эксперименты группы Миссури показали, что уровни мРНК стероидогенных ферментов и рецепторов гонадотропина в доминантном фолликуле также начинают снижаться вскоре после того, как произошел отбор (таблицы 3 и 4). Если лютеиновая регрессия происходит или индуцируется во время доминирования фолликула, снижение выработки эстрадиола может быть обращено вспять.Концентрация эстрадиола в фолликулярной жидкости увеличивается, и это связано с увеличением мРНК 17α-OH и повышенной секрецией андрогенов без изменения мРНК ароматазы [49]. Таким образом, оказывается, что доминантные фолликулы могут «выбегать» в течение, по крайней мере, нескольких дней после отбора и все еще реагировать на повышенную частоту импульсов ЛГ, которая сопровождает регресс лютеиновой кислоты, увеличением эстрадиола во время последующей фолликулярной фазы.
Резюме и выводы
Большой прогресс был достигнут в определении того, чем доминирующие фолликулы отличаются от подчиненных им фолликулов.Применение ультразвуковой визуализации яичников крупного рогатого скота для ежедневного наблюдения за отдельными фолликулами когорты было технологическим достижением, сделавшим этот прогресс возможным. Способность увеличивать выработку эстрадиола раньше подчиненных фолликулов кажется решающей для успеха доминирующего фолликула. Изменения в компонентах внутрифолликулярной системы IGF, особенно в ингибирующих IGFBP с низкой молекулярной массой, стали критическими компонентами механизмов, которые позволяют будущему доминантному фолликулу секретировать больше эстрадиола.Недавняя разработка методов отбора проб фолликулярной жидкости, не нарушающих нормальный характер роста фолликулов, является еще одним важным техническим достижением, которое должно способствовать развитию в будущем. Похоже, что при отборе фолликулов раса идет к фолликулу, который первым «выходит из строя», приобретая характеристики, усиливающие секрецию фолликулярного эстрадиола. Остается определить, почему только один фолликул приобретает эти характеристики.
Список литературы
1.Fortune
JE
.Динамика фолликулов во время полового цикла крупного рогатого скота: лимитирующий фактор в улучшении фертильности?
.Anim Reprod Sci
1993
33
:111
—125
2.Ginther
OJ
,Wiltbank
MC
,Fricke
000 PM
Кот
К
.Выбор доминирующего фолликула у крупного рогатого скота
.Biol Reprod
1996
55
:1187
—1194
3.Fortune
JE
.Рост и развитие фолликулов яичников у млекопитающих
.Biol Reprod
1994
50
:225
—232
4.Adams
GP
,Kot
K
,Smith
CA
ther
Gin
Выбор доминантного фолликула и подавление роста фолликулов у телок
.Anim Reprod Sci
1993
30
:259
—271
5.Rivera
GM
,Fortune
JE
.Развитие кодоминантных фолликулов у крупного рогатого скота связано с протеазой
, связывающей ФСГ-зависимый инсулиноподобный фактор роста, связывающий белок-4 (IGFBP-4).Биол Репрод
2001
;65
:112
—118
6.Badinga
L
,Driancourt
MA
,Savio
JD
,Wolfenson
D
D
де ла Сота
RL
,Тэтчер
WW
.Эндокринные реакции и реакции яичников, связанные с доминантным фолликулом первой волны у крупного рогатого скота
.Biol Reprod
1992
47
:871
—883
7.Bodensteiner
KJ
,Wiltbank
MC
,Bergfelt
DR
DR
Bergfelt
DR
Изменения в фолликулярных рецепторах эстрадиола и гонадотропина при развитии антральных фолликулов крупного рогатого скота
.Териогенология
1996
45
:499
—512
8.Эванс
ACO
,Fortune
JE
.Выбор доминирующего фолликула у крупного рогатого скота происходит при отсутствии различий в экспрессии мессенджера рибонуклеиновой кислоты для рецепторов гонадотропина
.Эндокринология
1997
138
:2963
—2971
9.Ginther
OJ
,Кот
K
,Kulick
LJЗабор фолликулярной жидкости без изменения фолликулярного статуса у крупного рогатого скота: концентрация эстрадиола в начале фолликулярной волны
.J Reprod Fertil
1997
;181
—186
10.Evans
ACO
,Komar
CM
,Wandji S-A, Fortune JE. Изменения секреции андрогенов и амплитуды пульса лютеинизирующего гормона связаны с привлечением и ростом фолликулов яичников во время лютеиновой фазы эстрального цикла крупного рогатого скота
.Biol Reprod
1997
57
:394
—401
11.Ginther
OJ
,Bergfelt
DR
,Kulick3000
L
Выбор доминирующего фолликула у крупного рогатого скота: роль эстрадиола
.Biol Reprod
2000
63
:383
—389
12.Ginther
OJ
,Bergfelt
DR
,Kulick3000
L
Выбор доминирующего фолликула у крупного рогатого скота: роль двустороннего функционального взаимодействия между фолликулостимулирующим гормоном и фолликулами
.Biol Reprod
2000
62
:920
—927
13.Kaneko
H
,Taya
K
,Watanabe
000
G2000 Kikuchi
K
,Shimada
A
,Hasegawa
Y
.Ингибин участвует в подавлении секреции ФСГ в фазе роста доминантного фолликула во время ранней лютеиновой фазы у коров
.Domest Anim Endocrinol
1997
14
:263
—271
14.Knight
PG
,Feist
SA
,Tannetta
DS2
DS2
Фаулер
PA
,O’Brien
M
,Groome
NP
.Измерение ингибина-A (димера α βA) во время эстрального цикла, после изменения активности яичников и во время беременности у овец
.J Reprod Fertil
1998
113
:159
—166
15.Ginther
OJ
,Кот
K
,Kulick
9J
Возникновение и отклонение фолликулов при развитии фолликулярных волн у крупного рогатого скота
.Териогенология
1997
48
:75
—87
16.Mihm
M
,Austin
EJ
,Good
TEM
9000 Knight,Knight
PG
,Рош
JF
,Ирландия
JJ
.Идентификация потенциальных внутрифолликулярных факторов, участвующих в отборе доминантных фолликулов у телок
.Biol Reprod
2000
63
:811
—819
17.Bao
B
,Garverick
HA
.Экспрессия генов стероидогенных ферментов и рецепторов гонадотропина в фолликулах крупного рогатого скота во время фолликулярных волн яичников: обзор
.J Anim Sci
1998
76
:1903
—1921
18.Xu
Z
,Garverick
HA
,Smith
GW
,Smith
GW
Гамильтон
SA
,Youngquist
RS
.Экспрессия матричной рибонуклеиновой кислоты, кодирующей расщепление боковой цепи цитохрома P450, 17α-гидроксилазу цитохрома P450 и ароматазу цитохрома P450 в фолликулах крупного рогатого скота во время первой фолликулярной волны
.Эндокринология
1995
136
:981
—989
19.Xu
Z
,Garverick
HA
,Smith
GWGW
SA
,Youngquist
RS
.Экспрессия рибонуклеиновых кислот фолликулостимулирующего гормона и рецептора лютеинизирующего гормона в фолликулах крупного рогатого скота во время первой фолликулярной волны
.Biol Reprod
1995
53
:951
—957
20.Bao
B
,Garverick
HA
,Smith
GW2
SalfenBE
,Youngquist
RS
.Изменения в матричной рибонуклеиновой кислоте, кодирующей рецептор лютеинизирующего гормона, расщеплении боковой цепи цитохрома P450 и ароматазе, связаны с привлечением и отбором фолликулов яичников крупного рогатого скота
.Biol Reprod
1997
56
:1158
—1168
21.Bao
B
,Garverick
HA
,Smith
GW2
SalfenBE
,Youngquist
RS
.Экспрессия матричной рибонуклеиновой кислоты (мРНК), кодирующей 3β-гидроксистероиддегидрогеназу Δ 4 , Δ 5 изомераза (3β-HSD) во время набора и отбора фолликулов яичников крупного рогатого скота: идентификация доминантных фолликулов по экспрессии мРНК 3β-HSD в слое гранулезных клеток
.Biol Reprod
1997
56
:1466
—1473
22.Bao
B
,Calder
MD
,Xie
S
, SalfenBE
,Youngquist
RS
,Garverick
HA
.Экспрессия стероидогенного белка-мессенджера рибонуклеиновой кислоты ограничена тканью здоровых фолликулов крупного рогатого скота, собранной во время набора, отбора и доминирования фолликулов первой фолликулярной волны
.Biol Reprod
1998
59
:953
—959
23.Berndtson
AK
,Vincent
SE
,Fortune
JE
JE
.
Низкие и высокие концентрации гонадотропинов по-разному регулируют выработку гормонов внутренними теками и клетками гранулезы из преовуляторных фолликулов крупного рогатого скота
.Biol Reprod
1995
52
:1334
—1342
24.Willis
DS
,Watson
H
,Mason
HD
a,
Brincat
M
,Franks
S
.Преждевременный ответ на лютеинизирующий гормон гранулезных клеток у ановуляторных женщин с синдромом поликистозных яичников: отношение к механизму ановуляции
.J Clin Endocrinol Metab
1998
83
:3984
—3991
25.Fortune
JE
,Hilbert
JL
.Секреция эстрадиола гранулезными клетками крыс с четырех- или пятидневным эстральным циклом: развитие ответов на фолликулостимулирующий гормон по сравнению с лютеинизирующим гормоном
.Эндокринология
1986
118
:2395
—2401
26.Железник
AJ
.Выбор фолликулов у приматов: «много званых, но мало избранных»
.Биол Репрод
2001
;65
:655
—659
27.Campbell
BK
,Dobson
H
,Baird
DT
,Scaramuzzi
.
Изучение относительной роли ФСГ и ЛГ в механизме отбора овуляторных фолликулов у овец
.J Reprod Fertil
1999
117
:355
—367
28.Fortune
JE
.Клетки тека и гранулезы крупного рогатого скота взаимодействуют, способствуя выработке андрогенов
.Biol Reprod
1986
35
:292
—299
29.Poretsky
L
,Cataldo
NA
,Rosenwaks
Rosenwaks
Связанная с инсулином система регуляции яичников в здоровье и болезнях
.Endocr Rev
1999
20
:535
—582
30.Spicer
LJ
,Echternkamp
SE
.Система инсулина яичников и инсулиноподобного фактора роста с акцентом на домашних животных
.Domest Anim Endocrinol
1995
12
:223
—245
31.Baker
J
,Hardy
MP
,Zhou
J
,Bondy
C
,Lupu
F
,000 A Belladve
0003Влияние нулевой мутации гена Igf1 на репродукцию мышей
.Mol Endocrinol
1996
10
:903
—918
32.Jones
JI
,Clemmons
DR
.Инсулиноподобные факторы роста и их связывающие белки: биологическое действие
.Endocr Ред.
1995
16
:3
—34
33.Monget
P
,Besnard
N
,Huet
C
,Monniaux
D
.Белки, связывающие инсулиноподобный фактор роста и фолликулогенез яичников
.Horm Res
1996
45
:211
—217
34.Kelley
KM
,Oh
Y
,Gargosky
SE
,Gucev
Z
,Matsumoto
T
,9000 9000 Hwa
Симпсон
DM
,Розенфельд
RG
.Белки, связывающие инсулиноподобный фактор роста (IGFBP) и их регуляторная динамика
.Int J Biochem Cell Biol
1996
28
:619
—637
35.юаней
W
,Bao
B
,Garverick
HA
,Youngquist
RS
,Lucy
MC
.Доминирование фолликулов у крупного рогатого скота связано с различными паттернами экспрессии генов яичников для инсулиноподобного фактора роста (IGF) -I, IGF-II и IGF-связывающего белка-2 в доминантных и подчиненных фолликулах
.Domest Anim Endocrinol
1998
15
:55
—63
36.Армстронг
DG
,Gutierrez
CG
,Baxter
G
,Глазырин
AL
,Mann
GE
000000
Woad
0003000Woad
Уэбб
Р
.Экспрессия мРНК, кодирующей IGF-I, IGF-II и рецептор IGF 1 типа в фолликулах яичников крупного рогатого скота
.Дж Эндокринол
2000
165
:101
—113
37.Spicer
LJ
,Alpizar
E
,Echternkamp
SE
.Влияние инсулина, инсулиноподобного фактора роста I и гонадотропинов на пролиферацию клеток гранулезы крупного рогатого скота, продукцию прогестерона, выработку эстрадиола и (или) выработку инсулиноподобного фактора роста I in vitro
.J Anim Sci
1993
71
:1232
—1241
38.Stewart
RE
,Spicer
LJ
,Hamilton
TD
Dawson
LJ
,Morgan
GL
,Echternkamp
SE
.Уровни белков, связывающих инсулиноподобный фактор роста (IGF), лютеинизирующего гормона и рецепторов IGF-I, а также стероидов в доминантных фолликулах во время первой фолликулярной волны у крупного рогатого скота, демонстрирующего регулярные половые циклы
.Эндокринология
1996
137
:2842
—2850
39.Khamsi
F
,Armstrong
DT
.Взаимодействие фолликулостимулирующего гормона и факторов роста в регуляции синтеза дезоксирибонуклеиновой кислоты в клетках гранулезы крупного рогатого скота
.Biol Reprod
1997
57
:684
—688
40.Echternkamp
SE
,Howard
HJ
,zzle Roberts
000 9ri0002 МудрыйТ
.Взаимосвязь между концентрациями стероидов, инсулиноподобного фактора роста-I и белков, связывающих инсулиноподобный фактор роста, в фолликулярной жидкости яичников мясного крупного рогатого скота
.Биол Репрод
1994
51
:971
—981
41.Станко
RL
,Cohick
WS
,Shaw
DW
,Harvey
RW
,Clemmons
DR
, WhitacreDR
,Whitacre
000
Влияние соматотропина и / или хорионического гонадотропина лошади на сывороточный и фолликулярный инсулиноподобный фактор роста I и белки, связывающие инсулиноподобный фактор роста у крупного рогатого скота
.Биол Репрод
1994
50
:290
—300
42.Funston
RN
,Seidel GE Jr, Klindt J, Roberts AJ. Инсулиноподобный фактор роста I и белки, связывающие инсулиноподобный фактор роста в бычьей сыворотке и фолликулярной жидкости до и после преовуляторного выброса лютеинизирующего гормона
.Biol Reprod
1996
55
:1390
—1396
43.de la Sota
RL
,Simmen
FA
,That Diaz
T .
Система инсулиноподобных факторов роста в доминантных и подчиненных фолликулах первой волны крупного рогатого скота
.Biol Reprod
1996
55
:803
—812
44.Armstrong
DG
,Baxter
G
,Gutierrez
000CG Глазырин
AL
,Campbell
BK
,Bramley
TA
,Webb
R
.Инсулиноподобный фактор роста, связывающий белок -2 и -4, мессенджер экспрессии рибонуклеиновой кислоты в фолликулах яичников крупного рогатого скота: влияние гонадотропинов и статус развития
.Эндокринология
1998
139
:2146
—2154
45.Rechler
MM
.Белки, связывающие инсулиноподобный фактор роста
.Vitam Horm
1993
47
:1
—114
46.Mihm
M
,Good
TEM
,Ирландия
JLH
,Ирландия
JJ
,Knight
PG
,Roche
.
Снижение концентрации фолликулостимулирующего гормона в сыворотке изменяет ключевые внутрифолликулярные факторы роста, участвующие в выборе доминирующего фолликула у телок
.Биол Репрод
1997
57
:1328
—1337
47.Армстронг
DG
,Hogg
CO
,Campbell
BK
,Webb
R
.Производство белка, связывающего инсулиноподобный фактор роста (IGF), первичными культурами овечьих гранулезных и тека-клеток. Эффекты IGF-I, гонадотропина и размер фолликула
.Biol Reprod
1996
55
:1163
—1171
48.Rivera
GM
,Chandrasekher
YA
,ACC
000
000
000 Evolution
000
000 Fortune
JE
.Потенциальная роль протеолиза белка-4, связывающего инсулиноподобный фактор роста (IGFBP-4), в установлении доминирования фолликулов яичников у крупного рогатого скота
.Биол Репрод
2001
;65
:102
—111
49.Tian
XC
,Berndtson
AK
,Fortune
JE
.Дифференциация преовуляторных фолликулов крупного рогатого скота во время фолликулярной фазы связана с увеличением содержания рибонуклеиновой кислоты-мессенджера для расщепления боковой цепи цитохрома P450, 3β-гидроксистероиддегидрогеназы и 17α-гидроксилазы P450, но не ароматазы P450
.Эндокринология
1995
136
:5102
—5110
Заметки автора
© 2001 Общество изучения репродукции, Inc.
Репродукция человека, Лекции: Жизненный цикл яичников
Яичник, постоянно меняющаяся ткань, представляет собой многокомпонентный орган с широким спектром различных биологические свойства. В ответ на циклическую секрецию гонадотропинов гипофизом различные фолликулярные отсеки взаимодействуют высоко интегрированным и, казалось бы, запрограммированным образом.Все это, конечно, разработан, чтобы служить единственной центральной цели; т. е. образование зрелой оплодотворяемой яйцеклетки для последующее сохранение вида. В Сердцем жизненного цикла яичников является фолликул, признанный фундаментальной функциональной единицей яичника. с середины шестнадцатого века.
Жизненный цикл яичников начинается в самом неожиданном месте; т.е. стенка желточного мешка и брюшная стенка задней кишки у истока аллантоисного выпячивания.Именно здесь первичные половые клетки происходят либо из, либо среди примитивных энтодермальных клеток где-то к концу третьего неделя беременности. Это, в свою очередь, сопровождается миграцией элементов зародышевой клетки в примитивные клетки. гонадные складки на 3-5 неделе жизни.
Эта замечательная транслокация сопровождается неуклонным увеличением количества клеток за счет митотической подразделения. Считается, что передвижение осуществляется амебоидными движениями, использованием псевдоподий, и, конечно же, некоторая форма хемотаксического руководства.
При появлении генитального гребня к пятой неделе беременности премейотические половые клетки, в настоящее время называемые как оогонии, продолжают размножаться по мере оседания. В течение последующих двух недель внутриутробного жизни, с 5-й по 7-ю недели беременности (часто именуемой «индифферентной стадией»), первичные гонадные структура представляет собой не более чем выпуклость на медиальной стороне мочеполового гребня.
С этого момента оогониальное наделение подлежит трем одновременным текущим процессам: митоз, мейоз и атрезия (дегенерация).Мейоз не только превращает оогонии в первичные ооциты. задолго до фактического образования фолликула, но, в отличие от митоза, также обеспечивает временную защиту от оогониальная атрезия, тем самым позволяя зародышевым клеткам заполнять себя клетками гранулезы и образовывать примордиальные фолликулы. В результате комбинированного воздействия митоза, уравновешенного атрезией, количество половых клеток достигает пика от 6 до 7 x 106 к 20 неделе беременности, при этом две трети все половые клетки являются внутримейотическими диктиатными первичными ооцитами, в то время как оставшаяся треть все еще может рассматриваться как оогониал.Некоторые из первых тем временем вложили в себя единственный слой веретена. сформированные (некубовидные) примордиальные (пре) гранулезные клетки, тем самым давая начало примордиальным фолликулам, формирование которых начинается примерно на 16 неделе беременности.
Однако, начиная с середины переваривания, неуклонное и необратимое истощение постепенно уменьшает накопление зародышевых клеток яичников посредством фолликулярной (а не оогониальной) атрезии, которая начинается около на шестом месяце беременности и продолжается на протяжении всей жизни.В конце концов, примерно 50 лет спустя то, что было так называемый «генный банк» ооцитов окончательно исчерпан. Следовательно, новорожденные младенцы женского пола попадают в жизнь, все еще далекая от реализации репродуктивного потенциала, потеряв до 80% своей половой клетки эндаумент. К началу полового созревания практически 95% всех фолликулов потеряны, всего от 400 до 500 из них. которые (т.е. <1% от общего числа) фактически будут овулировать в течение репродуктивной жизни.
Хотя в настоящее время существует мало информации о морфогенных принципах, ответственных за фолликулярную организации, совершенно очевидно, что формирование примордиальных фолликулов (закончиться не позднее, чем через полгода послеродовой), первый шаг в развитии фолликулов, полностью не зависит от гонадотропинов.Несмотря на то что другие факторы, несомненно, играют роль, практически наверняка даже самые ранние фазы фолликулярного развитие за пределами стадии примордиального фолликула является гонадотропин-зависимым. После приема на работу примордиальные фолликулы мигрируют в медуллярную область яичника для дальнейшего развития.
Следующая фаза развития фолликулов, так называемая фаза медленного роста, связана с преобразование примордиальных фолликулов диаметром 60 мкм в первичные фолликулы и, в конечном итоге, в созревание вторичные, но все же преантральные фолликулы диаметром 120 мкм.Процесс начинается, когда веретенообразный granulosa клетки-предшественники некоторых примордиальных фолликулов дифференцируются в один слой кубовидных клеток окружает первичный ооцит, образуя первичные фолликулы. После этого распространение первичных клетки фолликулярной гранулезы дают начало множеству клеточных слоев, тем самым образуя преантральный и, в конечном итоге, антральный «вторичный фолликул», максимальное количество клеток гранулезы которого оценивается в 600. это указывает на то, что клетки гранулезы становятся физиологически связанными щелевыми контактами.Результирующий электрическая связь дает расширенный, но интегрированный и функциональный синцитий, связанный с изменение метаболизма и транспорт диффузных низкомолекулярных веществ, тем самым компенсация бессосудистой внутрифолликулярной среды. Кроме того, клетки гранулезы расширяют цитоплазматические процессы, чтобы сформировать гестационные соединения, подобные щелевому соединению, с плазматической мембраной ооцит. Несомненно, именно эта последняя коммуникационная система в значительной мере отвечает за жесткий контроль со стороны гранулезных кумулюсных клеток над возобновлением мейоза за счет первичный ооцит.
Хотя ранняя «внутренняя тека» на самом деле была получена в конце стадии первичного фолликула, «внешняя тека» — это характеристика вторичного фолликула, образующегося только по мере его расширения и сжимает окружающую строму. В то время как клетки внутренней теки принимают эпителиоидный вид и характеристики стероидогенных клеток, внешняя тека, в свою очередь, сохраняет свою веретеновидную конфигурацию, тем самым сливаясь с соседними стромальными клетками.
Именно на этом этапе вторичный, все еще преантральный фолликул отправляется в 85-дневный путь, охватывающий три овуляторных цикла, во время которых вторичный фолликул диаметром 120 мкм превратится в Граафов преовуляторный фолликул диаметром 20 мм.Первый этап пути, так называемый ускоренный фаза роста, составляет фолликулогенный сегмент, в котором преантральные вторичные фолликулы 120 мкм в диаметром 2 мм преобразуются в антральные фолликулы. Эта фаза роста характеризуется 600-кратное увеличение количества клеток гранулезы одновременно с более чем 15-кратным увеличением общего диаметр фолликула. Это общее увеличение размера фолликулов достигается не только за счет гранулезных клеток. пролиферация, но также и за счет прогрессирующего увеличения антрального отдела (центральная полость, заполненная фолликулярной жидкостью), тем самым устанавливаются вторичные антральные фолликулы.
Термин набор используется здесь для обозначения того, что фолликул вступил в окончательную траекторию роста, т.е. хорошо охарактеризованный образец роста и развития. Это лютеиновый бассейн Вторичные антральные фолликулы диаметром 2 мм, которые представляют собой стартовую площадку, из которой фолликулы, предназначенные для овуляция в следующем цикле будет задействована. Действительно, фолликулы должны проходить через терминальную экспоненциальную фаза роста, в течение которой 2-миллиметровые фолликулы достигают преовуляторного (граафического) статуса (и 20-миллиметрового фолликула). диаметр), в которой ооцит занимает эксцентрическое положение, окруженный несколькими слоями кумулюс гранулезные клетки.
Важно отметить, что именно во время этой последней фазы фолликулогенеза завершается отбор фолликулов. Этот термин подразумевает окончательное рассеяние созревающей, но еще не вполне доминирующей фолликулярной когорты, путем атрезии, вниз до размера, равного типичной для вида овуляторной норме. У человека фолликулярный отбор предполагается, что это происходит в течение первых пяти дней цикла в то время, когда диаметр ведущего фолликула От 5 до 10 мм.
Термин «доминирование» относится к состоянию фолликула, которому суждена овуляция, учитывая его предполагаемую ключевую роль в регулирование размера овуляторной квоты. У человека принято считать, что выбранный фолликул становится доминирующей примерно за неделю до овуляции; т.е. уже на 5-7 дни цикла за раз когда диаметр фолликула составляет около 10 мм. Только доминантный фолликул на данный момент может похвастаться обнаруживаемые уровни ФСГ в фолликулярной жидкости.Ожидается, что тот же самый фолликул также имеет значительную фолликулярный уровень эстрадиола.
В конце концов, именно доминантный фолликул под воздействием выброса ЛГ в середине цикла подвергается драматические преобразования, направленные на дальнейшее созревание ооцитов, а также на разрыв фолликулов. Все Говорят, именно разрыв фолликула завершает жизненный цикл собственно фолликула, инициируя жизненный цикл его преемника — желтого тела.По мере приближения середины цикла отмечается резкий рост циркулирующих уровней эстрадиола, за которым, в свою очередь, следует выброс ЛГ (и, в меньшей степени, ФСГ), способный вызвать разрыв фолликула, хорошо учредил. Это выброс гонадотропинов в середине цикла, который знаменует конец фолликулярной фазы цикла. и предшествует фактическому разрыву на целых 36 часов. По не совсем понятным причинам, но, возможно, из-за уникальных обстоятельств микросреды происходит овуляция одного (редко более одного) фолликула и дает начало желтому телу во время каждого менструального цикла.Механически овуляция состоит из быстрого увеличения фолликула с последующим выпячиванием фолликула. с поверхности коры яичника. В конечном итоге разрыв фолликула приводит к экструзии ооцит-кумулюсный комплекс. Случайная эндоскопическая визуализация яичника во время овуляции показывает, что возвышение конической «стигмы» на поверхности выступающего фолликула предшествует разрыву. Разрыв этого клейма сопровождается мягким, а не взрывным изгнанием ооцита и антральная жидкость, что свидетельствует о том, что последняя не находится под высоким давлением.
После овуляции доминирующий фолликул реорганизуется и становится желтым телом. Таким образом, после разрыва фолликула, капилляры и фибробласты из окружающей стромы пролиферируют и проникают в базальные пластинка. Эта быстрая васкуляризация желтого тела может быть легко обусловлена ангиогенным фактором (ами). обнаруживается в фолликулярной жидкости. Одновременно клетки настенной гранулезы претерпевают морфологические изменения. вместе именуемые «лютеинизация».»Эти последние клетки, окружающие интерстициальные клетки теки и проникающая сосудистая сеть перемешивается, давая начало желтому телу. Понятно, что это эндокринная железа который является основным источником половых стероидных гормонов, секретируемых яичниками во время постовуляторной фазы цикла. Важным аспектом этого явления является проникновение в основание фолликула. через кровеносные сосуды, тем самым обеспечивая гранулезные / лютеиновые клетки циркулирующими уровнями ЛПНП.
В норме продолжительность функционирования желтого тела составляет 14 + 2 дня.После этого желтое тело самопроизвольно регрессирует, чтобы заменить (если не наступила беременность) по крайней мере пять циклов спустя бессосудистый рубец, именуемый «альбиканским телом». Механизмы, лежащие в основе лютеолиза, остаются не понятно. Однако нет сомнений в центральной роли ЛГ в поддержании желтого тела. функция. Таким образом, отмена поддержки олигогидрамниона при различных экспериментальных обстоятельствах практически всегда приводил к отмиранию лютеиновой кислоты. Однако в случае промежуточной беременности ХГЧ, секретируемый трофобластом плода, поддерживает способность желтого тела вырабатывать прогестерон, что позволяет поддерживать ранние сроки беременности до лютеоплацентарного сдвига.
Клетки преантральной гранулезы в основном нацелены на ФСГ. Действительно, незначительное количество LH рецепторов наблюдается в преантральных клетках гранулезы. В этот момент связывание ЛГ ограничивается тканью интерстициальные клетки. Однако важно отметить, что клетки гранулезы антральных фолликулов, по-видимому, способны связывать как ЛГ и ФСГ. Таким образом, в отличие от наличия рецепторов ФСГ в клетках гранулезы из фолликулов всех размеров, рецепторы ЛГ обнаруживаются только в клетках гранулезы крупных преовуляторных фолликулов.Эти наблюдения согласуются с представлением о том, что онтогенетическое приобретение рецепторов ЛГ находится под влиянием ФСГ. Гормональное действие ЛГ и ФСГ, по-видимому, требует промежуточного взаимодействия мембранно-ассоциированных фермент аденилатциклаза. Действительно, общепринято, что стимуляция гонадотропинами аденилатциклаза приводит к превращению внутриклеточного АТФ в цАМФ. Последнее, в свою очередь, считается связываться с регуляторной субъединицей протеинкиназы (обычно называемой А-киназой), после чего каталитическая субъединица фермента активируется и диссоциирует.Последний, в свою очередь, фосфорилирует ключевые внутриклеточные белки, центральные в последовательности передачи сигнала. Однако точная природа вовлеченные белки остаются неизвестными в настоящее время.
Клетки гранулезы являются клеточным источником двух наиболее важных стероидов яичников, эстрадиола и прогестерон. Хотя клетки гранулезы и их лютеинизированные аналоги способны продуцировать прогестерон не зависит от других типов клеток яичников, биосинтез эстрогенов требует сотрудничества между клетками гранулезы и их текальными соседями.Участие этих двух типов клеток и два гонадотропина (ФСГ и ЛГ) в биосинтезе эстрогенов яичниками лежат в основе концепции двух гипотеза клеток / двух гонадотропинов, интегративного процесса, необходимого для биосинтеза эстрогена в яичниках. Согласно этой точке зрения, производные теки, ЛГ-зависимые ароматизируемые андрогены (андростендион и тестостерон) под действием ФСГ-индуцируемой ароматазы клеток гранулезы. Более широкий взгляд на эта концепция может и, вероятно, должна позволить ее расширить, чтобы включить межклеточные обмены другими стероидогенные субстраты (например,g., прогестины C21).
Гранулезная (как и интерстициальная тека) клетка в достаточной степени наделена необходимостью осуществлять биосинтез прогестина. Центральным в этом процессе является наличие обильных запасов холестерина, который служит стартовой материал для стероидогенного каскада. Недавние исследования показали, что холестерин, используемый в качестве стероидов. Производство гормонов происходит в основном за счет циркулирующих в сыворотке липопротеидов низкой плотности (ЛПНП), а не чем от клеточного биосинтеза de novo из ацетата.Известно, что частицы ЛПНП связываются со специфическими мембранные рецепторы, комплексы ЛПНП-рецептор, проникающие в клетку посредством рецепторно-опосредованного эндоцитоза. Образовавшийся свободный холестерин повторно этерифицируется и сохраняется в цитоплазме в виде липидных капель. Столкнулся с стероидогенные потребности, сложный эфир холестерина гидролизуется, а свободный холестерин транспортируется в митохондрии для стандартной стероидогенной обработки. Соответственно холестерин превращается в прегненолон за счет лимитирующего скорость расщепления боковой цепи холестерина митохондриального фермента.В последующее превращение прегненолона в прогестерон происходит относительно легко благодаря относительной обилие цитоплазматических ферментов 3-бета-гидроксистероиддегидрогеназа / D5, D4-изомераза.
Нет никаких сомнений в том, что гранулезные и интерстициальные клетки теки способны вырабатывать большие количество белков, оцененное с помощью анализа гель-фракционирования. Столь же ясно, что идентичность большинства количество выработанных белков остается загадкой в настоящее время.С другой стороны, измеримое количество легко идентифицируемые белки. Многие, например стероидогенные ферменты и клеточная поверхность рецепторы, совершенно очевидны. Другие кратко обсуждаются ниже.
- Ингибин , ФСГ-индуцибельный (32 кДа) белок, представляет собой уникальный маркер гранулезных клеток, функциональная роль которых в репродуктивной физиологии активно исследуется. Структурно ингибин представляет собой гетеродимер, состоящий из общей альфа-субъединицы (18 кДа), но разные бета-субъединицы (14 кДа).Обе формы (a / BA и a / BB) ингибина (A и B соответственно) обладают схожими физиологическими свойствами. Хотя ингибин, вероятно, играет эндокринная роль за счет ингибирования высвобождения гонадотропинов гипофизом, недавние исследования показывают, что ингибин также может играть местную интраовариальную роль.
- Активин , в отличие от ингибина, состоит из димеров бета-субъединиц ингибина (BA / BB или BA / BA). Хотя, возможно, активна на уровне гипоталамо-гипофизарного блока, гранулезная Активин клеточного происхождения также усиливает индуцированную ФСГ индукцию рецепторы ЛГ гранулезных клеток.
- Фоллистатин , добавленный недавно, представляет собой одноцепочечный полипептид (315 аминокислотных остатков). кислоты), первоначально выделенные из фолликулярной жидкости свиньи. Хотя структурно отличается от как ингибин, так и активин, этот полипептид, производный от клеток гранулезы, индуцируемый ФСГ, появляется для подавления высвобождения гипофизарного ФСГ, но не ЛГ, подобно ингибину. Потенциальное значение фоллистатина для физиологии яичников, если таковое имеется, остается неизвестным в настоящее время. в этот раз.
Несмотря на воздействие высоких уровней циркулирующих гонадотропинов, яичник в постменопаузе атрофическая, желтоватая, матовая структура с морщинистой поверхностью, вес менее 10 г.Микроскопически кора тонкая и обычно лишена фолликулов (11,25; ранее 11,14). Несмотря на то что Менопаузальный яичник, лишенный фолликулов, не является отмершим эндокринным органом. Действительно, анализ кровь из периферических и яичниковых вен у женщин в постменопаузе указывает на то, что в постменопаузе яичники секретируют преимущественно андростендион и тестостерон. Фактически, концентрации тестостерон и андростендион в венозных выделениях яичников у женщин в постменопаузе — 15 и 4 в разы соответственно выше, чем их периферический венозный уровень.
Иногда в коре яичников в постменопаузе обнаруживаются признаки гиперплазии стромы. Когда гиперплазия стромы витая, яичник может быть увеличен, почти полностью состоящий из гиперплазии стромальные узелки. В таких случаях богатые липидами лютеинизированные клетки гиперпластической стромы напоминают внутренние клетки фолликула. Таким образом, яичники со стромальным гипертекозом могут производить достаточно андрогены, вызывающие циркуляцию тестостерона в мужском диапазоне, гирсутизм и вирилизацию.
Медулла яичника в постменопаузе большой по сравнению с корой, состоящая из белых тел. и Candicantia, пересеченная склерозированными кровеносными сосудами. Функционально наиболее важный медуллярный компонентом может быть корневая клетка, содержащая группы крупных эпителиоидных клеток, тесно связанных с пучки немиелинизированных нервных волокон и мелких сосудов. Гистохимически похож на интерстициальные клетки Предполагается, что коренные клетки семенников обладают значительным стероидогенным потенциалом.
Кормовые клетки редко вызывают функциональные новообразования; то есть опухоли клеток ворот. Последние обычно производят избыточное количество андрогенов, приводящее к признакам и симптомам вирилизма. Однако признаки и симптомы избытка эстрогена также может быть очевидным в обстоятельствах, характеризующихся значительным периферическим ароматизация.
Учитывая неизбежное гипоэстрогенное состояние вследствие прекращения функции яичников, несколько ключевых могут возникнуть осложнения. К ним относятся урогенитальная атрофия, приливы, остеопороз и повышенная сердечно-сосудистая заболеваемость и смертность.Эти осложнения, большинство из которых частично, если не полностью, связаны с дефицитом эстрогена, лучше всего управляются путем предоставления эстрогена заместительная терапия. По большей части это можно сделать, обеспечив эстрогеном некоторые или все календарный месяц. Эстроген, в свою очередь, может быть дополнен курсом прогестина для женщин. с неповрежденной маткой, в которой защита эндометрия имеет важное значение. Если не отмечено, постоянное безальтернативная эстрогенная стимуляция может привести к гиперплазии эндометрия и даже к раку эндометрия.Нет сомнений в том, что при отсутствии противопоказаний к заместительной терапии эстрогенами все Люди с недостаточностью эстрогена в менопаузе в принципе имеют право на заместительную терапию эстрогенами. Хотя последнее связано с небольшими, хотя и неопределенными рисками, текущий консенсус поддерживает эту идею. что преимущества намного перевешивают любые риски, связанные с этим терапевтическим подходом.
Регулирование и регулирующая роль передачи сигналов WNT в усилении действия ФСГ во время отбора доминантных фолликулов крупного рогатого скота
Abstract
Развитие фолликулов происходит волнообразно у одноплодных видов, таких как крупный рогатый скот и человек, и регулируется сложным взаимодействием гонадотропинов с местными внутрифолликулярными регуляторными молекулами.Для дальнейшего выяснения потенциальных механизмов, контролирующих отбор доминантных фолликулов, РНК клеток гранулезы, полученная из фолликулов F1 (самый большой) и F2 (второй по величине), выделенных на стадии предвариации (PD) и начала отклонения диаметра (OD) первой фолликулярной волны, была подвергнута предварительной обработке. Анализ транскриптома РНК. Наблюдалась экспрессия множества компонентов системы WNT. Поэтому были проведены эксперименты для проверки гипотезы о том, что передача сигналов WNT модулирует действие ФСГ на клетки гранулезы во время фолликулярных волн.Изобилие мРНК для участников пути WNT оценивали в клетках гранулезы, собранных из фолликулов на стадиях появления (EM), PD, OD и раннего доминирования (ED) первой фолликулярной волны. В фолликулах F1 численность мРНК CTNNB1 и DVL1 была выше, а мРНК AXIN2 была ниже на стадиях ED по сравнению с стадиями EM, а мРНК DVL1 и FZD6 была выше, а мРНК AXIN2 по сравнению с мРНК F12 была ниже в мРНК F12. этап ED. Клетки гранулезы крупного рогатого скота обрабатывали in vitro увеличивающимися дозами ингибитора WNT IWR-1 +/- максимальной стимулирующей дозы ФСГ.Обработка IWR-1 блокировала вызванное ФСГ увеличение количества клеток гранулезы и уменьшала вызванное ФСГ увеличение эстрадиола. Клетки гранулезы также культивировали в присутствии или в отсутствие ФСГ +/- IWR-1 и определяли гормональную регуляцию мРНК для участников пути WNT и известных мишеней ФСГ. Обработка ФСГ увеличила мРНК CYP19A1 , CCND2 , CTNNB1 , AXIN2 и FZD6 мРНК, а IWR-1 снизил стимулирующий эффект на мРНК CYP19A1 .Напротив, ФСГ уменьшал мРНК CARTPT , а IWR-1 частично обращал ингибирующий эффект ФСГ. Результаты подтверждают временную и гормональную регуляцию и потенциальную роль передачи сигналов WNT в усилении действия ФСГ во время отбора доминантных фолликулов.
Образец цитирования: Gupta PSP, Folger JK, Rajput SK, Lv L, Yao J, Ireland JJ, et al. (2014) Регулирование и регулирующая роль передачи сигналов WNT в усилении действия ФСГ во время отбора доминантных фолликулов крупного рогатого скота. PLoS ONE 9 (6): e100201.https://doi.org/10.1371/journal.pone.0100201
Редактор: Шерил С. Розенфельд, Университет Миссури, Соединенные Штаты Америки
Поступила: 12 февраля 2014 г .; Дата принятия: 22 мая 2014 г .; Опубликовано: 17 июня 2014 г.
Авторские права: © 2014 Gupta et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: P.S.P. Гупта получил поддержку в Университете штата Мичиган от Департамента биотехнологии, награды CREST правительства Индии. Этот проект был поддержан Конкурсным грантом Инициативы по исследованиям в области сельского хозяйства и пищевых продуктов No. 2009-65203-05700 от Национального института продовольствия и сельского хозяйства Министерства сельского хозяйства США в G.W.S., Грант Национального фонда естественных наук Китая № 31172211 L. Lv, а также финансирование от Программы репродуктивных наук и исследований развития Университета штата Мичиган и Michigan AgBioResearch.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Точные механизмы, регулирующие видоспецифичное количество фолликулов, которые растут и овулируют, в то время как все другие растущие фолликулы подвергаются атрезии, плохо изучены. У видов с единственной овуляцией, таких как крупный рогатый скот и человек, рост антрального фолликула происходит по характерной волнообразной схеме [1] — [3].Возникновению каждой фолликулярной волны предшествует преходящее повышение сывороточного ФСГ, что способствует появлению когорты малых антральных фолликулов. Перед лицом снижения концентрации ФСГ, как правило, единственный доминантный фолликул из этой когорты продолжает расти до овуляторного размера и вырабатывает повышенное количество эстрадиола. Оставшиеся более мелкие «подчиненные» фолликулы теряют способность производить эстрадиол и умирают из-за атрезии. Отбор единственного доминантного фолликула — это эволюционно законсервированный механизм, имеющий решающее значение для контроля числа потомков от одной беременности у одноплодных видов.
В то время как ключевая роль гонадотропинов гипофиза в опосредовании волновой модели фолликулярного развития хорошо известна, внутрифолликулярные механизмы и регуляторные молекулы, которые являются обязательными для выбора одного доминирующего фолликула во время каждой фолликулярной волны, полностью не установлены. Повышенная способность доминантного фолликула вырабатывать эстрадиол имеет решающее значение для поддержания роста доминантного фолликула и инициирования эстрального поведения, преовуляторного выброса гонадотропинов, возобновления мейоза и овуляции [4].Производство эстрадиола во время развития фолликулов у крупного рогатого скота регулируется различными гормонами и факторами роста, включая ФСГ [3], IGF1 [3], [5], [6], CART [7], BMP2 [8], а также сам эстрадиол [9] ]. Недавно на грызунах было показано, что продукция эстрадиола регулируется членами сигнального семейства сайтов интеграции вируса опухоли молочной железы мышей бескрылого типа (WNT), которые модулируют действие ФСГ [10], [11]. Хотя WNT важен для развития яичников [12], его механистическая роль в регуляции фолликулогенеза во взрослых яичниках, особенно в контексте фолликулярных волн, не совсем понятна.
WNT являются секретируемыми лигандами, которые передают свои сигналы путем связывания с Frizzled (FZD) семейством рецепторов, связанных с G-белками (обзор в [12]). WNT контролируют множественные процессы развития, включая спецификацию клеточной судьбы, пролиферацию, дифференцировку и апоптоз, а дисрегуляция WNT участвует в развитии рака, особенно рака прямой кишки [13]. Члены семейства WNT действуют тремя разными путями; канонический путь WNT / β-катенин (CTNNB1), путь неканонической планарной полярности клеток и путь WNT / Ca2 +.В нестимулированной клетке AXIN2 будет связываться с CTNNB1 в комплексе с GSK3β и APC, что приводит к быстрой протеолитической деградации CTNNB1. В каноническом пути лиганд WNT будет связываться со своим рецептором FZD и корецептором белка, связанного с рецептором LDL (LRP), который активирует Disheveled 1 (DVL1) для связывания с AXIN2 и нарушает образование AXIN2 / Комплекс GSK3β / APC / CTNNB1. Это останавливает протеолитическую деградацию CTNNB1, поэтому CTNNB1 может проникать в ядро и инициировать транскрипцию регулируемых генов [12].
В текущих исследованиях предварительное исследование секвенирования транскриптома РНК, разработанное для дальнейшего выяснения потенциальных механизмов, контролирующих отбор доминантных фолликулов, выявило экспрессию множества лигандов WNT, рецепторов и родственных внутриклеточных сигнальных молекул в фолликулах крупного рогатого скота, собранных на определенных этапах фолликулярной волны. Основываясь на этих результатах, мы предположили, что передача сигналов WNT является ключевым медиатором действия ФСГ, связанного с отбором доминантных фолликулов у крупного рогатого скота. Чтобы начать проверку этой гипотезы, была протестирована временная и гормональная регуляция мРНК для конкретных молекул WNT и FZD и связанных компонентов пути в клетках гранулезы крупного рогатого скота, а также изучено влияние низкомолекулярного ингибитора передачи сигналов WNT на действие ФСГ в клетках гранулезы крупного рогатого скота. .Результаты подтверждают потенциальную роль передачи сигналов WNT в регуляции действия ФСГ и отбора фолликулов яичников во время фолликулярных волн у крупного рогатого скота.
Материалы и методы
Заявление об этике
Все процедуры на животных были выполнены с одобрения IACUC Мичиганского государственного университета.
Сбор фолликулов на определенных стадиях фолликулярной волны
Не лактирующим молочным коровам голштинской породы (n = 18) делали две инъекции простагландина F2α с интервалом 14 дней, чтобы синхронизировать их эстральные циклы, и случайным образом назначали момент времени для овариэктомии.Через 2 дня после второй инъекции простагландина F2α яичники сканировали 2–3 раза в день с помощью ультразвукового исследования для мониторинга овуляции, а также возникновения и роста первой волны фолликулов. Фолликулы собирали на определенных этапах фолликулярной волны (в том числе при появлении [ЭМ; первое сканирование, при котором обнаруживается фолликул ≥4 мм; обычно в тот же день, что и овуляция; n = 3], предварительное отклонение [ПД; 1,5 дня после ЭМ ; ~ День 3 эстрального цикла; n = 5], начало отклонения диаметра [OD; первое сканирование, где рост F1 (самый большой; будущий доминантный) фолликул до> 8.Был обнаружен 5 мм, и фолликул F2 (второй по величине; будущий подчиненный) все еще продолжал расти; ∼ 4-й день цикла; n = 5] и ранняя стадия доминирования [ED; первое сканирование, при котором один фолликул в когорте был на 2 мм больше других; ∼ 5-й день цикла; n = 5]), как описано ранее [9]. Клетки гранулезы выделяли из фолликулов F1 и F2, немедленно лизировали и хранили при -80 ° C.
Выделение РНК
Суммарную РНКвыделяли из лизатов с использованием набора RNeasy mini (Qiagen) и обрабатывали ДНКазой на колонке в соответствии с протоколом производителя.Затем суммарную РНК (100 нг / образец) преобразовывали в кДНК с использованием набора для синтеза кДНК iScript (Bio-Rad), следуя инструкциям производителя. Затем добавляли воду, свободную от нуклеаз, для разбавления кДНК в целом до 40 мкл.
Q-PCR
Количественную ПЦР проводили с использованием дублированных 12,5 мкл реакционных смесей, содержащих 6,25 мкл супермикса SsoAdvanced SYBR Green (Biorad), 300 нМ прямого и обратного праймера (0,75 мкл каждого), 1 мкл кДНК и 3,75 мкл воды, свободной от нуклеаз. Праймеры были разработаны с использованием PerlPrimer или Primer express, и реакции были выполнены на приборе CFX96 touch (Bio-Rad) в течение 40 циклов при 95 ° C в течение 15 с, а затем при 60 ° C в течение 1 мин.Значения относительной экспрессии (ΔΔCT) рассчитывали с использованием программного обеспечения CFX manager 3.0 (Bio-Rad), используя RPS18 в качестве гена домашнего хозяйства. Последовательности праймеров можно найти в таблице 1.
Секвенирование РНК
Секвенирование РНКбыло выполнено W.M. Центр сравнительной и функциональной геномики Кека при Университете Иллинойса в Урбане-Шампейне. Образцы РНК из четырех фолликулов F1 и F2 на каждой стадии (PD и OD; 4 животных в группе) были объединены в рамках каждой стадии и классификации размеров, и библиотеки RNA-Seq были подготовлены с помощью набора для подготовки образцов TruSeq RNA Sample Preparation kit (Illumina) в соответствии с инструкциями производителя. инструкции.Объединенные образцы секвенировали на двух дорожках в течение 100 циклов на HiSeq2000 с использованием набора TruSeq SBS V5 (Illumina) и анализировали с помощью конвейера версии 1.8. CLC Genomics Workbench (CLC bio, Орхус, Дания) использовали для сопоставления считываний последовательностей с базой данных RefSeq крупного рогатого скота. Значения RPKM были рассчитаны для экспрессии генов в фолликулах на разных стадиях.
Культура клеток гранулезы
Три эксперимента были выполнены с использованием нашей ранее описанной [14] системы культивирования клеток гранулезы, где клетки отвечают на ФСГ дозозависимым увеличением эстрадиола и демонстрируют повышенную продукцию эстрадиола в культуре со временем [15].Вкратце, клетки гранулезы выделяли из яичников скотобойни (JBS Packerland, Plainwell, MI) и культивировали в течение 6 дней в среде (MEMα; Invitrogen, Carlsbad, CA), содержащей инсулин (1 нг / мл), трансферрин (5 мкг / мл). ), IGF1 (2 нг / мл), селенит натрия (4 нг / мл), андростендион (10 -6 M; все от Sigma, Сент-Луис, Миссури), пенициллин (100 МЕ / мл), стрептомицин (0,1 мг / мл) и фунгизона (0,625 мкл / мл; Invitrogen). Для всех экспериментов клетки гранулезы (100000 живых клеток на лунку) помещали в 96-луночные чашки для культивирования (BD Biosciences, Сан-Хосе, Калифорния).В первом эксперименте изучали влияние ингибитора передачи сигналов WNT IWR-1 на базальную и вызванную ФСГ продукцию эстрадиола и количество клеток. Ингибитор WNT стабилизирует взаимодействие AXIN2 с CTNNB1, что приводит к деградации CTNNB1 и ингибированию канонического пути WNT [16]. Обработка включала культуральную среду с ДМСО (контрольная группа разбавителя) или среда, содержащая 0,1, 1,0 или 10 мкМ IWR-1 (Cayman Chemical) с добавлением или без добавления максимальной стимулирующей дозы ФСГ (0,5 нг / мл; NHPP) на 6 человек. дней с 12 лунками на обработку в каждом повторном эксперименте.Медиа меняли каждые 2 дня. На 6 -й день культивирования среду удаляли и хранили при -20 ° C до анализа концентраций эстрадиола, клетки промывали, трипсинизировали и подсчитывали с использованием счетчика Коултера (Beckman Coulter), установленного для подсчета клеток от 5 до 20. мкм размером, как описано ранее [15]. Эксперимент повторяли 4 раза с яичниками, полученными в разные дни.
Во втором эксперименте определяли влияние ФСГ и максимальной ингибирующей дозы IWR-1 на количество мРНК для выбранных участников пути WNT и других модуляторов действия ФСГ.В этом эксперименте клетки гранулезы обрабатывали (24 лунки на обработку) ДМСО (контроль носителя) или максимально эффективной дозой IWR-1 (1 мкМ) в присутствии или в отсутствие ФСГ (0,5 нг / мл). На 6 -й день культивирования среду удаляли и хранили при -20 ° C до анализа концентраций эстрадиола, а клетки лизировали и хранили при -80 ° C до обработки для выделения общей РНК. Эксперимент повторяли 4 раза с яичниками, полученными в разные дни.
В третьем эксперименте определяли влияние обработки IWR-1 на содержание белков CTNB1 и AXIN2.Для этого эксперимента клетки гранулезы выделяли и культивировали, как описано для эксперимента 2. На 6 -й день культивирования среду удаляли и хранили при -20 ° C до анализа концентраций эстрадиола. Затем клетки промывали, отсасывали из лунок и центрифугировали при 3000 g в течение 5 мин. Осадок клеток затем мгновенно замораживали в жидком азоте и хранили при -80 ° C до анализа вестерн-блоттингом.
Радиоиммуноанализ
Концентрации эстрадиола [15] в образцах сред оценивали с использованием имеющихся в продаже наборов Coat-a-Count (Siemens Medical Diagnostics, Лос-Анджелес, Калифорния).Коэффициенты вариации внутри и между анализами составили 7,8% и 9,1% соответственно.
Вестерн-блот анализ
Осадкиклеток размораживали на льду в буфере RIPA (Sigma), содержащем смесь ингибиторов протеазы 1X (Roche Applied Science), в течение 30 мин при 4 ° C. Лизаты подвергали обработке ультразвуком высокой интенсивности (3 набора по 30 секундных импульсов), и нерастворимые материалы удаляли центрифугированием при 15000 об / мин в течение 15 минут при 4 ° C. Концентрацию общего белка для супернатантов определяли с использованием набора для анализа белка DC (Bio-Rad).Десять микрограммов белкового экстракта на образец разделяли в восстанавливающих условиях на 4–20% гелях TGX (Bio-Rad) с помощью электрофореза в SDS-PAGE и переносили на поливинилиденфторидные мембраны (Millipore). После блокирования безбелковым блокирующим буфером Pierce (Thermo Scientific) при комнатной температуре (RT) в течение 1 ч мембраны инкубировали в течение ночи при 4 ° C в безбелковом блокирующем буфере с соответствующими первичными антителами, а затем инкубировали с пероксидазой хрена (HRP). -конъюгированные вторичные антитела.Для визуализации использовали хемилюминесцентный субстрат SuperSignal west Dura (Thermo Scientific), и сигнал регистрировали на авторадиографической пленке Hybond-CL (Denville Scientific). Интенсивности полос для CTNNB1 и AXIN2 определяли с использованием программного обеспечения Image J и нормализовали относительно соответствующего уровня общего актина в каждой дорожке. Мембраны зондировали последовательно первичным кроличьим поликлональным антителом против Axin2 [1-1000 (об. / Об.), Sigma-Aldrich; # SAB3500619] и кроличьи поликлональные антитела против β-катенина [1-1000 (об. / Об.), Cell Signaling Technology; № 9581].После обнаружения AXIN2 и CTNNB1 на мембраны наносили полосок буфером для восстановления вестерн-блоттинга (Thermo Scientific) в течение 30 минут при комнатной температуре и повторно зондировали мышиным моноклональным антителом против актина (1-5000 (об. / Об.) Millipore; # MAB1501). HRP-конъюгированные Ant-Rabbit-IgG (Cell Signaling Technology) и Anti-mouse-IgG (Thermo Scientific) использовали в качестве вторичных антител при разведении 1-5000 (об. / Об.).
Статистический анализ
Все данные, кроме эксперимента по секвенированию РНК (описанного выше), были проанализированы с помощью однофакторного дисперсионного анализа с использованием Proc GLM в SAS версии 9.2 [17]. Данные были преобразованы в журнал перед анализом, если это требовалось для допущений о нормальности, и различия между средними значениями определялись с использованием Защищенного LSD Фишера. Данные представлены как нетрансформированное среднее значение ± стандартная ошибка среднего.
Результаты
Сигнальный путь WNT участвует в выборе доминантного фолликула
Предварительное секвенирование РНК на основе сравнительного транскриптомного анализа фолликулов крупного рогатого скота на стадиях предвариации (PD) и начала отклонения (OD) продемонстрировало экспрессию многих участников сигнальных путей WNT, включая молекулы лиганда WNT, рецепторы с завитками и катенины (Таблица S1).На основании этого наблюдения временная экспрессия избранных членов ( CTNNB1, AXIN2, DVL1 и FZD6 ), представляющих интерес для системы WNT, была дополнительно исследована с помощью ПЦР в реальном времени с использованием общей РНК, выделенной из наибольшего (F1) и второго по величине ( F2) фолликулы, собранные на четырех различных стадиях фолликулярной волны. В фолликулах F1 относительное количество мРНК FZD6 было примерно в 2 раза больше (P <0,05) в фолликулах, собранных на стадии ED, по сравнению со стадией OD (рис. 1A). Изобилие мРНК для DVL1 (рис. 1B) и CTNNB1 (рис. 1D) было значительно больше (P <0.05) и AXIN2 (рис. 1C) было примерно в 2 раза ниже (P <0,05) во время стадии ED по сравнению с стадией EM. ПЦР-анализ фолликулов F2 в реальном времени выявил аналогичный паттерн экспрессии транскриптов DVL1, AXIN2 и CTNNB1 (рис. 1B-D), наблюдаемый в фолликулах F1, однако транскрипт FZD6 не показал значительных различий в экспрессии на разных стадиях фолликула. разработка в F2 (рисунок 1A). Кроме того, количество мРНК FZD6 и DVL1 было выше (P <0.05) и AXIN2 был ниже (P <0,05) в фолликулах F1 (доминантный) по сравнению с F2 (подчиненный) на ранней стадии доминирования (сразу после выбора доминантного фолликула; рис. 1A и 1C).
Рис. 1. Профиль временной экспрессии выбранных компонентов системы WNT в клетках гранулезы, собранных из фолликулов F1 и F2 при появлении (EM; n = 3 животных), предваривании (PD; n = 5 животных), начале отклонения (OD; n = 5 животных) и ранней стадии доминирования (ED; n = 5 животных) первой фолликулярной волны Относительное содержание мРНК для FZD6 (A), DVL1 (B), AXIN2 (C) и CTNNB1 (D ) определяли с помощью Q-RTPCR.
Данные по экспрессииРНК были нормализованы относительно ACTIN в качестве внутреннего контроля. A, B P <0,05 для обилия транскриптов в фолликулах F1 на разных стадиях фолликулярной волны; X, Y P <0,05 для обилия транскриптов в фолликулах F2 на разных стадиях фолликулярной волны; * P <0,05 для обилия транскриптов между фолликулами F1 и F2 на стадии фолликулярной волны.
https://doi.org/10.1371/journal.pone.0100201.g001
Функциональная роль сигнального пути WNT в усилении действия ФСГ во время отбора доминантных фолликулов
Приведенные выше результаты подтверждают отчетливую временную регуляцию членов системы WNT во время выбора доминантного фолликула и наводят на мысль о регулирующей роли.Учитывая важную роль ФСГ в регуляции фолликулярных волн у крупного рогатого скота, был изучен потенциальный вклад передачи сигналов WNT в действие ФСГ на клетки гранулезы крупного рогатого скота. Когда клетки обрабатывали возрастающими концентрациями ингибитора передачи сигналов WNT IWR-1 в отсутствие ФСГ, небольшое увеличение продукции эстрадиола наблюдалось только при дозе 0,1 мкМ (P <0,05; рис. 2A). Однако обработка IWR-1 в присутствии максимальной стимулирующей дозы ФСГ (0,5 нг / мл) приводила к дозозависимому ингибированию стимулирующего эффекта ФСГ с ингибированием> 75% (рис. 2A), наблюдаемым при максимальной ингибирующей дозе IWR. -1 (1 мкМ; P <0.05). Напротив, не наблюдалось никакого влияния обработки IWR-1 на количество клеток гранулезы, полученных в конце культивирования (в отсутствие ФСГ), тогда как вызванное ФСГ увеличение количества клеток гранулезы блокировалось в ответ на все дозы IWR. -1 (Рисунок 2B; P <0,05).
Рисунок 2. Влияние возрастающих концентраций ингибитора передачи сигналов WNT IWR-1 на стимулированную ФСГ продукцию эстрадиола (A) и количество клеток (B) для клеток гранулезы крупного рогатого скота.
Клетки Granulosa обрабатывали 0,0.Концентрация IWR-1 1 мкМ, 1,0 мкМ и 10 мкМ в присутствии и в отсутствие максимальной стимулирующей дозы (0,5 нг / мл) ФСГ. Каждый столбец представляет собой среднее значение ± стандартная ошибка среднего для четырех независимых экспериментов. а, б, в, г, д, е P <0,05.
https://doi.org/10.1371/journal.pone.0100201.g002
Для дальнейшего выяснения роли передачи сигналов WNT в потенцировании действия ФСГ, влияние обработки IWR-1 на ФСГ-индуцированную регуляцию известных генов-мишеней ФСГ CYP19A1 , CCND2 и CARTPT исследовали с использованием клеток гранулезы крупного рогатого скота, культивированных в присутствии или отсутствии ФСГ и максимальной ингибирующей дозе IWR-1.Влияние обработки IWR-1 на количество мРНК CYP19A1 , CCND2 и CARTPT не наблюдалось для клеток, культивированных в отсутствие ФСГ (рис. 3). Лечение ФСГ увеличивало количество мРНК CYP19A1, и CCND2. Стимулирующие эффекты ФСГ на CYP19A1 (рис. 3A) были частично обращены в ответ на лечение ингибитором передачи сигналов WNT (IWR-1) (P <0,05), но обработка IWR-1 не подавляла стимуляцию FSH CCND2 мРНК. (Рисунок 3B).Напротив, обработка IWR-1 частично обратила ФСГ-индуцированное ингибирование экспрессии мРНК клеток гранулезы CARTPT (рис. 3C; P <0,05).
Фигура 3. Влияние опосредованного IWR-1 ингибирования передачи сигналов WNT на ФСГ-индуцированную регуляцию экспрессии мРНК гена-мишени ФСГ ( CYP19A1 , CCND2 и CARTP T) в клетках гранулезы крупного рогатого скота.
Количественный анализ ОТ-ПЦР выполняли для определения эффектов лечения 0 или 0,5 нг / мл ФСГ в присутствии или в отсутствие 1.0 мкМ IWR-1 на экспрессии мРНК CYP19A1 (A), , CCND2 (B) и CARTPT (C) в культивируемых клетках гранулезы. Экспрессию мРНК для представляющих интерес генов нормализовали относительно количества мРНК для ACTIN в качестве внутреннего контроля. Столбцы представляют собой среднее значение +/- SEM для четырех экспериментов. A, B P <0,05.
https://doi.org/10.1371/journal.pone.0100201.g003
Для подтверждения механизма действия IWR-1 по ингибированию передачи сигналов WNT в клетках гранулезы крупного рогатого скота был проведен вестерн-блоттинг на CTNNB1 и AXIN2.Результаты показали значительное увеличение AXIN2 в клетках гранулезы, обработанных FSH плюс IWR-1, по сравнению с клетками, обработанными только FSH (фиг. 4A). Кроме того, примерно в 1,8 раза (P <0,05) увеличение белка CTNNB1 наблюдалось в клетках гранулезы, обработанных ФСГ, по сравнению с необработанными контролями. Индуцированное ФСГ увеличение белка CTNNB1 было полностью блокировано в ответ на обработку IWR-1 (фиг. 4B), поддерживая эффекты IWR-1 на накопление белка CTNNB1.
Рисунок 4. Влияние обработки ингибитором передачи сигналов FSH и WNT (IWR-1) на содержание белков CTNNB1 и AXIN2 в клетках гранулезы крупного рогатого скота.
Относительное содержание белков AXIN2 (A) и CTNNB1 (B) (по данным вестерн-блоттинга и денситометрии) в клетках гранулезы крупного рогатого скота, культивируемых в присутствии или отсутствии 0,5 нг / мл ФСГ плюс 1,0 мкМ IWR-1. Результаты представляют собой среднее значение +/- SEM для четырех повторных экспериментов с относительным содержанием белка для CTNNB1 и AXIN2, нормализованным относительно ACTIN. A, B, C P <0,05.
https://doi.org/10.1371/journal.pone.0100201.g004
Гормональная регуляция членов сигнального пути WNT в клетках гранулезы крупного рогатого скота
Приведенные выше результаты подтверждают важную роль передачи сигналов WNT в усилении специфических компонентов действия ФСГ в клетках гранулезы крупного рогатого скота.Для дальнейшего понимания потенциальной функциональной роли в отборе фолликулов была исследована гормональная регуляция экспрессии выбранных компонентов системы WNT в клетках гранулезы крупного рогатого скота. Клетки гранулезы, культивируемые в присутствии ФСГ, демонстрировали повышенную экспрессию мРНК AXIN2 , CTNNB1 и FZD6 (рис. 5A-C) по сравнению с необработанными контролями (P <0,05), но не имели эффекта ингибирования передачи сигналов WNT посредством IWR. -1 на базальную и вызванную ФСГ экспрессию мРНК AXIN2 , CTNNB1 и FZD6 .Напротив, на количество мРНК DVL1 не влияла обработка ФСГ или IWR-1 (рис. 5D). Результаты подтверждают независимую от ФСГ регуляцию экспрессии специфических компонентов системы WNT в клетках гранулезы крупного рогатого скота, независимую от WNT-CTNNB1.
Фигура 5. Влияние обработки ингибитором передачи сигналов FSH и WNT (IWR-1) на содержание мРНК FZD6 , AXIN2 , CTNNB1 и DVL1 в клетках гранулезы крупного рогатого скота.
Количественный анализ RT-PCR был выполнен для определения эффектов лечения 0 или 0.Экспрессия мРНК FZD6 (A) , CCND2 (B) и CARTPT (C) в культивируемых клетках гранулезы 5 нг / мл ФСГ в присутствии или в отсутствие 1,0 мкМ IWR-1. Экспрессию мРНК для представляющих интерес генов нормализовали относительно количества мРНК для ACTIN в качестве внутреннего контроля. Столбцы представляют собой среднее значение +/- SEM для четырех экспериментов. A, B P <0,05.
https://doi.org/10.1371/journal.pone.0100201.g005
Обсуждение
В настоящем исследовании мы идентифицировали компоненты системы WNT, экспрессируемые в клетках гранулезы и потенциально участвующие в отборе доминантных фолликулов во время фолликулярных волн у крупного рогатого скота.Мы также установили интригующую регуляторную роль сигнального пути WNT в конкретных аспектах действия ФСГ на клетки гранулезы крупного рогатого скота, связанных с ростом фолликулов и стероидогенезом, а также новое понимание гормональной регуляции экспрессии компонентов системы WNT в клетках гранулезы крупного рогатого скота. В совокупности результаты подтверждают дополнительные исследования механизма действия и функциональных требований передачи сигналов WNT для отбора фолликулов у крупного рогатого скота.
Отклонение диаметра отмечает начало расхождения в скорости роста и способности продуцировать эстрадиол между F1 или крупнейшими (будущий доминант) и F2 или вторыми по величине (будущие подчиненные) растущими фолликулами, что приводит к приобретению доминирующего фолликула [3].Для дальнейшего выяснения потенциальных регуляторов этого ключевого перехода в развитии во время фолликулярных волн секвенирование транскриптома РНК было использовано для характеристики состава транскриптома клеток гранулезы в самом большом (F1) и втором по величине (F2) фолликулах непосредственно перед (предвариантная стадия; стадия PD) по сравнению с началом отклонения диаметра (стадия OD). Выявлена экспрессия в клетках гранулез многочисленных лигандов WNT, рецепторов FZD, катенинов и других компонентов внутриклеточных сигнальных путей.Сравнительный анализ транскриптома предполагает, что WNT, использующие как канонические ( WNT2B , WNT8B ), так и неканонические ( WNT5A , WNT11 , WNT16 ) пути передачи сигналов присутствуют во время развития крупного рогатого скота.
Преходящее повышение уровня ФСГ предшествует началу каждой фолликулярной волны, и выбор доминирующего фолликула происходит на фоне снижения концентрации ФСГ [1] — [3]. Результаты секвенирования транскриптома РНК предполагают, что передача сигналов WNT может играть важную роль в регуляции роста фолликулов во время фолликулярных волн.Следовательно, изменения в количестве транскриптов для избранных членов канонического пути ( FZD6 , DVL1 , AXIN2 и CTNNB1) на четырех прогрессивных стадиях (EM, PD, OD и ED) развития фолликулов (до и после доминантной отбор фолликулов) были дополнительно исследованы. Результаты продемонстрировали значительную понижающую регуляцию AXIN2 (по существу, необходимую для образования комплекса разрушения CTNNB1) и повышающую регуляцию экспрессии FZD6 , DVL1 и CTNNB1 (маркеры активации передачи сигналов WNT) на стадии ED по сравнению с стадией EM фолликулярной разработка.Кроме того, мРНК для AXIN2 была ниже, а для DVL1 и FZD6 была выше в фолликулах F1 (доминантный) по сравнению с F2 (подчиненный) на ранней стадии доминирования (сразу после выбора доминантного фолликула), что дополнительно подтверждает потенциальную роль в отборе доминантного фолликула. Экспрессия яичников и важная роль конкретных участников пути WNT в развитии яичников, фолликулогенезе и онкогенезе у грызунов были установлены [12]. Насколько нам известно, экспрессия компонентов пути WNT на определенных стадиях фолликулярной волны ранее не сообщалась.Предыдущие исследования продемонстрировали большее количество белка CTNNB1 в крупных фолликулах крупного рогатого скота, полученного на бойнях, с высокими по сравнению с низкими концентрациями эстрадиола в фолликулярной жидкости [18]. Хотя фолликулы не были сгруппированы с использованием известных критериев, указывающих на состояние здоровья фолликулов [19], [20], анализируемый диапазон размеров фолликулов [21] позволяет предположить, что большинство из них достигли стадии доминантного фолликула фолликулярной волны. В совокупности представленные результаты подтверждают нашу гипотезу о потенциальной роли канонического сигнального пути WNT в регуляции функций гранулезных клеток, связанных с отбором и (или) доминированием доминантного фолликула.
Плейотропное действие ФСГ имеет решающее значение для роста фолликулов яичников, включая регуляцию пролиферации гранулезных клеток, выработку эстрадиола и опосредовано регуляцией ключевых генов-мишеней [22]. Предыдущие исследования подтверждают важную роль передачи сигналов WNT в регуляции стероидогенеза яичников у грызунов [23]. В данном случае роль передачи сигналов WNT в модуляции множественных компонентов действия ФСГ на клетки гранулезы крупного рогатого скота была протестирована с использованием химического ингибитора (IWR-1), который ингибирует канонический путь WNT, стабилизируя цитоплазматический белок-зависимый комплекс деструкции AXIN2 и, таким образом, индуцируя протеосомный деградация CTNNB1 [24].Интересно, что мы наблюдали выраженное снижение количества клеток и продукции эстрадиола для обработанных ФСГ клеток гранулезы, подвергнутых обработке ингибитором WNT, что установило его функциональный вклад в действие ФСГ на клетки гранулезы крупного рогатого скота. О стимулирующем эффекте ФСГ на количество клеток гранулезы при использовании этой системы культивирования сообщалось ранее [6]. Снижение продукции эстрадиола и количества клеток гранулезы сопровождалось повышенными уровнями белка AXIN2 и ингибированием вызванного ФСГ роста белка CTNNB1 в клетках, обработанных ФСГ, культивируемых в присутствии IWR-1.Однако драматических эффектов лечения IWR-1 в отсутствие ФСГ не наблюдалось. Предыдущие исследования с использованием сверхэкспрессирующих CTNNB1 и нулевых мутантных мышей продемонстрировали роль передачи сигналов CTNNB1 и WNT в модуляции пролиферации гранулезных клеток и экспрессии целевого гена FSH у мышей [25]. Сходным образом недавнее исследование продемонстрировало, что нокдаун CTNNB1, ключевого члена канонического сигнального пути WNT, в клетках гранулезы мышей ставит под угрозу способность FSH способствовать мобилизации CX43 в щелевые соединения и, следовательно, снижает межклеточную коммуникацию щелевых соединений [26].
ФСГ-индуцированная пролиферация клеток и выработка эстрадиола через гранулезные клетки опосредуются посредством PKA-индуцированного фосфорилирования CREBP, CTNNB1 и других факторов транскрипции, которые индуцируют транскрипцию гена CYP19A1 , кодирующего фермент ароматазы, необходимый для катализирования превращения тестостерона в эстрадиол. [27], а также для CCND2 и других регуляторов клеточного цикла, которые модулируют пролиферацию клеток гранулезы [28]. Текущие и наши предыдущие исследования [15] продемонстрировали резкое увеличение количества транскриптов CYP19A1 в ответ на лечение ФСГ, и увеличение мРНК CCND2 также наблюдалось в клетках, обработанных ФСГ.Однако ингибирование сигнального пути WNT с помощью обработки IWR-1 значительно снижало способность ФСГ индуцировать экспрессию мРНК CYP19A1 , что приводило к снижению продукции эстрадиола гранулезными клетками, но не влияло на ФСГ-индуцированную регуляцию мРНК CCND2 . Учитывая это свидетельство, вполне вероятно, что активация передачи сигналов WNT помогает опосредовать стимулируемую ФСГ продукцию эстрадиола в клетках гранулезы, частично регулируя транскрипцию CYP19A1 посредством стабилизации и ядерной транслокации фактора транскрипции бета-катенина.Мы также ранее сообщали о важной роли CARTPT в негативной регуляции действия ФСГ в подчиненных фолликулах, связанных с отбором доминантных фолликулов [15], [29]. Однако мало что известно о факторах и сигнальных путях, которые регулируют экспрессию CARTPT . Ингибирующий эффект ФСГ на мРНК гранулезных клеток CARTPT наблюдался в текущих исследованиях, как сообщалось ранее [7], и обработка IWR-1 вызвала небольшое, но значительное снижение индуцированной ФСГ репрессии мРНК CARTPT .Результаты подтверждают специфичность усиления экспрессии целевого гена ФСГ посредством передачи сигналов WNT в клетках гранулезы крупного рогатого скота.
Мы также исследовали гормональную регуляцию экспрессии выбранных участников пути WNT с помощью ФСГ и сопутствующие эффекты ингибирования передачи сигналов WNT в клетках гранулезы крупного рогатого скота. Несмотря на повышенную экспрессию мРНК DVL1 в гранулезных клетках, связанную с прогрессированием фолликулярной волны, в текущих исследованиях не наблюдалось никакого влияния ФСГ и / или лечения IWR-1 на экспрессию DVL-1 .Интересно, что экспрессия FZD6 и значительно повышалась под действием ФСГ независимо от лечения IWR-1 (фиг. 5B). Соединения IWR избирательно ингибируют компоненты канонического пути WNT, которые функционируют ниже белков LRP и DVL [16]. Однако умеренное снижение мРНК FZD6 наблюдалось в мезенхимальных стволовых клетках человека, подвергнутых siRNA-опосредованному нокдауну CTNNB1 с использованием siRNA [30]. Учитывая, что экспрессия FZD6 в гранулезных клетках увеличивалась по сравнению с экспрессией CTNNB1 и DVL1 и была обратно пропорциональна экспрессии AXIN2 во время прогрессирования фолликулярной волны, в будущих исследованиях будет интересно определить функциональный вклад FZD6 в регуляцию ФСГ. действие, связанное с прогрессированием фолликулярной волны и выбором доминирующего фолликула.
Наши результаты также продемонстрировали стимулирующий эффект обработки ФСГ на мРНК AXIN2 и CTNNB1 и содержание белка в культивируемых клетках гранулезы крупного рогатого скота, но на экспрессию мРНК обработка IWR-1 не повлияла. Предыдущие исследования показали, что соединение IWR изменяет сродство AXIN2 к CTNNB1 за счет эндостабилизации и повышения уровня белка AXIN2. Однако предыдущие исследования продемонстрировали, что обработка IWR-1 не изменяет синтез de novo или транскрипцию AXIN2 и CTNNB1 [16], [24].
Таким образом, экспрессия множества компонентов системы WNT, включая лиганды WNT, рецепторы FZD и нижестоящие сигнальные молекулы, обнаруженные в клетках гранулезы крупного рогатого скота в текущих исследованиях, подтверждают потенциальную роль канонических и неканонических путей WNT во время фолликулярных волн у крупного рогатого скота. Наблюдаемая функциональная потребность в передаче сигналов WNT для множественных компонентов действия ФСГ, обнаруженных с использованием фармакологического подхода, в сочетании с повышенной экспрессией CTNNB1 и DVL1 и сниженной экспрессией AXIN2 в клетках гранулезы крупного рогатого скота, наблюдаемой во время прогрессирования волны до ранней стадии доминирования, подтверждает потенциально важную роль для передачи сигналов WNT в потенциале действия ФСГ перед лицом снижающихся концентраций ФСГ, характерных для отбора доминантных фолликулов.
Вклад авторов
Задумал и спроектировал эксперименты: PSPG JKF LL JY JJI GWS. Проведены эксперименты: PSPG JKF SR JY. Проанализированы данные: PSPG JKF SR LL JY JJI GWS. Написал статью: PSPG JKF SR LL JY JJI GWS.
Ссылки
- 1. Fortune JE, Rivera GM, Evans AC, Turzillo AM (2001) Дифференциация доминирующих и подчиненных фолликулов у крупного рогатого скота. Биол Репрод 65: 648–654.
- 2. Ирландия Дж. Дж., Михм М., Остин Э., Дискин М. Г., Рош Дж. Ф. (2000) Историческая перспектива оборота доминантных фолликулов во время полового цикла крупного рогатого скота: ключевые концепции, исследования, достижения и термины.J Dairy Sci 83: 1648–1658.
- 3. Бег М.А., Гинтер О.Дж. (2006) Выбор фолликулов у крупного рогатого скота и лошадей: роль внутрифолликулярных факторов. Репродукция 132: 365–377.
- 4. Гринвальд Г.С., Рой С.К. (1994) Развитие фолликулов и его контроль. В: Knobil E, Neill JD, редакторы. Физиология репродукции. 2-е изд. Нью-Йорк: Raven Press. 629–724.
- 5. Smith GW, Sen A, Folger JK, Ireland JJ (2010) Предполагаемая роль транскрипта, регулируемого кокаином и амфетамином (CARTPT), в отборе доминантных фолликулов у крупного рогатого скота.Soc Reprod Fertil Suppl 67: 105–117.
- 6. Gutierrez CG, Campbell BK, Webb R (1997) Разработка долгосрочной системы культивирования клеток гранулезы крупного рогатого скота: индукция и поддержание выработки эстрадиола, ответ на фолликулостимулирующий гормон и морфологические характеристики. Биол Репрод 56: 608–616.
- 7. Lv L, Jimenez-Krassel F, Sen A, Bettegowda A, Mondal M и др. (2009) Доказательства, подтверждающие роль транскрипта, регулируемого кокаином и амфетамином (CARTPT), в контроле выработки эстрадиола гранулезными клетками, связанной с отбором доминантных фолликулов у крупного рогатого скота.Биол Репрод 81: 580–586.
- 8. Selvaraju S, Folger JK, Gupta PS, Ireland JJ, Smith GW (2013) Стадийно-специфическая экспрессия и влияние костного морфогенетического белка 2 на продукцию эстрадиола в гранулезных клетках крупного рогатого скота: регуляция транскриптом, регулируемым кокаином и амфетамином. Domest Anim Endocrinol 44: 115–120.
- 9. Folger JK, Jimenez-Krassel F, Ireland JJ, Lv L, Smith GW (2013) Регулирование связывания кокаина и амфетамина регулируемого транскрипта (CART) гранулезных клеток и влияние ингибитора передачи сигналов CART на продукцию эстрадиола гранулезных клеток во время отбора доминантных фолликулов у крупного рогатого скота.Биол Репрод 89: 137.
- 10. Hernandez Gifford JA, Hunzicker-Dunn ME, Nilson JH (2009) Условная делеция бета-катенина, опосредованная Amhr2cre, у мышей вызывает женское бесплодие. Биол Репрод 80: 1282–1292.
- 11. Stapp AD, Gomez BI, Gifford CA, Hallford DM, Hernandez Gifford JA (2014) Каноническая передача сигналов WNT запрещает опосредованный фолликулостимулирующим гормоном стероидогенез в первичных культурах клеток гранулезы крысы. PLoS ONE 9: e86432.
- 12. Boyer A, Goff AK, Boerboom D (2010) Передача сигналов WNT в биологии фолликулов яичников и туморогенезе.Тенденции метаболизма эндокринола 21: 25–32.
- 13. Segditsas S, Tomlinson I (2006) Колоректальный рак и генетические изменения пути Wnt. Онкоген 25: 7531–7537.
- 14. Scheetz D, Folger JK, Smith GW, Ireland JJ (2012) Клетки гранулезы невосприимчивы к действию ФСГ у людей с низким количеством антральных фолликулов. Репрод Фертил Дев 24: 327–336.
- 15. Sen A, Bettegowda A, Jimenez-Krassel F, Ireland JJ, Smith GW (2007) Регулируемая кокаином и амфетамином регуляция транскрипта передачи сигнала фолликулостимулирующего гормона в клетках гранулезы крупного рогатого скота.Эндокринология 148: 4400–4410.
- 16. Чен Б., Додж М.Э., Тан В., Лу Дж., Ма З. и др. (2009) Опосредованное низкими молекулами нарушение Wnt-зависимой передачи сигналов при регенерации тканей и раке. Nat Chem Biol 5: 100–107.
- 17. SAS Institute Inc. (2009) SAS OnlineDoc® 9.2. 9.2 изд. Кэри, Северная Каролина: SAS Institute Inc.
- 18. Кастанон Б.И., Стапп А.Д., Гиффорд К.А., Спайсер Л.Дж., Холфорд Д.М. и др. (2012) Регулирование выработки эстрадиола фолликулостимулирующим гормоном: возможное участие WNT2 и бета-катенина в клетках гранулезы крупного рогатого скота.J Anim Sci 90: 3789–3797.
- 19. Ирландия Дж. Дж., Рош Дж. Ф. (1983) Развитие ноновуляторных антральных фолликулов у телок: изменения стероидов в фолликулярной жидкости и рецепторы гонадотропинов. Эндокринология 112: 150–156.
- 20. Сандерленд С. Дж., Кроу М. А., Боланд М. П., Рош Дж. Ф., Ирландия Дж. Дж. (1994) Отбор, доминирование и атрезия фолликулов во время эстрального цикла телок. J Reprod Fertil 101: 547–555.
- 21. Сюй З., Гарверик Х.А., Смит Г.В., Смит М.Ф., Гамильтон С.А. и др.(1995) Экспрессия рибонуклеиновых кислот фолликулостимулирующего гормона и рецептора лютеинизирующего гормона в фолликулах крупного рогатого скота во время первой фолликулярной волны. Biol Reprod 53: 951–957.
- 22. Hunzicker-Dunn M, Maizels ET (2006) Пути передачи сигналов ФСГ в незрелых клетках гранулезы, которые регулируют экспрессию целевого гена: ответвление от протеинкиназы А. Клеточный сигнал. 18: 1351–1359.
- 23. Lapointe E, Boerboom D (2011) Передача сигналов Wnt и регуляция стероидогенеза яичников.Front Biosci 3: 276–285.
- 24. Лу Дж., Ма З., Се Дж. К., Фан С. В., Чен Б. и др. (2009) Исследования взаимосвязи структура-активность низкомолекулярных ингибиторов ответа Wnt. Bioorg Med Chem Lett 19: 3825–3827.
- 25. Fan HY, O’Connor A, Shitanaka M, Shimada M, Liu Z и др. (2010) Бета-катенин (CTNNB1) способствует преовуляторному развитию фолликулов, но подавляет LH-опосредованную овуляцию и лютеинизацию. Мол эндокринол 24: 1529–1542.
- 26. Wang HX, Gillio-Meina C, Chen S, Gong XQ, Li TY и др.(2013) Канонический путь WNT2 и FSH взаимодействуют, чтобы регулировать сборку щелевых соединений в клетках гранулезы мышей. Биол Репрод 89: 39
- 27. Luo W, Wiltbank MC (2006) Четкая регуляция стероидами информационных РНК для FSHR и CYP19A1 в клетках гранулезы крупного рогатого скота. Биол Репрод 75: 217–225.
- 28. Han Y, Xia G, Tsang BK (2013) Регулирование экспрессии и деградации циклина D2 фолликулостимулирующим гормоном во время пролиферации гранулезных клеток крысы in vitro.Биол Репрод 88: 57
- 29. Sen A, Lv L, Bello N, Ireland JJ, Smith GW (2008) Транскрипт, регулируемый кокаином и амфетамином, ускоряет терминацию индуцированной фолликулостимулирующим гормоном внеклеточной регулируемой киназы 1/2 и активации Akt путем регулирования экспрессии и деградации специфических митоген-активируемые фосфатазы протеинкиназы в клетках гранулезы крупного рогатого скота. Мол эндокринол 22: 2655–2676.
- 30. Колбен Т., Перобнер И., Фернсебнер К., Лехнер Ф., Гайсслер С. и др.(2012) Анализ влияния рецепторов Frizzled на передачу сигналов Wnt / бета-катенин мезенхимальных стволовых клеток человека. Biol Chem 393: 1433–1447.
Что такое доминантный фолликул?
Что означает доминантный фолликул?
Доминантный фолликул — это заполненная жидкостью структура в яичнике, которая становится достаточно большой, чтобы высвободить зрелую яйцеклетку примерно на 14 день 28-дневного менструального цикла или примерно за неделю до середины цикла в процессе овуляции.
Доминантный фолликул также называется графовым фолликулом.
FertilitySmarts объясняет доминантный фолликул
Набор фолликулов
До полового созревания яичник содержит тысячи фолликулов, называемых примордиальными фолликулами. С наступлением половой зрелости в каждом цикле созревают 15-20 примордиальных фолликулов. Этот процесс называется набором фолликулов. Только один из 15-20 задействованных фолликулов становится доминирующим фолликулом, способным расширяться и выпускать зрелую яйцеклетку.
Происходит овуляция
Клетки в доминантном фолликуле производят эстроген. Остальные фолликулы сморщиваются и погибают. Когда доминантный фолликул достигает 2–4 см в диаметре, он лопается, высвобождая яйцеклетку, знаменуя начало овуляции. После овуляции доминантный фолликул частично сморщивается и теперь называется желтым телом и производит прогестерон во время последних фаз менструального цикла.
Что вызывает образование доминантного фолликула?
Когда начинается менструальный цикл, часть мозга, называемая гипоталамусом, выделяет гонадотропин-рилизинг-гормон (ГнРГ).ГнРГ действует на гипофиз, который, в свою очередь, секретирует фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ). Эти гормоны запускают созревание привлеченных фолликулов и, в конечном итоге, формирование доминирующего фолликула.
Лечение бесплодия
Во время лечения бесплодия, такого как экстракорпоральное оплодотворение (ЭКО) или внутриутробное оплодотворение (ВМИ), стимуляция яичников способствует созреванию большего количества задействованных фолликулов за счет использования высоких концентраций ФСГ, в отличие от естественного развития одного доминирующего фолликул во время типичного менструального цикла.
.