Что такое онкомаркеры и о чем свидетельствуют их показатели
Онкомаркеры — это особенные специфические белки/антигены, образующиеся в крови. В норме они выделяются клетками в незначительном количестве и выполняют в организме разнообразные функции. Однако при наличии злокачественного процесса концентрация этих веществ резко возрастает – онкомаркер может выделяться как самими опухолевыми клетками, так и здоровыми тканями, окружающими новообразование.
Ценностью исследования уровня онкомаркеров является возможность обнаружить патологический процесс задолго до появления первых проявлений заболевания. Кроме того, подобный анализ нередко ставит окончательную точку в сложных диагностических ситуациях.
Анализы крови на онкомаркеры обладают высокой информативностью при соблюдении рекомендаций перед сдачей:
- употребление алкоголя и курения до проведения анализа не рекомендуются;
- анализ проводят с утра натощак, приём пищи следует осуществлять за 8-12 часов до проведения забора крови;
- пить жидкость можно в неограниченных количествах;
- от приёма медикаментозных препаратов и различных медицинских манипуляция следует отказаться, а также уведомить о них своего врача;
- повышенная физическая активность также не рекомендуется;
- при проведении анализа у женщин также учитывают менструальный цикл женщины: анализ проводят в определённые дни.

Различные маркеры характеризуют различные опухоли. В некоторых случаях несколько маркеров характеризуют одну и ту же форму рака, тогда для повышения достоверности результатов одновременно проводят анализ нескольких опухолевых маркеров. Также один и тот же онкомаркер может свидетельствовать о нескольких формах рака.
- ПСА или простато-специфический антиген. Вырабатывает злокачественная опухоль простаты. Нормальное содержание — до 4 нг на мл. Количество 4-10 нг на мг свидетельствует об угрозе развития рака простаты, а превышение 10 нг на мл считается патологическим.
Значительное повышение уровня ПСА в сыворотке иногда обнаруживается при гипертрофии предстательной железы, а также при воспалительных её заболеваниях. Также, следует учитывать, что пальцевое ректальное исследование, цистоскопия, колоноскопия, трансуретральная биопсия, лазерная терапия, задержка мочи могут вызвать более или менее выраженный и длительный подъём уровня ПСА.
 Влияние этих процедур на уровень ПСА максимально выражено на следующий день после их проведения, причём наиболее значительно — у больных с гипертрофией простаты. Исследование ПСА в таких случаях рекомендуется проводить не ранее чем через 7 дней после проведения перечисленных процедур. Уровень ПСА повышается при доброкачественных и злокачественных заболеваниях предстательной железы. При этом при карциноме простаты больше увеличивается доля связанной фракции, поэтому соотношение между свободным и общим ПСА уменьшается.
Влияние этих процедур на уровень ПСА максимально выражено на следующий день после их проведения, причём наиболее значительно — у больных с гипертрофией простаты. Исследование ПСА в таких случаях рекомендуется проводить не ранее чем через 7 дней после проведения перечисленных процедур. Уровень ПСА повышается при доброкачественных и злокачественных заболеваниях предстательной железы. При этом при карциноме простаты больше увеличивается доля связанной фракции, поэтому соотношение между свободным и общим ПСА уменьшается. - РЭА или раково-эмбриональный антиген. Норма онкомаркера — до 5 нг/мл, 5-8 мг на мл рассматривается как пограничное состояние, а патологией является содержание этого онкомаркера в количестве выше 8 нг/мл. В данном случае возможно развитие рака легких, рака прямой или толстой кишки, желудка, яичников, рак груди, щитовидной или поджелудочной железы.
Определение содержания РЭА в сыворотке крови человека имеет диагностическое значение, и может быть использовано для мониторинга терапии, выявления рецидивов и недиагносцируемых метастазов рака различных локализаций и органной специфичности.

- Онкомаркер СА-125 вырабатывается раковой опухолью яичника. Норма — до 30 МЕ/мл. Уровень 30-40 МЕ/мл означает высокий риск развития рака, при содержании этого онкомаркера в количестве больше 40 МЕ/мл врач уже предполагает наличие раковой опухоли яичника.
Определение содержания СА-125 в сыворотке крови человека может быть использовано для диагностики рака яичников и динамического контроля его уровня с целью оценки эффективности проводимой терапии, раннего выявления метастазов, а также прогнозирования течения заболевания. Неонкологическая патология: повышение уровня СА-125 в крови наблюдается при вовлечении в процесс серозных оболочек — перитоните, перикардите, плеврите разной этиологии. Более высокое увеличение уровня СА-125 в крови наблюдается иногда при различных доброкачественных гинекологических опухолях (кисты яичников), а также при воспалительных процессах, вовлекающих придатки, и доброкачественной гиперплазии эндометрия.
- СА-19-9 — вырабатывается при развитии рака поджелудочной железы.
 Норма — до 30 МЕ/мл, опасные значения — 30-40 МЕ/мл, выше 40 МЕ/мл — развивается раковое новообразование.
Норма — до 30 МЕ/мл, опасные значения — 30-40 МЕ/мл, выше 40 МЕ/мл — развивается раковое новообразование.Уровень CА 19-9 повышается при злокачественных новообразованиях: рак поджелудочной железы; рак желчного пузыря и желчных путей; рак мочевого пузыря; первичный рак печени; рак желудка; рак прямой кишки; рак сигмовидной кишки; рак молочной железы; рак яичников; рак матки. Неонкологическая патология, которая сопровождается повышением уровня CА 19-9: цирроз печени; холецистит; муковисцидоз; гепатиты; желчекаменная болезнь.
- СА-15-3 — онкомаркер рака груди. Норма — не более 38 МЕ/мл.
Повышение уровня CA 15-3 наблюдается при злокачественных новообразованиях: рак молочной железы; бронхогенный рак; рак желудка; рак печени; рак поджелудочной железы; рак яичников; рак шейки матки; рак матки; рак эндометрия. Неонкологическая патология: доброкачественные заболевания молочных желез; цирроз печени; беременность в III триместре; аутоиммунные заболевания.
Важно помнить! Отклонение результатов от нормы не всегда является показателем онкологии. Уровень многих индикаторных соединений способен повышаться при воспалительных процессах, травмах органов, гормональных сбоев. В таком случае медицинским специалистом учитывается не только непосредственное повышение уровня онкомаркеров, но и степень данного увеличения, клинические симптомы, взаимосвязь с результатами других методов исследований и анализами. На основе всей этой диагностической картины и определяется причина патологических изменений.
Уровень многих индикаторных соединений способен повышаться при воспалительных процессах, травмах органов, гормональных сбоев. В таком случае медицинским специалистом учитывается не только непосредственное повышение уровня онкомаркеров, но и степень данного увеличения, клинические симптомы, взаимосвязь с результатами других методов исследований и анализами. На основе всей этой диагностической картины и определяется причина патологических изменений.
Анализ крови на Раково-эмбриональный антиген (РЭА) в лаборатории KDL.
Раково-эмбриональный антиген (РЭА) — один из наиболее широко используемых онкомаркеров. Представляет собой гликопротеин, относится к классу онкоэмбриональных антигенов. У плода он синтезируется в клетках слизистой оболочки желудка и кишечника. После рождения продукция данного антигена сохраняется в следовых количествах. При развитии опухолевого процесса концентрация РЭА в крови резко повышается, особенно при колоректальном раке, других карциномах желудочно-кишечного тракта, легких, молочной железы, яичников и матки. Его уровень также увеличивается при воспалительных заболеваниях кишечника, инфекциях легких и вследствие курения. РЭА разрушается в печени, поэтому его уровень возрастает при заболеваниях печени, особенно при циррозе. Однако скорость роста и максимальный уровень маркера в этих случаях значительно ниже, чем при злокачественных заболеваниях, и после клинического улучшения значения обычно нормализуются.
Его уровень также увеличивается при воспалительных заболеваниях кишечника, инфекциях легких и вследствие курения. РЭА разрушается в печени, поэтому его уровень возрастает при заболеваниях печени, особенно при циррозе. Однако скорость роста и максимальный уровень маркера в этих случаях значительно ниже, чем при злокачественных заболеваниях, и после клинического улучшения значения обычно нормализуются.
Повышение значений: 1.

Опухолевые маркеры: Рак толстой кишки (РТК)
Определяющим клиническими ОМ при РТК является раково-эмбриональный антиген РЭА (СЕА) и комплиментарный маркер СА19.9.
РЭА – гликопротеид, располагающийся в периферических слоях клеточной мембраны. Физиологическое значение РЭА точно неизвестно, возможно, что белок усиливает внутриклеточное сцепление молекул. Диагностическое и прогностическое значение обсуждается уже третье десятилетие. Клетки, экспрессирующие маркер, стимулируют метастазирование, связываясь с рецепторами РЭА в легких и печени.
Маркер СА19.9 имеет прогностическое значение: при уровне свыше 37 ед/мл риск смерти после операции в ближайшие 3 года возрастает в 4 раза.
Цитокератиновые антигены СК17 и СК18 экспрессируются при РТК у 28%. Указывают на наихудший прогноз для выживаемости. Являются мишенью для моноклональных антител.
У 865 больных РТК определяется сиалозил-Тн антиген, коррелирует с плохой выживаемостью. Антиген не выделяется нормальной слизистой, за исключением гиперпластического полипа.
Диагноз. Верхняя граница нормы для некурящих составляет 2.5-5.0 нг/мл; для здоровых курильщиков – 7-10.0 нг/мл. Несмотря на то, что 70-90% пациентов с аденокарциномой кишечника имеют повышенный уровень РЭА в крови, его чувствительность при ранних стадиях заболевания достигает лишь 20%.
Прогноз. Определение РЭА у пациентов с РТК до операции может использоваться в качестве прогностического индикатора в дополнение к патологическому стадированию и планированию объёма хирургического вмешательства. Показано, что повышенные значения РЭА до операции связаны с высоким риском рецидива и плохим прогнозом. На последней конференции Американский объединённый комитет по раку предложил включить РЭА в систему стадирования TNM для колоректального рака.
Мониторинг. После радикального удаления опухоли концентрация РЭА в крови, если она была повышенной до операции, должна снижаться до нормальных значений в соответствии с периодом полужизни. Если уровень РЭА не снижается до нормы, то вероятно, что имеет место неполная резекция опухоли, либо скрытые метастазы. Повышение уровня РЭА является первым подозрительным в отношении рецидива сигналом, который предсказывает рецидив в 80% случаев. Этот факт является основанием для проведения ревизионной лапаротомии даже при незначительном повышении уровня маркера и несмотря на то, что другие диагностические процедуры могут быть отрицательными. Наибольшая чувствительность РЭА показана при метастазах РТК в печень и забрюшинные л/узлы, невысокая чувствительность – при локальных, перитонеальных или лёгочных включениях.
После радикального удаления опухоли концентрация РЭА в крови, если она была повышенной до операции, должна снижаться до нормальных значений в соответствии с периодом полужизни. Если уровень РЭА не снижается до нормы, то вероятно, что имеет место неполная резекция опухоли, либо скрытые метастазы. Повышение уровня РЭА является первым подозрительным в отношении рецидива сигналом, который предсказывает рецидив в 80% случаев. Этот факт является основанием для проведения ревизионной лапаротомии даже при незначительном повышении уровня маркера и несмотря на то, что другие диагностические процедуры могут быть отрицательными. Наибольшая чувствительность РЭА показана при метастазах РТК в печень и забрюшинные л/узлы, невысокая чувствительность – при локальных, перитонеальных или лёгочных включениях.
Уровень РЭА не коррелирует с размерами опухоли, в большей степени зависит от дифференцировки: при недифференцированном раке часто негативен.
Медленное повышение уровней РЭА связано с локорегиональным рецидивом, тогда как быстрое повышение обычно означает метастазы в печень.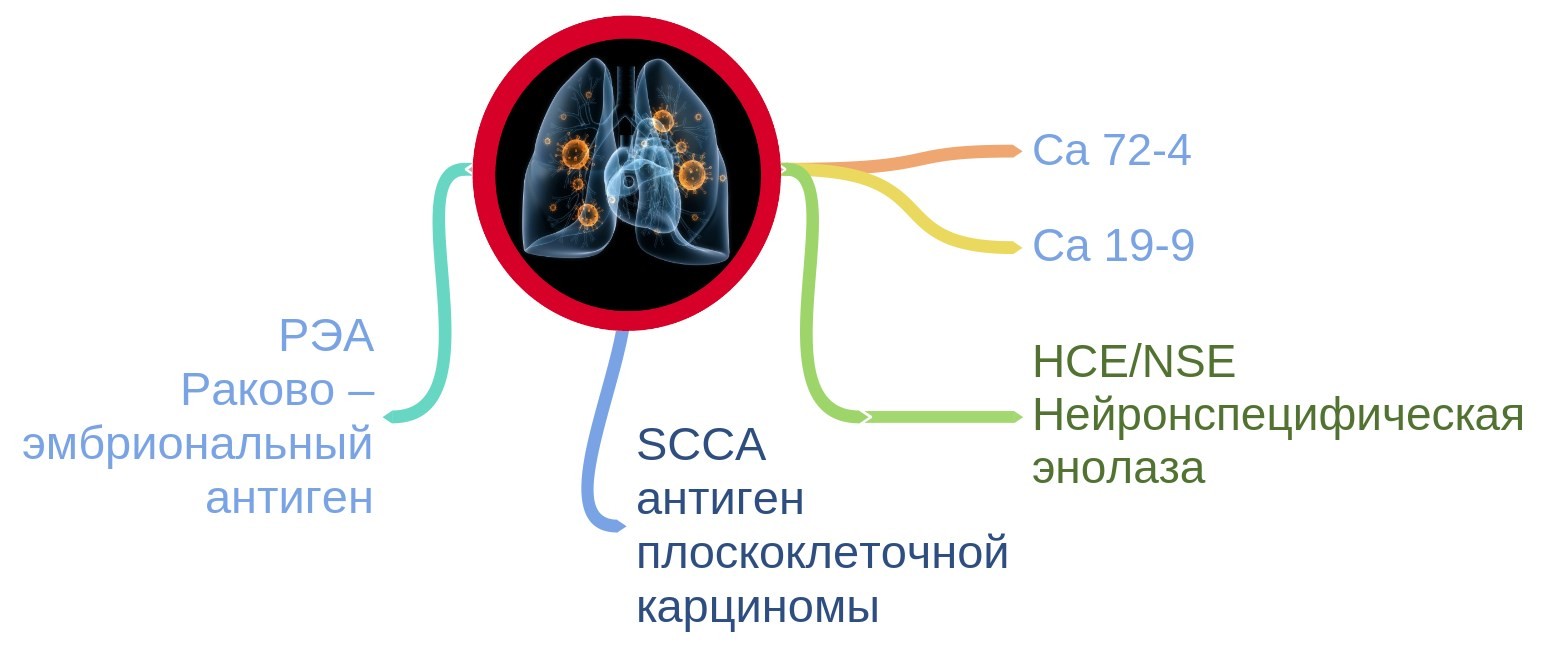 Использование РЭА в мониторинге пациентов способствует увеличению интервалов между радиологическими исследованиями и уменьшению числа этих исследований, хотя и не может полностью их заменить.
Использование РЭА в мониторинге пациентов способствует увеличению интервалов между радиологическими исследованиями и уменьшению числа этих исследований, хотя и не может полностью их заменить.
Контроль эффективности терапии. В случае метастатического заболевания РЭА точно отражает активность болезни и позволяет клиницисту распознать и прервать неэффективную терапию. Для оценки ответа, по рекомендациям ASCO и EGTM, РЭА должен определяться перед началом терапии и затем с регулярными интервалами в 2-3 месяца в течение, по крайней мере, первых двух лет после постановки диагноза (табл.1).
Таблица 1. Время после хирургического лечения первичного РТК и порядок обследования.
| До 2 лет | 3-4 года | Более 4 лет | |
|---|---|---|---|
| Определение РЭА | Каждые 2 мес. | Каждые 4 мес. | |
| Осмотр врача | Каждые 3-6 мес.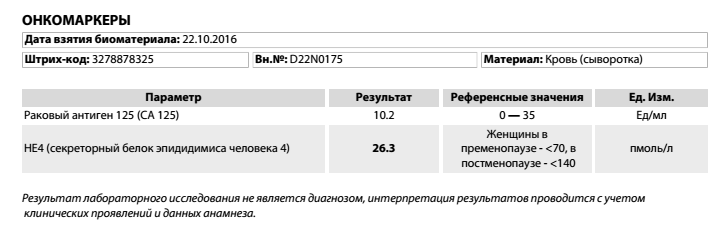 |
Каждые 6-12 мес. | Раз в год |
| Реакция кала на скрытую кровь |
Каждые 3-6 мес. | Каждые 6-12 мес. | Раз в год |
| Колоноскопия | Раз в год | Раз в 3 года | Раз в 3 года |
| Сигмоскопия | Каждые 6 мес. | Каждые 6-12 мес. | Каждые 6-12 мес. |
| Рентгеноскопия грудной клетки |
2 раза в год | Раз в год | Раз в год |
Прогрессирование болезни может быть документировано посредством двух последовательных определений РЭА, превышающих ДК, даже в отсутствии других подтверждающих критериев. Существует мнение, что прогностическое значение РЭА достаточно высоко и позволяет исключить необходимость подтверждающего тестирования.
Анализ крови на онкомаркеры — ФГБУ «НМИЦ ТПМ» Минздрава России
Очень часто люди живут, не подозревая о том, что у них есть онкологическое заболевание. Это очень опасно и чревато серьезными последствиями, вплоть до ухода из жизни. Чтобы этого не допустить, нужно периодически проводить диагностику состояния своего организма на выявление признаков подобных заболеваний. Для этого врачи рекомендуют сдавать анализ крови на онкомаркеры. С помощью такого исследования выявляются специфические белки и химические соединения, наличие и концентрация которых в крови могут быть вызваны злокачественной опухолью.
Это очень опасно и чревато серьезными последствиями, вплоть до ухода из жизни. Чтобы этого не допустить, нужно периодически проводить диагностику состояния своего организма на выявление признаков подобных заболеваний. Для этого врачи рекомендуют сдавать анализ крови на онкомаркеры. С помощью такого исследования выявляются специфические белки и химические соединения, наличие и концентрация которых в крови могут быть вызваны злокачественной опухолью.
Виды онкомаркеров
Одним из наиболее распространенных анализов для выявления онкологического заболевания является анализ на онкомаркер са 125. Он позволяет установить наличие рака или метастазов в яичниках. У здоровых людей показатель данного маркера близок к нулю. Если же он в несколько раз выше нормы, существует высокий риск наличия онкологического заболевания или его рецидива. Однако не всегда стоит паниковать. Например, в первый триместр беременности повышение этого вещества является нормальным физиологическим состоянием.
Другое, не менее известное и часто проводимое исследование — анализ на онкомаркер РЭА. Данная аббревиатура расшифровывается как раковый эмбриональный антиген, представляющий собой белково-углеводное соединение. В небольших количествах это вещество присутствует в клетках даже здорового человека. Однако показатели, превышающие норму, могут свидетельствовать о раке толстой и прямой кишки, желудка, легких, яичников и других внутренних органов. В некоторых случаях повышение РЭА может наблюдаться при воспалительных, аутоиммунных и иных заболеваниях. Поэтому в каждом случае необходимо посещать врача. Отклонение данного маркера от нормы может наблюдаться также у курильщиков и людей, злоупотребляющих алкоголем. Это не исчерпывающий перечень анализов, поскольку для каждого конкретного онклогического заболевания предусмотрен специфический маркер.
Данная аббревиатура расшифровывается как раковый эмбриональный антиген, представляющий собой белково-углеводное соединение. В небольших количествах это вещество присутствует в клетках даже здорового человека. Однако показатели, превышающие норму, могут свидетельствовать о раке толстой и прямой кишки, желудка, легких, яичников и других внутренних органов. В некоторых случаях повышение РЭА может наблюдаться при воспалительных, аутоиммунных и иных заболеваниях. Поэтому в каждом случае необходимо посещать врача. Отклонение данного маркера от нормы может наблюдаться также у курильщиков и людей, злоупотребляющих алкоголем. Это не исчерпывающий перечень анализов, поскольку для каждого конкретного онклогического заболевания предусмотрен специфический маркер.
Прохождение исследования
Многие люди, решившие проверить состояние своего организма, задаются вопросом, где сдать анализ на онкомаркеры. Такие услуги предлагают многие диагностические клиники. Наш центр профилактической медицины оснащен ультрасовременным оборудованием и имеет в штате ведущих специалистов – академиков и профессоров.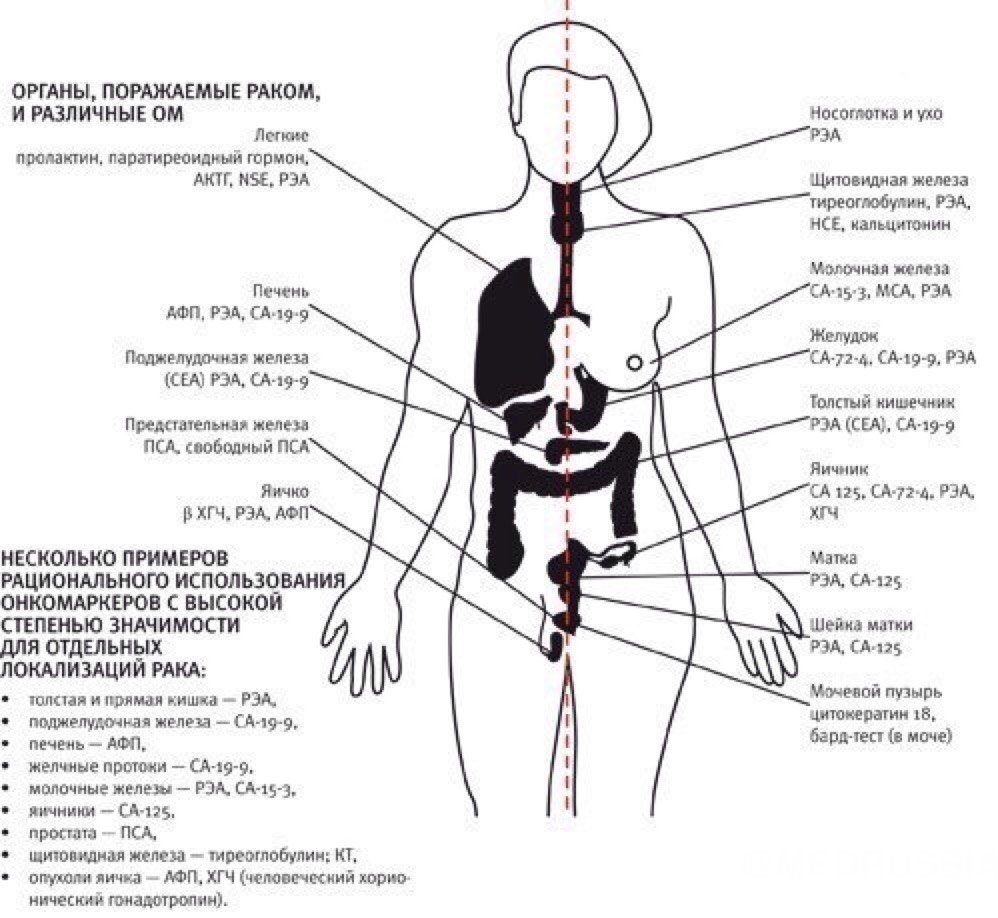 Обращение в наше учреждение дает гарантию получения качественных услуг и возможность своевременно выявлять серьезные заболевания. Чтобы узнать, сколько стоит анализ на онкомаркеры, достаточно зайти на сайт конкретного медицинского учреждения.
Обращение в наше учреждение дает гарантию получения качественных услуг и возможность своевременно выявлять серьезные заболевания. Чтобы узнать, сколько стоит анализ на онкомаркеры, достаточно зайти на сайт конкретного медицинского учреждения.
Анализ крови на онкомаркер представляет собой важное медицинское исследование. Оно не только дает информацию о наличии в организме опухоли или ее отсутствии, но также применяется для определения качества новообразования, оценки эффективности лечения и контроля заболевания.
Страница носит информационный характер. Точный перечень оказываемых услуг и особенности проведения процедур узнавайте по телефонам.
Онкомаркеры. Важный сигнал или деньги на ветер?
ПСА, СА125, СА242, СА15-5 и многие другие анализы известные как онкомаркеры. Насколько они точны и когда их стоит сдавать? Помогут ли они в раннем выявлении опухолей?
Что такое онкомаркеры?
Представим теоретическую ситуацию — врач дал направление на онкомаркеры, сейчас даже не будем выяснять, на какие именно: • Какие чувства испытывает пациент, получив такое направление и ожидая результата? • Какие эмоции вызовет цифра на бланке, если она окажется вне границ нормы? • Ужас, страх, отчаяние. А нужны ли они нам?
А нужны ли они нам?
Давайте разберемся насколько точны онкомаркеры и когда нужно определять их уровень. Мы будем использовать данные только очень серьезных источников: статистические данные Всемирной Организации здравоохранения и международные рекомендации разработанные Национальной Академией Клинической Биохимии (NACB, США) и Европейской Группой по Изучению Опухолевых Маркеров (EGTM), конечно с адаптацией к Российской действительности.
Давайте разберемся с самого начала:
Онкомаркерами называют те или иные вещества, которые определяют в биологических жидкостях организма (чаще всего речь идет о сыворотке крови), так же онкомаркеры могут выявлять в экстрактах или парафиновых блоках тканей. Идеальный маркер должен обладать двумя характеристиками: • чувствительность — это процент положительных результатов у людей с опухолью • специфичность — это процент здоровых людей, у которых тест дает отрицательный результат
Идеальными были бы 100% чувствительность и 100% специфичность. При этом онкомаркер должен быть характерным для какого-то конкретного вида опухолей.
При этом онкомаркер должен быть характерным для какого-то конкретного вида опухолей.
К сожалению, подобных маркеров еще не обнаружено, поэтому всегда сохраняется право на ошибку, как в сторону ложного диагноза, так и в сторону ложного спокойствия.
Важность диагностики опухолей
По данным Всемирной Организации Здравоохранения (ВОЗ) ежегодно 6 миллионов человек в мире умирает от злокачественных опухолей. И ежегодно выявляется более 10 миллионов новых случаев онкологических заболеваний. По прогнозам ВОЗ в ближайшие 20 лет ситуация будет только ухудшаться — смертность возрастет до 10 миллионов в год, в заболеваемость до 15 миллионов в год.
При этом до 40% случаев рака можно было избежать, сократив осознанные контакты с канцерогенами и 30% смертей можно предотвратить, выявляя опухоли на ранних этапах.
Какие онкомаркеры нам известны
Перечень известных онкомаркеров стремится к бесконечности. Большая часть из них очень специфичны и не известны врачам общей практики. Чаще всего врачей, которые не специализируются на ведении больных с онкопатологией, интересуют следующие:
Чаще всего врачей, которые не специализируются на ведении больных с онкопатологией, интересуют следующие:
- ПСА (простат-специфический антиген) — антиген характерный для ткани предстательной железы, его уровень в крови повышается как при злокачественных, так и при доброкачественных заболеваниях простаты. Кроме того уровень ПСА может быть повышен после травм, пальпации, механического раздражения железы или эякуляции накануне сдачи анализа.
- СА125 антиген, присутствующий в нормальной ткани эндометрия. Он проникает в кровоток только в случае повреждения природных барьеров. Его уровни в крови могут удваиваться во время менструации и при эндометриозе. Значительное повышение уровня СА125 происходит при раке яичников (в 80% случаев) и других органов женской половой системы, опухолях молочной и поджелудочной желез, прямой кишки, желудка легких и печени. Из доброкачественных заболеваний к повышению уровня этого маркера приводят воспалительные заболевания органов женской половой системы, гепатиты, циррозы и аутоиммунные заболевания.

- СА15-3 антиген, наиболее характерный для опухолевых клеток из молочной железы, его уровень может увеличиваться и при злокачественных опухолях других локализаций (желудка, печени, поджелудочной железы и органов женской репродуктивной системы). Кроме того его уровень повышается при доброкачественных заболеваниях молочных желез и аутоиммунных процессах
- СА19-9 антиген, который вырабатывается клетками карциномы поджелудочной железы, реже опухолей желудка (второй по значимости маркёр этих опухолей), печени и молочной железы. Из доброкачественных заболеваний к повышению его уровня приводят гепатиты и цирроз, холецистит и муковисцидоз.
- СА242 это маркёр злокачественных опухолей желудочно-кишечного тракта, в основном повышается при опухолях поджелудочной железы, кишечника и желудка, но может быть повышен и при доброкачественных заболеваниях этих органов.
- СЕА (он же РЕА- раково-эмбриональный антиген) обнаруживается в некоторых тканях взрослых в очень малых количествах.
 При опухолевых процессах концентрация РЭА в крови значительно повышается. Рост концентрации этого маркера происходит при колоректальном раке, раке лёгкого, молочной или поджелудочной желез, метастазах злокачественных опухолей в печень, костную ткань, опухолях простаты и яичников. При этом повышение происходит и при доброкачественных заболеваниях кишечника, печени и легких, особенно у заядлых курильщиков.
При опухолевых процессах концентрация РЭА в крови значительно повышается. Рост концентрации этого маркера происходит при колоректальном раке, раке лёгкого, молочной или поджелудочной желез, метастазах злокачественных опухолей в печень, костную ткань, опухолях простаты и яичников. При этом повышение происходит и при доброкачественных заболеваниях кишечника, печени и легких, особенно у заядлых курильщиков.
А теперь, давайте узнаем, в каких случаях стоит проводить подобный анализ.
Самые распространенные опухоли.
Достаточно часто люди боятся рака в целом. Но провериться на все болезни нельзя, поэтому посмотрим статистику ВОЗ и узнаем, какие опухоли уносят больше всего жизней у жителей России.
Мужчины:
- Раки трахеи, бронхов и легких- 27,8%
- Опухоли желудка — 12,55
- Раки толстой и прямой кишки — 11,8 %
- Рак предстательной железы — 7,7%
- Опухоли слизистых рта и ротоглотки 5,0%
- 35,3% приходится на смерти от всех остальных видов опухолей
Женщины:
- Опухоли молочных желез — 17,8%
- Опухоли прямой и толстой кишки — 16,5%
- Опухоли желудка — 10,9%
- Раки трахеи, бронхов и легких — 6,8%
- Опухоли поджелудочной железы 5,9%
- 42,2% приходится на смерти от всех остальных видов опухолей
А теперь рассмотрим возможности использования онкомаркеров для выявления и лечения людей с этими опухолями.
Раки трахеи, бронхов и легких
Маркерами которые могут быть использованы для определения прогнозов при раке легкого считаются НСЕ, РЕА и CYFRA21.1. НСЕ (нейрон-специфическая энолаза)-характерна только для одного вида этого рака-для мелкоклеточного. Для остальных видов рака легкого используются РЕА и CYFRA21.1. Ни один из этих маркеров не может быть использован для диагностики, так как специфичность их очень низка (другими словами выявляется достаточно много ложноположительных результатов при низкой чувствительности метода. Однако эти маркеры необходимы для оценки результатов лечения- при сравнении уровней их до начала терапии и в процессе лечения. Так же они могут применяться после хирургического лечения для выявления рецидива.
Опухоли молочных желез
Опухоли молочной железы являются самой частой причиной смерти женщин от онкологических заболеваний. Особенностью этих опухолей являются хорошие результаты лечения на ранних стадиях, поэтому очень важно своевременное выявление. При раке молочной железы наибольшее значение имеют РЭА и СА15.3 . Доказано, что у женщинам, перенесших радикальное лечение, повышение СА15.3 практически всегда говорит о рецидиве болезни. Динамика уровней этого маркера в процессе лечения отражает эффективность выбранного метода терапии. Однако учитывая низкую специфичность СА15.3 не рекомендуется использовать его для скрининга рака молочной железы
При раке молочной железы наибольшее значение имеют РЭА и СА15.3 . Доказано, что у женщинам, перенесших радикальное лечение, повышение СА15.3 практически всегда говорит о рецидиве болезни. Динамика уровней этого маркера в процессе лечения отражает эффективность выбранного метода терапии. Однако учитывая низкую специфичность СА15.3 не рекомендуется использовать его для скрининга рака молочной железы
Опухоли прямой и толстой кишки
Если колоректальный рак выявлен на ранней стадии, то 5-илетняя выживаемость после лечения достигает 90%, это очень хороший показатель в онкологии. Самым частым маркером этого вида опухолей является РЭА. Однако и здесь в рекомендациях экспертов мы видим картину схожую с предыдущими. Динамика РЭА может использоваться для выявления прогрессирования после проведенного лечения, особенно важен этот маркер для выявления прогрессирования после удаления метастазов из печени. Но его определение не используется для скрининга колоректального рака.
Опухоли предстательной железы
В России определение ПСА используется для скрининга рака предстательной железы при ежегодных диспансерных обследованиях мужчин старше 50 лет. В США и странах Европы так же рекомендовано определение этого маркера всем мужчинам старше 50 лет, а при отягощенной наследственности от 40-45 лет. Однако, полагаясь на результаты теста, необходимо учитывать несколько интересных фактов о данном маркере:
В США и странах Европы так же рекомендовано определение этого маркера всем мужчинам старше 50 лет, а при отягощенной наследственности от 40-45 лет. Однако, полагаясь на результаты теста, необходимо учитывать несколько интересных фактов о данном маркере:
- ПСА информативен только в сочетании с пальцевым ректальным исследованием
- При сдаче крови на анализ необходима соответствующая подготовка
- При оценке результата необходимо использовать возрастные нормы
- Мужчинам старше 75 лет подобный скрининг не назначается, так как лечение неклинических форм рака предстательной железы только ухудшает прогноз для жизни
- Данные исследований, опубликованные в 2011 году подтвердили, что раннее выявление рака предстательной железы благодаря скринингу в долгосрочной перспективе никак не повлияло на специфическую продолжительность жизни.
Поэтому даже такой специфичный и привычный маркер как ПСА сдает свои позиции в ранней диагностике.
Опухоли женской репродуктивной системы
Опухоли женской репродуктивной системы являются причиной примерно 10% смертей от злокачественных опухолей. Они не вошли в наш первоначальный список, так как в статистике ВОЗ они разделены по опухолям отдельных органов (опухоли эндометрия, шейки матки, яичников и т.д).
Среди них, рак яичников уносит больше всего женских жизней. Для дифференциальной диагностики между доброкачественными и злокачественными процессами при выявлении патологических образований в малом тазу можно использовать СА125. Этот маркер используется для дальнейшего наблюдения за пролеченными пациентками, а его уровни в динамике для оценки эффективности терапии. Анализ СА125 не рекомендуется экспертами для скрининга у женщин без каких-либо жалоб. Однако это исследование следует проводить каждые 6 месяцев совместно с УЗИ органов малого таза у женщин с высокой наследственной предрасположенностью — при наличии мутаций в генах BRCA1 и BRCA2.
Когда онкомаркеры действительно необходимы
Определение большей части онкомаркеров имеет значение и должно быть использовано при наличии клинических проявления опухоли и ее инструментальном подтверждении для дифференциальной диагностики или мониторинга эффективности терапии.
В качестве скрининга анализ на онкомаркеры не стоит использовать. Однако это не говорит о том, что маркер не способствует раннему выявлению опухолей, а лишь о том, что подобное обследование не улучшает прогноз средней группы людей. При этом никто не сможет сказать, как оно повлияет на жизнь конкретного человека.
Крайне важно, чтобы любое обследование назначал врач, который владеет достаточными знаниями и может трактовать результат анализа во благо пациента. Это поможет не только сохранить здоровье, а также избежать стрессовых ситуаций и лишних материальных трат.
Раннее выявление опухолей способно спасти миллионы жизней. Где место онкомаркеров в этом процессе?
Комоза Валентин Александрович
врач онколог-хирург ГАУЗ БООД
РЭА, сдать анализ на РЭА онкомаркер в крови
Метод определения Иммуноферментный анализ.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияРаковоэмбриональный антиген – один из широко используемых опухолевых маркеров. Наиболее информативен при желудочно-кишечных (особенно колоректальных) карциномах.
Наиболее информативен при желудочно-кишечных (особенно колоректальных) карциномах.
Синонимы: Анализ крови на РЭА; Раковый эмбриональный антиген.
Carcino Embryonic Antigen.
Краткое описание исследования Раковоэмбриональный антиген
Раково-эмбриональный антиген относится к онкофетальным антигенам (в норме продуцируемый в большом количестве специфическими клетками в эмбриональном периоде и лишь в следовых количествах – у взрослых людей). РЭА – гетерогенная группа сходных белков, выявляемых иммунометрически. Эта гетерогенность объясняет различия при проведении исследований разными лабораторными методами, поэтому мониторинг терапии пациента надо проводить в одной лаборатории с использованием одного и того же метода. Содержание РЭА увеличивается при карциномах желудочно-кишечного тракта, легких, молочной железы, яичников и матки. Его уровень растет также при воспалительных заболеваниях кишечника, инфекциях легких и вследствие курения. РЭА разрушается в печени, поэтому уровень его возрастает при заболеваниях печени, особенно при циррозе. Однако скорость роста концентрации и максимальный уровень маркера в этих случаях значительно ниже, чем при злокачественных заболеваниях, и после клинического улучшения значения обычно нормализуются. У здоровых людей РЭА редко бывает выше 3 нг/мл, но может достигать 5-10 нг/мл при доброкачественных опухолевых заболеваниях, 7-10 нг/мл у лиц, страдающих алкоголизмом, и даже 10-20 нг/мл у курильщиков. Повышение концентрации РЭА в крови особенно характерно для карцином толстой кишки. При опухолях толстой кишки уровень раково-эмбрионального антигена в начале лечения коррелирует со стадией процесса, продолжительностью безрецидивного периода и прогнозом жизни. У больных с локализованным процессом РЭА увеличивается в 25% случаев, у пациентов с метастазами – в 60-80% случаев (в зависимости от типа опухоли). Очень высокие начальные концентрации РЭА до оперативного лечения могут указывать и на метастазирование опухоли в регионарные лимфоузлы. Слабо дифференцированные опухоли не продуцируют РЭА.
Однако скорость роста концентрации и максимальный уровень маркера в этих случаях значительно ниже, чем при злокачественных заболеваниях, и после клинического улучшения значения обычно нормализуются. У здоровых людей РЭА редко бывает выше 3 нг/мл, но может достигать 5-10 нг/мл при доброкачественных опухолевых заболеваниях, 7-10 нг/мл у лиц, страдающих алкоголизмом, и даже 10-20 нг/мл у курильщиков. Повышение концентрации РЭА в крови особенно характерно для карцином толстой кишки. При опухолях толстой кишки уровень раково-эмбрионального антигена в начале лечения коррелирует со стадией процесса, продолжительностью безрецидивного периода и прогнозом жизни. У больных с локализованным процессом РЭА увеличивается в 25% случаев, у пациентов с метастазами – в 60-80% случаев (в зависимости от типа опухоли). Очень высокие начальные концентрации РЭА до оперативного лечения могут указывать и на метастазирование опухоли в регионарные лимфоузлы. Слабо дифференцированные опухоли не продуцируют РЭА.
Определение этого маркера наиболее информативно при мониторинге больных после проведенной терапии.
Снижающиеся показатели РЭА связаны, как правило, с успешным лечением, стойкое повышение его уровня свидетельствует об отсутствии адекватного ответа на терапию. Повышенный уровень РЭА указывает на вероятность рецидива за несколько месяцев до появления клинических признаков.
С какой целью определяют уровень РЭА в сыворотке крови
Исследование РЭА в сыворотке крови рекомендовано использовать преимущественно в целях прогноза, контроля лечения, выявления рецидивов определенных видов рака.
Сдать анализ: Раково-эмбриональный антиген (РЭА)
Описание анализа:
Раково-эмбриональный антиген (CEA ) — гликопротеин, вовлеченный в регуляции адгезии клеток и уровень экспрессии которого часто повышен при злокачественных новообразованиях.
При нормальных условиях РЭА производится в период эмбриогенеза, поэтому может определяться в сыворотке крови плода. В крови беременных женщин не определяется. После рождения ребенка, его синтез подавляется, и РЭА практически не обнаруживается ни в крови, ни в других биологических жидкостях взрослых здоровых людей, однако может определяться у активных курильщиков. РЭА является общим онкомаркером, уровень которого повышается при развитии опухолей различной локализации.
После рождения ребенка, его синтез подавляется, и РЭА практически не обнаруживается ни в крови, ни в других биологических жидкостях взрослых здоровых людей, однако может определяться у активных курильщиков. РЭА является общим онкомаркером, уровень которого повышается при развитии опухолей различной локализации.
Повышенный уровень РЭА определяется при злокачественных новообразованиях желудочно — кишечного тракта, а именно при раках желудка, поджелудочной железы, колоректальном раке. Также определение РЭА целесообразно при раке молочной железы, яичников и матки, раке легких, модулярном раке щитовидной железы.
Его уровень растет также при воспалительных заболеваниях кишечника, инфекциях легких и вследствие курения. Как и другие гликопротеины, РЭА разрушается в печени, поэтому уровень его возрастает при заболеваниях печени, особенно при циррозе печени. Однако, скорость роста концентрации и максимальный уровень маркера в этих случаях значительно ниже, чем при злокачественных заболеваниях, и после клинического улучшения значения обычно нормализуются.
Показания к назначению анализа:
1 . В комплексе исследований при диагностике опухолей.
2. Контроль эффективности хирургического лечения колоректального рака, опухолей молочной железы, опухолей желудка и легкого, выявление ранних рецидивов и метастазирования в отдаленном периоде после оперативного лечения.
3 . Диагностика С — клеточной карциномы.
Нормы для РЭА:
Для людей некурящих: <5 нг / мл
Для курящих: <10 нг / мл
Чувствительность теста составляет при:
— Колоректальном раке — 50 % при концентрации более 70 нг / мл;
— Рака печени — 33 % при концентрации более 70 нг / мл;
— Рака желудка — 27 % при концентрации более 70 нг / мл;
— Рака молочной железы — 28 % при концентрации более 42 нг / мл;
— Рака легких — 22 % при концентрации более 74 нг / мл.
Повышение значений :
Онкопатология ( 20 нг / мл и выше):
— Колоректальные карциномы.
— Рак легкого.
— Рак молочной железы.
— Карциномы поджелудочной железы.
— Метастазы злокачественных опухолей в печень, костную ткань.
— Опухоли простаты, яичников.
Соматическая патология (уровень РЭА редко превышает 10 нг / мл, при клиническом улучшении может нормализоваться):
— Цирроз печени и хронические гепатиты.
— Колоректальные полипы.
— Язвенный колит.
— Панкреатит.
— Туберкулез.
— Пневмония, бронхит, эмфизема легких.
— Муковисцидоз.
— Почечная недостаточность.
— Болезнь Крона.
— Аутоиммунные заболевания.
— Курение.
— Алкоголизм.
Подготовка к исследованию: не требуется.
Материал для исследования: сыворотка крови.
Метод определения: иммунохемилюминисцентный.
Запись на анализы
органо-специфических опухолевых маркеров: что нового?
Indian J Clin Biochem. 2012 Apr; 27 (2): 110–120.
2012 Apr; 27 (2): 110–120.
Каннан Вайдьянатан
Отдел биохимии, Институт медицинских наук Амрита, Кочи, 682041 Керала, Индия
DM Васудеван
Отделение биохимии, Институт медицинских наук Амрита, Индия, Керала, 68203, Керала, Керала, 68203, Керала
Отдел биохимии, Институт медицинских наук Амрита, Кочи, 682041 Керала, Индия
Автор, ответственный за переписку.Поступило 01.10.2011; Принято 11 октября 2011 г.
Copyright © Ассоциация клинических биохимиков Индии, 2011 г. Эта статья цитируется в других статьях в PMC.Abstract
Онкомаркеры — это молекулы, вырабатываемые в организме в ответ на рак. Идеальный онкомаркер должен обладать высокой чувствительностью и специфичностью, быть дешевым и легко обнаруживаться в жидкостях организма. Идентификация новых маркеров важна, и ожидается, что с появлением новых технологий будут обнаружены более надежные маркеры.В этом обзоре обсуждаются доступные в настоящее время онкомаркеры для различных злокачественных новообразований.
Ключевые слова: Иммуногистохимические маркеры, протеомные маркеры, Молекулярные маркеры
Введение
Опухолевые маркеры — это молекулы, продуцируемые опухолевыми клетками или другими клетками организма в ответ на рак или определенные доброкачественные состояния. Большинство опухолевых маркеров секретируются в кровь и могут быть определены в крови, но они также могут быть измерены в моче, тканях и т. Д. Онкомаркеры могут использоваться для диагностики, определения стадии и прогноза рака; их также можно использовать для мониторинга реакции на лечение, а также для проверки рецидива рака.Существует большое количество онкомаркеров, которые используются при различных типах рака; многие опухолевые маркеры также могут быть повышены при более чем одном типе рака. Сводка традиционных онкомаркеров приведена в таблице.
Таблица 1
Традиционно используемые опухолевые маркеры при различных типах рака
| Тип рака | Маркеры первой линии | Маркеры второй линии | |
|---|---|---|---|
| Рак почки | Нет | Углеводный антиген 50 ( CA 50), муциноподобный антиген, связанный с раком (MCA) | |
| Рак мочевого пузыря | Тканевый полипептидный антиген (TPA), CA 19.9 | Нет | |
| Рак головы и шеи | Нет | Антиген плоскоклеточного рака (SCC), тканевый полипептидный антиген (TPA) | |
| Рак легкого (Мелкоклеточный рак) | Нейронспецифическая энолаза (NSE) | Нет | |
| Рак легкого (эпидермоидный рак) | Цитокератиновый фрагмент 21.1 (Cyfra21.1) | Нет | |
| Рак легкого (аденокарцинома) | Карциноэмбриональный антиген (CEA) | Нил | Нил | Альфа-фетопротеин (AFP), β-хорионический гонадотропин (β-ХГЧ) | Нет |
| Рак яичников (Серозный рак) | CA 125 | Нет | |
| Рак яичников (Муцинозный рак) ) | CEA | Нет | |
| Рак матки (пузырный занос) | β-ХГЧ | Нет | |
| Ut рак матки (плоскоклеточный рак) | SCC | Нет | |
| Рак матки (аденокарцинома) | CEA | Нет | |
| Рак желудка | CA 19.9, CA 72,4 | CEA | |
| Рак пищевода | Нет | SCC, TPA, CEA | |
| Рак яичка | AFP, β-ХГЧ | Нет | |
| Колоректальный рак | CEA | CA 19.9, TPA | |
| Рак предстательной железы | Простатоспецифический антиген (PSA), кислотная фосфатаза простаты (PAP) | Nil | |
| Рак поджелудочной железы | CA 19.9 | CEA | |
| Рак печени | AFP | Ферритин | |
| Меланома | S-100 | NSE |
В последние годы появилось большое количество онкомаркеров.Раньше было два основных инструмента для оценки онкомаркеров; Иммуноферментный анализ (ELISA) и радиоиммуноанализ (RIA) [1]. Иммуногистохимические маркеры (рецепторы эстрогена и прогестерона, ER и PR), молекулярные инструменты (TMPRSS2: гены слияния ERG, профили экспрессии генов), а также протеомные инструменты теперь используются для количественной оценки маркеров рака. Некоторые из этих маркеров были приняты для использования в клинической практике (например, ER и PR, профили экспрессии генов при раке груди). В ближайшем будущем на рынок, вероятно, будет выпущено гораздо больше [2].
Классификация онкологических маркеров
Существуют различные способы классификации онкологических маркеров [1]. Один из традиционно принятых способов классификации — на
Онкофетальные антигены (CEA, AFP)
Гликопротеиновые антигены или углеводные антигены (CA 125, CA 19.9, CA 15-3)
Ферменты (PSA, ALP, NSE)
Рецепторы гормонов (ER, PR)
Гормоны (β-ХГЧ, кальцитонин)
Другие биомолекулы (VMA, 5HIAA).
Опухолевые маркеры также могут быть классифицированы на основе
Биохимическая структура
Функция
Сочетание биохимической структуры и функции и
Открытие онкофетального антигена.
Зачем нужны новые опухолевые маркеры
Идеальный опухолевый маркер должен обладать высокой чувствительностью и специфичностью [3]. Однако на практике чувствительность и специфичность отдельных маркеров могут широко варьироваться.В таблице приведены чувствительность и специфичность некоторых распространенных маркеров. Недостатки доступных онкомаркеров [4]:
Раннее выявление затруднено, так как низкие уровни наблюдаются у нормальных людей
Большой объем рака необходим для значительного повышения выше нормы
Некоторые люди с раком никогда не получить повышенные уровни
Повышенные уровни могут наблюдаться в незлокачественных условиях
Таблица 2
Чувствительность и специфичность важных онкомаркеров [76]
| Маркер опухоли | Первичный тип рака | Чувствительность (%) | Другие виды рака | Незлокачественные состояния |
|---|---|---|---|---|
| CA 27.29 | Грудь | 33 (ранний), | Толстая кишка, легкие, печень, желудок, поджелудочная железа, яичник, простата | Заболевания груди, печени и почек, киста яичника |
| 67 (поздно) | ||||
| CEA | Колоректальный | 25 (ранний), | Грудь, легкие, желудок, поджелудочная железа, мочевой пузырь, щитовидная железа, голова и шея, шейка матки, печень, лимфома, меланома | Курение сигарет, язвенная болезнь, воспалительное заболевание кишечника, панкреатит, цирроз , билиарная непроходимость, гипотиреоз, |
| 75 (поздно) | ||||
| CA 19.9 | Поджелудочная железа | 80–90 | Толстая кишка, пищевод, печень | Панкреатит, заболевания желчевыводящих путей, цирроз |
| AFP | HCC, GCT | 80 HCC | Желудок, поджелудочная железа, билиарный | Цирроз, вирусный гепатит, беременность |
| β-ХГЧ | Несеминоматозные опухоли половых клеток, гестационные трофобластные опухоли | 85 | Редко рак желудочно-кишечного тракта | Гипогонадальные состояния, марихуана |
| CA 125 | Яичников | ),Эндометрий, маточная труба, грудь, ушко, пищевод, желудок, печень, поджелудочная железа | Менструация, беременность, миома, кисты яичников, воспаление тазовых органов, цирроз, асцит, плевральный и перикардиальный выпот, эндометриоз | |
| 85 ( поздно) | ||||
| PSA | Простата | 75 | Нет | Простата, доброкачественный гипертроф предстательной железы y, травма простаты, после эякуляции |
Существует ряд физиологических и патологических факторов, которые могут повлиять на результаты [4]; например,
Почечная недостаточность, холестаз — повышенные уровни многих маркеров даже в незлокачественных условиях
Ревматические заболевания — CA 19.Уровень 9
Наркотики — например, антиандрогены — повышение уровня ПСА
Ректальное обследование, трансуретральные манипуляции — ПАП, повышение уровня ПСА
Курение сигарет — повышение СЕА
Чтобы преодолеть многие из этих недостатков традиционные маркеры, нужны более новые маркеры.
В этом обзоре кратко описаны недавние, а также другие принятые маркеры рака различных органов, таких как груди, яичников, поджелудочной железы, толстой кишки, легких и т. Д.Поскольку сообщается о большом количестве маркеров [5–7], упор делается на те маркеры, которые одобрены международными онкологическими агентствами для клинического использования, и другие маркеры-кандидаты, то есть многообещающие маркеры, которые еще не получили широкого распространения. Основное внимание будет уделяться органоспецифическим опухолевым маркерам.
Гинекологические онкологические заболевания
Основными гинекологическими злокачественными новообразованиями являются рак яичников, рак шейки матки, рак эндометрия и трофобластические опухоли. Большинство используемых онкомаркеров представляют собой гликопротеины, и их обнаруживают с помощью моноклональных антител.Очень полезны опухолевые маркеры, обладающие хорошей чувствительностью и специфичностью, а также те, которые могут влиять на выбор альтернативных планов лечения [8]. Для обнаружения новых маркеров используются протеомные методы [9]. Вирусы HPV и HSV были обнаружены при раке шейки матки в Южной Индии [10]. Основные маркеры гинекологического рака представлены в таблице.
Таблица 3
Маркеры гинекологического рака
| Важными гинекологическими маркерами являются |
| Альфа-фетопротеин (AFP) |
| β Человеческий хорионический гонадотропин (β-ХГЧ) |
| Раковый антиген (CA) ) |
| Углеводный антиген 19-9 |
| Эмбриональный антиген карцино (CEA) |
| Эстрадиол |
| Ферритин |
| Обратная транскриптаза теломеразы человека (hTERT) |
| Топоизомераза II |
| Фрагмент гонадотропина в моче |
| Другими появляющимися маркерами являются |
| Cyclin E |
| HE4 |
| Инсулиноподобный фактор роста, связывающий белок-3 |
| Inte рлейкин 8 |
| Лизофосфатидовая кислота |
| Фактор, стимулирующий колонии макрофагов |
| Мезотелин |
| Остеопонтин |
| OVX1 |
| Трипсин-ассоциированный фактор |
CA-125
CA-125 был впервые обнаружен в 1980-х годах и широко использовался для диагностики эпителиального рака яичников [11].Однако он также может быть повышен при ряде других воспалительных состояний, включая эндометриоз, аденомиоз, воспалительные заболевания органов малого таза, менструацию, миому матки и доброкачественные кисты. Он также может быть повышен при раке эндометрия, маточной трубы, поджелудочной железы, груди, толстой кишки и легких. Уровень CA-125 используется для наблюдения за прогрессом рака яичников. Увеличение — это показатель прогрессирования, а быстрое снижение — показатель благоприятного исхода. Скорость снижения — независимый прогностический фактор.Наряду с клиническим обследованием и трансвагинальным ультразвуковым исследованием его можно использовать для раннего выявления рака яичников.
β-Хорионический гонадотропин человека
β-Хорионический гонадотропин человека повышен в тканях плода и при различных гинекологических формах рака. Фрагмент гонадотропина в моче (который является основным β-фрагментом, выделяемым с мочой) и уровни липид-ассоциированной сиаловой кислоты повышены до 60% пациентов с раком эндометрия. Опухоли, демонстрирующие повышенный уровень β-ХГЧ, включают хориокарциному матки, эмбриональные карциномы, полиэмбриомы, смешанные клеточные опухоли и, в редких случаях, дисгерминомы.Наряду с плацентарным лактогеном человека (hPL), он является полезным маркером трофобластической болезни (частичные и полные пузырные заносы, гестационная хориокарцинома и т. Д.) [12].
Альфа-фетопротеин
Наряду с β-ХГЧ, AFP (альфа-фетопротеин) используется в лечении несеминоматозных опухолей зародышевых клеток [13]. Стойкое повышение уровня АФП и β-ХГЧ указывает на худший прогноз. У пациентов с внегонадной болезнью или метастазами на момент постановки диагноза значения АФП, превышающие 10 000 нг / мл, или уровни β-ХГЧ, превышающие 50 000 мМЕ / мл, являются плохим прогностическим признаком.Пациенты, находящиеся на аналогичной стадии с более низкими уровнями АФП и β-ХГЧ, имеют очень высокий процент излечения. АФП и β-ХГЧ вместе также используются для оценки низкодифференцированного метастатического рака.
Углеводный антиген 19-9
Повышен у 35% пациентов с раком эндометрия. Он в основном используется для последующей оценки пограничных опухолей яичников. Он не специфичен для рака яичников [11].
Раковый антиген 27-29
Повышен при раке толстой кишки, желудка, почек, легких, яичников, поджелудочной железы, матки и печени.Однако он также повышен при беременности в первом триместре, эндометриозе, кистах яичников, доброкачественных заболеваниях молочной железы, заболеваниях почек и печени [14].
Обратная транскриптаза теломеразы человека
Обратная транскриптаза теломеразы человека (hTERT) используется в качестве биомаркера при раке яичников и матки. Вероятно, это могло сыграть роль в ранней диагностике рака шейки матки и цервикальной интраэпителиальной неоплазии (CIN). Повышенная регуляция hTERT может быть патогенным механизмом при CIN [15].
Ингибин
Он достигает пика в фолликулярной фазе менструального цикла и не обнаруживается в сыворотке крови у женщин в постменопаузе. Его можно использовать для диагностики первичных и рецидивирующих опухолей гранулезных клеток и слизистых эпителиальных опухолей яичников [16]. Есть две формы ингибина А и В; оба повышены в этих опухолях. Также можно измерить свободную альфа-субъединицу ингибина [17].
Эстрадиол
Он также используется при опухолях гранулезных клеток, но недостаточно чувствителен; около 30% опухолей не производят эстрадиол.Его можно использовать для выявления рецидива [12].
Мюллерово-ингибирующее вещество (MIS)
Подобно ингибину, оно не обнаруживается в сыворотке у женщин в постменопаузе. Он очень специфичен для опухолей гранулезных клеток яичников [18].
Топоизомераза II
Это многообещающий маркер запущенного эпителиального рака яичников [19].
Другие недавние маркеры рака яичников включают лизофосфатидную кислоту (уровень липидов в сыворотке и асцитной жидкости), мезотелин, HE4, остеопонтин, фактор роста эндотелия сосудов (VEGF) и интерлейкин 8, фактор, стимулирующий колонии макрофагов, и другие калликрейнс.Эти многообещающие маркеры еще не утверждены в реальных клинических условиях [20].
Рак молочной железы
Есть много признанных онкомаркеров, используемых при раке груди [21, 22]. Опухолевые маркеры, используемые при скрининге, лечении и надзоре за раком молочной железы: CA 15-3 [23], CA 27.29 [14], карциноэмбриональный антиген (CEA) [24], рецептор эстрогена (ER) [25, 26], прогестерон. рецептора (PR) [25], рецептора 2 эпидермального фактора роста человека (HER2) [27], активатора плазминогена урокиназы (uPA) [28], ингибитора активатора плазминогена 1 (PAI-1) [28] и некоторых многопараметрических анализов для определения гена экспрессия (Mammoprint, Onco Type DX и т. д.) [29]. Определенные маркеры, такие как плоидность ДНК по данным проточной цитометрии [30], p53 [31], катепсин D [32], циклин E [33], протеомика [34], обнаружение микрометастазов костного мозга [35] и циркулирующие опухолевые клетки (ЦКО) [36] рассматриваются, но нет данных, которые рекомендовали бы их для рутинного клинического использования. Маркеры рака груди сведены в таблицу.
Таблица 4
| Обычно используемые маркеры — это |
| CA 15-3 |
| CA 27.29 |
| CEA |
| Рецепторы эстрогена и прогестерона (ER, PR) |
| HER2 |
| uPA |
| PAI-1 |
| Многопараметрические анализы экспрессии генов |
| Другими потенциальными маркерами являются |
| плоидность ДНК (проточная цитометрия) |
| p53 |
| Катепсин D |
| Циклин E |
| Протеомные маркеры |
| CTC |
| Костный мозг |
| Ki-67 |
| P27 |
| P21 |
| Тимидинкиназа |
| Топоизомераза II |
Мутации гена BRCA1 / 2 были описаны у пациентов с семейным раком груди.Наше собственное исследование выявило мутации в генах BRCA1 и BRCA2, включая высокую частоту мутации 185delAG в гене BRCA1 [38-40]. Мы изучили роль ErbB2 (HER2) и связанных с ним клинико-патологических параметров в индийской популяции и обнаружили, что ErbB2 сверхэкспрессируется у 43,2% пациентов [41].
Рецепторы эстрогена и прогестерона
Рецепторы эстрогена и PR следует измерять при каждом первичном инвазивном раке молочной железы и можно измерять при метастатических поражениях, если результаты повлияют на планирование лечения.Статус рецепторов стероидных гормонов следует использовать для выявления пациентов, которым эндокринная терапия с наибольшей вероятностью принесет пользу. У пациентов с протоковой карциномой in situ (DCIS), которые являются кандидатами на гормональную терапию, данных недостаточно, чтобы рекомендовать рутинное измерение ER и PR. Как в пременопаузе, так и в постменопаузе, статус рецепторов стероидных гормонов следует использовать для выявления пациентов, которые с наибольшей вероятностью получат пользу от эндокринных форм терапии как при раннем раке груди, так и при метастатическом заболевании.У пациентов с DCIS, которые являются кандидатами на гормональную терапию, данных недостаточно, чтобы рекомендовать рутинное измерение ER и PR для рекомендаций по терапии [25, 26].
HER-2 / neu
Для выбора трастузумаба (герцептина) в адъювантных или метастатических условиях, экспрессию или амплификацию HER2 следует оценивать при каждом первичном инвазивном раке молочной железы либо во время постановки диагноза, либо во время рецидива. [27]. HER2 может быть полезен для прогнозирования ответа на определенные химиотерапевтические агенты.На основании доказательств уровня II сверхэкспрессия HER2 (3+ по белку или> 2,0 коэффициент флуоресцентной гибридизации in situ [FISH] по амплификации гена) выявляет пациентов, которым может быть больше польза от адъювантной терапии на основе антрациклинов. Уровни HER-2 / neu сверхэкспрессируются примерно в 15–40% случаев рака груди. Это указывает на очень агрессивные опухоли, но они чувствительны к трастузумабу. Опухоли, которые являются HER-2 / neu-отрицательными, не реагируют на терапию трастузумабом.
Маркеры на основе иммуногистохимии
Маркеры пролиферации на основе иммуногистохимии — это новые тесты.Настоящих данных недостаточно, чтобы рекомендовать измерение маркеров пролиферации для отнесения пациентов к прогностическим группам. К ним относятся Ki67, циклин D, циклин E, p27, p21, тимидинкиназа и топоизомераза II [37].
uPA и PAI-1
Активатор плазминогена урокиназы и PAI-1 в качестве маркеров рака молочной железы — недавнее введение в лабораторную медицину [28]. У пациентов с впервые диагностированным раком молочной железы без лимфоузлов для определения прогноза можно использовать uPA и PAI-1, измеренные с помощью ELISA на 300 мг или более свежей или замороженной ткани рака молочной железы.Особенно у женщин с положительным рецептором гормона, которые будут получать адъювантную эндокринную терапию, низкие уровни обоих маркеров связаны с достаточно низким риском рецидива, так что химиотерапия принесет лишь минимальную дополнительную пользу. По сравнению с только наблюдением, адъювантная химиотерапия на основе циклофосфамида, метотрексата и 5-фторурацила (CMF) дает существенные преимущества у пациентов с высоким риском рецидива на основе высоких уровней uPA и PAI-1.
Cyclin E
Фрагменты циклина E как маркеры рака груди также являются новыми [33].Доступных в настоящее время данных недостаточно, чтобы рекомендовать использование циклина E по всей длине или по фрагментам для лечения пациентов с раком груди.
Протеомный анализ
Протеомный анализ рака груди также является новой разработкой; имеющихся данных недостаточно для поддержки использования протеомных паттернов для лечения рака груди [34].
Многопараметрический анализ экспрессии генов
Многопараметрический анализ экспрессии генов рака груди — новинка [29]. Анализ Onco type DX (Genomic Health Inc, Редвуд-Сити, Калифорния) может использоваться для прогнозирования риска рецидива у недавно диагностированных пациентов с лимфатическим узлом и ER-положительным раком молочной железы, получающих лечение тамоксифеном.Onco type DX может помочь выявить пациентов, которым адъювантный тамоксифен может быть наиболее полезен и которым может не потребоваться адъювантная химиотерапия. Пациенты с высокими показателями рецидивов, по-видимому, относительно больше выигрывают от адъювантной химиотерапии CMF, чем от тамоксифена.
Микрометастазы костного мозга
Микрометастазы костного мозга как маркеры рака груди — новая тема в руководстве [35]. Имеющихся в настоящее время доказательств недостаточно, чтобы рекомендовать оценку микрометастазов костного мозга для лечения пациентов с раком груди.
Анализы CTC
Анализы циркулирующих опухолевых клеток (CTC) в качестве маркера рака груди также являются новой темой руководства [36]. ЦКО не следует использовать для диагностики рака груди или для принятия каких-либо решений относительно лечения пациентов с раком груди. Тест Cell Search Assay (Veridex, Уоррен, Нью-Джерси) для определения ЦКО не рекомендуется пациентам с метастатическим раком груди.
Зародышевые опухоли яичек у мужчин
Опухоли зародышевых клеток (GCT) составляют 90–95% всех первичных опухолей яичек и делятся на категории семиномы и несеминомы, последняя включает все опухоли, не являющиеся чистой семиномой.GCT мужских яичек — одно из немногих злокачественных новообразований, для которых были идентифицированы специфические биохимические опухолевые маркеры, которые легко измерить в сыворотке крови и полезны для диагностики и лечения заболевания. Прогностическая полезность сывороточных онкомаркеров в GCT отражена в системе стадирования Американского объединенного комитета по раку (AJCC) / Международного союза против рака (UICC), которая включает отдельную категорию для учета повышения трех маркеров: альфа-фетопротеина (AFP). ), хорионический гонадотропин человека (ХГЧ) и лактатдегидрогеназа (ЛДГ) [42, 43].
Среди других маркеров GCT — гамма-глутамилтранспептидаза (GGT), фермент, обнаруживаемый в основном в печени и наиболее часто используемый в качестве маркера заболевания печени, желчевыводящей системы и поджелудочной железы. До одной трети пациентов с семиномами также имеют повышенный уровень GGT в сыворотке. Плацентароподобная щелочная фосфатаза (PLAP) часто повышается у пациентов с семиномами, но повышенные концентрации PLAP также связаны с рядом других злокачественных новообразований, а также с курением. Отсутствие чувствительности и специфичности для этих и других исследованных веществ ограничивает их клиническое применение.Онкомаркеры зародышевых клеток приведены в таблице.
Таблица 5
| Обычно используемые маркеры: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AFP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hCG | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LDH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие маркеры | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| GGT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PLAP | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обычно используемые маркеры: |
| PSA |
| PAP |
| Другие маркеры: |
| HER-2 |
| BCL-2 |
| TMPRSS2- Исследование слитого гена ERG |
Колоректальный рак
Ракообразующий эмбриональный антиген является давним маркером прогноза и рецидива.Однако он неспецифичен и может быть повышен при многих доброкачественных или злокачественных заболеваниях. Таким образом, повышение CEA не является диагностическим. Тем не менее, примерно у 80% пациентов с метастатическим поражением наблюдается повышение CEA. В рекомендациях NCCN измерение CEA рекомендуется на исходном уровне у всех пациентов с диагнозом колоректального рака и после завершения адъювантной терапии для наблюдения за рецидивом [48].
Мутации в гене KRAS в колоректальных опухолях были идентифицированы как предикторы отсутствия ответа на моноклональные антитела цетуксимаб и панитумумаб, нацеленные на рецептор эпидермального фактора роста (EGFR).В Рекомендациях NCCN по раку прямой и толстой кишки анализ мутации KRAS теперь рекомендуется у всех пациентов с метастатическим колоректальным раком после диагностики болезни стадии IV и до рассмотрения возможности лечения цетуксимабом или панитумумабом. Пациенты с опухолями, несущими мутацию KRAS , не должны лечиться ни одним из этих агентов [49].
Руководство NCCN недавно включило анализ мутации опухоли BRAF V600E в качестве дополнительного теста для пациентов с недавно диагностированным метастатическим колоректальным раком, не имеющим мутации KRAS , для облегчения прогнозирования реакции на терапию, направленную на EGFR. BRAF. Мутация V600E может быть связана с плохим прогнозом, что может затруднить понимание ее значения для прогнозирования реакции на ингибиторы EGFR. В текущих Рекомендациях NCCN признаются несоответствия в текущих данных, касающихся мутации BRAF V600E как прогностического маркера [49].
Нестабильность микросателлитов (MSI) отражает дефицит функции белка восстановления несоответствия (MMR), чаще всего MLh2, MSh3, MSH6 и PMS2. Тесты MSI и MMR приемлемы для диагностики синдрома Линча (наследственный неполипозный колоректальный рак) у пациентов и их семей.Поэтому рекомендации NCCN включают заявление, в котором отмечается, что такое тестирование следует рассматривать у всех пациентов с диагнозом колоректальный рак в возрасте до 50 лет [50].
Сверхэкспрессия HER2 с помощью иммуногистохимии или FISH выявляется примерно у 10–20% пациентов с раком желудочно-пищеводного тракта. При гепатоцеллюлярной карциноме (ГЦК) гликопротеин АФП можно измерить в сыворотке крови примерно в 70% случаев, хотя он не является ни чувствительным, ни специфическим диагностическим тестом для ГЦК.Тем не менее, результаты тестирования AFP могут быть полезны в сочетании с результатами других тестов для руководства ведением пациентов, у которых есть подозрение на диагноз HCC. Измерение уровня АФП в сыворотке рекомендуется в Руководстве NCCN в качестве инструмента скрининга пациентов с риском ГЦК, для помощи в диагностике у пациентов с подозрительным поражением печени, а также для наблюдения после хирургического вмешательства, местного абляционного лечения или трансплантации у пациентов с подтвержденным ГЦК [ 51]. В таблице приведены общие колоректальные маркеры.
Таблица 7
Маркеры колоректального рака
| Общие маркеры — это |
| CEA |
| Мутации KRAS |
| Мутация BRAF V600E |
| Нестабильность микросателлита |
| HER |
Рак поджелудочной железы
Основным полезным онкомаркером карциномы поджелудочной железы по-прежнему является углеводный антиген 19-9 (CA 19-9).CA 19-9 — мышиное моноклональное антитело, первоначально созданное против клеток колоректального рака. Антиген CA 19-9 представляет собой сиалированный олигосахарид, который чаще всего обнаруживается в циркулирующих муцинах у онкологических больных. Он также обычно присутствует в клетках желчных путей и может быть повышен при остром или хроническом заболевании желчевыводящих путей. Примерно у 5–10% пациентов отсутствует фермент, необходимый для выработки CA 19-9. При отсутствии обструкции желчных путей, внутреннего заболевания печени или доброкачественного заболевания поджелудочной железы значение CA 19-9 более 100 Ед / мл является высокоспецифичным для злокачественных новообразований, обычно поджелудочной железы [52].
Оценка уровней CA 19-9 использовалась в качестве дополнения к исследованиям визуализации, чтобы помочь определить потенциал резектабельности карциномы поджелудочной железы. Менее чем у 4% пациентов с уровнем СА 19-9 более 300 Ед / мл были обнаружены резектабельные опухоли. CA 19-9 наименее чувствителен к небольшим карциномам поджелудочной железы на ранней стадии и не доказал свою эффективность для раннего выявления рака поджелудочной железы или в качестве инструмента скрининга. Повышенный уровень CA 19-9 обнаруживается у 0,2% бессимптомной популяции старше 40 лет.80% из них — ложноположительные результаты. Если изучать только пациентов с симптомами, у 4,3% повышен уровень СА 19-9. Две трети этих результатов являются ложноположительными. Однако он приобретает все большее значение для определения стадии и последующего наблюдения за пациентами с этим заболеванием. Пациенты с низким уровнем CA 19-9 (<100 МЕ) вряд ли будут иметь скрытые метастазы. Падение CA 19-9 кажется полезным суррогатом клинического ответа на терапию. Если обструкции желчевыводящих путей нет, повышение CA 19-9 указывает на прогрессирующее заболевание.Предоперационные уровни CA 19-9 могут иметь прогностическое значение, при этом высокие уровни указывают на худший исход и меньшую вероятность резектабельности. Было показано, что предоперационные значения выше 50 Ед / мл связаны с более высокими шансами рецидива [52].
Карциноэмбриональный антиген — это высокомолекулярный гликопротеин, обычно обнаруживаемый в тканях плода. Он обычно используется в качестве онкомаркера при других злокачественных новообразованиях желудочно-кишечного тракта. Только 40–45% пациентов с карциномой поджелудочной железы имеют повышение уровня СЕА.Множественные другие доброкачественные и злокачественные заболевания могут привести к повышению уровня СЕА; таким образом, CEA не является чувствительным или специфическим маркером рака поджелудочной железы [53].
Многие другие опухолевые маркеры были изучены при раке поджелудочной железы, но пока не было показано, что ни один из них имеет общую клиническую ценность при этом заболевании. Как и в случае со всеми видами рака, растет интерес к молекулярной диагностике с использованием таких мощных методов, как микроматрицы экспрессии генов и протеомика. Эти новые тесты дополняют наше понимание основных дефектов, вызывающих новообразования поджелудочной железы и патобиологию.Однако в настоящее время это все еще инструменты исследования [54].
Рак легкого
Несколько молекулярных диагностических маркеров представляют ценность для пациентов с немелкоклеточным раком легкого (НМРЛ). Наиболее важные из них, сверхэкспрессия или мутация EGFR, как было показано, положительно предсказывают ответ на эрлотиниб или гефитиниб, которые являются нацеленными на EGFR ингибиторами тирозинкиназы. Частота мутации или сверхэкспрессии зависит от этнической принадлежности и, по-видимому, присутствует у 30-40% азиатских пациентов по сравнению с10–15% пациентов из Северной Америки. В рекомендациях NCCN теперь рекомендуется учитывать статус мутации EGFR (путем прямого секвенирования на мутацию, определения числа копий гена с помощью FISH или иммуногистохимии на сверхэкспрессию белка) при выборе терапии первой линии для пациентов с метастатическим или рецидивирующим НМРЛ, включая пациентов с плохой производительностью. статус [55, 56]. Кроме того, существует ряд других традиционных маркеров, которые сведены в таблицу.
Рак головы и шеи
Скрининг на ВПЧ
Рекомендации NCCN теперь рекомендуют тестирование на ВПЧ у пациентов с раком ротоглотки.Онкогенный подтип ВПЧ высокого риска ВПЧ-16 тесно связан с развитием плоскоклеточного рака ротоглотки и миндалин, независимо от курения и воздействия алкоголя; ВПЧ-16 связан с большинством опухолей головы и шеи; другие онкогенные подтипы ВПЧ также могут вызывать рак головы и шеи (например, ВПЧ-18, -31, -33, -35). У пациентов с опухолями, связанными с ВПЧ, значительно улучшились показатели ответа и общий прогноз [57]. SCC и TPA используются в качестве маркеров второй линии (см. Таблицу).
Рак щитовидной железы
Уровень тиреотропного гормона (ТТГ) в сыворотке очень чувствителен к гипертиреозу / гипотиреозу. Чувствительный анализ ТТГ полезен при оценке одиночных узлов щитовидной железы. Низкое значение ТТГ в сыворотке указывает на автономно функционирующий узелок, который обычно доброкачественный. Однако нельзя исключать злокачественное заболевание на основании низкого или высокого уровня ТТГ. Другие тесты функции щитовидной железы обычно не требуются при первоначальном обследовании [58].
Измерения сывороточного тиреоглобулина не являются полезными с диагностической точки зрения, поскольку они повышены при большинстве доброкачественных заболеваний щитовидной железы.Уровень тиреоглобулина в сыворотке крови является онкомаркером папиллярного, фолликулярного и клеточного рака щитовидной железы [58].
Уровни тиреотропного гормона, тиреоглобулина и антител к тиреоглобулину измеряются в послеоперационном периоде для принятия решения относительно использования радиоактивного йода, корректировки дозировки левотироксина и отслеживания рецидивов [58].
Повышенный уровень кальцитонина в сыворотке с большой вероятностью указывает на ЦПМ. Измерение кальцитонина в сыворотке, которое когда-то было основой диагностики FMTC, было заменено анализом чувствительной полимеразной цепной реакции (ПЦР) на мутации зародышевой линии в протоонкогене RET [59].Эти мутации присутствуют у пациентов с MEN 2A, MEN 2B и FMTC [60]. Однако кальцитонин и более чувствительный кальцитонин, стимулированный пентагастрином, используются в качестве опухолевых маркеров для наблюдения за пациентами, которые лечились от MTC. Из-за низкой распространенности MTC в целом исследование сывороточного кальцитонина не является рентабельным инструментом скрининга при первичном обследовании узлов щитовидной железы. У пациентов со спорадической медуллярной карциномой щитовидной железы, а также у пациентов с подозрением на семейный синдром (например, множественная эндокринная неоплазия типа 2A) рекомендуется тестирование на мутации протоонкогена RET для выявления новых родственников из группы риска и определения вероятность других состояний (таких как феохромоцитома и паращитовидная железа).Показатели прогноза, уровни кальцитонина в сыворотке и CEA должны быть проверены как на исходном уровне, так и после операции в качестве наблюдения за пациентами с медуллярной карциномой щитовидной железы. Послеоперационные уровни кальцитонина коррелируют с риском рецидива и выживаемостью.
Лимфомы / лейкемии
При хроническом миелоидном лейкозе (ХМЛ) тестирование гена BCR – ABL может проводиться в крови и костном мозге [61]. Ген используется для диагностики и наблюдения. Уровень B-2-микроглобулина (B2M) повышен при хроническом лимфолейкозе (CLL) и некоторых лимфомах.B2M также может быть повышен при множественной миеломе и некоторых незлокачественных заболеваниях, таких как заболевания почек и печени. Более высокий B2M означает плохой прогноз [62]. Аномальный кариотип был выявлен более чем у 50% всех жителей Южной Индии [63].
На поверхности лимфоцитов присутствует около 80 различных «маркеров CD», которые могут быть обнаружены в лимфомах (ходжкинских / неходжкинских) с помощью иммуногистохимии и / или проточной цитометрии [64]. Всего существует около 30 различных типов лимфом, и эти маркеры CD служат молекулярными сигнатурами для диагностики каждого типа.Дополнительные молекулярные тесты включают каппа / лямбда, циклин D1, реаранжировки генов TCR [65], реаранжировки генов рецепторов антигенов [66], цитогенетические / FISH-панели и т. Д.
Рак мочевого пузыря
Антиген опухоли мочевого пузыря (BTA) и NMP22 являются двумя опухолевыми маркерами. сделано при раке мочевого пузыря [67]. Онкомаркеры в моче не рекомендуются. Стандартные тесты для диагностики и последующего наблюдения — это цистоскопия и цитология мочи. При распространенном раке мочевого пузыря используются повышенные значения CEA, CA 125, CA 19-9 и TPA.Эти маркеры также могут быть использованы для последующего наблюдения [67].
Меланома
Потенциальные маркеры меланомы включают TA-90, CEACAM, ICAM-1, остеопонтин, MIA, GDF-15, TIMP-1 и S100B. Более высокие уровни этих маркеров обнаруживаются при метастатической меланоме [68].
Рак желудка
Онкомаркеры менее перспективны при лечении рака желудка. Доступные маркеры: CEA, CA 72-4, CA 19-9 и HER2 [69, 70]. Они не специфичны для рака желудка. Нарушение экспрессии гена IL-2R отмечается при раке желудка [71].
Рак полости рта
Вирусы, такие как HSV, HPV и HHV-6, участвуют в патогенезе рака полости рта [72]. p53 можно использовать в качестве онкомаркера для раннего выявления рака полости рта [73]. Лектин джекфрута можно использовать в дифференциальной диагностике предраковых и злокачественных поражений полости рта, исходя из различий в характере и интенсивности связывания [74]. Хромосомные аномалии также отмечаются при плоскоклеточном раке полости рта [75].
Резюме
В последние годы появилось совершенно новое количество биомаркеров.Это стало возможным благодаря развитию новых технологий, таких как протеомика и молекулярный анализ. Многие из этих маркеров очень многообещающие. Традиционные маркеры, широко используемые в настоящее время, имеют множество ограничений. Многие из них могут быть заменены новыми маркерами в будущем. Можно было бы надеяться, что новые методы приведут к идентификации маркеров с высокой специфичностью и чувствительностью, а это, в свою очередь, позволит более раннюю диагностику рака и улучшить лечение рака.
Ссылки
1. Наир Р.Р., Джонсон Дж. Словарь онкомаркеров и методов оценки. Advanced Biotech 2008; 22–32.
2. Maugeri-Saccà M, Maria R. Перевод фундаментальных исследований по лечению онкологических больных. Энн Ист Супер Санита. 2011; 47 (1): 64–71. [PubMed] [Google Scholar] 4. Исии М. Ограничения клинической применимости онкомаркера. Ган То Кагаку Риохо. 1995. 22 (9): 1139–1145. [PubMed] [Google Scholar] 5. Edge SB и др., Редакторы. Руководство по стадированию рака AJCC. Нью-Йорк: Спрингер; 2009 г.[Google Scholar] 6. Мостофи Ф.К., Сестерхенн И.А., Собин Л.Х. Всемирная организация здравоохранения: Международное гистологическое типирование опухолей. 2. Берлин: Спрингер; 1998. С. 1–132. [Google Scholar] 7. Бхатт А.Н., Матур Р., Фарук А., Верма А., Двараканатх Б.С. Биомаркеры рака — текущие перспективы. Индийский J Med Res. 2010. 132: 129–149. [PubMed] [Google Scholar] 8. Ren J, Cai H, Li Y, Zhang X, Liu Z, Wang JS и др. Онкомаркеры для раннего выявления рака яичников. Эксперт Rev Mol Diagn. 2010. 10 (6): 787–798. DOI: 10.1586 / erm.10.39. [PubMed] [CrossRef] [Google Scholar] 9. Gorp T, Cadron I, Vergote I. Полезность протеомики при гинекологическом раке. Curr Opin Obstet Gynecol. 2011; 23 (1): 3–7. DOI: 10.1097 / GCO.0b013e32834156e5. [PubMed] [CrossRef] [Google Scholar] 10. Синамани В., Кумари ТВ, Васудеван Д.М. Обнаружение последовательностей ДНК вируса простого герпеса типа 2 и вируса папилломы человека в ткани карциномы шейки матки путем молекулярной гибридизации. J Exp Pathol. 1992. 6 (1–2): 55–64. [PubMed] [Google Scholar] 11. Bast RC, Jr, Klug TL, Schaetzl E, Lavin P, Niloff JM, Greber TF и др.Мониторинг карциномы яичников человека с помощью комбинации CA 125, CA 19-9 и карциноэмбрионального антигена. Am J Obstet Gynecol. 1984. 149 (5): 553–559. [PubMed] [Google Scholar] 12. Давуд М.Ю., Ратнам СС, Теох ES. Эстрадиол-17 бета в сыворотке и хорионический гонадотропин человека в сыворотке крови у пациентов с пузырным заносом. Am J Obstet Gynecol. 1974. 119 (7): 904–910. [PubMed] [Google Scholar] 13. Ячнин С. Клиническое значение альфа-фетопротеина человека. Ann Clin Lab Sci. 1978. 8 (2): 84–90. [PubMed] [Google Scholar] 14.Беверидж Р.А. Обзор клинических исследований CA 27.29 в лечении рака груди. Маркеры Int J Biol. 1999. 14 (1): 36–39. [PubMed] [Google Scholar] 15. Ленер Р., Эномото Т., МакГрегор Дж. А., Шройер А. Л., Хауген Б. Р., Пугаженти Ю. и др. Количественный анализ мРНК теломеразы hTERT и активности теломеразы в эндометриоидной аденокарциноме и в нормальном эндометрии. Gynecol Oncol. 2002. 84 (1): 120–125. DOI: 10.1006 / gyno.2001.6474. [PubMed] [CrossRef] [Google Scholar] 16. Милонас I, Матсингу К., Кауфл С.Д., Брюнинг А.Бета-субъединица ингибина / активина в эндометриоидной аденокарциноме матки и клеточных линиях рака эндометрия: от иммуногистохимии к клиническим испытаниям? Gynecol Oncol. 2011. 122 (1): 132–140. DOI: 10.1016 / j.ygyno.2011.03.019. [PubMed] [CrossRef] [Google Scholar] 17. Mylonas I. Экспрессия субъединицы ингибина-α в эндометриоидных аденокарциномах матки и клеточных линиях рака эндометрия: потенциальный прогностический фактор. Int J Mol Med. 2011. 27 (3): 309–318. DOI: 10.3892 / ijmm.2010.586. [PubMed] [CrossRef] [Google Scholar] 18.Chang HL, Pahlavan N, Halpern EF, MacLaughlin DT. Уровни мюллерова ингибирующего вещества / антимюллерова гормона в сыворотке у пациентов с опухолями из взрослых гранулезных клеток напрямую коррелируют с совокупной массой опухоли, определяемой патологией или радиологией. Gynecol Oncol. 2009. 114 (1): 57–60. DOI: 10.1016 / j.ygyno.2009.02.023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Холден Дж. А., Сноу Г. В., Перкинс С. Л., Джоллес С. Дж., Кьелдсберг С. Р.. Иммуногистохимическое окрашивание ДНК-топоизомеразы II в замороженных и фиксированных формалином залитых парафином тканях человека.Мод Pathol. 1994. 7 (8): 829–834. [PubMed] [Google Scholar] 20. Макинтош М.В., Дрешер С., Карлан Б., Шоллер Н., Урбан Н., Хеллстром К.Э. и др. Комбинирование сывороточных маркеров CA 125 и SMR для диагностики и раннего выявления рака яичников. Gynecol Oncol. 2004. 95 (1): 9–15. DOI: 10.1016 / j.ygyno.2004.07.039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 21. Харрис Л., Фриче Х., Меннел Р., Нортон Л., Равдин П., Таубе С. и др. Американское общество клинической онкологии. Американское общество клинической онкологии, 2007 г., обновление рекомендаций по использованию онкомаркеров при раке груди.J Clin Oncol. 2007. 25 (33): 5287–5312. DOI: 10.1200 / JCO.2007.14.2364. [PubMed] [CrossRef] [Google Scholar] 22. Молина Р., Барак В., Дален А., Даффи М. Дж., Эйнарссон Р., Гион М. и др. Онкомаркеры при раке молочной железы — Европейская группа по рекомендациям по опухолевым маркерам. Tumor Biol. 2005. 26 (6): 281–293. DOI: 10,1159 / 000089260. [PubMed] [CrossRef] [Google Scholar] 23. Даффи MJ, Evoy D, McDermott EW. CA 15–3: использование и ограничение в качестве биомаркера рака груди. Clin Chim Acta. 2010. 411 (23–24): 1869–1874. DOI: 10.1016 / j.cca.2010.08.039. [PubMed] [CrossRef] [Google Scholar] 24. Нагелл Дж. Младший, Дональдсон Э.С., Вуд Э. Г., Гольденберг DM. Клиническое значение карциноэмбрионального антигена в плазме и опухолях больных гинекологическими злокачественными новообразованиями. Рак. 1978; 42 (3): 1527–1532. DOI: 10.1002 / 1097-0142 (197809) 42: 3+ <1527 :: AID-CNCR2820420826> 3.0.CO; 2-L. [PubMed] [CrossRef] [Google Scholar] 25. Фишер Б., Редмонд С.К., Викерхэм Д.Л., Рокетт Х.Э., Браун А., Аллегра Дж. И др. Связь содержания рецепторов эстрогена и / или прогестерона в раке груди с исходом для пациента после адъювантной химиотерапии.Лечение рака груди Res. 1983. 3 (4): 355–364. DOI: 10.1007 / BF01807588. [PubMed] [CrossRef] [Google Scholar] 26. Syrjänen KJ, Kosma VM. Уровни рецепторов гормонов, связанные с гистологическими параметрами взаимоотношений опухоль-хозяин при карциноме молочной железы у женщин. J Surg Oncol. 1982. 21 (1): 49–53. DOI: 10.1002 / jso.2930210113. [PubMed] [CrossRef] [Google Scholar] 27. Slamon DJ, Godolphin W., Jones LA, Holt JA, Wong SG, Keith DE, et al. Исследования протоонкогена HER-2 / neu при раке груди и яичников человека. Наука.1989; 244: 707–712. DOI: 10.1126 / science.2470152. [PubMed] [CrossRef] [Google Scholar] 28. Bouchet C, Spyratos F, Martin PM, Hacène K, Gentile A, Oglobine J. Прогностическое значение активатора плазминогена урокиназного типа (uPA) и ингибиторов активатора плазминогена PAI-1 и PAI-2 в карциномах молочной железы. Br J Рак. 1994. 69 (2): 398–405. DOI: 10.1038 / bjc.1994.74. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29. Ким С., Пайк С. Прогностические анализы на основе экспрессии генов для рака груди. Нат Рев Клин Онкол.2010. 7 (6): 340–347. DOI: 10.1038 / nrclinonc.2010.61. [PubMed] [CrossRef] [Google Scholar] 30. Каваути С., Фуруя Т., Икемото К., Накао М., Ямамото С., Ока М. и др. Аберрации числа копий ДНК, связанные с анеуплоидией и хромосомной нестабильностью при раке груди. Онкол Реп. 2010; 24 (4): 875–883. DOI: 10.3892 / или 2010.875. [PubMed] [CrossRef] [Google Scholar] 31. Ангелопопулу К., Диамандис EP, Сазерленд DJA. Распространенность сывороточных антител против белка гена-супрессора опухолей p53 при различных формах рака.Int J Can. 1994. 58: 480–487. DOI: 10.1002 / ijc.20404. [PubMed] [CrossRef] [Google Scholar] 32. Тандон А.К., Кларк Г.М., Чамнесс Г.К. и др. Катепсин D и прогноз при раке груди. N Eng J Med. 1990; 322: 239–331. DOI: 10.1056 / NEJM1913220504. [PubMed] [CrossRef] [Google Scholar] 33. Wingate H, Puskas A, Duong M, Bui T, Richardson D, Liu Y и др. Низкомолекулярный циклин E специфичен для рака груди и связан с механизмами прогрессирования опухоли. Клеточный цикл. 2009. 8 (7): 1062–1068.DOI: 10.4161 / cc.8.7.8119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Гонсалвес А., Бертуччи Ф. Клиническое применение протеомики при раке груди: современное состояние и перспективы. Med Princ Pract. 2011; 20 (1): 4–18. DOI: 10,1159 / 000319544. [PubMed] [CrossRef] [Google Scholar] 35. Schwarzenbach H, Pantel K, Kemper B, Beeger C, Otterbach F, Kimmig R et al. Сравнительная оценка внеклеточной опухолевой ДНК в крови и диссеминированных опухолевых клеток в костном мозге пациентов с первичным раком молочной железы.Рак молочной железы Res. 2009; 11 (5): Р71. DOI: 10.1186 / bcr2404. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 36. Lianidou ES, Markou A. Циркулирующие опухолевые клетки при раке груди: системы обнаружения, молекулярная характеристика и будущие проблемы. Clin Chem. 2011. 57 (9): 1242–1255. DOI: 10.1373 / Clinchem.2011.165068. [PubMed] [CrossRef] [Google Scholar] 37. Лу Дж., Чанг К.Л. Практическая иммуногистохимия в гематопатологии: обзор полезных антител для диагностики. Adv Anat Pathol. 2011. 18 (2): 133–151.DOI: 10.1097 / PAP.0b013e3182026dbd. [PubMed] [CrossRef] [Google Scholar] 38. Vaidyanathan K, Lakhotia S, Ravishankar HM, Tabassum U, Mukherjee G, Somsundaram K. Анализ мутаций зародышевой линии BRCA1 и BRCA2 среди индийских женщин: идентификация четырех новых мутаций и высокая частота встречаемости мутации 185delAG с независимым происхождением. J Biosci. 2009. 34 (3): 415–422. DOI: 10.1007 / s12038-009-0048-9. [PubMed] [CrossRef] [Google Scholar] 39. Вайдьянатан К. Роль генов BRCA1 / 2 в наследственном раке яичников — опыт IISc.Индийский J Med Pediatr Oncol. 2007. 27 (1): 21–22. [Google Scholar] 40. Вайдьянатан К., Рави Шанкер Х.М., Лахотия С., Сомасундарам К., Мукерджи Г. Роль генов BRCA1 и BRCA2 в наследственном раке груди / яичников. Чин Мед Дж. 2007; 120 (2): 115–116. [Google Scholar] 41. Vaidyanathan K, Kumar P, Reddy CO, Deshmane V, Somasundaram K, Mukherjee G. Экспрессия ErbB-2 и ее связь с другими биологическими параметрами рака груди среди индийских женщин. Индийский рак J. 2010. 47 (1): 8–15. DOI: 10.4103 / 0019-509X.58852. [PubMed] [CrossRef] [Google Scholar] 42. Гиллиган Т.Д., Зайденфельд Дж., Баш Э.М., Эйнхорн Л.Х., Фанчер Т., Смит Д.К. и др. Американское общество клинической онкологии. Руководство по клинической практике Американского общества клинической онкологии по использованию маркеров сывороточных опухолей у взрослых мужчин с опухолями половых клеток. J Clin Oncol. 2010. 28 (20): 3388–3404. DOI: 10.1200 / JCO.2009.26.4481. [PubMed] [CrossRef] [Google Scholar] 43. Джавадпур Н. Множественные биохимические онкомаркеры при семиноме. Двойное слепое исследование. Рак. 1983. 52 (5): 887–889.DOI: 10.1002 / 1097-0142 (19830901) 52: 5 <887 :: AID-CNCR2820520524> 3.0.CO; 2-C. [PubMed] [CrossRef] [Google Scholar] 44. Ферро М.А., Барнс И., Робертс Дж. Б., Смит П. Дж. Онкомаркеры рака простаты. Сравнение простатоспецифического антигена с кислой фосфатазой. Br J Urol. 1987. 60 (1): 69–73. DOI: 10.1111 / j.1464-410X.1987.tb09137.x. [PubMed] [CrossRef] [Google Scholar] 45. Жорда М., Моралес А., Гораб З., Фернандес Дж., Наджи М., Блок Н. Экспрессия Her2 при раке простаты: сравнение с карциномой молочной железы.J Urol. 2002; 168 (4 Pt 1): 1412–1414. [PubMed] [Google Scholar] 46. Fonseca GN, Srougi M, Leite KR, Nesrallah LJ, Ortiz V. Роль генов HER2 / neu, BCL2, p53 и ядерного белка пролиферирующих клеток как молекулярных прогностических параметров при локализованной карциноме простаты. Sao Paulo Med J. 2004; 122 (3): 124–127. DOI: 10.1590 / S1516-31802004000300009. [PubMed] [CrossRef] [Google Scholar] 47. Томлинс С.А., Обин С.М., Сиддики Дж., Лонигро Р.Дж., Сефтон-Миллер Л., Миик С. и др. TMPRSS2 в моче: расшифровка слияния ERG стратифицирует риск рака простаты у мужчин с повышенным уровнем ПСА в сыворотке.Sci Transl Med. 2011; 3 (94): 94ra72. DOI: 10.1126 / scitranslmed.3001970. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Engstrom PF, Benson AB, 3rd, Saltz L. Национальная комплексная сеть рака. Рак толстой кишки. Руководство по клинической практике в онкологии. J Natl Compr Canc Netw. 2003. 1 (1): 40–53. [PubMed] [Google Scholar] 49. Боханес П., Лабонте М.Дж., Виндер Т., Ленц Х.Дж. Прогностические молекулярные классификаторы при колоректальном раке. Семин Онкол. 2011. 38 (4): 576–587. DOI: 10.1053 / j.seminoncol.2011.05.012.[PubMed] [CrossRef] [Google Scholar] 50. Пино М.С., Чанг округ Колумбия. Нестабильность микросателлитов в лечении колоректального рака. Эксперт Рев Гастроэнтерол Гепатол. 2011. 5 (3): 385–399. DOI: 10.1586 / egh.11.25. [PubMed] [CrossRef] [Google Scholar] 51. Kruszewski WJ, Rzepko R, Ciesielski M, Szefel J, Zieliński J, Szajewski M, et al. Экспрессия HER2 при колоректальном раке не коррелирует с прогнозом. Маркеры Дис. 2010. 29 (5): 207–212. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Яланко Х., Куусела П., Робертс П., Сиппонен П., Хаглунд Калифорния, Мякеля О.Сравнение нового онкомаркера CA 19-9 с альфа-фетопротеином и карциноэмбриональным антигеном у пациентов с заболеваниями верхних отделов желудочно-кишечного тракта. J Clin Pathol. 1984. 37 (2): 218–222. DOI: 10.1136 / jcp.37.2.218. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Costello E, Neoptolemos JP. Рак поджелудочной железы в 2010 году: новые взгляды на раннее вмешательство и обнаружение. Нат Рев Гастроэнтерол Гепатол. 2011; 8 (2): 71–73. DOI: 10.1038 / nrgastro.2010.214. [PubMed] [CrossRef] [Google Scholar] 55. Вил Д., Эшкрофт Т., Марш С., Гибсон Г.Дж., Харрис А.Л.Рецепторы эпидермального фактора роста при немелкоклеточном раке легкого. Br J Рак. 1987. 55 (5): 513–516. DOI: 10.1038 / bjc.1987.104. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Педерсен М.В., Мелторн М., Дамструп Л., Поульсен Х.С. Мутация рецептора эпидермального фактора роста III типа. Биологическое значение и потенциальная мишень для противораковой терапии. Энн Онкол. 2001. 12 (6): 745–760. DOI: 10,1023 / А: 1011177318162. [PubMed] [CrossRef] [Google Scholar] 57. Sudhoff HH, Schwarze HP, Winder D, Steinstraesser L, Görner M, Stanley M и др.Доказательства причинной связи ВПЧ с раком головы и шеи. Eur Arch Otorhinolaryngol. 2011. 268 (11): 1541–1547. DOI: 10.1007 / s00405-011-1714-8. [PubMed] [CrossRef] [Google Scholar] 58. Шиварадж Г., Пракаш Б.Д., Сонал В., Шрути К., Винаяк Х., Авинаш М. Функциональные тесты щитовидной железы: обзор. Eur Rev Med Pharmacol Sci. 2009. 13 (5): 341–349. [PubMed] [Google Scholar] 59. Никифоров Ю.Е. Молекулярная диагностика опухолей щитовидной железы. Arch Pathol Lab Med. 2011. 135 (5): 569–577. [PubMed] [Google Scholar] 60. Марш DJ, Гимм О.Множественная эндокринная неоплазия: типы 1 и 2. Adv Оториноларингол. 2011; 70: 84–90. [PubMed] [Google Scholar] 62. Дельгадо Дж., Пратт Дж., Филлипс Н., Брионес Дж., Феган С., Номдеду Дж. И др. Бета2-микроглобулин является лучшим предиктором выживаемости без лечения у пациентов с хроническим лимфолейкозом, если его скорректировать в соответствии со скоростью клубочковой фильтрации. Br J Haematol. 2009. 145 (6): 801–805. DOI: 10.1111 / j.1365-2141.2009.07699.x. [PubMed] [CrossRef] [Google Scholar] 63. Анкатил Р., Стивен Дж., Васудеван Д.М., Кусумакумары П., Пиллай Г.Р., Наир МК.Прогностическое значение анализа кариотипа у детей с острым лимфобластным лейкозом. Гематол Онкол. 1992. 10 (6): 339–344. DOI: 10.1002 / hon.2 221 U. D. Antipina et al. / International Journal of Biomedicine 9 (3) (2019) 220-222 Материалы и методы Всего было обследовано 219 взрослых: 77 (9 мужчин и 68 женщин в Томмоте (Алданский район) и 142 (26 мужчин и 116 женщин) в Чулмане (Нерюнгринский район).Уровни TM (CEA, CA19-9, PSA, CA15-3) в сыворотке крови определяли методом ELISA на микропланшете Multiskan FC (Thermo Fisher Scientic, США) с использованием прибора Vector- Лучшие тестовые системы (Россия). Статистический анализ был выполнен с использованием SPSS (версия 19.0). Результаты Результаты исследования представлены в таблицах 1 и 2. Средние уровни исследуемых ТМ в сыворотке крови взрослых жителей находились в пределах нормы.Однако в обследованных женщинах из Чульмана в возрасте от 60 до 90 лет показатели CEA были повышены до 5,5 нг / мл в 1,6% из случаев; СА 15-3 до 144 Ед / мл в 3,2% случаев. У 4,5% из женщин из Томмота в возрасте от 60 до 74 лет уровни CEA были повышены до 7,4 нг / мл. У 22,2% обследованных мужчин в возрасте от 45 до 59 лет, из Чульман, уровень РЭА был повышен до 10,4 нг / мл , а уровень ПСА — до 8.29 нг / мл; у 7,7% мужчин в возрасте от 60 до 74 лет уровень ПСА был повышен до 15,8 нг / мл. У обследованных мужчин из Томмота эти онкомаркеров находились в пределах нормы. Обсуждение Полученные данные позволяют сделать вывод о необходимости тщательного наблюдения за состоянием здоровья лиц определенных возрастов: женщин от 60 лет и мужчин от 45 лет соответственно. Эти возрастные группы относятся к группе риска рака. Анализ литературы показывает, что некоторые ТМ специфичны для определенных групп рака. CEA представляет собой опухолевый эмбриональный антиген, продуцируемый в ткани пищеварительного тракта эмбриона и плода. После родов синтез РЭА подавляется; следовательно, в сыворотке здоровых взрослых практически не обнаруживается . Этот маркер обнаружен в очень малых количествах в некоторых тканях взрослых: в кишечнике, печени и поджелудочной железе.CEA — это белок острой фазы, поэтому уровень повышается при различных воспалительных и аутоиммунных заболеваниях. Незначительный рост зафиксирован у курильщиков. Уровень CEA зависит от курения и употребления алкоголя. Повышенный уровень CEA обнаруживается при колоректальном раке, раке желудка , раке легких, раке печени, раке поджелудочной железы и раке груди . Как тип опухолевого антигена для рака желудочно-кишечного тракта , CA 19-9 представляет собой сиалированное производное антигена группы крови Льюиса А.(6) CA19-9 обнаруживается в эпителии желудочно-кишечного тракта плода. Незначительные количества обнаружены у взрослых людей в клетках поджелудочной железы, печени и легких. CA 19-9 — выводится с желчью; следовательно, даже при незначительном холестазе его концентрация в сыворотке крови может значительно возрасти. Как онкомаркер , он имеет чувствительность к раку поджелудочной железы (до 82%), раку печени (до 75%), раку желудка (до 26%) и колоректальному раку (25%).CA19-9 имеет 79-81% чувствительность и 82-90% специфичность для диагностики протоков поджелудочной железы аденокарциномы (7) с ложноположительными результатами, наблюдаемыми при доброкачественных панкреатобилиарных заболеваниях, таких как панкреатит, холангит и механическая желтуха. (8-10) Кроме того, CA19-9 не экспрессируется у 8-10% европеоидной популяции с генотипом Lewis ab- , поскольку эпитоп CA19-9 является сиалилированным. Льюис А кровь групповой антиген.(10,11) CA 15-3 представляет собой антиген эпителиальной мембраны, экспрессируемый на нормальных клетках и обнаруживаемый в сыворотке. Повышенные уровни этого антигена обнаруживаются примерно в 60% случаев предоперационного рака груди и 80% случаев распространенного метастатического рака груди. Анализ CA 15-3 не подходит в качестве диагностического теста из-за его низкой чувствительности при стадиях I и II болезни. CA15-3 является маркером рака молочной железы , хотя при отсутствии рака концентрация CA 15-3 может быть значительно повышена у пациентов с дефицитом витамина B12 на и у некоторых здоровых женщин в течение лет. менструальный цикл.Панкреатит, болезнь Крона, язвенный колит и доброкачественные заболевания желудочно-кишечного тракта также могут вызывать некоторое повышение CA 15-3. (12) Повышенный уровень ПСА используется для раннего обнаружения и терапевтического мониторинга простаты рак (РПЖ). Преобладающие иммунореактивные формы ПСА , также известные как изоформы , которые были идентифицированы в сыворотке, включают свободный (некомплексный) ПСА (fPSA) и ПСА в комплексе с альфа 1-антихимотрипсином (PSA-ACT ).Было продемонстрировано, что у мужчин с РПЖ повышен ПСА-АКТ. (13) Напротив, доброкачественная гиперплазия предстательной железы, доброкачественное увеличение предстательной железы , связано с более высоким уровнем неинтактного свободного ПСА в сыворотке. уровней. (14) Результаты оценки опухолевых маркеров должны интерпретироваться в сочетании с клиническими данными и данными ультразвукового исследования и биопсии. Таблица 1. Сывороточные уровни ТМ у мужчин Возраст РЭА (до 5 нг / мл) CA19-9 (до 35 Ед / мл) ПСА (2.5-4,0 нг / мл) Томмот Чульман Томмот Чульман Томмот Чульман 18-44 лет 0, 9 2 0,1 0,1 0,1 0,5 45-59 лет 0,7 3,6 0,2 0,8 0,6 1,9 60-74 года 1,1 2,7 0,1 0,2 0,5 2,2 75-90 лет 3,1 0 1,9 Таблица 2. Сывороточные уровни ТМ у женщин Возраст REA (до 5 нг / мл) CA19-9 (до 35 Ед / мл ) CA15-3 (до 31,3 Ед / мл) Томмот Чульман Томмот Чульман Томмот Чулман 18-44 года 0,5 1,8 2.6 0,1 3,5 20,0 45-59 лет 0,5 2,4 0,9 0,3 5,2 18,9 60-74 года 1,1 2,4 3,6 0,4 7,1 25,5 75-90 лет 0,3 2,6 2,1 0,7 2,9 23,9 До появления современных методов визуализации и недавних разработок в области молекулярной диагностики опухолевые маркеры (ТМ) были одними из немногих доступных диагностических инструментов для ведения онкологических больных. Легко получаемые из образцов сыворотки или плазмы, ТМ минимально инвазивны и удобны, а связанные с этим затраты невысоки.Традиционно использовались одиночные TM, но они подверглись тщательной проверке из-за их низкой чувствительности и специфичности при использовании, например, в условиях скрининга. Однако недавние исследования показали превосходную эффективность при использовании комбинации нескольких TM в качестве панели для оценки или как часть проверенных алгоритмов, которые также включают другие клинические факторы. Кроме того, были обнаружены новые TM, которые имеют повышенный профиль чувствительности и специфичности для определенных злокачественных новообразований. Цель этого обзора — дать краткий обзор надлежащего использования как традиционных, так и новых ТМ и их роли в диагностике, прогнозе и наблюдении за пациентами в текущей клинической практике.Мы также смотрим на будущее направление ТМ и их интеграцию с другими диагностическими методами и другими появляющимися биомаркерами на основе сыворотки, такими как циркулирующие нуклеиновые кислоты, чтобы в конечном итоге улучшить диагностические характеристики и улучшить ведение пациентов. Термин опухолевый маркер (ТМ) традиционно относится к веществам, в основном белкам, которые либо непосредственно продуцируются злокачественными клетками, либо продуцируются другими клетками в ответ на определенные злокачественные или другие незлокачественные состояния.ТМ могут быть связаны со злокачественными новообразованиями конкретного органа (например, поверхностный антиген простаты [ПСА] при раке простаты и тиреоглобулин при раке щитовидной железы), но часто ТМ, например раковый антиген 19-9 (СА 19-9), может быть повышается при различных раковых заболеваниях (например, при раке поджелудочной железы, гепатобилиарном раке и аденокарциноме желудка) [1]. Кроме того, уровни TM не одинаково повышены у всех пациентов с диагнозом определенного злокачественного новообразования (например, карциноэмбриональный антиген [CEA] при колоректальной карциноме [CRC]) [2].Несмотря на эти ограничения и до появления современных методов визуализации и достижений в молекулярной диагностике, ТМ были одними из немногих доступных диагностических инструментов для ведения онкологических пациентов. Их легко измерить в жидкостях организма, в основном в образцах сыворотки или плазмы; результаты доступны быстро, а связанные с этим затраты на тестирование ТМ относительно невелики [3]. Таким образом, при многих злокачественных новообразованиях ТМ стали неотъемлемой частью ведения пациентов, а также включены в ряд клинических руководств [4–11].Отсутствие диагностических альтернатив и плохие варианты лечения для пациентов с запущенными формами рака подчеркнули необходимость раннего выявления и побудили медицинское сообщество провести несколько исследований, в которых тестировались отдельные ТМ для скрининга нескольких солидных опухолей. Однако различные причины их повышения в крови были связаны с недостаточной чувствительностью и специфичностью у бессимптомных пациентов, что делало использование одной ТМ для скрининга большинства солидных опухолей чрезвычайно сложной задачей.Даже в редких исключениях, таких как рак простаты, где для скрининга изначально был рекомендован конкретный ТМ, а именно ПСА, предполагаемое использование маркера в последнее время подверглось тщательной проверке, поскольку сам по себе ПСА не может определить наличие клинически значимых форм агрессивного рака. от более вялотекущих вариантов заболевания и, таким образом, привело к гипердиагностике и чрезмерному лечению [12]. Тем не менее, в случае подозрительных образований исследования показали, что новые TM обеспечивают улучшенные профили чувствительности и специфичности для определенных злокачественных новообразований, таких как прогастрин-высвобождающий пептид (ProGRP) для мелкоклеточного рака легкого [13] и белок эпидидимиса 4 человека (HE4) для рак яичников [14]. ТМ были обнаружены в эпоху, предшествовавшую появлению доказательной медицины, основанной на рекомендациях, и многие исследования, изучающие полезность ТМ, были либо недостаточно эффективными, либо использовались для сопоставления уровней ТМ с тем, что сейчас является устаревшими «золотыми стандартами» ( такие как обычные рентгеновские снимки для оценки ответа опухоли), или не показали строгого дизайна, необходимого в настоящее время для окончательной демонстрации клинически полезной конечной точки [15, 16]. За последнее десятилетие достижения в молекулярной и клеточной биологии привели к появлению новых диагностических инструментов в онкологии, которые измеряют циркулирующие опухолевые клетки или выявляют молекулярные события опухолей на уровне отдельного пациента, что привело к изменению парадигмы в том, как противоопухолевые препараты разрабатываются методы лечения, и пациенты отбираются для конкретной таргетной терапии [17–19].Усиленное внимание к характеристике опухолевой ткани за последнее десятилетие с использованием массивов генов, полимеразной цепной реакции (ПЦР), флуоресцентной гибридизации in situ (FISH), иммуногистохимии (IHC) и секвенирования следующего поколения (NGS) изменило онкологию и сделали точную медицину реальностью для многих пациентов [17]. Только совсем недавно мы смогли измерить общее количество и мутировавшую бесклеточную нуклеиновую кислоту, специфичную для опухоли пациента, в периферической крови, что откроет огромные новые возможности для диагностики и принятия решений о лечении в ближайшем будущем [20–27]. Учитывая впечатляющие достижения в области молекулярной диагностики, возникает вопрос: будут ли традиционные ТМ играть какую-либо роль в онкологии в будущем? Хотя исследования молекулярных маркеров в опухолевой ткани и крови уже показывают большой прогресс в создании и проверке новых технологий, все еще присутствуют многие внутренние биологические ограничения, включая гетерогенность опухолей, преобладание опухолеспецифических мутаций только в подгруппах рака. пациентов, и неоднородные ответы на таргетную терапию у тех же (например,g., положительные по мутации) подгруппы пациентов [28]. Поэтому мы предполагаем, что оптимальный поток ведения пациентов в будущем будет включать в себя новые и устоявшиеся инструменты, в том числе ТМ, и будет критически важно выбрать правильный маркер в правильной обстановке не только для оптимизации результатов на уровне пациента, но и для содержат связанные с этим расходы на здравоохранение для общества в целом. Основная цель этого краткого обзора — концептуально обрисовать, насколько «традиционные» ТМ могут иметь клиническую ценность. Несмотря на достижения в диагностике онкологии, использование ТМ в лечении пациентов с солидными опухолями имеет несколько установленных показаний, а также возможности для более широкого использования. В этом разделе мы кратко резюмируем, как ТМ можно использовать на каждом этапе по всему спектру ведения пациентов. В центре внимания здесь не углубленное обсуждение новых биомаркеров, таких как циркулирующие опухолевые клетки, циркулирующие нуклеиновые кислоты или новые подходы к протеомике, поскольку это выходит за рамки данного обзора.Однако авторы определят сохраняющуюся роль ТМ в контексте растущей важности новых биомаркеров. У людей с подозрением на рак ТМ могут быть очень полезны для сужения потенциальных дифференциальных диагнозов и сосредоточения дальнейших исследований. Например, хотя один антиген карциномы 125 (CA125) не рекомендуется для скрининга рака яичников [29], Lokich et al. может показать, что комбинация CA125 с HE4 с использованием алгоритма риска злокачественных новообразований яичников (ROMA) может более точно определить риск эпителиальной карциномы яичников, что потребует более агрессивных диагностических исследований (например,g., лапароскопия) по сравнению с более консервативной стратегией наблюдения за женщинами низкого риска [30]. Более того, недавние данные по скринингу на рак легких у лиц с высоким риском с использованием компьютерной томографии с низким разрешением показали улучшение смертности на популяционной основе [31]. Однако многие легочные узелки среднего размера не поддаются четкому диагнозу, основанному только на визуализации, и могут быть слишком маленькими для проведения КТ-биопсии или трансбронхиальной биопсии. Эти пациенты в настоящее время будут наблюдаться с помощью краткосрочной визуализации, что является дорогостоящим и подвергает их дополнительному облучению [32].Панель из шести ТМ (CEA, раковый антиген 15-3 [CA15-3], антиген плоскоклеточной карциномы [SCCA], фрагмент цитокератина 19 [CYFRA 21-1], нейрон-специфическая энолаза [NSE] и ProGRP) была недавно Показано, что он более точен в прогнозировании наличия рака легких, чем одна только ТМ или клинические факторы, такие как размер опухоли и статус курения [33]. Таким образом, эти TM могут использоваться для соответствующей сортировки неопределенных узелков в легких. Более того, было показано, что структура CEA, SCCA, CYFRA 21-1, NSE и ProGRP очень полезна для различения подтипов мелкоклеточного и немелкоклеточного рака легкого (SCLC и NSCLC, соответственно.) [33]. Это весьма актуально, учитывая, что значительная часть биопсии легких может быть недиагностической [34]. Другой пример улучшения диагностических характеристик комбинирования ТМ — это скрининг рака простаты. У мужчин без пальпируемого узелка простаты и со скрининговым значением ПСА в так называемой серой зоне, то есть с уровнем ПСА от 2 до 10 нг / мл, клиницист не может надежно отличить рак простаты от доброкачественной гиперплазии простаты без инвазивной биопсии простаты. . В этой ситуации измерение, помимо общего ПСА, уровней свободного ПСА и вычисление их соотношения (% fPSA) может быть полезным для диагностики основного рака простаты [35].Чем ниже% fPSA, тем выше вероятность рака простаты. В основополагающем исследовании Catalona et al., Тестирование% fPSA сократило количество ненужных биопсий на 20%, при этом сохранив 95% уровень выявления рака простаты [36]. Стокгольмская модель, которая объединяет свободный ПСА с множеством других данных оценки риска, недавно была показана как более чувствительный и специфический скрининговый тест, чем один только ПСА [37]. У пациентов с диагностированным неопознанным первичным раком (CUP) использование нескольких TM является частью диагностического процесса, как указано в таких руководствах, как Национальная комплексная сеть рака (NCCN) [38].В зависимости от того, какие ТМ повышены, целенаправленное диагностическое обследование может быть направлено на определенные органы, и, таким образом, могут быть снижены заболеваемость, временная задержка и стоимость дальнейших инвазивных диагностических процедур (например, бронхоскопии). Хотя тканевая диагностика почти всегда требуется для принятия решения о лечении в онкологии, два заметных исключения в значительной степени зависят от наличия ТМ. У пациентов мужского пола с опухолью яичек и повышенными ТМ (альфа-фетопротеин [AFP] и хорионический гонадотропин человека [ХГЧ] по отдельности или в комбинации) биопсия не требуется, и орхиэктомия является следующим терапевтическим и диагностическим шагом.Точно так же у пациентов с циррозом печени повышенный уровень АФП вместе с характерными данными многофазной визуализации достаточен для постановки диагноза гепатоцеллюлярной карциномы (ГЦК), и биопсия не рекомендуется. TM также полезны после установления диагноза злокачественного новообразования. В то время как несколько групп исследовали прогностическую роль геномных и иммунологических сигнатур биомаркеров на ранней стадии НМРЛ, Muley et al.продемонстрировали относительно простую комбинацию предоперационных уровней CEA и CYFRA-21, которые могут быть прогностическими для безрецидивной выживаемости в этой когорте пациентов стадии I-IIIA [39]. Другое недавнее исследование продемонстрировало, что у пациентов с МРЛ как уровни до лечения, так и абсолютные уровни ProGRP в конце первого цикла химиотерапии являются прогностическими для общей выживаемости [40]. При первичном раке молочной железы CA15-3, отдельно или в комбинации с другими ТМ, показал прогностический эффект в нескольких работах [41–44].Другим примером является CA19-9, уровень которого может быть повышен при гепатобилиарной карциноме, и он давно признан независимым прогностическим фактором у пациентов с запущенной аденокарциномой поджелудочной железы и, таким образом, был включен в качестве фактора стратификации в недавних крупных клинических исследованиях [45, 46 ]. При клинически ограниченном раке предстательной железы уровень ПСА 10–20 нг / мл определяет промежуточный риск, а ПСА> 20 нг / мл означает высокий риск, независимо от классификации Т и шкалы Глисона [47]. При метастатических несеминоматозных половых клеточных опухолях яичек TM также используется для определения пациентов с хорошим, промежуточным и низким риском, независимо от размера и расположения опухоли [48, 49]. Эти примеры показывают, что ТМ могут быть ценным инструментом для прогнозирования в определенных когортах пациентов, несмотря на наличие более сложных и дорогостоящих тестов. Пожалуй, наиболее распространенным и наиболее распространенным применением ТМ является мониторинг заболевания во время лечения. Связь многих ТМ с различными солидными опухолями была признана несколько десятилетий назад, и с тех пор их использование в качестве маркеров мониторинга стало признанным компонентом ведения пациентов.В таблице 1 приведен список часто используемых ТМ со связанными злокачественными новообразованиями. Более подробный обзор ТМ с их рекомендованным клиническим использованием в соответствии с различными руководствами можно найти в другом месте [50]. Привлекательность ТМ для мониторинга заболеваний основана на основном принципе наличия инструмента, который быстро информирует онколога об успехе лечения (в большинстве центров в течение нескольких часов) при относительно низкой стоимости (большинство ТМ стоят менее 40 долларов США [51]). с минимальными неудобствами для пациента (например, забор крови по сравнению с инвазивной биопсией или визуализацией).Кроме того, важно отметить, что специфичность не так важна для пациентов, у которых уже диагностировано определенное злокачественное новообразование, что еще больше увеличивает полезность ТМ в этих условиях. Наконец, TM, такой как CA125, может указывать при желудочно-кишечном и других раках брюшной полости наличие карциноматоза сальника, когда визуализация часто не позволяет обнаружить какое-либо измеримое заболевание, а в некоторых случаях мониторинг уровней CA125 остается единственным средством оценки успеха лечения. [52]. Однако для осмысленной клинической интерпретации кинетики ТМ использование тех же методов измерения маркеров имеет первостепенное значение. Кроме того, дополнительные лабораторные параметры, такие как уровни креатинина, трансаминаз и С-реактивного белка (СРБ), полезны для контроля потенциально влияющих состояний, таких как почечная и печеночная недостаточность или воспаления. Мониторинг терапии может быть наиболее эффективным, когда забор крови проводится в определенные моменты времени во время лечения, например, перед каждым применением нового химиотерапевтического цикла, и когда биохимический ответ или прогрессирование осуществляется на основе определенных изменений ТМ по отношению к индивидуальные базовые значения, а не фиксированные пороговые уровни, такие как эталонное значение любой контрольной группы.Таким образом, соответствующие изменения маркеров могут значительно варьироваться из-за разного времени половины или удвоения маркеров. Хотя эти факты кажутся логичными, значимые изменения TM плохо определены, и четкие графики определения маркеров пока редко используются для оценки ответа в клинической практике. Следующая волна диагностических достижений в мониторинге терапии сосредоточена на обнаружении нуклеиновых кислот из опухоли индивидуума в периферической крови после специфической мутации у этого конкретного пациента [53].Несомненно, эта разработка является еще одним шагом к точной медицине и станет важным дополнением к концепции «лечения правильного пациента правильными лекарствами». Однако означает ли это, что в этом случае TM станут устаревшими? Скорее всего, нет. Молекулярная диагностика будет очень ценной на этапах принятия решений во время ведения пациента: при постановке диагноза для определения правильного лечения и при прогрессировании для определения конкретной мутации устойчивости (рис. 1). Это определит следующую линию терапии, но между точками принятия решения, во время циклов химиотерапии, будет очень трудно показать преимущество молекулярной диагностики перед традиционными ТМ в мониторинге заболеваний.Даже сегодня ранний рост ТМ может предвещать будущее рентгенологическое прогрессирование, но не обязательно при первом росте может привести к смене лечения. Клинические исследования, сравнивающие циркулирующую опухолевую ДНК (цтДНК) с ТМ, показывают, что цтДНК лучше всего использовать у пациентов с не повышенным уровнем ТМ [54–57]. Никаких дополнительных преимуществ при сочетании с ТМ не выявлено. Это продемонстрировало бы, что обнаружение «молекулярной прогрессии» связано с улучшенными результатами по сравнению с прогрессией, основанной на ТМ, и, таким образом, оправдало бы более высокие затраты и время обработки.Такой подход может быть полезен при выборе высокоагрессивных видов рака с использованием нескольких направлений высокоэффективной терапии, но в большинстве случаев этот метод «высокой чувствительности» вряд ли сможет заменить уже устоявшуюся ТМ. Кроме того, для молекулярных маркеров необходимо определять клинически значимые изменения на уровне отдельного пациента, чтобы избежать ложноположительных (или отрицательных) результатов. Кроме того, необходимо учитывать непрерывность метода, а также контролировать преаналитические и влияющие факторы.Это в принципе похоже на введение визуализации с помощью компьютерной томографии (КТ) позитронно-эмиссионной томографии (ПЭТ) по сравнению с обычным сканированием КТ. По разным причинам, включая стоимость, ПЭТ-сканирование не могло регулярно заменять компьютерную томографию во время регулярных интервалов мониторинга заболевания. Таким образом, в будущем, в то время как молекулярная диагностика будет приобретать все большее значение в сортировке пациентов в точках принятия решений, промежуточная ТМ между этими точками будет по-прежнему использоваться в качестве спускового механизма для дальнейших сложных и более дорогостоящих тестов (например,g., визуализация или молекулярное тестирование на наличие новых мутаций). Не следует забывать, что, несмотря на фрагментацию и подклассификацию гистологических диагнозов в онкологии на генотипическом уровне для назначения лучшего лечения (например, KRAS, NRAS или BRAF при мутированном CRC [58]), большинство из них являются захвачены под зонтиком нескольких ТМ на основе крови на фенотипическом уровне (например, CEA и CA19-9 в CRC). Проще говоря, это означает, что один биомаркер можно использовать для многих молекулярно различных заболеваний, чтобы сказать нам, убиваются ли опухолевые клетки или нет.Это клинически актуально, поскольку молекулярные паттерны точно предсказывают ответ на лечение только у части пациентов, в то время как значительное число пациентов (до 50% у пациентов с рецидивирующим раком легкого) не отвечает на подходы таргетной терапии, несмотря на положительный эффект рецептора эпидермального фактора роста (EGFR). анализ мутаций [59, 60]. Кроме того, многие пациенты не подходят для молекулярного мониторинга, так как у них нет «поддающихся лечению» мутаций. Поскольку молекулярное профилирование показывает большие различия между отдельными людьми, нам не нужно создавать определенный набор праймеров для каждого пациента, чтобы отслеживать его реакцию на лечение, но для большинства из них можно использовать одну и ту же ТМ.Таким образом, мониторинг заболеваний во время системного лечения запущенных форм рака останется одним из основных показателей, по которым ТМ по-прежнему будут играть важную роль в будущем. При неметастатических формах рака, которые лечатся с лечебной целью, и при запущенных формах рака с хорошим ответом на химиотерапию первой линии рекомендуется наблюдение за пациентами на срок до пяти лет для выявления раннего рецидива. В некоторых случаях время наблюдения даже больше, например, при опухолях из половых клеток [61, 62].Основная гипотеза здесь заключается в том, что раннее обнаружение рецидива увеличит вероятность наличия ограниченного объема заболевания и, таким образом, либо (а) сможет вылечить рецидив с помощью окончательной местной терапии (хирургия и / или лучевая терапия), либо (б) иметь лучший ответ. к системному лечению из-за меньшей опухолевой нагрузки. Следовательно, при многих распространенных формах рака, которые поддаются скринингу и, таким образом, выявляются на неметастатической стадии у большинства пациентов (например, простаты, CRC или груди), использование TM для наблюдения после лечения либо уже включено в руководящие принципы, либо / или часть общей клинической практики [63–66].Из приведенных выше показаний для наблюдения за пациентами на предмет рецидива можно увидеть, что обычно спасительное лечение, особенно местное лечение (например, хирургическое или лучевая терапия), основано на анатомической локализации рецидива. Таким образом, ТМ сама по себе не инициирует лечение, а скорее станет следующим диагностическим тестом, который в конечном итоге подскажет лучшую стратегию лечения. Этот подход успешно применялся при раке груди с использованием CEA и CA 15-3 для наблюдения после оказания медицинской помощи [43, 67].Следует отметить, что принципы мониторинга маркеров (поддержание тех же методов, определенные временные графики определения TM, интерпретация в соответствии с изменениями маркеров по отношению к индивидуальным базовым значениям, а не в соответствии с фиксированными пороговыми значениями) были предпосылками для разработать наиболее эффективную процедуру мониторинга [68]. Более того, запуск чувствительной визуальной диагностики и терапевтических вмешательств имели первостепенное значение для получения преимущества во времени за счет раннего обнаружения рецидивов. Другие рандомизированные испытания по мониторингу рецидивов с ТМ, например, при раке яичников с использованием CA125, не показали улучшения выживаемости и не были включены в рекомендации [69, 70]. Было выявлено несколько причин неутешительных результатов, таких как неблагоприятный отбор пациентов с плохим прогнозом, неудовлетворительные хирургические результаты с слишком большим количеством опухолевых положительных границ, интерпретация уровней CA125 на основе фиксированных высоких пороговых значений, которые не привели к раннее выявление рецидивов и недостаточное количество препаратов второго ряда [71, 72].Таким образом, если обнаружение рецидива с помощью ТМ в этих случаях не рекомендуется, тогда трудно представить себе, чтобы еще более сложные маркеры крови, такие как внеклеточная ДНК, широко использовались в качестве маркеров наблюдения, учитывая более высокие затраты и несоблюдение процедурных графиков. с маркерами, доступными в настоящее время. Однако выживаемость может быть не лучшим критерием для оценки роли TM в этой ситуации. Чтобы полностью изучить это, потребуются крупные и долгосрочные рандомизированные исследования.Учитывая тот факт, что ТМ существуют уже несколько десятилетий и уже включены в ведение пациентов, было бы очень сложно найти ресурсы для проведения этих испытаний сегодня. Альтернативными более непосредственными конечными точками для исследования могло бы быть количество контрольных компьютерных томографов, сохраненных при мониторинге ТМ, или доля пациентов, которые проходят лечебную терапию с целью спасения. Primrose et al. недавно продемонстрировал в большом проспективном исследовании, что мониторинг рецидива CRC только с помощью CEA не хуже, чем обычная компьютерная томография [73].Можно представить себе, что молекулярные тесты на основе крови для мониторинга рецидива опухоли будут конкурировать с ТМ в будущем, учитывая вероятность того, что они покажут серологический рецидив без какой-либо рентгенологической корреляции, и, следовательно, отсутствие фактической цели для местного лечения спасения может привести к частому , дорогостоящее повторное тестирование до тех пор, пока не будет выявлено обнаруживаемое поражение. Совершенно очевидно, что ТМ могут быть очень полезными инструментами в ведении пациентов при правильном использовании.Но также очевидно, что требуется дополнительная работа для оптимизации клинического использования ТМ в повседневной практике. Традиционно TM использовались как отдельные маркеры, что вызывало опасения по поводу их низкой чувствительности или низкой специфичности. Это особенно верно для опухолей, которые в подавляющем большинстве не экспрессируют конкретный TM, например, NSCLC [74]. В этой популяции пациентов ни одна из ТМ не повышена у большей части пациентов. Тем не менее, панель из нескольких ТМ выявляет в большинстве случаев по крайней мере одну повышенную ТМ, которая затем может использоваться для мониторинга лечения.Важно отметить, что некоторые ТМ коррелируют с гистологическим подтипом, что может в дальнейшем определять выбор ТМ. Другие примеры включают CRC (CA19-9 в дополнение к CEA [75]) и рак яичников (HE4 в CA125-отрицательных опухолях [76]). Комбинация двух или более TM также может повысить прогностическую эффективность, например, с CEA и CYFRA 21-1 при NSCLC [39]. Кроме того, в будущих исследованиях, оценивающих диагностическую эффективность ТМ, исследователи должны не только сосредоточиться на одной временной точке, но и оценить тенденцию ТМ в течение определенного периода времени, например, внедрение кинетики ТМ с учетом риска рака яичников. алгоритма (ROCA) [77] или при оценке времени удвоения ПСА у пациентов с раком простаты [78]. Наконец, продолжаются исследования по поиску новой TM, которая по отдельности или в комбинации улучшит диагностические характеристики при определенных показаниях, например, комбинации ProGRP, NSE, CYFRA 21-1 и CEA при подтипах рака легких [33] . Кроме того, недавние данные показывают, что мониторинг лечения пациентов с SCLC можно оптимизировать, используя ProGRP и NSE в качестве TM [40]. Основываясь на той же концепции, добавление нуклеиновых кислот (например, ctDNA) может помочь закрыть диагностический пробел в опухолях без известных TM (например,g., саркомы) или в комбинации улучшают мониторинг злокачественных новообразований с менее установленными ТМ (например, S-100B при меланомах [79, 80]). Надеемся, что дальнейшие текущие исследования новых маркеров пополнят наш текущий арсенал доступных ТМ. Многие широко используемые TM, такие как CEA, CA125 и AFP, были описаны более 20 лет назад, и их внедрение в клиническую практику предшествовало появлению доказательной медицины [81–83]. Таким образом, было бы очень сложно, если не почти невозможно, найти ресурсы для восстановления клинических данных в отдельных клинических испытаниях, чтобы продемонстрировать полезность этих ТМ.Однако есть и другие возможности для сбора высококачественных данных для поддержки использования TM. Можно взять уже опубликованные данные и проанализировать несколько статей вместе в форме метаанализа, который предоставит больше доказательств использования ТМ при определенных показаниях. Для целей мониторинга заболевания можно проспективно собирать образцы крови у последовательных пациентов, которые проходят лечение от конкретных опухолей стандартной терапией вне терапевтического клинического исследования, и соотносить изменения TM с задокументированными ответами опухоли.Хотя этот вариант, безусловно, дешевле, чем проведение специализированных проспективных клинических испытаний ТМ, всегда есть проблемы с предвзятостью, установлением изменений ТМ с ответом и исходом, а также с различными временными точками сбора образцов. Следовательно, мы полагаем, что путь вперед для получения более надежных данных для существующих (и тестирования новых биомаркеров) будет ретроспективно на доступных образцах из крупных и хорошо аннотированных клинических испытаний. В качестве следующего шага предполагаемые коллекции образцов могут быть включены в будущие терапевтические клинические испытания.Более тщательная оценка новых маркеров в проспективных клинических испытаниях, которые имеют достаточную мощность и четкие конечные точки (например, оценка ответа по критериям оценки ответа в солидных опухолях [RECIST] [84]), вероятно, повысит принятие этих ТМ в клиническую практику. Это особенно верно для менее широко используемых TM (например, HE4), которые следует включить в будущие терапевтические испытания, чтобы продемонстрировать их полезность в качестве вторичной конечной точки. Эти подходы позволят решить многие проблемы, связанные с образцами, взятыми у пациентов вне испытаний, например, преимущество наличия жесткой временной корреляции сбора образцов с вмешательством и четко определенных критериев ответа.Наконец, подходящими конечными точками для определения роли ТМ в клинической практике не всегда должна быть общая выживаемость, как уже указывалось выше. ТМ могут использоваться в качестве недорогого и быстрого диагностического метода для запуска последующих тестов, и, следовательно, их полезность должна быть проверена в контексте экономических исследований в области здравоохранения, то есть изменения в управлении пациентами и экономии на лечении и дополнительных затратах, связанных с диагностикой. чем чисто клинические конечные точки, такие как общая выживаемость. Использование товарных знаков за пределами уже установленных целей (например,(например, опухоли половых клеток, колоректальные опухоли, опухоли предстательной железы, яичников, поджелудочной железы, гепатоцеллюлярные и нейроэндокринные опухоли) также будут зависеть от повышения уровня образования врачей. Это будет происходить посредством публикаций и презентаций на конференциях, но также должно начинаться на ранних этапах обучения стажеров-онкологов под руководством их ведущих врачей. Как и многие другие аспекты клинической практики, использование ТМ, вероятно, коррелирует с уровнем воздействия этих ТМ во время медицинского обучения. Таблица 2 концептуально резюмирует, как сбор ТМ может быть включен в будущие проспективные исследования.TM будут нарисованы в различные моменты времени, указанные в таблице 2 (a), с рутинной визуализацией и последующим наблюдением за пациентом, как указано в соответствующем протоколе. Различные расчеты с использованием уровней ТМ в моменты времени, указанные в Таблице 2 (а), затем могут быть выполнены в соответствии с Таблицей 2 (b) для определения диагностической эффективности ТМ для различных клинических конечных точек. Эти результаты будут способствовать более рациональному использованию ТМ, основанному на данных, на основе предоставленных данных. TM представляют собой удобный и экономичный диагностический инструмент для лечения различных злокачественных новообразований. Комбинирование нескольких TM, последовательных измерений и включение новых TM может улучшить их диагностические характеристики. Оценивая их полезность, следует понимать их роль в определенных показаниях (например, мониторинг болезни) в качестве теста первой линии для надлежащего запуска дальнейших обследований и более инвазивной диагностики, а не ТМ как отдельного теста, который будет напрямую влиять на результаты лечения. пациенты.Эта фундаментальная концептуальная основа также приведет к их дальнейшему использованию, несмотря на новые диагностические методы, такие как бесклеточное тестирование ДНК, или в качестве важного дополнения к ним. Текущие исследования и усовершенствованные платформы будущих открытий будут способствовать развитию ТМ и добавят новые маркеры в уже имеющийся арсенал. Фаршид Даяни был сотрудником Roche Diagnostics International Ltd, когда была инициирована эта проверка. Дэвид Моргенштерн — сотрудник компании Roche Diagnostics International Ltd.Стефан Холденридер получил гранты / исследовательскую поддержку от Roche Diagnostics. Лэнс Пальяро не заявляет о конфликте интересов. Редакционную поддержку оказывала Ким Браун из Roche Diagnostics International Ltd. Опухолевые маркеры имеют прогностическое значение, поэтому важно получить предоперационные уровни. У мужчин с раком яичек прогностическое значение онкомаркеров хорошо известно.Международный консорциум объединил данные о более чем 5000 мужчинах с раком яичек и использовал многомерный анализ для исследования прогностических факторов, которые могли разделить пациентов на группы высокого, среднего и низкого риска (см. Таблицу 23-7). Повышенные онкомаркеры — одна из основных переменных, определяющих отнесение к группе риска у взрослых. Другие неблагоприятные прогностические факторы включают первичное средостение и наличие нелегочных висцеральных метастазов. Было показано, что лактатдегидрогеназа (ЛДГ) является прогностическим фактором у мужчин с раком яичек, но не имеет прогностического значения у педиатрических пациентов, хотя анализы на сегодняшний день недостаточно мощны для изучения этой проблемы. Несколько ретроспективных исследований с участием мужчин с раком яичка показали, что более медленное, чем ожидалось, снижение онкомаркеров после начала лечения предсказывает более низкие EFS и OS. 400-402 При анализе мужчин с раком яичек, пролеченных в период с 1986 по 1998 год в Memorial Sloan-Kettering, у мужчин с удовлетворительным снижением опухолевых маркеров были отличные результаты за 2 года (EFS, 91%; OS, 95%) по сравнению с с неудовлетворительным снижением (EFS, 69%; OS, 72%). 402 В недавнем рандомизированном исследовании с участием пациентов с раком яичка из группы низкого риска сравнивали стандартную терапию, четыре цикла BEP (блеомицин, этопозид, цисплатин) с двумя циклами BEP, за которыми следовали два цикла высоких доз карбоплатина, этопозида и циклофосфамида ( BEP + HDCT).Хотя общие результаты исследования не показали разницы в выживаемости между двумя группами, в подгруппе из 67 пациентов с неудовлетворительным снижением онкомаркера стойкий полный ответ в течение 1 года составил 61% для пациентов, получавших HDCT, по сравнению с 34 пациентами. % для тех, кто получил только BEP. 403 Оценка прогностической значимости опухолевых маркеров в педиатрии была ограничена относительно небольшим числом участников клинических испытаний. Тем не менее, по данным последнего U.S. Педиатрическое межгрупповое исследование, британское исследование GC2 и французское исследование TGM85 и TGM90, AFP 10 000 МЕ / л или выше предвещает худший прогноз для EFS. 382,388-391 В многомерном анализе британских данных AFP 10 000 МЕ / л или выше был более сильным предиктором рецидива, чем место или стадия; у тех, у кого уровень АФП выше 10 000 МЕ / л, был в четыре раза выше риск рецидива. В двух педиатрических исследованиях AFP не был прогностическим, но оба анализа были ограничены только пациентами с внегонадными первичными заболеваниями. 404 405 β-ХГЧ и ЛДГ были оценены в данных США, и не было показано, что они имеют прогностическое значение при использовании точек отсечения, разработанных для мужчин в наборе данных IGCCC. 382 388 Участок внегонадной опухоли имел прогностическое значение в исследованиях в США, Великобритании и Франции, хотя в каждом исследовании он определялся немного по-разному. Общим для каждого исследования было включение средостения, что явно связано со снижением EFS во всех исследованиях. Относительное влияние других локализаций внегонадной болезни потребует изучения большего набора данных.Влияние удовлетворительного и неудовлетворительного снижения опухолевых маркеров не оценивалось у педиатрических пациентов с опухолями зародышевых клеток. Инь BWT: Молекулярное клонирование антигена рака яичников СА125. идентификация как новый муцин, muc16. J Biol Chem 2001, 276 (29): 27371–27375. CAS
PubMed
Статья
Google ученый Бафна С., Каур С., Батра СК: Мембранно-связанные муцины: механистическая основа изменений в росте и выживании раковых клеток. Онкоген 2010, 29: 2893–2904. CAS
PubMed Central
PubMed
Статья
Google ученый Gaetje R, Winnekendonk DW, Ahr A, Kaufmann M: Антиген рака яичников CA-125 влияет на адгезию клеточных линий человека и млекопитающих in vitro. Clin Exp Obstet Gynecol 2002, 29 (1): 34–36. CAS
PubMed
Google ученый Бишоф P: Что мы знаем о происхождении CA-125? Eur J Obstet Gynecol Reprod Biol 1993, 49: 93–98. CAS
PubMed
Статья
Google ученый Баст Р.С. младший, Сюй Ф.Дж., Ю Й.Х., Барнхилл С., Чжан З., Миллс GB: CA-125: прошлое и будущее. Int J Biol Markers 1998, 13: 179–187. CAS
PubMed
Google ученый Whitehouse C, Solomon E: Текущее состояние молекулярной характеристики антигена рака яичников CA125 и значение его использования в клиническом скрининге. Gynecol Oncol 2003, 88: S152-S157. CAS
PubMed
Статья
Google ученый Halila H, Stenman UH, Seppala M: Уровни антигена CA-125 рака яичников при воспалительных заболеваниях органов малого таза и беременности. Рак 1986, 57: 1327–1329. CAS
PubMed
Статья
Google ученый Barbieri RL, Niloff JM, Bast RC Jr, Scaetzl E, Kistner RW, Knapp RC: Повышенные концентрации CA-125 в сыворотке крови у пациентов с запущенным эндометриозом. Fertil Steril 1986, 45: 630–634. CAS
PubMed
Google ученый Молина Р., Филелла Х, Джо Дж., и др. .: СА-125 в биологических жидкостях. Int J Biol Markers 1998, 13: 224–230. CAS
PubMed
Google ученый Lindgren J, Kuusela P, Hellström PE, Pettersson T., Klockars M: Антиген CA-125, связанный с раком яичников, у пациентов с плевральным выпотом. Eur J Cancer Clin Oncol 1988, 24: 737–739. CAS
PubMed
Статья
Google ученый Йилмаз М.Б., Николау М., Коэн С.А.: Опухолевые биомаркеры при сердечной недостаточности: играет ли роль СА-125? Eur J Heart Fail 2011, 13: 579–583. CAS
PubMed
Статья
Google ученый Epiney M, Bertossa C, Weil A, Campana A, Bischof P: Производство CA125 брюшиной: исследования in vitro и in vivo. Hum Reprod 2000, 15: 1261–1265. CAS
PubMed
Статья
Google ученый Цукерман Э., Ланир А., Сабо Э., и др. .: Раковый антиген 125: чувствительный маркер асцита у пациентов с циррозом печени. Am J Gastroenterol 1999, 94: 1613–1618. CAS
PubMed
Статья
Google ученый Mezger J, Wilmanns W, Lamerz R: Повышенные уровни СА-125 в сыворотке у пациентов с доброкачественными асцитическими или плевральными выпотами. Tumor Biol 1988, 9: 47–52. CAS
PubMed
Статья
Google ученый Nägele H, Bahlo M, Klapdor R, Schaeperkoetter D, Rödiger W: CA-125 и его связь с сердечной функцией. Am Heart J 1999, 137: 1044–1049. PubMed
Статья
Google ученый Думан Д., Палит Ф., Симсек Е., Билгехан К.: Уровни 125 углеводного антигена в сыворотке крови при тяжелой сердечной недостаточности: связь с натрийуретическим пептидом B-типа и объемом левого предсердия. Eur J Heart Fail 2008, 10: 556–559. CAS
PubMed
Статья
Google ученый Kouris NT, Zacharos ID, Kontogianni DD, Goranitou GS, Sifaki MD, Grassos HE, Kalkandi EM, Babalis DK: Значение уровней CA125 у пациентов с хронической застойной сердечной недостаточностью. Корреляция с клинико-эхокардиографическими параметрами. Eur J Heart Fail 2005, 7: 199–203. CAS
PubMed
Статья
Google ученый Hung CL, Hung TC, Liu CC, Wu YJ, Kuo JY, Hou CJ, Yeh HI: Связь углеводного антигена-125 с ремоделированием левого предсердия и его прогностическая ценность у пациентов с сердечной недостаточностью и сохраненным левым фракция выброса желудочков у женщин. Am J Cardiol 2012, 110: 993–1000. CAS
PubMed
Статья
Google ученый D’Aloia A, Faggiano P, Aurigemma G, Bontempi L, Ruggeri G, Metra M, Nodari S, Dei CL: Уровни углеводного антигена 125 в сыворотке крови у пациентов с хронической сердечной недостаточностью: отношение к клинической степени тяжести , гемодинамические и допплерэхокардиографические нарушения, а также краткосрочный прогноз. J Am Coll Cardiol 2003, 41: 1805–1811. PubMed
Статья
CAS
Google ученый Vizzardi E, Nodari S, D’Aloia A, Chiari E, Faggiano P, Metra M, Dei CL: Уровни опухолевых маркеров CA-125 в плазме связаны с систолической и диастолической функцией желудочков и клиническим статусом пациенты с хронической сердечной недостаточностью. Эхокардиография 2008, 25: 955–960. PubMed
Статья
Google ученый Нуньес Дж., Санчис Дж., Боди В., и др. .: Улучшение стратификации риска с комбинацией углеводного антигена 125 онкомаркера и мозгового натрийуретического пептида у пациентов с острой сердечной недостаточностью. Eur Heart J 2010, 31: 1752–1763. CAS
PubMed
Статья
Google ученый Núñez J, Núñez E, Consuegra L, Sanchis J, Bodí V, Martínez-Brotons A, Bertomeu-González V, Robles R, Bosch MJ, Fácila L, Darmofal H, Llàcer Hydrate, антиген A: Углеводород. : новый прогностический фактор риска острой сердечной недостаточности? Сердце 2007, 93: 716–721. PubMed Central
PubMed
Статья
CAS
Google ученый Фаджиано П., Д’Алоя А., Брентана Л., Бигнотти Т., Фиорина С., Виззарди Е., Дей CL: Уровни различных онкомаркеров в сыворотке крови у пациентов с хронической сердечной недостаточностью. Eur J Heart Fail 2005, 7: 57–61. CAS
PubMed
Статья
Google ученый Chen YX, Wang XQ, Fang CF, Wang JF, Tang LJ: Значение BNP и онкомаркера CA125 у пациентов с сердечной недостаточностью. Acta Cardiol 2008, 63: 501–506. PubMed
Статья
Google ученый Núñez J, Núñez E, Sanchis J, Bodí V, Fonarow GC, Miñana G, Palau P, Bertomeu-González V, Carratalá A, Mainar L, Chorro FJ, Llàcer A: Углеводы антигена мозга и серийные измерения натрийуретического пептида для стратификации риска после эпизода острой сердечной недостаточности. Int J Cardiol 2012, 159: 21–28. PubMed
Статья
Google ученый Mathew B, Bhatia V, Mahy IR, Ahmed I., Francis L: Повышение уровня опухолевого маркера CA125 при правожелудочковой недостаточности. South Med J 2004, 97 (10): 1013–1014. PubMed
Статья
Google ученый Uz O, Kardesoglu E, Tas D, Acar G, Isilak Z, Yiginer O, Aparci M, Cingozbay BY, Cebeci BS: Уровень CA-125 связан с эхокардиографическими параметрами правого желудочка у пациентов с ХОБЛ. South Med J 2011, 104: 624–628. PubMed
Статья
Google ученый Йилмаз М.Б., Зорлу А., Доган О.Т., Карахан О., Тандоган И., Аккурт I: Роль CA-125 в выявлении правожелудочковой недостаточности при хронической обструктивной болезни легких. Clin Cardiol 2011, 34: 244–248. PubMed
Статья
Google ученый Йилмаз М.Б., Зорлу А., Тандоган I: Уровень CA-125 в плазме связан с обеими сторонами сердца: ретроспективный анализ. Int J Cardiol 2011, 149: 80–82. PubMed
Статья
Google ученый Zeimet AG, Offner FA, Marth C, Heim K, Feichtinger H, Daxenbichler G, Dapunt O: Модуляция высвобождения CA-125 воспалительными цитокинами в клетках мезотелия брюшины и яичников человека. Anticancer Res 1997, 17: 3129–3131. CAS
PubMed
Google ученый Косар Ф., Аксой Ю., Озгунтекин Г., Озерол И., Варол Е: Взаимосвязь между цитокинами и онкомаркерами у пациентов с хронической сердечной недостаточностью. Eur J Heart Fail 2006, 8 (3): 270–274. CAS
PubMed
Статья
Google ученый Тургут О., Тандоган И., Йилмаз М.Б., Гул И., Гурлек А: Уровни CA125 среди пациентов с тяжелой сердечной недостаточностью: новый независимый предиктор выживаемости. Int J Cardiol 2010, 145: 71. PubMed
Статья
Google ученый Хуанг Ф., Чен Дж., Лю И, Чжан К., Ван Дж., Хуанг Х .: Новый механизм повышения СА125 при сердечной недостаточности: механический стресс и воспалительные стимулы инициируют синтез СА125. Med Hypotheses 2012, 79: 381–383. CAS
PubMed
Статья
Google ученый Zeillemaker AM, Verbrugh HA: Hoynck van Papendrecht AA, Leguit P. Секреция CA-125 мезотелиальными клетками брюшины. J Clin Pathol 1994, 47: 263–265. CAS
PubMed Central
PubMed
Статья
Google ученый Minana G, Nunez J, Sanchis J, Bodi V, Nunez E, Llacer A: CA125 и иммуновоспалительная активность при острой сердечной недостаточности. Int J Cardiol 2010, 145: 547–548. PubMed
Статья
Google ученый Георгиад М, Фоллат Ф, Пониковски П., Барсук Дж. Х., Блэр Дж. Э., Клеланд Дж. Г., Дикштейн К., Дразнер М. Х., Фонаров Г. К., Яарсма Т., Жондо Дж., Сендон Дж. Л., Мебазаа А., Метиненра М. , Pang PS, Seferovic P, Stevenson LW, van Veldhuisen DJ, Zannad F, Anker SD, Rhodes A, McMurray JJ, Filippatos G: Европейское кардиологическое общество; Европейское общество интенсивной терапии.оценка и классификация застойных явлений при острой сердечной недостаточности: научное заявление комитета по острой сердечной недостаточности ассоциации сердечной недостаточности Европейского общества кардиологов и одобренное Европейским обществом интенсивной терапии. Eur J Heart Fail 2010, 12: 423–433. PubMed
Статья
Google ученый Krack A, Sharma R, Figulla HR, Anker SD: Важность желудочно-кишечной системы в патогенезе сердечной недостаточности. Eur Heart J 2005, 26: 2368–2374. CAS
PubMed
Статья
Google ученый Seo T, Ikeda Y, Onaka H, et al. .: Полезность измерения СА125 в сыворотке для мониторинга перикардиального выпота. Jpn Circ J 1993, 57: 489–494. CAS
PubMed
Статья
Google ученый Сома Л., Аллен М., Тобин Л., и др. .: Концентрации СА-125 у пациентов, ожидающих трансплантации сердца. Clin Chem 2002, 48: 2289–2290. CAS
PubMed
Google ученый Colombo PC, Ganda A, Lin J, Onat D, Harxhi A, Iyasere JE: Воспалительная активация: сердечные, почечные и кардио-почечные взаимодействия у пациентов с кардиоренальным синдромом. Heart Fail Ред. 2012, 17: 177–190. CAS
PubMed
Статья
Google ученый Topatan B, Basaran A: CA-125 и сердечная недостаточность: дежавю или «еще предстоит увидеть». Int J Cardiol 2010, 145: 626–629. PubMed
Статья
Google ученый Зустович Ф., Буя А., Да Пра М, Фарина Г., Зовато С., Буттарелло М., Периссинотто Э., Картей Г.: Поведение CA-125 в зависимости от пола и потенциальная прогностическая роль в ранней стадии рака легких. Терапия рака 2007, 5: 347–350. Google ученый Ordu S, Ozhan H, Alemdar R, Aydin M, Caglar O, Yuksel H, Kandis H: Углеводный антиген-125 и N-концевые уровни натрийуретического пептида головного мозга: сравниваются при прогнозировании сердечной недостаточности. Tex Heart Inst J 2012, 39: 30–35. PubMed Central
PubMed
Google ученый Folga A, Filipiak KJ, Mamcarz A, Obrebska-Tabaczka E, Opolski G: Одновременная прогностическая ценность NT-proBNP и CA-125 у пациентов с впервые диагностированной сердечной недостаточностью на поздней стадии: предварительные результаты. Arch Med Sci 2012, 8: 637–643. CAS
PubMed Central
PubMed
Статья
Google ученый Чунг-Ли Х, Чарльз Цзя-Инь Х, Гво-Чи Х, Джен-Юань К., Чиа-Ю Х, Ченг-Хо Т, Хун-И Й, Булвер БЭ, Я-Цзин Х: Мифы и факты о сердечной недостаточности с сохраненной фракцией выброса: факторы риска, долголетие, возможные фармакологические вмешательства и физические упражнения. Int J Gerontol 2013, 7: 1–7. Артикул
Google ученый % PDF-1.5
%
1 0 объект
> / OCGs [7 0 R] >> / Страницы 2 0 R / Тип / Каталог >>
эндобдж
35 0 объект
> поток
2021-10-31T00: 37: 27-07: 002006-09-27T14: 33: 22-07: 002021-10-31T00: 37: 27-07: 00uuid: 30529b25-1dda-4b1a-9125-9428079aada0uuid: 63af701a- 1dd2-11b2-0a00-bf00e8138cffapplication / pdf
конечный поток
эндобдж
2 0 obj
>
эндобдж
28 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 39 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
21 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 39 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
14 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 39 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
5 0 obj
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 39 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
36 0 объект
> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >>
эндобдж
46 0 объект
[52 0 R 53 0 R 54 0 R 55 0 R 56 0 R]
эндобдж
47 0 объект
> поток
q
540.0594177 0 0 68.6011963 35.9702911 675.3988037 см
/ Im0 Do
Q
BT
/ T1_0 1 Тс
10 0 0 10 85,56995 576,99985 тм
(1982; 42: 3244-3247.) Tj
/ T1_1 1 Тс
-5.55699 0 Тд
(Рак Res \ 240) Tj
/ T1_0 1 Тс
0 1 ТД
(\ 240) Tj
0 1.00001 TD
(Пол Х. Ланге, Хосе Л. Миллан, Торни Стигбранд и др.) Tj
/ T1_2 1 Тс
0 1 ТД
(\ 240) Tj
/ T1_3 1 Тс
18 0 0 18 30 616,99997 тм
(Семинома) Tj
Т *
(Плацентарная щелочная фосфатаза как опухолевый маркер) Tj
ET
30 522 552 35 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 529.99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-7.55696 1 тд
(Обновленная версия) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 521,99994 тм
(\ 240) Tj
/ T1_0 1 Тс
22,62295 1 тд
() Tj
0 0 1 рг
-22.62295 0 Тд
(http://cancerres.aacrjournals.org/content/42/8/3244)Tj
0 г
0 1.00001 TD
(См. Самую последнюю версию этой статьи по адресу:) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 501,99997 тм
(\ 240) Tj
0 1 ТД
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 481,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 461,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
30 347 552 115 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 429,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Оповещения по электронной почте) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 295,4996 442 тм
(относится к этой статье или журналу.) Tj
0 0 1 рг
-15.44996 0 Тд
(Зарегистрируйтесь, чтобы получать бесплатные уведомления по электронной почте) Tj
ET
BT
0 г
/ T1_0 1 Тс
11 0 0 11 120.94202 396.99994 тм
(\ 240) Tj
/ T1_3 1 Тс
-6.38997 1 тд
(Подписки) Tj
0,556 1,00001 тд
(Отпечатки и) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 399,99994 тм
(\ 240) Tj
13.46496 1 тд
(.) Tj
0 0 1 рг
-6.85098 0 Тд
([email protected]) Tj
0 г
-6.61398 0 Тд
(Отделение) Tj
0 1.00001 TD
(Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \
t Публикации AACR) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 120,94 202 374,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Разрешения) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 346,99988 тм
(\ 240) Tj
0 1 ТД
(Сайт Rightlink.) Tj
0 1.00001 TD
(Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \
Центр раннса \ (CCC \)) Tj
22,62295 1 тд
(.) Tj
0 0 1 рг
-22.62295 0 Тд
(http://cancerres.aacrjournals.org/content/42/8/3244)Tj
0 г
0 1 ТД
(Чтобы запросить разрешение на повторное использование всей или части этой статьи, используйте это li \
nk) Tj
ET
BT
/ T1_0 1 Тс
9 0 0 9 283.\ q В этом исследовании мы разрабатываем модель ML для скрининга рака с использованием самой большой на сегодняшний день базы данных RWD лиц, прошедших скрининг на стандартные опухолевые маркеры (из больницы Chang Gung Memorial (CGMH), Linkou Branch), для точного выявления скрытых форм рака у бессимптомных людей. быстро и в готовом виде на базе RWE. Кроме того, мы проверяем надежность и обобщение алгоритма с обучением на машинном обучении посредством внешней проверки с использованием набора данных независимого тестирования из другого медицинского центра (CGMH, филиал в Гаосюн).Мы также создаем и проверяем алгоритм, основанный на ML, чтобы предположить ткань происхождения рака после того, как случай был идентифицирован как подозрительный для рака.0607. [PubMed] [CrossRef] [Google Scholar] 64. Си Э.Д., Егаппан С. Иммунофенотипирование лимфомы: новая эра в иммуногистохимии парафиновых срезов. Adv Anat Pathol. 2001. 8 (4): 218–239. DOI: 10.1097 / 00125480-200107000-00003. [PubMed] [CrossRef] [Google Scholar] 65. Маха А, Ган Г.Г., Ко CL. Фенотип и перестройки генов TCR-гамма в малазийской когорте случаев Т-клеточного лейкоза / лимфомы.Гематология. 2010. 15 (6): 382–390. DOI: 10,1179 / 102453310X1271
. [PubMed] [CrossRef] [Google Scholar] 66. Бослер Д.С., Дуглас-Никитин В.К., Харрис В.Н., Смит MD. Обнаружение Т-регуляторных клеток может сыграть важную роль в диагностике классической лимфомы Ходжкина. Цитометрия B Clin Cytom. 2008. 74 (4): 227–235. [PubMed] [Google Scholar] 67. Будман Л.И., Кассуф В., Стейнберг-младший. Биомаркеры для обнаружения и наблюдения за раком мочевого пузыря. Кан Урол Асс Дж. 2008; 2 (3): 212–221. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68.Kluger HM, Hoyt K, Bacchiocchi A, Mayer T., Kirsch J, Kluger Y, et al. Плазменные маркеры для выявления пациентов с метастатической меланомой. Clin Cancer Res. 2011. 17 (8): 2417–2425. DOI: 10.1158 / 1078-0432.CCR-10-2402. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Kim DH, Oh SJ, Oh CA, Choi MG, Noh JH, Sohn TS et al. Взаимосвязь между периоперационным CEA, CA 19-9 и CA 72-4 и рецидивом у пациентов с раком желудка после радикальной радикальной гастрэктомии. J Surg Oncol. 2011. doi: 10.1002 / jso.21919. [PubMed] 70. Чуа ТК, Мерретт Н.Д. Клинико-патологические факторы, связанные с HER2-положительным раком желудка, и его влияние на результаты выживания — систематический обзор. Int J Cancer. DOI: 10.1002 / ijc.26292. [PubMed] 71. Суреш К., Джаявардханан К.К., Васудеван Д.М. Дефектная экспрессия гена интерлейкина-2 R у пациентов с карциномой желудка. Иммунол Инвест. 1995. 24 (4): 565–571. DOI: 10.3109 / 0882013950 57. [PubMed] [CrossRef] [Google Scholar] 72. Васудеван Д.М., Виджаякумар Т. Вирусы рака полости рта человека. J Exp Clin Cancer Res.1998. 17 (1): 27–31. [PubMed] [Google Scholar] 73. Pillay M, Vasudevan DM, Rao CP, Vidya M. Экспрессия p53 при раке полости рта: наблюдения южноиндийского исследования. J Exp Clin Cancer Res. 2003. 22 (3): 447–451. [PubMed] [Google Scholar] 74. Виджаян К.К., Ремани П., Биви В.М., Анкатил Р., Виджаякумар Т., Раджендран Р. и др. Паттерны связывания лектинов с тканями при предраковых и злокачественных поражениях полости рта. J Exp Pathol. 1987. 3 (3): 295–304. [PubMed] [Google Scholar] 75. Равиндран А., Виджаякумар Т., Судха Л., Ремани П., Васудеван Д.М., Стивен Дж. И др.Хромосомные аномалии при плоскоклеточном раке полости рта человека. Новообразования. 1990; 37 (2): 191–197. [PubMed] [Google Scholar] 76. Перкинс Г.Л., Слейтер Э.Д., Сандерс Г.К., Причард Дж. Онкомаркеры сыворотки. Я семейный врач. 2003. 68: 1075–1082. [PubMed] [Google Scholar] (PDF) Результаты скринингового исследования опухолевых маркеров (REA, CA19-9, PSA, CA15-3) среди населения Южной Якутии
Клинически значимое использование маркеров опухоли крови в Онкология
1. Введение
2. Роль ТМ в современной клинической практике
2.1. Дифференциальный диагноз
2.2. Стадия / прогноз
2.3. Мониторинг лечения
TM Тип злокачественного новообразования Дифференциальный диагноз Прогноз / стадия Мониторинг / наблюдение за лечением 96 Tgyroid x Кальцитонин Щитовидная железа (мозговая) x x β 2M (бета-2-микроглобулин) Множественная миелома Множественная миелома, CLL CEA CRC, панкреатический, желудочный / гастроэзофагеальный AC, пищеводный AC, NSCLC AC, грудь, эндометрий, щитовидная железа, ц-клетка x CA 125 яичник , карциноматоз сальника x x HE4 Яичники, НМРЛ, эндометрий x x Бета-ХГЧ GCT, хориокарцинома, уротелиальный x x x HCC (альфа-фето белок) (альфа-фето) , GCT x x x CA 15-3 Грудь, NSCLC AC x x CA 19-9 Поджелудочная железа, желчные пути, верхний отдел желудочно-кишечного тракта x x CA 72-4 Верхний отдел желудочно-кишечного тракта, слизистый яичник x CYFRA 21-1 НМРЛ, пищевод , мочевой пузырь, HNSCC, мочевой пузырь x x S100 Злокачественная меланома x NSE SCLC, NET, нейробластома 90 054 x x ProGRP SCLC, костно-мозговой канал щитовидной железы x x x Хромогранин A SCLC, NET x x ПСА / свободный ПСА Простата x x x SCCA SCC шейки матки, NSCLC SCC, пищеводный SCC, HNSCC x иммуноглобулин Множественная миелома x LC (легкие цепи) Множественная миелома x x Her-2-neu Рак груди x TK Множественная миелома, CLL x x x AC, аденокарцинома; SCC, плоскоклеточный рак; ХЛЛ, хронический лимфолейкоз; HNSCC, плоскоклеточный рак головы и шеи; ГКТ, опухоль зародышевых клеток; ЖКТ, желудочно-кишечный тракт; NET, нейроэндокринные опухоли; ТК, тимидинкиназа; ТГ, тиреоглобулин.
2.4. Наблюдение и мониторинг рецидивов
3. Будущие направления
3.1. Повышение эффективности диагностики
3.2. Создание более надежных данных и обучение
(a) Схематическое проспективное исследование Исходный уровень Лечение Наблюдение Прогрессирование смертности OS (PFS) / рецидив (RFS) Визуализация T0 T2 T3 T4 T5 TM T0 T296 T396 T396 T396 T5 (б) Использование ТМ в разных клинических конечных точках Прогноз Использование клинических данных Корреляция Уровни T0 с PFS / RFS и / или OS Возможный результат TM может использоваться в будущих исследованиях в качестве прогностического фактора для стратификации риска Пример клинического значения Для «пациентов с хорошим риском»: считайте меньше интенсивное лечение или более короткая продолжительность У «пациентов с низким риском»: рассмотреть вопрос о поддерживающем лечении после индукционной химиотерапии Клиническая конечная точка Ответ Использование клинических данных Соотнесите изменение уровней T0 с T1 и T2 с ответом на RECIST при визуализации на T2 Возможный результат Раннее изменение TM на T1 прогнозирует прогрессирование при первом визуализации на T2 Раннее изменение TM на T2 прогнозирует прогрессирование на 2-е изображение в Т3 (т.е., у пациентов со стабильным заболеванием на 1-м снимке в T2) Пример клинического значения Рандомизированное испытание продолжения той же химиотерапии в сравнении с ранним переходом на другой режим на основе ранней стратификации TM; первичным исходом может быть ЧОО, PFS / RFS или OS. лучший ответ по RECIST при визуализации в T3 Возможный результат Снижение панели TM коррелирует с ответом на визуализацию Пример клинического значения Меньше интервальных сканирований для пациентов со снижением маркеров Клиническая конечная точка Выявление раннего рецидива Использование клинических данных Коррелированное изменение нижнего предела TM в T3 с последующим лечением в T4 и T5 Уровни Возможный исход Увеличение TM в T4 по сравнению с T3 будет предсказывать прогрессирование t T5 Пример клинического значения Индивидуальная визуализация для наблюдения на основе уровней TM T0 до T5, различные моменты времени для забора крови и / или визуализации; ВБП — выживаемость без прогрессирования заболевания; RFS — безрецидивная выживаемость; ОС, общая выживаемость. 4. Заключение
Конкурирующие интересы
Онкологический маркер — обзор
Прогностические факторы при диагнозе
Помимо злокачественных новообразований: роль углеводного антигена 125 в сердечной недостаточности | Исследование биомаркеров
Раков | Бесплатный полнотекстовый | Улучшение контрольных тестов здоровья на множественные опухолевые биомаркеры с помощью алгоритмов машинного обучения
1. Введение
Раннее выявление рака является одним из основных ключей к повышению выживаемости пациентов за счет возможности раннего лечения, включая хирургическое удаление локализованной солидной опухоли, до метастазирование, когда выживаемость резко снижается до менее 50% даже при использовании самых современных системных методов лечения [1]. Многие виды рака могут развиться в течение нескольких лет, чтобы превратиться в метастазы из исходных очагов [2], что дает возможность обнаруживать рак на этой ранней стадии.В настоящее время для скрининга рака используется несколько инструментов [3], например, компьютерная томография грудной клетки (КТ) с низкой дозой облучения при раке легких, маммография при раке груди, мазок Папаниколау при раке шейки матки и скрытая кровь в стуле при колоректальном раке. Производительность этих инструментов варьируется. Отчасти это связано с их зависимостью от оператора [4,5], ограниченной доступностью и сложностью использования. Например, явные различия в доступности низкодозных приборов КТ грудной клетки ограничивают его широкое применение [6], в то время как сбор образцов лицами, не имеющими медицинского образования, ставит под угрозу точность анализа скрытой крови кала [7].Кроме того, эти инструменты обычно обнаруживают только один тип рака, а это означает, что людям может потребоваться посетить несколько медицинских служб, чтобы пройти различные скрининговые тесты. Эти недостатки приводят к низкой приверженности скринингу рака с помощью этих инструментов [8]. Онкомаркеры сывороточного белка, такие как CEA, AFP, CA-125, CA-19.9, PSA и т. Д., Десятилетиями используются для помощи в диагностике и лечении. различных раковых заболеваний. За исключением ПСА, большинство международных руководств рекомендуют рутинное использование этих маркеров для мониторинга рецидива рака или ответа на терапию, но не для скрининга или раннего выявления [3].Тем не менее, в Азии эти опухолевые маркеры обычно измеряются в рамках ежегодных медицинских осмотров десятков миллионов людей каждый год и успешно используются для раннего выявления рака [3,9]. Судя по интервью с медицинскими директорами десятков центров медицинского осмотра и медицинского осмотра в Японии, Тайване, Корее, Китае и России, популярность этого подхода к тестированию, похоже, растет. миллиарды долларов были вложены в открытие и проверку альтернатив сывороточным белковым опухолевым маркерам.Альтернативные мишени включают циркулирующую опухолевую ДНК, микроРНК и циркулирующие опухолевые клетки [10,11,12]; Тем не менее, на сегодняшний день ни один из этих подходов не получил широкого клинического применения из-за стоимости или отсутствия проспективной или реальной валидации. Чтобы точно оценить эффективность тестов в реальной популяции, не имеющей симптомов, абсолютно необходимо использовать доказательства из реального мира (RWE), полученные из реальных данных (RWD), для подтверждения результатов исследований с контролем случая и обобщения результатов. назад к ситуациям реального мира [13,14,15].Поскольку иммунологические измерения онкомаркеров проводились в течение ряда лет на большой популяции людей в преддиагностическом режиме, теперь существует RWD для этих биомаркеров. Хотя отдельные опухолевые маркеры могут не работать достаточно хорошо, использование панели маркеров, состоящей из нескольких опухолевых маркеров, может значительно улучшить эффективность скрининговых тестов на рак [3,9,10]. Таким образом, измерение маркеров опухолей в настоящее время обычно проводится в Восточной Азии и привело к раннему выявлению рака в бессимптомной популяции.Машинное обучение с учителем (ML) — хороший аналитический метод для решения проблем классификации путем выявления неявных шаблонов данных из сложных данных. Метод машинного обучения превосходит некоторые традиционные статистические методы (например, одномерный / многомерный анализ) из-за его превосходной способности обрабатывать сложные взаимодействия между большим количеством предикторов и хорошей производительности в задачах нелинейной классификации. ML успешно применяется в нескольких клинических областях и превосходит традиционные статистические методы [16,17,18]. 4. Обсуждение
Использование опухолевых биомаркеров для скрининга / раннего выявления рака в настоящее время является обычной практикой в Восточной Азии, поскольку десятки миллионов людей проходят эти скрининговые тесты в рамках своих ежегодных медицинских осмотров. Используя самую большую базу данных RWD и внешнюю валидацию, мы разработали и проверили программное обеспечение на основе ML, которое существенно улучшает тестирование биомаркеров опухоли (таблица S2) за счет включения значений шести или более биомаркеров с возрастом и полом для определения уровня риска рака.Кроме того, была разработана вторичная модель для прогнозирования трех наиболее вероятных пораженных систем органов у лиц, отнесенных к группе риска. Алгоритмы ML надежны и помогают обнаруживать рак на самых ранних стадиях у бессимптомных людей. Иммуноанализы на опухолевые маркеры были разработаны в течение последних нескольких десятилетий, и большинство из них используются для мониторинга во время последующего наблюдения после терапии, но не для предварительной диагностики. режим для скрининга бессимптомных лиц. Использование единичных опухолевых биомаркеров для скрининга рака было менее надежным; и даже PSA, единственный опухолевый маркер, широко используемый для скрининга рака, остается спорным [25].SCC как самостоятельный онкомаркер для скрининга рака подвергался сомнению клиническими врачами, в том числе в нашем учреждении, CGMH, Тайвань [3]. Cohen et al. оценили ряд онкомаркеров для скрининга рака в исследовании случай-контроль и обнаружили, что некоторые маркеры (включая AFP, CEA, CA19-9, CYFRA21-1, CA125 и CA15-3) можно использовать вместе в качестве панели, для повышения производительности [10]. Несколько исследований показали многообещающие результаты для скрининга рака (рак легкого [26,27]; несколько типов рака [3,10]) путем комбинирования алгоритмов ML и панелей маркеров опухолей, поскольку алгоритмы ML превосходят врачей-клиницистов в интерпретации аналитических результатов [3] .Клиницисты обычно интерпретируют лабораторные значения с помощью «метода единого порога», который основан на заранее определенных контрольных диапазонах для каждого отдельного маркера. Однако контрольные диапазоны устанавливаются исключительно на основе распределения значений в пределах нормальной популяции, а не для скрининга рака, они не корректируются в связи с другими уровнями маркеров и не учитывают возраст, пол или какие-либо другие характеристики пациента. Напротив, алгоритмы машинного обучения могут изучать и идентифицировать конкретный образец онкомаркеров и клинических факторов и их взаимозависимость для различения случаев рака от случаев, не связанных с раком.Недавние отчеты показали, что алгоритмы машинного обучения могут повысить точность диагностики при применении нескольких маркеров [28]. Однако существуют препятствия, мешающие широкому применению алгоритмов машинного обучения для скрининга. Барьер номер один заключается в том, что субъекты, используемые в клинических исследованиях, часто не имитируют население реального мира. Многие алгоритмы машинного обучения разрабатываются с помощью исследований случай-контроль с использованием четко определенных случаев для изучения плоскости принятия решений, способной классифицировать различные классы (например, рак и не рак).Биомаркеры раковых заболеваний, используемые в этих исследованиях случай-контроль, анализируются после, но не до постановки диагноза рака. Следовательно, биомаркеры более репрезентативны для пациентов с симптомами, у которых опухоли уже прогрессируют, а профили более указывают на запущенный рак у пациентов с симптомами, но не коррелируют с бессимптомной популяцией в реальном мире [10,26,27]. Следовательно, модели ML, обученные с использованием таких данных, должны рассматриваться как модели для диагностики рака, но не для скрининга, и дадут скомпрометированные результаты при применении к реальной бессимптомной предварительной диагностике.Напротив, мы использовали самый большой набор данных RWD, доступный в настоящее время, собранный за 14 лет как для обучения, так и для внешней проверки моделей ML для интерпретации панелей маркеров опухолей. Эти алгоритмы продемонстрировали превосходные рабочие характеристики (таблица 2, рисунок 1 и рисунок 2), а надежность этих моделей была подтверждена внешней проверкой. Кроме того, все субъекты в этом исследовании были людьми, проходящими ежегодный медицинский осмотр без предварительных признаков рака и, таким образом, представляли реальную бессимптомную популяцию [3,9].Благодаря использованию RWD, разработанная здесь модель машинного обучения готова к немедленному применению в реальных условиях. Как показано на рисунке 2, мы приводим три наиболее возможных (более одной) системы органов для дальнейшего изучения врачами или медперсоналом. возможное происхождение рака. В зависимости от дизайна в отчете субъект будет отмечен тремя наиболее возможными системами органов, например: «Грудь», «Ухо, нос и горло» и «Желудочно-кишечный тракт». Опытный врач дополнительно проверит конкретную историю воздействия человека (например,ж., курение, мелкие твердые частицы (PM 2,5 )) и проведите компьютерную томографию грудной клетки с низкой дозой, поскольку описанная картина может подразумевать клиническую картину злокачественных изменений глотки / гортани и легких, которые можно классифицировать по системам органов. ярлыки «Ухо, Нос и Горло» и «Сундук» соответственно. Что касается аспекта анализа и отчетности, мы использовали все случаи рака для перекрестной проверки модели KNN и оценки того, с помощью какого N мы могли бы помочь врачам точно определить тканевое происхождение рака.Причина для сообщения только о трех наиболее возможных системах органов была основана на (1) достижении наилучшего баланса между чувствительностью и специфичностью, который мог быть достигнут, и (2) три основных возможных тканевого происхождения были бы разумными и применимыми для дальнейшего клинического исследования. в большинстве клинических случаев. Еще одним препятствием для применения алгоритмов машинного обучения в клинической практике является отсутствие действенных рекомендаций [28]. Чтобы создать модель ML, пригодную для использования в клинических условиях, мы разработали двухуровневую модель для скрининга рака.Модель ML первого уровня определяет относительный риск развития рака у людей в ближайшем будущем, а модель ML второго уровня предсказывает три наиболее вероятных пораженных системы органов. В первом слое указаны четыре уровня риска. PPV для различных уровней риска вместе с их корреляцией со стадией рака на момент постановки диагноза (Рисунок 3) и временем до постановки диагноза (Рисунок 4) предполагают различные процедуры последующего наблюдения (Рисунок 5). TTD является важным фактором при определении последующего наблюдения за пациентом после скрининга.Короткий TTD (2–4 месяца) для лиц из группы высокого риска предполагает, что за этими пациентами следует наблюдать в краткосрочной перспективе. Для людей с умеренным и высоким риском, в зависимости от TTD, следующие шаги, вероятно, должны включать направление к специалисту для дальнейшего обследования, в идеале в течение 6 и 2 месяцев соответственно. Для подтверждения могут использоваться расширенные диагностические инструменты; например, КТ грудной клетки с низкой дозой может использоваться, когда «грудная клетка» прогнозируется как наиболее вероятная система органов. Действия, предпринимаемые после получения положительного сигнала о риске, должны быть на усмотрение врачей и в значительной степени зависеть от стандартных практик здравоохранения в разных странах.На Тайване колоноскопия будет использоваться в качестве диагностического инструмента для наблюдения за людьми из группы риска, поскольку она доступна и доступна почти в каждой больнице. В то же время, поскольку во многих случаях умеренного риска может быть предраковое состояние, которое является динамической стадией между развитием местной опухоли и ее устранением иммунной системой, а период полураспада большинства опухолевых маркеров меньше несколько дней [29], мы рекомендуем, чтобы эти люди прошли повторный скрининг на онкомаркеры через один месяц, чтобы проверить уровень риска.Будущее повторное тестирование с 6–12-месячными интервалами для отслеживания изменений в общей оценке и индивидуальных уровнях биомаркеров было бы разумным. Мы попробовали несколько алгоритмов машинного обучения и обнаружили, что простые / линейные алгоритмы хорошо справляются с задачами классификации в области медицины. Мы также обнаружили то же явление в других классификационных исследованиях [16,17,18,30,31,32,33,34]. Мы не до конца понимаем причину этого факта, но предполагаем, что феномен «простых / линейных алгоритмов хорошо работает» в исследовании может быть отнесен на счет репрезентативности характеристик (т.е., опухолевые маркеры белков сыворотки). Все опухолевые маркеры белков сыворотки, использованные в исследовании, были разработаны и валидированы для конкретных типов рака (например, CEA для колоректального рака; CA19-9 для рака поджелудочной железы). В истории разработки маркеров слабые предсказательные маркеры были отфильтрованы, и были выбраны только сильные предсказательные маркеры. На этом основании корреляция между опухолевыми маркерами белков сыворотки не будет слишком сложной. Таким образом, простые линейные алгоритмы могут хорошо работать с типом набора данных.Насколько нам известно, исследования [3,9], опубликованные ранее нашей командой, являются одними из немногих исследований, посвященных опухолевым маркерам при скрининге рака. Редкость таких исследований, вероятно, объясняется тем фактом, что долгосрочное наблюдение за большой популяцией, проводящей скрининг бессимптомных форм рака, является редким и трудным. Таким образом, мы сравнили текущие результаты с нашими предыдущими публикациями. В 2015 году мы проанализировали данные о опухолевых маркерах за 12 лет и показали, что панель опухолевых маркеров может использоваться для скрининга рака.В 2016 году мы продемонстрировали, что использование алгоритмов машинного обучения может улучшить полезность панели маркеров опухолей для скрининга рака в условиях внутренней проверки [3]. Исходя из этого, в текущем исследовании мы дополнительно демонстрируем воспроизводимость алгоритмов машинного обучения путем тестирования посредством внешней проверки. В настоящее время в некоторых разрабатываемых коммерческих продуктах, включая CancerSEEK [10] и Grail [12], используется технология секвенирования нуклеиновых кислот для обнаружения генов, связанных с раком, в крови для скрининга нескольких видов рака.Оба этих продукта заявляют о способности обнаруживать несколько типов рака и определять ткань их происхождения. Цели этих исследований очень похожи на наши, и результаты тестов многообещающие; однако тесты были подтверждены только в исследованиях «случай-контроль», в которых случаи рака не репрезентативны для бессимптомных случаев, обнаруженных в реальной популяции. Таким образом, результаты этих исследований было бы неуместно сравнивать с результатами текущего исследования. Скорость изменения онкомаркера или оценки риска между серийными тестами может быть полезной информацией для определения связанного риска и дальнейшего наблюдения.В то же время существует хорошо документированная информация о влиянии иммуноанализов на онкомаркеры, которую следует учитывать при интерпретации некоторых результатов, особенно для умеренного уровня риска. Например, реактивность гетерофильных антител может вызвать псевдоподъем нескольких опухолевых маркеров [35], в то время как плохой контроль сахара может привести к псевдо-повышению CA19-9 [36]. На иммуноанализы на основе биотина могут влиять люди, принимающие высокие дозы пищевых добавок, содержащих биотин [37].Сбор хорошо задокументированного анамнеза пациента и применение этой информации может уменьшить эти помехи. С учетом того факта, что ежегодно теряется 8,7 миллиона лет жизни из-за ранних смертей от рака, что приводит к потере доходов в размере 94,4 миллиарда долларов [38], инструмент скрининга рака для количество, необходимое для скрининга (NNS) менее 200 [3], послужит подходящим и доступным инструментом для скрининга рака и предотвращения преждевременной смерти от рака. Мы хотели бы признать несколько ограничений в этом исследовании. Во-первых, мы использовали кейсы только из двух третичных медицинских центров на Тайване для обучения и внешней проверки моделей машинного обучения соответственно.Было продемонстрировано обобщение моделей машинного обучения, однако возможность обобщения моделей на другие регионы или страны мира еще предстоит оценить. Мы предлагаем построить клинически полезную модель машинного обучения с использованием обобщаемого подхода и данных, релевантных для данной местности, с учетом вариабельности, существующей в популяциях или аналитических системах [39]. Во-вторых, мы не использовали алгоритм глубокого обучения (DL) для разработки наших моделей скрининга рака. В этом исследовании использовались только шесть признаков (то есть онкомаркеры) для мужчин и семь признаков для женщин, плюс один клинический фактор возраста.Мы использовали классические алгоритмы машинного обучения, чтобы построить надежные модели и избежать переобучения. В-третьих, хотя мы использовали RWD для обучения и проверки алгоритмов, проспективное исследование для оценки предотвращения преждевременной смерти от рака и экономии средств, которые можно отнести к инструменту скрининга рака, еще не проводилось.


 Влияние этих процедур на уровень ПСА максимально выражено на следующий день после их проведения, причём наиболее значительно — у больных с гипертрофией простаты. Исследование ПСА в таких случаях рекомендуется проводить не ранее чем через 7 дней после проведения перечисленных процедур. Уровень ПСА повышается при доброкачественных и злокачественных заболеваниях предстательной железы. При этом при карциноме простаты больше увеличивается доля связанной фракции, поэтому соотношение между свободным и общим ПСА уменьшается.
Влияние этих процедур на уровень ПСА максимально выражено на следующий день после их проведения, причём наиболее значительно — у больных с гипертрофией простаты. Исследование ПСА в таких случаях рекомендуется проводить не ранее чем через 7 дней после проведения перечисленных процедур. Уровень ПСА повышается при доброкачественных и злокачественных заболеваниях предстательной железы. При этом при карциноме простаты больше увеличивается доля связанной фракции, поэтому соотношение между свободным и общим ПСА уменьшается.
 Норма — до 30 МЕ/мл, опасные значения — 30-40 МЕ/мл, выше 40 МЕ/мл — развивается раковое новообразование.
Норма — до 30 МЕ/мл, опасные значения — 30-40 МЕ/мл, выше 40 МЕ/мл — развивается раковое новообразование.
 При опухолевых процессах концентрация РЭА в крови значительно повышается. Рост концентрации этого маркера происходит при колоректальном раке, раке лёгкого, молочной или поджелудочной желез, метастазах злокачественных опухолей в печень, костную ткань, опухолях простаты и яичников. При этом повышение происходит и при доброкачественных заболеваниях кишечника, печени и легких, особенно у заядлых курильщиков.
При опухолевых процессах концентрация РЭА в крови значительно повышается. Рост концентрации этого маркера происходит при колоректальном раке, раке лёгкого, молочной или поджелудочной желез, метастазах злокачественных опухолей в печень, костную ткань, опухолях простаты и яичников. При этом повышение происходит и при доброкачественных заболеваниях кишечника, печени и легких, особенно у заядлых курильщиков.