Некоторые особенности строения толстой кишки
Некоторые особенности строения толстой кишки
Л.Г. Пестерев, к. м. н.,
О.Ю. Смирнова, к. м. н.
Толстая кишка состоит из слепой кишки, червеобразного отростка, ободочной кишки (восходящей, поперечной, нисходящей), сигмовидной и прямой, которая заканчивается анальным отверстием. Длина толстой кишки у взрослого человека около 1,5 метров. (Рис. 1).
Рис. 1Непереваренные и невсосавшиеся остатки химуса в жидком виде попадают из тонкой кишки в слепую. В ободочной кишке из химуса происходит всасывание воды (около 7 литров жидкости в сутки, из которых около 1 литра слюны, 2 литра желудочного сока, 0,5 литра сока поджелудочной железы, 1 литра желчи, 1 литра кишечного сока и 1–2 литров выпиваемой воды) и химических элементов, что приводит к формированию каловых масс. Механическая функция толстой кишки включает проталкивание её содержимого в каудальном направлении и удаления из организма каловых масс.
Слепая кишка, начальный, небольшой отрезок толстой кишки, расположенный ниже впадения в неё подвздошной кишки. Длина её примерно равна ширине (6–8 см). Отверстие, ведущее из тонкой кишки в толстую, снабжено заслонкой, valvula ileocaecalis (баугиниева). Имея в основе циркулярную мускулатуру, заслонка похожа на воронку, узким концом направленную в просвет слепой кишки и ограниченную верхней и нижней складками («губами»). Встречается и другая форма — в виде сосочка (Рис. 2).
Рис. 2Стенка толстой кишки на всём протяжении образована слизистой оболочкой, подслизистой основой, мышечной и серозными оболочками.
Слизистая оболочка и подслизистая основа образуют полулунные складки. Ворсинки в толстой кишке отсутствуют. Эпителий слизистой — однослойный призматический.
Подслизистая основа — волокнистая соединительная ткань с многочисленными эластическими волокнами — содержит большое количество жировых клеток. В ней располагаются лимфатические узелки, элементы нервного, венозного и лимфатического сплетений.
В ней располагаются лимфатические узелки, элементы нервного, венозного и лимфатического сплетений.
Мышечная оболочка образована двумя слоями гладкой мышечной ткани: внутренним (сплошным) — циркулярным и наружным (не сплошным) — продольным.
Начиная со слепой кишки, продольно располагающиеся миоциты мышечной оболочки соединяются в три уплощенных тяжа, называемых лентами толстой кишки. Их длина меньше длины толстой кишки, вследствие чего кишка образует множественные мешковидные выпячивания — гаустры. Три мышечные ленты тянутся от слепой кишки до прямой, где они расходятся и частично сливаются, образуя мышечную оболочку прямой кишки. Спереди и сзади тяжи тоже несколько короче, поэтому на данном участке также имеются вздутия, и стенка прямой кишки выступает внутрь, образуя два поперечных тяжа, справа и слева, которые называются поперечными складками прямой кишки. Благодаря такому строению снижается нагрузка на стенку прямой кишки, создаваемая её содержимым, и облегчается работа анального сфинктера.
Наружная, серозная оболочка покрывает толстую кишку неравномерно. Слепая кишка считается покрытой ею со всех сторон (интраперитонеально), но брыжейки не имеет. Восходящая и нисходящая ободочные кишки расположены мезоперитонеально, что обеспечивает относительное постоянство их топографии. Поперечная ободочная, сигмовидная и верхний отдел прямой кишки расположены интраперитонеально и имеют брыжейки. Брыжейка сигмовидной кишки, равно как и сама кишка, довольно вариабельны (Рис.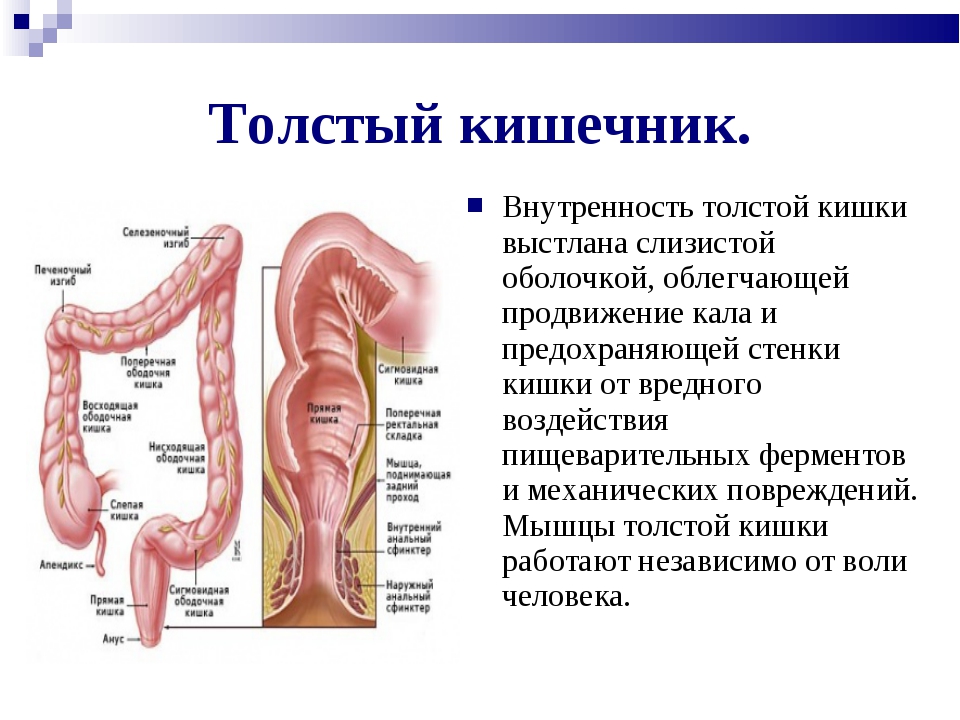 3).
3).
Над ампулой прямой кишки слизистая оболочка и подслизистая основа, а также циркулярный слой мышечной оболочки образуют три поперечные складки. Ниже этих складок, в анальном канале слизистая оболочка образует 5–10 продольных складок — ректальные колонки, которые внизу соединяются поперечными складками. Между колонками видны углубления — ректальные синусы. В анальной части различают три зоны: столбчатую, промежуточную и кожную (Рис. 4).
Рис. 4Эпителий слизистой прямой кишки в верхнем отделе (до анального канала) — однослойный призматический, в столбчатой зоне анального канала — многослойный плоский неороговевающий, в кожной — многослойный плоский ороговевающий. Переход от многослойного кубического эпителия к многослойному плоскому совершается резко в виде зигзагообразной аноректальной линии (зубчатая, гребешковая).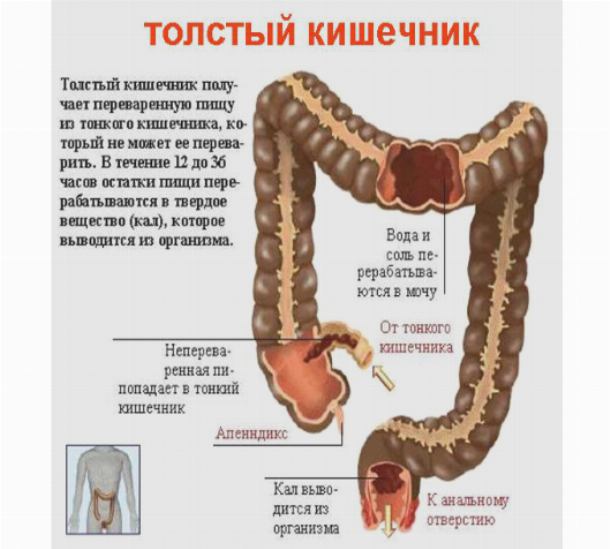
В подслизистой основе располагаются сосудистые и нервные сплетения, тонкостенные геморроидальные вены.
Мышечная оболочка состоит из двух слоёв: внутреннего циркулярного и продольного наружного.
Циркулярный слой на разных уровнях прямой кишки образует два утолщения, которые выделяются как отдельные анатомические сфинктеры. Внутренний анальный сфинктер — гладкомышечный. Наружный образован поперечно-полосатой мышечной тканью. Наружный продольный слой мышечной оболочки прямой кишки, в отличие от других отделов толстой кишки, сплошной.
Серозная оболочка покрывает прямую кишку лишь в верхней её части; в нижних отделах прямая кишка имеет соединительнотканную оболочку — фасцию (Рис. 5).
Рис. 5Строение пищеварительной системы
Давайте кратко рассмотри основные моменты строения пищеварительной системы.
Пища попадая в рот измельчается и смешивается со слюной, затем она продвигается через пищевод в желудок, там она смешивается с желудочным соком. Оттуда пищевая кашица направляется в двенадцатиперстную кишку, где подвергается дальнейшей обработке желчью, которую продуцирует печень, и соком поджелудочной железы.
Желчь и панкреатический сок являются очень важными составляющими в обработке пищи и подготовке её для последующего всасывания в тонком кишечнике, куда пищевая кашица поступает дальше. Именно там происходит основное всасывание питательных элементов и их поступление в кровоток. Содержимое тонкой кишки, как уже говорилось выше, напоминает кашицу зеленовато-коричневого цвета. Тонкая кишка подразделяется на два отдела – тощую и подвздошную кишку. Последняя переходит в толстый кишечник. Стому, которую сформировали на уровне подвздошной кишки, называют илеостомой.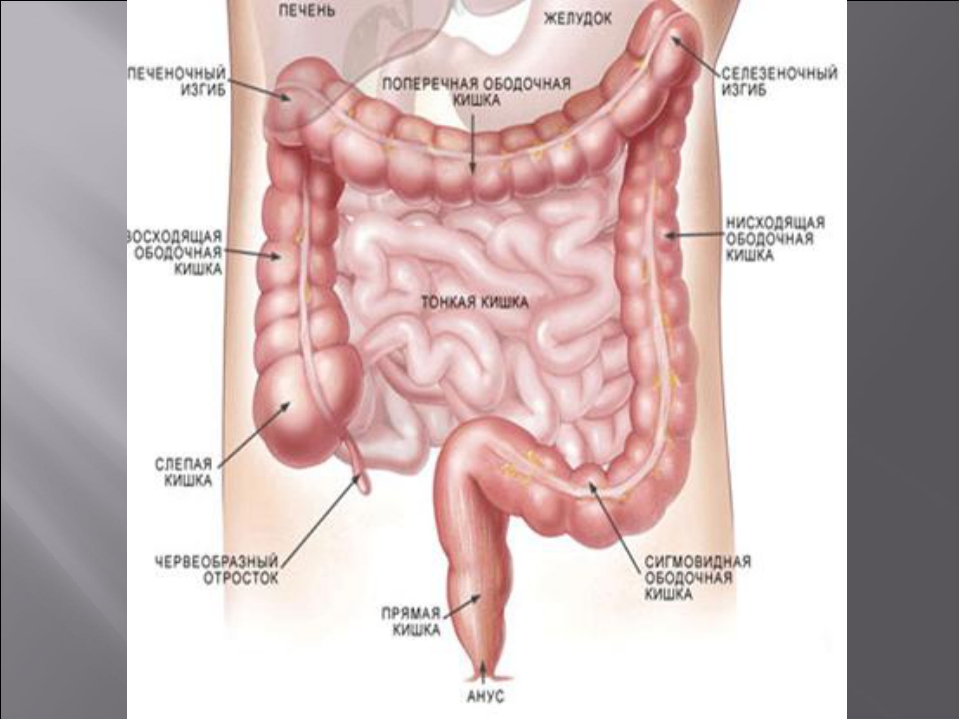
Толстая кишка состоит из ободочной и прямой кишок. Ободочная кишка в своем составе имеет слепую кишку с червеобразным отростком, восходящую, поперечную, нисходящую и ободочную часть и сигмовидную кишку.
Название стомы дается в зависимости латинского названия отдела ободочной кишки, в пределах которого она сформирована:
· Слепая кишка – цекостома
· Восходящая часть — асцендостома
· Поперечная часть – трансверзостома
· Нисходящая часть – десцендостома
· Сигмовидная кишка — сигмостома
Все виды стом, сформированные в пределах толстой кишки можно называть одним термином – колостома.
В толстом кишечнике происходит заключительное всасывание воды, углеводов, минеральных солей. Здесь по мере продвижения к конечному отделу толстой кишки происходит уплотнение и формирование каловых масс.
Таким образом, при отсутствии нарушения пищеварения отделяемое стомы в начальных отделах толстого кишечника будет кашицеобразным, а ближе к сигмовидной кишке это будут уже оформленные каловые массы.
подробное описание, строение, функциональные особенности, расположение в теле
Толстая кишка обладает собственными отличительными чертами, которые отделяют ее от тонкой кишки. Начать следует с местоположения, а затем идет форма и само строение. Главной отличительной особенностью можно считать диаметр. По сравнению с тонкой кишкой он несколько увеличен и равняется 4-5 сантиметрам. Толстая кишка обладает особым расположением мышечных слоев. У нее есть мышечные ленты, различные вздутия и сальниковые отростки.
У внешнего продольного мышечного слоя кишки есть специальные волокна. Они в отличие от тонкой кишки распределяются не только по всей поверхности стенки, но и могут прослеживаться в продольных мышечных лентах. Протяженность в длину подобных лент в обычной жизни может достигать 5-8 сантиметров.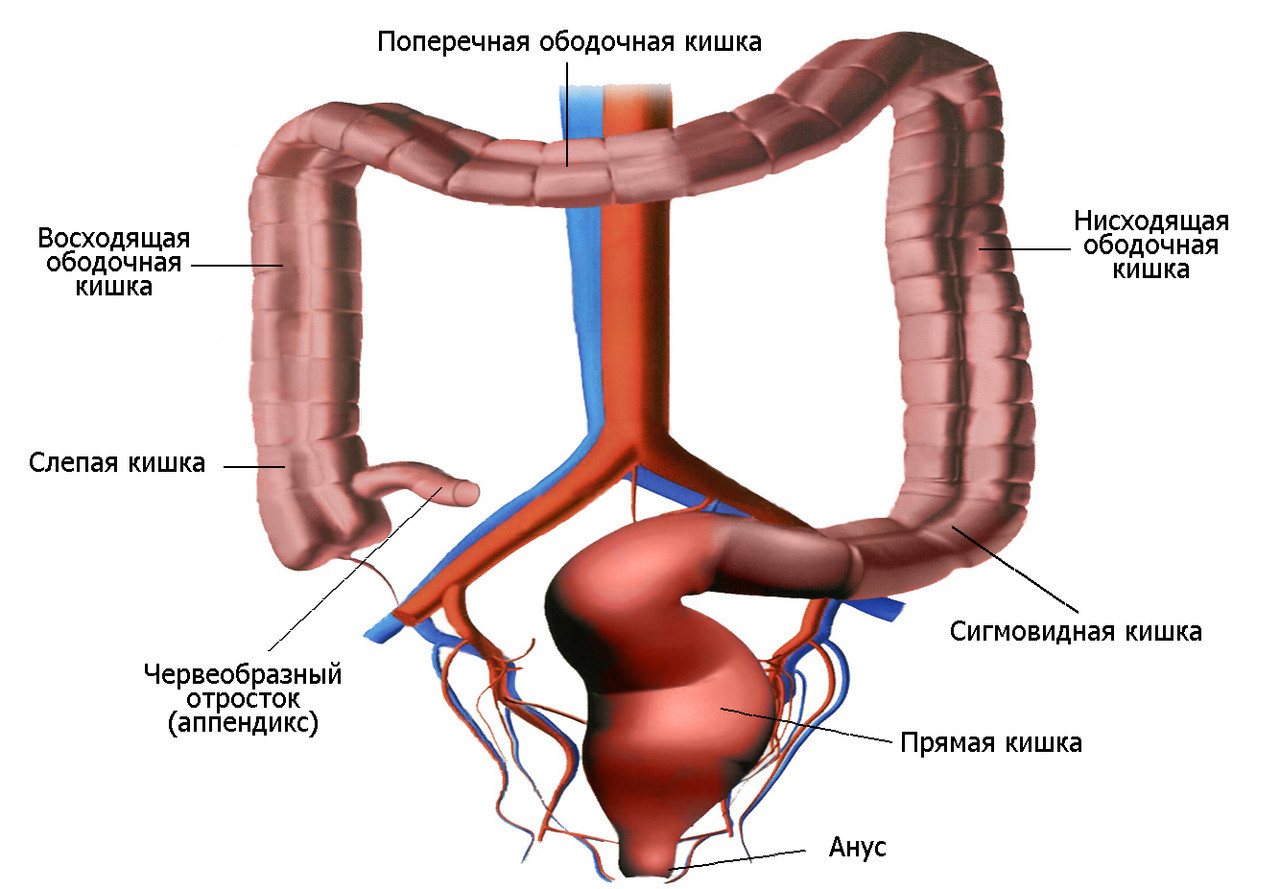 Они берут свое начало у основания червеобразного отростка, а затем проходят вдоль практически всей толстой кишки. Исключение составляют дистальные отделы сигмовидной кишки и еще прямой кишки. Поперечный разрез толстой кишки явно показывает, что ленты размещены по некоторым данным через каждые 120 градусов в отношении друг друга.
Они берут свое начало у основания червеобразного отростка, а затем проходят вдоль практически всей толстой кишки. Исключение составляют дистальные отделы сигмовидной кишки и еще прямой кишки. Поперечный разрез толстой кишки явно показывает, что ленты размещены по некоторым данным через каждые 120 градусов в отношении друг друга.
Каждая лента толстой кишки в зависимости от собственного местоположения или размещения по отношению к другим органам обладает своим названием. Существуют свободная и брыжеечная и сальниковая ленты. Все три разновидности ленты в ширину обычно достигают одного сантиметра. Поблизости от слепой кишки и свободная, и брыжеечная, и сальниковая лента приближаются друг другу, а у основания червеобразного отростка сходятся в одну, тем самым охватывая его сплошным мышечным слоем. Такое строение позволяет найти червеобразный отросток в течение убирания аппендицита. Для этого требуется обнаружить специальное место у слепой кишке, в котором три названных выше ленты заключают между собой союз. Данный принцип применяется в тот момент, когда ленты начинают расширяться к самому началу прямой кишки, тем самым образуя продольный мышечный слой.
Данный принцип применяется в тот момент, когда ленты начинают расширяться к самому началу прямой кишки, тем самым образуя продольный мышечный слой.
Брыжеечная лента толстой кишки была названа в соответствии с местом, к которому она прикрепляется у толстой кишки. То есть к поперечно ободочной, еще сигмовидной оболочной, их брыжеек, и еще к задней брюшной стенке.
Сальниковая лента размещается во фронтальной части поперечной ободочной кишки. Большой сальник прикрепляется к одноименной ленте, лежащей на поперечно ободочной кишке. Сальниковые отростки же прилегают к остальным частям толстой кишки. Они представляют собой пальцеобразные, пропитанные жиром, длина которых в обычном организме равняются приблизительно 3-5 сантиметрам. Все они покрываются висцеральной брюшиной. Частота, с которой распределяются сальниковые отростки, в дистальном направлении постоянно возрастает. Специалисты их уже даже прозвали жировыми депо организма. А вот второе название – это амортизаторы, способные демпфировать резкие деформации.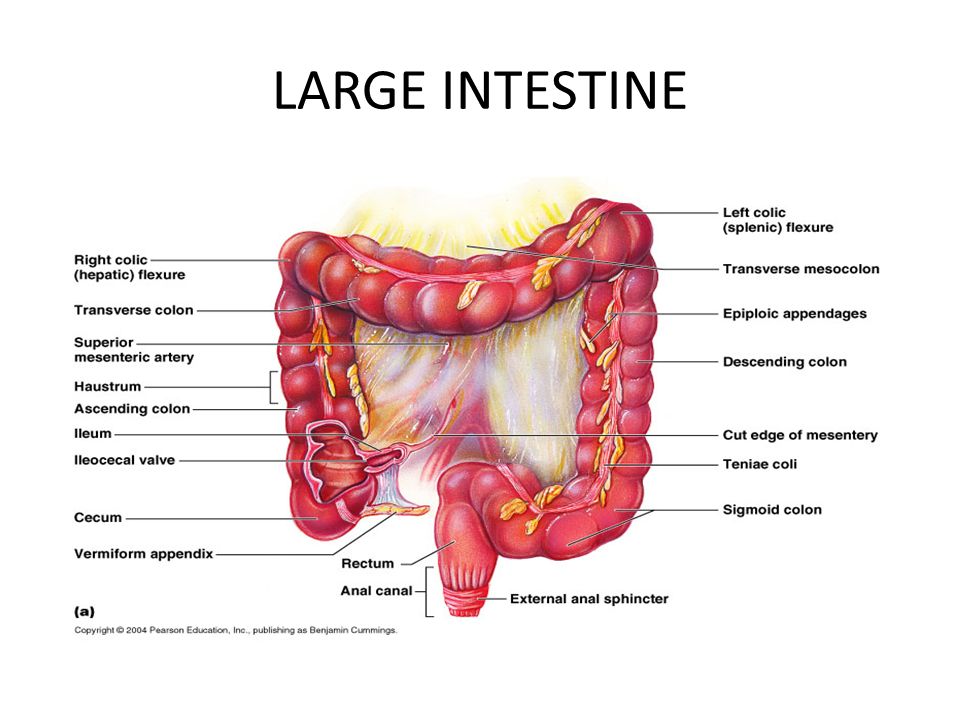 За счет них происходит обработка непереваренных остатков пищи. В некоторых, исключительных случаях, расположенные по соседству сальниковые отростки в этом ряду соединяются, тем самым создавая единую складку.
За счет них происходит обработка непереваренных остатков пищи. В некоторых, исключительных случаях, расположенные по соседству сальниковые отростки в этом ряду соединяются, тем самым создавая единую складку.
Свободная лента толстой кишки размещается на подобной зоне толстой кишки. Свободной у обеих частей ободочной кишки считают фронтальную зону. Поперечная ободочная кишка, обладающая большей длиной, немного провисает, а потом скручивается в спираль вдоль все оси. По некоторым подсчетам это происходит на девяносто градусов по часовой стрелке.
Благодаря процессу всасывания, протекающему в слизистой оболочке кишки, она признана достаточно слабой. Всасывается внутрь исключительно вода. Слизистая оболочка толстой кишки не владеет ни чем похожим на обычные ворсинки. Это и есть главная разница между ней и такой же оболочкой в тонкой кишке. Выходит, что она полностью гладкая. Еще одно немаловажное различие – это цвет. Толстая кишка в своем нормальном состоянии окрашивается в сероватый, можно даже сказать, пепельный оттенок. А вот стенка тонкой кишки в таком же состоянии будет нежно розовой.
А вот стенка тонкой кишки в таком же состоянии будет нежно розовой.
Анатомия, брюшная полость и таз, сигмовидная кишка — StatPearls
Введение
Сигмовидная кишка — это терминальная часть толстой кишки до достижения прямой кишки. Он соединяет нисходящую ободочную кишку с прямой кишкой. Сигмовидная кишка получила свое название от греческой буквы сигма. Его обычно локализуют в тазу, но, поскольку это подвижная структура с брыжейкой, она часто может перемещаться в брюшную полость. Основная функция сигмовидной кишки — поглощение воды, витаминов и минералов из непереваренных частиц пищи, как и предыдущие части кишечника; однако это происходит в меньшей степени.Сигмовидная кишка представляет собой структуру задней кишки и получает кровоснабжение, иннервацию, а также лимфатический дренаж, как и другие структуры задней кишки. Различные распространенные и необычные заболевания могут поражать сигмовидную кишку, многие из которых могут потребовать хирургической коррекции в случае неудачного лечения. [1] [2] [3]
[1] [2] [3]
Структура и функции
Состав:
Средняя длина сигмовидной кишки составляет от 25 до 40 см (от 10 до 15,75 дюйма). Сигмовидная кишка представляет собой S-образную часть толстой кишки, которая начинается перед краем таза как продолжение нисходящей толстой кишки и становится прямой кишкой на уровне третьего крестцового позвонка.В отличие от нисходящей ободочной кишки, брюшина окружает сигмовидную кишку и, таким образом, не является забрюшинной структурой. Мезоколон сигмовидной кишки прикрепляет сигмовидную кишку к задней стенке живота. На уровне S3 она снова становится забрюшинной структурой.
Функция:
Сигмовидная кишка получает стул, в котором к этому моменту реабсорбируется большая часть питательных веществ и воды. Его основная цель — удалить из содержимого кишечника последние компоненты, такие как вода, витамины и минералы, путем реабсорбции, чтобы стул стал достаточно твердым для хранения в прямой кишке.Затем сигмовидная кишка выталкивает твердый стул в прямую кишку через функциональный ректосигмовидный сфинктер с помощью сильных перистальтических сокращений при подготовке к экскреции с калом, что позволяет сохранить и запустить рефлекс дефекации. [4]
[4]
Эмбриология
Как и остальная часть толстой кишки, сигмовидная кишка происходит от трех основных зародышевых слоев (эктодермы, мезодермы и энтодермы) и развивается как структура задней кишки по отношению к кровоснабжению и иннервации.Гистологически эпителиальная выстилка возникает из энтодермы с компонентами гладких мышц и соединительной тканью, участвующими в перистальтических сокращениях, происходящих из слоя мезодермы. Последний слой эктодермы дает начало серозному покрытию сигмовидной кишки, а также клеткам нервного гребня, которые развиваются в кишечную нервную систему, давая начало автономному контролю желудочно-кишечного тракта. Кроме того, эта часть толстой кишки развивается и сохраняется как внутрибрюшинная структура и отмечает переход от забрюшинной нисходящей ободочной кишки и прямой кишки.[5]
Кровоснабжение и лимфатика
Кровоснабжение:
Поскольку сигмовидная кишка развивается как структура задней кишки, она получает кровоснабжение от нижней брыжеечной артерии (IMA) и, в частности, сигмовидных ветвей. Кроме того, сигмовидная кишка получает коллатеральный кровоток сверху от левой колической артерии и снизу от верхних ректальных артерий, обе из которых также исходят из IMA. Ректосигмовидное соединение является главной водоразделительной зоной, известной как точка Судека, которая склонна к ишемии в состояниях пониженной перфузии.Артерии, снабжающие этот внутрибрюшинный орган, проходят через сигмовидную мезоколону, которая представляет собой складку в брюшной выстилке брюшной полости, которая связывает толстую кишку с задней брюшной стенкой.
Кроме того, сигмовидная кишка получает коллатеральный кровоток сверху от левой колической артерии и снизу от верхних ректальных артерий, обе из которых также исходят из IMA. Ректосигмовидное соединение является главной водоразделительной зоной, известной как точка Судека, которая склонна к ишемии в состояниях пониженной перфузии.Артерии, снабжающие этот внутрибрюшинный орган, проходят через сигмовидную мезоколону, которая представляет собой складку в брюшной выстилке брюшной полости, которая связывает толстую кишку с задней брюшной стенкой.
Лимфодренаж:
Лимфодренаж сигмовидной кишки ретроградно следует по пути IMA и его разветвляющихся ветвей, дренируясь в лимфатические узлы, расположенные внутри брыжейки, и в конечном итоге попадая в преаортальные нижние брыжеечные узлы.[5] [6]
Нервы
Желудочно-кишечная моторика находится под контролем кишечной нервной системы, которая развивается по мере того, как клетки нервного гребня, полученные из зародышевого листка эктодермы, мигрируют в стенки толстой кишки; это формирует мышечно-кишечное сплетение или сплетение Ауэрбаха, которое находится между круговым и продольным слоями мышц, а также подслизистое сплетение или сплетение Мейснера, которое расположено непосредственно под слизистой оболочкой кишечника.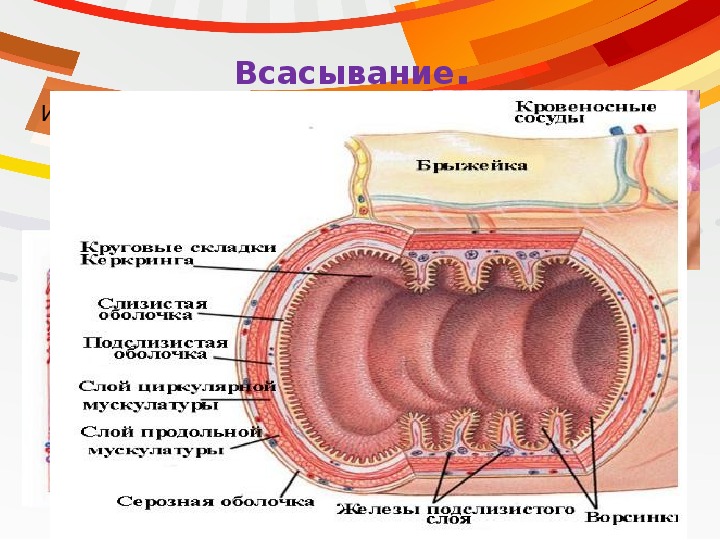 Эти нервы функционируют независимо от центральной нервной системы, контролируя как моторику, так и секрецию.Кишечная нервная система может подпадать под влияние изменений симпатического тонуса, происходящего от промежуточно-латерального клеточного столба L1-L2 спинного мозга, и парасимпатического тонуса от тазовых внутренних нервов S2-S4 [5].
Эти нервы функционируют независимо от центральной нервной системы, контролируя как моторику, так и секрецию.Кишечная нервная система может подпадать под влияние изменений симпатического тонуса, происходящего от промежуточно-латерального клеточного столба L1-L2 спинного мозга, и парасимпатического тонуса от тазовых внутренних нервов S2-S4 [5].
Мышцы
Подвижность сигмовидной кишки, как и остальной части кишечного тракта, зависит от двух слоев гладких мышц, расположенных внутри стенки структуры. Эти слои состоят из внутреннего кругового слоя мышечной ткани и внешнего продольного слоя.Продольные мышцы образуют три группы мышц, которые видны при внешнем осмотре толстой кишки, известные как taenia coli. Эти полосы видны по всей сигмовидной кишке и заканчиваются на ректосигмовидном соединении, отмечая переход от проксимального отдела сигмовидной кишки к дистальному отделу прямой кишки. Эти слои гладкой мускулатуры происходят из мезодермального зародышевого слоя и выполняют функцию разрушения, уплотнения и движения стула по мере его продвижения к прямой кишке для последующего выведения [5].
Физиологические варианты
Средняя длина сигмовидной кишки составляет от 25 до 40 см (от 10 до 15.75 дюймов). Был замечен физиологический вариант, при котором у человека развивается избыточная петля сигмовидной кишки. Избыточная петля возникает, когда сигмовидная кишка имеет длину более 40 см или кажется длиннее, чем может вместить живот человека. Этот избыточный кишечник может вызвать спектр клинических симптомов, начиная от тяжелой дисфункции кишечника и мочевого пузыря и заканчивая отсутствием симптомов вообще. [7]
Хирургическое вмешательство
В случае рецидивирующего дивертикулита или заворота, а также при подозрительном сигмовидном злокачественном новообразовании хирург может выполнить сигмовидную гемиколэктомию путем перевязки связанных сосудов, резекции пораженной толстой кишки и создания колостомы. или анастомоз между нисходящей ободочной и прямой кишкой.[8]
Клиническая значимость
Болезнь Гиршпрунга:
Болезнь Гиршпрунга или аганглионоз сигмовидной кишки — это заболевание, которое влияет на сократительную функцию хвостовой части сигмовидной кишки. При этом заболевании клетки нервного гребня не могут должным образом мигрировать в дистальный отдел толстой кишки. Это нарушение миграции приводит к нарушению кишечной нервной системы и, следовательно, подвижности и функции сигмовидной кишки. Эта аномалия обычно наблюдается у новорожденных, когда они не могут опорожнить свой первый стул (меконий).Это заболевание проявляется почти у 5% детей, рожденных с синдромом Дауна, и исследования показывают, что мутации как в зародышевой линии, так и в соматических клетках вносят свой вклад в патогенез [9].
При этом заболевании клетки нервного гребня не могут должным образом мигрировать в дистальный отдел толстой кишки. Это нарушение миграции приводит к нарушению кишечной нервной системы и, следовательно, подвижности и функции сигмовидной кишки. Эта аномалия обычно наблюдается у новорожденных, когда они не могут опорожнить свой первый стул (меконий).Это заболевание проявляется почти у 5% детей, рожденных с синдромом Дауна, и исследования показывают, что мутации как в зародышевой линии, так и в соматических клетках вносят свой вклад в патогенез [9].
Дивертикулит:
Дивертикулит — распространенное заболевание сигмовидной кишки, при котором воспаляются небольшие дивертикулы или выпячивания ослабленной стенки кишечника. Эти выпячивания представляют собой ложные дивертикулы, содержащие только слизистую оболочку и подслизистый слой. Дивертикулы образуются в тех местах, где кровеносные сосуды проникают в стенку кишечника для снабжения слизистой оболочки.Эти участки слабой стенки кишечника могут воспаляться и приводить к развитию абсцесса, свищей или перфораций, что приводит к сильной боли, локализующейся в нижнем левом квадранте брюшной полости из-за раздражения брюшины. Патогенез этого состояния является многофакторным и зависит от генетики, диеты, уровня активности и потребления клетчатки [10].
Патогенез этого состояния является многофакторным и зависит от генетики, диеты, уровня активности и потребления клетчатки [10].
Заворот:
Заворот сигмовидной кишки — это заболевание, которое развивается, когда толстая кишка скручивается вокруг мезоколонны; это происходит в области сигмовидной кишки из-за морфологической S-образной формы толстой кишки и высокого давления, которое может образоваться, когда стул уплотняется и готовится к экскреции.Когда это происходит, кровеносные сосуды, находящиеся в брыжейке, могут закупориться и привести к ишемии кишечника. Кроме того, перекручивание кишечника создает дистальную непроходимость, препятствующую продвижению стула в прямую кишку. Обычно это наблюдается у людей с избыточным кишечником, а также у людей, ведущих малоподвижный образ жизни и склонных к запорам. Медицинский осмотр покажет вздутие живота и барабанную перепонку, а визуализация покажет большое количество вздутого кишечника, часто называемого «признаком кофейных зерен». [11]
[11]
Рак толстой кишки:
Новообразования могут возникать в сигмовидной кишке и обычно проявляются изменениями в привычках кишечника, такими как уменьшение калибра стула и гематохезия. Рак толстой кишки имеет тенденцию метастазировать в печень через дренаж воротной вены и, в конечном итоге, в легкие через нижнюю полую вену [8].
Рисунок
FPC, Кисты, поражения, семейный полипоз кишечной палочки, рак толстой кишки. Предоставлено Стивом Бхимджи, MS, MD, PhD
Рисунок
РИСУНОК 2: Заворот сигмовидной кишки.По сравнению с заворотом слепой кишки, заворот сигмовидной кишки покажет признаки изогнутой внутренней трубки с вершиной заворота, расположенной в левом верхнем квадранте. Предоставлено Медицинским центром Вайкофф-Хайтс, 2016 г.
Рисунок
Сигмовидная кишка. Изображение любезно предоставлено S Bhimji MD
Ссылки
- 1.
- Kahai P, Mandiga P, Wehrle CJ, Lobo S. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 10 августа 2020 г.
 Анатомия, брюшная полость и таз, толстый кишечник.[PubMed: 29261962]
Анатомия, брюшная полость и таз, толстый кишечник.[PubMed: 29261962] - 2.
- Azzouz LL, Sharma S. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 27 июля 2020 г. Физиология, толстый кишечник. [PubMed: 29939634]
- 3.
- Огобуйро И., Гонсалес Дж., Тума Ф. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 25 апреля 2021 г. Физиология, желудочно-кишечный тракт. [PubMed: 30725788]
- 4.
- Шафик А. Рефлекс сигмовидно-ректального перехода: роль в механизме дефекации. Clin Anat.1996; 9 (6): 391-4. [PubMed: 8915619]
- 5.
- Бхатиа А., Шатаноф Р.А., Бордони Б. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 8 мая 2021 г. Эмбриология, желудочно-кишечный тракт. [PubMed: 30725857]
- 6.
- ван Тондер Дж. Дж., Бун Дж. М., Беккер Дж. Х., ван Шур А. Н.. Анатомические аспекты критической точки Судека и ее значение для колоректальной хирургии. Clin Anat.
 2007 Май; 20 (4): 424-7. [PubMed: 17022033]
2007 Май; 20 (4): 424-7. [PubMed: 17022033] - 7.
- Zarokosta M, Piperos Τ, Zoulamoglou M, Theodoropoulos P, Nikou E., Flessas I, Boumpa E, Bonatsos V, Noussios G, Mariolis-Sapsakos T.Аномальное течение сигмовидной кишки и мезосигмовидной кишки, обнаруженное во время колэктомии. Случай повторной петли сигмовидной кишки. Int J Surg Case Rep.2018; 46: 20-23. [Бесплатная статья PMC: PMC6000771] [PubMed: 29655020]
- 8.
- Recio-Boiles A, Cagir B. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 25 января 2021 г. Рак толстой кишки. [PubMed: 29262132]
- 9.
- Moore SW. Успехи в понимании связи между синдромом Дауна и болезнью Гиршпрунга (DS-HSCR).Pediatr Surg Int. 2018 ноя; 34 (11): 1127-1137. [PubMed: 30218169]
- 10.
- Резапур М., Али С., Столлман Н. Дивертикулярная болезнь: обновленная информация о патогенезе и лечении. Кишечная печень. 2018 15 марта; 12 (2): 125-132. [Бесплатная статья PMC: PMC5832336] [PubMed: 28494576]
- 11.

- Лиеске Б., Антунес К. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 10 августа 2020 г. Сигмовидный заворот. [PubMed: 28722954]
Колон | SpringerLink
Об этой книге
Введение
Функциональные и органические изменения толстой кишки — одна из основных причин, по которой пациенты обращаются к гастроэнтерологам.Раздраженная толстая кишка — одна из самых распространенных причин дискомфорта у людей. Органическая патология толстой кишки (злокачественные новообразования и хронические воспалительные заболевания) способствует, особенно у жителей Западной Европы, обескураживающе высокому уровню заболеваемости и смертности. Каждый понимает важность глубоких физиологических знаний толстой кишки для научного планирования функционального лечения органических заболеваний толстой кишки. Если мы рассмотрим большое количество опубликованных материалов по физиологии пищевода, желудка, тонкой кишки, поджелудочной железы и печени, мы поймем, что толстой кишке уделялось относительно мало внимания.Главы в этой книге написаны людьми, которые сделали все возможное, чтобы изменить этот дисбаланс. Я хочу поблагодарить всех участников за их щедрое сотрудничество, которое позволило мне представить в одном томе практически всю информацию, известную о структуре и функции толстой кишки, и выразить свою глубокую признательность доктору Говарду Спиро за его готовность включить это том в его серии. Я также хотел бы выразить искреннюю признательность Plenum Publishing Corporation за создание этой книги.Особая благодарность доктору
.Ключевые слова
толстая кишка гастроэнтерология печень поджелудочная железа желудок
Редакторы и филиалы
- 1. Школа медицины, Университет Буэнос-Айреса, Буэнос-Айрес, Аргентина, ,
Библиографическая информация
- Название книги Двоеточие
- Подзаголовок книги Структура и функции
- Редакторы
Луис Бустос-Фернандес
- Название серии Темы в гастроэнтерологии
- DOI https: // doi.org / 10.1007 / 978-1-4757-0307-8
- Информация об авторских правах Springer Science + Business Media, Нью-Йорк, 1983 г.
- Имя издателя Спрингер, Бостон, Массачусетс
- электронные книги Архив книг Springer
- ISBN в твердом переплете 978-0-306-41056-7
- ISBN в мягкой обложке 978-1-4757-0309-2
- электронная книга ISBN 978-1-4757-0307-8
- Номер издания 1
- Число страниц XVII, 308 г.
- Количество иллюстраций 0 ч / б иллюстраций, 0 иллюстраций в цвете
- Темы
Гастроэнтерология
- Купить эту книгу на сайте издателя
Комменсальная микробиота индуцирует структуру и функции кишечного барьера, которые способствуют гомеостазу
Мыши
Взрослые самцы и самки мышей GF C57BL / 6 (возраст 2–3 месяца) на стерилизуемой диете заводчиков мышей S-2335 (Teklad) были получены от Axenic Отделение гнотобиотиков в Университете Макмастера.Традиционно выращенные взрослые, самцы и самки мышей SPF C57BL / 6, выращенные на диете для грызунов NIH № 31 M, были получены от Taconic (Taconic Biosciences Inc, Germantown, New York; из комнат IBU04 и IBU14; возраст 2–3 месяца) и использованы для эксперименты после недели акклиматизации к питомнику McMaster Animal Facility и стерилизуемой диете заводчика мышей S-2335 (Teklad). Животных содержали при двенадцатчасовом цикле освещения и темноты и содержали в стерильных клетках с вентиляционным отверстием / стойкой с доступом ad libitum к пище (стерилизуемый рацион заводчика мышей Teklad S-2335) и воде в питомнике McMaster Animal Facility.Все эксперименты проводились в соответствии с протоколами использования животных Университета Макмастера, с одобрения Комитета по уходу за животными Университета Макмастера и проводились в соответствии с Рекомендациями Канадского совета по уходу за животными.
Общий дизайн
Были проведены сравнения между мышами GF и SPF, а также продольные исследования на колонизированных мышах на 1, 7 и 21 день после колонизации. В последнем случае мышей GF колонизировали через желудочный зонд с 0,2 мл фекальной суспензии (1:10 масс. / Об.) От одного здорового взрослого донора-человека, который, как ранее было показано, не содержит известных патогенов (дополнительный рис.S3) 14 . Фекальную суспензию готовили, как описано ранее 44 . В дополнительном эксперименте фекальную суспензию от того же донора наносили на лицо и передние лапы мышей GF вместо внутрижелудочного зонда в качестве альтернативного способа колонизации. Независимые эксперименты описывают отдельные экспериментальные повторы, в которых образцы были получены от мышей, колонизированных и / или умерших вместе в один и тот же день.
Измерения кишечной проницаемости
Оценивали кишечную проницаемость ex vivo с использованием камер Уссинга, как описано ранее 46 .Параклеточная и трансклеточная проницаемость оценивали с использованием 6 мкКи / мл зондов 51 Cr-EDTA и 5 × 10 5 M HRP (тип II; Sigma Aldrich), соответственно. Serosal 51 Cr-EDTA количественно определяли с использованием жидкостного сцинтилляционного счетчика и выражали в процентах извлечения / см 2 / час. Для количественной оценки серозной HRP 47 использовали модифицированный анализ Уортингтона.
Экстракция РНК
Свежую ткань толстой кишки или IEL-обогащенный компартмент инкубировали в течение ночи при 4 ° C в RNAlater (Life Technologies).Ткани толстой кишки хранили при -20 ° C. РНК экстрагировали с помощью набора RNeasy Mini Kit (Qiagen) с обработкой ДНКазой. Концентрацию РНК определяли с помощью спектрофотометра NanoDrop (Qiagen), а качество оценивали электрофорезом в агарозном геле.
Количественная ПЦР в реальном времени транспортных белков плотного соединения и апикального барьера
Для оценки экспрессии гена белка плотного соединения была проведена обратная транскрипция 1 мкг матрицы РНК с использованием обратной транскриптазы iScript (Bio-Rad).Количественную ПЦР в реальном времени проводили с использованием кДНК (50 нг / мкл), праймеров (0,5 мкМ) и SsoFast EvaGreen Supermix (Bio-Rad) (дополнительная таблица S1) и амплифицировали с использованием Mastercycler ep realplex 4 (Eppendorf). . Активацию фермента индуцировали при 95 ° C в течение 30 секунд, денатурацию при 95 ° C в течение 5 секунд и отжиг / удлинение при 60 ° C в течение 20 секунд проводили 45 циклов.
Для оценки экспрессии гена транспортного белка апикальной мембраны 50 нг кДНК с 0,15 мкМ праймерами (дополнительная таблица S1) подвергали обратной транскрипции и амплифицировали в одностадийной реакции с использованием Brillliant III Ultra-Fast SYBR Green qPCR Master Mix (Agilent Technologies) в Stratagene Mx3005P (Agilent Technologies).ПЦР продолжалась 40 циклов денатурации при 95 ° C в течение 20 секунд и отжига / удлинения при 60 ° C в течение 22 секунд. Экспрессия генов белков плотных контактов и транспортных белков апикальной мембраны была нормализована до Gapdh , а кратность изменений экспрессии относительно среднего значения GF Gapdh мыши GF определялась с использованием метода 2 -ΔΔCT .
Экспрессия муцина-2 и белка TJ с помощью иммунофлуоресценции
Экспрессия муцина-2 и белка TJ в проксимальном отделе толстой кишки оценивалась с помощью иммунофлуоресцентного окрашивания фиксированных формалином, залитых парафином срезов.Срезы разрезали до 4 мкм, депарафинизировали и регидратировали. Для извлечения антигена клаудина-1 срезы обрабатывали паром в натрийцитратном буфере (pH 6,0) в течение 30 минут. Для извлечения антигена окклюдина срезы обрабатывали протеиназой К (20 мкг / мл) в течение 10 минут при комнатной температуре. Для окрашивания клаудином-1 и окклюдином срезы тканей блокировали 2% BSA / PBS / 0,05% Tween 20 в течение 1 часа. Для окрашивания ZO-1 срезы обрабатывали 0,4% пепсином в 0,01 н. HCl в течение 30 минут при 37 ° C и блокировали 10% козьей сывороткой в течение 1 часа при комнатной температуре.Срезы тканей инкубировали в течение ночи при 4 ° C с одним из следующих первичных кроличьих антител в 1% BSA / PBS / 0,05% Tween 20: клаудин-1 (1: 100; Abcam ab15098), окклюдин (1: 200; антитела Bioss bs. -1495R) или ZO-1 (1: 200; Invitrogen 40–2200). Срезы инкубировали с козьим вторичным антителом против кролика Alexa Fluor 488 (1: 250; Thermo Fisher Scientific A11070) в течение 2 часов при комнатной температуре и закрепляли с помощью Prolong Gold Antifade с DAPI (Thermo Fisher Scientific). Контроли включали слайды, окрашенные в отсутствие первичного антитела, а также абсорбирующие контроли, где первичное антитело наносили с избытком пептида.Фиксированные по Карнуа (60% метанола, 30% хлороформа, 10% ледяной уксусной кислоты) слайды, залитые парафином, использовали для окрашивания муцином-2 (1: 100; Abcam ab76774), а также с вышеупомянутым вторичным антителом. Изображения были получены с помощью ImagePro Plus (Media Cybernetics). Окрашивание оценивали вслепую с помощью ImageJ v.1.49 (NIH), и оценивали только образцы с соответствующей ориентацией ткани и срезами. Полуколичественная оценка экспрессии белка представлена как кратное увеличение интенсивности сигнала по сравнению с контролями GF, которая была произвольно установлена на 1.
Оценка структуры кишечника с помощью EM
Поперечные срезы толстой кишки толщиной не более 0,4 см фиксировали в течение ночи 2% глутаральдегидом (об. / Об.) В 0,1 М буфере какодилата натрия (pH 7,4) при 4 ° C. Затем срезы фиксировали 1% тетроксидом осмия в 0,1 М буфере какодилата натрия, обезвоживали, промывали пропиленоксидом, подвергали градуированной серии смолы Spurr, полимеризовали в течение ночи в формах для заливки, заполненных 100% смолой Spurr, при 60 ° C, нарезали с помощью ультрамикротома Leica UCT и сняты с медных сеток.Срезы после окрашивания уранилацетатом и цитратом свинца просматривали с помощью просвечивающего электронного микроскопа JOEL JEM 1200 EX TEMSCAN при ускоряющем напряжении 80 кВ. Изображения были получены с помощью 4-мегапиксельной цифровой камеры AMT (Advanced Microscopy Techniques).
ЭМ-изображения с четкими поперечными сечениями микроворсинок были использованы для измерения длины микроворсинок в ImageJ (NIH). Срезы толстой кишки от трех мышей оценивали на группу, 5-6 изображений оценивали на срез, и 10 продольно разрезанных микроворсинок измеряли на каждое изображение.Каждая точка данных отображает среднюю длину микроворсинок (мкм) на изображение.
Анализ микробиоты
Образцы фекалий от тех же 7 мышей собирали на 1, 7 и 21 дни после колонизации, мгновенно замораживали и хранили при -80 ° C. ДНК экстрагировали с использованием MagMAX Express 96 (Life Technologies), гипервариабельную область V3 бактериального гена 16S рРНК секвенировали с использованием платформы Illumina MiSeq и выполняли анализ, как описано ранее 48,49 . Вкратце, последовательности редактировали с помощью программы Cutadapt версии 1.2.1 50 , выровнено с использованием PANDAseq v.2.8 51 , Обильный OTU использовался для выбора операционных таксономических единиц 52 , справочная база данных Greengenes использовалась для назначения таксономии, а QIIME использовалась для фильтрации операционных таксономических единиц ниже 0,01% Изобилие 53 . Образцы фекальной микробиоты отбирались на средней глубине 98 779 считываний на образец (медиана = 83 515). Рабочие таксономические единицы численности и графики Firmicutes: Bacteroidetes были созданы в GraphPad Prism 6.0 (GraphPad Software, Inc). Анализ главных компонентов с использованием невзвешенных ординаций несходства UniFrac и Брея Кертиса был выполнен в QIIME.
Оценка структуры слоя слизи и бактериального распределения путем окрашивания
Структура слоя слизи в проксимальной части толстой кишки оценивалась с помощью окрашивания альциановым синим и периодической кислотой по Шиффу фиксированного по Карнуа (60% метанола, 30% хлороформа, 10% ледяной уксусной кислоты), парафина -встроенные разделы. Депарафинизированные регидратированные срезы ткани обрабатывали 3% уксусной кислотой в течение 3 минут, альциановым синим в течение 15 минут, периодной кислотой в течение 5 минут, реагентом Шиффа в течение 15 минут и окрашивали гематоксилином.
Распространение бактерий в слизи проксимального отдела толстой кишки оценивали с помощью флуоресценции гена 16S рРНК in situ гибридизации и окрашивания муцином-2 IF фиксированных по Карнуа и залитых парафином срезов. Депарафинизированные регидратированные срезы ткани гибридизовали в течение ночи с 5 нг / мкл генного зонда 16S рРНК EUB338 (5′-5Cy3 GCT GCC TCC CGT AGG AGT-3 ‘) при 50 ° C в 20 мМ Трис-HCl (pH 7,4), 0,9 M NaCl, 0,1% SDS. Срезы блокировали в течение 30 минут при 4 ° C 5% фетальной бычьей сывороткой и инкубировали в течение ночи при 4 ° C с кроличьим антителом против муцина-2 (1: 200; Abcam ab76774) в блокирующем растворе.Срезы инкубировали в течение 2 часов при комнатной температуре с козьим вторичным антителом против кролика Alexa Fluor 488 (1: 250; Thermo Fisher Scientific A11070) и закрепляли с помощью Prolong Gold Antifade с DAPI (Thermo Fisher Scientific). Контроли включали слайды, окрашенные в отсутствие зонда EUB338 или первичного антитела. ImagePro Plus (Media Cybernetics) использовался для получения изображений.
Экспрессия генов, связанных с воспалением, в компартменте, обогащенном IEL
Компартмент толстой кишки, обогащенный IEL, выделяли с использованием модифицированного протокола 54 .Вкратце, толстые кишки собирали, очищали от содержимого и разрезали на кусочки 3–5 мм. Кусочки ткани инкубировали в DTT / HEPES / Hank’s в течение 15 минут при 37 ° C на шейкере и 5 раз в EDTA / HEPES / Dulbecco’s PBS с перемешиванием и процеживанием между инкубациями. Супернатант пропускали через фильтры с размером ячеек 70 мкм и отделение, обогащенное IEL, выделяли градиентом Перколла. Клетки ресуспендировали в RNAlater и хранили при 4 ° C в течение ночи перед экстракцией РНК. Качество РНК сначала проверяли с помощью RNA Nano Chip и Agilent 2100 Bioanalyzer (Agilent Technologies).Экспрессию генов определяли с использованием набора кодов nCounter ® Mouse Inflamutation v2 XT (NanoString Technologies Inc; дополнительная таблица S2), анализировали с помощью программного обеспечения nSolver Analysis Software v2.5.34 (NanoString Technologies Inc) и нормализовали значения трансформированных Log2 генов, отображенные на тепловых картах с Евклидова кластеризация, созданная в RStudio v1.0.143 (RStudio Inc).
Экспрессия IL-18 с помощью иммуногистохимии
Фиксированные формалином, залитые парафином срезы толстой кишки разрезали до 4 мкм, депарафинизировали, регидратировали и блокировали двойным блокирующим эндогенный фермент реагентом (Dako S2003) в течение 10 минут.Слайды обрабатывали паром в натрийцитратном буфере (pH 6,0) в течение 30 минут, блокировали 2% BSA / PBS / 0,05% Tween 20 в течение 2 часов, а также блокировали пероксидазу (Dako K4004) в течение 5 минут. Образцы окрашивали кроличьим антимышиным IL-18 (1: 100; Abcam ab71495) в течение ночи при 4 ° C в 1% BSA / PBS / 0,05% Tween 20, обработанном Envision System-HRP-меченным полимерным анти-кроличьим антителом (Dako K4003). ) в течение 30 минут, хромоген субстрата AEC (Dako K3464), контрастировали гематоксилином и закрепляли с помощью Aqua-Mount (Thermo Fisher Scientific).Контроли включали слайды, окрашенные в отсутствие первичного антитела, а также абсорбирующий контроль, где первичное антитело наносили с избытком пептида. Изображения были получены с помощью ImagePro Plus (Media Cybernetics). Окрашивание оценивали вслепую с помощью IHC Toolbox в ImageJ (NIH) и отображали как кратное увеличение интенсивности сигнала по сравнению с контролями GF, которое было произвольно установлено на 1.
TLR4 и NOD2 Репортерные анализы NFκB-SEAP
Для обнаружения LPS и MDP в сыворотке, колориметрические анализы репортера NFκB-SEAP проводили, как описано ранее 55 .Вкратце, инактивированная нагреванием сыворотка, разведенная 1: 5 в PBS, 1: 1 в воде и, наконец, 10 мкл на 190 мкл в среде для обнаружения голубого HEK (Invitrogen), инкубировали с линией клеток HEK293, экспрессирующих TLR4, MD2 и CD14, трансфицированные pNifty2-SEAP. для обнаружения LPS или клетки HEK293T, трансфицированные NOD2 и pNifty2-SEAP для обнаружения MDP. После 24-часовой инкубации при 37 ° C считывание проводили при 630 нм и рассчитывали активацию NFκB относительно контрольных значений GF.
Поражение кишечника, вызванное декстран-сульфатом натрия
Поражение кишечника и воспаление были вызваны введением 2% DSS (36 000–50 000 МВт; MP Biomedicals LLC) в питьевой воде в течение 5 дней, а затем 2 дня в обычной питьевой воде до жертва.Мышам отрицательного контроля для каждой группы давали обычную питьевую воду, и их объединяли в одну группу, поскольку не наблюдали значительных различий. При умерщвлении оценивали длину толстой кишки, процентное изменение веса, консистенцию стула и наличие крови. Консистенцию стула и кровь оценивали по шкале от 0 до 3, как указано в дополнительной таблице S3. Срезы толстой кишки, окрашенные гематоксилином и эозином, оценивали вслепую на предмет микроскопических повреждений по шкале 0–4, как описано ранее 56 .
Бактериальная транслокация
Транслокация живых бактерий оценивалась путем гомогенизации печени и селезенки (1:10 мас. / Об.) В предварительно восстановленном PBS, посева дублированных серийных разведений на средах для инфузии мозга и сердца (BD) с добавлением 0,5% овечьей крови ( Cedarlane) и инкубируют при 37 ° C в анаэробных условиях в течение 48 часов. Данные представлены в виде логарифма КОЕ / мг ткани.
Статистика
Значимость определялась тестом Краскела-Уоллиса с апостериорным тестом Данна или непарным двусторонним тестом Манна-Уитни, когда это было необходимо.Для анализа микробиоты в QIIME проводили тесты Краскела-Уоллиса с поправкой Бонферрони. P <0,05 считалось значимым.
Редкий случай полной структуры толстой кишки при зрелой кистозной тератоме яичника у женщины в менопаузе: описание случая | BMC Women’s Health
MCT яичника может встречаться у женщин от подростков до женщин в постменопаузе. Обычно он развивается односторонне, но в 8–15% случаев MCT происходит с обеих сторон. MCT — это медленно растущая опухоль, скорость роста которой, по оценкам, равна 1.8 см в год [7]. Кроме того, частота долгосрочных рецидивов после операции составляет 4,7% [8]. Таким образом, женщинам репродуктивного возраста с MCT были выполнены операции по сохранению фертильности [3].
Примерно 2% всех случаев MCT претерпевают злокачественную трансформацию. Плоскоклеточная карцинома является наиболее распространенным типом, на долю которого приходится 83%, а аденокарцинома, саркома и карциноидные опухоли составляют большинство остальных [3]. Кишечный тип МСТ связан с аденокарциномой, развивающейся из МСТ.Fishman et al. [9] задокументировали редкий случай аденокарциномы, возникшей из желудочно-кишечного эпителия MCT. С тех пор многие авторы сообщили о желудочно-кишечном эпителии, связанном с MCT [10–12]. Поскольку компоненты зародышевой линии MCT расположены бессистемно, MCT, содержащая хорошо ориентированную полную структуру кишечника, встречается очень редко, и только 3 случая описаны в литературе (Таблица 1). Fujiwara et al. [5] сообщили о 2 случаях MCT, один из которых был доброкачественной MCT, содержащей полный сегмент стенки кишечника, а другой — аденокарциномой из MCT с полной структурой толстой кишки и бронхиальным эпителием.Прогноз доброкачественной MCT был благоприятным, и пациенты были живы через 5 лет после операции без рецидивов. Tang et al. [6] сообщили об одном случае пациента, у которого была диагностирована доброкачественная MCT, содержащая полные структуры толстой кишки.
Таблица 1 Обзор MCT, содержащих полную структуру толстой кишки или эпителий кишечникаИммуногистохимическое окрашивание может использоваться для дифференциальной диагностики между MCT со стенкой толстой кишки и муцинозной опухолью. Они также определили, что нормальный толстый кишечник положителен на CK20 и отрицателен на CK7 по иммуногистохимии.Однако муцинозная цистаденома яичников показывает положительный результат на CK7 и отрицательный на CK 20 [6]. В отличие от доброкачественного муцинозного эпителия, злокачественный эпителий, связанный с MCT, чаще показывает отрицательный для CK7 и положительный для CK20, MUC2 и CDX2 [13]. Также сообщалось, что иммуногистохимическая положительная реакция на CEA, CA19-9 и CK-20 имеет тесную связь со злокачественным муцинозным эпителием [9].
В нашем случае мы обнаружили MCT яичника, содержащего полную структуру толстой кишки у женщин в менопаузе.Также не было никаких признаков злокачественной трансформации.
О ГРАММАТИЧЕСКОМ СОСТОЯНИИ «СТРУКТУР КОЛОНА» в JSTOR
АбстрактныйНастоящая статья представляет собой попытку изучить грамматический статус структуры, которая обычно прерывается двоеточием. В отличие от традиционной интерпретации этого паттерна, которая в значительной степени опирается на туманное понятие аппозиции, здесь утверждается, что структуры толстой кишки лучше всего рассматривать как дискурсивные процессы.Это означает не только то, что аппозиция должна быть исключена как возможный анализ, но также и то, что отношения зависимости (или даже любые другие сентенциональные отношения) неадекватны для работы с такого рода структурой. Основанием для текстовой интерпретации является то, что связность, характеризующая единицы, составляющие структуры толстой кишки, вообще не может быть адекватно выражена внутри предложения.
Информация о журналеОснованный в 1979 году, Atlantis — это рецензируемый научный журнал, который дважды в год издается Испанской ассоциацией англо-американских исследований (AEDEAN).Он принимает оригинальные, неопубликованные исследовательские статьи на английском языке от ученых как из Испании, так и из-за рубежа. Журнал охватывает литературу на английском языке, критическую теорию, мысли и культуру, включая кино, англоязычных сообществ, а также исследования в области лингвистики, анализа дискурса и прагматики. Приветствуются соответствующие кросс-культурные и междисциплинарные анализы. Также публикуются обзоры научных монографий и интервью. Никакие материалы не должны рассматриваться для публикации в другом месте.Пригодность рукописей к публикации определяется на основании отчетов специалистов в области двойного слепого исследования. Избранные статьи публикуются как в печати, так и в Интернете. Материалы могут быть отправлены в электронном виде в любое время Генеральному редактору. Инструкции по подаче документов и руководящие принципы представлены на веб-сайте Atlantis http://www.atlantisjournal.org и в печатных копиях.
Информация об издателеAEDEAN означает Asociación Española de Estudios Anglo-Norteamericanos.Основанная в Севилье в 1976 году, она насчитывает около 1 200 членов, включая университетских профессоров, преподавателей и аспирантов как из испанских университетов, так и из-за рубежа. AEDEAN проводит ежегодные конференции с 1977 года, которые каждый год организует и проводит испанский университет. С 1978 года AEDEAN является членом Европейской ассоциации американских исследований (EAAS), а в 1989 году ассоциация стала одним из основателей Европейского общества изучения английского языка (ESSE). Интересы членов AEDEAN очень широки.Они варьируются от теоретической, исторической и прикладной лингвистики до всей литературы, написанной на английском языке, а также культурологии, теории литературы, киноведения, феминистских и гендерных исследований и так далее. Эти интересы отражены в структуре конференций AEDEAN и в его публикациях, журнале Atlantis и бюллетене новостей (AEDEAN Nexus), каждый из которых выходит два раза в год.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Оценка контура складки толстой кишки для 3D-визуализации структуры толстой кишки из 2D-изображений колоноскопии — Mayo Clinic
@inproceedings {f9f3083d46a942798d5fcbf0fa84bcf8,
title = «Оценка контура толстой кишки для 3D-визуализации структуры толстой кишки из 2D-изображений колоноскопии
«, аннотация 9000 «В этой статье представлен новый метод оценки контура складки толстой кишки, важный шаг на пути к полностью автоматизированной реконструкции трехмерного сегмента толстой кишки из изображения, полученного при колоноскопии, для автоматической маркировки невидимых участков слизистой оболочки (где могут находиться полипы или аномальные поражения) во время колоноскопии.Затем эндоскопист может манипулировать эндоскопом, чтобы осмотреть эти невидимые области. Предлагаемый метод оценивает контуры складки толстой кишки, используя преимущества компьютерной графики и обработки изображений. Алгоритм обнаруживает края складок толстой кишки, фильтрует края шума, объединяет края из одной складки толстой кишки и, наконец, завершает контуры. Завершенные контуры складки толстой кишки и свойства пикселей вокруг контуров используются для реконструкции трехмерного виртуального сегмента толстой кишки. Мы оцениваем полноту и точность алгоритма, а также сходство между оцененными алгоритмом контурами складок и нарисованными вручную контурами складок.»,
keywords =» 3D-визуализация, 3D-реконструкция, колонокопия, структура толстой кишки, обработка изображений «,
author =» Донхо Хонг и Валлапак Таванапонг и Джонни Вонг и Чонхван О и {Де Гроэн}, {Пит К.} » ,
год = «2011»,
месяц = ноя,
день = «2»,
doi = «10.1109 / ISBI.2011.

 Анатомия, брюшная полость и таз, толстый кишечник.[PubMed: 29261962]
Анатомия, брюшная полость и таз, толстый кишечник.[PubMed: 29261962] 2007 Май; 20 (4): 424-7. [PubMed: 17022033]
2007 Май; 20 (4): 424-7. [PubMed: 17022033]