причины, признаки, диагностика, лечение — Медцентр «Надежда»
Дисбактериоз, лечение которого является необходимостью, характеризуется состоянием, которое видоизменяет состав микроорганизмов, находящихся в кишечнике. Это, как правило, способствует нарушению работы желудочно – кишечного тракта.
Дисбактериоз: симптомы
Как и любое заболевание, дисбактериоз кишечника имеет предпосылки появления. Дисбактериоз у взрослых имеет следующие причины:
- чрезмерный прием антибиотиков;
- наличие кишечных инфекций;
- наличие заболеваний органов пищеварения, к примеру, гастрит, язва и прочее;
- неправильное питание;
- пониженный иммунитет.
Дисбактериоз у детей также имеет ряд существенных причин, к ним можно отнести:
- позднее начало кормления грудью;
- кормление смесями;
- неправильное питание;
- нарушенная моторика кишечника;
- хронические болезни желудка;
- пищевые аллергические реакции;
- попадание инфекции.

Дисбактериоз кишечника у взрослых и детей имеет одинаковые симптомы. Недуг характеризуется появлением вредных грибков и бактерий. Они в кратчайшие сроки разрушают микрофлору. Таким образом, пациент получает нарушение пищеварения. В случае игнорирования лечения дисбактериоза у взрослых, симптомы будут ухудшаться. Начнут появляться сильные болевые ощущения, а также нарушение усвоения витаминов и полезных веществ, что приведет к резкому понижению веса.
Дисбактериоз кишечника: лечение
Прежде всего, лечение недуга предполагает обращение к врачу, а именно гастроэнтерологу. Он сможет провести диагностику и на ее основе назначить необходимый курс лечения.
Лечение дисбактериоза у взрослых предполагает следующие процедуры:
- Строгая диета. В рацион необходимо включить кисломолочные продукты, которые обогатят организм бифидобактериями.
- Прием антибиотиков, который поможет избавиться от бактерий наносящих вред организму.
- Специализированные медикаменты, которые помогут нормализировать микрофлору кишечника, к примеру, бификол, хиллак, линекс.

Лечение дисбактериоза кишечника у взрослых, как правило, восстанавливает микрофлору кишечника по истечении двух месяцев. Но стоит помнить о том, что микрофлора очень чувствительна к различным воздействиям. Для уменьшения рисков повторного заболевания необходимо уделить должное внимание вашему здоровью.
Дисбактериоз — симптомы, лечение — Медицинский центр
Что такое дисбактериоз?
Кишечник человека населен различными видами бактерий. Есть «хорошие» бактерии, которые помогают усваивать различные полезные вещества из съеденной пищи, поддерживают иммунитет, защищают от аллергии, снижают вероятность некоторых онкологических заболеваний и предотвращают заселение кишечника «плохими» бактериями.
В случае, если под влиянием каких-либо факторов снижается количество «хороших» бактерий, кишечник заселяют бактерии «плохие». Это состояние — нарушение состава и свойств микрофлоры — называется ДИСБАКТЕРИОЗОМ.
Таким образом, дисбактериоз — это не болезнь, а состояние, вызванное определенными факторами, вызывающими нарушение микрофлоры кишечника.
К этим факторам относятся: изменение состава употребляемой пищи и воды, пищевое отравление, применение антибиотиков и других лекарств, заболевания желудочно-кишечного тракта. Значит, для избавления от дисбактериоза необходимо избавиться в первую очередь от причин.
Симптомы дисбактериоза могут быть от простого урчания в животе (при легкой степени) до запоров или диареи, болей в животе, тошнота, рвота, неприятный запах изо рта, наличие непереваренной пищи в кале, в тяжелых случаях присоединяется быстрая утомляемость, сонливость или бессонница.
При легкой степени симптомы могут прекратиться при устранении причины. Более тяжелые формы могут приводить к воспалению стенки кишечника, нарушению всасывания пищи, появлению анемии и авитаминоза. Эта стадия требует тщательного обследования и назначения медикаментозного лечения. Причем лечить следует в первую очередь основное заболевание, служащее причиной дисбактериоза. Необходимо так же восстановить нарушенную микрофлору.
Основными методами лечения дисбактериоза служат:
Диета. Правильное питание, особенно при начальных стадиях, может полностью устранить проблему. Рацион должен быть максимально сбалансирован, в нем обязательно присутствие лакто- и бифидобактерий, клетчатки, пектина и ограничение тяжелой, жирной, острой пищи.
Правильное питание, особенно при начальных стадиях, может полностью устранить проблему. Рацион должен быть максимально сбалансирован, в нем обязательно присутствие лакто- и бифидобактерий, клетчатки, пектина и ограничение тяжелой, жирной, острой пищи.
Из медицинских препаратов используются пребиотики и пробиотики.
Пребиотики не всасываются в кишечнике, а являются питательной средой для полезной микрофлоры.
Пробиотики — это препараты, состоящие из специальных форм лакто и бифидобактерий. Они нужны для заселения кишечника полезной микрофлорой. Их эффективность не всегда доказана, так не всегда можно определить, каких именно микроорганизмов и в каком количестве не хватает.
При тяжелых формах применяются фармакологические препараты- антибиотики и бактериофаги, подавляющие рост и развитие патогенной микрофлоры.
Как вспомогательные, могут применяться и препараты, стимулирующие иммунную систему, спазмолитики, антиаллергические средства.
Хороший эффект для избавления от патогенной микрофлоры дает гидроколонотерапия.
В любом случае, поставить правильный диагноз и назначить лечение может только врач.
В медицинском центре «На Восточной» Вас ждет высококвалифицированный врач-гастроэнтеролог, который поможет справиться с проблемой, назначить необходимое обследование и лечение.
Симптомы и лечение дисбактериоза кишечника, диагностика дисбактериоза в Москве — Клиника «Доктор рядом»
Если у вас совпадает больше 80% перечисленных симптомов, то настоятельно рекомендуем вам обратиться к врачу за консультацией.
Дисбактериоз — это состояние, характеризующееся дисбалансом микрофлоры кишечника вследствие изменения видового состава бактерий. Несмотря на то, что дисбактериоз не считается заболеванием, он способствует нарушению функций кишечника и требует устранения. При

Поскольку количество первых у здорового человека строго ограничено, они не создают никаких проблем. Однако, при снижении резистентности организма, после инфекций и стрессов, они активируются, их количество растёт, что негативно сказывается на состоянии организма. Подобное состояние нередко является «спутником» целого ряда болезней органов ЖКТ, а также длительного неконтролируемого врачом приёма фармакологических препаратов: антибиотиков и иммунодепрессантов. Его проявления весьма неприятны и снижают качество жизни: нарушения стула, отсутствие аппетита, ощущение дискомфорта в животе, нарушения сна, высыпания на коже.
Причины развития дисбактериоза
Симптомы дисбактериоза крайне редко возникают сами по себе. Как правило, им предшествуют те или иные патологические состояния, сбои в работе внутренних органов или целых систем организма, из-за чего и происходит уменьшение количества полезных и увеличение числа условно-патогенных бактерий.
|
Этиология дисбактериоза |
|
| Инициирующий фактор | Чем проявлен? |
| Приём фармакологических препаратов | Ятрогенный дисбактериоз развивается вследствие длительного или неправильного приёма медикаментозных средств, подавляюще воздействующих на жизнедеятельность бифидо- и лактобактерий. К таким препаратам относят антибиотики, гормоны, цитостатики. |
| Неправильное питание или резкая смена рациона | Постоянное потребление продуктов, в составе которых имеются консерванты, химические красители, стабилизаторы, повышенное количеством белков или сахаров. Негативно скажется дефицит клетчатки, голодание в течение длительного времени, искусственное питание через вену. |
| Болезни кишечника инфекционной этиологии |
Дизентерия, брюшной тиф, сальмонеллёз, ротавирусная инфекция способны стать причиной того, что потребуется лечение дисбактериоза.
|
| Болезни органов ЖКТ |
|
| Нарушение биоритмов | Перелёт человека из одного климатического пояса в другой может привести к дисбактериозу из-за того, что его организм не успел перестроиться и требует некоторого времени на адаптацию к новым условиям. |
| Регулярные стрессы | Постоянное психоэмоциональное напряжение является наиболее частой причиной дисбактериоза у женщин. |
Почему своевременное лечение дисбактериоза играет важную роль?
В норме, кишечник взрослого человека содержит от двух до трёх килограммов микроорганизмов, принимающих участие в пищеварительных процессах. Они формируют микрофлору кишечника и пребывают в состоянии физиологического баланса, который нарушается при изменении их состава, что проявляется дисбактериозом.
- Обеспечение организму питательных веществ;
- Поставка аденозинтрифосфата, являющегося источником энергии для всех обменных процессов организма;
- Перистальтика кишечника, обеспечивающая продвижение каловых масс по нему;
- Регенерация эпителиальных клеток кишечника;
- Формирование биологически активных веществ;
- Производство иммуноглобулина, участие в обеспечении резистентности организма;
- Процесс обмена жиров, белков, витаминов и кислот.
Стоит понимать, что нередко дисбактериоз не требует коррекции, поскольку организм сам способен восстановить баланс. Тем не менее, в ряде случаев коррекция состояния всё же необходима, поскольку позволяет существенно улучшить состояние пациента. Для того, чтобы определить, требуется ли вмешательство специалиста, проводят анализ на дисбактериоз.
Дисбактериоз кишечника: симптомы
| Клинические проявления дисбактериоза | Чем характеризуются? |
| Нарушения стула |
Могут проявляться запорами или, наоборот, диареей. Помимо этого, присутствует повышенное газообразование, вздутие живота, специфический привкус во рту. Помимо этого, присутствует повышенное газообразование, вздутие живота, специфический привкус во рту.
|
| Аллергические реакции |
У детей и у взрослых при дисбактериозе могут проявиться нехарактерная аллергия на те или иные продукты питания. Помимо симптомов обычных для аллергий (зуд, отёки, крапивница) наблюдается:
|
| Синдром хронического расстройства процессов переваривания, передачи и всасывания питательных веществ |
|
| Снижение иммунитета |
Учащение случаев заболеваемости инфекционными болезнями.
|
Специалисты выделяют четыре стадии развития дисбактериоза, исходя из которых подбирают курс лечения:
| Стадия дисбактериоза | Клинические проявления |
| Первая | Снижается количество кишечной палочки. |
| Вторая | Помимо снижения количества кишечной палочки, несущественно снижается число бифидобактерий и наблюдается рост патогенов. |
| Третья | Недостаток бифидо- и лактобактерий, увеличение количества патогенной флоры, провоцирующей нарушения функций кишечника. |
| Четвёртая | Бифидофлора полностью отсутствует, лактобактерий практически нет. Запущены разрушительные процессы кишечника. |
Диагностика дисбактериоза
Для того, чтобы решить, как лечить дисбактериоз и нужно ли это делать, гастроэнтеролог проводит ряд диагностических мероприятий:
- Выявление нарушений исходя их жалоб пациента;
- Сбор анамнеза с особым вниманием к приёму медикаментов;
- Проведение физикального осмотра;
- Анализ на дисбактериоз;
- Бакпосев кала;
- Копрограмма.

Дисбактериоз кишечника: лечение
Тактику коррекции дисбактериоза подбирает лечащий врач, исходя из результатов диагностики и показаний пациента. Лечение направлено на устранение не только клинических проявлений, но и причин, вызвавших их появление:
- Снижение темпов развития патогенов в кишечнике;
- Стимулирование развития полезных микроорганизмов;
- Повышение резистентности организма в целом.
| Методы лечения дисбактериоза | Их описание |
| Приём медикаментов |
Предусматривает приём препаратов, содержащих живые полезные микроорганизмы, и ряда других, подобранных строго индивидуально, на основании результатов диагностики:
|
| Диетотерапия | Применяется диета № 4, подвид которой подбирают индивидуально. Она положительно сказывается на функционировании кишечника в целом и снижает гнилостные процессы. В рацион включаются продукты, богатые на пищевые волокна и живые бактериальные культуры. Рекомендуется устранить продукты питания, содержащие консерванты, стабилизаторы и любые компоненты химического происхождения. Помимо этого, следует отказаться от продуктов, способствующих газообразованию. |
| Патогенетическая терапия | В первую очередь направлена на лечение первичного заболевания. Также её цели заключаются в восстановлении моторных функций кишечника, устранении воспалительных процессов и проведении заместительной ферментной терапии. |
Прогноз и профилактика дисбактериоза
Если коррекция дисбактериоза была начата своевременно, то её прогноз благоприятен. Что касается профилактических мероприятий, то они предусматривают сбалансированный рацион питания, отказ от продуктов, содержащих химические ингредиенты, а также контролируемый приём препаратов, способных нарушить баланс микрофлоры.
Что касается профилактических мероприятий, то они предусматривают сбалансированный рацион питания, отказ от продуктов, содержащих химические ингредиенты, а также контролируемый приём препаратов, способных нарушить баланс микрофлоры.
Пройти диагностику и курс лечения дисбактериоза в Москве приглашает сеть клиник «Доктор рядом». Мы располагаем современной диагностической базой, позволяющей выявить любые нарушения микрофлоры и найти пути устранения проблемы. Наши врачи имеют многолетний опыт практической работы и широкий арсенал средств, позволяющих решить проблему и улучшить состояние пациентов, вернуть им радость жизни. Записывайтесь на приём, заполнив и отправив форму онлайн или позвонив нам: +7 (495) 154-92-31!
Синдром дисбактериоза кишечника — AptekaOnline
Дисбактериоз не является самостоятельным заболеванием, этот синдром указывает на развитие ряда болезней желудочно-кишечного тракта.
Кишечник является частью пищеварительной системы человека и отвечает за всасывание расщепленных питательных веществ и удаление излишков с каловыми массами. Нормальная работа кишечника напрямую связана с микрофлорой, живущей на его стенках. Многочисленные микроорганизмы в кишечнике участвуют в синтезе аминокислот, витаминов, усвоении микроэлементов, а также блокируют рост и размножение патогенных бактерий, вызывающих различные нарушения в работе кишечника. В ряде случаев здоровый баланс микрофлоры может быть нарушен и вредные микроорганизмы начинают быстро размножаться. Именно такие состояния называют дисбактериозом кишечника.
Нормальная работа кишечника напрямую связана с микрофлорой, живущей на его стенках. Многочисленные микроорганизмы в кишечнике участвуют в синтезе аминокислот, витаминов, усвоении микроэлементов, а также блокируют рост и размножение патогенных бактерий, вызывающих различные нарушения в работе кишечника. В ряде случаев здоровый баланс микрофлоры может быть нарушен и вредные микроорганизмы начинают быстро размножаться. Именно такие состояния называют дисбактериозом кишечника.
Развитие дисбактериоза
Считать дисбактериоз самостоятельным заболеванием ошибочно, ведь он развивается при появлении соответствующих условий, связанных с нарушением нормальной работы организма. Аллергия, склонность к ОРЗ и ОРВИ, несбалансированный рацион, кишечные инфекции, нарушения функций ЖКТ, стресс, изменения микрофлоры, связанные с возрастом, химическая и лучевая терапия, длительное лечение гормональными и антибактериальными препаратами (в частности, антибиотиками) — вот далеко не полный список причин, вызывающих дисбактериоз у пациентов.
Поэтому лечение дисбактериоза в первую очередь должно быть направлено на устранение причин, которыми он был вызван. В отдельных случаях устранить причину невозможно, например, для онкобольных отмена курса лечения вызовет гораздо более критичные последствия, чем нарушение микрофлоры кишечника. Для таких пациентов подбирается специальный рацион и медикаментозные препараты, которые позволяют ограничить количество патогенных микроорганизмов, что позволяет поддерживать удовлетворительную работу собственной микрофлоры и нормальное пищеварение.
Пациентам, у которых симптомы дисбактериоза проявились из-за неправильного питания, сильного стресса или временной антибиотикотерапии, для восстановления микрофлоры потребуется значительно меньше усилий и времени. Регулировка питания, снижение эмоциональных нагрузок, окончание курса антибиотиков — все это в большинстве случаев создает благоприятные условия для нормализации работы кишечника. Небольшой курс лечения дисбактериоза кишечника специализированными препаратами позволяет полностью восстановить функции органа пищеварения.
Симптомы дисбактериоза
Первыми признаками дисбактериоза являются появление тошноты и рвоты, металлического привкуса во рту, снижение аппетита или полное его отсутствие, нарушения стула (диарея, запор), вздутие живота, чувство незаконченного опорожнения кишечника, эпизодические боли в животе. Кроме того, картина может быть дополнена сопутствующими симптомами: слабостью, головными болями, нарушениями сна, высокой утомляемостью, в отдельных случаях на кожных покровах и слизистых оболочках могут появляться зудящие высыпания.
Симптомы дисбактериоза кишечника у всех пациентов индивидуальны. Какие именно признаки проявятся у отдельно взятого человека, зависит не только от причины дисбактериоза, но и от степени тяжести заболевания в каждом конкретном случае и возраста каждого пациента. Так, дисбактериоз у новорожденных укладывается в норму до определенного возраста — пока кишечник будет нормально заселен микрофлорой. По степени тяжести официальная медицина дисбактериоз у детей и взрослых разделяет на латентный, средний и тяжелый, а также на стафилококковую, протейную и ассоциированную формы.
Диагностика дисбактериоза
При появлении первых симптомов необходимо проконсультироваться у гастроэнтеролога и пройти необходимые обследования. Основными анализами на дисбактериоз являются микробиологическое (проверка кала на изменения биоценоза в кишечнике) и копрологическое (проверка характера нарушения переваривания и всасывания в кишечнике) исследования. Только после этих процедур врач может подтвердить наличие заболевания и определить, как лечить дисбактериоз с учетом индивидуальных особенностей, степени и вида у конкретного пациента.
Лечение дисбактериоза
Дисбактериоз является клинико-лабораторным синдромом, сильно зависящим от других заболеваний, возраста пациента, типа возбудителя и множества других факторов, поэтому его лечение необходимо начинать с выявления основных причин, вызвавших нарушения, и их устранения.
Параллельно с лечением основного заболевания, лечению дисбактериоза уделяется не меньшее внимание. Игнорирование проблемы дисбактериоза может негативно сказаться на общем течении заболеваний и стать причиной серьезных нарушений работы ЖКТ и других органов и систем.
Игнорирование проблемы дисбактериоза может негативно сказаться на общем течении заболеваний и стать причиной серьезных нарушений работы ЖКТ и других органов и систем.
Целью лечения непосредственно дисбактериоза является восстановление нормальной флоры кишечника. Для этого пациенту назначаются препараты, содержащие штаммы бифидобактерий, например линекс, лактофильтрум, хилак форте, а также специальная диета, направленная на поддержку заселения кишечника микрофлорой. Так, пациентам рекомендуется делать акцент в питании на кисломолочных продуктах, содержащих необходимые для восстановления микрофлоры организмы, либо применять препараты, в составе которых есть молочнокислые бактерии, такие как бифиформ, а для детей аципол. Кроме того, на время лечения ограничивают употребление алкоголя и курение, как небезопасные для флоры кишечника факторы. Назначение медикаментозной терапии (к примеру энтерофурила, де-нола) в каждом случае дисбактериоза индивидуально в зависимости от степени тяжести, возраста, экологических условий и других многочисленных факторов. Лечение дисбактериоза всегда является комплексным, решающим не только проблему дефицита полезной микрофлоры, но и исключающим условия для повторения недуга.
Лечение дисбактериоза всегда является комплексным, решающим не только проблему дефицита полезной микрофлоры, но и исключающим условия для повторения недуга.
Пройти диагностику и лечение дисбактериоза в Москве, цена
02.11.2021Статья проверена врачом-гепатологом, гастроэнтерологом Федел С., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
Дисбактериоз — состояние, связанное с изменением качественного и/или количественного состава микрофлоры кишечника. Термин «дисбактериоз» обычно не употребляют в отношении желудка или двенадцатиперстной кишки, потому что представленная в них флора очень скудная. В кишечнике в норме существует баланс множества бактерий, поэтому обычно и говорят о дисбактериозе именно этого отдела ЖКТ.
Дисбактериоз не является самостоятельным заболеванием. Это синдром (комплекс признаков и проявлений), который сопровождает другие заболевания.
Врачи отделения гастроэнтерологии Клинического госпиталя на Яузе в первую очередь работают над установлением причин, вызвавших дисбактериоз, а затем назначают оптимальное в каждом конкретном случае лечение.
Причины и патогенез дисбактериоза
Развитию дисбактериоза способствуют следующие основные факторы:
- заболевания органов ЖКТ (энтерит, гастрит, колит и другие)
- инфекции ЖКТ (лямблиоз, дизентерия и другие)
- хроническая диарея, влияющая на баланс кишечной флоры
- прием антибиотиков
- радио-, лучевая терапия
- злоупотребление механическим «очищением» кишечника (например, частые клизмы)
- длительный прием гормональных препаратов
- нарушения питания
- частые стрессы и т.д.
Симптомы дисбактериоза
Интенсивность проявления симптомов дисбактериоза зависит от многих обстоятельств: возраста пациента, состояния его иммунитета и других факторов.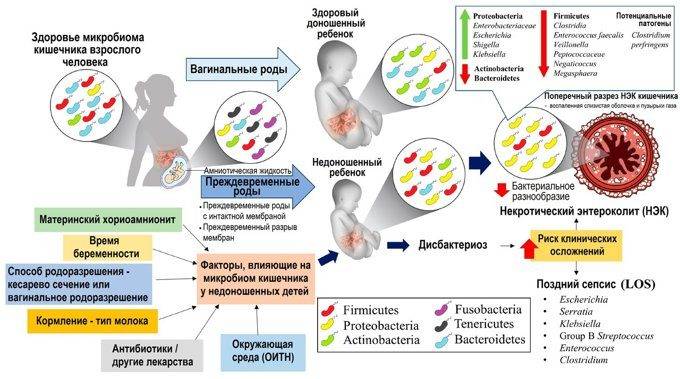 Иногда дисбактериоз может не проявляться и не приносить пациенту никакого заметного дискомфорта.
Иногда дисбактериоз может не проявляться и не приносить пациенту никакого заметного дискомфорта.
К основным признакам дисбактериоза относятся снижение аппетита, повышенная утомляемость. Отмечается вздутие живота, могут быть боли, расстройство стула. В случаях серьезного дисбактериоза возникает тошнота и рвота.
Процесс пищеварения идет медленнее, питательные вещества и витамины из пищи усваиваются не в полной мере. Именно поэтому пациенты с дисбактериозом часто имеют проблемы с кожей (разнообразные высыпания, сухость, шелушение), с ногтями (слоистость, ломкость) и волосами (повышенное выпадение, ломкость, тусклость).
Диагностика и лечение дисбактериоза в Клиническом госпитале на Яузе
При диагностике дисбактериоза специалисты отделения гастроэнтерологии нашей клиники в первую очередь стремятся определить, возникло ли заболевание на фоне нерационального применения антибиотиков, или является следствием хронических заболеваний органов пищеварения.
В зависимости от этого врач определяет необходимый перечень диагностических процедур.
Если к развитию заболевания привело применение антибактериальных средств, то необходимо прекратить их приём. Если корень дисбактериоза кроется в заболеваниях желудочно-кишечного тракта, то нужно лечить основное заболевание. Гастроэнтеролог Клинического госпиталя на Яузе назначит необходимую лекарственную терапию, направленную в первую очередь на лечение первопричины дисбактериоза с последующей коррекцией качественного и количественного состава микрофлоры.
Стоимость услуг
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Литература:
Белоусов С.С., Муратов С.В., Ахмад А.М. Гастроэзофагеальная рефлюксная болезнь и дуоденогастральный рефлюкс // НГМА. 2005.
Калинина А.
 В., Хазанова А.И. Гастроэнтерология и гепатология: диагностика и лечение: руководство для врачей // М.: Миклош. 2007.
В., Хазанова А.И. Гастроэнтерология и гепатология: диагностика и лечение: руководство для врачей // М.: Миклош. 2007.Ивашкин В.Т., Лапина Т.Л., Охлобыстин А.В., Буеверов А.О. Наиболее распространенные заболевания желудочно-кишечного тракта и печени: справ. для практикующих врачей // Литтерра. 2008.
, клиническое значение и предлагаемый протокол лечения (Протокол Перротта для клинического лечения кишечного дисбиоза, ВЗОМТ) для лечения и разрешения стойкого или хронического дисбактериоза
062
https://www.peertechzpublications.com/journals/archives -of-Clinical-Gastroenterology
Образец цитирования: Perrotta G (2021) Дисбактериоз кишечника: определение, клинические последствия и предлагаемый протокол лечения (Протокол Perrotta для клинического ведения
Кишечный дисбактериоз, ВЗОМТ) для лечения и разрешения стойких или хронических заболеваний. дисбактериоз.Arch Clin Gastroenterol 7 (2): 056-063.
дисбактериоз.Arch Clin Gastroenterol 7 (2): 056-063.
DOI: https://dx.doi.org/10.17352/2455-2283.000100
55. Perrotta G (2019) Биполярное расстройство: определение, дифференциальный диагноз, клинические
контексты и терапевтические подходы. J Neuroscience and Neurological
Surgery 5. Ссылка: https://bit.ly/3hKPdqM
56. Kim HN, Yun Y, Ryu S, Chang Y, Kwon MJ, et al (2018) Корреляция между микробиотой кишечника
и личность у взрослых: кросс-секционное исследование.Брейн Бех Имм
69: 374-485. Ссылка: https://bit.ly/2R7A3Dc
57. Бауэр М.Э., Тейшейра А.Л. (2018) Воспаление при психических расстройствах: какой
стоит первым? Ann N Y Acad Sci 1437: 57-67. Ссылка: https://bit.ly/34CUZVM
58. Kennedy PJ, Murphy AB, Cryan JF, Ross PR, Dinan TG, et al. (2016) Microbiome
в функции мозга и психическом здоровье. Тенденции в пищевой науке и технологиях 57:
289-301. Ссылка: https://bit.ly/3iLg1YX
59. Perrotta G (2020) Пограничное расстройство личности: определение, дифференциальный диагноз
Perrotta G (2020) Пограничное расстройство личности: определение, дифференциальный диагноз
, клинический контекст и терапевтические подходы. Ann Psychiatry
Treatm 4: 043-056. Ссылка: https://bit.ly/3hx2B1N
60. Perrotta G (2020) Нарциссизм и психопатологические профили: определения,
клинический контекст, нейробиологические аспекты и клинические методы лечения. J Clin Cases
Rep 4: 12-25. Ссылка: https://bit.ly/2X8wzzF
61. Perrotta G (2021) Истерическое расстройство личности: определение, клинические профили,
дифференциальная диагностика и терапевтическая основа.Arch Community Med
Общественное здравоохранение 7: 001-005. Ссылка: https://bit.ly/3cuga0H
62. Perrotta G (2021) Состояние сознания: от перцептивных изменений
к диссоциативным формам. Определяющие, нейробиологические и клинические профили. J Neuro
Neurol Sci Disord 7: 006-018. Ссылка: https://bit.ly/2P9JVvf
63. Perrotta G (2021) Избегающее расстройство личности: определение, клинические и нейробиологические профили
, дифференциальная диагностика и терапевтическая основа. J
J
Neuro Neurol Sci Disord 7: 001-005. Ссылка: https://bit.ly/3p5S9SP
64. Settani CR, Ianiro G, Bibbò S, Cammarota G, Gasbarrini A (2021) Кишечная микробиота
Изменение и модуляция при психических расстройствах: Текущие данные о фекальной микробиоте
трансплантация. Prog Neuropsychopharmacol Biol Psychiatry 109:
110258. Ссылка: https://bit.ly/3fWwzfn
65. Perrotta G (2021) Психологические и иммунобиологические последствия
Covid-19: возможная корреляция с предыдущими пандемиями и суггестивная
терапевтическая гипотеза выздоравливающей плазмы.Glob J Clin Virol 6: 007-011.
Ссылка: https://bit.ly/3fWi8b7
66. Скальдаферри Ф., Ианиро Дж., Привитера Дж., Лопетусо Л. Р., Ветрон Л. М. и др. (2020)
Захватывающее путешествие SARS-CoV-2 в кишечник: от патогенеза
к будущим клиническим последствиям. In amm Bowel Dis 26: 1306-1314. Ссылка:
https://bit.ly/3p5rQMy
67. Феррейра С., Виана С. Д., Рейс Ф. (2020) Является ли дисбактериоз кишечной микробиоты предиктором
Д., Рейс Ф. (2020) Является ли дисбактериоз кишечной микробиоты предиктором
повышенной восприимчивости к неблагоприятным исходам у пациентов с Covid-19? Обновление.
Микроорганизмы 9: 53. Ссылка: https://bit.ly/3x5yPr1
68. Perrotta G (2021) Пандемия Covid-19: все возможные эффективные решения
искоренить проблему. Поперечный анализ клинического, социально-экономического, политического и психологического профиля
. Arch Community Med Public Health 7: 099-
110. Ссылка: https://bit.ly/3BxkNSI
69. Iebba V (2018) Il microbiota. Un nuovo mondo inesplorato. Кароччи Эд, Рома.
70. Ottman N, Smidt H, de Vos WM, Belzer C (2012) Функция нашей микробиоты:
, кто там и что они делают?Front Cell Infect Microbiol 2: 104. Ссылка:
https://bit.ly/2WjWojk
71. Meng X, Zhang G, Cao H, Yu D, Fang X, et al. (2020) Дисбактериоз кишечника и
кишечное заболевание: механизм и лечение. J Appl Microbiol 129: 787-805.
Ссылка: https://bit. ly/3y5pdOz
ly/3y5pdOz
72. Сафури Г.Б., Шилдс-Катлер Р.Р., Чен Дж., Ян Й., Лекац Х.Р. и др. (2019)
Микробный дисбиоз тонкого кишечника лежит в основе симптомов, связанных
с функциональными желудочно-кишечными расстройствами.Nat Commun 10: 2012. Ссылка:
https://go.nature.com/2VggRFi
73. Candido TLN, Bressan J, Alfenas RCG (2018) Дисбиоз и метаболическая
эндотоксемия, вызванная диетой с высоким содержанием жиров. Nutr Hosp 35: 1432-1440. Ссылка:
https://bit.ly/3kTGRAO
74. Ghibbar R, Dieleman AL (2019) Микробиота кишечника при целиакии и
пробиотиков. Питательные вещества 11: 2375. Ссылка: https://bit.ly/3kUXSKV
75. Сон-Кюн К., Геварра Р.Б., Ким Ю.Т., Квон Дж., Ким Х и др.(2019) Роль
пробиотиков в заболеваниях кишечника человека, связанных с микробиомами. J Microbiol
Biotechnol 29: 1335-1340. Ссылка: https://bit.ly/2VdIlLG
76. Тохо Р., Суарес А., Клементе М.Г., де лос Рейес-Гавилан К.Г., Марголлес
А и др. (2014) Кишечная микробиота в здоровье и болезнях: роль
(2014) Кишечная микробиота в здоровье и болезнях: роль
бифидобактерий в гомеостазе кишечника. World J Gastroenterol 20: 15163-76. Ссылка:
https://bit.ly/3zD8K4a
77. Tsai YL, Lin TL, Chang CJ, Wu TR, Lai WF и др.(2019) Пробиотики, пребиотики
и облегчение болезней. J Biomed Sci 26: 3. Ссылка: https://bit.ly/3BF1qH8
78. Костантини Л., Молинари Р., Фаринон Б., Мерендино Н. (2017) Влияние
жирных кислот омега-3 на кишечную микробиоту. Int J Mol Sci 18: 2645. Ссылка:
https://bit.ly/3i1A5Y4
79. Гальярди А., Тотино В., Каччиотти Ф., Иебба В., Нерони Б. и др. (2018) Восстановление
экосистемы кишечной микробиоты. Int J Environ Res Public Health 15: 1679.Ссылка:
Ссылка: https://bit.ly/2V5yM1b
80. Лю Дж, Лю X, Xiong XQ, Ян Т., Цуй Т. и др. (2017) Влияние добавок витамина A
на микробиоту кишечника у детей с расстройствами аутистического спектра
— пилотное исследование. BMC Microbiol 17: 204. Ссылка: https://bit.ly/3y4UwZz
Ссылка: https://bit.ly/3y4UwZz
81. Cantorna MT, Snyder L, Arora J (2019) Витамин A и витамин D регулируют сложность микробов
, барьерную функцию и слизистую оболочку. иммунные ответы на
обеспечивают гомеостаз кишечника.Crit Rev Biochem Mol Biol 54: 184-192. Ссылка:
https://bit.ly/3iSR3aq
82. Sirisinha S (2015) Плейотропная роль витамина А в регуляции иммунитета слизистой оболочки
. Азиатский Pac J Allergy Immunol 33: 71-89. Ссылка: https://bit.ly/36ZK89B
83. Li Y, Luo ZY, Hu YY, Bi YW, Yang JM, et al. (2020) Микробиота кишечника регулирует
аутизмоподобного поведения, опосредуя гомеостаз витамина B 6 у мышей
с дефицитом EphB6. Микробиом 8: 120. Ссылка: https: // bit.ly / 3i2RDTu
84. ЛеБлан Дж. Г., Милани С., де Джорджи Г. С., Сесма Ф., ван Синдерен Д. и др. (2013)
Бактерии как поставщики витаминов для своего хозяина: перспектива кишечной микробиоты. Curr
Opin Biotechnol 24: 160-168. Ссылка: https://bit.ly/3eUt9tV
Ссылка: https://bit.ly/3eUt9tV
85. Jiang S, Zhu Q, Mai M, Yang W, Du G (2020) Витамин B и витамин D как
модуляторов микробиоты кишечника у людей с избыточным весом. Int J Food Sci Nutr 71:
1001-1009. Ссылка: https://bit.ly/3x9ubIt
86.Ratajczak AE, Szymczak-Tomczak A, Skrzypczak-Zielińska M, Rychter AM,
Zawada A, et al. (2020) Дефицит витамина С и риск остеопороза
у пациентов с воспалительным заболеванием кишечника. Питательные вещества 12: 2263. Ссылка:
https://bit.ly/3rAdo0e
87. Икеда С., Такахаши С., Сузуки Н., Ханзава Ф., Хорио Ф. и др. (2020) Кишечник
Микробиота не участвует в Индукция острой фазы экспрессии белка
, вызванная дефицитом витамина С.J Nutr Sci Vitaminol (Токио) 66: 19-23. Ссылка:
https://bit.ly/2WppZYN
88. Sassi F, Tamone C, D’Amelio P (2018) Витамин D: питательное вещество, гормон и иммуномодулятор
. Питательные вещества 10: 1656. Ссылка: https://bit.ly/2UPW63h
89. Риччио П., Россано Р. (2018) Диета, кишечная микробиота и витамины D + A при множественном склерозе
Риччио П., Россано Р. (2018) Диета, кишечная микробиота и витамины D + A при множественном склерозе
. Нейротерапия 15: 75-91. Ссылка: https://bit.ly/3y5pIIr
90. Чой Й, Ли С., Ким С., Ли Дж, Ха Дж и др. (2020) Потребление витамина E (α-токоферол)
влияет на состав микробиоты кишечника.Int J Food Sci Nutr 71:
221-225. Ссылка: https://bit.ly/372SsFQ
91. Шаббир У, Рубаб М., Далири Э.Б., Челлия Р., Джавед А. и др. (2021) Куркумин,
Кверцетин, катехины и метаболические заболевания: роль кишечника Микробиота.
Питательные вещества 13: 206. Ссылка: https://bit.ly/2VczWYC
Дисбактериоз кишечника и здоровье человека
Здоровье кишечника выходит далеко за рамки того, что происходит в пищеварительной системе. Плохое здоровье кишечника означает плохое общее состояние здоровья, а любой дисбаланс кишечных бактерий может вызвать широко распространенные проблемы со здоровьем.От проблем, связанных с кожей, до ожирения, кишечные бактерии играют определенную роль.
Давайте подробнее рассмотрим дисбактериоз кишечника, что это такое и почему несбалансированные кишечные бактерии вызывают такие распространенные проблемы со здоровьем.
Мы также рассмотрим различные лечебные средства, изменения в питании и образе жизни, которые вы можете внести, чтобы помочь лучше поддерживать кишечные бактерии и, таким образом, улучшить ваше здоровье.
Что такое дисбактериоз?
См. Также: Сколько токсичных экскрементов попадает в толстую кишку вашего тела?
Во-первых, давайте поговорим о том, что такое дисбактериоз.Это причудливое название для несбалансированных кишечных бактерий. Дисбактериоз кишечника может привести ко всем типам нежелательных симптомов, поскольку микробиом кишечника играет такую большую роль в общем состоянии здоровья. При правильном балансе кишечных бактерий пищеварение и иммунная функция имеют возможность работать должным образом. Когда присутствует дисбаланс, могут возникнуть серьезные проблемы с пищеварением и здоровьем.
Что вызывает дисбактериоз?
Дисбактериоз кишечника возникает, когда вредные микробы подавляют полезные кишечные бактерии.
Это может быть вызвано рядом причин, в том числе:
- Использование антибиотиков
- Длительное использование ингибиторов протонной помпы
- Употребление алкоголя — употребление более двух алкогольных напитков в день может привести к дисбиозу. . (1)
- Хронический стресс
- Пищевая аллергия или повышенная чувствительность
- Нездоровая диета без продуктов, богатых питательными веществами и клетчаткой
- Химиотерапия
- Использование противозачаточных таблеток
- Бактериальные инфекции
- Паразиты
Симптомы кишечного дисбактериоза
- Расстройство желудка
- Кислотный рефлюкс
- Кислотный рефлюксa Газ
- Судороги
- Вздутие живота
- Усталость
- Мозговой туман
- Неприятный запах изо рта
64- Беспокойство
- Депрессия
- Дефицит витаминов / минералов
- Увеличение веса или потеря веса
- Мигрень
Насколько важно для здоровья 9242 Насколько важно ваше здоровье 9242 знайте, что симптомы дисбактериоза действительно могут варьироваться от человека к человеку. Хотя дисбактериоз кишечника начинается в кишечнике, повреждение кишечника, вызванное дисбалансом бактерий, может привести к появлению симптомов, которые влияют на другие части тела. Дисбиоз был связан с рядом других проблем, связанных со здоровьем, включая: Как узнать, есть ли у вас дисбактериоз кишечника? Помимо знания симптомов, связанных с дисбактериозом кишечника, существуют также некоторые тесты, которые могут дать вам официальный диагноз. Многие врачи функциональной медицины знакомы с различными доступными тестами и могут предложить одно из следующих.(6) Важно помнить, что хотя диагностические тесты доступны, они могут быть дорогостоящими. Вам не обязательно иметь официальный диагноз, чтобы внести важные изменения в диету и образ жизни, необходимые для поддержания баланса здоровья кишечника. Итак, если ваши симптомы соответствуют дисбактериозу кишечника, не ждите, пока диагноз начнет вносить изменения, необходимые для улучшения вашего здоровья. Средства от дисбактериоза Когда у вас дисбактериоз кишечника, его может быть чрезвычайно сложно взять под контроль, особенно если вы не вносите надлежащих изменений в диету и образ жизни. Когда вредные кишечные бактерии побеждают полезные кишечные микробы, этих полезных бактерий становится все меньше и меньше. Когда это происходит, вредные бактерии имеют возможность размножаться, что ухудшает дисбактериоз и все симптомы, которые он может вызывать. Если вы страдаете дисбактериозом кишечника, вы можете сделать несколько вещей, чтобы восстановить баланс кишечных бактерий. Вы также хотите способствовать росту большего количества полезных бактерий, что возможно только в оптимальной кишечной среде. Вот несколько шагов, которые вы можете предпринять, чтобы помочь: Добавки с пробиотиками: Пробиотики — отличный выбор добавок при дисбактериозе кишечника.Пробиотики могут помочь пополнить запасы полезных бактерий в кишечнике, но важно выбирать пробиотики высокого качества. Пробиотики ProBion предназначены для растворения в течение 150 минут, чтобы обеспечить максимальное всасывание и активацию бактерий как в тонком, так и в толстом кишечнике. ProBion также содержит различные штаммы бактерий для оптимального баланса здоровья кишечника, а также инулин, пребиотик, который помогает питать полезные бактерии. Помимо важных изменений в диете и образе жизни, добавление пробиотиков ProBion — отличный способ пополнить кишечник полезными бактериями и помочь начать восстановление баланса. Изменения в рационе: Диета очень важна, когда дело доходит до здоровья кишечника, и это может быть разница между дальнейшим нарушением баланса кишечных бактерий или улучшением микробиома. Путем диетических изменений, таких как отказ от рафинированных и обработанных продуктов с высоким содержанием сахара, которые питают вредные бактерии, и соблюдение диеты из цельных продуктов, вы можете улучшить работу кишечника и общее состояние здоровья. Вот некоторые диетические рекомендации, которые следует учитывать при приеме пищи для поддержания здоровья кишечника. Продукты, которых следует избегать: Еда для удовольствия Выявление пищевой аллергии / чувствительности: Другой важной частью балансировки бактерий в кишечнике является выявление основных пищевых аллергий и чувствительности. Поскольку потребление продуктов, на которые реагирует ваше тело, может привести к воспалению и ухудшению здоровья кишечника, вам нужно исключить продукты, к которым вы чувствительны. Аллергологи могут идентифицировать настоящую пищевую аллергию, а врачи и диетологи могут проводить анализы крови, чтобы определить любую основную пищевую чувствительность, которая может вызывать как воспаление, так и симптомы кишечника. Другой способ определить потенциальную чувствительность к пище — это попробовать элиминационную диету, при которой вы исключаете продукты, к которым, как вы подозреваете, чувствительны, в течение как минимум двух недель. Затем вы могли бы повторно вводить их по одному и следить за любыми симптомами, которые могут появиться снова. Если проблемы с пищеварением или другие хронические симптомы возвращаются, вы захотите исключить эту пищу из своего рациона. Исключив воспалительные и реактивные продукты, ваш кишечник имеет гораздо больше шансов на выздоровление и восстановление оптимального баланса. Изменения образа жизни: Хронический стресс — основная причина проблем со здоровьем кишечника, включая дисбактериоз кишечника. Чтобы уменьшить стресс, подумайте о том, чтобы добавить больше регулярных упражнений в свой образ жизни, практиковать ежедневную медитацию и делать больше того, что вам нравится. Йога также может быть чрезвычайно полезной, поскольку помогает снизить стресс, а также поддерживает кровоток из мозга и кишечника. (9) Это мощный способ поддерживать связь между кишечником и мозгом, что является неотъемлемой частью поддержания как физического, так и психического здоровья. Постарайтесь найти время для ежедневного снижения стресса. Всего пятнадцать минут в день могут иметь огромное значение для вашего самочувствия. Устранение дефицита питательных веществ: К сожалению, дисбиоз кишечника может привести к дефициту питательных веществ, поэтому часть протокола лечения дисбактериоза кишечника будет пополнить ваши запасы питательных веществ. Всегда полезно работать с врачом, который может провести тесты, чтобы определить, каких витаминов и минералов у вас может быть дефицит, а затем разработать план по их восстановлению. Важно поддерживать ваши запасы витаминов и минералов, поскольку дисбактериоз кишечника может вызвать дефицит определенных питательных веществ, но определенный дефицит также может усугубить это состояние. Лучший способ получить достаточно того, что нужно вашему организму, — это исключить обработанные и воспалительные продукты и сосредоточиться на продуктах, богатых питательными веществами. Вы также можете получить много продуктов, богатых пробиотиками, из таких продуктов, как квашеная капуста, кимчи и жирный несладкий йогурт из кокосового молока в дополнение к вашей пробиотической добавке. Итог Существует множество исследований, доказывающих, что несбалансированная кишечная микробиота способствует развитию болезней, а дисбактериоз является серьезной проблемой и фактором риска многих хронических заболеваний. (10) Если вы страдаете от несбалансированных кишечных бактерий и имеете другие проблемы со здоровьем, возможно, существует более тесная связь между здоровьем вашего кишечника и другими симптомами, которые вы можете испытывать. Суть в том, что мы должны поддерживать здоровье кишечника, чтобы поддерживать общее состояние здоровья.Здоровье начинается в кишечнике, и очень важно серьезно относиться к состоянию кишечных бактерий. Если вы подозреваете, что имеете дело с дисбактериозом кишечника, подумайте о работе с практикующим специалистом по функциональной медицине, который может провести специальное диагностическое тестирование. Чтобы сразу же поддержать здоровье кишечника, вы также можете соблюдать необходимые диеты, образ жизни и дополнительные меры, чтобы восстановить баланс кишечных бактерий. Самым важным шагом, который вы можете предпринять для защиты своего здоровья и улучшения баланса кишечных бактерий, является отказ от употребления воспалительных и обработанных пищевых продуктов.Вы также можете наслаждаться ферментированными продуктами, уменьшать стресс и принимать добавки с высококачественными пробиотиками, такими как ProBion, чтобы помочь восстановить баланс кишечных бактерий и восстановить здоровье кишечника. Ресурсы (1,6,7,9) Что вызывает дисбактериоз и как его лечить? https://www.healthline.com/health/digestive-health/dysbiosis https://gut.bmj.com/content/53/7/1057.1 https://www.ncbi.nlm.nih.gov/pubmed/15253677 (8) Многочисленные преимущества костного бульона: всесторонний обзор. https://chriskresser.com/the-bountiful-benefits-of-bone-broth-a-comprehensive-guide/ (10) Дисбактериоз кишечной микробиоты при заболеваниях. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4315779/ Одна из многих проблем, ставящих в тупик ученых, исследующих COVID-19 — это всестороннее разнообразие его симптомов, которые выходят далеко за пределы обычного диапазона респираторных инфекций: от потери обоняния до образования тромбов и инсульта до боли в конечностях и обесцвечивания пальцев ног, вызванных COVID. Одно из наиболее частых недыхательных проявлений — желудочно-кишечные расстройства.До 50 процентов пациентов с COVID испытывают тошноту, диарею и / или боль в животе. И, согласно канадскому обзорному документу, для 16 процентов в одном большом исследовании это были единственные симптомы. Исследования показывают, что SARS-CoV-2 — вирус, вызывающий COVID, — может напрямую атаковать эпителиальные клетки, выстилающие желудочно-кишечный тракт, проникая через молекулярный дверной проем ангиотензинпревращающего фермента 2 (ACE2). Эти клетки экспрессируют высокие уровни ACE2, как и клетки, выстилающие легкие — первичный очаг инфекции. Но кишечник — это не просто пассивная мишень для вируса. Имеющиеся данные свидетельствуют о том, что он также играет важную роль в определении серьезности COVID-19. Всплеск исследований за последнее десятилетие показал, что крошечные обитатели пищеварительного тракта — кишечная микробиота — играют жизненно важную роль в защите организма от патогенов и в регулировании иммунных реакций на инфекции, и, похоже, именно так и в случае COVID. . Триллионы бактерий, грибов, вирусов и других одноклеточных организмов обитают в желудочно-кишечном тракте в динамичной комменсальной экосистеме.И у каждого из нас есть свое уникальное сообщество. Когда наша кишечная микробиота находится в разнообразном, но здоровом и сбалансированном состоянии, она поддерживает правильное функционирование нашей иммунной системы. Когда баланс нарушается — состояние, которое ученые называют дисбактериозом, — наша защита оказывается под угрозой, и мы становимся более восприимчивыми к инфекциям. Известно, что разнообразие кишечной микробиоты уменьшается с возрастом. Точно так же существует связь между измененной микробиотой кишечника и хроническими заболеваниями, такими как ожирение, диабет и сердечно-сосудистые заболевания — состояниями, которые предрасполагают людей к тяжелой форме COVID-19.Пока нет доказательств прямой связи между тяжестью COVID и дисбактериозом кишечника, но доказательств растет. В исследовании 2021 года с участием 100 пациентов, госпитализированных с COVID, Сью К. Нг и ее коллеги из Китайского университета Гонконга обнаружили, что в целом микробиом кишечника субъектов (измеренный в образцах стула) был значительно менее разнообразен, чем взятые образцы. из контрольной группы до пандемии, независимо от того, принимали ли пациенты антибиотики или другие препараты. У пациентов с COVID обнаружен дефицит ряда полезных видов бактерий (, ), а степень нарушения микробиома коррелировала с тяжестью заболевания и усилением признаков воспаления. «Некоторые кишечные микроорганизмы с известной иммуномодулирующей функцией были истощены у пациентов с COVID-19», — объясняет Нг. Их истощение может быть фактором «цитокинового шторма», опасного гипервоспалительного состояния, которое иногда наблюдается у пациентов с COVID, говорит Нг, заместитель директора Центра исследований кишечной микробиоты Китайского университета Гонконга. Этот сценарий — один из нескольких способов, с помощью которых жители нашего кишечника могут повлиять на тяжесть COVID. Точные механизмы еще не известны, «но мы можем предположить», — говорит Гарри Сокол, изучающий взаимосвязь между кишечными микробами и иммунной системой в больнице Сен-Антуан в Париже.Он предполагает, что «на ранней стадии инфекции происходит изменение микробиоты кишечника, ведущее к снижению производства [веществ], полученных из микробиоты, которые важны для контроля за инфекцией». Такие изменения наблюдались в исследовании 2021 года, проведенном Соколом, в котором макаки были инфицированы SARS-CoV-2. На более поздней стадии COVID, предполагает Сокол, сокращение количества определенных микробов может повлиять на целостность кишечника. Эти микробы обычно производят вещества, которые помогают поддерживать слизистую оболочку кишечника, включая короткоцепочечные жирные кислоты, такие как масляная кислота.Таким образом, более низкие уровни ключевых бактерий могут вызвать «дырявую кишку», что, в свою очередь, может вызвать вымывание провоспалительных молекул, усиливая цитокиновый шторм, который может вызвать обширное повреждение органов, наблюдаемое в тяжелых случаях COVID. Повреждение кишечника и других органов может быть результатом воспаления, самого вирусного нападения или нарушения нормальных функций ACE2. В кишечнике ACE2 играет множество ролей, в том числе регулирует экологию кишечной микробиоты. Таким образом, неясно, вызывает ли COVID нездоровый кишечник или нездоровый кишечник создает почву для тяжелого COVID.«Наверное, оба правдивы и связаны», — говорит Сокол. Кишечные микробы могут влиять на исход COVID посредством обмена химическими сигналами с клетками легких. Эта недавно обнаруженная «ось кишечник-легкие», как и большинство биологических осей, является двусторонней: кишечные микробы влияют на то, как легкие реагируют на инфекции, а воспаление легких также может изменять микробиоту кишечника. Например, обзорное исследование бразильских ученых, опубликованное ранее в этом году, показало, что химических сигналов, посылаемых кишечными бактериями и принимаемых клетками легких, могут помочь защитить мышей от заражения вирусом гриппа, в то время как мышам дают антибиотики. которые нарушают микробиоту кишечника, ставят под угрозу их иммунный ответ на грипп.Если то же самое верно и в отношении COVID у людей, клиницистам следует с осторожностью применять антибиотики у пациентов с COVID — если, конечно, у них нет вторичных микробных инфекций. По мере того, как ученые узнают больше о роли кишечника в COVID, могут возникнуть другие последствия для лечения и профилактики. Мониторинг здоровья кишечника может быть одним из способов прогнозирования тяжести, а использование пробиотиков и улучшенной диеты для увеличения микробиома может оказаться ценной стратегией. Нг отмечает, что в ее учреждении проводится несколько рандомизированных испытаний со специально разработанной смесью пробиотиков: эти испытания направлены на снижение риска COVID в уязвимых группах, таких как пожилые люди и люди с диабетом, и на улучшение реакции на вакцины COVID.Другие исследователи также проверяют возможные преимущества использования пробиотиков и трансплантации фекальных организмов пациентам с COVID с дефицитом кишечника. Могут быть даже уроки для ужасного «длительного COVID». В своем исследовании 2021 года Нг и ее коллеги обнаружили, что дисбактериоз кишечника сохранялся у многих выздоровевших пациентов с COVID, когда вирус больше не обнаруживался, и что он может способствовать текущим проблемам со здоровьем. В исследовании наблюдали за некоторыми пациентами в течение 30 дней после выздоровления, и авторы считают, что более длительное наблюдение за этой проблемой является оправданным.По словам Нг, «выздоровевшим пациентам может быть целесообразно придерживаться диеты или заниматься видами деятельности, которые, как известно, полезны для кишечного микробиома: увеличивать потребление клетчатки, принимать пробиотики и заниматься спортом». Это хороший совет при любых обстоятельствах. Эта статья является частью редакционно независимой коллекции Springer Nature , которая была подготовлена при финансовой поддержке Lonza . Дисбактериоз кишечника — это термин для описания дисбаланса в комменсальном (обычно резидентном) микробиоме кишечника.Когда баланс бактерий в кишечнике нарушается, обычно из-за слишком высокого содержания сахара и рафинированных углеводов в диете, содержимое кишечника становится более кислым. Это стимулирует разрастание стрептококков и подлесок электронной кишечной палочки. Персонал клиники совместно с Медицинской лабораторией Bioscreen изучает желудочно-кишечные изменения, отраженные в аномальных фекальных тестах пациентов с СРК, а также с РАС и тревогой. Результаты этих тестов и исследований помогают нам сформулировать эффективные протоколы лечения, которые привели к значительным улучшениям, если не нормализации функции кишечника и облегчению симптомов СРК. Здоровый желудочно-кишечный тракт — это тот желудочно-кишечный тракт, в котором обитает определенный набор бактерий. Обычно трудно изменить количество и тип этих здоровых бактерий, и они удивительно стабильны во многих различных популяциях по всему миру, даже несмотря на то, что мы живем в разных средах и питаемся по-разному. Становится широко признанным, что изменения в популяции и количестве этих бактерий могут отрицательно повлиять на наше здоровье.Это связано с тем, что бактерии в нашем пищеварительном тракте производят много витаминов, микроэлементов и химикатов, которые поддерживают здоровье нашего организма. Когда эти бактерии не распространяются нормально, химические вещества, вредные для нашего здоровья, могут вырабатываться в больших количествах и вызывать дисфункцию. Вот почему стало доступно так много бактериальных добавок (пробиотиков). Например, широко распространены пробиотики, содержащие Lactobacillus acidophillus и Bifidobacterium , и их польза для здоровья широко рекламируется.К сожалению, это не так просто, как разговоры о пробиотиках. Часто эти общие бактерии разрастаются в кишечнике, что приводит к увеличению выработки амина, что, в свою очередь, вызывает когнитивный дефицит и дефицит внимания, депрессию и усталость. В нашем толстом кишечнике есть два основных класса бактерий: аэробные бактерии, которым необходим кислород для выживания, и анаэробные бактерии, которые погибают в присутствии кислорода. Наиболее распространенными аэробными бактериями или аэробами, обнаруживаемыми у здоровых людей, являются Escherichia coli ( E.coli ) и составляет 90-95% всех аэробных бактерий. Второй по распространенности аэроб — это Enterococcus, , хотя он намного реже, чем E.coli , в среднем 5% в кишечнике. По нашему опыту, количество E.coli часто бывает довольно низким при СРК, примерно 50% по сравнению с нормальными 90-95%. Примерно у 80% пациентов с СРК, которых мы тестировали, процент E.coli составлял менее 10% аэробов и ассоциировался с депрессией и усталостью.В других 20% случаев перерос стрептококк , заменяющий E.coli , состояние, также связанное с аналогичными симптомами. Изменения в анаэробах или бактериях, которые не любят кислород, также обычно очевидны. Обычно Bacteroides являются наиболее многочисленными анаэробными бактериями в нашем толстом кишечнике. Мы постоянно обнаруживаем значительное снижение количества Bacteroides и увеличение количества Bifidobacteria в фекалиях пациентов с СРК по сравнению со здоровыми контрольными субъектами Анализ аминокислот в моче пациентов с СРК также показывает снижение основных аминокислот-предшественников нейромедиаторов и других аминокислот и органических кислот, участвующих в выработке энергии и метаболизме мышц.Триптофан имеет особое значение, поскольку он является предшественником серотонина, который является важным нейромедиатором головного мозга и необходим для поддержания моторики и функции желудочно-кишечного тракта. Интересно, что E.Coli и бактероиды производят триптофан, расщепляя белки. Мы используем анализы мочи Pathlab и фекальные тесты Bioscreen для выявления изменений в биохимии тела, микробиологии и пищеварительной способности.Характер результатов этих тестов может предоставить возможности для определения протоколов лечения, которые могут включать: Болезнь Хантингтона характеризуется триадой моторных, когнитивных и психических нарушений, а также непреднамеренной потерей веса. Хотя большая часть исследований была сосредоточена на когнитивных, моторных и психиатрических симптомах, степень периферической патологии и взаимосвязь между этими факторами и основными симптомами болезни Хантингтона относительно неизвестны.Микробиота кишечника является ключевым модулятором связи между мозгом и кишечником, а изменения в составе микробиоты (дисбиоз) могут отрицательно влиять на познавательные способности, поведение и аффективные функции и могут быть вовлечены в прогрессирование заболевания. Кроме того, недавно сообщалось о дисбактериозе кишечника у трансгенных мышей с болезнью Гентингтона. Наша основная цель состояла в том, чтобы охарактеризовать микробиом кишечника у людей с болезнью Гентингтона и определить, насколько состав кишечной микробиоты в значительной степени связан с клиническими показателями прогрессирования заболевания.Мы сравнили 42 носителя генной экспансии болезни Гентингтона, в том числе 19 человек, у которых была диагностирована болезнь Хантингтона (общая функциональная способность> 6), и 23 человека на стадии до проявления, с 36 здоровыми людьми из контрольной группы, сопоставимыми по возрасту и полу. Участники были охарактеризованы клинически с использованием набора когнитивных тестов и результатов секвенирования рРНК от 16S V3 до V4 образцов фекалий для характеристики микробиома кишечника. Для измерения микробиома кишечника мы обнаружили значительные различия в микробных сообществах (бета-разнообразие) на основе невзвешенного расстояния UniFrac ( P = 0.001), а также значительно более низкое альфа-разнообразие (видовое богатство и однородность) между нашей объединенной группой носителей экспансии гена болезни Хантингтона и здоровым контролем ( P = 0,001). Мы также обнаружили серьезные сдвиги в структуре микробного сообщества на уровне филума и семейства и идентифицировали функциональные пути и ферменты, затронутые в нашей группе носителей экспансии генов болезни Хантингтона. В группе носителей экспансии генов болезни Хантингтона мы также обнаружили ассоциации между кишечными бактериями, когнитивными функциями и клиническими исходами.В целом, наши результаты указывают на измененный микробиом кишечника у носителей экспансии генов болезни Хантингтона. Эти результаты подчеркивают важность биомаркеров кишечника и поднимают интересные вопросы относительно роли кишечника в болезни Хантингтона и того, может ли он быть потенциальной целью для будущего терапевтического вмешательства. Абстрактное графическое изображение Абстрактное графическое изображение Болезнь Хантингтона — это наследственное нейродегенеративное заболевание, которое вызывает прогрессирующее снижение моторики, когнитивную дисфункцию и психоневрологические симптомы (Walker, 2007).Болезнь Хантингтона вызывается зависящей от возраста пенетрантностью расширенной последовательности цитозин-аденин-гуаниновых повторов (CAG) в гене хантингтина (Tabrizi et al. , 2011). Большие экспансии CAG-повторов связаны с более ранним началом заболевания и более быстрым прогрессированием заболевания (Andrew et al. , 1993). На всем протяжении болезни болезнь Хантингтона влияет на широкий спектр функций, включая общение, осведомленность, исполнительную функцию, организацию, память и зрительно-пространственные способности, которые со временем снижаются (Craufurd et al., 2001; Berrios et al. , 2002; Paulsen et al. , 2008 г .; Росс и Тебризи, 2011). Снижение когнитивных функций в конечном итоге перерастает в деменцию, и, кроме того, депрессия и самоубийства, по оценкам, в 5–10 раз чаще встречаются при болезни Хантингтона, чем среди населения в целом (Berrios et al. , 2002; Walker, 2007). В головном мозге болезнь Хантингтона рано и серьезно поражает базальные ганглии, но последствия болезни Гентингтона для мозга прогрессируют и распространяются на ряд корковых и подкорковых структур, затрагивая как серое, так и белое вещество (Tabrizi et al., 2009, 2011; Domínguez et al. , 2016). Предполагается, что эти изменения головного мозга объясняют клинические проявления, наблюдаемые при болезни Хантингтона (Ross and Tabrizi, 2011), однако периферическая патология является малоизученной областью исследований. Помимо когнитивных, моторных и психоневрологических симптомов, которые, вероятно, связаны с изменениями мозга, люди с болезнью Хантингтона также испытывают ряд желудочно-кишечных расстройств, включая диарею, дефицит питательных веществ, гастрит и непреднамеренную потерю веса, которые считаются клиническими признаками. болезни Хантингтона (Djousse et al., 2002; Роббинс и др. , 2006; van der Burg et al. , 2017). Некоторые данные свидетельствуют о том, что эти нарушения являются проявлением дисфункции желудочно-кишечного тракта (van der Burg et al. , 2011). Кроме того, желудочно-кишечные расстройства могут быть косвенными последствиями других прогрессирующих признаков заболевания, таких как снижение когнитивных функций и снижение подвижности. Хотя большинство исследований патогенеза болезни Хантингтона сосредоточено на атрофии мозга и сопутствующих когнитивных, поведенческих и психиатрических симптомах, степень, в которой периферическая патология, и в частности кишечник, связана с основными симптомами болезни Хантингтона, остается относительно неизвестной. (Kong et al., 2018). В дополнение к этой картине, обширные данные подчеркивают взаимосвязь между кишечной нервной системой, кишечным микробиомом и мозгом, которые вместе называются осью кишечник-мозг (Carabotti et al. , 2015). Ось кишечник-мозг представляет собой двунаправленную химическую сигнальную систему между желудочно-кишечным трактом и центральной нервной системой (Burokas et al. , 2015). Кроме того, изменения микробиома кишечника влияют на регуляцию настроения, познание и сон (Cryan and Dinan, 2012), и все больше данных свидетельствует о том, что разнообразие кишечного микробиома важно для функции мозга (Dinan and Cryan, 2017).Признание функциональной значимости оси кишечник – мозг становится все более влиятельным и даже считается сдвигом парадигмы в нейробиологии (Mayer et al. , 2014). С ростом исследовательской активности по этой теме появляется все больше и больше данных, которые теперь связывают ось кишечник-мозг с нейродегенеративными, нейродегенеративными и нейропсихиатрическими заболеваниями (Marques et al. , 2016; Sarkar and Banerjee, 2019). Измененные профили микробиома кишечника были зарегистрированы при нескольких нейродегенеративных заболеваниях, таких как рассеянный склероз (Newland et al., 2016), болезнь Паркинсона (Scheperjans et al. , 2015), боковой амиотрофический склероз (Fang et al. , 2016) и болезнь Альцгеймера (Vogt et al. , 2017; полный обзор см. В Саркар и Банерджи, 2019). Наиболее многочисленными доказательствами дисбактериоза кишечника является болезнь Паркинсона (Keshavarzian et al. , 2015; Scheperjans et al. , 2015; Fitzgerald et al. , 2019). Считается, что при болезни Паркинсона изменения в микробиоте кишечника способствуют опосредованному α-синуклеином моторному дефициту и нейровоспалению, которое специфически связывает ось кишечник-мозг с патогенезом заболевания (Sampson et al., 2016; Фитцджеральд и др. , 2019). Кроме того, трансплантация кишечной микробиоты от людей с болезнью Паркинсона мышам обостряет двигательный дефицит, подчеркивая взаимосвязь между кишечной микробиотой и прогрессированием заболевания (Sampson et al. , 2016). Люди с болезнью Паркинсона также проявляют дисбактериоз, и большее количество Enterobacteriaceae коррелирует с тяжестью двигательных симптомов, включая постуральную нестабильность и аномалии походки (Scheperjans et al., 2015). Болезнь Паркинсона, как и другие нейродегенеративные заболевания, связана с более низкими, чем обычно, уровнями Eubacterium hallii и Prevotella (Louis et al. , 2010; Engels et al. , 2016; Gerhardt and Mohajeri, 2018 ). Эти бактерии участвуют в производстве короткоцепочечных жирных кислот, которые играют важную роль в гомеостазе кишечника, функции кишечника и толстой кишки (Bourassa et al. , 2016) и могут быть механизмом, лежащим в основе некоторых кишечных признаков и симптомы, наблюдаемые при болезни Паркинсона. По сравнению с обширными доказательствами болезни Паркинсона, исследований микробиома кишечника у людей с болезнью Хантингтона не сообщалось, несмотря на интригующие результаты, полученные на животных моделях с болезнью Хантингтона (Kong et al. , 2018; Radulescu et al. , 2019). Например, исследования на мышах с болезнью Хантингтона демонстрируют дисфункцию кишечника, а также доказательства эндокринной дисфункции, включая гормональные нарушения, снижение кишечных нейропептидов, уменьшение толщины слизистой оболочки и длины ворсинок (Ferrante et al., 2000; van der Burg et al. , 2011 г .; McCourt et al. , 2015). Более того, недостаточный энергетический обмен, а также различия в метаболизме сыворотки и спинномозговой жидкости наблюдались у трансгенных крыс с предсимптомной болезнью Хантингтона (Verwaest et al. , 2011). Совсем недавно на трансгенных мышах R6 / 1 Kong et al. (2018) обнаружил первое конкретное свидетельство дисбактериоза кишечника на модели болезни Хантингтона, обнаружив увеличение Bacteroidetes и пропорциональное уменьшение Firmicutes.В этом исследовании дисбактериоз кишечника также был связан с ухудшением массы тела и двигательными нарушениями. Учитывая доклинические данные о дисбактериозе кишечника на моделях болезни Хантингтона и клинические данные о симптомах кишечника при болезни Хантингтона, а также наметившуюся картину дисбактериоза кишечника при нейродегенеративных состояниях, в этом исследовании мы использовали образцы фекалий, чтобы выяснить, соответствует ли микробиом кишечника синдрому Хантингтона. Носители экспансии гена болезни (HDGEC) отличаются от здоровых людей из контрольной группы (HC) соответствующего возраста и пола.Мы стремились исследовать различия с точки зрения богатства и равномерности разнообразия кишечника, что придает устойчивость функции кишечника, состава микробных сообществ , на что указывает таксономический анализ и различные типы и семейства бактерий, составляющих композиционный состав. различия, и функциональные пути и ферменты , связанные с этими профилями кишечника. Мы также изучили взаимосвязь между типом, семейством и некоторыми видами бактерий с клиническими показателями двигательной и когнитивной функции. Мы изучили 42 HDGEC, в том числе 19 человек с диагнозом «болезнь Хантингтона», 23 человека на пре-манифестной стадии и 36 HCs. Генетически подтверждено, что все преманифестные HDGEC имеют расширение CAG при болезни Хантингтона (то есть CAG ≥ 39; за исключением одного преманифеста HDGEC, близкого к явному диагнозу). Для выборки болезни Хантингтона диагноз был поставлен путем неврологического обследования и классификации неврологом участника как клинически симптоматического на основании однозначных моторных признаков болезни Хантингтона с использованием унифицированной шкалы оценки болезни Хантингтона (UHDRS; Kieburtz et al., 2001). Мы использовали шкалу продуктов CAG-возраста (CAP S ), чтобы классифицировать участников с предварительным проявлением HDGEC на основе 5-летней вероятности симптоматического диагноза на пороговые значения низкой, средней и высокой вероятности на основе оптимизации. алгоритм из исследования PREDICT-HD (Epping et al. , 2013). CAP S вычисляется путем умножения возраста на момент тестирования (Возраст 0 ) на масштабирование длины повтора CAG, где CAP S = Возраст 0 × (CAG — 33.66) / 432,3326 (Чжан и др. , 2011 г.). У нас было семь предварительных участников в нижнем пороге (CAP S <0,67), семь участников в среднем пороге (CAP S между 0,67 и 0,85) и семь участников в высоком разрезе. -выкл (CAP S > 0,85). Мы не смогли рассчитать CAP S для двух участников из-за отсутствия генетических данных. Мы набрали участников из Государственной службы прогрессирующих неврологических заболеваний в больнице Calvary Health Care Bethlehem и из базы данных участников исследования экспериментальной нейропсихологии и клинической когнитивной неврологии Хантингтона в Университете Монаша, Мельбурн, Австралия.Критерии исключения для всех участников включали диагноз, поставленный терапевтом или медицинским работником синдрома раздраженного кишечника, целиакии, диабета или истории любого диагностированного состояния, которое может повлиять на общее состояние кишечника (например, болезнь Крона и язвенный колит). Кроме того, участники были исключены, если у них было психическое заболевание (за исключением психиатрических симптомов, связанных с болезнью Хантингтона), неврологическое заболевание (за исключением болезни Хантингтона), история черепно-мозговой травмы, недавнее использование антибиотиков или противовоспалительных препаратов (последние 2 месяца). или текущее употребление развлекательных веществ. Депрессия широко распространена при болезни Хантингтона (Walker, 2007) и может негативно повлиять на познавательные способности и микробиом кишечника. Поэтому мы провели скрининг участников с использованием пересмотренной шкалы депрессии Центра эпидемиологических исследований (Eaton et al. , 2004). Центр эпидемиологических исследований. Шкала депрессии. Пересмотренные баллы варьируются от 0 до 80, причем более высокие баллы указывают на более выраженные депрессивные симптомы. Поскольку в центре внимания этого исследования находился микробиом кишечника, мы хотели рассмотреть желудочно-кишечные симптомы.Поэтому мы включили клинически используемый показатель здоровья кишечника, опросник оценки состояния желудочно-кишечного тракта (Metagenics ® , 1992). Анкета оценки здоровья желудочно-кишечного тракта включает 35 вопросов, касающихся функционирования желудка, желудочно-кишечного воспаления, функционирования тонкой кишки и поджелудочной железы, а также функции толстой кишки. Баллы по опроснику оценки здоровья желудочно-кишечного тракта варьируются от 0 до 280, причем более высокие баллы указывают на более выраженные желудочно-кишечные симптомы.Мы провели тест чтения взрослых Векслера (Holdnack, 2001), чтобы оценить преморбидный интеллект участников. Тест Векслера по чтению для взрослых состоит из 50 слов, которые не соответствуют стандартным правилам произношения, и участники должны читать эти слова вслух. Более высокий балл (т. Е. Большее количество правильно произнесенных пунктов) отражает более высокую оценку коэффициента преморбидного интеллекта. По этим показателям группы не различались статистически по депрессивным симптомам, самопровозглашенным желудочно-кишечным симптомам или оценкам преморбидного интеллекта. Для HDGEC компоненты UHDRS (Kieburtz et al. , 2001) Total Motor Score (TMS) и Total Functional Capacity (TFC) использовались для характеристики тяжести двигательных признаков и стадии заболевания. Более высокий TMS указывает на более серьезные двигательные признаки. TFC — это шкала оценки клиницистов, включающая пункты, связанные с трудоспособностью, управлением финансами, выполнением домашних обязанностей, самообслуживанием и способностью жить самостоятельно (Shoulson and Fahn, 1979). Эти рейтинги дают оценку TFC, причем более высокие баллы указывают на лучшее функционирование и большую независимость.TFC и TMS были получены от лечащего невролога / клинициста каждого участника HDGEC. TMS для трех участников был недоступен. Демографические и клинические характеристики групп участников представлены в таблице 1. Дополнительная таблица 1 содержит демографическую и клиническую информацию об участниках HDGEC, разделенных по статусу заболевания (т.е. предварительное проявление или манифест). Демографический и клинический профиль участников HDGEC и HC 2 лет после постановки диагноза –13 Демографический и клинический профиль участников HDGEC и HC 2 лет после постановки диагноза –13 Комитет по этике исследований на людях Университета Монаша одобрил это исследование (MUHREC: 8031).Все участники предоставили письменное информированное согласие в соответствии с Хельсинкской декларацией (Всемирная медицинская ассоциация, 2013 г.). Данные, представленные в этом исследовании, были собраны в качестве исходных данных для клинического испытания пробиотиков, которое продолжалось, когда эта рукопись была подготовлена. Участники были проверены на соответствие критериям по телефону, а затем были назначены на 90-минутную сессию оценки в лаборатории. Чтобы сделать возможным сбор пробы фекалий, участникам заранее разослали комплекты для сбора стула.В комплект входили инструкции по сбору и хранению образца стула, а также пробирки для сбора, латексные перчатки, пластиковые контейнеры и герметичные пластиковые пакеты. Чтобы оценить панель кишечных бактерий, участники предоставили образец фекалий в течение 24 часов после сеанса лабораторного тестирования, который они хранили на льду до посещения сеанса тестирования. Когда участники прибыли на сеанс тестирования, мы хранили их образец стула при -80 ° C для последующей обработки. Затем мы выполнили ряд нейропсихологических задач и измерили преморбидный интеллект.Участники также заполнили самооценку депрессии и функции желудочно-кишечного тракта. Мы возместили участникам их время в конце сеанса тестирования. Мы использовали когнитивные показатели из Батареи когнитивных оценок при болезни Хантингтона (HD-CAB), которая представляет собой батарею, специально разработанную для когнитивной оценки в клинических испытаниях болезни Хантингтона (Stout et al., 2014). HD-CAB включает шесть когнитивных тестов. Мы описываем каждую задачу ниже; для более подробной информации обратитесь к Stout et al. (2014). Пересмотренный тест на вербальное обучение Хопкинса (Бенедикт и др. , 1998) — это задание на бумаге и карандаше, которое оценивает словесное обучение и память (немедленное и отложенное вспоминание). Выполняя это задание, участники должны вспомнить как можно больше элементов из списка слов в течение трех обучающих испытаний и испытания отложенного отзыва. Основным критерием результата является общее количество слов, запомненных в трех испытаниях, суммированное с количеством слов, запомненных в отсроченном испытании. Тест модальности символов и цифр измеряет скорость обработки и визуальное внимание (Смит, 1982). Участники должны обратиться к ключу и заполнить каждое пустое поле числом, которое правильно соответствует каждому символу, как можно быстрее в течение 90 секунд. Мерой результата является общее количество правильно заполненных ящиков. Тест на создание следов (Reitan, 1958), части A и B, измеряют скорость обработки и ручного движения, зрительно-пространственное внимание и исполнительные функции.Показателем результата, который мы использовали для этой задачи, является время, затраченное (в секундах) на выполнение части B теста на построение трассы, где участники должны нарисовать непрерывную линию, соединяющую числа и буквы поочередно (от 1 до A, от A до 2, от 2 до Б и др.). Более продолжительное время указывает на более низкую производительность. Постукивание в темпе (Rowe et al. , 2010; Stout et al. , 2014) — это компьютеризированная задача, используемая для измерения психомоторной координации и времени. Участникам предлагается нажимать на мышь, чередуя большие пальцы в постоянном ритме.Они проходят четыре идентичных испытания. Показателем результата для этой задачи является величина, обратная стандартному отклонению интервала между нажатиями, которая измеряет общую согласованность скорости нарезания резьбы. Более высокие значения указывают на лучшую производительность. Задача на распознавание эмоций (Johnson et al. , 2007) — это компьютеризированная мера способности участников распознавать эмоции в выражениях лиц. Участникам представлены черно-белые сфотографированные лица, на которых изображены семь эмоциональных выражений: гнев, отвращение, страх, счастье, печаль, удивление или нейтральный характер.Мерилом результата является правильное количество идентифицированных отрицательных эмоций (гнев, отвращение, страх и печаль). Более высокие баллы указывают на большую точность. Чулки One Touch Stockings of Cambridge (OTS) — это модифицированная сокращенная версия (6Touch20) задачи CANTAB ® OTS. OTS — это компьютеризированная задача, которая измеряет рабочую память и пространственное планирование (Роббинс и др. , 1994; Уоткинс и др. , 2000). Участники должны представить движущиеся шары (по одному), чтобы нижнее расположение шаров совпадало с верхним за как можно меньшее количество ходов.Во время каждого испытания участникам предлагается выбрать минимальное количество ходов (от одного до шести), необходимое для того, чтобы нижний набор соответствовал верхнему. Измерение результата — это среднее время для достижения правильного ответа (в секундах), усредненное по всем испытаниям. Более высокие значения указывают на более низкую производительность. Используя шесть тестов, включенных в HD-CAB, мы вычислили общий балл для измерения когнитивных результатов. Сначала мы изменили масштаб теста Trail Making Test (Часть B) и OTS, чтобы более высокие баллы отражали лучшую производительность.Для этих переменных все значения умножались на -1, а затем ко всем значениям добавлялось постоянное значение (максимальное значение для каждой переменной). Затем мы вычислили равновзвешенный составной балл, добавив средний стандартизованный балл Z для каждого отдельного теста (пересмотренный тест на вербальное обучение Хопкинса, тест на определение символьных цифр, тест на создание следов, часть B, темповое постукивание, распознавание эмоций и OTS) . Мы также вычислили отдельные равновзвешенные когнитивные композитные баллы, стандартизированные только для нашей группы HDGEC, для определенных анализов, ограниченных группой HDGEC. Мы извлекли аликвоту 200–250 мг из каждой замороженной пробы фекалий и поместили их в пробирки для экстракции гранул на 2 мл. Пробирки для экстракции гранул хранили на сухом льду и доставили в Австралийский центр геномных исследований в Аделаиде, Южная Австралия, для экстракции геномной ДНК бактерий. Все образцы, включенные в этот отчет, были извлечены в один момент времени, чтобы исключить вариации результатов из-за возможных эффектов партии.Ген 16S V3 – V4 рРНК (341F – 806 R), который является гипервариабельной областью бактериальной рРНК для отслеживания филогении, был амплифицирован, и конечные концентрации были определены с помощью флуорометрии. Все включенные аликвоты содержали> 0,50 нг / мкл пригодного для использования ампликона и считались достаточными для стадии секвенирования. Amplicon были объединены и секвенированы с использованием секвенатора нового поколения Illumina MiSeq. Затем считывания были демультиплексированы и качество обрезано перед удалением шума с использованием параметров по умолчанию в DADA2 v1.12 в R (Callahan et al., 2016), чтобы получить таблицу вариантов последовательности ампликона (ASV). Образцы, у которых не было как минимум 1000 считываний, не были включены в наш анализ. ASV были сопоставлены с базой данных SILVA 132_99 (Quast et al. , 2012) для получения таксономической идентичности считываний. Результаты этого процесса были представлены в виде таблицы относительной численности бактерий на уровне филюмов и семейств. Полный набор данных результатов, полученных в результате анализа, включал бактерии из семи типов, 32 семейств и 79 родов.Большинство бактериальных Phyla во всех образцах были Firmicutes (83%), Actinobacteria (9%), Bacteroidetes (4%) и Verrucomicrobia (1,1%). Чтобы охарактеризовать богатство , ровность и состав микробиомной среды , мы оценили альфа- и бета-разнообразия. Мы использовали количество наблюдаемых ASV, а также индекс Фишера, чтобы определить насыщенность и равномерность, т.е.е. альфа-разнообразие микробного сообщества каждого участника и невзвешенные расстояния UniFrac для группового состава среды, то есть бета-разнообразие. Для показателей альфа-разнообразия считывания были уменьшены до 1984 считываний, что является минимальным глобальным числом считываний в когорте. Для бета-разнообразия невзвешенные расстояния UniFrac были рассчитаны и упорядочены в основном скоординированном анализе для визуализации вариации данных. Невзвешенное расстояние UniFrac объясняет филогенетические отношения между ASV.Адонис (многомерный дисперсионный анализ перестановок) из «веганского» пакета v2.5.6 R был выполнен с 999 перестановками (Dixon, 2003). Adonis предоставляет значение R 2 по шкале от 0 до 1, что указывает на величину отклонения, объясняемую протестированными факторами. Как альфа-, так и бета-разнообразие анализировали с использованием пакета «Phyloseq» v1.28 R (McMurdie and Holmes, 2013). Для изучения различий, которые описывают наблюдаемые различия в составе микробной среды, мы использовали таксономический анализ на уровне типа и семейства.Редкие бактериальные семейства были отфильтрованы с использованием порогового значения минимум 10 считываний на образец, в результате было всего 29 бактериальных семейств и 7 типов. сырых последовательностей были пропущены через рабочий процесс PICRUSt2 для получения комиссионных номеров ферментов и численности ортологов Киотской энциклопедии генов и геномов, которые описывают потенциальные нарушения ферментов микробиома кишечника и функциональных путей, соответственно (Douglas et al., 2020). Как и в случае анализа состава микробиома, альфа- и бета-разнообразие Киотской энциклопедии генов и геномов, численность ортологов и номера комиссий по ферментам были проанализированы с помощью Phyloseq in R. Мы использовали тест Краскала-Уоллиса для сравнения измерений видового богатства и альфа-разнообразия между группами и многомерный дисперсионный анализ Adonis Permutation для сравнения микробного состава (индексы бета-разнообразия) между группами.Для изучения таксономий мы использовали анализ состава микробиомов, реализованный в QIIME2 v2019.7 (Caporaso et al. , 2010), чтобы проверить различие численности бактерий между группами HDGEC и HC на уровнях типа и семейства (Mandal ). и др., , 2015). Показано, что анализ состава микробиомов контролирует частоту ложных открытий при сохранении высокой мощности и намного лучше подходит для анализа данных об относительной численности микробиома по сравнению с другими стандартными статистическими тестами, такими как t -тест и ANOVA (Mandal et al. ., 2015). Значение W-статистики, полученное в результате анализа состава микробиомов, указывает, сколько раз нулевая гипотеза была отклонена для каждого ASV с коэффициентом ложного обнаружения <0,05. Для всех анализов групповых различий (HDGEC по сравнению с HC) мы контролировали гендерные эффекты. Чтобы сравнить функциональные пути и ферменты между группами, мы использовали многомерный разреженный частичный дискриминантный анализ методом наименьших квадратов, метод обучения с учителем, реализованный в пакете mixOmics v6.8.5 R (Le Cao et al., 2016), чтобы идентифицировать сигнатуру, отличающую HDGEC от группы HC. Мы использовали независимые выборки t -тест для изучения различий в когнитивных способностях (составной балл HD-CAB) между нашими группами HDGEC и HC. Затем, используя только HDGEC, мы изучили связи между микробиомом кишечника, когнитивными исходами (составной балл HD-CAB) и клиническими исходами, связанными с болезнью Хантингтона (UHDRS – TMS, UHDRS – TFC и CAP S ), с использованием шкалы Спирмена. коэффициенты ранговой корреляции, учитывая неравномерность распределения наших кишечных переменных.Для ассоциаций между UHDRS – TMS, UHDRS – TFC и бактериальными данными было необходимо ограничить анализ только проявлением HDGEC, потому что эти клинические меры, которые были разработаны для использования при симптоматической HD, демонстрируют существенные ограничения диапазона (эффекты потолка) в premanifest группа, где двигательные симптомы и функциональное снижение еще не очевидны. Кроме того, мы исследовали связь между бактериальными данными и оценками CAP S только для преманифестных HDGEC, учитывая, что CAP S является прогностическим критерием начала симптоматического заболевания.Переменные пола и возраста существенно не коррелировали с этими клиническими исходами. Секвенирование 16S рРНК дает тысячи кишечных переменных, поэтому важно ограничить анализ этих переменных, чтобы ограничить ошибку 1-го типа. Таким образом, мы выбрали исходы для бактерий на основе предыдущих исследований болезни Паркинсона и других состояний, которые документально подтвердили связь между конкретными бактериями, прогрессированием заболевания и когнитивными функциями (Bajaj et al. , 2012; Bruce-Keller et al., 2015; Manderino et al. , 2017; Парашар и Удаябану, 2017; Герхардт и Мохаджери, 2018; Жан и др. , 2018; Weis et al. , 2019). Для этих анализов на уровне Phylum мы исследовали Bacteroidetes, Firmicutes, Verrucomicrobia и Proteobacteria; на уровне семейства мы исследовали Akkermansiacea , Bacteroidaceae , Bifidobacteriaceae , Christensenellaceae , Lachnospiraceae , Ruminococcaceae и Streptococceae. Мы также исследовали один вид, E. hallii . Необработанные данные этих анализов доступны по разумному запросу. Что касается насыщенности и однородности микробной среды, которая обычно связана с сопротивляемостью кишечной среды, HDGEC показали меньшее альфа-разнообразие по сравнению с HC. В частности, для альфа-разнообразия наблюдаемые индексы и индексы Фишера были ниже ( P = 0.001), что указывает на меньшее количество присутствующих видов и более низкую равномерность в HDGEC, чем в HC; Рис. 1А. Бета-разнообразие, указывающее на структуру микробного сообщества, значительно различается в HDGEC по сравнению с HC, на основе невзвешенных расстояний UniFrac, P = 0,001; Рис. 1Б. Рисунок 1 Различия в альфа- и бета-разнообразии кишечного микробиома в группах HDGEC и HC. ( A ) Анализ альфа-разнообразия, изучающий богатство (наблюдаемое) и равномерность (Fisher) в группах HDGEC по сравнению с группами HC.( B ) Анализ бета-разнообразия, показывающий вариации в составе образцов на основе их филогенетического расстояния (невзвешенное расстояние UniFrac) в группах HDGEC по сравнению с группами HC. Рисунок 1 Различия в альфа- и бета-разнообразии кишечного микробиома в группах HDGEC и HC. ( A ) Анализ альфа-разнообразия, изучающий богатство (наблюдаемое) и равномерность (Fisher) в группах HDGEC по сравнению с группами HC. ( B ) Анализ бета-разнообразия, показывающий вариации в составе образцов на основе их филогенетического расстояния (невзвешенное расстояние UniFrac) в группах HDGEC по сравнению с группами HC. Затем, используя анализ состава микробиомов для изучения различий, наблюдаемых в составе микробиома кишечника на уровне типа и семьи, мы обнаружили значимое гендерное взаимодействие в группах с несколькими различиями, выявленными у мужчин. В частности, для мужчин на уровне филума Euryarchaeota, Firmicutes и Verrucomicrobia значительно различались между группами. На уровне семьи многие семьи значительно различались по полу между группами, в том числе Acidaminococcaceae , Akkermansiaceae , Bacteroidaceae , Bifidobacteriaceae , Christensenellaceae , bacterieceae , Corp. , Erysipelotrichaceae , Flavobacteriaceae , Lachnospiraceae , Methanobacteriaceae , Peptococcaceae , Peptostreptococcaceae ell и Rikinell.Для женщин ни на уровне филюма, ни на уровне семьи существенных различий не выявлено. С точки зрения функциональных путей кишечника, согласно Киотской энциклопедии генов и геномов, численность ортологов значительно различалась между HDGEC и HC как по альфа-, так и по бета-разнообразию. В частности, для альфа-разнообразия группа HDGEC показала значительно меньшее богатство и равномерность функциональных путей (наблюдаемые и Fisher) по сравнению с HC ( P = 0,001). HDGEC и HC также значительно различались по составу кишечных путей (бета-разнообразие, P = 0.001). Дополнительный анализ предсказанных путей с использованием разреженного частичного дискриминантного анализа методом наименьших квадратов выявил специфические функциональные пути кишечника, затронутые в группе HDGEC, включая супер-путь биосинтеза серина и глицина, V-путь деградации крахмала, метилэритритолфосфатный путь I, метилэритритолфосфатный путь II и NAD. путь биосинтеза I (рис. 2). На уровне ферментов ферменты глутатионтрансферазы и гомосерин-O-сукцинилтрансферазы значительно различались в группе HDGEC по сравнению с HCs (рис.3). Рисунок 2 Различия в функциональных путях микробиома кишечника между группами HDGEC и HC. Рисунок 2 Различия в функциональных путях микробиома кишечника между группами HDGEC и HC. Рисунок 3 Различия ферментов в микробиоме кишечника между группами HDGEC и HC. Рисунок 3 Различия ферментов в микробиоме кишечника между группами HDGEC и HC. Хотя выборки в группе HDGEC были небольшими, мы исследовали, отличаются ли манифестные HDGEC ( n = 19) от предварительно проявленных HDGEC ( n = 23).Мы не обнаружили статистически значимых различий в богатстве, равномерности и групповом микробном составе кишечника по показателям альфа- и бета-разнообразия. Различия в описании микробного состава, измеренные с помощью таксономического анализа, также не выявили различий между этими группами, за исключением значительной разницы в численности семейства Ruminococcaceae только для мужских HDGEC. Учитывая эти результаты, мы ограничили наше исследование кишечных результатов, представленных выше, сравнениями между комбинированной группой HDGEC (манифестная и преманифестированная HD) и HCs. Интересно, что в наших исследовательских анализах, связывающих показатели кишечника с клинически значимыми характеристиками HDGEC, мы обнаружили несколько ассоциаций, см. Рис. 4. В частности, в явных HDGEC более низкая численность E. hallii коррелировала с более тяжелой двигательной активностью. признаки (UHDRS – TMS; r s = -0,512, n = 16, P = 0,043), однако мы не обнаружили связи между численностью E. hallii и нашим клиническим показателем функциональная емкость (UHDRS – TFC; r с = 0.329, n = 19, P = 0,183). В premanifest HDGECs мы наблюдали значительную отрицательную связь между численностью E. hallii и предполагаемой близостью к началу заболевания (CAP S ), r s = -0,568, n = 21, P = 0,007. Рисунок 4 Взаимосвязь между E. hallii , клиническими показателями прогрессирования заболевания в манифестных HDGEC (TMS и TFC) и предполагаемым началом заболевания (CAP S ) в premanifest HDGEC. Рисунок 4 Взаимосвязь между E. hallii , клиническими показателями прогрессирования заболевания в манифестных HDGEC (TMS и TFC) и предполагаемым началом заболевания (CAP S ) в premanifest HDGEC. Перед тем, как приступить к оценке когнитивных показателей в контексте кишечных исходов, мы изучили групповые различия в общей когнитивной способности, чтобы установить, что, как и ожидалось, группа HDGEC имела когнитивные нарушения по сравнению с группой HC. Групповой анализ подтвердил эту ожидаемую разницу.В целом, группа HDGEC показала более низкие результаты, чем контрольная группа, по составному показателю HD-CAB для общей функции [ t (76) = 3,940, P < 0,001], с большим размером эффекта ( d = Коэна. 0.91), см. Рис. 5. Рисунок 5 Общая результативность между группами (HDGEC и HC) по когнитивным результатам (композитный балл HD-CAB). Рисунок 5 Общая результативность между группами (HDGEC и HC) по когнитивным результатам (композитный балл HD-CAB). С точки зрения ассоциаций между когнитивными и кишечными результатами, E. hallii был связан с характеристиками памяти в пересмотренном тесте на вербальное обучение Хопкинса, r s = 0,315, n = 42, P = 0,042, и аналогичная тенденция наблюдалась для показателя скорости обработки и внимания, Тест модальностей символов и цифр, r s = 0,278, n = 42, P = 0 .074. Эти ассоциации, однако, возникли в контексте многих других несущественных корреляций, и поэтому их следует интерпретировать с осторожностью, поскольку они могут быть ложными. Дополнительные таблицы 2–4 показывают полную степень корреляционного анализа между данными о кишечных бактериях, клиническими показателями и когнитивными функциями в HDGEC. В дополнительной таблице 5 подробно описаны корреляции между самопровозглашенными желудочно-кишечными симптомами (опросник оценки состояния здоровья желудочно-кишечного тракта) и индексами альфа-разнообразия, которые не были значимыми. Обоснование исследования кишечника при болезни Хантингтона подтверждается несколькими линиями доказательств, связывающих различия в изменениях кишечной микробиоты при различных заболеваниях (Dinan and Cryan, 2017; Kowalski and Mulak, 2019; Sarkar and Banerjee, 2019), клиническими показателями дисфункции кишечника при болезни Хантингтона (например, потеря веса, нарушения питания и желудочно-кишечные проблемы), а также недавние доказательства дисфункции кишечника у мышей с болезнью Хантингтона (Kong et al., 2018). Используя секвенирование гена 16S рРНК, наше исследование предоставляет первые доказательства дисбактериоза кишечника у людей с болезнью Хантингтона. Эти результаты подтверждают нашу основную гипотезу об изменении микробиома кишечника в HDGEC по сравнению с HCs, подобранными по возрасту и полу, с точки зрения различий в богатстве, равномерности и общем микробном составе кишечника, на что указывает альфа- и бета-разнообразие, а также дальнейшее описание. по таксономическим изменениям, функциональным путям и различиям ферментов. Мы также обнаружили устойчивые тенденции в развитии болезни Хантингтона, кишечной микробиоте и когнитивных результатах, хотя их следует интерпретировать с осторожностью, учитывая небольшой размер нашей выборки и необходимость проведения нескольких статистических тестов. В соответствии с нашими текущими данными по болезни Хантингтона о более низком альфа-разнообразии и различиях бета-разнообразия, указывающих на меньшее, чем обычно, богатство, однородность и измененный микробный состав кишечника, другие сообщали об аналогичных наблюдениях при нейродегенеративных состояниях, таких как болезнь Паркинсона, болезнь Альцгеймера и боковая амиотрофия. склерозом (Keshavarzian et al. , 2015; Rowin et al. , 2017; Vogt et al. , 2017). В то время как бактерии, ответственные за наблюдаемые изменения показателей разнообразия, варьируются в зависимости от спектра заболеваний, измененное разнообразие микробиоты кишечника при этих заболеваниях указывает на то, что дисбактериоз кишечника, по-видимому, является общей чертой по крайней мере некоторых нейродегенеративных заболеваний. Гомеостаз микробиома кишечника важен для здоровья человека и влияет на поведение и функции мозга через ось кишечник-мозг (Dinan and Cryan, 2017). Таким образом, некоторые из клинических проявлений или изменений мозга, очевидных при болезни Хантингтона, могут быть связаны с кишечной модуляцией воспалительных путей головного мозга посредством коммуникации между кишечником, эндокринными, иммунными и нервными путями (Burokas et al. , 2015). Исследования болезни Альцгеймера и болезни Паркинсона подтверждают связь между кишечником и невропатологией, с доказательствами того, что микробиота влияет на развитие амилоида при болезни Альцгеймера (Kowalski and Mulak, 2019) и патологию α-синуклеина при болезни Паркинсона (Sampson et al., 2016; Фитцджеральд и др. , 2019). Потребуются дальнейшие исследования болезни Хантингтона, чтобы определить связь между микробиотой кишечника и специфической для болезни Гентингтоном невропатологией. Хотя мы наблюдали различия между HDGEC и HC на уровне таксономии, включая гендерные эффекты, мы не наблюдали увеличения Bacteroidetes и пропорционального уменьшения Firmicutes, как это было показано в доклиническом исследовании болезни Хантингтона Kong et al. (2018). В нашей выборке различия, наблюдаемые в Phyla и Families, частично, но не полностью совпадают с опубликованными результатами по другим нейродегенеративным заболеваниям, что неудивительно, учитывая расхождения в литературе как между различными клиническими популяциями, так и между ними (полный обзор см. Герхардт и Мохаджери, 2018). Наше открытие значительно более низкой численности Firmicutes, Lachnospiraceae и Akkermansiaceae у самцов HDGEC интересно, поскольку оно связано с воспалительными процессами, учитывая роль Akkermansiaceae в поддержании кишечного барьера (Chelakkot et al., 2018) и роль Lachnospiraceaes ‘и Firmicutes в производстве масляной кислоты, уменьшении воспаления (Louis et al. , 2010; Stilling et al. , 2016; Truax et al. , 2018 ). Ранее было показано, что уменьшение количества этих бактерий связано с депрессией (Huang et al. , 2018), но мы не обнаружили такой значимой связи при контроле депрессивных симптомов или возраста. Обнаружение гендерного эффекта в результате таксономического анализа указывает на то, что кишечник поражен не только болезнью Хантингтона, но и другими факторами, такими как пол, которые могут влиять на взаимосвязь между микробиотой кишечника и прогрессированием заболевания.Хотя различия в составе кишечника интересны, особенно на ранней стадии нашего понимания микробиома кишечника в таких условиях, как болезнь Хантингтона, текущие исследования должны определить, являются ли наблюдаемые изменения в относительной численности бактерий причиной или результатом аномального поведения кишечника. –Функция мозга. Различия в составе кишечника при болезни Гентингтона по сравнению с HCs не обязательно приводят к желудочно-кишечным проблемам. Напротив, различия в функции кишечника по определению могут иметь клинически значимые последствия.Например, функциональные пути и различия ферментов, наблюдаемые в нашем исследовании, связаны с серином, метионином (включая различия ферментов в гомосерине) и биосинтезом глицина. Эти изменения могут быть важны, поскольку метионин связан с окислительным стрессом (Campbell et al. , 2016), и эти пути связаны с высвобождением глутамата, метаболизмом триптофана и синтезом серотонина и выработкой мелатонина (O’Mahony et al. ). , 2015; Yu, Lau, 2018; Hoglund et al., 2019). Обнаружение различий в этих путях в нашем образце болезни Хантингтона подтверждает предыдущие наблюдения, показывающие ненормальное управление метаболизмом триптофана при болезни Хантингтона, что приводит к более высокому уровню окислительного стресса, который может способствовать нейровоспалению и дисфункции мозга, а также депрессивным симптомам и проблемам с памятью. (Stoy et al. , 2005; Mendelsohn et al. , 2009; Bourassa et al. , 2016; Kałużna-Czaplińska et al., 2019; Gao et al. , 2020). Кроме того, на уровне ферментов значительно более низкие уровни глутатионтрансферазы были обнаружены при болезни Паркинсона и болезни Альцгеймера, и эти изменения связаны с повышенным окислительным стрессом и нейровоспалением (Mazzetti et al. , 2015). Таким образом, наше открытие в группе HDGEC функциональных путей и различий ферментов поднимает интересные вопросы о возможности будущего развития биомаркеров кишечника. Опубликованные данные относятся к познанию бактерий на разных таксономических уровнях, но предыдущие исследования на других нейродегенеративных образцах дали смешанные результаты относительно более высокой или низкой численности конкретных бактерий и их связи с познанием и прогрессированием заболевания (Keshavarzian et al., 2015; Vogt et al. , 2017; Фитцджеральд и др. , 2019; Саркар и Банерджи, 2019). Хотя это предположение, последовательная тенденция, которую мы наблюдали среди E. hallii , прогрессирования и познания болезни Хантингтона, также интересна, учитывая роль этой бактерии в производстве короткоцепочечных жирных кислот, метаболизме триптофана и воспалении. Мы не обнаружили никакой связи между Verrucomicrobia, Bacteroidetes, Proteobacteria и когнитивными исходами, о чем сообщалось в других исследованиях, таких как Manderino et al. (2017). Это исследование предоставляет первые доказательства дисбактериоза кишечника у людей с болезнью Гентингтона, добавляя к растущему числу исследований, которые продемонстрировали измененный профиль микробиома кишечника в различных неврологических и особенно нейродегенеративных популяциях. Понимание взаимодействия между осью кишечник-мозг, кишечным микробиомом и патогенезом прогрессирования заболевания остается постоянной проблемой, особенно с учетом большого количества переменных, которые необходимо анализировать, и неотъемлемой проблемы создания достаточно большого размера выборки у людей, чтобы надежно установить значимые различия.Это особенно актуально в таких исследованиях, как наше, которые ограничены небольшими размерами выборки, поперечным дизайном и другими мешающими переменными, которые затрудняют оценку здоровой микробиоты кишечника, учитывая влияние многих факторов, таких как возраст, лекарства, диета и т. Д. наркотики, окружающая среда и факторы образа жизни. Тем не менее, с точки зрения болезни Хантингтона, учитывая клинические доказательства кишечных симптомов при болезни Хантингтона, недавние доказательства изменения кишечного микробиома у мышей с болезнью Хантингтона (Kong et al., 2018), и теперь наше исследование, описывающее измененную микробиоту кишечника у людей с болезнью Гентингтона, эти первоначальные результаты подчеркивают важность понимания того, как кишечник вписывается в прогрессирование болезни Хантингтона. Чтобы полностью понять этот ключевой аспект болезни, необходимы более масштабные и продольные исследования. Кроме того, наши результаты открывают перспективу выявления биомаркеров кишечника при болезни Хантингтона, что станет возможным благодаря дальнейшему изучению и характеристике микробиома кишечника по отношению к другой фенотипической и, возможно, генотипической информации.Наконец, эти результаты поднимают заманчивое предположение о том, может ли кишечник быть потенциальной целью для будущего терапевтического вмешательства для улучшения результатов при болезни Хантингтона и других нейродегенеративных заболеваниях. Авторы благодарят всех участников, которые добровольно пожертвовали свое время для участия в этом исследовании. J.S. является ведущим научным сотрудником Национального совета здравоохранения и медицинских исследований (NHRMC) правительства Австралии, а А.Х. — главный научный сотрудник NHMRC. Этот проект частично поддерживался стипендией NHMRC — Австралийского исследовательского совета по развитию исследований деменции (грант № 1100862), присужденной Y. G-J. Мы высоко ценим дальнейшие щедрые пожертвования, полученные от Фонда семьи Фокс, Велосипедной группы Торки-Костер, и частное пожертвование от Тейси Фокс. J.S. является директором исследовательской компании Zindametrix, которая поддерживает спонсоров клинических испытаний в использовании HD-CAB и других когнитивных тестов в клинических испытаниях, а также предоставляет консультационные услуги по когнитивной оценке при болезни Хантингтона спонсорам клинических испытаний через Stout Neuropsych Pty Ltd.У остальных авторов нет конкурирующих интересов, о которых можно было бы сообщить. Андрей SE Goldberg PY Кремер Б Telenius H Theilmann J Адам S И знайте, что дисбактериоз может поражать каждую часть тела.
И знайте, что дисбактериоз может поражать каждую часть тела. Он поражает спину и шею, и изменения микрофлоры кишечника также связаны с этим типом артрита.
Он поражает спину и шею, и изменения микрофлоры кишечника также связаны с этим типом артрита.

 Имейте в виду, что вам нужно будет очень внимательно относиться к этим изменениям в питании и образе жизни, чтобы убедиться, что вы помогаете восстановить оптимальный баланс кишечных бактерий и предотвратить дальнейшее размножение вредных кишечных бактерий.
Имейте в виду, что вам нужно будет очень внимательно относиться к этим изменениям в питании и образе жизни, чтобы убедиться, что вы помогаете восстановить оптимальный баланс кишечных бактерий и предотвратить дальнейшее размножение вредных кишечных бактерий. Пробиотики ProBion также не содержат ГМО, молочных продуктов, сои, пшеницы и глютена, что делает их идеальным выбором для веганов или вегетарианцев, а также для тех, кто страдает аллергией на молочные продукты, сою или глютен.
Пробиотики ProBion также не содержат ГМО, молочных продуктов, сои, пшеницы и глютена, что делает их идеальным выбором для веганов или вегетарианцев, а также для тех, кто страдает аллергией на молочные продукты, сою или глютен. (7)
(7) Реакции кишечника: микробы в пищеварительном тракте влияют на тяжесть COVID
Дисбактериоз кишечника при СРК | BNC Melbourne, VIC 3108
КИШЕЧНЫЕ БАКТЕРИИ ПРИ СРК
АЭРОБНЫЕ И АНАЭРОБНЫЕ БАКТЕРИИ
АМИНОКИСЛОТ МОЧИ ПРИ СРК
ЧТО ЭТО ЗНАЧИТ ДЛЯ ЛЕЧЕНИЯ СРК
Дисбактериоз кишечника при болезни Хантингтона: взаимосвязь между микробиотой кишечника, когнитивными функциями и клиническими исходами | Мозговые коммуникации
Аннотация
Введение
Материалы и методы
Участники
Образец измерения характеристик
. . HDGEC = 42
. Контроль = 36
. P / χ 2 значение
. Пол M: F 22:20 15:21 0,345 Возраст (лет) M (SD) 50,16 (12,14) 50,16 (12,14) ) 0,948 Диапазон 26–75 24–69 UHDRS – TMS M (SD) 9.21 (12,71) Диапазон 0–41 UHDRS – TFC M (SD) 9080 Диапазон 6–13 Длительность заболевания M (SD) 5,06 (3,23) 90 Длина CAG M (SD) 41.26 (1,80) Диапазон 38–46 CAP S M (SD) Диапазон 0,32–1,40 Годы образования M (SD) 14,61 (2,94) 14,83 (390) 901 Диапазон 8–21 9–23 Расчетный IQ M (SD) 104,04 (6,99) 106,14 (6,4903) Диапазон 87–115 89–117 GIHAQ M (SD) 21,47 (25,44) 15,81 (21,33) 0,21 (21,33) 0–119 0–116 CESD-R M (SD) 10.92 (10,45) 7,06 (7,75) 0,071 Диапазон 0–43 0–31
Таблица 1 . . HDGEC = 42
. Контроль = 36
. P / χ 2 значение
. Пол M: F 22:20 15:21 0.345 Возраст (лет) M (SD) 50,16 (12,14) 50,55 (13,90) 0,948 Диапазон 26–75 24902 24902 UHDRS – TMS M (SD) 9,21 (12,71) Диапазон 0–41 UHD SD ) 10.90 (2,64) Диапазон 6–13 Продолжительность заболевания (годы после постановки диагноза) Диапазон 1–13 Длина CAG M (SD) 41,26 (1,80) 46 CAP S M (SD) 0.88 (0,25) Диапазон 0,32–1,40 Годы образования M (SD) 14,6901 0,461 Диапазон 8–21 9–23 Расчетный IQ M (SD) 104,04 (6,99) 106,14 (6.43) 0,171 Диапазон 87–115 89–117 GIHAQ M (SD) 21,47 (25,4 )
21,47 (25,4 ) 90
Диапазон 0–119 0–116 CESD-R M (SD) 10,92 (10,45) 0,071 2 7902 902 Диапазон 0–43 0–31 . . HDGEC = 42
. Контроль = 36
. P / χ 2 значение
. Пол M: F 22:20 15:21 0,345 Возраст (лет) M (SD) 50,16 (12,14) 50,16 (12,14) ) 0,948 Диапазон 26–75 24–69 UHDRS – TMS M (SD) 9.21 (12,71) Диапазон 0–41 UHDRS – TFC M (SD) 9080 Диапазон 6–13 Длительность заболевания M (SD) 5,06 (3,23) 90 Длина CAG M (SD) 41.26 (1,80) Диапазон 38–46 CAP S M (SD) Диапазон 0,32–1,40 Годы образования M (SD) 14,61 (2,94) 14,83 (390) 901 Диапазон 8–21 9–23 Расчетный IQ M (SD) 104,04 (6,99) 106,14 (6,4903) Диапазон 87–115 89–117 GIHAQ M (SD) 21,47 (25,44) 15,81 (21,33) 0,21 (21,33) 0–119 0–116 CESD-R M (SD) 10.92 (10,45) 7,06 (7,75) 0,071 Диапазон 0–43 0–31 . . HDGEC = 42
. Контроль = 36
. P / χ 2 значение
. Пол M: F 22:20 15:21 0.345 Возраст (лет) M (SD) 50,16 (12,14) 50,55 (13,90) 0,948 Диапазон 26–75 24902 24902 UHDRS – TMS M (SD) 9,21 (12,71) Диапазон 0–41 UHD SD ) 10.90 (2,64) Диапазон 6–13 Продолжительность заболевания (годы после постановки диагноза) Диапазон 1–13 Длина CAG M (SD) 41,26 (1,80) 46 CAP S M (SD) 0.88 (0,25) Диапазон 0,32–1,40 Годы образования M (SD) 14,6901 0,461 Диапазон 8–21 9–23 Расчетный IQ M (SD) 104,04 (6,99) 106,14 (6.43) 0,171 Диапазон 87–115 89–117 GIHAQ M (SD) 21,47 (25,4 )
21,47 (25,4 ) 90
Диапазон 0–119 0–116 CESD-R M (SD) 10,92 (10,45) 0,071 2 7902 902 Диапазон 0–43 0–31 Этическое разрешение
Процедура
Меры
Когнитивные меры
Извлечение, секвенирование и предварительная обработка фекальной ДНК
Определение основных критериев исхода по образцам фекалий
Анализ функции кишечника с использованием PICRUSt2 для определения функциональных путей и ферментов
Статистический анализ
Разведочные анализы
Клинические исходы и корреляция с микробиомом кишечника
Доступность данных
Результаты
Обсуждение
Благодарности
Финансирование
Конкурирующие интересы
Список литературы
Взаимосвязь между длиной тринуклеотидного (CAG) повтора и клиническими особенностями болезни Хантингтона
.Nat Genet
1993
;4
:398
—403
.Ассоциация WM.
Хельсинкская декларация Всемирной медицинской ассоциации: этические принципы медицинских исследований с участием людей
.JAMA
2013
;310
:2191
.Bajaj
JS
,Ридлон
JM
,Hylemon
PB
,Такер
LR
,Heuman
DM
,Смит
S
, и другие.Связь микробиома кишечника с познанием при печеночной энцефалопатии
.Am J Physiol Gastrointestin Liver Physiol
2012
;302
:G168
—75
.Бенедикт
RH
,Шретлен
D
,Гронингер
L
,Brandt
J.
Тест на вербальное обучение Хопкинса, пересмотренный: нормативные данные и анализ межформной и тест-ретестовой надежности
.Clin Neuropsychol
1998
;12
:43
—55
.Berrios
G
,Wagle
A
,Маркова
I
,Wagle
S
,Россер
А
,Hodges
J.
Психиатрические симптомы у неврологически бессимптомных носителей гена болезни Хантингтона: сравнение с генно-отрицательными субъектами риска
.Acta Psychiatr Scand
2002
;105
:224
—30
.Bourassa
МВт
,Алим
И
,Бультман
SJ
,Ратан
руб.
Бутират, нейроэпигенетика и микробиом кишечника: может ли диета с высоким содержанием клетчатки улучшить здоровье мозга?
Neurosci Lett
2016
;625
:56
—63
.Брюс-Келлер
AJ
,Salbaum
JM
,Luo
M
,Бланшар
E
,Тейлор
CM
,Валлийский
DA
, и другие.Кишечная микробиота с ожирением вызывает нейроповеденческие изменения в отсутствие ожирения
.Biol Psychiatry
2015
;77
:607
—15
.Бурокас
А
,Молони
РД
,Динан
TG
,Cryan
JF.
Регуляция микробиоты оси кишечник – мозг млекопитающих
.Adv Appl Microbiol
2015
;91
:1
—62
.Каллахан
BJ
,Макмерди
PJ
,Розен
МДж
,Хан
AW
,Джонсон
AJ
,Холмс
СП.
DADA2: вывод образца с высоким разрешением из данных ампликона Illumina
.Nat Methods
2016
;13
:581
–3
.Кэмпбелл
К
,Вовинкель
Дж
,Келлер
MA
,Ралсер
М.
Метионин метаболизм изменяет устойчивость к окислительному стрессу через пентозофосфатный путь
.Antioxid Redox Signal
2016
;24
:543
—7
.Caporaso
JG
,Kuczynski
J
,Stombaugh
J
,Биттингер
K
,Бушмен
ФД
,Костелло
EK
, и другие.QIIME позволяет анализировать высокопроизводительные данные секвенирования сообщества
.Nat Methods
2010
;7
:335
—6
.Каработти
M
,Scirocco
A
,Maselli
MA
,Севери
С.
Ось кишечник – мозг: взаимодействие между кишечной микробиотой, центральной и кишечной нервными системами
.Энн Гастроэнтерол
2015
;28
:1
—7
.Челаккот
C
,Чой
Y
,Kim
DK
,Парк
HT
,Гхим
Дж
,Квон
Y
, и другие.Внеклеточные везикулы, производные от Akkermansia muciniphila , влияют на проницаемость кишечника через регуляцию плотных контактов
.Exp Mol Med
2018
;50
:e450
.Крауфурд
D
,Томпсон
JC
,Сноуден
JS.
Поведенческие изменения при болезни Гентингтона
.Cogn Behav Neurol
2001
;14
:219
—26
.Крайан
JF
,Динан
ТГ.
Микроорганизмы, изменяющие сознание: влияние кишечной микробиоты на мозг и поведение
.Nat Rev Neurosci
2012
;13
:701
—12
.Динан
TG
,Cryan
JF.
Ось микробиом – кишечник – мозг в здоровье и болезни
.Гастроэнтерол Клин N Am
2017
;46
:77
—89
.Dixon
P.
VEGAN, пакет функций R для общественной экологии
.J Veg Sci
2003
;14
:927
—30
.Djousse
L
,Ноултон
B
,Чашки
л
,Мардер
К
,Шоулсон
I
,Майерс
Р.
Похудание на ранней стадии болезни Гентингтона
.Неврология
2002
;59
:1325
—30
.Domínguez
JF
,Стаут
JC
,Poudel
G
,Кладбище
А
,Чуа
P
,Иган
GF
, и другие.Биомаркеры мультимодальной визуализации при пред проявлении и ранней болезни Хантингтона: данные IMAGE-HD за 30 месяцев
.Br J Психиатрия
2016
;208
:571
—8
.Douglas
GM
,Maffei
VJ
,Zaneveld
J
,Yurgel
S
,Brown
CM JR
,Taylor PICRUSt2: улучшенный и расширяемый подход для вывода метагенома. BioRxiv
2020
;672295
.Eaton
WW
,Muntaner
C
,Tien
A
,Ybarra
M
.Шкала депрессии Центра эпидемиологических исследований: Обзор и пересмотр (CESD и CESD-R). В: Маруиш М.Е., редактор. Использование психологического тестирования для планирования лечения и оценки результатов. 3-е изд. Махва, Нью-Джерси: Лоуренс Эрлбаум; 2004. с. 363–377.Энгельс
C
,Ruscheweyh
HJ
,Beerenwinkel
N
,Лакруа
C
,Schwab
C.
Обычный кишечный микроб Eubacterium hallii также способствует образованию пропионата в кишечнике
.Передний микробиол
2016
;7
:713
.Эппинг
EA
,Мельницы
JA
,Beglinger
LJ
,Федорович
JG
,Крауфурд
D
,Смит
MM
, и другие.Характеристика депрессии при продромальной болезни Хантингтона в исследовании нейробиологических предикторов HD (PREDICT-HD)
.J Psychiatr Res
2013
;47
:1423
—31
.Клык
X
,Ван
X
,Ян
S
,Meng
F
,Ван
X
,Wei
H
, и другие.Оценка микробного разнообразия при боковом амиотрофическом склерозе с использованием высокопроизводительного секвенирования
.Передний микробиол
2016
;7
:1479
.Ферранте
RJ
,Андреассен
OA
,Дженкинс
BG
,Dedeoglu
A
,Kuemmerle
S
,Кубилус
JK
, и другие.Нейропротекторные эффекты креатина в модели трансгенной мыши с болезнью Хантингтона
.J Neurosci
2000
;20
:4389
—97
.Фитцджеральд
E
,Мерфи
S
,Мартинсон
HA.
Патология альфа-синуклеина и роль микробиоты в болезни Паркинсона
.Передняя Neurosci
2019
;13
:369
.Гао
К
,му
кл
,Фарзи
А
,Zhu
WY.
Метаболизм триптофана: связь между кишечной микробиотой и мозгом
.Adv Nutr
2020
;11
:709
—23
.Gerhardt
S
,Mohajeri
MH.
Изменение бактериального состава толстой кишки при болезни Паркинсона и других нейродегенеративных заболеваниях
.Питательные вещества
2018
;10
:708
.Hoglund
E
,Overli
O
,Винберг
С.
Метаболические пути триптофана и серотонинергическая активность мозга: сравнительный обзор
.Передний эндокринол
2019
;10
:158
.Сумка для хранения
H
, Тест Векслера по чтению взрослых: WTAR.Сан-Антонио, Техас
:Психологическая корпорация
;2001
.Хуан
Y
,Ши
X
,Li
Z
,Шэнь
Y
,Ши
X
,Ван
Л
, и другие.Возможная ассоциация Firmicutes в микробиоте кишечника пациентов с большим депрессивным расстройством
.NDT
2018
;14
:3329
—37
.Джонсон
SA
,Стаут
JC
,Соломон
AC
,Langbehn
DR
,Aylward
EH
,Cruce
CB
, и другие.За гранью отвращения: нарушение распознавания отрицательных эмоций до постановки диагноза болезни Хантингтона
.Мозг
2007
;130
:1732
—44
.Kałużna-Czaplińska
J
,Gątarek
P
,Чирумболо
S
,Chartrand
MS
,Bjørklund
G.
Насколько важен триптофан для здоровья человека?
Crit Rev Food Sci Nutr
2019
;59
:72
—88
.Кешаварзян
А
,Зеленый
SJ
,Engen
PA
,Войт
RM
,Накиб
A
,Форсайт
CB
, и другие.Бактериальный состав толстой кишки при болезни Паркинсона
.Mov Disord
2015
;30
:1351
—60
.Кибуртц
К
,Пенни
JB
,Corno
P
,Ранен
N
,Шоулсон
I
,Фейгин
А
, и другие.Единая шкала оценки болезни Хантингтона: надежность и последовательность
.Неврология
2001
;11
:136
—42
.Конг
G
,Cao
KL
,Джадд
LM
,Li
S
,Ренуар
Т
,Hannan
AJ.
Профилирование микробиома выявляет дисбактериоз кишечника на модели трансгенных мышей с болезнью Хантингтона
.Neurobiol Dis
2018
;135
:104268
.Ковальски
К
,Мулак
А.
Ось мозг – кишечник – микробиота при болезни Альцгеймера
.J Нейрогастроэнтерол Мотил
2019
;25
:48
—60
.Le Cao
K-A
,Костелло
M-E
,Лакис
VA
,Бартоло
Ф
,Чуа
X-Y
,Brazeilles
R
, и другие.MixMC: многомерная статистическая основа для понимания микробных сообществ
.PLoS One
2016
;11
:e0160169
.Луи
P
,Молодой
П
,Холтроп
G
,Флинт
HJ.
Разнообразие бактерий, продуцирующих бутират толстой кишки человека, выявленное с помощью анализа гена бутирил-КоА: ацетат-КоА-трансферазы
.Environ Microbiol
2010
;12
:304
–14
.Мандал
S
,Van Treuren
W
,Белый
RA
,Eggesbo
M
,Рыцарь
R
,Peddada
SD.
Анализ состава микробиомов: новый метод изучения микробного состава
.Microb Ecol Health Dis
2015
;26
:27663
.Мандерино
Л.
,Кэрролл
I
,Azcarate-Peril
MA
,Рошетт
A
,Хайнберг
L
,Торф
C
, и другие.Предварительные доказательства связи между составом микробиома кишечника и когнитивной функцией у неврологически здоровых пожилых людей
.J Int Neuropsychol Soc
2017
;23
:700
—5
.Маркиз
T
,Кобура
S
,Стенка
R
,Кениг
Дж
,Brummer
R
,de Vos
WM
, Связь микробиома кишечника со здоровьем и болезнями. In:Hyland
N
,Stanton
C
, editors,Ось кишечник – мозг
.Academic Press
;2016
.п.261
—91
.Майер
EA
,Рыцарь
R
,Мазманян
SK
,Крайан
JF
,Тиллиш
К.
Кишечные микробы и мозг: смена парадигмы в нейробиологии
.J Neurosci
2014
;34
:15490
—6
.Маццетти
AP
,Fiorile
MC
,Primavera
A
,Ло Белло
М.
Глутатион-трансферазы и нейродегенеративные заболевания
.Neurochem Int
2015
;82
:10
—8
.McCourt
AC
,О’Донован
KL
,Экблад
E
,Песок
E
,Крауфурд
D
,Россер
А
, и другие.Характеристика биопсий слизистой оболочки желудка выявляет изменения при болезни Гентингтона
.PLoS Curr
2015
;7
.Мак-Мерди
PJ
,Холмс
С.
phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома
.PLoS One
2013
;8
:e61217
.Мендельсон
D
,Ридель
WJ
,Sambeth
A.
Влияние острого истощения триптофана на память, внимание и исполнительные функции: систематический обзор
.Neurosci Biobehav Rev
2009
;33
:926
—52
.Newland
PK
,Heitkemper
M
,Чжоу
Ю.
Возникающая роль микробиома кишечника у взрослых пациентов с рассеянным склерозом
.J Neurosci Nurs
2016
;48
:358
—64
.O’Mahony
SM
,Кларк
G
,Борре
YE
,Динан
TG
,Cryan
JF.
Серотонин, метаболизм триптофана и ось мозг – кишечник – микробиом
.Behav Brain Res
2015
;277
:32
—48
.Парашар
А
,Удаябану
м.
Микробиота кишечника: значение при болезни Паркинсона
.Расстройство отношения паркинсонизма
2017
;38
:1
—7
.Паульсен
JS
,Langbehn
DR
,Стаут
JC
,Эйлуорд
E
,Росс
CA
,Nance
M
, и другие.Выявление болезни Хантингтона за десятилетия до постановки диагноза: исследование predic-HD
.J Neurol Neurosurg Psychiatry
2008
;79
:874
—80
.Quast
C
,Pruesse
E
,Йылмаз
П
,Gerken
J
,Schweer
T
,Ярза
П
, и другие.Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты
.Nucleic Acids Res
2012
;41
:D590
—6
.Радулеску
CI
,Гарсия-Мираллес
M
,Сидик
H
,Бардил
CF
,Юсоф
N
,Ли
HU
, и другие.Манипуляции с микробиотой выявляют измененную каллозальную миелинизацию и пластичность белого вещества на модели болезни Хантингтона
.Neurobiol Dis
2019
;127
:65
—75
.Рейтан
РМ.
Срок действия теста на следы как индикатора органического повреждения головного мозга
.Навыки восприятия моторики
1958
;8
:271
—6
.Роббинс
A
,Ho
A
,Баркер
р.
Изменение веса при болезни Гентингтона
.евро J Neurol
2006
;13
:e7
.Роббинс
TW
,Джеймс
M
,Оуэн
AM
,Саакян
BJ
,Макиннес
L
,Rabbitt
P.
Автоматизированная батарея Кембриджских нейропсихологических тестов (CANTAB): факторно-аналитическое исследование большой выборки здоровых пожилых добровольцев
.Dement Geriatr Cogn Disord
1994
;5
:266
—81
.Росс
CA
,Тебризи
SJ.
Болезнь Хантингтона: от молекулярного патогенеза к клиническому лечению
.Ланцет нейрол
2011
;10
:83
—98
.Роу
KC
,Паульсен
JS
,Langbehn
DR
,Дафф
К
,Beglinger
LJ
,Ван
С
, и другие.Самостоятельная синхронизация определяет и отслеживает изменения в продромальной болезни Хантингтона
.Нейропсихология
2010
;24
:435
—42
.Рядный
Дж
,ся
Y
,Юнг
B
,Вс
Дж.
Воспаление и дисбактериоз кишечника при заболевании двигательных нейронов человека
.Physiol Rep
2017
;5
:e13443
.Сампсон
т.р.
,Дебелиус
JW
,Трон
Т
,Янссен
S
,Шастри
ГГ
,Ильхан
ZE
, и другие.Микробиота кишечника регулирует двигательный дефицит и нейровоспаление в модели болезни Паркинсона
.Ячейка
2016
;167
:1469
—80.e12
.Саркар
SR
,Banerjee
S.
Микробиота кишечника при нейродегенеративных расстройствах
.J Нейроиммунол
2019
;328
:98
—104
.Scheperjans
F
,Ахо
В
,Перейра
PA
,Koskinen
K
,Паулина
Л
,Пекконен
E
, и другие.Микробиота кишечника связана с болезнью Паркинсона и клиническим фенотипом
.Mov Disord
2015
;30
:350
—8
.Шоулсон
I
,Fahn
S.
Клиническая помощь и оценка болезни Хантингтона
.Неврология
1979
;29
:1
.Смит
А.
Проверка модальностей цифр символа.Лос-Анджелес, Калифорния: западные психологические службы;1982
.Стиллинг
RM
,van de Wouw
M
,Кларк
G
,Стэнтон
C
,Динан
TG
,Cryan
JF.
Нейрофармакология бутирата: хлеб с маслом оси микробиота-кишечник-мозг?
Neurochem Int
2016
;99
:110
—32
.Стаут
JC
,Queller
S
,Бейкер
КН
,Cowlishaw
S
,Сампайо
C
,Фитцер ‐ Аттас
C
, и другие.HD ‐ CAB: батарея когнитивной оценки для клинических испытаний при болезни Хантингтона 1,2,3
.Mov Disord
2014
;29
:1281
—8
.Стой
N
,Маккей
GM
,Форрест
CM
,Христофидес
Дж
,Эгертон
М
,Камень
TW
, и другие.Метаболизм триптофана и окислительный стресс у пациентов с болезнью Хантингтона
.J Neurochem
2005
;93
:611
—23
.Тебризи
SJ
,Langbehn
DR
,Leavitt
BR
,Roos
RA
,Durr
A
,Крауфурд
D
, и другие.Биологические и клинические проявления болезни Хантингтона в продольном исследовании TRACK-HD: поперечный анализ исходных данных
.Ланцет нейрол
2009
;8
:791
—801
.Тебризи
SJ
,Scahill
RI
,Durr
A
,Roos
RA
,Leavitt
BR
,Джонс
Р
, и другие.Биологические и клинические изменения на преманифесте и ранней стадии болезни Хантингтона в исследовании TRACK-HD: 12-месячный продольный анализ
.Ланцет нейрол
2011
;10
:31
—42
.Truax
AD
,Чен
L
,Там
JW
,Cheng
N
,Guo
H
,Кобланский
AA
, и другие.Сенсор ингибирующего врожденного иммунитета NLRP12 поддерживает пороговое значение против ожирения, регулируя гомеостаз кишечной микробиоты
.Cell Host Microbe
2018
;24
:364
—78.e6
.ван дер Бург
JM
,Гардинер
SL
,Лудольф
AC
,Landwehrmeyer
GB
,Roos
RA
,Азиз
NA.
Масса тела является надежным показателем клинического прогрессирования болезни Хантингтона
.Ann Neurol
2017
;82
:479
—83
.ван дер Бург
JM
,Winqvist
A
,Азиз
NA
,Маат-Шиман
ML
,Roos
RA
,Бейтса
GP
, и другие.Желудочно-кишечная дисфункция способствует потере веса у мышей с болезнью Хантингтона
.Neurobiol Dis
2011
;44
:1
—8
.Verwaest
KA
,Ву
TN
,Лаукенс
К
,Клеменс
LE
,Нгуен
HP
,Ван Гассе
Б
, и другие.(1) Метаболомика спинномозговой жидкости и сыворотки крови на основе H ЯМР: метаболический профиль для трансгенной крысиной модели болезни Хантингтона
.Biochim Biophys Acta
2011
;1812
:1371
—9
.Vogt
NM
,Керби
RL
,Dill-McFarland
KA
,Хардинг
SJ
,Мерлуцци
AP
,Джонсон
SC
, и другие.Изменения микробиома кишечника при болезни Альцгеймера
.Sci Rep
2017
;7
:13537
.Walker
FO.
Болезнь Хантингтона
.Ланцет
2007
;369
:218
—28
.Уоткинс
L
,Роджерс
Р
,Лоуренс
A
,Саакян
Б
,Россер
А
,Роббинс
Т.
Нарушение планирования, но неизменное принятие решений при ранней стадии болезни Хантингтона: последствия для конкретной лобно-полосатой патологии
.Neuropsychologia
2000
;38
:1112
—25
.Weis
S
,Schwiertz
A
,Унгер
ММ
,Беккер
А
,Faßbender
K
,Рейтинг
S
, и другие.Влияние болезни Паркинсона и родственных лекарств на состав бактериальной микробиоты фекалий
.NPJ Parkinsons Dis
2019
;5
:28
.Ю
А
,Лау
AY.
Связывание глутамата и глицина с рецептором NMDA
.Структура
2018
;26
:1035
—43.e2
.Жан
G
,Ян
N
,Li
S
,Хуанг
N
,Клык
X
,Чжан
Дж
, и другие.Аномальный состав микробиоты кишечника способствует когнитивной дисфункции у мышей SAMP8
.Старение
2018
;10
:1257
—67
.Чжан
Y
,Длинный
JD
,Мельницы
JA
,Уорнер
JH
,Лю
Вт
,Паульсен
JS
, и другие.Индексирование прогрессирования заболевания на момент включения в исследование среди лиц с риском развития болезни Хантингтона
.Am J Med Genet B
2011
;156
:751
—63
.ASV =
вариантов ампликонной последовательности
CAG =
цитозин-аденин-гуанин
CAP S =
902 902
оценка продукта 9026
HCAG-age
HD-CAB =
Батарея когнитивных тестов по болезни Хантингтона
HDGECs =
Носители распространения гена болезни Хантингтона
OTS =
One Touch Stockings of Cambridge
902 902TMS =
UHDRS =
Единая шкала оценки болезни Хантингтона
© Автор (ы) (2020).Опубликовано Oxford University Press от имени Гарантов Мозга.
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает некоммерческое повторное использование, распространение, и воспроизведение на любом носителе при условии правильного цитирования оригинала. По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Ваша кишечная микробиота — сбалансирована или нет?
Микробиота кишечника — это обширный и разнообразный резервуар микроорганизмов, включая бактерии, грибы и вирусы, которые у здоровых людей живут в относительном равновесии.Ученые идентифицировали не менее 1000 различных видов бактерий, обитающих в нашем пищеварительном тракте, в первую очередь в толстой кишке. Однако изучение того, как эти виды по отдельности и в совокупности влияют на наше общее состояние здоровья, сложно, потому что большинство видов нельзя культивировать стандартными методами в лаборатории.
Исследования показывают, что кишечные микроорганизмы приносят нам пользу, производя витамины, предотвращая рост вредных бактерий, тренируя иммунную систему и ферментируя неиспользованную пищу (энергетические субстраты).Когда микроорганизмы в микробиоте живут в относительном равновесии, это состояние называется нормобиозом. Однако, когда этот баланс нарушается из-за того, что один или несколько микроорганизмов выросли непропорционально по сравнению с другими видами, это приводит к состоянию дисбактериоза кишечника.
Нормальный состав микробиоты кишечника сильно различается у разных людей, поэтому определить дисбактериоз и его влияние на болезнь сложно. Выполнение этого может в конечном итоге позволить современной медицине обнаруживать и исправлять дисбактериоз у пациентов, возможно, даже предотвращая возникновение болезни.
Некоторые бактерии являются провоспалительными, а другие — противовоспалительными, но по-разному влияют на различные заболевания. Например, микробная сигнатура видов бактерий Firmicutes, присутствующих в кишечном тракте у пациентов с болезнью Крона, значительно отличается у пациентов с язвенным колитом, но оба являются тесно связанными воспалительными заболеваниями кишечника. 1 По сравнению с пациентами Крона, находящимися в длительной ремиссии, у пациентов с рецидивом Крона уровни всех видов Firmicutes ниже. 2
Исследователи обнаружили прямую связь между дисбактериозом и рядом других состояний, включая синдром раздраженного кишечника (СРК), целиакию, ожирение, диабет I и II типа, депрессию и аутизм. 3 Исследования микробиоты кишечника в связи с болезнями продолжают показывать, что дисбаланс микробиоты может привести к расстройствам кишечника. Однако одна из самых больших проблем, которая остается, — это разработка точного стандартизованного подхода к выявлению и характеристике дополнительных эффектов дисбактериоза на заболевание и рецидивы.
Карта генетического анализа (GA Map ™) Тест на дисбактериоз
В статье, опубликованной в 2015 году в журнале Alimentary Pharmacology and Therapeutics , группа европейских исследователей представила новый алгоритмический тест, в котором используются ДНК-зонды для выявления и характеристики дисбактериоза в образцах кала для распознавания генетических профилей конкретных видов бактерий. 4 Это исследование представляет особый интерес из-за разной природы дисбактериоза при заболеваниях кишечника — СРК является функциональным состоянием, в то время как болезнь Крона и язвенный колит являются органическими воспалительными заболеваниями, но оба проявляют дисбактериоз кишечника.
Казен и др. . установили профиль нормобиоза путем отбора проб фекалий у 668 взрослых в возрасте от 17 до 76 лет, 69% из которых составляли женщины. В эту группу вошли 297 здоровых добровольцев, которые были контрольными, 236 пациентов с СРК, включая все подтипы, и 135 пациентов с ВЗК, включая болезнь Крона и язвенный колит. Затем они разработали специальные ДНК-зонды для распознавания типичного бактериального дисбаланса, связанного с дисбактериозом при СРК и ВЗК, как было выявлено в предыдущих исследованиях.После компьютерного и лабораторного тестирования (in vitro) исследователи остановились на окончательной панели из 54 зондов, охватывающих виды в этих доминирующих таксономиях кишечных бактерий: Firmicutes, Proteobacteria, Bacteroidetes, Actinobacteria, Tenericutes и Verrucomicrobia.
Исследователи создали алгоритм индекса дисбактериоза (DI), чтобы обеспечить числовое представление степени дисбактериоза на основе отклонения от нормобиоза. Они определили, что DI> 2 квалифицируется как клинически значимый дисбактериоз.Исследователи обнаружили дисбактериоз у 73% пациентов с СРК, у 70% пациентов с ВЗК, не получавших лечения, и у 80% пациентов с ВЗК в стадии клинической ремиссии. Однако они обнаружили дисбактериоз только у 16% контрольной группы.
Будущее медицины?
Результаты теста GA Map ™ подтверждают новую парадигму о дисбактериозе и болезнях. Используя отклонение от установленного профиля нормобиоза для индикации заболевания и рецидива, Casen et al. вселяет надежду на прорывный способ индивидуального лечения пациентов с СРК и ВЗК.Исследователи надеются, что это открытие приведет к дальнейшей разработке индивидуальных терапевтических планов лечения, которые работают для восстановления баланса кишечной микробиоты.
Хотя исследователи с оптимизмом смотрят на то, что врачи могут использовать свою модель индекса дисбактериоза для выявления болезненного состояния, их исследование имеет некоторые ограничения. Во-первых, использование в основном скандинавских субъектов для определения профиля нормобиоза ограничивает понимание научным сообществом здорового кишечника определенной демографической группой.Во-вторых, использование исследователями высокопроизводительного секвенирования в качестве инструмента для анализа кишечных бактерий означало, что они использовали только небольшую часть бактериального гена 16S рРНК для исследования огромного количества бактерий в кишечнике. Их модель не идентифицирует некоторые из менее доминирующих видов в микробиоте, которые все еще могут играть жизненно важную роль, и предлагает лишь небольшой снимок огромного множества микроорганизмов.
Тем не менее, это исследование является первым клиническим тестом для выявления и характеристики дисбактериоза на основе образцов кала, и оно имеет потенциал для лечения желудочно-кишечных и других состояний.Если другие исследователи по всему миру смогут воспроизвести этот процесс с разными этническими группами и получить аналогичные результаты, то будущие схемы лечения могут сильно отличаться от тех, которые используются сегодня.
Впервые опубликовано в выпуске информационного бюллетеня
Inside Tract ® 197 — 2016Изображение предоставлено: © fotolia.com/T. Л. Фуррер
1. Machiels K
et al. Уменьшение количества видов Roseburia hominis и Faecalibacterium prausnitzii, продуцирующих бутират, определяет дисбактериоз у пациентов с язвенным колитом. Кишечник 2014; 63: 1275-83.2. Rajca S et al. Изменения микробиома кишечника (дисбиоз) как предиктор рецидива после отмены инфликсимаба при болезни Крона. Воспаление кишечника 2014; 20: 978-86.
3. Динан Т.Г. и др. Меланхолические микробы: связь между кишечной микробиотой и депрессией? Нейрогастроэнтерол Мотил 2013; 25: 713-9.
4. Casen C et al . Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Aliment Pharmacol и Ther 2015; 42: 71-83.
New Frontiers for Treatment of Metabolic Diseases
Поддержание здорового метаболизма человека зависит от симбиотического консорциума, состоящего из бактерий, архей, вирусов, грибов и эукариотических клеток-хозяев во всем желудочно-кишечном тракте человека. Микробные сообщества обеспечивают ферментативный механизм и метаболические пути, которые способствуют перевариванию пищи, метаболизму ксенобиотиков и производству различных биоактивных молекул.К ним относятся витамины, аминокислоты, короткоцепочечные жирные кислоты (SCFA) и метаболиты, которые необходимы для взаимосвязанных путей гликолиза, цикла трикарбоновых кислот / Кребса, окислительного фосфорилирования (OXPHOS) и метаболизма аминокислот и жирных кислот. Недавние исследования показали, как питательные вещества, питающие метаболические процессы, влияют на то, как иммунные клетки, в частности, макрофаги, реагируют на различные стимулы в физиологических и патологических условиях, активируются и приобретают особую функцию.Два основных воспалительных фенотипа макрофагов контролируются за счет различного потребления глюкозы, глутамина и кислорода. Фенотип M1 запускается сигналом поляризации от бактериального липополисахарида (LPS) и провоспалительных цитокинов Th2, таких как интерферон- γ , TNF- α и IL-1 β или оба, тогда как фенотип M2 запускается цитокинами Th3 такие как интерлейкин-4 и интерлейкин-13, а также противовоспалительные цитокины, IL-10 и TGF β или глюкокортикоиды.Утилизация глюкозы и производство химических медиаторов, включая АТФ, активные формы кислорода (АФК), оксид азота (NO) и НАДФН, поддерживают эффекторную активность макрофагов M1. Дисбиоз — это дисбаланс комменсальных и патогенных бактерий, а также выработка микробных антигенов и метаболитов. Теперь известно, что продукты, полученные из кишечной микробиоты, вызывают низкую воспалительную активацию тканевых макрофагов и способствуют метаболическим и дегенеративным заболеваниям, включая диабет, ожирение, метаболический синдром и рак.Здесь мы обновляем возможное взаимодействие дисбактериоза микробиома кишечника хозяина и метаболических заболеваний. Мы также обобщаем достижения в области фекальной терапии, пробиотиков, пребиотиков, симбиотиков, а также питательных веществ и низкомолекулярных ингибиторов ферментов метаболического пути в качестве профилактических и терапевтических средств при метаболических заболеваниях.
1. Введение
Микробиомы человека относятся к коллективным геномам бактерий, архей, вирусов, простейших и грибов, которые совместно обитают в нескольких экосистемах человеческого тела (Bäckhed et al.[1], Белизарио и Наполитано [2]). Взрослый мужчина весом 70 кг может содержать до 3,8 × 10 13 бактерий, что равно количеству клеток в организме взрослого человека (Sender et al. [3]). Бактерии классифицируются морфологически и биохимически на основе различных свойств, включая тип стенки, форму, потребность в кислороде (анаэробный или аэробный), продукцию эндоспор, подвижность и их метаболизм. Бактерии также классифицируются по филогенетическому разнообразию вариабельных нуклеотидных последовательностей малых субъединичных оперонов рибосомной РНК или генов 16S и 18S рРНК [1, 2].
В рамках проекта «Микробиом человека» (HMP) были определены критерии высококачественного и всестороннего метагеномного анализа генетического материала, извлеченного непосредственно из различных участков человеческого тела, с целью определения относительной численности микробов множества штаммов и видов разных типов в физиологических условиях. [4–6]. Достижения в области вычислительной техники позволили изучить общедоступные человеческие метагеномы на основе филогенетической кластеризации и сборки бактериальных геномов в таксономический домен, царство, тип, класс, порядок, семейство, род и виды [4–8].Анализ различных наборов данных микробиома человека выявил огромное разнообразие как популяций, так и отдельных людей на протяжении эволюции и жизни [7–9]. Микробиота кишечника здоровых людей состоит из постоянных и преходящих микробных видов и подвидов более 17 кандидатных бактериальных типов, принадлежащих Firmicutes (> 70%), Bacteroidetes (> 30%), Proteobacteria (<5%), Actinobacteria (<2%). ), Fusobacteria и Verrucomicrobia (<1%) и другие типы. Новая сборка бактериального генома и таксономическое профилирование на основе 1550 геномов, собранных из метагенома (MAG), выявили около 70 000 геномов бактерий и архей, а также новые виды, которые находятся в стадии глубокого исследования [6–8].Обычный набор преобладающих видов микробов, обнаруживаемых в нормальном стуле человека, включает видов Clostridiales , таких как Coprococcus , Ruminococcus , Eubacterium , Bacteroides dorei и fragilis 126, aldontipes [7, 8]. Полностью широкое таксономическое распределение, микробная эволюция и метаболизм видов бактерий в отношении калорийной нагрузки и усвоения питательных веществ послужили объединению филотипов на уровне видов в основные энтеротипы человека [9–12].Преобладающий тип 1 энтеротипа человека характеризуется высокими уровнями Bacteroides , а тип 2 — небольшим количеством Bacteroides , но высокими уровнями Prevotella . Они, соответственно, связаны с людьми, потребляющими либо большое количество животного белка (тип 1), либо углеводов (тип 2).
Желудочно-кишечный тракт обладает собственной нервной системой, известной как кишечная нервная система. Эта система взаимодействует с центральной нервной системой через нервы, такие как блуждающий нерв, нейромодуляторы и нейротрансмиттеры симпатических и парасимпатических ветвей вегетативной нервной системы [1].Бактериальное богатство и разнообразие микробиоты ЖКТ играют центральную роль в нормальных метаболических и иммунологических функциях тканей и органов [1, 2]. Здесь мы расскажем о различных исследованиях, изучающих роль микробиомов, питательных веществ и метаболитов в функции иммунных клеток, этиологии воспалительных и метаболических заболеваний, включая широкий спектр их механизмов. Мы также описываем, почему и как новые диетические и фармакологические стратегии, включая трансплантацию фекалий, пробиотики, пребиотики и малые молекулы, могут помочь лечить и модулировать типы типов на уровне видов и способствовать восстановлению микробиомов, вызывающих метаболические синдромы.
2. Микробиота кишечника контролирует метаболические физиологические состояния хозяина
Микроорганизмы в кишечнике выполняют свои функции в основном через ферментные пути, чтобы переваривать сложные пищевые углеводы и белки [13, 14]. Микробиота кишечника обеспечивает аминокислоты с разветвленной цепью лейцин, изолейцин и валин, и особенно глицин, который необходим для синтеза глутатиона — основного внутриклеточного антиоксиданта и детоксифицирующего агента, необходимого для многих биологических функций организма-хозяина.Бактерии кишечника синтезируют большое количество сигнальных молекул с низким молекулярным весом, включая метан, сероводород и неосновные метаболиты [13, 14]. Эти продукты могут включать или выключать как гены хозяина, так и гены вирулентности и метаболизма микробов. Микроорганизмы также воспринимают различные сигналы окружающей среды, включая гормоны хозяина и питательные вещества, и реагируют на них посредством дифференциальной регуляции генов и адаптации к нише [13, 14].
Поддержание стабильной ферментативной микробиоты кишечника требует диеты, богатой цельными растительными продуктами, особенно богатыми клетчаткой [13, 14].Эти субстраты обрабатываются ферментами кишечной микробиоты, такими как гликозидгидролазы и полисахаридные лиазы, с образованием полиаминов, полифенолов и витаминов B и K. В анаэробных условиях виды, принадлежащие к роду Bacteroides и к Clostridiaceae и Семейства Lactobacillaceae , в частности штаммы Citrobacter и Serratia , продуцируют короткоцепочечные жирные кислоты (SCFA), которые представляют собой летучие жирные кислоты, способные преодолевать гематоэнцефалический барьер через переносчики монокарбоксилатов.SCFAs, продуцируемые кишечными бактериями, представляют собой ацетат (2 атома углерода), пропионат (3 атома углерода) и бутират (4 атома углерода), и их молярные отношения варьируются от 3: 1: 1 до 10: 2: 1 соответственно. Большинство SCFAs метаболизируются до CO 2 . Бутират действует на колоноциты, бокаловидные клетки и клетки Панета и обеспечивает энергию для клеточного метаболизма и регулирует апоптоз, клеточную дифференцировку и химическую модификацию ядерных белков и нуклеиновой кислоты. Ацетат и пропионат попадают в кровоток и поглощаются печенью и периферическими органами, где они могут действовать как субстраты для глюконеогенеза и липогенеза [14, 15].Рецепторы, связанные с G-белком (GPR), GPR41 и GPR43, также называемые рецепторами свободных жирных кислот 2 и 3 (FFARs 2/3), присутствующие во многих тканях, включая жировую ткань, энтероэндокринные клетки кишечника и воспалительные клетки, действуют как основные рецепторы SCFAs [14, 15]. В определенных физиологических условиях SCFAs могут индуцировать секрецию глюкагоноподобных пептидов (GLP-1 и GLP-2) и пептида YY (PYY). GLP1 стимулирует β клеток поджелудочной железы для выработки инсулина, тогда как PYY ингибирует всасывание питательных веществ в просвете кишечника, а также контролирует аппетит.Микробиота кишечника способствует отложению жира посредством регуляции ядерного фарнезоидного X-рецептора (FXR), рецептора желчных кислот, который отвечает за регуляцию синтеза желчных кислот и накопление триглицеридов в печени [16]. Желчные кислоты, например дезоксихолевая кислота, обладают противомикробным действием на микробы кишечника, а также индуцируют синтез антимикробных пептидов эпителиальной тканью кишечника [17]. Более того, микробиота превращает карнитин и холин в триметиламин и, таким образом, напрямую регулирует биодоступность холина и косвенно накопление триглицеридов в печени.Микробиота кишечника также способствует усвоению кальция, магния и железа. Высокая или низкая продукция SCFAs, метаболитов триптофана, ГАМК, норадреналина, дофамина, ацетилхолина и 5-гидрокситриптамина (серотонина) связана с различными воспалительными и метаболическими заболеваниями и нервно-психическими расстройствами [18]. Некоторые из этих факторов действуют как основные нейротрансмиттеры и модуляторы оси мозг-кишечник, а серотонин играет центральную роль в сексуальности, наркозависимости, аппетите, эмоциях и реакции на стресс [18].
Тысячи производных микробиоты метаболитов с известными и неизвестными функциями были идентифицированы как компоненты метаболома человека [19–21]. Микробиота ЖКТ производит большое количество эпигенетически активных метаболитов, таких как фолат и витамины A и B (включая рибофлавин (B 2 ), ниацин (B 3 ), пантотеновую кислоту (B 5 ), пиридоксин (B 6). ), фолиевой кислоты (B 9 ) и кобаламина (B 12 )), которые регулируют активность ферментов, модулирующих хроматин, и генетические ответы на сигналы окружающей среды [22].Ацетил-КоА, продуцируемый рядом метаболических процессов, является донором ацетила для модификации гистонов (ацетилирование и деацетилирование), катализируемой ацетилтрансферазами гистонов. Глицин, серин и метионин являются субстратами для ферментов метилирования и деметилирования ДНК. Следовательно, изменения микробиоты кишечника могут приводить к эпигеномным изменениям не только непосредственно в соседних клетках кишечника, но и в отдаленных клеточных клонах, таких как гепатоциты и адипоциты [22]. Наконец, бактерии могут подавлять рост своих конкурентов с помощью микробной коммуникации на большие расстояния, посредством высвобождения метаболитов и пептидов, чувствительных к кворуму, что считается биологической стратегией для поддержания плотности комменсальных видов и устранения патогенных бактерий [23, 24].
3. Микробиота кишечника управляет иммунологическими функциями хозяина
Коллекция из 100-400 × 10 12 бактерий обитает и живет в мутуалистических отношениях в желудочно-кишечном тракте человека [3]. Двойной слизистый слой GI образован сильно O-гликозилированными белками муцина, кодируемыми геном MUC2 из семейства белков муцина. Большинство бактерий толстой кишки плотно прикреплены к внешнему слою слизи, а внутренний слой образует физический барьер, ограничивающий контакт бактерий с эпителием.Большинство видов микробов в желудочно-кишечном тракте передаются младенцам в раннем возрасте через материнское молоко, которое содержит преимущественно видов Bifidobacteria и Lactobacillus [25, 26]. По мере перехода от младенчества к взрослой жизни увеличение источников пищи стимулирует сложность и разнообразие бактериальных сообществ родов Bacteroides , Parabacteroides (Bacteroidetes) и Clostridium (Firmicutes) [1, 2, 25, 26 ]. Плотность бактерий в тонкой / подвздошной кишке (<10 5 ) и в толстой кишке прогрессивно увеличивается по сравнению с желудком и двенадцатиперстной кишкой, а самые высокие таксоны и плотность клеток присутствуют в толстой кишке, которая содержит 10 9 -10 12 колониеобразующих единиц на мл (99% от общей популяции GI).Это анаэробы, такие как Bacteroides , Porphyromonas , Bifidobacterium , Lactobacillus и Clostridium . Анаэробные бактерии и чувствительные к кислороду микробы способны продуцировать короткоцепочечные жирные кислоты, чем факультативные аэробные бактерии, такие как E. coli , в 1000 раз. Нарушение динамической взаимосвязи между хозяином и микробными сообществами вызывает дисбиоз, что представляет собой бактериальный дисбаланс между соотношениями аэробных и факультативно-анаэробных бактерий [1, 2].Гипоксия предотвращает рост патогенных факультативных анаэробов, таких как E. coli и Salmonella . Разрыв кишечного барьера, спровоцированный дисбактериозом, приводит к локальному и системному воспалению [1, 2, 27]. Исследование Byndloss et al. недвусмысленно продемонстрировано, что дисбактериоз может быть вызван высоким уровнем кислорода и нитратов, которые являются соединениями, которые способствуют росту Escherichia и видов Salmonella [28]. Многие заболевания, включая воспалительные заболевания кишечника (ВЗК), синдром раздраженного кишечника (СРК), диабет, ожирение и рак, связаны со специфическим бактериальным дисбиозом [29–31].Возможные временные изменения видов микробиоты, например, за счет уменьшения количества противовоспалительных видов, таких как Faecalibacterium prausnitzii и Akkermansia muciniphila , которые преобладают у здоровых людей, или за счет размножения потенциально провоспалительных бактерий, таких как Bacteroides и Ruminococcus gnavus , могут способствовать прогрессированию и хронизации заболевания [29–32]. Сравнительные исследования на моделях худых и страдающих ожирением животных показали, что низкое соотношение Bacteroidetes / Firmicutes является признаком ожирения [33].Firmicutes в значительной степени зависят от пищевых углеводов, тогда как Proteobacteria полагаются на белки как на источник углерода. Например, Akkermansia muciniphila — это бактерия, разлагающая муцин в типе Verrucomicrobia , которая присутствует в большом количестве у здоровых людей, но присутствует в меньшем количестве у пациентов с воспалительными и желудочно-кишечными заболеваниями, ожирением и диабетом 2 типа. (T2D) [34]. Фактически, различные микробные сообщества и механизмы могут определять восприимчивость хозяина к заболеваниям и влиять на клинические исходы [35].
Кишечная микробиота играет критическую роль в иммунной системе, контролируя развитие и функциональность кишечных лимфоидных тканей (GALT), включая пейеровы бляшки, изолированные лимфоидные фолликулы и мезентериальные лимфатические узлы [30, 31, 36, 37] . Микробы и их продукты необходимы иммунной системе, чтобы отличать себя от чужого (захватчиков) на раннем этапе жизни, а также для активации и поддержания врожденных гемолимфоидных клеток (ILC1, 2 и 3), естественных клеток-киллеров (NK), а также цитотоксических и нецитотоксических и лимфоидные клетки-помощники [36–39].NK-клетки и ILC1 продуцируют большие количества IFN- γ , антимикробных пептидов (AMP), гранулизина, дефенсинов, лизоцима и Reg III γ , которые вместе играют критически важные функции в регуляции микробной экологии и иммунного надзора [24, 31, 39, 40]. Например, полисахарид A, α -галактозилцерамид и метаболиты триптофана, продуцируемые микробными сообществами, стимулируют иммунные клетки к выработке интерлейкина-22, Reg3 γ , IgA и интерлейкина-17 [37].IgA — один из важных компонентов врожденного ответа, предотвращающего вторжение микроорганизмов в кровообращение [30]. Т-хелперные (Th) 17-клетки и регуляторные Т-клетки (Treg) представляют собой антиген-специфические популяции, которые реагируют на трансформирующий фактор роста β и ретиноевую кислоту и контролируют иммунную толерантность [38, 39]. Этот контроль иммунной системы всего организма кишечными бактериями, по-видимому, является сложной структурой, поскольку потеря определенного вида может привести к чрезмерной реакции или подавлению врожденного иммунного ответа [27, 35, 36].
Множество мембранных и внутриклеточных рецепторов, называемых «рецепторами распознавания образов» или PRR, экспрессируемых на эпителиальных и иммунных клетках, действуют как сенсоры бактериальных и клеточных продуктов, которые называются патоген-ассоциированными молекулярными структурами (PAMP) и связанными с повреждениями молекулярными структурами. паттерны (DAMPs) [41, 42]. PAMP и DAMP, такие как липополисахариды (LPS), липид A, пептидогликаны, флагеллин, микробная РНК / ДНК, а также компоненты клетки-хозяина, такие как мочевая кислота, HMGB1 (белок группы 1 с высокой подвижностью), двухцепочечная ДНК, и митохондриальные, распознаются членами семейства Toll-подобных рецепторов (TLR) и ядерными доменами олигомеризации рецепторов семейства NOD / NLR [41, 42].Внеклеточные и внутриклеточные комплексы, образованные DAMP, PAMP и рецепторами NOD / NLR, составляют инфламмасомы [43]. Эти цитозольные комплексы связываются с адаптерным белком ASC (ассоциированный с апоптозом пятнистый белок) и провоспалительными протеазами семейства каспаз: каспаза 1, каспаза 11, каспаза 4 и каспаза 5 [43]. После активации инфламмасом происходит выработка интерлейкинов IL-1 β и IL-18. Эти цитокины увеличивают синтез других цитокинов, таких как TNF- α , IL-6, IL-17, IL-22 и IL-23, а также некоторых активных химических медиаторов воспаления [43].
Различные исследования с использованием генно-дефицитных моделей мышей определили прямое и сложное взаимодействие бактериального дисбиоза, генетических факторов и факторов окружающей среды [35, 36, 44]. Многие воспалительные заболевания вызваны мутациями или утратой некоторых генов врожденного ответа в лимфоидных тканях и более мелких пейеровских бляшках и мезентериальных лимфатических узлах [38, 39]. Компоненты инфламмасом, такие как MyD88, TLR, NOD, NLrp3 / 6, ASC, а также каспаза 1 и каспаза 11, как известно, контролируют дисбактериоз кишечника [29, 38, 39, 45, 46].Например, трансгенные мыши NOD1 — / — и NOD2 — / — обладают повышенной восприимчивостью не только к воспалительному заболеванию кишечника, но также к диабету 1 типа и раку [38, 39, 45, 46]. Условия содержания животных и состав микробиоты, обусловленный диетой, являются некоторыми примерами, которые могут быть ответственны за фенотипические различия штаммов у трансгенных животных [47, 48]. У мышей без зародышей (GF) обнаруживаются недоразвитые лимфоидные ткани, нарушение функции Т- и В-клеток и снижение выработки Т-клеток CD4 + и антител.Их клетки Th27 и Treg менее эффективны в борьбе с инфекцией. Колонизация мышей GF с ограниченным числом видов бактерий (модели мышей-гнотобиотов) может восстановить иммунологические функции [47, 48]. Фенотипы, наблюдаемые на этих моделях мышей, не всегда наблюдаются в исследованиях на людях. Важно отметить, что 85% видов микробиома мышей не были обнаружены в микробиомах человека [49, 50]. Более того, гуманизация мышиных моделей клетками человека или человеческой микробиотой не может адекватно отображать весь спектр соответствующих фенотипов болезней человека [47, 48].
На рисунке 1 показаны основные классы молекул, метаболитов и питательных веществ, продуцируемых видами бактерий, иммунными клетками, тканями и органами, которые регулируют динамическое взаимодействие между клетками-хозяевами и микробиомом кишечника, а также терапевтические стратегии для борьбы с дисбактериозом и заболеваниями.
4. Иммунометаболизм и пути перепрограммирования митохондрий
Митохондрии служат двигателем клетки, производя и высвобождая критические сигналы в окружающую среду и синтезируя АТФ, энергию тела, необходимую для метаболических процессов [51].Биоэнергетические пути гликолиза, цикл трикарбоновой кислоты (TCA) (также известный как цикл Кребса и цикл лимонной кислоты), метаболизм жирных кислот и аминокислот являются центральными метаболическими процессами для полного окисления всех питательных веществ в митохондриях [51, 52 ]. Клетки используют аэробный гликолиз для производства пирувата, производного от глюкозы, который превращается в ацетилкофермент А (ацетил-КоА). Молекулы ацетил-КоА, полученные из метаболизма глюкозы, глутамина или жирных кислот, входят в цикл TCA и превращаются в CO 2 , NADH и FADH 2 во время окислительного фосфорилирования (OXPHOS). молекулы-носители, называемые цепью переноса электронов, с помощью переносчиков электронов, таких как NAD (P) H и FADH 2 , которые служат субстратом для генерации аденозинтрифосфата (АТФ) в митохондриальном матриксе [51, 52].Электроны передаются от НАДН к О 2 через три белковых комплекса: НАДН-дегидрогеназа, цитохромредуктаза и цитохромоксидаза. Электронный транспорт между комплексами происходит через другие мобильные переносчики электронов, убихинон и цитохром c. Вновь синтезированный АТФ переносится в цитозоль транслоказой аденин-нуклеотида в обмен на АДФ. Ацетил-КоА является предшественником синтеза холестерина и жирных кислот, которые включены в клеточные плазматические мембраны.
Иммунометаболизм включает в себя центр биохимической активности иммунных клеток для модуляции профиля экспрессии генов и переключения метаболических путей и их ключевых ферментов [53]. После стимулирующего сигнала различные иммунные клетки, в частности, макрофаги, DC и Т-клетки, демонстрируют различные метаболические пути перепрограммирования, способствующие их активации, выживанию и образованию клонов [53]. Это перепрограммирование метаболических путей лучше всего охарактеризовано в макрофагах и показано на рисунке 2.Основополагающее исследование Newsholme et al. привело к открытию того, что скорость потребления глюкозы, глутамина и жирных кислот и ферментативная активность глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, цитратсинтазы, оксоглутаратдегидрогеназы и глутаминазы различаются в покоящихся и вызванных (воспалительных) макрофагах. [54]. Их исследование показало, что вся глюкоза, используемая воспалительными макрофагами, превращалась в лактат и очень мало ее окислялось [54, 55]. С тех пор переход от окислительного фосфорилирования (OXPHOS) к гликолизу и глутаминолизу рассматривается как путь метаболического репрограммирования воспалительных клеток.Примечательно, что макрофаги, Т-клетки и среди других иммунных клеток используют гликолиз для быстрого производства радикальных форм кислорода (АФК), используемых для ограничения инфекции. Гликолиз также обеспечивает быстрое производство АТФ и промежуточных продуктов метаболизма для синтеза рибозы для нуклеотидов и аминокислот для биосинтеза РНК и ДНК белков макрофагами. Гликолиз — предпочтительный путь активации дендритных клеток, CD4 + T-хелперов 1 (Th2), Th3 и Th27 клеток, NK-клеток и цитотоксических клеток CD8 + [51, 52].Интересно, что эта метаболическая адаптация к аэробному гликолизу (в присутствии кислорода) была впервые описана как отличительный признак опухолевых клеток Warburg et al. в основополагающем отчете, опубликованном 60 лет назад [56].
Нестимулированные макрофаги, проявляющие фенотип M0 и проявляющие маркеры поверхности дифференцировки CD68 + / CD80 / низкий / CD206 высокий приобретают и демонстрируют фенотип M1 (CD68 + / CD80 / низкий / CD80 / низкий низкий ) или фенотип M2 (CD68 + / CD80 высокий / CD206 / низкий ) после переключения их метаболизма и функции в ответ на стимулы или сигналы поляризации, которые инициируют про- или противовоспалительный ответ [57].Клетки M1 проявляют Th2-ориентированные провоспалительные эффекторные свойства и способствуют повреждению тканей и противомикробной и противоопухолевой устойчивости, тогда как клетки M2 проявляют функции ремоделирования и восстановления тканей, способствуют заживлению ран, ангиогенезу и устойчивости к паразитам, а также способствуют росту опухолей. Перепрограммирующие метаболические пути в макрофагах M1 / M2 изменяют их функции, включая продукцию цитокинов, фагоцитоз и презентацию антигена [58–60]. Классический путь активации или путь репрограммирования в макрофагах M1 способствует накоплению цитрата и высокой продукции NO, ROS, цитокинов и простагландинов [60, 61].Макрофаги M1 высвобождают АФК и NO в фагосомах, где они способствуют уничтожению патогенов. Цитокины Th3, такие как IL-4 и IL-13, регулируют альтернативный путь макрофагов или путь репрограммирования M2. Основная особенность путей репрограммирования M2 состоит в том, что цикл TCA связан с окислительным фосфорилированием, β -окислением жирных кислот и митохондриальным биогенезом. Кроме того, макрофаги M2 не производят NO. Важно учитывать, что макрофаги M2 проявляют различные различные формы (M2a, b и c) в зависимости от местной тканевой среды и воздействия раздражителей [57].
Образование промежуточных продуктов UDP-GlcNAc способствует гликозилированию M2-ассоциированных рецепторов, таких как рецептор маннозы [60]. Таким образом, фенотипы макрофагов M1 и M2 могут контролироваться либо кислородом и питательными веществами, либо цитокинами и сигналами, опосредованными повреждениями и патогенами молекулярных паттернов (DAMP- и PAMP-) [60]. Эти события контролируются сигнальными и транскрипционными путями, индуцированными каноническими регуляторами клеточного метаболизма, такими как фактор транскрипции C-myc, коактиваторные белки, такие как PPAR γ и PGC-1 β (рецептор, активируемый пролиферацией пероксисом γ . , коактиватор 1 β ) и сигнальные пути, управляемые AMPK (5-аденозинмонофосфат-активируемая протеинкиназа), mTORC1 / 2 (мишень рапамициновых комплексов млекопитающих) и STAT6 (преобразователь сигнала и активатор транскрипции) [51, 52 ].Подробный обзор метаболических путей макрофагов, фенотипических и функциональных исходов описан в другом месте [62].
В 2013 году Tannahil et al. сообщили, что экспрессия мРНК IL-1 β в макрофагах M1, стимулированных LPS, приводит к активации фактора транскрипции, индуцированного гипоксией, фактора 1 α (HIF1 α ) зависимым от гликолиза образом [63]. HIF1 α взаимодействует с изоферментом M2 пируваткиназы (PKM2) и способствует экспрессии индуцируемых HIF1 α генов, необходимых для гликолиза [64].Активация эффекта Варбурга (гликолиза) в LPS-стимулированных макрофагах вызывает накопление промежуточных продуктов цикла TCA, в частности, сукцината, малата и фумарата, из-за отклонения потока или «точки разрыва» пути цикла Кребса ( см. рисунок 2). Сукцинат выполняет множество иммунологических функций [52, 53, 63]. Окисление сукцината ферментом сукцинатдегидрогеназой (SHD), который превращает сукцинат в фумарат, стимулирует производство ROS из комплекса II в митохондриях, процесс, называемый обратным электронным транспортом (RET).Макрофаги отвечают на активацию HIF-1 α через АФК и повышают экспрессию IL-1 β [58]. Ингибирование SDH диметилмалонатом подавляет экспрессию IL-1 β , одновременно увеличивая продукцию иммуносупрессивного цитокина IL-10 [52, 63].
Итаконат является одним из важных метаболитов, образующихся при втором отклонении потока или «точке разрыва» пути цикла Кребса во время перехода макрофагов из неактивного в провоспалительное состояние [65]. Итаконат представляет собой ненасыщенную дикарбоновую кислоту, продуцируемую экстрамитохондриальным ферментом цис-аконитат-декарбоксилазой, кодируемым иммунно-чувствительным геном 1 ( Irg1 ).Этот фермент превращает цис-аконитат (полученный из цитрата) в итаконовую кислоту. Одним из замечательных эффектов, наблюдаемых после лечения итаконатом, является снижение экспрессии цитокинов IL-1 β , IL-6 и iNOS [65]. Исследования с использованием макрофагов, полученных из костного мозга мышей (BMDM) и клеток RAW-264.7, стимулированных LPS и цитокинами, показали, что отсутствие (нокдаун) гена Irg приводит к нарушению субстратного фосфорилирования (SLP) митохондрий [66 ]. SLP — это метаболическая реакция, которая приводит к образованию ATP или GTP путем прямого переноса фосфатной группы на ADP или GDP от другого фосфорилированного соединения.Введение итаконата (0,5–2 мМ) полностью меняет эту реакцию [66]. Исследования с использованием трансгенных мышей и иммунных клеток, дефицитных по гену Irg 1, продемонстрировали, что итаконат действует как эндогенный ингибитор сукцинатдегидрогеназы и что такое ингибирование вызывает накопление сукцината [67]. В совокупности эти исследования подтвердили, что итаконат регулирует уровни сукцината, митохондриальное дыхание и выработку воспалительных цитокинов и, следовательно, действует как важный регулятор активации макрофагов.Кроме того, итаконовая кислота обладает антимикробной активностью и убивает непосредственно внутриклеточные Salmonella typhimurium , Legionella pneumophila и Mycobacterium tuberculosis ; таким образом, он защищает от заражения. Цитотоксический эффект связан с ингибированием фермента изоцитратлиазы [68]. Изоцитратлиаза регулирует специфический для бактерий метаболический путь, известный как глиоксилатный шунт, в котором ацетил-КоА превращается в сукцинат для синтеза углеводов.По этому пути изоцитрат расщепляется ферментом ICL (кодируемым aceA) с образованием глиоксилата и сукцината, которые повторно входят в цикл TCA после стадий окислительного декарбоксилирования. Таким образом, глиоксилатный шунт действует как путь выживания микробов [66–68].
5. Дисбиоз кишечника, связанный с метаболическими заболеваниями
Исследования взаимосвязи между кишечными микробами, ожирением, инсулинорезистентностью и метаболическим синдромом показали сложное взаимодействие между диетой хозяина, генетикой и динамикой состава микробиома [49, 69, 70] .Серия экспериментов показала, что хронический воспалительный процесс, связанный с перемещением ЛПС кишечных бактерий в кровоток, вызывает «тихую» метаболическую эндотоксемию и, в конечном итоге, расстройства, связанные с ожирением [71–73]. Признаки клинических проявлений метаболического синдрома включают центральное ожирение, высокое кровяное давление и высокий уровень сахара в крови и триглицеридов сыворотки, которые являются наиболее значительными факторами развития инсулинорезистентности, диабета 2 типа, гипертонии и жировой болезни печени.Лица, сильно колонизированные бактериями и архей из родов Faecalibacterium , Bifidobacterium , Lactobacillus , Coprococcus и Methanobrevibacter , имеют значительно меньшую склонность к развитию метаболических и воспалительных процессов, а также к диабету 2 типа сердечно-сосудистые нарушения [49, 73]. Эти виды являются более высокими продуцентами SCFAs и перекиси водорода, которые, как известно, ингибируют образование биопленок патогенными видами, включая Staphylococcus aureus и E.coli [73].
Ожирение связано с поведенческими факторами и факторами окружающей среды, такими как чрезмерное потребление высококалорийной пищи и малоподвижный образ жизни [49, 73–75]. Первые ключи к разгадке роли микроорганизмов в энергетическом гомеостазе и ожирении появились в исследованиях на стерильных животных [76]. Остается ответить на несколько важных вопросов о сложном взаимодействии между хозяином и микробами в патофизиологии ожирения [49, 74, 75]. Исследования на генетических и индуцированных диетой моделях ожирения на мышах подтвердили, что соотношение Firmicutes к Bacteroidetes увеличивается у тучных животных по сравнению с контрольными животными, не страдающими ожирением [33, 49, 77].Более высокое соотношение Firmicutes к Bacteroidetes также было обнаружено в клинических исследованиях, в которых оценивали здоровых добровольцев с избыточной массой тела и ожирением [33], при этом было обнаружено высокое общее количество SCFAs в кале [78]. Мышиные и человеческие модели продемонстрировали обратную связь между колонизацией A. muciniphila и воспалительными состояниями. Фактически А . muciniphila присутствует в низких количествах у людей, страдающих ожирением, диабетом и кардиометаболическими заболеваниями, что подтверждает их роль в качестве штамма против ожирения [79].
Вклад оси GI гипоталамус-гипофиз-надпочечники в предрасположенность к ожирению до сих пор не полностью изучен [18, 70]. Недавно в одном исследовании описывалась взаимосвязь диеты с высоким содержанием жиров и уровней ацетата, продуцируемого кишечной микробиотой, на модели крыс [80]. Авторы пришли к выводу, что хронический обмен ацетата активирует парасимпатическую нервную систему, которая координирует секрецию стимулированного глюкозой инсулина, грелина и гиперфагии. Они пришли к выводу, что вместе эти факторы способствуют развитию ожирения [80].Ожирение, вызванное диетой с высоким содержанием жиров, также приводит к хроническому воспалению гипоталамуса низкой степени и активации как микроглии, так и астроцитов [81]. Исследование на мышиной модели предполагает, что ацетат накапливается в гипоталамусе. Это соединение играет центральную роль в предотвращении увеличения веса за счет аноректического эффекта [82]. Нейро-иммуно-эндокринный путь имеет решающее значение для гомеостаза глюкозы и контроля ожирения у людей с ожирением, восстанавливающихся после бариатрической хирургии [80]. После бариатрической хирургии с помощью методов обходного желудочного анастомоза по Ру (RYGB) модели людей и животных меняют пищевые предпочтения [83, 84].Обычно производное жирной кислоты под названием олеоилэтаноламид (OEA) образуется после приема жирной пищи. OEA может напрямую активировать рецепторы PPAR- α , которые отвечают за обеспечение насыщения через блуждающий нерв и высвобождение дофамина в головном мозге [84]. Животные с ожирением с подавлением дофамина демонстрируют низкий уровень OEA в головном мозге. После операции RYGB у этих животных повышается уровень экспрессии OEA и рецептора дофамина 1 (D1R), что способствует сдвигу в передаче сигналов по оси GI-мозг. Это приводит к резкому изменению пищевого поведения животных, в том числе к предпочтению нежирной пищи [84].Известно также, что RYGB глубоко влияет на секрецию многих желудочно-кишечных гормонов, включая грелин и GLP-1 [83]. Введение экзогенного GLP-1 или аналога GLP-1 способствует снижению веса и регуляции глюкозы у пациентов с СД2. Примечательно, что метформин, лекарство, используемое для лечения СД2, может увеличивать количество бактерий, продуцирующих бутират, и тем самым способствовать восстановлению здорового микробиома [85]. Вместе эти открытия открыли новые перспективы для будущих методов лечения, направленных на улучшение здоровья за счет воздействия на основные клетки-хозяева, микробы и метаболиты, полученные из микробиома.
6. Нацеленность на дисбактериоз кишечной микробиоты и метаболические пути
6.1. Пробиотики и пребиотики
Иммунолог Эли Мечников был первым, кто заявил, что употребление ферментированного молока (т.е. йогурта), приготовленного из Bacillus bulgaricus , улучшает здоровье и продлевает продолжительность жизни. Он предвидел рациональное использование пробиотиков из живых микроорганизмов с пользой для здоровья за счет изменения микробиома кишечника [86]. Lactobacillus plantaram и Bifidobacterium — это пробиотические бактерии, способные модулировать негативные эффекты диеты с высоким содержанием жиров и даже управлять иммунологическими реакциями, опосредованными воспалительными заболеваниями [25, 38, 45]. Bifidobacterium и Lactobacillus являются продуцентами фолиевой кислоты в кишечнике. Lactobacillus rhamnosus в сочетании с Lactobacillus gasseri и Bifidobacterium lactis может снизить прибавку в весе, в частности, ожирение жировой ткани у людей [87]. Исследования эффектов A. muciniphila , живого или пастеризованного, на мышах, получавших диету с высоким содержанием жиров, показали, что небольшой белок Amuc_1100 (30 кДа) активирует TLR2, что способствует развитию иммунного ответа на здоровье кишечника [79].
Известно, что диетические пребиотики обеспечивают иммунную и метаболическую пользу хозяину [14, 86]. Плохо усваиваемые углеводы, такие как некрахмальные полисахариды, резистентный крахмал, неперевариваемые олигосахариды (NDO) и полифенолы, являются источником различных сахаров, включая глюкозу, галактозу, рамнозу и рутинозу. Ферменты микробиоты толстой кишки, гидролизующие углеводы, способствуют ферментации пребиотиков, которые производят водород, метан, диоксид углерода и SCFA. Когда они связаны, пробиотик и пребиотик могут избирательно стимулировать рост и активность полезных для здоровья бактерий [14, 86].Таким образом, пробиотики и пребиотики могут модулировать метаболические процессы, связанные с СД2 и расстройствами, связанными с ожирением [14, 86]. Прием инулина или олигофруктозы улучшает метаболические нарушения, связанные с ожирением, включая инсулинорезистентность и метаболическую эндотоксемию [34, 71, 79]. Эти эффекты могут быть связаны с восстановлением целостности кишечного барьера и снижением высвобождения ЛПС грамотрицательными бактериями [25, 88].
6.2. Фекальный микробный трансплантат (FMT)
Использование антибиотиков постоянно изменяет микробное сообщество кишечника [89].Высокие дозы и частота приема антибиотиков, особенно против анаэробов, таких как ванкомицин, могут нарушить и дестабилизировать нормальный микробиом кишечника. Антибиотик расширенного спектра действия вызывает чрезмерный рост Clostridium difficile и хронический рецидивирующий колит [89]. Фекальная бактериотерапия — это клиническая процедура, при которой жидкая суспензия стула от человека-донора (члена семьи или здорового донора) инокулируется пациентам кишечника для восстановления микробиоты кишечника в рефрактерных случаях колоректальной инфекции Clostridium difficile после антибактериальная терапия [90, 91].Эти фекальные препараты могут содержать от 3,0% до 10% жизнеспособных мертвых бактерий и клеток толстой кишки и других компонентов, которые влияют на результаты трансплантации, усиливая или подавляя иммунную функцию врожденных лимфоидных клеток (ВЛК) [92]. Сегодня проводится более 150 клинических испытаний с участием FMT, в основном в США, для лечения большого количества метаболических, инфекционных и иммунологических заболеваний и осложнений, включая пациентов с трансплантированными почками и печенью, особенно с бактериальной колонизацией, устойчивой к антибиотикам или инфекция (ClinicalTrials.gov).
Исследования показали, что около 90% пациентов, получавших FMT от инфекции Clostridium difficile , были излечены, по сравнению с 31% пациентов, получавших только ванкомицин (van Nood et al. [93]). Известно, что Lactobacillus , Enterococcus , Bifidobacterium и Bacteroides обладают ингибирующей активностью против роста C. difficile . Например, вместе с FMT переносятся различные вирусы, археи, грибы, паразитические виды и метаболиты [92].Таким образом, необходимы дальнейшие исследования, чтобы подтвердить их способность потенциально способствовать развитию кишечного иммунитета хозяина при оптимизации разнообразия микробиома.
Серия исследований на животных моделях показала, что микробиом кишечника играет решающую роль в увеличении веса и ожирении [49, 50, 70]. Исследования на мышах и крысах с худым и генетическим ожирением (ob / ob) выявили большие различия в их кишечной абсорбции и составе микробиома, которые связаны с 50% сокращением Bacteroidetes и пропорциональным увеличением видов Firmicutes и Archaea [74, 75].Перенос микробиоты от толстых мышей к свободным от микробов мышам-хозяевам вызывает больший набор веса, чем у тех, кто получает микробиоту от тощих доноров [49, 50]. Потребление большого количества жиров увеличивает проницаемость кишечника и распространение ЛПС, связанное с ожирением. Напротив, введение Bifidobaterium infantis мышам снижает выработку провоспалительных цитокинов, одновременно способствуя приросту белой жировой ткани [68, 71]. Результаты лечения FMT людей с различными метаболическими нарушениями неубедительны.Перенос кишечной микробиоты от худых доноров слегка повысил чувствительность к инсулину у пациентов с метаболическим синдромом [94]. Кратковременное воздействие антибиотиков может улучшить периферическую чувствительность к инсулину у небольшого числа лиц с ожирением [94]. Кроме того, в исследовании с 75 добровольцами с ожирением и предиабетом, которые прошли 8-дневную терапию антибиотиками (амоксициллин и ванкомицин), дисбактериоз, вызванный антибиотиками, не повлиял на проницаемость кишечника, что подтверждается изменением уровней ЛПС и экспрессии липидных метаболических ферментов [ 95].Такая неоднородность может отражать сложные взаимодействия между генетическими факторами, образом жизни и факторами окружающей среды, полученными из различных модельных систем.
6.3. Small Molecules
Ацетат, пропионат и бутират являются наиболее важными SCFAs, которые в конечном итоге вводятся в виде пероральных пищевых добавок. SCFAs, действующие как сигнальные молекулы, вызывают у человека различные физиологические эффекты [96]. Они связываются с рецепторами GPR41 и GPR43 (рецепторы свободных жирных кислот 2 и 3, FFARs 2/3) в L-клетках кишечника, сигнализируя о высвобождении GLP-1 и пептида YY [78].Примечательно, что инъекция пептидов GLP-1 стимулирует передачу сигналов инсулина в белых жировых тканях, тем самым уменьшая ожирение. SCFAs также увеличивают секрецию лептина и адипогенез, ингибируя липолиз жировой ткани. В печени пропионат действует как глюконеогенный фактор, а ацетат и бутират действуют как липогенные факторы [96]. SCFAs, в частности пропионовая и масляная кислоты, могут напрямую предотвращать низкую воспалительную реакцию при ожирении, контролируя микробиоту кишечника [88]. Бутират, действующий на человеческие моноциты, ДК костного мозга и макрофаги, подавляет продукцию IL-12, снижает экспрессию костимулирующих молекул и блокирует транслокацию NF- κ B [37].Добавка бутирата, структурного аналога и кетонового тела β -гидроксибутирата (также известного как 3-гидроксибутират) может подавлять активность гистондеацетилаз (HDAC). HDACS способствует специфическим модификациям гистонов для регулирования транскрипции, репликации и репарации ДНК. Он также проявляет противовоспалительную активность, подавляя активацию NF- κ B и STAT1 [22–95]. Сукцинат является хорошо известным ингибитором гистоновых деметилаз (DNMT) и одиннадцати транслокационных (TET) метилцитозиндиоксигеназ, которые окисляют 5-метилцитозины, способствуя деметилированию ДНК [22].
Несколько низкомолекулярных ингибиторов метаболических путей, таких как 2-дезоксиглюкоза, дихроацетат, BPTES (бис-2- (5-фенилацетамидо-1,3,4-тиадиазол-2-ил) этилсульфид), диметилмалонат (DMM) , ротенон и метформин считаются многообещающими терапевтическими средствами [51, 52, 60]. Метформин — препарат первой линии для лечения СД2, который значительно улучшает метаболические параметры, такие как масса тела, уровень инсулина, глюкозы, лептина и С-реактивного белка в плазме [96]. Ингибируя комплекс I в дыхательной цепи митохондрий, метформин повышает уровень лактата в плазме.Лактоацидоз — актуальная проблема в клинической практике. Метформин вызывает переключение с OXPHOS на аэробный гликолиз [97]. Таким образом, у лиц, принимающих метформин, выше риск развития метформин-ассоциированного лактоацидоза. Лечение метформином значительно увеличивает относительное количество A. muciniphila в фекальной микробиоте мышей с ожирением [34]. А . muciniphila является продуцентом ацетата и пропионата посредством деградации муцина, и у пациентов с СД2, получавших метформин, увеличивается количество бактерий, продуцирующих бутират и пропионат, что, в свою очередь, может способствовать положительному эффекту метформина [85].Интересно спросить, связаны ли эффекты метформина также с путями метаболического репрограммирования макрофагов M1 / M2.
Сукцинат — сильный провоспалительный медиатор [51, 63]. DMM подавляет выработку митохондриальных АФК за счет ингибирования сукцинатдегидрогеназы (SDA), которая превращает сукцинат в фумарат. Это метаболическое изменение ограничивает продукцию IL-1 β , одновременно увеличивая синтез иммунодепрессивного IL-10 [67]. TEPP-46 и DASA-58, два низкомолекулярных ингибитора PKM2 (изофермент пируваткиназы 2), ингибируют LPS-индуцированный HIF-1 α и IL-1 β , тем самым способствуя репрограммированию макрофагов M1 в M2 [63 , 98].Таким образом, необходимы дальнейшие исследования для подтверждения этих фармакологических целей и подходов к контролю метаболических нарушений.
7. Выводы и перспективы
За последнее десятилетие секвенирование и анализ большого количества человеческих микробиомов и сборка их метаболических путей расширили наше понимание того, как бактериальные метаболиты участвуют во взаимодействиях микробов и хозяев при здоровье и болезнях. . Функциональные вариации микробиомов кишечника у разных людей показали, что анаболические и катаболические пути имеют важное значение для поддержания основных структур сообщества для гомеостаза всего тела.Появляющиеся новые биомаркеры обещают специфическое различение типов и видов, чтобы подтвердить доказательства прямого участия микробов в диабете II типа, ожирении, метаболических нарушениях, воспалительных заболеваниях кишечника и даже некоторых видах рака.
Нет сомнений в том, что дисбактериоз, изменяя метаболизм микробиома и, следовательно, метаболизм хозяина, не только влияет на воспалительные реакции и адаптивный иммунитет, но также способствует метаболическим нарушениям. Использование инновационных фармацевтических и нутрицевтических продуктов для управления микробной колонизацией и развития здорового кишечного микробного сообщества в раннем детстве и во взрослом возрасте может предотвратить возникновение распространенных воспалительных и метаболических патологий.Наконец, открытие и разработка лекарств, которые нацелены на ферменты метаболических путей, а также вызывают про- и противовоспалительные реакции иммунных клеток, в ближайшем будущем обеспечат новую передовую медицину для метаболической терапии.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
JEB, JF и MGM провели процесс обзора литературы и отобрали статьи, написали рукопись и подготовили рисунки.


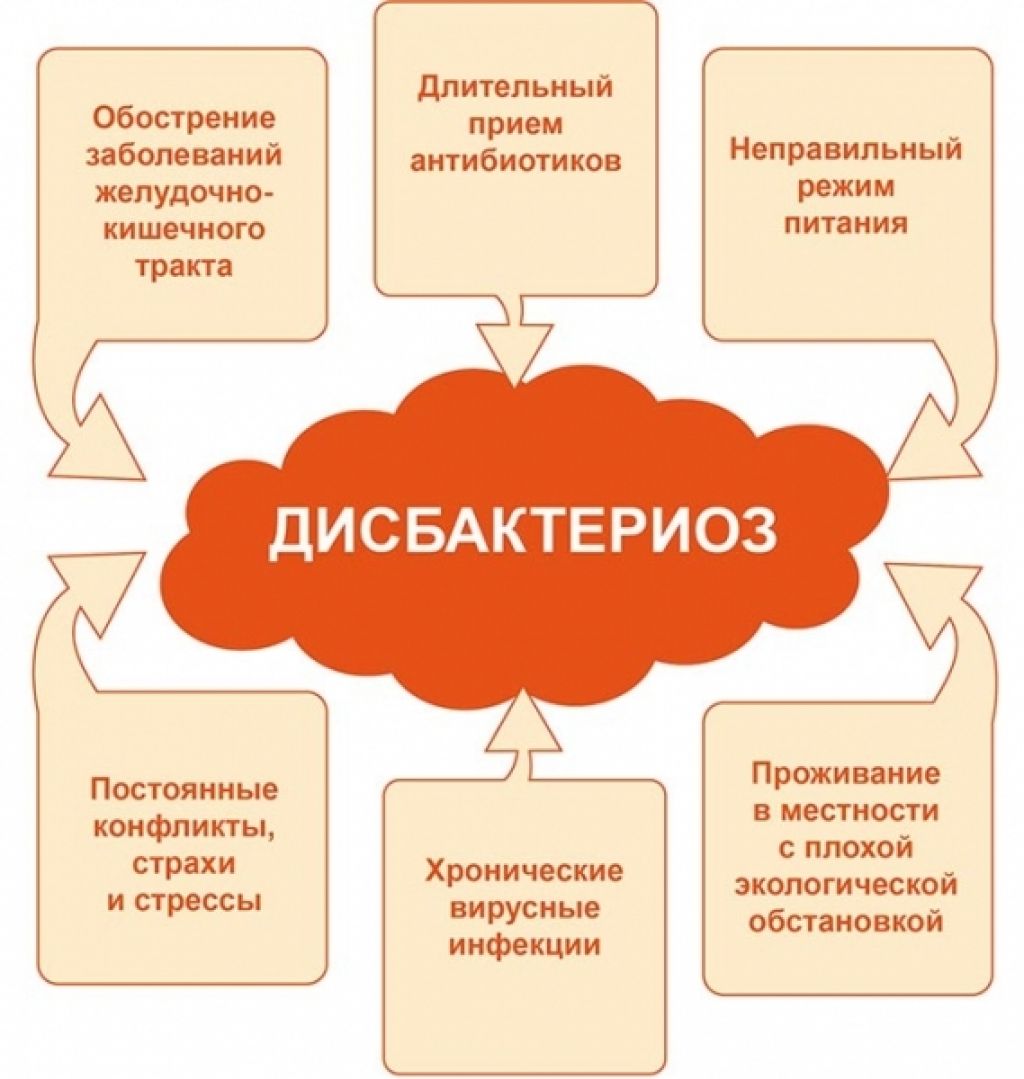


 В., Хазанова А.И. Гастроэнтерология и гепатология: диагностика и лечение: руководство для врачей // М.: Миклош. 2007.
В., Хазанова А.И. Гастроэнтерология и гепатология: диагностика и лечение: руководство для врачей // М.: Миклош. 2007.