что это такое, лечение, диета, отзывы
Метаплазия желудка — изменение строения тканей слизистой оболочки желудка. Под влиянием неблагоприятных факторов они становятся схожими с оболочками тонкого и толстого кишечника, благодаря чему нарушается основные функции пищеварительного тракта.
Это не отдельное заболевание, а очень тревожный симптом неполадок в организме. К тому же, при прогрессирующей метаплазии клетки начинают перерождаться, приводя к онкологии и летальному исходу.
Описание
К метаплазии приводят много факторов, главные из которых — регулярные погрешности питания, вредные привычки и системный прием медикаментозных препаратов. Под таким воздействием клетки слизистой оболочки желудка перестают выполнять свою функцию, развивается воспалительный процесс с дальнейшим изменением структуры оболочки.
Запущенный процесс переходит в дисплазию, при которой нарушается функциональная способность желудка и происходят изменения на клеточном уровне. Если метаплазия считается доброкачественными изменениями, поддающимися корректировке, то дисплазия лечению не поддается и приводит к развитию рака.
Виды
Классификацию по типам можно определить, как тонкокишечную (полную) и толстокишечную (неполную). Оба состояния достаточно опасные, вызваны различными причинами с обязательной медицинской корректировкой.- Тонкокишечная полная метаплазия чаще всего вызвана наличием хронического гастрита и приводит к образованию очагов изменений. Характерным признаком полной метаплазии является обнаружение в эпителии слизистой оболочки желудка ядер (клеток) Панета. Измененные ткани не только формируют стенки тонкого кишечника, но и начинают так же функционировать.
- Толстокишечная метаплазия еще более опасна. При этой патологии эпителий желудка практически полностью состоит из клеток толстого кишечника. Нарушается нормальный процесс формирования желез желудка, а также его пищеварительная функция. Это состояние является предраковой угрозой, ведь у более чем 94% пациентов с опухолями желудка процесс начинался именно так.
Степени
Развитие таких изменений происходит с разной скоростью. Считается, что к метаплазии склонны пожилые люди (особенно старше 70 лет), но зачастую такое заболевание встречается и у более молодых пациентов. Степень определяется согласно объему внедряемой ткани и площади поражения.
Считается, что к метаплазии склонны пожилые люди (особенно старше 70 лет), но зачастую такое заболевание встречается и у более молодых пациентов. Степень определяется согласно объему внедряемой ткани и площади поражения.
Имеется три вида изменений:
- Легкая метаплазия, при которой деструкция пищеварительного тракта не превышает 5%.
- Средняя степень характеризует изменения до 20%.
- Тяжелая форма, со степенью поражения свыше 25%.
Полная метаплазия означает, что, несмотря на изменения тканей, функции органов сохраняются, что обеспечивает более успешных прогресс лечения. Неполная степень встречается при толстокишечной метаплазии и означает частичную дисфункцию органа. Это состояние намного тяжелей и считается предраковым.
Основные разновидности
У метаплазии также существует градация по типам изменений в тканях. Она проводится по месту локализации поражений и бывает следующих видов.
Классификация по типам поражений:
- Пилорическая метаплазия.
 В этом случае происходит замещение трубчатых желез желудка слизистой тканью.
В этом случае происходит замещение трубчатых желез желудка слизистой тканью. - Реснитчатая метаплазия. В тканях пораженного органа появляются характерные клетки, которые приводят к появлению рака.
- Панкреатическая метаплазия. Достаточно редкое состояние, характеризующееся появлением мелкозернистых клеток.
Очаговая и диффузная форма метаплазии чаще всего встречается в антральном отделе желудка.
При очаговой метаплазии патологический процесс происходит в антральном отделе желудка в отдельно взятой части. Под влиянием неблагоприятных факторов клетки перестают обновляться, атрофируются и отмирают. Диффузная метаплазия происходит без отмирания тканей и затрагивания глубоких слоев.
Причины возникновения
Несмотря на многочисленные исследования в данной области, механизм возникновения таких патологий до конца не изучен.Считается, что первопричиной метаплазии является жизнедеятельность хеликобактер пилори, которая также вызывает некоторые виды гастрита и язвы.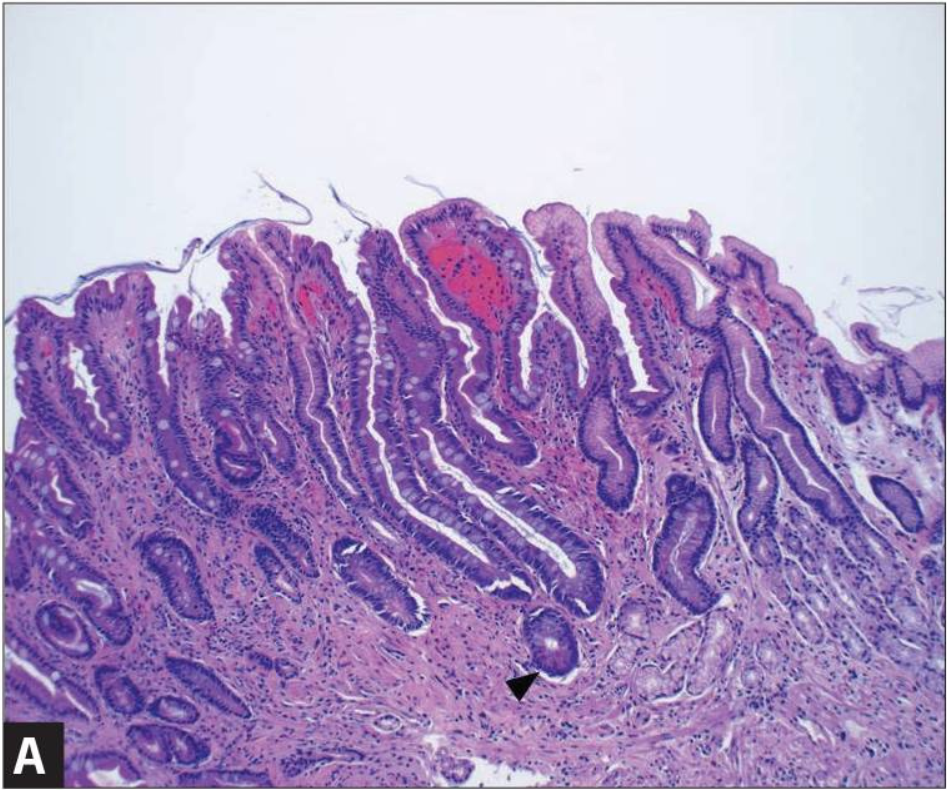
Другие причины развития метаплазии:
- Воспалительные процессы в органах ЖКТ.
- Хронические заболевания желудка.
- Регулярное раздражение стенок желудка.
- Пониженная кислотность желудочного сока.
- Проблемы с микрофлорой, частые дисбактериоза.
- Гормональный дисбаланс в организме.
- Стресс и сильное нервное перенапряжение.
Кроме того, недуг может развиться при кишечной дисфункции, когда происходит заброс дуоденального и гастрального содержимого в пищевод. Уничтожается нормальная микрофлора желудка, происходят патологические процессы в верхних слоях эпителиальной ткани.
Основные симптомы
Одна из главных угроз этого недуга заключается в практически бессимптомном течении. На ранних стадиях, когда лечение особо успешно, болезнь проявляет себя незначительным дискомфортом, на который обычно никто не обращает внимание.
Ситуацию ухудшает то, что обычно метаплазия развивается на фоне хронического гастрита или язвы, поэтому пациенты принимают признаки за симптоматику уже имеющихся заболеваний.
Основные признаки метаплазии желудка:
У большинства пациентов симптомы проявлялись нерегулярно и без большой интенсивности. Это значительно усложняет задачу диагностики, а также приводит к значительному прогрессу заболевания.
Методы диагностики
Основным исследованием, способным обнаружить или заподозрить патологические изменения эпителия желудка является эндоскопия.
При зондировании в местах локализации можно увидеть кровотечения, прободения и рубцы. Дальнейшее обследование проводится более углубленно, с применением современных методик диагностики.
Что может показать метаплазию:
- Развернутый анализ крови покажет содержание сульфамуцина, который провоцирует рост раковых клеток.
- При проведении анализов крови появляется реакция на раково – эмбриональный антиген.

- Использование контрастного вещества при проведении эндоскопии (хроматический метод). Измененные ткани приобретают специфическую окраску.
При обращении к гастроэнтерологу могут быть назначены специальные обследования, а процедуру эндоскопии необходимо будет пройти несколько раз. Важное значение при дальнейшей терапии имеет обнаружение первопричины заболевания
Лечение кишечной метаплазии слизистой желудка
Пациенты с метаплазией желудка должны настраиваться на длительное лечение. Специалист подберет комплексную терапию, включающую в себя медикаментозные средства, рецепты народной медицины, диету и корректировку привычного распорядка дня.
Используются следующие категории лекарственных препаратов:
- Протонные ингибиторы для нормализации кислотности желудочного сока («Пантопразол», «Омепразол», «Рабепразол» и другие).
- Блокаторы гистаминов, подавляющие секреторную активность («Ранитидин», «Циметидин»).
- Антациды, нейтрализующие соляную кислоту желудка («Фосфалюгель», «Маалокс»).

- Гастропротекторы, восстанавливающие слизистую оболочку желудка.
- Антибактериальные средства используются для уничтожения патогенных бактерий в желудке. Выбор препарата необходимо проводить в индивидуальном порядке.
Медикаментозная терапия требует тщательного соблюдения, наблюдения за прогрессом в лечении заболевания и корректировка препаратов и доз, при неэффективности лечения.
Операция
Кардинальным решением проблемы является операция. Проводится она после полного обследования, оценки рисков и шансов на успех и состояния пациента.Хирургическое вмешательство также рекомендуется при низкой эффективности приема медикаментов, чтобы не допустить перерождения патогенных тканей эпителия в злокачественную опухоль.
Различают два типа операций:
- Полостную, при которой процедура удаления тканей проводится через разрез брюшной полости. Используется при больших очагах поражения, характеризуется длительным периодом реабилитации.

- Лапароскопический метод, подразумевающий введение зонда и видеокамеры через небольшие отверстия. Ход операции контролируется при помощи эндоскопа, послеоперационный период менее болезненный. Недостатком метода считается возможность использования только при небольших участках поражения.
При операции удаляется часть тканей слизистой желудка, поэтому обязателен щадящий режим и диетическое питание после вмешательства. Необходимость такой процедуры, тип и дальнейшее лечение определяет лечащий врач на основании индивидуальных характеристик пациента.
Народные средства
Лечение метаплазии обычно не проводится исключительно рецептами народном медицины. Следует отметить, что такая проблема не пройдет сама по себе и способна прогрессировать в онкологические заболевания, поэтому не стоит терять драгоценное время, занимаясь самолечением.
Вместе с тем, эффективность некоторых домашних методик признают даже специалисты, поэтому нелишним будет взять на вооружение некоторые рецепты.
Рецепты народной медицины при метаплазии:
- Отвар льняных семян. Дневная дозировка: 25 грамм семян на стакан кипятка. Смесь необходимо проварить пять минут, после чего процедить и разделить на три – четыре приема. Пить перед едой.
- Настой зверобоя. Примерно 15 грамм сухой травы заваривают в термосе в 250 мл кипятка. После того, как смесь настоится, процедить и разделить на пять приемов. Пить курсами по две недели с перерывами в 7 дней.
- Лекарственный сбор из ромашки, календулы, тысячелистника и корня алтея. Все ингредиенты взять в равных пропорциях. На дневную дозу заварить 20 грамм смеси в полулитре кипятка. Настоять не менее двух часов, процедить и принимать по пять – шесть раз в день перед едой.
Принимаемые средства стоит обязательно обговорить с лечащим врачом. Только специалист может одобрить и разрешить использование средств народной медицины, которые многие из нас привыкли считать совершенно безопасными.
При самолечении и игнорировании медикаментозной терапии последствия могут быть самые плачевные, вплоть до летального исхода.
Диета
Огромное значение при патологиях желудочно – кишечного тракта занимает диетическое питание. Следует раз и навсегда изменить привычный образ жизни, отказаться от вредных привычек и больше времени уделять своему здоровью.Метаплазия не лечиться за один день, тем более, что велик риск рецидивов. Именно поэтому, стоит запомнить принципы диетического питания, которые помогут поддерживать органы ЖКТ здоровыми и снизить риск опухолей.
Основные тезисы диеты при метаплазии:
- Следует отказаться от всех вредных продуктов. К ним относятся консервы, копчености, полуфабрикаты, соленые и острые блюда. Одной из причин возникновения недуга является раздражение слизистой оболочки желудка, поэтому обязательно стоит устранить этот фактор.
- Дневной рацион необходимо разбить на несколько небольших порций, следует питаться часто, но понемногу.
 Основных приемов пищи должно быть три, между ними желательно сделать два – три легких перекуса.
Основных приемов пищи должно быть три, между ними желательно сделать два – три легких перекуса. - Вся пища должна быть легкоусвояемой и разнообразной. Нельзя придерживаться диеты и отказываться от каких – либо групп веществ, рацион должен быть разнообразным и полезным.
- Большое значение имеет способ приготовления пищи. Можно варить, запекать и тушить продукты, но нельзя жарить или засаливать.
- Температура принимаемой пищи должна быть комфортной. Слишком горячая или холодная еда может спровоцировать спазм сосудов или повышенную выработку желудочного сока.
Профилактика
Особых мероприятий для предупреждения развития метаплазии нет. Это принципы здорового питания, отказ от вредных привычек и самолечения (в том числе и народными рецептами), а также посильные физические нагрузки.
Большое значение в профилактике желудочно – кишечных проблем имеет нормальное психоэмоциональное состояние, поэтому стрессы и нервные перегрузки желательно исключить из своей жизни.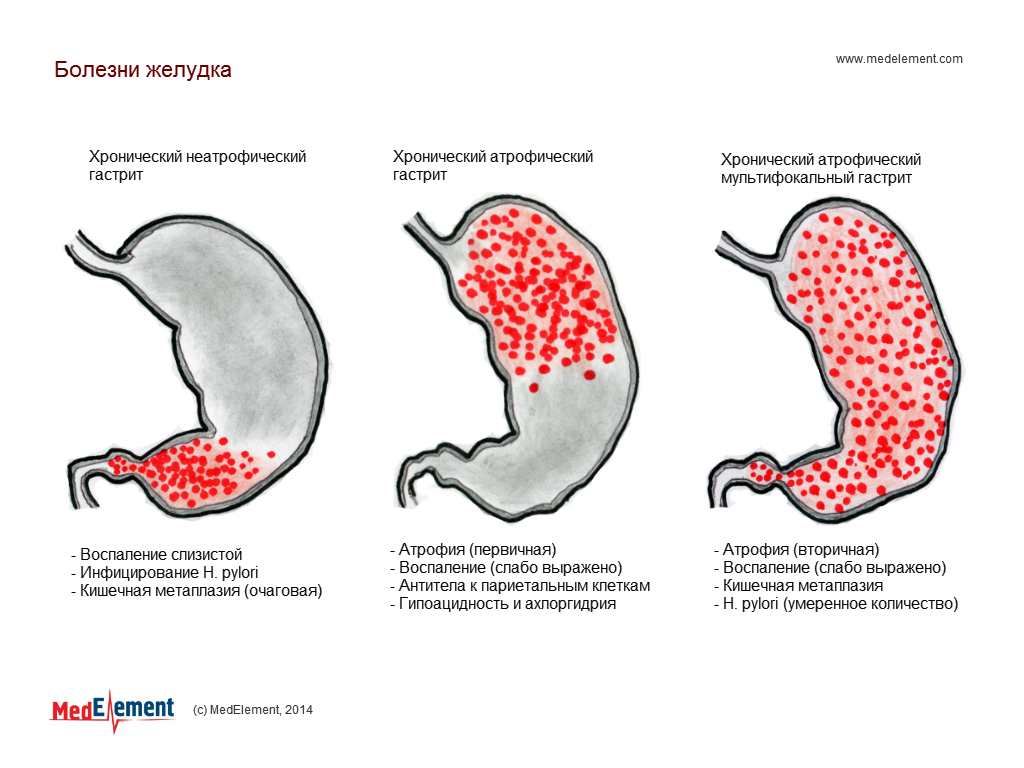 При обнаружении болей различной локализации, стоит своевременно проходить обследования, а также не забывать о терапии хронических заболеваний.
При обнаружении болей различной локализации, стоит своевременно проходить обследования, а также не забывать о терапии хронических заболеваний.
Все эти рекомендации помогут не только избежать развития этой страшной патологии, но и значительно улучшат качество жизни.
Метаплазия желудка — серьезный недуг, которые тяжело поддается лечению. К развитию заболевания приводят много факторов, некоторые из которых сложно предотвратить.
При обнаружении симптомом проблем органов ЖКТ, следует обязательно посетить врача для дальнейшего обследования. Опасность метаплазии заключается в бессимптомном начале и быстрому прогрессу до необратимых изменений.
Какими факторами может быть спровоцирован недуг, каковы основные симптомы и методы диагностики заболевания, а также подходящие виды лечения — вся интересующая информация по теме в нашей статье.
Отзывы больных
Яна:
Диагноз метаплазия поверг меня просто в шок. Гастрит у меня был с подросткового возраста, сказались перекусы бутербродами в период учебы.
До язвы, к счастью, не дошло, но с годами стала более внимательно относится к здоровью, поэтому примерно раз в год наблюдалась у гастроэнтеролога. На очередном приеме мне сказали пройти дополнительную эндоскопию с контрастным веществом, а затем отправили еще и на анализы. В итоге — метаплазия, причем для меня это слово сразу ассоциировалось с раком. Врач сказала, что болезнь обнаружена на раннем сроке, но порекомендовала операцию, так как лекарства не всегда дают эффект. Все прошло просто отлично, больше нервничала при подготовке к процедуре. Через два месяца после операции заново сделала все анализы, пока все в норме. Сейчас больше времени уделяю правильному питанию, ведь болезнь может вернуться.
Николай:
Мой отец умер в 40 лет от рака желудка, поэтому услышав от врача новость о патологических изменениях слизистой, я был просто в шоке. К счастью, медицина за это время намного продвинулась вперед, появились новые методики. После обследования ситуация немного улучшилась, так как у меня была «несложная» стадия метаплазии, поддающаяся медикаментозному лечению.
Сейчас прохожу полный курс, судя по анализам прогресс положительный. В семье пришлось полностью пересмотреть все взгляды на питание, отказаться от алкоголя и бросить курить. В целом, настраиваюсь на успех, на всякий случай ищу хорошего хирурга за границей.
Диета При Метаплазии Пищевода – Telegraph
>>> ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ <<<
Диета При Метаплазии Пищевода
ГЛАВНАЯ » БОЛЕЗНИ И НЕДОМОГАНИЯ » ЖЕЛУДОЧНО-КИШЕЧНЫЙ ТРАКТ
Каковы причины появления пищевода Барретта? В каких случаях существует риск развития рака? Исследуем симптомы и лечение метаплазии пищевода, а также диету борьбы с рефлюксом желудочного сока.
Пищевода Баррет – это заболевание, при котором клетки, которые покрывают внутренние стенки нижней части пищевода в непосредственной близости от кардиального отдела, во время непрерывного процесса репликации заменяются клетками типа тех, которые покрывают внутреннюю стенку желудка и двенадцатиперстной кишки (первая часть тонкого кишечника).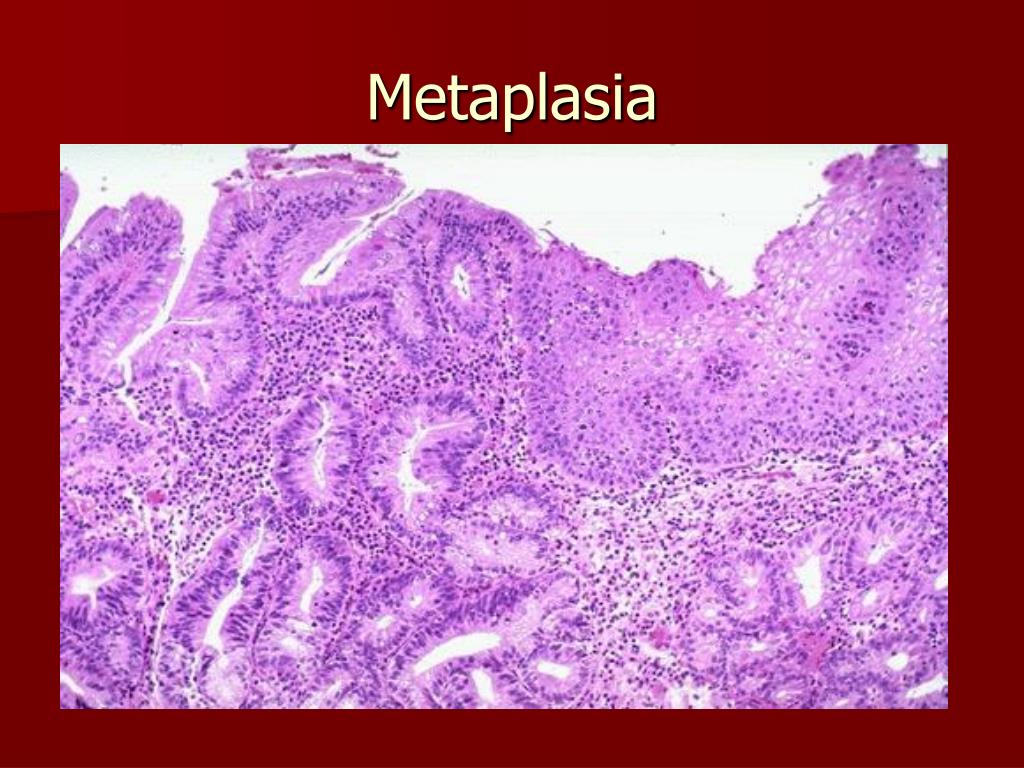
Процесс замены клеток, описанный выше, имеет название метаплазия.
Пищевод Барретта и метаплазия являются прямым следствием эрозии эпителия (поверхностных клеток) пищевода при воспалительном процессе, который развивается при продолжительном или случайном забросе в трубку пищевода соков желудка и кишечника.
Эти соки сильно кислые, поэтому разрушают нормальные клетки эпителия пищевода, которые не рассчитаны на такие условия.
Таким образом, образование пищевода Барретта может быть истолковано, как попытка защиты организма от постоянного травмирования пищевода. Патологическим состоянием, которое вызывает повторяющиеся контакты пищевода с желудочным соком, является рефлюкс эзофагит.
Сама болезнь практически бессимптомна и, следовательно, не добавляет каких-либо симптомов в плане клинической картины ГЭРБ. Пациент, по сути, не испытывает каких-либо признаков процесса замены клеток в его пищеводе. Поэтому было бы разумно предполагать, что пищевод Баррет не добавляет каких-либо проблем, связанным с желудочно-пищеводным рефлюксом.
На самом деле доказано, что пищевод Барретта увеличивает примерно в 30-40 раз вероятность развития редкой формы рака – аденокарцинома пищевода (встречается у 2-5% пациентов, имеющих пищевод Барретта). Аденокарцинома – это форма опухоли, для которой, к сожалению, ещё не существует эффективного лечения и, таким образом, она быстро приводит к смерти (выживаемость в течение 5 лет после постановки диагноза значительно ниже 10%).Конечно, образование пищевода Баррета не означает обязательного развития рака. Риск невелик, и снижается ещё, если заболевание своевременно диагностировано и проводится соответствующее лечение.
Классификации можно проводить в зависимости от размера повреждения:
Классификация может также осуществляться в зависимости от типа метаплазии, т.е. в зависимости от того как и какие клетки были заменены:
Как было сказано, пищевод Баррета – это практически бессимптомное заболевание. Однако, это сопровождается характерной клинической картиной желудочно-пищеводного рефлюкса, обращают на себя внимания следующие симптомы и признаки:
Как уже говорилось, было бы логично рассмотреть пищевод Барретта как осложнение от рефлюкс эзофагита.
По сути, организм пытается защитить эпителий пищевода от эрозии по действием желудочного сока, заменив нормальные клетки на клетки типичные для двенадцатиперстной кишки, которые способны противостоять высокой кислотности.
Но оказывается, что существует довольно много пациентов с пищеводом Барретта, которые никогда не страдали от изжоги и рефлюкса. Таким образом, в настоящее время истинная причина пищевода Барретта неизвестна.
Однако, прекрасно известны ряд факторов, увеличивающие риск его развития:
Диагностика проводится с помощью специального эндоскопического исследования верхних путей желудка. Исследование заключается во введении через рот в пищевод эндоскопа, который имеет на вершине лампочку и миниатюрную видеокамеру.
Через видеокамеру на внешний экран выводиться изображение эпителия, который покрывает внутренние стенки пищевода. В нормальных условиях эпителий имеет бледно-розовую и блестящую окраску. В случае болезни эпителий становится красным или алым и бархатистым.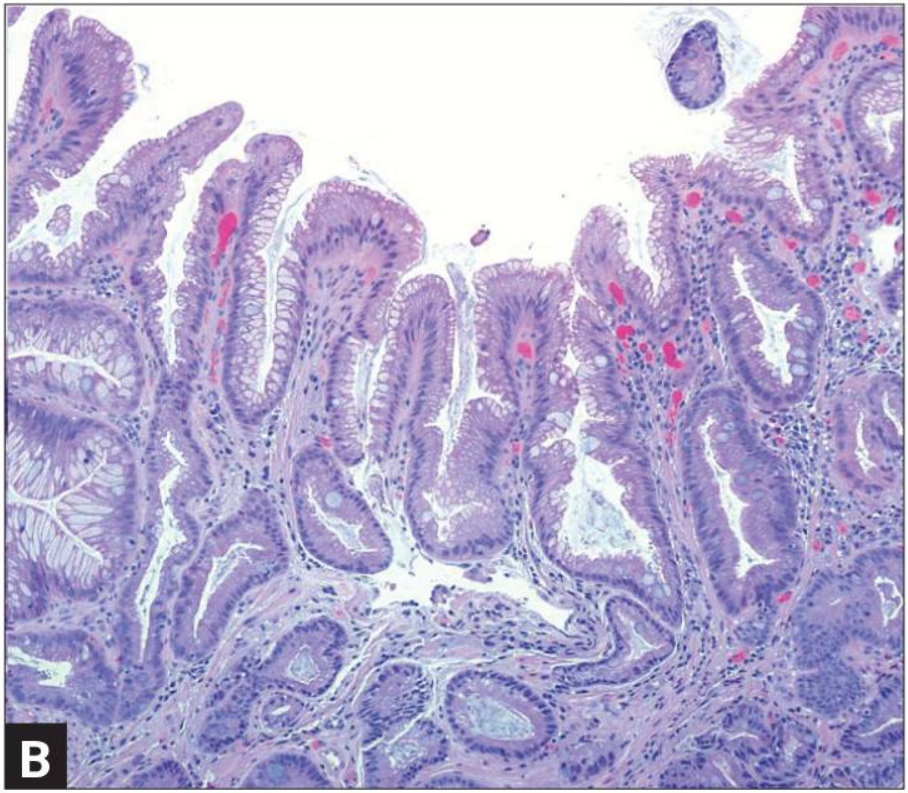
Эндоскоп позволяет также получить образцы ткани. Её забор осуществляется в нескольких точках подозрительных областей. Образцы в дальнейшем исследуются под электронным микроскопом, который позволяет оценить мутации клеток, а также степень дисплазии, что является признаком возможной раковой пролиферации.
Конечно, дисплазия высокой степени, как наиболее близкая к опухолевой дегенерации, требует быстрого принятия лечения.
Выбор терапии зависит, как уже сказано , от степень дисплазии клеток пищевода, что оценивают при диагностике. Если дисплазия отсутствует, то устранение проблемы рефлюкса, естественно, предотвращает развитие зон эрозии.
Частота мониторинга зависит от состояния дисплазии.
Если дисплазия отсутствует, то эндоскопию повторяют через год, если она по-прежнему отсутствует, то тест необходимо повторить через 3 года.
Если дисплазия низкого уровня, то исследование повторяют через шесть месяцев после первого теста.
Если обнаруживается дисплазия высокой степени – это требует хирургического лечения:
Соблюдение ряда элементарных правил гигиены, позволяет существенно снизить риск развития пищевода Баррета.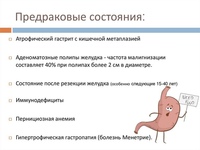
Также необходимо придерживаться здорового рациона питания. Чтобы предотвратить рефлюкс и заброс желудочного сока в пищевод необходимо придерживаться диеты, которая не вызывает медленного пищеварения и способствует быстрому опорожнению желудка.
Кроме того, рекомендуется принимать щелочные продукты, которые позволяют противостоять повышенной кислотности желудочного сока.
Источник: https://sekretizdorovya.ru/publ/metaplazija_pishhevoda/2-1-0-497
Аденокарцинома пищевода – крайне серьезное заболевание. Прогноз при раке пищевода напрямую зависит от того, на какой стадии было диагностировано заболевание и начато лечение.
К сожалению, большинство пациентов начинает лечиться в III-IV стадию, когда сделать уже практически ничего нельзя. Поэтому так важно выявлять и лечить те патологии, которые могут привести к опухолевому процессу.
Метаплазия слизистой оболочки пищевода (пищевод Барретта) – это одно из этих состояний.
Цилиндроклеточная метаплазия пищевода
Метаплазия пищевода – что это такое
Классификация метаплазии слизистой пищевода
Морфологическая характеристика цилиндроклеточной метаплазии пищевода
Профилактика и рекомендации по образу жизни
Метаплазия – это процесс неполной регенерации, когда в результате длительного действия на ткань повреждающих факторов (химического, термического, механического), она замещается другой дифференцированной тканью, не свойственной данной анатомической структуре, однако более приспособленная выдержать действие повреждающих факторов.
Так при длительном действии рефлюктата на слизистую пищевода, плоскоклеточный эпителий преобразуется в более устойчивый цилиндроклеточный. Таким образом, в основе метаплазии лежат компенсаторно-приспособительные процессы, защищающие орган от разрушения.
Метапластическая ткань высоко дифференцирована, в плане развития опухоли она не опасна. Но металлизированная ткань не может быть совершенно нормальной, так как она развивается в несвойственном ей анатомически месте. Часто в ней присутствуют очаги дисплазии.
Дисплазия – это измененный тип ткани. Дисплазия характеризуется нарастанием полиморфизма клеток и ядер, митотической активностью, нарушением ориентации клеток в тканях.
Никакой клинической симптоматикой этот процесс не сопровождается.
Цилиндроклеточная метаплазия пищевода – это приспособительная реакция организма к повреждающим условиям внешней среды, выражающаяся в замене одного типа эпителия (плоскоклеточного) на другой, более приспособленный к этим условиям (цилиндрический).
В настоящее время существует разногласие между ведущими клиническими школами на то, какие виды МП наиболее подвержены карциногенезу. Некоторые авторы считают, что только метаплазия по кишечному типу способна к переходу в злокачественную опухоль. Однако это мнение разделяют далеко не все исследователи, они включают в факторы риска аденокарциномы и метаплазию по гастральному типу.
Многие вопросы развития цилиндроклеточной метаплазии пищевода остаются не до конца выясненными. В настоящее время общепризнанной считается теория, согласно которой, под действием повреждающих факторов, стволовые клетки слизистой оболочки пищевода занимают поверхностное положение, где они дифференцируются в цилиндрический эпителий (желудочный или кишечный)
Неясными остаются и механизмы развития аденокарциномы при цилиндрической метаплазии. Но, тем не менее, разработанные ныне схемы лечения метаплазии пищевода предотвращают озлокачествление процессов.
Единой классификации метаплазий слизистой пищевода не существует. Это связано с тем, что не все звенья патогенеза до конца изучены.
Это связано с тем, что не все звенья патогенеза до конца изучены.
В настоящее время, процесс представляется следующим образом: под действием агрессивного рефлюктата, на фоне снижения клиренса пищевода, в его дистальном отделе (возле желудка) возникает воспалительная реакция.
Если повреждающий фактор продолжает действовать, возникает клиника эрозивно-язвенного эзофагита с воспалением внутри очага и лимфоцитарной инфильтрацией.
Единичные очаги сливаются, эпителий пищевода деструктурируется.
Молодые, способные дифференцироваться клетки, в норме находящиеся в глубине слизистой, оказываются на поверхности.
Испытывая действие рефлюктата, они дифференцируются не в плоскоклеточную ткань пищевода, а в железистый цилиндроклеточный эпителий, свойственный слизистой желудка и способной противостоять возникшим условиям.
Хотя вновь образованная ткань и высоко дифференцирована, она образована в условиях хронического воспаления в несвойственном ей анатомическом образовании, в ней образуются очаги дисплазии – нарушенной ткани с высоким митотическим потенциалом (склонны к быстрому делению).
Для описания процесса пользуются следующими характеристиками:
В зависимости от протяженности и удаленности от переходной линии (зубчатой линии) метаплазированного участка пищевода:
По морфологическому принципу, метаплазии пищевода делят:
Цилиндроклеточная метаплазия слизистой пищевода – это не клинический, а патанатомической феномен, возникающий как результат длительного повреждающего действия на слизистую пищевода гастро-дуоденального рефлюктата. Чаще всего причиной патологии является ГЭРБ (с хиатальной грыжей и без нее). Однако метаплазия развивается и при других заболеваниях:
Предрасполагающими факторами к развитию патологии являются:
Так как патология является результатом различных заболеваний, специфических симптомов метаплазии пищевода не существует.
Клиническими проявлениями метаплазии пищевода могут быть:
Отсутствие специфической симптоматики сильно усложняет раннюю диагностику этой патологии.
Диагноз выставляется на основании эндоскопического осмотра слизистой и цитологического исследования биоптатов (гистология).
Для правильной постановки диагноза, понимания причин возникновения данного состояния, а главное для предотвращения развития аденокарциномы необходимо максимально обследовать пациента
Вся эта информация необходима, чтобы выработать индивидуальную схему лечения данного конкретного больного.
Морфологическое исследование – это окончательный метод подтверждающий наличие цилиндроклеточной метаплазии пищевода.
Долгое время считалось, что кишечная метаплазия наиболее часто трансформируется в аденокарциному, однако сейчас на большом фактическом материале доказано, что вид метаплазии не влияет на частоту перерождения в рак, а поэтому и желудочные формы метаплазии требуют одинакового пристального внимания.
Понятие цилиндроклеточная метаплазия включает большой спектр изменений: от поражений без дисплазии до начальных форм рака. Следовательно, лечение и прогноз этих форм будут различными.
Даже размеры и количество очагов не всегда определяют прогноз заболевания. Множественные очаги метаплазии с высокодифференцированной, хотя и измененной тканью, могут в течение многих лет оставаться стабильными, а единичный очаг с недифференцированной тканью может потребовать срочной операции.
Хороший прогноз заболевания отмечается в случае полной ремиссии ГЭРБ и отсутствии гистологических признаков дисплазии. Плохой прогноз – высокая степень дисплазии на фоне сохраняющихся забросов рефлюктатов.
Плохим прогностическим признаком долгое время считалось наличие полной и неполной кишечной метаплазии (отличающейся от полной кишечной метаплазии наличием в биоптате желудочных клеток) на длинном сегменте (но даже этот признак сейчас признают не все ученые).
А между этими полярными состояниями есть масса других состояний. Поэтому однозначно сказать каков прогноз заболевания можно только на примере конкретного случая.
Конечно, первый вопрос, который волнует всех заболевших: «Сколько с этим живут?».
Здесь следует помнить о том, что цилиндроклеточная метаплазия – это не рак, а только повышенная вероятность его развития, поэтому при адекватном лечении и динамическим наблюдением за состоянием tunica mucosae пищевода, большинство пациентов продолжают вести нормальную жизнь и доживают до глубокой старости.
Медикаментозное лечение, как и лечение народными средствами, направлено не на борьбу с желудочной и кишечной метаплазией, а на снижение агрессивности рефлюктата, вызвавшего эти изменения, а также на борьбу с воспалительными реакциями.
Поэтому у некоторых больных возникает вопрос: «Лечиться или нет?».
Но при отсутствии лечения процесс будет прогрессировать, а значит, увеличится вероятность возникновения аденокарциномы и тогда лечиться только медикаментами не получится, тогда без операции не обойтись.
Однако даже длительное медикаментозное лечение не может повлиять на метаплазию пищевода.
Метод лазерной интерстициальной гипертермии (LITT), привлек внимание клиницистов. В основе метода лежит применение лазерного излучения высокой мощности. Действуя на очаг цилиндрической метаплазии, луч лазера резко повышает температуру, что вызывает некроз патологической ткани.
Метод основан на том, что участки дисплазии в измененной метаплазией слизистой пищевода, способны аккумулировать фотосенсибилизаторы в значительно большей степени, чем здоровые ткани.
Под действием светового луча (в клинике используется направленный луч лазера) энергия с фотосенсибилизатора передается на молекулу кислорода, в результате образуется атомарный кислород и молекулы, имеющие неспаренные электроны, которые действуя, на жизненно важные органеллы опухолевых клеток, вызывают их гибель.
Основной хирургический метод – это лапароскопическая фундопликация – создание барьера для попадания рефлюктата в пищевод, для этого сфинктер укрепляется особой муфтой, сформированной из тканей желудка. Другие хирургические методы используются редко.
Диета при метаплазии пищевода является дополнением к основной терапии.
Ее действие направлено на то, чтобы:
Детали пищевого рациона (что можно есть, а что нельзя), обговариваются с лечащим врачом.
Специфической профилактики метаплазии слизистой пищевода не существует. Профилактика патологии состоит:
Спорт больным с метаплазией противопоказан (так как он связан с большими мышечными напряжениями, в том числе и мышц пресса), однако пренебрегать физической активностью не стоит.
Отдых должен быть полноценным. По возможности исключить все психотравмирующие ситуации.
Грыжа пищевода — причины возникновения и методы лечения
Эндоскопическое лигирование варикозно расширенных вен пищевода при циррозе печени
Кандидозный эзофагит: симптомы и лечение
Что такое спазм пищевода и как его снять в домашних условиях
Что такое кардиоспазм пищевода и его причины, лечение
Эрозия пищевода: симптомы и лечение
Источник: https://stomach-diet.ru/metaplaziya-pischevoda/
Современные методы диагностики позволяют своевременно выявить опасные изменения структуры внутренних органов, способные в дальнейшем развивиться в раковую опухоль.
Одним из таких заболеваний, приводящих без должной терапии к серьезным осложнениям, является кишечная метаплазия желудка. В 100% клинических случаев она сопровождает рак желудка и атрофический гастрит, более чем в 80% — язвенное поражение желудка, около половины пациентов страдает дуоденитом. Чаще всего недуг поражает пожилых людей, но может встречаться и у больных зрелого возраста.
Что же это за болезнь, описанная еще сто лет назад, но до сих пор в недостаточной мере изученная? Специалисты склонны считать это состояние переходным: от негативных изменений под воздействием неблагоприятных факторов (отсутствие грамотной системы питания, злоупотребление алкоголем, длительный прием медикаментов, стрессы) к более тяжелым последствиям.
Начинается все с воспаления слизистой желудка, которое становится хроническим без должной терапии. Клетки желудочного эпителия постепенно атрофируются, переставая выполнять свое прямое назначение. На их месте появляются клетки кишечника, которые, естественно, реализуют свою основную функцию.
Таким образом, аномальные преобразования постепенно ведут к “выключению” желудка из пищеварительной системы. Являясь поначалу доброкачественными, изменения со временем принимают злокачественный характер.
Процесс полностью обратим на ранних этапах болезни, в запущенной форме состояние считается предраковым.
В зависимости от того, какие клетки замещают желудочный эпителий, выделяют 2 вида патологии:
Кроме того, различают слабую, умеренную и выраженную степени развития патологии. Для первой характерно поражение 5% площади органа, для второй — менее 20%, для третьей — более 20%.
Для первой характерно поражение 5% площади органа, для второй — менее 20%, для третьей — более 20%.
Стадии атрофии железистой ткани также могут различаться: тип А (незначительная), тип В (промежуточная), тип С (полная).
Причинами, провоцирующими развитие метаплазии кишечника, могут стать:
В результате понижения кислотности внутренней желудочной среды появляются предпосылки для замены желудочной микрофлоры на кишечную.
Очень опасно размножение Хеликобактер пилори (при халатном отношении человека к своему лечению). Именно эти бактерии, в процессе своей жизнедеятельности продуцируя огромное количество токсинов, чаще всего провоцируют аномальные изменения стенок внутренних органов, что в итоге заканчивается раком. Ускоряет процесс потребление алкогольных напитков и соленой еды.
Выраженных признаков патология не имеет. Симптоматическая картина, как правило, напоминает другие заболевания ЖКТ. Больного могут беспокоить:
Нередко метаплазия обнаруживается случайно во время эндоскопии по поводу других заболеваний ЖКТ. Основным методом для подтверждения диагноза станет проведение ФГДС с биопсией, в процессе исследования врач-гистолог как раз определит наличие в слизистой чужеродных клеток, продуцирующих сульфамуцин.
Основным методом для подтверждения диагноза станет проведение ФГДС с биопсией, в процессе исследования врач-гистолог как раз определит наличие в слизистой чужеродных клеток, продуцирующих сульфамуцин.
Данный секрет активно поглощает канцерогены, впоследствии провоцирующие развитие раковой опухоли. Кроме того, в крови пациента повышается содержание раково-эмбрионального антигена (РЭА).
Чтобы определить степень распространения поражения используется метод хромоэндоскопии. Специальный краситель подкрашивает больные клетки так, что их возможно увидеть под микроскопом. Таким образом, при постановке диагноза отмечаются также тип, размеры и локализация аномальных изменений.
Терапия может быть консервативной, но возможно и хирургическое вмешательство, в зависимости от вида и степени прогрессирования болезни.
Как и в случае с другими заболеваниями органов пищеварительного тракта, добиться улучшения состояния и выздоровления возможно только при соблюдении рекомендованной диеты:
По поводу народных средств необходимо проконсультироваться с врачом. Устранить первопричину заболевания они, конечно, не могут, но травяные настои способны справиться с некоторыми симптомами.
Устранить первопричину заболевания они, конечно, не могут, но травяные настои способны справиться с некоторыми симптомами.
Чтобы в дальнейшем не думать, как лечить кишечную метаплазию желудка, соблюдайте следующие меры:
При соблюдении этих несложных рекомендаций, а также при внимательном отношении к своему организму, Вы сможете вовремя заметить любое отклонение от нормы и предотвратить прогрессирование заболевания в сторону более тяжелых стадий. Берегите себя и будьте здоровы!
>>> : — 26.03.2017 — 416 Просмотров
Источник: https://tsitologiya.su/zheludok/dieta-pri-kishechnoj-metaplazii-slizistoj-zheludka
Метаплазия слизистой желудка – это серьезные патологические изменения в строении слизистой оболочки. Лечение кишечной метаплазии слизистой желудка необходимо проводить своевременно и тщательно, учитывая, что кишечная метаплазия, как правило, выступает проблемой, на фоне которой активно развиваются онкологические процессы.
Таким образом, в результате патологической замены эпителия желудок не может полноценно выполнять свои функции, что нарушает процессы обмена веществ и, конечно же, пищеварения.
Для начала необходимо разобраться, что такое метаплазия желудка. Кишечная метаплазия слизистой оболочки – это постепенное замещение желудочного эпителия кишечным. Первый – по своей природе однослойный призматический, последний же – однослойный цилиндрический, имеющий каемчатую поверхность.
Для эпителия желудка свойственно непрерывное клеточное обновление, кишечный же эпителий способностью к обновлению не обладает, точно так же, как и атрофированная слизистая желудка.
В современной медицине считается общепринятым, что кишечная метаплазия и атрофия слизистой – это стадии течения хеликобактерного хронического гастрита, чем и объясняется значение Хеликобактер пилори в развитии патологии.
Согласно классификации кишечной метаплазии желудка, она делится на два типа.
Следует учитывать, что метаплазию с явными клеточными элементами тонкой или толстой кишки называют тонко- и толстокишечной. Для характеристики полноты воспроизведения кишечного фенотипа клеток используют понятия полной и неполной метаплазии. Итак:
Итак:
Также можно выделить несколько видов метаплазии по локализации поражения:
Заболевание может вызываться рядом определенных факторов:
Важно! Хеликобактер пилори, хронический гастрит, кишечная метаплазия, атрофия и рак желудка – звенья одной цепи. Хеликобактер вызывает хроническое воспаление слизистой желудка, в последующем развиваются дисрегенераторные изменения эпителия, что является фоном для развития онкозаболевания.
В связи с тем, что кишечная метаплазия не является самостоятельным заболеванием, а лишь сопровождает другие болезни желудка, у нее нет специфических, т.е. характерных только для неё, симптомов. Чаще с кишечной метаплазией сочетаются атрофические процессы в слизистой желудка, для которых характерна сниженная секреторная функция.
Поэтому пациенты с метаплазией могут жаловаться на следующие неприятные ощущения: чувство полного желудка, тяжесть в эпигастральной области после еды, отрыжка воздухом, иногда с запахом «тухлого яйца», склонность к поносам.
Боль в животе как раз не характерна для данной патологии, возможен дискомфорт в верхней половине живота в виде тяжести, переполненности желудка.
Прежде чем понять, как лечить, нужно определить объем метаплазии. От этого зависит тип лечения: медикаментозное или хирургическое. Основной лечебный подход при кишечной метаплазии, ассоциированной с Хеликобактер пилори, – это эрадикационная терапия.
Лечение проводят по схеме первой линии: ингибитор протонной помпы (ИПП) – в двойной дозе, Амоксициллин (2 г в сутки) и Кларитромицин (1 г в сутки в течение 7 дней).
При ее неэффективности (отсутствие эрадикации ХБ через 4-6 недель после полной отмены антибиотиков и антисекреторных препаратов) назначают терапию второй линии: Де-Нол (480 мг в сутки), Тетрациклин (2 г в сутки), Метронидазол (1 г в сутки) и ИПП (в двойной дозе в течение 7 дней).
Контроль эрадикации проводится с помощью уреазного дыхательного теста, а в случае иммуноферментного анализа Хеликобактер пилори, лечащим врачом, кроме эрадикации, назначается курс медикаментов, которые нормализуют микрофлору кишечника. Примером такого лекарства является «Линекс», «Лактиале», «Пробилог-форте», «Бифидумбактерин» и т.д. Также при кишечной метаплазии необходимо принимать медикаменты, действие которых направлено на:
Примером такого лекарства является «Линекс», «Лактиале», «Пробилог-форте», «Бифидумбактерин» и т.д. Также при кишечной метаплазии необходимо принимать медикаменты, действие которых направлено на:
Когда медикаментозная терапия не решает все проблемы, необходимо применять хирургическое вмешательство. Чаще проводят лапароскопию – малоинвазивную операцию, для которой характерны: небольшое операционное поле, минимальный риск развития послеоперационных осложнений и короткий период реабилитации.
В дополнение к основному комплексному лечению можно провести терапию народными средствами, которые уменьшают воспаление, дискомфорт в области желудка. К таким средствам можно отнести различные отвары, например, с ромашкой, календулой и зверобоем.
Пациентам с данным заболеванием рекомендуется к соблюдению диета при метаплазии. Питание должно быть здоровым и сбалансированным. Необходимо исключить все вредные блюда, в том числе жареное, жирное, острое и сладкое.
Также следует воздержаться от молочных продуктов, т. к. они не обрабатываются должным образом в желудке, а дальше бродят в кишечнике с выходящими отсюда последствиями.
к. они не обрабатываются должным образом в желудке, а дальше бродят в кишечнике с выходящими отсюда последствиями.
В ежедневный рацион нужно обязательно включать крупы, свежие фрукты и овощи.
Рекомендуется дробное питание, включающее 5-6 приемов пищи в день. Объем порции нужно делать небольшим: примерно, размер одного стакана. Последняя трапеза должны быть не позднее, чем за два часа до сна: ночные перекусы дают очень большую нагрузку на желудочно-кишечный тракт.
Обязательное правило для пациентов с кишечной метаплазией желудка – полный отказ от алкоголя и курения. Вредные привычки могут провоцировать и ускорять развитие различных патологических процессов в организме человека.
Таким образом, кишечная метаплазия является действительно опасной патологией, которая приносит массу дискомфортных моментов и при прогрессировании ведёт к развитию онкопатологии. Поэтому необходимо как можно быстрее обратиться к врачу, диагностировать патологию, чтобы начать своевременное комплексное лечение под контролем квалифицированного специалиста.
Источник: https://xn--90ad9d.xn--p1ai/bolezni-kishechnika/kak-vylechit-kishechnuyu-metaplaziyu.html
Сохранить моё имя, email и адрес сайта в этом браузере для последующих моих комментариев.
Здравствуйте! Меня зовут Олег. На страницах своего журнала я собираю интересную и любопытную информацию из разных источников в интернете, обрабатываю, проверяю и выкладываю. Если вы видите ошибки и неточности, то напишите о них в комментариях, в группе ВК или Одноклассниках. Также, я всегда отвечу на любые вопросы. Задавайте их на соответствующей странице вверху сайта.
Синдром Жильбера Чем опасен синдром Жильбера и что
Профилактика запоров у взрослых Запор – эта одна из
Синдром Меллори-Вейса Синдром Меллори-Вейса — линейные
Ахалазия кардии (кардиоспазм пищевода): симптомы и
Прободная язва желудка: причины, симптомы и лечение
Питание при гастроэнтерите При заболеваниях органов
Повышенная кислотность желудка – чем опасна и какая
Кишечная колика: причины, виды, симптомы и методы лечения –
ВНИМАНИЮ ПРАВООБЛАДАТЕЛЕЙ! ВСЕ МАТЕРИАЛЫ РАЗМЕЩЕНЫ НА САЙТЕ СТРОГО В ИНФОРМАЦИОННЫХ И УЧЕБНЫХ ЦЕЛЯХ! ЕСЛИ ВЫ СЧИТАЕТЕ, ЧТО РАЗМЕЩЕНИЕ КАКОГО-ЛИБО МАТЕРИАЛА НАРУШАЕТ ВАШИ АВТОРСКИЕ ПРАВА – ОБЯЗАТЕЛЬНО СВЯЖИТЕСЬ С НАМИ ЧЕРЕЗ ФОРМУ КОНТАКТОВ И ВАШ МАТЕРИАЛ БУДЕТ УДАЛЁН!
Метаплазия пищевода: что это такое, формы, причины, симптомы. ..
..
Диета при метаплазии пищевода. Какое меню рекомендовано…
Диета при кишечной метаплазии слизистой желудка | tsitologiya.su
Цилиндроклеточная метоплазия пищевода — 24 ответа врачей на…
Питание и методы лечения при метаплазии слизистой оболочки…
Как Похудеть Яичная Диета
Диета При Гастрите Скачать
Доктор Борменталь Снижение Веса
Капустная Диета Для Похудения На 10 Кг
Коррекция Избыточного Веса
Гастрит, симптомы и лечение гастрита в Москве
02.11.2021Статья проверена врачом-гастроэнтерологом Мельниковой Е.Г., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
В отделении гастроэнтерологии Клинического госпиталя на Яузе выполняется комплексная диагностика и назначается оптимальное для каждого пациента лечение гастрита.
У нас можно пройти обследование желудка (в том числе — диагностику гастрита) и других органов пищеварительной системы по программе «»Контроль ЖКТ»» , включающей:
- полный спектр лабораторных анализов,
- экспертную гастродуоденоскопию с исследованием на бактерию Helicobacter pylori,
- УЗИ органов брюшной полости,
- консультации опытного гастроэнтеролога.

- Более 60% населения Земли страдает гастритом, однако к врачу обращаются всего около 10–15%.
- 90% гастритов и их осложнений сопровождается наличием в желудке бактерии Хеликобактер пилори
- Эрадикация Helicobacter pylori (уничтожение) необходима при наличии у пациента родственников, перенесших рак желудка
Гастрит — воспаление слизистой оболочки и подслизистого слоя желудка. Вследствие нарушения баланса факторов агрессии и защиты происходят деструктивные процессы в слизистых и подслизистых слоях желудка, приводящие к острому и хроническому воспалению, а в дальнейшем к атрофии и метаплазии желудочного эпителия (предраковому состоянию).
Без пристального внимания врача-гастроэнтеролога, точной диагностики и лечения гастрит значительно снижает качество жизни больного, а также способен трансформироваться в ещё более опасное заболевание (язвенную болезнь, полипоз, рак желудка).
Причины и патогенез гастрита
Существует ряд факторов, способствующих развитию гастрита:
- инфицирование Helicobacter pylori
- нарушение принципов правильного питания (злоупотребление грубой, острой, очень горячей пищи, перексы всухомятку, недостаточность в пище витаминов, белка, железа)
- пищевые токсикоинфекции
- аллергия на пищевые продукты
- длительный бесконтрольный прием ряда лекарств, вызывающих раздражение слизистой оболочки желудка
- злоупотребление спиртным (может развиться алкогольный гастрит)
- курение
- инфекционные заболевания
- эндокринные заболевания (сахарный диабет, тиреотоксикоз, гиперпаратиреоз)
- хронические стрессы, частое пребывание в состоянии раздражения
- профессиональная вредность
В развитии воспаления, как правило, участвуют несколько факторов.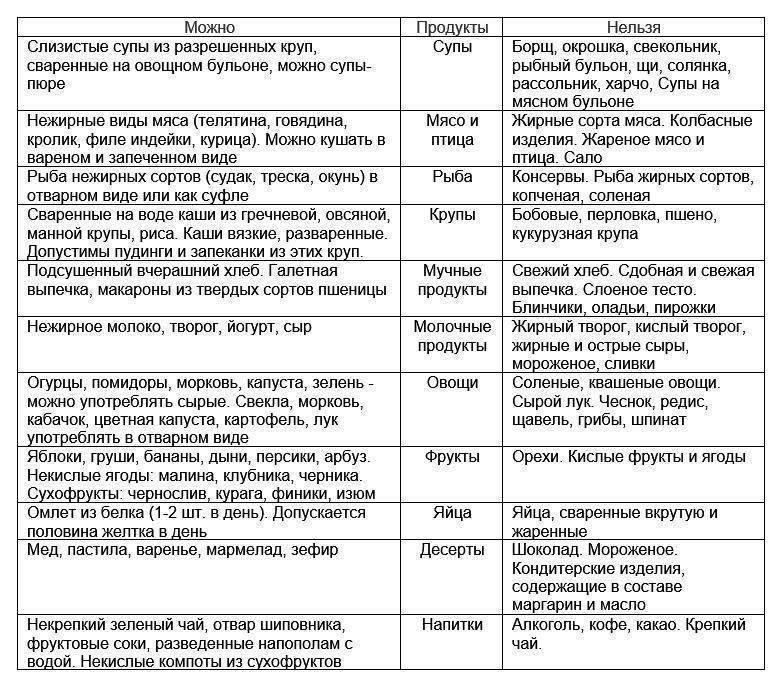 Под их воздействием развивается острый гастрит. Если неблагоприятное воздействие продолжается, а лечение гастрита не проводится, он переходит в хроническую форму. Хронизации процесса способствует сопутствующая патология других органов желудочно-кишечного тракта, эндокринной и сердечно-сосудистой системы.
Под их воздействием развивается острый гастрит. Если неблагоприятное воздействие продолжается, а лечение гастрита не проводится, он переходит в хроническую форму. Хронизации процесса способствует сопутствующая патология других органов желудочно-кишечного тракта, эндокринной и сердечно-сосудистой системы.
Также гастрит может развиться в ходе лечения гипертиреоза, сахарного диабета, гиперпаратиреоза, пернициозной анемии, болезни Крона и хронической почечной недостаточности, так как при их терапии применяются гормональные и железосодержащие препараты. Их длительный прием провоцирует гастрит.
При длительно текущем хроническом гастрите происходят более серьезные изменения слизистой оболочки желудка и ее атрофия. Заболевание периодически обостряется.
К осложнениям хронического гастрита помимо язвенной болезни и рака желудка относятся образование полипов, желудочные кровотечения из эрозий.
Симптомы гастрита
Характерные для гастрита симптомы и жалобы:
- боли в верхней части живота (под ложечкой),
- тошнота, рвота,
- изжога,
- отрыжка,
- нарушения стула.

Диагностика и лечение гастрита в Клиническом Госпитале на Яузе
Алиментарные факторы развития кишечной метаплазии желудка у пациентов с функциональной диспепсией
Контекст: Кишечная метаплазия желудка — это поражение, при котором происходит метаплазия эпителиальных клеток желудка по кишечному фенотипу. Метаплазия желудочно-кишечного тракта — это поражение, связанное с увеличением риска развития рака желудка. Эпидемиологические исследования показывают связь между диетическими привычками и развитием рака желудка, некоторые привычки повышают его риск, а другие обладают защитным эффектом, предполагая, что антиоксиданты, такие как витамины A, C и E, снижают риск этого типа рака. .Связь этих пищевых факторов с кишечной метаплазией неизвестна.
Методы: Это наблюдательное исследование случай-контроль, в котором оценивали 320 пациентов с функциональной диспепсией, разделенных на две группы. Пациенты группы I (люди с кишечной метаплазией) имели свой рацион питания по сравнению с контрольной группой, состоящей из людей, аналогичных тем, которые были в группе случая, но без кишечной метаплазии, с помощью опросника частоты приема пищи.
Пациенты группы I (люди с кишечной метаплазией) имели свой рацион питания по сравнению с контрольной группой, состоящей из людей, аналогичных тем, которые были в группе случая, но без кишечной метаплазии, с помощью опросника частоты приема пищи.
Полученные результаты: Анализ режима питания пациентов с функциональной диспепсией с кишечной метаплазией и его сравнение с пациентами без кишечной метаплазии показал более высокую частоту употребления консервов и копченостей в первой группе и, с другой стороны, более высокое потребление фруктов и овощей. овощи у пациентов без кишечной метаплазии. Эффекта от потребления соли не обнаружено.
Выводы: Результаты, полученные в этом исследовании, предполагают, что изменения в диете с уменьшением потребления копченых и консервированных продуктов и увеличением потребления фруктов и овощей могут привести к уменьшению случаев желудочно-кишечной метаплазии.
факторов питания и риск кишечной метаплазии желудка среди ветеранов США
Фон: Исследования диеты и риска желудочно-кишечной метаплазии (GIM) среди населения США отсутствуют.
Цель: Чтобы определить ассоциации диетических факторов и риска GIM среди населения США с типичной американской диетой.
Методы: Мы проанализировали данные перекрестного исследования ветеранов, посещающих клиники первичной медико-санитарной помощи и эндоскопии в Медицинском центре Хьюстона, штат Вирджиния.Пациенты заполнили анкету из 110 пунктов по частоте приема пищи, а затем прошли верхнюю эндоскопию с биопсией желудочного картирования. Мы сравнили случаи, определенные GIM на ≥ 1 биопсии желудка без кардии, с контрольными случаями без GIM. Связи диетических факторов и GIM оценивались с использованием моделей логистической регрессии как отношения шансов (OR) и 95% доверительные интервалы (CI).
Мы сравнили случаи, определенные GIM на ≥ 1 биопсии желудка без кардии, с контрольными случаями без GIM. Связи диетических факторов и GIM оценивались с использованием моделей логистической регрессии как отношения шансов (OR) и 95% доверительные интервалы (CI).
Полученные результаты: Среди 423 случаев GIM и 1796 контрольных случаев случаи были более старыми (62.1 по сравнению с 59,9 годами), более вероятно, что это будут мужчины (97,2% против 90,8%) и небелые (58,6% против 39,0%). У пациентов с GIM было более низкое потребление жиров (процент ккал из тертиля 1 жира: 43,6% против 33,4%) и более высокое потребление углеводов (процент ккал из углевода T3: 41,8% против 33,3%), чем в контрольной группе. С поправкой на возраст, пол, расу, курение и Helicobacter pylori, процент ккал из углеводов (T3 против T1: OR 1,35, 95% CI 1,08–1,67), потребление фруктов (T3 против T1: OR 1,28, 95% CI 1,02). -1,61) и потребление клетчатки (T3 по сравнению с T1: OR 1.37, 95% ДИ 1,04–1,80) были связаны с GIM. При анализе подгрупп эти ассоциации в основном наблюдались у небелых пациентов.
-1,61) и потребление клетчатки (T3 по сравнению с T1: OR 1.37, 95% ДИ 1,04–1,80) были связаны с GIM. При анализе подгрупп эти ассоциации в основном наблюдались у небелых пациентов.
Выводы: Некоторые диетические факторы, включая высокое потребление углеводов, связаны с повышенным риском GIM в популяциях США, независимо от H. pylori или курения.
Ключевые слова: Диета; Диетические факторы; Рак желудка; Желудочно-кишечная метаплазия; Питание.
Профилактика рака желудка | Можно ли предотвратить рак желудка?
Не существует надежного способа предотвратить рак желудка (также известный как рак желудка), но есть вещи, которые могут снизить риск.
Диета, питание, масса тела, физическая активность и употребление алкоголя
Избыточный вес или ожирение увеличивает риск некоторых видов рака желудка, поэтому , чтобы поддерживать и поддерживать здоровый вес , может снизить ваш риск.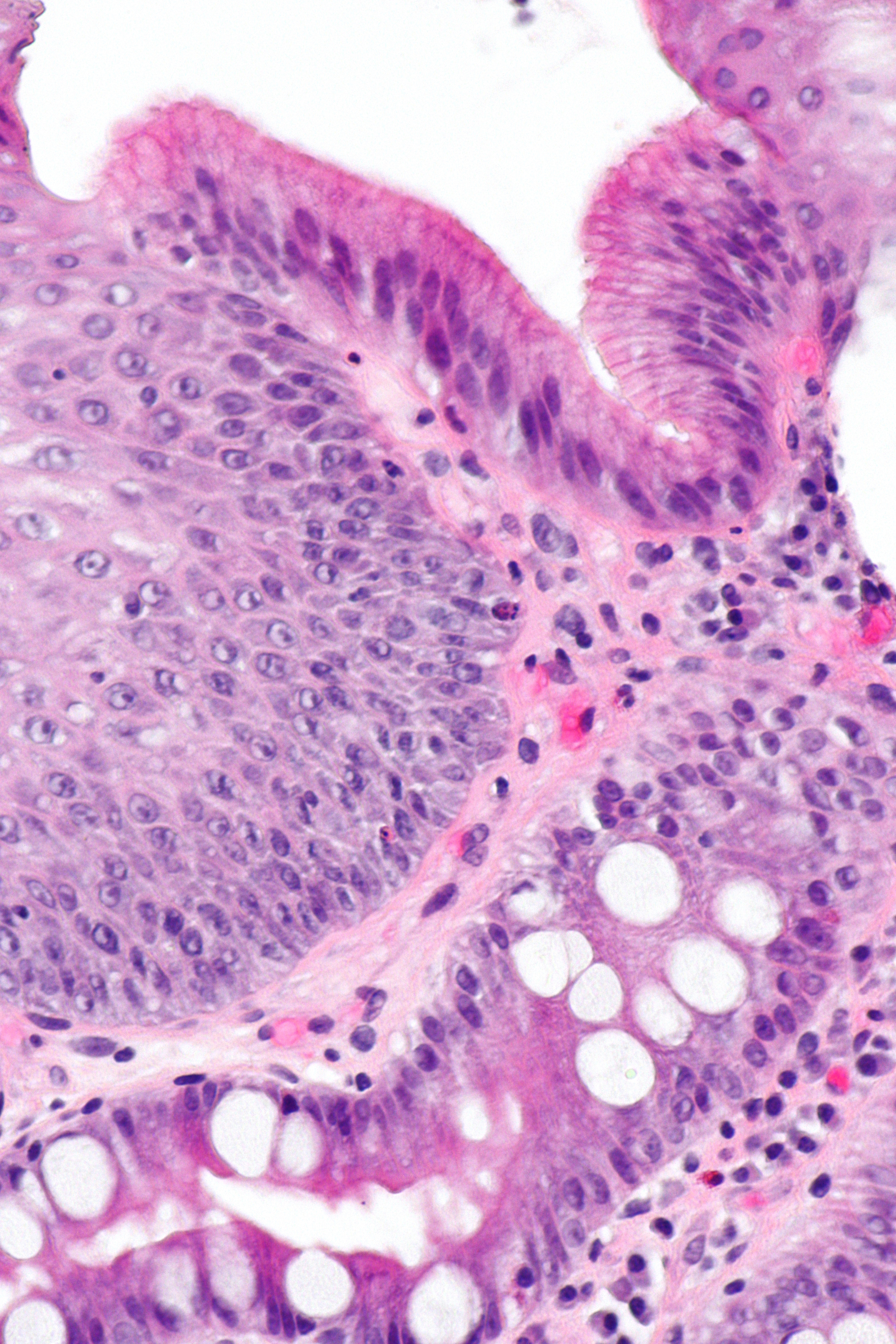
G Регулярная физическая активность также может помочь снизить риск рака желудка.
Помимо возможного воздействия на риск рака желудка, поддержание здорового веса и активность могут также снизить риск некоторых других видов рака и проблем со здоровьем.
Диета, включающая большое количество свежих фруктов и овощей, вероятно, также снижает риск рака желудка. Цитрусовые (например, апельсины, лимоны и грейпфрут) могут быть особенно полезны. но имейте в виду, что грейпфрут и грейпфрутовый сок могут изменить уровень в крови некоторых лекарств, которые вы принимаете.Поговорите об этом со своим лечащим врачом, прежде чем добавлять грейпфрут в свой рацион.
Американское онкологическое общество рекомендует людям придерживаться схемы здорового питания , которая включает в себя разнообразные красочные фрукты и овощи и цельнозерновые продукты, а также избегать или ограничивать употребление красного и обработанного мяса, сахаросодержащих напитков и продуктов с высокой степенью обработки.
Употребление алкоголя, вероятно, увеличивает риск рака желудка, поэтому избегание или ограничение употребления алкоголя может снизить ваш риск.
Дополнительную информацию о диете, массе тела, физической активности и употреблении алкоголя см. В Руководстве Американского онкологического общества по диете и физической активности для профилактики рака.
Исследования, в которых изучались другие диетические факторы, такие как прием пищевых добавок или употребление чая (особенно зеленого чая ), не привели к твердым выводам, когда речь идет о снижении риска рака желудка. В этих областях необходимы дальнейшие исследования.
Не курить
Курение может увеличить риск рака верхнего отдела желудка (его части, ближайшей к пищеводу).Употребление табака также увеличивает риск многих других видов рака. Если вы не употребляете табак, не начинайте. Если вы уже это делаете и вам нужна помощь в отказе от курения, позвоните в Американское онкологическое общество по телефону 1-800-227-2345.
Лечение
H pylori ИнфекцияПока не ясно, следует ли лечить антибиотиками людей, у которых слизистая оболочка желудка хронически инфицирована бактериями H pylori , но у которых нет никаких симптомов. Это тема текущих исследований.Некоторые исследования показали, что назначение антибиотиков людям с инфекцией H pylori может снизить количество предраковых поражений в желудке и снизить риск развития рака желудка. Но не все исследования обнаружили это.
Хотя еще не ясно, следует ли лечить всех людей с инфекцией H pylori , некоторые исследования показали, что может быть полезно лечить людей с H pylori , которые также имеют более высокий риск рака желудка по другим причинам, например как имеющий близкого родственника с раком желудка.
Необходимы дополнительные исследования, чтобы убедиться, что лечение других групп людей с инфекцией H pylori может снизить риск рака желудка.
Если ваш врач считает, что у вас может быть инфекция H pylori , есть несколько способов проверить это, включая дыхательный тест, анализ крови, анализ стула и процедуру эндоскопии, при которой выполняется биопсия.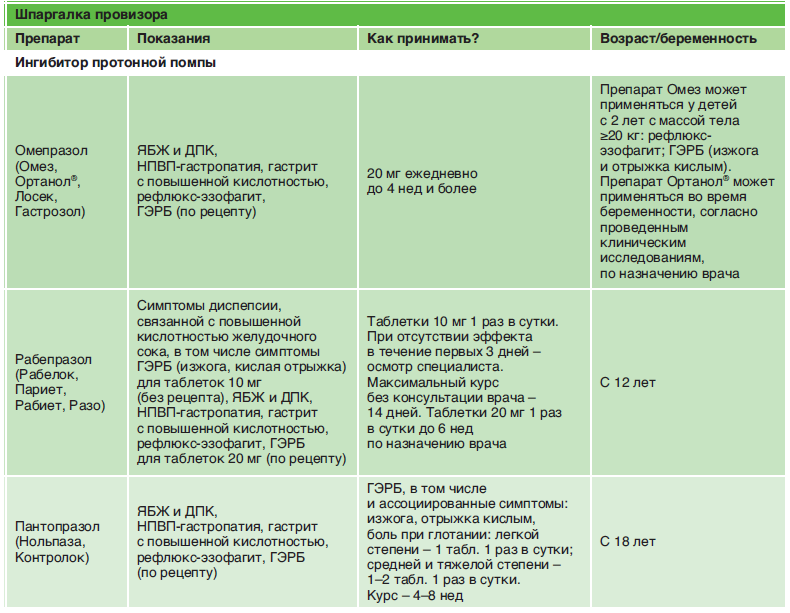 (См. Тесты на рак желудка.)
(См. Тесты на рак желудка.)
Использование аспирина
Использование аспирина или других нестероидных противовоспалительных препаратов (НПВП), таких как ибупрофен или напроксен, снижает риск рака желудка.Эти лекарства также могут снизить риск развития полипов толстой кишки и рака толстой кишки. Но они также могут вызвать серьезное (и даже опасное для жизни) внутреннее кровотечение и другие потенциальные риски для здоровья у некоторых людей.
Большинство врачей считают любое снижение риска рака дополнительным преимуществом для людей, которые принимают эти препараты по другим причинам, например, для лечения артрита. Но врачи обычно не рекомендуют принимать НПВП специально для предотвращения рака желудка. Исследования еще не определили, для каких людей преимущества снижения риска рака перевешивают риски кровотечений.
Для людей с повышенным риском
Наследственный диффузный рак желудка (HDGC) — это редкое наследственное заболевание, при котором люди имеют значительно повышенный риск рака желудка, который часто развивается в довольно раннем возрасте.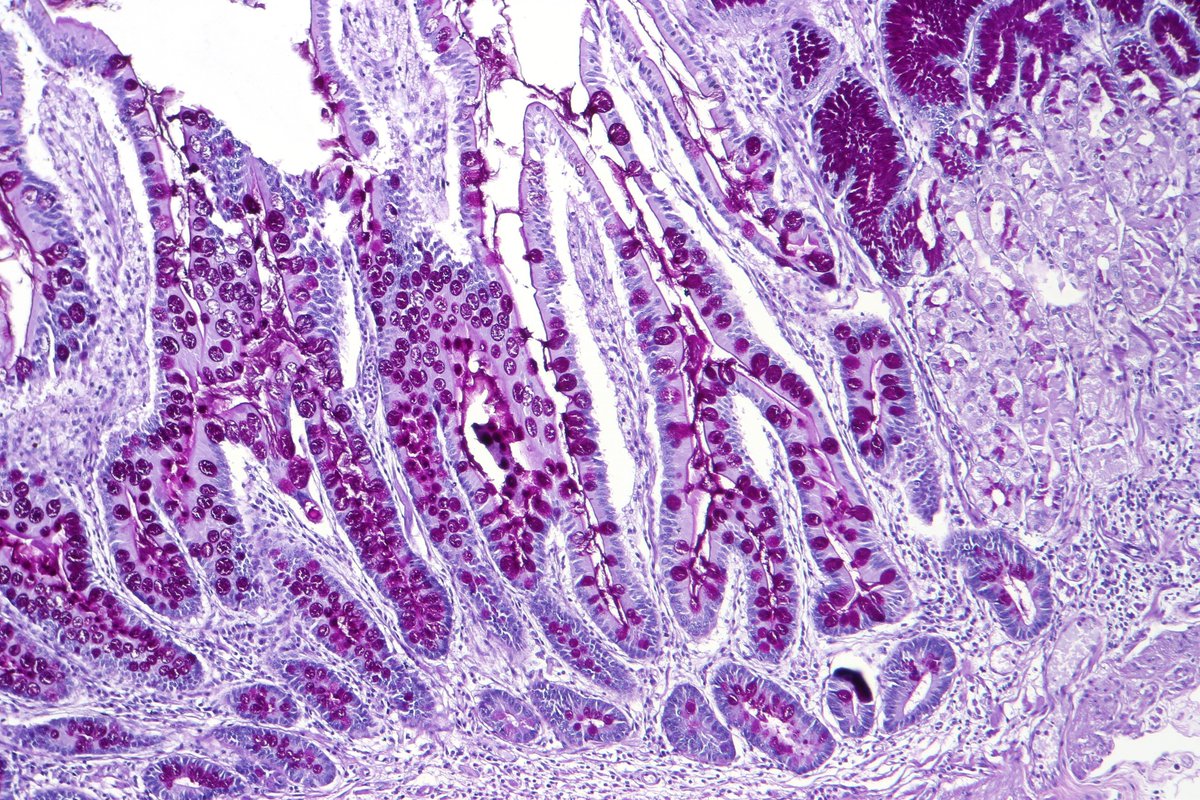 Этот редкий синдром чаще всего вызывается наследственной мутацией в гене CDh2 .
Этот редкий синдром чаще всего вызывается наследственной мутацией в гене CDh2 .
Очень важно распознавать людей и семьи с этим наследственным синдромом, потому что у большинства людей с ним развивается рак желудка.В семьях с HDGC обычно есть два или более близких родственника, у которых развивается рак желудка (обычно диффузного типа), и / или по крайней мере один человек, которому поставлен диагноз до 50 лет. У некоторых членов семьи также может развиться инвазивный лобулярный рак груди.
Врачи часто направляют людей, у которых может быть HDGC, к профессиональному генетику, чтобы они могли обсудить возможное прохождение генетического тестирования. Если тестирование показывает, что у человека есть мутация (аномальное изменение) в гене CDh2 , врачи часто рекомендуют рассмотреть возможность удаления желудка (обычно в возрасте от 20 до 30 лет) до развития рака.Однако эта операция (называемая тотальной гастрэктомией) может привести к долгосрочным изменениям в питании человека.
Некоторые другие наследственные синдромы рака также связаны с повышенным риском рака желудка, в том числе синдром Линча , семейный аденоматозный полипоз (FAP) , синдром Ли-Фраумени и синдром Пейтца-Егерса . Риск рака желудка при этих синдромах не так высок, как при HDGC, поэтому удаление желудка обычно не рекомендуется для людей с этими синдромами.Однако врачи могут порекомендовать проходить регулярные анализы, чтобы попытаться обнаружить рак желудка на ранней стадии у некоторых из этих людей.
Влияние диеты и курения на риск развития кишечной метаплазии желудка
Морсон до нашей эры: Карцинома, возникающая из областей кишечной метаплазии в слизистой оболочке желудка. Br J Cancer 9: 377–385, 1955
PubMed Google ученый
Фурихата К., Татэмацу М, Мики К., Кацуяма Т., Судо К., Мияги Н., Кубота Т., Джин С.С., Кодама К., Ито Н., Кониси И., Судзуки К., Мацусима Т: свойства желудочного и кишечного типа. рака желудка человека, трансплантированного голым мышам.Cancer Res 44: 727–733, 1984
PubMed Google ученый
Мирвиш С.С. Этиология рака желудка. J Natl Cancer Inst 71: 629–647, 1983
PubMed Google ученый
Correa P, Cuello C, Duque E: Карцинома и кишечная метаплазия желудка у колумбийских мигрантов. Национальный онкологический институт 44: 297–306, 1970
Google ученый
Stemmermann G, Haenszel W, Locke F: Эпидемиологическая патология язвы желудка и карциномы желудка среди японцев на Гавайях. Национальный институт рака 58: 13–20, 1977
PubMed Google ученый
Мацукура Н., Кавачи Т., Сасадзима К., Сано Т., Сугимура Т., Хирота Т.: индукция кишечной метаплазии в желудках крыс с помощью N -метил- N ′ -нитро- N -нитрозогуанидин. Национальный онкологический институт 61: 141–144, 1978
Google ученый
Сасадзима К., Кавачи Т., Мацукура Н., Сано Т., Сугимура Т.: Кишечная метаплазия в желудке крыс, вызванная N -пропил- N ‘-нитро-нитрозогуанидином. J Cancer Res Clin Oncol 94: 201–206, 1979
PubMed Google ученый
Watanabe H: экспериментально индуцированная кишечная метаплазия у крыс Wistar с помощью рентгеновского излучения. Гастроэнтерология 75: 796–799, 1978
PubMed Google ученый
Nomura A, Yamakawa H, Ishidate T, Kamiyama S, Masuda H, Stemmermann G, Heilbrun L, Hankin J: Кишечная метаплазия в Японии: Связь с диетой. Национальный онкологический институт 68: 401–405, 1982
Google ученый
Долл Р., Джонс Ф.А., Пиготт Ф .: Влияние курения на образование и поддержание язвы двенадцатиперстной кишки. Ланцет 1: 657–662, 1958
PubMed Google ученый
Kellow JE, Tao Z, Piper DW: Вентиляционная функция при хронической язвенной болезни. Гастроэнтерология 91: 590–595, 1986
PubMed Google ученый
Stemmermann G, Marcus E, Buist AS: Относительное влияние курения и снижения легочной функции на риск язвенной болезни. Гастроэнтерология 96: 1419–1424, 1989
PubMed Google ученый
Haenszel W, Kurihara M, Segi M, Lee RKC: Рак желудка у японцев на Гавайях.Национальный онкологический институт 49: 969–988, 1972
Google ученый
Берр М.Л., Самлофф И.М., Бейтс К.Дж., Холлидей Р.М.: Атрофический гастрит и статус витамина С в двух городах с разными показателями смертности от рака желудка. Br J Cancer 56: 166–167, 1987
Google ученый
Фонтам Э., Завала Д., Корреа П., Родригес Э., Хантер Ф., Хансель В., Танненбаум С. Диета и хронический атрофический гастрит; исследование случай-контроль.Национальный онкологический институт 76: 621–627, 1986
Google ученый
Тацута М., Ииши Х., Окуда С. Влияние курения сигарет на протяженность зоны секреции кислоты и кишечную метаплазию желудка. Dig Dis Sci 33: 23–39, 1988
PubMed Google ученый
Stemmermann G, Hayashi T: Кишечная метаплазия слизистой оболочки желудка: макроскопическое и микроскопическое исследование ее распределения при различных болезненных состояниях.Национальный онкологический институт 41: 627–634, 1968
Google ученый
Фройнд Р.Дж., Литтелл Р.С.: Система статистического анализа (SAS) для линейных моделей. Кэри, Северная Каролина, Институт САС, 1981
Google ученый
Breslow NE, Day NE. Статистические методы исследования рака: анализ исследований «случай-контроль», Том 1. Лион, Франция, Международное агентство по изучению рака, 1980
Google ученый
Харрелл Ф: Процедура ЛОГИСТИКА. Руководство пользователя дополнительной библиотеки SAS. Кэри, Северная Каролина, Институт SAS, 1983, стр. 181–202.
Google ученый
Cox DR: регрессионные модели и таблицы дожития (с обсуждением). J R Stat Soc (Ser B) 34: 187–220, 1972
Google ученый
Харрелл Ф: Процедура PHGLM. Руководство пользователя дополнительной библиотеки SUGI. Кэри, Северная Каролина, Институт SAS, 1983, стр.267–294.
Google ученый
МакГи Д., Роадс Дж., Ханкин Дж., Яно К., Тиллотсон Дж.: Изменчивость потребления питательных веществ внутри человека в группе гавайских мужчин японского происхождения. Am J Clin Nutr 36: 657–663, 1982
PubMed Google ученый
Joosens JV, Geboers J: Питание и рак желудка. Nutr Cancer 2: 250–261, 1981
PubMed Google ученый
Tatematsu M, Takahashi M, Fukushima S, Hananouchi M, Shirai T: Воздействие у крыс хлорида натрия на экспериментальный рак желудка, индуцированный N -метил- N ′ -нитро- N -нитрозогуанидин или 4- нитрозогуанидин-1-оксид. Национальный онкологический институт 55: 101–106, 1975
Google ученый
Tannenbaum SR, Moran D, Rand W, Cuello C, Correa P: Рак желудка в Колумбии. IV Нитриты и другие ионы в желудочном содержимом продуктов из регионов высокого риска.Национальный институт рака 62: 9–12, 1979
Google ученый
Shousha S, Barrison IG, El Sayeed W., Kahn S, Parkins RA: исследование частоты и взаимосвязи кишечной метаплазии антрального отдела желудка и желудочной метаплазии антрального отдела желудка и желудочной метаплазии двенадцатиперстной кишки у пациентов с неязвенная диспепсия. Dig Dis Sci 29: 311–316, 1984
PubMed Google ученый
Обзор современных концепций кишечной метаплазии и рака желудка — Гастроэнтерология и гепатология
Резюме: Желудочно-кишечная метаплазия — это предраковое изменение слизистой оболочки желудка с кишечным эпителием, связанное с повышенным риском дисплазии и рака.Патогенез рака желудка предлагается гипотезой Корреа как переход от нормального эпителия желудка к инвазивному раку через воспаление с последующим внутрислизистым раком и инвазией. Множественные факторы риска были связаны с развитием взаимодействия кишечной метаплазии желудка, включая инфекцию Helicobacter pylori и связанную с ней геномику, генетические факторы хозяина, окружающую среду, ревматологические расстройства, диету и кишечную микробиоту. В глобальном масштабе руководства по скринингу разработаны в странах с высокой заболеваемостью.В Соединенных Штатах такие рекомендации не были разработаны из-за более низкой, хотя и растущей заболеваемости. Американское общество эндоскопии желудочно-кишечного тракта рекомендует индивидуальную оценку пациента, основанную на эпидемиологии, генетике и факторах риска окружающей среды. Исследования изучали использование серологической биопсии для стратификации риска на основе таких факторов, как статус H pylori и факторы вирулентности, а также серологические маркеры хронического воспаления, включая пепсиноген I, пепсиноген II и гастрин.Пациентам из группы высокого риска может быть рекомендовано пройти эндоскопическое обследование с отображением биопсий антрального отдела (большая кривизна, меньшая кривизна), угловой режущей кромки и тела (большая кривизна, меньшая кривизна). Рекомендации по эпиднадзору для пациентов с известной метаплазией желудочно-кишечного тракта не установлены, но включают повторную эндоскопию с интервалами в соответствии с гистологическим риском злокачественной трансформации.
Метапластические изменения в пищеводе и желудке связаны с повышенным риском рака в соответствующих местах. 1 Пищевод Барретта, или замена многослойного плоского эпителия метапластическим столбчатым эпителием, как известно, приводит к 30-кратному увеличению риска рака пищевода по сравнению с обычным населением. 1 Несмотря на споры о рентабельности скрининга и наблюдения за пищеводом Барретта, существуют руководства по ведению этого состояния. 2 Несмотря на то, что предполагаемое количество новых случаев рака в США в 2017 г. было выше для рака желудка на 28 000, чем для рака пищевода на 16 940 (на основе данных эпиднадзора, эпидемиологии и конечных результатов [SEER]), подобных В США имеются руководства по лечению рака желудка. 3 В этой статье рассматриваются патогенез и факторы риска, а также текущие стратегии скрининга и эпиднадзора за желудочно-кишечной метаплазией.
Общие сведения о кишечной метаплазии желудка и раке желудка
Эпидемиология
Рак желудка неуклонно снижается с 1930-х годов, что частично может быть связано с появлением широко распространенного холодильного оборудования для пищевых продуктов , которое заменило копчение мяса в качестве средства сохранения.Было установлено, что процесс курения способствует развитию канцерогенов. 4 Однако, несмотря на глобальное охлаждение, рак желудка остается пятым по распространенности злокачественными новообразованиями и третьей по значимости причиной смерти от рака во всем мире, по данным Всемирной организации здравоохранения (ВОЗ) в 2012 г. умерло 723 000 человек. 5 Хотя распространенность желудочно-кишечной метаплазии (GIM) во всем мире в значительной степени неизвестна, положительная корреляция, хотя и не причинная, была связана с региональной заболеваемостью раком желудка. 6 В большом ретроспективном исследовании, проведенном Зонненбергом и его коллегами, было изучено 78 985 пациентов, перенесших верхнюю эндоскопию в США, и было обнаружено, что частота GIM составляет 7%. 7
Патогенез
Аденокарцинома желудка подразделяется на 2 подтипа: кишечный и диффузный. Кишечный тип сильно коррелирует с кишечной метаплазией, а диффузный тип считается в первую очередь генетически детерминированным и в меньшей степени связанным с факторами окружающей среды и воспалительным каскадом. 8 Аденокарцинома кишечного типа является причиной подавляющего большинства рака желудка. 9
GIM представляет собой предраковое поражение, определяемое как замещение поверхностного, фовеолярного и / или железистого эпителия оксинтной или антральной слизистой оболочки кишечным эпителием (рис. 1). 10 GIM классифицируется анатомически как ограниченный, если он ограничен 1 областью желудка, или как обширный, если поражены 2 области желудка. Гистологически ЖИМ считается полным или неполным. 10 Полная кишечная метаплазия (тип I) определяется слизистой оболочкой тонкого кишечника со зрелыми абсорбирующими клетками, бокаловидными клетками и щеточной каймой. Неполная кишечная метаплазия (тип II) секретирует сиаломуцины и похожа на эпителий толстой кишки с столбчатыми «промежуточными» клетками на различных стадиях дифференцировки, нерегулярными каплями муцина и отсутствием щеточной каймы. 11,12 Самый высокий риск рака желудка связан с неполным и / или обширным ЖИМ. 13 Систематический обзор, в который вошли 10 обсервационных исследований в Европе, Азии и Латинской Америке с периодом наблюдения от 10 месяцев до 19 лет, показал, что риск рака желудка при неполной метаплазии в 4-11 раз выше, чем при неполной метаплазии. без неполной метаплазии. 14
Патогенез прогрессирования от предраковых поражений к аденокарциноме желудка кишечного типа был предложен как прогрессирование от нормального желудочного эпителия к воспалению, атрофии, внутрислизистой карциноме и, наконец, инвазивной карциноме. 15 Многофакторное взаимодействие между геномикой Helicobacter pylori , генетическими факторами хозяина, окружающей средой, диетой и микробиотой кишечника предрасполагает слизистую оболочку желудка к воспалительному каскаду с канцерогенным потенциалом. 16
Первым гистологическим изменением в каскаде является активное хроническое воспаление с неатрофическим хроническим гастритом, характеризующимся наличием желез, или мультифокальным атрофическим гастритом. Последующие гистологические изменения прогрессируют через полную метаплазию, неполную метаплазию, дисплазию низкой и высокой степени, за которой следует карцинома. 14 В Нидерландах было проведено общенациональное когортное исследование для оценки риска рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, легкая-умеренная дисплазия и тяжелая дисплазия были связаны с ежегодной заболеваемостью раком желудка 0,1%, 0,25%, 0,6% и 6,0% соответственно. 17 Заболеваемость раком желудка, ассоциированным с GIM, колеблется от 0% до 10% в систематических обзорах, причем этот диапазон варьируется в зависимости от размера выборки и периодов наблюдения. 18,19
Молекулярные структуры
Недавнее исследование изучает спазмолитическую полипептид-экспрессирующую метаплазию (SPEM) как возможное предшествующее поражение по сравнению с комменсальным предраковым изменением с GIM. 20 SPEM — это метапластический фенотип слизистых клеток с гистологическими характеристиками клеток глубоких антральных желез, который ранее был описан как псевдопилорическая метаплазия, слизистая метаплазия и антрализация тела. 21,22 Предполагается, что это реакция на воспаление с точки зрения заживления ран, 20 было обнаружено, что атрофические изменения тела желудка, связанные с SPEM, могут быть в значительной степени связаны с развитием рака желудка, поскольку SPEM может быть предшественник GIM, 21,22 с биомаркером HE4, который, по-видимому, является специфическим маркером процесса SPEM. 23 В целом, наиболее вероятно, что рак желудка является результатом хронического воспалительного состояния с изменениями, накапливающимися в гиперпролиферативное состояние, уязвимое для вредных мутаций в популяциях стволовых клеток или клеток-предшественников, и что GIM и SPEM могут быть косвенными маркерами этой злокачественной трансформации. 21
Факторы риска кишечной метаплазии и рака желудка
Helicobacter pylori Инфекция
Предраковые поражения желудка тесно связаны с инфекцией H pylori .Фактически, H pylori был признан ВОЗ канцерогеном класса I в 1994 году, 24 , и метаанализ показал, что инфекция H pylori приводит к увеличению риска заражения в 2–3 раза. рак желудка. 25 Подсчитано, что примерно 75% глобального бремени рака желудка связано с воспалением, вызванным H pylori . 26
Было показано, что вирулентность H pylori обусловлена бактериальными факторами, вызывающими изменения в эпителиальных клетках желудка.Как только сигнальный белок бактериальной клетки cagA достигает цитозоля хозяина, он способен изменять последующие поколения клеток-предшественников, что приводит к развитию рака за счет изменений митотической активности, апоптоза, сборки клеток и передачи сигналов. 26 Хотя следует отметить, что, хотя присутствие белка cagA удваивает риск рака желудка, отрицательные цепи cagA также увеличивают риск рака дистальных отделов желудка. 27 Дополнительные факторы вирулентности H pylori включают babA2 , который кодирует бактериальную адгезию с эпителиальными клетками желудка, и вакуолизирующий цитотоксин A, который кодируется геном vacA . 28,29 Штаммы H. pylori , несущие некоторую комбинацию генов babA2 , cagA и vacA , были связаны с самым высоким риском развития кишечной метаплазии. Риск развития более серьезных поражений желудка прямо пропорционален количеству факторов вирулентности, содержащихся в генотипе данного штамма H pylori . 28
В продольном когортном исследовании участвовали 4655 здоровых бессимптомных субъектов из 7.7 лет, при этом рак желудка развился у 45 больных. 30 Рак не развился в группе H pylori– отрицательных / cagA -отрицательных. Риск рака желудка прогрессивно увеличивался с H pylori — отрицательный / cagA — отрицательный до H pylori — положительный / cagA — отрицательный, H pylori — положительный / cagA- положительный и, наконец, H pylori– отрицательный / cagA- положительный, так как потеря H. pylori может наблюдаться при обширной кишечной метаплазии. 30 Смысл этого исследования заключается в том, что тяжелый гастрит с обширной кишечной метаплазией, а не просто инфекция H pylori , является ключевым фактором риска рака желудка.
Инфекция H. pylori , как было показано, связана с железодефицитной анемией (ЖДА), и есть доказательства того, что маркеры ЖДА коррелируют с повышенным риском рака желудка. 31,32 Предполагается, что хроническое воспалительное состояние, вызванное инфекцией H pylori , приводит к усилению регуляции гепсидина и развитию ЖДА.Наиболее вирулентные и провоспалительные штаммы H pylori , cagA и vacA лучше всего приспособлены для жизни в среде с дефицитом железа. Следовательно, дефицит железа дополнительно приводит к селекции популяции преимущественно cagA -положительных и / или vacA -положительных штаммов, что создает более воспалительную и предопухолевую среду. 26
Аутоиммунный гастрит
Аутоиммунный гастрит (AIG) вызывается разрушением париетальных клеток; таким образом, в отличие от альтернативных причин хронического атрофического гастрита (например, H pylori , вызванного лекарством), он обнаруживается только в теле и дне, где расположены исключительно париетальные клетки.Утрата функциональных париетальных клеток приводит к снижению кислотности желудочного сока и повышению рН желудочного сока выше уровня, необходимого для абсорбции неорганических ионов, что приводит к дефициту железа, а потеря внутреннего фактора способствует мальабсорбции витамина B12 и развитию пернициозной анемии. 33-35
AIG был связан с двумя различными типами рака желудка, одним из которых является аденокарцинома желудка. Тем не менее, H pylori — отрицательный AIG, как полагают, не приводит к ранее описанному каскаду Correa от нормального эпителия желудка к инвазивной карциноме, что поднимает вопрос о том, достаточно ли AIG независимо, чтобы привести к аденокарциноме желудка. 33 В отличие от других причин хронического атрофического гастрита, AIG связан с карциноидными опухолями желудка I типа. Карциноидные опухоли желудка являются результатом гиперплазии энтерохромаффинных клеток, которая вызвана гиперпродукцией гастрина антральными G-клетками из-за хронической ахлоргидрии. 36 Карциноиды желудка относительно редки (<1%) по сравнению с аденокарциномами; однако примерно 50% всех карциноидных опухолей желудка связаны с пернициозной анемией. 37
Ревматологические заболевания
Определенные ревматологические заболевания связаны с риском рака желудка.Синдром Шегрена (СС) имеет хорошо известную ассоциацию с лимфомой лимфоидной ткани, ассоциированной со слизистой оболочкой, а желудок является наиболее частым местом поражения внегландулярной лимфомы при СС. В дополнение к лимфоматозному желудочному риску СС был связан с риском солидных опухолей, в частности аденокарциномы желудка. Недавнее испанское исследование показало стандартизованный коэффициент заболеваемости 2,53 (95% ДИ, 1,05–6,07) у женщин с СС. Этот риск не был замечен у мужчин в этом исследовании, поскольку в исследование было включено меньшее количество мужчин, поскольку это заболевание чаще ассоциируется с женщинами. 38 Кроме того, SS имеет установленную связь с атрофическим гастритом. 39 Однако эта связь чаще обнаруживается с легкой атрофией, чем с более тяжелыми атрофическими формами. 40 Тем не менее, хронический атрофический гастрит, характерный для SS, имеет положительную корреляцию по степени тяжести с известными системными серологическими параметрами с установленными воспалительными маркерами тяжести заболевания SS, такими как скорость оседания, уровень иммуноглобулина A и антитело SS-B. 41 Кроме того, уровни сывороточного пепсиногена I, обсуждаемые позже как статистически значимый маркер с отрицательной корреляцией с предраковыми поражениями и серологическими биопсиями, имели аналогичную отрицательную корреляцию с титром вышеупомянутых воспалительных маркеров. 41 В целом, учитывая связь СС с повышенным риском атрофического гастрита и рака желудка, было бы разумно принять во внимание это заболевание при принятии решения о скрининге пациентов, особенно пациентов с коррелирующими клиническими и биохимическими маркерами, предвещающими повышенный риск предраковые поражения.
Что касается других ревматологических заболеваний, у пациентов с остеоартритом и женщин с ревматоидным артритом снижен риск рака желудка. Это снижение риска связано с приемом нестероидных противовоспалительных препаратов (НПВП) и других лекарств, которые могут оказывать общий защитный эффект. 42
Генетические факторы хозяина
Рак, вовлекающий кардиальный отдел желудка, по-видимому, отличается от рака желудка, ограниченного дистальным отделом желудка без кардии.Общие факторы риска обоих типов рака желудка включают пожилой возраст, мужской пол, курение табака и семейный анамнез. Примерно 70% случаев рака желудка диагностируется в возрасте от 55 до 84 лет, и у мужчин риск развития кардиального и некардиального типов повышен в 5 и 2 раза соответственно. 18,43 Механизм предрасположенности мужчин к развитию рака желудка, вероятно, многофакторный. Исторически мужчины чаще курили табак, но также было высказано предположение, что эстроген обладает защитным действием, поскольку как отсроченная менопауза, так и повышенная фертильность снижают риск рака желудка. 44 Хорошо известно, что семейный анамнез является ключевым фактором риска развития рака желудка. Хотя в разных исследованиях есть различия, отношение шансов относительного развития рака желудка первой степени колеблется от 2 до 10 в зависимости от демографических характеристик исследуемой популяции. 18,45
Факторы риска рака желудка, развивающегося в области кардии, очень похожи на факторы риска пищевода Барретта и аденокарциномы пищевода. Характеристики группы риска включают белую расу, ожирение и гастроэзофагеальную рефлюксную болезнь.У белых примерно в 2 раза выше вероятность развития рака кардии, но вдвое меньше вероятность развития рака желудка без кардии. 43
Подавляющее большинство случаев некардиального рака желудка развивается у людей восточноазиатского, тихоокеанского, латиноамериканского и афроамериканского происхождения. Согласно данным регистров SEER, заболеваемость раком желудка (на 100000 в год) среди выходцев из Азии / островов Тихого океана (мужчин: 20,8, женщин: 11,7), афроамериканцев (мужчин: 18.4, женщины: 9,2), а выходцы из Латинской Америки (мужчины: 17,1, женщины: 10,0) почти вдвое выше, чем белые (мужчины: 10,7, женщины: 5,0). 3 Среди азиатско-американских подгрупп американцы корейского и японского происхождения имеют особенно высокие показатели заболеваемости. 18,46
Это преобладание небелого, некардиального рака желудка было отражено в национальной базе данных патологий в Соединенных Штатах, в которой было рассмотрено 800 000 субъектов с биопсией желудка. Распространенность ГИМ у лиц восточноазиатского происхождения (корейцы, японцы, китайцы, вьетнамцы) и латиноамериканского происхождения была значительно выше, чем у представителей всех других этнических групп: 20% и 12% против 8% соответственно. 47
В 2010 году Эдгрен и его коллеги оценили связь между группами крови ABO и раком желудка и язвенной болезнью в проспективном исследовании шведских и датских доноров крови. 48 В исследовании наблюдали 1 089 022 донора на срок до 35 лет и обнаружили, что группа крови А дает коэффициент заболеваемости 1,20 (95% ДИ 1,02–1,42). Хотя это исследование было ограничено особенно однородной популяцией с относительно низким риском рака желудка, вывод согласуется с ассоциацией между группой крови A и раком желудка, которая наблюдалась с 1950-х годов во всем мире. 49-51
Курение табака
В 2004 г., после обширного обзора имеющихся данных, Международное агентство ВОЗ по изучению рака пришло к выводу, что курение табака играет причинную роль в развитии рака желудка. 52 В метаанализе 40 исследований, посвященных взаимосвязи между курением табака и раком желудка, риск рака желудка среди курильщиков был в 1,5–1,6 раза выше, чем у некурящих.Было подсчитано, что более 80 000 случаев рака желудка, или 11% всех предполагаемых случаев, ежегодно связаны с курением табака. 53 Анализы показали различия во взаимосвязи между табаком и полом: от 13% до 16% и от 4% до 7% рака желудка связаны с употреблением табака мужчинами и женщинами, соответственно. 54 Предлагаемый механизм употребления табака, способствующий развитию рака желудка, — это повышенный риск перехода в дисплазию. Популяционное исследование, проведенное в Китае с участием 3000 жителей, показало, что курение сигарет почти удваивает риск перехода к дисплазии с легкой ассоциацией перехода к кишечной метаплазии.Риск перехода к дисплазии сильно коррелировал с семейным анамнезом рака желудка и группой крови A. 55
Рефлюкс желчной кислоты
Считается, что высокая концентрация желчных кислот, наблюдаемая при диете с высоким содержанием жиров или при избыточном рефлюксе желчных кислот в просвет желудка, предрасполагает пациентов к раку желудка, способствуя повреждению слизистой оболочки желудка. В проспективном исследовании 767 пациентов было показано, что желчная кислота способствует кишечной метаплазии и канцерогенезу желудка у H pylori -положительных пациентов. 56 Желчные кислоты косвенно повреждают ДНК, вызывая окислительный стресс, а также вызывают частый апоптоз. Оба механизма способствуют конститутивным мутациям, которые со временем приводят к селективным мутациям и повышают риск рака желудка. 57
Диета
Стремясь лучше понять стратегии профилактики рака желудка, Всемирный фонд исследований рака / Американский институт исследований рака (WCRF / AICR) провел обширный обзор влияния диеты на рак желудка.WCRF / AICR пришел к выводу, что овощи и фрукты, вероятно, являются защитными, а диета с высоким содержанием соли / соленых консервов и мясо животных, выкуренное в высокой степени, вероятно, были связаны с раком желудка. 58
Высокое потребление соли уже давно ассоциируется с повышенным риском рака желудка из-за повышенного риска инфицирования H pylori , а также продвижения вирулентности H pylori через cagA . 59,60 Исследование Ло и его коллег продемонстрировало, что высокая концентрация соли усиливает экспрессию cagA для избранных штаммов H pylori с уникальным мотивом ДНК. 61 Последующее исследование на животных показало, что cagA -положительных штаммов H pylori были необходимы, чтобы вызвать воспалительную реакцию в ответ на высокие концентрации соли. 62
Было показано, что воздействие N -нитрозосодержащих соединений с пищей увеличивает риск некардиального рака желудка за счет стимулирования желудочного канцерогенеза. 58 Обработанное мясо или мясо, подвергшееся консервированию в соли, копчению или ферментации, положительно связаны с некардиальным раком желудка в зависимости от дозы. 63 Механизм канцерогенности обработанного мяса является многофакторным и связан с высоким содержанием солей и добавками нитритов и нитратов. 64 N -нитрозо является экзогенным канцерогенным побочным продуктом нитритов и нитратов в сочетании с аминокислотами. 64 N -нитрозо также образуется эндогенно из гемового железа, содержащегося в красном мясе, которое способствует росту H pylori за счет окислительного стресса и повреждения ДНК. 65
Дополнительным диетическим фактором, который может изменить вирулентность инфекции H pylori , является фолиевая кислота, поскольку добавление фолиевой кислоты снижает воспаление желудка и дисплазию на мышиных моделях. 26,66
Микробиота
Микробиота желудочно-кишечного тракта, в частности взаимосвязь между H pylori и микробиотой, в которой преобладают Firmicutes или альтернативные энтерогепатические виды Helicobacter , может усиливать канцерогенный эффект инфекции H pylori , а Bacteroidetes может смягчать этот эффект. 26,67
Факторы риска суммированы и классифицированы в таблице.
Диагностика, скрининг и наблюдение за метаплазией желудочно-кишечного тракта
Скрининг населения
Массовый скрининг рака желудка показал свою эффективность в странах с высокой заболеваемостью раком желудка. Характеристики рака желудка, которые поддаются скринингу, включают адекватное время задержки в 44 месяца для перехода от ранней к поздней стадии, а также значительное снижение смертности при раннем вмешательстве. 68 Национальные программы скрининга в Японии и Корее рекомендуют эндоскопию всем мужчинам и женщинам старше 40 лет. Несколько неконтролируемых исследований показали, что эти программы скрининга привели к снижению смертности от рака желудка. 68,69 Однако единая глобальная стратегия скрининга не будет реально рентабельной из-за высокой вариабельности бремени рака желудка во всем мире. В странах с низкой заболеваемостью раком желудка, таких как США, пошаговый подход к скринингу может быть более разумным.
Серологическая биопсия
В странах с низкой заболеваемостью раком желудка было предложено сначала сортировать пациента на основе эпидемиологии, генетики и факторов риска окружающей среды. Затем эти люди с повышенным риском могут быть дополнительно стратифицированы на основе статуса H pylori и факторов вирулентности, а также серологических маркеров хронического воспаления, таких как пепсиноген I, пепсиноген II и гастрин. 70
Пепсиноген — профермент пепсина, эндопротеиназы желудочного сока. 71 Уровни пепсиногена в сыворотке отражают морфологическое и функциональное состояние слизистой оболочки желудка и служат маркером хронического атрофического гастрита. 8 Пепсиноген подразделяется на пепсиноген I и II. Пепсиноген I секретируется исключительно главными клетками и клетками слизистой шеи фундальных желез глазного дна и тела. Пепсиноген II секретируется всем желудком и двенадцатиперстной кишкой. 9 Установлены закономерности уровней пепсиногена, отражающие изменения слизистых оболочек, поскольку воспаление желудка приводит к снижению пепсиногена I и увеличению пепсиногена II, что привело к серологической биопсии. 72
Еще один интересный маркер — гастрин, фермент, синтезируемый и секретируемый почти исключительно G-клетками, расположенными в антральном отделе. Гастрин высвобождается G-клетками антрального отдела желудка в ответ на пониженную кислотность. Хроническая инфекция H pylori приводит к повышению уровня гастрина из-за гиперплазии G-клеток. Влияние на уровни гастрина от модуляции секреции кислоты зависит от пораженной области желудка. Уровни гастрина повышаются при преимущественном поражении слизистой оболочки тела и снижаются при атрофическом гастрите с преобладанием антрального отдела. 9
Ту и его коллеги сравнили эти серологические биомаркеры с традиционными факторами риска (возраст, пол, курение, семейный анамнез, симптомы) в большом скрининговом анализе населения Китая. 70 Пепсиноген I и II, а также соотношение пепсиногенов I / II оценивали в комбинации с гастрином подмножества гастрина-17 и антителом H pylori (HP IgG). Оценка серологических биомаркеров была установлена с использованием многовариантных точек риска с отношением шансов. Пепсиноген II, соотношение пепсиногена I / II и HP IgG были связаны с прогнозированием предраковых или злокачественных поражений на исходном уровне, а пепсиноген I, соотношение пепсиногена I / II и гастрин-17 были связаны с преимуществами последующего наблюдения.Таким образом, по мере того, как воспалительный каскад прогрессирует от неатрофического гастрита через спектр атрофического гастрита, кишечной метаплазии и опухолей, было обнаружено, что эти 5 специфических маркеров статистически значимы при прогнозировании предраковых поражений по сравнению с традиционными факторами риска
(рабочая характеристика приемника, 0,803 против 0,580). 70 Как обсуждалось ранее, рак желудка кишечного типа более тесно связан с каскадом атрофического гастрита и кишечной метаплазии, что объясняет более тесную корреляцию с раком желудка кишечного типа и серологической биопсией, чем рак желудка диффузного типа.
Кроме того, антитела к париетальным клеткам (APCA), которые нацелены на α- и β-субъединицы протонных насосов, являются маркерами аутоиммунного атрофического гастрита тела. 73 Предполагается, что APCA индуцируются с помощью молекулярной мимикрии с кислородными железами после того, как инфекция H pylori вызвала достаточную атрофию тела. 74 Японское исследование с участием H. pylori -положительных пациентов продемонстрировало хорошее соответствие между соотношением пепсиногена I / II и уровнями APCA в прогнозировании атрофии тела. 75
Эндоскопический скрининг
Когда установлено, что у пациента из группы с низкой заболеваемостью высокий риск предракового поражения желудка, целесообразно перейти к эндоскопии с гистологическим исследованием. Модифицированная Сиднейская система (MSS) была принята в качестве стандартной классификации гастрита с момента ее создания в 1994 году. 10 MSS имеет как эндоскопическую, так и гистологическую ветви, при этом гистологическая группа фокусируется на сочетании топографической, морфологической и этиологической информации. который является воспроизводимым и клинически полезным.Были оценены исследования картирования, и было определено, что наряду с целенаправленными биопсиями аномалий слизистой оболочки, неспецифической биопсией антрального отдела (большая кривизна, меньшая кривизна), угловой режущей кромки и тела (большая кривизна, меньшая кривизна) в общей сложности было проведено 5 биопсий. высокая вероятность установления точного статуса H pylori . Следует отметить, что биопсия тела была особенно ценной после длительного лечения ингибиторами протонной помпы, поскольку оксинтическая слизистая оболочка могла быть инфицирована исключительно.Биопсия угловой вырезки также особенно важна, поскольку с наибольшей вероятностью выявляется максимальная атрофия, кишечная метаплазия и предраковая дисплазия (рис. 2). 10,76,77
Хотя эндоскопия в белом свете является наиболее доступным методом эндоскопии верхних отделов желудка, существуют и другие методы, позволяющие провести более детальную эндоскопическую оценку желудка. Узкополосная визуализация (NBI) — это эндоскопический метод с высоким разрешением, который улучшает поверхность слизистой оболочки, и в настоящее время наиболее часто используется при оценке пищевода Барретта и воспалительных заболеваний кишечника.Используя определенные отфильтрованные синие и зеленые длины волн, мелкие детализированные изменения слизистой оболочки становятся более заметными с характерным светло-голубым рисунком гребня, указывающим на кишечную метаплазию. 78 Различные исследования изучали NBI по сравнению с эндоскопией в белом свете при наблюдении за GIM, отмечая, что NBI имеет чувствительность и специфичность в диапазоне от 70% до 90% по сравнению с примерно 50% при эндоскопии в белом свете. 77-79 Другими методами, позволяющими проводить более подробное обследование по сравнению с эндоскопией в белом свете, являются хромоэндоскопия, которая влечет за собой местное нанесение красителей или пигментов для улучшения характеристики ткани с помощью эндоскопии с увеличением, и конфокальная эндомикроскопия, которая включает реконструкцию изображения в рассеянном свете для создания повышенная детализация и разрешение.В целом, необходимы дальнейшие исследования для подтверждения паттернов NBI, хромоэндоскопии и конфокальной эндомикроскопии при скрининге и наблюдении GIM.
Эндоскопическое наблюдение
De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году, чтобы определить подходящий режим биопсии для наблюдения за предраковыми поражениями желудка у пациентов, у которых ранее была диагностирована кишечная метаплазия или дисплазия. 80 В это исследование были включены 112 пациентов с кишечной метаплазией или дисплазией низкой или высокой степени.Было взято семь или 9 ненаправленных биопсий из антрального отдела, угловой вырезки, тела и кардии, и их сравнили с контрольной группой с 5 участками биопсии на основе MSS. Получение 12 биопсий считалось золотым стандартом. 9 Биопсия, основанная на MSS, выявила 90% пациентов с GIM и 50% пациентов с дисплазией, по сравнению с 97% с GIM и 100% с дисплазией, когда было получено не менее 7 биопсий. Де Фрис и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для достаточного наблюдения за предраковыми поражениями в популяции с низкой заболеваемостью раком желудка. 80
Текущие рекомендации Американского общества по эндоскопии желудочно-кишечного тракта не рекомендуют сплошное наблюдение за пациентами с ГИМ, «если не присутствуют другие факторы риска рака желудка, такие как семейный анамнез рака желудка и азиатское происхождение». 81 Однако европейский аналог, Европейское общество гастроинтестинальной эндоскопии, рекомендует лечение H pylori , если у пациента обнаруживается инфекция бактериями, с последующим эпиднадзором с картированием биопсии на дисплазию каждые 3 года. 82 Если у пациента с ГИМ обнаружена дисплазия низкой степени тяжести, в течение 1 года необходимо провести контрольную эзофагогастродуоденоскопию (ЭГД) с картированием для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени при отсутствии эндоскопически видимых поражений рекомендуется пройти повторную ЭГДС в течение 6–12 месяцев для наблюдения за видимыми поражениями. Пациенты с поражениями должны пройти надлежащую стадию наряду с хирургической или эндоскопической резекцией из-за высокой вероятности сосуществования инвазивной аденокарциномы, поскольку 25% пациентов с дисплазией высокой степени могут прогрессировать до аденокарциномы в течение 1 года. 13
Химиопрофилактика и лечение
В настоящее время нет рекомендуемых лечебных средств для лечения или профилактики ЖИМ. НПВП были исследованы на предмет химиопрофилактических эффектов при различных типах злокачественных новообразований, и, хотя необходимы дальнейшие исследования, есть некоторые свидетельства того, что НПВП могут иметь профилактический характер при раке желудка. В 2010 году метаанализ 21 исследования продемонстрировал потенциальный защитный эффект НПВП с поправкой на известные факторы риска. 83 Кроме того, небольшие исследования изучали роль НПВП целекоксиба, селективного ингибитора циклооксигеназы-2 (ЦОГ-2). Пациенты с эрадикационной терапией H pylori с последующим лечением целекоксибом в течение 8–12 недель продемонстрировали регресс предраковых поражений желудка, включая атрофический гастрит, кишечную метаплазию и дисплазию низкой степени. 84,85 Предлагаемый механизм защитного действия селективных ингибиторов ЦОГ-2 связан с индукцией апоптоза и подавлением пролиферации клеток и ангиогенеза.Для уточнения этого потенциального эффекта необходимы дальнейшие рандомизированные контролируемые испытания. 85
Заключение
В целом, GIM несет в себе значительный потенциальный риск злокачественного новообразования и получает все большее признание, а также эпидемиологические, генетические и экологические факторы риска, связанные с его развитием. В настоящее время не существует общих рекомендаций по скринингу, поэтому оценка пациентов осуществляется в индивидуальном порядке. Отсутствие консенсуса возлагает бремя принятия решений на отдельных врачей.По мере того, как потребности в медико-санитарной помощи разнообразного населения продолжают расти в Соединенных Штатах, экономически эффективные методы скрининга и оценки риска, такие как серологическая биопсия и оценка H pylori , будут приобретать все большее значение. Доступность и развитие средств скрининга и обнаружения аденокарциномы желудка должны быть расширены, чтобы позволить большему количеству гастроэнтерологов развить как способности, так и знания о том, как эндоскопически локализовать и лечить предшествующие поражения. Необходимы дальнейшие исследования методов профилактики и лечения заболевания, которое по-прежнему является причиной высокого бремени заболеваемости и смертности.
Авторы выражают благодарность Брайану Тайзену, доктору медицины, за предоставленные рисунки патологии и подписи.
У авторов нет соответствующих конфликтов интересов, которые следует раскрывать.
Список литературы
1. Ван дер Вин А.Х., Дис Дж., Бланкенштейн Дж. Д., Ван Бланкенштейн М. Аденокарцинома пищевода Барретта: переоцененный риск. Кишка . 1989; 30 (1): 14-18.
2. Спехлер С.Дж., Шарма П., Соуза РФ, Инадоми Дж.М., Шахин Нью-Джерси; Американская гастроэнтерологическая ассоциация.Заявление о позиции врача Американской гастроэнтерологической ассоциации по лечению пищевода Барретта. Гастроэнтерология . 2011; 140 (3): 1084-1091.
3. Ховладер Н., Ноун А.М., Крапчо М. и др., Ред. Обзор статистики рака SEER, 1975-2014. Национальный институт рака. https://seer.cancer.gov/csr/1975_2014/. Опубликовано в апреле 2017 г. Обновлено 28 июня 2017 г. Проверено 23 января 2018 г.
4. Ла Веккья С., Негри Э., Д’Аванцо Б., Франчески С. Использование электрического холодильника и риск рака желудка. Дж. Рак . 1990; 62 (1): 136-137.
5. Международное агентство по изучению рака, Всемирная организация здравоохранения. GLOBOCAN 2012: оценочная заболеваемость, смертность и распространенность рака во всем мире в 2012 году. Http://globocan.iarc.fr/Default.aspx. По состоянию на 23 января 2018 г.
6. Сиппонен П., Кимура К. Кишечная метаплазия, атрофический гастрит и рак желудка: тенденции во времени. Eur J Гастроэнтерол Hepatol . 1994; 6 (приложение 1): S79-S83.
7. Зонненберг А., Лэш Р.Х., Гента Р.М.Национальное исследование инфекции Helicobactor pylori в образцах биопсии желудка. Гастроэнтерология . 2010; 139 (6): 1894-1901.e2.
8. Оиси Ю., Киёхара Ю., Кубо М. и др. Тест на пепсиноген в сыворотке как прогностический фактор рака желудка: исследование Хисаямы. Am J Epidemiol . 2006; 163 (7): 629-637.
9. de Vries AC, Kuipers EJ. Эпидемиология предраковых поражений желудка: значение для разработки стратегий скрининга и наблюдения. Хеликобактер .2007; 12 (приложение 2): 22-31.
10. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация и классификация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994. Am J Surg Pathol . 1996; 20 (10): 1161-1181.
11. Capelle LG, de Vries AC, Haringsma J, et al. Определение стадии гастрита с помощью системы OLGA с использованием кишечной метаплазии в качестве точной альтернативы атрофическому гастриту. Гастроинтест Эндоск .2010; 71 (7): 1150-1158.
12. Олмез С., Аслан М., Эртен Р., Саяр С., Байрам И. Распространенность кишечной метаплазии желудка и распространение инфекции Helicobacter pylori, атрофии, дисплазии и рака в ее подтипах. Гастроэнтерол Рес Прак . 2015; 2015: 434039.
13. Кассаро М., Рагге М., Гутьеррес О., Леандро Дж., Грэм Д. Ю., Гента Р. М.. Топографические закономерности кишечной метаплазии и рака желудка. Ам Дж. Гастроэнтерол . 2000; 95 (6): 1431-1438.
14.González CA, Sanz-Anquela JM, Gisbert JP, Correa P. Полезность субтипирования кишечной метаплазии как маркера риска рака желудка. Обзор доказательств. Инт Дж. Рак . 2013; 133 (5): 1023-1032.
15. Correa P, Piazuelo MB. Предраковый каскад желудка. J Dig Dis . 2012; 13 (1): 2-9.
16. Полк Д. Б., Пик Р. М. мл. Helicobacter pylori: рак желудка и не только. Нат Рев Рак . 2010; 10 (6): 403-414.
17. Де Фрис А.С., Ван Грикен Н.С., Луман К.В. и др.Риск рака желудка у пациентов с предраковыми поражениями желудка: общенациональное когортное исследование в Нидерландах. Гастроэнтерология . 2008; 134 (4): 945-952.
18. Ким Г. Х., Лян П. С., Банг С. Дж., Хван Дж. Х. Скрининг и наблюдение на рак желудка в США: нужно ли это? Гастроинтест Эндоск . 2016; 84 (1): 18-28.
19. Rugge M, Correa P, Dixon MF, et al. Дисплазия желудка: международная классификация Падуи. Am J Surg Pathol .2000; 24 (2): 167-176.
20. Spechler SJ, Merchant JL, Wang TC, et al. Резюме конференции Джеймса У. Фрестона Американской гастроэнтерологической ассоциации 2016 года: кишечная метаплазия в пищеводе и желудке: происхождение, различия, сходства и значение. Гастроэнтерология . 2017; 153 (1): e6-e13.
21. Голденринг Дж. Р., Нам К. Т., Ван Т. К., Миллс Дж. К., Райт Н. А.. Метаплазия, экспрессирующая спазмолитический полипептид, и кишечная метаплазия: время переоценки метаплазий и происхождения рака желудка. Гастроэнтерология. 2010; 138 (7): 2207-2210, 2210.e1.
22. Вайс В.Г., Голденринг младший. Современное понимание СПЭМ и ее положения в предопухолевом процессе. Рак желудка . 2009; 12 (4): 189-197.
23. Нозаки К., Огава М., Уильямс Дж. А. и др. Молекулярный признак метаплазии желудка, возникающий в ответ на острую потерю париетальных клеток. Гастроэнтерология . 2008; 134 (2): 511-522.
24. Паркин Д.М., Брей Ф., Ферли Дж., Пизани П. Глобальная статистика рака, 2002 г. CA Cancer J Clin . 2005; 55 (2): 74-108.
25. Хуанг Дж. К., Шридхар С., Чен Ю., Хант Р. Х. Мета-анализ связи между серопозитивностью Helicobacter pylori и раком желудка. Гастроэнтерология . 1998; 114 (6): 1169-1179.
26. Амиева М., Пик Р.М. мл. Патобиология рака желудка, вызванного Helicobacter pylori. Гастроэнтерология . 2016; 150 (1): 64-78.
27. Кикучи С., Крэбтри Дж. Э., Форман Д., Куросава М.; Исследовательская группа по профилактике рака желудка у молодых людей.Связь между инфекциями CagA-положительными или отрицательными штаммами Helicobacter pylori и риском рака желудка у молодых людей. Ам Дж. Гастроэнтерол . 1999; 94 (12): 3455-3459.
28. Höcker M, Hohenberger P. Факторы вирулентности Helicobacter pylori — часть общей картины. Ланцет . 2003; 362 (9391): 1231-1233.
29. Палфраман С.Л., Квок Т., Габриэль К. Вакуолизация цитотоксина А (VacA), ключевого токсина для патогенеза Helicobacter pylori. Микробиол фронтальных клеточных инфекций .2012; 2: 92.
30. Охата Х., Китаучи С., Йошимура Н. и др. Прогрессирование хронического атрофического гастрита, связанного с инфекцией Helicobacter pylori, увеличивает риск рака желудка. Инт Дж. Рак . 2004; 109 (1): 138-143.
31. Яманучи Дж., Адзума Т., Якушидзин Ю., Хато Т., Ясукава М. Драматическая и быстрая эффективность эрадикации Helicobacter pylori при лечении тяжелой рефрактерной железодефицитной анемии у взрослых. Энн Гематол . 2014; 93 (10): 1779-1780.
32. Ното Дж. М., Гэдди Дж. А., Ли Дж. Ю. и др. Дефицит железа ускоряет канцерогенез, вызванный Helicobacter pylori, у грызунов и людей. Дж. Клин Инвест . 2013; 123 (1): 479-492.
33. Минальян А., Бенхамму Дж. Н., Арташесян А., Льюис М. С., Писенья Дж. Р.. Аутоиммунный атрофический гастрит: современные перспективы. Clin Exp Гастроэнтерол . 2017; 10: 19-27.
34. Toh BH, Sentry JW, Alderuccio F. Причинный антиген H + / K + АТФазы в патогенезе аутоиммунного гастрита. Иммунол Сегодня . 2000; 21 (7): 348-354.
35. Фабер К. Achylia gastrica mit anamie. Мед Клин . 1909; 5: 1310.
36. Creutzfeldt W. Последовательность ахлоргидрия-карциноид: роль гастрина. Пищеварение . 1988; 39 (2): 61-79.
37. Нику Г.С., Ангелопулос Т.П. Современные представления о карциноидных опухолях желудка. Гастроэнтерол Рес Прак . 2012; 2012: 287825.
38. Брито-Зерон П., Костов Б., Фрайле Г. и др .; Исследовательская группа SS GEAS-SEMI.Характеристика и оценка риска рака у пациентов с первичным синдромом Шегрена. Дж Гематол Онкол . 2017; 10 (1): 90.
39. Покорный Г., Карачони Г., Лонович Дж., Худак Дж., Немет Дж., Варро В. Типы атрофического гастрита у пациентов с первичным синдромом Шегрена. Энн Рум Дис . 1991; 50 (2): 97-100.
40. Коллин П., Карвонен А.Л., Корпела М., Лайппала П., Хелин Х. Гастрит, классифицированный в соответствии с Сиднейской системой у пациентов с первичным синдромом Шегрена. Сканд Дж Гастроэнтерол . 1997; 32 (2): 108-111.
41. Maury CP, Törnroth T, Teppo AM. Атрофический гастрит при синдроме Шегрена. Морфологические, биохимические и иммунологические данные. Arthritis Rheum . 1985; 28 (4): 388-394.
42. Томас Э., Брюстер Д.Х., Блэк Р.Дж., Макфарлейн Г.Дж. Риск злокачественного новообразования у пациентов с ревматическими состояниями. Инт Дж. Рак . 2000; 88 (3): 497-502.
43. Браун Л. М., Девеса СС. Эпидемиологические тенденции рака пищевода и желудка в США. Surg Oncol Clin N Am . 2002; 11 (2): 235-256.
44. Дерахшан М.Х., Липтрот С., Пол Дж., Браун И.Л., Моррисон Д., Макколл К.Э. Аденокарциномы пищевода и желудочно-кишечного типа демонстрируют одинаковое преобладание у мужчин из-за задержки развития у женщин на 17 лет. Кишка . 2009; 58 (1): 16-23.
45. Shin CM, Kim N, Yang HJ, et al. Риск рака желудка у родственников рака желудка: взаимосвязь между инфекцией Helicobacter pylori и семейным анамнезом рака желудка для риска рака желудка. Дж Клин Гастроэнтерол . 2010; 44 (2): e34-e39.
46. Миллер Б.А., Чу К.С., Хэнки Б.Ф., Райс Л.А. Заболеваемость и смертность от рака среди конкретных популяций жителей азиатских и тихоокеанских островов в США Контроль причин рака . 2008; 19 (3): 227-256.
47. Song H, Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Заболеваемость раком желудка среди пациентов с предраковыми поражениями желудка: наблюдательное когортное исследование в западной популяции низкого риска. BMJ .2015; 351: h4867.
48. Эдгрен Г., Хьялгрим Х., Ростгаард К. и др. Риск рака желудка и пептических язв по отношению к группе крови ABO: когортное исследование. Am J Epidemiol . 2010; 172 (11): 1280-1285.
49. Aird I, Bentall HH, Roberts JA. Связь рака желудка с группами крови АВО. Br Med J . 1953; 1 (4814): 799-801.
50. Wang Z, Liu L, Ji J, et al. Система групп крови ABO и рак желудка: исследование случай-контроль и метаанализ. Int J Mol Sci . 2012; 13 (10): 13308-13321.
51. Риццато С., Като И., Пламмер М. и др. Риск развития предраковых поражений желудка у субъектов, инфицированных Helicobacter pylori, зависит от группы крови ABO и статуса cagA. Инт Дж. Рак . 2013; 133 (2): 315-322.
52. Рабочая группа МАИР по оценке канцерогенных рисков для людей. Табачный дым и непроизвольное курение. IARC Monogr Eval Carcinog Risks Hum . 2004; 83: 1-1438.
53.Треданиэль Дж., Боффетта П., Буйатти Э., Сараччи Р., Хирш А. Табакокурение и рак желудка: обзор и метаанализ. Инт Дж. Рак . 1997; 72 (4): 565-573.
54. Пелетейро Б., Кастро С., Мораис С., Ферро А., Лунет Н. Глобальное бремя рака желудка, связанное с курением табака, в 2012 г. и прогнозы на 2020 г. Dig Dis Sci . 2015; 60 (8): 2470-2476.
55. Kneller RW, You WC, Chang YS, et al. Курение сигарет и другие факторы риска прогрессирования предраковых поражений желудка. Национальный институт рака . 1992; 84 (16): 1261-1266.
56. Тацугами М., Ито М., Танака С. и др. Желчная кислота способствует кишечной метаплазии и канцерогенезу желудка. Биомаркеры эпидемиологии рака Предыдущая . 2012; 21 (11): 2101-2107.
57. Бернштейн Х., Бернштейн С., Пейн С.М., Дворакова К., Гарвал Х. Желчные кислоты как канцерогены при раке желудочно-кишечного тракта человека. Mutat Res . 2005; 589 (1): 47-65.
58. Вайзман М. Второй экспертный доклад Всемирного фонда исследований рака / Американского института исследований рака.Еда, питание, физическая активность и профилактика рака: глобальная перспектива. Proc Nutr Soc . 2008; 67 (3): 253-256.
59. Ли С.А., Канг Д., Шим К.Н., Чхве Дж. У., Хонг В.С., Чой Х. Влияние диеты и инфекции Helicobacter pylori на риск раннего рака желудка. J Эпидемиол . 2003; 13 (3): 162-168.
60. Фокс Дж. Дж., Данглер, Калифорния, Тейлор Н. С., Кинг А., Ко Т. Дж., Ван ТС. Диета с высоким содержанием соли вызывает гиперплазию желудочного эпителия и потерю париетальных клеток, а также усиливает колонизацию Helicobacter pylori у мышей C57BL / 6. Cancer Res . 1999; 59 (19): 4823-4828.
61. Ло Дж. Т., Торрес В. Дж., Обложка TL. Регуляция экспрессии cagA Helicobacter pylori в ответ на соль. Cancer Res . 2007; 67 (10): 4709-4715.
62. Гэдди Дж. А., Радин Дж. Н., Ло Дж. Т. и др. Высокое потребление соли с пищей усугубляет канцерогенез желудка, вызванный Helicobacter pylori. Заражение иммунной . 2013; 81 (6): 2258-2267.
63. Международный фонд исследований рака. Диета, питание, физическая активность и рак желудка.CUP: проект непрерывного обновления. http://www.wcrf.org/sites/default/files/Stomach-Cancer-2016-Report.pdf. По состоянию на 23 января 2018 г.
64. Takahashi M, Nishikawa A, Furukawa F, Enami T., Hasegawa T., Hayashi Y. Дозозависимые стимулирующие эффекты хлорида натрия (NaCl) на канцерогенез железистого желудка крысы, инициированный N-метил-N’-нитро-N- нитрозогуанидин. Канцерогенез . 1994; 15 (7): 1429-1432.
65. Cross AJ, Pollock JRA, Bingham SA. Гем, а не белок или неорганическое железо, отвечает за эндогенное N-нитрозирование кишечника, возникающее при употреблении красного мяса. Cancer Res . 2003; 63 (10): 2358-2360.
66. Гонда Т.А., Ким Ю.И., Салас М.К. и др. Фолиевая кислота увеличивает глобальное метилирование ДНК и уменьшает воспаление, чтобы предотвратить рак желудка, связанный с Helicobacter, у мышей. Гастроэнтерология . 2012; 142 (4): 824-833.e7.
67. Ge Z, Feng Y, Muthupalani S, et al. Коинфекция энтерогепатическими видами Helicobacter может улучшить или способствовать индуцированной Helicobacter pylori патологии желудка у мышей C57BL / 6. Заражение иммунной .2011; 79 (10): 3861-3871.
68. Ли К.Дж., Иноуэ М., Отани Т., Ивасаки М., Сасадзуки С., Цугане С. Исследовательская группа JPHC. Скрининг рака желудка и последующий риск рака желудка: крупномасштабное популяционное когортное исследование с последующим наблюдением в течение 13 лет в Японии. Инт Дж. Рак . 2006; 118 (9): 2315-2321.
69. Lin JT. Скрининг рака желудка: кто, когда и как. Клин Гастроэнтерол Гепатол . 2014; 12 (1): 135-138.
70. Ту Х, Сун Л., Донг Х и др. Серологическая биопсия с использованием пяти циркулирующих биомаркеров желудка для оценки риска рака желудка: многоэтапное исследование. Ам Дж. Гастроэнтерол . 2017; 112 (5): 704-715.
71. Динис-Рибейро М., да Коста-Перейра А., Лопес С. и др. Обоснованность соотношения сывороточного пепсиногена I / II для диагностики дисплазии эпителия желудка и кишечной метаплазии во время наблюдения за пациентами с риском аденокарциномы желудка кишечного типа. Новообразование . 2004; 6 (5): 449-456.
72. Самлофф И.М., Варис К., Ихамаки Т., Сирала М., Роттер Дж. Взаимосвязь между сывороточным пепсиногеном I, сывороточным пепсиногеном II и гистологией слизистой оболочки желудка.Исследование у родственников больных злокачественной анемией. Гастроэнтерология . 1982; 83 (1 пт 2):
204-209.
73. Karlsson FA, Burman P, Lööf L, Mårdh S. Основным антигеном париетальных клеток при аутоиммунном гастрите с пернициозной анемией является продуцирующая кислоту H +, K + -аденозинтрифосфатаза желудка. Дж. Клин Инвест . 1988; 81 (2): 475-479.
74. Негрини Р., Савио А., Поэси С. и др. Антигенная мимикрия между Helicobacter pylori и слизистой оболочкой желудка в патогенезе атрофического гастрита тела. Гастроэнтерология . 1996; 111 (3): 655-665.
75. Ито М., Харума К., Кая С. и др. Влияние уровней антител к париетальным клеткам на желудочно-кишечные заболевания, включая канцерогенез желудка. Dig Dis Sci . 2002; 47 (5): 1080-1085.
76. Феннерти М.Б., Эмерсон Дж. К., Сэмплинер Р. Э., Макги Д. Л., Хиксон Л. Дж., Гарвал Х. С.. Желудочно-кишечная метаплазия у этнических групп на юго-западе США. Биомаркеры эпидемиологии рака Предыдущая . 1992; 1 (4): 293-296.
77. Capelle LG, Haringsma J, de Vries AC, et al. Узкополосная визуализация для обнаружения кишечной метаплазии и дисплазии желудка во время контрольной эндоскопии. Dig Dis Sci . 2010; 55 (12): 3442-3448.
78. Уэдо Н., Исихара Р., Ииши Х. и др. Новый метод диагностики кишечной метаплазии желудка: узкополосная визуализация с увеличительной эндоскопией. Эндоскопия . 2006; 38 (8): 819-824.
79. Гонен С., Симсек И., Сариоглу С., Акпинар Х. Сравнение увеличительной эндоскопии с высоким разрешением и стандартной видеоэндоскопии для диагностики гастрита Helicobacter pylori в рутинной клинической практике: проспективное исследование. Хеликобактер . 2009; 14 (1): 12-21.
80. de Vries AC, Haringsma J, de Vries RA, et al. Стратегии биопсии для эндоскопического наблюдения за предзлокачественными поражениями желудка. Хеликобактер . 2010; 15 (4): 259-264.
81. Эванс Дж. А., Чандрасекхара В., Чатади К. В. и др .; Комитет по стандартам практики ASGE. Роль эндоскопии в лечении предраковых и злокачественных состояний желудка. Гастроинтест Эндоск . 2015; 82 (1): 1-8.
82.Динис-Рибейро М., Арейя М., де Фрис А.С. и др .; Европейское общество эндоскопии желудочно-кишечного тракта; Европейская группа изучения хеликобактер; Европейское общество патологов; Sociedade Portuguesa de Endoscopia Digestiva. Ведение предраковых состояний и поражений желудка (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта (ESGE), Европейской группы изучения хеликобактер (EHSG), Европейского общества патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ). Эндоскопия .2012; 44 (1): 74-94.
83. Тянь В., Чжао Ю., Лю С., Ли Х. Мета-анализ взаимосвязи между употреблением нестероидных противовоспалительных препаратов и раком желудка. Eur J Cancer Назад . 2010; 19 (4): 288-298.
84. Хунг К. Х., Ян Х. Б., Ченг Х. С., Ву Дж. Дж., Шеу Б. С.. Кратковременное применение целекоксиба для регресса долгосрочной стойкой кишечной метаплазии желудка после эрадикации Helicobacter pylori. J Гастроэнтерол Hepatol . 2010; 25 (1): 48-53.
85. Zhang LJ, Wang SY, Huo XH, et al.Анти-Helicobacter pylori терапия с последующим назначением целекоксиба при прогрессировании предраковых поражений желудка. Мир Дж. Гастроэнтерол . 2009; 15 (22): 2731-2738.
Раков | Бесплатный полнотекстовый | Связь между потреблением диетической соли и прогрессированием предракового процесса желудка
1. Введение
Хотя заболеваемость раком желудка снизилась за последнее столетие, он остается третьей ведущей причиной смерти от рака во всем мире; Ежегодно диагностируется почти миллион новых случаев рака желудка, из которых примерно две трети приходится на развивающиеся страны [1,2].Предполагаемый механизм канцерогенеза желудка включает воспаление и повреждение эпителия, которые приводят к предраковым поражениям желудка (атрофический гастрит, кишечная метаплазия и дисплазия) и раку желудка в таком порядке [3]. В США рак желудка был ведущей причиной возникновения рака желудка. смертность от рака до 1930 г .; однако в ХХ веке в США заболеваемость и смертность резко снизились [4,5]. Это снижение заставило исследователей предположить, что факторы питания и окружающей среды могут быть вовлечены в развитие рака желудка [6].В течение первой половины 20-го века методы консервирования пищевых продуктов быстро перешли от использования соли к охлаждению, поскольку охлаждение началось и стало широко распространенным [4]. Поскольку снижение заболеваемости и смертности от рака желудка, по-видимому, совпало с сокращением использования соли для консервирования пищевых продуктов, была выдвинута гипотеза, что потребление соли может быть вовлечено в этиологию рака желудка [4]. Самые ранние зарегистрированные доказательства потенциальной связи между потреблением соли и раком желудка были получены в нескольких исследованиях на животных и в экологических исследованиях [7,8,9,10,11].С тех пор в ряде поперечных, случай-контроль и когортных исследований изучалось влияние потребления соли на прогрессирование до предраковых поражений и / или рака желудка, но в этих исследованиях в основном использовались самооценки потребления соли и сообщалось о широкий диапазон оценок эффекта [12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33, 34,35,36,37,38,39,40,41,42,43]. Ценность самооценок потребления соли может быть ограничена, поскольку люди могут не знать количество соли, добавленной или естественным образом присутствующей в пищевых продуктах [13,44].Кроме того, оценка потребления соли по результатам самооценки, как сообщается, имеет низкую корреляцию с соотношением натрия / креатинина в моче, полученным из 24-часовых образцов мочи, золотым стандартом для оценки потребления соли с пищей [44,45]. Следовательно, большинство предыдущих исследований могли не точно измерить потребление соли [13,44]. Хотя измерение соотношения натрия / креатинина в 24-часовых образцах мочи считается лучшим способом определения потребления соли [44], получение 24-часового образца мочи, как правило, нецелесообразно, поскольку для этого требуется госпитализация участников исследования.Оценка соотношения натрия / креатинина в моче по выборочным образцам мочи, которая близко приближается к измерениям из 24-часовых образцов мочи, является более осуществимым подходом и имеет большую достоверность по сравнению с самооценками [45]. Следовательно, использование натрия в моче / Соотношение креатинина для оценки потребления соли с пищей важно для повышения достоверности исследований, оценивающих влияние потребления соли на предраковый процесс в желудке. Однако таких исследований мало. Кроме того, необходимы когортные исследования с адекватным последующим наблюдением, в которых потребление соли измеряется до прогрессирования предракового поражения или рака желудка.Кроме того, патогенез рака желудка многофакторен [1,2,3]; несколько факторов, включая инфекцию Helicobacter pylori и диету, могут влиять на этот процесс одновременно [1,2,3]. Таким образом, присутствие H. pylori может изменять влияние потребления соли с пищей на прогрессирование предракового процесса желудка. Чтобы восполнить эти пробелы, мы проанализировали данные когортного исследования, проведенного в Колумбии, Южная Америка [46], чтобы оценить влияние потребления соли на исходном уровне на будущее прогрессирование предраковых поражений желудка во всей когорте и в подгруппах с H.pylori.2. Результаты
Из 399 участников с исходными данными по натрию и креатинину 354 успешно прошли наблюдение через 5 и 309 месяцев в течение 11–12 лет. Окончательная подходящая аналитическая выборка из 260 участников состояла из тех, у кого не было дисплазии или рака желудка на исходном уровне, у которых также был полный гистологический диагноз на каждом временном интервале, данные натрия / креатинина в моче на исходном уровне и через 5 месяцев, а также данные о еженедельных фруктах. потребление овощей, пол, возраст и социально-экономический статус для корректировки в регрессионных моделях (дополнительный рисунок S1).Исходно среднее соотношение натрия к креатинину в моче составляло 1,66 ммоль / сг (стандартное отклонение: 0,8). Исходные характеристики участников представлены в таблице 1 в виде тертилей соотношений натрий / креатинин. Вкратце, участники с наивысшим показателем соотношения натрия / креатинина в моче на исходном уровне были старше, имели более низкий социально-экономический статус, потребляли меньше фруктов и овощей и имели более выраженные исходные поражения желудка. Все участники были положительными на H. pylori на исходном уровне, и все люди, которые тестировали H.pylori отрицательные через 5 месяцев, инфекция была устранена лечением.Среди 260 участников, включенных в анализ с использованием соотношения натрий / креатинин в качестве воздействия, более 33% (n = 85) имели некоторый тип прогрессирования предракового процесса после исходного уровня, который был задокументирован в течение 11–12 лет. вверх. Было 28 участников, которые прогрессировали до атрофического гастрита, 63 участника, которые прогрессировали до кишечной метаплазии, и 10 участников, которые прогрессировали до дисплазии или рака желудка.У некоторых участников развилось более одного предракового поражения желудка.
Мы не наблюдали положительной связи между соотношением натрия и креатинина в моче и общим прогрессом предракового процесса желудка после поправки на возраст, пол, социально-экономический статус и потребление фруктов и овощей, а также в подгруппах, у которых был положительный или отрицательный результат теста на H. pylori. (Таблица 2). Мы также не наблюдали положительной связи между потреблением соли и прогрессированием кишечной метаплазии.Мы наблюдали слабую положительную связь между соотношением натрия / креатинина и прогрессированием атрофического гастрита (скорректированный RR: 1,21; 95% CI: 0,93–1,57) и немного более сильную положительную связь с прогрессированием дисплазии или рака желудка (скорректированный RR: 1,32; 95% ДИ: 0,96–1,81) (Таблица 2). Кроме того, более сильная ассоциация прогрессирования дисплазии или рака желудка наблюдалась у пациентов с инфекцией H. pylori через пять месяцев (после лечения) (скорректированный ОР: 1,53; 95% ДИ: 1,12–2,09) и пациентов с персистирующей инфекцией H.pylori на протяжении всего периода наблюдения (скорректированный ОР: 1,49; 95% ДИ: 1,09–2,05), таблица 2. Из-за небольшого размера выборки в группе отрицательных по H. pylori, мы не смогли оценить скорректированный коэффициент риска прогрессирования дисплазии или раку желудка. Аналогичным образом, мы наблюдали, что соотношение натрия / креатинина в моче было положительно связано с прогрессированием дисплазии или рака желудка в общей когорте, сравнивая гистологический диагноз от 5-месячного периода наблюдения (после лечения) до 11-12 лет наблюдения (скорректированный RR). : 1.37, 95% ДИ: 1,05–1,78), а также у тех, кто продолжал инфицироваться H. pylori через пять месяцев после лечения (скорректированный ОР: 1,52; 95% ДИ: 1,14–2,03), а также у пациентов с устойчивым H. y инфекции pylori на протяжении всего периода исследования (скорректированный ОР: 1,48; 95% ДИ: 1,11–1,98) (дополнительная таблица S1). Грубые соотношения рисков представлены в дополнительных таблицах S2 и S3. Связь между потреблением соли, оцененной по частоте добавления соли в пищу и по количеству соли, добавляемой в пищу, и прогрессированием дисплазии желудка или рака желудка была аналогична таковой. оценивается по соотношению натрия / креатинина в моче, но наблюдаемые эффекты были менее точными и имели тенденцию быть слабее (дополнительные таблицы S4 и S5).3. Обсуждение
В этом исследовании мы исследовали влияние потребления соли на общее и специфическое для поражения прогрессирование предраковых поражений желудка и способы, которыми эти эффекты были изменены продолжительным присутствием инфекции H. pylori после лечения. Мы наблюдали связь между потреблением соли и прогрессированием до прогрессирующих поражений (дисплазия и рак желудка), особенно среди тех, кто продолжал инфицироваться H. pylori после лечения. Мы не наблюдали положительной связи между потреблением соли и прогрессированием предракового процесса желудка в целом, и данные были слишком скудными, чтобы рассчитать скорректированную оценку RR для запущенных поражений (дисплазия и рак желудка) среди пациентов без H.pylori.
В нашем обзоре литературы мы обнаружили 30 (19 случай-контроль, 10 когорт и одно поперечное сечение) [12,13,14,15,16,17,18,19,20,21,22,23 , 24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43] эпидемиологические исследования, оценивающие влияние потребления соли о предраковых поражениях желудка и / или раке желудка и предоставили данные для оценки влияния потребления соли на предраковые поражения желудка или рак. Этот обзор показал, что в некоторых предыдущих исследованиях сообщалось о повышенном риске прогрессирующих поражений (дисплазии или рака желудка) при повышенном потреблении соли [12,13,15,17,19,20,23,27,28,30,31,33,34, 37,38,40,41,42,43], что согласуется с нашим исследованием, в то время как другие не наблюдали ассоциации [14,16,17,20,21,24,25,26,29,30,31,32, 35,36,43].Различия в оценках потребления соли при предраковых поражениях желудка и / или раке желудка, полученные в предыдущих исследованиях, могли быть связаны с потенциальной модификацией воздействия инфекции H. pylori, которая не учитывалась в предыдущих исследованиях, но учитывалась в нашем исследовании. Кроме того, несоответствие между нашими результатами и результатами некоторых исследований может быть связано с неточностями в оценке потребления соли с использованием самоотчетов во всех предыдущих исследованиях, кроме одного [13]. Сообщается, что измерения потребления соли являются менее точными оценками потребления соли с пищей по сравнению с соотношениями натрия / креатинина с мочой, потому что соотношения натрия / креатинина с мочой не склонны к неточному воспроизведению и не учитывают потребление соли из всех источников [44,45,47 , 48].Потребление соли, оцененное по результатам самооценки, учитывает только отозванные продукты питания, перечисленные в вопросниках, и зависит от среднего содержания соли в каждом продукте на порцию, указанном в стандартных таблицах питания. Размеры каждой порции и количество соли, добавляемой при приготовлении продуктов, могут варьироваться в зависимости от человека, и это может влиять на количество соли в продуктах питания. Следовательно, содержание соли в каждом продукте питания, указанное в стандартных таблицах питания, может не быть репрезентативным для разных людей.Это может снизить точность самооценки потребления соли. Поэтому, в дополнение к самооценкам, мы использовали соотношение креатинина в моче и натрия для оценки потребления соли в нашем исследовании. Мы использовали точечные пробы мочи для оценки соотношения натрия / креатинина, поскольку сбор 24-часовых образцов мочи был невозможен, поскольку участники не были госпитализированы. Однако, как сообщается, соотношение натрия / креатинина в моче, оцененное по выборочным образцам мочи, сильно коррелирует с показателями золотого стандарта соотношений натрия / креатинина за 24 часа в моче и считается «потенциально более простым методом оценки потребления [натрия]». и может использоваться для замены [натрия] в суточной моче »[45].Нам известно только об одном предыдущем исследовании, кросс-секционном исследовании, проведенном Chen et al. [13], которые использовали соотношение натрия / креатинина в моче из точечных образцов мочи для оценки влияния потребления соли на предраковые поражения желудка. Как пишет Chen et al. [13] исследование было кросс-секционным, потребление соли и предраковые поражения измерялись в один и тот же момент времени, поэтому на результаты могли повлиять временная неоднозначность и протопатическая ошибка. Протопатическая предвзятость может быть результатом возможных изменений в диетических привычках после диагностики предраковых поражений желудка, так что время взятия пробы мочи не будет отражать потребление соли, которое могло способствовать развитию предраковых поражений [49].В текущем исследовании мы ограничили возможность протопатического смещения, используя соотношение натрий / креатинин, измеренное до того, как наступил результат — прогрессирование предраковых поражений желудка. Исследование Chen et al. [13] было похоже на текущее исследование в том, что было обнаружено, что потребление соли увеличивает риск развития предраковых поражений желудка (дисплазии) и атрофического гастрита в меньшей степени. В целом наши оценки были слабее, чем у Chen et al. [13]. Возможный механизм действия H.pylori о связи между потреблением соли и раком желудка сообщалось в исследованиях на животных. У мышей и монгольских песчанок диета с высоким содержанием соли может усугубить индуцированный H. pylori рак желудка [46,50,51]. У мышей это проявляется в увеличении пролиферации и удлинения желудочных ямок, что также может предоставить больше места для колонизации H. pylori [51]. Повышенная колонизация H. pylori в желудках животных может привести к усилению воспаления желудка и повреждению эпителия, что впоследствии может привести к предраковым поражениям желудка и раку [50,51,52].Влияние потребления соли на повреждение эпителия, т. Е. Истощение слизи, более преобладает на более поздних стадиях каскада, что может объяснить более сильную связь, наблюдаемую в текущем анализе между потреблением соли и прогрессированием до прогрессирующих предраковых поражений или рака, по сравнению с предыдущими. поражения. Наличие потенциального взаимодействия между потреблением соли и колонизацией H. pylori с целью увеличения риска развития предраковых поражений / рака желудка может быть причиной наблюдаемого более сильного положительного эффекта у пациентов с H.pylori, но у нашего исследования есть некоторые ограничения. Во-первых, ограниченная мощность не позволила нам оценить статистическое взаимодействие между потреблением соли и инфекцией H. pylori для увеличения предракового прогрессирования желудочной ассоциации. В нашем анализе подгруппы по статусу инфекции H. pylori мы наблюдали более сильное влияние потребления соли на прогрессирование дисплазии или рака желудка у людей с инфекцией H. pylori, но данные были слишком скудными, чтобы оценить скорректированный эффект для тех, у кого не было инфекционное заболевание.Во-вторых, потеря для последующего наблюдения и неполные данные были значительными в течение 12 лет. Однако смещение отбора из-за селективной потери для последующего наблюдения маловероятно, потому что смещение отбора могло бы иметь место только в том случае, если бы риск прогрессирования предраковых поражений желудка (который был бы неизвестен пациентам и их врачам) по-разному влиял на потерю на разных уровнях потребление соли. Наконец, мы исследовали влияние потребления соли на прогрессирование в основном до предраковых поражений, потому что только один случай рака желудка произошел в исследуемой когорте при 12-летнем наблюдении.Предраковые поражения желудка были суррогатными исходами рака желудка. Ограничение использования суррогатных результатов состоит в том, что влияние воздействия на окончательный клинический результат может отличаться от того, которое наблюдается на суррогатном исходе. Маловероятно, что это произошло в нашем исследовании, особенно в тех случаях, когда результатом было прогрессирование дисплазии или рака, потому что почти 65–80% тех, у кого дисплазия, вероятно, разовьются до рака желудка [53]. Наше исследование имеет несколько сильных сторон. Во-первых, как упоминалось ранее, в отличие от предыдущих исследований, мы оценивали потребление соли тремя методами (соотношение натрия / креатинина с мочой, частота добавления соли в пищу, о которой сообщают сами люди, и потребление поваренной соли).Кроме того, мы использовали среднее соотношение натрия / креатинина по сравнению с исходным уровнем и за пять месяцев, чтобы повысить надежность соотношений натрия / креатинина в моче. Во-вторых, насколько нам известно, наше исследование является первым с последующим дизайном для изучения модификации связи соли с предраковым процессом желудка, вызванной инфекцией H. pylori. Только в трех исследованиях были представлены оценки влияния потребления соли на рак желудка у лиц с инфекцией H. pylori и без нее, все из которых планировались как случай-контроль и использовали самооценки потребления соли [23,28,38] .В-третьих, мы использовали множественные биопсии, чтобы уменьшить количество ошибочных диагнозов предраковых поражений желудка и инфекций H. pylori, потому что они, как правило, возникают в виде пятен [54] и могут быть пропущены, если не используются множественные биопсии. В-четвертых, в отличие от предыдущих исследований, мы скорректировали возможные искажающие факторы (возраст, социально-экономический статус и потребление фруктов и овощей), выявленные направленными ациклическими графиками. Электронное значение может помочь нам в оценке того, могут ли наши результаты, вероятно, быть отнесены к искажению, и определяется как «минимальная сила связи по шкале соотношения рисков, которую неизмеряемый искажающий фактор должен иметь как с [подверженностью], так и с результатом. чтобы полностью объяснить конкретную связь [воздействие] — результат, обусловленную измеренными ковариатами »[55].Значение е для нашего исследования составляет 2,43, что означает, что неизмеряемый фактор, влияющий на результат, должен увеличить риск прогрессирования более чем в два раза (ОР = 2,43) и одновременно должен показать относительный риск 2,43 для связи между искажающим фактором. и соль. Хотя возможно, но маловероятно, что одновременно существуют такие сильные ассоциации. Таким образом, мы, вероятно, адекватно скорректировали с учетом искажения, и наши результаты вряд ли связаны с остаточным искажением.% PDF-1.5 % 1 0 объект > / OCGs [9 0 R] >> / Страницы 2 0 R / Тип / Каталог >> эндобдж 49 0 объект > / Шрифт >>> / Поля [] >> эндобдж 53 0 объект > поток 2021-11-25T01: 30: 33-08: 002006-09-27T10: 13: 39-07: 002021-11-25T01: 30: 33-08: 00uuid: f62e7b13-95dc-482f-a540-3984df25ab5fuuid: d6bd266c- 1dd1-11b2-0a00-9000c8d98fffapplication / pdf конечный поток эндобдж 2 0 obj > эндобдж 44 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Страница >> эндобдж 39 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 34 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 29 0 объект > / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 24 0 объект > / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 19 0 объект > / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 14 0 объект > / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 5 0 obj > / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3 57 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >> эндобдж 54 0 объект > / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >> эндобдж 72 0 объект [78 0 R 79 0 R 80 0 R 81 0 R 82 0 R] эндобдж 73 0 объект > поток q 540.0594177 0 0 68.6011963 35.9702911 675.3988037 см / Im0 Do Q BT / T1_0 1 Тс 10 0 0 10 85,56995 576,99985 тм (1975; 35: 3452-3459.) Tj / T1_1 1 Тс -5.55699 0 Тд (Рак Res \ 240) Tj / T1_0 1 Тс 0 1 ТД (\ 240) Tj 0 1.00001 TD (Уильям Хензель и Пелайо Корреа) Tj / T1_2 1 Тс 0 1 ТД (\ 240) Tj / T1_3 1 Тс 18 0 0 18 30 616,99997 тм (Прошлое десятилетие) Tj Т * (Развитие эпидемиологии рака желудка по поводу) Tj ET 30 522 552 35 рэ 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 120.94202 529.99997 тм (\ 240) Tj / T1_3 1 Тс -7,55696 1 тд (Обновленная версия) Tj ET BT / T1_2 1 Тс 10 0 0 10 141 521.99994 Тм (\ 240) Tj / T1_0 1 Тс 26.68095 1 тд () Tj 0 0 1 рг -26.68095 0 Тд (http://cancerres.aacrjournals.org/content/35/11_Part_2/3452)Tj 0 г 0 1.00001 TD (Последнюю версию этой статьи можно найти по адресу:) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 501,99997 тм (\ 240) Tj 0 1 ТД (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 481,99997 тм (\ 240) Tj Т * (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 30 461,99997 тм (\ 240) Tj Т * (\ 240) Tj ET 30 347 552 115 рэ 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 120.94202 429.99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Оповещения по электронной почте) Tj ET BT / T1_0 1 Тс 10 0 0 10 295,4996 442 тм (относится к этой статье или журналу.) Tj 0 0 1 рг -15.44996 0 Тд (Зарегистрируйтесь, чтобы получать бесплатные уведомления по электронной почте) Tj ET BT 0 г / T1_0 1 Тс 11 0 0 11 120.94202 396.99994 тм (\ 240) Tj / T1_3 1 Тс -6.38997 1 тд (Подписки) Tj 0,556 1,00001 тд (Отпечатки и) Tj ET BT / T1_0 1 Тс 10 0 0 10 141 399,99994 тм (\ 240) Tj 13,46496 1 тд (.) Tj 0 0 1 рг -6.85098 0 Тд ([email protected]) Tj 0 г -6.61398 0 Тд (Отделение) Tj 0 1.00001 TD (Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \ t Публикации AACR) Tj ET BT / T1_0 1 Тс 11 0 0 11 120.94202 374,99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Разрешения) Tj ET BT / T1_0 1 Тс 10 0 0 10 141 346,99988 тм (\ 240) Tj 0 1 ТД (Сайт Rightlink.) Tj 0 1.00001 TD (Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \ раннс Центр \ (CCC \)) Tj 26.

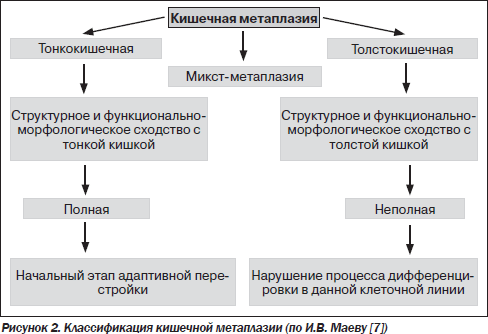 В этом случае происходит замещение трубчатых желез желудка слизистой тканью.
В этом случае происходит замещение трубчатых желез желудка слизистой тканью.

 Основных приемов пищи должно быть три, между ними желательно сделать два – три легких перекуса.
Основных приемов пищи должно быть три, между ними желательно сделать два – три легких перекуса. До язвы, к счастью, не дошло, но с годами стала более внимательно относится к здоровью, поэтому примерно раз в год наблюдалась у гастроэнтеролога. На очередном приеме мне сказали пройти дополнительную эндоскопию с контрастным веществом, а затем отправили еще и на анализы. В итоге — метаплазия, причем для меня это слово сразу ассоциировалось с раком. Врач сказала, что болезнь обнаружена на раннем сроке, но порекомендовала операцию, так как лекарства не всегда дают эффект. Все прошло просто отлично, больше нервничала при подготовке к процедуре. Через два месяца после операции заново сделала все анализы, пока все в норме. Сейчас больше времени уделяю правильному питанию, ведь болезнь может вернуться.
До язвы, к счастью, не дошло, но с годами стала более внимательно относится к здоровью, поэтому примерно раз в год наблюдалась у гастроэнтеролога. На очередном приеме мне сказали пройти дополнительную эндоскопию с контрастным веществом, а затем отправили еще и на анализы. В итоге — метаплазия, причем для меня это слово сразу ассоциировалось с раком. Врач сказала, что болезнь обнаружена на раннем сроке, но порекомендовала операцию, так как лекарства не всегда дают эффект. Все прошло просто отлично, больше нервничала при подготовке к процедуре. Через два месяца после операции заново сделала все анализы, пока все в норме. Сейчас больше времени уделяю правильному питанию, ведь болезнь может вернуться. Сейчас прохожу полный курс, судя по анализам прогресс положительный. В семье пришлось полностью пересмотреть все взгляды на питание, отказаться от алкоголя и бросить курить. В целом, настраиваюсь на успех, на всякий случай ищу хорошего хирурга за границей.
Сейчас прохожу полный курс, судя по анализам прогресс положительный. В семье пришлось полностью пересмотреть все взгляды на питание, отказаться от алкоголя и бросить курить. В целом, настраиваюсь на успех, на всякий случай ищу хорошего хирурга за границей.
