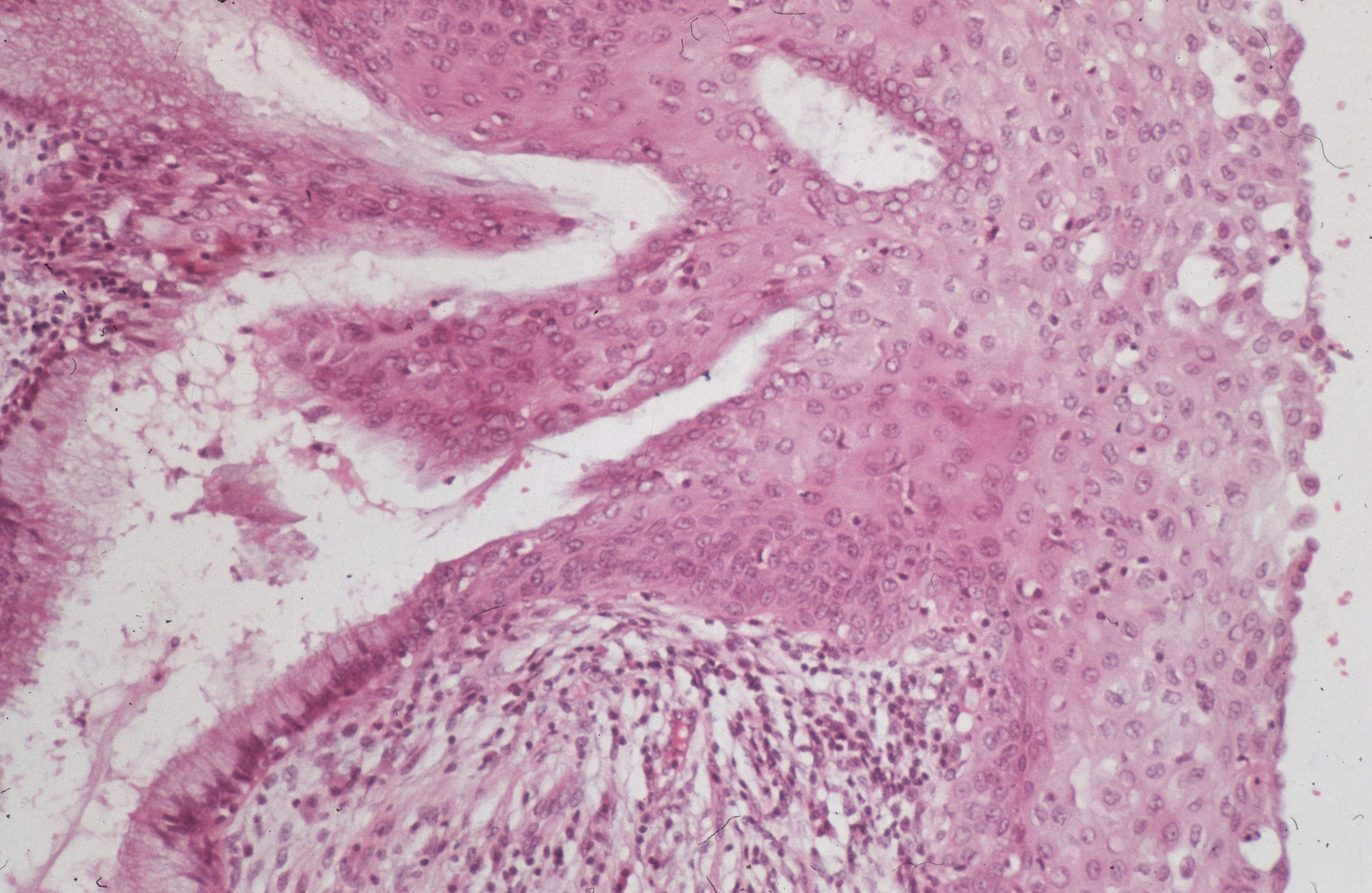
Пищевод Барретта | Статьи
Впервые патология описана в 1946 году Эллисоном, а английский хирург Норман Барретт описал её более полно в 1950, однако окончательные представления в вопросе, что именно считать пищеводом Барретта, а также вопросы тактики ведения подобных больных были сформированы в последние 10-15 лет, именно по этой причине в сети Интернет содержатся разноречивые данные на эту тему.
Основной причиной пищевода Барретта является гастроэзофагально рефлюксная болезнь (ГЭРБ), при которой возникает стойкий заброс содержимого желудка в пищевод, вследствие чего, возникает вначале воспаление в пищеводе с последующим эрозированием, а возможно, и с изъязвлением.
Образующиеся дефекты периодически заживляются, но слизистая пищевода не стойка к воздействию кислой среды желудка, в связи с чем указанные дефекты эпителизируются не слизистой пищевода, а слизистой желудка, из-за чего образуются высокие «зубцы» желудочной метаплазии в н/3 пищевода, но это ещё не пищевод Барретта.
Постепенно при постоянных репаративных процессах (клетки многократно делятся, чтобы «успеть» закрыть образовавшийся дефект слизистой) возникает «сбой» и вместо клеток слизистой желудка в пищеводе образуются очаги кишечного эпителия, вот именно такая ситуация и называется пищеводом Барретта.
При дальнейших «сбоях» такие клетки кишечного эпителия могут ещё более «упрощаться» при этом возникает, т.н. дисплазия-это промежуточный вариант между кишечным эпителием и раковой клеткой. Именно по этой причине пищевод Барретта является предраковым заболеванием.
Конечно, в выше упомянутых процессах определённую роль играет и наследственность, и угнетение апоптоза (естественный противоопухолевый механизм нашего организма) и т.д., но это уже детали сложного механизма. Таким образом, пищеводом Барретта называется наличие очагов кишечной! метаплазии в пищеводе.
Очаги метаплазии выявляются при ЭФГДС, а вот её характер (желудочная или кишечная), а также наличие или отсутствие дисплазии можно уточнить только при изучении гистологического материала, взятого по всем правилам при этом исследовании.
Общепринятой классификацией пищевода Барретта является пражская классификация 2004 года:
При лечении пищевода Барретта необходимо прежде всего устранить рефлюкс желудочного содержимого в пищевод, причиной которого нередко является несостоятельность антирефлюксных механизмов, что чаще всего бывает при грыже пищеводного отверстия диафрагмы.
Для этого используется комплексная консервативная терапия, а при наличии грыжи оперативное лечение, которое на данных этапах развития медицины может быть и лапароскопическим (через проколы без больших разрезов).
С этой целью в нашей клинике используется радиочастотная абляция, которая себя хорошо зарекомендовала как среди наших пациентов, так и во всём мире.
При этом «зубцы» желудочной метаплазии с очагами кишечной метаплазии обрабатываются радиоволной, что приводит к их эрадикации, далее эти участки в оптимальных условиях эпителизируются пищеводным эпителием.
Хотелось бы отметить, что помимо эрадикации указанных очагов, т.к. при этом суммарная высота распространения желудочной слизистой в пищеводе уменьшается, происходит уменьшение «закисления» пищеводного содержимого, что в свою очередь у пациентов проявляется в ослаблении изжоги, исчезновении или уменьшении интенсивности болей и иных клинических проявлений ГЭРБ.
Но необходимо помнить, что самое главное в лечении любого заболевания, это профилактика и ранняя диагностика, что достигается регулярными профилактическими осмотрами, здоровье пациентов в их собственных руках.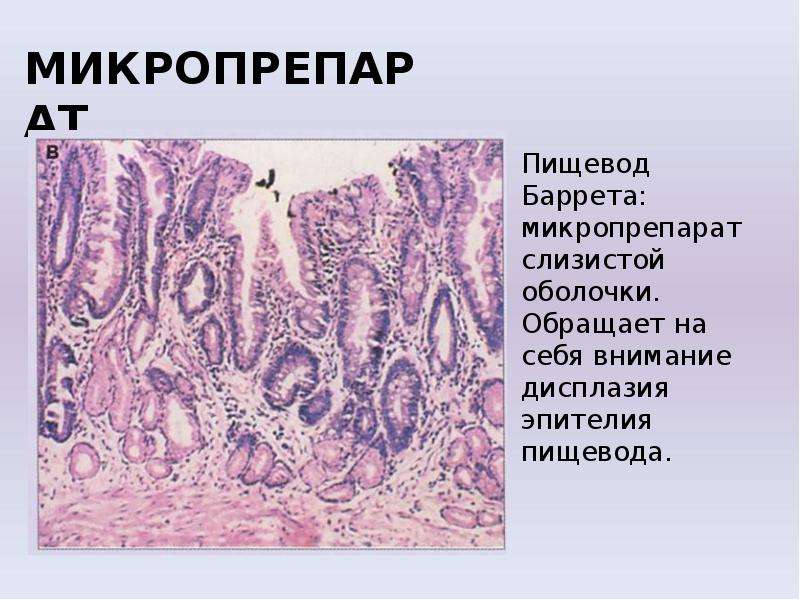
В Клинике «Андромеда» за лечением и диагностикой болезни пищевода Барретта, обращаться к врачу-эндоскописту Леликову Дмитрию Сергеевичу
Какие проблемы пищевода могут способствовать развитию рака?
К сожалению, наши пациенты достаточно долго не обращаются к гастроэнтерологам, испытывают изжогу в течение многого времени без лечения, без обследования. Если изжога проявляется, нужно идти к врачу-гастроэнтерологу, который назначит необходимый объем обследования, в первую очередь, это адекватный объем эндоскопического исследования.
Если говорить о гастроэзофагеальной рефлюксной болезни, то сама она не страшна, страшны ее осложнения. Наиболее ранней является эрозивный эзофагит, который достаточно хорошо подвергается терапии. Однако есть и более грозные осложнения, это язва пищевода, рубцовые стриктуры пищевода и самое важное – пищевод Барретта – предраковое заболевание для аденокарциномы пищевода. Считается, что пищевод Барретта развивается порядка у 4-6% больных с гастроэзофагеальной рефлюксной болезнью. За счёт заброса кислого содержимого желудка вместе с желчью в пищевод стволовые клетки, которые лежат на базальной мембране плоского эпителия, которым выслан нормальный пищевод, начинают развиваться по кишечному типу, развивается новый фенотип, новый вид клеток кишечной метаплазии, и она является абсолютным предраком. 15 лет назад синдрома пищевода Барретта тоже было много, но этот диагноз практически не выставляли. Сейчас его выставляют намного чаще, однако истинный критерий пищевода Барретта эндоскопически наши коллеги зачастую понимают неверно.
Считается, что пищевод Барретта развивается порядка у 4-6% больных с гастроэзофагеальной рефлюксной болезнью. За счёт заброса кислого содержимого желудка вместе с желчью в пищевод стволовые клетки, которые лежат на базальной мембране плоского эпителия, которым выслан нормальный пищевод, начинают развиваться по кишечному типу, развивается новый фенотип, новый вид клеток кишечной метаплазии, и она является абсолютным предраком. 15 лет назад синдрома пищевода Барретта тоже было много, но этот диагноз практически не выставляли. Сейчас его выставляют намного чаще, однако истинный критерий пищевода Барретта эндоскопически наши коллеги зачастую понимают неверно.
Обычно пациенты с гастроэзофагеальной рефлюксной болезнью длительное время жалуются на изжогу. Самым первым клиническим симптомом того, что у пациента появился пищевода Барретта, это самопроизвольное исчезновение изжоги без терапии. Поскольку кишечная метаплазия менее восприимчива к кислоте, обжигающий эффект происходит в меньшей степени.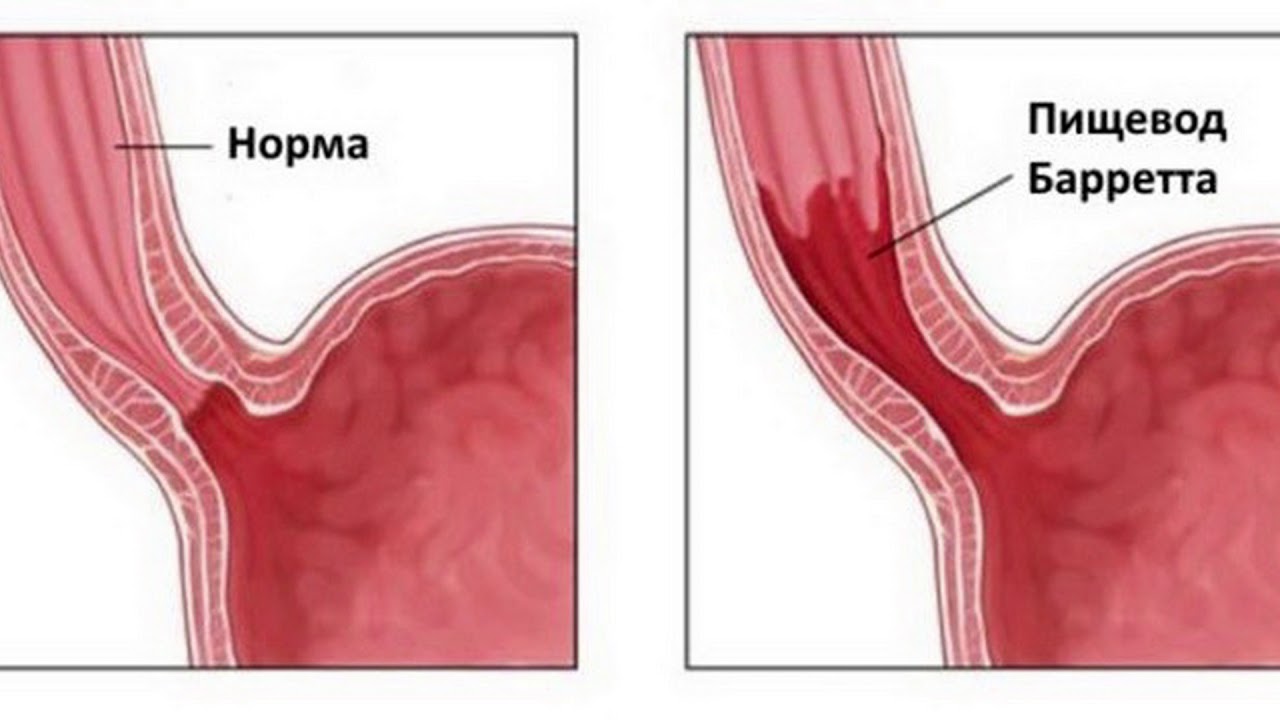
Желудочная метаплазия не является пищеводом Барретта. Такие пациенты требуют терапии в рамках стандартной терапии с гастроэзофагеальной рефлюксной болезнью, но это не предраковое заболевание. Пациентов с желудочной метаплазией можно раз в 3 года смотреть эндоскопически и лечить их как больных с ГЭРБ.
Другая ситуация с кишечной метаплазией. Кишечная метаплазия – тоже пищевод Барретта, всё, что длиной более сантиметра, такие больные требуют адекватной эндоскопической и морфологической диагностики. Потому что диагноз пищевод Барретта – это эндоскопический и морфологический диагноз.
Пищевод Барретта опасен раком аденокарциномы, и наша задача – не допустить развития такой ситуации.
Диагноз пищевода Барретта выставляет врач-гастроэнтеролог. Морфолог и врач-эндоскопист пишут заключение, а на основании заключения эндоскопического исследования, заключения морфологического исследования, врачом-гастроэнтерологом выставляется диагноз пищевода Барретта. Поэтому не совсем правомерно, когда морфолог пишет в заключении «пищевод Барретта».
Морфолог и врач-эндоскопист пишут заключение, а на основании заключения эндоскопического исследования, заключения морфологического исследования, врачом-гастроэнтерологом выставляется диагноз пищевода Барретта. Поэтому не совсем правомерно, когда морфолог пишет в заключении «пищевод Барретта».
Для пищевода доказано одно предраковое заболевание, это пищевод Барретта. Ни папилломы пищевода, ни другие заболевания не являются предраковыми. Единственное, что еще можно считать предраковыми, это дисплазия плоского эпителия, но она встречается крайне редко. В нашем институте онкологии им Герцена мы выявили таким сверхмалые участки, но не более 5-6% в год, что соответствует мировым данным.
По сравнению с ситуацией 15-тилетней давности сейчас ситуации изменилась, и в подавляющем большинстве регионов Российской Федерации существуют референтные центры, в которых возможно выполнение современного эндоскопического исследования, в которых адекватна морфологическая диагностика. Мы уходим от множественной биопсии, она должна быть таргетированная.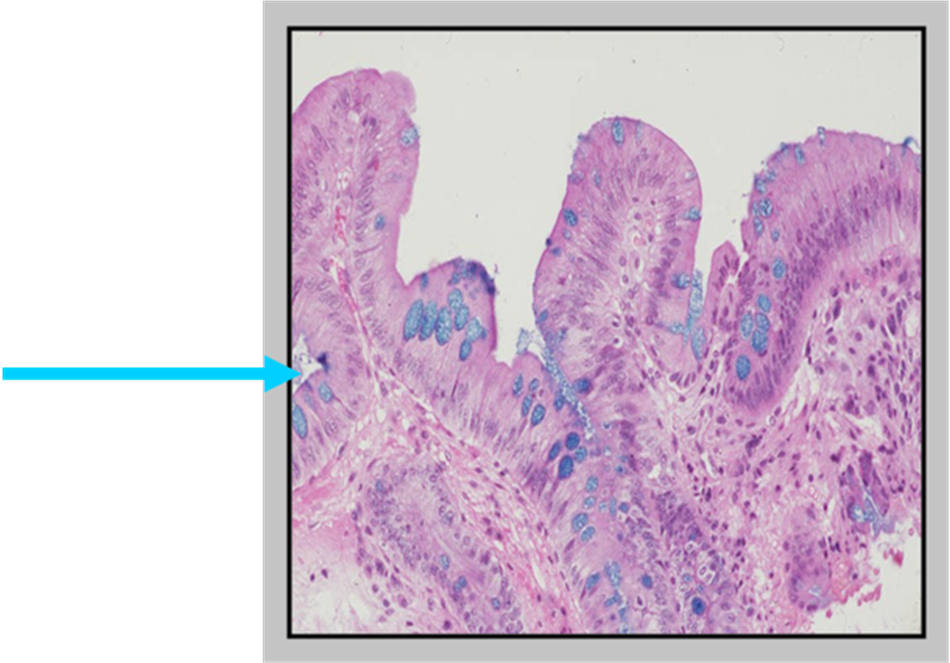
Пищевод Баррета
Пищевод Баррта — является одним из осложнений длительно существующей ГЭРБ. При этом состоянии клетки плоского неороговевающего эпителия пищевода замещаются метаплазированным цилиндрическим эпителием. Пищевод Баррета встречается примерно у 1 из 10 больных с эзофагитом и относится к предраковым состояниям.
Патогенез
Длительно существующий контакт соляной кислоты со слизистой оболочкой пищевода приводит к развитию воспаления, а при некоторых обстоятельствах к изъязвлению слизистой. Репарация сопровождается увеличением количества стволовых клеток. В условиях низкого рН, сопровождающего рефлюкс, эти клетки могут дифференцироваться в цилиндрический эпителий, который, конечно, более устойчив к воздействию кислоты, однако в этих условиях служит проявлением дисплазии. Пищевод Баррета характеризуется наличием ворсинчатой поверхности при эндоскопии и перстневидных клеток кишечного типа при гистологическом исследовании.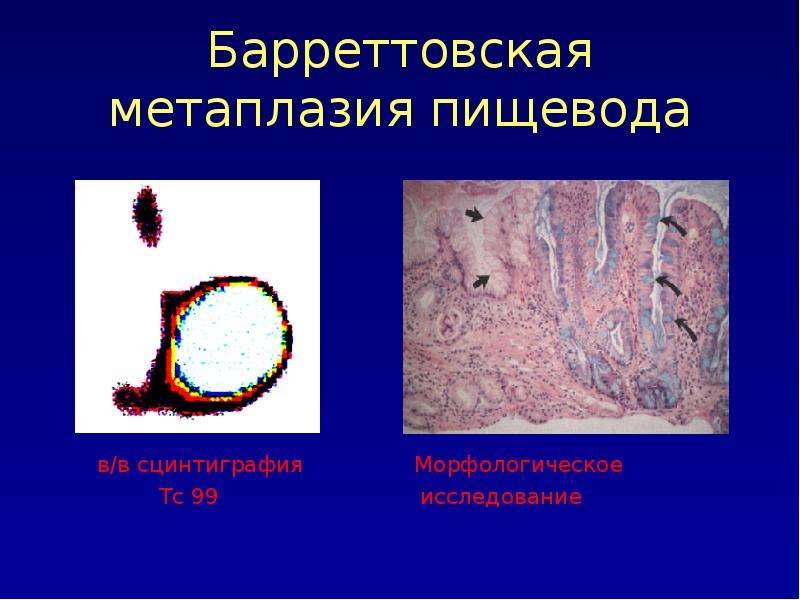 Изменения могут быть представлены также эпителием кардиального типа или фундального типа, содержащим кислотопродуцирующие париетальные клетки (рис. 2).
Изменения могут быть представлены также эпителием кардиального типа или фундального типа, содержащим кислотопродуцирующие париетальные клетки (рис. 2).
Эпидемиология
Пищевод Баррета может развиваться почти в 10% случаев эрозивного эзофагита. Однако довольно большая группа пациентов с пищеводом Баррета не имеет в анамнезе симптомов ГЭРБ.
Среди больных, которым проводится эндоскопическое исследование верхних отделов желудочно-кишечного тракта, пищевод Баррета с протяженностью поражения более 3 см встречается в 0,7% случаев. Наиболее часто пищевод Баррета выявляется у больных старше 70 лет, преимущественно у мужчин европеоидной расы.
Пищевод Баррета с протяженностью поражения менее 3 см может быть не распознан при эндоскопическом исследовании. Однако пищевод Баррета короткой протяженности выявляется в 7—18% случаев в целом и у 20% больных рефлюкс-эзофагитом. Вероятно, что данный вариант заболевания также является предраковым состоянием с угрозой развития аденокарциномы дистальной части пищевода или кардиальной части желудка.
Определение
Пищевод Баррета — патологическое состояние, при котором многослойный плоский эпителий пищевода замещается специализированным тонкокишечным цилиндрическим эпителием. Специализированный цилиндрический эпителий — это неполная тонкокишечная метаплазия с наличием бокаловидных клеток. Если метаплазия проявляется появлением цилиндрического эпителия кардиального или фундального типа слизистой желудка, то риск развития аденокарциномы пищевода не увеличивается. Однако при появлении специализированного тонкокишечного цилиндрического эпителия риск озлокачествления становится явным.
Клинические проявления
Характерные или патогномоничные симптомы пищевода Баррета отсутствуют. Поэтому пищевод Баррета необходимо исключать у любого пациента с длительным (более 5 лет) анамнезом ГЭРБ. Пищевод Баррета может развиваться также и у пациентов без предшествующего анамнеза ГЭРБ. Пищевод Баррета короткой протяженности может быть выявлен при гистологическом исследовании слизистой оболочки дистального отдела пищевода как у больных с анамнезом ГЭРБ, так и без такового. У большинства, если не у всех, больных с аденокарциномой пищевода есть пищевод Баррета, который может быть не обнаружен до установления диагноза аденокарциномы.
У большинства, если не у всех, больных с аденокарциномой пищевода есть пищевод Баррета, который может быть не обнаружен до установления диагноза аденокарциномы.
Рентгенологическое исследование
Диагноз пищевода Баррета не может быть установлен при рентгенологическом исследовании. Этот метод используется лишь для выявления грыжи пищеводного отверстия диафрагмы у больных с пищеводом Баррета.
Эндоскопическое исследование
Эндоскопический диагноз пищевода Баррета ставится при анализе изменений трех участков: места перехода плоского эпителия в цилиндрический, дистальной части пищевода, области вдавления диафрагмы. Проксимальная граница зоны складок слизистой оболочки желудка, вероятно, наиболее достоверный ориентир пищеводно-желудочного соединения. Пищевод Баррета нечасто выявляется в отсутствии грыжи пищеводного отверстия диафрагмы. Обычно окраска слизистой оболочки пищевода Баррета ярко-розовая, более насыщенная по цвету, чем обычная. Пищевод Баррета может представлять из себя языки слизистой, протягивающиеся вверх по грудному отделу пищевода, а может быть вообще не виден эндоскопически.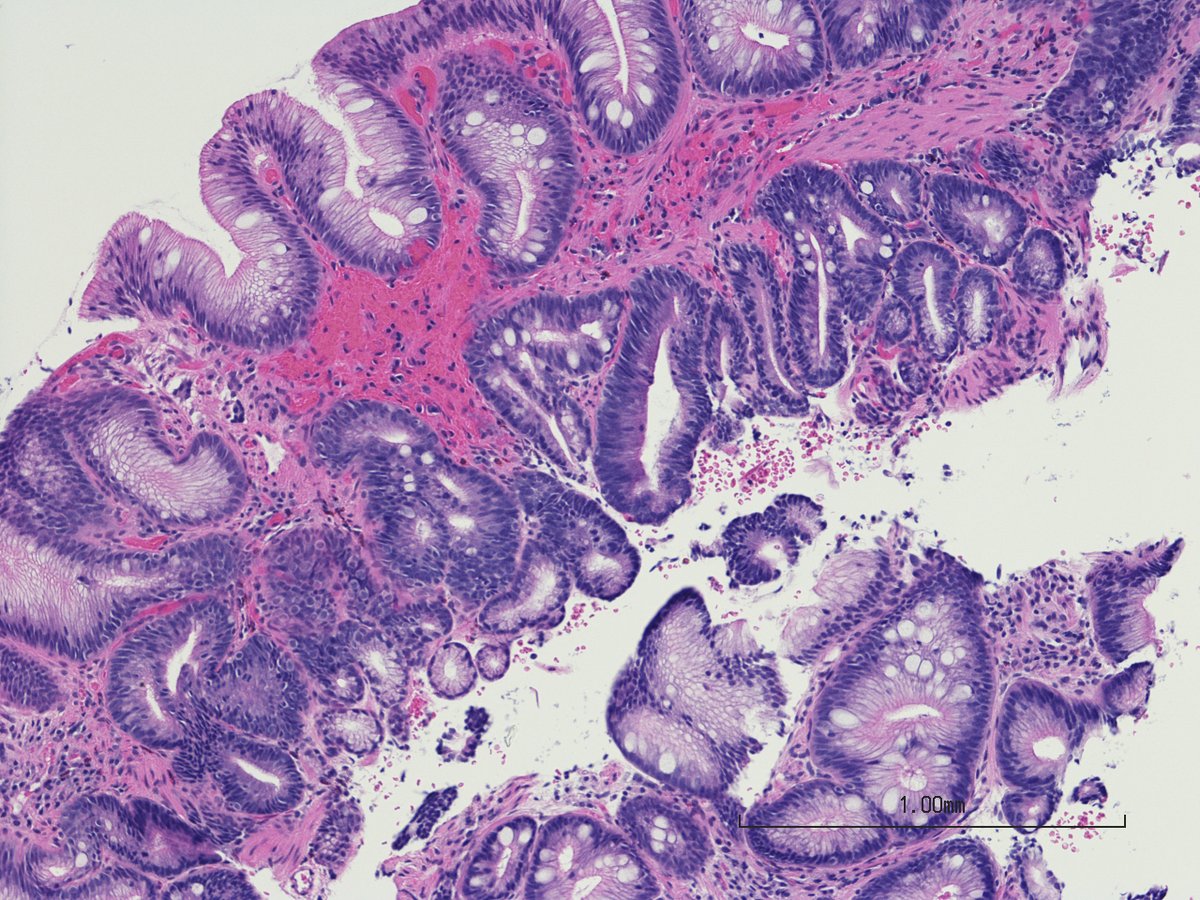
Гистологическое исследование
Диагноз пищевода Баррета правомочен при выявлении специализированного цилиндрического эпителия в биопсийном материале, взятом из любого участка слизистой грудного отдела пищевода. Так называемый пищевод Баррета короткой протяженности (менее 3 см) обозначает, что у некоторых пациентов как с наличием ГЭРБ, так и без таковой, находится специализированный цилиндрический эпителий только вокруг зоны пищеводно-желудочного соединения. Пищевод Баррета короткой протяженности может быть обнаружен только при проведении биопсии всем пациентам, подвергшимся эндоскопическому исследованию.
Современная эндоскопическая и морфологическая характеристика пищевода Барретта и рака пищевода
Наиболее частой опухолью пищевода до недавнего времени являлся плоскоклеточный рак (до 90-95% злокачественных новообразований). В России, США, странах Западной Европы, а также в ряде стран Азии в течение последние несколько десятилетий отмечается значительный подъем заболеваемости аденокарциномой пищевода.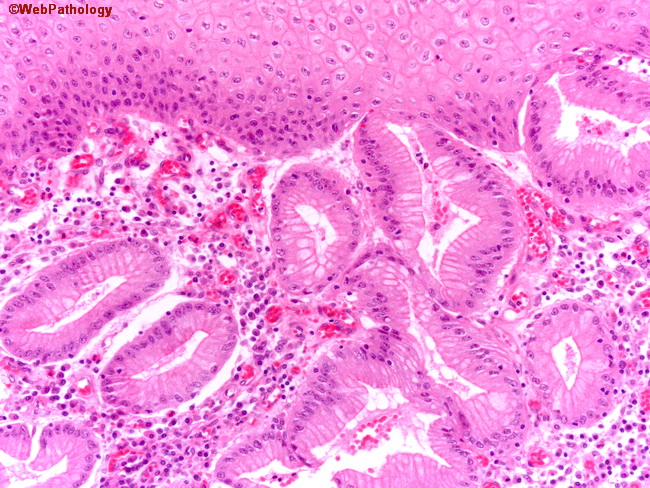
Неблагоприятный прогноз при этой патологии требует поиска точных методов ранней диагностики предраковых и фоновых состояний пищевода, позволяющих определять врачебную тактику и имеющих прогностическое значение. Как показано в большом количестве работ, аденокарцинома пищевода развивается из очагов железистого эпителия, замещающих нормальный многослойный плоский эпителий пищевода при тяжелом гастроэзофагеальном рефлюксе — состоянии впервые описанным английским хирургом Н.Р. Барреттом в 1950 г. и получившем его имя («пищевод Барретта»). В связи со значительными колебаниями протяженности очагов железистого эпителия, сложностью эндоскопического определения границы между пищеводом и желудком, а также наличием различных гистологических вариантов железистого эпителия, определение понятия «пищевод Барретта» (ПБ) до сих вызывает дискуссии. В настоящее время для обозначения всех видов железистого эпителия, развивающихся в слизистой оболочки пищевода, многими американскими авторами предлагается использовать понятие «пищевод, выстланный цилиндрическим эпителием».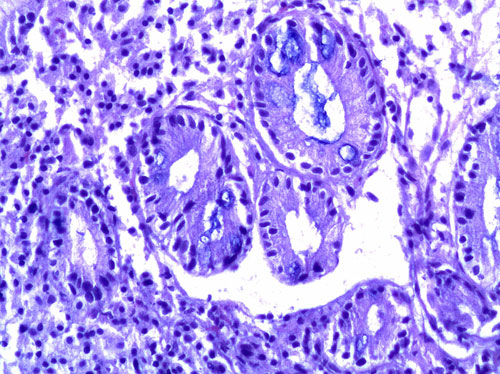 В своем исследовании мы использовали термин «пищевод Барретта», подразумевая пищевод, выстланный цилиндрическим эпителием. Несмотря на значительное количество публикаций за последние 20 лет, вопрос о происхождении цилиндрического эпителия в ПБ до сих пор не решен. До сих пор не разработаны критерии иммуногистохмимческой (ИГХ) и гистохимической диагностики ПБ для применения в повседневной практике, несмотря на точность и объективность метода. Остаются актуальными исследования молекулярных характеристик цилиндрического эпителия ПБ, достоверно указывающих на риск развития аденокарциномы, а также поиск рационального протокола терапии в зависимости от типа метаплазии. Цель собственного исследования — изучение морфогенеза метаплазий, дисплазий и аденокарцином в пищеводе Барретта.
В своем исследовании мы использовали термин «пищевод Барретта», подразумевая пищевод, выстланный цилиндрическим эпителием. Несмотря на значительное количество публикаций за последние 20 лет, вопрос о происхождении цилиндрического эпителия в ПБ до сих пор не решен. До сих пор не разработаны критерии иммуногистохмимческой (ИГХ) и гистохимической диагностики ПБ для применения в повседневной практике, несмотря на точность и объективность метода. Остаются актуальными исследования молекулярных характеристик цилиндрического эпителия ПБ, достоверно указывающих на риск развития аденокарциномы, а также поиск рационального протокола терапии в зависимости от типа метаплазии. Цель собственного исследования — изучение морфогенеза метаплазий, дисплазий и аденокарцином в пищеводе Барретта.
Материал и методы.
В соответствии с поставленными целью и задачами исследования за период с 2001 по 2007 гг. было проведено проспективное гистологическое, гистохимическое и иммуногистохимическое изучение материала от 87 больных с эндоскопически выявленной патологией пищевода (в Клиническом онкологическом диспансере Минздрава РТ, г.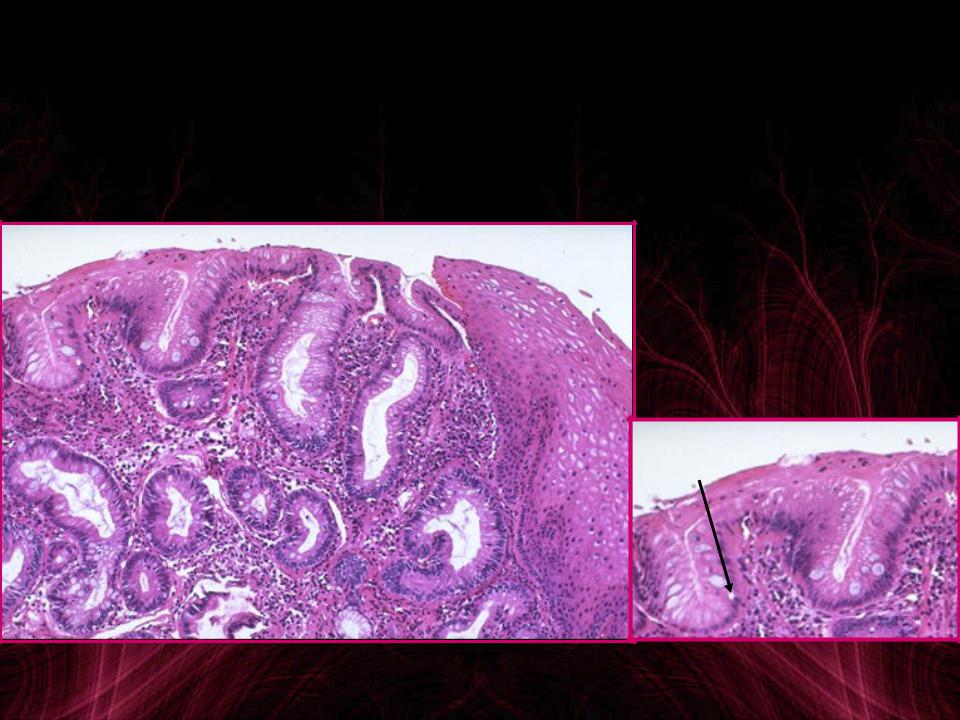 Казань), в том числе 67 случаев с подозрением на ПБ и 20 злокачественных новообразований нижней трети пищевода, а также контрольной группы, включавшей аутопсийный материал нормального пищевода взрослых лиц (4 случая) и плодов (6 случаев). Эндоскопическое исследование пораженного пищевода включало в себя определение границы между пищеводом и желудком (Z-линии). При подозрении на ПБ или злокачественное новообразование пищевода производилась биопсия только из подозрительных очагов в нижней трети пищевода, расположенных проксимальнее Z-линии и отделенных от желудка полосой нормального плоского эпителия шириной не менее 1,5 см. Для облегчения визуализации очагов кишечной метаплазии применялась хромоэндоскопия с использованием метиленовой сини.
Казань), в том числе 67 случаев с подозрением на ПБ и 20 злокачественных новообразований нижней трети пищевода, а также контрольной группы, включавшей аутопсийный материал нормального пищевода взрослых лиц (4 случая) и плодов (6 случаев). Эндоскопическое исследование пораженного пищевода включало в себя определение границы между пищеводом и желудком (Z-линии). При подозрении на ПБ или злокачественное новообразование пищевода производилась биопсия только из подозрительных очагов в нижней трети пищевода, расположенных проксимальнее Z-линии и отделенных от желудка полосой нормального плоского эпителия шириной не менее 1,5 см. Для облегчения визуализации очагов кишечной метаплазии применялась хромоэндоскопия с использованием метиленовой сини.
Материалы исследования
Материалом для исследования служили парафиновые блоки биопсийного, аутопсийного и операционного материала. Проводилось ИГХ исследование с использованием моно- и поликлональных первичных антител к белкам промежуточных филаментов эпителиальных клеток, клеток мезенхимального происхождения, маркерам дисплазии и пролиферации, а также ряду других тканеспецифических белков.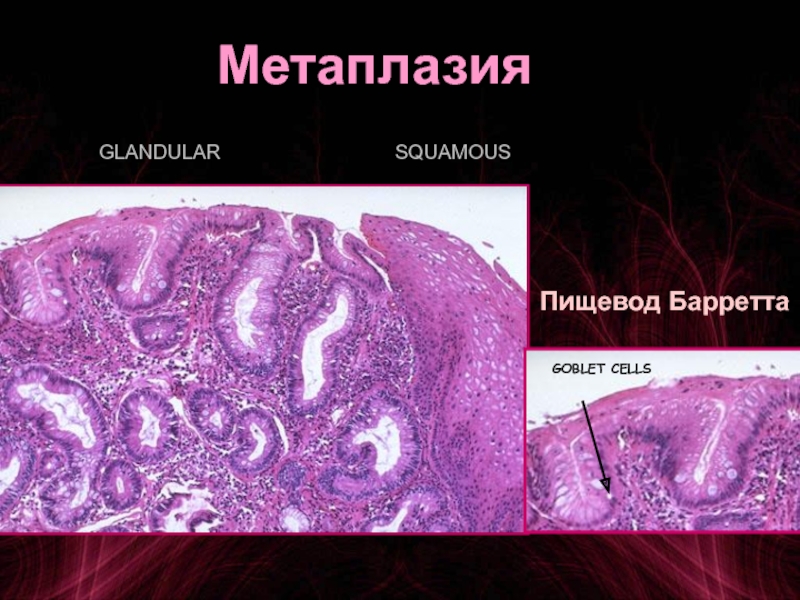
Результаты исследований.
У плодов на сроке 14-16 недель гестации эпителиальная выстилка пищевода и была представлена многослойным кубическим эпителием со светлыми вакуолями (соотвствующим переходному эпителию взрослых лиц). На сроке 18-20 недель гестации в пищеводе плодов одновременно обнаруживались участки и плоского, и многорядного кубического эпителия. На сроке 20-25 недель гестации выстилка пищевода была представлена преимущественно зрелым многослойным плоским неороговевающим эпителием. Гистохимически, при помощи ШИК-реакции, была выявлена позитивная реакция на гликоген в эпителии пищевода плодов всех исследованных сроков гестации. С увеличением срока гестации интенсивность ШИК-реакции увеличивалась от слабой (12-16 нед.) до яркой (18-20 нед. и более). При помощи иммуногистохимического метода на сроке 12-14 недель гестации в эпителии пищевода плода выявлялась яркая позитивная реакция на ЦКР №7 и ЦКР-PAN, негативная реакция на ЦКР №20 и виллин.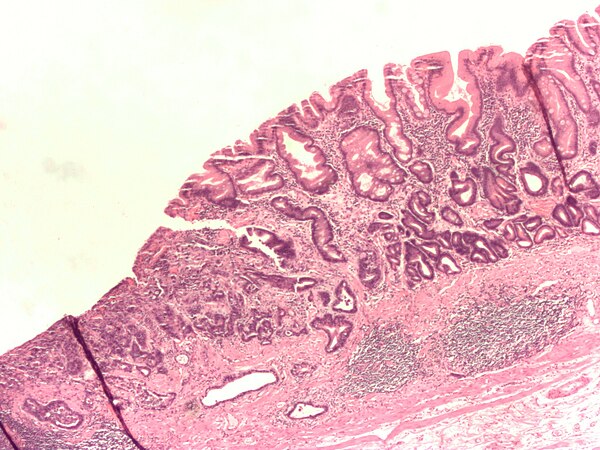 Реакция на ЦКР высокого молекулярного веса (характерная для нормального эпителия пищевода взрослых лиц) на этом сроке была негативной. На 18-20 неделе гестации в эпителии пищевода плода выявлялась яркая позитивная реакция на ЦКР-PAN, яркая позитивная реакция на ЦКР высокого молекулярного веса и негативная реакция на ЦКР №7, ЦКР №20 и виллин. На сроках 20-25 недель гестации реакция на ЦКР высокого молекулярного веса в эпителии пищевода была ярко позитивной; на ЦКР №20 и виллин – негативной. Среди 64 случаев гистологически выявленной железистой метаплазии эпителия пищевода желудочная метаплазия была выявлена у 28 больных, возраст которых составлял от 38 до 74 лет (в среднем 52,8 лет). В ПБ при метаплазии желудочного типа гистохимически определялись нейтральные муцины (яркая или умеренная ШИК реакция), гистохимические реакции на кислые и сульфатированные муцины были негативными.
Реакция на ЦКР высокого молекулярного веса (характерная для нормального эпителия пищевода взрослых лиц) на этом сроке была негативной. На 18-20 неделе гестации в эпителии пищевода плода выявлялась яркая позитивная реакция на ЦКР-PAN, яркая позитивная реакция на ЦКР высокого молекулярного веса и негативная реакция на ЦКР №7, ЦКР №20 и виллин. На сроках 20-25 недель гестации реакция на ЦКР высокого молекулярного веса в эпителии пищевода была ярко позитивной; на ЦКР №20 и виллин – негативной. Среди 64 случаев гистологически выявленной железистой метаплазии эпителия пищевода желудочная метаплазия была выявлена у 28 больных, возраст которых составлял от 38 до 74 лет (в среднем 52,8 лет). В ПБ при метаплазии желудочного типа гистохимически определялись нейтральные муцины (яркая или умеренная ШИК реакция), гистохимические реакции на кислые и сульфатированные муцины были негативными.
Иммуногистохимически желудочная метаплазия характеризовалась яркой позитивной реакцией с антителами к ЦКР №7, слабой или негативной реакцией с антителами к виллину, слабой апикальной реакцией на РЭА и негативной реакцией на ЦКР №20. В 7 из 28 случаев (25%) желудочной метаплазии была обнаружена позитивная реакция с антителами к цитокератинам высокой молекулярной массы. При анализе иммуногистохимической реакции с маркером Ki-67 в поверхностных отделах желез пролиферация была низкой (4,15±0,21%), в глубоких отделах – высокой (55,6±6,2%) (рис.1). Кишечная метаплазия эпителия пищевода была выявлена у 23 пациентов в возрасте от 31 до 61 года (в среднем 52,6 года). Метаплазия эпителия пищевода кишечного типа гистологически характеризовалась наличием в железах бокаловидных клеток и цилиндрических клеток. С помощью гистохимического и иммуногистохимического методов была выделена «полная» (7 случаев) и «неполная» (16 случаев) кишечная метаплазия. При «полной» кишечной метаплазии отмечалось окрашивание секрета бокаловидных клеток на нейтральные (ШИК-реакция по Мак-Манусу) и кислые (альциановым синим по Стидмену, рН 2,5) муцины, негативная гистохимическая реакция на сульфомуцины (окраска толуидиновым синим, рН 1,0). Цилиндрические клетки, лежащие между бокаловидными клетками не окрашивались гистохимическими методами на муцины.
В 7 из 28 случаев (25%) желудочной метаплазии была обнаружена позитивная реакция с антителами к цитокератинам высокой молекулярной массы. При анализе иммуногистохимической реакции с маркером Ki-67 в поверхностных отделах желез пролиферация была низкой (4,15±0,21%), в глубоких отделах – высокой (55,6±6,2%) (рис.1). Кишечная метаплазия эпителия пищевода была выявлена у 23 пациентов в возрасте от 31 до 61 года (в среднем 52,6 года). Метаплазия эпителия пищевода кишечного типа гистологически характеризовалась наличием в железах бокаловидных клеток и цилиндрических клеток. С помощью гистохимического и иммуногистохимического методов была выделена «полная» (7 случаев) и «неполная» (16 случаев) кишечная метаплазия. При «полной» кишечной метаплазии отмечалось окрашивание секрета бокаловидных клеток на нейтральные (ШИК-реакция по Мак-Манусу) и кислые (альциановым синим по Стидмену, рН 2,5) муцины, негативная гистохимическая реакция на сульфомуцины (окраска толуидиновым синим, рН 1,0). Цилиндрические клетки, лежащие между бокаловидными клетками не окрашивались гистохимическими методами на муцины.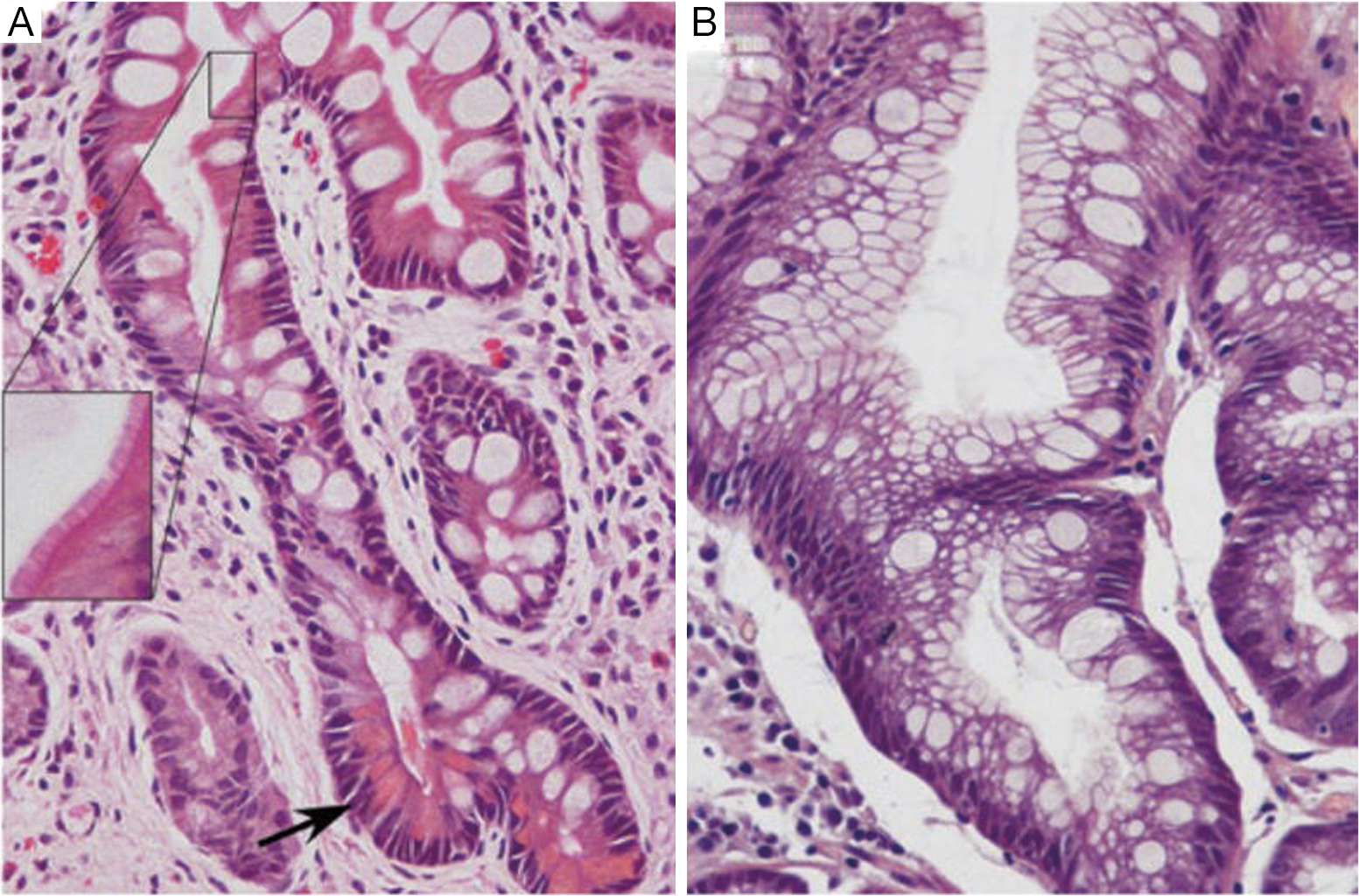 При «неполной» кишечной метаплазии секрет бокаловидных клеток включал не только нейтральные и кислые, но и сульфатированные муцины. При этом виде метаплазии в цилиндрических клетках, лежащих между бокаловидными клетками гистохимически выявились кислые муцины (окрашивание альциановым синим по Стидмену, рН 2,5). Иммуногистохимически «неполная» кишечная метаплазия характеризовалась яркой умеренной очаговой реакцией на ЦКР№7, очаговой неравномерной реакцией на ЦКР №20, яркой позитивной реакцией на виллин (апикально) и РЭА (цитоплазматически и апикально). Фенотип «полной» кишечной метаплазии по данным иммуногистохимического анализа включал в себя экспрессию ЦКР №7 в поверхностном и глубоком слоях железистого эпителия, яркую положительную реакцию на ЦКР №20 в поверхностных отделах желез и позитивную апикальную реакцию на виллин, апикальную реакцию на РЭА (рис.2). В 6 случаях из 23 (26,1%) кишечной метаплазии была обнаружена позитивная реакция (от умеренной до яркой) с антителами к цитокератинам высокой молекулярной массы.
При «неполной» кишечной метаплазии секрет бокаловидных клеток включал не только нейтральные и кислые, но и сульфатированные муцины. При этом виде метаплазии в цилиндрических клетках, лежащих между бокаловидными клетками гистохимически выявились кислые муцины (окрашивание альциановым синим по Стидмену, рН 2,5). Иммуногистохимически «неполная» кишечная метаплазия характеризовалась яркой умеренной очаговой реакцией на ЦКР№7, очаговой неравномерной реакцией на ЦКР №20, яркой позитивной реакцией на виллин (апикально) и РЭА (цитоплазматически и апикально). Фенотип «полной» кишечной метаплазии по данным иммуногистохимического анализа включал в себя экспрессию ЦКР №7 в поверхностном и глубоком слоях железистого эпителия, яркую положительную реакцию на ЦКР №20 в поверхностных отделах желез и позитивную апикальную реакцию на виллин, апикальную реакцию на РЭА (рис.2). В 6 случаях из 23 (26,1%) кишечной метаплазии была обнаружена позитивная реакция (от умеренной до яркой) с антителами к цитокератинам высокой молекулярной массы. При кишечной метаплазии по результатам иммуногистохимического анализа маркера Ki -67 уровень пролиферации в поверхностных отделах желез был достоверно выше (р<0,05), чем при метаплазии желудочного типа и составлял в среднем 8,45±0,33%. Средний уровень пролиферации в глубоких отделах желез был высоким (62±5,8%), разница с метаплазией желудочного типа статистически недостоверна (р>0,05). Желудочная метаплазия с очагами кишечной метаплазии была выявлена в 13 случаях, у пациентов в возрасте от 48 до 74 лет (средний возраст 59,6 лет). Гистологически эта патология пищевода характеризовалась наличием единичных желез, содержащих бокаловидные клетки среди преобладающих по количеству желез желудочного типа (без бокаловидных клеток). Гистохимически в метапластических железах желудочного типа выявлялись нейтральные муцины при отсутствии в них кислых и сульфатированных муцинов. Участки кишечного строения по гистохимическим свойствам были отнесены к «неполной» кишечной метаплазии. Иммуногистохимический фенотип очагов кишечного строения (на фоне желудочной метаплазии) соответствовал полной или неполной кишечной метаплазии и отличался от окружающих желез желудочного типа.
При кишечной метаплазии по результатам иммуногистохимического анализа маркера Ki -67 уровень пролиферации в поверхностных отделах желез был достоверно выше (р<0,05), чем при метаплазии желудочного типа и составлял в среднем 8,45±0,33%. Средний уровень пролиферации в глубоких отделах желез был высоким (62±5,8%), разница с метаплазией желудочного типа статистически недостоверна (р>0,05). Желудочная метаплазия с очагами кишечной метаплазии была выявлена в 13 случаях, у пациентов в возрасте от 48 до 74 лет (средний возраст 59,6 лет). Гистологически эта патология пищевода характеризовалась наличием единичных желез, содержащих бокаловидные клетки среди преобладающих по количеству желез желудочного типа (без бокаловидных клеток). Гистохимически в метапластических железах желудочного типа выявлялись нейтральные муцины при отсутствии в них кислых и сульфатированных муцинов. Участки кишечного строения по гистохимическим свойствам были отнесены к «неполной» кишечной метаплазии. Иммуногистохимический фенотип очагов кишечного строения (на фоне желудочной метаплазии) соответствовал полной или неполной кишечной метаплазии и отличался от окружающих желез желудочного типа. Железы желудочного типа характеризовались яркой реакцией на ЦКР №7, слабой апикальной реакцией на виллин в части желез и негативной реакцией на ЦКР №20 и РЭА. В очагах кишечного типа отмечалась умеренная очаговая реакция на ЦКР №20 (неполная кишечная метаплазия), яркая апикальная реакция на виллин и яркая цитоплазматическая реакция на РЭА. В 4 случаях (из 13) кишечной метаплазии на фоне желудочной метаплазии была обнаружена слабая позитивная реакция на цитокератины высокой молекулярной массы. Уровень пролиферации по количеству Ki -67 позитивных ядер в метапластических железах кишечного типа составил в среднем 5,8±1,3% в поверхностных отделах желез и 55,6±6,2% в глубоких отделах желез; различия пролиферативной активности с «чисто» кишечной и «чисто» желудочной метаплазиями статистически недостоверны (р1,2>0,05). Признаки дисплазии были выявлены только в 7 из 23 (13,0%) случаях кишечной метаплазии и 2 из 13 (15,3%) случаях кишечной метаплазии на фоне желудочной метаплазии. При иммуногистохимическом анализе с использованием антител к маркёру р53 позитивная реакция была выявлена в 2-х случаях кишечной метаплазии (8,7% всех случаев и 66,7% дисплазий при кишечной метаплазии), а также 1 случае кишечной метаплазии на фоне желудочной метаплазии (7,7% всех случаев и 50% дисплазий при данном виде метаплазии).
Железы желудочного типа характеризовались яркой реакцией на ЦКР №7, слабой апикальной реакцией на виллин в части желез и негативной реакцией на ЦКР №20 и РЭА. В очагах кишечного типа отмечалась умеренная очаговая реакция на ЦКР №20 (неполная кишечная метаплазия), яркая апикальная реакция на виллин и яркая цитоплазматическая реакция на РЭА. В 4 случаях (из 13) кишечной метаплазии на фоне желудочной метаплазии была обнаружена слабая позитивная реакция на цитокератины высокой молекулярной массы. Уровень пролиферации по количеству Ki -67 позитивных ядер в метапластических железах кишечного типа составил в среднем 5,8±1,3% в поверхностных отделах желез и 55,6±6,2% в глубоких отделах желез; различия пролиферативной активности с «чисто» кишечной и «чисто» желудочной метаплазиями статистически недостоверны (р1,2>0,05). Признаки дисплазии были выявлены только в 7 из 23 (13,0%) случаях кишечной метаплазии и 2 из 13 (15,3%) случаях кишечной метаплазии на фоне желудочной метаплазии. При иммуногистохимическом анализе с использованием антител к маркёру р53 позитивная реакция была выявлена в 2-х случаях кишечной метаплазии (8,7% всех случаев и 66,7% дисплазий при кишечной метаплазии), а также 1 случае кишечной метаплазии на фоне желудочной метаплазии (7,7% всех случаев и 50% дисплазий при данном виде метаплазии). Экспрессии циклина D1 и HER2/neu в случаях подозрения на дисплазию не обнаружено. В случае дисплазии в поверхностных отделах желез уровень пролиферации был достоверно выше (19,5±1,2%, р<0,05) (рис.3), чем в метаплазии кишечного и желудочного типов без признаков дисплазии. Уровень пролиферации в глубоких отделах желез составил 66,3±4,8%. Среди исследованных 20 случаев рака пищевода гистологически были выявлены аденокарцинома, низкодифференцированный рак и низкодифференцированный плоскоклеточный рак. Среди 11 выявленных случаев аденокарциномы пищевода гистологически определялись папиллярный, тубулярный и диффузный типы строения. Инвазия опухоли в прилежащие ткани выявлена во всех исследованных случаях. Гистохимически в атипических железах аденокарцином в 8 наблюдениях выявлены нейтральные муцины (интенсивность ШИК реакции была от слабой до выраженной) и в 6 случаях — кислые муцины. Гистохимическое определение сульфатированных муцинов было безрезультатным. По результатам проведенного иммуногистохимического анализа 11 случаев аденокарцином было выявлено 3 варианта фенотипа: 3 случая (27,3%) «желудочного типа» (экспрессия ЦКР №7 и виллина, нейтральных муцинов), 3 случая (27,3%) «смешанного кишечно-желудочного типа» (позитивная реакция на ЦКР №7 и №20, виллин, нейтральные и кислые муцины) и 5 случаев (45,4%) «кишечного типа» (экспрессия ЦКР №20 и виллина, а также нейтральных и кислых муцинов).
Экспрессии циклина D1 и HER2/neu в случаях подозрения на дисплазию не обнаружено. В случае дисплазии в поверхностных отделах желез уровень пролиферации был достоверно выше (19,5±1,2%, р<0,05) (рис.3), чем в метаплазии кишечного и желудочного типов без признаков дисплазии. Уровень пролиферации в глубоких отделах желез составил 66,3±4,8%. Среди исследованных 20 случаев рака пищевода гистологически были выявлены аденокарцинома, низкодифференцированный рак и низкодифференцированный плоскоклеточный рак. Среди 11 выявленных случаев аденокарциномы пищевода гистологически определялись папиллярный, тубулярный и диффузный типы строения. Инвазия опухоли в прилежащие ткани выявлена во всех исследованных случаях. Гистохимически в атипических железах аденокарцином в 8 наблюдениях выявлены нейтральные муцины (интенсивность ШИК реакции была от слабой до выраженной) и в 6 случаях — кислые муцины. Гистохимическое определение сульфатированных муцинов было безрезультатным. По результатам проведенного иммуногистохимического анализа 11 случаев аденокарцином было выявлено 3 варианта фенотипа: 3 случая (27,3%) «желудочного типа» (экспрессия ЦКР №7 и виллина, нейтральных муцинов), 3 случая (27,3%) «смешанного кишечно-желудочного типа» (позитивная реакция на ЦКР №7 и №20, виллин, нейтральные и кислые муцины) и 5 случаев (45,4%) «кишечного типа» (экспрессия ЦКР №20 и виллина, а также нейтральных и кислых муцинов).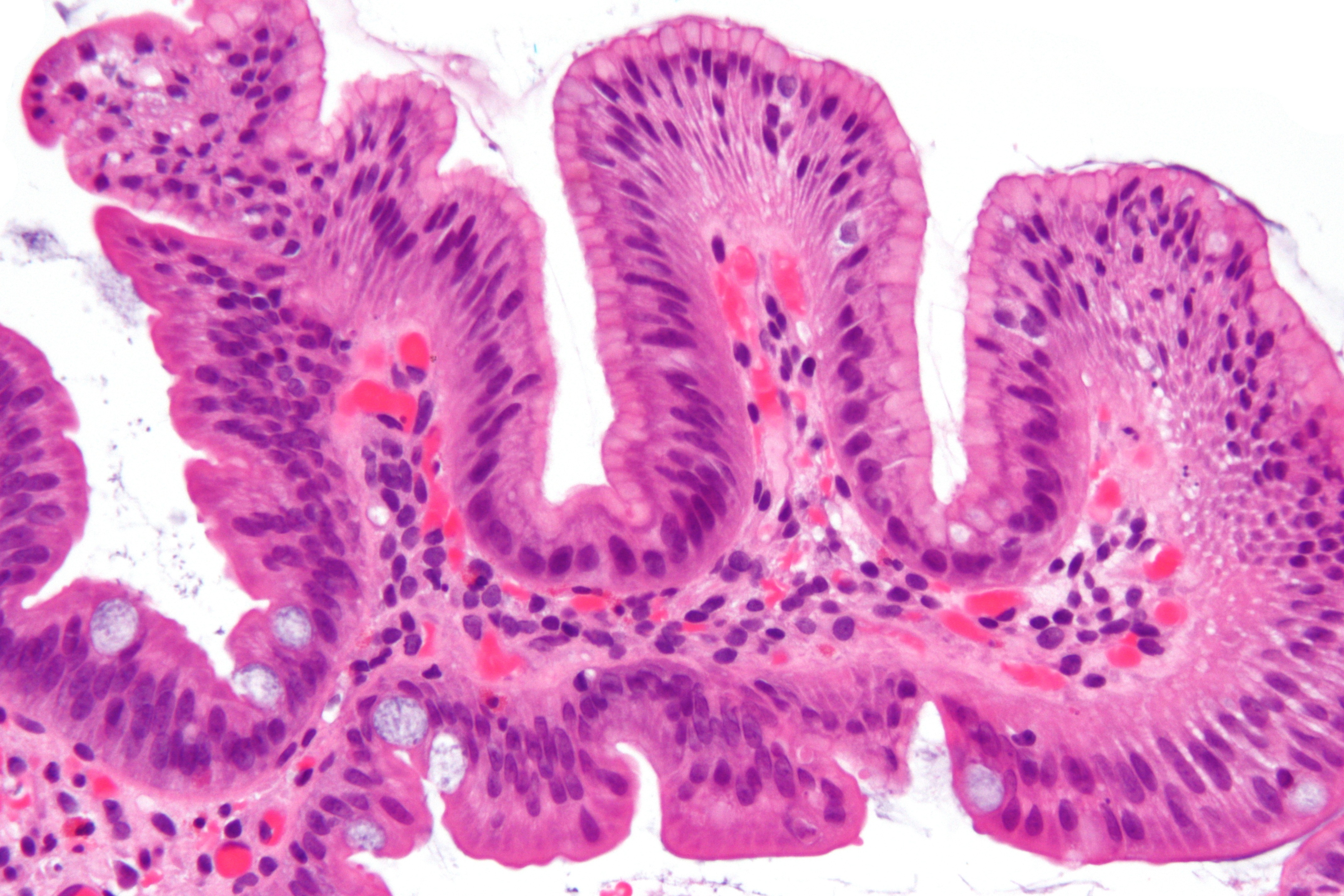 В 7 из 11 (63,4%) случаев аденокарцином при помощи ИГХ анализа нами была выявлена позитивная реакция в опухолевых клетках на цитокератины высокой молекулярной массы (№№ 5,14), экспрессируемые в норме плоскими и протоковыми эпителиями. В 5 случаях из 11 (45,4%) аденокарцином пищевода выявлена позитивная реакция на онкобелок р53. Уровень пролиферации при аденокарциномах пищевода был высоким и составлял 44±3,3%, разница между уровнем пролиферации в аденокарциномах и всех вариантах ПБ статистически достоверна (p<0,05). Инвазия опухоли была подтверждена при помощи иммуногистохимического окрашивания базальной мембраны (реакция на коллаген IV). Недифференцированный рак был выявлен у 5 пациентов и гистохимически характеризовался отсутствием реакций с нейтральными, кислыми и сульфатированными муцинами. Иммуногистохимически выявлялась экспрессия ЦКР-PAN, ЭМА и РЭА. Отсутствовала ИГХ реакция на ЦКР №7, ЦКР №20 и виллин. Уровень пролиферации при низкодифференцированном раке был высоким и составил 56±4,1%.
В 7 из 11 (63,4%) случаев аденокарцином при помощи ИГХ анализа нами была выявлена позитивная реакция в опухолевых клетках на цитокератины высокой молекулярной массы (№№ 5,14), экспрессируемые в норме плоскими и протоковыми эпителиями. В 5 случаях из 11 (45,4%) аденокарцином пищевода выявлена позитивная реакция на онкобелок р53. Уровень пролиферации при аденокарциномах пищевода был высоким и составлял 44±3,3%, разница между уровнем пролиферации в аденокарциномах и всех вариантах ПБ статистически достоверна (p<0,05). Инвазия опухоли была подтверждена при помощи иммуногистохимического окрашивания базальной мембраны (реакция на коллаген IV). Недифференцированный рак был выявлен у 5 пациентов и гистохимически характеризовался отсутствием реакций с нейтральными, кислыми и сульфатированными муцинами. Иммуногистохимически выявлялась экспрессия ЦКР-PAN, ЭМА и РЭА. Отсутствовала ИГХ реакция на ЦКР №7, ЦКР №20 и виллин. Уровень пролиферации при низкодифференцированном раке был высоким и составил 56±4,1%.
Низкодифференцированный плоскоклеточный рак был выявлен в 4 случаях и при гистохимическом исследовании вещества мукополисахаридной природы не выявлялись. Иммуногистохимически выявлялась экспрессия ЦКР-PAN , слабая или умеренная реакция на ЭМА и РЭА, а также умеренная или яркая реакция на цитокератины высокого молекулярного веса. ИГХ реакция с антителами к маркерам железистой дифференцировки (ЦКР №7, ЦКР №20, виллину) была негативной. Уровень пролиферации, определенный при помощи антител к Ki-67, был высоким и составил 48±2,3%.
Выводы
- Эпителий пищевода плода человека на сроках 12-16 недель гестации имеет сходный иммуногистохимический фенотип с пищеводом Барретта, что позволяет предположить «возврат к фетальному состоянию эпителия» при этой патологии.
- Для дифференциальной диагностики кишечной и желудочной метаплазии в ПБ рекомендуется гистохимическое выявление кислых и сульфатированных муцинов, иммуногистохимическое выявление экспрессии цитокератинов (ЦКР) №7, №20, виллина, лизоцима и раково-эмбрионального антигена (РЭА).

- Желудочная метаплазия не является тупиковой формой патологии пищевода, а может выступать в качестве раннего этапа в морфогенезе аденокарциномы пищевода.
- Экспрессия цитокератинов высокого молекулярного веса в ПБ говорит в пользу гипотезы о развитии железистой метаплазии из базальных клеток плоского эпителия.
- Аденокарцинома пищевода может иметь различные варианты иммуногистохимического фенотипа: желудочный, кишечный и смешанный. В ряде случаев аденокарциномы пищевода наблюдается экспрессия маркеров плоского эпителия. Аденокарцинома пищевода характеризуется достоверно более высоким уровнем пролиферации по сравнению с дисплазией в ПБ, более частым выявлением мутантного белка р53.
- Для дифференциальной диагностики и прогнозирования течения патологического процесса при ПБ рекомендуется использование моноклональных антител к ЦКР №7, №20, виллину, Ki-67, белку р53 как маркерам “первой линии” и к РЭА, циклину D1, CD 68, коллагену IV в расширенной «панели».

- Для дифференциальной диагностики низкодифференцированной аденокарциномы пищевода, низкодифференцированного плоскоклеточного и недифференцированного раков пищевода рекомендуется иммуногистохимическое определение экспрессии ЦКР-PAN, эпителиального мембранного антигена (ЭМА), РЭА, ЦКР №7, ЦКР №20, виллина и виментина.
ГАСТРОЭЗОФАГЕАЛЬНАЯ РЕФЛЮКСНАЯ БОЛЕЗНЬ У ДЕТЕЙ КАК ФАКТОР РИСКА АДЕНОКАРЦИНОМЫ ПИЩЕВОДА | Герасимова
1. KaplanBMachlis B., Spiegler G., Revicki D. Health related quality of life in primary care patients with gastro-oesophageal reflux disease. Ann. Pharmacother. 1999; 33: 1032–1036.
2. Van Soest E.M., Dieleman J.P., Siersema P.D., Sturkenboom M.C., Kuipers E.J. Increasing incidence of Barrett’s oesophagus in the general population. Gut. 2005; 54 (8): 1062–1066.
3. El-Serag H.B., Mason A.C., Petersen N., Key C.R. Epidemiological differences between adenocarcinoma of the oesophagus and adenocarcinoma of the gastric cardia in the USA. Gut. 2002; 50: 368–372.
4. Cheu H.W., Grosfeld J.L., Heifetz S.A., Fitzgerald J., Rescorla F., West K. Persistence of Barrett’s esophagus in children after antireflux surgery: influence on follow up care. J. Pediat. Surg. 1992; 27: 260–266.
5. Hassall E. Barrett’s esophagus: new definitions and approaches in children. J. Pediatr. Gastroenterol. Nutr. 1993; 16 (4): 345–364.
6. Busby W.F., Shuker D.E.G., Charnley G. et al. Carcinogenicity in rats of the nitrosated bile acid conjugates N nitrosoglycocholic acid and N nitrosotaurocholic acid. Cancer Res. 1985; 45: 1367–1371.
Cancer Res. 1985; 45: 1367–1371.
7. Chak A., Lee T., Kinnard M.F., Brock W., Faulx A., Willis J., Cooper G.S., Sivak M.V., Jr., Goddard K.A.B. Familial aggregation of Barrett’s oesophagus, oesophageal adenocarcinoma and oesophagogastric junctional adenocarcinomain Caucasian adults. Gut. 2002; 51: 323–328.
8. Hu F.Z., Preston R.A., Post J.C. et al. Mapping of a gene for severe pediatric gastroesophageal reflux to chromosome 13q14. JAMA. 2000; 284: 325–334.
9. Massey B.T. The implications of Helicobacter pylori infection for gastroesophageal reflux disease: studies presented at Digestive Disease Week 2003. Curr. Gastroenterol. Rep. 2004; 6 (3): 191–195.
10. Mesihovic R., Vucelic B. , Bratovic I., Gribajcevic M., Selak I. Effect of eradication of Helicobacter pylori infection on endoscopic findings and symptoms of gastroesophageal reflux. Med. Arсh. 2002; 56 (4): 201–206.
, Bratovic I., Gribajcevic M., Selak I. Effect of eradication of Helicobacter pylori infection on endoscopic findings and symptoms of gastroesophageal reflux. Med. Arсh. 2002; 56 (4): 201–206.
Новое в ведении пищевода Барретта
Авторы: Ф. Масиас-Гарсия, Х.Э. Домингес-Муньос
После первого описания в 1959 г. пищевода Барретта (ПБ) определение этого заболевания несколько раз пересматривалось. В настоящее время под ПБ понимают состояние, при котором предрасполагающий к развитию рака метапластический столбчатый эпителий любой протяженности замещает плоский эпителий, в норме выстилающий пищевод. Поскольку риск развития злокачественного новообразования достоверно повышает только кишечная метаплазия (с бокаловидными клетками), ее наличие необходимо для установления диагноза. Тем не менее некоторые научные сообщества полагают, что наличие кардиальной слизистой оболочки (с муцинпродуцирующими столбчатыми клетками без бокаловидных клеток) также позволяет диагностировать ПБ. Однако злокачественный потенциал при наличии этого типа эпителия в пищеводе остается неясным, поэтому в подобных случаях использовать термин «пищевод Барретта» в целом не рекомендуется.
Тем не менее некоторые научные сообщества полагают, что наличие кардиальной слизистой оболочки (с муцинпродуцирующими столбчатыми клетками без бокаловидных клеток) также позволяет диагностировать ПБ. Однако злокачественный потенциал при наличии этого типа эпителия в пищеводе остается неясным, поэтому в подобных случаях использовать термин «пищевод Барретта» в целом не рекомендуется.
Эпидемиология и клинические вопросы
В общей взрослой популяции распространенность ПБ составляет 2-7%, заболеваемость варьирует от 23,1 до 32,7% на 100 тыс. Пищевод Барретта выявляется у 4% пациентов, подвергшихся эндоскопии верхних отделов гастроинтестинального тракта, и у 9% мужчин старше 50 лет.
К факторам риска развития ПБ относят наличие тяжелого и длительно существующего гастроэзофагеального рефлюкса (при котором значимую роль играет воздействие желчи и панкреатического сока), старший возраст, мужской пол, европеоидная раса, ожирение и потребление табака. Защитные факторы, снижающие риск развития ПБ, включают применение нестероидных противовоспалительных препаратов, Helicobacter pylori, высокое потребление фруктов и овощей.
Несмотря на отсутствие каких-либо клинических проявлений, ПБ является важнейшим известным фактором риска развития аденокарциномы пищевода (АП). В странах Запада за последние 40 лет заболеваемость раком этой локализации увеличилась в 4 раза, и АП занял первое место по росту смертности от злокачественных новообразований. У пациентов с ПБ риск их развития составляет примерно 0,5% в год, что на 40-50% выше по сравнению с общей популяцией.
Каскад злокачественной дегенерации предположительно начинается с недиспластической кишечной метаплазии, затем развиваются дисплазия низкой степени (ДНС), дисплазия высокой степени (ДВС) и в итоге – АП. Риск прогрессирования ДНС до ДВС или АП составляет 0,5-13,4% в год, риск прогрессирования ДВС в АП – 6-19% в год.
Скрининг
Высококачественные доказательства, на основе которых можно было бы разработать рекомендации по скринингу, на сегодня отсутствуют. Тем не менее скрининг ПБ может быть целесообразным у пациентов с хроническими симптомами гастроэзофагеальной рефлюксной болезни (ГЭРБ), имеющих по крайней мере 1 дополнительный фактор риска развития АП. Такими факторами являются возраст ≥50 лет, мужской пол, европеоидная раса, грыжа пищеводного отверстия диафрагмы, абдоминальное ожирение и потребление табака.
Такими факторами являются возраст ≥50 лет, мужской пол, европеоидная раса, грыжа пищеводного отверстия диафрагмы, абдоминальное ожирение и потребление табака.
Эндоскопический диагноз
Гастроэзофагеальное соединение (ГЭС) не имеет четкого анатомического определения; ГЭС принято считать проксимальную границу складок желудка при его частичной инсуффляции. Плоскоклеточный эпителий пищевода имеет бледно-розовую окраску, в отличие от красного столбчатого эпителия слизистой желудка. Критериями диагноза ПБ является распространение столбчатого эпителия выше ГЭС и наличие столбчатой метаплазии, подтвержденной по данным биопсии пищевода.
В зависимости от протяженности метапластического эпителия ПБ разделяется на коротко- (<3 см) и длинносегментный (≥3 см). Тем не менее клиническая значимость этого разделения не установлена, поскольку отсутствуют четкие доказательства связи протяженности метапластического сегмента и риска возникновения рака. Более современной является Пражская классификация, при которой эндоскопически оценивается протяженность метаплазии по окружности пищевода (C) и ее максимальная протяженность (M).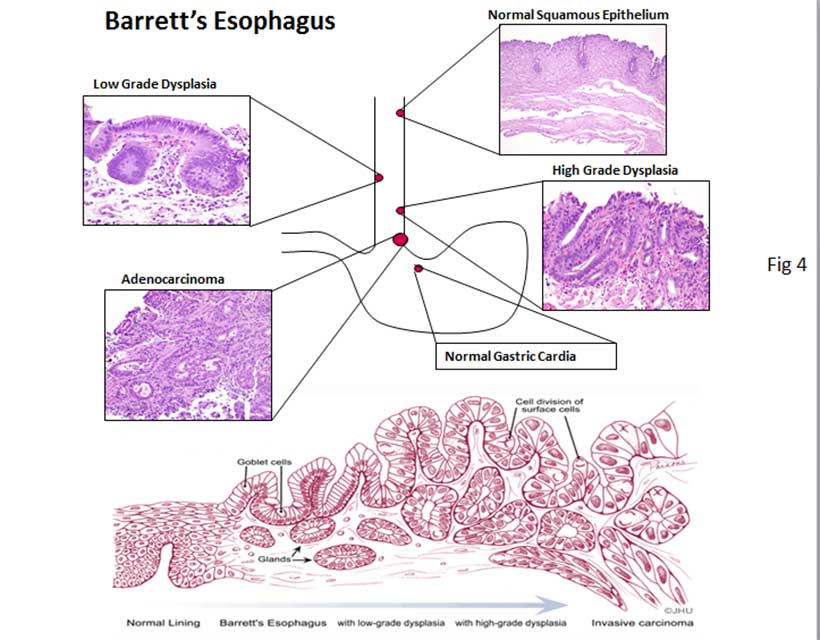 Эндоскопическое исследование не позволяет дифференцировать кишечную метаплазию от желудочной или распознавать дисплазию, поэтому для постановки диагноза в любом случае необходимо исследование биоптата.
Эндоскопическое исследование не позволяет дифференцировать кишечную метаплазию от желудочной или распознавать дисплазию, поэтому для постановки диагноза в любом случае необходимо исследование биоптата.
Наблюдение
Несмотря на отсутствие соответствующих рандомизированных контролируемых исследований, пациентов с ПБ целесообразно наблюдать, поскольку в опубликованных исследованиях активное наблюдение коррелировало с более ранней диагностикой рака и лучшей выживаемостью. С другой стороны, эффективность периодических обследований ограничивается относительно низкой частотой рака у пациентов с ПБ, а также сложностями в интерпретации наличия дисплазии (вследствие случайного забора образцов, вероятности ложноотрицательных результатов при гистологическом исследовании биоптатов и высокой вариабельности при интерпретации дисплазии). Большинство клинических руководств все же рекомендуют эндоскопическое наблюдение пациентов с ПБ с целью ранней диагностики ДНС и ее прогрессирования в ДВС или раннюю стадию рака (при этом метастазы в лимфоузлах присутствуют в 0-2% случаев). Однако чтобы установить, действительно ли эта стратегия снижает риск развития или смертность от рака, необходимы соответствующие долгосрочные исследования.
Однако чтобы установить, действительно ли эта стратегия снижает риск развития или смертность от рака, необходимы соответствующие долгосрочные исследования.
Для оптимальной оценки ПБ настоятельно рекомендуется использовать эндоскопические аппараты с высокой разрешающей способностью. Четырехквадрантная биопсия должна осуществляться с шагом 2 см или даже 1 см (при известной или предполагаемой дисплазии). Дополнительно следует проводить биопсию всех подозрительных очагов.
Более сложные методы визуализации, такие как хромоэндоскопия, электронная хромоэндоскопия и конфокальная лазерная эндомикроскопия, не превосходят стандартную эндоскопию с белым светом и поэтому не рекомендуются для рутинного применения. Однако эти методы могут быть полезными для прицельной биопсии подозрительных в плане дисплазии очагов.
При отсутствии дисплазии после 2 эндоскопий, проведенных с интервалом 6-12 мес, это исследование рекомендуется повторить через 3-5 лет. При выявлении дисплазии промежуточной степени следует интенсифицировать антисекреторную терапию с целью заживления воспаления пищевода и через 6 мес повторить биопсию. Если обнаружена ДНС, эндоскопический контроль проводится через 6-12 мес, затем ежегодно до подтверждения отсутствия дисплазии в двух исследованиях подряд; альтернативной является эндоскопическая эрадикационная терапия. У пациентов с ДВС эрадикационная терапия становится практически обязательной, лишь в некоторых случаях возможно наблюдение каждые 3 мес. Алгоритм скрининга, наблюдения и ведения ПБ представлен на рисунке 1.
Если обнаружена ДНС, эндоскопический контроль проводится через 6-12 мес, затем ежегодно до подтверждения отсутствия дисплазии в двух исследованиях подряд; альтернативной является эндоскопическая эрадикационная терапия. У пациентов с ДВС эрадикационная терапия становится практически обязательной, лишь в некоторых случаях возможно наблюдение каждые 3 мес. Алгоритм скрининга, наблюдения и ведения ПБ представлен на рисунке 1.
Ведение дисплазии и раннего рака
ДВС и интрамукозальная АП
Традиционно пациентам с ПБ, ДВС или ранним АП рекомендовалось хирургическое лечение – эзофагэктомия, однако эта процедура ассоциировалась с тяжелыми послеоперационными осложнениями и повышенной смертностью. Даже в центрах с высокой операционной активностью летальность при эзофагэктомии, проводимой по поводу ДВС или раннего АП, достигала 4%. Сегодня благодаря усовершенствованию эндоскопических методов хирургическое лечение проводится только пациентам с опухолевой инфильтрацией подслизистого слоя и/или отсутствием ответа на эндоскопическую терапию.
Цель эндоскопической эрадикационной терапии у пациентов с ПБ – полностью устранить все очаги кишечной метаплазии и достигнуть полной реверсии до плоского эпителия. В многочисленных исследованиях было продемонстрировано, что ДВС и опухоли Т1m можно элиминировать в 80-100% случаев, а ПБ с кишечной метаплазией – в >75% случаев. Кроме того, при эндоскопическом наблюдении частота прогрессирования в рак была значительно выше по сравнению с таковой при абляционной терапии (после эндоскопической резекции слизистой оболочки – ЭРС). Таким образом, пациентам с подтвержденной ДВС или интрамукозальной аденокарциномой (Т1m) в пределах ПБ рекомендуется эндоскопическая эрадикационная терапия с радиочастотной абляцией (РЧА), фотодинамической терапией (ФДИ) или ЭРС. Основными осложнениями, возникающими вследствие применения этих методик, являются стриктуры, кровотечение и перфорация; может временно наблюдаться боль в груди, лихорадка и одинофагия.
Эндоскопическая резекция ассоциируется с такой же выживаемостью, как и хирургическое лечение, но приводит к меньшим осложнениям.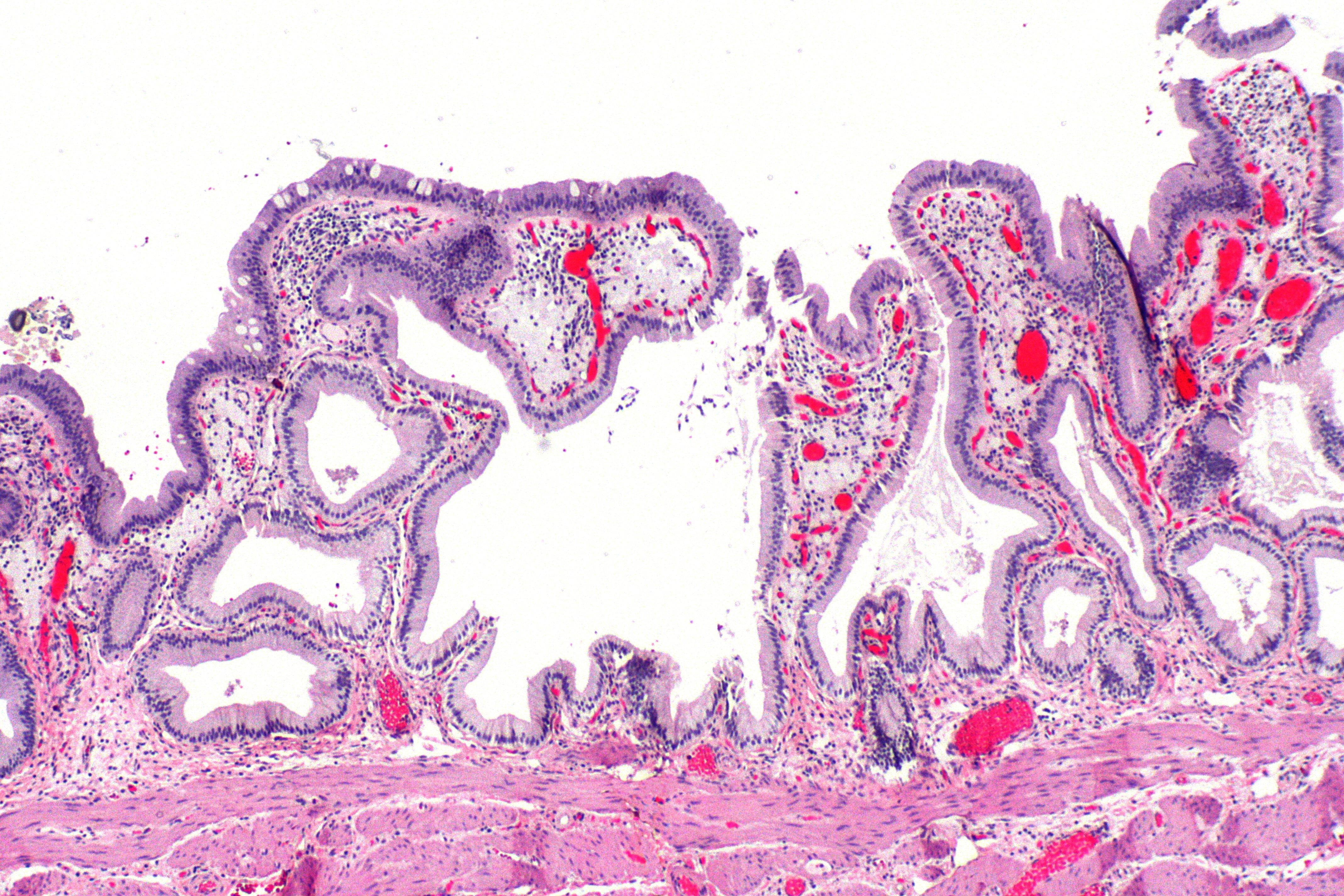 Следовательно, поскольку ДВС не связана с метастазированием в лимфоузлы (при исключении глубокой инвазии по данным ЭРС), эндоскопическое лечение имеет преимущества перед хирургическим у большинства пациентов с ПБ и ДВС. С другой стороны, эндоскопическая терапия ассоциируется с более высокой частотой рецидивов ДВС; тем не менее их также можно лечить эндоскопически.
Следовательно, поскольку ДВС не связана с метастазированием в лимфоузлы (при исключении глубокой инвазии по данным ЭРС), эндоскопическое лечение имеет преимущества перед хирургическим у большинства пациентов с ПБ и ДВС. С другой стороны, эндоскопическая терапия ассоциируется с более высокой частотой рецидивов ДВС; тем не менее их также можно лечить эндоскопически.
РЧА эффективно трансформирует пищевод с патологическими клетками в пищевод с нормальной слизистой, лишенной предраковых генетических отклонений. Недавно проведенный систематический обзор показал, что после РЧА стойкое устранение ДВС наблюдается у 90% пациентов. К преимуществам РЧА относятся безопасность и длительное сохранение эффекта (до 5 лет), которое ассоциируется со значительным снижением риска прогрессирования в рак. Для полной эрадикации метаплазии, как правило, требуется несколько сеансов абляции. Наиболее частым побочным эффектом (до 5% пациентов) является стеноз, однако частота тяжелых неблагоприятных событий при РЧА ниже по сравнению с другими абляционными техниками.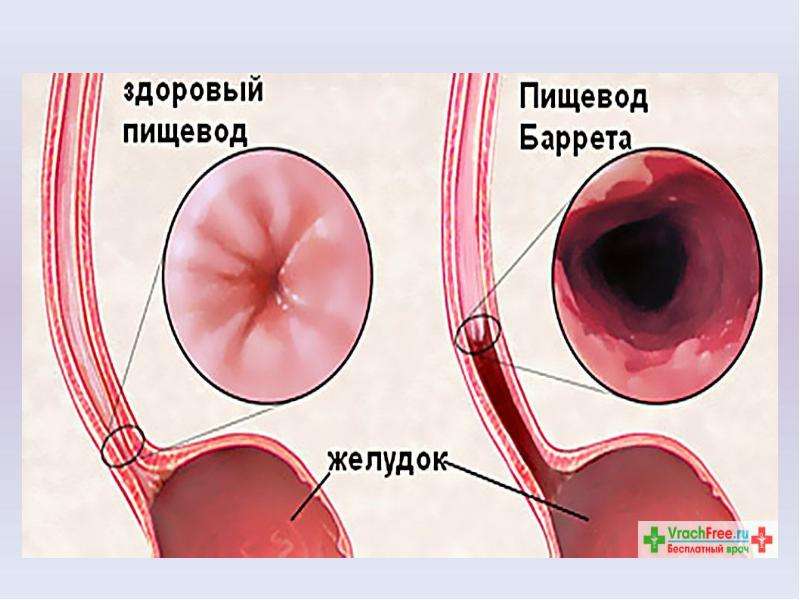 В целом РЧА считается лучшим методом по показателю «стоимость/эффективность» у пациентов с ДВС.
В целом РЧА считается лучшим методом по показателю «стоимость/эффективность» у пациентов с ДВС.
При ДВС на макроскопических очагах для адекватной постановки диагноза и определения стадии заболевания требуется ЭРС, поскольку при обнаружении АП в образце риск развития злокачественной лимфопатии зависит от глубины инвазии. В идеале ЭРС должна захватывать менее 2/3 окружности пищевода, что снижает риск развития стриктур. Стеноз, как правило, можно корригировать с помощью эндоскопической дилатации.
После завершения ЭРС всех видимых очагов ДВС/Т1m рекомендуется эндоскопическая абляция резидуального ПБ, поскольку при наличии остаточных очагов ПБ в 11-30% случаев в течение 3 лет наблюдается рецидив неоплазии. Лучшим методом для лечения плоской ДВС и эрадикации резидуального ПБ после ЭРС считается РЧА.
Фотодинамическая терапия (ФДТ) также снижает риск прогрессирования в рак по сравнению с наблюдением, однако этот метод ассоциируется с высокой частотой осложнений, в частности развития стриктур (36 vs 6% после РЧА). Кроме того, ДВС персистирует у 33-50% пациентов после ФДТ. Криотерапия и аргоноплазменная коагуляция в рандомизированных исследованиях не оценивались и на сегодня не рассматриваются как альтернатива РЧА.
При раннем ПБ, распространяющемся на подслизистый слой, лучшим методом является хирургическое лечение, что связанно со значительным риском метастазирования в лимфоузлы (20-25% по сравнению с <3% при Т1а). Тем не менее у некоторых пациентов с Т1b-Sm1 (инвазия ограничивается поверхностным слоем слизистой оболочки) и гистопатологическими признаками низкого риска (инвазия <500 мкм, степень дифференцировки G1-G2, отсутствие лимфососудистой инвазии) вместо эзофагэктомии может применяться эндоскопическое лечение, особенно при высоком хирургическом риске. В этом случае рекомендуется ультразвуковое исследование видимых лимфоузлов.
Алгоритм ведения ПБ с ДВС или ранней АП представлен на рисунке 2.
ДНС
Дисплазия низкой степени диагностируется у 25-40% пациентов с ПБ во время наблюдения. Большинство руководств рекомендуют эндоскопический контроль каждые 6-12 мес для исключения диспластического прогрессирования. Относительно естественного течения ДНС остается множество вопросов. У одних больных ДНС прогрессирует в ДВС илиАП, у других остается стабильной или спонтанно исчезает. Тем не менее в недавно проведенном исследовании сообщалось о высокой частоте прогрессирования ДНС в ДВС (13,4% в год), поэтому эндоскопическая терапия в данной популяции также может рассматриваться.
Влияние РЧА на риск неопластического прогрессирования у пациентов с ПБ и ДНС четко не установлено; в то же время РЧА обеспечивает полную реверсию до нормального плоского эпителия в >90% случаев. В рандомизированном контролируемом исследовании, включившем 136 пациентов с ПБ и подтвержденной ДНС (68 пациентов подверглись РЧА ± ЭРС vs 68 больных находились под эндоскопическим наблюдением), РЧА ассоциировалась со значительным снижением риска неопластического прогрессирования после 3 лет наблюдения (1,5 vs 35,9%; р<0,001). Этот результат соответствует показателю NNT=4 (количество пациентов, которым необходимо выполнить РЧА для предотвращения 1 случая прогрессирования). У большинства пациентов группы РЧА была достигнута стойкая эрадикация дисплазии и метаплазии. Авторы пришли к выводу, что абляционная терапия является рациональной опцией у пациентов с верифицированной ДНС.
ПБ без дисплазии
У пациентов с ПБ без дисплазии эндоскопическая эрадикационная терапия не рекомендуется из-за низкой вероятности прогрессирования в АП (0,1-0,3% в год) и потенциальных осложнений (10-15%).
Наблюдение после эрадикации
После эндоскопической или хирургической эрадикации ДВС обязателен эндоскопический контроль. После субтотальной эзофагэктомии эндоскопия должна проводиться через 2, 5 и 10 лет, при обнаружении ПБ – каждые 2 года. Четкие интервалы наблюдения после эндоскопического лечения на сегодня не определены.
Химиопрофилактика и контроль симптомов
При наличии симптомов ГЭРБ и/или рефлюксного эзофагита показано лечение. Химиопрофилактика с помощью кислотоснижающих препаратов пока не может рекомендоваться, хотя в некоторых исследованиях была установлена связь антирефлюксной терапии и сниженной частоты прогрессирования в АП даже у пациентов без симптомов ГЭРБ. Эти данные косвенно указывают на возможную положительную роль ингибиторов протонной помпы (ИПП) в профилактике ПБ. С другой стороны, кислотоснижающая терапия, в частности ИПП, не снижает риск прогрессирования дисплазии в рак. ИПП также использовались для профилактики кислотного рефлюкса и ускорения реэпителизации после ЭМС или абляции.
Риск развития АП у пациентов, перенесших антирефлюксное хирургическое лечение, такой же, как и у больных, получающих ИПП. Таким образом, антирефлюксная операция не защищает от рака, и показания к ее проведению у пациентов с ПБ соответствуют таковым у больных ГЭРБ.
Достаточных доказательств целесообразности применения аспирина и других химиопрофилактических агентов при ПБ на сегодня нет. Аспирин может рекомендоваться только пациентам с ПБ и факторами кардиоваскулярного риска (при которых этот препарат показан), поскольку соотношение «польза/риск» является благоприятным только в данной ситуации.
Список литературы находится в редакции.
Macias-Garcia F., Dominguez-Munoz J.E. Update on management of Barrett’s esophagus. World J Gastrointest Pharmacol Ther 2016 May 6; 7 (2): 227-234.
Перевел с англ. Алексей Терещенко
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
15.08.2021 Гастроентерологія Терапія та сімейна медицина Тактика ведення хворих із запальними захворюваннями кишечнику під час пандемії COVID-19Допоки COVID-19 є глобальною надзвичайною ситуацією, пацієнти із запальними захворюваннями кишечнику (ЗЗК) почувають особливе занепокоєння щодо ризику інфікування та продовження ними медикаментозної терапії. Ці оновлені клінічні рекомендації відображають сучасне розуміння проблеми COVID-19 та узагальнюють наявні вказівки для пацієнтів із ЗЗК і тих, хто за ними доглядає….
15.08.2021 Гастроентерологія Терапія та сімейна медицина Фуга назначению пробиотиков при СОVID‑19: использовать или пренебречь?Новый вирус SARS-CoV‑2, виновник коронавирусной болезни‑19 (COVID‑19), внезапно ворвался в жизнь всего человечества, изменив устоявшиеся жизненные привычки и практически толкнув мир на грань гибели, спровоцировав развитие пандемии. Несмотря на появление первых стандартов лечения и активное проведение вакцинации, количество инфицированных и умерших от COVID‑19 пока продолжает измеряться миллионами, появляются новые (более агрессивные) мутации вируса, растет количество случаев с тяжелым течением заболевания и фатальными последствиями; все это делает проблему единоборства и противостояния SARS-CoV‑2 глобальной и животрепещущей….
15.08.2021 Гастроентерологія Терапія та сімейна медицина Потенціал бактерій роду Bacillus як пробіотиківБактерії роду Bacillus завдяки здатності утворювати спори широко розповсюджені в природі й трапляються повсюдно – в ґрунті, воді, повітрі, харчових продуктах, а також в організмі людини та тварин [1, 2]. Характерною особливістю бацил є також їхня висока й різнобічна біологічна активність. Вони характеризуються вираженим антагонізмом до широкого спектра збудників захворювань людини та тварин, синтезують різні за своєю природою й механізмом дії сполуки з протимікробною активністю, а також ферменти, амінокислоти, полісахариди, вітаміни….
15.08.2021 Гастроентерологія Терапія та сімейна медицина Новітні технології в діагностиці та лікуванні хвороб печінки17-18 червня відбулася науково-практична конференція з міжнародною участю «ІХ наукова сесія Інституту гастроентерології НАМН України. Новітні технології в теоретичній та клінічній гастроентерології». Під час заходу пролунали тематичні виступи провідних вітчизняних і закордонних науковців, присвячені актуальним питанням діагностики, лікування та профілактики захворювань травного тракту. Значну увагу аудиторії привернув сателітний симпозіум компанії «Абботт» щодо новітніх технологій у діагностиці та лікуванні хвороб печінки….
Морфогенез метаплазий, дисплазий и аденокарцином в пищеводе Барретта (иммунологическое исследование)
На правах рукописи
АХМЕТОВ Тимур Рустэмович
Морфогенез метаплазий, дисплазий и аденокарцином в пищеводе Барретта (иммуногистохимическое исследование)
14 00 15 — патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Москва, 2007
003162652
Работа выполнена в ГОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель:
Доктор медицинских наук Цыплаков Дмитрий Эдуардович
Официальные оппоненты:
Член-корреспондент РАМН, профессор, доктор медицинских наук, Франк Георгий Авраамович
(Московский научно-исследовательский онкологический институт им П А Герцена)
Доктор медицинских наук, профессор Бабиченко Игорь Иванович (Российский Университет Дружбы Народов, Москва)
Ведущее учреждение:
НИИ морфологии РАМН, Москва
Защита состоится «/<& ([ 2007 года в часов на заседании диссертационного совета Д 208 072 04 при Российском государственном медицинском университете (117997, г Москва, ул Островитянова, д 1)
С диссертацией можно ознакомиться в библиотеке университета (117997, г Москва, ул Островитянова, д, 1).
Автореферат разослан « » 2007 г.
Ученый секретарь диссертационного совета доктор медицинских наук, профессор
Щеголев А И
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность Увеличение частоты злокачественных новообразований пищевода, особенно аденокарциномы, а также неблагоприятный прогноз при этой патологии требует поиска точных методов ранней диагностики предраковых и фоновых состояний пищевода, позволяющих определять врачебную тактику и имеющих прогностическое значение
Пятилетняя выживаемость при раке пищевода составляет лишь 10 % (результаты мониторинга EUROCARE -2 в Европе) и не зависит от гистологического типа опухоли и степени ее дифференцировки Низкий уровень пятилетней выживаемости отчасти связан с поздней диагностикой рака пищевода По данным Аксель Е М (2006 г), в 1996, 2000 и 2004 годах в России подавляющее большинство случаев рака пищевода (71,6%, 73,3% и 70,0% соответственно) диагностировалось в III — IV стадиях заболевания
Наиболее частой опухолью пищевода до недавнего времени являлся плоскоклеточный рак (до 90-95% злокачественных новообразований) В России, США, странах Западной Европы, а также в ряде стран Азии в течение последних 50 лет отмечается значительный подъем заболеваемости аденокарциномой пищевода, частота возникновения которой в отдельных регионах достигает уровня заболеваемости плоскоклеточным раком
Как показано в большом количестве работ, риск развития аденокарциномы пищевода связан с железистой метаплазией эпителия, получившей название «пищевод Барретта» До 80-90% случаев аденокарциномы дистального отдела пищевода развивается на фоне пищевода Барретта (ПБ) (Falk G W , 2003) Аденокарцинома пищевода развивается1 у 0,5% больных в год при легкой дисплазии, и у 6% больных в год при тяжелой дисплазии на фоне ПБ (А С Трухманов, 2001) В среднем, риск возникновения аденокарциномы пищевода в течение жизни у пациентов с ПБ составляет 10% (Spechler S J , 1997) Согласно данным Cameron A J (1997 г), частота клинического выявления ПБ составляет в среднем 22,6 на 100 тыс населения, тогда как для аутопсийного материала этот показатель значительно выше — 376 на 100 тыс населения Железистая метаплазия эпителия пищевода может быть представлена эпителием желудочного (фундального и кардиального) и кишечного типов В настоящее время для обозначения всех видов метаплазий эпителия слизистой оболочки пищевода многими зарубежными авторами предлагается использовать понятие «пищевод, выстланный цилиндрическим эпителием» вместо термина «пищевод Барретта» В своем исследовании мы использовали термин «пищевод Барретта» в том же значении, что и сам Норманн Рупперт Барретт, подразумевая пищевод, выстланный цилиндрическим эпителием
Несмотря на значительное количество публикаций за последние 20 лет, сохраняется неясность в отношении морфогенеза «пищевода Барретта» и «барретговой аденокарциномы»
Хотя иммуногистохимический (ИГХ) метод исследования экспрессии ткане- и цитоспецифичных антигенов широко используется в морфологических
исследованиях за рубежом, в работах, посвященных ПБ, как правило, использовалось ограниченное число (2-5) моноклональных антител Не проводилось сравнения различных вариантов ПБ, аденокарциномы пищевода, нормального эпителия пищевода взрослых лиц и эмбрионов по экспрессии широкого ряда ИГХ маркеров До сих пор не разработаны критерии ИГХ диагностики ПБ для применения в повседневной практике Остаются актуальными исследования молекулярных характеристик метапластического эпителия ПБ, достоверно указывающих на риск развития аденокарциномы, а также поиск рационального протокола терапии в зависимости от типа метаплазии
Цель и задачи работы
Цель изучить морфогенез метаплазий, дисплазий и аденокарцином в пищеводе Барретта
Для достижения этой цели решались следующие задачи
1) Изучить иммуногистохимический фенотип нормального эпителия пищевода у взрослых лиц разного возраста и у плодов,
2) Провести анализ изменений в эпителии пищевода при различных формах метаплазий,
3) Исследовать диспластические процессы в пищеводе Барретта,
4) Изучить иммуногистохимический фенотип аденокарцином, возникающих из пищевода Барретта,
5) Создать оптимальный алгоритм иммуногистохимической диагностики для повседневного морфологического исследования пищевода Барретта в онкологической практике
Научная новизна Впервые дана иммуногистохимическая оценка всех форм патологии при пищеводе Барретта с применением широкого ряда моноклональных антител Кроме того, впервые исследованы различия между фенотипом нормального эпителия пищевода у плодов и взрослых лиц и фенотипом эпителия в пищеводе Барретта
Практическая значимость
В результате проведенной работы были получены новые данные о морфогенезе эпителия пищевода Барретта и создан алгоритм ИГХ -диагностики предраковых и раковых состояний пищевода
Результаты проведенных исследований могут быть использованы при патоморфологической диагностике пищевода Барретта и аденокарциномы пищевода, а также в процессе преподавания гастроэнтерологии, онкологии и патологической анатомии в ВУЗах
На защиту выносятся следующие положения
1 Эпителий пищевода плода человека на сроках 12-16 недель гестации имеет сходный иммуногистохимический фенотип с пищеводом Барретта, что позволяет предположить «возврат к фетальному состоянию эпителия» при этой патологии ■
2 Для дифференциальной диагностики кишечной и желудочной метаплазии в ПБ рекомендуется гистохимическое выявление кислых и
сульфатированных муцинов, иммуногистохимическое выявление экспрессии цитокератинов (ЦКР) №№7, 20, виллина, лизоцима и раково-эмбрионального антигена (РЭА)
3 Желудочная метаплазия не является тупиковой формой патологии пищевода, а может выступать в качестве раннего этапа в морфогенезе аденокарциномы пищевода
4 Экспрессия цитокератинов высокого молекулярного веса в ПБ говорит в пользу гипотезы о развитии железистой метаплазии из базальных клеток плоского эпителия
5 Аденокарцинома пищевода может иметь различные варианты иммуногистохимического фенотипа желудочный, кишечный и смешанный В ряде случаев аденокарциномы пищевода наблюдается экспрессия маркеров плоского эпителия (ЦКР высокого молекулярного веса) Аденокарцинома пищевода характеризуется достоверно более высоким уровнем пролиферации по сравнению с дисплазией в ПБ, более частым выявлением мутантного белка р53
6 Для дифференциальной диагностики и прогнозирования течения патологического процесса при ПБ рекомендуется использование моноклональных антител к цитокератинам №7, №20, виллину, Кл -67, белку р53 как маркерам «первой линии» и к РЭА, циклину Dl, CD 68, коллагену IV в расширенной «панели»
7 Для дифференциальной диагностики низкодифференцированной аденокарциномы пищевода, низкодифференцированного плоскоклеточного и недифференцированного раков пищевода рекомендуется иммуногистохимическое определение экспрессии ЦКР- PAN , эпителиального мембранного антигена (ЭМА), РЭА, ЦКР№7, ЦКР№20, виллина и виментина
Апробация работы
Результаты исследования были представлены в докладах на 1-м конгрессе онкологов республики Узбекистан (Ташкент, 2005), X Всероссийской научно-практической конференции «Молодые ученые в медицине», посвященной 1000-летию г Казани и 60-летию Победы в Великой Отечественной Войне (Казань — 2005), Всероссийской конференции Российского общества патологоанатомов (Орел, 2005), 20-м конгрессе Европейского общества патологов (Париж, 2005), 100-м юбилейном конгрессе Международной академии патологии — IAP (Монреаль, Канада, 2006), докладывались на заседаниях Республиканского отделения Российского общества патологоанатомов (Казань, 2005 и 2006 гг )
Результаты работы внедрены в практическую работу патологоанатомических отделений Клинического онкологического диспансера Министерства Здравоохранения Республики Татарстан, а также в учебный процесс кафедры патологической анатомии Казанского государственного медицинского университета
Публикации Материалы диссертации отражены в 10 опубликованных работах, в том числе 2 за рубежом
Личный вклад автора Автор диссертации на базе лаборатории иммуногистохимической диагностики опухолей Клинического
онкологического диспансера МЗ РТ лично провел проспективное морфологическое исследование материала, полученного от 87 больных с эндоскопически выявленной патологией пищевода, в том числе 67 случаев с подозрением на пищевод Барретта (ПБ) и 20 наблюдений злокачественных новообразований нижней трети пищевода Автор проводил аутопсию и вырезку материала из нижней трети пищевода в контрольной группе, включавшей 4 наблюдения взрослых лиц и 6 плодов на базе патологоанатомического отделения РКБ №3 (г Казань) и Межрегиональном клинико-диагностическом центре (г Казань)
Диссертант для оценки пролиферативной активности самостоятельно выполнил морфометрический анализ иммуногистохимического маркера Кл -67, провел статистическую обработку полученных результатов Автором диссертации обоснована актуальность темы, сформулированы цель, задачи и выводы исследования, проведено сравнение результатов собственных исследований с литературными данными
Структура и объем диссертации Диссертация изложена на 168 странице машинописи и состоит из введения, литературного обзора, описания материалов и методов, главы результатов собственных исследований, обсуждения полученных данных, выводов, списка литературы и приложения Текст иллюстрирован 9 таблицами, 62 микрофотографиями, 1 схемой Список литературы содержит 217 наименований, из которых 21 отечественных и 196 иностранных
СОДЕРЖАНИЕ РАБОТЫ. Материал и методы исследования.
В соответствии с поставленными целью и задачами исследования за период с 2001 по 2007 гг было проведено гистологическое, гистохимическое и иммуногистохимическое изучение 87 случаев эндоскопически выявленной патологии пищевода, в том числе 67 случаев с подозрением на пищевод Барретта (ПБ) и 20 злокачественных новообразований нижней трети пищевода, а также контрольной группы, включавшей аутопсийный материал нормального пищевода взрослых лиц (4 случая) и плодов (6 случаев) Проспективно изучался материал, полученный у больных в процессе эндоскопического исследования или оперативного лечения в Клиническом онкологическом диспансере МЗ РТ (г Казань) по поводу пищевода Барретта или новообразований пищевода Парафиновые блоки аутопсийного материала пищевода взрослых лиц и плодов были предоставлены патологоанатомическим отделением РКБ№3, г Казань
Эндоскопическое исследование пораженного пищевода включало в себя определение границы между пищеводом и желудком (X -линии) При подозрении на пищевод Барретта или злокачественное новообразование пищевода производилась биопсия только из подозрительных очагов в нижней
трети пищевода, расположенных проксимальнее Z-линии и отделенных от желудка полосой нормального плоского эпителия шириной не менее 1,5 см Для облегчения визуализации очагов кишечной метаплазии применялась хромоэндоскопия с использованием метиленовой сини
Для точной характеристики изучаемой патологии был проведен анализ амбулаторных карт и историй болезни больных, находившихся на лечении в Клиническом онкологическом диспансере Республики Татарстан с 2001 по 2007 гг При оценке каждого случая ПБ учитывалась локализация, размер поражений, динамика процесса и паспортные данные (возраст и пол) В случае злокачественных новообразований пищевода учитывалась стадия опухоли в соответствии с системой TNM и паспортные данные (возраст и пол) В качестве контроля использовался аутопсийный материал нормального пищевода взрослых лиц (4 случая) Кроме того, изучался аутопсийный материал из нижней трети пищевода плодов человека 12-25 недель гестации, полученных в результате искусственного прерывания беременности по медико-социальным показаниям (2 случая) и мертворождения (4 случая) в отделении акушерства и гинекологии РКБ №3 г Казани Материалом для исследования служили парафиновые блоки биопсийного, аутопсийного и операционного материала
Выражаю глубокую признательное!ь дмн, профессору С В Петрову и коллективу ПАО Клинического онкологического диспансера Республики Татарстан за консультативную помощь и поддержку при выполнении этой работы
Гистологическое исследование
Для первоначальной морфологической характеристики патологических состояний пищевода и пищевода контрольной группы (взрослых лиц и плодов) проводилось рутинное гистологическое исследование Использовались парафиновые срезы толщиной 5-7 мкм, окрашенные гематоксилином и эозином
В случае железистой метаплазии эпителия пищевода (пищевод Барретта) оценивались клеточный состав (наличие бокаловидных клеток), строение слизистой (наличие валиков, ямок, крипт, ворсин, полипов), признаки дисплазии и воспаления
Степень дисплазии в пищеводе Барретта оценивалась согласно критериям Американской Академии Гастроэнтерологии с выделением следующих стадий дисплазия отсутствует, неопределенная степень дисплазии, легкая дисплазия, тяжелая дисплазия, рак in situ
При первоначальном гистологическом исследовании злокачественных новообразований пищевода проводилась оценка степени анаплазии, количества и характера митозов, наличия инвазии, вторичных изменений в опухоли Гистохимические методы
Для определения веществ мукополисахаридной природы использовались методы гистохимического окрашивания Шифф-йодной кислотой (ШИК) по Мак-Манусу, альциановым синим по Стидмену, толуидиновым синим, комбинированное окрашивание альциановым синим и ШИК (по Моури)
При исследовании кишечной метаплазии в ПБ оценивался клеточный состав и гистохимические свойства с использованием аналогичных критериев для кишечной метаплазии в желудке, предложенных отечественными и зарубежными авторами (Аруин Л И , 1998, Voutilainen М, 1999) Иммуногистохимическое исследование
Парафиновые срезы толщиной 5-7 мкм готовились на микротоме Leica (Германия), наносились на предметные стекла, обработанные поли-Ь-лизином и подсушивались на нагревательном столике при 37 °С в течение 10 часов
После депарафинирования и обезвоживания срезов проводилась демаскировка антигенных детерминант кипячением в 0,1М цитратном буфере pH 6,0 в течение 20 минут В ряде случаев после обработки в ксилоле и спиртах срезы промывали в 0,1М фосфатном буфере ( PBS — pH 7,4), обрабатывали 0,1% раствором трипсина на Tris -буфере (pH 7,6) в течение 30 мин при 37 °С во влажной камере Использовали моно- и поликлональные первичные антитела к белкам промежуточных филаментов эпителиальных клеток (цитокератинам -ЦКР №7, №20, ЦКР высокого молекулярного веса, ЦКР- PAN), клеток мезенхимального происхождения (виментину), маркерам дисплазии (р53, циклину D 1, HER2/neu) и пролиферации (Ki -67), а также ряду других тканеспецифических белков (эпителиальному мембранному антигену, раковому эмбриональному антигену, виллину, лизоциму, CD 68, миелопероксидазе, коллагену IV) В иммуногистохимических реакциях использовалась система визуализации стрептавидин-биотин (LSAB), DAKO
В качестве негативного контроля срезы инкубировали с нормальной сывороткой животного, от которого были получены первые антитела, а также с PBS Кроме того, проводили инкубацию первых антител со срезами тех тканей, в которых исследуемый антиген отсутствовал Позитивным контролем служила нормальная ткань слизистой оболочки пищевода и тонкого кишечника Просматривали стекла в микроскопе Leica CTR 5000 Характер иммуногистохимических реакций оценивали визуально в баллах с учетом интенсивности окраски и процента окрашенных клеток. В каждом случае подсчитывали 200 клеток Подсчет индекса пролиферации выполняли с помощью системы для морфометрии на базе IBM PC Pentium 4 и пакета программ » Leica Qwin 3000″. Подсчет проводился в 10 полях зрения каждого среза, при этом учитывалось 500 клеток При исследовании ПБ подсчет индекса пролиферации проводился отдельно в глубоких и поверхностных отделах метапластических желез
Статистическая обработка полученных данных
Была проведена статистическая обработка полученных данных при помощи программы «Microsoft Excel» пакета «Microsoft Office 2003» с определением доверительного интервала для средней (по Р Фишеру) и величины р (достоверность различий между изучаемыми группами) Степень достоверности различий показателей пролиферации между исследованными группами наблюдений оценивали с помощью t -критерия Стьюдента Различия считали достоверными при 95% уровне значимости (р < 0,05)
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ.
1 Гистологическая, гистохимическая и иммуногистохимическая характеристика нормальной слизистой оболочки пищевода и кардиального отдела желудка плода.
У плодов на сроке 14-16 недель гестации эпителиальная выстилка пищевода и желудка имела сходное гистологическое строение и была представлена многорядным кубическим эпителием со светлыми вакуолями В кардиальном отделе желудке на сроке 14 недель определялись формирующиеся ямки, отсутствующие в пищеводе На сроке 18-20 недель гестации в пищеводе плодов одновременно обнаруживались участки и плоского, и многорядного кубического эпителия Эпителий желудка на этом сроке гестации приближался по строению к цилиндрическому, увеличивалась глубина желудочных ямок На сроке 20-25 недель гестации выстилка пищевода была представлена преимущественно зрелым многослойным плоским неороговевающим эпителием
Гистохимически, при помощи ШИК-реакции, была выявлена позитивная реакция на гликоген в эпителии пищевода плодов всех исследованных сроков гестации С увеличением срока гестации интенсивность ШИК-реакции увеличивалась от слабой (12-16 нед) до яркой (18-20 нед и более) Гистохимическое выявление кислых и сульфатированных муцинов в эпителии пищевода плода было негативным на всех сроках гестации В эпителии желудка плода на всех сроках гестации обнаруживались ШИК- позитивные нейтральные муцины На сроке гестации 12-16 недель в эпителии желудка отмечалась позитивная гистохимическая реакции на кислые мукополисахариды (окрашивание альциановым синим по Стидмену, рН 2,5), на более поздних сроках гестации кислые муцины в эпителии желудка не выявлялись
При помощи иммуногистохимического метода на сроке 12-14 недель гестации в эпителии пищевода плода выявлялась яркая позитивная реакция на ЦКР№7 (более выраженная в поверхностных слоях эпителия) и ЦКР- PAN, негативная реакция на ЦКР№20 и виллин Реакция на ЦКР высокою молекулярного веса (характерная для нормального эпителия пищевода взрослых лиц) на этом сроке была негативной На сроке 14-16 недель гестации в формирующихся железах кардиального отдела желудка и в переходном эпителии пищевода иммуногистохимически выявлялась очаговая позитивная реакция на маркеры кишечной дифференцировки ЦКР№20 и РЭА Отмечалась яркая позитивная реакция на ЦКР высокого молекулярного веса в переходном эпителии пищевода и очаговая позитивная реакция в железах кардиальною отдела желудка В кардиальном отделе желудка на сроке 14-16 недель гестации также отмечалась яркая позитивная реакция на ЦКР№7 и ЦКР- PAN На 18-20 неделе гестации в эпителии пищевода плода выявлялась яркая позитивная реакция на ЦКР- PAN, яркая позитивная реакция на ЦКР высокого молекулярного веса и негативная реакция на ЦКР№7, ЦКР№ 20 и виллин На сроках 20-25 недель гестации реакция на ЦКР высокого молекулярного веса в эпителии пищевода была ярко позитивной, на ЦКР№20 и виллин -
негативной В кардиальном отделе желудка на сроке 20-25 недель отмечалась яркая позитивная реакция на ЦКР№7 и ЦКР- PAN, негативная реакция на ЦКР20, виллин и ЦКР высокого молекулярного веса Уровень пролиферации в эпителии пищевода, определенный при помощи маркера Ki-67, был сравнительно низким на всех сроках гестации и составлял в среднем 4,5±1,6%
2. Строение и иммуногистохимический фенотип слизистой оболочки пищевода взрослых лиц в норме и при хроническом эзофагите.
Эпителий пищевода взрослых лиц имел гистологическое строение многослойного плоского неороговевающего эпителия Гистохимически в многослойном плоском эпителии пищевода при помощи ШИК — реакции выявлялись включения гликогена
Иммуногистохимический фенотип эпителия нижней трети пищевода взрослых лиц соответствовал многорядным плоским неорогевающим эпителиям желудочно-кишечного тракта Отмечалась яркая позитивная реакция на «ПАН» — эпителиальные маркеры (ЭМА, ЦКР- PAN) и на цитокератины высокой молекулярной массы (специфичные для плоских и сложных эпителиев) Реакция на маркеры железистой дифференцировки — ЦКР №7, ЦКР №20, виллин была негативной
Среди 67 случаев, исследованных в связи с подозрением на ПБ, в 3 наблюдениях был выявлен хронический продуктивный эзофагит Возраст пациентов составил в среднем 54,5 года, все трое пациента были мужского пола
Хронический эзофагит сопровождался выраженной лимфоцитарной, плазмоцитарной и гистиоцитарной инфильтрацией слизистого и подслизистого слоев, гиперемией сосудов слизистой оболочки и склерозом стромы В эпителиальной выстилке отмечалась баллонная дистрофия плоского эпителия, акантоз Гистохимически в многослойном плоском эпителии выявлялся ШИК-позитивные гранулы с гликогеном, реакции на кислые и сульфатированные муцины были негативными
Иммуногистохимически многослойный плоский эпителий характеризовался яркой позитивной реакцией (сильнее в базальном слое) с антителами к ЦКР высокой молекулярной массы и ЭМА (равномерно во всех слоях) ИГХ реакция с маркерами железистой дифференцировки (ЦКР№7, №20, виллину) в многослойном плоском эпителии была негативной В гистиоцитах воспалительного инфильтрата отмечалась яркая позитивная реакция на CD 68, а в нейтрофильных лейкоцитах — на миелопероксидазу
3. Строение и фенотип метапластического эпителия в ПБ.
Среди 64 случаев гистологически выявленной железистой метаплазии эпителия пищевода в зависимости от строения и гистохимических характеристик мы выделили 2 основных варианта желудочная и кишечная (т н «полная» и «неполная»). Кроме того, в отдельную группу были выделены случаи кишечной метаплазии на фоне желудочной метаплазии Железистая
метаплазия эпителия пищевода выявлялась преимущественно у лиц мужского пола (47 больных, 73% наблюдений ПБ)
Желудочная метаплазия была выявлена у 28 больных, возраст которых составлял от 38 до 74 лет (в среднем 52,8 лет), 20 (71,4%) пациентов были мужского и 8 (28,56%) женского пола
Гистологически метаплазия желудочного типа была представлена железами, построенными из призматических клеток со светлой цитоплазмой, замещавшими нормальный плоский эпителий, бокаловидные клетки отсутствовали В 15 случаях из 28 (53,6%) желудочной метаплазии обнаруживалась умеренная лимфоцитарная и гистиоцитарная инфильтрация слизистой оболочки в зоне метаплазии, что сопровождалось кистозным расширением части метапластических желез В 4 случаях метаплазия желудочного типа была обнаружена в железистых полипах пищевода При метаплазии эпителия пищевода желудочного типа признаки дисплазии гистологически выявлены не были
В ПБ при метаплазии желудочного типа гистохимически определялись нейтральные муцины (яркая или умеренная ШИК реакция), гистохимические реакции на кислые и сульфатированные муцины были негативными
Желудочная метаплазия иммуногистохимически характеризовалась яркой позитивной реакцией с антителами к ЦКР №7, слабой или негативной реакцией с антителами к виллину, слабой апикальной реакцией на РЭА и негативной реакцией на ЦКР №20 В 7 из 28 случаев (25%) желудочной метаплазии была обнаружена позитивная реакция с антителами к цитокератинам высокой молекулярной массы
Клеточный состав воспалительного инфильтрата, обнаруженного в очагах желудочной метаплазии, включал СБ 68 — позитивные гистиоциты и лейкоциты, окрашенные на миелопероксидазу
При анализе иммуногистохимической реакции с маркером Кл -67 в случаях желудочной метаплазии в поверхностных отделах желез пролиферация была низкой (4,15±0,21%), в глубоких отделах — высокой (55,6±6,2%)
Кишечная метаплазия эпителия пищевода была выявлена у 23 пациентов в возрасте от 31 до 61 года (в среднем 52,6 года) 17 лиц были мужского и 6 -женского пола
Метаплазия эпителия пищевода кишечного типа гистологически характеризовалась наличием в железах бокаловидных клеток и цилиндрических клеток В 9 случаях из 23 (39,1%) в слизистой оболочке обнаруживались плазмоцитарные и гистиоцитарные инфильтраты С помощью гистохимического и иммуногистохимического методов была выделена «полная» (7 случаев) и «неполная» (16 случаев) кишечная метаплазия
При «полной» кишечной метаплазии отмечалось окрашивание секрета бокаловидных клеток на нейтральные (ШИК-реакция по Мак-Манусу) и кислые (альциановым синим по Стидмену, рН 2,5) муцины, негативная гистохимическая реакция на сульфомуцины (окраска толуидиновым синим, рН 1,0) Цилиндрические клетки, лежащие между бокаловидными клетками не
окрашивались гистохимическими методами на муцины Имелись структуры, напоминающие кишечные ворсинки
При «неполной» кишечной метаплазии секрет бокаловидных клеток включал не только нейтральные и кислые, но и сульфатированные муцины При этом виде метаплазии в цилиндрических клетках, лежащих между бокаловидными клетками гистохимически выявлись кислые муцины (окрашивание альциановым синим по Стидмену, рН 2,5)
Иммуногистохимически «неполная» кишечная метаплазия характеризовалась яркой умеренной очаговой реакцией на ЦКР№7, очаговой неравномерной реакцией на ЦКР №20, яркой позитивной реакцией на виллин (апикально) и РЭА (цитоплазматически и апикально) Фенотип «полной» кишечной метаплазии по данным иммуногистохимического анализа включал в себя экспрессию ЦКР №7 в поверхностном и глубоком слоях железистого эпителия, яркую положительную реакцию на ЦКР №20 в поверхностных отделах желез и позитивную апикальную реакцию на виллин, апикальную реакцию на РЭА
В 6 случаях из 23 (26,1%) кишечной метаплазии была обнаружена позитивная реакция (от умеренной до яркой) с антителами к цитокератинам высокой молекулярной массы Клеточный состав воспалительного инфильтрата, обнаруженного в очагах кишечной метаплазии включал преимущественно СБ68 — позитивные гистиоциты
При кишечной метаплазии по результатам иммуногистохимического анализа маркера К.1 -67 уровень пролиферации в поверхностных отделах желез был достоверно выше (р<0,05), чем при метаплазии желудочного типа и составлял в среднем 8,45±0,33% Средний уровень пролиферации в глубоких отделах желез был высоким (62±5,8%), разница с метаплазией желудочного типа статистически недостоверна (р>0,05).
Желудочная метаплазия с очагами кишечной метаплазии была выявлена в 13 случаях, у 10 мужчин и 3 женщин в возрасте от 48 до 74 лет (средний возраст 59,6 лет) Гистологически эта патология пищевода характеризовалась наличием единичных желез, содержащих бокаловидные клетки среди преобладающих по количеству желез желудочного типа (без бокаловидных клеток) В 2 случаях из 13 (15,4%) имелась лимфо- плазмоцитарная инфильтрация слизистой оболочки В 2 других случаях (15,4%) были обнаружены признаки легкой дисплазии в очагах кишечной метаплазии
Гистохимически в метапластических железах желудочного типа выявлялись нейтральные муцины при отсутствии в них кислых и сульфатированных муцинов
Участки кишечного строения по гистохимическим свойствам были отнесены к «неполной» кишечной метаплазии отмечалось накопление кислых, нейтральных и сульфатированных муцинов в бокаловидных клетках, а также положительная реакция на кислые муцины в цилиндрических клетках.
Иммуногистохимический фенотип очагов кишечного строения (на фоне желудочной метаплазии) соответствовал полной или неполной кишечной
метаплазии и отличался от окружающих желез желудочного типа Железы желудочного типа характеризовались яркой реакцией на ЦКР№7, слабой апикальной реакцией на виллин в части желез и негативной реакцией на ЦКР №20 и РЭА В очагах кишечного типа отмечалась умеренная очаговая реакция на ЦКР№20 (неполная кишечная метаплазия), яркая апикальная реакция на виллин и яркая цитоплазматическая реакция на РЭА В 4 случаях (из 13) кишечной метаплазии на фоне желудочной метаплазии была обнаружена слабая позитивная реакция на цитокератины высокой молекулярной массы
Воспалительные инфильтраты были представлены преимущественно СВ68 — позитивными гистиоцитами
Уровень пролиферации по количеству К.1 -67 позитивных ядер в метапластических железах кишечного типа составил в среднем 5,8±1,3% в поверхностных отделах желез и 55,6±6 2% в глубоких отделах желез, различия пролиферативной активности с «чисто» кишечной и «чисто» желудочной метаплазиями статистически недостоверны (р) 2>0,05)
На основании данных литературы и результатов собственного исследования мы можем предложить следующую схему оценки метапластических эпителиев в ПБ (табл 1)
Таблица 1 Гистохимические и иммуногистохимические характеристики эпителиев в ПБ
Маркер Желудочная метаплазия Кишечная метаплазия
Полная Неполная
ЦКР№7 ++ (во всех отделах желез) — + ++ (во всех отделах желез)
ЦКР№20 — +(очагово) + (в поверхностных слоях)
Виллин -/± (очагово, слабая апикальная реакция) + (ярко, апикально) + (яркая апикальная и умеренная цитоплазматическая реакция)
РЭА + (апикально, умеренно) + (умеренно, апикально) ++ (яркая апикальная и цитоплазматическая реакция)
Лизоцим + — -
Нейтральные муцины + + +
Кислые муцины + (в бокаловидных и каемчатых клетках) + (только в бокаловидных клетках)
Сульфатирован ные муцины — — + (в бокаловидных клетках)
4. Строение и фенотип дисплазий в пищеводе Барретта.
В результате исследования материала от 64 больных с диагнозом ПБ, признаки дисплазии были выявлены в девяти случаях
При желудочной метаплазии гистологические признаки дисплазии отсутствовали
Из исследованных нами 23 случаев кишечной метаплазии в ПБ, в семи были обнаружены признаки легкой дисплазии В 3-х случаях кишечной метаплазии из 23 (13,0%) гистологическая картина соответствовала легкой дисплазии- в клетках поверхностных желез обнаруживались гиперхромные ядра с нарушенной ориентацией при отсутствии признаков воспаления В 4-х случаях кишечной метаплазии также обнаруживались изменения, характерные для легкой дисплазии, однако они проявлялись на фоне выраженной плазмоцитарной и гистиоцитарной инфильтрации В этих случаях ставился диагноз «неопределенная степень дисплазии»
Признаки легкой дисплазии (при отсутствии признаков воспаления) были выявлены в 2-х из 13-ти (15,3%) случаях кишечной метаплазии на фоне желудочной метаплазии эпителия пищевода
Гистохимически в участках дисплазии на фоне ПБ выявлялась слабая неравномерная секреция или отсутствие секреции кислых и сульфатированных муцинов, умеренная секреция нейтральных муцинов
Иммуногистохимически в участках дисплазии выявлялся фенотип, характерный для кишечной метаплазии в ПБ При иммуногистохимическом анализе с использованием антител к маркеру р53 позитивная реакция была выявлена ,в 2-х случаях кишечной метаплазии (8,7% всех случаев и 66,7% дисплазий при кишечной метаплазии), а также 1 случае кишечной метаплазии на фоне желудочной метаплазии (7,7% всех случаев и 50% дисплазий при данном виде метаплазии) Экспрессии циклина 01 и НЕИ2/ пей в случаях подозрения на дисплазию не обнаружено
В случае дисплазии в поверхностных отделах желез уровень пролиферации был достоверно выше (19,5±1,2%, р<0,05), чем в метаплазии кишечного и желудочного типов без признаков дисплазии Уровень пролиферации в глубоких отделах желез составил 66,3±4,8%, разница между уровнем пролиферации в глубоких отделах желез при дисплазии на фоне кишечной метаплазии, кишечной и желудочной метаплазии без дисплазии статистически недостоверна (р>0,05)
Для визуализации базальной мембраны использовалось ИГХ окрашивание на коллаген IV При легкой дисплазии в ПБ нарушения целостности базальной мембраны метапластических желез не наблюдалось
5. Строение и фенотип злокачественных новообразований пищевода.
Среди исследованных 20 случаев рака пищевода гистологически были выявлены аденокарцинома, низкодифференцированный рак и низкодифференцированный плоскоклеточный рак
Аденокарцинома пищевода
Аденокарцинома пищевода была обнаружена в 11 случаях Возраст пациентов составлял от 52 до 81 года (в среднем 69,5 лет), 7 пациентов были мужского и 4 — женского пола Согласно классификации TNM выделены следующие стадии аденокарциномы пищевода 4 случая (36,4%) T3N0M0, 3 (27,2%) T3N1M0,4 (36,4%) T4N1M0
Среди 11 выявленных случаев аденокарциномы пищевода гистологически определялись папиллярный, тубулярный и диффузный типы строения Инвазия опухоли в прилежащие ткани выявлена во всех исследованных случаях Гистохимически в атипических железах аденокарцином в 8 наблюдениях выявлены нейтральные муцины (интенсивность ШИК реакции была от слабой до выраженной) и в 6 случаях — кислые муцины Гистохимическое определение сульфатированных муцинов было безрезультатным
По результатам проведенного иммуногистохимического анализа 11 случаев аденокарцином было выявлено 3 варианта фенотипа 3 случая (27,3%) «желудочного типа» (экспрессия ЦКР №7 и виллина, нейтральных муцинов), 3 случая (27,3%) «смешанного кишечно-желудочного типа» (позитивная реакция на ЦКР №7 и №20, виллин, нейтральные и кислые муцины) и 5 случаев (45,4%) «кишечного типа» (экспрессия ЦКР №20 и виллина, а также нейтральных и кислых муцинов)
В 7 из 11 (63,4%) случаев аденокарцином при помощи ИГХ анализа нами была выявлена позитивная реакция в опухолевых клетках на цитокератины высокой молекулярной массы (№№ 5,14), экспрессируемые в норме плоскими и протоковыми эпителиями
В 5 случаях из 11 (45,4%) аденокарцином пищевода выявлена позитивная реакция на онкобелок р53 Уровень пролиферации при аденокарциномах пищевода был высоким и составлял 44±3,3%, разница между уровнем пролиферации в аденокарциномах и всех вариантах ПБ статистически достоверна (р<0,05) Инвазия опухоли была подтверждена при помощи иммуногистохимического окрашивания базальной мембраны (реакция на коллаген IV)
Недифференцированный рак пищевода
Недифференцированный рак был выявлен у 5 пациентов (2 случая T3N1M0, 2 — случая T4N1M0, 1 случай T3N1M1), возраст составлял от 53 до 67 лет, (в среднем 57,6 лет), 4 пациента были мужского и 1 женского пола
Недифференцированный рак гистохимически характеризовался отсутствием реакций с нейтральными, кислыми и сульфатированными муцинами
Иммуногистохимически выявлялась экспрессия ЦКР- PAN , ЭМА и РЭА Отсутствовала ИГХ реакция на ЦКР№7, ЦКР№20 и виллин
Уровень пролиферации при низкодифференцированцом раке был высоким и составил 56±4,1%.
Низкодифференцированный плоскоклеточный рак пищевода
Низкодифференцированный плоскоклеточный рак был выявлен в 4 случаях (1 случай T3N1M0, 2 — случая T4N1M0 и 1 случай T3N1M1), возраст пациентов составлял от 57 до 70 лет (в среднем 64 года), все пациенты были мужского пола
При гистохимическом исследовании в низкодифференцированном плоскоклеточном раке вещества мукополисахаридной природы не выявлялись
Иммуногистохимически выявлялась экспрессия ЦКР- PAN , слабая или умеренная реакция на ЭМА и РЭА, а также умеренная или яркая реакция на цитокератины высокого молекулярного веса ИГХ реакция с антителами к маркерам железистой дифференцировки (ЦКР№7, ЦКР№20, виллину) была негативной Уровень пролиферации, определенный при помощи антител к Кд -67, был высоким и составил 48±2,3%
6. Использование полученных данных в клинике.
После анализа гистологического строения, гистохимических свойств и иммуногистохимического фенотипа исследованного материала 87 пациентам были поставлены следующие диагнозы в 28 (32,2%) случаях-пищевод Барретта с желудочной метаплазией, в 23 (26,4%)-пищевод Барретта с кишечной метаплазией (16-«неполная» и 7 -«полная» кишечная метаплазия, в 4- случаях — легкая дисплазия), в 13 (14,9%) -очаги кишечной метаплазии на фоне желудочной (в 2 случаях — с признаками легкой дисплазии) и в 3 (3,4%) случаях- хронический продуктивный эзофагит Среди раков пищевода в 11 (12,6%) случаях диагностирована аденокарцинома пищевода на фоне пищевода Барретта, в 5 (5,7%)-недифференцированный рак, 4 (4,6%)-низкодифференцированный плоскококлеточный рак Обобщенные результаты приведены в таблице 2
Таблица 2 Структура наблюдений
Диагноз Количество % (в круглых скобках % в группе)
1. Желудочная метаплазия 28 32,2
2. Кишечная метаплазия 23 26,5
Полная 7 (30,4)
Неполная 16 (69,6)
Легкая дисплазия 3 (13,0)
3. Желудочная метаплазия с очагами кишечной метаплазии 13 14,9
Легкая дисплазия 2 (15,4)
4. Хронический эзофагит 3 3,4
5. Аденокарцинома 11 12,7
6. Недифференцированный рак 5 5,7
7. Низкодифференцированный плоскоклеточный рак 4 4,6
В клинике с использованием полученных нами данных определялись группы больных, требующих различных вариантов врачебной тактики радикального хирургического вмешательства, локального эндоскопического лечения, консервативной терапии или наблюдения
Радикальное хирургическое лечение (резекция пищевода) применялось при аденокарциноме, плоскоклеточном, и низкодифференцированном раке Кроме того, 4 больным с диагнозом «пищевод Барретта» была проведена операция гастрофундопликации для устранения гастроэзофагеального рефлюкса При легкой дисплазии на фоне кишечной метаплазии в пищеводе Барретта проводилось местное удаление пораженных участков слизистой при помощи аргонового лазера под эндоскопическим контролем (д м н Бурмистров М В , Республиканский клинический онкологический диспансер, Казань) Как при желудочной, так и при кишечной метаплазии в пищеводе Барретта без признаков дисплазии, больным назначался курс консервативной противорефлюксной терапии с последующим эндоскопическим контролем При отсутствии положительной динамики после 2 курсов консервативной терапии больным с кишечной метаплазией эпителия пищевода предлагалось эндоскопическое удаление пораженных участков слизистой
7 Морфогенез метаплазий. дисплазий и аденокарцином в ПБ Молекулярные события, сопровождающие изменение направления дифференцировки камбиальных клеток плоского эпителия пищевода на железистый тип на данный момент не известны Изменение генетической программы клеток эпителиальной выстилки пищевода может приводить к появлению железистого эпителия желудочного или кишечного типа Обнаруженные нами случаи очагов кишечной метаплазии на фоне желудочной метаплазии, а также ряд зарубежных публикаций свидетельствуют о том, что метаплазия желудочного типа не всегда является «тупиковым» изменением слизистой оболочки пищевода, а предшествует кишечной метаплазии в ПБ
По данным литературы клетки в кишечной метаплазии эпителия пищевода характеризуются нестабильностью генома При продолжающемся воздействии повреждающих факторов на метапластический эпителий ПБ, развивается легкая, а затем тяжелая дисплазия Появление дисплазии может сопровождаться мутациями или изменением экспрессии генов р53, циклина Dl, Fh2T Переход тяжелой дисплазии в инвазивную аденокарциному может сопровождаться нарушениями функции генов с — туе , с — erb — В 2, е -кадгерина
Исходя из полученных данных и данных литературы, мы можем предложить модифицированную схему прогрессирования патологического процесса в пищеводе Барретта (по Chandrasoma Р Т, 2000 и Spechler S J , 1996 с изменениями)
Схема прогрессирования патологического процесса при ПБ Химическое повреждение
Ослабление защитног о барьера.
Сверхэкспрессия ЦОГ-2 и индуцируемой синтетазы оксида азота
Усиление пролиферативной активности
Изменение экспрессии р53, БШТ
Изменение экспрессии циклинаБ!
Нарушение функции генов с-тус, с-егЬ-В2, е-кадгерина
Нормальный эпителий пищевода
Рефлюкс — эзофагит
Желудочная метаплазия
Желудочная метаплазия с участками кишечной метаплазии
к
Кишечная метаплазия
1
Легкая дисплазия на фоне
кишечной метаплазии
1 Г
Тяжелая дисплазия на фоне кишечной метаплазии
ч
Аденокарцииома пищевода m situ
Инвазивная аденокарцииома
пищевода
ВЫВОДЫ.
1 Пищевод плода 12-14 недель гестации имеет сходство с пищеводом Барретта по экспрессии ряда молекул (цитокератину №7, РЭА)
2 Нормальный эпителий пищевода взрослых лиц характеризуется экспрессией цитокератинов высокого молекулярного веса и негативной реакцией на маркеры железистой дифференцировки (цитокератин №7, цитокератин № 20, виллин)
3 Кишечная и желудочная метаплазия в ПБ обладают различным иммуногистохимическим фенотипом и гистохимическими свойствами, что может использоваться при их дифференциальной диагностике
Желудочная метаплазия характеризуется статистически достоверно более низкой митотической активностью по сравнению с кишечной, признаки дисплазии при желудочной метаплазии в нашем исследовании отсутствовали Наличие очагов кишечной метаплазии на фоне желудочной может указывать на возможность постепенной трансформации желудочной метаплазии в кишечную Кишечная метаплазия характеризуется высокой митотической активностью и нередко имеет черты дисплазии Экспрессия цитокератинов №№5,14 в ПБ говорит в пользу гипотезы о развитии железистой метаплазии из базальных клеток плоского эпителия
4 Для верификации дисплазии в ПБ может использоваться маркер р53
5 Аденокарцинома пищевода может иметь различные варианты иммуногистохимического фенотипа желудочный, кишечный и смешанный В ряде случаев в аденокарциноме пищевода обнаруживается экспрессия маркеров плоского эпителия (цитокератины высокого молекулярного веса) Сходство между различными типами дифференцировки аденокарцином и метаплазий, экспрессия цитокератинов высокой молекулярной массы в обоих случаях, говорит в пользу теории происхождения аденокарцином из метапластического эпителия ПБ
Аденокарцинома пищевода характеризуется достоверно более высоким уровнем пролиферации по сравнению с дисплазией в ПБ, более частым выявлением мутантного белка р53 Для облегчения визуализации инвазии аденокарциномы в окружающие ткани можно использовать иммуногистохимический метод с антителами к коллагену IV
6 Для дифференциальной диагностики диффузного варианта низкодифференцированной аденокарциномы, низкодифференцированного плоскоклеточного рака и недифференцированного рака может быть использован иммуногистохимический метод с антителами к цитокератину №7, цитокератину № 20, виллину, раково-эмбриональному антигену, виментину, цитокератинам высокого молекулярного веса, «пан»-цитокератинам
7 Для дифференциальной диагностики и прогнозирования течения патологического процесса при ПБ рекомендуется использование ряда моноклональных антител к цитокератинам №№7,20, виллину, К1-67, белку р53 как маркерам «первой линии» и раково-эмбриональному антигену, циклину Б1, СБ68, коллагену IV в расширенной «панели»
Список опубликованных работ по теме диссертации.
1 Timur Akhmetov, Semyon Petrov, Eugeniy Burmistrov Essential Markers for the Evaluation of Metaplasia, Dysplasia and Cancer m Barrett’s oesophagus //Virchow’s Archiv, 2005, vol 447 №2, P 282
2 T P Ахметов, С В Петров, Д Э Цыплаков Иммуноморфологическая характеристика предраковых состояний и опухолей пищевода // Актуальные вопросы патологической анатомии Сборник научных работ Материалы Всероссийского конгресса Российского общества патологоанатомов Орел-
2005, С 234-235
3 Т Р Ахметов, С В Петров, M В Бурмистров Иммуногистохимический анализ молекулярных маркеров в диагностике опухолей пищевода // Актуальные проблемы онкологии Материалы 1-го конгресса онкологов республики Узбекистан Ташкент — 2005, С 75
4 Т Р Ахметов, С В Петров, M В Бурмистров Определение молекулярных маркеров помогает диагностике пограничных состояний и опухолей пищевода // Современные технологии в онкологии Материалы VI Всероссийского съезда онкологов Ростов-на-Дону, 2005, т 2, С 395
5 Т Р Ахметов Молекулярные маркеры для оценки метаплазии, дисплазии и рака в пищеводе Барретта // Тезисы докладов X Всероссийской научно-практической конференции «Молодые ученые в медицине», посвященной 1000-летию г Казани и 60-летию Победы в Великой Отечественной Войне Казань — 2005, С 122
6 Т Р Ахметов, С В Петров, Д Э Цыплаков Предраковые состояния и опухоли пищевода иммуноморфология некоторых молекулярных маркеров //Материалы IV Конференции российских патологоанатомов «Новые методы и разработки в онкоморфологии», посвященной 100-летию со дня рождения академика АМН СССР H А Краевского Москва, 2005, С 122
7 Т Р Ахметов, С В Петров, ДЭ Цыплаков, MB Бурмистров Молекулярные маркеры в иммуноморфологической характеристике предраковых состояний и опухолей пищевода// Современные проблемы клинической патоморфологии Тезисы Всероссийской конференции с международным участием, посвященной памяти чл -корр РАМН, з д н РФ, профессора Олега Константиновича Хмельницкого С-Пб, 2005, С 17-19
8 T R Akhmetov, S V Petrov Immunohistochemical évaluation of metaplasias, dyplasias and cancer in Barrett’s esophagus// Modem Pathology, 2006 vol 10, supplément 3, P 72
9 TP Ахметов Иммуногистохимическая характеристика метаплазий, дисплазий и аденокарцином в пищеводе Барретта //Омский научный вестник
2006, №9 (46), С 281-284
10 Ахметов ТР «Оценка метаплазий, дисплазий и аденокарцином в пищеводе Барретта при помощи иммуногистохимического анализа»// Врач-аспирант, научно-практический журнал, Воронеж, 2007 №1 (16) С 9-15
Печать ризографическая Бумага офсетная Гарнитура Times New Roman Тираж 200 экз Заказ №1293 Подписано в печать 28 09 2007 г Отпечатано с готового оригинал-макета в типографии «АртПечатьСервис» ИП Мартынов М Н Свидетельство о регистрации № 304166030100281 420061, г Казань, ул Космонавтов, 41 Тел 295-10-19
Желудочная метаплазия проксимального отдела пищевода, связанная с аденокарциномой пищевода и пищеводом Барретта: какая связь? Повторное посещение входного патрубка
Предпосылки / цель: Входной патч — это участок гетеротопической слизистой оболочки желудка, находящийся в проксимальном отделе пищевода на уровне верхнего сфинктера пищевода. Имеются ограниченные данные об этой форме метаплазии желудка, а также о ее частоте, значимости и возможной связи с другими заболеваниями пищевода.Мы сообщаем о наших наблюдениях таких метаплазий желудка у пациентов с аденокарциномой пищевода или пищевода Барретта и дисплазией высокой степени.
Методы: В это исследование были включены все пациенты с пищеводом Барретта и аденокарциномой, направленные на фотодинамическую терапию. Пациенты были проспективно обследованы эндоскопически на наличие желудочной метаплазии проксимального отдела пищевода (область лососевого цвета диаметром не менее 5 мм с метаплазией желудка кардиального типа при биопсии).
Полученные результаты: В это исследование было включено 36 пациентов: 11 пациентов с диспластическим пищеводом Барретта (8 мужчин, средний возраст 79 лет) и 25 пациентов с аденокарциномой (18 мужчин, средний возраст 71 год). При эндоскопии перед фотодинамической терапией у 11 пациентов (31%; 8 аденокарциномы, 3 диспластический пищевод Барретта) был отмечен участок слизистой оболочки желудка в проксимальном отделе пищевода.У каждого пациента между метаплазией желудка и патологией дистального отдела пищевода было не менее 5 см нормальной плоской слизистой оболочки.
Выводы: В этой отобранной группе пациентов с дисплазией пищевода Барретта высокой степени или аденокарциномой, направленных на фотодинамическую терапию, желудочная метаплазия проксимального отдела пищевода была обнаружена почти у одной трети. В настоящее время проводятся проспективные исследования для более широкого тестирования этой связи и определения того, является ли она маркером тяжести заболевания и результатом схожих патогенетических механизмов.
Пищевод Барретта (с дисплазией или без)
При биопсии пищевода с помощью эндоскопа взятые образцы были изучены под микроскопом врачом-специалистом с многолетней подготовкой под названием патолог . Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Информация в этом отчете будет использована для управления вашим лечением. Следующие вопросы и ответы призваны помочь вам понять медицинский язык, который вы можете найти в отчете о патологии по результатам биопсии.
Что означает GEJ?
Пищевод — трубчатый орган, соединяющий ротовую полость с желудком. Место, где пищевод встречается с желудком, называется желудочно-пищеводным соединением , или GEJ .
Что означает, если в моем отчете упоминаются термины Барретта, бокаловидные клетки или кишечная метаплазия?
Внутренняя оболочка пищевода известна как слизистая оболочка . Его называют плоской слизистой оболочкой , когда верхний слой состоит из плоских клеток.Плоскоклеточные клетки — это плоские клетки, которые при рассмотрении под микроскопом выглядят как рыбья чешуя. Большая часть пищевода выстлана плоской слизистой оболочкой.
Бокаловидные клетки обычно выстилают кишечник, а не пищевод. Когда бокаловидные клетки обнаруживаются в месте, где они не должны находиться, например в слизистой оболочке пищевода, это называется кишечной метаплазией . Кишечная метаплазия может развиться в любом месте, где обычно находится плоская слизистая оболочка. Когда кишечная метаплазия замещает плоскую слизистую оболочку пищевода, она называется пищеводом Барретта .
Что вызывает пищевод Барретта?
Пищевод Барретта возникает, когда хронический или длительный рефлюкс (регургитация) содержимого желудка в пищевод повреждает нормальную внутреннюю оболочку пищевода. Этот процесс обычно занимает много лет. (Заброс содержимого желудка в пищевод иногда называют гастроэзофагеальной рефлюксной болезнью или ГЭРБ . Это может вызвать изжогу.)
Связан ли пищевод Барретта с повышенным риском рака?
Да.Пациенты с пищеводом Барретта имеют более высокий риск рака пищевода. Однако большинство людей с пищеводом Барретта не болеют раком.
Что, если в моем отчете упоминается пищевод Барретта и дисплазия?
Иногда клетки пищевода Барретта становятся более аномальными. Это называется дисплазией . Дисплазия — это предраковое заболевание. Хотя клетки ненормальны, они не могут распространяться на другие участки. Это состояние поддается лечению. Дисплазию часто делят на 2 степени в зависимости от того, насколько аномальные клетки выглядят под микроскопом: низкую и высокую степень.(Это обсуждается более подробно позже.)
Что делать, если в моем отчете будет отрицательный результат на дисплазию?
Это означает, что в ваших биоптатах нет предраковых (предраковых) изменений.
Если в моем отчете говорится, что есть неопределенные для дисплазии изменения в пищеводе Барретта, что это означает?
Это означает, что ваша биопсия показала пищевод Барретта, который содержит некоторые аномальные клетки, но недостаточно аномальные, чтобы считать их дисплазией. Часто у людей с такими изменениями наблюдается сильный рефлюкс, который раздражает клетки пищевода, так что под микроскопом клетки выглядят ненормально.
Если в моем отчете говорится, что в пищеводе Барретта есть неопределенные изменения в отношении дисплазии, заболею ли я раком?
Люди с пищеводом Барретта с неопределенными для дисплазии изменениями имеют небольшое повышение риска рака пищевода, но у большинства из них этот рак не развивается.
Какое наблюдение необходимо при неопределенных изменениях в отношении дисплазии?
Если у вас есть такие результаты, ваш врач может попросить вас вернуться для повторной эндоскопии и дополнительных биопсий в течение 3–6 месяцев после увеличения приема лекарств для лечения рефлюкса.Однако графики наблюдения могут быть разными, поэтому вам следует обсудить с врачом, что лучше для вас.
Если в моем отчете говорится, что в пищеводе Барретта имеется дисплазия легкой степени, что это означает?
Дисплазия низкой степени означает, что некоторые клетки выглядят ненормально, если их увидеть под микроскопом. Эти клетки могут в чем-то очень похожи на раковые, но, в отличие от рака, они не способны распространяться по всему телу. Это очень ранняя форма предрака пищевода.
Если в моем отчете будет указано, что в пищеводе Барретта имеется дисплазия низкой степени, заболею ли я раком?
Люди с дисплазией пищевода Барретта низкой степени имеют повышенный риск рака пищевода, но у большинства из них этот рак не развивается.
Какое наблюдение необходимо при дисплазии легкой степени в пищеводе Барретта?
Ваш врач может захотеть сделать еще одну эндоскопию, чтобы получить больше биопсий пищевода, чтобы убедиться, что у вас нет чего-то худшего.Кроме того, ваш врач может попросить отправить ваши образцы эксперту для изучения их под микроскопом
.Ваш врач, вероятно, порекомендует какое-либо лечение для удаления аномальной области (обычно для удаления и области пищевода Барретта, и дисплазии). Вам следует обсудить варианты лечения со своим врачом.
Если в моем отчете говорится, что в пищеводе Барретта имеется дисплазия высокой степени, что это означает?
Дисплазия высокой степени означает, что некоторые клетки, содержащиеся в области пищевода Барретта, выглядят очень ненормально под микроскопом.Это более поздняя стадия предрака пищевода, чем дисплазия низкой степени.
Если в моем отчете будет указано, что в пищеводе Барретта имеется дисплазия высокой степени, заболею ли я раком?
Люди с дисплазией пищевода Барретта высокой степени имеют высокий риск заболеть раком пищевода.
Какое наблюдение необходимо при дисплазии пищевода Барретта высокой степени?
Ваш врач может захотеть повторить эндоскопию, чтобы сделать больше биопсий, чтобы убедиться, что у вас еще нет рака, который не был обнаружен в первый раз.Ваш врач может попросить отправить ваши слайды биопсии другому патологу для получения второго мнения относительно клеток на ваших слайдах.
Поскольку дисплазия высокой степени напрямую связана с раком, ваш врач порекомендует какое-либо лечение дисплазии. Разных пациентов можно лечить по-разному, поэтому обсудите варианты лечения со своим врачом. Большинство процедур можно проводить, не удаляя пищевод.
Что означает, если в моем отчете говорится, что у меня также есть воспаление?
Раздражать пищевод и приводить к воспалению может ряд различных факторов, включая кислотность желудочного сока, травмы от приема лекарств и инфекции.Ваш врач будет работать с вами, чтобы найти причину раздражения и лечить ее. Это может помочь предотвратить более серьезные проблемы.
Пищевод Барретта или гетеротопия желудка — FullText — Отчеты о случаях в гастроэнтерологии 2014, Vol. 8, № 3
Аннотация
Столбчатый эпителий в дистальной части пищевода обычно связан с пищеводом Барретта. Пищевод Барретта — хорошо известное предраковое поражение аденокарциномы пищевода.Поэтому важны его диагностика и наблюдение. Столбчатый эпителий пищевода, отличный от пищевода Барретта, может представлять собой гетеротопию желудка, которая обычно имеет место в верхней части пищевода и называется входным участком. Наличие метаплазии желудка в дистальной части пищевода встречается редко и может привести к ошибочному диагнозу. Следовательно, его дифференциация от пищевода Барретта важна. Здесь мы представляем случай гетеротопии желудка, расположенной в дистальной части пищевода, которая вызвала рефлюкс-подобные симптомы и требовала дифференциации от пищевода Барретта.
© 2014 S. Karger AG, Базель
Введение
Пищевод Барретта является осложнением гастроэзофагеальной рефлюксной болезни. Это хорошо известное предраковое поражение, которое может вызвать аденокарциному дистального отдела пищевода. Следовательно, его диагностика важна и требует эндоскопического наблюдения. Эндоскопически пищевод Барретта можно определить как смещение чешуйчато-столбчатого перехода проксимальнее гастроэзофагеального перехода [1], но для полного определения должны быть выполнены два критерия: во-первых, документальное подтверждение столбчатого эпителия в дистальной части пищевода, во-вторых, гистопатология столбчатого эпителия должна выявить кишечную метаплазию.Хотя некоторые авторы считают, что эпителий желудочного типа кардиального типа в пищеводе также может предрасполагать к раку и, таким образом, может считаться «пищеводом Барретта», большинство специалистов по-прежнему требует наличия кишечной метаплазии для однозначного диагноза [2,3].
Гетеротопическая слизистая оболочка желудка описана в различных частях желудочно-кишечного тракта от языка до прямой кишки [4]. Также сообщалось о случаях, когда он был обнаружен в желчном пузыре или пузырном протоке, омфаломозентериальном протоке, пупке и печени [5,6,7], но чаще всего поражается пищевод.Гетеротопическая слизистая оболочка пищевода обычно располагается в шейном отделе пищевода и называется входным участком [4]. Впускной патч считается врожденным [4,8]. Хотя он может быть причиной симптомов гортанного рефлюкса, боли и дисфагии [4,8,9], у большинства пациентов с впускным патчем симптомы отсутствуют и выявляются случайно во время оценки других желудочно-кишечных жалоб [4,8,10]. Присутствие Helicobacter pylori в этой области не является редкостью [11], а гетеротопическая слизистая оболочка желудка может быть причиной развития перепонок, стриктур, язв, свищей и, что очень редко, аденокарциномы [4].
Наличие гетеротопии желудка в пищеводе, кроме шейного отдела, не очень хорошо известно. Здесь мы представляем случай гетеротопии пищевода и желудка, которая была расположена в дистальной части пищевода и нуждалась в дифференцировке от пищевода Барретта.
История болезни
31-летняя женщина поступила в нашу больницу с симптомами рефлюкса, такими как ежедневная изжога и, в редких случаях, дисфагия. У нее не было симптомов при лечении ингибитором протонной помпы (ИПП).Основной причиной ее посещения нашей больницы было получение другого мнения из-за ее опасений, связанных с риском рака. У нее был диагноз пищевода Барретта, и она находилась под наблюдением в течение последних 5 лет. В течение периода наблюдения у нее не было симптомов при лечении ИПП.
Мы провели эндоскопию верхних отделов желудочно-кишечного тракта, которая выявила входной участок в верхней части пищевода (рис. 1). Кроме того, имелся круглый столбчатый эпителиальный сегмент длиной 3 см — на расстоянии 35-38 см от резцов — и дистальная часть этого сегмента окаймляла 2 см плоского эпителия (рис.2). Биопсия показала секретирующий кислоту оксинтический тип железистого желудочного эпителия, не было кишечной метаплазии или дисплазии, и ее тест был отрицательным для H. pylori .
Рис. 1
Входной патч (стрелка) в шейном отделе пищевода (снимок сделан с помощью узкополосной визуализации).
Рис. 2
Гетеротопия желудка в дистальном отделе пищевода. Беловатый участок — плоский эпителий (одна звездочка), участок лососевого цвета — цилиндрический эпителий (две звездочки).Гистопатологическое исследование показало секретирующий кислоту, оксинтический тип, железистый, желудочный эпителий (снимок был сделан с помощью узкополосной визуализации). Стрелка указывает на гастроэзофагеальный переход.
Мы следим за ней еще 2 года. Она все еще принимает ИПП, и у нее нет симптомов, связанных с пищеводным или экстраэзофагеальным рефлюксом.
Обсуждение
Столбчатый эпителий в дистальной части пищевода обычно связан с пищеводом Барретта. Пищевод Барретта — хорошо известное предраковое поражение аденокарциномы.Поэтому важна его диагностика. Диагноз пищевода Барретта основан на подозрении во время эндоскопического обследования, вызванном наличием столбчатого эпителия в дистальной части пищевода, и требует гистопатологического подтверждения, то есть наличия кишечной метаплазии [3]. В пищеводе Барретта цилиндрический эпителий простирается от желудка до гастроэзофагеального перехода в пищевод [3]. Похоже на продолжение слизистой оболочки желудка. Но в нашем случае столбчатый эпителий не был продолжением слизистой оболочки желудка, он четко отделялся от желудка 2 см плоского эпителия.Гистопатологическое исследование не выявило кишечной метаплазии или бокаловидных клеток, которые важны для диагностики пищевода Барретта [12]. У нашего пациента был также входной патч, который может указывать на то, что оба поражения являются врожденными и не связаны с рефлюксом, как в пищеводе Барретта.
На основе информации из литературы мы переоценили результаты в нашем случае как гетеротопию желудка, а не пищевода Барретта. Это редкое состояние, но оно может быть обнаружено в случаях неправильного диагноза пищевода Барретта, как у нашего пациента.
Мы полагаем, что у нашей пациентки нет гастроэзофагеальной рефлюксной болезни, но что ее рефлюкс-подобные симптомы связаны с секрецией кислоты желудочной гетеротопией в пищеводе. Мы посоветовали ей продолжить лечение ИПП, так как он контролировал ее симптомы. Можно обсудить абляцию области гетеротопии желудка. Однако мы не пробовали это из-за отсутствия поддержки в литературе. Неопластическая трансформация при гетеротопии желудка встречается чрезвычайно редко; поэтому, в отличие от пищевода Барретта, гетеротопия желудка не считалась предраковым поражением [4].Но входной патч был принят как предраковое поражение; тем не менее, у нас нет информации о большой площади гетеротопии желудка в пищеводе, потому что это очень редко. Поэтому мы не знаем, необходимо ли наблюдение в таком случае или нет.
В заключение, мы представляем случай гетеротопии желудка, локализованной в дистальной части пищевода и ошибочно диагностированной как пищевод Барретта. Этот тип желудочной гетеротопии также может вызывать симптомы рефлюкса, которые у нашего пациента очень хорошо разрешились при лечении ИПП.
Список литературы
- Ван К.К., Sampliner RE; Комитет по параметрам практики Американского колледжа гастроэнтерологии: обновленное руководство 2008 г. по диагностике, наблюдению и терапии пищевода Барретта. Am J Gastroenterol 2008; 103: 788-797.
- Ридделл Р.Х., Одзе Р.Д .: Определение пищевода Барретта: время переосмыслить — мертва ли кишечная метаплазия? Am J Gastroenterol 2009; 104: 2588-2594.
- Американская гастроэнтерологическая ассоциация, Spechler SJ, Sharma P, et al: Заявление о медицинской позиции Американской гастроэнтерологической ассоциации по лечению пищевода Барретта.Гастроэнтерология 2011; 140: 1084-1091.
- Фон Раден Б.Х., Штейн Г.Дж., Беккер К., Либерман-Мефферт Д., Сиверт Дж. Р.: Гетеротопическая слизистая оболочка желудка пищевода: обзор литературы и предложение клинико-патологической классификации. Am J Gastroenterol 2004; 99: 543-551.
- Горлин Р.Дж., Калниньш В., Изант Р.Дж. мл .: Возникновение гетеротопической слизистой оболочки желудка на языке.J Pediatr 1964; 64: 604-606.
- Мартинес-Уррутия М.Дж., Васкес Эстевес Дж., Ларраури Дж., Диез Пардо Дж. А.: Желудочная гетеротопия желчных путей. J Pediatr Surg 1990; 25: 356-357.
- Heo YS, Jeong SY, Son SW, Kim I, Seo SH: Гетеротопическая слизистая оболочка желудка в пупке.Энн Дерматол 2010; 22: 223-225.
- Чонг В.Х. Клиническое значение гетеротопного пластыря слизистой оболочки проксимального отдела пищевода. Всемирный журнал J Gastroenterol 2013; 19: 331-338.
- Akbayir N, Sökmen HM, Caliş AB, Bölükbaş C, Erdem L, Alkim C, Sakiz D, Mungan Z: Гетеротопическая слизистая оболочка желудка в шейном отделе пищевода: может ли это играть роль в патогенезе ларингофарингеального рефлюкса у задней подгруппы пациентов. ларингит? Сканд Дж. Гастроэнтерол 2005; 40: 1149-1156.
- Акбаир Н., Алким С., Эрдем Л., Сёкмен Х.М., Сунгун А., Башак Т., Тургут С., Мунган З .: Гетеротопическая слизистая оболочка желудка в шейном отделе пищевода (входной участок): распространенность эндоскопии, гистологические и клинические характеристики. J. Gastroenterol Hepatol 2004; 19: 891-896.
- Алагозлу Х., Симсек З., Унал С., Циндорук М., Думлу С., Дурсун А: Есть ли связь между Helicobacter pylori во входном участке и ощущением шара? Всемирный журнал J Gastroenterol 2010; 16: 42-47.
- Spechler SJ, Souza RF: пищевод Барретта; in Feldman M, Friedman LS, Barndt LJ (ред.): болезни желудочно-кишечного тракта и печени Слейзенгера и Фордтрана, изд 9. Филадельфия, Saunders Elsevier, 2010, стр. 727-733.
Автор Контакты
Zeynel Mungan
Koc University School of Medicine
Rumelifeneri Yolu
TR-35589 Стамбул (Турция)
Электронная почта zmungan @ ku.edu.tr
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 3 октября 2014 г.
Дата выпуска: сентябрь — декабрь
Количество страниц для печати: 4
Количество рисунков: 2
Количество столов: 0
eISSN: 1662-0631 (онлайн)
Для дополнительной информации: https: // www.karger.com/CRG
Лицензия открытого доступа / Дозировка лекарства / Отказ от ответственности
Лицензия открытого доступа: это статья в открытом доступе под лицензией Creative Commons Attribution-NonCommercial 3.0 Unported (CC BY-NC) (www.karger.com/OA-license), применимой к онлайн-версии только статья. Распространение разрешено только в некоммерческих целях.
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Кишечная метаплазия — обзор
Кишечная метаплазия
Кишечная метаплазия желудка характеризуется наличием дифференцированного эпителия, напоминающего тонкий кишечник на основе световой микроскопии и ультраструктурной морфологии, структуры муцина и гистохимии ферментов. 326–330 Развивается в слизистой оболочке желудка человека, измененной хроническим атрофическим гастритом. Его значение связано с тем, что кишечная метаплазия связана с наличием рака желудка. Хотя кишечная метаплазия гораздо реже встречается у лабораторных животных, сообщалось также, что она возникает в связи с неоплазией желудка, вызванной полихлорированными бифенилами. 331 Принимая во внимание эту связь с раком желудка, было высказано предположение, что кишечная метаплазия представляет собой предопухолевое поражение.Однако в последние годы проспективные клинические исследования и экспериментальные данные показали, что это эпифеномен, сосуществующий с развитием рака, но не связанный с ним.
У людей описано несколько форм кишечной метаплазии. Эти варианты делятся на две основные группы: так называемая неполная форма и полная форма . 266,332–334 Другие предположили, что его лучше всего рассматривать с точки зрения желудочного , кишечного и смешанных фенотипов. 335 Полная кишечная метаплазия характеризуется наличием бокаловидных клеток, клеток Панета и абсорбирующих клеток с щеточными краями и разнообразно развитыми кишечными ворсинками. Неполные формы более неоднородны, характеризуются бокаловидными и столбчатыми клетками слизистой оболочки, но не обладают абсорбирующими клетками и различными структурами муцина. Обычное окрашивание альциановым синим, выполняемое при pH 2,5 и периодическое окрашивание кислотой-Шиффом, позволяет различать кишечные кислые муцины (синий) и нейтральные муцины желудочного типа.Однако различные паттерны окрашивания сиаломуцином и сульфомуцином также наблюдаются при кишечной метаплазии у людей, если выполняется окрашивание с высоким содержанием диамина железа / альцианового синего. Неполная форма кишечной метаплазии, демонстрирующая выраженную секрецию сульфомуцина, чаще обнаруживается в связи с раком желудка у людей. 266,332,334 Однако вполне вероятно, что кишечная метаплазия сама по себе представляет собой адаптивный ответ на длительное хроническое воспаление и снижение секреции кислоты.Также было высказано предположение, что он представляет собой адаптивный защитный ответ на давнюю инфекцию Helicobacter pylori , поскольку слизистая оболочка кишечника более устойчива к этим организмам. 336,337 Иммуноцитохимическое исследование показало присутствие эндокринных клеток кишечника в различных формах кишечной метаплазии, которые, по-видимому, соответствуют фенотипу дифференцировки конкретных слизистых клеток. 335
Крысы Fischer 344, получавшие полихлорированный бифенил арохлор 1254, смешанные с диетой в течение двух лет, развили очаги кишечной метаплазии в эпителии желудка в сочетании с аденокарциномами желудка. 331,338 Эти поражения характеризовались обилием муцин-содержащих клеток с активностью щелочной фосфатазы, типичной для тонкого кишечника. О подобной, но более диффузной кишечной метаплазии сообщалось в желудке приматов, подвергшихся воздействию полихлорированных бифенилов, хотя это не было связано с неоплазией желудка. 339,340 Непостоянно сообщалось о кишечной метаплазии в желудках лабораторных животных, получавших мощные генотоксические желудочные канцерогены.Например, одно исследование крыс, получавших N-метил-N΄-нитро-N-нитрогуанидин, продемонстрировало только гиперплазию и очаги атипичных изменений (дисплазии) с незначительной кишечной метаплазией или без нее, тогда как другое показало кишечную метаплазию после введения того же препарата. агент. 203,258
Несмотря на эту связь с введением канцерогенов, кишечная метаплазия у грызунов может быть вызвана множеством различных процедур, которые не связаны с развитием рака желудка.Кишечная метаплазия может быть вызвана в железистом желудке грызунов фракционированным локализованным ионизирующим излучением, инъекцией ксеногенных желудочных антигенов, а также пропантелин бромида и неканцерогенного йодацетамина. 330,341–344 Также было показано, что кишечная метаплазия возникает как часть ответа на инфекцию Helicobacter pylori на модели мелких животных, монгольской песчанки, а также у мышей C57BL, инфицированных Helicobacter felis . 291,292
Характеристики кишечной метаплазии у лабораторных грызунов аналогичны характеристикам, наблюдаемым у людей с ранним повышением активности кишечных ферментов (щелочная фосфатаза, лактаза, треалаза, сахароза и мальтаза), развитием бокаловидных клеток, содержащих нейтральные, сиало- , или сульфомуцины, и кишечные крипты с клетками Панета или без них.И глазное дно, и антральный отдел могут показывать изменения, хотя, как и у людей, мужчины более склонны к развитию кишечной метаплазии, чем женщины. 330
На основании этих данных было высказано предположение, что кишечная метаплазия не является предраковым состоянием, а является адаптивной реакцией на хроническое повышение pH в желудочном секрете из-за ранней потери массы париетальных клеток, вызванной этими различными процедурами. . 330 Таким образом, данные свидетельствуют о том, что, хотя кишечная метаплазия связана с раком и, следовательно, может считаться полезным морфологическим признаком при оценке биопсии желудка человека, обнаружение изолированной кишечной метаплазии в исследованиях безопасности не указывает на предопухолевое состояние. .
Пищевод Барретта (с дисплазией или без)
Пищевод Барретта (с дисплазией или без)
Когда ваш врач обследовал ваш пищевод с помощью эндоскопа, он или она взял биопсию. Эти биопсии были отправлены специализированному врачу с многолетним обучением, называемому патологом, который исследовал их под микроскопом. Отчет о патологии сообщает вашему врачу диагноз в каждой из ваших проб и помогает управлять вашим лечением. Этот лист часто задаваемых вопросов разработан, чтобы помочь вам понять медицинский язык, используемый в отчете о патологии.
- Что означает «GEJ»?
Пищевод — трубчатый орган, соединяющий ротовую полость с желудком. GEJ означает «желудочно-пищеводный переход», где пищевод встречается с желудком.
- Что означает упоминание в моем отчете терминов «болезнь Барретта», «бокаловидные клетки» или «кишечная метаплазия»?
Выстилка пищевода известна как «слизистая оболочка». Большая часть пищевода выстлана плоскими клетками, похожими на те, что видны на поверхности кожи.Бокаловидные клетки — это нормальные клетки слизистой оболочки кишечника, но не пищевода. Когда бокаловидные клетки развиваются в месте, где они не должны быть, в данном случае в пищеводе, это называется «кишечной метаплазией». Пищевод Барретта — это когда слизистая оболочка пищевода меняется с нормальной (плоскоклеточные клетки) на тип, который обычно обнаруживается в кишечнике (бокаловидные клетки).
- Что вызывает пищевод Барретта?
Пищевод Барретта возникает, когда хроническая регургитация (рефлюкс, изжога) содержимого желудка в пищевод повреждает нормальную слизистую оболочку пищевода.Это процесс, который обычно занимает много лет.
- Связан ли пищевод Барретта с повышенным риском рака?
Да. Пациенты с пищеводом Барретта имеют повышенный риск развития рака пищевода. Однако большинство людей с пищеводом Барретта не болеют раком.
- Что, если в моем отчете упоминается пищевод Барретта и дисплазия?
Дисплазия — это предраковое состояние, но еще не приобрела способность распространяться на другие участки.Это состояние поддается лечению. Существуют разные степени выраженности дисплазии (см. Ниже).
- Что делать, если в моем отчете указано «отрицательный результат на дисплазию»?
Это означает, что у вас нет предраковых (т.е. предраковых) изменений в ваших биопсиях.
- Что означает «эпителиальные изменения, неопределенные для дисплазии»?
В вашей биопсии есть пищевод Барретта, а также некоторые клетки, которые достаточно аномальны, чтобы их заметил патолог, просматривающий ваши биопсии, но не настолько аномальные, чтобы считать их предраковыми.Часто у людей с такими изменениями наблюдается сильная изжога или рефлюкс, которые вызывают раздражение клеток пищевода, так что под микроскопом они выглядят ненормально.
- Если в моем отчете говорится, что есть «неопределенные изменения для дисплазии» и пищевода Барретта, заболею ли я раком?
Только от 5 до 10 человек из 100 с «неопределенными изменениями на дисплазию» обнаруживают рак пищевода в течение 5 лет.
- Какое наблюдение необходимо при «неопределенных изменениях дисплазии»?
Обычно, если у вас есть такие результаты, ваш врач попросит вас вернуться для дополнительных биопсий через 6 месяцев или год.Тем не менее, ваш обычный график скрининга следует обсудить с лечащим врачом, поскольку он может быть индивидуализирован для вашего конкретного случая.
- Если в моем отчете говорится, что в пищеводе Барретта имеется «дисплазия низкой степени», что это означает?
Дисплазия низкой степени означает, что клетки пищевода обладают некоторыми характеристиками рака, но не способны распространяться по всему телу. Другими словами, в пищеводе есть предраковые клетки, но они находятся в ранней форме.
- Если в моем отчете будет указано, что в пищеводе Барретта имеется «дисплазия легкой степени», заболею ли я раком?
Установлено, что до 20 человек из 100 с дисплазией пищевода Барретта низкой степени заболевают раком пищевода в течение 5 лет.
- Какое наблюдение необходимо при «дисплазии легкой степени» пищевода Барретта?
Обычно выполняется больше биопсий, чтобы убедиться, что у вас нет чего-то худшего. Некоторых людей с дисплазией низкой степени просто внимательно наблюдают, и им делают биопсию через промежутки времени, установленные врачом.Другие врачи могут порекомендовать лечение для удаления аномальной слизистой оболочки пищевода. Вам следует обсудить различные варианты со своим лечащим врачом, поскольку они могут быть индивидуализированы для вашего конкретного случая.
- Если в моем отчете говорится, что в пищеводе Барретта имеется «дисплазия высокой степени», что это означает?
Дисплазия высокой степени означает, что участки пищевода, взятые при биопсии, имеют большинство характеристик рака, за одним исключением.Они не могут распространяться по всему телу и считаются предраком пищевода.
- Если в моем отчете будет указано, что в пищеводе Барретта имеется «дисплазия высокой степени», заболею ли я раком?
Установлено, что от 30 до 60 человек из 100 с дисплазией пищевода Барретта высокой степени заболевают раком пищевода в течение 5 лет
- Какое наблюдение необходимо при «дисплазии высокой степени» пищевода Барретта?
Обычно вам нужно сделать больше биопсий, чтобы убедиться, что у вас еще нет рака, так как ваши первоначальные биопсии могли пропустить рак в другом месте пищевода.Вам следует обсудить различные варианты со своим лечащим врачом, поскольку они могут быть индивидуализированы для вашего конкретного случая.
- Что означает, если в моем отчете говорится, что у меня также есть воспаление?
Кислота из желудка, травмы от приема лекарств или инфекции могут вызвать раздражение пищевода, ведущее к воспалению. Лечащий врач вместе с вами устранит причины раздражения, что поможет предотвратить развитие дополнительных аномалий в пищеводе.
Детерминанты кишечной метаплазии в кишечнике, выстланном столбчатой оболочкой | Заболевание пищевода | JAMA Surgery
Гипотеза Клинико-физиологические особенности пациентов с короткими сегментами столбчатого пищевода (CLE) с кишечной метаплазией (IM) и без них различны.
Дизайн Ретроспективная серия кейсов.
Настройка Справочный центр вуза.
Пациенты Шестьдесят пять последовательных пациентов с эндоскопически видимой CLE длиной 2 см или меньше.
Вмешательства Тип CLE и наличие Helicobacter pylori были определены путем гистопатологического исследования биоптатов пищевода и антрального отдела желудка. Всем пациентам была выполнена манометрия пищевода с одновременным 24-часовым мониторингом pH и билирубина.
Основные показатели результатов Клинические и физиологические данные сравнивались у пациентов с ИМ и без него.
Результаты Тридцать шесть пациентов имели IM и 29 имели слизистую оболочку сердечного типа без IM в образцах биопсии из CLE. Существенной разницы в распределении по возрасту или полу не было, но продолжительность симптомов была значительно больше у пациентов с ИМ (10 против 5 лет; P = 0,03). Аномальное воздействие кислоты пищевода было обнаружено у 30 (83%) из 36 пациентов с ИМ и у 23 (79%) из 29 пациентов без ИМ. Распространенность аномального воздействия билирубина была значительно выше у пациентов с ИМ (75% [27/36]), чем у пациентов без ИМ (41% [12/29]; P =.01). Не было значительной разницы в распространенности инфекции H pylori между двумя группами (8% против 10%; P > 0,99).
Выводы Пациенты с короткими сегментами CLE и IM имеют аналогичное воздействие кислоты пищевода, но значительно более высокую частоту аномального воздействия билирубина и более длительную медианную продолжительность симптомов рефлюкса, чем пациенты без IM. Следовательно, CLE, независимо от гистологического типа, является проявлением гастроэзофагеальной рефлюксной болезни.Наличие дуоденоэзофагеального рефлюкса и продолжительность рефлюкса, по-видимому, важны в патогенезе ИМ.
ДО Второй мировой войны обнаружение столбчатого эпителия в канальцах пищевода было редкостью в клинической практике. Классическое описание Барретта было опубликовано в 1950 году, а кишечная метаплазия (IM), возникающая внутри столбчато-выровненного пищевода (CLE), оба из которых сейчас необходимы для диагностики пищевода Барретта, была впервые обнаружена в начале 1960-х годов.За последние несколько десятилетий распространенность пищевода Барретта резко возросла: с 1 на 1000 эндоскопий в начале 1980-х годов до 10 на 1000 эндоскопий в конце 1980-х годов до более чем 55 на 1000 эндоскопий в настоящее время. 1 Пищевод Барретта с длинным сегментом (> 3 см) в настоящее время выявляется у 4–6% пациентов с симптомами рефлюкса, у 1% всех эндоскопий верхних отделов и у 0,3% населения США. Пищевод Барретта с коротким сегментом (<3 см), вероятно, также широко распространен, эффективно удваивая размер популяции, подверженной риску. 2 -4 Наличие IM в CLE было связано с более чем 40-кратным повышением риска развития аденокарциномы пищевода, распространенность которой также резко возросла за последние 3 десятилетия. 5 -7
Клинические признаки, связанные с пищеводом Барретта, включают длительную гастроэзофагеальную рефлюксную болезнь (ГЭРБ), глубокую потерю гастроэзофагеального барьера и смешанный рефлюкс желудочного и двенадцатиперстного содержимого в пищевод.Пищевод Барретта, вероятно, является результатом замены поврежденного плоского эпителия слизистой оболочкой сердечного типа, внутри которой может развиваться IM. 2 , 8 -10 Патогенез ИМ изучен не полностью. Неизвестно, почему у некоторых пациентов с CLE развивается внутримышечный ритм, а у других — нет. Точно так же этиология и значение CLE без IM, состояния, эндоскопически идентичного короткому сегменту пищевода Барретта, неясны. Пациенты с этим заболеванием никогда не изучались, и его связь с ГЭРБ и Helicobacter pylori неизвестна.Возможно, что у пациентов с сегментами чистой слизистой оболочки сердца со временем и при надлежащих условиях просвета разовьется IM и связанный с этим риск прогрессирования дисплазии и аденокарциномы.
Факторы, влияющие на кишечник, было трудно изучить, потому что у большинства пациентов с длинными сегментами слизистой оболочки сердечного типа в пищеводе процесс кишечника уже произошел. 11 И наоборот, более короткие сегменты столбчатой выстилки пищевода с меньшей вероятностью будут подвергнуты кишечной обработке и предоставляют средства для сравнения различных клинических и патофизиологических признаков у пациентов с ИМ и без них.
Целью этого исследования было выявить потенциальные факторы риска развития IM в пределах CLE путем характеристики и сравнения физиологических, демографических и клинических данных у пациентов с IM и без IM в коротких сегментах столбчатой выстилки пищевода.
В период с апреля 1995 года по март 1999 года 414 последовательных пациентов были обследованы в отделении хирургии Медицинской школы Университета Южной Калифорнии, Лос-Анджелес, с помощью эндоскопии, манометрии пищевода и одновременного мониторинга pH пищевода и билирубина из-за симптомов, указывающих на заболевание передней кишки. — типичная изжога, срыгивание, дисфагия, некардиальная боль в груди, боль в эпигастрии или симптомы, указывающие на аспирацию, такие как рецидивирующая пневмония, хрипы и постоянный кашель.Пациенты с указанным нарушением моторики, ранее перенесшие операцию на желудке или пищеводе, были исключены. Исследуемая популяция состояла из 65 пациентов (42 мужчины и 23 женщины; средний возраст 52 года [диапазон 30-85 лет]), у которых был обнаружен эндоскопически очевидный сегмент цилиндрической выстилки пищевода размером 2 см или меньше. Длина столбчатого сегмента была ограничена менее 3 см, потому что распространенность ИМ в более длинных сегментах быстро возрастает и составляет почти 100% в сегментах длиной 3-4 см. 11
Эндоскопическая идентификация клетки
Всем пациентам было проведено три эндоскопических измерения.Первым было расположение ножек диафрагмы, определяемое по принюхиванию пациента. Во-вторых, расположение желудочно-пищеводного соединения определялось проксимальной протяженностью складок желудка, где начинается трубчатый пищевод. Грыжа пищеводного отверстия диафрагмы диагностировалась, когда разница между положением оттиска голени и гастроэзофагеального перехода составляла 2 см и более. Третьим измерением был чешуйчато-столбчатый переход, который был идентифицирован по переходу от розовой железистой слизистой оболочки к белому плоскому эпителию.Подозрение на CLE возникало, когда плоскостолбиковое соединение или любая часть его окружности выходили за пределы складок желудка. Это включало неправильное чешуйчато-столбчатое соединение с языками столбчатой слизистой оболочки, доходящими до пищевода. Наличие CLE было подтверждено гистологической оценкой образцов биопсии. Протяженность сегмента с столбчатой линией определялась как расстояние от гастроэзофагеального перехода до местоположения наивысшей точки чешуйчато-столбчатого перехода. Множественные образцы биопсии были получены из столбчатого сегмента у всех пациентов.Регистрировали каждый участок биопсии и отмечали наличие эрозивного эзофагита.
Все образцы биопсии подвергались стандартной фиксации и окрашиванию гематоксилин-эозином. Слизистая оболочка сердечного типа была охарактеризована железами, полностью состоящими из слизистых клеток, без париетальных или главных клеток. Специализированный IM был идентифицирован по присутствию четко выраженных бокаловидных клеток в цилиндрическом эпителии. Присутствие бокаловидных клеток подтверждали окрашиванием альциановым синим при pH 2.5.
Стандартная стационарная моторика выполнялась после ночного голодания. Давление в состоянии покоя нижнего сфинктера пищевода измеряли в точке инверсии дыхания, как описано ранее. 12 Давление покоя, общая длина и длина живота были рассчитаны на основе среднего значения 5 записей. Структурно дефектный сфинктер определялся давлением покоя менее 6 мм рт. Ст., Общей длиной сфинктера менее 2 см, длиной брюшной полости менее 1 см или комбинацией этих факторов.
КОМБИНИРОВАННЫЙ АМБУЛАТОРНЫЙ ПИЩЕВОДНЫЙ pH И СПЕКТРОМЕТРИЧЕСКИЙ МОНИТОРИНГ БИЛИРУБИНА
Мониторинг билирубина пищевода проводился одновременно с мониторингом pH. Стеклянный электрод (Ingold Incorp, Урдорф, Швейцария) и оптоволоконный зонд, предназначенный для обнаружения билирубина (Bilitec 2000; Medtronic Synectics, Shoreview, Minn), вводили трансназально и располагали на 5 см выше верхней границы манометрически определенного нижнего сфинктера пищевода.PH пищевода регистрировали на портативном цифровом регистраторе данных и анализировали, как описано ранее. 13 Пациенты были проинструктированы выполнять свои обычные повседневные дела, но избегать чрезмерных нагрузок. Введен дневник приема пищи и жидкости, симптомов и времени, проведенного в положении лежа на спине и вертикальном положении. Пациенты с pH пищевода менее 4 в течение более 4,4% зарегистрированного времени были классифицированы как имеющие аномальное воздействие кислоты пищевода.
Экспозиция билирубина пищевода измерялась спектрофотометрией на основе удельного поглощения света билирубином на длине волны 453 нм и регистрировалась на портативном оптоэлектрическом регистраторе данных. 14 -16 Был выбран порог поглощения 0,2, и воздействие билирубина количественно определялось как процент времени выше этого порога. 16 , 17 Волоконно-оптический зонд был откалиброван в воде до и после мониторинга. Записи с дрейфом поглощения билирубина 0,15 или более были отброшены. Пациенты были проинструктированы соблюдать специальную диету, которая включала ограничение 3-х разового питания и отказ от пищи с поглощением, аналогичным поглощению билирубина. 18 Круглосуточные данные по абсорбции билирубина были проанализированы с помощью программного обеспечения (Gastrosoft, Irving, Tex) для расчета общего процента времени, в течение которого абсорбция билирубина была больше 0,2 в течение всего периода наблюдения. На основании исследования 35 здоровых контрольных субъектов верхний предел нормы воздействия билирубина составлял 1,7% от общего времени выше порога поглощения 0,2. 16 , 17,19
Данные представлены как медианы и межквартильный размах, если не указано иное.Точный критерий Фишера использовался для сравнения пропорций между 2 группами, а тест χ 2 использовался для сравнения пропорций между более чем двумя группами. Для непрерывных данных тест Манна-Уитни U использовался для сравнения 2 групп, а тест Крускала-Уоллиса использовался для сравнения более чем 2 групп.
Тридцать шесть пациентов имели ИМ и 29 имели слизистую оболочку сердечного типа без ИМ в образцах биопсии из CLE. Перед исследованием кислотосупрессивная терапия была назначена 32 (89%) пациентам с ИМ и 26 (90%) пациентам без ИМ.Для одного пациента в каждой группе не было доступной информации о медикаментозном лечении. В таблице 1 сравниваются возраст, пол и продолжительность симптомов у пациентов с короткими сегментами цилиндрической выстилки пищевода, с ИМ и без него. Не было существенной разницы в среднем возрасте или половом распределении между двумя группами. Степень столбчатой выстилки пищевода была одинаковой в 2 группах. Пациенты с ИМ имели значительно более длительную продолжительность симптомов передней кишки по сравнению с группой только со слизистой оболочкой сердечного типа.
В таблице 2 показана степень воздействия на пищевод желудочного и двенадцатиперстного сока у пациентов с кишечной слизистой оболочкой сердечного типа и без нее. Не было значительной разницы в воздействии кислоты на пищевод между группами. Однако средний процент времени, проведенного выше поглощения билирубина 0,2, и распространенность аномального воздействия билирубина были значительно выше у пациентов с ИМ.
Распространенность эрозивного эзофагита у пациентов, у которых был обнаружен ИМ, существенно не различалась по сравнению с пациентами без ИМ (41% [12/29] против 50% [18/36]; P =.62).
Состояние гастроэзофагеального барьера и его связь с наличием и отсутствием IM в пределах короткого сегмента столбчатой выстилки пищевода показаны в таблице 3. Давление на нижний пищеводный сфинктер в состоянии покоя, общая длина и длина живота были одинаковыми в обеих группах. Это привело к сопоставимой распространенности механически дефектных сфинктеров в 2 группах. Не было значительных различий в распространенности грыжи пищеводного отверстия диафрагмы.
Функция клиренса пищевода, включая средние амплитуды сокращений дистальных отделов пищевода, количество эпизодов рефлюкса продолжительностью более 5 минут и продолжительность самого длительного эпизода рефлюкса, также была сходной у пациентов с ИМ и без него в пределах короткого сегмента столбчатой выстилки пищевода (Таблица 4) .
Helicobacter pylori не был обнаружен ни в одном из образцов биопсии CLE, но был обнаружен в образцах биопсии антрального отдела желудка у 3 (8%) из 36 пациентов с IM, что незначительно отличалось от пациентов без IM (10% [3/29]) ( P > 0,99).
Короткие сегменты цилиндрической выстилки пищевода все чаще диагностируются в дистальном отделе пищевода. Однако только у части этих пациентов есть внутримышечные инъекции при гистологической оценке образцов биопсии.В этом исследовании IM был обнаружен у 55% пациентов с сегментами цилиндрической выстилки пищевода размером 2 см или меньше. Это похоже на исследования других исследователей 2 , 20 , 21 , которые обнаружили IM у 48–61% пациентов с подозрением на наличие короткого сегмента пищевода Барретта. Кроме того, наши результаты предполагают, что продолжительность ГЭРБ и наличие дуоденоэзофагеального рефлюкса являются важными факторами патогенеза ИМ.
Пищевод Барретта считается результатом замены поврежденного плоского эпителия слизистой оболочкой сердечного типа, внутри которой со временем и стойким воспалением развивается IM. 2 , 8 -10 Хотя патогенез IM не полностью изучен, было высказано предположение, что IM развивается с возрастом. 22 , 23 Однако считается, что процесс метаплазии является следствием хронического воспаления, и поэтому маловероятно, что ИМ развивается только с возрастом. 20 Было показано 24 , что пациенты с пищеводом Барретта имеют не только аномалии воздействия кислоты на пищевод, но также высокую распространенность повышенного воздействия на пищевод дуоденального сока.Это первое исследование воздействия кислоты пищевода и билирубина у пациентов с ИМ и без него в сегменте цилиндрической выстилки пищевода. Аномальное воздействие билирубина пищевода было одной из двух детерминант, значимо связанных с наличием IM. Это открытие дополнительно подтверждает гипотезу о важности дуоденогастроэзофагеального рефлюкса в патогенезе ИМ.
Не все пациенты с аномальным воздействием билирубина пищевода имели IM. Сорок один процент пациентов с CLE без IM имел аномальное воздействие билирубина пищевода, что предполагает, что другие факторы могут играть роль в развитии IM.Возможные варианты включают лежащую в основе генетику пациента, другие компоненты рефлюкса, не измеренные с помощью теста на кислоту или билирубин, или ошибку выборки. Также возможно, что у некоторых из этих пациентов со временем разовьется IM, если рефлюкс будет продолжаться. Напротив, воздействие билирубина пищевода было нормальным у 25% (9/36) пациентов с ИМ, что предполагает, что аномальное воздействие билирубина пищевода не является существенным для развития ИМ, хотя ограничения амбулаторного измерения билирубина пищевода смягчают этот вывод.У некоторых из этих пациентов могут быть ложноотрицательные результаты исследования; другие могут быть отрицательными, поскольку воздействие кислоты пищевода и билирубина обычно измеряется на 5 см выше верхней границы сфинктера. Это намного выше области метапластических изменений, что создает возможность аномального воздействия на сфинктер или внутри него, а также на область метапластического эпителия, несмотря на нормальные результаты на 5 см выше.
Вторым определяющим фактором была продолжительность симптомов рефлюкса, которая была значительно дольше у пациентов с ИМ по сравнению с теми, у которых была обнаружена только слизистая оболочка сердечного типа.Взятые вместе, эти наблюдения предполагают, что пищевод Барретта, вероятно, является результатом замещения поврежденного плоского эпителия слизистой оболочкой сердечного типа, внутри которой, при наличии времени и надлежащих условий просвета, ИМ развивается как второй шаг в его патогенезе. 2 , 8 -10
Возможно, что эффект дуоденоэзофагеального рефлюкса заключается в изменении pH желудочного сока, поступающего в пищевод. Воздействие на культуры тканей слизистой оболочки Барретта импульсами с pH более 3.5 приводит к повышенной экспрессии ворсинок и морфологическим признакам образования ворсинок, оба из которых указывают на процесс кишечника. 25
Понимание факторов риска развития ИМ и связанного с ним риска аденокарциномы пищевода имеет важное значение для ведения пациентов с ГЭРБ. Раннее выявление пациентов из группы риска с последующим эффективным лечением для устранения основных факторов, связанных с развитием ИМ, может позволить прервать последовательность метаплазия-дисплазия-рак.Существующие варианты лечения включают кислотоподавляющую терапию и антирефлюксную хирургию; у обоих есть преимущества и риски, хотя антирефлюксная хирургия может быть лучшей альтернативой. Кислотоподавляющая терапия снижает патологический кислотный рефлюкс, но рефлюкс дуоденального сока, хотя и снижается, у многих пациентов превышает нормальный диапазон. 26 , 27 Более того, недавние данные показывают, что использование облегчения симптомов в качестве конечной точки терапии ненадежно. Кацка и Кастелл, 28 Уату-Ласкар и Триадафилопулос, 29 и другие показали, что от 40% до 80% пациентов с пищеводом Барретта продолжают иметь аномальное воздействие кислоты пищевода, несмотря на получение высоких доз (20 мг два раза в день) протона. ингибиторы помпы.Антирефлюксная хирургия приводит к более воспроизводимому и надежному устранению рефлюкса кислоты и дуоденального содержимого 27 , 30 , но может быть труднее поддерживать в долгосрочной перспективе у пациентов с пищеводом Барретта по сравнению с пациентами без него. 31 , 32
Поскольку риск прогрессирования дисплазии и рака у пациентов с метапластической столбчатой выстилкой пищевода зависит от наличия IM, 33 в настоящее время в программы наблюдения включены только пациенты с обоими признаками.
Величина риска развития дисплазии и аденокарциномы при коротком сегменте пищевода Барретта неясна. Считается, что риск меньше, чем при традиционном пищеводе Барретта, поскольку длина сегмента, выстланного столбчатыми стенками, 34 является значительным фактором риска прогрессирования опухоли. Sharma et al. 35 проспективно наблюдали группу из 59 пациентов с коротким сегментом пищевода Барретта в течение в среднем 36,9 месяцев.У пяти пациентов была дисплазия низкой степени во время первичной эндоскопии, и у 3 дополнительных пациентов развилась дисплазия низкой степени, а у 2 — дисплазия высокой степени во время последующего наблюдения. У одного пациента с дисплазией высокой степени впоследствии развилась аденокарцинома. Распространенность дисплазии составляла 8,5%, а заболеваемость дисплазией составляла 5,7% ежегодно. Авторы подчеркнули необходимость наблюдения за пациентами с коротким сегментом пищевода Барретта. Необходимы дальнейшие исследования для подтверждения риска неопластического прогрессирования при коротком сегменте пищевода Барретта.
Результаты настоящего исследования позволяют предположить, что короткие сегменты цилиндрической выстилки пищевода, с или без IM, являются проявлением ГЭРБ. На это указывают схожие изменения в каждой группе признаков ГЭРБ, включая снижение давления и длины нижнего сфинктера пищевода, а также повышенную степень воздействия кислоты пищевода. Распространенность аномального воздействия кислоты на пищевод, механически дефектных сфинктеров и эрозивного эзофагита была сопоставима в 2 группах.Неизвестно, разовьется ли впоследствии у пациентов с короткими сегментами чистой слизистой оболочки сердечного типа ИМ и следует ли поддерживать их в программах эндоскопического наблюдения.
На основании результатов этого исследования мы пришли к выводу, что пациенты с короткими сегментами CLE с IM имеют аналогичное воздействие кислоты пищевода, но значительно более высокую частоту воздействия ненормального билирубина и более длительную медианную продолжительность симптомов рефлюкса, чем пациенты без IM. Эти данные свидетельствуют о том, что цилиндрическая выстилка пищевода, независимо от гистологического типа, является проявлением ГЭРБ.Наличие дуоденоэзофагеального рефлюкса и продолжительность рефлюкса могут иметь важное значение в патогенезе ИМ.
Представлено на 107-й научной сессии Западной хирургической ассоциации, Санта-Фе, Нью-Мексико, 16 ноября 1999 г.
Автор, ответственный за переписку: Джеффри Х. Петерс, доктор медицины, отделение хирургии, Медицинская школа Университета Южной Калифорнии, 1510 San Pablo St, Suite 514, Los Angeles, CA-4612 (электронная почта: [email protected] ).
1. прах ATMacDonald Т.А. Хопвуд Д.А.Джонстон Д.А. Рост заболеваемости пищеводом Барретта: образование, энтузиазм или эпидемиология [письмо]? Ланцет. 1997; 350933Google ScholarCrossref 2. Вестон АПКрмпотич PMakdisi WF и другие. Короткий сегмент пищевода Барретта: клинические и гистологические особенности, соответствующие эндоскопические данные и связь с желудочно-кишечной метаплазией. Am J Gastroenterol. 1996; 91981-986Google Scholar3.Nandurkar STalley NJMartin CJNg THAdams S Короткий сегмент пищевода Барретта: распространенность, диагностика и ассоциации. Gut. 1997; 40710-715Google ScholarCrossref 4.Johnston MHHammond А.С.Ласкин WJones DM. Распространенность и клинические характеристики коротких сегментов специализированной кишечной метаплазии в дистальном отделе пищевода при рутинной эндоскопии. Am J Gastroenterol. 1996; 911507-1511Google Scholar5.Pera MCameron AJTrastek VFCarpenter HAZinsmeister AR Повышение заболеваемости аденокарциномой пищевода и пищеводно-желудочного перехода. Гастроэнтерология. 1993; 104510-513 Google Scholar6. WJDevesa С.С.Кнеллер RWFraumeni JF Jr. Рост заболеваемости аденокарциномой пищевода и кардии желудка. JAMA. 1991; 2651287-1289Google ScholarCrossref 7.Drewitz DJSampliner REGarewal HS Заболеваемость аденокарциномой пищевода Барретта: проспективное исследование 170 пациентов под наблюдением 4,8 года. Am J Gastroenterol. 1997; 92212-215 Google Scholar8. Голдман. MCBeckman Синдром Р. К. Барретта: клинический случай с обсуждением концепций патогенеза. Гастроэнтерология. 1960; 39104-110 Google Scholar9, Бреммер CGLynch В.П.Эллис Пищевод FHJ Барретта: врожденный или приобретенный? экспериментальное исследование регенерации слизистой оболочки пищевода у собак. Хирургия. 1970; 68209-216Google Scholar 10.Hage EPederson SA Морфологическая характеристика столбчатого эпителия нижнего отдела пищевода у пациентов с синдромом Барретта. Арка Вирхова. 1972; 357219-229Google ScholarCrossref 11. Öberg SDeMeester TRPeters JH и другие. Степень пищевода Барретта зависит от состояния нижнего сфинктера пищевода и степени воздействия кислоты на пищевод. J Thorac Cardiovasc Surg. 1999; 117572-580Google ScholarCrossref 12. Zaninotto GDeMeester TRSchwizer WJohansson KECheng SC Нижний сфинктер пищевода в состоянии здоровья и болезни. Am J Surg. 1988; 155104-111Google ScholarCrossref 13.Jamieson JRStein HJDeMeester TR и другие. Амбулаторный 24-часовой мониторинг pH пищевода: нормальные значения, оптимальные пороги, специфичность, чувствительность и воспроизводимость. Am J Gastroenterol. 1992; 871102-1111Google Scholar14.Бечи Пуччиани Ф.Балдини F и другие. Долгосрочный амбулаторный мониторинг энтерогастрального рефлюкса, валидация новой оптоволоконной техники. Dig Dis Sci. 1993; 381297-1306Google ScholarCrossref 15.Vaezi MFLacamera Р.Г. Рихтер JE Валидационные исследования Bilitec 2000: амбулаторная система мониторинга дуоденогастрального рефлюкса. Am J Physiol. 1994; 267G1050- G1057Google Scholar16.Kauer WKBurdiles Пиреланд AP и другие.Забегает ли дуоденальный сок в пищевод у пациентов с осложненным ГЭРБ? оценка оптоволоконного датчика на билирубин. Am J Surg. 1995; 16998-103Google ScholarCrossref 17.Fein MRitter MPPeters JH и другие. Оптимальный порог поглощения для спектрофотометрического мониторинга билирубина (Bilitec) в пищеводе [аннотация]. Гастроэнтерология. 1997; 112A115Google Scholar 18.Vaezi М.Ф.Рихтер JE Роль дуоденогастроэзофагеального рефлюкса в гастроэзофагеальной рефлюксной болезни. Гастроэнтерология. 1996; 1111192–1199Google ScholarCrossref 19.Fein Миреланд APRitter Депутат и другие. Дуоденогастральный рефлюкс усиливает повреждающие эффекты гастроэзофагеального рефлюкса. J Gastrointest Surg. 1997; 127-33Google ScholarCrossref 20.Cameron AJKamath PSCarpenter HA. Распространенность метаплазии пищевода Барретта и кишечной метаплазии в гастроэзофагеальном переходе [аннотация]. Гастроэнтерология. 1999; 112A82 Google Scholar 21.Диас Перрейра А.С.успиро AChaves P Короткие сегменты эпителия Барретта и кишечная метаплазия в нормально выглядящих сочленениях пищевода: одно и то же или два разных объекта? Gut. 1998; 42659-662Google ScholarCrossref 22.Qualman SJMurray RDMcClung HJLucas J Кишечная метаплазия пищевода Барретта связана с возрастом. Arch Pathol Lab Med. 1990; 1141236-1240Google Scholar23.Gulizia JMWang HAntonioli D и другие.Пролиферативные характеристики кишечной слизистой оболочки в дистальном отделе пищевода и гастроэзофагеальном переходе (пищевод Барретта с коротким сегментом): исследование случай-контроль. Хум Патол. 1999; 30412-418Google ScholarCrossref 24.Öberg SRitter MPCrookes ПФ и другие. Гастроэзофагеальная рефлюксная болезнь и повреждение слизистой оболочки с акцентом на коротком сегменте пищевода Барретта. J Gastrointest Surg. 1998; 2547-553Google ScholarCrossref 25.Фицджеральд RCOmary МБТриадафилопулос G Динамические эффекты кислоты на пищевод Барретта: модель пролиферации и дифференциации ex vivo. J Clin Invest. 1996; 982120-2128Google ScholarCrossref 26. Чемпион GRichter JEVaezi MFSingh САЛЕКСАНДР R Дуоденогастроэзофагеальный рефлюкс: отношение к pH и важность в пищеводе Барретта. Гастроэнтерология. 1994; 107747-754Google ScholarCrossref 27.Stein HJKauer WKFeussner HSiewert JR Рефлюкс желчи при доброкачественном и злокачественном пищеводе Барретта: эффект подавления медицинской кислоты и фундопликации Ниссена. J Gastrointest Surg. 1998; 2333-341Google ScholarCrossref 28.Katzka DACastell DO Успешное устранение симптомов рефлюкса не обеспечивает адекватного контроля кислотного рефлюкса у пациентов с пищеводом Барретта. Am J Gastroenterol. 1994; 89989-991Google Scholar 29.Ouatu-Lascar RTriadafilopoulos G Полное устранение симптомов рефлюкса не гарантирует нормализации внутрипищеводного кислотного рефлюкса у пациентов с пищеводом Барретта. Am J Gastroenterol. 1998; 93711-716Google ScholarCrossref 30. Watson ДИПике GKBaigrie RJ и другие. Проспективное двойное слепое рандомизированное исследование лапароскопической фундопликации по Ниссену с разделением и без разделения коротких желудочных сосудов. Ann Surg. 1997; 226642-652Google ScholarCrossref 31.Csendes ABraghetto IBurdiles п и другие. Отдаленные результаты классической антирефлюксной хирургии у 152 пациентов с пищеводом Барретта: клинический, рентгенологический, эндоскопический, манометрический и кислотный рефлюкс-тест до и после операции. Хирургия. 1998; 126645-657Google ScholarCrossref 32.Farrell TMSmith CDMetreveli RM и другие. Фундопликация обеспечивает эффективное и длительное облегчение симптомов у пациентов с пищеводом Баррретта. Am J Surg. 1999; 17818-21Google ScholarCrossref 33.Hameeteman WTytgat GNHouthoff HJvan den Tweel Пищевод Дж. Г. Барретта: развитие дисплазии и аденокарциномы. Гастроэнтерология. 1989; 961249-1256 Google Scholar 34.Ифтихар SYJames PDSteele RJHardcastle JDAtkinson M Длина пищевода Барретта: важный фактор в развитии дисплазии и аденокарциномы. Gut. 1992; 331155-1158Google ScholarCrossref 35.Sharma PMorales Т.Г. Хаттачарья А.Гаревал HSSampliner RE Дисплазия короткого сегмента пищевода Барретта: проспективное трехлетнее наблюдение. Am J Gastroenterol. 1997; 922012-2016.Лоуренс В.Уэй, доктор медицины, Сан-Франциско, Калифорния: Доктора Оберг, Петерс и ДеМестер внесли еще один важный вклад в изучение патогенеза метаплазии Барретта. В их эксперименте сравнивались клинические и лабораторные данные у 65 пациентов с 3 см или менее столбчатым пищеводом (CLE) в гастроэзофагеальном переходе, из которых чуть более половины имели кишечную метаплазию, признак болезни Барретта, которая почти повсеместно присутствует в желудочно-кишечном тракте. длинносегментный CLE. Результаты показали аналогичную тяжесть кислотного рефлюкса у пациентов с кишечной метаплазией и без нее, но более длительную историю симптомов рефлюкса и значительно большее воздействие рефлюкса дуоденального сока на желудочно-пищеводный переход, измеренное с помощью билирубинового зонда.Значит, рефлюкс дуоденального сока является этиологическим фактором патогенеза болезни Барретта. Их данные убедительно подтверждают вывод.
У меня 2 вопроса о пациентах и их рефлюксной болезни. Во-первых, хотя пациенты страдали изжогой в течение 5-10 лет и предположительно страдали ГЭРБ, только у 80% каждой группы при мониторинге pH было обнаружено аномальное воздействие кислоты. Учитывая их длительную историю симптомов, в том числе изжогу, и знание того, что кислотный рефлюкс обычно количественно выше у пациентов с болезнью Барретта, чем у пациентов с менее запущенной ГЭРБ, это меньше, чем ожидалось, и поднимает вопрос о диагнозе рефлюкса.Каковы были абсолютные показатели рефлюкса? О них не сообщалось в рукописи. Какова была история лечения? Все ли пациенты принимали ИПП [ингибиторы протонной помпы]? Можете ли вы разрешить это противоречие?
Наконец, проводились ли пациенты периодические эндоскопии, и если да, то как развивалась болезнь со временем? Исследование длилось достаточно долго, чтобы получить ответы на этот вопрос.
Марко Дж. Патти, доктор медицины, Сан-Франциско: Хотя я согласен с окончательными выводами, мне кажется, что 6 пациентов в каждой группе имели нормальное воздействие кислоты пищевода и 10 пациентов в каждой группе имели нормальное воздействие билирубина.Как вы думаете, почему у этих пациентов развился столбчатый эпителий? Как вы думаете, почему у этих пациентов была рефлюксная болезнь?
Dr Peters: Клиническое значение этого двоякое. Во-первых, хотя до сих пор существуют значительные разногласия относительно лечения пищевода Барретта, настоящим святым Граалем этого предракового поражения, как и любого другого предракового поражения, является его профилактика. По мере того, как мы видим все больше этой болезни, нам нужно думать о ее предотвращении. Для этого нам необходимо определить факторы риска, которые его создают.Во-вторых, активно обсуждается вопрос о том, когда именно у пациентов с рефлюксной болезнью следует проводить вмешательство с помощью эндоскопа. Это исследование дает нам немного информации в этом отношении, как и другие эпидемиологические исследования. Становится очевидным, что если у вас есть симптомы более 5 или 6 лет, кто-нибудь должен бросить эндоскоп, чтобы убедиться, что у вас нет кишечника в пищеводе.
На этом фоне позвольте мне ответить на вопросы.И доктор Патти, и доктор Уэй спросили, почему у некоторых людей есть отрицательные результаты исследований pH и Bilitec, учитывая, что мы изучаем ГЭРБ. Об этом спрашивают на фоне многих лет приравнивания положительного исследования pH к наличию рефлюкса. Недавно, действительно с появлением лапароскопа, хирурги начали видеть более ранние и более ранние заболевания и, таким образом, начали изучать ранние заболевания. В данном исследовании основное внимание уделяется группе пациентов, у которых по критериям отбора имеется раннее заболевание, т. Е. Очень небольшие изменения в гастроэзофагеальном переходе.Помните, что датчик pH помещается на 5 см выше верхней границы нижнего сфинктера пищевода. Сфинктер имеет длину около 4 см и, вероятно, охватывает желудочно-пищеводный переход. Таким образом, зонд pH и зонд Bilitec помещаются глубоко в просвет тела пищевода и намного выше желудочно-пищеводного соединения.
Когда мы начали изучать эпителиальные изменения в гастроэзофагеальном соединении, мы узнали, что эпителий, вероятно, является лучшим индикатором наличия рефлюксной болезни, чем зонд pH.При изучении этих пациентов сразу же сталкиваешься с концептуальной проблемой, т. Е. Как определить болезнь. Когда мы ищем новые маркеры, старые стандарты могут быть неадекватными. Нам остается идентифицировать признаки болезни и отбирать пациентов, у которых, по нашему мнению, они есть, для изучения. Это правда, что от 10% до 20% этих пациентов не имеют положительных результатов исследований pH, если смотреть на 5 см выше желудочно-пищеводного перехода. Мы и другие исследователи начинаем устанавливать зонд pH ниже, чтобы немного больше узнать о нормальных и аномальных состояниях кардии желудочно-пищеводного тракта.Это относится к заболеваемости Барреттом кардии и аденокарциномы кардии. Эти аргументы также касаются вопроса о совокупных баллах и процентном соотношении пациентов, получающих лечение ИПП, и процентном соотношении пациентов с симптомами. Ни один из них не очень хорошо коррелирует с наличием или отсутствием раннего заболевания.
Вопрос, который доктор Уэй задал о периодической эндоскопии, очень важен. В настоящее время мир считает, что мы не можем изменить естественное течение пищевода Барретта.По мере того как мы изучаем эту болезнь все раньше и раньше, мы начинаем понимать, что, возможно, этот вывод не так высечен в камне, как мы думали. Все пациенты с кишечником этих коротких сегментов периодически проходят эндоскопию. При отсутствии кишечника, потому что нет риска злокачественного новообразования, они этого не делают. Мы недавно сообщили в статье, которую Стив ДеМистер представил в прошлом году в Американской хирургической ассоциации, что, возможно, мы сможем обратить вспять или потерять кишечник у пациентов с коротким сегментом пищевода Барретта.Другие теперь подтвердили этот факт. Группа из Вашингтонского университета, которая придерживается совершенно иных предубеждений, чем мы, сообщила о подобных результатах. Это развивающаяся наука. Мы начинаем немного разбираться в ранних аспектах гастроэзофагеальной рефлюксной болезни и, возможно, некоторых факторах риска, предрасполагающих к развитию пищевода Барретта.
Очерки патологии — пищевод Барретта
Пищевод
Предраковое заболевание
Пищевод Барретта
Заместитель главного редактора: Рауль С.Gonzalez, MD
Тема завершена: 19 марта 2020 г.
Незначительные изменения: 26 мая 2021 г.
Авторские права: 2003-2021, PathologyOutlines.com, Inc.
Поиск в PubMed: Пищевод Барретта [TI] обзор [PT] полный текст [SB]
просмотров страниц в 2020 г .: 23,307
просмотров страниц в 2021 г. по настоящее время: 20,151
Цитируйте эту страницу: Пищевод Карамчандани Д. Барретта. Патологияcom веб-сайт. https://www.pathologyoutlines.com/topic/esophagusbarrettsgeneral.html. По состоянию на 25 августа 2021 г.
Определение / общее
- Американский колледж гастроэнтерологии (ACG), 2016 Определение BE: распространение слизистой оболочки лососевого цвета в трубчатый пищевод на ≥ 1 см проксимальнее гастроэзофагеального (GE) соединения с подтверждением биопсией кишечной метаплазии (бокаловидные клетки) (Am J Gastroenterol 2016; 111: 30)
- Британское общество гастроэнтерологов, 2014 г. Определение BE: столбчатый эпителий с бокаловидными клетками или без них, простирающийся на ≥ 1 см проксимальнее соединения GE (Gut 2014; 63: 7)
Терминология
- Длинный сегмент: любой сегмент BE размером> 3 см
- Короткий сегмент: любой сегмент BE, измеряющий Линия Z: плоскостолбчатое соединение
Кодировка МКБ
- МКБ-10: K22.7 — пищевод Барретта
- ICD-10: K22.70 — Пищевод Барретта без дисплазии
Участки
- Дистальный отдел пищевода, гастроэзофагеальный переход
Патофизиология
- Метаплазия при БЭ предположительно является результатом клеточного репрограммирования
- ГЭРБ-индуцированное повреждение ткани репрограммирует незрелые клетки-предшественники для экспрессии факторов транскрипции столбчатого развития
- Повреждение ткани активирует сигнальные пути, такие как Hedgehog, BMP4 и NF-KB, и подавляет передачу сигналов Notch
- Сигналы приводят к повышенной экспрессии SOX9 (индуцирует столбчатую дифференцировку), FOXA2, CDX1 и CDX2 (индуцирует кишечную дифференцировку) (J Clin Invest 2014; 124: 3767)
- Трансдифференцировка (особый тип многослойного эпителия в плоскостолбчатом соединении с признаками как плоского, так и столбчатого эпителия) может происходить при БЭ (Am J Gastroenterol 2016; 111: 30)
Этиология
- Известные факторы риска (Am J Gastroenterol 2016; 111: 30):
- Хронические (> 5 лет) симптомы ГЭРБ
- Пожилой возраст (> 50 лет)
- Мужской пол
- Использование табака
- Центральное ожирение
- Кавказская раса
- Чаще встречается у родственников первой степени родства лиц с известным БЭ
Диаграммы / таблицы
Образы, размещенные на других серверах:
Протокол биопсии ВЭ
BE Пражская классификация
Пражские критерии
Диагноз
- Характерный эндоскопический вид (сегмент аномальной слизистой оболочки размером не менее 1 см проксимальнее соединения ГЭ) плюс характерные гистологические данные (метапластический эпителий с кишечной метаплазией в США)
- Рекомендуется не менее восьми случайных биопсий
- Когда восемь биопсий невозможно получить (как в коротком сегменте BE), рекомендуется как минимум четыре биопсии / см периферической BE и одна биопсия / см языков BE.
- Нормальные линии Z и линии Z с вариабельностью менее 1 см не должны подвергаться биопсии (Am J Gastroenterol 2016; 111: 30, Gastroenterol Hepatol (N Y) 2016; 12: 449)
Лаборатория
- Оценка ступенчатых секций H&E из биопсии для документирования метаплазии бокаловидных клеток
Описание радиологии
- Передовые технологии визуализации продолжают оставаться областью исследовательского интереса
- Регулярное использование эндоскопии в белом свете высокой четкости теперь рекомендуется как часть эпиднадзора (Am J Gastroenterol 2016; 111: 30)
- Другие передовые методы визуализации (помимо электронной хромоэндоскопии) в настоящее время не рекомендуются
Факторы прогноза
- Риск прогрессирования рака при недиспластическом БЭ равен 0.2 — 0,5% в год (Am J Gastroenterol 2016; 111: 30)
- Годовой риск прогрессирования дисплазии низкой степени (0,7% в год) и дисплазии высокой степени (7% в год)
Лечение
- Пациенты с ПБ должны получать терапию ингибиторами протонной помпы один раз в день
- Аспирин, другие НПВП или антирефлюксная хирургия, которая обычно не назначается или не проводится
- Наблюдение должно выполняться с помощью эндоскопии в белом свете высокого разрешения / высокого разрешения
- При ПБ без дисплазии — эндоскопическое наблюдение с интервалом от трех до пяти лет
- При эндоскопическом наблюдении следует проводить биопсию из четырех квадрантов с интервалом 2 см у пациентов без дисплазии и с интервалом 1 см у пациентов с дисплазией в анамнезе.
- В отношении дисплазии BE см. Рекомендации по эпиднадзору в разделе дисплазия BE.
- Эндоскопическая резекция слизистой оболочки или эндоскопическая абляционная терапия: предпочтительные варианты лечения для пациентов с дисплазией (см. Раздел о дисплазии BE) (Am J Gastroenterol 2016; 111: 30)
Клинические изображения
Изображения AFIP
Normal и BE
Образы, размещенные на других серверах:
Слизистая оболочка лососевого цвета
Эндоскопия: эритема слизистой оболочки нижнего отдела пищевода
Общее описание
- Слизистая оболочка красного / лососевого цвета между бледной плоской слизистой оболочкой нижнего отдела пищевода и пышной розовой слизистой оболочкой желудка; могут иметь языки, выходящие вверх от соединения GE
- Эндоскописты используют Пражскую классификацию для описания степени заболевания (включая окружную длину и максимальную длину сегмента) слизистой оболочки Барретта (Am J Gastroenterol 2016; 111: 30)
Микроскопическое (гистологическое) описание
- Плоский эпителий пищевода замещен столбчатым эпителием кишечного типа с бокаловидными клетками
- Настоящие бокаловидные клетки: округлой формы, от прозрачного до голубоватого цитоплазматического муцина, разбросаны случайным образом, муцин обычно вдавливает ядро
- Недиспластический реактивный БЭ показывает наличие четырех линий (Surg Pathol Clin 2017; 10: 781)
- Первая линия: капля муцина фовеолярного типа желудка
- Вторая линия: основание фовеолярной муциновой вакуоли
- Третья линия: цитоплазма ниже муциновой вакуоли
- Четвертая строка: ряд ядер
- Исходная атипия слизистой оболочки Барретта — некоторые базальные железы могут демонстрировать увеличение ядер и расслоение, но при этом наблюдается полное созревание поверхности; это считается отрицательным при дисплазии
- Дупликация характерной находки muscularis mucosae при БЭ; наблюдается в 92% резекций БЭ, затрагивающих 5% сегмента Барретта (Am J Surg Pathol 2007; 31: 1719)
- Плоское разрастание над метапластическим эпителием, гибридные железы, наличие пищеводных протоков имеют высокую специфичность для БЭ (Am J Surg Pathol 2007; 31: 1733)
- Гистология послеабляции: замещение столбчатой слизистой оболочки на плоскоклеточную (неосквамозную) слизистую; остаточный метапластический эпителий может сохраняться под плоским эпителием (известный как скрытый эпителий Барретта) и прогрессировать до дисплазии или карциномы
Микроскопические (гистологические) изображения
Предоставлено Дипти М.Карамчандани, доктор медицины
BE
Бокальные клетки
Клетки псевдогоблетов
Четыре строки
Гибридные сальники
Плоскоклеточный нарост
Исходная атипия
Дупликация слизистой оболочки Muscularis
Виртуальные слайды
Изображения, размещенные на других серверах:
Пищевод Барретта
Описание цитологии
- Цитология имеет хорошую чувствительность (82%) и специфичность (88%) для выявления кишечной метаплазии с умеренным соглашением между наблюдателями (J Am Soc Cytopathol 2015; 4: 113)
- Цитология может быть синергетической с достижениями в других методах ведения пациентов с пищеводом Барретта
- Улучшение чистящих устройств может помочь снизить частоту недиагностики (Diagn Cytopathol 2011; 39: 60)
Положительные пятна
- H&E остается золотым стандартом диагностики БЭ и оценки дисплазии Барретта (Am J Surg Pathol 2016; 40: e83)
- Альциановый синий (при pH 2.5) окрашивание кислого муцина в истинных бокаловидных клетках в ярко-пурпурно-синий цвет; помогает отличить настоящие бокаловидные клетки от псевдогоблетных клеток в сложных случаях, рефлексивное использование при биопсии не оправдано
Отрицательные пятна
- Специальные пятна обычно не требуются для диагностики БЭ (Am J Surg Pathol 2016; 40: e83)
- Использование гликопротеинов муцина (MUC2, MUC5AC) для диагностики БЭ в настоящее время не показано
- Использование маркеров кишечного фенотипа (CDX2, Das-1, villin, HepPar1) для диагностики БЭ в настоящее время не показано
- Использование СК7 и СК20 для отличия БЭ от кишечной метаплазии кардии желудка, не обозначенных как недостаточно специфичные
Описание электронной микроскопии
- Гранулы муцина в метапластических клетках
Образец отчета о патологии
- Отчет об эндоскопии не предоставлен, а при биопсии обнаружена кишечная метаплазия
- Пищевод дистальный, биопсия:
- Слизистая оболочка Барретта без дисплазии (см. Комментарий)
- Комментарий: В соответствии с рекомендациями ACG 2016 г., в этом случае диагноз пищевода Барретта ставится на основании наличия бокаловидных клеток, при этом предполагается, что биопсия берется из дистального отдела пищевода, а неровности слизистой оболочки простираются как минимум на 1 см над поверхностью пищевода. верхняя часть желудочных складок.
- Ссылка: Am J Gastroenterol 2016; 111: 30
- Пищевод дистальный, биопсия:
- В отчете об эндоскопии указано, что неровность слизистой оболочки простирается не менее чем на 1 см проксимальнее желудочно-пищеводного перехода
- Пищевод дистальный, биопсия:
- Слизистая оболочка Барретта без дисплазии
- Пищевод дистальный, биопсия:
- Отчет об эндоскопии не предоставлен, при биопсии имеется кишечная метаплазия, и биопсия помечена как гастроэзофагеальный переход
- Гастроэзофагеальный переход, биопсия:
- Слизистая оболочка кардии желудка с кишечной метаплазией, без дисплазии (см. Комментарий)
- Комментарий: Если биопсия берется из канальцев пищевода и неровности слизистой оболочки простираются как минимум на 1 см выше вершины желудочных складок, то это соответствует пищеводу Барретта.Если биопсия берется из кардии желудка, то это представляет собой кишечную метаплазию кардии желудка.
- Ссылка: Am J Gastroenterol 2016; 111: 30
- Гастроэзофагеальный переход, биопсия:
- Ссылки: Ann Diagn Pathol 2019; 39: 111, Am J Gastroenterol 2016; 111: 30
Дифференциальный диагноз
- Кишечная метаплазия кардии желудка
- Требуется эндоскопическая корреляция; более низкая скорость прогрессирования дисплазии или карциномы
- Псевдогоблетные ячейки
- Сгруппированные, характерно расположенные спина к спине или линейный и непрерывный массив, в отличие от настоящих бокаловидных ячеек
- PAS / альциановый синий может быть полезным, но иногда псевдогоблетные клетки проявляют неспецифическую слабую альцианофилию на PAS / альциановом синем
Вопрос стиля обзора совета № 1
Ниже приведено изображение эндоскопической биопсии 60-летнего мужчины с клинической историей симптомов рефлюкса, биопсия отмечена как гастроэзофагеальный переход.Отчет об эндоскопии не предоставляется. Как бы вы вышли из дела?- Пищевод Барретта без дисплазии
- Слизистая оболочка желудка с кишечной метаплазией, совместимой с пищеводом Барретта
- Слизистая оболочка кардии желудка с кишечной метаплазией (см. Комментарий)
- Пищевод Барретта с дисплазией низкой степени
Стиль проверки Правлением, ответ № 1
C. Слизистая оболочка желудочного типа с кишечной метаплазией, с комментарием о том, что для диагностики пищевода Барретта необходимы эндоскопические доказательства патологии слизистой оболочки на расстоянии не менее 1 см проксимальнее желудочно-пищеводного соединения. .Комментарий здесь
Ссылка: Пищевод Барретта
Вопрос стиля обзора совета № 2
Какое пятно лучше всего для диагностики пищевода Барретта при биопсии?- H&E краситель
- PAS со специальной морилкой Alcian Blue
- Иммуноокрашивание CDX2
- Иммуноокрашивание СК7