Helicobacter pylori — Википедия
| Helicobacter pylori | |||
|---|---|---|---|
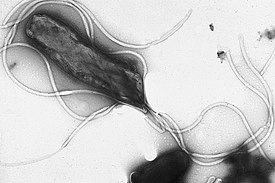 Helicobacter pylori. Микрофотография с использованием СЭМ | |||
промежуточные ранги
| |||
Helicobacter pylori (Marshall et al. 1985) Goodwin et al. 1989 | |||
Helicobacter pylori (лат. спиралевидная бактерия, обитающая в привратнике желудка[1], традиционная транскрипция — Х(Г)еликоба́ктер пило́ри[1][2]) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, рака желудка и, возможно, некоторые случаи лимфом желудка этиологически связаны с инфекцией
Спиральная форма бактерии, от которой произошло родовое название Helicobacter, как полагают, определяет способность этого микроорганизма проникать в слизистую оболочку желудка и двенадцатиперстной кишки и облегчает движение бактерии в слизистом геле, покрывающем слизистую желудка
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было забыто[6].
В 1886 году профессор Валерий Яворский (польск.) из Ягеллонского университета в Кракове, исследуя осадок из промывных вод желудка человека, обнаружил помимо бактерий, напоминавших по форме хворостины, также некоторое количество бактерий характерной спиралеобразной формы. Он назвал обнаруженную им бактерию Vibrio rugula. Он был первым, кто предположил возможную этиологическую роль этого микроорганизма в патогенезе заболеваний желудка. Его работа на эту тему была включена в польское «Руководство по заболеваниям желудка» и опубликована в 1899 году. Однако эта работа не имела большого влияния на остальной врачебный и научный мир, поскольку была написана на польском языке
В 1893 году итальянский исследователь Джулио Бидзодзеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак[8].
В 1974 году профессор И. А. Морозов из Москвы обнаружил спиралевидные бактерии в материале больных после ваготомии во внутриклеточных канальцах клеток желудка, а также у больных язвой, которым не делали ваготомию. Однако способ выращивания этих бактерий не был известен микробиологам, и обнаруженные бактерии были забыты ещё на десять лет
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах[11]. В оригинальной публикации[12] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori
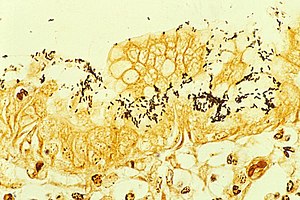 Гистологический препарат слизистой желудка, демонстрирующий геликобактерный гастрит и колонизацию слизистой геликобактером. Окраска серебром по Warthin-Starry.
Гистологический препарат слизистой желудка, демонстрирующий геликобактерный гастрит и колонизацию слизистой геликобактером. Окраска серебром по Warthin-Starry.Медицинское и научное сообщество медленно и неохотно признавало патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии
В 1994 году Национальный институт здравоохранения США опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине[18].
До того как стала понятна роль инфекции H. pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы h3-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты часто рецидивировали после прекращения лечения. Довольно часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был субсалицилат висмута (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Теперь стало ясно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них могут заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени[22].
Бактерия была вначале названа Campylobacter pyloridis в 1985 году, затем название было исправлено в соответствии с правилами латинской грамматики на Campylobacter pylori в 1987 году[23], и только в 1989 году, после того, как анализ последовательностей ДНК этой бактерии показал, что в действительности она не принадлежит к роду Campylobacter, её и близкие ей виды выделили в отдельный род, Helicobacter Goodwin et al. 1989[24]. Слово pylōri в названии является формой родительного падежа от «pylōrus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от др.-греч. πυλωρός, означающего буквально «привратник».
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделах кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis))[25]. Наибольший уровень сходства по результатам ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae[25].
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую
Разработано много методов определения как внутривидовой дифференциации штаммов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК[25]. Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменах, а также крупных внутригеномных перестройках, и высоких частотах трансформации[25].
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637[25].
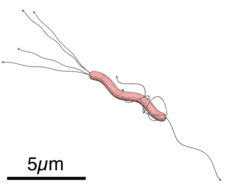 Размеры и схематическое строение H. pylori
Размеры и схематическое строение H. pyloriHelicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4–6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержится в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями[27]. Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки, способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина[28]. Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
В неблагоприятных условиях, а также в «зрелых» или старых культурах Helicobacter pylori обладает способностью превращаться из спиралевидной в круглую или шарообразную кокковидную форму. Это благоприятствует её выживанию и может являться важным фактором в эпидемиологии и распространении бактерии[29]. Кокковидная форма бактерии не поддаётся культивированию на искусственных питательных средах (хотя может спонтанно возникать по мере «старения» культур), но была обнаружена в водных источниках в США и других странах. Кокковидная форма бактерии также обладает способностью к адгезии к клеткам эпителия желудка in vitro. Кокковидные формы H. pylori могут обнаруживаться после попыток уничтожения, и имеются данные о том, что они более устойчивы к антибиотикам и синтезируют больше веществ, способствующих вирулентности и канцерогенезу, чем спиралевидные [30].
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1, 4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия)[31].
 Электронно-микроскопическая фотография H. pylori
Электронно-микроскопическая фотография H. pyloriИзвестно несколько штаммов Helicobacter pylori, и геном трёх из них полностью секвенирован[32][33][34][35].
Геном штамма «26695» представлен кольцевой двуцепочечной молекулой ДНК размером 1667867 пар оснований, и содержит 1630 генов, из которых 1576 кодируют белки, доля Г+Ц пар составляет 38%. Геном штамма «J99» представлен кольцевой двуцепочечной молекулой ДНК размером 1643831 пар оснований, и содержит 1535 генов, из которых 1489 кодируют белки, доля Г+Ц пар составляет 39%. Два изученных штамма демонстрируют значительные генетические различия, до 6% нуклеотидов у них различны.
Изучение генома H. pylori ведётся в основном с целью улучшить наше понимание патогенеза гастритов и язвенной болезни желудка, причин способности этого микроорганизма вызывать заболевание. На данный момент в базе данных генома Helicobacter pylori 62 гена отнесены к категории «генов патогенных» (то есть их наличие у бактерии коррелирует с её патогенностью). Оба изученных штамма имеют общий «остров патогенности» (общую последовательность генов, имеющих отношение к вирулентности и патогенности H. pylori) длиной около 40 Кб, так называемый Cag. Этот участок содержит более 40 генов. Он обычно отсутствует у штаммов, которые выделены от людей, являющихся бессимптомными носителями H. pylori.
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длиной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV[36]. После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток[37]. Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса[38].
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника[39]. Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с геликобактерной инфекцией и могут служить возможными диагностическими маркерами[40].
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида)[41]. Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок[42].
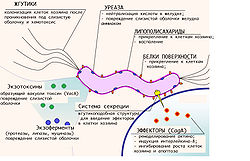 Факторы вирулентности H. pylori
Факторы вирулентности H. pyloriСпособность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии[43].
Одним из важных факторов вирулентности геликобактера является наличие у него жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
 Молекулярная модель уреазы H. pylori
Молекулярная модель уреазы H. pyloriОчень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6–7). Одновременно с этим аммиак вызывает химическое раздражение и воспаление, а впоследствии и гибель, клеток слизистой желудка.
Продукция геликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Специальная «инжекционная система», имеющаяся у H. pylori, предназначена для непосредственного впрыскивания в клетки слизистой оболочки желудка различных эффекторных белков (в частности, продуктов гена cagA), вызывающих воспаление, повышение продукции интерлейкина-8[44], угнетение апоптоза и избыточный рост определённых типов клеток. Полагают, что именно этим обусловлена наблюдающаяся при инфицировании геликобактером гиперплазия париетальных (кислотообразующих) клеток желудка, гиперсекреция соляной кислоты и пепсина, и в конечном итоге повышение вероятности рака желудка[45].
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей[43]. В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей[46][47].
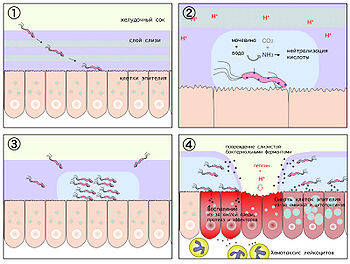 Схематическое изображение патогенеза язвы желудка
Схематическое изображение патогенеза язвы желудкаНа начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Эндотоксин VacA, вырабатываемый бактерией, вызывают вакуолизацию и гибель клеток эпителия желудка[48]. Продукты гена cagA вызывают дегенерацию клеток эпителия желудка, вызывая изменения фенотипа клеток (клетки становятся удлинёнными, приобретая так называемый «колибри фенотип»[49]). Привлечённые воспалением (в частности, секрецией интерлейкина-8 клетками слизистой желудка) лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой, бактерия также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка[50].
Диагностика хеликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов и затем выполнения тестов, подтверждающих или опровергающих наличие инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие геликобактерной инфекции включают определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченной углеродом 14C- или 13C мочевины, которую бактерия расщепляет с образованием, соответственно, 14C- или 13C-диоксида углерода, которую затем обнаруживают в выдыхаемом воздухе при помощи масс-спектрометрии или диодной лазерной спектроскопии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе[51]. Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Однако самым надёжным и «референсным» методом диагностики геликобактерной инфекции остаётся биопсия, производимая во время эндоскопического обследования желудка и двенадцатиперстной кишки. Взятую при биопсии ткань слизистой подвергают быстрому тестированию на наличие уреазы и антигенов H. pylori, гистологическому исследованию, а также культуральному исследованию с выделением возбудителя на искусственных питательных средах.
Ни один из методов диагностики инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике геликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам H. pylori имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой геликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.[источник не указан 2918 дней]
Заражение H. pylori может сопровождаться симптомами или протекать бессимптомно (без каких-либо жалоб со стороны инфицированного). Предполагается, что до 70 % случаев инфекции протекают бессимптомно и что около 2/3 населения Земли инфицированы геликобактером, что делает эту инфекцию самой распространённой в мире. Истинная частота встречаемости бессимптомного носительства геликобактера варьирует от страны к стране. В развитых странах Запада (Западная Европа, США, Австралия) эта частота составляет примерно 25 %; она значительно выше в странах так называемого «третьего мира», а также в посткоммунистических странах Восточной Европы и в особенности в странах бывшего Советского Союза. В странах третьего мира и в посткоммунистических странах, вследствие сравнительно низких санитарных стандартов и условий не редкостью является обнаружение геликобактерной инфекции у детей и подростков. В Соединённых Штатах и Западной Европе геликобактер чаще всего выявляется в старших возрастных категориях (около 50 % у лиц старше 60 лет, по сравнению с 20 % у лиц моложе 40 лет) и в наиболее бедных социально-экономических слоях.
Разница в частоте встречаемости геликобактерной инфекции в развитых странах Запада и в странах «третьего мира» приписывается более строгому соблюдению гигиенических стандартов и широкому использованию антибиотиков. Однако со временем стала проявляться проблема антибиотикоустойчивости H. pylori[52]. В настоящее время многие штаммы в Европе, США и даже в развивающихся странах уже устойчивы к метронидазолу.
Геликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой. Возможно (и весьма часто встречается) заражение геликобактером в учреждениях общественного питания.[источник не указан 2840 дней] Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
H. pylori в слизистой желудка. Окраска гематоксилин-эозином.Считается, что в отсутствие лечения H. pylori, однажды колонизовав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммунный ответ хозяина[53][54]. Однако у пожилых людей, а также у больных с давно существующим гастритом, геликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее благоприятной для обитания этого микроба. Вместе с тем, атрофический гастрит у пожилых или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем геликобактерные гастриты.
Процент острых геликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно неизвестен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя)[55][56].
Лечение Helicobacter pylori-ассоциированных заболеваний[править | править код]
У пациентов с язвой желудка, язвой двенадцатиперстной кишки, атрофическим гастритом, MALT-омой, состоянием после резекции желудка, близким родством с больными, страдающими раком желудка с доказанной геликобактерной этиологией обязательным является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке[57]. В то же время, уничтожение доказанной инфекции H. pylori в отсутствие перечисленных выше заболеваний (состояний) не всегда целесообразна, так как возможный вред от приёма антибиотиков может перевесить возможную пользу от лечения. Некоторые источники к числу обязательных для эрадикации H. pylori заболеваний (при наличии инфекции H. pylori) относят только язвенную болезнь[3].
Австралийский гастроэнтеролог Томас Бороди в 1987 году ввёл первый известный режим «трёхкомпонентной терапии» (англ. triple therapy)[58].
Возрастающая резистентность H. pylori к «стандартным» антибиотикам, необходимость уменьшить побочные эффекты от приёма антибиотиков, а также понизить стоимость лечения стимулировали создание новых схем эрадикации. За последние десятилетия были разработаны различные варианты эрадикационной терапии, направленные на использование других антимикробных средств, а также более современных ингибиторов протонного насоса[59][60].
Отмечены случаи непродуктивности антибиотикотерапии геликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков[61]. Отмечено появление полирезистентных к антибиотикам изолятов H. pylori[62], в том числе и кларитромицин-резистентных штаммов[63]. Также отмечены случаи появления хинолон-резистентных штаммов H. pylori[64].
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44[65], препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori[66]. Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели[67].
Маастрихтские консенсусы[править | править код]
Для выработки оптимальных подходов к диагностике и лечению Helicobacter pylori-ассоциированных заболеваний в 1987 году была создана Европейская группа по изучению Helicobacter pylori (англ. European Helicobacter Study Group) (EHSG), которая периодически публикует рекомендации, называемые Маастрихтскими консенсусами[68] или «Маастрихтами» (от названия голландского города Маастрихта, в котором была проведена первая согласительная конференция EHSG). Каждый следующий «Маастрихт» является обновлением предыдущего. Были опубликованы следующие «Маастрихты»[19]:
Однако некоторые гастроэнтерологи считают, что EHSG «монополизировала право определять стратегию и тактику анти-НР-терапии» и допускает при этом ряд просчётов, результатом которых является распространение резистентных к антимикробным средствам штаммов бактерий[68].
Критика теории решающей роли Helicobacter pylori в возникновении и развитии язвенной болезни желудка и двенадцатиперстной кишки[править | править код]
Скептически настроенные в отношении инфекционной теории язвы желудка и двенадцатиперстной кишки специалисты приводят следующие аргументы[70]:
- Ни сам Барри Маршалл, ни его последователи после самозаражения H. pylori ни разу не заболели язвенной болезнью, а только гастритом.
- Как правило, язвенные дефекты встречаются в виде одиночных образований, хотя инфекция H. pylori может затрагивать значительную часть органа.
- Инфекционная теория не объясняет цикличность заболевания: «рецидив-ремиссия-рецидив».
- Процент заражённых H. pylori при тяжёлых формах язвенной болезни значительно меньше, чем при неосложнённых. Некоторые исследователи называют такие цифры: если при неосложнённой язвенной болезни двенадцатиперстной кишки инфицированные H. pylori составляют около 95 %, инфицированные H. pylori при неосложнённой язве желудка — 75—80 %, то при осложнённой рубцово-язвенным пилородуоденальным суб- и декомпенсированным стенозом язве, H. pylori имеются только у 50 % больных, осложнённых кровотечением — у 40 %, перфорацией — у 40—70 %.
- Инфекционная теория не объясняет сезонность обострений язвенной болезни.
- Имеются исследования, доказывающие на большом статистическом материале, что полная эрадикация H. pylori почти в два раза увеличивает вероятность развития рефлюкс-эзофагита, пищевода Баррета и кардиоэзофагеальной аденокарциномы, а также то, что наличие H. pylori в теле желудка снижает риск развития онкологических заболеваний кардиального отдела желудка[71][72][73].
- Инфекционная теория не объясняет и не учитывает известные факты о нарушении секреции мелатонина у язвенных бол
ru.wikipedia.org
от чего появляется микроб в желудке, симптомы
Многие годы безуспешно боретесь с ГАСТРИТОМ и ЯЗВОЙ?
«Вы будете поражены, насколько просто можно вылечить гастрит и язву просто принимая каждый день…
Читать далее »
Небольшая бактерия, которая называется Хеликобактер пилори, часто становится причиной различных патологий органов желудочно-кишечного тракта. Бактерия тщательно изучалась учеными, на сегодняшний день ее роль в образовании заболеваний пищеварительной системы хорошо известна.
От чего появляется хеликобактер пилори
Helicobacter pylori это микроб, который переводится как бактерия спиралевидной формы, функционирующая в привратнике, то есть, в нижнем отделе желудке в области, переходящей в двенадцатиперстную кишку.
Бактерия живет в жидкости, которая выстилает слизистую оболочку желудка.
Для нее свойственны такие особенности:
- форма спирали и несколько жгутиков,
- отношение к группе условно-патогенных бактерий,
- нуждается в кислороде.
Микроорганизм находится и размножается в желудке человека. Он снижает уровень кислотности сока и довольно быстро ухудшает состояние слизистых.
Сначала внутри желудка формируются небольшие язвочки. Если инфекция не лечится, то микроб начинает активно паразитировать и язвы становятся крупнее и шире. В дальнейшем инфекция вызывает острый гастрит, язву двенадцатиперстной кишки или желудка. Спустя несколько лет может возникнуть злокачественная опухоль либо атрофический гастрит.
Микроорганизм вырабатывает особый энзим для поддержания нужного уровня кислотности, чтобы сохранялись наилучшие условия выживания. Также хеликобактер обосновывается там, где есть минимальная концентрация кислоты. Таким образом, бактерия может существовать в организме долгие годы, не вызывая у человека подозрений.
Способы передачи бактерии
Бактерия может появиться в организме при:
- употреблении загрязненной воды или продуктов питания,
- орально через контакт с больным человеком,
- бытовом взаимодействии.
Если у одного человека из семьи имеется такая инфекция, то во много раз увеличивается риск заражения. Микроорганизм может передаваться через поцелуи, общую посуду или средства гигиены в санитарном узле.
Дети часто заражаются через материнскую слюну.
Заболевания, которые вызваны хеликобактером пилори, объединены общим названием «хеликобактериоз». Примерно 60% людей на планете являются носителями данной бактерии, поэтому хеликобактериоз признан наиболее распространенным заболеванием инфекционного характера.
Симптоматика заражения
Хеликобактер может находиться в кишечнике длительное время, симптомы часто не выражены. Вследствие этого, многие люди ошибочно лечат заболевания ЖКТ, которых на самом деле нет. Терапия в этом случае часто состоит из понижения общей кислотности желудка, что не приносит ожидаемого эффекта, поскольку нет ликвидации основной причины.
В определенных ситуациях человек может испытывать:
- боли и дискомфорт в желудке,
- вздутие живота,
- рвота и тошнота,
- расстройства желудка,
- озноб и иногда небольшое увеличение температуры тела.
Некоторые люди с инфекцией имеют симптоматику, которая проявляется на лице. В частности, могут появляться прыщики на коже, которые бросаются в глаза. В некоторых случаях возникает неприятный специфический запах изо рта.
Врачи подчеркивают, что даже если проявления бактерии исчезли полностью — это не выступает гарантией полной ликвидации проблемы. Нужно сдать все необходимые анализы и пройти терапевтический курс при подтверждении диагноза.
Методы диагностики
В настоящее время в медицинской практике применяют несколько методов, дающих возможность с точностью определить наличие хеликобактера в организме:
- анализ крови. Выполняются исследование на наличие в крови антител, которые сигнализируют о том, что иммунитет борется с бактерией,
- анализ кала. Выявляется генетический материал вредоносного микроорганизма,
- дыхательный тест. Определяется уреазная активность бактерии, которая находится в организме человека,
- цитологическое исследование. Этот метод подразумевает нахождение вредоносного микроба при помощи микроскопа с рассмотрением проб слизистой оболочки желудка.
Чтобы добиться наибольшей достоверности результатов, врач может назначить пациенту несколько диагностических исследований.
Используемые препараты
Поскольку, микроб в желудке хеликобактер вызывает различные сбои в работе ЖКТ, необходимо неотложное лечение. При назначении препаратов следует учитывать стадию патологического процесса, тяжесть недуга и этиологические особенности.
Нейтрализовать бактерию можно с помощью:
- эрадикационного,
- комплексного,
- антибактериального лечения.
Эрадикация это тотальная ликвидация любых форм бактерии.
Самым эффективным признано сочетание препаратов:
- Амоксициллин,
- Кларитромицин,
- Рабепразол.
Если результаты неудовлетворительны, то назначается иная схема, включающая:
- Рабепразол,
- Метранидазол,
- Тетрациклин,
- Висмуса Субсалицилат.
Продолжительность приема лекарств составляет не более двух недель.
Нюансы лечения хеликобактер пилори
Вместе с эрадикационным лечением нужно употреблять пробиотические средства. С их помощью снижается вероятность формирования побочных эффектов.
Инфекция хеликобактер уничтожается с разной скоростью в зависимости от конкретной разновидности патологии. Важна правильность схемы лечения и установка чувствительности бактерии к препаратам.
Во многих случаях применение антибактериальных лекарств при остром гастрите или язве, позволяет организму полностью восстановиться без любых последствий.
Терапия гастрита хронической стадии, который сопровожден атрофическими изменениями, требует комплексного подхода. Часто невозможно полностью восстановить пораженные области. Следует неукоснительно придерживаться назначенной схемы лечения, поскольку заболевание может осложниться образованием злокачественной опухоли.
ogastrite.ru
Существует ли Хеликобактер и как его проверить? Хеликобактер симптомы и лечение
В мире существует множество микробов, они вокруг нас, они живут во внешней среде, а некоторые могут жить и внутри нас. Например, бактерии в кишечнике. Но не все бактерии могут до него дойти, так как большинство микробов гибнет в желудке. Бактерии попадают в желудок в большом количестве, и в таком же большом количестве гибнут в нем.
Нас интересует принципиально Хеликобактер, потому что потенциально он может вызывать проблемы в желудке. Другие микробы тоже могут, но к счастью они быстро гибнут в желудке, и если и успевают ему навредить, то очень незначительно. Так что с ними не приходится даже бороться. А вот Хеликобактер может жить в желудке неограниченно долго, поскольку организм не может от него избавиться своими силами.
Получить этого микроба можно от другого человека, у которого он уже есть. Можно, но не гарантированно! Нужно относиться к этой бактерии, как к любой другой инфекции, например, гриппу. Ведь им можно заболеть или не заболеть, даже если на вас чихнули. Потому, что существует 3 уровня иммунной защиты, которые в норме предотвращают заражение.
та бактерия поселяется в желудке надолго, в это основная проблема. Однако, бактерия бактерии рознь. И как породы собак или кошек, есть и «породы» Хеликобактер. Некоторые виды вызывают язву желудка, не моментально, а постепенно – сначала раздражение, потом небольшое воспаление, потом большое воспаление, потом эрозии, напоминающие ссадины, а потом уже и язвы. Другие виды Хеликобактер вызывают в желудке атрофию, тоже не сразу – сначала легкое воспаление, потом стенка желудка становится тонкой, выделяет меньше кислоты, в ней становится меньше сосудов, появляется атрофия, потом метаплазия, потом дисплазия, еще дисплазия и рак желудка.
Видимо, эта бактерия Хеликобактер действительно опасна, но в ней нет ничего экстренного и срочного. Мы можем успеть ее вылечить. Не всегда, но у очень многих людей мы можем определить, какой конкретно вид Хеликобактер попал в желудок.
Проверить не так уж сложно. Нужно всего лишь сдать анализы. Вот только ассортимент большой и выбрать бывает сложно. Есть самый простой тест, дыхательный экспресс-тест, быстро подышать в трубочку и получить результат. К сожалению, он показывает не саму бактерию, а продукты ее жизнедеятельности. Такие же отходы могут быть и от других бактерий, поэтому нет гарантии, что Хеликобактер действительно у вас в желудке. Такой же экспресс-тест делают и во время гастроскопии прямо внутри желудка.
Более достоверный анализ, это взятие образца из желудка (биопсия), специальная окраска и изучение под микроскопом с подсчетом количества микробов. Но это сейчас делают очень редко, слишком трудоемко. Намного проще сдать анализ кала и определить в нем антигены бактерии, то есть обломки ее оболочки. Если Хеликобактер присутствует в желудке, то всегда в достаточном количестве, чтобы ее кусочки выделялись с калом. Неудобно, но просто.
Есть еще и анализ крови на Хеликобактер, он тоже определяет не саму бактерию, а реакцию на нее иммунной системы. Поэтому данное обследование поможет только тем, у кого раньше не было Хеликобактер и ее нашли впервые. Так же отдельный вариант анализа крови позволяет определить, на что способна бактерия. То есть она может вызвать язву или атрофию, или и язву, и атрофию, или на безоружна и безопасна.
К сожалению, к анализам нужно готовиться, например, перед анализом крови не кушать, гормоны сдавать утром и так далее. Очень часто об это забывают, когда сдают анализы на Хеликобактер. В итоге мы получаем ложный положительный результат или ложный отрицательный, таким образом лечим то, что не надо, и не лечим, то что нужно вылечить.
Самый распространенный экспресс тест (дыхательный или эндоскопический) нужно перепроверять, у него очень низкая специфичность. Анализ крови только для тех, кто раньше не лечился от Хеликобактер. И, самое главное, нельзя принимать желудочные лекарства ч течение 1 месяца до анализа, чтобы получить правильный результат. А живот болит, и изжога мучает, поэтому многие не прекращают принимать таблетки и сдают анализ, в итоге получают неверный результат. Если вы уже начали принимать таблетки сами и перестать их принимать не получается потому что возвращаются боли, то нужно идти ко врачу за временным лечение для того, чтобы получить правильный результат анализов.
Ответ достаточно прост, но есть два условия. Первое, Хеликобактер нужно лечить, если он у вас есть, ведь если его нет, то и лечить просто нечего. Второе, лечить его нужно, если мы поняли, что он реально болезнетворный, ведь есть и не болезнетворные типы этой бактерии. Третье, лечить его нужно, если уже есть риск развития серьезных проблем с желудком.
В реальной жизни, так получается, что мы используем недостоверные методы диагностики, или принимаем лекарства, которые изменяют результаты анализов, а потом лечим ложный результата, да еще и не тем лекарствами. Хотя эффективные схемы лечения Хеликобактер известны, достаточно безопасны и практически не имеют побочных эффектов. Поэтому правильнее всего проверить себя достоверным методом и при необходимости вылечиться, а не носить бомбу замедленного действия с собой всю жизнь и не лечить то чего нет.
vyalov.com
