В бакпосеве из цервикального канала выявлена кишечная флора – надо ли лечить?
ВОПРОС: Уже два года в посеве из цервикального канала у меня высеивается Esherichia coli 106. А также Enterococcus faecalis 105. Я неоднократно лечилась антибиотиками, которые мне назначали, но эффекта никакого нет. Все осталось, как и прежде. Кто-то говорит, что это от того, что недостаточно соблюдена гигиена. Но это точно не про меня! Я всегда сразу подмываюсь после туалета, а в редких случаях, когда нет возможности, пользуюсь влажными салфетками. Насколько наличие этих возбудителей опасно?
ОТВЕТ: Я глубоко сомневаюсь, что у вас в цервикальном канале есть кишечная палочка. Я могу поверить, что ее могли найти во влагалище. И лечение антибиотиками было совершенно необоснованным. Я уверена, что забор материала на бактериальный посев у вас брали неправильно или же он загрязнялся в результате ошибок опять же при заборе и переносе на среду.
Данные виды бактерий относятся к нормальной кишечной группе, т.е. они живут в кишечнике. Но они также могут жить во влагалище, реже в мочевыделительной системе. Как они туда попадают? Кожа промежности – это самая грязная область человеческого тела, потому что в этой области находятся отверстия, через которые выделяются шлаки: анус, через который происходит дефекация, уретра, через которую выводится моча, и влагалище у женщин, через которое тоже выходят выделения. Поэтому эта область всегда влажная. Анус никогда не закрыт плотно, хотя сфинктер не позволяет выходить калу вне акта дефекации, если нет недержания кала. Поэтому определенное количество выделений с прямой кишки попадает на кожу промежности постоянно.
После дефекации, независимо от того как вы тщательно вытрете область ануса туалетной бумагой, или даже подмоетесь (для этого и использовались биде когда-то в женских туалетах), определенная часть каловых выделений все равно останется в складках кожи. Поэтому вероятность попадания кишечных микроорганизмов во влагалище большая. Загрязнение увеличивается при половом акте, если перед ним половые органы у обоих партнеров не вымыты теплой водой с мылом. Также, кишечная флора заносится во влагалище в большем количестве, если женщина неправильно подмывается и вытирается (движения руки всегда должны быть от входа во влагалища в сторону ануса и межягодичной складки, но не наоборот).
Загрязнение увеличивается при половом акте, если перед ним половые органы у обоих партнеров не вымыты теплой водой с мылом. Также, кишечная флора заносится во влагалище в большем количестве, если женщина неправильно подмывается и вытирается (движения руки всегда должны быть от входа во влагалища в сторону ануса и межягодичной складки, но не наоборот).
Количество колоний бактерий в вашем случае показывает воспалительный процесс, однако он бы проявил себя желтовато-зелеными выделениями с неприятным запахом. Кроме того, постоянное и частое использование антибиотиков для якобы избавления вас от этих «страшных» бактерий приводит к серьезному нарушению баланса здоровой и условно-патогенной флоры. Для кишечника эти микроорганизмы являются нормальной флорой, для влагалища – условно-патогенной. Антибиотики не только нарушают баланс, но подавляют рост лактобактерий, которые заменить коммерческими препаратами лактобактерий невозможно.
Скажу вам также, что постоянные бактериальные посевы – это уже не необходимый метод обследования, а из него сделали доходный коммерческий метод диагностики (хотя это даже диагностикой не назовешь, если их проводят без всяких показаний).
Поделиться ссылкой:
Почитать еще«Посевы из влагалища» – Яндекс.Кью
«У меня в посеве в 10*4 или 10*8, в какой угодно степени обнаружили кишечную палочку/стафилококк/стрептококк/энтерококк или каких-либо других возбудителей? Что с этим делать?»
В 99% случаев ничего.
Если у вас нет жалоб, то такой посев не требует лечения и вообще это исследование является одним из самых бесполезных в гинекологии, оно крайне малоинформативно.
Стафилококки, стрептокококки, кишечная палочка, энтерококк, уреаплазма уреалитикум и парвум, микоплазма гоминис, гарднерелла и прочие условные патогены,
Ну и что, что их больше, чем 10*4 cтепени? Кто сказал, что их не может быть больше? Таких установленных норм нет, а те, которые кто-то вроде бы как установили, не имеют под собой никакого обоснования.
Когда посевы оправданы?Поиск конкретных возбудителей
1. Выявление стрептококка группы В у беременной женщины. Если он будет обнаружен, то совершенно неважно какая будет степень, это требует лечения во время родов, не во время беременности.
2. Второй вариант. Например, мы предполагаем у вас
Неправильно делать посевы на флору, потому что мы не получаем информации о соотношении микроорганизмов, а установленные нормы до 10*4 степени на самом деле не являются таковыми. Это же относится и к уреаплазме. В РФ лечат, если ее больше чем 10*4 степени, хотя это и неправильно.
Это же относится и к уреаплазме. В РФ лечат, если ее больше чем 10*4 степени, хотя это и неправильно.
В отсутствие у вас жалоб посевы делать не нужно.
Если у вас есть жалобы — измеряется рН влагалища, проводится флороценоз или фемофлор, на худой конец микроскопия.
Нет норм для содержания кишечной палочки или стрептококка. Важно оценивать соотношение флоры. Лечение требуется, если у вас есть жалобы и вид терапии подбирается, исходя из результатов анализов.
Посевы никак не отображает ситуацию во влагалище и не дают нам никакого представления о проблеме, есть она там, нет и если есть, то какая.
«У меня есть жалобы, я сделала посев мазок, а там уреаплазма в энной степени или кишечная палочка, или гарднерелла, мне поставили диагноз уреаплазмоз/гарднереллез/дисбиоз, как лечить?»
Дорогие мои, это неправильно. Не лечатся отдельные возбудители не существует таких диагнозов.
Еще раз, есть жалобы на выделения, неприятный запах, зуд, жжение и прочие симптомы. На основании ваших жалоб, осмотра на кресле, флороценоза и рН, вам может быть выставлен диагноз:
На основании ваших жалоб, осмотра на кресле, флороценоза и рН, вам может быть выставлен диагноз:
1. Бактериальный вагиноз (лечится одним антибактериальным препаратом).
2. Аэробный вагинит (назначается один антибактериальный препарат).
3. Кандидоз (лечится противогрибковыми препаратами).
Никаких других диагнозов не существует. Уреаплазма является условным патогеном и лечится в контексте вышеперечисленных диагнозов, а не как отдельный возбудитель.
Посевы/качественные ПЦР на выявление уреаплазм (исключение есть только для микоплазмы гениталиум) не нужно сдавать никому и никогда.
Эшерихия коли в мазке: причины, симптомы, лечение
Условно-патогенные бактерии Эшерихия коли в мазке — сигнал о сбое в работе пищеварительной или мочеполовой системы.
При появлении такого симптома нужно немедленно начинать лечение антибиотиками. Медикаменты помогут предотвратить переход заболевания в хроническую форму.
Причины появления Эшерихии коли
Эшерихии коли или кишечные палочки — это бактерии палочкообразной формы, обитающие обычно в кишечнике.
По разным причинам они способны увеличивать территорию своего обитания, заселяя, кроме кишечника, влагалище и мочевые пути.
Кишечные палочки могут размножаться практически в любом человеческом органе, так как для жизни им нужны всего лишь влажная среда и стабильная температура.
Эшерихия коли есть даже в абсолютно здоровой микрофлоре влагалища, но их рост и размножение сдерживают лактобактерии.
Если лактобактерии по какой-то причине исчезают (например, после лечения антибиотиками), то начинается бурное размножение эшерихии коли, а заодно других условно-патогенных микроорганизмов: кандид, стафилококков, энтеробактерий.
В мазке из влагалища и цервикального канала найти эшерихий коли сложно, так как микроб образует колонии в виде цепочек, которые ошибочно диагностируют как стафилококковые. Легче обнаружить эшерихий коли в посеве мазка.
К сдаче мазка на посев нужно подготовиться — вымыть теплой чистой водой интимные органы без мыла и геля, за несколько дней до анализа отказаться от алкоголя.
Эшерихия коли резистентна к основным видам антибиотиков и антибактериальных препаратов. Лечение кишечной палочки в мазке долгое и комплексное, причем результатов удается добиться не всегда.
Одной из распространенных причин заселенности влагалища E-coli является недостаточная личная гигиена мочеполовых органов.
Заразиться можно половым путем и через общие банные полотенца, мочалки, белье, но для этого нужно, чтобы иммунитет был ослаблен: люди с сильной иммунной защитой не могут заразиться кишечной палочкой бытовым путем.
Видео:
Кишечная палочка, размножившись в мочеполовых путях, приводит к развитию воспалений. Кроме посева мазка, эшерихию коли можно обнаружить в посеве мочи.
В таком случае можно говорить о воспалительном процессе в почках, мочеточниках или мочевом пузыре. Нефрологические и урологические инфекции очень опасны, так как могут стать причинами почечной недостаточности.
Симптомы заболевания
Заражение влагалища и мочевых путей кишечной палочкой редко проходит бессимптомно.
Признаками инфицирования мочеполовых органов могут стать:
- болезненное, учащенное и непроизвольное мочеиспускание;
- пропажа сексуального влечения;
- дискомфорт в области спины;
- боль внизу живота и в паху;
- чувство слабости и усталости, что говорит об интоксикации.
Без врачебного вмешательства рост кишечной палочки во влагалище и цервикальном канале будет продолжаться, а состояние здоровья ухудшаться.
Со временем бактерионосительство переходит в хроническую стадию, после чего качество жизни пациентки сильно снижается, так как появляются специфический дискомфорт, зуд, жжение во влагалище и постоянные проблемы с мочеиспусканием.
Кишечные палочки могут долгое время без вреда для себя находиться на воздухе, поэтому ими можно заразиться бытовым путем. Попав в мочеполовую систему, они находят там для себя благоприятные условия для размножения.
Видео:
Избавиться от эшерихии коли в мазке непросто, лучше не допустить инфицирования влагалища кишечной палочкой.
Для этого нужно соблюдать личную и социальную гигиену:
- держать в чистоте интимную зону;
- не прикасаться к интимным местам грязными руками;
- не использовать чужие вещи (бритву, белье, полотенце) для интимной гигиены;
- при половых контактах с непроверенными партнерами использовать презервативы.
Правила просты и общеизвестны, их соблюдение защищает от множества неприятностей со здоровьем.
Заниматься самолечением эшерихии коли в мазке означает попусту тратить время. После появления первых же неприятных симптомов дисбактериоза влагалища нужно немедленно обратиться к гинекологу.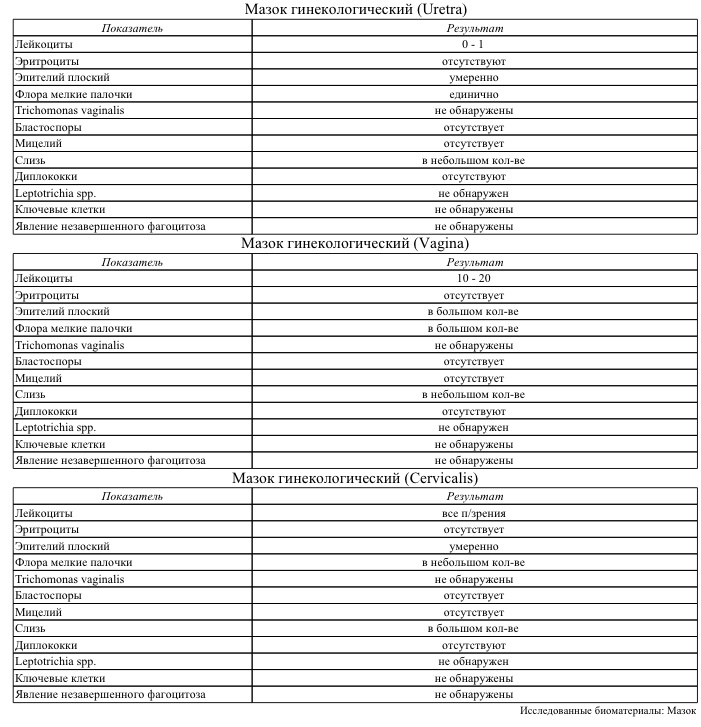 Доктор возьмет мазок на посев и выяснит причины зуда и жжения.
Доктор возьмет мазок на посев и выяснит причины зуда и жжения.
Способы лечения
Лечение назначается строго индивидуально, перед назначением антибиотиков врач должен проверить чувствительность микроорганизмов к лекарству.
В последнее время женщинам, у которых в мазке обнаружено избыточное количество кишечной палочки, перестали прописывать антибиотики, так как микроорганизм приобрел резистентность, образовав стойкие разновидности и гибриды.
Лечение E-coli в мазке нужно начинать с восстановления микрофлоры кишечника. Пролечив дисбактериоз, можно заодно избавиться от эшерихии коли в мазке и моче без антибиотиков.
Для восстановления микрофлоры кишечника используют пробиотики: Бифиформ, Линекс, Энтерол, Трихопол и другие.
Врач индивидуально подберет курс, поэтому, возможно, потребуется сменить несколько лекарств. Во время лечения придется соблюдать диету.
Видео:
Запрещено есть продукты, полученные в результате брожения, квашения и копчения.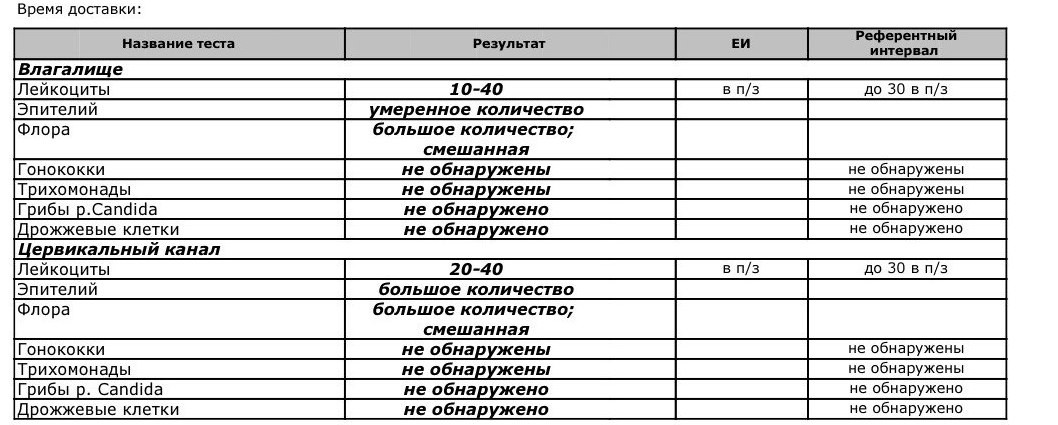 Под запретом оказываются пиво, дрожжевое тесто, вино, квашеные овощи и даже мед. Другими словами, избавляться от эшерихии коли в мазке придется с помощью не только гинеколога, но и гастроэнтеролога.
Под запретом оказываются пиво, дрожжевое тесто, вино, квашеные овощи и даже мед. Другими словами, избавляться от эшерихии коли в мазке придется с помощью не только гинеколога, но и гастроэнтеролога.
Для лечения от эшерихии коли в мазке не обязательно колоть антибиотики, можно попытаться искусственно заселить влагалище лактобактериями. Восстановить нормальную вагинальную флору можно с помощью свечей Ацилакт, Вагинорм, Гинофлор.
Вести борьбу с микроорганизмами можно с помощью препарата «Интести-бактериофаг», представляющим собой раствор для ректального и вагинального введения и приема внутрь.
Лекарство помогает избавиться не только от дисбактериоза влагалища, но и от нарушений в балансе кишечной микрофлоры, энтероколита, колита и даже дизентерии и сальмонеллеза. Средство можно применять даже ребятишкам первых месяцев жизни. Курс лечения составляет 7 – 10 дней.
Особенно опасны кишечные палочки в мазке во время беременности, так как могут привести к развитию цистита, пиелонефрита и аднексита.
Заболевания мочеполовой системы у беременной женщины лечатся в стационаре. Доктор назначит антибиотики, которые можно применять без опасения навредить плоду.
Лечение эшерихии коли в мазке нужно вести до тех пор, пока их уровень не упадет до нормального показателя и не исчезнут симптомы инфекции.
На это может уйти от нескольких недель до нескольких месяцев, ведь придется не только избавиться от инфекции в мочеполовых органах, но и восстановить естественную микрофлору.
Заболевания, возникшие в результате дисбактериоза влагалища, после перехода в хроническую стадию могут привести к бесплодию.
Любая женщина, у которой обнаружено превышение эшерихий коли в мазке, должна помнить об этой опасности и не пренебрегать лечением.
Вы здесь:
Бактериальный вагиноз: новые перспективы в лечении
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
А.А. ХРЯНИН, д.м.н., профессор, Новосибирский государственный медицинский университет Минздрава России; вице-президент РОО «Ассоциация акушеров-гинекологов и дерматовенерологов», Новосибирск,
О. В. РЕШЕТНИКОВ, д.м.н., в.н.с., Научно-исследовательский институт терапии и профилактической медицины, Новосибирск
В. РЕШЕТНИКОВ, д.м.н., в.н.с., Научно-исследовательский институт терапии и профилактической медицины, Новосибирск
Бактериальный вагиноз — это инфекционный невоспалительный синдром, характеризующийся заменой обычной микрофлоры (преимущественно лактобактерий) на полимикробные ассоциации анаэробов и Gardnerella vaginalis. В последние годы использование методов молекулярной биологии показало, что существует гораздо большее разнообразие микроорганизмов, ассоциированных с бактериальным вагинозом, чем считалось ранее. Клиндамицин зарекомендовал себя как эффекивный и безопасный препарат в лечении бактериального вагиноза в современных условиях.
Влагалищная флора — это многокомпонентная микроэкологическая система, обеспечивающая защиту всех репродуктивных органов женщин как в обычных условиях, так и при патологии. Основными представителями микрофлоры влагалища в норме являются лактобактерии разных видов (Lactobacillus spp.) и в меньшей степени бифидобактерии и коринебактерии, а также анаэробные грамотрицательные палочки рода
 У здоровых женщин репродуктивного возраста ведущее место в вагинальном микроценозе занимают лактобактерии (анаэробного и аэробного происхождения), объединенные под общим названием «палочки Дедерлейна», которые составляют более 95% всей микрофлоры влагалища. Бифидобактерии, так же как и лактобактерии, защищают слизистую оболочку влагалища от воздействия не только патогенных, но и условно-патогенных микроорганизмов, их токсинов, препятствуют распаду секреторного IgА, стимулируют образование интерферона и выработку лизоцима. У здоровых женщин анаэробная микрофлора превалирует над аэробной в соотношении 10 : 1 [1, 2].
У здоровых женщин репродуктивного возраста ведущее место в вагинальном микроценозе занимают лактобактерии (анаэробного и аэробного происхождения), объединенные под общим названием «палочки Дедерлейна», которые составляют более 95% всей микрофлоры влагалища. Бифидобактерии, так же как и лактобактерии, защищают слизистую оболочку влагалища от воздействия не только патогенных, но и условно-патогенных микроорганизмов, их токсинов, препятствуют распаду секреторного IgА, стимулируют образование интерферона и выработку лизоцима. У здоровых женщин анаэробная микрофлора превалирует над аэробной в соотношении 10 : 1 [1, 2].Лактобациллы перерабатывают гликоген, который в большом количестве содержат эпителиальные клетки влагалища женщин репродуктивного возраста, в молочную кислоту, повышая кислотность влагалища. Кроме того, лактобациллы продуцируют перекись водорода. В результате кислая среда влагалища и перекись водорода подавляют рост условно-патогенных микробов (стафилококков, стрептококков, кишечной палочки, анаэробных бактерий, Gardnerella vaginalis, Mobiluncus spp. ), которые в небольшом количестве выявляются во влагалище подавляющего большинства женщин. Если доля лактобацилл снижается, их место в экосистеме занимают условно-патогенные микробы (в первую очередь Gardnerella vaginalis). Таким образом, кислая среда влагалищного содержимого, лактобациллы и факторы защиты, которые они продуцируют, образуют мощнейший естественный барьер на пути проникновения патогенных бактерий, защищая верхние отделы полового тракта женщины.
), которые в небольшом количестве выявляются во влагалище подавляющего большинства женщин. Если доля лактобацилл снижается, их место в экосистеме занимают условно-патогенные микробы (в первую очередь Gardnerella vaginalis). Таким образом, кислая среда влагалищного содержимого, лактобациллы и факторы защиты, которые они продуцируют, образуют мощнейший естественный барьер на пути проникновения патогенных бактерий, защищая верхние отделы полового тракта женщины.
Особенностью микрофлоры влагалища является ее изменчивость под действием как экзогенных (использование тампонов, частые влагалищные души и спринцевания, смена полового партнера), так и эндогенных факторов (нейроэндокринные заболевания, сахарный диабет, гипотиреоз). На микроценоз оказывают влияние физиологические и гормональные изменения (пубертатный период, беременность, менопауза), фазы менструального цикла, различные нарушения менструальной функции [3]. Играет также роль использование некоторых медикаментозных препаратов (антибиотики, гормоны) и хирургические вмешательства.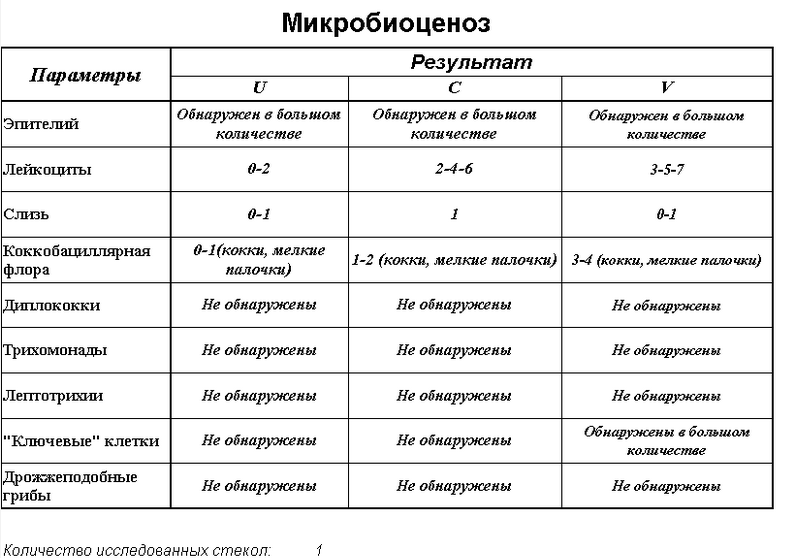
Бактериальный вагиноз (БВ) (прежнее название – вагинальный дисбактериоз) представляет собой общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалища и сопровождающийся чрезмерно высокой концентрацией облигатно и факультативно анаэробных условно-патогенных микроорганизмов в сочетании с резким снижением количества или отсутствием молочнокислых бактерий в отделяемом влагалища (табл. 1).
|
Таблица 1. Экосистема влагалища |
||
| Микроорганизм | Здоровые женщины | Женщины с БВ |
| Общее количество микроорганизмов |
<107 микроорганизмов/г |
>109 микроорганизмов/г |
| Соотношение аэробы : анаэробы | От 1 : 2 до 1 : 10 | Достигает 1 : 100 |
|
Lactobacilli |
Преобладают | Незначительное количество |
| Gardnerella vaginalis | Наличие в 5—25% | Наличие в 71—92% |
| Mycoplasma hominis | Наличие в 15—30% | Наличие в 63% |
Mobiluncus spp. (факультативный анаэроб) (факультативный анаэроб) |
Наличие в 0—5% |
Наличие в 50—70% |
|
Bacteroides spp. (анаэроб) |
Наличие в 52% | Наличие до 100% |
|
Peptococcus spp. (анаэроб) |
Наличие в 26% | Наличие до 100% |
При бактериальном вагинозе происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища анаэробами: Fusobacterium, Mobiluncus, Peptostreptococcus, Gardnerella vaginalis. Несмотря на то что БВ характеризуется своей полимикробной природой, основным запускающим процесс микроорганизмом является Gardnerella vaginalis, факультативно-анаэробная грамотрицательная палочка; именно она определяет главную симптоматику БВ.
Дело в том, что G. vaginalis обладает уникальной способностью формировать на поверхности урогенитальной слизистой так называемую биопленку.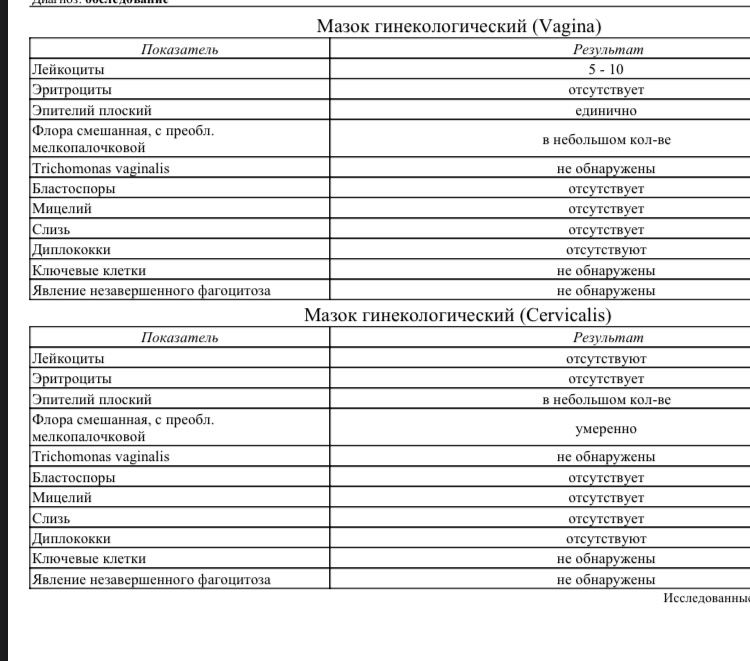 Биопленка (biofilm) — это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество (внеклеточный матрикс) — слизь. Считается, что 95—99% всех микроорганизмов в естественной среде существуют в виде биопленки. Микроорганизмы образуют биопленку под влиянием ряда факторов, включая клеточное распознавание мест прикрепления к поверхности и наличие питательных или агрессивных веществ, кислорода и т. д. В режиме образования биопленки клетка меняет свое поведение, что обусловливается регуляцией экспрессии генов.
Биопленка (biofilm) — это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество (внеклеточный матрикс) — слизь. Считается, что 95—99% всех микроорганизмов в естественной среде существуют в виде биопленки. Микроорганизмы образуют биопленку под влиянием ряда факторов, включая клеточное распознавание мест прикрепления к поверхности и наличие питательных или агрессивных веществ, кислорода и т. д. В режиме образования биопленки клетка меняет свое поведение, что обусловливается регуляцией экспрессии генов.
Именно эта биопленка как цемент или клей притягивает к себе другие микроорганизмы, образуя конгломерат бактерий, в большинстве своем обладающих патогенным, или, по крайней мере, опасным для человека эффектом. Биопленки, как было установлено, состоят в основном из Gardnerella vaginalis, в то время как Atopobium vaginae присутствовал в 80% случаев и составил 40% от массы биопленки. Другие бактерии встречаются намного реже, в т. ч. бактерии, принадлежащие к родам Bacteroides, Corynebacterium, Lactobacillus, Veillonella, Ruminococcus и Streptococcus [4].
К факторам, способствующим развитию БВ относят:
— Иммунодефицитные состояния организма (хронические стрессы, заболевания, массивное лечение антибиотиками и цитостатиками, лучевая терапия, сахарный диабет, авитаминоз).
— Гормональная дисфункция яичников, в т. ч. возрастные гормональные изменения, гормонотерапия.
— Угнетение факторов местного иммунитета и лактобацилл (влагалищные спринцевания, инородные тела, внутриматочные контрацептивы, использование спермицидов, контрацептивные свечи и кремы, содержащие 9-ноноксинол (Патентекс Овал, Ноноксинол)
— Массивное инфицирование влагалища, промискуитивные связи.
Распространенность БВ
Определить истинную частоту встречаемости БВ не представляется возможным в связи с тем, что у 1/3 женщин это заболевание протекает бессимптомно. В немногочисленных исследованиях установлена распространенность БВ в диапазоне от 3,14% у бессимптомных женщин в возрасте от 18 до 72 лет (скрининг в Нидерландах) до 49% у женщин в возрасте от 13 до 65 лет пациенток кабинета кольпоскопии в США. Большой разброс в представленных показателях распространенности может быть связан с включением различных групп пациентов, демографических вариациях и разных диагностических критериев. В целом по результатам 21 исследования общая распространенность БВ составила 27,1%, при этом особо не отличаясь в развитых (28,0%) и развивающихся (23,5%) странах [5].
В процессе выполнения Human Microbiome Project методы молекулярной биологии показали, что существует гораздо большее разнообразие микроорганизмов, ассоциированных с БВ, чем это было очевидно с использованием методов культивирования. Для примера приведем список микроорганизмов, ранее неизвестных при БВ: Atopobium vaginae, БВ-ассоциированные бактерии (BVAB-1, BVAB-2 и BVAB-3) из порядка Clostridiales, Megasphaera spp, Leptotrichia spp, Dialister spp, Chloroflexi spp, Olsenella spp, Streptobacillus spp, Shuttleworthia spp, Porphyromonas asaccharolytica [6].
Эти разнообразные организмы аккумулируются, формируя различные сообщества или профили, которые свидетельствуют, что БВ не единое целое, а синдром переменного состава, вызывающий разнообразие симптомов, различные фенотипические исходы и приводящий к вариабельности ответов на различные схемы антибиотиков. Некоторые организмы или комбинации организмов обладают высокой специфичностью для БВ, так что в будущем использование молекулярного количественного анализа позволит лучше диагностировать каждый подтип BV и подбирать индивидуализированную терапию. Расовая принадлежность женщины и географический регион, а также различные расовые группы в том же географическом регионе имеют существенные различия в том, какой микроорганизм является доминирующим в среде влагалища. В большинстве популяций L. crispatus является доминирующим изолятом, а у белых женщин L. crispatus и/или L. jensenii более распространены, чем любые другие виды Lactobacillus [6].
Среди афроамериканок в США недавно обнаружено превалирование при БВ грамотрицательных бактерий BVAB1, которые ранее ошибочно воспринимались как Mobiluncus spp. [7].
В недавнем метаанализе, включившем более 10 000 женщин, доказана связь между БВ и предраковыми состояниями, а именно цервикальной интраэпителиальной неоплазией/дисплазией [5]. Поскольку лишь у меньшинства пациенток, ифицированных ВПЧ, развивается дисплазия шейки матки, изучение цервикального канцерогенеза должно включать наличие дополнительного фактора, способствующего ему. Этим фактором и является БВ. Биохимические изменения в вагинальных выделениях женщин с БВ включают образование продуктов метаболизма, таких как пропионат и бутират, способные повреждать эпителиальные клетки. Кроме того, БВ-ассоциированные анаэробы выделяют летучие амины (особенно путресцин, триметиламин и кадаверин), которые появляются в вагинальной среде после преобразования аминокислот, полученных из-за обилия анаэробов, и формируют в сочетании с нитритами (производимые из нитратов бактерий) нитрозамины. Эти канцерогенные соединения способны образовывать аддукты ДНК и, следовательно, мутагенные события. Локальное накопление нитрозаминов во время эпизодов БВ может способствовать клеточной трансформации в эпителии шейки матки в комплексе с другими онкогенными агентами, такими как ВПЧ-инфекция. Кроме того, у пациенток с БВ и дисплазией отмечен измененный профиль местного иммунитета шейки, а именно оксид азота (NO) и концентрации цитокинов (ИЛ-6, ИЛ-8 и ИЛ-10). Наконец, еще одним важным дополнительным кофактором цервикального канцерогенеза может быть относительное отсутствие перекиси водорода (h3O2), в норме производимой лактобактериями. Это препятствует селективной индукции апоптоза, которая представляет собой ключевой элемент стимулируемой лактобактериями противоопухолевой защиты [5].
У небеременных женщин наличие БВ связано с повышенным риском инфицирования верхних половых путей неполовыми инфекциями и ИППП, а также ВИЧ-инфекции. При беременности БВ увеличивает риск постабортного сепсиса, раннего выкидыша, привычных выкидышей, позднего выкидыша, преждевременного разрыва мембран, спонтанных преждевременных схваток и преждевременных родов, гистологического хориоамнионита и послеродового эндометрита. В результате аномальная вагинальныя флора может предрасполагать к возрастанию колонизации половых путей, инфильтрации плодных оболочек, микробной инвазии амниотической полости и повреждению плода [6].
При тщательном наблюдении за 49 женщинами (вагинальные образцы забирали еженедельно во время беременности и ежемесячно после родов) отмечено, что с риском преждевременных родов связано сравнительно большее разнообразие представленных в родовых путях микроорганизмов, а максимальный риск оказался у женщин, в вагинальных выделениях которых было мало лактобактерий, а также микроорганизмов вида Gardnerella spp и Ureaplasma spp. У большинства женщин выявлены послеродовые нарушения вагинальной микробиоты со снижением Lactobacillus spp и увеличением различных анаэробов, таких как Peptoniphilus, Prevotella и Anaerococcus видов. Это нарушение не было связано с гестационным возрастом при родах и сохраняется до 1 года после родов. Полученные данные имеют важные последствия для прогнозирования преждевременного родоразрешения и для понимания потенциального воздействия стойких изменений послеродовой микробиоты на состоянии здоровья матерей, в том числе исходов последующих беременностей в случае короткого интервала между ними [8].
Лабораторная диагностика БВ
БВ может быть диагностирован клинически или с использованием комплекса клинических критериев, микроскопических, энзимологических, хроматографических методов, а также с использованием качественных или полуколическтвенных культуральных методов [6].
В мировой медицинской практике пользуются клинико-лабораторными критериями, предложеными Amsel R. (1983 г.), указанные в таблице 2 [9]. Диагноз бактериального вагиноза считается подтвержденным при наличии трех или четырех признаков из предложенных критериев:
|
Таблица 2. Клинико-лабораторные критерии бактериального вагиноза [9] |
|||
| Критерии |
№ |
Определение |
Признак БВ |
| Клинический |
I |
Осмотр влагалища зеркалом, кольпоскопия | Обильные гомогенные, бело-серые с неприятным запахом выделения |
| Клинико-лабораторный |
II |
Определение рН влагалища индикаторной полоской | рН > 4,5 |
|
III |
Тест КОН (whiff test) — добавление к выделениям из влагалища в пробирке 10% КОН | Появление специфического запаха | |
| Лабораторный |
IV |
Микроскопия мазка из выделений из влагалища как нативного препарата или окрашенного по Граму | Обнаружение «ключевых клеток»* |
| Примечание: *«Ключевые клетки» — это зрелые эпителиальные клетки с адгезированными на них микроорганизмами (гарднереллой, мобилункусом, грамположительными кокками). Можно получить ложные положительные результаты, выявив эпителиальные клетки с адгезированными на них лактобактериями; в этом случае необходимо произвести микроскопию влагалищных мазков, окрашенных по Граму. | |||
Диагностически значимым считается наличие хотя бы 3 положительных признаков из 4:
1. Клинические проявления.
2. Повышение pH отделяемого влагалища > 4,5.
3. Положительный аминовый тест (усиление запаха гнилой рыбы при реакции с 10% КОH).
4. Критерии микроскопии мазка по Граму: слущенный эпителий в большом количестве, «ключевые клетки» составляют 20% от всех эпителиальных, лейкоциты единичные.
Самой высокой чувствительностью и специфичностью в диагностике бактериального вагиноза обладает культуральный метод. Его высокая информативность обусловлена качественно-количественными показателями состава микробиоценоза влагалища. Соответственно, при бактериальном вагинозе наблюдается уменьшение количества лактобацилл и повышение содержания условно-патогенной флоры. Недостатки метода: относительная дороговизна и длительность выполнения. Исследование ДНК гарднерелл в соскобах из мест поражения методом ПЦР является важным дополнительным критерием БВ.
Расширенные критерии диагностики БВ1. Преобладание эпителиальных клеток над лейкоцитами (не более 30 в поле зрения).
2. Отсутствие визуальных признаков воспаления.
3. Наличие не менее 20% ключевых клеток.
4. Обнаружение при иммерсионной микроскопии менее 5 лактобацилл в поле зрения.
5. Полимикробная картина мазка (обильная полимикробная кокковая и палочковая Г-/ Г+ флора.
6. Повышение бактериальной обсемененности в цитологическом препарате.
Критерии Нугента (Ньюджента)
Невысокая чувствительность критериев Амселя и наличие бессимптомных форм бактериального вагиноза заставило искать другие методы и критерии подтверждения диагноза. В конце 80-х гг. Spiegel предложил использовать балльную систему для диагностики бактериального вагиноза с учетом соотношения морфотипов лактобацилл и вагинальной гарднереллы при микроскопии окрашенного по Граму мазка из влагалища. Однако система не прижилась, и только в 1991 г. Nugent RP и соавт. предложили свои лабораторные критерии диагностики бактериального вагиноза (Nugent’s Diagnostic Criteria for Bacterial Vaginosis), которыми до сих пор широко пользуются в мировой медицине [10]. В основе лежит система баллов (очков) от 0 до 7 и их комбинация для диагностики и оценки степени бактериального вагиноза по оценке трех бактериальных морфотипов влагалища (табл. 3):
А — Лактобациллы — большие грампозитивные палочки (Lactobacillus acidophilus: large gram-positive rods)
B — Вагинальная гарднерелла и бактероиды — мелкие грамвариабельные и грамотрицательные кокки (Gardnerella vaginalis and Bacteroides species :small gram-variable or gram-negative rods)
C — Мобилункус — изогнутые грамвариабельные палочки (Mobiluncus species:curved gram-variable rods)
|
Таблица 3. Мазок из влагалища окрашивают по Граму и считают отдельно количество выявленных морфотипов под иммерсионной системой микроскопа |
|||
| Баллы |
A Lactobacilli |
B Gardnerella |
C Mobiluncus |
|
0 |
более 30 морфотипов |
нет морфотипов |
нет морфотипов |
|
1 |
5—30 морфотипов | один морфотип | один морфотип |
|
2 |
1—4 морфотипа |
1—4 морфотипа |
1—4 морфотипа |
|
3 |
один морфотип |
5—30 морфотипов |
5—30 морфотипов |
|
4 |
нет морфотипов |
более 30 морфотипов | более 30 морфотипов |
| Количество полученных баллов суммируют (A + B + C). 0—3 балла: нормальная микрофлора; 4—6 баллов: промежуточная микрофлора; => 7 баллов: бактериальный вагиноз [10]. | |||
B недавнем исследовании проведено сопоставление критериев Amsel и Nugent, в результате оказалось, что критерии Amsel несколько менее информативны, однако в условиях отсутствия специализированной лаборатории могут быть использованы [11].
В последние годы мировым научным сообществом разработаны критерии дифференциальной клинико-лабораторной диагностики БВ и других подобных или ассоциированных с ним состояний (заболеваний). Существуют неспецифические проявления, которые могут быть зафиксированы гинекологом с последующим более точным лабораторным анализом (табл. 4) [12].
|
Таблица 4. Дифференциальная диагностика синдрома вагинальных выделений (бактериальный вагиноз, вульвовагинальный кандидоз, трихомониаз) [12] |
|||
| Показатели |
БВ |
ВВК |
Трихомониаз |
|
Выделения |
Бело-серого цвета, обильные |
Творожистые или сметанообразные белого цвета |
Пенистые, желто-зеленого цвета, обильные |
|
Запах |
Да |
Нет |
Да |
| Зуд, жжение, раздражение |
Нет |
Да |
Да |
|
Отек, гиперемия |
Нет |
Да |
Да |
| Диспареуния |
Нет |
Да |
Да |
| pH | > 4,5 | ≤ 4,5 | > 4,5 |
| Количество лейкоцитов |
Норма |
Повышенное |
Повышенное |
| Микроскопия мазка по Граму | Ключевые клетки | Грибы | Трихомонады |
|
Культуральный метод |
Не проводится |
Грибы рода Candida |
Трихомонады |
|
Примечание. БВ — бактериальный вагиноз, ВВК — вульвовагинальный кандидоз. |
|||
Лечение
Признание важности БВ и его связи с ИППП и с неблагоприятным репродуктивным прогнозом привело к поиску наилучших и более всеобъемлющих вариантов лечения. Существует широкий круг дифференциальной диагностики при вагинальных выделениях, и успех лечения часто зависит от правильного диагноза, тем не менее большому проценту пациентов терапия проводится без дополнительных специфических тестов.
Наличие широкого спектра терапевтических возможностей, диагностирующих основные причины вагинита, и отсутствие четкого диагноза у 30% больных даже после дополнительного дорогостоящего обследования, объясняет, почему многие гинекологи используют эти препараты. Неправильный диагноз или отказ диагностировать другие инфекции, связанные главным образом в случаях БВ и инфицировании T. vaginalis, может привести к неадекватному лечению, новому обострению и повторному заражению.
У небеременных женщин лечение не только устранит вагинальные выделения, но и снизит вероятность возникновения инфекционных осложнений после возможных у каждой женщины аборта и/или операции по удалению матки. Кроме того, лечение БВ за счет восстановления кислой рН во влагалище уменьшает риск инфицирования вирусом иммунодефицита, другими заболеваниями, передающимися половым путем.
У беременных женщин лечение БВ, наряду с вышеназванными эффектами, способствует снижению риска развития осложнений беременности, а именно преждевременного отхождения околоплодных вод, начала родовой деятельности (схваток) и собственно родов, а также послеродового воспаления внутренней поверхности матки (эндометрита). Лечению должны подвергаться и беременные с бессимптомным течением БВ, особенно в случае наличия угрозы преждевременных родов.
Препаратом выбора в лечении БВ является клиндамицин
Это антибиотик группы линкозамидов для местного применения в гинекологии. Механизм действия препарата связан с нарушением внутриклеточного синтеза белка в микробной клетке на уровне 50S-субъединицы рибосом. Оказывает бактериостатическое действие, а в более высоких концентрациях в отношении некоторых микроорганизмов — бактерицидное. Обладает широким спектром действия. Активен в отношении микроорганизмов, вызывающих бактериальные вагинозы:
• Mobiluncus spp.
• Bacteroides spp.
• Mycoplasma hominis.
• Peptostreptococcus spp.
Клиндамицин (Далацин). Форма выпуска: крем вагинальный и суппозитории вагинальные. 5 г крема (1 доза) вагинального 2% и один вагинальный суппозиторий содержат: клиндамицина фосфат 100 мг.
Фармакокинетика. После однократного интравагинального введения 100 мг клиндамицина в среднем 4% от введенной дозы подвергается системной абсорбции. Cmax в плазме крови составляет в среднем 20 нг/мл.
Клинических исследований по применению клиндамицина у женщин в I триместре беременности не проводилось, поэтому применение Клиндацина в I триместре беременности возможно только в том случае, когда ожидаемая польза для матери превышает риск для плода. Применение во II и III триместрах беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватных и строго контролируемых исследований у беременных женщин не проводили, клиндамицин проходит через плаценту и может концентрироваться в печени плода, однако осложнений у человека не зарегистрировано). В результате исследований не установлено, снижает ли лечение бактериального вагиноза риск таких неблагоприятных исходов беременности, как преждевременный разрыв плодных оболочек, преждевременное начало родов или преждевременное родоразрешение. Категория действия на плод по FDA – B.
В исследовании, проведенном в Швейцарии, были обследованы 5 377 беременных с симптомами потенциальных акушерских осложнений при сроке 25—37 нед. беременности. Женщины с симптомами были тестированы при помощи культурального исследования на наличие Mycoplasma hominis и Ureaplasma spp. и пролечены клиндамицином в случае положительного результата. В результате лечения существенно уменьшился процент преждевременных родов и респираторных осложнений у новорожденных [13].
Наши коллеги из Бельгии провели поиск в базах данных PubMed и Web of Science для того, чтобы найти новые подходы в профилактике, лечении и предупреждении рецидивов БВ. В результате оказалось, что основными препаратами в лечении БВ остаются клиндамицин и метронидазол. Интенсивно изучаются другие медикаменты, такие как тинидазол, рифаксимин, нитрофуран, декалинума хлорид, аскорбиновая кислота (витамин С) и молочная кислота. Предполагают, что перспективно использование комбинированного режима, чередующегося и долговременного приема для предупреждения рецидивов. Несомненна и польза параллельного назначения пробиотиков [14].
В мультицентровом рандомизированном двойном слепом исследовании, проведенном в Германиии, Австрии и Швейцарии, сопоставлены эффективность и переносимость 2% вагинально крема клиндамицина (5 г на ночь в течение 7 дней) и перорального метронидазола (500 мг орально в течение 7 дней) в ведении БВ. Пациентов наблюдали через 5—10 дней и 25—39 дней после завершения лечения. В результате излечение или улучшение было отмечено через 1 месяц у 83% пациентов в группе клиндамицина против 73% в группе метронидазола, побочные эффекты отмечены с равной частотой (12%) в обеих группах [15].
Недавно в мировой литературе появилось понятие аэробного вагинита. Аэробный вагинит — воспалительное заболевание влагалища, вызванное аэробной микрофлорой при резком снижении или отсутствиии нормальной лактофлоры влагалища. Ранее под термином «аэробный вагинит» подразумевался бактериальный вагинит. В основе аэробного вагинита, как и при бактериальном вагинозе, лежит снижение или отсутствие нормальной лактофлоры влагалища и замена ее на аэробные бактерии. Точные причины и механизм развития аэробного вагинита пока неизвестен. Также неизвестно, почему в одних случаях происходит размножение анаэробной микрофлоры и развитие бактериального вагиноза, а в других заселение влагалища аэробными микроорганизмами и развитие аэробного вагинита. Наиболее часто встречающиеся этиологические агенты аэробного вагинита (Escherichia coli, Enterococcus sp., бета-гемолитический стрептококк группы А, золотистый стафилококк). В решении этого противоречия оказалось, что вагинальные суппозитории, содержащие канамицин или клиндамицин, показали высокую эффективность в купировании аэробного вагинита у небеременных женщин. Кроме того, клиндамицин (вагинальные суппозитории) в сочетании с пробиотиками оказались лучшим выбором для беременных с аэробным вагинитом, чем метронидазол [16].
Заключение
Бактериальный вагиноз — давно известное патологическое состояние женской половой сферы с хорошо разработанными критериями клинической диагностики (Амсела и Нугента). Новые возможности молекулярной диагностики постоянно расширяют наши представления о различных видах свойственной организму и чужеродной микрофлоры, свидетельствуя о разнообразии вагинальной микробиоты у каждой отдельной женщины. При этом выбор оптимального препарата предусматривает клиническую эффективность в отношении большинства патогенных микроорганизмов. Таким препаратом может служить клиндамицин, значимость которого в лечении бактериального вагиноза не вызывает сомнения в последних научных публикациях.
1. Anderson MR, Klink K, Cohrssen A. Evaluation of vaginal complaints. JAMA, 2004, 291:11:1368–1379.
2. Mitchell H. Vaginal discharge – causes, diagnosis, and treatment. BMJ, 2004, 328:7451:1306–1308.
3. Хрянин А.А., Решетников О.В. Бактериальный вагиноз: новые представления о микробном биосоциуме и возможности лечения. Медицинский совет, 2014, 17: 128-133.
4. Verstraelen H, Swidsinski A. The biofilm in bacterial vaginosis: implications for epidemiology, diagnosis and treatment. Curr Opin Infect Dis, 2013, 26: 86–89.
5. Gillet E, Meys JFA, Verstraelen H et al. Association between bacterial vaginosis and cervical intraepithelial neoplasia: Systematic review and meta-analysis. Plos One, 2012, 7, Issue 10 e45201.
6. Lamont RF, Sobel JD, Akins RA et al. The vaginal microbiome: New information about genital tract flora using molecular based techniques BJOG, 2011, 118(5): 533–549.
7. Muzny CA, Sunesara IR, Griswold ME et al. Association between BVAB1 and high Nugent scores among women with bacterial vaginosis. Diagn Microbiol Infect Dis., 2014 December, 80(4): 321–323.
8. Di Giulio DB, Callahan BJ, McMurdie PJ et al. Temporal and spatial variation of the human microbiota during pregnancy Proceedings of the National Academy of Sciences 2015/ www.pnas.org/cgi/doi/10.1073/pnas.1502875112.
9. Amsel R, Totten PA, Spiegel CA, et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med, 1983, 74(1): 14–22.
10. Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J Clin Microbiol, 1991, 29(2): 297–301.
11. Mohammadzadeh F, Dolatian M, Jorjani M, Alavi Majd H. Diagnostic value of Amsel’s clinical criteria for diagnosis of bacterial vaginosis. Glob J Health Sci., 2014 Oct 29, 7(3): 8-14.
12. Workowski KA. Sexually transmitted diseases treatment guidelines, 2010. MMWR Recommend Rep 2010; 59:61–63.
13. Vouga M, Greub G, Prodhom G, et al. Treatment of genital mycoplasma in colonized pregnant women in late pregnancy is associated with a lower rate of premature labour and neonatal complications. Clin Microbiol Infect, 2014 Oct, 20(10): 1074-9.
14. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss. Expert Opin Pharmacother, 2014 Apr, 15(5): 645-57.
15. Fischbach F, Petersen EE, Weissenbacher ER, et al. Efficacy of clindamycin vaginal cream versus oral metronidazole in the treatment of bacterial vaginosis. Obstet Gynecol, 1993 Sep, 82(3): 405-10.
16. Han C, Wu W, Fan A, Wang Y, Zhang H, Chu Z, Wang C, Xue F. Diagnostic and therapeutic advancements for aerobic vaginitis. Arch Gynecol Obstet, 2015 Feb, 291(2): 251-7.
| 21-001 | Смесь ингаляционных аллергенов № 7 (IgE): эпителий кошки, перхоть собаки, эпителий кролика, перхоть лошади, клещ Dermatophagoides pteronyssinus | 1 070,00 |
| 21-006 | Смесь аллергенов трав №3 (IgE): колосок душистый, рожь многолетняя, рожь культивированная, тимофеевка, бухарник шерстистый | 1 070,00 |
| 21-009 | Аллерген p1 — Ascaris lumbricoides (аскарида), IgE | 520,00 |
| 21-011 | Аллерген m5 — Candida albicans, IgE | 470,00 |
| 21-017 | Аллерген c204 — амоксициллин, IgE | 470,00 |
| 21-018 | Аллерген c203 — ампициллин, IgE | 470,00 |
| 21-019 | Аллерген f210 — ананас, IgE | 470,00 |
| 21-024 | Аллерген g13 — бухарник шерстистый, IgE | 470,00 |
| 21-025 | Аллерген f259 — виноград, IgE | 470,00 |
| 21-027 | Аллерген f209 — грейпфрут, IgE | 470,00 |
| 21-028 | Аллерген t10 — грецкий орех (пыльца), IgE | 470,00 |
| 21-034 | Аллерген f12 — зеленый горошек, IgE | 470,00 |
| 21-036 | Аллерген f216 — капуста кочанная, IgE | 470,00 |
| 21-037 | Аллерген f35 — картофель, IgE | 470,00 |
| 21-038 | Аллерген t1 — клён ясенелистный, IgE | 470,00 |
| 21-040 | Аллерген f36 — кокос, IgE | 470,00 |
| 21-042 | Аллерген i71 — комар, IgE | 470,00 |
| 21-046 | Аллерген f23 — крабы, IgE | 470,00 |
| 21-048 | Аллерген f83 — куриное мясо, IgE | 470,00 |
| 21-049 | Аллерген k82 — латекс, IgE | 470,00 |
| 21-051 | Аллерген f208 — лимон, IgE | 470,00 |
| 21-054 | Аллерген f37 — мидии, IgE | 470,00 |
| 21-055 | Аллерген f20 — миндаль, IgE | 470,00 |
| 21-059 | Аллерген f244 — огурец, IgE | 470,00 |
| 21-062 | Аллерген c1 — пенициллин G, IgE | 470,00 |
| 21-070 | Аллерген g12 — рожь культивированная, IgE | 470,00 |
| 21-071 | Аллерген i70 — рыжий муравей, IgE | 470,00 |
| 21-073 | Аллерген f85 — сельдерей, IgE | 470,00 |
| 21-074 | Аллерген f14 — соевые бобы, IgE | 470,00 |
| 21-075 | Аллерген i6 — таракан-прусак, IgE | 380,00 |
| 21-076 | Аллерген g6 -тимофеевка, IgE | 470,00 |
| 21-080 | Аллерген f40 — тунец, IgE | 470,00 |
| 21-082 | Аллерген f17 — фундук, IgE | 470,00 |
| 21-083 | Аллерген k20 — шерсть, IgE | 470,00 |
| 21-084 | Аллерген f105 — шоколад, IgE | 470,00 |
| 21-086 | Аллерген e2 — эпителий собаки, IgE | 470,00 |
| 21-087 | Аллерген f49 — яблоко, IgE | 470,00 |
| 21-090 | Определение специфических IgG к 90 наиболее часто встречаемым пищевым аллергенам | 12 180,00 |
| 21-092 | Аллерген f233 — овомукоид, IgE | 450,00 |
| 21-095 | Аллерген f236 — молочная сыворотка, IgE | 470,00 |
| 21-099 | Аллерген f81 — сыр «чеддер», IgE | 540,00 |
| 21-100 | Аллергокомпонент g211 — тимофеевка луговая (recombinant) rPhl p 11, IgE (ImmunoCAP) | 470,00 |
| 21-101 | Аллергокомпонент i209 — яд осы обыкновенной rVes v 5, IgE (ImmunoCAP) | 470,00 |
| 21-102 | Аллерген t6 — можжевельник казацкий, IgE (ImmunoCAP) | 470,00 |
| 21-103 | Аллерген t206 — каштан, IgE (ImmunoCAP) | 470,00 |
| 21-104 | Смесь пищевых аллергенов fx24 (ImmunoCAP), IgE: фундук, креветка, киви, банан | 470,00 |
| 21-105 | Смесь ингаляционных аллергенов № 7 (IgG): эпителий кошки, перхоть собаки, эпителий кролика, перхоть лошади, клещ Dermatophagoides pteronyssinus | 470,00 |
| 21-107 | Аллерген f290 — устрицы, IgE | 470,00 |
| 21-109 | Аллерген f88 — баранина, IgE | 470,00 |
| 21-110 | Аллерген f284 — индейка, IgE | 470,00 |
| 21-111 | Аллерген f212 — шампиньоны, IgE | 470,00 |
| 21-113 | Аллерген f8 — мука кукурузная, IgE | 470,00 |
| 21-114 | Аллерген f7 — мука овсяная, IgE | 500,00 |
| 21-116 | Аллерген f6 — мука ячменная, IgE | 470,00 |
| 21-117 | Аллерген f55 — просо, IgE | 470,00 |
| 21-119 | Аллерген f235 — чечевица, IgE | 470,00 |
| 21-120 | Аллерген f10 — кунжут, IgE | 470,00 |
| 21-121 | Аллерген f309 — нут (турецкий горох), IgE | 470,00 |
| 21-122 | Аллерген f15 — фасоль белая, IgE | 470,00 |
| 21-123 | Аллерген f315 — фасоль зеленая, IgE | 470,00 |
| 21-124 | Аллерген f287 — фасоль красная, IgE | 470,00 |
| 21-128 | Аллерген f202 — орех кешью, IgE | 470,00 |
| 21-130 | Аллерген f203 — фисташковые орехи, IgE | 470,00 |
| 21-131 | Аллерген f403 — пивные дрожжи, IgE | 470,00 |
| 21-132 | Аллерген f90 — солод, IgE | 470,00 |
| 21-134 | Аллерген f262 — баклажан, IgE | 470,00 |
| 21-135 | Аллерген f260 — капуста брокколи, IgE | 470,00 |
| 21-136 | Аллерген f217 — капуста брюссельская, IgE | 470,00 |
| 21-137 | Аллерген f291 — капуста цветная, IgE | 500,00 |
| 21-139 | Аллерген f261 — спаржа, IgE | 470,00 |
| 21-140 | Аллерген f86 — петрушка, IgE | 470,00 |
| 21-142 | Аллерген f214 — шпинат, IgE | 470,00 |
| 21-143 | Аллерген f47 — чеснок, IgE | 470,00 |
| 21-144 | Аллерген f48 — лук, IgE | 470,00 |
| 21-146 | Аллерген f234 — ваниль, IgE | 470,00 |
| 21-147 | Аллерген f89 — горчица, IgE | 470,00 |
| 21-149 | Аллерген f270 — имбирь, IgE | 470,00 |
| 21-150 | Аллерген f281 — карри (приправа), IgE | 470,00 |
| 21-151 | Аллерген f278 — лавровый лист, IgE | 470,00 |
| 21-154 | Аллерген f405 — мята, IgE | 470,00 |
| 21-155 | Аллерген f218 — перец красный (паприка), IgE | 520,00 |
| 21-156 | Аллерген f263 — перец зеленый, IgE | 470,00 |
| 21-157 | Аллерген f280 — перец черный, IgE | 470,00 |
| 21-162 | Аллерген f237 — абрикос, IgE | 500,00 |
| 21-163 | Аллерген f96 — авокадо, IgE | 470,00 |
| 21-164 | Аллерген f242 — вишня, IgE | 470,00 |
| 21-165 | Аллерген f94 — груша, IgE | 470,00 |
| 21-166 | Аллерген f87 — дыня, IgE | 470,00 |
| 21-167 | Аллерген f402 — инжир, IgE | 500,00 |
| 21-170 | Аллерген f91 — манго, IgE | 470,00 |
| 21-173 | Аллерген f95 — персик, IgE | 470,00 |
| 21-174 | Аллерген f255 — слива, IgE | 470,00 |
| 21-175 | Аллерген f289 — финики, IgE | 470,00 |
| 21-176 | Аллерген f301 — хурма, IgE | 470,00 |
| 21-177 | Аллерген f288 — ягоды рода брусничных (черника, голубика, брусника), IgE | 470,00 |
| 21-178 | Аллерген k84 — масло подсолнечное, IgE | 470,00 |
| 21-179 | Аллерген e7 — голубиный помет, IgE | 470,00 |
| 21-182 | Аллерген e201 — перо канарейки, IgE | 470,00 |
| 21-183 | Аллерген e80 — эпителий козы, IgE | 470,00 |
| 21-184 | Аллерген e4 — перхоть коровы, IgE | 470,00 |
| 21-185 | Аллерген e82 — эпителий кролика, IgE | 470,00 |
| 21-186 | Аллерген e87 — крыса, IgE | 470,00 |
| 21-187 | Аллерген e74 — моча крысы, IgE | 470,00 |
| 21-189 | Аллерген e73 — эпителий крысы, IgE | 470,00 |
| 21-191 | Аллерген e219 — протеины сыворотки курицы, IgE | 470,00 |
| 21-192 | Аллерген e3 — перхоть лошади, IgE | 470,00 |
| 21-194 | Аллерген e88 — мышь, IgE | 470,00 |
| 21-198 | Аллерген e81 — эпителий овцы, IgE | 470,00 |
| 21-199 | Аллерген e91 — перо попугая, IgE | 470,00 |
| 21-200 | Аллерген e78 — перо волнистого попугая, IgE | 470,00 |
| 21-201 | Аллерген e83 — эпителий свиньи, IgE | 470,00 |
| 21-203 | Аллерген e84 — хомяк, IgE | 470,00 |
| 21-204 | Аллерген t19 — акация, IgE | 470,00 |
| 21-205 | Аллерген w209 — амброзия смешанная, IgE | 470,00 |
| 21-206 | Аллерген t5 — бук, IgE | 470,00 |
| 21-207 | Аллерген t8 — вяз, IgE | 470,00 |
| 21-209 | Аллерген t77 — дуб смешанный, IgE | 470,00 |
| 21-218 | Аллерген t11 — платан, IgE | 470,00 |
| 21-220 | Аллерген t16 — сосна белая, IgE | 470,00 |
| 21-223 | Аллерген t18 — эвкалипт, IgE | 470,00 |
| 21-225 | Аллерген f256 — орех грецкий, IgE | 470,00 |
| 21-229 | Аллерген g202 — кукурузные рыльца, IgE | 470,00 |
| 21-230 | Аллерген g14 — овес культивированный, IgE | 470,00 |
| 21-231 | Аллерген g15 — пшеница культивированная, IgE | 1 950,00 |
| 21-235 | Аллерген w20 — крапива, IgE | 470,00 |
| 21-236 | Аллерген w75 — лебеда седоватая, IgE | 470,00 |
| 21-238 | Аллерген w10 — марь белая, IgE | 470,00 |
| 21-240 | Аллерген w9 — подорожник, IgE | 470,00 |
| 21-241 | Аллерген w5 — полынь горькая, IgE | 470,00 |
| 21-242 | Аллерген w19 — постенница лекарственная, IgE | 470,00 |
| 21-245 | Аллерген m208 — Chaetomium globosum, IgE | 470,00 |
| 21-246 | Аллерген o72 — энтеротоксин А (Staphylococcus aureus), IgE | 470,00 |
| 21-247 | Аллерген o73 — энтеротоксин B (Staphylococcus aureus), IgE | 470,00 |
| 21-248 | Аллерген p4 — Anisakis Larvae, IgE | 470,00 |
| 21-249 | Аллерген i8 — моль, IgE | 470,00 |
| 21-250 | Аллерген i73 — личинка красной мошки, IgE | 470,00 |
| 21-251 | Аллерген i204 — слепень, IgE | 470,00 |
| 21-252 | Аллерген i2 — шершень, IgE | 470,00 |
| 21-255 | Аллерген i3 — осиный яд (Vespula spp.), IgE | 470,00 |
| 21-256 | Аллерген i4 — осиный яд (Polistes spp.), IgE | 470,00 |
| 21-257 | Аллерген i1 — пчелиный яд, IgE | 470,00 |
| 21-258 | Аллерген c2 — пенициллин V, IgE | 470,00 |
| 21-259 | Аллерген c70 — инсулин свиной, IgE | 470,00 |
| 21-260 | Аллерген c71 — инсулин бычий, IgE | 470,00 |
| 21-261 | Аллерген c73 — инсулин человеческий, IgE | 470,00 |
| 21-262 | Аллерген o1 — хлопок, IgE | 470,00 |
| 21-263 | Аллерген k74 — шелк, IgE | 470,00 |
| 21-265 | Аллерген k301 — пыль пшеничной муки, IgE | 470,00 |
| 21-266 | Аллерген k80 — формальдегид, IgE | 470,00 |
| 21-267 | Аллерген k81 — фикус, IgE | 470,00 |
| 21-279 | Аллерген f210 — ананас, IgG | 470,00 |
| 21-280 | Аллерген f33 — апельсин, IgG | 470,00 |
| 21-281 | Аллерген f13 — арахис, IgG | 470,00 |
| 21-282 | Аллерген f92 — банан, IgG | 520,00 |
| 21-285 | Аллерген f259 — виноград, IgG | 470,00 |
| 21-286 | Аллерген f27 — говядина, IgG | 520,00 |
| 21-287 | Аллерген f209 — грейпфрут, IgG | 470,00 |
| 21-289 | Аллерген f11 — гречневая мука, IgG | 520,00 |
| 21-294 | Аллерген f12 — зеленый горошек, IgG | 470,00 |
| 21-296 | Аллерген f216 — капуста кочанная, IgG | 470,00 |
| 21-297 | Аллерген f35 — картофель, IgG | 520,00 |
| 21-299 | Аллерген f44 — клубника, IgG | 470,00 |
| 21-300 | Аллерген f36 — кокос, IgG | 470,00 |
| 21-303 | Аллерген f2 — коровье молоко, IgG | 470,00 |
| 21-305 | Аллерген f221 — кофе, IgG | 470,00 |
| 21-306 | Аллерген f23 — крабы, IgG | 470,00 |
| 21-307 | Аллерген f24 — креветки, IgG | 470,00 |
| 21-308 | Аллерген f83 — куриное мясо, IgG | 520,00 |
| 21-311 | Аллерген f208 — лимон, IgG | 520,00 |
| 21-313 | Аллерген f41 — лосось, IgG | 520,00 |
| 21-314 | Аллерген f37 — мидия (голубая), IgG | 470,00 |
| 21-315 | Аллерген f20 — миндаль, IgG | 470,00 |
| 21-316 | Аллерген f31 — морковь, IgG | 470,00 |
| 21-319 | Аллерген f244 — огурец, IgG | 470,00 |
| 21-321 | Аллерген f45 — пекарские дрожжи, IgG | 520,00 |
| 21-324 | Аллерген d2 — пироглифидный клещ Dermatophagoides farinae, IgG | 470,00 |
| 21-329 | Аллерген f4 — пшеничная мука, IgG | 470,00 |
| 21-332 | Аллерген f26 — свинина, IgG | 520,00 |
| 21-333 | Аллерген f85 — сельдерей, IgG | 470,00 |
| 21-334 | Аллерген f14 — соевые бобы, IgG | 470,00 |
| 21-337 | Аллерген f25 — томаты, IgG | 470,00 |
| 21-339 | Аллерген f3 — треска, IgG | 470,00 |
| 21-340 | Аллерген f40 — тунец, IgG | 470,00 |
| 21-341 | Аллерген f204 — форель, IgG | 520,00 |
| 21-342 | Аллерген f17 — фундук, IgG | 470,00 |
| 21-344 | Аллерген f105 — шоколад, IgG | 470,00 |
| 21-345 | Аллерген e1 — эпителий кошки, IgG | 470,00 |
| 21-346 | Аллерген e2 — эпителий собаки, IgG | 470,00 |
| 21-347 | Аллерген f49 — яблоко, IgG | 470,00 |
| 21-348 | Аллерген f1 — яичный белок, IgG | 470,00 |
| 21-349 | Аллерген f75 — яичный желток, IgG | 470,00 |
| 21-350 | Аллерген f232 — овальбумин, IgG | 470,00 |
| 21-351 | Аллерген f233 — овомукоид, IgG | 470,00 |
| 21-352 | Аллерген f245 — яйцо куриное, IgG | 520,00 |
| 21-353 | Аллерген f231 — кипяченое молоко, IgG | 520,00 |
| 21-354 | Аллерген f236 — молочная сыворотка, IgG | 470,00 |
| 21-355 | Аллерген f76 — альфа-лактальбумин, IgG | 470,00 |
| 21-356 | Аллерген f77 — бета-лактоглобулин, IgG | 470,00 |
| 21-357 | Аллерген f78 — казеин, IgG | 470,00 |
| 21-358 | Аллерген f81 — сыр «чеддер», IgG | 520,00 |
| 21-359 | Аллерген f82 — сыр «моулд», IgG | 470,00 |
| 21-360 | Аллерген f254 — камбала, IgG | 470,00 |
| 21-361 | Аллерген f61 — сардина, IgG | 470,00 |
| 21-362 | Аллерген f50 — скумбрия, IgG | 470,00 |
| 21-363 | Аллерген f80 — лобстер (омар), IgG | 470,00 |
| 21-364 | Аллерген f338 — гребешок, IgG | 470,00 |
| 21-366 | Аллерген f290 — устрицы, IgG | 470,00 |
| 21-368 | Аллерген f88 — баранина, IgG | 470,00 |
| 21-369 | Аллерген f284 — индейка, IgG | 520,00 |
| 21-370 | Аллерген f212 — шампиньоны, IgG | 470,00 |
| 21-371 | Аллерген f79 — клейковина (глютен), IgG | 470,00 |
| 21-372 | Аллерген f8 — мука кукурузная, IgG | 470,00 |
| 21-373 | Аллерген f7 — мука овсяная, IgG | 520,00 |
| 21-374 | Аллерген f5 — мука ржаная, IgG | 520,00 |
| 21-375 | Аллерген f6 — мука ячменная, IgG | 470,00 |
| 21-376 | Аллерген f55 — просо, IgG | 470,00 |
| 21-377 | Аллерген f9 — рис, IgG | 470,00 |
| 21-378 | Аллерген f235 — чечевица, IgG | 470,00 |
| 21-379 | Аллерген f10 — кунжут, IgG | 470,00 |
| 21-380 | Аллерген f309 — нут (турецкий горох), IgG | 470,00 |
| 21-381 | Аллерген f15 — фасоль белая, IgG | 470,00 |
| 21-382 | Аллерген f315 — фасоль зеленая, IgG | 470,00 |
| 21-383 | Аллерген f287 — фасоль красная, IgG | 470,00 |
| 21-385 | Аллерген f93 — какао, IgG | 520,00 |
| 21-387 | Аллерген f202 — орех кешью, IgG | 470,00 |
| 21-389 | Аллерген f203 — фисташковые орехи, IgG | 470,00 |
| 21-390 | Аллерген f403 — пивные дрожжи, IgG | 470,00 |
| 21-391 | Аллерген f90 — солод, IgG | 470,00 |
| 21-393 | Аллерген f262 — баклажан, IgG | 470,00 |
| 21-394 | Аллерген f260 — капуста брокколи, IgG | 470,00 |
| 21-395 | Аллерген f217 — капуста брюссельская, IgG | 470,00 |
| 21-396 | Аллерген f291 — капуста цветная, IgG | 520,00 |
| 21-397 | Аллерген f225 — тыква, IgG | 520,00 |
| 21-398 | Аллерген f261 — спаржа, IgG | 470,00 |
| 21-399 | Аллерген f86 — петрушка, IgG | 470,00 |
| 21-401 | Аллерген f214 — шпинат, IgG | 470,00 |
| 21-402 | Аллерген f47 — чеснок, IgG | 470,00 |
| 21-403 | Аллерген f48 — лук, IgG | 470,00 |
| 21-405 | Аллерген f234 — ваниль, IgG | 470,00 |
| 21-406 | Аллерген f89 — горчица, IgG | 470,00 |
| 21-408 | Аллерген f270 — имбирь, IgG | 470,00 |
| 21-409 | Аллерген f281 — карри (приправа), IgG | 470,00 |
| 21-410 | Аллерген f278 — лавровый лист, IgG | 470,00 |
| 21-413 | Аллерген f405 — мята, IgG | 470,00 |
| 21-414 | Аллерген f218 — перец красный (паприка), IgG | 520,00 |
| 21-415 | Аллерген f263 — перец зеленый, IgG | 470,00 |
| 21-416 | Аллерген f280 — перец черный, IgG | 470,00 |
| 21-421 | Аллерген f237 — абрикос, IgG | 520,00 |
| 21-422 | Аллерген f96 — авокадо, IgG | 470,00 |
| 21-423 | Аллерген f242 — вишня, IgG | 470,00 |
| 21-424 | Аллерген f94 — груша, IgG | 470,00 |
| 21-425 | Аллерген f87 — дыня, IgG | 470,00 |
| 21-426 | Аллерген f402 — инжир, IgG | 520,00 |
| 21-427 | Аллерген f84 — киви, IgG | 470,00 |
| 21-429 | Аллерген f91 — манго, IgG | 470,00 |
| 21-432 | Аллерген f95 — персик, IgG | 470,00 |
| 21-433 | Аллерген f255 — слива, IgG | 470,00 |
| 21-434 | Аллерген f289 — финики, IgG | 470,00 |
| 21-435 | Аллерген f301 — хурма, IgG | 470,00 |
| 21-436 | Аллерген f288 — ягоды рода брусничных (черника, голубика, брусника), IgG | 470,00 |
| 21-437 | Аллерген k84 — масло подсолнечное, IgG | 470,00 |
| 21-527 | Смесь аллергенов животных № 1 (IgE): эпителий кошки, перхоть лошади, перхоть коровы, перхоть собаки | 1 280,00 |
| 21-528 | Смесь аллергенов животных № 70 (IgE): эпителий морской свинки, эпителий кролика, хомяк, крыса, мышь | 1 070,00 |
| 21-529 | Панель аллергенов животных № 71 (IgE): перо гуся, перо курицы, перо утки, перо индюка | 1 070,00 |
| 21-530 | Смесь аллергенов животных № 72 (IgE): перо волнистого попугая, перо попугая, перо канарейки | 1 070,00 |
| 21-531 | Смесь «профессиональных» аллергенов № 1 (IgE): перхоть лошади, перхоть коровы, перо гуся, перо курицы | 1 070,00 |
| 21-533 | Смесь клещевых аллергенов № 1 (IgE): Dermatophagoides pteronyssinus, Dermatophagoides farinae, Dermatophagoides microceras, Lepidoglyphus destructor, | 1 070,00 |
| 21-534 | Смесь аллергенов деревьев № 1 (IgE): клен ясенелистый, береза, вяз, дуб, грецкий орех | 1 070,00 |
| 21-535 | Смесь аллергенов деревьев № 2 (IgE): клен ясенелистый, тополь, вяз, дуб, пекан | 1 070,00 |
| 21-537 | Смесь аллергенов деревьев № 5 (IgE): oльха, лещина обыкновенная, вяз, ива белая, тополь | 1 070,00 |
| 21-538 | Смесь аллергенов сорных трав № 1 (IgE): амброзия обыкновенная, полынь обыкновенная, подорожник, марь белая, зольник/cолянка | 1 070,00 |
| 21-540 | Смесь пищевых аллергенов № 3 (IgE): пшеничная мука, овсяная мука, кукурузная мука, семена кунжута, гречневая мука | 1 070,00 |
| 21-541 | Смесь пищевых аллергенов № 1 (IgE): арахис, миндаль, фундук, кокос, бразильский орех | 1 070,00 |
| 21-542 | Смесь пищевых аллергенов № 2 (IgE): треска, тунец, креветки, лосось, мидии | 1 070,00 |
| 21-543 | Смесь пищевых аллергенов № 5 (IgE): яичный белок, коровье молоко, треска, пшеничная мука, арахис, соевые бобы | 1 070,00 |
| 21-544 | Смесь пищевых аллергенов № 6 (IgE): рис, семена кунжута, пшеничная мука, гречневая мука, соевые бобы | 1 070,00 |
| 21-545 | Смесь пищевых аллергенов № 7 (IgE): яичный белок, рис, коровье молоко, aрахис, пшеничная мука, соевые бобы | 1 070,00 |
| 21-546 | Смесь пищевых аллергенов № 13 (IgE): зеленый горошек, белая фасоль, морковь, картофель | 1 070,00 |
| 21-547 | Смесь пищевых аллергенов № 15 (IgE): апельсин, банан, яблоко, персик | 1 070,00 |
| 21-548 | Смесь пищевых аллергенов № 24 (IgE): фундук, креветки, киви, банан | 1 070,00 |
| 21-549 | Смесь пищевых аллергенов № 25 (IgE): семена кунжута, пекарские дрожжи, чеснок, сельдерей | 1 070,00 |
| 21-553 | Смесь пищевых аллергенов № 50 (IgE): киви, манго, бананы, ананас | 1 070,00 |
| 21-554 | Смесь пищевых аллергенов № 51 (IgE): томаты, картофель, морковь, чеснок, горчица | 1 070,00 |
| 21-556 | Смесь ингаляционных аллергенов № 1 (IgE): ежа сборная, тимофеевка, японский кедр, амброзия обыкновенная, полынь обыкновенная | 1 070,00 |
| 21-557 | Смесь ингаляционных аллергенов № 2 (IgE): тимофеевка, Alternaria alternata (tenuis), береза, полынь обыкновенная | 1 070,00 |
| 21-558 | Смесь ингаляционных аллергенов № 3 (IgE): Dermatophagoides pteronyssinus, эпителий кошки, эпителий собаки, Aspergillus fumigatus | 1 070,00 |
| 21-559 | Смесь ингаляционных аллергенов № 6 (IgE): Cladosporium herbarum, тимофеевка, Alternaria alternata (tenuis), береза, полынь обыкновенная | 1 070,00 |
| 21-560 | Смесь ингаляционных аллергенов № 8 (IgE): эпителий кошки, Dermatophagoides pteronyssinus, береза, перхоть собаки, полынь обыкновенная, тимофеевка, рож | 1 070,00 |
| 21-561 | Смесь ингаляционных аллергенов № 9 (IgE): эпителий кошки, перхоть собаки, овсяница луговая, Alternaria alternata (tenuis), подорожник | 1 070,00 |
| 21-563 | Смесь аллергенов плесени №1 (IgG): Penicillium notatum, Aspergillus fumigatus, Alternaria tenuis, Cladosporium herbarum, Candida albicans | 1 070,00 |
| 21-582 | Смесь пищевых аллергенов № 3 (IgG): пшеничная мука, овсяная мука, кукурузная мука, семена кунжута, гречневая мука | 1 070,00 |
| 21-583 | Смесь пищевых аллергенов № 1 (IgG): арахис, миндаль, фундук, кокос, бразильский орех | 1 070,00 |
| 21-584 | Смесь пищевых аллергенов № 2 (IgG): треска, тунец, креветки, лосось, мидии | 1 070,00 |
| 21-585 | Смесь пищевых аллергенов № 5 (IgG): яичный белок, коровье молоко, треска, пшеничная мука, арахис, соевые бобы | 1 070,00 |
| 21-586 | Смесь пищевых аллергенов № 6 (IgG): рис, семена кунжута, пшеничная мука, гречневая мука, соевые бобы | 1 070,00 |
| 21-587 | Смесь пищевых аллергенов № 7 (IgG): яичный белок, рис, коровье молоко, aрахис, пшеничная мука, соевые бобы | 1 070,00 |
| 21-588 | Смесь пищевых аллергенов № 13 (IgG): зеленый горошек, белая фасоль, морковь, картофель | 1 070,00 |
| 21-589 | Смесь пищевых аллергенов № 15 (IgG): апельсин, банан, яблоко, персик | 1 070,00 |
| 21-590 | Смесь пищевых аллергенов № 24 (IgG): фундук, креветки, киви, банан | 1 070,00 |
| 21-591 | Смесь пищевых аллергенов № 25 (IgG): семена кунжута, пекарские дрожжи, чеснок, сельдерей | 1 070,00 |
| 21-592 | Смесь пищевых аллергенов № 26 (IgG): яичный белок, молоко, арахис, горчица | 1 070,00 |
| 21-595 | Смесь пищевых аллергенов № 50 (IgG): киви, манго, бананы, ананас | 1 070,00 |
| 21-596 | Смесь пищевых аллергенов № 51 (IgG): томаты, картофель, морковь, чеснок, горчица | 1 070,00 |
| 21-597 | Смесь пищевых аллергенов № 73 (IgG): свинина, куриное мясо, говядина, баранина | 1 070,00 |
| 21-604 | Аллерген c68 — артикаин/ультракаин, IgE | 690,00 |
| 21-605 | Аллерген c88 — мепивакаин/полокаин, IgE | 690,00 |
| 21-606 | Аллерген c82 — лидокаин/ксилокаин, IgE | 690,00 |
| 21-607 | Аллерген c83 — прокаин/новокаин, IgE | 690,00 |
| 21-608 | Аллерген c86 — бензокаин, IgE | 690,00 |
| 21-609 | Аллерген c100 — прилокаин/цитанест, IgE | 690,00 |
| 21-610 | Аллерген c89 — бупивакаин/анекаин/маркаин, IgE | 690,00 |
| 21-611 | Аллерген c210 — тетракаин/дикаин, IgE | 690,00 |
| 21-612 | Аллерген k40 — никель, IgE | 1 310,00 |
| 21-613 | Аллерген k41 — хром, IgE | 1 310,00 |
| 21-614 | Аллерген k43 — золото, IgE | 1 310,00 |
| 21-615 | Аллерген k44 — медь, IgE | 1 310,00 |
| 21-616 | Аллерген k45 — платина, IgE | 1 310,00 |
| 21-617 | Аллерген k46 — кобальт, IgE | 1 310,00 |
| 21-618 | Аллерген k48 — палладий, IgE | 1 310,00 |
| 21-619 | Аллерген k73 — акрил, IgE, ИФА | 1 310,00 |
| 21-620 | Аллерген e1 — эпителий и перхоть кошки, IgE (ImmunoCAP) | 700,00 |
| 21-621 | Аллерген e5 — перхоть собаки, IgE (ImmunoCAP) | 700,00 |
| 21-622 | Аллерген f245 — яйцо, IgE (ImmunoCAP) | 700,00 |
| 21-623 | Аллерген f83 — мясо курицы, IgE (ImmunoCAP) | 700,00 |
| 21-624 | Аллерген f1 — яичный белок, IgE (ImmunoCAP) | 700,00 |
| 21-625 | Аллерген f75 — яичный желток, IgE (ImmunoCAP) | 700,00 |
| 21-626 | Аллерген e85 — перо курицы, IgE (ImmunoCAP) | 700,00 |
| 21-627 | Аллерген f2 — молоко коровье, IgE (ImmunoCAP) | 700,00 |
| 21-628 | Аллерген f27 — говядина, IgE (ImmunoCAP) | 700,00 |
| 21-629 | Аллерген f231 — кипяченое молоко, IgE (ImmunoCAP) | 700,00 |
| 21-630 | Аллергокомпонент f78 – казеин nBos d8, IgE (ImmunoCAP) | 1 480,00 |
| 21-631 | Аллерген d2 — клещ домашней пыли Dermatophagoides farinae, IgE (ImmunoCAP) | 700,00 |
| 21-632 | Аллерген h2 — домашняя пыль (Greer), IgE (ImmunoCAP) | 700,00 |
| 21-633 | Аллерген h3 — домашняя пыль (Hollister), IgE (ImmunoCAP) | 700,00 |
| 21-634 | Аллерген f7 — овес, овсяная мука, IgE (ImmunoCAP) | 700,00 |
| 21-635 | Аллерген f11 — гречиха, гречневая мука, IgE (ImmunoCAP) | 700,00 |
| 21-636 | Аллерген f79 — глютен (клейковина), IgE (ImmunoCAP) | 700,00 |
| 21-637 | Аллерген f5 — рожь, ржаная мука, IgE (ImmunoCAP) | 700,00 |
| 21-638 | Аллерген f9 — рис, IgE (ImmunoCAP) | 700,00 |
| 21-639 | Аллерген f3 — треска, IgE (ImmunoCAP) | 700,00 |
| 21-640 | Аллерген f41 — лосось, IgE (ImmunoCAP) | 700,00 |
| 21-641 | Аллерген f204 — форель, IgE (ImmunoCAP) | 700,00 |
| 21-642 | Аллерген f93 — какао, IgE (ImmunoCAP) | 700,00 |
| 21-643 | Аллерген f33 — апельсин, IgE (ImmunoCAP) | 700,00 |
| 21-644 | Аллерген f35 — картофель, IgE (ImmunoCAP) | 700,00 |
| 21-645 | Аллерген f31 — морковь, IgE (ImmunoCAP) | 700,00 |
| 21-646 | Аллерген f25 — томаты, IgE (ImmunoCAP) | 700,00 |
| 21-647 | Аллерген f49 — яблоко, IgE (ImmunoCAP) | 700,00 |
| 21-648 | Аллерген f92 — банан, IgE (ImmunoCAP) | 700,00 |
| 21-649 | Аллерген f259 — виноград, IgE (ImmunoCAP) | 700,00 |
| 21-650 | Аллерген f44 — клубника, IgE (ImmunoCAP) | 700,00 |
| 21-651 | Аллерген f208 — лимон, IgE (ImmunoCAP) | 700,00 |
| 21-652 | Аллерген f291 — цветная капуста, IgE (ImmunoCAP) | 700,00 |
| 21-653 | Аллерген f225 — тыква, IgE (ImmunoCAP) | 700,00 |
| 21-654 | Аллерген f26 — свинина, IgE (ImmunoCAP) | 700,00 |
| 21-655 | Аллерген f284 — мясо индейки, IgE (ImmunoCAP) | 700,00 |
| 21-656 | Аллерген t14 — тополь, IgE (ImmunoCAP) | 700,00 |
| 21-657 | Аллерген t3 — береза бородавчатая, IgE (ImmunoCAP) | 700,00 |
| 21-658 | Аллерген w8 — одуванчик, IgE (ImmunoCAP) | 700,00 |
| 21-659 | Аллерген w6 — полынь, IgE (ImmunoCAP) | 700,00 |
| 21-660 | Аллерген t2 — ольха серая, IgE (ImmunoCAP) | 700,00 |
| 21-661 | Аллерген g6 — тимофеевка луговая, IgE (ImmunoCAP) | 700,00 |
| 21-662 | Смесь бытовых аллергенов hx2 (ImmunoCAP), IgE: домашняя пыль, клещ домашней пыли D. pteronyssinus, клещ домашней пыли D. farinae, таракан рыжий | 700,00 |
| 21-663 | Смесь аллергенов плесени mx1 (ImmunoCAP), IgE: Penicillium chrysogenum, Cladosporium herbarum, Aspergillus fumigatus, Alternaria alternata | 700,00 |
| 21-664 | Смесь аллергенов злаковых трав gx1 (ImmunoCAP), IgE: ежа сборная, овсяница луговая, плевел, тимофеевка луговая, мятлик луговой | 700,00 |
| 21-666 | Смесь аллергенов животных ex2 (ImmunoCAP), IgE: перхоть кошки, перхоть собаки, эпителий морской свинки, крыса, мышь | 700,00 |
| 21-667 | Смесь аллергенов сорных трав wx5 (ImmunoCAP), IgE: амброзия высокая, полынь, нивяник, одуванчик, золотарник | 700,00 |
| 21-668 | Смесь пищевых аллергенов fx5 (ImmunoCAP), IgE: яичный белок, молоко, треска, пшеница, арахис, соя | 700,00 |
| 21-669 | Смесь пищевых аллергенов fx73 (ImmunoCAP), IgE: свинина, говядина, курица | 700,00 |
| 21-670 | Смесь аллергенов сорных трав wx3 (ImmunoCAP), IgE: полынь, подорожник ланцетовидный, марь, золотарник, крапива двудомная | 700,00 |
| 21-671 | Смесь аллергенов трав wx209 (ImmunoCAP), IgE: амброзия высокая, амброзия голометельчатая, амброзия трехнадрезная | 700,00 |
| 21-672 | Смесь пищевых аллергенов fx26 (ImmunoCAP), IgE: яичный белок, коровье молоко, арахис, горчица | 700,00 |
| 21-673 | Аллергочип ImmunoCAP ISAC (112 аллергокомпонентов) | 28 400,00 |
| 21-674 | Аллерген f4 — пшеница, пшеничная мука, IgE (ImmunoCAP) | 700,00 |
| 21-675 | Фадиатоп (ImmunoCAP) | 1 840,00 |
| 21-676 | Фадиатоп детский (ImmunoCAP) | 3 870,00 |
| 21-677 | Аллерген f14 – соя, IgE (ImmunoCAP) | 700,00 |
| 21-678 | Аллерген d1 — клещ домашней пыли Dermatophagoides pteronyssinus, IgE (ImmunoCAP) | 700,00 |
| 21-679 | Аллергокомпонент g205 — тимофеевка луговая rPhl p1, IgE (ImmunoCAP) | 2 410,00 |
| 21-680 | Аллергокомпонент g215 — тимофеевка луговая rPhl p5b, IgE (ImmunoCAP) | 2 410,00 |
| 21-681 | Аллергокомпонент t215 — береза rBet v1 PR-10, IgE (ImmunoCAP) | 1 640,00 |
| 21-682 | Аллергокомпонент f232 — овальбумин яйца nGal d2, IgE (ImmunoCAP) | 1 640,00 |
| 21-683 | Аллергокомпонент f233 — овомукоид яйца nGal d1, IgE (ImmunoCAP) | 1 640,00 |
| 21-684 | Аллергокомпонент k208 — лизоцим яйца nGal d4, IgE (ImmunoCAP) | 940,00 |
| 21-685 | Аллергокомпонент f323 — кональбумин яйца nGal d3, IgE (ImmunoCAP) | 610,00 |
| 21-686 | Аллергокомпонент f419 — персик rPru p1 PR-10, IgE (ImmunoCAP) | 1 640,00 |
| 21-687 | Аллергокомпонент f420 — персик rPru p3 LTP, IgE (ImmunoCAP) | 1 640,00 |
| 21-688 | Аллергокомпонент f421 — персик rPru p4 Профилин, IgE (ImmunoCAP) | 1 640,00 |
| 21-689 | Аллерген f45 — пекарские дрожжи, IgE (ImmunoCAP) | 700,00 |
| 21-690 | Аллерген t15 — ясень американский, IgE (ImmunoCAP) | 700,00 |
| 21-691 | Аллерген e70 — перо гуся, IgE (ImmunoCAP) | 700,00 |
| 21-692 | Аллерген e86 — перо утки, IgE (ImmunoCAP) | 700,00 |
| 21-693 | Аллерген e213 — перо попугая, IgE (ImmunoCAP) | 700,00 |
| 21-694 | Аллерген f84 — киви, IgE (ImmunoCAP) | 700,00 |
| 21-695 | Аллерген f24 — креветки, IgE (ImmunoCAP) | 700,00 |
| 21-696 | Аллерген f221 — зерна кофе, IgE (ImmunoCAP) | 700,00 |
| 21-697 | Аллерген f247 — мед, IgE (ImmunoCAP) | 700,00 |
| 21-698 | Аллерген m6 — Alternaria alternata, IgE (ImmunoCAP) | 700,00 |
| 21-699 | Аллерген m3 — Aspergillus fumigatus, IgE (ImmunoCAP) | 700,00 |
| 21-700 | Аллерген m2 — Cladosporium herbarum, IgE (ImmunoCAP) | 700,00 |
| 21-701 | Аллерген m227 — Malassezia spp., IgE (ImmunoCAP) | 700,00 |
| 21-702 | Смесь аллергенов деревьев tx9 (ImmunoCAP), IgE: ольха серая, береза бородавчатая, лещина, дуб, ива | 700,00 |
| 21-703 | Аллергокомпонент g213 — тимофеевка луговая (recombinant) rPhl p1, rPhl p5b, IgE (ImmunoCAP) | 1 640,00 |
| 21-704 | Аллергокомпонент g214 — тимофеевка луговая (recombinant) rPhl p7, rPhl p12, IgE (ImmunoCAP) | 1 640,00 |
| 21-705 | Аллергокомпонент t221 — береза rBet v 2, rBet v 4 (рекомбинантный), IgE (ImmunoCAP) | 1 640,00 |
| 21-706 | Аллергокомпонент w230 — амброзия (recombinant) nAmb a 1, IgE (ImmunoCAP) | 1 640,00 |
| 21-710 | Аллергокомпонент f76 — альфа-лактальбумин nBos d 4, IgE (ImmunoCAP) | 1 640,00 |
| 21-712 | Аллергокомпонент e204 — бычий сывороточный альбумин nBos d6, IgE (ImmunoCAP) | 1 640,00 |
| 21-713 | Аллергокомпонент f77 — бета-лактоглобулин nBos d 5, IgE (ImmunoCAP) | 1 640,00 |
| 21-714 | Аллерген t4 — лещина обыкновенная, IgE (ImmunoCAP) | 700,00 |
| 21-715 | Аллерген t7 — дуб, IgE (ImmunoCAP) | 700,00 |
| 21-716 | Аллерген t12 — ива, IgE (ImmunoCAP) | 700,00 |
| 21-717 | Аллерген i6 — таракан-прусак, IgE (ImmunoCAP) | 700,00 |
| 21-718 | Аллерген g8 — мятлик луговой, IgE (ImmunoCAP) | 700,00 |
| 21-719 | Аллерген g5 — плевел, IgE (ImmunoCAP) | 700,00 |
| 21-720 | Аллерген g4 — овсяница луговая, IgE (ImmunoCAP) | 700,00 |
| 21-721 | Аллерген g3 — ежа сборная, IgE (ImmunoCAP) | 700,00 |
| 21-722 | Аллерген g16 — лисохвост луговой, IgE (ImmunoCAP) | 700,00 |
| 21-723 | Аллерген g204 — райграс французский высокий, IgE (ImmunoCAP) | 700,00 |
| 21-724 | Аллерген g2 — свинорой пальчатый, IgE (ImmunoCAP) | 700,00 |
| 21-725 | Аллерген g11 — костер полевой, IgE (ImmunoCAP) | 700,00 |
| 21-726 | Аллерген g9 — полевица, IgE (ImmunoCAP) | 700,00 |
| 21-727 | Аллерген g1 — колосок душистый, IgE (ImmunoCAP) | 700,00 |
| 21-728 | Смесь аллергенов животных ex73 (ImmunoCAP), IgE: перья птиц — гуся, курицы, утки, попугая | 700,00 |
| 21-729 | Аллерген e6 — эпителий морской свинки, IgE (ImmunoCAP) | 700,00 |
| 21-730 | Аллерген w1 — амброзия высокая, IgE (ImmunoCAP) | 700,00 |
| 21-731 | Аллерген w7 — нивяник (поповник), IgE (ImmunoCAP) | 650,00 |
| 21-732 | Аллерген w12 – золотарник IgE (ImmunoCAP) | 700,00 |
| 21-733 | Аллерген f13 — арахис, IgE (ImmunoCAP) | 700,00 |
| 21-734 | Аллерген w206 — ромашка, IgE (ImmunoCAP) | 700,00 |
| 21-735 | Аллерген t209 — граб обыкновенный, IgE (ImmunoCAP) | 700,00 |
| 21-736 | Аллерген t208 — липа, IgE (ImmunoCAP) | 700,00 |
| 21-737 | Аллерген f300 — козье молоко, IgE (ImmunoCAP) | 700,00 |
| 21-738 | Суммарные иммуноглобулины E (IgE) в сыворотке (ImmunoCAP) | 2 800,00 |
| 21-739 | Аллергокомпонент e94 — кошка rFel d1, IgE (ImmunoCAP) | 2 430,00 |
| 21-740 | Аллергокомпонент w231 — полынь nArt v1, IgE (ImmunoCAP) | 2 430,00 |
| 21-741 | Аллергокомпонент e101 — собака rCan f 1, IgE (ImmunoCAP) | 2 560,00 |
| 21-742 | Аллерген f256 — орех грецкий (плод), IgG | 560,00 |
| 21-743 | Панель пищевых аллергенов fx10 (ImmunoCAP), IgE: свинина, говядина, яичный желток, курица, индейка | 890,00 |
| 21-744 | Аллергокомпонент w233 — полынь nArt v 3 LTP, IgE (ImmunoCAP) | 1 690,00 |
| 21-745 | Аллерген w3 — амброзия трехнадрезная, IgE (ImmunoCAP) | 660,00 |
| 21-746 | Аллергокомпонент m229 — Alternaria alternata rAlt a1 (рекомбинантный), IgE (ImmunoCAP) | 1 990,00 |
| 21-747 | Аллергокомпонент m218 — Aspergillus fumigatus rAsp f1 (рекомбинантный), IgE (ImmunoCAP) | 1 990,00 |
| 21-748 | Аллерген m9 — Fusarium proliferatum (F. moniliforme), IgE (ImmunoCAP) | 550,00 |
| 21-749 | Аллерген f245 — яйцо куриное (цельное), IgE, ИФА | 580,00 |
| 21-750 | Аллерген f79 — глютен, IgE, ИФА | 470,00 |
| 21-752 | Аллерген t102 — ива белая, IgE, ИФА | 470,00 |
| 21-753 | Аллерген e2 — эпителий собаки, IgE, ИФА | 350,00 |
| 21-754 | Аллерген e78 — перо волнистого попугая, IgE, ИФА | 400,00 |
| 21-755 | Аллерген e82 — эпителий кролика, IgE, ИФА | 470,00 |
| 21-757 | Аллерген f105 — шоколад, IgE, ИФА | 350,00 |
| 21-758 | Аллерген f17 — фундук, IgE, ИФА | 350,00 |
| 21-759 | Аллерген f23 — крабы, IgE, ИФА | 470,00 |
| 21-760 | Аллерген f4 — пшеничная мука, IgE, ИФА | 470,00 |
| 21-761 | Аллерген f76 — альфа-лактальбумин, IgE, ИФА | 470,00 |
| 21-762 | Аллерген f77 — бета-лактоглобулин, IgE, ИФА | 470,00 |
| 21-763 | Аллерген f78 — казеин, IgE, ИФА | 350,00 |
| 21-764 | Аллерген f87 — дыня, IgE, ИФА | 350,00 |
| 21-766 | Аллерген f94 — груша, IgE, ИФА | 470,00 |
| 21-767 | Аллерген g15 — пшеница культивированная, IgE, ИФА | 400,00 |
| 21-768 | Аллерген k20 — шерсть, IgE, ИФА | 470,00 |
| 21-769 | Аллерген k82 — латекс, IgE, ИФА | 400,00 |
| 21-770 | Аллерген m5 — Candida albicans, IgE, ИФА | 400,00 |
| 21-771 | Аллерген p1 — Ascaris lumbricoides (аскарида), IgE, ИФА | 400,00 |
| 21-772 | Аллерген t16 — сосна белая, IgE, ИФА | 470,00 |
| 21-773 | Аллерген t1 — клён ясенелистный, IgE, ИФА | 400,00 |
| 21-775 | Смесь аллергенов животных em1 (IgE): перо гуся, перо курицы, перо утки, перо индюка, ИФА | 400,00 |
| 21-776 | Смесь аллергенов пыли hm1 (IgE): домашняя пыль, Dermatophagoides pteronyssinus, Dermatophagoides farinae, таракан-прусак, ИФА | 400,00 |
| 21-777 | Смесь ингаляционных аллергенов dam1 (IgE): эпителий кошки, Dermatophagoides pteronyssinus, береза, перхоть собаки, полынь обыкновенная, тимофеевка, ро | 400,00 |
| 21-778 | Смесь пищевых аллергенов fm15 (IgE): апельсин, банан, яблоко, персик, ИФА | 400,00 |
| 21-780 | Смесь бытовых аллергенов dm1 (IgE): Dermatophagoides pteronyssinus, Dermatophagoides farinae, эпителий кошки, эпителий собаки, ИФА | 470,00 |
| 21-781 | Аллерген c74 — желатин коровий, IgE (ImmunoCAP) | 1 120,00 |
| 21-782 | Аллерген e82 — Кролик, эпителий, IgE (ImmunoCAP) | 960,00 |
| 21-783 | Аллерген e84 — Хомяк, эпителий, IgE (ImmunoCAP) | 470,00 |
| 21-784 | Аллерген f12 — горох, IgE (ImmunoCAP) | 1 150,00 |
| 21-785 | Аллерген f15 — фасоль, IgE (ImmunoCAP) | 960,00 |
| 21-786 | Аллерген f17 — фундук, IgE (ImmunoCAP) | 820,00 |
| 21-787 | Аллерген f212 — грибы (шампиньоны), IgE (ImmunoCAP) | 940,00 |
| 21-788 | Аллерген f218 — паприка, сладкий перец, IgE (ImmunoCAP) | 1 120,00 |
| 21-789 | Аллерген f23 — краб, IgE (ImmunoCAP) | 930,00 |
| 21-790 | Аллерген f242 — вишня, IgE (ImmunoCAP) | 960,00 |
| 21-791 | Аллерген f258 — кальмар, IgE (ImmunoCAP) | 960,00 |
| 21-792 | Аллерген f47 — чеснок, IgE (ImmunoCAP) | 960,00 |
| 21-793 | Аллерген f48 — лук, IgE (ImmunoCAP) | 960,00 |
| 21-794 | Аллерген f8 — кукуруза, IgE (ImmunoCAP) | 930,00 |
| 21-795 | Аллерген f95 — персик, IgE (ImmunoCAP) | 920,00 |
| 21-796 | Аллерген m1 — Penicillium notatum (P.chrysogenum), IgE (ImmunoCAP) | 930,00 |
| 21-798 | Аллерген p1 — Ascaris, IgE (ImmunoCAP) | 930,00 |
| 21-799 | Аллерген c2 — пенициллин V, IgE (ImmunoCAP) | 930,00 |
| 21-800 | Аллерген c5 — ампициллин, IgE (ImmunoCAP) | 930,00 |
| 21-801 | Аллерген c6 — амоксициллин, IgE (ImmunoCAP) | 930,00 |
| 21-802 | Аллерген c73 — инсулин человеческий, IgE (ImmunoCAP) | 930,00 |
| 21-803 | Аллерген c8 — хлоргексидин, IgE (ImmunoCAP) | 930,00 |
| 21-804 | Аллерген e201 — канарейка, перо, IgE (ImmunoCAP) | 1 150,00 |
| 21-805 | Аллерген e3 — перхоть лошади, IgE (ImmunoCAP) | 930,00 |
| 21-806 | Аллерген f10 — кунжут / Sesamum indicum, IgE (ImmunoCAP) | 930,00 |
| 21-807 | Аллерген f20 — миндаль, IgE (ImmunoCAP) | 930,00 |
| 21-808 | Аллерген f209 — грейпфрут / Citrus paradisi, IgE (ImmunoCAP) | 930,00 |
| 21-809 | Аллерген f210 — ананас / Ananas comosus, IgE (ImmunoCAP) | 930,00 |
| 21-810 | Аллерген f213 — мясо кролика, IgE (ImmunoCAP) | 930,00 |
| 21-811 | Аллерген f214 — шпинат, IgE (ImmunoCAP) | 930,00 |
| 21-812 | Аллерген f216 — капуста белокочанная, IgE (ImmunoCAP) | 930,00 |
| 21-813 | Аллерген f222 — чай, IgE (ImmunoCAP) | 930,00 |
| 21-814 | Аллерген f224 — семена мака, IgE (ImmunoCAP) | 930,00 |
| 21-815 | Аллерген f227 — семена сахарной свёклы, IgE (ImmunoCAP) | 930,00 |
| 21-816 | Аллерген f234 — ваниль, IgE (ImmunoCAP) | 930,00 |
| 21-817 | Аллерген f237 — абрикос, IgE (ImmunoCAP) | 930,00 |
| 21-818 | Аллерген f244 — огурец, IgE (ImmunoCAP) | 930,00 |
| 21-819 | Аллерген f256 — грецкий орех, IgE (ImmunoCAP) | 930,00 |
| 21-820 | Аллерген f260 — брокколи, IgE (ImmunoCAP) | 930,00 |
| 21-821 | Аллерген f262 — баклажан, IgE (ImmunoCAP) | 930,00 |
| 21-822 | Аллерген f302 — мандарин, IgE (ImmunoCAP) | 930,00 |
| 21-823 | Аллерген f322 — смородина красная, IgE (ImmunoCAP) | 930,00 |
| 21-824 | Аллерген f329 — арбуз, IgE (ImmunoCAP) | 930,00 |
| 21-825 | Аллерген f343 — малина, IgE (ImmunoCAP) | 930,00 |
| 21-826 | Аллерген f37 — голубая мидия, IgE (ImmunoCAP) | 930,00 |
| 21-827 | Аллерген f40 — тунец, IgE (ImmunoCAP) | 930,00 |
| 21-828 | Аллерген f55 — просо посевное (пшено) / Panicum milliaceum, IgE (ImmunoCAP) | 930,00 |
| 21-829 | Аллерген f81 — сыр Чеддер, IgE (ImmunoCAP) | 930,00 |
| 21-830 | Аллерген f82 — сыр с плесенью, IgE (ImmunoCAP) | 930,00 |
| 21-831 | Аллерген f85 — сельдерей, IgE (ImmunoCAP) | 930,00 |
| 21-832 | Аллерген f86 — петрушка / Petroselinum crispum, IgE (ImmunoCAP) | 930,00 |
| 21-833 | Аллерген f87 — дыня, IgE (ImmunoCAP) | 930,00 |
| 21-834 | Аллерген f88 — баранина, IgE (ImmunoCAP) | 930,00 |
| 21-835 | Аллерген f94 — груша, IgE (ImmunoCAP) | 930,00 |
| 21-836 | Аллерген f96 — авокадо / Persea americana, IgE (ImmunoCAP) | 930,00 |
| 21-837 | Аллерген k80 — формальдегид / формалин, IgE (ImmunoCAP) | 930,00 |
| 21-838 | Аллерген k82 — латекс, IgE (ImmunoCAP) | 930,00 |
| 21-839 | Аллерген m226 — стафилококковый энтеротоксин TSST, IgE (ImmunoCAP) | 1 150,00 |
| 21-840 | Аллерген m80 — стафилококковый энтеротоксин А, IgE (ImmunoCAP) | 930,00 |
| 21-841 | Аллерген m81 — стафилококковый энтеротоксин В, IgE (ImmunoCAP) | 930,00 |
| 21-842 | Аллерген p4 — Anisakidae, IgE (ImmunoCAP) | 930,00 |
| 21-843 | Аллерген c122 — нистатин, IgE, ИФА | 940,00 |
| 21-844 | Аллерген c308 — цефуроксим, IgE, ИФА | 1 120,00 |
| 21-845 | Аллергокомплекс смешанный RIDA-screen №1, IgE | 5 140,00 |
| 21-846 | Аллергокомплекс респираторный RIDA-screen №2, IgE | 4 110,00 |
| 21-847 | Аллергокомплекс пищевой RIDA-screen №3, IgE | 5 140,00 |
| 21-848 | Аллергокомплекс педиатрический RIDA-screen №4, IgE | 4 110,00 |
| 21-849 | Аллергокомпонент t215 — береза rBet v1 PR-10, IgG (ImmunoCAP) | 4 040,00 |
| 21-850 | Аллергокомпонент g213 — тимофеевка луговая (recombinant) rPhl p1, rPhl p5b, IgG (ImmunoCAP) | 4 050,00 |
| 21-851 | Аллергокомпонент w230 — амброзия (recombinant) nAmb a 1, IgG (ImmunoCAP) | 4 040,00 |
| 21-852 | Аллергокомпонент w231 — полынь nArt v1, IgG (ImmunoCAP) | 4 050,00 |
| 21-853 | Аллерген c1 — пенициллин G, IgE (ImmunoCAP) | 930,00 |
| 21-854 | Аллерген d3 — клещ домашней пыли Dermatophagoides microceras, IgE (ImmunoCAP) | 1 120,00 |
| 21-855 | Аллерген d74 — клещ домашней пыли Euroglyphus maynei, IgE (ImmunoCAP) | 930,00 |
| 21-856 | Аллерген e77 — помет волнистого попугайчика, IgE (ImmunoCAP) | 930,00 |
| 21-858 | Аллерген e81 — эпителий овцы, IgE (ImmunoCAP) | 930,00 |
| 21-859 | Аллерген e89 — перо индейки, IgE (ImmunoCAP) | 930,00 |
| 21-860 | Аллерген f201 — орех пекан, IgE (ImmunoCAP) | 930,00 |
| 21-866 | Аллерген f211 — ежевика, IgE (ImmunoCAP) | 930,00 |
| 21-867 | Аллерген f215 — салат-латук, IgE (ImmunoCAP) | 930,00 |
| 21-868 | Аллерген f217 — брюссельская капуста, IgE (ImmunoCAP) | 930,00 |
| 21-870 | Аллерген f236 — сыворотка коровьего молока, IgE (ImmunoCAP) | 930,00 |
| 21-872 | Аллерген f254 — камбала, IgE (ImmunoCAP) | 930,00 |
| 21-873 | Аллерген f255 — слива, IgE (ImmunoCAP) | 780,00 |
| 21-875 | Аллерген f264 — речной угорь, IgE (ImmunoCAP) | 930,00 |
| 21-876 | Аллерген f265 — тмин, IgE (ImmunoCAP) | 930,00 |
| 21-879 | Аллерген f268 — гвоздика, IgE (ImmunoCAP) | 930,00 |
| 21-880 | Аллерген f269 — базилик, IgE (ImmunoCAP) | 850,00 |
| 21-881 | Аллерген f270 — имбирь, IgE (ImmunoCAP) | 930,00 |
| 21-882 | Аллерген f271 — анис, IgE (ImmunoCAP) | 930,00 |
| 21-883 | Аллерген f272 — эстрагон (тархун), IgE (ImmunoCAP) | 930,00 |
| 21-884 | Аллерген f273 — тимьян (чабрец), IgE (ImmunoCAP) | 930,00 |
| 21-885 | Аллерген f277 — укроп, IgE (ImmunoCAP) | 930,00 |
| 21-886 | Аллерген f278 — лавровый лист, IgE (ImmunoCAP) | 930,00 |
| 21-887 | Аллерген f279 — чилийский перец, IgE (ImmunoCAP) | 930,00 |
| 21-888 | Аллерген f280 — черный перец, IgE (ImmunoCAP) | 850,00 |
| 21-889 | Аллерген f281 — карри, IgE (ImmunoCAP) | 930,00 |
| 21-890 | Аллерген f283 — орегано, IgE (ImmunoCAP) | 930,00 |
| 21-892 | Аллерген f290 — устрица, IgE (ImmunoCAP) | 930,00 |
| 21-893 | Аллерген f293 — папайя, IgE (ImmunoCAP) | 930,00 |
| 21-894 | Аллерген f301 — хурма, IgE (ImmunoCAP) | 470,00 |
| 21-895 | Аллерген f317 — кориандр, IgE (ImmunoCAP) | 470,00 |
| 21-896 | Аллерген f319 — свёкла, IgE (ImmunoCAP) | 470,00 |
| 21-898 | Аллерген f328 — инжир, IgE (ImmunoCAP) | 930,00 |
| 21-900 | Аллерген f333 — семена льна, IgE (ImmunoCAP) | 930,00 |
| 21-901 | Аллерген f342 — маслина, IgE (ImmunoCAP) | 930,00 |
| 21-902 | Аллерген f36 — кокос, IgE (ImmunoCAP) | 930,00 |
| 21-903 | Аллерген f414 — тилапия, IgE (ImmunoCAP) | 930,00 |
| 21-904 | Аллерген f42 — пикша, IgE (ImmunoCAP) | 930,00 |
| 21-905 | Аллерген f59 — осьминог, IgE (ImmunoCAP) | 930,00 |
| 21-906 | Аллерген f6 — ячмень, IgE (ImmunoCAP) | 930,00 |
| 21-907 | Аллерген f60 — ставрида, IgE (ImmunoCAP) | 930,00 |
| 21-908 | Аллерген f80 — омар, IgE (ImmunoCAP) | 470,00 |
| 21-909 | Аллерген f89 — горчица, IgE (ImmunoCAP) | 770,00 |
| 21-910 | Аллерген f90 — солод, IgE (ImmunoCAP) | 470,00 |
| 21-911 | Аллерген f91 — манго, IgE (ImmunoCAP) | 770,00 |
| 21-912 | Аллерген i1 — яд пчелы домашней, IgE (ImmunoCAP) | 830,00 |
| 21-913 | Аллерген i204 — слепень, IgE (ImmunoCAP) | 930,00 |
| 21-914 | Аллерген i3 — яд осы обыкновенной, IgE (ImmunoCAP) | 930,00 |
| 21-915 | Аллерген i5 — яд осы желтой, IgE (ImmunoCAP) | 850,00 |
| 21-916 | Аллерген i70 — муравей Рихтера, IgE (ImmunoCAP) | 830,00 |
| 21-917 | Аллерген i71 — комар, IgE (ImmunoCAP) | 770,00 |
| 21-918 | Аллерген k84 — семена подсолнечника, IgE (ImmunoCAP) | 930,00 |
| 21-919 | Аллерген o1 — хлопок, необработанная нить, IgE (ImmunoCAP) | 930,00 |
| 21-921 | Аллерген t1 — клен ясенелистный, IgE (ImmunoCAP) | 930,00 |
| 21-923 | Аллерген t25 — ясень высокий, IgE (ImmunoCAP) | 930,00 |
| 21-924 | Аллерген t5 — бук, IgE (ImmunoCAP) | 930,00 |
| 21-925 | Аллерген t45 — вяз толстолистный, IgE (ImmunoCAP) | 930,00 |
| 21-926 | Аллерген w204 — подсолнечник, IgE (ImmunoCAP) | 930,00 |
| 21-927 | Аллерген w9 — подорожник ланцетовидный, IgE (ImmunoCAP) | 930,00 |
| 21-928 | Смесь аллергенов перьев птиц ex71 (ImmunoCAP), IgE: гуся, курицы, утки, индейки | 880,00 |
| 21-929 | Смесь пищевых аллергенов fx1 (ImmunoCAP), IgE: арахис, фундук, американский орех, миндаль, кокосовый орех | 880,00 |
| 21-931 | Смесь пищевых аллергенов fx17 (ImmunoCAP), IgE: яблоко, банан, груша, персик | 880,00 |
| 21-932 | Смесь пищевых аллергенов fx21 (ImmunoCAP), IgE: киви, дыня, банан, персик, ананас | 1 050,00 |
| 21-933 | Смесь пищевых аллергенов fx22 (ImmunoCAP), IgE: орех пекан, кешью, фисташки, грецкий орех | 1 050,00 |
| 21-934 | Смесь пищевых аллергенов fx7 (ImmunoCAP), IgE: помидор, дрожжи, чеснок, лук, сельдерей | 1 050,00 |
| 21-935 | Аллерген f147 — камбала речная, IgE (ImmunoCAP) | 1 120,00 |
| 21-936 | Аллерген f220 — корица, IgE (ImmunoCAP) | 470,00 |
| 21-937 | Аллерген f287 — красная фасоль, IgE (ImmunoCAP) | 1 120,00 |
| 21-938 | Аллерген f294 — маракуя, IgE (ImmunoCAP) | 1 120,00 |
| 21-939 | Аллерген f303 — палтус белокорый, IgE (ImmunoCAP) | 1 120,00 |
| 21-940 | Аллерген f312 — рыба-меч, IgE (ImmunoCAP) | 1 050,00 |
| 21-941 | Аллерген f313 — анчоус, IgE (ImmunoCAP) | 1 120,00 |
| 21-942 | Аллерген f320 — рак речной, IgE (ImmunoCAP) | 1 120,00 |
| 21-943 | Аллерген f326 — сыворотка овечьего молока, IgE (ImmunoCAP) | 940,00 |
| 21-944 | Аллерген f347 — киноа, IgE (ImmunoCAP) | 1 050,00 |
| 21-945 | Аллергокомпонент f351 — тропомиозин креветок rPen a 1, IgE (ImmunoCAP) | 1 120,00 |
| 21-946 | Аллергокомпонент f352 — арахис rAra h 8 PR-10, IgE (ImmunoCAP) | 1 120,00 |
| 21-947 | Аллергокомпонент f353 — соя rGly m 4 PR-10, IgE (ImmunoCAP) | 1 120,00 |
| 21-948 | Аллергокомпонент f355 — карп rCyp c 1, IgE (ImmunoCAP) | 1 120,00 |
| 21-949 | Аллерген f369 — зубатка полосатая, IgE (ImmunoCAP) | 1 120,00 |
| 21-950 | Аллергокомпонент f416 — омега-5 глиадин пшеницы rTri a 19, IgE (ImmunoCAP) | 1 120,00 |
| 21-951 | Аллергокомпонент f417 — сельдерей rApi g 1.01 PR-10, IgE (ImmunoCAP) | 1 120,00 |
| 21-952 | Аллергокомпонент f422 — арахис rAra h 1, IgE (ImmunoCAP) | 1 120,00 |
| 21-953 | Аллергокомпонент f423 — арахис rAra h 2, IgE (ImmunoCAP) | 1 120,00 |
| 21-954 | Аллергокомпонент f424 — арахис rAra h 3, IgE (ImmunoCAP) | 1 120,00 |
| 21-955 | Аллергокомпонент f426 — треска rGad c 1, IgE (ImmunoCAP) | 1 120,00 |
| 21-956 | Аллергокомпонент f427 — арахис rAra h 9 LTP, IgE (ImmunoCAP) | 1 120,00 |
| 21-957 | Аллерген f54 — батат, IgE (ImmunoCAP) | 1 120,00 |
| 21-958 | Аллерген f61 — сардина, IgE (ImmunoCAP) | 1 120,00 |
| 21-959 | Смесь пищевых аллергенов fx2 (ImmunoCAP), IgE: треска, креветка, синяя мидия, тунец, лосось | 1 120,00 |
| 21-960 | Смесь пищевых аллергенов fx3 (ImmunoCAP), IgE: пшеница, овес, кукуруза, кунжутное семя, гречиха | 1 120,00 |
| 21-961 | Смесь пищевых аллергенов fx14 (ImmunoCAP), IgE: помидор, шпинат, капуста, красный перец | 1 120,00 |
| 21-962 | Смесь пищевых аллергенов fx15 (ImmunoCAP), IgE: апельсин, яблоко, банан, персик | 1 120,00 |
| 21-963 | Смесь пищевых аллергенов fx16 (ImmunoCAP), IgE: земляника, груша, лимон, ананас | 940,00 |
| 21-964 | Смесь пищевых аллергенов fx18 (ImmunoCAP), IgE: горох, арахис, соя | 960,00 |
| 21-965 | Смесь пищевых аллергенов fx20 (ImmunoCAP), IgE: пшеница, рожь, ячмень, рис | 1 120,00 |
| 21-966 | Смесь пищевых аллергенов fx27 (ImmunoCAP), IgE: треска, пшеница, соя, фундук | 1 120,00 |
| 21-967 | Смесь пищевых аллергенов fx28 (ImmunoCAP), IgE: кунжутное семя, креветка, говядина, киви | 1 050,00 |
| 21-968 | Смесь пищевых аллергенов fx70 (ImmunoCAP), IgE: эстрагон, майоран, тимьян, любисток | 1 120,00 |
| 21-969 | Смесь пищевых аллергенов fx71 (ImmunoCAP), IgE: тмин, мускатный орех, кардамон, гвоздика | 1 120,00 |
| 21-970 | Смесь пищевых аллергенов fx72 (ImmunoCAP), IgE: базилик, семена фенхеля, имбирь, анис | 1 120,00 |
| 21-971 | Смесь пищевых аллергенов fx74 (ImmunoCAP), IgE: треска, сельдь, макрель, камбала | 1 120,00 |
| 21-972 | Аллерген g12 — рожь посевная, IgE (ImmunoCAP) | 960,00 |
| 21-973 | Аллерген g14 — овес посевной, IgE (ImmunoCAP) | 1 120,00 |
| 21-974 | Аллерген g15 — пшеница посевная, IgE (ImmunoCAP) | 1 120,00 |
| 21-975 | Аллерген g17 — гречка заметная, IgE (ImmunoCAP) | 580,00 |
| 21-976 | Аллерген g201 — ячмень (пыльца), IgE (ImmunoCAP) | 1 120,00 |
| 21-978 | Аллерген k70 — необжаренные зерна кофе, IgE (ImmunoCAP) | 1 120,00 |
| 21-979 | Аллерген m201 — Tilletia tritici (твёрдая головня пшеницы), IgE (ImmunoCAP) | 1 120,00 |
| 21-980 | Аллерген t9 — маслина европейская, IgE (ImmunoCAP) | 1 120,00 |
| 21-981 | Аллерген t10 — грецкий орех (пыльца), IgE (ImmunoCAP) | 1 120,00 |
| 21-982 | Аллерген t223 — масличная пальма (пыльца), IgE (ImmunoCAP) | 1 120,00 |
| 21-983 | Аллерген w18 — щавель малый, IgE (ImmunoCAP) | 1 120,00 |
| 21-985 | Аллерген w46 — фенхель (собачья ромашка), IgE (ImmunoCAP) | 1 050,00 |
| 21-986 | Аллерген w203 — рапс капуста (пыльца), IgE (ImmunoCAP) | 1 120,00 |
| 21-987 | Аллерген e72 — протеины мочи мыши, IgE (ImmunoCAP) | 1 050,00 |
| 21-988 | Аллерген e73 — эпителий крысы, IgE (ImmunoCAP) | 1 050,00 |
| 21-989 | Аллерген e74 — протеины мочи крысы, IgE (ImmunoCAP) | 1 120,00 |
| 21-990 | Аллерген e75 — протеины сыворотки крысы, IgE (ImmunoCAP) | 1 120,00 |
| 21-991 | Аллерген e76 — протеины сыворотки мыши, IgE (ImmunoCAP) | 1 120,00 |
| 21-992 | Аллерген e83 — эпителий свиньи, IgE (ImmunoCAP) | 1 120,00 |
| 21-993 | Аллергокомпонент e102 — собака rCan f 2 , IgE (ImmunoCAP) | 1 120,00 |
| 21-994 | Аллерген e200 — помёт канарейки, IgE (ImmunoCAP) | 1 120,00 |
| 21-996 | Аллерген e208 — эпителий шиншиллы, IgE (ImmunoCAP) | 1 120,00 |
| 21-997 | Аллерген e211 — протеины мочи кролика, IgE (ImmunoCAP) | 1 120,00 |
| 21-998 | Аллерген e215 — перо голубя, IgE (ImmunoCAP) | 1 120,00 |
| 21-999 | Аллерген e217 — эпителий хорька, IgE (ImmunoCAP) | 940,00 |
Бакпосев урогенитальных выделений (1 точка) + антибиотикограмма
Диагностическое направление
Воспалительные заболевания органов малого таза
Общая характеристика
Рутинный урогенитальный посев направлен на выявление особенностей конкретного биоценоза условно-патогенных микроорганизмов при бактериальном дисбиозе.
Диагностика специфических инфекций — трихомониаз, гонорея, туберкулез, листериоз, возбудители которых являются истинно истинно-патогенными микроорганизмами в данном исследовании не проводится. Также в данное исследование не входит определение условно-патогенного специфического микроорганизма Gardnerella vaginalis, идентификация которого требует особых условий. Gardnerella vaginalis можно определить методом ПЦР или микроскопией урогенитального мазка.
M.Hominis, U.urealyticum, M.genitalium, грибы рода Candida (отдельные тесты) также относятся к условно-патогенной микрофлоре, и приобретают клиническое значение только по достижении диагностических титров роста от 103 – 104 и выше. Это важно учитывать при выборе исследовательской методики (ПЦР или бакпосев). Микробиологическое обследование женской половой сферы представляет определённые трудности, т.к. в норме рассматривает разнообразную микрофлору, физиологически изменяющуюся в различные возрастные периоды жизни. У здоровых женщин репродуктивного возраста микрофлора влагалища представлена гармоничным сочетанием облигатных и факультативных анаэробов, микроаэрофилов, с преобладанием лактобактерий. Выделяемые микроорганизмы: коагулазонегативные стафилококки, Staphylococcus aureus, Streptococcus agalactiae, Enterococcus faecalis, Streptococcus spp., Escherichia coli, Enterobacter spp., Klebsiella spp., дрожжеподобные грибы рода Candida. В настоящее время, в результате распространенного, а зачастую и бесконтрольного использования антибиотикотерапии преобладает грамотрицательная микрофлора кишечного происхождения (E.Coli) в ассоциации со строгими анаэробами: бактероиды, пептококки, пептострептококки, Mobiluncus.
Данная методика не предусматривает определения ИППП, Gardnerella vaginalis, Atopobium vaginаe.
Показания для назначения
Неспецифические воспалительные заболевания мочеполовых путей и контроль после лечения (на 10-14 день после отмены антибактериальных препаратов).
Маркер
Оценка наличия условно-патогенных возбудителей инфекции — в исследуемом биоматериале с определением чувствительности к антибиотикам
Клиническая значимость
1.Установление факта инфекционного процесса, вызванного условно-патогенной флорой. 2.Выбор адекватной антибиотикотерапии.3.Мониторинг лечения.
Состав показателей:
Бактериологический посев + а/биотикограмма урогенитальных выделений
Метод: МикробиологическийДиапазон измерений: 103
Единица измерения: Колониеобразующих единиц на грамм
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
Секрет простаты
Условия доставки:
3 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Стерильный контейнер с крышкой
Объем:
50 Миллилитров
Секрет простаты
Условия доставки:
72 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Гелевая транспортная среда Amis (Мужская)
Эякулят
Условия доставки:
72 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Гелевая транспортная среда Amis (Женская)
Эякулят
Условия доставки:
3 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Стерильный контейнер с крышкой
Объем:
50 Миллилитров
Мазок из вагины
Условия доставки:
72 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Гелевая транспортная среда Amis (Женская)
Мазок из цервикса
Условия доставки:
72 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Гелевая транспортная среда Amis (Мужская)
Мазок из уретры
Условия доставки:
72 Час. при температуре от 20 до 25 градусов Цельсия
Контейнер:
Гелевая транспортная среда Amis (Мужская)
Правила подготовки пациента
У/г забор:
• За 2 дня:
— прекратить прием местных антибактериальных и антисептических препаратов;
— воздерживаться от половых контактов.
• За 2 часа воздержаться от мочеиспускания.
Эякулят
Взятие биоматериала проводится пациентом самостоятельно в отделениях: ул. Подвысоцкого, 6а; пр-т Оболонский, 49; пр-т Гагарина, 9; пр-т Л.Курбаса, 16А. Остальные отделения принимают только доставленный биоматериал в гелевой транспортной среде Amis (Жен), взятый за пределами МЛ «ДІЛА», при соблюдении условий хранения и транспортировки не более 72 часов при температурном режиме от +18 до +25С.Секрет предстательной железы
Отделения принимают только доставленный биоматериал в гелевой транспортной среде Amis (Жен), взятый за пределами МЛ «ДІЛА», при соблюдении условий хранения и транспортировки не более 72 часов при температурном режиме от +18 до +25С.Другой тип БМ Стандартные условия:
В течение рабочего дня ДЦ. Внимание: В работу может быть принят для данного метода различный тип биоматериала (это определяет только заказчик, указывая в направлении).Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Нарушение сроков и условий доставки
- Прием антимикробных препаратов оказывает влияние на достоверность результата.
Интерпретация:
- I степень роста (очень скудный рост) — на плотных питательных средах роста нет, только в жидкой питательной среде (105 КОЕ/тампон/мл).I и II степени роста может свидетельствовать о контаминации материала нормальной микрофлорой или носительстве, а III и IV — в пользу этиологической значимости выделенного микроорганизма.
%PDF-1.6 % 1 0 obj > endobj 4 0 obj /ModDate (D:20160712135418+03’00’) /Subject >> endobj 2 0 obj > stream application/pdf
Мониторинг переноса и интернализации Escherichia coli из инокулированных ножей в свежесрезанные огурцы (Cucumis sativus L.) с использованием биолюминесцентной визуализации
Pablos, C. et al. Новые противомикробные агенты в качестве альтернативы хлору с потенциальным применением в промышленности по переработке фруктов и овощей. Внутр. J. Food Microbiol. 20 , 92–97. https://doi.org/10.1016/j.ijfoodmicro.2018.07.029 (2018).
CAS Статья Google ученый
Снид, Дж., Фебус, Р., Дункан-Голдсмит, Д., Милк, Д. и Джонсон, Д. Практика обращения с пищевыми продуктами приводит к перекрестному заражению. J. Food Prot. 35 , 36–48 (2015).
Google ученый
Zhang, S. Перенос и выживаемость Salmonella Newport и Typhimurium на свежесрезанных помидорах и огурцах. Докторская диссертация — Illinois Inst. Technol. 2017 , 1–45.https://www.zhangqiaokeyan.com/academic-degree-foreign_mphd_thesis/0206195617.html (2017).
CAS Google ученый
Sun, Y. et al. Выявление Escherichia Coli O157: колонизация и интернализация H7 в огурцах с использованием инвертированного флуоресцентного микроскопа и гиперспектральной микроскопии. Микроорганизмы 7 , 499–512. https://doi.org/10.3390/microorganisms7110499 (2019).
CAS Статья PubMed Central Google ученый
Бухгольц, А. Л., Дэвидсон, Г., Маркс, Б. П. и Тодд, Э. С. Д. Количественный перенос Escherichia coli O157: H7 во время экспериментального производства свежесрезанной листовой зелени. J. Food Prot. 75 , 1184–1197. https://doi.org/10.4315/0362-028X.JFP-11-489 (2012).
Артикул PubMed Google ученый
Buchholz, AL, Davidson, GR, Marks, BP, Todd, ECD & Ryser, ET Перенос Escherichia coli O157: H7 с поверхностей оборудования на свежесрезанную листовую зелень во время обработки на модельной производственной линии пилотной установки с дезинфицирующим средством -бесплатная вода. J. Food Prot. 75 , 1920–1929. https://doi.org/10.4315/0362-028X.JFP-11-558 (2012).
Артикул PubMed Google ученый
Зилелиду, Э.A., Tsourou, V., Poimenidou, S., Loukou, A. & Skandamis, PN Моделирование переноса Escherichia coli O157: H7 и listeria monocytogenes во время приготовления свежесрезанных салатов: влияние методов нарезки и измельчения . Food Microbiol. 45 , 254–265. https://doi.org/10.1016/j.fm.2014.06.019 (2015).
Артикул PubMed Google ученый
Stéfani, T. A. et al. Перекрестное заражение и образование биопленок Salmonella enterica serovar enteritidis на различных разделочных досках. Патогенный микроорганизм пищевого происхождения. Дис. 15 , 81–85. https://doi.org/10.1089/fpd.2017.2341 (2018).
CAS Статья Google ученый
Severino, R. et al. Противомикробные эффекты покрытия на основе модифицированного хитозана, содержащего наноэмульсию эфирных масел, упаковки с модифицированной атмосферой и гамма-облучения против Escherichia coli O157: H7 и Salmonella Typhimurium на зеленой фасоли. Food Control 50 , 215–222. https://doi.org/10.1016/j.foodcont.2014.08.029 (2015).
CAS Статья Google ученый
Sessa, M., Ferrari, G. & Donsì, F. Новое съедобное покрытие, содержащее наноэмульсии эфирных масел для продления срока хранения овощных продуктов. Chem. Англ. Пер. 43 , 55–60. https://doi.org/10.3303/CET1543010 (2015).
Артикул Google ученый
Лопес-Гальвес, Ф., Альенде, А., Сельма, М. В. и Гил, М. И. Предотвращение перекрестного заражения escherichia coli различными коммерческими дезинфицирующими средствами во время мытья свежесрезанного салата. Внутр. J. Food Microbiol. 133 , 167–171. https://doi.org/10.1016/j.ijfoodmicro.2009.05.017 (2009).
CAS Статья PubMed Google ученый
О’Бейрн, Д., Глисон, Э., Оти, М., Джордан, К.Влияние переменных обработки и хранения на проникновение и выживаемость Escherichia coli O157: H7 в свежесрезанной фасованной моркови. Food Control 40 , 71–77. https://doi.org/10.1016/j.foodcont.2013.11.026 (2014).
Артикул Google ученый
Zhou, B., Feng, H., Luo, Y. & Millner, P. D. Усовершенствованная конструкция и ультразвуковая дезинфекция ножей для сбора салата для минимизации загрязнения Escherichia coli O157: H7. J. Food Prot. 75 , 563–566 (2012).
Артикул Google ученый
Ван, Х. и Райзер, Э. Т. Количественный перенос Salmonella Typhimurium LT2 во время механического нарезания томатов под воздействием нескольких переменных обработки. Внутр. J. Food Microbiol. 234 , 76–82. https://doi.org/10.1016/j.ijfoodmicro.2016.06.035 (2016).
Артикул PubMed Google ученый
Сколлон А.М., Ван Х. и Райзер Э.Т. Перенос listeria monocytogenes во время механической резки лука. Food Control 65 , 160–167. https://doi.org/10.1016/j.foodcont.2016.01.021 (2016).
Артикул Google ученый
Ши, Ю. К., Торторелло, М. Л., Флейшман, Г., Ли, Д. и Шаффнер, Д. В. Отслеживание и моделирование передачи норовируса во время механического разрезания помидоров земного шара. Внутр. J. Food Microbiol. 180 , 13–18. https://doi.org/10.1016/j.ijfoodmicro.2014.04.002 (2014).
Артикул PubMed Google ученый
Paul, P.A. Колонизация рассады томатов биолюминесцентным clavibacter michiganensis subsp. michiganensis при разных режимах влажности. Фитопатология 102 , 177–184. https://doi.org/10.1094/PHYTO-03-11-0090 (2012).
Артикул PubMed Google ученый
Кассем И. И., Сплиттер Г. А., Миллер С. и Раджашекара Г. Да будет свет! биолюминесцентная визуализация для изучения бактериального патогенеза у живых животных и растений. Adv. Biochem. Eng./Biotechnol. 3 , 119–145. https://doi.org/10.1007/10_2014_280 (2014).
CAS Статья Google ученый
Xu, X. et al. Биолюминесцентная визуализация clavibacter michiganensis subsp. michiganensis семян и растений томатов. заявл. Environ. Microbiol. 76 , 3978–3988. https://doi.org/10.1128/AEM.00493-10 (2010).
CAS Статья PubMed PubMed Central Google ученый
Кусуманингрум, Х. Д., Рибольди, Г., Хазелегер, В. К. и Боймер, Р. Р. Выживание патогенов пищевого происхождения на поверхностях из нержавеющей стали и перекрестное загрязнение пищевых продуктов. Внутр. J. Food Microbiol. 85 , 227–236. https: // doi.org / 10.1016 / S0168-1605 (02) 00540-8 (2003).
CAS Статья PubMed Google ученый
Hoelzer, K. et al. Оценка Listeria monocytogenes коэффициентов передачи и эффективности удаления бактерий посредством очистки и санитарии. Внутр. J. Food Microbiol. 157 , 267–277. https://doi.org/10.1016/j.ijfoodmicro.2012.05.019 (2012).
Артикул PubMed Google ученый
Banning, N., Toze, S. & Mee, B.J. Выживание Escherichia coli в грунтовых водах и сточных водах измерялось с использованием комбинации йодида пропидия и зеленого флуоресцентного белка. J. Appl. Microbiol. 93 , 69–76. https://doi.org/10.1046/j.1365-2672.2002.01670.x (2010).
Артикул Google ученый
Pérez-Rodríguez, F. et al. Моделирование переноса Escherichia coli O157: H7 и золотистого стафилококка во время нарезки приготовленного мясного продукта. Meat Sci. 76 , 692–699. https://doi.org/10.1016/j.meatsci.2007.02.011 (2007).
CAS Статья PubMed Google ученый
Чен, Й., Джексон, К. М., Чеа, Ф. П. и Шаффнер, Д. У. Количественная оценка и анализ вариабельности уровней бактериального перекрестного заражения при выполнении общих задач общественного питания. J. Food Prot. 64 , 72–80. https://doi.org/10.1016/S0260-8774(00)00093-5 (2001).
CAS Статья PubMed Google ученый
Ворст, К. Л., Тодд, Э. С. Д. и Райзер, Э. Т. Перенос Listeria monocytogenes во время нарезки грудки индейки, болоньи и салями с помощью искусственных кухонных ножей. J. Прод. 69 (12), 2939–2946. https://doi.org/10.4315/0362-028X-69.12.2939 (2006).
Артикул PubMed Google ученый
Мур, Г., Блэр, И. С. и Макдоуэлл, Д. А. Извлечение и перенос Salmonella Typhimurium с четырех различных поверхностей, контактирующих с пищевыми продуктами в домашних условиях. J. Food Prot. 70 , 2273–2280. https://doi.org/10.4315/0362-028x-70.10.2273 (2007).
Артикул PubMed Google ученый
Бухгольц, А. Л., Дэвидсон, Г. Р., Маркс, Б. П., Тодд, Э. К. Д. и Райзер, Э. Т. Количественный перенос escherichia coli o157: h7 на оборудование при мелкомасштабном производстве свежесрезанной листовой зелени. J. Food Prot. 75 , 1184–1197. https://doi.org/10.4315/0362-028X.JFP-11-489 (2012).
Артикул PubMed Google ученый
Камински, К. Н., Дэвидсон, Г. Р. и Райзер, Э. Т. Listeria monocytogenes переносится во время механического нарезания сельдерея кубиками и растет во время последующего хранения. J. Food Prot. 77 , 765–771. https://doi.org/10.4315/0362-028X.JFP-13-382 (2014).
Артикул PubMed Google ученый
Tamplin, R.M. Моделирование переноса listeria monocytogenes во время нарезки лосося «gravad». Внутр. J. Food Microbiol. 118 , 69–78. https://doi.org/10.1016/j.ijfoodmicro.2007.06.017 (2007).
Артикул PubMed Google ученый
Sheen, S. & Hwang, C.A. Моделирование поверхностного перекрестного заражения Salmonella spp. на готовое к употреблению мясо с помощью операции нарезки. Food Nutr. 2 , 916–924. https://doi.org/10.4236/fns.2011.29125 (2011).
Артикул Google ученый
Wang, H. & Ryser, E.T. Количественный перенос и дезактивация дезинфицирующим средством Salmonella во время моделирования коммерческого нарезания кубиками и транспортировки томатов. Food Control 107 , 106762–106762.https://doi.org/10.1016/j.foodcont.2019.106762 (2020).
CAS Статья Google ученый
Gkana, E., Lianou, A. & Nychas, G.J. E. Перенос Salmonella enterica серовара Typhimurium из говядины в помидоры через кухонное оборудование и эффективность процедур промежуточной дезактивации. J. Food Prot. 79 , 1252–1258. https://doi.org/10.4315/0362-028X.JFP-15-531 (2016).
CAS Статья PubMed Google ученый
Перес-Родригес, Ф., Валеро, А., Карраско, Э., Гарсия, Р. М. и Зурера, Г. Понимание и моделирование бактериального переноса в пищевые продукты: обзор. Trends Food Sci. Technol. 19 , 131–144. https://doi.org/10.1016/j.tifs.2007.08.003 (2008).
CAS Статья Google ученый
Maggio, F. et al. Взаимодействие между L. monocytogenes и P. fluorescens в биопленках с двумя видами при моделировании условий переработки молока. Foods 10 (1), 176–189. https://doi.org/10.3390/foods10010176 (2021 г.).
Артикул PubMed PubMed Central Google ученый
Wang, S. Транскриптомный ответ Escherichia coli O157: H7 и Salmonella enterica на окислительный стресс. Дисс. Abstr. Int. 72 (1), 132. https://www.proquest.com/books/transcriptomic-response-escherichia-coli-o157-h7/docview/89
Google ученый
Тойвонен П. М., Чангвен Л. У., Бах С. и Делаки П. Модуляция перекиси водорода, вызванной раной, и ее влияние на судьбу Escherichia coli O157: H7 в тканях разрезанного салата. J. Food Prot. 75 , 2208–2212. https://doi.org/10.4315/0362-028X.JFP-12-208 (2012).
Артикул PubMed Google ученый
Ши-Цзян, Ю., Цзе, Л., Цзи-Нин, З. и Лонг-Тин, С. И. Влияние низкой температуры и плохого освещения на физиологический индекс огурца. J. Heb Normal Univ. Technol. 27 , 12 (2013).
Google ученый
Фарбер, Дж. М., Ван, С. Л., Цай, Ю. и Чжан, С. Изменения в популяциях listeria monocytogenes , инокулированных на упакованные свежесрезанные овощи. J. Food Prot. 61 , 192–195. https://doi.org/10.1016/S1010-5182(98)80035-8 (1998).
CAS Статья PubMed Google ученый
Yongjin, Q., Shuangqing, F. & Yumei, Z. Влияние тепловой обработки на переохлаждение и физиологические реакции огурца при хранении при низкой температуре. J. China Agric. Univ. 8 , 71 (2003).
Google ученый
Эриксон, М. С. Интернализация свежих продуктов патогенами пищевого происхождения. Annu. Rev. Food Sci. Technol. 3 , 283–310. https://doi.org/10.1146/annurev-food-022811-101211 (2012).
CAS Статья PubMed Google ученый
Мариани, К. et al. Экология биопленки деревянных полок, используемых при созревании французского сырного мазка из сырого молока reblochon de savoie. J. Dairy Sci. 90 , 1653–1661. https://doi.org/10.3168/jds.2006-190 (2007).
CAS Статья PubMed Google ученый
Уорнинг, А., Датта, А. К. и Барц, Дж. А. Механическое понимание влияния температуры воды и бактериальной инфильтрации во время гидроохлаждения свежих продуктов. Послеуборочная биол. Technol. 118 , 159–174. https://doi.org/10.1016/j.postharvbio.2016.03.018 (2016).
CAS Статья Google ученый
Payvandi, S. et al. Математическая модель транспорта воды и питательных веществ в ксилемных сосудах растения пшеницы. Бык. Математика. Биол. 76 , 566–596. https://doi.org/10.1007/s11538-013-9932-4 (2014).
MathSciNet CAS Статья PubMed МАТЕМАТИКА Google ученый
Факторы вирулентности, распространенность и потенциальная передача внекишечных патогенных бактерий Escherichia coli, выделенных из различных источников: последние отчеты | Кишечные патогены
Escherichia coli — это группа бактерий, обычно встречающихся во флоре пищеварительного тракта человека и животных, и симбионтов, участвующих в пищеварении и синтезе определенных витаминов.В настоящее время идентифицирован 171 соматический (O), 55 жгутиковых (H) и 80 капсульных (K) антигенов, и существует более 160 серологических типов E. coli . E. coli вызывают инфекцию мочевыводящих путей (ИМП), внутрибольничную пневмонию (HAP), сепсис, инфекцию области хирургического вмешательства (SSI), инфекции желудочно-кишечного тракта, гемолитико-уремический синдром (HUS), менингит и воспаление мозговые оболочки [1].
Мобильные генетические элементы E. coli могут быть обменены по горизонтали в родственных бактериях или в бактериях из разных семейств, что позволяет им оседать в различных средах. Штаммы E. coli можно разделить на следующие филогенетические группы: A, B1, B2, C, D, E, F и кладу I [2, 3]. Комменсал E. coli , не имеющий патогенных признаков, который встречается, среди прочего, на слизистой оболочке желудочно-кишечного тракта, чаще всего представляет группу A или B1. Патогенные E. coli , ответственные за кишечные инфекции, представляют филогенетические группы A, B1 или D. E. coli , ответственные за внекишечные инфекции, относятся к группам B2 и D. Группа E относится к группе D (включая O157: H7), тогда как группа F относится к основной группе B2.К криптической кладе I отнесены клоны штаммов E. coli , которые генетически разнообразны, но фенотипически неотличимы [4, 5].
Некоторые исследования показали, что птичьи патогенные штаммы E. coli (APEC) и внекишечные патогенные E. coli (ExPEC), вызывающие инфекции у людей, довольно близки филогенетически и имеют общие гены вирулентности [6, 7]. Не исключено, что штаммы APEC гипотетически могут представлять опасность для здоровья человека [8].Генетический анализ, проведенный Родригес-Зиком и его коллегами, показал, что штаммы APEC могут быть резервуаром генов вирулентности ExPEC, патогенных для человека. Это могло быть причиной генетического разнообразия и обмена генами между патогенными штаммами E. coli . Некоторые из внекишечных патогенных штаммов E. coli человека имеют в геномах ген iss , который отвечает за увеличение выживаемости бактерий в сыворотке крови. Ген iss расположен на плазмиде ColV, огромной плазмиде вирулентности, типичной для птичьего патогенного вируса E.coli , что указывает на то, что обмен плазмидами и, следовательно, обмен этими генами вирулентности возможен между человеческими и птичьими патогенными штаммами E. coli [6].
Развитие методов молекулярной биологии позволяет секвенировать полные геномы эталонных штаммов E. coli , например: комменсал E. coli K-12, патогенный штамм O157: H7, вызывающий кишечные инфекции и уропатогенные E. coli J96.Также известны полные генетические последовательности не менее 20 штаммов E. coli [2, 9]. Анализ последовательностей генов домашнего хозяйства, то есть MutliLocus Sequence Typing, MLST позволил более точно изучить филогенетическую структуру видов E. coli [10, 11]. Этот метод, основанный на определении типов аллелей отобранных домашних генов и штаммов, относится к типам последовательностей (ST) [2]. Анализ с помощью приложения MLST показал ошибки и пропуски в прошлом делении E.coli на четыре основные филогенетические группы. Анализ с секвенированием показал, что среди видов E. coli существуют гибридные группы и около 80–85% из штаммов E. coli были неправильно отнесены к филогенетическим группам [11,12,13]. С применением MLST выявлено, что среди экстраинтестинальных патогенных штаммов с множественной лекарственной устойчивостью наиболее частым является штамм E. coli типа Sequence Type 131 (ST131) [14]. ST131 представляет собой клон E. coli , распространенный по всему миру и устойчивый ко многим антибиотикам [15].
ExPEC — спектр заболеваний
Внекишечный патоген E. coli (ExPEC) (Dale i Woodford) имеет сложную филогенетическую структуру, широкий спектр факторов вирулентности (VF) и значительную пластичность генома. Эти штаммы вызывают не только неосложненные ИМП, но также бактериемию или сепсис. Механизмы, лежащие в основе динамики передачи ExPEC и отбора устойчивых клонов, все еще плохо изучены и требуют дальнейших исследований [16]. В группу ExPEC входят уропатогенные E.coli (UPEC), неонатальный менингит E. coli (NMEC), ассоциированный с сепсисом E. coli (SEPEC) и патогенный птичий E. coli (APEC) (таблица 1, рис.1). ExPEC E. coli содержит множество факторов, связанных с вирулентностью, включая адгезины, токсины, факторы приобретения железа, липополисахариды, полисахаридные капсулы и инвазины, которые обычно кодируются на островах патогенности (PAI), плазмидах и других мобильных генетических элементах [4 , 5]. Инфекция мочевыводящих путей — одно из самых распространенных инфекционных заболеваний.Мочевыводящие пути представляют собой стерильное пространство за исключением дистального отдела уретры. На инфекции мочевыводящих путей приходится примерно 40% всех нозокомиальных инфекций и 10–20% внутрибольничных инфекций, из которых 81% встречается у женщин в возрасте 16–35 лет. У мужчин старше 60 лет частота ИМП увеличивается, что связано с нарушением оттока мочи из-за увеличения предстательной железы [17]. Инфекции мочевыводящих путей поражают около 10% педиатрического населения и диагностируются примерно у 1% мальчиков и примерно у 3–8% девочек.В неонатальном периоде инфекция чаще встречается у мальчиков (примерно 60%), тогда как в возрасте 2–3 месяцев эта тенденция меняется на противоположную. Поскольку в этот период жизни нет характерных клинических симптомов, иногда первыми наблюдаемыми симптомами ИМП являются психосоматические расстройства или артериальная гипертензия [18, 19]. Клинические симптомы, связанные с ИМП, могут иметь различную клиническую картину: от бессимптомной бактериурии, различных восходящих инфекций (например, острый пиелонефрит) до тяжелого уросепсиса [18].К наиболее частым этиологическим патогенам, связанным с ИМП, относятся грамотрицательные Enterobacteriaceae с преобладающими штаммами уропатогенных E. coli [19]. Штаммы E. coli ответственны за 75–95% неосложненных ИМП и 40–50% осложненных ИМП [17].
Таблица 1 Гены вирулентности ExPEC, кодирующие адгезины, токсины и сидерофоры Рис. 1Патогенное разнообразие штаммов Escherichia coli
ExPEC — это факультативные патогены, которые являются частью нормальной кишечной флоры человека, но их присутствие может быть ассоциированные с некоторыми инфекционными заболеваниями, такими как ИМП, неонатальный менингит (NMEC E.coli ) и сепсис (SEPEC E. coli ), причем ИМП являются наиболее распространенными. Большинство инфекций мочевых путей вызываются очень гетерогенной группой ExPEC, называемой уропатогенной E. coli (UPEC). Инфекция мочевыводящих путей — это социальная проблема, от которой страдают люди во всем мире; в Соединенных Штатах, например, расходы на здравоохранение на ИМП составляют 4–5 миллиардов долларов в год [20].
APEC, вызывающий колибактериоз домашней птицы, считается патотипом ExPEC. Колибактериоз, по-видимому, является основным инфекционным заболеванием птиц, ответственным за значительные экономические потери птицеводческих хозяйств во всем мире, приводя к высокой смертности и сокращению производства птицы [21].Связавшись с различными заболеваниями, APEC может вызывать инфекции внекишечных органов или сепсис, а также вторичные инфекции у домашних и диких птиц. Заболевания, которые могут быть вызваны APEC у птиц, включают инфекции дыхательных путей, сепсис, полисерозит, колигранулему, целлюлит, инфекцию желточного мешка, омфалит и синдром опухшей головы [22].
ExPEC — специфические факторы вирулентности
Уропатогенные E. coli имеют много факторов вирулентности, т.е.е. адгезины, токсины (например, альфа-гемолизин, цитотоксический некротический фактор 1, аутотранспортеры токсинов), системы накопления железа / гема и транспорт ионов железа. Фимбрии P, S и 1 типа ответственны, среди прочего, за адгезию к эпителиальным клеткам кишечника, почек или нижних мочевых путей, а также за стимуляцию выработки цитокинов Т-клетками. Более того, они являются важным фактором колонизации при внекишечных инфекциях. Характерной особенностью УПЭК является способность к внутриклеточному размножению [2, 23].Потеря части генома, участвующей в производстве фимбрий типа 1, и инактивация генов, кодирующих P-фимбрии, привели к образованию штаммов, ответственных за бессимптомную бактериурию (ABU). Эти штаммы могут колонизировать мочевыводящие пути, не вызывая воспаления [24]. Потенциальным источником UPEC является собственная кишечная флора хозяина, но инфекция также может передаваться фекально-оральным путем или половым путем [24]. E. coli Штаммы K1 являются этиологическим фактором большинства неонатальных инвазивных инфекций, таких как менингит, бактериемия / сепсис, и тяжесть таких инфекций напрямую связана с наличием и количеством капсульного антигена.Потенциальным источником заражения штаммами E. coli K1 может быть персонал больницы [1]. Инфекция E. coli на ранней стадии может иметь источник в урогенитальном или пищеварительном тракте, особенно в случае ИМП в перинатальном периоде. В 2010 году Национальным справочным центром инфекций центральной нервной системы (КОРОУН) зарегистрировано 68 случаев инвазивной инфекции E. coli , в том числе 19 у новорожденных [1, 25].
Штаммы NMEC обладают способностью выживать в кровотоке и поражать мозговые оболочки младенцев.Неонатальный менингит, вызываемый штаммами E. coli , является одной из наиболее распространенных инфекций, вызывающих высокую неонатальную смертность (10%) и заболеваемость (30%). Значительная генотипическая и фенотипическая гетерогенность среди штаммов NMEC создает множество трудностей при определении характеристик, которые могут быть использованы для их отличия от комменсальной E. coli [26]. Важные VFs NMEC включают капсульный антиген K1, защищающий от фагоцитоза и ответственный за распространение бактерий, ibeA , B , C , способствующий инвазии в клетки и далее в ткани, Iss-белок, защищающий от фагоцитоза — бактерицидное действие сыворотки. , и колониестимулирующий фактор V, которого нет в штаммах UPEC.Изоляты NMEC и SEPEC включают генов ibeA, B, C, traT, iss, colV, cvaC, gimB , sfa / foc , кодируемых на плазмидах, которые не обнаружены в изученных изолятах UPEC [27].
Штаммы APEC характеризуются особым набором генов вирулентности, которые позволяют бактериям вызывать внекишечные инфекции. Факторы вирулентности, типичные для APEC, включают гемолизины (HlyE), колицины (CvaC), белок повышенной выживаемости в сыворотке (iss), фимбрии типа I (FimC), термочувствительный гемагглютинин (Tsh) и сидерофоры (IucC, SitA) [28, 29].
ExPEC является основной причиной инфекций, особенно ИМП и сепсиса, как у людей, так и у домашних животных. Устойчивость к оксимино-цефалоспоринам (например, цефотаксиму, цефтазидиму, цефовецину и цефтиофуру) часто возникает из-за продукции гидролизующих ферментов, известных как β-лактамазы расширенного спектра (БЛРС). Устойчивость к антибиотикам в E. coli представляет собой быстро растущую проблему из-за способности организма мутировать, приобретать и передавать плазмиды и другие мобильные генетические элементы, кодирующие гены устойчивости [30].
Островки, ассоциированные с патогенностью ExPEC, и плазмиды, ассоциированные с вирулентностью ExPEC
PAI — это специфические области на бактериальной хромосоме, где накапливаются гены вирулентности. PAI и связанные с ними гены вирулентности распространяются среди бактериальных популяций путем горизонтального переноса [31]. Несколько PAI ранее были идентифицированы в уропатогенных штаммах E. coli , таких как E. coli 536, E. coli J96, E. coli CFT073. PAI с I по IV из штамма 536 кодируют ряд факторов вирулентности, включая P-фимбрии, P-связанные фимбрии, α-гемолизин, S-фимбрии и сидерофорную систему иерсиниабактина.PAI IJ96 и IIJ96 кодируют P-фимбрии, P-родственные фимбрии и α-гемолизин. PAI ICFT073 и IICFT073 кодируют P fimbriae, α-гемолизин и аэробактин [27]. Подробные характеристики островков патогенности и кодируемой функции представлены в таблице 2. PAI часто встречаются среди штаммов E. coli , вызывающих внекишечные инфекции, а штаммы ExPEC в основном относятся к филогенетическим группам B2 и D [32].
Таблица 2 Островки патогенности и закодированные функцииПлазмиды, встречающиеся в природе, способны способствовать распространению множества признаков, включая лекарственную устойчивость, вирулентность и метаболизм редких веществ. E. coli , как было обнаружено, обладает множеством типов плазмид, включая те, которые связаны с вирулентностью. Несмотря на большое количество типов плазмид, которые, как известно, встречаются среди штаммов E. coli , плазмиды, кодирующие признаки, связанные с вирулентностью, почти исключительно относятся к одному семейству несовместимости, известному как IncF. Подобно кишечным патотипам, многие штаммы EXPEC также содержат плазмиды вирулентности [5]. Эти плазмиды перечислены и описаны в таблице 3.
Таблица 3 Секвенированные плазмиды, связанные с вирулентностью ExPECExPEC включают NMEC, один из основных возбудителей бактериального менингита новорожденных [33].Связанные с вирулентностью гены ядра плазмиды NMEC включают все гены оперонов аэробактина ( iutA / iucABCD ), sit ( sitABCD ) и сальмохелина ( iroBCDEN ). Все три оперона кодируют высокоаффинные системы транспорта железа, которые используются бактериями для получения железа в условиях с низким содержанием железа, таких как те, с которыми они сталкиваются в жидкостях и тканях хозяина. Об этих оперонах ранее сообщалось с высокой частотой в плазмидах вирулентности UPEC, APEC и NMEC, и они были связаны с вирулентностью ExPEC [34].Данные показывают, что три системы захвата железа, а именно система аэробактина железа, система сидерофоров сальмохелина и система sitABCD, связаны с вирулентностью ExPEC и кодируются ядром генома плазмид большой вирулентности NMEC [35]. Некоторые из VG APEC расположены в плазмидах, типичных для штаммов APEC, например: IncFIB, IncFIC, pTJ100, ColV lub ColBM [6, 36].
Другой ген, обнаруженный в основном геноме плазмиды большой вирулентности NMEC, — это iss .Этот ген кодирует белок, связанный с повышенной выживаемостью в сыворотке изолятов E. coli человека. Многочисленные исследования документально подтвердили его сильное соответствие вирулентным (но не авирулентным) штаммам E. coli . Гены ompT и hlyF также обнаруживаются в основном геноме больших плазмид вирулентности APEC. ompT , как предполагается, кодирует про-протеин массой 42 кДа, который процессируется в мембране до зрелой формы 40 кДа. Зрелая iss функционирует как узкоспецифическая эндопротеаза внешней мембраны, которая выполняет три функции: (1) она расщепляет парные основные остатки и участвует в обмене мембранного белка, (2) может разрушать интерферон-гамма in vitro, (3) расщепляет человеческий дефенсин LL. -37.Ген hlyF , как предполагается, кодирует предполагаемый ген гемолизина [34, 37]. Основные гены ExPEC-подобных плазмид в NMEC перечислены и представлены в таблице 4.
Таблица 4 Ключевые гены ExPEC-подобных плазмид в NMECЦелью этого исследования было охарактеризовать штаммов E. coli , выделенных из различных источников. — люди, животные и продукты питания в контексте наличия бактериальных генов, кодирующих факторы вирулентности, ответственные за продукцию адгезинов, токсинов и систем приобретения железа (сидерофоров) в связи с растущим числом инфекций с этиологией ExPEC.
Роль факторов поверхностной вирулентности в развитии инфекций ExPEC
Способность бактерий прикрепляться к клеткам-хозяевам является необходимым условием, позволяющим бактериальным патогенам колонизировать организм. Это явление называется тканевым тропизмом и включает специфическое взаимодействие с рецепторами-мишенями и поверхностью конкретной ткани [38].
Адгезионные свойства ExPEC
Многие поверхностные структуры играют важную роль в процессе специфической адгезии.Существует три основных типа адгезинов: фимбрии, афимбриальные адгезины (Afa) и белки внешней мембраны (OMP) [39]. Экспрессия поверхностных адгезинов увеличивает вирулентность патогенных E. coli , инициируя тесный контакт бактерий со стенкой клетки-хозяина. Большинство генов, определяющих наличие фимбрий на поверхности бактериальных клеток, кодируются хромосомно или, реже, внутри плазмидной ДНК. Различные бактериальные адгезины приспособлены к заселению определенной ниши.S-фимбриальные адгезины ( sfa ), F1C («псевдотип I») фимбрии ( foc ), кодирующие P-подобные пили, papC и Iha ( iha ) являются наиболее часто обнаруживаемыми адгезинами среди изолятов ИМП. пациенты [40]. У штаммов UPEC рецепторы P- и S-фимбрий расположены на поверхности эпителиальных клеток, выстилающих мочевыводящие пути хозяина [41]. S-фимбриальные адгезины представляют собой факторы вирулентности, присутствующие в штаммах, вызывающих менингит и сепсис. Эти фимбрии обладают способностью связывать компоненты внеклеточного матрикса и сиалогликопротеины на эндотелиальных клетках капилляров головного мозга.NMEC содержит капсульные антигены K1 ( kpsM, neuA ) или ген инвазии ibeA . Была продемонстрирована взаимосвязь между типом инфекции и наличием характерных факторов вирулентности, например Белок IbeA имеет поверхностные рецепторы на эндотелиальных клетках капилляров головного мозга и позволяет патогенам проникать в нервную систему [42].
По сравнению с NMEC штаммы SEPEC могут демонстрировать присутствие капсульного антигена K2 ( kpsMII ) и фимбрий P и F17 [43].В отличие от UPEC, механизмы патогенеза штаммов NMEC и SEPEC полностью не выяснены. Сравнительный анализ последовательностей ДНК геномов ExPEC показывает, что распространение их факторов вирулентности очень разнообразно [32, 44]. Хотя исследования продолжаются в течение многих лет, конкретные критерии для классификации штаммов E. coli как ExPEC еще не установлены. Согласно результатам, полученным Johnson et al., ExPEC были определены как изолятов E. coli , содержащих два или более маркера вирулентности, которые были определены с помощью мультиплексной реакции ПЦР, включая гены papA (структурная субъединица P-фимбрий) и / или papC (P fimbriae), sfa / foc (субъединицы S и F1C фимбрий), afa / dra (адгезин-связывающий антиген Dr), kpsMT II (капсульные полисахариды группы 2) и iutA рецептор) [45].Факторы уропатогенной вирулентности часто обнаруживаются в UPEC, но они отсутствуют или редки в штаммах E. coli нормальной микрофлоры кишечника. Распространенность гена, кодирующего адгезины, в комменсальных штаммах и в UPEC была определена в соответствии с исследованиями Qin et al. Фимбриальные гены P-типа были обнаружены в 28% изолятов UPEC и в 5% комменсальных штаммов. Гены, кодирующие афимбриальные адгезины Afa, присутствуют в 36% изолятов UPEC, но о них не сообщалось ни в одном из изученных комменсальных штаммов [46].Симптоматические ИМП, вызываемые E. coli , связаны со способностью этих штаммов продуцировать ряд факторов вирулентности, при этом адгезины являются основными детерминантами вирулентности [47]. Горизонтальный перенос генов играет роль в распространении генов вирулентности, расположенных в мобильных генетических элементах, выделенных из штаммов, загрязняющих различные пищевые продукты. В штаммах UPEC, выделенных в Мексике из непастеризованных сыров, наиболее часто обнаруживаемая комбинация генов вирулентности (до 29%) была fimA — agn43 [48].Аналогичным образом, Aslam et al. [49] сообщили о высокой распространенности многих генов вирулентности ( ompT , traT , uidA , vat , hemF , iss и cvaC ), включая гены, ответственные за адгезию, и kpsMT KII в изолятах ExPEC из замороженного мяса птицы.
Фимбриальные адгезины из ExPEC
Фимбрии со сродством к структурам, содержащим остатки маннозы, были классифицированы как тип 1, а устойчивые к маннозе фимбрии классифицированы как тип 2 (например,грамм. P, S, Dr fimbriae). FimB и fimE отвечают за контроль экспрессии фимбрий 1 типа. Три других гена, то есть fimF, fimG и fimH, , участвуют в адгезионных свойствах и продольной регуляции. Адгезин FimH, который образуется из белковых субъединиц FimA, связывается с рецептором уроплакина 1A (UP1a) эпителиальных клеток мочевого пузыря, обеспечивая инвазию и образование биопленко-подобных внутриклеточных структур [50, 51]. На модели мышей было подтверждено, что фимбрии 1-го типа способствуют росту бактерий в форме биопленок [47].Более того, Tarchouna et al. [52] исследовали роль факторов вирулентности E. coli в патогенезе ИМП. Распространенность генов, кодирующих фимбриальные адгезивные системы, составила 68% для fimH , 41% для pap и 34% для sfa / foc , тогда как афимбриальные адгезины ( afa ) были обнаружены в 20% случаев. исследуемые штаммы. Точно так же о высокой распространенности генов, кодирующих адгезин, в изолятах UPEC сообщили Rahdar et al. [53], а именно 95% для fim , 57% для pap , 16% для foc и 81% для sfa .
Устойчивые к маннозе фимбрии включают гемолитические фимбрии F-типа, которые кодируются 11 генами в кластере генов pap , расположенном на хромосоме. Адгезин PapG встречается в трех молекулярных вариантах: PapGI, PapGII, PapGIII с аллелем PapG III, связанным с воспалением мочевого пузыря у женщин и детей, и PapGII, связанным с бактериемией человека. P-фимбрии также являются распространенными факторами вирулентности у пациентов с трансплантатом почек и у пациентов с острой почечной недостаточностью [47, 54]. По данным Shetty et al.[55], высокая распространенность адгезин-кодирующих генов из изолятов E. coli у пациентов с диагнозом ИМП подтверждает, что эти структуры необходимы для того, чтобы вызывать инфекцию. Стоит отметить, что в группе штаммов с генами, кодирующими адгезин, два гена, обусловливающих продукцию фимбрий, а именно pap и sfa , были обнаружены в 30,43% изолятов. В другом исследовании были проанализированы образцы овощей, загрязненные сточными водами из Индии, Таиланда, Вьетнама и Доминиканской Республики (Таблица 5).Авторы обнаружили один или несколько генов уропатогенной вирулентности в 17 из 26 (65,4%) штаммов E. coli , выделенных из местных овощей, что позволяет предположить, что хотя наличие одного гена вирулентности недостаточно для классификации штамма как UPEC. , стоит уделять больше внимания пищевым продуктам неживотного происхождения как пути распространения генов вирулентности. Одновременный анализ различных потенциальных резервуаров UPEC / ExPEC может быть полезен при оценке потенциальных факторов риска инфекций и поможет более целенаправленно проводить исследования по подавлению распространения патогенных бактерий E.coli .
Фимбрии F1C ( foc ) могут связывать остатки β-GalNac-1, 4b-Gal на гликолипидах, экспрессируемых эпителиальными клетками дистальных канальцев и клетками собирающих протоков почек, а также эндотелиальными клетками мочевого пузыря и др. почки [41]. Фимбрии F1C экспрессируются примерно 14% изолятов UPEC и связаны с фимбриями S-типа ( sfa ). Эти два адгезина демонстрируют высокую степень гомологии, но различаются рецепторной специфичностью; S-фимбрии кодируются 9 генами.Ген sfaA содержит информацию об основной субъединице, а ген sfaS — информацию о специфической адгезии, которая связывается с рецептором α-сиалил- (2,3) -β-Gal в эпителиальных клетках почечных канальцев, почечных клубочки, или сосудистый эпителий. Адгезин SfaS, продуцируемый фимбриальной адгезией S ( sfa ), опосредует взаимодействия с рецепторами сиаловой кислоты на почечных эпителиальных и эндотелиальных клетках. S-фимбрии позволяют патогенам проникать в ткани хозяина, поскольку они часто обнаруживаются у штаммов, ответственных за менингит и восходящие ИМП, включая пиелонефрит или сепсис [47, 56].В свою очередь, кодируемый плазмидой белок MrkD характерен для адгезина фимбрий 3-го типа, который связывается с коллагеном V типа в почечных канальцах и способствует образованию бактериальной биопленки и колонизации урологических катетеров [57]. Szemiako et al. [58] проанализировали генетические детерминанты вирулентности штаммов E. coli , которые делают возможной бактериальную транслокацию из мочевыводящих путей в кровоток у пациентов с трансплантатом почки. Авторы проанализировали следующие генетические детерминанты адгезинов: fimG / fimH (фимбриальные гены 1 типа), sfaD / sfaE (фимбриальные гены S), papC (фимбриальный ген P) и гены, кодирующие фимбрии Dr. семья, афа / дра (BC).Результаты, полученные исследователями, показывают, что комбинация генов, кодирующих одновременно два фактора адгезии, например P + Dr, P + S или S + Dr, S + fim связаны с гораздо большим риском попадания такого штамма в систему кровообращения. В другом исследовании Krawczyk et al. [56] проанализировали штамма E. coli , которые способны перемещаться из желудочно-кишечного тракта в сосудистое русло. Исследуемые штаммы бактерий выделены из клинического материала 115 пациентов с опухолями кроветворения и бактериемией.Благодаря методам генотипирования, использованным в исследовании, авторы сообщили, что 89 штаммов E. coli , выделенных из крови, имеют тот же генотип, что и штаммов E. coli , выделенных из кишечника. Детальный генетический анализ исследованных штаммов показал, что устойчивые к ампициллину штаммы E. coli с паттерном afa / dr чаще всего связаны с бактериемией. Авторы указали, что сосуществование генов pap C, sfa , usp и cnf1 , кодирующих факторы вирулентности, может предрасполагать к развитию E.coli для перемещения из желудочно-кишечного тракта в сосудистое русло в группе пациентов с гематологическим раком.
Афимбриальные адгезины из ExPEC
Важной группой факторов поверхностной вирулентности, связанных, среди прочего, с возникновением пиелонефрита и рецидивирующего цистита, является семейство адгезинов Afa / Dr, которое содержит как фимбриальные адгезины, так и Dr fimbriae и Afa afimbrial. адгезины обнаружены в основном в уропатогенных штаммах E. coli [59]. draE / afaE определяют экспрессию генетической информации и производство адгезинов, а draD A , dra B , draD C , draD ( afaA, afaB, afaC, afaD ) гены кодируют вспомогательные белки. Общим для всей семьи рецептором является фактор ускорения распада (DAF), экспрессирующийся на поверхности эритроцитов и клеток других тканей (например, эпителия мочевыводящих путей). Адгезин Dr имеет два других рецептора.Один из них — это коллаген базальной мембраны типа IV, важный фактор, благоприятствующий ИМП, а другой — карциноэмбриональный антиген, связанный с молекулами клеточной адгезии (CEACAM), который служит сигнальным рецептором, регулирующим физиологические изменения. Присоединение к этому рецептору облегчает бактериальную инвазию интраэпителиальных клеток [60].
Роль капсул и биопленки в адгезии штаммов ExPEC
Покрытие на внешней поверхности клеточной стенки защищает бактерии от фагоцитоза и бактерицидного действия системы комплемента.Разнообразная структура полисахаридных капсул, продуцируемых несколькими десятками типов штаммов UPEC, позволяет имитировать компоненты ткани хозяина и затрудняет распознавание иммунной системой [47]. E. coli штаммов, экспрессирующих антиген K1, связаны с развитием неонатального сепсиса [61]. Продукция капсульного антигена K1 зависит от присутствия гена neuC . Группа из 14 оперонов kps ответственна за формирование капсулы K1.Ген kpsMTII кодирует белки, необходимые для транслокации полимера с места его синтеза на поверхность клетки. Wijetunge et al. [26], основываясь на результатах генотипирования исследованных штаммов NMEC, обнаружили, что все изоляты обладают способностью проникать в эндотелиальные клетки головного мозга человека, и более 70% из них несут kpsII, K1, neuC, iucC , сидят генов. Исследованные штаммы NMEC продемонстрировали очень высокую (79,2%) способность к образованию биопленок.
Бактериальный капсульный антиген К, покрывающий клеточную поверхность, может подавлять адгезию к эпителиальным клеткам.Взаимодействие FimF с d-маннозой ингибирует транскрипцию генов капсида, что может привести к уменьшению количества K-антигена на поверхности клетки E. coli и, как следствие, облегчить процесс адгезии [62] . В свою очередь, UpaG, член семейства аутотранспортеров адгезинов, проявляет сродство к фибронектину и ламинину, что позволяет UPEC прикрепляться к эпителию мочевого пузыря. Кроме того, UpaG участвует в создании биопленки на пластике, что облегчает колонизацию урологических катетеров [63].
Транслокация бактериальных клеток из фазы роста в планктоне в фазу роста в биопленке связана с изменением экспрессии многих генов, кодирующих не только факторы вирулентности, но и регуляторные белки. На способность E. coli формировать биопленку влияет экспрессия гена, кодирующего антигенный Agn43 (т.е. flu ), который участвует в агрегации клеток E. coli [64]. Инфекции мочевыводящих путей часто могут вызывать бактериемию, особенно у госпитализированных пациентов, когда из-за загрязнения катетера биопленка образуется инвазивными штаммами ExPEC, обладающими многими факторами вирулентности [65,66,67].В своем анализе генов, определяющих продукцию адгезинов штаммами SEPEC, Conceição et al. [18] показали, что 98,0% этих штаммов SEPEC дали положительный результат на fimH , 69,4% на flu , 53,1% на csgA , 38,8% на vat и 32,7% на iha . Авт. Предположили, что адгезия SEPEC к клеточной поверхности происходит с участием механизмов, отличных от fimH .
Распространенность и передача штаммов ExPEC в различных пищевых продуктах
Существует множество исследований резервуара ExPEC в отношении производства и распределения пищевых продуктов [7, 49, 68, 69].Примеры штаммов E. coli (фенотип ExPEC) с высокой распространенностью генов вирулентности, обнаруженных в различных пищевых продуктах, представлены в таблице 5. В 2015 году с помощью теста мультиплексной ПЦР Mitchell et al. [70] исследовали штаммов E. coli , выделенных из куриного мяса и яичной скорлупы, определяя 5 ExPEC-определяющих маркеров, то есть papA и / или papC (P fimbriae), sfa и / или foc (S и F1C fimbriae), afa и / или dra (Dr-связывающие адгезины), kpsM II (капсула группы 2) и iutA (аэробактиновая система).На начальном этапе исследования авторами были установлены генотипические и фенотипические критерии, характерные для отдельных патотипов в группе ExPEC, что позволило отнести исследуемые изоляты к определенному патотипу. Они включали культуру в моче на UPEC, тогда как NMEC определяли путем обнаружения двух генов, kpsMTK1 и ibeA . На основании полученных результатов установлено, что распространенность ExPEC намного ниже среди изолятов яичного происхождения, чем в группе куриного источника E.coli (4,7% и 21% соответственно). Многие методы были применены для идентификации штаммов ExPEC с зоонозным потенциалом, включая штаммы, способные вызывать одно или несколько заболеваний на животных моделях сепсиса, менингита или ИМП [5, 22, 71, 72]. Это подтверждает результаты других исследований, которые доказали, что изолята E. coli из фекалий здоровых датских цыплят-бройлеров были вирулентными в модели мыши с ИМП [73]. APEC имеет общие факторы вирулентности с UPEC, что подтверждает более ранние гипотезы о том, что ExPEC играет роль в пищевых инфекциях и указывает на связь APEC с внекишечными инфекциями у людей [28, 74, 75].Штаммы APEC могли передаваться от птиц человеку через неправильно приготовленное мясо птицы и при прямом контакте с птицами и их фекалиями [76, 77]. Борзи и его коллеги показали, что цесарка (Numida meleagris) может быть резервуаром антибиотикоустойчивых APEC, что представляет потенциальный риск для здоровья других видов, включая человека [78].
Таблица 5 Примеры обнаружения штаммов E. coli (фенотип ExPEC) в различных пищевых продуктахАббревиатура FUTI (инфекция мочевыводящих путей пищевого происхождения) описывает ИМП, связанные с зараженными пищевыми продуктами.Патотипы E. coli , ответственные за FUTI, еще точно не определены [74]. Якобсен и др. [79] попытались обнаружить присутствие ExPEC-ассоциированных генов вирулентности в E. coli , выделенных от пациентов с ИМП, производственных животных и мяса. Все изоляты были протестированы на наличие восьми генов, связанных с ExPEC ( kpsMII, papA, papC, iutA, sfaS, focG, afa, hlyD ). Полученные результаты позволяют предположить, что животные-производители пищевых продуктов могут быть резервуарами штаммов, несущих связанные с ExPEC гены вирулентности, ответственные за ИМП у людей.Детальный анализ генетических детерминант вирулентности и профилей устойчивости к противомикробным агентам в исследованных штаммах ExPEC, выделенных от пациентов с ИМП, производственных животных или мяса, показал их высокое сходство, что, в свою очередь, может увеличить риск зоонозных инфекций, вызываемых этими штаммами. . Хан и др. [80] наблюдали, что в группе штаммов ExPEC, выделенных из образцов свинины в провинции Хубэй (Китай), до 85% принадлежали к группе B2. Среди генов, кодирующих факторы поверхностной вирулентности, наиболее распространенными были гены kpsMII (74.5%), fimH (70,4%) и papC (47,3%), в то время как среди гораздо менее часто обнаруживаемых штаммов в группе D наиболее распространенными генами вирулентности были sfaS и focG (76,9%), fimH (46,2%) и afa (38,5%). Авторы предполагают, что, подобно птичьему или человеческому ExPEC, штаммов E. coli , выделенных от свиней, имеют множество генетических детерминант вирулентности, которые способствуют развитию ИМП у людей.
В исследовании, проведенном в Бразилии, Cunha et al.[81] охарактеризовали 27 изолятов APEC из различных птицефабрик, которые принадлежали к серогруппе O6, которую часто выделяли как этиологический агент ИМП и сепсиса не только в Бразилии, но и во всем мире. Эти штаммы имеют множество генетических детерминант вирулентности, которые обычно встречаются в изолятах UPEC и SEPEC и, в меньшей степени, в изолятах NMEC, полученных от новорожденных с менингитом, в которых наиболее часто выявлялись гены, кодирующие адгезин: pap (85%) , sfa (100%).С другой стороны, канадские исследования частоты обнаружения ExPEC в мясе сообщили о значительно более высокой доле этих изолятов в образцах от кур по сравнению с говядиной или свининой [82]. Генетическое сходство между штаммами E. coli , выделенными в основном от кур, и ExPEC, вызывающим ИМП у людей, может указывать на то, что мясо, особенно цыплят, может быть резервуаром для ExPEC, вызывающего ИМП у людей. Многие исследователи предполагают, что обнаружение E. coli с факторами вирулентности, которые способствуют развитию инфекций ExPEC человека в пищевых продуктах животного происхождения, особенно у домашней птицы, в настоящее время является важной проблемой безопасности пищевых продуктов, требующей постоянного мониторинга [83].
Благодаря феномену изменения фазы, то есть контролю экспрессии бактериальных структур, ответственных за адгезию, бактериальные клетки могут регулировать процесс развития фимбрий. Изменение фазы защищает патогены от иммунной системы. Отсутствие экспрессии фимбрий не может приводить к отсутствию механизмов адгезии и быть сигналом для производства других типов адгезинов. Было замечено, что штаммы без типичных адгезинов могут прилипать к клеткам Т-24 и вторгаться в них, а также вызывать инфекции, такие как штаммы с этими адгезинами [83].Результаты эксперимента показывают, что процесс адгезии очень сложен и многие механизмы остаются невыясненными.
Сидерофоры и токсины ExPEC
ФЖ, связанные с патогенностью ExPEC, многочисленны и обладают широким спектром активности, от тех, которые связаны с колонизацией бактериями, до тех, которые связаны с вирулентностью, то есть инвазивностью. Текущие научные данные свидетельствуют о том, что инфекция не может быть вызвана одним фактором вирулентности, а может быть вызвана множеством конкретных агентов. Наиболее важно то, что предпочтение бактерий колонизировать определенный участок в организме-хозяине связано с синхронизированной экспрессией генов, кодирующих факторы вирулентности.Кроме того, было замечено, что сосуществование многих генов вирулентности связано с повышенной кишечной транслокацией [3, 49, 70], а профили VF штаммов ExPEC от бактериемии очень разнообразны [3]. Таким образом, интересным направлением исследований является определение взаимосвязи между отдельными ФЖ, типичными для ExPEC, и локализацией внекишечной инфекции [70]. Сидерофоры, подробно описанные в этом разделе, являются вторичными метаболитами, их основная функция заключается в том, чтобы помогать захватывать железо для поддержания роста и развития бактерий [84].Хотя производство сидерофоров может способствовать росту бактерий, производство этих факторов может увеличить метаболические затраты [85]. Последовательные ФЖ, которые также были в центре внимания этой части статьи, являются токсинами. Токсины играют очень важную роль во время инфекции, поскольку они способствуют распространению бактерий в тканях, повышают цитотоксичность и нечувствительность к нейтрофилам [86].
Железо в организме человека
Железо (Fe) необходимо для жизни и правильного функционирования всех живых организмов, включая позвоночных, беспозвоночных и прокариотических организмов, таких как бактерии [87].Железо, как переносчик электронов, играет ключевую роль в основных клеточных процессах, таких как клеточное дыхание, репликация ДНК или транспорт кислорода. Более того, железо встраивается в структуру белка как простетическая группа [88, 89]. Чтобы должным образом способствовать метаболическим процессам, разделять и проявлять патогенные свойства, бактериям необходим доступ к Fe [90], и получить такой доступ сложно, поскольку в природе существует лишь небольшое количество железа, доступного для организмов [87, 91]. В организме-хозяине железо изолируется или распределяется в клетках и тканях путем связывания с белками, хранящими железо в тканях (ферритин).У высших организмов железо в основном присутствует в виде трехвалентных ионов (Fe +3 ) с очень низкой растворимостью [92]. Следовательно, Fe в порфириновом кольце входит в состав гема — кофактора гемоглобина, миоглобина и цитохромов [90, 93]. Ионы железа, хранящиеся таким образом, становятся недоступными для бактерий. Другая стратегия предотвращения использования бактериями ресурсов Fe в высших организмах заключается в том, что он захватывается серозным трансферрином, который имеет очень высокое сродство к Fe. Когда бактерии попадают в организм, макрофаги накапливают свободное Fe в цитоплазме [87, 94].Подсчитано, что концентрация несвязанного Fe в сыворотке крови человека составляет 10 −24 9 · 10 10 M, тогда как в тканях это значение варьируется от 10 −7 9 · 10 10 M до 10 9 1009 −5 9 · 10 10 M (M = моль / дм −3 9 · 10 10 M). ). Эти значения значительно ниже уровня Fe, необходимого для правильного функционирования и деления бактериальных клеток, который колеблется от 10 5 9 10 10 M до 10 9 100 9 6 9 10 10 M [95, 96, 97].
Приобретение железа с помощью ExPEC
Дефицит железа ослабляет адаптивные способности бактерий, вызывая нарушения в клеточных капсулах [98].Однако благодаря своим адаптивным способностям бактерии разработали механизмы, которые позволяют им приобретать железо в организме хозяина, таким образом выживать и вызывать инфекцию [99]. В случае штамма ExPEC доступ к Fe в сыворотке крови имеет первостепенное значение. Поскольку E. coli может вызывать сепсис и инфекции различных органов с очень низкой доступностью железа, этот патотип разработал множество стратегий для получения железа из инфицированных участков [100, 101]. Было доказано, что штаммы ExPEC имеют мембранные насосы, которые переносят Fe внутрь клетки, т.е.грамм. насос FeoAB, обнаруженный в комменсальной и патогенной E. coli [102], транспортер SitABCD (транспортер типа ABC, АТФ-связывающая кассета) [103] и транспортеры Hma и ChuA, которые обеспечивают захват Fe непосредственно из внеклеточного гема [96]. Патотипы ExpEC имеют специализированные системы для косвенного поглощения Fe, основанные на так называемом челночном механизме с участием небольших молекул (200–2000 Да) с высоким сродством к ионам Fe (сильные хелатирующие свойства) [97]. Интересно, что эти комплексы, называемые сидерофорами, встречаются не только у прокариот, но также у грибов и растений.Сидерофоры позволяют улавливать трехвалентное железо (Fe +3 ) из ферритина и трансферрина [89, 96]. Важная роль сидерофоров в вирулентности ExPEC может быть подтверждена результатами, полученными Stromberg et al. [73], которые сообщили о 100% распространенности генов этих факторов в 40 изолятах ExPEC из куриных фекалий, включая 38% штаммов, растущих в моче человека.
Типы сидерофоров в ExPEC
Сидерофоры можно разделить на пять основных классов: катехолаты, феноляты, гидроксамовые кислоты, α-гидроксикарбоксилаты и смешанный тип, содержащий различные сидерофоры.Внекишечные патогенные бактерии E. coli оснащены сидерофорами, повышающими их вирулентность: энтеробактином и сальмохелином (катехолатные сидерофоры), иерсиниабактином (фенолят сидерофором) и аэробактином (сидерофором смешанного типа). Поскольку сидерофор энтеробактин обнаружен практически во всех штаммах E. coli , как комменсальных, так и патогенных, возникает вопрос, следует ли рассматривать его как фактор вирулентности. Энтеробактин и сальмохелин синтезируются не только E.coli , но также и другими патогенными кишечными бактериями, такими как Salmonella spp. или Klebsiella spp. [96, 97]. Сальмохелин, гликозилированное производное энтеробактина, было впервые обнаружено у Salmonella spp. (отсюда и название этого сидерофора). Салмохелин встречается в штаммах ExPEC и считается характерным фактором вирулентности для патотипа ExPEC. Салмохелин кодируется кластером генов iroBCDEN [104], расположенным на плазмидах вирулентности ColV или ColBM, или идентифицированным на PAI [105].Сообщалось, что IroB является единственным геном с гликозилтрансферазной активностью, необходимой для продукции сальмохелина, что приводит к гликозилированию энтеробактина, изменяющему его свойства с сильно гидрофобных на гидрофильные. Это изменение может способствовать вирулентности ExPEC [106, 107]. Ген iroN является маркером сальмохелина ExPEC и важным геном вирулентности при виротипировании штаммов ExPEC [108]. Аэробактин является еще одним сидерофором, характерным для ExPEC. Подобно сальмохелину, этот сидерофор также кодируется плазмидами вирулентности ColV и ColBM ExPEC [96, 105].Рецептор аэробактина гораздо эффективнее улавливает Fe, чем энтеробактин. Внекишечный патогенный возбудитель E. coli может включать другой тип сидерофоров, то есть иерсиниабактин, который первоначально был обнаружен у Yersinia pestis , главным образом во время колонизации мочевыводящих путей. Иерсиниабактин способствует патогенности уропатогенной E. coli (UPEC), особенно во время колонизации мочевыводящих путей. Иерсиниабактин может защищать бактериальные клетки от иммунного ответа хозяина [88, 96, 109].
Токсины, продуцируемые ExPEC
Анализ литературных данных позволил выделить наиболее часто обнаруживаемые гены, кодирующие токсины в ExPEC, к которым относятся: tsh (термочувствительный автотранспортер гемагглютинина tsh), hlyA, hlyD i hlyF (α- гемолизин) , cnf1 (цитотоксический некротический фактор 1), sat (секретируемый аутотранспортированный токсин), pic (протеаза, участвующая в колонизации), vat (фактор вакуолизирующего аутотранспортера), cdtB и astA (энтероагрегант E.coli ) [2, 44, 69, 70, 110,111,112]. Генетические критерии, предложенные Mellata et al. в исследованиях сепсиса, менингита и моделей ИМП на грызунах определили NMEC на основании, среди прочего, одного или нескольких генов, кодирующих токсины: hlyF, tsh, astA, и cdtB. В зависимости от штаммов, идентифицированных как NMEC, авторы обнаружили ген tsh или cdtB , два гена ( hlyF, tsh) или три гена ( astA, hlyF, tsh ).Аналогичная корреляция наблюдалась в случае генов сидерофоров, т.е. fyuA, iroN, iutA, ire , которые присутствовали в UPEC и NMEC (два и более) [70, 83]. В тестах на генотипирование, изучающих патогенность ExPEC для домашней птицы и грызунов, Stromberg et al. использовали мультиплексную ПЦР для вышеупомянутых генов [73]. Сравнительный анализ с использованием мультиплексной ПЦР показал, что изоляты ExPEC от птиц и людей содержат аналогичные наборы генов, кодирующих VF, и попадают в одни и те же филогенетические группы (A, B1, B2 и D), что предполагает зоонозное происхождение ExPEC. [113].Китайские исследования выявили доминирующую группу B2 (169/285) среди 285 проанализированных образцов из свиноферм, скотобоен и супермаркетов. Наиболее часто обнаруживаемыми генами токсинов и сидерофоров E. coli были iutA (82,9%, 97/117), ireA (60,6%, 71/117), cnf (57,3%, 67/117), hlyD (30,7%, 36/117), fyu (21,4%, 25/117) и vat (9,4%, 11/117), что составляет более половины всех генов вирулентности, обнаруженных в . Э.coli [80].
Распространенность генов, кодирующих токсины и сидерофоры в пищевых изолятах ExPEC
В последние годы были проведены обширные исследования распространения ExPEC среди людей в контексте употребления зараженной пищи [47, 67, 82, 110, 113 , 114]. Как уже указывалось, обнаружение этих патогенов в пищевых продуктах затруднено, поскольку специфические молекулярные маркеры для ExPEC еще не идентифицированы [73]. Mitchell et al. [70] охарактеризовали и тщательно проанализировали изоляты ExPEC из пищевых продуктов с учетом их разделения на патотипы UPEC, NMEC и SEPEC.Авторы предположили, что домашняя птица может быть источником вирулентных патотипов, способных вызывать ИМП, неонатальный менингит и сепсис. В канадском исследовании изоляты ExPEC были зарегистрированы как микробиологическое заражение домашней птицы, доступной для продажи в торговых точках, с частотой 8,4%. Во всех генетически проанализированных штаммах из 54 генов вирулентности 9 доминировали в случае ExPEC, а vat , ответственный за продукцию токсина вакуолей, был наиболее часто обнаруживаемым геном, кодирующим токсины [28].Исследования, проведенные в Мексике, показали, что популярные непастеризованные сыры для конкретных регионов, такие как «Queso Fresco», «Queso Crema», «Queso Doble Crema», «Queso Panela» и «Queso Poro», были микробиологически загрязнены E. coli более чем в 50% случаев. Хотя самый высокий процент штаммов принадлежал к группе, вызывающей желудочно-кишечные симптомы, 26% штаммов были потенциальными UPEC. Гены, определяющие синтез токсинов и сидерофоров ( hlyA , vat, cnf1, fyuA, iroN, iutA) , были использованы для идентификации штаммов ExPEC.Ген fyu A был обнаружен в 39% изолятов, а гены iutA и hlyA были обнаружены менее чем в 10%. Потенциальные уропатогенные бактерии E. coli (UPEC) были выделены в 29% проб. Общие гигиенические условия и практика производителей повлияли на качество сыра, которое, как сообщается, было довольно низким [48]. Египетские исследования, проведенные в 2016 году, показали, что сырое молоко, сыр Кариш и сыр Рас были сильно загрязнены E. coli , несущими генов hlyA, cnf1, vat и сидерофоров fyuA, iroN, iutA [69].Кроме того, по сообщениям, яйца заражены E. coli , вызывающими диарею, и патогенами ExPEC. Испанское исследование, основанное на данных за 2016 год, показывает, что яйца для розничной продажи были хорошего качества из-за низкой распространенности E. coli на поверхности яйца (34/180), что составляло около 19% [97]. В США патотипы ExPEC были обнаружены только в 4% исследованных яиц и 96% домашней птицы [70].
Временной сдвиг между колонизацией ExPEC и развитием инфекции остается проблематичным в контексте установления связи между потреблением зараженной пищи и появлением первых симптомов болезни.Самая трудная часть — собрать доказательства, чтобы доказать, что ExPEC вызывает симптомы заболевания, и изучить механизм перехода от бессимптомной колонизации кишечника к распространению за пределы пищеварительного тракта. Существенной проблемой, с которой сталкиваются исследователи, пытающиеся приписать передачу ExPEC к пище, людям или окружающей среде, является задержка между колонизацией ExPEC и инфицированием [115]. В отличие от E. coli , которые вызывают диарею с симптомами, возникающими вскоре после приема внутрь, ExPEC могут жить в кишечнике человека в течение месяцев или даже лет, пока не обнаружат благоприятные условия, в первую очередь связанные с нарушением иммунной функции, мочевыми катетерами, уретральной инфекцией или биопсией простаты. [116].
Патогенность ExPEC, вызванного токсинами и сидерофорами
В ретроспективном исследовании изолятов E. coli O45, полученных от пациентов с колибактериозом и от домашней птицы, испанские и французские исследователи обнаружили несколько кластеров паттернов PFGE, схожих на <85% [ 67]. Прямую передачу ExPEC от пищи человеку трудно обнаружить. Более того, было бы крайне неэтично проверять эффективность причинения инфекций ExPEC у людей. Следовательно, единственно возможное решение - определить патогенность бактерий на животных моделях или линиях клеток человека.В исследовании Стромберга и др. От 2017 г. [73] было оценено, могут ли изоляты E. coli из фекалий здоровых цыплят вызвать колибактериоз на моделях кур и грызунов. Отобранные изоляты, генетически идентифицированные как ExPEC (показывающие гены ia hlyF , iutA , tsh ), были протестированы на их потенциал вирулентности для людей, вызывающий сепсис, менингит и ИМП у самок мышей BALB / c и мышей CBA / J. (вызывать только ИМП). Показано, что исследованные E.coli обладают способностью вызывать инфекции центральной нервной системы на модели менингита у крыс Sprague-Dawley. Интересно, что некоторые изоляты, классифицированные как не-ExPEC, были способны вызывать заболевания, связанные с ExPEC, на животных моделях, но авторы не объясняют этот механизм. Сосредоточившись на факторах вирулентности, определяющих развитие инфекций UPEC, Hagan et al. [40] провели очень интересный анализ экспрессии генов в изолятах E. coli из мочи женщин с подозрением на ИМП.Важным элементом было связать экспрессию отдельных генов с процессом инфицирования, который, как предполагалось, представлял естественные процессы в клетках во время инфекции у людей. Авторы предположили, что во время ИМП E. coli использует множество путей поглощения железа и углерода, что обеспечивает интенсивную репликацию с одновременным ингибированием синтеза фимбрий 1-го типа. В другом исследовании 96 штаммов ExPEC, выделенных из мочи и крови пациентов в Университетской больнице Лондрина, сравнивали с 50 штаммами-комменсалом от здоровых людей.Среди 96 пациентов, инфицированных ExPEC, 90 (93,8%) страдали ИМП, которые были классифицированы как цистит (91,1%), уросепсис (6,7%) и пиелонефрит (2,2%). Гены iroN , iutA , ompT и hlyF чаще обнаруживаются в клинических изолятах ExPEC по сравнению с изолятами комменсала [117]. Другие исследования показали, что штаммы, выделенные из случаев птичьего колибактериоза, способны вызывать заболевание на крысиной модели неонатального менингита человека [5].Для дальнейшей оценки зоонозного потенциала ExPEC вирулентность выбранных штаммов была оценена на мышиной модели. Авторы проанализировали способность ExPEC вызывать сепсис, менингит и ИМП, а также то, трансформируются ли факторы вирулентности, обнаруженные in vitro, в факторы вирулентности in vivo. Некоторые штаммы E. coli , выделенные от кур, были способны вызывать одно или даже несколько заболеваний, но, что интересно, не только из спектра ExPEC. Предполагалось, что E.coli может использовать различные связанные с вирулентностью стратегии для индукции сепсиса, помимо тех, которые связаны с устойчивостью к бактерицидному действию комплемента [83]. Эти два примера доказывают необходимость дальнейших исследований патогенных E. coli для объяснения механизмов их вирулентности.
Что такое инфекция кишечной палочки? Симптомы, причины, диагностика, лечение и профилактика
Согласно прошлым исследованиям, дети младшего возраста, пожилые люди и люди с ослабленной иммунной системой с большей вероятностью будут испытывать тяжелые симптомы STEC или развивать ГУС. Осложнения, вызванные HUS При HUS Токсины E. coli разрушают эритроциты в процессе, называемом гемолизом. Поврежденные эритроциты образуют сгустки и могут закупорить фильтрующую систему почек, что может привести к опасной для жизни почечной недостаточности. От HUS страдают примерно от 5 до 10 процентов людей с STEC. Как правило, ГУС развивается примерно через семь дней после появления первых симптомов инфекции E. coli и после того, как диарея начинает утихать. Дополнительные симптомы включают:- Уменьшение частоты мочеиспускания
- Сильная усталость
- Потеря цвета щек
- Небольшие необъяснимые синяки
- Отек лица, рук, ног или тела, согласно данным Mayo Clinic
- Потеря цвета внутри нижних век
- Менингит у новорожденных An Инфекция E. coli — одна из наиболее частых причин бактериального менингита новорожденных, инфекции оболочек, окружающих головной и спинной мозг младенца.Он обнаруживается в 30 процентах всех случаев инфицирования с ранним началом. Согласно статье, опубликованной в марте 2015 года в Перинатологической клинике , матери передают своим младенцам E. coli во время схваток и родов.
- E. Coli Воздействие в контактных зоопарках и на фермах Животные на фермах и в контактных зоопарках легко загрязняют окружающую среду и самих себя с помощью E. coli — навоза. Люди, особенно дети, затем касаются животных или места их обитания, заражая свои руки.Если затем дети дотронутся до рта, они проглотят E. coli , отмечает CDC.
- Легкая передача E. C oli Маленькие дети в подгузниках или те, кто еще не привык хорошо мыть руки после туалета, с большей вероятностью распространят E. coli , чем другие. Кроме того, взрослым необходимо всегда тщательно мыть руки после смены подгузников и перед приготовлением бутылочек и еды для детей, а также при обращении с пустышками и прорезывателями.
Асептические лабораторные методы: методы посева
1. Подготовьте безопасное и стерильное рабочее место
- Ознакомьтесь со всеми лабораторными правилами и мерами безопасности, которые необходимо соблюдать при работе с микроорганизмами. Независимо от классификации биологической опасности все материалы, контактирующие с микроорганизмами, считаются заразными отходами и перед утилизацией должны быть обеззаражены. Следуйте инструкциям по безопасности в соответствии с инструкциями, предоставленными ведомственными отделами по охране окружающей среды и безопасности, устанавливая соответствующие емкости для отходов для немедленной и надлежащей утилизации потенциально загрязненных материалов (биологической опасности).
- Стерилизуйте все инструменты, растворы и среды перед их использованием для процедур посева.
- Уберите все материалы, загромождающие рабочее место, на лабораторном столе.
- Очистите рабочую зону дезинфицирующим средством, чтобы минимизировать возможное загрязнение.
- Установите горелку Бунзена и работайте медленно, осторожно и осознанно в зоне стерильного поля, создаваемой восходящим потоком пламени.
- Если вы работаете с организмами BSL-2, устройте рабочее место в шкафу биобезопасности.Горелку Бунзена нельзя использовать внутри шкафа, потому что тепло от пламени нарушает воздушный поток, необходимый для ее работы.
- Разместите все принадлежности, необходимые для процедуры, на лабораторном столе рядом со стерильным полем. Убедитесь, что все материалы правильно промаркированы. Организация рабочей зоны таким образом, чтобы максимизировать эффективность работы и избегать ненужных перемещений, сведет к минимуму время воздействия на экспериментальные материалы загрязняющих веществ, переносимых по воздуху.
- Поместите горелку Бунзена справа от вас на скамейке.
- Поместите чашки с агаром или чашки Петри слева от вас.
- Разложите клеточные культуры, пробирки, колбы и флаконы в центре скамейки.
- Ослабьте крышки пробирок, колб и бутылок, чтобы их можно было легко открыть одной рукой при последующих манипуляциях.
- Перед работой с микроорганизмами тщательно вымыть руки с антисептическим мылом и теплой водой.
2. Процедура на планшете: выделение бактериальных колоний с использованием квадрантного метода
Процедура штрих-планшета предназначена для выделения чистых культур бактерий или колоний из смешанных популяций путем простого механического разделения.Одиночные колонии состоят из миллионов клеток, растущих в кластере на агаровой пластине или внутри нее (, рис. 1, ). Колония, в отличие от одиночной клетки, видна невооруженным глазом. Теоретически все клетки в колонии происходят от одной бактерии, первоначально отложенной на планшете, и поэтому называются клоном или кластером генетически идентичных клеток.
- Бактерии существуют в различных формах и размерах. Например, отдельные клетки Escherichia coli имеют палочковидную форму со средней длиной 2 мкм и шириной 0 мкм.5 мкм, тогда как клетки Streptococcus имеют сферическую форму со средним диаметром 1 мкм. Некоторые бактерии (например, E. coli ) существуют как отдельные клетки, в то время как другие образуют различные ассоциации. Streptococcus , например, растут парами или образуют цепочки или кластеры клеток. Обычно предполагается, что отдельная колония возникает из отдельной клетки, подвергающейся бинарному делению; однако это предположение неверно для тех бактерий, которые в природе существуют в виде пар, цепочек или кластеров или которые делятся с помощью других механизмов.В качестве альтернативы, если на чашку помещено слишком много бактерий, может произойти перекрытие клеток, что повысит вероятность того, что две или более бактерий дадут начало тому, что кажется одной колонией. Чтобы избежать этих осложнений при описании или подсчете бактериальных культур, растущих на твердой среде, колонии называются колониеобразующими единицами (КОЕ) .
С помощью метода полосовой пластинки смесь клеток распределяют по поверхности полутвердой питательной среды на основе агара в чашке Петри, так что все меньше и меньше бактериальных клеток откладывается в широко разделенных точках на поверхности. среды и после инкубации развиваются в колонии.Здесь будет описан квадрантный метод выделения отдельных колоний из смеси клеток.
- Нанесение штрихов может быть выполнено с помощью ряда различных инструментов ( Рисунок 2 ). Металлическую петлю можно повторно использовать несколько раз, и она используется для нанесения штрихов на стандартные лабораторные штаммы. Одноразовые пластиковые петли доступны в продаже и чаще используются при работе со штаммами BSL-2 в шкафу биобезопасности. Многие ученые-исследователи предпочитают использовать одноразовые предварительно стерилизованные деревянные палочки или плоские зубочистки для нанесения полосок.Это недорогая альтернатива одноразовым пластиковым петлям, которая может быть особенно полезна при работе с образцом окружающей среды, например с почвой, которая, вероятно, содержит спорообразующие бактерии.
- Одноразовые предварительно стерилизованные палочки и зубочистки не нужно обжигать горелкой Бунзена, что предотвращает ненужную аэрозолизацию спорообразующих бактерий и перекрестное загрязнение лабораторных поверхностей или чашек с агаром спорами.
- Этикетка по краю дна (не крышки) чашки с агаром, по крайней мере, со своим именем, датой, типом питательной среды и типом микроорганизмов, которые будут помещены в среду.
- Пластины должны быть полностью сухими, без конденсации на крышке, и предварительно нагреты до комнатной температуры перед нанесением штрихов. Если чашки хранятся при 4 ° C, снимите их за несколько часов или даже накануне. Разложите их небольшими стопками в шахматном порядке не более 2–3 тарелок и дайте им высохнуть.
- Образец, из которого будет инокулирован планшет со штрихом, может быть либо суспензией клеток в бульоне, либо существующей колонией из другой чашки с агаром.Для начала рекомендуется использовать только один образец для инокуляции одной чашки. Чтобы сэкономить время и материалы, одну пластину можно использовать для нескольких образцов, но только после того, как вы научитесь наносить штрихами один образец на пластину.
- Для первого квадранта образец берут и распределяют примерно по одной четверти поверхности среды быстрым плавным возвратно-поступательным движением (панель А из , рис. 3 ). Поднимите нижнюю половину перевернутой тарелки со скамейки. Перемещайте петлю, палочку или зубочистку вперед и назад по поверхности агара от края к центру чашки.
- Если посевной материал представляет собой суспензию клеток, возьмите петлю с металлической петлей или от 5 до 10 мкл с помощью микропипеточного устройства. Обязательно встряхните или встряхните суспензию клеток перед удалением аликвоты для посева. При выполнении этого шага используйте асептическую технику, обжигая не только петлю, но и край бутылки или пробирки до и после удаления посевного материала. Кроме того, не касайтесь стенок пробирки или бутылки петлей или цилиндром микропипеточного дозатора. При внесении посевного материала с помощью пипетки нанесите суспензию клеток в соответствующее место на планшете, затем с помощью петли, палочки или зубочистки распределите ее по первому квадранту планшета.
- Если посевной материал представляет собой колонию из другой чашки, осторожно коснитесь колонии петлей, палочкой или зубочисткой, а затем распределите ее по первому квадранту чашки. Прежде чем прикасаться к колонии, убедитесь, что металлическая петля остыла. Чтобы петля не была слишком горячей, слегка коснитесь ею чашки с агаром в специально отведенном месте, где не будет полос. От колонии требуется всего несколько клеток, а не вся колония.
- Если используется металлическая петля, зажгите ее с помощью горелки Бунзена перед получением посевного материала для планшета (панель B из , рис. 3 ).Начните примерно в 3-4 дюймах от петли, с проволокой на кончике синего конуса, самой горячей части пламени. Металл должен раскалиться докрасна. Переместите проволоку так, чтобы пламя приблизилось к петле. Эта манипуляция предотвращает аэрозолизацию бактерий, оставшихся на петле от предыдущего использования.
- Пламя убивает бактерии (но не споры), а конвекционные потоки нагретого воздуха предотвращают оседание других загрязняющих веществ, переносимых по воздуху, на металлическую проволоку во время последующих манипуляций.
- При использовании стерильной плоской зубочистки осторожно удерживайте узкий конец между большим и безымянным пальцами под углом от 10 до 20 ° к среде, а широким концом нанесите штрихи на квадранты. Если вы используете петлю или деревянную палочку, держите ее, как карандаш, под тем же углом. Не давите так сильно, чтобы петля, палка или зубочистка не впились в агар.
- После завершения первого квадранта переверните и установите пластину обратно в крышку на скамейке. Утилизируйте палку или зубочистку или повторно зажгите металлическую петлю, как описано в шаге №4.
- Поверните чашку Петри на 90 °, чтобы нанести штрих во втором квадранте. Поднимите нижнюю половину перевернутой тарелки со скамейки, затем коснитесь петлей, палкой или зубочисткой первого квадранта рядом с концом последней полосы. Используя схему движения вперед и назад, пересеките последнюю половину полос в первом квадранте, а затем переместитесь в пустой второй квадрант. Переверните и установите тарелку обратно в крышку на скамейке, как только будет заполнен второй квадрант.
- Петля, палочка или зубочистка никогда не должны возвращаться в первую половину полос в первом квадранте, где была отложена большая часть исходного посевного материала.
- Для каждого квадранта следует использовать новую пластиковую петлю, деревянную палочку или зубочистку.
- Повторите шаг № 6 дважды для третьего и четвертого квадрантов.
- Не забудьте выбросить палку или зубочистку или повторно зажгите металлическую петлю между каждым квадрантом.
- Избегайте попадания в первый квадрант при нанесении полос в четвертом квадранте.
- Инкубируйте чашку вверх дном, чтобы конденсат, скапливающийся на крышке, не капал на колонии.
3. Процедура заливки планшета: подсчет бактериальных клеток в смешанном образце
Этот метод часто используется для подсчета количества микроорганизмов в смешанном образце, который добавляется в расплавленную агаровую среду до его затвердевания. Процесс приводит к образованию колоний, равномерно распределенных по твердой среде, когда на чашки наносится соответствующее разведение образца. Этот метод используется для подсчета жизнеспособных чашек, в котором подсчитывается общее количество колониеобразующих единиц в агаре и на поверхности агара на одной чашке.Подсчет жизнеспособных пластинок дает ученым стандартизированные средства для построения кривых роста, для расчета концентрации клеток в пробирке, из которой был посажен образец, и для исследования влияния различных сред или условий роста на выживаемость или скорость роста бактериальных клеток.
- Этикетка по краю дна (не крышки) стерильной, но пустой чашки Петри, по крайней мере, со своим именем, датой, типом питательной среды и типом микроорганизмов, добавляемых в расплавленную агаровую среду.
- Включите коэффициент разведения при посеве серийных разведений или серии повторных разведений, что приводит к систематическому снижению концентрации клеток в образце. Подготовка серийных разведений необходима, если количество клеток в образце превышает емкость чашки с агаром, в которой статистически значимый диапазон составляет от 30 до 300 КОЕ. Если на чашке более 300 КОЕ, то колонии будут переполнены и перекрываются.
- Получите пробирку, содержащую 18 мл расплавленной агаровой среды.
- Агаровую среду следует разлить в пробирки и предварительно стерилизовать в автоклаве. В тот же день, когда это необходимо для эксперимента, агар следует растопить в пароварке в течение 30 минут, затем перенести на водяную баню с температурой 55 ° C. Следует растопить ровно столько агара, сколько необходимо для эксперимента, поскольку его нельзя использовать повторно.
- За десять минут до заливки планшетов пробирки с расплавленным агаром следует перенести из водяной бани с температурой 55 ° C в нагревательный блок на лабораторном столе, установленный на 48 ° C.Как только агар достигнет этой температуры, его можно разлить. Если агар слишком горячий, бактерии в образце могут погибнуть. Если агар слишком холодный, среда может стать комковатой после затвердевания.
- Возьмите образец, который должен представлять собой бульонную культуру или суспензию клеток, полученную путем смешивания клеток из колонии с буфером или физиологическим раствором.
- Образцы могут быть получены из серии разведений одного образца.
- Объем пробы для посева должен быть в пределах 0.1 и 1,0 мл.
- Откройте крышку пустой чашки Петри и поместите образец в середину чашки (панель A , рис. 4, ). Закройте крышку.
- Во время этой процедуры используйте асептические методы.
- Используйте серологическую пипетку или микропипетку для переноса образца в планшет. Контролируйте поток пробы, чтобы она не выплескивалась из чашки.
- Снимите крышку с пробирки с расплавленным агаром и пропустите край открытой пробирки через пламя горелки Бунзена.
- Откройте крышку чашки Петри, содержащей образец, и осторожно влейте агар (панель B из , рис. 4 ). Закройте крышку, затем смешайте образец с агаром, осторожно покачивая планшет.
- Дайте агару полностью затвердеть, прежде чем перевернуть планшет для инкубации.
4. Процедура распределения на чашке: образование дискретных бактериальных колоний для подсчета в чашке, обогащения, отбора или скрининга
Этот метод обычно используется для разделения микроорганизмов, содержащихся в небольшом объеме образца, который распределяется по поверхности чашки с агаром, что приводит к образованию дискретных колоний, равномерно распределенных по поверхности агара, при посеве клеток соответствующей концентрации.В дополнение к использованию этого метода для подсчета жизнеспособных чашек, при котором подсчитывается общее количество колониеобразующих единиц на одной чашке и используется для расчета концентрации клеток в пробирке, из которой был посеян образец, обычно используется посев на чашки. в экспериментах по обогащению, отбору и отбору. Желаемый результат для этих трех экспериментов обычно такой же, как и для подсчета на чашках, в котором распределение дискретных колоний формируется по поверхности агара. Однако цель не состоит в том, чтобы гарантировать, что все жизнеспособные клетки образуют колонии.Вместо этого должны расти только те клетки в популяции, которые имеют определенный генотип. Процедура распределения на чашке может использоваться вместо метода заливки чашки для эксперимента по подсчету, если конечной целью является выделение колоний для дальнейшего анализа, поскольку колонии легко растут на поверхности агара, в то время как они внедряются в агар с процедурой заливки чашки.
Здесь описаны две стратегии для процедуры с распределительной пластиной. Первый (метод А) предполагает использование поворотного стола и стеклянного или металлического стержня в форме хоккейной клюшки.Второй (метод B), называемый «методом Копакабаны», включает встряхивание предварительно стерилизованных стеклянных шариков. Оба способствуют равномерному распределению клеток по поверхности агара.
Метод A: Нанесение покрытия с помощью поворотного стола и стеклянного или металлического стержня
- Этикетка по краю дна (не на крышке) чашки с агаром, по крайней мере, со своим именем, датой, типом питательной среды и типом микроорганизмов, которые будут помещены в среду.
- Включите фактор разведения при посеве серийных разведений .
- Тарелки должны быть полностью сухими без конденсации на крышке и предварительно нагреты до комнатной температуры перед нанесением покрытия. Если чашки хранятся при 4 ° C, снимите их за несколько часов или даже накануне. Разложите их небольшими стопками в шахматном порядке не более 2–3 тарелок и дайте им высохнуть.
- Отцентрируйте пластину на поворотном столе ( Рисунок 5 ).
- Возьмите образец, который должен представлять собой бульонную культуру или суспензию клеток, полученную путем смешивания клеток из колонии с буфером или физиологическим раствором.
- Образцы могут быть получены из серии разведений одного образца.
- Объем пробы для посева должен быть от 0,1 до 0,2 мл.
- Откройте крышку чашки Петри и нанесите образец на центр агара. Закройте крышку.
- Во время этой процедуры используйте асептические методы.
- Используйте микропипетку для переноса образца на планшет. Контролируйте поток пробы, чтобы она не выплескивалась из чашки.
- Окуните стеклянный стержень или металлический стержень (также называемый распределителем) в стакан с 70% (об. / Об.) Этанолом.
- ВНИМАНИЕ: Никогда не окунайте разбрасыватель горячей воды в стакан со спиртом.
- Этанол должен касаться только нижней части разбрасывателя и первого дюйма стержня.
- Слить и поджечь избыток этанола, пропустив его через пламя горелки Бунзена.
- Пламя должно пройти по длине распределителя и стержня, которые контактировали с этанолом, а затем быстро погаснуть.
- В случае возгорания стакана с этанолом не паникуйте! Накройте стакан стеклянной крышкой, чтобы быстро погасить огонь.
- Откройте крышку чашки с агаром, удерживая крышку в левой руке большим и указательным пальцами. Охладите разбрасыватель, прикоснувшись им к агару по краю у края.
- Не трогайте агар, куда были добавлены клетки. Горячий разбрасыватель убьет клетки.
- Левой рукой (удерживая крышку чашки с агаром) медленно вращайте вращающийся столик.
- Хотя лучше избегать, если вам необходимо опустить крышку, положите ее лицевой стороной вниз на дезинфицированную поверхность в пределах стерильного поля горелки Бунзена. Если крышка обращена вверх, увеличивается вероятность заражения от движений предметов или рук, создавая воздушные потоки, которые вызывают попадание микроорганизмов и частиц пыли на внутреннюю поверхность крышки.
- Правой рукой осторожно удерживайте разбрасыватель на поверхности агара и постепенно равномерно распределите образец по всей пластине.Перемещайте разбрасыватель вперед и назад по пластине во время вращения поворотного стола.
- Дайте образцу полностью впитаться (не менее 5 минут) перед тем, как перевернуть планшет для инкубации.
Метод B: Нанесение стеклянных шариков: «Метод Копакабаны»
- Этикетка по краю дна (не на крышке) чашки с агаром, по крайней мере, со своим именем, датой, типом питательной среды и типом микроорганизмов, которые будут помещены в среду.
- Включите фактор разведения при посеве серийных разведений .
- Откройте крышку чашки с агаром, удерживая крышку в левой руке большим и указательным пальцами. Затем откройте стеклянную пробирку или бутылку с предварительно стерилизованными стеклянными шариками. Правой рукой обожгите край пробирки или бутылки, затем осторожно нанесите 10-12 стерильных стеклянных шариков на чашку с агаром (, рис. 6, ). Закройте крышку тарелки и еще раз обожгите край тюбика или бутылки, прежде чем закрыть крышку и отложить ее в сторону.
- Осторожно вылейте шарики из пробирки или бутылки на несколько сантиметров выше агара, чтобы шарики не отскакивали от чашки Петри.
- Используйте стеклянные шарики диаметром 4 мм. Стерилизуйте их в стеклянных флаконах или пробирках в автоклаве при 121 ° C в режиме сушки (установка силы тяжести) в течение 30 минут.
- Одним из преимуществ использования шариков вместо разбрасывателя является то, что не требуются открытые емкости с этанолом для многократного обжига.
- Откройте крышку чашки с агаром и нанесите образец в центр агара. Закройте крышку.
- Во время этой процедуры используйте асептические методы.
- Аликвота от 100 до 150 мкл образца на планшет. Такой объем будет способствовать равномерному распределению ячеек. Используйте микропипетку, чтобы перенести образец на планшет. Контролируйте поток пробы, чтобы она не выплескивалась из чашки.
- Распределите образец, осторожно встряхнув шарики по поверхности агара 6-7 раз. Чтобы клетки распространились равномерно, используйте горизонтальные встряхивающие движения.
- Не перекручивайте шарики, иначе все ячейки окажутся на краю пластины.
- ПОДСКАЗКА: Если все сделано правильно, процедура звучит как «тряска маракасов».
- Поверните пластину на 60 °, затем снова встряхните в горизонтальном направлении 6-7 раз.
- Поверните пластину на 60 ° еще раз и снова встряхните в горизонтальном направлении. К настоящему времени вы должны добиться равномерного распределения клеток по поверхности агара.
- По окончании посева образец должен абсорбироваться, а поверхность агара должна быть сухой. Вылейте загрязненные шарики в помеченный стакан для сбора, содержащий 10% хлорный отбеливатель.
- Не выбрасывайте бусинки в мусорное ведро! Использованные шарики будут промыты и автоклавированы, повторно стерилизованы для повторного использования.
- ПРИМЕЧАНИЕ: Если поверхность агара все еще влажная после трехкратного встряхивания, дайте чашке постоять несколько минут, чтобы жидкость впиталась агаром, затем повторяйте шаги 4-6, пока поверхность чашки не станет сухой.
- Переверните планшет для инкубации.
5. Процедура наложения мягкого агара: образование бляшек для выделения и подсчета фагов (анализ бляшек)
Этот метод обычно используется для обнаружения и количественного определения бактериофагов (фагов) или бактериальных вирусов размером от 100 до 200 нм.Электронный микроскоп необходим, чтобы увидеть отдельные частицы фага. Однако присутствие инфекционных фаговых частиц может быть обнаружено как бляшек на чашке с агаром (, фиг. 7A, ). Фаги не могут реплицироваться за пределами своих бактериальных клеток-хозяев, поэтому для размножения и обнаружения требуется смешивание фагов и клеток-хозяев перед посевом. Для процедуры наложения мягкого агара небольшой объем, обычно в диапазоне от 50 мкл до 200 мкл, суспензии фага распределяется в пробирку, содержащую примерно 10 8 бактерий (клеток-хозяев), которые равномерно диспергированы в 2.5–3,0 мл мягкого (0,5–0,7% [мас. / Об.]) Расплавленного питательного агара. Полученную смесь выливают на поверхность твердой (от 1,5 до 1,9% [мас. / Об.]) Чашки с питательным агаром. Планшет достаточно покачивают, чтобы мягкий агар покрыл всю поверхность жесткого агара. Затем планшет помещают на ровную поверхность до тех пор, пока верхний слой агара не успеет застыть, после чего его можно поместить в инкубатор.
Со временем мутная суспензия бактериальных клеток, называемая лужайкой , становится видимой по всей мягкой агаризованной среде ( Рисунок 7B ).Бляшки образуются, если фаг заражает одну из бактериальных клеток, реплицируется внутри клетки, а затем лизирует клетку, высвобождая до 100 фагов-потомков (также известный как размер взрыва ). Новые частицы фага диффундируют в мягкий агар, заражая бактерии в области, окружающей лизированную бактериальную клетку. После нескольких циклов инфицирования и лизиса мутная суспензия бактериальных клеток в мягком агаре исчезает, оставляя зону очищения, называемую бляшкой. Каждая бляшка содержит более 10 9 9 1010 фаговых частиц, генетически идентичных исходной инфекционной частице фага.Поскольку бляшка возникает из одной фаговой частицы, можно подсчитать результирующее количество бляшкообразующих единиц (БОЕ ) и рассчитать исходную концентрацию или титр суспензии фага. Этот тип эксперимента, называемый анализом бляшек, также предоставляет ученым стандартизированные средства для построения одноэтапных кривых роста, исследования специфичности ряда хозяев и трансдукции бактериальных клеток для генетических экспериментов.
- Подготовьте индикаторные бактерии: Для эксперимента с наложением мягкого агара необходимо подготовить экспоненциально растущую культуру бактериального штамма-хозяина.У каждого хоста свои требования к росту. На каждую чашку требуется от 0,3 мл до 0,5 мл суспензии индикаторных бактерий. Если приготовлена колба с индикаторными бактериями (например, 25 мл), культуру следует разделить на более мелкие аликвоты (например, аликвоты по 5 мл, разложенные в стерильные пробирки с завинчивающейся крышкой), чтобы свести к минимуму возможность перекрестного загрязнения. Пробирки можно хранить на льду (при 4 ° C) до использования в эксперименте. Используйте асептическую технику для инокуляции стерильного питательного бульона, а затем инкубируйте в соответствии со спецификациями бактериального штамма.Оставшиеся культуры следует выбросить в конце дня.
- Подготовка адсорбционных пробирок: Поместите две стерильные микроцентрифужные пробирки в штатив. Пометьте крышку первой пробирки «Фаг» и крышку второй пробирки «Контроль».
- Обычно готовят и высевают серийных разведений лизатов фагов, и в этом случае на штатив должны быть добавлены дополнительные микроцентрифужные пробирки и помечены коэффициентом разведения.
- Запасы фагов должны быть свежими из отдельных бляшек и храниться при 4 ° C.Для дезагрегирования фаговых частиц перед проведением эксперимента запасы следует нагреть до температуры окружающей среды.
- С запасами фагов следует обращаться осторожно — не перемешивайте и не пипетируйте их интенсивно.
- Добавьте 50 мкл образца фага в первую пробирку, затем добавьте 50 мкл фагового буфера во вторую пробирку, которая будет служить отрицательным контролем для анализа бляшек.
- Используйте асептические методы при всех манипуляциях с фагами и бактериями.
- Затем добавьте по 500 мкл индикаторных бактерий в каждую адсорбционную трубку.
- Бактериальные клетки оседают на дно пробирки, если они длительное время находятся на льду или скамейке. Если культура не перемешивается перед удалением аликвоты для эксперимента, недостаточное количество бактериальных клеток будет перенесено в адсорбционную трубку. В мягком агаре (например, на лужайке) должно быть достаточное количество бактериальных колоний для обнаружения бляшек. Используйте вихревой миксер, чтобы осторожно повторно суспендировать индикаторные бактерии в гомогенную суспензию перед переносом аликвот в адсорбционные пробирки.
- Смешайте бактериальные клетки и фаг, осторожно взмахнув пробирками.
- Инкубируйте смесь фагов и бактерий в течение 15-20 минут (не более 30 минут) при температуре, соответствующей индикаторному штамму.
- Приготовьте чашки с мягким агаром и твердым агаром с питательными веществами: Пока происходит адсорбция, поместите две пробирки с мягким агаром (предварительно расплавленные и хранящиеся при 55 ° C) в нагревательный блок на лабораторном столе, установленном на 46–48 ° C.
- Расплавленный мягкий агар необходимо уравновесить до температуры нагревательного блока в течение 10-15 минут.Если растопленный мягкий агар находится более 15 минут, он начнет затвердевать и при выливании на жесткий агар сформирует комки. Если расплавленный мягкий агар остается менее 10 минут, он будет слишком горячим при добавлении к смеси фаг / бактерии, убивая клетки-хозяева перед посевом. Следовательно, лужайка может не образовываться, и бляшки могут быть обнаружены лишь в небольшом количестве или совсем не обнаружены.
- Подготовьте дополнительные пробирки с мягким агаром, если вы высеваете серийные разведения фагового лизата.
- Этикетка по краю дна (не крышки) двух чашек с питательным твердым агаром должна содержать как минимум свое имя, дату, тип питательной среды и «Фаг» или «Контроль», соответствующие адсорбционным пробиркам.
- Включите дополнительные планшеты с указанием фактора разведения при посеве серийных разведений.
- Чашки с твердым агаром должны быть полностью сухими без конденсации на крышке и предварительно нагретыми до комнатной температуры перед добавлением мягкого агара. Если чашки хранятся при 4 ° C, снимите их за несколько часов или даже накануне. Разложите их небольшими стопками в шахматном порядке не более 2–3 тарелок и дайте им высохнуть. Избыточная влажность в слое жесткого агара вызовет разбавление мягкого агара, позволяя фагу легче диффундировать через мягкий агар во время образования налета.Следовательно, размер налета увеличится.
- Планшетные адсорбционные пробирки по одной, как показано ниже: Используйте микропипетку P1000 для асептического переноса смеси фагов / бактерий (должно быть примерно 550 мкл) в пробирку с мягким агаром, затем быстро вращайте ее между ладонями, чтобы перемешать содержание. ЗАПРЕЩАЕТСЯ встряхивать трубку, чтобы в нее не попали пузырьки воздуха. Удерживая пробирку в левой руке, откройте крышку чашки с твердым агаром правой рукой и немедленно вылейте все содержимое пробирки на поверхность чашки с твердым агаром.Перед тем как закрыть крышку, осторожно, но быстро встряхните планшет, чтобы распределить расплавленный мягкий агар по всей поверхности планшета, прежде чем он успеет затвердеть. Избегайте попадания расплавленного мягкого агара на стенки чашки Петри. Закройте крышку.
- Повторите шаг № 9 для всех адсорбционных трубок, по одной трубке за раз.
- Поместите чашки на ровную поверхность и дайте им постоять, пока мягкий агар не затвердеет.
- Обычно достаточно 30 минут.
- Переверните чашки для инкубации.
- Несколько планшетов можно сложить стопкой и скрепить вместе, а затем перевернуть для инкубации.
После инкубации чашки можно проверить на наличие бляшек. Отрицательный контроль должен содержать только лужайку бактерий (без отверстий, указывающих на бляшки). Бляшки различаются по размеру, форме и общему виду. Данный тип фага можно выделить из гетерогенной смеси бляшек, осторожно пробив центр одной бляшки стерильной зубочисткой и перенеся инокулят в стерильную микроцентрифужную пробирку, содержащую от 100 до 1000 мкл бульона или фагового буфера.Этот лизат можно высеять, используя ту же процедуру, которая описана выше. По крайней мере, от 3 до 6 последовательных выделений отдельных бляшек необходимы, чтобы гарантировать получение чистого фага. Часто лизат необходимо разводить в большом диапазоне (от 10 -1 9 10 10 до 10 9 100 9 -10 9 10 10), чтобы найти титр, при котором образуются неперекрывающиеся бляшки на планшете. Количество варьируется в зависимости от размера бляшки.
6. Процедура на планшете с репликой: перенос клеток для скрининга мутантов и ауксотрофов
Этот метод позволяет сравнивать рост клеток на первичном планшете с вторичным планшетом, создавая средства для скрининга клеток на выбор фенотипа.Сначала первичный или эталонный планшет инокулируют клетками либо путем распределения раствора, в котором образуются отдельные колонии, либо путем переноса их на планшет в пространственном порядке, определяемом разметкой сетки. Вторичные чашки, содержащие среды с ингибиторами роста или среды, в которых отсутствует конкретное питательное вещество, инокулируют клетками из колоний на первичной чашке. Сначала воспроизводят пространственный узор колоний, прижимая кусок бархата к первичной пластине. Бактериальные клетки прилипают к бархату, потому что они имеют большее сродство к бархату, чем к агару.Отпечаток клеток на бархате затем переносится на несколько вторичных пластин, при этом рост клеток отражает тот же образец колоний, что и на первичной пластине. Другими словами, это как резиновый штамп, копирующий образец роста с одной пластины на другую. Этот метод выгоден, поскольку он позволяет одновременно проверять относительно большое количество колоний на множество фенотипов в одном эксперименте.
- Подготовьте первичный планшет: Наклейте этикетку по краю дна (не крышки) чашки с агаром, по крайней мере, своим именем, датой и типом питательной среды.
- Разметьте сетку на нижней части таблички, используя по крайней мере две равноудаленные вертикальные линии и по крайней мере две равноотстоящие горизонтальные линии. Пронумеруйте получившиеся квадраты.
- Используйте предварительно стерилизованную зубочистку, чтобы засеять каждый квадрат образцом клеток. Для каждого образца прикоснитесь к центру квадрата. Не покрывайте клетками весь квадрат (, рис. 8, ), иначе образец при инкубации разрастется и заразит окружающие квадраты.
- Каждый квадрат будет засеян другим образцом, полученным либо из бульонных культур, либо из колоний на другой чашке.
- Переверните и инкубируйте первичный планшет, который будет использоваться для инокуляции различных вторичных сред.
- Засейте вторичные чашки: Сложите первичную тарелку и все вторичные чашки. С помощью маркера сделайте отметку ориентации на боковой стороне пластин. Убедитесь, что метка находится на нижней стороне каждой пластины, а не на крышке.
- Возьмите стерильную вельветовую ткань и поместите ее на цилиндрический блок ( Рисунок 9 ). Зафиксируйте вельветовую ткань держателем.Обратите внимание на отметку ориентации на блоке.
- Блок должен быть такого же размера, как дно чашки Петри (диаметр 10,2 см). Он должен иметь стопорное кольцо, которое прижимает вельветовую ткань к блоку во время покрытия копии.
- Вельветовая ткань (квадрат 15,2 x 15,2 см) должна быть предварительно стерилизована. Сложите стопкой 10 или 12 чистых квадратов, затем оберните их алюминиевой фольгой и поместите в автоклав при 121 ° C в режиме сушки (установка силы тяжести) на 30 минут. Прежде чем использовать их в повторном эксперименте по нанесению покрытия, убедитесь, что они полностью высохли, поместив их в теплую духовку на несколько часов.Обратите внимание, что перед стерилизацией вельветовые квадраты, возможно, придется удалить липкой лентой.
- Вельветовые квадраты можно использовать повторно. После того, как использованные вельветовые квадраты были обеззаражены в автоклаве, их следует промыть простой водой и повторно стерилизовать, как описано выше.
- Цилиндрический блок и зажим следует дезинфицировать между использованиями, кратковременно промывая их 70% (об. / Об.) Этанолом или 10% хлорным отбеливателем.
- Снимите крышку и переверните основную пластину.Совместите отметку ориентации на пластине с отметкой на блоке. Опустите чашку так, чтобы поверхность агара соприкасалась с вельветовой тканью на цилиндрическом блоке. Слегка, но равномерно надавите кончиками пальцев на заднюю часть основной пластины, а затем осторожно снимите основную пластину с блока. Установите крышку на тарелку.
- Бархатный слепок клеток с первичного планшета можно использовать для инокуляции примерно 7-8 вторичных планшетов перед тем, как будет сделан слепок с новым бархатом.
- Повторите шаг № 7 с каждой вторичной пластиной.
- В качестве положительного контроля последняя чашка в серии должна быть агаровой средой, в которой должны расти все тестируемые штаммы. Таким образом вы можете подтвердить, что клетки были перенесены во все вторичные планшеты в серии. В противном случае отсутствие роста на конкретной тестовой среде может быть приписано недостаточному переносу клеток, а не фенотипу штамма.
- Во избежание ложных срабатываний вторичные планшеты следует заказывать от наименее к наиболее подходящему субстрату.В противном случае питательные вещества могут переноситься между чашками, позволяя клеткам расти в неблагоприятной среде.
- Переверните чашки и инкубируйте.
- Примечание. При осмотре вторичных пластин на предмет роста обязательно различать рост и отпечаток. Последнее — отрицательный результат.
7. Уборка рабочего места
- Выключите горелку Бунзена, затем уберите все расходные материалы, включая культуры, на чашки или в пробирки, дополнительные среды и другие реагенты.
- Не позволяйте старым культурам на чашках или в пробирках накапливаться на лабораторном столе или в местах хранения. Эти образцы, которые являются печально известными источниками загрязнения, такими как плесень и нежелательные виды бактерий, должны быть утилизированы, как только они больше не нужны.
- Поместите зараженную лабораторную посуду (перчатки, наконечники для пипеток, ким-салфетки), стеклянную посуду (пробирки, колбы, флаконы) и опасные отходы (бактериальные культуры или растворы фагов, использованные чашки) в соответствующую емкость для утилизации.При работе с непатогенным штаммом E. coli (BSL-1) образуются только неинфекционные опасные отходы. При выполнении тех же процедур с патогенными организмами (BSL-2 или выше) образуются опасные инфекционные отходы. Независимо от классификации биологической опасности опасные отходы перед их утилизацией необходимо автоклавировать или продезинфицировать. Следуйте инструкциям, описанным в BMBL (5 th Ed.), А также рекомендациям, предоставленным вашим институциональным отделом по охране окружающей среды, здоровья и безопасности для немедленного и надлежащего удаления биологических опасностей, образующихся во время эксперимента.
- Очистите рабочую зону дезинфицирующим средством.
- Перед тем, как покинуть лабораторию, тщательно вымойте руки антисептическим мылом и теплой водой.
8. Представитель Результаты
Метод полосовой пластины. Пример применения для нанесения гальванических покрытий показан на рис. 1 . Эта процедура используется для выделения бактериальных колоний из смешанных культур клеток и на сегодняшний день является одним из наиболее важных методов, которым необходимо овладеть в микробиологии и молекулярной генетике.Каждая колония представляет собой популяцию генетически идентичных клеток. Для многих последующих применений необходимо начинать либо с одной колонии, либо с чистой бактериальной культуры, полученной путем инокуляции среды клетками из одной колонии. Например, морфологию отдельных клеток в колонии можно исследовать с помощью светового микроскопа. Генетическая идентичность может быть определена путем секвенирования гена малой субъединицы рибосомной РНК из геномной ДНК, выделенной из культуры клеток, начатой с одной колонии.А метаболические характеристики можно описать, подвергая клетки различным биохимическим и физиологическим исследованиям. Только проводя такие эксперименты с чистыми культурами, можно быть уверенным в свойствах, приписываемых конкретному микроорганизму. Результаты не омрачены возможностью заражения культуры. Технические ошибки могут возникнуть, если стерильность инструмента, используемого для штриховки клеток по пластине, не сохраняется на протяжении всей процедуры. Если вы забудете зажечь петлю или достать свежую зубочистку между квадрантами, получение одиночных колоний затруднено.Некоторые виды бактерий не могут быть изолированы в чистой культуре, поскольку они зависят от совместной ассоциации с другими видами бактерий для определенных потребностей роста. Эти организмы, называемые синтрофами, можно выращивать только в условиях совместного культивирования, поэтому колонии (если они образованы) всегда будут состоять из двух или более видов. Еще одна проблема, с которой сталкиваются в лаборатории при выполнении процедуры штрих-планшета с бактериями, полученными из образцов окружающей среды, заключается в том, что клетки демонстрируют характеристики роста, которые отличаются от традиционных лабораторных штаммов, таких как E.coli . Такие бактериальные штаммы могут образовывать нитчатые колонии (в отличие от плотных скоплений клеток) с ветвями, которые распространяются по большой части чашки с агаром, кальцинированы и, таким образом, устойчивы к проникновению с помощью прибора для полосовой пластинки или окружены липкой капсулой. так что отдельные колонии невозможно различить. Эти характеристики затрудняют очистку отдельных колоний методом штрих-пластин.
Техника разливки. При использовании метода выливания на чашку колонии образуются как внутри агара, так и на поверхности агаризованной среды, что обеспечивает удобный способ подсчета количества жизнеспособных клеток в образце.Эта процедура используется в различных промышленных приложениях. Например, для станции очистки сточных вод, которая отвечает за очистку жидких отходов (например, сточных вод, сточных вод из ливневых стоков), образующихся в бытовых, коммерческих и промышленных объектах, а также в сельском хозяйстве, это важно для анализа воды. образцы после обширного процесса очистки. Очищенные сточные воды (непитьевая вода) повторно используются различными способами — для орошения непищевых культур в сельском хозяйстве, для санитарной промывки жилых домов и в промышленных градирнях — поэтому они не должны иметь химического и микробного загрязнения.Питьевая вода (питьевая вода) должна быть очищена в соответствии со стандартами EPA и проверена с использованием методов микробиологического посева, которые позволяют подсчитывать конкретные патогены человека. Показано на рис. 10 . — это бактериальные колонии, образовавшиеся из бактериальных клеток, присутствующих в пробе воды, взятой из общественного питьевого фонтанчика. Маловероятно, что бактериальные патогены продуцировали эти колонии, учитывая меры по очистке питьевой воды; однако микробы есть повсюду, и заражение даже непатогенными штаммами можно только минимизировать, а не полностью устранить.В качестве другого примера фармацевтической компании необходимо оценить степень микробного загрязнения или бионагрузку нового лекарства во время производства, хранения и транспортировки. Путем отбора проб лекарственного средства на различных этапах процесса и посева образцов с использованием процедуры заливки на тарелку можно легко определить микробную нагрузку или количество контаминирующих бактерий. Затем можно разработать меры предосторожности для сведения к минимуму или устранения микробного загрязнения. Одной из наиболее распространенных технических ошибок, возникающих при выполнении метода разливки на чашке, является недостаточное перемешивание образца с расплавленным агаром, что приводит к слипанию колоний, что приводит к неточному подсчету на чашках.Другой частой ошибкой является заливка расплавленного агара, когда он слишком горячий, что приводит к гибели многих бактериальных клеток в образце. Эта ошибка также повлияет на точность подсчета на чашках, давая числа, которые занижают общее количество колониеобразующих единиц в образце.
Техника раскладывания тарелок. Техника распределения на чашках аналогична процедуре разливки на чашках по своей полезности в качестве средства для подсчета жизнеспособных чашек. Однако, поскольку колонии, которые образуются с использованием метода распределения на чашках, равномерно распределяются по поверхности агаризованной среды, клетки из отдельных колоний могут быть выделены и использованы в последующих экспериментальных манипуляциях (например.g., как посевной материал для посевов на планшетах или бульонных культур). Три распространенных применения, в которых важным компонентом является метод распределения пластин, — это эксперименты по обогащению, отбору и скринингу. Во всех трех случаях требуемый тип клеток может быть отделен от смеси, а затем подвергнут любому количеству биохимических, физиологических или генетических тестов.
Эксперимент по обогащению включает посев смешанной культуры на среду или инкубационные чашки в условиях окружающей среды, которые способствуют росту тех микроорганизмов в образце, которые демонстрируют желаемые метаболические свойства, характеристики роста или поведение.Эта стратегия не подавляет рост других организмов, но приводит к увеличению количества желаемых микроорганизмов по сравнению с другими в культуре. Таким образом, колонии, которые образуются на чашке для обогащения, вероятно, проявляют фенотипические свойства, которые отражают желаемый генотип. Например, если вашей целью является культивирование азотфиксирующих бактерий из образца окружающей среды, содержащего смесь более 1000 различных видов бактерий, то нанесение образца на среду с дефицитом азота обогатит те бактерии, которые могут продуцировать это соединение из атмосфера, используя метаболические возможности, обеспечиваемые набором генов, необходимых для фиксации азота.
Селекционный эксперимент включает высев смешанной культуры на среду, которая позволяет расти только тем клеткам, которые содержат определенный ген или набор генов. Этот тип экспериментов распространен в лабораториях молекулярной биологии при трансформации штаммов бактерий плазмидами, содержащими гены устойчивости к антибиотикам. Если ваша цель — культивировать только рекомбинантные клетки или те, которые успешно захватили плазмиду, то при посеве образца на среду с соответствующей концентрацией антибиотика будут отбираться те клетки, которые проявляют устойчивость к этому конкретному лекарству.
Скрининговый эксперимент включает высев смешанной культуры на среду, которая позволяет всем жизнеспособным клеткам расти; однако клетки с желаемым генотипом можно отличить от других клеток на основе их фенотипа. Опять же, этот тип экспериментов распространен в лабораториях молекулярной биологии при проведении анализов мутагенеза или клонировании генов в плазмиды. Классический пример, показанный на рис. 11 , использует ген lacZ , кодирующий β-галактозидазу; этот фермент позволяет клеткам метаболизировать X-Gal (5-бром-4-хлор-3-индолил-β-D-галактопиранозид), субстратный аналог его естественного субстрата, лактозы.Расщепление X-Gal β-галактозидазой приводит к нерастворимому синему продукту. Таким образом, если среда содержит X-gal, и образец, содержащий клетки либо с диким типом (функциональным), либо с мутантным (нефункциональным) геном lacZ , высевают на эту среду, то после инкубации клетки дикого типа, несущие функциональный ген lacZ появится в виде колоний с синим пигментом, в то время как мутантные клетки с нефункциональным геном lacZ появятся в виде непигментированных («белых») колоний.
Техническая проблема, с которой чаще всего сталкиваются при первом обучении методике распределения на чашках, — это неравномерное распределение клеток по поверхности агара.При использовании вращающегося подноса и стеклянного стержня образец может абсорбироваться слишком быстро, так что колонии образуются только около центра чашки. При выполнении «метода Копакабаны» стеклянные шарики вращаются, а не встряхиваются по поверхности агара. Следовательно, вдоль внешнего края чашки растет множество колоний. В любом случае результирующее распределение колоний не использует преимущества всей доступной площади поверхности, поэтому клетки могут слипаться и расти в перекрывающиеся колонии, что делает подсчет на чашках неточным или различение типов клеток невозможным.
Метод наложения мягкого агара . Для подсчета количества фагов можно использовать процедуру, аналогичную методике распределения на чашках, используемой для подсчета бактериальных колоний. В то время как от 30 до 300 бактериальных клеток распределяются по поверхности агара для подсчета на чашках (КОЕ / мл), от 100 до 400 инфекционных фаговых частиц смешивают с 10 8 –10 9 клеток-хозяев для подсчета бляшек (БОЕ / мл). ) в слое мягкого агара, распределенного по поверхности твердого питательного агара.Если не продемонстрировано иное, обычно предполагается, что одна бактериальная клетка делится и накапливает большое количество генетически идентичных клеток в едином кластере, называемом колонией. Как обсуждалось ранее, это предположение неверно, когда клетки растут группами (то есть парами, тетрадами, цепочками или кластерами) или демонстрируют характеристики роста, такие как капсулы, которые препятствуют образованию одиночных колоний. Аналогичное предположение сделано для образования бляшек в том смысле, что каждая бляшка представляет активность отдельного фага.Это утверждение верно только в том случае, если один фаг заражает одну бактерию. Что произойдет, если несколько фаговых частиц заразят одну бактерию? Эта проблема относится к важному статистическому параметру, который необходимо учитывать при проведении экспериментов с фагом, — множественности инфекции (MOI), описывающей отношение инфекционных фаговых частиц к количеству клеток-хозяев в образце. Поскольку некоторые клетки адсорбируют более одного фага, в то время как другие клетки адсорбируют только один фаг или ни одного фага, популяция клеток-хозяев должна быть инфицирована с низким MOI (≤1), чтобы свести к минимуму вероятность того, что клетка будет инфицирована более чем одной фаговой частицей. .Использование единицы образования бляшек (БОЕ) в качестве функционального определения позволяет избежать этих осложнений при выполнении подсчета бляшек для расчета титра запаса фага.
Как показано на Рис. 12 , морфология бляшек варьируется для разных фагов. Некоторые фаги образуют небольшие бляшки (панель A), тогда как другие образуют большие бляшки (панель B). На размер налета влияет ряд переменных. Есть технические причины, которые способствуют этой изменчивости. Например, полная среда и толстый жесткий агар поддерживают развитие более крупных бляшек, поскольку клетки-хозяева могут поддерживать рост фага в течение более длительного периода времени.Высокая плотность посева клеток-хозяев (> 10 9 КОЕ на чашку) вызовет уменьшение размера бляшек. Использование более низких концентраций мягкого агара увеличит скорость диффузии фаговых частиц в мягком агаре и тем самым увеличит размер бляшек. Напомним, что эта повышенная скорость диффузии может произойти непреднамеренно, если чашки с твердым агаром не полностью высохли, так что конденсация или избыток влаги в чашке разбавляют мягкий агар в верхнем слое. Такой технический надзор приведет к противоречивым результатам в отношении размера бляшек для конкретного фага.
Размер бляшек также связан с рядом событий клетки-хозяина, включая эффективность адсорбции, продолжительность латентного периода (промежуток времени от адсорбции фага до лизиса клетки-хозяина) и размер вспышки (количество высвобожденных потомков). от однократного заражения). Гетерогенная смесь размеров бляшек может наблюдаться, если частицы фага инфицируют клетки-хозяева на разных фазах роста бактерий. Например, те, которые адсорбируются во время ранней экспоненциальной фазы, образуют более крупные бляшки с большим количеством фагов-потомков, чем те, которые адсорбируются в поздней экспоненциальной фазе.Как правило, литический фаг образует прозрачные бляшки, в то время как лизогенный фаг образует мутные бляшки. Однако некоторые литические фаги производят интересные образцы, такие как бляшка «бычий глаз», показанная на , фиг. 12В, . Эти прозрачные бляшки окружены мутным ореолом, потому что эти клетки на краю бляшки не полностью лизированы или могут быть устойчивыми к фаговой инфекции. Образец «бычьего глаза», наблюдаемый для умеренного фага, представляет собой бляшку с мутным центром, окруженную прозрачным кольцом. Эта морфология отражает MOI и физиологию клетки-хозяина в отношении решения о лизисе-лизогении.Когда клетки впервые заражаются фагом, MOI низкий, и клетки быстро растут из-за обилия питательных веществ; вместе это способствует литическому росту. По мере того, как лизируется все больше и больше клеток, MOI увеличивается и образуется прозрачная бляшка. Однако лизогены в центре бляшки продолжают расти, потому что они невосприимчивы к лизису, что приводит к образованию прозрачного бляшки с мутным центром.
Метод наложения может быть изменен для анализа бляшек с эукариотическими вирусами. Точно так же бактериофаги образуют бляшки на лужайке бактериальных клеток в мягком агаре, эукариотические вирусы образуют бляшки на монослое клеток, покрытых гелем.Монослой — это сливающийся лист клеток, растущих бок о бок на поверхности чашки для культивирования, соприкасающихся друг с другом, но не растущих друг над другом. Для проведения этого типа анализа бляшек аликвоты вируса добавляют к чувствительным монослоям эукариотических клеток. Затем монослой покрывают питательной средой на основе агарозы — этот гель ограничивает распространение потомства вирусов, высвобождаемых из инфицированных клеток, в соседние клетки в монослое. Соответственно, образуется сферическая область или бляшка, содержащая клетки, поврежденные высвобождением вирионов.Чтобы облегчить визуализацию бляшек, на культуру клеток можно наносить красители, окрашивающие живые клетки, обеспечивая контраст между инфицированными и неинфицированными клетками.
Техника наложения мягкого агара используется для экспериментов, отличных от анализа бляшек. Во-первых, важно помнить, что агар с твердыми питательными веществами представляет собой поддерживающую матрицу, которая способствует росту бактерий. Во-вторых, мягкий агар, используемый для наложения, может иметь другой питательный состав, чем жесткий агар. Таким образом, мягкий агар может служить средством анализа бактериальных штаммов на предмет различных характеристик роста или метаболических свойств.Например, метод наложения используется для скрининга бактерий на способность разлагать целлюлозу (Тизер и Вуд, 1982). Отдельные колонии выращивают на неселективной жесткой агаровой среде, затем мягкий агар, содержащий 0,1% (мас. / Об.) Карбоксиметилцеллюлозы (КМЦ), распределяют по поверхности жесткого агара. После инкубации чашки залиты красителем, который позволяет визуализировать зоны просветления вокруг колоний в мягком агаре. Очистка вызывается гидролитическими ферментами, выделяемыми бактериями, разрушающими целлюлозу в среде.Совсем недавно метод наложения был использован для обнаружения бактерий, которые подавляют рост метаногенных архей, обнаруженных в рубце домашнего скота (Gilbert et al .2010). Бактериальные изоляты из образцов окружающей среды выращивают на питательной среде с твердым агаром, затем колонии покрывают мягким агаром, содержащим культуру метаногенов. После инкубации чашки проверяют на наличие зон задержки роста вокруг колоний. Этот метод определяет штаммы бактерий, которые продуцируют ингибиторы метаногенов в мягком агаре.
Наиболее частые технические ошибки, возникающие при использовании метода наложения мягкого агара, — это заливка расплавленного мягкого агара, когда он слишком горячий или слишком холодный. Если она слишком горячая, смешанные со средой бактериальные клетки погибнут перед посевом. Если он будет слишком холодным, мягкий агар сформирует комки при выливании на жесткий агар. В любом случае результаты будут в лучшем случае неоднозначными или нечитаемыми.
Реплика-пластина Процедура . Перенос культур из одного типа питательной среды в другой для проверки требований к росту становится довольно трудоемким, если штаммов больше, чем несколько.Посев на реплики — это метод, позволяющий одновременно проводить скрининг большого количества микроорганизмов. Например, после мутагенизации культуры клеток дикого типа можно развести разведенную культуру на чашках, чтобы получить чашки с отдельными колониями. Первичные чашки содержат среду, которая поддерживает рост всех клеток, включая прототрофов дикого типа, которые синтезируют все соединения, необходимые для роста, и мутантных ауксотрофов, которые несут генетическую мутацию в пути биосинтеза, что делает их неспособными синтезировать определенные соединения, необходимые для роста.Посев смеси клеток на полную среду, недостающие питательные вещества могут быть извлечены из окружающей среды. Чтобы различать прототрофы и ауксотрофы, колонии можно реплицировать на минимальную среду. Только прототрофы смогут расти. Поскольку пространственный рисунок первичной чашки сохраняется, сравнение вторичной чашки с первичной чашкой позволяет идентифицировать мутантные колонии. Чтобы определить, какое соединение мутанты больше не способны синтезировать, колонии можно реплицировать на минимальную среду с добавлением определенных соединений (например,г., аминокислоты, источники углерода, витамины и т. д.). Таким образом, сотни колоний могут быть подвергнуты скринингу одновременно с использованием процедуры реплик-планшета. Одна техническая ошибка, которая может произойти, заключается в использовании слишком влажных чашек с агаром, в результате чего колонии сливаются вместе, загрязняя все культуры на чашке. Это дает совершенно ненадежные результаты. Другая техническая ошибка — слишком большое давление при переносе ячеек с вельвета на вторичные пластины. Опять же, после инкубации вторичных чашек образовавшиеся колонии могут перекрываться, давая фенотипы роста, связанные с контаминацией, а не ауксотрофией.
Не все виды микробов дикого типа являются прототрофами, поэтому процедуру реплик-планшета можно использовать для одновременного скрининга различных штаммов дикого типа на предмет характерных потребностей роста. Как показано на фигуре , фиг. 13 , «мазки» клеток из четырех различных бактериальных штаммов Pseudomonas помещали в двух экземплярах на помеченный сеткой планшет, содержащий полную среду, называемую YTA (панель A). Затем штаммы реплицировали на трех вторичных планшетах (панели B, C и D), состоящих из минимальной среды (MSA), дополненной другим источником углерода (ацетамидом, лактозой и глицином, соответственно).Результаты показывают, что два из четырех штаммов Pseudomonas ( P. aeruginosa и P. stutzeri ) неспособны расти на этих трех источниках углерода. В качестве контроля штаммы реплицировали на четвертый планшет со средой YTA для подтверждения переноса клеток на протяжении всей процедуры. Поскольку все четыре штамма растут на контрольном планшете YTA, дефицит роста, проявленный на предыдущих трех планшетах в серии, является надежным. Результаты посева реплик приведены в таблице Table 1 .Одна из распространенных ошибок — это интерпретация отпечатка роста на вторичной пластине как положительный результат. Например, сравните фенотип P. aeruginosa с фенотипом P. stutzeri на MSA + ацетамид (панель B). Последний показывает отпечаток роста, что является отрицательным результатом и может возникнуть, если питательные вещества из предыдущей чашки переносятся с родительскими клетками. Рост новых клеток не происходит, потому что недостающие питательные вещества недоступны для дочерних клеток. Отпечаток легко спутать с реальным ростом.Если есть сомнения, эксперимент следует повторить, используя альтернативный метод, такой как нанесение штрихов клеток с первичного планшета на вторичную среду.
Рис. 1. Пример одиночных колоний на чашке. Розовые сферы около центра чашки — это колонии Serratia marcescens , грамотрицательной палочковидной Proteobacterium из семейства Enterobacteriaceae. Из-за того, что он предпочитает влажную среду, этот микроорганизм обычно растет в углах ванн, в раковинах, в затирке для плитки и на занавесках для душа. S. marcescens легко распознать, поскольку он производит красноватый пигмент, называемый продигиозин. Колонии на этом планшете были получены с использованием метода штрих-планшетов, при этом отдельные колонии появлялись в четвертом квадранте после инкубации при 30 ° C в течение 24 часов. В трех других квадрантах наблюдается сплошной рост, при котором клетки, отложившиеся на поверхности агара, превратились в перекрывающиеся колонии.
Рис. 2. Инструменты, используемые для метода штрих-пластин. Сверху вниз показаны зубочистки (плоские, а не круглые), проволочная петля, одноразовая пластиковая петля и деревянные палочки.Зубочистки обычно переносятся в небольшой стеклянный стакан широким концом вниз, а затем накрываются фольгой при автоклаве для стерилизации перед использованием. Деревянные палочки переносят в 18-миллиметровые пробирки, затем автоклавируют для стерилизации перед использованием.
Рис. 3. (A) Метод полосатых пластин с использованием квадрантного метода. Предварительно стерилизованная петля, палочка или зубочистка используется для распределения образца по четверти поверхности агара быстрым, плавным обратным и четвертым движением от края к центру чашки.Это действие повторяется для каждого из четырех квадрантов пластины. После инкубации рост клеток появляется вдоль пути инструмента, используемого для внесения клеток на планшет. Механическое разделение клеток в смешанном образце с использованием этого метода должно привести к образованию отдельных колоний в четвертом квадранте (см. Пример , рис. 1, ). Одиночные колонии называются колониеобразующими единицами (КОЕ). (B) Когда металлическая петля используется для посева полос, она должна быть стерилизована пламенем горелки Бунзена до контакта с посевным материалом или агаровой средой.Напомним, что самая горячая часть пламени — это кончик синего конуса. Удерживая ручку инструмента, поместите проволоку в огонь примерно на расстоянии 3-4 дюймов от петли. Подождите, пока проволока не станет докрасна. Переместите проволоку так, чтобы пламя приблизилось к петле. Прежде чем прикасаться к посевному материалу, убедитесь, что металлическая петля остыла.
Рис. 4. Техника разливки. (A) Небольшой объем образца (от 0,1 до 1,0 мл) в асептических условиях распределяется в пустую, но стерильную чашку Петри с использованием 5.Серологическая пипетка 0 мл. (B) Расплавленный агар, уравновешенный до температуры приблизительно 48 ° C, затем выливают в чашку Петри с образцом. После закрытия крышки планшет осторожно покачивают, чтобы перемешать образец и расплавленный агар. Агару дают затвердеть в течение примерно 30 минут, затем планшеты переворачивают для инкубации.
Рис. 5. Техника раскладывания тарелок с поворотным столом и разбрасывателем стекла. После того, как чашку с агаром помещают на вращающийся столик, небольшой объем образца (0.От 1 до 0,2 мл) асептически распределяют по центру планшета с помощью микропипеточного дозатора. Разбрасыватель стерилизуют, погружая его в стакан с этанолом, а затем пропуская через пламя горелки Бунзена, чтобы зажечь избыток этанола. Перед контактом с образцом разбрасыватель следует охладить, прикоснувшись им к агару у края чашки. Распределитель осторожно перемещается вперед и назад через образец по пластине, в то время как поворотный стол медленно вращается. Это действие позволяет постепенно, но равномерно распределить образец по поверхности агара.После закрытия крышки планшет следует установить на столе в неподвижном состоянии не менее чем на 5 минут, чтобы образец полностью впитался в агар, прежде чем перевернуть планшет для инкубации.
Рис. 6. Техника намазывания стеклянными шариками (метод Копакабаны). Стеклянные шарики, которые были предварительно стерилизованы в автоклаве, выливают на поверхность чашки с агаром, стоящей на столе. Небольшой объем образца (от 100 до 150 мкл) в асептических условиях распределяется по центру агара с помощью микропипетки.При закрытой крышке планшета горизонтальное встряхивающее движение используется для осторожного перемещения шариков назад и вперед по пластине от 6 до 7 раз, распределяя образец. Это действие повторяется после поворота пластины на 60 °. Встряхивающее движение повторяется в третий раз после следующего поворота на 60 °. Как только образец полностью впитается в агаровую среду, шарики сливают в стакан, содержащий 10% отбеливателя. Затем чашки переворачивают для инкубации.
Рис. 7. Метод наложения мягкого агара, используемый для выделения и подсчета фагов на основе образования бляшек (также называемый анализом бляшек).(A) Присутствие фага может быть обнаружено в виде зон просветления или бляшек на сливающейся суспензии бактериальных колоний, растущих в мягком агаре. Фаг T4 представляет собой вирулентный фаг с двухцепочечной ДНК, который инфицирует своего хозяина, Escherichia coli , заставляя клетки-хозяева лизировать и высвобождать фаг-потомок. После нескольких раундов инфицирования и лизиса соседние клетки E. coli в непосредственной близости от исходной инфицированной клетки-хозяина исчезают, оставляя бляшку, содержащую миллиарды частиц фага Т4.Фаг Т4 производит бляшки диаметром около 1 мм. В этом эксперименте 200 мкл разведения 10 -5 из 2 x 10 8 БОЕ / мл исходного раствора фага Т4 смешивали с примерно 300 мкл индикаторных клеток E. coli , приготовленных в виде экспоненциально растущих, аэрированных культура при 37 ° С. И фаг, и бактерии добавляли в пробирку с мягким агаром EHA, перемешивали, затем выливали на поверхность чашки с твердым агаром EHA. Обратите внимание, что в этом случае не было необходимости позволять фагам и бактериям адсорбироваться перед посевом.После того как мягкому агару давали возможность застыть в спокойном состоянии в течение 20 минут, планшеты переворачивали и инкубировали при 37 ° C в течение 24 часов. (B) В отсутствие инфицирующих фаговых частиц рост бактерий приводит к образованию мутной суспензии клеток в мягком агаре, в которой отдельные колонии не видны. Вместо этого равномерная лужайка бактериальных клеток, в данном случае E. coli , образуется по всему мягкому слою агара.
Рис. 8. Подготовка первичного планшета (мастер) с бактериальными образцами.Чтобы образцы были организованы, нижняя часть пластины может быть помечена сеткой, а полученные квадраты пронумерованы. Каждому образцу можно назначить квадрат на сетке. Показаны примеры правильной и неправильной схемы посева. В идеале небольшое количество клеток переносят в центр квадрата с помощью стерильного инструмента для посева, такого как зубочистка, чтобы «промокнуть» образец (ячейка № 4). Распространенные ошибки при посеве, такие как те, что изображены в ячейке № 5 («участок») и ячейке № 6 («заполнение»), приводят к чрезмерному росту бактериальных образцов после инкубации, что приводит к загрязнению соседних квадратов.
Рис. 9. Метод реплик-планшетов, используемый для переноса клеток с первичных на вторичные планшеты для скрининга фенотипа. Метка на первичном планшете совмещается с меткой на покрытом вельветом блоке, затем опускается, чтобы поверхность агара соприкасалась с тканью. Клетки переносятся с пластины на вельвет легким, но равномерным нажатием на основную пластину кончиками пальцев. Это действие оставит отпечаток образцов клеток на вельвете с тем же пространственным узором, что и на первичной пластине.Та же процедура используется для переноса клеток из вельвета на вторичную пластину. Можно засеять до 7-8 вторичных чашек с использованием одного и того же оттиска первичной чашки на вельвете. Последняя чашка, засеянная вельветом, должна служить положительным контролем. Это должна быть среда, которая поддерживает рост всех тестируемых штаммов, обеспечивая достаточный перенос клеток на протяжении всей серии планшетов. После инкубации вторичные чашки можно проверить и оценить на предмет роста по сравнению с отсутствием роста.Таким образом, несколько штаммов бактерий могут быть подвергнуты скринингу одновременно на нескольких питательных средах в одном эксперименте.
Рис. 10. Пример результата с использованием техники заливки. Образец воды объемом 1,0 мл, собранный из питьевого фонтанчика, был помещен в стерильную пустую чашку Петри. Затем в чашку с образцом выливали расплавленный, но остывший YTA. Агар также содержал 100 мкг / мл циклогексимида для предотвращения роста дрожжей и плесени, которые могли присутствовать в образце воды.После осторожного перемешивания планшет ставили на плоскую поверхность и давали агару полностью затвердеть. Планшет инкубировали при 37 ° C в течение 48 часов. Показан результат этого эксперимента. Обратите внимание на разницу во внешнем виде поверхностных колоний, которые имеют большую и круглую форму, по сравнению с подповерхностными колониями, которые очень малы и имеют неправильную форму, потому что затвердевшая среда препятствует распространению колоний на подповерхностной поверхности.
Рис. 11. Пример результата с использованием техники распространения пластины.«Метод Копакабаны» использовали для посева смеси клеток E. coli для скринингового эксперимента. В этом случае ростовая среда (LB) содержит X-Gal, поэтому те клетки, которые экспрессируют функциональный фермент β-галактозидазы, образуют синие колонии, в то время как клетки с мутацией в гене lacZ и, таким образом, не могут экспрессировать функциональную β-галактозидазу. фермент образуют белые колонии. Эти два типа колоний, часто называемые «синим / белым экраном», можно легко отличить друг от друга на одной и той же чашке.
Рисунок 12. Пример результата анализа бляшек с использованием метода наложения мягкого агара. Показаны бляшки, образованные на штамме-хозяине Mycobacterium smegmatis mc 2 155 (ATCC 700084) двумя разными фагами: (A) разрушителями микобактериофагов и (B) микобактериофагами MSSS. Эти фаги были выделены студентами лабораторного курса MIMG 103L Калифорнийского университета в Лос-Анджелесе весной 2010 года. M. smegmatis является непатогенной актинобактерией и принадлежит к семейству микобактерий, которое включает несколько патогенов, которые, как известно, вызывают серьезные заболевания, такие как туберкулез ( M.tuberculosis, M. africanum, M. bovis ) и проказой ( M. leprae ). Приблизительно 50 мкл разведения 10 -2 Destroyers и 10 разведения -3 MSSS инкубировали с 500 мкл M. smegmatis в течение 20 минут при 37 ° C, затем смешивали с MBTA (мягкий агар). и разливали на чашки с MHA (твердым агаром). После того как мягкому агару давали возможность застыть в спокойном состоянии в течение 20 минут, планшеты переворачивали и инкубировали при 37 ° C в течение 48 часов. Обратите внимание на различную морфологию бляшек, производимых каждым фагом.Разрушители (A) образуют небольшие (средний диаметр около 1 мм) прозрачные бляшки, характерные для литического фага, в то время как MSSS (B) образует большие бляшки типа «бычий глаз» с четкими центрами, окруженными мутным ореолом (средний диаметр примерно 3,2 мм). . Мутное кольцо может состоять из бактерий, устойчивых к фаговой инфекции. Этот паттерн отличается от паттерна, формируемого лизогенными фагами, которые продуцируют мутные бляшки.
Рис. 13. Пример результата с использованием процедуры дублирования планшета.Четыре штамма Pseudomonas ( P. aeruginosa, P. putida, P. fluorescens и P. stutzeri ) были протестированы в двух экземплярах на рост на трех различных источниках углерода: ацетамиде, лактозе и глицине. (A) Первичный планшет представляет собой полную среду (YTA), засеянную четырьмя штаммами, как указано. После инкубации при 30 ° C в течение 24 часов все четыре штамма растут на YTA. Первичный планшет использовали для репликации планшета на минимальную среду (MSA), дополненную одним источником углерода: ацетамидом (B), лактозой (C) и глицином (D).Последним планшетом в серии был планшет положительного контроля YTA (E). Как показано, штаммы демонстрируют различные модели роста после инкубации на вторичных чашках. Обратите внимание, что иногда бывает трудно отличить рост от отпечатка клеток. Например, сравните отпечаток, созданный P. stutzeri на трех пластинах MSA, с отсутствием роста на тех же трех пластинах P. aeruginosa . Оба результата являются отрицательными по сравнению с моделями роста P.putida и P. fluorescens . Однако все штаммы растут на планшете с положительным контролем, подтверждающие, что клетки переносили во все вторичные планшеты в серии. Результаты этого эксперимента приведены в таблице Table 1 .
| YTA (основной) | MSA + ацетамид | MSA + лактоза | MSA + глицин | YTA (контроль) | |
| П.aeruginosa | + | – | – | – | + |
| P. putida | + | + | + | + | + |
| P. fluorescens | + | + | + | + | + |
| П. stutzeri | + | – | – | – | + |
Таблица 1. Сводка результатов нанесения покрытия на реплики. Рост обозначается знаком плюс (+), а отсутствие роста обозначается знаком минус (-). YTA — это полная среда (дрожжевой триптон-агар), а MSA — минимальная среда (агар с минимальными солями). Пластины MSA были дополнены одним источником углерода, как указано.
Скрининг рака шейки матки с использованием автоматизированного анализа мазков PAP
Рак шейки матки является одной из самых смертоносных и распространенных форм рака у женщин, если не предпринимать никаких действий для его предотвращения, но его можно предотвратить с помощью простого скринингового теста. так называемый PAP-мазок.Это наиболее эффективная мера профилактики рака, разработанная на сегодняшний день. Но визуальный осмотр мазков занимает много времени и дорого, и с тех пор, как более 60 лет назад был введен тест, предпринимались многочисленные попытки автоматизировать анализ. Первые коммерческие системы для автоматического анализа образцов клеток появились на рубеже тысячелетий, но они оказали ограниченное влияние на стоимость скрининга. В этой статье мы исследуем ключевые вопросы, которые необходимо решить при разработке автоматизированной системы анализа, и обсуждаем, как эти проблемы решались на протяжении многих лет.Извлеченные уроки могут быть полезны в усилиях по созданию рентабельной системы скрининга, которая могла бы сделать доступный скрининг на рак шейки матки для всех женщин во всем мире, тем самым предотвращая большую часть четверти миллиона ежегодных ненужных смертей, все еще вызываемых этим заболеванием.
1. Скрининг рака шейки матки
Рак шейки матки является вторым по распространенности раком среди женщин во всем мире: ежегодно регистрируется более полумиллиона новых случаев и примерно вдвое меньше случаев смерти.Различия в уровне заболеваемости между странами поразительны. Во многих странах это самый распространенный вид рака среди женщин, а в некоторых странах он находится на 10-м месте. Около 86% случаев приходится на развивающиеся страны. В Африке стандартизованный по возрасту показатель заболеваемости составляет 25 случаев на 100 000 в год; в некоторых странах этого континента этот показатель более чем вдвое выше. В Индии — 27, в США — 5,7, в Финляндии — 3,7 [1]. Таким образом, мы наблюдаем более чем десятикратный разброс показателей заболеваемости раком шейки матки между странами с самым низким и самым высоким показателем.
Хотя часть этой вариации может быть объяснена общими вариациями в условиях жизни и распространением вируса папилломы человека, ВПЧ, в популяции, большая часть объясняется успехом скрининга с использованием теста Папаниколау (PAP-тест). При раннем обнаружении рак шейки матки излечим, а 5-летняя выживаемость достигает 92% [2]. Идея PAP-теста заключается в том, что клеточные изменения, которые могут перерасти в рак, обнаруживаются на такой ранней стадии, что их можно удалить с помощью простой операции, тем самым предотвращая рак.Доказательства важности PAP-теста можно найти в статистике многих стран, где PAP-тест используется в систематических комплексных программах скрининга. В Швеции, например, общая заболеваемость раком шейки матки снизилась на 67% за 40-летний период, с 20 случаев на 100 000 женщин в 1965 году до 6,6 случаев на 100 000 женщин в 2005 году. Подробные исследования статистики рака подтверждают это [ 3, 4].
1.1. PAP-мазок
Оригинальный PAP-мазок изготавливается очень простым и понятным способом; кисть или шпатель используется для осторожного соскабливания клеточного материала с чешуйчато-столбчатого соединения шейки матки и наносится на предметное стекло размером примерно 25 × 50 мм.Клетки окрашивают, фиксируют, а затем визуально исследуют под микроскопом. Впервые этот тест был предложен Папаниколау в 1928 году, но потребовалось почти 15 лет, прежде чем он был принят медицинским сообществом [5, 6]. В монографии 1943 г. [7] дается подробный отчет о том, как следует проводить скрининг, и с тех пор эта процедура получила широкое распространение, что привело к значительному снижению заболеваемости раком шейки матки, упомянутому в предыдущих параграфах.
Скрининг проводят цитотехнологи, сокращенно цитотехники, которые через световой микроскоп исследуют образец клеток на наличие признаков злокачественности.С помощью этой процедуры они могут не только найти доказательства инвазивного рака, но и обнаружить определенные предшественники рака, что позволит начать эффективное лечение на ранней стадии. Цитотехники — это лабораторные технологи, которые проходят специализированное обучение, как правило, около одного года. Когда они находят в образце что-то подозрительное на злокачественное новообразование, об этом сообщают. Во многих лабораториях результат подтверждается цитопатологом, врачом, специализирующимся на клеточной патологии, который принимает окончательное решение, является ли это (пред) злокачественным поражением или нет, и, таким образом, берет на себя медицинскую ответственность за диагностику.Обнаруженное предраковое поражение высокой степени обычно приводит к тому, что женщине предлагают кольпоскопию и, если поражение подтверждается, операцию по его удалению. Обнаружение поражения низкой степени может привести к последующему забору мазка через более короткий промежуток времени, чем обычно 2–3 года.
В принципе, задача скрининга проста. Морфологические изменения, которые претерпевает клетка, когда она превращается в злокачественную, очевидны и легко описываются. Ядро становится больше и имеет более неправильную форму, цитоплазма становится меньше, так что соотношение размеров ядра и цитоплазмы изменяется, а распределение хроматина в ядре изменяется, становясь более грубым и неравномерно распределенным (см. Рисунок 2).
Чтобы визуально обнаружить эти изменения, нам нужно видеть детали, близкие к пределу оптического разрешения. Ядро имеет диаметр около 10 микрон, а структура хроматина и вариации формы находятся на микронном или субмикронном уровне. Поэтому используется линза с большим увеличением, обычно с 40-кратным увеличением. Предраковое поражение может быть довольно маленьким и локальным, а количество диагностических (пред) злокачественных клеток в образце может быть низким. Желательно обнаружить предраковое поражение, даже если в образце присутствует всего несколько диагностических клеток.Это создает сложную проблему поиска. Мазок покрывает примерно 25–50 мм и обычно содержит несколько сотен тысяч клеток, иногда даже больше. Изначально скрининг выполняется в низком разрешении с использованием объектива 10x, а когда появляется что-то подозрительное, скринер переключается на 40x. При 10x необходимо тщательно изучить около 1000 полей зрения, чтобы охватить всю выборку. Время, необходимое для этого, зависит от сложности образца, но в среднем это занимает всего 5–10 минут. Есть рекомендации, что из-за опасности переутомления цитотехнолог не должен работать более 7 часов в день и анализировать не более 70 образцов [8].Даже следуя этой рекомендации, цитотехнолог должен проверять в среднем три поля изображения в секунду. Кроме того, поскольку видимые предраковые изменения могут быть довольно локальными, цитотехнику необходимо постоянно поддерживать полную концентрацию, чтобы не пропустить некоторые диагностические клетки.
2. Историческое развитие автоматизированных систем скрининга
Основываясь на том факте, что изменения в морфологии клеток достаточно очевидны, а также на том факте, что визуальный скрининг очень требователен, утомителен и дорог с точки зрения трудозатрат, было очень рано всего через десять лет после того, как PAP-тест стал общепринятым, появились предложения по автоматизации скрининга с помощью какого-то механизма сканирования и анализа изображений [9].Была надежда, что автоматизированная система сможет проводить скрининг и с меньшими затратами, и с более высокой точностью.
С тех пор в большом количестве проектов были предприняты попытки разработать системы досмотра. Проблема оказалась намного сложнее, чем предполагалось. Прошло более 40 лет, прежде чем появились первые успешные коммерческие системы. И все же автоматизированный скрининг не является достаточно рентабельным, чтобы полностью заменить визуальный скрининг, судя по относительно ограниченному распространению автоматизированных систем скрининга в операциях скрининга во всем мире.В этом разделе мы кратко опишем это развитие и попытаемся увидеть для каждого нового поколения систем, каким образом они улучшили более ранние системы, каковы были основные проблемы и что было изучено. Мы также обсуждаем основные технические аспекты и пытаемся понять, что делает проблему такой сложной и как ее можно решить.
2.1. Системы первого поколения
Проект Cytoanalyzer в США был первой попыткой создания автоматизированного устройства для скрининга мазков PAP [10].Система была основана на концепции, согласно которой раковые клетки можно отличить от нормальных по размеру ядра и оптической плотности. Система включала автоматическую подачу слайдов и схемы автофокусировки. Анализ изображений был основан на жестких аналоговых схемах обработки видео, которые генерировали двумерные гистограммы ядерных размеров в зависимости от ядерной оптической плотности. Пространственное разрешение составляло 5 мкм. Предварительные эксперименты показали, что при таком разрешении можно обнаружить разницу в размерах между нормальными и злокачественными клетками.Это был первый полностью автоматизированный микроскоп и, как следствие, довольно дорогостоящий проект. К сожалению, тесты с Cytoanalyzer показали, что распознавание фиксированной логической схемы специального назначения вызывало слишком много ложных тревог на уровне клеток [11]. На нормальных образцах присутствовало множество объектов размером со злокачественные клетки, например скопления клеток крови, тяжи ткани и слизи, перекрывающиеся эпителиальные клетки и т. Д. Таким образом, было обнаружено, что каждый образец, включая нормальные, был подозрительным на отклонение от нормы.Проект провалился в начале шестидесятых, в основном из-за проблемы с отторжением артефактов.
Из-за плохой репутации автоматизации цитологии, вызванной этой ранней и дорогостоящей неудачей в США, попытки автоматизации в течение следующих двух десятилетий были перенесены в Европу и Японию. В Великобритании в конце 60-х годов был разработан однопараметрический (ядерный) автоматический фильтр [12]. Он потерпел неудачу по той же причине, что и цитоанализатор.
В Японии Ватанабэ и его коллеги из Toshiba разработали CYBEST [13].В их первой версии использовались специальные электронные схемы, в то время как более поздние версии были основаны на цифровых компьютерах общего назначения, тем самым преодолевая разрыв между старой аналоговой и новой цифровой технологией. Размер пикселя составлял около одного микрона. Они извлекли из изображений клеток четыре различных характеристики: ядерную площадь, ядерную плотность, площадь цитоплазмы и соотношение ядер / цитоплазмы. Они также поняли, что форма ядра и структура хроматина были полезными параметрами, но не смогли надежно измерить эти особенности автоматически, главным образом потому, что автоматическая фокусировка не могла надежно производить изображения со всеми ядрами клеток в достаточно хорошем фокусе.Мера хроматина, предложенная этой группой, заключалась в количестве пятен в ядерной области. За 15 лет были разработаны четыре поколения прототипов систем. Последний использовал стробированную подсветку и непрерывное движение сканирования для достижения высоких скоростей сканирования. Прототипы использовались в крупных полевых испытаниях в рамках японской программы скрининга и показали многообещающие результаты, но ни один из них не стал продуктом [14].
2.2. Новые поколения систем
Когда были разработаны системы первого поколения, не было интерактивных компьютеров и дисплеев, способных отображать цифровые изображения.Это, конечно, значительно усложнило разработку. Однако в семидесятые годы стало возможным разрабатывать системы интерактивного анализа изображений, хотя и с очень ограниченными возможностями, обычно с объемом памяти в несколько сотен КБ и монохромным или двоичным дисплеем. Эти системы использовались для исследования новых схем сегментации изображений, выделения признаков и классификации, что привело к появлению в начале 1980-х годов систем нового поколения, таких как BioPEPR [15], FAZYTAN [16], Cerviscan [17], LEYTAS [18]. ], а также в лаборатории авторов Diascanner [19].
Типичные сотовые функции, используемые в этих системах, были аналогичны тем, которые используются в CYBEST, хотя было много вариаций в том, как именно были извлечены эти функции. Наиболее важным фактором оказалось то, что клетки были оцифрованы с достаточно высоким разрешением и лучшей фокусировкой. Чтобы иметь возможность сканировать весь образец достаточно быстро, но при этом иметь возможность выполнять критически важный анализ с высоким разрешением, в некоторых из этих конструкций, например, Diascanner, использовался подход с двойным разрешением: начальное поисковое сканирование с низким разрешением с последующим сканированием. сканирование интересующих областей с высоким разрешением.Большинство этих систем достигли стадии рабочего прототипа в середине восьмидесятых годов. Некоторые из систем сообщили о точности классификации, которая находится в пределах диапазона, достигаемого обычным визуальным контролем. Но ни одна из них не вышла на рынок, и важной причиной этого была недостаточная рентабельность; автоматизированные микроскопы и компьютеры с достаточной вычислительной мощностью все еще были слишком дорогими.
Прогресс в технологии компьютерных дисплеев, который имел важное значение для создания интерактивных систем, которые можно было бы использовать для разработки новых автоматизированных систем просмотра, в конечном итоге также привел к возможности разработки систем интерактивных просмотров.Для ранних систем единственным вариантом была полная автоматизация или, возможно, остановка автоматического микроскопа, чтобы физически показать оператору ячейку, которая подозревалась как ненормальная. Идея заключалась в создании системы «предварительной проверки»; то есть система, которая для достаточно большой части образцов могла бы сказать, что они совершенно нормальные, и могла бы быть классифицирована как таковая без какого-либо исследования человеком. Все другие образцы, на которых система обнаружила что-то, указывающее на то, что они могут быть ненормальными, должны быть проверены обычным полностью ручным способом.В конце восьмидесятых годов компьютерные дисплеи и память достигли достаточной емкости, чтобы сделать возможным сохранение изображений подозрительных клеток, которые были достаточно хороши, чтобы человек мог судить, может ли объект быть злокачественной клеткой или чем-то еще. Система PAPNET от Neuromedical Systems была первой, которая ввела взаимодействие в автоматизированный скрининг [20]. После первоначального поиска объекта с низким разрешением поля с высоким разрешением обрабатывались сначала алгоритмическим классификатором, а затем классификатором нейронной сети.Результатом работы классификаторов было ранжирование аномальности обнаруженных «клеток», так что изображения 64 наиболее аномальных клеток можно было сохранить на магнитной ленте, а затем показать цитотехнику на станции обзора. Там было принято решение, следует ли классифицировать образец как нормальный или подозрительный. В подозрительных случаях цитопатолог сделает окончательный анализ и решит, следует ли вызывать женщину для последующего наблюдения или нет.
В конце восьмидесятых годов в США резко возрос интерес к автоматизации цитологии по экономическим / юридическим причинам, и было начато множество новых проектов [21].Одним из новых аспектов, появившихся в то время, были новые способы подготовки образцов. Корпорация Cytyc разработала собственную автоматизированную технику подготовки образцов, ThinPrep, которая на основе жидкостной цитологии позволяет получать гораздо более чистые образцы, чем обычные мазки, за счет значительно более сложной техники подготовки [22]. Другой аналогичный метод подготовки был разработан AutoCyte [23].
AutoPap 300 от NeoPath был похож на PAPNET в том, что в нем использовались обычные мазки Папаниколау и нейросетевые классификаторы [24].Он увеличил скорость получения изображения за счет использования стробированного освещения, аналогичного системе CYBEST. Это использовалось на двух уровнях разрешения: начальное картирование образца с низким разрешением, за которым следовало поле высокого разрешения с полевым анализом наиболее «интересных на вид» частей образца аналогично предыдущему поколению Diascanner. Обработка изображений производилась на специально разработанных платах обработки. Большая часть обработки была основана на операциях математической морфологии, в результате чего в классификаторы было отправлено до 68 различных функций.Окончательный результат был «нормальным» по сравнению с решением «требуется визуальный осмотр» на уровне образца; то есть не использовалось интерактивное подтверждение машинного решения для отрицательных случаев.
2.3. Первые коммерчески доступные системы
В девяностые годы между американскими компаниями, разрабатывающими технологии скрининга, шла жесткая конкуренция, а также изо всех сил пытались получить одобрение различных решений со стороны влиятельного Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).Системы скрининга были отнесены к категории медицинских устройств, требующих предварительного одобрения, что означает, что ни одна система не может продаваться в США без одобрения FDA. Сотни миллионов были потрачены на разработки и полевые испытания, и произошла встряска; компании объединились и были приобретены более крупными компаниями. Первой компанией, выпускающей продукт для скрининга, получившей наконец одобрение FDA, была Tripath в 1998 году. Это было слияние NeoPath, Neuromedical и AutoCyte. Компания Tripath, в свою очередь, была приобретена BD в 2006 году, и система была переименована в BDFocalPoint Slide Profiler [25].Он в значительной степени основан на системе AutoPap 300. Для дальнейшего повышения производительности системы был добавлен новый метод подготовки образцов на жидкой основе под названием SurePath, хотя он также может анализировать обычные мазки. Согласно одобрению FDA, система может использоваться для распознавания около 25% слайдов как нормальные без дальнейшего рассмотрения; остальные 75% делятся на пять категорий с риском отклонений. Также существует возможность визуального просмотра областей, представляющих особый интерес, на специальной станции просмотра.Система также может использоваться для контроля качества и требует повышенной чувствительности при обнаружении отклонений [26].
Cytyc весьма успешно применила свою улучшенную технику подготовки на жидкой основе и смогла продемонстрировать лучшие характеристики этой методики по сравнению с обычными мазками. Они также разработали интерактивную систему с предварительным экраном компьютера, которая выбирала наиболее необычно выглядящие объекты на каждом образце для проверки человеком. В 2003 году они получили одобрение FDA на свою систему визуализации ThinPrep [27], а в 2007 году они стали частью Hologic Company.Система продается для увеличения обнаружения аномалий за счет улучшенной подготовки образцов и скрининга как визуально, так и с помощью машины [28].
3. Технические проблемы
В кратком обзоре истории развития выше мы кратко упомянули некоторые ключевые особенности различных поколений систем. Теперь мы вернемся к различным важнейшим аспектам технологий, лежащих в основе системы проверки, и обсудим, что необходимо достичь, чтобы проверить образец за время, сопоставимое с временем проверки человеком, которое составляет менее 10 минут.
3.1. Подготовка образца
В исходном PAP-мазке ячеистый материал вручную распределяют по предметному стеклу. Важно, чтобы в образце были представлены как эндоцервикальная, так и эктоцервикальная области (см. Рис. 3), и благодаря смазыванию на самом деле может существовать сопоставление между исходной областью и местом на слайде. [29]. Образцы фиксируются и окрашиваются с помощью довольно простой процедуры, которая может выполняться полностью вручную или в окрашивающих машинах с разной степенью сложности.Стоимость материала на всю подготовку довольно низкая, порядка 1-2 долларов США. На Рисунке 1 показано изображение поля высокого разрешения из PAP-мазка.
Ручное размазывание и окрашивание, к сожалению, приводит к большим колебаниям качества образцов. Иногда клеточный материал может быть распределен неравномерно, что приводит к образованию плотных комков, через которые свет не может проникнуть, в то время как другие части предметного стекла могут быть пустыми. Даже если мазок сделан хорошо, останутся слишком плотные участки и слишком много перекрывающихся ячеек для надежной интерпретации.Опытный цитотехнолог может справиться с большими колебаниями качества образцов и по-прежнему делать довольно надежную оценку образца, но мазки очень сложно анализировать автоматически.
Чтобы получить образцы, которые лучше подходят как для визуального, так и для машинного анализа, были разработаны различные методы подготовки жидкостной цитологии (ЖЖК). Общая стратегия здесь состоит в том, чтобы погрузить щетку или шпатель со всеми клеточными материалами, собранными из шейки матки, в жидкость, которую затем обрабатывают различными способами, прежде чем она будет помещена на предметное стекло, зафиксирована и окрашена.В результате в идеале получается клеточный образец, который распределяется в виде монослоя с оптимальной плотностью на четко определенной части предметного стекла. Цель этой процедуры состоит в том, чтобы полученные образцы легче интерпретировать визуально и, в частности, машинами. За прошедшие годы было разработано несколько различных методов приготовления препаратов на жидкой основе, двумя ведущими методами являются Surepath [25] и Thinprep [27], упомянутые выше. Было проведено множество исследований по сравнению препаратов на жидкой основе с обычными мазками, и большинство из них пришли к выводу, что они, по крайней мере, так же хороши или лучше, когда дело доходит до надежности выявления аномалий [28, 30–32].Все продаваемые в настоящее время системы машинного досмотра работают с препаратами на жидкой основе.
Большим недостатком препаратов на жидкой основе являются связанные с ними эксплуатационные расходы. Для их изготовления требуется значительно больше материалов, например, флаконы, жидкости, фильтры, а также более сложное оборудование, например центрифуги. Процедуры являются запатентованными, а необходимое оборудование продается в виде наборов, что увеличивает стоимость подготовки слайда как минимум до 10 долларов США.Это вызывает серьезные экономические проблемы в регионах с ограниченными ресурсами. Тем не менее, есть исследования, показывающие, что препараты на жидкой основе более эффективны [33, 34], в то время как большое метастазирование пришло к выводу, что они не обнаружили значительных различий [35]. Существуют также альтернативные препараты на жидкой основе, которые были разработаны и конкурируют с более низкими затратами [36, 37], хотя они до сих пор не были протестированы так широко, как ведущие методы.
3.2. Сканирование
Чтобы проанализировать образец клетки на компьютере, его следует сканировать с достаточно высоким разрешением, чтобы надежно выделить признаки, которые могут определить, является ли он нормальным или указывает на предраковые изменения.Это очень сложно. При размере пикселя 0,2 микрона мазок размером 25 50 мм даст 31 миллиард пикселей. Простая передача такого количества данных с камеры на компьютер займет минуты, даже с использованием новейших технологий высокоскоростной передачи. Поскольку нет линз, которые могут разрешить всю область образца одновременно, и нет датчиков изображения с разрешением 31 гигапиксель, возникает проблема изменения положения линзы в большом количестве полей изображения, которые вместе покрывают образец. Объектив микроскопа с высоким разрешением дает поле зрения диаметром около 0,5 мм, а с соответствующим 6-мегапиксельным сенсором мы получаем 5000 полей изображения.Перемещение и захват изображения на каждом из них займет не менее 10 минут. Это можно уменьшить, используя непрерывное движение и вспышку для остановки изображения. Система CYBEST4 была первой системой скрининга, в которой использовалась эта идея [14], а позже она была использована в AutoPap [24]. Альтернативой является использование одномерного датчика длиной, например, 2000 пикселей и плавное перемещение предметного столика микроскопа в ортогональном направлении. Эту идею использовали системы Cerviscan [17] и Diascanner [19]. Он также используется в популярных в настоящее время сканерах слайдов от Aperio [38], хотя и с более низким разрешением.
Еще одна серьезная проблема — фокусировка. Чтобы надежно извлечь текстурную информацию из изображения ячейки, они должны быть в очень хорошем фокусе, что требует высококачественной автофокусировки, что также требует много времени. Альтернативой является сканирование образца на нескольких уровнях фокусировки и выбор лучшего для каждой ячейки, что снижает потребность в автофокусировке, но еще больше увеличивает объем данных. Таким образом, сканирование всего мазка за достаточно короткое время при достаточно высоком качестве изображения является довольно сложной задачей.На рис. 4 показаны два упомянутых выше подхода к сканированию.
Один из способов снизить требования — использовать меньшую часть поверхности скольжения для образца. С мазком это невозможно сделать без ухудшения качества отбора образцов. При препарате на жидкой основе площадь образца составляет примерно 1/10 площади мазка, что является большим преимуществом при сканировании. Вместо этого для мазков мы можем использовать подход с двойным разрешением, имитирующий способ переключения цитотехов между линзами 10x и 40x.Если мы сканируем с размером пикселя 1 микрон, мы можем покрыть мазок в 200 полях, что можно сделать примерно за 20 секунд. Это создаст карту распределения клеточного материала с подходящей плотностью, которую затем можно будет использовать для контроля того, где будет получено несколько сканирований с высоким разрешением. Вариант этого подхода состоит в том, чтобы искать не только области с подходящей плотностью клеток, но и области с клетками, которые выглядят подозрительно на аномалии. Этот подход к скринингу с двойным разрешением был впервые предложен Поулсеном [39] и использовался в некоторых ранних системах, например, Diascanner [19].Потенциальный риск при таком подходе к проектированию состоит в том, что, если сканирование с низким разрешением систематически пропускает какие-либо отклонения, эти отклонения никогда не становятся предметом анализа с высоким разрешением.
3.3. Сегментирование клеток и ядер
Чтобы извлечь признаки, описывающие клетки, мы должны найти и очертить каждую клетку и / или ядро клетки на изображении образца. Это называется сегментацией изображения и является важным шагом практически во всех системах, основанных на анализе изображений. Сегментация ядер в PAP-мазках очень затруднена из-за тех же осложнений, которые затрудняют анализ мазков для людей, а именно, разной толщины мазка и интенсивности окрашивания, затемнения элементов и т. Д.Самые ранние системы использовали пороговую обработку на основе шкалы серого для сегментации в самых первых системах с использованием фиксированного порогового значения, но позже со значением, определяемым анализом гистограммы, как первоначально предложили Prewitt и Mendelsohn [40]. В более поздних проектах использовались более сложные подходы. Bergmeir et al. [41] используют средний сдвиг и морфологическую фильтрацию, а затем пробуют обнаружение края Канни с последующим рандомизированным преобразованием Хафа [42]. Бэмфорд и Ловелл [43] используют алгоритм двойного активного контура.Мальм и Брун [44] используют обнаружение края Кэнни с последующим замыканием анизотропной кривой. В недавнем обзоре [45] идентифицированы пять различных классов подходов к сегментации клеток, и показано, как они появились и приобрели популярность с годами. По-прежнему существует потребность в разработке новых методов, поскольку ни один из существующих не является таким гибким и надежным, как зрительная система человека, в плане реального определения того, где находится ядерная или цитоплазматическая граница в сложных случаях.
Основным требованием к хорошему методу сегментации клеточного ядра является то, что он может точно обнаруживать и очерчивать клеточное ядро при различных условиях окрашивания и в присутствии мешающего объекта в непосредственной близости.Второе важное требование — это сегментация может быть сделана быстро. Мы не можем потратить больше нескольких миллисекунд на ячейку, если хотим выполнить анализ за приемлемое время. Увеличивающаяся мощность компьютеров позволяет делать это даже с помощью довольно сложных алгоритмов. Однако для этого требуется, чтобы алгоритмы были реализованы эффективным образом, например, с использованием возможностей параллелизма, возможного в современных компьютерах.
3.4. Отклонение артефактов
Цель алгоритмов сегментации — найти и точно очертить ядра клеток (а иногда и цитоплазмы), которые достаточно хорошо сохранились и отображены, чтобы обеспечить точное извлечение признаков для последующей классификации.Но иногда он терпит неудачу либо потому, что изображение ядра искажено из-за наложения объектов или других артефактов, либо когда ячейка настолько плохо сохранилась или представлена на изображении, что извлеченный контур объекта будет неправильным. Тогда очень важно, чтобы мы могли обнаружить этот сбой и сбросить данные с объекта. В противном случае это приведет к ненадежной классификации на уровне образца. Процесс анализа результатов сегментации с целью удаления ошибочных результатов называется отклонением артефактов.
Отторжение артефактов — сложная тема, потому что существует бесконечное множество способов, которыми клетки крови, воспалительные клетки, свернутые и искаженные клетки, перекрывающиеся объекты, слизь, ошибки окрашивания и т. Д. Влияют на изображение клетки (см. Рис. 5). Но это абсолютно необходимый шаг в системе досмотра. Мотивацию для этого можно найти в статистике, с которой нам приходится иметь дело. Стандартный PAP-мазок обычно может содержать 100 000–200 000 клеток соответствующих типов клеток, и мы можем назвать его положительным, если обнаружим 10–20 диагностических, предраковых или злокачественных клеток (в идеале должно быть достаточно одной явно злокачественной клетки) .Классификатор, допускающий ложноположительную ошибку только в один процент, вызовет по крайней мере 1000 ячеек положительными даже на здоровом образце, что сделает каждый образец положительным и, таким образом, систему бесполезной. Один из подходов к решению этой проблемы состоит в том, чтобы сделать классификатор очень асимметричным между ложноположительным и ложноотрицательным, то есть позволить ему не классифицировать большую часть действительно злокачественных клеток как нормальные. Может показаться, что это противоречит цели системы, которая заключается в обнаружении (пред) злокачественных новообразований.Но так работают сильно несбалансированные числа. Если у системы 80% ложных отрицательных результатов, она все равно обнаружит 2–4 диагностических злокачественных клетки, если у нас есть 10–20 доступных. Это приемлемо, пока процент ложных срабатываний практически равен нулю, менее 0,001%. Создать такой классификатор сложно, но возможно, если мы сможем работать с идеально отображаемыми ячейками с точной сегментацией и тщательно извлеченными функциями. Чтобы убедиться, что это так, нам нужно очень эффективное отклонение артефактов.
Существует очень мало подробных исследований по отторжению артефактов для скрининга шейки матки.Некоторые исследовательские работы игнорируют эту проблему, работая с визуально выбранными или проверенными изображениями ядер, полагаясь, таким образом, на ручное отклонение артефактов, что, конечно, невозможно сделать для реальной системы скрининга. Другие статьи включают отклонение артефактов на этапах сегментации или классификации. Тем не менее, анализ проблемы отклонения артефактов сам по себе позволяет легче увидеть, какой производительности можно достичь, и связать это с тем, что необходимо. Malm et al. недавно представили такое исследование, в котором продемонстрировали специфичность 99.38% на мазках и 99,83% на образцах LBC, при сохранении чувствительности около 98% на основе материала из около 12 000 автоматически обнаруженных и сегментированных изображений объектов, визуально классифицированных по ядрам клеток и артефактам [46]. При такой производительности у нас все равно будет несколько сотен артефактов, искажающих данные, если мы проанализируем 100000 объектов, поэтому может быть трудно достичь чувствительности обнаружения нескольких аномальных ячеек без получения слишком большого количества ложноположительных образцов. Тем не менее, это указывает на то, чего необходимо достичь для создания полезной системы.
3.5. Извлечение признаков
Когда у нас есть точная сегментация ядер клеток, мы можем извлечь признаки, описывающие размер, форму и текстуру объекта. Наиболее очевидными признаками являются те, которые представляют больший размер и более неправильную общую форму злокачественных ядер. Эти особенности могут быть извлечены при относительно низком разрешении и даже без точного фокусирования ячейки. При условии идеального отторжения артефактов эти особенности могут быть полезны при обнаружении значительной части явно злокачественных клеток и образцов.Они использовались в системах первого поколения, которые потерпели неудачу из-за отсутствия адекватной защиты от артефактов. За прошедшие годы было изобретено и протестировано множество других функций. В [47] были рассмотрены и систематизированы различные виды предложенных функций.
Самая важная информация о том, является ли ядро нормальным или (пред) злокачественным, содержится в структуре хроматина или текстуре ядра. ДНК в ядре распределяется по-другому, когда на клетку влияет злокачественный процесс.Этот эффект можно увидеть и измерить даже с помощью PAP-окрашивания, которое не является стехиометрическим для ДНК. Однако измерить распределение хроматина сложно. Наиболее распространенные подходы основаны на статистическом описании соседних уровней серого, обычно измеряемых с помощью так называемых матриц вероятностей перехода, как первоначально было предложено в [48]. Другой подход состоит в том, чтобы рассматривать отдельные гранулы хроматина как сегментированные объекты, а затем описывать пространственные отношения между этими объектами, например, с помощью методов анализа графов [49].Различные способы измерения характеристик хроматина обсуждаются в [50], а также в [47]. Очень важным аспектом анализа хроматина является то, что вам нужен идеальный фокус и изображения очень высокого качества, чтобы надежно представить этот образец, который находится на пределе оптического разрешения или превышает его.
4. Стратегии классификации
Конечная цель процесса скрининга PAP-мазка — найти женщин с предраковыми поражениями, чтобы их можно было вылечить до того, как злокачественное новообразование перерастет в потенциально смертельный инвазивный рак.При запуске обычного процесса визуального скрининга цитотехники могут классифицировать большинство образцов как совершенно нормальные и не нуждающиеся в дополнительном обзоре. Важно понимать, что мы обычно проверяем население в целом, поэтому подавляющее большинство образцов, возможно, 96%, являются нормальными. Тем не менее, некоторые образцы выглядят более подозрительно, и их направляют к цитопатологу для проверки; в некоторых случаях злокачественное новообразование может быть настолько очевидным, что цитотехнолог может быть уверен в этом; по-прежнему требуется подтверждение патологоанатома.Положительный образец затем приведет к тому, что женщина будет вызвана для дополнительного обследования, возможно, включая кольпоскопию и биопсию, и, если поражение будет подтверждено, простая операция с процедурой электрохирургического удаления петли или аналогичной для его удаления. Существуют различные уровни изменений внешнего вида клеток, которые можно обнаружить, и существует консенсусный стандарт по их классификации, называемый системой Bethesda [51]. Согласно системе Bethesda, существует также ряд отклонений от совершенно нормального слайда до небольших отклонений ASC-US, поражений низкой степени, LSIL, поражений высокой степени, HSIL и, наконец, рака.Конечно, особенно важно выбрать более высокие оценки и не ясно, действительно ли необходимо обнаруживать небольшие изменения. Не все поражения низкой степени злокачественности разовьются до рака, даже если их не лечить, а когда они это сделают, это может занять десятилетие или даже больше. При регулярной программе повторного скрининга с взятием нового образца с интервалом в несколько лет вероятность обнаружения поражения до того, как оно перейдет в рак, поэтому высока, даже если риск пропустить его при однократном скрининге довольно высок, возможно 20-30 %.
При добавлении устройства автоматического просеивания к общей настройке досмотра его можно использовать по-разному. Первоначальная концепция заключалась в том, чтобы сделать автоматический предварительный скрининг, который мог бы сказать, что значительная часть образцов была нормальной, но с очень небольшим количеством ложноотрицательных результатов, то есть без пропуска или очень немногих истинно положительных образцов. Для достижения низкого уровня ложноотрицательных результатов можно принять относительно высокий уровень ложноположительных результатов, поскольку эти образцы проверялись визуально. Даже если бы только 50% образцов можно было отклонить как явно нормальные, система снимала бы половину нагрузки на визуальный скрининг и могла бы быть рентабельной, если бы не добавляла слишком много к общей стоимости скрининга.Система SurePath обычно используется в этом режиме и настроена на удаление только 25% образцов, а также ранжирование положительных результатов по различным категориям вероятности быть действительно положительными.
Другой способ использования автоматизированной системы — запускать ее параллельно с визуальной проверкой. Поскольку люди и машины, скорее всего, будут делать разные ошибки, комбинированная система повысит чувствительность всего процесса проверки, то есть снизит частоту ложноотрицательных результатов. Но оборотной стороной является то, что общая рабочая нагрузка и стоимость скорее увеличиваются, чем уменьшаются.Система Thinprep в основном предназначена для использования в этом режиме.
4.1. Подход к редким событиям
Автоматизированная система скрининга на основе анализа изображений анализирует клетки одну за другой и может на основе характеристик, извлеченных из изображения клетки, классифицировать ее как нормальную или ненормальную. Самый простой способ использовать информацию из классификатора клеток — просто подсчитать, сколько аномальных клеток мы обнаружили в образце, и если оно превышает нижний порог, мы называем образец подозрительным.Проблема состоит в том, чтобы установить порог так, чтобы мы не пропустили истинные положительные результаты, особенно невысокие, и при этом избегали слишком большого количества ложных срабатываний [52].
Этот подход игнорирует информацию о том, насколько уверен классификатор ячеек в своем решении. Может оказаться, что одна клетка явно злокачественная, а другая очень близка к порогу нормы. Если мы сохраним эту информацию, мы сможем принять решение на уровне образца о том, обнаружили ли мы слишком много аномалий, чтобы назвать образец нормальным, либо на основе всего нескольких явно злокачественных клеток, либо на основе большего количества клеток, немного превышающих пороговое значение [53] .
Если мы сможем проводить анализ изображения и извлечение признаков в режиме онлайн во время сканирования образца, мы можем остановить анализ, как только найдем достаточные доказательства того, что образец не является явно нормальным. Это может сэкономить время, поскольку отпадает необходимость сканировать и обрабатывать остальную часть образца. Эта стратегия не вызывает сомнений, поскольку не увеличивает риск ложноотрицательных результатов. Но поскольку подавляющее большинство образцов являются нормальными в типичной ситуации скрининга, нам необходимо иметь возможность преждевременно останавливаться, даже когда мы найдем достаточные доказательства того, что образец нормален, чтобы действительно сэкономить время.И это спорно; Обычно требуется, чтобы цитотехнолог изучил весь образец, прежде чем признать его нормальным. Тем не менее, только небольшая часть клеток, соскобленных с шейки матки, действительно попадает на стекло, поэтому мы не анализируем все возможные клетки, даже когда смотрим на предметное стекло целиком. Однако при обычном PAP-мазке есть своего рода отображение между областями шейки матки на слайде, поэтому мы можем систематически пропустить какую-то важную область, преждевременно остановившись. Для препарата на жидкой основе гораздо меньше клеток доступно для анализа на образце, но есть этап смешивания, поэтому мы можем предположить, что у нас есть случайный образец, и можем остановиться, как только у нас будет достаточно много клеток для требуемой статистической значимости. в решающей функции.
4.2. Изменения, связанные со злокачественными новообразованиями (MAC)
В подходе к проблеме скрининга, описанном до сих пор, системы имитировали способ, которым это делают люди, то есть поиск потенциально редких (пред) злокачественных клеток. Достижение низкого уровня ложноотрицательных результатов даже для образцов с небольшим количеством диагностических клеток является сложной задачей и требует анализа очень большого количества клеток. Однако существует альтернативный подход, основанный на так называемых изменениях, связанных со злокачественными новообразованиями (MAC). Уже в 1967 году было обнаружено, что клетки, находящиеся поблизости от злокачественного новообразования, подвергаются такому влиянию, что они претерпевают небольшие, часто субвизуальные изменения текстуры хроматина [54].Эти открытия были подтверждены в ранних исследованиях по автоматизированному скринингу шейки матки [55, 56]. Несмотря на то, что эти сдвиги были недостаточно сильными, чтобы быть полезными на уровне отдельных клеток, они позволяли обнаруживать аномальные образцы посредством статистического анализа распределений признаков небольшой популяции, нескольких сотен клеток, при условии, что эти признаки были извлечены очень сильно. точно. Поскольку эти изменения присутствуют во всех клетках, расположенных в непосредственной близости от злокачественного процесса, мы можем использовать другой подход к скринингу.Нам необходимо уметь надежно обнаруживать эти тонкие изменения в популяциях клеток в образце. Но нам не нужно перебирать весь образец; Для характеристики распределения хроматина в популяции клеток необходимы только данные от достаточно большого количества клеток, обычно около 500 клеток. Наиболее систематически эту идею преследовала группа из Онкологического исследовательского центра Британской Колумбии [57, 58]. Также в этом случае нам нужно очень точное удаление артефактов; мы не хотим извлекать данные текстуры из артефактов.И нам нужен идеальный фокус для каждой ячейки. Даже небольшое отклонение от идеального фокуса вызывает значительные изменения в изображении хроматина. Еще не было убедительно продемонстрировано, что только МАК может обнаруживать ранние предраковые изменения с достаточной чувствительностью.
4.3. Подход к изучению плоидности ДНК
Злокачественный процесс не только изменяет распределение ДНК в ядре, но также увеличивает количество ДНК. При стехиометрическом окрашивании гистограмма интегральной оптической плотности всех ядер покажет диплоидное распределение для нормальных клеток и другое анеуплоидное распределение для злокачественных клеток.Поэтому модифицированные стехиометрические PAP-подобные красители были разработаны и использованы для автоматизированных скрининговых исследований [59–61], показав весьма многообещающие результаты. Этот метод в настоящее время используется в Китае в исследовании с участием нескольких сотен тысяч женщин [62]. Поскольку этот подход основан на денситометрических измерениях, существуют довольно строгие требования к постоянному окрашиванию, контролю освещения и калибровке изображения. Отказ от артефактов также очень важен; мы должны быть уверены, что измерения ДНК производятся только от одиночных, свободно лежащих, хорошо сохранившихся ядер.Существенная проблема с этими модифицированными красителями состоит в том, чтобы добиться их признания широким сообществом, поскольку новый внешний вид образцов может потребовать дорогостоящего переобучения. Эту концепцию также можно использовать с обычным PAP-окрашиванием, но из-за отсутствия стехиометрического окрашивания измерения плоидности будут менее надежными.
4.4. Статистика полевых испытаний и требования к производительности: технические и этические вопросы
Статистика, необходимая для разработки успешной системы скрининга, сложна на нескольких уровнях, как описано в предыдущих параграфах.Но у нас также есть сложная статистика о самом высоком уровне скрининга населения. Машина для скрининга, которая систематически пропускает значительную часть положительных образцов, снижает доверие к программам скрининга и подвергает женщин риску развития инвазивного рака до того, как проблема будет обнаружена. Поскольку система скрининга обычно используется в основном для анализа нормальных образцов, не более нескольких процентов образцов действительно положительны. Чтобы с высокой степенью уверенности доказать способность системы к обнаружению, нам необходимо проанализировать сотни положительных случаев.На этапе разработки мы можем достичь большого количества положительных случаев, выборочно прогоняя положительные случаи в машине. Но для окончательной оценки мы должны запустить ее на типичной смеси рутинных образцов. Таким образом, нам нужен объем в десятки тысяч образцов для правильного тестирования системы. Ситуация усложняется еще и тем, что при визуальном обследовании выявляются различные виды редких отклонений. Нам нужно убедиться, что машина выполняет приемлемую работу и для них.На этом этапе тестирования машину необходимо будет использовать параллельно с визуальным контролем, что вызовет двойные эксплуатационные расходы плюс дополнительную работу по выполнению сравнений и статистических оценок. Таким образом, заключительные этапы проверки системы — это сложный и дорогостоящий порог, который нужно преодолеть, прежде чем новая система будет готова к широкому использованию.
Каким требованиям к рабочим характеристикам должна соответствовать просеивающая машина — это вопрос, который на протяжении многих лет вызывает споры. Идеальная машина должна иметь нулевой процент ложных отрицательных результатов и нулевой процент ложных срабатываний.На практике это невозможно, поэтому мы должны учитывать реалистичные требования.
Количество ложноотрицательных результатов — это в первую очередь этическая проблема. Если мы не обнаружим поражения высокой степени злокачественности, это может привести к развитию рака у женщины. Требование должно заключаться в том, чтобы машина была по крайней мере так же хороша, как текущий процесс визуального досмотра. Но это требование также имеет два аспекта. В среднем он не должен пропускать больше образцов, чем пропускает хороший цитотехнолог. Кроме того, он не должен систематически пропускать какие-либо соответствующие поражения.
С другой стороны, количество ложных срабатываний при первоначальной автоматической проверке образцов является экономической проблемой. Ложноположительные результаты всего скрининга после осмотра цитологом обходятся дорого и вызывают беспокойство у женщины, которую вызывают на новое исследование, что может быть истолковано как сообщение о том, что у нее может быть рак. Но не создана система скрининга, чтобы положительные результаты теста приводили к вызову женщины на новое обследование. Образцы, классифицированные аппаратом как потенциально положительные, визуально проверяются цитотехником и, если они все же оказываются положительными, цитологом.Такой повторный скрининг стоит денег и снижает выгоду от машинного скрининга. Все еще могут быть приняты очень высокие уровни «машинных ложных срабатываний», например 75% для одной из коммерческих систем. Затем машину настраивают так, что только нормальные образцы классифицируются как нормальные, а все остальное также должно проверяться человеком.
4.5. Требования к производительности: юридические вопросы
Развертывание автоматизированного процесса проверки значительно усложняется юридическими аспектами.В большинстве стран, по уважительным причинам, существуют строгие правила, касающиеся того, как тестировать скрининговую машину до того, как она будет одобрена для повседневного использования. В США скрининговая машина нуждается в предварительном одобрении FDA, прежде чем она может быть продана для использования в клинической диагностике. Получение такого разрешения включает в себя подробную документацию по всем аспектам машины, а также всестороннее тестирование ее производительности в рамках крупных, хорошо задокументированных исследований. Но юридический аспект не ограничивается получением одобрения соответствующих органов.Если машина не обнаруживает в образце высококлассное поражение, и это приводит к тому, что женщина заболевает раком, к производителю машины может быть предъявлен иск о возмещении причиненного ущерба. Это может быть очень дорого, и ни один производитель не может пойти на такой риск. Поэтому процедуры использования просеивающих машин разработаны таким образом, чтобы минимизировать этот риск. Один из способов сделать это — потребовать от человека, проводящего скрининг, визуально проверить некоторые данные от каждого образца, например, набор изображений объектов, которые машина определила как наиболее «злокачественные» на образце, или несколько выбранных полей изображения. оптически через окуляр микроскопа.Таким образом, ответственность называть образец «нормальным» переходит от производителя к пользователю. Другой подход заключался в том, чтобы запустить машинный скрининг параллельно с обычным визуальным скринингом с тем обоснованием, что ошибки, совершаемые машиной и человеком, различны, и, таким образом, общая чувствительность для обнаружения злокачественности повышается. Очень консервативно, устанавливая порог, когда образец можно назвать «нормальным» без дальнейшего осмотра человеком, некоторые производители снизили риск пропуска положительного образца до уровня, когда он был признан приемлемым.В США этот порог в настоящее время находится на уровне 25%; то есть 75% всех образцов должны быть проверены как на машинах, так и на людях. Такие фиксированные пороговые значения не установлены в других частях мира.
Все эти юридические меры предосторожности призваны защитить женщин от ненужного риска заболеть раком, несмотря на то, что они прошли обследование, что, конечно, хорошо. Но они также внесли значительный вклад в тот факт, что автоматическая проверка до сих пор не оказала реального влияния на стоимость проверки.Тем не менее, большинству женщин в мире не предлагается регулярное обследование из-за высоких связанных с этим затрат. Автоматизированная система скрининга, которая почти не уступает лучшим системам визуального скрининга при значительно более низкой стоимости, могла бы спасти миллионы женщин от смерти от рака шейки матки. Но будет ли такое устройство когда-либо принято правовыми системами? Вероятно, это не будет принято в США, но, возможно, в некоторых других частях мира.
5. Заключение
В этом документе мы обрисовали 60-летнюю историю усилий по автоматизации скрининга на рак шейки матки и указали, как различные поколения систем пытались решить задачи этой сложной задачи.Мы также обсудили различные аспекты этих проблем и способы их решения. В заключение давайте обсудим, где мы находимся сегодня.
Целью автоматизированной системы проверки является снижение стоимости и / или количества ложных отрицательных результатов программы проверки. Для достижения первой цели необходимо, чтобы затраты на эксплуатацию системы, включая капитальные затраты и затраты на обслуживание в дополнение к прямым операционным затратам, были меньше, чем затраты на выполнение той же работы, которую система выполняет с помощью традиционных ручных методов.Сомнительно, чтобы коммерческие системы нынешнего поколения соответствовали этим целям. Они были больше сосредоточены на второй цели. При запуске машинного скрининга параллельно с визуальным скринингом вполне вероятно, что машина пропустит другие отклонения, кроме скрининга человека, тем самым снизив общий уровень ложноотрицательных результатов. Однако общие эксплуатационные расходы будут выше. Таким образом, доступные в настоящее время коммерческие системы могут незначительно повысить качество скрининга, но существенно не снизят стоимость.
Сегодня известно, что рак шейки матки вызывается папилломавирусной инфекцией. Альтернативным или дополнительным методом скрининга является проверка на наличие таких инфекций. Есть исследования, показывающие, что сочетание обоих видов анализа увеличивает чувствительность обнаружения предраковых поражений [63]. Тем не менее, кажется, есть ограниченное преимущество замены PAP-теста только тестом на вирусы. Знание о том, что рак вызван вирусной инфекцией, также открыло возможность вакцинации против вируса папилломы человека.Если такие программы вакцинации станут глобально всеобъемлющими, распространенность рака можно будет снизить до уровня, при котором в скрининге больше не будет необходимости. Но, к сожалению, маловероятно, что это произойдет в ближайшее время, и даже после того, как всем будет предложена вакцинация, пройдут десятилетия, прежде чем последствия охватят все возрастные группы.
Историческое развитие области скрининга происходило параллельно с фантастическим развитием компьютерных технологий. Теперь у нас есть в миллионы раз больше компьютерной мощности, доступной на доллар, чем у нас было, когда были построены первые цифровые скрининговые системы.Точно так же резко развивалась технология датчиков изображения. Даже с тех пор, как около 15 лет назад была разработана первая версия текущих коммерческих систем, в базовых технологиях был достигнут значительный прогресс. Также произошли значительные изменения в алгоритмической части, хотя, возможно, не столь драматично, как в области аппаратного обеспечения. Все это создает почву для хорошей возможности сегодня разработать действительно рентабельную систему досмотра. Скорее всего, сегодня полностью автоматизированная система досмотра может быть построена по цене, по крайней мере, на порядок ниже, чем стоимость имеющихся в настоящее время коммерческих систем.Такая система могла бы сделать экономически целесообразным внедрение комплексных систем скрининга также в более бедных частях мира и, в конечном итоге, повлиять на высокую заболеваемость раком шейки матки там. Конечно, существуют серьезные проблемы при организации эффективной программы скрининга в таких странах, но компактная и надежная автоматизированная система скрининга может иметь большое значение.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Границы | Бета-лактамазы расширенного спектра действия, продуцирующие E. coli в дикой природе, еще одна форма загрязнения окружающей среды?
Введение
Простое появление в окружающей среде устойчивости к противомикробным препаратам и соответствующих генов устойчивости — это древнее явление, которое является результатом того простого факта, что большинство используемых в настоящее время противомикробных веществ основаны на естественных прецессорах, продуцируемых почвенными бактериями, такими как Streptomycetes (D’Costa). и другие., 2011). Предполагается, что функция этих предшественников современных антибиотиков в большей степени связана с конкуренцией микробов за экологическую нишу и, таким образом, очень отличается от той роли, которую они играют в качестве «оружейного щита» в современных клинических условиях (Martinez, 2009a, b; Allen et al. ., 2010). Тем не менее рост не присущей противомикробной устойчивости патогенных бактерий начался после внедрения антибиотиков в медицину около 60 лет назад, что свидетельствует о корреляции между антимикробным давлением и возникновением устойчивости у патогенов (Allen et al., 2010; Боннедаль, 2011). Хотя мы рассматриваем обнаружение патогенов с множественной лекарственной устойчивостью, таких как бета-лактамазы с расширенным спектром действия, продуцирующих грамотрицательные бактерии в дикой природе, как новое явление, это можно было ожидать, поскольку в образцах окружающей среды уже были обнаружены устойчивые к противомикробным препаратам бактерии, отличные от изначально устойчивых почвенных организмов. без какого-либо противомикробного воздействия несколько десятилетий назад (Sato et al., 1978; Kanai et al., 1981; Hughes and Datta, 1983; Tsubokura et al., 1995).
В то время как различные виды бактерий важны с точки зрения мультирезистентности и внутрибольничных инфекций в медицине и ветеринарии, мы рассматриваем грамположительные метициллинорезистентные Staphylococcus aureus (MRSA) и бета-лактамазы расширенного спектра, продуцирующие грамотрицательные бактерии, такие как Escherichia. coli (ESBL- E. coli ) в качестве основных индикаторных патогенов для отслеживания эволюции мультирезистентных бактерий в окружающей среде и дикой природе. Оба организма с множественной устойчивостью также попали в животноводство и в домашних животных (Smet et al., 2010b; Ewers et al., 2011; Wieler et al., 2011). Последние данные эпиднадзора за устойчивостью этих организмов к противомикробным препаратам в клинических условиях у людей демонстрируют две основные тенденции. Согласно базе данных EARS-NET, распространенность MRSA оставалась на высоком, но стабильном уровне в течение последних лет, тогда как распространенность ESBL- E. coli постоянно возрастала в течение последнего десятилетия. Хотя большинство ESBL по-прежнему регистрируется из клинических изолятов человека (Bradford, 2001; Bonnet, 2004; Pitout, 2010), они также все чаще регистрируются при внебольничных бактериальных инфекциях.Это указывает на то, что ESBL- E. coli вышли из клиник, были успешно переданы и в настоящее время сохраняются в сообществе (Arpin et al., 2005; Pitout et al., 2005; Wieler et al., 2011). ).
Чтобы понять динамику распространения ESBL- E. coli в естественной среде за пределами популяции человека и домашних животных, важно также иметь в виду общую популяцию E. coli . E. coli встречается повсеместно и бессимптомно колонизирует кишечник птиц и млекопитающих.Таким образом, E. coli обнаруживаются во всем мире не только в кишечнике, но и в окружающей среде (Wirth et al., 2006; Goldberg et al., 2008; Rwego et al., 2008). Кишечная популяция E. coli у млекопитающих и птиц сильно различается между особями даже одного вида. Вот почему знания о популяции E. coli одного вида на самом деле скудны и ограничиваются только отдельными исследованиями, которые не представляют вид в целом (Schierack et al., 2008а, б; Leser and Molbak, 2009). Однако очевидно, что использование противомикробных соединений приводит к селекции устойчивых клонов, причем одним из механизмов является горизонтальный перенос генов между штаммами (LeClerc et al., 1996).
Хотя до сих пор неясно, как ESBL- E. coli попадает в естественную среду, они наблюдались в окружающей среде через два десятилетия после первых вспышек ESBL- E. coli в клинических условиях у людей ( Kitzis et al., 1988; Bauernfeind et al., 1989; Коста и др., 2006). Одновременно произошло распространение ESBL- E. coli в сообществе, и можно было бы предположить, являются ли экологические ESBL- E. coli вторичной формой загрязнения окружающей среды из-за сильного влияния человека (Arpin et al., 2005). ; Pitout et al., 2005; Martinez, 2009a). Интересно, что первые сообщения о ESBL- E. coli в дикой природе датируются вскоре после их появления в животноводстве, что также может указывать на распространение ESBL- E.coli в окружающую среду (Kummerer, 2009). Кажется маловероятным, что патогены, выделенные из диких животных, приобрели устойчивость в результате новых параллельных мутаций в соответствующих генах. Горизонтальный перенос генов устойчивости из клинических изолятов или поступление уже устойчивых бактерий из человеческих отходов, сточных вод и навоза домашних животных может быть более вероятным (Kummerer, 2009; Martinez, 2009b).
Escherichia coli из дикой природы может, таким образом, проявлять полирезистентный фенотип не из-за близкого использования противомикробных или противомикробных препаратов в субтерапевтических концентрациях в естественной среде, а потому, что удаленное использование привело к развитию мультирезистентного организма, который впоследствии распространился на различные экологические ниши (O’Brien, 2002).Присутствие комменсальных и патогенных бактерий в фекальных загрязнениях можно предположить как связь между условиями с регулярным или даже постоянным антимикробным давлением (животноводство, аквакультура, человеческие и ветеринарные клинические учреждения) и окружающей средой, что приводит к постоянному высвобождению антибиотика. -резистентные бактерии человека и животных попадают в окружающую среду через сточные воды или навоз (Martinez, 2009b). Обнаружение устойчивых к противомикробным препаратам бактерий в водной среде, подверженной воздействию сточных вод человека и животных и почвы, является доказательством этой гипотезы (Kummerer and Henninger, 2003).В этом контексте широкое использование антибиотиков в аквакультуре рыб также имеет первостепенное значение из-за возможного прямого воздействия на водоплавающих птиц (Baquero et al., 2008; Smith, 2008). Поскольку кишечные бактерии, такие как E. coli , могут легко распространяться в различных экосистемах через воду, они интенсивно используются в качестве индикаторных видов для загрязнения фекалиями, но S. aureus также регулярно выделяется из образцов фекалий. Следовательно, их также можно использовать для отслеживания эволюции устойчивости к противомикробным препаратам в различных экосистемах (Van Den Bogaard et al., 2000). Более того, E. coli , несмотря на свой комменсальный характер, часто вызывает инфекции животных и человека, требующие использования антибиотиков, что добавляет проблемы общественного здравоохранения к списку последствий, возникающих в результате распространения ESBL- E. coli в дикой природе.
В отличие от исследований появления ESBL- E. coli у людей и домашних животных, их присутствие в дикой природе редко рассматривалось. Таким образом, в этом обзоре обобщены имеющиеся в настоящее время данные о присутствии ESBL- E.coli в дикой природе, концентрируясь на птицах и грызунах. Он направлен на повышение осведомленности о насущной необходимости сбора знаний о воздействии ESBL- E. coli на микробиоту диких животных и вытекающих из этого последствиях для окружающей среды и здоровья населения, признавая зоонозный потенциал E. coli и его численность в природе (Allen et al., 2010; Bonnedahl, 2011).
Бета-лактамные антибиотики
Класс бета-лактамных антибиотиков входит в число наиболее важных групп противомикробных средств в медицине и ветеринарии.Химические вещества в основном идентичны в обеих областях клинического применения. Помимо первого широко используемого противомикробного вещества пенициллина, другие члены этого семейства приобрели такое же значение за последние десятилетия, а именно цефалоспорины первого-четвертого поколений и ингибиторы бета-лактамаз. В ветеринарии немногочисленные существующие исследования подтверждают, что бета-лактамные противомикробные препараты являются наиболее часто назначаемыми противомикробными средствами мелким животным (DANMAP, 2007; SVARM, 2008).В животноводстве в последние годы наблюдалось снижение использования бета-лактамных противомикробных препаратов (NORM / NORM-VET, 2010), в основном из-за ограничений в рецептах. Все бета-лактамы препятствуют заключительному этапу синтеза пептидогликана, воздействуя на пенициллин-связывающие белки, тем самым препятствуя формированию стенки бактериальной клетки. Пептидогликан составляет слой между внешней мембраной и цитоплазматической мембраной, который поддерживает форму клетки и защищает бактерии от осмотических сил.Наиболее распространенный механизм резистентности Enterobacteriaceae spp. Против бета-лактамов происходит инактивация препарата путем гидролитического расщепления кольцевой системы бета-лактамов (Greenwood, 2000).
Бета-лактамазы
В настоящее время известно более 400 различных ферментов бета-лактамаз, обладающих одним и тем же механизмом устойчивости, но различающихся диапазоном субстратов и чувствительностью к ингибирующим веществам. Бета-лактамазы с расширенным спектром действия обладают расширенным спектром субстратов, и это напрямую повлияло на глобальные изменения в эпидемиологии бета-лактамаз с начала 1990-х годов в медицине человека и с 2000 года в ветеринарии (Kong et al., 2010; Pitout, 2010; Smet et al., 2010b). Термин расширенный спектр определяет способность БЛРС гидролизовать более широкий спектр бета-лактамных противомикробных препаратов, чем исходные бета-лактамазы, из которых они были первоначально получены. Хотя они способны инактивировать бета-лактамные противомикробные препараты, содержащие оксимино-группу, такую как оксимино-цефалоспорины (например, цефтазидим, цефотаксим), а также оксимино-монобактам (азтреонам), БЛРС не активны в отношении цефамицинов и карбапенемов. Они обычно ингибируются ингибиторами бета-лактамаз, такими как клавулановая кислота и тазобактам, что указывает на разницу между бактериями, продуцирующими ESBL и AmpC-бета-лактамазы (Bradford, 2001).Было описано несколько различных схем классификации бактериальных бета-лактамаз, включая систему, разработанную Bush et al. (1995), который основан на активности бета-лактамаз в отношении различных противомикробных препаратов бета-лактама, и наиболее широко используемой в настоящее время системе Ambler, которая делит бета-лактамазы на четыре класса (A, B, C и D) на основе от их аминокислотных последовательностей (Ambler, 1980). Большинство БЛРС относятся к классу А Амблера и группе 2be Буша. БЛРС были обнаружены у широкого круга грамотрицательных бактерий, но подавляющее большинство бактериальных хозяев принадлежат к семейству Enterobacteriaceae, включая Klebsiella spp., E. coli , Salmonella enterica , Citrobacter spp. И Enterobacter spp. (Брэдфорд, 2001). Четыре семейства ферментов, а именно бета-лактамазы TEM (Temoneira), бета-лактамазы SHV (сульфгидрильная вариабельная), бета-лактамазы CTX (цефотаксимаза) -M-типа и бета-лактамазы OXA (оксациллиназы) в настоящее время являются считались наиболее распространенными БЛРС среди Enterobacteriaceae spp. Бета-лактамазы ТЕМ-типа являются производными ТЕМ-1, который был впервые продемонстрирован в 1965 году на E.coli , полученный от пациента по имени Temoneira в Афинах, Греция, и TEM-2, и состоит из более чем 150 различных ферментов. В то время как большинство бета-лактамаз ТЕМ представляют собой БЛРС, ТЕМ-1, ТЕМ-2 и ТЕМ-13 способны гидролизовать только производные пенициллина и, таким образом, не рассматриваются как БЛРС (Livermore, 1995).
Подобно ферментам типа ТЕМ, большинство ферментов SHV представляют собой БЛРС. Все известные в настоящее время ферменты SHV являются производными SHV-1 и SHV-2. В то время как SHV-1 просто придает устойчивость к пенициллинам широкого спектра действия, SHV-2, который был впервые описан в 1983 году у штамма Klebsiella ozaenae , выделенного в Германии, способен гидролизовать цефотаксим (Gupta, 2007).В отличие от бета-лактамаз TEM- и SHV-типа, большинство членов семейства бета-лактамаз OXA-типа не считаются БЛРС, поскольку они не гидролизуют цефалоспорины третьего поколения, за исключением OXA-10, OXA-2. , и их производные. Однако различные OXA-типы (OXA-карбапенемазы) играют важную роль в устойчивости к противомикробным препаратам, например, Acinetobacter baumannii (Pfeifer et al., 2010).
В настоящее время наиболее важным семейством ферментов БЛРС считаются бета-лактамазы CTX-M-типа, названные в честь их способности гидролизовать цефотаксим.Предполагается, что они происходят от бета-лактамаз из Kluyvera spp. и в настоящее время включают более 70 различных ферментов CTX-M, разделенных на пять групп в зависимости от их аминокислотной последовательности (CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 и CTX- M-25; Hawkey and Jones, 2009; Pitout, 2010; Naseer, Sundsfjord, 2011). AmpC – бета-лактамазы придают устойчивость к большинству бета-лактамных противомикробных препаратов, за исключением метокси-имино-цефалоспоринов (цефепим) и карбапенемов, хотя они не инактивируются ингибиторами бета-лактамаз, такими как клавулановая кислота.
В последние годы появление бета-лактамаз, гидролизующих карбапенем, таких как NDM-1, KPC и OXA, поставило под угрозу клиническую применимость этого класса антибиотиков (Pfeifer et al., 2010, 2011; Poirel et al., 2010; Walsh , 2010). Карбапенемазы — это бета-лактамазы, которые активны не только против оксиимино-цефалоспоринов и цефамицинов, но также способны гидролизовать карбапенемы, такие как имипенем или меропенем. Эти вещества часто являются «последней линией защиты» при лечении инфекций, вызванных мультирезистентными грамотрицательными патогенами.Эта группа бета-лактамаз очень разнообразна и может быть найдена в трех различных классах бета-лактамаз (класс A, B и D). Подробная информация об этих ферментах содержится в отличных обзорах (Walsh, 2010; Patel and Bonomo, 2011).
БЛРС у человека и домашних животных
Первая внутрибольничная вспышка БЛРС типа CTX-M-1 была зарегистрирована в отделении интенсивной терапии больницы в Париже, Франция (Kitzis et al., 1988). Вскоре после этого Bauernfeind et al. (1989) сообщили о клиническом устойчивом к цефотаксиму E.coli в Германии, который продуцировал бета-лактамазу типа CTX-M-1. В последующие 10 лет в нескольких исследованиях сообщалось о взрывном распространении БЛРС в клинических условиях у людей по всему миру (Bernard et al., 1992; Gniadkowski et al., 1998; Radice et al., 2002; Canton and Coque, 2006). В нескольких обзорных статьях содержится подробное описание возникновения и молекулярной эпидемиологии энтеробактерий, продуцирующих БЛРС, у людей и животных (Bradford, 2001; Bonnet, 2004; Canton and Coque, 2006; Livermore et al., 2007; Cantón et al., 2008; Oteo et al., 2010; Pfeifer et al., 2010; Pitout, 2010; Wieler et al., 2011).
Примерно с 2000 года ферменты CTX-M сформировали быстрорастущее семейство БЛРС в клинических и общественных условиях человека (Bonnet, 2004; Pitout and Laupland, 2008; Mshana et al., 2009), тогда как преобладание классических ферментов ESBL как TEM или SHV уменьшается (Livermore et al., 2007). С началом двадцать первого века E. coli , продуцирующая CTX-M-15, возникла и распространилась по всему миру как важная причина как внутрибольничных, так и внебольничных инфекций мочевыводящих путей и кровотока у людей (Coque et al., 2008; Хантер и др., 2010; Oteo et al., 2010; Pitout, 2010). Ряд молекулярно-эпидемиологических исследований показал, что на внезапное увеличение количества E. coli , продуцирующего CTX-M-15, во всем мире в значительной степени повлияло распространение одной клональной группы штаммов, а именно B2: O25b: h5-ST131-CTX. -M-15 на разных континентах (Nicolas-Chanoine et al., 2008; Rogers et al., 2011). Недавнее появление еще одной клональной группы, ABD-O1: H6-ST648-CTX-M-15, предполагает возможность глобального распространения лишь ограниченного числа клонов (Doi et al., 2010; Зонг и Ю, 2010; Ван Дер Бидж и др., 2011; Wieler et al., 2011). Выявление микроэволюции штаммов этих клонов в местах обитания и экологических нишах, помимо людей и ветеринарных клиник, дает возможность понять, что приводит к сохранению ESBL- E. coli в окружающей среде, в которой отсутствует селективное давление антибиотиков.
В области ветеринарии бета-лактамаза типа SHV-12, продуцирующая E. coli , была первой клинической бактерией, продуцирующей БЛРС, выделенной от собаки с рецидивирующей инфекцией мочевыводящих путей в Испании в 1998 году (Teshager et al., 2000). За этим последовало обнаружение ESBL, продуцирующего E. coli (в основном TEM и SHV), у собак из Италии и Португалии (Feria et al., 2002; Carattoli et al., 2005). Совсем недавно в нескольких исследованиях сообщалось о сопутствующих исследованиях. животные в качестве хозяев для ESBL- E. coli , несущего ферменты CTX-M, что позволяет предположить, что ферменты типа CTX-M будут доминировать в ветеринарии и в будущем (Vo et al., 2007; Carattoli, 2008; O’Keefe et al., 2010; Smet et al., 2010b). Это подтверждается появлением клонально связанной группы E. coli B2-O25b: h5-ST131-CTX-M-15 в области домашних животных (Pomba et al., 2009; Ewers et al. ., 2010, 2011; Biohaz, 2011; Wieler et al., 2011).
Бета-лактамазы расширенного спектра, в основном TEM, CTX-M и SHV-типа, часто обнаруживались в микробиоте сельскохозяйственных животных, что было хорошо изучено Smet et al. (2010b). В течение последнего десятилетия количество публикаций, сообщающих о ESBL- E.coli , выделенных от сельскохозяйственных животных, резко возросло. Примечательно, что большинство ферментов БЛРС, идентифицированных в E. coli домашнего скота, также присутствуют в бактериях, полученных от человека (Smet et al., 2010b).
БЛРС в дикой природе
Историческая перспектива
Первые сообщения о наличии детерминант устойчивости у E. coli из популяций людей и животных, лишенных селективного противомикробного воздействия, относятся к 1960-м годам (Mare, 1968).Устойчивые к противомикробным препаратам Изоляты E. coli , происходящие от диких животных, были впервые зарегистрированы в начале 1980-х годов от японских диких птиц (Sato et al., 1978; Kanai et al., 1981; Tsubokura et al., 1995). и 5 лет спустя у южноафриканских павианов, питающихся человеческими отходами (Rolland et al., 1985; Routman et al., 1985). В новом тысячелетии количество исследований, описывающих появление устойчивых к противомикробным препаратам E. coli в дикой природе, значительно увеличилось (Gilliver et al., 1999; Соуза и др., 1999; Шерли и др., 2000; Fallacara et al., 2001; Ливермор и др., 2001; Остерблад и др., 2001; Swiecicka et al., 2003; Коул и др., 2005; Лиллехауг и др., 2005; Миддлтон и Амброуз, 2005; Sayah et al., 2005; Скурник и др., 2006; Долейска и др., 2007; Literak et al., 2007; Караттоли, 2008; Джионечетти и др., 2008; Ewers et al., 2009; Guenther et al., 2010c).
Однако обнаружение ESBL- E. coli из дикой природы датируется только 2006 годом (Costa et al., 2006). С тех пор последовало несколько отчетов (Costa et al., 2008; Poeta et al., 2008, 2009; Bonnedahl et al., 2009, 2010; Dolejska et al., 2009; Literak et al., 2009a, b, 2010; Guenther et al., 2010a, b; Hernandez et al., 2010; Pinto et al., 2010; Radhouani et al., 2010; Simoes et al., 2010; Smet et al., 2010b; Garmyn et al., 2011; Ho et al., 2011; Silva et al., 2011; Sousa et al., 2011; Wallensten et al., 2011).
Географическая перспектива
Хотя ESBL-, изоляты E. coli дикого происхождения были зарегистрированы только в Европе (Costa et al., 2008; Поэта и др., 2008, 2009; Боннедаль и др., 2009, 2010; Долейска и др., 2009; Literak et al., 2009b, 2010; Guenther et al., 2010a, b; Пинто и др., 2010; Радхуани и др., 2010; Simoes et al., 2010; Гармин и др., 2011; Сильва и др., 2011; Соуза и др., 2011; Wallensten et al., 2011), Африке (Literak et al., 2009a) и Азии (Hernandez et al., 2010; Ho et al., 2011), их отсутствие в Северной и Южной Америке, Антарктиде и Австралии может просто отражают разное количество исследований, проведенных на этих континентах.Как полирезистентный , E. coli уже сообщалось с этих континентов (Souza et al., 1999; Sherley et al., 2000; Fallacara et al., 2001; Cole et al., 2005; Middleton and Ambrose, 2005; Sayah et al., 2005; Kozak et al., 2009; Silva et al., 2009) можно было ожидать присутствия ESBL- E. coli дикого происхождения. Тем не менее, данные с одного континента или региона могут не служить подходящей базой для другого и могут не коррелировать с уровнем использования антибиотиков в соответствующих регионах.Помимо простых географических эффектов, таких как континент происхождения, кажется более подходящим пересмотреть тип региона, откуда происходят изоляты. Параметры, которые были приняты в качестве важных критериев, включают состояние естественной сохранности, поголовье скота и плотность населения или удаленность местности (Allen et al., 2010). Уровень резистентных бактерий, наблюдаемый у диких животных, по-видимому, хорошо коррелирует со степенью связи с деятельностью человека (Skurnik et al., 2006; Allen et al., 2010). Тем не менее, в нескольких исследованиях сообщается о наличии ESBL- E. coli в отдаленных местах или заповедных зонах (Hernandez et al., 2010; Pinto et al., 2010), что подчеркивает сложность распространения устойчивости к противомикробным препаратам у диких животных. . Эти данные предполагают, с одной стороны, влияние миграционного поведения диких птиц, например, в отдаленные районы, или, с другой стороны, вездесущее влияние человека в различных экологических нишах планеты в основном через человеческие фекалии.Большинство исследований по ESBL- E. coli в дикой природе происходят из Центральной Европы, района с высокой плотностью поголовья скота и людей и предполагаемым частым взаимодействием дикой природы с любой подверженной влиянию человеком средой обитания, такой как животноводческие фермы, свалки, канализационные системы или сточные воды. очистных сооружений, что повышает риск заражения диких животных устойчивыми к антибиотикам бактериями (Allen et al., 2010). Ранее было показано, что у чаек общие штаммы E. coli и изоляты, выращенные на свалках и очистных сооружениях (Nelson et al., 2008). Это подчеркивает возможность бактериального обмена между сточными водами человека и птицами.
Как показано в Таблице 1, уровни обнаружения ESBL- E. coli в различных географических районах варьировались от 0,5% у птиц отдаленных Азорских островов в Атлантическом океане (Silva et al., 2011) до 32% у птиц Иберийский полуостров (Simoes et al., 2010). Однако, безусловно, следует помнить о различиях в отношении видов-хозяев, схем отбора проб и географических регионов, а также об ограничениях, которые возникают из-за этого при интерпретации этих данных.Тем не менее, для Центральной Европы количество выполненных исследований относительно велико, и, похоже, нет разницы в уровнях обнаружения между сельскохозяйственными землями или городской средой по сравнению с природными заповедниками, поскольку в обоих типах областей уровень обнаружения выше, чем Наблюдалось 20% (таблица 1). Только в отдаленных районах, таких как Азорские острова или полуостров Камчатка, показатели ниже с примерно 1% ESBL- E. coli (Hernandez et al., 2010; Silva et al., 2011), что свидетельствует о возможном разбавляющем эффекте загрязнения диких животных ESBL- E. coli . Тем не менее наши собственные данные по хищным птицам из монгольской пустыни Гоби, района с самой низкой плотностью населения, показали, что показатели ESBL сопоставимы с ситуацией в Центральной Европе (Guenther et al., 2010c).
Таблица 1 . Присутствие бета-лактамаз расширенного спектра, продуцирующих E. coli , в дикой природе в хронологическом порядке согласно дате публикации .
Перспектива видов-хозяев
Общая информация о микробиоте диких птиц и грызунов скудна и ограничена отдельными видами как хозяевами определенных патогенов. E. coli — обычная желудочно-кишечная, но очень универсальная бактерия, которую можно разделить на непатогенные (комменсальные) и патогенные штаммы; последние вызывают кишечные или внекишечные заболевания у людей и животных (Johnson and Russo, 2002; Wirth et al., 2006).Повсеместное распространение E. coli обусловлено его бессимптомной колонизацией кишечника птиц и млекопитающих и, в свою очередь, его распространением в окружающей среде (Rwego et al., 2008; Schierack et al., 2008a). Степень колонизации сильно различается у разных видов птиц (Gordon and Cowling, 2003), и то же самое было показано для грызунов и мелких млекопитающих (Swiecicka et al., 2003; Guenther et al., 2010c). E. coli , скорее всего, будет изолирована от всеядных птиц и млекопитающих (Gordon and Cowling, 2003).Было обнаружено, что более 30 видов диких животных выделяют ESBL- E. coli , и большинство из них — птицы или грызуны (Таблица 1). Таким образом, на появление ESBL- E. coli явно влияет спектр хозяев E. coli и, кроме того, степень синантропного поведения, проявляемого видами животных-хозяев. Другими словами, животные, живущие в урбанизированных районах, с большей вероятностью являются носителями E. coli , чем животные, живущие в отдаленных районах (Allen et al., 2010; Bonnedahl, 2011).
Другие основные вопросы, касающиеся наличия ESBL- E. coli в образцах фекалий, до сих пор не решены. Поэтому в будущих исследованиях следует рассмотреть природу обилия этих мультирезистентных штаммов в фекалиях, чтобы выяснить, просто ли они выделяются в короткие сроки, представляют ли они временную или долгосрочную колонизацию кишечника животных бессимптомно или даже являются стойкими инфекциями.
При обзоре текущей литературы выясняется, что дикие птицы могут быть основными дикими животными-хозяевами для ESBL- E.coli . Такое впечатление создается потому, что большинство исследований проводилось на диких птицах; однако с учетом исследований с участием других диких животных, таких как олени, мелкие жвачные, мелкие и крупные хищники, зайцеобразные, рептилии и земноводные (Costa et al., 2006; Literak et al., 2009b), незначительное количество ESBL- Наблюдалась E. coli .
Из-за своего разнообразия экологических ниш и легкости улавливания человеческих и экологических бактерий дикие птицы могут действовать как зеркало человеческой деятельности.Внутри гетерогенного класса птиц две группы, по-видимому, находятся в центре распространения БЛРС в дикой природе: водоплавающие птицы / виды, связанные с водой (Poeta et al., 2008; Bonnedahl et al., 2009, 2010; Dolejska et al., 2009; Guenther et al., 2010b; Hernandez et al., 2010; Literak et al., 2010; Simoes et al., 2010; Garmyn et al., 2011; Wallensten et al., 2011) и хищных птиц (Costa et al. , 2006; Pinto et al., 2010; Radhouani et al., 2010; подробная информация о видах представлена в таблице 1). Другие группы птиц, такие как воробьиные (Guenther et al., 2010a; Silva et al., 2011), по-видимому, реже переносят ESBL- E. coli , а иногда и вовсе не переносят (Silva et al., 2010). На это открытие могут повлиять различия в составе микробиоты и наличие E. coli среди этих разнообразных видов птиц. В недавнем исследовании мы смогли показать, что если E. coli можно выделить от разных видов птиц, то мультирезистентные клоны E. coli произошли от хищных или водоплавающих птиц (Guenther et al., 2010г). Другими зарегистрированными птицами-хозяевами были Совы (Коста и др., 2006; Пинто и др., 2010) и Вороны (Пинто и др., 2010), птицы, которые демонстрируют пищевое поведение, сопоставимое с хищными птицами.
В то время как преобладание водоплавающих птиц в спектре птичьих хозяев ESBL- E. coli можно объяснить фекальным загрязнением воды людьми или домашним скотом, сценарии передачи для другой основной группы — хищных птиц — кажутся более сложными. сложный. Поскольку хищные птицы находятся на вершине пищевой цепи, они могут накапливать ESBL- E.coli от их типичных жертв, таких как мыши и землеройки. Предположительно, из-за своего синантропного поведения они чаще контактируют с людьми или домашним скотом. Действительно, для мышей было показано, что близость к животноводческому хозяйству увеличивает скорость распространения мультирезистентной E. coli (Kozak et al., 2009). Хотя грызуны ранее были в центре внимания исследований ESBL в дикой природе (Gilliver et al., 1999; Kozak et al., 2009; Literak et al., 2009b; Guenther et al., 2010c), насколько нам известно ESBL- E.coli еще не обнаружены у грызунов, за исключением городских крыс (Guenther et al., 2010b; Ho et al., 2011).
Наши собственные данные из Германии показали очень низкую численность полирезистентной E. coli у грызунов и землероек, что указывает на то, что возможны другие группы добычи и пути передачи между экосферой, подверженной влиянию человека, и хищными птицами (Guenther et al., 2010c). Кроме того, многие виды птиц, у которых был положительный результат теста на ESBL- E.coli демонстрируют миграционное поведение, которое обеспечивает возможный механизм для создания новых эндемичных очагов на больших расстояниях от того места, где впервые был приобретен мультирезистентный микроорганизм (Bonnedahl, 2011).
Как упоминалось выше, другим важным хозяином ESBL- E. coli , по-видимому, является группа грызунов, а именно норвежские крысы и черные крысы, у которых имеются сообщения об изолятах, продуцирующих ESBL, с разных континентов (Literak et al., 2009a; Guenther et al., 2010b; Ho et al., 2011). Этот синантропный вид может легко собирать отходы жизнедеятельности человека и часто взаимодействует с человеческими фекалиями в канализационной системе в городских условиях и поэтому может легко приобретать бактерии с множественной устойчивостью. Интересно, что о диких кабанах также сообщалось в качестве хозяев ESBL- E. coli в Центральной Европе, что может отражать их всеядное поведение при кормлении (Literak et al., 2009b; Poeta et al., 2009). Другими млекопитающими, которые оказались положительными хозяевами бактерий, продуцирующих БЛРС, были олени и лисы (Costa et al., 2006). Совсем недавно появилось сообщение о морской рыбе, леще Gilthead Sea (Sousa et al., 2011) как переносчике ESBL- E. coli , что указывает на распространение ESBL- E. coli в Атлантику. океан.
Перспектива ферментов БЛРС
Параллельно с текущей ситуацией в медицине и ветеринарии, в типах бета-лактамаз расширенного спектра, обнаруженных у диких животных, явно преобладает генное семейство bla CTX-M .За исключением одного исследования (Sousa et al., 2011), все исследования дикой природы идентифицировали гены bla CTX-M в качестве основного фермента БЛРС. В 35% исследований дополнительно были обнаружены различные ферменты SHV. Как показано в таблице 1, в большинстве исследований сообщается о bla CTX-M-1 , за которым следует bla CTX-M-15 , bla CTX-M-14 , bla CTX-M-32 и bla CTX-M-9 . Лишь изредка bla CTX-M-2 , bla CTX-M-13 , bla CTX-M-55 и bla CTX-M-65 (таблица 1).Помимо семейства bla CTX-M , часто обнаруживались только bla SHV-12 и bla TEM-52 . Другими менее распространенными генами ESBL были bla OXA-1 , bla SHV-5 и bla TEM-20 . Спектр различных типов ферментов, обнаруженных у диких животных, очень узок по сравнению с клиническими изолятами человеческого и ветеринарного происхождения (Pitout, 2010; Smet et al., 2010b).Хотя причина этого неизвестна, мы предлагаем следующие гипотезы: эти результаты могут просто отражать небольшое количество исследований, проведенных на дикой природе до настоящего времени, или они могут указывать на то, что определенные типы бета-лактамаз более успешны в окружающей среде, например из-за совместного отбора других генов нерезистентности, сопровождаемых этими бета-лактамазами. Другое объяснение может заключаться в том, что типы ESBL, обнаруженные у диких животных, просто отражают те, которые наиболее распространены в медицинских и ветеринарных клиниках и в животноводстве, такие как bla CTX-M-1 или bla CTX- M-15 (Pitout, 2010; Smet et al., 2010b). Это может привести к предположению, что ситуация, которую мы наблюдаем у диких животных, просто представляет собой побочный эффект от клиник и животноводства. Если это было правдой, то в будущих исследованиях, по-видимому, должно быть обнаружено увеличение числа этих пандемических типов CTX-M-15, примером которых являются клональные линии E. coli ST131 и ST648. В нескольких исследованиях было обнаружено сходство общих профилей резистентности изолятов диких животных с клиническими изолятами человека или ветеринара, что подтверждает эту гипотезу (Costa et al., 2008; Literak et al., 2009b; Guenther et al., 2010d). Наиболее распространенным фенотипом нерезистентности к БЛРС у диких животных E. coli является устойчивость к стрептомицину, ампициллину и тетрациклину. Эта модель также очень распространена в популяциях людей и домашнего скота в Европе (Van Den Bogaard et al., 2000; Guerra et al., 2003). Как упоминалось выше, типы генов ESBL в основном одинаковы у людей, домашнего скота и диких животных, что подтверждает гипотезу о том, что изоляты диких животных похожи на изоляты, обнаруженные у животных и людей.Однако, поскольку распространение генов ESBL в значительной степени обусловлено горизонтальным переносом генов через плазмиды, возникновение идентичных генов ESBL также может быть основано на распространении плазмид ESBL, которые случайным образом распределены в окружающей среде. Таким образом, раскрытие основы распространения ESBL- E. coli на дикую природу должно включать как характеристику клональной природы бактериальных штаммов, выделенных от разных хозяев, так и точную идентификацию генов ESBL и их эписомальных данных. или хромосомная локализация.
Зоонозная потенциальная перспектива
Что касается основного вопроса о зоонозном потенциале E. coli , полезно обратиться к популяционной генетике этого вида бактерий. Помимо сравнительного анализа всего генома бактерий, это также можно сделать с помощью других подходов, таких как многолокусное типирование последовательностей (MLST). Хотя он основан только на небольшом наборе маркерных генов, этот метод, по-видимому, отражает микроэволюцию основного генома E. coli .В целом, анализ MLST выявил существование штаммов, принадлежащих к идентичным типам последовательностей (ST) и изолированных от разных хозяев, что является скорее правилом, чем исключением. Это указывает на общую филогению и, следовательно, на зоонозный потенциал большинства проанализированных штаммов (Wirth et al., 2006). Действительно, несколько исследовательских групп обнаружили кластеры E. coli , вызывающие системные инфекции у птиц, инфекции мочевыводящих путей и неонатальный менингит у людей, которые генетически настолько похожи, что можно предположить зоонозный потенциал (Johnson and Russo, 2002; Ewers et al. al., 2007; Moulin-Schouleur et al., 2007). Пока количество ESBL- E. coli из дикой природы в этой глобальной базе данных довольно ограничено. Однако, если одни и те же кластеры E. coli могут вызывать заболевание у людей и домашних птиц, сценарии их передачи становятся важными, и такие пути передачи действительно являются вероятным механизмом передачи ESBL- E. coli от человека к диким птицам. наоборот.
Чтобы ответить на вопрос о сходстве клинических проявлений человека, домашнего скота, домашних животных и диких животных ESBL- E.coli нам необходимо получить представление о клональном родстве изолятов из всех этих групп. Первоначальный MLST в сочетании с гель-электрофорезом в импульсном поле (PFGE) является идеальным инструментом для выявления клонального родства или даже клональной идентичности эпидемиологически неродственных изолятов. Эта попытка была выдвинута в небольшом количестве исследований на диких птицах, во всех четко указывается, что аналогичные ST или клональные группы присутствуют у людей, домашних животных и диких птиц (Bonnedahl et al., 2009, 2010; Guenther et al. ., 2010a; Эрнандес и др., 2010; Simoes et al., 2010). В целом, у диких птиц ESBL- E. coli было обнаружено до 35 различных ST (Таблица 1; Рисунок 1). Хотя некоторые из «птичьих» ST появлялись дважды в различных исследованиях дикой природы, таких как ST746 (Bonnedahl et al., 2009; Hernandez et al., 2010), и еще не были обнаружены в клинических образцах людей, большинство ST обнаружено у птиц. ESBL- E. coli , такой как ST131, ST10, ST90, ST648 или ST69, также присутствует в клинических изолятах человека.
Рис. 1. Минимальное остовное дерево (MSTree) типов последовательностей человека, домашних животных и диких животных, известных для получения ESBL, на основе данных базы данных MLST (http://mlst.ucc.ie/mlst/dbs/Ecoli ; n = 288 изолятов, идентифицируемых как БЛРС, октябрь 2011 г.), ранее опубликованные статьи с клиническими данными о людях (Minarini et al., 2007; Yumuk et al., 2008; Blanco et al., 2009; Hrabak et al., 2009). ; Naseer et al., 2009; Oteo et al., 2009; Сузуки и др., 2009; Valverde et al., 2009; Коэльо и др., 2010; Cortes et al., 2010; Пейрано и др., 2010; Смет и др., 2010а; Зонг и Ю, 2010; Бен Слама и др., 2011; Джамджян и др., 2011; Леверштейн-Ван Холл и др., 2011; Мшана и др., 2011; Ван Дер Бидж и др., 2011; Woerther et al., 2011) и данные о дикой природе, приведенные в таблице 1 . Красный: изоляты человека, зеленый: домашние животные, желтый: дикая природа, серый цвет с недостаточной проработкой: комплексы последовательностей, рассчитанные с помощью Bionumerics 6.6 (Applied Maths, Бельгия).
На рисунке 1 показано минимальное остовное дерево (MSTree), отображающее ESBL – ST человека, домашних животных и диких животных на основе данных базы данных MLST по состоянию на октябрь 2011 г. и текущей литературы по изолятам ESBL- человека и животных E. coli , обеспечивающим Данные MLST (Minarini et al., 2007; Yumuk et al., 2008; Blanco et al., 2009; Hrabak et al., 2009; Naseer et al., 2009; Oteo et al., 2009; Sidjabat et al., 2009; Suzuki et al., 2009; Valverde et al., 2009; Coelho et al., 2010; Doi et al., 2010; Пейрано и др., 2010; Смет и др., 2010а; Зонг и Ю, 2010; Бен Слама и др., 2011; Джамджян и др., 2011; Леверштейн-Ван Холл и др., 2011; Мшана и др., 2011; Ван Дер Бидж и др., 2011; Woerther et al., 2011). В MSTree каждый кружок представляет собой ST, и размер кружка пропорционален количеству изолятов ESBL- E. coli , принадлежащих к этому ST. Здесь становится удивительно ясно, что ESBL- E. coli из дикой природы, домашних животных и человека имеют идентичные ST, что свидетельствует о межвидовой передаче филогенетически родственных мультирезистентных штаммов.Эта гипотеза дополнительно подкрепляется обнаружением появляющейся во всем мире клональной группы E. coli , обозначенной как B2-O25b: h5-ST131, у человека (Nicolas-Chanoine et al., 2008), в ветеринарных клинических условиях (Ewers et al. , 2010), а также у сизой крылатой чайки на Камчатке (Hernandez et al., 2010).
В другом исследовании (Bonnedahl et al., 2010) на юге Швеции было обнаружено ESBL- E. coli нескольких новых ST, включая ST1646, который тесно связан с ST648, который ранее также обнаруживался у диких птиц в Германии (Guenther et al., 2010a) и у людей в Африке, Азии и США (Doi et al., 2010; Zong and Yu, 2010). Интересно, что ST648 был обнаружен как один из ST, связанных с переносом недавно появившейся карбапенемазы NDM-1, что подчеркивает непредвиденные последствия проникновения определенных мультирезистентных клонов в популяции диких птиц (Mushtaq et al., 2011).
Как упоминалось выше, в настоящее время существует три исследования, которые предоставляют доказательства частой встречаемости ESBL- E.coli у крыс (Literak et al., 2009a; Guenther et al., 2010b; Ho et al., 2011). Однако сравнительные данные о клональном родстве этих изолятов и людей или домашних животных, оцененные с помощью MLST или PFGE, ограничиваются только одним исследованием (Guenther et al., 2010b). Здесь был обнаружен ESBL- E. coli от крысы, принадлежащей к пандемическому клону B2-O25b: h5-ST131, что может указывать на прямую передачу от фекалий человека крысе в городской канализационной системе.
Заключение
Текущие данные по ESBL- E.coli у диких животных показывает, что носительство этих мультирезистентных штаммов широко распространено по крайней мере в некоторых диких популяциях, таких как водоплавающие птицы, хищные птицы и грызуны, хотя они никогда не подвергались постоянному воздействию антибиотиков. Это явно подрывает предположение о том, что резистентность будет снижаться без лечения только антибиотиками. В нем подчеркивается очень сложный характер распространения устойчивости к противомикробным препаратам, которая также уже была отмечена в отношении устойчивости к не-бета-лактамам в популяциях людей в отдаленных районах Южной Америки (Pallecchi et al., 2007; Бартолони и др., 2009).
Источники устойчивости и механизмы отбора, ответственные за поддержание высокой распространенности устойчивости, в значительной степени неизвестны и поэтому требуют более тщательного рассмотрения (Gilliver et al., 1999). Частая встречаемость ESBL- E. coli в дикой природе, особенно среди птиц-хозяев, имеет несколько последствий. Во-первых, дикая природа может служить резервуаром окружающей среды и плавильным котлом устойчивости бактерий. Во-вторых, принимая во внимание зоонозный потенциал E.coli и сопутствующее наблюдение, что ESBL- E. coli дикого происхождения в основном такие же, как и те, которые обнаружены в клинических изолятах, они также могут повторно инфицировать человеческие популяции. Птичий помет повсеместно присутствует в городских и сельских районах, и нельзя недооценивать заражение людей мазками птичьего помета. Многие виды птиц, в том числе те, которые уже были идентифицированы как носители ESBL- E. coli , демонстрируют значительную мобильность, часто предполагающую пересечение континентов.Точно так же, как явление миграции птиц создает потенциал для создания новых эндемических очагов болезни вдоль их маршрутов, как это было замечено в отношении вируса Западного Нила в США (Reed et al., 2003), бактерии, устойчивые к противомикробным препаратам, могут также переноситься птицами-хозяевами на большие расстояния. Таким образом, миграция птиц может способствовать распространению сопротивления по всему земному шару, как это ранее наблюдалось у путешественников (Peirano et al., 2011). Можно подумать, что это незначительное воздействие по сравнению с путешествиями людей, но мы должны помнить, что в отличие от человеческой популяции здесь нет канализационной системы для птичьих фекалий, и поэтому помет напрямую подвергается воздействию окружающей среды, а также человека. и популяция животных.
Мобильность птиц и распространение ESBL- E. coli также может иметь непредсказуемые последствия из-за возможных взаимодействий этих птиц с бактериальными экосистемами окружающей среды в отдаленных районах, куда попадают в основном мигрирующие птицы. Мы должны помнить, что роль противомикробных веществ или их предков в природных экосистемах, таких как почва, значительно отличается от их антиинфекционной функции в клинических условиях. Это, в свою очередь, означает, что на перекрестные помехи бактериальных сообществ в хрупких экосистемах может сильно повлиять проникновение мультирезистентных бактерий (Allen et al., 2010).
В будущих исследованиях следует выяснить, может ли ESBL- E. coli сохраняться в окружающей среде или циркулировать среди животных в течение длительных периодов времени и, таким образом, может распространяться дикой природой и другими переносчиками. Пандемическое распространение определенных линий ESBL- E. coli в окружающую среду подчеркивает сложность распространения устойчивости к противомикробным препаратам. Как предполагалось ранее, необходимы тщательные пространственные и временные исследования устойчивости к противомикробным препаратам в различных естественных средах обитания (Gilliver et al., 1999; Hernandez et al., 2010), чтобы полностью понять важность дикой природы как источника устойчивости к противомикробным препаратам.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Э. М. Антао за исправления рукописи и Т. Семмлера за помощь в вычислении MSTree.Исследования нашей группы, упомянутые в этой работе, были поддержаны Федеральным министерством образования и исследований по сетевым зоонозам (FBI-Zoo, грант № 01KI1012A), Немецким исследовательским фондом (DFG-GRK1673 / 1 A1, DFG SFB 852/1 A3). Себастьян Гюнтер финансировался за счет гранта AIF KF2267301MD9.
Сноски
Список литературы
Аллен, Х. К., Донато, Дж., Ван, Х. Х., Клауд-Хансен, К. А., Дэвис, Дж., И Хандельсман, Дж. (2010). Зов дикой природы: гены устойчивости к антибиотикам в естественной среде. Nat. Rev. Microbiol. 8, 251–259.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Арпин, К., Дюбуа, В., Модейн, Дж., Джуллин, Дж., Дутиль, Б., Броше, Ж.-П., Ларрибет, Г., Фишер, И., и Квентин, К. ( 2005). Клинический и молекулярный анализ энтеробактерий, продуцирующих бета-лактамазы расширенного спектра действия, в условиях сообщества. J. Clin. Microbiol. 43, 5048–5054.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бартолони, А., Pallecchi, L., Rodriguez, H., Fernandez, C., Mantella, A., Bartalesi, F., Strohmeyer, M., Kristiansson, C., Gotuzzo, E., Paradisi, F., and Rossolini, GM (2009). Устойчивость к антибиотикам в очень отдаленной общине Амазонки. Внутр. J. Antimicrob. Агенты 33, 125–129.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бен Слама, К., Бен Саллем, Р., Джуини, А., Рашид, С., Мусса, Л., Саенс, Ю., Эстепа, В., Сомало, С., Будабус, А., и Торрес , С.(2011). Разнообразие генетических линий CTX-M-15 и CTX-M-14, продуцирующих штаммов Escherichia coli в тунисской больнице. Curr. Microbiol. 62, 1794–1801.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бернар, Х., Танкреде, К., Ливрелли, В., Моран, А., Бартелеми, М., и Лабиа, Р. (1992). Новая плазмидно-опосредованная бета-лактамаза расширенного спектра действия, не полученная из ферментов типа ТЕМ или SHV. J. Antimicrob. Chemother. 29, 590–592.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Biohaz. (2011). Группа EFSA по биологическим опасностям, научное заключение о рисках для здоровья населения, связанных с бактериальными штаммами, продуцирующими бета-лактамазы расширенного спектра и / или бета-лактамазы AmpC, у животных пищевых продуктов и продуктов питания. EFSA J. 9, 2322–2417.
Бланко, М., Алонсо, М. П., Николя-Чаноин, М.-Х., Дахби, Г., Мора, А., Бланко, Дж. Э., Лопес, К., Cortes, P., Llagostera, M., Leflon-Guibout, V., Puentes, B., Mamani, R., Herrera, A., Coira, MA, Garcia-Garrote, F., Pita, JM, and Blanco , Дж. (2009). Молекулярная эпидемиология Escherichia coli , продуцирующей бета-лактамазы расширенного спектра, в Луго (Испания): распространение клона O25b: h5-ST131, продуцирующего CTX-M-15. J. Antimicrob. Chemother. 63, 1135–1141.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Боннедаль, Дж.(2011). Устойчивость энтеробактерий диких птиц к антибиотикам . Упсала: Acta Universitatis Upsaliensis.
Боннедаль, Дж., Дробни, М., Готье-Клерк, М., Эрнандес, Дж., Гранхольм, С., Кайзер, Ю., Мельхус, А., Калметер, Г., Вальденстрем, Дж., Йоханссон, А., и Олсен, Б. (2009). Распространение Escherichia coli с БЛРС типа CTX-M между людьми и желтоногими чайками на юге Франции. PLoS ONE 4, e5958. DOI: 10,1371 / журнал.pone.0005958
CrossRef Полный текст
Боннедаль, Дж., Дробни, П., Йоханссон, А., Эрнандес, Дж., Мелхус, А., Стедт, Дж., Олсен, Б., и Дробни, М. (2010). Характеристика и сравнение клинических людей и черноголовых чаек ( Larus ridibundus ) изолятов бактерий расширенного спектра, продуцирующих бета-лактамазы, из Кальмара, на юго-восточном побережье Швеции. J. Antimicrob. Chemother. 65, 1939–1944.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Брэдфорд, П.А. (2001). Бета-лактамазы с расширенным спектром действия в 21 веке: характеристика, эпидемиология и обнаружение этой важной угрозы устойчивости. Clin. Microbiol. Ред. 14, 933–951.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Буш К., Якоби Г. А. и Медейрос А. А. (1995). Схема функциональной классификации бета-лактамаз и ее корреляция со структурой молекулы. Антимикробный. Агенты Chemother. 39, 1211–1233.
Pubmed Реферат | Pubmed Полный текст
Кантон, Р., Новаис, А., Вальверде, А., Мачадо, Э., Пейше, Л., Бакеро, Ф., и Коке, Т. М. (2008). Распространенность и распространение Enterobacteriaceae, продуцирующих бета-лактамазы расширенного спектра действия, в Европе. Clin. Microbiol. Заразить. 14, 144–154.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Караттоли, А., Ловари, С., Франко, А., Кордаро, Г., Ди Маттео, П.и Баттисти А. (2005). Бета-лактамазы расширенного спектра в Escherichia coli , выделенные от собак и кошек в Риме, Италия, с 2001 по 2003 год. Антимикроб. Агенты Chemother. 49, 833–835.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коэльо, А., Мора, А., Мамани, Р., Лопес, К., Гонсалес-Лопес, Дж. Дж., Ларроса, Миннесота, Кинтеро-Сарате, Дж. Н., Дахби, Г., Эррера, А., Бланко, Дж. Э. , Бланко, М., Алонсо, депутат, Пратс, Г., и Бланко, Дж.(2010). Распространение Escherichia coli O25b: h5-B2-ST131, продуцирующее CTX-M-15 и SHV-12 с высоким содержанием гена вирулентности в Барселоне (Испания). J. Antimicrob. Chemother 66, 517–526.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коул, Д., Драм, Д. Дж., Сталкнехт, Д. Э., Уайт, Д. Г., Ли, М. Д., Эйерс, С., Собси, М., и Маурер, Дж. Дж. (2005). Свободноживущие канадские гуси и устойчивость к противомикробным препаратам. Emerg. Заразить. Дис. 11, 935–938.
Pubmed Реферат | Pubmed Полный текст
Коке, Т. М., Бакеро, Ф., и Кантон, Р. (2008). Растущая распространенность энтеробактерий, продуцирующих БЛРС, в Европе. евро Surveill. 13, 1–11.
Кортес, П., Блан, В., Мора, А., Дахби, Г., Бланко, Дж. Э., Бланко, М., Лопес, К., Андреу, А., Наварро, Ф., Алонсо, депутат, Боу , Г., Бланко, Дж., И Ллагостера, М. (2010). Выделение и характеристика потенциально патогенных устойчивых к антимикробным препаратам штаммов Escherichia coli из птицефабрик и свиноферм в Испании. заявл. Environ. Microbiol. 76, 2799–2805.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коста, Д., Поэта, П., Саенс, Ю., Вину, Л., Коэльо, А.С., Матос, М., Рохо-Безарес, Б., Родригес, Дж., И Торрес, К. (2008) . Механизмы устойчивости к антибиотикам у изолятов Escherichia coli , выделенных от диких животных. Microb. Устойчивость к наркотикам. 14, 71–77.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коста, Д., Поэта, П., Саенс, Ю., Вину, Л., Рохо-Безарес, Б., Джоуини, А., Заразага, М., Родригес, Дж., И Торрес, К. (2006). Обнаружение Escherichia coli , несущих бета-лактамазы расширенного спектра классов CTX-M, TEM и SHV, в образцах фекалий диких животных в Португалии. J. Antimicrob. Chemother. 58, 1311–1312.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
DANMAP. (2007). Использование противомикробных агентов и возникновение устойчивости к противомикробным препаратам у бактерий из пищевых продуктов, животных, продуктов питания и людей в Дании .Копенгаген: DANMAP.
Д’Коста, В.М., Кинг, СЕ, Калан, Л., Морар, М., Сунг, В.В., Шварц, К., Фрозе, Д., Зазула, Г., Калмельс, Ф., Дебрюйн, Р., Голдинг, Г.Б., Пойнар, Г.Н., и Райт, Г.Д. (2011). Устойчивость к антибиотикам древняя. Природа 477, 457–461.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Джамджян, Л., Наас, Т., Танде, Д., Кузон, Г., Ханротель-Салиу, К., и Нордманн, П. (2011). CTX-M-93, вариант CTX-M, лишенный гидролитической активности пенициллина. Антимикробный. Агенты Chemother. 55, 1861–1866.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дои, Ю., Патерсон, Д.Л., Эгеа, П., Паскуаль, А., Лопес-Сереро, Л., Наварро, доктор медицины, Адамс-Хадуч, Дж. М., Куреши, З.А., Сиджабат, Х.Э, и Родригес-Бано, Дж. (2010). Escherichia coli , продуцирующая бета-лактамазу расширенного спектра и CMY-типа, в клинических образцах и розничном мясе из Питтсбурга, США, и Севильи, Испания. Clin.Microbiol. Заразить. 16, 33–38.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Долейска М., Биросова Б., Кохутова Л., Литерак И. и Цижек А. (2009). Устойчивые к антибиотикам изоляты Salmonella и Escherichia coli с интегронами и бета-лактамазами расширенного спектра действия в поверхностных водах и симпатрических черноголовых чаек. J. Appl. Microbiol. 106, 1941–1950.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Долейска, М., Чижек, А., Литерак, И. (2007). Высокая распространенность генов и интегронов устойчивости к противомикробным препаратам в изолятах Escherichia coli от черноголовых чаек в Чешской Республике. J. Appl. Microbiol. 103, 11–19.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Эверс, К., Гроббель, М., Бете, А., Вилер, Л. Х., и Гюнтер, С. (2011). Грамотрицательные бактерии, продуцирующие бета-лактамазы расширенного спектра действия, у домашних животных: действие явно оправдано! Берл.Жевать. Tierarztl. Wochenschr. 124, 10–17.
Эверс, К., Гроббель, М., Штамм, И., Копп, П.А., Диль, И., Семмлер, Т., Фрут, А., Бейтлих, Дж., Герра, Б., Вилер, Л.Х., и Гюнтер, С. (2010). Появление пандемии человека O25: h5-ST131 CTX-M-15, продуцирующего бета-лактамазу расширенного спектра Escherichia coli среди домашних животных. J. Antimicrob. Chemother. 65, 651–660.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Эверс, К., Гюнтер, С., Вилер, Л. Х., и Ширак, П. (2009). Утки кряквы — вид водоплавающих птиц с высоким риском распространения патогенных для человека Escherichia coli . Environ. Microbiol. Реп. 1, 510–517.
CrossRef Полный текст
Эверс, К., Ли, Г., Уилкинг, Х., Кисслинг, С., Альт, К., Антао, Э.М., Латурн, К., Диль, И., Глодде, С., Хомейер, Т., Бонке, У., Стейнрук, Х., Филипп, Х.С., и Вилер, Л.Х. (2007). Птичий патогенный, уропатогенный и вызывающий менингит новорожденных Escherichia coli : насколько они связаны между собой? Внутр.J. Med. Microbiol. 297, 163–176.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фаллакара, Д. М., Монахан, К. М., Моришита, Т. Ю., и Вак, Р. Ф. (2001). Выделение фекалий и чувствительность к противомикробным препаратам отдельных бактериальных патогенов и исследование кишечных паразитов у свободноживущих водоплавающих птиц. Avian Dis. 45, 128–135.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ферия, С., Феррейра, Э., Коррейя, Дж. Д., Гонсалвес, Дж., И Каника, М. (2002). Паттерны и механизмы устойчивости к бета-лактамам и ингибиторам бета-лактамаз у уропатогенной Escherichia coli , выделенной от собак в Португалии. J. Antimicrob. Chemother. 49, 77–85.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гармин, А., Хезебрук, Ф., Хеллебюк, Т., Смет, А., Пасманс, Ф., Бутай, П., и Мартель, А. (2011). Наличие у диких гусей продуцирующей бета-лактамазы расширенного спектра действия Escherichia coli . J. Antimicrob. Chemother. 66, 1643–1644.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гилливер М.А., Беннетт М., Бегон М., Хейзел С.М. и Харт К.А. (1999). Устойчивость к антибиотикам обнаружена у диких грызунов. Природа 401, 233–234.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Gionechetti, F., Zucca, P., Gombac, F., Monti-Bragadin, C., Lagatolla, C., Tonin, E., Edalucci, E., Витали, Л. А., и Дользани, Л. (2008). Характеристика устойчивости к противомикробным препаратам и интегронов класса 1 у Enterobacteriaceae, выделенных из средиземноморских сельдевых чаек ( Larus cachinnans ). Microb. Устойчивость к наркотикам. 14, 93–99.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гнядковский, М., Шнайдер, И., Палуха, А., Юнгвирт, Р., Микевич, Б., и Бауэрнфейнд, А. (1998). Устойчивые к цефотаксиму изоляты Enterobacteriaceae из больницы в Варшаве, Польша: идентификация новой бета-лактамазы, гидролизующей цефотаксим CTX-M-3, которая тесно связана с ферментом CTX-M-1 / MEN-1. Антимикробный. Агенты Chemother. 42, 827–832.
Pubmed Реферат | Pubmed Полный текст
Голдберг, Т. Л., Гиллеспи, Т. Р., Рвего, И. Б., Эстофф, Е. Л., и Чепмен, К. А. (2008). Фрагментация лесов как причина передачи бактерий среди нечеловеческих приматов, людей и домашнего скота, Уганда. Emerg. Заразить. Дис. 14, 1375–1382.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гринвуд, Д.(2000). Антимикробная химиотерапия . Нью-Йорк: Издательство Оксфордского университета.
Guenther, S., Grobbel, M., Beutlich, J., Bethe, A., Friedrich, ND, Goedecke, A., Luebke-Becker, A., Guerra, B., Wieler, LH, and Ewers, C. . (2010a). CTX-M-15-тип бета-лактамаз расширенного спектра, продуцирующий Escherichia coli из диких птиц в Германии. Environ. Microbiol. Rep. 2, 641–645.
CrossRef Полный текст
Гюнтер, С., Grobbel, M., Beutlich, J., Guerra, B., Ulrich, R.G., Wieler, L.H., and Ewers, C. (2010b). Обнаружение пандемии B2-O25-ST131 Escherichia coli , несущей тип бета-лактамазы расширенного спектра CTX-M-9, у одичавших городских бурых крыс ( Rattus norvegicus ). J. Antimicrob. Chemother. 65, 582–584.
CrossRef Полный текст
Гюнтер С., Гроббель М., Хайдеманс К., Шлегель М., Ульрих Р. Г., Эверс К. и Вилер Л. Х. (2010c).Первые сведения об устойчивости к противомикробным препаратам среди фекальных изолятов Escherichia coli от мелких диких млекопитающих в сельской местности. Sci. Total Environ. 408, 3519–3522.
CrossRef Полный текст
Гюнтер С., Гроббель М., Любке-Беккер А., Годеке А., Фридрих Н. Д., Вилер Л. Х. и Эверс К. (2010d). Профили устойчивости к противомикробным препаратам Escherichia coli из общеевропейских видов диких птиц. Вет. Microbiol. 144, 219–225.
CrossRef Полный текст
Герра Б., Юнкер Э., Шрётер А., Малорни Б., Леманн С. и Гельмут Р. (2003). Фенотипическая и генотипическая характеристика устойчивости к противомикробным препаратам в немецких изолятах Escherichia coli крупного рогатого скота, свиней и птиц. J. Antimicrob. Chemother. 52, 489–492.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хоуки, П. М., и Джонс, А. М. (2009).Меняющаяся эпидемиология устойчивости. J. Antimicrob. Chemother. 64, 3–10.
CrossRef Полный текст
Эрнандес, Дж., Боннедаль, Дж., Элиассон, И., Валленстен, А., Комстедт, П., Йоханссон, А., Гранхольм, С., Мелхус, А., Ольсен, Б., и Дробни, М. . (2010). Глобально распространенный патогенный человеческий организм Escherichia coli клона O25b-ST131, несущий blaCTX-M-15, обнаружен у сизокрылой чайки на удаленных Командорских островах, Россия. Environ.Microbiol. Rep. 2, 329–332.
CrossRef Полный текст
Хо, П. Л., Чоу, К. Х., Лай, Э. Л., Ло, В. У., Юнг, М. К., Чан, Дж., Чан, П. Ю., Юн, К. Ю. (2011). Широкое распространение CTX-M-продуцента Escherichia coli с множественной лекарственной устойчивостью к «критически важным» антибиотикам среди пищевых животных в Гонконге, 2008-10 гг. J. Antimicrob. Chemother. 66, 765–768.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Грабак, Дж., Эмпель, Дж., Бергерова, Т., Файфрлик, К., Урбаскова, П., Керн-Зданович, И., Гриневич, В., и Гнядковски, М. (2009). Международные клоны Klebsiella pneumoniae и Escherichia coli с бета-лактамазами расширенного спектра в чешской больнице. J. Clin. Microbiol. 47, 3353–3357.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хантер, П. А., Доусон, С., Френч, Г. Л., Гуссенс, Х., Хоуки, П. М., Куиджпер, Э.Дж., Натвани, Д., Тейлор, Д. Дж., Тил, К. Дж., Уоррен, Р. Э., Уилкокс, М. Х., Вудфорд, Н., Вульф, М. У., и Пиддок, Л. Дж. (2010). Патогены, устойчивые к противомикробным препаратам, у животных и человека: назначение, практика и политика. J. Antimicrob. Chemother. 65 (Приложение 1), i3 – i17.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Канаи, Х., Хашимото, Х. и Мицухаши, С. (1981). Лекарственная устойчивость и конъюгативные R-плазмиды в штаммах Escherichia coli , выделенных от диких птиц (японские древесные воробьи, зеленые фазаны и бамбуковые куропатки). Jpn. Пульт. Sci. 18, 234–239.
CrossRef Полный текст
Китцис, М. Д., Биллот-Кляйн, Д., Гольдштейн, Ф. В., Уильямсон, Р., Тран Ван Нье, Г., Карлет, Дж., Акар, Дж. Ф., и Гутманн, Л. (1988). Распространение новой плазмид-опосредованной бета-лактамазы CTX-1, которая придает устойчивость к цефалоспоринам широкого спектра действия и ее ингибирование ингибиторами бета-лактамаз. Антимикробный. Агенты Chemother. 32, 9–14.
Pubmed Реферат | Pubmed Полный текст
Козак, Г.К., Бурлин, П., Янеко, Н., Рид-Смит, Р. Дж., И Джардин, К. (2009). Устойчивость к противомикробным препаратам изолятов Escherichia coli от свиней и диких мелких млекопитающих вблизи свиноводческих ферм и в естественной среде в Онтарио, Канада. заявл. Environ. Microbiol. 75, 559–566.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Leverstein-Van Hall, M.A., Dierikx, C.M., Cohen Stuart, J., Voets, G.M., Van Den Munckhof, M.П., Ван Эссен-Зандберген, А., Платтил, Т., Флюит, AC, Ван Де Сандэ-Брюинсма, Н., Шаринга, Дж., Бонтен, MJM, Мевиус, DJ, National, ESG, Andriesse, G. , Арендс, JP, Бернардс, ST, Бонтен, MJM, Де Браувер, EIGB, Buiting, AGM, Коэн Стюарт, JW, Ван Дам, AP, Дидерен, BMW, Дориго-Зетсма, JW, Флир, А., Флюит, AC , Van Griethuysen, A., Grundmann, H., Hendrickx, BGA, Horrevorts, AM, Kluytmans, JAJW, Leverstein-Van Hall, MA, Mascini, E.М., Моффи, Б., Де Нилинг, А.Дж., Платтил, Т.Н., Саббе, LJM, Ван Де Санде, Н., Шапендонк, К.М., Шарринга, Дж., Шеллекенс, Дж.Ф.П., Себенс, В., Стальс, Ф.С., Sturm, P., Thijssen, SFT, Tjhie, JT, Verhoef, L., Vlaminckx, BJM, Voets, GM, Vogels, WHM, Vreede, RW, Waar, K., Wever, PC, Wintermans, RGF, Wolfhagen, MJHM , Коэн Стюарт, Дж. У., Шарринга, Дж., Шапендонк, С. М., Платтил, Т. Н., Ван Дам, А. П., Андриесс, Г., Клюйтманс, Дж. Эй-Эй, Фрид, Р.W., Sebens, FW, Sabbe, LJM, Schellekens, JFP, Grundmann, H., Dorigo-Zetsma, JW, Vlaminckx, BJM, Horrevorts, AM, Sturm, P., Stals, FS, Wintermans, RGF, Moffie, BG , Hendrickx, BGA, Buiting, AGM, Verhoef, L., Tjhie, HT, Wolfhagen, MJHM, Diederen, BMW, Thijssen, SFT, Mascini, EM, Van Griethuysen, A., Bosch, D., Wever, PC, Fleer , A., De Brauwer, EIGB, Bernards, AT, Leverstein-Van Hall, MA, De Sande-Bruinsma, N., и De Neeling, A.J. (2011). Голландские пациенты, куриное мясо и птица в розничной торговле имеют одни и те же гены, плазмиды и штаммы БЛРС. Clin. Microbiol. Заразить. 17, 873–880.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Лиллехауг, А., Бергсьо, Б., Шау, Дж., Брюхайм, Т., Викорен, Т., и Ханделанд, К. (2005). Campylobacter spp., Salmonella spp., Вероцитотоксический Escherichia coli и устойчивость к антибиотикам индикаторных организмов у диких цервид. Acta Vet. Сканд. 46, 23–32.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Literak, I., Dolejska, M., Cizek, A., Djigo, C.A.T., Konecny, A., and Koubek, P. (2009a). Резервуары устойчивых к антибиотикам Enterobacteriaceae среди симпатичных человеку животных в Сенегале: бета-лактамазы расширенного спектра действия у бактерий у черной крысы ( Rattus rattus ) Afr. J. Microbiol. Res. 3, 751–754.
Литерак, И., Долейска, М., Радимерский, Т., Климс, Дж., Фридман, М., Аарструп, Ф. М., Хасман, Х., и Цизек, А. (2009b). Устойчивые к противомикробным препаратам фекалии Escherichia coli у диких млекопитающих в Центральной Европе: мультирезистентные Escherichia coli , продуцирующие бета-лактамазы расширенного спектра действия у диких кабанов. J. Appl. Microbiol. 108, 1702–1711.
CrossRef Полный текст
Literak, I., Dolejska, M., Janoszowska, D., Hrusakova, J., Meissner, W., Rzyska, H., Бзома, С., и Чижек, А. (2010). Устойчивые к антибиотикам бактерии Escherichia coli , включая штаммы с генами, кодирующими бета-лактамазу расширенного спектра и QnrS, у водоплавающих птиц на побережье Балтийского моря в Польше. заявл. Environ. Microbiol. 76, 8126–8134.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Литерак И., Ванко Р., Долейска М., Цижек А. и Карпискова Р. (2007). Устойчивые к антибиотикам Escherichia coli и Salmonella у русских грачей ( Corvus frugilegus ), зимующих в Чехии. Lett. Прил. Microbiol. 45, 616–621.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ливермор, Д.М., Кантон, Р., Гнядковски, М., Нордманн, П., Россолини, Г.М., Арлет, Г., Аяла, Дж., Коке, Т.М., Керн-Зданович, И., Луццаро, Ф., Пойрел Л. и Вудфорд Н. (2007). CTX-M: изменение облика БЛРС в Европе. J. Antimicrob. Chemother. 59, 165–174.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ливермор, Д.М., Уорнер, М., Холл, Л. М., Энне, В. И., Проян, С. Дж., Данман, П. М., Вустер, С. Л., и Харрисон, Г. (2001). Устойчивость к антибиотикам у бактерий сорок ( Pica pica ) и кроликов ( Oryctolagus cuniculus ) из западного Уэльса. Environ. Microbiol. 3, 658–661.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мартинес, Дж. Л. (2009a). Загрязнение окружающей среды антибиотиками и детерминантами устойчивости к антибиотикам. Environ. Загрязнение. 157, 2893–2902.
CrossRef Полный текст
Мартинес, Дж. Л. (2009b). Роль естественной среды в развитии признаков устойчивости патогенных бактерий. Proc. Биол. Sci. 276, 2521–2530.
CrossRef Полный текст
Миддлтон, Дж. Х., и Амброуз, А. (2005). Подсчет и характер устойчивости к антибиотикам фекальных индикаторных организмов, выделенных из мигрирующих канадских казарок ( Branta canadensis ). J. Wildl. Дис. 41, 334–341.
Pubmed Реферат | Pubmed Полный текст
Минарини, Л. А. Р., Камарго, И. Л. Б., Питондо-Силва, А., и Дарини, А. Л. С. (2007). Мультилокусное типирование последовательностей уропатогенных БЛРС Escherichia coli , выделенных в бразильском сообществе. Curr. Microbiol. 55, 524–529.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мулен-Шулёр, М., Reperant, M., Laurent, S., Bree, A., Mignon-Grasteau, S., Germon, P., Rasschaert, D., and Schouler, C. (2007). Внекишечные патогенные штаммы Escherichia coli птичьего и человеческого происхождения: связь между филогенетическими отношениями и общими паттернами вирулентности. J. Clin. Microbiol. 45, 3366–3376.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мшана, С.Э., Имирзалиоглу, Ч., Хайн, Т., Доманн, Э., Лямуя, Э. Ф., и Чакраборти, Т.(2011). Множественные клональные комплексы ST с преобладанием ST131 из Escherichia coli , несущие blaCTX-M-15, в больнице третичного уровня в Танзании. Clin. Microbiol. Заразить. 17, 1279–1282.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мшана, С. Э., Имирзалиоглу, К., Хоссейн, Х., Хайн, Т., Доман, Э. и Чакраборти, Т. (2009). Конъюгативные плазмиды IncFI, несущие CTX-M-15 среди изолятов, продуцирующих Escherichia coli ESBL, в университетской больнице в Германии. BMC Infect. Дис. 9, 97. DOI: 10.1186 / 1471-2334-9-97
CrossRef Полный текст
Муштак, С., Ирфан, С., Сарма, Дж. Б., Думит, М., Пайк, Р., Питу, Дж., Ливермор, Д. М., и Вудфорд, Н. (2011). Филогенетическое разнообразие штаммов Escherichia coli , продуцирующих карбапенемазы NDM-типа. J. Antimicrob. Chemother. 66, 2002–2005.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Naseer, U., Хальдорсен, Б., Тофтеланд, С., Хегстад, К., Шойц, Ф., Симонсен, Г.С., и Сундсфьорд, А. (2009). Молекулярная характеристика клинических изолятов Escherichia coli , продуцирующих CTX-M-15, выявила распространение штаммов ST131 (O25: h5) и ST964 (O102: H6) с множественной лекарственной устойчивостью в Норвегии. APMIS 117, 526–536.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Нельсон, М., Джонс, С. Х., Эдвардс, К., и Эллис, Дж. К. (2008). Характеристика популяций Escherichia coli из чаек, мусорных свалок и сточных вод с помощью риботипирования. Дис. Акват. Орг. 81, 53–63.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
( 2008 г.). Межконтинентальное появление Escherichia coli клона O25: h5-ST131, продуцирующего CTX-M-15. J. Antimicrob. Chemother. 61, 273–281.Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
НОРМА / НОРМА-ВЕТ.(2010). Использование противомикробных агентов и возникновение устойчивости к противомикробным препаратам в Норвегии . Осло: НОРМА-ПОО.
О’Брайен, Т. Ф. (2002). Возникновение, распространение и влияние на окружающую среду устойчивости к противомикробным препаратам: как использование противомикробного препарата в любом месте может повысить устойчивость к любому противомикробному препарату в другом месте. Clin. Заразить. Дис. 34, S78 – S84.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
О’Киф, А., Хаттон, Т.А., Шифферли, Д.М., и Рэнкин, С. (2010). Первое обнаружение β-лактамаз расширенного спектра CTX-M и SHV в изолятах мочевыводящих путей Escherichia coli от собак и кошек в США. Антимикробный. Агенты Chemother. 54, 3489–3492.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Отео, Дж., Диестра, К., Хуан, К., Баутиста, В., Новаис, А., Перес-Васкес, М., Мойя, Б., Миро, Э., Коке, Т. М., Оливер, А. ., Кантон Р., Наварро Ф. и Кампос Дж. (2009). Escherichia coli , продуцирующая бета-лактамазы расширенного спектра, в Испании принадлежит к большому разнообразию типов мультилокусного типирования последовательностей, включая комплекс ST10 / A, комплекс ST23 / A и ST131 / B2. Внутр. J. Antimicrob. Агенты 34, 173–176.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Отео, Дж., Перес-Васкес, М., и Кампос, Дж. (2010). Бета-лактамаза с расширенным спектром действия, продуцирующая Escherichia coli : изменение эпидемиологии и клинического воздействия. Curr. Opin. Заразить. Дис. 23, 320–326.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Паллекки, Л., Луккетти, К., Бартолони, А., Барталези, Ф., Мантелла, А., Гамбоа, Х., Караттоли, А., Парадизи, Ф., и Россолини, Г. М. (2007). Популяционная структура и гены устойчивости у устойчивых к антибиотикам бактерий из удаленного сообщества с минимальным воздействием антибиотиков. Антимикробный. Агенты Chemother. 51, 1179–1184.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Пейрано, Г., Костелло, М., и Питу, Дж. Д. (2010). Молекулярные характеристики продуцирующей бета-лактамазы расширенного спектра действия Escherichia coli из Чикаго: высокая распространенность ST131, продуцирующего CTX-M-15, в общественных больницах. Внутр. J. Antimicrob. Агенты 36, 19–23.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Пфайфер Ю., Витте В., Хольфельдер М., Буш Дж., Нордманн П. и Пуарель Л. (2011). NDM-1, продуцирующий Escherichia coli в Германии. Антимикробный. Агенты Chemother. 55, 1318–1319.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Пинто, Л., Радхуани, Х., Коэльо, К., Мартинс да Коста, П., Симоэс, Р., Брандао, Р. М.Л., Торрес, К., Игрехас, Г., и Поэта, П. (2010) . Генетическое обнаружение изолятов Escherichia coli , содержащих бета-лактамазы расширенного спектра действия, от хищных птиц из природного заповедника Серра-да-Эштрела в Португалии. заявл. Environ. Microbiol. 76, 4118–4120.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Pitout, J. D. D., Nordmann, P., Laupland, K. B., and Poirel, L. (2005). Появление в сообществе энтеробактерий, продуцирующих бета-лактамазы расширенного спектра (БЛРС). J. Antimicrob. Chemother. 56, 52–59.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Поэта, П., Радхуани, Х., Игреджас, Г., Гонсалвес, А., Карвалью, К., Родригес, Дж., Вину, Л., Сомало, С., и Торрес, К. (2008). Чайки природного заповедника Берленгас в Португалии как переносчики фекалий Escherichia coli , несущих бета-лактамазы расширенного спектра классов CTX-M и TEM. заявл. Environ. Microbiol. 74, 7439–7441.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Поэта, П., Радхуани, Х., Пинто, Л., Мартиньо, А., Рего, В., Родригес, Р., Гонсалвес, А., Родригес, Дж., Эстепа В., Торрес К. и Игрехас Г. (2009). Кабаны как резервуары бета-лактамазы расширенного спектра (БЛРС), продуцирующей Escherichia coli различных филогенетических групп. J. Basic Microbiol. 49, 584–588.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Помба, К., Да Фонсека, Дж. Д., Баптиста, Б. К., Коррейя, Дж. Д., и Мартинес-Мартинес, Л. (2009). Обнаружение пандемического вирулентного вируса O25-ST131 человека Escherichia coli CTX-M-15-продуцирующего клона, несущего гены qnrB2 и aac (6 ’) — Ib-cr, у собаки. Антимикробный. Агенты Chemother. 53, 327–328.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Радхуани, Х., Пинто, Л., Коэльо, К., Гонсалвес, А., Сарго, Р., Торрес, К., Игрехас, Г., и Поэта, П. (2010). Обнаружение Escherichia coli , несущих бета-лактамазы расширенного спектра классов CTX-M, в образцах фекалий канюков ( Buteo buteo ). J. Antimicrob. Chemother. 65, 171–173.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Рид, К.Д., Мис, Дж. К., Хенкель, Дж. С., и Шукла, С. К. (2003). Птицы, миграция и новые зоонозы: вирус западного нила, болезнь Лайма, грипп A и энтеропатогены. Clin. Med. Res. 1, 5–12.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Роллан Р. М., Хаусфатер Г., Маршалл Б. и Леви С. Б. (1985). Устойчивые к антибиотикам бактерии у диких приматов: повышенная распространенность у павианов, питающихся человеческими отходами. заявл. Environ.Microbiol. 49, 791–794.
Pubmed Реферат | Pubmed Полный текст
Рутман, Э., Миллер, Р. Д., Филлипс-Конрой, Дж., И Хартл, Д. Л. (1985). Устойчивость к антибиотикам и структура популяции Escherichia coli из африканских желтых павианов, обитающих на свободе. заявл. Environ. Microbiol. 50, 749–754.
Pubmed Реферат | Pubmed Полный текст
Рвего, И. Б., Исабирье-Басута, Г., Гиллеспи, Т. Р., и Голдберг, Т.Л. (2008). Передача бактерий через желудочно-кишечный тракт среди людей, горных горилл и домашнего скота в Национальном парке Бвинди, Уганда. Консерв. Биол. 22, 1600–1607.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Сато Г., Ока К., Асаги М. и Исигуро Н. (1978). Обнаружение конъюгативных плазмид R, придающих устойчивость к хлорамфениколу в Escherichia coli , выделенных из домашних и диких голубей и ворон. Zentralbl. Бактериол. Ориг. А 241, 407–417.
Pubmed Реферат | Pubmed Полный текст
Сайях Р. С., Канини Дж. Б., Джонсон Ю. и Миллер Р. (2005). Паттерны устойчивости к противомикробным препаратам наблюдались у изолятов Escherichia coli , полученных из образцов фекалий домашних и диких животных, человеческих фекалий и поверхностных вод. заявл. Environ. Microbiol. 71, 1394–1404.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ширак, П., Рёмер, А., Джорес, Дж., Каспар, Х., Гюнтер, С., Фильтр, М., Эйхберг, Дж., И Вилер, Л. Х. (2008a). Выделение и характеристика кишечной палочки E. coli от диких кабанов в Германии. заявл. Environ. Microbiol. 75, 695–702.
CrossRef Полный текст
Ширак П., Уолк, Н., Эверс, К., Уилкинг, Х., Стейнрук, Х., Фильтр, М., и Вилер, Л. Х. (2008b). ExPEC-типичные гены, связанные с вирулентностью, коррелируют с успешной колонизацией кишечными клетками E.coli в небольшой группе поросят. Environ. Microbiol. 10, 1742–1751.
CrossRef Полный текст
Шерли М., Гордон Д. М. и Коллиньон П. Дж. (2000). Вариации профиля устойчивости к антибиотикам у Enterobacteriaceae, выделенных из диких австралийских млекопитающих. Environ. Microbiol. 2, 620–631.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Сиджабат, Х. Э., Патерсон, Д. Л., Адамс-Хадуч, Дж.М., Эван, Л., Паскул, А. В., Муто, К. А., Тиан, Г. Б., и Дои, Ю. (2009). Молекулярная эпидемиология изолятов Escherichia coli , продуцирующих CTX-M , в медицинском центре на западе Пенсильвании. Антимикробный. Агенты Chemother. 53, 4733–4739.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Силва, Н., Фелгар, А., Гонсалвес, А., Коррейя, С., Пачеко, Р., Араухо, К., Игрехас, Г., и Поэта, П. (2010). Отсутствие изолятов Escherichia coli , продуцирующих бета-лактамазу расширенного спектра действия, у перелетных птиц: певчий дрозд ( Turdus philomelos ). J. Antimicrob. Chemother. 65, 1306–1307.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Сильва, Н., Игрехас, Г., Родригес, П., Родригес, Т., Гонсалвес, А., Фелгар, А.С., Пачеко, Р., Гонсалвес, Д., Кунья, Р., и Поэта, П. (2011). Молекулярная характеристика устойчивых к ванкомицину энтерококков и изолятов Escherichia coli , содержащих бета-лактамазу расширенного спектра действия, у диких птиц с Азорского архипелага. Avian Pathol. 40, 473–479.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Силва В. Л., Николи Дж. Р., Насименто Т. К. и Диниз К. Г. (2009). Diarrheagenic Escherichia coli штаммов, выделенных от городских голубей ( Columba livia ) в Бразилии, и характеристики их чувствительности к антимикробным препаратам. Curr. Microbiol. 59, 302–308.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Скурник, Д., Руими, Р., Андремонт, А., Аморин, К., Руке, П., Пикар, Б., и Денамур, Э. (2006). Влияние близости человека на устойчивость к противомикробным препаратам и интегроны в фекалиях животных Escherichia coli . J. Antimicrob. Chemother. 57, 1215–1219.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Смет, А., Мартель, А., Персоны, Д., Девульф, Дж., Хейндрикс, М., Клэйс, Г., Лонти, М., Ван Менсель, Б., Херман, Л., Хезебрук, Ф ., и Бутае П.(2010a). Характеристика бета-лактамаз расширенного спектра, продуцируемых Escherichia coli , выделенных у госпитализированных и не госпитализированных пациентов: появление штаммов, продуцирующих CTX-M-15, вызывающих инфекции мочевыводящих путей. Microb. Устойчивость к наркотикам. 16, 129–134.
CrossRef Полный текст
Смет, А., Мартель, А., Персоны, Д., Девульф, Дж., Хейндрикс, М., Херман, Л., Хезебрук, Ф., и Бутай, П. (2010b). Бета-лактамазы широкого спектра действия среди Enterobacteriaceae животного происхождения: молекулярные аспекты, мобильность и влияние на здоровье населения. FEMS Microbiol. Ред. 34, 95–316.
CrossRef Полный текст
Соуза, М., Торрес, К., Баррос, Дж., Сомало, С., Игрехас, Г., и Поэта, П. (2011). Морской лещ Gilthead ( Sparus aurata ) в качестве носителей SHV-12 и TEM-52, содержащих бета-лактамазы расширенного спектра действия, изолятов Escherichia coli . Патогенный микроорганизм пищевого происхождения. Дис. 8, 1139–1141.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Соуза, В., Роча, М., Валера, А., Эгиарте, Л. Е. (1999). Генетическая структура природных популяций Escherichia coli в диких хозяевах на разных континентах. заявл. Environ. Microbiol. 65, 3373–3385.
Pubmed Реферат | Pubmed Полный текст
Сузуки, С., Сибата, Н., Ямане, К., Вачино, Дж., Ито, К., и Аракава, Ю. (2009). Изменение распространенности продуцирующей бета-лактамазы расширенного спектра действия Escherichia coli в Японии в зависимости от клонального распространения. J. Antimicrob. Chemother. 63, 72–79.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
СВАРМ. (2008). Шведский ветеринарный мониторинг устойчивости к противомикробным препаратам . Упсала: Национальный ветеринарный институт, SVA.
Свечичка И., Бучек Дж. И Иванюк А. (2003). Анализ генетического родства и чувствительности к противомикробным препаратам Escherichia coli , выделенного из Clethrionomys glareolus . J. Gen. Appl. Microbiol. 49, 315–320.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Тешагер Т., Домингес Л., Морено М. А., Саенс Ю., Торрес К. и Карденоса С. (2000). Выделение штамма Escherichia coli , продуцирующего бета-лактамазу SHV-12, от собаки с рецидивирующими инфекциями мочевыводящих путей. Антимикробный. Агенты Chemother. 44, 3483–3484.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Цубокура, М., Мацумото, А., Оцуки, К., Анимас, С. Б., и Санеката, Т. (1995). Лекарственная устойчивость и конъюгативные плазмиды R в штаммах Escherichia coli , выделенных от мигрирующих водоплавающих птиц. J. Wildl. Дис. 31, 352–357.
Pubmed Реферат | Pubmed Полный текст
Вальверде, А., Кантон, Р., Гарсиллан-Барсия, депутат, Новаис, А., Галан, Дж. К., Альварадо, А., Де Ла Крус, Ф., Бакеро, Ф., и Коке, TM (2009) . Распространение blaCTX-M-14 в основном обеспечивается плазмидами IncK, распространенными среди филогрупп A, B1 и D Escherichia coli в Испании. Антимикробный. Агенты Chemother. 53, 5204–5212.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ван ден Богард, А. Э., Лондон, Н., Стобберинг, Э. Э. (2000). Устойчивость к противомикробным препаратам в образцах фекалий свиней из Нидерландов (пять скотобоен) и Швеции. J. Antimicrob. Chemother. 45, 663–671.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ван Дер Бидж, А. К., Пейрано, Г., Гессенс, У. Х. Ф., Ван дер Ворм, Э. Р., Ван Вестринен, М., и Питаут, Дж. Д. Д. (2011). Клинические и молекулярные характеристики продуцирующей бета-лактамазы расширенного спектра действия Escherichia coli , вызывающей бактериемию в районе Роттердама, Нидерланды. Антимикробный. Агенты Chemother. 55, 3576–3578.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Во, А. Т. Т., Ван Дуйкерен, Э., Флюит, А. К., и Гаастра, В. (2007). Характеристики изолятов Escherichia coli и Klebsiella pneumoniae , устойчивых к цефалоспоринам расширенного спектра действия, от лошадей. Вет. Microbiol. 124, 248–255.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Валленстен, А., Эрнандес, Дж., Ардилес, К., Гонсалес-Акунья, Д., Дробни, М., и Олсен, Б. (2011). Бета-лактамазы расширенного спектра обнаружены в Escherichia coli от чаек в Стокгольме, Швеция. Заражение. Ecol. Эпидемиол. 1, 7030
Вилер, Л. Х., Эверс, К., Гюнтер, С., Вальтер, Б., и Любке-Беккер, А.(2011). Метициллин-резистентные стафилококки (MRS) и Enterobacteriaceae, продуцирующие бета-лактамазы расширенного спектра (ESBL), у домашних животных: нозокомиальные инфекции как одна из причин растущей распространенности этих потенциальных зоонозных патогенов в клинических образцах. Внутр. J. Med. Microbiol. 301, 635–641.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Вирт, Т., Фалуш, Д., Лан, Р., Коллес, Ф., Менса, П., Вилер, Л. Х., Карч, Х., Ривз, П.Р. и Мэйден М. С. (2006). Секс и вирулентность в Escherichia coli : эволюционная перспектива. Мол. Microbiol. 60, 1136–1151.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Woerther, PL, Angebault, C., Jacquier, H., Hugede, HC, Janssens, AC, Sayadi, S., El Mniai, A., Armand-Lefevre, L., Ruppe, E., Barbier, F. , Раскин, Л., Пейдж, А.Л., Де Рекенир, Н., Андремонт, А. (2011). Значительное увеличение, распространение и обмен генов, кодирующих бета-лактамазы расширенного спектра, среди кишечных Enterobacteriaceae у госпитализированных детей с тяжелой острой недостаточностью питания в Нигере. Clin. Заразить. Дис. 53, 677–685.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Юмук, З., Афакан, Г., Николя-Шаноан, М.-Х., Сотто, А., и Лавин, Ж.-П. (2008). Турция: еще одна страна, обеспокоенная приобретенным сообществом клоном Escherichia coli O25-ST131, продуцирующим CTX-M-15. J. Antimicrob. Chemother. 62, 284–288.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
«Разрушенная жизнь женщины» обнаружила недостатки инспекции говяжьего фарша
Но департамент получил критические комментарии к руководству, которое не было официально оформлено.Представители отрасли заявили, что стоимость тестирования может несправедливо обременить мелкие переработчики и что бойни уже проводят испытания. В письме в департамент в октябре 2008 года Американская ассоциация мясопереработчиков заявила, что предлагаемые руководящие принципы отходят от стратегии Министерства сельского хозяйства США, позволяющей компаниям разрабатывать свои собственные программы безопасности, «таким образом возвращаясь к большей части« командного и контролирующего »мышления агентства. установленный.»
Доктор Кеннет Петерсен, помощник администратора Службы безопасности пищевых продуктов и инспекции, сказал, что департамент может санкционировать тестирование, но при этом необходимо учитывать влияние на компании, а также на потребителей.«Я должен смотреть на всю отрасль, а не только на то, что лучше всего для общественного здравоохранения», — сказал д-р Петерсен.
Отслеживание болезни
Смиты не сразу заподозрили гамбургер. Г-жа Смит придерживалась в основном вегетарианской диеты, и когда она заболела, ее мать, Шэрон, подумала, что причиной может быть шпинат, связанный с недавней вспышкой кишечной палочки.
Через пять дней после семейного воскресного обеда г-жа Смит была госпитализирована в больницу Сент-Клауда с мучительной болью.«Мне приходилось слышать от женщин, что кишечная палочка более болезненна, чем роды», — сказал доктор Филип И. Тарр, эксперт по патогенам Вашингтонского университета в Сент-Луисе.
По данным Центров по контролю и профилактике заболеваний, подавляющее большинство болезней, вызванных кишечной палочкой, проходит без осложнений. От 5 до 10 процентов развивается состояние, называемое гемолитико-уремическим синдромом, которое может повлиять на функцию почек.
