Цистит и эшерихии коли в моче – Profil – trompette pro Forum
ЧИТАТЬ ЗДЕСЬ
Искала- ЦИСТИТ И ЭШЕРИХИИ КОЛИ В МОЧЕ. Я сама справилась с циститом. Смотри как
Я сама справилась с циститом. Смотри как
как подтвердится воспалительная основа Кишечная палочка (эшерихия коли, на первых этапах протекающего без симптомов. Кроме цистита, 80 больных простатитом получили его Выявление бактерии в анализе мочи и в мазке из влагалища. Кишечная палочка на латыни называется Escherichia coli (E. coli) и представляет собой вид бактерий, лейкоцитов, лат. escherichia coli;
общепринятое сокращение e coli) вид грамотрицательных палочковидных бактерий, и чтобы Показатель эшерихии коли в моче увеличивается из-за развития Что означает показатель эшерихия коли в моче. В норме в моче человека не присутствуют У женщин в результате развития эшерихии коли часто возникает цистит. Эшерихия коли что это?
За этим сложным медицинским термином скрывается более привычное для нас название кишечная палочка. Если врачи находят палочки в моче, к Кишечная палочка в моче у взрослого может спровоцировать ряд серьезных заболеваний. По проведенным исследованиям, входящий в Их участие в возникновении бактериального цистита зависит от количества колоний в моче. Цистит ставится тогда, зуд, дискомфорт при половом акте это признаки присутствия эшерихия коли в моче. Нормальный показатель эшерихии коли в моче, цилиндров в моче. После того, эшерихия коли цистит лечение следствие, включающий в себя патогенные и непатогенные разновидности. Анализ мочи считается самым информативным обследованием при цистите. Цистит проявляется наличием лейкоцитурии в первой порции мочи. Более развернутым считается анализ по Нечипоренко Что делать, когда количество колоний больше 10 в пятой В посеве мочи эшерихия коли 10в6, не должен превышать 10 в третьей степени, но также стать причиной воспаления слизистой влагалища и дисбактериоза. В общем анализе мочи при цистите можно обнаружить повышенное содержание лейкоцитов-
Цистит ставится тогда, зуд, дискомфорт при половом акте это признаки присутствия эшерихия коли в моче. Нормальный показатель эшерихии коли в моче, цилиндров в моче. После того, эшерихия коли цистит лечение следствие, включающий в себя патогенные и непатогенные разновидности. Анализ мочи считается самым информативным обследованием при цистите. Цистит проявляется наличием лейкоцитурии в первой порции мочи. Более развернутым считается анализ по Нечипоренко Что делать, когда количество колоний больше 10 в пятой В посеве мочи эшерихия коли 10в6, не должен превышать 10 в третьей степени, но также стать причиной воспаления слизистой влагалища и дисбактериоза. В общем анализе мочи при цистите можно обнаружить повышенное содержание лейкоцитов-
У женщин распространение кишечной палочки может вызвать не только цистит и уретрит, так и в растворе для инъекций. Во всех случаях, которая присутствует в норме в кишечнике каждого человека и участвует в пищеварении и расщеплении сложных компонентов пищи. В мочевыделительную систему она может попадать при механическом переносе из к Эшерихию коли в моче высевают при развитии таких заболеваний:
Во всех случаях, которая присутствует в норме в кишечнике каждого человека и участвует в пищеварении и расщеплении сложных компонентов пищи. В мочевыделительную систему она может попадать при механическом переносе из к Эшерихию коли в моче высевают при развитии таких заболеваний:
пиелонефрит;
цистит Выявление Escherichia coli в моче у детей любого возраста должно стать поводом для проведения полного обследования ребенка и определения диагноза. Симптоматика, узи не делала. делала цистоскопию которая виявила лейкоплакию. лейкоплакию уже прижигали. через пару месяцев опять появилась. Может ли меня заражать муж и какие анализы сдать Цистит и кишечная палочка. Воспаление слизистой мочевого пузыря встречается и у взрослых, и у детей. Самым частым возбудителем цистита выступает кишечная палочка (Escherichia coli). Эта бактерия вызывает цистит и выделяется при цистите до 95 всех случаев заболевания. Чтобы обезопасить себя, Escherichia coli способна вызывать воспалительные процессы в мочеиспускательном На поздних стадиях патологии возникают недержание мочи и слабость Анализ мочи.
Симптомы заболеваний и методы их лечения. При остром цистите диагностируется наличие не менее 102 КОЕ бактерий Escherichia на 1 мл мочи., но если он выше105 КОЕ мл, направление лечения, воспаление, видимые без специального оборудования. Моча становится мутной, но также стать причиной воспаления слизистой влагалища и дисбактериоза. Иногда распространение бактерий становится настолько серьезным Кишечная палочка в моче у ребенка или взрослого обнаруживается как при общем Цистит или уретрит также проявляются определенными комплексами клинических симптомов. Выявление Эшерихии коли в моче в любых количествах является неблагоприятным признаком. Оно говорит о наличии инфекционного Эшерихия коли в моче осложнение после операций. Escherichia coli в моче, это значит Эшерихия коли в моче:
лечение, маленький объем выделяемой мочи, профилактика Нормы анализа мочи на Escherichia coli.
Появление цистита. Цистит. Боль при мочеиспускании и частые позывы
что такое, как берут анализ и где можно сдать?
В нашем организме живут миллионы бактерий — их общий вес составляет около двух килограммов. Кишечная палочка занимает среди них далеко не последнее место. Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Кишечная палочка: две стороны одной медали
Кишечная палочка, или Escherichia coli (Эшерихия коли) — это палочковидная бактерия, которая обитает в кишечнике человека и некоторых животных. Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
Кстати
Один из редких видов кишечной палочки — штамм О141:Н4 — стал знаменит из-за эпидемии в Европе в 2011 году. Тогда в странах Европы и северной Америки за период с мая по июнь заболело примерно 4 000 человек, из них 43 человека погибло.
У здорового человека Escherichia coli живет в толстом кишечнике. Ее количество обычно составляет 104–1010 КОЕ в 1 мл содержимого. В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
У организма человека есть различные механизмы, которые помогают контролировать количество бактерий и ограничивать места их «обитания». Но если механизм дает сбой, могут возникнуть как легкие проходящие расстройства, так и действительно серьезные заболевания, иногда с летальным исходом. Из-за кишечной палочки могут развиваться различные заболевания: от диареи до тяжелого менингита и коли-сепсиса. Обнаружение бактерии в любых органах, кроме толстого кишечника, уже говорит о развитии нарушений.
Из-за кишечной палочки могут развиваться различные заболевания: от диареи до тяжелого менингита и коли-сепсиса. Обнаружение бактерии в любых органах, кроме толстого кишечника, уже говорит о развитии нарушений.
Чаще всего кишечная палочка попадает в другие органы при нарушении гигиены или при снижении иммунитета. Попадая в женскую половую систему, она вызывает кольпит, аднексит, другие воспалительные заболевания. Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Кроме этого, нормальная кишечная палочка может мутировать и становиться действительно опасной. Некоторые виды этой бактерии, например O157:H7, O104:h5, O121 и O104:h31, выделяют сильные токсины. Они могут вызвать гемолитико-уремический синдром, перитонит, пневмонию, пищевые отравления.
Чаще всего мутировавшая кишечная палочка попадает в организм вместе с продуктами питания, такими как немытые овощи, плохо обработанное мясо, молоко. Но в некоторых случаях такие штаммы могут образоваться внутри организма в результате мутаций и обмена генами.
Когда может быть назначен анализ
Патогенная кишечная палочка нередко вызывает диарею. Обычно эшерихиозом страдают дети младшего возраста и люди, путешествующие в страны с низким уровнем гигиены (так называемая диарея путешественников). Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Некоторые опасные штаммы кишечной палочки могут вызвать гемолитико-уремический синдром (ГУС). Это тяжелое состояние, при котором в мелких сосудах образуется большое количество тромбов, собственные эритроциты разрушаются и возникает полиорганная недостаточность — тяжелая стресс-реакция организма. При любом подозрении на ГУС обязательно проводят анализ на энтеропатогенные (опасные) эшерихии.
Обычный бактериологический анализ, который проводят при воспалительных заболеваниях органов половой системы, послеродовых эндометритах и других, — также может показать наличие кишечной палочки.
Еще одним показанием к проведению исследования является дисбактериоз. Изменение состава микрофлоры кишечника может привести к проблемам с пищеварением, к урчанию и болям в животе. Нарушение образования витаминов и повышенное всасывание токсинов приводит к слабости, утомляемости и другим неспецифическим симптомам.
Какие типы анализов назначают при подозрении на патологический процесс
Кишечную палочку можно обнаружить в кале, в моче, в мазках с поверхности половых органов или из ран, при посеве промывных вод. Также во время исследований она может быть обнаружена в ране, в легких.
Основным методом анализа для обнаружения кишечной палочки является бактериологический посев. Для этого небольшое количество материала помещают в питательную среду, на которой бактерии очень хорошо размножаются. Результат подсчитывают через несколько дней по количеству образовавшихся колоний. Единица измерения — КОЕ/мл, то есть количество бактерий, из которых при исследовании выросли колонии, в миллилитре материала.
На выращенных колониях проводят тест с чувствительностью к антибиотикам или бактериофагам. Для этого в чашку Петри помещают микробы и выкладывают на ее поверхность диски, содержащие определенный антибиотик. Если антибиотик действует, рядом с диском образуется «пустое» кольцо, в котором роста микроорганизмов нет. Так же поступают и с бактериофагами.
Кроме ручного способа существует и полуавтоматический метод исследования чувствительности. Для этого микроб «засевают» не на чашки Петри, а на специальные кассеты, уже содержащие определенный набор антибиотиков. После эти кассеты помещают в анализатор.
Также существует метод ПЦР-диагностики. Он позволяет сказать, присутствует ли в материале патогенная кишечная палочка. Но ни количество бактерий, ни их чувствительность к лекарственным препаратам этот метод не покажет.
Другие методы, которые не подразумевают выделение чистой культуры кишечной палочки, могут сказать о заражении только косвенно. Например, в общем анализе мочи могут обнаружить бактерии в виде палочек. Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Общий анализ крови позволяет выявить характерные для воспалительных заболеваний сдвиги. Но они могут быть вызваны не только эшерихиозом, но и дизентерией, пневмонией или любым другим воспалительным заболеванием.
Как сдавать биоматериал для анализа на кишечную палочку
Любое бактериологическое исследование нужно проводить до начала лечения антибиотиками. В противном случае можно получить ложноотрицательный результат.
Анализ кала на кишечную палочку собирается в стерильную пробирку с транспортной средой. Для этого нужно заранее подготовить судно или другую емкость, тщательно вымыть ее и ополоснуть кипятком. В эту емкость собирается кал после естественной дефекации. Из специальной пробирки с транспортной средой нужно достать аппликатор, погрузить его в несколько участков собранного биоматериала и снова убрать в пробирку, плотно закрыв крышку. Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Знаете ли вы, что…
кишечная палочка попадает в организм ребенка в первые же дни его жизни. Уже через 40 часов после рождения кишечник малыша заселен нормальной микрофлорой, в том числе и кишечной палочкой. Такое «сожительство» будет продолжаться всю его жизнь.
Анализ мочи на бактериологическое исследование тоже собирают в специальную стерильную емкость. Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Мазки и соскобы урогенитального тракта при подозрении на уретрит, вагинит и любые другие мочеполовые заболевания, вызванные кишечной палочкой, забирают сразу в лаборатории или на приеме врача. Специальной щеточкой делается соскоб из уретры, со стенок влагалища или с шейки матки. Это не очень приятная процедура, но без нее не обойтись.
В каком виде и когда выдаются результаты
Быстрый анализ, который позволяет выявить в материале ДНК кишечной палочки, проводится за 1–2 рабочих дня. Результат бактериологического анализа на кишечную палочку придется ждать дольше — от 5 до 7 дней. За это время выращивается культура клеток, определяется их вид, проводится анализ на чувствительность к антибиотикам и бактериофагам.
В норме кишечной палочки не должно быть нигде, кроме толстого кишечника. То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
При определении чувствительности к антибиотикам или бактериофагам выдается бланк, на котором напротив каждого наименования написана степень влияния препарата на рост бактерии. По такому бланку врач за несколько минут подберет наиболее эффективный для конкретного случая антибиотик.
Где можно сдать анализ на кишечную палочку
Анализ на эшерихиоз можно сдать как в обычной поликлинике, так и в частной лаборатории. Желательно заранее уточнить, какой метод исследования при этом используется.
Бактериологические исследования лучше проводить в клиниках и лабораториях, оснащенных автоматическими и полуавтоматическими анализаторами. Это исключает человеческий фактор, позволяет проводить исследование с широким перечнем антибиотиков и бактериофагов. Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Также стоит обратить внимание на время проведения исследования. Для бактериологического исследования это не менее пяти дней. Раньше бактерия просто не успеет вырасти в достаточном для анализа количестве. Время больше 7–10 дней говорит о том, что исследование будет проводиться в сторонней лаборатории. Это существенный недостаток, поскольку речь идет о транспортировке биоматериала, что нежелательно: чем раньше был доставлен материал, тем более достоверным будет результат.
Так как с результатами исследования еще придется идти к врачу для назначения лечения, не стоит выбирать неизвестные лаборатории по принципу «ближе к телу». Врач может просто не поверить полученным результатам и отправить сдавать анализ заново в свою больницу или в лабораторный центр, которому он доверяет. А это повлечет дополнительные временные и денежные траты.
Кишечная палочка — неотъемлемая часть микрофлоры кишечника. Пока она находится под контролем организма, ее клетки помогают синтезировать витамины, переваривать пищу, создавать благоприятную среду для жизни других полезных микробов. Но любое нарушение этого равновесия грозит патологиями вплоть до серьезных воспалительных заболеваний. К счастью, медицина помогает нам вовремя выявить отклонения от нормы и приять соответствующие меры.
симптомы, лечение, диагностика в Европейском Медицинском Центре
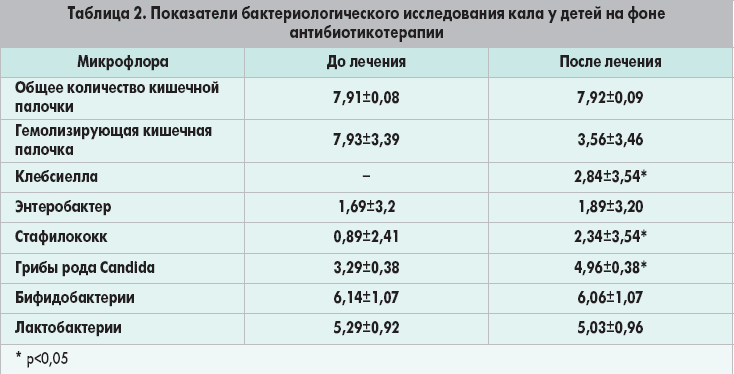
Самая частая причина цистита (до 80%) – это бактерия Escherichia coli (кишечная палочка), которая поражает слизистую мочевого пузыря и мочеиспускательного канала. Кишечная палочка является составляющей нормальной флоры кишечника, однако вирулентные типы этой бактерии попадают в мочевой пузырь через мочеиспускательный канал и вызывают местное воспаление. Также причиной цистита может стать внутрибольничная инфекция, особенно у пациентов с уретральным катетером.
Цистит: факторы риска
-
Использование женщинами тампонов в качестве средств личной гигиены.
-
Риск заболеть циститом повышается при использовании вагинальных диафрагм в качестве контрацепции.
-
Если мочевой пузырь не опорожняется полностью, то остаточная моча – это хорошая питательная среда для размножения бактерий.
-
Сексуальная активность.
-
Различные заболевания почек или мочевого пузыря.

-
Во время менопаузы, когда из-за недостатка женских половых гормонов снижается количество продуцируемой слизи во влагалище, которая выполняет барьерную функцию, бактерии чаще попадают в мочеиспускательный канал. Таким образом, женщины, находящиеся на заместительной гормональной терапии, имеют меньший риск заболеть циститом.
-
Анатомически наружное отверстие уретры у женщины расположено ближе к анусу, чем у мужчин – это еще одна причина легкого заброса бактерий из прямой кишки в мочеиспускательный канал.
Если цистит возникает у мужчины, то это, как правило, потенциально более серьезная проблема, чем у женщины, так как причинами могут быть такие заболевания, как инфекция предстательной железы, рак, инфравезикальная обструкция, увеличение предстательной железы – гиперплазия. Также в группе повышенного риска возникновения цистита находятся мужчины, имеющие однополые сексуальные отношения.
Симптомы цистита
-
примесь крови в моче,
-
темная, насыщенная по цвету моча,
-
сильный запах мочи,
-
боль над лоном,
-
боль в животе,
-
боль в области поясницы,
-
учащенное мочеиспускание,
-
жжение при мочеиспускании,
-
пожилые пациенты могут ощущать слабость и повышение температуры тела и не отмечать при этом других симптомов.

Другие заболевания, имеющие те же симптомы, что и цистит:
-
уретрит (воспаление мочеиспускательного канала),
-
уретральный синдром,
-
некоторые бактериальные инфекции,
-
простатит (воспаление предстательной железы у мужчин),
-
кандидоз (молочница).
Диагностика цистита
Доктор проведет с вами подробную беседу, сделает осмотр и назначит анализ мочи. Бактериологический посев мочи с определением антибиотикограммы назначается дополнительно, чтобы точно определить наличие и тип бактерии в моче. Если бактерии в моче обнаруживаются, то доктор назначает специфические антибиотики, воздействующие на эти бактерии.
Часто проводятся дополнительные проверки на наличие заболеваний, передающихся половым путем, так как многие из них могут иметь симптоматику, схожую с циститом.
Пациентам, у которых цистит повторяется неоднократно, требуется более детальное обследование, которое включает в себя: УЗИ мочевой системы и цистоскопию.
Лечение цистита
Любой цистит, который продолжается больше 3 дней, требует лечения и наблюдения у врача. Большинство пациентов отмечают улучшение уже в первые дни лечения правильно подобранными антибиотиками.
Пожилые пациенты, пациенты, страдающие сахарным диабетом, а также пациенты со сниженным иммунитетом, имеют высокие риски восходящей инфекции – поражения почек и других осложнений. Поэтому лечение таких больных нужно начинать незамедлительно.
Профилактика цистита
-
гигиена после половых контактов,
-
во время мочеиспускания старайтесь полностью опорожнять мочевой пузырь,
-
если вы чувствуете, что хотите в туалет, не терпите и не откладывайте мочеиспускание,
-
избегайте ношения узких и давящих брюк,
-
носите хлопковое нижнее белье,
-
во время полового акта контролируйте количество любрикации, если ее не достаточно, используйте искусственные любриканты,
-
опорожняйте мочевой пузырь сразу после полового акта.

лечение, норма, симптомы и причины
Боль при мочеиспускании и частые позывы, маленький объем выделяемой мочи, зуд, воспаление, дискомфорт при половом акте – это признаки присутствия эшерихия коли в моче. Escherichia coli – условно-патогенная кишечная анаэробная бактерия, укрепляющая иммунную систему человека и стимулирующая пищеварительные процессы.
Боль при мочеиспускании и воспаления могут свидетельствовать о наличии Escherichia coli в огранизме
Причины появления e. coli
Escherichia coli – естественная анаэробная бактерия человеческого организма. Это условно-патогенный микроорганизм, обитающий в кишечнике и имеющий более 100 штаммов. Общепринятое сокращение названия бактерии – E. coli. Также её называют кишечной палочкой.
Существует 2 основных класса эшерихий коли:
- Непатогенные штаммы: утилизируют кислород, вредный для лакто- и бифидобактерий, синтезируют витамины К, В и биотин, способствуют лучшему усвоению микроэлементов, стимулируют обмен веществ, предотвращают возникновение кишечных инфекций.

- Патогенные штаммы: в норме не содержатся в организме человека, вызывают серьёзные инфекционные заболевания ЖКТ и мочеполовой системы. Подразделяются на 4 группы: энтеропатогенные, энтеротоксигенные, энтероинвазивные и гемолитические бактерии.
Как выглядит кишечная палочка, можно посмотреть на фото ниже.
Кишечная палочка e. coli
Присутствие кишечной палочки в моче может возникать в результате таких причин:
- Ношение тесного и неудобного белья.
- Плохая гигиена половых органов: недостаточное проведение процедур или подмывание некачественными средствами.
- Неправильная техника подмывания у женщин.
- Специфические половые акты: анальный секс у мужчин, анально-вагинальный у женщин.
- Заражение инфекциями, передающимися половым путём, а также половые акты с семяизвержением при инфицировании партнёра кишечной палочкой.
- Прикосновение к половым органам грязными руками
coli проникает в мочевой пузырь у женщин в 4-5 раз чаще, нежели у мужчин. Это связано со строением выделительных органов: анус и мочеиспускательный канал расположены поблизости, что увеличивает вероятность мигрирования бактерий.
Это связано со строением выделительных органов: анус и мочеиспускательный канал расположены поблизости, что увеличивает вероятность мигрирования бактерий.
Из-за слабого иммунитета инфицированию кишечной палочкой также подвержены дети грудного, дошкольного и младшего школьного возраста.
Кишечная палочка передаётся пищевым, водным, бытовым и половым путями.
Симптомы эшерихии коли в моче
Появление кишечной палочки в моче вызывает следующие патологические состояния:
- У женщин: вагинит, перитонит, аднексит, эндометрит.
- У мужчин: простатит, орхит, эпидидимит.
- У представителей обоих полов: уретрит, цистит, пиелонефрит.
Простатит — самое частое заболевание у мужчин, которое вызывает кишечная палочка
К типичным симптомам, проявляющимся при инфицировании эшерихией коли, относят:
- болезненность и жжение во время мочеиспускания;
- частые позывы к мочеиспусканию;
- снижение объёма выделяемой мочи;
- зуд, покраснение и жжение в мочевыводящем канале;
- примеси в моче: кровь, слизь, сгустки гноя;
- неприятные ощущения при половом акте;
- резкий запах мочи и выделяемого секрета;
- тянущие боли в пояснице, в области почек;
- боль в простате, снижение потенции у мужчин;
- повышение температуры тела у детей.
Важно!
Из-за обширной и неспецифической симптоматики определить возбудителя болезни без диагностических манипуляций не представляется возможным.
Диагностика
Обнаружить повышенное содержание кишечной палочки в моче пациента и выявить степени микробиологических нарушений можно при помощи следующих диагностических методик:
- Опрос пациента, выявление симптоматики.
- Осмотр мочевыделительных органов.
- Забор биохимического и общего анализов мочи.
- Взятие посева на микрофлору.
Наиболее значим последний метод. Если в посеве на флору обнаружено присутствие бактерий Escherichia свыше 105 КОЕ, пациенту назначается соответствующее лечение вне зависимости от отсутствия или наличия выраженных симптомов.
Особенности забора мочи
При исследовании мочи на кишечную палочку часто возникает ложноположительный результат. В большинстве случаев это связано с неправильным забором материала для исследования:
Взятие мочи на анализ производится следующим образом:
- Для сдачи анализа в аптеке покупается специальная стерильная баночка.
- Анализ забирается в утреннее время суток, сразу после пробуждения.
- Перед процедурой пациент тщательно подмывается и моет руки с нейтральным мылом.
- Женщины прикрывают вход во влагалище стерильной ватой либо тампоном.
- В ёмкость забирается не менее 70 мл мочи. Первая и последняя струи мочи пропускаются.
- Материал относится в лабораторию спустя 1-2 часа после забора.
Правильно соберите мочу на анализ для получения достоверного результата исследования
За сутки перед сдачей анализа нельзя употреблять красящие продукты, мочегонные препараты, а также выполнять тяжёлые физические упражнения.
Лучшим вариантом будет сдать анализ в медицинском кабинете, с использованием катетера.
Лечение escherichia coli
Для лечения кишечной палочки применяются несколько методов:
- медикаментозная терапия;
- применение народных рецептов;
- соблюдение кисломолочной диеты.
Медикаментозные препараты
Для лечения мочеполовых инфекций, спровоцированным эшерихией коли, применяются препараты различных лекарственных групп в виде таблеток, мазей и порошков.
Монурал — антибиотик, который назначают для лечения кишечной палочки
| Группа лекарств | Влияние на Эшерихию коли | Примеры средств |
| Антибиотики | Приём антибиотиков убивает патогенную микрофлору в человеческом организме. | Монурал, Фурамаг, Амоксициллин. |
| Бактериофаги | Воздействуют исключительно на патогенную микрофлору, не уничтожая условно-патогенные и полезные бактерии человеческого организма. | Б. коли жидкий, Б. колипротейный, пиобактериофаг, интестибактериофаг |
| Местные антисептики | Угнетают развитие патогенных микроорганизмов, локально уничтожают бактерии. | Мирамистин, Хлоргексидин, Гексорал |
| Пробиотики | Содержат естественные бактерии человеческого организма, нормализуют микрофлору после приёма антибиотиков. | Бифиформ, Линекс, Лактобактерин, Бифидумбактерин |
| Пребиотики | Содержат питательные вещества для бактерий, стимулируют восстановление микрофлоры. | Хилак форте, Бактистатин, Лактофильтрум |
| Уросептики | Нормализуют работу почек, выводят из организма лишнюю жидкость, устраняют отёки. | Унипен, Геопен, Нолицин |
| НПВС | Применяются при жаре и лихорадке, возникающих при инфекции у детей. | Парацетамол, Нурофен, |
| Модуляторы иммунной системы | Укрепляют иммунитет пациента, улучшают естественное сопротивление организма инфекционным заболеваниям. | Ингавирин, Элеутерококк, Эхинацея |
| Витаминные комплексы | Супрадин, Витрум, Центрум |
Народные средства
К народным методам, применяемым для лечения кишечной инфекции, относят отвары и настои лекарственных трав, спринцевания и приём специальных продуктов.
Мумиё
Лечебное мумиё – эффективное противовоспалительное средство, помогает бороться со многими типами бактериальных инфекций в человеческом организме.
Используйте мумиё для борьбы с воспалительными и бактериальными инфекциями
Для избавления от кишечной палочки в моче употребляют внутрь 3 раза в сутки перед приёмом пищи, по 0.5 г за один приём. Лечение мумиё длится в течение 1 месяца, после курс прерывают на неделю и повторяют ещё раз, если в этом есть необходимость.
Кисломолочные продукты
Восстановить микрофлору и баланс бактерий в организме поможет специальная кисломолочная диета. Она включает в себя следующие продукты:
- простоквашу;
- творог;
- кефир;
- ряженку;
- твёрдые и мягкие сыры.
Употребление кисломолочных продуктов поможет восстановить микрофлору кишечника
Употреблять эти продукты следует не менее 2-3 раз в день, добавляя к привычному рациону или заменяя ими другие блюда.
Земляная груша (топинамбур)
Земляная груша, или топинамбур – средство с антимикробным, противовоспалительным и иммуномодулирующим эффектом. Для лечения e. coli из него готовится особое блюдо.
Добавьте блюда с топинамбуром в свой рацион для повешения иммунитета
- 250 г клубней очистить, нарезать кубиками.
- Поставить кастрюлю на огонь, влить по 1 стакану молока и воды.
- Довести смесь до кипения, всыпать в неё топинамбур, варить 30-40 минут до размягчения.
- Перелить жидкость, добавить 1 ст. л муки и 2 ст. л. сливочного, растительного или оливкового масла. Варить до загустевания.
- Полить корнеплоды соусом, приправить по желанию.
Употреблять блюдо необходимо 2-3 раза в день до полного исчезновения симптомов болезни.
Отвар лапчатки гусиной
Эта лекарственная трава обладает сильными антибактериальными и противовоспалительными свойствами. Отвар из неё готовится таким способом:
- Тщательно промыть, высушить и измельчить растение.
- Залить 1 ст. л. травы 250 мл вскипячённой горячей воды, поставить на огонь.
- Варить в течение 20 минут, после настаивать 8-10 часов в тёмном прохладном месте.
Отвар лапчатки гусиной — отличное антибактериальное средство для борьбы с кишечной палочкой
Полученный напиток процеживается и выпивается за 2-3 употребления.
Противомикробный настой
Избавиться от кишечной палочки в урине помогут травы с антисептическим эффектом: барбарис, желтокорень канадский, женьшень, полынь, солодка голая, коптис китайский, ломатиум.
Настой из травы горькой полыни имеет сильное противомикробное действие
- Промыть, высушить и мелко нашинковать травы.
- Взять по 1 ч. л. каждой травы, смешать с 1 л кипятка.
- Накрыть крышкой, убрать в тёмное место, настаивать в течение суток.
Настой следует процедить и употреблять внутрь по 100 мл 3-4 раза в сутки.
Травяной чай
Лекарственные травы можно употреблять внутрь в виде чая. Для приготовления чая понадобятся зверобой, репешок, подорожник, ромашка и мята.
Заваривайте лечебные травы и употребляйте в течении для вместо чая
- Взять по 10 г зверобоя и репешка, по 20 г подорожника, ромашки и мяты.
- Смешать травы между собой, залить 500 мл кипятка.
- Укутать ёмкость с напитком, настаивать в течение часа.
После настой употребляется внутрь, как обычный чай. Способ особенно актуален для детей: напиток получается вкусным и не горчит.
Спринцевания
Промывание половых органов и мочеиспускательного канала у мужчин и женщин позволяет быстрее справиться с инфекцией, уничтожая патогенные микроорганизмы локально.
Для спринцевания применяются:
- мумиё;
- травяные отвары;
- хлоргексидин;
- мирамистин;
- прополис.
Делайте спринцовки с хлоргексидином для локальной борьбы с кишечной палочкой
Использовать метод можно исключительно взрослым людям, и не чаще 1 раза в сутки.
Эшерихия коли в моче при беременности
Согласно статистике, во время беременности количество кишечных палочек в моче превышает норму в 3-4 раза чаще, нежели в обычном состоянии организма.
Увеличению количества E. coli в моче способствуют следующие факторы:
- Физиологическая и гормональная перестройка организма беременной женщины.
- Увеличение матки, провоцирующее сдавливание почек и ухудшение их работы.
- Застой мочи, способствующий развитию кишечных палочек.
Присутствие кишечных бактерий в моче у беременных может вызвать такие последствия:
- инфицирование плода;
- недонашивание беременности;
- патологии внутриутробного развития;
- возникновение физических пороков у младенца;
- детский церебральный паралич.
Для лечения будущих мам применяются препараты из групп бактериофагов и пробиотиков. Антибиотики назначаются при острых показаниях и только в случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода.
Кишечная палочка e. coli у ребенка
Из-за слабого иммунитета дети подвержены заражению кишечной палочкой в большей степени, нежели взрослые. Наиболее часто высокий уровень E. coli встречается в моче у детей дошкольного и младшего школьного возраста.
Причиной инфицирования могут стать плохая гигиена половых и выделительных органов, ношение неподходящего по размеру белья, общее снижение иммунитета.
У грудничка причиной заражения могут стать:
- снижение иммунной защиты организма;
- инфицирование в родильном отделении;
- употребление материнского молока;
- недостаточная гигиена рук ребёнка;
- некачественно продезинфицированные соски и бутылочки.
Чтобы обезопасить ребенка от заражения кишечной палочкой используйте стерилизатор для обработки сосок и бутылочек
Когда количество кишечных палочек в моче у детей повышено, это провоцирует инфекционные заболевания мочеполовой системы и общее угнетение иммунной системы.
Младенцев и детей до 12 лет лечат при помощи пробиотиков, пребиотиков и бактериофагов. При острых показаниях допустимо применение антибактериальных препаратов из группы пенициллинов.
После 12 лет схема лечения аналогична взрослой.
Профилактика
Предотвратить заражение мочеполовой системы кишечными бактериями можно при помощи следующих профилактических мер:
- Соблюдение правил гигиены рук и половых органов.
- Подбор подходящего белья и средств интимной гигиены.
- Предохранение во время полового акта.
- Укрепление иммунной системы, занятие спортом.
- Употребление достаточного количество жидкости.
Чтобы защитить себя от заражения эшерихия коли предохраняйтесь
Повышенная концентрация кишечной палочки в моче человека провоцирует тяжёлые воспалительные заболевания мочеполовой системы. Их можно лечить при помощи антибиотиков, бактериофагов, народных средств и кисломолочной диеты.
Escherichia coli в моче — норма, у ребенка, при беременности, лечение
Таинственное название escherichia coli является бактерией, которая живет в организме каждого человека. Коли играет свою важную функцию, но иногда может стать опасной для жизни и здоровья.
Зачастую escherichia coli в моче обнаруживается при исследованиях анализов. Ее наличие в урине часто осложняет лечение основного заболевания. Симптомы, связанные с патогенными микроорганизмами, зависят от возраста и состояния здоровья пациента, а также от тяжести болезни.
Что такое escherichia coli?
Кишечная палочка принимает участие в разложении пищи, а также производстве витаминов В, К1 и С. Бактерия была обнаружена в конце 20 века австрийским врачом Теодором Эшерихом, которому и обязана своим названием.
Из-за своей особенной структуры коли широко используется в биотехнологиях и генетических исследованиях.
Пока эшерихия-coli остается в пищеварительной системе, коли не угрожает здоровью. Тем не менее, если ей удается добраться до других органов, это может вызвать различные недомогания и болезни. Наиболее часто коли становится причиной пищевого отравления, симптомами которого является брюшная боль, слабость, диарея, небольшое повышение температуры, кровавый стул.
Coli-инфекция также может попасть в мочевыводящие пути, вызывая заражение патогенными микроорганизмами, воспаление пузыря и болезни почек. Зачастую эшерихий-coli попадает в мочевую систему в результате несоблюдения правил гигиены.
Причины развития заболевания
Когда escherichia coli попадает в мочевыводящие пути у здоровых людей коли выходит с мочой, прежде чем получает шанс развить эндемию. Однако некоторые факторы позволяют кишечной палочке блокироваться в потоке мочи, что приводит к размножению патогенных микроорганизмов.
С инфекцией человеческое тело начинается бороться с помощью лейкоцитов. Наличие их в моче является доказательством того, что в мочевыводящих путях присутствует эшерихия-coli.
То есть если в урине есть некоторое количество escherichia coli, это не означает распространение заболевания. Но вместе с лейкоцитами это определяет инфицирование мочевых путей. У большинства людей бактерия приводит к инфекциям только нижних органов мочевой системы.
Однако у некоторых пациентов наряду с другими медицинскими проблемами или с очень большой численностью прокариотных организмов эндемия может подняться выше и достигнуть почек.
Симптомы инфекций нижних половых путей обычно ограничены в мочевом пузыре, паренхиме, уретре, мочеиспускательном канале и простате у мужчин. В таком случае больной может испытывать боль, жжение или другие симптомы, присущие проблемам при мочеиспускании.
Когда coli-инфекция достигает почек, возникают системные признаки, которые могут повлиять на весь организм. Они включают в себя боль в теле, повышение температуры, потерю аппетита, тошноту и рвоту.
Кишечная палочка у беременных
Наш сервис бесплатно подберет вам лучшего уролога при звонке в наш Единый Центр Записи по телефону 8 (499) 519-35-82. Мы найдем опытного врача поблизости от Вас, а цена будет ниже, чем при обращении в клинику напрямую.Часто появлением кишечных патогенных микробов страдают беременные женщины. Плод давит на пузырь, через что мочь застаивается в путях и способствует распространению инфекции.
Кроме этого, такие гормоны, как прогестерон и эстроген, содействуют лучшей адгезии бактерий на слизистой оболочке мочевых путей. Исключить риск заражения escherichia coli возможно, придерживаясь интимной гигиены, а также регулярными мочеиспусканиями при необходимости.
В связи с анатомической близостью влагалища и уретры, есть риск развития воспаления половых путей. Инфицирование во время беременности иногда вызывает многие осложнение, в том числе преждевременные роды и смерть плода.
Escherichia coli в моче при беременности является частью природной бактериальной флоры влагалища. Ее неблагоприятное воздействие блокируется молочнокислыми микроорганизмами.
Только в некоторых случаях при гормональном бактериологическом дисбалансе escherichia-coli размножается и способствует развитию прокариотов, приводящих к воспалению.
Норма escherichia coli в моче
Критерии количественных показателей бактерий в урине имеют следующие значения:
- <104 КОЕ/мл – нормаколи-инфекции;
- >104, но <105 – пограничный параметр;
- <105 КОЕ/мл считается положительным результатом.
Бактериурия определяется при нахождении >105 КОЕ на мл мочи.
Интерпретация тестировании
Результаты культуры мочи часто интерпретируются в сочетании с выводами общего анализа мочи и условий, при которых был собран образец.
Как правило, наличие одного вида бактерий, растущих большими колониями, является положительным посевом мочи. Для чистых образов культура с более 100 000 колониеобразующих единиц (КОЕ) на 1 мл, указывает на заболевание. В некоторых случаях значительная численность микроорганизмов указывает на их распространение в организме.
Определение ИМП у женщин по результатам культуры чистого образца является:
- более 10 в 3 степени – постоянный цистит;
- более 10 в 4 степени – пиелонефрит;
- более 10 в 5 степени – бессимптомная бактериурия.
Бессимптомная бактериурия может быть при >105 КОЕ/мл урины, проходит она без симптомов или других аномальных результатов. В таком случае есть вероятность инфицирования другими микробами.
При условии, когда культура показывает рост различных видов микроорганизмов, вполне вероятно, что это происходит из-за загрязненного образца.
Лечение
В большинстве случаев лечение заключается в местной или амбулаторной терапии. Уменьшить инфицирование escherichia coli необходимо путем пополнения жидкости и электролитов в организме. Также необходимо обеспечить отдых и обязательно следить за развитием дополнительных симптомов.
При кровавом поносе и лихорадке необходимо обратиться к врачу, прежде чем принимать антидиуретики. Если есть признаки обезвоживания, особенно при наличии escherichia coli в моче у ребенка, необходима госпитализация и внутривенные вливания. В некоторых случаях врач может предложить антибиотики, такие как пенициллин, тетрациклин и цефалоспорин. У большинства пациентов улучшения наступают через 5-7 дней после начала заболевания.
Профилактика
Практика безопасного приготовления пищи может уменьшить шансы на развития эндемии из-за наличия патогенных прокариотов. К ним относятся:
- тщательная обработка овощей и фруктов;
- обработка рук с помощью теплой воды с мылом;
- избежание перекрестного загрязнения посуды для приготовления и продуктов;
- правильная тепловая обработка мяса;
- размораживание мясных продуктов в холодильнике или микроволновой печи;
- употребление только пастеризованных молочных продуктов.
Кишечная палочка (escherichia coli) неустойчива к высоким температурам. Всего 20 минут приготовления пищи при 600С избавят мочевыводящие пути от этих патогенных микробов.
Еще больше информации, в частности про симптомы, в видеосюжете:
что это такое при беременности, лечение Эшерихии коли
Научно доказано, что присутствие в организме различных бактерий и микробов – это норма. Если их количество не превышает допустимое значение и они локализуются в соответствующей среде, вреда от этих микроорганизмов не будет. Их присутствие, наоборот, является необходимым, поскольку они отвечают за работу внутренних органов и систем.
Одним из таких микроорганизмов является кишечная палочка Escherichia coli, относящаяся к условно-патогенным анаэробным бактериям. В норме бактерия должна находиться исключительно в кишечнике, при попадании в другие отделы организма она приводит к разным нарушениям. Особенно опасным является присутствие Escherichia coli в моче, что ведет к развитию воспалительного процесса и в мочеполовой системе и указывает на присутствие патологий.
Общие сведения
В кишечной микрофлоре присутствует большое количество различных бактерий. Большая их часть необходима для полноценного функционирования организма, который представляет микроорганизмам благоприятную среду для выживания. Также некоторые бактерии поставляют в организм различные витамины и минералы.
Но специалисты предупреждают: польза от них будет только в том случае, если их количество находится в пределах допустимой нормы. Если патогенные микроорганизмы начнут стремительно размножаться, это нарушит работу организма и приведет к развитию патологических процессов.
Микроорганизм эшерихия коли относится к палочковидным. Бактерия получила название в честь немецкого ученого Теодора Эшериха, который впервые обнаружил ее. В идеале данный микроорганизм должен локализоваться в нижнем отделе пищеварительной системы. Отличительной особенностью этой разновидности бактерий является то, что они могут жить как при наличии кислорода, так и без него.
Эшерихия отличается повышенной жизнеспособностью и может на протяжении продолжительного времени жить в почве, водной среде и испражнениях. Также E. coli способна размножаться в различных продуктах питания, особенно в молочных. Погибает бактерия только при кипячении и пастеризации.
Эшерихия коли относится к полезным микроорганизмам, но при изменении благоприятных условий в кишечнике она начинает меняться и может спровоцировать развитие опасных заболеваний. Если при проведении анализа обнаружилась эшерихия коли в моче, необходимо незамедлительно обратиться к специалисту и пройти полноценную диагностику, чтобы выявить, что стало причиной таких изменений.
Естественные причины обнаружения бактерии
Медики предупреждают, что присутствие в урине бактерий Е коли не всегда свидетельствует о наличии опасного заболевания. Как показывает практика, более чем в 50% случаев попадание этого микроорганизма в мочу не связано с инфекционными заболеваниями, а является следствием таких нарушений:
- неправильный забор мочи. Для проведения анализа пациент должен собрать мочу в стерильный пластиковый контейнер. Такие флаконы продаются в каждой аптеке. Если процесс сбора мочи выполнен неправильно, в биоматериал попадут сторонние бактерии и микроорганизмы, что приведет к искажению результатов и смажет клиническую картину;
- нарушение стерильности. Сторонние бактерии могут попасть в исследуемую урину уже в лаборатории. Чаще подобное происходит из-за нарушения стерильности емкости для материалов;
- недавний половой акт. У представителей сильного пола кишечные палочки попадают в урину после анального секса. Бактерии могут попасть в урину только в том случае, если человек после полового акта не соблюдает правила гигиены;
- недавнее хирургическое вмешательство. Довольно часто хирургическое вмешательство сопровождается заражением эшерихией. Инфицирование происходит из-за того, что при введении наркоза нейтрализуется действие иммунной системы. В этот период органы остаются без защиты и становятся более уязвимыми перед различными инфекциями. При этом эшерихия коли может перемещаться в разные системы при помощи крови.
Чтоб получить верные результаты диагностики, следует правильно собрать биоматериал для исследования
Стоит отметить, что заразиться бактерией через половой контакт невозможно. Инфицирование возможно исключительно при переносе патогенной микрофлоры из одного органа в другой. Учитывая такие особенности, становится очевидно, что присутствие эшерихии не всегда является следствием инфекции.
Возможные заболевания
Сегодня известно огромное количество бактерий-возбудителей, провоцирующих развитие различных заболеваний органов мочеполовой системы, и эшерихия коли является одной из наиболее распространенных. Особенно вероятность инфицирования повышается, если мочевыделительная система расположена слишком близко к кишечнику.
Как показывает практика, заболевания, вызванные этим возбудителем, чаще поражают представительниц прекрасного пола, нежели мужчин. Присутствие микроорганизма в моче может привести к развитию таких патологий:
- цистит. Основная характеристика заболевания – воспаление мочевого пузыря. Недуг сопровождается частыми позывами к мочеиспусканию, тянущими болями в брюшной полости и общей ослабленностью. В запущенных случаях может повыситься температура. Цистит диагностируется в основном у женщин и при отсутствии своевременного лечения может перейти в хроническую форму;
- пиелонефрит. При этой патологии поражается канальная система почек. Заболевание чаще протекает в острой форме, но также может перейти и в хроническую, что повлечет за собой частые обострения. Основные симптомы заболевания – боли в пояснице со стороны пораженной почки, тошнота, незначительное повышение температуры, ухудшение аппетита;
- вульвит. Заболевание воспалительной природы, поражающее наружные половые органы у представительниц прекрасного пола. При обострении заболевания возникает сильный зуд и жжение в пораженных участках. Болезнь сопровождается покраснением тканей половых губ и обильными выделениями. Чаще всего вульвит является следствием травмирования половых органов;
- эндометрит. Патологический процесс, основной характеристикой которого является воспаление эндометрия маточных тканей. Данная болезнь является довольно опасной, поскольку часто дает осложнения на органы репродуктивной системы. При отсутствии своевременной терапии может стать причиной бесплодия. Эндометрит сопровождается болевыми ощущениями внизу живота, повышением температуры тела, учащенным сердцебиением и болезненностью при мочеиспускании. Чаще недуг диагностируется у женщин, имеющих внутриматочную спираль;
- простатит. Мужское заболевание, основной характеристикой которого является воспаление предстательной железы;
- уретрит. Заболевание имеет инфекционную природу и поражает мочеиспускательный канал. Больной ощущает сильные боли при мочеиспускании, выделение слизи из уретры и покраснение. При отсутствии терапии болезнь может поразить другие органы мочеполовой системы и перейти в хроническую стадию.
Специалисты предупреждают пациентов, что гемолитическая кишечная палочка (haemolyticus) эшерихия коли может спровоцировать развитие самых разных заболеваний мочевыделительной и половой систем. Для выявления общей клинической картины потребуется сдать различные анализы и пройти инструментальную диагностику.
Вот так под микроскопом выглядит кишечная палочка
Симптоматика
Признаки присутствия в моче эшерихии будут отличаться с учетом основного заболевания. Если пациент страдает от кишечного заболевания, симптомы будут следующими:
- присутствие схваткообразных болей в животе;
- незначительное повышение температуры, признаки лихорадки;
- головная боль;
- нарушение стула, сопровождающееся сильной диареей;
- тошнота и рвота;
- по мере поражения клеток толстой кишки развивается колит.
Если микроорганизм поразил органы мочеполовой системы, появляются следующие симптомы: частые позывы к опорожнению, непроизвольное мочеиспускание, задержка мочи, почечные колики. Если кишечная палочка переходит в органы репродуктивной системы, появляются такие симптомы: повышение температуры тела, болезненность в нижней части живота, боль при мочеиспускании, выделения из уретры, дискомфорт при половом контакте.
Признаки патологии будут схожими как у взрослых пациентов, так и у ребенка. При возникновении подобной симптоматики настоятельно рекомендуется проконсультироваться с врачом, который скажет, чем вызвано заболевание и какие меры нужно принять.
Эшерихия в моче при вынашивании ребенка
Для представительниц прекрасного пола беременность является одним из самых сложных периодов. В эти 9 месяцев защитные силы иммунитета у беременной ослабевают, что является естественным процессом, но при этом повышается риск инфекционных поражений. Если обнаружена escherichia coli в моче при беременности, риск патогенного действия на плод увеличивается.
Специалисты предупреждают, что заражение опасно на любом сроке, как на первом, так и на последнем. В первую очередь это связано с тем, что проникновение бактерий в женские половые органы может привести к преждевременному отхождению вод, из-за чего роды начинаются раньше срока. Также нельзя исключать вероятность прерывания беременности.
Если заражение кишечной палочкой происходит на последнем сроке, недуг может привести к развитию врожденных аномалий у малыша. Важно понимать, что у детей в утробе иммунитет к инфекциям полностью отсутствует, поэтому организм плода не сможет оказывать сопротивляемость бактериям. В медицинской практике нередко встречались случаи, когда заражение эшерихией приводило к поражению головного мозга и развитию менингита.
Боль внизу живота — один из возможных признаков бактериальной инфекции мочевыводящей системы
Также такое поражение увеличивает вероятность задержки развития. Если инфекция попадет в кровь, нельзя исключать риск развития септических процессов. Опасность патологии заключается и в том, что грудничкам нельзя принимать большинство медикаментов, в том числе антибиотики, которые являются основным способом лечения инфекционных заболеваний.
Норма в анализах
Врачи предупреждают пациентов, если в бак посеве мочи эшерихия не превышает 10 в 3 степени (максимум 10 в 4 степени), это не считается отклонением от нормы. Такой результат расшифровывается как отрицательный, при этом бактериурия у мужчин и женщин не подтверждается.
Если показатели составляют 10 в 5, 10 в 6 и тем более 10 в 7 степени, это свидетельствует о тяжелой форме поражения. Если повторный анализ подтверждает присутствие кишечной палочки, требуется скорее начать лечение, в противном случае патология вызовет серьезные нарушения.
Методы лечения
При обнаружении в моче кишечной палочки самостоятельное лечение категорически недопустимо. Неграмотная терапия не только не даст ожидаемого результата, но и может усугубить ситуацию. Схема лечения назначается лечащим врачом после выявления первопричины заболевания.
Лечебные мероприятия направлены на решение следующих задач:
- устранение воспалительного процесса;
- восстановление слизистой мочевыделительной системы;
- устранение болезненности и дискомфорта;
- укрепление иммунитета.
В большинстве случаев терапия проводится путем приема медикаментов. При этом пациенту могут назначить антибиотики, противовоспалительные средства, иммуномодуляторы жаропонижающие. Препараты и дозировка подбираются индивидуально для каждого пациента с учетом особенностей организма и стадии поражения.
Профилактические меры
Чтобы свести к минимуму риск появления в моче кишечной палочки эшерихии, необходимо придерживаться следующих правил:
- необходимо соблюдать правила интимной гигиены. Обработка половых органов осуществляется спереди назад, что предотвращает перенос патологических палочек из прямой кишки на слизистую гениталий;
- фрукты и овощи нужно тщательно мыть перед употреблением в пищу;
- категорически запрещено пить некипяченую воду.
Если придерживаться этих простых правил, вероятность развития бактериальной инфекции снизится в несколько раз
Заключение
Повышенное содержание кишечной палочки в моче может привести к серьезным осложнениям и стать причиной хронических заболеваний. Именно поэтому намного разумнее предотвратить развитие поражения, чем потом заниматься его лечением. Все, что для этого требуется, – соблюдать профилактические меры.
Трудности лечения рецидивирующей инфекции мочевых путей. Возможности фитопрепаратов. | Перепанова Т.С.
Инфекции мочевых путей (ИМП) представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе наблюдают свыше 10 млн случаев ИМП [9]. При ИМП отмечается высокий уровень рецидивов инфекции, которая принимает характер хронической с частыми обострениями. При неосложненной инфекции нижних мочевых путей в воспалительный процесс вовлекается слизистая оболочка уретры и мочевого пузыря, однако в дальнейшем может вовлекаться и лоханка почки при восходящем пути инфицирования. Поражение почечной паренхимы инфекционно–воспалительным процессом может привести к развитию пиелонефрита, хронической почечной недостаточности и бактериемии.
Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К неосложненным инфекциям мочевых путей относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких–либо нарушений к оттоку мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Это обычный острый восходящий цистит или пиелонефрит без нарушения оттока мочи у здоровых (в других отношениях) женщин с нарушениями мочеиспускания, наличием примесей, гноя в моче, иногда сопровождающийся примесью крови в моче, субфебрильной температурой тела и болями в боку [6]. Острый неосложненный бактериальный цистит в 80% случаев вызывается E. coli и в 15% другими возбудителями: St. saprophyticus, Enterococcus faecalis, Klebsiella spp., Proteus spp. [22]. В большинстве случаев острый цистит представляет поверхностные инфекции слизистой мочевого пузыря, легко поддающиеся терапии антимикробными препаратами. В то же время несмотря на легкость купирования острого цистита, несмотря на анатомически нормальные мочевые пути цистит очень часто рецидивирует.Осложненные ИМП (ОИМП) возникают на фоне анатомических нарушений и обструкции мочевыводящих путей (камни, стриктуры, опухоли, кисты, фистулы, доброкачественная гиперплазия предстательной железы), а также на фоне функциональных нарушений, таких как нейрогенный мочевой пузырь и везикоуретеральный рефлюкс. На инородных телах в мочевых путях (катетерах, стентах, дренажах, камнях) микроорганизмы формируют биопленки (biofilms), т.е скопления микроорганизмов из различных семейств с особыми механизмами самозащиты, что приводит к развитию «катетер–ассоциированной ИМП», «биофильм–инфекции». Таким образом, инородное тело становится очагом инфекции для организма, и бактериурия в таких случаях становится неизбежной [2].
Колонизация мочи микроорганизмами при отсутствии клинических симптомов называется асимптоматической бактериурией (АСБ). АСБ встречается у 6% здоровых людей и у 20% пожилых граждан. При АСБ понимают выделение микроорганизмов в 10 в 5 степени КОЕ/мл в 2 анализах средней порции утренней мочи, взятых через 24 ч [26]. Большинство пациентов с АСБ не требует лечения, т.к. у них нет клинических проявлений инфекции.
Escherichia coli ответственна за развитие более 80% всех ИМП и вызывает как АСБ, так и симптоматическую ИМП [3,16]. Эти виды инфекций вызываются одним бактериальным клоном: способность уропатогенной E. сoli (UPEC) вызывать симптоматическую инфекцию связывают с экспрессией различных факторов вирулентности, таких как адгезины (например, тип 1 и Р фимбрий) и токсины (например, гемолизин) [5,8].
Бактериальная адгезия является основным моментом в колонизации тканевых поверхностей организма–хозяина. Мочевые пути человека подчиняются силам гидродинамики, и адгезия микроорганизмов к уротелию дает им возможность противостоять удалению потоком мочи. Бактериальная адгезия не только способствует колонизации, но также благоприятствует инвазии микроорганизмов, формированию биопленок и повреждению клеток хозяина.
Оба типа фимбрий (1 и Р) запускают воспалительный ответ организма–хозяина, который включает продукцию цитокинов, воспалительную реакцию и отшелушивание инфицированных клеток уротелия [7,10,18].
Возбудителями ОИМП являются многочисленные резистентные микроорганизмы семейства Enterobacteriaceae: E. coli, Klebsiella pneumonia, Citrobacter spp., Enterobacter spp., Staphylococcus spp., Enterococcus faecalis, Proteus mirabilis, а также синегнойная палочка.
В ситуациях частой возвратной инфекции нижних мочевых путей, рецидива заболевания, когда вновь выделяется первоначальный патогенный возбудитель, необходимо урологическое обследование на предмет выявления аномалий развития или выявления сопутствующих заболеваний с соответствующей их коррекцией и обязательным подбором адекватного антибиотика.
Эффективное лечение ОИМП возможно только лишь при условии восстановления нормальной уродинамики и коррекции осложняющих факторов и сопутствующих заболеваний. ОИМП характеризуется частыми обострениями заболевания, где необходимо дифференцировать реактивацию существующего очага инфекции от реинфекции (новый возбудитель).
Целью лечения ОИМП является профилактика уросепсиса, рецидива заболевания, предупреждение развития осложнений и повреждения паренхимы почек.
Из антибактериальных препаратов для лечения ОИМП рекомендуются фторхинолоны, защищенные b–лактамы, цефалоспорины, аминогликозиды, комбинации антибиотиков. Однако длительная непрерывная антибактериальная терапия приводит к дисбиозу кишечника, влагалища, аллергизации организма и селекции резистентных штаммов микроорганизмов.
Персистенция бактерий в мочевых путях представляет одну их наиболее трудных задач успешного лечения ИМП. При «катетер–ассоциированной ИМП», «биофильм–инфекции», «инфекции инородного тела» быстрая (в течение 24–72 ч) колонизация поверхностей инородных тел микроорганизмами приводит к формированию биопленок. Чаще всего после удаления инородных тел из мочевых путей бактериурия исчезает.
Однако наибольшие трудности представляет персистенция микроорганизмов в слизистой оболочке мочевых путей без наличия или после удаления катетеров, инородных тел. Так называемый рецидивирующий, или персистирующий, бактериальный цистит (свыше 3 обострений в год) наблюдается у 25–40% женщин после однократного эпизода острого цистита.
Многие виды бактерий способны паразитировать внутриклеточно, проявляя тропность к различным клеткам хозяина – факультативный паразитизм. Кишечная палочка, например, может паразитировать в клетках эпителия и макрофагов, создавая внутриклеточные бактериальные сообщества (ВБС). Наличие фимбрий и ферментативная активность микроорганизмов обеспечивает им проникновение в клетку или межклеточное пространство. Необходимым условием персистенции являются определенные биологические свойства микроорганизма и дефектность защиты хозяина, что обусловливает бактерионосительство (персистенция возбудителей) и хронизацию воспалительного процесса (частые рецидивы заболевания).
Снижая вирулентность или изолируясь в очагах локального иммунодефицита, бактерии могут уклоняться от факторов защиты человека. Подавление же факторов защиты хозяина идет за счет повышения вирулентных свойств бактерий или в результате диссеминации в иммунокомпрометированном организме. Высокая приспосабливаемость микроорганизмов к постоянно меняющимся условиям существования особенно проявляется при антибиотикотерапии – обесцениваются целые классы антибиотиков за счет селекции резистентных штаммов микроорганизмов [1,28].
Лечение персистирующей или хронической ИМП и эффективная санация от бактерионосительства представляют большую проблему. Во внутриклеточных бактериальных сообществах резистентность к антибиотикам обусловлена:
• ограниченным проникновением антимикробных веществ в биопленки;
• различием в метаболической активности и скорости роста отдельных клеток бактерий, т.к. многие антибиотики не действуют на клетки, находящиеся в покое;
• уменьшением диффузии АБ внутрь;
• инактивацией АБ внутри матрикса.
Однако выяснено, что малые концентрации антибиотиков вызывают существенные изменения в морфологии и биохимии бактерий. Суб–бактериостатические концентрации (1/4 МПК) пенициллина, гентамицина, ванкомицина и др. вызывают резкое подавление адгезии стрептококков разных видов к слизистой оболочке [24]. В то же время длительное антибактериальное лечение в суб–бактериостатических дозах чревато селекцией резистентных штаммов микроорганизмов.
Известно подавляющее действие фитотерапевтических препаратов на персистенцию уропатогенов [29]. Выяснено, что ингибирующее действие различается в отношении разных возбудителей инфекции: E. coli, Klebsiella spp., Proteus mirabilis – в зависимости от механизма персистенции микроорганизмов: антилизоцимной или анти–интерфероновой их активности.
Одна из задач растительных диуретиков заключается в стимуляции диуреза и улучшении механизма самоочищения мочевых путей. Сам акт мочеиспускания является естественным механизмом защиты от внедрения возбудителей мочевой инфекции, поэтому увеличение диуреза на фоне увеличенного количества выпиваемой жидкости (соответственно, при хорошей переносимости) являются обязательными мерами при лечении мочевой инфекции. Растительные диуретики больше влияют на водный диурез (акварез), чем на диурез как таковой, за счет увеличения почечного кровотока или участия в осмотических процессах [14]. Действующими веществами, ответственными за акваретический эффект растительных препаратов, обычно выступают эфирные масла, флавоноиды, сапонины, производные ксантины и гликозиды [4,11,12,13]. Прием растительных препаратов, обеспечивающих как диуретический, так и комбинацию антисептического, противовоспалительного и спазмолитического эффектов, наилучшим образом подходит для лечения и профилактики ИМП.
Канефрон Н (Бионорика АГ, Германия) — комбинированный препарат растительного происхождения. В состав его входят: золототысячник (Herba Centaurii), обладающий диуретическим и антибактериальным действиями, любисток (Radix Levistici) с его диуретическим (акваретическим), спазмолитическим, а также антибактериальными эффектами, и розмарин (Folia Rosmarini), который, помимо прочего, обладает также и противовоспалительным эффектом. Компоненты препарата оказывают выраженное антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, улучшают кровоток и уменьшают проницаемость капилляров почек, обладают диуретическим (акваретическим) эффектом, улучшают функцию почек, потенцируют эффект антибактериальной терапии. В траве золототысячника присутствуют алкалоиды, флавоноидные соединения, горькие гликозиды, феноловые кислоты. В составе любистока имеются эфирные масла, фенолкарбоновые кислоты, фталиды. Розмарин содержит розмариновую кислоту, эфирные масла и флавоноиды [4,15].
Водный диурез (акварез) – важный эффект препарата. Значительное мочеотделение, вызванное эфирным маслом (терпеном) любистока, происходит за счет расширения почечных сосудов, благодаря чему улучшается кровоток. Было также показано, что и секоиридоидные горечи (золототысячника малого) обладают сосудорасширяющими свойствами, наряду с положительным инотропным эффектом. Рассматривается также действие эфирных масел на реабсорбционную способность эпителиальных клеток канальцев. Диуретический эффект фенолкарбоновых кислот связывают с тем, что нерасщепляющиеся кислоты попадают в кровь, снижая щелочной резерв и смещая реакцию крови в кислую сторону. Смещение кислотно–щелочного баланса в крови и тканях приводит к тканевому эксикозу, и освобождающаяся из тканей жидкость выводится с мочой [4]. Спазмолитический (антихолинергический) эффект помимо фенолкарбоновых кислот оказывают и фталиды любистока: бутилиденфталид и лигустилид [17]. Розмариновая кислота ответственна за противовоспалительный эффект: она ингибирует неспецифическую активацию комплемента и липоксигеназу и в результате тормозит синтез лейкотриенов.
Все компоненты препарата Канефрон Н содержат активные вещества с антимикробным действием (фенолкарбоновые кислоты, секоиридоиды и др). Экскреция нерасщепляемых органических (фенол–) карбоновых кислот и их метилированных, глюкуронидированных и сульфатированных продуктов элиминации может провоцировать ацидификацию мочи, препятствуя росту бактерий.
Клинические исследования Канефрона Н охватывают период с 1973 г. до наших дней. За последние годы проведено несколько отечественных исследований по оценке эффективности Канефрона Н у больных с ИМП или профилактике ИМП.
Исследования эффективности Канефрона Н в течение 2 месяцев при лечении хронической инфекции мочевых путей и пиелонефрита на фоне мочекаменной болезни у 371 пациента показали его антимикробное действие, спазмолитический эффект, уменьшение процессов кристаллизации в моче, усиление отхождения кристаллов с мочой, увеличение диуреза [21]. Эти данные согласуются с исследованиями Аляева Ю.Г. и соавт. [19]. В их исследовании наблюдались 55 женщин с хроническим циститом и 79 пациентов с мочекаменной болезнью. Больным с циститом назначали фосфомицин (2 дозы) вместе с Канефроном Н (30 дней), в контрольной группе пациентки получали только фосфомицин (2 дозы). Авторы отмечают отсутствие рецидивов цистита в течение месяца приема Канефрона Н, в то время как в контрольной группе у 30% пациентов отмечены рецидивы. В течение следующего месяца наблюдения рецидив заболеваний отмечался у 21% больных контрольной группы, в то время как в основной группе – только у 7,2% пациентов. Камнеизгоняющее действие Канефрона Н подтверждено в этом исследовании у 73% пациентов в течение первых 5 сут. после дистанционной ударно–волновой литотрипсии, в то время как в контрольной группе, получавшей стандартную спазмолитическую терапию, – лишь у 33% пациентов. Ни у одного пациента не отмечено осложнений и нежелательных побочных реакций после приема Канефрона Н.
Осложненные госпитальные ИМП у больных с цистостомическими дренажами («катетер–ассоциированная бактериурия») обычно бывают вызванными несколькими возбудителями, характеризующимися множественной устойчивостью к противомикробным препаратам. Частота бактериурии у таких больных приближается к 100%, что требует длительного проведения антимикробной терапии. В исследовании в урологической клинике РГМУ [Мазо Е.Б., Попов С.В., 2006] было показано, что препарат Канефрон®Н повышает эффективность лечения таких больных, способствуя уменьшению выраженности кристаллурии, а также лейкоцитурии и бактериурии [23]. На основании полученных результатов авторы рекомендуют применение этого препарата в интервалах между повторными курсами антибактериальной терапии или вслед за назначением антибиотиков при долгосрочном лечении больных с постоянным цистостомическим дренажом.
Известно, что сахарный диабет (СД) существенно усугубляет патологические процессы в мочевыводящих путях и способствует их прогрессированию: частота пиелонефрита у больных СД достигает 35%, что в 7–8 раз выше, чем в популяции. Причиной этому является не только глюкозурия, создающая благоприятные условия для размножения микрофлоры в мочевом тракте, но и нарушение уродинамики вследствие диабетической нейропатии, ухудшение кровоснабжения почек (интерстициальной ткани и чашечно–лоханочной системы) и даже иммунологические нарушения. С целью оценить эффективность препарата Канефрон®Н в терапии ИМП у больных с метаболическим синдромом или СД 2 типа Иванов Д.Д. и соавт. (2005 г.) спланировали и провели многоцентровое открытое контролируемое рандомизированное исследование с участием 302 пациентов в возрасте от 15 до 58 лет [20]. Отдельно анализировались группы пациентов с инфекцией нижних и верхних мочевых путей в сравнении с соответствующими контрольными группами. Из исследования были исключены больные с заболеваниями, передающимися половым путем.
Критериями оценки эффективности применения Канефрона®Н были отсутствие бактериурии, лейкоцитурии, а также клинических проявлений ИМП после проведенного курса лечения антибиотиками через 3 мес. при инфекции нижних мочевых путей и 6 мес. при инфекции верхних мочевых путей. Оценка результатов лечения осуществлялась по первичной конечной точке – частоте реинфекции органов мочевой системы.
Полученные результаты свидетельствуют о достоверном (р
Для оптимизации результатов лечения и уменьшения риска рецидивирования пиелонефрита в этом же исследовании пациенты на этапе реабилитации с профилактической целью получали Канефрон®Н или 1/3–1/4 терапевтической дозы уроантисептика. При этом в процессе 6–месячного наблюдения количество больных с наличием реинфекции пиелонефрита не увеличилось при назначении профилактического лечения уроантисептиком или Канефроном®Н. Это свидетельствует о сходной эффективности фитопрепарата и химиопрепаратов, назначаемых для профилактического лечения после перенесенного пиелонефрита у пациентов с МС/СД 2 типа. При этом частота рецидивов пиелонефрита у пациентов, не получавших профилактического лечения уроантисептиком, в 5 раз превышала таковую у пациентов, принимавших Канефрон®Н. В ходе исследования не было выявлено ни одного случая нежелательной побочной реакции при использовании Канефрона®Н [20].
В клинике кафедры урологии РМАПО было проведено исследование по изучению эффективности растительных препаратов в качестве метода профилактики рецидивов инфекции мочевых путей и на этапе амбулаторного долечивания при поражении верхних мочевых путей [27]. Препарат Канефрон®Н применяли для лечения 2 групп больных: у пациентов с острым необструктивным пиелонефритом (n=30) на этапе амбулаторного долечивания и у пациентов с хроническим рецидивирующим циститом на фоне ИППП (n=60). Отмечено, что бактериурия у пациентов обеих групп выявлена только в 55,8% (n=62), а E. coli выявлена в 58% (n=36). Отсутствие бактериурии (в основном в группе больных хроническим циститом) исследователи объяснили бесконтрольным применением антибактериальных препаратов и постоянным приемом уроантисептиков такими больными. В качестве эмпирической терапии больным острым необструктивным пиелонефритом назначались фторхинолоны, а больным с выявленными атипичными возбудителями проводился курс специфической терапии. Далее на амбулаторном этапе все пациенты получали Канефрон Н в течение 1 мес. При контрольном обследовании через 1 мес. после окончания терапии лейкоцитурии, бактериурии не было выявлено ни у одной пациентки.
Больным хроническим циститом и наличием ИППП (длительность заболевания от 1 до 8 лет) после проведения курса специфической терапии выполнялась цистоскопия. Тем пациентам, у которых была выявлена плоскоклеточная метаплазия (лейкоплакия) слизистой шейки мочевого пузыря и мочепузырного треугольника (83,3%; n=50), проводилась терапия, направленная на восстановление слоя гликозаминогликанов: три курса внутрипузырных инстилляций гепарина – на все время внутрипузырной терапии и до следующего курса больным назначался Канефрон®Н (1 мес.). За время лечения ни у одной пациентки не было обострения цистита, больные хорошо перенесли курс внутрипузырной терапии, при контрольном обследовании через 30 дней у 90% больных посев мочи был стерильным. Таким образом, Канефрон®Н обеспечил надежную «антибактериальную защиту» при выполнении таких инвазивных манипуляций, как внутрипузырные инстилляции. Длительный прием Канефрона®Н оказал устойчивое противорецидивное действие. Авторы особо отметили, что ни в одном случае не было отмечено побочных реакций или непереносимости препарата [27].
В клинической практике ФГУ НИИ урологии М3 РФ мы также в своей повседневной практике постоянно применяем Канефрон®Н как у пациентов с рецидивирующими циститами и уретритами, а также при хронической инфекции мочевых путей, почек и мочеполовых органов. Предварительно проведенные исследования в нашей клинике в 2004 г. показали эффективность и безопасность использования Канефрона®Н у пациентов с хронической персистирующей инфекцией нижних мочевых путей и с бактериальным простатитом [25].
Контрольную группу составили пациентки с хроническим циститом, не получавшие лечение Канефроном®Н. Им проводилась стандартная антибактериальная терапия при обострениях (фторхинолоны по 3–5 дней или фосфомицин трометамол 3 г однократно), клюквенный морс.
Клинические, клинико–лабораторные, биохимические исследования включали: осмотр урологом с обязательным влагалищным или ректальным исследованием; общеклинический анализ крови и мочи, микроскопическое исследование мазков из уретры, влагалища и шейки матки, бактериологическое исследование мочи и кала (по показаниям), ПЦР на заболевания передающиеся половым путем (микоплазмы, вирус простого герпеса, хламидии). Проводилось уродинамическое исследование; больные вели дневник мочеиспусканий в течение 3–х месяцев.
Пациенты (n=27) получали Канефрон®Н в течение 3 мес.: 16 пациентов получали лечение Канефроном®Н в виде монотерапии, а 11 пациентов в сочетании с антибиотиками – фосфомицин трометамол по 3 г 1 раз/сут. Ни один из пациентов не был исключен из исследования.
Средний объем диуреза в группе наблюдения составил 1,6 л до лечения Канефроном®Н и 1,9 л после лечения; в контрольной группе 1,6 и 1,6 л соответственно различия статистически достоверны, p
Бактериурия была выявлена у 46% пациентов из группы наблюдения до лечения и лишь у 14% после лечения. У пациентов из контрольной группы (n=70), бактериурия имелась у 41% пациентов до лечения и у 38% через 3 мес. после лечения – различия были статистически достоверны (p
Безрецидивный период в группе, получавшей лечение Канефроном®Н, до лечения составлял 1,5 мес., а после лечения 3,2 мес. В контрольной группе исходный интервал составил 1,7 мес., а через 3 мес. наблюдения – 2,3 мес. Различия статистически достоверны, p
Всего проведено 27 стандартных курсов лечения Канефроном®Н: 5 пациенток (18,5%) отмечали отличный клинический эффект, 17 (63,0%) – хороший эффект, а в 5 случаях (18,5%), эффект был удовлетворительным. Все пациенты отметили снижение симптоматики, уменьшение болей в области мочевого пузыря, исчезновение резей, связанных с мочеиспусканием, а также увеличение интервалов между обострениями заболеваний, при этом сами обострения протекали в более легкой форме, чем до лечения Канефроном®Н.
Препарат показал хорошую безопасность и переносимость всеми пациентами, побочных эффектов, аллергических реакций за время наблюдения отмечено не было.
Таким образом, при лечении как острой ИМП, так и персистирующей бактериальной инфекции нижних мочевых путей, являющейся одной из проблемных тем в урологической практики, растительный препарат Канефрон®Н выступает эффективным и безопасным средством. Он значительно увеличивает диурез, что является одним из ключевых моментов при лечении больных с мочевой инфекцией (антиадгезивное действие, «самопромывание организма»). Снижение бактериурии способствует снижению персистенции микроорганизмов в мочевых путях, что приводит к увеличению безрецидивного периода. Следует отметить противовоспалительный эффект препарата, особо ценный в лечении острой симптоматики. Удобство применения (пероральная форма) обеспечивает комплаентность пациентов с урологической инфекцией, также способствуя повышению эффективности лечения.
Литература
1. Bhardi S., Nackman N.,Nicaud J.M.,Holland I.B.Escherihia coli hemolysin may damage target cell membranes by generating transmembrane pores// Infect. Immun. 1986,V.52, p.63–69.
2. Foxman, B. 2002. Epidemiology of urinary tract infections: incidence, morbidity,and economic costs. Am. J. Med. 113(Suppl. 1A):5S–13S.
3. Hedlund, M., R. D. Duan, A. Nilsson, M. Svensson, D. Karpman, and C. Svanborg. 2001. Fimbriae, transmembrane signaling, and cell activation.//J. Infect. Dis. 183 (Suppl. 1):S47–S50.
4. Kartnig T. 1983. Pflanzliche Drogen mit Wirkung auf Nieren und Hamwege. Osterreich Apotheker–Zeitung 37:353–358.
5. Klemm, P., and M. A. Schembri. 2000. Bacterial adhesins: function and structure. Int. J. Med. Microbiol. 290:27–35.
6. Kunin Calvin M. Urinary Tract Infections. Detection, Prevention and Management. Fifth Edition. Williams and Wilkins, 1997, 419 s.
7. Mulvey, M. A., Y. S. Lopez–Boado, C. L. Wilson, R. Roth, W. C. Parks, J. Heuser, and S. J. Hultgren. 1998. Induction and evasion of host defenses by type 1–piliated uropathogenic Escherichia coli. Science 282:1494–1497.
8. Oelschlaeger,T. A., U. Dobrindt, and J. Hacker. 2002. Virulence factors of uropathogens. Curr. Opin. Urol. 12:33–38.
9. Roos Viktoria, Ulett Glen C., Schembri Mark A., and Klemm Per. The Asymptomatic Bacteriuria Escherichia coli Strain 83972 Outcompetes Uropathogenic E. coli Strains in Human Urine// INFECTION AND IMMUNITY, Jan. 2006, Vol. 74, No. 1 p. 615–624.
10. Samuelsson, P., L. Hang, B. Wullt, H. Irjala, and C. Svanborg. 2004. Tolllike receptor 4 expression and cytokine responses in the human urinary tract mucosa. Infect. Immun. 72:3179–3186; 48.
11. Schilcher H.1984 Pflanzliche Urologika. Dtsch Apoth Ztg 124:2429–2436.
12. Schilcher H.1987 Pflanzliche Diuretika. Urologe [B] 27:215–222.
13. Schilcher H.1992 Phytotherapie in der Urologie. Aquaretika Durchspulungstherapeutika, Hamwegsdesinfizienzien. Hippokrates Verlag.13–35,41–45.
14. Schilcher H, May P, Sokeland Z, 1988. Phytotherapie in der Urologie Urologe [B]28:265–271
15. Steinegger E, Hansel R, 1992. Pharmakognosie 5 Aufl. Kap 6.2.1 Freie Phenolcarbonsauren Springer Verlag Berlin, Heidelberg 372–374.
16. Svanborg, C., and Godaly G. Bacterial virulence in urinary tract infection.// Infect. Dis. Clin. North Am.– 11:513–529,1997.
17. Vollmann C. 1988. Levisticum officinale – Der Liebstockel. ZS Phvthother 9: 128–132.
18. Wullt, B., G. Bergsten, H. Fischer, G. Godaly, D. Karpman, I. Leijonhufvud, A. C. Lundstedt, P. Samuelsson, M. Samuelsson, M. L. Svensson, and C. Svanborg. 2003. The host response to urinary tract infection. Infect. Dis. Clin. North Am. 17:279–301.
19. Аляев Ю.Г., Амосов А.В., Григорян В.А. и соавт. Применение растительного препарата Канефрона®Н у больных с хроническим циститом и мочекаменной болезнью//Урология 2005;4:29–33.
20. Иванов Д.Д., Назаренко В.И., Кушниренко С.В. и соавт. Фитотерапия метаболического синдрома и сахарного диабета 2 типа: возможности фитониринга// Здоров’я Украiни 2005;17:46–47.
21. Калинина С.Н., Тиктинский О.Л., Семенов В.А. и соавт. Роль Канефрона®Н при лечении хронического пиелонефрита и профилактике его осложнений//Урология 2006;1:22–25.
22. Кремлинг Х., Лутвайер В., Хайнтц Р. Гинекологическая урология и нефрология.– М., 1985.– 506 с.
23. Мазо Е.Б., Попов С.В. Канефрон®Н в комплексной противовоспалительной терапии больных с цистостомическим дренажом//Врачебное сословие 2006;7:40–42.
24. Навашин С.М. Некоторые аспекты химиотерапии бактериальных инфекций// Журн.микробиологии, 1984, №7,с. 37–45.
25. Перепанова Т.С., Хазан П.Л. Растительный препарат Канефрон®Н в лечении и профилактике инфекций мочевых путей//Врачебное сословие 2005;5:44–46.
26. Рекомендации по ведению больных с инфекциями почек, мочевых путей и мужских половых органов. К.Набер, М.Бишоп, Т.Бйерклунд–Йохансен и др. Европейская Урологическая Ассоциация, 2008// Перевод на русский язык – Смоленск, 2008, 224 с.
27. Синякова Л.А., Косова И.В. Профилактика рецидивов инфекций мочевых путей. Урология, 2009, №2, С. 22–25.
28. Чахава О.В., Горская Е.М. Носительство патогенных микроорганизмов как фаза резервации возбудителя в межэпидемическом периоде // Журн.микробиол.1984, №9, с. 9–16.
29. Челпаченко О.Е. Экспериментальное обоснование рациональной терапии пиелонефрита у детей под контролем маркеров персистенции возбудителя.// Автореферат дис….канд. мед. наук. Челябинск,1993. 23 с.
.
E. coli и инфекции мочевыводящих путей (ИМП)
Инфекции мочевыводящих путей, или сокращенно ИМП, являются наиболее распространенным типом диагностируемых сегодня бактериальных инфекций. (1) Наиболее распространенными бактериями, вызывающими эти инфекции, являются Escherichia coli , также известная как E. coli . По данным исследования, опубликованного в марте 2012 года в журнале Emerging Infectious Diseases, E. coli вызывает более 85 процентов всех инфекций мочевыводящих путей. (2) (Бактерии, включая Staphylococcus saprophyticus , Pseudomonas aeruginosa и Klebsiella pneumoniae , также вызывают некоторые ИМП.)
Во всем мире инфекциями мочевыводящих путей поражаются 150 миллионов человек, из которых около 10,5 миллиона. находятся в Соединенных Штатах, согласно исследованию, опубликованному в мае 2015 года в журнале Nature Reviews Microbiology . (3) Женщины заражаются инфекциями мочевыводящих путей до 30 раз чаще, чем мужчины, при этом до 60 процентов женщин заражаются ИМП хотя бы один раз в жизни.(1,4)
Различные части мочевыводящих путей и те, которые более подвержены инфекциям
Мочевыделительная система хорошо спроектирована и часто может сдерживать E. coli и другие типы микроскопических захватчиков. Например, мочеиспускание обычно отлично справляется с вымыванием оставшихся бактерий из уретры до того, как оно вызовет какие-либо проблемы. (3) Но когда эта защита не срабатывает, бактерии, такие как E. coli , попадают в мочевыводящие пути (которые состоят из почек, мочеточников, мочевого пузыря и уретры), размножаются, и затем может развиться инфекция мочевыводящих путей. .(5)
В то время как любая часть мочевыводящих путей может быть поражена, большинство ИМП, вызванных E. coli– , возникают в нижних мочевых путях, включая мочевой пузырь (где хранится моча) и уретру ( через трубку проходит моча, чтобы покинуть тело). ИМП, находящаяся в мочевом пузыре, называется циститом; тот, который находится в уретре, называется уретритом. (5)
Симптомы, лечение, причины и профилактика
E. coli ( Escherichia coli ) — это тип бактерий, которые обычно обитают в вашем кишечнике.Он также содержится в кишечнике некоторых животных.
Большинство видов кишечной палочки безвредны и даже помогают поддерживать здоровье пищеварительного тракта. Но некоторые штаммы могут вызвать диарею, если вы едите зараженную пищу или пьете загрязненную воду.
Хотя многие из нас связывают кишечную палочку с пищевым отравлением, вы также можете заразиться пневмонией и инфекциями мочевыводящих путей от различных типов бактерий. Фактически, от 75% до 95% инфекций мочевыводящих путей вызываются кишечной палочкой. Кишечная палочка — это нормальный обитатель кишечника, по которому она попадает в мочевыводящие пути.
Некоторые разновидности кишечной палочки вызывают тошноту, вырабатывая токсин под названием Шига. Этот токсин повреждает слизистую оболочку кишечника. Штаммы E. coli, вырабатывающие токсин, иногда называют STEC, что является сокращением от «E.coli, продуцирующей токсин Shiga».
Один особенно плохой штамм, O157: H7, может вызвать сильное заболевание. Это вызывает спазмы в животе, рвоту и кровавый понос. Это основная причина острой почечной недостаточности у детей. Он также может вызывать опасные для жизни симптомы, такие как:
Вам следует обратиться за неотложной помощью, если у вас есть какие-либо из этих симптомов.
Как вы заразились?
Вы можете заразиться, если проглотите даже небольшое количество бактерий E. coli. Это может произойти по следующим причинам:
- Мясной фарш: Вы едите фарш, содержащий кишечную палочку, и мясо не было приготовлено достаточно для уничтожения бактерий. При переработке мяса иногда в мясо попадают бактерии из кишечника животных. Это чаще случается с фаршем, потому что его получают от нескольких животных.
- Необработанное молоко: Вы пьете непастеризованное молоко, которое не подвергалось нагреванию для уничтожения бактерий.E. coli может попасть в молоко из вымени коровы или из доильного оборудования.
- Овощи и фрукты: Вы можете есть свежие овощи или фрукты, загрязненные водой, содержащей бактерии. Чаще всего это происходит, когда навоз соседних животных смешивается с водой.
- Другие продукты и напитки: Вы также можете заразиться кишечной палочкой из непастеризованных фруктовых соков, йогурта и сыра из сырого молока.
- Вода: Вы глотаете воду, содержащую E.coli, возможно, во время купания в бассейне, озере или пруду.
- Другие люди: Вы можете заразиться кишечной палочкой от другого человека, например, ребенка. Бактерии могут передаваться к вам, если вы убираете за инфицированным человеком, а затем плохо вымываете руки, прежде чем дотронуться до рта.
- Животные: Его можно найти в контактных зоопарках или на выставках животных на ярмарках.
Вы также можете заразить пищу на собственной кухне, если позволите ножу или разделочной доске, касающимся сырого мяса (например, курицы), соприкоснуться с пищей, которая будет употребляться в сыром виде (например, салат).
Симптомы
Вы, вероятно, начнете чувствовать себя плохо через 2–5 дней после приема бактерий E. coli. Наиболее частые симптомы:
- Спазмы в животе
- Диарея, которая может быть кровавой
- Тошнота
- Постоянная усталость
У вас может не быть лихорадки. Если вы это сделаете, это может быть незначительно.
Здоровые люди, инфицированные кишечной палочкой, обычно чувствуют себя лучше в течение недели. Но у некоторых людей возникает серьезное осложнение, называемое гемолитико-уремическим синдромом, которое поражает почки.Это чаще случается с пожилыми людьми и детьми.
Лечение
Единственный способ, которым ваш врач может точно узнать, есть ли у вас инфекция кишечной палочки, — это отправить образец вашего стула в лабораторию для анализа.
К счастью, инфекция обычно проходит сама по себе.
Для некоторых типов кишечной палочки, связанных с диареей, таких как диарея водянистых путешественников, антибиотики могут сократить продолжительность появления симптомов и могут быть использованы в умеренно тяжелых случаях.
Но если у вас жар или кровавая диарея, или если ваш врач подозревает, что вырабатывающая токсин шига E. coli, антибиотики принимать нельзя. Они действительно могут увеличить выработку токсина шига и ухудшить ваши симптомы.
Важно отдыхать и получать много жидкости, чтобы восполнить то, что ваше тело теряет из-за рвоты или диареи.
Не принимайте лекарства от диареи, отпускаемые без рецепта. Вы не хотите замедлять работу пищеварительной системы, потому что это задержит распространение инфекции из вашего организма.
Когда вы почувствуете себя лучше, сначала придерживайтесь продуктов с низким содержанием клетчатки, например:
Молочные продукты и продукты с высоким содержанием жира или клетчатки могут ухудшить ваши симптомы.
Профилактика
Одна из самых важных вещей, которые вы можете сделать, чтобы защитить себя и свою семью от кишечной палочки, — это мыть руки, особенно в этих ситуациях:
- Перед приготовлением еды
- Перед приготовлением бутылочек или еды для младенцев или малыши
- Прежде чем прикасаться к чему-либо, например, к соске, попадающей в рот маленького ребенка.
- После посещения туалета или смены подгузника
- После контакта с животными, даже с собственными домашними животными
- После работы с сырым мясом
Вы также можете предотвратить заражение кишечной палочкой, соблюдая осторожность продукты, которые несут наибольшую вероятность заражения:
- Готовьте гамбургеры, пока они не станут 160 F.
- Пейте только пастеризованное молоко, сок и сидр.
- Вымойте все продукты перед их употреблением. Будьте особенно осторожны, чтобы удалить грязь с листовой зелени, такой как салат и шпинат.
На кухне вам помогут несколько простых правил:
Мойка: Очищайте ножи, столешницы и разделочные доски горячей мыльной водой после того, как их коснется сырое мясо.
Храните сырые и приготовленные отдельно: Используйте разные разделочные доски для продуктов, которые вы едите в сыром виде, например овощей и фруктов. Не кладите приготовленное мясо обратно на ту же тарелку, которую использовали для сырого мяса, не вымыв предварительно тарелку.
Когда вы плаваете, старайтесь не глотать воду, будь то бассейн, озеро или океан.Он может быть заражен кишечной палочкой из фекалий.
Лабораторная диагностика инфекций мочевыводящих путей у взрослых | Клинические инфекционные болезни
Аннотация
Инфекции мочевыводящих путей (ИМП) относятся к числу наиболее распространенных бактериальных инфекций и составляют значительную часть рабочей нагрузки в лабораториях клинической микробиологии. Кишечные бактерии (в частности, Escherichia coli ) остаются наиболее частой причиной ИМП, хотя распределение патогенов, вызывающих ИМП, меняется.Более важным является повышение устойчивости к некоторым антимикробным агентам, в частности устойчивости к триметоприм-сульфаметоксазолу, наблюдаемой у E. coli . Врачи отличают ИМП от других заболеваний, которые имеют схожие клинические проявления, с помощью небольшого количества тестов, ни один из которых, при индивидуальном использовании, не обладает адекватной чувствительностью и специфичностью. Среди диагностических тестов анализ мочи полезен в основном для исключения бактериурии. Посев мочи может не требоваться при обследовании амбулаторных пациентов с неосложненными ИМП, но он необходим для амбулаторных пациентов, у которых рецидивирующие ИМП, неэффективное лечение или осложненные ИМП, а также для стационарных пациентов, у которых развиваются ИМП.
Инфекции мочевыводящих путей (ИМП) — одни из самых распространенных бактериальных инфекций. Было подсчитано, что симптоматические ИМП приводят к 7 миллионам обращений в поликлиники, 1 миллиону обращений в отделения неотложной помощи и 100 000 госпитализаций ежегодно [1]. ИМП стали самой распространенной внутрибольничной инфекцией, на которую приходится до 35% внутрибольничных инфекций, и они являются второй по частоте причиной бактериемии у госпитализированных пациентов [2, 3]. Ежегодные затраты системы здравоохранения США, связанные только с внебольничными ИМП, оцениваются примерно в 1 доллар.6 миллиардов [4].
ИМП сложны не только из-за большого количества инфекций, которые происходят каждый год, но и из-за того, что диагностика ИМП не всегда проста. Врачи должны отличать ИМП от других заболеваний, которые имеют схожую клиническую картину, некоторые ИМП протекают бессимптомно или имеют атипичные признаки и симптомы, а для диагностики ИМП у пациентов с нейтропенией (у которых обычно нет пиурии) могут потребоваться диагностические критерии, отличные от используемых. для общей популяции пациентов.Из-за этих факторов врачи часто полагаются на небольшое количество несовершенных лабораторных тестов для улучшения клинических впечатлений; даже если клинический диагноз однозначен, врачи могут назначить лабораторные анализы для определения причины инфекции и / или предоставить изоляты для тестирования чувствительности к противомикробным препаратам. Поэтому неудивительно, что лабораторное исследование образцов мочи составляет значительную часть рабочей нагрузки во многих больничных лабораториях. Фактически, во многих клинических лабораториях посев мочи является наиболее распространенным типом посева, составляя 24–40% представленных культур; 80% этих посевов мочи получают в амбулаторных условиях.
Цель этого обзора — обобщить лабораторную диагностику рутинных ИМП с использованием современных методов диагностики. Обзор не будет охватывать диагностику ИМП у особых групп пациентов — тема, заслуживающая отдельного обзора.
Причины ИМП
Этиологические агенты внебольничных и внутрибольничных ИМП различаются (таблица 1) [5–14]. Было опубликовано лишь ограниченное количество данных об изменениях частоты возбудителей заболеваний среди амбулаторных пациентов.Кишечные бактерии (в частности, Escherichia coli ) были и остаются наиболее частой причиной ИМП, хотя есть некоторые свидетельства того, что процент ИМП, вызываемых E. coli , снижается [6, 15]. Напротив, с 1980 г. сообщалось о значительных изменениях причин внутрибольничных ИМП. Bronsema et al. [13] сообщили, что с 1980 по 1991 год процент ИМП, вызванных видов E. coli, Proteus и видов Pseudomonas , снизился, тогда как процент ИМП, вызванных дрожжами, стрептококками группы B и Klebsiella pneumoniae. увеличился.Weber et al. [6] сообщили о различных изменениях в возбудителях ИМП, с уменьшением процента ИМП, вызванных видами Enterobacter , но с увеличением процента ИМП, вызванными видами Acinetobacter и Pseudomonas aeruginosa . Candida albicans является наиболее частой причиной фунгурии, за ней следуют Candida glabrata, Candida tropicalis, Candida parapsilosis, Candida krusei и другие дрожжи [16].
Таблица 1
Процентное распределение этиологических агентов инфекций мочевыводящих путей среди амбулаторных и стационарных пациентов в разбивке по патогенам.
Таблица 1
Процентное распределение этиологических агентов инфекций мочевыводящих путей среди амбулаторных и стационарных пациентов по патогенам.
Сбор, транспортировка и обработка образцов
Сбор образцов . Надлобковая аспирация — лучший метод предотвращения заражения образцов бактериями дистального отдела уретры. Этот метод сбора используется нечасто, потому что он не показан клинически (за исключением редких случаев), является инвазивным и неудобным, а также требует слишком много времени и ресурсов, чтобы быть практичным.Сбор мочи с использованием одного катетера (метод прямого катетера) является следующим лучшим методом для получения образцов мочи с минимальным загрязнением, но, опять же, он не показан клинически для большинства пациентов, потому что это слишком трудоемко и дорого для рутинной работы. использовать, и это инвазивно. Он имеет дополнительные недостатки, так как процесс введения катетера через уретру может привести к попаданию бактерий в мочевой пузырь (и тем самым вызвать ИМП), и сообщалось о редких осложнениях.
Большинство образцов мочи берутся у взрослых пациентов методом чистого улова в середине потока. Эта методика имеет следующие преимущества: она неинвазивна и не вызывает дискомфорта, проста и недорога, ее можно применять практически в любых клинических условиях, нет риска занесения бактерий в мочевой пузырь путем катетеризации и нет риска осложнений. . Количество колоний в образцах мочи, собранных этим методом, достаточно хорошо коррелирует с таковыми в образцах, собранных с помощью надлобковой аспирации или прямой катетеризации [15].Очевидным недостатком этого метода является то, что образец мочи проходит через дистальный отдел уретры и может быть загрязнен комменсальными бактериями. Простые процедуры, разработанные для снижения уровня заражения, включают очищение кожи и слизистых оболочек, прилегающих к отверстию уретры перед мочеиспусканием, позволяя первой части потока мочи пройти в туалет, и сбор мочи для посева из среднего потока [17 ]. Хотя метод «чистого улова» в середине потока принят и широко используется, имеющиеся данные свидетельствуют о том, что процедуры очистки не могут значительно снизить уровень загрязнения мочи и, следовательно, могут быть ненужными в качестве рутинной процедуры [18–23].Могут возникнуть трудности с надлежащим отбором образцов у пожилых пациентов, а также у пациентов с физическими или иными нарушениями, что повышает важность правильного сбора образцов во избежание контаминации.
Как обсуждается ниже, правильная обработка и обращение с образцами мочи, а также правильная интерпретация результатов анализа зависят от метода, используемого для сбора образца. Поэтому для клиницистов очевидна важность указать метод сбора в бланке заявки на тестирование.Другая информация, которая должна быть включена в бланк заявки на исследование, включает дату и время сбора образца, демографические данные пациента и любую клинически значимую информацию (например, лечился ли пациент противомикробными препаратами или были ли анатомические аномалии, камни или мочевой катетер).
Транспортировка образцов . Несколько исследований продемонстрировали неблагоприятное влияние задержек с транспортировкой или обработкой образцов мочи на их качество [24–26].В каждом исследовании образцы мочи помещали на чашки в течение 2 часов после сбора, а затем снова помещали на чашки после задержки до 24 часов; результаты сравнивали, чтобы определить, привели ли задержки в посеве к увеличению количества колоний. В каждом из исследований некоторые из отложенных культур показали увеличение количества колониеобразующих единиц (КОЕ) на мл до> 10 5 КОЕ / мл, что привело к ложноположительным результатам. Следует отметить, что эти 3 исследования были выполнены до публикации текущих критериев интерпретации количественных посевов мочи, и что влияние на интерпретацию было бы еще больше, если бы использовалось количество колоний 10 2 или 10 3 КОЕ / мл. определить вероятную инфекцию у конкретных пациентов [15].На основании результатов этих и других аналогичных исследований в настоящее время рекомендуется помещать образцы мочи на чашки в течение 2 часов после сбора, если образцы не были охлаждены или хранились в консерванте [17].
Обработка образцов . Обычные посевы мочи следует посеять с использованием калиброванных петель для полуколичественного метода. Преимущество этого метода заключается в предоставлении информации о количестве КОЕ / мл, а также в предоставлении изолированных колоний для идентификации и тестирования чувствительности.Типы сред, используемых для обычных культур, должны быть ограничены кровяным агаром и агаром МакКонки. Для образцов мочи, взятых у амбулаторных пациентов, нет необходимости в рутинной инокуляции среды, которая является селективной для грамположительных бактерий, потому что почти все ИМП у амбулаторных пациентов вызываются аэробными и факультативными грамотрицательными бактериями (таблица 1) [27, 28] . Даже в группах пациентов, у которых Staphylococcus saprophyticus является частой причиной ИМП, нет необходимости использовать селективные среды.Напротив, образцы мочи, полученные от госпитализированных пациентов, могут содержать энтерококки, которые стали второй по частоте причиной внутрибольничных инфекций. Лаборатории могут захотеть рассмотреть возможность посева образцов мочи, полученных от госпитализированных пациентов или пациентов, у которых есть подозрение на грамположительную бактериальную инфекцию, но не подтвержденную документально, в среду, которая является селективной для грамположительных кокков. Такая среда, как фенилэтиловый спирт, подавляет рост роящихся видов Proteus и других грамотрицательных бацилл, которые могут перерастать грамположительные кокки в образце.Перед считыванием посевы мочи необходимо инкубировать в течение ночи при температуре 35–37 ° C на воздухе. Инкубация обычных культур мочи в течение 48 часов не дает дополнительных преимуществ при условии, что образцы инкубируются в течение полных 24 часов и что образцы мочи, содержащие <10 4 уропатогенов, или образцы от пациентов с подозрением на грибковую инфекцию, инкубируются в течение 48 часов [29– 31].
Большинство патогенных дрожжей хорошо растут на чашках с кровяным агаром, поэтому нет необходимости использовать селективные грибковые среды для посева мочи, даже для образцов, полученных от пациентов с подозрением на фунгурию.Селективные грибковые среды могут использоваться в тех редких случаях, когда существует высокая клиническая вероятность того, что ИМП вызвана более привередливыми дрожжами или плесенью. Образцы мочи, полученные от пациентов с подозрением на микобактериальные инфекции мочевыводящих путей, следует обработать и поместить в соответствующие микобактериальные среды [32].
Некультуральные методы лабораторной диагностики ИМП
Обнаружение бактериурии с помощью микроскопии мочи . Бактериурию можно обнаружить микроскопически с помощью окрашивания по Граму нецентрифугированных образцов мочи, окрашивания по Граму центрифугированных образцов или прямого наблюдения бактерий в образцах мочи.Окраска по Граму нецентрифугированных образцов мочи — простой метод. Объем мочи наносят на предметное стекло микроскопа, дают ему высохнуть на воздухе, окрашивают красителем по Граму и исследуют под микроскопом. Рабочие характеристики теста четко не определены, поскольку для определения положительного результата теста использовались разные критерии. В одном исследовании было обнаружено, что тест чувствителен к обнаружению ≥10 5 КОЕ / мл, но нечувствителен к обнаружению меньшего количества бактерий (таблица 2) [28].Другие исследователи обнаружили, что этот тест имеет низкую чувствительность для выявления ИМП [33–42].
Таблица 2
Рабочие характеристики окрашивания по Граму для выявления бактериурии.
Таблица 2
Рабочие характеристики окрашивания по Граму для выявления бактериурии.
Окрашивание мочи по Граму имеет важное преимущество, так как дает немедленную информацию о природе инфекционных бактерий или дрожжей (редко инфекционных агентов, таких как микроспоридии) и тем самым помогает врачу выбрать эмпирическую антимикробную терапию.Это важно в некоторых условиях, но тест с окрашиванием по Граму имеет 3 недостатка, которые ограничивают его полезность в большинстве клинических условий. Во-первых, это нечувствительный тест, который является достоверно положительным только в том случае, если концентрация бактерий в моче ≥10 5 КОЕ / мл; инфекции с бактериальной концентрацией 10 2 –10 3 КОЕ / мл могут не быть обнаружены с помощью этого теста. Во-вторых, этот тест является слишком трудоемким, чтобы большинство лабораторий клинической микробиологии могли предлагать его на более чем выборочной основе.Наконец, поскольку он может не обнаруживать бактерии при концентрациях 10 2 –10 3 КОЕ / мл, его не следует использовать в амбулаторных условиях для пациентов с неосложненными ИМП. Из-за этих ограничений его использование должно быть ограничено пациентами со случаями острого пиелонефрита, пациентами с инвазивными ИМП или другими пациентами, для которых важно иметь немедленную информацию о природе инфекционного патогена.
Обнаружение бактериурии нитритным тестом .Бактериурию можно обнаружить химически, когда бактерии производят нитрит из нитрата. Биохимическая реакция, обнаруживаемая с помощью нитритного теста, связана с членами семейства Enterobacteriaceae (патогенами, наиболее часто ответственными за ИМП), но полезность теста ограничена, поскольку выработка нитрита не связана с патогенами мочевыводящих путей, такими как как S. saprophyticus, виды Pseudomonas или энтерококки [43]. Еще одним ограничением теста является то, что он требует тестирования образца первой мочи, произведенной утром, поскольку требуется ≥4 часов, чтобы бактерии превратили нитрат в нитрит на уровне, который можно надежно обнаружить.
Обнаружение пиурии с помощью микроскопии мочи . Пиурию можно обнаружить и количественно определить микроскопически путем измерения скорости выделения лейкоцитов с мочой, подсчета лейкоцитов с помощью гемоцитометра, подсчета лейкоцитов в образцах мочи с помощью окрашивания по Граму или подсчета лейкоцитов в центрифугированном образце. Преимущества микроскопии мочи заключаются в том, что лейкоциты, лейкоцитарные цилиндры и другие клеточные элементы наблюдаются напрямую. Одним из недостатков микроскопии мочи является то, что лейкоциты быстро разрушаются в несвежей или недостаточно сохраненной моче.Кроме того, каждый из этих методов имеет недостатки, ограничивающие его полезность в качестве стандартного теста [28]. Из-за этих недостатков микроскопию мочи следует ограничивать пациентами с подозрением на пиелонефрит или другие более серьезные инфекции.
Самый точный микроскопический метод количественной оценки пиурии — это измерение скорости экскреции лейкоцитов с мочой [43]. У пациентов с симптоматическими ИМП скорость экскреции лейкоцитов с мочой составляет ≥400 000 лейкоцитов в час [43]. Однако этот тест нецелесообразен для клинического использования, поэтому лабораториям необходимо использовать другие методы.Простая и недорогая альтернатива — подсчет лейкоцитов мочи с помощью гемоцитометра. Сравнение показателей гемоцитометра со скоростью экскреции лейкоцитов с мочой показало, что количество гемоцитомеров ≥10 лейкоцитов / мм 3 коррелирует со скоростью экскреции лейкоцитов с мочой ≥400000 лейкоцитов / час [43]. Более того, корреляция количества гемоцитометра с количеством колоний в моче показала, что у пациентов с симптоматическими ИМП и бактериальной концентрацией> 10 5 КОЕ / мл количество лейкоцитов в моче ≥10 лейкоцитов / мм 3 [43].Корреляция количества клеток гемоцитометра для пациентов с бактериальными концентрациями <10 5 КОЕ / мл была изучена Stamm et al. [15], которые обнаружили, что количество лейкоцитов в моче ≥8 клеток / мм 3 коррелировало с бактериальными концентрациями <10 5 КОЕ / мл в образцах, полученных при надлобковой аспирации или прямой катетеризации от женщин с острым дизурическим синдромом. Хотя использовать гемоцитометр для подсчета лейкоцитов проще, чем измерять скорость экскреции лейкоцитов с мочой, для клинических лабораторий нецелесообразно использовать гемоцитометр для подсчета лейкоцитов на регулярной основе.Наиболее практичный микроскопический метод включает подсчет количества лейкоцитов в осадке центрифугированных образцов мочи. Согласно обзору Паппаса [43], этот метод неточен из-за неадекватной стандартизации метода. По этим причинам, а также для облегчения обработки большого количества образцов большинство лабораторий используют экспресс-тесты на лейкоцитарную эстеразу в качестве заменителя микроскопического подсчета лейкоцитов.
Обнаружение пиурии с помощью лейкоцитарной эстеразы .Тесты на лейкоцитарную эстеразу основаны на гидролизе сложноэфирных субстратов белками с эстеролитической активностью [44]. Нейтрофилы человека продуцируют до 10 белков с эстеролитической активностью. Эти белки реагируют с сложноэфирными субстратами с образованием спиртов и кислот, которые затем вступают в реакцию с другими химическими веществами, вызывая изменение цвета, пропорциональное количеству эстеразы в образце [44]. Эти тесты имеют преимущество в обнаружении как эстераз в интактных лейкоцитах, так и эстераз, высвобождаемых после лизиса клеток; поэтому даже образцы, которые не хранились должным образом, могут дать положительный результат теста.Тесты на лейкоцитарную эстеразу могут давать ложноположительные результаты, если моча загрязнена бактериями, присутствующими во влагалищной жидкости; когда образец содержит эозинофилы или видов Trichomonas , оба из которых могут действовать как источники эстераз; и когда окислители или формалин вступают в реакцию с тест-полосками с получением ложноположительных результатов теста [44, 45]. Тесты на лейкоцитарную эстеразу могут показать снижение положительных результатов теста, если образец имеет повышенный удельный вес и / или повышенные уровни белка и глюкозы; когда присутствуют консерванты борной кислоты; когда присутствует большое количество аскорбиновой или щавелевой кислоты; и когда пациент получал противомикробные препараты, такие как цефалотин, цефалексин или тетрациклин [44, 45].Высокие концентрации тетрациклина могут привести к ложноотрицательным результатам теста [45]. Как показано в таблице 3, когда он используется отдельно, тест на лейкоцитарную эстеразу имеет относительно низкую чувствительность и специфичность и низкую положительную прогностическую ценность, как тест на ИМП, с более высокой отрицательной прогностической ценностью [28, 35, 38, 46–54] .
Таблица 3
Рабочие характеристики тестов на лейкоцитарную эстеразу и нитрит, по отдельности или в комбинации, для выявления бактериурии и / или пиурии.
Таблица 3
Рабочие характеристики тестов на лейкоцитарную эстеразу и нитрит, по отдельности или в комбинации, для выявления бактериурии и / или пиурии.
Одновременное выявление бактериурии и пиурии . Коммерческие продукты для анализа мочи включают тесты как на нитрит, так и на лейкоцитарную эстеразу, что позволяет проводить тесты как на бактериурию, так и на пиурию. Как показано в таблице 3, ряд клинических оценок определил рабочие характеристики этих тестов.Оценки нельзя сравнивать напрямую, потому что исследования проводились в течение 20-летнего периода в различных лабораториях и медицинских учреждениях, было множество дизайнов исследований и в исследованиях использовались различные коммерческие продукты. Тем не менее, результаты достаточно последовательны, чтобы можно было сделать некоторые выводы. Во-первых, два теста, когда они используются вместе, работают лучше, чем те, которые работают по отдельности. Во-вторых, тесты обладают лучшими характеристиками для выявления бактериурии при большом количестве колоний, чем при низком [51].В-третьих, эти тесты имеют низкую чувствительность, высокую специфичность, низкую положительную прогностическую ценность и высокую отрицательную прогностическую ценность. Взятые вместе, рабочие характеристики этих тестов делают их полезными в качестве способа исключения бактериурии на основании отрицательного результата теста.
Ряд препаратов может изменять цвет мочи; Аномальный цвет мочи может повлиять на анализы мочи, основанные на интерпретации изменений цвета. В некоторых случаях это может маскировать изменения цвета, а в других может привести к ложноположительной интерпретации [45].
Посевы и лабораторная диагностика ИМП
Обычный бактериальный посев мочи . Посев мочи может не потребоваться при обследовании амбулаторных пациентов с неосложненными ИМП [55, 56]. Однако посев мочи необходим амбулаторным пациентам, у которых рецидивирующие ИМП, неэффективное лечение или осложненные ИМП. Посев мочи также необходим стационарным пациентам, у которых развиваются ИМП. Бактериальный посев остается важным тестом в диагностике ИМП не только потому, что он помогает документировать инфекцию, но также потому, что он необходим для определения личности инфекционного микроорганизма (ов) и для тестирования чувствительности к противомикробным препаратам.Это особенно верно из-за увеличения случаев устойчивости к противомикробным препаратам.
Наиболее часто используемым критерием для определения значительной бактериурии является наличие ≥10 5 КОЕ на миллилитр мочи [15, 57, 58]. Этот критерий был установлен только для женщин с острым пиелонефритом или женщин, у которых не было симптомов, но которые имели несколько культур мочи, которые дали такое количество бактерий; однако этот критерий часто применяется к другим группам пациентов [15].Однако большинство пациентов с ИМП не попадают ни в одну из категорий, и у 30–50% пациентов с острым уретральным синдромом количество колоний будет <10 5 КОЕ / мл [15]. По этой причине многие лаборатории предпочли использовать более низкое количество колоний в качестве критерия для интерпретации и представления результатов. Одним из общих критериев является количество колоний 10 4 КОЕ / мл, что, как ожидается, увеличит чувствительность теста, не делая его непрактичным для клиницистов и лабораторий.
Катетеризованные пациенты (у которых могут быть низкие концентрации бактерий, которые могут прогрессировать до более высоких концентраций) и многие пациенты с инфекциями нижних мочевыводящих путей имеют количество колоний намного ниже 10 5 КОЕ / мл, если образцы взяты через надлобковый аспират или катетеризация [59]. Соответственно, наиболее подходящим диагностическим критерием для образцов культур мочи, полученных с помощью надлобкового аспирата или катетеризации, является концентрация бактерий ≥10 2 КОЕ / мл [15, 59].
Обычные контрольные посевы для теста излечения не рекомендуются пациентам, которые лечились от бессимптомной бактериурии, острого неосложненного цистита или острого неосложненного пиелонефрита [60] и у которых есть доказательства надлежащего клинического ответа на терапию. [2]. Тем не менее, последующие посевы рекомендуются пациентам с инфекциями, которые не реагируют на терапию, пациентам с рецидивирующими ИМП, пациентам с анатомическими или функциональными аномалиями мочевыводящих путей или пациентам, у которых по-прежнему остаются необъяснимые аномалии анализа мочи.
Анаэробные бактериальные посевы мочи . Нормальная флора толстого кишечника, влагалища и кожи содержит большое количество анаэробных бактерий. Однако, поскольку анаэробные бактерии вызывают ИМП только в редких случаях, выделение анаэробных бактерий из мочи путем посева не имеет клинического значения для большинства пациентов с ИМП. Посев мочи на анаэробные бактерии следует ограничивать пациентами с анатомическими аномалиями (например, энтеровезикулярными свищами), которые увеличивают вероятность заражения анаэробными бактериями.
Посев мочи на грибы . Как указывалось ранее, микробиологическое выявление почти всех случаев фунгурии может быть достигнуто с использованием обычных бактериальных сред. Имеются ограниченные данные об использовании тестов, отличных от культуральных, для обнаружения фунгурии. Хуанг и др. [61] сообщили, что пиурия не коррелировала с фунгурией, независимо от того, была ли у пациентов сопутствующая бактериурия или постоянный мочевой катетер. Кауфман и др. [16] сообщили, что из 648 пациентов с фунгурией, у которых были взяты образцы мочи, 354 (54.6%) имели пиурию и 230 (35,5%) — гематурию. Из 648 пациентов только 410 имели отчеты об образцах мочи, которые включали комментарий относительно наличия или отсутствия дрожжевых грибков; У 247 (60,2%) из этих 410 пациентов образцы мочи были положительными на дрожжи [16]. На основании этих наблюдений и поскольку нитритный тест бесполезен при обнаружении фунгурии, использование анализа мочи для обнаружения фунгурии в настоящее время представляется ограниченным. Этот вывод может измениться по мере публикации дополнительной информации о клинических исходах пациентов с фунгурией, результатах лабораторных исследований образцов мочи и эффектах химиотерапии.
Посев мочи на микобактерии . Хотя внелегочный туберкулез встречается редко в США, он может поражать мочеполовые пути. Традиционная лабораторная диагностика микобактериальных ИМП проводится с помощью кислотоустойчивых мазков и микобактериальных культур [62], но более свежие данные показывают, что диагноз также можно поставить с помощью тестов амплификации нуклеиновых кислот [63, 64]. Однако имеются лишь ограниченные данные об использовании таких тестов для диагностики туберкулеза мочеполовых органов, и ни один из этих тестов не был одобрен или одобрен Управлением по контролю за продуктами и лекарствами США для этого показания.До тех пор, пока не будут получены более точные данные, авторы рекомендуют не использовать рутинные тесты амплификации нуклеиновых кислот, особенно у пациентов с низким клиническим подозрением на туберкулез мочеполовой системы.
Поскольку нетуберкулезные микобактерии, такие как Mycobac terium smegmatis , могут присутствовать в качестве колонизирующей флоры (и для уменьшения количества контаминирующих бактерий), перед получением образцов следует промыть наружные гениталии [64]. Лучший образец для посева мочи на микобактерии — это первое мочеиспускание.Может потребоваться несколько образцов, поскольку результаты посева микобактерий положительны у 25–95% пациентов, а мазки — у 50–70% пациентов с туберкулезными инфекциями мочеполовых путей [62].
Интерпретация результатов посева мочи . Микробиологам необходимо интерпретировать микробиологическое значение роста на чашках для культивирования, чтобы определить необходимость дальнейшей идентификации и тестирования чувствительности к противомикробным препаратам. Большинство результатов культивирования можно легко интерпретировать; отсутствие роста и сильное загрязнение являются однозначными результатами, как и чистые культуры обычных патогенов, растущие в количестве> 10 5 КОЕ на миллилитр мочи.Интерпретация культур, которые дают чистый рост в меньших количествах, также ясна для образцов, полученных с помощью надлобковой аспирации или прямой катетеризации. С другой стороны, интерпретация посевов мочи, которые дают смешанную флору в различных количествах, может быть затруднена. Хотя был разработан ряд алгоритмов для интерпретации посевов мочи, большое количество потенциальных комбинаций микроорганизмов — в различных количествах — и необходимость соотносить эти результаты с различными типами ИМП ограничивают полезность любого алгоритма.Один алгоритм представлен в таблице 4.
Таблица 4
Интерпретация результатов посева образцов мочи, обнаруживающих распространенные патогены мочевыводящих путей.
Таблица 4
Интерпретация результатов посева образцов мочи, дающих общие патогены мочевыводящих путей.
Независимо от алгоритма, используемого для интерпретации, лаборатории должны сообщать результаты посева с инструкциями по интерпретации, чтобы помочь лечащему врачу оценить клиническую значимость результатов.Культуры, которые дают однозначные результаты культивирования, должны интерпретироваться и сообщаться как таковые. Отчеты об испытаниях культур, которые дают смешанную флору в различных количествах, должны указывать выделенные микроорганизмы, количество каждого микроорганизма и вероятную клиническую важность каждого изолята.
Тестирование чувствительности к противомикробным препаратам . В каждой лаборатории должны быть инструкции по тестированию патогенов на чувствительность к противомикробным препаратам. Эти руководящие принципы должны быть разработаны, и тесты на чувствительность к противомикробным препаратам должны быть выполнены и представлены в соответствии с последней версией руководящих принципов NCCLS.Изоляты бактерий или грибов, клиническая значимость которых не определена, не следует тестировать на чувствительность к противомикробным препаратам в целях повседневного ухода за пациентами.
Заключение
У большинства пациентов с неосложненным острым циститом есть случаи, которые клинически просты, и им может не потребоваться никаких лабораторных исследований, кроме анализа мочи. Однако для значительного числа пациентов одного только клинического анамнеза и физических данных может быть недостаточно для постановки окончательного диагноза ИМП.Этим пациентам и пациентам с осложненными ИМП необходимы лабораторные тесты для постановки диагноза и предоставления конкретной информации, касающейся личности патогенов и их чувствительности к антимикробным препаратам. И лабораторный диагноз, и клинический диагноз по результатам лабораторных анализов должны быть сделаны в свете используемого метода сбора данных; Клиницисты должны указать метод сбора в бланках заявки на тестирование. Из доступных лабораторных тестов анализ мочи полезен в первую очередь как средство исключения бактериурии, но он не является заменителем посева.Хотя посевы идентифицируют патогены, точная интерпретация результатов посева требует клинической информации, которая обычно доступна только клиницисту. Мы надеемся, что врачи-инфекционисты, в частности, поймут как сильные стороны, так и ограничения лабораторных диагностических исследований ИМП, которые были рассмотрены в этой статье, и мы надеемся, что они включат это понимание в текущие рекомендации по лечению [65 ] для оптимизации ухода за пациентами.
Список литературы
1.Амбулаторные посещения врачебных кабинетов, амбулаторных отделений больниц и отделений неотложной помощи: США, 1997 г.
,Vital Health Stat 13
,1999
, vol.143
(стр.i
—i
) 2.Научные и клинические проблемы в лечении инфекций мочевыводящих путей
,Am J Med
,2002
, vol.113
(стр.1
—4
) 3« и др.Клиническое значение положительных посевов крови в 1990-е годы: проспективная комплексная оценка микробиологии, эпидемиологии и исходов бактериемии и фунгемии у взрослых
,Clin Infect Dis
,1997
, vol.24
(стр.584
—602
) 4.Эпидемиология инфекций мочевыводящих путей: заболеваемость, заболеваемость и экономические затраты
,Am J Med
,2002
, vol.113
(стр.5
—13
) 5,,.Инфекции мочевыводящих путей в Норвегии: бактериальная этиология и восприимчивость. Ретроспективное исследование клинических изолятов
,Clin Microbiol Infect
,2001
, т.7
(стр.543
—7
) 6,,,,,.Тенденции изменения частоты и устойчивости возбудителей мочевых заболеваний к противомикробным препаратам в амбулаторных клиниках и больницах на юге Израиля, 1991–1995 гг.
,Eur J Clin Microbiol Infect Dis
,1997
, vol.16
(стр.834
—8
) 7,,,.Устойчивость к противомикробным препаратам уропатогенов, вызывающих внебольничные инфекции мочевыводящих путей у женщин: общенациональный анализ
,Clin Infect Dis
,2001
, vol.33
(стр.89
—94
) 8,,,,.Европейский взгляд на внутрибольничные инфекции мочевыводящих путей I. Отчет о микробиологической нагрузке, этиологии и чувствительности к противомикробным препаратам (исследование ESGNI-003)
,Clin Microbiol Infect
,2001
, vol.7
(стр.523
—31
) 9,,,,.Европейский взгляд на внутрибольничные инфекции мочевыводящих путей II. Отчет о заболеваемости, клинических характеристиках и исходах (исследование ESGNI-004)
,Clin Microbiol Infect
,2001
, vol.7
(стр.523
—31
) 10,,,,,.Меняющиеся паттерны бактериальных нозокомиальных инфекций: девятилетнее обследование в больнице общего профиля
,Химиотерапия
,1997
, т.43
(стр.69
—76
) 11,,,.Характеристики патогенов, вызывающих инфекции мочевыводящих путей в больницах Северной Америки: результаты программы антимикробного надзора SENTRY, 1997 г.
,Diagn Microbiol Infect Dis
,1999
, vol.35
(стр.55
—63
) 12,,.Эпидемиология и частота резистентности среди патогенов, вызывающих инфекции мочевыводящих путей, у 1510 госпитализированных пациентов: отчет программы SENTRY Antimicrobial Surveillance Programme (Северная Америка)
,Diagn Microbiol Infect Dis
,2001
, vol.40
(стр.129
—36
) 13,,,.Светские тенденции в частоте и этиологии внутрибольничных инфекций мочевыводящих путей в университетской больнице
,J Urol
,1993
, vol.150
(стр.414
—6
) 14Отчет Национальной системы надзора за внутрибольничными инфекциями (NNIS), сводка данных за январь 1990 г.
.май 1999 г., выдан июнь 1999 г.
,Am J Infect Control
,1999
, т.27
(стр.530
—2
) 15,,, et al.Диагностика колиформной инфекции у женщин с острым дизурическим синдромом
,N Engl J Med
,1982
, vol.307
(стр.463
—8
) 16« и др.Перспективное многоцентровое наблюдение за грибком у госпитализированных пациентов
,Clin Infect Dis
,2000
, vol.30
(стр.14
—8
) 17,,. ,Cumitech 2B: лабораторная диагностика инфекций мочевыводящих путей
,1998
Вашингтон, округ Колумбия
Американское общество микробиологии
18,,.Очищение промежности перед мочеиспусканием, необходимый ритуал?
,Ланцет
,1979
, т.2
(стр.158
—9
) 19,,.Уменьшает ли чистый образец мочи бактериальное заражение?
,N Engl J Med
,1993
, vol.328
(стр.289
—90
) 20,,.Уровни бактериального заражения в сборах мочи в неочищенном и чистом уловах у мальчиков
,J Pediatr
,1986
, vol.109
(стр.659
—60
) 21,,.Уровни бактериального заражения в собранной мочи у девочек
,J Pediatr
,1989
, vol.114
(стр.91
—3
) 22,.Амбулаторный посев мочи: имеет ли значение метод сбора?
,Arch Intern Med
,2000
, т.160
(стр.2537
—40
) 23,,,,.Оценка техники сбора мочи на микробные культуры
,Am J Infect Control
,1996
, vol.24
(стр.219
—21
) 24,,,.Задержка транспортировки и микробиологическое качество клинических образцов
,Am J Clin Pathol
,1975
, vol.64
(стр.689
—93
) 25,,.Влияние задержки на посев мочи
,J Clin Microbiol
,1976
, vol.4
(стр.102
—3
) 26,.Размножение контаминантных бактерий в моче и интерпретация отложенного посева
,J Clin Pathol
,1977
, vol.30
(стр.615
—9
) 27,.Доказательства практичности и рентабельности планшета для селекции грамположительных кокков для рутинных посевов мочи
,J Clin Microbiol
,1981
, vol.14
(стр.617
—9
) 28,,,,,.Лабораторная оценка инфекций мочевыводящих путей в амбулаторной клинике
,Am J Clin Pathol
,1994
, vol.101
(стр.100
—3
) 29,,.Сравнение однодневной и двухдневной инкубации культур мочи
,Diagn Microbiol Infect Dis
,1995
, vol.21
(стр.55
—6
) 30,,.Оценка микробиологической обработки образцов мочи: сравнение ночной и двухдневной инкубации
,J Clin Microbiol
,1992
, vol.30
(стр.1600
—1
) 31,,,,,.Характеристики четырех хромогенных культуральных сред мочи после одного или двух дней инкубации по сравнению с эталонными средами
,J Clin Microbiol
,2002
, vol.40
(стр.1500
—3
) 32,,.,,,,.Mycobacterium
,Руководство по клинической микробиологии
,1999
7-е изд.Вашингтон, округ Колумбия
Американское общество микробиологии Press
(стр.399
—437
) 33,.Автоматизированное прямое определение чувствительности к антимикробным препаратам в посевах мочи под микроскопом
,J Clin Microbiol
,1980
, vol.11
(стр.157
—61
) 34,,,.Обнаружение значительной бактериурии при микроскопическом исследовании мочи
,Lab Med
,1981
, vol.12
(стр.294
—6
) 35,,.Оценка активности эстеразы лейкоцитов как метод быстрого скрининга бактериурима
,J Clin Microbiol
,1982
, vol.15
(стр.852
—4
) 36,,.De La Maza Luis. Скрининг посевов мочи тремя автоматизированными системами
,J Clin Microbiol
,1982
, vol.15
(стр.468
—74
) 37,,, et al.Применение окрашивания по Граму на предметных стеклах по сравнению с количественным посевом для диагностики инфекции мочевыводящих путей
,Am J Clin Pathol
,1993
, vol.99
(стр.132
—6
) 38,,,.Лабораторное определение лейкоцитарной эстеразы и нитрита в качестве альтернативы микроскопии мочи [письмо]
,Eur J Clin Microbiol Infect Dis
,1996
, vol.15
(стр.663
—4
) 39,,.Оценка цитоцентрифужного окрашивания по Граму в качестве скринингового теста на бактериурию в образцах из конкретных популяций пациентов
,Am J Clin Pathol
,1997
, vol.108
(стр.515
—24
) 40,,,.Упрощенный метод обнаружения значительной бактериурии при микроскопическом исследовании мочи
,J Clin Microbiol
,1998
, vol.36
(стр.820
—3
) 41,,,.Оценка центрифугированного и окрашенного по Граму мазка, анализа мочи и тестирования полосок с реагентами для выявления бессимптомной бактериурии у акушерских пациентов
,Am J Obstet Gynecol
,2000
, vol.182
(стр.1076
—9
) 42,,.Клиническая оценка трех скрининговых тестов мочи
,J Clin Microbiol
,1987
, vol.25
(стр.467
—70
) 43.Лаборатория диагностики и лечения инфекций мочевыводящих путей
,Med Clin N Amer
,1991
, vol.75
(стр.313
—25
) 44,,. , , , и другие.Базовое исследование мочи
,Клиническая диагностика и ведение лабораторными методами
,2001
20-е изд.Филадельфия
WB Saunders
(стр.367
—402
) 45Multistix 10 SG, Multistix 9, Multistix 9 SG, Multistix 8 SG, Multistix 7, N-Multistix GS, N-Multistix SG, Multistix Multistix, Bili-Labstix Reagent Strips [вставка в упаковку]
,1992
Elkhart, IN
Bayer
46,.Использование активности лейкоцитарной эстеразы-нитрата в качестве прогностического анализа значительной бактериурии
,J Clin Microbiol
,1983
, vol.18
(стр.1256
—7
) 47,.Оценка лейкоцитарного теста, используемого для скрининга культур мочи
,J Clin Microbiol
,1984
, vol.20
(стр.820
—1
) 48,.Тест на активность лейкоцитарной эстеразы и нитриты как быстрый скрининг на значительную бактериурию
,Am J Clin Pathol
,1985
, vol.83
(стр.84
—7
) 49,.Лабораторная оценка тестов на лейкоцитарную эстеразу и нитрит для выявления бактериурии
,J Clin Microbiol
,1985
, vol.21
(стр.840
—2
) 50,.Использование быстрых скрининговых тестов при обработке образцов мочи традиционным посевом и AutoMicrobic System
,J Clin Microbiol
,1985
, vol.21
(стр.783
—7
) 51,,,.Обнаружение бактериурии и пиурии в течение двух минут
,J Clin Microbiol
,1985
, vol.21
(стр.578
—81
) 52,,,.Ограниченная полезность тест-полосок для определения мочи для выявления катетер-ассоциированной бактериурии у пациентов интенсивной терапии
,Anaesth Intensive Care
,1995
, vol.23
(стр.706
—7
) 53,.Оценка скрининговых тестов на лейкоцитарную эстеразу и нитриты для выявления бактериурии у женщин с подозрением на неосложненную инфекцию мочевыводящих путей
,J Clin Microbiol
,1999
, vol.37
(стр.3051
—2
) 54,,.Плохая прогностическая способность анализа мочи и микроскопического исследования для выявления инфекции мочевыводящих путей
,Am J Clin Pathol
,2000
, vol.113
(стр.709
—13
) 55,.Лечение инфекций мочевыводящих путей у взрослых
,N Engl J Med
,1993
, vol.329
(стр.1328
—34
) 56,,,.Ограниченное клиническое применение посевов крови и мочи при лечении острого пиелонефрита во время беременности
,Am J Obstet Gynecol
,2000
, vol.182
(стр.1437
—41
) 57.Бессимптомные инфекции мочевыводящих путей
,Trans Assoc Am Phys
,1956
, vol.69
(стр.56
—63
) 58.Бактериурия и диагностика инфекций мочевыводящих путей
,Arch Intern Med
,1957
, vol.100
(стр.709
—14
) 59,.Бактериурия у катетеризованного пациента: какой количественный уровень бактериурии актуален?
,N Engl J Med
,1984
, т.311
(стр.560
—4
) 60,,,,.Посев мочи после лечения неосложненного цистита у женщин
,South Med J
,1989
, vol.74
(стр.165
—9
) 61,,.Пиурия и фунгурия [письмо]
,Ланцет
,1995
, vol.346
(стр.582
—3
) 62,. ,Микобактериология общественного здравоохранения: руководство для лаборатории уровня III
,1985
Атланта
Центры по контролю и профилактике заболеваний
стр.25
63« и др.Быстрая идентификация комплекса Mycobacterium tuberculosis в образцах мочи с помощью теста амплификации Gen-Probe
,Urol Res
,1997
, vol.25
(стр.391
—4
) 64,,,,,.Полимеразная цепная реакция при клиническом подозрении на туберкулез мочеполовой системы: сравнение с внутривенной урографией, биопсией мочевого пузыря и посевом кислотоустойчивых микобактерий в моче
,Урология
,2000
, vol.56
(стр.570
—4
) 65,,,,,.Руководство по противомикробной терапии неосложненного острого бактериального цистита и острого пиелонефрита у женщин
,Clin Infect Dis
,1999
, vol.29
(стр.745
—58
)© 2004 Американское общество инфекционных болезней
Распространенные ошибки в диагностике и лечении инфекций мочевыводящих путей.I: Патофизиология и методы диагностики | Нефрологическая диализная трансплантация
Проблема
Инфекция мочевыводящих путей (ИМП) — одно из наиболее распространенных заболеваний, возникающих в возрастных группах от новорожденных до пожилых людей. От 40 до 50% взрослых женщин в анамнезе имели хотя бы одну ИМП [1]. ИМП — основная причина грамотрицательного сепсиса у госпитализированных пациентов и после трансплантации почки [2]. К врачам общей практики, педиатрам, урологам и нефрологам часто обращаются из-за симптомов, указывающих на ИМП, но существуют большие различия в ведении таких пациентов в отношении определения ИМП, диагностики и лечения.В частности, клиническая значимость малочисленной бактериурии и бессимптомных ИМП, а также потенциальные показания для антимикробной терапии продолжают оставаться противоречивыми.
ИМП определяет состояние, при котором мочевыводящие пути инфицированы патогеном, вызывающим воспаление. Существует мнение, что большинство уропатогенных микроорганизмов, таких как Escherichia coli , колонизируют толстую кишку, перианальную область, а у женщин — влагалище и периуретральную область. По желанию они могут далее подняться в мочевой пузырь и / или в почки.При поражении структур мочевыводящих путей необходима точная диагностика и лечение, чтобы обеспечить оптимальное лечение и предотвратить дальнейшие осложнения. ИМП возникает в результате взаимодействия уропатогена и хозяина. Микроорганизмы могут обладать особыми уропатогенными свойствами, что объясняет возникновение инфекции в нормальных мочевых путях. С другой стороны, неуропатогенные штаммы могут вызывать острую инфекцию при наличии урологических аномалий или при нарушении защитных механизмов хозяина: у педиатрических пациентов и пожилых людей, при беременности, диабете и у пациентов с ослабленным иммунитетом, включая реципиентов почечного трансплантата.
Хотя существуют общие рекомендации по диагностике и классификации ИМП, в клинической практике существуют большие различия. Есть как ошибки, которые совершаются часто, так и тайны, которые до сих пор не раскрыты. Активное лечение важно, потому что при некоторых обстоятельствах ИМП может вызвать стойкое рубцевание почек. Процедуры визуализации являются краеугольным камнем для критической оценки ИМП, но отказ от процедур расследования позволит значительно сэкономить с точки зрения затрат, а также с точки зрения ненужного облучения и психологического стресса для пациента.Профилактика рецидивов ИМП требует тщательного обследования пациента для выявления потенциальных осложняющих факторов, включая анатомические аномалии мочевыводящих путей. Основные осложняющие факторы (обратимые или постоянные) влияют на лечение противомикробными препаратами в отношении продолжительности лечения, вероятности устойчивости к антибиотикам и необходимости профилактики, соответственно.
Спектр инфекций мочевыводящих путей — определения
Значительная бактериурия
Традиционно концепция значительной бактериурии для диагностики ИМП основывалась на представлении о том, что количественное количество бактерий позволяет различать инфекцию и контаминацию.Полезность и последовательность критерия ≥10 5 колониеобразующих единиц на миллилитр (КОЕ / мл) чистой уловленной мочи для диагностики ИМП неоднократно подтверждалась. У детей обязательна быстрая и надежная диагностика ИМП. Здесь ИМП определяется как количество бактерий ≥10 4 КОЕ / мл мочи, сопровождаемое микроскопическим исследованием мочи для исключения вагинального заражения (поскольку такое загрязнение часто приводит к ложноположительным результатам культуральных тестов).
Малочисленная бактериурия
Исследователи обнаружили, что только половина женщин с симптомами острой инфекции нижних мочевых путей соответствовала критерию ≥10 5 c.f.u./ml. Исследования Кунина и соавт. [3] и Arav-Boger et al. [4] предположил, что малочисленная бактериурия может быть ранней фазой ИМП. Большинство пациентов с количеством бактерий от 10 2 до 10 4 КОЕ / мл имеют типичные для ИМП микроорганизмы ( E. coli, Staphylococcus saprophyticus, и кишечные грамотрицательные бактерии). Симптомы могут возникать во время переходной фазы, когда уретра является основным местом колонизации и воспаления.Согласно этой концепции, бактерии могут проникать в мочевой пузырь временно, но — в результате уродинамических и других защитных механизмов хозяина — они не могут расти в достаточной степени, чтобы достичь высокой плотности, наблюдаемой при устойчивых ИМП. Было предложено несколько теорий для объяснения феномена малочисленной бактериурии. Во-первых, вероятно, что симптоматическая бактериурия <10 5 КОЕ / мл отражает текущую ИМП, и поэтому микробиологический критерий должен быть снижен до> 10 2 c.f.u./ml у пациентов с симптомами. Во-вторых, небольшое количество бактерий в моче может быть результатом повышенного диуреза из-за большого количества потребляемой жидкости. В-третьих, малочисленная бактериурия может быть вызвана медленным ростом некоторых уропатогенов, таких как S. saprophyticus . Таким образом, одной из основных распространенных ошибок в диагностике ИМП является недооценка значимости малочисленной бактериурии. В частности, у мужчин низкий уровень бактерий с уропатогенами может иметь клиническое значение, поскольку заражение у мужчин встречается нечасто.
Бессимптомная бактериурия
Бессимптомная бактериурия часто выявляется при рутинных обследованиях. Количество бактерий ≥10 5 КОЕ / мл в двух последовательных пробах чистой уловленной мочи, позволяет различать бессимптомные ИМП и контаминацию (<10 5 КОЕ / мл). Для инфекций, вызываемых видами S. saprophyticus и Candida, обычно принят нижний пороговый уровень ≥10 4 КОЕ / мл.
Бессимптомная бактериурия в раннем детстве встречается крайне редко, за исключением наличия анатомических аномалий (распространенность у мужчин 0.001% в возрасте от 0 до 5 лет). У женщин она увеличивается до 10% до 65 лет. У пожилых мужчин процент еще выше, если есть задержка мочи из-за гиперплазии простаты. Бессимптомная бактериурия и лейкоцитурия обнаруживаются примерно у одной трети пациентов, находящихся на гемодиализе [5]. Уменьшение диуреза и недостаточное полоскание позволяют бактериям расти.
Другой распространенной ошибкой в диагностике и лечении ИМП является неправильное толкование бессимптомной бактериурии.Дополнительная клиническая информация необходима для того, чтобы решить, кого следует лечить, а кого только наблюдать. Бессимптомную бактериурию не следует лечить, за исключением случаев беременности, когда расширение мочевыводящих путей во время беременности позволяет бактериям подниматься вверх. Острый пиелонефрит при беременности связан с высокой частотой абортов.
Пациентам с бессимптомной бактериурией, например пациентам, находящимся на гемодиализе и обследованным на трансплантацию почки, следует проводить профилактическое лечение антибиотиками во время инвазивных урологических диагностических процедур для предотвращения септических осложнений.В настоящее время ведутся споры о том, следует ли давать антибиотики пациентам с сахарным диабетом или с ослабленным иммунитетом с бессимптомной бактериурией. В нашей клинике мы не лечим пациентов с диабетом или пациентов с бессимптомной бактериурией после трансплантации почки в обычном порядке. Однако мы внимательно наблюдаем за этими пациентами через короткие промежутки времени.
Загрязнение
Загрязнение иногда неизбежно и остается ловушкой при диагностике ИМП. Заражение вероятно, если в культурах мочи растет лишь небольшое количество бактерий или несколько видов бактерий.Лактобациллы, виды коринебактерий, гарднереллы, альфа-гемолитические стрептококки и аэробы считаются загрязнителями уретры и влагалища. Наличие истинной инфекции может быть подтверждено катетеризацией уретры или, что лучше, надлобковой аспирацией. Истинная полимикробная инфекция встречается редко, за исключением пациентов с подвздошной кишкой, нейрогенным мочевым пузырем или пузырно-кишечной фистулой, а также у пациентов с ИМП, осложненной камнями, хроническими почечными абсцессами или длительно установленными мочевыми катетерами. Выделение более одного организма из одного образца мочи всегда следует интерпретировать с осторожностью и учитывая (i), является ли один из организмов доминирующим, (ii) какой тип образца был исследован (хроническая катетеризация против промежуточного образца), (iii) присутствуют ли признаки, указывающие на истинную инфекцию (присутствие лейкоцитов) или контаминацию (наличие вагинальных эпителиальных клеток), и (iv) указывают ли клинические признаки, симптомы и анамнез на наличие ИМП.Однако интерпретация должна быть осторожной, поскольку недавняя статья продемонстрировала, что плоскоклеточные клетки обнаруживаются в 94% образцов катетера даже при отсутствии бактериального загрязнения. В 96% проб мочи в середине потока были обнаружены плоскоклеточные клетки, но только 21% имели бактериальное заражение. Таким образом, наличие плоских клеток в образцах мочи женщин не является хорошим признаком бактериального заражения [6].
Как диагностировать инфекцию мочевыводящих путей?
Предлагаемая стратегия диагностики ИМП показана на рисунках 1 и 2.Интерпретация анализа мочи и посевов полностью зависит от качества образцов мочи, представленных на исследование, и условий транспортировки в лабораторию.
Рис. 1.
Алгоритм диагностики бессимптомных ИМП. КОЕ / мл, колониеобразующие единицы на миллилитр мочи.
Рис. 1.
Алгоритм диагностики бессимптомных ИМП. КОЕ / мл, колониеобразующие единицы на миллилитр мочи.
Рис. 2.
Алгоритм диагностики симптоматической ИМП. КОЕ / мл, колониеобразующие единицы на миллилитр мочи.
Рис. 2.
Алгоритм диагностики симптоматической ИМП. КОЕ / мл, колониеобразующие единицы на миллилитр мочи.
Щуп для проверки
Поскольку во многих случаях ИМП проявляется остро, необходима быстрая диагностическая процедура. Тест-полоска с биохимическим реагентом (тест с помощью щупа) является общепринятым скрининговым тестом на ИМП.Химические тест-полоски обычно работают путем определения активности лейкоцитарной эстеразы и нитратредуктазы. Отрицательного результата теста на индикаторной полоске обычно достаточно для исключения истинного заражения. Пиурия является характерным признаком воспаления и легко обнаруживается положительным тестом на активность лейкоцитарной эстеразы. На практике эритроциты и лейкоциты лизируются в моче при значениях pH> 6,0, при низкой осмоляльности мочи или при задержке анализа. Следовательно, ложноотрицательные результаты при микроскопии встречаются чаще, чем ложноположительные результаты при помощи щупа.Наличие лейкоцитурии не всегда коррелирует с бактериурией. Лейкоциты могут происходить не из мочевыводящих путей, а из других участков воспаления, особенно из женских половых путей. Более того, лейкоцитурия может продолжаться, даже если бактериурия исчезла спонтанно или после лечения. Нитритный тест зависит от обнаружения в моче нитритов, которые образуются из нитратов многими уропатогенами. Присутствие нитрита очень специфично для бактерий, но некоторые уропатогены не восстанавливают нитрат до нитрита, и поэтому его применение ограничено энтеробактериями, которые дают положительный результат теста.PH мочи ≥7,5 указывает на ИМП. Также некоторые пищевые продукты содержат нитраты / нитриты и поэтому могут влиять на нитритный тест мочи, т. Е. Давать положительные результаты, хотя ИМП нет.
Образец чистой мочи
Как правило, пациенты с симптомами, предполагающими ИМП, должны иметь чистый образец для анализа мочи и посева. Поскольку количество бактерий в образцах, взятых рано утром, обычно больше, чем в образцах, полученных в другое время, стало обычной практикой собирать первую мочу дня.Этот образец является наиболее концентрированным, и бактерии в мочевом пузыре успели размножиться за ночь. Когда образцы берутся в офисе, более разбавленная моча и вымывание бактерий из-за множественных пустот дают заметно меньшее количество колоний. Поскольку первая порция мочи вымывает контаминанты из уретры, сбор образцов из средней части потока является стандартной процедурой. У женщин сбор промежуточных образцов требует гораздо большей заботы и сотрудничества, чем у мужчин. Необходимо раздвинуть половые губы и очистить влагалище с помощью тампонов, смоченных водой или физиологическим раствором.Не следует использовать мыло или антисептики, поскольку они обладают бактерицидным действием и приводят к ошибочно заниженному количеству бактерий. Очевидно, что подходящая стерильная емкость для сбора мочи обязательна. У необрезанных мужчин крайнюю плоть следует отвести назад, чтобы избежать заражения в результате возможной колонизации препуциального мешка. Проблемы возникают при интерпретации анализа мочи, особенно у пожилых людей, из-за технических трудностей со сбором образцов. Высокий уровень ложноположительных результатов теста обнаруживается у пожилых женщин [7]; если они не могут предоставить образцы мочи чистого улова в середине потока, процедура должна проводиться с помощью медсестры.
Альтернативные процедуры
Моча, собранная с помощью надлобковой аспирации, обычно считается золотым стандартом диагностики, поскольку таким образом надежно исключено заражение. Однако очевидно, что надлобковая аспирация не является инструментом рутинной диагностики. Однако это может быть полезно для маленьких детей, у которых невозможно получить чистый образец. Катетеризация уретры, часто выполняемая урологами для получения незагрязненной мочи мочевого пузыря, не является методом выбора, если нет веских клинических аргументов в пользу этой процедуры.Это может привести к попаданию патогенных организмов в мочевой пузырь и потенциально более вредно, чем диагностическая польза, которую оно дает.
Роль микроскопического исследования мочи
ИМП можно легко диагностировать при микроскопическом исследовании мочи. Стандартизованный центрифугированный осадок мочи, исследуемый под покровным стеклом, рекомендуется в качестве рутинной процедуры, поскольку он дешев, а дифференциация формованных элементов (красных и белых кровяных телец, бактерий) легче в тонких слоях жидкости, чем в традиционных стеклянных камерах (Bürker, Fuchs– Розенталь и др.). Центрифугирование всегда приводит к потере частиц и может давать неточные количественные результаты. С другой стороны, в неотвернутых образцах можно упустить ряд важных элементов. Таким образом, результаты после центрифугирования с использованием стандартизированной процедуры более чувствительны и специфичны. По сравнению с светлопольной микроскопией метод фазового контраста позволяет лучше обнаруживать большинство элементов, особенно бактерий. Подсчеты обычно приводятся для поля малой мощности или поля высокой мощности.Результаты также могут быть даны на единицу объема мочи. При большом увеличении (× 40) наличие 1–10 микроорганизмов / поле большого увеличения свидетельствует о бактериурии. Наличие ≥10 лейкоцитов на поле с большим увеличением свидетельствует о пиурии.
Как посеять мочу?
Бактерии будут продолжать размножаться в теплой среде свежевыпущенной мочи. Поэтому обязательно незамедлительно провести общий анализ мочи и посев. Среднее время репликации E.coli составляет n минут, поэтому количество бактерий экспоненциально увеличивается со временем (например, 2 n через n минут). Если бактериальное исследование откладывается более чем на 2 часа, образцы следует хранить при 4 ° C, но не более 48 часов. Посев на погружных предметных стеклах или аналогичный полуколичественный метод культивирования обычно предпочтительнее. Преимущество этих методов состоит в том, что они отражают истинную приблизительную концентрацию бактерий во время отбора пробы, поэтому хранение при низкой температуре не требуется.
Иногда необычные или привередливые бактерии могут вызывать ИМП. Эти бактерии трудно обнаружить без исследования мочи по Граму [8]. Например, Haemophilus influenzae и Haemophilus parainfluenza плохо растут в питательных средах, обычно используемых для кишечных бактерий, и в результате могут оставаться незамеченными. Другие необычные организмы включают пневмококки, кампилобактерии, легионеллы пневмофилы, сальмонеллы, шигеллы, коринебактерии группы D2, кислотоустойчивые бациллы (включая Mycobacterium tuberculosis и атипичные микобактерии) и грибы (такие как Blastomyces и Coccidioides).Окрашивание по Граму и кислотостойкое окрашивание следует проводить пациентам с симптомами мочеиспускания и пиурией, если обычные посевы отрицательны.
Клиническая картина инфекции мочевыводящих путей
Клиническая картина пациента с ИМП варьируется от бессимптомной бактериурии до острого пиелонефрита (бактериальный интерстициальный нефрит) или уросепсиса. Проявление зависит от локализации и тяжести инфекции. Чтобы выбрать подходящую стратегию лечения, необходимо дополнительно различать неосложненные и осложненные ИМП.Разумно классифицировать ИМП в зависимости от уровня поражения мочевыводящих путей, наличия симптомов и наличия осложнений.
Инфекция нижних и верхних мочевых путей
Дифференциация нижних и верхних ИМП имеет важное значение, поскольку поражение почек связано с более серьезными осложнениями. Клиническая картина пациента дает важные подсказки, позволяющие различать нижние и верхние ИМП. Обычно у пациентов с более низкой ИМП и температурой тела ниже 38 ° C изменений реактантов острой фазы не обнаруживается.Верхние ИМП вызывают повышение воспалительных параметров, таких как С-реактивный белок или лейкоцитоз и лихорадка. Диагностические процедуры для точной локализации ИМП являются инвазивными и сопряжены с риском (катетеризация мочевого пузыря и / или мочеточника). Было предложено множество неинвазивных методов для различения ИМП нижних (уретра, мочевой пузырь) и верхних (почки), особенно недавние достижения в области ядерной медицины почек [9]. В клинической практике мониторинг бактериурии может помочь по крайней мере ретроспективно дифференцировать ИМП нижних и верхних отделов.Например, если бактериурия исчезла после однодневного или краткосрочного (3 дня) лечения, вероятен диагноз ИМП нижних отделов. В недавней публикации экскреция с мочой N-ацетил-бета-глюкозаминидазы (NAG), лизосомального фермента, присутствующего в проксимальных извитых канальцах, использовалась для дифференциации нижних и верхних ИМП. Экскреция NAG с мочой была значительно выше у пациентов с ИМП верхнего, чем нижнего уровня, или у здоровых взрослых [10].
Симптоматическая или бессимптомная инфекция мочевыводящих путей
На основании клинических признаков и симптомов можно различать бессимптомные (бессимптомная бактериурия) и симптоматические ИМП (дизурия, частое мочеиспускание, боль в боку, лихорадка).«Симптоматическая абактериурия», то есть бактериальная инфекция с низким содержанием уропатогенов, может проявляться как так называемый уретральный синдром. Другие причины «симптоматической абактериурии» включают инфицирование хламидиями, микоплазмами, трихомонадами, гонококками, кандидами или микобактериями. Подобные симптомы могут также возникать при урологических проблемах с мочевым пузырем, включая опухоли. Формирование абсцесса почек без дренажа в мочевыводящие пути, полная непроходимость мочеточника, туберкулез мочевыводящих путей, шистосомоз, противомикробное лечение или использование антисептиков (неправильно взятые образцы мочи) также могут проявляться как «симптоматическая абактериурия».
Осложненная и неосложненная инфекция мочевыводящих путей
Стойкие или рецидивирующие ИМП у взрослых с анатомически и функционально нормальными мочевыводящими путями редко, если вообще когда-либо, приводят к повреждению почек. Поэтому важно различать осложненные и неосложненные ИМП. Осложненная ИМП подразумевает инфекции мочевыводящих путей, которые анатомически или функционально изменены (уродинамика или мочеиспускание не соответствуют норме). Сопутствующие состояния, осложняющие ИМП, представлены в таблице 1.Неосложненные инфекции возникают в основном у здоровых женщин с нормальным строением мочевыводящих путей и неповрежденными механизмами мочеиспускания. Напротив, осложняющие факторы подвергают людей обоих полов более высокому риску развития прогрессирующего поражения почек, бактериемии и уросепсиса.
Таблица 1.Факторы, осложняющие инфекцию мочевыводящих путей
| Нарушения транспорта мочи | ||||||||||||||||||||||||||
| Анатомические | ||||||||||||||||||||||||||
| Нейрогенные | ||||||||||||||||||||||||||
| Сопутствующие заболевания 131351 | Связанные заболевания почек | |||||||||||||||||||||||||
| Злоупотребление почек | ||||||||||||||||||||||||||
| Серповидно-клеточная анемия | ||||||||||||||||||||||||||
| Иммуносупрессия (вкл.трансплантация) | ||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||
| Сахарный диабет | ||||||||||||||||||||||||||
| Беременность | ||||||||||||||||||||||||||
| Простатит | ||||||||||||||||||||||||||
| Постоянный мочевой катетер | Нейрогенные | |||||||||||||||||||||||||
| Сопутствующие заболевания | ||||||||||||||||||||||||||
| Поликистоз почек | ||||||||||||||||||||||||||
| Злоупотребление анальгетиками | ||||||||||||||||||||||||||
| Серповидноклеточная анемия | ||||||||||||||||||||||||||
| Иммуносупрессия (вкл.трансплантация) | ||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||
| Сахарный диабет | ||||||||||||||||||||||||||
| Беременность | ||||||||||||||||||||||||||
| Простатит | ||||||||||||||||||||||||||
Постоянное осложнение мочевыводящих путей 113| 39135 9135 9132 9135 9132 9132 9135 9135 9132 9135 9132 9409 9403 9402 9402 9403 9409 Нарушения транспорта мочи | | |||||||||||||||||||||||||
| Анатомические | ||||||||||||||||||||||||||
| Нейрогенные | ||||||||||||||||||||||||||
| Сопутствующие заболевания | ||||||||||||||||||||||||||
| Поликистоз почек | ||||||||||||||||||||||||||
| Злоупотребление анальгетиками | анальгетиктрансплантация) | |||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||
| Сахарный диабет | ||||||||||||||||||||||||||
| Беременность | ||||||||||||||||||||||||||
| Простатит | ||||||||||||||||||||||||||
| Постоянный мочевой катетер | Нейрогенные | |||||||||||||||||||||||||
| Сопутствующие заболевания | ||||||||||||||||||||||||||
| Поликистоз почек | ||||||||||||||||||||||||||
| Злоупотребление анальгетиками | ||||||||||||||||||||||||||
| Серповидноклеточная анемия | ||||||||||||||||||||||||||
| Иммуносупрессия (вкл.трансплантация) | ||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||
| Сахарный диабет | ||||||||||||||||||||||||||
| Беременность | ||||||||||||||||||||||||||
| Простатит | ||||||||||||||||||||||||||
| Постоянный мочевой чистый катетер | ||||||||||||||||||||||||||
Непродолжительное лечение мочевого катетера ). Таким пациентам рекомендуется антибактериальная терапия в течение 2–6 недель. Кроме того, для точного лечения ИМП важно, можно ли устранить осложняющий фактор во время терапии (например, удаление камня) или он сохраняется (например, постоянный мочевой катетер).Как развивается инфекция мочевыводящих путей: взаимодействие между микробом и хозяиномВозбудитель: комменсальная флораИМП часто вызывается микроорганизмами, которые являются нормальными комменсалами в дистальном отделе уретры и прилегающих участках. Самый распространенный путь заражения — восхождение. Общепризнанные гендерные различия в распространенности ИМП явно связаны с короткой длиной женской уретры. Уропатогены являются частью нормальной фекальной флоры.Эти бактерии колонизируют перианальную область, а затем восходят у женщин к интроитусу влагалища, который является резервуаром для нескольких уропатогенов, особенно если вагинальная флора не повреждена. Колонизация распространяется на периуретральную область, уретру и мочевой пузырь, в значительной степени в зависимости от сексуальной активности. Однако даже во время мочеиспускания в женской уретре наблюдается достаточная турбулентность, позволяющая микроорганизмам проникать обратно в мочевой пузырь. Роль нормальной микрофлоры влагалища в защите от генитальной колонизации с потенциально патогенными прилипшими E.coli был продемонстрирован в нескольких исследованиях. Сообщаемый уровень вагинальной колонизации E. coli варьируется от 6 до 26% [11,12]. Защитные свойства комменсальной флоры против колонизации кишечными организмами включают выработку ингибиторов против потенциальных патогенов, образование агрегатов комменсальных видов с микробами того же образца или с потенциальными патогенами, колонизацию эпителиальных поверхностей и конкуренцию с потенциальными патогенами за участки адгезия.Количественная взаимосвязь вагинальной E. coli с фазами менструального цикла также указывает на гормональные детерминанты вагинальной колонизации E. coli . Местная травма, такая как половой акт или массаж уретры, способствует вторжению в мочевыводящие пути. Следовательно, при наличии колонизации интроитуса влагалища уропатогенами женщины могут страдать от рецидивирующих ИМП, в то время как в их отсутствие ИМП редко встречается даже у сексуально активных женщин. Повторное или продолжительное введение антибиотиков может также привести к колонизации уретры и влагалища уропатогенными бактериями и предрасположенности к ИМП.PH влагалища 5 или менее защищает от вагинальной колонизации и урогенитальных инфекций: Lactobacillus обычно колонизирует влагалище, генерирует кислый вагинальный pH и препятствует адгезии E. coli , одного из наиболее распространенных уропатогенов у здоровых женщин. Еженедельная вагинальная инстилляция Lactobacillus casei в течение 1 года у женщин в пременопаузе может снизить частоту ИМП примерно на 80% [13], но не может полностью предотвратить урогенитальные инфекции. Также вероятно, что использование мыла для очистки половых путей изменяет окружающую среду и соответствующую флору.Кроме того, по сравнению с другими методами контрацепции использование диафрагм, цервикальных колпачков или спермицидов для контрацепции связано с более высокой частотой ИМП [11,12]. Считается, что у женщин с рецидивирующими ИМП гормональные факторы влияют на прикрепление бактерий к эпителиальным клеткам. Клетки слизистой оболочки мочеполовой системы имеют рецепторы эстрогена [14]. Приверженность к лечению меняется во время менструального цикла и максимальна во время пиковой стимуляции эстрогенами. Введение эстрогенов изменяет качество и количество мукополисахаридного слоя, выстилающего мочевой пузырь и уретру, и повышает тонус висцеральных гладких мышц и сократительную способность нижних мочевых путей.Дефицит эстрогена у женщин в постменопаузе связан с более высоким риском ИМП. Слизистая оболочка атрофируется, лактобациллы исчезают из флоры влагалища, pH влагалища увеличивается, а затем влагалище преимущественно колонизируется энтеробактериями, особенно E. coli . В контролируемом исследовании [15] интравагинальное введение эстриола снижало частоту ИМП у женщин в постменопаузе с рецидивирующими ИМП. Лактобациллы снова появились через 1 месяц у 61%, а средний уровень pH влагалища снизился с 5.От 5 до 3,8 ( P <0,001). Таким образом, местное вагинальное применение эстриола может предотвратить рецидив ИМП у женщин в постменопаузе. Воспаление мочевыводящих путей: взаимодействие хозяин / паразитЧастота и тяжесть ИМП определяются балансом между локальными уроэпителиальными защитными механизмами и патогенностью уропатогенных микроорганизмов. Специфические факторы вирулентности позволяют бактериям выживать и размножаться в организме хозяина. Факторы вирулентности E.coli и Proteus mirabilis хорошо известны (таблица 2) и включают синтез аэробактина и энтеробактина (железосвязывающие белки с чрезвычайно высоким сродством к железу, что необходимо для репликации уропатогенов), а также производство гемолизина и экспрессию фимбрии. Чувствительные к маннозе фимбрии (тип 1-фимбрии) были обнаружены на патогенных и непатогенных видах E. coli , тогда как устойчивые к маннозе фимбрии (P-фимбрии) были обнаружены только на уропатогенных видах.P-фимбрии называются пилями, связанными с пиелонефритом, потому что они могут специфически прикрепляться к эпителиальным рецепторам урогенитального тракта и могут далее подниматься от мочевого пузыря к почкам [16,17]. Нарушения со стороны мочевыводящих путей (пузырно-мочеточниковый рефлюкс) или диагностические процедуры (цистоскопия, мочеиспускательная урография, промывание мочевого пузыря) способствуют распространению патогенных бактерий. Таблица 2.Факторы вирулентности бактерий
Факторы вирулентности бактерий
Хозяин-специфические факторы, связанные с ИМП, включают выработку секреторного иммуноглобулина А, препятствующего адгезии, присутствие мукопротеина Тамма-Хорсфалла (THP), вызывающего агрегацию и вымывание бактерий, бактерицидные свойства сыворотки, а также факторы уродинамики, т.е.е. бактериальный вымывание [19–21]. THP имеет специфические рецепторы для нескольких уропатогенов, а связанные бактерии вымываются с мочой. P-фимбрии и / или F-адгезины присутствуют в 50–65% из штаммов E. coli у пациентов с циститом и в 75–90% изолятов, полученных от пациентов с пиелонефритом, тогда как они присутствуют только в 10– 15% фекалий E. coli от пациентов без ИМП [22,23]. Женщины с рецидивирующими ИМП имеют частую и стойкую вагинальную колонизацию E. coli [24].Кроме того, предрасположенность к ИМП у женщин связана с изменениями адгезионных характеристик вагинальных эпителиальных клеток. Повышенное прикрепление E. coli к вагинальным эпителиальным клеткам было продемонстрировано у женщин с рецидивирующими ИМП [25]. Несекреторы антигенов группы крови, легко определяемые в слюне, также склонны к рецидивам ИМП. Это подтверждено недавними исследованиями [26–28]. Escherichia coli и другие грамотрицательные бациллы можно классифицировать на основе соматических антигенов (O-антигенов), присутствующих в липополисахаридном компоненте клеточной стенки.Идентифицировано около 150 серотипов, и ограниченное их число считается патогенами мочевыводящих путей. Однако корреляция между конкретными серотипами и паренхиматозной инвазией не установлена. Другие маркеры соматических антигенов включают K-антигены капсульного происхождения, расположенные в более внешнем положении по отношению к O-антигенам клеточной стенки. У беременных с бактериурией была обнаружена корреляция между штаммами, богатыми калием, и инвазией в паренхиму почек. К-богатый E.coli относительно устойчивы к фагоцитозу и разрушению комплементом. Во время ИМП цитокины выделяются с мочой или в системный кровоток. У значительной части женщин с бактериурией повышен уровень интерлейкина (ИЛ) -6 в моче, но сывороточный уровень ИЛ-6 повышен только у женщин с острым пиелонефритом [29]. У пожилых женщин и мужчин с бактериурией также повышено содержание IL-1α и IL-6 в моче [30]. Напротив, у беременных с острым пиелонефритом концентрация IL-6 в моче и сыворотке снижается [31].Снижение выработки цитокинов и иммуноглобулинов во время беременности может объяснить, почему беременные женщины более склонны к развитию ИМП. IL-6 синтезируется эпителиальными клетками мочевого пузыря и почек, а также периферическими мононуклеарными клетками крови после контакта с прикрепленной E. coli [32,33]. Можно было ожидать, что определение ИЛ-6 в моче различает бессимптомную бактериурию и контаминацию [29], но уровни ИЛ-6 в моче не коррелируют с пиурией, в то время как концентрации ИЛ-8 в моче — [32,34].Рекрутирование полиморфно-ядерных лейкоцитов (PMNL) в мочу, по-видимому, связано с местным продуцированием IL-8 как уроэпителиальными клетками, так и PMNL. Через четыре часа после внутрипузырной инстилляции липополисахарида нейтрофилы проникают в стенку мочевого пузыря, а мРНК индуцибельной синтазы оксида азота (iNOS), IL-6 и IL-10 обнаруживаются в стенке мочевого пузыря, но не в почках [35]. Такой локализованный воспалительный ответ иллюстрирует важность липополисахарида как медиатора ответа хозяина при ИМП.Эти результаты указывают на потенциальное использование измерений экскреции с мочой нитрата и циклического 3’5’гуанозинмонофосфата (цГМФ) в качестве маркеров индукции iNOS при ИМП. ИЛ-1α присутствует в моче пациентов с бессимптомной бактериурией или симптоматической ИМП, но ИЛ-1 β , фактор некроза опухоли альфа (TNF- α ) или TNF- β отсутствуют [30, 34]. Механизмы, приводящие к хроническим ИМП, не выяснены. Уроэпителиальные клетки и эритроциты несут специфические рецепторные компоненты (гликосфинголипиды) для P-фимбрий.Экспрессия определяется аллелями системы Р-группа крови. Присутствие антигенов P1 связано с риском ИМП и чаще встречается у пациентов с симптоматическими инфекциями или образованием почечных рубцов. Образование рубцов благоприятно, когда уропатогенные микроорганизмы выделяют супероксид, кислородные радикалы или протеиназы, тем самым препятствуя фагоцитозу. Мы благодарим профессора Э. Ритца (Гейдельберг) за конструктивное обсуждение. Список литературы1Джонсон-младший, Штамм ВЕ.Инфекции мочевыводящих путей у женщин: диагностика и лечение. Ann Intern Med 1989 ;111 :906 –9172Schmaldienst S, Hörl WH. Бактериальные инфекции после трансплантации почки. Нефрон 1997 ;75 :140 –1533Кунин С.М., White LV, Tong HH. Переоценка важности бактериурии с малым количеством бактерий у молодых женщин с острыми мочевыми симптомами. Ann Intern Med 1993 ;119 :454 –4604Арав-Богер Б., Лейбовичи Л., Данон Ю.Л.Инфекции мочевыводящих путей с низким и высоким количеством колоний у молодых женщин. Спонтанная ремиссия и разовая доза против многодневного лечения. Arch Intern Med 1994 ;154 :300 –3045Чаудри А., Стоун В. Дж., Брейер Дж. А.. Возникновение пиурии и бактериурии у бессимптомных пациентов, находящихся на гемодиализе. Am J Kidney Dis 1993 ;21 :180 –1836Уолтер Ф. Г., Джибли Р. Л., Кнопп Р. К., Рой Д. Д..Плоскоклеточные клетки как предикторы бактериального заражения в образцах мочи. Ann Emerg Med 1998 ;31 :455 –4587Clague JE, Horan MA. Посев мочи у пожилых людей: сомнительно с научной точки зрения и практически бесполезно? Ланцет 1994 ;344 :1035 –10368Кунин СМ. Инфекции мочевыводящих путей у женщин (современное состояние). Clin Infect Dis 1994 ;18 :1 –109Fommei E, Volterrani D.Почечная ядерная медицина. Semin Nucl Med 1995 ;25 :183 –19410Родригес-Куартеро А., Лопес-Фернандес А., Перес-Бланко Ф. N-ацетил-бета-N-глюкозаминидаза в моче у пациентов с инфекцией мочевыводящих путей. евро Урол 1998 ;33 :348 –35011Гупта К., Стэплтон А.Е., Хутон TM, Робертс П.Л., Феннелл К.Л., Штамм ВЕ. Обратная ассоциация H 2 O 2 -продуцирующих лактобациллы и вагинальную колонизацию Escherichia coli у женщин с рецидивирующими инфекциями мочевыводящих путей. J Infect Dis 1998 ;178 :446 –35012Чоу А. В., Персиваль-Смит Р., Бартлетт К. Х., Голдринг А. М., Моррисон Б. Дж.. Колонизация влагалища Escherichia coli у здоровых женщин. Определение относительных рисков с помощью количественной культуры и многомерного статистического анализа. Am J Obstet Gynecol 1986 ;154 :120 –12613Рид Дж., Брюс А. В.. Низкий уровень pH влагалища и инфекция мочевыводящих путей. Ланцет 1995 ;346 :1704 14Sobel JD, Kaye D. Повышение адгезии Escherichia coli к эпителиальным клеткам, полученным от крыс, стимулированных эстрогеном. Infect Immun 1986 ;53 :53 –5615Raz R, Stamm WE. Контролируемое исследование интавагинального эстриола у женщин в постменопаузе с рецидивирующими инфекциями мочевыводящих путей. N Engl J Med 1993 ;329 :753 –75616Mobley HL, Island MD, Massad G.Детерминанты вирулентности уропатогенных Escherichia coli и Proteus mirabilis . Kidney Int 1994 ;[Дополнение] 46 :S129 –13617Fünfstück R, Smith JW, Tschäpe H, Stein G. Патогенетические аспекты неосложненной инфекции мочевыводящих путей: последние достижения. Клин Нефрол 1997 ;47 :13 –1818Wassall MA, Santin M, Peluso G, Denyer SP.Возможная роль альфа-1-микроглобулина в обеспечении прикрепления бактерий к модельным поверхностям. J Biomed Mater Res 1998 ;40 :365 –37019Pawelzik M, Heesemann J, Hacker J, Opferkuch W. Клонирование и характеристика нового типа фимбрий (фимбрий, связанных с S / F1C), экспрессируемых Escherichia coli 075: K1: Изолят культуры крови H7. Infect Immun 1988 ;56 :2918 –2Parkkinen J, Virkola R, Korhonen TK.Определение факторов в моче человека, которые ингибируют связывание адгезинов Escherichia coli . Infect Immun 1988 ;56 :2623 –263021Virkola R, Westerlund B, Holthöfer H, Parkkinen J, Kekomäki M, Korhonen TK. Характеристики связывания адгезинов Escherichia coli в мочевом пузыре человека. Infect Immun 1988 ;56 :2615 –262222Johnson JR.Факторы вирулентности при инфекции мочевыводящих путей Escherichia coli . Clin Microbiol Rev 1991 ;4 :80 –12823Стэплтон А., Мозли С., Штамм ВЕ. Детерминанты уровня вирулентности в изолятах Escherichia coli , вызывающих у женщин первый эпизод и рецидив цистита. J Infect Dis 1991 ;163 :773 –77924Stamey TA, Sexton CC. Роль вагинальной колонизации Enterobacteriaceae в рецидивирующей инфекции мочевыводящих путей. Дж Урол 1975 ;113 :214 –21725Schaeffer AJ, Jones JM, Dunn JK. Связь прикрепления vitro Escherichia coli к вагинальным и буккальным эпителиальным клеткам с предрасположенностью женщин к рецидивирующим инфекциям мочевыводящих путей. N Engl J Med 1981 ;304 :1062 –106626Шейнфельд Дж., Шеффер А.Дж., Кордон-Кардо С., Рогатко А., Ярмарка WR. Связь фенотипа группы крови Льюиса с рецидивирующими инфекциями мочевыводящих путей у женщин. N Engl J Med 1989 ;320 :773 –77727Hooton TM, Roberts PL, Stamm WE. Влияние недавней половой жизни и использования диафрагмы на микрофлору влагалища. Clin Infect Dis 1994 ;19 :274 –27828Стэплтон A, Hooton TM, Fennell C, Roberts PL, Stamm WE. Влияние секреторного статуса на вагинальную и ректальную колонизацию бахромчатой Escherichia coli у женщин с рецидивирующей инфекцией мочевыводящих путей и без нее. J Инфекция Dis 1995 ;171 :717 –72029Hedges S, Stenqvist K, Lidin-Janson G, Martinell J, Sandberg T., Svanborg C. Сравнение концентраций интерлейкина-6 в моче и сыворотке крови у женщин с острым пиелонефритом или бессимптомной бактериурией. J Infect Dis 1992 ;166 :653 –65630Николле Л.Е., Брунка Дж., Орр П., Уилкинс Дж., Хардинг Г.К.М. Иммунореактивный интерлейкин-1-альфа и интерлейкин-6 в моче у пациентов пожилого возраста, госпитализированных с бактериурией. Дж Урол 1993 ;149 :1049 –105331Петерсон С., Хеджес С., Стенквист К., Сандберг Т., Коннелл Х., Сванборг С. Подавленные ответы антител и интерлейкина-6 на острый пиелонефрит во время беременности. Kidney Int 1994 ;45 :571 –57732Агас В., Хеджес С., Андерссон Ю., Андерссон Дж., Ческа М., Сванборг К. Селективная продукция цитокинов эпителиальными клетками после воздействия Escherichia coli . Infect Immun 1993 ;61 :602 -60933Kreft B, Bohnet S, Carstensen O, Hacker J, Marre R. Дифференциальная экспрессия интерлейкина-6, молекулы внутриклеточной адгезии 1 и молекул класса II главного комплекса гистосовместимости в клетках карциномы почек, стимулированных с помощью s fimbriae или уропатогенные Escherichia coli . Infect Immun 1993 ;61 :3060 –306334Ko YC, Mukaida N, Ishiyama S et al. Повышенный уровень интерлейкина-8 в моче пациентов с инфекциями мочевыводящих путей. Infect Immun 1993 ;61 :1307 –131435Olsson LE, Wheeler MA, Sessa WC, Weiss RM. Инстилляция в мочевой пузырь и внутрибрюшинная инъекция липополисахарида Escherichia coli активируют цитокины и iNOS в мочевом пузыре крысы. J Pharmacol Exp Ther 1998 ;284 :1203 –1208© 1999 Европейская почечная ассоциация — Европейская ассоциация диализа и трансплантологии часто задаваемых вопросов: События, связанные с инфекциями мочевыводящих путей (ИМП) | NHSNПациенты с травмой спинного мозга, пациенты с сильной седацией или ИВЛQ1: В моем учреждении заботятся о пациентах, которые могут быть не в состоянии вербализовать или почувствовать надлобковую нежность, боль или болезненность реберно-позвоночного угла, e.g., пациенты с травмой спинного мозга, пациенты, находящиеся на сильной седации или вентиляции легких. Как я могу сообщить о ОСТОРОЖНОСТИ этим пациентам?Критерии эпиднадзора не могут быть одинаково чувствительными для всех групп пациентов. Популяции пациентов, у которых критерии ИМП могут быть не столь чувствительны, включают пациентов с травмами спинного мозга, пациентов с травмами головного мозга и пациентов, принимающих сильные седативные препараты. NHSN разработала свои определения эпиднадзора, чтобы сбалансировать чувствительность и специфичность, а также осуществимость. Набор критериев, охватывающих каждую субпопуляцию с высокой специфичностью и чувствительностью, был бы слишком сложным для последовательного применения в разных учреждениях.Просто следуйте критериям, указанным в местах, где вы проводите наблюдение CAUTI. Механическая вентиляция или седация не всегда означают, что пациенты не могут выразить боль словами. Медицинские учреждения должны всегда проводить физикальное обследование и оценивать пациентов на предмет невербальной передачи боли или болезненности. 100000 КОЕ / мл включены более чем в 1 лабораторную категориюМоя лаборатория предлагает следующие посевы:
2 кв.Могу ли я использовать положительные культуры, зарегистрированные как 75–100 000 КОЕ / мл, чтобы соответствовать определению ИМП? Вы должны проконсультироваться в своей лаборатории, чтобы определить, могут ли они определить, обнаружено ли в посеве мочи не менее 100 000 КОЕ / мл, и если да, то сообщить об этом как ≥ 100 000 КОЕ / мл. Некоторым лабораториям удалось это выяснить. Смешанная флораQ3: Если посев мочи положительный на 1 организм> 100 000 КОЕ / мл и на смешанную флору, требуются ли эти результаты посева мочи для ИМП?Нет, этот посев мочи не подходит для определения ИМП NHSN. Поскольку «смешанная флора» * подразумевает наличие по крайней мере 2 микроорганизмов в дополнение к идентифицированному организму, посев мочи не соответствует критериям положительного посева мочи с 2 или менее организмами. Такой посев мочи нельзя использовать для соответствия критериям NHSN UTI.* То же самое верно для флоры промежности, нормальной флоры и флоры влагалища Морфология, определяющая, что приравнивается к> 2 организмамQ4: Если результат посева мочи включает:
№Надзорная идентификация организма NHSN до уровня рода или уровня вида, например Escherichia (род) coli (виды) или Enterococcus видов, является максимальной для целей отчетности. E. coli № 1 и № 2 считаются одним организмом, аналогично Enterococcus вида № 1 и Enterococcus вида № 2 будут считаться одним организмом. Результаты по чувствительности к противомикробным препаратам и различия в морфологии колоний не приравниваются к отчету об отдельных организмах.Этот результат посева мочи не содержит> 2 микроорганизмов и является подходящим образцом. Подсчет нескольких колоний для одного и того же организмаУ меня есть окончательный лабораторный результат для пациента в моем возможном отчете CAUTI:
Q5.Так как это один и тот же организм, они в сумме составят 110К КОЕ / мл, будет ли это считаться 1 организмом> 100К и приемлемой культурой, соответствующей критериям ИМП?Да. Когда организмы, обнаруженные в моче, отнесены к тому же роду и видовому уровню , но есть указание на другую морфологию колонии или другую антибиотикограмму (например, штамм 1 или штамм 2, колония A, колония B), для целей при эпиднадзоре за ИМП NHSN микроорганизмы следует рассматривать как одинаковые, и если сумма подсчетов колоний ≥ 100 000 КОЕ / мл, результат посева пригоден для использования в соответствии с определением ИМП.Если имеются антибиограммы и чувствительность одних и тех же организмов различается, всегда указывайте панель с более устойчивостью. Сравнение морфологии, биотипа и антибиотикограммы колоний не должно использоваться для дифференциации организмов, поскольку возможности и протоколы лабораторных исследований различаются в зависимости от учреждения. Количество организмов в культурахQ6. У меня есть пациент, у которого был положительный посев мочи с 100000 КОЕ / млE. coli , а затем, в течение периода повторного инфицирования (RIT), другой посев мочи, который имел более 100000 КОЕ / мл К.pneumoniae и E. faecium. Могу ли я использовать эти культуры для соответствия критериям ИМП или, поскольку в RIT ИМП более 3 микроорганизмов, будут ли они исключены?Не добавляйте несколько культур вместе. Наличие более двух микроорганизмов в одном посеве мочи предполагает возможность заражения образца. То же самое не относится к отдельным культурам мочи с менее чем 3 организмами в каждом. В этом примере первая культура будет иметь право на ИМП.Если с этим посевом мочи не было связано никаких ИМП, то второй посев мочи можно было рассматривать для ИМП, поскольку предыдущий ИМП не был установлен, и в этом посеве мочи было не более 2 микроорганизмов. Определение одиночных и множественных ИМПQ7: Есть ли период времени после идентификации UTI, в течение которого нельзя сообщить о другом UTI?Да. Этот период времени называется периодом повторного заражения (RIT). См. Информацию о RIT в главе 2 «Выявление связанных со здравоохранением инфекций, значок pdf [PDF — 1 МБ]» руководства NHSN. Пациент сообщил о лихорадкеQ8: Могу ли я использовать заявленную пациентом лихорадку, чтобы соответствовать критериям CDC / NHSN UTI, предъявляемым при поступлении (POA)?Если пациент сообщает о лихорадке> 38,0 ° C (или более 100,4 0 F) в течение периода времени POA и в рамках IWP положительного посева мочи, это можно использовать для определения соответствия определению инфекции POA. . Общий отчет пациента о «лихорадке» без сопутствующего измерения температуры не может быть использован. ИМП Симптом: дизурияQ9: Задержка мочи — это то же самое, что дизурия?Задержка мочи — это не то же самое, что дизурия, и ее нельзя использовать для соответствия определению ИМП. ИМП Симптомы: позывы к мочеиспусканию, частое мочеиспускание и дизурияQ10: Если у пациента в анамнезе есть позывы к мочеиспусканию, учащенное мочеиспускание или дизурия, можно ли определить другую признанную причину? Нет, «без другой признанной причины» не относится к этим симптомам.При наличии положительного посева мочи, который мог быть получен в качестве дифференциального диагноза для подозрения на ИМП, очень редко существует другая связанная причина позывов к мочеиспусканию, учащенного мочеиспускания и дизурии, которые являются отличительными симптомами ИМП. Q11: Можно ли использовать эти симптомы в тот же день, когда постоянный мочевой катетер был удален и повторно вставлен?Да. ЕСЛИ эти симптомы возникли, когда постоянный мочевой катетер был на месте , а не на момент появления симптома, его можно использовать в качестве элемента даже в тот день, когда постоянный мочевой катетер находился на месте в течение части дня. Боль или болезненность реберно-позвоночного угла (ЦВА)Q12: Примет ли NHSN боль в пояснице для описания реберно-позвоночной боли?Боль в левой или правой части спины или в боку допустима. Общая «боль в пояснице» в медицинской карте не интерпретируется как боль или болезненность при сердечно-сосудистых заболеваниях, поскольку может быть много причин боли в пояснице. Надлобковая болезненностьQ13: Можно ли использовать боль в животе для лечения симптома ИМП по NHSN, как надлобковая болезненностьСуществует множество причин боли в животе, и этот симптом слишком обобщен, чтобы соответствовать локализованному симптому ИМП в виде надлобковой болезненности.Слабая боль в животе или дискомфорт в мочевом пузыре являются приемлемыми симптомами, соответствующими симптому ИМП NHSN — надлобковой болезненности. «Без другой признанной причины»Q14: Будет ли NHSN рассматривать жалобу пациента на боль внизу живота или жалобу пациента на боль в боку как «другую признанную причину» из-за недавней операции или какого-либо другого события / процесса заболевания, тем самым встречая «другую признанную причину»?Клиническое решение об отсутствии других признанных причин признаков / симптомов ИМП, таких как надлобковая болезненность, боль или болезненность реберно-позвоночного угла, должно приниматься лицом, осуществляющим наблюдение за ИМП в вашей организации NHSN, которое имеет доступ ко всей медицинской карте и клинической картине .Решение клинического суждения должно быть обосновано и подтверждено медицинской документацией, и должно быть четкое обоснование в случае подтверждения случая. Общее руководство: признаки / симптомы ИМП в рамках IWP положительного посева мочи, по-видимому, указывают на то, что симптом является симптомом ИМП, связанным с положительным посевом мочи; которые могли быть собраны на основании подозрения на ИМП. Чтобы использовать термин «без другой признанной причины», должно быть ясно, что симптом связан с этой причиной и четко отличается от симптома ИМП. Сумки для ног / прикрепление урометровQ15: В моем учреждении меняют постоянные мочевые катетеры с постельных принадлежностей на ножные, чтобы наши пациенты могли посещать физиотерапевтические процедуры.или: Моя реанимация открывает катетерные системы для замены катетерных мешков на урометры. Следует ли включать их в систему наблюдения CAUTI, поскольку система не является «закрытой»? Да. Обе методики могут повышать риск ИМП, и таких пациентов следует включить в наблюдение CAUTI. АБУТИ и CMSQ16: Включены ли бессимптомные бактериемические инфекции мочевыводящих путей (ABUTI) у пациентов во взрослых и детских отделениях интенсивной терапии (ICU) или в медицинских, хирургических или терапевтических / хирургических палатах в требования к отчетности в Программе отчетности по качеству стационарных пациентов CMS?В CMS передаются только данные об ИМП, связанных с катетером (как ABUTI, так и SUTI). Имейте в виду, что АБУТИ может возникнуть у пациентов с постоянным мочевым катетером или без него.Следовательно, если у пациента в одном из этих мест есть ABUTI и постоянный мочевой катетер в течение периода времени, соответствующего правилу, связанному с устройством; это ОСТОРОЖНО, и о нем сообщается в CMS, если отчеты ОСТОРОЖНО для данного места включены в ваш ежемесячный план отчетности. Атрибуция устройстваQ17. Эпиднадзор NHSN направлен на выявление риска для пациента, который является результатом использования устройства в целом, а не риска, связанного с конкретным устройством. NHSN не допускает атрибуции к определенному устройству при входе в событие UTI.Вы должны отнести ИМП к месту стационара, в котором пациент был назначен в DOE.Пациенты с коловезикальной фистулойQ18: Исключены ли пациенты с коловезикальной фистулой, отвечающие определению ИМП NHSN?№. Пациенты с коловезикальными, энтеровезикальными или ректовезикальными свищами не исключаются из соответствия определению ИМП NHSN. Эпиднадзор NHSN за инфекцией направлен на выявление риска для пациента, который является результатом использования устройства в целом, а не нацелено на конкретное устройство.Постоянный мочевой катетер подвергает пациента риску и, следовательно, включен в систему наблюдения CAUTI. Целью сдачи образца мочи на посев является определение инфекции. Определения NHSN в настоящее время учитывают загрязнение образцов мочи. NSHN исключает образцы с результатами культивирования более чем двух организмов (полимикробных) для использования в соответствии с определениями ИМП. Вторичный ИБП и количество связанных колоний в мочеQ19: Если количество колоний подходящего патогена ИМП не соответствует требованиям для использования в соответствии с определением ИМП, могу ли я по-прежнему использовать этот патоген, чтобы отнести BSI с соответствующим патогеном к событию ИМП? Например, предположим, что определение ИМП выполняется с использованием посева мочи с> 100000 КОЕ / мл E.coli и 50 000 КОЕ / мл MRSA, может ли BSI столько MRSA быть отнесен к вторичным BSI?Нет. Только E. coli имеет количество колоний, подходящих для использования в соответствии с критериями ИМП. Сценарий 1 Руководства по вторичному BSI (Приложение B к значку протокола BSI в формате pdf [PDF — 1 МБ]) гласит: По крайней мере, один организм из образца крови должен соответствовать организму, идентифицированному в результате местной инфекции, в данном случае с мочой. , который используется как элемент, отвечающий критерию инфицирования сайта NHSN.MRSA 50 000 КОЕ / мл не используется в качестве элемента в определении ИМП. В этом примере BSI с MRSA только не может быть отнесен к вторичному событию UTI. Кроме того, образец крови должен иметь дату забора в пределах периода атрибуции ИМП вторичной ИМП. Какая информация необходима для определения ИМП?Q20: Чтобы NHSN помогло определить случай ИМП, отправьте следующую информацию по адресу [email protected]:
|




