Диагностика овуляции и определение её дня
Диагностика овуляции
Говоря о диагностике овуляции, нужно иметь в виду диагностику факта овуляции и дня овуляции.Понимание факта овуляции (есть овуляция или нет) необходимо для оценки перспектив естественного зачатия: если она есть, зачатие возможно, если нет, возможно, требуется лечение.
Знание дня овуляции необходимо для расчета оптимального момента для естественного зачатия и при многих видах лечения бесплодия.
Итак, сначала о том, как понять, есть ли овуляция?
Понять за 1 минуту
Достаточно задаться вопросом – есть ли предменструальный синдром (ПМС)?
Если есть, значит, есть овуляция. ПМС без овуляции не бывает. Болезненная менструация – еще один признак овуляции.
Уточним, ПМС – это любые циклические изменения в самочувствии, связанные с приближением менструации. Это могут быть головные боли, боли в спине, внизу живота, болезненность и/или нагрубание молочных желез, раздражительность, плаксивость, повышенный аппетит, прибавка веса и т.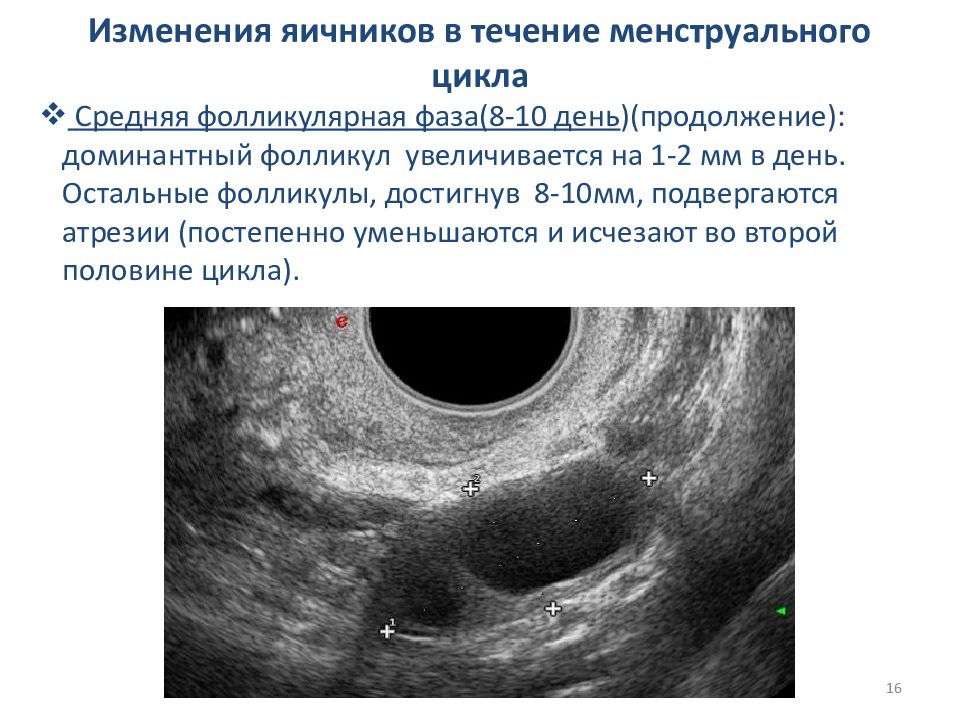
У 98 женщин с овуляцией из 100 при тщательном расспросе удается выявить ПМС или болезненную менструацию. Крайне редко случается, что при наличии овуляции у женщины нет ни ПМС, ни болезненной менструации. И вот тогда, чтобы понять, есть ли овуляция, приходится прибегать к современным методам диагностики: , тестам на овуляцию, анализам крови на гормоны.
Наиболее распространенный способ диагностики овуляции – это УЗИ.
При регулярном 28-дневном менструальном цикле, чтобы понять, есть ли овуляция, УЗИ надо делать на 21-23 день цикла. Если врач видит желтое тело, значит все в порядке, овуляция есть. При 24-дневном цикле УЗИ надо делать на 17-18 день цикла.
Труднее рассчитать время УЗИ для диагностики овуляции при нерегулярном менструальном цикле. Если появляются симптомы ПМС, УЗИ надо сделать в это время. Желтое тело является подтверждением факта овуляции. Другой подход — делать УЗИ каждые две недели до появления растущего фолликула, затем каждые 3-4 дня.
Другой подход — делать УЗИ каждые две недели до появления растущего фолликула, затем каждые 3-4 дня.
Для подтверждения факта овуляции также можно определять прогестерон (гормон желтого тела) в крови. Время взятия крови для определения прогестерона – за неделю до ожидаемой менструации при регулярном цикле и при появлении симптомов ПМС при нерегулярном
Определение дня овуляции
Если вы попали к врачу в первой половине цикла (до 14-го дня), он увидит растущий фолликул. Размеры его будут от 6-7 мм на 6 день цикла до 18-22 на 14 день цикла. Такой фолликул называется преовуляторным или доминантным. Именно он овулирует в данном цикле, то есть из него выйдет яйцеклетка, которая может быть оплодотворена.
Доминантный фолликул растет со скоростью 2 мм в день, начиная с 10 мм (примерно с 6 дня цикла).
Овуляция происходит при размере фолликула примерно 18-22 мм
Таким образом, увидев на 8 день цикла фолликул 10 мм, врач легко рассчитает, что овуляция произойдет на 12-14 день цикла, а значит оптимальный дни для зачатия с 13 по 15.
Тесты на овуляцию надо начинать делать за 2 дня до предполагаемого дня овуляции. Рассчитать его можно путем вычитания из длительности цикла 14 дней. Так, при 28-дневном цикле овуляция в идеале происходит на 14 день +/- 2 дня. При нерегулярном цикле «ловить» овуляцию по тестам нецелесообразно: долго, дорого и ненадежно.
Измерение ректальной температуры (температуры в прямой кишке) по утрам – давно ушедший день. Но для тех, кому лень идти на УЗИ или делать тесты на овуляцию, вполне приемлемый, хотя и не очень точный метод.
Желаем вам хорошей овуляции и удачного зачатия!
Фолликулометрия | Что это | Блог медицинского центра в Киеве Профмедикал
Фолликулометрия — наблюдение за ростом и развитием фолликула и динамическими изменениями эндометрия в течение менструального цикла с помощью ультразвука.
Гинекология в Киеве
Зачем нужна фолликулометрия
На сегодняшний день этот метод является единственным достоверным способом отслеживания овуляции и является альтернативой устаревшему «графику измерения базальной температуры» и аптечным овуляторным тестам.
Обычно фолликулометрия используется при планировании беременности либо когда желанная беременность не наступает, при контролированной стимуляции яичников, подготовке к проведению внутриматочной инсеминации или программы ЭКО. Также фолликулометрия может быть полезна при диагностике нарушений менструального цикла, кист яичников и заболеваний эндометрия (гиперплазии, полипы эндометрия).
Фолликулометрия основана на наблюдении за процессом роста доминантного фолликула с помощью аппарата УЗИ. В одном менструальном цикле обычно требуется 3-4 исследования, начиная с 7-10 дня менструального цикла. Дни проведения УЗИ подбираются индивидуально для каждой пациентки, и основываются на длине ее менструального цикла. У подавляющего большинства женщин менструальный цикл составляет от 28 до 32 дней. В таком случае мониторить доминантный фолликул можно начиная с 10 дня цикла. В случае короткого менструального цикла (21-26 дней), начинать фолликулометрию можно с 7-8 дня цикла. Если же цикл длиннее 35 дней — начинаем с 12-14 дня цикла.
Обычно, начиная с 1 дня менструального цикла ( 1 дня менструации) начинается подготовка к предстоящей овуляции. В процессе нее выбирается один, реже два, доминантных фолликула. На 8-10 день менструального цикла он может достигать 10-14 мм диаметром и расти примерно по 2 мм в день. Овуляция — разрыв оболочек фолликула и выход яйцеклетки — наступает при достижении фолликулом размеров 18-24 мм. После овуляции высвободившаяся яйцеклетка должна попасть в маточную трубу. В этом процессе ей «помогают» фимбрии — специальные ворсинки, которыми заканчивается маточная труба. На месте лопнувшего доминантного фолликула формируется «желтое тело» — временный эндокринный орган, который синтезирует прогестерон на протяжении около 10-14 дней.
Наиболее часто диагностируемые отклонения при проведении фолликулометрии
- Отсутствие роста доминантного фолликула. Это норма, так как далеко не все менструальные циклы у женщин овуляторные. Беспокоиться стоит если ситуация повторяется 3-4 менструальных цикла подряд
- Атрезия фолликула — ситуация, когда доминантный фолликул внезапно останавливается в росте и постепенно регрессирует.

- Преждевременная лютеинизация фолликула — формирование желтого тела на месте доминантного фолликула без предшествующей овуляции
- Персистенция фолликула — происходит рост и развитие доминантного фолликула до ожидаемых размеров, но овуляции не происходит. Иногда фолликул достигает 30 и более мм в диаметре, и тогда он называется уже фолликулярной кистой. Данное образование обычно не требует специального лечения и самостоятельно регрессирует в течение 1-3 менструальных циклов.
В описанных ситуациях овуляция отсутствует и нет выхода яйцеклетки в маточную трубу, где она может быть оплодотворена. Соответственно, беременность не наступает. Основная причина — гормональные нарушения и спаечный процесс в области придатков. Данная ситуация требует дополнительного обследования и квалифицированной помощи акушера-гинеколога, репродуктолога.
Контроль овуляции и расчет оптимального времени зачатия
Контроль овуляции и расчет оптимального времени зачатия
Важное значение для лечения бесплодия имеет не только установление факта физиологического процесса овуляции (выхода зрелой яйцеклетки из фолликула), но и определение сроков наиболее оптимальных для зачатия (фертильных дней).
Одним из способов контроля овуляции и расчета оптимального времени зачатия применяемых в клинике МЦКТ «Нью Лайф» в Оренбурге является динамический ультразвуковой мониторинг роста фолликула и развития эндометрия.
Контроль роста фолликула проводится в первой фазе менструального цикла путем последовательных ультразвуковых исследований. При этом наши репродуктологи оренбург
производят измерение растущих фолликулов, определяют структуру и толщину эндометрия. Эти измерения позволяют зафиксировать факт овуляции и рассчитать оптимальное время для зачатия.
В первые дни менструального цикла в яичниках женщины начинают развиваться сразу несколько фолликулов. В последующие дни выделяется один лидирующий (доминантный) фолликул, который опережает в размерах оставшиеся. Оставшиеся фолликулы подвергаются обратному развитию (атрезии). Доминантный фолликул продолжает расти, с каждым днем он увеличивается в размере на 2-3 мм. И к моменту овуляции достигает 18-24 мм.
Срок начала проведения контроля роста фолликула определяется индивидуально, в зависимости от длительности менструального цикла. Так, например у женщины с длиной цикла 28 дней первое УЗИ рекомендуется провести на 8-10 день цикла. Последующие исследования проводятся ежедневно или с интервалом в 1-2 дня до установления факта овуляции. Критерием диагностики овуляции считается: отсутствие доминантного фолликула на очередном ультразвуковом осмотре, наличие на его месте желтого тела, наличие в малом тазу небольшого количества жидкости.
Для получения консультации акушера гинеколога можно заказать звонок или написать вопрос врачу. Также Вам подскажут какие необходимые анализы при планировании беременности надо сдать.
Что такое фолликулометрия в гинекологии, как делается, что показывает, результаты УЗИ теста на овуляцию, норма
Фолликулометрия в гинекологии
Фолликулометрия – это ультразвуковое наблюдение деятельности яичников, а именно степени созревания фолликула со дня начала менструального цикла. Проводится, чтобы вычислить благоприятные дни для зачатия ребёнка.
Проводится, чтобы вычислить благоприятные дни для зачатия ребёнка.
Когда необходима процедура?
- если планируемая беременность не наступает по неизвестным причинам;
- при нерегулярном менструальном цикле;
- при подготовке к экстракорпоральному оплодотворению (ЭКО).
Фолликулометрия позволяет:
- подтвердить наличие овуляции и её период, чтобы грамотно планировать беременность;
- оценить лютеиновую фазу цикла, исходя из характеристик жёлтого тела;
- установить причины нарушения цикла, созревания фолликула и работы яичников;
- контролировать ранее сделанную фолликулометрию при ЭКО;
- наблюдать за общим гормональным фоном и состоянием репродуктивной системы.
Как делается фолликулометрия?
Процедура проводится с помощью ультразвукового исследования с двумя датчиками. Частый вопрос среди пациенток – на какой день цикла делается фолликулометрия? Обычно – на 8-10 день, но, если цикл нерегулярный, исследование начинают раньше. Далее повторяют его несколько раз по назначению лечащего врача.
Далее повторяют его несколько раз по назначению лечащего врача.
Как подготовиться?
При подготовке к фолликулометрии за несколько дней стоит скорректировать рацион, исключив продукты, вызывающие повышенное газообразование, например, капусту, бобовые, чёрный хлеб и газированные напитки.
Это необходимая мера, которая позволяет получить достоверные результаты фолликулометрии. Ведь, если в кишечнике образуются газы, рассмотреть фолликулы намного труднее.
Важно уточнить у врача способ проведения обследования. Если трансабдоминально, то за полтора часа до процедуры нужно выпить около литра воды. Если трансвагинально, тогда мочевой пузырь должен быть пустым.
Расшифровка фолликулометрии
По результатам исследования определяется степень вероятности успешного зачатия и рождения здорового ребёнка, а также нарушения, которые могут этому препятствовать.
В заключении указывается уровень гормонов, который говорит о том, насколько удачной является овуляция. На основании полученных данных врач принимает решение о дальнейшем наблюдении и лечении.
На основании полученных данных врач принимает решение о дальнейшем наблюдении и лечении.
Проконсультироваться о фолликулометрии и записаться к специалисту вы можете, позвонив в нашу клинику или через форму на сайте.
УЗНАТЬ ЦЕНЫ
Фолликулометрия в Екатеринбурге. Медицинский центр «УРО-ПРО»
Как проходит фолликулометрия
Ультразвуковой мониторинг — наблюдения с помощью УЗИ за тем, как происходят изменения в матке и яичниках на протяжении менструального цикла. На 8-10 день классического менструального цикла на экране аппарата УЗИ виден один доминантный фолликул, достигший в диаметре 12-15 мм на фоне остальных, значительно меньших фолликулов. В редких случаях доминантных фолликулов может быть два или больше. С каждым днем фолликул увеличивается в размерах, в день овуляции он может достигать 18-25 мм в диаметре.
Во время фолликулометрии на то, что овуляция произошла, указывают следующие признаки:
- наличие зрелого фолликула накануне овуляции;
- исчезновение или постепенное уменьшение доминантного фолликула, разрушение его стенок;
- после нормальной овуляции в брюшной полости появляется свободная жидкость;
- вместо зрелого фолликула появляется желтое тело.

Нужно отметить, что иногда даже визуализация зрелого фолликула и наличие вместо него желтого тела спустя неделю не дает стопроцентной гарантии, что овуляция прошла полноценно. Так же, как и единичная фолликулометрия, на которой не было видно доминантного фолликула либо желтого тела, не говорит о полном отсутствии овуляции. Каждый из подобных случаев требует более тщательных и регулярных наблюдений.
Виды нарушений фолликулогенеза
К сожалению, часто фолликулогенез проходит неправильно, что сказывается на здоровье женщины и на способности зачать ребенка. УЗИ может дать следующую информацию, подтверждающую нарушение фолликулогенеза:
- регрессия (атрезия) фолликула. Доминантный фолликул визуализировался, развивался, а затем резко остановился в развитии и начал уменьшаться, в результате чего овуляция не произошла;
- персистенция фолликула – нарушение фолликулогенеза, для которого характерным является отсутствие разрыва фолликула и, соответственно, выхода яйцеклетки.
 При такой патологии фолликул может существовать на протяжении всего цикла, а также после менструации;
При такой патологии фолликул может существовать на протяжении всего цикла, а также после менструации; - фолликулярная киста. Доминантный фолликул дорастает до нужных размеров, но его разрыв не происходит. Впоследствии в нем накапливается фолликулярная жидкость и образуется киста;
- лютеинизация фолликула. Это нарушение фолликулогенеза, при котором желтое тело образовывается на фоне отсутствия разрыва фолликула. Причиной может быть преждевременное повышение гормонов, влияющих на овуляцию, или патология структуры яичников;
- отсутствие развития фолликулов – случай, когда отсутствует развитие доминантного фолликула, из-за чего овуляция невозможна.
Если фолликулометрия показала, что овуляция не происходит по одной из вышеперечисленных причин, врач назначает дополнительные исследования и анализы. Затем по результатам анализов назначается лечение, цель которого — нормализовать гормональный фон и стимулировать овуляцию.
Преимущества клиники «УРО-ПРО»
Ультразвуковое обследование проводится на современном оборудовании экспертного класса.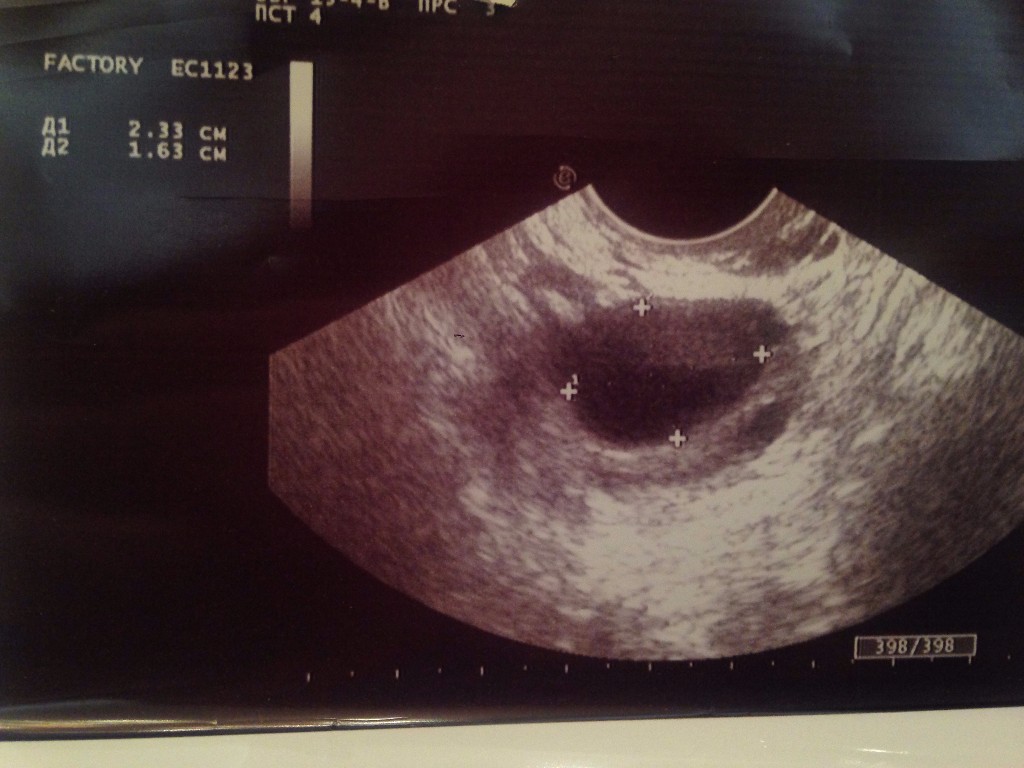 Наши специалисты обладают высокой квалификацией и имеют большой практический опыт. Профессиональная расшифровка результатов позволяет лечащему врачу поставить правильный диагноз и назначить курс эффективного лечения.
Наши специалисты обладают высокой квалификацией и имеют большой практический опыт. Профессиональная расшифровка результатов позволяет лечащему врачу поставить правильный диагноз и назначить курс эффективного лечения.
Диагностика причины женского бесплодия и лечение в гинекологии поликлиники Литфонда
Зачатие ребенка, является актуальной проблемой для многих семей. Программа «Диагностика причин бесплодия», разработанная в Поликлинике Литфонда, позволяет эффективно помочь семейным парам выявить все факторы приведшие к бесплодию и решить эту проблему.
Какие существуют причины женского бесплодия?
Зачастую, причиной женского бесплодия являются гормональные нарушения. Это может приводить к отсутствию менструаций вообще, либо к отсутствию созревания яйцеклетки. При этом нарушения могут касаться как половых гормонов, так и любых других, например, щитовидной железы, поджелудочной железы.
Ниже на рисунке представлен менструальный цикл, развитие яйцеклетки, изменения в эндометрии и изменение гормонального фона (по 4 гормонам) у здоровой женщины.
Гормональные причины бесплодия
Гормональные причины бесплодия могут быть вызваны нарушениями нормы содержания в крови таких основных гормонов, как ФСГ (фолликулостимулирующий гормон), ЛГ (лютеинизирующий гормон), пролактин, эстрадиол, прогестерон, тестостерон, ДЭА-сульфат и других. Как правило, всестороннее исследование гормонального статуса позволяет выявить данную причину и приступить к эффективному лечению выявленного(ых) нарушения.
Проблемы с овуляцией
Если у женщины отсутствует регулярный менструальный цикл, или если менструальный цикл меньше 21 дня или больше 35 дней, то есть риск, что яйцеклетка не созревает или нежизнеспособна.
При этом почти в половине случаев отсутствия овуляции яичники не вырабатывают зрелые фолликулы, из которых потом могли бы развиться яйцеклетки. Поэтому овуляция невозможна, зрелые яйцеклетки не появляются, сперматозоидам нечего оплодотворять. Это наиболее распространенная причина женского бесплодия.
Основная цель обследования женщин в этом направлении — проследить все этапы образования, созревания и выхода яйцеклетки, готовой к оплодотворению. Обследование может выявить нарушение на одном из этапов или опровергнуть наличие нарушения в созревании яйцеклетки.
Обследование может выявить нарушение на одном из этапов или опровергнуть наличие нарушения в созревании яйцеклетки.
Дисфункция яичников
Дисфункция яичников (нарушение процесса формирования «юной» яйцеклетки [фолликула]) в 20 % случаев бывает следствием нарушений выработки гормонов в системе гипоталамус-гипофиз. Если деятельность этой системы нарушена, в яичники не поступают соответствующие сигналы, а потому ритмичная выработка гормонов нарушается. Лютеинизирующий гормон (ЛГ) и Фолликулостимулирующий гормон (ФСГ) вырабатываются в слишком больших или слишком малых количествах, либо нарушается их соотношение. Соответственно, нарушается созревание фолликула, яйцеклетка либо не созревает вообще, либо нежизнеспособна.
Самый простой способ проконтролировать образование фолликулов – это ультразвуковое исследование (УЗИ) яичников, которое проводится на седьмой-девятый день менструального цикла. В одном яичнике должно образоваться, как минимум, несколько фолликулов.
Ранний климакс
Ранний климакс редко бывает причиной отсутствия овуляции. Обычный возраст женского климакса – 45-55 лет, но у некоторых женщин запасы яйцеклеток, по неясным причинам, исчерпываются раньше, менструации прекращаются до 45 лет. Многие врачи не склонны считать такое состояние нормой и говорят о синдроме истощения функции яичников. В ряде случаев это состояние удается преодолеть при помощи гормонального лечения, физиотерапии, даже активизации половой жизни.
Поликистоз яичников
Поликистоз яичников – это гормональные изменения приводящие к выработке множества недееспособных (нефункциональных) фолликулов.
Среди нескольких фолликулов должен созреть один – доминантный, то есть превосходящий остальные по размерам и непосредственно участвующий в овуляции. Происходит это ближе к середине менструального цикла (на 11-13 день). И это можно наблюдать в ходе ультразвукового исследования. Несвоевременность и неполноценность созревания доминантного фолликула может быть причиной бесплодия. Эта проблема бесплодия, называющаяся поликистозом яичников, встречается достаточно часто.
Эта проблема бесплодия, называющаяся поликистозом яичников, встречается достаточно часто.
Поликистоз яичников приводит как к нарушениям в обмене гормонов, так и к изменениям в яичниках. Внешне он проявляется усиленным оволосением, нарушениями менструального цикла или даже аменореей, отсутствием овуляции, бесплодием. При поликистозе снижена выработка (ФСГ), хотя уровень (ЛГ), эстрогена и тестостерона в пределах нормы или повышен. Считается, что низкий уровень ФСГ вызывает постоянное недоразвитие фолликулов, вырабатываемых яичниками, а потому и отсутствие зрелых яйцеклеток. При этом образуется множество фолликулярных кист размером до 6-8 мм, которые легко можно увидеть с помощью ультразвукового исследования (УЗИ). Пораженный яичник обычно увеличен в 2 раза, его поверхность покрыта гладкой белой капсулой, через которую не может пройти даже созревшая яйцеклетка. Это заболевание успешно поддается эффективному и адекватному лечению.
Воспалительный процесс в яичниках
Созревший доминантный фолликул должен разорвать оболочку яичника. При воспалениях стенка значительно утолщается, соответственно, фолликул не может выйти из яичника. Это и есть еще одна причина бесплодия. Перед тем, как начать попытки забеременеть, необходимо провести анализ на наличие скрытых инфекций, в том числе половых, ведь именно они чаще всего вызывают вялотекущий воспалительный процесс в яичниках и влияют как на зачатие, так и на течение беременности.
При воспалениях стенка значительно утолщается, соответственно, фолликул не может выйти из яичника. Это и есть еще одна причина бесплодия. Перед тем, как начать попытки забеременеть, необходимо провести анализ на наличие скрытых инфекций, в том числе половых, ведь именно они чаще всего вызывают вялотекущий воспалительный процесс в яичниках и влияют как на зачатие, так и на течение беременности.
Повреждение маточных труб
Повреждение маточных труб – их полная непроходимость, а также измененная подвижность трубы.
Вышедшая из доминантного фолликула и готовая к оплодотворению яйцеклетка направляется к маточным (фаллопиевым) трубам и находится там, ожидая сперматозоид. Естественно, если проходимость труб нарушена, оплодотворение будет крайне затруднено.
Чаще всего трубы бывают повреждены в результате воспаления, вызванного инфекциями, передающимися половым путем. При этом нарушения в трубах могут быть самые разные – от повреждения ресничек, выстилающих трубы изнутри, до образования гидросальпинкса (скопление жидкости в маточной трубе, запаянной в результате воспаления).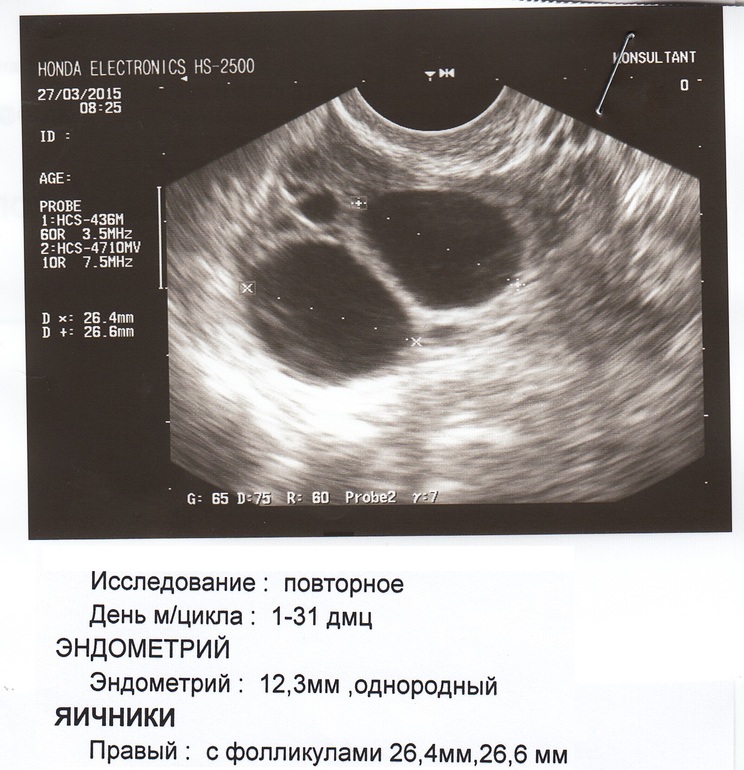
Для определения проходимости маточных труб применяют гистеросальпингографию. Суть этого метода заключается в том, что в полость матки вводится контрастное вещество, и под рентген-контролем проверяется движение контраста по маточным трубам и проникновение его в брюшную полость, также есть метод соногистерография – проверка проходимости маточных труб при помощи УЗИ.
Нарушения строения матки
Любые образования, деформирующие полость матки, действуют как внутриматочная спираль, не позволяя яйцеклетке прикрепиться к эндометрию. К подобным заболеваниям относят полипы слизистой матки, миому матки, эндометриоидные образования, а также врожденные аномалии развития матки – седловидную, двурогую матку, матку с неполной перегородкой, полное удвоение матки и другие.
Многие заболевания влияют на качество слизи шейки матки. Если она слишком густая, то сперматозоиды не могут преодолеть ее. Если же слизь ядовита для сперматозоидов (по химическому составу или из-за иммунных особенностей), то они просто погибнут.
Истинная эрозия шейки матки, а также полипы цервикального канала шейки могут быть причиной бесплодия за счет изменения показателей слизи, и поэтому требуют обязательного удаления до начала лечения бесплодия.
Эндометриоз
В норме, клетки эндометрия образуют внутреннюю поверхность матки, помогают эмбриону питаться, а в отсутствие беременности участвуют в менструации. При эндометриозе клетки эндометрия разрастаются, образуя нечто вроде полипов или глубоких «карманов» в толще матки, могут проникать в маточные трубы, яичники и даже в брюшную полость. Эндометриоз нарушает процессы созревания яйцеклетки, мешает слиянию яйцеклетки и сперматозоида, а также нарушает прикрепление оплодотворенной яйцеклетки к стенке матки.
Психологические причины
Психологические причины также бывают причиной бесплодия. Известны такие состояния, как аменорея военного времени, стрессовая аменорея, даже экзаменационная аменорея, когда из-за стресса нарушается работа функций гормонозависимых органов.
К психологическим относят причины идиопатического бесплодия (бесплодия неясного генеза). У женщины (реже у мужчины) подсознательно сложилось отрицательное отношение к возможной беременности, а потому организм сам, автоматически не позволяет совершиться процессам, приводящим к зачатию.
Если все те причины бесплодия, о которых уже сказано, у семейной пары отсутствуют, то в этом случае лечение бесплодия не требуется. Для зачатия тогда значимым фактором является синхронизация времени «встречи» сперматозоида с яйцеклеткой. Созревшая яйцеклетка может «ожидать встречу» со сперматозоидом от 12 часов до нескольких дней.
Абсолютное женское бесплодие (показание ЭКО)Абсолютное женское бесплодие – отсутствие или стойкая непроходимость маточных труб – является показанием к экстракорпоральному оплодотворению с последующим переносом эмбрионов в матку матери (ЭКО).
При всех видах бесплодия, кроме абсолютного, как правило, удается провести лечение, позволяющее забеременеть естественным путем и подготовить организм к нормальному протеканию беременности и родов.
Записывайтесь на консультацию гинеколога по телефону +7(495)150-60-01
Возврат к списку
Трансвагинальная пункция фолликулов яичников при ЭКО — цена в Москве, как подготовиться и восстановиться
В программе ЭКО (экстракорпорального оплодотворения) трансвагинальная пункция фолликулов яичников является завершающим этапом стимуляции суперовуляции. Процедура проводится одновременно с забором спермы у будущего отца.
Цель процедуры
Пункция фолликулов при ЭКО имеет единственную цель – забор достаточного количества зрелых яйцеклеток (превуоляторных ооцитов) для их последующего оплодотворения в лабораторных условиях. Полученные в результате наиболее качественные эмбрионы переносятся в полость матки.
Показания
Показанием для экстракорпорального оплодотворения является женское и мужское бесплодие. В первом случае это может быть
- трубное или трубно-перитонеальное бесплодие (ТПБ) — результат отсутствия или непроходимости маточных труб,
- бесплодие, вызванное эндометриозом,
- эндокринное бесплодие, в том числе, синдром поликистозных яичников (СПКЯ) – в том случае, если консервативное лечение на протяжении 6-12 месяцев не дает результата,
- бесплодие неясного генеза (идиопатическое бесплодие), установленное после проведения всех необходимых исследований, результаты которых соответствуют норме.
Причиной мужского бесплодия могут быть
- олигоспермия – уменьшение количества эякулята,
- астеноспермия – снижение количества сперматозоидов,
- тератозооспермия I–II степени – больше половины паталогически измененных сперматозоидов в эякуляте.
Сколько фолликулов удастся получить в каждом конкретном случае, предсказать невозможно – в норме их бывает 1-2, но при суперовуляции количество может вырасти до 10. Иногда достаточно хотя бы одного фолликула, желательно диаметром около 20 мм.
Противопоказания
Противопоказанием для проведения пункции фолликулов может стать любой острый воспалительный процесс в организме женщины.
Подготовка к трансвагинальной пункуции фолликулов
Говоря о том, на какой день цикла проводится трансвагинальная пункция фолликулов, следует отметить, что медики стараются проводить эту процедуру в естественном цикле женщины, но всегда при помощи стимуляции суперовуляции.
Подготовка к пункции выглядит так: за 35-38 часов, женщине делают инъекцию гормона хорионического гонадотропина человека (ХГЧ). Очень важно соблюсти именно этот промежуток времени между введением овуляторной дозы ХГЧ и процедурой: в противном случае может наступить овуляция, в результате которой яйцеклетки выйдут их фолликулов, и извлечь их станет невозможно.
Кроме того, за 5 дней перед пункцией фолликулов будущим родителям рекомендуют соблюдать половой покой, отказаться от спиртного, острой или копченой пищи, а также не принимать горячие ванны, не посещать баню и сауну.
Накануне процедуры медики советуют легко поужинать не позже 17:30 и не пить жидкости после 24:00.
В день пункции до процедуры не следует пить и принимать пищу, чтобы не ослабить действие наркоза. Не стоит наносить макияж и надевать контактные линзы, также желательно, чтобы ногти женщины также были не накрашены — это необходимо для того, доктор про необходимости мог оценить размер зрачков, цвет глаз, губ и ногтевых пластин пациентки.
Методика
Как проходит трансвагинальная пункция фолликулов яичников? Процедура проводится под местным либо общим наркозом и внешне напоминает обычное УЗИ. Однако в этом случае к влагалищному датчику крепятся специальный прицел и игла, направление которой отображается на экране монитора пунктирной линией. Убедившись, что игла войдет точно в фолликул, врач делает ей прокол в стенке влагалища. В полости фолликула начинает работать вакумоотсос, и фолликулярная жидкость вместе в содержащимися в ней ооцитами под давлением поступает в пробирки.
С полученным материалом дальше работает эмбриолог, задача которого – оценка, культивирование и оплодотворение яйцеклеток.
Эффективность процедуры
На эффективность программы экстракорпорального оплодотворения могут повлиять несколько моментов
- качество обследований и подготовки к протоколу ЭКО
- качество выполнения каждого этапа в отдельности
- качество переноса эмбрионов в полость матки и ведения последующего периода
В этом сложном процессе очень многое зависит от уровня квалификации специалистов и оборудования, которым оснащена клиника. Медицинский персонал и оснащение ЦКБ РАН соответствуют самым строгим требованиям современных международных стандартов, цена на услуги при этом остается доступной для пациентов.
Осложнения
Состояние современной медицины позволяет свести к минимуму осложнения после пункции фолликулов. Среди тех, что все же периодически случаются — кровотечение из расположенных рядом с яичниками кровеносных сосудов и, как следствие, образование гематом. В этом случае обычно бывает достаточно консервативного лечения, хирургическое вмешательство требуется крайне редко.
Если для пункции необходимо проколоть иглой миометрий – возникает возможность кровотечения, повреждения тазовых органов либо инфицирование это области. Все остальные случаи осложнений единичны и являются, скорее, исключением из правил. Лучшим способом их избежать является выбор клиники с безупречной репутацией.
Стоимость процедуры
| Название услуги | Стоимость, руб |
|
Трансвагинальная пункция фолликулов и аспирация их содержимого под контролем УЗИ |
20700 |
Как яичниковые и антральные фолликулы связаны с фертильностью
| Возрастной диапазон | Среднее значение AFC | Самый низкий AFC | Самый высокий AFC |
| от 25 до 34 | 15 | 3 | 30 |
| от 35 до 40 | 9 | 1 | 25 |
| 41 до 46 | 4 | 1 | 17 |
Низкий запас яичников не означает, что вы не можете забеременеть.Но это означает, что ваши яичники могут не реагировать на препараты для лечения бесплодия так же, как женщины с лучшими запасами яичников. На результаты могут повлиять навыки специалиста по УЗИ и само ультразвуковое оборудование. Если один тест показывает плохой результат, подумайте о том, чтобы получить второе мнение.
У женщин с очень низким числом антральных фолликулов до 40 лет может быть диагностирована первичная недостаточность яичников, также известная как преждевременная недостаточность яичников. Число антральных фолликулов, естественно, уменьшается с возрастом женщины.Необычно высокое количество антральных фолликулов может указывать на синдром поликистозных яичников (СПКЯ).
Роль фолликулов в менструальном цикле
Ваш менструальный цикл разделен на две основные части: фолликулярная фаза и лютеиновая фаза. Во время фолликулярной стадии фолликулы на третичной стадии развития и задействуются и начинают процесс, который в конечном итоге приведет к овуляции.
В то время как в этой гонке появляются несколько фолликулов, только один (или два) достигает полной зрелости и выпускает яйцеклетку.Если вы принимаете препараты для лечения бесплодия, некоторые фолликулы могут достичь стадии овуляции. Сами фолликулы несут ответственность за:
- Питание и защита ооцита в процессе оогенеза
- Высвобождение основных репродуктивных гормонов
- Преобразование в желтое тело после овуляции, которое высвобождает гормон прогестерон (жизненно важный для сохранения толщины и пышности слизистой оболочки матки для имплантации во время беременности)
Фолликулярная фаза менструального цикла
Фолликулярная фаза вашего цикла начинается в первый день менструации.Менструация — это высвобождение организмом верхнего слоя ткани эндометрия, который был образован в ожидании беременности. В конце менструации слизистая оболочка матки станет тонкой. Подкладка после овуляции снова вырастет и станет толще.
Но до того, как это произойдет, во время менструации ваши яичники готовят следующее яйцо к овуляции. В яичнике начнут расти от пяти до шести фолликулов. Гормон ФСГ — фолликулостимулирующий гормон — вырабатывается и высвобождается гипофизом.Именно этот гормон вызывает созревание фолликулов.
По мере увеличения размера фолликулы выделяют больше эстрогена. Более высокий уровень эстрогена сигнализирует гипофизу о замедлении выработки ФСГ. Даже если вы начали с пяти или шести фолликулов, только один (а иногда и два) доживает до зрелости. Более низкие уровни ФСГ заставляют более мелкие фолликулы расти медленнее или даже прекращать рост, в то время как более крупный фолликул продолжает устойчивое развитие.
В конце концов, один фолликул становится доминирующим фолликулом; другие перестают расти и распадаются.Когда фолликул приближается к своему максимальному размеру, он выделяет еще больше эстрогена.
Очень высокий уровень эстрогена вызывает выработку и высвобождение ЛГ или лютеинизирующего гормона гипофизом. Это подталкивает фолликул к завершению последних стадий развития. Наконец, фолликул лопнет и выпустит яйцеклетку. Это момент овуляции.
Фолликулогенез: этапы развития фолликулов
Вы можете подумать, что развитие фолликулов начинается и заканчивается во время фолликулярной фазы менструального цикла, но это не так.Полный жизненный цикл фолликулов начинается еще до рождения человека, когда у растущего плода впервые развиваются яичники.
В это время яичники содержат только примордиальные фолликулы. Фолликулы могут оставаться в этом «спящем» состоянии до 50 лет, прежде чем проснуться и пройти через стадии развития. Для перехода от примордиального фолликула к зрелому, готовому к овуляции фолликул требуется от шести месяцев до одного года.
На каждой стадии развития фолликулов многие фолликулы прекращают развитие и умирают.Не каждый примордиальный фолликул проходит через каждую стадию. Думайте об этом как о соревновании, чтобы попасть на Олимпиаду овуляции. Некоторые фолликулы выпадут, а другие продолжат работу. Фактическая овуляция яйцеклетки составляет менее 1%. Этапы фолликулогенеза:
- Первичный фолликул : стадия, на которой все фолликулы находятся в яичниках новорожденного ребенка
- Первичные фолликулы : A Несколько примордиальных фолликулов переходят в стадию первичного фолликула каждый день, начиная с периода полового созревания и продолжаясь до менопаузы
- Вторичные фолликулы : Включает добавление тека-клеток, которые будут секретировать гормоны
- Третичные фолликулы , также известные как антральные фолликулы: фолликулы, содержащие заполненную жидкостью полость, называемую антральным отделом; фолликулы на этой стадии видны при трансвагинальном УЗИ
- Графов фолликул : фолликул, достаточно большой для овуляции; только один или два третичных фолликула в каждом цикле созреют до овуляции
- Corpus luteum : больше не фолликул; развивается из открытого фолликула, выпустившего яйцеклетку
Размер фолликула
Если вы проходите курс лечения бесплодия, ваш врач может контролировать развитие фолликулов с помощью ультразвука.Во время этих ультразвуковых исследований будет подсчитано количество развивающихся фолликулов. Их тоже будут измерять.
Фолликулы измеряются в миллиметрах (мм). Обычно ваш врач захочет запланировать триггерный укол или инъекцию ХГЧ / ЛГ, когда ваши фолликулы почти достигнут полного зрелого размера. Это около 18 мм. Зрелый фолликул, который вот-вот овулирует, будет иметь размер от 18 до 25 мм.
Сколько фолликулов необходимо для лечения бесплодия
Желаемое количество фолликулов отличается для различных методов лечения бесплодия.Например, вам нужно больше фолликулов для экстракорпорального оплодотворения (ЭКО).
Фолликулы, необходимые для цикла кломидов
В идеале вам нужен только один или два фолликула хорошего размера во время цикла кломида. Вы можете разочароваться, когда узнаете, что только один или два фолликула достаточно велики для овуляции. Однако помните, что больше — не обязательно хорошо. Каждый фолликул зрелого размера может выпустить яйцеклетку, и эта яйцеклетка может стать оплодотворенной.
Если у вас два фолликула, вы можете зачать близнецов.Или вы можете зачать одного ребенка. Или вы можете вообще не забеременеть. Овуляция не гарантирует беременность.
Фолликулы, необходимые для цикла ВМИ или цикла гонадотропинов
Как и в случае с кломидом, в идеале вам нужно, чтобы один или два фолликула выросли до зрелости. Инъекционные препараты для лечения бесплодия (гонадотропины) имеют более высокий риск многоплодной беременности. Возможно развитие трех, четырех и даже более зрелых фолликулов.
Если у вас четыре или более фолликула, ваш врач может отменить цикл лечения.Это может означать отмену запланированной процедуры ВМИ, отмену триггерного укола и / или указание вам воздержаться от полового акта.
Если ваш врач говорит вам не заниматься сексом, вы обязательно прислушиваетесь. При таком большом количестве зрелых фолликулов высок риск зачать тройню или четверку. Многоплодная беременность подвергнет риску вашу жизнь и жизнь ваших детей. Лучше подождать и попробовать еще раз в другом цикле.
Фолликулы, необходимые для цикла ЭКО
Во время лечения ЭКО ваш врач хочет стимулировать ваши яичники к созреванию нескольких фолликулов.Приемлемым количеством считается от 8 до 15 фолликулов.
Во время извлечения яйцеклеток ваш врач аспирирует фолликулы с помощью иглы под контролем ультразвука. Не обязательно, чтобы каждый фолликул содержал качественную яйцеклетку. Поэтому не удивляйтесь, если количество извлеченных яйцеклеток окажется меньше количества фолликулов здорового размера, о которых вам говорили.
Слово от Verywell
Размер и количество фолликулов могут быть источником стресса. Особенно сложно справиться с диагнозом «низкие резервы яичников».Ваш врач может порекомендовать ЭКО с донором яйцеклеток — путь, по которому не все пары могут или хотят идти.
Хотя количество фолликулов является важным показателем фертильности, помните, что одно число не определяет вас и даже не может полностью предсказать ваше будущее фертильности. Если вы не уверены, что означает количество ваших фолликулов, поговорите со своим врачом. Не бойтесь узнать мнение другого человека о результатах тестирования и диагностики фертильности. И обязательно обратитесь за поддержкой. Тестирование на фертильность и лечение — это стресс.Вам не нужно делать это в одиночку.
2D Ультразвук в мониторинге фолликулов для АРТ
Рис. 19.1 Исходный уровень
до начала стимуляции гонадотропинами. Яичник с антральными фолликулами
Рис. 19.2
На пятый день стимуляции показаны рекрутированные фолликулы размером 10–12 мм
Рис. 19.3
На 7-й день стимуляции показан яичник с ведущим фолликулом> 12 мм
Рис. 19.4
День стимуляции 9, показывает яичник с растущими фолликулами
Рис.19,5
11-й день стимуляции, 2–3 фолликула размером 17–18 мм
Рис. 19,6
День индукции овуляции. Ведущие фолликулы размером более 18 мм
Рис. 19.7
Киста желтого тела — «огненное кольцо»
Размер и объем фолликулов
Во время индукции овуляции реально задействовать от пяти до десяти яичников. фолликулы в каждом яичнике; однако количество, скорость роста каждого фолликула и количество дней стимуляции могут сильно различаться.
После 6–7 дней стимуляции гонадотропинами ожидаются фолликулы размером более 10 мм.
Когда размер доминантного фолликула превышает 12 мм, ожидается рост фолликулов на 2 мм (1–3 мм) в день [ 12 ]. Рост продолжается до созревания фолликулов на уровне 18–21 мм, и в этот момент ооцит внутри готов к овуляции, то есть к полному мейозу, и будет выпущен для подготовки к оплодотворению.
Критерии, используемые для запуска овуляции
Критерии, используемые для запуска вызывающего овуляцию окончательного созревания ооцитов, различаются в разных протоколах, но все они направлены на производство зрелых ооцитов для оплодотворения; важно иметь в виду, что зрелые ооциты — это те, которые завершили мейоз I, экструдировали первое полярное тельце и снова встали в метафазу мейоза II.Чаще всего ХГЧ вводят для имитации выброса эндогенного ЛГ, чтобы спровоцировать повторную инициацию мейоза из состояния покоя профазы I. Как уже отмечалось, протоколы различаются и часто меняются, но чаще всего овуляция провоцируется, когда на УЗИ определяется ≥3 фолликулов ≥17 мм. Другой подход, который используют многие клиницисты, заключается в том, чтобы вызвать окончательное созревание ооцитов, когда наблюдается ≥3 фолликулов, каждый с максимальным диаметром 18 мм, или, наконец, когда идентифицируются ≥1 фолликул ≥18 мм и три фолликула ≥15 мм.Более сложные критерии учитывали уровни эстрадиола в сыворотке; ХГЧ вводится, когда ведущий фолликул достигает 18–20 мм и соответствующий уровень эстрадиола в сыворотке указывает на удовлетворительное развитие фолликулов. Кроме того, индукция окончательного созревания ооцитов проводилась при наличии по крайней мере одного фолликула ≥20 мм и уровня эстрадиола в сыворотке ≥1200 пг / мл. Наконец, ХГЧ вводился при наличии по крайней мере одного фолликула размером ≥20 мм или при уровне эстрадиола в сыворотке ≥1200 пг / мл [ 13 ].Нет данных, позволяющих предположить, что какой-либо один протокол значительно превосходит любой другой, и протоколы будут варьироваться в зависимости от индивидуальных предпочтений врача и реакции пациента на стимуляцию.
Таким образом, для определения времени введения ХГЧ количество фолликулов адекватного размера (12-24 мм), по-видимому, более важно, чем размер ведущего фолликула [ 14 ]. Было показано, что когда ХГЧ вводится в присутствии ведущего фолликула> 20 мм, скорость оплодотворения выше, а скорость имплантации эмбриона выше, чем при введении ХГЧ с ведущим фолликулом меньшего размера [ 15 ].
Как предсказать извлечение зрелых ооцитов?
Размер фолликулов и объем фолликулярной жидкости всегда считались возможными предикторами качества ооцитов, в частности ооцитов, которые будут оплодотворены и приведут к появлению эмбрионов, которые имплантируются и приведут к рождению живого ребенка. В одном исследовании качество эмбриона, определяемое как снижение фрагментации эмбриона и увеличение скорости дробления, а также частота имплантации была выше, а частота клинических и продолжающихся беременностей имела тенденцию быть выше, когда ХГЧ вводился после того, как наблюдался больший размер фолликула [ 16 ] .Объем фолликула вместе с числом фолликулов являются единственными двумя независимыми предикторами количества ооцитов, которые будут извлечены, скорости оплодотворения, а также количества и морфологического качества развивающихся эмбрионов [ 17 ].
Попытки найти общепринятый порог размера фолликула, который стоит проколоть, оказались неудачными из-за противоречивых результатов. Принято считать, что большой фолликул с большей вероятностью приведет к извлечению зрелого ооцита, чем меньший фолликул.Корреляция между размером фолликула и вероятностью извлечения зрелого ооцита может быть наблюдаемым физическим проявлением идеи о том, что более крупные фолликулы завершили процесс созревания и высвободили массу ооцит-кумулюсных клеток в виде свободно плавающей структуры в антральной жидкости. до разрыва фолликула [ 18 ]. Согласно Teissier [ 19 ], диаметр 14 мм следует рассматривать как пороговый размер фолликула, чтобы получить приемлемый шанс обнаружения мейотически компетентных ооцитов при извлечении как в нормальных, так и в поликистозных яичниках.Для пациентов с ЭКО Bergh et al. обнаружили, что ооциты в фолликулах со средним диаметром> 16 мм имеют значительно более высокую скорость оплодотворения (71,4%) по сравнению с ооцитами из более мелких фолликулов (58,1%). Интересно, что в том же исследовании авторы отмечают, что после оплодотворения ооцита частота дробления эмбриона была одинаковой (95,4 и 93,9 соответственно), но частота наступления беременности для двух групп резко различалась — 47 и 15% соответственно. Для пациентов с интрацитоплазматической инъекцией спермы (ИКСИ) коэффициент оплодотворения составил 72.0 и 71,1% для ооцитов из больших и малых фолликулов соответственно; соответствующая частота дробления составила 93,0 и 91,1%, а частота наступления беременности для двух групп составляла 41 и 42% [ 20 ]. Было обнаружено, что фолликулы размером 11-15 мм имеют 50% шанс дать зрелый ооцит [ 21 ].
Зрелые ооциты в метафазе II (MII) чаще извлекаются из фолликулов диаметром от 16 до 22 мм (объем 2–5 мл), а из ооцитов MII, как правило, развиваются эмбрионы с наилучшими морфологическими оценками.Напротив, фолликулы со средним диаметром более 22 мм приводят к более низкому восстановлению зрелых, оплодотворяемых ооцитов, поскольку они часто содержат незрелые яйцеклетки, что, как предполагается, является результатом развития внутрифолликулярной атрезии и дегенеративных явлений [ 22 ].
Другие исследователи также наблюдали корреляцию между приспособленностью ооцитов и размером, измеренным ультразвуком до извлечения. Например, более высокая доля ооцитов на стадии незрелых зародышевых пузырьков (GV) обнаруживается в более мелких фолликулах, особенно в фолликулах со средним диаметром менее 12 мм.Однако это не универсальное открытие, поскольку даже маленькие фолликулы могут генерировать зрелые ооциты MII [ 20 , 23 ]. Wittmaack et al. [ 14 ] обнаружили, что оптимальный объем фолликула составляет> 1 мл, что соответствует ≥12 мм, а максимальный объем составляет 6-7 мл, что соответствует фолликулу диаметром 24 мм. Они наблюдали более высокую скорость восстановления ооцитов, более высокую скорость оплодотворения и более высокую скорость расщепления фолликулов в этом интервале. Сообщается, что ооциты из более крупных фолликулов обеспечивают более высокую скорость оплодотворения и генерируют лучшие эмбрионы.
Напротив, в проспективном исследовании, включающем 9 933 фолликула из 535 циклов ЭКО, было обнаружено, что ооциты из фолликулов объемом 24 ].
Однако в этих исследованиях не удалось идентифицировать четкую взаимосвязь между размером фолликула и морфологическим качеством эмбрионов, полученных in vitro. Это может быть связано с тем фактом, что фолликулы с объемом в пределах определенного интервала содержат ооциты, которые приводят к эмбрионам с сопоставимыми морфологическими показателями, и / или с тем фактом, что мужская гамета также способствует качеству эмбриона и ее необходимо учитывать наряду с ооцит.
Важно отметить, что размер, объем, морфология или васкуляризация фолликулов не дают достаточной информации для определения качества ооцитов, когда качество определяется как зачатие эуплоидного ребенка. Однако наилучшим приближением к качеству является то, что в фолликуле диаметром не менее 14 мм, объемом более 0,6 мл и хорошо развитой сосудистой системой находится ооцит, который с большей вероятностью может быть успешно оплодотворен.
Мониторинг пролиферации эндометрия
Во время пролиферативной фазы менструального цикла были изучены и идентифицированы многие факторы, способствующие успешной беременности у пациенток, подвергающихся вспомогательной репродукции.Целью 2D-мониторинга фолликулярной фазы при ВРТ является не только мониторинг развития фолликулов, но и развитие эндометрия. Предсказание вероятности беременности путем оценки степени развития эндометрия с помощью сонографии было целью многочисленных исследований.
Толщина и структура эндометрия в ответ на секрецию эстрогена фолликулами яичников меняются на протяжении менструального цикла. Сразу после менструации эндометрий тонкий (2–5 мм), утолщается во время пролиферативной фазы, является трехламинарным до овуляции и толстым и эхогенным в секреторной фазе цикла.Небольшое количество эндометриальной жидкости (пленка 0,5–1,0 мм в середине полости), которое считается слизью, можно увидеть до овуляции, считается нормальным явлением и быстро исчезает. Однако значительное количество жидкости в эндометрии во время переноса эмбриона (ЭТ), часто видимое при наличии гидросальпинга, связано с более плохим прогнозом. Когда делается это наблюдение, часто считается, что замораживание всех эмбрионов дает время для оптимизации лечения.
Что касается дифференцировки эндометрия, предикторы сонографии, которые часто изучаются, включают кровоток эндометрия, эхо-картину эндометрия и толщину эндометрия.
Утолщенный эндометрий является критическим местом для прикрепления эмбриона. Однако существуют разногласия относительно клинического значения наблюдаемых вариаций толщины эндометрия по отношению к частоте наступления беременности (PR) во время ЭКО. В некоторых исследованиях сообщалось об отсутствии корреляции между толщиной эндометрия и PR, в то время как другие предполагают положительную корреляцию между толщиной эндометрия и PR, сообщая о значительно большей толщине эндометрия в успешных циклах ЭКО по сравнению с неудачными.Возможные причины наблюдаемого несоответствия результатов могут быть связаны с разными протоколами лечения и / или различной этиологией бесплодия. Однако все исследования сходятся во мнении, что «тонкий» эндометрий вреден для имплантации и развития беременности [ 25 ]. Пациенты с тонким эндометрием ставят перед клиницистом дилемму: продолжать ли цикл, несмотря на возможное снижение шансов на беременность, или отменить цикл и заморозить эмбрионы [ 26 ].Совсем недавно метаанализ 2011 года обнаружил значительную разницу в средней толщине эндометрия в день введения ХГЧ между пациентками ЭКО, достигшими беременности, и пациентами, у которых беременность не наступила; сообщалось о разнице в 0,4 мм (95% ДИ 0,22–0,58) и отношении шансов для беременности 1,40 (95% ДИ 1,24–1,58) [ 27 ].
Также изучалось использование кровотока эндометрия для прогнозирования восприимчивости эндометрия. Наличие эндометриального и субэндометриального кровотока коррелирует с более высокой частотой имплантации и беременностей, а отсутствие эндометриального и субэндометриального кровотока связано с более тонким эндометрием и связано с более высоким сопротивлением маточной артерии [ 28 , 29 ].
Исследования показывают, что эхогенные паттерны эндометрия отражают гистологические процессы, которые, как полагают, также участвуют в установлении восприимчивости. Это может объяснить сообщаемую связь между преждевременным гиперэхогенным паттерном эндометрия и низкой частотой имплантации [ 30 Только золотые участники могут продолжить чтение. Войдите или зарегистрируйтесь, чтобы продолжить
Взаимосвязь между размером фолликула при оплодотворении и успешностью беременности
Абстрактные
Введение гонадотропин-рилизинг-гормона (ГнРГ) вызывает выброс лютеинизирующего гормона и овуляцию у различных видов животных, включая людей.Наши цели состояли в том, чтобы определить влияние размера фолликула во время овуляции на функцию желтого тела, а также на установление и поддержание беременности у коров, у которых овуляция была спонтанной или индуцированной гонадолиберином. ГнРГ-индуцированная овуляция фолликулов диаметром 11 мм приводила к снижению частоты наступления беременности и увеличению поздней эмбриональной смертности. Это снижение фертильности было связано с более низкими концентрациями эстрадиола в крови в день осеменения, сниженной скоростью увеличения прогестерона после осеменения и, в конечном итоге, со снижением концентраций прогестерона в кровотоке.Напротив, размер овуляторного фолликула не оказывал заметного влияния на фертильность, когда овуляция происходила спонтанно. Фолликулы, в которых происходит спонтанная овуляция, имеют широкий диапазон размеров, когда они физиологически зрелые. Следовательно, введение GnRH для индукции овуляции, вероятно, инициирует преовуляторный выброс гонадотропинов до того, как некоторые доминирующие фолликулы достигнут физиологической зрелости. Овуляция физиологически незрелых фолликулов, вызванная гонадолиберином, оказывает негативное влияние на частоту наступления беременности и позднюю выживаемость эмбриона / плода.Эти наблюдения у крупного рогатого скота могут иметь значение для вспомогательных репродуктивных процедур у людей.
Процедуры, контролирующие время овуляции у людей и других млекопитающих, имеют огромное значение в продвижении использования вспомогательных репродуктивных технологий. У крупного рогатого скота несколько протоколов эффективно контролируют половой цикл и сокращают время, необходимое для выявления течки (1–3), но время овуляции неточно, что затрудняет осеменение коров в фиксированное время.Когда применяются протоколы фиксированного времени осеменения (протоколы, которые синхронизируют овуляцию), для индукции овуляции используется гонадотропин-высвобождающий гормон (ГнРГ). В некоторых протоколах синхронизации ГнРГ вводят за 9 дней до оплодотворения, чтобы вызвать овуляцию и образование желтого тела (ЖТ), а также вызвать новую фолликулярную волну. За два дня до оплодотворения вводят простагландин F 2α для индукции лютеолиза, а через 48 часов вводят GnRH для индукции овуляции преовуляторного фолликула (4, 5).Осеменение проводится во время второй инъекции ГнРГ (4) или через 16–24 ч после второй инъекции ГнРГ (5).
Фолликулы крупного рогатого скота достигают овуляторной способности при диаметре ≈10 мм. Однако для индукции овуляции 10-миллиметрового фолликула требуется большая доза лютеинизирующего гормона, чем для индукции овуляции более крупных фолликулов (6). У крупного рогатого скота эффективность однократной инъекции ГнРГ для индукции овуляции и, таким образом, синхронизации начала последующей фолликулярной волны составляет всего 66% при оценке на всех стадиях эстрального цикла (7).Из-за такой вариабельности овуляторной реакции мы предположили, что во время инсеминации / индукции овуляции второй инъекцией гонадолиберина могут существовать значительные вариации в размере фолликула. Соответственно, цели этих исследований состояли в том, чтобы определить, влияет ли размер фолликула при GnRH-индуцированной или спонтанной овуляции на последующую функцию CL, частоту наступления беременности и эмбриональную / фетальную смертность.
Материалы и методы
Эксперимент 1. Опытный образец . Послеродовые повторнородящие (3–13 лет) мясные коровы, скрещенные ангусами ( n = 40) на говяжьей ферме Университета Миссури-Колумбия, были разделены поровну на две группы со статусом эстрального цикла (анестезирующая или циклическая) в зависимости от возраста. (4–13 лет) и оценка физического состояния коровы (1 = истощение и 9 = ожирение; диапазон 5–7). Образцы крови собирали на –23, –16 и –10 дни (день 0 = индукция овуляции и осеменения). Коровы считались анестезирующими, если сывороточные концентрации прогестерона были <1 нг / мл в каждом из предыдущих образцов, и считались циклическими, если сывороточные концентрации прогестерона были> 1 нг / мл в день –23, –16 или –10.Коровам вводили GnRH (100 мкг в виде 2 мл Cystorelin im, Merial, Athens, GA) на 9 день и простагландин F 2α (PGF 2α ) (25 мг в виде 5 мл Lutalyse im, Pharmacia Animal Health , Каламазу, Мичиган) в день –2. Через 48 часов после инъекции PGF 2α (день 0) коровы получали ГнРГ (цисторелин, 100 мкг внутримышечно) и были искусственно оплодотворены спермой одного из двух быков. Осеменение всех коров производил один и тот же техник.
Все коровы в эксперименте содержались как одна группа, и телятам позволяли сосать грудь без ограничений.Коров наблюдали дважды в день на предмет признаков эстрального поведения. Четыре коровы с анестезом были исключены из исследования, поскольку у них не произошло овуляции в ответ на вторую инъекцию гонадолиберина. Одна корова в группе, участвовавшей в цикле, умерла (не связана с лечением) на 30-й день и поэтому не отображается в окончательных данных по стельности.
Забор крови, РИА и ИФА . Образцы крови собирали путем пункции яремной вены в пробирки Vacutainer объемом 10 мл (Fisher Scientific) в дни –23, –16 и –10; ежедневно с –9 до 22 дня; и еженедельно с 25 по 60 день после осеменения.Крови давали возможность свернуться при комнатной температуре, хранили при 4 ° C в течение 24 часов и центрифугировали при 1200 × g в течение 30 минут. Сыворотку собирали и хранили при –20 ° C до проведения анализа. Концентрации прогестерона в сыворотке крови были проанализированы во всех образцах с помощью RIA (8) (Diagnostic Products, Лос-Анджелес). Коэффициенты вариации анализов прогестерона внутри и между анализами составляли 2,75% и 10% соответственно, а чувствительность анализа составляла 0,5 нг / мл. Концентрации эстрадиола-17β в сыворотке крови были проанализированы в образцах, собранных в дни –3–0 с помощью РИА (9).Коэффициенты вариации внутри- и межисследований для анализов эстрадиола-17β составляли 3,3% и 9,8% соответственно, а чувствительность анализа составляла 0,5 пг / мл. Сывороточные концентрации связанных с беременностью гликопротеинов (ПАГ) были проанализированы во всех образцах сыворотки с помощью ELISA (10). Коэффициенты вариации внутри- и межисследований для анализов PAG составляли 7,0% и 15,2% соответственно, а чувствительность анализа составляла 1 нг / мл.
УЗИ . Яичники всех коров были исследованы трансректальным ультразвуковым исследованием для характеристики развития фолликулов (дни –2, –1 и 0) и подтверждения овуляции (день 2) с помощью ультразвука Aloka 500V с линейным датчиком 7,5 МГц (Aloka, Wallingford, CT). Были зарегистрированы все фолликулы диаметром ≥8 мм. Размер фолликула определяли путем усреднения диаметра фолликула в самом широком месте и под прямым углом к первому измерению с помощью внутренних штангенциркулей Aloka 500V. Овуляция определялась как исчезновение большого фолликула из яичника в течение 2 дней после введения гонадолиберина.Начиная с 25-го дня, матки всех коров еженедельно в течение 6 недель исследовали трансректальным ультразвуковым исследованием для определения статуса стельности и жизнеспособности эмбриона (сердцебиения) с помощью ультразвука Aloka 500V с линейным датчиком 5 МГц.
Эксперимент 2. Схема эксперимента . Послеродовые (2–11 лет) мясные коровы (половина Red Angus × 1/4 Шароле × 1/4 Тарантез; n = 273) с детенышами-сосунками в Форт-Кио Службы сельскохозяйственных исследований Министерства сельского хозяйства США Лаборатория животноводства и пастбищных исследований обрабатывалась в соответствии с протоколом синхронизации, описанным в эксперименте 1, и была искусственно осеменена одним из двух техников спермой от 1 из 13 быков во время второй инъекции GnRH (индуцированная овуляция).Размер фолликула во время осеменения использовали для определения взаимосвязи между размером фолликула и успешностью стельности у коров, у которых индуцировалась овуляция. Впоследствии 179 коров были повторно осеменены после обнаружения течки электронной системой определения течки HeatWatch (DDx, Денвер) в течение 37-дневного сезона размножения (спонтанная овуляция). Коровы считались охваченными течкой, если в течение 4-часового периода регистрировались три наступления продолжительностью 2 с или более. Коров, у которых была определена течка, искусственно осеменяли через ≈12 ч после начала стоячей охоты.Размер фолликула во время осеменения также использовался для определения взаимосвязи между размером фолликула и успешностью беременности у коров, у которых произошла спонтанная овуляция. Образцы крови собирали в дни –16 и –9 для определения статуса эстрального цикла, как описано в эксперименте 1. В начале лечения (–9 день) коровы были разделены на две повторяющиеся группы до дня 1 (лечение группы 2 было начато. Через 24 часа после группы 1, чтобы лучше справиться с количеством животных). После осеменения коров содержали как одну группу до конца эксперимента, и телятам позволяли сосать грудь без ограничений.Коровы исключались из группы индуцированной овуляции ( n = 108), если у них наблюдалась стоячая течка до запланированного осеменения ( n = 49), не происходила овуляция в ответ на вторую инъекцию GnRH ( n = 51) или показали короткую лютеиновую фазу после осеменения ( n = 8).
Забор крови, РИА и ИФА. Образцы крови были собраны путем пункции хвостового сосуда в 10-миллилитровые пробирки Vacutainer (Fisher Scientific) в дни –16, –9, –2 и 0 для определения циркулирующих концентраций прогестерона (дни –16, –9, –2 и 0) и эстрадиол (–2 и 0 дни).Сыворотку собирали, как описано в эксперименте 1, и хранили при –20 ° C до проведения анализа. На 13, 19, 27, 41, 55 и 68 дни образцы крови собирали в 10-мл пробирки Vacutainer (Fisher Scientific), содержащие ЭДТА, и центрифугировали при 1200 × g в течение 30 минут для отделения плазмы. Плазму собирали и хранили при –20 ° C до проведения анализа. Циркулирующие концентрации прогестерона определяли во всех образцах, собранных с помощью RIA (11) (Diagnostic Products). Коэффициенты вариации внутри и между исследованиями были равны 1.7% и 11% соответственно, а чувствительность анализа составила 0,4 нг / мл. Концентрации эстрадиола в сыворотке определяли с помощью РИА в образцах, собранных в дни –2 и 0, как описано ранее. Коэффициенты вариации внутри и между анализами составляли 3,3% и 9,8% соответственно, а чувствительность анализа составляла 0,5 пг / мл. Концентрации ПАГ определяли с помощью ELISA во всех образцах плазмы, как описано ранее. Коэффициенты вариации внутри и между анализами составляли 7,0% и 15,2% соответственно, а чувствительность анализа составляла 1.0 нг / мл.
Ультрасонография. Яичники исследовали трансректальным ультразвуковым исследованием для характеристики развития фолликулов и овуляции на -2, 0 и 2 дни, как описано в эксперименте 1 (индуцированная овуляция) и во время оплодотворения (спонтанная овуляция). Статус беременности и жизнеспособность эмбриона определяли, как описано в эксперименте 1, на 27, 41, 55 и 68 дни после осеменения.Первое определение стельности было выполнено у коров, у которых произошла спонтанная овуляция между 25 и 39 днями после осеменения, а второй диагноз стельности был поставлен на срок> 40 дней после осеменения.
Статистический анализ. В каждом эксперименте модели логистической регрессии были подогнаны методом максимальной вероятности с использованием sas (PROC LOGISTIC) (12) для определения влияния размера фолликула во время осеменения на частоту наступления беременности на 25–27 и 60–68 дни. .Были смоделированы непрерывные эффекты первого порядка (линейный) и второго порядка (квадратичный) размера фолликула, поскольку предварительный анализ показал значительное отсутствие соответствия моделям, которые включали только линейные эффекты. Кроме того, в эксперименте 1 было определено, были ли взаимосвязи между размером фолликула и частотой стельности однородными для анестезированных коров и коров с циклической нагрузкой. Аналогичным образом, в эксперименте 2 было определено, были ли отношения между размером фолликула и частотой стельности однородными для коров, у которых была вызвана овуляция, и у коров, у которых овуляция произошла спонтанно.Для каждой группы коров первая производная скорости стельности по размеру фолликула была решена для ее корня в диапазоне наблюдаемых размеров фолликула, чтобы получить размер фолликула, который дает максимальный прогнозируемый показатель стельности. Доверительный интервал 90% для прогнозируемого максимума был рассчитан путем обратного преобразования соответствующих критических значений для их линейных предикторов и использовался для установления более низких критических значений, при которых частота наступления беременности была значительно снижена ( P = 0.05) относительно максимума. Таким образом, был сделан вывод о субоптимальных размерах фолликулов, для которых частота наступления беременности была меньше нижнего критического значения доверительного интервала.
Различия между коровами, находящимися под анестезией, и коровами с циклическим режимом (эксперимент 1) в росте доминантного фолликула, размере овуляторного фолликула и скорости повышения прогестерона определяли с помощью дисперсионного анализа sas (PROC GLM) (12). Когда статистика F была значимой ( P <0,05), среднее разделение выполнялось с использованием наименьших значимых различий (средние значения ± стандартная ошибка среднего) (13).
Циркулирующие концентрации прогестерона, эстрадиола-17β и ПАГ анализировали с помощью дисперсионного анализа для повторных измерений в sas (PROC MIXED) (14). Статистическая модель состояла из тестируемых переменных (размер фолликула, статус беременности или смертность плода), день и их взаимодействия. Влияние размера фолликула, статуса беременности или смертности плода анализировали с использованием животных в пределах размера фолликула, статуса беременности или смертности плода в качестве условия ошибки, а влияние дня и любого взаимодействия анализировали с использованием остатка в качестве члена ошибки.
Результаты
Эксперимент 1. Рост доминантного фолликула со 2-го дня до 0-го дня (циклические животные, 1,2 ± 0,1 мм / день; анестезированные животные, 0,9 ± 0,2 мм / день) и размер овуляторного фолликула при осеменении (циклические животные, 13,9 ± 0,2 мм; анестезированные животные, 14,8 ± 0,3 мм) не различались ( P > 0,20) между группами, подвергавшимися велоспорту, и группами, которым вводили наркоз. Кроме того, не было разницы в частоте наступления беременности ( P > 0.05) между ездящими на велосипеде и анестезированными животными, когда овулировали фолликулы сопоставимого размера. Когда животные из обеих этих групп были объединены, соотношение логарифмических шансов между размером фолликула на момент осеменения и частотой наступления беременности, как правило, было криволинейным на 25-й день ( P = 0,13) (рис. 1 a ). ). Регрессионный анализ показал, что максимальная частота наступления беременности составила 84,0 ± 16,6% на 25-й день, когда овуляторные фолликулы были 14,7 мм. Возникла тенденция ( P = 0.10) для коров, у которых овулировали фолликулы диаметром менее 12,1 мм, с меньшей вероятностью поддержат беременность до 25 дня после осеменения по сравнению с коровами, у которых овулировали фолликулы диаметром 14,7 мм (Рис.1 a ). У коров нет фолликулов с овуляцией> 17 мм или <10 мм в диаметре.
Рисунок 1.Регрессионный анализ влияния размера овуляторного фолликула на частоту наступления беременности.( a и b ) Размеры фолликулов, при которых частота наступления беременности снижалась ( P <0,05) ниже максимальной частоты наступления беременности, указаны вертикальными линиями. Результаты показаны для влияния размера фолликула во время инъекции GnRH на 25-й и 60-й день частоты наступления беременности для эксперимента 1 ( a ) и на 27 день и 68 день частоты наступления беременности для эксперимента 2 ( b ). ( c ) Влияние размера овуляторного фолликула во время стоячей течки на частоту наступления беременности при ранней (<39 дней, PG 1) и поздней (> 40 дней, PG 2) диагностике.Размер фолликулов, у которых произошла спонтанная овуляция, не повлиял на частоту последующих беременностей. Показаны результаты для эксперимента 2.
Тринадцать процентов всех коров испытали позднюю эмбриональную смертность между 25 и 39 днями, что было отражено потерей сердцебиения после того, как беременность была первоначально подтверждена ультразвуком на 25 день. Фактически, вся поздняя эмбриональная / эмбриональная смертность произошла у коров, у которых произошла овуляция фолликулов. ≤13,5 мм (33% коров с овуляцией ≤13,5 мм).5-миллиметровые фолликулы потеряли беременность). Криволинейная взаимосвязь между размером фолликула и частотой наступления беременности на 60-й день была более выражена, чем на 25-й день ( P = 0,07), а регрессионный анализ показал максимальную частоту наступления беременности 81,2 ± 17,6% при размере фолликула 15,2 мм (рис. 1 а ). Опять же, коровы, у которых овулировали фолликулы <12,8 мм, как правило, с меньшей вероятностью ( P = 0,10) поддерживали беременность до 60 дня после осеменения по сравнению с коровами, у которых овулировали 15.2-миллиметровые фолликулы.
Наблюдалось влияние статуса беременности ( P <0,01) на сывороточные концентрации прогестерона (рис. 2) в течение первых 3 недель беременности. Концентрации прогестерона были значительно выше ( P <0,05) начиная с 9-го дня, а скорость увеличения концентраций прогестерона от осеменения до 16-го дня была выше ( P <0,01) у коров, которые впоследствии были беременны в этот день. 25 по сравнению с не беременными коровами.Размер овуляторного фолликула во время осеменения также влиял на концентрацию прогестерона в кровотоке (рис. 3). Более конкретно, концентрации прогестерона повышались медленнее ( P <0,01) и имели тенденцию к снижению ( P = 0,11) после индуцированной ГнРГ овуляции фолликулов <12,8 мм по сравнению с более крупными фолликулами (рис. 3).
Инжир.2.Сывороточные концентрации прогестерона у коров в эксперименте 1, которые были определены как беременные или небеременные, и скорость повышения прогестерона с 0 по 16 день. AI, день искусственного осеменения (день 0). Статус беременности, P <0,01; день, P <0,01; статус беременности по дням, P <0,01; беременные по сравнению с небеременными, P <0,01.
Инжир.3.Влияние размера овуляторного фолликула на сывороточные концентрации прогестерона в эксперименте 1 с 0-го дня (осеменение) по 22-й день и влияние размера овуляторного фолликула на скорость повышения прогестерона с 0-го по 16-й день. Размер овуляторного фолликула, P = 0,04; день, P <0,01; размер овуляторного фолликула по дням, P = 0,12; скорость повышения прогестерона P <0,01.
Размер овуляторных фолликулов не повлиял ( P = 0.29) циркулирующие концентрации эстрадиола (5,69 ± 0,44 и 6,01 ± 0,27 для фолликулов размером <12,8 мм и ≥12,8 мм соответственно). Кроме того, концентрации эстрадиола не различались ( P = 0,56) между анестезирующими (6,08 ± 0,36 пг / мл) и велосипедными (5,80 ± 0,32 пг / мл) коровами или между стельными (5,91 ± 0,28 пг / мл) и небеременными коровами. (5,97 ± 0,46 пг / мл; P = 0,90) коров.
Секреторные белки трофобласта, известные как PAG, были обнаружены между 22 и 25 днями после осеменения у стельных коров.Не было обнаружено различий ( P = 0,57) в циркулирующих концентрациях PAG между коровами, у которых овулировали фолликулы размером ≥13,2 мм, и коровами, у которых овулировали фолликулы <13,2 мм (данные не показаны).
Эксперимент 2. Отношение логарифма шансов между размером фолликула и частотой наступления беременности на 27 день, наблюдаемое в эксперименте 2, криволинейно зависело от того, была ли у коров индуцирована овуляция или овуляция спонтанная ( P = 0,10). Для тех коров, у которых была индуцирована овуляция, логистическая регрессия показала максимальный уровень стельности на 27 день из 53.4 ± 10,7% при размере фолликула 14,5 мм. Коровы, у которых овулировали фолликулы <10,3 мм, с меньшей вероятностью поддержали беременность до 27 дня после осеменения по сравнению с коровами, у которых овулировали фолликулы диаметром 14,5 мм ( P = 0,05; Рис.1 b ). Овулированные фолликулы были ≤20 мм и> 9 мм у всех коров. Поздняя эмбриональная / эмбриональная смертность между 27 и 68 днями произошла у 7% всех коров. Опять же, как и в эксперименте 1, поздняя потеря эмбриона была ограничена теми животными, у которых овулировали маленькие фолликулы.Тридцать девять процентов коров с овулирующими фолликулами размером менее 11 мм потеряли беременность; поздней эмбриональной / эмбриональной смертности у животных с овуляцией более крупных фолликулов не наблюдалось. У тех коров, у которых произошла спонтанная овуляция, частота наступления беременности на 27 день практически не зависела от размера фолликула ( P > 0,40; Рис.1 c ).
Как и на 27 день, частота наступления беременности на 68 день практически не зависела от размера фолликула ( P > 0,40; Рис.1 b ) у тех коров, у которых произошла спонтанная овуляция.Однако из-за потери 39% беременностей у коров, которые были вызваны к овуляции и имели фолликулы ≤11 мм, взаимосвязь между размером фолликула во время осеменения и частотой наступления беременности на 60-й день в этой группе была более криволинейной, чем в день. 27 ( P <0,02; рис.1 b ). При мониторинге частоты наступления беременности на 68 день, логистический регрессионный анализ показал, что максимальная частота наступления беременности составляет 56,3 ± 10,8% при размере фолликула 14,6 мм. Коровы, у которых произошла овуляция фолликулов <11.3 мм реже поддерживали беременность до 60 дня по сравнению с коровами, у которых овулировали 14,6-миллиметровые фолликулы (рис. 1 b ).
При сравнении размера фолликулов во время овуляции, у большего процента коров была индуцирована овуляция фолликулов размером ≤11 мм (26%; P <0,02), чем у коров, у которых была индуцирована овуляция 12-, 14-, 15- или ≥ Фолликулы размером 16 мм (13%, 15%, 12% и 12% соответственно). Процент животных, у которых овулировали 13-миллиметровые фолликулы (22%), был промежуточным по сравнению с двумя предыдущими группами.
У 23% коров наблюдалась стоячая течка при своевременном осеменении (± 24 часа). Коровы, у которых была течка при осеменении, имели более высокие ( P <0,01) показатели стельности (90% и 88% на 26-й и 68-й дни соответственно), чем те коровы, у которых не было течки при осеменении (29% и 26% на 26-й день). и 68 соответственно). Концентрации эстрадиола в сыворотке крови были выше ( P <0,01) у коров, у которых была выявлена течка (6,1 ± 0,4 и 9,9 ± 0,6 пг / мл в дни –2 и 0, соответственно), по сравнению с коровами, у которых не выявлена течка (3.4 ± 0,2 и 8,1 ± 0,3 пг / мл соответственно).
Примечательным результатом этих результатов было то, что у коров, у которых не была выявлена течка и у которых индуцировалась овуляция фолликулов <11,3 мм, снизилась ( P <0,01) концентрация эстрадиола в день 0 по сравнению с коровами, у которых индуцировалась овуляция более крупных фолликулов (6,04 ± 0,59 и 8,90 ± 0,38 пг / мл соответственно) (рис.4). Напротив, когда у коров была выявлена стадия стоячей охоты, размер фолликула не влиял на концентрацию эстрадиола в сыворотке крови на -2 или 0 день (рис.4).
Рис. 4.Влияние размера овуляторного фолликула на циркулирующую концентрацию эстрадиола у коров, не обнаруженную или не обнаруженную в течке (24 ч до или после рассчитанного по времени осеменения). a, b, y и z указывают разные средние концентрации эстрадиола. ( P <0,02.)
Без разницы ( P = 0.35) был обнаружен при концентрациях ПАГ между коровами, у которых индуцировалась овуляция фолликулов ≥11,3 мм, по сравнению с коровами, у которых индуцировалась овуляция фолликулов <11,3 мм. Однако концентрация ПАГ действительно различалась у животных, которым суждено было перенести позднюю утрату эмбриона. По сравнению с коровами, которые успешно вынашивали беременность, коровы, у которых наблюдалась поздняя эмбриональная смертность между 27 и 41 днями, имели тенденцию ( P = 0,11) к снижению концентрации ПАГ на 27 день, когда беременность была подтверждена ультразвуком (9.94 ± 1,24> 2,16 ± 4,63 нг / мл). На 41 день, после того, как произошла потеря эмбриона / плода, концентрации ПАГ (18,11 ± 1,95> 2,86 ± 7,3 нг / мл) стали значительно сниженными ( P = 0,05) по сравнению с коровами, у которых сохранялась беременность.
В течение 37-дневного сезона размножения больше коров, у которых спонтанно овулировали фолликулы 13, 14 или ≥16 мм (21%, 24% и 21% соответственно) после течки стоя, по сравнению с процентом коров, у которых спонтанно овулировали ≤11- мм (8%), 12 мм (12%) или 15 мм (14%) фолликулы ( P <0.02). У коров нет фолликулов с овуляцией> 23 мм или <9 мм, а размер фолликулов у коров, у которых произошла спонтанная овуляция, не влиял на частоту наступления беременности ( P > 0,40; Рис. 1 c ). Кроме того, размер фолликула у коров, у которых произошла спонтанная овуляция, не влиял ( P > 0,53) на последующие концентрации прогестерона в сыворотке (данные не показаны).
Обсуждение
Для повышения эффективности протоколов своевременного осеменения необходимо контролировать время овуляции.Производство жизнеспособного эмбриона требует овуляции компетентного ооцита, адекватной продукции прогестерона CL и адекватной среды матки. В эксперименте 1 коровы, у которых овулировали фолликулы размером ≤13,2 мм, имели пониженную концентрацию прогестерона и замедленное повышение прогестерона по сравнению с коровами, у которых овулировали более крупные фолликулы. У дойных коров, у которых индуцировалась овуляция мелких фолликулов (11,5 ± 0,2 мм), развивались меньшие КЛ и выделялось меньше прогестерона по сравнению с коровами, у которых индуцировалась овуляция более крупных фолликулов (14.47 ± 0,39 мм) (15). Точно так же фолликулы овцы, у которых индуцировалась овуляция через 12 часов после регрессии лютеиновой кислоты, имели меньшее количество клеток гранулезы и образовывали меньшие клетки, которые секретировали меньше прогестерона, чем фолликулы, индуцированные к овуляции через 36 часов после регрессии лютеиновой кислоты (16). Клетки гранулезы дифференцируются в большие лютеиновые клетки (17), и примерно 80% прогестерона, секретируемого КЛ овцы, по сообщениям, секретируется большими лютеиновыми клетками (18). Кроме того, количество крупных лютеиновых клеток овцы не увеличивается во время лютеиновой фазы (19).Следовательно, снижение концентрации прогестерона после индуцированной овуляции более мелких фолликулов может быть результатом меньшего количества гранулезных клеток, присутствующих в фолликуле до овуляции, что приводит к меньшему количеству крупных лютеиновых клеток в CL. МакНатти и др. (20) предположил, что развитие нормальной ХЛ зависит от преовуляторных фолликулов, имеющих: (—) адекватное количество клеток гранулезы, ( ii ) адекватное количество рецепторов лютеинизирующего гормона на гранулезных и текальных клетках и ( iii ) клетки гранулезы, способные синтезировать адекватное количество прогестерона после лютеинизации.Однако в эксперименте 2 размер фолликула не влиял на последующие концентрации прогестерона при спонтанной овуляции у коров. Следовательно, сам по себе размер фолликула не является отличительной характеристикой. Более мелкие фолликулы, способные к спонтанной овуляции, возможно, имеют пониженное количество гранулезных / больших лютеиновых клеток, но это состояние не препятствует секреции этими фолликулярными клетками адекватного количества прогестерона после лютеинизации.
Интрафолликулярные концентрации эстрадиола могут играть роль в подготовке фолликулярных клеток к образованию и функционированию лютеина.Эстрадиол оказывает следующие действия на клетки гранулезы: ( i ) усиление клеточной пролиферации (21–23), ( ii ) образование щелевых контактов (24, 25), ( iii ) усиление стимулирующего действия фолликулостимулирующих веществ. гормон на активность ароматазы (26–28), ( iv ) усиливал стимуляцию синтеза прогестина после стимуляции гонадотропинами (29, 30) и ( v ) усиливал усвоение рецепторов лютеинизирующего гормона (31–33). Кроме того, способность лютеинизированных клеток гранулезы человека секретировать прогестерон увеличивалась, когда клетки собирали из фолликулов с повышенными концентрациями эстрадиола в фолликулярной жидкости по сравнению с клетками гранулезы, собранными из фолликулов с более низкими концентрациями эстрадиола (20), а секреция прогестерона задерживалась в овцематкам перед индуцированной овуляцией давали ингибитор ароматазы (34).Следовательно, коровы, у которых наблюдалась стоячая течка, могли достичь концентраций эстрадиола, необходимых для адекватной подготовки фолликулярных клеток к лютеинизации, независимо от размера фолликулов.
Секреция лютеинового прогестерона необходима для поддержания беременности (35) и стимулирует секрецию эндометрия (36) и рост / развитие эмбриона (37). Коровы, которые были беременными, имели более высокие сывороточные концентрации прогестерона, начиная с 9-го дня после осеменения, по сравнению с небеременными коровами.Об аналогичных различиях в циркулирующих концентрациях прогестерона уже на 6-й день после оплодотворения сообщалось у коров, которые забеременели, по сравнению с коровами, которые не забеременели (38). У коров, у которых наблюдалось более раннее повышение уровня прогестерона, были эмбрионы, которые получили дальнейшее развитие и продуцировали больше антилютеолитического белка IFN-τ к 16-му дню, чем коровы, у которых повышение концентрации прогестерона было отложено (39). Эти данные показывают, что более раннее повышение уровня прогестерона может способствовать увеличению выживаемости эмбриона / плода.
Эмбриональная / эмбриональная смертность может значительно снизить репродуктивную эффективность. У молочных коров частота гибели эмбрионов с 25 по 98 день после индуцированной овуляции колебалась от 14% до 40% (40–42), при этом наибольшая доля гибели (17%) приходилась на период между 28 и 56 днями. Поздняя эмбриональная / эмбриональная смертность, имевшая место в настоящем исследовании, зависела от размера фолликула при индукции овуляции, но не при спонтанной овуляции. Причины поздней эмбриональной / эмбриональной смертности после индуцированной ГнРГ овуляции более мелких фолликулов могут быть связаны с неправильной маточной средой, связанной со снижением циркулирующей концентрации прогестерона, замедленным повышением уровня прогестерона после овуляции и / или снижением концентрации эстрадиола в день. осеменения по сравнению с коровами, у которых индуцировалась овуляция более крупных фолликулов.Когда инъекция эстрогена, предшествующая длительному лечению прогестероном, отсутствовала у овариэктомированных овец, выживаемость эмбриона после переноса эмбриона, масса матки, белок матки, соотношение РНК к ДНК и скорость синтеза белка снижались (44). Следовательно, снижение концентрации эстрадиола перед овуляцией, вызванной ГнРГ, может повлиять на способность матки поддерживать беременность.
Неадекватное развитие ооцитов — еще одно возможное объяснение эмбриональной / эмбриональной смертности, когда небольшие фолликулы были вызваны к овуляции.Во время роста и развития ооцита мРНК и белки продуцируются и хранятся в ооците (45). Компетентность в отношении развития ооцитов продолжает увеличиваться с увеличением диаметра фолликулов у крупного рогатого скота (46), а низкие уровни синтеза РНК по-прежнему наблюдаются в крупных ооцитах (47). Мало что известно о различиях в качестве ооцитов среди преовуляторных фолликулов крупного рогатого скота. Однако у людей ооциты, собранные из фолликулов <14 мм, имели более низкую скорость развития по сравнению с ооцитами, собранными из фолликулов> 14 мм (48).Кроме того, после обычных процедур оплодотворения in vitro ооциты, собранные из человеческих фолликулов размером> 15 мм, имели более высокие показатели оплодотворения и наступления беременности по сравнению с ооцитами, полученными из более мелких фолликулов (49). Таким образом, выживание эмбриона / плода у некоторых видов может быть нарушено, если ооциты получены из еще не полностью созревших фолликулов. В настоящем исследовании, когда произошла спонтанная овуляция, не было обнаружено различий в частоте наступления беременности среди фолликулов разного размера.Следовательно, когда фолликул / ооцит созрел и способен инициировать каскад событий, ведущих к овуляции, жизнеспособный эмбрион может развиться независимо от размера фолликула.
Потеря эмбриона произошла в настоящих и других исследованиях (40–42) примерно во время прикрепления эмбриона к матке (дни 21–42) (50). ПАГ экспрессируются в двуядерных клетках плаценты примерно в это время беременности (51). Экзоцитоз гранул из двуядерных клеток в направлении ложа материнских капилляров позволяет продуктам трофэктодермальных клеток (например,g., PAGs) для достижения материнского кровоснабжения при прикреплении трофэктодермы к матке (43). Тенденция к снижению циркулирующих концентраций ПАГ у коров с внутриутробной смертностью, вероятно, указывает на недостаточность развития плаценты во время прикрепления, вызванную неоптимальным развитием эмбриона, неоптимальной маточной средой или сочетанием этих двух факторов.
Таким образом, индуцированная ГнРГ овуляция фолликулов размером ≤11 мм привела к снижению частоты беременностей и увеличению поздней эмбриональной / эмбриональной смертности.Это наблюдение важно из-за широкого использования ГнРГ во многих режимах синхронизации. Снижение фертильности было связано со снижением циркулирующих концентраций эстрадиола в день осеменения, более низкой скоростью увеличения прогестерона после осеменения и снижением циркулирующих концентраций прогестерона. Однако размер овуляторного фолликула не оказывал видимого влияния на фертильность, когда овуляция происходила спонтанно. Таким образом, фолликулы, в которых происходит спонтанная овуляция, имеют широкий диапазон размеров, когда они физиологически зрелые.Следовательно, введение ГнРГ для индукции овуляции, вероятно, инициирует преовуляторный выброс гонадотропинов до того, как доминантный фолликул достиг физиологической зрелости, а индуцированная ГнРГ овуляция физиологически незрелых фолликулов оказывает негативное влияние на частоту наступления беременности и позднюю выживаемость эмбриона / плода.
Благодарности
Мы благодарны Дж. Бадеру, С. Беллоузу, Б. Маккормаку, С. Рейлу, Б. Шиппу, Э. Уиллису и У.Р. Ламберсону за техническую помощь.
Сноски
↵ ‡ Кому следует отправлять корреспонденцию по текущему адресу: Департамент зоотехники и ареала, Государственный университет Южной Дакоты, Box 2170 ASC 214, Brookings, SD 57007-0392. Электронная почта: george.perry {at} sdstate.edu.
Авторские работы: Г.A.P., M.F.S., M.C.L. и T.W.G. спланированное исследование; G.A.P., M.F.S., A.J.R. и T.W.G. проведенное исследование; J.A.G. и T.E.P. внесены новые реагенты / аналитические инструменты; ЗАЗОР. и M.D.M. проанализированные данные; и G.A.P. написал газету.
Сокращения: GnRH, гонадотропин-рилизинг-гормон; CL, желтое тело; ПАГ, гликопротеин, связанный с беременностью.
↵ § Васконселос, Дж., Silcox, R., Lacerda, J., Pursley, J. & Wiltbank, M. (1997) Biol. Репродукция. 56, Доп. 1, 140 (аннотация).
↵ ¶ Миллер Б. Г. и Мур Н. В. (1976) Theriogenology 6, 636 (абстракция).
- Авторские права © 2005, Национальная академия наук
Приносит ли большой (> 24 мм) фолликул компетентный ооцит / эмбрион? — FullText — Гинекологическое и акушерское исследование 2020, Vol.85, № 5
Абстрактные
Цель: Оценить влияние большого размера фолликулов (≥24 мм) в день получения ооцитов на качество ооцитов / эмбрионов. Пациенты и методы: Когортное исследование было проведено в одном медицинском центре третичного уровня в период с июля 2018 г. по май 2019 г. Перед аспирацией фолликулов под контролем УЗИ фолликулы были измерены и разделены на 2 группы в соответствии с их максимальным размером: большие: ≥24 мм и нормальный: <24 мм.Микроскопическое исследование фолликулярных аспиратов проводил эмбриолог. Каждый аспирированный фолликул оценивался на предмет созревания ооцитов, оплодотворения ооцитов и качества эмбриона. Результаты: 428 фолликулов были измерены, в том числе 383 (62,81%) в нормальных и 45 (14,06%) в больших группах фолликулов. Ооциты были получены во время аспирации из 297 (75,5%) и 29 (64,4%) групп нормальных и крупных фолликулов, соответственно ( p = 0,05). Никаких межгрупповых различий не наблюдалось в отношении зрелых ооцитов (MII), оплодотворения и эмбрионов высшего качества (TQE).Тем не менее, как только зигота (2PN) была достигнута, тенденция к более высокому уровню TQE / 2PN была обнаружена в группе крупных фолликулов (16/19 [84,2%] против 115/171 [67,3%]; p = 0,062 ). Заключение: Хотя незначительное снижение скорости восстановления ооцитов было обнаружено в фолликулах размером ≥24 мм, зигота и TQE на фолликул были сопоставимы.
© 2020 S. Karger AG, Базель
Предпосылки
Контролируемая гиперстимуляция яичников (COH) является важным шагом в вспомогательной репродукции, направленной на увеличение числа растущих фолликулов, которые дадут компетентные ооциты.Фолликулы яичников растут с разной скоростью, и мониторинг COH обычно определяется размером фолликулов, а не их компетенцией [1]. Исследования показали, что в фолликулах большего диаметра чаще всего обнаруживаются зрелые ооциты, которые способны к оплодотворению и лучше всего подходят для развития в эмбрионы высокого качества [2-4].
Существуют данные как на моделях человека, так и на животных, об оптимальном размере фолликулов в день извлечения ооцитов, которые с наибольшей вероятностью дадут зрелый ооцит [5].Фолликулы размером 16–22 мм с большей вероятностью дадут зрелые ооциты, чем фолликулы меньшего размера, тогда как более крупные фолликулы с большей вероятностью дадут «постзрелые» ооциты, которые не способны к оплодотворению [6]. Однако в то время как Dubey et al. [7] наблюдали сравнимую скорость оплодотворения в ооцитах из фолликулов размером 16–22 мм и в ооцитах из фолликулов размером 22–26 мм, Ectors et al. [6] наблюдали, что фолликулы размером 16–23 мм в день извлечения ооцитов имели более высокую степень оплодотворения, чем фолликулы> 23 мм. Однако было продемонстрировано, что процент ооцитов с хорошей оценкой увеличился с 55.От 4% фолликулов размером 16–23 мм до 64,6% фолликулов> 23 мм [6].
Недавно мы продемонстрировали в когортном проспективном исследовании [8] оценку связи между размером фолликула (максимальный размерный размер: большой: ≥16 мм, средний: 15–13 мм и маленький: <13 мм) и качеством ооцита / эмбриона. этот показатель зрелых ооцитов (MII) был значительно выше в больших и средних группах по сравнению с группами малых размеров фолликулов. Тем не менее, не наблюдалось межгрупповых различий ни в оплодотворении, ни в процентном соотношении эмбрионов высшего качества (TQE) среди зрелых ооцитов, независимо от диаметра фолликула, из которого они произошли.
На основании вышеупомянутых наблюдений мы хотели оценить связь между большим размером фолликула (≥24 мм) и развитием и качеством ооцитов. С этой целью мы повторно проанализировали данные нашего ранее опубликованного проспективного когортного исследования (Mohr-Sasson et al. [8]).
Материалы и методы
Данные, использованные в этом исследовании, были собраны в когортном проспективном исследовании, о котором сообщалось в другом месте (Mohr-Sasson et al. [8]). В исследование были включены женщины, перенесшие КГ с использованием протокола многократного введения антагонистов ГнРГ в период с июля 2018 г. по май 2019 г. в едином аффилированном университете третичном медицинском центре.Были включены только те, кто моложе 43 лет, без истории болезни эндометриоза или мутации гена ломкой X. Протокол исследования был одобрен нашим IRB (ID 4689-17-SMC) и зарегистрирован Национальными институтами здравоохранения (NCT02821702).
Данные о возрасте пациентов, переменных, связанных с лечением бесплодия, и характеристиках стимуляции яичников были взяты из медицинских карт женщин. Решение об окончательном инициировании созревания фолликулов было основано на заключении врача [9]. Время было основано на когорте ведущих фолликулов, обычно с как минимум 2 ведущими фолликулами размером ≥17 мм для максимального диаметра.Через 36 часов после начала введения была проведена трансвагинальная аспирация фолликулов под контролем сонографии.
При извлечении у каждой женщины перед аспирацией было измерено до 4 ведущих фолликулов. Фолликулы были разделены на 2 фолликулярные группы в соответствии с их максимальным размерным размером: нормальные: <24 мм и большие ≥24 мм. Поиск проводился отдельно для каждого измеренного фолликула. Микроскопическое исследование фолликулярных аспиратов проводилось эмбриологом. В случае отсутствия ооцитов промывка системы выполнялась с использованием 0.5–1 см3 среды с Hepes (Quinn’s Advantage®, Sage, США).
Затем было выполнено стандартное ЭКО или интрацитоплазматическая инъекция сперматозоидов (ИКСИ), если это необходимо. Каждый эмбрион культивировали отдельно до трансвагинальной ЭТ, которую проводили через 48–72 ч после OPU. Все пациенты получали лютеиновую поддержку прогестероном.
Классификация эмбрионов была основана на индивидуальных параметрах оценки эмбрионов, где TQE определялись как эмбрионы на 2 или 3 дня с 3–4 или 7–8 клетками (соответственно) и степенью фрагментации ≤10%.Информация для каждого ооцита, начиная с размера фолликула, отслеживалась в ходе всех лабораторных процедур, включая осеменение, удаление ооцитов для ИКСИ, ИКСИ, оплодотворение и культивирование эмбрионов.
Первичный результат определялся как количество ооцитов, извлеченных из каждой фолликулярной группы (скорость восстановления ооцитов). Вторичные результаты включали в себя ядерное созревание ооцитов (MII), скорость оплодотворения и скорость TQE. Анализ подгрупп, который мы представляем здесь, не был запланирован в исходном протоколе.Отсечение для анализа было выбрано после завершения первоначального испытания [8].
Статистический анализ
Сравнение несвязанных переменных проводилось с помощью теста Стьюдента t и U-критерия Манна-Уитни, в зависимости от ситуации. Для сравнения категориальных переменных использовались критерии χ 2 и точные критерии Фишера. Значимость была принята на уровне p <0,05. Статистический анализ проводился с использованием статистического пакета IBM для социальных наук (IBM SPSS v.19; IBM Corporation Inc., Армонк, Нью-Йорк, США).
Результаты
В течение периода исследования критериям включения соответствовали 199 женщин, у которых было измерено 428 фолликулов, в том числе 383 (89,5%) в нормальных и 45 (10,5%) в больших группах фолликулов. Никаких межгрупповых различий в индексе массы тела пациентов или характеристиках COH не наблюдалось. Ооциты были получены во время аспирации из 297 (77,5%) и 29 (64,4%) групп нормальных и крупных фолликулов, соответственно ( p = 0.051). Никаких межгрупповых различий в уровне оплодотворения и TQE на фолликул не наблюдалось (таблица 1). Тем не менее, как только зигота (2PN) была достигнута, тенденция к более высокому уровню TQE / 2PN была обнаружена в группе крупных фолликулов (16/19 [84,2%] против 115/171 [67,3%]; p = 0,062 ).
Таблица 1.
Эмбриологический исход в зависимости от размера фолликула
Обсуждение
В настоящем анализе, хотя скорость восстановления ооцитов была незначительно снижена в фолликулах ≥24 мм, соотношение 2PN и TQE на фолликул было сопоставимым.Более того, зиготы, полученные из большого фолликула (≥24 мм), давали несущественно более высокую частоту TQE.
Связь между размером фолликулов и созреванием ооцитов была изучена уже три десятилетия назад, и она определяет время срабатывания конечного триггера созревания фолликулов, когда несколько фолликулов достигают диаметра> 17–20 мм [6, 7, 10, 11] . В нашем предыдущем исследовании [8] мы продемонстрировали более высокую скорость восстановления ооцитов в больших (≥16 мм) и средних больших (13–15 мм) группах фолликулов по сравнению с небольшими (<13 мм) группами фолликулов, что согласуется с результатами предыдущих исследований [ 2, 11-13].Более того, ооциты MII чаще обнаруживались в средних и крупных группах фолликулов [8, 11, 14].
В проспективном исследовании, проведенном Triwitayakorn et al. [13], включая 991 фолликул, уровень оплодотворения зрелых ооцитов, а также количество эмбрионов хорошего качества, показали тенденцию к увеличению от группы малых фолликулов к группе больших фолликулов; однако это открытие не было значительным. Dubey et al. [7] сообщили, что частота оплодотворения ооцитов имела положительную линейную корреляцию с увеличением диаметра фолликула, в то время как Nogueira et al.[15] продемонстрировали, что созревшие ооциты, извлеченные из небольших фолликулов, генерируют эмбрионы с более низким потенциалом развития, чем ооциты, полученные из более крупных фолликулов.
В большинстве исследований большие фолликулы относятся к фолликулам диаметром ≥16 мм. Лишь немногие считали, что диаметр больше (≥24 мм). В настоящем анализе мы наблюдали незначительное снижение скорости восстановления ооцитов в фолликулах размером ≥24 мм при сопоставимых соотношениях 2PN и TQE на фолликул. Однако, как только зигота была извлечена из большого фолликула (≥24 мм), наблюдалась незначительно более высокая частота TQE.Согласно нашим наблюдениям, Ectors et al. [6] наблюдали, что фолликулы размером> 23 мм в день извлечения ооцитов имели более высокую скорость созревания по сравнению с фолликулами <23 мм. Более того, процент хорошо оцененных эмбрионов увеличился с 55,4% фолликулов размером 16–23 мм до 64,6% фолликулов> 23 мм (Ectors et al. [6]).
В большинстве центров окончательное созревание фолликулов запускается, когда 2–3 фолликула достигают не менее 17–18 мм в диаметре, фактически за 2 дня до извлечения ооцитов.Иногда несколько фолликулов достигают необходимого размера, в то время как другие остаются маленькими или средними, и обычно «жертвуют» более крупными фолликулами, чтобы дать возможность развиваться меньшей когорте фолликулов. В настоящем исследовании мы продемонстрировали, что, позволяя фолликулам развиваться до большего диаметра (≥24 мм), они не только не приносятся в жертву, но также имеют хорошую вероятность дать MII-ооциты, а после восстановления они превратятся в TQE.
Сильные стороны и ограничения
Исследование имеет несколько ограничений.Женщины, включенные в исследование, лечились от бесплодия по разным причинам. Кроме того, протоколы лечения не были однородными для всей исследуемой популяции; поэтому были включены фолликулы, подвергшиеся воздействию различных гонадотропинов и триггерных режимов. Более того, поскольку мы проанализировали только 383 фолликула в нормальных и 45 в больших группах фолликулов, риск ошибки 2-го типа все еще возможен.
Хотя существуют различные исследования связи между размером фолликулов и скоростью восстановления ооцитов при извлечении, данных, касающихся больших (≥24 мм) фолликулов, недостаточно.Сила этого исследования заключается в том, что оно проводится в едином центре профессиональной последовательной командой в большой исследовательской группе.
Выводы
Таким образом, результаты этого исследования показывают, что, хотя скорость восстановления ооцитов была незначительно снижена в фолликулах размером ≥24 мм, зигота и TQE на фолликул сопоставимы. Более того, зиготы, полученные из большого фолликула (≥24 мм), давали несущественно более высокую частоту TQE. Эта информация должна быть полезна как врачам, так и пациентам.Для подтверждения этого вывода необходимы дальнейшие исследования.
Благодарности
Мы благодарим команду эмбриологической лаборатории Медицинского центра Шиба за сотрудничество.
Заявление об этике
Протокол исследования был одобрен Наблюдательным советом «Медицинского центра Шиба» (ID 4689-17-SMC) 21 декабря 2017 г. и поддержан Национальными институтами здравоохранения (NCT02821702).
Заявление о конфликте интересов
Авторам нечего заявлять.
Источники финансирования
Эта рукопись не финансировалась за счет специального финансирования.
Вклад авторов
R.O. был главным исследователем, разработал исследование, написал статью и отредактировал ее во всех ее исправлениях. A.M.S. участвовал в разработке исследования, извлекал данные, выполнял статистические оценки, вычитывал документ и принимал участие в обсуждениях результатов. С.Б., Р.Н., А.А. извлекли данные, вычитали статью и приняли участие в обсуждениях результатов.J.H. участвовал в разработке исследования, помогал в написании и редактировании статьи, вычитывал ее и принимал участие в обсуждениях результатов.
Доступность данных и материалов
Данные будут предоставлены соответствующим автором по запросу.
Список литературы
- Миллер К.Ф., Гольдберг Дж. М., Фальконе Т.Размер фолликула и имплантация эмбрионов в результате экстракорпорального оплодотворения. Obstet Gynecol. 1996. 88 (4 Pt 1): 583–6.
- Wittmaack FM, Kreger DO, Blasco L, Tureck RW, Mastroianni L, Lessey BA. Влияние размера фолликулов на извлечение ооцитов, оплодотворение, дробление и качество эмбрионов в циклах экстракорпорального оплодотворения: сбор данных за 6 лет.Fertil Steril. 1994. 62 (6): 1205–10.
- Берг С, Броден Х, Лундин К., Хамбергер Л. Сравнение оплодотворения, расщепления и беременности ооцитов из больших и малых фолликулов. Hum Reprod. 1998. 13 (7): 1912–5.
- Rosen MP, Shen S, Dobson AT, Rinaudo PF, McCulloch CE, Cedars MI.Количественная оценка размера фолликула на компетентность в развитии ооцитов. Fertil Steril. 2008. 90 (3): 684–90.
- Revelli A, Martiny G, Delle Piane L, Benedetto C, Rinaudo P, Tur-Kaspa I. Критический обзор двумерных и трехмерных ультразвуковых методов для мониторинга роста фолликулов: помогают ли они улучшить результаты ЭКО? Reprod Biol Endocrinol.2014; 12: 107.
- Ectors FJ, Vanderzwalmen P, Van Hoeck J, Nijs M, Verhaegen G, Delvigne A и др. Взаимосвязь диаметра фолликула человека с оплодотворением и развитием ооцитов после экстракорпорального оплодотворения или интрацитоплазматической инъекции сперматозоидов. Hum Reprod. 1997. 12 (9): 2002–5.
- Дубей А.К., Ван Х.А., Даффи П., Пензиас А.С. Корреляция между измерениями фолликулов, морфологией ооцитов и скоростью оплодотворения в программе экстракорпорального оплодотворения. Fertil Steril. 1995. 64 (4): 787–90.
- Мор-Сассон А., Орвието Р., Блюменфельд С., Аксельрод М., Мор-Хадар Д., Грин Л. и др.Связь между размером фолликула и развитием ооцитов как функция запуска окончательного созревания фолликулов. Репродукция Биомед онлайн. 2020; 40 (6): 887–93.
- Орвието Р. Запуск окончательного созревания фолликулов: ХГЧ, агонист ГнРГ или оба, когда и кому? J Ovarian Res. 2015; 8:60.
- Симонетти С., Вик Л.Л., Джонс Х.В. Корреляция объема фолликулярной жидкости с морфологией ооцитов из фолликулов, стимулированных менопаузальным гонадотропином человека. Fertil Steril. 1985. 44 (2): 177–80.
- Scott RT, Hofmann GE, Muasher SJ, Acosta AA, Kreiner DK, Rosenwaks Z.Корреляция диаметра фолликулов с восстановлением и зрелостью ооцитов во время трансвагинальной аспирации фолликулов. J In vitro Fert Embryo Transf. 1989. 6 (2): 73–5.
- Haines CJ, Emes AL. Взаимосвязь между диаметром фолликула, скоростью оплодотворения и микроскопическим качеством эмбриона.Fertil Steril. 1991. 55 (1): 205–7.
- Triwitayakorn A, Suwajanakorn S, Pruksananonda K, Sereepapong W., Ahnonkitpanit V. Корреляция между диаметром фолликула человека и результатами ооцитов в программе ИКСИ. J Assist Reprod Genet. 2003. 20 (4): 143–147.
- Мехри С., Леви Сетти ЧП, Греко К., Саккас Д., Мартинес Дж., Патрицио П.Корреляция между диаметром фолликулов и промыванием по сравнению с отсутствием промывки со зрелостью ооцитов, скоростью оплодотворения и качеством эмбриона. J Assist Reprod Genet. 2014; 31 (1): 73–7.
- Nogueira D, Friedler S, Schachter M, Raziel A, Ron-El R, Smitz J. Зрелость ооцитов и предимплантационное развитие в зависимости от диаметра фолликулов при лечении агонистами или антагонистами гонадотропин-рилизинг-гормона.Fertil Steril. 2006. 85 (3): 578–83.
Автор Контакты
Jigal Haas
Отделение акушерства и гинекологии, Медицинский центр Sheba
TAU, Derech Sheba 2, Tel-Hashomer
Ramat Gan 52621 (Израиль)
jigalh @ hotmail.com
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 5 июня 2020 г.
Дата принятия: 30 июля 2020 г.
Опубликована онлайн: 23 сентября 2020 г.
Дата выпуска: декабрь 2020 г.
Количество страниц для печати: 4
Количество рисунков: 0
Количество столов: 1
ISSN: 0378-7346 (печатный)
eISSN: 1423-002X (онлайн)
Для дополнительной информации: https: // www.karger.com/GOI
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Преждевременно разорвавшиеся доминантные фолликулы часто сохраняют компетентные ооциты у бесплодных женщин
Это исследование продемонстрировало, что ооциты можно было извлечь из> 40% подтвержденных ультразвуковым исследованием доминантных фолликулов, которые могли быть аспирированы во время естественного или минимально стимулированного ЭКО-ЭКО.Кроме того, мы обнаружили, что эти ооциты были такими же компетентными, как и ооциты, полученные из фолликулов до разрыва. Эти данные подтверждают идею о том, что разрыв фолликула (выделение жидкости) и овуляция (экструзия КОК) являются отдельными процессами в последовательности событий.
Настоящее исследование также подтвердило, что задержка ооцитов может происходить у большого числа пациентов, о чем ранее сообщалось в циклах контролируемой гиперстимуляции яичников 1,2 , и расширило эту возможность до разрыва единственного доминантного фолликула.Скорость восстановления ооцитов в настоящем исследовании (43,4%) ниже, чем ранее сообщавшаяся скорость восстановления (13/22, 60%), что может быть связано с различными методами аспирации (трансвагинальная аспирация под контролем ультразвука по сравнению с прямой аспирацией с лапароскопической визуализацией. ). Наиболее заметным следствием настоящего исследования является то, что задержка ооцитов (потеря экструзии) может происходить даже в спонтанных овуляторных циклах (естественных циклах), которые генерируют единственный доминантный фолликул.
Есть несколько возможных объяснений потери экструзии, которую мы наблюдали в доминантных фолликулах после разрыва.Первое объяснение связано с истинным нарушением овуляторного процесса, при котором ооциты никогда не выходят из фолликула. В этом контексте расширение кумулюсных клеток считается существенным для высвобождения COC из клеточного слоя настенной гранулезы, хотя точный механизм этого высвобождения остается неизвестным 3,4 . После выброса ЛГ клетки кумулюса начинают продуцировать и секретировать внеклеточный матрикс, состоящий из гиалуронана, протеогликанов и протеогликан-связывающих белков, что облегчает отделение клеток от КОК и высвобождение КОК из клеточного слоя настенной гранулезы 5 .Связь между размножением кумулюсных клеток и высвобождением КОК также подтверждается данными, полученными на моделях мышей, поскольку генетические нарушения внеклеточного матрикса снижают частоту овуляции и увеличивают захват ооцитов в лютеинизированных фолликулах, что предполагает, что экспансия кумулюсных клеток и высвобождение КОК неразделимы. -зависимые процессы 3,6,7,8,9,10 . Наши результаты показали, что у значительного числа доминантных фолликулов после разрыва было меньше увеличенных кумулюсных клеток (т. Е.незрелые КОК), несмотря на ускоренное созревание ооцита (т. е. более высокую долю метафазы II). Следовательно, мы предполагаем, что ограниченное расширение кумулюсных клеток в сочетании с ускоренным созреванием ооцитов может способствовать потере экструзии в преждевременно разорванных доминантных фолликулах. Однако это не может быть основным механизмом, поскольку большинство КОК после разрыва состояли из зрелых ооцитов и зрелых кумулюсных клеток. Внутрифолликулярная беременность яичников, при которой концептус располагается глубоко внутри желтого тела, может быть следствием истинного нарушения экструзии ооцитов.В этом сценарии сперматозоид может проникнуть в фолликул через рыльце и оплодотворить ооцит, заключенный в фолликуле, что приведет к имплантации in situ 11,12,13 .
Второе объяснение потери экструзии — задержка овуляторного процесса. В этом контексте экструзия ооцитов может происходить медленнее, чем мы предполагали, или процесс экструзии может возобновиться спустя долгое время после разрыва фолликула. Тем не менее, трансвагинальное ультразвуковое исследование фолликулов, вызванных хорионическим гонадотропином человека, показало, что потеря фолликулярной жидкости — быстрый процесс со средним временем 0.9 мин для потери жидкости фолликулами> 70% и 6,1 мин для полной потери жидкости 14 . Кроме того, лапароскопические наблюдения подтверждают столь же быстрый процесс, поскольку ооциты появляются на поверхности яичника или маточной трубы в течение 2–3 минут после разрыва фолликула 15 . Другие лапароскопические наблюдения показали, что высвобождение фолликулярной жидкости было более сопоставимо со взрывом, чем с медленным истечением 2 , и авторы предположили, что сильный отток фолликулярной жидкости способствовал экструзии свободно плавающего COC 2 .Таким образом, трудно представить, что уменьшенный фолликул после высвобождения фолликулярной жидкости возобновляет процесс экструзии ооцита, который был захвачен кровосодержащими жидкостями 2 . Кроме того, наши наблюдения показали, что ооциты оставались внутри фолликулов после разрыва, несмотря на сжимающее давление трансвагинального ультразвукового датчика и пункцию иглой во время извлечения ооцитов. Это говорит о том, что разорванные фолликулы не подвержены внешнему давлению сжатия во время экструзии ооцитов.Таким образом, основываясь на предыдущих отчетах и на нашем опыте, мы не считаем, что наблюдаемые нами результаты являются всего лишь моментальным снимком текущего процесса экструзии ооцитов.
Третье объяснение потери экструзии — это эффекты экзогенных манипуляций, включая использование лекарств для запуска выброса ЛГ, который модулирует некоторые биохимические последовательности во время овуляторного процесса. Интересно, что потеря экструзии происходила чаще в циклах с более низкими уровнями ЛГ при запуске, чем в циклах с более высокими уровнями ЛГ при запуске (Таблица 3).Это может указывать на то, что несоответствующий преждевременный запуск может увеличить вероятность задержки ооцитов. Тем не менее, отношение шансов, приписываемое уровню ЛГ при срабатывании, было всего 0,99, что позволяет предположить, что время срабатывания триггера лишь незначительно влияло на вероятность удержания ооцитов. Помимо времени, фармакологические действия бусерелина могут увеличить вероятность потери экструзии, хотя мы не можем комментировать эту возможность, поскольку все женщины получали бусерелин в этом исследовании.
В этом исследовании есть несколько ограничений. Во-первых, исследование включало циклы ЭКО-ЭТ, которые были гетерогенными с точки зрения стимуляции яичников. Другим ограничением является возможное смещение отбора, которое могло быть вызвано рассмотрением только фолликулов, которые преждевременно разорвались до запланированного извлечения ооцитов. Более того, наш опыт был ограничен женщинами с бесплодием, которым было показано ЭКО-ЭКО. Следовательно, наши результаты не могут быть воспроизведены во время циклов, в которых разрыв фолликула происходит позже, чем через 33–35 ч после запуска ЛГ, или в циклах фертильных женщин.Более того, коэффициент восстановления ооцитов из фолликула после разрыва (43,4%) может быть завышен, поскольку довольно много случаев были признаны невозможными для пункции иглой, а минимально возможная оценка коэффициента восстановления ооцитов, основанная на наших данных, составляет 23,8% (255 / 1071 от общего числа разорванных фолликулов).
В заключение, это исследование показало, что зрелые ооциты можно регулярно извлекать из фолликулов, которые преждевременно разорвались у бесплодных женщин, что позволяет предположить, что потеря экструзии не является редкостью среди этих женщин.Будущие исследования должны определить, происходит ли потеря экструзии только во время манипуляций с выбросом ЛГ с преждевременным разрывом фолликулов у бесплодных женщин, или же это происходит во время спонтанных овуляторных циклов у нормально фертильных женщин.
Синдром поликистозных яичников: MedlinePlus Genetics
Синдром поликистозных яичников — это заболевание, которое поражает женщин в детородном возрасте и изменяет уровни нескольких гормонов, что приводит к проблемам, влияющим на многие системы организма.
Большинство женщин с синдромом поликистозных яичников вырабатывают избыток мужских половых гормонов (андрогенов), состояние, называемое гиперандрогенизмом.Слишком много этих гормонов обычно приводит к чрезмерному росту волос на теле (гирсутизм), акне и облысению по мужскому типу.
Гиперандрогения и аномальные уровни других половых гормонов препятствуют нормальному высвобождению яйцеклеток из яичников (овуляция) и регулярным менструальным периодам, что приводит к трудностям зачатия ребенка (субфертильность) или полной неспособности зачать ребенка (бесплодие). Для тех, кто забеременел, существует повышенный риск осложнений и прерывания беременности. Из-за нерегулярных и нечастых менструаций и гормональных нарушений у пораженных женщин повышен риск рака слизистой оболочки матки (рака эндометрия).
При синдроме поликистозных яичников один или оба яичника могут содержать несколько небольших незрелых фолликулов яичников, которые на медицинских изображениях могут выглядеть как кисты. Обычно фолликулы яичников содержат яйцеклетки, которые выделяются во время овуляции. При синдроме поликистозных яичников аномальный уровень гормонов препятствует росту и созреванию фолликулов для высвобождения яйцеклеток. Вместо этого незрелые фолликулы накапливаются в яичниках. У пораженных женщин таких фолликулов может быть 12 или более. Количество этих фолликулов обычно уменьшается с возрастом.
Около половины всех женщин с синдромом поликистозных яичников имеют избыточный вес или ожирение и имеют повышенный риск ожирения печени. Кроме того, у многих женщин с синдромом поликистозных яичников повышен уровень инсулина, гормона, который помогает контролировать уровень сахара в крови. К 40 годам около 10 процентов женщин с избыточным весом с синдромом поликистозных яичников развивают аномально высокий уровень сахара в крови (диабет 2 типа), и до 35 процентов заболевают преддиабетом (более высокие, чем обычно, уровни сахара в крови, которые не достигают порогового значения для диабета. ).Ожирение и повышенный уровень инсулина (гиперинсулинемия) дополнительно увеличивают выработку андрогенов при синдроме поликистозных яичников.
Женщины с синдромом поликистозных яичников также подвержены повышенному риску развития метаболического синдрома, который представляет собой группу состояний, включающих высокое кровяное давление (гипертония), повышенный жир на животе, высокий уровень нездоровых жиров и низкий уровень здоровых жиров в крови. и высокий уровень сахара в крови. Около 20 процентов взрослых людей испытывают остановки дыхания во время сна (апноэ во сне).Женщины с синдромом поликистозных яичников чаще, чем женщины в целом, страдают расстройствами настроения, такими как депрессия.
Обзор физиологии применения летрозола при бесплодии: оптимальны ли существующие протоколы?
Летрозол все чаще используется в терапии бесплодия. Летрозол блокирует превращение андрогенов C-19 в эстрогены C-18 путем конкурентного ингибирования фермента ароматазы (цитохрома P-450 19), что является важным этапом биосинтеза эстрогена в яичниках и других тканях.Использование летрозола приводит к увеличению андрогенов и снижению эстрогенов в тканях по всему телу [1, 2]. Летрозол оказался ценным лекарством при лечении рака молочной железы, положительного по рецепторам эстрогена, который составляет около двух третей всех случаев рака молочной железы [3, 4].
В этом мини-обзоре мы исследуем четыре применения летрозола для лечения бесплодия, которые появились в медицинской литературе. Основное внимание в этом обзоре уделяется тому, как эти методы лечения используют фармакологические свойства и физиологические последствия летрозола для яичников.Первоначальное применение летрозола при бесплодии имитирует длительное использование цитрата кломифена в терапии бесплодия. Цитрат кломифена использовался для увеличения секреции ФСГ из гипофиза путем блокирования отрицательной петли обратной связи по эстрадиолу путем связывания с рецепторами эстрадиола в гипоталамусе. Современные применения летрозола при бесплодии используют ту же петлю отрицательной обратной связи для увеличения секреции ФСГ, но делают это за счет снижения выработки эстрадиола яичниками и другими тканями.
Применение летрозола при бесплодии сильно отличается от основного медицинского применения летрозола для лечения рака груди.Ингибиторы ароматазы используются у женщин в постменопаузе с раком груди, у которых (относительно) большая продолжительность запланированного лечения. Воздействие летрозола на фоне быстрых эндокринных сдвигов требует более тонкой оценки его воздействия. Летрозол влияет на развитие фолликулов, рост фолликулов и атрезию фолликулов. Эти эффекты на данный фолликул яичника сложны, потому что они различаются в зависимости от того, где этот фолликул находится на траектории своего роста, и от того, какие другие лекарства используются одновременно.Теоретически использование летрозола исключительно для усиления секреции ФСГ означает использование только части его воздействия на яичники. В настоящее время имеется мало информации о том, является ли клинически полезным пытаться включить не-ФСГ воздействия летрозола на яичники в терапию бесплодия.
Целью данной статьи является первый обзор клинически важных фармакологических аспектов летрозола. Затем мы рассмотрим физиологию фолликулов и эндокринную активность, поскольку фолликул превращается из преантрального фолликула в преовуляторный.Далее мы рассмотрим некоторые воздействия эндокринологических изменений, вызванных андрогенами, на апоптоз гранулезных клеток и атрезию антрального фолликула. Наконец, мы рассмотрим четыре выбранных применения летрозола (см. Таблицу 1) из литературы по бесплодию, чтобы увидеть, как в этих приложениях используется летрозол или как они могут более полно использовать влияние летрозола на физиологию яичников.
Таблица 1 Четыре выбранных применения летрозолаФармакология летрозола
Ингибиторы ароматазы первого поколения доступны с 1970-х годов, но, хотя они блокируют биосинтез эстрогена, они также ингибируют биосинтез кортизола, альдостерона и гормона щитовидной железы [ 14].Дополнительной проблемой была токсичность для печени. Ингибиторы ароматазы второго поколения были более безопасными и более эффективными, но все же не были достаточно селективными в отношении ингибирования выработки эстрогена. Ингибиторы ароматазы третьего поколения стали доступны в 1990-х годах. Они были созданы с использованием новых методов молекулярного моделирования, предназначенных для лучшего связывания с активным центром ароматазы. Летрозол был одной из созданных молекул, которые достигли цели высокой эффективности и селективности. Летрозол и анастрозол являются клинически доступными нестероидными препаратами (т.е., тип II) ингибиторы ароматазы третьего поколения.
Летрозол имеет биодоступность 99,9% после перорального приема. Конечный период полувыведения однократной дозы составляет 42 часа, но стационарная концентрация не достигается в течение 2-6 недель (период полувыведения в стационарном состоянии составляет 118 часов) [1, 15]. Считается, что это связано с тем, что летрозол метаболизируется в неактивные метаболиты двумя ферментами цитохрома P-450: 3A4 и 2A6. Цитохром P-450 2A6 имеет гораздо более высокое сродство (и является более эффективным метаболизатором) к летрозолу, чем 3A4, но становится насыщенным при дозе летрозола около 2.5 мг [1, 15].
Подавление эстрогена летрозолом изучалось во многих условиях in vitro, например, в ткани плаценты человека, ткани яичника хомяка, различных линиях раковых клеток, ткани груди человека, жировых фибробластах человека, клетках грызунов и ткани рака молочной железы в виде частиц [1 ]. В этих условиях летрозол очень эффективно подавляет выработку эстрогена. Следовательно, летрозол является эффективным препаратом для лечения рака груди у женщин в постменопаузе [4, 15]. Летрозол не был разработан для краткосрочного применения у женщин в пременопаузе, и существует относительно ограниченное количество прямых исследований того, как он влияет на фолликул яичника на протяжении его развития.
Ароматаза является членом суперсемейства цитохромов P450, которое насчитывает более 480 членов. Ароматаза содержится в тканях по всему телу, и ее экспрессия регулируется тканеспецифическими промоторами и активаторами. В яичниках цАМФ и гонадотропины регулируют экспрессию ароматазы [16]. Существенная экспрессия ароматазы не происходит в гранулезных клетках фолликулов до тех пор, пока они не станут примерно 9 мм в диаметре, и начинает заметно ускоряться в 10-миллиметровых фолликулах [17,18,19]. Однако везде, где встречается ароматаза, она очень специфична для связывания андрогенов и, по замыслу, летрозола.Если тестостерон стыкуется с молекулой ароматазы в ткани яичников, он быстро превращается в эстрадиол, который имеет к нему лишь слабое сродство, и молекула эстрадиола быстро высвобождается в цитоплазму. Тогда сайт связывания ароматазы свободен для конкурентной стыковки с молекулой андрогена или летрозола. Летрозол циркулирует, на 55% связанный с белком, и влияние его фармакологии заключается в том, что активность ароматазы снижается более чем на 99% (в дозе 2,5 мг) [1, 15, 16]. У женщин в пременопаузе, лечившихся от бесплодия летрозолом, эстрадиол все еще может вырабатываться во время фолликулярной фазы менструального цикла либо из-за уменьшения доступности летрозола из-за периода полувыведения летрозола, режима лечения, либо из-за повышенной ароматазы. экспрессия в первую очередь из-за увеличения доступности ФСГ и рецепторов ФСГ.
Летрозол напрямую не увеличивает выработку андрогенов. У женщин в пременопаузе уровни андрогенов в яичниках повышены, в первую очередь потому, что для биосинтеза эстрогенов используется меньше субстрата андрогенов. Производство андрогенов яичниками происходит в теках (и интерстициальных) клетках в ответ на ЛГ и в большом фолликуле увеличивается за счет IGF-1. Однако в раннем фолликуле фактор дифференцировки роста 9 (GFD9), происходящий из ооцитов, важен для дифференцировки клеток теки и продукции андрогенов [20, 21].Фолликулы с плохим развитием клеток теки не развиваются.
Развитие фолликулов
Развитие фолликулов у женщин — сложное событие, которое сложно понять на молекулярном уровне. Чтобы понять, как летрозол влияет на физиологию яичников, текущая номенклатура не полностью отражает изменение молекулярной эндокринной среды фолликула. Наиболее широко используемая номенклатура, описывающая рост фолликулов, делит фолликулы на примордиальные, первичные, вторичные, преантральные, антральные (или третичные) и преовуляторные стадии на основе однозначно определенных морфологических характеристик (рис.1). Эта характеристика не является оптимальной для применения физиологии яичников к лечению бесплодия, поскольку большинство используемых манипуляций с циклом происходит на поздних стадиях преантрального и антрального фолликулов. Характеризуя рост фолликулов у людей, Гужон определяет восемь стадий развития на основе количества гранулезных клеток в фолликулах, которое также коррелирует с диаметром фолликула (рис. 2) [22]. Характеристика Гужона более полезна для понимания вмешательств при бесплодии у людей, поскольку диаметры человеческих фолликулов легко получить, но они напрямую не способствуют конкретному применению исследований, проведенных на других видах (которые имеют другой диаметр фолликулов и количество гранулезных клеток), на людях; передача информации потребует более физиологической характеристики роста фолликулов.Пример такого типа наблюдения, ограниченного значением ФСГ для роста фолликулов, приведен Orisaka et al. [23] (рис. 3). Рецепторы ФСГ обнаруживаются на клетках гранулезы в раннем преантральном фолликуле [17, 23] и, таким образом, могут реагировать на ФСГ за несколько месяцев до овуляции. Однако время, когда фолликул переходит от ФСГ-зависимости к ФСГ-зависимой, имеет клиническое значение и встречается у всех млекопитающих. У человека это происходит, когда диаметр фолликулов составляет от 4 до 6 мм (класс Gougeon от 5 до 6).Как будет показано ниже, примерно в это же время также происходит переход от пика андрогенной зависимости [18, 24].
Рис. 1Гистологические срезы, показывающие различные стадии развития фолликула. a Первородный фолликул; b , c Первичные фолликулы; d Преантральный фолликул; e Антральный фолликул; f Преовуляторный фолликул. Nu — ядро ооцита; О, ооцит; GC — клетки гранулезы; ZP, zona pellucida; А, антральный отдел; TC, клетки теки.Из Селестино и др. Механизмы атрезии фолликулов яичников. Anim Reprod 2009; 6 (4): 495–508
Рис. 2Классификация фолликулов яичника человека по Гужену. От Gougeon. Регуляция развития фолликулов яичников у приматов: факты и гипотезы Endocrine Rev . 1996; 17 (2): 121–155
Рис. 3Развитие фолликулов, подчеркивающее независимость, отзывчивость или зависимость от ФСГ. По материалам Orisaka et al. Взаимодействия ооцитов, гранулезы и теки во время преантрального развития фолликулов. J Ovarian Res 2009; 2: 9
Благоприятные эффекты андрогенов на маленькие фолликулы
Исследования неизменно показывают, что андрогены играют важную положительную роль в преантральном и раннем антральном развитии фолликулов [12, 25, 26, 27, 28, 29]. В этих условиях они способствуют митозу клеток гранулезы [24, 25, 30], увеличивают экспрессию рецептора ФСГ и рецепторного белка ФСГ [21, 26, 30, 31] и предотвращают апоптоз клеток гранулезы [31]. Хотя андрогены являются критическими гормонами на стадии развития фолликула от преантрального до раннего антрального, они не действуют в одиночку, способствуя росту и развитию фолликула.Например, действуя вместе с ФСГ и модулируя IGF-1 и GDF9 (положительно) и AMH и BMP15 (отрицательно), андрогены способствуют пролиферации клеток гранулезы [24] (рис. 4).
Рис. 4Пути действия андрогенов на преантральный рост фолликулов. Тестостерон или дигидротестостерон (ДГТ) действуют через рецепторы андрогенов, увеличивая пролиферацию гранулезных клеток (ГК). Это может быть прямо или косвенно опосредовано повышением рецепторов ФСГ (стимуляция митоза ГК) или снижением АМГ (снижение ингибирования АМГ).АМГ дополнительно снижается за счет андроген-индуцированного снижения ВМР15, который обычно стимулирует уровни АМГ. По материалам Laird et al. Андроген стимулирует рост преантральных фолликулов мыши in vitro: взаимодействие с фолликулостимулирующим гормоном и факторами роста суперсемейства TGFbeta. Endocrinol 2007; 158: 920–935
Пиковое количество рецепторов андрогенов обнаруживается в гранулезных клетках антральных фолликулов человека диаметром от 3 до 6 мм [18, 19, 24]. Рецепторов андрогенов становится меньше в клетках гранулезы более крупных антральных фолликулов и значительно уменьшается в клетках гранулезы ранних преовуляторных фолликулов [18, 19, 24].Антральные отделы малых антральных фолликулов человека менее 7 мм в диаметре преимущественно андрогенны [18, 32]. В течение этого периода повышенной чувствительности к действию андрогенов через их рецептор антральный фолликул человека увеличил свою клеточную массу гранулезы с нескольких тысяч клеток до примерно десяти миллионов клеток [22, 33]. Фолликулы, которые продолжают расти и дифференцироваться, чтобы стать преовуляторными, должны будут продолжать митоз в этом темпе, чтобы примерно через 1 неделю создать массу гранулезных клеток примерно в 50 миллионов клеток.Классическая передача сигналов стероидного андрогенного гормона с активацией рецептора в цитоплазме, перенос активированного рецептора в ядро и связывание активированного рецептора с промотором гена происходит реже после того, как фолликул вырастает из этой небольшой стадии антрального фолликула, и почти не происходит. существует на последних стадиях роста фолликула. Механизм митоза гранулезных клеток и роста фолликулов должен измениться от системы, в основном управляемой андрогенами.
Действие ФСГ и эстрогена на клетки гранулезы становится важным для продления роста фолликулов за пределы ранней точки перехода антрального фолликула [27, 34, 35].Тем не менее, экспрессия рецептора ФСГ заметно снижается на гранулезную клетку в человеческих фолликулах диаметром 5-6 мм и продолжает снижаться по мере увеличения диаметра фолликула [18, 19]. Фактически, Джеппесен обнаружил 250-кратное снижение экспрессии рецептора ФСГ на клетку гранулезы от малых антральных до преовуляторных фолликулов перед овуляцией [19]. Чтобы доминантный (или спасенный) фолликул мог поддерживать здоровую популяцию рецепторов ФСГ, чтобы адекватно реагировать на ФСГ с выработкой эстрогена, он должен увеличить количество своих гранулезных клеток.ФСГ индуцирует экспрессию ароматазы в клетках гранулезы, и эта экспрессия начинает заметно увеличиваться в человеческом фолликуле размером 11-13 мм с сопутствующим повышением эстрадиола и продолжает увеличиваться по мере увеличения диаметра фолликула до предовуляторного размера фолликула [19]. Больше клеток гранулезы в фолликуле приводит к большему количеству рецепторов ФСГ на фолликул с увеличением производства эстрогена, что приводит к большему количеству митозов [27, 33]. Эстроген также важен для экспрессии рецептора ЛГ в клетке гранулезы, который начинает экспрессироваться только на клетках гранулезы в антральном фолликуле более 10 мм в диаметре и необходим для возможной овуляции [24].
Большинство атретических фолликулов человека имеют диаметр в диапазоне от 1 до 10 мм (классы 5, 6 и 7 по Gougeon), причем большая часть атрезии возникает в более мелких антральных фолликулах [35]. Gougeon обнаружил, что время удвоения митоза клеток гранулезы уменьшилось на 50% (с 10 до 5 дней) в фолликуле человека диаметром 5 мм по сравнению с делением клеток гранулезы в фолликулах несколько меньшего размера [22]. McNatty et al. обнаружили, что здоровые антральные фолликулы содержат более чем в два раза больше гранулезных клеток, чем атретические фолликулы того же размера, и что количество гранулезных клеток коррелирует с уровнем эстрадиола в антральной жидкости [33].Это говорит о том, что фолликулы размером 6–12 мм находятся на одной из чувствительных стадий своей судьбы, возможно, из-за этой повышенной потребности в ускоренном митозе. По мере того, как рецептор-опосредованная польза андрогенов уменьшается, фолликул должен иметь возможность использовать опосредованную рецептором ФСГ пользу для продолжения роста. Для этого необходимы здоровые фолликулы, чтобы ускорить митоз клеток гранулезы, который по мере увеличения фолликула в первую очередь является следствием ФСГ [16, 35, 36].
Активность ФСГ необходима для развития фолликулов, чтобы они содержали оплодотворяемые ооциты.Продукция эстрогена необходима клеткам гранулезы для выработки рецепторов ЛГ, в конечном итоге обеспечивающих спонтанную овуляцию [37]. ФСГ действует через свой G-сопряженный рецептор клеточной поверхности на клетках гранулезы, чтобы активировать протеинкиназу A (через цАМФ) и, следовательно, путь, который приводит к фосфорилированию и активации протеинкиназы B (Akt) [34, 38]. Путь Akt является необходимым (но недостаточным) активатором многих генов-мишеней ФСГ, включая рецептор ЛГ и ароматазу. Путь Akt работает путем фосфорилирования многих белков (было идентифицировано не менее пятидесяти), что приводит либо к стимуляции, либо к ингибированию различных процессов [39].Некоторые из этих путей также требуют активации других путей для достижения определенного действия. В частности, Akt фосфорилирует членов семейства forkhead box O (FOXO), чтобы стимулировать митоз и ингибировать апоптоз (путем ингибирования экспрессии проапоптотического белка) [39,40,41].
Хотя андрогены необходимы для преантрального и раннего антрального развития фолликулов, ранняя фолликулярная единица работает, чтобы сдерживать выработку андрогенов из клеток теки с факторами как из клеток гранулезы, так и из ооцита [27].Избыток андрогенов, вторичный по отношению к лечению летрозолом, будет ограничиваться количеством эстрогена, которое пытается произвести фолликулярная единица (в зависимости от количества андрогена, производимого тека-клетками). Клинически остается открытым вопрос, насколько эффективным может быть летрозол в повышении уровня внутрифолликулярных андрогенов в этих ранних фолликулах и может ли это повышение эффективно использоваться фолликулом.
Апоптоз гранулезных клеток и атрезия антрального фолликула
Апоптоз — это клеточное событие, тогда как атрезия — это фолликулярное событие.Клеточный апоптоз характеризуется потерей клеточного объема (конденсация цитоплазмы), ядерным пикнозом (в результате маргинализации хроматина и перераспределения по ядерной мембране) и цитоплазматического пузыря (образование связанных с мембраной пузырьков, содержащих интактные цитоплазматические органеллы). Эти везикулы или апоптотические тела фагоцитируются соседними клетками, так что гибель клеток и выведение клетки из фолликула происходят без воспалительного ответа. Отличительным признаком апоптоза является опосредованное эндонуклеазой расщепление ДНК клетки на фрагменты, кратные 185 парам оснований [42,43,44].
Морфологические и гистологические данные антрального фолликула в процессе атрезии включают увеличение количества пикнотических ядер (апоптотических телец), разбросанных по гранулезной мембране, отслоение клеток гранулезы от базальной пластинки, которая складывается сама по себе как фолликул сморщивается. Проникновение макрофагами базальной пластинки (без деградации) в антральный отдел фолликулов, клеточная гипертрофия внутренней теки, появление клеточного мусора в антральном отделе, разрушение ооцит-кумульных клеточных связей и, в конечном итоге, мейозоподобные морфологические изменения ооцит с последующей фрагментацией ооцита [45, 46].Обратите внимание, что преантральные фолликулы используют другой путь к атрезии и имеют другую гистологию [47, 48].
Антральная стадия фолликулярной атрезии начинается с апоптоза гранулезных клеток [49]. Здоровые фолликулы могут содержать некоторые апоптотические гранулезные клетки, а апоптотические гранулезные клетки в больших антральных фолликулах не ухудшают и не предсказывают качество ооцитов [44, 50, 51]. Однако, когда количество или доля апоптотических гранулезных клеток превышает определенный порог, фолликулы становятся необратимо атретичными.Клинически существуют различные степени атрезии фолликулов, и на ранних стадиях процесс атретизации может быть приостановлен, чаще всего путем предотвращения дальнейшего апоптоза гранулезных клеток с помощью спасения ФСГ.
Апоптоз гранулезных клеток — это непатологический процесс, который сложно регулируется. Существует два основных пути апоптоза гранулезных клеток: поверхностный путь и митохондриальный путь. Запуск любого из этих путей включает экспрессию одного или нескольких факторов, вызывающих «смерть», которые не сбалансированы должным образом рядом факторов «выживания» или антиапоптотических факторов.Рисунки 5 и 6 иллюстрируют эти типы взаимодействий, происходящие в клетке гранулезы, участвующие в поддержании здорового фолликула или в создании атретического фолликула [42, 43, 52]. Как экспериментально, так и клинически экзогенный ФСГ является высокоэффективным фактором выживания для клеток гранулезы и в поздних антральных и преовуляторных фолликулах позволяет фолликулам избегать атрезии.
Рис. 5Схематическая модель здоровых растущих клеток гранулезы. ФСГ, секретируемый гипофизом, необходим для выживания гранулезных клеток.IGF-1, эстрадиол, IL-6 и IL-6sR экспрессируются из клеток гранулезы, действуя как факторы выживания клеток гранулезы паракринным / аутокринным образом. IGF-1 и FSH активируют внутриклеточный путь PI3K / AKT и фосфорилируют факторы транскрипции FOXO, которые удерживают FOXO в цитоплазме. Эстрадиол подавляет транскрипцию проапоптотических генов p53, и Bax. Рецепторы лиганда смерти (FASLG-FAS и TRAIL-DcR1) экспрессируются на клеточных мембранах. Внутриклеточная молекула cFLIP ингибирует сигнал смерти FASLG-FAS.Сигнал TRAIL подавляется его рецептором-ловушкой, DcR1. BCL2 подавляет апоптоз, опосредованный митохондриями. Из Matsuda et al. Рост фолликулов и атрезия в яичниках млекопитающих: регулирование выживанием и гибелью клеток гранулезы. J Reprod Dev 2012; 58 (1): 44–50
Рис. 6Схематическая модель клеток гранулезы, подвергающихся апоптозу. Сигналы выживания клеток, такие как ФСГ, ИФР, эстрадиол и ИЛ-6, снижаются. В результате FOXO дефосфорилируется и переносится в ядро, где он трансактивирует проапоптотические факторы, FASLG и BCL2L11.Рецепторы лиганда смерти (FASLG-FAS и TRAIL-DR4), экспрессируемые на клеточной мембране, увеличиваются. Последующая активация внутриклеточной передачи сигналов (FADD, CASP8 и CASP3) вызывает фрагментацию ДНК. CASP8 также стимулирует митохондриальный апоптотический путь, индуцируя BID, BAX, высвобождение Cyt c, APAF1 и CASP9. Из Matsuda et al. Рост фолликулов и атрезия в яичниках млекопитающих: регулирование выживанием и гибелью клеток гранулезы. J Reprod Dev 2012 ; 58 (1): 44–50
Подведем итог: андрогены являются основным антиапоптотическим фактором в преантральных и ранних антральных фолликулах.Андрогены опосредованно обладают антиапоптотическим действием, увеличивая количество рецепторов ФСГ и стимулируя митоз. Кроме того, андрогены напрямую ингибируют апоптоз в клетках гранулезы за счет продукции микроРНК-125b, которая подавляет продукцию проапоптотического белка [31]. ФСГ является основным антиапоптотическим фактором в более крупных фолликулах.
Вредное действие андрогенов на клетки гранулезы
Высокий уровень андрогенов или воздействие андрогенов во время позднего развития фолликулов может способствовать атрезии фолликулов [53,54,55].Уже давно установлено, что большие атретические фолликулы содержат высокое соотношение андрогенов и эстрогенов [33]. У транссексуалов от женщин к мужчинам количество атретических фолликулов в яичниках увеличивается в 3,5 раза [56]. Имеющиеся данные свидетельствуют о том, что уровни андрогенов не повышаются в атретических фолликулах во время спонтанного менструального цикла; скорее, уровни эстрогена заметно снижаются в атретическом фолликуле, что приводит к высокому соотношению андрогенов к эстрогенам [33].
Chen et al. использовали модель крыс для изучения воздействия дигидротестостерона (ДГТ), андрогена, который не может быть преобразован в эстроген, на большие антральные / преовуляторные фолликулы [57].Они попытались смоделировать уровни андрогенов, соответствующие уровням у женщин с синдромом поликистозных яичников (СПКЯ). В одном непродолжительном эксперименте они культивировали клетки гранулезы молодых крыс. Обработка ФСГ значительно усиливала пролиферацию клеток, но ДГТ подавляла это усиление пролиферации за счет накопления клеток гранулезы, остановленных в фазе G2 / M клеточного цикла. Было обнаружено, что DHT ингибирует индуцированное ФСГ фосфорилирование Akt. Фосфорилированный Akt играет важную роль в выживании и пролиферации гранулезных клеток [40].Обработка DHT также способствует экспрессии PTEN (гомолог фосфатазы и тензина, удаленный на хромосоме 10), который участвует в остановке клеточного цикла [58]. PPARɣ, один из транскрипционных факторов, повышающих экспрессию PTEN [59], также усиливался обработкой DHT. Повышенная экспрессия мРНК PTEN после обработки DHT значительно подавлялась за счет подавления РНК (siRNA) PPARɣ. Поскольку большие фолликулы содержат мало рецепторов андрогенов или не содержат их, это воздействие андрогенов должно использовать негеномный (не андрогенный рецептор) путь [57].
Chen et al. также изучили долгосрочные эффекты лечения андрогенами ДГТ in vivo на больших фолликулах крыс [57]. Опять же, DHT вызывает уменьшение клеточной пролиферации в крупных фолликулах, подавление фосфорилированного Akt и усиление PTEN и PPARɣ. Таким образом, они обнаружили одинаковое влияние уменьшения пролиферации клеток гранулезы по одному и тому же механизму как в краткосрочной культуре клеток гранулезы с DHT, так и в долгосрочной терапии DHT интактных животных на больших антральных фолликулах.
Однако клетки гранулезы из фолликулов от интактных животных также оценивали на предмет апоптоза, и не было обнаружено различий в частоте апоптоза с помощью окрашивания TUNEL (метка конца никеля дезокси-UTP) в фолликулах животных, получавших DHT, и необработанных.Тем не менее, у этих длительно леченных DHT животных было значительно меньше зрелых и овулированных фолликулов. У обработанных животных также были более длинные и меньшие эстральные циклы, чем у контрольных животных. Неясно, почему именно в этих крупных фолликулах с замедленным развитием апоптоз не обнаружен. Окрашивание TUNEL не позволяет обнаружить весь апоптоз в клетках гранулезы [60]. Однако, поскольку овулировавших фолликулов было меньше, этот эксперимент предполагает, что фолликулы были потеряны из овуляторного пула. Vendola et al. лечили макак-резусов ДГТ или тестостероном и обнаружили, что количество мелких фолликулов увеличилось в три раза, но большие антральные фолликулы были аналогичны контрольной группе, не получавшей лечения [25].Медленно растущие фолликулы могут оставаться жизнеспособными и не овуляторными, становясь кистами [61]. Фолликулы в моделях ПКЯ на животных, длительное время подвергавшихся лечению андрогенами, которые не завершают овуляцию, часто становятся кистозными и в конечном итоге умирают по другому пути, кроме апоптоза [61]. Noorafshan et al. изучили влияние лечения летрозолом (21 день) на крыс и обнаружили, что количество клеток гранулезы уменьшилось на 56%, а объем кист яичников увеличился в пять раз по сравнению с контрольной группой [62]. Paixão et al.рассмотрели модели животных различных видов, используя разные андрогены при краткосрочном и долгосрочном воздействии андрогенов, а также при воздействии андрогенов в разные периоды развития животных [63]. Большинство исследований этих моделей обнаружили увеличение как атретических, так и кистозных фолликулов, но в некоторых моделях преобладали атретические или кистозные фолликулы. У людей с тяжелым СПКЯ естественные повышенные андрогены редко образуют фолликулы размером более 10 мм, при этом большинство фолликулов задерживаются ниже 7 мм, но выживают в течение нескольких месяцев [64].



 При такой патологии фолликул может существовать на протяжении всего цикла, а также после менструации;
При такой патологии фолликул может существовать на протяжении всего цикла, а также после менструации;