Ингибиторы МАО — список лекарств, торговые названия, ингибиторы моноаминоксидазы
Ингибиторы МАО – один из распространенных классов антидепрессантов. В настоящее время этот тип препаратов используется реже, чем раньше, однако полностью еще не утратил своего значения. В аптеках продается большое количество ингибиторов МАО. Разумеется, подобные препараты отпускаются только по рецепту врача. Однако многим пациентам было бы полезно знать, какие разновидности данных препаратов существуют.
Что такое ингибиторы МАО?
Ингибиторы МАО (ИМАО) – один из самых старых типов препаратов-антидепрессантов. Механизм их действия основан на блокаде моноаминоксидазы – белкового фермента, который разрушает моноамины. Каким же образом это обстоятельство может быть связано с лечение депрессий? Все очень просто – ведь к моноаминам относятся многие вещества, которые принято называть нейромедиаторами – серотонин, дофамин, норадреналин. Именно их недостаток в организме (точнее, в нервных цепях) и вызывает угнетенное настроение, состояние депрессии. ИМАО уничтожают моноаминоксидазу или же временно блокируют ее действие, в результате чего уровень нейромедиаторов в нейронных цепях повышается. Мозг начинает работать более эффективно, а это влияет и на настроение человека – он избавляется от депрессии, уныния и апатии.
Эффект от ингибиторов МАО проявляется при снижении активности фермента примерно в 2 раза.
Разновидности
Препараты данного класса делятся на три группы:
- необратимые неизбирательные,
- необратимые избирательные,
- обратимые избирательные.
Необратимые антидепрессанты уничтожают молекулу моноаминоксидазы. Обратимые лишь связываются с ней, лишая активности, на несколько часов.
Существует 2 разновидности фермента – А и В. Дезаминированием нейромедиаторов занимается в основном лишь первая разновидность. По этому принципу препараты делятся на два типа. Первый тип, неизбирательные ингибиторы моноаминоксидазы, активен сразу по отношению к обоим типам фермента. Избирательные ингибиторы воздействуют в основном на первый тип, однако есть и ингибиторы, активные только против второго типа.
К неселективным необратимым средствам относятся:
- ипрониазид,
- изониазид,
- ниаламид,
- изокарбоксазид,
- фенелзин.
Обратимые ингибиторы:
- моклобемид (торговое название Аурорикс),
- пирлиндол (торговое название Пиразидол),
- бефол,
- метралиндол,
- гармалин.
Обратимые ингибиторы несколько уступают по силе действия необратимым, однако отличаются большей безопасностью использования и наличием меньшего количества побочных эффектов.
Из необратимых селективных ингибиторов наиболее известны селегилин и разагилин.
Показания
Антидепрессанты данного класса не относятся к числу препаратов первой линии. Однако их до сих пор широко применяют при лечении депрессий, особенно в тех случаях, когда болезнь оказывается резистентной к применению других средств (ТЦА и СИОЗС).
Ингибиторы МАО назначаются при:
- депрессиях различного генеза,
- болезнях Паркинсона и Альцгеймера,
- алкоголизме,
- ВСД,
Ингибирование ферментов — Википедия
Рис. 1: Общая схема ингибирования ферментаФерментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов.
Конкурентное ингибирование[править | править код]
 Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … [I]=0, 2 … [I]>0, 3 … [I]>[I]2)
Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 … [I]=0, 2 … [I]>0, 3 … [I]>[I]2) 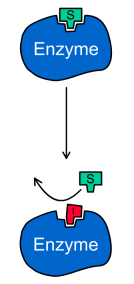
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki‘ >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} | v0=Vmax[S][S]+Km(1+[I]Ki){\displaystyle v_{0}={\frac {V_{max}[S]}{[S]+K_{m}(1+{\frac {[I]}{K_{i}}})}}} |
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/v0 от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование[править | править код]
![v_{0}={\frac {V_{{max}}[S]}{[S]+K_{m}(1+{\frac {[I]}{K_{i}}})}}](/800/600/https/upload.wikimedia.org/wikipedia/ru/thumb/d/d4/Nicht-kompetitive_Hemmung_doppeltreziprok.jpg/300px-Nicht-kompetitive_Hemmung_doppeltreziprok.jpg) Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … [I]=0, 2 … [I]>0, 3 … [I]>[I]2)
Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 … [I]=0, 2 … [I]>0, 3 … [I]>[I]2)Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} | v0=Vmax(1+[I]Ki)[S][S]+Km{\displaystyle v_{0}={\frac {{\frac {V_{max}}{(1+{\frac {[I]}{K_{i}}})}}[S]}{[S]+K_{m}}}} |
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование[править | править код]
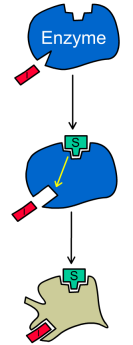
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} | v0=Vmax(1+[I]KI)[S][S]+Km(1+[I]KI){\displaystyle v_{0}={\frac {{\frac {V_{max}}{(1+{\frac {[I]}{K_{I}}})}}[S]}{[S]+{\frac {K_{m}}{(1+{\frac {[I]}{K_{I}}})}}}}} |
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом[править | править код]
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
E+S⟶ES⟶E+P{\displaystyle E+S\longrightarrow ES\longrightarrow E+P} | v0=Vmax[S][S]+Km+[S]2KI{\displaystyle v_{0}={\frac {V_{max}[S]}{[S]+K_{m}+{\frac {[S]^{2}}{K_{I}}}}}} |
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
![v_{0}={\frac {V_{{max}}[S]}{[S]+K_{m}+{\frac {[S]^{2}}{K_{I}}}}}](/800/600/https/upload.wikimedia.org/wikipedia/ru/thumb/c/c7/Quin_active_site_copy.jpg/300px-Quin_active_site_copy.jpg) Рис. 4: Структура активного центра трипантионредуктазы с двумя молекулами ингибиторов, один из которых связан необратимо, а другой обратимо. Фермент показан синим цветом. Изображение создано на основе PDB 1GXF.
Рис. 4: Структура активного центра трипантионредуктазы с двумя молекулами ингибиторов, один из которых связан необратимо, а другой обратимо. Фермент показан синим цветом. Изображение создано на основе PDB 1GXF.Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Ингибиторы протеасомы — Википедия
Материал из Википедии — свободной энциклопедии
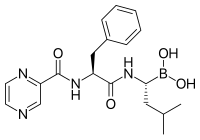 Структурная формула бортезомиба, первого ингибитора протеасомы, зарегистрированного как лекарство.
Структурная формула бортезомиба, первого ингибитора протеасомы, зарегистрированного как лекарство.Ингибиторы протеасом — лекарственные средства, блокирующие работу протеасом — клеточных комплексов, которые разрушают белки, например белок p53. Ингибиторы протеасом исследуются для терапии рака, в первую очередь множественной миеломы.
- Первым открытым непептидным ингибитором протеасом был лактацистин (lactacystin).[1]
- В 2003, бортезомиб стал первым ингибитором протеасом, разрешенным к применению в США.
- Другим веществом, предположительно ингибирующим протеасомы, был назван дисульфирам (Disulfiram).[2][3][4]
- Еще одним таким веществом был назван эпигаллокатехин-3-галлат (epigallocatechin-3-gallate).[5]
- Были начаты клинические исследования салиноспроамид А (Salinosporamide A) для множественной миеломы.
- Карфилзомиб (carfilzomib) был разрешен FDA для рецидивирующих множественных миелом 20 июля 2012.
- Эпоксомицин (Epoxomicin) — встречающийся в природе селективный ингибитор.[7]
- MG132 — часто используемый в in vitro исследованиях пептид.
- ↑ Fenteany G., Standaert R.F., Lane W.S., Choi S., Corey E.J., Schreiber SL. Inhibition of proteasome activities and subunit-specific amino-terminal threonine modification by lactacystin (англ.) // Science : journal. — 1995. — Vol. 268. — P. 726—731. — DOI:10.1126/science.7732382. — PMID 7732382.
- ↑ Lövborg H., Oberg F., Rickardson L., Gullbo J., Nygren P., Larsson R. Inhibition of proteasome activity, nuclear factor-KappaB translocation and cell survival by the antialcoholism drug disulfiram (англ.) // International Journal of Cancer (англ.)русск. : journal. — 2006. — March (vol. 118, no. 6). — P. 1577—1580. — DOI:10.1002/ijc.21534. — PMID 16206267.
- ↑ Wickström M., Danielsson K., Rickardson L., et al. Pharmacological profiling of disulfiram using human tumor cell lines and human tumor cells from patients (англ.) // Biochemical Pharmacology (англ.)русск. : journal. — 2007. — January (vol. 73, no. 1). — P. 25—33. — DOI:10.1016/j.bcp.2006.08.016. — PMID 17026967.
- ↑ Cvek B., Dvorak Z. The value of proteasome inhibition in cancer. Can the old drug, disulfiram, have a bright new future as a novel proteasome inhibitor? (англ.) // Drug Discovery Today (англ.)русск. : journal. — 2008. — August (vol. 13, no. 15—16). — P. 716—722. — DOI:10.1016/j.drudis.2008.05.003. — PMID 18579431.
- ↑ Osanai K., Landis-Piwowar K.R., Dou Q.P., Chan T.H. A para-amino substituent on the D-ring of green tea polyphenol epigallocatechin-3-gallate as a novel proteasome inhibitor and cancer cell apoptosis inducer (англ.) // Bioorg. Med. Chem. (англ.)русск. : journal. — 2007. — August (vol. 15, no. 15). — P. 5076—5082. — DOI:10.1016/j.bmc.2007.05.041. — PMID 17544279.
- ↑ Current Advances in Novel Proteasome Inhibitor–Based Approaches to the Treatment of Relapsed/Refractory Multiple Myeloma (неопр.) (2011). Архивировано 26 июня 2013 года.
- ↑ Meng, L. et al. {{{заглавие}}} (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1999. — Vol. 96. — P. 10403—10408. — DOI:10.1073/pnas.96.18.10403. — PMID 10468620.
Таргетная терапия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 апреля 2018; проверки требуют 15 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 апреля 2018; проверки требуют 15 правок.Таргетная терапия или молекулярно-таргетная («молекулярно-прицельная») терапия (англ. target «цель, мишень») является одним из значительных направлений медикаментозного лечения (фармакотерапии) рака; другими являются гормональная терапия и химиотерапия. Как вид молекулярной медицины, таргетная терапия блокирует рост раковых клеток с помощью вмешательства в механизм действия конкретных целевых (таргетных) молекул, необходимых для канцерогенеза и роста опухоли,[1] а не просто препятствуя размножению всех быстро делящихся клеток (как, например, делает традиционная химиотерапия). Поскольку большинство препаратов для таргетной терапии являются биофармацевтическими, синонимом таргетной терапии иногда служит термин биологическая терапия при использовании в контексте терапии рака (и, следовательно, таковая отличается от химиотерапии, то есть цитотоксической терапии). Тем не менее, эти методы могут использоваться в сочетаниях друг с другом, когда комплексы лекарственных средств на основе антител объединяют биологические и цитотоксические механизмы в одном таргетном препарате.
Таргетная терапия рака, как ожидается, будет более эффективной, чем прежние виды лечения, и менее вредной для нормальных клеток. Многие таргетные методы лечения являются примерами иммунотерапии (так как используют иммунные механизмы для терапевтических целей), разрабатываемой в области онкоиммунологии. Таким образом, являясь иммуномодуляторами, они представляют собой один из типов модификаторов биологического ответа.
Наиболее успешные таргетные методы лечения используют химические субстанции, которые нацелены или преимущественно нацелены на какой-либо белок или фермент, который несёт мутацию или другие генетические изменения, являющиеся специфичными для раковых клеток и не присутствуют в нормальной ткани хозяина. Одним из наиболее успешных молекулярных таргетных лекарственных препаратов является Гливек (Gleevec), который представляет собой ингибитор киназы с исключительной сродством к гибридному белку BCR-ABL, который является важным фактором онкогенеза при хроническом миелолейкозе. Несмотря на наличие целого ряда других показаний, Гливек является наиболее эффективным в отношении BCR-ABL. Другие примеры молекулярно-таргетных препаратов, подавляющих мутировавшие онкогены, включают PLX27892 который нацелен на мутантный B-Raf при меланоме.
Существуют таргетные препараты для лечения рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы и других раковых заболеваний[2].
Решающие эксперименты, которые показали, что молекулярно-прицельная терапия способна обратить развитие злокачественного фенотипа опухолевых клеток, проводились при лечении HER2 / NEU трансформированных клеток моноклональными антителами in vitro (в пробирке) и in vivo (на живом организме) в лаборатории Марка Грина, и их проведение освещалось с 1985 года[3].
Некоторые оспаривали применение термина, заявив, что такие препараты, как правило, недостаточно избирательны[4]. Таргетные лекарства также могли бы считаться «химиотерапией» или «нецитотоксической химиотерапией», так как в широком смысле «химиотерапия» означает «лечение химическими веществами» вообще. Однако в принятом медиками словоупотреблении термин «химиотерапия» в настоящее время в основном используется только для «традиционной» химиотерапии.
Основные категории таргетных препаратов в настоящее время основаны на двух типах веществ: малые молекулы (низкомолекулярные биологически активные вещества) и моноклональные антитела
Ингибиторы тирозинкиназы (малые молекулы)[править | править код]
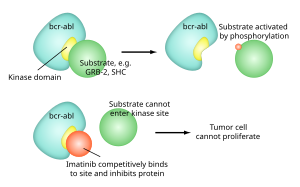 Механизм действия иматиниба
Механизм действия иматинибаМногие представляют собой ингибиторы тирозинкиназы.
- Мезилат иматиниба (Гливек, также известный как STI-571) предназначен для лечения хронического миелолейкоза желудочно-кишечной стромальной опухоли и некоторых других видов рака. Ранние клинические испытания показывают, что иматиниб может быть эффективным в лечении dermatofibrosarcoma protuberans.
- Гефитиниб (Иресса, также известный как ZD1839), нацелен на рецептор эпидермального фактора роста (EGFR) тирозинкиназы и одобрен в США для немелкоклеточного рака легких.
- Эрлотиниб (торговое название Tarceva). Эрлотиниб ингибирует рецептор эпидермального фактора роста,[5] и обладает аналогичным механизмом действия с гефитинибом. Эрлотиниб показал увеличение выживаемости больных метастатическим немелкоклеточным раком легких, при использовании в качестве терапии второй линии. Из-за этого факта эрлотиниб пришел на замену гефитинибу при данном заболевании.
- Сорафениб (Nexavar)[6]
- Сунитиниб (Сутент)
- Дазатиниб (Sprycel)
- Лапатиниб (Tykerb)
- Нилотиниб (Tasigna)
- Бортезомиб (Velcade) является ингибитором протеасом, препаратом, вызывающим апоптоз; под действием его раковые клетки подвергаются клеточной гибели, так как он нарушает синтез их белков. Он одобрен в США для лечения множественной миеломы, которая не ответила на другие виды лечения.
- Селективный модулятор рецептора эстрогена тамоксифен был описан как основа целенаправленной терапии.[7]
- Ингибиторы Янус-киназы, например, одобренный FDA tofacitinib
- ALK-ингибитор, например, кризотиниб[8]
- Bcl-2 ингибиторы (например, обатоклакс на клинических испытаниях, навитоклакс и госсипол.[9]
- Ингибиторы PARP (например, инипариб, Олапариб на клинических испытаниях)
- Ингибитор PI3K (например, перифозин в фазе III клинических испытаний)
- Апатиниб является селективным ингибитором VEGF рецептора 2 , который показывает обнадеживающую противоопухолевую активность в широком диапазоне злокачественных новообразований на клинических испытаниях.[10] Апатиниб в настоящее время в клинической разработке для лечения метастатического рака желудка, метастатического рака молочной железы и распространенного печеночноклеточного рака.[11]
- АН-152 (AEZS-108, доксорубицин) связывающийся с [D-Lys (6)] -. ЛГРГ, Результаты клинических испытаний фазы II в отношении рака яичников[12]
- BRAF-ингибиторы (вемурафениб[13], дабрафениб[14], LGX818) используются для лечения метастатической меланомы, развивающейся при мутации BRAF V600E
- Ингибиторы MEK (киназы митоген-активируемой протеинкиназы, англ. itogen-activated protein kinase kinase) (траметиниб[15], MEK162) (англ. MEK inhibitors) используются в экспериментах, часто в сочетании с ингибиторами BRAF для лечения меланомы
- Ингибиторы циклин-зависимой киназы (CDK), например, PD-0332991, LEE011 — на стадии клинических испытаний
- Ингибиторы Hsp90 (англ. heat shock protein 90 inhibitors), некоторые на клинических испытаниях
- Салиномицин[16][17] продемонстрировал эффективность в поражении раковых стволовых клеток при вызванных в лабораторных условиях и естественно развивающихся опухолях молочной железы у мышей.
Комплексные препараты малых молекул[править | править код]
- Винтафолид[18] — комплексный лекарственный препарат малых молекул, состоящая из малых молекул, нацеленных на рецептор фолиевой кислоты. В настоящее время он находится на клинических испытаниях в отношении устойчивого к препаратам платины рака яичников (испытания PROCEED) и испытаниях фазы 2b (испытания TARGET) против немелкоклеточного рака лёгкого (НМРЛ)
Ингибиторы серин / треонин киназы (малые молекулы)[править | править код]
Моноклональные антитела[править | править код]
Несколько находятся в стадии разработки, а несколько было лицензировано FDA. Примеры лицензированных моноклональных антител включают в себя:
В настоящее время разрабатываются многие комплексные препараты «антитело-лекарственное средство» с (АЦП). См. также ADEPT (антитело-направляемые ферментные пролекарственные препараты).
В США действует Программа разработки молекулярных таргетных препаратов Национального института рака, направленная на выявление и оценку молекулярных мишеней, которые могут быть кандидатами на разработку лекарств.
- CancerDriver: свободная и открытая база данных для поиска таргетных препаратов в соответствии с особенностями пациента.
- База данных по таргетной терапии [1] Проекта молекулярного картирования меланомы [2]
- Targeted therapy Fact sheet from the U.S. National Cancer Institute
- Molecular Oncology: Receptor-Based Therapy Special issue of Journal of Clinical Oncology (April 10, 2005) dedicated to targeted therapies in cancer treatment
- Targeting Targeted Therapy New England Journal of Medicine (2004)
- ↑ Definition of targeted therapy — NCI Dictionary of Cancer Terms (неопр.).
- ↑ NCI: Targeted Therapy tutorials
- ↑ Perantoni A. O., Rice J. M., Reed C. D., Watatani M., Wenk M. L. Activated neu oncogene sequences in primary tumors of the peripheral nervous system induced in rats by transplacental exposure to ethylnitrosourea (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1987. — September (vol. 84, no. 17). — P. 6317—6321. — DOI:10.1073/pnas.84.17.6317. — PMID 3476947.
Drebin J. A., Link V. C., Weinberg R. A., Greene M. I. Inhibition of tumor growth by a monoclonal antibody reactive with an oncogene-encoded tumor antigen (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1986. — December (vol. 83, no. 23). — P. 9129—9133. — DOI:10.1073/pnas.83.23.9129. — PMID 3466178.
Drebin J. A., Link V. C., Stern D. F., Weinberg R. A., Greene M. I. Down-modulation of an oncogene protein product and reversion of the transformed phenotype by monoclonal antibodies (англ.) // Cell : journal. — Cell Press (англ.)русск., 1985. — July (vol. 41, no. 3). — P. 697—706. — DOI:10.1016/S0092-8674(85)80050-7. — PMID 2860972. - ↑ Zhukov N. V., Tjulandin S. A. Targeted therapy in the treatment of solid tumors: practice contradicts theory (англ.) // Biochemistry Mosc. (англ.)русск. : journal. — 2008. — May (vol. 73, no. 5). — P. 605—618. — DOI:10.1134/S000629790805012X. — PMID 18605984.
- ↑ Katzel J. A., Fanucchi M. P., Li Z. Recent advances of novel targeted therapy in non-small cell lung cancer (англ.) // J Hematol Oncol : journal. — 2009. — January (vol. 2, no. 1). — P. 2. — DOI:10.1186/1756-8722-2-2. — PMID 19159467.
- ↑ Lacroix, Marc. Targeted Therapies in Cancer (неопр.). — Hauppauge , NY: Nova Sciences Publishers, 2014. — ISBN 978-1-63321-687-7. Архивная копия от 26 июня 2015 на Wayback Machine
- ↑ Jordan V. C. Tamoxifen: catalyst for the change to targeted therapy (англ.) // Eur. J. Cancer (англ.)русск. : journal. — 2008. — January (vol. 44, no. 1). — P. 30—38. — DOI:10.1016/j.ejca.2007.11.002. — PMID 18068350.
- ↑ КРИЗОТИНИБ | Активные вещества (неопр.). www.vidal.ru. Дата обращения 21 января 2016.
- ↑ Warr M. R., Shore G. C. Small-molecule Bcl-2 antagonists as targeted therapy in oncology (англ.) // Curr Oncol (англ.)русск. : journal. — 2008. — December (vol. 15, no. 6). — P. 256—261. — PMID 19079626.
- ↑ Li J., Zhao X., Chen L., etal. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies (англ.) // BMC Cancer (англ.)русск. : journal. — 2010. — Vol. 10. — P. 529. — DOI:10.1186/1471-2407-10-529. — PMID 20923544.
- ↑ Search of: apatinib — List Results — ClinicalTrials.gov
- ↑ Phase II study of AEZS-108 (AN-152), a targeted cytotoxic LHRH analog, in patients with LHRH receptor-positive platinum resistant ovarian cancer. (неопр.) (недоступная ссылка) (2010). Дата обращения 21 января 2016. Архивировано 23 марта 2012 года.
- ↑ Зелбораф (Zelboraf, вемурафениб) — лекарство, описание, инструкция, отзывы, цена, где купить препарат Зелбораф | Roche (неопр.). www.roche.ru. Дата обращения 21 января 2016.
- ↑ Дабрафениб (Tafinalar) и Траметиниб (Mekinist) – два новых препарата, одобренные FDA для лечения пациентов с меланомой (неопр.). www.rosoncoweb.ru. Дата обращения 21 января 2016.
- ↑ Melanoma Unit, Ltd. Траметиниб (Мекинист) (рус.) (недоступная ссылка). assuta.melanomaunit.ru. Дата обращения 21 января 2016. Архивировано 30 января 2016 года.
- ↑ лечение онкологических заболеваний, антибиотик салиномицин, аутоантитела, иммуноферментные тест-системы, злокачественные клетки :: Деловой журнал :: Газета РБК (неопр.) (недоступная ссылка). www.rbcdaily.ru. Дата обращения 21 января 2016. Архивировано 26 января 2016 года.
- ↑ alexander. Противоопухолевая активность ионофорного антибиотика салиномицина: мишень – опухолевые стволовые клетки — Издательский дом РУССКИЙ ВРАЧ (неопр.) (недоступная ссылка). www.rusvrach.ru. Дата обращения 21 января 2016. Архивировано 29 января 2016 года.
- ↑ Винтафолид » Клиническая фармация. Журнал (неопр.). clinical-pharmacy.ru. Дата обращения 21 января 2016.
- ↑ Merck, Endocyte in Development Deal
- ↑ Рош в России — Инструкция (Герцептин) (неопр.). www.roche.ru. Дата обращения 21 января 2016.
- ↑ Pollack, Andrew. F.D.A. Panel Supports Avastin to Treat Brain Tumor, New York Times (31 марта 2009). Дата обращения 13 августа 2009.
Ингибиторы фактора некроза опухоли — Википедия
Материал из Википедии — свободной энциклопедии

Ингибиторы ФНО (TNF-ингибиторы) — молекулы, в первую очередь искусственно синтезированные, способные ингибировать активность провоспалительного цитокина ФНО (Фактор некроза опухоли, англ. TNF) и тем самым влиять на симптомы ряда заболеваний.
Способность ингибировать ФНО имеют моноклональные антитела, такие как инфликсимаб и адалимумаб, а также гибридные белки, например, этанерцепт. Эти лекарственные препараты широко используются в качестве средств для лечения псориаза[1]. Половину мирового рынка антипсориатических средств занимают ингибиторы ФНО[1].
Среди побочных эффектов ингибиторов ФНО выделяют опасность развития оппортунистических инфекций[2], это было отмечено FDA[3].
- ↑ 1 2 Rizvi S., Chaudhari K., Syed B. A. The psoriasis drugs market // Nature Reviews Drug Discovery. — 2015. — Vol. 14. — P. 745-746. — DOI:10.1038/nrd4763.
- ↑ Keane J., Gershon S., Wise R. P., Mirabile-Levens E., Kasznica J., Schwieterman W. D., Siegel J. N., Braun M. M. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. (англ.) // The New England journal of medicine. — 2001. — Vol. 345, no. 15. — P. 1098—1104. — DOI:10.1056/NEJMoa011110. — PMID 11596589. [исправить]
- ↑ Information for Healthcare Professionals: Cimzia® (certolizumab pegol), Enbrel® (etanercept), Humira® (adalimumab), and Remicade® (infliximab) (неопр.) (недоступная ссылка). Food and Drug Administration (4 сентября 2008). Дата обращения 12 октября 2008. Архивировано 16 сентября 2008 года.
Наследственный ангионевротический отёк — Википедия
Наследственный ангионевротический отёк (НАО) — редкое заболевание, связанное с количественной недостаточностью (тип НАО — 1) или недостаточной активностью (тип НАО — 2) C1-ингибитора (англ.)русск. системы комплемента человека, что приводит к неконтролируемым внутренним реакциям в крови и проявляется в виде отёков на теле. Чаще всего отеки возникают на руках, ногах, лице, в брюшной полости, а также в гортани.
Отек гортани часто затрудняет поступление воздуха в организм, что в свою очередь, может привести к удушью. Поэтому, в случае возникновения отека гортани, госпитализация обязательна. Отеки в брюшной полости сопровождаются острыми болями и сильной рвотой и также требуют госпитализации.
C1-ингибитор — высокогликозилированный белок сыворотки, синтезируемый в печени и угнетающий протеолитическую активность субкомпонентов Clr и Cls, предупреждая таким образом активацию С4 и С2 компонентов комплемента. Недостаточность C1-ингибитора приводит к неконтролируемой активации ранних компонентов комплемента. Причем в 15 % случаев концентрация С1-ингибитора остаётся в норме, а снижена только его функциональная активность. Определение причины дефицита имеет принципиальное значение для выбора метода лечения этого аутоиммунного заболевания.
Патогенез НАО сходен с патогенезом крапивницы и связан с дилатацией и повышением проницаемости сосудов (преимущественно венул) глубоких (в отличие от крапивницы) слоев дермы и подслизистого слоя, вызванной компонентами комплемента и кининами калликреин-брадикининовой цепи. Кроме того, эти вазоактивные пептиды вызывают спазм гладкой мускулатуры пищеварительного тракта и полых органов.
Структура C1-ингибитора закодирована в 11-ой хромосоме, этот протеин является альфа-2-глобулином и вырабатывается преимущественно в гепатоцитах, хотя активированные моноциты, мегакариоциты, эндотелиальные клетки и фибробласты способны синтезировать его в небольших количествах. Существуют три типа НАО, фенотипически идентичные.
НАО 1-го типа[править | править код]
НАО 1-го типа (85 % случаев). Дефицит С1-ингибитора обусловлен нефункционирующим геном. Мутация заключается в разнообразных включениях или делециях одного или нескольких нуклеотидов в области гена, кодирующего С1-ингибитор. Мутация наследуется как аутосомно-доминантный, менделирующий признак, хотя приблизительно 25 % случаев НАО обусловлены спонтанной мутацией.
НАО 2-го типа[править | править код]
НАО 2-го типа (15 % случаев). У пациента вырабатывается нормальное или повышенное количество неправильно функционирующего С1-ингибитора. Обычная причина — точечная мутация в позиции Аргинин 444 локуса, который кодирует «реактивный центр» — активный связывающий/разделяющий участок молекулы. Не функционирующий С1-ингибитор не расходуется, что приводит к более высокой, чем в норме, концентрации в сыворотке крови.
НАО 3-го типа[править | править код]
НАО 3-го типа (распространённость неизвестна) — недавно описанное заболевание. Концентрация С1-ингибитора в плазме крови нормальная, механизм заболевания неизвестен и, вероятно, не связан с С1-ингибитором. До недавнего времени считалось, что этот тип НАО встречается только у женщин (характер родословных предполагает Х-сцепленный доминантный тип наследования), однако были выявлены семьи, в которых данный тип НАО был диагностирован и у мужчин.
Приобретенный ангионевротический отёк вследствие дефицита С1-ингибитора встречается у пожилых людей, часто ассоциирован с лимфопролиферативными заболеваниями, наличием антител к С1-ингибитору или с хронической инфекцией.
Начало истории наследственного ангиоотека положил немецкий врач-терапевт и хирург, автор большого числа открытий и новшеств в области медицины Иренеус Квинке.
1882 — Иренеус Квинке впервые описывает отёк Квинке.
1888 — У. Осиер (W. Osier) наблюдает и описывает наследственную форму отека Квинке. Отеки периодически появляются у 24-летней женщины. Осиер обращает внимание на семейную форму данного заболевания, так как подобные симптомы наблюдались у пяти предшедствующих поколений семьи пациентки. Отек впервые описывается, как Наследсвенный ангионевротический отек.
1917 — Становится известно об аутосомно-доминантном характере заболевания
1963 — Donaldson и Evans описали причину этого заболевания как биохимический дефект — отсутствие ингибитора С1 (C1INH deficiency).
1986 — Было установлено, что этот генный дефект связан с хромосомой 11.
1972 — Caldwell впервые описал взаимосвязь дефицита ингибитора С1-эстеразы с лимфопролиферативными заболеваниями (приобретённый ангиоотек)
1987 — Alsenz, Bork и Loos обнаружили IgG1-антитела к ингибитору С1-эстеразы (приобретённый ангиоотек).
2000 — описаны эстрогензависимые отеки.
Лечение наследственного ангионевротического отёка[править | править код]
Лечение во время острых приступов наследственного ангионевротического отёка[править | править код]
Лечение должно быть начато настолько рано, насколько это возможно!
- Концентрат C1-ингибитора.
- нативный С1-ингибитор (выделенный из плазмы): Berinert, Cinryze (у подростков и взрослых), Cetor;
- рекомбинантный С1-ингибитор (получаемый из молока генномодифицированных кроликов): Rhucin.
- Антагонисты рецептора к брадикинину: инкатибант.
- Только для взрослых. В педиатрии исследования продолжаются.
- Ингибитор калликреина: Kalbitor (Ecallantide)
- Свежезамороженная плазма, если нет возможности использовать препараты С1-ингибитора и другие современные лекарства.
Долгосрочная профилактика наследственного ангионевротического отёка[править | править код]
Долгосрочная профилактика требуется пациентам, если:
- частота обострений НАО более, чем одно обострение в месяц;
- когда-либо возникал отёк гортани;
- когда-либо требовалась интубация трахеи или госпитализации в отделение реанимации/интенсивной терапии;
- приступы НАО сопровождаются временной нетрудоспособностью или пропусками занятий более, чем 10 дней в год;
- из-за приступов НАО наблюдается значительное снижение качества жизни;
- у пациента существует какая-либо наркотическая зависимость;
- контакт пациента с центрами здравоохранения ограничен;
- у пациента происходит резкое развитие обострений НАО;
- если неэффективна т. н. on-demand therapy (терапия по требованию).
Для долгосрочной профилактики эксперты Международного Консенсуса по лечению НАО (2010) рекомендуют следующие группы препаратов:
- Т. н. «облегчённые» андрогены: Станозолол, Даназол, Оксандролон.
Эта группа препаратов достаточно эффективна, но обладает большим количеством серьёзных побочных эффектов. И, если для получения клинического эффекта (состояния контролируемости) необходима доза более 200мг/сутки (по Даназолу), то следует взвесить ожидаемую пользу и возможный риск развития побочных эффектов. - Ингибиторы фибринолиза (антифибринолитики): ε-аминокапроновая и Транексамовая кислоты.
Эти препараты могут быть эффективны для долгосрочной профилактики, но имеют многочисленные побочные эффекты, в связи с чем специалисты предпочитают назначению этой группы применение андрогенов, как более эффективных средств. - С-1 ингибитор
а) нативный (плазменный): Cinryze (у подростков и взрослых), Berinert, Cetor,
б) рекомбинантный: Rhucin, Ruconest — пока проходит клинические испытания для разрешения использования в качестве профилактического средства). Его эффективность показана в многоцентровых исследованиях.
Краткосрочная профилактика наследственного ангионевротического отёка[править | править код]
Рекомендована всем пациентам с НАО накануне медицинских, стоматологических манипуляций (в том числе и малых), перед действием стрессорных факторов (например, экзамен, собеседование и т. д.).
Применяются препараты, используемые для лечения обострений НАО. В случае наличия симптомов продромального периода (предвестников) может быть эффективной Транексамовая кислота или Даназол в течение 2-3 дней для предотвращения развития обострения.
Лекарственные препараты, применяемые для лечения и профилактики наследственного ангионевротического отёка[править | править код]
В настоящее время для лечения НАО рекомендованы и применяются на практике в различных странах следующие препараты:
- Инкатибант — антагонист рецептора B2 (англ.)русск.. Производитель: Shire Human Genetic Therapies (HGT).
- Berinert — концентрат C1-ингибитора. Производитель: CSL Behring.
- Cinryze — концентрат C1-ингибитора. Производитель: Viropharma.
- Cetor — концентрат C1-ингибитора. Производитель: Sanquin.
- Kalbitor — ингибитор Калликреина — Ecallantide (DX-88). Производитель: Dyax Corp.
- Ruconest — Рекомбинантный C1 ингибитор. Производитель: Swedish Orphan Biovitrum (Sobi).
- Rhucin — Рекомбинантный C1 ингибитор. Производитель: Pharming Group NV.
- Станозолол — анаболический стероидный препарат, производное андростана (дигидротестостерона). Торговые наименования: Winstrol (пероральный), Tenabol и Winstrol Depot (внутримышечный).
- Даназол — антигонадотропное средство, являющееся синтетическим андрогеном, полученным из этистерона. Торговые наименования: Даназол, Дановал, Данол, Danocrine.
- Оксандролон — анаболический стероидный препарат, получаемый на основе дигидротестостерона. Торговые наименования: Oxandrin, Anavar
- Транексамовая кислота — антифибринолитическое, противоаллергическое, противовоспалительное вещество. Торговые наименования: Транексам, Транексамовая кислота, Трансамча, Троксаминат, Экзацил
- Аминокапроновая кислота — лекарственное гемостатическое средство. Торговые наименования: Amicar, Поликапран (Polycapran), ε-Ahx, 6-aminohexanoic acid.
Лекарственные препараты, которых следует избегать при наследственном ангионевротическом отёке[править | править код]
Препараты этих типов могут провоцировать приступы НАО:
Международная организация пациентов НАО[править | править код]
В ноябре 2004 года, во Франции была зарегистрирована международная организация пациентов с недостаточностью C1-ингибитора HAEi[1].
Организация оказывает помощь специалистам НАО, а также национальным организациям и группам пациентов НАО по всему миру. Целью международной организации пациентов НАО является облегчение доступа к эффективной диагностике и лечению Наследственного ангионевротического отёка (отёка Квинке и других заболеваний, связанных с дефицитом ингибитора C1).
«Общество пациентов с Наследственным Ангионевротическим Отеком». (МОО «ОПНАО»).[править | править код]
В мае 2016 года, в России была зарегистрирована межрегиональная общественная организация «Общество пациентов с Наследственным Ангионевротическим Отеком».
Целью организации является объединение членов для объединения и консолидации пациентов с Наследственным Ангионевротическим Отеком, содействия в решении проблем лечения и профилактики заболевания, реабилитационного и санаторного лечения, предупреждения и снижения инвалидности, в том числе детей и подростков, страдающих Наследственным Ангионевротическим Отеком, содействия в организации получения ими необходимого образования, трудоустройства и социально-бытового обеспечения с учётом специфики заболевания.[2]
16 мая — ежегодный международный день осведомленности о НАО. Мероприятия, приуроченные ко дню НАО и проводимые по всему миру, направлены на повышение знаний о заболевании в обществе и среди специалистов, ранней и более точной диагностике, эффективному лечению и профилактике — всему тому, что позволит пациентам НАО вести нормальный образ жизни. Дню НАО посвящён веб-сайт www.haeday.org.
- www.hereditary-angioedema.org — Наследственный/врождённый ангиоотек (НАО), Hereditary Angioedema (HAE), Наследственный ангионевротический отек (НАО)
- www.haei.org — HAEI — International Patient Organization for C1-Inhibitor Deficiencies
- www.haeday.org — hae day 🙂
- https://facebook.com/groups/HAEinternational — международное facebook-сообщество « HAEI — International Patient Organization for C1 Inhibitor Deficiencies»
- www.allabouthae.com — американское сообщество врачей и пациентов НАО. На сайте можно проверить симптомы, составить генетическое дерево, задать вопрос специалисту, создать и вести свой дневник, делиться личными историями о болезни с другими пользователями сайта.
- www.haea.org — американское сообщество врачей и пациентов НАО. На сайте есть фотографии отеков (до и во время).
- www.immuno.health-ua.com/article/40.html — Наследственный ангионевротический отек — статья Л. В. Забродской
- www.op-nao.ru — Российская Межрегиональная общественная организация «Общество пациентов с Наследственным Ангионевротическим Отеком». (МОО «ОПНАО»).
- by.haei.org — Республиканское общественное объединение “Помощь пациентам НАО” (Беларусь)
Ответы@Mail.Ru: что такое ингибитор?
«Тормознутель» ! ;-)))
Ингибитор (лат. inhibere — задерживать) — вещества, замедляющие или предотвращающие течение различных химических реакций: окисления, полимеризации, коррозию металлов и др. Например, гидрохинон — ингибитор окисления бензальдегида; соединения технеция — ингибитор коррозии сталей.<br><br>Применительно к коррозии металла ингибитором называют вещество, которое, адсорбируясь на поверхности металла, делает ее потенциал более положительным, тем самым замедляя процесс коррозии.
это вещество, которое замедляет протекание химической реакции, но сам ингибитор в реакции не участвует и не расходуется
Ингибиторы-вещества,способные в малых колличествах замедлять протекание химических прцессов.Например,-ингибитор коррозии металлов.
здрасти, праехали:<br>ингибитор-белки, ферменты, замедляющие протекание химической реакции, сами же в реакцию не вступают….<br>а катализатор, наоборот, увеличивают скорость реакции….<br>это курс химии и физики чсредней школы…
В биохимии это в-ва блокирующие либо значительно замедляющие реакции, антоним фермента. В микробиологии под ингибированием понимают воздействие фактора или вещества частично или полностью останавливающего рост микроорганизма.
Ингибитор — физико-химическая структура, обратная катализатору. Поясню: титан служит катализатором некоторых реакций, но в виде пористой, почти мягкой губки с высокой абсорбционной способностью, а не чушки 150x20x20.
Это «катализатор наоборот». Катализаторы, как известно, способны резко ускорять химические реакции, сами в них не участвуя. А ингибиторы — как раз наоборот. Они ЗАМЕДЛЯЮТ или вообще подавляют определённую реакцию. Особенно важны ингибиторы коррозии — они значительно увеличивают срок службы металических изделий и конструкций (трубопрводы, прежде всего).
Ингибитор АПФ. Уменьшает образование ангиотензина 2, устраняет его <br><br>сосудосуживающее действие. Снижает ОПСС (постнагрузку), АД, снижает давление в <br><br>правом предсердии и мкк (преднагрузку). Уменьшает гипертрофию миокарда и стенок <br><br>сосудов. Назначается с гипотензивной целью.<br>
…это то, чем стучат по барышням с именем Инга
ингибитор — катализатор замедляет ; но в реакцию не вступает
Тут вся информация вот ссылка на сайт <a rel=»nofollow» href=»http://priborservice.ru» target=»_blank»>http://priborservice.ru</a>
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
