Карбонат кальция: универсальное вещество
Карбонат кальция представляет собой химическое соединение неорганической природы, в состав которого входит природный кальций и соль угольной кислоты. Данное соединение широко встречается в природе в составе известняков, мела, твердых пород мрамора, а также в виде природных минералов кальцита, арагонита и других.
Карбонат кальция используется в самых различных областях промышленности – он незаменим при производстве стекла, широко применяется в пищевой промышленности (там он более известен под маркой Е170) в качестве пищевого красителя белого цвета, является одним из компонентов при изготовлении красок, пластмасс, предметов личной гигиены. Основные потребители карбоната кальция – это производители всевозможных пластмасс и пластиков, ведь даже привычные всем сегодня пластиковые панели, линолеум, ковровые покрытия и черепица — это производные карбоната кальция. Но самым привычным видом, в котором нам знакомо это вещество, являются, конечно же, известные всем с детства таблетки.
Карбонат кальция: применение в медицине.
Использование данного неорганического соединения в медицине обусловлено, прежде всего, содержанием в нем кальция в чистом виде. Поэтому данный препарат применяют для восполнения кальция в организме, а также в составе комплексной терапии при лечении заболеваний суставов. Карбонат кальция отлично помогает укрепить кости и зубы, а также рекомендован для улучшения качества ногтей и волос. Помимо этого препарат обладает уникальным свойством нейтрализовать действие соляной кислоты и приводить в норму повышенную кислотность желудка.
Основными показаниями к применению данного препарата являются:
— Гиперацидность желудочного сока, а также возникающие на ее фоне всевозможные заболевания желудочно-кишечного тракта. Это гастриты, в том числе и в фазе обострения, дуодениты, язвенные обострения, а также изжога.
— Дефицит кальция или повышенная потребность в нем в отдельные периоды жизни: рахит и ранний кариес у детей, остеопороз, в том числе возникший после менопаузы, а также период беременности, лактации, гипокальциемия, возникающая в результате плохого всасывания кальция или же вследствие его повышенного выведения из организма.
Карбонат кальция: инструкция по применению.
При дозировании препарата учитывают возраст пациента, а также специфику заболевания. Для детей в возрасте до 10 при лечении рахита или кариеса доза колеблется, в зависимости от веса, от 300 до 600 мг в сутки.
При заболевания ЖКТ препарат назначают для приема внутрь, доза составляет от 0,5 до 1 гр. в сутки.
Для восполнения дефицита кальция, профилактики остеопороза, а также в составе комплексного лечения состояния волос и ногтей, доза препарата подбирается индивидуально, с учетом лекарственного взаимодействия, веса, роста, и состояния ЖКТ. Она может колебаться в диапазоне от 250 мл до 1,5 гр. в сутки.
Противопоказания.
Несмотря на широкий спектр действия, природное происхождение и универсальность, данный препарат также имеет некоторые ограничения в применении.
— Наличие камней в почках, особенно кальциевого происхождения.
— Склонность кровеносной системы к образованию тромбов.
— Атеросклероз в тяжелой форме.
— Индивидуальная непереносимость препарата.
— Гиперкальциемия.
Также при приеме карбоната кальция следует учитывать и некоторые особенности его взаимодействия с другими препаратами. Так, он обладает способностью при одновременном приеме с антибиотиками, относящимися к группе тетрациклина, снижать их эффективность и уменьшать концентрацию тетрациклина в крови. Также препарат способен снижать абсорбцию индометацина, левотироксина и некоторых других лекарственных средств.
инструкция по применению :: SYL.ru
Лекарство «Кальция карбонат» является антацидным препаратом.
Терапевтическое действие средства «Карбонат кальция»
 Лекарство ослабляет разрушающее воздействие на слизистые пищевода и желудка соляной кислоты. Кроме того, кальций участвует в создании костной ткани, поддержании стабильной работы сердца, передаче нервных импульсов, свертывании крови. Действие медикамента не вызывает повышенного выделения кислоты, снижает расщепление белков в соке желудка, при этом кислотно-щелочное равновесие не изменяется. Производится препарат «Карбонат кальция» в форме порошка и таблеток. Лекарство активизирует процессы обмена, оказывает антиагрегантное, спазмолитическое, антиаритимическое действие, приводит в норму воспроизводство белка и нуклеиновых кислот, отвечает за процессы переноса, утилизации и хранения энергии.
Лекарство ослабляет разрушающее воздействие на слизистые пищевода и желудка соляной кислоты. Кроме того, кальций участвует в создании костной ткани, поддержании стабильной работы сердца, передаче нервных импульсов, свертывании крови. Действие медикамента не вызывает повышенного выделения кислоты, снижает расщепление белков в соке желудка, при этом кислотно-щелочное равновесие не изменяется. Производится препарат «Карбонат кальция» в форме порошка и таблеток. Лекарство активизирует процессы обмена, оказывает антиагрегантное, спазмолитическое, антиаритимическое действие, приводит в норму воспроизводство белка и нуклеиновых кислот, отвечает за процессы переноса, утилизации и хранения энергии.Препарат «Карбонат кальция»: применение
Медикамент выписывают при расстройствах пищеварительной системы, рефлюксэзофагите, болях и дискомфорте в эпигастрии, для предупреждения остеопороза, рахита и кариеса у детей. Лекарство позволяет облегчить состояния, которые сопровождаются повышенной кислотностью.
Средство «Карбонат кальция»: инструкция
Для нейтрализации действия соляной кислоты взрослым назначают принимать порошок в объеме 0,5-1 грамма. Для предупреждения остеопороза дневная доза составляет 0,6-1,2 граммов. Для лечения рахита и кариеса детям дают 0,3-0,6 г препарата в день. Подросткам, которым более 12 лет, назначают по две таблетки после еды (при изжоге). Возможен прием медикамента каждые два часа. Взрослым предписана такая же схема терапии. Однако следует учесть, что больше 12 драже в день принимать запрещается. Таблетки требуется рассасывать, а не глотать.
Побочные действия
Средство «Карбонат кальция» при долговременном приеме может спровоцировать возникновение алкалоза (повышения уровня в тканях и крови рН). Это происходит из-за накопления в организме щелочных элементов. Использование медикамента может изменить консистенцию стула. Употребление повышенного объема препарата способно привести к излишнему выделению желудочного сока. Продолжительный прием лекарства в повышенных количествах в некоторых ситуациях вызывает гиперкальциемию, которая после завершения терапии проходит. У пациентов с дисфункцией почек при использовании медикамента может образоваться гипермагниемия.
Средство «Карбонат кальция»: противопоказания
Запрещается принимать порошок при излишней чувствительности к лекарству, гиперкальциемии, атеросклерозе тяжелом, тромбозе. Не рекомендуется использовать медикамент при фенилкетонурии, нарушениях почечного функционирования. Во время беременности и грудного вскармливания препарат принимают с разрешения наблюдающего гинеколога.

Цена и аналоги
Препаратами, оказывающими схожее воздействие, являются: «Ренни», «Кальцивид», «Гастал» и другие. Стоимость средства «Карбонат кальция» в порошке составляет меньше одного рубля.
Карбонат кальция — это… Что такое Карбонат кальция?
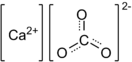
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
 Таблетки из карбоната кальция
Таблетки из карбоната кальцияОчищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Карбонат часто встречается в геологической среде. Он находится как полиморф. Полиморфами являются минералы с той же химической формулой, но разной химической структуры. Арагонит, кальцит, известняк, мел, мрамор, травертин, туф и др. — все они имеют формулу CaCO
В тропических условиях вода теплая и чистая. Таким образом, вы можете увидеть много кораллов в данной среде по сравнению с холодной, где вода холодная. Производители карбоната кальция, такие как кораллы, водоросли и микроорганизмы, которые обычно встречаются в мелководных водоемах, как фильтраторы, требуют солнечный свет для производства карбоната кальция.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[1]:
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению:
- .
В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2
- .
Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту.
При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II)
- .
Примечания
Ссылки
Шаблон:АТХ код A02
Кальция карбонат, применение — Справочник химика 21
Кальций. Физико-химические свойства. Сгорание на воздухе. Оксид и гидроксид кальция, гашение извести. Взаимодействие гидроксида кальция с диоксидом углерода в растворе. Соли кальция -карбонат и сульфат. Нахождение в природе и применение. [c.170] Очень важной и в то же время довольно сложной областью применения химии поверхностей является флотационное разделение минералов. Этот метод представляет исключительную ценность для горнодобывающей промышленности, так как позволяет экономично обрабатывать огромные количества измельченных руд и отделять ценные минералы от пустой породы. Первоначально флотация применялась только для переработки некоторых сульфидных и окисленных руд, однако в настоящее время она применяется и во многих других случаях. В далеко не полный перечень руд, обогащаемых методом флотации в промышленном масштабе, можно включить никеле- и золотоносные руды, кальцит, флюорит, барит (сульфат бария), шеелит (вольфрамат кальция), карбонат и окись марганца, окислы железа, гранатовые породы, титанжелезные окислы, окислы кремния и силикаты, уголь, графит, серу и некоторые растворимые соли, например сильвинит (хлорид калия). Подсчитано, что ежегодно флотационным методом перерабатывается 10 т руды [15, 16] Приблизительно до 1920 г. флотационные процессы были довольно примитивными и основывались прежде всего на эмпирическом наблюдении, что пульпа медной или свинцово-цинковой руды (смеси измельченной руды с водой) может обогащаться (т. е. в ней может повышаться содержание собственно минерала) при обработке большими количествами жиров или масел. Частицы ценного минерала собираются в слое масла и, таким образом, отделяются от пустой породы и воды. Позже масляная флотация была почти полностью вытеснена так называемой пенной флотацией. При использовании пенной флотации к пульпе прибавляют небольшое количество масла и вспенивают, перемешивая ее или иробулькивая через нее пузырьки воздуха. Частицы минералов концентрируются в образовавшейся пене, которую периодически снимают с пульпы.
Стабилизация подкислением (соляной или серной кислотой) препятствует выпадению из соленой воды карбоната кальция и гидроокиси магния. Применение соляной кислоты предпочтительней, так как при обработке серной кислотой увеличивается концентрация ионов SO4 , что повышает угрозу накипеобразования. [c.15]
Напишите уравнения реакции регенерации пермутита кальция карбонатом натрия в исходный пермутит натрия. Какое применение имеет пермутит натрия в технике
Даны хлорид натрия, карбонат кальция, кокс, вода, воздух. Как получить из них не менее 20 веществ (органических и неорганических), имеющих практическое применение [c.76]
Установлено, что целый ряд неорганических соединений способен ускорять процесс вулканизации. К их числу относятся такие вещества, как окиси магния, цинка, свинца, гидроокись кальция, карбонаты калия и натрия, многосернистые соединения. Но наибольшее практическое применение имеют только окиси магния, цинка, свинца, гидроокись кальция. Неорганические ускорители не растворяются в каучуке и плохо распределяются в нем. Для улучшения их распределения в резиновых смесях применяются жирные кислоты и канифоль, которые активируют неорганические ускорители вулканизации.
Большая часть выпускаемой на сегодняшний день бумаги производится с применением щелочи и использованием кальций карбоната в качестве наполнителя, а значит, оборудование должно подвергаться кислотной очистке. Под оборудованием понимаются как емкости, так и линии, используемые в процессе изготовления бумаги, в том числе для хранения вторично используемого сырья. Здесь для промывки оборудования применяются сложные эфиры фосфорной кислоты и ЛАБС. Если используется H l, то обязательно с хорошими пенообразователями для формирования барьерного слоя пены. [c.110]
Метод припудривания гранул или кристаллов аммиачной селитры неорганическими веществами нашел широкое применение за рубежом. Для этой цели используют фосфат аммония, гипс, оксид магния, инфузорную землю и др., иногда фосфат кальция, карбонаты магния и кальция в количестве 4ч-5 мас.%. [c.127]
Из большого числа веществ с сильно развитой поверхностью, которые можно было бы использовать для хроматографии, более или менее широкое применение получили окись алюминия, силикагель, окись магиия, гидрат окиси кальция, карбонаты и сульфаты кальция и магния, основной карбонат цинка, естественные силикаты — активные земли (флоридин, фуллерова земля и др.), искусственные силикаты, крахмал, целлюлоза и активированный уголь. [c.190]
Применение в качестве источника СО2 карбоната кальция позволяет осуществлять те же реакции, что и с реагентом СО2, но требуют более высоких температур. Эти реакции, естественно, более эндотермичны. [c.348]
Применение подобных центрифуг рекомендуется для осветления фосфорной кислоты после выпаривания, отделения осажденных пигментов, карбоната кальция, обезвоживания санитарных и промышленных отбросов и т. д. [108, 109]. [c.94]
Перечислите области применения гидроксида кальция. 0 15-121. Можно ли приготовить раствор в воде а) оксида кальция б) гидроксида кальция в) карбида кальция г) карбоната кальция д) хлорида кальция е) гидрокарбоната кальция Ответы мотивируйте. [c.119]
Данные табл. 11 облегчают выбор и позволяют ограничить число единовременно применяемых конструкций бункерных устройств, питателей и др. Кроме того, создаются условия для количественной оценки целесообразности применения побудителей потока внутри бункера. Например, для карбоната кальция указаны следующие данные (в скобках дано число баллов) [c.48]
Природные соединения кальция находят широчайшее применение (производство строительных материалов, извести, карбида, удобрений и т. д.). Особую роль играют кальций и магний при эксплуатации водных ресурсов. От содержания в воде ионов Са + и + зависит жесткость воды. Если концентрация этих ионов велика, воду назьшают жесткой, если мала — мягкой. Карбонатная жесткость связана с присутствием гидрокарбонат-иона НСОГ. При кипячении такой воды равновесие реакции сдвигается в сторону образования нерастворимого карбоната кальция или магния [c.149]
&en
Кальция карбонат (CALCIUM CARBONATE): описание, рецепт, инструкция
- Главная
- Антациды
- Кальция карбонат
Аналоги (дженерики, синонимы)
Рецепт (международный)
Rp.: Tab. Calcii carbonati 0.5 № 100
D.S. По схеме.
Фармакологическое действие
Антацидное средство, нейтрализует свободную соляную кислоту в желудке. Кальций — макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, осуществления процессов передачи нервных импульсов.
Способ применения
Для взрослых: Индивидуальный. Для взрослых при применении в качестве антацидного средства разовая доза составляет 0.5-1 г. Для профилактики остеопороза суточная доза — 0.6-1.2 г.
У детей для профилактики и лечения рахита и кариеса применяют в суточной дозе 300-600 мг.
Показания
— Изжога, дискомфорт в области эпигастрия.
— Профилактика остеопороза (в т.ч. при артритах, раке молочной железы, у лиц пожилого возраста).
— Профилактика и лечение рахита и кариеса у детей.
Противопоказания
— Гиперкальциемия
— Тромбоз
— Тяжелый атеросклероз,
— Повышенная чувствительность к кальция карбонату.
Побочные действия
— При длительном применении в высоких дозах возможно развитие алкалоза.
Форма выпуска
Таблетки 500 мг. № 100.
ВНИМАНИЕ!
Информация на просматриваемой вами странице создана исключительно в ознакомительных целях и никак не пропагандирует самолечение. Ресурс предназначен для ознакомления сотрудников здравоохранения с дополнительными сведениями о тех или иных медикаментах, повысив тем самым уровень их профессионализма. Использование препарата «Кальция карбонат» в обязательном порядке предусматривает консультацию со специалистом, а также его рекомендации по способу применения и дозировке выбранного вами лекарства.
| Карбонат кальция | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Общие | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
| Хим. формула | CaCO3 | ||
| Физические свойства | |||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Оптические свойства | |||
| Показатель преломления | 1,60 | ||
| Структура | |||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| Классификация | |||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | C(=O)([O-])[O-].[Ca+2] | ||
| InChI |
| ||
Гидрокарбонат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Гидрокарбона́т ка́льция — неорганическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — Ca(HCO3)2{\displaystyle {\mathsf {Ca(HCO_{3})_{2}}}}.
Как известно, все гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций[уточнить] в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Ca(HCO3)2→tCaCO3↓+h3O+CO2{\displaystyle {\mathsf {Ca(HCO_{3})_{2}}}{\xrightarrow {t}}{\mathsf {CaCO_{3}}}\downarrow {\mathsf {+H_{2}O+CO_{2}}}}
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³.
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
CaCO3+CO2+h3O⟶ Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow \ Ca(HCO_{3})_{2}}}}





 (
(