Анализ крови на прогестерон в Москве. Расшифровка и норма. Сдать анализы в МЦ «Здоровье» ЮАО (Варшавская и Аннино), ЦАО (Краснопресненская и Рижская).
Прогестерон — это стероидный гормон, который есть как в мужских организмах (вырабатывается яичками), так и в женских (вырабатывается яичниками). Также, в малом количестве, прогестерон продуцируют надпочечники. В основном, этот гормон влияет на половую сферу — в частности, при беременности прогестерон способствует закреплению оплодотворённой яйцеклетки и дальнейшему вынашиванию плода.
Что показывает анализ крови на прогестерон?
Анализ прогестерона — это один из основных диагностических методов исследования овуляции. Концентрация данного гормона в женском организме изменяется в соответствии с фазами менструального цикла, а перед овуляцией (при отсутствии нарушений) уровень прогестерона возрастает в 10 раз. Если анализ показывает, что повышения прогестерона нет, это прямое указание на то, что есть какие-то отклонения — возможно, опасные.
Недостаточное количество прогестерона при беременности — это потенциальная угроза выкидыша. Исходя из этого, анализ на прогестерон является необходимым мероприятием. В другое время повышение прогестерона указывает на возможность наличия:
- Нарушений менструального цикла
- Кисты желтого тела
- Дисфункциальных маточных кровотечений
- Нарушений развития плаценты
- Нарушения функции надпочечников
- Почечной недостаточности
Нехватка прогестерона может указывать на:
- Нарушенную функцию плаценты либо желтого тела
- Отсутствие овуляции
- Задержку внутриутробного развития плода
- Высокий риск аборта, спровоцированного гормональным дисбалансом
- Хронические воспаления, затрагивающие половые органы
- Маточные кровотечения
Важно учитывать, что повышенный или пониженный прогестерон может быть результатом приёма различных медикаментозных препаратов.
Как делают анализ на прогестерон?
Обычно анализ на прогестерон сдают в период после овуляции — как правило, на 23—24 день (при цикле 29—30 дней). Перед исследованием нужно 8—10 часов ничего не есть и не пить ничего, кроме воды. Анализ сдаётся утром, натощак.
Расшифровка результатов. Нормы прогестерона в крови
Нормы прогестерона (нмоль/л)
Взрослые мужчины:
Взрослые женщины:
- Фолликулярная фаза: от 0,32 до 2,23
- Овуляторная фаза: от 0,48 до 9,41
- Лютеиновая фаза: от 6,99 до 56,63
Беременные женщины:
- 1 триместр: от 8,9 до 468,4
- 2 триместр: от 71,5 до 303,1
- 3 триместр: от 88,7 до 771,5
Где сделать анализ крови на прогестерон?
Обратитесь в медицинский центр «Здоровье». Мы сделаем анализ точно и быстро, подробно объясним его результаты и, при необходимости, предложим необходимое лечение.
Прогестерон (S-Prog) – SYNLAB Eesti
Прогестерон – это стероидный гормон, который синтезируется в яичниках, но, в отличие от эстрадиола,, в основном, в corpus luteum и при беременности в плаценте. Прогестерон стимулирует секрецию желез эндометрия, подготавливая его для имплантации оплодотворенной яйцеклетки и уменьшая контрактильность матки при беременности. Увеличенный синтез прогестерона в лютеиновую фазу повышает базальную температуру на 0,3-0,5°C. Синтез прогестерона в желтом теле индуцируют LH и hCG, прогестерон же в свою очередь ингибирует синтез гонадотропинов. Для проявления биологического действия прогестерона необходима эстрогенная стимуляция.
Показания:
- Диагностика гипофункции corpus luteum (оценка риска раннего спонтанного аборта)
- Определение овуляторного и неовуляторного цикла
- Определение внематочной беременности (определяется вместе с hCG)
- Контроль при лечении прогестероном Метод анализа: Хемилюминисцентный метод
Референтные значения:
| < 11 л | 0,67 – 3,5 nmol/L |
| Фаза фолликула, Ж | < 2,89 nmol/L |
| Лютеиновая фаза, Ж | 8,58 – 68,4 nmol/L |
| Постменопауза, Ж | < 1,24 nmol/L |
| 13,0 –108 nmol/L | |
| Беременные II триместр, Ж | 76 – 241 nmol/L |
| Беременные III триместр, Ж | 165 – 960 nmol/L |
| > 11 л M | < 4,11 nmol/L |
Интерпретация результата:
- Определение концентрации прогестерона подходит для оценки функции corpus luteum.
 Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами.
Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами. - Функция желтого тела считается нормальной, если сумма трех полученных измерений содержания прогестерона >60 nmol/L.
- Определение прогестерона вместе с ультразвуковой диагностикой помогает диа- гностировать эктопическую беременность. Если на 5 неделе беременности значение прогестерона остается ниже 48 nmol/L, то с большой вероятностью беременность внематочная.
Сдать анализ крови на Прогестерон в лаборатории KDL
Прогестерон 7.2.А5.201 Общие сведения.
Прогестерон – это стероидный гормон, продуцируемый желтым телом яичника. Его основная функция – подготовка организма женщины к беременности и сопровождение развития плода на раннем сроке.
Прогестерон вырабатывается в небольшом количестве в надпочечниках. У мужчин играет важную роль в процессе сперматогенеза.
В каких случаях обычно назначают исследование?
Анализ на прогестерон – обычный тест при обследовании женщин с бесплодием или с нарушениями менструального цикла. Его также используют при диагностике внематочной или замершей беременности, совместно с измерением ХГЧ.
Что означают результаты теста?
Интерпретация результатов анализа зависит от причины назначения и требует знания фазы менструального цикла или срока беременности пациентки.
Если уровень прогестерона не повышается и не падает ежемесячно, это говорит об отсутствии овуляции и других нарушениях менструального цикла. Это может быть причиной бесплодия.
Отсутствие повышения концентрации гормона на ранних сроках может указывать на внематочную или замершую беременность, а также быть признаком недостаточной функции желтого тела.
Повышенный уровень прогестерона может наблюдаться при следующих состояниях:
- Нормальная беременность
- Прием гормональных препаратов
- Опухоли яичников
- Врожденная гиперплазия надпочечников
Сроки выполнения теста.
Обычно результат анализа можно получить уже на следующий день.
Как подготовиться к анализу?
Исследование обычно проводится на 19-23 день менструального цикла, если лечащий врач не назначил иначе.
Сдать анализ крови на гармон прогестерон, норма, результаты. Когда сдавать анализ на прогестерон при беременности, расшифровка – Медицинский центр Медикафарм
Прогестерон – гормон, необходимый для всех этапов беременности.
Анализ на гормоны прогестерон назначается женщинам для выявления:
- причин нарушений менструации,
- причин бесплодия,
- причин маточных кровотечений,
- оценки состояния плаценты во втором и третьем триместре беременности,
- причин перенашивания беременности.
Когда сдавать анализ на прогестерон? Без специальных указаний врача исследование проводится на 22-23 день менструального цикла. После последнего принятия пищи должно пройти 8-12 часов, анализ берут утром. Если сдача анализа на прогестерон утром невозможна, следует исключить из завтрака жиры, потом выдержать не менее 6 часов без приема пищи, а уже затем прийти на исследование.
Анализ на прогестерон при беременности или для других целей также включает информацию о дне цикла, неделе беременности, менопаузе, о приеме лекарств, влияющих на уровень гормонов.
Результаты анализа на прогестерон варьируются в зависимости от фазы менструации. Перед овуляцией прогестерон повышается в 10 раз – это так называемая лютеиновая фаза. Прогестерон повышается и при беременности. Нехватка гормона может привести к ее прерыванию. Во второй части беременности врачу нужно быть уверенным в нормальном для этого периода количестве прогестерона.
Расшифровка анализов на прогестерон – норма или патология
Если результат исследования показывает завышенные показатели, это значит, что врач может диагностировать: беременность, маточные кровотечения, аменорею, отклонения в развитии плаценты, кисту желтого тела. Кроме того, почечная недостаточность либо патологии образования гормонов надпочечниками также сопровождаются понижением уровня прогестерона.
Если же обнаружен недостаток прогестерона, это позволяет предполагать отсутствие овуляции, отклонения в функции желтого тела, хронические воспаления половых органов, нарушения менструального цикла. У беременных женщины нехватка гормона может говорить о задержке внутриутробного развития плода, угрозе самоаборта, перенашивании беременности. Также низкий уровень гормона — показатель маточных кровотечений или приема некоторых лекарств. Анализ на прогестерон в норме должен показывать такие результаты: женщины с подросткового возраста до постменопаузы в зависимости от периода менструального цикла – 0,32-2,23 нмоль/л (фолликулярная фаза), 0,48-9,41 нмоль/л (овуляторная), 6,99-56,63 нмоль/л (лютеиновая фаза), у беременных женщин результат должен быть: 8,9-468,4 (1 триместр), 71,5-303,1 нмоль/л (2 триместр), 88,7-771,5 нмоль/л (3 триместр), в период постменопаузы прогестерона должно быть менее 0,64 нмоль/л.
У беременных женщины нехватка гормона может говорить о задержке внутриутробного развития плода, угрозе самоаборта, перенашивании беременности. Также низкий уровень гормона — показатель маточных кровотечений или приема некоторых лекарств. Анализ на прогестерон в норме должен показывать такие результаты: женщины с подросткового возраста до постменопаузы в зависимости от периода менструального цикла – 0,32-2,23 нмоль/л (фолликулярная фаза), 0,48-9,41 нмоль/л (овуляторная), 6,99-56,63 нмоль/л (лютеиновая фаза), у беременных женщин результат должен быть: 8,9-468,4 (1 триместр), 71,5-303,1 нмоль/л (2 триместр), 88,7-771,5 нмоль/л (3 триместр), в период постменопаузы прогестерона должно быть менее 0,64 нмоль/л.
| КОД | НАИМЕНОВАНИЕ УСЛУГИ | БИОЛОГИЧЕСКИЙ МАТЕРИАЛ | Срок выполнения | ЦЕНА |
29. 115 115 | Прогестерон | кровь (сыворотка) | 1 р.д. | 300р. |
Женское здоровье. Гормоны и беременность.
Течение и сохранение беременности напрямую зависит от гормонального фона. Если при беременности изменяется норма прогестерона, это становится заметно на раннем сроке. Но такое состояние поддается коррекции с учетом правильно проведенного обследования и назначения нужных препаратов.Влияние прогестерона на женский организм начинается со второй половины менструального цикла. Он увеличивает секрецию слизи в фаллопиевых трубах. Она служит питательной средой для продвигающейся оплодотворенной яйцеклетки.
Под влиянием прогестерона протекают следующие процессы:
1. Происходит секреторная трансформация, увеличивается число кровеносных сосудов, которые будут обеспечивать питание бластоцисты после имплантации. Гормон способен тормозить сократительную активность миометрия. Это необходимо для сохранения беременности и предупреждения отторжения зародыша.
Это необходимо для сохранения беременности и предупреждения отторжения зародыша.
2. Перестраивается эпителий канала шейки матки. Он проиводит большое количество слизи, которая не позволяет проникать внутрь патогенным микроорганизмам.
3. В начале беременности происходит усиленное воздействие долек молочной железы и альвеолярных ходов. Грудная железа подготавливается к секреции молока.
Повышенный прогестерон при беременности проявляется:
- Увеличением отложения подкожного жира.
- Задержкой жидкости в организме, что приводит к появлению отеков
- Повышением сальность и кожи и склонностью к образованию угрей
- Ослабление иммунитета для предотвращения отторжения организмом матери плода.
- Нарушение моторики кишечника
- Торможение психических процессов в коре головного мозга – проявляется нестабильность настроения, плаксивость, снижением памяти.
У беременных уровень прогестерона может измениться как в большую, так и в меньшую сторону.
 Причины снижения концентрации разнообразны. На ранних сроках его недостаточность может говорить о нарушении функции желтого тела и плаценты.
Причины снижения концентрации разнообразны. На ранних сроках его недостаточность может говорить о нарушении функции желтого тела и плаценты.Пройти необходимые обследования и получить консультацию опытного специалиста Вы можете в клинике Dixion в удобное для Вас время и день. Будьте здоровы!
17-ОН – что это такое? Свойства и показания
Материал для исследования: сыворотка.
Подготовка к исследованию: кровь сдается натощак; у женщин обычно кровь для исследования берут на 3-5 день цикла.
17-ОН-прогестерон (17-гидроксипрогестерон) — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона. В надпочечниках 17-ОН-прогестерон (при участии 21-гидроксилазы и 11-b-гидроксилазы) далее превращается в кортизол. 17-ОН-прогестерон может также превращаться в андростендион — предшественник тестостерона и эстрадиола.
Для 17-ОН-прогестерона характерны АКТГ-зависимые суточные колебания (максимальные значения выявляются утром, минимальные ночью). У женщин образование 17-ОН-прогестерона в яичниках колеблется в течение менструального цикла. За день до пика лютеинизирующего гормона (ЛГ) наблюдается значительный подъем 17-ОН-прогестерона, затем следует пик, который совпадает с пиком ЛГ в середине цикла, после этого наступает кратковременное понижение, сменяющееся подъемом, коррелирующим с уровнем эстрадиола и прогестерона. Содержание 17-ОН-прогестерона увеличивается во время беременности. Уровень 17-ОН-прогестерона зависит от возраста: высокие значения наблюдаются в течение фетального периода и сразу после рождения (у недоношенных новорожденных концентрации 17-ОН-прогестерона относительно выше). В течение первой недели жизни уровень 17-ОН-прогестерона падает и остается постоянно низкими в детстве, прогрессивно повышается в период половой зрелости, достигая концентрации взрослых.
У женщин образование 17-ОН-прогестерона в яичниках колеблется в течение менструального цикла. За день до пика лютеинизирующего гормона (ЛГ) наблюдается значительный подъем 17-ОН-прогестерона, затем следует пик, который совпадает с пиком ЛГ в середине цикла, после этого наступает кратковременное понижение, сменяющееся подъемом, коррелирующим с уровнем эстрадиола и прогестерона. Содержание 17-ОН-прогестерона увеличивается во время беременности. Уровень 17-ОН-прогестерона зависит от возраста: высокие значения наблюдаются в течение фетального периода и сразу после рождения (у недоношенных новорожденных концентрации 17-ОН-прогестерона относительно выше). В течение первой недели жизни уровень 17-ОН-прогестерона падает и остается постоянно низкими в детстве, прогрессивно повышается в период половой зрелости, достигая концентрации взрослых.
Дефицит ферментов, участвующих в синтезе стероидов (в 90% случаев это дефицит 21-гидроксилазы), вызывает снижение уровня кортизола и альдостерона и накопление промежуточных продуктов, к которым относится 17-ОН-прогестерон. Определение 17-ОН-прогестерона (базального и АКТГ-стимулированного уровня) преимущественно используется в диагностике различных форм дефицита 21-гидроксилазы и мониторинге пациентов с врожденной гиперплазией надпочечников (врожденный адреногенитальный синдром).
Определение 17-ОН-прогестерона (базального и АКТГ-стимулированного уровня) преимущественно используется в диагностике различных форм дефицита 21-гидроксилазы и мониторинге пациентов с врожденной гиперплазией надпочечников (врожденный адреногенитальный синдром).
Показания к назначению анализа:
диагностика и мониторинг пациентов с врожденной гиперплазией надпочечников и другими формами дефицита 21-гидроксилазы и 11-гидроксилазы; гирсутизм; нарушения цикла и бесплодие у женщин; опухоли надпочечников.
Повышение уровня: врожденная гиперплазия надпочечников, обусловленная дефицитом 21-гидроксилазы или 11-b-гидроксилазы;
некоторые случаи опухолей надпочечников или яичников.
Понижение уровня: болезнь Аддисона; псевдогермафродитизм у мужчин (дефицит 17a-гидроксилазы).
НОРМА:
мужчины 0,5-2,1 нг/мл
женщины:
фолликулиновая фаза 0,1-0,8 нг/мл
лютеиновая фаза 0,6-2,3 нг/мл
овуляторный пик 0,3-1,4 нг/мл
постменопауза 0,13-0,51 нг/мл
3 триместр беременности 2,0-12 нг/мл
Новорожденные:
5-30 дней до 2,5 нг/мл
31-60 дней (девочки) 0,5-2,3 нг/мл
31-60 дней (мальчики) 0,8-5,0 ммл
Дети: 3-14 лет 0,07-1,7 мг/мл
Анализ крови на гормоны, норма и расшифровка результатов показателей
Гормоны – это биологически активные вещества, которые вырабатываются эндокринной системой. Они отвечают за работу большинства жизненно важных органов, регулируют рост и обмен веществ. Хотя их содержание в кровеносной системе, по сравнению с другими компонентами, незначительное, они играют одну из ключевых ролей в организме. Различные гормоны выполняют разные функции, они могут как дополнять друг друга, так и вызывать негативный эффект. Для того, чтобы наш организм нормально функционировал, его гормональный фон должен находиться в равновесии. Отклонения в ту или иную сторону незамедлительно приводят к расстройствам, а иногда даже к серьезным патологиям. Гормональные нормы – это не постоянная единица, их процентное содержание зависит от пола, возраста и ряда других факторов.
Они отвечают за работу большинства жизненно важных органов, регулируют рост и обмен веществ. Хотя их содержание в кровеносной системе, по сравнению с другими компонентами, незначительное, они играют одну из ключевых ролей в организме. Различные гормоны выполняют разные функции, они могут как дополнять друг друга, так и вызывать негативный эффект. Для того, чтобы наш организм нормально функционировал, его гормональный фон должен находиться в равновесии. Отклонения в ту или иную сторону незамедлительно приводят к расстройствам, а иногда даже к серьезным патологиям. Гормональные нормы – это не постоянная единица, их процентное содержание зависит от пола, возраста и ряда других факторов.
Общее определение
Анализ крови на гормоны позволяет выявить, не нарушен ли гормональный баланс. Сегодня отмечается рост эндокринных заболеваний, вызванных расстройством функций желез внутренней секреции. Чтобы предотвратить негативные последствия, своевременно начав терапию, рекомендовано регулярно проверять свой гормональный фон. Это можно сделать в нашем многопрофильном медицинском центре «ВЫМПЕЛ-МЕДЦЕНТР». Высококвалифицированные специалисты, в распоряжении которых находится лучшее диагностическое оборудование, помогут выявить проблемы в работе организма на самых ранних стадиях.
Это можно сделать в нашем многопрофильном медицинском центре «ВЫМПЕЛ-МЕДЦЕНТР». Высококвалифицированные специалисты, в распоряжении которых находится лучшее диагностическое оборудование, помогут выявить проблемы в работе организма на самых ранних стадиях.
Когда назначается исследование гормонального фона
Практически во всех жизненно важных процессах человеческого организма так или иначе принимают участие гормоны. Начиная с самого рождения, они регулируют здоровье человека, его психоэмоциональное состояние и жизнь в целом. За счет этих биологически активных веществ человек приспосабливается к изменениям окружающей среды, вступает в отношения, заводит детей, другими словами, нормально существует. Нарушение же гормонального баланса может иметь самые серьезные последствия.
Анализ крови на гормоны просто так не назначается. То есть при плановом осмотре делать исследование эндокринной системы никто не будет. Подобная диагностика, как правило, проводится исключительно по направлению врача, который имеет подозрение на нарушения в работе щитовидной железы, сахарный диабет или другое эндокринное заболевание. Помимо этого, такой анализ часто назначается девушкам и женщинам, страдающим постоянными сбоями менструального цикла, бесплодием, угревой сыпью, периодическими выкидышами и ожирением.
Помимо этого, такой анализ часто назначается девушкам и женщинам, страдающим постоянными сбоями менструального цикла, бесплодием, угревой сыпью, периодическими выкидышами и ожирением.
Для беременных женщин — это одно из обязательных исследований, так как недостаток того или иного гормона может привести к необратимым последствиям.
Как правильно сдавать
Кровь на анализ берется из вены. В зависимости от симптоматики доктор выделяет группу гормонов, которые нужно проверить. Желательно за 12 часов полностью ограничить физические и психоэмоциональные нагрузки, не употреблять спиртные напитки, медпрепараты и еду, содержащую йод.
Особого внимания требует подготовка к сдаче образцов крови для представительниц прекрасной половины – она должна проводиться в определенный промежуток менструального цикла, который обозначает доктор. Сама процедура сдачи, как правило, назначается на утренние часы, на пустой желудок.
Общие показатели, расшифровка
Полное представление о состоянии организма и гормонального фона можно получить, сдав один из следующих видов анализов:
Гормоны щитовидной железы:
- Т4 свободный – одно из наиболее важных биологически активных веществ щитовидной железы, которое отвечает за транспортировку белковых соединений и поддержания их оптимального баланса в организме.
 Нормальный показатель содержания в плазме для здорового человека равен от 10 до 22 ммоль/л. Переизбыток говорит о соматических или психических недугах, липемии. Дефицит – о беременности, плохом питании, больших физических нагрузках, употреблении ряда лекарственных препаратов.
Нормальный показатель содержания в плазме для здорового человека равен от 10 до 22 ммоль/л. Переизбыток говорит о соматических или психических недугах, липемии. Дефицит – о беременности, плохом питании, больших физических нагрузках, употреблении ряда лекарственных препаратов. - ТТГ – непосредственно влияет на щитовидку, отвечает за циркуляцию ее компонентов. Норма для абсолютно здорового человека – от 0,4 до 4 мЕд/литр. Превышение говорит о надпочечниковой недостаточности, сложной нетироидной патологии и т.д. Низкий уровень – о тиреотоксикозе, дисбалансе кортизола и т.д.
- Т3 общий – нужен для стабилизации периферийных желез внутренней секреции. Норма – 1,3 – 2,7 нМоль/л. Переизбыток гормона говорит о беременности, приеме наркотических средств или эстрогенов. Недостаток – о патологии ЖКТ, акромегалии, гемолизе, голодании и других расстройствах.
- Т4 общий – одно из главных биоактивных веществ щитовидной железы. Правильные показатели – от 59 до 160 нмоль/л. Выход за рамки этих цифр в большую сторону может говорить об ожирении, наличии гепатита, беременности и т.
 д., в меньшую – о голодании, чересчур больших физических нагрузках, болезнях почек и ЖКТ.
д., в меньшую – о голодании, чересчур больших физических нагрузках, болезнях почек и ЖКТ. - Т3 свободный – стимулирует циркуляцию кислорода в мягких тканях. Норма находится в пределах – от 2,6 до 5,6 пмоль на литр. Превышение показателей говорит о гипертиреозе, токсикозе, недостача – о синдроме периферического сопротивления сосудов, приеме йодсодержащих лекарственных препаратов.
- Антитела к тиреоглобулину (АТ-ТГ) помогают выявить некоторые аутоиммунные болезни. Нормальный показатель находится в рамках от 0 до 4,11 Ед/мл.
- ТСГ – один из основных функциональных элементов щитовидной железы. Норма для здорового человека лежит в пределах от 258 до 574 нмоль/литр. Больший показатель может указывать на беременность, гепатит или гипопротеинемию.
Половые гормоны:
- Эстрадиол – активный компонент в крови женщин, который отвечает за созревание половых клеток и влияет на правильное развитие плода во время беременности. Норма разнится в зависимости от жизненного цикла: от 200 до 286 пм/л (для дам в фолликулярной фазе), от 52 до 136 пм/л (для женщин в период менопаузы) и от 441 до 576 (девушек в лютеиновой фазе).
 Переизбыток говорит об возможных опухолях на яичниках, недостаток – о сбое выделения гонадотропных гормонов.
Переизбыток говорит об возможных опухолях на яичниках, недостаток – о сбое выделения гонадотропных гормонов. - Тестостерон – непосредственно влияет на нарастание мышечной массы, укрепление костей, формирование половых признаков. Показатели лежат в пределах от 2 до 10 нг/мл у мужчин и от 0,2 до 1 у женщин
- Прогестерон — появляется в организме после формирования яйцеклетки. Гормон беременности, как его еще называют, отвечает за стабильность развития внутриутробного плода. Норма – от 22 до 30 нм/л в лютеиновой фазе, 1 – 2,3 нм/л в фолликулярной фазе, 1 – 1,8 при менопаузе. Если значение выше нормы, то это может свидетельствовать о патологических процессах в коре надпочечников, если меньше – о склерозе яичников.
Гормоны гипофиза:
- АКТГ – отвечает за выделение биоактивных веществ в коре надпочечников. Корректные показатели – до 50 пг/мл. Если больше – возможна гиперплазия, меньше – надпочечниковая недостаточность, опухоль.
- Пролактин — отвечает за стимуляцию лактации у женщин, работу простаты у представителей сильной половины.
 Для последних норма составляет от 100 до 266 мкг/л, для дам в детородном возрасте от 129 до 539 мкг/л, женщин в менопаузе – от 106 до 289 мкг/л.
Для последних норма составляет от 100 до 266 мкг/л, для дам в детородном возрасте от 129 до 539 мкг/л, женщин в менопаузе – от 106 до 289 мкг/л. - СТГ – отвечает за развитие костной и мышечной массы и других важных органов. Норма – до 10 нг/мл. Повышенные показатели говорят об акромегалии или гигантизме, пониженные свидетельствуют о гипофизарном нанизме.
- ЛГ – обеспечивает полное созревание яйцеклетки у женщин и сперматозоидов у мужчин. Норма для парней – от 2,12 до 4 мЕД/мл, для девушек, в зависимости от менструального цикла – от 1,55 до 53 мЕД/мл. Отклонение в ту или иную сторону – признак разных дисфункций половых желез.
Гормоны надпочечников:
- Адреналин и норадреналин – отвечают за ритм работы сердечной мышцы, давление, сосуды, моторику, формируют уровень глюкозы. Корректные показатели – от 1,9 до 2,45 нм/л и от 0,6 до 3,22 соответственно. Переизбыток сигнализирует о желтухе, почечных патологиях, недостаток – о миастении либо поражении гипоталамуса.

- Кортизол – отвечает за восприимчивость к аллергическим реакциям, систематизирует производство антител. Норма – от 229 до 749 нм/л. Если показатели меньше, есть вероятность болезни Аддисона или заболевания надпочечников, превышение нормы свидетельствует о аденоме или раке.
- Альдостерон – важный гормон, отвечающий за баланс воды и соли. Правильное значение колеблется от 30 до 172 пг/мл. Недостаток – признак тромбоза, плохого питания, эмболии артерии. Избыток может говорить о новообразовании в надпочечниках или гиперплазии.
Резюме
Нельзя пренебрегать сдачей анализов на гормоны, которую рекомендует Ваш лечащий врач. Подобная диагностика позволяет выявить серьезные заболевания еще на стадии их первичного формирования, тем самым увеличив шансы на быстрое выздоровление. «ВЫМПЕЛ-МЕДЦЕНТР» – это высококачественные и точные исследования, подробные консультации и лечение различных заболеваний в Москве. Записаться на прием Вы можете на сайте или по телефону.
Дата публикации: 24.09.2020 16:28:13
Уровень прогестерона в сыворотке и частота продолжающихся беременностей после переноса замороженных-размороженных эмбрионов после подготовки искусственного эндометрия: моноцентрическое ретроспективное исследование
Вступление: В некоторых исследованиях частота потери беременности на ранних сроках (EPL) выше при искусственном цикле (AC) подготовки эндометрия к переносу замороженного-размороженного эмбриона (FET), чем при использовании других протоколов, хотя частота наступления беременности аналогична.Эти данные можно объяснить недостаточной поддержкой лютеиновой фазы. Целью этого исследования было сравнение уровней прогестерона (PG) в сыворотке у пациенток, у которых была беременность после FET с препаратом эндометрия AC, между теми, у которых была EPL или продолжающаяся беременность.
Материал и методы: Моноцентрическое ретроспективное когортное исследование, проведенное в центре репродуктивной медицины при университете, изучило 130 циклов FET с подготовкой эндометрия AC в период с июня 2016 года по июль 2017 года. Уровни PG в сыворотке сравнивали в соответствии с репродуктивными исходами и протоколом подготовки эндометрия на 10 или 12 день после FET (PG0) в зависимости от стадии эмбриона и каждые 48 часов в случае беременности (то есть PG1; PG2).
Уровни PG в сыворотке сравнивали в соответствии с репродуктивными исходами и протоколом подготовки эндометрия на 10 или 12 день после FET (PG0) в зависимости от стадии эмбриона и каждые 48 часов в случае беременности (то есть PG1; PG2).
Результаты: Среди пациенток, у которых была беременность после FET с AC (n = 33), уровни PG в сыворотке были выше в случае продолжающейся беременности, чем EPL, только значительно на PG1 (PG0 12.4 нг / мл [7,5–14,6] против 8,2 нг / мл [6,0–13,0], p = 0,320; PG1 15,0 нг / мл [14,0-15,9] против 8,5 нг / мл [5,9-13,8], p = 0,048).
Обсуждение: Мы обнаружили, что уровень PG в сыворотке был ниже у женщин, перенесших раннюю потерю беременности после FET с подготовкой эндометрия AC, что может отражать отсутствие соответствующей поддержки лютеиновой фазы с помощью PG. Циклический тест AC, отслеживающий уровень PG в сыворотке после его устойчивого состояния, может обнаружить этот недостаток PG, что позволяет врачам адаптировать добавку PG.
Циклический тест AC, отслеживающий уровень PG в сыворотке после его устойчивого состояния, может обнаружить этот недостаток PG, что позволяет врачам адаптировать добавку PG.
Ключевые слова: Искусственный цикл; Потеря беременности на ранних сроках; Перенос замороженных эмбрионов; Заместительная гормональная терапия; Поддержка лютеиновой фазы; Прогестерон.
Уровни прогестерона позволяют прогнозировать исходы беременности у лиц с бесплодием, связанным с фаллопиевыми трубами | BMC по беременности и родам
Дизайн исследования
Это ретроспективное исследование было проведено на когорте участников, проходивших лечение в Центре репродуктивной медицины и генетики при провинциальной больнице традиционной китайской медицины Шаньдун с января 2010 года по ноябрь 2018 года.Из случаев, замеченных в течение периода исследования, 854 соответствовали нашим критериям включения. Этическое одобрение этого исследования было предоставлено этическим комитетом больницы традиционной китайской медицины провинции Шаньдун.
Этическое одобрение этого исследования было предоставлено этическим комитетом больницы традиционной китайской медицины провинции Шаньдун.
Критерии включения пациентов
Участвовавшие женщины были включены только в том случае, если они соответствовали следующим критериям: (i) у них проводилась вспомогательная репродукция с переносом свежего аутологичного эмбриона на 3-й день после получения ооцитов; (ii) имел бесплодие, вызванное факторами маточной трубы; (iii) они были нормальными респондентами яичников (6-19 ооцитов) [10] и (iv) имели уровни фолликулостимулирующего гормона (ФСГ) <10 МЕ / л на второй день менструации.Пациенты были исключены из исследования, если их причины для ЭКО были связаны с мужским бесплодием, яичниками, эндометриозом, генетическими, маточными или идиопатическими факторами. Также были исключены пациенты с гидросальпинксом.
Протоколы контролируемой гиперстимуляции яичников
Снижение регуляции гипофиза было достигнуто путем лечения агонистом ГнРГ (Трипторелин® / Диферелин®) или антагонистом (Ганиреликс® / Цетротид®). Выбор протокола и дозы гонадотропина были индивидуализированы в зависимости от клинической картины пациента и предпочтений врача.Дозировка гонадотропинов (Puregon® / Gonal®) варьировала от 75 до 450 МЕ / день. Когда доминантный фолликул достигал ≥ 18 мм в диаметре, добавляли 10000 МЕ ХГЧ (Овидрел®) или 0,1 мг агониста ГнРГ плюс 4000 МЕ ХГЧ, чтобы вызвать окончательное созревание, и яйцеклетка собиралась через 36 часов после обработки. Сыворотка была получена от участников перед введением ХГЧ или агониста гонадолиберина. Уровни прогестерона в сыворотке определяли количественно с использованием количественного электрохемилюминесцентного иммунного анализа «ECLIA» на иммуноанализаторе (Beckman Coulter).Сперму собирали путем мастурбации перед ЭКО, а эмбрионы переносили через 3 дня после извлечения ооцитов. Качество эмбрионов определялось в соответствии с рекомендациями Общества вспомогательных репродуктивных технологий и оценивалось как хорошее, удовлетворительное или плохое. Лютеиновая поддержка обеспечивалась вагинальным введением фосфора или внутримышечной инъекцией фосфора.
Выбор протокола и дозы гонадотропина были индивидуализированы в зависимости от клинической картины пациента и предпочтений врача.Дозировка гонадотропинов (Puregon® / Gonal®) варьировала от 75 до 450 МЕ / день. Когда доминантный фолликул достигал ≥ 18 мм в диаметре, добавляли 10000 МЕ ХГЧ (Овидрел®) или 0,1 мг агониста ГнРГ плюс 4000 МЕ ХГЧ, чтобы вызвать окончательное созревание, и яйцеклетка собиралась через 36 часов после обработки. Сыворотка была получена от участников перед введением ХГЧ или агониста гонадолиберина. Уровни прогестерона в сыворотке определяли количественно с использованием количественного электрохемилюминесцентного иммунного анализа «ECLIA» на иммуноанализаторе (Beckman Coulter).Сперму собирали путем мастурбации перед ЭКО, а эмбрионы переносили через 3 дня после извлечения ооцитов. Качество эмбрионов определялось в соответствии с рекомендациями Общества вспомогательных репродуктивных технологий и оценивалось как хорошее, удовлетворительное или плохое. Лютеиновая поддержка обеспечивалась вагинальным введением фосфора или внутримышечной инъекцией фосфора. Уровни ХГЧ в сыворотке определялись через 14 дней после переноса свежих эмбрионов, а значения бета ≥ 50 МЕ считались положительным признаком беременности. Клинически беременность определялась наличием внутриутробного сердцебиения при трансвагинальном УЗИ на 7 неделе аменореи.Живорожденными считаются дети, родившиеся после 28 недель беременности.
Уровни ХГЧ в сыворотке определялись через 14 дней после переноса свежих эмбрионов, а значения бета ≥ 50 МЕ считались положительным признаком беременности. Клинически беременность определялась наличием внутриутробного сердцебиения при трансвагинальном УЗИ на 7 неделе аменореи.Живорожденными считаются дети, родившиеся после 28 недель беременности.
Сбор данных
Данные были получены из электронных медицинских карт АРТ. Оцениваемые характеристики участников включали возраст, индекс массы тела (ИМТ), продолжительность с момента постановки диагноза бесплодия и базальные уровни ФСГ в сыворотке. Дополнительные параметры, которые были проанализированы, включали протоколы, используемые для контролируемой гиперстимуляции яичников, общая продолжительность гонадотропина (Gn), доза Gn, пиковый уровень эстрадиола в сыворотке, уровень лютеинизирующего гормона (LH), уровни P в день введения ХГЧ, количество ооцитов. получено 2 пронуклеарных (PN) фертильности, общее количество эмбрионов, количество эмбрионов высокого качества, количество перенесенных эмбрионов на 3-й день, клинический статус беременности, количество успешных живорождений и количество новорожденных. Первичным показателем была корреляция между уровнями P в сыворотке в день индукции овуляции во время ЭКО и ее влиянием на исход лечения.
Первичным показателем была корреляция между уровнями P в сыворотке в день индукции овуляции во время ЭКО и ее влиянием на исход лечения.
Статистический анализ
Данные были проанализированы и представлены как среднее ± стандартное отклонение, частоты или проценты. Сначала были выполнены тесты на нормальность и однородность дисперсии. Если распределение популяции соответствовало нормальности и дисперсия была удовлетворена, то выполнялись параметрические тесты. Количественные переменные сравнивались с использованием независимых t-критериев Стьюдента, в то время как дисперсионный анализ и категориальные данные сравнивались с использованием критериев хи-квадрат.В противном случае проводились непараметрические тесты. Коэффициенты корреляции Пирсона были рассчитаны для установления связи между P и клиническими параметрами. Анализ рабочих характеристик приемника (ROC) был проведен для установления наиболее эффективных значений порогового значения P для различения успешных и неудачных исходов ЭКО у женщин, перенесших трансплантацию свежего эмбриона на третий день. Наилучшие значения отсечки были установлены на основе эквивалентной чувствительности и специфичности, а также наивысшего значения для площади под кривой ROC (AUC).В каждой когорте использовались одномерные и многомерные модели анализа для проверки преимущественного влияния всех независимых на LBR. Статистические различия считались значимыми при p ≤ 0,05). Статистический анализ проводился с использованием статистического пакета SPSS версии 21 (IBM).
Наилучшие значения отсечки были установлены на основе эквивалентной чувствительности и специфичности, а также наивысшего значения для площади под кривой ROC (AUC).В каждой когорте использовались одномерные и многомерные модели анализа для проверки преимущественного влияния всех независимых на LBR. Статистические различия считались значимыми при p ≤ 0,05). Статистический анализ проводился с использованием статистического пакета SPSS версии 21 (IBM).
Прогестерон | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Sit, A. et. al. (10 мая 2017 г., обновлено). Прогестерон сыворотки. Медицинская энциклопедия MedlinePlus.Доступно на сайте https://medlineplus.gov/ency/article/003714.htm. Доступно 07.07.18.
(31 января 2017 г., обновлено). Как диагностируется бесплодие? Национальные институты здоровья. Юнис Кеннеди Шрайвер. Национальный институт детского здоровья и развития человека. Доступно в Интернете по адресу https://www. nichd.nih.gov/health/topics/infertility/conditioninfo/diagnposed. Доступно 07.07.18.
nichd.nih.gov/health/topics/infertility/conditioninfo/diagnposed. Доступно 07.07.18.
Bayrak-Toydemir, P. et. al. (Март 2018 г., обновлено). Бесплодие. ARUP Consult. Доступно в Интернете по адресу https: // arupconsult.ru / content / infertility. Доступно 07.07.18.
(© 1995–2018). Прогестерон. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/8141. Доступно 07.07.18.
(октябрь 2017 г.). FAQ по оценке бесплодия. Американский колледж акушеров и гинекологов. Доступно в Интернете по адресу https://www.acog.org/Patients/FAQs/Evaluating-Infertility. Доступно 07.07.18.
(© 2018). Что такое прогестерон? Сеть гормонального здоровья.Доступно в Интернете по адресу https://www.hormone.org/hormones-and-health/hormones/progesterone. Доступно 07.07.18.
Пинкертон, Дж. (Сентябрь 2017 г.). Аменорея. Руководство Merck Professional Version. Доступно на сайте https://www.merckmanuals. com/professional/gynecology-and-obstetrics/menstrual-abnormalities/amenorrhea. Доступно 07.07.18.
com/professional/gynecology-and-obstetrics/menstrual-abnormalities/amenorrhea. Доступно 07.07.18.
Источники, использованные в предыдущих обзорах
Девкота, Б. (Обновлено 16 января 2014 г.) Прогестерон. Справочник по Medscape [Он-лайн информация].Доступно в Интернете по адресу http://emedicine.medscape.com/article/2089378-overview. По состоянию на апрель 2014 г.
Пушек, Э. и Вудард, Т. (обновлено 10 июня 2013 г.). Бесплодие. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/274143-overview#showall. По состоянию на апрель 2014 г.
Meikle, A. и Straseski, J. (обновлено в ноябре 2013 г.). Бесплодие. ARUP Consult [Он-лайн информация]. Доступно в Интернете по адресу http: // www.arupconsult.com/Topics/Infertility.html?client_ID=LTD#tabs=0. По состоянию на апрель 2014 г.
Форвик, Л. (Обновлено 8 февраля 2013 г.). Бесплодие. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001191.htm. По состоянию на апрель 2014 г.
Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001191.htm. По состоянию на апрель 2014 г.
Форвик, Л. (Обновлено 2 июня 2011 г.). Прогестерон сыворотки. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003714.htm. По состоянию на апрель 2014 г.
(© 1995–2014). Прогестерон, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8141. По состоянию на апрель 2014 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2011). Справочник Мосби по диагностике и лабораторным испытаниям, 10-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 786-787.
Кларк, У., редактор (© 2011). Современная практика клинической химии, 2-е издание: AACC Press, Вашингтон, округ Колумбия.С. 476-477.
Томас, Клейтон Л. , редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
, редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник Мосби по диагностике и лабораторным испытаниям, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
Ориэл, К. и Шрагер, С. (1 октября 1999 г.). Аномальное маточное кровотечение. Американский семейный врач [Электронный журнал]. Доступно в Интернете по адресу http://www.aafp.org/afp/9
ap/1371.html.Chen, P. Обновлено (10 августа 2001 г., обновлено). Прогестерон сыворотки. Информация о здоровье MedlinePlus [онлайн-информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003714.htm.
Теноре, Дж. (15 февраля 2000 г.). Внематочная беременность. Американский семейный врач [Электронный журнал]. Доступно в Интернете по адресу http://www.aafp.org/afp/20000215/1080.html.
NHLBI (2002). Инициатива по охране здоровья женщин. Новые факты об эстрогеновой / прогестиновой гормональной терапии. Национальные институты здоровья, Национальный институт сердца, легких и крови [Он-лайн информация]. Доступно в Интернете по адресу http://www.nhlbi.nih.gov/whi/hrtupd/ep_facts.htm.
Национальные институты здоровья, Национальный институт сердца, легких и крови [Он-лайн информация]. Доступно в Интернете по адресу http://www.nhlbi.nih.gov/whi/hrtupd/ep_facts.htm.
ARUP. Прогестерон. Руководство ARUP по клиническим лабораторным исследованиям (CLT) [онлайн-информация]. Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_148b.htm.
Spengler, R. (30 октября 2000 г., обновлено). Прогестерон. WebMD [он-лайн информация]. Доступно в Интернете по адресу http://my.webmd.com/encyclopedia/article/1689.52570.
NCI (2002, 16 июля). Вопросы и ответы: использование гормонов после менопаузы. Национальный институт рака, новости NCI [он-лайн пресс-релиз]. Доступно в Интернете по адресу http://newscenter.cancer.gov/pressreleases/estrogenplus.html.
Merck. Гормоны и размножение. Руководство по медицинской информации Merck — Домашняя версия [Он-лайн информация]. Доступно в Интернете по адресу http://www.merck.com/pubs/mmanual_home/sec22/232. htm.
htm.
Пагана, К. Д. и Пагана, Т. Дж. (© 2007).Справочник Мосби по диагностике и лабораторным испытаниям, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 763-764.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 359-360.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури. С. 894-897.
Форвик, Л. и Сторк, С. (Обновлено 12 апреля 2009 г.). Прогестерон сыворотки. Медицинская энциклопедия MedlinePlus [Он-лайн информация].Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003714.htm. По состоянию на ноябрь 2009 г.
(© 2003). Американское общество репродуктивной медицины. Возраст и фертильность, Руководство для пациентов [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.asrm.org/Patients/patientbooklets/agefertility.pdf. По состоянию на ноябрь 2009 г.
Повышение уровня прогестерона в сыворотке отрицательно влияет на совокупную частоту живорождений у различных яичников, отвечающих на вопросы во время экстракорпорального оплодотворения и переноса эмбрионов: большое ретроспективное исследование
Abstract
Для изучения взаимосвязи между уровнем прогестерона (P) в сыворотке крови в день введения хорионического гонадотропина (ХГЧ) и совокупной частотой живорождений у пациентов с различным ответом яичников во время оплодотворения in vitro (ЭКО) мы провела это ретроспективное когортное исследование с участием 4651 пациента, прошедшего первые циклы ЭКО с января 2011 года по декабрь 2012 года.Все пациенты с окончательным исходом живорождения (4332 пациентки) были разделены на три группы в соответствии с ответом яичников: плохой ответ яичников (≤5 ооцитов, 785 пациенток), средний ответ яичников (6-19 ооцитов, 3065 пациентов) и высокий ответ яичников. (≥20 ооцитов, 482 пациента). Пороговые значения повышения P в сыворотке составляли 1,60 нг / мл, 2,24 нг / мл и 2,50 нг / мл для пациентов с плохим, средним и высоким уровнем ответа яичников, соответственно. Кумулятивный коэффициент живорождения за цикл извлечения ооцитов был рассчитан в каждой группе.Взаимосвязь между уровнем P в сыворотке и кумулятивным коэффициентом живорождения оценивалась как с помощью одномерного, так и многомерного логистического регрессионного анализа. Кумулятивная частота живорождений за цикл извлечения ооцитов была обратно пропорциональна уровню P в сыворотке у пациентов с различным ответом яичников. Для всех респондентов пациенты с повышенным уровнем P имели значительно большее количество извлеченных ооцитов, но более низкую частоту эмбрионов высокого качества и более низкий кумулятивный коэффициент живорождения по сравнению с пациентами с нормальным уровнем P в сыворотке.Кроме того, уровень фосфора в сыворотке отрицательно повлиял на совокупную частоту живорождений как при одномерном, так и при многомерном логистическом регрессионном анализе, независимо от реакции яичников. Повышение уровня P в сыворотке в день введения ХГЧ отрицательно влияет на совокупную частоту живорождений за цикл извлечения ооцитов у пациентов с различной реакцией яичников.
Кумулятивный коэффициент живорождения за цикл извлечения ооцитов был рассчитан в каждой группе.Взаимосвязь между уровнем P в сыворотке и кумулятивным коэффициентом живорождения оценивалась как с помощью одномерного, так и многомерного логистического регрессионного анализа. Кумулятивная частота живорождений за цикл извлечения ооцитов была обратно пропорциональна уровню P в сыворотке у пациентов с различным ответом яичников. Для всех респондентов пациенты с повышенным уровнем P имели значительно большее количество извлеченных ооцитов, но более низкую частоту эмбрионов высокого качества и более низкий кумулятивный коэффициент живорождения по сравнению с пациентами с нормальным уровнем P в сыворотке.Кроме того, уровень фосфора в сыворотке отрицательно повлиял на совокупную частоту живорождений как при одномерном, так и при многомерном логистическом регрессионном анализе, независимо от реакции яичников. Повышение уровня P в сыворотке в день введения ХГЧ отрицательно влияет на совокупную частоту живорождений за цикл извлечения ооцитов у пациентов с различной реакцией яичников.
Образец цитирования: Bu Z, Zhao F, Wang K, Guo Y, Su Y, Zhai J, et al. (2014) Повышение уровня прогестерона в сыворотке отрицательно влияет на совокупную частоту живорождений у различных респондеров яичников во время оплодотворения In vitro и переноса эмбрионов: большое ретроспективное исследование.PLoS ONE 9 (6): e100011. https://doi.org/10.1371/journal.pone.0100011
Редактор: Цин-Юань Сунь, Институт зоологии Китайской академии наук, Китай
Поступила: 9 апреля 2014 г .; Принята к печати: 19 мая 2014 г .; Опубликовано: 13 июня 2014 г.
Авторские права: © 2014 Bu et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Авторы подтверждают, что все данные, лежащие в основе выводов, полностью доступны без ограничений. Нет данных.
Финансирование: Эта работа была поддержана Национальным фондом естественных наук Китая (грант № 31271605 и U1304315) и Молодежным фондом Первой дочерней больницы Университета Чжэнчжоу. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Связь между уровнем прогестерона (P) в сыворотке крови в день введения хорионического гонадотропина (ХГЧ) человека и исходом оплодотворения in vitro / интрацитоплазматической инъекции сперматозоидов (ИКСИ) и переноса эмбриона (ЭТ) спорна в течение нескольких десятилетий [1], [2], [3], [4], [5], [6]. В большинстве исследований оценивалась связь между уровнем P в сыворотке и клиническим исходом в свежих циклах ЭКО / ИКСИ и утверждается, что повышение уровня P в сыворотке в день введения ХГЧ может отрицательно повлиять на клинический результат, ставя под угрозу восприимчивость эндометрия [7], [8], [7], [8], [ 9]. Однако криоконсервация эмбрионов сейчас широко используется во всем мире, что дает клиницистам возможность использовать избыточные эмбрионы в циклах переноса замороженных-размороженных эмбрионов (FET). Таким образом, многие центры репродуктивной медицины предлагают своим пациентам с повышенным уровнем фосфора в сыворотке дождаться переноса эмбрионов в следующих циклах FET. Поскольку замороженные эмбрионы также производятся в свежих циклах, чтобы оценить влияние повышения уровня фосфора в сыворотке на исход цикла ЭКО / ИКСИ, было бы логичнее рассмотреть совокупную частоту живорождений из свежих циклов и всех циклов FET вместе взятых. вместо того, чтобы просто смотреть на результат единственного свежего цикла.
Однако криоконсервация эмбрионов сейчас широко используется во всем мире, что дает клиницистам возможность использовать избыточные эмбрионы в циклах переноса замороженных-размороженных эмбрионов (FET). Таким образом, многие центры репродуктивной медицины предлагают своим пациентам с повышенным уровнем фосфора в сыворотке дождаться переноса эмбрионов в следующих циклах FET. Поскольку замороженные эмбрионы также производятся в свежих циклах, чтобы оценить влияние повышения уровня фосфора в сыворотке на исход цикла ЭКО / ИКСИ, было бы логичнее рассмотреть совокупную частоту живорождений из свежих циклов и всех циклов FET вместе взятых. вместо того, чтобы просто смотреть на результат единственного свежего цикла.
Еще один вопрос, который необходимо решить, — это взаимосвязь между уровнем P в сыворотке и ответом яичников. Недавние исследования показали, что уровень фосфора в сыворотке положительно связан с ответом яичников [10], [11]. Таким образом, разумно и важно оценить взаимосвязь между уровнем P в сыворотке и результатами ЭКО / ИКСИ в соответствии с различным ответом яичников.
Таким образом, целью настоящего исследования является изучение взаимосвязи между уровнем P в сыворотке в день введения ХГЧ во время ЭКО / ИКСИ и совокупной частотой живорождений за цикл извлечения ооцитов у пациентов с различным ответом яичников.
Материалы и методы
Пациенты
Это ретроспективное когортное исследование включало 4651 пациента, которым были выполнены первые циклы ЭКО / ИКСИ, проведенные в период с января 2011 г. по декабрь 2012 г. в Центре репродуктивной медицины Первой дочерней больницы Университета Чжэнчжоу, Китай. Циклы, проводимые для предимплантационной генетической диагностики (PGD) или с донорскими гаметами, были исключены из этого анализа. Все пациенты подписали письменное информированное согласие. Институциональный наблюдательный совет Первой дочерней больницы Университета Чжэнчжоу одобрил это исследование.
Протоколы контролируемой гиперстимуляции яичников
Понижающая регуляция гипофиза выполнялась с использованием стандартного протокола длинных агонистов ГнРГ, (модифицированного) протокола сверхдлинных агонистов ГнРГ или протокола антагонистов ГнРГ, как показано в предыдущих исследованиях [12], [13]. Выбор протокола и дозы гонадотропина были индивидуализированы в соответствии с основной информацией каждого пациента и предпочтениями клинициста.
Выбор протокола и дозы гонадотропина были индивидуализированы в соответствии с основной информацией каждого пациента и предпочтениями клинициста.
Оценка качества эмбрионов проводилась на стадии дробления.Критерии оценки были описаны в другом месте [14]. Эмбрионы 1 и 2 степени считались эмбрионами высокого качества. Перенос эмбрионов происходил между 2 и 6 днями после извлечения ооцитов. Количество перенесенных эмбрионов соответствовало национальным нормам и ответам и запросам яичников пациентки. Можно перенести максимум три эмбриона.
Криоконсервацию проводили через 3–6 дней после извлечения ооцитов. Подробности протоколов замораживания и оттаивания в нашем центре сообщались ранее [15].
Определения некоторых клинических параметров в этом исследовании представлены следующим образом: Скорость оплодотворения = количество 2 PN (пронуклеусов) / количество извлеченных ооцитов. Количество доступных эмбрионов = количество доступных эмбрионов / количество извлеченных ооцитов. Показатель высокого качества = количество эмбрионов высокого качества / количество извлеченных ооцитов.
Показатель высокого качества = количество эмбрионов высокого качества / количество извлеченных ооцитов.
Сбор данных
Данные получены из компьютеризированных баз данных. Были оценены характеристики пациентов, включая возраст, индекс массы тела (ИМТ), диагноз бесплодия, продолжительность бесплодия и базальный уровень гормона стимуляции фолликулов (ФСГ) в сыворотке крови.Также регистрировались другие параметры, полученные для каждого цикла, включая общую продолжительность и дозу гонадотропинов, пиковый уровень эстрадиола в сыворотке, уровень лютеинизирующего гормона (ЛГ) и уровень Р в день введения ХГЧ; количество ооцитов, полученных за цикл, частота оплодотворения, количество доступных эмбрионов, количество высококачественных эмбрионов и живорожденные. Первичным результатом было кумулятивное живорождение в свежем цикле и во всех циклах FET, объединенных после одного и того же цикла индексной стимуляции.
Статистический анализ
Пациенты были разделены на три группы в зависимости от ответа яичников: слабый ответ яичников (получено ≤5 ооцитов), средний ответчик яичников (получено 6-19 ооцитов) и высокий ответ яичников (получено ≥20 ооцитов).Затем во всех трех группах яичников пациенты были разделены на шесть отдельных групп в зависимости от уровня P в сыворотке крови в день введения ХГЧ: ≤0,49, 0,50–0,99, 1,00–1,49, 1,50–1,99, 2,00–2,49 и ≥2,50. нг / мл. Повышение уровня P в сыворотке в день введения ХГЧ определялось как кумулятивное 95% уровня P в каждой группе ответа яичников: плохой ответ яичников (≥1,60 нг / мл), средний ответ яичников (≥2,24 нг / мл) и высокий ответ яичников. (≥2,50 нг / мл).
Кумулятивный коэффициент живорождения был рассчитан для каждого интервала P.Коэффициенты корреляции порядка Спирмена использовались для определения взаимосвязи между уровнем P в сыворотке и основными характеристиками пациента. Демографические и клинические характеристики в группах с повышением P и без него сравнивались с использованием теста Стьюдента и критерия хи-квадрат, в зависимости от ситуации. Одномерный логистический регрессионный анализ использовался для изучения связи между всеми факторами и совокупным живорождением. А те, которые имели значительную связь с кумулятивным живорождением с помощью одномерного анализа, были включены в многомерную логистическую регрессию для дальнейшего анализа.
Статистический анализ проводился с использованием Статистической программы для социальных наук (SPSS Inc., версия 17.0, Чикаго, Иллинойс, США). Во всех случаях значение P <0,05 считалось статистически значимым.
Результаты
Характеристики пациента
Основная информация о пациентах представлена в таблице 1. Из 4651 пациента, прошедшего свои первые циклы ЭКО / ИКСИ, у 4332 пациентов был окончательный совокупный исход живорождений (2518 пациентов родились живыми, а у 1814 пациентов не было и не было эмбрионов. левый).Общий совокупный коэффициент живорождения у этих 4332 пациентов составил 58,18%.
В таблице 2 показана взаимосвязь между уровнем P в сыворотке крови в день введения ХГЧ и основными и клиническими параметрами пациента. Основываясь на простом регрессионном анализе объединенных данных, уровень P в сыворотке наиболее положительно коррелировал с количеством извлеченных ооцитов (r = 0,27, P = 0,00), уровнем E 2 в сыворотке в день введения ХГЧ (r = 0,41, P = 0,00).
Плохие ответчики яичников
На рис. 1 показана связь между совокупным коэффициентом живорождения и уровнем P в сыворотке у пациентов с плохим ответом яичников (n = 785).Кумулятивная частота живорождений отрицательно связана с уровнем P в сыворотке и резко снижается, когда P ≥1,50 нг / мл. По сравнению с пациентами в группе с повышением P в сыворотке (P ≥1,50 нг / мл), пациенты с не повышенным P в сыворотке (P <1,50 нг / мл) имели значительно более высокие уровни ФСГ и более низкие пиковые уровни E 2 . Между тем, количество извлеченных ооцитов было ниже в группе без повышения, даже несмотря на то, что разница не достигла статистической значимости. Однако результаты показывают, что количество высококачественных эмбрионов, доступная частота эмбрионов, частота высококачественных эмбрионов и совокупная частота живорождений были выше в группе без повышения, чем в группе с повышенным уровнем P в сыворотке (Таблица 3).
Одномерная логистическая регрессия показала, что возраст пациента, продолжительность бесплодия, базальный уровень ФСГ, количество извлеченных ооцитов, скорость оплодотворения, количество доступных эмбрионов, количество высококачественных эмбрионов, доступная частота эмбрионов, частота высококачественных эмбрионов и уровень сывороточного P на день введения ХГЧ были значительно связаны с кумулятивной частотой живорождений у пациентов с плохим ответом яичников. Однако после учета связанных факторов в многомерном логистическом регрессионном анализе только возраст пациента, продолжительность бесплодия и уровень P в сыворотке были связаны с кумулятивным коэффициентом живорождения (таблица 4).
Промежуточные ответчики яичников
Взаимосвязь между кумулятивным коэффициентом живорождения и уровнем P в сыворотке у респондеров со средним уровнем реакции яичников (n = 3 065) показана на Рисунке 2. Наблюдалось снижение кумулятивного коэффициента живорождений с прогрессивно более высокими концентрациями уровня P в сыворотке. По сравнению с пациентами без повышения уровня (P <2,24 нг / мл), пациенты с повышенным уровнем P (P ≥ 2,24 нг / мл) имели значительно более высокие пиковые уровни E 2 , количество извлеченных ооцитов и количество доступных эмбрионов.Несмотря на то, что частота оплодотворения, количество высококачественных эмбрионов, доступное количество эмбрионов и количество высококачественных эмбрионов были сопоставимы между этими двумя группами, кумулятивная частота живорождений была значительно ниже у пациентов с повышенным уровнем P по сравнению с пациентами без повышенного уровня (Таблица 5 ).
Рисунок 2.
Взаимосвязь между уровнем P в сыворотке в день введения ХГЧ и кумулятивным коэффициентом живорождения за цикл извлечения ооцитов у промежуточных респондентов из яичников (6≤ извлеченные ооциты ≤19).
https://doi.org/10.1371/journal.pone.0100011.g002
Как и в случае с плохими ответчиками яичников, одномерный логистический регрессионный анализ у промежуточных респондентов яичников также показал, что большинство параметров, включая уровень P в сыворотке, объединены в анализ. были связаны с совокупным коэффициентом живорождения. Однако при многомерном логистическом регрессионном анализе уровень P в сыворотке по-прежнему значимо ассоциировался с совокупным коэффициентом живорождения (таблица 4).
Ответчики с высоким уровнем яичников
У респондеров с высоким уровнем ответа яичников (n = 482) кумулятивная частота живорождений также снижалась с увеличением уровня P в сыворотке, особенно когда уровень P в сыворотке ≥2.50 нг / мл (рис. 3). Основная информация о пациентах и клинические параметры представлены в таблице 5. Доза гонадотропина и пиковый уровень E 2 были значительно выше у пациентов с повышенным уровнем P в сыворотке (P ≥ 2,50 нг / мл). Не было обнаружено различий в количестве извлеченных ооцитов, скорости оплодотворения, количестве доступных эмбрионов, количестве эмбрионов высокого качества, количестве доступных эмбрионов и количестве эмбрионов высокого качества. Однако совокупный коэффициент живорождения был значительно ниже в группе с повышенным уровнем P в сыворотке (таблица 6).
Согласно одномерному логистическому регрессионному анализу, факторы, связанные с совокупным коэффициентом живорождения, включали продолжительность бесплодия, коэффициент оплодотворения, количество доступных эмбрионов, количество высококачественных эмбрионов, доступное количество эмбрионов, количество высококачественных эмбрионов и уровень сывороточного фосфора. Обратная связь между уровнем P в сыворотке и кумулятивным коэффициентом живорождения оставалась значимой после поправки на смешивающие факторы, которые, как было установлено, связаны с кумулятивным коэффициентом живорождения с помощью одномерного анализа (таблица 4).
Обсуждение
Повышение уровня фосфора в сыворотке крови в день введения ХГЧ, которое в более ранних исследованиях считалось преждевременной лютеинизацией, более вероятно из-за накопления в большом количестве фолликулов [16]. В отличие от большинства предыдущих исследований, которые просто оценивали взаимосвязь между уровнем P в сыворотке и исходом ЭКО / ИКСИ у всех пациентов, недавние исследования показали, что разумно разделить пациентов на разные группы в соответствии с ответом яичников [10].Кроме того, другое исследование показало, что также важно изучить связь между продолжительностью повышения уровня P в сыворотке до введения ХГЧ, а не только абсолютным пороговым значением уровня P, и исходом ЭКО / ИКСИ [16]. Однако, независимо от методологии каждого исследования, большинство ученых пришли к единому мнению о неблагоприятном влиянии повышения уровня фосфора в сыворотке на исход ЭКО / ИКСИ.
С точки зрения пациентов, наиболее ценным параметром для них является кумулятивная частота живорождений за цикл извлечения ооцитов, которая очень похожа на скорость «забрать ребенка домой».Для клиницистов кумулятивная частота живорождений за цикл извлечения ооцитов также имеет большее значение, поскольку это дает нам возможность отслеживать окончательный клинический результат, принимая во внимание результаты как свежих, так и замороженных эмбрионов, полученных в рамках одного цикла извлечения ооцитов [17]. , [18]. Настоящее крупное когортное исследование, которое включает 4651 пациентку, прошедшую первый цикл ЭКО / ИКСИ, демонстрирует, что кумулятивная частота живорождений за цикл извлечения ооцитов была значительно снижена у пациентов с повышенным уровнем P в сыворотке крови, независимо от реакции яичников.
Известно, что восприимчивость эндометрия и качество ооцитов / эмбрионов — два основных фактора, связанных с имплантацией [19]. Следующий вопрос заключается в том, как повышенный уровень фосфора в сыворотке отрицательно влияет на исход ЭКО / ИКСИ. Повышение уровня фосфора в сыворотке влияет только на восприимчивость эндометрия в циклах свежего переноса, как было показано в большинстве исследований? Или качество ооцитов, полученных в результате свежих циклов, также было нарушено?
Среди большого количества исследований, посвященных взаимосвязи между повышением уровня P в сыворотке и результатами ЭКО / ИКСИ, некоторые из них сообщили, что повышение уровня P в сыворотке изменяет окно имплантации, а не качество эмбриона, о чем свидетельствуют циклы донорства ооцитов [20].Совсем недавно крупное ретроспективное исследование, включающее более 10 000 циклов, также продемонстрировало отсутствие связи между повышенным уровнем P и качеством ооцитов у всех респондентов, поскольку частота оплодотворения и скорость расщепления были сопоставимы между группами с повышенным и не повышенным P. Кроме того, исследование также показало, что частота продолжающейся беременности, по-видимому, была намного лучше в циклах FET, чем в свежих циклах для женщин с повышенным уровнем P в сыворотке [10]. Однако было также проспективное исследование, которое прямо показало, что высокий уровень эстрогена во время ЭКО снижает частоту имплантации, влияя на адгезию эмбриона.Высокая концентрация эстрогена, которая также означает высокий уровень фосфора, как показало наше исследование, снижает как восприимчивость эндометрия, так и качество эмбриона [21].
Для всех пациентов, включенных в это исследование, количество извлеченных ооцитов оказалось выше в группе с повышенным уровнем P в сыворотке по сравнению с таковой в группе без повышения. Однако лабораторные параметры в этом исследовании не показали лучших результатов у пациентов с повышенным уровнем P в сыворотке, особенно у пациентов с плохим ответом. Более того, соотношение эмбрионов высокого качества было ниже в группе с повышением уровня P в сыворотке, хотя разница не достигла статистической значимости.Все эти результаты показывают, что на качество ооцитов также может отрицательно влиять повышение уровня фосфора в сыворотке. Кроме того, значительно сниженная кумулятивная частота живорождений у пациентов с повышенным уровнем P в сыворотке крови с различным ответом также косвенно подтверждала эту гипотезу.
В настоящем исследовании также есть некоторые ограничения. Несмотря на то, что мы оценили взаимосвязь между уровнем P в сыворотке и совокупной частотой живорождений у разных респондентов, что является эффективным способом контроля вмешивающихся факторов, ретроспективный характер исследования, который мог привести к смещению в интерпретации данных.Другое ограничение состоит в том, что наши данные не имеют прямых доказательств того, что качество ооцитов ухудшается у пациентов с повышенным уровнем фосфора в сыворотке. В этом исследовании мы использовали морфологию эмбриона в качестве критерия оценки эмбриона, которая может не отражать «реальное качество» эмбрионов [22], [23].
В совокупности, наше большое ретроспективное одноцентровое исследование показало, что повышение уровня P в сыворотке в день введения ХГЧ во время ЭКО / ИКСИ-ЭТ отрицательно влияет на совокупную частоту живорождений за цикл извлечения ооцитов у пациентов с различным ответом яичников.Влияние повышения уровня фосфора на качество эмбриона заслуживает более тщательного изучения.
Благодарности
Авторы выражают благодарность всему коллективу Центра репродуктивной медицины, First
.Аффилированная больница Чжэнчжоуского университета. Мы также хотели бы поблагодарить Yujing Xiong за ее критическое прочтение рукописи и полезное обсуждение.
Вклад авторов
Задумал и спроектировал эксперименты: ZB FZ. Проведены эксперименты: ZB KW.Проанализированы данные: KW. Предоставленные реагенты / материалы / инструменты анализа: ZB YG Y. Su JZ. Участвовал в написании рукописи: ZB. Руководил этим исследованием и получил финансирование: Y. Sun.
Список литературы
- 1. Долди Н., Марсильо Э., Дестефани А., Гесси А., Мерати Г. и др. (1999) Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ при ЭКО связан с более высокой частотой наступления беременности при синдроме поликистозных яичников. Hum Reprod 14: 601–605.
- 2. Silverberg KM, Martin M, Olive DL, Burns WN, Schenken RS (1994) Повышенные уровни прогестерона в сыворотке в день введения хорионического гонадотропина человека в циклах оплодотворения in vitro не оказывают отрицательного воздействия на качество эмбриона.Fertil Steril 61: 508–513.
- 3. Папаниколау Э.Г., Колибианакис Э.М., Поццобон С., Танк П., Турне Х. и др. (2009) Повышение уровня прогестерона в день введения хорионического гонадотропина человека ухудшает исход беременности на 3-й день переноса одного эмбриона и не влияет на 5-й день переноса единичной бластоцисты. Fertil Steril 91: 949–952.
- 4. Bosch E, Labarta E, Crespo J, Simon C, Remohi J и др. (2010) Уровни циркулирующего прогестерона и частота продолжающихся беременностей в контролируемых циклах стимуляции яичников для экстракорпорального оплодотворения: анализ более 4000 циклов.Hum Reprod 25: 2092–2100.
- 5. Venetis CA, Kolibianakis EM, Bosdou JK, Tarlatzis BC (2013) Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Обновление Hum Reprod 19: 433–457.
- 6. Сигал С., Глатштейн И., МакШейн П., Хотамислигил С., Эскурра Д. и др. (2009) Преждевременная лютеинизация и исход экстракорпорального оплодотворения в циклах антагонистов гонадотропина / гонадотропин-рилизинг-гормона у женщин с синдромом поликистозных яичников.Fertil Steril 91: 1755–1759.
- 7. Li R, Qiao J, Wang L, Zhen X, Lu Y (2008) Концентрация прогестерона в сыворотке в день введения ХГЧ и исход ЭКО. Reprod Biomed Online 16: 627–631.
- 8. Labarta E, Martinez-Conejero JA, Alama P, Horcajadas JA, Pellicer A, et al. (2011) У женщин с высоким уровнем циркулирующего прогестерона в конце фолликулярной фазы влияет на восприимчивость эндометрия: анализ функциональной геномики. Hum Reprod 26: 1813–1825.
- 9. Шапиро Б.С., Данешманд С.Т., Гарнер ФК, Агирре М., Хадсон С. и др. (2011) Доказательства нарушения рецептивности эндометрия после стимуляции яичников для экстракорпорального оплодотворения: проспективное рандомизированное исследование, сравнивающее перенос свежих и замороженных-размороженных эмбрионов у пациентов с высокой степенью ответа. Fertil Steril 96: 516–518.
- 10. Сюй Б, Ли З, Чжан Х, Цзинь Л, Ли И и др. (2012) Влияние уровня прогестерона в сыворотке на исход экстракорпорального оплодотворения у пациентов с различным ответом яичников: анализ более 10 000 циклов.Fertil Steril 97: 1321–1327.
- 11. Griesinger G, Mannaerts B, Andersen CY, Witjes H, Kolibianakis EM, et al. (2013) Повышение уровня прогестерона не влияет на частоту наступления беременности у лиц с высоким ответом: объединенный анализ пациенток с экстракорпоральным оплодотворением, получавших рекомбинантный фолликулостимулирующий гормон / антагонист гонадотропин-рилизинг-гормона в шести испытаниях. Fertil Steril 100: 1622–1628.
- 12. Гарсия-Веласко Дж. А., Бермехо А., Руис Ф., Мартинес-Салазар Дж., Рекена А. и др.(2011) Планирование цикла приема оральных противозачаточных таблеток в протоколе антагонистов ГнРГ по сравнению с длинным протоколом: рандомизированное контролируемое исследование. Fertil Steril 96: 590–593.
- 13. Zhang HJ, Song XR, Lu R, Xue FX (2012) Модифицированный протокол сверхдолгого подавления улучшает оплодотворение и беременность у пациентов с плохой реакцией яичников. Чин Мед Ж. (англ.) 125: 2837–2840.
- 14. Балабан Б., Урман Б., Исиклар А., Алатас С., Аксой С. и др. (2001) Влияние морфологии пронуклеуса на параметры качества эмбриона и исход переноса бластоцисты.Hum Reprod 16: 2357–2361.
- 15. Zhang YL, Sun J, Su YC, Guo YH, Sun YP (2013) Внематочная беременность при переносе замороженных-размороженных эмбрионов: ретроспективный анализ 4034 циклов и связанных факторов. Syst Biol Reprod Med 59: 34–37.
- 16. Хуанг С.К., Лиен Ю.Р., Чен Х.Ф., Чен М.Дж., Шие С.Дж. (2012) Продолжительность преовуляторного повышения уровня прогестерона в сыворотке до введения ХГЧ влияет на исход циклов ЭКО / ИКСИ. Hum Reprod 27: 2036–2045.
- 17.Ли Х.В., Ли В.К., Лау Э.Й., Йунг В.С., Хо ПК и др. (2013) Роль исходного количества антральных фолликулов и антимюллеровского гормона в прогнозировании кумулятивного живорождения в первом цикле экстракорпорального оплодотворения: ретроспективный когортный анализ. PLoS One 8: e61095.
- 18. Гарридо Н., Беллвер Дж., Ремохи Дж., Саймон С., Пеллисер А (2011) Совокупный коэффициент живорождений на общее количество эмбрионов, необходимых для достижения новорожденного в последовательных циклах экстракорпорального оплодотворения (ЭКО): новый подход к измерению вероятности ЭКО успех.Fertil Steril 96: 40–46.
- 19. Roque M, Lattes K, Serra S, Sola I, Geber S и др. (2013) Перенос свежих эмбрионов по сравнению с переносом замороженных эмбрионов в циклах экстракорпорального оплодотворения: систематический обзор и метаанализ. Fertil Steril 99: 156–162.
- 20. Мело М., Месегер М., Гарридо Н., Бош Э., Пеллисер А. и др. (2006) Значение преждевременной лютеинизации в программе донорства ооцитов. Репродукция человека 21: 1503–1507.
- 21. Вальбуэна Д., Мартин Дж., Де Пабло Дж. Л., Ремохи Дж., Пеллисер А. и др.(2001) Повышенные уровни эстрадиола вредны для эмбриональной имплантации, потому что они напрямую влияют на эмбрион. Fertil Steril 76: 962–968.
- 22. Коце Д. Д., Хансен П., Кескинтепе Л., Сноуден Е., Шер Г. и др. (2010) Критерии отбора эмбрионов, основанные на морфологии ПРОТИВ экспрессии биохимического маркера (sHLA-G) и градуированной оценки эмбриона: прогнозирование исхода беременности. Журнал вспомогательной репродукции и генетики 27: 309–316.
- 23. Форман Э.Дж., Тао Х, Ферри К.М., Тейлор Д., Трефф Н.Р. и др.(2012) Перенос одного эмбриона с комплексным хромосомным скринингом приводит к повышению частоты продолжающихся беременностей и снижению частоты выкидышей. Репродукция человека 27: 1217–1222.
Повышение уровня прогестерона в день срабатывания триггера ХГЧ оказывает пагубное влияние на частоту живорождений у лиц с низким и средним уровнем ответа яичников, но не у лиц с высоким ответом. Преждевременная лютеинизация в
циклах оплодотворения in vitro с использованием агониста гонадотропин-рилизинг-гормона (GnRH-a) и рекомбинантного фолликулостимулирующего гормона (FSH) и GnRH-a и мочевого FSH. Fertil. Стерил. 66 , 275–280 (1996).CAS Статья Google Scholar
Wu, Z. et al. . Влияние ХГЧ-дневных концентраций прогестерона и эстрадиола в сыворотке на исходы беременности в циклах агонистов ГнРГ. Репродукция. Биомед. Интернет: 24 , 511–520, https://doi.org/10.1016/j.rbmo.2012.02.003 (2012).
CAS Статья PubMed Google Scholar
Bu, Z. et al. . Повышение уровня прогестерона в сыворотке отрицательно влияет на кумулятивную частоту живорождений у различных овариальных респондентов во время оплодотворения in vitro и переноса эмбриона : большое ретроспективное исследование. PLoS One 9 , e100011, https://doi.org/10.1371/journal.pone.0100011 (2014).
ADS CAS Статья PubMed PubMed Central Google Scholar
Huang, Y. и др. . Повышение уровня прогестерона в день введения хорионического гонадотропина человека отрицательно влияет на исход ЭКО с перенесенными эмбрионами на разных стадиях развития. Репродукция. Биол. Эндокринол. 13 , 82, https://doi.org/10.1186/s12958-015-0075-3 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Демир Б. и др. . Изменение прогестерона в поздней фолликулярной фазе влияет на частоту наступления беременности как с агонистами, так и с антагонистами у нормальных респондентов: исследование «случай-контроль» в циклах ИКСИ. Gynecol. Эндокринол. 32 , 361–365, https://doi.org/10.3109/09513590.2015.1121226 (2016).
CAS Статья PubMed Google Scholar
Fanchin, R. et al. . Последствия преждевременного повышения прогестерона на исход оплодотворения in vitro : понимание противоречий. Fertil. Стерил. 68 , 799–805 (1997).
CAS Статья Google Scholar
Bourgain, C. & Devroey, P. Эндометрий в циклах стимуляции для ЭКО. Hum. Репрод. Обновление 9 , 515–522 (2003).
Артикул Google Scholar
Папаниколау, Э. Г. и др. . Повышение прогестерона в день введения хорионического гонадотропина человека ухудшает исход беременности на 3-й день переноса одного эмбриона и не влияет на 5-й день переноса единичной бластоцисты. Fertil.Стерил. 91 , 949–952, https://doi.org/10.1016/j.fertnstert.2006.12.064 (2009).
CAS Статья PubMed Google Scholar
Хуанг Б. и др. . Повышенный уровень прогестерона в день созревания ооцитов может повлиять на циклы ЭКО эмбрионов высшего качества. PLoS One 11 , e0145895, https://doi.org/10.1371/journal.pone.0145895 (2016).
CAS Статья PubMed PubMed Central Google Scholar
Сантос-Рибейро, С. и др. . Уровень живорождений после ЭКО снижается как из-за низкого, так и из-за высокого уровня прогестерона в день введения хорионического гонадотропина человека. Hum. Репрод. 29 , 1698–1705, https://doi.org/10.1093/humrep/deu151 (2014).
CAS Статья PubMed Google Scholar
Урман Б. и др. . Повышенный уровень прогестерона в сыворотке крови в день введения хорионического гонадотропина человека не оказывает отрицательного влияния на частоту имплантации после интрацитоплазматической инъекции сперматозоидов и переноса эмбриона. Fertil. Стерил. 72 , 975–979 (1999).
CAS Статья Google Scholar
Venetis, C.A. et al. . Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Hum. Репрод. Обновление 13 , 343–355, https: // doi.org / 10.1093 / humupd / dmm007 (2007).
CAS Статья PubMed Google Scholar
Griesinger, G. et al. . Повышение уровня прогестерона не влияет на частоту наступления беременности у лиц с высоким ответом: объединенный анализ пациенток с оплодотворением in vitro, пациенток, получавших рекомбинантный фолликулостимулирующий гормон / антагонист гонадотропин-рилизинг-гормона, в шести испытаниях. Fertil. Стерил. 100 (1622–1628), e1621–1623, https: // doi.org / 10.1016 / j.fertnstert.2013.08.045 (2013).
CAS Статья Google Scholar
Venetis, C.A. et al. . Оценка чистого эффекта повышения прогестерона в день ХГЧ на частоту живорождений после ЭКО: когортный анализ 3296 циклов ЭКО. Hum. Репрод. 30 , 684–691, https://doi.org/10.1093/humrep/deu362 (2015).
CAS Статья PubMed Google Scholar
Сюй, Б. и др. . Влияние уровня прогестерона в сыворотке на исход оплодотворения in vitro у пациентов с различным ответом яичников: анализ более 10 000 циклов. Fertil. Стерил. 97 (1321–1327), e1321–1324, https://doi.org/10.1016/j.fertnstert.2012.03.014 (2012).
CAS Статья Google Scholar
Ли В. К. и др. . Влияние преовуляторного повышения прогестерона и продолжительности повышения прогестерона на частоту наступления беременности при переносе замороженных-размороженных эмбрионов в естественных циклах. Fertil. Стерил. 101 , 1288–1293, https://doi.org/10.1016/j.fertnstert.2014.01.040 (2014).
CAS Статья PubMed Google Scholar
Велева, З., Орава, М., Нуоджуа-Хуттунен, С., Тапанайнен, Дж. С. и Мартикайнен, Х. Факторы, влияющие на исход переноса замороженных-размороженных эмбрионов. Hum. Репрод. 28 , 2425–2431, https://doi.org/10.1093/humrep/det251 (2013).
Артикул PubMed Google Scholar
Fanchin, R. et al. . Преждевременное повышение уровня прогестерона снижает уровень бластуляции, но не снижает частоту наступления беременности при оплодотворении in vitro с сокультивированием. Fertil. Стерил. 68 , 648–652 (1997).
CAS Статья Google Scholar
Huang, R., Fang, C., Xu, S., Yi, Y. & Liang, X. Преждевременное повышение прогестерона отрицательно коррелировало с частотой живорождений в циклах ЭКО с агонистом ГнРГ: анализ 2,566 циклы. Fertil. Стерил. 98 , 664–670 e662, https://doi.org/10.1016/j.fertnstert.2012.05.024 (2012).
CAS Статья PubMed Google Scholar
Граймс, Д. А. и Шульц, К. Ф. Предвзятость и причинно-следственные связи в обсервационных исследованиях. Lancet 359 , 248–252, https://doi.org/10.1016/S0140-6736(02)07451-2 (2002).
Артикул PubMed Google Scholar
Ротман К. Дж. И Гренландия С. Причинность и причинно-следственные связи в эпидемиологии. Am. J. Public. Здравоохранение 95 (Дополнение 1), S144–150, https://doi.org/10.2105/AJPH.2004.059204 (2005).
Артикул PubMed Google Scholar
Penzias, A. S. и др. . Нафарелин против лейпролида в индукции овуляции для оплодотворения in vitro : рандомизированное клиническое испытание. Акушерство.Гинеколь. 79 , 739–742 (1992).
CAS PubMed Google Scholar
Prien, S. D., Canez, M. S. & Messer, R.H. Повышение уровня прогестерона после введения хорионического гонадотропина человека может предсказать исход цикла у пациентов, перенесших in vitro оплодотворение — перенос эмбриона. Fertil. Стерил. 62 , 1066–1068 (1994).
CAS Статья Google Scholar
Мартинес, Ф. и др. . Следует ли по-прежнему измерять прогестерон в день хорионического гонадотропина человека? Fertil. Стерил. 105 , 86–92, https://doi.org/10.1016/j.fertnstert.2015.09.008 (2016).
CAS Статья PubMed Google Scholar
Ванни, В. С. и др. . Является ли чрезвычайно высокий уровень прогестерона проблемой при ЭКО? J. Endocrinol. Вкладывать деньги. 40 , 69–75, https: // doi.org / 10.1007 / s40618-016-0531-8 (2017).
CAS Статья PubMed Google Scholar
Martinez, F. et al. . Концентрация прогестерона в сыворотке крови в день введения ХГЧ не может предсказать беременность в циклах вспомогательной репродукции. Репродукция. Биомед. Интернет 8 , 183–190 (2004).
CAS Статья Google Scholar
Ку, Х. С. и др. . Высокий ответ на контролируемую стимуляцию яичников вызывает преждевременную лютеинизацию с отрицательным влиянием на исход беременности в цикле антагонистов гонадотропин-рилизинг-гормона. Clin. Exp. Репрод. Med. 42 , 149–155, https://doi.org/10.5653/cerm.2015.42.4.149 (2015).
Артикул PubMed PubMed Central Google Scholar
Ли, Р., Цяо, Дж., Ван, Л., Zhen, X. & Lu, Y. Концентрация прогестерона в сыворотке в день введения ХГЧ и исход ЭКО. Репродукция. Биомед. Интернет: 16 , 627–631 (2008).
CAS Статья Google Scholar
Kilicdag, E. B., Haydardedeoglu, B., Cok, T., Hacivelioglu, S.O. & Bagis, T. Преждевременное повышение уровня прогестерона ухудшает имплантацию и снижает уровень живорождений в циклах ЭКО / ИКСИ с агонистами ГнРГ. Arch. Гинеколь.Акушерство. 281 , 747–752, https://doi.org/10.1007/s00404-009-1248-0 (2010).
CAS Статья PubMed Google Scholar
Андерсен, А. Н., Витес, Х., Гордон, К., Маннаертс, Б. и Xpect, i. Факторы прогнозирования ответа яичников и клинического исхода после ЭКО / ИКСИ по протоколу антагонистов рФСГ / ГнРГ с предварительным лечением оральными контрацептивами или без него. Hum. Репрод. 26 , 3413–3423, https: // doi.org / 10.1093 / humrep / der318 (2011).
CAS Статья PubMed Google Scholar
Ochsenkuhn, R. et al. . Незначительное повышение прогестерона в день введения хорионического гонадотропина человека связано с более низким уровнем живорождения у женщин, перенесших вспомогательные репродуктивные технологии: ретроспективное исследование с 2555 пересадками свежих эмбрионов. Fertil. Стерил. 98 , 347–354, https: // doi.org / 10.1016 / j.fertnstert.2012.04.041 (2012).
CAS Статья PubMed Google Scholar
Долди, Н. и др. . Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ при ЭКО связан с более высокой частотой наступления беременности при синдроме поликистозных яичников. Hum. Репрод. 14 , 601–605 (1999).
CAS Статья Google Scholar
Роке, М. и др. . Перенос свежих эмбрионов по сравнению с переносом замороженных эмбрионов в циклах оплодотворения in vitro : систематический обзор и метаанализ. Fertil. Стерил. 99 , 156–162, https://doi.org/10.1016/j.fertnstert.2012.09.003 (2013).
Артикул PubMed Google Scholar
Lu, X. et al. . Повышенный уровень прогестерона в триггерный день не ухудшает исход циклов лечения менотропинами, гонадотропином и медроксипрогестерона ацетатом человека. Sci. Отчет 6 , 31112, https://doi.org/10.1038/srep31112 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar
Lahoud, R. et al. . Повышенный уровень прогестерона в агонистах гонадолиберина, подавляющий циклов оплодотворения in vitro, (IVFICSI) снижает частоту живорождений, но не качество эмбрионов. Arch. Гинеколь. Акушерство. 285 , 535–540, https: // doi.org / 10.1007 / s00404-011-2045-0 (2012).
CAS Статья PubMed Google Scholar
Ди Паола, Р. и др. . Выбираем ли мы правильную начальную дозу ФСГ во время контролируемой стимуляции яичников для циклов внутриматочного осеменения? Возможное применение номограммы в зависимости от возраста женщины и маркеров овариального резерва. Arch Gynecol Obstet 298 , 1029–1035, https://doi.org/10.1007/s00404-018-4906-2 (2018).
CAS Статья PubMed Google Scholar
Рейес-Муньос, Э. и др. . Синдром поликистозных яичников: влияние на метаболизм лекарств для вспомогательных репродуктивных технологий — обзор литературы. Adv Ther 35 , 1805–1815, https://doi.org/10.1007/s12325-018-0810-1 (2018).
CAS Статья PubMed PubMed Central Google Scholar
Витале С.Г. и др. . Как получить высококачественные ооциты? Ключевая роль мио-инозита и мелатонина. Int J Endocrinol 2016 , 4987436, https://doi.org/10.1155/2016/4987436 (2016).
CAS Статья PubMed PubMed Central Google Scholar
Лагана, А.С., Гарсон, С., Касарин, Дж., Франки, М. и Геззи, Ф. Инозитол при синдроме поликистозных яичников: восстановление фертильности с помощью подхода, основанного на патофизиологии. Trends Endocrinol Metab 29 , 768–780, https://doi.org/10.1016/j.tem.2018.09.001 (2018).
CAS Статья PubMed Google Scholar
Larue, L. et al. . Трансвагинальный перенос эмбрионов под контролем УЗИ при ЭКО. J Gynecol Obstet Hum Reprod 46 , 411–416, https://doi.org/10.1016/j.jogoh.2017.02.015 (2017).
CAS Статья PubMed Google Scholar
Cozzolino, M. и др. . Перенос эмбрионов под ультразвуковым контролем: краткое изложение фактов и новые перспективы. Систематический обзор и метаанализ. Reprod Biomed Online 36 , 524–542, https://doi.org/10.1016/j.rbmo.2018.01.015 (2018).
Артикул PubMed Google Scholar
Balaban, B. et al. . Влияние морфологии пронуклеусов на параметры качества эмбриона и исход переноса бластоцисты. Hum. Репрод. 16 , 2357–2361 (2001).
CAS Статья Google Scholar
Эльнашар, А. М. Повышение прогестерона в день введения ХГЧ (преждевременная лютеинизация) при ЭКО: запоздалое обновление. J. Assist. Репрод. Genet. 27 , 149–155, https://doi.org/10.1007/s10815-010-9393-8 (2010).
Артикул PubMed PubMed Central Google Scholar
Венетис, К. А., Колибианакис, Э. М., Босду, Дж. К. и Тарлатзис, Б. С. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Hum. Репрод. Обновление 19 , 433–457, https://doi.org/10.1093/humupd/dmt014 (2013).
CAS Статья PubMed Google Scholar
Границы | Внутримышечное или вагинальное введение прогестерона не может изменить частоту живорождений или исходы новорожденных в циклах переноса искусственно замороженных-размороженных эмбрионов
Введение
Поскольку криоконсервация является эффективной и надежной лабораторной процедурой, все большее распространение получает политика замораживания всего тела и плановая криоконсервация эмбрионов. с различными клиническими показаниями, такими как предотвращение OHSS, имплантация PGT-A, сохранение фертильности и т. д. (1).Число применяемых циклов FET растет из-за синхронности эндометрия и относительно стабильной эндокринной среды по сравнению с супрафизиологической средой эстрогена, создаваемой контролируемой стимуляцией яичников (COS) в новых циклах ЭКО. Однако мы должны признать неблагоприятные перинатальные исходы FET, такие как более высокий риск макросомии, перинатальной смертности и осложнений беременности (2–5). В сообщениях было высказано предположение, что одиночные дети от FET были связаны с более высоким риском рождения крупных и родившихся детей, срастания плаценты, преэклампсии по сравнению со свежим переносом и естественной беременностью (6–9).Причины тому разные. В некоторых сообщениях предполагалось, что криоконсервация эмбриона изменила регуляцию эпигенетики и вызвала аномальную плаценту и рост плода (7). Некоторые исследования показали, что чрезмерное введение эстрогена вызывает акушерские осложнения (10, 11). Тем не менее, немногочисленная литература была сосредоточена на супрафизиологическом воздействии прогестерона в глубокую плацентацию.
Прогестин напрямую способствовал пролиферации сосудов во время плацентации (12). Супрафизиологическое воздействие прогестина при ЗГТ может вызвать чрезмерно глубокую плаценту, что повлияет на массу тела ребенка при рождении и акушерские последствия (13).Предыдущие исследования изучали перинатальные исходы при подготовке эндометрия и указали на более низкую частоту живорождений с большим количеством акушерских осложнений, таких как гипертоническое расстройство, срастание плаценты, послеродовые роды и макросомия при искусственном цикле FET, чем при естественном цикле FET. Они предположили связь между неблагоприятными акушерскими исходами и отсутствием секреции эндогенного прогестерона функциональным желтым телом (14–16). Но нет исследований, посвященных изучению того, был ли неблагоприятный акушерский исход связан с различными методами подготовки эндометрия в циклах ЗГТ-ФЭТ, особенно с аномально высоким значением циркулирующего прогестерона, вызванным неоптимальной дозой и способом введения прогестерона.Режим и количество прогестерона, применяемого в циклах HRT-FET, сильно различались в разных центрах ЭКО, а экзогенный прогестерон, вводимый в HRT, обычно в несколько раз превышает эндогенный прогестерон менструальных циклов. Нет единого мнения об идеальном пути и дозе введения. Оптимизация может иметь решающее значение для максимального увеличения количества успешных клинических и неонатальных заболеваний. Таким образом, наше исследование было направлено на изучение того, влияют ли значения циркулирующего прогестерона, вызванные различными режимами прогестерона, на коэффициент живорождения и исходы новорожденных.
Методы
Участники
Ретроспективное исследование было проведено в отделении вспомогательной репродуктивной медицины в Шанхайской больнице общего профиля, входящей в медицинскую школу Шанхайского университета Цзяо Тонг, с участием 856 женщин, прошедших первый FET с января 2015 года по декабрь 2018 года. Критериями были: возраст матери <48 лет, перенос эмбрионов на стадии дробления на 2-й или 3-й день после подготовки эндометрия ЗГТ. Пациенты с криоконсервированными ооцитами или донорскими ооцитами и с предыдущими попытками зачатия через ЭКО и FET были исключены из исследования.Окончательная база данных включала в критерии 856 женщин и 240 живорожденных одиночек. Мы продолжали повторное обследование пациентов в первом триместре, а затем звонили по телефону после первого триместра.
ЭКО и лабораторные протоколы
Стимуляция яичников, извлечение ооцитов и процедуры ЭКО / ИКСИ были описаны ранее (17). Для ЭКО ооциты осеменяли трубочной жидкостью человека с добавлением 10% заменителя сыворотки и примерно 300000 прогрессивно подвижных сперматозоидов.Для ИКСИ ооциты помещали в среду для оплодотворения сразу после микроинъекции. Оплодотворение оценивали через 18 часов после осеменения. Эмбрионы культивировали в среде раннего расщепления до 3-го дня и после этого в среде для мультибластов. Все эмбрионы культивировали в инкубаторе при 37 ° C, концентрации 5% O 2 и 6% CO 2 . Развитие эмбриона оценивали на 2, 3, 5 и 6 дни. Эмбрионы на стадии дробления на 2 или 3 день с по меньшей мере двумя или шестью бластомерами соответственно и с фрагментацией <20% согласно руководящим принципам (18) подходили для криоконсервации.Критериями для эмбриона хорошего качества были: от четырех до шести клеток с менее чем 10% фрагментацией для эмбрионов на второй день, от семи до девяти клеток с менее чем 10% фрагментацией для эмбрионов на третий день.
Протокол переноса замороженных эмбрионов
В цикле FET пациентам последовательно вводили эстроген и прогестерон для подготовки эндометрия перед FET. Пациенты начали с эстрогена, вводимого перорально (эстрадиол валерат или эстрадиол фемостон) 6 мг в день с или без добавления эстрогена вагинально (эстрадиол фемостон) 2 мг в день.Трансвагинальное ультразвуковое исследование, уровень Е2, ЛГ и прогестерона в сыворотке измеряли при каждом посещении еженедельно. После определения времени FET ежедневно вводили прогестерон внутримышечно (60 мг в день) или вагинальный гель Crinone (90 мг в день). Они оба сочетались с дидрогестероном перорально 30 мг в день и эстрадиолом перорально 6 мг в день. Внутримышечный прогестерон или вагинальный кринон был выбран в соответствии с предпочтениями пациентов после полного информирования их о преимуществах и побочных эффектах различных путей, таких как вагинальный зуд и выделения или подкожный отек, возникающий при внутримышечной инъекции.Пациенты, которым был проведен перенос эмбрионов на 2-й или 3-й день стадии дробления, начали прием прогестерона за 2 или 3 дня до FET, соответственно. Процедура витрификации и оттаивания была представлена ранее (17). Перенос эмбрионов был выполнен через тот же гибкий катетер под трансабдоминальным ультразвуковым контролем. После FET ежедневное введение эстрогена и прогестерона продолжалось до отрицательного результата теста на беременность на 14-й день после переноса эмбриона. Если беременность наступила, введение гормона продолжалось до 12 недель беременности.
Показатели и определения результатов
Для того, чтобы оценить влияние режимов введения прогестерона на клинический исход, основным критерием оценки был коэффициент живорождения. Вторичные критерии оценки включали частоту клинической беременности, массу новорожденного при рождении, большую для гестационного возраста (LGA), малую для гестационного возраста (SGA), частоту преждевременных родов. Живорождение определялось как рождение жизнеспособного ребенка после 28-й недели беременности. Клиническая беременность — это беременность, подтвержденная подтверждением гестационного мешка или сердцебиения.Гестационный возраст рассчитывали от 14 дней до переноса эмбриона. Преждевременные роды были определены как роды на сроке от 28 до 37 недель беременности. SGA и LGA были определены как масса тела при рождении <10-го и> 90-го процентиля соответственно. Z-балл применялся для расчета веса при рождении с поправкой на гестационный возраст и пол новорожденного по формуле: Z-балл = (χ − μ) / σ, где χ — вес ребенка при рождении, μ — средний вес при рождении для того же пола и того же гестационного возраста. возраст в контрольной группе, а σ — стандартное отклонение контрольной группы.Ссылка — китайские одиночки новорожденных (19).
Статистический анализ
Демографический исходный уровень живорожденных пациентов и одиночных детей, характеристики цикла, клинические и неонатальные исходы сравнивали с использованием t-критерия Стьюдента, U-критерия Манна-Уитни, хи-квадрат и точных критериев Фишера, в зависимости от ситуации. Изменялись ли бинарные живорождения и клиническая беременность схемами прогестерона, оценивали с помощью многовариантной логистической регрессии с поправкой на основные коварианты, такие как возраст матери, ИМТ, способ введения эстрогена, продолжительность лечения эстрадиолом> 21 дня, наличие хотя бы одного хорошего качественный эмбрион был перенесен.Для оценки режимов воздействия прогестерона на исходы новорожденных применялась многовариантная логистическая регрессия с поправкой на основные ковариаты, упомянутые выше, плюс пол новорожденного. Сообщалось о скорректированных отношениях шансов (OR) и 95% доверительных интервалах (95% CI). Все анализы проводились со статистикой SPSS. Значение P <0,05 считалось статистически значимым.
Этическое одобрение
Получено одобрение институционального наблюдательного совета и этического комитета Шанхайской больницы общего профиля.
Результаты
Клинические результаты
Этот анализ включал 856 женщин и 240 живорожденных одиночек со следующими результатами: 44,04% процент клинической беременности, 35,63% живорождений. 333 пациента получали прогестерон внутримышечно и 523 пациента получали прогестерон вагинально. Исходные демографические данные и характеристики сравнивались между пациентами с разными режимами прогестерона (таблица 1). Среди 856 женщин не было выявлено каких-либо существенных различий в отношении возраста матери, ИМТ, наличия хотя бы одного перенесенного эмбриона хорошего качества, толщины эндометрия в день начала приема прогестерона, дней действия эстрогена, E2, P, уровня ЛГ в начале приема прогестерона. день между двумя группами.Доля пациенток, получавших эстрадиол вагинально и перорально вместе в группе прогестерона вагинально, была значительно выше, чем в группе, получавшей прогестерон внутримышечно. Уровень прогестерона в сыворотке на 14-й день после переноса эмбриона был значительно выше в группе, получавшей прогестерон внутримышечно, чем в группе, получавшей прогестерон вагинально (40,5 пмоль / л против 14,95 пмоль / л). Нет существенной разницы в уровне живорождений (общий OR 1,181, 95% CI 0,895, 1,557, p = 0,282) и частоте клинической беременности (общий OR 1.170, 95% ДИ 0,879, 1,557, p = 0,239) между различными схемами прогестерона (таблица 2). Контроль за возрастом матери, ИМТ, способом введения эстрогена, продолжительностью действия эстрадиола более 21 дня, наличием хотя бы одного перенесенного эмбриона хорошего качества, режим введения прогестерона не повлиял на шансы достижения живорождений (Скорректированный OR 1.128, 95% ДИ 0,842, 1,511, p = 0,420) или клиническая беременность (Скорректированный OR 1,144, 95% ДИ 0,863, 1,518, p = 0,349) (Таблица 2).Возраст матери и, по крайней мере, один перенесенный эмбрион хорошего качества были единственными независимыми факторами, которые увеличили частоту живорождений и частоту клинической беременности.
Таблица 1 Исходные демографические данные и характеристики цикла в зависимости от различных маршрутов прогестерона.
Таблица 2 Клинические исходы в зависимости от различных путей введения прогестерона.
Неонатальные исходы
Для дальнейшего изучения влияния режима прогестерона на массу тела при рождении одиночек и гестационный возраст была дополнительно исследована когорта из 240 одиночных новорожденных из 856 пациентов.Неонатальные исходы, стратифицированные схемами введения прогестерона, были представлены в таблице 3. Пол новорожденного, гестационный возраст, средний вес при рождении, Z-баллы, частота преждевременных родов, частота SGA и LGA не различались в двух группах (таблица 3). В многофакторном анализе (таблица 3): риск преждевременных родов (скорректированный OR 1,920, 95% ДИ 0,603, 6,11, p = 0,269), риск LGA (скорректированный OR 0,862, 95% CI 0,425, 1,749, p = 0,681). , и SGA (скорректированное отношение шансов 0,227, 95% доверительный интервал 0,027, 1,934, p = 0,175) достоверно не различались между двумя группами после поправки на возраст матери, ИМТ, способ введения эстрадиола, продолжалось ли введение эстрогена более 21 дня, будь то хотя бы один был перенесен эмбрион хорошего качества и пола новорожденного.
Таблица 3 Перинатальные исходы одиночных детей, рожденных живыми, в зависимости от различных маршрутов прогестерона.
Анализ подгрупп
Для изучения влияния циркулирующего сывороточного прогестерона на недельную беременность и массу тела при рождении была дополнительно исследована когорта из 262 пациенток с внутримышечным введением прогестерона и 77 одиночных новорожденных. Мы не анализировали вагинальную когорту прогестерона, потому что системное значение прогестерона сыворотки не было отражением прогестерона, абсорбируемого вагинально (20).В таблице 4 сравнивались клинические и неонатальные исходы пациентов с сывороточным уровнем прогестерона> 41,82 пмоль / л и ≤41,82 пмоль / л на 14-й день после переноса эмбриона. Среднее значение сывороточного уровня прогестерона составило 41,82 пмоль / л. на 14-й день после переноса эмбрионов пациентам, которым вводили прогестерон внутримышечно. Пациенты с сывороточным уровнем P> 41,82 пмоль / л продемонстрировали более высокий уровень клинической беременности (скорректированный OR 1,670, 95% CI 1,005, 2,774, p = 0,048) и более высокий уровень живорождений (скорректированный OR 1.690, 95% ДИ 1,002, 2,849, p = 0,049), чем пациенты с уровнем P в сыворотке ≤41,82 пмоль как в однофакторном анализе, так и в многофакторном анализе с поправкой на возраст матери, ИМТ, был ли перенесен хотя бы один эмбрион хорошего качества, режим эстрогена, будь то дни введения эстрогена> 21. В то время как масса тела при рождении, Z-оценка, частота преждевременных родов, частота LGA и SGA не различались между этими двумя группами. Многовариантный анализ не проводился для частоты преждевременных родов, LGA и SGA, поскольку размер выборки в этой категории был слишком мал.
Таблица 4 Клинические и перинатальные исходы между группами с уровнем P> 41,82 пмоль / л и уровнем P ≤41,82 пмоль / л при внутримышечном введении прогестерона в циклах HRT-FET.
Обсуждение
Основные результаты
В ходе нашего исследования мы не обнаружили разницы в частоте живорождений, частоте клинической беременности, массе тела при рождении одиночкой, частоте преждевременных родов, частоте LGA и SGA между вагинальным и внутримышечным введением прогестерона в циклах HRT-FET. Относительно более высокий уровень прогестерона в сыворотке, вызванный внутримышечным режимом, не увеличивал вес новорожденного при рождении и не удлинял гестационные недели по сравнению с вагинальным режимом.Что касается внутримышечного введения прогестерона, концентрация прогестерона в сыворотке выше 41,82 пмоль / л на 14 день после FET была связана с улучшением частоты живорождений и сопоставимыми неонатальными исходами по сравнению с уровнем P ≤41,82 пмоль / л. Мониторинг уровня прогестерона в сыворотке и оптимизация дозы прогестерона по мере необходимости во время внутримышечных циклов прогестерона HRT-FET играет роль в улучшении клинических исходов без влияния на перинатальные исходы.
Интерпретация данных
Предыдущие исследования показали, что FET приводит к увеличению риска гипертонии, вызванной беременностью, LGA и новорожденных после родов по сравнению с новыми циклами ЭКО-ЭТ (2, 6–8).Разница в сроках беременности и весе при рождении между одиночными циклами FET и одиночными сериями свежих циклов ЭКО заставила людей предположить связь качества плацентации и характеристик гормонов из разных циклов. Люди предположили, что причины этого явления связаны с супрафизиологической средой эстрогена в циклах, стимулированных яичниками (10, 11), техникой криоконсервации эмбриона per se, вызванной эпигенетическими изменениями (7), и отсутствием функционального желтого тела в циклах HRT-FET (14). –16).Однако нет доступных данных о том, были ли связаны гестационный возраст новорожденного, масса тела при рождении и плацентарные акушерские осложнения со специфическими протоколами подготовки эндометрия в циклах FET, особенно с режимами заместительной терапии прогестероном. В циклах HRT-FET, как только будет достигнута адекватная пролиферация эндометрия, ежедневное введение прогестерона начинается до запланированного переноса эмбриона, что вызывает децидуализацию эстроген-примированных стромальных клеток эндометрия и развивает рецептивность эндометрия.Прогестин способствует инвазии вневорсинчатого трофобласта (EVT) и ремоделированию сосудов эндометрия, которые важны для беременности, поскольку дефекты инвазии вневорсинчатого трофобласта могут вызвать децидуальное кровоизлияние в первом триместре и вызвать более поздние неблагоприятные исходы, такие как преэклампсия и роды после родов (21). Прогестерон действует на эндометрий, подавляя сократительную способность матки и вызывая покой матки (22). При ЗГТ не происходит выработки желтых тел и эндогенного прогестерона.Замещение прогестерона, применяемое в циклах FET, обычно создавало среду с относительно высоким P. В нескольких исследованиях без участия человека сообщалось о негативном влиянии очень высокого уровня прогестерона на созревание и имплантацию эндометрия (23, 24). Аберрантно более высокие уровни прогестерона на ранних сроках беременности могут привести к чрезмерной инвазии вневорсинчатого трофобласта, влияя на функции синцитиального трофобласта и децидуальных клеток, тем самым потенцируя более позднюю поверхностную плацентацию, которая влияет на вес новорожденного при рождении и недели гестации (12, 21, 25).
Идеальный способ введения, продолжительность и дозировка прогестерона в циклах HRT-FET не были определены. Вагинальный кринон и внутримышечный прогестерон являются двумя предпочтительными режимами лютеиновой поддержки. Прогестерон, доставленный вагинально, достигал матки напрямую и индуцировал более высокую концентрацию прогестерона в эндометрии матки с относительно более низким уровнем циркулирующего P по сравнению с внутримышечным режимом (26). Отчет предположил, что микронизированная вагинальная добавка P помогла снизить частоту сокращений матки и снизить риск смещения эмбриона в свежих циклах ЭКО-ЭТ (27).В то время как вагинальное введение прогестерона для лютеиновой поддержки предоставило убедительные доказательства схожести исходов беременности и родов по сравнению с внутримышечным П в новых циклах ЭКО (28–30). Тем не менее, в циклах FET более успешным является внутримышечное введение прогестерона по сравнению с вагинальным и пероральным введением (1, 31, 32). Примечательно, что сравнение различных способов введения прогестерона полезно для выяснения не только наиболее эффективного, но и относительно более безопасного.Здесь наше исследование было сосредоточено на том, влияют ли значения прогестерона с большим охватом циркуляции, вызванные различными режимами лютеиновой поддержки, как на успешный клинический исход, так и на исходы новорожденных, включая недели гестации новорожденных и массу тела при рождении.
На основании нашего исследования мы показали, что вагинальное введение прогестерона приводит к сопоставимой частоте живорождений при внутримышечном режиме в качестве лютеиновой поддержки в циклах ЗГТ-ФЭТ, что соответствует аналогичным результатам, полученным в новых циклах ЭКО (33–35).Мы дополнительно проанализировали неонатальные исходы, стратифицированные различными режимами прогестерона, и не обнаружили существенных различий в весе новорожденных, частоте преждевременных родов, частоте SGA и LGA между двумя группами. Хотя более высокий риск LGA и новорожденных после свидания был обнаружен у одиночных FET по сравнению со свежими циклами ET (2, 6-8), и исследование показало, что аномально более высокие уровни прогестерона привели к чрезмерной инвазии EVT, которая вмешалась в перинатальный период. исход (12), относительно более высокий уровень прогестерона в периферической сыворотке крови при введении внутримышечно прогестерона не приводил к увеличению массы тела при рождении и удлинению недель беременности по сравнению с вагинальным режимом в нашей когорте.Можно предположить, что на формирование плаценты и ангиогенез может влиять не только уровень циркулирующего прогестерона, но и локальный уровень прогестерона в матке. Гель прогестерона, доставленный вагинально, может создавать высокую концентрацию прогестерона на границе раздела матери и плода, но его трудно обнаружить при взятии крови. В нашей когорте пациенты получали дидрогестерон перорально одновременно в случае вагинальной мальабсорбции, хотя пероральный прием дидрогестерона также не влиял на уровень прогестерона в сыворотке.И не следует пренебрегать тем, что вагинальное распределение поглощения прогестерона и метаболизм сильно различаются между пациентами. Кроме того, это может быть недостаток желтого тела и отсутствие вазоактивных гормонов, таких как релаксин, высвобождаемых из желтого тела в циклах ЗГТ-ФЕТ, которые играют доминирующую роль в неблагоприятных перинатальных исходах (16, 36). Таким образом, различная степень высокого уровня прогестерона, вызванная разным замещением прогестина, не повлияла на вес новорожденного при рождении и недели гестации в нашем анализе.В нашем исследовании сравнивались конкретные протоколы подготовки эндометрия, используемые для циклов искусственного полового акта, и добавлены некоторые доказательства, подтверждающие, что большие уровни циркулирующего прогестерона, вызванные различными путями прогестерона, не меняют неонатальные исходы, такие как масса тела при рождении одиночки и гестационный возраст.
Некоторые исследования показали, что низкий уровень прогестерона в сыворотке крови в день переноса эмбриона связан с неблагоприятной клинической беременностью как в циклах искусственного FET, так и в свежих циклах ЭКО-ЭТ (37–39). В нашем исследовании мы проанализировали концентрацию циркулирующего прогестерона на 14-й день после переноса эмбриона в циклах HRT-FET, что также является днем теста на ХГЧ.В это время почти нет эндогенного прогестерона из плаценты. Лишь небольшое количество прогестерона из трофобластов способствует концентрации прогестерона в сыворотке крови в периимплантационный период. Наши результаты показали, что при применении внутримышечно введенного прогестерона в качестве лютеиновой поддержки более высокий уровень прогестерона в сыворотке на 14-й день после переноса эмбриона был более успешным, чем аналоги с более низким уровнем P в циклах HRT-FET. Таким образом, врачи могут оптимизировать внутримышечное введение прогестерона в соответствии с мониторингом Р.Наши результаты подтвердили предыдущие данные о том, что уровень лютеинового прогестерона за пределами диапазона снижает частоту клинической беременности (40–42). Но мы дополнительно исследовали массу новорожденных при рождении и гестационный возраст в этой группе внутримышечных прогестеронов и показали, что системный уровень P выше 41,82 пмоль / л не увеличивает вес при рождении и не удлиняет гестационные недели, но увеличивает частоту живорождений. Таким образом, рекомендуется контролировать системную концентрацию P и назначать более высокие дозы прогестерона, если это необходимо пациентам с внутримышечным введением прогестерона, чтобы оптимизировать коэффициент живорождения без влияния на исходы новорожденных.Повышение дозы внутримышечного прогестерона при значении P в кровотоке ниже 41,82 пмоль / л считалось преимуществом. Мы не анализировали влияние значения циркулирующего прогестерона в когорте вагинального прогестерона, потому что концентрация циркулирующего прогестерона не служит суррогатным маркером количества абсорбированного вагинального прогестерона (20).
Сильные стороны и ограничения
Настоящее исследование имеет следующие сильные стороны. Анализ проводился в одном центре ЭКО, что гарантировало те же лабораторные процедуры и тех же сонографистов.В анализ были включены только пациенты с их первыми циклами FET, чтобы обеспечить переносимый эмбрион относительного хорошего качества и исключить повторяющиеся случаи отказа эмбриона. Мы исключили перенос бластоцисты, чтобы смягчить длительное влияние культуры эмбрионов in vitro на на исходы новорожденных (43, 44). Для контроля предвзятости в отношении пола ребенка и гестационного возраста был рассчитан z-показатель для двух групп. В этом исследовании были ограничения. Это ретроспективный анализ, и возможна ошибка отбора. Хотя мы учли некоторые связанные факторы в многомерном анализе, неизвестные факторы могли повлиять на результаты.Требуется большое рандомизированное проспективное исследование. Мы не могли следить за пациентом по поводу акушерских деталей, что мешало нам оценить перинатальные исходы, такие как гестационная гипертензия, преэклампсия, срастание и предлежание плаценты. Детали акушерства позволят нам лучше понять влияние высокого уровня прогестерона в сыворотке на формирование плаценты во время беременности. Кроме того, чтобы проанализировать, была ли акушерская неполноценность ЗГТ-ФЕТ связана с отсутствием секреции эндогенного прогестерона функциональным желтым телом или с субоптимальной дозой или путем введения экзогенного прогестерона, лучше решить эту проблему, сравнив перинатальные исходы между различные протоколы режима прогестерона как в искусственных, так и в естественных циклах.
Заключение
В заключение, это первое исследование, демонстрирующее связь протоколов режима прогестерона и исходов новорожденных. Относительно более высокий уровень прогестерона в сыворотке, вызванный внутримышечным режимом, не повлиял на частоту живорождений, не увеличил вес новорожденного при рождении или не продлил гестационные недели по сравнению с вагинальным режимом. Во время внутримышечного введения прогестерона в циклах HRT-FET концентрация циркулирующего прогестерона выше 41,82 пмоль / л на 14-й день после FET была связана с улучшением коэффициента живорождения.Мониторинг уровня прогестерона в сыворотке и оптимизация дозы прогестерона по мере необходимости во время внутримышечных циклов прогестерона HRT-FET играет роль в улучшении клинических исходов без влияния на исходы новорожденных.
Заявление о доступности данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены наблюдательным советом учреждения и этическим комитетом Шанхайской больницы общего профиля.Комитет по этике отказался от требования письменного информированного согласия на участие.
Вклад авторов
YL и YW участвовали в разработке концепции и дизайна исследования. YL собрал и проанализировал данные. YL подготовил статью. YW отредактировал его для важного интеллектуального содержания. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование было поддержано грантом Национального фонда естественных наук Китая (No.82002738). Деньги были на то, чтобы оценить кропотливый труд всех авторов.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта рукопись была выпущена в виде препринта в Research Square (YL, YW) (45).
Сокращения
ЗГТ, заместительная гормональная терапия; FET — перенос замороженных-размороженных эмбрионов; COS, контролируемая стимуляция яичников; ЭКО, in vitro, оплодотворение; ИКСИ, интрацитоплазматическая инъекция спермы; LGA, большая для гестационного возраста; SGA, малый для гестационного возраста; ЭВТ, вневорсинчатый трофобласт; 95% ДИ, 95% доверительные интервалы; ИЛИ, отношения шансов; ИМТ, индекс массы тела.
Ссылки
1. Роке М., Хаар Т., Гебер С., Эстевес С.К., Хумайдан П. Сравнение свежего и планового переноса замороженных эмбрионов в циклах ЭКО / ИКСИ: систематический обзор и метаанализ репродуктивных результатов. Обновление Hum Reprod (2019) 25 (1): 2–14. doi: 10.1093 / humupd / dmy033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Веннергольм У. Б., Хеннингсен А. К., Ромундстад Л. Б., Берг С., Пинборг А., Скьяервен Р. и др. Перинатальные исходы у детей, родившихся после переноса замороженных-размороженных эмбрионов: когортное исследование северных стран из группы CoNARTaS. Hum Reprod (2013) 28 (9): 2545–53. doi: 10.1093 / humrep / det272
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Сазонова А., Каллен К., Турин-Челлберг А., Веннергольм У.Б., Берг К. Акушерские исходы у одиночных детей после экстракорпорального оплодотворения криоконсервированными / размороженными эмбрионами. Hum Reprod (2012) 27 (5): 1343–50. doi: 10.1093 / humrep / des036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Опдал С., Хеннингсен А.А., Тийтинен А., Берг С., Пинборг А., Ромундстад П. Р. и др.Риск гипертонических расстройств при беременности после вспомогательных репродуктивных технологий: когортное исследование из группы CoNARTaS. Hum Reprod (2015) 30 (7): 1724–31. doi: 10.1093 / humrep / dev090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Махешвари А., Пандей С., Амальрадж Раджа Е., Шетти А., Гамильтон М., Бхаттачарья С. Лучше ли перенос замороженных эмбрионов для матерей и младенцев? Может ли совокупный метаанализ дать окончательный ответ? Обновление Hum Reprod (2018) 24 (1): 35–58.doi: 10.1093 / humupd / dmx031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Пинборг А., Хеннингсен А.А., Лофт А, Мальчау С.С., Форман Дж., Андерсен А.Н. Синдром крупного ребенка у одиноких детей, рожденных после переноса замороженных эмбрионов (FET): это связано с материнскими факторами или криотехникой? Hum Reprod (2014) 29 (3): 618–27. doi: 10.1093 / humrep / det440
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Ша Т., Инь X, Ченг В., Месси И.Ю. Осложнения, связанные с беременностью, и перинатальные исходы в результате переноса криоконсервированных эмбрионов в сравнении со свежими эмбрионами при экстракорпоральном оплодотворении: метаанализ. Fertil Steril (2018) 109 (2): 330–42.e9. doi: 10.1016 / j.fertnstert.2017.10.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Сайты CK, Wilson D, Barsky M, Bernson D, Bernstein IM, Boulet S, et al. Криоконсервация эмбрионов и риск преэклампсии. Fertil Steril (2017) 108 (5): 784–90. doi: 10.1016 / j.fertnstert.2017.08.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Перейра Н., Элиас Р. Т., Христос П. Дж., Петрини А. С., Хэнкок К., Лекович Дж. П. и др.Супрафизиологический эстрадиол является независимым предиктором низкой массы тела при рождении у доношенных одиноких детей, рожденных после переноса свежих эмбрионов. Hum Reprod (2017) 32 (7): 1410–7. doi: 10.1093 / humrep / dex095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Zhang W, Ma Y, Xiong Y, Xiao X, Chen S, Wang X. Супрафизиологический сывороточный эстрадиол отрицательно влияет на массу тела при рождении при криоконсервированных переносах эмбрионов: ретроспективное когортное исследование. Reprod BioMed Online (2019) 39 (2): 312–20.doi: 10.1016 / j.rbmo.2019.04.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Уолтер Л. М., Роджерс П. А., Гирлинг Дж. Э. Роль прогестерона в ангиогенезе эндометрия у беременных и овариэктомированных мышей. Reprod (Cambridge Engl) (2005) 129 (6): 765–77. doi: 10.1530 / rep.1.00625
CrossRef Полный текст | Google Scholar
13. Pirtea P, de Ziegler D, Ayoubi JM. Скорость имплантации эуплоидных эмбрионов не зависит от продолжительности прайминга эстрадиола, но гормональная среда — эстрадиол и прогестерон — может влиять на плаценту. Fertil Steril (2019) 111 (6): 1117–8. doi: 10.1016 / j.fertnstert.2019.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Jing S, Li XF, Zhang S, Gong F, Lu G, Lin G. Увеличение осложнений беременности после переноса замороженных-размороженных эмбрионов во время искусственного цикла. J Assist Reprod Gen (2019) 36 (5): 925–33. doi: 10.1007 / s10815-019-01420-1
CrossRef Полный текст | Google Scholar
15. Сайто К., Кувахара А., Исикава Т., Морисаки Н., Миядо М., Миядо К. и др.Методы подготовки эндометрия для переноса замороженных-размороженных эмбрионов связаны с измененными рисками гипертензивных расстройств беременности, приращения плаценты и гестационного сахарного диабета. Hum Reprod (2019) 34 (8): 1567–75. doi: 10.1093 / humrep / dez079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Гинстром Эрнстад Э., Веннерхольм У. Б., Хатиби А., Петцольд М., Берг С. Исход новорожденных и матери после переноса замороженных эмбрионов: повышенные риски в запрограммированных циклах. Am J Obstet Gynecol (2019) 221 (2): 126.e1 – .e18. doi: 10.1016 / j.ajog.2019.03.010
CrossRef Полный текст | Google Scholar
17. Чжан Дж., Лю Х., Мао Х, Чен Кью, Си Дж., Фань Й и др. Влияние толщины эндометрия на массу тела при рождении в циклах переноса замороженных эмбрионов: анализ, включающий 6181 новорожденных-одиночек. Hum Reprod (2019) 34 (9): 1707–15. doi: 10.1093 / humrep / dez103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Альфа-ученые в репродуктивной медицине и специальная группа эмбриологии ESHRE.Стамбульский консенсусный семинар по оценке эмбрионов: материалы совещания экспертов. Hum Reprod (2011) 26 (6): 1270–83. doi: 10.1093 / humrep / der037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Boelig RC, Zuppa AF, Kraft WK, Caritis S. Фармакокинетика вагинального прогестерона при беременности. Am J Obstet Gynecol (2019) 221 (3): e1 – e7: 263. doi: 10.1016 / j.ajog.2019.06.019
CrossRef Полный текст | Google Scholar
21.Чен Дж.З., Шихан П.М., Бреннеке С.П., Кио Р.Дж. Ремоделирование сосудов, гормоны беременности и функция вневорсинчатого трофобласта. Mol Cell Endocrinol (2012) 349 (2): 138–44. doi: 10.1016 / j.mce.2011.10.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Тамими Р., Лагиу П., Ваттен Л.Дж., Муччи Л., Тричопулос Д., Хеллерстайн С. и др. Гормоны беременности, преэклампсия и влияние на риск рака груди у потомства. Cancer Epidem Biomar (2003) 12 (7): 647–50.
Google Scholar
24. Ногейра MF, Melo DS, Carvalho LM, Fuck EJ, Trinca LA, Barros CM. Уменьшают ли высокие концентрации прогестерона частоту наступления беременности у реципиентов-эмбрионов, синхронизированных с PGF2alpha и eCG? Териогенология (2004) 61 (7-8): 1283–90. DOI: 10.1016 / j.theriogenology.2003.07.012
PubMed Реферат | CrossRef Полный текст | Google Scholar
25. Пийненборг Р., Веркрюсс Л., Хансенс М. Спиральные артерии матки при беременности человека: факты и противоречия. Плацента (2006) 27 (9-10): 939–58. doi: 10.1016 / j.placenta.2005.12.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Cicinelli E, Schonauer LM, Galantino P, Matteo MG, Cassetta R, Pinto V. Механизмы специфичности матки вагинального прогестерона. Hum Reprod (2000) 15 (Дополнение 1): 159–65. doi: 10.1093 / humrep / 15.suppl_1.159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Fanchin R, Righini C, de Ziegler D, Olivennes F, Ledee N, Frydman R.Влияние вагинального введения прогестерона на сократительную способность матки во время переноса эмбриона. Fertil Steril (2001) 75 (6): 1136–40. doi: 10.1016 / s0015-0282 (01) 01787-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Ван дер Линден М., Бэкингем К., Фаркуар К., Кремер Дж. А., Метвалли М. Поддержка лютеиновой фазы для циклов вспомогательной репродукции. Cochrane Syst Rev (2015) 7): Cd009154. doi: 10.1002 / 14651858.CD009154.pub3
CrossRef Полный текст | Google Scholar
29.Kahraman S, Karagozoglu SH, Karlikaya G. Эффективность вагинального геля прогестерона по сравнению с внутримышечным прогестероном для добавления лютеиновой фазы в циклах антагонистов гонадотропин-рилизинг гормона: проспективное клиническое испытание. Fertil Steril (2010) 94 (2): 761–3. DOI: 10.1016 / j.fertnstert.2009.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Silverberg KM, Vaughn TC, Hansard LJ, Burger NZ, Minter T. Вагинальный гель (Crinone 8%) против внутримышечного прогестерона в масле для поддержки лютеиновой фазы при экстракорпоральном оплодотворении: большое перспективное исследование. Fertil Steril (2012) 97 (2): 344–8. doi: 10.1016 / j.fertnstert.2011.11.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Дивайн К., Рихтер К.С., Видра Е.А., Маккиби Дж. Л.. Циклы переноса витрифицированных бластоцист с использованием только вагинального замещения прогестерона эндометрином имеют более низкие показатели продолжающейся беременности: результаты запланированного промежуточного анализа трехгруппового рандомизированного контролируемого исследования не меньшей эффективности. Fertil Steril (2018) 109 (2): 266–75.doi: 10.1016 / j.fertnstert.2017.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Касер Д. Д., Гинзбург Е. С., Миссмер С. А., Коррейя К. Ф., Раковски С. Внутримышечный прогестерон по сравнению с 8% вагинальным гелем Crinone для поддержки лютеиновой фазы при переносе криоконсервированных эмбрионов на 3 день. Fertil Steril (2012) 98 (6): 1464–9. doi: 10.1016 / j.fertnstert.2012.08.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Mitwally MF, Diamond MP, Abuzeid M.Вагинальный микронизированный прогестерон по сравнению с внутримышечным прогестероном для лютеиновой поддержки у женщин, перенесших экстракорпоральное оплодотворение с переносом эмбриона. Fertil Steril (2010) 93 (2): 554–69. doi: 10.1016 / j.fertnstert.2009.02.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Зарей А., Сохаил П., Парсанежад М.Э., Альборзи С., Самсами А., Азизи М. Сравнение четырех протоколов поддержки лютеиновой фазы в циклах переноса замороженных-размороженных эмбрионов: рандомизированное клиническое испытание. Arch Gynecol Obstet (2017) 295 (1): 239–46. doi: 10.1007 / s00404-016-4217-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Шапиро Д.Б., Паппадакис Дж. А., Эллсворт Н. М., Хайт Х. И., Надь З. П.. Замена прогестерона вагинальным гелем по сравнению с в / м. инъекции: цикл и исходы беременности у пациенток ЭКО, получавших витрифицированные бластоцисты. Hum Reprod (2014) 29 (8): 1706–11. doi: 10.1093 / humrep / deu121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.фон Версен-Хойнк Ф., Шауб А.М., Чи Ю.Й., Чиу К.Х., Лю Дж., Лингис М. и др. Повышенный риск преэклампсии и снижение соответствия аорты циклам экстракорпорального оплодотворения при отсутствии желтого тела. Hypertens (Dallas Tex 1979) (2019) 73 (3): 640–9. doi: 10.1161 / hypertensionaha.118.12043
CrossRef Полный текст | Google Scholar
37. Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование. Hum Reprod (2017) 32 (12): 2437–42. doi: 10.1093 / humrep / dex316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Бойнукалин Ф.К., Гултомрук М., Тургут Э., Демир Б., Финдикли Н., Сердарогуллари М. и др. Измерение уровня прогестерона в сыворотке крови в день переноса может быть дополнительным инструментом для максимального увеличения продолжающихся беременностей при переносе одиночных эуплоидных замороженных бластоцист. Reprod Biol Endocrin (2019) 17 (1): 102. doi: 10.1186 / s12958-019-0549-9
CrossRef Полный текст | Google Scholar
39.Cedrin-Durnerin I, Isnard T., Mahdjoub S, Sonigo C, Seroka A, Comtet M, et al. Концентрация прогестерона в сыворотке и коэффициент живорождений при переносе замороженных-размороженных эмбрионов с гормонально подготовленным эндометрием. Reprod BioMed Online (2019) 38 (3): 472–80. doi: 10.1016 / j.rbmo.2018.11.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Йович Дж. Л., Консейсао Дж. Л., Стангер Дж. Д., Хинчлифф П. М., Кин К. Н.. Средне-лютеиновые концентрации прогестерона в сыворотке определяют частоту имплантации криоконсервированных переносов эмбрионов, проводимых при заместительной гормональной терапии. Reprod BioMed Online (2015) 31 (2): 180–91. doi: 10.1016 / j.rbmo.2015.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Баснаяке С.К., Воловский М., Ромбаутс Л., Осианлис Т., Волленховен Б., Хили М. Концентрации и дозировка прогестерона при переносе замороженных эмбрионов — что лучше? Aust Nz Obstet Gyn (2018) 58 (5): 533–8. doi: 10.1111 / ajo.12757
CrossRef Полный текст | Google Scholar
42. Alsbjerg B, Thomsen L, Elbaek HO, Laursen R, Povlsen BB, Haahr T, et al.Уровни прогестерона в день теста на беременность после циклов переноса криоконсервированных эмбрионов на заместительную гормональную терапию и соответствующие репродуктивные результаты. Reprod BioMed Online (2018) 37 (5): 641–7. doi: 10.1016 / j.rbmo.2018.08.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Zhang J, Wang Y, Liu H, Mao X, Chen Q, Fan Y и др. Влияние периода культивирования in vitro на массу тела при рождении после циклов переноса в витрифицированном-подогретом виде: анализ 4201 новорожденного-одиночки. Fertil Steril (2019) 111 (1): 97–104. doi: 10.1016 / j.fertnstert.2018.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Ginstrom Ernstad E, Spangmose AL, Opdahl S, Henningsen AA, Romundstad LB, Tiitinen A, et al. Перинатальные и материнские исходы после витрификации бластоцист: нордическое исследование на одиночных препаратах из группы CoNARTaS. Hum Reprod (2019) 34 (11): 2282–9. doi: 10.1093 / humrep / dez212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пороговый уровень прогестерона 25 нг / мл для поддержания беременности в первом триместре у женщин с бесплодием или выкидышем в анамнезе
Аннотация
Введение : Важность выработки прогестерона желтым телом для поддержания беременности в первом триместре была впервые признана в 1970-х годах.С тех пор профилактический прогестерон используется для снижения частоты абортов в первом триместре у женщин с выкидышами в анамнезе. Однако до недавнего времени исследования не смогли установить целевой уровень прогестерона, при котором беременность могла бы поддерживаться в этой популяции.
Цель : Целью исследования было оценить эффективность порогового значения сывороточного прогестерона 25 нг / мл для поддержания беременности в первом триместре у пациенток с бесплодием или выкидышем в анамнезе.
Дизайн исследования : В этот ретроспективный обзор диаграммы мы включили 182 пациентки (329 беременностей) в возрасте от 22 до 45 лет, у которых была хотя бы одна попытка беременности в частной клинике бесплодия в период с 1996 по 2013 год. Мы исключили пациентов с анатомическими дефектами, внематочными беременностями, молярными беременностями, пораженными яйцеклетками, аномальным уровнем иммунитета или использованием донорских яйцеклеток. Все пациенты прошли полное обследование, включая анатомический скрининг и иммунные медиаторы. Уровни прогестерона регистрировали при первом посещении и через 10 недель.Дополнительный прогестерон вводили в течение первого триместра беременности, если уровни сыворотки упали ниже 25 нг / мл, и продолжали до тех пор, пока не было определено, что плацента взяла на себя выработку прогестерона. Женщины были разделены по возрасту на две группы: возраст бесплодия (22-34 года) и пожилой возраст матери (35-45 лет). Тесты хи-квадрат были выполнены на 329 беременностях для анализа связи между жизнеспособными беременностями в первом триместре и адекватными уровнями прогестерона в сыворотке (≥ 25 нг / мл при начальном и / или 10-недельном посещении) для каждой возрастной группы.
Результаты : Статистически значимая разница в уровне жизнеспособной беременности в первом триместре и адекватных (≥ 25 нг / мл) уровнях прогестерона в сыворотке была обнаружена для обеих возрастных групп первичной фертильности (X 2 = 57,424, N = 221, p <0,0001) и пожилой возрастной группе матери (X 2 = 10,973, N = 108, p = 0,001).
Выводы : Это исследование демонстрирует, что поддержание сывороточного уровня прогестерона 25 нг / мл или выше снижает риск выкидыша в первом триместре у женщин любого репродуктивного возраста.
Ключевые слова
первый триместр, бесплодие, выкидыш, прогестерон, самопроизвольный аборт
Введение
Прогестерон считается «гормоном беременности» из-за его важной роли в подготовке эндометрия к имплантации и поддержании беременности [1]. В течение первого триместра беременности желтое тело в первую очередь отвечает за выработку прогестерона. Желтое тело регрессирует примерно через 9 недель, после чего происходит синтез прогестерона из плаценты [2].Важность выработки прогестерона желтым телом была впервые признана Чапо, который продемонстрировал, что удаление желтого тела до 7-недельного гестационного возраста всегда приводит к выкидышу. Во время этого исследования он наблюдал постоянное снижение прогестерона, повышение внутриматочного давления и развитие раскрытия шейки матки перед неизбежным абортом [3]. Основываясь на этих знаниях, он назначил дополнительный прогестерон для предотвращения выкидышей, связанных с отменой прогестерона, вызванной лютеэктомией, что в конечном итоге привело к устойчивой беременности [4].
Выкидыш — частое осложнение беременности на ранних сроках, при этом большинство выкидышей приходится на срок до 8 недель [2,5]. Общий показатель потери беременности на ранних сроках (≥ 12 недель) составляет около 13,5%. Этот показатель увеличивается с возрастом матери после 20 лет, увеличиваясь с 11,5% у женщин 20-24 лет до 18,6% у женщин старше 30 лет [6]. Кроме того, у женщин с бесплодием в анамнезе наблюдалась более высокая частота выкидышей по сравнению с населением в целом [7].
Было высказано предположение, что профилактическое применение прогестерона можно использовать для снижения риска самопроизвольных абортов в первом триместре у женщин с невынашиванием беременности в анамнезе [8]. До недавнего времени исследования не могли установить целевой уровень прогестерона, выше которого беременность, скорее всего, будет продолжаться в этой группе населения. McCord et al. [9] провели ретроспективный анализ 3674 беременностей, чтобы изучить вероятность жизнеспособной внутриутробной беременности для данной концентрации прогестерона в сыворотке.Исследование показало, что вероятность жизнеспособной внутриутробной беременности в зависимости от концентрации прогестерона увеличивалась в виде сигмовидной кривой. Эта кривая выровнялась около 25 нг / мл и коррелировала с вероятностью жизнеспособной внутриутробной беременности 89%, что предполагает 25 нг / мл как важную целевую концентрацию прогестерона для поддержания беременности.
Объектив
Мы стремимся оценить эффективность порогового уровня прогестерона 25 нг / мл для поддержания беременности в первом триместре у женщин с выкидышем или бесплодием в анамнезе.
Материалы и методы
Был проведен ретроспективный обзор пациентов из частной клиники по лечению бесплодия в Рокфорде, штат Иллинойс, в период с 1996 по 2013 год. Подходили женщины, у которых была хотя бы одна попытка зачатия в клинике. Мы исключили пациентов с анатомическими дефектами, внематочными беременностями, молярными беременностями, пораженными яйцеклетками, аномальным уровнем иммунитета или использованием донорских яйцеклеток. Все другие эндокринопатии были устранены и исправлены. В исследовании приняли участие 182 женщины в возрасте от 22 до 45 лет, в общей сложности 329 беременных. Эти пациенты были разделены на две группы: первичного фертильного возраста (22-34 года) и пожилого возраста матери (35-45 лет).
Все пациенты прошли полное обследование, включая полный анамнез и физикальное, трансвагинальное ультразвуковое исследование, гистеросальпингограмму и / или соногистерограмму с инфузией физиологического раствора. Уровни прогестерона в сыворотке регистрировали при первом посещении (2-6 недель после зачатия) и 10-недельном посещении и контролировали каждые 2 недели до завершения перехода от выработки прогестерона яичниками к плацентарной.Это было определено путем изучения тенденции сывороточного прогестерона в течение первого триместра. После того, как уровни сыворотки повысились до точки, при которой после отмены добавки пациенты все еще оставались на уровне 25 нг / мл или выше, добавление прогестерона было прекращено. Уровни прогестерона проверяли через 2-3 дня после прекращения приема, чтобы убедиться, что уровни были на уровне или выше 25 нг / мл, подтверждая переход к выработке прогестерона плацентой. После выработки прогестерона плацентой уход за пациентом был передан общественным акушерам.За 12 лет беременности требовалась гормональная поддержка на протяжении всей беременности. В течение второго триместра уход за этими пациентами по-прежнему передавался местным акушерам, но мы продолжали контролировать их уровень гормонов на протяжении всей беременности.
В этом исследовании адекватный уровень прогестерона в сыворотке был определен как ≥ 25 нг / мл при первоначальном и / или 10-недельном посещении. Дополнительный прогестерон вводили пациентам, если уровень прогестерона в сыворотке упал ниже 25 нг / мл во время первого или 10-недельного визита.В случаях, когда пациенты уже получали дополнительный прогестерон, доза прогестерона была увеличена для достижения адекватного уровня прогестерона в сыворотке. Метод добавления прогестерона был определен на основе предпочтений пациента и побочных эффектов и включал: пероральное, вагинальное и внутримышечное введение. Пациентам с плохой абсорбцией или плохой переносимостью прогестерона перорально или вагинально вводили внутримышечно прогестерон в масле.
Первичным результатом была жизнеспособная беременность в первом триместре.Жизнеспособная беременность определялась детальным морфологическим ультразвуковым исследованием плода на сроке 11-13 недель. Мы не вели наблюдение после того, как пациентка была передана общественному акушеру, за исключением 12 случаев, описанных ранее, которые требовали постоянного наблюдения в течение всего срока беременности. Следует отметить, что все 12 беременностей достигли конца третьего триместра.
Было проведенотестов хи-квадрат для анализа связи между жизнеспособной беременностью и адекватным уровнем прогестерона в сыворотке.Был использован a priori альфа-уровень 0,05. Для всего статистического анализа использовалась версия 24 SPSS Statistics.
Результаты
В общей сложности было включено 329 беременностей, из которых 221 — в возрастной группе первичной фертильности (22–34 года) и 108 — в возрастной группе пожилой матери (35–45 лет). У женщин всех возрастов в 287 из 329 беременностей (87%) был достигнут адекватный уровень прогестерона (≥ 25 нг / мл при первоначальном и / или 10-недельном посещении). 188 из 221 (85%) беременностей в возрастной группе с высокой фертильностью и 99 из 108 (92%) в возрастной группе пожилых матерей достигли адекватного уровня прогестерона (Таблица 1).
Адекватный уровень прогестерона с разбивкой по возрастным группам | ||
Недостаточный уровень прогестерона в сыворотке a | Достаточный уровень прогестерона в сыворотке b | |
Все возрасты (22-45 лет) | 42 (13%) | 287 (87%) |
Первичный возраст фертильности (22-34 года) | 33 (15%) | 188 (85%) |
Пожилой возраст матери (35-45 лет) | 9 (8%) | 99 (92%) |
a Менее 25 нг / мл при первоначальном и 10-недельном посещении b Больше или равно 25 нг / мл при первоначальном и / или 10-недельном посещении | ||
Таблица 1. Адекватный уровень прогестерона с разбивкой по возрастным группам.
Показатель жизнеспособной беременности был неизменно выше во всех возрастных группах у тех, у кого был адекватный уровень прогестерона, по сравнению с теми, у кого был недостаточный уровень прогестерона. В общей сложности 208 из 287 (72%) беременностей с адекватным уровнем прогестерона закончились жизнеспособной беременностью, в то время как только 5 из 42 (12%) беременностей с недостаточным уровнем прогестерона закончились жизнеспособной беременностью (n = 329, X 2 58,883 , p <0.0001). В возрастной группе основной фертильности (22-34 года) 151 из 188 (80%) беременностей с адекватным уровнем прогестерона закончилась жизнеспособной беременностью, в то время как только 5 из 33 (15%) беременностей с недостаточным уровнем прогестерона привели к жизнеспособной беременности. (n = 221, X 2 57,424, p <0,0001). В возрастной группе матери преклонного возраста (35-45 лет) 57 из 99 (58%) беременностей с адекватным уровнем прогестерона закончились жизнеспособной беременностью, в то время как 0 из 9 (0%) беременностей с недостаточным уровнем прогестерона закончились жизнеспособной беременностью ( п = 108, Х 2 10.973, p = 0,001) (таблица 2).
Жизнеспособность беременностей в первом триместре с разбивкой по возрастным группам | |||
Жизнеспособная беременность в первом триместре a | Статистическое сравнение d | ||
Недостаточный уровень прогестерона в сыворотке b | Достаточный уровень прогестерона в сыворотке c | ||
Все возрасты (22-45 лет) | 5 (12%) | 208 (72%) | р <0.0001 |
Первичный возраст фертильности (22-34 года) | 5 (15%) | 151 (80%) | р <0,0001 |
Пожилой возраст матери (35-45 лет) | 0 (0%) | 57 (58%) | p = 0.001 |
a Определено при детальном морфологическом ультразвуковом исследовании через 11-13 недель b Менее 25 нг / мл при первом посещении и посещении через 10 недель c Больше или равно 25 нг / мл при первоначальном и / или 10-недельном посещении d X 2 квадратный тест для категориальных значений для оценки связи между жизнеспособной беременностью и адекватным уровнем прогестерона в сыворотке | |||
Таблица 2. Жизнеспособность беременностей в первом триместре с разбивкой по возрастным группам.
Обсуждение
Насколько нам известно, это первое исследование, посвященное изучению порогового уровня прогестерона для поддержания беременности. Результаты показывают, что 25 нг / мл — это эффективный пороговый уровень прогестерона в сыворотке крови для поддержания беременности в первом триместре у женщин с выкидышем или бесплодием в анамнезе как у женщин первичного фертильного возраста (22-34 года), так и у женщин пожилого возраста матери (35-35 лет). 45 лет).Данные показывают, что поддержание уровня прогестерона 25 нг / мл в течение первого триместра беременности снижает риск выкидыша в этой популяции.
Это исследование имеет несколько ограничений. Поскольку все пациенты были из одного центра по лечению бесплодия, результаты могут иметь ограниченную применимость к другим группам населения. Будущие многоцентровые исследования с более разнообразным населением и большим размером выборки позволят расширить демографические результаты и сделать возможным дальнейшее расслоение.
Кроме того, у пациентов в этом исследовании различались методы зачатия.Было высказано предположение, что у ранее бесплодных пациенток, зачатых с помощью искусственных репродуктивных технологий (ВРТ), частота самопроизвольных абортов была лишь немного выше или аналогична им по сравнению с естественным зачатием [10,11]. Поскольку наша популяция пациентов включает женщин с бесплодием в анамнезе, бесплодные пациенты, зачатые с помощью АРТ, могут не отражать влияние порогового уровня прогестерона 25 нг / мл для этой популяции пациентов.
Метод добавления прогестерона также не контролировался в этом исследовании.Было высказано предположение, что разные способы приема прогестерона по-разному влияют на эндометрий, скорость всасывания и выведения, а также профили распределения. Например, было обнаружено, что пероральный прогестерон неэффективен в отношении секреторной трансформации эндометрия на уровне сывороточного прогестерона, который считается адекватным для этого процесса. Аналогичным образом, вагинальный прогестерон проявлял свое действие на эндометрий при более низких концентрациях в сыворотке крови из-за его выраженного воздействия на матку, так называемый эффект первого прохождения через матку [12].В нашем исследовании предполагалось, что концентрация прогестерона в сыворотке 25 нг / мл или выше, независимо от способа доставки прогестерона, была достаточной для оказания его воздействия на матку во время внутриутробной беременности. Будущие исследования, контролирующие метод приема прогестерона, могут уменьшить несоответствия в изменениях матки, вызванных прогестероном.
Наконец, это исследование не контролировало многоплодную беременность (например, двойню). Исследования подтвердили, что прогестерон является самым сильным предиктором жизнеспособной беременности, и предположили, что для поддержания беременности может потребоваться уровень прогестерона в сыворотке до 58 нг / мл [13,14].В то время как в нашем исследовании было зафиксировано 35 беременностей двойней и тройней в первом триместре с порогом 25 нг / мл, в этих беременностях средний уровень прогестерона превышал 100 нг / мл, что почти вдвое выше среднего показателя жизнеспособных беременностей одноплодной беременностью (65 нг / мл). . Таким образом, часть нежизнеспособных беременностей в нашем исследовании может быть связана с недостаточным уровнем прогестерона у женщин, вынашивающих многоплодную беременность. Дальнейшие исследования помогут определить, нужны ли разные пороги сывороточного прогестерона для одноплодной или многоплодной беременности.
Наши результаты также поддерживают будущие исследования, направленные на установление более высоких пороговых значений сывороточного прогестерона для женщин пожилого возраста матери. В нашем исследовании большая часть женщин с адекватным уровнем прогестерона в сыворотке в пожилой возрастной группе матери все еще приводила к выкидышу. Кроме того, 0% женщин в пожилом возрасте матери с недостаточным уровнем прогестерона имели жизнеспособную беременность. Это говорит о том, что женщинам 35 лет и старше может потребоваться более высокий пороговый уровень прогестерона, чем женщинам моложе 35 лет.Поскольку все больше женщин откладывают беременность до достижения возраста 35 лет, было бы полезно провести дополнительное исследование более высокого порогового уровня для женщин пожилого возраста матери [15].
Насколько нам известно, это первое исследование, в котором установлен эффективный целевой уровень прогестерона для поддержания беременности в первом триместре у женщин с бесплодием или выкидышем в анамнезе. Это исследование демонстрирует необходимость быть более бдительным при мониторинге уровня прогестерона в первом триместре беременности и при необходимости вмешиваться женщинам с бесплодием или выкидышем в анамнезе.
Конфликт интересов
Авторы сообщают об отсутствии конфликта интересов
Финансирование
В данном исследовании не использовались источники финансирования исследований.
Список литературы
- Ragusa A, de Carolis C, dal Lago A, Miriello D, Ruggiero G и др. (2004) Добавка прогестерона во время беременности: иммунологическая терапия? Волчанка 13: 639-642.[Crossref]
- Габбе С.Г., Нибил Дж.Р., Галан Х.Л. (2012) Акушерство: нормальная и проблемная беременность: нормальная и проблемная беременность. Сент-Луис, США: Сондерс 17: 592-593.
- Csapo A, Pulkkinen M, Kaihola HL (1972) Значение желтого тела человека в поддержании беременности: предварительные исследования. Am J Obstet Gynecol 112: 1061-1067. [Crossref]
- Csapo AI, Pulkkinen MO, Wiest WG (1973) Эффекты лютеэктомии и заместительной терапии прогестероном у пациенток с ранней беременностью. Am J Obstet Gynecol 115: 759-765. [Crossref]
- Regan L, Rai R (2000) Эпидемиология и медицинские причины выкидыша. Baillieres Best Practices Clin Obstet Gynaecol 14: 839-854. [Crossref]
- Rossen L, Ahren K, Branum A (2017) Тенденции риска потери беременности среди женщин в США, 1990-2011 гг. Детская и перинатальная эпидемиол.
- Coulam CB (1992) Связь между бесплодием и самопроизвольным абортом. Am J Reprod Immunol 27: 128-129. [Crossref]
- Check JH, Chase JS, Nowroozi K, Wu CH, Adelson HG (1987) Прогестероновая терапия для уменьшения самопроизвольных абортов в первом триместре у предыдущих абортов. Int J Fertil 32: 192-193. [Crossref]
- МакКорд М., Мурам Д., Бастер Дж., Архарт К., Стовалл Т. и др. (1996) Прогестерон в одной сыворотке как скрининг на внематочную беременность: обмен специфичностью и чувствительностью для получения оптимальных результатов теста.Fertil Steril 66: 513-516. [Crossref]
- Wang JX, Norman RJ, Wilcox AJ (2004) Частота самопроизвольных абортов среди беременностей, вызванных вспомогательными репродуктивными технологиями. Hum Reprod 19: 272-277. [Crossref]
- Schieve LA, Tatham L, Peterson HB, Toner J, Jeng G (2003) Самопроизвольный аборт среди беременных, зачатых с использованием вспомогательных репродуктивных технологий в Соединенных Штатах. Акушерский гинекол 101: 959-967.[Crossref]
- Tavaniotou A, Smitz J, Bourgain C, Devroey P (2000) Сравнение различных способов введения прогестерона в качестве поддержки лютеиновой фазы при лечении бесплодия. Обновление Hum Reprod 6: 139-148. [Crossref]
- Elson J, Salim R, Tailor A, Banerjee S, Zosmer N (2003) Прогнозирование жизнеспособности беременности на ранних сроках при отсутствии эмбриона, определяемого ультразвуком. Ультразвуковой акушерский гинеколь 21: 57-61.[ Crossref]
- Гоктолга У, Гунгор С., Джейхан С., Кескин У, Фидан У и др. (2008) Оценка прогностической ценности сывороточного уровня прогестерона для прогноза ранней беременности при спонтанной беременности двойней: проспективное исследование. Eur J Obstet Gynecol Reprod Biol 137: 185-188. [Crossref]
- Мартин Дж., Гамильтон Б., Остерман М.

 Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами.
Значение прогестерона больше 25 nmol/L на 7 день после предполагаемой овуляции – признак овуляторного цикла. Для более точной оценки функции желтого тела рекомендуется назначать анализ за 4 -10 дней до начала нового менструального цикла три раза с трехдневными интервалами. Нормальный показатель содержания в плазме для здорового человека равен от 10 до 22 ммоль/л. Переизбыток говорит о соматических или психических недугах, липемии. Дефицит – о беременности, плохом питании, больших физических нагрузках, употреблении ряда лекарственных препаратов.
Нормальный показатель содержания в плазме для здорового человека равен от 10 до 22 ммоль/л. Переизбыток говорит о соматических или психических недугах, липемии. Дефицит – о беременности, плохом питании, больших физических нагрузках, употреблении ряда лекарственных препаратов. д., в меньшую – о голодании, чересчур больших физических нагрузках, болезнях почек и ЖКТ.
д., в меньшую – о голодании, чересчур больших физических нагрузках, болезнях почек и ЖКТ. Переизбыток говорит об возможных опухолях на яичниках, недостаток – о сбое выделения гонадотропных гормонов.
Переизбыток говорит об возможных опухолях на яичниках, недостаток – о сбое выделения гонадотропных гормонов.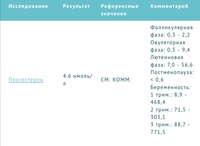 Для последних норма составляет от 100 до 266 мкг/л, для дам в детородном возрасте от 129 до 539 мкг/л, женщин в менопаузе – от 106 до 289 мкг/л.
Для последних норма составляет от 100 до 266 мкг/л, для дам в детородном возрасте от 129 до 539 мкг/л, женщин в менопаузе – от 106 до 289 мкг/л.