Аденокарцинома желудка: прогноз, сколько живут после операции, лечение и стадии, классификация
Аденокарцинома желудка — это одна из наиболее часто встречающихся разновидностей рака данной локализации. На ее долю приходится до 95% всех злокачественных новообразований желудка. Заболевание коварно тем, что на начальных стадиях никак себя не проявляет, затем возникают боли, тошнота, потеря аппетита, на фоне этих симптомов нарастает слабость и потеря веса. Единственный на сегодняшний день радикальный метод лечения аденокарциномы это хирургическая операция. Лучевая терапия и химиотерапия назначаются в качестве дополнительного лечения или при невозможности хирургического вмешательства.
Причины развития
Причина злокачественной трансформации клеток слизистой оболочки до конца не выявлены, но ученые определили несколько факторов, которые достоверно повышают такую вероятность:
- Хронический атрофический гастрит. На его фоне развивается до 60% всех случаев рака желудка.
 При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз.
При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз. - Нарушение питания — употребление большого количества острых и соленых продуктов, маринадов, копченостей, вяленого мяса, а также жиров, особенно подвергшихся термической обработке. Имеет значение характер приема пищи. Переедание, недостаточно тщательное пережевывание пищи может привести к хронической травматизации стенки желудка и на этом фоне — к злокачественному перерождению клеток.
- Инфицирование бактерией Хеликобактер пилори увеличивает риски в 3-4 раза.
- Курение и злоупотребление алкоголем.
- Наличие в анамнезе операций на желудке. Риск развития рака увеличивается в 4 раза.
- Пернициозная анемия — злокачественная анемия, связанная с невозможностью усвоения витамина В12. На этом фоне происходит снижение иммунитета, что в 10% случаев приводит к развитию рака.
- Иммунодефицитные состояния, в том числе СПИД.

- Наследственная предрасположенность по данным разных авторов увеличивает риск на 5-20%. В научной литературе описаны случаи наследования аденокарциномы желудка.
- Работа с вредными производственными факторами (никель, асбест).
- Язва желудка. При ее расположении в теле желудка, риски малигнизации увеличиваются в 2 раза, а при поражении антрального отдела данной закономерности не отмечается.
Виды аденокарциномы желудка
Согласно современной классификации выделяют следующие виды аденокарцином, поражающих желудок:
- Папиллярная — визуально напоминает полип.
- Тубулярная. Произрастает из клеток кубического или цилиндрического эпителия.
- Муцинозная. Произрастает из слизисто-продуцирующих клеток.
По степени дифференцировки выделяют следующие формы:
- Высокодифференцированная аденокарцинома желудка. Клетки опухоли имеют высокий уровень дифференцировки и «напоминают» здоровую ткань. Характеризуется медленным ростом и, при своевременной диагностике, хорошо поддается излечению.

- Умеренно дифференцированная аденокарцинома желудка. Клетки этой опухоли сложно идентифицировать с тканью, из которой она произрастает. Характеризуется умеренной злокачественностью и скоростью роста.
- Низкодифференцированная аденокарцинома желудка. Клетки данной опухоли невозможно идентифицировать с определенной тканью. Это наиболее злокачественный тип рака желудка. Характеризуется быстрым ростом и метастазированием.
Симптомы
- Потеря аппетита.
- Явления диспепсии — вздутие живота, тошнота, отрыжка, чувство тяжести. Если опухоль имеет большие размеры, она может перекрывать просвет желудка, что вызывает рвоту при приеме пищи, но это происходит уже на последних стадиях.
- Слабость и апатия.
- Боль. Как правило, она возникает не сразу, а преимущественно на распространенных стадиях.
 В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
Как мы видим, эти симптомы неспецифичны, и человек может долгое время пытаться купировать их самостоятельно.
Диагностика аденокарциномы желудка
Своевременная диагностика рака желудка имеет важнейшее значение, поскольку прогноз на ранних стадиях заболевания куда более благоприятен, чем при распространенном опухолевом процессе. Но аденокарцинома на начальных стадиях характеризуется либо бессимптомным течением, либо ее симптомы воспринимаются как признаки другого заболевания, например, гастрита, язвы, желчнокаменной болезни, панкреатита. В результате пациенты не обращаются к врачу, купируя симптомы самостоятельно с помощью препаратов, купленных в аптеке.
Стадии аденокарциномы
- 0 стадия или рак in situ. Злокачественные клетки не распространяются на пределы эпителиального слоя.

- 1 стадия. Опухоль прорастает эпителий и распространяется на другие слои стенки желудка, но не выходит за ее пределы.
- 2 стадия. Опухоль увеличивается в размерах и дает метастазы в регионарные лимфатические узлы.
- 3 стадия. Аденокарцинома прорастает в соседние органы (поджелудочная железа, печень) и/или дает метастазы в несколько групп лимфатических узлов.
- На четвертой стадии, аденокарцинома дает метастазы в отдаленно расположенные органы и лимфатические узлы.
Диагностика
Диагностика аденокарциномы желудка носит комплексный характер и включает ряд обследований, которые не только помогают определить тип опухоли, но и стадию заболевания:
- ФГДС — обследование, которое осуществляется с использованием специального прибора — гибкого эндоскопа. С его помощью производится визуальный осмотр слизистой оболочки желудка, причем прибор транслирует увеличенное изображение исследуемого участка на монитор, что позволяет обнаружить незначительные изменения слизистой.
 Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.
Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток. - УЗИ. Этот метод исследования позволяет уточнить размер опухоли, ее соотношение с соседними органами, наличие метастазов в регионарные лимфатические узлы.
- КТ и МРТ также помогают верифицировать размеры злокачественного новообразования и его врастание в окружающие ткани, но главной целью является поиск метастазов в лимфоузлы и отдаленные органы (например, легкие).
- ПЭТ-КТ (позитронно-эмиссионная компьютерная томография) позволяет обнаружить отдаленные метастазы размером до 1 мм.
- Определение онкомаркеров РЭА, СА72-4, СА19-9. При раке желудка эти маркеры не имеют диагностического значения как такового, но при исходном повышении нормы, их можно использовать в качестве контроля лечения и возникновения рецидива. После операции уровень онкомаркеров должен снизиться, он может достичь нормы.
 При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
Доктор М.С. Бурдюков проводит диагностическое обследование желудка – ФГДС
Метастазирование аденокарциномы желудка
Для аденокарциномы характерно лимфогенное, гематогенное и имплантационное метастазирование.
Имплантационное метастазирование предполагает распространение клеток посредством контакта опухоли с воспринимающей поверхностью. В случае рака желудка такой поверхностью может быть брюшина, плевра, перикард, диафрагма. На четвертой стадии часто обнаруживается канцероматоз (массивное метастазирование в различные ткани).
Лимфогенное метастазирование подразумевает распространение опухоли по лимфатическим сосудам. Сначала поражаются близлежащие лимфатические узлы, а потом и более отдаленные. При раке желудка существуют специфические формы лимфогенных метастазов:
- Поражение узлов левой надключичной области — метастазы Вирхова.
- Поражение параректальных ЛУ — метастазы Шницлера.

- Поражение подмышечных ЛУ — метастазы Айриша.
Гематогенное метастазирование предполагает перенос раковых клеток по кровеносным сосудам. Чаще всего поражается печень в результате миграции клеток по воротной вене. Также возможно поражение легких, почек, головного мозга, костного мозга.
Лечение аденокарциномы желудка
Лечение аденокарциномы зависит от стадии заболевания и гистологического типа опухоли. Как правило, оно носит комплексный характер и предполагает сочетание хирургической операции с химио- или лучевой терапией. Хирургический компонент здесь является ключевым фактором.
В рамках лечения может проводиться удаление всего желудка (гастрэктомия), или его части (резекция желудка). Одновременно удаляются ткани, пораженные злокачественными клетками — регионарные лимфатические узлы, части органов, куда проросла опухоль (печень, тонкая кишка, брюшина и др).
Химиотерапия и лучевая терапия могут применяться в дооперационном (неоадъювантный режим) и послеоперационном периоде (адъювантный режим).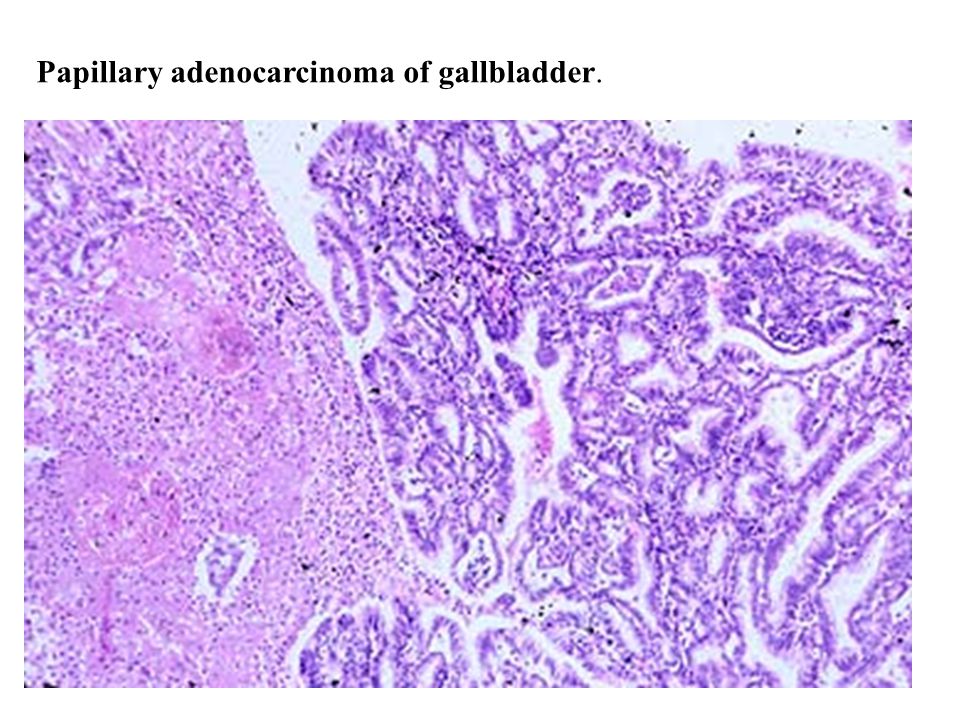 В первом случае их целью является уменьшение размеров опухоли, чтобы ее можно было удалить с наименьшим объемом тканей, а во втором — уничтожение оставшихся раковых клеток. Кроме того, применение химиотерапии и лучевой терапии может уменьшить выраженность болевого синдрома.
В первом случае их целью является уменьшение размеров опухоли, чтобы ее можно было удалить с наименьшим объемом тканей, а во втором — уничтожение оставшихся раковых клеток. Кроме того, применение химиотерапии и лучевой терапии может уменьшить выраженность болевого синдрома.
Если радикальное удаление образования невозможно, проводится паллиативное лечение. В этом случае оно направлено на устранение осложнений, вызванных аденокарциномой, и улучшение качества жизни больного. Например, если опухоль перекрыла просвет желудка, накладываются обходные анастамозы или выводится гастростома, благодаря чему пациент сможет питаться.
Прогноз аденокарциномы желудка
Прогноз при аденокарциноме зависит от стадии заболевания. Чем раньше начать лечение, тем более эффективным оно будет:
- При первой стадии пятилетняя выживаемость достигает 80%. Причем высоки шансы на полное выздоровление. К сожалению, на этой стадии рак желудка выявляется очень редко, как правило, случайно.

- На второй стадии пятилетняя выживаемость приближается к 55%. Половина из этих людей имеет шансы на полное излечение. Согласно данным литературы, менее 10% злокачественных опухолей желудка выявляются на второй стадии.
- При третьей стадии пятилетняя выживаемость находится на уровне менее 40%, а при четвертой — не превышает 5%. К сожалению, до 75% аденокарцином выявляется именно на четвертой стадии.
Профилактика
Профилактика рака желудка направлена на предотвращение или снижение воздействия факторов риска, приводящих к развитию данного заболевания:
- Нормализация питания. Употребление в пищу достаточного количества пищевых волокон (овощи, фрукты, каши), ограничение употребления соли, пряностей, маринадов и копченостей.
- Отказ от курения и злоупотребления алкоголем.
- Лечение инфекций и предраковых заболеваний — хронический гастрит, полипы желудка.
- Поддержание достаточного уровня физической активности
Низкодифференцированная аденокарцинома желудка
Онкологические заболевания желудка классифицируются по различным признакам. Дифференцировка – один из них. Специалисты различают:
Дифференцировка – один из них. Специалисты различают:
- Высокодифференцированную форму аденокарциномы. Специфика опухолевых клеток с высоким уровнем дифференцировки имеет много общего со здоровыми тканями. Новообразования медленно увеличиваются в размере. Своевременная диагностика – залог успешного результата лечения. Начальная стадия отличается отсутствием симптоматики, поэтому трудно обнаруживается. Эндоскопическое исследование не всегда выявляет новообразование. Обнаружение опухоли на позднем этапе развития снижает шансы на результативность лечебных процедур;
- Аденокарцинома с умеренной дифференцировкой. Опухолевые очаги практически не поддаются идентификации на тканях, где они расположены. Злокачественность умеренная. Новообразование увеличивается медленно;
- Низкодифференцированное новообразование. Идентификация клеток таких образований с определенными тканями невозможна. Опухоль относится к категориям с высокой злокачественностью. Быстро увеличивается в размерах, метастазы начинают распространяться на ранних стадиях.

Симптоматика низкодифференцированной аденокарциномы
Когда заболевание достигает определенной стадии, ощущается следующая симптоматика:
- Больной теряет аппетит;
- Появляются признаки диспепсии: вздувается живот, человеку тошнит, его мучает отрыжка;
- Большие новообразования перекрывают просветы в желудке, это стимулирует рвотные порывы при потреблении еды. Характерно для последних стадий;
- Падение работоспособности;
- Низкодифференцированная форма сопровождается болями. С течением болезни они становятся постоянными, не зависят от того, ел больной пищу или нет.
Этапы развития низкодифференцированной аденокарциномы
В самом начале развития заболевания эпителиальный слой не поражается злокачественными клетками рака. Болезнь прогрессирует в четыре этапа:
- Прорастание новообразования в эпителиальный слой, распространение по другим слоям желудочных стенок без выхода за их границы.
- Увеличение опухоли, метастазирование на область региональных лимфатических узлов.

- Прорастание в зону соседних органов: поджелудочной железы, печени. Метастазирование на лимфатические узлы.
- Метастазирование по органам, расположенным отдельно от желудка.
Как лечат низкодифференцированную аденокарциному
Хирургическое вмешательство – единственный способ избавить человека от ракового новообразования. В некоторых случаях рекомендуется провести курс химической терапии перед операцией. Лучевая терапия используется для снятия болевых синдромов. Она помогает уничтожить оставшиеся клетки рака.
Лечение онкологии в Tel Aviv Medical Clinic
Лучшие специалисты Израиля в области онкологии и хирургии на протяжении многих лет помогают пациентам клиники Tel Aviv Medical Clinic побороть рак. Тысячи людей избавились от сложнейших заболеваний благодаря высокой квалификации врачей, ультрасовременному оборудованию, инновационным технологиям, используемых в медицинском центре.
Рак желудка
Рак желудка – это злокачественная опухоль, образующаяся из клеток желудка.
Это один из самых распространенных видов рака. Чаще всего он появляется в пожилом возрасте, причем мужчины заболевают в 2 раза чаще, чем женщины.
Успешность терапии зависит от типа рака и стадии, на которой он был выявлен. Основной метод лечения – удаление части или всего желудка.
Синонимы русские
Аденокарцинома желудка, карцинома желудка.
Синонимы английские
Stomach cancer, gastric cancer.
Симптомы
На ранних стадиях рак желудка часто протекает незаметно. Проявление большинства симптомов с высокой вероятностью указывает на запущенность заболевания.
Симптомы рака желудка:
- боль и дискомфорт в верхней части живота,
- тяжесть, вздутие, чувство переполнения живота,
- чувство быстрого насыщения,
- тошнота, рвота,
- изжога,
- отрыжка,
- потеря массы тела,
- изменения характера вкусовых предпочтений, отсутствие аппетита,
- слабость, утомляемость.

Общая информация о заболевании
Рак желудка – это злокачественная опухоль в области желудка.
Желудок – орган в виде мышечного мешка, который является «резервуаром» для поступающей пищи, вырабатывает желудочный сок и в небольшой степени выполняет функцию всасывания.
При раке здоровые клетки превращаются в измененные, раковые. В норме клетки, появляясь в нужном количестве, в определенное время отмирают, уступая место новым. Раковые же клетки начинают бесконтрольно размножаться, не отмирая в положенное время, и их скопления образуют опухоль.
Также раковые клетки могут распространяться в близлежащие ткани организма и образовывать метастазы (метастазировать). Рак желудка часто метастазирует в лимфатические узлы, находящиеся рядом с яичниками (у женщин), левой ключицей, прямой кишкой, а также в печень и другие органы.
На данный момент причины рака желудка не установлены. Он может быть связан с такими факторами, как употребление большого количества соленых, маринованных, копченых продуктов, курение, инфекция хеликобактер пилори, наследственная предрасположенность, язва желудка, атрофический гастрит, ожирение, полипы. Одновременное воздействие нескольких факторов значительно увеличивает риск развития рака желудка.
Одновременное воздействие нескольких факторов значительно увеличивает риск развития рака желудка.
В зависимости от типа клеток, перерождающихся в раковые, выделяются основные типы рака желудка.
- Аденокарцинома – мутация железистых клеток эпителия, выстилающих внутреннюю поверхность желудка и вырабатывающих слизь для защиты от соляной кислоты. Это самый распространенный тип.
- Лимфома – в раковые перерождаются клетки иммунной системы, в небольшом количестве имеющиеся в стенках желудка. Встречается редко.
- Карциноидный рак желудка. В данном случае рак развивается из клеток, выделяющих гормоны. Также встречается нечасто.
Стадии развития рака желудка
1. Раковая опухоль небольшого размера находится в пределах верхнего слоя клеток, выстилающих внутреннюю поверхность желудка. Раковые клетки могут распространяться на некоторые близлежащие лимфатические узлы.
2. Рак распространяется глубже, поражая мышечную оболочку стенки желудка, иногда лимфатические узлы.
3. Рак поражает все слои желудка или распространяется на большое количество лимфатических узлов.
4. Раковая опухоль увеличивается. Рак распространяется на лимфатические узлы, печень, кишечник, поджелудочную железу и другие близлежащие органы; могут поражаться и отдаленные участки.
Кто в группе риска?
- Курящие.
- Страдающие ожирением.
- Лица с наследственной предрасположенностью к раку желудка.
- Инфицированные бактерией хеликобактер пилори. Она присутствует в желудке большого количества людей, в большинстве случаев бессимптомно.
- Перенесшие операции на желудке.
- Пациенты с язвой, с полипами желудка.
- Страдающие атрофическим гастритом, В12-дефицитной анемией.
Диагностика
В большинстве случаев рак желудка выявляется на поздних стадиях. При подозрении нанего проводится полный комплекс всех доступных исследований для подтверждения диагноза, составления прогноза заболевания и выбора стратегии лечения.
Лабораторные исследования:
Другие методы обследования
- Фиброгастродуоденоскопия (ФГДС) – через горло в желудок проводится тонкая трубка с объективом (эндоскопом). Производится биопсия – взятие клеток с измененных участков слизистой желудка для их последующего изучения под микроскопом. Именно биопсия позволяет определить тип рака.
- Рентгенография желудка. Пациент выпивает барий – вещество, которое видно на рентгеновских снимках. Попадая в желудок, он обволакивает складки слизистой, за счет чего возникает возможность оценить рельеф желудка, его контуры – при раке они изменяются.
- Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) помогают обнаружить опухоль в желудке, определить ее размеры, расположение, а также наличие метастазов.
- Лапароскопия – обследование желудка через отверстия в брюшной стенке величиной 0,5-1,5 см, в которые вводится трубка с камерой. Лапароскопия позволяет осмотреть органы брюшной полости, выявить метастазы, осуществить биопсию.

- Эндоскопическое УЗИ используют, чтобы определить глубину проникновения опухоли и выявить метастазы в лимфатических узлах.
Лечение
- Хирургия. Целью операции является удаление раковой опухоли и минимального количества окружающих здоровых тканей. В зависимости от распространенности рака хирургическая операция может включать:
- Удаление раковой опухоли небольшого размера. Данная операция проводится на ранней стадии.
- Субтотальную резекцию желудка — удаление части желудка, пораженной раком.
- Тотальную гастрэктомию — удаление всего желудка. В ходе операции также удаляются окружающие здоровые ткани.
- Удаление лимфатических узлов, пораженных раком.
- Лучевая терапия. Лучевая терапия использует излучение, направленное на уничтожение раковых клеток. Может быть использована до или после проведения хирургической операции.
- Химиотерапия. Химиотерапией применяются препараты для уничтожения раковых клеток.
 Химиотерапия может применяться до или после проведения операции. Также химиотерапия может сочетаться с лучевой терапией.
Химиотерапия может применяться до или после проведения операции. Также химиотерапия может сочетаться с лучевой терапией. - Паллиативная терапия применяется, когда заболевание неизлечимо, она проводится для облегчения симптомов. Для этого может использоваться хирургическая операция по удалению части желудка, применение лекарственных препаратов.
Профилактика
- Здоровое питание. Необходимо ограничить в рационе количество копченых, соленых, маринованных продуктов, употреблять больше овощей и фруктов.
- Отказ от курения.
Рекомендуемые анализы
- Общий анализ крови (ОАК)
- СА 72-4
- СА 19-9
- Раковый эмбриональный антиген (РЭА)
- Свободная β-субъединица хорионического гонадотропина человека (бета-ХГЧ свободный)
- Фрагменты цитокератина 19 CYFRA 21-1
Идентификация маркеров аденокарциномы желудка на основе биоинформатического поиска и анализа генной экспрессии | Волкоморов
1. Diamandis E.P. Towards identification of true cancer biomarkers. BMC Med 2014;12(1):156.
Diamandis E.P. Towards identification of true cancer biomarkers. BMC Med 2014;12(1):156.
2. Hu Y., He K., Wang D. et al. TMEPAI regulates EMT in lung cancer cells by modulating the ROS and IRS-1 signaling pathways. Carcinogenesis 2013;34(8):1764–72.
3. Jeung H.C., Rha S.Y., Im C.K. et al. A randomized phase 2 study of docetaxel and S-1 versus docetaxel and cisplatin in advanced gastric cancer with an evaluation of SPARC expression for personalized. Cancer 2011;117(10): 2050–7.
4. Ramaswamy S., Tamayo P., Rifkin R. et al. Multiclass cancer diagnosis using tumor gene expression signatures. Proc Natl Acad Sci U S A 2001;98(26):15149–54.
5. Букурова Ю.А., Краснов Г.С., Никитина И. Г. и др. Методы поиска маркеров для сывороточной диагностики опухолей. Молекулярная биология 2013;47(1):3–11. [Bukurova Yu.A., Krasnov G.S., Nikitina I.G. et al. Serological diagnosis of tumors: methods of marker’s search. Molekulyarnaya biologiya = Molecular Biology 2013;47(1):3–11. (In Russ.)].
Г. и др. Методы поиска маркеров для сывороточной диагностики опухолей. Молекулярная биология 2013;47(1):3–11. [Bukurova Yu.A., Krasnov G.S., Nikitina I.G. et al. Serological diagnosis of tumors: methods of marker’s search. Molekulyarnaya biologiya = Molecular Biology 2013;47(1):3–11. (In Russ.)].
6. Kulasingam V., Diamandis E.P. Strategies for discovering novel cancer biomarkers through utilization of emerging technologies. Nat Clin Pract Oncol 2008;5(10):588–99.
7. Kropotova E.S., Zinov’eva O.L., Zyrianova A.F. et al. Expression of genes involved in retinoic acid biosynthesis in human gastric cancer. Mol Biol 2013;47(2):280–92.
8. Никитина И.Г., Сабирова Е.Ю., Солопова О.Н. и др. Новый формат иммуно-ПЦР для сывороточной диагностики рака толстой кишки.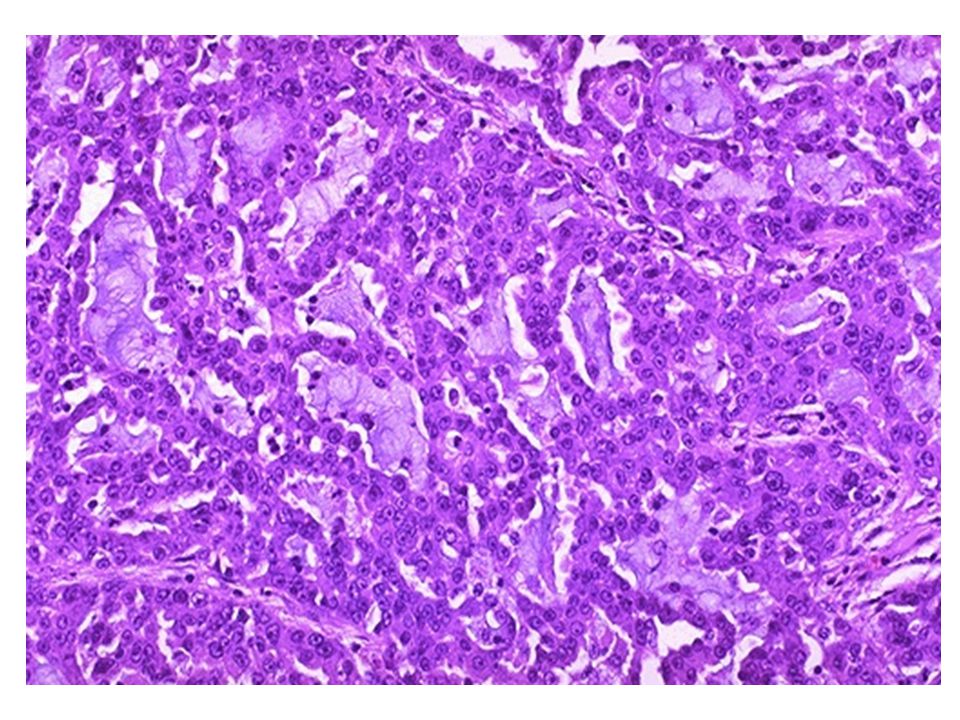 Молекулярная биология 2014;48(1):117–23. [Nikitina I.G., Sabirova E.Yu., Solopova O.N. et al. A new immuno-PCR format for serological diagnosis of colon cancer. Molekulyarnaya biologiya = Molecular Biology 2014;48(1):117–23. (In Russ.)].
Молекулярная биология 2014;48(1):117–23. [Nikitina I.G., Sabirova E.Yu., Solopova O.N. et al. A new immuno-PCR format for serological diagnosis of colon cancer. Molekulyarnaya biologiya = Molecular Biology 2014;48(1):117–23. (In Russ.)].
9. Maconi G., Manes G., Porro G.B. Role of symptoms in diagnosis and outcome of gastric cancer. World J Gastroenterol 2008;14(8):1149–55.
10. Watanabe Y., Itoh S., Goto T. et al. TMEPAI, a transmembrane TGF-betainducible protein, sequesters Smad proteins from active participation in TGF-beta signaling. Mol Cell 2010;37(1):123–34.
11. Anders S., Huber W. Differential expression analysis for sequence count data. Genome Biol 2010;11(10): R106.
12. Bullard J.H., Purdom E., Hansen K.D., Dudoit S. Evaluation of statistical methods for normalization and differential expression in mRNA-Seq experiments. BMC Bioinformatics 2010;11:94.
Bullard J.H., Purdom E., Hansen K.D., Dudoit S. Evaluation of statistical methods for normalization and differential expression in mRNA-Seq experiments. BMC Bioinformatics 2010;11:94.
13. Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J Royal Statistic Society, Series B: Methodol 1995;57:289–300.
14. Volkomorov V., Grigoryeva E., Krasnov G. et al. Search for potential gastric cancer markers using miRNA databases and their gene expression analysis. Exp Oncol 2013; 35(1):1–6.
15. Rajkumar T., Vijayalakshmi N., Gopal G. et al. Identification and validation of genes involved in gastric tumorigenesis. Cancer Cell Int 2010;10:45.
16. Sharad S., Ravindranath L., Haffner M.C. et al. Methylation of the PMEPA1 gene, a negative regulator of the androgen receptor in prostate cancer. Epigenetics 2014;9(6):918–27.
Sharad S., Ravindranath L., Haffner M.C. et al. Methylation of the PMEPA1 gene, a negative regulator of the androgen receptor in prostate cancer. Epigenetics 2014;9(6):918–27.
17. Lamouille S., Xu J., Derynck R. Molecular mechanisms of epithelialmesenchymal transition. Nat Rev Mol Cell Biol 2014;15(3):178–96.
18. Arvelo F., Sojo F., Cotte C. Tumour progression and metastasis. Ecancermedicalscience 2016;10:617.
19. Sato T., Oshima T., Yamamoto N. et al. Clinical significance of SPARC gene expression in patients with gastric cancer. J Surg Oncol 2013;108(6):364–8.
20. Yin J., Chen G., Liu Y. et al. Downregulation of SPARC expression decreases gastric cancer cellular invasion and survival. J Exp Clin Cancer Res 2010;29:59.
J Exp Clin Cancer Res 2010;29:59.
Особенности хемилюминесцентной активности моноцитов при раке желудка | Смирнова
1. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020.
2. Олейник Е.К., Шибаев М.И., Олейник В.М. Иммунологическое состояние больных с опухолями желудочно-кишечного тракта в Карелии. Иммунология. 2004;25(2):100–3.
3. Соловьева И.Г., Егоров Д.Н., Черенкова М.М., Вардосанидзе К.В., Черных Е.Р., Абраов В.В. Экспрессия HLA-DR на моноцитах и результаты лечения больных раком желудка. Медицинская иммунология. 2004;6(6):523–8.
2004;6(6):523–8.
4. Arii K., Tanimura H., Iwahashi M., Tsunoda T., Tani M., Noguchi K., et al. Neutrophil functions and cytokine production in patients with gastric cancer. Hepatogastroenterology. 2000;47(31):291–7.
5. Bennett M.W., O’Сonnell J., O’Sullivan G.C., Roche D., Brady C., Kelly J., et al. Expression of Fas ligand by human gastric adenocarcinomas: a potential mechanism of immune escape in stomach cancer. Gut. 1999;44(2):156–62. DOI: 10.1136/gut.44.2.156
6. Nagashima H., Mori M., Sadanaga N., Mashino K., Yoshikawa Y., Sugimachi K. Expression of Fas ligand in gastric carcinoma relates to lymph node metastasis. Int J Oncol. 2001;18(6):1157–62. DOI: 10.3892/ijo.18.6.1157
7. Yao X.X., Yin L., Sun Z.C. The expression of hTERT mRNA and cellular immunity in gastric cancer and precancerosis. World J Gastroenterol. 2002;8(4):586–90. DOI: 10.3748/wjg.v8.i4.586
Yao X.X., Yin L., Sun Z.C. The expression of hTERT mRNA and cellular immunity in gastric cancer and precancerosis. World J Gastroenterol. 2002;8(4):586–90. DOI: 10.3748/wjg.v8.i4.586
8. Антонов В.Г., Козлов В.К. Патогенез онкологических заболеваний: Иммунные и биохимические феномены и механизмы. Внеклеточные и клеточные механизмы общей иммунодепрессии и иммунной резистентности. Цитокины и воспаление. 2004;3(1):8–19.
9. Головизин М.В. Вмешательство раковых клеток в процессы созревания и селекции Т-лимфоцитов как фактор опухолевой прогрессии. Иммунология. 2001; 6:4–10.
10. Majima T., Ichikura T., Seki S., Takayama E., Hiraide H., Mochizuki H. Interleukin-10 and interferon-gamma levels within the peritoneal cavity of patients with gastric cancer. J Surg Oncol.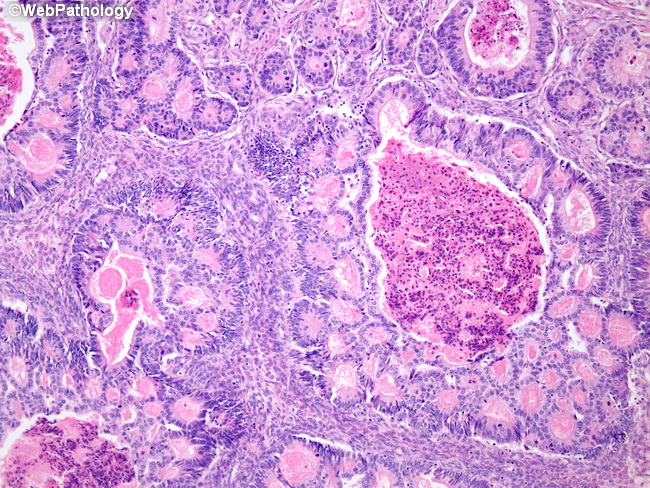 2001;78(2):124–30. DOI: 10.1002/jso.1131
2001;78(2):124–30. DOI: 10.1002/jso.1131
11. Saito H., Tsujitani S., Oka S., Kondo A., Ikeguchi M., Maeta M., et al. The expression of transforming growth factor-beta1is significantly correlated with the expression of vascular endothelial growth factor and poor prognosis of patients with advanced gastric carcinoma. Cancer (Philad). 1999;86(8):1455–62. DOI: 10.1002/(sici)1097-0142(19991015)86:83.0.co;2-L
12. Чердынцева Н.В., Колишо Е.В., Кондакова И.В. Сравнительная оценка способности опухолеассоциированных и перитонеальных макрофагов мышей продуцировать активные формы кислорода. Иммунология. 1998; 2:39–42.
Рак желудка| Блог UNIM
Страны Восточной Европы, Южной Америки, Восточная Азия – регионы с высокой заболеваемостью раком желудка. Среди факторов риска – диета, богатая солёной пищей, копчёностями, с высоким содержанием нитратов, с низким содержанием овощей и антиоксидантов, гастрит, ассоциированный с H.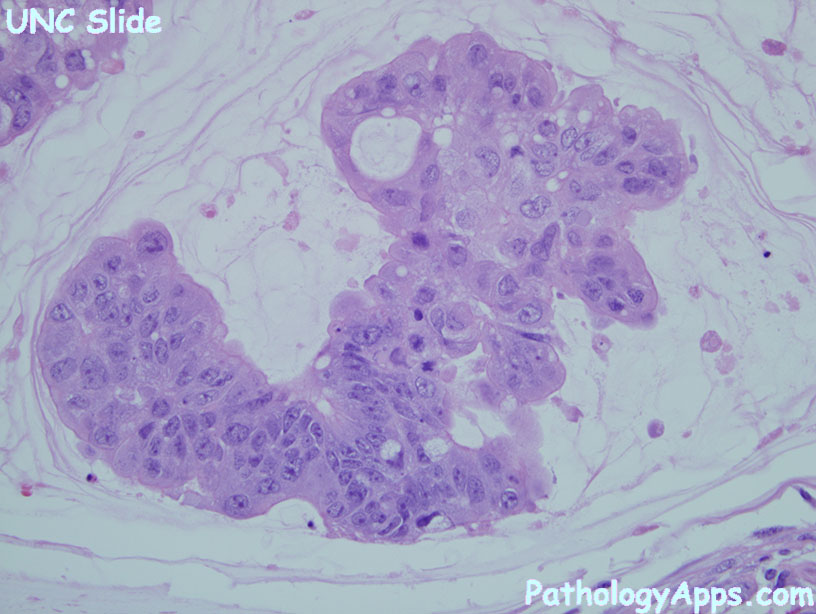 pylori и атрофический гастрит, курение, резекция желудка в анамнезе, воздействие ионизирующего излучения, наличие некоторых синдромов (синдром Линча, наследственный аденоматозный полипоз, синдром Пейтса-Егерса).
pylori и атрофический гастрит, курение, резекция желудка в анамнезе, воздействие ионизирующего излучения, наличие некоторых синдромов (синдром Линча, наследственный аденоматозный полипоз, синдром Пейтса-Егерса).
Симптомы рака желудка включают в себя боль в животе, потерю веса, тошноту и рвоту, примесь крови в рвотных массах и стуле (их окрашивание в чёрный цвет), анемию. Рак желудка метастазирует в регионарные лимфатические узлы. Иногда возникает поражение специфических для рака желудка областей: надключичных лимфоузлов слева (метастаз Вирхова), яичников (метастазы Крукенберга), параректальных лимфоузлов (метастазы Шницлера), подмышечных лимфоузлов (метастазы Айриша), в пупок (метастаз сестры Марии Джозеф). Решающее значение в диагностике имеют гастроскопия с биопсией и рентгенологическое исследование с двойным контрастированием.
Рак желудка составляет 90% всех злокачественных опухолей желудка. 10% приходится на лимфомы, опухоли мягких тканей, тератомы, гастроинтестинальные стромальные опухоли, нейроэндокринные опухоли. Протоколы лечения и прогноз при этих новообразованиях существенно отличаются, поэтому исключительное значение имеет гистологическая верификация диагноза. Гистологически выделяют аденокарциному кишечного типа (рак имеет строение, аналогичное аденокарциноме кишки и возникает, как правило, на фоне кишечной метаплазии) и диффузного типа (отдельные клетки и их мелкие скопления инфильтрируют стенку желудка без формирования желез), тубулярную, муцинозную аденокарциному, перстневидно-клеточный рак, аденоплоскоклеточный рак. Реже встречаются другие гистологические типы рака: плоскоклеточный, мелкоклеточный, недифференцированный и другие формы рака. Отдельно выделяют ранний рак желудка (когда распространенность опухоли ограничена слизистой оболочкой, независимо от поражения регионарных лимфоузлов). Диагноз на этой стадии обеспечивает наиболее благоприятный прогноз (5-летняя выживаемость при поражении только слизистой оболочки составляет 85-92%, подслизистой — 68-78%). Примечательно, что в Японии (где заболеваемость раком желудка одна из самых высоких в мире) рак желудка выявляют в этой стадии в 35% случаях, а в остальных странах только в 10%.
Протоколы лечения и прогноз при этих новообразованиях существенно отличаются, поэтому исключительное значение имеет гистологическая верификация диагноза. Гистологически выделяют аденокарциному кишечного типа (рак имеет строение, аналогичное аденокарциноме кишки и возникает, как правило, на фоне кишечной метаплазии) и диффузного типа (отдельные клетки и их мелкие скопления инфильтрируют стенку желудка без формирования желез), тубулярную, муцинозную аденокарциному, перстневидно-клеточный рак, аденоплоскоклеточный рак. Реже встречаются другие гистологические типы рака: плоскоклеточный, мелкоклеточный, недифференцированный и другие формы рака. Отдельно выделяют ранний рак желудка (когда распространенность опухоли ограничена слизистой оболочкой, независимо от поражения регионарных лимфоузлов). Диагноз на этой стадии обеспечивает наиболее благоприятный прогноз (5-летняя выживаемость при поражении только слизистой оболочки составляет 85-92%, подслизистой — 68-78%). Примечательно, что в Японии (где заболеваемость раком желудка одна из самых высоких в мире) рак желудка выявляют в этой стадии в 35% случаях, а в остальных странах только в 10%.
Основным методом лечения рака желудка является хирургический. В зависимости от локализации опухоли, макроскопического типа и гистологического строения выполняются субтотальная дистальная, субтотальная проксимальная резекция желудка, гастрэктомия. Главное условие радикальности операции заключается в удалении единым блоком пораженного опухолью желудка или соответствующей его части и регионарных лимфоузлов с окружающей их клетчаткой. При распространенном раке используется химиотерапия. При наличии гиперэкспрессии эпидермального фактора роста Her2/neu возможно применение таргетной терапии трастузумабом.
Рак желудка — вопросы и ответы
Эта статья дает ответы на наиболее часто встречающиеся вопросы пациентов, страдающих или
страдавших раком желудка, и их близких.
На приеме у врача не всегда есть возможность эти
вопросы задать и, тем более, получить подробный ответ. Надеюсь, что данная публикация
окажется полезной, как для пациентов, так и для врачей.
Европейский кодекс против рака.
«… Если обращать внимание на эти “Десять европейских правил” и руководствоваться ими в
повседневной жизни, то можно уменьшить число смертей от рака в Европе на 15%.»
… из “Руководства по борьбе с раком” Европейского сообщества.
Определенных онкологических заболеваний можно избежать, если:
1. Не курить! Курящие должны как можно скорее победить эту вредную привычку и в
дальнейшем избегать находиться в помещениях, где курят.
2. Уменьшите Ваше потребление алкоголя: пиво, вино, крепкие спиртные напитки
3. Избегайте сильного солнечного облучения!
4. Обращайте внимание на меры безопасности на Вашем рабочем месте, если Вы
используете, производите или имеете контакт с вызывающими онкозаболевания веществами
или материалами.
Ваше общее состояние здоровья зависит от следующих двух советов, которые снижают риск
большинства онкозаболеваний:
5. Чаще употребляйте в пищу свежие фрукты и овощи, а также продукты растительного
происхождения с высоким содержанием волокон.
6. Избегайте лишнего веса, ограничивайте себя в приеме продуктов с богатым
содержанием жира.
Все больше онкологических заболеваний можно вылечить, если распознать их на
ранней стадии.
7. Обращайтесь к врачу, если Вы обнаружили у себя необычные припухлости,
изменения родимых пятен на коже или несвойственное Вам кровотечение.
8. Обращайтесь к врачу, если Вы длительное время жалуетесь на хронический кашель,
осиплость голоса, продолжающиеся и обращающие на себя внимание изменения в
пищеварении или непонятная потеря веса.
9. Один раз в год проходите исследование по раннему выявлению онкологических
заболеваний.
Для женщин:
10. Регулярно обследуйте Вашу грудь; если Вы старше 40 лет, проходите маммографическое
исследование в определенные назначенные Вашим врачом промежутки времени.
Вопросы, касающиеся природы и течения заболевания.
1. Сколько пациентов, больных карциномой желудка, имеется в Республике Беларусь?
Карцинома желудка является четвертым (третьим) по частоте встречаемости онкологическим
заболеванием у мужчин после карциномы легкого, карциномы простаты и опухолей кожи. У
У
женщин рак желудка занимает также четвертую позицию после карциномы молочной железы,
рака толстой кишки и рака кожи. Можно считать, что в Республике Беларусь ежегодно
выявляется около ………………………… вновь заболевших пациентов.
2. Я слышал, что заболеваемость раком желудка в республике выросла (снизилась). Правда
ли это?
Раньше рак желудка был самым распространенным онкологическим заболеванием во всем
мире. Сегодня можно констатировать снижение заболеваемости повсеместно, особенно в
развитых индустриальных странах. Значительное снижение заболеваемости раком желудка
касается, однако, карциному, расположенную в средней и нижней трети тела желудка. Число
заболевших карциномой, локализующейся в верхней трети желудка, наоборот, скорее
2
увеличилось. В настоящее время насчитывается значительно больше пациентов с раком груди,
раком предстательной железы или раком толстой кишки. Такое положение вещей не связано с
тем, что число злокачественных опухолей других локализаций по сравнению с карциномой
желудка абсолютно выросло.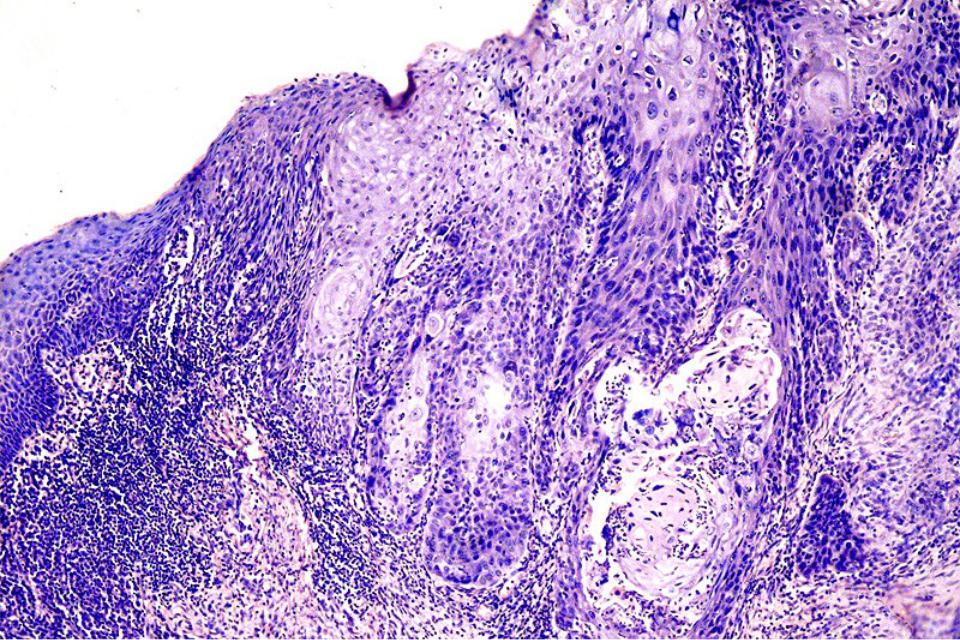 На практике регистрируется действительное снижение
На практике регистрируется действительное снижение
заболеваемости раком желудка. И лишь в некоторых дальневосточных странах карцинома
желудка является еще наиболее часто встречающейся опухолью.
3. Можно ли назвать некоторые причины, почему раньше риск рака желудка был значительно
выше, а также почему сегодня еще есть регионы, например, дальневосточная Азия, где
люди болеют им значительно чаще?
Существуют лишь предположения, что за это ответственны прежде всего сложившиеся со
временем местные традиции в питании. Если сравнить по привычкам питания регионы с
высоким уровнем заболеваемости раком желудка и регионы с низким уровнем заболеваемости,
то в глаза бросаются некоторые характерные особенности. В регионах с повышенным риском
заболеть раком желудка традиционно употребляют пищу с:
Малым количеством животных жиров и белков
Много комплексных углеводов
Относительно высоким содержанием белка растительного происхождения, в основном
зернового
Мало салатов и свежих овощей в виде листьев
Мало свежих фруктов, особенно цитрусовых
Богатым содержанием соли
Высоким содержанием нитратов
Особенно потребление большого количества соли, а также копченых продуктов называют все
чаще основной причиной такого положения дел. Ведь известно, что богатая солью пища
Ведь известно, что богатая солью пища
благоприятствует развитию хронического воспаления слизистой оболочки желудка —
атрофическому гастриту. Это в свою очередь ведет к усиленному росту в желудке образующих
нитрит бактерий, которые продуцируют нитрозамины. Эти вещества являются – это известно из
опытов над животными – особенно канцерогенными. Так азиаты, особенно японцы, едят все
очень соленое, а потребление нитратов у них почти в четыре раза выше, чем у европейцев.
Эти можно объяснить, что в этих регионах мира карцинома желудка имеет значительно более
высокое распространение.
В западных индустриально развитых странах произошло значительное изменение привычек
питания. Сегодня в этих странах потребляются чаще сахар, жиры и молочные продукты, и в
целом питание стало также более богатым витаминами.
Витамины, в особенности витамин С, должны защищать от карциномы желудка.
В прошлом – до того времени, когда появились холодильники и морозильники и существовали
лишь естественные способы консервирования – имело место подобное более частое
употребление в пищу копченостей, копченой на дыму рыбы или жареного на костре мяса, т.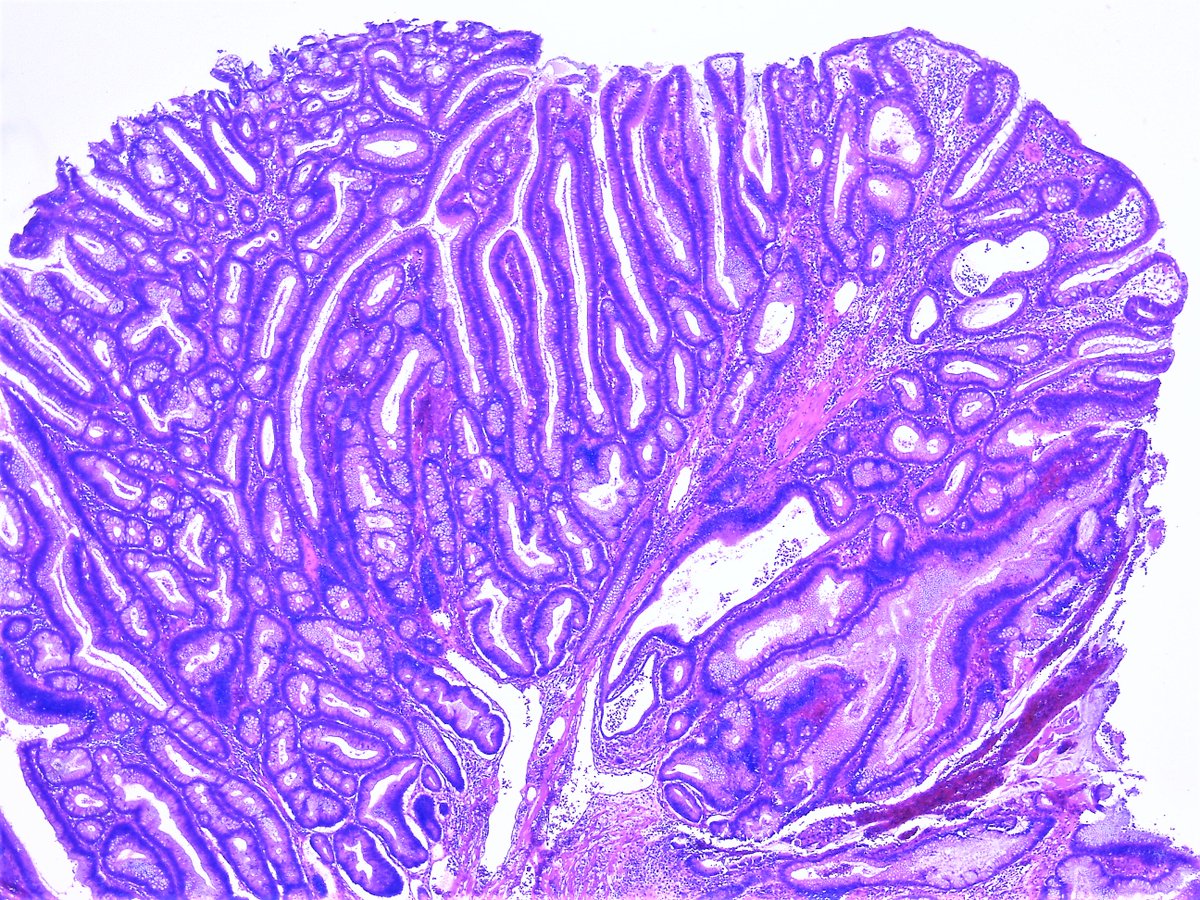 е.
е.
продуктов, содержащих высокие концентрации канцерогенных нитрозаминов. Так как пища,
подвергшаяся копчению, и копченая на дыму рыба, сегодня все еще представлены в
ежедневном рационе восточной Азии, считается, что эти продукты являются одной из причин
большого числа случаев рака желудка в этих регионах.
4. Почему карцинома желудка так редко встречается у детей и подростков?
Преобладают внешние влияния, приводящие к заболеванию раком. Они должны очень долгое
время оказывать свое патологическое влияние. По научным оценкам – минимум 20-40 лет. Если
же рак желудка встречается у молодых людей, то ответственными за его возникновение
считают скорее врожденные, чем приобретенные факторы.
Впрочем, злокачественные опухоли желудка бывают также и у детей. Но тогда речь идет чаще
всего о злокачественном разрастании имеющейся в желудке лимфатической ткани или о
саркоме. Причинами этих злокачественных опухолей желудка являются совсем другие
факторы, чем при карциноме желудка.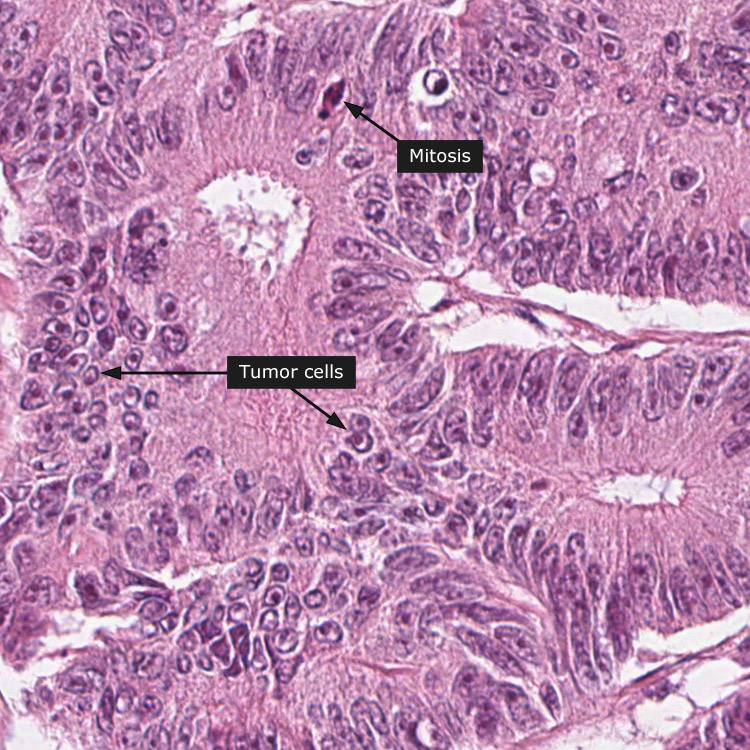
5. У моего отца и брата моего дедушки тоже был рак желудка. Передается ли рак желудка по
наследству? Заболеют ли мои дети раком желудка?
3
Рак желудка не передается по наследству, хотя определенная семейная предрасположенность
к этому заболеванию, вероятно, существует. В Европе исходят из того, что риск карциномы
желудка в 3,7 раза выше, если кто-то из Ваших родственников первой степени страдал этим
заболеванием.
Большие эпидемиологические исследования показали, что люди с группой крови А (II)
статистически чаще болеют раком желудка, чем имеющие группу крови В (III) или 0 (I). В
целом исходят из того, что 90 % всех карцином желудка – это следствие влияния факторов
окружающей среды, и лишь максимум 10% приходится на генетическую предрасположенность.
6. Какие существуют другие факторы риска наряду с генетической склонностью к
заболеванию карциномой желудка?
К самым известным факторам риска относят особую форму малокровия (пернициозную
анемию), особый вид хронического воспаления слизистой оболочки желудка (атрофический
гастрит), определенные типы полипов желудка и изменения слизистой оболочки желудка.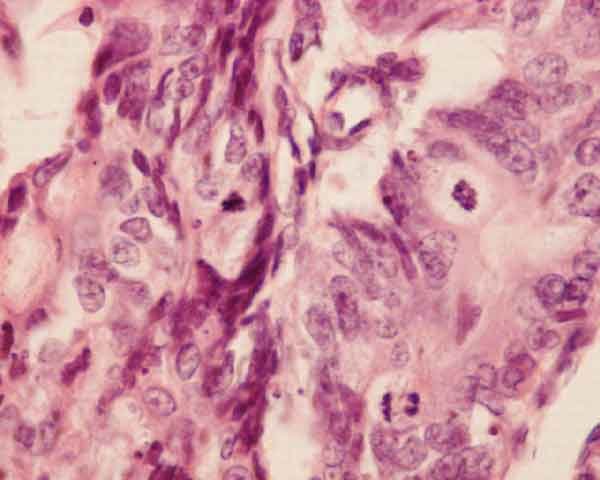 (см.
(см.
таблицу)
Таблица: Эндогенные и экзогенные заболевания и факторы риска для развития в будущем
карциномы желудка
Пернициозная анемия
Болезнь Менетрие (гипертрофический гастрит)
Полипы желудка
Атрофический гастрит
Семейная предрасположенность у людей группы крови А (II) для диффузного типа
карциномы
Синдром Пейтца-Йегерса
Бывшие дети и подростки, лечившиеся ранее по поводу лимфомы
Значительное потребление копченостей, вяленого и повареной соли
Резецированный желудок более чем 15 лет назад
Дисплазия слизистой желудка высокой степени
7. Я слышал утверждение, что снижение заболеваемости раком желудка произошло
одновременно с распространением холодильников. Как это понимать? Может ли
употребление охлажденной пищи защитить от рака желудка?
Это утверждение следует критически прокоментировать. За достоверность этой гипотезы
говорит то, что снижение заболеваемости раком желудка происходило параллельно появлению
в повседневной жизни людей замороженных продуктов питания, уменьшенному потреблению
копченой и инфицированной плесень образующими грибами пищи. Питание сегодня является
Питание сегодня является
более свежим и содержит большее количество «защищающего от рака» витамина С. Так как
копчености сами по себе содержат особенно много нитрозаминов, а плесневые грибки
образуют канцерогенные нитрозамины, благодаря появлению замороженных продуктов
питания, отпадает тем самым очень значительный провоцирующий образование рака фактор.
Но все же замороженные продукты питания ни в коем случае не являются гарантированной
защитой, тем более не от рецидива заболевания.
8. Я слышал, богатая солью питание может увеличить риск рака желудка. Касается это так же
риска повторного заболевания? Должен я теперь есть только несоленую пищу?
Повышенный риск карциномы желудка объясняют тем, что соленая пища благоприятствует
возникновению хронического гастрита (воспаления слизистой оболочки желудка) и в конечном
итоге развитию пониженной или даже нулевой кислотности (атрофический гастрит).
Отсутствие кислоты в желудке приводит к усилению деятельности бактерий, что в свою
очередь ведет к образованию больших концентраций канцерогенных нитрзаминов.
Вам нет необходимости есть пищу вообще без соли. Но и злоупотреблять ею не стоит. Даже
если у Вас резецирован желудок, время экспозиции нитрозаминов, приводящее к
возникновению карциномы, оценивается около 15-20 лет.
9. Верно ли, что из-за недостатка витаминов развивается рак желудка?
Витамин С тормозит образование нитрозаминов. Витамин А и Е (бета-каротин) приводят к
созреванию клеток. Оба витамина тем самым имеют свойство защиты от карциномы желудка.
4
10. Какое влияние имеют нитрозамины при возникновении рака желудка?
Нитрозаминами можно в экспериментах на животных вызвать рак желудка. В научной
литературе есть многочисленные указания на то, что усиленное потребление нитратов – и
вместе с тем нитрозаминов – ведет к повышенному риску карциномы желудка.
Благодаря деятельности бактерий в желудке нитраты редуцируются в нитриты. Потом
последние могут после реакции с другими содержащими азот компонентами образовывать
канцерогенные нитрозамины. Витамин С тормозит эту реакцию в цепи.
При определенных формах хронического воспаления слизистой оболочки желудка
(атрофический гастрит) в нем находятся в большем количестве нитрит образующие бактерии.
Если же имеет место недостаток витаминов А, С и Е, то это приводит к повышенным
концентрациям нитрозаминов и, тем самым, к возможному развитию карциномы.
11. Означают ли операции на желудке в прошлом риск заболеть раком желудка?
Что касается этого вопроса, то среди ученых нет единого мнения. Ранее считалось, что
операция на желудке является одним из важнейших факторов влияющих на развитие
карциномы в резецированном желудке. Сегодня это, будучи ранее догматичным, утверждение,
поддается критическому рассмотрению.
Если оценивать в целом, то риск возникновения рака в области операционного рубца
возникает самое раннее через 15 – 20 лет. Причиной этого повышенного риска рака
рассматривается продукция или недостаточное разрушение в оперированном желудке
канцерогенных веществ. Такая точка зрения объясняла бы также и длительный период
времени в 15-20 лет, необходимый для возникновения карциномы.
12. Меня удивляет, что почти никогда не называют хроническую язвенную болезнь желудка и
12 перстной кишки в качестве фактора риска. Почему?
Злокачественное перерождение язв 12 перстной кишки само по себе очень редкое явление.
Наличие хронической язвы желудка или 12 перстной кишки длительное время не связано с
повышенным риском заболеть карциномой. Хотя как рентгенологически, так и эндоскопически
при гастроскопии карцинома желудка очень похожа на доброкачественную язву и может быть
ошибочно за нее принята. В таком случае за диагнозом «хроническая язва желудка» может
скрываться карцинома.
Исходя из этого, врачи при проведении фиброгастроскопии, принципиально берут пробу ткани
– даже из кажущейся доброкачественной язвы желудка – для микроскопического
исследования. Они настаивают на контрольном исследовании через примерно 6-8 недель, даже
если результат микроскопического исследования ткани был нормальный, а все жалобы и
симптомы исчезли.
13. Существует ли связь, зависимость между душевным состоянием и риском заболевания
раком желудка?
Не существует никаких однозначных научных выводов по этому поводу, хотя в дилетантских
кругах подобное утверждение можно часто слышать. В случаях с доброкачественными язвами
желудка и 12 перстной кишки оно в какой-то мере справедливо.
Наоборот, органические заболевания желудочно-кишечного тракта часто ведут к изменениям
душевного состояния пациента. И даже не редкость, что у пациентов со злокачественными
опухолями желудочно-кишечного тракта, изменения психического состояния могут опережать
клинические их проявления.
14. Можно ли по анализу крови своевременно распознать карциному желудка?
Нет, в настоящее время еще не существует такого рода возможности ранней диагностики этого
заболевания. В случаях т.н. указывающих на заболевание карциномой раковых тестах
(опухолевых маркерах) речь идет об очень неспецифических результатах, которые могут быть
положительны также и у здоровых людей, и при доброкачественных различных заболеваниях.
Врача эндоскопического отделения МКДЦ Дорожко М.В.
Рак желудка — Лечение в клинике Мэйо
Лечение рака желудка в клинике Мэйо
Врачи клиники Мэйо пользуются уважением за их знания и опыт в уходе за людьми с раком желудка.
Ваша команда по уходу в клинике Мэйо
Mayo Clinic Connect: ракВ клинике Майо врачи разных специальностей работают как одна команда, чтобы обеспечить комплексную помощь людям с раком желудка.В вашу команду по уходу может входить:
- Врачи-онкологи
- Гастроэнтерологи
- Онкологи-радиологи
- Хирурги общего профиля
- Торакальные хирурги
- Патологоанатомы
- Диетологи
- Медицинские генетики
- Эрготерапевты
- Специалисты по паллиативной помощи
- Фармакологи
- Физиотерапевты
- Социальные работники
При необходимости могут быть включены другие специалисты.
Расширенная диагностика и лечение
Примите меры, чтобы снизить риск рака желудка.
Нажмите здесь, чтобы увидеть инфографику, чтобы узнать большеОпытные гастроэнтерологи клиники Mayo используют передовые эндоскопические ультразвуковые методы для точного определения стадии вашего рака. Ваша медицинская бригада имеет доступ к новейшим методам визуализации, таким как сканирование ПЭТ / МРТ, чтобы помочь обнаружить рак и определить его степень.
В клинике Майо у вас есть доступ к полному спектру процедур, включая новейшие достижения в области лечения. Ваша медицинская группа будет работать с вами, чтобы рассмотреть варианты лечения и разработать план лечения, который наилучшим образом соответствует вашим потребностям и целям.
Варианты лечения в клинике Мэйо включают:
- Полный спектр возможностей лечения. В вашу лечебную бригаду входят врачи многих специальностей, поэтому при составлении плана лечения учитываются все варианты лечения.Варианты могут включать эндоскопическую резекцию, хирургическое вмешательство, химиотерапию, лучевую терапию, таргетную терапию, иммунотерапию, гипертермическую внутрибрюшинную химиотерапию (HIPEC) и другие.
- Минимально инвазивная хирургия. Хирурги Mayo Clinic владеют всеми хирургическими методами, включая минимально инвазивную хирургию, эзофагэктомию, субтотальную резекцию желудка и полную гастрэктомию.
- Точная лучевая терапия. Онкологи-радиологи клиники Мэйо обладают опытом использования протонно-лучевой терапии для лечения рака.В этом новом типе лучевой терапии используется высокоточный лазерный луч для лечения рака, расположенного рядом с критически важными органами и структурами тела.
- Тщательно подобранная системная терапия. Онкологи клиники Мэйо тщательно выбирают препараты таргетной терапии и иммунотерапевтические методы лечения, которые с наибольшей вероятностью будут работать против вашего рака. Патологоанатомы используют секвенирование следующего поколения для анализа раковых клеток, поэтому лечение может быть адаптировано для людей с запущенным раком желудка.
- Доступ к новейшим методам лечения. Люди, обращающиеся за помощью в клинику Мэйо, имеют доступ к клиническим испытаниям, изучающим новейшие методы лечения рака желудка.
Экспертиза и рейтинг
Врачи клиники Мэйо пользуются большим уважением за их знания и опыт в уходе за людьми с раком желудка. Когда вы обратитесь за помощью в клинику Mayo, вы можете ожидать:
- Индивидуальный уход. В клинике Mayo онкологи, гастроэнтерологи, онкологи-радиологи, общие хирурги, торакальные хирурги, патологи и фармакологи работают как многопрофильная команда, чтобы обеспечить комплексную помощь пациентам с раком желудка.
- Опыт, которому можно доверять. Врачи клиники Мэйо имеют большой опыт лечения рака желудка, в том числе рака желудочно-пищеводного перехода. Ежегодно врачи клиники Майо лечат более 900 человек с раком желудка.
- Национально признанный опыт. Онкологический центр Mayo Clinic соответствует строгим стандартам комплексного онкологического центра Национального института рака, которые признают научные достижения и многопрофильный подход, ориентированный на профилактику, диагностику и лечение рака.
Клиника Мэйо в Рочестере, Миннесота, клиника Мэйо в Фениксе / Скоттсдейле, Аризона, и клиника Мэйо в Джексонвилле, Флорида, вошли в число лучших онкологических больниц по версии U.S. News & World Report.
Расположение, поездки и проживание
Mayo Clinic имеет крупные кампусы в Фениксе и Скоттсдейле, штат Аризона; Джексонвилл, Флорида; и Рочестер, штат Миннесота. Система здравоохранения клиники Мэйо имеет десятки отделений в нескольких штатах.
Для получения дополнительной информации о посещении клиники Мэйо выберите свое местоположение ниже:
Расходы и страхование
Mayo Clinic работает с сотнями страховых компаний и является поставщиком услуг внутри сети для миллионов людей.
В большинстве случаев клиника Мэйо не требует направления к врачу. Некоторые страховщики требуют направления или могут иметь дополнительные требования для определенного медицинского обслуживания. Приоритет всех посещений определяется медицинской потребностью.
Узнайте больше о приемах в клинику Мэйо.
Пожалуйста, свяжитесь со своей страховой компанией, чтобы подтвердить медицинское страхование и получить необходимое разрешение до вашего визита. Часто номер службы поддержки вашего страховщика напечатан на обратной стороне вашей страховой карты.
Получайте самую свежую информацию о здоровье из клиники Мэйо на свой почтовый ящик.
Подпишитесь бесплатно и получите подробное руководство по преодолению трудностей. с раком, а также полезные советы о том, как получить второе мнение. Вы можете отказаться от подписки в любой время.
Я хотел бы узнать больше оПодписывайся
Узнайте больше об использовании данных Mayo Clinic.Чтобы предоставить вам наиболее актуальную и полезную информацию и понять, какие информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с другая имеющаяся у нас информация о вас.Если вы пациент клиники Мэйо, это может включать защищенную медицинскую информацию. Если мы объединим эту информацию с вашими защищенными информация о здоровье, мы будем рассматривать всю эту информацию как защищенную информацию и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о политика конфиденциальности. Вы можете отказаться от рассылки по электронной почте в любое время, нажав на ссылку для отказа от подписки в электронном письме.
Спасибо за подписку
Ваше подробное руководство по борьбе с раком скоро будет в вашем почтовом ящике. Вы также получать электронные письма от Mayo Clinic с последними новостями о раке, исследованиями и уходом.
Если вы не получите наше письмо в течение 5 минут, проверьте папку со спамом и свяжитесь с нами. в информационных бюллетенях @ mayoclinic.com.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить
Дополнительная информация о выставлении счетов и страховании:
Клиника Майо в Аризоне, Флориде и Миннесоте
Система здравоохранения клиники Мэйо
Аденокарцинома желудка
Рак желудка является вторым по распространенности во всем мире раком, частота которого сильно варьируется в разных географических регионах. 1 Это относительно редко встречающееся новообразование в Северной Америке, но оно вносит значительный вклад в бремя смертности от рака. 2–5 В Северной Америке рак желудка является третьим по распространенности злокачественным новообразованием желудочно-кишечного тракта после рака прямой и поджелудочной железы и третьим по частоте летальным исходом новообразованием в целом. 4 Несмотря на снижение заболеваемости во всем мире, на рак желудка приходится от 3% до 10% всех смертей, связанных с раком. 6 Хотя выживаемость при раке желудка неуклонно повышается в таких странах, как Япония, этого не происходит в Северной Америке. 3 Несмотря на технические достижения в хирургии и использование адъювантной терапии, преобладала высокая смертность, связанная с раком желудка.
Девяносто процентов всех опухолей желудка являются злокачественными, а аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований. 7 Лечебная терапия включает хирургическую резекцию, чаще всего полную или субтотальную резекцию желудка, с сопутствующей лимфаденэктомией. Общая 5-летняя выживаемость пациентов с операбельным раком желудка колеблется от 10% до 30%. 8–10
ЭПИДЕМИОЛОГИЯ
Рак желудка редко встречается в возрасте до 40 лет, но после этого частота его заболеваемости неуклонно растет и достигает пика в седьмом десятилетии жизни. 11 По оценкам, в 2000 году было диагностировано 876 340 случаев первичного рака желудка, что привело к почти 650 000 смертей во всем мире. 4 В Северной Америке вероятность развития и смерти от рака желудка в течение жизни составляет 1,5% и 1,0% соответственно. 4 В целом стандартизованные по возрасту коэффициенты смертности среди женщин снизились (9.От 9 до 4,2 на 100 000) и мужчин (от 21,2 до 9,1 на 100 000) за последние 30 лет в Канаде. 5 В США ежегодно регистрируется 24 000 новых случаев заболевания и 14 000 случаев смерти. 12 В ретроспективном исследовании с участием более 50000 пациентов, пролеченных по поводу первичного рака желудка, Hundahl et al. 13 продемонстрировали, что 65% рака желудка в США находятся на поздней стадии (T3 / T4), из них почти 85%. опухолей, сопровождающихся метастазами в лимфатические узлы при постановке диагноза.Эта проблема еще более усложняется тем, что у пациентов, подвергнутых резекции с лечебной целью, частота рецидивов составляет от 40% до 65%. 14 При отсутствии официальных программ скрининга у большинства пациентов наблюдается продвинутая патологическая стадия, и средняя выживаемость при опухолях, резецированных с лечебной целью, может составлять 24 месяца (20–30% 5-летняя выживаемость), средняя выживаемость составляет 8,1 месяца. после паллиативных процедур и медиана выживаемости всего 5,4 месяца при запущенном заболевании без операции. 15–17
ФАКТОРЫ РИСКА
Сравнительные исследования между азиатскими и западными странами демонстрируют разительные различия в заболеваемости и общей выживаемости рака желудка, что указывает на этническое происхождение как возможный фактор риска. 3,11,18 Самый высокий уровень заболеваемости в Японии (> 40 на 100 000), Восточной Азии, Южной Америке и Восточной Европе; тогда как Канада (10 на 100 000), Северная Европа, Африка и США имеют самые низкие показатели заболеваемости. 19 Национальный институт рака при исследовании этнической принадлежности как фактора риска рака желудка выделил 3 группы: группы с высоким уровнем (корейцы, вьетнамцы, японцы, коренные американцы и гавайцы), средним уровнем (латиноамериканцы, китайцы и чернокожие). ) и низкая заболеваемость раком желудка с поправкой на возраст (филиппинцы и белые). 4
Мигранты первого поколения из стран с высокой заболеваемостью в страны с низкой заболеваемостью сохраняют уровень риска своей родной страны, тогда как последующие поколения приобретают уровень риска своей новой среды. 11,20 Это говорит о том, что этиологическое влияние может быть больше связано с факторами окружающей среды, чем с факторами этнической принадлежности. 11 С тех пор были подробно изучены некоторые диетические и поведенческие факторы. В исследовании случай-контроль Ramon et al. 21 определили, что диеты, богатые солью, копчеными или плохо консервированными продуктами, нитратами, нитритами и вторичными аминами, связаны с повышенным риском рака желудка.Считается, что эта связь возникает из-за длительного чрезмерного употребления соленой или маринованной пищи, что приводит к атрофическому гастриту и изменению среды желудка с образованием канцерогенных N-нитрозосоединений. 11 Напротив, диета, богатая фруктами и овощами, может быть связана со снижением риска рака. Haung et al, 20 в ретроспективном опросе 877 японских пациентов с раком желудка предположили, что частое употребление сырых овощей и фруктов значительно снижает риск смерти, связанной с раком желудка (отношение рисков, 0.74; 95% доверительный интервал [ДИ] 0,56–0,98) за счет их антиоксидантного действия. Было высказано предположение, что кальций, витамин А и витамин С оказывают защитное действие на слизистую оболочку желудка за счет снижения образования N-нитрозоканцерогенных соединений. 11,20 Исследования методом случай-контроль показывают, что у курильщиков сигарет риск развития проксимального рака желудка в 2–3 раза выше. 22 Эти результаты были подтверждены в исследовании Haung et al, 20 , которые продемонстрировали отношение шансов, равное 2.53 (ДИ 1,22–5,29) для постоянных курильщиков и тенденция к значимости для пациентов с привычным потреблением алкоголя.
Большинство случаев рака желудка возникает спорадически, в то время как от 8% до 10% имеют наследственный семейный компонент. 23 Карцинома желудка иногда развивается в семьях с мутациями зародышевой линии в p53 (синдром Ли-Фраумени) и BRCA2. 19 В 1-3% случаев рака желудка мутации зародышевой линии в гене, кодирующем белок клеточной адгезии E-кадгерин, приводят к аутосомно-доминантной предрасположенности к карциноме желудка, называемой наследственным диффузным раком желудка, которая имеет пенетрантность примерно 70%. 19,24–27 Huntsman et al. 24 предположили, что идентификация мутации E-кадгерина должна способствовать профилактической гастрэктомии у пораженных родственников. Рак желудка может развиваться как часть синдрома наследственного неполипозного рака толстой кишки (HNPCC), а также как часть синдромов желудочно-кишечного полипоза, включая семейный аденоматозный полипоз (FAP) и синдром Пейтца-Егерса. 19
Важным достижением в эпидемиологии карциномы желудка стало признание связи с инфекцией Helicobacter pylori . 19 В трех независимых исследованиях сообщалось о значительном повышении риска у субъектов, у которых была подтверждена инфекция H. pylori за 10 или более лет до постановки диагноза рака. 28–30 Последующий метаанализ 42 обсервационных исследований, проведенных Эсликом и др. 31 , показал значительную взаимосвязь между H. pylori и раком желудка (отношение шансов [OR], 2,04; CI, 1,69–2,45 ). H. pylori , как впоследствии было показано, вызывает изменения слизистой оболочки желудка и желудочной флоры, предрасполагающие к развитию карциномы у людей. 19 Кроме того, H. pylori способен прикрепляться к антигену группы крови Льюиса и может быть важным фактором, способствующим хронической инфекции и последующему повышенному риску рака, наблюдаемому у пациентов с фенотипом группы крови А. 19
К другим факторам, связанным с повышенным риском рака желудка, относятся хронический атрофический гастрит (например, злокачественная анемия, токсические и диетические агенты, предыдущие операции на желудке с рефлюксом желчи), гипертрофическая гастропатия (болезнь Метенье), полипы желудка, низкие социально-экономические показатели. статус и ожирение. 11,19
АДЕНОКАРЦИНОМА ЖЕЛУДКА: КЛИНИЧЕСКИЕ СООБРАЖЕНИЯ
Определение / описание случая
Диагноз рака желудка требует гистопатологической оценки ткани или цитологической оценки чистки / промываний желудка. Было предложено несколько систем классификации, чтобы помочь описать рак желудка либо с помощью макроскопических признаков (Borrmann), либо на основе микроскопической конфигурации (Ming, Carniero и Goseki). 19,32 Двумя наиболее часто используемыми являются системы Лорена и Всемирной организации здравоохранения (ВОЗ). 19
Классификация Лорена делит рак желудка на 2 основных гистологических типа: кишечный или диффузный. 11,33,34 Эта система описывает опухоли на основе микроскопической конфигурации и характера роста. 11 Рак диффузного типа имеет некогезивные опухолевые клетки, диффузно инфильтрирующие строму желудка, и часто проявляется глубокая инфильтрация стенки желудка с небольшим образованием желез или без них. 19,32 Диффузные опухоли могут проявлять выраженную десмоплазию и ассоциированное воспаление с относительной щадью покрывающей слизистой оболочки. 32 По сравнению с раком желудка кишечного типа, рак желудка диффузного типа в меньшей степени связан с влиянием окружающей среды, имеет повышенную относительную заболеваемость, чаще встречается у молодых пациентов и связан с худшим прогнозом. 19 Эти виды рака не связаны с кишечной метаплазией, не локализуются в антральном отделе и могут возникать в результате одноклеточных мутаций в нормальных железах желудка, как в случае недавно описанной наследственной диффузной карциномы желудка. 23,24,35
Рак кишечного типа демонстрирует распознаваемое образование железы, похожее по микроскопическому виду на слизистую оболочку толстой кишки. 11,19,32 Железистые образования варьируются от хорошо до низкодифференцированных опухолей, которые растут по расширяющимся, а не инфильтративным структурам. 6,11 Считается, что рак кишечника возникает вторично по отношению к хроническому атрофическому гастриту. 11,19
H. pylori и аутоиммунный гастрит являются наиболее частыми этиологическими поражениями, которые создают среду, способствующую воспалению желудка.Если гастрит не проходит, возникает атрофия желудка с последующей кишечной метаплазией, которая, в свою очередь, может привести к дисплазии. Дисплазия может возникать как в собственном желудочном, так и в «кишечном» желудочном эпителии. 19 Термин аденома применяется, когда диспластическая пролиферация вызывает макроскопическое выступающее поражение и морфологически описывается как тубулярная, тубуловиллярная или ворсинчатая аденома. 19 Аденомы, как правило, возникают в дистальных отделах желудка, часто имеют длительную предраковую фазу и расширяющийся характер роста. 6,11,19 Карцинома диагностируется, когда опухоль проникает в собственную пластинку или через мышечную слизистую оболочку. 19 До 80% диспластических поражений могут прогрессировать до инвазии.
Классификация Лорена оказалась полезной при оценке естественного течения рака желудка, особенно в отношении тенденций заболеваемости, клинико-патологических корреляций и этиологических предшественников. 6,11,33 Несмотря на очевидное использование классификации Лорена, ВОЗ 19 пересмотрела определение рака желудка на «злокачественные эпителиальные опухоли слизистой оболочки желудка с железистой дифференцировкой».«Система ВОЗ оценивает аденокарциному на основании степени сходства с метапластической тканью кишечника. 6,19,32 Он подразделяет гистологические образцы на 5 подтипов: аденокарцинома (кишечная и диффузная), папиллярная, тубулярная, муцинозная и клетка с перстневым кольцом. 19,32
Клинические проявления
Карцинома желудка часто не вызывает специфических симптомов, если она поверхностная и потенциально поддается хирургическому лечению, хотя до 50% пациентов могут иметь неспецифические желудочно-кишечные жалобы, такие как диспепсия. 11 В западных странах, даже при эндоскопическом обследовании, рак желудка обнаруживается только у 1-2% пациентов с диспепсией. Отсутствие ранних патогномоничных симптомов часто задерживает постановку диагноза. Следовательно, от 80% до 90% пациентов с раком желудка имеют местнораспространенные или метастатические опухоли с низкой степенью резектабельности. 19 Пациенты могут иметь анорексию и потерю веса (95%), а также боль в животе, которая носит неопределенный и незаметный характер. Тошнота, рвота и преждевременное насыщение могут возникать при объемных опухолях, закупоривающих просвет желудочно-кишечного тракта, или при инфильтративных поражениях, которые ухудшают вздутие живота. 11 Язвенные опухоли могут вызывать кровотечение, которое проявляется в виде кровавой рвоты, мелены или массивного кровотечения из верхних отделов желудочно-кишечного тракта.
Физикальное обследование рака желудка на ранних стадиях обычно малоинформативно. Пациенты с запущенными опухолями могут проявлять пальпируемое образование в брюшной полости, кахексию, непроходимость кишечника, асцит, гепатомегалию и отек нижних конечностей. 11,36,37 Посев в брюшину может вызвать поражение яичников (опухоль Крукенберга) или тазового тупика (полка Блюмера), обнаруживаемого при ректальном исследовании. 37 Метастазы могут проявляться в виде увеличенного надключичного лимфатического узла (узел Вирхова), левого подмышечного лимфатического узла (узел Ирландии) или околопупочного лимфатического узла (узел сестры Мэри-Джозеф). 11,37
Скрининг рака желудка
Целью массового скрининга (бессимптомные группы населения) или наблюдения (группы риска) является обнаружение и диагностика рака желудка на ранней и, следовательно, потенциально излечимой стадии. 19 Массовый скрининг для раннего выявления рака желудка является рентабельным и рекомендуется в регионах с высокой заболеваемостью, таких как Япония и Китай, где от 50% до 80% выявленных злокачественных новообразований составляют ранний рак желудка. 19 В Северной Америке нет официальных программ проверки. Американское общество эндоскопии желудочно-кишечного тракта рекомендует проводить эндоскопическое наблюдение за лицами с высоким риском (аденома желудка в анамнезе, FAP, HNCC, синдром Пейтца-Егерса и болезнь Метенье) каждые 1-2 года. 11 Массовый эндоскопический / радиологический скрининг не рекомендуется в регионах с низкой заболеваемостью, таких как Канада и США. 11
Диагностика и стадирование
Эндоскопия считается наиболее чувствительным и специфическим методом диагностики у пациентов с подозрением на рак желудка. 12 Эндоскопия позволяет напрямую визуализировать расположение опухоли, степень поражения слизистой и биопсию (или цитологическую чистку) для диагностики тканей. 38 В сочетании с эндоскопией и рентгенологическими методами эндоскопическое ультразвуковое исследование (EUS) может максимизировать стадирование опухоли, предоставляя информацию о глубине инвазии опухоли и оценивая степень перигастральной лимфаденопатии. Willis et al., , 39, предполагают, что EUS в настоящее время является наиболее ценным диагностическим инструментом для предоперационной стадии рака желудка (точность 82% при оценке глубины инвазии опухоли) и для определения резектабельности опухоли.Karpeh et al., , 12, предполагают, что комбинированное использование EUS и лапароскопического определения стадии облегчает выбор пациента, предоставляя информацию о глубине опухоли и вовлечении перигастральных лимфатических узлов. Однако они предупреждают, что EUS менее точен (50–87%) при определении статуса лимфатических узлов.
Исследование бария в верхних отделах желудочно-кишечного тракта (UGI) включает в себя закапывание жидкого бария в желудок и комбинацию 4 техник: оценка с наполнением барием, двойное контрастирование, рельеф слизистой оболочки и сжатие желудка. 40 Процедура позволяет выявить неровности слизистой оболочки. Halvorsen et al. 40 предположили, что, хотя эндоскопия все чаще становится методом выбора, эти 2 метода дополняют друг друга и обладают эквивалентной диагностической эффективностью.
Компьютерная томография (КТ) — наиболее часто используемый метод определения стадии рака желудка. 40 CT может обнаруживать метастазы в печени, региональную и отдаленную лимфаденопатию и может прогнозировать прямое вторжение в соседние структуры.Кунц и др. 41 предположили, что КТ имеет чувствительность 88% для обнаружения опухолей. Способность КТ точно определять инфильтрацию опухоли (стадия Т 58%) или статус перигастральных лимфатических узлов (25–86%) широко варьировала и не считалась надежным предиктором степени заболевания в нескольких исследованиях. 41–43
Магнитно-резонансная томография (МРТ) имела ограниченное применение для определения стадии рака желудка, главным образом из-за трудностей с артефактами движения, стоимости, времени, необходимого для обследования, и отсутствия подходящего перорального контрастного вещества. 44,45 Однако в недавнем исследовании, сравнивающем МРТ с КТ, Sohn et al. 44 задокументировали распространенный рак желудка, который легко обнаруживался с помощью обоих методов. Они показали, что МРТ была немного лучше, чем КТ при Т-стадии рака желудка. 44 Точно так же Ким и др. 46 документально подтвердили, что точность определения стадии T МРТ была выше, чем КТ (81% против 73%, P <0,05). Это исследование показало, что МРТ склонна к завышению патологической толщины опухоли. 46 Сообщается, что общая точность определения стадии T составляет от 73% до 88%. 45 Использование МРТ для определения стадии N затруднено из-за тех же трудностей, что и при постановке КТ, при которой статус узлов оценивается на основе размера лимфатических узлов. Несколько исследований показывают, что точность постановки узлов на МРТ ниже, чем при постановке КТ (65% против 73% соответственно, P > 0,05), причем оба метода имеют тенденцию к снижению узлового статуса. 45,46 Наконец, Motohara et al. 45 рассмотрели способность МРТ выявлять внегастральные метастазы и пришли к выводу, что МРТ имеет большую чувствительность, чем КТ, при обнаружении диссеминации печени, костей и брюшины.Очевидное преимущество постановки МРТ заключается, прежде всего, в ее многоплоскостных возможностях, отсутствии ионизирующего излучения и использовании у пациентов с гиперчувствительностью к контрасту. 44 Другие методы стадирования включают УЗИ брюшной полости, сканирование позитронно-эмиссионной томографии и стадионную лапароскопию. 36
ХИРУРГИЧЕСКАЯ ТЕРАПИЯ
Итого по сравнению с промежуточным итогом по сравнению с проксимальной гастрэктомией
Выбор хирургической процедуры при резектабельном раке желудка определяется размером, расположением и возможностью достичь хирургических границ, свободных от макроскопических и микроскопических заболеваний.Несколько европейских исследований показали, что для достижения адекватных границ, свободных от болезни, должно быть расстояние 5 см от опухоли до ближайшей линии резекции в опухолях кишечного типа и 10 см в опухолях диффузного типа. 39,47–49
Обычно опухоли, ограниченные проксимальной третью желудка, лечат тотальной гастрэктомией, чтобы гарантировать адекватные границы резекции. Спорно, связана ли проксимальная гастрэктомия с плохим функциональным исходом дистального остатка желудка по сравнению с тотальной гастрэктомией с реконструкцией.Хотя исследований, посвященных этой проблеме, немного, но Harrison et al, 50 в ретроспективном обзоре продемонстрировали, что пациенты с проксимальным раком желудка, перенесшие тотальную гастрэктомию или проксимальную гастрэктомию, имели одинаковую общую продолжительность жизни и частоту рецидивов. Это исследование показало, что обе процедуры могут быть выполнены безопасно. Авторы предполагают, что, хотя две процедуры эквивалентны с точки зрения выживаемости и рецидива, необходимы дальнейшие исследования для оценки питания и качества жизни.Исследования продемонстрировали улучшение качества жизни при субтотальной гастрэктомии по сравнению с группой тотальной гастрэктомии 51–53 ; однако только одно исследование 53 конкретно продемонстрировало снижение качества жизни проксимальной гастрэктомии по сравнению с тотальной и дистальной субтотальной резекциями.
Остается спорным вопрос о выборе процедуры при опухолях средней и дистальной трети желудка. В большом европейском опросе, в котором участвовали 62 центра, Heberer et al. 54 продемонстрировали, что 44% хирургов предпочитают тотальную гастрэктомию при диффузном типе рака желудка антрального отдела на основании улучшенного клиренса опухоли и частоты местных рецидивов.При анализе 6400 пациентов в Национальной базе данных по раку США, Hundahl et al 13 показали, что 12,3% пациентов с раком антрального отдела или привратника, независимо от типа опухоли, лечились тотальной гастрэктомией. В многоцентровом рандомизированном исследовании 618 пациентов Bozzetti et al 1 пришли к выводу, что пациенты с раком средней и дистальной трети желудка, перенесшие либо субтотальную, либо полную гастрэктомию, имели одинаковую 5-летнюю выживаемость. Это исследование показало, что пациенты, перенесшие субтотальную резекцию желудка, имели более короткое пребывание в больнице, лучший статус питания, меньше осложнений и лучшее качество жизни. 1 Кроме того, пациенты, перенесшие тотальную резекцию желудка, имели более высокий уровень спленэктомии с увеличением послеоперационных осложнений и восприимчивости к инфекции, что подтверждает роль субтотальной резекции желудка, когда это возможно. 1 Авторы пришли к выводу, что если рак желудка поражает соседние органы, эти органы должны быть удалены en bloc вместе с желудком, при условии, что комбинированная процедура позволяет достичь четких границ резекции. 47,48
Ограниченная или расширенная лимфаденэктомия
Частота поражения лимфатических узлов колеблется от 3% до 5% для опухолей, ограниченных слизистой оболочкой, от 16% до 25% для опухолей, ограниченных подслизистой оболочкой, и от 80% до 90 % у пациентов с III или IV стадией заболевания. 11,55 Существуют значительные разногласия относительно надлежащей степени диссекции лимфатических узлов (LND). Ретроспективные исследования, проведенные в Японии с участием более 10 000 пациентов, показывают, что расширенная LND в сочетании с гастрэктомией продлевает выживаемость по сравнению с ограниченной LND. 56–59 Расширенная LND обеспечила общую 5-летнюю выживаемость от 50% до 62% по сравнению с 15% до 30%, полученными при ограниченных резекциях в США. 10,58,60 Японские исследователи утверждают, что расширенная LND (D2) удаляет опухоль в регионарных лимфатических узлах до того, как она может дать метастазы.Кроме того, утверждается, что расширенный LND улучшает точность постановки. 55–59
Несоответствие в общей выживаемости между японскими и западными центрами после расширенной LND привело к 2 крупным многоцентровым рандомизированным проспективным испытаниям. Голландская группа по раку желудка 61 рандомизировала 711 пациентов (380 в ограниченную [D1] и 331 — в расширенную [D2]) для проведения резекции с лечебной целью. Это исследование показало, что пациенты в группе D2 имели значительно более высокий уровень послеоперационных осложнений, чем пациенты в группе D1 (43% vs.25%; P <0,001), большее количество послеоперационных смертей (10% против 4%; P = 0,004 и более длительное пребывание в больнице (медиана, 16 дней против 14; P <0,001). 61 Кроме того, Пятилетняя выживаемость была схожей в 2 группах (45% в группе D1 и 47% в группе D2). 61 В голландском исследовании авторы отметили, что миграция стадий произошла в 30% группы D2 и может объяснили разницу в выживаемости между Востоком и Западом у пациентов, соответствующих стадии. 61 Авторы пришли к выводу, что результаты не подтверждают рутинное использование D2 LND. Однако при анализе подгрупп они показали значительную разницу у пациентов со стадией II и IIIA, которым предложили резекцию D2, наблюдение, подтвержденное Siewert et al. 62 в Немецком исследовании рака желудка. Кроме того, Hundahl et al., 13 , изучая зрелые результаты голландского исследования, отметили, что риск рецидива выше в группе D1, чем в группе D2 (41% против 29%; P = 0.02), что подтверждает роль расширенной резекции лимфатических узлов.
Cuschieri et al. 63 провели рандомизированное сравнение резекций D1 (n = 200) и D2 (n = 200) для потенциально излечимого распространенного рака желудка в исследовании Совета по медицинским исследованиям (MRC). Результаты исследования продемонстрировали значительную разницу между группой D2 и группой D1 по послеоперационной смертности (13% против 6,5%; P = 0,04) и заболеваемости (46% против 28%; P <0,001). , без разницы в общей 5-летней выживаемости для D2 по сравнению с D1 (33% vs.35%). 63 Как и в голландском исследовании, MRC не продемонстрировал преимущества в выживаемости с классической японской расширенной резекцией; однако анализ подгрупп исследования MRC продемонстрировал несколько интересных результатов. Во-первых, наибольшим фактором послеоперационной заболеваемости и смертности в группе D2 было добавление панкреатикоспленэктомии (отношение рисков 1,53; ДИ 1,17–2,01). 63 Во-вторых, сохранение поджелудочной железы и селезенки с сопутствующей резекцией D2 может обеспечить лучшую выживаемость, чем резекция D1, и может быть выполнено с низкой послеоперационной заболеваемостью и смертностью. 63 Интересно, что в исследованиях как в Голландии, так и в MRC, когда для всех пациентов требовалась как минимум резекция D1 (удаление как минимум узлов уровня N1), общая 5-летняя выживаемость в группе D1 резко увеличивалась. Выживаемость от 20% до 34% (MRC) и 45% (голландцы), что снова указывает на сильную связь между выживаемостью и адекватным расслоением LN. 13 Cuschieri et al. 63 пришли к выводу, что «резекция D2 без панкреатико-спленэктомии может быть лучше, чем стандартная резекция D1, и не может быть отклонена результатами этого исследования.”
Несколько последующих исследований, основанных на результатах Нидерландов и MRC, изучали роль расширенной LND с сохранением поджелудочной железы и селезенки на послеоперационную заболеваемость, смертность и общую выживаемость. 10,55,56,62,64–69 Эти исследования продемонстрировали, что расширенная LND с сохранением селезенки и поджелудочной железы может быть выполнена при послеоперационной заболеваемости и смертности, эквивалентной ограниченной LND. Несколько хорошо проведенных проспективных исследований 10,62,64–66,69 продемонстрировали, что расширенная LND не связана с увеличением заболеваемости или смертности при проведении в опытных центрах и заметно улучшает долгосрочную выживаемость у пациентов со стадией II, IIIA 10,62,64–66,69 и, возможно, болезнь IIIB. 10 На основании этих исследований, гастрэктомия с расширенной лимфодиссекцией остается процедурой выбора в специализированных центрах. 56,69–73
Новые проблемы с лимфаденэктомией при раке желудка
Ранние версии критериев стадирования TNM касались статуса N, определяемого расположением метастазов лимфатических узлов (ЛУ) относительно первичной опухоли. 74 Это вызвало разногласия в отношении соответствующих резекций лимфатических узлов и предотвратило обобщение результатов азиатских исследований, проведенных с использованием Японской классификации рака желудка (JCGC). 75 JCGC классифицировал степень метастазов в LN на основе анатомической станции LN (). Наличие метастазов в каждой группе LN отражает статус N и составляет основу категорий D (). 74 С признанием преимущества расширенных резекций (D2) на выживаемость, пятое издание TNM AJCC было изменено, чтобы включить доступные клинические, радиологические, эндоскопические и хирургические средства для оценки степени заболевания. 76 Пятое издание классифицирует метастазы LN на основе количества положительных узлов, в которых по крайней мере 15 LN должны быть рассечены и исследованы для точного определения стадии (). 75,76 В исторической когорте Karpeh et al. 75 продемонстрировали, что количество положительных узлов обеспечивает лучший прогноз, чем анатомическое расположение, как определено в более раннем издании TNM. Точно так же Kodera et al. 77 применили стадию TNM 1997 года к 493 японским пациентам, у которых была резекция D2 или D3, и пришли к выводу, что количество вовлеченных узлов является сильным прогностическим индикатором, который должен заменить категорию N в JCGC. С тех пор это открытие было поддержано несколькими группами, которые аналогичным образом обнаружили, что увеличение количества LN улучшает прогноз, сводит к минимуму эффекты миграции стадий, улучшает стадирование узлов в разных регионах и странах, помогает выбрать подходящую мультимодальную терапию и дает лучшее представление о бремени болезни. 75,76,78 В 1995 году патологическая стадия N определялась количеством метастатических ЛУ, таким образом достигая единой унифицированной системы стадирования. 75
ТАБЛИЦА 1. Японская классификация рака желудка (JCGC)
ТАБЛИЦА 2. Классификация рака желудка Американским объединенным комитетом (AJCC) (5-е издание)
растет консенсус о том, что для точного определения стадии опухоли необходимо извлечение как минимум 15 LN.Однако в хирургических центрах Северной Америки и Европы наблюдается значительное несоблюдение режима лечения. Mullaney et al. 76 показали, что только 31% (диапазон 10–44%) хирургически удаленных случаев можно точно оценить на предмет статуса лимфатических узлов. Недостаток LN для определения стадии имеет значение как для прогноза, так и для миграции стадии. 76 Это наблюдение было подтверждено в исследовании, в котором изучались 1038 пациентов в одном американском учреждении, и было обнаружено, что до 27% случаев обследовали менее 15 узлов. 75 Еще более тревожным был отчет из Национальной базы данных США, который продемонстрировал, что всего у 18% пациентов в США проанализировано ≥15 LN. 13 Авторы предполагают, что у этих пациентов высока вероятность остаточного нелеченого поражения регионарных лимфатических узлов. Несоблюдение режима может быть непринятием обширных резекций для улучшения прогноза, незнанием степени резекции, необходимой для достижения минимального количества ЛУ, и неадекватной патологической оценки. 13,75,76,78
Адъювантная или неоадъювантная терапия
Пациенты с локализованным раком желудка без лимфоузлов имеют 5-летнюю выживаемость, которая приближается к 75% при лечении только хирургическим вмешательством. 79 Это контрастирует с пациентами с поражением лимфатических узлов, у которых выживаемость колеблется от 10% до 30%. 9 Исход рака желудка осложняется высокой частотой местных рецидивов и отдаленных метастазов после лечебной хирургии, что вызвало интерес к адъювантной терапии в надежде на улучшение результатов лечения. 58 Исследования адъювантной и неоадъювантной терапии при лечении рака желудка дали противоречивые результаты. Несоответствие может быть отражением различий между изученными популяциями (группы высокого и низкого риска), патологической классификации 80 , степени хирургической процедуры 81 (D2 по сравнению с D1) 68 , а также различий в содержание и сроки адъювантной терапии (немедленная или отсроченная). Было опубликовано несколько метаанализов 82–88 в попытке устранить расхождения, описанные в литературе, результаты которых суммированы в.
ТАБЛИЦА 3. Мета-анализы рандомизированных клинических испытаний адъювантной химиотерапии
Три из 7 метаанализов предполагают небольшое, но значительное преимущество адъювантной химиотерапии в лечении полностью резецированного рака желудка. 83,84,87 Однако эти авторы предлагают интерпретировать результаты с осторожностью, потому что результаты имеют пограничную значимость 83 и могут зависеть от ряда предубеждений, а также низкого методологического качества. 84 Этот вывод отражал более ранний отчет, в котором были рассмотрены результаты 43 рандомизированных исследований, проведенных в период с 1967 по 1993 год по всем адъювантным методам лечения рака желудка, включая опубликованные в японской литературе. 89 В этом обзоре сделан вывод о том, что результаты рандомизированных исследований в Северной Америке и Европе не подтверждают рутинное использование адъювантной химиотерапии при раке желудка. 89
Janunger et al, 85 в систематическом обзоре 153 научных статей (с участием 12 367 пациентов) исследовали эффекты адъювантной химиотерапии при раке желудка.В их метаанализе было продемонстрировано значительное улучшение общей выживаемости (). Однако раздельный анализ западных и азиатских исследований продемонстрировал значительную разницу в результатах в азиатских (OR, 0,58; 95% ДИ, 0,44–0,76), но не в западных (OR, 0,96; 95% ДИ, 0,83–1,12) отчетах. разница объясняется сроками постановки диагноза, объемом операции и переносом стадии. 85 В более позднем метаанализе, Jununger et al., 88 , применяя современные комбинации лекарств в течение последних 10 лет, не смогли продемонстрировать какого-либо значительного улучшения выживаемости ().В целом, в настоящее время недостаточно данных, чтобы рекомендовать послеоперационную химиотерапию в качестве стандартного адъювантного лечения в западных центрах. 82–85,88
Неоадъювантная терапия (химиотерапия, химиорадиотерапия, лучевая или иммунотерапия, отдельно или в комбинации) использовалась с местнораспространенными опухолями и опухолями с высоким риском рецидива, несмотря на очевидно излечивающую операцию. Сообщалось о степени резектабельности от 40% до 100% и потенциально излечивающих резекциях в 37-80% случаев. 85 Тем не менее, только 2 рандомизированных исследования касались неоадъювантной химиотерапии, ни одно из которых убедительно не продемонстрировало явной пользы. 90–92 Исследования адъювантной внутрибрюшинной химиотерапии также неубедительны и обычно не проводятся вне рамок клинических испытаний. 85
Предварительные исследования адъювантной химиолучевой терапии показали многообещающие результаты у пациентов, подвергнутых резекции с лечебной целью. 93,94 Роль адъювантной химиолучевой терапии изучалась в первую очередь в исследовании Intergroup 0116 95 , в котором было рандомизировано 566 пациентов со стадией IB-IVM0, полностью резецированной аденокарциномой желудка или гастроэзофагеальной аденокарциномы для проведения только хирургического вмешательства или хирургического вмешательства в сочетании с химиолучевой терапией (5f + лейковорин с последующей 45 Гр излучения).В группе только хирургического вмешательства дела обстояли значительно хуже по сравнению с группой адъювантной химиолучевой терапии с точки зрения безрецидивной выживаемости (отношение рисков 1,52; 95% ДИ 1,23–1,86) и смерти (отношение рисков 1,35; 95% ДИ 1,09–1,66. ). 14 Добавление адъювантной химиолучевой терапии значительно улучшило медианное значение выживаемости ( P = 0,005) с 27 до 36 месяцев. 14 Отдаленный рецидив был наиболее частым местом рецидива в группе адъювантной терапии (33% против 18%), тогда как местный рецидив был более распространен в группе, получавшей только хирургическое вмешательство (29% против 18%).19%). 14 Значительная токсичность (степень 3 или выше) наблюдалась в группе химиолучевой терапии, при этом 3 пациента (1%) умерли от токсичности, связанной с лечением. Кроме того, хотя хирургический протокол рекомендовал обширную резекцию лимфатических узлов, менее 10% пациентов получили формальную диссекцию D2, тогда как 54% подверглись диссекции D0. 14 Авторы приходят к выводу, что наибольшая польза от химиолучевой терапии может быть у пациентов из группы высокого риска, получавших неадекватные резекции D2.Несмотря на результаты этого исследования, некоторые учреждения рекомендуют только адъювантную химиотерапию пациентам, не переносящим лучевую терапию; однако оптимальный режим в этой ситуации еще предстоит определить. 92
Неоперабельное местнораспространенное или метастатическое заболевание
Более 50% пациентов поступают с неоперабельной местнораспространенной или метастатической аденокарциномой желудка. 96 У большинства пациентов, в том числе с ранней стадией заболевания, в какой-то момент в течение болезни развиваются метастазы.Облегчение симптомов в этой группе пациентов имеет первостепенное значение и может рассматриваться как местная и / или системная терапия. Лечение местных симптомов включает паллиативную хирургию, лучевую терапию и / или эндоскопические процедуры. У пациентов с метастатическим заболеванием системная химиотерапия является единственным методом лечения, который продемонстрировал значительное улучшение выживаемости. 88 Было показано, что у выбранных пациентов с хорошим статусом работоспособности по сравнению с одной только лучшей поддерживающей терапией комбинированная химиотерапия улучшает среднюю выживаемость на 3–9 месяцев, а также демонстрирует улучшение или сохранение качества жизни. 97–100 Было изучено множество традиционных режимов химиотерапии с одним агентом, при этом различные комбинации, оцененные в исследованиях фазы III, продемонстрировали частоту ответа от 25% до 40%. 101 Несмотря на количество оцененных схем, единой комбинированной схемы не появилось. 88 Стандартные протоколы в Северной Америке включают эпирубицин, цисплатин и непрерывную инфузию 5FU (ECF), 102 цисплатин и 5-дневную инфузию 5FU (CF), а также этопозид, лейковорин и болюсный 5FU (ELF). 103 Комбинированные схемы третьего поколения включают новые агенты, такие как иринотекан, оксалиплатин и таксаны, все из которых в настоящее время проходят оценку фазы II – III. Несмотря на использование традиционной комбинированной химиотерапии, средняя выживаемость редко превышает 10 месяцев.
ПРОГНОСТИЧЕСКИЕ ПЕРЕМЕННЫЕ
Стадия
Было доказано, что патологическая стадия имеет прогностическое значение как для 5-летней выживаемости, так и для частоты местных рецидивов. 62,104–106 Siewert et al, 62 в проспективном многоцентровом наблюдательном исследовании продемонстрировали, что соотношение лимфатических узлов более 20% (между положительными и удаленными узлами) было единственным наиболее важным независимым прогностическим фактором ( P <0.0001), затем следует статус остаточной опухоли ( P <0,0001) и категория T ( P <0,0001). В многомерном подгрупповом анализе полностью резецированных опухолей (R0) они подтвердили, что узловой статус был наиболее важным предиктором, за которым следовала категория T. 62
Степень
Степень относится к степени дифференцировки опухолевых клеток и, как было показано, коррелирует с агрессивностью новообразования. 6 По степени патологии опухоли подразделяются на 1 из 3 категорий: хорошо, умеренно или слабо дифференцированные / анапластические. 6 Хотя степень злокачественности обычно указывается в патологических отчетах, прогностическое влияние рака желудка еще предстоит выяснить, поскольку в нескольких ретроспективных исследованиях не удалось определить степень как независимый прогностический фактор. 106–108
Размер
Размер первичной опухоли, измеренный в наибольшем измерении, был определен в нескольких ретроспективных исследованиях как имеющий прогностическое значение. 9,105,106 Эти исследования показывают, что увеличение диаметра опухоли связано с метастазами в лимфатические узлы и 5-летней выживаемостью.Это было подтверждено в проспективном рандомизированном исследовании, которое продемонстрировало, что размер опухоли является независимым прогностическим фактором в многофакторном анализе ( P = 0,0002; ДИ 1,3–2,2) у пациентов с свободными от опухоли краями. 62
Местоположение опухоли
Влияние местоположения опухоли имеет несколько важных последствий для лечения и прогноза рака желудка. Хотя есть исследования, которые не показали связи между локализацией и прогнозом, 105,107–109 несколько исследований показали, что карцинома желудка проксимальной трети желудка представляет собой отдельную клиническую сущность с прогностическим значением. 2,9,11,105,106,110,111 Недавнее исследование показало, что проксимальные опухоли чаще имеют больший размер, обширное проникновение в стенки, венозную инвазию, узловые метастазы и более позднюю стадию с общей худшей выживаемостью по сравнению с дистальными опухолями. 111 Проксимальные опухоли могут потребовать другого хирургического подхода, основанного на потенциально другом биологическом поведении.
Лимфатическая и сосудистая инвазия
Присутствие опухолевых эмболов в перитууморальных сосудах и лимфатических сосудах недавно вызвало интерес как потенциальный независимый прогностический индикатор.Исследования показали, что поражение лимфатических узлов является статистически значимым предиктором выживаемости, а наличие опухолевых эмболов значительно влияет на рецидив опухоли и смерть после радикальной резекции. 72,105,110 Yokota et al. 110 обнаружили, что лимфатическая инвазия сохраняет свою значимость (относительный риск 11,43; ДИ 2,63–49,55) даже в условиях конкуренции с другими значимыми переменными в многофакторном анализе. Эти данные были недавно подтверждены в отчете Hyung et al, 112 , который сообщил о плохом прогнозе, связанном с продвинутой стадией T и наличием сосудистой инвазии.Kooby et al. 113 аналогичным образом продемонстрировали, что у пациентов с адекватной стадией поражения лимфатических узлов сосудистая инвазия является независимым негативным прогностическим фактором и может быть предиктором биологической агрессивности.
Возраст и пол
Ни возраст, ни пол окончательно не показали прогностического значения для смерти от рецидивирующего или метастатического рака. 62,109,114 Два небольших ретроспективных исследования в анализе подгрупп определили возраст как значительную прогностическую переменную, 105,108 , тогда как в другом исследовании влияние возраста не имело независимой прогностической ценности. 114 Это исследование показало, что выживаемость определялась стадией и полнотой резекции.
Другие факторы
Несколько других факторов связаны с увеличением местных рецидивов и снижением выживаемости при раке желудка. Предполагаемые опухолевые маркеры (p53, E-cadherin, CD-34, c-ErbB2, CA 72–4, CEA) в последнее время приобрели популярность в качестве потенциальных прогностических индикаторов для прогнозирования поведения опухоли. 111,115–117 Эти маркеры, вероятно, будут приобретать все большее значение, поскольку область анализа экспрессии генов продолжает расширяться. 117 Другие факторы включают перфорацию опухоли, экстренную операцию и переливание крови.
Анализ выживаемости и его применение при раке желудка
Использование определения прогноза заболевания является двукратным. Прогнозирование предоставляет пациентам и врачам информацию о будущем течении и естественном течении болезни и позволяет проводить сравнительный анализ данного исхода между двумя или более популяциями. 118119
Прогностические исследования часто включают сравнения между 2 или более группами пациентов, которые различаются по статусу болезни.Можно построить кривые выживаемости для каждой группы и сравнить соответствующие кривые с помощью логарифмического рангового теста. 118 В качестве альтернативы, многомерные модели могут использоваться для включения в анализ как времени, так и влияния множества факторов на время достижения заданного результата. 118 Этот анализ может использоваться для выявления комбинации факторов, которые лучше всего предсказывают прогноз в группе пациентов или влияние отдельных факторов независимо.
Методы анализа выживаемости широко применялись при изучении рака желудка для определения значимости прогностических факторов при принятии клинических решений.Недавно в ходе исследований выживаемости были созданы многомерные прогностические модели, основанные на клинико-патологических факторах и связанные с молекулярными путями. Этот подход включает профили экспрессии генов, представляющие биологическое поведение опухолей, полученные из исследований микроматриц, в прогностические модели, и может использоваться для руководства хирургической и адъювантной терапией.
Будущие направления
Некоторые виды эпителиального рака, по-видимому, развиваются по многоступенчатому пути канцерогенеза. В этих опухолях корреляция между генетическими аномалиями и последовательными фенотипическими изменениями позволила получить точную клиническую и патологическую характеристику. 36,120–123 Однако рак желудка демонстрирует неоднородность гистопатологии и молекулярных изменений, которые препятствуют его полному молекулярному разграничению. 121 Только несколько генов (например, c-met, c-erbB2, K-sam, E-cadherin) участвуют в развитии рака желудка. 124 Из них только E-кадгерин был окончательно связан как маркер наследственного диффузного рака желудка. 23,25–27,35 Как уже упоминалось, большинство случаев рака желудка возникает спорадически, при этом от 8% до 10% имеют наследственный семейный компонент.Чаще всего рак желудка возникает без каких-либо устойчивых мутаций. Патогенез значительно варьируется, от постепенного прогрессирования изменений (гастрит → метаплазия → инвазивная карцинома) до опухолей, возникающих при отсутствии предшествующего поражения. 121 Новые технологии, такие как профилирование экспрессии генов на основе микрочипов, предоставляют информацию об экспрессии многих генов, участвующих в раковых заболеваниях человека. 125 Этот подход обещает изменить наше понимание молекулярных взаимодействий, которые в конечном итоге описывают фенотип и поведение опухоли.
Профилирование экспрессии генов на основе микрочипов
ДНК-последовательности не говорят нам, как экспрессия генов вызывает фенотип или как экспрессия генов изменяет последующие молекулярные побочные продукты. 126 Текущие ограничения на понимание желудочного канцерогенеза — это методы, позволяющие связать структурные знания генов с функциональными изменениями, которые происходят между компонентами, тем самым обеспечивая понимание поведения опухоли. 124,126,127 Характеристика генов, которые дифференциально экспрессируются при раке желудка, имеет важное значение для точной диагностики и характеристики опухоли, а также для принятия обоснованных решений о хирургической и адъювантной терапии, разработки новых терапевтических средств и описания поведения опухоли для более точного прогноза. 124
Микромассивы расширили молекулярные исследования, выходящие за рамки подхода генов-кандидатов, и начинают устанавливать связь между экспрессией генов и функциональными взаимодействиями. 121,124–129 Преимущество микрочипов состоит в том, что это инструмент трансляции, который включает функциональные взаимодействия в попытке понять биологию, а не просто идентифицировать составные части пути. 126 Исследования экспрессии генов позволяют охарактеризовать гены, которые дифференциально экспрессируются или транскрибируются из геномной ДНК. 122,124 Полученный набор генов, называемый профилем экспрессии, считается основным детерминантом клеточного фенотипа и функции. 126 Понимание различий в экспрессии генов между нормальной тканью и злокачественной тканью, а также реакции экспрессии генов на стимулы окружающей среды является центральным для понимания регуляторных механизмов, участвующих в развитии и прогрессировании рака. 125,126,129
Многомерный регрессионный анализ широко применялся при изучении рака.Эти исследования позволили определить большое количество важных клинико-патологических факторов, которыми клиницисты могут руководствоваться при выборе стратегии ведения. Несмотря на это, традиционные прогностические факторы имеют ограниченную прогностическую силу и изменили текущие стратегии лечения только для нескольких типов рака. 130 Однако технология микрочипов в сочетании с многомерными прогностическими моделями вызвала интерес к использованию профилей экспрессии генов в качестве прогностических моделей.
Статус лимфатических узлов, статус рецепторов, протоонкогены и генные мутации коррелировали с прогнозом рака груди. 131 Однако рак груди сложен, и знание индивидуальных прогностических факторов дает ограниченную информацию о биологии рака груди. Несколько недавних исследований, связывающих новые данные об экспрессии генов с многомерными прогностическими моделями, были использованы для изучения выживаемости и разработки более точных маркеров биологического поведения, чтобы преодолеть ограничения современных методов прогнозного моделирования. 130–132 Эти исследования продемонстрировали, что микроматричный анализ может точно идентифицировать отдельные подклассы рака груди 131,132 и независимо предсказывать общую и безрецидивную выживаемость на основе «прогностических наборов генов», которые превосходят доступные в настоящее время клинические и гистологические прогностические модели. . 130,132
Применение микроматричного анализа к таким заболеваниям, как немелкоклеточный рак легкого, гепатоцеллюлярная карцинома, карцинома пищевода и пищевод Барретта, аналогичным образом продемонстрировало использование микроматрицы для документирования различных прогностических групп, систем молекулярного стадирования, моделей, способных точно прогнозировать общая и специфическая для болезни выживаемость и частота рецидивов за пределами существующих методов. 133–135 Таким образом, применение профилей экспрессии генов может иметь потенциал для уточнения диагноза, прогноза и ведения пациентов. 134
Большинство исследований с использованием микроматриц, изучающих аденокарциному желудка, было направлено на разработку исследовательских профилей генов опухолей желудка или клеточных линий рака желудка для идентификации генов, связанных с раком желудка, определения молекулярных фенотипов, демонстрации подтипов опухолей и выявления функциональных кластеров генов. как потенциальные маркеры биологического поведения. 124,136–141 Есть несколько исследований, в которых применялись комбинированные микроматрицы и методология прогнозного моделирования к раку желудка.Недавние исследования показали, что микроматрица в сочетании со статистическим моделированием точно предсказывает поведение опухоли в отношении прогрессирования опухоли, метастатического потенциала, рецидива опухоли и общего прогноза. 142,143 Хотя анализ экспрессии генов в сочетании с прогностическими моделями находится в зачаточном состоянии, он обещает расширить наше понимание карциномы желудка. Относительная скудность имеющихся данных, связывающих профили генов рака желудка с прогнозом и успешность лечения различных других видов рака, сильно усиливает необходимость дальнейшего изучения этого метода.С помощью методов, способных амплифицировать небольшие количества опухолевой РНК, можно предположить, что образцы ткани, полученные эндоскопически, могут быть использованы для создания предоперационных прогностических кластеров генов. При этом идентификация функциональных кластеров генов может позволить улучшить отбор пациентов для неоадъювантной и адъювантной терапии, индивидуализированные хирургические резекции, выявить новые кластеры генов для дизайна таргетной терапии и улучшить прогноз, чтобы облегчить принятие решений как клиницистом, так и пациентом.
Аденокарцинома желудка
Рак желудка является вторым по распространенности во всем мире раком, частота которого сильно различается в разных географических регионах. 1 Это относительно редко встречающееся новообразование в Северной Америке, но оно вносит значительный вклад в бремя смертности от рака. 2–5 В Северной Америке рак желудка является третьим по распространенности злокачественным новообразованием желудочно-кишечного тракта после рака прямой и поджелудочной железы и третьим по частоте летальным исходом новообразованием в целом. 4 Несмотря на снижение заболеваемости во всем мире, на рак желудка приходится от 3% до 10% всех смертей, связанных с раком. 6 Хотя выживаемость при раке желудка неуклонно повышается в таких странах, как Япония, этого не происходит в Северной Америке. 3 Несмотря на технические достижения в хирургии и использование адъювантной терапии, преобладала высокая смертность, связанная с раком желудка.
Девяносто процентов всех опухолей желудка являются злокачественными, а аденокарцинома желудка составляет 95% от общего числа злокачественных новообразований. 7 Лечебная терапия включает хирургическую резекцию, чаще всего полную или субтотальную резекцию желудка, с сопутствующей лимфаденэктомией. Общая 5-летняя выживаемость пациентов с операбельным раком желудка колеблется от 10% до 30%. 8–10
ЭПИДЕМИОЛОГИЯ
Рак желудка редко встречается в возрасте до 40 лет, но после этого частота его заболеваемости неуклонно растет и достигает пика в седьмом десятилетии жизни. 11 По оценкам, в 2000 году было диагностировано 876 340 случаев первичного рака желудка, что привело к почти 650 000 смертей во всем мире. 4 В Северной Америке вероятность развития и смерти от рака желудка в течение жизни составляет 1,5% и 1,0% соответственно. 4 В целом стандартизованные по возрасту коэффициенты смертности в Канаде снизились у женщин (с 9,9 до 4,2 на 100 000) и мужчин (с 21,2 до 9,1 на 100 000) за последние 30 лет. 5 В США ежегодно регистрируется 24 000 новых случаев заболевания и 14 000 случаев смерти. 12 В ретроспективном исследовании с участием более 50000 пациентов, пролеченных по поводу первичного рака желудка, Hundahl et al. 13 продемонстрировали, что 65% рака желудка в США находятся на поздней стадии (T3 / T4), из них почти 85%. опухолей, сопровождающихся метастазами в лимфатические узлы при постановке диагноза.Эта проблема еще более усложняется тем, что у пациентов, подвергнутых резекции с лечебной целью, частота рецидивов составляет от 40% до 65%. 14 При отсутствии официальных программ скрининга у большинства пациентов наблюдается продвинутая патологическая стадия, и средняя выживаемость при опухолях, резецированных с лечебной целью, может составлять 24 месяца (20–30% 5-летняя выживаемость), средняя выживаемость составляет 8,1 месяца. после паллиативных процедур и медиана выживаемости всего 5,4 месяца при запущенном заболевании без операции. 15–17
ФАКТОРЫ РИСКА
Сравнительные исследования между азиатскими и западными странами демонстрируют разительные различия в заболеваемости и общей выживаемости рака желудка, что указывает на этническое происхождение как возможный фактор риска. 3,11,18 Самый высокий уровень заболеваемости в Японии (> 40 на 100 000), Восточной Азии, Южной Америке и Восточной Европе; тогда как Канада (10 на 100 000), Северная Европа, Африка и США имеют самые низкие показатели заболеваемости. 19 Национальный институт рака при исследовании этнической принадлежности как фактора риска рака желудка выделил 3 группы: группы с высоким уровнем (корейцы, вьетнамцы, японцы, коренные американцы и гавайцы), средним уровнем (латиноамериканцы, китайцы и чернокожие). ) и низкая заболеваемость раком желудка с поправкой на возраст (филиппинцы и белые). 4
Мигранты первого поколения из стран с высокой заболеваемостью в страны с низкой заболеваемостью сохраняют уровень риска своей родной страны, тогда как последующие поколения приобретают уровень риска своей новой среды. 11,20 Это говорит о том, что этиологическое влияние может быть больше связано с факторами окружающей среды, чем с факторами этнической принадлежности. 11 С тех пор были подробно изучены некоторые диетические и поведенческие факторы. В исследовании случай-контроль Ramon et al. 21 определили, что диеты, богатые солью, копчеными или плохо консервированными продуктами, нитратами, нитритами и вторичными аминами, связаны с повышенным риском рака желудка.Считается, что эта связь возникает из-за длительного чрезмерного употребления соленой или маринованной пищи, что приводит к атрофическому гастриту и изменению среды желудка с образованием канцерогенных N-нитрозосоединений. 11 Напротив, диета, богатая фруктами и овощами, может быть связана со снижением риска рака. Haung et al, 20 в ретроспективном опросе 877 японских пациентов с раком желудка предположили, что частое употребление сырых овощей и фруктов значительно снижает риск смерти, связанной с раком желудка (отношение рисков, 0.74; 95% доверительный интервал [ДИ] 0,56–0,98) за счет их антиоксидантного действия. Было высказано предположение, что кальций, витамин А и витамин С оказывают защитное действие на слизистую оболочку желудка за счет снижения образования N-нитрозоканцерогенных соединений. 11,20 Исследования методом случай-контроль показывают, что у курильщиков сигарет риск развития проксимального рака желудка в 2–3 раза выше. 22 Эти результаты были подтверждены в исследовании Haung et al, 20 , которые продемонстрировали отношение шансов, равное 2.53 (ДИ 1,22–5,29) для постоянных курильщиков и тенденция к значимости для пациентов с привычным потреблением алкоголя.
Большинство случаев рака желудка возникает спорадически, в то время как от 8% до 10% имеют наследственный семейный компонент. 23 Карцинома желудка иногда развивается в семьях с мутациями зародышевой линии в p53 (синдром Ли-Фраумени) и BRCA2. 19 В 1-3% случаев рака желудка мутации зародышевой линии в гене, кодирующем белок клеточной адгезии E-кадгерин, приводят к аутосомно-доминантной предрасположенности к карциноме желудка, называемой наследственным диффузным раком желудка, которая имеет пенетрантность примерно 70%. 19,24–27 Huntsman et al. 24 предположили, что идентификация мутации E-кадгерина должна способствовать профилактической гастрэктомии у пораженных родственников. Рак желудка может развиваться как часть синдрома наследственного неполипозного рака толстой кишки (HNPCC), а также как часть синдромов желудочно-кишечного полипоза, включая семейный аденоматозный полипоз (FAP) и синдром Пейтца-Егерса. 19
Важным достижением в эпидемиологии карциномы желудка стало признание связи с инфекцией Helicobacter pylori . 19 В трех независимых исследованиях сообщалось о значительном повышении риска у субъектов, у которых была подтверждена инфекция H. pylori за 10 или более лет до постановки диагноза рака. 28–30 Последующий метаанализ 42 обсервационных исследований, проведенных Эсликом и др. 31 , показал значительную взаимосвязь между H. pylori и раком желудка (отношение шансов [OR], 2,04; CI, 1,69–2,45 ). H. pylori , как впоследствии было показано, вызывает изменения слизистой оболочки желудка и желудочной флоры, предрасполагающие к развитию карциномы у людей. 19 Кроме того, H. pylori способен прикрепляться к антигену группы крови Льюиса и может быть важным фактором, способствующим хронической инфекции и последующему повышенному риску рака, наблюдаемому у пациентов с фенотипом группы крови А. 19
К другим факторам, связанным с повышенным риском рака желудка, относятся хронический атрофический гастрит (например, злокачественная анемия, токсические и диетические агенты, предыдущие операции на желудке с рефлюксом желчи), гипертрофическая гастропатия (болезнь Метенье), полипы желудка, низкие социально-экономические показатели. статус и ожирение. 11,19
АДЕНОКАРЦИНОМА ЖЕЛУДКА: КЛИНИЧЕСКИЕ СООБРАЖЕНИЯ
Определение / описание случая
Диагноз рака желудка требует гистопатологической оценки ткани или цитологической оценки чистки / промываний желудка. Было предложено несколько систем классификации, чтобы помочь описать рак желудка либо с помощью макроскопических признаков (Borrmann), либо на основе микроскопической конфигурации (Ming, Carniero и Goseki). 19,32 Двумя наиболее часто используемыми являются системы Лорена и Всемирной организации здравоохранения (ВОЗ). 19
Классификация Лорена делит рак желудка на 2 основных гистологических типа: кишечный или диффузный. 11,33,34 Эта система описывает опухоли на основе микроскопической конфигурации и характера роста. 11 Рак диффузного типа имеет некогезивные опухолевые клетки, диффузно инфильтрирующие строму желудка, и часто проявляется глубокая инфильтрация стенки желудка с небольшим образованием желез или без них. 19,32 Диффузные опухоли могут проявлять выраженную десмоплазию и ассоциированное воспаление с относительной щадью покрывающей слизистой оболочки. 32 По сравнению с раком желудка кишечного типа, рак желудка диффузного типа в меньшей степени связан с влиянием окружающей среды, имеет повышенную относительную заболеваемость, чаще встречается у молодых пациентов и связан с худшим прогнозом. 19 Эти виды рака не связаны с кишечной метаплазией, не локализуются в антральном отделе и могут возникать в результате одноклеточных мутаций в нормальных железах желудка, как в случае недавно описанной наследственной диффузной карциномы желудка. 23,24,35
Рак кишечного типа демонстрирует распознаваемое образование железы, похожее по микроскопическому виду на слизистую оболочку толстой кишки. 11,19,32 Железистые образования варьируются от хорошо до низкодифференцированных опухолей, которые растут по расширяющимся, а не инфильтративным структурам. 6,11 Считается, что рак кишечника возникает вторично по отношению к хроническому атрофическому гастриту. 11,19
H. pylori и аутоиммунный гастрит являются наиболее частыми этиологическими поражениями, которые создают среду, способствующую воспалению желудка.Если гастрит не проходит, возникает атрофия желудка с последующей кишечной метаплазией, которая, в свою очередь, может привести к дисплазии. Дисплазия может возникать как в собственном желудочном, так и в «кишечном» желудочном эпителии. 19 Термин аденома применяется, когда диспластическая пролиферация вызывает макроскопическое выступающее поражение и морфологически описывается как тубулярная, тубуловиллярная или ворсинчатая аденома. 19 Аденомы, как правило, возникают в дистальных отделах желудка, часто имеют длительную предраковую фазу и расширяющийся характер роста. 6,11,19 Карцинома диагностируется, когда опухоль проникает в собственную пластинку или через мышечную слизистую оболочку. 19 До 80% диспластических поражений могут прогрессировать до инвазии.
Классификация Лорена оказалась полезной при оценке естественного течения рака желудка, особенно в отношении тенденций заболеваемости, клинико-патологических корреляций и этиологических предшественников. 6,11,33 Несмотря на очевидное использование классификации Лорена, ВОЗ 19 пересмотрела определение рака желудка на «злокачественные эпителиальные опухоли слизистой оболочки желудка с железистой дифференцировкой».«Система ВОЗ оценивает аденокарциному на основании степени сходства с метапластической тканью кишечника. 6,19,32 Он подразделяет гистологические образцы на 5 подтипов: аденокарцинома (кишечная и диффузная), папиллярная, тубулярная, муцинозная и клетка с перстневым кольцом. 19,32
Клинические проявления
Карцинома желудка часто не вызывает специфических симптомов, если она поверхностная и потенциально поддается хирургическому лечению, хотя до 50% пациентов могут иметь неспецифические желудочно-кишечные жалобы, такие как диспепсия. 11 В западных странах, даже при эндоскопическом обследовании, рак желудка обнаруживается только у 1-2% пациентов с диспепсией. Отсутствие ранних патогномоничных симптомов часто задерживает постановку диагноза. Следовательно, от 80% до 90% пациентов с раком желудка имеют местнораспространенные или метастатические опухоли с низкой степенью резектабельности. 19 Пациенты могут иметь анорексию и потерю веса (95%), а также боль в животе, которая носит неопределенный и незаметный характер. Тошнота, рвота и преждевременное насыщение могут возникать при объемных опухолях, закупоривающих просвет желудочно-кишечного тракта, или при инфильтративных поражениях, которые ухудшают вздутие живота. 11 Язвенные опухоли могут вызывать кровотечение, которое проявляется в виде кровавой рвоты, мелены или массивного кровотечения из верхних отделов желудочно-кишечного тракта.
Физикальное обследование рака желудка на ранних стадиях обычно малоинформативно. Пациенты с запущенными опухолями могут проявлять пальпируемое образование в брюшной полости, кахексию, непроходимость кишечника, асцит, гепатомегалию и отек нижних конечностей. 11,36,37 Посев в брюшину может вызвать поражение яичников (опухоль Крукенберга) или тазового тупика (полка Блюмера), обнаруживаемого при ректальном исследовании. 37 Метастазы могут проявляться в виде увеличенного надключичного лимфатического узла (узел Вирхова), левого подмышечного лимфатического узла (узел Ирландии) или околопупочного лимфатического узла (узел сестры Мэри-Джозеф). 11,37
Скрининг рака желудка
Целью массового скрининга (бессимптомные группы населения) или наблюдения (группы риска) является обнаружение и диагностика рака желудка на ранней и, следовательно, потенциально излечимой стадии. 19 Массовый скрининг для раннего выявления рака желудка является рентабельным и рекомендуется в регионах с высокой заболеваемостью, таких как Япония и Китай, где от 50% до 80% выявленных злокачественных новообразований составляют ранний рак желудка. 19 В Северной Америке нет официальных программ проверки. Американское общество эндоскопии желудочно-кишечного тракта рекомендует проводить эндоскопическое наблюдение за лицами с высоким риском (аденома желудка в анамнезе, FAP, HNCC, синдром Пейтца-Егерса и болезнь Метенье) каждые 1-2 года. 11 Массовый эндоскопический / радиологический скрининг не рекомендуется в регионах с низкой заболеваемостью, таких как Канада и США. 11
Диагностика и стадирование
Эндоскопия считается наиболее чувствительным и специфическим методом диагностики у пациентов с подозрением на рак желудка. 12 Эндоскопия позволяет напрямую визуализировать расположение опухоли, степень поражения слизистой и биопсию (или цитологическую чистку) для диагностики тканей. 38 В сочетании с эндоскопией и рентгенологическими методами эндоскопическое ультразвуковое исследование (EUS) может максимизировать стадирование опухоли, предоставляя информацию о глубине инвазии опухоли и оценивая степень перигастральной лимфаденопатии. Willis et al., , 39, предполагают, что EUS в настоящее время является наиболее ценным диагностическим инструментом для предоперационной стадии рака желудка (точность 82% при оценке глубины инвазии опухоли) и для определения резектабельности опухоли.Karpeh et al., , 12, предполагают, что комбинированное использование EUS и лапароскопического определения стадии облегчает выбор пациента, предоставляя информацию о глубине опухоли и вовлечении перигастральных лимфатических узлов. Однако они предупреждают, что EUS менее точен (50–87%) при определении статуса лимфатических узлов.
Исследование бария в верхних отделах желудочно-кишечного тракта (UGI) включает в себя закапывание жидкого бария в желудок и комбинацию 4 техник: оценка с наполнением барием, двойное контрастирование, рельеф слизистой оболочки и сжатие желудка. 40 Процедура позволяет выявить неровности слизистой оболочки. Halvorsen et al. 40 предположили, что, хотя эндоскопия все чаще становится методом выбора, эти 2 метода дополняют друг друга и обладают эквивалентной диагностической эффективностью.
Компьютерная томография (КТ) — наиболее часто используемый метод определения стадии рака желудка. 40 CT может обнаруживать метастазы в печени, региональную и отдаленную лимфаденопатию и может прогнозировать прямое вторжение в соседние структуры.Кунц и др. 41 предположили, что КТ имеет чувствительность 88% для обнаружения опухолей. Способность КТ точно определять инфильтрацию опухоли (стадия Т 58%) или статус перигастральных лимфатических узлов (25–86%) широко варьировала и не считалась надежным предиктором степени заболевания в нескольких исследованиях. 41–43
Магнитно-резонансная томография (МРТ) имела ограниченное применение для определения стадии рака желудка, главным образом из-за трудностей с артефактами движения, стоимости, времени, необходимого для обследования, и отсутствия подходящего перорального контрастного вещества. 44,45 Однако в недавнем исследовании, сравнивающем МРТ с КТ, Sohn et al. 44 задокументировали распространенный рак желудка, который легко обнаруживался с помощью обоих методов. Они показали, что МРТ была немного лучше, чем КТ при Т-стадии рака желудка. 44 Точно так же Ким и др. 46 документально подтвердили, что точность определения стадии T МРТ была выше, чем КТ (81% против 73%, P <0,05). Это исследование показало, что МРТ склонна к завышению патологической толщины опухоли. 46 Сообщается, что общая точность определения стадии T составляет от 73% до 88%. 45 Использование МРТ для определения стадии N затруднено из-за тех же трудностей, что и при постановке КТ, при которой статус узлов оценивается на основе размера лимфатических узлов. Несколько исследований показывают, что точность постановки узлов на МРТ ниже, чем при постановке КТ (65% против 73% соответственно, P > 0,05), причем оба метода имеют тенденцию к снижению узлового статуса. 45,46 Наконец, Motohara et al. 45 рассмотрели способность МРТ выявлять внегастральные метастазы и пришли к выводу, что МРТ имеет большую чувствительность, чем КТ, при обнаружении диссеминации печени, костей и брюшины.Очевидное преимущество постановки МРТ заключается, прежде всего, в ее многоплоскостных возможностях, отсутствии ионизирующего излучения и использовании у пациентов с гиперчувствительностью к контрасту. 44 Другие методы стадирования включают УЗИ брюшной полости, сканирование позитронно-эмиссионной томографии и стадионную лапароскопию. 36
ХИРУРГИЧЕСКАЯ ТЕРАПИЯ
Итого по сравнению с промежуточным итогом по сравнению с проксимальной гастрэктомией
Выбор хирургической процедуры при резектабельном раке желудка определяется размером, расположением и возможностью достичь хирургических границ, свободных от макроскопических и микроскопических заболеваний.Несколько европейских исследований показали, что для достижения адекватных границ, свободных от болезни, должно быть расстояние 5 см от опухоли до ближайшей линии резекции в опухолях кишечного типа и 10 см в опухолях диффузного типа. 39,47–49
Обычно опухоли, ограниченные проксимальной третью желудка, лечат тотальной гастрэктомией, чтобы гарантировать адекватные границы резекции. Спорно, связана ли проксимальная гастрэктомия с плохим функциональным исходом дистального остатка желудка по сравнению с тотальной гастрэктомией с реконструкцией.Хотя исследований, посвященных этой проблеме, немного, но Harrison et al, 50 в ретроспективном обзоре продемонстрировали, что пациенты с проксимальным раком желудка, перенесшие тотальную гастрэктомию или проксимальную гастрэктомию, имели одинаковую общую продолжительность жизни и частоту рецидивов. Это исследование показало, что обе процедуры могут быть выполнены безопасно. Авторы предполагают, что, хотя две процедуры эквивалентны с точки зрения выживаемости и рецидива, необходимы дальнейшие исследования для оценки питания и качества жизни.Исследования продемонстрировали улучшение качества жизни при субтотальной гастрэктомии по сравнению с группой тотальной гастрэктомии 51–53 ; однако только одно исследование 53 конкретно продемонстрировало снижение качества жизни проксимальной гастрэктомии по сравнению с тотальной и дистальной субтотальной резекциями.
Остается спорным вопрос о выборе процедуры при опухолях средней и дистальной трети желудка. В большом европейском опросе, в котором участвовали 62 центра, Heberer et al. 54 продемонстрировали, что 44% хирургов предпочитают тотальную гастрэктомию при диффузном типе рака желудка антрального отдела на основании улучшенного клиренса опухоли и частоты местных рецидивов.При анализе 6400 пациентов в Национальной базе данных по раку США, Hundahl et al 13 показали, что 12,3% пациентов с раком антрального отдела или привратника, независимо от типа опухоли, лечились тотальной гастрэктомией. В многоцентровом рандомизированном исследовании 618 пациентов Bozzetti et al 1 пришли к выводу, что пациенты с раком средней и дистальной трети желудка, перенесшие либо субтотальную, либо полную гастрэктомию, имели одинаковую 5-летнюю выживаемость. Это исследование показало, что пациенты, перенесшие субтотальную резекцию желудка, имели более короткое пребывание в больнице, лучший статус питания, меньше осложнений и лучшее качество жизни. 1 Кроме того, пациенты, перенесшие тотальную резекцию желудка, имели более высокий уровень спленэктомии с увеличением послеоперационных осложнений и восприимчивости к инфекции, что подтверждает роль субтотальной резекции желудка, когда это возможно. 1 Авторы пришли к выводу, что если рак желудка поражает соседние органы, эти органы должны быть удалены en bloc вместе с желудком, при условии, что комбинированная процедура позволяет достичь четких границ резекции. 47,48
Ограниченная или расширенная лимфаденэктомия
Частота поражения лимфатических узлов колеблется от 3% до 5% для опухолей, ограниченных слизистой оболочкой, от 16% до 25% для опухолей, ограниченных подслизистой оболочкой, и от 80% до 90 % у пациентов с III или IV стадией заболевания. 11,55 Существуют значительные разногласия относительно надлежащей степени диссекции лимфатических узлов (LND). Ретроспективные исследования, проведенные в Японии с участием более 10 000 пациентов, показывают, что расширенная LND в сочетании с гастрэктомией продлевает выживаемость по сравнению с ограниченной LND. 56–59 Расширенная LND обеспечила общую 5-летнюю выживаемость от 50% до 62% по сравнению с 15% до 30%, полученными при ограниченных резекциях в США. 10,58,60 Японские исследователи утверждают, что расширенная LND (D2) удаляет опухоль в регионарных лимфатических узлах до того, как она может дать метастазы.Кроме того, утверждается, что расширенный LND улучшает точность постановки. 55–59
Несоответствие в общей выживаемости между японскими и западными центрами после расширенной LND привело к 2 крупным многоцентровым рандомизированным проспективным испытаниям. Голландская группа по раку желудка 61 рандомизировала 711 пациентов (380 в ограниченную [D1] и 331 — в расширенную [D2]) для проведения резекции с лечебной целью. Это исследование показало, что пациенты в группе D2 имели значительно более высокий уровень послеоперационных осложнений, чем пациенты в группе D1 (43% vs.25%; P <0,001), большее количество послеоперационных смертей (10% против 4%; P = 0,004 и более длительное пребывание в больнице (медиана, 16 дней против 14; P <0,001). 61 Кроме того, Пятилетняя выживаемость была схожей в 2 группах (45% в группе D1 и 47% в группе D2). 61 В голландском исследовании авторы отметили, что миграция стадий произошла в 30% группы D2 и может объяснили разницу в выживаемости между Востоком и Западом у пациентов, соответствующих стадии. 61 Авторы пришли к выводу, что результаты не подтверждают рутинное использование D2 LND. Однако при анализе подгрупп они показали значительную разницу у пациентов со стадией II и IIIA, которым предложили резекцию D2, наблюдение, подтвержденное Siewert et al. 62 в Немецком исследовании рака желудка. Кроме того, Hundahl et al., 13 , изучая зрелые результаты голландского исследования, отметили, что риск рецидива выше в группе D1, чем в группе D2 (41% против 29%; P = 0.02), что подтверждает роль расширенной резекции лимфатических узлов.
Cuschieri et al. 63 провели рандомизированное сравнение резекций D1 (n = 200) и D2 (n = 200) для потенциально излечимого распространенного рака желудка в исследовании Совета по медицинским исследованиям (MRC). Результаты исследования продемонстрировали значительную разницу между группой D2 и группой D1 по послеоперационной смертности (13% против 6,5%; P = 0,04) и заболеваемости (46% против 28%; P <0,001). , без разницы в общей 5-летней выживаемости для D2 по сравнению с D1 (33% vs.35%). 63 Как и в голландском исследовании, MRC не продемонстрировал преимущества в выживаемости с классической японской расширенной резекцией; однако анализ подгрупп исследования MRC продемонстрировал несколько интересных результатов. Во-первых, наибольшим фактором послеоперационной заболеваемости и смертности в группе D2 было добавление панкреатикоспленэктомии (отношение рисков 1,53; ДИ 1,17–2,01). 63 Во-вторых, сохранение поджелудочной железы и селезенки с сопутствующей резекцией D2 может обеспечить лучшую выживаемость, чем резекция D1, и может быть выполнено с низкой послеоперационной заболеваемостью и смертностью. 63 Интересно, что в исследованиях как в Голландии, так и в MRC, когда для всех пациентов требовалась как минимум резекция D1 (удаление как минимум узлов уровня N1), общая 5-летняя выживаемость в группе D1 резко увеличивалась. Выживаемость от 20% до 34% (MRC) и 45% (голландцы), что снова указывает на сильную связь между выживаемостью и адекватным расслоением LN. 13 Cuschieri et al. 63 пришли к выводу, что «резекция D2 без панкреатико-спленэктомии может быть лучше, чем стандартная резекция D1, и не может быть отклонена результатами этого исследования.”
Несколько последующих исследований, основанных на результатах Нидерландов и MRC, изучали роль расширенной LND с сохранением поджелудочной железы и селезенки на послеоперационную заболеваемость, смертность и общую выживаемость. 10,55,56,62,64–69 Эти исследования продемонстрировали, что расширенная LND с сохранением селезенки и поджелудочной железы может быть выполнена при послеоперационной заболеваемости и смертности, эквивалентной ограниченной LND. Несколько хорошо проведенных проспективных исследований 10,62,64–66,69 продемонстрировали, что расширенная LND не связана с увеличением заболеваемости или смертности при проведении в опытных центрах и заметно улучшает долгосрочную выживаемость у пациентов со стадией II, IIIA 10,62,64–66,69 и, возможно, болезнь IIIB. 10 На основании этих исследований, гастрэктомия с расширенной лимфодиссекцией остается процедурой выбора в специализированных центрах. 56,69–73
Новые проблемы с лимфаденэктомией при раке желудка
Ранние версии критериев стадирования TNM касались статуса N, определяемого расположением метастазов лимфатических узлов (ЛУ) относительно первичной опухоли. 74 Это вызвало разногласия в отношении соответствующих резекций лимфатических узлов и предотвратило обобщение результатов азиатских исследований, проведенных с использованием Японской классификации рака желудка (JCGC). 75 JCGC классифицировал степень метастазов в LN на основе анатомической станции LN (). Наличие метастазов в каждой группе LN отражает статус N и составляет основу категорий D (). 74 С признанием преимущества расширенных резекций (D2) на выживаемость, пятое издание TNM AJCC было изменено, чтобы включить доступные клинические, радиологические, эндоскопические и хирургические средства для оценки степени заболевания. 76 Пятое издание классифицирует метастазы LN на основе количества положительных узлов, в которых по крайней мере 15 LN должны быть рассечены и исследованы для точного определения стадии (). 75,76 В исторической когорте Karpeh et al. 75 продемонстрировали, что количество положительных узлов обеспечивает лучший прогноз, чем анатомическое расположение, как определено в более раннем издании TNM. Точно так же Kodera et al. 77 применили стадию TNM 1997 года к 493 японским пациентам, у которых была резекция D2 или D3, и пришли к выводу, что количество вовлеченных узлов является сильным прогностическим индикатором, который должен заменить категорию N в JCGC. С тех пор это открытие было поддержано несколькими группами, которые аналогичным образом обнаружили, что увеличение количества LN улучшает прогноз, сводит к минимуму эффекты миграции стадий, улучшает стадирование узлов в разных регионах и странах, помогает выбрать подходящую мультимодальную терапию и дает лучшее представление о бремени болезни. 75,76,78 В 1995 году патологическая стадия N определялась количеством метастатических ЛУ, таким образом достигая единой унифицированной системы стадирования. 75
ТАБЛИЦА 1. Японская классификация рака желудка (JCGC)
ТАБЛИЦА 2. Классификация рака желудка Американским объединенным комитетом (AJCC) (5-е издание)
растет консенсус о том, что для точного определения стадии опухоли необходимо извлечение как минимум 15 LN.Однако в хирургических центрах Северной Америки и Европы наблюдается значительное несоблюдение режима лечения. Mullaney et al. 76 показали, что только 31% (диапазон 10–44%) хирургически удаленных случаев можно точно оценить на предмет статуса лимфатических узлов. Недостаток LN для определения стадии имеет значение как для прогноза, так и для миграции стадии. 76 Это наблюдение было подтверждено в исследовании, в котором изучались 1038 пациентов в одном американском учреждении, и было обнаружено, что до 27% случаев обследовали менее 15 узлов. 75 Еще более тревожным был отчет из Национальной базы данных США, который продемонстрировал, что всего у 18% пациентов в США проанализировано ≥15 LN. 13 Авторы предполагают, что у этих пациентов высока вероятность остаточного нелеченого поражения регионарных лимфатических узлов. Несоблюдение режима может быть непринятием обширных резекций для улучшения прогноза, незнанием степени резекции, необходимой для достижения минимального количества ЛУ, и неадекватной патологической оценки. 13,75,76,78
Адъювантная или неоадъювантная терапия
Пациенты с локализованным раком желудка без лимфоузлов имеют 5-летнюю выживаемость, которая приближается к 75% при лечении только хирургическим вмешательством. 79 Это контрастирует с пациентами с поражением лимфатических узлов, у которых выживаемость колеблется от 10% до 30%. 9 Исход рака желудка осложняется высокой частотой местных рецидивов и отдаленных метастазов после лечебной хирургии, что вызвало интерес к адъювантной терапии в надежде на улучшение результатов лечения. 58 Исследования адъювантной и неоадъювантной терапии при лечении рака желудка дали противоречивые результаты. Несоответствие может быть отражением различий между изученными популяциями (группы высокого и низкого риска), патологической классификации 80 , степени хирургической процедуры 81 (D2 по сравнению с D1) 68 , а также различий в содержание и сроки адъювантной терапии (немедленная или отсроченная). Было опубликовано несколько метаанализов 82–88 в попытке устранить расхождения, описанные в литературе, результаты которых суммированы в.
ТАБЛИЦА 3. Мета-анализы рандомизированных клинических испытаний адъювантной химиотерапии
Три из 7 метаанализов предполагают небольшое, но значительное преимущество адъювантной химиотерапии в лечении полностью резецированного рака желудка. 83,84,87 Однако эти авторы предлагают интерпретировать результаты с осторожностью, потому что результаты имеют пограничную значимость 83 и могут зависеть от ряда предубеждений, а также низкого методологического качества. 84 Этот вывод отражал более ранний отчет, в котором были рассмотрены результаты 43 рандомизированных исследований, проведенных в период с 1967 по 1993 год по всем адъювантным методам лечения рака желудка, включая опубликованные в японской литературе. 89 В этом обзоре сделан вывод о том, что результаты рандомизированных исследований в Северной Америке и Европе не подтверждают рутинное использование адъювантной химиотерапии при раке желудка. 89
Janunger et al, 85 в систематическом обзоре 153 научных статей (с участием 12 367 пациентов) исследовали эффекты адъювантной химиотерапии при раке желудка.В их метаанализе было продемонстрировано значительное улучшение общей выживаемости (). Однако раздельный анализ западных и азиатских исследований продемонстрировал значительную разницу в результатах в азиатских (OR, 0,58; 95% ДИ, 0,44–0,76), но не в западных (OR, 0,96; 95% ДИ, 0,83–1,12) отчетах. разница объясняется сроками постановки диагноза, объемом операции и переносом стадии. 85 В более позднем метаанализе, Jununger et al., 88 , применяя современные комбинации лекарств в течение последних 10 лет, не смогли продемонстрировать какого-либо значительного улучшения выживаемости ().В целом, в настоящее время недостаточно данных, чтобы рекомендовать послеоперационную химиотерапию в качестве стандартного адъювантного лечения в западных центрах. 82–85,88
Неоадъювантная терапия (химиотерапия, химиорадиотерапия, лучевая или иммунотерапия, отдельно или в комбинации) использовалась с местнораспространенными опухолями и опухолями с высоким риском рецидива, несмотря на очевидно излечивающую операцию. Сообщалось о степени резектабельности от 40% до 100% и потенциально излечивающих резекциях в 37-80% случаев. 85 Тем не менее, только 2 рандомизированных исследования касались неоадъювантной химиотерапии, ни одно из которых убедительно не продемонстрировало явной пользы. 90–92 Исследования адъювантной внутрибрюшинной химиотерапии также неубедительны и обычно не проводятся вне рамок клинических испытаний. 85
Предварительные исследования адъювантной химиолучевой терапии показали многообещающие результаты у пациентов, подвергнутых резекции с лечебной целью. 93,94 Роль адъювантной химиолучевой терапии изучалась в первую очередь в исследовании Intergroup 0116 95 , в котором было рандомизировано 566 пациентов со стадией IB-IVM0, полностью резецированной аденокарциномой желудка или гастроэзофагеальной аденокарциномы для проведения только хирургического вмешательства или хирургического вмешательства в сочетании с химиолучевой терапией (5f + лейковорин с последующей 45 Гр излучения).В группе только хирургического вмешательства дела обстояли значительно хуже по сравнению с группой адъювантной химиолучевой терапии с точки зрения безрецидивной выживаемости (отношение рисков 1,52; 95% ДИ 1,23–1,86) и смерти (отношение рисков 1,35; 95% ДИ 1,09–1,66. ). 14 Добавление адъювантной химиолучевой терапии значительно улучшило медианное значение выживаемости ( P = 0,005) с 27 до 36 месяцев. 14 Отдаленный рецидив был наиболее частым местом рецидива в группе адъювантной терапии (33% против 18%), тогда как местный рецидив был более распространен в группе, получавшей только хирургическое вмешательство (29% против 18%).19%). 14 Значительная токсичность (степень 3 или выше) наблюдалась в группе химиолучевой терапии, при этом 3 пациента (1%) умерли от токсичности, связанной с лечением. Кроме того, хотя хирургический протокол рекомендовал обширную резекцию лимфатических узлов, менее 10% пациентов получили формальную диссекцию D2, тогда как 54% подверглись диссекции D0. 14 Авторы приходят к выводу, что наибольшая польза от химиолучевой терапии может быть у пациентов из группы высокого риска, получавших неадекватные резекции D2.Несмотря на результаты этого исследования, некоторые учреждения рекомендуют только адъювантную химиотерапию пациентам, не переносящим лучевую терапию; однако оптимальный режим в этой ситуации еще предстоит определить. 92
Неоперабельное местнораспространенное или метастатическое заболевание
Более 50% пациентов поступают с неоперабельной местнораспространенной или метастатической аденокарциномой желудка. 96 У большинства пациентов, в том числе с ранней стадией заболевания, в какой-то момент в течение болезни развиваются метастазы.Облегчение симптомов в этой группе пациентов имеет первостепенное значение и может рассматриваться как местная и / или системная терапия. Лечение местных симптомов включает паллиативную хирургию, лучевую терапию и / или эндоскопические процедуры. У пациентов с метастатическим заболеванием системная химиотерапия является единственным методом лечения, который продемонстрировал значительное улучшение выживаемости. 88 Было показано, что у выбранных пациентов с хорошим статусом работоспособности по сравнению с одной только лучшей поддерживающей терапией комбинированная химиотерапия улучшает среднюю выживаемость на 3–9 месяцев, а также демонстрирует улучшение или сохранение качества жизни. 97–100 Было изучено множество традиционных режимов химиотерапии с одним агентом, при этом различные комбинации, оцененные в исследованиях фазы III, продемонстрировали частоту ответа от 25% до 40%. 101 Несмотря на количество оцененных схем, единой комбинированной схемы не появилось. 88 Стандартные протоколы в Северной Америке включают эпирубицин, цисплатин и непрерывную инфузию 5FU (ECF), 102 цисплатин и 5-дневную инфузию 5FU (CF), а также этопозид, лейковорин и болюсный 5FU (ELF). 103 Комбинированные схемы третьего поколения включают новые агенты, такие как иринотекан, оксалиплатин и таксаны, все из которых в настоящее время проходят оценку фазы II – III. Несмотря на использование традиционной комбинированной химиотерапии, средняя выживаемость редко превышает 10 месяцев.
ПРОГНОСТИЧЕСКИЕ ПЕРЕМЕННЫЕ
Стадия
Было доказано, что патологическая стадия имеет прогностическое значение как для 5-летней выживаемости, так и для частоты местных рецидивов. 62,104–106 Siewert et al, 62 в проспективном многоцентровом наблюдательном исследовании продемонстрировали, что соотношение лимфатических узлов более 20% (между положительными и удаленными узлами) было единственным наиболее важным независимым прогностическим фактором ( P <0.0001), затем следует статус остаточной опухоли ( P <0,0001) и категория T ( P <0,0001). В многомерном подгрупповом анализе полностью резецированных опухолей (R0) они подтвердили, что узловой статус был наиболее важным предиктором, за которым следовала категория T. 62
Степень
Степень относится к степени дифференцировки опухолевых клеток и, как было показано, коррелирует с агрессивностью новообразования. 6 По степени патологии опухоли подразделяются на 1 из 3 категорий: хорошо, умеренно или слабо дифференцированные / анапластические. 6 Хотя степень злокачественности обычно указывается в патологических отчетах, прогностическое влияние рака желудка еще предстоит выяснить, поскольку в нескольких ретроспективных исследованиях не удалось определить степень как независимый прогностический фактор. 106–108
Размер
Размер первичной опухоли, измеренный в наибольшем измерении, был определен в нескольких ретроспективных исследованиях как имеющий прогностическое значение. 9,105,106 Эти исследования показывают, что увеличение диаметра опухоли связано с метастазами в лимфатические узлы и 5-летней выживаемостью.Это было подтверждено в проспективном рандомизированном исследовании, которое продемонстрировало, что размер опухоли является независимым прогностическим фактором в многофакторном анализе ( P = 0,0002; ДИ 1,3–2,2) у пациентов с свободными от опухоли краями. 62
Местоположение опухоли
Влияние местоположения опухоли имеет несколько важных последствий для лечения и прогноза рака желудка. Хотя есть исследования, которые не показали связи между локализацией и прогнозом, 105,107–109 несколько исследований показали, что карцинома желудка проксимальной трети желудка представляет собой отдельную клиническую сущность с прогностическим значением. 2,9,11,105,106,110,111 Недавнее исследование показало, что проксимальные опухоли чаще имеют больший размер, обширное проникновение в стенки, венозную инвазию, узловые метастазы и более позднюю стадию с общей худшей выживаемостью по сравнению с дистальными опухолями. 111 Проксимальные опухоли могут потребовать другого хирургического подхода, основанного на потенциально другом биологическом поведении.
Лимфатическая и сосудистая инвазия
Присутствие опухолевых эмболов в перитууморальных сосудах и лимфатических сосудах недавно вызвало интерес как потенциальный независимый прогностический индикатор.Исследования показали, что поражение лимфатических узлов является статистически значимым предиктором выживаемости, а наличие опухолевых эмболов значительно влияет на рецидив опухоли и смерть после радикальной резекции. 72,105,110 Yokota et al. 110 обнаружили, что лимфатическая инвазия сохраняет свою значимость (относительный риск 11,43; ДИ 2,63–49,55) даже в условиях конкуренции с другими значимыми переменными в многофакторном анализе. Эти данные были недавно подтверждены в отчете Hyung et al, 112 , который сообщил о плохом прогнозе, связанном с продвинутой стадией T и наличием сосудистой инвазии.Kooby et al. 113 аналогичным образом продемонстрировали, что у пациентов с адекватной стадией поражения лимфатических узлов сосудистая инвазия является независимым негативным прогностическим фактором и может быть предиктором биологической агрессивности.
Возраст и пол
Ни возраст, ни пол окончательно не показали прогностического значения для смерти от рецидивирующего или метастатического рака. 62,109,114 Два небольших ретроспективных исследования в анализе подгрупп определили возраст как значительную прогностическую переменную, 105,108 , тогда как в другом исследовании влияние возраста не имело независимой прогностической ценности. 114 Это исследование показало, что выживаемость определялась стадией и полнотой резекции.
Другие факторы
Несколько других факторов связаны с увеличением местных рецидивов и снижением выживаемости при раке желудка. Предполагаемые опухолевые маркеры (p53, E-cadherin, CD-34, c-ErbB2, CA 72–4, CEA) в последнее время приобрели популярность в качестве потенциальных прогностических индикаторов для прогнозирования поведения опухоли. 111,115–117 Эти маркеры, вероятно, будут приобретать все большее значение, поскольку область анализа экспрессии генов продолжает расширяться. 117 Другие факторы включают перфорацию опухоли, экстренную операцию и переливание крови.
Анализ выживаемости и его применение при раке желудка
Использование определения прогноза заболевания является двукратным. Прогнозирование предоставляет пациентам и врачам информацию о будущем течении и естественном течении болезни и позволяет проводить сравнительный анализ данного исхода между двумя или более популяциями. 118119
Прогностические исследования часто включают сравнения между 2 или более группами пациентов, которые различаются по статусу болезни.Можно построить кривые выживаемости для каждой группы и сравнить соответствующие кривые с помощью логарифмического рангового теста. 118 В качестве альтернативы, многомерные модели могут использоваться для включения в анализ как времени, так и влияния множества факторов на время достижения заданного результата. 118 Этот анализ может использоваться для выявления комбинации факторов, которые лучше всего предсказывают прогноз в группе пациентов или влияние отдельных факторов независимо.
Методы анализа выживаемости широко применялись при изучении рака желудка для определения значимости прогностических факторов при принятии клинических решений.Недавно в ходе исследований выживаемости были созданы многомерные прогностические модели, основанные на клинико-патологических факторах и связанные с молекулярными путями. Этот подход включает профили экспрессии генов, представляющие биологическое поведение опухолей, полученные из исследований микроматриц, в прогностические модели, и может использоваться для руководства хирургической и адъювантной терапией.
Будущие направления
Некоторые виды эпителиального рака, по-видимому, развиваются по многоступенчатому пути канцерогенеза. В этих опухолях корреляция между генетическими аномалиями и последовательными фенотипическими изменениями позволила получить точную клиническую и патологическую характеристику. 36,120–123 Однако рак желудка демонстрирует неоднородность гистопатологии и молекулярных изменений, которые препятствуют его полному молекулярному разграничению. 121 Только несколько генов (например, c-met, c-erbB2, K-sam, E-cadherin) участвуют в развитии рака желудка. 124 Из них только E-кадгерин был окончательно связан как маркер наследственного диффузного рака желудка. 23,25–27,35 Как уже упоминалось, большинство случаев рака желудка возникает спорадически, при этом от 8% до 10% имеют наследственный семейный компонент.Чаще всего рак желудка возникает без каких-либо устойчивых мутаций. Патогенез значительно варьируется, от постепенного прогрессирования изменений (гастрит → метаплазия → инвазивная карцинома) до опухолей, возникающих при отсутствии предшествующего поражения. 121 Новые технологии, такие как профилирование экспрессии генов на основе микрочипов, предоставляют информацию об экспрессии многих генов, участвующих в раковых заболеваниях человека. 125 Этот подход обещает изменить наше понимание молекулярных взаимодействий, которые в конечном итоге описывают фенотип и поведение опухоли.
Профилирование экспрессии генов на основе микрочипов
ДНК-последовательности не говорят нам, как экспрессия генов вызывает фенотип или как экспрессия генов изменяет последующие молекулярные побочные продукты. 126 Текущие ограничения на понимание желудочного канцерогенеза — это методы, позволяющие связать структурные знания генов с функциональными изменениями, которые происходят между компонентами, тем самым обеспечивая понимание поведения опухоли. 124,126,127 Характеристика генов, которые дифференциально экспрессируются при раке желудка, имеет важное значение для точной диагностики и характеристики опухоли, а также для принятия обоснованных решений о хирургической и адъювантной терапии, разработки новых терапевтических средств и описания поведения опухоли для более точного прогноза. 124
Микромассивы расширили молекулярные исследования, выходящие за рамки подхода генов-кандидатов, и начинают устанавливать связь между экспрессией генов и функциональными взаимодействиями. 121,124–129 Преимущество микрочипов состоит в том, что это инструмент трансляции, который включает функциональные взаимодействия в попытке понять биологию, а не просто идентифицировать составные части пути. 126 Исследования экспрессии генов позволяют охарактеризовать гены, которые дифференциально экспрессируются или транскрибируются из геномной ДНК. 122,124 Полученный набор генов, называемый профилем экспрессии, считается основным детерминантом клеточного фенотипа и функции. 126 Понимание различий в экспрессии генов между нормальной тканью и злокачественной тканью, а также реакции экспрессии генов на стимулы окружающей среды является центральным для понимания регуляторных механизмов, участвующих в развитии и прогрессировании рака. 125,126,129
Многомерный регрессионный анализ широко применялся при изучении рака.Эти исследования позволили определить большое количество важных клинико-патологических факторов, которыми клиницисты могут руководствоваться при выборе стратегии ведения. Несмотря на это, традиционные прогностические факторы имеют ограниченную прогностическую силу и изменили текущие стратегии лечения только для нескольких типов рака. 130 Однако технология микрочипов в сочетании с многомерными прогностическими моделями вызвала интерес к использованию профилей экспрессии генов в качестве прогностических моделей.
Статус лимфатических узлов, статус рецепторов, протоонкогены и генные мутации коррелировали с прогнозом рака груди. 131 Однако рак груди сложен, и знание индивидуальных прогностических факторов дает ограниченную информацию о биологии рака груди. Несколько недавних исследований, связывающих новые данные об экспрессии генов с многомерными прогностическими моделями, были использованы для изучения выживаемости и разработки более точных маркеров биологического поведения, чтобы преодолеть ограничения современных методов прогнозного моделирования. 130–132 Эти исследования продемонстрировали, что микроматричный анализ может точно идентифицировать отдельные подклассы рака груди 131,132 и независимо предсказывать общую и безрецидивную выживаемость на основе «прогностических наборов генов», которые превосходят доступные в настоящее время клинические и гистологические прогностические модели. . 130,132
Применение микроматричного анализа к таким заболеваниям, как немелкоклеточный рак легкого, гепатоцеллюлярная карцинома, карцинома пищевода и пищевод Барретта, аналогичным образом продемонстрировало использование микроматрицы для документирования различных прогностических групп, систем молекулярного стадирования, моделей, способных точно прогнозировать общая и специфическая для болезни выживаемость и частота рецидивов за пределами существующих методов. 133–135 Таким образом, применение профилей экспрессии генов может иметь потенциал для уточнения диагноза, прогноза и ведения пациентов. 134
Большинство исследований с использованием микроматриц, изучающих аденокарциному желудка, было направлено на разработку исследовательских профилей генов опухолей желудка или клеточных линий рака желудка для идентификации генов, связанных с раком желудка, определения молекулярных фенотипов, демонстрации подтипов опухолей и выявления функциональных кластеров генов. как потенциальные маркеры биологического поведения. 124,136–141 Есть несколько исследований, в которых применялись комбинированные микроматрицы и методология прогнозного моделирования к раку желудка.Недавние исследования показали, что микроматрица в сочетании со статистическим моделированием точно предсказывает поведение опухоли в отношении прогрессирования опухоли, метастатического потенциала, рецидива опухоли и общего прогноза. 142,143 Хотя анализ экспрессии генов в сочетании с прогностическими моделями находится в зачаточном состоянии, он обещает расширить наше понимание карциномы желудка. Относительная скудность имеющихся данных, связывающих профили генов рака желудка с прогнозом и успешность лечения различных других видов рака, сильно усиливает необходимость дальнейшего изучения этого метода.С помощью методов, способных амплифицировать небольшие количества опухолевой РНК, можно предположить, что образцы ткани, полученные эндоскопически, могут быть использованы для создания предоперационных прогностических кластеров генов. При этом идентификация функциональных кластеров генов может позволить улучшить отбор пациентов для неоадъювантной и адъювантной терапии, индивидуализированные хирургические резекции, выявить новые кластеры генов для дизайна таргетной терапии и улучшить прогноз, чтобы облегчить принятие решений как клиницистом, так и пациентом.
Причины, симптомы, диагностика и лечение
Обзор
Что такое рак желудка?
При раке желудка (также называемом раком желудка) раковые клетки обычно начинаются на внутренней выстилке стенок желудка, а затем проникают глубже в стенки желудка по мере развития рака. Опухоль может разрастаться, поражая близлежащие органы, такие как печень и поджелудочная железа.
Рак желудка — одно из самых распространенных онкологических заболеваний во всем мире, но реже встречается в Соединенных Штатах.Число случаев рака желудка неуклонно снижается в течение последних нескольких десятилетий, возможно, из-за широкого использования холодильного оборудования, которое увеличило доступ к свежим продуктам без консервантов и бактериального загрязнения.
Симптомы и причины
Каковы причины рака желудка?
Основной причиной рака желудка является генетическая мутация (изменение) в клетках желудка, которая заставляет клетки быстро расти и в конечном итоге образовывать опухоль. Факторы риска, которые могут увеличить вероятность заболевания раком желудка, включают:
Каковы симптомы рака желудка?
Диагностика и тесты
Как диагностируется рак желудка?
Для диагностики рака желудка можно использовать несколько различных тестов.
- Радиологические тесты, такие как компьютерная томография, проглатывание бария и МРТ, могут помочь определить проблему в желудке, если опухоль достаточно велика.
- Верхняя эндоскопия используется для взятия биопсии (образца) поражения для постановки диагноза или выявления рака на ранней стадии до того, как опухоль станет достаточно большой, чтобы ее можно было увидеть при радиологических исследованиях. Верхняя эндоскопия выполняется путем введения тонкой трубки с крошечной камерой через рот в желудок, где берут биопсию опухоли.
- Чтобы узнать, какую часть стенки желудка поражает опухоль, и оценить «стадию» рака, врач назначит эндоскопическое ультразвуковое исследование, при котором используется специальный тип эндоскопа с ультразвуковым датчиком. Эндоскоп вводится в желудок через рот. Ультразвуковой зонд может смотреть через поверхность слизистой оболочки желудка до стенки желудка за ее пределами и видеть, какая часть желудка поражена опухолью.
Ведение и лечение
Как лечится рак желудка?
Есть несколько подходов к лечению рака желудка.Во многих случаях хирургического вмешательства можно избежать.
На ранних стадиях, когда рак ограничен поверхностными (самыми верхними) слоями желудка, рак может быть удален с помощью эндоскопии, проводимой гастроэнтерологом. В этой процедуре (эндоскопическая диссекция подслизистой оболочки или ESD) опухоль отделяется от остальной стенки желудка и удаляется через рот.
Как только опухоль выходит за пределы поверхностных слоев желудка, требуется хирургическое вмешательство, чтобы удалить желудок и соединить пищевод (трубку, через которую проходит пища) с тонким кишечником, чтобы обеспечить пищеварение.
Лучевая терапия использует мощные лучи энергии для уничтожения раковых клеток. Химиотерапия использует химические вещества для уничтожения раковых клеток. Эти методы лечения обычно комбинируются.
Есть также несколько лекарств от рака желудка. Лечение зависит от степени тяжести рака и выбирается врачом после постановки диагноза.
Профилактика
Как предотвратить рак желудка?
Рак желудка можно предотвратить с помощью следующих методов:
- Лучший способ предотвратить рак желудка — придерживаться здоровой диеты с высоким содержанием фруктов и овощей и низким содержанием соли и красного мяса.
- Поддерживайте здоровый вес и практикуйте правильные упражнения.
- Избегайте курения, потому что это увеличивает риск рака желудка и многих других видов рака.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с раком желудка?
Прогноз рака желудка зависит от стадии рака. Люди на ранних стадиях рака желудка выживают гораздо чаще, чем на более поздних стадиях:
- Если рак желудка обнаружен на самой ранней стадии и может быть удален с помощью эндоскопа, пятилетняя выживаемость превышает 90 процентов.
- Если рак обнаружен после того, как он распространился на области, окружающие желудок, пятилетняя выживаемость составляет 28 процентов.
- Если рак распространился на области за пределами желудка, пятилетняя выживаемость составляет 4 процента.
Рак желудка | Мемориальный онкологический центр им. Слоуна Кеттеринга
Обычно рак желудка (желудка) начинается в слизистой оболочке желудка, медленно растет в течение нескольких лет и вызывает незначительные симптомы или вызывает их вообще.
Верхняя пищеварительная система
Эксперты по раку желудка в Memorial Sloan Kettering предлагают комплексную помощь людям со всеми типами рака желудка и наблюдают больше людей с этим заболеванием, чем любой другой онкологический центр в Соединенных Штатах. Благодаря повышению точности постановки болезни и прогрессу в хирургических методах, был достигнут значительный прогресс в диагностике и лечении этого заболевания.А благодаря нашим клиническим испытаниям у вас может быть доступ к лечению до того, как оно станет доступным где-либо еще.
Типы рака желудка
У большинства людей (до 95 процентов) развивается рак желудка, называемый аденокарциномой , , который начинается в тканях, составляющих слизистую оболочку желудка.
Существует три типа аденокарциномы:
Некардиальный (дистальный) рак желудка
Этот тип рака желудка может быть связан с длительными периодами воспаления и раздражения в нижней части желудка.Это часто связано с хронической инфекцией бактерий под названием Helicobacter pylori и чаще встречается в развивающихся странах, чем в других частях мира.
Рак проксимального отдела желудка
Этот тип рака желудка начинается в первой (проксимальной) части желудка и может распространяться на желудочно-пищеводный переход (там, где пищевод соединяется с желудком). Этот рак более распространен в Соединенных Штатах, чем в других частях мира, и, как правило, начинается у людей, страдающих ожирением или гастроэзофагеальной рефлюксной болезнью.
Диффузный рак желудка
Этот агрессивный рак быстро разрастается в клетках стенки желудка. Он не образует новообразование или опухоль, поэтому его может быть сложно диагностировать. Как правило, он начинается у молодых людей с семейным анамнезом заболевания или связанного с ним генетического синдрома.
Менее распространенные типы рака желудка включают опухоли стромы желудочно-кишечного тракта , которые начинаются в мышцах желудка или соединительной ткани; карциноидные опухоли , которые начинаются в клетках, продуцирующих гормоны желудка, и лимфома , которые возникают в иммунных клетках желудка.
Симптомы, лечение и возможные причины
Рак желудка начинается, когда раковые клетки образуются во внутренней оболочке желудка. Эти клетки могут перерасти в опухоль. Заболевание, также называемое раком желудка, обычно медленно нарастает в течение многих лет.
Если вам известны симптомы, которые он вызывает, вы и ваш врач можете обнаружить его на ранней стадии, когда его легче всего вылечить.
Что вызывает рак желудка?
Ученые точно не знают, что заставляет раковые клетки расти в желудке.Но они знают несколько вещей, которые могут повысить риск заболевания. Один из них — инфекция, вызванная распространенной бактерией H. pylori , которая вызывает язвы. Воспаление кишечника, называемое гастритом, определенный тип хронической анемии, называемой злокачественной анемией, и новообразования в желудке, называемые полипами, также могут повысить вероятность заболевания раком.
Другие факторы, которые, по-видимому, играют роль в повышении риска, включают:
- Курение
- Избыточный вес или ожирение
- Диета с высоким содержанием копченой, маринованной или соленой пищи
- Операция на желудке при язве
- Тип- А кровь
- Инфекция вируса Эпштейна-Барра
- Определенные гены
- Работа в угольной, металлургической, лесной или резиновой промышленности
- Воздействие асбеста
Симптомы
Рак желудка на ранней стадии может вызвать:
Просто несварение желудка или изжога после еды не означает, что у вас рак.Но если вы часто чувствуете эти симптомы, поговорите со своим врачом. Они могут увидеть, есть ли у вас другие факторы риска, и протестировать вас на предмет каких-либо проблем.
По мере роста опухоли желудка у вас могут появиться более серьезные симптомы, такие как:
Получение диагноза
Врачи обычно не проводят рутинный скрининг на рак желудка. Это в основном потому, что это не так часто, поэтому дополнительные тесты часто бесполезны.
Если вы подвержены более высокому риску этого заболевания, поговорите со своим врачом, чтобы узнать, как следить за этим.Вы можете пройти те же тесты, что и если бы у вас были симптомы и вы искали диагноз.
Чтобы выяснить, есть ли у вас рак желудка, врач начинает с медицинского осмотра. Они также спросят о вашей истории болезни, чтобы узнать, есть ли у вас какие-либо факторы риска рака желудка или у кого-либо из членов семьи, у которых он был. Затем они могут дать вам несколько анализов, в том числе:
- Анализы крови для поиска признаков рака в вашем теле.
- Верхняя эндоскопия .Ваш врач вставит вам в горло тонкую гибкую трубку с маленькой камерой, чтобы заглянуть в ваш желудок.
- Тест серии верхних GI . Вы выпьете меловую жидкость с веществом под названием барий. Жидкость покрывает ваш желудок и делает его более четким на рентгеновских снимках.
- КТ . Это мощный рентгеновский снимок, который делает подробные снимки внутренней части вашего тела.
- Биопсия . Врач берет небольшой кусочек ткани вашего желудка, чтобы посмотреть под микроскопом на наличие признаков раковых клеток.Они могут сделать это во время эндоскопии.
Лечение
Многие методы лечения могут помочь в борьбе с раком желудка. То, что вы выберете и ваш врач, будет зависеть от того, как долго вы страдаете этим заболеванием или насколько оно распространилось по вашему телу, что называется стадией вашего рака:
Стадия 0. Это когда внутренняя оболочка вашего В желудке есть группа нездоровых клеток, которые могут перерасти в рак. Обычно это лечит хирургическое вмешательство. Врач может удалить часть или весь желудок, а также близлежащие лимфатические узлы — небольшие органы, которые являются частью системы борьбы с микробами вашего тела.
Стадия I. На данный момент у вас опухоль в слизистой оболочке желудка, которая, возможно, распространилась на ваши лимфатические узлы. Как и на стадии 0, вам, скорее всего, предстоит операция по удалению части или всего желудка и близлежащих лимфатических узлов. Вы также можете пройти химиотерапию или химиолучевую терапию. Эти методы лечения можно использовать до операции, чтобы уменьшить опухоль, а после нее убить любой оставшийся рак.
В химиотерапии используются лекарства для поражения раковых клеток. Химиолучевая терапия — это химиотерапия плюс лучевая терапия, которая разрушает раковые клетки лучами высокой энергии.
II этап. Рак распространился на более глубокие слои желудка и, возможно, на близлежащие лимфатические узлы. Основным лечением по-прежнему является операция по удалению части или всего желудка, а также близлежащих лимфатических узлов. Вы, скорее всего, получите химиотерапию или химиолучевую терапию заранее, а также можете пройти одну из них после.
III этап. Рак теперь может быть во всех слоях желудка, а также в других близлежащих органах, таких как селезенка или толстая кишка. Или он может быть меньше, но проникать глубоко в лимфатические узлы.
Обычно вам делают операцию по удалению всего желудка, а также химиотерапию или химиолучевую терапию. Иногда это может вылечить. В противном случае это может, по крайней мере, помочь с симптомами.
Если вы слишком больны для операции, вы можете пройти курс химиотерапии, лучевой терапии или и то, и другое, в зависимости от того, с чем может справиться ваше тело.
IV этап. На этой последней стадии рак распространился на такие органы, как печень, легкие или мозг. Вылечить это намного сложнее, но ваш врач может помочь вам справиться с этим и облегчить симптомы.
Если опухоль блокирует часть вашей желудочно-кишечной системы, вы можете получить:
- Процедура, при которой часть опухоли разрушается с помощью лазера на эндоскопе, тонкой трубке, которая скользит по горлу.
- Тонкая металлическая трубка, называемая стентом, которая может поддерживать поток. Вы можете получить один из них между желудком и пищеводом или между желудком и тонкой кишкой.
- Операция обходного желудочного анастомоза для создания обходного пути вокруг опухоли.
- Операция по удалению части желудка.
На этом этапе также можно использовать химиотерапию, облучение или и то, и другое. Вы также можете пройти таргетную терапию. Эти препараты атакуют раковые клетки, но оставляют в покое здоровые, что может означать меньше побочных эффектов.
Как предотвратить рак желудка?
Лечение желудочных инфекций. Если у вас есть язвы, вызванные инфекцией H. pylori , обратитесь за лечением. Антибиотики могут убить бактерии, а другие лекарства залечивают язвы на слизистой оболочке желудка, снижая риск рака.
Ешьте здоровую пищу. Получайте больше свежих фруктов и овощей на тарелку каждый день. Они богаты клетчаткой и некоторыми витаминами, которые могут снизить риск рака. Избегайте очень соленых, маринованных, вяленых или копченых продуктов, таких как хот-доги, мясные полуфабрикаты или копченые сыры. Также держите свой вес на нормальном уровне. Избыточный вес или ожирение также могут повысить риск заболевания.
Не курите. Риск рака желудка удваивается, если вы употребляете табак.
Наблюдайте за приемом аспирина или НПВП. Если вы ежедневно принимаете аспирин для профилактики сердечных заболеваний или НПВП от артрита, поговорите со своим врачом о том, как эти препараты могут повлиять на ваш желудок.
Рак желудка: основы практики, история вопроса, анатомия
Всемирная организация здравоохранения. Рак. КТО. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs297/en/. 12 сентября 2018 г .; Дата обращения: 22 февраля 2021 г.
Программа эпиднадзора, эпидемиологии и конечных результатов. Информационные бюллетени SEER Stat: рак желудка.Национальный институт рака. Доступно по адресу http://seer.cancer.gov/statfacts/html/stomach.html. Дата обращения: 22 февраля 2021 г.
Авиталь I, Стоядинович А., Пистерс П.В.Т., Кельсен Д.П., Виллетт К.Г. Рак желудка. ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии . 10-е изд. Филадельфия, Пенсильвания: Уолтерс Клувер; 2015. 613-42.
[Рекомендации] Национальная комплексная онкологическая сеть.Руководство NCCN по клинической практике в онкологии: рак желудка. NCCN. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf. Версия 1.2021 — 9 февраля 2021 г .; Дата обращения: 22 февраля 2021 г.
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 видов рака в 185 странах во всем мире. CA Cancer J Clin . 2018 ноябрь 68 (6): 394-424. [Медлайн]. [Полный текст].
Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, et al. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001, 6 сентября. 345 (10): 725-30. [Медлайн].
Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Периоперационная химиотерапия в сравнении с хирургическим вмешательством при резектабельном раке пищевода. N Engl J Med . 2006 июл 6. 355 (1): 11-20. [Медлайн].
Ooi CH, Иванова Т., Ву Дж., Ли М., Тан И.Б., Тао Дж. И др. Комбинации онкогенных путей прогнозируют клинический прогноз при раке желудка. PLoS Genet . 5 (10) октября 2009 г .: e1000676. [Медлайн]. [Полный текст].
Song H, Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Заболеваемость раком желудка среди пациентов с предраковыми поражениями желудка: наблюдательное когортное исследование в западной популяции низкого риска. BMJ . 2015 27 июля. 351: h4867. [Медлайн]. [Полный текст].
Американское онкологическое общество. Ключевые статистические данные о раке желудка. Американское онкологическое общество. Доступно по адресу http://www.cancer.org/cancer/stomachcancer/detailedguide/stomach-cancer-key-statistics. 22 января 2021 г .; Дата обращения: 22 февраля 2021 г.
Arnold M, Park JY, Camargo MC, Lunet N, Forman D, Soerjomataram I. Становится ли рак желудка редким заболеванием? Глобальная оценка прогнозируемых тенденций заболеваемости до 2035 года. Кишечник . 2020 30 января. [Medline].
Гундерсон Л.Л., Сосин Х. Аденокарцинома желудка: области неудач в серии повторных операций (второй или симптоматический взгляд) клинико-патологическая корреляция и последствия для адъювантной терапии. Int J Radiat Oncol Biol Phys . 1982 8 января (1): 1-11. [Медлайн].
Корреа П. Модификация диеты и профилактика рака желудка. Национальный институт рака, монография . 1992. 75-8. [Медлайн].
Buiatti E, Palli D, Decarli A, Amadori D, Avellini C, Bianchi S и др. Исследование «случай-контроль» рака желудка и диеты в Италии. Инт Дж. Рак . 1989 15 октября. 44 (4): 611-6. [Медлайн].
Steevens J, Schouten LJ, Goldbohm RA, van den Brandt PA. Потребление алкоголя, курение сигарет и риск подтипов рака пищевода и желудка: проспективное когортное исследование. Кишечник . 2010 Январь 59 (1): 39-48. [Медлайн].
González CA, Pera G, Agudo A, Palli D, Krogh V, Vineis P, et al.Курение и риск рака желудка в Европейском проспективном исследовании рака и питания (EPIC). Инт Дж. Рак . 20 ноября 2003 г. 107 (4): 629-34. [Медлайн].
Wu X, Zeng Z, Chen B, Yu J, Xue L, Hao Y, et al. Связь полиморфизмов генов интерлейкина-17A и интерлейкина-17F и риски рака желудка. Инт Дж. Рак . 2009 10 ноября. [Medline].
Рабочая группа МАИР по оценке канцерогенных рисков для людей, Schistosom.Том 61 монографий МАИР по оценке канцерогенных рисков для человека. Международное агентство по изучению рака, Лион, 1994. J Clin Oncol . 2004. 22: 2069.
Harrison P.Hpylori Therapy уменьшает рак желудка у пациентов из группы высокого риска. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/924545. 30 января 2020 г .; Дата обращения: 5 февраля 2020 г.
Choi IJ, Kim CG, Lee JY, Kim YI, Kook MC, Park B, et al.Семейный анамнез рака желудка и лечения Helicobacter pylori . N Engl J Med . 2020 30 января. 382 (5): 427-436. [Медлайн].
Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK. Долгосрочные ингибиторы протонной помпы и риск развития рака желудка после лечения Helicobacter pylori: популяционное исследование. Кишечник. Доступно по адресу http://gut.bmj.com/content/early/2017/09/18/gutjnl-2017-314605. 31 октября 2017 г .; Доступ: 1 ноября 2017 г.
Профилактика рака желудка (PDQ®) — Версия для специалистов здравоохранения. Национальный институт рака. Доступно по адресу http://www.cancer.gov/cancertopics/pdq/prevention/gastric/HealthProfessional. 21 сентября 2018 г .; Дата обращения: 27 февраля 2019 г.
Neugut AI, Hayek M, Howe G. Эпидемиология рака желудка. Семин Онкол . 1996, 23 июня (3): 281-91. [Медлайн].
Guilford P, Hopkins J, Harraway J, et al.Мутации зародышевой линии E-кадгерина при семейном раке желудка. Природа . 1998. 392: 402. [Медлайн].
Cardwell CR, Abnet CC, Cantwell MM, Murray LJ. Воздействие пероральных бисфосфонатов и риск рака пищевода. ДЖАМА . 2010 г. 11 августа. 304 (6): 657-63. [Медлайн]. [Полный текст].
Филиппи Л., Д’Ариензо М., Скопинаро Ф., Сальватори Р., Баньи О. Полезность визуализации с двумя временными точками после газированной воды для визуализации фтордезоксиглюкозно-позитронно-эмиссионной визуализации перитонеального карциноматоза при раке толстой кишки. Cancer Biother Radiopharm . 2013 28 января (1): 29-33. [Медлайн].
Брукс М. Новый подтип рака желудка реагирует на 5-ФУ. Medscape Medical News . 4 сентября 2013 г. [Полный текст].
Lei Z, Tan IB, Das K, et al. Идентификация молекулярных подтипов рака желудка с различными ответами на ингибиторы PI3-киназы и 5-фторурацил. Гастроэнтерология . 2013 Сентябрь 145 (3): 554-65. [Медлайн].
Тернер Э.С., Тернер-младший.Расширение классификации Лорен: новый подтип рака желудка? [редакционная статья]. Гастроэнтерология . 2013 Сентябрь 145 (3): 505-8. [Медлайн].
Американский объединенный комитет по раку. Желудок. Amin MB, Edge S, Greene F, Byrd DR, Brookland RK и др., Под ред. Руководство по стадированию рака AJCC . 8-е изд. Нью-Йорк: Спрингер; 2017.
Наджам А.А., Яо Дж. К., Лензи Р. и др. Пластический линит часто встречается у женщин и в гистологиях низкодифференцированных и перстневых клеток: анализ 217 пациентов (аннотация). Proc Am Soc Clin Oncol . 2002. 21: 166a.
Shen KH, Wu CW, Lo SS, et al. Факторы коррелировали с количеством метастатических лимфатических узлов при раке желудка. Ам Дж. Гастроэнтерол . 1999, январь, 94 (1): 104-8. [Медлайн].
Lee SE, Ryu KW, Nam BH, Lee JH, Choi IJ, Kook MC и др. Прогностическое значение интраоперационно оцененного этапа хирургического вмешательства у больных раком желудка после радикальной резекции. Дж. Ам Колл Сург .2009 Октябрь 209 (4): 461-7. [Медлайн].
Озкан С., Баркаускас Д.А., Рухаак Л.Р., Хавьер Торрес Дж., Кук С.Л., Ан Х и др. Гликановые признаки рака желудка в сыворотке крови. Cancer Prev Res (Phila) . 2013 10 декабря [Medline].
Вакнин Ю. Исследователи обнаружили «гликановый отпечаток пальца» при раке желудка. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/818637. 3 января 2014 г .; Доступ: 24 апреля 2018 г.
Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L.Промежуточный итог по сравнению с тотальной гастрэктомией при раке желудка: пятилетняя выживаемость в многоцентровом рандомизированном итальянском исследовании. Итальянская группа по изучению опухолей желудочно-кишечного тракта. Энн Сург . 1999 августа 230 (2): 170-8. [Медлайн].
Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJ, Welvaart K, Songun I, et al. ван де Вельде, CJ. Расширенная лимфодиссекция при раке желудка. N Engl J Med . 1999 25 марта. 340: 908. [Медлайн].
Hartgrink HH, van de Velde CJ, Putter H, Bonenkamp JJ, Klein Kranenbarg E, Songun I, et al.Расширенная лимфодиссекция при раке желудка: кому может быть полезно? Окончательные результаты рандомизированного голландского группового исследования рака желудка. Дж. Клин Онкол . 2004, 1 июня, 22 (11): 2069-77. [Медлайн].
Degiuli M, Sasako M, Ponti A. Заболеваемость и смертность в рандомизированном клиническом исследовании итальянской группы по изучению рака желудка по сравнению с резекцией D1 и D2 при раке желудка. Br J Surg . 2010 май. 97 (5): 643-9. [Медлайн].
Мемон М.А., Субраманья М.С., Хан С. и др.Мета-анализ D1 и D2 гастрэктомии при аденокарциноме желудка. Энн Сург . 2011 Май. 253 (5): 900-11. [Медлайн].
Coccolini F, Nardi M, Montori G, Ceresoli M, Celotti A, Cascinu S и др. Неоадъювантная химиотерапия при запущенном раке желудка и пищевода-желудка. Метаанализ рандомизированных исследований. Int J Surg . 2018 Март 51: 120-127. [Медлайн].
Sindelar WG, Kinsella TJ. Рандомизированное исследование резекции и интраоперационной лучевой терапии при местнораспространенном раке желудка. Proc Ann Meet Am Soc Clin Oncol . 1987. 6: A357.
Moertel CG, Childs DS, Reitemeier RJ, et al. Комбинированная 5-фторурацил и лучевая терапия сверхвысоким напряжением местного неоперабельного рака желудочно-кишечного тракта. Ланцет . 1969 25 октября. 2 (7626): 865-7. [Медлайн].
Hallissey MT, Dunn JA, Ward LC, Allum WH. Второе испытание британской группы по лечению рака желудка адъювантной лучевой терапии или химиотерапии при резектабельном раке желудка: пятилетнее наблюдение. Ланцет . 1994 28 мая. 343 (8909): 1309-12. [Медлайн].
Группа изучения опухолей желудочно-кишечного тракта. Понятие о местнораспространенном раке желудка. Влияние лечения на исход. Группа исследования опухолей желудочно-кишечного тракта. Рак . 1990 декабрь 1. 66 (11): 2324-30. [Медлайн].
Moertel CG, Childs DS, O’Fallon JR, et al. Комбинированный 5-фторурацил и лучевая терапия в качестве хирургического вспомогательного средства при плохом прогнозе карциномы желудка. Дж. Клин Онкол . 1984, ноябрь 2 (11): 1249-54. [Медлайн].
Smalley SR, Benedetti JK, Haller DG, Hundahl SA, Estes NC, Ajani JA, et al. Обновленный анализ проведенного SWOG межгруппового исследования 0116: Испытание фазы III адъювантной радиохимиотерапии по сравнению с наблюдением после лечебной резекции рака желудка. Дж. Клин Онкол . 2012 г. 1 июля. 30 (19): 2327-33. [Медлайн].
Earle CC, Maroun JA. Адъювантная химиотерапия после радикальной резекции рака желудка у пациентов неазиатского происхождения: пересмотр метаанализа рандомизированных исследований. Eur J Cancer . 1999 июл.35 (7): 1059-64. [Медлайн].
Bang YJ, Kim YW, Yang HK, et al. Адъювант капецитабин и оксалиплатин при раке желудка после гастрэктомии D2 (CLASSIC): открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 2012 28 января. 379 (9813): 315-21. [Медлайн].
Fuchs CS, Niedzwiecki D, Mamon HJ, Tepper JE, Ye X, Swanson RS, et al. Адъювантная химиолучевая терапия эпирубицином, цисплатином и фторурацилом по сравнению с адъювантной химиолучевой терапией фторурацилом и лейковорином после лечебной резекции рака желудка: результаты исследования CALGB 80101 (Alliance). Дж. Клин Онкол . 2017 10 ноября. 35 (32): 3671-3677. [Медлайн]. [Полный текст].
Нарахара Х., Коидзуми Т., Хара А. и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином в лечении распространенного рака желудка. Дж. Клин Онкол . Июнь 2007. 25: 201с.
Wagner AD, Syn NL, Moehler M, Grothe W., Yong WP, Tai BC, et al. Химиотерапия при распространенном раке желудка. Кокрановская база данных Syst Rev . 2017 29 августа.8: CD004064. [Медлайн].
Hartgrink HH, Jansen EP, van Grieken NC, van de Velde CJ. Рак желудка. Ланцет . 2009 8 августа. 374 (9688): 477-90. [Медлайн].
Ким Х. К., Чой И. Дж., Ким К. Г., Осима А., Грин Дж. Э.. Сигнатуры экспрессии генов для прогнозирования ответа рака желудка на цисплатин и фторурацил. Дж. Клин Онкол . 2009/05. 27: [Полный текст].
Исидо К., Адзума М., Коидзуми В., Такеучи А., Сакурамото С., Ватанабе М. и др.Оценка прогностических факторов ответа на S-1 у пациентов с распространенным раком желудка II или III стадии, перенесших гастрэктомию. Фармакогенет Геномика . 2009 5 ноября. [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA одобрило Cyramza для лечения рака желудка [пресс-релиз]. 21 апреля 2014 г. Доступно по адресу https://wayback.archive-it.org/7993/20170112023840/http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm394107.htm. 21 апреля 2014 г .; Доступ: 24 апреля 2018 г.
Fuchs CS, Doi T, Jang RW, Muro K, Satoh T. и др. Безопасность и эффективность монотерапии пембролизумабом у пациентов с ранее леченным распространенным раком желудка и гастроэзофагеального перехода: клиническое испытание фазы 2 KEYNOTE-059. JAMA Oncol . 2018 15 марта. [Medline]. [Полный текст].
Камада Т., Тогаши Ю., Тай С., Ха Д., Сасаки А., Накамура Ю. и др. PD-1 + регуляторные Т-клетки, амплифицированные блокадой PD-1, способствуют гиперпрогрессии рака. Proc Natl Acad Sci U S A . 14 мая 2019 г. 116 (20): 9999-10008. [Медлайн]. [Полный текст].
Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Трастузумаб в сочетании с химиотерапией по сравнению с одной химиотерапией для лечения HER2-положительного распространенного рака желудка или желудочно-пищеводного перехода (ToGA): открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 28 августа 2010 г. 376 (9742): 687-97. [Медлайн].
Шитара К., Банг Й.Дж., Иваса С., Сугимото Н. и др.Трастузумаб Дерустекан при ранее леченном HER2-положительном раке желудка. N Engl J Med . 2020 18 июня. 382 (25): 2419-2430. [Медлайн]. [Полный текст].
Ohtsu A, Shah MA, Van Cutsem E, Rha SY, Sawaki A, Park SR, et al. Бевацизумаб в сочетании с химиотерапией в качестве терапии первой линии при распространенном раке желудка: рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы III. Дж. Клин Онкол . 2011 20 октября. 29 (30): 3968-76. [Медлайн]. [Полный текст].
Van Cutsem E, de Haas S, Kang YK, Ohtsu A, Tebbutt NC, Ming Xu J и др. Бевацизумаб в сочетании с химиотерапией в качестве терапии первой линии при распространенном раке желудка: оценка биомаркеров по результатам рандомизированного исследования III фазы AVAGAST. Дж. Клин Онкол . 2012 июн 10, 30 (17): 2119-27. [Медлайн].
Шитара К., Дои Т., Дворкин М., Мансур В., Аркенау Х.Т., Прохарау А. и др. Трифлуридин / типирацил по сравнению с плацебо у пациентов с метастатическим раком желудка (TAGS), ранее получавшим тяжелое лечение: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3. Ланцет Онкол . 2018 19 ноября (11): 1437-1448. [Медлайн].
Давенпорт Л. «Сдвиг парадигмы» при раке желудочного перехода с помощью ниволумаба. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/937916. 23 сентября 2020 г .; Дата обращения: 10 октября 2020 г.
Moehler M, Shitara K, Garrido M, Salman P, Shen L, Wyriwicz L, et al. Ниволумаб (nivo) плюс химиотерапия (химиотерапия) по сравнению с химиотерапией в качестве лечения первой линии (1L) для лечения распространенного рака желудка / рака желудочно-пищеводного перехода (GC / GEJC) / аденокарциномы пищевода (EAC): первые результаты исследования CheckMate 649 (аннотация).Представлено на Виртуальном конгрессе Европейского общества медицинской онкологии; 21 сентября 2020 г. Энн Онкол . 2020.31 (приложение 4): S1142-S-1215. [Полный текст].
Ротвелл П.М., Фаукс Г.Р., Белч Дж.Ф., Огава Х., Варлоу С.П., Мид Т.В. Влияние ежедневного приема аспирина на долгосрочный риск смерти от рака: анализ данных отдельных пациентов из рандомизированных исследований. Ланцет . 7 декабря 2010 г .; Ранняя онлайн-публикация. [Полный текст].
Скрининг рака желудка (желудка) (PDQ®) Версия для специалистов здравоохранения.Национальный институт рака. Доступно по адресу http://www.cancer.gov/cancertopics/pdq/screening/gastric/HealthProfessional. 20 февраля 2020 г .; Дата обращения: 22 февраля 2021 г.
[Рекомендации] Dinis-Ribeiro M, Areia M, de Vries AC, et al. Ведение предраковых состояний и поражений желудка (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта (ESGE), Европейской группы изучения хеликобактер (EHSG), Европейского общества патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ). Эндоскопия . 2012 Январь 44 (1): 74-94. [Медлайн]. [Полный текст].
[Рекомендации] Chey WD, Wong BC, Комитет по параметрам практики Американского колледжа гастроэнтерологии. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2007 августа 102 (8): 1808-25. [Медлайн]. [Полный текст].
[Директива] Мальфертайнер П., Мегро Ф., О’Морайн, Калифорния, Атертон Дж., Аксон А. Т., Баццоли Ф. и др.Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник . 2012 май. 61 (5): 646-64. [Медлайн].
[Рекомендации] Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. Торонтский консенсус по лечению инфекции Helicobacter pylori у взрослых. Гастроэнтерология . 2016 Июль 151 (1): 51-69.e14. [Медлайн]. [Полный текст].
[Рекомендации] Национальная комплексная онкологическая сеть.Руководство по клинической практике в онкологии: генетическая / семейная оценка высокого риска: колоректальный. NCCN. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf. Версия 3.2019 — 13 декабря 2019 г .; Дата обращения: 24 февраля 2020 г.
[Рекомендации] Фитцджеральд Р.К., Хардвик Р., Хантсман Д., Карнейро Ф., Гилфорд П., Блэр В. и др. Наследственный диффузный рак желудка: обновленные согласованные руководящие принципы клинического ведения и направления будущих исследований. Дж. Мед Генет .2010 июл. 47 (7): 436-44. [Медлайн]. [Полный текст].
[Рекомендации] van der Post RS, Vogelaar IP, Carneiro F, et al. Наследственный диффузный рак желудка: обновленные клинические рекомендации с акцентом на носителей мутации CDh2 в зародышевой линии. Дж. Мед Генет . 2015 июн. 52 (6): 361-74. [Медлайн]. [Полный текст].
[Рекомендации] Джардиелло Ф.М., Аллен Дж. И., Аксилбунд Дж. Э., Боланд С. Р., Берк Калифорния, Берт Р. В. и др. Руководящие принципы по генетической оценке и лечению синдрома Линча: согласованное заявление Многосоциальной целевой группы США по колоректальному раку. Ам Дж. Гастроэнтерол . 2014 августа 109 (8): 1159-79. [Медлайн].
[Рекомендации] Смит ЕС, Верхей М., Аллум В., Каннингем Д., Сервантес А., Арнольд Д. и др. Рак желудка: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2016, 27 сентября (приложение 5): v38-v49. [Медлайн]. [Полный текст].
[Рекомендации] Vasen HF, Blanco I, Aktan-Collan K, et al. Пересмотренное руководство по клиническому ведению синдрома Линча (HNPCC): рекомендации группы европейских экспертов.

 При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз.
При локализации атрофического процесса в теле желудка, риск увеличивается в 3-5 раз, в антральной его части — в 18 раз, а если поражен весь желудок — в 90 раз.
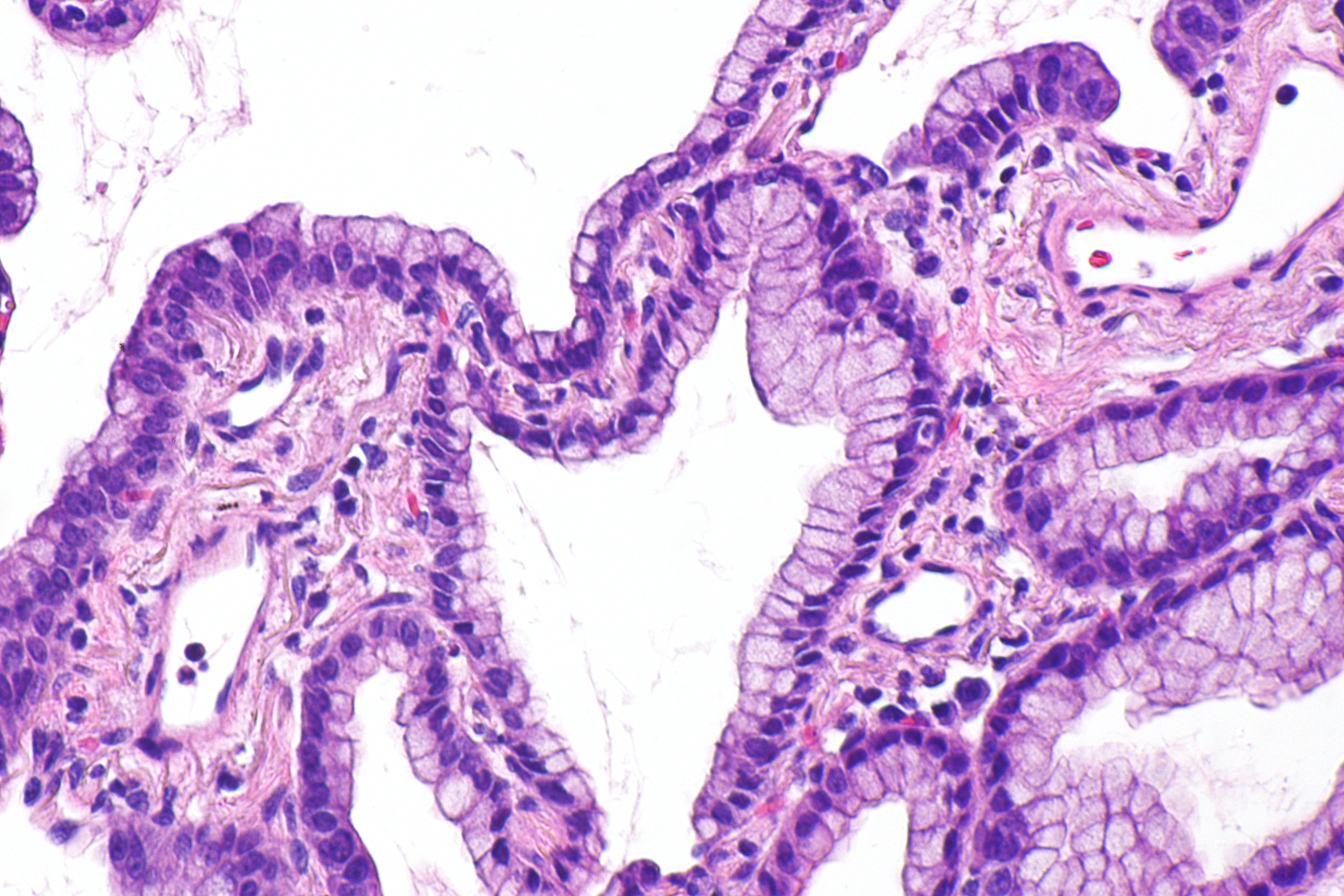
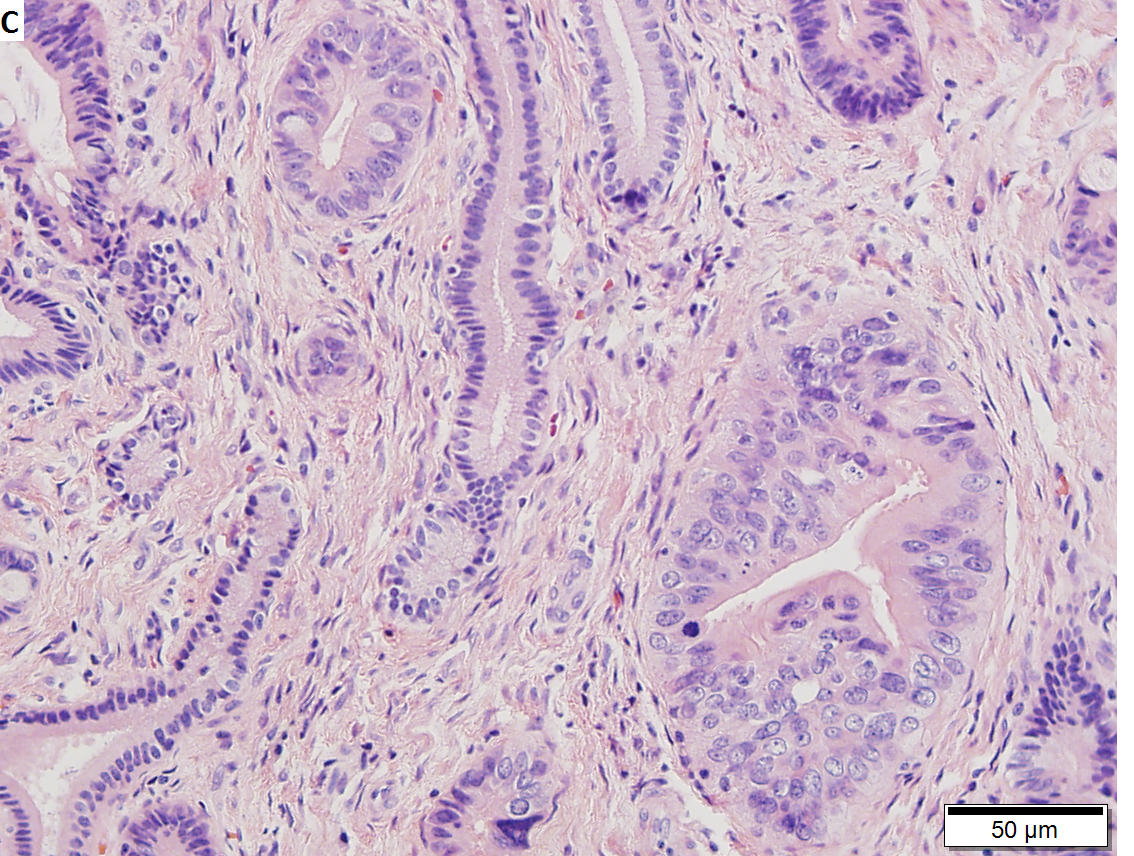 В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
В это время она носит постоянный характер и не зависит от приема пищи. Возникает без видимых причин и часто усиливается после еды. На последних стадиях она настолько сильная, что не купируется привычными анальгетиками.
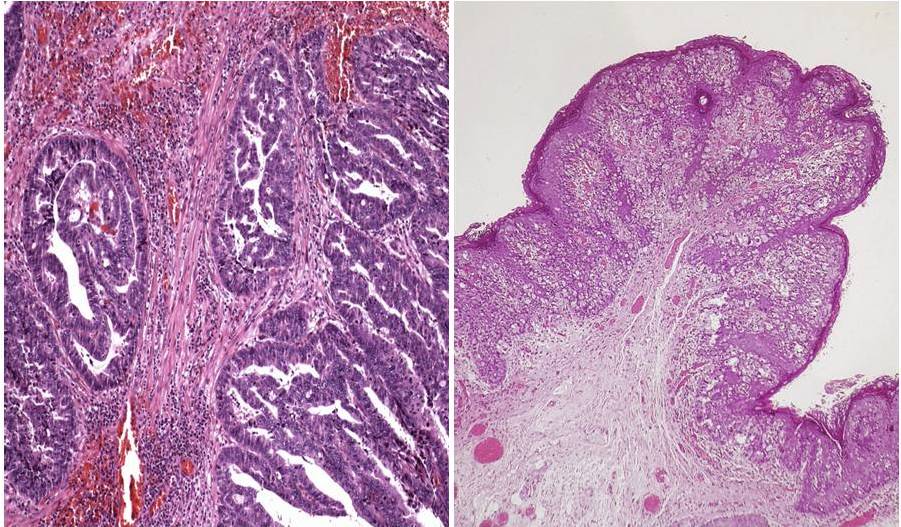 Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток.
Во-вторых, эндоскоп оснащен специальной манипуляционной системой, с помощью которой можно взять кусочек ткани на гистологический анализ и точно определить вид опухоли и степень дифференцировки ее клеток. При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.
При возникновении рецидива или прогрессирования заболевания, он будет опять нарастать.

.jpg)



.jpg) Химиотерапия может применяться до или после проведения операции. Также химиотерапия может сочетаться с лучевой терапией.
Химиотерапия может применяться до или после проведения операции. Также химиотерапия может сочетаться с лучевой терапией.