Лабораторная диагностика рака желудка
Комплексное исследование — определение онкомаркеров, — используемое в диагностике рака желудка; определяемый онкомаркер CA 19, ассоциированный с раковыми патологиями, и специфический антиген СА 72-4, продуцируемый в большом количестве злокачественными опухолями железистой ткани, такими как карцинома желудка, для большей диагностической ценности исследуются совместно с еще одним онкомаркером — РЭА — раково-эмбриональным антигеном. Исследование информативно в том случае, когда имеется подозрение на рак органа, в целях мониторинга состояния больного после радикальной операции, для того чтобы убедиться, что во время удаления части желудка опухоль удалена полностью; чтобы спрогнозировать вероятность рецидива заболевания; в целях мониторинга эффективности проводимой противоопухолевой терапии.
Состав исследования:
- CA 19-9
- CA 72-4
- Раковый эмбриональный антиген (РЭА)
Синонимы русские
Углеводный антиген 19-9, раковый антиген СА 19-9, карциноэмбриональный антиген, раково-эмбриональный антиген.
Синонимы английские
Ca 19-9, Cancer Antigen 19-9, Carbohydrate Antigen 19-9, Gastrointestinal Cancer Antigen, Carcino Embryonic Antigen, Carcinoembryonic Antigen, CEA, CA 72-4.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
Рак желудка — подробнее о заболевании: https://helix.ru/kb/item/735.
Раковый антиген СА 19-9 – это высокомолекулярный гликопротеин, который в норме вырабатывается клетками эпителия желудочно-кишечного тракта.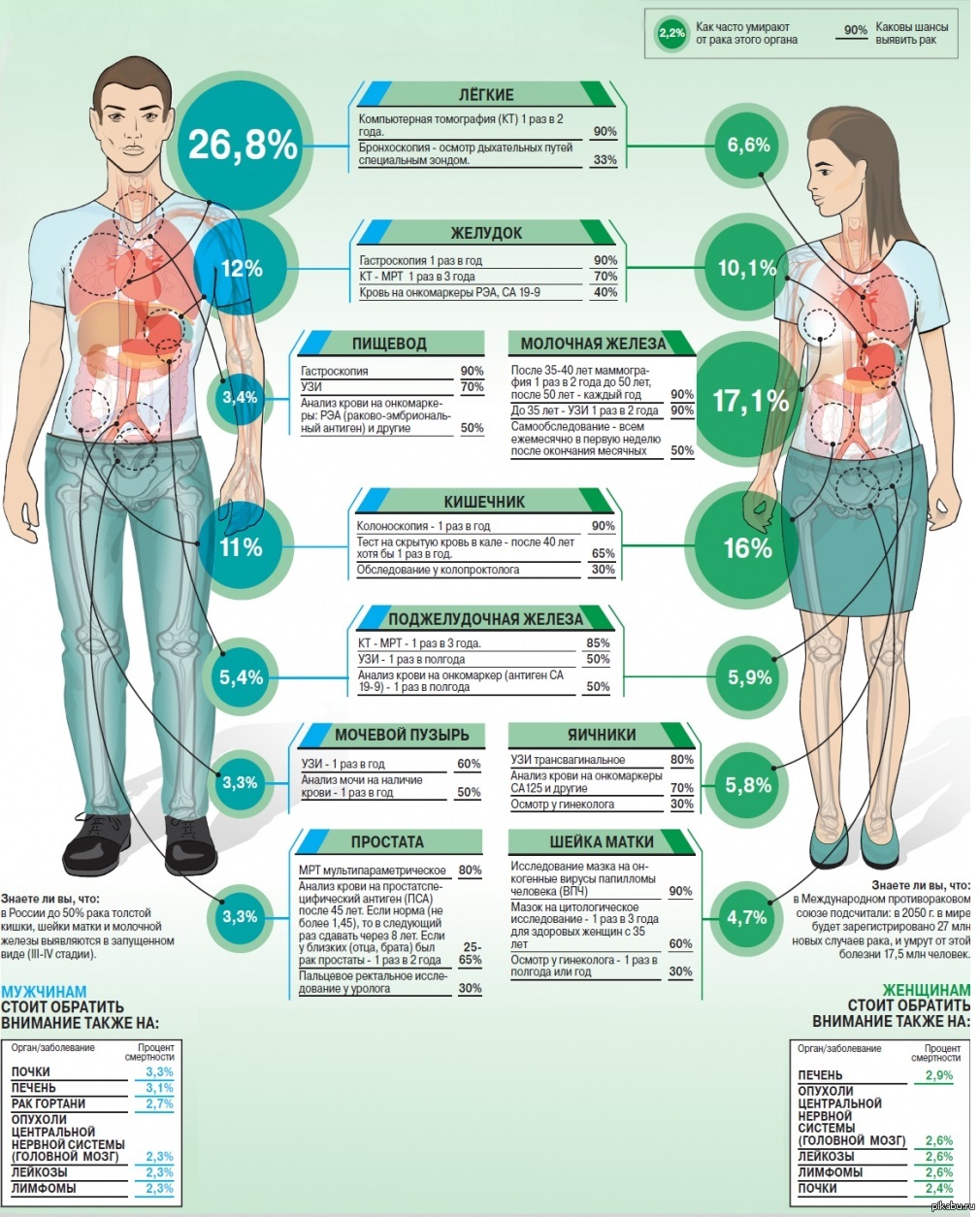
Уровень онкомаркера CA 19-9 повышен у 70 % пациентов с раком поджелудочной железы.
Может увеличиваться его концентрация и при опухолях других локализаций (колоректальном раке, раке печени, желудка, желчного пузыря или желчных путей, яичников), заболеваниях печени (гепатите, циррозе), желчнокаменной болезни, панкреатите, муковисцидозе.
При этом сам по себе тест на СА 19-9 не используется для первичной диагностики рака, так как не обладает достаточной чувствительностью и специфичностью. В данном исследовании для большей достоверности и точности диагностики он определяется совместно с еще одним онкомаркером — РЭА.
В случаях когда повторный тест показывает меньшие значения, чем в первый раз, можно говорить о затухании воспалительного процесса, о высокой эффективности лечения. Если же после удаления опухоли онкомаркер держится на стабильно одинаковых, высоких результатах, речь идет о метастазировании.
Если же после удаления опухоли онкомаркер держится на стабильно одинаковых, высоких результатах, речь идет о метастазировании.
Раковый антиген СА 72-4 – это высокомолекулярный муциноподобный гликопротеин, который вырабатывается во многих тканях плода и в норме практически не обнаруживается у взрослого человека. Производство СА 72-4 увеличивается практически у всех пациентов со злокачественными опухолями железистого генеза, особенно при раке желудка, муцинозном раке яичников.
СА 72-4 продуцируется опухолевыми клетками и поступает в кровоток, что делает его эффективным маркером опухоли.
Раковый эмбриональный антиген (РЭА) – это вещество белковой природы, которое используется в лабораторной практике в качестве тканевого маркера онкологических заболеваний. Определение уровня РЭА используется для диагностики ряда злокачественных опухолей, в первую очередь рака толстой и прямой кишки. Если в норме содержание РЭА очень низкое, то при онкологическом процессе оно резко возрастает и может достигать очень больших значений.
Для чего используется исследование?
- Для контроля за эффективностью лечения рака поджелудочной железы и выявления рецидивов заболевания.
- Для получения информации о распространенности опухолевого процесса, наличии отдаленных метастазов при раке поджелудочной железы.
- Для дифференциальной диагностики рака поджелудочной железы с другими заболеваниями, такими как панкреатит.
Когда назначается исследование?
- При симптомах рака поджелудочной железы: боли в животе, тошноте, потере веса, желтухе.

- Для мониторинга карциномы поджелудочной железы.
- Периодически для контроля за эффективностью лечения и выявления рецидивов у пациентов с раком поджелудочной железы с изначально повышенным уровнем CA 19-9.
- При подозрении на рак печени, желчного пузыря или желчных путей, желудка, толстого кишечника (в комплексе с другими онкомаркерами).
Что означают результаты?
Изолированное использование исследования в целях скрининга и диагностики онкологических заболеваний недопустимо. Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. Диагностика любого заболевания строится на основании разностороннего обследования с использованием различных, не только лабораторных методов и осуществляется исключительно врачом.
CA 19-9
Референсные значения: 0 — 34 Ед/мл.
Отсутствие или низкий уровень ракового антигена СА 19-9 в крови характерен для здоровых людей.
Чрезмерное содержание онкомаркера СА 19-9 в крови чаще всего свидетельствует о раке поджелудочной железы. Как правило, чем выше у пациента уровень СА 19-9, тем более у него поздняя стадия заболевания. Очень высокая концентрация СА 19-9 наблюдается в случае метастазирования рака поджелудочной железы.
Кроме того, высокий показатель CA 19-9 может указывать на различные заболевания: колоректальный рак, рак печени, желудка, желчного пузыря или желчных путей, яичников, заболевания печени (гепатит, цирроз), желчнокаменную болезнь, панкреатит, муковисцидоз.
При этом нормальная концентрация CA 19-9 не исключает наличия рака поджелудочной железы. Так бывает на начальной стадии опухолевого процесса, когда уровень CA 19-9 еще не повысился.
Периодические измерения СА 19-9 могут быть полезны во время и после лечения рака поджелудочной железы. По нарастанию или снижению его уровня можно оценивать эффективность проводимого лечения или выявлять рецидивы опухоли.
Отсутствие или пониженное содержание раковых антигенов СА 19-9 в крови означает:
- норму,
- успешность проводимого лечения,
- раннюю стадию рака поджелудочной железы, когда уровень онкомаркеров не успел повыситься.

Повышенное содержание раковых антигенов СА 19-9 в крови означает:
- рак поджелудочной железы,
- опухоль других локализаций (колоректальный рак, рак печени, желудка, желчного пузыря или желчных путей, яичников),
- заболевания печени (гепатит, цирроз),
- желчнокаменную болезнь,
- панкреатит,
- муковисцидоз.
CA 72-4
Референсные значения: 0 — 6,9 Ед/мл.
Отсутствие или низкий уровень ракового антигена СА 72-4 в крови характерен для здоровых людей.
По нарастанию или снижению концентрации СА 72-4 со временем можно оценить эффективность проводимого лечения или выявить рецидивы опухоли.
Причины повышения CA 72-4
- Рак желудка (обычно чем выше уровень СА 72-4, тем более поздняя стадия рака желудка).
- Муцинозный рак яичников.
- Метастазирование рака желудка.
- Опухоли других локализаций (колоректальный рак, рак легких).

- Заболевания печени (гепатит, цирроз).
- Доброкачественные заболевания яичников (киста).
- Воспалительные заболевания желудочно-кишечного тракта (язвенная болезнь желудка).
РЭА
Референсные значения
- Для некурящих: 0 — 3,8 нг/мл;
- для курящих: 0 — 5,5 нг/мл.
Нормальное количество РЭА в сыворотке крови указывает на низкий риск онкологического заболевания. Кроме того, такой результат возможен, если данный тест нечувствителен к тому или иному типу опухоли.
Причины повышения уровня РЭА
- Злокачественные новообразования:
- толстого кишечника,
- прямой кишки,
- желудка,
- легких,
- молочной железы,
- рака поджелудочной железы.
- Метастазы злокачественных опухолей в печень, костную ткань.
- Рецидив онкологического процесса.
- Цирроз печени и хронические гепатиты.

- Полипы толстого кишечника и прямой кишки.
- Язвенный колит.
- Панкреатит.
- Туберкулез.
- Пневмония, бронхит, эмфизема легких.
- Муковисцидоз.
- Почечная недостаточность.
- Болезнь Крона.
- Аутоиммунные заболевания.
- Курение.
Небольшое повышение уровня РЭА может быть связано с доброкачественными заболеваниями внутренних органов в их острой стадии, однако не исключает начальной стадии онкологического заболевания.
Значительное повышение концентрации РЭА (кратное) возникает при злокачественных опухолях. При метастазах обычно наблюдается повышение в десятки раз.
Причины снижения уровня РЭА
- Хирургическое удаление злокачественной опухоли.
- Успешная терапия онкологического заболевания.
- Ремиссия доброкачественной опухоли.
Онкомаркеры ЖКТ | анализы крови со скидкой 50% от стоимости в Lab4U
Информация об анализе
Рак желудка является 5-м наиболее распространенным раком в мире. Рак пищевода не так распространен, но его отличает высокая смертность в первый год установления диагноза.
Рак пищевода не так распространен, но его отличает высокая смертность в первый год установления диагноза.
Комплекс показан лицам с хроническим атрофическим гастритом, особенно с кишечной метаплазией и хеликобактерной инфекцией, аденоматозными полипами желудка, язвенной болезнью желудка, гипертрофической гастропатией (болезнь Менетрие), перенесших операции на желудке.
Также комплекс рекомендован при длительно сохраняющихся тяжести и боли в желудке после еды, отрыжке, желудочных кровотечениях, ощущении прохождения пищи по пищеводу, затруднении при глотании, особенно на фоне нарушения общего самочувствия, отсутствия аппетита, потери веса.
Интерпретацию результатов, выбор обследований и лечения определяет лечащий врач.
Материал для исследования — Сыворотка крови
Состав и результаты
Срок исполнения
Анализ будет готов в
течение 7 дней, исключая субботу, воскресенье и день забора. Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Подготовка к анализу
ЗаранееОбсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
НаканунеЗа 24 часа до взятия крови:
- Ограничьте жирную и жареную пищу, не принимайте алкоголь.
- Исключите тяжёлые физические нагрузки.

Не менее 4х часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
В день сдачиПеред забором крови
- 60 минут не курить,
- 15-30 минут находиться в спокойном состоянии.
Новообразования желудочно-кишечного тракта
Рак желудка является 5-м наиболее распространенным раком в мире и 7-м наиболее распространенным в Европе. Рак пищевода встречается реже, находится на 19м месте по распространению рака в Европе. В России количество впервые выявленных случаев остается на высоком уровне. Более чем у 40% диагностируется 4я стадия заболевания.
Скрининг на рак желудка проводится в Японии, поскольку это наиболее частый рак в стране.
Рак пищевода является относительно редким заболеванием с тяжелым течением, неблагоприятным прогнозом, относится к категории онкологических заболеваний с высокой летальностью с момента установления диагноза.
Факторы риска: хронический атрофический гастрит с кишечной метаплазией, ассоциированной с хеликобактерной инфекцией, пернициозная анемия, аденоматозные полипы желудка, язвенная болезнь желудка, гипертрофическая гастропатия (болезнь Менетрие), лица, оперированные на желудке по поводу доброкачественных заболеваний более 10-15 лет назад.
Возможные симптомы: ухудшение общего самочувствия, беспричинная слабость, снижение трудоспособности, быстрая утомляемость, отвращения к пище, стойкое снижение аппетита, потеря веса, беспричинное прогрессирующее похудание. Ощущение переполнения и тяжести в желудке после еды, боли после приема пищи, отрыжка, рвота, приносящая облегчение, желудочные кровотечения, ощущение прохождения пищи по пищеводу, затруднения при глотании. Анемия.
Обследование:
- ЭГДС с биопсией (гистологическое и цитологическое исследование биоптата)
- Рентгенологическое исследование желудка
- УЗИ брюшной полости, лимфатических узлов шейно-надключичных зон
- Определение опухолевых маркеров: РЭА, СА 19-9, СА 72-4 в сыворотке крови
- Консультация онколога (уточняющая диагностика)
Онкомаркерами являются высокомолекулярные соединения, исследуемые в крови, в моче или на поверхности клеток, идентификация и определение их уровня используется для диагностики пациентов и планирования лечения. Онкомаркеры выделяются из клеток опухоли, либо нормальными клетками в присутствии опухоли. Однако не следует слишком переоценивать их диагностическое значение, так как повышенные показатели онкомаркеров могут встречаются у пациентов с изменениями, не связанными со злокачественными новообразованиями. С другой стороны, несмотря на наличие злокачественной опухоли, уровень онкомаркера может быть в пределах референсных значений. Это бывает часто при начальных стадиях развития опухоли.
Онкомаркеры выделяются из клеток опухоли, либо нормальными клетками в присутствии опухоли. Однако не следует слишком переоценивать их диагностическое значение, так как повышенные показатели онкомаркеров могут встречаются у пациентов с изменениями, не связанными со злокачественными новообразованиями. С другой стороны, несмотря на наличие злокачественной опухоли, уровень онкомаркера может быть в пределах референсных значений. Это бывает часто при начальных стадиях развития опухоли.
В клинической практике определение уровня онкомаркеров проводится как дополнительный метод диагностики онкологических заболеваний в сочетании с другими методами исследований. Исследование онкомаркеров проводиться также с целью раннего обнаружения опухоли и метастазов (скрининговые обследования групп риска) и прогноза течения заболевания. Ещё одно важное направление применения исследования онкомаркеров в клинике, это ведение онкологических больных: мониторинг терапии и контроль течения заболевания, идентификация множественных опухолей и их метастазов, контроль полноты удаления опухоли (концентрация онкомаркера после лечения может быть повышена за счёт распада опухоли, поэтому контрольные исследования лучше проводить через 2-3 недели после начала лечения).
Общая схема назначения исследования онкомаркеров в клинической практике:
- Перед началом лечения рекомендуется провести исследования необходимых онкомаркеров и в дальнейшем проводить исследования тех онкомаркеров, концентрация которых была повышена.
- После курса лечения или операции исследование онкомаркеров рекомендуется провести через 10-21 дней (в соответствии с периодом полураспада онкомаркера) с целью установления исходного уровня для дальнейшего мониторинга.
- Для оценки эффективности проведенного лечения исследование онкомаркеров проводится через месяц, далее исследование концентрации онкомаркеров рекомендуется проводить с интервалом в 3-4 месяца в течение 2-х лет, затем с интервалом в 6 месяцев в течение 3-5 лет.
- Исследование концентрации онкомаркеров рекомендуется проводить перед любым изменением лечения.
- Определение онкомаркеров проводится при подозрении на рецидив или метастазирование опухоли.

- Повторное определение уровня онкомаркера рекомендуется провести через 3-4 недели, после первого выявления повышенной концентрации.
Сдать анализ: Онкомаркер желудка (СА 72-4)
Описание анализа:
Онкомаркер желудка (СА72-4) — углеводный антиген, онкомаркер для мониторинга рака желудка. СА 72-4 — высокомолекулярный гликопротеин, компонент поверхности эпителия. Этот белок экспрессируется тканями желудочно — кишечного тракта в эмбриональном периоде, а также разнообразными карциномами — толстого кишечника, легких, яичников, эндометрия, желудка, поджелудочной железы, молочных желез. В норме практически не экспрессируется здоровыми тканями у взрослых.
Увеличение концентрации СА 72-4 отмечается в 40 % случаев рака желудочно — кишечного тракта, в 36% случаев рака легких , в 24% случаев рака яичников.
СА 72-4 может определяться в 6,7 % случаев у пациентов с разнообразными доброкачественными заболеваниями (панкреатиты, циррозы печени, легочные заболевания, кисты яичников, ревматические болезни, доброкачественные заболевания желудочно — кишечного тракта).
СА72 -4 используют преимущественно в комбинации с РЭА или СА 19-9 в целях контроля течения и терапии рака желудка, или вместе с СА -125 в целях мониторинга рака яичников, что увеличивает диагностическую чувствительность тестирования.
Показания к назначению анализа:
1. В комплексе с клиническими методами исследования при первичной диагностике и в прогностических целях в случае рака желудка и яичников.
2. Оценка эффективности хирургического вмешательства и следующий мониторинг при раке желудка, яичников, колоректальном раке ( при повышенной концентрации на момент первичной постановки диагноза).
Повышенные значения:
1. Рак желудка, молочных желез, легких, толстого кишечника, эндометрия, поджелудочной железы.
2. Доброкачественные заболевания: панкреатит, цирроз печени, кисты яичников, легочные заболевания, ревматические заболевания.
Нормы для онкомаркеру желудка СА 72-4:
< 2.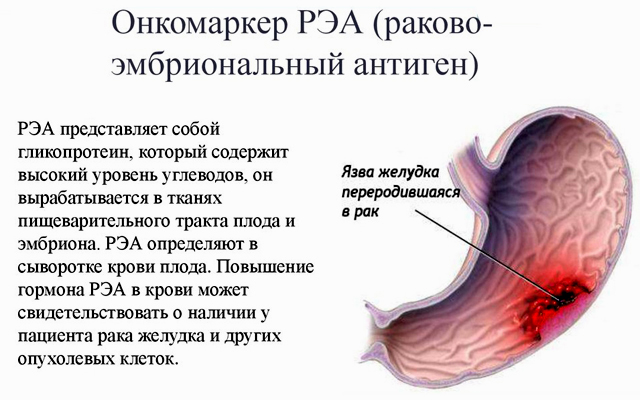 68 Ед / мл
68 Ед / мл
Подготовка к исследованию: не требуется.
Материал для исследования: сыворотка крови.
Метод определения: иммуноферментный.
Запись на анализы
Диагностика рака: почему онкомаркеры «не работают»
Анализ крови на онкомаркеры – одно из самых популярных исследований, которые люди назначают себе «на всякий случай». Почему этого делать нельзя, и какие диагностические методы на самом деле помогают выявить рак на ранней стадии, рассказывает онколог ЕМС, д.м.н. Гелена Петровна Генс.
Гелена Петровна, можно ли с помощью онкомаркеров диагностировать рак на ранней стадии?
Действительно, у многих пациентов существует устойчивая вера в то, что опухолевые клетки выделяют определенные вещества, которые циркулируют в крови с момента зарождения новообразования, и достаточно периодически сдавать анализ крови на онкомаркеры, чтобы удостовериться, что рака нет.
Есть множество материалов в интернете на эту тему, которые содержат, к сожалению, абсолютно ложные утверждения о том, что проверяя кровь на онкомаркеры, возможно обнаружить заболевание на ранней стадии.
На самом деле использование онкомаркеров для достоверного выявления рака не показало своей эффективности ни в одном исследовании, соответственно, они не могут быть рекомендованы для первичной диагностики онкологических заболеваний.
Далеко не всегда значения онкомаркеров коррелируют с заболеванием. Для примера приведу случай из своей практики: недавно у меня проходила лечение пациентка – молодая женщина, у которой был диагностирован метастатический рак молочной железы, при этом значения онкомаркера CA 15.3 оставались в пределах нормы.
Какие причины кроме онкологических заболеваний, могут вызвать повышение онкомаркеров?
В диагностике есть два критерия, которыми мы оцениваем любое исследование – это чувствительность и специфичность. Маркеры могут быть высокочувствительными, но низкоспецифичными. Это говорит о том, что их повышение может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. Например, маркер рака яичников CA 125 может быть повышен не только при опухолях или воспалительных заболеваниях яичников, а, например, при нарушении функции печени, воспалительных заболеваниях шейки матки и самой матки. Часто при нарушениях функции печени повышается раковоэмбриональный антиген (РЭА). Таким образом, значения онкомаркеров зависят от целого ряда процессов, в том числе и воспалительных, которые могут происходить в организме.
Маркеры могут быть высокочувствительными, но низкоспецифичными. Это говорит о том, что их повышение может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. Например, маркер рака яичников CA 125 может быть повышен не только при опухолях или воспалительных заболеваниях яичников, а, например, при нарушении функции печени, воспалительных заболеваниях шейки матки и самой матки. Часто при нарушениях функции печени повышается раковоэмбриональный антиген (РЭА). Таким образом, значения онкомаркеров зависят от целого ряда процессов, в том числе и воспалительных, которые могут происходить в организме.
При этом бывает так, что незначительное повышение онкомаркера служит началом для старта целого ряда диагностических процедур вплоть до такого небезвредного исследования, как позитронно-эмиссионная томография (ПЭТ/КТ), и как выясняется впоследствии, эти процедуры были совсем не нужны этому пациенту.
Для чего применяются онкомаркеры?
Онкомаркеры в основном используются для мониторинга течения заболевания и оценки эффективности лекарственной терапии опухолевых заболеваний. В том случае, если изначально при установлении диагноза у пациента было обнаружено повышение онкомаркера, в дальнейшем с его помощью мы можем отслеживать, как проходит лечение. Часто после операции или проведенного химиотерапевтического лечения мы видим, как уровень маркера с нескольких тысяч единиц буквально «обваливается» до нормальных значений. Его повышение в динамике может говорить о том что, произошел либо рецидив опухоли, либо оставшаяся, как говорят врачи, – «резидуальная» опухоль проявила резистентность к лечению. Наряду с результатами других исследований это может послужить для врачей сигналом о том, что следует подумать о смене тактики лечения и о дальнейшем полном обследовании пациента.
В том случае, если изначально при установлении диагноза у пациента было обнаружено повышение онкомаркера, в дальнейшем с его помощью мы можем отслеживать, как проходит лечение. Часто после операции или проведенного химиотерапевтического лечения мы видим, как уровень маркера с нескольких тысяч единиц буквально «обваливается» до нормальных значений. Его повышение в динамике может говорить о том что, произошел либо рецидив опухоли, либо оставшаяся, как говорят врачи, – «резидуальная» опухоль проявила резистентность к лечению. Наряду с результатами других исследований это может послужить для врачей сигналом о том, что следует подумать о смене тактики лечения и о дальнейшем полном обследовании пациента.
Есть ли исследования, которые действительно помогают выявить рак на ранней стадии?
Существуют исследования для выявления некоторых видов рака, которые показали свою надежность и действенность в больших эпидемиологических исследованиях и рекомендуются для применения в скрининговом режиме.
Так, например, Специальная комиссия США по профилактике заболеваний (United States Preventive Service Task Force — USPSTF) по результатам недавних клинических исследований рекомендует проведение низкодозовой компьютерной томографии для скрининга рака легкого. Низкодозовая КТ рекомендуется людям в возрастной группе от 55 до 80 лет и которые при этом имеют 30-летнюю историю курения или бросили курить не более, чем 15 назад. На сегодняшний день это самый точный метод для раннего выявления рака легкого, эффективность которого подтверждена с точки зрения доказательной медицины.
Ни рентгеновское исследование, ни тем более флюорография органов грудной клетки, которые применялись ранее, не могут заменить низкодозовую КТ, так как их разрешающая способность позволяет выявить только крупноочаговые образования, которые свидетельствуют о поздних стадиях онкологического процесса.
При этом взгляды на некоторые виды скрининга, которые массово применялись в течение нескольких десятилетий, сегодня пересматриваются. Например, раньше мужчинам врачи рекомендовали сдавать анализ крови на ПСА для скрининга рака простаты. Но последние исследования показали, что уровень ПСА не всегда служит надежным основанием для начала диагностических мероприятий. Поэтому сейчас мы рекомендуем сдавать ПСА только после консультации с урологом.
Например, раньше мужчинам врачи рекомендовали сдавать анализ крови на ПСА для скрининга рака простаты. Но последние исследования показали, что уровень ПСА не всегда служит надежным основанием для начала диагностических мероприятий. Поэтому сейчас мы рекомендуем сдавать ПСА только после консультации с урологом.
Для скрининга рака молочной железы рекомендации остаются прежними – для женщин, не входящих в группу риска по раку молочной железы, обязательная маммография после 50 лет раз в два года. При повышенной плотности тканей молочной железы (встречается примерно у 40% женщин) необходимо дополнительно к маммографии проводить УЗИ молочных желез.
Еще одно очень распространенное онкологическое заболевание, которое может быть выявлено с помощью скрининга – рак кишечника.
Для выявления рака кишечника рекомендуется колоноскопия, которую достаточно проводить раз в пять лет, начиная с 50 лет, в том случае если нет жалоб и отягощенной наследственности по данному заболеванию. По желанию пациента обследование может быть проведено под анестезией и не доставить никаких неприятных ощущений, при этом оно является самым точным и эффективном методом диагностики колоректального рака.
По желанию пациента обследование может быть проведено под анестезией и не доставить никаких неприятных ощущений, при этом оно является самым точным и эффективном методом диагностики колоректального рака.
Сегодня существуют и альтернативные методики: КТ-колонография, или «виртуальная колоноскопия», позволяет провести исследование толстой кишки без введения эндоскопа — на компьютерном томографе. Метод обладает высокой чувствительностью: 90% при диагностике полипов более 1 см при продолжительности исследования около 10 минут. Ее можно рекомендовать тем, кто уже ранее проходил традиционную скрининговую колоноскопию, которая не выявила никаких отклонений.
На что стоит обратить внимание молодым людям?
Скрининг, который начинается в более раннем возрасте – это скрининг на рак шейки матки. Мазок на онкоцитологию (ПАП-тест), по американским рекомендациям, необходимо сдавать с 21 года. Кроме того, необходимо сдавать тест на вирус папилломы человека (ВПЧ), так как длительное носительство определенных онкогенных типов ВПЧ ассоциируется с высоким риском развития рака шейки матки.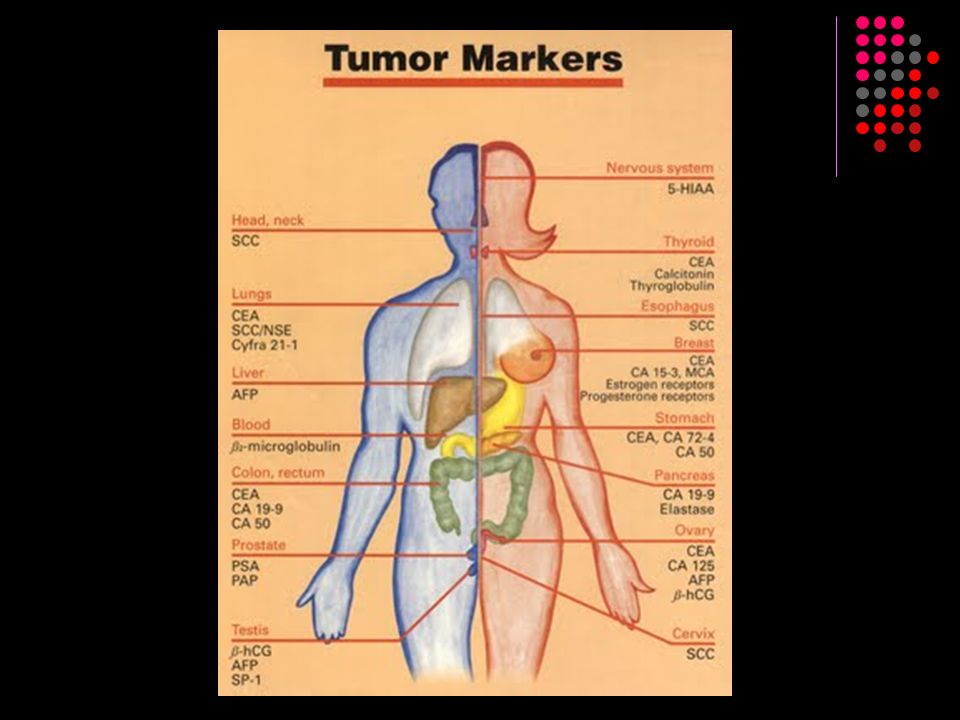 Надежным методом защиты от рака шейки матки является вакцинация девочек и молодых женщин против ВПЧ.
Надежным методом защиты от рака шейки матки является вакцинация девочек и молодых женщин против ВПЧ.
К сожалению, в последнее время увеличивается заболеваемость раком кожи и меланомой. Поэтому желательно показывать так называемые «родинки» и другие пигментные образования на коже дерматологу раз в год, особенно если вы находитесь в группе риска: у вас светлая кожа, были случаи заболевания раком кожи или меланомой в семье, были случаи солнечных ожогов, или вы любитель посещать солярии, которые, кстати, запрещены в некоторых странах к посещению до 18 лет. Доказано, что два и больше эпизодов солнечных ожогов кожи повышают риск возникновения рака кожи и меланомы.
Можно ли следить за «родинками» самостоятельно?
К самоосмотрам у специалистов отношение скептическое. Например, самоосмотр молочных желез, который так пропагандировали раньше, не доказал своей эффективности. Теперь это считается вредным, потому что усыпляет бдительность и не позволяет вовремя провести диагностику.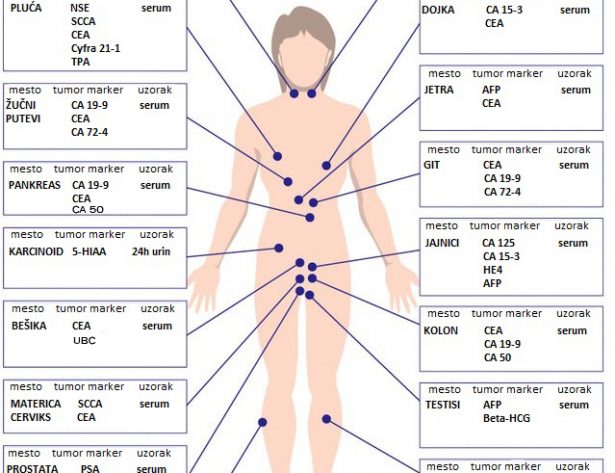 Так же и осмотром кожи. Лучше, если его проведет дерматолог.
Так же и осмотром кожи. Лучше, если его проведет дерматолог.
Могут ли онкологические заболевания передаваться по наследству?
К счастью, большинство онкозаболеваний не передаются по наследству. Из всех видов рака только около 15% являются наследственными. Яркий пример наследственного рака – это носительство мутаций в антионкогенах BRCA 1 и BRCA 2, которое связано с повышенным риском рака молочной железы и в меньшей степени с раком яичников. Всем хорошо известна история Анжелины Джоли, мама и бабушка которой умерли от рака молочной железы. Таким женщинам необходимо регулярно наблюдаться и проходить обследования молочной железы и яичников, чтобы предотвратить развитие наследственного рака.
Остальные 85% опухолей — это опухоли, которые возникают спонтанно, не зависят от какой-либо наследственной предрасположенности.
Однако если в семье несколько кровных родственников страдали онкологическими заболеваниями, мы говорим о том, что их дети могут иметь сниженную способность к метаболизму канцерогенных веществ, а также к репарации ДНК, то есть к «починке» ДНК, если говорить упрощенно.
Каковы основные факторы риска развития онкологических заболеваний?
К основным факторам риска можно отнести работу на вредных производствах, курение, частое (более трех раз в неделю) и длительное употребление алкоголя, ежедневное употребление красного мяса, постоянное употребление пищи, которая прошла термическую обработку, была заморожена и продается в готовом к употреблению виде. Такая пища бедна волокнами, витаминами и другими необходимыми человеку веществами, что может вести к повышенному риску возникновения, например, рака молочной железы. Курение — это один из наиболее распространенных и грозных факторов риска – оно приводит не только к раку легких, но и раку пищевода, желудка, мочевого пузыря, опухолей головы и шеи: раку гортани, раку слизистой щеки, раку языка и т.д.
Для рака кожи и меланомы, как мы уже упоминали, фактором риска является пребывание на солнце до солнечных ожогов.
Длительное употребление гормональных препаратов, например, заместительной гормональной терапии, более 5 лет и не под наблюдением врачей, может вести к повышению риска заболевания раком молочной железы и раком матки у женщин, поэтому прием таких препаратов должен проводиться под строгим контролем маммолога и гинеколога.
Как мы уже упоминали выше, фактором риска могут являться и вирусы, в том числе онкогенные типы вируса ВПЧ, которые приводят к раку половых органов и раку полости рта. Некоторые неканцерогенные вирусы могут также являться факторами риска. Например, вирусы гепатита B и C: они не вызывают напрямую рак печени, но приводят к хроническому воспалительному заболеванию печени – гепатиту, и через 15 лет у пациента с хроническим гепатитом B и C может развиться гепатоцеллюлярный рак.
Когда стоит проконсультироваться с врачом?
Если есть факторы риска, или человек чувствует беспокойство, лучше проконсультироваться с врачом-онкологом. Чего точно не стоит делать – назначать обследования самому себе. Вы можете получить массу ложноположительных и ложноотрицательных результатов, которые усложнят Вашу жизнь и могут привести к стрессу, ненужным диагностическим процедурам и вмешательствам. Конечно, если вдруг появились тревожные симптомы, то проконсультироваться с онкологом нужно обязательно, независимо от рисков.
На консультации мы задаем очень много вопросов, нас интересует все: образ жизни, стаж курения, употребление алкоголя, частота стрессов, характер питания, аппетит, индекс массы тела, наследственность, условия работы, как пациент спит ночью и др. Если это женщина, важен гормональный статус, репродуктивный анамнез: во сколько лет появился первый ребенок, сколько было родов, кормила ли женщина грудью и т.д. Пациенту может показаться, что эти вопросы не имеют отношения к его проблеме, но для нас они важны, они позволяют составить индивидуальный портрет человека, оценить риски развития у него тех или иных онкологических заболеваний и назначить именно тот комплекс обследований, который ему необходим.
Персонализированный онкологический чек-ап в Европейском медицинском центре.
Исследования на онкомаркеры
В поликлиническом комплексе ЛДЦ можно сделать исследования крови на онкомаркеры. Обычно лечащий врач выбирает несколько позиций, наиболее информативных в каждом конкретном случае. Наиболее часто используются следующие их них:
для женщин
- РЭА (Раково эмбриональный антиген) — маркер рака желудка, толстого кишечника, прямой кишки, легких, молочных желез, яичников, матки;
- СА 72-4 – маркер рака желудка, карциномы яичников;
- СА 19-9 — маркер рака поджелудочной железы, желчного пузыря и желчных путей, желудка, прямой и сигмовидной кишки, молочной железы, яичника (прежде всего муцинозного типа), матки, первичного рака печени, метастазы перечисленных выше карцином в печени;
- СА 242 – маркер рака поджелудочной железы, толстого кишечника и прямой кишки
- СА 125 маркер рака яичников, матки (эндометрия), молочной железы, поджелудочной железы, желудка, бронхогенной карциномы, первичного рака печени, рак прямой и сигмовидной кишки, метастазов представленных выше карцином в печени
- ROMA (СА 125, НЕ4) – расчет риска рака яичника;
- СА 15-3 — маркер рака молочной железы, желудка, печени, поджелудочной железы, яичников, матки, бронхогенной карциномы;
- NSE – нейронспецифическая энолаза — маркер рака бронхов, щитовидной железы, головного мозга.
для мужчин
- РЭА (Раково эмбриональный антиген) — маркер рака желудка, толстого кишечника, прямой кишки, легких, молочных желез, простаты;
- СА 72-4 – маркер рака желудка;
- СА 19-9 — маркер рака поджелудочной железы, желчного пузыря и желчных путей, желудка, прямой и сигмовидной кишки, молочной железы, первичного рака печени, метастазы перечисленных выше карцином в печени;
- СА 242 – маркер рака поджелудочной железы, толстого кишечника и прямой кишки
- NSE – нейронспецифическая энолаза — маркер рака бронхов, щитовидной железы, головного мозга;
- PSA общий — маркер рака простаты;
- PSA свободный — маркер рака простаты;
- CYFRA 21-1 (Фрагмент цитокератина 19) – маркер рака легкого (немелкоклеточная карцинома легких и плоскоклеточная карцинома легких) и мочевого пузыря;
- Альфа-фетопротеин – маркер рака печени, яичка, желудка, толстого кишечника, поджелудочной железы, молочной железы, бронхиальные опухоли.
Сдать анализ на онкомаркер Cа 72-4 (Углеводный антиген 72-4, CA 72-4)
Метод определения Иммуноферментный анализ.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Анализ крови на СА 72-4; Углеводный антиген 72-4; Раковый антиген СА 72-4.
Cancer Antigen 72-4; Carbohydrate Antigen 72-4; Tumor-Associated Glycoprotein 72; Tag 72.
Краткое описание исследования «CA 72-4»
CA 72-4 – высокомолекулярный гликопротеин (молекулярная масса 220-1000 кДа), компонент поверхности эпителия. Этот белок экспрессируется тканями желудочно-кишечного тракта в эмбриональном периоде, а также разнообразными карциномами: молочной железы, толстого кишечника, легких, яичников, эндометрия, поджелудочной железы, желудка. В норме у взрослых практически не экспрессируется здоровыми тканями. Увеличенная концентрация CA 72-4 отмечается в 40% случаев рака желудочно-кишечного тракта, 36% случаев рака легких, 24% случаев рака яичников.
CA 72-4 используют в комбинации с РЭА (см. тест № 141) или CA 19-9 (см. тест № 144) в целях контроля течения и терапии рака желудка, или вместе с CA-125 (см. тест № 143) в целях мониторинга рака яичников, что увеличивает диагностическую чувствительность исследований.Рак желудка. Идеального онкомаркера для рака желудка пока не существует. В литературе приводят данные по диагностической чувствительности теста CA 72-4 при данной патологии от 28 до 80%, в среднем 40-46%. Степень повышения уровня CA 72-4 коррелирует со стадией заболевания. После хирургического вмешательства уровень CA 72-4 возвращается к норме примерно за 3-4 недели. Данный маркер обладает несколько более высокой чувствительностью к последующим рецидивам заболевания по сравнению с РЭА и CA 19-9. Комплексное применение этих тестов повышает диагностическую чувствительность и специфичность тестирования.
Рак яичников. Данные по диагностической чувствительности исследования варьируют от 47 до 80%. Комбинированное использование CA 72-4 и CA-125 повышает диагностическую чувствительность обследования как при первичной диагностике, так и при дальнейшем мониторинге.
Колоректальный рак. Диагностическая чувствительность метода 20-41%, при этом уровень маркера коррелирует с клинической стадией заболевания. После резекции опухоли концентрация CA 72-4 заметно снижается. При долгосрочном контроле постоянно повышенная концентрация CA 72-4 наблюдается в случае резидуальной опухоли. Комбинированное использование CA 72-4 и РЭА увеличивает чувствительность исследования к рецидивам заболевания.
С какой целью определяют уровень CA 72-4 в сыворотке крови
Определение СА-72-4 в сыворотке крови может применяться для оценки проведенного лечения и последующего наблюдения при раке желудка, яичников, колоректальном раке (если на момент постановки диагноза опухоль характеризовалась повышением уровня маркера).
Что может вызвать повышение уровня СА 72-4, кроме онкопатологий
Повышение уровня CA 72-4 можно обнаружить у 6,7% пациентов с различными доброкачественными заболеваниями (панкреатиты, циррозы печени, легочные заболевания, доброкачественные заболевания яичников, кисты яичников, ревматические заболевания, гинекологические болезни, патологии молочной железы, доброкачественные заболевания желудочно-кишечного тракта).
Рак желудка и кишечника будут выявлять по анализу крови
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анализы крови могут заменить эндоскопические исследования (гастроскопию и колоноскопию) при поиске злокачественных новообразований желудка и кишечника, сообщает Iol.co.za. Два соответствующих доклада были представлены на онкологическом конгрессе ECCO-ESMO в Берлине.
Группа исследователей под руководством Ульрики Штайн (Ulrike Stein) из берлинского Центра молекулярной медицины и клинической больницы Шарите разработала тест, основанных на обнаружении в крови пациента гена S100A4, который связан с колоректальным раком и злокачественными опухолями желудка, а также определяет вероятность метастазирования этих опухолей.
Исследование проводилось на 185 пациентах с раком толстой кишки, 190 пациентах с раком прямой кишки и 91 пациенте с раком желудка. В контрольной группе был 51 человек.
Вторая работа была подготовлена Джустом Луаджи (Joost Louwagie) в бельгийской биотехнологической компании OncoMethylome. Изучались образцы крови 193 пациентов, которых оперировали в связи с колоректальным раком и 688 человек, прошедших колоноскопию, в которых выявляли наличие генов SYNE1 и FOXE1, также связанных с раком кишечника.
Колоректальный рак поражает каждого семнадцатого человека в развитых странах. Смертность от этого вида опухолей в значительной степени зависит от времени их обнаружения.
Для проведения эндоскопических исследований требуется дорогое оборудование и высококвалифицированный персонал. В сравнении с ними, исследования крови, забор которой может производиться медсестрой, а исследования — проводиться централизованно, значительно выгоднее. Кроме того, анализ крови значительно удобнее и безопаснее для пациента.
Источник: http://medportal.ru
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Классические онкомаркеры при раке желудка. Действующие стандарты и ограничения
Clujul Med. 2015; 88 (2): 111–115.
CĂLIN CĂINAP
1 Кафедра онкологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
2 Кафедра онкологии, Институт онкологии им. И. Кирикутэ, Румыния 9000, Клуж-Напока 9000, Клуж-Напока, Румыния 9000
1 Отделение онкологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
2 Отделение онкологии, I.Онкологический институт Кирикутэ, Клуж-Напока, Румыния
АЛЕКСАНДРА ГЕРМАН
2 Отделение онкологии, Онкологический институт им. И. Кирикутэ, Клуж-Напока, Румыния
САНЗИАНА ЦЕТЕАН
c, Университет Онкологии,Медицина и фармацевтика, Клуж-Напока, Румыния
ISTVAN LASZLO
2 Отделение онкологии, Онкологический институт им. И. Кирикутэ, Клуж-Напока, Румыния
ANNE-MARIE CONSTANTIN
Iulphi 3 9000i Медицинский и фармацевтический университет, Клуж-Напока, Румыния
SIMONA CĂINAP
4 Кафедра педиатрии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
5 2-я педиатрическая клиника, отделение скорой помощи Госпиталь, Клуж-Напока, Румыния
1 Отделение онкологии, Университет М Юлиу Хатиегану edicine and Pharmacy, Клуж-Напока, Румыния
2 Отделение онкологии, I.Онкологический институт Кирикутэ, Клуж-Напока, Румыния
3 Кафедра морфологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
4 Кафедра педиатрии, Университет медицины и фармации Юлиу Хатиегану Напока, Румыния
5 2-е педиатрическое отделение, Детская клиническая больница скорой помощи, Клуж-Напока, Румыния
Поступило 1 февраля 2015 г .; Принято 13 марта 2015 г.
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия
Эта статья цитируется в других статьях в PMC.Abstract
Прогресс, достигнутый за последние несколько лет, сделал доступным большой объем информации, которую онкологи должны интегрировать и упорядочивать. Онкомаркеры — это одна из частей, которые врачи должны решить в большую головоломку. В этой статье будут подробно описаны наиболее частые этиологии скачков уровня карциноэмбрионального антигена (CEA), антигена, связанного с раком 72-4 (CA 72-4), антигена, связанного с раком 19-9 (CA 19-9), в сыворотке крови и их показания.
Хотя онкомаркеры являются бесценным активом для медицинской практики, их роль в скрининге, диагностике и онкологическом лечении остается плохо стандартизованной. Текущие или будущие клинические испытания прольют свет на нерешенные проблемы.
Ключевые слова: онкомаркеров, CEA, CA 72-4, CA 19-9, рак желудка
Рак представляет собой серьезную проблему для общественного здравоохранения, заболеваемость и смертность от него постоянно растут. По оценкам Globocan 2012, ежегодно выявляется 14,1 миллиона новых случаев заболевания при 8 летальных исходах.2 миллиона [1]. Рак желудка — пятая по распространенности форма рака, ежегодно диагностируется около миллиона новых случаев. Это единственная форма рака, заболеваемость которой снизилась [1]. 50% этих случаев приходится на развивающиеся страны. Снижение числа случаев рака желудка не сопровождается снижением уровня смертности. Рак желудка занимает третье место по уровню смертности, что доказывает, что он остается одним из очагов опухоли с чрезвычайно тяжелым прогнозом [1].В Румынии заболеваемость и смертность выше среднего по Европе, составляя 5,2 и 7,1 на 100 000 жителей соответственно по сравнению с 3,5 и 4,9 соответственно [2]. В Румынии рак желудка — это новообразование, заболеваемость которым заметно увеличивается. Число смертей от рака желудка выше, чем в среднем по Европе.
Менее 20% вновь диагностированных случаев относятся к стадии I или II, остальные из них уже являются региональными или отдаленными метастазами, и в этом случае шансы на выздоровление близки к нулю, а средняя выживаемость составляет от 6 месяцев до 1. год [3].
Рак желудка представляет собой трудный участок опухоли из-за поздней диагностики. В свете имеющихся в настоящее время данных, международные руководящие принципы клинической онкологической практики не рекомендуют скрининг населения, а рекомендуют активный мониторинг субъектов высокого риска [4].
Объем информации об этом неопластическом заболевании огромен для читателей, интересующихся последними новостями в этой области. Ежедневно тысячи статей вносят элемент новизны, который способствует лучшему пониманию этого неопластического заболевания.Онкомаркеры представляют собой такой элемент, роль которого в лечении рака давно переоценивалась. Современный медицинский подход к онкологическим заболеваниям является интегративным: информацию из всех областей необходимо собирать вместе, как в пазл. Онкомаркеры — не более чем часть этой головоломки.
Идеальный опухолевый маркер — это биохимический индикатор, который селективно секретируется только раковыми клетками, в кровь или другие жидкости организма, что теоретически должно позволить точный и относительно простой диагноз неоплазии.Тем не менее, в действительности эти маркеры не являются ни специфичными (высокие уровни встречаются при патологиях, кроме неоплазии), ни чувствительными (метастатические случаи могут включать несекретирующие опухоли). Кроме того, нормальные уровни устанавливались с помощью функции Гаусса. Пороговое значение, по которому можно отличить рак от доброкачественного состояния, несомненно, отличается. Таким образом, исследования, в которых участвовали больные раком, пациенты, страдающие доброкачественными заболеваниями желудка, и группа здоровых субъектов, показали тот факт, что установка более высокого референтного уровня для связанного с раком антигена 72-4 (CA 72-4) с помощью регрессионных кривых увеличивает чувствительность дискриминации. диагностики злокачественных патологий по сравнению с другими патологиями [5,6].Международные руководства не принимают онкомаркеры в процессе диагностики рака желудка [4]. Их полезность при раке желудка может быть подтверждена в:
— мониторинг эффективности цитостатиков — радиологическая оценка остается золотым стандартом [4].
— период наблюдения — их роль противоречива, поскольку раннее выявление рецидива не улучшает выживаемость [4].
Идеальный онкомаркер соответствует следующим критериям: — определяется простым и недорогим методом; — имеет специфичность не менее 70% и чувствительность 90% [7].На практике основными ограничениями их использования являются: ограниченная органоспецифичность, а также низкая чувствительность, которые предотвращают раннюю диагностику рака или определяют рост даже в доброкачественных состояниях, что влечет за собой ложноположительные результаты.
При раке желудка наиболее часто используемыми опухолевыми маркерами являются: CA 72-4, карциноэмбриональный антиген (CEA) и связанный с раком антиген 19-9 (CA 19-9).
Раковый антиген 72-4
CA 72-4 — гликопротеин, обнаруживаемый на поверхности опухолевых клеток, с массой 200–420 кДа [8].Спектр опухолей, в которых он выращивается, включает, помимо рака желудка, опухоли поджелудочной железы, яичников, груди и толстой кишки [9,10].
Нормальное значение (в зависимости от лабораторной техники): <6,9 Ед / мл [11]. Предел обнаружения: 0,2 ед / мл [11].
Общая чувствительность этого теста оценивается в 40% при раке желудка (как при колоректальном раке; она составляет 50% при раке яичников) с общей специфичностью 95% [12].
Этот маркер анализируется в периферической крови, но есть исследования, в которых уровни сыворотки сравниваются с уровнями жидкости в перитонеальном лаваже [13].Похоже, что скачок уровней в сыворотке лучше всего коррелирует со стадией поражения лимфатических узлов (категория N), тогда как уровни перитонеальной жидкости также коррелируют со стадией N и стадией T (вовлечение сыворотки), что более точно характеризует продвинутую локорегиональную стадию опухоль желудка, а также прогноз [14,15].
Другие исследования подчеркнули роль CA 72-4 в отборе оперируемых пациентов, причем корреляция между уровнями в сыворотке и резектабельностью опухоли была статистически значимой [16].
Метаанализ Чена [17], который включал 33 опубликованных исследования, обнаружил общую точность 77% для CA 72-4, что намного выше, чем точность других исследуемых маркеров.
Карциноэмбриональный антиген
СЕА — это гликопротеин, прикрепленный к поверхности энтероцитов, с массой 200 кДа и участвующий в запрограммированной гибели клеток и клеточной адгезии [18].
Нормальные значения составляют <3 нг / мл у некурящих или <5 нг / мл у курильщиков [11]. Его период полувыведения составляет в среднем 3 дня, что позволяет повторять маркер каждые 7 дней.
Высокие до терапевтические уровни CEA коррелируют со стадией заболевания, особенно у пациентов с серозной карциномой брюшины [19].
Как и CA 72-4, чувствительность CEA изучалась как в периферической крови, так и в перитонеальной жидкости. В исследовании Мандорвски [20] СА 72-4 является наиболее чувствительным маркером в сыворотке крови, тогда как в перитонеальной жидкости маркером, который лучше всего коррелирует со стадией заболевания (особенно в случае серозной карциномы брюшины), является СЕА.В некоторых исследованиях [21] пороговое значение для CEA в жидкости перитонеального лаважа составляло 100 нг / мл. Метаанализ Сяо доказал, что высокие уровни СЕА в перитонеальной жидкости статистически значительно лучше коррелируют с диагнозом перитонеального рецидива рака желудка, чем стандартная цитология [22].
Некоторые исследования доказали, что корреляция между CEA и локорегиональным рецидивом является статистически значимой [23,24], являясь прогностическим фактором рака желудка. В случае рецидива метастазов в печень уровень СЕА может повыситься примерно за 3 месяца до рентгенологического подтверждения заболевания.
Нормальные до терапевтические уровни могут быть положительным прогностическим фактором, коррелирующим с лучшей выживаемостью, особенно у пациентов, получающих периоперационную химиотерапию [25]. Нормальные послеоперационные уровни в течение периода, не превышающего 2 месяцев, также коррелируют с лучшей общей выживаемостью [26,27]. Повышение его уровня обычно указывает на рецидив, по крайней мере, на перитонеальном уровне. Он менее чувствителен к другим участкам метастазирования рака [28,29].
Интересная клиническая особенность заключается в возникновении рака желудка у молодых пациентов в возрасте от 18 до 30 лет, для которых секреция CEA опухолью статистически значима гораздо чаще, уровни сыворотки намного выше — это является прогностическим признаком. фактор общей выживаемости — опухоли крупнее и чаще поражаются лимфатические сосуды [30].
Раковый антиген 19-9
CA 19-9 представляет собой белок, который играет роль в клеточной адгезии. Его нормальное значение составляет <37 UI / л. Его период полувыведения составляет от 1 до 3 дней [11].
Анализируется в периферической крови. Измерение уровня CA 19-9 в перитонеальной жидкости, по-видимому, имеет более высокую точность с точки зрения предоперационной предсказуемости стадии заболевания [22].
По окончании хирургического лечения CA 19-9 должен вернуться к нормальным значениям максимум за 2 месяца. Повышенные значения в последние 2 месяца влекут за собой осторожный прогноз [27,31].Предоперационный уровень можно привязать к ранней стадии заболевания [14,16].
CA 19-9 был изучен в качестве предоперационной оценки у пациентов с раком желудка. Он статистически коррелировал с поражением лимфатических узлов [32], но не внес такой большой вклад, как CEA в идентификацию оперируемых пациентов [33].
При наблюдении за пациентами с раком желудка регулярная оценка уровня CA 19-9 в сыворотке подтверждает рецидив примерно на 2 месяца раньше, чем рентгенологический метод [24].
CA 19-9, по-видимому, является независимым прогностическим фактором в случае метастатических или рецидивирующих пациентов, а также, возможно, для тех, кто подвергается лечебной хирургии [34].
Сравнение опухолевых маркеров, используемых при раке желудка
CEA по сравнению с CA 19-9
Чувствительность и специфичность опухолевых маркеров сравнивали в различных исследованиях. Багария оценил эти маркеры на разных участках опухоли: пищеводе, желудке и толстой кишке. При раке желудка чувствительность CEA составляет примерно 30% с отрицательной прогностической ценностью (NPV) 58.82% по сравнению с колоректальным раком, при котором его чувствительность составляет 74%, а NPV — 79,36%. Чувствительность CA 19-9 при раке желудка выше, чем CEA, и составляет 42% с NPV 63,29%. Напротив, при колоректальном раке CA 19-9 менее эффективен, его чувствительность составляет всего 26% с NPV 57,47%. Если случаи оцениваются путем связывания двух маркеров, чувствительность повышается до 58% со значением NPV 70,42% [35]. CEA, по-видимому, является предпочтительным маркером при колоректальном раке, тогда как CA 19-9, по-видимому, более чувствителен при раке желудка.
В исследовании Исигами сравнивали CEA и CA 19-9 при предоперационной оценке. Учитывая, что пороговое значение статистического анализа вдвое превышает нормальное значение (10 нг / мл для CEA и 74 U / мл для CA 19-9), было обнаружено, что CEA является более ценным для прогнозирования успеха. хирургической резекции, поражения лимфатических узлов и стадии T. У этих пациентов скачки обоих маркеров способствуют гораздо лучшей оценке положительности их метастатического статуса [36].Более недавнее исследование выявило прогностическую роль до терапевтических значений CEA и CA 19-9, которые коррелировали со стадией TNM, инвазией лимфатических узлов и категорией T [37]. Неоадъювантная химиотерапия снижает количество СЕА и СА 19-9, секретируемых примитивной опухолью, количественно определяемое иммуногистохимическим окрашиванием с неясным значением.
CEA по сравнению с CA 19-9 по сравнению с CA 72-4
Что касается периоперационной оценки, корейское исследование пациентов, перенесших лечебную операцию, показало, что CEA, по-видимому, является маркером с самой высокой чувствительностью как при раннем раке желудка, так и на более поздних стадиях заболевания: 40% и 100% соответственно по сравнению с CA 19-9 (5.6% и 68,2%) и CA 72-4 (2,8% и 51,3%) [38]. Послеоперационный уровень CEA является прогностическим фактором рецидива [38].
В других исследованиях CA 72-4 приписывается с точностью 77%, что выше, чем для других онкомаркеров [17]. Использование тестов для всех перечисленных маркеров увеличивает чувствительность до 74% без повышения специфичности [17].
Японский метаанализ изучал роль онкомаркеров в развитии рака желудка. Из доступных публикаций было отобрано более 4900 статей.Из этих статей только 187 имели ссылки на CEA и CA 19-9 и только 19 — на все три маркера. Общий истинно положительный результат составил 21% для CEA, 27,8% для CA 19-9 и 30% для CA 72-4 [24]. Доступные данные предполагают статистически значимую корреляцию между уровнем в сыворотке, с одной стороны, и стадией опухоли и выживаемостью, с другой стороны. Мониторинг пациентов с использованием онкомаркеров позволяет раннюю диагностику метастазов или рецидивов, несмотря на тот факт, что в рекомендациях ESMO подчеркивается, что ранняя диагностика не улучшает выживаемость [4,24].
Данные, касающиеся 1500 пациентов с раком желудка, перенесших радикальные хирургические вмешательства, показали, что существует значимая статистическая корреляция между CEA и риском поражения лимфатических узлов, тогда как CA 19-9 и CA 72-4 были отрицательными прогностическими факторами для общая выживаемость на стадиях N1 – N2 (до 6 пораженных лимфатических узлов) [14].
У пациентов с метастазами и поражениями, не обнаруживаемыми с помощью КТ, оценка эффективности онкологического лечения и, косвенно, терапевтического решения может быть сделана на основе эволюции онкомаркеров с положительным статистически значимым влиянием на общую выживаемость. [39].Динамическая оценка онкомаркеров позволяет отбирать пациентов с благоприятным прогнозом [40].
Обнаружение высоких уровней в перитонеальной жидкости может означать, что случай неоперабельный или существует риск образования остатков опухоли после резекции (R1). Это очень полезно при первичной оценке или в конце неоадъювантной химиотерапии, поскольку у этой категории пациентов высок риск раннего рецидива на перитонеальном уровне [41].
Польза маркеров для мониторинга лечения оспаривается.Увеличение маркера после одного цикла или во время лечения не может быть автоматически обозначено как прогрессирование опухоли — увеличение также может быть вызвано разрушением опухоли, как было доказано в исследовании Кима [42], при этом «феномен всплеска» сочетается с радиологическим исследованием. ответ на химиотерапию. Продолжительность этого «явления всплеска» зависит от фармакокинетики маркеров. Для достижения пика CEA может потребоваться 2,8 недели, а в целом он может длиться 9,1 недели. Для CA 19-9 эти значения составляют 2,3 недели и 7.1 неделя соответственно. Высокие значения CEA и CA 19-9 в конце адъювантной химиотерапии могут указывать на высокий риск раннего рецидива [43].
Существуют исследования, в которых сравнивается чувствительность и специфичность маркеров, используемых при раке желудка в период последующего наблюдения. Среди них CA 72-4, по-видимому, имеет самую высокую чувствительность и специфичность (Se = 50%, Sp = 100%) по сравнению с CEA (Se = 16%, Sp = 100%) и CA 19-9 (Se = 33,3%, Sp = 93,3%) [44,45]. Некоторые авторы считают, что CEA представляет больший интерес в ущерб CA 72-4 [45].Пороговые значения для CEA и CA 19-9 во время наблюдения составляют 5 нг / мл и 100 UI / мл соответственно.
Заключение
Полезность онкомаркеров, а также их показания в настоящее время обсуждаются. Они могут сыграть роль в отборе пациентов, которые получат наибольшую пользу от их использования во время последующего наблюдения или в оценке лечения в случае рецидива или метастазирования. Текущие данные в основном предоставлены ретроспективными исследованиями, в которых участвовало небольшое количество пациентов и которые пока не позволяют сделать однозначные выводы.Это причина того, что международные руководящие принципы не очень точны.
Благодарность
Эта статья была опубликована в рамках Оперативной программы развития человеческих ресурсов на 2007–2013 гг. Европейского социального фонда, проект № POSDRU / 159 / 1.5 / 138776.
Ссылки
1. Ферли Дж., Стелиарова-Фуше Э., Лорте-Тилент Дж., Россо С., Коберг Дж. В., Комбер Х. и др. Заболеваемость и смертность от рака в Европе: оценки для 40 стран в 2012 г. Eur J Cancer. 2013. 49 (6): 1374–1403.[PubMed] [Google Scholar] 2. Форман Д., Брей Ф., Брюстер Д.Х., Гомбе Мбалава С., Колер Б., Пиньерос М. и др., Редакторы. Заболеваемость раком на пяти континентах, Том X (электронная версия) Лион: IARC; 2013. Цитировано [01-12-2013]. Доступно по адресу: http://ci5.iarc.fr. [Google Scholar] 3. Американское онкологическое общество. Факты и цифры о раке, 2014 г. Атланта, штат Джорджия: Американское онкологическое общество; 2014. [Google Scholar] 4. Уодделл Т., Верхей М., Аллум В., Каннингем Д., Сервантес А., Арнольд Д. и др. Рак желудка: Руководство по клинической практике ESMO-ESSO-ESTRO по диагностике, лечению и последующему наблюдению.Энн Онкол. 2013; 24 (Дополнение 6): 57–63. [PubMed] [Google Scholar] 5. Ян А.П., Лю Дж., Лэй Х.Й., Чжан К.В., Чжао Л., Ян Г.Х. CA72-4 в сочетании с CEA, CA125 и CAl9-9 повышает чувствительность для ранней диагностики рака желудка. Clin Chim Acta. 2014; 437: 183–186. [PubMed] [Google Scholar] 6. He CZ, Zhang KH, Li Q, Liu XH, Hong Y, Lv NH. Комбинированное использование AFP, CEA, CA125 и CAl9-9 повышает чувствительность диагностики рака желудка. BMC Gastroenterol. 2013; 13:87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7.Cooner WH. Определение идеального онкомаркера. Urol Clin North Am. 1993. 20 (4): 575–579. [PubMed] [Google Scholar] 8. Sun Z, Zhang N. Клиническая оценка CEA, CA19-9, CA72-4 и CA125 у пациентов с раком желудка с неоадъювантной химиотерапией. Мир J Surg Oncol. 2014; 12: 397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Louhimo J, Alfthan H, Stenman UH, Haglund C. Сыворотка HCG beta и CA 72-4 являются более сильными прогностическими факторами, чем CEA, CA 19-9 и CA 242 при раке поджелудочной железы. Онкология. 2004. 66 (2): 126–131.[PubMed] [Google Scholar] 10. Louhimo J, Carpelan-Holmström M, Alfthan H, Stenman UH, Järvinen HJ, Haglund C. Сыворотка HCG beta, CA 72-4 и CEA являются независимыми прогностическими факторами при колоректальном раке. Int J Cancer. 2002. 101 (6): 545–548. [PubMed] [Google Scholar] 12. Emoto S, Ishigami H, Yamashita H, Yamaguchi H, Kaisaki S, Kitayama J. Клиническое значение CA125 и CA72-4 при раке желудка с перитонеальной диссеминацией. Рак желудка. 2012. 15 (2): 154–161. [PubMed] [Google Scholar] 13. Фернандес Л.Л., Мартинс Л.С., Нагашима Калифорния, Нагае А.С., Вайсберг Д.Р., Вайсберг Дж.Уровни антигена CA72-4 в сыворотке и перитонеальном смыве при раке желудка. Корреляция с морфологическими аспектами новообразований. Арк Гастроэнтерол. 2007. 44 (3): 235–239. [PubMed] [Google Scholar] 14. Ли Ф, Ли С., Вэй Л., Лян Х, Чжан Х., Лю Дж. Корреляция между предоперационными сывороточными опухолевыми маркерами и метастазами в лимфатические узлы у пациентов с раком желудка, проходящих лечебное лечение. Биомаркеры. 2013. 18 (7): 632–637. [PubMed] [Google Scholar] 15. Ямамото М., Йошинага К., Мацуяма А., Цуцуи С., Исида Т. Уровни CEA / CA72-4 в жидкости перитонеального лаважа являются прогностическими факторами у пациентов с карциномой желудка.J Cancer Res Clin Oncol. 2014. 140 (4): 607–612. [PubMed] [Google Scholar] 16. Cidón EU, Bustamante R. Рак желудка: онкомаркеры как прогностические факторы для предоперационного определения стадии. J Gastrointest Cancer. 2011; 42 (3): 127–130. [PubMed] [Google Scholar] 17. Чен XZ, Чжан В.К., Ян К., Ван Л.Л., Лю Дж., Ван Л. и др. Корреляция между сывороткой CA724 и раком желудка: множественные анализы на основе населения Китая. Mol Biol Rep. 2012; 39 (9): 9031–9039. [PubMed] [Google Scholar] 18. Телес-Авила FI, Гарсия-Осогобио SM.Карциноэмбриональный антиген: по поводу старого друга. Rev Invest Clin. 2005. 57 (6): 814–819. [PubMed] [Google Scholar] 19. Чжан Й.Х., Ли И., Чен Ц., Пэн Ц.В. Уровень карциноэмбрионального антигена связан с инвазией опухоли в серозную оболочку желудка: исследование на 166 случаях и предложение новой терапии. Гепатогастроэнтерология. 2009. 56 (96): 1750–1754. [PubMed] [Google Scholar] 20. Мандорвски С, Лоуренсо Л.Г., Форонес Н.М. CA72-4 и CEA в сыворотке и промывании брюшины при раке желудка. Арк Гастроэнтерол. 2002. 39 (1): 17–21.[PubMed] [Google Scholar] 21. Канетака К., Ито С., Сусуму С., Йонеда А., Фудзита Ф., Такацуки М. и др. Клиническое значение карциноэмбрионального антигена в перитонеальном лаваже больных раком желудка. Операция. 2013. 154 (3): 563–572. [PubMed] [Google Scholar] 22. Li GC, Zhang Z, Ma XJ, Gu WL, Wang YN, Li J. Коррелируют ли биомаркеры с типами рецидивов у пациентов с резектабельной аденокарциномой желудка. Mol Biol Rep. 2012; 39 (1): 399–405. [PubMed] [Google Scholar] 23. Сяо Ю., Чжан Дж., Хэ Икс, Джи Дж., Ван Г.Диагностические значения карциноэмбрионального антигена в прогнозировании перитонеального рецидива после радикальной резекции рака желудка: метаанализ. Ir J Med Sci. 2014. 183 (4): 557–564. [PubMed] [Google Scholar] 24. Шимада Х., Нойе Т., Охаши М., Оба К., Такахаши Ю. Клиническое значение сывороточных онкомаркеров для рака желудка: систематический обзор литературы Целевой группой Японской ассоциации рака желудка. Рак желудка. 2014. 17 (1): 26–33. [PubMed] [Google Scholar] 25. Chen S, Chen YB, Li YF, Feng XY, Zhou ZW, Yuan XH и др.Нормальный карциноэмбриональный антиген указывает на пользу периоперационной химиотерапии для пациентов с карциномой желудка. Мир Дж. Гастроэнтерол. 2012. 18 (29): 3910–3916. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Чен С., Фэн XY, Ли ЮФ, Чжао Б.В., Чжоу З.В., Чен Ю.Б. Прогноз для пациентов с раком желудка с незначительно повышенными значениями карциноэмбрионального антигена (CEA) после радикальной гастрэктомии D2. J Surg Oncol. 2013. 107 (6): 641–645. [PubMed] [Google Scholar] 27. Нам Д.Х., Ли Ю.К., Пак Дж.С., Ли Х., Шин С.К., Ли С.К. и др.Прогностическое значение раннего послеоперационного ответа онкомаркера при раке желудка. Энн Сург Онкол. 2013. 20 (12): 3905–3911. [PubMed] [Google Scholar] 28. Хан Э.С., Ли Х. Х., Ли Дж. С., Сон К. Ю., Пак Ч., Чон Х. М.. На какой стадии прогрессирования рака желудка повышаются уровни карциноэмбрионального антигена и углеводного антигена 19-9? Применение при лечении запущенного рака желудка. J Рак желудка. 2014. 14 (2): 123–128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Таката А., Курокава Ю., Фудзивара Ю., Накамура Ю., Такахаши Т., Ямасаки М. и др.Прогностическое значение мРНК CEA и CK20 в жидкости перитонеального лаважа пациентов, перенесших лечебные операции по поводу рака желудка. Мир J Surg. 2014. 38 (5): 1107–1111. [PubMed] [Google Scholar] 30. Пак Х.Дж., Ан Дж.Й., Юнг Х.Й., Лим Х., Ли Дж.Х., Чой К.С. и др. Клинические характеристики и исходы у больных раком желудка в возрасте 18–30 лет. Рак желудка. 2014. 17 (4): 649–660. [PubMed] [Google Scholar] 31. Kwon OK, Yu W, Chung H. Прогностическое значение послеоперационной нормализации CA19-9 у пациентов с распространенным раком желудка.Гепатогастроэнтерология. 2013. 60 (122): 240–243. [PubMed] [Google Scholar] 32. Диледж Э., Михманли М., Демир Ю., Озер К., Бостанчи О, Кая С. и др. Прогностическое значение предоперационных уровней CEA и CA 19-9 при резектабельном раке желудка. Гепатогастроэнтерология. 2010. 57 (99–100): 674–677. [PubMed] [Google Scholar] 33. Дуракер Н, Челик АН. Прогностическое значение предоперационной сыворотки CA 19-9 у пациентов с резектабельной карциномой желудка: сравнение с CEA. J Surg Oncol. 2001. 76 (4): 266–271. [PubMed] [Google Scholar] 34.Jo JC, Ryu MH, Koo DH, Ryoo BY, Kim HJ, Kim TW и др. CA 19-9 в сыворотке как прогностический фактор у пациентов с метастатическим раком желудка. Азия Пак Дж. Клин Онкол. 2013. 9 (4): 324–330. [PubMed] [Google Scholar] 35. Багария Б., Суд С., Шарма Р., Лалвани С. Сравнительное исследование CEA и CA19-9 при раке пищевода, желудка и толстой кишки по отдельности и в комбинации (анализ кривой ROC) Cancer Biol Med. 2013. 10 (3): 148–157. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Исигами С., Нацуго С., Хокита С., Че Икс, Токуда К., Накаджо А. и др.Клиническое значение предоперационных уровней карциноэмбрионального антигена и углеводного антигена 19-9 при раке желудка. J Clin Gastroenterol. 2001. 32 (1): 41–44. [PubMed] [Google Scholar] 37. Ван Дж. Х., Май С., Хун Дж., Чжан Кью, Тан Х.С., Тан Й.К. и др. Прогнозирование значения CEA и CA19-9 в сыворотке при неоадъювантной химиотерапии запущенной карциномы желудка. Чжунхуа Вэй Чанг Вай Кэ За Чжи. 2012. 15 (12): 1273–1276. [PubMed] [Google Scholar] 38. Kim DH, Oh SJ, Oh CA, Choi MG, Noh JH, Sohn TS и др. Взаимосвязь между периоперационным CEA, CA 19-9 и CA 72-4 и рецидивом у пациентов с раком желудка после радикальной радикальной гастрэктомии.J Surg Oncol. 2011. 104 (6): 585–591. [PubMed] [Google Scholar] 39. Хасегава Х., Фудзитани К., Накадзуру С., Хирао М., Ямамото К., Мита Е. и др. Критерии изменения оптимального лечения распространенного рака желудка с неизмеримыми перитонеальными метастазами: на основе симптомов / опухолевых маркеров по сравнению с КТ. Anticancer Res. 2014. 34 (9): 5169–5174. [PubMed] [Google Scholar] 40. Komatsu S, Ichikawa D, Nishimura Y, Kubota T, Okamoto K, Shiozaki A и др. Лучшие результаты за счет мониторинга динамики опухоли с использованием чувствительных онкомаркеров у пациентов с рецидивирующим раком желудка.Anticancer Res. 2013. 33 (4): 1621–1627. [PubMed] [Google Scholar] 41. Хосковец Д., Варга Дж., Конечна Э., Антос Ф. Уровни CEA и Ca 19-9 в сыворотке крови и брюшной полости у пациентов с раком желудка и поджелудочной железы. Acta Cir Bras. 2012. 27 (6): 410–416. [PubMed] [Google Scholar] 42. Ким HJ, Ли KW, Ким YJ, Oh DY, Kim JH, Im SA и др. Вызванные химиотерапией преходящие выбросы CEA и CA19-9 у пациентов с метастатическим или рецидивирующим раком желудка. Acta Oncol. 2009. 48 (3): 385–390. [PubMed] [Google Scholar] 43.Li Y, Yang Y, Lu M, Shen L. Прогностическое значение сывороточного CEA, CA19-9 и CA72.4 в ранней диагностике рецидива после радикальной резекции рака желудка. Гепатогастроэнтерология. 2011. 58 (112): 2166–2170. [PubMed] [Google Scholar] 44. Патрити А., Грациози Л., Баффа Н., Пасифико Е., Ламприни П., Валиани С. и др. Послеоперационное наблюдение за аденокарциномой желудка с неопластическими маркерами и 18-FDG-PET / TC. Ann Ital Chir. 2007. 78 (6): 481–485. [PubMed] [Google Scholar] 45. Qiu MZ, Lin JZ, Wang ZQ, Wang FH, Pan ZZ, Luo HY и др.Пороговое значение повышения уровней карциноэмбрионального антигена и углеводного антигена 19-9 для мониторинга рецидива у пациентов с резектабельной аденокарциномой желудка. Маркеры Int J Biol. 2009. 24 (4): 258–264. [PubMed] [Google Scholar]классических онкомаркеров при раке желудка. Действующие стандарты и ограничения
Clujul Med. 2015; 88 (2): 111–115.
CĂLIN CĂINAP
1 Отделение онкологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
2 Отделение онкологии, I.Онкологический институт Кирикутэ, Клуж-Напока, Румыния
VIORICA NAGY
1 Кафедра онкологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
2 Онкологический институт, I. Клуж-Напока, Румыния
АЛЕКСАНДРА ГЕРМАН
2 Отделение онкологии, Онкологический институт им. И. Чирикутэ, Клуж-Напока, Румыния
САНЗИАНА ЦЕТАН
1 Кафедра медицины и фармации им. Клуж-Напока, Румыния
ISTVAN LASZLO
2 Отделение онкологии, I.Онкологический институт Кирикутэ, Клуж-Напока, Румыния
ANNE-MARIE CONSTANTIN
3 Кафедра морфологии, Университет медицины и фармации им. Юлиу Хатиегану, Клуж-Напока, Румыния
Отделение педиатрии SIMONA
Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
5 2-е отделение педиатрической клиники, Педиатрическая больница скорой помощи, Клуж-Напока, Румыния
1 Отделение онкологии, Университет медицины и фармации Юлиу Хатиегану Клуж-Напока, Румыния
2 Отделение онкологии, I.Онкологический институт Кирикутэ, Клуж-Напока, Румыния
3 Кафедра морфологии, Университет медицины и фармации Юлиу Хатиегану, Клуж-Напока, Румыния
4 Кафедра педиатрии, Университет медицины и фармации Юлиу Хатиегану Напока, Румыния
5 2-е педиатрическое отделение, Детская клиническая больница скорой помощи, Клуж-Напока, Румыния
Поступило 1 февраля 2015 г .; Принято 13 марта 2015 г.
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия
Эта статья цитируется в других статьях в PMC.Abstract
Прогресс, достигнутый за последние несколько лет, сделал доступным большой объем информации, которую онкологи должны интегрировать и упорядочивать. Онкомаркеры — это одна из частей, которые врачи должны решить в большую головоломку. В этой статье будут подробно описаны наиболее частые этиологии скачков уровня карциноэмбрионального антигена (CEA), антигена, связанного с раком 72-4 (CA 72-4), антигена, связанного с раком 19-9 (CA 19-9), в сыворотке крови и их показания.
Хотя онкомаркеры являются бесценным активом для медицинской практики, их роль в скрининге, диагностике и онкологическом лечении остается плохо стандартизованной. Текущие или будущие клинические испытания прольют свет на нерешенные проблемы.
Ключевые слова: онкомаркеров, CEA, CA 72-4, CA 19-9, рак желудка
Рак представляет собой серьезную проблему для общественного здравоохранения, заболеваемость и смертность от него постоянно растут. По оценкам Globocan 2012, ежегодно выявляется 14,1 миллиона новых случаев заболевания при 8 летальных исходах.2 миллиона [1]. Рак желудка — пятая по распространенности форма рака, ежегодно диагностируется около миллиона новых случаев. Это единственная форма рака, заболеваемость которой снизилась [1]. 50% этих случаев приходится на развивающиеся страны. Снижение числа случаев рака желудка не сопровождается снижением уровня смертности. Рак желудка занимает третье место по уровню смертности, что доказывает, что он остается одним из очагов опухоли с чрезвычайно тяжелым прогнозом [1].В Румынии заболеваемость и смертность выше среднего по Европе, составляя 5,2 и 7,1 на 100 000 жителей соответственно по сравнению с 3,5 и 4,9 соответственно [2]. В Румынии рак желудка — это новообразование, заболеваемость которым заметно увеличивается. Число смертей от рака желудка выше, чем в среднем по Европе.
Менее 20% вновь диагностированных случаев относятся к стадии I или II, остальные из них уже являются региональными или отдаленными метастазами, и в этом случае шансы на выздоровление близки к нулю, а средняя выживаемость составляет от 6 месяцев до 1. год [3].
Рак желудка представляет собой трудный участок опухоли из-за поздней диагностики. В свете имеющихся в настоящее время данных, международные руководящие принципы клинической онкологической практики не рекомендуют скрининг населения, а рекомендуют активный мониторинг субъектов высокого риска [4].
Объем информации об этом неопластическом заболевании огромен для читателей, интересующихся последними новостями в этой области. Ежедневно тысячи статей вносят элемент новизны, который способствует лучшему пониманию этого неопластического заболевания.Онкомаркеры представляют собой такой элемент, роль которого в лечении рака давно переоценивалась. Современный медицинский подход к онкологическим заболеваниям является интегративным: информацию из всех областей необходимо собирать вместе, как в пазл. Онкомаркеры — не более чем часть этой головоломки.
Идеальный опухолевый маркер — это биохимический индикатор, который селективно секретируется только раковыми клетками, в кровь или другие жидкости организма, что теоретически должно позволить точный и относительно простой диагноз неоплазии.Тем не менее, в действительности эти маркеры не являются ни специфичными (высокие уровни встречаются при патологиях, кроме неоплазии), ни чувствительными (метастатические случаи могут включать несекретирующие опухоли). Кроме того, нормальные уровни устанавливались с помощью функции Гаусса. Пороговое значение, по которому можно отличить рак от доброкачественного состояния, несомненно, отличается. Таким образом, исследования, в которых участвовали больные раком, пациенты, страдающие доброкачественными заболеваниями желудка, и группа здоровых субъектов, показали тот факт, что установка более высокого референтного уровня для связанного с раком антигена 72-4 (CA 72-4) с помощью регрессионных кривых увеличивает чувствительность дискриминации. диагностики злокачественных патологий по сравнению с другими патологиями [5,6].Международные руководства не принимают онкомаркеры в процессе диагностики рака желудка [4]. Их полезность при раке желудка может быть подтверждена в:
— мониторинг эффективности цитостатиков — радиологическая оценка остается золотым стандартом [4].
— период наблюдения — их роль противоречива, поскольку раннее выявление рецидива не улучшает выживаемость [4].
Идеальный онкомаркер соответствует следующим критериям: — определяется простым и недорогим методом; — имеет специфичность не менее 70% и чувствительность 90% [7].На практике основными ограничениями их использования являются: ограниченная органоспецифичность, а также низкая чувствительность, которые предотвращают раннюю диагностику рака или определяют рост даже в доброкачественных состояниях, что влечет за собой ложноположительные результаты.
При раке желудка наиболее часто используемыми опухолевыми маркерами являются: CA 72-4, карциноэмбриональный антиген (CEA) и связанный с раком антиген 19-9 (CA 19-9).
Раковый антиген 72-4
CA 72-4 — гликопротеин, обнаруживаемый на поверхности опухолевых клеток, с массой 200–420 кДа [8].Спектр опухолей, в которых он выращивается, включает, помимо рака желудка, опухоли поджелудочной железы, яичников, груди и толстой кишки [9,10].
Нормальное значение (в зависимости от лабораторной техники): <6,9 Ед / мл [11]. Предел обнаружения: 0,2 ед / мл [11].
Общая чувствительность этого теста оценивается в 40% при раке желудка (как при колоректальном раке; она составляет 50% при раке яичников) с общей специфичностью 95% [12].
Этот маркер анализируется в периферической крови, но есть исследования, в которых уровни сыворотки сравниваются с уровнями жидкости в перитонеальном лаваже [13].Похоже, что скачок уровней в сыворотке лучше всего коррелирует со стадией поражения лимфатических узлов (категория N), тогда как уровни перитонеальной жидкости также коррелируют со стадией N и стадией T (вовлечение сыворотки), что более точно характеризует продвинутую локорегиональную стадию опухоль желудка, а также прогноз [14,15].
Другие исследования подчеркнули роль CA 72-4 в отборе оперируемых пациентов, причем корреляция между уровнями в сыворотке и резектабельностью опухоли была статистически значимой [16].
Метаанализ Чена [17], который включал 33 опубликованных исследования, обнаружил общую точность 77% для CA 72-4, что намного выше, чем точность других исследуемых маркеров.
Карциноэмбриональный антиген
СЕА — это гликопротеин, прикрепленный к поверхности энтероцитов, с массой 200 кДа и участвующий в запрограммированной гибели клеток и клеточной адгезии [18].
Нормальные значения составляют <3 нг / мл у некурящих или <5 нг / мл у курильщиков [11]. Его период полувыведения составляет в среднем 3 дня, что позволяет повторять маркер каждые 7 дней.
Высокие до терапевтические уровни CEA коррелируют со стадией заболевания, особенно у пациентов с серозной карциномой брюшины [19].
Как и CA 72-4, чувствительность CEA изучалась как в периферической крови, так и в перитонеальной жидкости. В исследовании Мандорвски [20] СА 72-4 является наиболее чувствительным маркером в сыворотке крови, тогда как в перитонеальной жидкости маркером, который лучше всего коррелирует со стадией заболевания (особенно в случае серозной карциномы брюшины), является СЕА.В некоторых исследованиях [21] пороговое значение для CEA в жидкости перитонеального лаважа составляло 100 нг / мл. Метаанализ Сяо доказал, что высокие уровни СЕА в перитонеальной жидкости статистически значительно лучше коррелируют с диагнозом перитонеального рецидива рака желудка, чем стандартная цитология [22].
Некоторые исследования доказали, что корреляция между CEA и локорегиональным рецидивом является статистически значимой [23,24], являясь прогностическим фактором рака желудка. В случае рецидива метастазов в печень уровень СЕА может повыситься примерно за 3 месяца до рентгенологического подтверждения заболевания.
Нормальные до терапевтические уровни могут быть положительным прогностическим фактором, коррелирующим с лучшей выживаемостью, особенно у пациентов, получающих периоперационную химиотерапию [25]. Нормальные послеоперационные уровни в течение периода, не превышающего 2 месяцев, также коррелируют с лучшей общей выживаемостью [26,27]. Повышение его уровня обычно указывает на рецидив, по крайней мере, на перитонеальном уровне. Он менее чувствителен к другим участкам метастазирования рака [28,29].
Интересная клиническая особенность заключается в возникновении рака желудка у молодых пациентов в возрасте от 18 до 30 лет, для которых секреция CEA опухолью статистически значима гораздо чаще, уровни сыворотки намного выше — это является прогностическим признаком. фактор общей выживаемости — опухоли крупнее и чаще поражаются лимфатические сосуды [30].
Раковый антиген 19-9
CA 19-9 представляет собой белок, который играет роль в клеточной адгезии. Его нормальное значение составляет <37 UI / л. Его период полувыведения составляет от 1 до 3 дней [11].
Анализируется в периферической крови. Измерение уровня CA 19-9 в перитонеальной жидкости, по-видимому, имеет более высокую точность с точки зрения предоперационной предсказуемости стадии заболевания [22].
По окончании хирургического лечения CA 19-9 должен вернуться к нормальным значениям максимум за 2 месяца. Повышенные значения в последние 2 месяца влекут за собой осторожный прогноз [27,31].Предоперационный уровень можно привязать к ранней стадии заболевания [14,16].
CA 19-9 был изучен в качестве предоперационной оценки у пациентов с раком желудка. Он статистически коррелировал с поражением лимфатических узлов [32], но не внес такой большой вклад, как CEA в идентификацию оперируемых пациентов [33].
При наблюдении за пациентами с раком желудка регулярная оценка уровня CA 19-9 в сыворотке подтверждает рецидив примерно на 2 месяца раньше, чем рентгенологический метод [24].
CA 19-9, по-видимому, является независимым прогностическим фактором в случае метастатических или рецидивирующих пациентов, а также, возможно, для тех, кто подвергается лечебной хирургии [34].
Сравнение опухолевых маркеров, используемых при раке желудка
CEA по сравнению с CA 19-9
Чувствительность и специфичность опухолевых маркеров сравнивали в различных исследованиях. Багария оценил эти маркеры на разных участках опухоли: пищеводе, желудке и толстой кишке. При раке желудка чувствительность CEA составляет примерно 30% с отрицательной прогностической ценностью (NPV) 58.82% по сравнению с колоректальным раком, при котором его чувствительность составляет 74%, а NPV — 79,36%. Чувствительность CA 19-9 при раке желудка выше, чем CEA, и составляет 42% с NPV 63,29%. Напротив, при колоректальном раке CA 19-9 менее эффективен, его чувствительность составляет всего 26% с NPV 57,47%. Если случаи оцениваются путем связывания двух маркеров, чувствительность повышается до 58% со значением NPV 70,42% [35]. CEA, по-видимому, является предпочтительным маркером при колоректальном раке, тогда как CA 19-9, по-видимому, более чувствителен при раке желудка.
В исследовании Исигами сравнивали CEA и CA 19-9 при предоперационной оценке. Учитывая, что пороговое значение статистического анализа вдвое превышает нормальное значение (10 нг / мл для CEA и 74 U / мл для CA 19-9), было обнаружено, что CEA является более ценным для прогнозирования успеха. хирургической резекции, поражения лимфатических узлов и стадии T. У этих пациентов скачки обоих маркеров способствуют гораздо лучшей оценке положительности их метастатического статуса [36].Более недавнее исследование выявило прогностическую роль до терапевтических значений CEA и CA 19-9, которые коррелировали со стадией TNM, инвазией лимфатических узлов и категорией T [37]. Неоадъювантная химиотерапия снижает количество СЕА и СА 19-9, секретируемых примитивной опухолью, количественно определяемое иммуногистохимическим окрашиванием с неясным значением.
CEA по сравнению с CA 19-9 по сравнению с CA 72-4
Что касается периоперационной оценки, корейское исследование пациентов, перенесших лечебную операцию, показало, что CEA, по-видимому, является маркером с самой высокой чувствительностью как при раннем раке желудка, так и на более поздних стадиях заболевания: 40% и 100% соответственно по сравнению с CA 19-9 (5.6% и 68,2%) и CA 72-4 (2,8% и 51,3%) [38]. Послеоперационный уровень CEA является прогностическим фактором рецидива [38].
В других исследованиях CA 72-4 приписывается с точностью 77%, что выше, чем для других онкомаркеров [17]. Использование тестов для всех перечисленных маркеров увеличивает чувствительность до 74% без повышения специфичности [17].
Японский метаанализ изучал роль онкомаркеров в развитии рака желудка. Из доступных публикаций было отобрано более 4900 статей.Из этих статей только 187 имели ссылки на CEA и CA 19-9 и только 19 — на все три маркера. Общий истинно положительный результат составил 21% для CEA, 27,8% для CA 19-9 и 30% для CA 72-4 [24]. Доступные данные предполагают статистически значимую корреляцию между уровнем в сыворотке, с одной стороны, и стадией опухоли и выживаемостью, с другой стороны. Мониторинг пациентов с использованием онкомаркеров позволяет раннюю диагностику метастазов или рецидивов, несмотря на тот факт, что в рекомендациях ESMO подчеркивается, что ранняя диагностика не улучшает выживаемость [4,24].
Данные, касающиеся 1500 пациентов с раком желудка, перенесших радикальные хирургические вмешательства, показали, что существует значимая статистическая корреляция между CEA и риском поражения лимфатических узлов, тогда как CA 19-9 и CA 72-4 были отрицательными прогностическими факторами для общая выживаемость на стадиях N1 – N2 (до 6 пораженных лимфатических узлов) [14].
У пациентов с метастазами и поражениями, не обнаруживаемыми с помощью КТ, оценка эффективности онкологического лечения и, косвенно, терапевтического решения может быть сделана на основе эволюции онкомаркеров с положительным статистически значимым влиянием на общую выживаемость. [39].Динамическая оценка онкомаркеров позволяет отбирать пациентов с благоприятным прогнозом [40].
Обнаружение высоких уровней в перитонеальной жидкости может означать, что случай неоперабельный или существует риск образования остатков опухоли после резекции (R1). Это очень полезно при первичной оценке или в конце неоадъювантной химиотерапии, поскольку у этой категории пациентов высок риск раннего рецидива на перитонеальном уровне [41].
Польза маркеров для мониторинга лечения оспаривается.Увеличение маркера после одного цикла или во время лечения не может быть автоматически обозначено как прогрессирование опухоли — увеличение также может быть вызвано разрушением опухоли, как было доказано в исследовании Кима [42], при этом «феномен всплеска» сочетается с радиологическим исследованием. ответ на химиотерапию. Продолжительность этого «явления всплеска» зависит от фармакокинетики маркеров. Для достижения пика CEA может потребоваться 2,8 недели, а в целом он может длиться 9,1 недели. Для CA 19-9 эти значения составляют 2,3 недели и 7.1 неделя соответственно. Высокие значения CEA и CA 19-9 в конце адъювантной химиотерапии могут указывать на высокий риск раннего рецидива [43].
Существуют исследования, в которых сравнивается чувствительность и специфичность маркеров, используемых при раке желудка в период последующего наблюдения. Среди них CA 72-4, по-видимому, имеет самую высокую чувствительность и специфичность (Se = 50%, Sp = 100%) по сравнению с CEA (Se = 16%, Sp = 100%) и CA 19-9 (Se = 33,3%, Sp = 93,3%) [44,45]. Некоторые авторы считают, что CEA представляет больший интерес в ущерб CA 72-4 [45].Пороговые значения для CEA и CA 19-9 во время наблюдения составляют 5 нг / мл и 100 UI / мл соответственно.
Заключение
Полезность онкомаркеров, а также их показания в настоящее время обсуждаются. Они могут сыграть роль в отборе пациентов, которые получат наибольшую пользу от их использования во время последующего наблюдения или в оценке лечения в случае рецидива или метастазирования. Текущие данные в основном предоставлены ретроспективными исследованиями, в которых участвовало небольшое количество пациентов и которые пока не позволяют сделать однозначные выводы.Это причина того, что международные руководящие принципы не очень точны.
Благодарность
Эта статья была опубликована в рамках Оперативной программы развития человеческих ресурсов на 2007–2013 гг. Европейского социального фонда, проект № POSDRU / 159 / 1.5 / 138776.
Ссылки
1. Ферли Дж., Стелиарова-Фуше Э., Лорте-Тилент Дж., Россо С., Коберг Дж. В., Комбер Х. и др. Заболеваемость и смертность от рака в Европе: оценки для 40 стран в 2012 г. Eur J Cancer. 2013. 49 (6): 1374–1403.[PubMed] [Google Scholar] 2. Форман Д., Брей Ф., Брюстер Д.Х., Гомбе Мбалава С., Колер Б., Пиньерос М. и др., Редакторы. Заболеваемость раком на пяти континентах, Том X (электронная версия) Лион: IARC; 2013. Цитировано [01-12-2013]. Доступно по адресу: http://ci5.iarc.fr. [Google Scholar] 3. Американское онкологическое общество. Факты и цифры о раке, 2014 г. Атланта, штат Джорджия: Американское онкологическое общество; 2014. [Google Scholar] 4. Уодделл Т., Верхей М., Аллум В., Каннингем Д., Сервантес А., Арнольд Д. и др. Рак желудка: Руководство по клинической практике ESMO-ESSO-ESTRO по диагностике, лечению и последующему наблюдению.Энн Онкол. 2013; 24 (Дополнение 6): 57–63. [PubMed] [Google Scholar] 5. Ян А.П., Лю Дж., Лэй Х.Й., Чжан К.В., Чжао Л., Ян Г.Х. CA72-4 в сочетании с CEA, CA125 и CAl9-9 повышает чувствительность для ранней диагностики рака желудка. Clin Chim Acta. 2014; 437: 183–186. [PubMed] [Google Scholar] 6. He CZ, Zhang KH, Li Q, Liu XH, Hong Y, Lv NH. Комбинированное использование AFP, CEA, CA125 и CAl9-9 повышает чувствительность диагностики рака желудка. BMC Gastroenterol. 2013; 13:87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7.Cooner WH. Определение идеального онкомаркера. Urol Clin North Am. 1993. 20 (4): 575–579. [PubMed] [Google Scholar] 8. Sun Z, Zhang N. Клиническая оценка CEA, CA19-9, CA72-4 и CA125 у пациентов с раком желудка с неоадъювантной химиотерапией. Мир J Surg Oncol. 2014; 12: 397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Louhimo J, Alfthan H, Stenman UH, Haglund C. Сыворотка HCG beta и CA 72-4 являются более сильными прогностическими факторами, чем CEA, CA 19-9 и CA 242 при раке поджелудочной железы. Онкология. 2004. 66 (2): 126–131.[PubMed] [Google Scholar] 10. Louhimo J, Carpelan-Holmström M, Alfthan H, Stenman UH, Järvinen HJ, Haglund C. Сыворотка HCG beta, CA 72-4 и CEA являются независимыми прогностическими факторами при колоректальном раке. Int J Cancer. 2002. 101 (6): 545–548. [PubMed] [Google Scholar] 12. Emoto S, Ishigami H, Yamashita H, Yamaguchi H, Kaisaki S, Kitayama J. Клиническое значение CA125 и CA72-4 при раке желудка с перитонеальной диссеминацией. Рак желудка. 2012. 15 (2): 154–161. [PubMed] [Google Scholar] 13. Фернандес Л.Л., Мартинс Л.С., Нагашима Калифорния, Нагае А.С., Вайсберг Д.Р., Вайсберг Дж.Уровни антигена CA72-4 в сыворотке и перитонеальном смыве при раке желудка. Корреляция с морфологическими аспектами новообразований. Арк Гастроэнтерол. 2007. 44 (3): 235–239. [PubMed] [Google Scholar] 14. Ли Ф, Ли С., Вэй Л., Лян Х, Чжан Х., Лю Дж. Корреляция между предоперационными сывороточными опухолевыми маркерами и метастазами в лимфатические узлы у пациентов с раком желудка, проходящих лечебное лечение. Биомаркеры. 2013. 18 (7): 632–637. [PubMed] [Google Scholar] 15. Ямамото М., Йошинага К., Мацуяма А., Цуцуи С., Исида Т. Уровни CEA / CA72-4 в жидкости перитонеального лаважа являются прогностическими факторами у пациентов с карциномой желудка.J Cancer Res Clin Oncol. 2014. 140 (4): 607–612. [PubMed] [Google Scholar] 16. Cidón EU, Bustamante R. Рак желудка: онкомаркеры как прогностические факторы для предоперационного определения стадии. J Gastrointest Cancer. 2011; 42 (3): 127–130. [PubMed] [Google Scholar] 17. Чен XZ, Чжан В.К., Ян К., Ван Л.Л., Лю Дж., Ван Л. и др. Корреляция между сывороткой CA724 и раком желудка: множественные анализы на основе населения Китая. Mol Biol Rep. 2012; 39 (9): 9031–9039. [PubMed] [Google Scholar] 18. Телес-Авила FI, Гарсия-Осогобио SM.Карциноэмбриональный антиген: по поводу старого друга. Rev Invest Clin. 2005. 57 (6): 814–819. [PubMed] [Google Scholar] 19. Чжан Й.Х., Ли И., Чен Ц., Пэн Ц.В. Уровень карциноэмбрионального антигена связан с инвазией опухоли в серозную оболочку желудка: исследование на 166 случаях и предложение новой терапии. Гепатогастроэнтерология. 2009. 56 (96): 1750–1754. [PubMed] [Google Scholar] 20. Мандорвски С, Лоуренсо Л.Г., Форонес Н.М. CA72-4 и CEA в сыворотке и промывании брюшины при раке желудка. Арк Гастроэнтерол. 2002. 39 (1): 17–21.[PubMed] [Google Scholar] 21. Канетака К., Ито С., Сусуму С., Йонеда А., Фудзита Ф., Такацуки М. и др. Клиническое значение карциноэмбрионального антигена в перитонеальном лаваже больных раком желудка. Операция. 2013. 154 (3): 563–572. [PubMed] [Google Scholar] 22. Li GC, Zhang Z, Ma XJ, Gu WL, Wang YN, Li J. Коррелируют ли биомаркеры с типами рецидивов у пациентов с резектабельной аденокарциномой желудка. Mol Biol Rep. 2012; 39 (1): 399–405. [PubMed] [Google Scholar] 23. Сяо Ю., Чжан Дж., Хэ Икс, Джи Дж., Ван Г.Диагностические значения карциноэмбрионального антигена в прогнозировании перитонеального рецидива после радикальной резекции рака желудка: метаанализ. Ir J Med Sci. 2014. 183 (4): 557–564. [PubMed] [Google Scholar] 24. Шимада Х., Нойе Т., Охаши М., Оба К., Такахаши Ю. Клиническое значение сывороточных онкомаркеров для рака желудка: систематический обзор литературы Целевой группой Японской ассоциации рака желудка. Рак желудка. 2014. 17 (1): 26–33. [PubMed] [Google Scholar] 25. Chen S, Chen YB, Li YF, Feng XY, Zhou ZW, Yuan XH и др.Нормальный карциноэмбриональный антиген указывает на пользу периоперационной химиотерапии для пациентов с карциномой желудка. Мир Дж. Гастроэнтерол. 2012. 18 (29): 3910–3916. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Чен С., Фэн XY, Ли ЮФ, Чжао Б.В., Чжоу З.В., Чен Ю.Б. Прогноз для пациентов с раком желудка с незначительно повышенными значениями карциноэмбрионального антигена (CEA) после радикальной гастрэктомии D2. J Surg Oncol. 2013. 107 (6): 641–645. [PubMed] [Google Scholar] 27. Нам Д.Х., Ли Ю.К., Пак Дж.С., Ли Х., Шин С.К., Ли С.К. и др.Прогностическое значение раннего послеоперационного ответа онкомаркера при раке желудка. Энн Сург Онкол. 2013. 20 (12): 3905–3911. [PubMed] [Google Scholar] 28. Хан Э.С., Ли Х. Х., Ли Дж. С., Сон К. Ю., Пак Ч., Чон Х. М.. На какой стадии прогрессирования рака желудка повышаются уровни карциноэмбрионального антигена и углеводного антигена 19-9? Применение при лечении запущенного рака желудка. J Рак желудка. 2014. 14 (2): 123–128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Таката А., Курокава Ю., Фудзивара Ю., Накамура Ю., Такахаши Т., Ямасаки М. и др.Прогностическое значение мРНК CEA и CK20 в жидкости перитонеального лаважа пациентов, перенесших лечебные операции по поводу рака желудка. Мир J Surg. 2014. 38 (5): 1107–1111. [PubMed] [Google Scholar] 30. Пак Х.Дж., Ан Дж.Й., Юнг Х.Й., Лим Х., Ли Дж.Х., Чой К.С. и др. Клинические характеристики и исходы у больных раком желудка в возрасте 18–30 лет. Рак желудка. 2014. 17 (4): 649–660. [PubMed] [Google Scholar] 31. Kwon OK, Yu W, Chung H. Прогностическое значение послеоперационной нормализации CA19-9 у пациентов с распространенным раком желудка.Гепатогастроэнтерология. 2013. 60 (122): 240–243. [PubMed] [Google Scholar] 32. Диледж Э., Михманли М., Демир Ю., Озер К., Бостанчи О, Кая С. и др. Прогностическое значение предоперационных уровней CEA и CA 19-9 при резектабельном раке желудка. Гепатогастроэнтерология. 2010. 57 (99–100): 674–677. [PubMed] [Google Scholar] 33. Дуракер Н, Челик АН. Прогностическое значение предоперационной сыворотки CA 19-9 у пациентов с резектабельной карциномой желудка: сравнение с CEA. J Surg Oncol. 2001. 76 (4): 266–271. [PubMed] [Google Scholar] 34.Jo JC, Ryu MH, Koo DH, Ryoo BY, Kim HJ, Kim TW и др. CA 19-9 в сыворотке как прогностический фактор у пациентов с метастатическим раком желудка. Азия Пак Дж. Клин Онкол. 2013. 9 (4): 324–330. [PubMed] [Google Scholar] 35. Багария Б., Суд С., Шарма Р., Лалвани С. Сравнительное исследование CEA и CA19-9 при раке пищевода, желудка и толстой кишки по отдельности и в комбинации (анализ кривой ROC) Cancer Biol Med. 2013. 10 (3): 148–157. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Исигами С., Нацуго С., Хокита С., Че Икс, Токуда К., Накаджо А. и др.Клиническое значение предоперационных уровней карциноэмбрионального антигена и углеводного антигена 19-9 при раке желудка. J Clin Gastroenterol. 2001. 32 (1): 41–44. [PubMed] [Google Scholar] 37. Ван Дж. Х., Май С., Хун Дж., Чжан Кью, Тан Х.С., Тан Й.К. и др. Прогнозирование значения CEA и CA19-9 в сыворотке при неоадъювантной химиотерапии запущенной карциномы желудка. Чжунхуа Вэй Чанг Вай Кэ За Чжи. 2012. 15 (12): 1273–1276. [PubMed] [Google Scholar] 38. Kim DH, Oh SJ, Oh CA, Choi MG, Noh JH, Sohn TS и др. Взаимосвязь между периоперационным CEA, CA 19-9 и CA 72-4 и рецидивом у пациентов с раком желудка после радикальной радикальной гастрэктомии.J Surg Oncol. 2011. 104 (6): 585–591. [PubMed] [Google Scholar] 39. Хасегава Х., Фудзитани К., Накадзуру С., Хирао М., Ямамото К., Мита Е. и др. Критерии изменения оптимального лечения распространенного рака желудка с неизмеримыми перитонеальными метастазами: на основе симптомов / опухолевых маркеров по сравнению с КТ. Anticancer Res. 2014. 34 (9): 5169–5174. [PubMed] [Google Scholar] 40. Komatsu S, Ichikawa D, Nishimura Y, Kubota T, Okamoto K, Shiozaki A и др. Лучшие результаты за счет мониторинга динамики опухоли с использованием чувствительных онкомаркеров у пациентов с рецидивирующим раком желудка.Anticancer Res. 2013. 33 (4): 1621–1627. [PubMed] [Google Scholar] 41. Хосковец Д., Варга Дж., Конечна Э., Антос Ф. Уровни CEA и Ca 19-9 в сыворотке крови и брюшной полости у пациентов с раком желудка и поджелудочной железы. Acta Cir Bras. 2012. 27 (6): 410–416. [PubMed] [Google Scholar] 42. Ким HJ, Ли KW, Ким YJ, Oh DY, Kim JH, Im SA и др. Вызванные химиотерапией преходящие выбросы CEA и CA19-9 у пациентов с метастатическим или рецидивирующим раком желудка. Acta Oncol. 2009. 48 (3): 385–390. [PubMed] [Google Scholar] 43.Li Y, Yang Y, Lu M, Shen L. Прогностическое значение сывороточного CEA, CA19-9 и CA72.4 в ранней диагностике рецидива после радикальной резекции рака желудка. Гепатогастроэнтерология. 2011. 58 (112): 2166–2170. [PubMed] [Google Scholar] 44. Патрити А., Грациози Л., Баффа Н., Пасифико Е., Ламприни П., Валиани С. и др. Послеоперационное наблюдение за аденокарциномой желудка с неопластическими маркерами и 18-FDG-PET / TC. Ann Ital Chir. 2007. 78 (6): 481–485. [PubMed] [Google Scholar] 45. Qiu MZ, Lin JZ, Wang ZQ, Wang FH, Pan ZZ, Luo HY и др.Пороговое значение повышения уровней карциноэмбрионального антигена и углеводного антигена 19-9 для мониторинга рецидива у пациентов с резектабельной аденокарциномой желудка. Маркеры Int J Biol. 2009. 24 (4): 258–264. [PubMed] [Google Scholar]тестов на рак желудка | Диагностика рака желудка
Рак желудка (также известный как рак желудка) обычно обнаруживается, когда человек обращается к врачу из-за имеющихся у него признаков или симптомов. При подозрении на рак желудка потребуются обследования и анализы, чтобы точно выяснить это.Если рак обнаружен, могут потребоваться другие тесты, чтобы узнать о нем больше.
История болезни, медицинский осмотр и анализы на кровотечение
Изучая вашу историю болезни , врач спросит о ваших симптомах (таких как проблемы с питанием, боль, вздутие живота и т. Д.) И возможных факторах риска, чтобы узнать, могут ли они предполагать рак желудка или другую причину. Медицинский осмотр может дать вашему врачу информацию о возможных признаках рака желудка или других проблемах со здоровьем.В частности, врач будет прощупывать ваш живот на предмет каких-либо отклонений от нормы.
Врач может назначить анализ крови, чтобы выявить анемию (низкое количество красных кровяных телец), которая могла быть вызвана кровотечением из рака желудка. Также может быть проведен тест для поиска крови в стуле (фекалиях), которую нельзя увидеть невооруженным глазом, что также может быть признаком кровотечения в желудке.
Если ваш врач считает, что у вас может быть рак желудка или другой тип проблемы с желудком, он или она, скорее всего, направит вас к гастроэнтерологу (врач, который лечит заболевания пищеварительного тракта), который осмотрит вас и, возможно, проведет дальнейшее обследование. .
Верхняя эндоскопия
Верхняя эндоскопия (также называемая эзофагогастродуоденоскопия или EGD ) — это обследование, которое чаще всего проводится, если врач считает, что у вас может быть рак желудка.
Во время этого теста врач пропускает эндоскоп, который представляет собой тонкую, гибкую, освещенную трубку с небольшой видеокамерой на конце, вам в глотку. Это позволяет врачу увидеть внутреннюю оболочку пищевода, желудка и первую часть тонкой кишки.Если видны аномальные области, образцы биопсии могут быть взяты с помощью инструментов, пропущенных через эндоскоп. Образцы тканей отправляются в лабораторию, где их исследуют под микроскопом, чтобы определить, содержат ли они рак.
К сожалению, некоторые виды рака желудка трудно обнаружить при эндоскопии.
Эндоскопия также может использоваться как часть специального визуализирующего теста, известного как эндоскопическое ультразвуковое исследование , , которое описано ниже.
В некоторых случаях эндоскопия может использоваться для удаления рака на очень ранней стадии.Его также можно использовать для предотвращения или облегчения симптомов или других осложнений рака желудка без необходимости в более обширном хирургическом вмешательстве. (См. Хирургия рака желудка.)
Скорее всего, перед эндоскопией вам дадут лекарство от сонливости (седативный эффект).
Биопсия
Ваш врач может заподозрить рак, если при эндоскопии или визуализационном обследовании будет обнаружена аномально выглядящая область, но единственный способ точно определить, рак ли это, — провести биопсию.Во время биопсии врач удаляет небольшие кусочки (образцы) аномальной области.
Биопсии для проверки на рак желудка чаще всего выполняются во время эндоскопии верхних отделов желудка. Если во время эндоскопии врач видит какие-либо аномальные участки в слизистой оболочке желудка, инструменты могут быть переданы по эндоскопу для их биопсии.
Некоторые виды рака желудка могут начинаться глубоко в стенке желудка, что затрудняет их биопсию с помощью стандартной эндоскопии. Если врач подозревает, что рак может проникнуть глубже в стенку желудка, можно использовать эндоскопический ультразвук (описанный ниже), чтобы ввести тонкую полую иглу в стенку желудка для получения образца биопсии.
Биопсии также могут быть взяты из областей возможного распространения рака, таких как близлежащие лимфатические узлы или подозрительные области в других частях тела.
Исследование образцов биопсии
Образцы биопсии отправляются в лабораторию для изучения под микроскопом. Образцы проверяются, чтобы увидеть, содержат ли они рак, и если да, то какой он вид (например, кишечная или диффузная аденокарцинома, карциноидная опухоль, стромальная опухоль желудочно-кишечного тракта [GIST] или лимфома).
При обнаружении рака желудка можно провести дополнительные лабораторные исследования образцов биопсии, чтобы узнать больше о раковых клетках.Это может повлиять на лечение рака.
Тестирование HER2: Раковые клетки могут быть проверены, чтобы увидеть, не слишком ли много в них стимулирующего рост белка, называемого HER2. Раки с повышенным уровнем HER2 называются HER2-положительными . Эти виды рака можно лечить с помощью лекарств, нацеленных на белок HER2.
Образец биопсии обычно тестируется на HER2 с использованием иммуногистохимии (IHC) или флуоресцентной гибридизации in situ (FISH). Часто сначала используется тест IHC, который дает результаты по шкале от 0 до 3+.
- Если результат 0 или 1+, рак является HER2-отрицательным, поэтому лекарства, нацеленные на HER2, вряд ли помогут.
- Если тест возвращается 3+, рак является HER2-положительным, поэтому лечение препаратами, нацеленными на HER2, может быть вариантом.
- Когда результат 2+, HER2-статус рака неясен, поэтому его необходимо проверить с помощью FISH, чтобы уточнить результат.
Тестирование на другие изменения генов или белков: Раковые клетки также могут быть проверены на другие изменения генов или белков, которые могут повлиять на лечение.Например:
- Если в клетках есть определенное количество белка иммунной контрольной точки, называемого PD-L1 , лечение ингибитором иммунной контрольной точки, таким как пембролизумаб (Кейтруда), может быть вариантом.
- Если клетки имеют высокий уровень микросателлитной нестабильности (MSI-H) или дефект в гене восстановления несоответствия (dMMR) , лечение ингибитором иммунных контрольных точек может быть вариантом.
- Если клетки имеют высокое бремя мутаций опухоли (TMB-H) , что означает, что они имеют много генных мутаций, лечение ингибитором иммунных контрольных точек может быть вариантом.
- Если в клетках есть изменения в одном из генов , , NTRK, , , некоторые целевые препараты могут быть вариантом лечения.
См. Раздел «Тестирование биопсийных и цитологических образцов на рак», чтобы узнать больше о различных типах биопсий и тестов, о том, как они используются для диагностики рака и что могут сказать вам результаты.
Визуальные тесты
Визуализирующие тесты используют рентгеновские лучи, магнитные поля, звуковые волны или радиоактивные вещества для создания изображений внутренней части вашего тела.Визуализационные тесты могут проводиться по ряду причин, в том числе:
- Чтобы помочь выяснить, может ли подозрительная область быть раком
- Чтобы узнать, насколько далеко зашел рак
- Чтобы помочь определить, было ли лечение эффективным
Верхний отдел желудочно-кишечного тракта (ЖКТ), серия
Это рентгеновский тест для изучения внутренней оболочки пищевода, желудка и первой части тонкой кишки. Этот тест используется реже, чем верхняя эндоскопия, для выявления рака желудка или других проблем с желудком, поскольку он может пропустить некоторые аномальные области и не позволяет врачу брать образцы биопсии.Но он менее инвазивен, чем эндоскопия, и может быть полезен в некоторых ситуациях.
Для этого теста вы выпиваете белый меловой раствор, содержащий вещество под названием барий . Барий покрывает внутреннюю оболочку пищевода, желудка и тонкой кишки. (В это время воздух также может закачиваться в желудок через тонкую трубку.) Затем делается несколько рентгеновских снимков. Поскольку рентгеновские лучи не могут проходить через покрытие из бария, они очерчивают любые аномальные области в слизистой оболочке этих органов.
Компьютерная томография (КТ или CAT)
При компьютерной томографии используются рентгеновские лучи для получения подробных изображений поперечного сечения мягких тканей тела.
КТ может довольно четко показать желудок и часто может подтвердить местонахождение рака. КТ также может показать другие части тела, на которые мог распространиться рак желудка, например, печень и близлежащие лимфатические узлы. Это может помочь определить степень (стадию) рака и то, может ли операция стать хорошим вариантом лечения.
Игольная биопсия под контролем КТ: КТ-сканирование также может использоваться для направления иглы для биопсии в предполагаемую область распространения рака. Для этого теста вы будете лежать на столе для компьютерной томографии, а врач проведет иглой для биопсии через кожу в направлении массы. КТ повторяется до тех пор, пока игла не окажется внутри массы. Затем образец биопсии удаляется и отправляется в лабораторию для тестирования.
Эндоскопическое УЗИ
Эндоскопическое ультразвуковое исследование (ЭУЗИ) часто используется для определения степени распространения рака на стенку желудка, на близлежащие области или близлежащие лимфатические узлы.
Для этого теста на кончик эндоскопа помещается небольшой ультразвуковой датчик. Пока вы находитесь под действием седативных препаратов, эндоскоп проходит по горлу в желудок. Зонд прикладывают к стенке желудка, где находится рак. Он излучает звуковые волны и обнаруживает отраженное эхо, которое затем преобразуется в изображения. Врачи могут использовать эти изображения, чтобы изучить слои стенки желудка, а также близлежащие лимфатические узлы и другие структуры за пределами желудка.
EUS также можно использовать для ввода иглы в подозрительную область для получения образца биопсии (известная как игла для биопсии под контролем EUS ).
Позитронно-эмиссионная томография (ПЭТ) сканирование
ПЭТ-сканирование может быть полезно для определения степени рака в организме. Для этого теста вам вводят слегка радиоактивную форму сахара, которая накапливается в основном в раковых клетках. Затем используется специальная камера для создания изображения радиоактивных участков тела.Изображение не детализировано, как при КТ или МРТ, но ПЭТ позволяет выявить возможные области рака, распространяющиеся сразу на все части тела.
Многие новые аппараты могут одновременно выполнять и ПЭТ, и компьютерную томографию (ПЭТ / КТ). Это позволяет врачу более подробно увидеть области, которые «светятся» на ПЭТ-сканировании.
Несмотря на то, что ПЭТ-сканирование может быть полезно для обнаружения областей распространения рака, оно не всегда помогает при определенных видах рака желудка, поскольку некоторые виды не поглощают много радиоактивного сахара.
Магнитно-резонансная томография (МРТ)
Как и компьютерная томография, МРТ может показать подробные изображения мягких тканей тела. Но в МРТ вместо рентгеновских лучей используются радиоволны и сильные магниты.
Этот тест не используется так часто, как компьютерная томография, для выявления рака желудка, но он может быть полезен в определенных ситуациях, например, при поиске опухолей в печени.
Рентген грудной клетки
Этот тест может помочь определить, распространился ли рак на легкие. Его также можно использовать, чтобы определить, есть ли у человека серьезные заболевания легких или сердца, которые могут повлиять на то, будет ли операция вариантом лечения.Рентген грудной клетки не требуется, если была сделана компьютерная томография грудной клетки.
Дополнительную информацию о тестах на визуализацию можно найти в разделе «Визуализирующие (радиологические) тесты на рак».
Прочие испытания
Лапароскопия
Если рак желудка уже обнаружен, а визуализирующие исследования, такие как компьютерная томография или ПЭТ, не показали, что он распространился на другие части тела, врачи могут провести лапароскопию перед любой другой операцией. Это может помочь подтвердить, что рак все еще находится только в желудке, а это означает, что операция по его удалению все еще может быть вариантом.
Эта процедура проводится в операционной, когда вы находитесь под общим наркозом (в глубоком сне). Лапароскоп (тонкая гибкая трубка с маленькой видеокамерой на конце) вводится через небольшой разрез на животе. Это позволяет врачу внимательно изучить поверхности органов и близлежащие лимфатические узлы внутри брюшной полости или даже удалить небольшие образцы ткани, которые затем могут быть проверены на рак.
Если не похоже, что рак распространился, врач иногда «промывает» брюшную полость физиологическим раствором (соленой водой).Это называется промывание брюшины . Затем жидкость собирается и проверяется на наличие раковых клеток.
Иногда лапароскопию сочетают с ультразвуком, чтобы лучше понять рак.
Тесты функции органов
Если обнаружен рак, врач может порекомендовать определенные лабораторные анализы, особенно если возможно хирургическое вмешательство. Например, будут сданы анализы крови, чтобы убедиться, что ваша печень и почки работают нормально и что ваша кровь нормально свертывается.
Если планируется операция или вы собираетесь получать лекарства, которые могут повлиять на сердце, вам также могут сделать электрокардиограмму (ЭКГ) и / или эхокардиограмму (УЗИ сердца), чтобы убедиться, что ваше сердце работает нормально.
Прогностическое значение онкомаркеров при раке желудка Т4а | World Journal of Surgical Oncology
Основными результатами этого исследования были: (1) опухолевые маркеры, включая CEA, CA19-9 и CA50, были независимыми прогностическими факторами для рака желудка на стадии T4a; и (2) были значительные различия в общей 5-летней выживаемости между CEA (+) и CEA (-) в соответствии со стадиями II и III; между CA19-9 (+) и CA19-9 (-) согласно стадии III; между СА50 (+) и СА50 (-) согласно стадии III.
Различные опухолевые маркеры были идентифицированы с тех пор, как Голд и Фридман впервые сообщили об открытии карциноэмбрионального антигена (РЭА) в 1965 году [14]. Эти опухолевые маркеры изучались в первую очередь на предмет применимости и осуществимости с точки зрения раннего обнаружения опухолей. Среди этих опухолей AFP, CEA, CA19-9, CA50 и CA72-4 считались относительно специфическими маркерами рака желудка. В частности, CA 72-4 считался одним из наиболее специфичных и чувствительных маркеров рака желудка.Однако в качестве ретроспективного исследования мы могли оценить только прогностическую ценность AFP, CEA, CA19-9 и CA50 для рака желудка, которые оценивались в нашем институте. В нескольких исследованиях изучали значение различных онкомаркеров, включая CEA, CA19-9 и CA50, при раке желудка [21–23]. Некоторые отчеты показали, что один или несколько опухолевых маркеров могут предсказать конкретные клинические исходы, такие как прогноз, ответ на лечение и рецидив, хотя результаты не были согласованными. Кроме того, этим исследованиям противодействовали несколько методологических недостатков: (1) включение пациентов с различными стадиями опухоли от локализованной до метастатической; и (2) гетерогенная схема лечения.Поэтому необходимо уточнить значение онкомаркеров в однородной группе больных раком желудка.
Мы оценивали только пациентов с раком желудка T4a N0-3 M0, которым была сделана гастрэктомия D2. Причины включения только рака желудка T4a следующие: (1) Было проведено несколько исследований прогностического влияния опухолевых маркеров при раке желудка, но в предыдущих исследованиях редко оценивалось прогностическое влияние опухолевых маркеров при определенной глубине инвазии. , особенно в классификации T4a, на которую приходится более 40% случаев рака желудка.Следовательно, точное определение прогностической ценности онкомаркеров при раке желудка T4a имеет важное клиническое значение. (2) Поскольку некоторые предыдущие исследования показали связь между глубиной инвазии опухоли и уровнями сывороточных опухолевых маркеров [24, 25], было трудно идентифицировать важные прогностические факторы как результат взаимосвязанных факторов. В каждом случае было рассмотрено 15 или более лимфатических узлов в соответствии с классификацией AJCC / TNM. В этом исследовании процент положительных результатов у пациентов с повышенным уровнем сывороточного АФП составил 5.9%, что было аналогично данным других исследователей [12, 24, 26]. Частота положительных результатов CEA и CA19-9 составила 16,1% и 32,6% соответственно, что ниже, чем в других исследованиях [27, 28]. Соответствующая доля пациентов с повышенным уровнем СА50 в сыворотке составила 29,7%. Считается, что на положительные показатели опухолевых маркеров влияет прогрессирование опухоли во время презентации. Когда сывороточные положительные уровни AFP, CEA, CA19-9 и CA50 были оценены в соответствии с группировкой стадий TNM, это показало, что положительные показатели постепенно увеличивались со стадией.
Мы сравнили другие клинико-патологические факторы у пациентов с повышенным уровнем опухолевых маркеров и пациентов с нормальным уровнем сывороточных опухолевых маркеров. Доля пациентов с повышенным уровнем АФП в сыворотке была значительно выше среди пациентов с Bormmann IV. Повышенный уровень CEA в сыворотке был связан с полом, локализацией опухоли и стадией pN. Повышенный уровень CA19-9 в сыворотке был связан с возрастом, локализацией опухоли, лимфоваскулярной инвазией и стадией pN. Положительность CA50 была достоверно связана с возрастом, размером опухоли, локализацией опухоли и стадией pN.Мы обнаружили, что эти опухолевые маркеры были связаны со стадией pN. Это открытие показало, что количество положительных опухолевых маркеров увеличивалось по мере прогрессирования опухоли. Это согласуется с предыдущими исследованиями AFP, CEA и CA19-9 [25, 26]. Кроме того, мы обнаружили, что частота положительных результатов CEA была выше у мужчин, чем у женщин, что не соответствовало некоторым предыдущим исследованиям [26, 29]. Возможно, ограниченные выборки в этих исследованиях способствовали отрицательной корреляции между СЕА и полом.Этот результат показал, что сывороточный CEA следует исследовать у пациентов с раком желудка, особенно у пациентов мужского пола.
Согласно одномерному анализу, наши результаты показали, что существует значительная разница в общей 5-летней выживаемости с точки зрения онкомаркеров и различных клинико-патологических факторов, которые включали возраст, размер опухоли, локализацию опухоли, тип Бормана, стадию лимфатического узла, нервную систему. инвазия и лимфоваскулярная инвазия. Мы обнаружили, что уровни AFP, CEA, CA19-9 и CA50 в сыворотке достоверно коррелировали с выживаемостью у пациентов с раком желудка на стадии T4a, что согласуется с предыдущими исследованиями AFP, CEA и CA19-9 [25, 26, 29].Эти корреляции показали, что пациенты с положительными значениями онкомаркеров имеют худший прогноз, что, в свою очередь, может быть связано с преобладающей долей распространенного рака желудка в этой группе пациентов.
Многомерный анализ с использованием модели пропорциональных рисков Кокса показал, что опухолевые маркеры, включая CEA, CA19-9, CA50, были независимыми прогностическими факторами, такими как размер опухоли, стадия лимфатического узла и нервная инвазия. Регрессионный анализ пропорциональных рисков Кокса показал, что пациенты с повышенными уровнями СЕА, СА19-9 и СА50 имели более высокий риск смерти, чем пациенты с низкими уровнями этих маркеров.За исключением CA50, прогностическое значение CEA и CA19-9 при раке желудка было широко изучено. Токчи и др. . [30] обнаружили, что CEA и CA19-9 обеспечивают независимую прогностическую ценность у пациентов с раком желудка, но другие исследования не показали стойких результатов [26, 29]. Вероятно, это было связано с неоднородностью пациентов, включенных в эти исследования, в том числе пациентов с локализованным заболеванием, перенесших гастрэктомию, и пациентов с местнораспространенным и диссеминированным заболеванием, которым может не проводиться резекция.
Чтобы оценить, могут ли сывороточные CEA, CA19-9 и CA50 предоставить дополнительную прогностическую информацию на основе системы стадий AJCC / TNM, мы сравнили кумулятивные кривые выживаемости в соответствии с CEA, CA19-9 и CA50. Результаты показали, что существуют значительные различия между пациентами с повышенными уровнями и пациентами с нормальными уровнями СЕА, СА19-9 и СА50 в сыворотке на стадии III. Эти данные показали, что сывороточные уровни CEA, CA19-9 и CA50 могут предоставить дополнительную прогностическую информацию у части пациентов с раком желудка на стадии T4a.Аналогичные результаты у пациентов с раком желудка были получены и другими исследователями. В предыдущем исследовании сообщалось, что выживаемость пациентов с раком желудка на стадиях I, II и III с повышенным уровнем СЕА в сыворотке была значительно ниже, чем у пациентов с нормальным уровнем [31]. В другом исследовании сообщалось о значительных различиях между пациентами с повышенным уровнем CA19-9 и пациентами с нормальным уровнем на стадии I [23]. Причина, по которой предоперационные уровни онкомаркеров могут влиять на длительную выживаемость рака желудка T4a, все еще не ясна; возможно, здесь задействован ряд биологических факторов.CEA и CA19-9 принадлежали к молекулам межклеточной адгезии, поэтому клетки, экспрессирующие эти гликопротеины, могут иметь больший инвазивный потенциал [8]. CA50 действует как своего рода гликолипидный антиген, который играет роль в росте и дифференцировке клеток, что позволяет предположить, что клетки, экспрессирующие этот антиген, будут обладать повышенной пролиферативной активностью [16].
Следует отметить некоторые ограничения этого исследования. Во-первых, мы оценивали только пациентов с раком желудка T4a N0-3 M0. Несмотря на то, что это план исследования, только включение рака желудка на стадии T4a ограничит применение результатов к ранней стадии или более неблагоприятной средней стадии рака желудка.Во-вторых, CA72-4 не подвергался рутинным испытаниям на рак желудка до 2005 года в нашей больнице, поэтому его значение для прогнозирования рака желудка неизвестно. В-третьих, из-за неполных данных о рецидивах было невозможно оценить корреляцию между маркерами опухолей и рецидивом. В-четвертых, мы не смогли определить прогностическую ценность цитологии брюшины в нашем исследовании, потому что мы не проводили цитологию брюшины при лечении рака желудка. Следовательно, это могло повлиять на данные о выживаемости.Кроме того, некоторые другие молекулярные маркеры, такие как внеклеточная ДНК (вкДНК) и миРНК, должны быть исследованы в будущем. Предыдущие исследования продемонстрировали увеличение циркулирующей вкДНК при различных типах рака [32]. МикроРНК (миРНК) играет важную роль в регуляции экспрессии генов. Чен и др. [33] обнаружили, что паттерн экспрессии сывороточной miRNA изменялся в зависимости от различных заболеваний.
Клиническая эффективность CEA, CA19-9, CA15-3, CA125 и AFP при раке желудочно-кишечного тракта с использованием анализов на основе LOCI ™
Реферат
Предпосылки / цель: Доступно мало данных о клинических характеристиках опухоли на основе LOCI ™ маркерные анализы.Мы исследовали диагностическую способность канцерогенного антигена, углеводного антигена 19-9, углеводного антигена 15-3, углеводного антигена 125 и альфа-фетопротеина для выявления рака желудочно-кишечного тракта (ЖКТ). Пациенты и методы. Мы проанализировали сыворотки 204 пациентов (107 с раком желудочно-кишечного тракта, 73 с доброкачественными заболеваниями желудочно-кишечного тракта и 24 здоровых пациента) с использованием анализатора Dimension ™ Vista1500. Результаты. Уровни биомаркеров у здоровых контрольных пациентов были в ожидаемых пределах и были лишь немного выше в контрольных группах доброкачественных заболеваний ЖКТ.Установленные маркеры, связанные с типом опухоли, были повышены при определенных типах рака и хорошо различались между раковыми и доброкачественными контролями. Лучшая эффективность была обнаружена для CEA при колоректальном раке (площадь под кривой = 0,84, чувствительность = 51,7% при 95% специфичности по сравнению с доброкачественным), CA19-9 при раке желчного пузыря / поджелудочной железы (AUC = 0,85, чувствительность = 60,6%) и AFP. при раке печени (AUC = 0,87, чувствительность = 68,4%). Заключение. Наше исследование продемонстрировало высокую диагностическую силу известных биомаркеров. Анализы опухолевых маркеров на основе LOCI ™ дают надежные результаты в повседневной диагностике.
По оценкам, в 2012 году во всем мире было зарегистрировано 14 миллионов новых случаев рака, из которых более 8 миллионов умерли от рака (1). Среди впервые выявленных солидных опухолевых заболеваний большое количество приходилось на рак желудочно-кишечного тракта. Из них, в порядке убывания их заболеваемости во всем мире, 1,36 миллиона были колоректальным раком, затем 952000 — раком желудка, 782000 — раком печени и 456, 100 — раком пищевода, а оценочная заболеваемость раком поджелудочной железы составила 338000 (2). Несмотря на улучшения в диагностике и терапии рака желудочно-кишечного тракта, уровень смертности остается высоким (3).Уровень смертности во всем мире был в порядке убывания: 746 000 от рака печени, 723 000 от рака желудка, 694 000 от колоректального рака, 400 000 от рака пищевода и 330 000 от рака поджелудочной железы (2).
Определение уровней определенных опухолевых маркеров в сыворотке имеет фундаментальное значение например, в области скрининга, диагностики, контроля терапии и мониторинга запущенных заболеваний при раке желудочно-кишечного тракта (4). При колоректальном раке канцерогенный антиген (CEA) имеет прогностическое значение, при этом более высокие уровни CEA, по-видимому, связаны с более плохим исходом в предоперационных условиях (5).Кроме того, КЭА имеет диагностическую ценность при послеоперационном наблюдении и раннем выявлении рецидивов заболевания (4). Для целей скрининга нельзя использовать CEA из-за его низкой чувствительности на ранних стадиях рака и низкой частоты рака в бессимптомных популяциях (6). Хотя CEA является важным опухолевым маркером при колоректальном раке, его уровни в сыворотке также могут быть повышены при доброкачественных заболеваниях (7). При раке печени альфа-фетопротеин (AFP) может использоваться в качестве маркера скрининга у пациентов с высоким риском развития гепатоцеллюлярной карциномы, до операции для оценки прогноза, для послеоперационного мониторинга, а также в качестве онкомаркера для мониторинга запущенного заболевания.Важно, что уровень АФП может повышаться не только при гепатоцеллюлярной карциноме, но и при других доброкачественных заболеваниях и злокачественных новообразованиях (8). При раке желудка не рекомендуется использовать онкомаркеры для скрининга или диагностики. (8). При раке поджелудочной железы CA19-9 является хорошо зарекомендовавшим себя опухолевым маркером (9, 10) и остается золотым стандартом опухолевого маркера при последующем наблюдении после операции. Роль CA19-9 в диагностике рака поджелудочной железы остается неясной (11). CA19-9 часто повышается при запущенных злокачественных новообразованиях желудочно-кишечного тракта, но также и при доброкачественных заболеваниях желудочно-кишечного тракта (12, 13).Следует отметить, что CA19-9 не экспрессируется у лиц с фенотипом Льюиса (a-b-), поэтому у этих пациентов требуются другие опухолевые маркеры (14).
Когда разрабатываются новые методы измерения онкомаркеров, все важные руководящие принципы рекомендуют сравнение методов и клиническую оценку. Даже если два метода определения опухолевых маркеров достаточно хорошо коррелируют друг с другом, у отдельных пациентов или подгрупп могут наблюдаться совершенно разные значения. В более раннем исследовании мы показали, что хемилюминесцентные анализы по сравнению с анализами опухолевых маркеров на основе люминесцентного иммуноанализа с канализацией кислорода (LOCI ™) показали хорошую общую корреляцию для опухолевых маркеров AFP, CEA, CA15-3, простатоспецифического антигена (PSA), CA19-9 и углеводный антиген (CA125).Однако для CA15-3 и CA19-9 были обнаружены большие вариации (15, 16). Таким образом, необходимы дальнейшие исследования для оценки клинической эффективности этих анализов опухолевых маркеров. Чтобы ответить на важные клинические вопросы, больных раком необходимо сравнивать не только со здоровыми людьми из контрольной группы, но и с пациентами с доброкачественными заболеваниями. Несмотря на то, что существует множество опубликованных исследований, посвященных оценке онкомаркеров при желудочно-кишечных заболеваниях, было проведено мало исследований относительно клинической эффективности анализов опухолевых маркеров на основе LOCI ™ при раке желудочно-кишечного тракта.Анализы опухолевых маркеров на основе LOCI ™ представляют собой гомогенные сэндвич-хемилюминесцентные иммуноанализы, которые считаются несколько менее специфичными из-за пропуска стадии промывки. Поэтому возникает вопрос, являются ли эти гомогенные анализы такими же хорошими, как установленные гетерогенные анализы.
Целью настоящего исследования было заполнить этот пробел путем изучения диагностической силы основанных на LOCI ™ анализов на онкомаркеры CEA, CA19-9, CA15-3, CA125 и AFP у пациентов с раком желудочно-кишечного тракта по сравнению со здоровыми людьми из контрольной группы. и пациенты с доброкачественными заболеваниями желудочно-кишечного тракта.
Пациенты и методы
Пациенты. Всего в настоящее исследование было включено 204 пациента. Среди них было 24 здоровых человека, 73 пациента с доброкачественными желудочно-кишечными заболеваниями (, например, дивертикулит, болезнь Крона, колит, аденома прямой кишки, гастрит, диафрагмальная грыжа, холецистит и панкреатит) и 107 пациентов с раком желудочно-кишечного тракта (35 колоректального рака, 33 поджелудочной железы / рак желчного пузыря, 19 рака печени и 20 рака пищевода / желудка).Соотношение мужчин и женщин, средний возраст и диапазон всех включенных пациентов показаны в таблице I.
Все венозные пункции для сбора сыворотки проводились в активной фазе заболевания до начала какой-либо терапии. Все пациенты и здоровые люди дали свое информированное согласие на забор крови. Образцы были собраны в биобанке биожидкостей при университетской клинике Бонна в Институте клинической химии и клинической фармакологии. Исследование, связанное с использованием человеком, соответствовало всем соответствующим национальным нормам, институциональной политике и принципам Хельсинкской декларации и было одобрено местным комитетом по этике (номер одобрения: 319-12).
Процесс обработки крови включал немедленную доставку в центральную лабораторию университетской клиники Бонна с последующим центрифугированием (3300 × г ) в течение 10 мин. Образцы сыворотки первоначально хранили при 4 ° C. После этого их аликвотировали в полипропиленовые флаконы и хранили при -80 ° C. Все образцы были анономизированы дважды.
Таблица I.Характеристики пациентов. Включены абсолютное количество пациентов, соотношение мужчин и женщин, средний возраст и диапазон здоровых людей, а также лица с доброкачественными заболеваниями желудочно-кишечного тракта (ЖКТ), раком печени, раком желчного пузыря / поджелудочной железы, колоректальным раком и раком пищевода / желудка.
Методы. Были собраны образцы крови и определены опухолевые маркеры желудочно-кишечного тракта. Определение CEA, CA19-9, CA15-3, CA125 и AFP выполняли с помощью анализов опухолевых маркеров на основе LOCI ™ для анализатора Dimension ™ Vista 1500 (Siemens Healthcare Diagnostics, Эшборн, Германия). Технология LOCI ™ работает с сэндвич-хемилюминесцентным иммуноанализом. Chemibeads содержат хемилюминесцентный краситель, а sensibeads — фотосенсибилизирующий краситель. Через биотинилированные антитела как антитела, так и химические соединения образуют бутерброды.Иммунокомплексы образуются при дальнейшем добавлении сенсибилидов. При 680 нм запускается хемилюминесцентная реакция, и в конечном итоге конечный сигнал обнаруживается при 612 нм (согласно инструкциям производителя). Анализы опухолевых маркеров на CEA, CA19-9, CA15-3, CA125 и AFP для анализатора Dimension ™ Vista 1500 были частью стандартных методов Центральной лаборатории университетских клиник Бонна. Следовательно, требования к точности внутреннего и внешнего контроля качества выполнялись в соответствии с рекомендациями Федерального медицинского общества Германии (RiliBÄK) (17).Предел обнаружения (LoD) и предел холостого опыта (LoB) были следующими: CEA: 0,2 и 0,12 нг / мл, CA19-9: 2,0 и 1,0 Ед / мл, CA15-3: 1,0 и 0,3 Ед / мл, CA125. : 1,5 и 0,5 Ед / мл и АФП: 0,5 и 0,2 нг / мл соответственно.
Статистический анализ. Данные были статистически проанализированы с использованием IBM SPSS Statistics, версия 20 (IBM Corp., Армонк, Нью-Йорк, США). Статистически значимым считалось значение p <0,05. Медиана, диапазон и 95-й процентиль были рассчитаны для всех групп.Различия между коллективами рассчитывались с помощью критериев Вилкоксона. Коробчатые диаграммы отображают распределения значений различных онкомаркеров. Кривые рабочих характеристик приемника (ROC) показывают диагностическую мощность CEA, CA19-9, CA15-3, CA125 и AFP. Площадь под кривыми ROC (AUC) и чувствительность при 95% -ной специфичности были вычислены: против здоровых контролей и против доброкачественных пациентов с желудочно-кишечными заболеваниями.
Результаты
Описательные данные для здоровых людей и пациентов с доброкачественными заболеваниями, а также пациентов с различными подгруппами рака желудочно-кишечного тракта показаны в таблице II.У здоровых людей значения AFP, CA125, CA15-3, CA19-9 и CEA были в пределах ожидаемого диапазона, в то время как у людей с доброкачественными заболеваниями. желудочно-кишечные заболевания, были получены несколько более высокие значения AFP, CA125, CA15-3, CA19-9 и CEA (см. рисунок 1). Отдельные пациенты с сильно повышенным уровнем онкомаркеров СА125 и СА19-9 страдали гепатитом С с циррозом печени.
Таблица II.Медиана, диапазон и 95-й перцентили (95%) показаны для сывороточных уровней альфа-фетопротеина (AFP), углеводного антигена 12-5 (CA125), углеводного антигена 15-3 (CA15-3), углеводного антигена 19-9 ( CA19-9) и карциноэмбриональный антиген (CEA) у здоровых людей, пациентов с доброкачественными желудочно-кишечными заболеваниями, с раком печени, раком желчного пузыря / поджелудочной железы, колоректальным раком и раком пищевода / желудка.
Рак печени. По сравнению со здоровым контролем, пациенты с раком печени имели значительно более высокие уровни, особенно AFP ( p <0,001), но также CA19-9 ( p <0,001), CEA ( p = 0,002), CA125 ( p = 0,004) и CA15-3 ( p = 0,044). Кроме того, у пациентов с раком печени по сравнению с пациентами с доброкачественными заболеваниями желудочно-кишечного тракта уровень АФП был значительно выше ( p <0,001) и CA19-9 ( p = 0.025) (рисунок 1).
Что касается выделения пациентов с раком печени из контрольных групп, то лучшая диагностическая эффективность была достигнута для AFP ( против здоровых контролей: AUC = 0,88, с чувствительностью 73,7% при 95% специфичности; против доброкачественных желудочно-кишечных заболеваний: AUC = 0,87, чувствительность 68,4% при специфичности 95%) (рис. 2).
Рак желчного пузыря / поджелудочной железы. По сравнению со здоровым контролем, пациенты с раком желчного пузыря / поджелудочной железы имели значительно более высокие уровни CA19-9 ( p <0.001), но также и CEA ( p ≤0,001), CA125 ( p <0,001) и CA15-3 ( p = 0,018). Кроме того, уровни CA19-9 ( p <0,001) и CEA ( p = 0,012) были значительно выше у пациентов с раком желчного пузыря / поджелудочной железы, чем у пациентов с доброкачественными желудочно-кишечными заболеваниями (Рисунок 1).
Что касается выделения пациентов с раком желчного пузыря / поджелудочной железы из контрольных групп, наилучшая диагностическая эффективность была достигнута для CA19-9 ( vs. здоровых контроля: AUC = 0,93, чувствительность 81,8% при специфичности 95%; против доброкачественных желудочно-кишечных заболеваний: AUC = 0,85, с чувствительностью 60,6% при специфичности 95%) (рис. 2).
Колоректальный рак. По сравнению со здоровым контролем, пациенты с колоректальным раком имели особенно значительно более высокие уровни CEA ( p <0,001) и CA19-9 ( p <0,001). Значения AFP, CA125 и CA15-3 не были значительно выше. По сравнению с пациентами с доброкачественными желудочно-кишечными заболеваниями, пациенты с колоректальным раком имели только значительно более высокие уровни СЕА ( p <0.001) и CA19-9 ( p = 0,004) (рисунок 1).
Что касается выделения пациентов с колоректальным раком из контрольных групп, то лучшая диагностическая эффективность была достигнута для CEA ( против здоровых контролей: AUC = 0,89, с чувствительностью 80,00% при 95% специфичности; против доброкачественных желудочно-кишечных заболеваний: AUC = 0,84, с чувствительностью 51,7% при% специфичности) (рис. 2).
Рак пищевода / желудка. По сравнению со здоровым контролем, пациенты с раком пищевода / желудка имели значительно более высокие уровни CEA ( p = 0.001) и CA19-9 ( p <0,001). Однако не было значительных различий по какому-либо из опухолевых маркеров между пациентами с раком пищевода / желудка и доброкачественными желудочно-кишечными заболеваниями (рис. 1).
Обсуждение
Полезность определения онкомаркера в сыворотке крови в клинической диагностике была показана для многих различных форм рака (18, 19). Определение опухолевых маркеров, связанных с типом опухоли, рекомендовано в опубликованных рекомендациях (4, 8).При изменении методов обнаружения онкомаркеров принципиально важно для клинической оценки проводить параллельные сравнительные измерения. Таким образом, в настоящем исследовании мы исследовали диагностическую силу CEA, CA19-9, CA15-3, CA125 и AFP у пациентов с раком желудочно-кишечного тракта по сравнению со здоровыми людьми контрольной группы и доброкачественными желудочно-кишечными заболеваниями в качестве релевантной группы для дифференциальной диагностики.
В наших предыдущих исследованиях мы показали, что уровни регрессии между хемилюминесцентным анализом и анализом опухолевых маркеров на основе LOCI ™ были приемлемыми, но показали незначительные различия в подгруппы пациентов e.грамм. для AFP (15, 16). Основное различие в методике гомогенных LOCI ™ -исследований заключается в том, что пропускается одна стадия промывки, что может повлиять на специфичность в более низких диапазонах. Что касается эффективности анализов на основе LOCI ™, Peake et al. показал, что для N-концевого натрийуретического белка про-B-типа не было обнаружено значительных различий между концентрациями в сыворотке при сравнении метода Dimension Vista LOCI ™ с Siemens Immulite 2500 (20). Для сердечного тропонина I была обнаружена приемлемая аналитическая производительность метода LOCI ™ на Dimension EXL (Siemens Healthcare Diagnostics) (21).Оценка аналитических характеристик CA19-9 с использованием иммуноанализов, не основанных на LOCI ™, выявила минимальные различия в наклонах и пересечениях при сравнении двух разных иммуноанализов; хорошая корреляция была показана для всех пациентов в их коллективе (22). Кроме того, для CA15-3 аналитический производительность была точной, но не оптимальной, и была обнаружена разница в наклоне на 20-40% более низких концентраций для применяемого метода (23). Анализируя аналитические характеристики CA125, сообщалось об отличной корреляции и лишь минимальных различиях в наклонах и пересечениях (24).Мы пришли к выводу, что аналитические проблемы и ограничения видны для большинства различных методов, применяемых в рутинном измерении онкомаркеров. Чтобы достичь высокой диагностической мощности, в нашем исследовании сравнивали не только здоровых людей из контрольной группы и пациентов с опухолями, но и пациентов с доброкачественными желудочно-кишечными заболеваниями, которые имеют огромное диагностическое значение (25, 26). Мы показали, что анализы опухолевых маркеров на основе LOCI ™ правильно выявляли нашу здоровую контрольную группу. Эти результаты соответствовали контрольным данным по здоровью, представленным производителем.В соответствии с предыдущими результатами, наше исследование также показало, что многие маркеры хорошо различаются между здоровыми контрольными пациентами и пациентами с раком желудочно-кишечного тракта, но только маркеры, связанные с типом опухоли, различают доброкачественные контрольные группы и пациентов с раком (4, 27).
Рисунок 1.Неровные и квадратные диаграммы для сывороточного карциноэмбрионального антигена (CEA), углеводного антигена 19-9 (CA19-9), углеводного антигена 15-3 (CA15-3), углеводного антигена 125 (CA125) и альфа-фетопротеина (AFP). ) значения в разных диагностических группах.p-значения были рассчитаны с помощью тестов Вилкоксона. Столбцы представляют собой медиану, прямоугольные диаграммы показывают межквартильный диапазон, а усы показывают крайние верхние и нижние значения. Сравнение (Comp) показано для различения от других групп. GI: желудочно-кишечный тракт, CA: рак, Dis: болезни, Eso: пищевод, Gall: желчный пузырь.
Рис. 2. Кривые рабочих характеристик приемникаи площади под кривой (AUC) для различения пациентов с опухолями желудочно-кишечного тракта и здоровых людей из контрольной группы и пациентов с доброкачественными желудочно-кишечными заболеваниями с использованием сывороточного альфафетопротеина (AFP), углеводного антигена 125 (CA125), углеводов антиген 15-3 (CA15-3), углеводный антиген 19-9 (CA19-9) и карциноэмбриональный антиген (CEA) при раке печени, раке желчного пузыря / поджелудочной железы, колоректальном раке, раке пищевода / желудка.
CA19-9 имеет чувствительность 70-80% при раке поджелудочной железы (независимо от дифференцировки опухоли) (28). Мы показали, что при раке поджелудочной железы и желчного пузыря лучшая диагностическая мощность была достигнута с помощью CA19-9 с AUC 0,85 и чувствительностью 60,6% при 95% специфичности против доброкачественных желудочно-кишечных заболеваний. Эти результаты согласуются с более ранним исследованием рака поджелудочной железы, которое описало AUC 0,827 (чувствительность 53,2% при 95% специфичности) и 0,850 (чувствительность 58.1% при 95% специфичности) при сравнении их с доброкачественными желудочно-кишечными заболеваниями с использованием монитора Access ™ GI Monitor и Elecsys ™ CA19-9 (22). При колоректальном раке лучшая эффективность была достигнута с помощью CEA с AUC 0,84 и чувствительностью 51,7% при 95% специфичности по сравнению с доброкачественными желудочно-кишечными заболеваниями. В другом исследовании сообщалось о AUC 0,79 и чувствительности 64,5% CEA при сравнении колоректального рака с доброкачественными колоректальными заболеваниями (29). При раке печени мы показали, что AFP с AUC 0.87 и чувствительность 68,4% при 95% специфичности против доброкачественных желудочно-кишечных заболеваний показали наилучшие результаты. AFP обладает высокой специфичностью в отношении гепатоцеллюлярной карциномы. В частности, у пациентов с доброкачественными заболеваниями печени, такими как цирроз печени и хронический гепатит, AFP используется в качестве инструмента скрининга гепатоцеллюлярной карциномы (28). Следовательно, очень важно посмотреть на различительную способность используемого анализа по сравнению с доброкачественными заболеваниями. При раке пищевода и желудка не было обнаружено ни одного маркера с высокой диагностической силой.Это соответствовало другим исследованиям (22-24). У пациентов, страдающих гепатитом С с циррозом печени, были измерены единичные повышенные опухолевые маркеры. Более ранние результаты говорят о повышенных уровнях , например. CA125 и CA19-9 из-за выпота или холестаза (30, 31).
В настоящем исследовании мы соблюдали требования к оценке клинических маркеров опухолей, предложенные Европейской группой по маркерам опухолей, включив образцы от пациентов с раком, здоровых людей из контрольной группы и доброкачественных заболеваний, связанных с органами, в качестве соответствующих групп для дифференциальной диагностики.Для достижения диагностических настроек в реальном времени образцы были измерены в обычных условиях, включая преаналитическую обработку, а также внутренний и внешний контроль качества. Тем не менее, образцы были собраны стандартизованным образом в биобанке биожидкостей университета и проанализированы партиями для исследовательских целей.
Хотя количество образцов в настоящем исследовании ограничено, мы оценили все доступные маркеры на основе LOCI ™ в наших условиях и подтвердили более ранние результаты, полученные с помощью других методов.
В нашем исследовании мы оценили клиническую эффективность основанных на LOCI ™ анализов на онкомаркеры CEA, CA19-9, CA15-3, CA125 и AFP у пациентов с раком желудочно-кишечного тракта и продемонстрировали их высокую диагностическую эффективность.Анализы опухолевых маркеров на основе LOCI ™ дают надежные результаты в повседневной диагностике.
- Получено 15 ноября 2016 г.
- Исправление получено 9 декабря 2016 г.
- Принято 16 декабря 2016 г.
- Copyright © 2017 Международный институт противораковых исследований (доктор Джон Г. Делинассиос), Все права защищены
Обычные онкомаркеры
Онкомаркер — это все, что присутствует в раковых клетках или других клетках организма или вырабатывается ими в ответ на рак или определенные доброкачественные (доброкачественные) состояния, которые предоставляют информацию о раке, например, насколько он агрессивен, можно ли его лечить с помощью таргетная терапия, или реагирует ли она на лечение.См. Информационный бюллетень по опухолевым маркерам для получения дополнительной информации.
Ниже перечислены опухолевые маркеры, которые широко используются, в основном, для определения лечения или для постановки диагноза рака. Новые опухолевые маркеры часто становятся доступными и не могут быть отражены в этом списке.
В этот список не включены многие опухолевые маркеры, которые тестируются с помощью иммунофенотипирования и иммуногистохимии, чтобы помочь диагностировать рак и различать различные типы рака. Некоторые опухолевые маркеры, перечисленные ниже, являются мишенями для таргетной терапии при множественных формах рака, но служат онкомаркерами только для подгруппы видов рака.
Перестройки и сверхэкспрессия гена ALK
Типы рака или раковые состояния: Немелкоклеточный рак легкого, анапластическая крупноклеточная лимфома, гистиоцитозы
Что анализировали: Опухоль
Как использовали: Для определения лечения и прогноза
Альфа-фетопротеин (AFP)
Типы рака: Рак печени и опухоли половых клеток
Что проанализировано: Кровь
Как используется: Для диагностики рака печени и отслеживания реакции на лечение; для оценки стадии, прогноза и ответа на лечение опухолей половых клеток
Перестройка гена В-клеточного иммуноглобулина
Тип рака: B-клеточная лимфома
Что анализировали: Кровь, костный мозг или опухолевая ткань
Как использовалось: Для помощи в диагностике, оценки эффективности лечения и проверки на рецидив
BCL2 генная реаранжировка
Типы рака: Лимфомы, лейкемии
Что анализируется: Кровь, костный мозг или опухолевые ткани
Как используется: Для диагностики и планирования терапии
Бета-2-микроглобулин (B2M)
Типы рака: Множественная миелома, хронический лимфолейкоз и некоторые лимфомы
Что анализировали: Кровь, моча или спинномозговая жидкость
Как использовалось: Для определения прогноза и отслеживания реакции на лечение
Бета-хорионический гонадотропин человека (Бета-ХГЧ)
Типы рака: Хориокарцинома и опухоли половых клеток
Что анализировали: Моча или кровь
Как использовалось: Для оценки стадии, прогноза и ответа на лечение
Опухолевый антиген мочевого пузыря (BTA)
Типы рака: Рак мочевого пузыря и рак почки или мочеточника
Что анализировали : Моча
Как используется: В качестве эпиднадзора с цитологией и цистоскопией за пациентами, у которых уже известен рак мочевого пузыря
BRCA1 и BRCA2 мутации гена
Типы рака: Рак яичников и груди
Что анализировали: Кровь и / или опухоль
Как использовалось: Для помощи в выборе лечения
Ген слияния BCR-ABL (Филадельфийская хромосома)
Типы рака: Хронический миелоидный лейкоз, острый лимфобластный лейкоз и острый миелогенный лейкоз
Что анализировали: Кровь или костный мозг
Как использовалось: Для подтверждения диагноза, прогнозирования ответа на таргетную терапию, помощи в выборе лечения и мониторинга статус болезни
Мутации BRAF V600
Типы рака или похожие на рак состояния: Меланома кожи, болезнь Эрдхейма-Честера, гистиоцитоз клеток Лангерганса, колоректальный рак и немелкоклеточный рак легкого
Что анализировали: Опухоль
Как использовалось: Для определения лечения
Комплект C / CD117
Типы рака: Желудочно-кишечная стромальная опухоль, меланома слизистой оболочки, острый миелоидный лейкоз и заболевание тучных клеток
Что анализировали: Опухоль, кровь или костный мозг
Как используется: Для помощи в диагностике и выбора лечения
CA15-3 / CA27.29
Тип рака: Рак молочной железы
Что анализировали: Кровь
Как использовалось: Для оценки эффективности лечения или рецидива рака
CA19-9
Типы рака: Рак поджелудочной железы, желчного пузыря, желчных протоков и желудка
Что было проанализировано: Кровь
Как использовалось: Для оценки эффективности лечения
CA-125
Тип рака: Рак яичников
Что анализировали: Кровь
Как использовали: Для помощи в диагностике, оценке реакции на лечение и оценке рецидива
CA 27.29
Тип рака: Рак молочной железы
Что анализировали: Кровь
Как использовали: Для обнаружения метастазов или рецидивов
Кальцитонин
Тип рака: Медуллярный рак щитовидной железы
Что было проанализировано: Кровь
Как использовалось: Чтобы помочь в диагностике, проверить эффективность лечения и оценить рецидив
Карциноэмбриональный антиген (CEA)
Типы рака: Колоректальный рак и некоторые другие виды рака
Что проанализировано: Кровь
Как используется: Чтобы отслеживать эффективность лечения рака и проверять, вернулся ли рак или распространился
CD19
Типы рака: В-клеточные лимфомы и лейкемии
Что проанализировано: Кровь и костный мозг
Как используется: Для помощи в диагностике и помощи в выборе лечения
CD20
Тип рака: Неходжкинская лимфома
Что было проанализировано: Кровь
Как использовалось: Для определения лечения
CD22
Типы рака: В-клеточные лимфомы и лейкемии
Что проанализировано: Кровь и костный мозг
Как используется: Для помощи в диагностике и помощи в выборе лечения
CD25
Тип рака: Неходжкинская (Т-клеточная) лимфома
Что было проанализировано: Кровь
Как использовалось: Для определения лечения
CD30
Типы рака: Классическая лимфома Ходжкина, В-клеточные и Т-клеточные лимфомы
Что анализировали: Опухоль
Как использовали: Для определения лечения
CD33
Тип рака: Острый миелоидный лейкоз
Что анализировали: Кровь
Как использовали: Для определения лечения
Хромогранин А (CgA)
Тип рака: Нейроэндокринные опухоли
Что анализировали: Кровь
Как использовали: Для помощи в диагностике, оценке реакции на лечение и оценке рецидива
Делеция 17p хромосомы
Тип рака: Хронический лимфолейкоз
Что анализировали: Кровь
Как использовали: Для определения лечения
Хромосомы 3, 7, 17 и 9p21
Тип рака: Рак мочевого пузыря
Что анализировали: Моча
Как использовали: Для помощи в мониторинге рецидива опухоли
Циркулирующие опухолевые клетки эпителиального происхождения (CELLSEARCH)
Типы рака: Метастатический рак молочной железы, простаты и колоректального рака
Что проанализировано: Кровь
Как используется: Для принятия клинических решений и оценки прогноза
Цитокератиновый фрагмент 21-1
Тип рака: Рак легкого
Что анализировали: Кровь
Как использовали: Для помощи в мониторинге рецидива
Перестройка или экспрессия гена циклина D1 ( CCND1 )
Типы рака: Лимфома, миелома
Что анализировали: Опухоль
Как использовали: Для помощи в диагностике
Де-гамма-карбоксипротромбин (DCP)
Тип рака: Гепатоцеллюлярная карцинома
Что анализировали: Кровь
Как использовали: Для контроля эффективности лечения и выявления рецидивов
Мутация гена DPD
Типы рака: Рак груди, толстой кишки, желудка и поджелудочной железы
Что анализировали: Кровь
Как использовалось: Для прогнозирования риска токсической реакции на терапию 5-фторурацилом
Мутация гена EGFR
Тип рака: Немелкоклеточный рак легкого
Что анализировали: Опухоль
Как использовали: Чтобы помочь определить лечение и прогноз
Рецептор эстрогена (ER) / рецептор прогестерона (PR)
Тип рака: Рак молочной железы
Что анализировали: Опухоль
Как использовали: Для помощи в выборе лечения
FGFR2 и FGFR3 мутации гена
Тип рака: Рак мочевого пузыря
Что анализировали: Опухоль
Как использовали: Для помощи в выборе лечения
Фибрин / фибриноген
Тип рака: Рак мочевого пузыря
Что анализировали: Моча
Как использовалась: Для отслеживания прогрессирования и реакции на лечение
FLT3 генные мутации
Тип рака: Острый миелоидный лейкоз
Что было проанализировано: Кровь
Как использовалось: Для определения лечения
Гастрин
Тип рака: Гастринпродуцирующая опухоль (гастринома)
Что было проанализировано: Кровь
Как использовалось: Для помощи в диагностике, контроля эффективности лечения и выявления рецидива
HE4
Тип рака: Рак яичников
Что было проанализировано: Кровь
Как использовалось: Для планирования лечения рака, оценки прогрессирования заболевания и отслеживания рецидивов
Амплификация гена HER2 / neu или сверхэкспрессия белка
Типы рака: Рак груди, яичников, мочевого пузыря, поджелудочной железы и желудка
Что анализировали: Опухоль
Как использовали: Для помощи в выборе лечения
5-HIAA
Тип рака: Карциноидные опухоли
Что анализировали: Моча
Как использовалась: Для помощи в диагностике и наблюдении за заболеванием
IDh2 и IDh3 мутации гена
Тип рака: Острый миелоидный лейкоз
Что анализировали: Костный мозг и кровь
Как использовали: Чтобы определить лечение
Иммуноглобулины
Типы рака: Множественная миелома и макроглобулинемия Вальденстрема
Что проанализировано: Кровь и моча
Как используется: Для диагностики заболевания, оценки реакции на лечение и поиска рецидивов
IRF4 генная реаранжировка
Типы рака: Лимфома
Что анализируется: Опухоль
Как используется: Для помощи в диагностике
Мутация гена JAK2
Тип рака: Определенные типы лейкемии
Что анализировали: Кровь и костный мозг
Как использовали: Для помощи в диагностике
Мутация гена KRAS
Типы рака: Колоректальный рак и немелкоклеточный рак легкого
Что проанализировано: Опухоль
Как используется: Для помощи в выборе лечения
Лактатдегидрогеназа
Типы рака: Опухоли зародышевых клеток, лимфома, лейкемия, меланома и нейробластома
Что анализировали: Кровь
Как использовалось: Для оценки стадии, прогноза и реакции на лечение
Нестабильность микроспутника (MSI) и / или дефект восстановления несоответствия (dMMR)
Типы рака : Колоректальный рак и другие солидные опухоли
Что проанализировано: Опухоль
Как используется: Для руководства лечением и выявления лиц с высоким риском определенных предрасполагающих к раку синдромов
MYC Экспрессия гена
Типы рака: Лимфомы, лейкемии
Что проанализировано: Опухоль
Как используется: Для помощи в диагностике и выбора лечения
MYD88 генная мутация
Типы рака: Лимфома, макроглобулинемия Вальденстрема
Что проанализировано: Опухоль
Как используется: Для помощи в диагностике и выбора лечения
Миелопероксидаза (МПО)
Тип рака: Лейкемия
Что анализировали: Кровь
Как использовали: Для помощи в диагностике
Нейрон-специфическая энолаза (NSE)
Типы рака: Мелкоклеточный рак легкого и нейробластома
Что анализировали: Кровь
Как использовали: Для помощи в диагностике и оценки реакции на лечение
НТРК Слияние генов
Тип рака: Любая солидная опухоль
Что анализировали: Опухоль
Как использовали: Чтобы помочь в выборе лечения
Ядерный матричный белок 22
Тип рака: Рак мочевого пузыря
Что анализировали: Моча
Как использовалось: Для отслеживания реакции на лечение
мРНК PCA3
Тип рака: Рак предстательной железы
Что анализировали: Моча (собрана после пальцевого ректального исследования)
Как использовалась: Для определения необходимости повторной биопсии после отрицательной биопсии
Ген слияния PML / RARα
Тип рака: Острый промиелоцитарный лейкоз (APL)
Что проанализировано: Кровь и костный мозг
Как используется: Для диагностики APL, для прогнозирования реакции на полностью транс-ретиноевую кислоту или мышьяк терапия триоксидом для оценки эффективности терапии, контроля минимальной остаточной болезни и прогнозирования раннего рецидива
Кислая фосфатаза простаты (PAP)
Тип рака: Метастатический рак простаты
Что проанализировано: Кровь
Как используется : Для помощи в диагностике низкодифференцированной карциномы
Лиганд запрограммированной смерти 1 (PD-L1)
Типы рака: Немелкоклеточный рак легкого, рак печени, рак желудка, рак желудочно-пищеводного перехода, классическая лимфома Ходжкина и другие агрессивные подтипы лимфомы
Что анализировали: Опухоль
Как использовалось: Помочь определить лечение
Простатоспецифический антиген (ПСА)
Тип рака: Рак простаты
Что анализировали: Кровь
Как использовалось: Для помощи в диагностике, оценки реакции на лечение и поиска рецидивов
ROS1 генная реаранжировка
Тип рака: Немелкоклеточный рак легкого
Что анализировали: Опухоль
Как использовали: Для помощи в выборе лечения
Растворимые пептиды, родственные мезотелину (SMRP)
Тип рака: Мезотелиома
Что анализировали: Кровь
Как использовали: Для отслеживания прогрессирования или рецидива
Рецептор соматостатина
Тип рака: Нейроэндокринные опухоли, поражающие поджелудочную железу или желудочно-кишечный тракт (GEP-NET)
Что проанализировано: Опухоль (по данным диагностической визуализации)
Как используется: Для определения лечения
Перестройка гена Т-клеточного рецептора
Тип рака: Т-клеточная лимфома
Что анализировали: Костный мозг, ткань, биологические жидкости, кровь
Как используется: Для помощи в диагностике; иногда для выявления и оценки остаточной болезни
Терминальная трансфераза (TdT)
Типы рака: Лейкемия, лимфома
Что анализировали: Опухоль, кровь
Как использовали: Для помощи в диагностике
Активность фермента тиопурин-S-метилтрансферазы (TPMT) или Генетический тест TPMT
Тип рака: Острый лимфобластный лейкоз
Что проанализировано: Кровь и щечный (щечный) мазок
Как используется: Для прогнозирования риска тяжелой токсичности костного мозга (миелосупрессии) при лечении тиопурином
Тиреоглобулин
Тип рака: Рак щитовидной железы
Что анализировали: Кровь
Как использовалось: Для оценки реакции на лечение и поиска рецидива
UGT1A1 * 28 вариант гомозиготности
Тип рака: Колоректальный рак
Что анализировали: Кровь и щечный (щечный) мазок
Как использовался: Для прогнозирования токсичности терапии иринотеканом
Катехоламины в моче: VMA и HVA
Тип рака: Нейробластома
Что анализировали: Моча
Как использовали: Для помощи в диагностике
Активатор плазминогена урокиназы (uPA) и ингибитор активатора плазминогена (PAI-1)
Тип рака: Рак молочной железы
Что анализировали: Опухоль
Как использовали: Для определения агрессивности рака и направления лечения
Геномный тест FoundationOne CDx (F1CDx)
Тип рака: Любая солидная опухоль
Что анализировали: Опухоль, кровь
Как использовали: В качестве сопутствующего диагностического теста для определения лечения
Геномный тест Guardant360 CDx
Тип рака: Любая солидная опухоль
Что анализируется: Кровь
Как используется: В качестве сопутствующего диагностического теста для определения лечения и для определения общего профиля мутаций опухоли
5-белковая подпись (OVA1)
Тип рака: Рак яичников
Что анализировали: Кровь
Как использовали: Для предоперационной оценки массы таза при подозрении на рак яичников
Сигнатура 17-гена (тест Oncotype DX GPS)
Тип рака: Рак простаты
Что анализировали: Опухоль
Как использовалось: Для прогнозирования агрессивности рака простаты и помощи в лечении
Сигнатура 21 гена (Oncotype DX)
Тип рака: Рак груди
Что анализировали: Опухоль
Как использовалось: Для оценки риска отдаленного рецидива и помощи в планировании лечения
46-генная подпись (Prolaris)
Тип рака: Рак простаты
Что анализировали: Опухоль
Как использовалось: Для прогнозирования агрессивности рака простаты и помощи в лечении
70-генная подпись (Mammaprint)
Тип рака: Рак груди
Что анализировали: Опухоль
Как использовали: Для оценки риска рецидива
Текущие темы и перспективы на будущее
ВВЕДЕНИЕ
Рак желудка (РЖ) является четвертым по распространенности злокачественным заболеванием и второй ведущей причиной смерти от рака во всем мире [1].Несмотря на значительное улучшение выживаемости пациентов с ГК за последние несколько десятилетий, ГК часто диагностируется на поздней стадии, и прогнозы все еще неудовлетворительны из-за высокой частоты рецидивов [2]. Поскольку ГК в основном протекает бессимптомно, пока не прогрессирует до поздних стадий, раннее выявление с использованием эффективных подходов скрининга важно для снижения смертности от ГК [2]. Биомаркеры — это характеристики, которые объективно измеряются и оцениваются как индикатор нормального биологического процесса, патогенных процессов или фармакологического ответа на терапевтическое вмешательство.Различные биомаркеры, относящиеся к ДНК, РНК, экзосомам и т. Д., Были обнаружены в результате последних достижений в области анализа генома. Ожидается, что разработка этих биомаркеров в области лечения рака внесет большой вклад в прогрессирование рака, выбор соответствующих терапевтических стратегий и эффективных программ последующего наблюдения.
GC — это гетерогенное заболевание, при котором каждый больной раком проявляет свой генетический и молекулярный профиль. К сожалению, хотя было проведено множество исследований молекулярных биомаркеров, большинство идентифицированных биомаркеров не прошли валидационные исследования.Почти пациенты с поздними стадиями ГК все еще не могут получать таргетную терапию, и в настоящее время не видно диагностических маркеров для вторичной профилактики. Чтобы иметь возможность использовать биомаркеры, связанные с GC, в клинической помощи пациентам, необходимо провести всесторонний обзор, чтобы определить направление для определения точного биомаркера, который может быть исследован для персонализированной терапии.
Этот обзор направлен на классификацию тем, которые развиваются в отношении биомаркеров в ГК, и при этом дает представление о потенциальных кандидатах на основе новой молекулярной классификации, которая в конечном итоге подчеркивает молекулярные исследования и клиническую реализацию.Эти результаты должны быть полезны для перевода молекулярной классификации и профилирования опухолей в терапевтические цели и прогностические биомаркеры для достижения персонализированного лечения в будущем.
БИОМАРКЕРЫ ГК, ПРИМЕНЯЕМЫЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Онкомаркеры желудка использовались для диагностики, определения клинической стадии, оценки реакции на лечение и скрининга рецидивов после успешной терапии [3]. Хотя сообщалось о многих биомаркерах для GC, включая углеводный антиген (CA) 72-4, альфа-фетопротеин, углеводный антиген (CA) 12-5, SLE, BCA-225, hCG и пепсиноген I / II, карциноэмбриональный антиген (CEA) и CA19-9 по-прежнему являются наиболее часто используемыми биомаркерами в клинической практике для GC.
CEA
CEA является наиболее широко и часто используемым в клинической практике маркером рака желудочно-кишечного тракта. CEA известен как независимый фактор риска прогнозируемого рецидива метастазов в печень [3]. Повышенные уровни CEA обнаруживаются на поздних стадиях GC у части всех пациентов GC; поэтому уровни CEA не являются эффективным методом скрининга. Считается, что уровни CEA в жидкости перитонеального лаважа точно предсказывают рецидив брюшины после радикальной резекции GC [4].Добавление иммуногистохимического измерения СЕА к стандартной цитологии привело к повышению чувствительности. Измерение мРНК СЕА с помощью ОТ-ПЦР полезно для обнаружения микрометастазов в брюшной полости [5].
CA19-9
CA19-9 — это гликолипидный антиген, который был идентифицирован при колоректальном раке, и это лиганд для E-селектина, который экспрессируется на поверхности эндотелиальных клеток [3]. CA19-9 ранее был широко используемым маркером рака желудочно-кишечного тракта; тем не менее, он присутствует при ряде типов рака, в частности рака поджелудочной железы и рака поджелудочной железы.CA19-9-положительные ГК продемонстрировали отчетливые клинико-патологические характеристики, такие как антральное расположение, дифференцированная гистология, выраженная лимфатическая и венозная инвазия, более высокая доля метастазов в лимфатические узлы и продвинутая стадия [6]. В предыдущих исследованиях сообщалось, что чувствительность к рецидиву CA19-9 составляла 56%, а специфичность — 74% [7]. Более того, комбинация CA19-9 и других онкомаркеров предоставила более полезную информацию для прогнозирования рецидива [8]. Сообщалось о повышении чувствительности до 87% при сочетании CA19-9 с CEA.
Другие традиционные биомаркеры
Онкомаркеры, такие как CA72-4, альфа-фетопротеин и CA125, широко используются для диагностики ГК.
Хотя CA72-4 часто обеспечивает более высокую чувствительность и точность по сравнению с CEA, исследований по прогностическому скринингу или раннему выявлению CA72-4 в данных обстоятельствах немного. AFP-положительный GC имеет характеристики высокой стадии и легкого возникновения метастазов в печень [9]. ГК, продуцирующий AFP, в AFP-положительной группе также демонстрирует агрессивную пролиферацию и усиленную неоваскуляризацию по сравнению с AFP-отрицательной группой [10].Считается, что уровень CA12-5 в значительной степени связан с возникновением перитонеальной диссеминации при РЖ [3]. У пациентов, перенесших лечебную операцию, положительность CA125 может служить предиктором перитонеальной диссеминации [11].
HER2
HER2 — это первый молекулярный биомаркер, доступный для пациентов с ГК в клинической практике. HER2 (протоонкоген, кодируемый ERBB2 на хромосоме 17) представляет собой рецепторную тирозинкиназу, связанную с клеточной мембраной, и является одним из четырех членов семейства EGFR человека, включая EGFR / HER1, HER2 / neu, HER3, и HER4 [12].Хотя значимость прогностической и прогностической ценности HER2 при GC не установлена, важность HER2 как биомаркера, как известно, возрастает. Изученная амплификация HER2 у пациентов с ГК колеблется от 6% до 23% [13-15]. Гистологическая оценка показала, что уровень сверхэкспрессии / амплификации HER2 преимущественно наблюдался при раке кишечного типа, чем при раке диффузного типа (32% против 6%) [15-18].
Трастузумаб, агент, нацеленный на HER2, ингибирует HER2-опосредованную передачу сигналов и предотвращает расщепление внеклеточного домена HER2 [13].Трастузумаб — первый препарат молекулярного таргетинга, одобренный в качестве стандартного лечения при ГЖ. Исследование трастузумаба для лечения рака желудка (ToGA), открытое рандомизированное контролируемое исследование фазы III, показало, что добавление трастузумаба к капецитабину или 5-ФУ и цисплатину продемонстрировало клиническую пользу по сравнению с одной химиотерапией с точки зрения ответа опухоли и в настоящее время считается стандартом лечения HER2-положительных ГК [13]. Более того, оценка экспрессии HER2 в первичной опухоли желудка является надежным основанием для изучения лечения анти-HER2 агентами у пациентов со вторичными очагами [17,18].Есть несколько других агентов, нацеленных на HER2, таких как пертузумаб, лапатиниб и трастузумаб эмтанзин, которые исследуются в рандомизированных клинических испытаниях у пациентов с HER2-положительным ГК [19–21]. Однако никаких существенных доказательств пока не обнаружено. Несколько препятствий, таких как определение подходящей дозы трастузумаба, идентификация прогностического биомаркера, существуют для продвижения HER2-таргетной терапии при ГК [22]. Некоторые исследования доказали полезность нескольких факторов для мониторинга эффективности одного трастузумаба или комбинированной химиотерапии, таких как p27 Kip1 и внеклеточный домен HER2 [23,24].Устойчивость к трастузумабу также в настоящее время является предметом изучения HER2-положительных ГК. Одним из наиболее важных механизмов, лежащих в основе устойчивости к трастузумабу, является нарушение регуляции пути фосфатидилинозитол-3-киназы (PI3K) / Akt / mTOR. Хорошо известно, что мутации PIK3CA и инактивация фосфатов и гомологов тензина (PTEN) могут влиять на эффективность HER2-таргетной терапии [25]. Таким образом, комбинированная терапия трастузумабом с ингибиторами PI3K может дать существенную пользу пациентам с HER2-положительным ГК.Амплификация CCNE1 , одно из наиболее популярных сопутствующих изменений числа копий, отрицательно связано с ответом на HER2-направленную терапию, предполагая ее потенциальную роль в качестве биомаркера устойчивости у пациентов с GC, амплифицированным ERBB2 [26].
ТЕКУЩИЕ ТЕМЫ БИОМАРКЕРОВ В GC
Измерение обычных сывороточных биомаркеров опухолей широко используется в диагностике и прогнозировании рецидивов в GC. Однако из-за их недостаточной специфичности и чувствительности эти молекулярные маркеры не могут применяться для раннего обнаружения GC.Поэтому срочно необходимы новые и надежные биомаркеры опухолей.
Гены, связанные с метастазами
FGFR2: С развитием молекулярно-биологических методов за последние несколько лет, исследователи стали глубже понимать механизмы онкогенеза. Помимо хорошо известного патогенного фактора, с помощью разнообразных экспериментальных процедур были установлены многочисленные онкогены и гены-супрессоры опухолей, включая гены клеточного цикла в клеточном росте и сигнальных путях [27-29].Хорошо организованное разъяснение этой сложности молекулярных и генетических профилей приведет к точным стратегиям индивидуального лечения. Семейство рецепторов фактора роста фибробластов (FGFR) состоит из четырех членов: FGFR1, FGFR2, FGFR3 и FGFR4. Эти рецепторы связываются со своими высокоаффинными лигандами, факторами роста фибробластов (FGF) [30]. Амплификация гена FGFR вызывает сверхэкспрессию рецептора, хромосомную транслокацию и точечную мутацию или усиление киназной активности [31]. Различное базовое разнообразное клеточное поведение и клеточные процессы, такие как митогенез, дифференцировка, пролиферация клеток, ангиогенез и инвазия, опосредуются посредством сигнального пути FGFRs [30].Частота сверхэкспрессии FGFR2 составляла 31,1% и была более распространена, чем EGFR (23,5%), HER2 (11,8%), MET (24,9%) [32]. Таким образом, FGFR должны привлекать значительное внимание как полезный терапевтический кандидат для нацеленных противораковых агентов. Было обнаружено, что амплификация FGFR2 связана с более высокой стадией pT, более высокой стадией pN, метастазами в лимфатические узлы и связана с плохой общей выживаемостью [33]. Недавнее исследование показало, что экспрессия FGFR была положительно связана с частотой рецидивов более 5 лет у пациентов со стадией II / III GC, перенесших лечебную операцию и адъювантную химиотерапию с S-1 [34].Этот результат указывает на то, что FGFR2 может быть биомаркером для прогнозирования долгосрочной неудачи адъювантного лечения S-1 у пациентов с радикальной резекцией по поводу поздней стадии GC.
E-кадгерин: E-кадгерин представляет собой трансмембранную молекулу, которая участвует в клеточной адгезии, опосредованной кальцием. Он кодируется CDh2 , расположенным на хромосоме 16 (q22.1). Е-кадгерин тесно связан с адгезией и дифференцировкой эпителиальных клеток желудка, что является важной профилактикой злокачественного образования [35]. CDh2 является одним из основных генов-супрессоров опухолей в GC, и было доказано, что нарушение его активности тесно связано с инвазивной способностью и способностью к метастазированию [36]. Ген E-кадгерина может быть инактивирован несколькими механизмами, включая мутаций CDh2, , гиперметилирование, потерю гетерозиготности (LOH), инфекцию H pylori , связывание репрессии транскрипции с элементом CDh2-E box и фосфолилирование тирозина ( например, ., EGFR, MET и FGFR) [36].Наследственный диффузный GC (HDGC) — это аутосомно-доминирующий онкологический синдром, составляющий примерно 2% всех GC [37]. Мутации зародышевой линии в гене CDh2 идентифицированы в HGDC, что приводит к гистологическим характеристикам, аналогичным GC диффузного типа. Кумулятивный риск GC к 80 годам у мужчин-носителей мутации CDh2 составляет 83% для продвинутых GC [38]. К сожалению, пациенты с метастатическим HGDC показывают более низкую выживаемость по сравнению с другими спорадическими GC. Недавнее исследование показало, что перекрестные помехи E-кадгерин / катенин-EGFR тесно связаны с HDGC.Повышенная чувствительность к ингибированию киназы EGFR и PI3K была вызвана потерей взаимодействия E-кадгерин / катенин-EGFR в семьях HDGC с мутациями CDh2 зародышевой линии, что позволяет предположить, что эти ингибиторы будут привлекательным инструментом для таргетной терапии у пациентов с HGC в ближайшем будущем. будущее.
Пациенты с GC, демонстрирующие соматические CDh2 эпигенетические и структурные изменения, имеют худшую общую выживаемость, чем пациенты с опухолями, отрицательными для CDHI изменений.Это открытие указывает на то, что присутствие CDh2 эпигенетических и структурных изменений в диагностической / предоперационной биопсии может служить клинически полезным биомаркером [39]. Недавнее исследование изучило диагностическую роль статуса метилирования промотора CDh2 в образцах крови пациентов с GC [40]. Интересно, что значительное облегчение метилирования промотора CDh2 было показано в образцах крови, предполагая, что метилирование промотора CDh2 может быть хорошим кандидатом в биомаркеры у пациентов с GC.
PI3K / Akt / mTOR: PI3K / Akt / механистическая мишень передачи сигналов рапамицина (mTOR) является важным медиатором многих важных клеточных процессов; геномная нестабильность, клеточный цикл, рост, метаболизм, выживаемость, метастазирование и устойчивость к химиотерапии [41]. Ген PIK3CA , кодирующий каталитическую изоформу PI3K p110α, является вторым наиболее часто мутируемым онкогеном, а PTEN , кодирующий главную фосфатидилизозитолфосфатазу, является одним из наиболее мутировавших генов-супрессоров опухолей. Дерегуляция пути PI3K / Akt / mTOR может происходить. онкогенные мутации PIK3CA [42,43].Генетическая дерегуляция пути PI3K / Akt / mTOR часто выявляется при GC. Экспрессия PI3K / Akt / mTOR была связана со статусом лимфатических узлов и плохой выживаемостью [44]. Сообщается, что PI3KCA выявляется у 4–25% пациентов с ГК [25]. Хотя мутации PIK3CA играют решающую роль в устойчивости к противоопухолевым препаратам и приобретении метастатического потенциала, их мутации вряд ли имеют установленную эффективность для прогноза. Сообщалось, что не существует этнических различий в частотах мутаций PIK3CA, тогда как мутации PIK3CA преимущественно обнаруживаются в 80% подгрупп, положительных по вирусу Эпштейна-Барра (EBV) [45].Недавнее исследование показало, что p-AKT-отрицательные опухоли более злокачественны, чем p-AKT-положительные, но их спасает адъювантная химиотерапия для пациентов с GC, перенесших гастрэктомию, независимо от статуса мутации PIK3CA [46].
MET: MET представляет собой трансмембранный рецептор тирозинкиназы, идентифицированный как рецептор фактора роста гепатоцитов / фактора рассеяния (HGF / SF). Активация МЕТ фосфорилирует несколько каскадов передачи сигналов, приводящих к росту раковых клеток, ангиогенезу, миграции и метастазам [47].Сообщалось, что амплификация MET и / или сверхэкспрессия его секретируемого белка участвует в канцерогенезе, эффективности терапии и исходе GC [48,49]. Измерение и оценка активности HGF сыграли решающую роль в понимании микросреды опухоли, которая вызывает метастазирование опухоли и устойчивость к лекарствам [47]. Недавний эксперимент по иммуноокрашиванию показал, что экспрессия MET в значительной степени связана с инвазией лимфатических сосудов и плохой общей выживаемостью (OS), подразумевая, что экспрессия пути HGF / c-Met может служить предполагаемым прогностическим фактором у пациентов с GC [50,51 ].Интересно, что пациенты с более низким уровнем HGF до лечения показали положительный ответ на лечение трастузумабом. Уровень HGF в сыворотке крови был повышен у пациентов, у которых не было эффекта на тастузумаб, по сравнению с уровнем до лечения [52]. Между тем, MET может быть полезным прогностическим маркером для химиотерапии, поскольку передача сигналов MET положительно связана с химиорезистентностью терапии GC через , увеличивая уровень UGT1A1 [53].
Фактор роста эндотелия сосудов: Доказано, что несколько путей передачи сигнала связаны с опухолевым ангиогенезом, включая фактор роста эндотелия сосудов (VEGF) [54].VEGF — это ключевой фактор роста и сигнальная молекула, способствующая образованию новых кровеносных сосудов. Связывание с его рецептором, VEGFR, активирует сложный каскад нижестоящих сигнальных путей, что приводит к неоваскуляризации и расширению сосудов [54]. Ингибирование активности VEGF и / или VEGFR нарушает эти пути, что приводит к снижению пролиферации, выживаемости и инвазии опухоли. VEGF и его рецепторы активируются в 40–36% случаев соответственно при GC [55].
Было показано, что антитела против VEGF и VEGFR обладают противоопухолевым эффектом, и на сегодняшний день комбинированная терапия с цитотоксической химиотерапией адаптирована как стандартное лечение первой или второй линии ГК.Рамуцирумаб представляет собой рекомбинантное гуманизированное моноклональное антитело (mAb), специфичное к VEGF-R2 и нарушающее его активность за счет VEGF. Рамуцирумаб проявил противоопухолевый эффект в клинической практике в качестве единственного агента (исследование REGARD) и в комбинации с паклитакселом (исследование RAINBOW) [56,57]. Недавно VEGFR-2 как прогностический биомаркер был показан в двух независимых исследованиях фазы III, оценивающих роль рамуцирумаба при ГК. В исследовании RAISE лечение второй линии ремуцирумабом в сочетании с FOLFORI показало, что группа с высокой экспрессией VEGF-D имела более длительную выживаемость по сравнению с группой с низкой экспрессией VEGF-D при колоректальном раке [58].Следовательно, вполне вероятно, что VEGF-D будет многообещающим прогностическим биомаркером эффективности рамуцирумаба при ГК.
TP53: Ген TP53 является чрезвычайно важным супрессором опухолей, который играет роль важного регулятора различных клеточных процессов, включая остановку роста и апоптоз, повреждение ДНК и аберрантные пролиферативные сигналы [59]. Мутационный сайт p53 в GC обширен, и сообщаемая частота мутаций p53 колеблется от 3,2% до 65% [60]. Частота мутации p53 была значительно ниже у EBV-GC ( n = 1) по сравнению с non-EBV-GC ( n = 10) [61].Мутация TP53 чаще всего выявляется при кишечном типе ГК [62]. Однонуклеотидный полиморфизм (SNP) кодона 72 TP53 Arg72Pro коррелировал с более коротким исходом у пациентов с GC. Было показано, что SNP кодона 72 TP53 предсказывает ответ на химиотерапию и связан со временем до прогрессирования у пациентов с прогрессирующим РЖ, получавших химиотерапию паклитакселом и цисплатином [63].
Иммунная контрольная точка
Запрограммированная клеточная смерть 1 (PD-1) и 2 (PD-2) являются ключевыми рецепторами контрольных точек иммунитета, экспрессируемыми на активированных Т- и В-лимфоцитах, естественных Т-клетках-киллерах и моноцитах [64].Связывание двух его лигандов, лигандов запрограммированной смерти-1 (PD-Ls) 1 и 2, с PD-1 на активированных Т-клетках приводит к подавлению активности цитотоксических Т-клеток, а также вызывает иммунную толерантность к опухоли. Экспрессия PD-L1 у пациентов с ГК находится в диапазоне от 15% до 70% случаев, и они коррелируют с плохим исходом [65]. Нацеливание на путь PD-1 и блокада иммунных контрольных точек оказались новым инструментом для лечения GC. Пембролизумаб и ниволумаб представляют собой моноклональные антитела против PD1, и они способствуют укреплению иммунной системы.Исследование фазы II (KEYNOTE-059) продемонстрировало, что применение одного пембролизумаба показало клиническую эффективность при ранее леченных поздних стадиях ГК [66]. Лечение пембролизумабом показало более высокую частоту общего ответа (ЧОО) у пациентов с PD-L1-положительными опухолями, чем у пациентов с PD-L1-отрицательными опухолями. Интересно, что пациенты с высоким уровнем микросателлит (MSI-High) показали более высокий ответ по сравнению с пациентами с опухолями без MSI-High, что позволяет предположить, что уровни PD-L1 и MSI-High могут служить прогностическими биомаркерами эффективности пембролизумаба.Кроме того, повышенная экспрессия PD-L1 / 2 была показана в EBV-положительном подтипе опухолей [67]. Результаты этих исследований способствовали адаптации ингибиторов иммунных контрольных точек в целом у пациентов с ГК.
Всесторонний анализ генов
Секвенирование всего генома до целевого секвенирования сыграло решающую роль в идентификации генетических вариаций и аномалий, что привело к развитию GC. Инициирование GC тесно связано с эпигенетическими модификациями и изменениями генома.Недавно был завершен проект генома человека, и было разработано исследование профилей экспрессии генов. Несколько критических генов как биомаркеров были идентифицированы с помощью полногеномного профиля экспрессии GC [68-70]. Для анализа генома в основном использовались микроматрицы кДНК и серийный анализ экспрессии генов (SAGE) [71]. Подобно технике микрочипов, SAGE представляет собой мощный метод количественного анализа экспрессии генов во всем мире без предварительного понимания последовательностей генов [72].Недавний анализ микроматрицы кДНК предположил, что семь генов экспрессируются исключительно у пациентов с положительными метастазами в лимфатические узлы, а пять генов полностью экспрессируются у пациентов с отрицательными лимфатическими узлами. Гены (включая Egr-1 ), которые участвуют в росте, транскрипции и васкуляризации клеток, были активированы, тогда как гены в апоптозе и дифференцировке клеток были подавлены [73]. Было показано, что повышающая регуляция CEACEM6, APOC1 и YF13h22 часто повышается при GC [74].Между тем, достоверная корреляция FUS , CDh27 , COLIA1 , COLIA2 и APOE с инвазией и метастазированием была доказана. Недавний комплексный анализ с использованием SAGE и ловушки секреции ампициллина Escherichia coli (CAST) обнаружил несколько изменений генов в GC. Среди них CDh27 , REG4 , OLFM4 , HOXA10 , DSC2 , TSPAN8 и TM9SF3 были активированы, а CLDN18 подавлены [75] в GC.Эти молекулы могут служить не просто биомаркерами, а терапевтической мишенью.
MSI
Микросателлиты — это повторяющиеся единицы последовательностей ДНК длиной от 1 до 6 нуклеотидов, которые могут быть обнаружены как в некодирующих, так и в кодирующих белки последовательностях ДНК [76]. MSI определяется как соматические изменения в микросателлитных последовательностях из-за вставки или удаления этих повторяющихся единиц, которые приводят к геномной нестабильности и увеличению восприимчивости к развитию опухоли. Опухоли, демонстрирующие 10–29% нестабильного микросателлита, считаются с низким MSI, в то время как опухоли с ≥ 30% нестабильного микросателлита классифицируются как MSI с высоким.При GC 15-30% опухоли демонстрируют MSI, в основном из-за эпигенетического подавления полного гиперметилирования промотора MLh2 [77]. Недавний комплексный анализ, проведенный в Корее, показал, что более 63% GC MSI-high идентифицировали мутации в мононуклеотидных трактах в TGFBR2 , CEP164 , MIS18BP1 , RNPC3 , KIAA2018 , CCDC150 генов [78]. Высокий статус мутаций PIK3CA в MSI-положительных ГК показал эффективность ингибиторов PIK3CA в персонализированном лечении MSI-положительных пациентов [79].Исследования показали сильную ассоциацию локусов MSI в GC с кишечным типом, который подвергается большей геномной нестабильности по сравнению с диффузным типом [80]. Интересно, что опухоли с высоким уровнем MSI имели лучший прогноз, чем опухоли с низким уровнем MSI, поскольку опухоли с высоким уровнем MSI показали меньшую способность к инвазии и метастазам в лимфатические узлы [81]. Недавнее рандомизированное клиническое исследование (исследование MAGIC) показало, что прогноз у пациентов с раком желудочно-пищеводного тракта с высоким уровнем MSI был значительно дольше по сравнению с пациентами с MSS / MSI-низким при лечении только хирургическим вмешательством.Напротив, когда пациенты получали хирургическое лечение и периоперационную химиотерапию, прогноз был короче у пациентов с высоким MSI, что позволяет предположить, что периоперационная химиотерапия не может принести пользу пациентам с высоким MSI [82]. Эти показательные результаты предполагают, что частота MSI может быть полезным прогностическим биомаркером у пациентов с GC.
Эпигенетические изменения
Нарушение эпигенетической системы вызвано патогенетическим механизмом, который приводит к канцерогенезу нескольких видов рака.Было проведено множество исследований, связывающих аберрантные профили метилирования ДНК и модификации гистонов с прогрессирующими заболеваниями, включая рак. Наиболее широко изученным эпигенетическим изменением при раке является аберрантное метилирование ДНК [83]. У людей метилирование ДНК происходит по остаткам цитозина, предшествующим гуанинам, которые называются динуклеотидами CpG (C-фосфодиэфир-G). Аномальное метилирование ДНК в промоторной области генов, приводящее к инактивации супрессора опухолей и других генов, имеющих отношение к раку, является наиболее четко определенной эпигенетической полосой в GC.Различные факторы риска, такие как возраст, хроническое воспаление и инфицирование H. Pylori и EBV, могут вызывать аберрантное метилирование гена в GC [84]. Дефектное метилирование ДНК в CDh2 , CHFR , DAPK , GSTP1 , p15 , p16 , RAR β, RASSF1A , RUNX9 RUNX9 , RUNX3 905 биомаркер для диагностики ГК [84,85]. Среди них ген митотической контрольной точки, метилирование CHFR , было обнаружено значительно выше в слизистой оболочке пациентов с GC по сравнению со слизистой оболочкой нормальной ткани желудка. Метилирование промотора CHFR связано с дифференцировкой опухоли и вовлечением лимфатических узлов [86]. Аберрантное метилирование ДНК в доброкачественной слизистой оболочке желудка участвует в канцерогенезе желудка и может быть полезным биомаркером для оценки риска GC. Недавнее исследование показало, что дефект экспрессии гена FAT4 был обнаружен в высокометилированных линиях клеток GC, а нарушение метилирования снижает его экспрессию. Инфекция H. Pylori также связана с частотой метилирования гена FAT4 [87].Понимание, полученное в результате генетических исследований молекулярного патогенеза GC, может служить побудительной причиной для различных экспериментов по выявлению различных генетических биомаркеров для ранней диагностики и прогноза этого типа злокачественного новообразования.
Генетический полиморфизм
Генетический полиморфизм играет ключевую роль в злокачественных новообразованиях человека, а тесная связь между раком и генетическим полиморфизмом для инициации опухоли была продемонстрирована в различных экспериментальных исследованиях [88]. Одним из важных генетических полиморфизмов в GC является интерлейкин-1β (IL1-β).IL1-β и IL-1RN имеют много функционально родственных полиморфизмов, которые связаны с секрецией IL1-β. Было показано, что наличие полиморфизмов IL-1β и IL-1RN с инфекцией H. pylori обеспечивает прогрессирование хронического атрофического гастрита и GC в алжирской популяции [89]. На сегодняшний день достижения в исследованиях доказали важность SNP в отображении индивидуальных специфических вариаций генных аберраций. Недавнее исследование показало, что CD44 SNP генотип, rs187116 был значимым прогностическим фактором для раннего рецидива GC, а переключение изоформы CD44 с CD44v на CD44s было тесно связано с этим эффектом CD44 rs187116 на рецидив опухоли [90].Кроме того, этот SNP CD44, был независимым фактором риска выживания без болезней, что позволяет предположить, что CD44 rs187116 может служить полезным биомаркером у пациента с GC в популяции Японии. Исследование по выявлению вариаций числа копий и мутаций показало, что наиболее часто встречающиеся мутировавшие гены: TP53 , SYNE1 , CSMD3 , LRP1B , CDh2 , PIK3CA , ARID901A [91].Вариация числа копий была идентифицирована для генов KRAS , JAK2 , CD274 и PDCD1LG2 с использованием повторного секвенирования одной клетки, амплифицированного с помощью различных трех амплификаций полногенома [92].
НЕИНВАЗИВНЫЕ БИОМАРКЕРЫ; ЖИДКИЕ БИОПСИИ
Основная проблема диагностики, лечения и наблюдения за солидным раком — необходимость частого получения опухоли соответствующего объема, а производные опухоли не полностью отражают характер всей опухоли.«Жидкая биопсия» — это, в принципе, образец любой жидкости организма, которая может содержать генетический материал опухоли, например кровь, мочу, слюну или спинномозговую жидкость [93]. Прогресс в области жидкостной биопсии может решить проблемы с биопсией тканей за счет использования биопсийных жидкостей для исследования биомаркеров заболеваний. Среди вариантов жидкостной биопсии наиболее широко изучаются образцы крови [93]. Образцы периферической крови больных раком содержат циркулирующие опухолевые клетки (ЦКО), внеклеточную ДНК, микро РНК, внеклеточную РНК и везикулы клеточного происхождения, такие как экзосомы.
ЦОК
ЦОК представляют собой диссеминированные опухолевые клетки в виде отдельных клеток или, реже, в виде кластеров клеток, происходящих из первичных опухолей или метастазов, циркулирующих в кровотоке [94]. Считается, что наличие ЦКО клинически связано с прогрессирующим или метастатическим заболеванием. Следовательно, ЦКО можно использовать для мониторинга запущенной стадии заболевания без использования других маркеров наблюдения. В частности, ЦОК могут быть обнаружены на ранней стадии до появления метастазов [94,95]. Таким образом, ЦКО могут выявлять пациентов, которым адъювантное лечение будет лучше после хирургического вмешательства по поводу первичного рака [94].
В GC, недавний метаанализ ЦОК у пациентов с ГК предположил ассоциации ЦКО с прогнозом, стадией опухоли, гистологическим типом и лимфоваскулярной инвазией [96]. Подмножество обнаруженных ЦОК с подобными стволовым клеткам характеристиками или свойствами эпителиально-мезенхимального перехода (ЭМП), которые должны обладать способностью выживать и мигрировать во вторичные очаги, могут играть ключевую роль в оценке стадии опухоли и прогнозировании рецидива. CD44 был идентифицирован как маркер стволовых клеток GC, а в CD44-положительных клетках GC была обнаружена повышенная устойчивость к гибели клеток, вызванной химиотерапией или радиацией [97].Экспрессия эпителиальных маркеров pan-CK, E-cadherin была снижена, а мезенхимальные маркеры N-cadherin, vimentin были сверхэкспрессированы в желудочных ЦКО, что может предоставить более полезную информацию для прогнозирования рецидива [98]. К сожалению, на сегодняшний день использование ЦОК при РЖ не вошло в клиническую практику. Необходимо разработать новые инновационные подходы к обнаружению ЦКО ЕМТ или циркулирующих стволовых клеток, и необходима оценка в клинических испытаниях. Интересно, что недавнее исследование фазы II показало, что предварительно отобранные пациенты с первичными опухолями HER2-, но у которых было HER2 + ЦКО, имели показатели ответа, эквивалентные тем, о которых сообщалось в группе трастузумаб плюс химиотерапия в исследовании ToGA [99].
Циркулирующая внеклеточная ДНК
Циркулирующая внеклеточная ДНК (вкДНК) — это внеклеточная внеклеточная ДНК, происходящая из нормальных и раковых клеток, идентичных в крови (плазме или сыворотке) [100]. Фракция внеклеточной ДНК, полученная из первичных опухолей, метастазов или из ЦКО, называется втДНК. В настоящее время использование ctDNA в лечении рака является наиболее изученным вопросом в исследованиях cfDNA. По сравнению с ограничениями традиционной биопсии, которая приводит к значительным травмам и дает небольшой размер образца, обнаружение цДНК дает несколько преимуществ, включая удобный отбор образцов, минимальную инвазивность и высокую повторяемость.Более того, было показано, что ктДНК более чувствительна, чем СТС [100]. Потенциальная диагностическая и / или прогностическая ценность количественного определения cf-ДНК у пациентов с GC по сравнению со здоровыми людьми из контрольной группы оценивалась в различных исследованиях.
В GC области метилированного промотора широко используются для идентификации ctDNA как в сыворотке, так и в плазме с помощью специфичной к метилированию ПЦР. Недавнее исследование метаанализа показало, что обнаружение ctDNA имеет очевидное преимущество в специфичности диагностики GC, хотя по чувствительности не было обнаружено превосходства ctDNA над обычными белковыми биомаркерами, такими как CEA, CA125 и CA72-4 [101].Что касается прогностической ценности, у пациентов были выявлены значительно худшие DFS и OS. Недавнее исследование показало, что гиперметилирование промотора 1A APC и промотора RASSF1A в cfDNA было частым эпигенетическим событием у пациентов с ранним операбельным GC [102]. Интересно, что cfDNA, показывающая ДНК вируса Эпштейна-Барра (EBV), оказалась полезной для идентификации подтипа GC, связанного с EBV, мониторинга развития опухоли и управления ответом у пациентов с этим подтипом [103]. Опухолевые ответы на лапатиниб плюс капецитабин были тесно связаны с изменениями в плазме, обнаруженными в количестве копий ERBB2 посредством серийного секвенирования вкДНК [26].
MicroRNA
Нарушение регуляции некодирующих регуляторных РНК может способствовать инициации и развитию рака [104]. Класс малых клеточных РНК, называемых микроРНК (миРНК), представляет собой некодирующие фрагменты РНК длиной от 18 до 24 нуклеотидов, функция которых заключается в связывании области 3’UTR их гена-мишени и регулировании его экспрессии путем нарушения трансляции [105-107]. МикроРНК являются ключевыми игроками в регуляции нескольких биологических процессов клеточной пролиферации, дифференцировки, миграции и инвазии [105].
Профили экспрессии микроРНК показали отличительные сигнатуры этих малых регуляторных РНК при различных формах рака, включая GC [108]. Было идентифицировано множество микроРНК и признано их участие в GC [108,109]. MiRNA могут играть решающую роль в прогрессировании раковых клеток через EMT в метастазы. Семейство miR-200 способствует EMT, что приводит к миграции раковых клеток путем подавления экспрессии E-cadherin и ZEB2 [110]. Известно, что miRNA могут увеличивать экспрессию онкогенов или снижать экспрессию генов-супрессоров опухолей [111]. Обилие дифференциально экспрессируемых miRNA связано с различными стадиями GC.miRNA, такие как miR-21, miR-23a, miR-27a, miR-106b-25, miR-130b, miR-199a, miR-215, miR-222-221 и miR-370, были связаны с онкогенной активностью GC. Принимая во внимание, что miR-29a, miR-101, miR-125a, miR-129, miR-148b, miR-181c, miR-212, miR-218, miR-335, miR-375, miR-449, miR-486 и miR-512 проявляет опухолевую супрессивную активность [108].
Недавно исследование miRNA как биомаркера злокачественных новообразований человека облегчилось благодаря уникальной особенности miRNA. Бесклеточные миРНК (cfmiRNA) могут быть получены из раковых клеток в жидкости организма через секретирующих частиц экзосом, которые приводят к защите от опосредованной РНКазой деградации в кровотоке и, таким образом, легко извлекаются из различных жидкостей организма, включая кровь, слюну. , моча, кал пр. .Таким образом, cf-miRNA может быть полезным неинвазивным биомаркером для диагностики и рецидива GC. Недавние экспериментальные анализы подтвердили, что уровни экспрессии cfmiRNAs в сыворотке согласуются с тканью опухоли желудка [112]. Исследование, основанное на анализе всестороннего профилирования экспрессии miRNA, показало, что высокая экспрессия двух потенциальных биомаркеров (miR-331 и miR-21) наблюдалась в периферической крови, чем в вене, дренирующей первичную опухоль, и было предложено в качестве потенциального диагностического биомаркера [113 ].Значительно более низкая ОС была показана в группе с высокой экспрессией miR-21 по сравнению с группой с низкой экспрессией miR-21 в исследовании метаанализа. Несколько других miRNA показали значительную прогностическую ценность в этом исследовании. Среди них miR-20b, 125a, 137, 141, 146a, 196a, 206, 218, 486-5p и 506 убедительно показали себя в качестве прогностических биомаркеров у пациентов с GC [114]. Сверхэкспрессия шести сывороточных miRNA (miR10b-5p, miR132-3p, miR185-5p, miR195-5p, miR-20a3p и miR296-5p) была показана в GC по сравнению с нормальным контролем с использованием панели Exiqon на основе qRT-PCR [115].В руке, не получающей химиотерапию, высокая экспрессия miR10b-5p или miR296-5p в тканях коррелировала с более коротким OS. Следовательно, cfmiRNA будут играть все более важную роль в диагностике, прогнозе и / или прогнозировании рецидива GC. Напротив, было сказано, что трудно использовать miRNA в качестве биомаркера рака в клинической практике [116]. Однако на сегодняшний день продолжаются клинические исследования по анализу уровня экспрессии miRNA с использованием секвенирования следующего поколения (NGS) в GC ткани и крови по ответу на химиотерапию (NCT03253107).Сходным образом, в настоящее время проводится исследование фазы II, чтобы выяснить, можно ли предсказать ответ на пралатрексат с помощью miR-215-5p (NCT02050178). Когда эти испытания завершатся убедительными доказательствами, miRNA станут многообещающими маркерами или новыми терапевтическими мишенями для прогнозирования и контроля лекарственного ответа, а также для модификации традиционной адъювантной терапии.
Длинные некодирующие РНК
Длинные некодирующие РНК (днРНК) представляют собой последовательности нуклеотидов длиной более 200, которые могут действовать как онкогенные или опухолевые супрессоры [117].LncRNA действуют как медиатор транскрипции, регулятор сплайсинга, посттранскрипционный процессор, энхансер, молекулярная губка для miRNA, ремоделирующий хроматин. LncRNAs часто экспрессируются в зависимости от заболевания или развития и, таким образом, являются потенциальными биомаркерами [111]. В настоящее время идентифицировано более 56000 днРНК человека, населяющих геном человека, и около 135 днРНК признаны нерегулируемыми в GC, поэтому они тесно связаны с онкогенезом, метастазами и прогнозом [117,118].Нарушение экспрессии ncRuPAR в значительной степени связано с метастазированием в лимфатические узлы, отдаленными метастазами, размером опухоли и стадией TNM у пациентов с ГК [119]. Подавление экспрессии AI364715, GACAT1 и GACAT2 в тканях GC также может служить прогностическим маркером [120]. LncRNA PVT1 был заметно сверхэкспрессирован в тканях GC по сравнению с таковым в нормальном контроле и мог быть независимым прогностическим маркером [121, 122]. Однако необходимы дальнейшие исследования днРНК, чтобы определить их возможное клиническое использование.
Экзосомы
Экзосомы, везикулы, полученные из мелких клеток, могут защищать РНК и миРНК от разрушения [123-127]. Когда экзосомы подвергались действию РНКазы, содержащиеся в них РНК были защищены от деградации, в то время как клеточная РНК расщеплялась той же самой РНКазой [126]. Экзосомы обладают большим потенциалом как для диагностики, так и для прогноза заболеваний и исключительно полезны в качестве биомаркеров рака [128]. miR-19b и miR-106a, идентифицированные в экзосомах, циркулирующих в сыворотке крови, значительно сверхэкспрессируются у людей с GC по сравнению со здоровым контролем.Более того, подтвержденные miRNAs коррелировали с лимфатическими метастазами и экспрессировались на более высоких уровнях на стадиях III и IV по сравнению с I и II стадиями в GC [129]. Сходным образом, повышенная экспрессия экзосомальных miR-21 и miR-1225-5p, выделенная жидкость для перитонеального лаважа, была обнаружена у пациентов с раком стадии Т4 по сравнению с таковой у пациентов стадии Т1-Т3 [130]. Эти данные свидетельствуют о том, что экзосомы могут служить новыми диагностическими и терапевтическими биомаркерами для GC.
БИОМАРКЕР ДЛЯ ЖЕЛУДКА
Промывание желудка / желудочный сок
Поскольку в желудочном соке можно найти много клеток слизистой оболочки, обнаружение молекулярных маркеров в желудочном соке является возможным неинвазивным подходом к скринингу на ГК.Желудочный сок может служить отличным источником биомаркеров GC, потому что они напрямую выделяются опухолью, но не исключены печенью. Таким образом, промывание желудка представляет собой альтернативный источник для обнаружения аберрантного метилирования ДНК. Анализ уровней метилирования шести генов ( ADAM23 , GDNF , MINT25 , MLF1 , PRDM5 , RORA ) показал, что комбинация маркеров MINT25 , 09 PRDM5 GDNF обладает высокой чувствительностью (95%) и специфичностью (92%) [131].Также, метилирование BARHL2 в ДНК промывания желудка или экзосомальной ДНК желудочного сока значительно ослабляется после эндоскопической резекции, указывая тем самым, что метилирование BARHL2 может быть полезным для прогнозирования рецидива опухоли [132]. Уровни PVT1 в желудочном соке пациентов с желудком были значительно выше, чем у здоровых людей. PVT1 может служить многообещающим биомаркером для раннего выявления и прогноза GC [121]. Желудочный сок miR-421, miR-21 , miR-106a и miR-129 представляют собой потенциальный биомаркер для скрининга GC [133].
Другой специфический биомаркер
Микроаэрофильная спиралевидная грамотрицательная бактерия Инфекция Helicobacter pylori (H.pylori), как сообщается в клинико-эпидемиологических исследованиях, связана с инициированием GC [134]. H. pylori Цитотоксин-ассоциированный ген A (CagA) — первый идентифицированный бактериальный белок, играющий положительную роль в прогрессировании GC [135]. Молекулярный механизм, лежащий в основе CagA-позитивных H. pylori -индуцированных GC, широко изучен.CagA вызывает нарушение регуляции множества сигнальных путей, включая Wnt / β-catenin, PI3K / Akt, JNK, NF-κB, Hedgehog, JAK / ATAT, что приводит к канцерогенезу GC [136]. Интересно, что развитие EBV-позитивных GC, как было показано, вызывается активностью H. pylori CagA, посредством ингибирования SHP1 посредством проявления гиперметилирования PTPN6 [137]. Аналогичным образом, инфекция H. pylori , продуцирующая другой бактериальный токсин, вакуолизирующая токсин A (vacA), была значимо связана с повышенным риском GC [138].
Гастрокин 1 (GKN1) представляет собой тканеспецифический белок 18 кДа, который значительно экспрессируется в ткани желудка и секретируется в желудок, но отсутствует в GC. Его биологическая функция до сих пор неясна, но считается, что он служит для восполнения поверхностного слоя эпителиальных клеток просвета при поддержании целостности слизистой оболочки [139]. GKN1 действует как опухолевый супрессор и модулятор апоптотических сигналов в GC. Из-за повышенного риска желудочного канцерогенеза у пациентов с более низкой экспрессией белка GKN1 также можно рассматривать как биомаркер рака, специфичного для желудка.Эпигенетические механизмы, приводящие к инактивации GKN1 , играют ключевую роль в многоступенчатом процессе желудочного канцерогенеза.
ЗАКЛЮЧЕНИЕ
Благодаря недавнему быстрому углубленному пониманию биологии рака, особенно в области передачи сигналов молекулярными клетками и генетической и / или эпигенетической дисрегуляции, структура желудочного канцерогенеза и задействованные пути стали более ясными. Эти данные могут предоставить ценные цели для ранней диагностики ГК.Надежные прогностические и прогностические маркеры, упомянутые выше, могут способствовать улучшению результатов расширенного GC. Текущие темы биомаркера GC, основанные на различных молекулярных и генетических характеристиках в этой обзорной статье, были обобщены в таблице 1. Мы также классифицировали эти биомаркеры для ранней диагностики, прогноза рецидивов и оценки преимуществ химиотерапии (дополнительная таблица 1). Использование этих новых биомаркеров, например, оценка уровней экспрессии различных белков и генов (, т.е. ., FGFR, CDh2, PI3K, MET, VEGFR, TP53 и PD-1) и различные образцы биологических жидкостей (CTC, cfDNA, miRNAs и экзосомы) открыли новые возможности для диагностики и мониторинга пациентов с GC. И эти маркеры будут продолжать тестироваться на основе знания нового подхода, такого как NGS [140]. Это способствовало бы более индивидуализированным подходам к лечению.
Таблица 1 Актуальные темы молекулярных маркеров, связанных с диагностикой, прогнозом, предсказанием терапевтического ответа при раке желудка.| Маркер | Изменение | Клиническое назначение | Метод обнаружения | Ссылка . | |||
| Гены, связанные с метастазами | |||||||
| Факторы роста | |||||||
| HER2, FGFR, PI3K / Akt / mTOR ( PIK3CA ), VEGF27-D-2 (VEGF27-D2) Сверхэкспрессия | Диагностический / прогностический / терапевтический | Ткань | [16-18,25,32,33, 44-46,55,58] | ||||
| Регуляция клеточного цикла | |||||||
| TP53 | 50 МутацияДиагностика | Ткань | [60,61,63] | ||||
| Молекула адгезии | |||||||
| Е-кадгерин ( CDh2 ) | Мутация / эпигенетическое изменение крови 50 | / Прогнозирующее изменение крови 50/[39,40] | |||||
| Контрольная точка иммунитета | |||||||
| PD-L1 | Мутация | Прогностическая / терапевтическая | Ткань | [66,67] | |||
| Co mprehensive генный анализ | |||||||
| CEACEM6, APOC1, YF13h22, CDh27, REG4, OLFM4, HOXA10, DSC2, TSPAN8, TM9SF3, FUS, COLIA1, COLIA2, APOE | 927 927 Ткань[74,75] | ||||||
| ATP4B, S100A9, CYP20A1, ARPC3, DDX5 CLDN18 | С пониженной регуляцией | Диагностическая / прогностическая / терапевтическая | Высокий уровень | Прогностический / терапевтический | Ткань | [79,81,82] | |
| Эпигенетические изменения | |||||||
| CDh2, CHFR, DAPK, p15590, p15590, GSTP16, RASSF1A, RUNX3, TFPI2 | Гиперметилирование | Диагностическое | Ткань | [84-86] | |||
| Генетический полиморфизм | |||||||
| 0 β, IL-1RN , CD44 | SNP | Prognostic | Ткань | [89,90] | |||
| TP53, SYNE1, PKMD3, LRP1BIK3ASCA, J, ARAKHD, PK CD274, PDCD1LG2 | Варианты / мутации числа копий | Диагностические / прогностические / терапевтические | Ткань | [91,92] | |||
| Циркулирующие опухолевые клетки | |||||||
| CD44in, N-cad27 927 927 927 | Диагностическое / терапевтическое | Кровь | [96] | ||||
| пан-СК, Е-кадгерин | Пониженная экспрессия | Процесс ЭМТ | Кровь | [97] | |||
| Избыточное HER | Кровь | [99] | |||||
| Циркулирующая бесклеточная ДНК | |||||||
| Промотор APC 1, RASSF1A | Гиперметилирование | Диаметр гностик | Кровь / плазма | [102] | |||
| ERBB2 | Варианты числа копий | Терапевтический | Плазма | [26] | |||
| с повышенным уровнем регуляции | Диагностический / прогностический / терапевтический | Кровь / плазма | [108,111] | ||||
| miR-29a, miR-101, miR-125a, miR-129, miR-148b, miR-181c, miR-212, miR-218, miR-335, miR-375, miR- 449, miR-486, miR-512 | Повышенная регуляция | Диагностическая / прогностическая / терапевтическая | Кровь / плазма | [108,111] | |||
| Бесклеточные miRNA | |||||||
| miR-21R-331 и miR-21 | Повышенная регуляция | Диагностика / прогноз | Кровь | [113] | |||
| miR-20b, 125a, 137, 141, 146a, 196a, 206, 2 18, 486-5p | Повышенная регуляция | Прогноз | Кровь / плазма | [114] | |||
| miR10b-5p, miR132-3p, miR185-5p, miR195-5p, miR-20a3p, miR29 | Повышенная регуляция | Прогностическая | Плазма | [115] | |||
| Длинные некодирующие РНК | |||||||
| ncRuPAR | Пониженная регуляция | 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 927 0 AI364715, GACAT1, GACAT2 | с пониженной регуляцией | Prognostic | Tissue | [120] | |
| PVT1 | Up-регулируемый | Prognostic | MiR-19b, miR-106a | Повышенная регуляция | Диагностическая / прогностическая | Плазма | [129] |
| miR-21, miR-1225-5p | Повышенная регуляция | 9275 0 Диагностический / терапевтическийPLF | [130] | ||||
| Желудочно-специфический биомаркер | |||||||
| ADAM23, GDNF, MINT25, MLF1, PRDM5, RORA | Гиперметилирование | 927 927 927 927 927 927 927 927 927||||||
| BARHL2 | Гиперметилирование | Диагностическое / терапевтическое | Промывание желудка / сок | [132] | |||
| PVT1 | Регулируемый с повышением | Диагностический / прогностический 49 | miR-421, miR-21, miR-106a, miR-129 | Повышенная регуляция | Диагностика | Желудочный сок | [133] |
| CagA | Диагностика | Ткань[137] | |||||
| VacA | Повышенная регуляция | Диагностическая | Ткань | [138] | Гастрокин 1 | Инактивация | Прогностический | Ткань | [139] |
ПЕРСПЕКТИВЫ НА БУДУЩЕЕ
Хотя биологические исследователи показали множество новых открытий в отношении биомаркеров GC в многочисленных публикациях, только обычные биомаркеры (CEA, CA19-9, и т. Д. .) и HER2 все еще используются в клинической практике. Срочно ожидается разработка биомаркеров, которые будут обычными, неинвазивными, высокоспецифичными, способными к раннему обнаружению и ведущими к выбору лечения. Идеальные биомаркеры для раннего выявления рака должны быть активированы у большинства пациентов с высоким уровнем в раковых тканях.
GC — очень гетерогенное заболевание, при котором даже сходные клинические и патологические признаки приводят к разным результатам, что позволяет предположить, что предыдущие системы стадирования, возможно, расширились до предела их полезности для прогнозирования исхода и лечения пациентов.Таким образом, необходима новая классификация пациентов с ГК для обеспечения профилактических и терапевтических подходов на основе анализа генома и клинических данных. В последнее время геномная характеристика GC привела к разработке новой классификации Исследовательской сетью Атласа генома рака (TCGA). Разделение GC на четыре молекулярных типа: (1) опухоли, положительные для EBV, (2) опухоли с высоким MSI, (3) геномно стабильные опухоли и (4) опухоли с хромосомной нестабильностью, позволяет идентифицировать пациентов на основе молекулярной особенности [67].Будущие стратегии, направленные на преобразование молекулярной классификации и профилирования опухолей в терапевтические мишени и прогностические биомаркеры в GC, будут полезны. Подтип EBV-положительного рака характеризуется повторяющимися мутациями PIK3CA и ARID1A и высокой экспрессией PD-L1 и PD-L2, крайним гиперметилированием ДНК, что должно быть хорошим кандидатом в качестве диагностических и терапевтических биомаркеров. Ингибирование метилирования ДНК и подавление иммунных контрольных точек являются многообещающей мишенью этого подтипа.Подтип MSI-high часто обнаруживает мутации нескольких генов, таких как HER2 и HER3. Таким образом, помимо MSI, семейство ErB может быть значительным биомаркером этого подтипа. Как упоминалось ранее, опухоли желудка с высоким MSI представляют собой высокую частоту экспрессии PD-L1. Следовательно, этот подтип может быть основным кандидатом на терапию против PD-1. Геномно стабильный подтип имеет несколько соматических изменений числа копий, но включает в себя мутаций ARID1A и RHOA или слияний генов CLDN18-ARHGAP .RhoA и родственные ему гены могут действовать как терапевтический биомаркер этого подтипа. Подтип с хромосомной нестабильностью богат мутациями TP53 и имеет относительно многочисленные амплификации генов RTK. Следовательно, этот подтип может быть целевой терапией для RTK, включая EGFR и VEGF. Молекулярная классификация ГХ дополнительно подчеркнет необходимость идентификации и использования молекулярных биомаркеров.
Полногеномное исследование транскриптомов рака выявило много новых генов-кандидатов.Напротив, списки генов-кандидатов, полученные на основе всестороннего анализа генов, значительно различаются в отдельных исследованиях. Таким образом, важно определить ключевых игроков, которые могут быть исследованы для разработки биомаркеров и потенциальных клиентов для более эффективного лечения рака. С другой стороны, что касается молекулярных нацеленных агентов, их молекулы-мишени и родственные гены могут быть пригодны для более точного прогнозирования ответа на лечение.
Открытие точного биомаркера, тесно связанного с разработкой ГК, также может быть применено к лечению.






