Хронический гастрит и риск развития рака желудка
Рак желудка является одним из заболеваний, возникающих из-за хронического гастрита – воспаления слизистой оболочки желудка. Наиболее частой причиной хронического гастрита считается инфицирование бактериями Helicobacter pylori (далее, H. pylori). В свою очередь, заболеваемость раком слизистой желудка, который не поражен хеликобактер пилори, составляет всего 1% и менее. Следовательно, если уничтожить эти вредные бактерии, то заболеваемость раком желудка снизится. Именно поэтому с февраля 2013 года в рамках страховой медицинской помощи в Японии началась программа эрадикационной терапии (т.е. лечения, направленного на уничтожение вредных бактерий), которая стала применяться у людей с хроническим гастритом, вызванным инфекцией H. pylori. До введения этой программы эрадикационная терапия в рамках медицинского страхования проводилась только у пациентов с раком желудка, язвой желудка и двенадцатиперстной кишки, а также у людей с заболеванием крови, связанным с инфекцией хэликобактер пилори.
Поэтому тем людям, кто проходил медосмотр или просто ФГДС в прошлом, особенно тем, у кого был диагностирован атрофический или хронический гастрит, рекомендуется провериться на предмет наличия Helicobacter pylori, так как возможно в то время диагностика данной инфекции еще не входила в программу обследования.
Хронический гастрит, вызванный Helicobacter pylori, еще называют атрофическим гастритом. Атрофия (истончение) слизистой желудка может начаться в 20-летнем возрасте и за несколько лет распространится на всю слизистую оболочку. Примерно у 10% людей с атрофией через 10 лет появляется риск развития рака желудка, который с годами увеличивается. Именно поэтому такое обследование как ФГДС является чрезвычайно важным методом диагностики, который позволяет не просто выявить рак, а спрогнозировать риск развития рака исходя из степени атрофии слизистой желудка. При высокой степени атрофии слизистой желудка важно наблюдаться с помощью ФГДС 1 раз в год, чтобы была возможность выявить рак на самой ранней стадии.
К тому же, с помощью эрадикационной терапии H. pylori есть возможность снизить риск развития рака желудка. В докладах сообщается, что «у пациентов, у которых после лечения рака желудка на ранней стадии проводилась эрадикационная терапия, по сравнению с пациентами, у которых данная терапия не проводилась, рецидив рака желудка в течение 3-х лет появился только у 1/3 пациентов». К сожалению, только лишь с помощью уничтожения бактерий пилори невозможно свести риск развития рака желудка до 0%, однако можно предупредить заболевание, поэтому мы призываем активно применять данный вид лечения в качестве профилактической меры.
Источник: Raffles Japanese Clinic
что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим.

Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».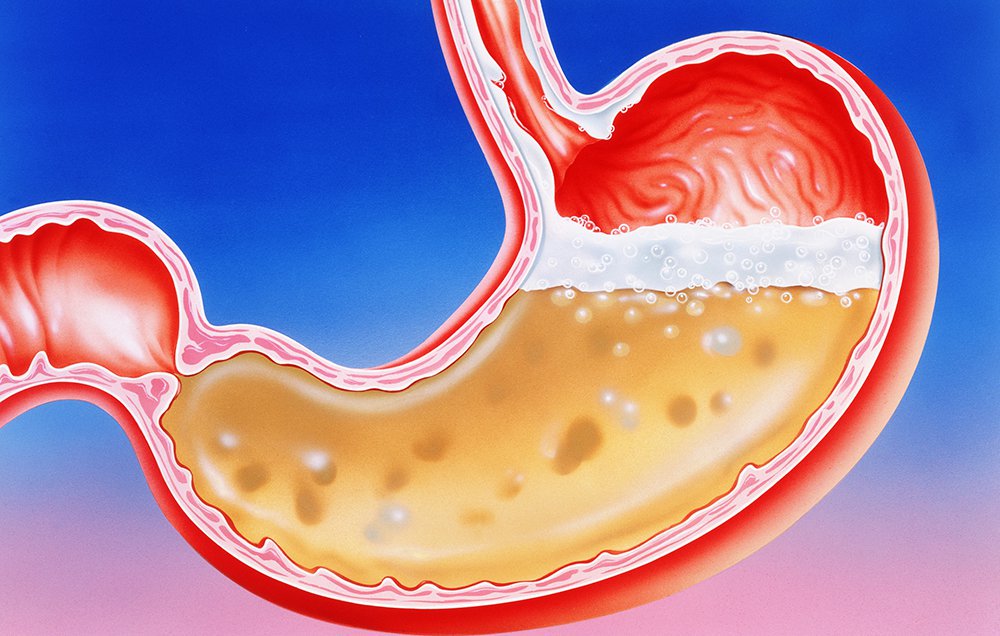
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
И последний пример. Пациенту 55 лет с хроническим Helicobacter-ассоциированным гастритом, выраженной атрофией (стадия III) – должен отметить, риск рака желудка априори увеличен в 5-6 раз по сравнению с популяцией – выполнена успешная эрадикационная терапия. Эндоскопическое исследование через 4 недели после окончания терапии имеет следующий результат. Взяты 5 фрагментов по схеме. Вот это картинки, которые мы с вами рассматриваем в микроскоп. Это пластическая атрофия в антральном отделе, но что нас особенно взволновало – это то, что спустя месяц после окончания эрадикационной терапии в собственной пластинке слизистой оболочки в инфильтрате сохранились нейтрофильные лейкоциты. А мы с вами уже договорились, чем чреват кислородный взрыв нейтрофильных лейкоцитов, и это атрофический гастрит, кстати говоря.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Атрофический гастрит
Атрофический гастрит – заболевание, характеризующееся атрофией слизистой оболочки желудка и уменьшением функционирующих клеток желудка.
Причины атрофического гастрита
Выделяют несколько видов заболевания, имеющих разные причины возникновения:
— Аутоиммунный атрофический гастрит образуется из-за генетических факторов либо из-за вирусов и бактерий;
— Атрофический антральный гастрит, как правило, вызывают другие заболевания ЖКТ (панкреатит, холецистит). Очаговый атрофический гастрит характеризуется нарушением функции всасывания и переваривания пищи;
— Гиперпластический атрофический гастрит возникает из-за того, что клетки слизистой оболочки желудка перестают нормально обновляться, например, по причине воздействия бактерий.
Симптомы атрофического гастрита
Больные жалуются на следующие проявления заболевания:
— Боль в области желудка;
— Ощущение тяжести в животе;
— Снижение аппетита;
— Диарея или запоры;
-Похудение;
— Отрыжка, имеющая неприятный запах;
— Изжога.
Также при атрофическом гастрите может возникать слабость, головокружения, повышенная потливость.
Длительно протекающий хронический атрофический гастрит повышает риск развития рака желудка, поэтому, если появились его симптомы, нужно немедленно обратиться к врачу-гастроэнтерологу.
Лечение атрофического гастрита
Самым важным исследованием при диагностике и лечении атрофического гастрита является гастроскопия, которая позволяет внимательно осмотреть внутреннюю часть желудка и взять образец слизистой оболочки желудка для анализа.
В период обострения атрофического гастрита больному назначаются лекарственные препараты, снимающие болевой синдром и улучшающие процесс пищеварения.
Диета при атрофическом гастрите играет ключевую роль в лечебной терапии. Из рациона убираются продукты, оказывающие раздражающее действие на слизистую оболочку желудка. Нельзя употреблять в пищу острые и жирные блюда, приготовленные путем обжарки или копчения. Пища перед употреблением должна быть измельчена, например, в блендере, и иметь комфортную теплую температуру для слизистой оболочки желудка. Полезно есть легкие супы с добавлением нежирного мяса, приготовленные на овощном бульоне, а также овощные супы-пюре. Можно употреблять в пищу различные мягкие каши, например, манную, овсяную или рисовую. Из напитков рекомендуется отвар шиповника, кисели и сладкие компоты. Кисломолочные продукты, сладости и кислые фрукты стоит исключить из меню при гастрите.
Полезно есть легкие супы с добавлением нежирного мяса, приготовленные на овощном бульоне, а также овощные супы-пюре. Можно употреблять в пищу различные мягкие каши, например, манную, овсяную или рисовую. Из напитков рекомендуется отвар шиповника, кисели и сладкие компоты. Кисломолочные продукты, сладости и кислые фрукты стоит исключить из меню при гастрите.
Лечение народными средствами атрофического гастрита может проводиться в качестве дополнения к основной терапии, но только с разрешения врача. Наиболее эффективными народным методами являются отвары из лекарственных растений, таких как ромашка, шалфей, мята, зверобой и другие.
Прогноз и профилактика атрофического гастрита
Самым страшным осложнением хронического атрофического гастрита является рак желудка. В настоящее время гастроэнтерологам хорошо известны симптомы и лечение атрофического гастрита, поэтому рак желудка можно предотвратить. Для этого больному стоит пересмотреть свой рацион и образ жизни в целом. Самое главное – отказаться от курения и алкоголя, а также придерживаться диеты, которую необходимо не только в момент обострения гастрита, но и в периоды ремиссии.
Атрофический гастрит: прогнозы и перспективы
О.Я. Бабак,
д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите?
Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter Pylori (Н.Pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический.
Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите.
Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка.
Другие методы исследования – рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография – в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни?
Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый – длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант – в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем – к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем – к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим.
По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия – это неоплазия, другими словами – опухоль. Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака – до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β).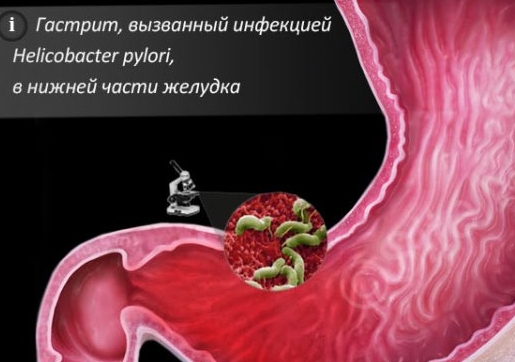 В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите.
Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori – это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека.
В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора – каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез – многоэтапный процесс, характеризующийся развитием хронического гастрита – первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге – к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Этот процесс называют именем описавшего его автора – каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез – многоэтапный процесс, характеризующийся развитием хронического гастрита – первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге – к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка?
Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних. При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка – первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии.
Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии – прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию.
Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка.
Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка.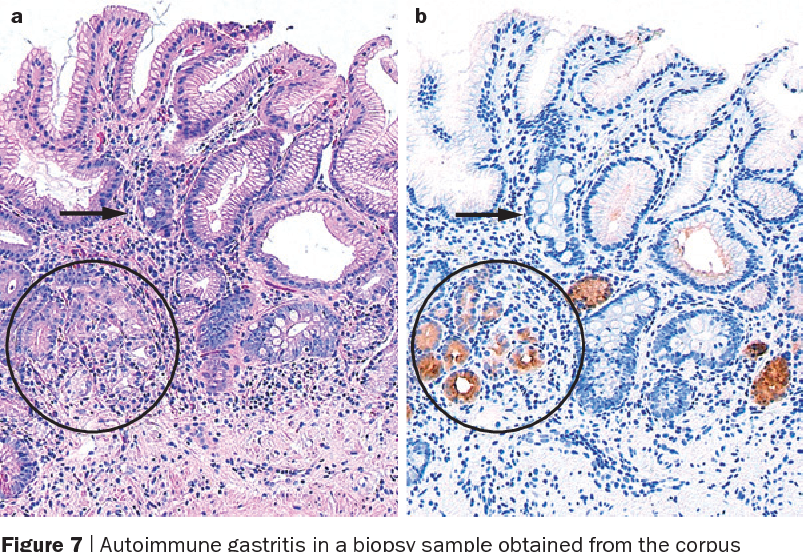
Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования.
Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) – неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрина-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток).
Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот.
Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17.
Совокупная точность тестовой панели в диагностике атрофического гастрита – около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного.
Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия.
В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода.
В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта – исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг.
Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori – Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут.
Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка.
Главная цель первичной профилактики атрофического гастрита – своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения.
Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований. Мониторирование – постоянное наблюдение с периодическим повторным обследованием – абсолютно обязательно для пациентов с атрофическим гастритом
Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования – эндоскопического, морфологического, гематологического (тестовой панели) и других – способствует его точной диагностике. Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература
1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11.
2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32.
3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19.
4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт – 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91.
5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal metaplasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. – 2000. – Vol. 45. – 1754-1762.
6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection – The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P. 167-180.
Как лечить антральный очаговый атрофический гастрит? — Вопрос гастроэнтерологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 69 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гинеколога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.23% вопросов.
Оставайтесь с нами и будьте здоровы!
Атрофический гастрит — причины, симптомы особенности диеты и лечения
Гастритом называют воспалительные процессы на слизистой желудка. Под атрофическим гастритом подразумевается воспалительно-дегенеративный процесс с потерей желудочных желез, отвечающий за выработку веществ расщепляющих пищу. Морфологической особенностью атрофического гастрита считается сокращение грандулоцитов (клетки секреторной железы слизистой оболочки желудка), с последующей заменой их простыми клетками вырабатывающими слизкую субстанцию. Широкая атрофия слизистой чаще всего обуславливается нарушением (уменьшением) секреции соляной кислоты и пепсина (фермент отвечающий за расщепление белков), приводя к пониженной кислотности. Иными словами атрофический гастрит с пониженной кислотностью способствует широкому распространению атрофических участков. При этом для атрофического гастрита с повышенной кислотностью (при гиперсекреции соляной кислоты и пепсиногена) характерно очаговое распространение. Очаговый атрофический гастрит представляет собой участки истощенной слизистой теля желудка с сокращением толщины и выраженной сосудистой сеткой. Помимо основной причины, чаще всего вызывающей атрофический гастрит – патогенной бактерии Helikobacter pylori, существуют ряд дополнительных причин: неправильное питание, бесконтрольное употребление алкоголя, предпочтение жирных и жаренных продуктов, отравление токсичными веществами, длительный прием лекарственных средств, раздражающих слизистую желудка и рефлюкс. Рефлюск – заброс содержимого кишечника в желудок, а в некоторый случаях в пищевод. При повторяющемся рефлюксе в пищевод, говорят от необходимости диагностики гастроэзофагеальной рефлюксной болезни, поскольку эта патология может провоцировать перерождение гастрита в предраковое состояние с последующим развитием онкологического заболевания. Рефлюкс эзофагит (ГЭРБ) может быть следствием асцита, который в свою очередь чаще всего проявляется при серьезном нарушении функции печени. Асцит печени провоцируется острым токсическим гепатитов, алкогольным гепатитом, очаговым фиброзом печени и не только. Таким образом патологии гастроэнтерологического характера очень тесно связанны, имеют схожие симптомы и требуют комплексного подхода.
Симптомы при атрофическом гастрите характерны клинической картине с нарушениями функций пищеварения, и проявляются тяжестью в желудке, преимущественно после принятия пищи, тошнотой, отрыжка после еды, часто в неприятным привкусом, общее недомогание и снижение веса, потеря аппетита и изжога. Особенными симптомами указывающими на атрофический гастрит, а не на иные отклонение кастроэнтерологической области – снижение зрения и необычная сухость кожи, как следствие нарушения усваивания витамина А из за ферментных отклонений в желудке.
Хронический атрофический гастрит, приводящий к существенному снижению кислотности в среде желудка, незамедлительно требуем заместительную терапию, в отсутствии которой наблюдаются все признаки нарушения пищеварительных процессов. При худшем сценарии, обострение атрофического гастрита может выразится в трансформации в онкологическую форму, иными словами в рак желудка.
Различают четыре основных разновидности заболевания: субатрофический гастрит – начальный этап атрофических процессов, очаговый атрофический гастрит – проявление очагов с атрофированной слизистой, замещенной клетками простого эпителия, антральный атрофический гастрит – достижение атрофическими процессами антрального отдела желудка, и мультифакторный – предраковое состояние с обширной площадью поражения. При этом заболевание классифицируют и по степени морфологических изменений: умеренный, выраженный и гиперпластический атрофический гастрит, при котором наблюдается явное изменение морфологической структуры желудка, в некоторых случаях с образованием кист и жировыми дегенеративными процессами.
Атрофический гастрит желудка требует незамедлительного вмешательства квалифицированных медиков, поскольку промедление может упустить момент перехода гастрита в рак и стоить жизни пациенту.
Над вопросом: можно ли вылечить атрофический гастрит, бились не один год величайшие светилы мира медицины и израильские врачи в том числе. Благодаря прогрессивным методам лечения гастрита в клиниках Израиля и использованию высоко технологичного, суперсовременного оборудования, лечение атрофического гастрита стало возможным и дает замечательные результаты при своевременном обращении.
Методы лечения атрофического гастрита зависят от симптомов, составляющих клиническую картину. После некоторых исследований состояния желудка, при помощи серологических методов исследования (иммунные тесты), гастродуоденоскопии (высокоинформативное исследование, применяемое израильскими медиками, дающее широкую картину о состоянии слизистой желудка) и биопсии слизистой (забор ткани при эндоскопии, для гистологического исследования (структура ткани)), врач назначит адекватные терапевтические меры.
Поскольку кислотность при атрофическом гастрите играет большую роль, медики делают попытки регулировать состояние желудочной среды при помощи диеты. Диета при атрофическом гастрите с пониженной кислотностью включает продукты, провоцирующие и раздражающие железы, ответственные за выработку пепсина и гастрина. Это одни из не многих случаев в гастроэнтерологии когда позволительно принимать некоторое количество жаренной пищи, при рекомендации врача, ягодные соки, позволительно употребления чая и кофе, а так же мясных и рыбных бульонов. При этом следует исключить ягоды содержащие крупные косточки, продукты с грубой клетчаткой, слишком жирную и копченную пищу.
Питание при атрофическом гастрите с повышенной кислотностью исключает все продукты провоцирующие секреторные железы желудка: жаренные продукты, пряности и посолы, копчения и маринады, кофе и газированные напитки. При этом варенная овсянка натощак, благотворно влияет на слизистую, так же рекомендуется варить «слизистые» супы и использованием риса, овсяных хлопьев, отварного картофеля.
Ответом израильских медиков на вопрос: как вылечить атрофический гастрит, стал целый комплекс мероприятий направленный на остановку дегенеративного процесса и восстановления нормальной функции пищеварения. Лечение хронического атрофического гастрита предусматривает использование медикаментозной терапии, в том числе витаминной (для поддержания метаболических процессов), применения медикаментов заместительной терапии (препараты содержащие ферменты для окисления среды желудка и нормализации пищеварения). Для исключение аутоиммунного компонента, при необходимости назначают глюкортикоиды, а так же возможно применение антигистаминных, седативных средств и гастроцитопротекторов.
Лечение атрофического гастрита в Израиле, позволяет применение радикальных методов при выявлении опасной метаплазии (изменения клеток), предшествующей раковым образованиям, и хирургическое вмешательство с частичной резекцией атрофированной слизистой желудка с последующим наложением анастомоза – искусственное соединение, в данном случае меж двенадцатиперстной кишкой и телом желудка.
Loading…Комплексная диагностика атрофического гастрита в хирургической клинике
на правах рукописи
Князев Михаил Викторович
«Комплексная диагностика атрофического гастрита в хирургической клинике».
14.00.27.-хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Москва-2008г.
□03451347
003451347
Работа выполнена в ФГУ Государственный научный центр лазерной медицины и в филиале «Мединцентр» Главного коммерческого управления по обслуживанию Дипломатического корпуса при МИД России.
Научный руководитель:
доктор медицинских наук, профессор Бурцев Илья Михайлович Официальные оппоненты:
доктор медицинских наук, профессор Харнас Сергей Саумовнч, доктор медицинских наук, профессор Королев Михаил Павлович
Ведущая организация:
Российский научный центр хирургии имени академика Б.В. Петровского
Защита состоится « 17 » ноября 2008г. в 14-00 часов на заседании Диссертационного совета Д.208.040.03 при Московской медицинской академии имени И.М.Сеченова (119991, г.Москва, ул.Трубецкая, дом 8,с троение2).
С диссертацией можно ознакомиться в Центральной Медицинской Научной Библиотеке ГОУ ВПО ММА им. И.М.Сеченова по адресу: 117998, г Москва, Нахимовский проспект, дом 49.
Автореферат разослан «16» октября 2008г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Шулутко Александр Михайлович
Список принятых сокращений слов и терминов.
АГА — атрофический гастрит антрального отдела желудка
АГТ — атрофический гастрит тела желудка
АИГ — аутоиммунный гастрит
AT Hp — антитела к бактерии Helicobacter pylori
АТПКЖ — антитела к париетальным клеткам желудка
АТТПО — антитела к тиреопексидазе щитовидной железы
Г17 — гастрин 17
ДПК — двенадцатиперстная кишка
дс — диагностическая специфичность
ДЧ — диагностическая чувствительность
ДЭ — диагностическая эффективность
Ил — интерлейкин
лдпк — луковица двенадцатиперстной кишки
Пг1 — пепсиноген 1
ПЦОР — прогностическая ценность отрицательного результата
ПЦПР — прогностическая ценность положительного результата
РЖ — рак желудка
сож — слизистая оболочка желудка
ФНО — фактор некроза опухоли
ХАГ — хронический атрофический гастрит
ЯБ — язвенная болезнь
ЯЛ — язва луковицы двенадцатиперстной кишки
Hp — бактерия Helicobacter pylori
Актуальность проблемы.
Злокачественные новообразования слизистой желудка развиваются на фоне предшествующих «предраковых» изменений, к которым в первую очередь относится хронический атрофический гастрит (ХАГ) (Аруин Л.И.). При раке желудка в 61% случаев выявляется атрофия эпителия(Соггеа Р.). При длительном динамическом наблюдении за больными с ХАГ обнаружено, что через 10 лет после диагностирования гастрита, рак желудка развивается у 1 из 150 наблюдаемых пациентов, а через 15 лет — около 10% больных заболевают раком . Ежегодная частота возникновения ХАГ в популяции составляет 1-3% (Filipe M.I). Существует параллелизм между распространенностью атрофического гастрита, кишечной метаплазией и аденокарциномой (Rokkas Т). Наличие кишечной метаплазии увеличивает вероятность разви-
тия рака желудка в 10 раз . Риск появления рака желудка повышается параллельно тяжести атрофического гастрита.
Стандартная диагностика ХАГ основана на эндоскопии и морфологическом исследовании биопсийного материала. Трудность морфологической диагностики атрофии связана с возможностью её имитации при воспалительном процессе в СОЖ. Достоверность диагностики основана на повторном исследовании биоптатов после курса противовоспалительной тера-пии(Аруин Л.И). Однако заключение носит локальный характер и отражает состояние СОЖ в точке биопсии. Поэтому возникает необходимость в получении информации о функциональной активности и структуре слизистой оболочки желудка в целом.
Новое поколение эндоскопов позволяет оценивать на субгистологическом уровне строение СОЖ за счет оптического увеличения до 115 раз. С помощью эндоскопической оптической когерентной томографии проводится лазерное сканирование и получение изображения структур стенки желудка. Основной упор при применении этих методов делается на диагностику локальных поражений, их дифференцировку для выявления ранних форм рака. Вопросы идентификации ХАГ этими новыми методами не достаточно изучены.
Соотношение функциональных и морфологических нарушений при атрофии слизистой желудка определяется по уровню выделения соляной кислоты, ферментов и гормонов слизистой желудка.¡ропеп Р.а1 е1). Сбой гуморальной регуляции
является первой фазой нарушений «клеточного пути», приводящего к запуску звеньев канцерогенеза в слизистой желудка .
Определение диагностической ценности «серологической биопсии» и других современных эндоскопических методик в сравнении со стандартной эндоскопией с исследованием биоптатов; изучение последовательности и необходимости такого многопрофильного обследования, для раннего выявления атрофического гастрита и рака, в доступной научной литературе не представлено или объективно не изучено, что ограничивает их практическое применение.
Цель исследования.
Улучшить и оценить эффективность современной комплексной эндоскопической и серологической диагностики атрофического гастрита.
Задачи исследования. 1 .Определить информативность диагностики атрофии СОЖ по уровню сывороточного Пг1и стимулированного Г17, в сравнении со стандартной эндоскопией исследованием биоптата при Нр-инфицированности желудка.
2.Выявить частоту определения атрофии СОЖ при АИГ, а так же в сочетании с аутоиммунноым тироидитом по серологическим показателям и эндоскопическим признакам.
3.Установишь особенности микроструктурного строения СОЖ при атрофии с помощью эндоскопической оптической когерентной томографии и определить их прогностическую значимость.
4,Определить признаки строения СОЖ при атрофии с помощью эндоскопии с оптическим увеличением, оценить их значимость.
Научная новизна.
• Проведена комплексная оценка возможности диагностики атрофического гастрита с помощью серологических показателей экскреторной функции желудка, эндоскопии с оптическим увеличением и эндоскопической оптической когерентной томографии.
• Определены характерные для атрофического гастрита микроструктурные изменения строения желудочных желез, визуализируемые при эндоскопии с оптическим увеличением.
• Методом эндоскопии с оптическим увеличением выявлены особенности строения желудочных желез при атрофии СОЖ, подтвержденные серологическим и морфологическим методами.
Практическая значимость.
Результаты проведенной работы позволили повысить выявляе-
мость больных атрофическим гастритом, сформировать алгоритм комплексного обследования и наблюдения за этими больными, сформировать группы риска по развитию рака желудка.
Сочетание атрофического аутоиммунного гастрита с другими аутоиммунными внежелудочными заболеваниями, позволило оптимизировать комплексное лечение, мониторировать процесс регрессирования атрофиче-ских изменений при восстановлении ферментной и гормональной активности слизистой оболочки желудка.
Разработка критериев диагностики атрофического поражения СОЖ при эндоскопии с оптическим увеличением, позволило оценить регресс атрофии СОЖ в результате адекватного этиопатогенетического лечения.
Основные положения, выносимые на защиту.
• Серологический метод определения атрофии слизистой желудка по уровню стимулированного Пг1 и Г17 (серологическая биопсия) является чувствительным и специфичным, дает возможность комплексно оценить морфо-функциональное состояние слизистой и распространение атрофии по отделам желудка.
• Эндоскопия с оптическим увеличением позволяет диагностировать атрофию слизистой оболочки желудка. Диагностика основана на визуальном выявлении строения желудочных желез по тубулярному типу и нерегулярному рисунку собирательных венул, исчезновению типичного для этого отдела строения желез.
• Атрофический аутоиммунный гастрит связан с развитием очаговых гиперпластических поражений слизистой с высокой пролиферативной активностью и дисплазией и требует активного эндохирургического лечения.
• Комплексное сочетание серологического и эндоскопического методов диагностики позволяет улучшить выявляемость атрофического гастрита, который требуют динамического эндоскопического наблюдения и комбинированного лечения.
Реализация результатов работы.
Разработанный комплексный подход к диагностике атрофического гастрита внедрен в клиническую практику филиала «Мединцентр» Глав УпДК при МИД России.
Апробация работы.
Диссертация обсуждена и апробирована на совместном заседании клинического и медико-биологического отделов ФГУ « ГНЦ лазерной медицины Росздрава» и врачей городской клинической больницы № 51 от 25 июня 2008г. Работа выполнена в ФГУ « ГНЦ лазерной медицины Росздрава» и филиале «Мединцентр» ГлавУпДК при МИД России.
Объём и структура диссертации.
Работа написана на русском языке, состоит из введения, обзора литературы, 3 глав собственных исследования, заключения, выводов, списка литературы. Работа изложена на 102 страницах компьютерной печати, содержит 27 таблиц и 24 рисунков. Список литературы включает в себя 14 отечественных и 88 зарубежных авторов.
Содержание работы.
Клиническая характеристика больных и методы исследования.
В работе изучены пациенты, находящиеся на лечении в хирургическом отделе филиала «Мединцентр» ГлавУ пДК при МИД России в период с 2004 по 2007г.г.. В исследование включено 243 (мужчин 97,женщин 146) па-
циентов с диспепсическими жалобами, средний возраст 47 +- 13.5. В амбу-латорно-поликлинических условиях обследовано 195 пациентов, и 48 пациентов, находящихся на стационарном лечении. Проводилось полное клиническое обследование, включающее в себя физикальные и инструментальные методы (ультразвуковые, рентгенологические, функциональные), консультации соответствующих специалистов.
В работе применялась методика сравнительного анализа. В качестве эталона использовались данные морфологического исследования гастро-биоптатов у всех испытуемых. Проводилось сравнение выявленной атрофии при применении методов эндоскопии с оптическим увеличением, ЭОКТ и лабораторных тестов с эталоном. Всем испытуемым проводился лабораторный метод идентификации атрофии, аутоиммунного поражения СОЖ, Нр инфекции, морфологическое исследование гастробиоптатов, а так же один из инструментальных методов исследования (эндоскопия с оптическим увеличением, либо ЭОКТ). Количество пациентов по каждому виду инструментального и лабораторного методам исследования представлены в таблице 1.
Таблица 1. Количество пациентов в выборке по каждому методу диагностики.
~~~ —- __ _ Лабораторные тесты Метод диагностики ~~~ —-___ Пг1, Г17 Нр Ат ПКЖ Ат ТПО
Гастроскопия стандартная, морфологическое исследование биоптатов 194 194 194 43
Эндоскопия с оптическим увеличением, морфологическое исследование биоптатов 34 34 34 14
Эндоскопическая оптическая когерентная томография, морфологическое исследование биоптатов 15 13 4 4
Диагностическая эндоскопия выполнялась 194 , из них в 34 случаях было про-
ведена эндоскопия в режиме оптического увеличения изображения в 115 раз. Савельев B.C. Буянов В.М. соав.)
Эндоскопия с оптическим увеличением включала в себя: эндоскопическое исследование гастровидеоскопом Gif Q160Z Exera I, Олимпус, но общепринятым стандартам и методикой. Проводилось фотографирование в цифровом режиме основных отделов пищевода, желудка и ДПК. Изображение СОЖ в режиме увеличения фиксировалось функцией «freeze» и фотографировалось. Витальное окрашивание метиленовым синим через распыляющую канюля, проведенную по биопсийному каналу эндоскопа. Забор материала для гистоморфологического исследования осуществлялся эндоскопическими стандартными щипцами.
В настоящей работе при увеличительной эндоскопии использовался визуально-аналоговый метод при описании микроструктур желудочных желез и микрососудистой сети но классификации Sakaki. Классификация Sakaki представлена на рисунке 2. Имеется основных 4 типа строения желудочных желез и их комбинация, в совокупности составляют 7 признаков.
Рисунок 2. Классификация строения желудочных желез по Sakaki.A: Dotted pits — Пунктирные ямки, В: Short linear pits -Короткие линейные ямки, С: Stripe grooves -Углубления полосы,D: Meshlike -Подобный сетке.
. Для характеристики изменений микрососудистой сети при эндоскопии с оптическим увеличением использовались критерии, разработанные Yagi а! а!..
Метод эндоскопической оптической когерентной томографии (ЭОКТ) заключается в сканировании СОЖ и получении изображения в поперечном разрезе с разрешением 10-15 мкм. Используется инфракрасная волна лазера с мощностью 1 мВт., длинна волны 1.3 уш,. Низкокогерентное излучение поступает по зонду 2,4 мм в диаметре длинной 2.1 м, проведенного по биопсийному каналу эндоскопа. Зонд приставляется к поверхности
СОЖ и производится сканирование. Глубина проникновения волны до 2 мм. Использование ЭОКТ позволяет получить изображение микроструктуры СОЖ и поделизистого слоя, лимфатических фолликулов, крипт, кровеносных сосудов. Проводилась эзофагога-стровидеоскопия по общепринятой методике. По биопсийному каналу проводился зонд, присоединенный к оптическому когерентному томографу. Зонд прикасался к поверхности СОЖ. Полученные томографические изображения сохранялись в виде цифровых фотографий в компьютере.
Для определения концентрации Г17, Пг1 и титра антител класса IgG использовались специфические наборы для иммуноферментного анализа (ИФА) согласно инструкции фирмы производителя Biohit Pic. Все методы основывались на измерении абсорбции после реакции переоксидации при длине волны 450 нм. Согласно инструкции фирмы-производителя, маркером атрофии слизистой оболочки: желудка считали уровни: ПГ1<25 мкг\л для фундалыюго отдела, G-17 < 5 пмоль\л для антралыюго отдела, и G-17 от 5 до 10 пмоль\л в сочетании с ПГ1 менее 50 мкг\л умеренно выраженная атрофия.
Титр антител к париетальным клеткам желудка определяли иммунофлюорис-центным сандвич методом фирмы «Имко»США. При выявлении антител к париетальным клеткам желудка титр до 1: 20 негативный и 1:20-и выше позитивный. Уровень антител к тиреопексидазе щитовидной железы титр от 1 до 15 оптимальный и от 16 и выше — повышенным. При выявление антител к H.pylori титр (EIU-иммуноферментная едини-ца)34 EIU негативный,34-37 EIU сомнительный, 38 EIU и выше позитивный результат.
Статистическую обработку данных осуществляли при помощи компьютерной программы для непараметричесих данных, тесты Манна-Уитни, кси-квадрат Statistica 6,0 StatsofCt. .
Результаты исследования и их обсуждение.
Для сравнительной характеристики возможности диагностики ат-рофических изменений со стороны СОЖ по вычислению уровня Пг1 и Г17 по сравнению с традиционной эндоскопической и морфологической методиками были отобраны 160 взрослый пациента (м\ж 76\84, средний возраст 49±8.9). В зависимости от уровня Пг1 и Г17 и титра Ат Нр пациенты каждой группы были распределены и классифицированы согласно диагностическому алгоритму по (Siponen Р.). Была выделена группа с атрофическим поражением СОЖ.
— и -
Были выделены группы Нр-негативных 67 и 11р+позитивных 93случаев. В группе Нр негативных по уровню продуцирования Пг1 и Г17 выявлено 61 (91%) случаев с нормальной СОЖ и 6 (9%) атрофии, из них атрофический аутоиммунный гастрит тела желудка в 5 случаях и 1 случай мультифокально-го атрофического аутоиммунного гастрита тела и антрума.
В подгруппе с уровнем Пг1 и Г17 соответствующие нормотрофии СОЖ (п=61) выявлены 3(5 %) случаев с эндоскопической картиной атрофии и кишечной метаплазий, подтвержденной гистоморфологней биоптатов. Показатели Пг1 и Г17 в 58 случаях эндоморфологической нормотрофии составляли 115,7± 86,9мкг\л и 18,5±18,1пмоль\л соответственно. Показатели Пг1 и Г17 в 3 случаях с эндоморфологической атрофией, вписываются в диапазон физиологической нормы и составляли для Пг1 90,3±35,1 мкг\л и 15,4±8,9 рмоль\л для Г17. Различие между двумя средними значениями Пг1 в группе с серологической нормотрофией и группе с гистоморфологической атрофией проведено с помощью теста Манна-Уитни. Рассчитанный Р равен 0.48. т.е Р>0.05, на этом основании можно утверждать, что различия между средними значениями Пг1 в сравниваемых группах статистически незначимы. Аналогичное вычисление проведено так же в отношении Г17 и составили Р=0,69, т.е. Р>0.05. Между средними значениями Г17 в сравниваемых группах нет статистически значимых различий.
Вторую группу составили 93 пациента, у которых титр антител к Нр был выше 38 ЕШ. По данным серологических тестов выявлено 73 пациента, у которых показатели Пг1 и Г17 соответствовали неатрофическому гастриту, и 20 пациентов с серологическим признаками атрофии.
Совпадение со стандартной эндоскопической диагностикой отмечалось в 69% случаев. Для определения возможности диагностирования атрофии СОЖ по более точным данным уровня Пг1 и Г17 были выделены 2 подгруппы: подгруппа 1 без морфологических признаков атрофии (п=54) и подгруппа 2 с морфологическими признаками атрофии (п=19). Распределе-
ние Нр+ позитивных пациентов представлено на рисунке 3. Распределения случаев по нозологии в каждой из подгрупп представлены в таблице 4.
Рисунок 3.Распределение случаев по типу гастрита в зависимости от серологических показателей среди Нр позитивных пациентов (п=93).
Таблица 4.Распределение случаев по нозологиям при неатрофическом гастрите у Нр+ по_зитивных в подгруппах 1 и 2. __
Тип гастрита по лабораторно серологическим данным Диагноз нозологический (эндоскопический) подгруппа 1 (нормотрофия серологическая ) подгруппа 2 (атрофия эндо-морфологическая) Всего:
п= 54 п=19 N=73
Неатрофический гастрит НР+ Атрофический гастрит антрума 37 7 44
Язва желудка 2 2 4
Деформация луковицы ДПК, бульбит 3 20% 3 37% 6
ЯЛ 8 4 12
Рсфлюкс-эзофагит 4 2 6
Очаговый гипертрофический гастрит, полипы СОЖ 4 4
Рак желудка — 2 2
В подгруппе 1 уровень Г17 практически равняется нормальному показателю и составляет 22,8+-15,6 ршо1\1, а в подгруппе 2 уровень Г17 определялся ниже на 20.1% и составлял 18,2+-10,9 ршо1\1. Уровень Пг1 в подгруппе 2 составлял 181,2 мкг\л. При статистическом сравнении различия средних показателей Пг1 и Г17 в группах 1 и 2 по методу Манна-Уитни для
Пг1 и Г17 статистически незначимы (Р=0,1044, и 0,24 соответственно Р> 0,05).
В группе Нр+ позитивных пациентов выявлено 20 (21%) случаев атрофического типа гастрита различных отделов СОЖ по серологическими данным, из них АГТ — 4 случая, АГА-15, АГТ и АГА-1 случай. Эндоскопические диагнозы при каждом типе гастрита представлены в таблице 5.
Среди 20 случаев в группе с серологическими показателями атрофии при стандартной эндоскопии удалось установить этот диагноз в 13 случаях (65%), при морфологическом исследовании диагноз атрофии выявлялся в 18 случаях.
Таблица 5.Эндоскопические диагнозы при различных типах атрофического гастрита у Нр+познтнвных.пациентов (п=20). __
Тип гастрита по лабора-торно-ссрологичсским данным К-во N=20 Диагноз эндоскопический К-во Пг1 Г17
Атрофичсский гастрит тела 4 Атрофичсский гастрит тела желудка 4 15,2±7,8 66±40,8.
Атрофичсский гастрит антрума 15 Атрофичсский гастрит антрума 9 135± 128,3 2,2±1,7
Язва желудка 1
Язва двенадцатиперстной кишки 3
Рубцовая деформация луковицы двенадцатиперстной кишки, бульбит 3
Очаговый гипертрофический гастрит 1
Атрофичсский гастрит антрума и тела желудка 1 Рак желудка 1 22 8
В группе пациентов с признаками атрофии СОЖ отмечается более
высокая заболеваемость язвенной болезнью желудка и ДПК и РЖ. Так в группе АГА выявлены 1 случай язвы желудка, 3 язвы луковицы ДПК в стадии обострения, 3 рубцовой деформации с бульбитом луковицы ДПК (стадия ремиссии язвы луковицы ДПК). Относительная частота заболеваемости язвенной болезнью желудка в группе АГА превышает в 2 раза составляет г=0.1, при отсутствии атрофии г=0.05 (р=0.85). Относительная частота заболеваемости язвенной болезнью желудка превышает в 3 раза г =0,46 при атрофии СОЖ и г =0,16 без неё (р=0.26). В подгруппе 2 с выявленной атрофией ЯЛ составляла 37% (4), против 20% (8) в подгруппе 1 .. Общее количество
ЯЖ и ЯЛ при атрофии у Нр позитивных в 2.5раза больше, чем в случаях без атрофии СОЖ.
В группе с атрофией слизистой в теле желудка выявлено 3 случая РЖ (характеристика этих случаев представлена в таблице 6), а так же по одному случаю аденокарциномы яичника и мочевого пузыря, 2 случая аде-номатозной очаговой гиперплазии. Все пациенты оперированы. Показатели Пг и Г17 при язвенной форме РЖ имели нормальные значения, что объясняется локальным поражением с сохранением функциональной активности
париетальных клеток желудка.
Таблица 6. Показатели Пг1 и Г17 при выявленных случаях РЖ.
Случай РЖ Диагноз и тип РЖ Локализация в желудке Пг1 Г17
А Низкодифференцированная аденокарцинома язвенная форма Тело желудка малая кривизна 96 мкгУп, 9 пмоль\л
В Умеренно дифференцированная аденокарцинома Антральный отдел, привратник 247 мкг\л, 6.4 пмоль\л
С Умеренно дифференцированная аденокарцинома Тело и антральный отдел 22 мкг\л, 8 пмоль\л
М=7,8±1,3
Вычислены ДЧ и ДС и составляли 62 и 98% соответственно для Нр
негативных 49 и 96% для Нр позитивных. ДЭ серологического метода составила 89 и 72,5%.Эти показатели соответствуют литературным данным, за исключение более низкого ДЧ у Нр позитивных. Незначительное расхождение по чувствительности метода обусловлено учетом всех случаев обнаружения морфологических признаков атрофии вне зависимости от степени выраженности и распространенности по отделам желудка. Исследователи в своих работах определяли ДЧ и ДС метода серологической биопсии для ХАГ, при котором атрофия считается только в теле желудка. В нашей работе учитывалась атрофия СОЖ как в теле, так и в антральном отделах желудка, и при вычислении ДЧ имеет значение несколько ниже литературных.. Метод серологической биопсии при показателях Пг 25 мкг\л и Г17 5
пмоль\л позволил определять атрофию вне зависимости от инфицирован-ности Нр.
Атрофический гастрит, вызванный аутоиммунным поражением СОЖ, является второй после Нр инфекции самой частой причиной его возникновения. Диагноз АИГ устанавливается по обнаружению аутоантител. Эндоскопические и морфологические признаки атрофии СОЖ при АИГ и ХАГ идентичны, поэтому для проверки возможности диагностирования АИГ с помощью серологического метода проведено комплексное обследование 198 пациентов (м\ж 73\125 средний возраст 41±5.6). Выявлено 13 случаев АИГ с повышенным титром Ат ПКЖ, что составило 6,5%, и 19 случаев ат-рофического гастрита тела желудка по серологическим данным. При сопоставлении в 69% из 13 случаев АИГ определялась атрофия, из них 4 были Нр+ позитивными. Титр антител к париетальным клеткам желудка колебался от 1:80 до 1:256000ед. При АИГ отмечены гипопепсиногенемия, гиперга-стринемия > 65 рмоль\л, и отсутсвием Нр. Было отмечено полное совпадение серологической и морфологической диагностики атрофического поражения СОЖ при аутоиммунном гастрите.
Учитывая, что по литературным данным АИГ чаще всего сочетается с аутоиммунным тироидитом (горе1тап а! е1.), проведено исследования с целью определения возможности диагностирования по уровню Пг1 и Г17 атрофии СОЖ при сочетанном аутоиммунном поражении желудка и щитовидной железы, осуществлено вычисление этих показателей в зависимости от уровня титров антител к тиреопепсидазе щитовидной железы (Ат ТПО) и присутствия антител к париетальным клеткам желудка (Ат ПКЖ). Были обследованы 43 пациента (м\ж 12\41, средний возраст 37±9.7) с различными видами гастропатии. Пациенты были разделены на 3 группы и представлены в таблице 7: группа «С»- контрольная 27 случаев с нормальным уровнем Ат ТПО. (Пг и Г17 =144,3±112,1 мкг\л и 23,7±24,8 пмоль\л), группа «В»- 10 случаев с повышенным уровнем АтТПО и с нормотрофией СОЖ, т.е с нормальным уровнем Пг1 и Г17. (142,3±102,1 мкг\л и 35,6
±41,7пмоль\л), группа «А»- 6 случаев с повышенным уровнем АтТПО и серологическими признаками атрофии в теле, уровнь Пг1 и Г17. (8,2±3,6 мкг\л и 79,4±20,2пмоль\л)
В группе С из 27 пациентов в 1 случае (3,7%) было сочетание с АИГ. При показателях Ат ТПО выше нормы АИГ встречается в 20% случаев при нормотрофических показателях Пг1 и Г17 (Группа В), в 83% случаев при серологических показателях атрофии СОЖ. (группа А) При сочетании высоких титров Ат ТПО и высоких титров АтПКЖ морфологические признаки атрофии отмечены в 63%, против 29% при нормальных показателях Ат ТПО. Из 43 случаев атрофия слизистой в теле желудка выявлена в 6 случаях, которые имели высокие титры антител как к ТПО, так и ПКЖ с развитием мультифокальной атрофии. В группе с нормальным уровнем титров Ат ТПО атрофический гастрит в теле не наблюдался, отмечена атрофия в антруме в 29%. Таким образом, аутоиммунный тироидит является отягощающим фактором при АИГ, и в 2 раза чаще вызывает мультифокальную атрофию СОЖ..
Таблица 7.Распределения пациентов с одновременным определением Ат ТПО , Ат ПКЖ и
Серологическая диагностика Эндо-морфол, диагностика
группа п Ат ПКЖ Пг1. Г17 АГА \% АГТ\% АГА+ АГТ\%
к-во\ %
1 2 3 4 5 6 7 8 9
АтТПО титр Пг1 Г17
С норма 27 1\ 3.7 % 125,4 ±70,0 18,4±13,4 8\ 29% — 8\ 29%
В высокий 10 2\ 20 % 104,3±68,7 24,0±28,8 4\ 40% — 10*\
А высокий 6 5\ 83% 8,2 ±3,6 79,4±20,2 6\ 100 % б\ 100 % 63%
По литературным данным, риск развития рака желудка выше при фундальном аутоиммунном атрофическом гастрите, чем при просто атрофи-ческом фундальном гастрите. Высокую степень пролиферативной активности нам удалось проиллюстрировать на выявлении у пациентов с АИГ с выраженной атрофией, установленной по данным серологической биопсии. Из 6 таких пациентов в 4 случаях определялись очаговые гипертрофиче-
ские образования на слизистой желудка, в основном локализовавшиеся в теле и переходной зоне. Такие образования имеют полиморфизм строения от плоско возвышающихся до полиповидных, от нескольких миллиметров до нескольких сантиметров. Таких наблюдений только 4 случая, и для подтверждения достоверности этой тенденции в изменении СОЖ требуется дальнейшее накопление материала.
У 22 пациентов с АИГ были ретроспективно за последние 5 лет проверены показатели красной крови и компоненты синтеза гемма (гемоглобин, эритроциты, сывороточное железо, витамин В12, фоллаты, ферритин, трансферритин, эритропоэтин). В литературе остается спорный вопрос о развитии других видов анемии при ХАГ кроме В12 дефицитной, авторы которых утверждают об отсутствии прямой связи развития анемии и атрофического гастрита и полагают, что она связана с хроническими кровопотерями. В нашем исследовании нам удалось проследить развитие анемии в 12 случаях, из которых в 3 случаях анемия носила выраженный характер, в 9-скрытый, но имелся дефицит как минимум 2 компонентов гемапоэза. Таким образом, АИГ представляется гораздо более сложной проблемой с высоким риском развития РЖ.
Метод серологической биопсии при показателях Пг 25 мкг\л и Г17 5 пмоль\л позволил определять атрофию вне зависимости от инфицированное™ Нр или аутоиммунном поражении. Выявлено 15 случаев атрофии слизистой антрального отдела желудка (все Нр+) и 19 случаев атрофии слизистой тела желудка (6 Нр-,13 Нр+), из которых 9 имели аутоиммунный характер поражения.
В работе было вычислено, что при сочетании АИГ и повышенного уровня АТ ТПО (тироидит) атрофия слизистой в теле желудка возникает почти в 2 раза чаще и является отягощающим фактором.
Применение метода серологической биопсии позволило выявлять атрофическое поражение слизистой желудка, определять природу этого поражения (инфекционное или аутоиммунное), топографию и распространение
на отделы желудка, степень функциональной выраженности. Полученные данные позволили доказать отягощающую роль атрофии СОЖ в формировании язвенной болезни, РЖ, аденоматозных предраковых изменений и карциномы внежелудочной локализации. Высокая диагностическая эффективность метода серологической биопсии позволила использовать его в дальнейшей работе по возможности определения атрофии СОЖ при использовании методов ЭОКТ и эндоскопии с оптическим увеличением.
Для проведения сравнительного анализа возможности выявления атрофии СОЖ с помощью ЭОКТ было проведено комплексное исследование 15 пациентам с различной гастроэнтерологической патологией. Пациенты распределились по полу м-7, ж-8, по возрасту 43±8,7 , НР позитивные 7 -случаев. Было проведено визуально аналоговое сравнение ОКТ изображений у Нр позитивных (7 случаев) и негативных пациентов (группа контрольная 6 случаев) для выявления отличительных признаков при \нр инфицированное™.. У Пр позитиыных были определены 4 отличительных признака : более плотный рисунок слизистой, присутствие внутрислизистых микрокист, расширение первого слоя слизистой, более выраженный рисунок по-сдслизистого слоя. В контрольной группе отмечалось более гомогенное распределение структур слизистого и подслизистого слоев. Представлено на рисунке 8 .
Рисунок 8. ЭОКТ изображения тела и антрального отделов желудка характерные для Нр позитивных и негативных пациентов.
Среди всех 15 пациентов, которым было выполнено ЭОКТ, выявлено 9 с атрофией СОЖ подтвержденных гнстоморфологическими данными. Из них в 4 случаях по показателям Пг1 и Г17 была установлена мультифокальная атрофия. Из 9 случаев оптических когерентных изображений соответствующих атрофии СОЖ были проверены 3 признака, каждый признак имел два варианта интерпретации. Этими признаками были толщина слизистого слоя (более или менее1 мм), гомогенность строения (равномерное или неравномерное) и визуализация слоев стенки желудка (не менее 4 или не менее 2 слоев). Количественно каждый признак был представлен следующим образом и отражено в таблице 9.
Таблица 9.Количественное распределение признаков при ЭОКТ сканирования атрофии
СОЖ(п=9).
Признак К-во случаев
Неравномерность строения СОЖ 3 ; -
Визуализация 4 слоев СОЖ 3 : -
Толщина слизистой более 1 мм 4 :
толщина слизистой менее 1 мм 5 : :
Визуализация 2 слоев СОЖ 6
Равномерность строения СОЖ 6 е :
Самым распространенными признаками оказались равномерность строения СОЖ и визуализация не менее 2 слоев, которые встречаются в 6 случаях. Однако эти же признаки являются определяющими при нормотро-фии, взятой за контроль. Для выявления ЭОКТ признаков атрофии СОЖ проведен анализ сканирующих изображений пациентов не только с гнстоморфологическими признаками атрофии СОЖ, но и с мультифокальной атрофией, подтвержденной серологическим тестом (4 случая).
При визуально аналоговом анализе ОКТ изображения СОЖ при атрофии не удалось выявить кардинальных доминантных признаков, отличающих сканирующие изображения при нормотрофии, а также при атрофии установленной как морфологическим, так и серологическими методами
По литературным данным метод ЭОКТ хорошо себя зарекомендовал при диагностике очаговых поражений слизистой, когда есть возможность сравнения пораженных и нормальных участков слизистой . Необходи-
мо продолжить изучение в этом направлении изучение возможности применения ЭОКТ для диагностики атрофических поражений.
Для определения закономерности строения структуры слизистой тела и антрального отделов желудка при атрофическом гастрите было проведена эндоскопия с увеличением у 30 пациентов, м\ж-12\18 , средний возраст 33+-6.7. Были выявлено 12 случаев морфологически подтвержденных признаков атрофии СОЖ, из них в 5 случаях сопровождались серологическими признаками атрофии, из которых аутоиммунный характер поражения был в 4 случаях. Контрольную группу В составили 18 (нормоторфия) пациента без серологических и морфологических признаков атрофии. Распределение пациентов представлено в таблице 10. За стандарт строения желудочных желез использовались схематические изображения желудочных желез по классификации Закакт. Проведен сравнительный анализ присутствия типов строения желудочных желез при эндоскопии с увеличением в теле и антральном отделах желудка между группами контрольной 18 случаев и с атрофией 12 случаев, подтвержденной морфологическими данными. Аналогичный анализ проведен в группах нормотрофии 25случаев и атрофии 5 случаев, подтвержденной серологическими методами.
Таблица 10. Распределение случаев при эндоскопии с оптическим увеличением
Всего п=30
Морфологический уровень в т.ч.: Атрофия 12 Нормотрофия 18 (контрольная группа В)
Серологическая диагностика в т.ч.: Атрофия 5 Нормотрофия 25
Аутоиммунный гастрит 4
При анализе полученных результатов отмечено, что при атрофии СОЖ структура желудочных желез сохраняется типичной и соответствует норме в антральном отделе желудка В,ВС, С, СО. Эти типы строения желез присутствуют во всех группах, независимо от метода определения атрофии СОЖ. В теле желудка появляется полиморфизм строения желудочных желез: помимо нормального строения желез тип А и АВ появляются промежуточные структуры ВС и структуры, характерные для антрального отдела
С и СО. Признаки С и СО в группе атрофии СОЖ установленной морфологическим методом составляет 33%, а в группе с серологическими признаками атрофии составляет 80%., из которых при ЛИГ 100%.. Данные отражены в таблице 11
Таблица 11. Распределение типов строения желудочных желез СОЖ при эндоскопии с увеличением (п=30). Серым 0 прямоугольником выделены нормальные изменения СОЖ соответственно отделу желудка_
Распределение признаков по отделам желудка
тело антрум
! 2 3 4 5 6
Диагностика и метод \ заключение тип признака К-во тип признака К-во
Морфология 1 Атрофия 12 АВ.В ВС C.CD 6, 2, 4. C.CD 12
2 Нормотрофия 18 A.AB. 18 C.CD ВС 16, 2
Серология 3 Атрофия 5 C.CD ВС 4, I C.CD 5
4 Нормотрофия 25 А.АВ 25 CCD в 22, 3
5 аутоиммунный гастрит 4 C.CD 4 С,CD 4
Частота присутствия признаков С и СО в теле проверена с помощью
вычисления доверительного интервала.мл = 0,204, 1=1.96, ДК= 95%, р=0,05 границы ДИ =[0,01; 0,78] ДИ не включает 0, следовательно, различия между группами по признаку «С, СО» являются статистически значимыми.
Рисунок 12. Тубулярное строение желудочных желез в теле желудка при атрофии СОЖ ( эндоскопия с оптическим увеличением ), а)эндофотография, б) схема строения в норме, в) схема строения СОЖ при атрофии..
На рисунке 12 отображены эндофотография случая перестройки
строение структуры желудочных желез в теле по тубулярному типу и схематическое строение СОЖ в норме и при атрофии. В контрольной группе с
нормотрофией строение слизистой отделов желудка при увеличивающей эндоскопии соответствовало типичной нормальной картине. В литературе есть подтверждение, что при атрофии происходит потеря строения желез по типу «пчелиный соты» и нарушения строения собирательных венул а! е1.)
Второй структурой для визуально-аналогового анализа атрофическо-го изменения СОЖ была использован вид микроваскулярной сети СОЖ при эндоскопии с оптическим увеличением. В качестве признаков для характеристики строения и вида микроваскулярной сети при атрофии СОЖ взяты были 4 и представлены : Е- наличие красного сосудистого капиллярного рисунка в центре желудочного валика; Н- соотношение ширины сосудистого рисунка и эпителиального в желудочной железе более 1\2 соответственно; К- наличие собирательных венул и структура их виде « морской звезды»; М- неправильный и неупорядоченный рисунок собирательной венулы. Таблица 13. Распределение признаков вида микроваскулярной сети эндоскопии с увели-
Распределение признаков
1 2 3 4
Диагностика и метод заключение тип признака К-во
Морфология 1 Атрофия 12 Е К Н М 3 (25%) 4 4 8 (66%)
2 Нормотрофия 18 Е К Н М 3 (16%) 3 3 15(82%)
Серология 3 Атрофия 5 Е К Н м 1 (20%) 1 2 3 (60%)
4 Нормотрофия 25 Е К Н М 4(16%) 3 4 19(76%)
Самым распространенным признаком является «М»- неправильный и неупорядоченный рисунок собирательной венулы. Он практически одинаково распространен как при атрофии СОЖ, так и при нормотрофии (66, 82% соответственно). При атрофии, выявленной морфологическими методами доля признака М составляет 66%, при серологическом методе 60%. На все
остальные признаки (Е, К, Н) приходится от 33 до 18%.. Представлены в таблице 14.
Целью статистического анализа было сравнить группу морфологической атрофии и нормотрофии по относительной частоте представления признаков «Е» и «М». мд=0,01097, 1=1.96 , ДК= 95%, р=0,05 границы ДИ =[0,06; 0Д1].ДИ не включает 0, следовательно, различия между группами по признаку «Е» являются статистически значимыми..
Самым представительным признаком оказался «М». 1=1.96, ДК= 95%, р=0,05, гпд=0,16. ДИ- доверительный интервал для разности относительных частот признака. Границы ДИ = [0,48; 0,05],ДИ не включает 0, следовательно, различия между группами по признаку «М» являются статистически значимыми.
При увеличивающей эндоскопии можно с высокой степенью достоверности установить диагноз атрофии по тубулярному типу строения желудочных желез в теле, нерегулярному строению микрососудистой сети.
Выводы.
• чувствительность метода серологической биопсии составляет 62%,специфичность 98% у Нр негативных пациентов и 49 и 96% у Нр+ соответственно. Данный метод может использоваться как диагностический, так и скрининговый для выявления атрофии СОЖ.
• Серологический метод позволяет диагностировать АИГ, который в в 1\3 случаев сочетается с аутоиммунным тироидитом, сопровождается анемией и формированием очаговых гипертрофических образований с высокой пролиферативной активностью и риском развития РЖ.
• Метод ЭОКТ позволяет дифференцировать очаговые поражения СОЖ и подслизистого слоя Применение метода ЭОКТ для идентификации атрофического поражения СОЖ ограничено.
• При атрофии СОЖ отмечается перестройка желудочных желез в теле желудка по тубулярному типу, принимающих строение, близкое к
структуре строения желудочных желез антрального отдела. Собирательные венулы приобретают нерегулярный тип строения. Данные изменения позволяет диагностировать увеличительная эндоскопия.
Практические рекомендации.
Сочетание двух методов лабораторного и эндоскопии с оптическим увеличением взаимно дополняют и усиливают друг друга. Необходимо включить в стандарт обследования при абдоминальной патологии определение уровня Пг1 , Г17, Ат НР, Ат ПКЖ. Что позволит сформировать группу риска по развитию атрофии СОЖ, определить природу этого поражения инфекционная ,либо аутоиммунная, или их сочетание. Высокие показатели экскреторных гормонов желудка , указывающие на гиперхлоргидрию, позволят выделить пациентов с склонностью к язваобразованию и рефлюксным состояниям. Выявление группы риска по развитию РЖ по низким показателям Пг1 и Г17 требует дальнейшего эндоскопического исследования.
По результатам исследования определяется выбор методов лечения. При Нр инфекции назначается эрадикационная терапия, при высоких показателях Пг1 и Г17 назначаются препараты протонной помпы, при показателях Пг1 и Г17 соответствующих атрофии целесообразно воздержаться от назначения ингибиторов протонной помпы и Н2-блокаторовт.е. лечение должно быть дифференцированным. При выявлении высоких титров Ат ПКЖ необходимо провести комплексное обследование пациента на предмет сочетания других аутоиммунных заболевания, в первую очередь аутоиммунного тироидита. Таких пациентов надо тщательно обследовать на наличие скрытой анемии. Эндоскопическое исследование позволит определить наличие очаговых поражений СОЖ, получить их характеристику в том числе и гистологическую. В случае подтверждения высокого пролиферативного риска применять активную тактику от эндоскопической резекции слизистой до резекции желудка.
Публикацнн по теме диссертации
1. Князев М.В. «Сравнительная оценка эндоскопического и серологического методов в диагностике атрофии слизистой желудка» // Сборник научно-практических работ, Издательство «Известия»,2005.с.313-18.
2. Князев М.В. «Содержание пепсиногена1 и гастрина17 при гипергомо-цистеинемии в зависимости от инфицирования Helicobacter pylori» // Тезисы VI съезда Научного общества гастроэнтерологов России 2006г,т 29,А14,с11-12.
3. Буриев И.М., Князев М.В. «Возможности метода эндоскопической оптической когерентной томографии в диагностике атрофии слизистой желудка в зависимости от инфицирования Helicobacter pylori» // Материалы межрегиональной конференции «Актуальные вопросы диагностики в клинической практике», Москва, 2007,с.89-91.
4. Дуванский В.А., Дзагнидзе Н.С., Князев М.В. «Эндоскопическая оптическая когерентная томография слизистой желудка при Hp инфицировании и атрофическом гастрите»// Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2007, т. 17, № 5, с. 106.
5. Буриев И.М., Дзагнидзе Н.С., Дуванский В.А, Князев М.В. «Эндоскопия с оптическим увеличением и оптическая когерентная томография в диагностике атрофии слизистой оболочки желудка» // Материалы XII съезда по эндохирургии 23-25 апреля 2008г. г. Москва, с.43.
6. Дуванский В.А., Дзагнидзе Н.С., Князев М.В. «Оптическая когерентная томография и zoom-эндоскопия в диагностике атрофии слизистой оболочки желудка» //Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2008, т. 18, № 5, с. 159.
ъ
новых результатов, основанных на разрезе всего желудка
11. Miehlke S, Hackelsberger A, Meining A, et al.
Тяжелая форма гастрита тела характерна для рака желудка
больных, инфицированных Helicobacter pylori.Br J Рак. 1998;
78: 263-266.
12. Филипе М.И., Нуноз Н., Матко И. и др. Кишечная метаплазия
типов и риск рака желудка: когортное исследование в Slov-
enia. Int J Cancer. 1994; 57: 324-329.
13. Хуанг С.Б., Сюй Дж., Хуан Дж. Ф., Мэн Сюй. Сульфомуцин толстой кишки
типа кишечная метаплазия и карцинома желудка: гистохимическое исследование
115 случаев, полученных с помощью биопсии. Кан-
сер. 1986; 57: 1370-1375.
14. Филипе М.И., Потет Ф., Богомолец В.В. и др. Неполная sul-
фомуцин-секретирующая кишечная метаплазия при раке желудка.
Предварительные данные проспективного исследования в трех центрах.
tres. Кишечник. 1985; 26: 1319-1326.
15. Craanen ME, Blok P, Dekker W., Ferwerda J, Tytgat CN.
Распространенность подтипов кишечной метаплазии в желудке
Слизистая оболочка антрального отдела. Dig Dis Sci. 1991; 36: 1529-1536.
16. Сугано Х., Накамура К., Като Ю. Патологические исследования рака желудка человека
. Acta Pathol Jpn. 1982; 32: 329-347.
17. Японское исследовательское общество рака желудка. Макроскопические
находок. В: Ниси М., Омори Й., Мива К., редакторы. Японский
классификация рака желудка.1-е англ. Изд. Токио:
Kanehara & Co. Ltd., 1995: 3-14.
18. Эль-Зимайти Х.М.Т., Ота Х., Скотт С., Киллен Д.Е., Грэм Д.Ю. Новый тройной краситель
на Helicobacter pylori, подходящий для красителя au-
. Arch Pathol Lab Med. 1998; 122: 732-736.
19. Эль-Зимайты HMT. Модифицированное тройное окрашивание (карбол фуксин / Al-
циановый синий / гематоксилин-эозин) для идентификации Heli-
cobacter pylori. Arch Pathol Lab Med. 2000; 124: 1417.
20.Лорен П. Два основных гистологических типа рака желудка — нома
. Диффузная и так называемая карцинома кишечного типа. Acta
Pathol Microbiol Scand. 1965; 64: 31-49.
21. Феноглио-Прейзер С., Карнейро Ф., Корреа П. и др. Опухоли желудка
. В: Гамильтон С.Р., Аалтонен Л.А., редакторы. Патология
и генетика: Опухоли пищеварительной системы. 1-е изд. Лион:
Международное агентство по изучению рака, 2000: 37-52.
22. Эль-Зимайти Х.М., Грэм Д.Й., Аль-Асси М.Т. и др.Interobserver
вариации в гистопатологической оценке гастрита Helicobac-
ter pylori. Hum Pathol. 1996; 27: 35-41.
23. Роккас Т., Филипе М.И., Сладен Г.Е. Обнаружение увеличенной на
заболеваемости ранним раком желудка у пациентов с
кишечной метаплазией типа III, находящихся под пристальным наблюдением. Кишечник. 1991;
32: 1110-1113.
24. Сильва С., Филипе М.И., Пиньо А. Варианты кишечной метаплазии
в развитии хронического атрофического гастрита и язвы желудка
.Последующее исследование. Кишечник. 1990; 31: 1097-1104.
25. Диксон М.Ф., Гента Р.М., Ярдли Дж. Х., Корреа П. Классификация
и классификация гастрита. Обновленная Сиднейская система. Inter-
национальный семинар по гистопатологии гастрита,
Хьюстон 1994. Am J Surg Pathol. 1996; 20: 1161-1181.
26. Корреа П. Хронический гастрит: клинико-патологическая классификация
. Am J Gastroenterol. 1988; 83: 504-509.
27. Сэмюэлс М.Л., Лу Т-ФК. Требования к размеру выборки для биномиального доверительного интервала
.Амер
Стат. 1992; 46: 228-231.
28. Фортофер RN, Ли ES. Распределения вероятностей. В: Forthofer
RN, Lee ES, редакторы. Введение в биостатистику. 1-е изд. Сан
Диего: Academic Press, 1995: 125-176.
29. Correa P, Cuello C, Duque E, et al. Рак желудка в Коломе —
млрд. Лет. III. Естественная история предшествующих поражений. J Natl Cancer
Inst. 1976; 57: 1027-1035.
30. Эль-Зимайти ХМТ, Гутьеррес О., Ким Дж. Г. и др. Географические различия —
в распространении кишечной метаплазии у
больных язвенной болезнью двенадцатиперстной кишки.Am J Gastroenterol. 2001; 96: 666-672.
31. Ои М., Осида К., Сугимура С. Локализация язвы желудка.
Гастроэнтерология. 1959; 36: 45-56.
32. Кимура К., Такемото Т. Эндоскопическое распознавание атрофической границы
и ее значение при хроническом гастрите.
Эндоскопия. 1969; 1: 87-97.
33. Хеббель Р. Топография хронического гастрита при остальном
нормальных желудках. Am J Pathol. 1949; 25: 125-141.
34. Кимура К.Хронологический переход фундально-пилорической границы
определяется при пошаговой биопсии малой и
большой кривизны желудка. Гастроэнтерология. 1972;
63: 584-592.
35. Такемото Т. Эндоскопическая диагностика хронического гастрита. Di-
agn Treat 1966; 54: 1274-1285.
36. Мива К., Камата Т., Миядзаки И., Хаттори Т. Кинетические изменения
и экспериментальный канцерогенез после газоэктомии по Бильроту I и II —
. Br J Surg.1993; 80: 893-896.
37. Сэвидж А., Джонс С. Гистологический вид слизистой оболочки желудка
через 15–27 лет после частичной гастрэктомии. J Clin Pathol.
1979; 32: 179-186.
38. Хаттори Т. Развитие аденокарциномы в животе —
ач. Рак. 1986; 57: 1528-1534.
39. Оохара Т., Тохма Т., Таказое К. и др. Мелкий рак желудка —
ном диаметром менее 5 мм. Рак. 1982; 50: 801-810.
40. Morson BC, Sobin LH, Grundmann E, et al.Предраковые состояния
и дисплазия эпителия желудка. J Clin
Pathol. 1980; 33: 231-240.
41. Эль-Зимайти ХМТ, Рамхатесингх Дж., Саид М.А., Грэм Д.Ю.
Желудочно-кишечная метаплазия: подтипы и естественное течение.
J Clin Pathol .. 2001; 54: 679-683.
42. Рамесар К.С., Сандерс Д.С., Хопвуд Д. Ограниченное значение типа
III кишечной метаплазии в прогнозировании риска рака желудка —
нома. J Clin Pathol. 1987; 40: 1287-1290.
43. Като Ю., Сугано Х. Морфологические исследования предраковых
поражений желудка и толстой кишки [обзор]. Ган То
Кагаку Риохо. 1983; 10: 443-458.
44. Грэм Д.Ю., Лехаго Дж. Количество G-клеток и D-клеток антрального канала в
Инфекция Helicobacter pylori: эффект ликвидации Helicobacter pylori
. Гастроэнтерология. 1993; 104: 1655-1660.
45. Фрай Дж. Язвенная болезнь: профиль. Br Med J. 1964; 2: 809-812.
46. Грейб Дж., Бугге П., Гьёруп Т., Лауритцен Т., Бонневи О., Вульф
HR.Долгосрочный прогноз язвенной болезни двенадцатиперстной кишки: контрольное исследование
и опрос врачей. Бр Мед Дж. 1977; 2:
1572-1574.
1436 РАК 1 марта 2002 г. / Том 94 / номер 5
Визуализация в синем свете и связанная цветная визуализация для характеристики изменений слизистой оболочки при хроническом гастрите: взгляд клиницистов и краткий технический отчет — FullText — Digestive Diseases 2020, Vol. 38, № 1
Аннотация
Справочная информация: Визуализация в синем свете (BLI) и связанная цветная визуализация (LCI) — это новые методы визуализации для эндоскопической оценки изменений слизистой оболочки пищеварительного тракта.Имеется небольшой опыт использования этих методов для характеристики хронического гастрита (ХГ), кишечной метаплазии (ИМ) и атрофии желудка. Цели и методы: В одноцентровом пилотном наблюдательном исследовании мы сопоставили результаты эндоскопии с гистологией у выбранных пациентов. Результаты: В анализ были включены данные 29 пациентов. Шесть пациентов имели макроскопически нормальную слизистую желудка при эндоскопии, и это было подтверждено гистологически у 5 из них.При эндоскопии у 15 пациентов прогнозировалось наличие ИМ в антральном отделе, что было подтверждено гистологически у 11 (73%). В корпусе мы предсказали наличие ИМ у 14 пациентов, и это было подтверждено у 11 (78%) при гистологии. У 11 пациентов было эндоскопическое подозрение на атрофию антрального отдела, которое было подтверждено у 9 пациентов (82%). Всего у 14 пациентов было эндоскопическое подозрение на атрофию слизистой оболочки тела при эндоскопии, но только у 10 пациентов было подтверждено гистологическое исследование (71%). Соответствие эндоскопической классификации и гистологии составило 93% для антрального отдела и 88% для тела.Положительная прогностическая ценность и отрицательная прогностическая ценность для IM составили 0,74 и 0,83, а для атрофии 0,63 и 0,97 соответственно. Выводы: LCI и BLI полезны для характеристики изменений слизистой оболочки при ХГ. Возможность исключить предраковые состояния с помощью эндоскопии отражает только клиническое использование и имеет важное клиническое значение.
© 2019 S. Karger AG, Базель
Введение
Текущим и широко признанным золотым стандартом эндоскопической характеристики изменений слизистой оболочки верхних отделов желудочно-кишечного тракта (ЖКТ) является использование виртуальной хромоэндоскопии с увеличением, которое позволяет визуализировать структуру ямок и сосудистые изменения [1-3 ].Узкополосная визуализация (NBI) в настоящее время является наиболее изученным методом. Он работает с оптическим фильтром, который пропускает только небольшие полосы света, что приводит к усилению сосудистой сети слизистой оболочки и рисунка ямок. Использование NBI для характеристики неопластических или воспалительных изменений в желудочно-кишечном тракте интенсивно исследуется.
Недавно был разработан новый метод, использующий эквивалентный физический принцип. Здесь лазер с длиной волны 410 нм используется для создания сильно суженной синей полосы вместе с другими длинами волн, которые являются непрерывными в спектре, но с меньшей интенсивностью [4, 5].Результаты изображения показывают сходство с NBI; однако NBI фильтрует видимый спектр ксеноновой лампы, что приводит к получению света меньшей интенсивности. Напротив, синий лазерный свет передается напрямую без фильтра, что приводит к более высокой интенсивности света.
Самым последним достижением в светоизлучающей технологии является так называемое многосветовое освещение (MLI), которое состоит из света от 4 различных светоизлучающих диодов (LED) [6]. Увеличивая количество света, излучаемого каждым светодиодом с разной интенсивностью, можно достичь набора определенных режимов света.
Визуализация в синем свете (BLI) характеризуется непрерывным световым спектром с пиками интенсивности при 410 и 450 нм, улучшая поверхностные и сосудистые структуры. Однако благодаря непрерывному световому спектру он также улучшает видимость других структур, таких как сосуды, расположенные более глубоко в подслизистой оболочке. Кроме того, режим белого света MLI не показывает непрерывный спектр света, сравнимый с ксеноновым белым светом, который характеризуется однородной интенсивностью всех длин волн, но характеризуется пиками в непрерывном спектре.
Связанное цветное изображение (LCI), режим, состоящий из яркого света BLI в сочетании с алгоритмом постобработки, который показывает цвета, которые больше похожи на изображение в белом свете, но с повышенным контрастом красного и красного. Это достигается перераспределением цветов в цветовом пространстве [7, 8]. Перераспределение означает, что длины волн цвета, которые обнаруживаются датчиком CMOS, заменяются на дисплее другой длиной волны цвета. Это приводит к увеличению количества отображаемых цветов и, следовательно, автоматически к увеличению цветового различия.
Несмотря на высокую вероятность того, что этот метод даст изображения, подобные NBI, для исследования этой новой технологии необходимы надежные данные, поскольку существуют некоторые заметные отличия от других технологий виртуальной хромоэндоскопии. Большая сила света и спектральный состав могут предоставить дополнительные данные, которые могут улучшить визуализацию по сравнению с NBI. В настоящее время данные о значении характеристик изменений слизистой оболочки с помощью BLI скудны, независимо от того, используются ли они с лазерной системой, доступной только на азиатских рынках, или с MLI, доступной только в Европе.
Существует большой клинический интерес к способности обнаруживать хронический гастрит (ХГ), кишечную метаплазию (IM) и атрофию при эндоскопии, поскольку это может минимизировать ошибку отбора проб, уменьшить количество ненужных биопсий и позволить оценить их распределение. поражения. Текущие рекомендации MAPS, касающиеся предраковых состояний желудка, рекомендуют наблюдение за пациентами с атрофией или ИМ только при наличии обширного заболевания [9]. Однако точное распределение гистологических изменений может быть определено только улучшенной эндоскопической идентификацией этих состояний и тщательной и тщательной документацией того, где были взяты образцы.Например, гистологический отчет пациента, имеющего только очаговую область ИМ как в антральном отделе, так и в теле, может привести к 3 различным интерпретациям отчетов. Если бы биопсии были взяты только из поражения или проблемной области, гистологический отчет можно было бы ошибочно интерпретировать как общее распределение IM в антральном отделе и теле. Если бы был взят образец только ткани вне поражения, желудок был бы классифицирован как полностью нормальный, а если бы был взят образец как из поражения, так и из прилегающей ткани, информация о распределении изменений слизистой оболочки была бы недоступна.Следовательно, только гистология вместе с эндоскопическим отчетом может помочь правильно определить ХГ.
В этом исследовании мы исследовали прогностическую ценность BLI с MLI для характеристики изменений слизистой оболочки желудка в небольшой когорте, используя гистологию в качестве золотого стандарта. Кроме того, мы даем техническую информацию об этом новом методе визуализации.
Методы
Это исследование представляет собой одноцентровый неконтролируемый анализ проспективно отобранных пациентов с клиническим подозрением на ХГ или с уже диагностированным ХГ на поздних стадиях, например, атрофия слизистой оболочки или ИМ.Пациенты были включены в исследование в течение 12 недель.
Исследование соответствует Хельсинкской декларации и закону о защите данных.
Все пациенты дали письменное информированное согласие до проведения эндоскопии. Им был введен седативный эффект пропофола, эндоскопия была проведена в левом боковом положении.
Все пациенты были обследованы с помощью гастроскопа EG 760ZP (Fujifilm, Япония). Источником света и видеопроцессором служил Eluxeo (Fujifilm, Япония) с 30-кратным увеличением. Изображения всех анатомических сторон и очаговых поражений были получены с использованием всех доступных режимов освещения.Эндоскопия всегда проводилась в следующей последовательности. Первая интубация двенадцатиперстной кишки белым светом. Втягивание в желудок. Осмотр с использованием WLE с последующим LCI, включая антеградное и ретроградное положения. После этого очаговые поражения исследовали с помощью BLI.
Эндоскопическая классификация была основана на следующих параметрах:
a. Нормальная слизистая оболочка желудка определяется как слизистая оболочка с видимой поверхностной капиллярной сетью без каких-либо очаговых поражений.
г. Атрофический гастрит определялся по побелению слизистой оболочки с видимой более глубокой сосудистой структурой в белом свете, BLI и LCI или по видимости более глубоких извилистых ямок.
г. IM слизистой оболочки определяли по ворсинчатой или ребристой поверхности с отбеливанием в LCI или белым светом или голубым гребнем в BLI.
г. ХГ был диагностирован в случае потери поверхностной капиллярной сети или очаговых поражений, не соответствующих определению других очаговых поражений или рака.
Биопсии были взяты из каждого идентифицированного очагового поражения в дополнение к обновленной системе классификации Сиднея (2 образца антрального отдела, 2 образца тела). Helicobacter pylori Тестирование проводилось у всех пациентов в плановом порядке с использованием экспресс-теста на уреазу и гистологического исследования.Направление прицельной биопсии выполнялось под BLI с увеличением или без увеличения с открытыми щипцами в ближайшем к рабочему каналу положении. Зажимы для биопсии закрывали после достижения целевого поражения, чтобы обеспечить правильный отбор проб. Во время обследования эндоскопист предсказал гистологию и распределение изменений отдельно для антрального отдела и тела в отчете. См. Рисунок 1 для примеров эндоскопических результатов. Результаты гистологии и эндоскопии коррелировали.Таким образом, были определены 3 клинически значимых исхода: 1-е точное совпадение между прогнозом эндоскопии и гистологией, 2-е гистология и эндоскопия дают разные результаты, но все же приводят к тем же рекомендациям в отношении последующего наблюдения, 3-е гистология и эндоскопия не коррелируют, а эндоскопия само по себе могло привести к неправильному последующему наблюдению.
Рис. 1.
Типичные изображения патологии желудка с использованием MLI. a , b Один и тот же пациент, ( c , d ) разные пациенты. a Обзорное изображение КГ с большими участками атрофии слизистой оболочки с желтым оттенком в белом свете. b Атрофия слизистой оболочки по малой кривизне с использованием атрофии LCI выглядит белой, и могут быть визуализированы более глубокие сосудистые структуры. c Точечное распределение IM в антральном отделе, проявляющееся в виде белых областей в режиме BLI. d При увеличении угла виден голубой гребешок (стрелки) как признак IM.
Результаты
Всего в анализ было включено 29 пациентов (15 женщин, 14 мужчин, возраст 65 лет [25–85 лет]).У шести пациентов при эндоскопии была предсказана нормальная слизистая оболочка желудка, что было подтверждено гистологически у 5 пациентов. У другого пациента по гистологии была КГ легкой степени. Эндоскопически у 15 пациентов был предсказан ИМ в антральном отделе. Из этих 15 пациентов 11 (73%) были подтверждены гистологией. В корпусе мы обнаружили 14 пациентов, которым была предсказана внутримышечная эндоскопия, и 11 (78%) пациентов, подтвержденных гистологическим исследованием. У 11 пациентов было подозрение на атрофию антрального отдела желудка, которое было подтверждено у 9 пациентов (82%). У четырнадцати пациентов была предсказана атрофия тела при эндоскопии, но только у 10 пациентов была подтверждена гистология (71%).Рисунок 2 суммирует результаты.
Рис. 2.
Графическая сводка результатов, показывающая сравнение эндоскопических и гистологических результатов у всех пациентов. Диаметр соединительных путей выражает количество случаев. Обратите внимание, что существует больше связей, изменяющих окончательный диагноз в антральном отделе, по сравнению с корпусом, демонстрирующим более высокий уровень неопределенности. ХГ — хронический гастрит; IM, кишечная метаплазия; АГ, атрофический гастрит.
Согласно критериям MAPS, 12 пациентов имели обширное заболевание с предраковыми состояниями как в антральном отделе, так и в теле.Соответствие эндоскопической классификации и гистологии составило 93% в антральном отделе и 88% в теле.
Положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) были рассчитаны для каждого, IM и атрофии. Для IM PPV и NPV составили 0,74 (0,63 в антральном отделе и 0,875 в теле) и 0,83 (0,92 в антральном отделе и 0,75 в теле) соответственно, а для атрофии PPV и NPV составили 0,63 (0,5 в антральном отделе и 0,75 в теле) соответственно. 0,7 в теле) и 0,97 (0,94 в антральном отделе и 1,0 в теле) соответственно.Когда имелось несоответствие между гистологией и эндоскопическим прогнозом, интервал для наблюдения в соответствии с рекомендациями MAPS был бы правильно рекомендован исключительно на основе эндоскопической оценки во всех случаях, кроме 1. Рекомендация в описанном выше случае привела бы к завышенной оценке и, следовательно, к более раннему эндоскопическому наблюдению.
У одного пациента обнаружен рак желудка на ранней стадии, который был диагностирован правильно, а у одного пациента была небольшая нейроэндокринная опухоль, которая также была выявлена при эндоскопии.
Нам удалось идентифицировать IM и атрофию, используя те же функции, которые ранее были определены для использования в NBI, например, голубой значок гребня для IM. Никаких дополнительных свойств слизистой оболочки в нашей серии выявлено не было.
Обсуждение
Наш предварительный отчет демонстрирует возможность использования BLI и LCI для характеристики ХГ и предопухолевых состояний желудка. Однако результаты не предполагают, что следует исключить гистологический забор, а скорее, что роль этого метода может заключаться в содействии более тщательной оценке слизистой оболочки желудка и помощи в интерпретации гистологии посредством тщательной эндоскопической оценки.Причины, по которым этот метод улучшает только гистологию, разнообразны. Во-первых, гистологическая оценка ХГ и особенно степень атрофии имеет очень низкое согласие между патологоанатомами, что затрудняет сравнение эндоскопии и гистологического золотого стандарта [10]. В исследовании, оценивающем специальную подготовку для улучшения оценки атрофии патологами, значение каппа на исходном уровне составляло всего 0,19. После обучения значение увеличилось до 0,43, что все еще не является полностью удовлетворительным золотым стандартом [10].Эта трудность приводит ко второму пункту, а именно к отсутствию единой системы эндоскопической классификации ХГ в антральном отделе и теле. В частности, атрофия тела желудка может быть ошибочно принята за IM из-за извилистого вида железистых структур, которые появляются при ранней фовеолярной атрофии. Это отражено в наших результатах, которые были лучшими в прогнозировании атрофии антрального отдела и в прогнозировании ИМ в теле.
Однако мы обнаружили лучшие результаты по NPV, чем по PPV, что означает, что вероятность отсутствия IM или атрофии удовлетворительно высока, если эндоскопия не позволяет предсказать их наличие.Это можно интерпретировать как основное клиническое воздействие этих новых технологий.
В нашем исследовании IM показал те же функции в BLI, уже известные от NBI. Эти особенности, такие как отбеливание и / или знак светло-голубого гребня, поэтому приписываются физическим свойствам слизистой оболочки и не являются специфическими для метода визуализации.
В 2016 году Sun et al. [8] опубликовали первую попытку эндоскопической классификации заболеваний дистального отдела желудка на основе изменения цвета в LCI. Основываясь на повседневной эндоскопической практике, мы ставим под сомнение полезность этой простой системы классификации для полного преодоления трудностей в правильном прогнозировании гистологии, особенно в антральном отделе, из-за проблем, описанных выше.
В будущих исследованиях необходимо будет сравнить эндоскопию в белом свете с LCI и BLI, чтобы выяснить, превосходят ли эти новые методы хромоэндоскопии эндоскопию в белом свете.
Некоторые авторы отметили различия в обнаружении поражений желудка при визуализации в белом свете между источниками света с использованием ксеноновых ламп или мульти-светодиодов [11]. Это можно объяснить разными спектрограммами разных типов белого света. В то время как белый свет ксеноновой лампы имеет однородное распределение интенсивности света по всей длине волны видимого диапазона, белый свет, состоящий из 4-х цветных светодиодов, уже подчеркивает разные длины волн, такие как 410 и 450 нм.Это может уже привести к более сильному контрасту сосудистых структур, при этом все еще выглядя как белый свет за счет цветового спектра изображения.
Из крупномасштабных исследований с использованием NBI в КГ уже известно, что эндоскопия в белом свете уступает NBI. Однако NBI имеет определенные ограничения в идентификации поражений для последующей характеристики из-за более темных изображений. LCI может помочь обнаружить поражения, которые позже можно охарактеризовать с помощью BLI и увеличения. Действительно, это уже было доказано в исследованиях, в которых изучались LCI и BLI для обнаружения и характеристики полипов толстой кишки, которые показали более высокую эффективность обнаружения аденомы с использованием LCI по сравнению с эндоскопией в белом свете [4, 12-14].
Однако наше исследование ограничено из-за его высокой избирательности и небольшого размера выборки. Следовательно, для решения этого вопроса потребуются дальнейшие проспективные исследования.
Таким образом, используя BLI и LCI в качестве новых методов визуализации, мы приближаемся к нашей цели — охарактеризовать КГ и предопухолевые поражения желудка путем интеграции эндоскопии и гистологии. Эндоскопия играет важную роль в выявлении поражений и их локального распространения, в то время как гистология в большинстве случаев позволяет определить обнаруженные изменения.Эндоскопическая информация имеет большое значение, поскольку только гистология не может полностью оценить КГ. Поэтому настоятельно рекомендуется междисциплинарный диагностический подход, сочетающий гистологическое и эндоскопическое обследование.
Благодарность
Исследование было поддержано Оксфордским центром биомедицинских исследований Национального института медицинских исследований (NIHR). Выраженные взгляды принадлежат автору (авторам) и не обязательно принадлежат NHS, NIHR или Министерству здравоохранения.
Заявление об этике
Исследование соответствует Хельсинкской декларации.
Заявление о раскрытии информации
J.W .: Стоимость лекций, научный грант и эндоскопы от Fujifilm Europe. PM: Эндоскопический материал от Fujifilm. У всех остальных авторов нет Конфликта интересов в отношении данной рукописи.
Список литературы
- Уэдо Н., Исихара Р., Ииси Х., Ямамото С., Ямамото С., Ямада Т. и др.Новый метод диагностики кишечной метаплазии желудка: узкополосная визуализация с увеличительной эндоскопией. Эндоскопия. 2006 август; 38 (8): 819–24.
- Уэдо Н., Яо К. Эндолюминальная диагностика раннего рака желудка и его предшественников: устранение разрыва между эндоскопией и патологией.Adv Exp Med Biol. 2016; 908: 293–316.
- Саварино Е., Корбо М., Дульбекко П., Джеминьяни Л., Джамбруно Е., Мастраччи Л. и др. Узкополосная визуализация с помощью эндоскопии с увеличением позволяет точно обнаружить метаплазию желудочно-кишечного тракта. Мир Дж. Гастроэнтерол. 2013 Май; 19 (17): 2668–75.
- Йошида Н., Яги Н., Инада Й, Кугай М., Окаяма Т., Камада К. и др.Возможность новой системы визуализации с синим лазером для диагностики колоректальных полипов. Dig Endosc. 2014 Март; 26 (2): 250–8.
- Йошида Н., Хисабэ Т., Инада Ю., Кугай М., Яги Н., Хираи Ф. и др. Возможность новой системы визуализации с синим лазером для диагностики глубины инвазии колоректальных новообразований.J Gastroenterol. 2014, январь; 49 (1): 73–80.
- Бишопс Р., Хассан С., Бхандари П., Корон Е., Нойман Н., Печ О. и др. BASIC (BLI Adenoma Serrated International Classification) классификация для характеристики колоректального полипа с помощью визуализации в синем свете. Эндоскопия. Март 2018; 50 (3): 211–20.
- Оно С., Абико С., Като М. Связанные цветные изображения усиливают рак желудка при кишечной метаплазии желудка. Dig Endosc. 2017 Март; 29 (2): 230–1.
- Sun X, Dong T, Bi Y, Min M, Shen W, Xu Y и др.Приложение для получения связанных цветных изображений для повышения точности эндоскопической диагностики: пилотное исследование. Научный доклад, сентябрь 2016 г .; 6 (1): 33473.
- Динис-Рибейро М., Арейя М., де Фрис А.С., Маркос-Пинто Р., Монтейро-Соарес М., О’Коннор А. и др .; Европейское общество эндоскопии желудочно-кишечного тракта; Европейская группа изучения хеликобактер; Европейское общество патологов; Sociedade Portuguesa de Endoscopia Digestiva.Ведение предраковых состояний и поражений желудка (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта (ESGE), Европейской группы изучения хеликобактер (EHSG), Европейского общества патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ). Эндоскопия. 2012 Янв; 44 (1): 74–94.
- Ким С.С., Кук М.С., Шин О.Р., Ким Х.С., Бэ Х.И., Со А. и др.Факторы для улучшения согласия между наблюдателями в отношении атрофии желудка и кишечной метаплазии: консенсус в определении и критериях. Гистопатология. 2018 апр; 72 (5): 838–45.
- Фукуда Х., Миура Й., Хаяси Й., Такедзава Т., Ино И, Окада М. и др. Технология связанных цветных изображений облегчает раннее обнаружение плоского рака желудка.Clin J Gastroenterol. 2015 декабрь; 8 (6): 385–9.
- Йошида Н., Наито Ю., Ясуда Р., Мураками Т., Хиросе Р., Огисо К. и др. Связанная цветная визуализация улучшает видимость различных колоректальных полипов по оценке эндоскописта и величине разницы в цвете. Int J Colorectal Dis.2017 Сен; 32 (9): 1253–60.
- Судзуки Т., Хара Т., Китагава Ю., Такаширо Х., Нанкинзан Р., Сугита О. и др. Связанные цвета изображения улучшают эндоскопическую видимость колоректальных негранулярных плоских поражений. Gastrointest Endosc. 2017 Октябрь; 86 (4): 692–7.
- Мин М, Дэн П, Чжан В., Сунь Х, Лю И, Нонг Б.Сравнение связанных цветных изображений и колоноскопии в белом свете для обнаружения колоректальных полипов: многоцентровое рандомизированное перекрестное исследование. Gastrointest Endosc. 2017 Октябрь; 86 (4): 724–30.
Автор Контакты
PD Dr. med. Йохен Вайгт
Отделение гастроэнтерологии, гепатологии и инфекционных заболеваний
Университет Отто-фон Герике, Магдебург
Leipziger Strasse 44, DE – 39120 Магдебург (Германия)
E-Mail [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 22 ноября 2018 г.
Дата принятия: 1 июня 2019 г.
Опубликована онлайн: 23 июля 2019 г.
Дата выпуска: 2020 январь
Количество страниц для печати: 6
Количество рисунков: 2
Количество столов: 0
ISSN: 0257-2753 (печатный)
eISSN: 1421-9875 (онлайн)
Для дополнительной информации: https: // www.karger.com/DDI
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако с учетом продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
