Дисбактериоз симптомы, лечение в Новосибирске
Дисбактериоз: правда и миф. Симптомы и лечение в Новосибирске.
Дисбактериоз — одна из наиболее частых обсуждаемых проблем со здоровьем, в основном, среди детского населения. Давайте поговорим о том, что это такое в свете современных знаний.
Дисбактериоз – микро экологические нарушения в желудочно-кишечном тракте. Это клиническая совокупность нарушений в макроорганизме (человек), вызванных изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз – по сути результат посева кала на известные и возможные для исследования микроорганизмы толстого кишечника. В последнее время чаще говорят о дисбиозе — это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно ? В свете последних молекулярно — генетических исследований микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела, конечно, большая часть кишечник и толстый и тонкий, но при этом 80-90% не культивируются (т.
Что же делает микрофлора в нашем теле?
-противостоит болезнетворным бактериям и сдерживает рост условно — патогенных бактерий
-участвует в синтезе и всасывании многих витаминов
-производит разрушение и выведение токсинов
-вырабатывает вещества, участвующие в обмене холестерина, жирных кислот, липопротеидов, оксалатов, стероидных гормонов
-участвует в формировании как местного, так и системного иммунитета.
-участвует в переваривании многих пищевых ингредиентов
-питает, поддерживает работу клеток кишечной стенки
Это далеко не всё, только основные направления работы нашей микрофлоры. Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идёт на поддержание нашей микрофлоры.
Как проявляется дисбиоз хорошо известно всем: диспептический синдром (поносы, запоры , метеоризм, повышенное газообразование, отрыжка ), боли в животе, аллергия ( любая – кожные высыпания , бронхиальная астма , насморк , непереносимость некоторых пищевых продуктов ), частые простудные заболевания, как правило протекающие длительно и волнообразно, синдром мальабсорбции — нарушение всасывания (гиповитаминоз, анемия, неврологические расстройства, задержка роста и развития ), хроническая интоксикация (недомогание, плохой аппетит, головные боли, субфебрильная температура)
Как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов индивидуальных для каждого человека.
-наличие у мамы любых инфекций: хронических урогенитальных и других, даже вне обострения, острых (ОРЗ и др.), прием лекарств, не рациональное питание
-роды путём кесарева сечения
-позднее (не в родовом зале) прикладывание к груди. Млечные ходы молочной железы заселены лакто — и бифидобактериями, даже если новорожденный высосет 3-5 мл молозива он получит первой «хорошую семейную» микрофлору, а не больничную, вероятнее всего вредную
-гипоксия нервной системы любой степени тяжести
-долгое нахождение в родильном доме
-раздельное нахождение мамы и младенца в роддоме
-искусственное вскармливание
-применение антибиотиков и многих других лекарств
-раннее введение прикормов и прекращение грудного вскармливания
-не рациональное питание
Какие анализы можно сдать для выявления дисбиоза:
-кал на дисбиоз
До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день.
-копрограмма
Показывает нарушения характера пищеварения: своевременно ли и в достаточном ли количестве выделяется желчь и секрет поджелудочной железы.
-газо — жидкостная хроматография и молекулярно — генетическое исследование фекалий
показывают истинное состояние микрофлоры, её полный количественный и качественный состав (в том числе тонкокишечный и то, который невозможно вырастить вне человека), энтеротип человека. Проводится в нескольких НИИ в мире, в широком применении будет только в ближайшие 5-10 лет.
У всех детей первого полугодия 99-98% микрофлоры — это бифидо и лактобактерии, значит надо обеспечить и их достаточное количество. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактозной недостаточности в кишечнике неблагоприятная среда, а бифидо и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов, изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная Организация Здравоохранения), но решение принимается только индивидуально!
Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактозной недостаточности в кишечнике неблагоприятная среда, а бифидо и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов, изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная Организация Здравоохранения), но решение принимается только индивидуально!
Получается, мы живем в океане микробов, и только так мы можем жить. Если мы хотим жить долго и здорово — мы должны заботится о них. Лечение — это одно, а постоянное поддержание здоровья — это другое. Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справится! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь – лекарственные препараты и всё по рекомендации врача!
Дисбактериоз у грудничка – симптомы, причины и лечение
ОБЩЕЕ
Дисбактериоз у новорожденных и детей первого года жизни представляет очень актуальную проблему современной педиатрии. Ведь это состояние выявляется почти у половины детей раннего возраста.
Ведь это состояние выявляется почти у половины детей раннего возраста.
Факты о дисбактериозе у грудничка:
- Нормальная микрофлора кишечника у грудничков представлена, в основном, анаэробной флорой (лактобациллами, бифидобактериями, бактероидами, кишечной палочкой и т. д.). Незначительную часть (1-4%) нормального биоценоза кишечника составляют некоторые типы стафилококков, грибов, протея и других видов условно-патогенной флоры.
- При нарушении биоценоза нормальная флора кишечника замещается условно-патогенной.
- До момента рождения малыш находится в абсолютно стерильной среде материнского организма. В период родов возникает первичная колонизация кожи, слизистых оболочек и частично кишечника микроорганизмами, находящимися во влагалище матери (лакто- и бифидобактерии, кишечная палочка).
- В течение первых часов и дней происходит массивное заселение организма новорожденного микрофлорой, содержащейся в воздухе, при тактильном контакте и т.
 д.
д.
- Примерно на третий-пятый день от рождения практически у всех детей развивается так называемый транзиторный вид дисбактериоза. Основными его признаками являются: периодическое возникновение жидкого стула, учащенное срыгивание, боли в животе спастического характера. Такие симптомы дисбактериоза у новорожденного обычно самостоятельно исчезают на 10–14 день жизни.
- В молозиве содержатся различные иммунные факторы, которые препятствуют развитию условно-патогенной флоры в кишечнике новорожденного. В связи с этим раннее прикладывание к груди является мощным профилактическим фактором развития дисбактериоза у грудничка.
- У грудничка дисбактериоз может протекать абсолютно бессимптомно. А характерные изменения кала при отсутствии клинических проявлений не служат показаниями к назначению медикаментозного лечения.
ПРИЧИНЫ
Дисбактериоз у грудничка является вторичным состоянием, сигнализирующим о каких-либо нарушениях в организме младенца.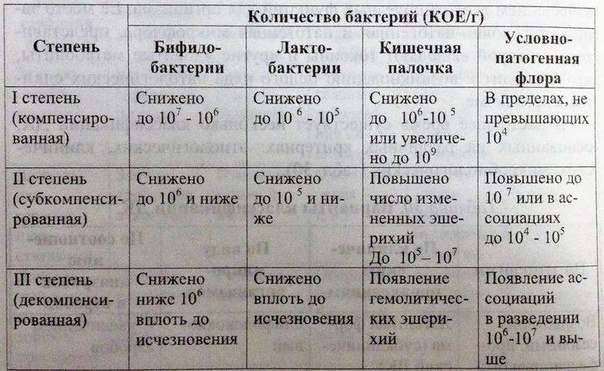 Исходя из этого, выделяют множество факторов риска, воздействие которых может привести к изменению видового или количественного состава микрофлоры кишечника.
Исходя из этого, выделяют множество факторов риска, воздействие которых может привести к изменению видового или количественного состава микрофлоры кишечника.
Факторы риска дисбактериоза у младенцев:
- Осложненное течение беременности и/или родов.
- Недоношенность.
- Реанимационные мероприятия новорожденного.
- Гнойно-воспалительные заболевания влагалища и/или молочных желез у матери.
- Позднее начало грудного вскармливания.
- Продолжительное пребывание в условиях родильного дома.
- Наличие локальных гнойно-септических заболеваний у новорожденного (везикулопустулез, пузырчатка, мастит, омфалит и т. д.).
- Первичное иммунодефицитное состояние.
- Нерациональное искусственное вскармливание.
- Неправильное введение прикорма.
- Острые инфекционные заболевания.
- Применение антибактериальных и гормональных средств у ребенка или у кормящей матери.

- Хирургические вмешательства.
- Нарушение моторики кишечника по разным причинам.
- Аллергические заболевания.
- Плохая экология, неблагоприятная обстановка в семье.
- Острая и хроническая патология желудочно-кишечного тракта, анемии, гипотрофия, рахит и другие заболевания у грудничка.
Значительную роль в возникновении дисбактериоза у детей первого года жизни играет и функциональная незрелость желудочно-кишечного тракта.
КЛАССИФИКАЦИЯ
У новорожденных и грудных детей дисбактериоз классифицируют по степени компенсации, а также по характеру выявленной микрофлоры при лабораторном анализе кала.
Виды дисбактериоза:
- Компенсированный – протекает абсолютно бессимптомно, а признаки невыраженного микробного дисбаланса выявляются при анализе кала, который исследуется совершенно по другому поводу.
- Субкомпенсированный – проявления заболевания маловыражены или же обострение симптоматики происходит периодически.
 В анализе кала диагностируются изменения видового и количественного содержания микрофлоры.
В анализе кала диагностируются изменения видового и количественного содержания микрофлоры.
- Декомпенсированный – характеризуется возникновением яркой клинической симптоматики и выраженными изменениями состава кишечной микрофлоры. Требует назначения лечения.
Микробиологическая классификация (степени):
- Первая. Снижение общего количества основных представителей нормальной микрофлоры (бифидо-, лактобактерий и т. д.) до 10*7–10*8 КОЕ/г. Могут выявляться не более двух видов представителей условно-патогенных микроорганизмов в количестве до 10*3–10*4 КОЕ/г. Лечение дисбактериоза у грудничка при таких симптомах не требуется.
- Вторая. Снижение уровня главных представителей нормальной микрофлоры до 10*5 КОЕ/г. Вытеснение нормальных форм кишечной палочки лактозонегативными ее формами. Увеличение количества видов анаэробной условно-патогенной флоры.
- Третья. Количество лакто- и бифидобацилл прогрессирующе снижается и достигает не более 10*3 КОЕ/г.
 Кишечная палочка с нормальной ферментативной активностью не выявляется. Преобладает разнообразная аэробная и анаэробная микрофлора.
Кишечная палочка с нормальной ферментативной активностью не выявляется. Преобладает разнообразная аэробная и анаэробная микрофлора.
- Четвертая. Нормальная анаэробная флора не определяется. Абсолютное преобладание условно-патогенной и явно патогенной микрофлоры. Достаточно редкое явление у грудничков.
СИМПТОМЫ
Клинические признаки дисбактериоза достаточно разнообразны. Однако нужно помнить, что такие же проявления могут иметь и органические заболевания, например, желудочно-кишечного тракта.
Проявления дисбактериоза у грудничков:
- Главным симптомом дисбактериоза кишечника у грудничка является изменение характера стула – окраски, запаха и консистенции.
- Нормальный стул у грудничка окрашен в желтый цвет, кашицеобразной консистенции и почти не имеет запаха.
- При дисбактериозе кишечника стул изменяет свой цвет – становится темным или с зеленым оттенком. Часто в нем появляются комочки, прожилки слизи или даже крови.

- Консистенция стула может варьировать от очень жидкого, пенистого до твердого с кисловатым или гнилостным запахом.
- Боли в животе (колики) также встречаются практически у всех младенцев с этой патологией. Они часто сопровождаются вздутием живота и метеоризмом.
- Характерно появление боли через некоторое время после еды. Грудничок сильно плачет, выгибается, поджимает ножки к животу и может отказываться от еды, несмотря на голод.
- Часто возникают срыгивания и даже рвота.
- Беспокойство, плохой сон, частый «беспричинный» плач.
- Понос или запоры у грудничка как проявление нарушения моторики кишечника.
- Иногда появляется неприятный запах изо рта, повышенное слюноотделение, сухость кожных покровов.
- Ребенок может плохо набирать вес.
- Проявления аллергического дерматита, стоматита являются частыми спутниками дисбактериоза у малышей.
Важно знать, что незначительные изменения стула могут встречаться и у абсолютно здоровых детей. Например, появление комочков или частиц непереваренной пищи часто сопровождает введение прикорма.
Например, появление комочков или частиц непереваренной пищи часто сопровождает введение прикорма.
ДИАГНОСТИКА
Учитывая, что симптомы дисбактериоза кишечника у грудничка не являются специфичными, клинический осмотр обычно малоинформативен.
Ведущим методом диагностики степени нарушений видового и количественного содержания микрофлоры кишечника является лабораторное исследование кала. При этом выполняется микробиологический (бактериологический) и биохимический анализ кала.
Для выявления возможной причины дисбактериоза у грудничка могут применяться и дополнительные методы обследования: ультразвуковое исследование брюшной полости, биохимические анализы крови и т. д.
ЛЕЧЕНИЕ
Коррекцию дисбактериоза у новорожденных и детей первого года жизни должен проводить только врач на основании выявленных нарушений биоценоза кишечника.
Принципы лечения заболевания:
- Начинать лечить дисбактериоз кишечника у младенца следует с выяснения и устранения возможной причины, вызывающей заболевание.

- Главным моментом терапии микробного дисбаланса является грудное вскармливание или же применение адаптированных молочных смесей при его невозможности.
- Медикаментозное лечение дисбактериоза у грудничка состоит из двух этапов.
- На первом этапе терапии следует подавить излишний рост условно-патогенной микрофлоры. Это достигается применением специфических иммунных препаратов (бактериофагов), а также кишечных антисептиков и антибиотиков.
- При выборе антибактериальных препаратов предпочтение отдается таким видам, которые реализуют свою функцию исключительно в просвете кишечника, не оказывая системного действия.
- По показаниям применяют энтеросорбенты, ферментные препараты.
- Целью второго этапа является заселение кишечника «полезными» микроорганизмами. Для этого используются различные биопрепараты для орального применения, содержащие в своем составе лакто- и бифидобактерии.
ОСЛОЖНЕНИЯ
При дисбактериозе кишечника у грудничков могут развиваться различные осложнения, влияющие на состояние иммунной системы и развитие организма в целом.
Последствия дисбактериоза:
- Недостаточное поступление в организм некоторых витаминов и микроэлементов.
- Развитие анемии.
- Недостаточный набор веса.
- Частые инфекционные заболевания.
- Повышенный риск развития патологии желудочно-кишечного тракта у грудничка (колит, энтероколит и т. д.).
- Аллергические заболевания.
ПРОФИЛАКТИКА
Выраженность симптомов и лечение этой патологии прямо зависят от причины, вызвавшей микробный дисбаланс в кишечнике. Именно поэтому важным направлением профилактических мероприятий является устранение таких факторов еще до момента их воздействия на организм младенца.
Профилактика дисбактериоза у детей:
- Своевременная диагностика и санация очагов инфекции у беременной и кормящей женщины.
- Раннее прикладывание к груди (не позднее двух часов с момента рождения).
- Грудное вскармливание не менее года.
- При невозможности грудного вскармливания – применение адаптированных молочных смесей.

- Своевременное и рациональное введение прикорма. Включение в рацион кисломолочных продуктов в соответствии с возрастом ребенка.
- Достаточное пребывание на свежем воздухе, физические упражнения и элементы закаливания позволяют укрепить неспецифический иммунитет у младенца.
ПРОГНОЗ НА ВЫЗДОРОВЛЕНИЕ
Дисбактериоз кишечника у новорожденных и детей первого года жизни достаточно хорошо поддается коррекции, поэтому прогноз на выздоровление благоприятный.
Легкие формы нарушения микробного баланса кишечника у грудничков при соблюдении общих рекомендаций в большинстве случаев элиминируются самостоятельно.
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
Полезная статья Дисбактериоз кишечника у взрослых Дисбактериоз – это расстройство, характеризующееся дисбалансом количественного и качественного состава микроорганизмов, которые формируют микрофлору кишечника человека. Дисбактериоз кишечника у взрослого…
Дисбактериоз кишечника у взрослого…
Дисбактериоз у детей
Одним из часто встречающихся у детей заболеваний является дисбактериоз кишечника. При этом состоянии нарушается нормальный баланс микрофлоры, которая необходима для жизнедеятельности организма. Снижается количество «полезных» бактерий и увеличивается содержание патогенных микроорганизмов.
Причины
Основной причиной развития дисбактериоза у новорожденных и детей старшего возраста является нерациональная медикаментозная терапия. Особенно это относится к антибактериальному лечению. Однако дисбаланс микрофлоры может появляться и при наличии других заболеваний, а также под влиянием факторов, снижающих иммунитет:
- ожоги;
- тяжелые операции;
- повышенное влияние ионизирующего излучения;
- ухудшение экологической ситуации;
- перевод на искусственное питание, позднее начало грудного вскармливания, заболевания матери.
Симптомы дисбактериоза
Симптомы дисбактериоза зависят возраста ребенка.
У детей старшего возраста может наблюдаться:
- жидкий стул или запор;
- кусочки непереваренной пищи и прожилки крови в кале.
У грудничка патология проявляется следующими симптомами:
- рвота, срыгивания;
- вздутие и боли в животе; урчание в животе;
- обильный жидкий или кашицеобразный стул;
- медленный набор веса.
Такие дети плохо растут и мало прибавляют в весе, могут болеть рахитом или анемией.
Диагностика
Для определения нарушения микрофлоры используются следующие исследования:
- анализ кала, в том числе биохимическое исследование;
- бактериологическое изучение состава кишечного содержимого и желчи;
- эзофагогастроскопия с последующим бактериологическим изучением соскоба со слизистой оболочки двенадцатиперстной кишки;
- колоноскопия с бактериологическим исследованием соскоба слизистой оболочки толстой и прямой кишки.
Лечение дисбактериоза у детей
Лечение дисбактериоза начинается с устранения причины, которая способствовала его развитию. Для нормализации состава микрофлоры применяются пребиотики и пробиотики. В целом лечение похоже на лечение Дисбактериоз у взрослых.
Диета
Диета при дисбактериозе у детей зависит от особенностей клинической картины у каждого пациента: показателей кислотности желудочного сока, степени нарушения пищеварения, локализации патологического процесса. Питание ребенка при дисбактериозе должно быть сбалансированным и легкоусвояемым.
Опасность
Опасность заключается в нарушении водно-электролитного баланса, истощения малыша вследствие длительного поноса.
Группа риска
В группу риска входят малыши, которые перенесли:
- родовые травмы;
- глистные инвазии;
- искусственное вскармливание;
- Колит, энтерит;
- инфекционные заболевания (дизентерия, тиф).
Профилактика
Профилактика заключается в соблюдении режима питания малыша и проведении рациональной антибиотикотерапии.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Дисбактериоз кишечника у грудничка: симптомы и терапия
По словам специалистов, все дети появляются на свет с абсолютно «стерильным» кишечником. Однако в момент прохождения по родовым путям, туда заселяются микроорганизмы. С течением времени у крохи могут появиться неприятные ощущения и дискомфорт в этом органе. Так, очень часто врачи уже в первые недели жизни диагностируют дисбактериоз кишечника у грудничка. Каковы основные его причины? Каким должно быть лечение? Именно об этом мы и расскажем в данной статье.
Первоочередные причины
По словам специалистов, дисбактериоз кишечника у грудничка может появиться по нескольким причинам, среди которых: прием лекарственных препаратов, неправильное питание, а также некоторые болезни органов пищеварения. Заметим, что лечение может начаться и действительно принести пользу только в том случае, если врачу удастся определить первоочередной фактор, вызвавший недуг.
Дисбактериоз кишечника. Симптомы у грудничков
Практически всегда у маленьких пациентов при данном диагнозе появляются следующие симптомы: нарушение стула, высыпания на коже, дискомфорт и боли в зоне живота, пищевая аллергия. Дисбактериоз кишечника у грудничка, как утверждают врачи, чаще всего начинается с жидкого стула с белыми пенистыми комочками. Малыша постоянно тошнит, не прекращается урчание в животе, он часто срыгивает. У ослабленных детей (родившихся недоношенными) данное заболевание нередко сопровождается анемией и развитием молочницы исключительно в ротовой полости.
Диагностика дисбактериоза кишечника у маленьких детей
В первую очередь необходимо отметить, что при появлении первичных симптомов, описанных выше, родители должны в обязательном порядке обратиться к врачу. Вероятнее всего, он назначит ряд анализов, после которых диагноз подтвердится. Заметим, что лабораторный анализ далеко не всегда способен в действительности показать состояние кишечника. Все дело в том, что микрофлора каждого отдельного человека весьма индивидуальна и одновременно переменчива. Кроме того, данное обследование чаще всего не затрагивает саму тонкую кишку, изменения в которой, безусловно, также влияют на общее состояние непосредственно пищеварительной системы. Именно поэтому в некоторых случаях требуются дополнительные анализы (к примеру, крови, мочи), консультация гастроэнтеролога (а также так называемая гастроскопия).
Лечение
По словам специалистов, лечение такого заболевания, как дисбактериоз кишечника у грудничка, должно осуществляться в два этапа. Так, первый подразумевает под собой подавление роста условно патогенных организмов. Здесь, как правило, используются иммунопрепараты, которые отличаются способностью поглощать и одновременно растворять микробные клетки. На втором этапе уже проводится коррекция всего микробного пейзажа кишечника. Данный шаг преследует исключительно одну цель — заселения кишечника так называемой здоровой флорой. При таком лечении используются различного рода пробиотики (лекарственные препараты, которые имеют в своем составе живые бактерии), а также пребиотики (средства с неперевариваемыми веществами для восстановления микрофлоры). Выбор того или иного препарата целиком зависит от индивидуальных показателей здоровья ребенка.
Материалы по теме:
Синдром избыточного бактериального роста / Заболевания / Клиника ЭКСПЕРТ
Синдром избыточного бактериального роста (СИБР) – патологическое состояние, которое характеризуется повышением количества бактерий в тонкой кишке с развитием диарейного синдрома и нарушением всасывания некоторых питательных веществ.
Это состояние/заболевание в отечественной литературе нередко называют частным случаем дисбактериоза/дисбиоза кишечника.
Распространенность СИБРРаспространенность данного синдрома в мире остается неизвестной. В литературе чаще всего проводится оценка встречаемости СИБР при различных заболеваниях желудочно-кишечного тракта (ЖКТ) и других органов. В частности, известно, что СИБР отмечается у 38% пациентов с синдромом раздраженного кишечника и у 50-60% больных циррозом печени. Нередко данный патологический синдром выявляется у лиц, страдающих воспалительными заболеваниями кишечника, системными болезнями соединительной ткани (например, склеродермия), эндокринными патологиями (сахарный диабет) и т.д.
Причины и механизмы развития СИБРВ норме различные отделы пищеварительной трубки имеют разный видовой и количественный состав заселяющих их микроорганизмов. Так, например, в желудке и верхних отделах тонкой кишки микробный состав довольно беден, ограничиваясь небольшим (103-104 колониеобразующих единиц (КОЕ) в миллилитре аспирата) количеством бактерий, среди которых преобладают лактобактерии, энтерококки и некоторые другие аэробные бактерии.
В конечных отделах тонкой кишки, прежде всего в терминальном отделе подвздошной кишки, растет число и разнообразие микроорганизмов. В этой переходной зоне между тонкой и толстой кишкой количество микроорганизмов увеличивается до 107-109 КОЕ/мл. Основные бактерии, выявляемые в этом регионе, представлены лакто- и бифидобактериями, стрептококками, бактероидами и т.д.
Наконец, толстая кишка – место «проживания» анаэробных бактерий, которым для жизнедеятельности не требуется кислород (бактероиды, бифидобактерии, энтерококки и клостридии, лактобациллы, кишечные палочки, стрептококки, стафилококки и т.д.). Количество микроорганизмов в этом отделе кишечника максимально и может достигать 1012 КОЕ/мл.
Количественный и качественный микробный состав в разных отделах ЖКТ поддерживается несколькими механизмами. Это и кислая среда желудка, и бактерицидное действие желчи в тонкой кишке, а также сохранная моторика желудка и кишечника. Очень важной является нормальная двигательная и замыкательная функция сфинктеров ЖКТ, таких как пилорический сфинктер (клапан между желудком и 12-перстной кишкой) и илеоцекальный клапан (между подвздошной и толстой кишкой).
Нарушение этой регуляции приводит к тому, что увеличивается количество микроорганизмов в тонкой кишке, и это приводит к различным расстройствам пищеварения. Данное состояние и называется СИБР или синдром избыточного бактериального роста в тонкой кишке.
Основные причины развития СИБР:
- Состояния, приводящие к снижение продукции соляной кислоты в желудке – гипо- и ахлоргидрия на фоне атрофического или аутоиммунного гастритов, вследствие применения препаратов из группы h3-гистаминоблокаторов и ингибиторов протонной помпы;
- Нарушение моторики желудка и/или тонкой кишки – нередко наблюдается при сахарном диабете, циррозе печени, хронической почечной недостаточности, склеродермии, полимиозите, целиакии, болезни Крона и т.д.;
- Анатомические нарушения – последствия оперативных вмешательств (резекция желудка, илеоцекального клапана и др.), дивертикулы тонкой кишки, стриктуры тонкой кишки любого происхождения и т.д.;
- Применение антибиотиков, нестероидных противовоспалительных препаратов, цитостатиков, стероидных гормонов, трициклических антидепрессантов, опиатов и т.д.;
- Иммунные нарушения, включая дефицит секреторного иммуноглобулина А;
- Хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы;
- Хроническое злоупотребление алкоголем;
- Пожилой и старческий возраст – увеличивают риск возникновения СИБР.
Следствием увеличения количества тонкокишечных микроорганизмов является:
- снижение содержания и активности внутрипросветных и пристеночных ферментов за счет их разрушения бактериями;
- недостаточное расщепление питательных веществ, нарушение их всасывания и увеличение жидкой части кишечного содержимого с развитием диареи;
- преждевременная деконъюгация желчных кислот в начальных отделах тонкой кишки с развитием химического повреждения слизистой тонкой кишки и диареей.
Из-за нарушения всасывания в тонкой кишке развивается дефицит некоторых микро- и макроэлементов, а также витаминов (например, витамина В12).
Симптомы СИБР- Вздутие живота и/или повышенное газообразование – наиболее частый симптом;
- Послабление стула – от кашицеобразного 1-2 раза в сутки до жидкого несколько раз в день;
- Запоры – встречаются редко, но не исключают диагноза СИБР;
- Слабые боли в животе (часто на фоне повышенного газообразования) – обычно локализуются в околопупочной области;
- Ощущение «переливания» или урчания в животе;
- Снижение массы тела – возможно при выраженном и длительном СИБР;
- Различные жалобы, обусловленные дефицитом микро-, макроэлементов и витаминов.
Типичная клиническая картина заболевания и анамнез (например, указание на применение антибиотиков) позволяют заподозрить диагноз СИБР. Подтверждением служат результаты дополнительные тесты.
В связи с тем, что СИБР связан с увеличением количества бактерий в тонкой кишке, использование традиционного в нашей стране анализа кала на дисбиоз/дисбактероз для диагностики этого синдрома не имеет ценности. При исследовании бактериального состава кала этим методом оцениваются образцы каловых масс из толстой кишки. Анализ включает в себя определение лишь 20 разновидностей бактерий, тогда как в кишечнике человека их выделено более 1000.
В научных целях и крупных медицинских центрах для диагностики используется жидкое содержимое (аспират) 12-перстной кишки. Этот аспират может быть посеян на специальные среды для выявления аэробных и анаэробных бактерий и определения количества КОЕ. Альтернативой является метод полимеразной цепной реакции (ПЦР), которым также определяется количество (реже качественный состав) тонкокишечных бактерий и других микроорганизмов.
По самым современным рекомендациям при увеличении количества микроорганизмов в аспирате из тонкой кишки более чем 103 КОЕ/мл высока вероятность СИБР. Увы, предложенные методы исследования дорогостоящие и не могут быть использованы с рутинной практике.
Если с количественными характеристиками СИБР все более-менее ясно, то качественные изменения бактериального состава тонкой кишки при этом состоянии остаются малоизученными. Существует лишь небольшое количество работ при некоторых заболеваниях (например, при синдроме раздраженного кишечника), где выявлены определенные изменения соотношений одних групп бактерий к другим. Клиническое значение таких изменений до сих пор неясно.
В настоящее время большинство рекомендаций предлагает использовать для диагностики СИБР водородный дыхательный тест с лактулозой или глюкозой. В норме водород продуцируется только кишечными бактериями при переработке некоторых углеводов. Образовавшийся водород всасывается в кровоток, достигает легких и может быть определен специальным анализатором в выдыхаемом воздухе. В ходе теста оценивается изменение концентрации водорода после употребления внутрь раствора углевода. В качестве тестового субстрата чаще всего используется невсасываемый углевод лактулоза, реже применяется глюкоза.
У части лиц симптомы СИБР могут быть вызваны избыточным ростом метанпродуцирующих микроорганизмов, и в этом случае возможно использование метанового дыхательного теста.
Существуют и другие дыхательные тесты, однако они малодоступны в рутинной практике.
Лечение СИБРВ настоящее время СИБР рассматривается как вторичное состояние, которое возникает как следствие имеющегося «фонового» заболевания или внешнего воздействия (в т.ч. лекарственной терапии). Поэтому во всех рекомендациях по лечению СИБР на первом месте стоит лечение основного заболевания для предотвращения повторного появления жалоб.
Одним из главных методов лечения СИБР – так называемая «санация» кишечника путем назначения антибиотиков. Предпочтение отдается невсасываемым антибиотикам (например, рифаксимину) и другим антибактериальным препаратам, доказавшим свою эффективность.
Диетотерапия с ограничением продуктов, богатых ферментируемыми углеводами (так называемая диета lowFODMAP) может быть эффективна у некоторых пациентов.
Назначение пре- и пробиотиков в качестве дополнительных средств коррекции СИБР может уменьшить часть симптомов – вздутие живота, дискомфорт в животе. Однако эти препараты редко бывают эффективны в качестве единственной терапии.
Также в лечении СИБР нередко используются дополнительные лекарственные средства, такие как полиферментные препараты, регуляторы кишечной моторики, сорбенты и т.д.
Прогноз СИБРВ большинстве случаев СИБР протекает благоприятно. При устранении причинного фактора, вызвавшего СИБР, в случае правильно подобранной терапии происходит полное излечение пациента. Однако при сохранении условий для развития СИБР (хроническое заболевание, перенесенное хирургическое вмешательство и др.) возможны рецидивы симптомов, требующие повторных курсов лечения.
Дисбактериоз кишечника — Педиатрия | Nutricia
По материалам Peterson and Round, 2014. 1
Что вызывает дисбактериоз кишечной микробиоты у младенцев?
Ранняя жизнь — критическое время для развития микробиома кишечника, поэтому кишечник младенца особенно уязвим для дисбактериоза. Есть несколько факторов, которые влияют на состав кишечного микробиома у младенцев, в том числе: 1,4-6
- Срок беременности
- Материнское окружение
- Способ родов (вагинальные или кесарево)
- Питание (грудное или искусственное вскармливание)
- Использование антибиотиков
- Диета
- Загрязнение воздуха
- Генетика
Генетические факторы и изменения в факторах окружающей среды могут изменить состав микробиома кишечника, что приведет к дисбактериозу. 1
Какая связь между дисбактериозом кишечной микробиоты и аллергией?
Сообщалось о дисбиозе кишечной микробиоты у младенцев с аллергическими состояниями, такими как аллергия на белок коровьего молока (CMPA). У здоровых младенцев, находящихся на грудном вскармливании, в кишечнике обычно преобладает группа полезных бактерий, известных как бифидобактерии. Эти бактерии сначала передаются от матери во время родов и с грудным молоком. 7–9
У младенцев с аллергическими заболеваниями факторы окружающей среды могут влиять на состав микробиоты кишечника.Младенцы с АБКМ часто имеют более низкие уровни бифидобактерий в микробиоте кишечника по сравнению со здоровыми младенцами, находящимися на грудном вскармливании. 9 В настоящее время считается, что дисбактериоз кишечника потенциально может привести к развитию аллергии и другим последствиям для здоровья в более позднем возрасте. 1
Может ли дисбактериоз кишечной микробиоты влиять на развитие иммунной системы?
Ранний период жизни — критический период как для развития иммунной системы, так и для кишечной микробиоты.Иммунная система развивается быстро в течение первых 1000 дней жизни, и хорошо известно, что между иммунной системой и микробиотой кишечника возникает перекрестное взаимодействие.
Таким образом, дисбиоз кишечной микробиоты может повлиять на развитие иммунной системы, что может привести к аллергии, такой как CMPA, и другим последствиям для здоровья, таким как астма, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 4,15–17
Может ли дисбактериоз кишечной микробиоты привести к аллергическим заболеваниям, таким как аллергия на белок коровьего молока, у младенцев?
Считается, что дисбиоз кишечной микробиоты играет определенную роль в развитии пищевой аллергии, такой как аллергия на белок коровьего молока (CMPA), в раннем возрасте.Несколько исследований показали, что дисбактериоз кишечника у младенцев может задерживать развитие оральной толерантности — процесса, при котором подавляется иммунный ответ на пищевой белок.
Нарушение пероральной толерантности может привести к развитию пищевой аллергии. 16 Дисбактериоз кишечника в раннем возрасте также был связан с развитием ряда заболеваний, включая астму, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 17
Можем ли мы вернуть баланс к здоровой микробиоте кишечника?
Грудное молоко содержит как пребиотики природного происхождения, такие как олигосахариды грудного молока (HMO), так и полезные бактерии (пробиотики).Оба эти элемента помогают поддерживать здоровую микробиоту кишечника и поддерживать развитие иммунной системы. 16,17
Если грудное вскармливание невозможно, добавление уникальной комбинации пребиотиков и пробиотиков, известных как синбиотики, к детской смеси, восстанавливает баланс кишечного микробиома и способствует пероральной переносимости, потенциально снижая риск аллергических заболеваний. 20,23,24
Почему стоит рассмотреть уникальную смесь синбиотиков при аллергии на белок коровьего молока?
Растущее количество клинических данных свидетельствует о том, что уникальная смесь синбиотиков может иметь положительный эффект у младенцев с риском пищевой аллергии или живущих с ней, таких как АБКМ. 12,23,24 Признавая потенциальные преимущества пре- и пробиотиков, Группа рекомендаций Всемирной организации по аллергии предлагает рассмотреть вопрос о добавлении пре- и пробиотиков для младенцев с риском аллергии, если они не находятся на исключительно грудном вскармливании. 21,22
В настоящее время большинство содержащих пробиотики детских смесей включают виды Bifidobacterium и / или молочнокислые бактерии, такие как Lactobacillus views, 25 , которые обычно считаются безопасными и разрешенными для использования в пищевых продуктах в соответствии с Правилами Австралии и Новой Зеландии по пищевым стандартам.
В последнее десятилетие различные пребиотические смеси галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) были изучены на предмет их положительного воздействия на младенцев с риском пищевой аллергии или живущих с ней. Клинические исследования пребиотических смесей для младенцев, состоящих из короткоцепочечной (sc) GOS и длинноцепочечной (lc) FOS, scGOS / lcFOS в соотношении 9: 1, напоминающих олигосахаридные компоненты грудного молока как по количеству, так и по разнообразию, показали преимущества, связанные с регулированием микробиоты кишечника и иммунной системы, снижением частоты инфекций и размягчением стула. 25
Отобранные продукты Nutricia для лечения аллергии на белок коровьего молока содержат уникальную запатентованную смесь синбиотиков пребиотиков (включая scGOS / lcFOS (9: 1)) и пробиотиков (Bifidobacterium breve M16V), вдохновленных компонентами грудного молока.
Микробиота кишечника и развитие детских заболеваний
Turnbaugh PJ, Ley RE, Hamady M, et al. Проект микробиома человека. Природа. 2007. 449 (7164): 804–10.
CAS PubMed Central PubMed Статья Google ученый
Сюй Дж., Гордон Дж. Почитай симбионтов твоих. Proc Natl Acad Sci U S. A. 2003; 100 (18): 10452–9.
CAS PubMed Central PubMed Статья Google ученый
Гилл С.Р., Поп М., Дебой Р.Т. и др. Метагеномный анализ микробиома дистального отдела кишечника человека. Наука. 2006. 312 (5778): 1355–9.
CAS PubMed Central PubMed Статья Google ученый
Палмер С., Бик Э.М., ДиДжиулио Д.Б. и др. Развитие кишечной микробиоты младенца у человека. PLoS Biol. 2007; 5 (7): e177.
PubMed Central PubMed Статья Google ученый
Azad MB, Konya T, Maughan H, et al. Микробиота кишечника младенцев и гигиеническая гипотеза аллергического заболевания: влияние домашних животных и братьев и сестер на состав и разнообразие микробиоты. Allergy Asthma Clin Immunol. 2013; 9 (1): 15.
PubMed Central PubMed Статья Google ученый
Виртанен С.М., Таккинен Х.М., Нвару Б.И. и др. Воздействие микробов в младенчестве и последующее появление аутоантител, связанных с сахарным диабетом 1 типа: когортное исследование. JAMA Pediatr. 2014. 168 (8): 755–63.
PubMed Статья Google ученый
Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, et al. Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения.J Педиатр Гастроэнтерол Нутр. 2000. 30 (1): 61–7.
CAS PubMed Статья Google ученый
Penders J, Thijs C, Vink C, et al. Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия. 2006. 118 (2): 511–21.
PubMed Статья Google ученый
Тернбо П. Дж., Ридаура В. К., Фейт Дж. Дж. И др. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных мышах-гнотобиотах.Sci Transl Med. 2009; 1 (6): 6ра14.
PubMed Central PubMed Статья Google ученый
Ву Г.Д., Чен Дж., Хоффманн С. и др. Связь долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука. 2011. 334 (6052): 105–8.
CAS PubMed Central PubMed Статья Google ученый
Домингес-Беллоа М.Г., Костеллоб Е.К., Контрерас М. и др.Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S. A. 2010; 107 (26): 11971–5.
CAS Статья Google ученый
Jakobsson HE, Abrahamsson TR, Jenmalm MC, et al. Уменьшение разнообразия кишечной микробиоты, задержка колонизации Bacteroidetes и снижение ответа Th2 у младенцев, рожденных с помощью кесарева сечения. Кишечник. 2014. 63 (4): 559–66.
CAS PubMed Статья Google ученый
Капоне К.А., Дауд С.Е., Стаматас Г.Н. и др. Разнообразие микробиома кожи человека в раннем возрасте. J Investigate Dermatol. 2011. 131 (10): 2026–2032.
CAS PubMed Central PubMed Статья Google ученый
Munyaka PM, Khafipour E, Ghia JE. Внешнее влияние на формирование микробиоты кишечника в раннем детстве и последующие последствия для здоровья. Фронт Педиатр. 2014; 2: 109.
PubMed Central PubMed Статья Google ученый
Жако А., Неве Д., Аужулат Ф. и др. Динамика и клиническая эволюция бактериальной микрофлоры кишечника у крайне недоношенных пациентов. J Pediatr. 2011. 158 (3): 390–6.
PubMed Статья Google ученый
Fouhy F, Guinane CM, Hussey S, et al. Высокопроизводительное секвенирование показывает неполное краткосрочное восстановление микробиоты кишечника младенцев после парентерального лечения антибиотиками ампициллином и гентамицином. Антимикробные агенты Chemother.2012. 56 (11): 5811–20.
CAS PubMed Central PubMed Статья Google ученый
Стюарт CJ, Marrs EC, Nelson A, et al. Развитие кишечного микробиома недоношенных близнецов с риском некротизирующего энтероколита и сепсиса. PLoS One. 2013; 8 (8): e73465.
CAS PubMed Central PubMed Статья Google ученый
Чанг Дж.Й., Антонопулос Д.А., Калра А. и др.Снижение разнообразия фекального микробиома при рецидивирующей диарее, связанной с Clostridium difficile. J Infect Dis. 2008. 197 (3): 435–8.
PubMed Статья Google ученый
Детлефсен Л., Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4554–61.
CAS PubMed Central PubMed Статья Google ученый
Рассел С.Л., Голд М.Дж., Хартманн М. и др. Изменения микробиоты в раннем возрасте, вызванные приемом антибиотиков, повышают восприимчивость к аллергической астме. EMBO Rep. 2012; 13 (5): 440–7.
CAS PubMed Central PubMed Статья Google ученый
Bailey LC, Forrest CB, Zhang P, et al. Связь антибиотиков в младенчестве с ожирением в раннем детстве. JAMA Pediatr. 2014. 168 (11): 1063–9.
PubMed Статья Google ученый
Рамакришна Б.С. Роль микробиоты кишечника в питании и метаболизме человека. J Gastroenterol Hepatol. 2013; 28 (Приложение 4): 9–17.
CAS PubMed Статья Google ученый
Collado MC, Isolauri E, Salminen S. Специфические пробиотические штаммы и их комбинации противодействуют адгезии Enterobacter sakazakii к кишечной слизи. FEMS Microbiol Lett. 2008. 285 (1): 58–64.
CAS PubMed Статья Google ученый
Yu LC, Shih YA, Wu LL, et al. Кишечный дисбактериоз способствует развитию устойчивых к антибиотикам бактериальных инфекций: системного распространения устойчивых и комменсальных бактерий через эпителиальный трансцитоз. Am J Physiol Gastrointest Liver Physiol. 2014; 307 (8): G824–35.
CAS PubMed Статья Google ученый
Рудин А., Лунделл А.С. Воспоминания о младенческих В-клетках и бактериальная колонизация кишечника. Кишечные микробы. 2012; 3 (5): 474–5.
PubMed Central PubMed Статья Google ученый
Mazmanian SK, Liu CH, Tzianabos AO и др. Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Клетка. 2005. 122 (1): 107–18.
CAS PubMed Статья Google ученый
Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy. 2014; 44 (6): 842–50.
CAS PubMed Статья Google ученый
Биззарро М.Дж., Эренкранц Р.А., Галлахер П.Г. Сопутствующие инфекции кровотока у младенцев с некротическим энтероколитом. J Pediatr. 2014. 164 (1): 61–6.
PubMed Статья Google ученый
Май В., Янг С.М., Уханова М. и др. Микробиота кала у недоношенных детей до некротического энтероколита. PLoS One. 2011; 6 (6): e20647.
CAS PubMed Central PubMed Статья Google ученый
Claud EC, Keegan KP, Brulc JM, et al. Структура бактериального сообщества и функциональный вклад в возникновение некротического энтероколита у недоношенных детей. Микробиом. 2013; 1 (1): 20.
PubMed Central PubMed Статья Google ученый
Александр В.Н., Нортруп В., Биззарро М.Дж. Воздействие антибиотиков в отделении интенсивной терапии новорожденных и риск некротического энтероколита. J Pediatr. 2011. 159 (3): 392–7.
PubMed Central PubMed Статья Google ученый
Sullivan S, Schanler RJ, Kim JH, et al. Диета, основанная исключительно на грудном молоке, связана с более низким уровнем некротического энтероколита, чем диета на основе грудного молока и продуктов на основе коровьего молока. J Pediatr. 2010. 156 (4): 562e1–567e1.
Google ученый
Бергманн К.Р., Лю С.Х., Тиан Р. и др.Бифидобактерии стабилизируют клаудины в плотных контактах и предотвращают дисфункцию кишечного барьера при некротическом энтероколите у мышей. Am J Pathol. 2013. 182 (5): 1595–606.
CAS PubMed Central PubMed Статья Google ученый
Prideaux L, Kamm MA, De Cruz PP, et al. Воспалительное заболевание кишечника в Азии: систематический обзор. J Gastroenterol Hepatol. 2012. 27 (8): 1266–80.
PubMed Статья Google ученый
Диксвед Дж., Халфварсон Дж., Розенквист М. и др. Молекулярный анализ микробиоты кишечника однояйцевых близнецов с болезнью Крона. ISME J. 2008; 2 (7): 716–27.
CAS PubMed Статья Google ученый
Франк Д. Н., Сент-Аманд А. Л., Фельдман Р. А. и др. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S. A. 2007; 104 (34): 13780–5.
CAS PubMed Central PubMed Статья Google ученый
Мартин Р., Чейн Ф, Микель С. и др. Комменсальная бактерия Faecalibacterium prausnitzii является защитной в моделях хронического умеренного и тяжелого колита, вызванного DNBS. Воспаление кишечника. 2014; 20 (3): 417–30.
PubMed Статья Google ученый
Каллиомяки М., Колладо М.С., Салминен С. и др. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am J Clin Nutr. 2008. 87 (3): 534–8.
PubMed Google ученый
Cho I, Yamanishi S, Cox L, et al. Антибиотики в раннем возрасте изменяют микробиом толстой кишки и ожирение мышей. Природа. 2012. 488 (7413): 621–6.
CAS PubMed Central PubMed Статья Google ученый
Райли Л.В., Рафаэль Э., Фаерштейн Э. Ожирение в Соединенных Штатах — дисбактериоз от воздействия низких доз антибиотиков? Фронт общественного здравоохранения. 2013; 1:69.
PubMed Central PubMed Статья Google ученый
Эге М.Дж., Майер М., Норманд А.С. и др. Воздействие микроорганизмов окружающей среды и детская астма. N Engl J Med. 2011; 364 (8): 701–9.
CAS PubMed Статья Google ученый
Страчан Д.П. Сенная лихорадка, гигиена и размер домочадца. BMJ. 1989. 299 (6710): 1259–60.
CAS PubMed Central PubMed Статья Google ученый
Smith PM, Garrett WS.Микробиота кишечника и Т-клетки слизистой оболочки. Front Microbiol. 2011; 2: 111.
PubMed Central PubMed Статья Google ученый
Kalliomäki M, Kirjavainen P, Eerola E, et al. Отчетливые закономерности микрофлоры кишечника новорожденных у младенцев, у которых атопия развивалась и не развивалась. J Allergy Clin Immunol. 2001. 107 (1): 129–34.
PubMed Статья Google ученый
Abrahamsson TR, Wu RY, Jenmalm MC. Микробиота кишечника и аллергия: важность периода беременности. Pediatr Res. 2015; 77 (1–2): 214–9.
PubMed Статья Google ученый
Рассел С.Л., Голд М.Дж., Рейнольдс Л.А. и др. Перинатальные изменения микробиоты кишечника, вызванные приемом антибиотиков, по-разному влияют на воспалительные заболевания легких. J Allergy Clin Immunol. 2015; 135 (1): 100–9.
CAS PubMed Статья Google ученый
Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Низкое разнообразие микробиоты кишечника у младенцев с атопической экземой. J Allergy Clin Immunol. 2012; 129 (2): 434–40.e2.
PubMed Статья Google ученый
Iemoli E, Trabattoni D, Parisotto S, et al. Пробиотики уменьшают транслокацию кишечных микробов и улучшают атопический дерматит у взрослых. J Clin Gastroenterol. 2012; 46 (Прил.): S33–40.
PubMed Статья Google ученый
Нермес М., Кантеле Дж. М., Атосуо Т. Дж. И др. Взаимодействие перорально вводимого Lactobacillus rhamnosus GG с микробиотой кожи и кишечника и гуморальным иммунитетом у младенцев с атопическим дерматитом. Clin Exp Allergy. 2011. 41 (3): 370–7.
CAS PubMed Статья Google ученый
Минемура М., Симидзу Ю. Микробиота кишечника и заболевания печени. Мир Дж. Гастроэнтерол. 2015; 21 (6): 1691–702.
CAS PubMed Central PubMed Статья Google ученый
Chou HH, Chien WH, Wu LL, et al. Возрастное иммунное очищение от инфекции вируса гепатита B требует установления микробиоты кишечника. Proc Natl Acad Sci U S. A. 2015; 112 (7): 2175–80.
CAS PubMed Статья Google ученый
Chen Y, Yang F, Lu H, et al. Характеристика фекальных микробных сообществ у пациентов с циррозом печени. Гепатология. 2011; 54 (2): 562–72.
PubMed Статья Google ученый
Bajaj JS, Ridlon JM, Hylemon PB и др. Связь микробиома кишечника с познанием при печеночной энцефалопатии. Am J Physiol Gastrointest Liver Physiol. 2012; 302 (1): G168–75.
CAS PubMed Central PubMed Статья Google ученый
Fox JG, Feng Y, Theve EJ, Raczynski AR, et al. Кишечные микробы определяют риск рака печени у мышей, подвергшихся воздействию химических и вирусных трансгенных канцерогенов. Кишечник. 2010. 59 (1): 88–97.
CAS PubMed Central PubMed Статья Google ученый
Furrie E, Macfarlane S, Kennedy A, et al. Синбиотическая терапия (Bifidobacterium longum / Synergy 1) инициирует разрешение воспаления у пациентов с активным язвенным колитом: рандомизированное контролируемое пилотное исследование. Кишечник. 2005. 54 (2): 242–9.
CAS PubMed Central PubMed Статья Google ученый
Петроф Е.О., Кодзима К., Ропелески М.Дж. и др. Пробиотики ингибируют ядерный фактор-κB и индуцируют белки теплового шока в эпителиальных клетках толстой кишки посредством ингибирования протеасом. Гастроэнтерология. 2004. 127 (5): 1474–87.
CAS PubMed Статья Google ученый
Кикучи Ю., Кунито-Асари А., Хаякава К. и др. Пероральное введение штамма Lactobacillus plantarum AYA усиливает секрецию IgA и обеспечивает защиту выживания от инфицирования вирусом гриппа у мышей.PLoS One. 2014; 9 (1): e86416.
PubMed Central PubMed Статья Google ученый
Орландо А., Линсалата М., Нотарникола М. и др. Lactobacillus GG: восстановление индуцированного глиадином разрушения эпителиального барьера: роль клеточных полиаминов. BMC Microbiol. 2014; 14:19.
PubMed Central PubMed Статья Google ученый
Кунце В.А., Мао Ю.К., Ван Б. и др.Lactobacillus reuteri усиливает возбудимость нейронов АГ толстой кишки, ингибируя открытие кальцийзависимых калиевых каналов. J Cell Mol Med. 2009. 13 (8B): 2261–70.
PubMed Статья Google ученый
Остин М., Меллоу М., Тирни В.М. Трансплантация фекальной микробиоты в лечении инфекций Clostridium difficile. Am J Med. 2014. 127 (6): 479–83.
PubMed Статья Google ученый
Collado MC, Rautava S, Isolauri E, et al. Микробиота кишечника: источник новых средств для снижения риска заболеваний человека? Pediatr Res. 2015; 77 (1–2): 182–8.
PubMed Статья Google ученый
Culligan EP, Sleator RD, Marchesi JR, et al. Функциональный экологический скрининг метагеномной библиотеки идентифицирует stlA; уникальный локус солеустойчивости из микробиома кишечника человека. PLoS One. 2013; 8 (12): e82985.
PubMed Central PubMed Статья Google ученый
Юн СС, Ким Е.К., Ли В.Дж. Функциональный геномный и метагеномный подходы к пониманию мутуализма кишечной микробиоты и животных. Curr Opin Microbiol. 2015; 24: 38–46.
CAS PubMed Статья Google ученый
Lakhdari O, Cultrone A, Tap J, et al. Функциональная метагеномика: метод высокопроизводительного скрининга для расшифровки модуляции NF-κB, вызванной микробиотой, в кишечнике человека. PLoS One. 2010; 5 (9): e13092.
Дисбиоз носоглотки предшествует развитию инфекций нижних дыхательных путей у детей раннего возраста, продольное когортное исследование новорожденных
Резюме
Предпосылки Младенцы, страдающие инфекциями нижних дыхательных путей (ИНДП), имеют различные профили носоглоточного микроба (НП). при тяжести заболевания.Неизвестно, предшествуют ли эти профили инфекции или ее последствиям. Чтобы ответить на этот вопрос, необходимы лонгитюдные исследования.
Методы Мы провели анализ лонгитюдного проспективного когортного исследования с участием 1981 замбийской пары мать-младенец, которым производилась выборка NP в возрасте от 1 до 14 недель с интервалом в 2-3 недели. У десяти младенцев в когорте развились НИОП, и их сравнивали со здоровыми препаратами сравнения 3: 1. Мы завершили секвенирование гена 16S рРНК на образцах, внесенных каждым из этих младенцев, а также на исходных образцах от матерей младенцев и охарактеризовали нормальное созревание микробиома здорового младенца NP по сравнению с младенцами, у которых развились LRTI.
Результаты Созревание микробиома младенцев NP характеризовалось переходом от доминантных профилей Staphylococcus к доминантным профилям респираторного рода в течение первых трех месяцев жизни, аналогично тому, что описано в литературе. Интересно, что младенцы, у которых развились НИПТ, до инфицирования имели дисбактериоз НП, в большинстве случаев уже на первой неделе жизни. Дисбактериоз характеризовался наличием новосфингобиума, дельфтии , высокой относительной численностью анаэробациллы, бациллы и низкой относительной численностью долосигранулума по сравнению со здоровыми контрольными животными.Матери младенцев с ИНДП также имели низкую относительную численность Dolosigranulum в исходных образцах по сравнению с матерями младенцев, у которых не развились ИНДП.
Выводы Наши результаты показывают, что дисбактериоз микробиома NP предшествует LRTI у маленьких детей и может также присутствовать у их матерей. Ранний дисбактериоз может играть роль в причинном пути, ведущем к ИДП, или может быть маркером других патогенных сил, которые непосредственно приводят к ИДП.
Финансирование Эта работа была поддержана Исследованием коклюша матерей в Южной Африке — носоглоточное носительство (SAMIPS-NPC).П. И. Гилл. Спонсор NIH / NIAID (1R01AI133080). WEJ и TF поддерживались фондами NIH, U01CA220413 и R01GM127430.
Общие сведения
Инфекции нижних дыхательных путей (ИДП), включая пневмонию и бронхиолит, являются основной причиной смерти детей в возрасте до пяти лет, вызывая 1,3 миллиона случаев смерти ежегодно, при этом 81% приходится на детей в возрасте 2 лет и младше (Cao et al., 2019; Fischer Walker et al., 2013). Необходимым этапом, ведущим к ИНДП, является приобретение респираторного патогена, такого как Streptococcus pneumoniae .Однако пневмококковое носительство почти повсеместно встречается среди младенцев, лишь у немногих из которых развивается тяжелое инвазивное заболевание (Balsells et al., 2018; Yildirim et al., 2017, 2010). Это указывает на то, что присутствие патогена, хотя и необходимо, не дает адекватного ответа на более фундаментальный вопрос о том, почему у некоторых младенцев развиваются НИПТ, а у большинства — нет.
Все чаще ИДП рассматривается как следствие взаимодействия между патогеном и другими контекстными факторами. Такие факторы включают чистое иммунное состояние хозяина, интеркуррентные вирусные инфекции, которые могут действовать временно или, в случае ВИЧ, в течение продолжительных периодов времени.Еще одним фактором может быть микробная экосистема, в которой существует патоген, –. и ., Микробиом носоглотки. Рассмотрение микробиома как модели экосистемы предполагает, что отдельные члены этой экосистемы существуют в некотором динамическом равновесии, характеризующемся взаимными петлями взаимодействия. Таким образом, взаимодействие между микробиомом и конкретным потенциальным патогеном (т., 2016; Стюарт и др., 2017).
В поддержку этой экосистемной модели несколько перекрестных исследований показали, что у детей с ИДПТ часто наблюдаются различные профили микробиома носоглотки (НП) во время инфекции по сравнению со здоровыми детьми. В профилях микробиома NP, по-видимому, преобладают виды бактерий, которые различаются в зависимости от респираторных инфекций и состояния здоровья. Например, микробиомы NP с преобладанием Streptococcus и Haemophilus связаны с LRTI, тогда как профили микробиомов с преобладанием Moraxella, Corynebacterium и / или Dolosigranulum характерны для здоровых детей.Кроме того, характеристики микробиома NP коррелируют с тяжестью респираторного заболевания и клиническими исходами (de Steenhuijsen Piters et al., 2015; Hasegawa et al., 2017). Хотя такие наблюдения носят провокационный характер, они в основном основаны на перекрестных исследованиях и поэтому не могут определить направление причинно-следственной связи: мы не знаем, являются ли эти микробные профили результатом инфекции или они предшествовали ей. Если последнее верно, то различия в микробиоме NP могут потенциально представлять состояние уязвимости, участвуя в причинном пути, ведущем к LRTI.
Чтобы сделать такие выводы, необходимо иметь продольные данные с выборкой младенцев до разработки ИДПТ. Поскольку ИНДП — редкое событие, сбор продольных данных затруднен из-за необходимости наблюдения за большим количеством младенцев. В период с 2015 по 2016 год наша команда провела проспективное когортное исследование и смогла создать библиотеку биологических образцов, которая позволила провести такой лонгитюдный анализ. Исследование проводилось в Лусаке, Замбия, среди 1981 пары мать-ребенок: Исследование коклюша матери-младенца в Южной Африке — SAMIPS (Gill et al., 2016). Пары были зарегистрированы через неделю после родов. Все зачисленные младенцы были здоровыми и родились доношенными. На исходном уровне и каждые две-три недели после этого в возрасте 14 недель мы брали образцы NP от матери и ребенка.
В этой когорте из 1981 здорового младенца в подгруппе из 10 младенцев развилась тяжелая ИНДП на основании стандартных клинических критериев ВОЗ ( Пересмотренная классификация ВОЗ и лечение детской пневмонии в медицинских учреждениях • РЕЗЮМЕ ДОКАЗАТЕЛЬСТВ • , н.о.). Сравнивая младенцев, у которых развились LRTI, с подобранными здоровыми младенцами, мы смогли провести анализ временных рядов микробиома NP обеих популяций младенцев, используя секвенирование рибосомной ДНК 16S.Мы сосредоточились на следующих фундаментальных анализах: 1) каков «нормальный» образец созревания микробиома NP в течение первых нескольких месяцев жизни? 2) как это контрастирует с созреванием микробиома NP у младенцев, у которых развились LRTI? 3) есть ли доказательства того, что дисбактериоз НП предшествует возникновению НИПТ? 4) существуют ли отдельные профили микробиома, которые характеризуют болезнь, здоровье и другие характеристики младенца? 5) Имеются ли доказательства НП-дисбактериоза среди матерей младенцев, у которых позже развились НИПТ?
Результаты
В когорте SAMIPS мы идентифицировали десять младенцев, у которых развились НИПТ в течение периода исследования в соответствии с клиническими критериями ВОЗ: кашель, холод и учащенное дыхание, втягивание грудной клетки или другие общие опасные признаки (вялость, затрудненное кормление, постоянная рвота. , и судороги) ( Пересмотренная классификация ВОЗ и лечение детской пневмонии в медицинских учреждениях • РЕЗЮМЕ ДОКАЗАТЕЛЬСТВ • , n.д.). Затем мы сопоставили этих заболевших младенцев по сезону рождения, количеству братьев и сестер и статусу контакта с ВИЧ со здоровыми компараторами. С десятью младенцами с LRTI и соответствием 3: 1 наша аналитическая группа состояла из 40 младенцев в ~ 7 временных точек каждый. Все дети родились здоровыми путем естественных родов. Мужской пол чаще встречался у младенцев, у которых развились НИПТ (p = 0,067). Треть младенцев с ИНДП родилась от ВИЧ-инфицированных матерей (получающих антиретровирусное лечение) по сравнению с 40% младенцев в группе здоровых детей.Основные характеристики 40 младенцев приведены в таблице 1 . Симптомы и время отбора проб у десяти младенцев, у которых развились НИПТ, показаны в Таблице 2 .
Таблица 1.Характеристики здоровых младенцев и младенцев с LRTI
Таблица 2.Клинические симптомы и возраст 10 младенцев с LRTI в каждом исследовании отбор проб цисит / NP
Данные секвенирования и обработки ампликона рибосомной ДНК 16S
Мы успешно секвенировали 265 Мазки NP от 40 младенцев, в среднем по семь образцов от каждого младенца.Средний возраст при первой выборке составлял семь дней, а средний возраст при окончательной выборке — 104 дня. Мы также секвенировали два мазка NP от матери каждого младенца в первый и последний моменты времени, в общей сложности 345 образцов от матери и ребенка вместе взятых. В шести из этих образцов менее 10 000 считываний соответствовали эталонным геномам RefSeq и были исключены из дальнейшего анализа. Остальные 339 образцов имели среднее значение 101 979 считываний на образец, отнесенный к эталонным геномам, и были включены в анализ.Из них мы обнаружили 421 уникальный род, охватывающий 14 уникальных типов, которым было присвоено не менее 100 последовательностей чтения во всех выборках. Основываясь на этих результатах, мы были уверены в нашей способности продолжить последующий анализ.
Анализ первый: каково созревание микробиома NP у здоровых младенцев в первые три месяца жизни?
Учитывая нашу конечную цель — выявить характеристики микробиома NP у младенцев, у которых развиваются LRTI, в качестве первого шага мы описываем характеристики и эволюцию микробиома NP здоровых младенцев.Мы проанализировали образцы NP от всех младенцев, которые оставались свободными от LRTI до конца наблюдения, используя линейную регрессию для отслеживания изменений относительной численности родов с течением времени, охватывающего период между включением в исследование после рождения и до достижения 14-недельного возраста.
Мы наблюдали ступенчатую модель созревания по мере старения младенцев, обобщенную в Рис. 1a , показывающую относительную численность различных родов в каждой усредненной по возрасту страте. Как можно видеть, со временем наблюдается явный сдвиг в изобилии доминирующих родов: одни доминируют в раннем возрасте, а другие становятся более заметными по мере взросления детей.В начале жизни доминантными родами были Staphylococcus и Corynebacteria . Согласно модели со смешанными эффектами, относительная численность этих родов снижалась с возрастом младенцев ( Staphylococcus : p <10E-7, Corynebacteria : p <0,001) и были заменены в основном Streptococcus (p <0,01 Dolosigranulum (p <0,001), Moraxella (p <0,001) и Haemophilus (p = 0,02).
Рисунок 1:Созревание микробиомов NP у здоровых младенцев без симптомов (n = 30), и Б) младенцы с ИНДП (n = 10) в течение трех месяцев наблюдения.Эти составные столбчатые диаграммы показывают среднюю относительную численность наиболее распространенных родов, обнаруженных у новорожденных NP, с выборками, распределенными по возрасту.
Мы не измерили каких-либо значительных изменений в альфа-разнообразии (богатстве в пределах данной выборки) микробиомов NP у здоровых младенцев в возрасте, измеренных либо индексом Шеннона (p = 0,32), либо индексом Chao1 (p = 0,15). Однако альфа-разнообразие отражает только количество доминантных родов, а не то, разнообразны ли сами доминантные роды. Таким образом, когда мы сгруппировали образцы на основе бета-разнообразия (между разнообразием образцов), измеренного как несходство Брея-Кертиса между парами образцов, мы определили отчетливый профиль, связанный с образцами от очень маленьких детей, который контрастировал с несколькими профилями для более зрелых младенцев NP. ( Дополнительный рисунок 1a ).В то время как в каждом кластере преобладают один или несколько наиболее распространенных родов, очень немногие образцы от здоровых младенцев имели высокую численность родов за пределами шести наиболее известных родов. Основная ось основного координатного анализа (PCoA) (, дополнительный рисунок 1b, ) коррелировала с возрастом младенцев на момент отбора проб, а образцы стратифицировались в основном по относительной численности Staphylococcus и Corynebacterium у младенцев младшего возраста по сравнению с y роды, которые чаще встречались в более старшем возрасте.По второй оси PCoA проводилось различие между образцами, богатыми Moraxella или Dolosigranulum , и образцами, богатыми Streptococcus или Haemophilus . Таким образом, этот анализ показал, что микробиомы раннего младенчества были очень динамичными с течением времени, но эти сдвиги происходили по структурированному и стереотипному образцу.
Анализ второй: Отличается ли созревание микробиома NP у младенцев, у которых развились LRTI, по сравнению со здоровыми младенцами?
Учитывая доказательства из предшествующей литературы о том, что во время ИДП микробиом НП у младенцев отличается от такового у здоровых младенцев, мы решили проверить, изменяется ли созревание микробиома НП в первые месяцы жизни у младенцев, у которых развиваются ИНДП. .Мы повторили наш анализ, как описано для здоровых младенцев, разделив на возрастные группы и составив карту эволюции микробиома NP в течение первых трех месяцев жизни (, рис. 1b, ). Младенцы, у которых развились НИПТ, имели общие модели преемственности, аналогичные описанным для здоровых младенцев, с высокой относительной численностью Staphylococcus в раннем возрасте, замененной относительной численностью Streptococcus, Haemophilus, Corynebacterium, Dolosigranulum и Moraxella .Несмотря на то, что общий образец наследования микробиома NP у младенцев с LRTI был подобен моделям преемственности здоровых младенцев, они демонстрировали отличные характеристики. Примечательно, что микробиом NP младенцев, у которых развились НИПТ, имел в среднем более высокую относительную численность определенных родов, включая Bacillus (p = 0,05) и Delfia (p <0,001), и более низкое относительное количество Dolosigranulum (p < 0,001).
Как и в случае со здоровыми младенцами из контрольной группы в нашем анализе 1, мы не наблюдали каких-либо изменений альфа-разнообразия у младенцев с ИНДП по мере их старения (Шеннон: p = 0.08, Чао1: p = 0,74). Анализ бета-разнообразия между образцами младенцев LRTI еще раз выявил кластер образцов, взятых в очень ранние моменты времени, в которых преобладает Staphylococcus , причем образцы, взятые из более старых временных точек, демонстрируют профили, богатые Streptococcus, Dolosigranulum, Moraxella и Haemophilus. . Однако у младенцев с ИНДП мы также наблюдали большой шестой кластер, характеризующийся высокой численностью Anaerobacillus , а также различных других редких родов ( Дополнительный рисунок 2 ).
Неметрическое многомерное масштабирование (NMDS) масштабирование матрицы несходства бета-разнообразия между всеми выборками позволяет нам визуализировать более целостные структурные различия в сообществах NP здоровых младенцев по сравнению с LRTI ( Рисунок 2 ). Когда мы проецируем возраст и возможный статус LRTI младенцев в пространство ординаций NMDS, мы можем видеть, что возраст тесно коррелирует с первичной осью NMDS, тогда как статус LRTI в основном коррелирует с вторичной и третичной осями, указывая на различия в микробиомах NP между здоровыми и младенцев с ИНДП независимо от процесса старения.
Рисунок 2: Графики порядков по неметрической многомерной шкале (NMDS) для всех младенцев (n = 40) носоглоточных (NP) образцов.Мы применили трехмерную ординацию NMDS к матрице различий Брея-Кертиса между мазками NP всех младенцев и спроецировали векторы в это пространство ординации, представляющее наилучшие корреляции для возраста при выборке (черные стрелки) и статуса LRTI (голубые стрелки). стрелки представляют контрольных младенцев, красные стрелки представляют младенцев с ИНДП). Графики A и C показывают первые две оси NMDS, а графики B и D показывают вторую и третью оси.Образцы на графиках A и B окрашены в зависимости от прогрессирования симптомов ИНДП, тогда как образцы на графиках C и D окрашены в соответствии с их членством в кластере первичного таксономического профиля (подробности см. На Рисунке 3). Возраст сильно коррелирует с первой осью NMDS, и образцы на молодом конце вектора возраста в основном принадлежат профилю с преобладанием Staphylococcus , тогда как образцы на более старом конце имеют тенденцию больше принадлежать к Haemophilus и Moraxella . -доминированные профили (А).Профиль с преобладанием Dolosigranulum связан со здоровым концом вектора для определения статуса LRTI, тогда как профиль с преобладанием Anaerbacillus связан с заболеванием (A, C).
Поскольку каждый младенец развивал ИНДП в разном возрасте, стратификация младенцев по возрастным группам привела к объединению младенцев в группы в разные моменты времени в зависимости от их заболевания — до ИНДП, во время ИНДП и после ИНДП. Чтобы описать созревание микробиома до времени LRTI, мы создали отдельные графики микробиома NP для каждого из десяти больных младенцев ( Дополнительный рисунок 3 ).Они подчеркивают высокую степень неоднородности моделей во времени у разных людей.
Анализ третий: Выявляется ли дисбактериоз при рождении у младенцев, у которых позже развиваются НИПТ?
Чтобы ответить на этот вопрос, мы провели анализ самых ранних проб NP, взятых у каждого ребенка в возрасте 7 дней, сравнивая микробиомы тех младенцев, у которых в конечном итоге развились ИДП, с теми, у кого их не было. На момент включения в исследование все младенцы были здоровыми по определению (на основании критериев включения / исключения), и, следовательно, младенцев, у которых развились НИПТ, можно было вместе сгруппировать как «до заражения» в этот момент времени.
Мы использовали R-пакет DESeq2 для выполнения тестов дифференциальной численности. Чтобы считаться значимым, данный род должен быть дифференциально численным с скорректированным по FDR p-значением менее 0,1, а также средней относительной численностью не менее 0,1% среди здоровых или больных младенцев. Мы определили три варианта, по которым род может различаться между двумя группами: во-первых, род, который был идентифицирован исключительно у младенцев, у которых развились НИПТ, например, Novosphingobium (4/10).Во-вторых, роды, которые чаще встречались у младенцев с ИНДП (но присутствовали в обеих группах), такие как Delftia (8/10 у младенцев с ИНДП против 13/30 у здоровых младенцев). И в-третьих, были роды, которые были обнаружены в обеих группах, но присутствовали с более высокой относительной численностью у младенцев с ИНДП по сравнению со здоровыми младенцами, такие как Anaerobacillus, Bacillus, Blastococcus, Brachybacterium, Ochrobactrum, Ornithinimicrobium и Sphingomonas . . В целом, десять родов значительно различались у младенцев, у которых позже в первый момент времени развились ИДП (, таблица 3, ).Примечательно, что Dolosigranulum , который был идентифицирован в предыдущих исследованиях как связанный со здоровым микробиомом, как это имело место среди здоровых младенцев, имел значительно меньшую относительную численность у младенцев, у которых развились ИДП, чем у здоровых сверстников до ИДП и даже в первый момент времени выборки.
Таблица 3.Разница в численности между контрольными младенцами и младенцами с ИНДП в самый ранний наблюдаемый момент времени
Анализ четвертый: Существуют ли отдельные профили микробиома, которые характеризуют болезнь и здоровье, а также другие характеристики младенцев?
Чтобы идентифицировать конкретные микробные профили, мы применили иерархическую кластеризацию к матрице различий Брея-Кертиса между каждой парой образцов от всех младенцев.Матрица несходства Брея-Кертиса является обычным инструментом в экологии для измерения расстояния между различными популяциями с точки зрения бета-разнообразия и ограничена между 0 и 1, охватывая «отсутствие различия» до «полное несходство». Мы рассчитали на уровне рода, используя пакет hclust в R. Мы использовали индексы кластеризации Silhouette и Frey (NbClust), чтобы определить оптимальную высоту, на которой нужно обрезать дендрограмму, созданную функцией hclust в R, разделив наши выборки на шесть основных кластеров (индекс Силуэт) и 13 подкластеров (индекс Фрея).Затем эти шесть основных профилей были названы в честь доминирующего рода в каждом кластере (род с самой высокой относительной численностью). В результате были получены следующие кластеры: Staphylococcus доминантный Streptococcus доминантный, Moraxella доминантный, Dolosigranulum доминантный, Haemophilus доминантный и Anaerobacillus доминантный профиль и Anaerobacillus доминантных профилей, соответствующих шести доминирующим профилям. , как показано в Таблице 4 . Corynebacterium — единственный высокоразвитый род, который не составляет большую часть (или множество) относительной численности в пределах какого-либо кластера; вместо того, чтобы быть доминирующим в подмножестве образцов, Corynebacterium часто сосуществовали вместе с более доминирующим Staphylococcus или, в меньшей степени, Dolosigranulum . Для простоты отчетности мы в дальнейшем будем называть каждый кластер его наиболее многочисленным родом.
Таблица 4.Относительная численность и частота наиболее распространенных родов, наблюдаемых в микробиоме NP здоровых контрольных младенцев и младенцев с ИНДП
На Рисунке 3 показан микробный состав каждой из 262 проб младенцев в нашем исследовании, прошедших фильтры качества проб, сгруппированных шестью первичными профилями (, фиг. 3A, ) и 13 подпрофилями (, фиг. 3B, ).
Рисунок 3:Таксономические профили всех образцов младенцев NP (n = 40), сгруппированные по попарному несходству Брея-Кертиса. Кластеры были определены путем выполнения иерархической кластеризации на матрице бета-разнообразия и последующего разрезания полученной дендрограммы на оптимальное количество кластеров в соответствии с A) индексом силуэта (6 кластеров) и B) индексом Фрея (13 кластеров). Цветные полосы над составными столбчатыми диаграммами показывают возраст младенцев на момент взятия каждой пробы, а их статус LRTI — «здоровый» указывает на то, что у младенца не развились симптомы LRTI во время нашего наблюдения.
Точные тесты Фишера показали, что доминантный профиль Anaerobacillus был тесно связан с младенцами, у которых развились ИДПТ (p <0,01, оценочное отношение шансов = 5,74). Подпрофиль Staphylococcus был связан с младенцами с ИНДП (p = 0,04, расчетное отношение шансов = 2,26), а подкластер Streptococcus Strep-C (который также богат Moraxella ) был связан с здоровые младенцы (р = 0,07). Используя ANOVA для оценки ассоциации каждого профиля с возрастом, доминантный профиль Staphylococcus был явно связан с образцами от младенцев младшего возраста по сравнению со всеми другими профилями, а доминирующий профиль Anaerobacillus был связан с более молодыми образцами по сравнению с Haemophilus. Профили и Streptococcus ( Таблица 5 ).
Таблица 5.Связь между профилями микробиома NP со статусом LRTI и возрастом
Мы визуализировали связь между статусом LRTI и таксономическими профилями NP, используя ординацию NMDS ( рисунки 2C и 2D ). Спроецируя статус и возраст LRTI младенцев в пространство ординации, мы можем увидеть, что вектор, соответствующий здоровым образцам, указывает на профиль Dolosigranulum (и в меньшей степени на профиль Moraxella ), в то время как вектор LRTI указывает в сторону профиль Anaerobacillus .
Вместе эти результаты подтверждают ряд наших предыдущих наблюдений; в частности, мы можем видеть, что существует общая тенденция для профилей микробиома младенцев NP к смещению с преобладания Staphylococcus вскоре после рождения на несколько других профилей. Мы также видим четкую картину дисбиотической системы, включающую более высокую, чем обычно, относительную численность Anaerobacillus , а также более высокую распространенность редких родов, которые обычно составляют чрезвычайно низкую часть (или полностью отсутствуют) здоровых микробиомов NP.
Анализ пятый: Отличается ли микробиом NP матерей младенцев, у которых развиваются LRTI, от матерей здоровых младенцев?
Наблюдение за отдельными характеристиками микробиома NP у младенцев в возрасте 7 дней позволило предположить, что эти профили могут быть связаны с внутриутробным воздействием, передаваемыми иммунологическими факторами и / или генетикой хозяина. Это заставило нас задуматься о том, обладают ли матери младенцев, у которых развиваются НИПТ, отличительными характеристиками микробиома NP. Мы проанализировали первые мазки NP от каждой из матерей, включенных в наше исследование, взятые во время посещения младенцев на семь дней регистрации, коррелировали их микробиомы с микробиомами их младенцев и использовали DESeq2, чтобы установить, какие роды были дифференциально многочисленны между матерями младенцев с ИНДП и матери здоровых младенцев.Подобно модели, наблюдаемой у самих младенцев, у матерей младенцев, у которых развились ИДПТ, значительно снизилась относительная численность Dolosigranulum (p = 0,05) по сравнению с матерями здоровых младенцев на 7-й день жизни младенца.
Обсуждение
В этом анализе мы показываем, что микробиом NP младенцев с LRTI отличается от такового у здоровых младенцев и что есть четкие доказательства дисбактериоза, предшествующего началу LRTI. Интересно то, что мы наблюдали различные паттерны микробиома у матерей младенцев, у которых позже развились ИДП, и у тех, чьи дети остались здоровыми.Это, а также тот факт, что микробиом пар мать-младенец более тесно коррелирован внутри пар, чем между парами, предполагает, что некоторые из младенческих дисбактериозов имеют трансгенерационное происхождение. В целом наши данные позволяют предположить, что существуют количественные и качественные различия между младенцами (и их матерями), у которых развиваются и не развиваются НИПТ. Это подтверждает гипотезу о том, что ИНДП не является случайным событием, а скорее может отражать предрасположенности, которые, как правило, не наблюдаются, но тем не менее могут играть существенную или способствующую роль в патогенезе ИНДП у детей.
Носоглотка — экологическая ниша респираторных патобионтов, и в этой экосистеме они либо станут инвазивными, либо останутся просто колонизаторами. Микробиом NP во время инфекции связан с риском развития ИДП и его тяжестью. Но есть также веские основания полагать, что созревание микробиома NP в первые месяцы жизни, а не только его характеристики во время инфекции, связаны с респираторным здоровьем и развитием болезни в более позднем возрасте.Например, известно, что созревание микробиома кишечника регулирует эволюцию иммунной системы и связано с развитием заболеваний в более позднем возрасте, таких как ожирение и диабет 1 типа (Bokulich et al., 2016; Stewart et al., 2018). Микробный дисбактериоз кишечника у детей часто предрасполагает к рецидивирующим инфекциям, вызываемым C. difficile (Ihekweazu and Versalovic, 2018). Таким образом, подобная связь между микробиомом NP и риском респираторных инфекций является правдоподобной теорией, имеющей прецедент.
Мы показали, что можем охарактеризовать нормальное, здоровое созревание микробиома NP в течение первых месяцев жизни, а также то, как это созревание отличается у младенцев, у которых развиваются ранние LRTI. Хотя эволюция нормального микробиома очень динамична, она протекает стереотипно, со ступенчатыми переходами от флоры, в которой преобладают кожные организмы ( Staphylococcus) , к флоре, в которой преобладают роды, более часто связанные с дыхательными путями (). Dolosigranulum, Streptococcus, Haemophilus и Moraxella) .Подобные модели микробной последовательности были ранее описаны в других когортах рождения (Biesbroek et al., 2014).
Напротив, младенцы, у которых развиваются НИПТ, имеют такие же общие модели преемственности, как и здоровые младенцы; переход от высокой относительной численности Staphylococcus к высокой относительной численности родов, связанных с дыхательными путями, но, в отличие от здоровых младенцев, эволюция их микробиома NP характеризуется низкой относительной численностью конкретных родов, связанных со « здоровьем », таких как Dolosigranulum и высокая относительная численность других родов, которые кажутся уникальными, таких как Anaerobacillus, Bacillus и смесь «других» необычных родов.Кроме того, микробиомы младенцев с ИНДП включают большее количество необычных и преходящих родов, что создает более хаотичную картину, чем то, что наблюдается у здоровых младенцев.
Исследования «случай-контроль» неизменно демонстрируют связь между характеристиками микробиома NP и LRTI во время заболевания, хотя интерпретацию с точки зрения причинно-следственной связи показать не удалось. Относительно высокая численность Dolosigranulum / Corynebacterium и Moraxella коррелирует с состоянием здоровья (Mansbach et al., 2016), тогда как микробиомы NP, обогащенные Streptococcus и Haemophilus , связаны с LRTI, что также коррелирует с тяжестью заболевания (de Steenhuijsen Piters et al., 2016; Kelly et al., 2017). Но являются ли эти микробные профили результатом инфекции? Или они присутствовали до заражения?
Нам удалось идентифицировать несколько профилей микробиома, которые, по-видимому, группируются по хронологическому возрасту, ИДП и состоянию здоровья. Наши результаты показывают, что младенцы, у которых развились НИПТ, имели дисбактериоз микробиома NP до заражения инфекцией и уже в течение 7 дней жизни.Эти младенцы имеют микробиом NP, обогащенный Aneorobaccillus / Bacillus, Acinetobacter и другими необычными / неуточненными родами, а также относительно более низкое содержание Dolosigranulum . Наши интригующие результаты предполагают, что микробиом NP их матери в тот же ранний момент времени также отличался от такового у матерей здоровых младенцев.
Взаимодействие между хозяином, микробиомом и патобионтами является сложным и, скорее всего, разнонаправленным. Микробиом NP, как известно, связан с факторами окружающей среды (грудное вскармливание, способ родоразрешения) (Bosch et al., 2017; Brugger et al., 2016). также вполне может быть отражением или маркером генетики хозяина и функции иммунной системы, что могло бы объяснить, почему наблюдаются профили «высокого риска» в столь раннем возрасте. Новое поступление патобионта в носоглотку инициирует взаимодействия между патобионтом и другими организмами, находящимися в носоглотке. Эти взаимодействия изменяют метаболическую активность и экспрессию генов патобионта, которые влияют на то, станет ли патобионт инвазивным. Сами по себе взаимодействия между организмами в носоглотке также изменяют иммунный ответ хозяина, что подчеркивает сложные взаимоотношения между хозяином, микробиомом и патогенами (de Steenhuijsen Piters et al., 2019).
Ключевой нерешенный вопрос заключается в том, какую роль дисбиоз играет в причинном пути, ведущем к пневмонии: является ли дисбактериоз маркером других ненаблюдаемых факторов, которые приводят к пневмонии, таких как лежащие в основе генетические или иммунологические факторы хозяина? Или дисбактериоз играет роль в причинном пути, ведущем к ИДП? Хотя наши данные не могут решить этот вопрос, наши выводы имеют существенное значение. Наши результаты показывают, что дисбактериоз НП, выявленный в первые дни жизни, связан с более высоким риском развития НИПТ в раннем младенчестве.Это говорит о том, что есть важное окно возможностей для идентификации этих младенцев и вмешательства. Согласно нашим выводам, возможно, мы даже сможем идентифицировать этих младенцев, обследовав их матерей.
У нашего исследования есть несколько ограничений. Младенцы наблюдались до достижения трехмесячного возраста, поэтому наши результаты нельзя было обобщить на старшие возрастные группы. С другой стороны, возможно, что у младенцев, включенных в нашу здоровую контрольную группу, развились ИНДП после периода исследования, в этом случае наши результаты смещены в сторону нуля, что, возможно, недооценивает различия между двумя группами.
Еще одним ограничением является то, что нам неизвестен возбудитель, вызывающий ИДП, и были ли они ИДП вирусными, бактериальными или смешанными патогенами. LRTI представляет собой гетерогенный набор состояний, и вполне вероятно, что дисбактериоз может взаимодействовать специфическим для патогена образом. Диагноз ИНДП основывался только на клинических данных. Несмотря на то, что разные патогены по-разному взаимодействуют с микробиомом NP и иммунной системой хозяина, наши данные свидетельствуют о том, что существует общий профиль риска микробиома NP, независимо от возбудителя.Наконец, хотя наш анализ включал очень большое количество продольных выборок, размер нашей выборки включал только 10 младенцев, у которых развились НИПТ. Однако ИДП — сравнительно редкое явление и требует длительного наблюдения за тысячами субъектов в течение длительного периода для выявления даже нескольких случаев, что объясняет недостаточность исследований по этой теме. С точки зрения логистики создание и выборка когорты таким же образом, как и мы, является чрезвычайно сложной задачей и требует значительных ресурсов. Тем не менее, для подтверждения или уточнения этих первоначальных наблюдений потребуются дальнейшие исследования.В случае подтверждения эти результаты имеют решающее значение не только для нашего понимания факторов, которые приводят к развитию ИДП, и того, почему у одного ребенка развиваются ИДП, а у других — нет, это также говорит о том, что у нас есть окно возможностей для выявления этих «ат- рисковать »младенцами до их заражения и потенциально вмешиваться. Эти профилактические меры могут иметь большое влияние на снижение бремени инфекций нижних дыхательных путей в младенчестве.
Выводы
Дисбактериоз микробиома NP у младенцев предшествует инфекциям нижних дыхательных путей, что указывает как минимум на наличие у детей повышенного риска инфекций нижних дыхательных путей и, возможно, на причинную роль в развитии этих инфекций.Специфические профили микробиома NP, которые можно идентифицировать перинатально и которые, по-видимому, связаны с более высоким риском развития LRTI в раннем младенчестве, представляют собой потенциальное окно возможностей для вмешательств. Наши выводы должны быть подтверждены крупномасштабными продольными исследованиями.
Материалы и методы
Популяция исследования
Это сравнительное исследование вложенных временных рядов в рамках проспективного продольного исследования коклюша матери и ребенка в Южной Африке (SAMIPS).SAMIPS — это исследование, проведенное в Замбии, в котором младенцы и их матери наблюдались в течение первых 3 месяцев жизни. Полное описание методов подробно описано ранее Gill et al. (Gill et al., 2016), вкратце: все младенцы, зарегистрированные в SAMIPS, были младше десяти дней, родились доношенными через естественные естественные роды и считались здоровыми после рождения. Все младенцы получили плановые прививки. Письменное информированное согласие было получено при необходимости от матерей младенцев, включенных в исследование.
Исследование было одобрено комитетами по этике в ERES Converge IRB в Лусаке, Замбия, и в Медицинском центре Бостонского университета.Все матери предоставили письменное информированное согласие на английском языке, языке бемба или ньянджа по выбору участницы.
Дизайн исследования
Пары мать-младенец были включены в исследование, когда матери вернулись на свой первый послеродовой визит в целях благополучия ребенка в возрасте одной недели. При включении в исследование и с интервалом в 2-3 недели после этого, в течение 14 недель, мы взяли мазок из заднего носоглотки (NP) как от матери, так и от ребенка, с дополнительными мазками, полученными случайно, если один из них вернулся в поисках помощи по поводу острой респираторной инфекции.
В когорте SAMIPS мы определили десять младенцев, которые в течение периода исследования страдали от симптомов инфекции нижних дыхательных путей (ИДП) в соответствии с рекомендациями ВОЗ ( Пересмотренная классификация ВОЗ и лечение детской пневмонии в медицинских учреждениях • РЕЗЮМЕ ДОКАЗАТЕЛЬСТВ • , nd). Больных младенцев сравнивали 1: 3 со здоровыми компараторами по сезону зачисления, возрасту матери и составу домохозяйства.
Обработка и хранение образцов
мазков NP получали из задней части носоглотки с использованием стерильного нейлонового тампона с ворсистым наконечником (Copan Diagnostics, Merrieta, California).Затем мазки помещали в универсальную транспортную среду, помещали на лед и переносили в нашу лабораторию в том же кампусе, где их разделяли на аликвоты и хранили при -80 ° C до экстракции ДНК. ДНК экстрагировали с использованием системы NucliSENS EasyMagG (bioMérieux, Marcy l’Etoile, Франция). Извлеченная ДНК хранилась в нашей лаборатории, расположенной в университетской больнице в Лусаке, при -80 ° C. Сбор, обработка и хранение образцов были описаны ранее (Gill et al., 2016).
Амплификация рибосомной ДНК 16S и секвенирование MiSeq
Для препаратов библиотеки 16S были выполнены две реакции ПЦР на матричной ДНК.Первоначально ДНК была амплифицирована с праймерами, специфичными для области V3 – V4 гена 16S рРНК (Klindworth et al., 2013). Пары праймеров 16S включали выступающий адаптер Illumina (Прямой праймер 16S 5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGNGGCWGCAG-3 ‘; обратный праймер 16S 5’-GTCTCGTGGGCTCGGATAGATGTG ∼12 (PCTAGGACGACGACT-матрица ДНК) 1 μR1 (PCTAGVGACGACGACT) , 5 мкл обратного праймера (1 мкМ), 12,5 мкл 2 X готовая смесь Kapa HiFi Hotstart (KAPA Biosystems Woburn, MA) и вода для ПЦР до конечного объема 25 мкл.ПЦР-амплификацию проводили следующим образом: крышка нагрета до 110 ° C, 95 ° C в течение 3 минут, 25 циклов 95 ° C в течение 30 секунд, 55 ° C в течение 30 секунд, 72 ° C в течение 30 секунд, затем 72 ° C в течение 5 минут и выдерживается при 4 ° C. Одновременно проводили реакции отрицательного контроля без какой-либо ДНК-матрицы.
ПЦР-продуктов визуализировали с помощью Agilent TapeStation (Agilent Technologies, Германия). Успешные продукты ПЦР очищали с использованием очистки на основе магнитных шариков AMPure XP (Beckman Coulter, IN). Набор IDT для Illumina Nextera DNA UD Indexes (Illumina, San Diego, CA) с уникальными адаптерами с двойным индексом использовался для обеспечения мультиплексирования.Каждая реакция ПЦР содержала очищенную ДНК (5 мкМ), 10 мкл смеси индексных праймеров, 25 мкл смеси 2X Kapa HiFi Hot Start Ready и 10 мкл воды для ПЦР. Реакции ПЦР выполняли на термоциклере Bio-Rad C1000 (Bio-Rad, Hercules, CA). Условия цикла состояли из одного цикла при 95 ° C в течение 3 минут, за которым следовали восемь циклов при 95 ° C в течение 30 с, 55 ° C. в течение 30 секунд и 72 ° C в течение 30 секунд, после чего следует последний цикл удлинения при 72 ° C в течение 5 минут.
Перед объединением библиотек проиндексированные библиотеки очищали с помощью гранул Ampure XP и количественно оценивали с использованием набора Qubit dsDNA HS Assay Kit (Thermo Fisher Scientific, Waltham, MA).Очищенные ампликоны запускали на Agilent TapeStation (Agilent Technologies, Германия) для анализа качества перед секвенированием. Пул образцов (2 нМ) денатурировали 0,2 н. NaOH, затем разбавляли до 4 пМ и объединяли с 10% (об. / Об.) Денатурированным 20 пМ PhiX, приготовленным в соответствии с рекомендациями Illumina. Образцы секвенировали на платформе для секвенирования MiSeq в центре секвенирования NICD с использованием набора V3 2 × 300 циклов, следуя стандартным протоколам секвенирования Illumina.
Данные секвенирования обрабатывали с помощью QIIME2 (Bolyen et al., 2019) и Pathoscope2 (Hong et al., 2014). Образцы с менее чем 10 000 считываний были исключены из дальнейшего анализа.
Обработка данных
Мы оценили качество данных секвенирования с помощью FastQC (Andrews, 2010), который показал, что общее качество секвенирования было отличным, со средними показателями качества Phred, оставшимися выше 30 (точность> 99,9%) для более 200 пар оснований. как для прямого, так и для обратного чтения. Мы использовали Trimmomatic (Bolger et al., 2014) для обрезки адаптеров Illumina и удаления низкокачественных последовательностей, установив параметры инструмента на LEADING: 6, TRAILING: 6, SLIDINGWINDOW: 6: 15 и MINLEN: 36.Эта качественная фильтрация удаляла менее 0,5% считываний из каждой выборки.
Мы использовали PathoScope 2 для привязки считываний секвенирования к бактериальным геномам. Мы использовали все репрезентативные бактериальные геномы RefSeq (загруженные 2 ноября 2018 г.) в качестве справочной библиотеки PathoScope. На основе окончательных показателей наиболее удачного считывания на уровне подвидов мы составили таблицы подсчета и таблицы относительной численности для каждой выборки от типа, рода и, где это возможно, до уровня видов.
Данные и статистический анализ
Характеристики микробиома NP и эволюция во времени
Мы описываем нормальную эволюцию микробиома NP у здоровых младенцев в течение первых трех месяцев жизни.Мы рассчитали микробное богатство, используя индекс Chao1, и разнообразие микробных таксонов, используя индекс разнообразия Шеннона. Мы сообщаем об индивидуальной эволюции микробиома NP у каждого из 10 младенцев, у которых развиваются LRTI. Чтобы установить статистическую значимость, мы использовали функцию lmer из пакета lme4 для R (Bates et al., 2015), чтобы применить линейную модель со смешанными эффектами к значению логарифма на миллион (logCPM) каждого рода, включая возраст и подверженность ВИЧ как фиксированные эффекты и объект исследования как случайный эффект.Все значения p, полученные с помощью этих линейных моделей, сообщаются после корректировки коэффициента ложного обнаружения (FDR) для множественных сравнений с использованием метода Бенджамини-Хохберга (Benjamini and Hochberg, 1995). Мы создали только модели со смешанными эффектами для родов, средняя относительная численность которых составляла не менее 0,5% по всем выборкам здоровых младенцев.
Для визуализации развития здоровой микробиоты NP мы сгруппировали все образцы младенцев по возрасту (в днях) в 7 групп, каждая из которых содержит 16-дневное возрастное окно (0-15 дней, 16-31 день и т. Д.).Мы визуализировали только те роды, которые имели среднюю относительную численность не менее 1% по всем выборкам. Относительная численность всех родов, которые не соответствовали этому пороговому значению, были суммированы в группу, обозначенную «Прочие / Низкая численность», только для целей построения графика.
Мы рассчитали оценки альфа-разнообразия в каждой выборке на основе таблиц подсчета на уровне видов, созданных PathoScope 2. Мы рассчитали альфа-разнообразие, используя два метода: индекс Chao1, который оценивает общее количество видов, присутствующих в выборке, и индекс Шеннона, основанный на энтропии показатель, который включает как количество присутствующих видов, так и равномерность их численности.Индекс Chao1 был рассчитан с использованием пакета R fossil (Vavrek, 2011), а индекс Шеннона был рассчитан с использованием пакета R vegan (доступен через CRAN) (Oksanen et al., 2019), каждый с глубиной разрежения 10000 . Мы построили линейную модель со смешанными эффектами, как описано выше, за исключением того, что использовали каждый показатель альфа-разнообразия в качестве переменной ответа, чтобы проверить, изменилось ли альфа-разнообразие по мере взросления младенцев.
Анализ связи между микробиомом NP и развитием LRTI
Мы использовали функцию lmer из пакета lme4 (описанного выше) для построения линейных моделей со смешанными эффектами для сравнения развития микробиомов NP у младенцев, которые разработанные LRTI, как и у здоровых младенцев.На этот раз мы включили инфекционный статус и взаимодействие инфекционного статуса с возрастом в качестве ковариант с фиксированным эффектом в дополнение к возрасту и контакту с ВИЧ, а также субъект исследования в качестве случайного эффекта. И снова p-значения были сгенерированы с использованием функции Anova пакета car (Weisberg, 2019), а затем скорректированы FDR.
Мы аналогичным образом модифицировали модели, которые мы использовали для тестирования альфа-разнообразия, чтобы увидеть, различались ли значения индекса Шеннона или Chao1 у младенцев с ИНДП, снова добавив инфекционный статус и взаимосвязь между инфекционным статусом и возрастом в качестве фиксированных эффектов.
Анализ дифференциальной численности в первые моменты времени
Мы выполнили дифференциальную численность между первыми образцами от здоровых детей и младенцев с ИНДП, используя пакет R DESeq2 (Love et al., 2014), доступный через Bioconductor (Huber et al., 2015). Мы импортировали нашу ненормализованную таблицу подсчета родов, скомпилированную из PathoScope2, как DESeqDataSet, и запустили функцию DESeq, используя модель проектирования, которая включала контакт младенцев с ВИЧ (от ВИЧ-инфицированной матери) в качестве ковариаты.Для данных микробиома DESeq2 показал более низкий уровень ложных открытий, чем другие дифференциальные тесты (Mcmurdie and Holmes, 2014), и особенно хорошо работает для небольших экспериментов (Weiss et al., 2017).
Чтобы проверить, связано ли присутствие или отсутствие определенных родов в первый выбранный момент времени с LRTI, мы выполнили точный тест Фишера, чтобы определить, одинаково ли вероятность наличия каждого рода в микробиоме NP у здоровых младенцев и младенцев LRTI. Поскольку роды с очень низкой численностью могут быть результатом ложного сопоставления или загрязнения, мы исследовали как высокий порог (относительная численность> 1%), так и низкий порог (> 0.1% относительной численности) для определения присутствия рода.
Бета-разнообразие и кластеризация
Мы вычислили матрицу несходства Брея-Кертиса между выборками, используя функцию vegdist vegan . Применительно к значениям относительной численности несходство Брея-Кертиса между двумя образцами i и j определяется как где g в — относительная численность рода n в образце i . Мы выполнили иерархическую кластеризацию выборок на основе этой матрицы несходства, используя функцию hclust R с методом, установленным на «ward.D ». Мы определили кластеры, используя функцию дерева сечения R, со значением k, выбранным путем максимизации индексов Silhouette и Frey, рассчитанных с помощью пакета NbClust (Charrad et al., 2014). Для каждого кластера мы выполнили точные тесты Фишера, чтобы определить, был ли этот кластер обогащен образцами LRTI в целом, образцами до симптомов, образцами с активными симптомами или образцами, контактировавшими с ВИЧ.
Мы использовали функцию metaMDS из пакета R vegan для выполнения ординации неметрического многомерного масштабирования (NMDS) на нашей матрице несходства Брея-Катриса, используя в качестве параметров k = 3, try = 50 и trymax = 1000.Масштабирование наших данных только по двум измерениям с использованием NMDS дало значение напряжения более 0,2, что указывает на плохое соответствие; вместо этого мы масштабировали данные по трем измерениям (стресс = 0,13) и использовали веганскую функцию envfit, чтобы спроецировать возраст и статус LRTI каждого образца в ординацию NMDS. Двумерные графики наших упорядоченных данных NMDS можно найти на рис. 2 , а трехмерный график можно найти на дополнительном рис. 4 .
Дифференциальный анализ микробиомов материнских NP
Мы использовали коэффициенты корреляции Спирмена, чтобы убедиться, что состав микробиомов NP младенцев связан с микробиомом NP их матери.Мы выбрали корреляцию Спирмена, которая использует порядок ранжирования, а не непрерывные значения, из-за композиционного характера данных о численности бактерий. Мы рассчитали ρ Спирмена для относительной численности каждого рода между матерями и их младенцами. Мы проверили значимость этих корреляций, сравнив распределение значений ρ с 1000 нулевыми распределениями той же метрики, сгенерированных путем случайной перестановки меток мать / ребенок.
Мы использовали DESeq2 для проверки дифференциальной численности родов в микробиомах NP матерей младенцев с ИНДП и матерей младенцев из контрольной группы.Для этого анализа мы включили только образцы, взятые у матерей при самых ранних посещениях педиатра, до того, как у их младенцев начали проявляться симптомы ИНДП. Мы включили ВИЧ-статус матерей в качестве ковариаты в регрессионную модель DESeq2. Мы сообщаем p-значения после коррекции FDR с помощью процедуры Бенджамини-Хохберга и считаем скорректированные p-значения ниже 0,1 значимыми.
Доступность данных
Необработанные и обработанные данные секвенирования из этого исследования доступны в репозитории SRA под номером доступа, ожидающим рассмотрения.Кроме того, весь код, обработанные данные и образцы метаданных информации доступны в следующем репозитории GitHub: https://github.com/tfaits/Infant_Nasopharyngeal_Dysbiosis. Таблицы подсчета таксонов называются «разновидности.RDS», «род.RDS» и «phylum.RDS». Для подсчета штаммов / подвидов «PathoScopeTable.txt» содержит нефильтрованные / необработанные выходные данные из PathoScope.
https://github.com/tfaits/Infant_Nasopharyngeal_Dysbiosis
Заявления
Утверждение этических норм и согласие на участие
Исследование было одобрено комитетами по этике в ERES Converge IRB в Лусаке, Замбия, и в Медицинском центре Бостонского университета.Все матери предоставили письменное информированное согласие на английском языке, языке бемба или ньянджа по выбору участницы.
Согласие на публикацию
Н / Д
Доступность данных и материалов
Необработанные и обработанные данные секвенирования этого исследования доступны в репозитории SRA под номером доступа, ожидающим рассмотрения. Кроме того, весь код, обработанные данные и образцы метаданных информации доступны в следующем репозитории GitHub: https: // github.com / tfaits / Infant_Nasopharyngeal_Dysbiosis. Таблицы подсчета таксонов называются «разновидности.RDS», «род.RDS» и «phylum.RDS». Для подсчета на уровне штаммов / подвидов «PathoScopeTable.txt» содержит нефильтрованные / необработанные выходные данные из PathoScope.
Конкурирующие интересы
Все авторы заявляют об отсутствии конкурирующих интересов.
Финансирование
Эта работа была поддержана Исследованием коклюша матерей в Южной Африке — носоглоточное носительство (SAMIPS-NPC). П. И. Гилл. Спонсор NIH / NIAID (1R01AI133080).WEJ и TF поддерживались фондами NIH, U01CA220413 и R01GM127430.
Дополнительные цифры
Дополнительная фигура 1A)Таксономические профили образцов NP здоровых младенцев (n = 30), сгруппированные по попарному несходству Брея-Кертиса. Кластеры были определены путем выполнения иерархической кластеризации на матрице бета-разнообразия и последующего разрезания полученной дендрограммы на оптимальное количество кластеров в соответствии с индексом Силуэта (5) и индексом Фрея (15). Цветные полосы над составными столбцами графиков показывают возраст младенцев на момент каждой выборки.
Дополнительный рисунок 1B)Анализ главных координат (PCoA) матрицы несходства Брея-Кертиса между выборками здоровых младенцев, окрашенных по возрасту и относительной численности доминантных родов.
Дополнительная фигура 2:Таксономические профили образцов NP младенцев LRTI (n = 10), сгруппированные по попарному несходству Брея-Кертиса. Кластеры были определены путем выполнения иерархической кластеризации на матрице бета-разнообразия и последующего разрезания полученной дендрограммы на оптимальное количество кластеров в соответствии с индексом Силуэта (6) и индексом Фрея (15).Цветные полосы над составными столбчатыми графиками показывают возраст младенцев и статус симптомов на момент взятия каждой пробы.
Дополнительный рисунок 3:Трехмерная диаграмма рассеяния образцов из носоглотки младенцев, спроецированных в пространство порядков неметрического многомерного шкалирования (NMDS). Мы применили трехмерную ординацию NMDS к матрице различий Брея-Кертиса между мазками NP всех младенцев и спроецировали векторы в это пространство ординации, представляющее наилучшие корреляции для возраста при выборке (черный вектор) и статуса LRTI (голубой вектор). представляют контрольных младенцев, красный вектор представляет младенцев LRTI).Образцы окрашены в соответствии с их членством в кластере основного таксономического профиля (подробности см. На Рисунке 3). Возраст сильно коррелирует с осью абсцисс, и образцы на молодом конце вектора возраста в основном принадлежат профилю с преобладанием Staphylococcus , тогда как образцы на более старом конце имеют тенденцию больше принадлежать к Haemophilus и Moraxella . -доминированные профили. Профиль с преобладанием Dolosigranulum связан со здоровым концом вектора для определения статуса LRTI, тогда как профиль с преобладанием Anaerbacillus связан с заболеванием.
Supplemental Figure 4:Каждая грань представляет собой относительную численность бактериальных родов в носоглотке одного младенца с течением времени. Образцы расположены в хронологическом порядке слева направо, с метками на оси абсцисс, отображающими возраст младенца на момент взятия мазка NP. Моменты времени, когда у младенцев наблюдались тяжелые респираторные симптомы, отмечены цифрой * . Моменты времени, когда у младенцев наблюдались легкие симптомы, которые не были квалифицированы как ИНДП, отмечены цифрами + .
Обратите внимание, что порядок этих младенцев (чтение строк слева направо, верхний ряд сначала) такой же, как в таблице 2 (Клинические симптомы)
Дополнительный рисунок 5:Отслеживание созревания NP здоровых младенцев. Каждая грань представляет собой относительное количество родов бактерий в носоглотке одного младенца с течением времени. Образцы расположены в хронологическом порядке слева направо, с метками на оси абсцисс, отображающими возраст младенца на момент взятия мазка NP.
Благодарности
Не применимо.
Как микробиом кишечника может предоставить новый инструмент для лечения аутизма | Наука
Было показано, что микробиом — совокупность организмов, включая бактерии, археи, грибы и вирусы, живущие в кишечнике человека, играет важную роль в работе мозга. wildpixel / iStockВ молодом возрасте у Итана был диагностирован аутизм от умеренной до тяжелой степени. К семи годам, несмотря на героические усилия специалистов по семье и реабилитации, его словарный запас, диета и социальные взаимодействия были крайне ограничены.Его даже не приучили к горшку.
Однажды утром, всего через четыре недели после начала специального клинического испытания, мать Итана, Дана, проснулась от него с широкой улыбкой на лице и сказала: «Доброе утро, мама». Превращение было чудесным, стороны ее сына она никогда раньше не видела, и она расплакалась от радости.
Это было чудо с какашками. Не совсем сырые продукты из туалета, а переработанные кишечные микробные организмы от тщательно проверенного донора, которых Итан смешивал со своими напитками в рамках испытания.
«Существует очень высокая корреляция между тяжестью [желудочно-кишечного тракта] и тяжестью аутизма — по языку, социальному взаимодействию, поведению, всем основным симптомам аутизма», — говорит Джим Адамс, профессор и исследователь аутизма в Университете штата Аризона. Он лично убедился в этой связи, когда его дочери поставили диагноз РАС: «Вопрос в том, это из-за боли и дискомфорта, связанных с проблемами желудочно-кишечного тракта, или это нечто большее?»
Когда Адамс покопался в научной литературе, он обнаружил, что дисбактериоз или нарушение нормальной экосистемы бактерий и других организмов в кишечнике может влиять как на симптомы РАС, так и на симптомы со стороны желудочно-кишечного тракта.Лечение ванкомицином, мощным антибиотиком, который не всасывается в кровоток, но остается в кишечнике, может принести временное облегчение. Но антибиотик можно использовать только в течение короткого периода времени, прежде чем у бактерий появится устойчивость к нему.
Более десяти лет назад начала появляться теория о связи кишечника и мозга, при которой дисфункция кишечника также может влиять на мозговую деятельность. «Семьдесят процентов наших нервов, которые входят в центральную нервную систему, входят в наш кишечник. Это почему?» — спрашивает Саркис Мазманян, медицинский исследователь Калифорнийского технологического института.Мазманян отметил, что у мышей, лишенных микробов и бактерий в кишечнике, «такие вещи, как беспокойство, передвижение, депрессия и даже развитие мозга, похоже, изменены» по сравнению с нормальными животными.
Мазманиан и группа исследователей продемонстрировали эту связь между кишечником и мозгом на мышиной модели аутизма в 2013 году. Три года спустя группа исследователей проделала то же самое с болезнью Паркинсона. А недавно они показали, что пересадка фекалий человека с аутизмом стерильным мышам вызовет у животных многие симптомы РАС.
После трансплантации образцов микробиома от людей с РАС стерильным мышам у мышей проявились поведенческие симптомы аутизма. После дальнейшей обработки микробиомом мыши проявили повышенную коммуникабельность. Гил Шарон и др. / Ячейка 2019.05.004Здоровая экосистема кишечника содержит около тысячи различных типов бактерий, а также архей, грибов и вирусов, хотя конкретные организмы и их количество могут варьироваться от человека к человеку. Напротив, количество бактерий, обнаруживаемых у людей с РАС, примерно на 25 процентов ниже, чем у здоровых людей.В их кишечнике отсутствуют сотни различных видов бактерий, часто важных для ферментации и производства короткоцепочечных жирных кислот, влияющих на здоровье.
Адамс стремился свести воедино все нити этих различных направлений исследований, проведя исследование эффективности трансплантации фекалий у детей с РАС. Его команда в ASU, Программа исследований аутизма / Аспергера, наняла эксперта по выявлению бактерий в кишечнике, Розу Краймальник-Браун, более известную как доктор.Рози. Мало что было известно о трансплантации фекалий у детей в то время, когда было предложено исследование, поэтому FDA сначала потребовало небольшое предварительное исследование безопасности, ограниченное детьми в возрасте от семи лет и старше.
В исследование было включено 18 детей в возрасте от 7 до 18 лет с диагнозом РАС и значительными проблемами желудочно-кишечного тракта. Режим был строгим, но относительно дружелюбным к детям. Сначала использовали антибиотик ванкомицин, чтобы снизить количество микробов в кишечнике. Затем дети получали ежедневные дозы очищенных микробов из кишечника здоровых доноров, которые суспендировали в жидкости и смешивали с напитками, вместе с антацидом для снижения кислотности желудочного сока, который может уничтожить микробы до того, как они достигнут кишечника.Лечение кишечника продолжалось десять недель.
Поначалу исследователи ASU не увидели особого отклика. Вполне вероятно, что первоначальный дисбиоз повредил некоторые клетки, выстилающие кишечник, как это происходит у пациентов с синдромом раздраженного кишечника (СРК), и потребовалось некоторое время, чтобы эти раны зажили в достаточной степени, чтобы поддержать колонизацию донорскими бактериями. Но на полпути к режиму у большинства участников наблюдались нарастающие признаки улучшения.
Всего два участника показали минимальный ответ, примерно на 30% улучшение их желудочно-кишечных симптомов, и это длилось недолго после завершения лечения.Но у 16 детей симптомы желудочно-кишечного тракта улучшились как минимум на 70%, и, что важно, улучшились поведенческие симптомы аутизма. Этот документ был опубликован в январе 2017 года и произвел такое впечатление на Пентагон, что Министерство обороны согласилось профинансировать крупное исследование микробных трансплантатов у взрослых с аутизмом, в которое начали набирать пациентов в начале 2018 года.
Адамс был удивлен, услышав, что родители говорят, что их дети продолжали показывать улучшения в поведении, связанном с РАС, еще долгое время после завершения исследования.Команда решила провести последующие два года, чтобы увидеть, что происходит.
Независимый профессиональный оценщик, использующий шкалу оценки детского аутизма (CARS), обнаружил, что симптомы были на 23% менее серьезными в конце лечения, чем в начале; два года спустя этот показатель увеличился до 47 процентов. Первоначально 83 процента участников были отнесены к тяжелому концу шкалы РАС, но после двухлетнего наблюдения это число упало до 17 процентов, в то время как 44 процента улучшились до такой степени, что они упали ниже диагностического порога РАС. .
Согласно последующему документу, опубликованному в апреле этого года, измерения с использованием шкалы социальной реакции (SRS), рассчитанной родителями, показали параллельные улучшения. Кажется, что микробиом кишечника может предоставить новый инструмент для лечения РАС.
После последующего наблюдения участники по-прежнему демонстрировали здоровое разнообразие микробиома, но популяции бактерий в их кишечнике перестали напоминать донора и стали более индивидуализированными. Изменения отражали диету, воздействие окружающей среды, иммунную систему и генетику, уникальные для каждого человека.
«Аналогия — это когда у вас есть компания с прекрасной рабочей средой, хорошие люди хотят приходить и работать в этой компании», — говорит Краймальник-Браун. «В кишечнике, если у вас хорошая окружающая среда, значит, у вас есть хорошие микробы, и другие хорошие микробы тоже хотят прийти и оказаться там».
Однако команда не утверждает, что все улучшения связаны с лечением кишечных бактерий. Хотя Адамс считает, что восстановление здорового микробиома кишечника приносит пользу оси кишечник-мозг, которая смещена в сторону при РАС, он также считает, что простое устранение боли и отвлечения дисбиотического кишечника может помочь детям сконцентрироваться, сосредоточиться и получить пользу от речи, поведения и поведения. другие виды лечения, предлагаемые государственными и социальными службами.
«К сожалению, эти симптомы со стороны желудочно-кишечного тракта обычно игнорируются, даже когда родители детей с аутизмом сообщают, что поведение их ребенка улучшается при лечении этих симптомов», — говорит Пол Эшвуд, микробиолог, изучающий РАС из Калифорнийского университета в Дэвисе. Он признает ограничения исследования Адамса и Краймальника-Брауна, такие как небольшой размер выборки и влияние внешних факторов, но говорит, что «данные очень интересны и требуют дальнейшего изучения».
Как и при любом новом подходе к лечению заболеваний, первоначальный успех вызывает больше вопросов, чем дает ответов.Будет ли этот подход полезным для более широкой группы пациентов с РАС, включая тех, кто не страдает значительным расстройством желудочно-кишечного тракта? Нужен ли ванкомицин для подавления существующей микробной экосистемы до притока здоровых кишечных бактерий? Какая продолжительность лечения лучше всего? Чтобы ответить на эти вопросы, потребуется время и многочисленные исследования, но Адамс надеется, что лицензированное микробное лечение РАС станет доступным через несколько лет.
Тем временем команда ASU готовит еще одно испытание для детей.Их сотрудники разработали микробную трансплантат в форме таблеток, которая, по их мнению, поможет обойти проблему желудочной кислоты и доставит более стабильный продукт в кишечник. Таблетка уже используется в других исследованиях, и Адамс считает, что это изменение даст более стабильные результаты, чем их первое испытание.
Со своей стороны, Дана довольна «фантастическим прогрессом», которого продолжает достигать 12-летний Итан. Он достиг всех целей, поставленных логопедом и эрготерапевтами, и продолжает работать над социальными и жизненными навыками, такими как обучение тому, как понимать свои собственные эмоции и эмоции других, и формулировать то, что он чувствует.Если медицинские исследователи, такие как команда ASU, смогут продолжать развивать микробиомное лечение РАС, гораздо больше детей смогут извлечь выгоду из многократной ценности здорового кишечника.
Здоровье Микробы, бактерии, вирусы Микробиом НеврологияРекомендованные видео
Стресс изменяет микробиом кишечника
Росс Мальц, доктор медицинских наук, врач-клиницист и лечащий гастроэнтеролог отделения гастроэнтерологии, гепатологии и питания Детского центра Nationwide.Гастроэнтерологи хорошо знают связь между мозгом и кишечником. Пациенты с большей вероятностью будут испытывать обострения заболеваний, усиление воспаления и ухудшение качества жизни, связанного со здоровьем, в периоды стресса. Хотя бактерии, присутствующие в кишечнике, давно изучались на предмет их важности в воспалительных процессах и активности заболеваний, их роль во время стресса была изучена только недавно.
Врачи-исследователи из Национальной детской больницы опубликовали исследования в журналах PLoS One и Journal of Pediatric Gastroenterology and Nutrition , подтверждающие связь между воздействием стресса, воспалением толстой кишки, уровнями и разнообразием кишечных бактерий и уровнями определенные бактериальные метаболиты (жирные кислоты с короткой цепью) у мышей.
«Мы изучаем влияние стресса на воспаление кишечника и механизм его усугубления», — говорит Росс Мальц, доктор медицинских наук, врач-клиницист и гастроэнтеролог отделения гастроэнтерологии, гепатологии и питания Детского центра Nationwide. «Часть микробиома — это бактерии, выстилающие желудочно-кишечный тракт. Бактерии расщепляют пищу и производят множество метаболитов, которые обладают способностью взаимодействовать с кишечником и иммунной системой, и мы считаем, что нарушение этого механизма способствует воспалению, наблюдаемому при воспалительном заболевании кишечника.”
Чтобы проверить теорию своего исследования JPGN , доктор Мальц и его коллега Майкл Бейли, доктор философии, главный исследователь Центра микробного патогенеза в Исследовательском институте Nationwide Children’s, и их исследовательская группа использовали мышей, которые были либо подвергали стрессу или оставляли в покое, а затем инфицировали Citrobacter rodentium , бактериальным штаммом, аналогичным E. coli у людей. Исследователи изучили влияние стресса на микробиом, уровни короткоцепочечных жирных кислот, вырабатываемых в желудочно-кишечном тракте, и степень воспаления.Они исследовали воспаление толстой кишки и попытались определить корреляцию между воспалением, стрессовым воздействием и уровнями ряда бактерий и метаболитов.
«Когда мы подвергали мышей стрессу и инфекции одновременно, это значительно усиливало воспаление, наблюдаемое в толстой кишке», — говорит д-р Мальц, который также является доцентом клинической педиатрии в Университете штата Огайо. главный исследователь Центра микробного патогенеза Научно-исследовательского института Nationwide Children’s.«В то же время у мышей, подвергшихся стрессу, микробиомы сильно отличались от тех, которые не подвергались стрессу».
Некоторые типы бактерий увеличиваются как при стрессе, так и при инфекции, в то время как другие, такие как Parabacteroides , которые, как известно, низкие у пациентов с активной ВЗК и потенциально выполняют защитную роль против воспаления, уменьшились. Кроме того, уровни короткоцепочечных жирных кислот снижались только при воздействии стресса, а экспрессия их рецепторов изменялась при наличии как стресса, так и инфекции.Исследование PLoS One показало очень похожие результаты с использованием другой модели стресса.
Короче говоря, стресс изменил микробиом, что, в свою очередь, увеличило уровень воспаления толстой кишки.
«Эти данные подтверждают нашу гипотезу о том, что изменения в микробиоме связаны с ухудшением здоровья желудочно-кишечного тракта во время стресса», — говорит д-р Мальц. Его команда проводит дополнительные исследования, изучающие изменения других метаболитов в микробиоме в ответ на стресс и инфекцию, некоторые из которых находятся на моделях мышей, которые напоминают ВЗК у людей.
Чтобы лучше понять потенциальный механизм у людей, доктор Мальц также проводит клинические исследования для измерения стресса, уровня кортизола, изменений в микробиоме и метаболитов у пациентов с ВЗК в первый год после постановки диагноза. Он надеется, что лучшее понимание взаимосвязи между стрессом, микробиомом и активностью заболевания как у мышей, так и у пациентов с ВЗК также предоставит ценную информацию для пациентов.
«Конечная цель нашего исследования состоит в том, чтобы понять, как воздействие стресса усугубляет болезнь и как мы можем уменьшить воздействие стресса на пациентов», — говорит д-р.Мальц. «Затем мы можем попробовать ряд терапевтических средств, таких как пре- или пробиотики, методы управления поведенческим стрессом, диетические изменения или лекарства — чтобы уменьшить влияние стресса на микробиом и его последующее воздействие на воспаление в кишечнике».
Артикул:
Мальц Р.М., Кейрси Дж., Ким С.К., Макос А.Р., Гараибех Р.З., Мур С.К., Сюй Дж., Сомоги А., Бейли М.Т. Социальный стресс влияет на воспаление толстой кишки, микробиом кишечника, а также на уровни и рецепторы короткоцепочечных жирных кислот. Журнал детской гастроэнтерологии и питания. 11 декабря 2018 г. [Epub перед печатью]
Мальц Р.М., Кейрси Дж., Ким С.К., Макос А.Р., Гарайбе Р.З., Мур С.К., Сю Дж., Бактаватчалу В., Сомоги А., Бейли М.Т. Длительное воздействие сдерживающего стрессора у беспородных мышей CD-1 влияет на микробиоту, воспаление толстой кишки и короткоцепочечные жирные кислоты. PLoS One . 2018 9 мая; 13 (5): e0196961.RACGP — Микробиом кишечника
Майенааз Сидху
Давид ван дер Поортен
Предпосылки
Более триллиона, в основном полезных, микробов обитают в нашем желудочно-кишечном тракте и отвечают за жизненно важные метаболические, иммунные и пищевые функции.Дисбиоз, то есть неадаптивный дисбаланс микробиома, связан со многими распространенными заболеваниями и является целью лечения.
Цель / с
В этой статье представлен обзор микробиома кишечника при его здоровье и болезнях, выделяя такие состояния, как инфекция, вызванная Clostridium difficile , воспалительное заболевание кишечника, синдром раздраженного кишечника, ожирение и неалкогольная жировая болезнь печени, сопровождающаяся дисбактериозом. связано. Обсуждается информация о методах лечения, влияющих на микробиом кишечника, включая пробиотики и трансплантацию фекальной микробиоты.
Обсуждение
По мере того, как наши знания о микробиоме расширяются, мы, вероятно, лучше поймем сложные взаимодействия, вызывающие заболевания, и разработаем новые и более эффективные методы лечения многих распространенных состояний.
Триллионы бактерий, вирусов, грибов, архей и эукариотических организмов живут в желудочно-кишечном тракте человека и составляют то, что в совокупности называется микробиомом кишечника. Эти организмы составляют более 50% клеток человеческого тела и весят до 2 кг в среднем у взрослого человека. 1,2 В желудке и тонком кишечнике относительно мало организмов из-за кислой среды, присутствия желчи и панкреатического сока, а также эффектов перистальтики, которые ограничивают стабильную колонизацию. Таким образом, именно в толстой кишке подавляющее большинство (10 12 ) микробиоты живет и взаимодействует с человеческим хозяином. Наши знания о микробиоме кишечника человека с точки зрения здоровья и болезней быстро расширились за последние 10 лет благодаря увеличению доступности и снижению стоимости секвенирования генов. 3 Это предоставило убедительные доказательства жизненно важной роли кишечного микробиома в нормальном обмене веществ, питании, иммунной функции, физиологии и профилактике заболеваний. Помимо прямого воздействия на слизистую оболочку кишечника и кишечную нервную систему, многие химические медиаторы, вырабатываемые микробиомом кишечника, попадают в кровоток и взаимодействуют с дистальными органами, такими как мозг, сердце и печень. 4
Микробиом в здоровье
Хотя стандартного определения здорового микробиома кишечника не существует, важными характеристиками являются микробиом с высоким уровнем разнообразия, стабильности, устойчивости к изменениям, связанным со стрессом (антибиотики, инфекции, иммуносупрессия), и высоким уровнем избыточности метаболических путей. 5
Развивающийся микробиом кишечника
Исторически кишечник in utero воспринимался как стерильная среда; однако появляющиеся данные свидетельствуют о том, что контакт с микробами начинается еще до рождения с материнской микробиоты. 6 Более обширная колонизация начинается при рождении и во время родов защитными вагинальными микробами, такими как Lactobacillus . Младенцы, родившиеся через кесарево сечение и дети, не находящиеся на исключительно грудном вскармливании, могут быть колонизированы кожными и больничными бактериями, такими как Staphylococcus и Acinetobacter , в результате чего микробиом изначально менее разнообразен и менее здоров. 6,7 Эти младенцы кажутся более предрасположенными к развитию астмы, аллергического ринита, диабета и целиакии. 8 Развивающийся микробиом кишечника в первый год жизни похож на микробиом матери, но вскоре на него влияет множество факторов, включая диету, привычки питания и окружающую среду. 9 Зрелый микробиом кишечника устанавливается в возрасте от одного до трех лет и после этого становится относительно стабильным. К этому времени он в основном состоит из анаэробных бактерий, представленных более чем 50 типами и 1000 видами.Несмотря на это разнообразие, большинство микробов происходят из двух типов бактерий: Bacteroidetes и Firmicutes. 10
Метаболические и сигнальные функции
Микробиом кишечника отвечает за ряд жизненно важных метаболических и сигнальных функций, многие из которых недоступны одному человеческому организму. К ним относятся синтез всех витаминов группы B (B 1 –B 12 ) и витамина K, 11 обработка пищевых продуктов, переваривание сложных полисахаридов (крахмалы, целлюлоза и камеди), синтез незаменимых аминокислот, биотрансформация желчи, способствующая метаболизму глюкозы и холестерина, а также производство метаболитов короткоцепочечных жирных кислот, таких как бутират и ацетат, которые действуют как источник энергии для бактерий толстой кишки и могут оказывать противовоспалительное действие. 12 Некоторые частично усвояемые продукты, в свою очередь, могут обогатить определенные полезные микробные популяции, хотя прямая польза для здоровья еще не установлена. Примеры этих продуктов, часто называемых пребиотиками, включают злаки, спаржу, лук-порей, артишоки, бобовые, капусту и капусту. 12 Микробиота кишечника может также взаимодействовать с центральной нервной системой через несколько путей, включая блуждающий нерв, ось гипоталамус-гипофиз-надпочечники, производство нейротрансмиттеров или их предшественников, включая серотонин, триптофан, гамма-аминомасляную кислоту, дофамин, l -допа и норадреналин, а также через гормоны, такие как кортизол, грелин, лептин и глюкагоноподобный пептид -1. 13
Защитные иммунные функции
Нормальная микробиота кишечника — наша первая внутренняя линия защиты от патогенов и токсинов, защищающая организм от болезней в тандеме с иммунной системой хозяина. Одна из ключевых функций здорового микробиома — предотвращение колонизации болезнетворными микроорганизмами за счет барьерного эффекта. Это происходит за счет производства противомикробных соединений, таких как бактериоцин, и борьбы патогенов за питательные вещества и места прикрепления за счет огромной численности. 3 Кишечные бактерии также являются неотъемлемой частью развития врожденной иммунной системы слизистых оболочек за счет прямого взаимодействия с кишечными эпителиальными клетками. Раннее воздействие различных бактерий обеспечивает своего рода тренировку иммунной системы, так что нормальные защитные реакции возникают на комменсалов, а соответствующие воспалительные реакции возникают при воздействии патогенов. И наоборот, уменьшение разнообразия микробов и воздействие на них в раннем возрасте может привести к иммунной системе, которая чрезмерно реагирует на антигены, что предрасполагает к аутоиммунным и аллергическим заболеваниям. 14
Микробиом и болезни
Многие желудочно-кишечные заболевания связаны с изменениями микробиома кишечника, равно как и метаболические нарушения, заболевания печени, некоторые неврологические расстройства и расстройства настроения, артрит и иммунологические состояния. 15 Дисбиоз, означающий дисбаланс или дезадаптивное состояние микробиома, встречается почти во всех этих состояниях, хотя в большинстве случаев не установлено, является ли это причиной или следствием. Мы рассматриваем эти состояния с наибольшим количеством доказательств и обсуждаем исследования по модуляции кишечных бактерий в качестве терапии.
Clostridium difficile ИнфекцияClostridium difficile — спорообразующий грамположительный анаэроб, продуцирующий токсины A и B; последний отвечает за воспаление толстой кишки и развитие псевдомембранозного колита. Заболеваемость и тяжесть инфекции C. difficile (CDI) в Австралии и во всем мире растет: в 2012 г. в австралийских больницах было зарегистрировано более 12 000 случаев, что привело к относительной смертности в 6–7%. 16 C. difficile редко вызывает заболевание у здоровых взрослых; скорее, это требует нарушения нормальных механизмов резистентности и флоры хозяина, что чаще всего вызвано антибиотиками широкого спектра действия, иммуносупрессией или применением ингибиторов протонной помпы. 17
Традиционным лечением ИКД является метронидазол или ванкомицин и удаление вызывающего нарушение антибиотика; однако это оказывается все более неэффективным с частотой рецидивов до 50% и увеличением заболеваемости молниеносной болезнью.После публикации 2013 года Академического медицинского центра в Амстердаме, 18 было показано, что коррекция основного дисбиоза с помощью трансплантации фекальной микробиоты (FMT) более эффективна и долговечна, чем терапия антибиотиками при рецидивирующей ИКД. Эти результаты были воспроизведены в Австралии. 19 Непосредственное воздействие FMT при тяжелом псевдомембранозном колите показано на Рисунке 1.
Рисунок 1. Тяжелая инфекция Clostridium difficile у пациента в возрасте 79 лет.
A. Псевдомембранозный колит; Б. Пять дней после трансплантации фекальной микробиоты
Воспалительное заболевание кишечника
Язвенный колит и болезнь Крона — хронические воспалительные состояния неизвестной этиологии, основной патогенез которых, по-видимому, связан с множеством факторов, включая генетическую предрасположенность, триггеры окружающей среды, измененную иммунную функцию и аномальные реакции на микробиом кишечника. Дисбиоз присутствует у пациентов с воспалительным заболеванием кишечника (ВЗК), характеризующимся более высоким соотношением патогенных и комменсальных бактерий, сниженным количеством бактерий в областях активного воспаления и участках бактериальной инвазии слизистой оболочки, что редко, если вообще когда-либо, наблюдается у здоровых людей. частные лица. 20 Модуляция кишечных бактерий антибиотиками, такими как ципрофлоксацин и метронидазол, является общепринятым методом лечения для уменьшения послеоперационных рецидивов болезни Крона, в то время как пробиотики могут быть эффективны при паучите, связанном с ВЗК, после колэктомии. 21,22 В ряде исследований FMT рассматривался как лечение ВЗК, но с противоречивыми результатами. Систематический обзор небольших серий случаев показал общую эффективность 36%, при этом пациенты с болезнью Крона с большей вероятностью ответят на лечение, чем пациенты с язвенным колитом. 23 Австралийское рандомизированное плацебо-контролируемое исследование показало аналогичную эффективность при язвенном колите (44% ремиссия без стероидов) с использованием интенсивного протокола FMT с помощью колоноскопии и клизм в течение восьми недель. 24 В двух дополнительных рандомизированных контролируемых испытаниях язвенного колита одно не показало преимуществ по сравнению с плацебо, 25 , а в другом FMT достиг ремиссии в 24% по сравнению с 5% в группе плацебо. 26
Синдром раздраженного кишечника
Синдром раздраженного кишечника (СРК) — распространенное заболевание, характеризующееся дискомфортом в животе и изменением привычки кишечника при отсутствии основной органической причины.Патофизиология СРК остается неясной, но, вероятно, будет многофакторной, с важными изменениями моторики и обработки пищи, висцеральной гиперчувствительностью, генетической предрасположенностью и изменениями в микробиоме кишечника. 27 Лица с СРК с преобладанием диареи имеют дисбактериоз, характеризующийся более низкой экспрессией филотипа Clostridium thermosuccinogenes , 28 , тогда как у людей с СРК и запором наблюдается увеличение количества бактерий, которые производят и используют лактат, что приводит к более высокому производству сульфидов и водорода. 29 Кроме того, СРК, возникающий после гастроэнтерита, хорошо распознается (постинфекционный СРК), и у пораженных людей наблюдаются изменения в Bacteroidetes и Clostridia по сравнению со здоровыми людьми из контрольной группы. 30 Изменение кишечных бактерий с помощью антибиотиков может помочь, и рифаксимин, наиболее хорошо изученный, показал умеренное симптоматическое улучшение при СРК с преобладанием диареи. Это привело к одобрению этого показания в США, но не в Австралии. 31 Систематический обзор и метаанализ показали, что пробиотики оказывают умеренное благотворное влияние на общие показатели боли в животе, вздутие живота и метеоризм при СРК, а комбинированные схемы более эффективны. 32 Из-за неоднородности исследований отдельные полезные штаммы или режимы дозирования выделить не удалось. Было показано, что диета с низким содержанием FODMAP, направленная на снижение ферментируемых олигосахаридов, дисахаридов, моносахаридов и полиолов, эффективна при СРК, но сама по себе может ограничивать количество бактерий в фекалиях, включая полезные бактерии. 33
Болезнь обмена веществ
Мировая эпидемия ожирения и связанных с ним метаболических заболеваний в первую очередь объясняется диетой и отсутствием физических упражнений; однако теперь ясно, что микробиом кишечника также играет роль друга и врага.Микробиота кишечника необходима для набора веса, вызванного диетой (рис. 2А), при этом мыши без микробов набирают минимальный вес, несмотря на диету с высоким содержанием жиров / сахара, тогда как идентичные мыши, содержащие кишечные бактерии, становятся ожирением. 34 Дисбиоз, характеризующийся снижением численности Bacteroidetes и увеличением числа Firmicutes, изменяя их нормальное соотношение, был причастен к ожирению у мышей и людей; 35 однако, два недавних метаанализа объединенных исследований на людях не смогли выявить эти изменения в бактериальных типах, с лишь незначительным сокращением микробного разнообразия и богатства. 36,37 Тем не менее, метаболические фенотипы с ожирением и худой у мышей могут передаваться через FMT (Рисунок 2B), 38,39 процесс, более зависимый от микробиоты, чем от генетики (Рисунок 2C), поскольку FMT от однояйцевых близнецов не соответствует ожирению. по-прежнему приводил к передаче фенотипа худощавости или ожирения у мышей. 40 Совместное содержание двух групп, где мыши ели фекалии друг друга, привело к фенотипу постного мяса, предположительно из-за повторной инвазии определенных Bacteroidetes в тучных мышей. 40 В недавнем исследовании пациентов с метаболическим синдромом FMT от худощавого донора улучшил чувствительность к инсулину всего за шесть недель, что отчасти обусловлено увеличением количества кишечных бактерий, продуцирующих бутират. 41
Рисунок 2. Ожирение и микробиом
A. Свободные от микробов мыши устойчивы к ожирению, вызванному диетой; B. Метаболический фенотип передается через трансплантацию микробиоты от худых доноров, производящих худых мышей, и от доноров с ожирением, производящих мышей с ожирением; С.Трансплантат микробиоты от однояйцевых близнецов, дискордантных по ожирению, также передает метаболический фенотип мышам, свободным от микробов, однако при совместном размещении преобладает худой фенотип; GF, без микробов; L, тощая N, нормальная; О, ожирение
Неалкогольная жировая болезнь печени
Помимо изменений микробиоты при ожирении, изменения кишечных бактерий при неалкогольной жировой болезни печени (НАЖБП) и неалкогольном стеатогепатите (НАСГ) связаны с кишечной бактериальной транслокацией, что приводит к увеличению доставки липополисахаридов, свободных жирных кислот. кислоты и другие токсины прямо в печень из воротной вены. 42 Кроме того, пациенты с НАСГ имеют большее количество бактерий семейства Escherichia , группы, которая ферментирует углеводы и производит эндогенный этанол. 43 Это приводит к периферическому повышению уровня алкоголя, что является возможным сопутствующим фактором в патогенезе жировой болезни печени. В настоящее время проводится ряд исследований для оценки роли пробиотиков, FMT или других кишечных модулирующих процедур у пациентов с НАЖБП.
Изменение микробиома кишечника
Трансплантат фекальной микробиоты
FMT был впервые использован в современной медицине в 1958 году, когда четыре пациента с псевдомембранозным колитом были вылечены фекальной клизмой. 44 Существуют доказательства роли FMT в рецидивирующей ИКД, и появляются новые доказательства его роли при ВЗК и метаболических заболеваниях. 15 Процесс, лежащий в основе FMT, относительно прост. Доноры проходят скрининг на все известные патогены, передающиеся с кровью и калом, и должны быть здоровыми, худыми и не иметь заболеваний, потенциально передаваемых через кишечные бактерии. Донорский стул смешивают со стерильным физиологическим раствором / глицерином и можно давать свежим или замороженным. Стул, замороженный при –80 ° C, жизнеспособен и эффективен в течение как минимум шести-девяти месяцев. 19 Донорский стул может быть доставлен через назо-еюнальную трубку или в слепую кишку при колоноскопии. В целом процедура безопасна; Общие нежелательные явления включают вздутие живота, диарею и субфебрильную температуру, которые обычно проходят в течение 48 часов. 15 Серьезные события, связанные с эндоскопической процедурой, такие как перфорация кишечника и аспирация, случаются редко. Долгосрочные эффекты FMT неизвестны и, вероятно, могут включать в себя индукцию хронических заболеваний, связанных с изменениями в кишечных бактериях или передачей нераспознанных в настоящее время инфекционных агентов. 15 Исследователи из банка стула OpenBiome в США, среди прочих, разработали фекальную капсулу, которая может сделать эту терапию, изменяющую кишечник, более доступной в будущем.
Антибиотики
Обработка кишечных бактерий с помощью антибиотиков, таких как ципрофлоксацин и метронидазол, в течение некоторого времени использовалась для лечения кишечных расстройств, таких как болезнь Крона; однако их способность уменьшать количество патогенных грамотрицательных бактерий, паразитов и анаэробов достигается за счет снижения бактериального разнообразия и устойчивости, а также ИКД. 12 Недавно минимально абсорбируемый антибиотик широкого спектра действия рифаксимин получил признание благодаря своей эффективности при печеночной энцефалопатии и СРК, а также низкому потенциалу развития бактериальной резистентности. 12
Пробиотики
Пробиотики определены Всемирной организацией здравоохранения как «живые бактерии или дрожжи, которые при введении в адекватных количествах приносят пользу здоровью потребителя». Однако доказательства их эффективности неоднозначны. Наиболее хорошо изученными бактериальными пробиотиками являются пробиотики видов Lactobacillus , Bifidobacterium и Lactococcus , а наиболее часто используемые дрожжи — это Saccharomyces boulardii . 12 Пробиотики временно колонизируют кишечник и могут оказывать положительное воздействие за счет усиления естественного кишечного барьера (как физического, так и слизистого), стимуляции секреции IgA, подавления выработки воспалительных цитокинов и прямого антагонизма патогенов. 45 На основе метаанализов рандомизированных контролируемых исследований пробиотики умеренно эффективны для уменьшения общих симптомов СРК (количество, необходимое для лечения [NNT] = 8), 32 и для уменьшения диареи, связанной с антибиотиками, у детей в возрасте от одного месяца до 18 лет (NNT = 10) 46 и взрослые до 64 лет (относительный риск = 0.47), но не у пожилых людей. 47 Продолжительность использования пробиотиков (5–21 день) не повлияла на пользу, и, в разной степени, результаты зависели от штамма; наибольшее преимущество было получено от Lactobacillus и S. boulardii . 47 Для других заболеваний результаты могут зависеть от препарата, и только дорогостоящий комбинированный пробиотик VSL # 3 (восемь видов Lactobacillus , Bifidobacterium и Streptococcus ; 130 долларов США) эффективен для профилактики и лечения паучита в ВЗК после колэктомии, 22 и Lactobacillus casei и смешанный исследовательский препарат L.acidophilus , L. delbruecki var bulgaris , Streptococcus thermphilus и B. bifidu в течение пяти дней, уменьшая продолжительность и тяжесть симптомов у детей с острой инфекционной диареей. 48 Доказательства того, что пробиотики помогают при внекишечных заболеваниях или помогают поддерживать общее состояние здоровья, остаются противоречивыми. Большинство коммерческих пробиотиков состоят из смеси штаммов, эффективность которых обычно приписывается конкретным штаммам и их количеству. Однако недавнее исследование показало, что только 58% имеют правильную маркировку. 49 Кроме того, существуют проблемы с поддержанием жизнеспособности пробиотиков во время хранения и их способности противостоять кислоте и желчи, чтобы достичь толстой кишки, где может произойти колонизация. 50 В то время как пробиотики кажутся безопасными для большинства людей, сообщения о случаях заболевания повышают вероятность оппортунистической инфекции из-за воздействия на комменсальную микрофлору, особенно у тяжелобольных взрослых и новорожденных, у которых после приема препарата иногда наблюдались бактериемия и фунгемия. Lactobacillus rhamnosus и S.boulardii . 51 Крупные рандомизированные испытания не подтвердили повышенный риск; тем не менее, при использовании пробиотиков рекомендуется оценка риска и пользы.
Заключение
Микробиом кишечника — сложная и важная часть нашего тела, которая обеспечивает жизненно важную поддержку нормального обмена веществ и защиту от болезней. Дисбактериоз связан с множеством болезненных состояний и является целью лечения и будущих исследований.
Благодарности
Авторы выражают благодарность г-ну Эндрю Барнсу за его помощь в оформлении рисунка 2.
Авторы
Майенааз Сидху, бакалавр магистратуры в области гастроэнтерологии, стажер, больница Вестмид, Сидней, Новый Южный Уэльс
Дэвид ван дер Поортен Бакалавр медицинских наук, MBBS (с отличием) FRACP, доктор философии, штатный специалист-гастроэнтеролог больницы Вестмид, Сидней, Новый Южный Уэльс, и клинический доцент Сиднейского университета, Сидней, Новый Южный Уэльс. [email protected]
Конкурирующие интересы: Нет
Происхождение и экспертная оценка: заказано, внешняя экспертная оценка.
Список литературы
- Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol 2016; 14 (8): e1002533.
- Кларк Дж., Стиллинг Р. М., Кеннеди П. Дж., Стэнтон С., Крайан Дж. Ф., Динан Т. Г.. Мини-обзор: Микробиота кишечника: запущенный эндокринный орган. Мол Эндокринол 2014 Авг; 28 (8): 1221−38.
- Bull MJ, Plummer NT. Часть 1. Микробиом кишечника человека в условиях здоровья и болезней. Integr Med (Encinitas) 2014; 13 (6): 17–22.
- Эванс Дж. М., Моррис Л. С., Марчези Дж. Р. Микробиом кишечника: роль виртуального органа в эндокринологии хозяина. J Endocrinol 2013; 218 (3): R37–47.
- Bäckhed F, Fraser CM, Ringel Y, et al. Определение здорового микробиома кишечника человека: современные концепции, будущие направления и клиническое применение. Клеточный микроб-хозяин 2012; 12 (5): 611–22.
- Collado MC, Rautava S, Isolauri E, Salminen S. Микробиота кишечника: источник новых инструментов для снижения риска заболеваний человека? Педиатр Res 2015; 77 (1-2): 182–88.
- Хурре А., Каллиомяки М., Раутава С., Ринне М., Салминен С., Изолаури Э. Способ доставки — Влияние на микробиоту кишечника и гуморальный иммунитет. Неонатология 2008; 93 (4): 236–40.
- Neu J, Rushing J. Кесарево сечение по сравнению с вагинальными родами: долгосрочные результаты для младенцев и гигиеническая гипотеза. Clin Perinatol 2011; 38 (2): 321–31.
- Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr 1999; 69 (5): 1035S – 45S.
- Schloss PD, Handelsman J. Статус микробной переписи. Microbiol Mol Biol Rev 2004; 68 (4): 686–91.
- LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Бактерии как поставщики витаминов для своего хозяина: взгляд на микробиоту кишечника. Curr Opin Biotechnol 2013; 24 (2): 160–68.
- Галло А., Пассаро Г., Гасбаррини А., Ландольфи Р., Монтальто М. Модуляция микробиоты как лечение воспалительных заболеваний кишечника: обновление. Мировой журнал J Gastroenterol 2016; 22 (32): 7186–202.
- Scheperjans F. Кишечная микробиота, 1013 новых элементов в головоломке «Болезнь Паркинсона». Curr Opin Neurol 2016; 29 (6): 773–80.
- Björkstén B, Sepp E, Julge K, Voor T., Mikelsaar M. Развитие аллергии и кишечная микрофлора в течение первого года жизни. J Allergy Clin Immunol 2001; 108 (4): 516–20.
- Choi HH, Cho Y-S. Трансплантация фекальной микробиоты: текущие применения, эффективность и перспективы на будущее. Clin Endosc 2016; 49 (3): 257–65.
- Slimings C, Armstrong P, Beckingham WD, et al.Рост заболеваемости инфекцией Clostridium difficile, Австралия, 2011-2012 гг. Med J Aust 2014; 200 (5): 272–76.
- Bartlett JG. Описательный обзор: новая эпидемия кишечного заболевания, ассоциированного с Clostridium difficile . Энн Интерн Мед 2006; 145 (10): 758–64.
- van Nood E, Vrieze A, Nieuwdorp M, et al. Дуоденальная инфузия донорских фекалий при рецидиве Clostridium difficile . N Engl J Med 2013; 368 (5): 407–15.
- Costello SP, Conlon MA, Vuaran MS, Roberts-Thomson IC, Andrews JM.Пересадка фекальной микробиоты при рецидивирующей инфекции Clostridium difficile с использованием длительного замороженного стула эффективна: данные о клинической эффективности и жизнеспособности бактерий. Aliment Pharmacol Ther 2015; 42 (8): 1011–18.
- Лопес Дж., Гринспан А. Трансплантация фекальной микробиоты при воспалительном заболевании кишечника. Гастроэнтерол Hepatol 2016; 12 (6): 374–79.
- Rutgeerts P, Hiele M, Geboes K и др. Контролируемое испытание лечения метронидазолом для профилактики рецидива Крона после резекции подвздошной кишки.Гастроэнтерология 1995; 108 (6): 1617–21.
- Сингх С., Страуд А.М., Голубар С.Д., Сандборн В.Дж., Парди Д.С. Лечение и профилактика поучита после анастомоза подвздошно-анальный мешок при хроническом язвенном колите. Кокрановская база данных Syst Rev 2015; (11): CD001176.
- Colman RJ, Rubin DT. Трансплантация фекальной микробиоты как терапия воспалительного заболевания кишечника: систематический обзор и метаанализ. J. Crohns Colitis 2014; 8 (12): 1569–81.
- Paramsothy S, Kamm M, van den Bogaerde J, Samuel D, Leong R.Трансплантация интенсивной фекальной микробиоты от нескольких доноров — эффективное лечение резистентного язвенного колита: рандомизированное плацебо-контролируемое исследование. J Gastroenterol Hepatol 2016; 150 (4): S122–23.
- Россен Н.Г., Фуэнтес С., ван дер Спек М.Дж. и др. Результаты рандомизированного контролируемого исследования трансплантации фекалий пациентам с язвенным колитом. Гастроэнтерология 2015; 149 (1): 110–14.
- Моайеди П., Суретт М.Г., Ким П.Т. и др. Трансплантация фекальной микробиоты вызывает ремиссию у пациентов с активным язвенным колитом в рандомизированном контролируемом исследовании.Гастроэнтерология 2015; 149 (1): 102–06.
- Камиллери М. Периферические механизмы при синдроме раздраженного кишечника. N Engl J Med 2013; 368 (6): 578–79.
- Lyra A, Rinttilä T, Nikkilä J и др. Синдром раздраженного кишечника с преобладанием диареи, различимый по количественной оценке филотипа гена 16S рРНК. Мировой журнал J Gastroenterol 2009; 15 (47): 5936–45.
- Chassard C, Dapoigny M, Scott KP и др. Функциональный дисбактериоз микробиоты кишечника у пациентов с синдромом раздраженного запора кишечника.Aliment Pharmacol Ther 2012; 35 (7): 828–38.
- Jalanka-Tuovinen J, Salojärvi J, Salonen A, et al. Состав фекальной микробиоты и перекрестный диалог между хозяином и микробом после гастроэнтерита и постинфекционного синдрома раздраженного кишечника. Gut 2014; 63 (11): 1737–45.
- Cremonini F, Lembo A. Рифаксимин для лечения синдрома раздраженного кишечника. Экспертное мнение Pharmacother 2012; 13 (3): 433–40.
- Ford AC, Quigley EMM, Lacy BE и др. Эффективность пребиотиков, пробиотиков и синбиотиков при синдроме раздраженного кишечника и хронических идиопатических запорах: систематический обзор и метаанализ.Am J Gastroenterol 2014; 109 (10): 1547–61 – quiz1546–1562.
- Tuck CJ, Muir JG, Barrett JS, Gibson PR. Ферментируемые олигосахариды, дисахариды, моносахариды и полиолы: роль в синдроме раздраженного кишечника. Exp Rev Gastroenterol Hepatol 2014; 8 (7): 819–34.
- Бэкхед Ф., Манчестер Дж. К., Семенкович Ф. К., Гордон Дж. Механизмы, лежащие в основе устойчивости к ожирению, вызванному диетой, у стерильных мышей. Proc Natl Acad Sci USA 2007; 104 (3): 979–84.
- Каллус С.Дж., Брандт Л.Дж.Микробиота кишечника и ожирение. J Clin Gastroenterol 2012; 46 (1): 16–24.
- Sze MA, Schloss PD. Ищем сигнал в шуме: возвращаемся к ожирению и микробиому. MBio 2016; 7 (4): e01018–16.
- Уолтерс В.А., Сюй З., Найт Р. Мета-анализ кишечных микробов человека, связанных с ожирением и ВЗК. FEBS Lett 2014; 588 (22): 4223–33.
- Лиу А.П., Пазюк М., Лювано Дж.М., Машинени С., Тернбо П.Дж., Каплан Л.М. Сохраненные сдвиги в микробиоте кишечника из-за обходного желудочного анастомоза снижают вес хозяина и ожирение.Sci Transl Med 2013; 5 (178): 178ra41.
- Turnbaugh PJ, Bäckhed F, Fulton L, Gordon JI. Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мыши. Клеточный микроб-хозяин 2008; 3 (4): 213–23.
- Ридаура В.К., Фейт Дж. Дж., Рей Ф. Е., Ченг Дж., Дункан А. Э., Кау А. Л. и др. Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука 2013; 341 (6150): 1241214.
- Vrieze A, van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JFWM и др.Перенос кишечной микробиоты от худых доноров увеличивает чувствительность к инсулину у людей с метаболическим синдромом. Гастроэнтерология 2012; 143 (4): 913–17.
- Виланд А., Франк Д. Н., Харнке Б., Бамбха К. Систематический обзор: микробный дисбиоз и неалкогольная жировая болезнь печени. Aliment Pharmacol Ther 2015; 42 (9): 1051–63.
- Чжу Л., Бейкер С.С., Гилл С. и др. Характеристика микробиомов кишечника у пациентов с неалкогольным стеатогепатитом (НАСГ): связь между эндогенным алкоголем и НАСГ.Гепатология 2013; 57 (2): 601–09.
- Eiseman B, Silen W, Bascom GS, Kauvar AJ. Фекальная клизма как вспомогательное средство при лечении псевдомембранозного энтероколита. Хирургия 1958; 44 (5): 854–59.
- Вандерпул С, Ян Ф, Полк ДБ. Механизмы действия пробиотиков: значение для терапевтического применения при воспалительных заболеваниях кишечника. Воспаление кишечника 2008; 14 (11): 1585–96.
- Джонстон BC, Голденберг JZ, Parkin PC. Пробиотики и профилактика диареи, связанной с антибиотиками, у младенцев и детей.JAMA 2016; 316 (14): 1484-85.
- Джафарнеджад С., Шаб-Бидар С., Спикман Дж. Р., Парастуй К., Данеши-Маскуни М., Джафариан К. Пробиотики снижают риск диареи, связанной с антибиотиками, у взрослых (18–64 лет), но не пожилых людей (> 65 лет): Метаанализ. Nutr Clin Pract 2016; 31 (4): 502–13.
- Canani RB, Cirillo P, Terrin G и др. Пробиотики для лечения острой диареи у детей: рандомизированное клиническое испытание пяти различных препаратов. BMJ 2007; 335 (7615): 340.
- Морович В., Хибберд А.А., Забель Б., Баррангу Р., Шталь Б. Генотипирование с помощью ПЦР и высокопроизводительное секвенирование коммерческих пробиотических продуктов выявляют систематические ошибки в составе. Front Microbiol 2016; 7: 1747.
- Сандерс М.Э., Ленуар-Вейнкооп I, Салминен С. и др. Пробиотики и пребиотики: перспективы для рекомендаций по общественному здоровью и питанию. Ann N Y Acad Sci 2014; 1309 (1): 19–29.
- Didari T, Solki S, Mozaffari S, Nikfar S, Abdollahi M. Систематический обзор безопасности пробиотиков.Мнение эксперта Drug Saf 2014; 13 (2): 227–39.
Переписка [email protected]
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать или загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как …». Следуйте подсказкам, чтобы выбрать место.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader. Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word. Они будут иметь «DOC» в скобках вместе с размером файла для загрузки.Для просмотра этих документов вам понадобится программа, которая может читать формат Microsoft Word. Если у вас ничего нет, вы можете бесплатно скачать MS Word Viewer.
MP3 Большинство веб-браузеров воспроизводят аудио в формате MP3 в браузере
экспертов оценивают новаторские исследования микробиома в отношении иммунитета, здоровья костей и суставов на фоне COVID-19
Здоровье костей, суставов и обмена веществ также находятся на переднем крае исследований микробиома в ответ на старение населения, заявила группа экспертов во время первого. день Цифрового саммита Probiota Asia 2021.
Цифровой саммит Probiota Asia 2021 — это четырехдневное онлайн-мероприятие, организованное NutraIngredients-Asia.
Мероприятие началось во вторник (26 октября) с презентаций и панельной дискуссии экспертов на тему «Научные открытия: передовые исследования микробиома в условиях пандемии».
Ключевым моментом, поднятым во время мероприятия, было то, как микробиом организма может повлиять на эффективность вакцины.
Например, было показано, что дисбактериоз микробиома кишечника, вызванный воздействием антибиотиков, вызывает более слабый ответ на вакцины как на мышиной модели, так и в продолжающемся исследовании с участием младенцев, сказал основной докладчик профессор Дэвид Линн, руководитель группы EMBL Australia, и программный директор The SAHMRI Precision Medicine Theme.
« Мы обнаружили, что воздействие антибиотиков приводит к значительным изменениям в реакции младенца на иммунизацию», — сказал профессор Линн, отметив, что у младенцев, подвергшихся воздействию антибиотиков, наблюдается повышенная экспрессия воспалительного ответа и генов, связанных с моноцитами, и снижается экспрессия генов, относящихся к В-клеткам
«T Данные показывают, что воздействие антибиотиков на младенцев, вероятно, [влияет на микробиоту кишечника], изменяя состав микробиома, который влияет на иммунный ответ на вакцинацию на уровне экспрессии генов.»
Взаимосвязь между микробиомом кишечника и иммуногенностью вакцины была также поднята профессором Сью К. Нг, заместителем директора Центра исследований кишечной микробиоты Китайского университета Гонконга.
В своей презентации она указала на что восстановление дисбактериоза кишечника может улучшить ответ на вакцину, помимо того, что оно действует как адъювантное лечение, чтобы помочь ускорить выздоровление у пациентов с COVID-19.
Фактически, в первые дни пандемии профессор Нг и ее команда уже успели наблюдали, что состав микробиоты кишечника у пациентов с COVID-19 отличался от людей, которые не были инфицированы этим вирусом.
«У пациентов с COVID-19 был дефицит известных кишечных бактерий, обладающих иммуномодулирующим потенциалом.
«Состав микробиоты кишечника у пациентов с COVID-19 соответствует тяжести заболевания и величине концентрации маркеров воспаления», — сказал профессор Нг.
Другими словами, кишечник человека также является мишенью вируса COVID-19.
Профессор Нг (слева) и ее команда из Китайского университета Гонконга обнаружили, что в кишечнике пациентов с COVID-19 отсутствует ряд полезных бактерий.«На раннем этапе пандемии мы узнали, что COVID-19 — это не только респираторное заболевание. Человеческий кишечник также является мишенью. Вирус можно найти в разных частях кишечника человека. Это связано с нашим пониманием того, что вирусный ACE2 высоко экспрессируется в кишечнике человека ».
Она добавила, что стойкие различия в составе микробиоты кишечника — даже если вирус исчез — могут способствовать появлению симптомов «длительного COVID».
Потребности для старенияПомимо COVID-19, проводятся исследования микробиома, пробиотиков и возрастных заболеваний, включая проблемы со здоровьем костей и суставов.
В случае Китая решение проблем, связанных со старением, является приоритетом для гигантов питания, таких как Yili, поскольку это часть стратегии страны «Здоровый Китай до 2030 года».
В Китае, в связи с растущим спросом потребителей на здоровье и продвижением стратегии «Здоровый Китай 2030», промышленность пробиотиков [сейчас] находится в сильном развитии. По оценкам, проблема старения населения Китая вступит в период ускорения после 2023 года.
Основной докладчик, доктор Уильям Хунг, директор по научным исследованиям и руководитель исследовательского центра пробиотиков в Йили.
Компания отвечает на потребности здоровья костей с помощью своего запатентованного штамма Bifidobacterium Lactis BL-99, который, по словам доктора Хонга, может способствовать здоровью пищеварительной системы, а также предотвращать остеопороз на основе оси кишечника и кости.
Вдобавок к этому он выделил три других запатентованных штамма компании, которые также имеют отношение к концепции «Здоровый Китай 2030».
Это Lactobacillus paracasei K56 для метаболического здоровья, Lactobacillus paracasei ET-22 для здоровья полости рта и Bifidobacterium infantis YLGB-1496 для здоровья кожи.
«Здоровая полость рта, здоровый вес и здоровые кости будут ключевыми направлениями политики [Здоровый Китай 2030]», — сказал он.
Удовлетворение потребностей старения посредством модуляции микробиома также обсуждалось во время сегмента панельной дискуссии на мероприятии.
В панельной дискуссии участвовали профессор Линн, д-р Сэмюэл Дж. К. Абрахам, руководитель отдела исследований и разработок в GN Corporation, д-р Майкл Колон, главный научный сотрудник подразделения здравоохранения и биобезопасности национального исследовательского агентства Австралии CSIRO, и профессор Баламуруган Рамадасс, дополнительный профессор Всеиндийского университета. Институт медицинских наук (AIIMS), Бхубанешвар.
Например, профессор Рамадасс наблюдал в ходе своего исследования наличие оси кишечника и сустава.
В частности, было обнаружено, что пациенты с остеоартритом коленного сустава имеют состав микробиома кишечника, отличный от здоровых людей, и что витамин D является модулирующим фактором.
«В продолжение нашего первоначального исследования концепции, мы сейчас пытаемся дополнить этих пациентов витамином D.
« Мы изучаем иммунный фенотип, изменение иммунного ответа до и после приема витамина. Добавка D… Определенно существует эта сильная ось сустава кишечника », — сказал он .
Бета-глюкан, новые кандидаты в пре / пробиотикиВ ходе панельной дискуссии также обсуждались исследования новых кандидатов в пре / пробиотики и бета-глюкана для модуляции микробиоты кишечника.
Например, по словам доктора Колона, в настоящее время проводятся исследования по использованию морских источников в качестве потенциального пребиотика.
“ Есть много обычно встречающихся волокон, которые люди используют в качестве пребиотиков для воздействия на здоровье кишечника.
«Существует реальный интерес к поиску новых форм волокон или других молекул, [особенно] к поиску легко извлекаемых форм, экологически чистых форм волокон и т. Д., Которые имеют экономический смысл.
«Итак, это комбинация открытия новых вещей и потенциально новых способов модуляции кишечной микробиоты с помощью волокон или полифенолов, а также, надеюсь, поиск лучших способов производства нутрицевтиков», — сказал он.
Было также предложено использование модели мышей без микробов для определения пробиотических штаммов, которые могут наилучшим образом поддерживать иммуногенность вакцины.
Проф Линн сказал, что с помощью этой модели он обнаружил, что мыши, колонизированные определенными пробиотиками, значительно улучшили реакцию на иммунизацию.
«У свободных от зародышей мышей нарушен ответ на некоторые, но не на все вакцины, и это дает полезную модель для определения конкретных типов пробиотиков, которые могут восстанавливать ответы на вакцинацию», — сказал он.
Помимо пре / пробиотиков, доктор Абрахам также изучает, как бета-глюкан может повлиять на микробиом кишечника.
Это продолжение его предыдущего исследования того, как добавка бета-глюкана может уменьшить биомаркеры цитокинового шторма и коагулопатии у пациентов с COVID-19.

 д.
д.

 В анализе кала диагностируются изменения видового и количественного содержания микрофлоры.
В анализе кала диагностируются изменения видового и количественного содержания микрофлоры.
 Кишечная палочка с нормальной ферментативной активностью не выявляется. Преобладает разнообразная аэробная и анаэробная микрофлора.
Кишечная палочка с нормальной ферментативной активностью не выявляется. Преобладает разнообразная аэробная и анаэробная микрофлора.


