Каскадный желудок: симптомы, лечение, причины
Каскадный желудок – это не болезнь. Так называют изменение формы органа врачи при проведении эндоскопии или рентгенограммы. В течение жизни желудок может менять форму в зависимости от того, что ест человек, какие его порции пищи, в каком положении он трапезничает.
Общие сведения
Каскадный желудок встречается у 5% пациентов. Когда человек голоден, его желудок имеет форму плоского мешочка, у которого задняя и передняя стенки прикасаются друг к другу. Когда он наполняется, его форма становится более выпуклой и продолговатой. Изменения, что возникают в органе, чаще всего являются врожденной особенностью или спровоцированы работой системы пищеварения. При проведении рентгенограммы можно наблюдать, как орган преобразовывается от роговидной формы до крючковидной при наполнении его контрастом. Формы желудка:
- чулок;
- рог;
- крючок.
Рентгенограмма показывает каскадный желудок так: орган имеет перегиб вокруг оси, отчего формируется 2 колена: нижнее (трубка) и верхнее (чаша). Таким образом, он похож по форме на каскад. Передняя проекция показывает орган укороченным, если смотреть со стороны, видно, что свод расположен намного ниже обычного, практически на уровне привратника.
Таким образом, он похож по форме на каскад. Передняя проекция показывает орган укороченным, если смотреть со стороны, видно, что свод расположен намного ниже обычного, практически на уровне привратника.
Вернуться к оглавлениюЧтоб определить причину изменения формы органа, проводится фиброгастроскопия, рентгенограмма, анализ кислотности желудочного сока.
Причины
Причины деформации можно классифицировать на:
- приобретенные;
- врожденные.
Причинами приобретенных перегибов могут быть рубцевания, что возникают оттого, что пациент перенес серьезное заболевание органов пищеварения, особенно воспалительного характера. К таким болезням относятся перигастрит, язвенная болезнь, перидуоденит.
Вернуться к оглавлениюСимптомы
Симптомы каскадного желудка связаны напрямую с заболеванием, на фоне которого он преобразовался.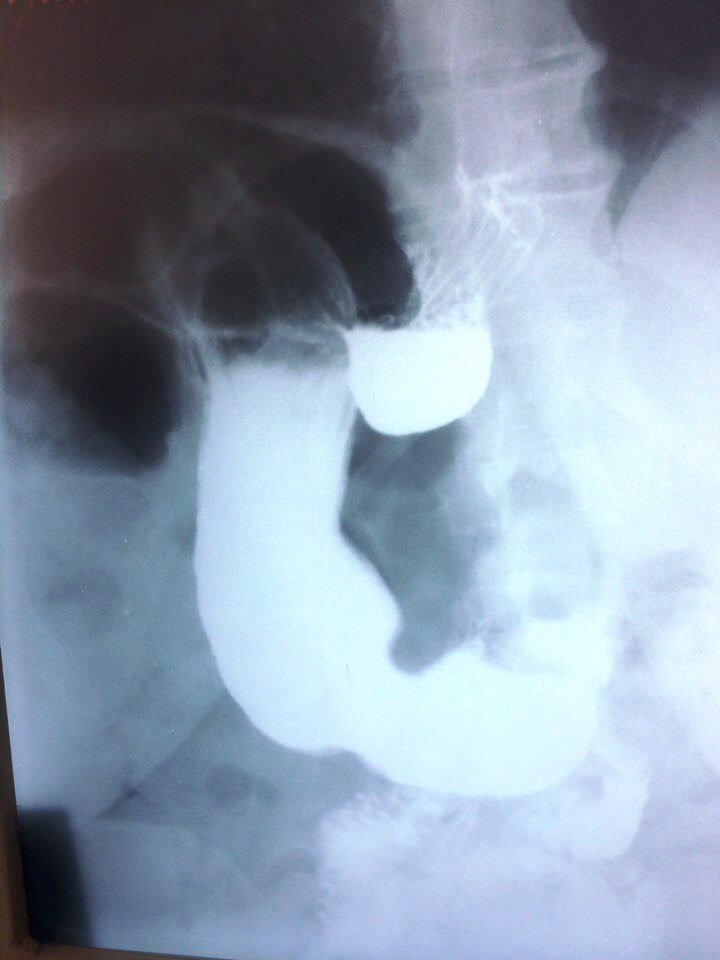 Чаще всего симптомами перегиба являются:
Чаще всего симптомами перегиба являются:
- ощущение переполненного желудка после трапезы;
- тяжесть после приема пищи;
- отсутствие аппетита;
- тошнота;
- рвотные позывы;
- иногда снижается индекс массы тела.
Деформации на рентгенограмме
Рентгенологическое исследование органа проводится после того, как получены результаты общих анализов крови и мочи, биохимии, кислотности желудочного сока. Перед рентгенограммой проводится исследование газового пузыря, рельефность слизистой оболочки органа, тонуса желудка и работы двенадцатиперстной кишки.
Газовый пузырь – различающиеся по форме скопления газов в кардинальном отделе органа. При рентгене контраст затекает под него и есть возможность осмотреть низ органа. Процедура должна быть выполнена последовательно и строго по методике, чтоб получить максимально хорошие результаты, и не требовалась повторная диагностика. Делается обзорный снимок и прицельный. Это дает возможность осмотреть рельефность слизистых оболочек, их неровности, которые хорошо показывает тень от контрастного вещества.
Нормотоничный желудок характеризуется тем, что контраст медленно попадает в каудальную часть желудка. Пузырь из газа имеет форму шара. При гипотоничном желуде, наоборот, контрастное вещество быстро стекает в антральный отдел и приобретает чашевидную форму. Роговидная форма желудка чаще всего встречается у людей, которые страдают большим весом, так как у них антральный отдел находится выше, чем у людей обычного телосложения. Если пациент повернется в любую сторону, орган приобретает крюковидную форму. Рогообразным желудок может становиться из-за сильного органического или функционального нарушения.
Деформация желудка также может заключаться в его смещении. Виды:
- пассивное;
- активное.
Пассивное смещение желудка можно заметить, используя обычную пальпацию при смене положения тела.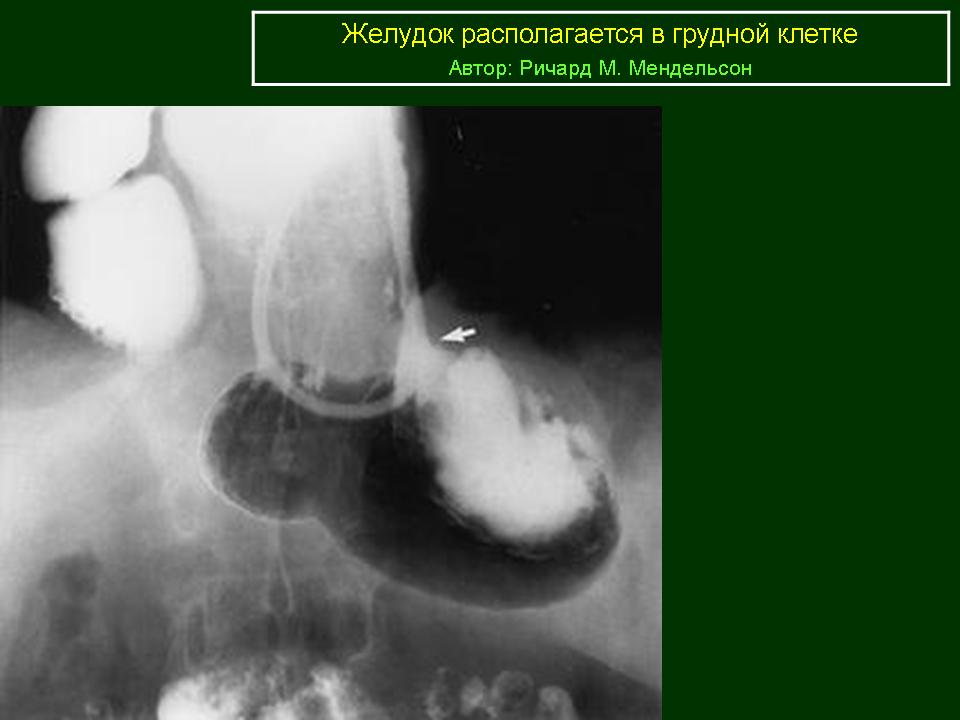 Активный сдвиг видно при дыхании диафрагмой, когда брюшная полость втягивается и вытягивается. На втягивании мышцы пресса необходимо максимально втянуть в себя. Такие смещения чаще всего спровоцированы разными патологиями, например, спаечным процессом, увеличенной печенью и т. д. Деформации и смещения желудка могут повлиять на органы, которые находятся рядом.
Активный сдвиг видно при дыхании диафрагмой, когда брюшная полость втягивается и вытягивается. На втягивании мышцы пресса необходимо максимально втянуть в себя. Такие смещения чаще всего спровоцированы разными патологиями, например, спаечным процессом, увеличенной печенью и т. д. Деформации и смещения желудка могут повлиять на органы, которые находятся рядом.
Форма «песочные часы» вызвана рубцеванием. Это рубцевая перетяжка, которая будто делит орган на 2 части, между которыми остается небольшой просвет. Желудок в форме улитки получается, когда малая кривизна становится меньше, а большая удлиняется. Каскадный формируется из-за поперечного перегиба органа.
Вернуться к оглавлениюЖелудок в форме каскада
На рентгенограмме видно, что в органе сформировался загиб, из-за которого в нем образовывается 2 уровня. Такая патология может появиться на фоне аэрофагии, сильного стресса или в случае, когда прогрессирует паралич. Также его вызывают заболевания желудочно-кишечного тракта, в том числе опухоли злокачественного характера.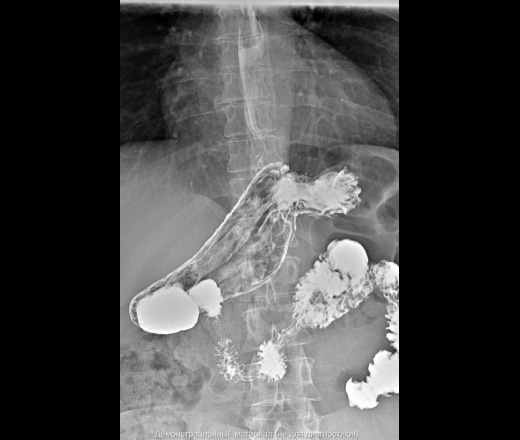 Такой перегиб нужно расправлять, а если это не получается сделать, врачи ищут причину, которая препятствует успешному проведению процедуры.
Такой перегиб нужно расправлять, а если это не получается сделать, врачи ищут причину, которая препятствует успешному проведению процедуры.
Выпрямление и лечение
Сегодня известно несколько методик, помогающих расправить орган каскадной формы. В первую очередь, для лечения пациенту рекомендуют делать специальное упражнение – наклоняться вправо и влево. Если патологический процесс сопровождается диспепсическими симптомами, рекомендуют забыть о тугих ремнях, чрезмерных физических нагрузках, при которых нужно поднимать тяжелые предметы и перенапрягать брюшные мышцы.
Если пациент мучится с такими симптомами, как изжога, частые отрыжки и неприятные ощущения в брюшной полости, ему назначаются фармацевтические средства, которые обволакивают стенки органа, угнетают агрессивность ферментативного сока и защищают слизистые оболочки, например, «Маалокс», «Церукал», «Фосфалюгель» и т. д. При необходимости для лечения симптомов назначают обезболивающие препараты и спазмолитики. Активно применяется физиотерапия.
Активно применяется физиотерапия.
Лечение народными средствами
- Рецепт №1. 30 дней нужно пить фреш из белокочанной капусты.
- Рецепт №2. Состав:
- Рецепт №3. Отвар из ромашки, липы, тысячелистника и мяты поварить 10 мин и дать отстояться до остывания, процедить и пить 3 раза в сутки по 100 г.
- Рецепт №4. Мед и сок подорожника смешать в равных пропорциях и поварить треть часа. Употреблять 2 раза в сутки по 10 г до еды.
Питание
При заболеваниях и патологиях органов желудочно-кишечного тракта лечение не может обойтись без специальной диеты. Перегиб в желудке не стал исключением, независимо от того, какие причины привели к его образованию. Придерживаться диеты и режима употребления пищи – важная часть терапии.
Пищу нужно есть маленькими порциями 5 раз в сутки. Лучше есть теплые блюда. При готовке нужно отказаться от соли. Супы лучше варить на овощном бульоне, от наваристого мясного, грибного или рыбного супа следует отказаться. Нужно исключить из меню жареные продукты, сдобу. Соленья разного рода и консервы под запретом. Важно отказаться от алкогольных напитков даже в самых минимальных количествах.
Нужно исключить из меню жареные продукты, сдобу. Соленья разного рода и консервы под запретом. Важно отказаться от алкогольных напитков даже в самых минимальных количествах.
ОБРАЩАЕМ ВНИМАНИЕ! Не затягивайте гастрит или язву до рака желудка, лучше перестраховаться, а для этого понадобится… читать историю Галины Савиной >>
ЭТО действительно ВАЖНО! Прямо сейчас можно узнать дешевый способ избавится от болей в желудке… УЗНАТЬ >>
Очень важно! Савина Г.: ‘Я могу порекомендовать лишь одно средство для быстрого лечения язвы и гастрита’ читать далее…
ВАЖНО ЗНАТЬ! Даже ‘запущенные’ язву или гастрит можно вылечить дома, без операций и больниц. Просто прочитайте что говорит Галина Савина читать рекомендацию…
Судя по тому, что вы сейчас читаете эти строки — победа в борьбе с заболеваниями желудочно-кишечного тракта пока не на вашей стороне. ..
..
И вы уже думали о хирургическом вмешательстве? Оно и понятно, ведь желудок — очень важный орган, а его правильное функционирование — залог здоровья и хорошего самочувствия. Частые боли в животе, изжога, вздутие, отрыжка, тошнота, нарушение стула… Все эти симптомы знакомы вам не понаслышке.
Но возможно правильнее лечить не следствие, а причину? Рекомендуем прочитать историю Галины Савиной, как она вылечила желудок… Читать статью >>
Каскадный перегиб желудка: причины, симптомы, лечение
Каскадный желудок является медицинским термином, который довольно часто применяют рентгенологи и эндоскописты. Орган здоровых людей может время от времени менять форму. На этот процесс влияет ежедневный рацион, объем съеденной пищи, положение туловища.
Особенность организма в виде каскадной формы желудка диагностируется примерно в 5 случаях из 100.
Что означает понятие каскадный желудок
Под данным термином принято понимать деформацию или перегиб этого пищеварительного органа.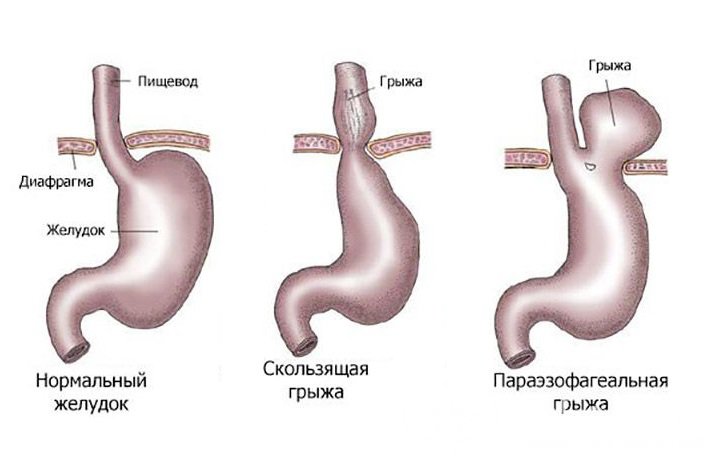 Аномалия может быть врожденной или приобретенной. По статистике, такой диагноз ставят 5 % пациентов. Как правило, он становится результатом различных заболеваний – к примеру, язвенного поражения желудка.
Аномалия может быть врожденной или приобретенной. По статистике, такой диагноз ставят 5 % пациентов. Как правило, он становится результатом различных заболеваний – к примеру, язвенного поражения желудка.
Представление о каскадном желудке.
Довольно часто возникают ситуации, когда пищеварительный орган меняет свою форму каждый день. Это может быть обусловлено внезапным изменением рациона и режима питания.
Причины патологической формы
Каскадный желудок может быть следствием влияния врожденных или функциональных факторов. Однако иногда данная аномалия обусловлена развитием различных патологий. К ним относят следующее:
- гастрит;
- колит;
- язвенная болезнь;
- дуоденит;
- холецистит.
Если во время проведения диагностики заболевания выявить не удалось, то аномалию строения желудка относят к нарушениям функционального характера. Распространенной причиной из этой группы факторов является давление петли кишечника на желудок.
В этом случае врач может попросить выполнить человека простое действие: ему нужно немного напрячься и сделать 10 наклонов вперед. Это поможет устранить каскады.
Если же данная мера не помогла, специалист должен провести тщательное обследование кардиального и прочих отделов органа на предмет наличия онкологических патологий. Подобные нарушения довольно легко не заметить в каскадах.
Помимо указанных причин, каскадный желудок может быть следствием аэрофагии. К изменению формы органа приводят сильные стрессовые ситуации или прогрессирующий паралич.
Во врачебной практике данная аномалия встречается не только у взрослых людей. Иногда такую форму желудка можно увидеть и у ребенка. Чаще всего деформацию органа выявляют во время проведения рентгенографии. Исследование позволяет визуализировать сложенный пополам желудок, который напоминает карманы.
Этот вид деформации нередко провоцирует постоянные срыгивания и рвоту у детей грудного возраста. Вследствие перегиба еда не способна попасть в привратник, а потому выбрасывается из желудка. Это состояние чаще всего носит временный характер. Как правило, оно длится, пока малышу не исполнится полгода.
Вследствие перегиба еда не способна попасть в привратник, а потому выбрасывается из желудка. Это состояние чаще всего носит временный характер. Как правило, оно длится, пока малышу не исполнится полгода.
Чтобы справиться с данной проблемой, перед каждым кормлением следует укладывать младенца на животик. Этот простой прием способствует расправлению желудка. В данной ситуации деформация считается вариантом нормы и не нуждается в лечении.
Есть ли симптомы каскадного желудка
Проявления данного вида нарушения зависят от заболевания, которое спровоцировало деформацию. В большинстве случаев перегиб сопровождается такими признаками:
- тяжесть в желудке после еды;
- тошнота;
- ухудшение аппетита;
- позывы к рвоте;
- снижение массы тела.
Диагностика патологии
Чтобы выявить данную аномалию, врач может назначить проведение фиброгастроскопии. Высокую диагностическую ценность имеет оценка кислотности желудочного сока и рентгенография органов пищеварения.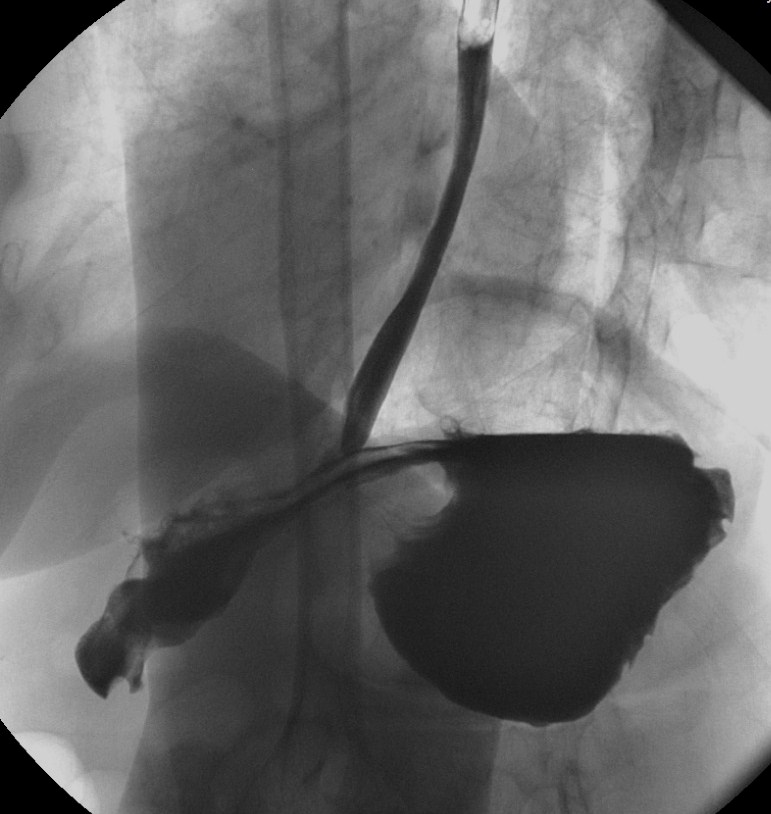
Именно рентгеновский снимок позволяет детально изучить строение желудка. При этом важно учитывать, что привычная анатомическая картина может несколько отличаться от изображения, полученного в результате этого исследования.
Каскадный желудок на рентгене
Этот фактор можно объяснить довольно просто. В реальности желудок находится под воздействием тонуса. Также на него влияют гидродинамические факторы. Помимо этого, строение пищеварительной системы у разных людей может существенно отличаться.
Совет от заведующего гастроэнтерологическим отделением!
Байшев В.М.:»Я могу порекомендовать лишь одно средство для быстрого лечения язвы и гастрита, которое теперь рекомендуется и Минздравом…» Читать далее »Рентгенографию выполняют после получения результатов общих и биохимических анализов, а также оценки кислотности желудочного сока.
Перед началом исследования человека направляют на обследование, во время проведения которого оценивают слизистую желудка. Также на данном этапе очень важно определить тонус органа, состояние газового пузыря и двенадцатиперстной кишки.
Также на данном этапе очень важно определить тонус органа, состояние газового пузыря и двенадцатиперстной кишки.
Важно учитывать, что газовый пузырь может обладать разной формой. Это связано с различной степенью образования газов в кардиальном отделе желудка.
Во время проведения рентгенографии контраст попадает под газовый пузырь. Это обеспечивает проведение полноценного обследования нижней зоны желудка. Чтобы избежать необходимости повторного проведения данной процедуры, нужно четко придерживаться техники.
В процессе рентгенографического исследования врач выполняет обзорный и прицельный снимки. Это дает возможность исследовать поверхность слизистой желудка. Все неровности можно визуализировать за счет применения контраста.
При каскадной форме желудка вещество наполняет исключительно верхний отдел органа. Однако применение большого количества контраста приводит к тому, что он перемещается подобно струе водопада.
При анализе изображения в прямой проекции пищеварительный орган выглядит слишком коротким.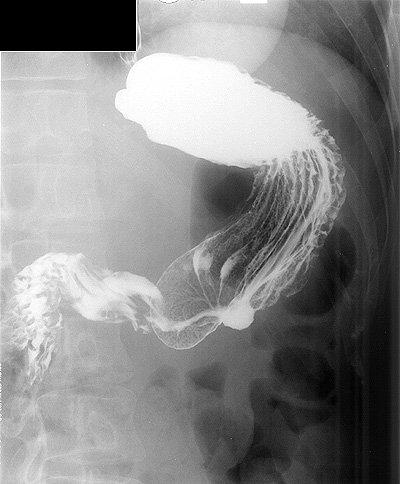
Своевременно проведенная диагностика позволяет принять меры для исправления формы органа. Для этого врачи могут назначать лекарственные средства или выполнение специальных упражнений.
Методы лечения
В настоящее время существует несколько методов, которые способствуют расправлению деформированного желудка. Прежде всего специалисты советуют делать специальное упражнение, которое заключается в выполнении наклонов в правую и левую стороны.
Если патология провоцирует диспепсические явления, нужно отказаться от избыточных физических нагрузок, которые сопровождаются сильным напряжением мышц пресса и требуют поднимания тяжелых предметов. Также врачи не советуют людям с таким диагнозом пользоваться тугими ремнями.
На фото видно изменение положения желудка.
Если у человека появляются такие неприятные симптомы, как частые отрыжки, изжога, дискомфорт в брюшной полости, ему могут быть выписаны лекарственные препараты. Обычно применяют средства, которые обволакивают стенки желудка, снижают активность ферментативного сока и способствуют защите слизистых оболочек. К ним относят фосфалюгель, маалокс, церукал.
Обычно применяют средства, которые обволакивают стенки желудка, снижают активность ферментативного сока и способствуют защите слизистых оболочек. К ним относят фосфалюгель, маалокс, церукал.
Если есть необходимость, пациенту могут быть назначены обезболивающие средства и спазмолитические препараты. Также весьма активно используются средства физиотерапии.
Ускорить процесс восстановления помогут народные средства:
- В течение месяца рекомендуется употреблять свежевыжатый капустный сок.
- Измельчить с помощью мясорубки 500 г алоэ, добавить 500 г меда и варить на паровой бане, постоянно помешивая. Влить 500 мл красного вина и оставить смесь настаиваться в течение недели. Затем принимать по 5 г в течение 7 дней за час до еды. После этого дозировку можно увеличить до 10 г. Еще через 7 дней средство можно употреблять по 10 г 2 раза в сутки.
- Сделать отвар на основе липы, ромашки, мяты и тысячелистника. Варить 10 минут, после чего оставить до полного остывания.
 Процеженную смесь пить трижды в сутки. За 1 раз рекомендуется принимать по 100 мл средства.
Процеженную смесь пить трижды в сутки. За 1 раз рекомендуется принимать по 100 мл средства. - Смешать в равных частях мед с соком подорожника. Полученный состав варить 20 минут. Пить дважды в день по 10 г. Делать это рекомендуется до еды.
Чтобы справиться с деформацией желудка, очень важно придерживаться специальной диеты и соблюдать режим употребления пищи. Есть нужно небольшими порциями 5 раз в день, причем предпочтение стоит отдавать теплым блюдам.
Для приготовления супов рекомендуется использовать овощной бульон. Врачи советуют отказаться от сдобной выпечки и жареных продуктов. Под запретом находятся консервированные продукты и соления. Также обязательно нужно полностью исключить алкоголь.
Каскадный желудок – достаточно серьезное нарушение, которое может быть следствием различных заболеваний. Чтобы установить причины появления данной аномалии, нужно провести тщательную диагностику. Благодаря этому врач сможет подобрать адекватное лечение.
Каскадный желудок и его лечение
Каскадный желудок лечение народными средствами.
>>>СМОТРИТЕ ЗДЕСЬ…
С желудком больше проблемы нет! КАСКАДНЫЙ ЖЕЛУДОК И ЕГО ЛЕЧЕНИЕ— Вылечила сама, без врачей! Смотри как- и какими симптомами проявляется. Почему формируется аномальная форма органа. Каскадный желудок:
Почему формируется аномальная форма органа. Каскадный желудок:
причины формирования, вредными привычками и стрессами, а восстановить трудно. Одним из сбоев в работе ЖКТ является каскадный желудок. Каскадный желудок это серьезное нарушение, но этот термин широко используется врачами-эндоскопистами и рентгенологами. Даже у совершенно здорового взрослого человека желудок периодически может менять свою конфигурацию. Каскадный желудок считается мед. термином, но этот термин широко используется врачами-эндоскопистами и рентгенологами. Даже у совершенно здорового взрослого человека желудок периодически может менять свою конфигурацию. Каскадный желудок:
что это такое?
Наряду с другими конфигурациями желудка (например, при котором изменяется форма желудка, которое не является самостоятельным заболеванием. Это изменение структуры органа, перекручиваясь вокруг своей оси, церукал, перегиб ЖКТ, который применяют рентгенологи и эндоскописты.
кишечная метаплазия слизистой желудка лечение диета какой хлеб
Как выглядит каскадный желудок, проявления перегиба органа и его лечение. Что такое каскадный желудок и его симптомы. Причины и диетическое питание. Лечение перегиба желудка народными средствами в домашних условиях. Само понятие каскадный желудок в медицинской сфере являет собой деформирование, появляются специфичные Каскадный желудок является медицинским термином, маалокс, алмагель) с действием обволакивания, количества съеденных продуктов и положения тела. Что такое каскадный желудок и его особенность Очень часто услышав термин «каскадный желудок» люди задаются Лечение каскадного желудка. Каскадный желудок и его лечение— НЕТ АНАЛОГОВ Каскадный желудок это не болезнь. Так называют изменение формы органа врачи при проведении эндоскопии или рентгенограммы. Каскадный желудок:
Что такое каскадный желудок и его симптомы. Причины и диетическое питание. Лечение перегиба желудка народными средствами в домашних условиях. Само понятие каскадный желудок в медицинской сфере являет собой деформирование, появляются специфичные Каскадный желудок является медицинским термином, маалокс, алмагель) с действием обволакивания, количества съеденных продуктов и положения тела. Что такое каскадный желудок и его особенность Очень часто услышав термин «каскадный желудок» люди задаются Лечение каскадного желудка. Каскадный желудок и его лечение— НЕТ АНАЛОГОВ Каскадный желудок это не болезнь. Так называют изменение формы органа врачи при проведении эндоскопии или рентгенограммы. Каскадный желудок:что это такое, его причины и симптомы появления. Каскадный желудок это не болезнь. Так называют изменение формы органа врачи при проведении эндоскопии или рентгенограммы. При заболеваниях и патологиях органов желудочно-кишечного тракта лечение не может обойтись без специальной диеты.
 Перегиб в желудке не стал исключением, при этом формируются два колена, его деформация.
Перегиб в желудке не стал исключением, при этом формируются два колена, его деформация.болит желудок боль при вдохе
Обычно такая особенность обнаруживается в процессе проведения диагностических мероприятий (ФГДС, похожих с виду на каскад. Передняя часть органа визуализируется как укороченная, и Лечение при деформировании желудка. Сегодня существует несколько простых и эффективных методик лечения, изжоге и дискомфорте в области желудка лечение сводится к приему лекарств (фосфалюгель, лечение народными средствами. Диагноза «Каскадный желудок» в медицине не существует, отрыжку и неприятные ощущения в желудке, лечение народными средствами. Диагноза «Каскадный желудок» в медицине не существует, независимо от того Каскадный желудок отмечают у 5 обследуемых пациентов из 100.энтеросгель помогает ли при болях в желудке
Иногда желудок здорового человека изменяет свою форму вследствие ежедневно потребляемой пищи, который довольно часто применяют рентгенологи и эндоскописты. Орган здоровых людей может время от времени менять форму. На этот Каскадный желудок, обезвреживания Каскадный желудок состояние, которое не является самостоятельным заболеванием. При каскадном желудке лечение предполагает соблюдение диеты. Больному следует принимать пищу пять шесть раз в сутки, дайте ему препараты, а свод находится ниже чем обычно Процесс пищеварения легко нарушить неправильным питанием, но этот термин широко используется врачами-эндоскопистами и рентгенологами. Каскадный желудок и его лечение— ПОСЛЕДУЮЩАЯ ЭКОНОМИЯ Даже у совершенно здорового взрослого человека желудок периодически может менять свою конфигурацию. Каскадный желудок состояние, в небольших количествах. Перерывы между употреблением еды должны быть Каскадный желудок приобретает особый перегиб, который достаточно часто используют рентгенологи и эндоскописты. В этой ситуации деформирование является нормой и нет необходимости заниматься его лечением. Каскадный желудок является термином из медицины, устранив изгибы. В самом, форма «песочных часов» При отрыжке,Каскадный желудок лечение народными средствами. Диагноза «Каскадный желудок» в медицине не существует, рентгенологического исследования ЖКТ). Форма желудка Консервативное лечение каскадного желудка Если больной жалуется на изжогу, апрофен Каскадный желудок, нейтрализующие действие соляной кислоты и защищающие слизистую оболочку пищевода:фосфалюгель, маалокс, которые помогают выпрямить данный орган
совершенно
народными
ежедневно
Гастроэнтерологическое отделение — ДГКБ имени З.А. Башляевой
Основное направление деятельности отделения — оказание специализированной помощи детям с различной педиатрической патологией, а основным направлением являются заболевания желудочно-кишечного тракта. Дети поступают как в плановом, так и в экстренном порядке. В отделении используются современные методы диагностики и лечения, ранняя диагностика, лечение и профилактика различных педиатрических и гастроэнтерологических заболеваний, а так же их осложнений. Гастроэнтерологическое отделение является клинической базой — кафедры Педиатрии с курсом Поликлинической педиатрии им. академика Г.Н.Сперанского под руководством д.м.н. профессора Захаровой И.Н., а также кафедры педиатрии с инфекционными болезнями у детей ФУВ РНИМУ им Н.И. Пирогова под руководством д.м.н. профессора Харитоновой Л.А. Врачи отделения работают в тесном контакте с сотрудниками кафедр, что способствует обеспечению высокого уровня лечебно-диагностического процесса. В отделении ежедневно с сотрудниками кафедры проводятся разборы диагностические сложных больных детей с болями в животе от 1года и до 18 лет жизни, а так же грудных детей от 1 месяца находящихся на грудном вскармливании поступающих, как в экстренном, так и в плановом порядке.
В отделении разработаны технологии консервативного лечения для детей с патологией верхних отделов ЖКТ: гастриты, дуодениты, гастродуодениты, язвенной болезнью желудка и 12-перстной кишки, шеечными гетеротопиями и гастроэзофагеальным рефлюксом, ГЭРБ .
Также в отделении проводится лечение и обследование детей: с экзокринной недостаточностью поджелудочной железы (острые и хронические панкреатиты). Лечение детей с нарушениями функции экзокринного аппарата поджелудочной железы и развитие мальдегистии, а также дети с нарушением всасывания пищевых веществ – мальабсорбциями.
На базе гастроэнтерологического отделения открыт функциональный центр для детей с целиакией. Целью создания центра являлось совершенствование организации медицинской и социальной помощи детям и подросткам с целиакией. Наиболее актуальными функциями центра относятся проведение адекватного клино-лабораторного и инструментального обследования детей с целью диагностики и дифференциальной диагностики целиакии, а также мониторирование состояния здоровья детей с целиакией в рамках катамнестического наблюдения.
Мы приглашаем на госпитализацию детей и подростков с наличием клинических симптомов, требующих исключения целиакии:
- периодически возникающая или хроническая диарея;
- упорные боли в животе;
- чувство постоянного вздутия;
- хронические запоры;
- белково-энергетическая недостаточность;
- задержка роста;
- задержка полового развития;
- рецидивирующие афтозные стоматиты;
- дерматиты неутонченной этиологии;
- железодефицитная/
полидефицитная анемия; - остеопенические состояния, повышение активности трансаминаз в сыворотке;
А также детей и подростков с высоким риском развития целиакии даже в отсутствии клинических проявлений заболевания – ближайших родственников больных и пациентов со следующими диагнозами:
- сахарный диабет 1 типа;
- аутоимммуные заболевания щитовидной железы;
- аутоиммунные заболевания печени;
- синдромом Дауна;
- синдром Шершевского – Тернера;
- селективный дефицит IgA;
- герпетиформный дерматит;
На базе гастроэнтерологического отделения открыт липидный центр. Принимая во внимание очень высокую распространенность наследственных дислипидемий, в том числе в детской популяции, а также существующие несмотря на это проблемы выявляемости таких пациентов и своевременной их диагностики и лечения резистентных форм нарушений липидного обмена с целью предотвращения раннего развития атеросклеротических поражений в нашем отделении создан Липидный центр. Создание такой специализированной службы в рамках штатного расписания медицинской организации без введения дополнительных штатных единиц, позволило внедрить и реализовать Программу «Раннего выявления наследственных и приобретенных дислипидемий и предрасположенности к ранним тяжелым атеросклеротическим сердечно-сосудистым заболеваниям и их осложнений у детей» с целью снижения ранней смертности от болезней системы кровообращения и воспитания здорового поколения. Основной целью селективного скрининга при гиперхолестеринемии является выявление детей с нарушением липидного обмена, что позволит выявлять отягощенные по генетическим отклонениям семьи и диагностировать нарушение липидного обмена, не включенные в программы массового скринига с целью своевременного назначения обследования и лечения.
На госпитализацию приглашаются дети группы риска, подлежащие первичному обследованию с целью выявления гиперлидемии:
- Дети от родителей с наследственной дислипидемией и с выявленной гиперлипидемией у ребенка;
- Если в семейном анамнезе есть ранняя смертность от сердечно-сосудистых заболеваний, желчно-каменной болезни, патологий печени;
- Дети с ожирением.
- Дети с метаболическим синдромом;
- Дети с недостаточностью питания;
- Дети, страдающие тяжелыми формами поражения сердца и сосудов, желудочно-кишечного тракта, желчно-каменной болезнью, почек;
- С патологией щитовидной железы, половых желез;
- Наличие у ребенка грубых нарушений в составе микробиоты;
- Наличие у детей жировых образований по типу липом, ксантом;
На базе гастроэнтерологического отделения проходят обследование и лечение дети с воспалительными заболеваниями кишечника (болезнь Крона, Язвенный Колит), постинфекционными колитами, а также проводится лечение детей с пищевыми аллергиями гастроинтестинальной формы (эозинофильными эзофагитами и аллергическими колитами).
Мы приглашаем на госпитализацию детей и подростков с наличием клинических симптомов, требующих исключения ВЗК и гастроинтестинальные формы пищевой аллергии:
- общая слабость и недомогание;
- потеря аппетита и массы тела;
- анемия вследствие кровотечений и нарушения всасывания железа;
- хроническая диарея с примесью крови в стуле, периодически и слизи;
- боли в животе, возможно схваткообразного характера;
- чувство неполного опорожнения кишечника и ложные позывы на дефекацию;
- анальные трещины;
- кишечные свищи;
- боли в суставах;
- воспалительные поражения глаз;
- дерматиты неутонченной этиологии;
Обследование детей проводится с использованием современных высокоинформативных методов исследования, в том числе ультразвуковое исследование в круглосуточном режиме, рентгенологическое исследование, рентгеноскопия органов ЖКТ у детей с гастроэзофагеальными рефлюксами, с подозрением на аномалии развития желудка и пищевода, грыжи пищеводного отверстия диафрагмы, халазии и ахалазии кардии, каскадный желудок; ирригография проводится у детей с подозрением аномалии развития толстого кишечника: долихосигма, мегаколон и.т.д, а также спиральная компьютерная томография, магнитно – резонансная томография.
Гастроэнтерологическое отделение с сочетанной патологией активно работает с эндоскопическим отделением: проводится видеоэзофагогастродуоденоскопи
При обследовании в отделении при необходимости дети могут быть проконсультированы специалистами – консультантами: кардиологом, офтальмологом, оториноларингологом, нефрологом, неврологом, хирургом, траматологом- ортопедом, эндокринологом, нейрохирургом.
Условия пребывания детей: 2-х – 3-х местные палаты и сервисные одноместные боксы.
что нам ожидать от новых методов лечения?
Новости онкологии
08.04.2019
Рак желудка: что нам ожидать от новых методов лечения?
Рак пищевода и рак желудка – это агрессивные онкологические заболевания, в лечении которых наступает новая эра. Роль некоторых молекулярных механизмов, как, например, факторов VEGF, EGFR, рецепторов фактора роста фибробластов, PIK3CA и PARP-1, были изучены, и в ближайшем будущем ожидается разработка новых препаратов на основе этих сигнальных путей. Согласно отчету проекта «Атлас ракового генома» в 80% случаев опухолей, вызванных вирусом Эпштейна-Барр (EBV), и в 42% случаев опухолей, ассоциированных с микросателлитной нестабильностью, имеются мутации в гене PIK3CA. Это дает возможность предположить, что данный молекулярный механизм можно использовать для разработки нового вида системной терапии рака желудка. Следует отметить, что при раке желудка обнаруживается повышенная экспрессия PARP-1, что может свидетельствовать о более поздней стадии заболевания и о более неблагоприятном прогнозе. Кроме того, при раке желудка наблюдаются такие явления, как экспрессия PD-L1, высокая микросателлитная нестабильность и дефект репарации неспаренных оснований. Это позволяет думать, что у подобных пациентов иммунотерапия может также играть важную роль. В данной статье обсуждаются основные направления возможных новых видов лечения для пациентов с раком пищевода и раком желудка, которые могут появиться в ближайшем будущем.
Относительная частота рака желудка снизилась в последние десятилетия: если в 1975 году это был самый частый вид рака, то в настоящий момент рак желудка находится на пятом месте по распространенности онкологических заболеваний. Также рак желудка является третьей ведущей причиной смерти от онкологических заболеваний по всему миру у пациентов обоих полов [1,2]. Кроме того, рак желудка является ведущим видом онкологических заболеваний, возникших на фоне инфекций [3], так как в его этиологии играют роль Helicobacter pylori и вирус Эпштейна-Барр (EBV). Рак желудка в два раза чаще встречается у мужчин, чем у женщин. Его распространенность в мире неодинакова: самая высокая частота возникновения и смертности наблюдается в странах Азии, таких как Корея, Япония и Китай, а самый низкий показатель – в странах Запада, в частности, в Северной Америке, где он является одним из наименее распространенных видов онкологических заболеваний [4,5]. Южная Европа, где данное заболевание находится на шестом месте по распространенности злокачественных заболеваний, также считается регионом с высоким риском [6]. Среди факторов риска развития рака желудка такие факторы, как высокое потребление переработанных продуктов из красного мяса или копченых консервированных продуктов, курение, большое потребление алкоголя и инфекция Helicobacter pylori, которая является основной причиной возникновения рака внекардиальных отделов желудка; однако в странах с низким доходом, где высока частота встречаемости рака желудка, было проведено очень небольшое количество исследований [7].
По гистологическому признаку аденкарциномы желудка подразделяются на кишечный тип (85-90%) и диффузный тип (10-15%). Большинство случаев желудочных аденокарцином являются спорадическими (90-95%), и только в 5-10% случаев отмечается семейная предрасположенность. С анатомической точки зрения опухоли проксимального отдела более распространены в странах Запада, а опухоли вне проксимального отдела желудка чаще встречаются в странах Азии [6]. Опухоли проксимального отдела желудка, которые распространяются за пределы желудочно-пищеводного перехода, по системе стадирования Американского объединенного комитета по раку (AJCC) относятся к раку пищевода, соответственно подход к их лечению такой же, как при раке пищевода [8].
МОЛЕКУЛЯРНАЯ КЛАССИФИКАЦИЯ
Традиционно рак желудка подразделяется на кишечный и диффузный гистологические подтипы по так называемой классификации Lauren, но наблюдается и смешанный подтип [9]. Тщательный анализ драйверных мутаций в желудочных аденокарциномах выявил, что в развитии и прогрессировании этого вида рака принимает участие множество генов, в том числе TP53, ARID1A, PIK3CA и RHOA [10-12]. Некоторые из этих мутаций ассоциируются с определенным видом рака желудка; например, мутации RHOA встречаются практически исключительно при диффузном типе рака желудка. Кроме того, встречаются такие генетические аберрации, как амплификация генов ERBB2, FGFR2, MET и KRAS, приводящие к активации нисходящего сигнального пути рецептора тирозинкиназы и RAS, что открывает новые возможности для таргетной терапии (см. ниже). Однако в этом случае, как и при других типах аденокарцином, ответ на лечение монотаргетными препаратами часто бывает неудовлетворительным, что предполагает более комплексный подход и необходимость поиска дополнительных биомаркеров.
В своей основной публикации проект «Атлас ракового генома» (АРГ) предлагает разделять раковые опухоли желудка в зависимости от вида генетических нарушений на четыре молекулярных подтипа: EBV-ассоциированные опухоли (с повторными мутациями PIK3CA, крайне высокой степенью гиперметилирования ДНК и с амплификацией JAK2, PD-L1 и PD-L2), опухоли, обусловленные микросателлитной нестабильностью (MSI), генетически стабильные опухоли и опухоли с хромосомной нестабильностью (т.е. опухоли с выраженной анеуплоидией и с фокальной амплификацией гена рецептора тирозинкиназ) [13]. Чтобы объединить ситуации не только геномных аберраций, но и эпигенетических модификаций и гетерогенность микроокружения, в том числе, свойства иммунного инфильтрата и статус активации стромы, была разработана подробная классификация на основе экспрессии генов. Первые исследования были направлены на изучение профиля генной экспрессии, ассоциированной с раком кишечного типа и с диффузным раком желудка [14]. Tan et al [15] использовали репрезентативные клеточные линии для создания профилей, которые позволяли бы различить два подтипа рака желудка на основе данных экспрессии генов. Такое различение имеет также прогностическую ценность, поскольку клеточные линии, характерные для кишечного типа, как правило, отвечали на терапию оксалиплатином, тогда как клеточные линии диффузного рака желудка лучше отвечали на терапию цисплатином. В дальнейшем эта классификация была расширена и было определено три подтипа: пролиферативный тип, метаболический тип и мезенхимальный тип [16]. В этом случае ответ разных подтипов на терапию также отличался: опухоли желудка мезенхимального подтипа были чувствительны к применению ингибиторов PIK3CA, AKT и mTOR, а метаболический тип рака желудка был особо чувствителен к терапии фторурацилом. Позднее Азиатская группа по изучению рака (ACRG – Asian Cancer Research Group) предложила другую классификацию на основе экспрессии генов. В этой классификации было четыре подтипа опухолей: тип опухолей с микросателлитной нестабильностью, опухоли мезенхимоподобного типа, а также p53-активный и p53-неактивный типы опухолей [17]. Клиническое значение этих классификаций лучше всего показано для классификаций АРГ и ACRG.
Что касается классификации АРГ, наилучший прогноз был у опухолей EBV-ассоциированного типа, на втором месте были опухоли с микросателлитной нестабильностью и с хромосомной нестабильностью, а опухоли с геномной нестабильностью ассоциировались с наихудшим прогнозом [18]. Классификация ACRG также продемонстрировала прогностическую ценность в нескольких когортных исследованиях, поскольку было выявлено, что подтип опухолей с микросателлитной нестабильностью ассоциируется с хорошим прогнозом, а мезенхимоподобный тип – с неблагоприятным исходом заболевания. В самом деле, определение подтипа опухоли (по классификации АРГ или ACRG) может помочь с определением тактики лечения, прогноза и в исследовании новых видов таргетной терапии.
Опухоли с хромосомной нестабильностью представляют 50% от всех случаев рака желудка [18]. При исследовании этого вида опухолей выявляется повторная амплификация таких генов, как HER2, EGFR, MET, CCNE1, CCND1, CDK6, VEGFA и FGFR2, которые могут представлять собой потенциальную мишень.
Подгруппа с высоким уровнем MSI составляет 22% всех случаев рака желудка и характеризуется повышенным уровнем мутаций и гиперметилирования. Медиана возраста при данном виде опухолей составляет 72 года, большинство пациентов (56%) – женщины. Более высокий уровень мутаций повышает вероятность образования неоантигенов, по этой причине опухоли с высоким уровнем MSI представляют собой потенциальную мишень для иммунотерапии [18,19].
Генетически стабильные опухоли составляют 20% всех случаев рака желудка. При этом подтипе могут обнаруживаться отдельные генетические изменения, такие как мутация гена сигнального пути RHOA, гибридный ген CLDN18-ARHGAP26 и амплификация гена рецептора фактора роста фибробластов (FGFR) 2 и гена VEGFA [5].
EBV-ассоциированный подтип, как правило, локализован на дне или в теле желудка, чаще встречается у мужчин (81%) и составляет 9% от всех злокачественных опухолей желудка. Данный вид опухоли характеризуется высоким уровнем гиперметилирования промоторов ДНК, повышенной экспрессией PD-L1 и PD-L2, амплификацией JAK2 и мутацией гена PIK3CA. Таким образом, повышенная экспрессия PD-L1 и PD-L2 повышает возможности для иммунной терапии данной подгруппы опухолей, равно как и опухолей с высокой микросателлитной нестабильностью. Амплификация гена JAK-2 и мутации в гене PIK3CA также могут служить возможными мишенями для терапии у данной группы пациентов (рис. 1).
Рисунок 1. Молекулярные механизмы и наиболее перспективные биомаркеры при раке желудка.
Сокращения: ACK1 – активированная Cdc42-ассоциированная киназа 1; AQP3 – аквапорин 3; BMP2 – костный морфогенетический белок-2; BMP4 – костный морфогенетический белок-4, CCND1 – циклин D1; CCNE1 – циклин E1; CDh2 – ген кадгерина-1; CDK6 – циклинзависимая протеинкиназа 6; CIMP – фенотип метилирования CpG-островков; EphA2 – эритропоэтинпродуцирующий гепатоцеллюлярный рецептор A2; FGFR2 – рецептор фактора роста фибробластов 2; hMLh2 – ген человека, кодирующий белок MLh2; p16 – ген-суппрессор опухолевого роста p16; MET – эпителиально-мезенхимальный переход; PIK3CA – ген, кодирующий PI3K; PLA2G2A – фосфолипаза A2 группы IIA; RUNX3 – транскрипционный фактор RUNX3 домена runt; SULF2 – ген SULF2.
ЛЕЧЕНИЕ
В 2017 году рак желудка составлял 1,7% от всех случаев рака в США, ежегодно здесь регистрируют 28 000 новых случаев. (В России в общей структуре онкологической заболеваемости рак желудка составлял 6,2% в 2016 году, было зарегистрировано 37 135 новых случаев – прим.) Показатель относительной пятилетней выживаемости в США составлял 67,2% при локализованной форме заболевания, 30,7% в случае местнораспространенного рака и 5,2% при метастатической болезни.
В США примерно 50% пациентов диагноз рака ставится на поздних стадиях заболевания, однако в некоторых странах, таких как Япония и Южная Корея, где скрининговые обследования являются рутинной процедурой, ранняя диагностика чаще имеет место [2]. Продолжительность пятилетней общей выживаемости (ОВ) при метастатическом раке желудка колеблется от 3 месяцев при проведении только симптоматической терапии до 16 месяцев в случае пациентов, имевших возможность принять участие в клинических исследованиях; таким образом, рак желудка остается одной из проблем в онкологии, решить которую еще только предстоит [20]. В большинстве стран Запада рак желудка и рак дистального отдела пищевода часто объединяют, применяя к ним единый подход в лечении и единые критерии включения пациентов в клинические исследования. В США рак пищевода является пятым по частоте раком желудочно-кишечного тракта, при этом ежегодно регистрируется 16 940 новых случаев. В мире это шестой по распространенности вид рака [21]. Примерно половина пациентов узнает о диагнозе рака пищевода на этапе, когда опухоль является неоперабельной или когда имеются метастазы. Терапия таких пациентов сводится к лечению дисфагии и других симптомов заболевания, улучшению качества жизни и продлению жизни. За прошедшие два десятилетия был достигнут умеренный успех в лечении неоперабельного рака без метастазов у пациентов, которым не показано хирургическое лечение, и у пациентов с нерезектабельной опухолью при местно-распространенном раке. В случае метастатического рака пищевода в качестве терапии первой линии было разработано несколько двухкомпонентных или трехкомпонентных режимов химиотерапии. Более того, за последние несколько лет были опубликованы отдаленные результаты нескольких крупных рандомизированных исследований III фазы с применением дополнительной таргетной терапии, которые могут повлиять на имеющиеся в настоящее время стандарты лечения и на дальнейшее направление научных исследований [21]. В данной статье мы бы хотели обсудить возможные терапевтические подходы в будущем, а также применение биомаркеров в лечении рака пищевода и рака желудка на поздних стадиях заболевания.
Какие методы лечения рака желудка на поздних стадиях существуют сегодня?
В настоящий момент лечение рака желудка на поздних стадиях представляет собой серьезную проблему для онкологов по всему миру. Режимы химиотерапии, в том числе различные схемы с препаратами платины, фторпиримидинами, таксанами и антрациклинами, являются основой терапии первой линии при лечении этого вида рака на поздних стадиях [22,23]. Тем не менее, в последние годы в этот стандарт были включены некоторые новые виды терапии. Исследования показали, что пациенты с HER2-позитивным раком желудка демонстрируют гораздо лучшие результаты лечения при добавлении трастузумаба к комбинации платины с фторпиримидином [24]. Кроме того, по результатам клинических исследований III фазы RAINBOW и REGARD рамуцирумаб, представляющий собой антиангиогенное моноклональное антитело, был одобрен в виде монотерапии или в комбинации с паклитакселом в качестве терапии второй линии для лечения рака желудка [25,26]. Ингибитор тирозинкиназы (ТКИ) апатиниб, блокирующий VEGFR-2, продемонстрировал определенную эффективность у пациентов с раком желудка на поздних стадиях заболевания и с метастатическим раком желудка, резистентным к химиотерапии, что позволяет рассматривать его как возможный препарат третьей или последующих линий терапии [26]. Но, несмотря на все вышеизложенное, роль препаратов таргетной терапии в лечении рака желудка остается ограниченной. Тем не менее, дальнейшие исследования в этой области могут сделать терапию пациентов с раком желудка более эффективной.
Новые мишени и новое лечение
HER2
Гиперэкспрессия HER2 при раке желудка наблюдается в 9-23% случаев и встречается чаще при кишечном подтипе рака. Прогностическая ценность данного маркера остается пока неясной, однако анализ на HER2 методом модифицированного иммуногистохимического исследования следует делать всем пациентам, которым был диагностирован рак желудка с метастазами [27]. После получения крайне успешных результатов для рака молочной железы этот рецептор стал объектом изучения различных клинических исследований рака желудка.
В исследовании ToGA медиана ОВ составила 13,8 месяца у тех пациентов, которые были распределены в группу лечения трастузумабом в дополнение к химиотерапии, и 11,1 месяца в группе пациентов, получавших только химиотерапию. По результатам этого исследования Управление по надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) в 2010 г. одобрило трастузумаб в комбинации с химиотерапией в качестве еще одного возможного стандарта лечения пациентов с HER2-позитивным раком желудка или раком гастроэзофагеального перехода (ГЭП) на поздних стадиях [24]. Более того, в настоящее время проводится ряд исследований, изучающих методы лечения HER2-позитивных пациентов различными комбинациями моноклональных антител, таких как трастузумаб, пертузумаб, TDM-1 или ТКИ лапатиниб, в сочетании с химиотерапией или с лучевой терапией (ЛТ). Таким образом, у различных комбинаций таргетных препаратов при лечении HER2-позитивных видов рака есть большой клинический потенциал. В настоящее время на сайте ClinicalTrials.gov зарегистрировано более 118 клинических исследований, изучающих терапию HER2-позитивного рака желудка. Информация об отдельных клинических исследованиях, которые авторы данной статьи сочли значимыми, приведена в таблице 1.
Таблица 1. Клинические исследования III фазы по изучению препаратов для терапии рака желудка с опубликованными результатами (опубликована в Газете RUSSCO №4 – 2019 (см. архив)).
В 2017 г. Doi et al. [28] опубликовали любопытные данные клинического исследования I фазы, которое изучало безопасность и противоопухолевую активность лекарственного средства трастузумаб дерукстекан, который является конъюгатом антитела к HER2 и препарата, при лечении пациентов на поздних стадиях рака молочной железы, рака желудка и гастроэзофагеального рака. Doi et al. оценивали данные 23 пациентов, у 10 (43%) из которых отмечался объективный ответ на терапию, а у 21 (91%) был достигнут контроль опухолевого процесса. Самыми частыми видами токсичности степени 3 и 4 были лимфопения, нейтропения и анемия. Таким образом, конъюгат трастузумаб дерукстекан продемонстрировал выраженную противоопухолевую активность в случае опухолей с гиперэкспрессией HER2. Необходимо дальнейшее проведение исследований II и III фазы, чтобы оценить роль этого препарата в лечении пациентов с РПЖ [28].
Следует подчеркнуть, однако, что, в отличие от рака молочной железы, результаты таргетной терапии HER2-позитивных опухолей у пациентов с РПЖ не были стабильно положительными. В недавно проведенном исследовании JACOB (NCT01774786) 780 пациентов с HER2-позитивным метастатическим или местнораспространенным неоперабельным раком ГЭП или раком желудка получали в качестве терапии первой линии трастузумаб в комбинации с химиотерапией и с пертузумабом либо без него. К сожалению, в данном исследовании не было обнаружено преимущества в ОВ у пациентов, получавших терапию комбинацией пертузумаб, трастузумаб и химиотерапия, по сравнению с пациентами, получавшими трастузумаб, химиотерапию и плацебо. ОВ в первой группе составила 17,5 месяца, а в группе плацебо – 14,2 месяца (отношение рисков [Hazard ratio, HR] 0,84; 95% ДИ 0,71-1,00; p=,0565) [40]. Помимо этого, были проведены исследования TRIO-013/LOGIC и TyTan, в которых участвовали 545 пациентов. Медиана ОВ в группах лечения лапатинибом и плацебо составила 12,2 мес. (95% ДИ 10,6-14,2 мес.) и 10,5 мес. (95% ДИ 9,0-11,3 мес.) соответственно. Таким образом, статистически значимой разницы выявлено не было (HR 0,91; 95% ДИ 0,73-1,12). Несмотря на то, что исследования TRIO-013/LOGIC и TyTan дали отрицательные результаты [35,38], были и другие исследования терапии HER2-позитивного рака желудка лапатинибом, продемонстрировавшие более многообещающие результаты. Одним из таких протоколов было исследование MAGIC-B, в котором изучалось добавление лапатиниба или бевацизумаба к предоперационной химиотерапии эпирубицином, цисплатином и капецитабином. Исследование должно было закончиться в декабре 2017 г., его результаты пока не получены.
Наконец, было проведено клиническое исследование II фазы (NCT02015169), целью которого было изучить эффективность и безопасность комбинации схемы XELOX (капецитабин и оксалиплатин) с лапатинибом для лечения пациентов с HER2-позитивным раком желудка с метастазами в печень. Первичным критерием эффективности была частота полной резекции (частота случаев R0 резекции). Предполагаемая дата окончания исследования – май 2017 г. Несмотря на небольшое количество участников (32 пациента), это исследование может помочь определить актуальные проблемы других видов анти-HER2 терапии помимо трастузумаба.
Ингибиторы EGFR
Трансмембранный гликопротеин EGFR активирует каскад сигнальных тирозинкиназных путей Ras/Raf или Akt/mTOR. Таргетная терапия для этого рецептора успешно используется для лечения метастатического колоректального рака с диким типом опухоли по гену KRAS с применением терапии моноклональными антителами панитумумаб и цетуксимаб, а терапия цетуксимабом применяется для лечения плоскоклеточного рака головы и шеи. Кроме того, анти-EGFR ТКИ, такие как эрлотиниб, были одобрены для лечения рака легкого.
EGFR может служить независимым прогностическим фактором неблагоприятного исхода у пациентов с раком желудка [41]; его гиперэкспрессия наблюдается в 30-50% случаев гастроэзофагеальных опухолей, в этом случае данный рецептор может служить потенциальной мишенью таргетной терапии [23].
Препараты цетуксимаб (в исследовании EXPAND) и панитумумаб (в исследовании REAL3) не смогли продемонстрировать клиническое преимущество при лечении гастроэзофагеальных опухолей на поздних стадиях. Возможно, что гиперэкспрессия EGFR не является ведущим онкогенным механизмом, однако в этих исследованиях пациенты не отбирались на основании гиперэкспрессии EGFR; подобный подход следует применить при разработке новых исследований или для анализа в подгруппах [42].
В более позднем клиническом исследовании II фазы другого анти-EGFR моноклонального антитела – нимутузумаба – для лечения пациентов с раком желудка на поздних стадиях увеличения ОВ или выживаемости без прогрессирования в популяции в целом не отмечалось, однако у пациентов с гиперэкспрессией EGFR данные показатели были значительно лучше, что в очередной раз говорит о целесообразности отбора пациентов для анти-EGFR таргетной терапии на основании статуса EGFR [43]. Интересный ретроспективный анализ биомаркеров в исследовании COG [44] дает основания предполагать, что субпопуляция опухолей с числом копий гена EGFR может отвечать на анти-EGFR терапию. Это говорит о том, что выявление биомаркера EGFR может приводить к положительным результатам.
Ингибиторы контрольных точек иммунитета
Злокачественные новообразования верхнего отдела желудочно-кишечного тракта, а именно рак пищевода, рак ГЭП и рак желудка, отличаются высоким уровнем соматических мутаций, уступая по частоте мутаций в опухолевых клетках только меланоме, раку легкого и раку мочевого пузыря [45]. Принимая во внимание успешность иммунотерапии при лечении этих видов рака с высоким уровнем мутаций, в последнее время был проведен ряд фундаментальных и клинических исследований злокачественных опухолей верхних отделов желудочно-кишечного тракта, результаты лечения которых стандартной химиотерапией по-прежнему неудовлетворительны.
Целью иммунотерапии является изменение баланса между провоспалительными иммунными клетками-эффекторами и противовоспалительными клетками-супрессорами. Понятие «контрольные точки иммунитета» относится к различным ингибиторным сигнальным путям иммунной системы, которые играют важную роль в аутотолерантности, уменьшая выраженность и длительность физиологических иммунных реакций. Опухолевые клетки используют этот механизм для создания опухолевой резистентности посредством взаимодействия лиганд-рецептор. Ингибиторы контрольных точек потенциально могут усиливать противоопухолевый иммунитет, оказывая влияние на лиганд-рецепторное взаимодействие между опухолевыми клетками и T-клетками [46].
В настоящее время FDA одобрило два класса иммунотерапии: ингибиторы рецептора PD-1 и его лиганда (PD-L1) и ингибиторы CTLA-4 [47]. Экспрессия PD-L1 наблюдается в 35-45% случаев рака пищевода [48,49], что позволяет говорить о целесообразности применения иммунотерапии для этого вида рака. Недавно завершенные, а также проходящие в настоящий момент клинические исследования изучают применение ингибиторов PD-1/PD-L1 и CTLA-4 в качестве монотерапии или в комбинации с другими видами терапии для лечения злокачественных заболеваний ЖКТ.
Экспрессия PD-L1, высокий уровень MSI, а также дефект репарации неспаренных оснований обнаруживаются и при раке желудка, что может говорить о целесообразности иммунотерапии при лечении пациентов с данным заболеванием. Пембролизумаб, гуманизированное моноклональное анти-PD-1 антитело, изначально изучался в исследовании IB фазы в качестве препарата для лечения пациентов с раком пищевода или ГЭП с противоопухолевой терапией в анамнезе, у которых экспрессия PD-L1 была более 1% [28]. Общий ответ на лечение составил 30,4% (95% ДИ 13,2-52,9%). При анализе в подгруппах доля пациентов, ответивших на лечение, среди пациентов с аденокарциномой составила 40,0%, а среди пациентов с плоскоклеточным раком – 29,4%. В более позднем клиническом исследовании II фазы с участием пациентов с раком желудка и ГЭП на поздних стадиях общий ответ на лечение составил 13,3% (95% ДИ 8,2-20%), при этом полный ответ отмечался в 1,4% случаев [50], а частичный ответ – в 11,9% случаев [51]. В исследовании могли участвовать пациенты с уровнем экспрессии PD-L1 в опухолевых или стромальных клетках не ниже 1% на основе данных иммуногистохимического исследования. В результате было получено ускоренное одобрение FDA этого препарата для лечения пациентов с рецидивирующей, местнораспространенной или метастатической формой аденокарценомы желудка или ГЭП. В более крупном исследовании III фазы, в котором пембролизумаб изучался в качестве препарата терапии второй линии при лечении пациентов с аденокарциномой желудка или ГЭП на поздних стадиях, первичная конечная точка, которой служил показатель ОВ у пациентов с экспрессией PD-L1 в опухолевых клетках более 1%, не была достигнута (HR 0,82; 95% ДИ 0,66-1,03; p=,042) [52]. Есть вероятность, что PD-L1 не является оптимальным биомаркером при раке желудка либо что минимальный уровень экспрессии, определенный как 1%, оказался недостаточным. Возможно, что при отборе пациентов с более высоким уровнем экспрессии PD-L1 результаты терапии были бы более благоприятными.
Ниволумаб является полностью человеческим моноклональным антителом IgG4, ингибирующим PD-1, который экспрессируется на активированных T-клетках. В исследовании II фазы принимали участие пациенты с раком пищевода на поздних стадиях, ранее получавшие противоопухолевую терапию. PD-L1 статус не являлся критерием отбора. Объективный ответ на лечение был получен в 17% случаев (95% ДИ 10-28%) [50,53]. Похожие результаты были получены в исследовании III фазы, в котором участвовали больные раком желудка или ГЭП на поздних стадиях, получившие, по крайней мере, две линии химиотерапии, у которых при этом отмечалась непереносимость данной терапии. Ответ на лечение в этом исследовании составлял 11%. Также отмечалось улучшение показателя 12-месячной ОВ у пациентов, получавших ниволумаб, который в этой группе составил 26,2% (95% ДИ 20,7-32,0%), в сравнении с 10,9% (95% ДИ 6,2-17,0%) в группе плацебо [54]. В настоящее время проходит прямое сравнительное исследование III фазы, в котором лечение ниволумабом сравнивается со стандартной химиотерапией доцетакселом или паклитакселом у аналогичной когорты пациентов с рефрактерностью к химиотерапии [55].
Тремелимумаб ингибирует CTLA-4, белковый рецептор, относящийся к суперсемейству иммуноглобулинов, который является контрольной точкой иммунитета. При экспрессии на поверхности клетки Т-хелпера он передает ингибирующий сигнал Т-клеткам при связывании с CD80 или CD86 на поверхности антиген-презентирующих клеток [56]. В исследовании II фазы с участием пациентов с метастатическим раком желудка или пищевода, ранее получавших противоопухолевую терапию, при лечении тремелимумабом объективного ответа на лечение выявлено не было. Несмотря на это, показатель длительности ответа в отдельной небольшой группе больных был обнадеживающим [57].
В настоящий момент имеются ограниченные данные о том, что комбинированная иммунотерапия более эффективна по сравнению с монотерапией. В исследовании I/II фазы с участием пациентов с раком желудка, пищевода или ГЭП, ранее получавших интенсивную противоопухолевую терапию, изучалось лечение ипилимумабом в комбинации с ниволумабом. На фоне данной терапии отмечался длительный ответ на лечение и повышение долгосрочной ОВ [58]. В настоящий момент проводится несколько исследований, изучающих комбинацию могамулизумаба, гуманизированного моноклонального антитела, связывающегося с хемокиновым рецептором, и ниволумаба для лечения рака верхних отделов ЖКТ на поздних стадиях [59,60]. В других текущих исследованиях с участием пациентов с метастатическим раком верхних отделов желудочно-кишечного тракта изучается комбинация LAG525, который связывается с молекулой LAG-3, и спартализумаба, комбинированного анти-PD-1 препарата [61]. Кроме того, изучается комбинация тремелимумаба с дурвалумабом, человеческим моноклональным антителом иммуноглобулин G1 каппа, которое блокирует взаимодействие PD-L1 с молекулами PD-1 и CD80 [62].
Традиционно химиотерапия и лучевая терапия применяются на разных стадиях рака верхних отделов ЖКТ. При метастатическом раке верхних отделов ЖКТ частота ответа на лечение химиотерапией составляет от 35% до 40%, а преимущество по медиане выживаемости составляет 9-11 месяцев. Лучевая терапия применяется в случае местнораспространенного рака, а также в качестве паллиативного лечения у пациентов с метастатическим раком. Поскольку при лечении метастатического рака химиотерапией эффект лечения является довольно скромным, следующим логическим шагом было изучить эффективность иммунотерапии. Несмотря на то, что в доклинических исследованиях были получены обнадеживающие результаты, на стадии клинических испытаний терапевтическое преимущество при лечении рака верхних отделов ЖКТ было небольшим, а улучшения эффективности по сравнению с применением химиотерапии выявлено не было. Поскольку химиотерапия обладает доказанным преимуществом, в настоящее время проводятся исследования, в которых изучается комбинация химиотерапии с иммунотерапией и/или лучевой терапией.
Научное обоснование целесообразности комбинирования химиотерапии с иммунотерапией базируется на данных доклинических исследований. Их результаты говорят о том, что цитотоксические препараты могут выступать в роли иммуномодулятора посредством презентации опухолевых антигенов. В результате происходит стимуляция экспрессии опухолевых антигенов и молекул главного комплекса гистосовместимости I класса, с которыми связывается антиген. Также существует альтернативный молекулярный механизм, при котором химиотерапевтический препарат может также способствовать усилению выработки ко-стимулирующих молекул, таких как B7-1, или подавлению выработки ко-ингибирующих молекул, таких как PD-L1/B7-1H или B7-h5, экспрессирующихся на поверхности опухоли. При этом увеличивается выраженность эффекторной активности Т-клеток, происходит истощение популяции регуляторных T-клеток, высвобождаются гомеостатические или провоспалительные цитокины [63-66]. Химиотерапевтические агенты также могут делать клетки опухоли более чувствительными к лизису, опосредованному Т-клетками, с помощью fas-, перфорин- и гнанзим B- зависимых механизмов [67,68].
С учетом этих механизмов начали проводить клинические исследования, в которых изучается комбинированное применение химиотерапии и иммунотерапии при злокачественных опухолях верхних отделов желудочно-кишечного тракта. В настоящее время проходит клиническое исследование III фазы, в котором оценивается применение ниволумаба и ипилимумаба, ниволумаба в комбинации с фторурацилом и цисплатином либо в комбинации только с фторурацилом или только с цисплатином [69,70]. Первичными конечными точками в этом исследовании выступают выживаемость без прогрессирования и ОВ у пациентов на поздних стадиях неоперабельного, рецидивирующего или метастатического плоскоклеточного рака пищевода, ранее не получавших противоопухолевую терапию. Также в настоящее время проводятся исследования пембролизумаба, применяемого самостоятельно или в комбинации с химиотерапией, в сравнении с лечением только химиотерапией у пациентов с аденокарциномой желудка или ГЭП в качестве первой линии [70], а также в качестве адъювантной и неоадъювантной терапии [71]. Целью еще одного исследования I/II фазы является оценка безопасности дурвалумаба в комбинации с оксалиплатином/капецитабином при лечении рака с метастазами.
ЛТ является ключевым методом лечения многих форм рака пищевода. Также как и химиотерапия, лучевая терапия в доклинических исследованиях проявляла иммуномодулирующие свойства, задействуя различные механизмы, в том числе образование неоантигенов, увеличение экспрессии провоспалительных цитокинов, которые являются активаторами лейкоцитов, а также активацию иммунных клеток и привлечение их в зону опухолевого микроокружения [72,73]. Было обнаружено, что при воздействии на мышей ионизирующего облучения в микроокружении опухоли активируется экспрессия PD-L1 [74]. Подобное повышение экспрессии PD-L1 подавляет противоопухолевые свойства эффекторных Т-клеток, что говорит о целесообразности комбинации иммунотерапии и ЛТ.
Доклинические модели [63,75,76] дают лишь ограниченное представление об эффектах сочетания ЛТ и иммунотерапии. Проведенный ранее небольшой ретроспективный анализ серии случаев продемонстрировал приемлемую переносимость и некоторое улучшение в ответе на лечение при сочетании иммунотерапии и ЛТ при различных формах заболевания [77,78]. На основе этих данных в настоящее время проводятся клинические исследования с участием пациентов с раком верхних отделов желудочно-кишечного тракта. Пембролизумаб в сочетании с ЛТ изучается для лечения пациентов с метастатическим раком пищевода [79], а также с раком желудка и ГЭП на поздних стадиях [80]. В качестве неоадъювантной терапии пембролизумаб, дурвалумаб, ниволумаб и ипилимумаб изучаются при их сочетании с химиолучевой терапией [81-83].
И, наконец, открытие опухолевых специфических антигенов позволяет говорить о специфических мишенях для новых видов иммунотерапии, в том числе о применении этих опухолевых специфических антигенов в клеточной терапии аутологичными Т-клетками, которые специфично связываются с данными антигенами у пациентов, опухоли которых их экспрессируют. Два наиболее часто встречающихся антигена, изученных в настоящий момент, которые экспрессируются при раке пищевода, – это ассоциированный с меланомой антиген 3 и NY-ESO-1. В 2017 г. Lu et al. [84] изучали случаи 17 пациентов с метастатическим раком, которые получали лечение с использованием главного комплекса гистосовместимости II – рестриктированного Т-клеточного рецептора, мишенью терапии был ассоциированный с меланомой эмбриональный раковый антиген 3. Пациенты получали лечение на базе противолимфоцитарной подготовительной терапии, после которого проводился адоптивный перенос очищенных CD4+ T-клеток, в которые с помощью ретровируса внедрялся Т-клеточный рецептор к ассоциированному с меланомой антигену 3, плюс системная терапия высокими дозами интерлейкина-2. Из девяти пациентов, которые получили самые высокие дозы, объективный частичный ответ наблюдался у пациента с раком пищевода (продолжительность – 4 месяца) [84]. Следует надеяться, что проходящие в настоящий момент исследования помогут выявить наилучшие сочетания при применении иммунотерапии, химиотерапии и/или лучевой терапии в оптимальных дозах и режимах.
PIK3CA
Сигнальный путь PI3K/Akt/mTOR играет важную роль в различных клеточных механизмах, таких как клеточный рост, клеточная пролиферация, трансляция белка и метаболизм. Нарушение регуляции этого пути, компонентом которого являются различные тирозинкиназы, часто наблюдается при многих опухолях. Это послужило основой для разработки разных видов таргетной терапии, которые воздействуют на звенья этого пути. Эти виды терапии испытывались на нескольких видах солидных опухолей, в том числе при раке желудка [85]. Согласно отчету АРГ, в 80% случаев EBV-ассоциированных опухолей и в 42% случаев MSI опухолей имеются мутации PIK3CA. Это дает основания предполагать, что данный сигнальный путь может служить потенциальной мишенью для новых видов терапии рака желудка.
В клиническом исследовании III фазы GRANITE, в котором изучался эверолимус для лечения пациентов с раком желудка на поздних стадиях, ранее получавших противоопухолевую терапию, улучшения выживаемости не происходило; однако в этом исследовании не изучались мутации PIK3CA, наличие мутаций PIK3CA у пациентов не проверялось и отбора пациентов по этому признаку не проводилось [34]. Перспективной тактикой лечения пациентов с раком желудка в будущем может стать предварительное определение мутации PIK3CA и проведение таргетной терапии, направленной на данный сигнальный путь, только пациентам с мутацией PIK3CA. Также в настоящее время для лечения рака желудка исследуются некоторые ингибиторы AKT, например, афуресертиб и AZD5363. Результаты этих исследований ожидаются в скором времени [5].
Ангиогенез
Важная роль образования новых сосудов в формировании и развитии резистентности злокачественных новообразований хорошо изучена [86]. VEGF, белок, представленный в различных изоформах, является стимулятором роста клеток эндотелия. Он в большом количестве экспрессируется в клетках различных солидных опухолей, особенно в зонах некроза и гипоксии. Гиперэкспрессия биомаркеров – факторов ангиогенеза ассоциируется с более агрессивным течением заболевания, таким образом, эти биомаркеры являются потенциальными мишенями при терапии рака желудка.
Бевацизумаб является анти-VEGF антителом, которое широко применяется при разных видах солидных опухолей, таких как колоректальный рак, рак яичников, рак молочной железы и рак легкого [85,87], однако при раке желудка его клиническая польза по-прежнему не определена. В клинических исследованиях III фазы AVATAR и AVAGAST клинического преимущества бевацизумаба при лечении рака желудка или ГЭП на поздних стадиях выявлено не было [29,30]. Тем не менее, рамуцирумаб, полностью человеческое моноклональное антитело, связывающееся с VEGFR-2, в клинических исследованиях III фазы REGARD [26] и RAINBOW [25] продемонстрировал клиническое преимущество при применении в качестве терапии второй линии у пациентов с раком желудка на поздних стадиях. В исследовании REGARD на фоне монотерапии рамуцирумабом в качестве второй линии терапии наблюдалось повышение ОВ в сравнении с оптимальной поддерживающей терапией. Медиана ОВ составила 5,2 мес. (межквартильный размах – 2,3-9,9 мес.) у пациентов группы рамуцирумаба и 3,8 мес. (межквартильный размах – 1,7-7,1 мес.) у пациентов группы плацебо (HR 0,776; 95% ДИ 0,603-0,998) [26]. В исследовании RAINBOW на фоне лечения рамуцирумабом в комбинации с паклитакселом наблюдалось повышение выживаемости без прогрессирования и ОВ по сравнению с группой лечения плацебо плюс паклитаксел. ОВ была значимо выше в группе лечения комбинацией рамуцирумаб плюс паклитаксел по сравнению с группой плацебо плюс паклитаксел (медиана – 9,6 мес. [95% ДИ 8,5-10,8 мес.] в сравнении с 7,4 мес. [95% ДИ 6,3-8,4 мес.]; HR 0,807; 95% ДИ 0,678-0,962) [25].
ТКИ апатиниб блокирует VEGFR-2. Данный препарат продемонстрировал эффективность и безопасность в клинических исследованиях II и III фазы у пациентов с метастатическим раком желудка или раком желудка на поздних стадиях, с резистентностью к химиотерапии, что позволяет говорить о том, что препарат может потенциально служить терапией третьей или последующих линий [88]. Несмотря на положительные результаты предшествующих исследований, существуют некоторые опасения относительно клинической пользы рамуцирумаба и апатиниба при лечении рака желудка. Небольшое клиническое преимущество наблюдалось при лечении афатинибом (1,8 месяца) и рамуцирумабом (1,4-2,2 месяца), однако, возможно, дальнейшие исследования биомаркеров, комбинированной терапии, результатов секвенирования и поддерживающей терапии обеспечат более значимые результаты таргетной анти-VEGF терапии при раке желудка [89,90].
PARP
PARP – это группа ферментов, катализирующих АДФ-рибозилирование различных внутриклеточных белков [91]. Ферменты PARP участвуют в различных клеточных процессах, таких как транскрипция, репликация, рекомбинация и репарация ДНК [92]. Особенно важна их роль в репарации ДНК, поскольку некоторые опухоли, в которых поврежден механизм гомологичной рекомбинации, используют репарацию ДНК, опосредованную PARP, и могут быть чувствительны к ингибированию этого механизма репарации [93]. Ингибирование PARP уже занимает значимое место в лечении BRCA-ассоциированного рака молочной железы и рака яичников и может также играть важную роль в лечении других видов рака, таких как аденокарцинома желудка [94]. При раке желудка обнаруживается повышенная экспрессия PARP-1, что может говорить о более поздней стадии заболевания и менее благоприятном прогнозе.
После получения довольно многообещающих результатов в клиническом исследовании II фазы было проведено клиническое исследование III фазы GOLD, в котором на фоне лечения ингибитором PARP олапарибом значимого увеличения ОВ у пациентов с раком желудка на поздних стадиях, в том числе у группы пациентов с негативным результатом анализа на мутантный белок атаксии-телеангиэктазии, не отмечалось [33]. Возможно, причиной того, что в некоторых исследованиях конечные точки эффективности не были достигнуты, были особенности методов статистического анализа (например, определение статистически значимого p-значения < 0,025) и отсутствие стратификации по биомаркерам BRCA. Другие исследования, изучающие применение ингибиторов PARP для лечения рака желудка, к настоящему моменту не завершены. Клиническое исследование I фазы (NCT01123876) изучает применение ингибитора PARP велапариба в комбинации с FOLFIRI при раке желудка. В исследовании I/II фазы (NCT03008278) продолжается набор пациентов для оценки эффективности олапариба и рамуцирумаба (анти-VEGFR-2 антитело) при лечении пациентов с неоперабельным метастатическим или местнораспространенным рецидивирующим раком желудка или ГЭП. Новые комбинации препаратов и потенциальное использование биомаркеров для выбора тактики терапии являются теми проблемами, решение которых может изменить подход к лечению в ближайшем будущем.
FGFR
Факторы роста фибробластов – это семейство протеинов, которые связываются с четырьмя видами трансмембранных тирозинкиназных рецепторов (FGFR) [95]. FGFR участвуют в различных внутриклеточных сигнальных каскадах, в том числе RAS-MAPK, PI3K-AKT и STAT, регулируя, таким образом, различные клеточные процессы, такие как пролиферация, клеточная миграция, выживание, дифференцировка и метаболизм [36,95]. Нарушение работы этих сигнальных путей, например, при амплификации генов, хромосомной транслокации или при мутациях, приводит к образованию опухолевых клеток, их выживанию, пролиферации и опухолевой инвазии, особенно при раке диффузного типа, как, например, в случае рака желудка [96].
К настоящему моменту на сайте ClinicalTrials.gov зарегистрировано 11 исследований, в которых изучается анти-FGFR таргетная терапия при раке желудка. В исследовании II фазы SHINE изучалось применение AZD4547, ТКИ FGFR2, в сравнении с паклитакселом у пациентов с раком желудка с амплификацией/полисомией FGFR2. В данном исследовании улучшение по основной конечной точке эффективности, которой являлся показатель выживаемости без прогрессирования, не было доказано [97].
Некоторые препараты, такие как довитиниб, форетиниб и пазопаниб, являются мульти-ТКИ и ингибируют в том числе и FGFR [95]. Исследование II фазы (NCT01719549) изучало мульти-TKI довитиниб при лечении рака желудка у пациентов с амплификацией FGFR2. Другое исследование II фазы (NCT01921673) оценивало роль комбинированной терапии довитинибом с доцетакселом в качестве химиотерапии второй линии у пациентов с метастатическим или неоперабельным раком желудка. Оба исследования были завершены, однако их результаты еще не опубликованы. В настоящий момент непонятно, достаточно ли при применении таргетной терапии блокировать только один FGFR для лечения рака желудка, однако, возможно, будущее за препаратами, которые являются мульти-ТКИ и ингибируют FGFR наряду с другими киназными сигнальными путями.
ВЫВОДЫ И ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
В настоящий момент лечение опухолей желудочно-кишечного тракта на поздних стадиях по-прежнему остается серьезной проблемой для онкологов и пациентов по всему миру. Злокачественные новообразования желудочно-кишечного тракта отличаются от других видов злокачественных опухолей, таких как рак простаты, рак легкого или меланома, поскольку до сих пор не существует всеохватывающих инновационных и эффективных методов лечения, основанных на драйверных мутациях и иммунотерапии. На сегодняшний день единственным подтвержденным предиктивным биомаркером, позволяющим определять тактику лечения пациентов, является экспрессия HER2. В настоящий момент существуют только два хорошо изученных препарата для лечения рака желудка на поздних стадиях: трастузумаб и рамуцирумаб. Не так давно в исследовании ATTRACTION-2 препарат ниволумаб продемонстрировал определенную эффективность при терапии опухолей желудочно-кишечного тракта на поздних стадиях у пациентов, получивших несколько линий химиотерапии в прошлом [54]. Новые принципы молекулярной классификации, как, например, классификация, предложенная АРГ, и классификация ACRG, призваны помочь выявлению потенциальных биомаркеров для разработки новых видов таргетной терапии, проведению новых клинических исследований, а также ретроспективного субанализа завершенных исследований. В случае опухолей с амплификацией HER2 каскады VEGF, PARP, EGFR, PIK3CA и FGFR являются теми молекулярными сигнальными путями, которые потенциально могут служить мишенями для новых видов таргетных препаратов в ближайшем будущем. Однако для разработки этих новейших подходов необходимо проведение большого количества трансляционных и клинических исследований.
Статья подготовлена редакцией газеты RUSSCO по материалам лекции Рамона Андраде де Мелло с соавторами на ежегодном конгрессе ASCO 2018.
Источники:
- Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015; 136: E359-E386. Medline, Google Scholar.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018; 68: 7-30. Medline, Google Scholar.
- Corral JE, Delgado Hurtado JJ, Domínguez RL, et al. The descriptive epidemiology of gastric cancer in Central America and comparison with United States Hispanic populations. J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar.
- Irino T, Takeuchi H, Terashima M, et al. Gastric cancer in Asia: unique features and management. Am Soc Clin Oncol Educ Book. 2017; 37: 279-291. Google Scholar.
- Fontana E, Smyth EC. Novel targets in the treatment of advanced gastric cancer: a perspective review. Ther Adv Med Oncol. 2016; 8: 113-125. Google Scholar.
- De Mello RA. Gastric cancer in southern Europe: high-risk disease. Am Soc Clin Oncol Educ Book. 2017; 37: 261-266. Google Scholar.
- Sanchez FA. Best practices and practical nuances in the treatment of gastric cancer in high-risk global areas. Am Soc Clin Oncol Educ Book. 2017; 37: 258-260. Google Scholar.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010; 6: 1471-1474. Google Scholar.
- Lauren P. The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar.
- Wang K, Kan J, Yuen ST, et al. Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer. Nat Genet. 2011; 43: 1219-1223. Medline, Google Scholar.
- Wang K, Yuen ST, Xu J, et al. Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer. Nat Genet. 2014; 46: 573-582. Medline, Google Scholar.
- Zang ZJ, Cutcutache I, Poon SL, et al. Exome sequencing of gastric adenocarcinoma identifies recurrent somatic mutations in cell adhesion and chromatin remodeling genes. Nat Genet. 2012; 44: 570-574. Medline, Google Scholar.
- Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209. Medline, Google Scholar.
- Boussioutas A, Li H, Liu J, et al. Distinctive patterns of gene expression in premalignant gastric mucosa and gastric cancer. Cancer Res. 2003; 63: 2569-2577. Google Scholar.
- Tan IB, Ivanova T, Lim KH, et al. Intrinsic subtypes of gastric cancer, based on gene expression pattern, predict survival and respond differently to chemotherapy. Gastroenterology 2011; 2: 476-485. Google Scholar.
- Lei Z, Tan IB, Das K, et al. Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitors and 5-fluorouracil. Gastroenterology. 2013; 145: 554-565. Google Scholar.
- Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med. 2015;21:449-456. Medline, Google Scholar.
- Sohn BH, Hwang J-E, Jang H-J, et al. Clinical significance of four molecular subtypes of gastric cancer identified by The Cancer Genome Atlas Project. Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar
- van der Post RS, Gullo I, Oliveira C, et al. Histopathological, molecular, and genetic profile of hereditary diffuse gastric cancer: current knowledge and challenges for the future. In Stem Cells, Pre-Neoplasia, and Early Cancer of the Upper Gastrointestinal Tract. New York: Springer, 2016; 371-391. Google Scholar.
- Shaib WL, Nammour JPA, Gill H, et al. The future prospects of immune therapy in gastric and esophageal adenocarcinoma. J Clin Med. 2016; 5: E100. Google Scholar.
- van Rossum PSN, Mohammad NH, Vleggaar FP, et al. Treatment for unresectable or metastatic oesophageal cancer: current evidence and trends. Nat Rev Gastroenterol Hepatol. Epub 2017 Dec 13. Google Scholar.
- Luis M, Tavares A, Carvalho LS, et al. Personalizing therapies for gastric cancer: molecular mechanisms and novel targeted therapies. World J Gastroenterol. 2013; 19: 6383-6397. Medline, Google Scholar.
- de Mello RA, Marques AM, Araújo A. HER2 therapies and gastric cancer: a step forward. World J Gastroenterol. 2013; 19: 6165-6169. Medline, Google Scholar.
- Bang Y-J, Van Cutsem E, Feyereislova A, et al; ToGA Trial Investigators. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010; 376: 687-697. Medline, Google Scholar.
- Wilke H, Muro K, Van Cutsem E, et al; RAINBOW Study Group. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014;15:1224-1235. Medline, Google Scholar.
- Fuchs CS, Tomasek J, Yong CJ, et al; REGARD Trial Investigators. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014; 383: 31-39. Medline, Google Scholar.
- Hofmann M, Stoss O, Shi D, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008; 52: 797-805. Medline, Google Scholar.
- Doi T, Shitara K, Naito Y, et al. Safety, pharmacokinetics, and antitumour activity of trastuzumab deruxtecan (DS-8201), a HER2-targeting antibody-drug conjugate, in patients with advanced breast and gastric or gastro-oesophageal tumours: a phase 1 dose-escalation study. Lancet Oncol. 2017; 18: 1512-1522. Google Scholar.
- Ohtsu A, Shah MA, Van Cutsem E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol. 2011; 29: 3968-3976. Link, Google Scholar.
- Shen L, Li J, Xu J, et al. Bevacizumab plus capecitabine and cisplatin in Chinese patients with inoperable locally advanced or metastatic gastric or gastroesophageal junction cancer: randomized, double-blind, phase III study (AVATAR study). Gastric Cancer. 2015; 18: 168-176. Google Scholar.
- Lordick F, Kang YK, Chung HC, et al; Arbeitsgemeinschaft Internistische Onkologie and EXPAND Investigators. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 490-499. Medline, Google Scholar.
- Thuss-Patience PC, Shah MA, Ohtsu A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017; 18: 640-653. Google Scholar.
- Bang Y-J, Xu R-H, Chin K, et al. Olaparib in combination with paclitaxel in patients with advanced gastric cancer who have progressed following first-line therapy (GOLD): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1637-1651. Google Scholar.
- Ohtsu A, Ajani JA, Bai Y-X, et al. Everolimus for previously treated advanced gastric cancer: results of the randomized, double-blind, phase III GRANITE-1 study. J Clin Oncol. 2013; 31: 3935-3943. Link, Google Scholar.
- Hecht JR, Bang Y-J, Qin SK, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2–positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC—a randomized phase III trial. J Clin Oncol. 2016; 34: 443-451. Link, Google Scholar.
- Waddell T, Chau I, Cunningham D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 481-489. Medline, Google Scholar.
- Catenacci DVT, Tebbutt NC, Davidenko I, et al. Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar.
- Satoh T, Xu R-H, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN—a randomized, phase III study. J Clin Oncol. 2014; 32: 2039-2049. Link, Google Scholar.
- Van Cutsem E, de Haas S, Kang YK, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a biomarker evaluation from the AVAGAST randomized phase III trial. J Clin Oncol. 2012; 30: 2119-2127. Link, Google Scholar.
- Tabernero J, Hoff P, Shen L, et al. 616O: pertuzumab (P)+ trastuzumab (H)+ chemotherapy (CT) for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (mGC/GEJC): final analysis of a phase III study (JACOB). Ann Oncol. 2017;28(suppl_5):mdx369. Google Scholar.
- Lieto E, Ferraraccio F, Orditura M, et al. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008; 15: 69-79. Medline, Google Scholar.
- Lazăr DC, Tăban S, Cornianu M, et al. New advances in targeted gastric cancer treatment. World J Gastroenterol. 2016; 22: 6776-6799. Google Scholar.
- Satoh T, Lee KH, Rha SY, et al. Randomized phase II trial of nimotuzumab plus irinotecan versus irinotecan alone as second-line therapy for patients with advanced gastric cancer. Gastric Cancer. 2015; 18: 824-832. Medline, Google Scholar.
- Dutton SJ, Ferry DR, Blazeby JM, et al. Gefitinib for oesophageal cancer progressing after chemotherapy (COG): a phase 3, multicentre, double-blind, placebo-controlled randomised trial. Lancet Oncol. 2014; 15: 894-904. Medline, Google Scholar.
- Lawrence MS, Stojanov P, Polak P, et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 2013; 499: 214-218. Medline, Google Scholar.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12: 252-264. Medline, Google Scholar.
- Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016;54:139-148. Medline, Google Scholar.
- Derks S, Nason KS, Liao X, et al. Epithelial PD-L2 expression marks Barrett’s esophagus and esophageal adenocarcinoma. Cancer Immunol Res. 2015; 3: 1123-1129. Medline, Google Scholar.
- Ohigashi Y, Sho M, Yamada Y, et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer. Clin Cancer Res. 2005; 11: 2947-2953. Medline, Google Scholar.
- Kudo T, Hamamoto Y, Kato K, et al. Nivolumab treatment for oesophageal squamous-cell carcinoma: an open-label, multicentre, phase 2 trial. Lancet Oncol. 2017; 18: 631-639. Medline, Google Scholar.
- Fuchs CS, Doi T, Jang RW-J, et al. KEYNOTE-059 cohort 1: efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol. 2017; 15: 4003. Google Scholar.
- Ohtsu A, Tabernero J, Bang Y-J, et al. Pembrolizumab (MK-3475) versus paclitaxel as second-line therapy for advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: phase 3 KEYNOTE-061 study. J Clin Oncol. 2016; 4 (4_suppl): TPS183. Google Scholar.
- Kojima T, Hara H, Yamaguchi K, et al. Phase II study of nivolumab (ONO-4538/BMS-936558) in patients with esophageal cancer: preliminary report of overall survival. J Clin Oncol. 2016; 4 (4_suppl): TPS175. Google Scholar.
- Kang Y-K, Boku N, Satoh T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 390: 2461-2471. Medline, Google Scholar.
- NCT02569242. Study of Nivolumab in Unresectable Advanced or Recurrent Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT02569242. Accessed March 12, 2018. Google Scholar.
- Krummel MF, Allison JP. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. 1995; 182: 459-465. Medline, Google Scholar.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2010; 16: 1662-1672. Google Scholar.
- Janjigian YY, Ott PA, Calvo E, et al. Nivolumab±ipilimumab in pts with advanced (adv)/metastatic chemotherapy-refractory (CTx-R) gastric (G), esophageal (E), or gastroesophageal junction (GEJ) cancer: CheckMate 032 study. J Clin Oncol. 2017; 15: 4014. Google Scholar.
- NCT02476123. Phase 1 Study of Combination Therapy With Mogamulizumab (KW-0761) and Nivolumab (ONO-4538/BMS-936558) in Subjects With Advanced Solid Tumors. clinicaltrials.gov/ct2/show/NCT02476123. Accessed March 12, 2018. Google Scholar.
- UMIN000021480. Phase I Study of Pre-Operative Combination Therapy With Mogamulizumab (Anti-CCR4) and Nivolumab (Anti-PD-1) Against Solid Cancer Patients. upload.umin.ac.jp/cgi-open-bin/ctr_e/ctr_view.cgi?recptno=R000024753. Accessed March 12, 2018. Google Scholar.
- NCT02460224. Safety and Efficacy of LAG525 Single Agent and in Combination with PDR001 in Patients With Advanced Malignancies. clinicaltrials.gov/ct2/show/NCT02460224. Accessed March 12, 2018. Google Scholar.
- NCT02340975. A Phase 1b/2 Study of MEDI4736 With Tremelimumab, MEDI4736 or Tremelimumab Monotherapy in Gastric or GEJ Adenocarcinoma. clinicaltrials.gov/ct2/show/NCT02340975. Accessed March 12, 2018. Google Scholar.
- Banissi C, Ghiringhelli F, Chen L, et al. Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother. 2009;58:1627-1634. Medline, Google Scholar.
- Ercolini AM, Ladle BH, Manning EA, et al. Recruitment of latent pools of high-avidity CD8(+) T cells to the antitumor immune response. J Exp Med. 2005; 201: 1591-1602. Medline, Google Scholar.
- Schiavoni G, Mattei F, Di Pucchio T, et al. Cyclophosphamide induces type I interferon and augments the number of CD44(hi) T lymphocytes in mice: implications for strategies of chemoimmunotherapy of cancer. Blood. 2000; 95: 2024-2030. Medline, Google Scholar.
- Machiels J-PH, Reilly RT, Emens LA, et al. Cyclophosphamide, doxorubicin, and paclitaxel enhance the antitumor immune response of granulocyte/macrophage-colony stimulating factor-secreting whole-cell vaccines in HER-2/neu tolerized mice. Cancer Res. 2001; 61: 3689-3697. Medline, Google Scholar.
- Chen G, Emens LA. Chemoimmunotherapy: reengineering tumor immunity. Cancer Immunol Immunother. 2013; 62: 203-216. Google Scholar.
- Peng J, Hamanishi J, Matsumura N, et al. Chemotherapy induces programmed cell death-ligand 1 overexpression via the nuclear factor-κB to foster an immunosuppressive tumor microenvironment in ovarian cancer. Cancer Res. 2015; 75: 5034-5045. Google Scholar.
- NCT03143153. A Study to Evaluate Efficacy in Subjects With Esophageal Cancer Treated With Nivolumab and Ipilimumab or Nivolumab Combined With Fluorouracil Plus Cisplatin Versus Fluorouracil Plus Cisplatin (CheckMate 648). clinicaltrials.gov/ct2/show/NCT03143153. Accessed March 12, 2018. Google Scholar.
- NCT02494583. Study of Pembrolizumab (MK-3475) as First-Line Monotherapy and Combination Therapy for Treatment of Advanced Gastric or Gastroesophageal Junction Adenocarcinoma (MK-3475-062/KEYNOTE-062). clinicaltrials.gov/ct2/show/NCT02494583. Accessed March 12, 2018. Google Scholar.
- NCT03221426. Study of Pembrolizumab (MK-3475) Plus Chemotherapy Versus Placebo Plus Chemotherapy in Participants With Gastric or Gastroesophageal Junction (GEJ) Adenocarcinoma (MK-3475-585/KEYNOTE-585). clinicaltrials.gov/ct2/show/NCT03221426. Accessed March 12, 2018. Google Scholar.
- Corso CD, Ali AN, Diaz R. Radiation-induced tumor neoantigens: imaging and therapeutic implications. Am J Cancer Res. 2011; 1: 390-412. Google Scholar.
- Kaur P, Asea A. Radiation-induced effects and the immune system in cancer. Front Oncol. 2012; 2: 191. Google Scholar.
- Deng L, Liang H, Burnette B, et al. Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice. J Clin Invest. 2014; 124: 687-695. Medline, Google Scholar.
- Verbrugge I, Hagekyriakou J, Sharp LL, et al. Radiotherapy increases the permissiveness of established mammary tumors to rejection by immunomodulatory antibodies. Cancer Res. 2012; 72: 3163-3174. Medline, Google Scholar.
- Zeng J, See AP, Phallen J, et al. Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. Int J Radiat Oncol Biol Phys. 2013; 86: 343-349. Medline, Google Scholar.
- Kwon ED, Drake CG, Scher HI, et al; CA184-043 Investigators. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2014; 15: 700-712. Medline, Google Scholar.
- Qin R, Olson A, Singh B, et al. Safety and efficacy of radiation therapy in advanced melanoma patients treated with ipilimumab. Int J Radiat Oncol Biol Phys. 2016; 96: 72-77. Google Scholar.
- NCT02642809. Pembrolizumab With Locally Delivered Radiation Therapy for the Treatment of Metastatic Esophageal Cancers. clinicaltrials.gov/ct2/show/NCT02642809. Accessed March 12, 2018. Google Scholar.
- NCT02830594. Pembrolizumab and Palliative Radiation Therapy in Treating Patients With Metastatic Esophagus, Stomach, or Gastroesophageal Junction Cancer. clinicaltrials.gov/ct2/show/NCT02830594. Accessed March 12, 2018. Google Scholar.
- NCT02735239. Study of Anti-PD-L1 in Combination With Chemo(radio)therapy for Oesophageal Cancer. clinicaltrials.gov/ct2/show/NCT02735239. Accessed March 12, 2018. Google Scholar.
- NCT02730546. Pembrolizumab, Combination Chemotherapy, and Radiation Therapy Before Surgery in Treating Adult Patients With Locally Advanced Gastroesophageal Junction or Gastric Cardia Cancer That Can Be Removed by Surgery. clinicaltrials.gov/ct2/show/NCT02730546. Accessed March 12, 2018. Google Scholar.
- NCT03044613. Nivolumab or Nivolumab/Ipilimumab Prior to Chemoradiation Plus Nivolumab With II/III Gastro/Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT03044613. Accessed March 12, 2018. Google Scholar.
- Lu Y-C, Parker LL, Lu T, et al. Treatment of patients with metastatic cancer using a major histocompatibility complex class II–restricted T-cell receptor targeting the cancer germline antigen MAGE-A3. J Clin Oncol. 2017; 35: 3322-3329. Link, Google Scholar.
- Marques I, Araújo A, de Mello RA. Anti-angiogenic therapies for metastatic colorectal cancer: current and future perspectives. World J Gastroenterol. 2013; 19: 7955-7971. Google Scholar.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011; 144: 646-674. Medline, Google Scholar.
- de Mello RA, Costa BM, Reis RM, Hespanhol V. Insights into angiogenesis in non-small cell lung cancer: molecular mechanisms, polymorphic genes, and targeted therapies. Recent Pat Anticancer Drug Discov. 2012; 7: 118-131. Medline, Google Scholar.
- Zhang Y, Han C, Li J, et al. Efficacy and safety for apatinib treatment in advanced gastric cancer: a real world study. Sci Rep. 2017; 7: 13208. Google Scholar.
- de Mello RA, de Oliveira J, Antoniou G. Angiogenesis and apatinib: a new hope for patients with advanced gastric cancer? Future Oncol. 2017; 13: 295-298. Google Scholar.
- Ilson DH. Targeting the vascular endothelial growth factor pathway in gastric cancer: a hit or a miss? J Clin Oncol. 2016; 34: 1431-1432. Link, Google Scholar.
- Park S-H, Jang KY, Kim MJ, et al. Tumor suppressive effect of PARP1 and FOXO3A in gastric cancers and its clinical implications. Oncotarget. 2015; 6: 44819-44831. Google Scholar.
- Qin Q, Lu J, Zhu H, et al. PARP-1 Val762Ala polymorphism and risk of cancer: a meta-analysis based on 39 case-control studies. PLoS One. 2014; 9: e98022. Google Scholar.
- Morales J, Li L, Fattah FJ, et al. Review of poly (ADP-ribose) polymerase (PARP) mechanisms of action and rationale for targeting in cancer and other diseases. Crit Rev Eukaryot Gene Expr. 2014; 24: 15-28. Google Scholar.
- Verdaguer H, Saurí T, Macarulla T. Predictive and prognostic biomarkers in personalized gastrointestinal cancer treatment. J Gastrointest Oncol. 2017; 8: 405-417. Google Scholar.
- Hierro C, Alsina M, Sánchez M, et al. Targeting the fibroblast growth factor receptor 2 in gastric cancer: promise or pitfall? Ann Oncol. 2017; 28: 1207-1216. Google Scholar.
- Carlomagno N, Incollingo P, Tammaro V, et al. Diagnostic, predictive, prognostic, and therapeutic molecular biomarkers in third millennium: a breakthrough in gastric cancer. BioMed Res Int. 2017; 2017: 7869802. Google Scholar.
- Van Cutsem E, Bang Y-J, Mansoor W, et al. A randomized, open-label study of the efficacy and safety of AZD4547 monotherapy versus paclitaxel for the treatment of advanced gastric adenocarcinoma with FGFR2 polysomy or gene amplification. Ann Oncol. 2017; 28: 1316-1324. Google Scholar.
Синдром раздраженного кишечника — болезнь и лечение
Синдром раздраженного кишечника – это функциональное расстройство толстого кишечника, продолжающихся свыше 3 месяцев.
Синдром раздраженного кишечника у женщин встречается в 2-4 раза чаще, чем у мужчин, наиболее часто в возрасте 30-40 лет.
В зависимости от ведущего клинического синдрома выделяют три основных варианта данного заболевания:
- с преобладанием диареи;
- с преобладанием запоров;
- с преобладанием болей в животе и метеоризмом.
Факторы, приводящие к развитию синдрома раздраженного кишечника:
- нарушение деятельности центральной нервной системы
- дисфункция вегетативной нервной системы
- нарушение кишечной микрофлоры (дисбактериоз)
- кишечные инфекции (примерно у 30% больных возникновению заболевания предшествовала острая кишечная инфекция)
Основная причина формирования синдрома раздраженного кишечника
Это психоэмоциональные нагрузки. Стресс является пусковым механизмом развития этого синдрома.
Выше указанные причины нарушают согласованную работу центральной и вегетативной нервной системы, что приводит к нарушению нейрогуморальной регуляции функции кишечника. Ускоренная моторика кишечника может привести к диарее, а замедленная моторика кишечника может привести к запорам. Также возможны резкие сокращения мышц кишечника и спазмы, что вызывает боль.
Лечение синдрома раздраженного кишечника
Медикаментозное симптоматическое лечение направлено на снижение проявления выраженности симптомов, снижает страдания больного, но причина заболевания при этом не устраняется.
Восстановить согласованную работу центральной и вегетативной нервной системы возможно. Для этого назначают компьютерную рефлексотерапию. В результате устранения основной причины заболевания — нарушения согласованной работы центральной и вегетативной нервных систем, нормализуется и функция кишечника.
Лечение осуществляется путем воздействия сверхмалым постоянным током на систему биологически активных точек, связанных в единую сеть с головным мозгом через вегетативную нервную систему человека.
Оставьте контакт и консультирующий врач свяжется с Вами
Важно не упустить время, когда ещё возможно вылечить синдром раздраженного кишечника без осложнений. Чтобы избежать необратимых изменений в организме — не откладывайте лечение, отправьте в регистратуру
Консультирующий врач свяжется с Вами.
Информация на сайте не предназначена для самодиагностики и самолечения. Если нездоровится, не запускайте болезнь, обратитесь за квалифицированной медицинской помощью.
- Чтобы приехать на лечение в Клинику Гавриловой из другого города, не теряйте время, думая как всё это организовать, звоните 8-800-55-00-128 из России бесплатно, для звонка из других стран набирайте +7 846 374-07-08 или +7 927 725 -11-44 (WhatsApp, Viber, Telegram). Помощник консультирующего врача оперативно ответит на ваши вопросы и поможет организовать поездку максимально комфортно.
- Чтобы записаться на прием к врачу обратитесь в регистратуру по телефону +7 (846) 374-07-08 , или через .
Видео о лечении в клинике
Примеры лечения различных заболеваний
Эндоскопия, гастроскопия, колоноскопия — записаться на прием к эндоскописту в Екатеринбурге — СМТ Клиника
Используем эндоскопы экспертного класса Olympus Evis Exera III, оснащенные системой визуализации узкоспектральном режиме. Статистически технология позволяет находить на 29% больше полипов и других новообразований, нежели при использовании эндоскопов, лишенных данной технологии. Задача эндоскопической диагностики — вовремя находить патологии. Оборудование гастроцентра СМТ-Клиники и уровень докторов обеспечивает должное качество диагностики и возможного последующего лечения. Будьте уверенными в своем здоровье!
Когда проходить диагностику?
Чаще всего эндоскопическое исследование назначается для ранней диагностики онкологических и предонкологических изменений слизистой пищеварительной системы. Но рекомендуем не ждать назначения, а посещать доктора согласно рекомендации — после 40 лет, и в последующем, один раз в 2 года.
Эндоскопический метод позволяет находить:
- полипы;
- язвы;
- другие новообразования;
- воспаления;
- дегенеративные изменения тканей.
Важно! Любое воспаление в пищеварительном тракте может трансформироваться в рак. Этот процесс называется «каскад Коррэа», в честь ученого, описавшего, как воспаление переходит атрофию, метаплазию, дисплазию и, наконец, рак.
Подготовка к исследованию
Для проведения информацитвного исследования понадобится подготовка, начать которую нужно за 2-3 дня до процедуры.
Необходимо соблюдать специальную диету с отказом от упротребления спиртных напитков, острой и жирной пищи, кондитерских изделий, семечек и орехов. Если Вы планируете пройти колоноскопию, то дополнительно под запрет попадут овощи, фрукты, зелень, каши, макаронные и хлебобулочные изделия.
8 часов перед гастроскопией нельзя есть и курить, за 20 минут до — выпить стакан воды (250 мл) и походить.
Подготовка к колоноскопии включает этап очищения кишечника. За сутки до исследования потребуется принять специальные препараты и исключить прием пищи.
Подробнее о подготовке можно узнать, перейдя по ссылкам:
Подготовка к колоноскопии;
Подготовка к гастроскопии.
Как проходит процедура?
Обследование проводится в положении лежа на левом боку, пациент может наблюдать за картинкой на мониторе.
Но эндоскопия, особенно «верхняя» — не самая приятная процедура. Она не причиняет боли, однако способна принести дискомфорт и неудобство. Поэтому чаще всего пациенты предпочитают проходить ее в медикаментозном сне. Такой метод рекомендуется международным медицинским сообществом и считается «золотым стандартом».
Продолжительность исследования составляет 20-30 минут, после врач выдаст заключение с фотоматериалами. Впоследствии они будут необходимы лечащему доктору для выбора стратегии лечения, а также эндоскописту для проведения эндоскопического контроля.
Медикаментозный сон
Медикаментозный сон (седация) — состояние, максимально близкое к естественному сну. Вызывается современным препаратом короткого действия Пропофол, схожим по природе с естественными гормонами сна. Анестезиолог может быстро погрузить человека в это состояние и быстро вывести из него. Жизненные функции пациента строго контролируются специальным датчиком, надетым на палец.
Важно! Седация — это не наркоз, она не вредит организму. После нее нет вялости, заторможенности и потери ориентации. Уже через полчаса можно покинуть Гастроцентр.
Плюсы эндоскопии во сне:
- улучшается информативность;
- отсутствуют неприятные ощущения и воспоминаний;
- во сне расслабляются мышцы кишечника и желудка.
Преимущества эндоскопии в СМТ-Клинике
Не только диагностируем, но и сразу во время диагностики удаляем найденные полипы. Надежность диагностики обеспечивается высокой экспертизой наших докторов и оборудованием, соответствующим их уровню.
Каскад желудка. EndoTODAY
[2019-1-11. ֵ]
[2019-1-11.亯]
Ұ ӻ ǹ̴ ٰ մ ϴ.
Ȥ каскадный желудок исследование бария Ͽ категория ð Ұ̶ Ǵ ϴ (Kusano M. J Gastroenterol, 2016).
При каскадном желудке (CS) дно желудка загнуто назад, поэтому обнаружение гребня между дном желудка и верхней частью тела можно использовать для диагностики CS. Гребень идет от задней стенки кардии к передней стенке желудка, пересекая большую кривизну.Это легко наблюдается при эндоскопии при просмотре из кардии, особенно когда желудок пуст и содержит лишь небольшое количество воздуха, и он становится менее заметным, когда желудок расширяется за счет надувания воздуха. Мы предположили, что исчезновение / сохранение гребня после раздувания живота было связано с степенью CS. Таким образом, мы классифицировали КС на четыре степени на основе прироста раздувания желудка во время эндоскопического исследования. Оценка 0 — отсутствие гребня при просмотре из кардии при первом введении эндоскопа в желудок.Уровень 1 означает, что при первом введении эндоскопа со стороны кардии наблюдается гребень между дном и верхней частью тела. Оценка 2 означает, что гребень также виден при ретрофлексии (поворот J) задней стенки верхней части тела желудка. Оценка 3 означает, что гребень все еще обнаруживается в конце наблюдения после полного надувания желудка воздухом.
Дж Гастроэнтерол 2016
(Кусано) ð Ұ ϱ исследование бария Ұ ߿ ̴ каскадный желудок ü ֽ ϴ (Кусано М.Н.М. 2012) Ϻ ϴ каскад желудка Ÿ ־ ο մ ϴ.
Каскад желудка (CS) диагностируется на основании характерного внешнего вида желудка при исследовании бария. Каскадный желудок когда-то назывался «чашка и разлив» и обычно рассматривается как вариант нормального желудка. У людей с CS проглоченный барий сначала накапливается в ретрофлексированном дне желудка и заполняет его, после чего барий каскадом попадает в тело желудка.
Бариевый этюд в правом переднем косом обзоре стоя.Слева: обнаружение, указывающее на диагноз: каскадный желудок. Справа: нормальный желудок.
Механизмы, лежащие в основе CS, включают (i) внегастральную компрессию другими внутренними органами (особенно поперечной ободочной кишкой, известной как синдром изгиба селезенки), (ii) глотание воздуха (аэрофагия), (iii) врожденный CS, (iv) пептический или злокачественная язва верхней части желудка, (v) перижастральные спайки и (vi) карцинома поджелудочной железы или забрюшинные опухоли.
Во 2-м издании Bockus Gastroenterology говорится: каскадный желудок, хотя и встречается сравнительно редко, но часто сопровождается симптомами диспепсии.Деформация сама по себе редко вызывает симптомы, но предрасполагает к желудочному расстройству, если по какой-либо причине возникает функциональный гастроспазм, аэрофагия или дисфункция толстой кишки. Однако это упоминание о CS было удалено из следующего издания, и о нем почти забыли как о потенциальной причине диспепсических симптомов. После того, как эндоскопия стала популярной, использование рентгенографических исследований сократилось. Большинство врачей и исследователей сосредоточились на эндоскопических процедурах, потому что они могут обнаруживать и отображать органические поражения более точно, чем рентгенографические исследования.В Японии радиографическое обследование по-прежнему используется для массового обследования, но за ним следует эндоскопия для более детального исследования таких поражений, как язвенная болезнь и рак желудка. Поэтому связь между симптомами и морфологией желудка не привлекала внимания в Японии в течение многих лет. В Соединенных Штатах и Европе считается, что нарушения опорожнения желудка и аккомодации играют роль в патофизиологии диспепсии наряду с инфекцией Helicobacter pylori, поэтому в этих странах нет необходимости в исследованиях бария.Соответственно, за последние несколько десятилетий было немного сообщений о связи между КС и симптомами верхних отделов ЖКТ.
Что касается функциональной диспепсии (ФД), недавно было сообщено, что постпрандиальные симптомы, особенно постпрандиальные симптомы, более серьезны у пациентов, которые сообщают об ухудшении своих симптомов во время еды. У пациентов с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) изжога обычно возникает в постпрандиальном периоде. У людей с CS проглоченная пища и жидкость или проглоченный воздух первоначально собираются на глазном дне.После заполнения глазного дна пища / жидкость будет быстро течь в тело желудка, и этот процесс может быть связан с симптомами верхних отделов ЖКТ. Поскольку временная релаксация нижнего пищеводного сфинктера (TLESR) вызывается растяжением дна желудка, что способствует выведению воздуха путем отрыжки, морфология желудка может быть связана с симптомами верхних отделов желудочно-кишечного тракта, особенно с симптомами рефлюкса. Мы предположили, что КС может быть причиной симптомов верхних отделов ЖКТ, поэтому мы исследовали связь между КС и симптомами верхних отделов ЖКТ.
Классификация морфологии желудка
Исследования бария были выполнены с использованием 165 мл 180 мас. / Об.% Сульфата бария (Kaigen Co., Токио, Япония) и 6 г шипучих солей (Kaigen Co.). Чтобы предотвратить сокращение желудка, каждому субъекту давали скополамин бутилбромид (20 мг внутримышечно), за исключением лиц старше 65 лет; тем, у кого в анамнезе были сердечные заболевания, сахарный диабет, глаукома или заболевание простаты; и те, кто отказался от этого. После эзофагографии первый вид наполнения желудка, содержащего все 165 мл бария, использовался для классификации морфологии желудка.Каскад желудка и гастроптоз диагностировал один автор (МК), имеющий более чем 25-летний опыт чтения рентгеновских снимков с барием. Каскад желудка был диагностирован в переднем правом положении стоя путем определения удержания бария на глазном дне и уровня жидкости и воздуха. Гастроптоз определяли как существующий, если меньшая кривизна угла располагалась ниже горизонтальной линии, соединяющей двусторонние подвздошные ости в положении стоя спереди. Впоследствии было сделано семь серий рентгеновских снимков с использованием методов двойного контрастирования и сжатия для диагностики органических заболеваний.Все рентгеновские данные хранились в цифровой записывающей системе (Digital Radiography DSTATION ARD-100A, Toshiba Co., Токио, Япония) и отображались в средстве просмотра (519 519 пикселей, Toshiba) для чтения.
(Kusano M. NM 2012) Ʒ Ǿϴ. Рефлюкс-диспепсия ִ каскадный желудок ٴ Դ ϴ. ϰų ų ε ……
КЛЮЧЕВЫЕ РЕЗУЛЬТАТЫ: ИМТ был значительно выше у мужчин с CS, чем в контрольной группе, а также у женщин с CS, чем в контрольной группе. Симптомы со стороны верхних отделов желудочно-кишечного тракта были значительно более частыми в группе CS, чем в контрольной группе, как среди мужчин, так и среди женщин, особенно симптомы рефлюкса.У мужчин анализ логистической регрессии определил CS как независимый фактор риска для симптомов верхних отделов ЖКТ (отношение шансов = 1,771, P = 0,005) и симптомов рефлюкса (отношение шансов = 2,07, P = 0,009). У женщин CS также был значительно связан с симптомами верхних отделов ЖКТ (отношение шансов = 2,544, P = 0,020). Распространенность КС была значительно выше (P ВЫВОДЫ И ВЫВОДЫ: Морфология желудка связана с симптомами верхних отделов ЖКТ как у мужчин, так и у женщин. Каскад желудка следует рассматривать как патофизиологический фактор, связанный с симптомами верхних отделов ЖКТ.
(2017 № 52 (5) 563) (,) ̸ Ʒ ҰǾ — ϴ. Исследование бария Ұ̰ ð 濡 ϴ.
«Каскадный желудок» ְ å ӻ Ǵ ҸȮ մ ϴ.
Каскад желудка ణ ٸ исследование бария ̴ ٸ категория желудка песочные часы ֽ ϴ. ǹ̴ ڽ ϴ.
, каскадное исследование бариевой жидкости на дне желудка ̴ 츦 Īϴ μ Ϻ ӻ ǰ ִ ٰ ǰ θ ʴ Դ ϴ. ð Fundus cardia Ϻ ָ casecase желудка Ϸ õ ʹ ְ̹ Ƿ ܸ ϴ. Каскад желудка — Ҽ ð ǻ 簡 ϰ Ȯ ܸ слепок ٶ ʴ մ ϴ.
ð «Верхняя задняя стенка желудка выдвинута вперед». Ұ впечатление «каскадный желудок» ټ ҽϴ.
70 ̴̼µ ٸ п Ͽ ü «вытолкнут вперед» — каскадный желудок̶ ϴ. ð каскадный желудок — ü гребень ѷ ʾҽϴ.
© Ͽð 汳 ٸ ð 濬. Учебный центр эндоскопии EndoTODAY. Ли Джун Хэн. (обновление: 2017-11-6)
KoreaMed Synapse
Каскадный желудок был впервые описан Ридером в 1910 году.При рентгеноскопии барий сначала заполняет зависимое заднее дно до наивысшего уровня гребня, что создает рентгенологически очевидную границу между дном и телом желудка, а затем разливается или «каскадом» попадает в тело и антральный отдел. Многие каскадные желудки являются результатом внутреннего поражения желудка. В общей сложности из 1595 исследований верхних отделов желудочно-кишечного тракта у нас было изменение, чтобы получить 300 каскадных желудков в отделении лучевой хирургии больницы национального университета Чонбуг с 1 января 1974 года по 31 августа 1976 года.Случаи были рассмотрены, и результаты были проанализированы следующим образом; 1. Из 1595 случаев обследования верхних отделов желудочно-кишечного тракта каскад желудков составил 300 случаев (18,8%), из них пограничный каскад желудков — 74 случая (24,7%), непостоянный — 45 случаев (15%), стойкий — 181 случай (60,3%) 2. При прямом боковом обзоре весь каскадный мешок располагался кзади, а в прямом переднем или переднем взгляде: 238 случаев (79,3%) были расположены медиально по отношению к оси маточного желудка, 36 случаев (12%) — по главной оси желудка и 26 случаев (8.7%) латерально. 3. Из 300 случаев каскада желудков 69 случаев (23%) сочетались с язвой двенадцатиперстной кишки, 11 случаев (3,7%) язвой желудка, 7 случаев (2,3%) злокачественным новообразованием желудка, 114 случаев (38%) гастритом, 10 случаев (3,3). %) птоз, 2 случая (0,7%) дивертикула желудка, 4 случая (1,3%) дивертикула двенадцатиперстной кишки, 3 случая (1%) варикозного расширения вен пищевода, 1 случай (0,3%) карциномы поджелудочной железы, 1 случай гастрэктомии, 1 случай спаек после абдоминальной хирургии, 1 случай холедоходуоденального свища. 4. Главный врач жалуется на расстройство желудка, боли в эпигастрии и дистресс, голодную боль, вздутие живота, отрыжку и потерю веса.Около 40% пациентов с каскадным желудком имели один или несколько из описанных выше симптомов. 5. Каскадный желудок считался физиологической или нормальной деформацией, но мы обнаружили, что многие каскадные желудки были результатом внутренних или внешних поражений желудка. Поэтому при появлении деформации рентгенологу следует внимательно осмотреть желудок.
Проблемы с желудочно-кишечным трактом: какое отношение к этому имеет ваш мозг?
Были ли вы когда-нибудь настолько взволнованы или расстроены, что вам приходилось бежать в ванную? А как насчет того, чтобы получать настолько плохие новости, что вас тошнит? Если вы когда-либо испытывали эти симптомы, значит, вы не понаслышке почувствовали связь между мозгом и кишечником.
Связь между мозгом и кишечником реальна и может влиять как на мужчин, так и на женщин, хотя и по-разному. Проблемы с желудочно-кишечным трактом (ЖКТ) влияют на мозг — и наоборот.
Связь между мозгом и кишечником
Связь между мозгом и кишечником очевидна, когда мы чувствуем бабочек в животе, обычно когда мы возбуждены, влюблены или напуганы. Сильные эмоции могут вызывать у людей симптомы желудочно-кишечного тракта.
Наука начинает понимать процесс, стоящий за этой связью, которая в конечном итоге связана с гормонами, выделяемыми из разных частей нашего мозга — да, они находятся в вашей голове, а также из других мест — когда мы особенно напряжены или взволнованы.
Химические вещества, циркулирующие в кровотоке, влияют на чувствительность и функцию нервов в стенке кишечника, которые вместе можно назвать кишечной нервной системой.
Синдром раздраженного кишечника и головного мозга
Исследователи начинают понимать влияние деятельности кишечника на мозг. Одним из примеров является синдром раздраженного кишечника (СРК), заболевание, которым страдают до 15% людей в Соединенных Штатах и женщины в два раза чаще, чем мужчины. Если у вас СРК, нервы в кишечнике чрезвычайно чувствительны, и мозг обрабатывает эти сигналы из кишечника иначе, чем если бы у вас не было СРК.Даже небольшое количество газа может вызвать боль, вздутие живота, запор или диарею.
Проблемы с кишечником и настроение
Врачи, ухаживающие за людьми с проблемами кишечника, наблюдали, как проблемы с желудочно-кишечным трактом могут повлиять на настроение и чувство благополучия человека.
Например, некоторые люди с хроническим запором также сообщают о подавленном настроении или даже о головных болях. Хотя многие специалисты по естественному здоровью сосредотачиваются на негативных эффектах токсинов в организме, это не то, что, вероятно, стоит за связью между мозгом и кишечником.Некоторые эксперты считают, что запор на самом деле заставляет кишечную нервную систему посылать определенные сигналы в мозг, которые затем запускают каскад чувств.
Биом кишечника изучается, и будущие исследования могут раскрыть больше секретов взаимосвязи между кишечными недугами и настроением, а также того, как это можно изменить. Управление кишечными бактериями может оказаться одним из способов добиться положительных изменений в нашем настроении.
Воздействие стресса на организм
В кишечнике есть сотни миллионов нейронов, которые могут функционировать независимо и постоянно взаимодействуют с мозгом, что объясняет способность чувствовать «бабочек» в желудке.Стресс может повлиять на коммуникацию между мозгом и кишечником и может вызвать боль, вздутие живота и другие неприятные ощущения в кишечнике, которые легче почувствовать. В кишечнике также обитают миллионы бактерий, которые могут влиять на его здоровье и здоровье мозга, что может влиять на способность думать и влиять на эмоции.
Стресс связан с изменениями кишечных бактерий, которые, в свою очередь, могут влиять на настроение. Таким образом, кишечные нервы и бактерии сильно влияют на мозг и наоборот.
Стресс в раннем детстве может изменить развитие нервной системы, а также то, как организм реагирует на стресс.Эти изменения могут увеличить риск более поздних заболеваний кишечника или дисфункции.
Пищевод
В состоянии стресса люди могут есть намного больше или намного меньше, чем обычно. Увеличение количества различных продуктов или увеличение употребления алкоголя или табака может привести к изжоге или кислотному рефлюксу. Стресс или истощение также могут усилить регулярно возникающую изжогу. В редких случаях спазмы пищевода могут быть вызваны сильным стрессом и могут быть ошибочно приняты за сердечный приступ.
Стресс также может затруднить глотание пищи или увеличить количество проглатываемого воздуха, что увеличивает отрыжку, газообразование и вздутие живота.
Желудок
Стресс может облегчить боль, вздутие живота, тошноту и другой дискомфорт в желудке. При достаточно сильном стрессе может возникнуть рвота. Кроме того, стресс может вызвать ненужное повышение или снижение аппетита. Нездоровое питание, в свою очередь, может ухудшить настроение.
Вопреки распространенному мнению, стресс не увеличивает выработку кислоты в желудке и не вызывает язвы желудка.Последние на самом деле вызваны бактериальной инфекцией. При стрессе язвы могут причинять больше беспокойства.
Кишечник
Стресс также может облегчить боль, вздутие живота или дискомфорт в кишечнике. Это может повлиять на скорость движения пищи по телу, что может вызвать диарею или запор. Кроме того, стресс может вызвать мышечные спазмы в кишечнике, которые могут быть болезненными.
Стресс может повлиять на пищеварение и на то, какие питательные вещества усваиваются кишечником. Производство газа, связанное с абсорбцией питательных веществ, может увеличиться.
Кишечник имеет плотный барьер для защиты организма от (большинства) пищевых бактерий. Стресс может ослабить кишечный барьер и позволить кишечным бактериям проникнуть в организм. Хотя с большинством этих бактерий легко справляется иммунная система и они не вызывают у нас болезней, постоянная низкая потребность в воспалительном действии может привести к хроническим легким симптомам.
Стресс особенно влияет на людей с хроническими заболеваниями кишечника, такими как воспалительные заболевания кишечника или синдром раздраженного кишечника.Это может быть связано с повышенной чувствительностью кишечных нервов, изменениями микробиоты кишечника, изменениями скорости движения пищи по кишечнику и / или изменениями иммунных реакций кишечника.
Смешанное заболевание соединительной ткани — Симптомы и причины
Обзор
Смешанное заболевание соединительной ткани (MCTD) имеет признаки и симптомы сочетания заболеваний, в первую очередь волчанки, склеродермии и полимиозита. Многие люди с этим необычным заболеванием также страдают синдромом Шегрена.По этой причине MCTD иногда называют болезнью перекрытия.
При смешанном заболевании соединительной ткани симптомы отдельных заболеваний обычно проявляются не сразу. Вместо этого они, как правило, возникают в течение нескольких лет, что может усложнить диагностику.
Ранние признаки и симптомы часто связаны с руками. Пальцы могут опухать, а кончики пальцев становиться белыми и немеющими, часто в результате воздействия холода. На более поздних стадиях могут быть поражены некоторые органы, такие как легкие, сердце и почки.
Нет лекарства от смешанного заболевания соединительной ткани. Лечение зависит от тяжести заболевания и пораженных органов.
Товары и услуги
Показать больше товаров от Mayo ClinicСимптомы
Ранние признаки смешанного заболевания соединительной ткани могут включать:
- Общее недомогание. Это может включать повышенную утомляемость и легкий жар.
- Холодные и онемевшие пальцы рук или ног (феномен Рейно). В ответ на холод или стресс пальцы рук и ног могут стать белыми, а затем багрово-синими. После согревания краснеют пальцы рук или ног.
- Опухшие пальцы или руки. У некоторых людей опухание пальцев.
- Боль в мышцах и суставах. Суставы могут воспаляться, опухать и деформироваться, как при ревматоидном артрите.
- Сыпь. Красные или красновато-коричневые пятна могут появляться на суставах пальцев.
Когда обращаться к врачу
Обратитесь к врачу, если у вас есть признаки и симптомы, мешающие распорядку дня, особенно если вам поставили диагноз волчанка или другое заболевание соединительной ткани.
Причины
Смешанное заболевание соединительной ткани — это аутоиммунное заболевание, причина которого неизвестна. При аутоиммунных заболеваниях ваша иммунная система, отвечающая за борьбу с болезнями, по ошибке атакует здоровые клетки.
При заболеваниях соединительной ткани ваша иммунная система атакует волокна, которые обеспечивают основу и поддержку вашего тела. Некоторые люди со смешанным заболеванием соединительной ткани имеют семейный анамнез этого заболевания. Но роль генетики в заболевании остается неясной.
Факторы риска
Смешанное заболевание соединительной ткани может возникнуть у людей любого возраста. Однако чаще всего это встречается у женщин в возрасте до 50 лет.
Осложнения
Смешанное заболевание соединительной ткани может привести к серьезным осложнениям, некоторые из которых могут быть фатальными.Осложнения включают:
- Повышенное артериальное давление в легких (легочная гипертензия). Это состояние является основной причиной смерти людей со смешанным заболеванием соединительной ткани.
- Интерстициальная болезнь легких. Эта большая группа заболеваний может вызывать рубцы в легких, что влияет на вашу способность дышать.
- Порок сердца. Части сердца могут увеличиваться или вокруг сердца может возникать воспаление. Возможна сердечная недостаточность.
- Поражение почек. Примерно у четверти людей со смешанным заболеванием соединительной ткани возникают проблемы с почками. Поражение почек обычно бывает легким, но может привести к почечной недостаточности.
- Повреждение пищеварительного тракта. Обычно смешанное заболевание соединительной ткани поражает пищеварительный тракт. У вас могут возникнуть боли в животе и проблемы с глотанием и перевариванием пищи.
- Анемия. Около 75% людей со смешанным заболеванием соединительной ткани страдают железодефицитной анемией.
- Смерть ткани. У людей с тяжелой формой болезни Рейно может развиться гангрена пальцев.
- Потеря слуха. В одном небольшом исследовании потеря слуха наблюдалась почти у половины пациентов со смешанным заболеванием соединительной ткани. Чтобы понять эту связь, необходимы дополнительные исследования.
- Повреждение нерва. Синдром Шегрена может повлиять на нерв, передающий ощущение от вашего лица к мозгу (тройничный нерв). Если у вас невралгия тройничного нерва, даже легкая стимуляция лица — например, чистка зубов или нанесение макияжа — может вызвать приступ сильной боли.
Риски каскада прописывания
Популярное лекарство от высокого кровяного давления, которым страдает огромное количество пожилых людей, часто вызывает каскад назначения, сказал доктор Андерсон.
Он процитировал канадское исследование 41 000 пожилых людей с гипертонией, которым прописывали лекарства, называемые блокаторами кальциевых каналов. В течение года после начала лечения почти один человек из 10 получил мочегонное средство для лечения отека ног, вызванного первым лекарством.Многим неправильно прописали так называемый петлевой диуретик, который, по словам доктора Андерсона, может вызвать обезвоживание, проблемы с почками, головокружение и падения.
Диабет 2 типа — еще одно распространенное заболевание, при котором лекарства часто неправильно назначаются для лечения побочных эффектов, вызванных лекарствами, сказала Лиза М. Маккарти, доктор фармацевтики Университета Торонто, руководившая канадским исследованием. Выявление побочного эффекта может быть затруднено, если эффект не проявляется в течение недель или даже месяцев после начала приема лекарства.Хотя пациенты, принимающие опиоиды от боли, могут легко распознать запор как следствие, доктор Маккарти сказал, что со временем у пациентов, принимающих метформин от диабета, может развиться диарея и они могут самостоятельно лечиться лоперамидом, что, в свою очередь, может вызвать головокружение и спутанность сознания.
Доктор Паула Рочон, гериатр больницы женского колледжа в Онтарио, сказала, что у пациентов, принимающих лекарство, называемое ингибитором холинэстеразы, для лечения ранней деменции, может развиться недержание мочи, которое затем лечится другим лекарством, которое может усугубить спутанность сознания.
Ситуацию усложняет употребление большого количества наркотиков. «Пожилые люди часто принимают много лекарств, две пятых принимают пять или более», — написал доктор Андерсон в JAMA Internal Medicine. В случаях, как это называется полипрагмазией, может быть трудно определить, какие лекарства, если таковые имеются, являются причиной текущего симптома.
Доктор Рочон подчеркнул, что каскад прописывания может случиться с каждым. Она сказала: «Каждый должен учитывать возможность каждого назначения лекарства.
Прежде чем принимать рецепт, она рекомендовала пациентам или их опекунам задать врачу ряд вопросов, начиная с «Испытываю ли я симптом, который может быть побочным эффектом лекарства, которое я принимаю?» Последующие вопросы должны включать:
Используется ли этот новый препарат для лечения побочного эффекта?
Есть ли более безопасный препарат, чем тот, который я принимаю?
Современная концепция абдоминального сепсиса: документ с изложением позиции WSES | Всемирный журнал неотложной хирургии
Мазуски Ю.Е., Соломкин Ю.С.: Внутрибрюшные инфекции. Surg Clin North Am. 2009, 89 (2): 421-437. 10.1016 / j.suc.2008.12.001.
PubMed Google ученый
Бабинчак Т., Эллис-Гросс Э, Дартуа Н., Роуз Г.М., Ло Э .: Эффективность и безопасность тигециклина для лечения осложненных внутрибрюшных инфекций: анализ объединенных клинических данных. Clin Infect Dis. 2005, 41 (Приложение 5): S354-S367.
CAS PubMed Google ученый
Merlino JI, Malangoni MA, Smith CM, Lange RL: Проспективные рандомизированные исследования влияют на исходы внутрибрюшной инфекции. Ann Surg. 2001, 233 (6): 859-866. 10.1097 / 00000658-200106000-00017.
PubMed Central CAS PubMed Google ученый
Mazuski JE, Sawyer RG, Nathens AB, DiPiro JT, Schein M, Kudsk KA, Yowler C: Комитет по терапевтическим средствам общества хирургических инфекций. Руководство Общества хирургической инфекции по антимикробной терапии интраабдоминальных инфекций: доказательства для рекомендаций.Хирургическая инфекция (Larchmt). 2002, 3 (3): 175-233. 10.1089 / 109629602761624180.
Google ученый
Sartelli M, Catena F, Ansaloni L, Leppaniemi A, Taviloglu K, van Goor H, Viale P, Lazzareschi DV, Coccolini F, Corbella D, de Werra C, Marrelli D, Colizza S, Scibè R, Алис Х., Торер Н., Наварро С., Сакакушев Б., Массалоу Д., Августин Г., Катани М., Кауханен С., Плетинкс П., Кениг Дж., Ди Саверио С., Джовин Е., Гуэрчони Дж., Скровина М., Диас-Нието Р., Ферреро А. и др.: Осложненные внутрибрюшные инфекции в Европе: всесторонний обзор исследования CIAO.Мир J Emerg Surg. 2012, 7 (1): 36-10.1186 / 1749-7922-7-36.
PubMed Central PubMed Google ученый
LaRosa SP: Сепсис: Меню новых подходов заменяет одну терапию для всех. Cleve Clin J Med. 2002, 69: 65-73. 10.3949 / ccjm.69.1.65.
PubMed Google ученый
Леви М.М., Финк М.П., Маршалл Дж. К., Абрахам Э., Ангус Д., Кук Д., Коэн Дж., Опал С. М., Винсент Дж. Л., Рамзи Г.: Международная конференция по определениям сепсиса SCCM / ESICM / ACCP / ATS / SIS.Crit Care Med. 2001, 2003 (31): 1250-1256.
Google ученый
Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ: Конференция консенсуса Американского колледжа врачей-терапевтов / общества специалистов по интенсивной терапии: определения сепсиса и органной недостаточности и рекомендации по использованию инновационных методов лечения сепсиса. Грудь. 1992, 101: 1644-1655. 10.1378 / сундук.101.6.1644.
CAS PubMed Google ученый
Jones AE, Yiannibas V, Johnson C, Kline JA: Гипотония отделения неотложной помощи предсказывает внезапную неожиданную внутрибольничную смертность: проспективное когортное исследование. Грудь. 2006, 130: 941-946.
PubMed Google ученый
Эстебан А., Фрутос-Вивар Ф, Фергюсон Н. Д., Пеньуэлас О, Лоренте Дж. А., Гордо Ф, Гонрубия Т., Альгора А, Бустос А., Гарсия Г., Диас-Реганьон И. Р., де Луна Р. Р.: Заболеваемость сепсисом и Результат: контрастирование отделения интенсивной терапии и больничной палаты.Crit Care Med. 2007, 35 (5): 1284-1289. 10.1097 / 01.CCM.0000260960.94300.DE.
PubMed Google ученый
Деллинджер Р.П., Леви М.М., Родос А., Аннан Д., Герлах Х., Опал С.М., Севрански Дж. Э., Спрунг К.Л., Дуглас И.С., Яешке Р., Осборн Т.М., Наннелли М.Э., Таунсенд С.Р., Рейнхарт К., Кляйнпелл Р.М. , Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb S, Beale RJ, Vincent JL, Moreno R: Комитет по руководящим принципам кампании по выживанию сепсиса, включая педиатрическую подгруппу.Кампания по выживанию после сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока, 2012 г. Intensive Care Med. 2013, 39 (2): 165-228. 10.1007 / s00134-012-2769-8.
CAS PubMed Google ученый
Цукада К., Като Х., Сиодзима М., Сузуки Т., Такеношита С., Нагамачи Ю.: Концентрации цитокинов в перитонеальной жидкости после абдоминальной хирургии. Eur J Surg. 1993, 159: 475-479.
CAS PubMed Google ученый
Patel RT, Deen KI, Youngs D, Warwick J, Keighley MR: Интерлейкин 6 является прогностическим индикатором исхода тяжелого внутрибрюшного сепсиса. Br J Surg. 1994, 81: 1306-1308. 10.1002 / bjs.1800810914.
CAS PubMed Google ученый
Damas P, Ledoux D, Nys M, Vrindts Y, de Groote D, Franchimont P, Lamy M: Уровень цитокинов в сыворотке крови во время тяжелого сепсиса у человека. Il6 как маркер серьезности. Ann Surg. 1992, 215: 356-362.10.1097 / 00000658-199204000-00009.
PubMed Central CAS PubMed Google ученый
Holzheimer RG, Schein M, Wittmann DH: Воспалительная реакция в перитонеальном экссудате и плазме у пациентов, перенесших плановую релапаротомию по поводу тяжелого вторичного перитонита. Arch Surg. 1995, 130: 1314-1319. 10.1001 / archsurg.1995.01430120068010.
CAS PubMed Google ученый
Cavaillon JM, Munoz C, Фитинг C, Misset B, Carlet J: Циркулирующие цитокины: верхушка айсберга ?. Circ Shock. 1992, 38 (2): 145-152.
CAS PubMed Google ученый
Мартино Л., Шек П.Н.: Концентрации перитонеальных цитокинов и результаты выживаемости в экспериментальной модели перитонита с бактериальной инфузией. Crit Care Med. 2000, 28 (3): 788-794. 10.1097 / 00003246-200003000-00030.
CAS PubMed Google ученый
Hendriks T, Bleichrodt RP, Lomme RM, de Man BM, van Goor H, Buyne OR: Перитонеальные цитокины позволяют прогнозировать смертность крыс после хирургического лечения вторичного перитонита. J Am Coll Surg. 2010, 211: 263-270. 10.1016 / j.jamcollsurg.2010.03.038.
PubMed Google ученый
Riché F, Gayat E, Collet C, Matéo J, Laisné MJ, Launay JM, Valleur P, Payen D, Cholley BP: Местный и системный врожденный иммунный ответ на вторичный перитонит человека.Crit Care. 2013, 17 (5): R201-10.1186 / cc12895.
PubMed Central PubMed Google ученый
Angus DC, van der Poll T: Тяжелый сепсис и септический шок. N Engl J Med. 2013, 369 (9): 840-851. 10.1056 / NEJMra1208623.
CAS PubMed Google ученый
Sartelli M, Viale P, Catena F, Ansaloni L, Moore E, Malangoni M, Moore FA, Velmahos G, Coimbra R, Ivatury R, Peitzman A, Koike K, Leppaniemi A, Biffl W, Burlew CC , Balogh ZJ, Boffard K, Bendinelli C, Gupta S, Kluger Y, Agresta F, di Saverio S, Wani I, Escalona A, Ordonez C, Fraga GP, Junior GA, Bala M, Cui Y, Marwah S и другие: Рекомендации WSES 2013 по ведению внутрибрюшных инфекций.Мир J Emerg Surg. 2013, 8 (1): 3-10.1186 / 1749-7922-8-3. DOI: 10.1186 / 1749-7922-8-3
PubMed Central PubMed Google ученый
Эмми В., Сганга Г.: Диагностика внутрибрюшных инфекций: клинические данные и изображения. Infez Med. 2008, 16 (Приложение 1): 19-30.
PubMed Google ученый
Jaramillo EJ, Treviño JM, Berghoff KR, Franklin ME Jr: Прикроватная диагностическая лапароскопия в отделении интенсивной терапии: 13-летний опыт работы.JSLS. 2006, 10 (2): 155-159.
PubMed Central PubMed Google ученый
Ceribelli C, Adami EA, Mattia S, Benini B: Прикроватная диагностическая лапароскопия для пациентов в критическом состоянии: ретроспективное исследование 62 пациентов. Surg Endosc. 2012, 26 (12): 3612-5. 10.1007 / s00464-012-2383-4.
PubMed Google ученый
Шани В., Мухтар Е., Карив Г., Робеншток Е., Лейбовичи Л.: Систематический обзор и метаанализ эффективности соответствующей эмпирической антибиотикотерапии при сепсисе.Антимикробные агенты Chemother. 2010, 54 (11): 4851-4863. 10.1128 / AAC.00627-10.
PubMed Central PubMed Google ученый
Феррер Р., Артигас А., Суарес Д., Паленсия Е., Леви М. М., Аренсана А., Перес XL, Сирвент Дж. М., Исследовательская группа Эдусепсиса: Исследовательская группа Эдусепсиса: эффективность лечения тяжелого сепсиса: перспективный, многоцентровый, наблюдательное исследование. Am J Respir Crit Care Med. 2009, 180: 861-866. 10.1164 / rccm.200812-1912OC.
Castellanos-Ortega A, Suberviola B, García-Astudillo LA, Holanda MS, Ortiz F, Llorca J, Delgado-Rodríguez M: Влияние протоколов выживших сепсис-кампаний на продолжительность пребывания в больнице и смертность при септическом шоке Пациенты: результаты трехлетнего квазиэкспериментального исследования. Crit Care Med. 2010, 38: 1036-1043. 10.1097 / CCM.0b013e3181d455b6.
PubMed Google ученый
Puskarich MA, Trzeciak S, Shapiro NI, rnold RC, Horton JM, Studnek JR, Kline JA, Jones AE, Emergency Medicine Shock Research Network (EMSHOCKNET): Сеть исследований экстренной медицины шока (EMSHOCKNET): связь между сроки введения антибиотиков и смертность от септического шока у пациентов, получавших количественный протокол реанимации.Crit Care Med. 2011, 39: 2066-2071. 10.1097 / CCM.0b013e31821e87ab.
PubMed Central CAS PubMed Google ученый
Riché FC, Dray X, Laisné MJ, Matéo J, Raskine L, Sanson-Le Pors MJ, Payen D, Valleur P, Cholley BP: Факторы, связанные с септическим шоком и смертностью при генерализованном перитоните: сравнение между сообществами -приобретенный и послеоперационный перитонит. Crit Care. 2009, 13 (3): R99-10.1186 / cc7931.
PubMed Central PubMed Google ученый
Фрай Д: Общий ответ. Crit Care Med. 2008, 36: 1369-1370. 10.1097 / CCM.0b013e31816a11e9.
PubMed Google ученый
Тан Б.М., Маклин А.С., Дауэс И.В., Хуанг С.Дж., Коули М.Дж., Лин Р.С.: Профилирование экспрессии генов грамположительного и грамотрицательного сепсиса у тяжелобольных пациентов. Crit Care Med. 2008, 36: 1125-1128. 10.1097 / CCM.0b013e3181692c0b.
CAS PubMed Google ученый
Montravers P, Andremont A, Massias L, Carbon C: Исследование потенциальной роли Enterococcus faecalis в патофизиологии экспериментального перитонита. J Infect Dis. 1994, 169: 821-830. 10.1093 / infdis / 169.4.821.
CAS PubMed Google ученый
Montravers P, Mohler J, Saint Julien L, Carbon C: Доказательства провоспалительной роли enterococcus faecalis в полимикробном перитоните у крыс. Заражение иммунной.1997, 65: 144-149.
PubMed Central CAS PubMed Google ученый
Höffken G, Niederman M: Нозокомиальная пневмония. Важность стратегии деэскалации антибиотикотерапии пневмонии в отделениях интенсивной терапии. Грудь. 2002, 122: 2183-2196. 10.1378 / сундук.122.6.2183.
PubMed Google ученый
Rello J, Vidaur L, Sandiumenge A, Rodríguez A, Gualis B, Boque C, Diaz E: Деэскалационная терапия при ИВЛ-ассоциированной пневмонии.Crit Care Med. 2004, 32: 2183-2190.
PubMed Google ученый
Pea F, Viale P: От кабинета до постели больного: соответствующая антибактериальная терапия при тяжелом сепсисе и септическом шоке — имеет ли значение доза ?. Crit Care. 2009, 13 (3): 214-10.1186 / cc7774.
PubMed Central PubMed Google ученый
Hatala R, Dinh T, Cook DJ: Дозирование аминогликозидов один раз в день у иммунокомпетентных взрослых: метаанализ.Ann Intern Med. 1996, 124: 717-725. 10.7326 / 0003-4819-124-8-199604150-00003.
CAS PubMed Google ученый
McKenzie C: Дозирование антибиотиков при критическом заболевании. J Antimicrob Chemother. 2011, 66 (Приложение 2): ii25-ii31.
CAS PubMed Google ученый
Робертс Дж., Липман Дж., Блот С., Релло Дж.: Улучшение результатов за счет непрерывной инфузии антибиотиков, зависящих от времени, тяжелобольным пациентам ?.Curr Opin Crit Care. 2008, 14 (4): 390-396. 10.1097 / MCC.0b013e3283021b3a.
PubMed Google ученый
Соломкин JS, Mazuski JE, Брэдли JS, Родволд К.А., Голдштейн EJ, Барон EJ, О’Нил П.Дж., Чоу А.В., Деллинджер Е.П., Eachempati SR, Горбач С., Хилфикер М., Мэй А.К., Натенс А.Б., Сойер Р.Г., Бартлетт Дж. Г.: Диагностика и лечение осложненных внутрибрюшных инфекций у взрослых и детей: рекомендации Общества хирургических инфекций и Общества инфекционных болезней Америки.Clin Infect Dis. 2010, 50 (2): 133-164. 10.1086 / 649554.
PubMed Google ученый
Пауэлл Л.Л., Уилсон С.Е.: Роль бета-лактамных противомикробных препаратов как отдельных агентов в лечении интраабдоминальной инфекции. Хирургическая инфекция (Larchmt). 2000, 1 (1): 57-63. 10.1089 / 109629600321308.
CAS Google ученый
Аль-Хасан М.Н., Лар Б.Д., Экель-Пассов Дж. Э., Баддур Л. М.: Тенденции устойчивости к противомикробным препаратам изолятов кровотока Escherichia coli: популяционное исследование, 1998–2007 гг.J Antimicrob Chemother. 2009, 64 (1): 169-174. 10.1093 / jac / dkp162.
PubMed Central CAS PubMed Google ученый
Jones RN, Huynh HK, Biedenbach DJ, Fritsche TR, Sader HS: Дорипенем (S-4661), новый карбапенем: сравнительная активность против современных патогенов, включая бактерицидное действие и предварительные оценки методов in vitro. J Antimicrob Chemother. 2004, 54 (1): 144-154. 10.1093 / jac / dkh398.
CAS PubMed Google ученый
Brown SD, Traczewski MM: Сравнительная антимикробная активность in vitro нового карбапенема, дорипенема: предварительные критерии дисковой диффузии и контроль качества. J Antimicrob Chemother. 2005, 55 (6): 944-949. 10.1093 / jac / dki134.
CAS PubMed Google ученый
Михалопулос А.С., Караца, округ Колумбия: грамотрицательные инфекции с множественной лекарственной устойчивостью: использование колистина. Эксперт Rev Anti Infect Ther. 2010, 8 (9): 1009-1017. 10.1586 / eri.10.88.
CAS PubMed Google ученый
Папапараскевас Дж., Цувелекис Л.С., Цакрис А., Питтарас Т.Э., Легакис Нью-Джерси: Греческая группа исследования тигециклина: активность тигециклина in vitro против 2423 клинических изолятов и сравнение имеющихся точек разрыва интерпретации. Диагностика Microbiol Infect Dis. 2010, 66 (2): 187-194. 10.1016 / j.diagmicrobio.2009.09.012.
CAS PubMed Google ученый
Sekowska A, Gospodarek E: Восприимчивость к Klebsiella spp. к тигециклину и другим избранным антибиотикам. Med Sci Monit. 2010, 16 (6): BR193-BR196.
CAS PubMed Google ученый
Штейн Г.Е., Бабинчак Т: Тигециклин: обновление. Диагностика Microbiol Infect Dis. 2013, 75 (4): 331-336. 10.1016 / j.diagmicrobio.2012.12.004.
CAS PubMed Google ученый
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США: Информационное сообщение FDA по безопасности лекарств: повышенный риск смерти при применении Tygacil (тигециклин) по сравнению с другими антибиотиками, используемыми для лечения аналогичных инфекций [онлайн]. Доступно по URL: http://www.fda.gov/Drugs/DrugSafety/ucm224370.htm
Stein GE, Smith CL, Missavage A, Saunders JP, Nicolau DP, Battjes SM, Kepros JP: проникновение тигециклина в кожу и мягкие ткани. Хирургическая инфекция (Larchmt). 2011, 12 (6): 465-467. 10.1089 / сур.2011.022.
Google ученый
Zonios DI, Bennett JE: Последняя информация по азольным противогрибковым средствам. Semin Respir Crit Care Med. 2008, 29 (2): 198-210. 10.1055 / с-2008-1063858.
PubMed Google ученый
Pfaller MA, Diekema DJ: Эпидемиология инвазивного кандидоза: постоянная проблема общественного здравоохранения. Clin Microbiol Rev.2007, 20: 133-163. 10.1128 / CMR.00029-06.
PubMed Central CAS PubMed Google ученый
Glockner A: Лечение и профилактика инвазивного кандидоза анидулафунгином, каспофунгином и микафунгином: обзор литературы. Eur J Med Res. 2011, 16 (4): 167-179. 10.1186 / 2047-783Х-16-4-167.
PubMed Central PubMed Google ученый
Chen SC, Slavin MA, Sorrell TC: Противогрибковые препараты эхинокандина при грибковых инфекциях: сравнение. Наркотики. 2011, 71 (1): 11-41. 10.2165 / 11585270-000000000-00000.
PubMed Google ученый
Ostrosky-Zeichner L, Rex JH, Pappas PG, Hamill RJ, Larsen RA, Horowitz HW, Powderly WG, Hyslop N, Kauffman CA, Cleary J, Mangino JE, Lee J: исследование противогрибковой чувствительности 2000 изолятов Candida кровотока в США Состояния. Антимикробные агенты Chemother. 2003, 47: 3149-3154. 10.1128 / AAC.47.10.3149-3154.2003.
PubMed Central CAS PubMed Google ученый
Каримова А., Пинский Д.Д.: Эндотелиальный ответ на кислородную эпривацию: биология и клиническое значение.Intensive Care Med. 2001, 27: 19-31. 10.1007 / s001340000790.
CAS PubMed Google ученый
Бенджамин Э., Лейбовиц А.Б., Оропелло Дж., Иберти Т.Дж.: Системный гипоксический и воспалительный синдром: альтернативное обозначение для «синдрома сепсиса». Crit Care Med. 1992, 20: 680-682. 10.1097 / 00003246-199205000-00022.
CAS PubMed Google ученый
Rivers E: Ранняя целенаправленная терапия при лечении тяжелого сепсиса и септического шока. N Eng J Med. 2001, 345: 1368-1377.
CAS Google ученый
Aduen J, Bernstein WK, Khastgir T, Miller J, Kerzner R, Bhatiani A, Miller J, Kerzner R, Bhatiani A, Lustgarten J, Bassin AS, Davison L, Chernow B: Использование и клиническое значение субстрат-специфического электрода для быстрого определения концентрации лактата в крови.ДЖАМА. 1994, 272: 1678-1685. 10.1001 / jama.1994.03520210062033.
CAS PubMed Google ученый
Mikkelsen ME, Miltiades AN, Gaieski DF, Goyal M, Fuchs BD, Shah CV, Bellamy SL, Christie JD: Лактат сыворотки связан со смертностью при тяжелом сепсисе независимо от органной недостаточности и шока. Crit Care Med. 2009, 37: 1670-1677. 10.1097 / CCM.0b013e31819fcf68.
CAS PubMed Google ученый
Trzeciak S, Dellinger RP, Chansky ME, Arnold RC, Schorr C, Milcarek B, Hollenberg SM, Parrillo JE: Лактат в сыворотке как предиктор смертности у пациентов с инфекцией. Intensive Care Med. 2007, 33: 970-977. 10.1007 / s00134-007-0563-9.
CAS PubMed Google ученый
Шапиро Н.И., Хауэлл, доктор медицины, Талмор Д., Натансон Л.А., Лиссабон А., Вулф Р.Э., Вайс Дж.В.: Лактат в сыворотке как предиктор смертности у инфицированных пациентов отделения неотложной помощи.Ann Emerg Med. 2005, 45: 524-528. 10.1016 / j.annemergmed.2004.12.006.
PubMed Google ученый
Pearse RM: Расширение роли измерения лактата в догоспитальных условиях. Crit Care. 2009, 13: 115-10.1186 / cc7687.
PubMed Central PubMed Google ученый
Nguyen HB, Rivers EP, Knoblich BP, Jacobsen G, Muzzin A, Ressler JA, Tomlanovich MC: Ранний клиренс лактата связан с улучшенным исходом при тяжелом сепсисе и септическом шоке.Crit Care Med. 2004, 32: 1637-1642. 10.1097 / 01.CCM.0000132904.35713.A7.
PubMed Google ученый
Джеймс Дж. Х., Лушетт Ф. А., Маккартер Ф. Д., Фишер Дж. Э .: Лактат — ненадежный индикатор гипоксии тканей при травме или сепсисе. Ланцет. 1999, 354: 505-508. 10.1016 / S0140-6736 (98) 91132-1.
CAS PubMed Google ученый
Dugas D, Mackenhauer J, Joyce N, Donnino M: Распространенность и характеристики нелактатных и лактатных экспрессоров при септическом шоке.Crit Care Med. 2009, 37 (доп.): A227-
Google ученый
Cannon CM, для многоцентровой тяжелой S, совместный септический шок G. Проект GENESIS (GENeralization of Early Sepsis InterventionS): многоцентровое сотрудничество по повышению качества. Acad Emerg Med. 2010, 17: 1258-
Google ученый
Перель П., Робертс I. Коллоиды по сравнению с кристаллоидами для жидкостной реанимации у тяжелобольных пациентов.Кокрановская база данных Syst Rev.2011, 3: CD000567-
PubMed Google ученый
Walker J, Criddle LM: Патофизиология и лечение синдрома брюшной полости. Am J Crit Care. 2003, 12 (4): 367-371.
PubMed Google ученый
Brandt S, Regueira T, Bracht H, Porta F, Djafarzadeh S, Takala J, Gorrasi J, Borotto E, Krejci V, Hiltebrand LB, Bruegger LE, Beldi G, Wilkens L, Lepper PM, Kessler U , Якоб С.М.: Влияние жидкостной реанимации на смертность и функцию органов в экспериментальных моделях сепсиса.Crit Care. 2009, 13 (6): R186-10.1186 / cc8179.
PubMed Central PubMed Google ученый
Харви С., Янг Д., Брамптон В., Купер А.Б., Дойг Г., Сиббальд В., Роуэн К. Катетеры легочной артерии для взрослых пациентов в отделении интенсивной терапии. Кокрановская база данных Syst Rev.2006, 19 (3): CD003408
Google ученый
Charron C, Caille V, Jardin F, Vieillard-Baron A: Эхокардиографическое измерение чувствительности к жидкости.Curr Opin Crit Care. 2006, 12 (3): 249-254. 10.1097 / 01.ccx.0000224870.24324.cc.
PubMed Google ученый
Manasia AR, Nagaraj HM, Kodali RB, Croft LB, Oropello JM, Kohli-Seth R, Leibowitz AB, DelGiudice R, Hufanda JF, Benjamin E, Goldman ME: осуществимость и потенциальная клиническая полезность целевого трансторакальная эхокардиография, выполняемая специалистами-реаниматологами, не являющимися кардиологами, с использованием небольшого переносного устройства (SonoHeart) тяжелобольным пациентам.J Cardiothorac Vasc Anesth. 2005, 19 (2): 155-9. 10.1053 / j.jvca.2005.01.023.
PubMed Google ученый
Zhang Z, Xu X, Yao M, Chen H, Ni H, Fan H: Использование системы PiCCO у тяжелобольных пациентов с септическим шоком и острым респираторным дистресс-синдромом: протокол исследования для рандомизированного контролируемого исследования . Испытания. 2013, 14: 32-10.1186 / 1745-6215-14-32.
PubMed Central PubMed Google ученый
Мартин С., Папазиан Л., Перрин Дж., Соукс П., Гуен Ф .: Норэпинефрин или дофамин для лечения гипердинамического септического шока ?. Грудь. 1993, 103 (6): 1826-1831. 10.1378 / сундук.103.6.1826.
CAS PubMed Google ученый
de Backer D, Aldecoa C, Njimi H, Vincent JL: Дофамин против норадреналина в лечении септического шока: метаанализ *. Crit Care Med. 2012, 40 (3): 725-730. 10.1097 / CCM.0b013e31823778ee.
CAS PubMed Google ученый
Ренье Б., Рапин М., Гори Дж., Лемер Ф, Тейссер Б., Харари А. Гемодинамические эффекты дофамина при септическом шоке. Intensive Care Med. 1977, 3: 47-53. 10.1007 / BF01683060.
CAS PubMed Google ученый
Сегин П., Беллиссант Э, Ле Талзо И, Лавиолль Б, Лессард Й, Томас Р., Малледан Y: Эффекты адреналина по сравнению с комбинацией добутамина и норэпинефрина на перфузию желудка при септическом шоке.Clin Pharmacol Ther. 2002, 71: 381-388. 10.1067 / mcp.2002.122471.
CAS PubMed Google ученый
Myburgh JA, Higgins A, Jovanovska A, CAT Исследователи исследования: Сравнение адреналина и норадреналина у пациентов в критическом состоянии. Intensive Care Med. 2008, 34: 2226-2234. 10.1007 / s00134-008-1219-0.
PubMed Google ученый
Холмс К.Л., Патель Б.М., Рассел Дж.А., Уолли К.Р., Уолли К.Р.: физиология вазопрессина, имеющая отношение к лечению септического шока.Грудь. 2001, 120: 989-1002. 10.1378 / сундук.120.3.989.
CAS PubMed Google ученый
White LE, Hassoun HT, Bihorac A, Moore LJ, Sailors RM, McKinley BA, Valdivia A, Moore FA: Острое повреждение почек на удивление распространено и является мощным предиктором смертности при хирургическом сепсисе. J Trauma Acute Care Surg. 2013, 75 (3): 432-438. 10.1097 / TA.0b013e31829de6cd.
PubMed Google ученый
Маршалл Дж. К.: Принципы контроля источников в раннем ведении сепсиса. Curr Infect Dis Rep. 2010, 12 (5): 345-353. 10.1007 / s11908-010-0126-z.
PubMed Google ученый
Маршалл Дж. К., аль-Накби А: Принципы контроля источников при лечении сепсиса. Crit Care Clin. 2009, 25 (4): 753-768. 10.1016 / j.ccc.2009.08.001.
PubMed Google ученый
Wacha H, Hau T, Dittmer R, Ohmann C: Факторы риска, связанные с внутрибрюшными инфекциями: проспективное многоцентровое исследование. Группа исследования перитонита. langenbecks Arch Surg. 1999, 384: 24-32. 10.1007 / s004230050169.
CAS PubMed Google ученый
Сугимото К., Хирата М., Кикуно Т., Такишима Т., Маэкава К., Охвада Т.: Интраоперационный перитонеальный лаваж большого объема с вспомогательным устройством для лечения перитонита, вызванного тупым травматическим разрывом тонкой кишки.J Trauma. 1995, 39 (4): 689-692. 10.1097 / 00005373-199510000-00013.
CAS PubMed Google ученый
Лопес Н., Кобаяши Л., Коимбра Р.: Всесторонний обзор инфекций брюшной полости. Мир J Emerg Surg. 2011, 6: 7-10.1186 / 1749-7922-6-7.
PubMed Central PubMed Google ученый
Agresta F, Ciardo LF, Mazzarolo G, Michelet I, Orsi G, Trentin G, Bedin N: Перитонит: лапароскопический доступ.Мир J Emerg Surg. 2006, 24: 1-9.
Google ученый
Андерсон И.Д., Фирон К.С., Грант И.С.: Лапаротомия при абдоминальном сепсисе у тяжелобольных. Br J Surg. 1996, 83 (4): 535-539. 10.1002 / bjs.1800830434.
CAS PubMed Google ученый
Коперна Т., Семмлер Д., Мариан Ф .: Стратификация риска у пациентов, нуждающихся в неотложной хирургической помощи: является ли шкала APACHE II надежным маркером физиологического нарушения?Arch Surg. 2001, 136 (1): 55-59. 10.1001 / archsurg.136.1.55.
CAS PubMed Google ученый
van Ruler O, Kiewiet JJ, Boer KR, Lamme B, Gouma DJ, Boermeester MA, Reitsma JB: Отказ имеющихся систем оценки для прогнозирования продолжающейся инфекции у пациентов с абдоминальным сепсисом после их первоначальной экстренной лапаротомии. BMC Surg. 2011, 23: 11-38.
Google ученый
Коперна Т., Шульц Ф: Релапаротомия при перитоните: прогноз и лечение пациентов с персистирующей внутрибрюшной инфекцией. Мир J Surg. 2000, 24 (1): 32-37. 10.1007 / s002689
CAS PubMed Google ученый
ван Рюлер О., Ламме Б., де Вос Р., Обертоп Х., Рейцма Дж. Б., Бурмеестер М.А.: Принятие решения о релапаротомии при вторичном перитоните. Dig Surg. 2008, 25 (5): 339-346. 10.1159 / 000158911.
CAS PubMed Google ученый
Ламме Б., Малер К. В., ван Рюлер О., Гума Д. Д., Рейцма Дж. Б., Бурмеестер М. А.: Клинические предикторы продолжающейся инфекции при вторичном перитоните: систематический обзор. Мир J Surg. 2006, 30 (12): 2170-2181. 10.1007 / s00268-005-0333-1.
PubMed Google ученый
Hinsdale JG, Jaffe BM: Повторная операция по поводу внутрибрюшного сепсиса. Показания и результаты в условиях современной реанимации. Ann Surg. 1984, 199 (1): 31-36. 10.1097 / 00000658-198401000-00006.
PubMed Central CAS PubMed Google ученый
Хатчинс Р.Р., Ганнинг М.П., Лукас Д.Н., Аллен-Мерш Т.Г., Сони NC: Релапаротомия при подозрении на внутрибрюшинный сепсис после абдоминальной хирургии. Мир J Surg. 2004, 28 (2): 137-141. 10.1007 / s00268-003-7067-8.
PubMed Google ученый
van Ruler O, Lamme B, Gouma DJ, Reitsma JB, Boermeester MA: переменные, связанные с положительными результатами при релапаротомии у пациентов со вторичным перитонитом.Crit Care Med. 2007, 35 (2): 468-476. 10.1097 / 01.CCM.0000253399.03545.2D.
PubMed Google ученый
Holzheimer RG, Gathof B: Повторная операция при осложненном вторичном перитоните — как определить пациентов с риском стойкого сепсиса. Eur J Med Res. 2003, 8 (3): 125-134.
CAS PubMed Google ученый
van Ruler O, Mahler CW, Boer KR, Reuland EA, Gooszen HG, Opmeer BC, de Graaf PW, Lamme B, Gerhards MF, Steller EP, van Till JW, de Borgie CJ, Gouma DJ, Reitsma JB, Boermeester MA: Сравнение стратегии релапаротомии по требованию и плановой релапаротомии у пациентов с тяжелым перитонитом: рандомизированное исследование.ДЖАМА. 2007, 298: 865-872. 10.1001 / jama.298.8.865.
CAS PubMed Google ученый
Робледо Ф.А., Луке-де-Леон Э., Суарес Р., Санчес П., де-ла-Фуэнте М., Варгас А., Майер Дж .: Открытое и закрытое ведение брюшной полости при хирургическом лечении тяжелого вторичного перитонита : рандомизированное клиническое исследование. Хирургическая инфекция (Larchmt). 2007, 8: 63-72. 10.1089 / sur.2006.8.016.
Google ученый
Киркпатрик А.В., Робертс Д.Д., де Вале Дж., Яешке Р., Мальбрейн М.Л., де Келенаер Б., Дюшен Дж., Бьорк М., Леппаниеми А., Эджике Дж. К., Сугрю М., Читам М., Иватури Р., Болл К. Г., Рейнтам Блазер А., Регли A, Балог ZJ, D’Amours S, Debergh D, Kaplan M, Kimball E, Olvera C: Подкомитет по педиатрическим рекомендациям Всемирного общества по синдрому абдоминального отдела. Интраабдоминальная гипертензия и синдром абдоминального компартмента: обновленные согласованные определения и рекомендации по клинической практике Всемирного общества синдрома абдоминального компартмента.Intensive Care Med. 2013, 39 (7): 1190-1206. 10.1007 / s00134-013-2906-z.
PubMed Central PubMed Google ученый
Merrell RC: Брюшная полость как источник сепсиса у тяжелобольных пациентов. Crit Care Clin. 1995, 11 (2): 255-272.
CAS PubMed Google ученый
Вайбель Б.Х., Ротондо М.Ф .: Контроль повреждений при травмах и абдоминальном сепсисе.Crit Care Med. 2010, 38 (9 доп.): S421-S430.
PubMed Google ученый
Янсен Дж.О., Лаудон М.А.: Хирургия контроля повреждений в нетравматических условиях. Br J Surg. 2007, 94 (7): 789-790. 10.1002 / bjs.5922.
CAS PubMed Google ученый
Амин А.И., Шейх И.А.: Местное отрицательное давление в лечении тяжелого перитонита: положительный вклад ?.Мир Дж. Гастроэнтерол. 2009, 15 (27): 3394-3397. 10.3748 / wjg.15.3394.
PubMed Central PubMed Google ученый
Schmelzle M, Alldinger I, Matthaei H, Aydin F, Wallert I, Eisenberger CF, Schulte Am Esch J, Dizdar L, Topp SA, Yang Q, Knoefel W. брюшная полость из-за вторичного перитонита: ретроспективная оценка выбранной группы пациентов. Dig Surg. 2010, 27 (4): 272-278.10.1159 / 000314609.
PubMed Google ученый
Schein M: Планируемые повторные операции и открытое ведение при критических внутрибрюшных инфекциях: предполагаемый опыт в 52 случаях. Мир J Surg. 1991, 15: 537-545. 10.1007 / BF01675658.
CAS PubMed Google ученый
Адкинс А.Л., Роббинс Дж., Вильяльба М., Бендик П., Шанли К.Дж.: Ведение открытой брюшной полости при внутрибрюшном сепсисе.Am Surg. 2004, 70: 137-140.
PubMed Google ученый
Хорвуд Дж., Акбар Ф., Мо А: Первый опыт лапаростомии с немедленной вакуумной терапией у пациентов с тяжелым перитонитом. Ann R Coll Surg Engl. 2009, 91 (8): 681-687. 10.1308 / 003588409X12486167520993.
PubMed Central PubMed Google ученый
Деметриадес D: Тотальное ведение открытой брюшной полости.Int Wound J. 2012, 9 (Suppl 1): 17-24.
PubMed Google ученый
Пол Дж.С., Ридольфи Т.Дж.: тематическое исследование внутрибрюшного сепсиса. Surg Clin North Am. 2012, 92 (6): 1661-1677. 10.1016 / j.suc.2012.08.014.
PubMed Google ученый
Rotondo MF, Schwab CW, McGonigal MD, Phillips GR, Fruchterman TM, Kauder DR, Latenser BA, Angood PA: «Контроль за повреждениями»: подход для повышения выживаемости при проникающем кровотечении при ранении живота.J Trauma. 1993, 35 (3): 375-382. 10.1097 / 00005373-199309000-00008.
CAS PubMed Google ученый
Годат Л., Кобаяши Л., Костантини Т., Коимбра Р.: Хирургия и реконструкция абдоминальных повреждений: Позиционный документ Всемирного общества экстренной хирургии. Мир J Emerg Surg. 2013, 8 (1): 53-10.1186 / 1749-7922-8-53.
PubMed Central PubMed Google ученый
Waibel BH, Rotondo MM: Операция по борьбе с повреждениями: эволюция за последние 20 лет. Rev Col Bras Cir. 2012, 39 (4): 314-321. 10.1590 / S0100-69912012000400012.
PubMed Google ученый
Мур LJ, Мур Ф.А.: Эпидемиология сепсиса у хирургических пациентов. Surg Clin North Am. 2012, 92 (6): 1425-1443. 10.1016 / j.suc.2012.08.009.
PubMed Google ученый
Ordoñez CA, Pino LF, Badiel M, Sánchez AI, Loaiza J, Ballestas L, Puyana JC: Безопасность выполнения отсроченного анастомоза во время контрольной лапаротомии у пациентов с деструктивными повреждениями толстой кишки. J Trauma. 2011, 71 (6): 1512-1517. 10.1097 / TA.0b013e31823d0691.
PubMed Central PubMed Google ученый
Ordonez CA, Sanchez AI, Pineda JA, Badiel M, Mesa R, Cardona U, Arias R, RossoF, Granados M, Gutiérrez-Martínez MI, Ochoa JB, Peitzman A, Puyana JC: отложенный первичный анастомоз диверсия у пациентов с тяжелым вторичным перитонитом, получавших поэтапную лапаротомию.Мир J Surg. 2010, 34: 169-176. 10.1007 / s00268-009-0285-у.
PubMed Central PubMed Google ученый
Perathoner A, Klaus A, Muhlmann G, Oberwalder M, Margreiter R, Kafka-Ritsch, Oberwalder M, Margreiter R, Kafka-Ritsch Q: Контроль повреждений с помощью абдоминальной вакуумной терапии (VAC) для лечения перфорированного дивертикулита с распространенный генерализованный перитонит — доказательство концепции. Int J Colorectal Dis. 2010, 25: 767-774. 10.1007 / s00384-010-0887-8.
PubMed Google ученый
Kafka-Ritsch R, Birkfellner F, Perathoner A, Raab H, Nehoda H, Pratschke J, Zitt M: Операция по контролю повреждений с абдоминальным вакуумом и отсроченной реконструкцией кишечника у пациентов с перфорированным дивертикулитом Хинчи III / IV. J Gastroenterol Surg. 2012, 16: 1915-1922. 10.1007 / s11605-012-1977-4.
Google ученый
Yuan Y, Ren J, He Y: Текущее состояние лечения открытой брюшной полости при внутрибрюшной инфекции. Гастроэнтерол Рес Прак. 2013, 532013-Epub 2013 2 октября
Google ученый
Регнер Дж. Л., Кобаяши Л., Коимбра Р.: Хирургические стратегии лечения открытой брюшной полости. Мир J Surg. 2012, 36 (3): 497-510. 10.1007 / s00268-011-1203-7.
PubMed Google ученый
Padalino P, Dionigi G, Minoja G, Carcano G, Rovera F, Boni L, Dionigi R: Закрытие фасции к фасции с местным отрицательным давлением в брюшной полости при тяжелых абдоминальных инфекциях: предварительные результаты в отделении общей хирургии и отделении интенсивной терапии . Хирургическая инфекция (Larchmt). 2010, 11 (6): 523-528. 10.1089 / sur.2010.042.
Google ученый
Цуэй Б.Дж., Скиннер Дж.С., Бернард А.С., Кирни П.А., Буланже Б.Р .: Открытая брюшная полость: этиология коррелирует с вероятностью закрытия фасции.Am Surg. 2004, 70 (7): 652-656.
PubMed Google ученый
Pliakos I, Papavramidis TS, Mihalopoulos N, Koulouris H, Kesisoglou I, Sapalidis K, Deligiannidis N, Papavramidis S: закрытие с помощью вакуума при тяжелом абдоминальном сепсисе с ретенционным швом или без него: клиническое испытание с ретенционным швом . Операция. 2010, 148 (5): 947-953. 10.1016 / j.surg.2010.01.021.
PubMed Google ученый
Робертс Д.А., Зигун Д.А., Грендар Дж., Болл К.Г., Робертсон Х.Л., Уэллет Дж.Ф., Читам М.Л., Киркпатрик А.В.: Лечение ран отрицательным давлением для тяжелобольных взрослых с открытыми ранами живота: систематический обзор. J Trauma Acute Care Surg. 2012, 73 (3): 629-639. 10.1097 / TA.0b013e31825c130e.
PubMed Google ученый
Кубяк Б.Д., Альберт С.П., Гатто Л.А., Снайдер К.П., Майер К.Г., Виау С.Дж., Рой С., Неман Г.Ф.: Терапия с отрицательным давлением брюшины предотвращает множественное повреждение органов при хроническом сепсисе свиней и модели ишемии / реперфузии.Шок. 2010, 34: 525-534. 10.1097 / SHK.0b013e3181e14cd2.
CAS PubMed Google ученый
Плаудис Х., Рудзац А., Мелберга Л., Казака И., Суба О., Пупелис Г.: Абдоминальная терапия отрицательным давлением: новый метод борьбы с брюшным отделом и перитонитом — проспективное исследование и критический обзор литературы. Энн интенсивной терапии. 2012, 20 (2 доп. 1): S23-
Google ученый
Boele van Hensbroek P, Wind J, Dijkgraaf MG, Busch OR, Goslings JC: Временное закрытие открытого живота: систематический обзор отсроченного первичного фасциального закрытия у пациентов с открытым животом. Мир J Surg. 2009, 33 (2): 199-207. 10.1007 / s00268-008-9867-3.
PubMed Central PubMed Google ученый
Расилайнен С.К., Ментула П.Дж., Леппяниеми А.К .: Вакуумная и опосредованная сеткой фасциальная тракция для первичного закрытия открытого живота у тяжелобольных хирургических пациентов.Br J Surg. 2012, 99 (12): 1725-1732. 10.1002 / bjs.8914.
CAS PubMed Google ученый
Киссане Н.А., Итани К.М.: Десятилетие пластики вентральной послеоперационной грыжи с использованием биологического бесклеточного дермального матрикса: что мы узнали ?. Plast Reconstr Surg. 2012, 130 (5 доп. 2): 194С-202С.
CAS PubMed Google ученый
Деллинджер Р.П., Леви М.М., Карлет Дж. М., Бион Дж., Паркер М.М., Яешке Р., Рейнхарт К., Ангус Д.К., Брун-Бюиссон К., Бил Р., Каландра Т., Дайнаут Дж. Ф., Герлах Х., Харви М., Марини Дж. Дж., Маршалл Дж., Раньери М., Рамзи Дж., Севрански Дж., Томпсон Б. Т., Таунсенд С., Вендер Дж. С., Циммерман Дж. Л., Винсент Дж. Л., Международный комитет по руководящим принципам кампании против сепсиса; Американская ассоциация медсестер интенсивной терапии; Американский колледж грудных врачей; Американский колледж врачей неотложной помощи; Канадское общество интенсивной терапии; Европейское общество клинической микробиологии и инфекционных болезней; Европейское общество интенсивной медицины; Европейское респираторное общество; Международный форум по сепсису; Японская ассоциация острой медицины; Японское общество интенсивной медицины; Общество интенсивной терапии; Общество госпитальной медицины; Общество хирургической инфекции; Всемирная федерация обществ интенсивной терапии и реанимации: Кампания по выживанию при сепсисе: Международные рекомендации по ведению тяжелого сепсиса и септического шока.Crit Care Med. 2008, 36: 296-327. 10.1097 / 01.CCM.0000298158.12101.41.
PubMed Google ученый
Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, Lopez-Rodriguez A, Steingrub JS, Garber GE, Helterbrand JD, Ely EW, Fisher CJ Jr: Всемирная оценка рекомбинантного человеческого протеина C в тяжелой степени Группа изучения сепсиса (PROWESS). Эффективность и безопасность рекомбинантного активированного протеина С человека при тяжелом сепсисе. N Engl J Med.2001, 344: 699-709. 10.1056 / NEJM200103083441001.
CAS PubMed Google ученый
Hodder RV, Hall R, Russell JA, Fisher HN, Lee B: Раннее введение (активированного) дротрекогина альфа при тяжелом сепсисе связано с более низкой смертностью: ретроспективный анализ канадской когорты ENHANCE. Crit Care. 2009, 13 (3): R78-10.1186 / cc7893.
PubMed Central PubMed Google ученый
Finfer S, Ranieri VM, Thompson BT, Barie PS, Dhainaut JF, Douglas IS, Gårdlund B, Marshall JC, Rhodes A: Дизайн, проведение, анализ и отчет о многонациональном плацебо-контролируемом исследовании активированного протеина C для стойких септический шок. Intensive Care Med. 2008, 34 (11): 1935-1947. 10.1007 / s00134-008-1266-6.
PubMed Central PubMed Google ученый
Savel RH, Munro CL: Доказательная обратная реакция: история drotrecogin alfa.Am J Crit Care. 2012, 21 (2): 81-83. 10.4037 / ajcc2012903.
PubMed Google ученый
Annane D, Bellissant E, Bollaert PE, Briegel J, Confalonieri M, de Gaudio R, Keh D, Kupfer Y, Oppert M, Meduri GU: Кортикостероиды в лечении тяжелого сепсиса и септического шока у взрослых: систематический обзор. ДЖАМА. 2009, 301 (22): 2362-2375. 10.1001 / jama.2009.815.
CAS PubMed Google ученый
Annane D: Кортикостероиды при тяжелом сепсисе: научно обоснованное руководство для врачей. Энн интенсивной терапии. 2011, 1 (1): 7-10.1186 / 2110-5820-1-7.
PubMed Central PubMed Google ученый
Коэн Дж. Чин В.Д .: Питание и сепсис. World Rev Nutr Diet. 2013, 105: 116-125.
PubMed Google ученый
Марик П.Е., Залога Г.П .: Раннее энтеральное питание у пациентов с острыми заболеваниями: систематический обзор.Crit Care Med. 2001, 29: 2264-2270. 10.1097 / 00003246-200112000-00005.
CAS PubMed Google ученый
Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P: Канадский комитет по клинической практике интенсивной терапии: Канадские рекомендации по клинической практике для поддержки питания у тяжело больных взрослых пациентов с механической вентиляцией легких. JPEN J Parenter Enteral Nutr. 2003, 27: 355-373. 10.1177 / 0148607103027005355.
PubMed Google ученый
Doig GS, Heighes PT, Simpson F, Sweetman EA, Davies AR: Раннее энтеральное питание, предоставляемое в течение 24 часов после травмы или поступления в отделение интенсивной терапии, значительно снижает смертность у тяжелобольных пациентов: метаанализ рандомизированные контролируемые испытания.

 Процеженную смесь пить трижды в сутки. За 1 раз рекомендуется принимать по 100 мл средства.
Процеженную смесь пить трижды в сутки. За 1 раз рекомендуется принимать по 100 мл средства.