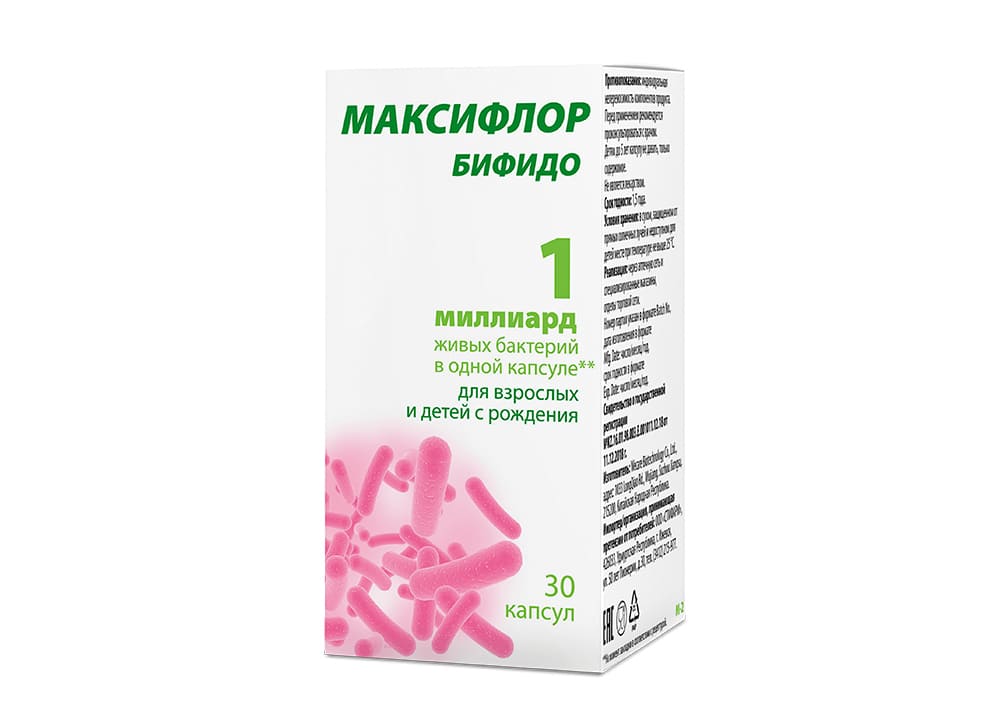
список препаратов — лучшие пробиотики для восстановления микрофлоры кишечника
Ребенок появляется на свет со стерильным кишечником, но уже к году состав микрофлоры совпадает со взрослым человеком. На протяжении жизни под влиянием питания, болезней и других факторов баланс микроорганизмов в пищеварительном тракте изменяется, но постепенно восстанавливается до нормальных концентраций. Иногда этот процесс затягивается. Тогда врач может рекомендовать пребиотики и пробиотики для кишечника.
Виды пробиотиков
Для восстановления кишечника применяют два типа лечебных средств. Пробиотики – это препараты, которые содержат полезные бактерии в высушенном или растворенном виде. Чаще всего это микроорганизмы из рода Lactobacillus и Bifidobacterium, которые в норме доминируют в пищеварительном тракте человека.
Пребиотиками называются вещества, необходимые для роста хорошей микрофлоры. В некоторых случаях без них можно обойтись, но после тяжелых болезней, лечения антибиотиками или отравления они ускорят восстановление за счет создания благоприятной среды для бактерий.
В пищеварительном тракте здорового взрослого человека обитает несколько десятков видов бактерий, но преобладают два типа микробов: бифидобактерии и лактобактерии. Другие находятся в меньшинстве. Поэтому выделяют следующие виды пробиотиков в зависимости от состава:
- состоят только из лактобактерий – рекомендуют принимать при кишечных вирусных инфекциях;
- в составе только бифидобактерии – врачи назначают их при кандидозном поражении кишечника и как восстановление женщинам после вагинального кандидоза;
- комбинированные препараты – содержат бифидо- и лактобактерии, полезны при бактериальной инфекции кишечника.
Восстанавливать нормальную микрофлору можно разными формами препаратов. Пробиотики выпускают в сухой форме, из которой перед применением самостоятельно готовят суспензию. Существуют готовые жидкие формы лекарства, которые удобно давать маленькому ребенку. Некоторые средства производят в капсулах в желатиновой оболочке. Она не повреждается в желудке и растворяется только в кишечнике. Это защищает бактерии от действия соляной кислоты.
Это защищает бактерии от действия соляной кислоты.
Создание препаратов для решения проблем с пищеварением проходило в несколько этапов. Поэтому фармацевты выделяют несколько поколений пробиотиков:
- 1 поколение – это монопрепараты, которые состоят из одного типа бактерий, обитающих в кишечнике, к ним относятся Бифидумбактерин, Лактобактерин.
- 2 поколение – содержат хорошие бактерии, которые являются антагонистами вредной флоры. Они выделяют вещества, которые уничтожают опасные микроорганизмы и подготавливают среду для заселения полезной микрофлорой. К препаратам этого типа относится Энтерол и Бактисубтил.
- 3 поколение – пробиотики, которые содержат от 2 до 30 штаммов одного живого микроорганизма или комбинацию из нескольких видов бактерий. К этой группе препаратов относятся Линекс, Бификол, Бифилонг.
- 4 поколение – содержат не только хорошие бактерии, но и вещества из группы пребиотиков. Они служат питательной средой, помогают расти, размножаться микрофлоре и ускоряют ее восстановление.
 К этой группе препаратов относят Бифилиз, Кипацид.
К этой группе препаратов относят Бифилиз, Кипацид. - 5 поколение – синбиотики, это несколько типов полезных бактерий и вещества, необходимые для колонизации кишечника. Они способны регулировать рост и метаболическую активность микробиоты. К этой группе относятся Флористин, Бифиформ и другие средства.
Какой препарат подойдет в конкретном случае, должен решать врач с учетом состояния пациента, его возраста. Для взрослых требуется большая дозировка и кратность приема пробиотиков.
ТОП-10 лучших пробиотиков
В аптеках продается большое количество пробиотиков, из которых тяжело выбрать нужный препарат. Правильное решение – обратиться к врачу-гастроэнтерологу или терапевту, чтобы назначили лекарственное средство с хорошим эффектом.
Чтобы решить, какой из них лучше, можно ориентироваться на список ТОП-10:
- Линекс – один из самых популярных препаратов, который помогает восстановить микрофлору кишечника. В его составе живые лиофилизированные бифидо- и лактобактерии, а также энтерококки.

- Хилак Форте – капли для лечения дисбактериоза, в состав входят лактобациллы, их эффект дополняет непатогенная кишечная палочка и стрептококки. Может использоваться при синдроме раздраженного кишечника, гастроэнтерите, колите, болезнях желчного пузыря и печени, вызванных патологией пищеварительного тракта.
- Флорин Форте – восстанавливает микрофлору за счет присутствия бифидо- и лактобактерий. В состав входит лактоза, необходимая для процесса брожения, смещения рН в кишечнике в кислую сторону. Выпускается в виде саше с порошком, который необходимо растворять перед использованием.
- Нормобакт L – помогает восстанавливать кишечную флору при помощи молочнокислых бактерий и пребиотиков, необходимых для их размножения. В состав входят фруктоолигосахариды, которые являются питательной средой, увеличивают выживаемость микробиоты и увеличивают эффективность лечения.

- Аципол – средство для лечения дисбактериоза у взрослых и детей. Он помогает после длительного лечения антибиотиками терапевтических заболеваний, используется для лечения острых кишечных инфекций, хронического колита, у склонных к аллергии и атопическому дерматиту.
- Бифиформ – пробиотик, в состав которого входят энтеробактерии и бифидобактерии. В кишечнике они образуют естественный симбиоз и поддерживают существование друг друга. Энтерококк заселяет петли тонкой кишки, а используемый тип бифидобактерий обладает высокой скоростью роста, поэтому быстро восстанавливает микробиоту толстого кишечника.
- Нормофлорин Л – жидкий пробиотик, состоящий их лактобактерий. Он положительно влияет на организм благодаря добавлению в раствор пребиотика лактита, который улучшает рост бактерий. Перед использованием необходимую дозу препарата смешивают с любой жидкостью.
- Флорок – пробиотик, который состоит из лактобацилл, бифидобактерий и лактозы, необходимой для нормальной колонизации пищеварительного тракта.

- Бак-сет Форте – это капсулы, в состав которых входит 14 видов живых полезных бактерий. Препарат рекомендован для детей старше 3 лет и взрослых для лечения нарушений стула и профилактики дисбактериоза.
- Риофлора – комплексный пробиотик, включает несколько штаммов бифидобатерий и лактобацилл, а также непатогенные стрептококки. Но в капсулах могут быть следы лактозы, молока и сои, поэтому производитель не рекомендует их использовать при повышенной чувствительности к этим веществам.
Советы по выбору
Какой из перечисленных пробиотиков поможет справиться с проблемами пищеварения, зависит от заболевания. Если организму необходима помощь после курса лечения антибиотиками, лучше использовать комплексные препараты, где добавлен пребиотик. Он ускорит заселение бактериями слизистой кишечника.
Вне зависимости от названия, для взрослых походят препараты в виде порошка, капсул или раствора. Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
При использовании средств с пробиотическими эффектами, симптомы вздутия живота, урчания, метеоризм могут усилиться из-за процесса брожения. Но это проходит самостоятельно и не требует отмены терапии. Если на фоне приема пробиотиков появилась аллергическая сыпь, лечение прекращают.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
13141516171819
20212223242526
2728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Пребиотики и пробиотики для собак и кошек
Для начала необходимо разобраться, что же такое пребиотики и пробиотики, и чем они отличаются?
Пробиотики – это живые полезные бактерии. В норме множество микроорганизмов находятся в кишечнике любого животного, а пробиотики позволяют восполнить их количество и, соответственно, подавить вредную микрофлору. Микрофлора кишечника – очень важный компонент для правильной работы желудочно-кишечного тракта. Она выполняет множество различных функций, которые не всегда под силу организму животного.
В норме множество микроорганизмов находятся в кишечнике любого животного, а пробиотики позволяют восполнить их количество и, соответственно, подавить вредную микрофлору. Микрофлора кишечника – очень важный компонент для правильной работы желудочно-кишечного тракта. Она выполняет множество различных функций, которые не всегда под силу организму животного.
Пребиотики же – это компоненты пищи, которые не перевариваются и не усваиваются в желудке и кишечнике животного, но являются пищей для микроорганизмов, заселяющих кишечник. И самое главное, эти компоненты питают только полезную микрофлору, не позволяя питаться вредной. Это возможно за счет «подкисления» среды кишечника, которая становится неблагоприятной для роста вредных бактерий.
Зачем нужно давать пре- и пробиотики?
Как мы уже выяснили, микрофлора кишечника очень важна для правильной работы желудочно-кишечного тракта. Неправильное кормление, резкая смена рациона, лечение, особенно антибиотиками, поедание грязного снега или питье воды из луж, а также стрессы, поездки, снижение иммунитета – все это подрывает здоровую флору, уменьшает ее количество – возникает дисбактериоз. Пре- и пробиотики используют не только для лечения, но и для профилактики дисбактериоза. Если Вы решили поменять корм питомцу, либо собираетесь в поездку, или когда Ваша собака на прогулке попила воды в ближайшем пруду, лучше подстраховаться и дать ей курс пре- или пробиотиков.
Пре- и пробиотики используют не только для лечения, но и для профилактики дисбактериоза. Если Вы решили поменять корм питомцу, либо собираетесь в поездку, или когда Ваша собака на прогулке попила воды в ближайшем пруду, лучше подстраховаться и дать ей курс пре- или пробиотиков.
Когда стоит давать питомцу курс пре- или пробиотиков?
При переходе на новый корм. Вне зависимости от того, на сколько похожи два разных корма, они производятся из разного сырья, по разным методикам и нередко даже на разных заводах. Поэтому желудочно-кишечный тракт Вашего питомца может негативно среагировать при переходе на новый корм. Если начать давать пре- и пробиотики незадолго до перевода на новый корм, и продолжать давать их до тех пор, пока питомец не начнет есть только новый корм, можно предотвратить срыв стула, а также добавить корму привлекательность для питомца.
Любое лечение, особенно антибиотиками, влияет на микрофлору желудочно-кишечного тракта. К сожалению, полностью избежать этого невозможно. Но Вы можете помочь микрофлоре кишечника, если после лечения дадите любимцу курс пре- и пробиотиков. Тогда микрофлора быстрее восстановится, и можно будет избежать срыва стула.
Но Вы можете помочь микрофлоре кишечника, если после лечения дадите любимцу курс пре- и пробиотиков. Тогда микрофлора быстрее восстановится, и можно будет избежать срыва стула.
Зимой на прогулках многие собаки кушают снег, а летом и в межсезонье пьют из луж и водоемов. Вода из этих источников обычно загрязнена вредными веществами, а в стоячей воде очень много различных микроорганизмов, которые неблаготворно воздействуют на кишечник собаки. Питье воды из таких источников может привести к рвоте и диарее. Профилактический курс пре- и пробиотиков поможет заранее усилить микрофлору кишечника и снизить воздействие вредных веществ на организм Вашего питомца.
Стрессы, например, во время салютов или походов в ветеринарную клинику, переездов неблагоприятно действуют на организм животного. Конечно же, страдает и кишечник, вместе с бактериями, которые обитают в нем. Снижение иммунитета в следствие болезней, в период вакцинации, в межсезонье также влияет на полезную микрофлору кишечника.![]() Поддержать микрофлору, заранее увеличить ее количественный и качественный состав можно курсом пре- и пробиотиков.
Поддержать микрофлору, заранее увеличить ее количественный и качественный состав можно курсом пре- и пробиотиков.
Что лучше выбрать?
В настоящее время нет необходимости экспериментировать с препаратами для людей, в магазинах можно найти пре- и пробиотики специально для собак и кошек. Давайте разберем несколько препаратов и выясним, для какой ситуации лучше подходит каждый из них.
FortiFlora
Это пробиотический препарат в виде сухого порошка, который содержит живые микроорганизмы Enterococcus faecium. Пробиотик содержится в виде микрокапсул, что исключает переваривание бактерий в желудке. Защитная пленка растворяется только при воздействии желудочного сока, позволяя бактериям беспрепятственно проникать в кишечник. Добавка продается в пакетиках, по 30 пакетиков в коробке.
Есть FortiFlora для собак и для кошек, отличаются они содержанием добавочных веществ. В препарате для кошек дополнительно есть таурин, который не вырабатывается в организме у кошек, а препарат для собак богат витамином С. Все содержимое пакетика необходимо высыпать на корм Вашего питомца 1 раз в день. В составе добавки FortiFlora содержится мясо и продукты его переработки, поэтому добавка имеет привлекательный запах, поэтому с удовольствием поедается и собаками, и кошками. Порошок удобно высыпать на корм, но, к сожалению, он может частично сыпаться на дно миски, и съедаться не весь.
Все содержимое пакетика необходимо высыпать на корм Вашего питомца 1 раз в день. В составе добавки FortiFlora содержится мясо и продукты его переработки, поэтому добавка имеет привлекательный запах, поэтому с удовольствием поедается и собаками, и кошками. Порошок удобно высыпать на корм, но, к сожалению, он может частично сыпаться на дно миски, и съедаться не весь.
Pro-Kolin Protexin
Этот препарат также является пробиотиком Enterococcus faecium, но выпускается в форме пасты, которую очень удобно выдавливать из шприца-дозатора. Пасту можно выдавить на корм, либо прямо в пасть животного. А привередливым кошкам можно испачкать в ней лапы – кошка начнет умываться и слижет весь пробиотик! Pro-Kolin имеет в составе ароматизатор говядины, который увеличивает его привлекательность для наших питомцев. Но белка говядины пробиотик не содержит, следовательно, на него не может быть аллергии. Выпускается в объеме 15 мл, 30 мл и 60 мл, что позволяет купить столько препарата, сколько необходимо на курс именно для Вашего питомца.
Также в состав пробиотика Pro-Kolin входит пектин и каолин. Каолин – это белая глина, состоящая из минерала каолинита. Каолин является естественным адсорбентом вредных веществ, а также он обладает бактерицидными свойствами. При диарее каолин всасывает в себя вредные вещества, формирует кал и помогает уменьшить или полностью устранить диарею. Пектин – это полисахариды, которые способны угнетать рост вредной микрофлоры кишечника. Пектин, как и каолин, обладает адсорбирующим действием. Оба этих вещества помогают в кратчайшие сроки остановить или уменьшить диарею, за счет чего полезным бактериям становится проще заселить кишечник.
Не смотря на множество полезных свойств, Pro-Kolin не является лекарством. Если у Вашего питомца рвота, очень интенсивная диарея, которая не прекращается дольше 8-12 часов, не стоит экспериментировать с лечением, необходимо срочно обратиться к ветеринару.
Viyo Reinforces
Это напиток-пребиотик, который не содержит живые микроорганизмы. В состав данного пребиотика входят волокна фруктоолигосахаридов и инулин. Они не перевариваются в ЖКТ животных, а достигают толстого кишечника, где ферментируются и служат пищей для полезной микрофлоры, подавляя при этом вредную. Продается пребиотик в пакетиках, по 7 пакетиков в упаковке. Viyo разработан для собак и кошек разных возрастов, поэтому не составляет труда подобрать добавку именно для Вашего питомца. Пребиотик можно применять в чистом виде, смешивать с кормом или водой.
В состав данного пребиотика входят волокна фруктоолигосахаридов и инулин. Они не перевариваются в ЖКТ животных, а достигают толстого кишечника, где ферментируются и служат пищей для полезной микрофлоры, подавляя при этом вредную. Продается пребиотик в пакетиках, по 7 пакетиков в упаковке. Viyo разработан для собак и кошек разных возрастов, поэтому не составляет труда подобрать добавку именно для Вашего питомца. Пребиотик можно применять в чистом виде, смешивать с кормом или водой.
Производители много лет добивались высокой поедаемости продукта, и на данный момент она составляет 85-95%! Такой высокий коэффициент достигается за счет особого сочетания в составе мяса, субпродуктов животного происхождения, растительных продуктов, масел, жиров, молока и молочных продуктов. Так как этот напиток очень вкусный, его часто дают кошкам, которые мало пьют. Добавляя пребиотик в воду, можно сделать ее более привлекательной для кошки, и она будет пить с большим удовольствием. Очень удобно также с помощью Viyo переводить питомца на новый корм. Вкусный напиток сделает новый корм более привлекательным для Вашего питомца, а пребиотик, который в нем содержится, поддержит микрофлору кишечника, пока организм привыкает к новому рациону.
Вкусный напиток сделает новый корм более привлекательным для Вашего питомца, а пребиотик, который в нем содержится, поддержит микрофлору кишечника, пока организм привыкает к новому рациону.
Видимый результат от приема препарата наступает примерно через две недели ежедневного применения. Рекомендуется давать напиток животным в течение 4 недель, повторяя курс 4 раза в год.
Виды Viyo:
Напиток-пребиотик Viyo Reinforces Cat Kitten для котят.
Напиток-пребиотик Viyo Reinforces Cat Adult для взрослых кошек.
Напиток-пребиотик Viyo Reinforces Cat Senior для пожилых кошек.
Напиток-пребиотик Viyo Reinforces Dog Puppy для щенков.
Напиток-пребиотик Viyo Reinforces Dog Adult для взрослых собак.
Напиток-пребиотик Viyo Reinforces Dog Senior для пожилых собак, 7*30 мл.
Синбиотик Protexin DC
Этот препарат отличается от всех, перечисленных выше, так как он содержит и пребиотик гуммиарабик, и пробиотик Enterococcus faecium. Выпускается в виде капсул, но если Вам сложно уговорить питомца съесть капсулу, Вы можете открыть ее и высыпать содержимое на еду. Живые бактерии и пища для них же в одной капсуле – что может быть удобнее! Действительно, большинство препаратов содержат или пребиотик, или пробиотик. Но во многих ситуациях необходимо и то, и другое. Тогда гораздо удобнее и дешевле будет выбрать синбиотик, а не смешивать несколько разных добавок.
Выпускается в виде капсул, но если Вам сложно уговорить питомца съесть капсулу, Вы можете открыть ее и высыпать содержимое на еду. Живые бактерии и пища для них же в одной капсуле – что может быть удобнее! Действительно, большинство препаратов содержат или пребиотик, или пробиотик. Но во многих ситуациях необходимо и то, и другое. Тогда гораздо удобнее и дешевле будет выбрать синбиотик, а не смешивать несколько разных добавок.
Ниже представлена сравнительная таблица всех добавок, перечисленных в статье.
Сравнительная таблица пре- и пробиотиков
FortiFlora | Pro-Kolin Protexin | Viyo Reinforces | Синбиотик Protexin DC | |
|---|---|---|---|---|
Пробиотик | Enterococcus faecium | Enterococcus faecium | Не содержит | Enterococcus faecium |
Пребиотик | Не содержит | Фруктоолигосахариды | Фруктоолигосахариды и инулин | Гуммиарабик |
Для собак и кошек | Подразделяется | Не подразделяется | Подразделяется | Не подразделяется |
Для разных возрастов | Не подразделяется | Не подразделяется | Подразделяется | Не подразделяется |
Форма выпуска | Порошок | Паста | Напиток | Капсулы |
Упаковка | Пакетики, по 30 в коробке | Тюбики 15, 30 и 60 мл | Пакетики, по 7 в коробке | 50 капсул в упаковке |
Вкусо-ароматические добавки | Мясо и продукты переработки мяса | Ароматизатор говядины, не содержит говяжий белок | Мясо, субпродукты животного происхождения, растительные продукты, масла, жиры, молоко и молочные продукты | Отсутствуют |
Дополнительные вещества | Таурин для кошек и витамин С для собак | Пектин и каолин | Отсутствуют | Отсутствуют |
Какие выводы мы можем сделать?
Пре- и пробиотики – очень важные добавки, поддерживающие микрофлору кишечника на уровне, необходимом для хорошей работы желудочно-кишечного тракта. Многие факторы в жизни наших питомцев отрицательно влияют на полезные бактерии кишечника. Стрессы, смена рациона, некачественная еда и корм, снижение иммунитета и многое другое может повлиять на микрофлору, снижая ее количественный и качественный состав.
Многие факторы в жизни наших питомцев отрицательно влияют на полезные бактерии кишечника. Стрессы, смена рациона, некачественная еда и корм, снижение иммунитета и многое другое может повлиять на микрофлору, снижая ее количественный и качественный состав.
Чаще всего, это не приводит к видимым для нас последствиям, таким как диарея. Но это не обязательно означает, что микрофлора не пострадала. Просто кишечник и иммунная система животного справляются и компенсируют недостаток микрофлоры.
Для того, чтобы восстановить количество полезных бактерий кишечника, используют пре- и пробиотики. Пребиотики, являясь пищей только для полезных бактерий, косвенно улучшают микрофлору кишечника, а с помощью пробиотиков можно «заселить» кишечник бактериями напрямую. Полезная микрофлора не только участвует в работе желудочно-кишечного тракта, но и уничтожает вредные бактерии, не позволяя животному заболеть.
Пре- и пробиотики не являются лекарственными препаратами, они не имеют побочных эффектов и их невозможно передозировать. Самое худшее, что случится, если Вы дадите питомцу сразу много добавок – большая часть просто не сможет закрепиться и выйдет с фекалиями, но необходимое количество их все же останется в кишечнике.
Самое худшее, что случится, если Вы дадите питомцу сразу много добавок – большая часть просто не сможет закрепиться и выйдет с фекалиями, но необходимое количество их все же останется в кишечнике.
Профилактика – это лучшее лечение. Если Вашего питомца вскоре ждут какие-либо изменения, если он съел или выпил что-то неподходящее, можете дать ему курс пре- и пробиотиков для профилактики дисбактериоза. Или можете давать эти добавки курсами, рекомендованными в инструкции, чтобы всегда поддерживать микрофлору кишечника у Вашего питомца на должном уровне.
В интернет-зоомагазине Мистер Гав Вы можете купить пребиотики и пробиотики для собак и для кошек с доставкой по России, Казахстану и Беларуси. Быстро отправим добавки в любой город, а для Челябинска и Копейска — доставим собственной курьерской службой до двери.
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействия, дозировка и отзывы
Акацу, Х., Ивабучи, Н., Сяо, Д. З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т. и Маруяма М. Клинические эффекты пробиотика Bifidobacterium longum BB536 на иммунную функцию и кишечную микробиоту у пожилых пациентов, получающих питание через зонд. JPEN J Parenter Enteral Nutr 11-27-2012; Просмотреть аннотацию.
З., Мацуяма, З., Курихара, Р., Окуда, К., Ямамото, Т. и Маруяма М. Клинические эффекты пробиотика Bifidobacterium longum BB536 на иммунную функцию и кишечную микробиоту у пожилых пациентов, получающих питание через зонд. JPEN J Parenter Enteral Nutr 11-27-2012; Просмотреть аннотацию.
Андраде, С. и Борхес, Н. Влияние ферментированного молока, содержащего Lactobacillus acidophilus и Bifidobacterium longum, на липиды плазмы женщин с нормальным или умеренно повышенным холестерином.J.Dairy Res. 2009; 76 (4): 469-474. Просмотреть аннотацию.
Арая-Кодзима Томоко, Яэшима Томоко Исибаши Норио Симамура Сэйити Хаясава Хиротоши. Ингибирующее действие Bifidobacterium longum BB536 на вредные кишечные бактерии. Бифидобактерии Microflora 1995; 14 (2): 59-66.
Ballongue J, Grill J Baratte-Euloge P. Действие на флоре кишечных ферментов с бифидобактериями. Lait 1993; 73: 249-256.
Беннет Р., Норд К. Э. и Зеттерстром Р. Временная колонизация кишечника новорожденных младенцев перорально вводимыми бифидобактериями и лактобактериями. Acta Paediatr. 1992; 81 (10): 784-787. Просмотреть аннотацию.
Acta Paediatr. 1992; 81 (10): 784-787. Просмотреть аннотацию.
Chouraqui, JP, Grathwohl, D., Labaune, JM, Hascoet, JM, de, Montgolfier, I, Leclaire, M., Giarre, M., and Steenhout, P. Оценка безопасности, переносимости и защитного эффекта против диареи детских смесей, содержащих смеси пробиотиков или пробиотиков и пребиотиков, в рандомизированном контролируемом исследовании. Am.J Clin.Nutr. 2008; 87 (5): 1365-1373. Просмотреть аннотацию.
Дас Р.Р. Сингх М., Шафик Н. Пробиотики в лечении аллергического ринита.Журнал Всемирной организации аллергии 2010; 3 (9): 239-244.
del Giudice, M. M. и Brunese, F. P. Пробиотики, пребиотики и аллергия у детей: что нового за последний год? J Clin.Gastroenterol. 2008; 42 Приложение 3, часть 2: S205-S208. Просмотреть аннотацию.
Dimidi E, Zdanaviciene A, Christodoulides S, et al. Рандомизированное клиническое исследование: пробиотик Bifidobacterium lactis NCC2818 по сравнению с плацебо и влияние на время прохождения через кишечник, симптомы и микробиологию кишечника при хроническом запоре. Алимент Pharmacol Ther.2019; 49 (3): 251-264. Просмотреть аннотацию.
Алимент Pharmacol Ther.2019; 49 (3): 251-264. Просмотреть аннотацию.
Фирмансьях, А., Двапурванторо, П.Г., Кадим, М., Алатас, С., Конус, Н., Лестарина, Л., Буиссе, Ф., и Стинхаут, П. Улучшение роста малышей, которых кормили молоком, содержащим синбиотики . Азиатско-Тихоокеанский регион J Clin.Nutr. 2011; 20 (1): 69-76. Просмотреть аннотацию.
Джанотти, Л., Морелли, Л., Галбиати, Ф., Роккетти, С., Коппола, С., Бенедуче, А., Джилардини, К., Зоненсчейн, Д., Несполи, А., и Брага, M. Рандомизированное двойное слепое исследование периоперационного введения пробиотиков пациентам с колоректальным раком.Мир Дж. Гастроэнтерол. 1-14-2010; 16 (2): 167-175. Просмотреть аннотацию.
Hascoet, J.M., Hubert, C., Rochat, F., Legagneur, H., Gaga, S., Emady-Azar, S., и Steenhout, P.G. Влияние состава смеси на развитие микробиоты кишечника младенцев. J Педиатр.Гастроэнтерол.Нутр. 2011; 52 (6): 756-762. Просмотреть аннотацию.
Игараси М., Иияма И Като Р. Томита М. Асами Н. Эзава И. Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии.Бифид 1994; 7: 139-147.
Влияние Bifidobacterium longum и лактулозы на прочность кости в моделях остеопороза после овариэктомии.Бифид 1994; 7: 139-147.
Ивабучи Н., Хирута Н. Канетада С. Яешима Т. Ивацуки К. Ясуи Х. Эффекты интраназального введения Bifidobacterium longum BB536 на иммунную систему слизистой оболочки дыхательных путей и вирусную инфекцию гриппа у мышей. Наука о молоке 2009; 38 (3): 129-133.
Ивабучи, Н., Такахаши, Н., Сяо, Дж. З., Мияджи, К., и Ивацуки, К. In vitro Th2-независимые цитокин-независимые Th3 подавляющие эффекты бифидобактерий. Microbiol.Immunol. 2007; 51 (7): 649-660. Просмотреть аннотацию.
Ивабути, Н., Такахаши, Н., Сяо, Дж. З., Йонедзава, С., Яэшима, Т., Ивацуки, К., и Хачимура, С. Подавляющее действие Bifidobacterium longum на производство Th3-привлекающих хемокинов индуцировало с взаимодействиями Т-лимфоцитов с антигенпредставляющими клетками. FEMS Immunol.Med.Microbiol. 2009; 55 (3): 324-334. Просмотреть аннотацию.
Ивабучи, Н., Сяо, Дж. З., Яэшима, Т. , и Ивацуки, К. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей. Биол.Pharm.Bull. 2011; 34 (8): 1352-1355. Просмотреть аннотацию.
, и Ивацуки, К. Пероральное введение Bifidobacterium longum уменьшает инфекцию вируса гриппа у мышей. Биол.Pharm.Bull. 2011; 34 (8): 1352-1355. Просмотреть аннотацию.
Кагеяма Т., Накано и Томода Т. Сравнительное исследование перорального приема некоторых препаратов бифидобактерий. Медицина и биология (Япония) 1987; 115 (2): 65-68.
Кагеяма Т., Томода Т. Накано Ю. Эффект введения бифидобактерий у больных лейкемией. Бифидобактерии Microflora. 1984; 3 (1): 29-33.
Кондо, Дж., Сяо, Дж. З., Сирахата, А., Баба, М., Абэ, А., Огава, К., и Шимода, Т. Модулирующие эффекты Bifidobacterium longum BB536 на дефекацию у пожилых пациентов, получающих энтеральное питание .Всемирный журнал J Gastroenterol 4-14-2013; 19 (14): 2162-2170. Просмотреть аннотацию.
Мацумото, Т., Исикава, Х., Татеда, К., Яэшима, Т., Ишибаши, Н. и Ямагути, К. Пероральное введение Bifidobacterium longum предотвращает кишечный сепсис Pseudomonas aeruginosa у мышей. J Appl.Microbiol. 2008; 104 (3): 672-680.![]() Просмотреть аннотацию.
Просмотреть аннотацию.
Намба К., Яешима Т. Исибаши Н. Хаясава Х и Ямадзаки Сёдзи. Ингибирующее действие Bifidobacterium longum на энтерогеморрагическую Escherichia coli O157: H7. Биологическая микрофлора 2003; 22 (3): 85-91.
Намба, К., Хатано, М., Яешима, Т., Такасе, М., и Сузуки, К. Влияние введения Bifidobacterium longum BB536 на гриппозную инфекцию, титр антител к вакцине против гриппа и клеточный иммунитет у пожилых людей . Biosci.Biotechnol.Biochem. 2010; 74 (5): 939-945. Просмотреть аннотацию.
Одамаки, Т., Сугахара, Х., Ёнэдзава, С., Яешима, Т., Ивацуки, К., Танабэ, С., Томинага, Т., Тогаши, Х., Бенно, Ю., и Сяо, JZ Влияние перорального приема йогурта, содержащего Bifidobacterium longum BB536, на количество клеток энтеротоксигенных Bacteroides fragilis в микробиоте.Анаэроб. 2012; 18 (1): 14-18. Просмотреть аннотацию.
Одамаки, Т., Сяо, Д.З., Ивабучи, Н., Сакамото, М., Такахаши, Н., Кондо, С., Ивацуки, К., Кокубо, С., Тогаши, Х., Эномото, Т. , и Бенно, Ю. Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков. J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотреть аннотацию.
Колебания фекальной микробиоты у людей с поллинозом японского кедра во время сезона пыльцы и влияние приема пробиотиков. J Investig.Allergol.Clin.Immunol. 2007; 17 (2): 92-100. Просмотреть аннотацию.
Одамаки, Т., Сяо, Дж. З., Ивабучи, Н., Сакамото, М., Такахаши, Н., Кондо, С., Мияджи, К., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Влияние приема Bifidobacterium longum BB536 на фекальную микробиоту у людей с поллинозом японского кедра в сезон пыльцы. J Med.Microbiol. 2007; 56 (Pt 10): 1301-1308. Просмотреть аннотацию.
Одамаки, Т., Сяо, Дж. З., Сакамото, М., Кондо, С., Яешима, Т., Ивацуки, К., Тогаши, Х., Эномото, Т., и Бенно, Ю. Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра.Appl.Environ.Microbiol. 2008; 74 (21): 6814-6817. Просмотреть аннотацию.
Огата Т., Кингаку М. Яэшима Т. Терагути С. Фукуватари и Ишибаши Н. Хаясава Х. Фудзисава Т. Лино Х. Влияние приема йогурта Bifidobacterium longum BB536 на кишечную среду здоровых взрослых. Microb Ecol Health Dis 1999; 11: 41-46.
Microb Ecol Health Dis 1999; 11: 41-46.
Огата Т., Накамура Т. Анджитсу К. Яешима Т. Такахаши С. Фукуватари Й Ишибаши Н. Хаясава Х. Фудзисава Т. Иино Х. Влияние введения Bifidobacterium longum BB536 на кишечную среду, частоту дефекации и фекальные характеристики добровольцев-людей.Biosci Microflora 1997; 16: 53-58.
Орраге, К., Шостедт, С., и Норд, С. E. Влияние добавок с молочнокислыми бактериями и олигофруктозой на микрофлору кишечника при введении цефподоксима проксетила. J Antimicrob.Chemother. 2000; 46 (4): 603-612. Просмотреть аннотацию.
Пуччио, Г., Кахоццо, К., Мели, Ф., Рошат, Ф., Гратволь, Д., и Стинхаут, П. Клиническая оценка новой закваски для младенцев, содержащей живые Bifidobacterium longum BL999 и пребиотики.Питание 2007; 23 (1): 1-8. Просмотреть аннотацию.
Редди Б. С. и Ривенсон А. Ингибирующий эффект Bifidobacterium longum на канцерогенез толстой кишки, молочной железы и печени, индуцированный 2-амино-3-метилимидазо [4,5-f] хинолином, пищевым мутагеном. Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотреть аннотацию.
Cancer Res. 9-1-1993; 53 (17): 3914-3918. Просмотреть аннотацию.
Rouge, C., Piloquet, H., Butel, MJ, Berger, B., Rochat, F., Ferraris, L., Des, Robert C., Legrand, A., de la Cochetiere, MF, N ‘ Гайен, Дж. М., Водовар, М., Войер, М., Дармаун, Д., и Розе, Дж.C. Пероральный прием пробиотиков у недоношенных детей с очень низкой массой тела при рождении: рандомизированное двойное слепое плацебо-контролируемое исследование. Am.J Clin.Nutr. 2009; 89 (6): 1828-1835. Просмотреть аннотацию.
Секи М., Игараси Т. Фукуда И Симамура С Касвашима Т. Огаса К. Влияние кисломолочного продукта Bifidobacterium на «регулярность» среди пожилой группы. Nutr Foodstuff 1978; 31: 379-387.
Sekine I, Yoshiwara S Homma N Takanori H Tonosuka S. Влияние молока, содержащего бифидобактерии, на реакцию хемилюминесценции периферических лейкоцитов и средний корпускулярный объем эритроцитов — возможная роль Bifidobacterium в активации макрофагов.Therapeutics (Япония) 1985; 14: 691-695.
Simakachorn, N. , Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., and Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр.Гастроэнтерол.Нутр. 2011; 53 (2): 174-181. Просмотреть аннотацию.
, Bibiloni, R., Yimyaem, P., Tongpenyai, Y., Varavithaya, W., Grathwohl, D., Reuteler, G., Maire, JC, Blum, S., Steenhout, P. , Benyacoub, J., and Schiffrin, EJ. Толерантность, безопасность и влияние на фекальную микробиоту энтеральной смеси, дополненной пре- и пробиотиками, у детей в критическом состоянии. J Педиатр.Гастроэнтерол.Нутр. 2011; 53 (2): 174-181. Просмотреть аннотацию.
Сингх, Дж., Ривенсон, А., Томита, М., Шимамура, С., Ishibashi, N., and Reddy, B. S. Bifidobacterium longum, кишечная бактерия, продуцирующая молочную кислоту, подавляет рак толстой кишки и модулирует промежуточные биомаркеры канцерогенеза толстой кишки. Канцерогенез 1997; 18 (4): 833-841. Просмотреть аннотацию.
Soh, SE, Aw, M., Gerez, I., Chong, YS, Rauff, M., Ng, YP, Wong, HB, Pai, N., Lee, BW, and Shek, LP Пробиотические добавки в первые 6 месяцев жизни у азиатских младенцев из группы риска — влияние на экзему и атопическую сенсибилизацию в возрасте 1 года.Клиническая экспертиза аллергии 2009; 39 (4): 571-578. Просмотреть аннотацию.
Просмотреть аннотацию.
Takeda, Y., Nakase, H., Namba, K., Inoue, S., Ueno, S., Uza, N., and Chiba, T. Улучшается регуляция T-bet и молекул плотных контактов с помощью Bifidobactrium longum воспаление толстой кишки при язвенном колите. Воспаление. 2009; 15 (11): 1617-1618. Просмотреть аннотацию.
Тан, М. Л., Лахтинен, С. Дж., И Бойл, Р. Дж. Пробиотики и пребиотики: клинические эффекты при аллергических заболеваниях. Curr.Opin.Pediatr. 2010; 22 (5): 626-634. Просмотреть аннотацию.
Томода Т., Накано Ю. Кагеяма Т. Разрастание кишечных Candida и кандидозная инфекция у пациентов с лейкемией: эффект от введения бифидобактерий. Бифидобактерии Microflora 1988; 7 (2): 71-74.
Томода Т., Накано Ю. Кагеяма Т. Вариации в небольших группах постоянной кишечной флоры во время приема противоопухолевых или иммунодепрессивных препаратов. Медицина и биология (Япония) 1981; 103 (1): 45-49.
Сяо Дж., Кондол С Одамаки Т Мияджи К Яешима Т Ивацуки К Тогаши Х Бенно Й.Влияние йогурта, содержащего Bifidobacterium longum BB 536, на частоту дефекации и фекальные характеристики здоровых взрослых: двойное слепое перекрестное исследование. Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Японский журнал молочнокислых бактерий 2007; 18 (1): 31-36.
Xiao, JZ, Kondo, S., Takahashi, N., Odamaki, T., Iwabuchi, N., Miyaji, K., Iwatsuki, K., and Enomoto, T. Изменения уровней TARC в плазме во время пыльцы японского кедра сезон и связь с развитием симптомов. Int.Arch.Allergy Immunol. 2007; 144 (2): 123-127.Просмотреть аннотацию.
Зивковиц, М., Фекаду, К., Зонтаг, Г., Набингер, У., Хубер, У.В., Кунди, М., Чакраборти, А., Фуасси, Х., и Кнасмюллер, С. Предотвращение образования гетероциклических аминов -индуцированное повреждение ДНК в толстой кишке и печени крыс различными штаммами лактобацилл. Канцерогенез 2003; 24 (12): 1913-1918. Просмотреть аннотацию.
Аль Фалех К., Анабрис Дж. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных Syst Rev.2014; (4): CD005496. Просмотреть аннотацию.
АльФалех К., Анабрис Дж., Басслер Д., Аль-Харфи Т. Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотреть аннотацию.
Кокрановская база данных систематических обзоров 2011 г., выпуск 3. Ст. №: CD005496. DOI: 10.1002 / 14651858.CD005496.pub3. Просмотреть аннотацию.
Аллен С.Дж., Джордан С., Стори М., Торнтон К.А., Гравенор М.Б., Гараиова И., Пламмер С.Ф., Ван Д., Морган Г. Пробиотики в профилактике экземы: рандомизированное контролируемое исследование. Arch Dis Child 2014; 99 (11): 1014-9. Просмотреть аннотацию.
Аллен SJ, Wareham K, Wang D, Bradley C, Hutchings H, Harris W, Dhar A, Brown H, Foden A, Gravenor MB, Mack D.Лактобациллы и бифидобактерии в профилактике антибиотико-ассоциированной диареи и диареи Clostridium difficile у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование. Ланцет. 2013, 12 октября; 382 (9900): 1249-57. Просмотреть аннотацию.
Амат-Боу М, Гарсия-Рибера С., Климент Э и др. Эффекты Bifidobacterium animalis Subsp. lactis (BPL1) у детей и подростков с синдромом Прадера-Уилли: рандомизированное перекрестное исследование. Питательные вещества.2020; 12 (10): 3123. Просмотреть аннотацию.
Питательные вещества.2020; 12 (10): 3123. Просмотреть аннотацию.
Андресен В., Гшоссманн Дж., Лайер П. Термоинактивированные Bifidobacterium bifidum MIMBb75 (SYN-HI-001) в лечении синдрома раздраженного кишечника: многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. Ланцет Гастроэнтерол Гепатол. 2020; 5 (7): 658-666. Просмотреть аннотацию.
Аруначалам К., Гилл Х.С., Чандра РК. Повышение естественной иммунной функции за счет диетического потребления Bifidobacterium lactis (HN019). Eur J Clin Nutr 2000; 54: 263-7.Просмотреть аннотацию.
Атали-Джапе Г., Минаи Н., Натан Э. и др. Результаты для недоношенных маленьких детей по сравнению с подходящими для беременных после приема Bifidobacterium breve M-16 V. J Matern Fetal Neonatal Med. 2020; 33 (13): 2209-2215. Просмотреть аннотацию.
Бадехноуш Б., Карамали М., Заррати М. и др. Влияние пробиотических добавок на биомаркеры воспаления, окислительного стресса и исходы беременности при гестационном диабете.![]() J Matern Fetal Neonatal Med. 2018 Май; 31 (9): 1128-1136.Просмотреть аннотацию.
J Matern Fetal Neonatal Med. 2018 Май; 31 (9): 1128-1136.Просмотреть аннотацию.
Бастюрк А., Артан Р., Йилмаз А. Эффективность лечения синбиотиками, пробиотиками и пребиотиками при синдроме раздраженного кишечника у детей: рандомизированное контролируемое исследование. Turk J Gastroenterol 2016; 27 (5): 439-43. Просмотреть аннотацию.
Begtrup LM, de Muckadell OB, Kjeldsen J, Christensen RD, Jarbøl DE. Длительное лечение пробиотиками у пациентов первичного звена с синдромом раздраженного кишечника — рандомизированное двойное слепое плацебо-контролируемое исследование. Сканд Дж. Гастроэнтерол 2013; 48 (10): 1127-35.Просмотреть аннотацию.
Бернини Л.Дж., Симау А.Н., Альфиери Д.Ф. и др. Благоприятные эффекты Bifidobacterium lactis на липидный профиль и цитокины у пациентов с метаболическим синдромом: рандомизированное исследование. Влияние пробиотиков на метаболический синдром. Питание. 2016; 32 (6): 716-9. Просмотреть аннотацию.
Бибилони Р., Федорак Р.Н., Таннок Г. В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотреть аннотацию.
В. и др. Пробиотическая смесь VSL # 3 вызывает ремиссию у пациентов с активным язвенным колитом. Am J Gastroenterol 2005; 100: 1539-46. Просмотреть аннотацию.
Blaabjerg S, Artzi DM, Aabenhus R.Пробиотики для профилактики диареи, связанной с антибиотиками, у амбулаторных больных — систематический обзор и метаанализ. Антибиотики (Базель). 2017; 6 (4). Просмотреть аннотацию.
Bouhnik Y, Pochart P, Marteau P и др. Восстановление фекалий у людей жизнеспособных бифидобактерий, попавших в ферментированное молоко. Гастроэнтерология 1992; 102: 875-8. Просмотреть аннотацию.
Батлер С.К., Лау М., Гиллеспи Д. и др. Влияние использования пробиотиков на введение антибиотиков среди жителей домов престарелых: рандомизированное клиническое испытание.ДЖАМА. 2020; 324 (1): 47-56. Просмотреть аннотацию.
Caglar E. Влияние йогурта, содержащего Bifidobacterium bifidum, на бактерии зубного налета у детей. J Clin Pediatr Dent. 2014; 38 (4): 329-32. Просмотреть аннотацию.
Callaway LK, McIntyre HD, Barrett HL и др. Пробиотики для профилактики гестационного сахарного диабета у женщин с избыточным весом и ожирением: результаты двойного слепого рандомизированного контролируемого исследования SPRING. Уход за диабетом. 2019; 42 (3): 364-371. Просмотреть аннотацию.
Пробиотики для профилактики гестационного сахарного диабета у женщин с избыточным весом и ожирением: результаты двойного слепого рандомизированного контролируемого исследования SPRING. Уход за диабетом. 2019; 42 (3): 364-371. Просмотреть аннотацию.
Chang HY, Chen JH, Chang JH, Lin HC, Lin CY, Peng CC.Пробиотики с множественными штаммами, по-видимому, являются наиболее эффективными пробиотиками в профилактике некротического энтероколита и смертности: обновленный метаанализ. PLoS One. 2017; 12 (2): e0171579. Просмотреть аннотацию.
Чен Р.М., Ву Дж.Дж., Ли С.К. и др. Увеличение кишечных бифидобактерий и подавление бактерий группы кишечной палочки при кратковременном приеме йогурта. J Dairy Sci 1999: 82: 2308-14. Просмотреть аннотацию.
Chi C, Li C, Buys N, Wang W, Yin C, Sun J. Эффекты пробиотиков у недоношенных детей: сетевой метаанализ.Педиатрия. 2021; 147 (1): e20200706. Просмотреть аннотацию.
Chiang BL, Sheih YH, Wang LH и др. Повышение иммунитета путем употребления с пищей пробиотических молочнокислых бактерий (Bifidobacterium lactis HN019): оптимизация и определение клеточных иммунных ответов. Eur J Clin Nutr 2000; 54: 849-55. Просмотреть аннотацию.
Eur J Clin Nutr 2000; 54: 849-55. Просмотреть аннотацию.
Colombel JF, Cortot A, Neut C, Romond C. Йогурт с Bifidobacterium longum снижает желудочно-кишечные эффекты, вызванные эритромицином. Ланцет 1987; 2: 43.
Костелое К., Харди П., Ющак Э., Уилкс М., Миллар М. Р.; Пробиотики в совместной группе по изучению недоношенных детей.Bifidobacterium breve BBG-001 у очень недоношенных детей: рандомизированное контролируемое исследование фазы 3. Ланцет. 2016 13 февраля; 387 (10019): 649-60. Просмотреть аннотацию.
Кремонини Ф, Ди Каро С., Ковино М. и др. Влияние различных пробиотических препаратов на побочные эффекты, связанные с терапией против Helicobacter pylori: параллельное групповое, тройное слепое, плацебо-контролируемое исследование. Am J Gastroenterol 2002; 97: 2744-9. Просмотреть аннотацию.
Czajeczny D, Kabzi & nacute; ska K, W & oacute; jciak RW. Помогают ли добавки с пробиотиками похудеть? Рандомизированное простое слепое плацебо-контролируемое исследование с добавлением Bifidobacterium lactis BS01 и Lactobacillus acidophilus LA02. Ешьте расстройство веса. 2020. Посмотреть аннотацию.
Ешьте расстройство веса. 2020. Посмотреть аннотацию.
Дэвидсон С.Дж., Барретт Х.Л., Прайс С.А., Каллауэй Л.К., Деккер Нитерт М. Пробиотики для предотвращения гестационного диабета. Кокрановская база данных Syst Rev.2021; 4 (4): CD009951. Просмотреть аннотацию.
Дикерсон Ф., Адамос М., Кацафанас Э. и др. Дополнительные пробиотические микроорганизмы для предотвращения повторной госпитализации пациентов с острой манией: рандомизированное контролируемое исследование. Биполярное расстройство. 2018 25 апреля. Посмотреть аннотацию.
Димиди Э., Христодулидес С., Фрагкос К.С., Скотт С.М., Уилан К.Влияние пробиотиков на функциональный запор у взрослых: систематический обзор и метаанализ рандомизированных контролируемых исследований. Am J Clin Nutr. 2014; 100 (4): 1075-84. Просмотреть аннотацию.
Элмер GW, Суравич CM, МакФарланд LV. Биотерапевтические агенты, метод лечения и профилактики отдельных кишечных и вагинальных инфекций, которым пренебрегают. JAMA 1996; 275: 870-5. Просмотреть аннотацию.
Просмотреть аннотацию.
Эскесен Д., Йесперсен Л., Михельсен Б., Уорвелл П.Дж., Мюллер-Лисснер С., Морберг К.М. Действие пробиотического штамма Bifidobacterium animalis subsp.lactis, BB-12®, о частоте дефекации у здоровых субъектов с низкой частотой дефекации и дискомфортом в животе: рандомизированное двойное слепое плацебо-контролируемое исследование в параллельных группах. Br J Nutr. 2015 28 ноября; 114 (10): 1638-46. Просмотреть аннотацию.
Фамури Ф., Шариат З., Хашемипур М., Кейха М., Келишади Р. Влияние пробиотиков на неалкогольную жировую болезнь печени у детей и подростков с ожирением. J Педиатр Гастроэнтерол Нутр. 2017; 64 (3): 413-417. Просмотреть аннотацию.
Fernández-Carrocera LA, Solis-Herrera A, Cabanillas-Ayón M, Gallardo-Sarmiento RB, García-Pérez CS, Montaño-Rodríguez R, Echániz-Aviles MO.Двойной слепой рандомизированный клинический анализ для оценки эффективности пробиотиков у недоношенных новорожденных с массой тела менее 1500 г в профилактике некротизирующего энтероколита. Arch Dis Child Fetal Neonatal Ed 2013; 98 (1): F5-9. Просмотреть аннотацию.
Arch Dis Child Fetal Neonatal Ed 2013; 98 (1): F5-9. Просмотреть аннотацию.
Gionchetti P, Rizzello F, Venturi A, et al. Пероральная бактериотерапия в качестве поддерживающей терапии у пациентов с хроническим поучитом: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология 2000; 119: 305-9. Просмотреть аннотацию.
Goldenberg JZ, Lytvyn L, Steurich J, Parkin P, Mahant S, Johnston BC.Пробиотики для профилактики детской диареи, связанной с приемом антибиотиков. Кокрановская база данных Syst Rev.2015; (12): CD004827. Просмотреть аннотацию.
Голдин BR. Польза пробиотиков для здоровья. Br J Nutr 1998; 80: S203-7. Просмотреть аннотацию.
Гор C, Custovic A, Tannock GW, Munro K, Kerry G, Johnson K, Peterson C, Morris J, Chaloner C, Murray CS, Woodcock A. Лечебные и вторичные профилактические эффекты пробиотиков Lactobacillus paracasei или Bifidobacterium lactis на раннем этапе детская экзема: рандомизированное контролируемое исследование с последующим наблюдением до возраста 3 лет. Clin Exp Allergy 2012; 42 (1): 112-22. Просмотреть аннотацию.
Clin Exp Allergy 2012; 42 (1): 112-22. Просмотреть аннотацию.
Guardamagna O, Amaretti A, Puddu PE, et al. Добавка бифидобактерий: влияние на липидный профиль плазмы у детей с дислипидемией. Питание. 2014; 30 (7-8): 831-6. Просмотреть аннотацию.
Гульельметти С., Мора Д., Гшвендер М., Попп К. Рандомизированное клиническое испытание: Bifidobacterium bifidum MIMBb75 значительно облегчает синдром раздраженного кишечника и улучшает качество жизни — двойное слепое плацебо-контролируемое исследование. Алимент Pharmacol Ther.2011 Май; 33 (10): 1123-32. Просмотреть аннотацию.
Ha GY, Yang CH, Kim H, Chong Y. Случай сепсиса, вызванного Bifidobacterium longum. J Clin Microbiol 1999; 37: 1227-8. Просмотреть аннотацию.
Хан К., Ван Дж, Со Дж. Г., Ким Х. Эффективность пробиотиков с двойным покрытием при синдроме раздраженного кишечника: рандомизированное двойное слепое контролируемое исследование. J Gastroenterol. 2017; 52 (4): 432-443. Просмотреть аннотацию.
Хираяма К. , Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6.Просмотреть аннотацию.
, Рафтер Дж. Роль пробиотических бактерий в профилактике рака. Microbes Infect 2000; 2: 681-6.Просмотреть аннотацию.
Hojsak I, Tokic Pivac V, Mocic Pavic A, Pasini AM, Kolacek S. Bifidobacterium animalis subsp. lactis не предотвращает распространенные инфекции у госпитализированных детей: рандомизированное двойное слепое плацебо-контролируемое исследование. Am J Clin Nutr. 2015 Март; 101 (3): 680-4. Просмотреть аннотацию.
Hoyos AB. Снижение частоты возникновения некротического энтероколита, связанного с энтеральным введением Lactobacillus acidophilus и Bifidobacterium infantis новорожденным в отделении интенсивной терапии.Int J Infect Dis 1999; 3: 197-202. Просмотреть аннотацию.
Ibarra A, Latreille-Barbier M, Donazzolo Y, Pelletier X, Ouwehand AC. Эффекты 28-дневного Bifidobacterium animalis subsp. lactis HN019 в отношении времени прохождения через толстую кишку и желудочно-кишечных симптомов у взрослых с функциональным запором: двойное слепое, рандомизированное, плацебо-контролируемое исследование с определением дозировки. Кишечные микробы. 2018; 9 (3): 236-251. Просмотреть аннотацию.
Кишечные микробы. 2018; 9 (3): 236-251. Просмотреть аннотацию.
Иноуэ Т., Кобаяши Ю., Мори Н. и др. Влияние комбинированного приема бифидобактерий и тренировок с отягощениями на когнитивные функции, состав тела и привычки кишечника здоровых пожилых людей.Benef Microbes. 2018; 9 (6): 843-853. Просмотреть аннотацию.
Invernici MM, Furlaneto FAC, Salvador SL, et al. Bifidobacterium animalis subsp lactis HN019 обладает антимикробным потенциалом в отношении пародонтопатогенов и модулирует иммунологический ответ слизистой оболочки полости рта у пациентов с пародонтитом. PLoS One. 2020; 15 (9): e0238425. Просмотреть аннотацию.
Invernici MM, Salvador SL, Silva PHF и др. Влияние пробиотика Bifidobacterium на лечение хронического пародонтита: рандомизированное клиническое испытание.J Clin Periodontol. 2018; 45 (10): 1198-1210. Просмотреть аннотацию.
Исикава Х., Акедо И., Умесаки Ю. и др. Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 2003; 22: 56-63. Просмотреть аннотацию.
J Am Coll Nutr 2003; 22: 56-63. Просмотреть аннотацию.
Isolauri E, Arvola T, Sutas Y, et al. Пробиотики в лечении атопической экземы. Clin Exp Allergy 2000; 30: 1604-10. Просмотреть аннотацию.
Jäger R, Purpura M, Stone JD и др. Прием пробиотиков Streptococcus thermophilus FP4 и Bifidobacterium breve BR03 снижает работоспособность и объем движений после упражнений с повреждением мышц.Питательные вещества 2016; 8 (10). pii: E642. Просмотреть аннотацию.
Jayasimhan S, Yap NY, Roest Y, Rajandram R, Chin KF. Эффективность препарата микробных клеток в улучшении хронического запора: рандомизированное двойное слепое плацебо-контролируемое исследование. Clin Nutr 2013; 32 (6): 928-34. Просмотреть аннотацию.
Jiang C, Wang H, Xia C, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование пробиотиков для уменьшения тяжести мукозита полости рта, вызванного химиолучевой терапией, у пациентов с карциномой носоглотки.Рак. 2019; 125 (7): 1081-1090. Просмотреть аннотацию.
Просмотреть аннотацию.
Jiao X, Fu MD, Wang YY, Xue J, Zhang Y. Bifidobacterium и Lactobacillus для предотвращения некротического энтероколита у недоношенных детей с очень низкой массой тела при рождении: систематический обзор и метаанализ. Мир J Pediatr. 2020; 16 (2): 135-142. Просмотреть аннотацию.
Калима П., Мастертон Р.Г., Родди П.Х. и др. Инфекция Lactobacillus rhamnosus у ребенка после трансплантации костного мозга. J Infect 1996; 32: 165-7. Просмотреть аннотацию.
Карамали М., Дадхах Ф., Садрханлоу М. и др.Влияние пробиотических добавок на гликемический контроль и липидный профиль при гестационном диабете: рандомизированное двойное слепое плацебо-контролируемое исследование. Диабет Метаб 2016; 42 (4): 234-41. Просмотреть аннотацию.
Като К., Мизуно С., Умесаки Ю. и др. Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Фармакол Тер 2004; 20: 1133-41. Просмотреть аннотацию.
Просмотреть аннотацию.
Kim HJ, Camilleri M, McKinzie S, et al. Рандомизированное контролируемое испытание пробиотика VSL # 3 в отношении кишечного транзита и симптомов синдрома раздраженного кишечника с преобладанием диареи.Алимент Фармакол Тер 2003; 17: 895-904. . Просмотреть аннотацию.
Кобаяши Y, Кухара Т, Оки М, Сяо Джозеф. Влияние Bifidobacterium breve A1 на когнитивные функции пожилых людей с жалобами на память: рандомизированное двойное слепое плацебо-контролируемое исследование. Benef Microbes. 2019; 10 (5): 511-520. Просмотреть аннотацию.
Корщунов В.М., Смеянов В.В., Ефимов Б.А. и др. Терапевтическое применение препарата устойчивых к антибиотикам бифидобактерий у мужчин, подвергшихся воздействию высоких доз гамма-излучения. J Med Microbiol 1996; 44: 70-4.Просмотреть аннотацию.
Кухбахер Т., Отт С.Дж., Хельвиг У. и др. Бактериальная и грибковая микробиота в связи с пробиотической терапией (VSL # 3) при поучите. Кишечник 2006; 55: 833-41. Просмотреть аннотацию.![]()
Куру Б.Е., Лалеман И., Ялнизоглу Т., Куру Л., Тойгельс В. Влияние пробиотика Bifidobacterium animalis на здоровье десен: рандомизированное контролируемое клиническое исследование. J Periodontol. 2017; 88 (11): 1115-1123. Просмотреть аннотацию.
Langkamp-Henken B, Rowe CC, Ford AL, Christman MC, Nieves C. Jr, Khouri L, Specht GJ, Girard SA, Spaiser SJ, Dahl WJ.Bifidobacterium bifidum R0071 приводит к большему количеству дней здорового образа жизни и меньшему проценту студентов, испытывающих академический стресс, сообщающих о дне простуды / гриппа: рандомизированное двойное слепое плацебо-контролируемое исследование. Br J Nutr. 2015 14; 113 (3): 426-34. Просмотреть аннотацию.
Lau AS, Yanagisawa N, Hor YY, et al. Bifidobacterium longum BB536 облегчает заболевания верхних дыхательных путей и регулирует профили кишечной микробиоты у малазийских дошкольников. Benef Microbes. 2018; 9 (1): 61-70. Просмотреть аннотацию.
Лау С.С., Чемберлен Р.С. Пробиотики эффективны для предотвращения диареи, связанной с Clostridium difficile: систематический обзор и метаанализ. Int J Gen Med. 2016; 9: 27-37. Просмотреть аннотацию.
Int J Gen Med. 2016; 9: 27-37. Просмотреть аннотацию.
Льюис Э.Д., Энтони Дж. М., Кроули, округ Колумбия, и др. Эффективность Lactobacillus paracasei HA-196 и Bifidobacterium longum R0175 в облегчении симптомов синдрома раздраженного кишечника (СРК): рандомизированное плацебо-контролируемое исследование. Питательные вещества. 2020; 12 (4): 1159. Просмотреть аннотацию.
Льюис С.Дж., Фридман АР.Обзорная статья: использование биотерапевтических средств в профилактике и лечении желудочно-кишечных заболеваний. Aliment Pharmacol Ther 1998; 12: 807-22. Просмотреть аннотацию.
Leyer GJ, Li S, Mubasher ME, et al. Влияние пробиотиков на частоту и продолжительность симптомов простуды и гриппа у детей. Педиатрия 2009; 124: e172-e179. Просмотреть аннотацию.
Ливин В., Пайффер И., Худо С. и др. Штаммы Bifidobacterium из резидентной микрофлоры желудочно-кишечного тракта человека грудного возраста обладают антимикробной активностью.Gut 2000; 47: 646-52. Просмотреть аннотацию.
Lin CL, Hsu YJ, Ho HH и др. Bifidobacterium longum subsp. Добавка longum OLP-01 во время тренировок по бегу на выносливость улучшает результаты упражнений у бегунов на средние и длинные дистанции: контролируемое испытание двойным слепым методом. Питательные вещества. 2020; 12 (7): 1972. Просмотреть аннотацию.
Linn YH, Thu KK, Win NHH. Эффект пробиотиков для профилактики острой радиационно-индуцированной диареи среди пациентов с раком шейки матки: рандомизированное двойное слепое плацебо-контролируемое исследование.Пробиотики, антимикробные белки. 2019; 11 (2): 638-647. Просмотреть аннотацию.
Лю Дж, Хуанг XE. Эффективность таблеток жизнеспособных бактерий Bifidobacterium tetragenous для онкологических больных с функциональным запором. Азиатский Pac J Cancer Prev. 2014; 15 (23): 10241-4. Просмотреть аннотацию.
Macfarlane GT, Каммингс Дж. Х. Пробиотики и пребиотики: может ли регулирование активности кишечных бактерий принести пользу здоровью? BMJ 1999; 318: 999-1003. Просмотреть аннотацию.
Просмотреть аннотацию.
Мальдонадо Дж., Хиль-Кампос М., Мальдонадо-Лобон Дж. А. и др.Оценка безопасности, переносимости и эффективности годичного потребления детской смеси с добавлением Lactobacillus fermentum CECT5716 Lc40 или Bifidobacterium breve CECT7263: рандомизированное контролируемое исследование. BMC Pediatr. 2019; 19 (1): 361. Просмотреть аннотацию.
Мальдонадо-Лобон JA, Бланко-Рохо Р., Мальдонадо Дж. И др. Эффективность Bifidobacterium breve CECT7263 для лечения детских колик: открытое параллельное рандомизированное контролируемое исследование. Benef Microbes. 2021; 12 (1): 55-67. Просмотреть аннотацию.
Манжалий Э., Вирченко О., Фалалеева Т., Берегова Т., Стреммель В. Лечебная эффективность пробиотического препарата при неалкогольном стеатогепатите: пилотное исследование. J Dig Dis. 2017; 18 (12): 698-703. Просмотреть аннотацию.
Мацуока К., Уэмура Ю., Канаи Т. и др. Эффективность ферментированного молока Bifidobacterium breve в поддержании ремиссии язвенного колита. Dig Dis Sci. 2018; 63 (7): 1910-1919. Просмотреть аннотацию.
Dig Dis Sci. 2018; 63 (7): 1910-1919. Просмотреть аннотацию.
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, связанной с антибиотиками, и лечения болезни Clostridium difficile.Am J Gastroenterol 2006; 101: 812-22. Просмотреть аннотацию.
Мейдани С.Н., Ха В.К. Иммунологические эффекты йогурта. Am J Clin Nutr 2000; 71: 861-72. Просмотреть аннотацию.
Майкл Д.Р., Джек А.А., Мазетти Дж. И др. Рандомизированное контролируемое исследование показывает, что добавление лактобактерий и бифидобактерий взрослым с избыточным весом и ожирением снижает массу тела и улучшает самочувствие. Научный доклад 2020; 10 (1): 4183. Просмотреть аннотацию.
Miele E, Pascarella F, Giannetti E. et al. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом.Am J Gastroenterol 2009; 104: 437-43. Просмотреть аннотацию.
Мимура Т., Риццелло Ф., Хельвиг У. и др. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите. Кишечник 2004; 53: 108-14. Просмотреть аннотацию.
Кишечник 2004; 53: 108-14. Просмотреть аннотацию.
Морган Р.Л., Прейдис Г.А., Кашьяп П.С. и др. Пробиотики снижают смертность и заболеваемость недоношенных детей с низкой массой тела при рождении: систематический обзор и сетевой метаанализ рандомизированных исследований. Гастроэнтерология 2020; 159 (2): 467-80. Просмотреть аннотацию.
Морваридзаде М., Нахвак С.М., Мохаммади Р. и др. Пробиотический йогурт, обогащенный витамином D, может улучшить гликемический статус у пациентов с неалкогольной жировой болезнью печени: рандомизированное клиническое исследование. Clin Nutr Res. 2021; 10 (1): 36-47. Просмотреть аннотацию.
О’Каллаган А., ван Синдерен Д. Бифидобактерии и их роль как членов кишечной микробиоты человека. Front Microbiol. 2016 15 июня; 7: 925. Просмотреть аннотацию.
О’Махони Л., Маккарти Дж., Келли П. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов.Гастроэнтерология 2005; 128: 541-51. Просмотреть аннотацию.
Просмотреть аннотацию.
Okesene-Gafa KA, Moore AE, Jordan V, McCowan L, Crowther CA. Лечение пробиотиками для женщин с гестационным диабетом для улучшения здоровья и благополучия матери и ребенка. Кокрановская база данных Syst Rev 2020; 6 (6): CD012970. Просмотреть аннотацию.
Olivares M, Castillejo G, Varea V, Sanz Y. Двойное слепое рандомизированное плацебо-контролируемое исследование с целью оценки эффектов Bifidobacterium longum CECT 7347 у детей с впервые диагностированной целиакией.Br J Nutr. 2014 июл 14; 112 (1): 30-40. Просмотреть аннотацию.
Park MS, Kwon B, Ku S, Ji GE4. Эффективность лечения пробиотиками Bifidobacterium longum BORI и Lactobacillus acidophilus AD031 у младенцев с ротавирусной инфекцией. Питательные вещества. 2017; 9 (8). pii: E887. Просмотреть аннотацию.
Педрет А., Валлс Р.М., Кальдерон-Перес Л. и др. Влияние ежедневного употребления пробиотика Bifidobacterium animalis subsp. lactis CECT 8145 по антропометрическим биомаркерам ожирения у субъектов с абдоминальным ожирением: рандомизированное контролируемое исследование.Int J Obes (Лондон). 2019; 43 (9): 1863-1868. Просмотреть аннотацию.
Pellonperä O, Mokkala K, Houttu N, et al. Эффективность рыбьего жира и / или пробиотического вмешательства на частоту гестационного сахарного диабета в группе риска у женщин с избыточным весом и ожирением: рандомизированное плацебо-контролируемое двойное слепое клиническое исследование. Уход за диабетом. 2019; 42 (6): 1009-1017. Просмотреть аннотацию.
Pellonperä O, Vahlberg T, Mokkala K, et al. Увеличение веса и состав тела во время беременности: рандомизированное пилотное испытание с пробиотиками и / или рыбьим жиром.Br J Nutr. 2020 ноябрь 4: 1-11. Просмотреть аннотацию.
Phuapradit P, Varavithya W., Vathanophas K, et al. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai 1999; 82: S43-8. Просмотреть аннотацию.
Пирс А. Практическое руководство по натуральным лекарствам Американской фармацевтической ассоциации. Нью-Йорк: The Stonesong Press, 1999: 19.
Pinto GS, Cenci MS, Azevedo MS, Epifanio M, Jones MH. Действие йогурта, содержащего Bifidobacterium animalis subsp.lactis DN-173010 пробиотик на зубном налете и слюне у ортодонтических пациентов. Caries Res. 2014; 48 (1): 63-8. Просмотреть аннотацию.
Pinto-Sanchez MI, Hall GB, Ghajar K, et al. Пробиотик Bifidobacterium longum NCC3001 снижает показатели депрессии и изменяет активность мозга: пилотное исследование у пациентов с синдромом раздраженного кишечника. Гастроэнтерология 2017; 153 (2): 448-459.e8. Просмотреть аннотацию.
Pruccoli G, Silvestro E, Pace Napoleone C, Aidala E, Garazzino S, Scolfaro C. Безопасны ли пробиотики? Бифидобактериальная бактериемия у ребенка с тяжелой сердечной недостаточностью.Infez Med. 2019; 27 (2): 175-178. Просмотреть аннотацию.
Расталл РА. Бактерии в кишечнике: друзья и враги и как изменить баланс. J Nutr 2004; 134: 2022S-2026S. Просмотреть аннотацию.
Rautava S, Kainonen E, Salminen S, Isolauri E. Материнский пробиотик добавление во время беременности и кормления грудью снижает риск экземы у младенца. J Allergy Clin Immunol. 2012; 130 (6): 1355-60. Просмотреть аннотацию.
Раутио М., Джусими-Сомер Н., Каума Н. и др. Абсцесс печени, вызванный штаммом Lactobacillus rhamnosus, неотличимым от L.rhamnosus штамм GG. Clin Infect Dis 1999; 28: 1159-60. Просмотреть аннотацию.
Rerksuppaphol S, Rerksuppaphol L. Рандомизированное контролируемое испытание пробиотиков для лечения простуды у школьников. Pediatr Int. 2012; 54 (5): 682-7. Просмотреть аннотацию.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr 2000; 71: 1682S-7S. Просмотреть аннотацию.
Роберфроид МБ. Пребиотики и пробиотики: это функциональные продукты? Am J Clin Nutr. 2000; 71 (6 доп.): 1682С-7С; обсуждение 1688С-90С.Просмотреть аннотацию.
Saavedra JM, et al. Кормление младенцев в больнице бифидобактериями бифидум и термофильным стрептококком для профилактики диареи и выделения ротавируса. Ланцет 1994; 344: 1046-9. Просмотреть аннотацию.
Sadeghi-Bojd S, Naghshizadian R, Mazaheri M, Ghane Sharbaf F, Assadi F. Эффективность пробиотической профилактики после первой лихорадочной инфекции мочевыводящих путей у детей с нормальными мочевыводящими путями. J Pediatric Infect Dis Soc. 2020; 9 (3): 305-310. Просмотреть аннотацию.
Самими М., Дадхах А., Хаддад Кашани Х., Таджабади-Эбрахими М., Сейед Хоссейни Э., Асеми З. Влияние синбиотических добавок на метаболический статус у женщин с синдромом поликистозных яичников: рандомизированное двойное слепое клиническое испытание. Пробиотики, антимикробные белки. 2019; 11 (4): 1355-1361. Просмотреть аннотацию.
Сато С., Учида Т., Кувана С. и др. Бактериемия, вызванная Bifidobacterium breve у новорожденного с экстрофией клоаки. Pediatr Int. 2016; 58 (11): 1226-8. Просмотреть аннотацию.
Saxelin M, Chuang NH, Chassy B и др.Лактобациллы и бактериемия на юге Финляндии 1989-1992 гг. Clin Infect Dis 1996; 22: 564-6. Просмотреть аннотацию.
Шмидт Р.М., Пилманн Лаурсен Р., Бруун С. и др. Пробиотики в младенчестве снижают частоту возникновения экземы: рандомизированное контролируемое исследование. Pediatr Allergy Immunol. 2019; 30 (3): 335-340. Просмотреть аннотацию.
Шариф А, Кашани Х. Х., Насри Э, Сулеймани З., Шариф MR. Роль пробиотиков в лечении дизентерии: рандомизированное двойное слепое клиническое испытание. Пробиотики, антимикробные белки.2017; 9 (4): 380-385. Просмотреть аннотацию.
Sharif S, Meader N, Oddie SJ, Rojas-Reyes MX, McGuire W. Пробиотики для предотвращения некротизирующего энтероколита у очень недоношенных младенцев или младенцев с очень низкой массой тела при рождении. Кокрановская база данных Syst Rev.2020; 10: CD005496. Просмотреть аннотацию.
Shavakhi A, Tabesh E, Yaghoutkar A, Hashemi H, Tabesh F, Khodadoostan M, Minakari M, Shavakhi S, Gholamrezaei A. Влияние пробиотического соединения с множеством штаммов на висмутсодержащую четырехкомпонентную терапию для инфекции Helicobacter pylori — рандомизированное контролируемое тройное слепое исследование.Helicobacter. 2013; 18 (4): 280-4. Просмотреть аннотацию.
Шэнь Дж., Цзо З.С., Мао А.П. Влияние пробиотиков на вызывание ремиссии и поддерживающую терапию при язвенном колите, болезни Крона и поучите: метаанализ рандомизированных контролируемых исследований. Воспаление кишечника. 2014; 20 (1): 21-35. Просмотреть аннотацию.
Симрен М., Оман Л., Олссон Дж. И др. Клиническое испытание: влияние ферментированного молока, содержащего три пробиотических бактерии, на пациентов с синдромом раздраженного кишечника — рандомизированное двойное слепое контролируемое исследование.Алимент Фармакол Тер 2010; 31 (2): 218-27. Просмотреть аннотацию.
Сликерман Р.Ф., Кан Дж., Ван Зил Н. и др. Влияние раннего приема пробиотиков на когнитивные способности, поведение и настроение в детстве — рандомизированное плацебо-контролируемое исследование. Acta Paediatr. 2018; 107 (12): 2172-2178. Просмотреть аннотацию.
Сёндергаард Б., Олссон Дж., Олсон К., Свенссон Ю., Битцер П., Экесбо Р. Влияние пробиотической ферментированного молока на симптомы и кишечную флору у пациентов с синдромом раздраженного кишечника: рандомизированное плацебо-контролируемое исследование.Сканд Дж. Гастроэнтерол 2011; 46 (6): 663-72. Просмотреть аннотацию.
Staudacher HM, Lomer MCE, Farquharson FM, et al. Диета с низким содержанием FODMAP уменьшает симптомы у пациентов с синдромом раздраженного кишечника, а пробиотик восстанавливает виды Bifidobacterium: рандомизированное контролируемое исследование. Гастроэнтерология. 2017; 153 (4): 936-947. Просмотреть аннотацию.
Стенман Л.К., Лехтинен М.Дж., Меланд Н. и др. Пробиотик с клетчаткой или без нее, связанный с сывороточным зонулином, регулирует жировую массу тела в рандомизированном контролируемом исследовании для взрослых с избыточным весом и ожирением.EBioMedicine 2016; 13: 190-200. Просмотреть аннотацию.
Салливан А, Баркхольт Л, Север СЕ. Lactobacillus acidophilus, Bifidobacterium lactis и Lactobacillus F19 предотвращают связанные с антибиотиками экологические нарушения Bacteroides fragilis в кишечнике. Журнал Antimicrob Chemother 2003; 52: 308-11. Просмотреть аннотацию.
Табберс М.М., Миллиано I, Роузбум М.Г., Беннинга М.А. Эффективны ли Bifidobacterium breve при лечении запоров у детей? Результаты пилотного исследования. Нутр Ж. 2011; 10:19.Просмотреть аннотацию.
Tomasz B, Zoran S, Jaroslaw W, Ryszard M, Marcin G, Robert B, Piotr K, Lukasz K, Jacek P, Piotr G, Przemyslaw P, Michal D. Долгосрочное использование пробиотиков Lactobacillus и Bifidobacterium имеет профилактическое действие влияние на возникновение и тяжесть поучита: рандомизированное проспективное исследование. Biomed Res Int. 2014; 2014: 208064. Просмотреть аннотацию.
Tursi A, Brandimarte G, Giorgetti GM, et al. Низкие дозы бальсалазида в сочетании с сильнодействующим пробиотическим препаратом более эффективны, чем один бальсалазид или месалазин при лечении острого язвенного колита легкой или средней степени тяжести.Med Sci Monit 2004; 10: PI126-31. Просмотреть аннотацию.
Вентури А., Джиончетти П., Риццелло Ф. и др. Влияние нового пробиотического препарата на состав фекальной флоры: предварительные данные по поддерживающей терапии больных язвенным колитом. Алимент Фармакол Тер 1999; 13: 1103-8. Просмотреть аннотацию.
Videlock EJ, Cremonini F. Мета-анализ: пробиотики при диарее, связанной с антибиотиками. Алимент Pharmacol Ther. 2012; 35 (12): 1355-69. Просмотреть аннотацию.
Vitellio P, Celano G, Bonfrate L, Gobbetti M, Portincasa P, De Angelis M.Влияние Bifidobacterium longum и Lactobacillus rhamnosus на микробиоту кишечника у пациентов с непереносимостью лактозы и сохраняющимися функциональными желудочно-кишечными симптомами: рандомизированное двойное слепое перекрестное исследование. Питательные вещества. 2019; 11 (4): 886. Просмотреть аннотацию.
Уоллес CJK, Милев Р.В. Эффективность, безопасность и переносимость пробиотиков при депрессии: клинические результаты открытого пилотного исследования. Фронтальная психиатрия. 2021; 12: 618279. Просмотреть аннотацию.
Ван Г, Фэн Д. Терапевтический эффект Saccharomyces boulardii в сочетании с Bifidobacterium и на клеточную иммунную функцию у детей с острой диареей.Exp Ther Med. 2019; 18 (4): 2653-2659. Просмотреть аннотацию.
Ван Ю. Х., Хуанг Ю. Влияние добавок Lactobacillus acidophilus и Bifidobacterium bifidum к стандартной тройной терапии на эрадикацию Helicobacter pylori и динамические изменения кишечной флоры. Мир J Microbiol Biotechnol. 2014; 30 (3): 847-53. Просмотреть аннотацию.
Ван Чж, Гао Цюй, Фан Цзюй. Мета-анализ эффективности и безопасности препаратов пробиотических соединений, содержащих лактобактерии и бифидобактерии, в эрадикационной терапии Helicobacter pylori.J Clin Gastroenterol. 2013; 47 (1): 25-32. Просмотреть аннотацию.
Whorwell PJ, Altringer L, Morel J, et al. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J Gastroenterol. Июль 2006; 101 (7): 1581-90. Просмотреть аннотацию.
Wildt S, Nordgaard I, Hansen U, Brockmann E, Rumessen JJ. Рандомизированное двойное слепое плацебо-контролируемое исследование с Lactobacillus acidophilus La-5 и Bifidobacterium animalis subsp. lactis BB-12 для поддержания ремиссии при язвенном колите.J. Crohns Colitis 2011; 5 (2): 115-21. Просмотреть аннотацию.
Wu G, Chen X, Cui N, et al. Профилактическое действие добавок Bifidobacterium на неонатальный холестаз у недоношенных новорожденных с очень низкой массой тела при рождении. Гастроэнтерол Рес Прак. 2020; 2020: 4625315. Просмотреть аннотацию.
Сяо Дж., Кацумата Н., Бернье Ф. и др. Пробиотик bifidobacterium breve в улучшении когнитивных функций у пожилых людей с подозрением на легкие когнитивные нарушения: рандомизированное двойное слепое плацебо-контролируемое исследование.J. Alzheimers Dis. 2020; 77 (1): 139-147. Просмотреть аннотацию.
Сяо Дж. З., Такахаши С., Одамаки Т. и др. Чувствительность к антибиотикам штаммов бифидобактерий, распространенных на японском рынке. Biosci Biotechnol Biochem. 2010; 74 (2): 336-42. Просмотреть аннотацию.
Замани Б., Голкар Х.Р., Фаршбаф С. и др. Клинический и метаболический ответ на добавление пробиотиков у пациентов с ревматоидным артритом: рандомизированное двойное слепое плацебо-контролируемое исследование. Int J Rheum Dis 2016; 19 (9): 869-79.Просмотреть аннотацию.
Чжан Дж., Ма С., Ву С., Го С., Лонг С., Тан Х. Эффекты пробиотических добавок у беременных женщин с гестационным сахарным диабетом: систематический обзор и метаанализ рандомизированных контролируемых исследований. J Diabetes Res. 2019; 2019: 5364730. Просмотреть аннотацию.
Чжу XL, Тан XG, Цюй Ф, Чжэн Y, Чжан WH, Diao YQ. Bifidobacterium может способствовать профилактике некротического энтероколита у недоношенных детей: систематический обзор и метаанализ. Int J Surg. 2019; 61: 17-25.Просмотреть аннотацию.
Пробиотические штаммы Bifidobacterium и галактоолигосахариды улучшают барьерную функцию кишечника у взрослых с ожирением, но не проявляют синергизма при совместном использовании в качестве синбиотиков | Microbiome
Joyce SA, Gahan CGM. Микробиота кишечника и метаболическое здоровье хозяина. Курр Опин Гастроэнтерол. 2014; 30: 120–7.
Артикул PubMed CAS Google Scholar
Клементе Дж. К., Урселл Л.К., Парфри Л.В., Найт Р.Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Клетка. 2012; 148: 1258–70.
Артикул PubMed PubMed Central CAS Google Scholar
Флинт Х.Дж., Скотт К.П., Луис П., Дункан Ш. Роль микробиоты кишечника в питании и здоровье. Нат Рев Гастроэнтерол Гепатол. 2012; 9: 577–89.
Артикул PubMed CAS Google Scholar
Marchesi JR, Adams DH, Fava F, Hermes GDA, Hirschfield GM и др. Микробиота кишечника и здоровье хозяина: новый клинический рубеж. Кишечник. 2015; 65: 330–9.
Артикул PubMed PubMed Central Google Scholar
Зоммер Ф., Бэкхед Ф. Кишечная микробиота — хозяева развития и физиологии. Nat Rev Microbiol. 2013; 11: 227–38.
Артикул PubMed CAS Google Scholar
Cani PD, Everard A. Говорящие микробы: когда кишечные бактерии взаимодействуют с диетой и органами хозяина. Mol Nutr Food Res. 2016; 60: 58–66.
Артикул PubMed CAS Google Scholar
Тран CD, Грайс Д.М., Уэйд Б., Керр С.А., Бауэр Д.К. и др. Проницаемость кишечника, его взаимодействие с микрофлорой кишечника и влияние на метаболизм опосредуются лимфатической системой, печенью и желчной кислотой. Future Microbiol. 2015; 10: 1339–53.
Артикул PubMed CAS Google Scholar
Фархади А., Банан А., Филдс Дж., Кешаварзян А. Кишечный барьер: граница между здоровьем и болезнью. J Gastroenterol Hepatol. 2003. 18: 479–97.
Артикул PubMed Google Scholar
Ле Шателье Э, Нильсен Т., Цин Дж., Прифти Э, Хильдебранд Ф. и др. Богатство микробиома кишечника человека коррелирует с метаболическими маркерами. Природа. 2013; 500: 541–6.
Артикул PubMed CAS Google Scholar
Esser N, Legrand-Poels S, Piette J, Scheen AJ, Paquot N. Воспаление как связь между ожирением, метаболическим синдромом и диабетом 2 типа. Диабет Res Clin Pract. 2014; 105: 141–50.
Артикул PubMed CAS Google Scholar
Zeyda M, Stulnig TM. Ожирение, воспаление и инсулинорезистентность — мини-обзор. Геронтология. 2009; 55: 379–86.
Артикул PubMed CAS Google Scholar
Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C и др. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Сахарный диабет. 2007; 56: 1761–72.
Артикул PubMed CAS Google Scholar
Невес А.Л., Коэльо Дж., Коуто Л., Лейте-Морейра А., Ронкон-Альбукерк Р. Метаболическая эндотоксемия: молекулярная связь между ожирением и риском сердечно-сосудистых заболеваний. J Mol Endocrinol. 2013; 51: R51–64.
Артикул PubMed CAS Google Scholar
Cani PD. Взаимодействие между кишечными микробами и клетками-хозяевами контролирует кишечный барьер и метаболизм. Int J Obes Suppl. 2016; 6: S28–31.
Артикул PubMed PubMed Central CAS Google Scholar
Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM и др. Изменения в микробиоте кишечника контролируют метаболическое воспаление, вызванное диетой, при ожирении и диабете, вызванном диетой с высоким содержанием жиров. Сахарный диабет. 2008; 57: 1470–81.
Артикул PubMed CAS Google Scholar
Cani PD, Osto M, Geurts L, Everard A. Участие кишечной микробиоты в развитии воспаления низкой степени и диабета 2 типа, связанного с ожирением. Кишечные микробы. 2012; 3: 279–88.
Артикул PubMed PubMed Central Google Scholar
Акбари П., Брабер С., Ализаде А., Верхейден К., Шотерман М. и др. Галактоолигосахариды защищают кишечный барьер, поддерживая сеть плотных контактов и модулируя воспалительные реакции после заражения микотоксином дезоксиниваленолом в монослоях клеток Caco-2 человека и мышах B6C3F1.J Nutr. 2015; 145: 1604–13.
Артикул PubMed CAS Google Scholar
Акбари П., Финк-Греммельс Дж., Виллемс РАМ, Дифилиппо Э., Схолс Н.А. и др. Характеристика независящих от микробиоты эффектов олигосахаридов на эпителиальные клетки кишечника: понимание роли структуры и размера: взаимосвязь между структурой и активностью неперевариваемых олигосахаридов. Eur J Nutr. 2017; 56: 1919–30.
Артикул PubMed CAS Google Scholar
Ализаде А., Акбари П., Дифилиппо Э., Схолс Н.А., Ульфман Л.Х. и др. Поросенок как модель для изучения диетических компонентов в рационах младенцев: влияние галактоолигосахаридов на функции кишечника. Br J Nutr. 2015; 115: 605–18.
Артикул PubMed CAS Google Scholar
Мэдсен К., Корниш А., Сопер П., МакКейни С., Джихон Х. и др. Пробиотические бактерии усиливают барьерную функцию кишечного эпителия у мышей и человека.Гастроэнтерология. 2001; 121: 580–91.
Артикул PubMed CAS Google Scholar
Hsieh C-Y, Osaka T., Moriyama E, Date Y, Kikuchi J, et al. Укрепление плотного соединения эпителия кишечника с помощью Bifidobacterium bifidum. Physiol Rep.2015; 3: e12327.
Артикул PubMed PubMed Central CAS Google Scholar
Гуо С., Джиллингем Т., Гуо Й, Мэн Д., Чжу В., Уокер В.А. и др.Секреции Bifidobacterium infantis и Lactobacillus acidophilus защищают барьерную функцию кишечного эпителия. J Педиатр Гастроэнтерол Нутр. 2017; 64: 404–12.
Артикул PubMed CAS Google Scholar
Андерсон Р.К., Куксон А.Л., Макнабб В.К., Келли В.Дж., Рой Н. Lactobacillus plantarum DSM 2648 — потенциальный пробиотик, который усиливает барьерную функцию кишечника. FEMS Microbiol Lett. 2010; 309: 184–92.
PubMed CAS Google Scholar
Mujagic Z, De Vos P, Boekschoten MV, Govers C., Pieters HJH, De Wit NJ, et al. Влияние Lactobacillus plantarum на барьерную функцию тонкого кишечника и транскрипцию генов слизистой оболочки; рандомизированное двойное слепое плацебо-контролируемое исследование. Научный доклад 2017; 4: 40128.
Артикул CAS Google Scholar
Рен К., Доктер-Фоккенс Дж., Фигероа Лозано С., Чжан К., Хаан Б.Дж. и др. Молочнокислые бактерии могут влиять на барьерную функцию кишечника, модулируя бокаловидные клетки.Mol Nutr Food Res. 2018; 62: 1700572.
Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, et al. Избирательное увеличение количества бифидобактерий в микрофлоре кишечника улучшает диабет, вызванный диетой с высоким содержанием жиров, у мышей за счет механизма, связанного с эндотоксемией. Диабетология. 2007. 50: 2374–83.
Артикул PubMed CAS Google Scholar
Cani PD, Delzenne NM. Взаимодействие между ожирением и связанными с ним метаболическими нарушениями: новое понимание микробиоты кишечника.Curr Opin Pharmacol. 2009; 9: 737–43.
Артикул PubMed CAS Google Scholar
Миллс Д.А. Номенклатура пробиотиков имеет значение редукция: путаница с Bifidobacterium longum subsp. Infantis сохраняется. Curr Med Res Opin. 2017; 33: 2097.
Артикул PubMed Google Scholar
Ewaschuk JB, Diaz H, Meddings L, Diederichs B, Dmytrash A, et al.Секретируемые биоактивные факторы Bifidobacterium infantis усиливают барьерную функцию эпителиальных клеток. Am J Physiol Gastrointest Liver Physiol. 2008; 295: G1025–34.
Артикул PubMed CAS Google Scholar
Бергманн К.Р., Лю SXL, Тиан Р., Кушнир А., Тернер Дж. Р. и др. Бифидобактерии стабилизируют клаудины в плотных контактах и предотвращают дисфункцию кишечного барьера при некротическом энтероколите у мышей. Am J Pathol. 2013; 182: 1596–606.
Артикул CAS Google Scholar
Гриффитс Э.А., Даффи Л.С., Шанбахер Флорида, Цяо Х., Дриджа Д. и др. Эффекты in vivo бифидобактерий и лактоферрина на концентрацию эндотоксина в кишечнике и иммунитет слизистой оболочки мышей balb / c. Dig Dis Sci. 2004; 49: 579–89.
Артикул PubMed CAS Google Scholar
Ван З., Сяо Г, Яо И, Го С., Лу К. и др.Роль бифидобактерий в барьерной функции кишечника после термической травмы у крыс. J Trauma-Injury Infect Crit Care. 2006; 61: 650–7.
Артикул Google Scholar
Чен Дж, Ван РР-Л, Ли Х-Ф, Ван РР-Л. Добавка Bifidobacterium adolescentis улучшает накопление висцерального жира и чувствительность к инсулину в экспериментальной модели метаболического синдрома. Br J Nutr. 2012; 107: 1429–34.
Артикул PubMed CAS Google Scholar
Reichold A, Brenner SA, Spruss A, Förster-Fromme K, Bergheim I, et al. Bifidobacterium adolescentis защищает от развития неалкогольного стеатогепатита на мышиной модели. J Nutr Biochem. 2014; 25: 118–25.
Артикул PubMed CAS Google Scholar
Мартинес И., Уоллес Дж., Чжан С., Легге Р., Бенсон А. К. и др. Индуцированные диетой улучшения метаболизма на модели гиперхолестеринемии у хомяков тесно связаны с изменениями микробиоты кишечника.Appl Environ Microbiol. 2009. 75: 4175–84.
Артикул PubMed PubMed Central CAS Google Scholar
Fanaro S, Marten B, Bagna R, Vigi V, Fabris C и др. Галактоолигосахариды бифидогенны и безопасны при отлучении от груди: двойное слепое рандомизированное многоцентровое исследование. J Педиатр Гастроэнтерол Нутр. 2009. 48: 82–8.
Артикул PubMed CAS Google Scholar
Сьерра С., Бернал М.-Дж., Бласко Дж., Мартинес Р., Далмау Дж. И др. Эффект пребиотика в течение первого года жизни у здоровых младенцев, получавших смесь, содержащую GOS в качестве единственного пребиотика: многоцентровое, рандомизированное, двойное слепое и плацебо-контролируемое исследование. Eur J Nutr. 2015; 54: 89–99.
Артикул PubMed CAS Google Scholar
Хаарман М., Кнол Дж. Количественный анализ ПЦР в реальном времени фекальных видов Lactobacillus у младенцев, получающих пребиотическую смесь для грудных детей.Appl Environ Microbiol. 2006. 72: 2359–65.
Артикул PubMed PubMed Central CAS Google Scholar
Дэвис Л.М.Г., Мартинес И., Вальтер Дж., Хаткинс Р. Дозозависимое влияние пребиотических галактоолигосахаридов на кишечную микробиоту здоровых взрослых. Int J Food Microbiol. 2010; 144: 285–92.
Артикул PubMed CAS Google Scholar
Walton GE, van den Heuvel EGHM, Kosters MHW, Rastall RA, Tuohy KM, et al. Рандомизированное перекрестное исследование, изучающее влияние галактоолигосахаридов на фекальную микробиоту у мужчин и женщин старше 50 лет. Br J Nutr. 2012; 107: 1466–75.
Артикул PubMed CAS Google Scholar
Вулевич Дж., Юрич А., Цорцис Дж., Гибсон Г.Р. Смесь трансгалактоолигосахаридов снижает маркеры метаболического синдрома и модулирует фекальную микробиоту и иммунную функцию взрослых с избыточным весом.J Nutr. 2013: 324–31.
Bouhnik Y, Raskine L, Simoneau G, Paineau D, Bornet F. Способность короткоцепочечных фруктоолигосахаридов стимулировать фекальные бифидобактерии: исследование зависимости от дозы у здоровых людей. Нутр Дж. 2006; 5: 8.
Артикул PubMed PubMed Central CAS Google Scholar
Рамирес-Фариас С., Слезак К., Фуллер З., Дункан А., Холтроп Г. и др. Влияние инулина на микробиоту кишечника человека: стимуляция Bifidobacterium adolescentis и Faecalibacterium prausnitzii.Br J Nutr. 2008; 101: 541–50.
PubMed Google Scholar
Clarke ST, Brooks SP, Inglis GD, Yanke LJ, Green J, Petronella N., Ramdath DD, Bercik P, Green-Johnson JM, Kalmokoff M. Влияние β2-1 фруктана на изменение фекального сообщества: результаты плацебо-контролируемого рандомизированного двойного слепого перекрестного исследования у здоровых взрослых. Br J Nutr. 2017; 118: 441–53.
Дэвис Л., Мартинес И., Уолтер Дж., Гоин С., Хаткинс Р.В.Пиросеквенирование со штрих-кодом показывает, что потребление галактоолигосахаридов приводит к высокоспецифичному бифидогенному ответу у людей. PLoS One. 2011; 6: e25200.
Артикул PubMed PubMed Central CAS Google Scholar
Мартинес И., Ким Дж., Даффи П.Р., Шлегель В.Л., Вальтер Дж. Резистентные крахмалы типов 2 и 4 по-разному влияют на состав фекальной микробиоты у людей. PLoS One. 2010; 5: e15046.
Артикул PubMed PubMed Central CAS Google Scholar
Рингель-Кулька Т., Ченг Дж., Рингель Ю., Салоярви Дж., Кэрролл И. и др. Кишечная микробиота у здоровых маленьких детей и взрослых в США — высокопроизводительный микроматричный анализ. PLoS One. 2013; 8: e64315.
Артикул PubMed PubMed Central CAS Google Scholar
Аганс Р., Ригсби Л., Кенче Х., Михаил С., Хамис Х.Д. и др.Микробиота дистального отдела кишечника детей подросткового возраста отличается от таковой взрослых. FEMS Microbiol Ecol. 2011; 77: 404–12.
Артикул PubMed PubMed Central CAS Google Scholar
Salonen A, Lahti L, Salojärvi J, Holtrop G, Korpela K, et al. Влияние диеты и индивидуальных особенностей на состав кишечной микробиоты и продукты ферментации у мужчин с ожирением. ISME J. 2014; 8: 2218–30.
Артикул PubMed PubMed Central CAS Google Scholar
Venkataraman A, Sieber JR, Schmidt AW, Waldron C, Theis KR, et al. Различные ответы микробиомов человека на пищевые добавки с резистентным крахмалом. Микробиом. 2016; 4:33.
Артикул PubMed PubMed Central CAS Google Scholar
Колида С, Гибсон ГР. Синбиотики в здоровье и болезни. Annu Rev Food Sci Technol. 2011; 2: 373–93.
Артикул PubMed Google Scholar
Mallon CA, Van Elsas JD, Salles JF. Микробные инвазии: процесс, закономерности и механизмы. Trends Microbiol. 2015; 23: 719–29.
Артикул PubMed CAS Google Scholar
Вальтер Дж., Мальдонадо-Гомес М.Х., Мартинес И. Приживать или не приживать: экологическая основа для модуляции микробиома кишечника с помощью живых микробов. Curr Opin Biotechnol. 2017; 49: 129–39.
Артикул PubMed CAS Google Scholar
Freitas MB, Moreira EAM, de Lima Oliveira D, Tomio C, Rosa JS, Moreno YMF и др. Эффект синбиотических добавок у детей и подростков с муковисцидозом: рандомизированное контролируемое клиническое исследование. Eur J Clin Nutr.2018; 72: 736–43.
Паниграхи П., Парида С., Нанда, Северная Каролина, Сатпатия Р., Прадхан Л. и др. Рандомизированное испытание синбиотиков для профилактики сепсиса среди младенцев в сельских районах Индии. Природа. Epub в преддверии печати 2017 г. https://doi.org/10.1038/nature23480.
Росси М., Джонсон Д. В., Моррисон М., Паско Е. М., Кумбес Дж. С. и др. Синбиотики, облегчающие почечную недостаточность за счет улучшения микробиологии кишечника (SYNERGY): рандомизированное исследование. Clin J Am Soc Nephrol. 2016; 11: 223–31.
Артикул PubMed PubMed Central CAS Google Scholar
Огава Т., Асаи Ю., Ясуда К., Сакамото Х. Оральная иммуноадъювантная активность нового синбиотика Lactobacillus casei subsp casei в сочетании с декстраном у мышей BALB / c.Nutr Res. 2005; 25: 295–304.
Артикул CAS Google Scholar
Танака Р., Такаяма Х., Моротоми М., Куросима Т., Уэяма С. и др. Влияние введения TOS и Bifidobacterium breve 4006 на фекальную флору человека. Бифидобактная микрофлора. 1983; 2: 17–24.
Артикул CAS Google Scholar
Пьетро Ф.А., Лучери С., Долара П., Джаннини А., Биггери А. и др.Противоопухолевое действие пребиотика инулина, обогащенного олигофруктозой, в сочетании с пробиотиками Lactobacillus rhamnosus и Bifidobacterium lactis на индуцированный азоксиметаном канцерогенез толстой кишки у крыс. Канцерогенез. 2002; 23: 1953–60.
Артикул Google Scholar
Wang X, Brown IL, Evans AJ, Conway PL. Защитное действие гранул кукурузного крахмала с высоким содержанием амилозы (амиломаиза) на выживаемость Bifidobacterium spp.в кишечном тракте мышей. J Appl Microbiol. 1999; 87: 631–9.
Артикул PubMed CAS Google Scholar
Krumbeck JA, Maldonado-Gomez MX, Martínez I., Frese SA, Burkey TE, et al. Селекция in vivo для выявления штаммов бактерий с улучшенными экологическими характеристиками при применении синбиотиков. Appl Environ Microbiol. 2015; 81: 2455–65.
Артикул PubMed PubMed Central CAS Google Scholar
Крамбек Дж., Уолтер Дж., Хаткинс Р. У. Синбиотики для улучшения здоровья человека: последние события, проблемы и возможности. Annu Rev Food Sci Technol. 2018; 9: 451–79.
Мальдонадо-Гомес М.Х., Мартинес И., Боттачини Ф., О’Каллаган А., Вентура М. и др. Стабильное приживление Bifidobacterium longum Ah2206 в желудочно-кишечном тракте человека зависит от индивидуальных особенностей резидентного микробиома. Клеточный микроб-хозяин. 2016; 20: 515–26.
Артикул PubMed CAS Google Scholar
Bindels LB, Munoz RRS, Gomes-Neto JC, Mutemberezi V, Martínez I., Salazar N, et al. Резистентный крахмал может улучшить чувствительность к инсулину независимо от микробиоты кишечника. Микробиом. 2017; 5: 12.
Артикул PubMed PubMed Central Google Scholar
Wu RY, Määttänen P, Napper S, Scruten E, Li B и др. Неперевариваемые олигосахариды напрямую регулируют кином хозяина, чтобы модулировать воспалительные реакции хозяина без изменения микробиоты кишечника.Микробиом. 2017; 5: 135.
Артикул PubMed PubMed Central CAS Google Scholar
Fransen F, Sahasrabudhe NM, Elderman M, Bosveld M, El Aidy S, Hugenholtz F, et al. β2 → 1-фруктаны модулируют иммунную систему in vivo в зависимости от микробиоты и независимо от нее. Фронт Иммунол. 2017; 8: 154.
PubMed PubMed Central Google Scholar
Покусаева К., Фицджеральд Г.Ф., Синдерен Д. Углеводный обмен у бифидобактерий. Genes Nutr. 2011; 6: 285.
Артикул PubMed PubMed Central CAS Google Scholar
Вернацца К.Л., Гибсон Г.Р., Расталл Р. Предпочтение углеводов, кислотная толерантность и толерантность к желчи в пяти штаммах Bifidobacterium. J Appl Microbiol. 2006; 100: 846–53.
Артикул PubMed CAS Google Scholar
Тонгарам Т., Хефлингер Дж. Л., Чоу Дж., Миллер МД. Метаболизм пребиотических галактоолигосахаридов пробиотическими лактобактериями и бифидобактериями. J. Agric Food Chem. 2017; 65: 4184–92.
Артикул PubMed CAS Google Scholar
Аландер М., Мэтто Дж., Кнайфель В., Йоханссон М., Коегле Б. и др. Влияние добавок галактоолигосахаридов на фекальную микрофлору человека, а также на выживаемость и устойчивость Bifidobacterium lactis Bb-12 в желудочно-кишечном тракте.Int Dair. 2001; 11: 817–25.
Артикул CAS Google Scholar
Малинен Э., Мэтто Дж., Салмити М., Аландер М., Саарела М. и др. ПЦР-ИФА II: анализ популяций Bifidobacterium в образцах фекалий человека из испытания потребления с Bifidobacterium lactis Bb-12 и препаратом галактоолигосахарида. Syst Appl Microbiol. 2002; 25: 249–58.
PubMed CAS Google Scholar
Satokari RM, Vaughan EE, Akkermans AD, Saarela M, de Vos WM. Полимеразная цепная реакция и мониторинг денатурирующего градиентного гель-электрофореза популяций фекальных Bifidobacterium в испытании кормления пребиотиками и пробиотиками. Syst Appl Microbiol. 2001; 231: 227–31.
Weiss S, Xu ZZ, Peddada S, Amir A, Bittinger K, et al. Стратегии нормализации и дифференциальной численности микробов зависят от характеристик данных. Микробиом. 2017; 5: 1–18.
Артикул Google Scholar
Тайпале Т., Пиенихаккинен К., Изолаури Э., Ларсен Ч., Брокманн Э. и др. Bifidobacterium animalis subsp. lactis BB-12 в снижении риска инфекций в младенчестве. Br J Nutr. 2010; 105: 409–16.
Артикул PubMed CAS Google Scholar
Shaikh M, Rajan K, Forsyth CB, Voigt RM, Keshavarzian A. Одновременное газохроматографическое измерение мочи с помощью зондов сахара для оценки кишечной проницаемости: использование анализа динамики изменений для оптимизации его использования для оценки региональной проницаемости кишечника.Clin Chim Acta. 2015; 10: 24–32.
Артикул CAS Google Scholar
Фархади А., Гундлапалли С., Шейх М., Францидес С., Харрелл Л. и др. Восприимчивость к кишечной проницаемости: возможный механизм эндотоксемии при неалкогольном стеатогепатите. Liver Int. 2008. 28: 1026–33.
Артикул PubMed PubMed Central Google Scholar
Хилсден Р., Меддингс Дж., Сазерленд Л.Изменения кишечной проницаемости в ответ на ацетилсалициловую кислоту у родственников пациентов с болезнью Крона. Гастроэнтерология. 1996; 110: 1395–403.
Артикул PubMed CAS Google Scholar
Бен X-M, Li J, Feng Z-T, Shi S-Y, Lu Y-D, et al. Низкий уровень галактоолигосахарида в детской смеси стимулирует рост кишечных бифидобактерий и лактобактерий. Мир Дж. Гастроэнтерол. 2008. 14: 6564–8.
Артикул PubMed PubMed Central Google Scholar
Вулевич Дж., Дракулараку А., Якуб П., Цорцис Дж., Гибсон Г.Р. Модуляция профиля фекальной микрофлоры и иммунной функции с помощью новой смеси трансгалактоолигосахаридов (B-GOS) у здоровых пожилых добровольцев. Am J Clin Nutr. 2008; 88: 1438–46.
PubMed CAS Google Scholar
Chandel D, Perez-Munoz M, Yu F, Boissy R, Satpathy R, et al. Изменения микробиоты кишечника после раннего приема пероральных синбиотиков младенцам в Индии.J Педиатр Гастроэнтерол Нутр. 2017; 65: 218–24.
Артикул PubMed PubMed Central Google Scholar
Ковачева-Датчари П., Нильссон А., Акрами Р., Ли Ю.С., Де Ваддер Ф. и др. Улучшение метаболизма глюкозы за счет пищевых волокон связано с увеличением численности Prevotella. Cell Metab. 2015; 22: 971–82.
Артикул PubMed CAS Google Scholar
Wu GD, Chen J, Hoffmann C, Bittinger K, Chen Y, et al. Связь долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука (80-). 2011; 334: 105–9.
Артикул CAS Google Scholar
Hjorth MF, Roager HM, Larsen TM, Poulsen SK, Licht TR, et al. Отношение микробов Prevotella к Bacteroides до обработки определяет успех потери жира в организме в течение 6-месячного рандомизированного контролируемого диетического вмешательства. Int J Obes.2018; 42: 580–3.
Angelakis E, Lagier JC. Примеры и методы, демонстрирующие связь между ожирением и микробиотой Microb Pathog Epub в преддверии печати 2016 г. https://doi.org/10.1016/j.micpath.2016.01.024.
Блехман Р., Гудрич Дж. К., Хуанг К., Сан К., Буковски Р. и др. Генетическая изменчивость хозяина влияет на состав микробиома на разных участках тела человека. Genome Biol. 2015; 16: 191.
Артикул PubMed PubMed Central CAS Google Scholar
Тишкофф С.А., Рид Ф.А., Ранчиаро А., Войт Б.Ф., Кортни С. и др. Конвергентная адаптация персистенции лактазы человека в Африке и Европе. Нат Жене. 2007; 39: 31–40.
Артикул PubMed CAS Google Scholar
Szilagyi A. Новое определение лактозы как условного пребиотика. Можно J Гастроэнтерол. 2004; 18: 163–7.
Артикул PubMed Google Scholar
Parche S, Jacobs D, Arigoni F, Titgemeyer F, Jankovic I. Предпочтение лактозы перед глюкозой в Bifidobacterium longum NCC2705: glcP, кодирующий переносчик глюкозы, подвергается репрессии лактозы. J Bacteriol. 2006; 188: 1260–5.
Артикул PubMed PubMed Central CAS Google Scholar
Азкарат-Перил М.А., Риттер А.Дж., Саваиано Д., Монтеагудо-Мера А., Андерсон С., Магнесс СТ, Клаенхаммер ТР. Влияние короткоцепочечных галактоолигосахаридов на микробиом кишечника людей с непереносимостью лактозы.PNAS. 2017; 114: E367–75.
Антони Л., Нудинг С., Векамп Дж., Штанге Э.Ф. Кишечный барьер при воспалительном заболевании кишечника. World J Gastrointerol. 2014; 20: 1165–79.
Артикул CAS Google Scholar
Скарпеллини Е., Лупо М., Иегри С., Гасбаррини А., Де Сантис А. и др. Кишечная проницаемость при неалкогольной жировой болезни печени: ось кишечник-печень. Rev Последние клинические испытания. 2014; 9: 141–7.
PubMed CAS Google Scholar
Форсайт К., Шеннон К., Кордовер Дж., Фойгт Р., Шейх М. и др. Повышенная кишечная проницаемость коррелирует с окрашиванием альфа-синуклеином слизистой сигмовидной кишки и маркерами воздействия эндотоксина на ранних стадиях болезни Паркинсона. PLoS One. 2011; 6: e28032.
Артикул PubMed PubMed Central CAS Google Scholar
Чжун Ю., Цай Д., Цай В., Гэн С., Чен Л. и др. Защитный эффект энтерального питания с добавлением галактоолигосахаридов на барьерную функцию кишечника у крыс с тяжелым острым панкреатитом.Clin Nutr. 2009; 28: 575–80.
Артикул PubMed CAS Google Scholar
Мартин Р., Лаваль Л., Чейн Ф, Микель С., Нативидад Дж. И др. Bifidobacterium animalis ssp. lactis CNCM-I2494 восстанавливает проницаемость кишечного барьера у мышей с хроническим легким воспалением. Front Microbiol. 2016; 7: 1–12.
Google Scholar
Агостини С., Губерн М., Тондеро В., Сальвадор-Картье С., Безирар В. и др.Продаваемый на рынок ферментированный молочный продукт, содержащий Bifidobacterium lactis CNCM I-2494, подавляет гиперчувствительность кишечника и нарушение кишечного барьера, вызванное острым стрессом у крыс. Нейрогастроэнтерол Мотил. 2012; 24: 376 – e172.
Артикул PubMed CAS Google Scholar
Schroeder B, Birchenough GM, Stahlman M, Arike L, Johansson ME, et al. Бифидобактерии или клетчатка защищают от вызванного диетой разрушения слизи толстой кишки, опосредованного микробиотой.Клеточный микроб-хозяин. 2018; 23: 27–40.e7.
Артикул PubMed CAS Google Scholar
Морел Ф., Дай К., Ни Дж., Томас Д., Парнет П. и др. α-Галактоолигосахариды дозозависимо снижают аппетит и уменьшают воспаление у взрослых с избыточным весом. J Nutr. 2015; 145: 2052–9.
Артикул PubMed CAS Google Scholar
Rodes L, Saha S, Tomaro-Duchesneau C, Prakash S.Микроинкапсулированные Bifidobacterium longum subsp. Infantis ATCC 15697 благоприятно модулирует микробиоту кишечника и снижает уровень эндотоксинов в крови у крыс F344. Biomed Res Int. 2014; 602832. https://www.hindawi.com/journals/bmri/2014/602832/abs/.
Canfora EE, van der Beek, Christina M Hermes GDA, Gijs GH, Jocken JWE, Holst JJ, et al. Дополнение рациона галактоолигосахаридами увеличивает бифидобактерии, но не повышает чувствительность к инсулину у лиц с преддиабетическим ожирением. Гастроэнтерология.2017; 153: 87–97.e3.
Артикул PubMed CAS Google Scholar
Карвалью-Уэллс А.Л., Гельмольц К., Узел С., Мольцер С., Леонард С. и др. Определение пребиотического потенциала цельнозернового завтрака на основе кукурузы in vivo: исследование кормления человека. Br J Nutr. 2010; 104: 1353–6.
Артикул PubMed CAS Google Scholar
Пробиотик Bifidobacterium breve индуцирует продуцирующие IL-10 клетки Tr1 в толстой кишке
Abstract
Было показано, что специфическая кишечная микробиота индуцирует развитие регуляторных Т-клеток Foxp3 + .Однако остается неясным, как развитие другой субпопуляции регуляторных Т-клеток, Tr1-клеток, регулируется в кишечнике. Здесь мы проанализировали роль двух пробиотических штаммов кишечных бактерий, Lactobacillus casei и Bifidobacterium breve в развитии Т-клеток в кишечнике. B. breve , но не L. casei , индуцировал развитие клеток Tr1, продуцирующих IL-10, которые экспрессируют cMaf, IL-21 и Ahr в толстой кишке. Кишечные CD103 + дендритные клетки (ДК), опосредованные B.breve -индуцированное развитие Т-клеток, продуцирующих ИЛ-10. CD103 + DC из Il10 — / — , Tlr2 — / — и Myd88 — / — мыши показали дефектное развитие клеток Tr1, индуцированное B. breve . B. breve -обработанные CD103 + DC не смогли индуцировать продукцию IL-10 из совместно культивированных Il27ra — / — Т-клеток. Обработка B. breve Tlr2 — / — мышей не увеличивала количество Т-клеток, продуцирующих IL-10, в собственной пластинке толстой кишки.Таким образом, B. breve активирует кишечные CD103, + DC с продуцированием IL-10 и IL-27 по пути TLR2 / MyD88, тем самым индуцируя продуцирующие IL-10 клетки Tr1 в толстом кишечнике. Оральное введение B. breve облегчило колит у мышей с ослабленным иммунитетом, получавших наивные CD4 + Т-клетки от мышей дикого типа, но не Il10 — / — мышей. Эти данные демонстрируют, что B. breve предотвращает воспаление кишечника за счет индукции кишечных IL-10-продуцирующих клеток Tr1.
Информация об авторе
В отличие от индукции развития регуляторных Т-клеток Foxp3 + , остается неясным, как факторы окружающей среды кишечника регулируют развитие другой субпопуляции регуляторных Т-клеток, клеток Tr1, которые продуцируют IL-10. В этом исследовании мы обнаружили, что пробиотический штамм Bifidobacterium breve индуцирует продуцирующие IL-10 клетки Tr1, которые экспрессируют c-Maf, IL-21 и Ahr, посредством активации кишечных CD103 + DC в толстом кишечнике. Используя несколько мышей, нацеленных на ген, мы показываем, что B.Индуцированное breve развитие клеток Tr1, продуцирующих IL-10, зависит от секреции DC IL-10 и 27 посредством пути TLR2 / MyD88. Наконец, мы показываем, что B. breve ослабляет Т-клеточный колит у мышей с ослабленным иммунитетом за счет продукции Т-клетками ИЛ-10. Эти данные демонстрируют, что B. breve поддерживает гомеостаз кишечника за счет индукции кишечных IL-10-продуцирующих клеток Tr1.
Образец цитирования: Jeon SG, Kayama H, Ueda Y, Takahashi T., Asahara T., Tsuji H, et al.(2012) Пробиотик Bifidobacterium breve индуцирует продуцирующие IL-10 клетки Tr1 в толстой кишке. PLoS Pathog 8 (5): e1002714. https://doi.org/10.1371/journal.ppat.1002714
Редактор: Эндрю Л. Гудман, Йельский университет, Соединенные Штаты Америки
Поступила: 31 октября 2011 г .; Принято к печати: 5 апреля 2012 г .; Опубликовано: 31 мая 2012 г.
Авторские права: © 2012 Jeon et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана грантом Министерства образования, культуры, спорта, науки и технологий; Министерство здравоохранения, труда и социального обеспечения; Мемориальный фонд Като для исследований Намбио; и Осакский фонд содействия клинической иммунологии. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Последние достижения в метагеномном анализе кишечных бактерий показали, что воспалительные заболевания кишечника (ВЗК) связаны с дисбактериозом кишечной микрофлоры [1], [2], [3]. В поддержку этих исследований на людях анализ мышей, лишенных NLRP6, показал, что измененный состав кишечных симбиотических бактерий вносит вклад в патогенез колита [4]. Пробиотики, живые микроорганизмы, которые при введении в соответствующих количествах приносят пользу здоровью хозяина, использовались для лечения ВЗК [5] — [8].Было показано, что пробиотики модулируют кишечные симбиотические бактерии, что приводит к поддержанию кишечного гомеостаза [9], [10]. Было показано, что модуляция микробиоты пробиотиками вызывается противодействием патогенным бактериям за счет снижения pH в просвете, ингибирования прикрепления бактерий или выработки антимикробных молекул [8]. Также было показано, что пробиотики усиливают барьерные функции кишечных эпителиальных клеток [11]. Таким образом, было постулировано несколько механизмов перекрестного взаимодействия между пробиотиками и хозяином.
Накопленные недавно данные показали, что кишечная комменсальная микробиота имеет большое влияние на кишечную иммунную систему хозяина [12] — [14]. Комменсальная микробиота, как было показано, индуцирует IgA-опосредованные ответы и развитие эффекторных Т-клеток Th2 / Th27, а также регуляторных Т (Treg) -клеток [15] — [17]. Совсем недавно была продемонстрирована специфическая микробиота, которая индуцирует развитие клеток Th27 или Treg-клеток. Сегментированные нитчатые бактерии (SFB), которые, как ранее было показано, индуцируют IgA-продуцирующие клетки в тонком кишечнике, индуцируют развитие клеток Th27 в тонком кишечнике мышей [18], [19].Симбиотическая бактерия человека, Bacteroides fragilis , как было показано, опосредует Toll-подобный рецептор 2 (TLR2) -зависимое развитие Foxp3 + Treg-клеток в толстой кишке [20] — [22]. Виды Clostridium опосредуют TLR-независимую индукцию Foxp3 + Treg клеток в толстом кишечнике [23]. Таким образом, несколько селективных кишечных бактерий способствуют развитию кишечных Т-клеток посредством различных механизмов. Совсем недавно было показано, что микробиота-зависимая индукция Treg-клеток Foxp3 + необходима для установления кишечного гомеостаза CD4 + Т-клеток [24].Кроме того, было показано, что комменсальная микробиота обучает Foxp3 + Treg-клетки приобретать антиген-специфический репертуар их Т-клеточных рецепторов [25]. Также было показано, что пробиотики непосредственно модулируют иммунную систему хозяина, особенно индукцию Foxp3 + Treg или развитие TGF-β-несущих Treg клеток [26] — [29]. Таким образом, постулируется несколько механизмов зависимого от кишечных бактерий развития Treg-клеток Foxp3 + .
Кишечный гомеостаз поддерживается популяциями регуляторных Т-клеток, состоящими из двух основных субпопуляций Т-лимфоцитов CD4 + ; Foxp3 + Treg-клетки и продуцирующие IL-10 регуляторные T (Tr1) -клетки 1 типа [30].Клетки Tr1 модулируют иммунные ответы с помощью механизмов, отличных от тех, которые используются клетками Foxp3 + Treg [31]. Действительно, клетки Tr1 не экспрессируют основной фактор транскрипции Treg Foxp3 и индуцируются отдельными цитокинами, такими как IL-10 и IL-27 [32], [33]. Клетки Tr1 в изобилии присутствуют в собственной пластинке кишечника [34], но остается неясным, как клетки Tr1 развиваются в кишечнике.
В этом исследовании мы проанализировали влияние двух штаммов пробиотиков, Bifidobacterium breve и Lactobacillus casei , на ответы Т-клеток кишечника.Пероральное введение B. breve , но не L. casei , привело к увеличению продукции IL-10 из CD4 + Т-клеток толстой кишки без увеличения экспрессии Foxp3. B. breve -индуцированные IL-10-продуцирующие CD4 + Т-клетки обладали свойствами клеток Tr1, о чем свидетельствует экспрессия cMaf, Il21 и Ahr . B. breve -зависимая индукция клеток Tr1 опосредована кишечными дендритными клетками CD103 + через TLR2 / MyD88-зависимую продукцию IL-10 и IL-27.Введение B. breve ослабило воспаление кишечника у мышей с ослабленным иммунитетом, перенесших наивные CD4 + Т-клетки IL-10-зависимым образом. Эти данные устанавливают механизмы индукции клеток Tr1 пробиотиком B. breve , который модулирует иммунные ответы хозяина.
Результаты
B. breve индуцирует продуцирующие IL-10 CD4 + Т-клетки в толстой кишкеLactobacillus casei штамм Shirota и Bifidobacterium breve Yakult доказали свою эффективность для лечения ряда заболеваний, таких как сахарный диабет, артрит и воспалительные заболевания кишечника [35] — [40].Чтобы проанализировать влияние этих пробиотических штаммов на гомеостаз кишечника, мы перорально вводили мышей C57BL / 6 L. casei и B. breve (10 9 бактерий каждая) в течение 3 месяцев. Сначала мы проанализировали фекальную микробиоту, используя методы количественной ПЦР и количественной ПЦР с обратной транскрипцией, нацеленной на рДНК и рРНК, соответственно [41]. Введение L. casei и B. breve не вызывало значительного изменения количества и состава микробиоты (текст S1, таблица S1).Поскольку было показано, что некоторые микробиоты индуцируют дифференцировку кишечных CD4 + T-клеток [17], мы проанализировали продукцию IL-10, IL-17 и IFN-γ из CD4 + T-клеток в тонком и толстом кишечнике. мышей, получавших перорально L. casei и B. breve . Количество Т-клеток, продуцирующих IL-10, IL-17 и IFN-γ, как в тонком, так и в толстом кишечнике, не изменилось у мышей, которым вводили L. casei (рис. 1A, B).У животных, получавших B. breve , количество Т-клеток, продуцирующих IL-17 и IFN-γ, в тонком и толстом кишечнике существенно не изменилось. Однако количество Т-клеток, продуцирующих IL-10, увеличилось примерно в два раза в толстом кишечнике, но не изменилось в тонком кишечнике, селезенке и брыжеечных лимфатических узлах (MLN) (Рисунок 1C, D и Рисунок S1). Таким образом, введение B. breve мышам C57BL / 6 избирательно увеличивало количество Т-клеток CD4 + , продуцирующих IL-10, в толстом кишечнике без модуляции кишечной микробиоты.
Рисунок 1. Индукция Т-клеток CD4 + , продуцирующих IL-10, B. breve в собственной пластинке толстой кишки.
6-недельных мышей C57BL / 6 кормили L. casei или B. breve или плацебо ежедневно (каждое, 1 × 10 9 ) через желудочный зонд в течение 3 месяцев (n = 8). Лимфоциты собственной пластинки кишечника анализировали на продукцию цитокинов с помощью проточной цитометрии. Процент Т-клеток CD4, продуцирующих IL-10, IL-17 и IFN-γ + у мышей, которым вводили L.casei ( A ) или B. breve ( C ). * P <0,05. ( B , D ) Репрезентативные точечные диаграммы FACS, показывающие продукцию IL-10 и IFN-γ, гейтированных на CD4 + Т-клеток толстой кишки у указанных мышей.
https://doi.org/10.1371/journal.ppat.1002714.g001
B. breve индуцирует Foxp3 — Т-клетки, продуцирующие IL-10Затем мы проанализировали влияние B. breve на линию мышей BALB / c.Мышей BALB / c перорально вводили B. breve (10 9 бактерий) в течение указанного времени перед анализом экспрессии IL-10 в CD4 + Т-клетках собственной пластинки толстой кишки. Количество Т-клеток, продуцирующих IL-10 в толстой кишке, увеличивалось после 2 недель лечения, а к 3 неделям количество клеток, продуцирующих IL-10, удвоилось (рис. 2A, C). Поскольку было показано, что IL-10 продуцируется из популяций Foxp3 + и Foxp3 — кишечных Т-клеток, мы проанализировали экспрессию Foxp3 в Т-клетках толстой кишки в B.breve -обработанных мышей BALB / c. Количество Foxp3 + CD4 + Т-клеток в толстом кишечнике не изменилось у мышей, получавших B. breve (фиг. 2B, D). Поэтому мы перорально вводили B. breve мышам Foxp3-GFP и анализировали экспрессию IL-10 в Т-клетках CD4 + толстой кишки через 3 недели после начала лечения. Количество IL-10-продуцирующих клеток увеличивалось в популяции Foxp3 —, но не в популяции Foxp3 + из B.breve -обработанных мышей (рис. 2 E, F). Таким образом, введение B. breve избирательно увеличивало продуцирующие IL-10 Foxp3 — CD4 + Т-клетки в толстом кишечнике.
Рисунок 2. Индукция Foxp3 — Т-лимфоцитов CD4 + , продуцирующих IL-10, B. breve .
6-недельным мышам BALB / c вводили B. breve или плацебо перорально в течение 1–4 недель (n = 5). В указанный момент мышей умерщвляли и Т-клетки CD4 + в собственной пластинке толстой кишки анализировали с помощью проточной цитометрии.Показаны процентные содержания CD4 + , IL-10, + Т-клеток ( A ) и CD4 + Foxp3 + Т-клеток ( B ). * P <0,02. Показаны характерные точечные графики FACS для Т-клеток IL-10 + и IL-17 + ( C ) и гистограмма для Т-клеток Foxp3 + ( D ), стробированных на Т-лимфоцитах CD4 + . . ( E ) Foxp3 GFP мышей кормили B. breve в течение 4 недель.CD4 + Т-клетки в собственной пластинке толстой кишки анализировали на экспрессию GFP и IL-10. ( F ) Процентное содержание IL-10 + Т-клеток в Foxp3 + или Foxp3 — CD4 + Т-клеток (n = 5). Данные представляют два независимых эксперимента; означает ± S.D. * P <0,02.
https://doi.org/10.1371/journal.ppat.1002714.g002
CD103 в кишечнике
+ ДК способствуют развитию B. breve -зависимых клеток Tr1Далее мы проанализировали, как B.breve индуцирует Т-клетки, продуцирующие ИЛ-10. Поскольку дендритные клетки кишечника (ДК) модулируют дифференцировку Т-клеток в эффекторные или регуляторные Т-клетки, клетки CD11c + были выделены из собственной пластинки толстой кишки, стимулированы B. breve или L. casei , а затем совместно культивированы. с наивными CD4 + Т-лимфоцитами в селезенке. Через 4 дня совместного культивирования Т-клетки собирали и стимулировали с помощью покрытых оболочкой mAb против CD3 и растворимых mAb против CD28. CD4 + Т-клетки, культивированные совместно с B.кишечные ДК, обработанные breve , но не обработанные L. casei , продуцировали высокие количества ИЛ-10 (рис. 3А). Мы проанализировали действие других Bifidobacterium spp. Кишечные DC, обработанные B. adolescentis или B. bifidum , не индуцировали продукцию IL-10 из совместно культивированных CD4 + Т-клеток, хотя B. longum -обработанные DC умеренно индуцировали IL-10-продуцирующие T-клетки. ячеек (рис. 3В). Таким образом, B. breve сильно индуцировал Т-клетки, продуцирующие IL-10, посредством активации кишечных DC.В отличие от высокой индукции IL-10, обработанные B. breve кишечные клетки CD11c + не индуцировали экспрессию Foxp3 в совместно культивируемых Т-клетках CD4 + (фиг. 3C). Т-клетки Foxp3 —, продуцирующие IL-10, были охарактеризованы как регуляторные T (Tr1) -клетки 1-го типа, экспрессирующие c-Maf, арилуглеводородный рецептор (Ahr) и IL-21 [42] — [44]. Таким образом, мы проанализировали экспрессию cMaf , Ahr и Il21 . Экспрессия cMaf , Ahr и Il21 была увеличена в CD4 + Т-клетках, совместно культивируемых с B.breve , но не обработанные L. casei , кишечные клетки CD11c + (фигура 3D). Эти данные показывают, что кишечные ДК, обработанные B. breve , способствуют индукции продуцирующих IL-10 клеток Tr1.
Рисунок 3. Кишечные DCs опосредуют B. breve -зависимое развитие клеток Tr1.
CD11c + DC (5 × 10 4 ) были выделены из собственной пластинки толстой кишки и культивированы с B. breve , L.casei, B. adolescentis, B. longum или B. bifidum (5 × 10 4 ) в течение 24 часов. После отмывки DC совместно культивировали с наивными CD4 + Т-клетками селезенки (5 × 10 4 ) в присутствии растворимых mAb против CD3 в течение 4 дней. ( A ) Т-клетки собирали и повторно стимулировали связанными с планшетом анти-CD3 и растворимыми mAb против CD28 в течение 24 часов. Концентрации IL-10 в супернатантах культур анализировали с помощью ELISA. * P <0,001. ( B ) Т-клетки собирали и повторно стимулировали связанными с планшетом анти-CD3 и растворимыми mAb против CD28 в течение 24 часов.Концентрации IL-10 в супернатантах культур анализировали с помощью ELISA. * P <0,001. ( C ) Т-клетки собирали и затем окрашивали на CD4 и Foxp3. Показана экспрессия Foxp3 в клетках CD4 + . ( D ) Т-клетки собирали и стимулировали mAb против CD3 и против CD28 в течение 4 часов. Затем экстрагировали тотальную РНК для анализа экспрессии cMaf , Il21 и Ahr с помощью количественной ОТ-ПЦР в реальном времени. Данные представляют пять независимых экспериментов и показывают средние значения ± S.D. трехкратных определений. * P <0,05, ** P <0,01.
https://doi.org/10.1371/journal.ppat.1002714.g003
Кишечные DC состоят из двух основных подмножеств; CD103 + CX 3 CR1 — CD11b — DC (CD103 + DCs) и CX 3 CR1 + CD11b + DCs (CX + DCs (CX ) 45], [46]. Таким образом, мы проанализировали, какая подгруппа опосредует B. breve -зависимое развитие клеток Tr1.CD103 + DC и CX 3 CR1 + DC выделяли из собственной пластинки толстой кишки, обрабатывали B. breve и затем совместно культивировали с наивными CD4 + Т-клетками. CD4 + Т-клетки, совместно культивированные с B. breve -обработанные CD103 + DC, но не CX 3 CR1 + DC, продуцировали высокие количества IL-10 (рис. 4A, B). B. breve вызывал дозозависимое увеличение продукции IL-10 Т-клетками, совместно культивированными с CD103 + DC (фигура S2).CD103 + DCs, как было показано, индуцируют Foxp3 + Treg клетки [47], [48]. Действительно, DC CD103 + индуцировали низкие уровни экспрессии Foxp3 на совместно культивируемых Т-клетках CD4 + даже в отсутствие TGF-β или ретиноевой кислоты (фиг. 4B). Однако обработанные B. breve CD103 + DC не индуцировали экспрессию Foxp3, но индуцировали повышенную продукцию IL-10 в совместно культивируемых Т-клетках.
Рисунок 4. DC CD103 + , но не CX3CR1 + DC, индуцируют B.breve -зависимая дифференцировка клеток Tr1.
CD103 + CX 3 CR1 — CD11b — CD11c + DC (CD103 + DC) и CX 3 CR1 + CD11b 1c 3 CR1 + DC) выделяли из собственной пластинки толстой кишки и обрабатывали такими же количествами B. breve в течение 24 часов. После отмывки наивные CD4 + Т-клетки селезенки совместно культивировали с B.обработанные breve CD103 + DC или CX 3 CR1 + DC в присутствии mAb против CD3 в течение 4 дней. ( A ) Т-клетки затем собирали и повторно стимулировали в течение 24 часов для анализа продукции IL-10 с помощью ELISA. * P <0,05. ( B ) Т-клетки собирали и повторно стимулировали PMA и ионофор в течение 8 часов. Затем внутриклеточную экспрессию Foxp3 и IL-10 анализировали с помощью проточной цитометрии. ( C ) Мышей C57BL / 6J (n = 5) кормили B. breve в течение 3 недель.Затем CD103 + DC выделяли из MLN и собственной пластинки толстой кишки и совместно культивировали с наивными CD4 + Т-клетками в селезенке. Совместно культивируемые Т-клетки повторно стимулировали, и концентрацию IL-10 в супернатантах анализировали с помощью ELISA. Данные представляют четыре независимых эксперимента и показывают средние значения ± стандартное отклонение. трех определений. * P <0,05, ** P <0,01.
https://doi.org/10.1371/journal.ppat.1002714.g004
Затем мы проанализировали, действительно ли кишечные CD103 + DC в B.Breve -обработанные мыши инструктируют развитие клеток Tr1. Поскольку постулировано, что DC CD103 + собирают образцы кишечных антигенов в собственной пластинке и перемещаются в MLN, где они индуцируют Т-клетки Foxp3 + [49], мы проанализировали DC CD103 + в MLN и собственной пластинке толстой кишки. Мышей C57BL / 6 кормили B. breve в течение 3 недель, прежде чем DC CD103 + были выделены из MLN и собственной ламии толстой кишки и культивированы совместно с наивными CD4 + Т-клетками.CD4 + Т-клетки, совместно культивируемые с CD103 + DC из собственной пластинки толстой кишки мышей, получавших B. breve , показали более высокую продукцию IL-10, с более низкими уровнями, наблюдаемыми в совместных культурах CD4 + Т-клеток с контроллерами домена MLN CD103 + (рисунок 4C). Таким образом, кишечные CD103 + DC обладают повышенной способностью индуцировать клетки Tr1 при обработке B. breve у мышей. Эти данные показывают, что кишечные CD103 + DC ответственны за B.breve -зависимое развитие клеток Tr1.
B. breve индуцирует клетки Tr1 через IL-10 и IL-27 Первоначально было показано, чтоIL-10 индуцирует клетки Tr1 [50]. Впоследствии IL-27 был идентифицирован как фактор роста и дифференцировки клеток Tr1 [51] — [53]. Поэтому мы проанализировали экспрессию этих ключевых цитокинов в обработанных B. breve CD103 + DC. Обработка B. breve увеличивала экспрессию Il27p28 , Ebi3 (оба из которых кодируют субъединицы IL-27) и Il10 в CD103 + DC (фиг. 5A).Кроме того, нейтрализация mAb к IL-10 или IL-27 серьезно или умеренно блокировала опосредованное B. breve развитие клеток Tr1, соответственно, и комбинация обоих mAb почти полностью блокировала развитие клеток Tr1. Напротив, ни антагонист рецептора ретиноевой кислоты LE540, ни нейтрализующее антитело против TGF-β не ингибировали B. breve -опосредованную индукцию клеток Tr1 (фиг. 5B и фиг. S3). Эти данные показывают, что IL-10 и IL-27, которые продуцируются из обработанных B. breve CD103 + DC, опосредуют развитие клеток Tr1.Чтобы подтвердить эти результаты, мы проанализировали мышей Il10 — / — и Il27ra — / — мышей. Сначала мы обработали CD103 + DC из собственной пластинки толстой кишки мышей дикого типа или Il10 — / — с помощью B. breve перед их совместным культивированием с наивными CD4 + T-клетками дикого типа. . CD4 + Т-клетки, совместно культивированные с обработанными B. breve Il10 — / — DC, продуцировали сильно сниженные уровни IL-10 (фиг. 5C).Затем CD4 + Т-клетки выделяли из селезенки мышей Il27ra — / — и совместно культивировали с обработанными B. breve CD103 + ДК дикого типа. Продукция IL-10 из Il27ra — / — Т-клеток была сильно снижена (фиг. 5D). Взятые вместе, эти данные демонстрируют, что IL-10 и IL-27, которые продуцируются B. breve -обработанными CD103 + DC, кооперативно опосредуют индукцию клеток Tr1.
Рисунок 5.Развитие IL-10 / IL-27-зависимых клеток Tr1 под действием обработанных B. breve DC.
( A ) CD103 + DC выделяли из собственной пластинки толстой кишки и инкубировали с B. breve в течение 4 часов. Полную РНК экстрагировали и анализировали на экспрессию мРНК Il27p28 , Ebi3 и Il10 с помощью количественной ОТ-ПЦР в реальном времени. Н.Д., не обнаружено. ** P <0,01, *** P <0,001. ( B ) Наивные Т-клетки культивировали совместно с B.breve -обработанный CD103 + DC в присутствии указанного нейтрализующего антитела в течение 4 дней. Затем Т-клетки собирали и повторно стимулировали mAb против CD3 и CD28 в течение 24 часов. Концентрации IL-10 в супернатантах измеряли с помощью ELISA. * P <0,05, ** P <0,01, *** P <0,001, N.S, не значимо. ( C ) CD103 + DC выделяли из собственной пластинки толстой кишки мышей дикого типа и мышей Il10 — / — (фон C57BL / 6) и инкубировали с B.Бреве . Затем наивные CD4 + Т-клетки от мышей C57BL / 6 дикого типа совместно культивировали с DC, обработанными B. breve . Продукция IL-10 Т-клетками анализировалась с помощью ELISA. Н.Д., не обнаружено. ( D ) CD103 + DC выделяли из собственной пластинки толстой кишки мышей BALB / c дикого типа и инкубировали с B. breve . Наивные CD4 + Т-клетки от мышей дикого типа и Il27ra — / — мышей (фон BALB / c) затем совместно культивировали с B.breve -обработанные DC. Продукция IL-10 Т-клетками измерялась с помощью ELISA. Данные представляют три независимых эксперимента и показывают средние значения ± стандартное отклонение. трех определений. * P <0,05.
https://doi.org/10.1371/journal.ppat.1002714.g005
B. breve индуцирует клетки Tr1 TLR2 / MyD88-зависимым образомЗатем мы проанализировали, какой сигнальный путь отвечает за B. breve -зависимую продукцию IL-10 и IL-27 из CD103 + DC.Некоторые рецепторы распознавания образов опосредуют активацию врожденного иммунитета через распознавание молекулярных паттернов, связанных с микробами [54]. Таким образом, мы проанализировали участие передачи сигналов Toll-подобного рецептора (TLR) с использованием мышей Myd88 — / — . В кишечных CD103 + DC мышей Myd88 — / — , B. breve -индуцированная экспрессия Il27p28 , Ebi3 и Il10 была сильно снижена (фигура 6A).Кроме того, CD4 + Т-клетки дикого типа, которые были совместно культивированы с обработанными B. breve Myd88 — / — CD103 + DC, не смогли продуцировать IL-10 (фигура 6B). Эти находки показывают, что путь передачи сигналов TLR в DC CD103 + критически участвует в развитии клеток Tr1, опосредованных B. breve . Мы также проанализировали, какой TLR опосредует B. breve -опосредованные ответы. B. breve -индуцированная экспрессия Il27p28 , Ebi3 и Il10 была сильно снижена в кишечных CD103 + DC Tlr2 — / — мышей (фиг. 6C).Кроме того, обработанные B. breve Tlr2 — / — CD103 + DC не способствовали развитию Т-клеток, продуцирующих IL-10 (фигура 6D). B. breve -обработанные Tlr4 — / — и Tlr9 — / — CD103 + DCs обычно индуцировали IL-10-продуцирующие клетки (фигура S4). CD103 + DC, обработанные лигандом TLR2, но не лигандом TLR4 или TLR5, индуцировали клетки Tr1, хотя и уменьшались по сравнению с B.breve (рисунок S5). Критическое участие TLR2-опосредованного пути в B. breve -зависимой индукции Tr1 было дополнительно подтверждено на Tlr2 — / — мышах, которым перорально вводили B. breve в течение 4 недель (фиг. 6E, F). У Tlr2 — / — мышей обработка B. breve не увеличивала количество продуцирующих IL-10 CD4 + Т-клеток в собственной пластинке толстой кишки. Взятые вместе, эти результаты демонстрируют, что TLR2 / MyD88-зависимый путь в CD103 + DC опосредует B.breve -опосредованная индукция клеток Tr1.
Рисунок 6. B. breve индуцирует клетки Tr1 TLR2 / MyD88-зависимым образом.
( A, C ) CD103 + DC были выделены из собственной пластинки толстой кишки дикого типа, Myd88 — / — (A) и Tlr2 — / — (C) мышей , инкубировали с B. breve в течение 4 часов, а затем анализировали на экспрессию мРНК Il27p28 , Ebi3 и Il10 .* P <0,05, ** P <0,01. ( B, D ) дикого типа, Myd88 — / — (B) и Tlr2 — / — (D) CD103 + DC инкубировали с B. breve в течение 24 часов. , а затем совместно культивировали с наивными CD4 + Т-клетками от мышей дикого типа в течение 4 дней. Т-клетки собирали и повторно стимулировали в течение 24 часов. Продукция IL-10 в супернатантах анализировалась с помощью ELISA. Данные представляют три независимых эксперимента и показывают средние значения ± S.D. трехкратных определений. * P <0,05. Н.Д., не обнаружено. ( E ) 6-недельных мышей дикого типа и Tlr2 — / — (фон BALB / c) кормили B. breve или плацебо в течение 3 недель (n = 5). Затем мышей умерщвляли и лимфоциты собственной пластинки толстой кишки анализировали на продукцию IL-10 с помощью проточной цитометрии. Процент клеток IL-10 + , заблокированных Т-клетками CD4 + , показан у указанных мышей. Данные представляют три независимых эксперимента и показывают средние значения ± S.D. трехкратных определений. * P <0,05. ( F ) Были показаны типичные графики FACS для Т-клеток CD4 + , продуцирующих IL-10 и IFN-γ.
https://doi.org/10.1371/journal.ppat.1002714.g006
B. breve улучшает воспаление кишечника за счет индукции выработки Т-клетками IL-10 Было показано, чтопробиотических штаммов бактерий можно использовать для лечения нескольких заболеваний, включая ВЗК [5] — [8]. Поэтому мы проанализировали действие орального B.breve при воспалении кишечника, вызванном переносом наивных CD4 + Т-клеток мышам с тяжелым комбинированным иммунодефицитом (SCID) с ослабленным иммунитетом. Ежедневное лечение B. breve заметно уменьшило тяжесть воспаления кишечника (рис. 7 A, D, E). У мышей SCID, получавших B. breve , концентрация IL-10 в тканях толстой кишки была увеличена, тогда как концентрация IFN-γ была снижена (фиг. 7C). Затем мы проанализировали, отвечает ли IL-10 за предотвращение воспаления кишечника.Мышам SCID переносили наивные CD4 + Т-клетки от мышей Il10 — / — и перорально вводили B. breve . Не наблюдалось никакого эффекта на уменьшение воспаления кишечника у мышей SCID, получавших Il10 — / — CD4 + Т-клетки (фиг. 7B, D, E). Эти данные демонстрируют, что IL-10, полученный из Т-клеток, подавляет зависимое от Т-клеток воспаление кишечника у мышей SCID, леченных B. breve .
Рисунок 7.IL-10-зависимое уменьшение воспаления кишечника с помощью B. breve .
( A, C ) 6-недельным мышам SCID (n = 8 на группу) внутрибрюшинно вводили PBS или 3 × 10 5 наивных CD4 + Т-клеток от мышей BALB / c дикого типа (A) или Il10 — / — мышей (фон BALB / c) ( B ). Мышам ежедневно перорально вводили B. breve от 1 недели до переноса Т-клеток до конца эксперимента.Ежедневно отслеживали изменения массы тела и представляли их относительно исходной массы тела. * P <0,05, планки погрешностей, S.E.M. ( C ) Продукция IL-10, IL-17 и IFN-γ из толстой кишки мышей SCID с перенесенными Т-клетками дикого типа, которым ежедневно вводили B. breve или плацебо (n = 5 на группу). * P <0,0064, ** P <0,0005. ( D ) Окрашивание гематоксилином и эозином срезов толстой кишки через 4 недели после переноса. Оригинальное увеличение, × 400. ( E ) Клинические баллы по колиту были показаны в указанной группе.Данные представляют два независимых эксперимента. * P <0,05, ** P <0,01. N.S, не имеет значения.
https://doi.org/10.1371/journal.ppat.1002714.g007
Обсуждение
В настоящем исследовании мы показываем, что пробиотик B. breve способствует развитию продуцирующих IL-10 клеток Tr1 в толстой кишке без изменения состава кишечной комменсальной флоры. Кишечные CD103 + DC опосредуют B. breve -индуцированное развитие клеток Tr1 посредством TLR2 / MyD88-зависимой индукции IL-27 и IL-10.Накапливающиеся в последнее время данные свидетельствуют о том, что конкретная микробиота влияет на развитие Т-клеток кишечника. Было показано, что сегментированные нитчатые бактерии индуцируют клетки Th27 в тонком кишечнике [18], [19]. Было показано, что полисахарид A (PSA) B. fragilis способствует развитию клеток Foxp3 + Treg посредством TLR2, экспрессируемого на Т-клетках в толстой кишке [21], в то время как виды Clostridium индуцируют Foxp3 + Treg-клеток в толстой кишке через индукцию TGF-β эпителиальных клеток [23].Было также показано, что несколько пробиотических штаммов комменсальных бактерий индуцируют Treg-клетки Foxp3 + или TGF-β-экспрессирующие Treg-клетки [27] — [29], [55]. Несколько исследований также показали, что селективные пробиотики индуцируют выработку IL-10 в кишечнике или развитие продуцирующих IL-10 Т-клеток in vitro [26], [29], [56]. Однако точный механизм, с помощью которого пробиотики индуцируют Т-клетки, продуцирующие ИЛ-10, в собственной пластинке кишечника, оставался неизвестным. Это исследование ясно демонстрирует, что пробиотический штамм бактерий, B.breve , способствует развитию Foxp3 — Tr1-типа Т-клеток.
Несколько недавних исследований продемонстрировали, что колонизация специфической микробиоты у стерильных мышей индуцирует развитие Treg-клеток и клеток Th27 [18], [19], [21], [23]. Однако пероральное введение пробиотика B. breve не индуцировало клетки Tr1 толстой кишки у стерильных мышей. Это может быть связано с тем фактом, что B. breve имеет низкую способность к колонизации в кишечнике.Как и в других исследованиях [18], [19], [21], [23], стерильным мышам однократно вводили B. breve . Однако из-за низкой способности колонизировать в кишечнике B. breve может быть неспособен индуцировать развитие клеток Tr1 однократным введением. В качестве альтернативы этому пробиотическому штамму может потребоваться помощь других комменсальных бактерий для поглощения или распознавания кишечными ДК. Низкая способность к колонизации в кишечнике B. breve может коррелировать с тем фактом, что пероральное введение этой бактерии не вызывало видимых изменений в составе комменсальной микробиоты.
КлеткиTr1 были идентифицированы как вторая подгруппа регуляторных Т-клеток CD4 + [50]. И Foxp3 + Treg клетки, и клетки Tr1 критически вовлечены в поддержание гомеостаза кишечника [30]. Исследования in vitro показали, что IL-10 и IL-27 имеют решающее значение для индукции клеток Tr1 [51] — [53]. Настоящее исследование показывает, что кишечные клетки Tr1 индуцируются как IL-10, так и IL-27, который продуцируется кишечными CD103 + DC, которые подвергаются воздействию B.Бреве . Однако клетки Tr1 присутствуют в собственной пластинке кишечника мышей, которым не давали B. breve [34]. В этом отношении, учитывая, что в кишечнике существует много типов Bifidobacterium (Таблица S1), эти местные Bifidobacterium могут способствовать развитию кишечных клеток Tr1. Действительно, наши данные предполагают, что B. longum , одна из местных комменсальных бактерий, умеренно индуцировала клетки Tr1. Индуцированное B. breve увеличение клеток Tr1 наблюдалось в толстом кишечнике, но не в тонком кишечнике.Это может быть связано с характеристиками B. breve , которые преимущественно колонизируют в толстом кишечнике, а не в тонком [57].
Развитие клеток Tr1, индуцированное B. breve , зависит от пути TLR2 / MyD88. Пути TLR играют обязательную роль в элиминации патогенных микроорганизмов [54]. Предыдущие исследования показали, что мыши с дефицитом MyD88, TLR2 или TLR4 были высокочувствительны к воспалению кишечника, вызванному лечением декстраном сульфатом натрия [58], [59].Однако механизм TLR-зависимого поддержания гомеостаза кишечника остается неясным. Это исследование демонстрирует, что путь TLR2 в ДК полезен для подавления воспаления кишечника за счет индукции продуцирующих IL-10 клеток Tr1. Интересно отметить, что клетки Tr1 присутствуют у мышей Tlr2 — / — и Myd88 — / — , что указывает на то, что развитие клеток Tr1 в кишечнике в устойчивых состояниях индуцируется независимо от передачи сигналов TLR.TLR-независимая индукция кишечных клеток Tr1 может быть индуцирована другими, до сих пор неизвестными бактериями.
Наши эксперименты с in vitro ясно показывают, что кишечные CD103 + CX 3 CR1 — CD11b — DC отвечают на B. breve и способствуют развитию клеток Tr1. Кишечные CD103 + DC, расположенные в собственной пластинке толстой кишки и MLN, показали повышенную способность индуцировать продуцирующие IL-10 клетки Tr1 после B.breve лечение. CD103 + DC из MLN были менее эффективны в индукции клеток Tr1 по сравнению с CD103 + DC lamina proprial. Таким образом, возможно, что DC CD103 + в MLN и собственной пластинке толстой кишки обладают различными характеристиками в индукции клеток Tr1. Кроме того, остается неясным, как CD103 + DC воспринимают B. breve в слизистой оболочке кишечника. CX 3 CR1-экспрессирующие кишечные ДК, как было показано, распространяют свои дендриты в просвет кишечника для отбора проб содержимого просвета [60].Однако DC CD103 + не экспрессируют CX 3 CR1, который необходим для расширения дендритов. Было показано, что некоторые метаболиты, продуцируемые комменсальной микробиотой, влияют на экспрессию генов клетки-хозяина [61]. Однако культуральные супернатанты B. breve не индуцировали продукцию IL-10 Т-клетками, совместно культивированными с CD103 + DC, что указывает на то, что B. breve непосредственно действует на кишечные DC (фигура S6). Выяснение того, как DC CD103 + распознают B.breve в собственной пластинке кишечника будет интересным вопросом в будущем.
IL-10-продуцирующие клетки Tr1 могут быть индуцированы УФ-облучением B. breve или даже ультразвуком B. breve (фигура S7). Эти данные показывают, что компоненты B. breve непосредственно действуют на кишечные DC, возможно, взаимодействуя с TLR2, и способствуют развитию клеток Tr1. Было показано, что TLR2 распознает уникальную полисахаридную структуру (PSA) B. fragilis , чтобы индуцировать Foxp3 + Treg-клетки [21].Пробиотический штамм B. breve , использованный в этом исследовании, также обладает уникальной структурой полисахарида в их клеточных стенках [62]. Следовательно, в будущем было бы интересно проанализировать, распознается ли полисахарид B. breve TLR2 для индукции клеток Tr1. Идентификация таких компонентов B. breve , которые активируют путь TLR2, приведет к разработке нового эффективного агента для лечения IBD.
В отличие от развития клеток Tr1, стимулированного B.breve , L. casei не оказал никакого влияния на дифференцировку кишечных Т-клеток, хотя он хорошо известен как полезный пробиотический штамм, обладающий несколькими полезными для здоровья эффектами [63]. В связи с этим постулируется несколько механизмов действия пробиотиков, помимо влияния на развитие Т-клеток хозяина [7], [8]. К ним относятся усиление барьерных функций эпителиальных клеток, модификация комменсальной флоры и воздействие на дендритные клетки и моноциты / макрофаги.Сообщалось о нескольких механизмах действия, опосредованного видами Lactobaciluus [55], [56], [64]. Наши результаты показывают, что каждый пробиотический штамм имеет свои специфические способы воздействия на хозяина. VSL # 3, содержащий несколько пробиотиков (три бифидобактерии, пять лактобацилл и Streptococcus salivarius subsp. thermophilus ), как сообщается, оказывает сильное воздействие на здоровье и болезни хозяина [26]. Это может быть связано с синергическим эффектом этих различных пробиотических штаммов, которые имеют разные механизмы действия.
В настоящем исследовании мы показываем, что пробиотическая бактерия, B. breve , индуцирует клетки Tr1 кишечника и, таким образом, улучшает воспаление кишечника. Анализ влияния этого пробиотически-зависимого развития клеток Tr1 на другие модели заболеваний расширит область применения B. breve в качестве терапевтического агента.
Материалы и методы
Заявление об этике
Все эксперименты на животных проводились в строгом соответствии с Руководством по экспериментам на животных Японской ассоциации лабораторных животных.Протокол был одобрен комитетом по экспериментам на животных Университета Осаки (номер разрешения: 21-058-0).
Реагенты
Lactobacilus casei штамм Shirota ( L. casei ) и Bifidobacterium breve штамм Yakult ( B. breve ) были такими, как описано [35], [40]. Для экспериментов использовали B. bifidum (штамм Yakult YIT10347), B. adolescntis (ATCC15703) и B. longum (ATCC15707). Для перорального лечения мышей используют лиофилизированные препараты объемом л.casei и B. breve растворяли в дистиллированной воде и вводили 1 × 10 9 бактерий. Пакетик B. breve содержал 4 × 10 9 лиофилизированных живых бактерий, кукурузный крахмал и гидроксипропилцеллюлозу в качестве носителя. Саше с плацебо B. breve содержало только кукурузный крахмал и гидроксипропилцеллюлозу. Пакетик с L. casei состоял из 5 × 10 9 лиофилизированных живых бактерий с лактозой, кукурузным крахмалом, сухим обезжиренным молоком, кристаллизованной целлюлозой и гидроксипропилцеллюлозой.Пакетик с плацебо L. casei состоял только из обычных вспомогательных веществ. Для стимуляции in vitro , B. breve инокулировали в бульон GAM (Nissui Pharmaceutical) с добавлением 1% (мас. / Об.) Глюкозы и культивировали в течение 24 ч при 37 ° C в анаэробных условиях, затем центрифугировали и гранулы суспендировали в питательной среде. Количество B. breve измеряли путем культивирования на чашке с агаром MRS. Нейтрализующий антимышиный IL-10 был приобретен у BD biosciences, антимышиный IL-27p28 и антитела, блокирующие TGF-β (1D11), были приобретены у R&D systems.Антимышиные CD3 (145-2C11) и CD28 (37,51) были получены от BioLegend. LE540 был приобретен у WAKO Chemicals (Токио, Япония).
Животные
мышей BALB / c и C57BL / 6J были приобретены в CLEA Japan или Japan SLC. Мыши CB17-SCID были получены от CLEA Japan. Il10 — / — , Foxp3 eGFP были приобретены в лабораториях Джексона, а Myd88 — / — , Tlr2 — / — , Tlr4 — Tlr9 — / — мышей были созданы ранее [65]. Il27ra — / — мыши были любезно предоставлены Amgen [66]. Этих мышей подвергали обратному скрещиванию в восьми или более поколениях на BALB / c или C57BL / 6J. Мышам C57BL / 6J перорально вводили L. casei или B. breve (по 10 9 бактерий каждая), а также плацебо ежедневно через желудочные зонды в течение 3 месяцев. В качестве альтернативы пробиотики вводили перорально мышам BALB / c, C57BL / 6J или Foxp3 eGFP в течение 1–4 недель.
Анализ фекальной микробиоты
Методы анализа фекальных бактерий описаны в тексте S1.
Проточная цитометрия
Для проточной цитометрии использовали следующие антитела: PerCP / Cy5.5-конъюгированные анти-CD4 (GK1.5), Alexa Fluor 647-конъюгированные CD11c (N418), CD62L (MEL-14), конъюгированные со стрептавидином PE / Cy7. от BioLegend, FITC-конъюгированный анти-CD11b (M1 / 70), CD25 (7D4) и PE-конъюгированный CD103, антимышиный CD16 / 32 (рецептор Fcγ III / II) от BD PharMingen, PE-конъюгированный CD44 (IM7) , Foxp3, конъюгированный с Alexa Fluor 647 (FJK-16s), и конъюгированный с биотином CX3CR1 от eBiosciences. Проточный цитометрический анализ выполняли с использованием проточного цитометра FACS Canto II (BD Biosciences) с программным обеспечением FlowJo (Tree Star).
Выделение субпопуляций DC lamina propria кишечника и лимфоцитов
ДК Lamina propria и лимфоциты выделяли, как описано ранее [67], с простыми модификациями. Вкратце, толстую кишку и тонкий кишечник открывали в продольном направлении и тщательно промывали PBS. Кишечник встряхивали в HBSS, содержащем 5 мМ EDTA и 5% фетальную бычью сыворотку (FBS), в течение 20 минут при 37 ° C. После удаления эпителиальных слоев и жировой ткани кишечник разрезали на мелкие кусочки и инкубировали с RPMI 1640, содержащим 5% FBS, 1 мг / мл коллагеназы D (Roche Diagnostics), 1 мг / мл диспазы (Invitrogen) и 40 мкг. / мл ДНКазы I (Roche Diagnostics) в течение 1 ч при 37 ° C на встряхиваемой водяной бане.Переваренные ткани промывали HBSS, содержащим 5 мМ EDTA. Суспензии клеток фильтровали через сетчатый фильтр для клеток 40 мкм в охлажденный PBS и центрифугировали. Затем клеточные суспензии от ферментного переваривания наносили на градиент перколла (GE Healthcare) (для DC: 30% перколла вверху, 75% перколла внизу и для лимфоцитов: 40% перколла вверху, 80% перколла внизу). центрифугированием при 780 г в течение 20 мин при 25 ° C. Клетки на границе раздела были взяты и дважды промыты буфером FACS.Для очистки субпопуляций lamina propria DC суспензии отдельных клеток обрабатывали антителом против рецептора Fcγ мыши в течение 5 мин при 4 ° C. Затем клетки окрашивали CD11c-APC, CD11b-FITC, CD103-PE и CX3CR1-PE-Cy7 и затем сортировали с использованием FACSAria (BD Biosciences) до чистоты> 98%. Клетки сразу использовали для каждого эксперимента.
Выделение из селезенки наивных CD4
+ клетокДля приготовления суспензий единичных клеток из селезенки их измельчали между предметными стеклами и пропускали через сетчатый фильтр для клеток 40 мкм.Спленоциты обрабатывали буфером для лизиса эритроцитов (0,15 M NH 4 Cl, 1 мМ KHCO 3 , 0,1 мМ EDTA) в течение 5 минут и дважды промывали PBS. Для FACS-сортировки клетки окрашивали PerCP / Cy5.5-конъюгированным анти-CD4 (Biolegend), APC-конъюгированным анти-CD62L, FITC-конъюгированным анти-CD25 и PE-конъюгированным анти-CD44 (BD Biosciences). Наивные CD4 + Т-клетки были отсортированы с использованием FACSAria для CD4 + CD62L высокий CD25 — CD44 низкий . Чистота отсортированных клеток обычно составляла> 98%.
Окрашивание внутриклеточных цитокинов
Внутриклеточную экспрессию IFN-γ, IL-17 и IL-10 в Т-клетках CD4 + анализировали с помощью Cytofix / Cytoperm Kit Plus (с Golgistop; BD Biosciences) в соответствии с инструкциями производителя. Вкратце, лимфоциты, полученные из собственной пластинки кишечника, инкубировали с 50 нг / мл форболмиристата ацетата (PMA; Sigma) и 5 мкМ кальциевого ионофора A23187 (Sigma) и Golgistop в полной среде RPMI1640 при 37 ° C в течение 4 часов.Окрашивание поверхности проводили конъюгированным с PerCP / Cy5.5 анти-CD4 в течение 20 минут при 4 ° C. После обработки Fix / Perm в течение 20 минут проводили окрашивание внутриклеточных цитокинов с помощью PE-конъюгированного анти-IL-10, FITC-конъюгированного анти-IFN-γ и APC-конъюгированного анти-IL-17 в течение 20 минут. Данные были получены с использованием FACS Canto II и проанализированы с помощью программного обеспечения FlowJo. Альтернативно, для внутриклеточного окрашивания на Foxp3 и IL-10 клетки окрашивали с использованием набора буфера для окрашивания Foxp3 (eBiosciences).
Анализ совместного культивирования in vitroПодмножества DC Colonic (5 × 10 4 ) инкубировали с таким же или указанным количеством L.casei или B. breve в 100 мкл полной среды RPMI1640 в течение 24 ч в 96-луночном планшете с круглым дном. Затем DC промывали PBS и наивные CD4 + Т-клетки (5 × 10 4 ) добавляли в культуру с 2 мкг / мл растворимого mAb против CD3. Через 4 дня Т-клетки собирали, промывали и подсчитывали. Такое же количество Т-клеток повторно стимулировали с помощью связанных с планшетом mAb против CD3 (2 мкг / мл) и растворимых mAb против CD28 (2 мкг / мл) в течение 24 часов. Повторно стимулированная продукция цитокинов Т-клетками в супернатантах анализировалась с помощью ELISA (системы R&D).В качестве альтернативы, Т-клетки повторно стимулировали 50 нг / мл PMA и 5 мкМ кальциевого ионофора A23187 в течение 6 часов перед тем, как проводить окрашивание внутриклеточных цитокинов, как описано выше. Голгистоп добавлен за последние 2 ч.
Количественная ОТ-ПЦР в реальном времени
Тотальную РНК выделяли с помощью набора RNeasy Mini (Qiagen), и 1-2 мкг общей РНК подвергали обратной транскрипции с использованием обратной транскриптазы M-MLV (Promega) и случайных праймеров (Toyobo) после обработки RQ1 ДНКазой I (Promega).Комплементарные ДНК анализировали с помощью qPCR с использованием GoTaq qPCR Master Mix (Promega) в системе ABI 7300 (Applied Biosystems). Все значения были нормализованы к экспрессии Gapdh , кодирующей глицеральгид-3-фосфатдегидрогеназу, и показана кратная разница в экспрессии по сравнению с экспрессией для Gapdh . Условия амплификации: 50 ° C (2 мин), 95 ° C (10 мин) и 40 циклов 95 ° C (15 с) и 60 ° C (60 с). Использовали следующие наборы праймеров: cMaf , 5′-AATCCTGGCCTGTTTCACAT-3 ‘и 5′-TGACGCCAACATAGGAGGTG-3’; Il21, , 5′-GCCAGATCGCCTCCTGATTA-3 ‘и 5′-CATGCTCACAGTGCCCCTTT-3’; Il27p28 , 5′-TTCCCAATGTTTCCCTGACTTT-3 ‘и 5′-AAGTGTGGTAGCGAGGAAGCA-3’; Ebi3 , 5′-TGAAACAGCTCTCGTGGCTCTA-3 ‘и 5′-GCCACGGGATACCGAGAA-3’; Il10 , 5′-TTTCAAACAAAGGACCAG-3 ‘и 5′-GGATCATTTCCGATAAGG-3’; и Gapdh , 5′-TGTGTCCGTCGTGGATCTGA-3 ‘и 5′-CCTGCTTCACCACCTTCTTGA-3’
Колит, опосредованный Т-клетками, модель
Наивный CD4 + CD62L высокий CD25 — CD44 низкий Т-клетки селезенки от мышей BALB / c или Il10 — / — мышей (фон BALB / c) были очищены и внутрибрюшинно перенесены в SCID. (3 × 10 5 клеток на мышь). B. breve (10 9 бактерий) скармливали через желудочный зонд за 3 дня до переноса и до конца экспериментов. Изменения веса контролировали каждый день. Мышей умерщвляли и гистохимически исследовали толстую кишку после окрашивания гематоксилином и эозином. В качестве альтернативы, толстые кишки разрезали на мелкие кусочки после промывки и культивировали в течение 24 часов. Затем собирали культуральные супернатанты и измеряли уровень IL-10, IL-17A и IFN-γ с помощью ELISA (системы R&D).
Гистопатологический анализ
Были сделаны срезызалитых парафином образцов толстой кишки и окрашены гематоксилином и эозином. Тяжесть колита оценивалась по стандартной системе баллов, как описано ранее [68]. Пять областей ободочной кишки (слепая кишка; восходящая, поперечная и нисходящая ободочная кишка; и прямая кишка) были оценены полуколичественно от 0 (без изменений) до 5 (наиболее серьезное изменение). Классификация отражает возрастающую частоту и степень воспаления, потери бокаловидных клеток, изъязвления и фиброза собственной пластинки.Подсчет очков производился слепым методом. Изображения окрашивания гематоксилином и эозином и окрашивания Мэй-Грюнвальда-Гимзы получали с использованием Biozero (Keyence).
Статистический анализ
Статистический анализ проводился с использованием программного обеспечения PRISM 4. Для определения значимости экспериментов использовали непарный критерий Стьюдента t и U-критерий Манна-Уитни. Значения P менее 0,05 считались статистически значимыми.
Дополнительная информация
Рисунок S1.
Процент IL-10 + или Foxp3 + CD4 + Т-клетки в MLN или селезенке не изменились при пероральном введении B. breve . 6-недельных мышей C57BL / 6 кормили B. breve или плацебо ежедневно через желудочный зонд в течение 3 месяцев (n = 8). Брали MLN и селезенки и анализировали на экспрессию цитокинов и Foxp3 с помощью проточной цитометрии. Репрезентативные точечные диаграммы FACS были показаны с привязкой к Т-клеткам CD4 + . A : MLN, B : Селезенка.
https://doi.org/10.1371/journal.ppat.1002714.s001
(PDF)
Рисунок S2.
B. breve индуцирует продуцирующие IL-10 клетки Tr1 дозозависимым образом. CD11c высокий CD11b — CD103 + DC (CD103 + DC) (5 × 10 4 ) были выделены из собственной пластинки толстой кишки мышей C57BL / 6J и обработаны увеличивающимся числом Б.breve (от 5 × 10 1 до 5 × 10 5 ) в течение 24 часов в 96-луночном планшете с круглым дном. После отмывки наивные CD4 + Т-клетки селезенки (5 × 10 4 ) совместно культивировали с обработанными B.breve CD103 + DC в присутствии mAb против CD3 в течение 4 дней. Затем Т-клетки собирали и повторно стимулировали. Продукция IL-10 в культуральных супернатантах анализировалась с помощью ELISA. Данные представляют два независимых эксперимента. Планки погрешностей, S.D. * P <0,05, ** P <0.01.
https://doi.org/10.1371/journal.ppat.1002714.s002
(PDF)
Рисунок S3.
Независимая от ретиноевой кислоты индукция клеток Tr1 B. breve . Обработанные B. breve CD103 + DC совместно культивировали с наивными CD4 + Т-клетками селезенки в присутствии ингибитора рецептора ретиноевой кислоты (2 мкМ LE540, WAKO Chemicals, JAPAN) в течение 4 дней. . Продукция IL-10 повторно стимулированными Т-клетками определялась количественно с помощью ELISA.Данные представляют два независимых эксперимента. Планки погрешностей, S.D. * P <0,01, N.S, не значимо.
https://doi.org/10.1371/journal.ppat.1002714.s003
(PDF)
Рисунок S4.
TLR4 / TLR9-независимая индукция клеток Tr1 B. breve . Кишечные CD103 + DC мышей дикого типа, Tlr4 — / — и Tlr9 — / — мышей лечили B.breve в течение 24 часов, а затем совместное культивирование с наивными CD4 + Т-клетками в селезенке в течение 4 дней. Продукция IL-10 повторно стимулированными Т-клетками определялась количественно с помощью ELISA. Данные представляют два независимых эксперимента. Планки погрешностей, S.D. * Р <0,01.
https://doi.org/10.1371/journal.ppat.1002714.s004
(PDF)
Рисунок S5.
TLR2-зависимая индукция клеток Tr1. Кишечные CD103 + DC стимулировали B. breve или лигандами TLR, такими как LPS (лиганд TLR4), Pam3 (лиганд TLR2) или флагеллин (лиганд TLR5) в течение 24 часов, а затем совместно культивировали с наивным CD4 в селезенке. + Т-клеток на 4 дня.Продукция IL-10 повторно стимулированными Т-клетками определялась количественно с помощью ELISA. Данные представляют два независимых эксперимента. Планки погрешностей, S.D. * Р <0,01.
https://doi.org/10.1371/journal.ppat.1002714.s005
(PDF)
Рисунок S6.
B. breve непосредственно действует на CD103 + DC, индуцируя клетки Tr1. CD103 + DC обрабатывали B.breve или супернатантом культуры (10-кратно концентрированным) B.breve на 24 часа. После отмывки наивные Т-клетки CD4 + совместно культивировали с обработанными DC CD103 + в течение 4 дней. Затем Т-клетки собирали и повторно стимулировали mAb против CD3 и CD28. Концентрацию IL-10 в супернатантах количественно определяли с помощью ELISA. Репрезентативные данные были показаны из двух независимых экспериментов. Планки погрешностей, S.D. Н.Д., не обнаружено.
https://doi.org/10.1371/journal.ppat.1002714.s006
(PDF)
Рисунок S7.
Индукция развития клеток Tr1 убитыми B.бреве . CD103 + DC обрабатывали живыми, убитыми УФ излучением или обработанными ультразвуком B. breve в течение 24 часов, а затем совместно культивировали с наивными CD4 + Т-клетками в течение 4 дней. Т-клетки собирали и повторно стимулировали mAb против CD3 и CD28. Концентрацию IL-10 в супернатантах количественно определяли с помощью ELISA. Данные были репрезентативными для трех независимых экспериментов. Планки погрешностей, S.D. * P <0,01, N.S, не значимо.
https://doi.org/10.1371/journal.ppat.1002714.s007
(PDF)
Таблица S1.
Состав фекальной комменсальной микрофлоры у мышей, получавших пробиотики. 6-недельных мышей C57BL / 6 кормили L. casei , B. breve или плацебо ежедневно (1 × 10 9 ) через желудочный зонд в течение 3 месяцев (n = 5, соответственно). Образцы фекалий собирали, взвешивали и суспендировали в 9 объемах стерилизованной анаэробной среды для переноса. Фракции общей РНК и ДНК, выделенные из каждого образца, оценивали с помощью RT-qPCR или qPCR с конкретными праймерами.«Число» указывает КОЕ каждой бактерии, рассчитанное с использованием контрольных культивированных бактерий. (x / 5) указывает правую часть «числа», показывающую уровень обнаружения проанализированных мышей.
https://doi.org/10.1371/journal.ppat.1002714.s008
(PDF)
Благодарности
Мы благодарим О. Такеучи и С. Акиру за предоставление мышей Tlr2 — / — и Myd88 — / — , а также Amgen за предоставление мышей Il27ra — / — . К. Хидака за секретарскую помощь, Ю.Magota за техническую помощь.
Вклад авторов
Эксперимент задумал и разработал: К. Такеда. Выполняли эксперименты: S.G. Jeon, H. Kayama, Y. Ueda, J.S. Ма, Т. Кусу, Р. Окумура. Проанализировали данные: С.Г. Чон, Х. Каяма, М. Ямамото, К. Такеда. Предоставленные реагенты / материалы / инструменты анализа: Т. Такахаши, Т. Асахара, Х. Цуджи, Н. М. Цуджи, Х. Киёно, Х. Хара, Х. Йошида, К. Номото. Написал статью: К. Такеда.
Список литературы
- 1. Франк Д. Н., Сент-Аманд А. Л., Фельдман Р. А., Boedeker EC, Harpaz N и др.(2007) Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S A 104: 13780–13785.
- 2. Петерсон Д.А., Франк Д. Н., Пейс Н. Р., Гордон Дж. И. (2008) Метагеномные подходы для определения патогенеза воспалительных заболеваний кишечника. Клеточный микроб-хозяин 3: 417–427.
- 3. Цинь Дж., Ли Р., Раес Дж., Арумугам М., Бургдорф К.С. и др. (2010) Каталог кишечных микробных генов человека, созданный с помощью метагеномного секвенирования.Природа 464: 59–65.
- 4. Элинав Э., Строиг Т., Кау А.Л., Хенао-Мехиа Дж., Тайсс Калифорния и др. (2011) Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Cell 145: 745–757.
- 5. Hart AL, Stagg AJ, Kamm MA (2003) Использование пробиотиков при лечении воспалительного заболевания кишечника. J Clin Gastroenterol 36: 111–119.
- 6. Sartor RB (2005) Пробиотическая терапия воспалений и инфекций кишечника. Curr Opin Gastroenterol 21: 44–50.
- 7. Boirivant M, Strober W (2007) Механизм действия пробиотиков. Curr Opin Gastroenterol 23: 679–692.
- 8. Ng SC, Hart AL, Kamm MA, Stagg AJ, Knight SC (2009) Механизмы действия пробиотиков: последние достижения. Воспаление кишечника Dis 15: 300–310.
- 9. Мартин Ф. П., Ван Й., Шпренгер Н., Яп И. К., Лундштедт Т. и др. (2008) Пробиотическая модуляция метаболических взаимодействий симбиотических кишечных микробов-хозяев в гуманизированной модели микробиома на мышах.Мол Сист Биол 4: 157.
- 10. Зонненбург JL, Chen CT, Gordon JI (2006) Геномные и метаболические исследования воздействия пробиотиков на модельный симбионт кишечника и хозяина. PLoS Biol 4: e413.
- 11. Mennigen R, Bruewer M (2009) Влияние пробиотиков на барьерную функцию кишечника. Энн Н. И. Акад. Наук, 1165: 183–189.
- 12. Round JL, Mazmanian SK (2009) Микробиота кишечника формирует иммунные реакции кишечника во время здоровья и болезни. Nat Rev Immunol 9: 313–323.
- 13. Chung H, Kasper DL (2010) Иммунные механизмы, стимулированные микробиотой, для поддержания гомеостаза кишечника. Curr Opin Immunol 22: 455–460.
- 14. Hooper LV, Macpherson AJ (2010) Иммунные адаптации, которые поддерживают гомеостаз с кишечной микробиотой. Nat Rev Immunol 10: 159–169.
- 15. Hapfelmeier S, Lawson MA, Slack E, Kirundi JK, Stoel M и др. (2010) Обратимая микробная колонизация стерильных мышей показывает динамику иммунных ответов IgA.Science 328: 1705–1709.
- 16. Slack E, Hapfelmeier S, Stecher B, Velykoredko Y, Stoel M и др. (2009) Врожденный и адаптивный иммунитет гибко взаимодействуют друг с другом, чтобы поддерживать мутуализм между хозяином и микробиотой. Science 325: 617–620.
- 17. Ли Ю.К., Мазманян С.К. (2010) Играла ли микробиота решающую роль в эволюции адаптивной иммунной системы? Наука 330: 1768–1773.
- 18. Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, Mulder I., Lan A, et al.(2009) Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет 31: 677–689.
- 19. Иванов И.И., Атараши К., Манель Н., Броди Э.Л., Шима Т. и др. (2009) Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Ячейка 139: 485–498.
- 20. Mazmanian SK, Round JL, Kasper DL (2008) Фактор микробного симбиоза предотвращает воспалительные заболевания кишечника. Природа 453: 620–625.
- 21.Round JL, Mazmanian SK (2010) Индуцируемое развитие Foxp3 + регуляторных Т-клеток комменсальной бактерией кишечной микробиоты. Proc Natl Acad Sci U S A 107: 12204–12209.
- 22. Раунд Дж. Л., Ли С. М., Ли Дж., Тран Дж., Джабри Б. и др. (2011) Путь Toll-подобного рецептора 2 устанавливает колонизацию комменсалом человеческой микробиоты. Science 332: 974–977.
- 23. Атараси К., Тануэ Т., Шима Т., Имаока А., Кувахара Т. и др. (2011) Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium.Наука 331: 337–341.
- 24. Geuking MB, Cahenzli J, Lawson MA, Ng DC, Slack E, et al. (2011) Бактериальная колонизация кишечника вызывает взаимные регуляторные Т-клеточные реакции. Иммунитет 34: 794–806.
- 25. Латроп С.К., Блум С.М., Рао С.М., Натч К., Лио С.В. и др. (2011) Периферическое образование иммунной системы комменсальной микробиотой толстой кишки. Природа 478: 250–4.
- 26. Di Giacinto C, Marinaro M, Sanchez M, Strober W, Boirivant M (2005) Пробиотики улучшают рецидивирующий Th2-опосредованный колит у мышей, индуцируя IL-10 и IL-10-зависимые регулирующие клетки, несущие TGF-beta.J Immunol 174: 3237–3246.
- 27. Лайонс А., О’Махони Д., О’Брайен Ф., МакШарри Дж., Шейл Б. и др. (2010) Бактериальная штамм-специфическая индукция Foxp3 + Т-регуляторных клеток является защитной в моделях аллергии на мышах. Clin Exp Allergy 40: 811–819.
- 28. О’Махони С., Скалли П., О’Махони Д., Мерфи С., О’Брайен Ф. и др. (2008) Комменсал-индуцированные регуляторные Т-клетки опосредуют защиту от стимулируемой патогенами активации NF-kappaB. PLoS Pathog 4: e1000112.
- 29.Лавасани С., Джамбазов Б., Нури М., Фак Ф, Буске С. и др. (2010) Новая смесь пробиотиков оказывает терапевтический эффект на экспериментальный аутоиммунный энцефаломиелит, опосредованный регуляторными Т-клетками, продуцирующими IL-10. PLoS One 5: e9009.
- 30. Барнс MJ, Powrie F (2009) Регулирующие Т-клетки усиливают гомеостаз кишечника. Иммунитет 31: 401–411.
- 31. Виейра П.Л., Кристенсен Дж. Р., Минаи С., О’Нил Э. Дж., Баррат Ф. Дж. И др. (2004) Секретирующие ИЛ-10 регуляторные Т-клетки не экспрессируют Foxp3, но обладают сравнимой регуляторной функцией с природными регуляторными Т-клетками CD4 + CD25 +.J Immunol 172: 5986–5993.
- 32. O’Garra A, Vieira PL, Vieira P, Goldfeld AE (2004) ИЛ-10-продуцирующие и встречающиеся в природе Treg-клетки CD4 +: ограничение побочного ущерба. Дж. Клин Инвест 114: 1372–1378.
- 33. Pot C, Apetoh L, Awasthi A, Kuchroo VK (2010) Молекулярные пути индукции регулирующих клеток типа 1, управляемых интерлейкином-27. J Интерферон цитокин Res 30: 381–388.
- 34. Maynard CL, Harrington LE, Janowski KM, Oliver JR, Zindl CL, et al.(2007) Регуляторные Т-клетки, экспрессирующие интерлейкин 10, развиваются из клеток-предшественников Foxp3 + и Foxp3- в отсутствие интерлейкина 10. Nat Immunol 8: 931–941.
- 35. Мацудзаки Т., Нагата Ю., Кадо С., Учида К., Като И. и др. (1997) Профилактика развития инсулинозависимого сахарного диабета на мышах NOD путем перорального кормления Lactobacillus casei. APMIS 105: 643–649.
- 36. Matsuzaki T, Yamazaki R, Hashimoto S, Yokokura T (1997) Антидиабетические эффекты перорального введения Lactobacillus casei в модели инсулиннезависимого сахарного диабета (NIDDM) с использованием мышей KK-Ay.Endocr J 44: 357–365.
- 37. Като I, Эндо-Танака К., Йококура Т. (1998) Подавляющие эффекты перорального введения Lactobacillus casei на индуцированный коллагеном артрит типа II у мышей DBA / 1. Life Sci 63: 635–644.
- 38. Мацумото С., Хара Т., Хори Т., Мицуяма К., Нагаока М. и др. (2005) Вызванное пробиотиком Lactobacillus улучшение при хроническом воспалительном заболевании кишечника у мышей связано с подавлением провоспалительных цитокинов в мононуклеарных клетках собственной пластинки.Clin Exp Immunol 140: 417–426.
- 39. Исикава Х., Акедо И., Умесаки Ю., Танака Р., Имаока А. и др. (2003) Рандомизированное контролируемое исследование влияния ферментированного бифидобактериями молока на язвенный колит. J Am Coll Nutr 22: 56–63.
- 40. Като К., Мидзуно С., Умесаки Ю., Исии Ю., Сугитани М. и др. (2004) Рандомизированное плацебо-контролируемое исследование по оценке влияния ферментированного бифидобактериями молока на активный язвенный колит. Алимент Pharmacol Ther 20: 1133–1141.
- 41. Мацуда К., Цудзи Х., Асахара Т., Мацумото К., Такада Т. и др. (2009) Создание аналитической системы для фекальной микробиоты человека, основанной на количественной ПЦР с обратной транскрипцией, нацеленной на многокопийные молекулы рРНК. Appl Environ Microbiol 75: 1961–1969.
- 42. Ронкароло М.Г., Грегори С., Батталья М., Баккетта Р., Флейшхауэр К. и др. (2006) Секретирующие интерлейкин-10 регуляторные Т-клетки 1 типа у грызунов и людей. Immunol Rev 212: 28–50.
- 43. Pot C, Jin H, Awasthi A, Liu SM, Lai CY и др. (2009) Передний край: IL-27 индуцирует фактор транскрипции c-Maf, цитокин IL-21 и костимулирующий рецептор ICOS, которые координированно действуют вместе, способствуя дифференцировке клеток Tr1, продуцирующих IL-10. J Immunol 183: 797–801.
- 44. Apetoh L, Quintana FJ, Pot C, Joller N, Xiao S и др. (2010) Арилуглеводородный рецептор взаимодействует с c-Maf, способствуя дифференцировке регуляторных Т-клеток 1-го типа, индуцированной IL-27.Nat Immunol 11: 854–861.
- 45. Laffont S, Powrie F (2009) Иммунология: генеалогия дендритных клеток. Природа 462: 732–733.
- 46. Варол С., Валлон-Эберхард А., Элинав Э., Айчек Т., Шапира Ю. и др. (2009) Субпопуляции дендритных клеток собственной пластинки кишечника имеют разное происхождение и функции. Иммунитет 31: 502–512.
- 47. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M и др. (2007) Дендритные клетки собственной пластинки тонкой кишки способствуют образованию de novo рег-клеток Foxp3 с помощью ретиноевой кислоты.J Exp Med 204: 1775–1785.
- 48. Coombes JL, Siddiqui KR, Arancibia-Carcamo CV, Hall J, Sun CM и др. (2007) Функционально специализированная популяция CD103 + DC слизистой оболочки индуцирует Foxp3 + регуляторные Т-клетки посредством TGF-бета и механизма, зависимого от ретиноевой кислоты. J Exp Med 204: 1757–1764.
- 49. Scott CL, Aumeunier AM, Mowat AM (2011) Дендритные клетки CD103 (+) кишечника: главные регуляторы толерантности? Trends Immunol 32: 412–419.
- 50. Groux H, O’Garra A, Bigler M, Rouleau M, Antonenko S и др.(1997) Подмножество CD4 + Т-клеток ингибирует антиген-специфические Т-клеточные ответы и предотвращает колит. Nature 389: 737–742.
- 51. Awasthi A, Carrier Y, Peron JP, Bettelli E, Kamanaka M и др. (2007) Доминирующая функция интерлейкина 27 в создании продуцирующих интерлейкин 10 противовоспалительных Т-клеток. Nat Immunol 8: 1380–1389.
- 52. Stumhofer JS, Silver JS, Laurence A, Porrett PM, Harris TH и др. (2007) Интерлейкины 27 и 6 индуцируют STAT3-опосредованную продукцию интерлейкина 10 Т-клетками.Nat Immunol 8: 1363–1371.
- 53. Фитцджеральд Д.К., Чжан Г.Х., Эль-Бехи М., Фонсека-Келли З., Ли Х. и др. (2007) Подавление аутоиммунного воспаления центральной нервной системы интерлейкином 10, секретируемым Т-клетками, стимулированными интерлейкином 27. Nat Immunol 8: 1372–1379.
- 54. Акира С., Уэмацу С., Такеучи О. (2006) Распознавание патогенов и врожденный иммунитет. Ячейка 124: 783–801.
- 55. Карими К., Инман, доктор медицины, Биненшток Дж., Форсайт П. (2009) Регулирующие Т-клетки, индуцированные Lactobacillus reuteri, защищают от аллергической реакции дыхательных путей у мышей.Am J Respir Crit Care Med 179: 186–193.
- 56. Смитс Х. Х., Энгеринг А., ван дер Клей Д., де Йонг Э. К., Шиппер К. и др. (2005) Селективные пробиотические бактерии индуцируют продуцирующие IL-10 регуляторные Т-клетки in vitro, модулируя функцию дендритных клеток посредством специфичной для дендритных клеток межклеточной адгезии молекулы 3, захватывающей неинтегрин. J Allergy Clin Immunol 115: 1260–1267.
- 57. Сима Т., Фукусима К., Сетояма Х., Имаока А., Мацумото С. и др. (2008) Дифференциальные эффекты двух пробиотических штаммов с разными бактериологическими свойствами на экспрессию генов кишечника, с особым упором на местные бактерии.FEMS Immunol Med Microbiol 52: 69–77.
- 58. Араки А., Канаи Т., Исикура Т., Макита С., Ураушихара К. и др. (2005) У мышей с дефицитом MyD88 развивается тяжелое воспаление кишечника при колите, вызванном сульфатом натрия и декстраном. J Gastroenterol 40: 16–23.
- 59. Rakoff-Nahoum S, Paglino J, Eslami-Varzaneh F, Edberg S, Medzhitov R (2004) Распознавание комменсальной микрофлоры toll-подобными рецепторами необходимо для гомеостаза кишечника. Ячейка 118: 229–241.
- 60.Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta G и др. (2001) Дендритные клетки экспрессируют белки плотных контактов и проникают в монослои эпителия кишечника, чтобы взять образцы бактерий. Nat Immunol 2: 361–367.
- 61. Фукуда С., Тох Х, Хасе К., Осима К., Наканиши Ю. и др. (2011) Бифидобактерии могут защищать от энтеропатогенной инфекции за счет выработки ацетата. Природа 469: 543–547.
- 62. Habu Y, Nagaoka M, Yokokura T, Azuma I (1987) Структурные исследования полисахаридов клеточной стенки из Bifidobacterium breve YIT 4010 и родственных видов Bifidobacterium.J Biochem 102: 1423–1432.
- 63. Шида К., Нанно М. (2008) Пробиотики и иммунология: отделение пшеницы от плевел. Тенденции Immunol 29: 565–573.
- 64. Kaji R, Kiyoshima-Shibata J, Nagaoka M, Nanno M, Shida K (2010) Бактериальные тейхоевые кислоты меняют преобладающую продукцию IL-12, индуцированную некоторыми штаммами лактобацилл, в преобладающую продукцию IL-10 посредством TLR2-зависимой активации ERK в макрофагах. J Immunol 184: 3505–3513.
- 65.Такеучи О, Хосино К., Кавай Т., Санджо Х., Такада Х. и др. (1999) Различная роль TLR2 и TLR4 в распознавании грамотрицательных и грамположительных компонентов клеточной стенки бактерий. Иммунитет 11: 443–451.
- 66. Йошида Х., Хамано С., Сенальди Дж., Кови Т., Фаггиони Р. и др. (2001) WSX-1 необходим для инициирования ответов Th2 и устойчивости к инфекции L. major. Иммунитет 15: 569–578.
- 67. Атараси К., Нисимура Дж., Шима Т., Умесаки Ю., Ямамото М. и др.(2008) АТФ управляет дифференцировкой клеток собственной пластинки T (H) 17. Природа 455: 808–812.
- 68. Кобаяши М., Квеон М.Н., Кувата Х., Шрайбер Р.Д., Кийоно Х. и др. (2003) Зависимая от толл-подобных рецепторов продукция IL-12p40 вызывает хронический энтероколит у мышей с дефицитом Stat3, специфичных к миелоидным клеткам. Дж. Клин Инвест 111: 1297–1308.
Пробиотики: подробный обзор
US Pharm. 2003; 33 (6): 40-44.
Пробиотики диетические добавки, которые веками использовались как натуральные компоненты в полезные для здоровья продукты. Пробиотики содержат потенциально полезные бактерии или дрожжи. Согласно принятому в настоящее время определению World Health Организация / Продовольственная Сельскохозяйственная Организация, пробиотики «живые» микроорганизмы, которые при введении в адекватных количествах обеспечивают здоровье пользу для хозяина ». 1 Молочнокислые бактерии являются наиболее распространенный тип бактерий, используемых в пищевой промышленности и применяемый для многих лет, потому что они способны преобразовывать сахар (включая лактозу) и другие углеводы в молочную кислоту.Это не только обеспечивает характерную кислинку. вкус кисломолочных продуктов, таких как йогурт, но при понижении pH он может также создают меньше шансов для роста патогенных организмов, тем самым обеспечивая многие преимущества для здоровья, такие как предотвращение желудочно-кишечных инфекций. 2 Наиболее широко используемые пробиотические бактерии — это Lactobacillus, и . Бифидобактерии .
Обоснование использования Пробиотики — это то, что в организме содержатся определенные бактерии, известные как кишечная флора .Естественная микрофлора кишечника выходит из равновесия в широком диапазоне. ряд обстоятельств, включая использование антибиотиков или других лекарств, чрезмерное употребление алкоголя, стресс, определенные заболевания или воздействие токсичных веществ. В в таких случаях бактерии, которые хорошо работают с нашим телом, могут уменьшаться в число, позволяющее вредным конкурентам поставить под угрозу наше здоровье. 3
Рекомендуются пробиотики чаще диетологами, а иногда и врачами после курса антибиотики или как часть лечения кандидоза кишечника.В прием пробиотиков был связан с положительным эффектом из-за их иммуномодулирующая активность, такая как повышение устойчивости к болезням и снижение риск аллергии. 4 Однако поддержание здоровой микрофлоры кишечника зависит от многих факторов, особенно от качества приема пищи. А значительная доля пребиотических продуктов в рационе поддерживать здоровую микрофлору кишечника и может быть еще одним средством достижения желаемые преимущества для здоровья, обещанные пробиотиками.Интерес к пробиотикам в общее росло; Расходы американцев на пробиотические добавки для Например, с 1994 по 2007 год он почти утроился.
История пробиотиков
В начале 20-го
века впервые была отмечена положительная роль некоторых непатогенных бактерий.
русского ученого, лауреата Нобелевской премии Эли Мечникова. Он предположил, что это
можно было бы изменить флору кишечника и заменить вредные бактерии
полезные бактерии.Мечников считал, что протеолитические бактерии производят токсичные вещества.
такие вещества, как фенол, индолы, Ü и аммиак в толстом кишечнике из
переваривание белков. В результате он предположил, что эти соединения были
отвечает за кишечную аутоинтоксикацию, которая, по его словам, вызвала
физические изменения, связанные со старостью.
Тем временем исследователи обнаружил, что молоко, ферментированное молочнокислыми бактериями, подавляет рост протеолитических бактерий из-за низкого pH, производимого лактозой ферментация.Мечников также заметил, что некоторые русские, которые жили в основном на молоке, ферментированном молочнокислыми бактериями. долгожитель. Основываясь на этих фактах, Мечников предположил, что потребление ферментированное молоко засевает кишечник безвредными молочнокислыми бактериями и снизить pH в кишечнике, что, в свою очередь, подавит рост протеолитические бактерии.
Впоследствии Генри Тиссье из Института Пастера изолировал бифидобактерии от младенца, находящегося на грудном вскармливании. и назвал его Bacillus bifidus communis (позже переименован в Bifidobacterium bifidum ).Тиссье показал, что бифидобактерии преобладает в кишечной флоре детей, находящихся на грудном вскармливании, и он рекомендовал введение бифидобактерий младенцам, страдающим диареей. В утвержденный механизм заключался в том, что бифидобактерии вытесняют протеолитические бактерии, вызывающие заболевание.
После смерти Мечникова в В 1916 году центр пробиотической активности переместился в США. Это было предположил, что бактерии, происходящие из кишечника, с большей вероятностью производят желаемый эффект в кишечнике, и в 1935 году определенные штаммы Lactobacillus acidophilus оказались очень активными при имплантации человеку пищеварительный тракт.Испытания проводились с использованием этого организма, и обнадеживающие были получены результаты, особенно при лечении хронических запоров. В 1970-е годы молочная промышленность начала продвигать кисломолочные продукты. содержащий л ацидофила . В последующие десятилетия прочие Было интродуцировано вида Lactobacillus, в том числе Lactobacillus rhamnosus , Lactobacillus casei и Lactobacillus johnsonii , потому что это виды кишечника с полезными свойствами. 5
Пробиотики в сравнении с
Пребиотики
Пробиотики не являются
то же самое, что и пребиотики — неперевариваемые пищевые ингредиенты, которые выборочно
стимулировать рост и / или активность полезных микроорганизмов уже в
толстая кишка. Когда пробиотики и пребиотики смешиваются, они образуют синбиотик.
Пробиотики можно использовать как дополнительная и альтернативная медицина? (CAM) для профилактики и лечения некоторых болезни и поддерживать общее самочувствие.Они доступны в продуктах питания и пищевые добавки в виде капсул, таблеток и порошков, а также в некоторых других формах также. Примеры продуктов, содержащих пробиотики: йогурт, ферментированный и несброженное молоко, мисо, темпе, а также некоторые соки и соевые напитки.
Большинство пробиотиков непатогенные бактерии, подобные тем, которые естественным образом обнаруживаются в кишечнике людей, особенно у младенцев, находящихся на грудном вскармливании (у которых есть естественная защита от многие болезни). Чаще всего бактерии происходят от двух ранее названных виды, L acidophilus и B bifidum .Внутри каждого вида доступны различные штаммы или разновидности. Поэтому важно помните, что безопасность и эффективность пробиотиков зависят от от штамма бактерий и могут широко различаться, даже среди аналогичных виды бактерий. Несколько распространенных пробиотиков, таких как Saccharomyces boulardii , это дрожжи, которые отличаются от бактерий. 6
Lactobacillus видов
Lactobacillus
acidophilus — это
бактерия, вырабатывающая молочную кислоту, тем самым создавая среду
неблагоприятен для разрастания потенциально патогенных грибов и бактерий
(включая гнилостные бактерии) и способствующие созданию ацидурической флоры. 7
L acidophilus и Lactobacillus bulgaricus использовались более 75 лет в лечение неосложненной диареи, особенно диареи, вызванной модификация кишечной флоры антибиотиками. Лактобациллы препараты могут помочь в восстановлении нормальной физиологической и бактериальной флора кишечного тракта, а также использовались у пациентов с инфекционная диарея, язвенный колит, раздражение толстой кишки, дивертикулит, колостомы с диареей или запором, функциональный запор, слизистая или спастическая диарея и диарея после амебиаза.Однако там в настоящее время отсутствуют существенные доказательства из хорошо разработанных, контролируемых исследования, подтверждающие утверждения об эффективности препаратов Lactobacillus в лечение диареи.
L acidophilus вводится перорально, предпочтительно с молоком, фруктовым соком или водой. В обычные капсулы, таблетки и гранулы можно жевать или глотать целиком, и гранулы или содержимое капсул Intestinex могут быть добавлены или приняты с хлопьями, едой, молоком, фруктовым соком или водой.Коммерчески доступные Капсулы с энтеросолюбильным покрытием следует проглатывать целиком.
Дозировка
Дозировка
коммерческий препарат, содержащий л ацидофила и натрия
карбоксиметилцеллюлоза — две капсулы два-четыре раза в день. Дозировка
коммерческие препараты, содержащие л ацидофилус и л болгарик две капсулы, четыре таблетки или один пакет гранул три или четыре раза
ежедневно.Дозировка коммерчески доступных капсул с энтеросолюбильным покрытием, содержащих L acidophilus и L casei — одна капсула в день для первых двух
недели терапии; затем дозировка может быть увеличена максимум до трех
капсулы ежедневно при необходимости.
Для самолечения диарея, л Препараты acidophilus , как правило, не следует применять при более двух дней или при высокой температуре, если не указано иное под руководством врача.Они могут вызывать увеличение кишечных газов в начало терапии, но это обычно проходит при продолжении использования. Один производитель рекомендует не использовать L acidophilus для лечения диарея у младенцев и детей младше 3 лет, если они не руководство и наблюдение врача. Лица, чувствительные к молоку продукты не следует использовать препарат. 8
Коммерческие препараты должны храниться при температуре от 2 ° C до 8 ° C.Имеющиеся в продаже таблетки Lactinex и гранулы имеют срок годности 18 месяцев, а капсулы — двухлетний срок годности. срок хранения. Никаких методов стандартизации культур, используемых в опубликованы коммерческие препараты.
Бифидобактерии видов
Bifidobacterium включают более 28 видов, которые являются нормальным компонентом бактериального
флора нижних отделов желудочно-кишечного тракта.Их метаболическая активность производит
множество полезных витаминов, а также среда, подавляющая
рост патогенных видов. Бифидобактерии толстой кишки переваривают сахара до
кислые короткоцепочечные жирные кислоты, создающие слабокислый pH, который
подавляет рост бактерий, дрожжей и других патогенных организмов.
Бифидобактерии могут влиять на метаболизм жирных кислот, желчных кислот,
холестерин и стероидные гормоны в кишечном тракте. Они также производят
количество витаминов, в том числе несколько витаминов группы В и витамин К, которые
всасывается в кровоток.Кроме того, короткоцепочечные жирные кислоты
производятся Bifidobacterium видов являются основным источником энергии для
эпителиальные клетки толстой кишки. 9
Специфичность штамма
Пробиотические бактерии
проявляют множество свойств, в том числе иммуномодулирующую активность, которая
уникальны для определенного сорта. Таким образом, не все виды обязательно будут иметь
тот же терапевтический потенциал в конкретном состоянии.Последние исследования
сравнили реакцию симптомов и соотношения цитокинов при раздраженном кишечнике
синдром (СРК) с приемом пробиотических препаратов, содержащих Lactobacillus или штамм Bifidobacterium . Bifidobacterium infantis 35624 оказался пробиотиком, который особенно облегчает многие из
симптомы СРК. Этот симптоматический ответ был связан с нормализацией
соотношения противовоспалительных и провоспалительных цитокинов, что позволяет предположить
иммуномодулирующая роль для этого конкретного организма. 10
Медицинское пособие
Обобщение
пробиотические эффекты не должны производиться, и критическая научная оценка должна
использоваться для указания пациентам выбрать подходящий пробиотик. Есть
несколько причин, по которым люди интересуются пробиотиками в медицинских целях. 11 Во-первых, мир полон микроорганизмов (в том числе бактерий) и
то же самое происходит с телами людей — на коже и на коже, в кишечнике и других отверстиях.Дружественные бактерии жизненно важны для правильного развития иммунной системы,
защита от микроорганизмов, которые могут вызвать заболевание, и
переваривание и всасывание пищи и питательных веществ. Смесь бактерий каждого человека
меняется. Взаимодействие между человеком и микроорганизмами в его или ее
тела и среди самих микроорганизмов могут иметь решающее значение для
общее состояние здоровья и благополучия.
Патогенные микроорганизмы, такие как поскольку болезнетворные бактерии, дрожжи, грибки и паразиты также могут нарушать остаток средств.Исследователи изучают, могут ли пробиотики остановить эти недружелюбные агенты в первую очередь и / или подавляют их рост и активность при таких состояниях, как инфекционная диарея, СРК, воспалительное заболевание кишечника (например, язвенный колит и болезнь Крона), инфицирование Helicobacter pylori ( H pylori , бактерия, вызывающая большинство язв и многие типы хроническое воспаление желудка), кариес и пародонтоз, вагинальный инфекции, желудочные и респираторные инфекции, которые дети приобретают в детские сады и кожные инфекции.
Еще одна причина Интерес к пробиотикам проистекает из того факта, что в пищеварительный тракт, связанный с иммунной системой. Верят что изменение микроорганизмов в кишечном тракте человека (например, введение пробиотических бактерий) может повлиять на защитные силы иммунной системы.
Некоторые виды использования пробиотиков для
что есть некоторые обнадеживающие свидетельства: 12 :
• Лечить
диарея (это наиболее убедительные доказательства, особенно диареи от
ротавирус)
• Для предотвращения и
лечить инфекции мочевыводящих путей или женских половых путей
• Для лечения СРК
• Чтобы сократить
продолжительность кишечной инфекции, вызванной бактерией Clostridium difficile
• Для предотвращения и
лечить поучит (состояние, которое может возникнуть после операции по удалению толстой кишки).
Риски
Намного больше
необходимы научные знания о пробиотиках, включая их безопасность и
надлежащее использование. Эффекты, обнаруженные от одного вида или штамма пробиотиков, не
обязательно верно для других, или даже для различных приготовлений
того же вида или силы. Безопасность пробиотиков досконально не изучена.
с научной точки зрения, и требуется больше информации, особенно о том, насколько они безопасны
предназначены для маленьких детей, пожилых людей и людей с ослабленным иммунитетом.
системы.Как правило, побочные эффекты пробиотиков незначительны и вызывают нарушение пищеварения.
(например, газы или вздутие живота). У некоторых людей наблюдались более серьезные последствия.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США предъявляет особые требования к маркировке пищевых продуктов.
добавки и рассматривает их как пищу, а не как лекарства. Не использовать CAM-терапию.
вместо обычной медицинской помощи или для отсрочки обращения за ней.
Ключевые области будущих исследований
включая следующее:
1) Изучение бактерий
на молекулярном уровне, чтобы узнать, как они могут взаимодействовать с телом (например,
кишечник и его бактерии) для профилактики и лечения заболеваний.Достижения в
технологии и медицина позволяют много изучать эти области.
лучше, чем в прошлом.
2) Определение того, что
происходит, когда пробиотические бактерии обрабатываются или добавляются в пищу. Является их
способность выживать, расти и иметь терапевтический эффект изменился?
3) В поисках лучшего
способы введения пробиотиков в терапевтических целях, а также лучшие
дозы и графики.
4) Расследование
потенциал пробиотиков в решении проблемы устойчивости к антибиотикам
бактерии в кишечнике и могут ли они предотвратить распространение недружелюбных бактерий
проникновение через кожу или слизистые оболочки и перемещение по телу
(е.g., что может произойти при ожогах, шоке, травмах или подавлении иммунитета). 13
Роль фармацевтов и
Врачи
В США,
Давление потребителей, несомненно, вызовет большой интерес к пробиотикам.
В результате фармацевтам, диетологам и семейным врачам необходимо улучшать
их знания и информацию о них, чтобы они могли посоветовать своим пациентам
соответственно. Основываясь на текущем понимании, положительное влияние на здоровье
о пробиотиках сообщалось при лечении диареи и воспалительных заболеваний.
и аллергические заболевания у взрослых и младенцев. 14 В результате получается
важно знать, что это за штамм продукта и какие исследования подтверждают это
напряжение. Следует поощрять врачей и фармацевтов к исследованию штамма.
бактерий и продукта, прежде чем они их рекомендуют, в качестве ряда
пробиотические продукты были связаны с проблемами качества, в том числе
заражение штаммами, не указанными на этикетке.
ССЫЛКИ
1. Продовольствие и сельское хозяйство
Организация (ФАО) ООН и Всемирная организация здравоохранения (ВОЗ).Руководство по оценке пробиотиков в продуктах питания. Отчет Совместного ФАО / ВОЗ
рабочая группа по разработке руководящих принципов оценки пробиотиков в пищевых продуктах.
По состоянию на 7 декабря 2006 г.
2. Альварес-Олмос М.И.,
Оберхельман Р.А. Пробиотические агенты и инфекционные заболевания: современная перспектива
на традиционной терапии. Clin Infect Dis. 2001; 32: 1567-1576.
3. Дорон С., Горбач С.Л.
Пробиотики: их роль в лечении и профилактике заболеваний. Эксперт
Rev Anti Infect Ther. 2006; 4: 261-275.
4. Эзендам Дж., Фургон
Ловерен Х. Пробиотики: иммуномодуляция и оценка безопасности и эффективности. Обзоры питания. 2006; 64: 1-14.
5. История
пробиотики. http://en.wikipedia.org/wiki/Probiotic.
6. Вандерхоф Дж. А., Янг
RJ. Текущее и потенциальное использование пробиотиков. Ann Allergy Asthma Immunol. 2004; 93 (5 доп. 3): S33-S37.
7. Reid G, Hammond JA.Пробиотики: некоторые доказательства их эффективности. Врач Джан Фам. 2005; 51: 1487-1493.
8. Lactobacillus.
Веб-сайт системы Thomson MICROMEDEX AltMedDex. По состоянию на 7 декабря 2006 г.
9. Бифид. Томсон
МИКРОМЕДЭКС Система АльтМедДекс. Веб-сайт. По состоянию на 7 декабря 2006 г.
10. Whorwell PJ,
Альтрингер Л., Морел Дж. И др. Эффективность инкапсулированного пробиотика
Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J
Гастроэнтерол. 2006; 101: 1581-1590.
11. Cabana MD, Shane
А.Л., Чао С. и др. Пробиотики в педиатрии первичного звена. Clin Pediatr. 2006; 45: 405-410.
12. Хаммерман С,
Бин-Нун А., Каплан М. Безопасность пробиотиков: сравнение двух популярных штаммов. BMJ. , 2006; 333: 1006-1008.
13. Хюбнер Э.С.,
Суравич CM. Пробиотики в профилактике и лечении желудочно-кишечного тракта.
инфекции. Gastroenterol Clin North Am., 2006; 35: 355-365.
14. Salminen SJ,
Геймонд М., Изолаури Э. Пробиотики, которые изменяют риск заболевания. J Nutr. 2005; 135: 1294-1298.
Чтобы прокомментировать статью, обращайтесь [email protected].
Бифидобактерии и их роль в здоровье человека
Cruickshank, J. 1925. Bacillus bifidus : характеры и выделение из кишечника младенцев. J. Hyg. 24: 241–254.
Google Scholar
Хотта, М., Ю. Сайто, С. Ивата, Н. Ямасита, К. Сунакава, Т. Оикава, Р. Танака, К. Ватанабэ, Х. Такаяма, М. Ядзима, С. Секигути, С. Араи, Т. Сакураи и М. Мутаи. 1987. Клинические эффекты препаратов Bifidobacterium при трудноизлечимой диарее у детей. Keio J. Med. 36: 298–314.
Google Scholar
Кови Ю., Я. Хашимото и З. Тамура. 1982. Противоопухолевый и иммунологический адъювантный эффект Bifidobacterium infantis на мышей.Бифидобактерии Микрофлора 1: 61–68.
Google Scholar
Кохмото Т., Ф. Фукуи, Х. Такаку, Ю. Мачида, М. Араи и Т. Мицуока. 1988. Влияние изомальтоолигосахаридов на фекальную флору человека. Бифидобактерии Microflora 7: 61–69.
Google Scholar
Коидзуми Т., Н. Мицуя, Т. Мукута, С. Фудзита, Х. Исидзу и Х. Йошиока. 1980. Влияние введения препарата Bifidobacterium (BBG-02) на печеночную кому.Сого Ринсё 29: 2473–2478 (на японском языке).
Google Scholar
Мицуока, Т. 1982. Последние тенденции в исследованиях кишечной флоры. Бифидобактерии Микрофлора 1: 3–24.
Google Scholar
Мицуока, Т. 1984. Таксономия и экология бифидобактерий. Бифидобактерии Microflora 3: 11–28.
Google Scholar
Мицуока, Т.и К. Хаякава. 1972. Die Faekalflora bei Menschen. I. Mitteilung: Die Zusammensetzung der Faekalflora der verschiedenen Altersgruppen Zbl. Бакт. Hyg., I. Abt. Ориг. А 223: 333–342.
Google Scholar
Мицуока Т., Х. Хидака и Т. Эйда. 1987. Влияние фруктоолигосахаридов на микрофлору кишечника. Die Nahrung 31: 5–6.
Google Scholar
Мицуока, Т.и К. Оно. 1977. Die Faekalflora bei menschen. V. Mitteiling: Die Schwankungen in der Zusammensetsung der Faekalflora gesunder Erwachsener. Zbl. Бакт. Hyg., I. Abt. Ориг. А 238: 228–236.
Google Scholar
Мизутани Т. и Т. Мицуока. 1980. Ингибирующее действие некоторых кишечных бактерий на онкогенез печени у самцов мышей-гнотобиотиков C3H / He. Cancer Lett. 11: 89–95.
Google Scholar
Müting, D., W. Escherich и J.P. Mayer. 1968. Влияние Bifidobacterium bifidum на кишечную бактериальную флору и токсические белковые метаболиты при хронических заболеваниях печени. Являюсь. J. Proetol. 19: 336–342.
Google Scholar
Орла-Йенсен, С. 1924. Классификация лактических бактерий. Lait 4: 468–474.
Google Scholar
Секин, К., Тойда Т., М.Сайто, М. Кубояма и Ю. Хашимото. 1985. Новый морфологически охарактеризованный препарат клеточной стенки (цельный пептидогликан) из Bifidobacterium infantis с более высокой эффективностью в отношении регрессии установленной опухоли у мышей. Cancer Res. 45: 1300–1307.
Google Scholar
Танака Р., Х. Такаяма, М. Моротоми, Т. Куросима, С. Уэяма, К. Мацумото, А. Курода и М. Мутаи. 1983. Влияние введения TOS и Bifidobacterium breve 4006 на фекальную флору человека.Бифидобактерии Microflora 2: 17–24.
Google Scholar
Тиссье, Х. 1900. Recherches sur la flore кишечные нормальные и патологические, нуриссон, стр. 1–253. Thèse de Paris.
Тохьяма К., Р. Танака, Ю. Кобаяси и М. Мутаи. 1982. Взаимосвязь между метаболической регуляцией микрофлоры кишечника при кормлении Bifidobacterium и функцией печени хозяина. Бифидобактерии Микрофлора 1: 45–50.
Google Scholar
Weiss, J.E. and L.F. Rettger. 1934. Lactobacillus bifidus . J. Bacteriol. 28: 501–527.
Google Scholar
Донор фекалий, богатый бифидобактериями, может быть положительным предиктором успешной трансплантации фекальной микробиоты у пациентов с синдромом раздраженного кишечника — FullText — Digestion 2017, Vol. 96, № 1
Абстрактные
Предпосылки / цели: Дисбиоз связан с различными системными расстройствами, включая синдром раздраженного кишечника (СРК).Трансплантация фекальной микробиоты (FMT) может восстановить микробный баланс кишечника. Целью исследования было определение безопасности и эффективности FMT у пациентов с СРК, а также положительных предикторов FMT. Методы: Это было открытое исследование с одной группой. Подходящие пациенты были диагностированы на основании диагностических критериев Рима III. Фекальные материалы вводились пациенту с помощью колоноскопии. Первичной конечной точкой было изменение Бристольской шкалы формы стула через 4 недели после FMT.Выздоровление до 3-4-го типа считалось клиническим ответом. Вторичной конечной точкой было изменение кишечной микробиоты и психологического статуса по шкале Гамильтона. Результаты: В исследование были включены десять пациентов. Шесть пациентов достигли клинического ответа. Разнообразие пациентов через 4 недели после FMT значительно увеличилось по сравнению с пациентами до FMT, а количество пациентов, ответивших на лечение, было значительно выше, чем пациентов, не ответивших на лечение. Численность Bifidobacterium у эффективных доноров была значительно выше, чем у неэффективных доноров и пациентов.Психологический статус всех пациентов значительно улучшился после ТФМ. Выводы: FMT для пациентов с СРК безопасен и относительно эффективен. Донор фекалий, богатый Bifidobacterium , может быть положительным предиктором успешного FMT. Ключевое резюме: (1) Дисбиоз связан с различными желудочно-кишечными расстройствами, включая СРК. (2) FMT может восстанавливать микробный баланс кишечника. (3) Мы показали, что FMT улучшает форму стула и психологический статус пациентов с СРК.(4) Bifidobacterium -богатый донор эффективно индуцировал симбиоз у пациентов с СРК.
© 2017 Автор (ы) Опубликовано S. Karger AG, Базель
Введение
Функциональные желудочно-кишечные расстройства характеризуются наличием симптомов и отсутствием органических и структурных аномалий, которые легко объясняют симптомы. Синдром раздраженного кишечника (СРК) — это функциональное желудочно-кишечное расстройство, симптомы которого, как считается, происходят из среднего или нижнего отдела желудочно-кишечного тракта.Поскольку его диагноз основан только на симптомах, его этиология и патогенез считаются неоднородными. Таким образом, несмотря на его высокую распространенность, до сих пор нет установленных терапевтических возможностей. Более того, симптомы СРК влияют на качество жизни пациентов, и, таким образом, СРК является значительным бременем для общества [1,2].
Недавние исследования показали, что состав кишечной микробиоты у пациентов с СРК отличался от здорового контроля [3,4]. Изменения в кишечной среде вызывают композиционный дисбаланс микробиоты, называемый «дисбактериозом», который связан с СРК [5,6].Текущие исследования взаимодействий кишечника и мозга микробиоты продемонстрировали, что изменения состава кишечной микробиоты связаны с соответствующими аномальными функциями желудочно-кишечного тракта и оси мозг-кишечник у пациентов с СРК [7,8]. Считается, что висцеральная гиперчувствительность является патофизиологическим признаком СРК, который индуцирует усиленные сигналы из желудочно-кишечного тракта в мозг. Этот сигнальный путь приводит к усилению симптоматической реакции у пациентов с СРК. Недавнее исследование показало, что кишечная микробиота и психологический стресс на работе были медиаторами висцеральной гиперчувствительности [9].Основываясь на этих выводах, было много попыток улучшить симптомы СРК с помощью манипуляции с кишечной микробиотой. Прием пробиотиков — традиционное лечение дисбактериоза. Лечение Bacteroides infantis 35624 облегчило симптомы СРК, сопровождавшиеся изменениями цитокинового профиля [10]. Ферментируемые олигосахариды, дисахариды, моносахариды и полиолы (FODMAP) могут вызывать симптомы СРК, а диета с низким содержанием FODMAP облегчает симптомы СРК [11,12]. Недавно McIntosh et al.[13] показали, что диета с низким содержанием FODMAP изменяет метаболом у пациентов с СРК и увеличивает богатство и разнообразие актинобактерий . Однако этот подход вызывает некоторые опасения, поскольку при использовании антибиотиков для лечения СРК может возникнуть дисбактериоз. В предыдущих клинических испытаниях сообщалось о положительном эффекте пробиотиков у пациентов с СРК, но эффективность была ограничена. Фекалии человека содержат более разнообразные бактерии, чем пробиотики. Следовательно, трансплантация фекальной микробиоты человека (FMT) может быть кандидатом на лечение для улучшения дисбактериоза у пациентов с IBS.При рецидивирующих инфекциях Clostridium difficile FMT имел более высокий показатель излечения, чем стандартное лечение антибиотиками [14], а предыдущие сообщения показали, что FMT может восстанавливать микробный баланс кишечника при заболеваниях человека [15].
На сегодняшний день мало исследований, посвященных оценке эффективности FMT у пациентов с СРК [16]. Более того, недавние отчеты показали, что микробиом кишечника японского населения значительно отличается от микробиома других популяций [17]. Мы уже безопасно провели FMT для японских пациентов с язвенным колитом [18].Чтобы прояснить эффективность FMT у японских пациентов с IBS, мы провели открытое, нерандомизированное исследование FMT с метагеномным и психологическим анализами.
Материалы и методы
Этика
Комитет по этике Медицинской школы Университета Кейо одобрил протокол (№ 20130488), и все участники предоставили письменное информированное согласие. Исследование было зарегистрировано в Сетевом медицинском информационном центре университетской больницы (UMIN000014617).
Дизайн исследования
В этом одноцентровом открытом нерандомизированном исследовании безопасность и эффективность FMT оценивалась у пациентов с рефрактерным СРК, не ответивших на медикаментозное лечение.Клиническое наблюдение проводилось в течение 12 недель после FMT.
Участники
Пациенты с СРК, подходящие для исследования пациенты были 20 лет и старше с диагнозом СРК на основании диагностических критериев Рима III [19]. В исследование были включены пациенты со стойкими симптомами, несмотря на медикаментозное лечение в течение как минимум года. Пациенты были исключены, если они были беременны или не могли дать информированное согласие, а также если они страдали тяжелым нарушением функции печени или почек. Также были исключены пациенты, которым не удалось пройти эндоскопию из-за психического расстройства.
Доноры, как мы ранее сообщали [18], здоровые родственники в пределах второй степени родства (возраст ≥20 лет) были проверены с помощью кала и серологического анализа на бактериальные, паразитарные и вирусные патогены.
FMT. Процедура
Как мы ранее сообщали [20], доноры были проинструктированы собирать фекалии в AneroPack ™ (Mitsubishi Gas Chemical Co. Inc., Токио, Япония) и приносить упаковку в больницу при температуре 4 ° C. день запланированного FMT. Приблизительно 100 г фекалий собирали у доноров, растворяли в 200 мл физиологического раствора и фильтровали через металлический фильтр для получения жидкой суспензии.Фекалии вводили пациенту с помощью колоноскопии после стандартной подготовки кишечника.
Клинические результаты
Первичной конечной точкой было изменение бристольской шкалы формы стула через 4 недели после FMT. Выздоровление до 3-4-го типа считалось клиническим ответом [21]. Вторичной конечной точкой было изменение кишечной микробиоты и психиатрического статуса в течение 12 недель после FMT. Психиатрический статус оценивался с использованием шкалы оценки депрессии Гамильтона (HAM-D) и шкалы оценки тревожности Гамильтона (HAM-A), соответственно, хорошо подготовленным психологом и / или психиатром слепым методом [22,23].Процедура исследования показана на Рисунке 1а.
Рис. 1
a Обзор процедуры исследования. b Изменение шкалы формы стула у пациентов с ответом и без ответа с использованием Бристольской шкалы формы стула на исходном уровне и через 4 недели после FMT.
Сбор образцов фекалий
Образцы фекалий были продольно взяты у пациентов на 0, 4 и 12 неделях после FMT, а также у доноров в день FMT. У пациентов и доноров было собрано 40 образцов кала.Собранные свежие фекалии хранили в анаэробных условиях в AneroPack ™ при 4 ° C. Кал замораживали в 20% глицерине (Wako Pure Chemical Industries, Осака, Япония) / фосфатно-солевом буферном растворе (Life Technologies, Токио, Япония) жидким азотом и хранили при -80 ° C до использования.
Извлечение бактерий из образцов фекалий и экстракция бактериальной ДНК
Бактериальную ДНК получали, как описано ранее [17]. Вкратце, бактериальная ДНК была экстрагирована ферментативным лизисом с использованием лизоцима (Sigma-Aldrich Co.LCC, Токио, Япония) и ахромопептидаза (Wako). Затем образцы ДНК очищали обработкой рибонуклеазой A (Wako) с последующим осаждением 20% раствором полиэтиленгликоля (PEG6000 в 2,5 М хлориде натрия). Затем ДНК осаждали центрифугированием, промывали 75% этанолом и растворяли в буфере трис-этилендиаминтетрауксусной кислоты.
Секвенирование и процессинг генов бактериальной 16S рРНК из фекальной ДНК
Мультиплексное секвенирование ампликона 16S выполняли на платформе MiSeq Illumina; Область V1-V2 гена 16S рРНК амплифицировали с помощью ПЦР с использованием праймеров 27Fmod и 338R, содержащих последовательности адаптера Illumina и уникальный штрих-код длиной 8 пар оснований.Ампликоны для ПЦР очищали с помощью гранул для магнитной очистки AMPure XP (Beckman Coulter, Inc.) и количественно оценивали с помощью набора Quant-iT PicoGreen dsDNA Assay Kit. Равное количество каждого ПЦР-ампликона смешивали и затем секвенировали с использованием набора реагентов MiSeq Reagent Kit v3 (600 циклов). На основе штрих-кодов конкретных образцов полученные считывания были присвоены каждому образцу, а считывания с парных концов были объединены с помощью программы fastq-join. Считывания со средним значением качества <25, несоответствия универсальным праймерам и возможные химерные считывания были удалены.Среди высококачественных считываний 3000 считываний на выборку были случайным образом выбраны и сгруппированы в рабочие таксономические единицы путем кластеризации с использованием алгоритма UCLUST с порогом идентичности 96%. Таксономические присвоения для каждой оперативной таксономической единицы были сделаны путем поиска сходства с общедоступными базами данных генома 16S и NCBI с использованием программы GLSEARCH. Для присвоения на уровне типа, семейства, рода и вида использовались пороги сходства последовательностей 70, 90, 94 и 96% соответственно.Все высококачественные последовательности 16S V1-V2, проанализированные в этом исследовании, были депонированы в базу данных DDBJ / GenBank / EMBL с регистрационным номером DRA005522. Для оценки сходства структур микробиоты между каждой парой образцов использовали анализ расстояния UniFrac и анализа главных координат.
Статистический анализ
Результаты выражены как среднее ± стандартное отклонение. Группы данных сравнивали с использованием критерия Стьюдента t . Для множественных сравнений статистический анализ проводился с использованием теста Краскела-Уоллиса или одностороннего анализа дисперсии в зависимости от распределения данных.Апостериорный анализ выполняли с помощью теста Тьюки-Крамера. Различия считались статистически значимыми, когда значение p было <0,05. Все анализы проводились с использованием программного обеспечения GraphPad Prism версии 6 (GraphPad Software, Сан-Диего, Калифорния, США).
Результаты
Набор пациентов
Мы включили 10 пациентов с июля 2014 г. по февраль 2016 г., в том числе 8 пациентов с СРК с преобладанием диареи, 1 с СРК с преобладанием запора и 1 с СРК смешанного типа.Клинические характеристики пациентов и доноров представлены в таблице 1.
Таблица 1
Исходные характеристики пациентов и доноров. Тип заболевания определялся в соответствии с диагностическими критериями Рима III.
Скрининг доноров
В результате скрининга 11 здоровых субъектов на патогены стула и серологических исследований было выбрано 10 подходящих доноров. Один пациент был исключен из-за положительных результатов скрининга на инфекционные агенты в кале. Все доноры сдавали пациентам фекалии, которые использовались для инфузий.Средний возраст донора имел тенденцию быть выше возраста пациента ( p = 0,09). Существенной разницы по полу между донорами и пациентами не было.
Улучшение формы стула после FMT
Шесть пациентов достигли клинического ответа. Изменение шкалы формы стула показано на Рисунке 1b. Шкала стула у 1 пациента в группе респондентов ухудшилась на 12-й неделе, и ни один из пациентов в группе, не ответившей на лечение, не достиг клинического ответа на 12-й неделе (онлайн-приложение.Рисунок 1; для всех онлайн-доп. материалы см. www.karger.com/doi/10.1159/000471919). В этом исследовании не было нежелательных явлений.
Эти результаты свидетельствуют о том, что наш единственный протокол FMT может улучшить форму стула у пациентов с СРК, но эффект сохраняется в течение ограниченного времени.
FMT улучшил разнообразие кишечной микробиоты у респондеров
Микробный анализ кишечника был проведен путем извлечения геномной ДНК из образцов фекалий пациентов и доноров: 30 образцов были собраны у 10 пациентов и 10 образцов были взяты у 10 доноров.Разнообразие фекальной микробиоты у пациентов значительно увеличилось через 4 недели после FMT ( p = 0,03; рис. 2a слева), хотя на исходном уровне значимой разницы между донорами и пациентами не было. Через четыре недели после FMT разнообразие микробиоты у респондеров было значительно выше, чем у не ответивших ( p = 0,02; рис. 2a справа). Анализ избыточности микробиоты не показал значительных изменений до и после FMT (рис. 2b, c). Эти результаты показали, что существует взаимосвязь между восстановлением разнообразия микробиоты у пациентов и терапевтическими эффектами FMT.
Рис. 2
a Слева: разнообразие микробиоты (индекс Шеннона) 10 доноров и 10 пациентов до и через 4 недели после FMT. Справа: разнообразие микробиоты пациентов у респондеров ( n = 6) и неответчиков ( n = 4) до и через 4 недели после FMT. b Анализ избыточности микробиоты от доноров и пациентов до и через 4 недели после FMT у респондентов и неответчиков с помощью взвешенного анализа UniFrac. c Анализ избыточности микробиоты от доноров и пациентов до и через 4 недели после FMT у респондентов и неответчиков с помощью невзвешенного анализа UniFrac.
FMT восстановил изобилие Bifidobacterium у респондеров
При сравнении образцов от пациентов на исходном уровне с образцами от доноров для респондеров (эффективных доноров) и доноров для пациентов, не ответивших (неэффективные доноры), таксономические профили показали, что тип Firmicutes был доминирующим. практически у всех доноров и у пациентов значимой разницы. Следует отметить, что численность филума Actinobacteria у эффективных доноров была значительно выше, чем у неэффективных доноров ( p = 0.02) и пациентов ( p = 0,01). Напротив, не было существенной разницы между неэффективными донорами и пациентами (рис. 3а). Как показано на Рисунке 3b, численность актинобактерий у пациентов не восстановилась до уровней доноров через 4 недели после FMT в группе респондентов, в то время как она была намного выше у доноров по сравнению с пациентами на исходном уровне ( p = 0,01 ). В группе, не ответившей на лечение, существенной разницы не было. Изменения в численности Actinobacteria между индивидуумами продемонстрировали тенденцию к росту после FMT у респондентов, но этого не наблюдалось у не ответивших (онлайн-приложение.Рис. 2а). Изменения численности Firmicutes между особями показали обратную тенденцию (онлайн-приложение, рис. 2b).
Рис. 3
Анализ микробиома. a Сравнение 7 фекальных бактерий на уровне филума у эффективных доноров ( n = 6), неэффективных доноров ( n = 4) и всех пациентов ( n = 10). b Численность актинобактерий у доноров и пациентов до и через 4 и 12 недель после FMT у респондеров ( n = 6) и неответчиков ( n = 4). c Сравнение топ-7 фекальных бактерий на уровне рода у эффективных доноров ( n = 6), неэффективных доноров ( n = 4) и всех пациентов ( n = 10). d Обилие Bifidobacterium у доноров и пациентов до и через 4 и 12 недель после FMT у респондеров ( n = 6) и неответчиков ( n = 4). Для каждой группы показана средняя численность OTU. OTU, операционная таксономическая единица; нс, не имеет значения.
Численность рода Bifidobacterium , относящегося к филуму Actinobacteria , у эффективных доноров была значительно выше, чем у неэффективных ( p = 0.007) и пациентов ( p = 0,02), но не было существенной разницы между неэффективными донорами и пациентами (рис. 3c). На рисунке 3d показано, что количество Bifidobacterium у пациентов не восстановилось до уровней доноров через 4 недели после FMT у респондеров, тогда как количество Bifidobacterium у доноров было значительно выше, чем у пациентов на исходном уровне ( p = 0,02). Не было значительных различий между 3 группами среди лиц, не ответивших на лечение.Изменения численности Bifidobacterium продемонстрировали тенденцию к росту после FMT у респондеров, но не наблюдались у не отвечающих (онлайн-приложение, рис. 2c).
Эти результаты показали, что численность рода Bifidobacterium в донорских фекалиях была связана с терапевтической эффективностью FMT, но повышение уровня Bifidobacterium у пациентов не коррелировало с терапевтической эффективностью FMT.
FMT Улучшение психиатрического статуса и абдоминальных симптомов как у респондеров, так и у не ответивших
Пациенты с СРК часто страдают психиатрическими симптомами [24].Таким образом, оценивали HAM-D до и через 4 и 12 недель после FMT. Психологические оценки для 1 респондента и 1 не ответившего не проводились. Показатель HAM-D значительно улучшился через 4 недели после FMT ( p = 0,01), но вернулся к исходному уровню через 12 недель (рис. 4a слева). HAM-A также оценивался и улучшился через 4 недели после FMT, но не было значимой разницы ( p = 0,06; рис. 4b слева). Интересно, что изменение показателей HAM-D и HAM-A не показало значимой разницы между респондерами и не отвечающими (рис.4a, b справа), но желудочно-кишечные симптомы, включая боль в животе, после FMT, оцененного с помощью HAM-A, были значительно улучшены у респондентов, а не у пациентов, не ответивших (рис. 4c; онлайн-приложение, рис. 3a). Мы также проанализировали изменения численности актинобактерий у каждого пациента на исходном уровне и через 4 недели после FMT. Эффективные пациенты были определены как пациенты, достигшие улучшения симптомов со стороны желудочно-кишечного тракта, но нет значимой корреляции между изменениями численности актинобактерий и улучшением желудочно-кишечных симптомов после FMT (онлайн-приложение.Рис. 3б).
Рис. 4
Анализ психологического статуса пациентов и абдоминальных симптомов. — баллов по шкале HAM-D у пациентов на исходном уровне и через 4 и 12 недель после FMT у 8 пациентов: слева: у респондентов ( n, = 5) и справа: у пациентов, не ответивших ( n = 3). b Оценка пациентов по шкале HAM-A на исходном уровне и через 4 и 12 недель после FMT у 8 пациентов: слева: респонденты ( n, = 5) и справа: не отвечающие ( n = 3). c Желудочно-кишечные симптомы, оцененные в HAM-A пациентов в начале исследования и через 12 недель после FMT у 8 пациентов: слева: респонденты ( n = 5) и справа: не ответившие ( n = 3).
Эти результаты предполагают, что FMT оказывает терапевтический эффект на психиатрический статус пациентов с СРК независимо от наличия или отсутствия аномалий стула, но эффект может не сохраняться в течение 12 недель.
Обсуждение
Это открытое пилотное исследование продемонстрировало, что FMT для пациентов с IBS был безопасным и относительно эффективным; 6 из 10 пациентов вернулись к 3-4 типу стула через 4 недели после FMT. Метагеномный анализ в этом исследовании показал, что (1) снижение разнообразия микробиоты у пациентов до FMT было восстановлено до уровня донора после FMT, и (2) эффективность FMT явно зависела от статуса увеличенного количества актинобактерий phylum (особенно рода Bifidobacterium ) в донорских фекалиях, но не при изменении состава микробиоты пациента до или после FMT.Неожиданно мы также обнаружили, что FMT значительно улучшил психологический статус после FMT независимо от респондентов IBS и не отвечающих.
Это первое исследование, посвященное анализу состава кишечной микробиоты у доноров и пациентов и изменения состава микробиоты до и после FMT у пациентов с СРК. Число включенных в исследование пациентов было небольшим, но достаточным для первого зарегистрированного испытания, чтобы оценить эффективность FMT в дополнение к профилю безопасности у пациентов с СРК.
В этом исследовании мы попытались расширить применение FMT для лечения трудноизлечимых кишечных заболеваний. Результаты 2 РКИ у пациентов с язвенным колитом были противоречивыми [25,26]. В одном положительном РКИ исследователи использовали фекалии одного конкретного здорового человека после того, как они заметили, что фекалии конкретного донора были эффективны в продолжающемся исследовании, предлагая концепцию «супердонора» для успешного FMT. Точно так же в этом исследовании мы обнаружили, что одним из положительных предикторов эффективности FMT для пациентов с СРК был фактор донора; специфические доноры, содержащие большое количество рода Bifidobacterium , были эффективны для пациентов с СРК.Это говорит о том, что FMT с использованием специфических донорских фекалий, богатых родом Bifidobacterium , может стимулировать микробиоту пациента к восстановлению после снижения разнообразия до уровня микробиоты донора. Хотя необходимы дальнейшие исследования, эти данные показывают, что выбор донорских фекалий является решающим фактором успеха FMT. Недавнее исследование показало, что стимуляция, но не замена микробиоты реципиента донорскими фекалиями важна как терапевтический механизм FMT [27]. Взятые вместе с результатами нашего текущего исследования, фекальная микробиота «стимуляция» микробиоты реципиента донорскими фекалиями, но не фекальная микробиота «трансплантация» донорских фекалий, кажется подходящим термином для протоколов переноса фекальной микробиоты, которые используются в настоящее время.
Помимо кишечных заболеваний, недавние исследования показали, что микробиота кишечника у пациентов с некоторыми внекишечными расстройствами отличается от таковой у здоровых людей. Одно плацебо-контролируемое РКИ FMT у пациентов с метаболическим синдромом показало, что чувствительность к инсулину значительно повышалась после FMT [28]. Более того, другая группа провела пилотное исследование FMT у 4 пациентов с острой реакцией «трансплантат против хозяина», получавших трансплантацию костного мозга [29]. Предыдущие исследования показали, что изменения кишечной микробиоты меняют психиатрический статус пациентов [30], а модуляция взаимосвязи между стрессом и составом кишечной микробиоты изменяет функции мозга [31].Недавнее исследование показало, что количество Bifidobacterium в микробиоте кишечника пациентов с большим депрессивным расстройством было значительно ниже, чем у здоровых добровольцев [32]. Было проведено рандомизированное контролируемое исследование влияния пробиотиков на нейрофизиологические параметры пациентов с расстройствами аутистического спектра [33]. Также были сообщения о некоторых случаях FMT при нейрогенных расстройствах [34]. Наши результаты показали, что FMT для пациентов с СРК может улучшить их психический статус.Предыдущее исследование показало, что пациенты с СРК с преобладанием диареи и депрессией имели аналогичные изменения в фекальной микробиоте. Вместе с нашим исследованием эти результаты показывают, что FMT может быть эффективным для пациентов с депрессией. Более того, короткоцепочечные фруктоолигосахариды значительно снижали показатели тревожности и увеличивали фекальные Bifidobacterium [35]. Мы показали, что количество Bifidobacterium имеет тенденцию к увеличению после FMT у респондеров. Кроме того, улучшение формы стула у пациентов с СРК было связано с увеличением уровня Bifidobacterium .Мы также показали, что снижение разнообразия микробиоты у пациентов до FMT восстановилось до уровня донора после FMT. Эти данные предполагают, что донорские фекалии, богатые Bifidobacterium , могут стимулировать рост минорных штаммов в микробиоте пациентов, которые не были обнаружены до FMT, чтобы увеличить их разнообразие после FMT.
Помимо анализа абдоминальных симптомов, мы оценивали психиатрический статус пациентов. Удивительно, но оценка HAM-D снизилась у 7 из 8 пациентов через 4 недели после FMT, независимо от того, ответили ли они на FMT.Это указывало на то, что улучшение клинических симптомов у пациентов с СРК было вызвано не эффектом плацебо, а изменением кишечной микробиоты. Терапевтический эффект FMT на пациентов с психологическими расстройствами сохранялся в течение ограниченного времени, до 4 недель после FMT, а численность Bifidobacterium имела тенденцию к снижению с 4 до 12 недель после FMT (онлайн-приложение, рис. 2c). Этот результат показал, что улучшение абдоминальных симптомов у пациентов с СРК зависело от микробных изменений кишечника, вызванных FMT.
В заключение, это исследование продемонстрировало, что FMT может улучшить форму стула и подавленное настроение и / или тревогу за счет изменений кишечной микробиоты. Примечательно, что донорские фекалии, богатые Bifidobacterium , могут стимулировать рост незначительных штаммов микробиоты пациента, которые не были обнаружены до FMT, чтобы увеличить их разнообразие после FMT. Хотя требуются крупномасштабные РКИ, текущее исследование подчеркивает потенциал FMT как терапевтического варианта для пациентов с СРК, а также с психическими расстройствами, такими как серьезные депрессивные расстройства и тревожные расстройства.
Благодарности
Авторы благодарят К. Хирата, Х. Киёхара, Т. Ямане и К. Мори (Университет Кейо) за техническую помощь. Авторы также благодарят K. Nanki, Y. Nakazato, H. Ogata и Y. Iwao (Университет Кэйо) за полезные обсуждения и K. Matsuoka (Tokyo Medical and Dental University) за установление процедуры FMT.
Заявление о раскрытии информации
Все авторы заявляют об отсутствии конфликта интересов.
Финансирование
Это исследование было частично поддержано грантами на исследования в области здравоохранения и науки о труде для исследований трудноизлечимых заболеваний от Министерства здравоохранения Японии (T.K.), грант на научные исследования C (25460301, TM), Takeda Science Foundation (SM), Keio Gijuku Academic Development Funds (TM) и грант Университета Кейо для поощрения молодых ученых-медиков (СМ).
Список литературы
- Gralnek IM, Hays RD, Kilbourne A, Naliboff B, Mayer EA: Влияние синдрома раздраженного кишечника на качество жизни, связанное со здоровьем.Гастроэнтерология 2000; 119: 654-660.
- Simren M, Svedlund J, Posserud I., Bjornsson ES, Abrahamsson H: Связанное со здоровьем качество жизни пациентов, посещающих амбулаторную гастроэнтерологическую клинику: функциональные расстройства по сравнению с органическими заболеваниями. Clin Gastroenterol Hepatol 2006; 4: 187-195.
- Kassinen A, Krogius-Kurikka L, Makivuokko H, Rinttila T., Paulin L, Corander J, Malinen E, Apajalahti J, Palva A: Микробиота кала пациентов с синдромом раздраженного кишечника значительно отличается от таковой у здоровых людей. Гастроэнтерология 2007; 133: 24-33.
- Krogius-Kurikka L, Lyra A, Malinen E, Aarnikunnas J, Tuimala J, Paulin L, Makivuokko H, Kajander K, Palva A: Анализ микробного сообщества выявляет филогенетические изменения высокого уровня в общей микробиоте желудочно-кишечного тракта при синдроме раздраженного кишечника с преобладанием диареи .БМК Гастроэнтерол 2009; 9: 95.
- Барбара Дж., Фейнл-Биссет С., Гошаль UC, Куигли Е.М., Сантос Дж., Ваннер С., Верньолле Н., Зоетендал Е.Г.: Микроокружение кишечника и функциональные желудочно-кишечные расстройства. Гастроэнтерология 2016; пии: S0016-5085 (16) 00219-5.
- Симрен М., Барбара Дж., Флинт Х. Дж., Шпигель Б. М., Спиллер Р. К., Ваннер С., Верду Э. Ф., Уорвелл П. Дж., Зоэтендал Э. Г.; Комитет Римского фонда: Кишечная микробиота при функциональных расстройствах кишечника: доклад Римского фонда.Кишечник 2013; 62: 159-176.
- Mayer EA, Savidge T, Shulman RJ: Взаимодействие микробиома мозга и кишечника и функциональные расстройства кишечника. Гастроэнтерология 2014; 146: 1500-1512.
- Mayer EA, Tillisch K, Gupta A: Ось кишечника / мозга и микробиота.Дж. Клин Инвест, 2015; 125: 926-938.
- Hungin AP, Becher A, Cayley B, Heidelbaugh JJ, Muris JW, Rubin G, Seifert B, Russell A, De Wit NJ: Синдром раздраженного кишечника: интегрированная объяснительная модель для клинической практики. Нейрогастроэнтерол Мотил 2015; 27: 750-763.
- O’Mahony L, McCarthy J, Kelly P, Hurley G, Luo F, Chen K, O’Sullivan GC, Kiely B, Collins JK, Shanahan F, Quigley EM: Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и отношение к цитокиновым профилям.Гастроэнтерология 2005; 128: 541-551.
- Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG: Диета с низким содержанием FODMAP снижает симптомы синдрома раздраженного кишечника. Гастроэнтерология 2014; 146: 67-75.e5.
- Tuck CJ, Muir JG, Barrett JS, Gibson PR: Ферментируемые олигосахариды, дисахариды, моносахариды и полиолы: роль в синдроме раздраженного кишечника.Эксперт Rev Gastroenterol Hepatol 2014; 8: 819-834.
- McIntosh K, Reed DE, Schneider T, Dang F, Keshteli AH, De Palma G, Madsen K, Bercik P, Vanner S: FODMAP меняют симптомы и метаболом пациентов с СРК: рандомизированное контролируемое исследование. Gut 2016; pii: gutjnl-2015-311339.
- van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, Visser CE, Kuijper EJ, Bartelsman JF, Tijssen JG, Speelman P, Dijkgraaf MG, Keller JJ: Дуоденальная инфузия донорских фекалий при рецидиве Clost difficile . N Engl J Med 2013; 368: 407-415.
- Seekatz AM, Aas J, Gessert CE, Rubin TA, Saman DM, Bakken JS, Young VB: Восстановление микробиома кишечника после трансплантации фекальной микробиоты. MBio 2014; 5: e00893-e00894.
- Пинн Д.М., Арониадис О.К., Брандт Л.Дж.: Является ли трансплантация фекальной микробиоты ответом на синдром раздраженного кишечника? Единый центр опыта.Am J Gastroenterol 2014; 109: 1831-1832.
- Нисидзима С., Суда В., Осима К., Ким С. В., Хиросе Й, Морита Х, Хаттори М.: Кишечный микробиом здорового японца и его микробная и функциональная уникальность. ДНК Res 2016; 23: 125-133.
- Mizuno S, Nanki K, Matsuoka K, Saigusa K, Ono K, Arai M, Sugimoto S, Kiyohara H, Nakashima M, Takeshita K, Naganuma M, Suda W, Hattori M, Kanai T. Одна трансплантация фекальной микробиоты не смогла изменить кишечник микробиота и имела ограниченную эффективность против язвенного колита у японских пациентов.Intest Res 2017; 15: 68-74.
- Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC: Функциональные расстройства кишечника. Гастроэнтерология 2006; 130: 1480-1491.
- Мацуока К., Мидзуно С., Хаяси А., Хисамацу Т., Наганума М., Канаи Т.: Трансплантация фекальной микробиоты при желудочно-кишечных заболеваниях.Кейо Дж. Мед 2014; 63: 69-74.
- Льюис С.Дж., Хитон К.В.: Шкала формы стула как полезный показатель времени прохождения через кишечник. Scand J Gastroenterol 1997; 32: 920-924.
- Гамильтон М: Оценка тревожных состояний по рейтингу.Br J Med Psychol 1959; 32: 50-55.
- Гамильтон М: шкала оценки депрессии. J. Neurol Neurosurg Psychiatry 1960; 23: 56-62.
- Lackner JM, Gudleski GD, Thakur ER, Stewart TJ, Iacobucci GJ, Spiegel BM: Влияние физических жалоб, социальной среды и психологического функционирования на восприятие здоровья пациентов с СРК: не ограничиваясь тяжестью желудочно-кишечных симптомов.Am J Gastroenterol 2014; 109: 224-233.
- Moayyedi P, Surette MG, Kim PT, Libertucci J, Wolfe M, Onischi C, Armstrong D, Marshall JK, Kassam Z, Reinisch W., Lee CH: Трансплантация фекальной микробиоты вызывает ремиссию у пациентов с активным язвенным колитом в рандомизированном контролируемом исследовании.Гастроэнтерология 2015; 149: 102-109.e6.
- Россен Н.Г., Фуэнтес С., ван дер Спек М.Дж., Тейссен Дж.Г., Хартман Дж. Х., Дюфлоу А., Ловенберг М., ван ден Бринк Г.Р., Матус-Флиген Е.М., де Вос В.М., Зоетендал Е.Г., Д’Хаенс Г.Р., Понсиоэн К.Ю.: выводы из рандомизированное контролируемое исследование трансплантации фекалий пациентам с язвенным колитом.Гастроэнтерология 2015; 149: 110-118.e4.
- Ли С.С., Чжу А., Бенеш В., Костя П.И., Херцог Р., Хильдебранд Ф., Уэрта-Сепас Дж., Ньивдорп М., Салоярви Дж., Фойгт А.Ю., Зеллер Г., Сунагава С., де Вос В.М., Борк П.: Долговременное сосуществование донора и штаммы-реципиенты после трансплантации фекальной микробиоты.Наука 2016; 352: 586-589.
- Вризе А., де Гроот П.Ф., Кутте Р.С., Кнаапен М., ван Нуд Э., Ньивдорп М.: Трансплантация фекалий: безопасная и устойчивая клиническая терапия для восстановления баланса кишечных микробов при заболеваниях человека? Лучшая практика Res Clin Gastroenterol 2013; 27: 127-137.
- Kakihana K, Fujioka Y, Suda W, Najima Y, Kuwata G, Sasajima S, Mimura I, Morita H, Sugiyama D, Nishikawa H, Hattori M, Hino Y, Ikegawa S, Yamamoto K, Toya T, Doki N, Koizumi K , Honda K, Ohashi K: Трансплантация фекальной микробиоты для пациентов с устойчивой к стероидам острой болезнью кишечника «трансплантат против хозяина».Кровь 2016; 128: 2083-2088.
- Mangiola F, Ianiro G, Franceschi F, Fagiuoli S, Gasbarrini G, Gasbarrini A: Кишечная микробиота при аутизме и расстройствах настроения. Всемирный журнал J Gastroenterol 2016; 22: 361-368.
- Wong ML, Inserra A, Lewis MD, Mastronardi CA, Leong L, Choo J, Kentish S, Xie P, Morrison M, Wesselingh SL, Rogers GB, Licinio J: Передача сигналов инфламмасомы влияет на поведение, подобное тревожному и депрессивному, и состав кишечного микробиома. .Мол Психиатрия 2016; 21: 797-805.
- Aizawa E, Tsuji H, Asahara T, Takahashi T, Teraishi T, Yoshida S, Ota M, Koga N, Hattori K, Kunugi H: возможная ассоциация Bifidobacterium и Lactobacillus в микробиоте кишечника пациентов с большим депрессивным расстройством.J Влияет на Disord 2016; 202: 254-257.
- Santocchi E, Guiducci L, Fulceri F, Billeci L, Buzzigoli E, Apicella F, Calderoni S, Grossi E, Morales MA, Muratori F: Взаимодействие кишечника с мозгом при расстройствах аутистического спектра: рандомизированное контролируемое исследование роли пробиотиков в клинических условиях. , биохимические и нейрофизиологические параметры.BMC Psychiatry 2016; 16: 183.
- Xu MQ, Cao HL, Wang WQ, Wang S, Cao XC, Yan F, Wang BM: Трансплантация фекальной микробиоты, выходящая за рамки кишечных расстройств. Мировой журнал J Gastroenterol 2015; 21: 102-111.
- Azpiroz F, Dubray C, Bernalier-Donadille A, Cardot JM, Accarino A, Serra J, Wagner A, Respondek F, Dapoigny M: Влияние scFOS на состав фекальной микробиоты и беспокойство у пациентов с синдромом раздраженного кишечника: рандомизированный, двойное слепое плацебо-контролируемое исследование.Neurogastroenterol Motil 2017;29.
Author Contacts
Takanori Kanai, MD, PhD
Division of Gastroenterology and Hepatology
School of Medicine, Keio University
35 Shinanomachi, Shinjuku-ku, Tokyo 160-8582 (Japan)
E-Mail [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 9 февраля 2017 г.
Принята к публикации: 21 марта 2017 г.
Опубликована онлайн: 21 июня 2017 г.
Дата выпуска: август 2017 г.
Количество страниц для печати: 10
Количество рисунков: 4
Количество столов: 1
ISSN: 0012-2823 (печать)
eISSN: 1421-9867 (онлайн)
Для дополнительной информации: https: // www.karger.com/DIG
Лицензия открытого доступа / Дозировка лекарства / Отказ от ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарственного средства: авторы и издатель приложили все усилия для обеспечения того, чтобы выбор и дозировка лекарств, указанные в этом тексте, соответствовали текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным средством является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
B. infantis снижает воспаление кишечника у младенцев
(SACRAMENTO)В недавнем исследовании, опубликованном в Pediatric Research , исследователи продемонстрировали, что колонизация младенцев особым штаммом пробиотических бактерий — B.infantis EVC001 — уменьшает воспаление кишечника до 55 раз по сравнению с младенцами, получающими только грудное молоко. Марк Андервуд, профессор педиатрии и заведующий отделением неонатологии Детской больницы Калифорнийского университета в Дэвисе
Предыдущие исследования показали, что Bifidobacterium longum infantis (B. infantis), штамм бактерий, естественным образом обитающих в кишечнике младенцев, почти уничтожен у младенцев, рожденных в промышленно развитые страны. Считается, что такое резкое снижение заболеваемости B. infantis связано с современными методами здравоохранения, такими как увеличение использования антибиотиков, кормление смесью и родоразрешение.
Исследователи предполагают, что недостаток B. infantis в кишечнике может быть причиной недавнего роста аутоиммунных заболеваний.
«Если отсутствие B. infantis сыграло роль в росте заболеваний, связанных с воспалением, повторное введение его в раннем возрасте могло бы значительно снизить частоту возникновения некоторых из этих состояний», — сказал Марк Андервуд, соавтор исследования, и профессор педиатрии и заведующий отделением неонатологии детской больницы Калифорнийского университета в Дэвисе.
B. infantis и воспаление кишечника
В ходе исследования было изучено 37 семейств бактерий, обычно встречающихся в кишечнике младенцев, включая семейства, содержащие штаммы бактерий, продаваемые в качестве пищевых добавок. Bifidobacteriaceae были единственным семейством кишечных бактерий, которое, как было обнаружено, коррелировало со значительным снижением ключевых маркеров воспаления.
Медицинские работники ищут признаки воспаления кишечника, измеряя ключевые маркеры, такие как цитокины, кальпротектин и эндотоксин.Исследование показало, что младенцы, получавшие B. infantis EVC001, вырабатывали значительно более низкие уровни этих трех маркеров по сравнению с младенцами в контрольной группе.
Младенцы, колонизированные B. infantis EVC001, показали значительное снижение провоспалительных цитокинов — пептидов, связанных с повышенной кишечной проницаемостью, состоянием, которое может влиять на развитие диабета 1 типа.
Младенцы с низким содержанием Bifidobacterium показали уровни калпротектина — белка, выделяемого при воспалении кишечника — аналогично тем, которые, как было показано, вызывают вдвое больший риск астмы и атопического дерматита у доношенных детей.

 К этой группе препаратов относят Бифилиз, Кипацид.
К этой группе препаратов относят Бифилиз, Кипацид.