Вульвит у детей причины и решения
27.06.2019
Вульвит, или воспалительный процесс вульвы, — частое гинекологическое заболевание у девочек с 1 года до 8 лет.
Причин для развития вульвита много. Существуют инфекционные (бактериальные, вирусные), а так же не инфекционные (в следствие энтеробиоза, инородного тела влагалища и др.) причины.
Но наиболее частой причиной вульвита являются
- обменные нарушения в организме ребенка,
- острые вирусные инфекции,
- аллергия,
- дисбактериоз кишечника,
- заболевания мочевыводящих путей,
- различные острые детские инфекции.
В 85% случаев — вульвит в дошкольном возрасте — вторичный процесс, являющийся следствием фоновых заболеваний.
В настоящее время пищевая аллергия все чаще проявляет себя на половых органах. Поэтому есть риск, что у девочки разовьется аллергодерматоз вульвы.
В развитии и поддержании воспалительного процесса предрасполагающими факторами являются
- анатомические особенности,
- аномалии развития наружных гениталий
- и физиологические особенности девочек в этом возрасте.
Местные иммунные механизмы защиты у девочек в данный период развития находятся только в состоянии функционального становления, и роль их минимальна. А частые и хронические заболевания у ребенка снижают местный иммунитет и в результате нарушается нормальное функционирование микробиоценоза влагалища.
Основные жалобы девочек — зуд и (или) жжение наружных половых органов, дискомфорт при подмывание… а их мамы могут заметить покраснение и (или) выделения в области вульвы , либо на трусиках девочки.
Успешное лечение воспалительных заболеваний половых органов во многом зависит от
- полноценности лабораторной диагностики,
- комплексного обследования ребенка специалистами,
- правильной оценки клинической диагностики вульвита детским гинекологом.

Профилактикой нарушений репродуктивного здоровья девочки заключается в состоянии ее общефизического здоровья.
Обязательно нужно
- соблюдать правила личной гигиены,
- следить за поддержанием иммунитета,
- ограничивать ребенка от неправильного питания,
- своевременно санировать очаги хронической инфекции (особенно тонзиллиты, циститы, заболевания верхних дыхательных путей).
А своевременная санация вульвы и влагалища, правильно подобранное антибактериальное лечение детским гинекологом в период острого течения заболевания, будет препятствовать переходу в хроническое течение вульвита
Материал подготовлен на основании диссертационной работы «клиника, диагностика и лечение гинекологической патологии у девочек с инфекцией мочевой системы», к.м.н, Силенко О. Н.
Н.
Возврат к списку
Кесарево сечение приводит к тому, что новорожденный не получает материнских бактерий, из-за чего у ребенка развивается аллергия
У детей, появившихся на свет с помощью кесарева сечения, в первые два года жизни меньше полезных бактерий в кишечнике, чем у тех, кто был рожден через родовые пути матери.
Ученые выявили связь между аллергией у детей раннего возраста, микрофлорой их кишечника и способом, которым они появились на свет. До сих пор все предположения о влиянии кесарева сечения на здоровье новорожденных не имели под собой достаточно оснований.
Специалисты из Швеции проанализировали кишечную микрофлору 24 младенцев. Девять из этих детей родились с помощью кесарева сечения, пятнадцать – традиционным способом.
Результаты исследования показали, что у детей, родившихся с помощью кесарева сечения, в кишечнике не хватало представителей одной из основных групп кишечных бактерий, Bacteroidetes, которые присутствовали у всех рожденных через родовые пути.
Кроме того, у некоторых из этих младенцев бактерии группы Bacteroidetes так и не заселяли кишечник вплоть до 12-месячного возраста, пишут Андерс Андерсон из Королевского института науки и техники в Стокгольме и Мария Дженмалм из Университета Линчепинг
Исследователи также отмечают, что в целом спектр микрофлоры, ее разнообразие у «кесарят» заметно беднее. У младенцев, рожденных естественным путем, бактериальный состав кишечника обычно сходен с материнским. У тех, кто появился на свет в результате кесарева сечения, состав бактерий заметно отличается от материнского.
Недостаток полезных кишечных бактерий сказывается и на развитии иммунитета.
Бактерии группы Bacteroidetes важны для формирования способности иммунной системы адекватно реагировать на сигналы, приводящие ее в действие. Когда иммунная система чрезмерно активна из-за отсутствия нужных бактерий в кишечнике, это может привести к аллергии, диабету и воспалительным заболеваниям желудочно-кишечного тракта.
В образцах крови младенцев через шесть, двенадцать и двадцать четыре месяца после рождения определяли Th2- и Th3-ассоциированные хемокины. Хемокины — это низкомолекулярные белки, контролирующие миграцию клеток иммунной системы в организме. Th2 и Th3 – разновидности лимфоцитов, называемых Т-хелперами . Высокий уровень Th3 -ассоциированных хемокинов способствует развитию аллергии, а Th2-хемокинов, наоборот, ликвидации ее последствий.
Хемокины — это низкомолекулярные белки, контролирующие миграцию клеток иммунной системы в организме. Th2 и Th3 – разновидности лимфоцитов, называемых Т-хелперами . Высокий уровень Th3 -ассоциированных хемокинов способствует развитию аллергии, а Th2-хемокинов, наоборот, ликвидации ее последствий.
В более ранних исследованиях уже находили связь между кесаревым сечением и аллергией у детей. Теперь становится ясна ее причина.
Кишечные бактерии составляют в ней промежуточное звено.
Возможно, предполагают авторы работы, если найти способ передать новорожденному фетальные и вагинальные бактерии, которые могли бы заселить его организм в случае рождения естественным путем, удалось бы нормализовать его микрофлору и избежать развития аллергии. По мнению шведских ученых, дальнейшие усилия следует направить на изучение данной возможности.
А пока такого способа не нашли, специалисты считают, что для того, чтобы нормализовать кишечную микрофлору, дети, рожденные с помощью кесарева сечения, нуждаются в специальных пробиотиках.
Анализы в детском медцентре «АпрельКа»
Мария Якимова

Делали ребенку пластику уздечки языка под общим наркозом, сильно переживали, но все прошло хорошо, клиника у вас хорошая нам понравилось. Хочу поблагодарить Логинову Александру Геннадьевну и анестезиолога Свириденко Дмитрия Владимировича, всего им хорошего и самого доброго)).
Юлия Федорова
Замечательный центр, очень вежливый и внимательный персонал. Лечили этим летом зубы ребёнку у доктора Крюковой.
Замечательный центр, очень вежливый и внимательный персонал. Лечили этим летом зубы ребёнку у доктора Крюковой. Замечательный доктор, кстати, собираемся к вам на следующей неделе)).
Лечили этим летом зубы ребёнку у доктора Крюковой. Замечательный доктор, кстати, собираемся к вам на следующей неделе)).
Елена Кружко
Хочу выразить огромную благодарность терапевту-стоматологу детскому Крюковой Александре Олеговне!!!
Хочу выразить огромную благодарность терапевту-стоматологу детскому Крюковой Александре Олеговне!!! Посетили медицинский центр «Апрель» 16.06.2016 на осмотр близняшкам и 20.06.2016 уже на лечение старшей дочери. Очень качественное обслуживание, внимательное отношение и грамотные детальные рекомендации. Мы нашли врача нашим трем детям!!!
Очень качественное обслуживание, внимательное отношение и грамотные детальные рекомендации. Мы нашли врача нашим трем детям!!!
Для проверки состояния здоровья ребенка вы можете сдать его комплексные анализы в диагностическом центре:
- Ежегодное профилактическое обследование
- Биохимический анализ крови
- Гемостазиограмма
- Перед операцией
- Обследование печени, почек, щитовидной железы
- Профилактика заболеваний сердца, сосудов
- Диагностика анемий
- Онкориск — женский, мужской
- Ревматологический
- Для госпитализации
- Здоровый ребенок (для детей от 0 до 14 лет)
- Анализы для детского сада, школы
- Анализы крови на определение аллергии
Рекомендации перед сдачей анализа мочи
- Для анализа собирается первая утренняя моча, в количестве не менее 50мл.

- Данный анализ необходимо приносить в стерильном контейнере, который вы можете получить в регистратуре нашего медицинского центра или приобрести в аптеке.
- Перед сбором мочи проводится тщательный гигиенический туалет наружных половых органов, с целью получения более точного результата.
- Накануне не включайте в рацион ребенка овощи и фрукты, имеющие ярко выраженный цвет, а также от соленые и кислые продукты, так как это может повлиять на результаты исследования.
Рекомендации перед сдачей анализа крови
- Все анализы крови необходимо сдавать строго натощак, т.е. период между последним приемом пищи и сдачей крови должен составлять не менее 8 часов.
- За несколько дней до исследования нужно исключить из рациона жареные и жирные продукты.
- Так как в нашем медицинском центре кровь на анализы берется только из вены, что позволяет провести более точную диагностику, то необходимо исключить факторы, которые могут повлиять на результаты исследований.
 Такие, как эмоциональное возбуждение и физическое напряжение.
Такие, как эмоциональное возбуждение и физическое напряжение.
Рекомендации перед сдачей анализа на энтеробиоз
- На кануне сбора биоматериала не проводится туалет кожных покровов в области ягодиц и ануса.
Рекомендации перед сдачей анализа анализ кала на яйца гельминтов
- Специфической подготовки не требуется.
Анализы крови на гормоны в Калининграде
Контролировать свой гормональный фон желательно каждому человеку еще того, как начались какие-либо проблемы со здоровьем. А при ряде заболеваний без этих исследований просто не обойтись.
В диагностическом отделении нашей клиники вы также можете сдать анализы на гормоны: надпочечников, половых желез, щитовидной железы и гипофиза.
Цены на анализы в нашей клинике вы можете узнать в разделе «Прейскурант на услуги».
Данные медицинские услуги вы можете получить в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи в медицинских учреждениях по месту жительства или месту пребывания.
Дисбактериоз. Причины. Диагностика. Лечение. | Клиника Здоровья
Под дисбактериозом понимают количественное и качественное видоизменение состава натуральной микрофлоры кишечника, с сопровождением излишнего прироста патогенной микрофлоры в просвете кишечника.
Подобные нарушения бактериальных и микробных связей сопровождаются зачастую обменными, иммунными и пищеварительными расстройствами. Дисбактериоз по сути сложно назвать отдельной, самостоятельной болезнью, потому как зачастую он выказывается следствием прочих недомоганий.
Причины появления болезни
Независимо от формы, степени протекания и вида заболевания, дисбактериоз, как и любое недомогание возникает из-за ряда оснований.
Существенные причины дисбактериоза, это:
- Стресс, раздражение, психоэмоциональное перенапряжение.

-
Усталость.
-
Аномалии или срывы функционирования пищеварительных органов.
-
Нарушение сна.
-
Некорректное, бессистемное питание, перекусы и злоупотребление алкоголем.
-
Депрессионное состояние.
-
Длительный прием врачебных препаратов, в том числе гормонов, антибиотиков, психотропных, слабительных и т. д.
-
Иммунодефицит.
-
Любые инфекционные недуги разной этимологии.
-
Чрезмерные физические нагрузки.
-
Болезни органов пищеварения.
-
Аллергические недомогания.
Возможно, на более запущенных стадиях, болезнь может протекать с образованием на кожном покрове прыщей и анемией.
Стоит отметить, что болезнь достаточно часто встречается и у детей, даже грудничков. При этом у последних ее появление связывают с недоношенностью, ранним искусственным вскармливанием, наличием внутриутробных инфекций, а также кормлением неподходящими смесями.
Симптомы дисбактериоза
По сути дисбактериозе характеризуется определенными указывающими на заболевание симптомами, потому как они могут быть различной выраженности, проявлении и зависеть от условий жизни, иммунитета, развития, возраста и прочих характеристик. Его можно спутать с любым из гастроэнтерологических хворей, потому как больных беспокоит:
- Нарушения стула: понос, запор, с образованием пены, изменением запаха и цвета.
- Повышенное образование газов.
- Дискомфортные ощущения в области заднего прохода, жжение.
- Вздутие живота, сопровождающееся болями разной локализации.
- Аллергические сыпи, образование шелушений, появление трещин на губах, «заедов» и прочих признаков нехватки минералов и витаминов.

- Быстрая утомляемость.
У некоторых больных заболевание проявляется исключительно при выявлении результатов клинических или бактериологических исследований.
Диагностика дисбактериоза
Естественно, на сегодняшний день существует множество современных методологий, которые могут подтвердить дисбактериоз. К самому востребованному среди медперсонала относят такое бактериологическое исследование, как посев кала на дисбактериоз. Однако, данная методика, которая,кстати, отличается немалой стоимостью, имеет некоторые недостатки, в том числе длительность получения результата.
Помимо посевов диагностика дисбактериоза включает в себя следующие клинические методики выявления болезни:
- копрограмму;
-
хроматографию кала, крови, тонкокишечной жидкости;
-
биохимию кала;
-
водородный, дыхательный тесты, тест с С-14-гликохолатом, а также с С-14-D-ксилозой;
-
определение количества индола и в моче;
-
ПЦР или молекулярное тестирование.

Лечение дисбактериоза
Важно отметить, что, так как дисбактериоз является зачастую следствием определенного недуга, медики в первую очередь направляют лечебные мероприятия на стержневое заболевание, которое повлияло на видоизменения микробного фона. В противной ситуации, это чревато сменой симптомов, кратковременным улучшением и дальнейшим протеканием болезни в скрытой форме.
Также врачи производят корректировку существующих нарушений микрофлоры кишечника, для чего проводят эффективные и доступные методики:
Лечение дисбактериоза непременно должно сопровождаться комплексным подходом, наличием схемы лечения.
Почему же наши гастроэнтерологи лучше других?
-
Знания и опыт врачей нашей клиники позволяют добиться поразительных успехов в лечении гастроэнтерологических заболеваний.
-
В Клинике Здоровья самое современное диагностическое оборудование, которое позволяет поставить точный диагноз и начать лечение.

-
Расположение в самом центре Москвы, в шаговой доступности от двух станций метро.
-
Привлекательные цены
-
Удобное время для посещения врача.
Мы работаем для того, что бы вы были здоровы.
Запись на приём по телефону: +7(495) 961-27-67
Дисбактериоз у ребенка: стоит ли его лечить
Лидия Бабич
педиатр-неонатолог
Дисбактериоз — один из самых популярных диагнозов в педиатрии. Особенно часто этот диагноз ставится в небольших поликлиниках небольших городов.
Burda Media
Наш консультант, педиатр Лидия Бабич, отвечая на вопрос нашей читательницы, утверждает, что лечение дисбактериоза с позиций доказательной медицины не находит своего подтверждения.
ЧИТАЙТЕ ТАКЖЕ: Воспитание детей: какие фразы подрывают веру ребенка в себя и приводят к неврозу
«У нашего ребенка 2–3 раза в неделю случается зеленоватый стул. Это дисбактериоз? И нам нужно как можно скорее сдать посев и начать лечение?» — такой вопрос пришел в нашу редакцию. Ответ на него дает педиатр Лидия Бабич.
Это дисбактериоз? И нам нужно как можно скорее сдать посев и начать лечение?» — такой вопрос пришел в нашу редакцию. Ответ на него дает педиатр Лидия Бабич.
Лечение дисбактериоза с некоторых пор приобрело большую популярность. Но я должна разочаровать вас: информативность таких посевов стремится к нулю. Да и целесообразность лечения дисбактериоза с позиций доказательной медицины не подтверждается. Советую вам не тревожиться понапрасну по поводу стула малютки: у младенцев, находящихся на грудном вскармливании, стул может быть очень разным — желтым, оранжевым, зеленоватым. Иногда в кале можно заметить слизь. Частота испражнений тоже может быть очень разной. Для некоторых малышей норма — 3–5 раз в день. Другие детки какают один раз в 2–4 дня. И это тоже — норма!
ЧИТАЙТЕ ТАКЖЕ:
Лечение гриппа и ОРЗ: какие продукты мешают вашему выздоровлению
Детское питание: 5 существенных причин включить в рацион ребенка тыкву
Мнение редакции может не совпадать с мнением автора
статьи.
Использование фото: П.4 ст.21 ЗУ «Об авторских и смежных правах — «Воспроизведение с целью освещения текущих событий средствами фотографии или кинематографии, публичное сообщение или сообщение произведений, увиденных или услышанных во время таких событий, в объеме, оправданном информационной целью.»
как собрать и сдать кал, что показывает расшифровка?
Каждая мамочка волнуется о своих детях, особенно в начале их жизненного пути. Не зря. Покидая утробу матери, новорожденный ребенок сталкивается с совершенно новым и незнакомым миром. В том числе с миром бактерий, вирусов и иных микроорганизмов.
Ребенок, появляясь на свет, впервые встречается с бактериями, поэтому неудивительно, что баланс микрофлоры у детей до года нарушается чаще всего. Заболевание кишечника, связанное с таким отклонением, называется дисбактериозом. Не нужно пугаться, если грудничку назначили сдавать кал для анализа на дисбактериоз, но разобраться в специфике процесса стоит.
Когда назначается исследование кала на дисбактериоз?
Анализ на дисбактериоз – исследование, в процессе которого определяется наличие и количество микроорганизмов в кале младенца. Как правило, в первый год жизни ребенка желудочно-кишечный тракт не справляется со своей функцией в полной мере. Именно поэтому в этот период грудничкам делают анализ на дисбактериоз чаще. Этим объясняются и основные симптомы, при которых назначают исследование:
Как правило, в первый год жизни ребенка желудочно-кишечный тракт не справляется со своей функцией в полной мере. Именно поэтому в этот период грудничкам делают анализ на дисбактериоз чаще. Этим объясняются и основные симптомы, при которых назначают исследование:
- Запоры. Проблемы с дефекацией доставляют хлопоты не только взрослым, но и грудным малюткам, которые переживают это еще труднее.
- Поносы. Жидкий стул является тревожным звоночком. Желательно отправиться на прием к врачу-педиатру. В зависимости от продолжительности состояния, можно определить, вызван понос дисбактериозом или это единичная реакция организма на что-либо.
- Боль в области живота. Боль в животе у малышей — очень распространенный симптом, который, тем не менее, может быть признаком другого, гораздо более серьезного заболевания, например, аппендицита.
- Метеоризм. Излишнее накопление организмом газа — не столько болезненный, сколько неприятный повод отправиться на обследование. Не стоит его игнорировать.
 Чаще всего этот процесс — не самостоятельная болезнь, а реакция на нарушение работы какой-то из систем организма.
Чаще всего этот процесс — не самостоятельная болезнь, а реакция на нарушение работы какой-то из систем организма. - Сыпь. У маленьких деток довольно часто появляется сыпь непонятного происхождения, для выяснения причины которой необходимо обследование. Оно помогает выявить, на какие именно продукты организм малыша так реагирует. По результатам обследования можно составить безопасный рацион питания.
- Ухудшение аппетита. Именно анализ поможет определить, болен ваш малыш или это исключительно свойство его организма — потреблять мало пищи.
- Наличие кровянистых выделений или слизи зеленого цвета в кале.
Лечение антибиотиками также может стать причиной направления на анализ для выявления дисбактериоза. Диагностика поможет отследить результаты терапии.
Как правильно собрать кал для анализа у грудничка?
Точность и эффективность анализа на дисбактериоз во многом определяет правильность сбора биоматериала. Готовиться к сдаче кала начинают за 3-5 дней. Матери не стоит менять рацион свой и ребенка, чтобы результат был достоверным.
Матери не стоит менять рацион свой и ребенка, чтобы результат был достоверным.
Однако следует исключить:
- лекарственные препараты, содержащие железо;
- сорбенты;
- слабительное;
- вещества, оказывающие красящий эффект;
- свечи.
Биоматериал должен быть свежим, иначе некоторые микроорганизмы не сохранятся, и доставлен в течение двух часов после сбора. Если нет возможности немедленно отправиться в лабораторный центр, где проводится исследование, можно сохранить материал в холодильнике, но помните, что долго он храниться не может. Проследите, чтобы в кал не попала моча. Для этого дождитесь опорожнения мочевого пузыря и подмойте грудничка.
Для исследования хватит 5-10 г кала. Поместить его можно в небольшую чистую баночку или специальный контейнер, купленный в аптеке. Если у малыша проблемы с дефекацией или необходимо ускорить процесс, помогает легкий массаж животика круговыми движениями по часовой стрелке. При жидком стуле лучше собрать кал в мочеприемник. Не рекомендуется перед анализом использовать грелки и клизмы.
Не рекомендуется перед анализом использовать грелки и клизмы.
Как проводятся анализы на дисбактериоз?
Анализ проводится лабораторией городской больницы. Также исследование возможно в отдельных лабораториях по направлению врача или личному желанию родителей за отдельную плату.
Сам анализ – это численная оценка содержания микроорганизмов в материале. Разделяют полезную, условно-патогенную и патогенную микрофлору:
- Полезные микроорганизмы. Поддерживают правильную и эффективную работу организма и особенно кишечника. К ним относятся бифидо-, лактобактерии, эшерхии (в порядке убывания количества).
- Условно-патогенные. Не патогенные, но могут ими стать. Стафилококки, энтерококки, грибы рода Кандида, клостридии – потенциальные враги здоровья малыша (рекомендуем прочитать: капли «Кандид»: способ применения и дозировки для новорожденных).
- Патогенные. Проводят свою диверсионную деятельность быстро и часто с успехом, вызывая кишечные заболевания. В листочке с результатами анализов лучше видеть их рядом с цифрой ноль, но врага стоит знать в лицо.
 Сальмонелла, шигелла не должны появляться в фекалиях малыша.
Сальмонелла, шигелла не должны появляться в фекалиях малыша.
Микробиологическое исследование на УПФ проводится следующим образом: кал многократно разводят в специальном растворе, после берут на посев одну десятую миллилитра биоматериала и изучают на скорость развития колоний бактерий. Количество колоний подсчитывают и указывают в специальном бланке результат. Этот бланк взволнованные родители и получают в медицинском учреждении. Исследование ведется около семи дней. Расшифровкой занимается врач-гастроэнтеролог.
Расшифровка результатов
Интересующий листок получен, но, если родители не медики, он больше напомнит китайскую грамоту. Так как для малышей есть свои, индивидуальные нормы, то сравнивать со своей расшифровкой анализа или тем более чужой не только бесполезно, но и вредно. Исключительно для нервов родителей. Чтобы сохранить нервы и время, вы можете изучить нормы содержания микроорганизмов в кишечнике грудных деток и причины отклонения от них.
Нормы для грудничков
В зависимости от выбора медицинского учреждения, могут изменяться некоторые пункты и порядок следования. 8.
8.
Причины изменения количества бактерий
Патогенные бактерии не должны находиться в кале или могут присутствовать в малых количествах. Наличие их указывает на развитие в организме детей до года кишечной инфекции.
Возможен такой результат, когда анализ на дисбактериоз сдавался для уточнения эффективности лечения. В таком случае нельзя говорить об окончательном выздоровлении ребенка: терапию антибиотиками стоит продолжать.Кишечная палочка необходима детскому организму для правильного развития и соблюдения баланса кишечной микрофлоры. При пониженном количестве кишечной палочки, которая является полезным микроорганизмом, нужно подумать о более здоровом и спланированном питании ребенка, если не принимаются антибиотики, которые оказывают негативное влияние.
Повышенный уровень грибов рода Кандида и энтерококков наблюдается при молочнице, или кандидозе. Происходит пролиферация, грибы поражают поверхность анального прохода, при этом малыш испытывает дискомфорт.
Бифидобактерии отвечают за стимуляцию деятельности кишечника и всасывания пищи. Кроме того, бактерии дезактивируют токсичные вещества. Пониженный уровень бифидобактерий свидетельствует о развитии у ребенка дисбактериоза.
Кроме того, бактерии дезактивируют токсичные вещества. Пониженный уровень бифидобактерий свидетельствует о развитии у ребенка дисбактериоза.
Лактобактерии поддерживают защиту организма от аллергенов, провоцирует синтез молочной кислоты и лактазы. Из-за уменьшения количества этих бактерий может развиться аллергия, запоры, недостаток лактазы в организме.
Недостатки анализа на дисбактериоз
Процесс анализа на микрофлору кишечника не идеален и подвергался критике со стороны пациентов и медиков. Основные тезисы дискуссии:
- Сбор материала. Спор связан со сбором и транспортировкой биоматериала к месту сдачи: при неправильном хранении результат неточен из-за разрушения микроорганизмов, что не дает показывать достоверную клиническую картину.
- Высокая стоимость. Исследование имеет довольно высокую цену как для медицинского учреждения, так и для взволнованных родителей, что ограничивает его доступность.
- Неточность передачи. При анализе исследуется кал, который является копией микрофлоры кишечника, то есть, опять же, при расшифровке полной картины можно не увидеть.

- Предвзятость. Касается не отношения людей друг к другу, а микроорганизмов. Природа не вешает ярлыков: полезные бактерии при определенных условиях тоже могут быть причиной заболевания.
 Подробнее »
Подробнее »Поделитесь с друьями!
молочница у новорожденных и грудничков, симптомы и лечение кандидоза кишечника и паха
Появляющаяся молочница вызывает у ребенка много дискомфортных симптомов. Частые обострения заболевания говорят о том, что в детском организме присутствуют признаки выраженного неблагополучия, о котором он сигналит проявлениями кандидоза.
Что это такое?
Кандидозы — это заболевания, которые вызываются грибками. В быту за ними закрепилось название «молочница». Это обусловлено наличием специфических симптомов, которые возникают при кандидозе. Протекает обычно заболевание у маленьких детей по-разному. В большинстве случаев течение болезни проходит в легкой форме. У новорожденных кандидоз развивается более тяжело и сопровождается появлением многочисленных дискомфортных симптомов, сильно ухудшающих самочувствие малыша.
Это обусловлено наличием специфических симптомов, которые возникают при кандидозе. Протекает обычно заболевание у маленьких детей по-разному. В большинстве случаев течение болезни проходит в легкой форме. У новорожденных кандидоз развивается более тяжело и сопровождается появлением многочисленных дискомфортных симптомов, сильно ухудшающих самочувствие малыша.
Виновником заболевания считаются особые виды грибков — Candida. Они могут присутствовать в небольшом количестве и у здорового ребенка. При воздействии различных провоцирующих экзогенных и эндогенных факторов количество кандиды в организме многократно увеличивается. Возросшие грибковые колонии способны поселяться на различных слизистых оболочках. Это и обуславливает многочисленные клинические варианты заболевания с разной локализацией.
Заболевание может встречаться как у девочек, так и у мальчиков. По статистике, случаи кандидоза чаще регистрируются у малышек. Такая особенность обусловлена особенностью строения и физиологии женского организма. В раннем детском возрасте как мальчики, так и девочки заболевают кандидозом одинаково часто. Для устранения неблагоприятных симптомов болезни требуется назначение специального лечения.
По статистике, случаи кандидоза чаще регистрируются у малышек. Такая особенность обусловлена особенностью строения и физиологии женского организма. В раннем детском возрасте как мальчики, так и девочки заболевают кандидозом одинаково часто. Для устранения неблагоприятных симптомов болезни требуется назначение специального лечения.
Причины
В настоящее время существует огромное количество провоцирующих факторов, приводящих к усиленному росту и размножению грибковой флоры. Для каждого возраста характерны свои лидирующие причины, способствующие заболеванию. Активизация роста грибков возможна при любом физиологическом состоянии, сопровождающимся снижением иммунитета.
К наиболее частым причинам заболевания относят:
- Заражение во время проведения родов.
 В этом случае инфицирование ребенка происходит в тот момент, когда он проходит по родовым путям. Если мама больна кандидозом, то малыш часто имеет признаки данной инфекции сразу после рождения. В этой ситуации неблагоприятные симптомы болезни можно обнаружить уже у грудничка.
В этом случае инфицирование ребенка происходит в тот момент, когда он проходит по родовым путям. Если мама больна кандидозом, то малыш часто имеет признаки данной инфекции сразу после рождения. В этой ситуации неблагоприятные симптомы болезни можно обнаружить уже у грудничка. - Непосредственный контакт с матерью. Данная форма заболевания встречается обычно в первые дни после рождения малыша. Если у мамы есть признаки острой формы кандидоза, то она может заразить новорожденного ребенка этим заболеванием. Наиболее подвержены такому виду инфицирования недоношенные малыши.
- Невыполнение правил личной гигиены. Заразиться кандидозом можно при использовании чужих полотенец. Также существуют подтвержденные случаи заболевания после купания в необработанной предварительно дезинфицирующими растворами ванной. Риск заражения у малышей раннего возраста при этом выше, чем у деток постарше.
- Недоношенность. У рожденных раньше положенного срока малышей часто снижены показатели работы иммунной системы.
 Любая инфекция, в том числе и грибковая, легко вызывает у них инфицирование и появление неблагоприятных симптомов.
Любая инфекция, в том числе и грибковая, легко вызывает у них инфицирование и появление неблагоприятных симптомов.
- Заболевания или клинические состояния, протекающие с нарушением углеводного обмена. Сахарный диабет второго типа или алиментарное ожирение способствуют развитию молочницы у малышей. Гликемия или повышенное содержание глюкозы в крови провоцирует активный рост и быстрое размножение грибковой флоры. Хронические нарушения обмена веществ часто способствуют развитию детского кандидоза.
- Слишком длительный прием ряда лекарственных препаратов. К ним относятся: антибактериальные средства, цитостатики и стероидные гормоны. При их длительном приеме нарушается работа иммунной системы. Впоследствии это приводит к развитию у ребенка признаков иммуннодефицитных состояний, способствующих появлению молочницы.
- Частые респираторные инфекции. Ослабленные малыши имеют более низкий иммунитет.
 После тяжелых и частых простуд организм ребенка резко ослабевает. У таких деток, как правило, усиливается рост грибковой флоры, что приводит к появлению признаков кандидоза.
После тяжелых и частых простуд организм ребенка резко ослабевает. У таких деток, как правило, усиливается рост грибковой флоры, что приводит к появлению признаков кандидоза. - Иммунодефицитные состояния. Могут быть врожденными и приобретенными в результате различных заболеваний. Не достаточно эффективная работа иммунной системы часто способствует бурному росту различных условно-патогенных микроорганизмов, в том числе и грибков Candida. Длительное снижение иммунитета приводит к появлению у ребенка неблагоприятных симптомов молочницы.
- Хронические заболевания внутренних органов. Патологии органов желудочно-кишечного тракта часто способствуют появлению грибковой инфекции в организме. Нарушенное пищеварение провоцирует бурное развитие грибков у детей. Если лечение хронических заболеваний органов желудочно-кишечного тракта проводится не в полной мере или подобрано не правильно, то это может вызвать появление стойкой молочницы.
Виды
Врачи выделяют несколько вариантов заболевания по локализации:
- В ротовой полости.
 Поселяясь во рту, грибки вызывают различные многочисленные повреждения. К ним относятся: хейлит, стоматит, гингивит, глассит. По статистике, кандидоз ротовой полости чаще всего встречается у грудничков и школьников. Новорожденные малыши могут заразиться от матери во время проведения грудных вскармливаний.
Поселяясь во рту, грибки вызывают различные многочисленные повреждения. К ним относятся: хейлит, стоматит, гингивит, глассит. По статистике, кандидоз ротовой полости чаще всего встречается у грудничков и школьников. Новорожденные малыши могут заразиться от матери во время проведения грудных вскармливаний. - В горле. Довольно редкая форма кандидоза. Часто данный клинический вид молочницы маскируется под различные детские инфекции. Для установления правильного диагноза в этом случае требуется проведение дифференциальной диагностики. Такой вид кандидоза обычно нарушает дыхание и может протекать в довольно тяжелом виде.
- На лице и в области глаз. Данный вид кандидоза протекает с появлением слезотечения, сильного отека век. В некоторых случаях из глаз вытекает белое мутное отделяемое, в котором содержится большое количество грибков. Данная форма кандидоза опасна появлением осложнений — различных нарушений зрения.
- В кишечнике.
 Провоцирующей причиной в этом случае часто становится дисбактериоз или хронические заболевания желудочно-кишечного тракта. Длительные запоры способствуют формированию у малыша также анальных форм кандидоза. Лечением таких форм молочницы занимается детский гастроэнтеролог.
Провоцирующей причиной в этом случае часто становится дисбактериоз или хронические заболевания желудочно-кишечного тракта. Длительные запоры способствуют формированию у малыша также анальных форм кандидоза. Лечением таких форм молочницы занимается детский гастроэнтеролог. - В пищеводе. Вызывает диспепсию и провоцирует появление изжоги. Для выявления кандидоза пищевода необходимо проведение фиброгастроскопии с забором биологического материала для исследования. Такая дифференциальная диагностика проводится с целью исключить различные новообразования в пищеводе.
- В головном мозге. Довольно редкая клиническая форма, однако, весьма опасная. Течение заболевания крайне тяжелое. По симптоматике болезнь напоминает менингит. Для устранения неблагоприятных симптомов, среди которых выраженная головная боль и постоянная тошнота, применяются большие дозы противогрибковых препаратов.
- Вагинальный.
 Является самой распространенной формой. Локализация — в паху. У девочек при данной форме кандидоза появляются творожистые выделения из влагалища. Многие острые формы молочницы при этом могут переходить в хронические.
Является самой распространенной формой. Локализация — в паху. У девочек при данной форме кандидоза появляются творожистые выделения из влагалища. Многие острые формы молочницы при этом могут переходить в хронические. - В органах дыхания. Грибковая флора способствует возникновению кандидозного бронхита. Это заболевание вызывает у ребенка покашливания и нарушения дыхания. Кашель чаще всего сухой, но при присоединении бактериальной флоры может появиться мокрота. В некоторых случаях появляется осиплость или хрипота голоса, а также повышается температура тела и нарастает интоксикация.
- На руках. Чаще всего кандидозная инфекция поражает ногти. Они становятся ломкими и тусклыми, а также довольно легко ломаются и крошатся. На верхней поверхности ногтей появляются многочисленные поперечные белые борозды.
Грибки Candida любят поселяться на различных слизистых оболочках, реже — на коже.
Такая избирательная особенность вызвана особенностью их анатомического и физиологического строения. Это также обуславливает многообразие различных клинических вариантов болезни.
Симптомы
Молочница протекает с многочисленными клиническими проявлениями. Они достаточно тяжело переносятся и приносят малышу сильный дискомфорт. Степень выраженности симптомов может быть разной и зависит от исходного состояния ребенка до болезни.
Наличие у малыша большого количества хронических заболеваний или выраженный иммуннодефицит заметно ухудшают течение заболевания и способствуют переходу его в хроническую форму.
К самым распространенным симптомам относятся:
- Появление белого творожистого налета.
 Он может в небольшом количестве или существенно покрывать поврежденные участки. При прикасании к налету — он начинает крошиться и ломаться. При попытках его снятия на слизистых оболочках остаются эрозированные участки, которые могут кровоточить. Цвет налета -чаще белый или с сероватым оттенком.
Он может в небольшом количестве или существенно покрывать поврежденные участки. При прикасании к налету — он начинает крошиться и ломаться. При попытках его снятия на слизистых оболочках остаются эрозированные участки, которые могут кровоточить. Цвет налета -чаще белый или с сероватым оттенком. - Отечность. Размножаясь, грибки вызывают сильное воспаление. Воспалительный процесс провоцирует появление отека тканей. Воспаленные слизистые становятся плотными, ярко-красными. Отек языка приводит к болезненности при глотании, а также способствует уменьшению аппетита.
- Нарушение сосания. Оральные формы кандидоза вызывают у грудничков проблемы при кормлении. Они с трудом способны сосать материнское молоко. Во время кормления ребенок становится капризным, плачет. Выраженная болезненность в ротовой полости, а также жжение приводят к тому, что малыш все меньше прикладывается к материнской груди.
- Трещины в углах рта.
 Встречаются при кандидозном хейлите. Этот симптом можно заметить и в домашних условиях. Во внешних уголках рта у ребенка появляются глубокие бороздки. Во время приема пищи они могут травмироваться и кровоточить.
Встречаются при кандидозном хейлите. Этот симптом можно заметить и в домашних условиях. Во внешних уголках рта у ребенка появляются глубокие бороздки. Во время приема пищи они могут травмироваться и кровоточить. - Слезотечение и болезненность век. Данный симптом характерен для кандидозного конъюнктивита. Обычно процесс — двухсторонний. Длительность заболевания в этом случае варьируется. В среднем, она составляет около 2-3 недель.
- Зуд и жжение на половых органах. Возникают при кандидозе интимной зоны. Приносят ребенку сильный дискомфорт и ухудшают его самочувствие.
- Учащенное мочеиспускание. Встречается при вагинальном кандидозе, а также при поражении грибковой инфекцией мочевыводящих путей. Порции мочи при этом не изменяются, как и общее количество за сутки. Увеличивается лишь кратность и количество позывов помочиться.

- Тошнота и рвота. Возникают при кандидозе органов желудочно-кишечного тракта. Установить диагноз в этом случае — весьма сложная задача. Тошнота может быть постоянной и плохо поддается устранению с помощью обычных лекарственных средств.
- Изменение кожных покровов и ногтей. По внешнему виду может напоминать дерматит. У малышей раннего возраста обычно в первую очередь появляется в области кожных складок. По внешнему виду может напоминать небольшие опухшие шишечки с мутным содержимым внутри.
- Нарушение общего самочувствия. Тяжелые формы кандидоза сопровождаются повышением температуры тела и нарастанием интоксикационных симптомов. Довольно тяжело молочница протекает и у малышей первого года жизни. Тяжесть состояния влияет на поведение ребенка. Он становится более вялым и капризным, нарастает дневная сонливость и некоторая пассивность, увеличивается нервозность.
Диагностика
Заподозрить первые признаки кандидоза может любая мама. Они обычно довольно ярко проявляются и бывают весьма специфичными. Однако при обнаружении клинических кандидозных признаков следует обязательно показать малыша врачу. Доктор проведет клиническое обследование, а в некоторых случаях также дополнительные исследования для дифференциальной диагностики.
Они обычно довольно ярко проявляются и бывают весьма специфичными. Однако при обнаружении клинических кандидозных признаков следует обязательно показать малыша врачу. Доктор проведет клиническое обследование, а в некоторых случаях также дополнительные исследования для дифференциальной диагностики.
Это нужно для того, чтобы исключить все заболевания, под которые может маскироваться кандидоз.
Обычно при кандидозной инфекции назначают:
- Общий анализ крови. Дает описательную картину о наличии инфекции в детском организме. Помогает также установить степень выраженности функциональных нарушений. Данный метод является ориентировочным и не лежит в основе установления диагноза.
- ПЦР.
 Этот метод позволяет точно выявлять наличие грибка в различном биологическом материале. Для проведения данного теста потребуется предварительный забор налета.
Этот метод позволяет точно выявлять наличие грибка в различном биологическом материале. Для проведения данного теста потребуется предварительный забор налета. - Микроскопирование. С помощью микроскопа высокой разрешающей способности можно обнаружить грибок в любой среде. В некоторых случаях для более точного результата врачи используют предварительное окрашивание материала. Это помогает выявить грибок даже в сложных диагностических случаях.
- Серология. С помощью РСК и реакции агглютинации можно обнаружить кандидные грибки в моче, крови, отделяемом из глаз, налете из влагалища и других секретах. В некоторых случаях к проведению данного метода прибегают для выявления висцеральных форм кандидоза или после проведения спинномозговой пункции.
Лечение
Лечить кандидозную инфекцию следует максимально быстро, сразу же после установления диагноза. Запоздалая терапия может способствовать прогрессированию заболевания и переходу его в хроническую форму. Для лечения используются различные лекарственные препараты, оказывающие губительное действие на грибок, а также улучшающие показатели иммунитета. Для устранения симптомов кандидозной инфекции у малышей используются различные противогрибковые препараты. Они могут быть системного и местного действия.
Запоздалая терапия может способствовать прогрессированию заболевания и переходу его в хроническую форму. Для лечения используются различные лекарственные препараты, оказывающие губительное действие на грибок, а также улучшающие показатели иммунитета. Для устранения симптомов кандидозной инфекции у малышей используются различные противогрибковые препараты. Они могут быть системного и местного действия.
Выбор средства, его дозировку и кратность лечения выбирает лечащий врач исходя из исходной тяжести состояния ребенка и наличия у него сопутствующих заболеваний внутренних органов.
Местное лечение проводится различными мазями, обладающими губительным действием на кандидные грибки. К ним относятся: клотримазол, пимафуцин (натамицин), изоконазол (травоген), кетоконазол, тридерм (эффективен для терапии кандидоза стоп) и другие. Для устранения неблагоприятных симптомов болезни обычно требуется около двух недель. Более длительное использование лекарственных мазей обсуждается с лечащим врачом. Если заболевание протекает в более затяжном виде, то уже требуется назначение противогрибковых препаратов, обладающих системным действием. Для усиления терапевтического эффекта к местной терапии добавляется флуконазол.
Для устранения неблагоприятных симптомов болезни обычно требуется около двух недель. Более длительное использование лекарственных мазей обсуждается с лечащим врачом. Если заболевание протекает в более затяжном виде, то уже требуется назначение противогрибковых препаратов, обладающих системным действием. Для усиления терапевтического эффекта к местной терапии добавляется флуконазол.
Он может быть в различных формах выпуска: суспензии и капсулах, а также в таблетках. Обычно в сутки используется доза 6-8 мг/кг. Срок лечения устанавливается в зависимости от тяжести течения заболевания.
Распространенные формы кандидоза кожи лечатся с назначением флюконазола в дозировке 8-10 мг/кг в сутки. Обычно вся доза лекарственного средства принимается один раз в течение дня. Терапия кандидоза кожи также включает в себя назначение местных форм противогрибковых препаратов. Средняя длительность курса лечения составляет обычно 14-21 день.
Обычно вся доза лекарственного средства принимается один раз в течение дня. Терапия кандидоза кожи также включает в себя назначение местных форм противогрибковых препаратов. Средняя длительность курса лечения составляет обычно 14-21 день.
Для обработки воспаленных и поврежденных кандидозной инфекцией слизистых оболочек полости рта можно использовать гексорал или 2% раствор биглюконата натрия. Обрабатывать участки следует 3-4 раза в сутки. Если процесс протекает в легкой форме, то такого местного лечения вполне достаточно. При рецидивировании заболевания требуется уже назначение флуконазола (дифлюкана, микосиста, медофлюкона) внутрь.
В условиях больницы у новорожденных малышей могут применяться схемы лечения, в которых включены терапевтические дозировки нистатина.
При кандидозе половых органов можно воспользоваться противогрибковыми мазями. Для этого подойдут 1% клотримазол и 1% травоген. Длительность назначения препаратов зависит от тяжести течения заболевания и выраженности клинических симптомов. При неэффективности местного лечения, а также при ухудшении состояния требуется назначение системных противогрибковых средств. Висцеральный кандидоз — трудная задача для лечения. Обычно для устранения неблагоприятных симптомов требуется назначение комплексной терапии. При кандидозе органов желудочно-кишечного тракта используются лечебные схемы, включающие в себя сочетанное назначение флуконазола и нистатина одновременно. Флуконазол назначается в дозировке 9-10 мг/ кг веса, а нистатин 70 000- 100 000 ЕД/ сутки до 3-4 раз в день.
Для этого подойдут 1% клотримазол и 1% травоген. Длительность назначения препаратов зависит от тяжести течения заболевания и выраженности клинических симптомов. При неэффективности местного лечения, а также при ухудшении состояния требуется назначение системных противогрибковых средств. Висцеральный кандидоз — трудная задача для лечения. Обычно для устранения неблагоприятных симптомов требуется назначение комплексной терапии. При кандидозе органов желудочно-кишечного тракта используются лечебные схемы, включающие в себя сочетанное назначение флуконазола и нистатина одновременно. Флуконазол назначается в дозировке 9-10 мг/ кг веса, а нистатин 70 000- 100 000 ЕД/ сутки до 3-4 раз в день.
Длительность использования лекарственных препаратов зависит от клинической формы кандидоза, а также его локализации. В среднем, для устранения неблагоприятных симптомов достаточно 1.5- 2 недель. Однако в некоторых случаях требуется более длительный прием препаратов. Лечение должно быть подобрано правильно, чтобы максимально предотвратить возможные рецидивы болезни в дальнейшем. В течение курса терапии обязательно проводится контроль эффективности назначенного лечения. Также врачи могут назначать малышу общие анализы крови. Эти тесты необходимы для установления неблагоприятных побочных реакций со стороны детского организма при длительном применении противогрибковых препаратов.
Лечение должно быть подобрано правильно, чтобы максимально предотвратить возможные рецидивы болезни в дальнейшем. В течение курса терапии обязательно проводится контроль эффективности назначенного лечения. Также врачи могут назначать малышу общие анализы крови. Эти тесты необходимы для установления неблагоприятных побочных реакций со стороны детского организма при длительном применении противогрибковых препаратов.
В конце курса проведенного лечения обязательно проводится полный лабораторный контроль с определением остаточного наличия грибков.
В лечении грибковых инфекций следует уделить большое внимание питанию малыша. На весь острый период заболевания ребенку назначается специальная диета. Она полностью исключает любые сладкие продукты, так как это способствует росту грибковой флоры. Также из рациона убираются все маринованные и консервированные блюда, пряная или острая еда. Питание должно быть дробным, не менее 4-5 раз в сутки.
Питание должно быть дробным, не менее 4-5 раз в сутки.
Для приготовления блюд лучше использовать мультиварку или пароварку, допускается тушение и обработка паром.
Профилактика
Профилактические меры играют важную роль в предотвращении кандидоза у малышей. Регулярное соблюдение простых правил поможет сохранить организм ребенка здоровым и убережет от молочницы. Важно помнить, что соблюдать их следует каждый день. Любое нарушение может привести к появлению неблагоприятных симптомов кандидоза.
Для того чтобы не заболеть молочницей, следует:
- Укреплять иммунитет. Этому способствует правильное полноценное питание, здоровый сон, а также оптимально подобранные физические нагрузки. Сильный стресс заметно ослабляет работу иммунной системы.
 Чрезмерные психоэмоциональные нагрузки лучше исключить. Регулярное закаливание также улучшает показатели иммунитета.
Чрезмерные психоэмоциональные нагрузки лучше исключить. Регулярное закаливание также улучшает показатели иммунитета. - Благоприятный микроклимат в помещении. Многие врачи считают, что к развитию кандидоза могут приводить излишняя сухость в детской комнате, а также неправильная температура. Для поддержания хорошего здоровья ребенка старайтесь следить за влажностью в помещении. В этом помогут специальные приборы, увлажняющие воздух.
- Совершать прогулки на свежем воздухе. Научно доказано, что кислород оказывает губительное действие на различные микроорганизмы. Регулярные прогулки на улице будут способствовать лучшей работе иммунной системы и улучшат выносливость малыша.
- Соблюдать правила личной гигиены. Регулярное мытье рук, обработка сосков до и после кормлений грудью, использование личных полотенец и мочалок для душа — простые способы предотвратить контактный способ заражения кандидозом. Выполнять правила личной гигиены следует всем членам семьи. Малышей следует приучать к этому с самых ранних лет жизни.
О том, как лечить кандидоз полости рта у детей, смотрите в следующем видео.
Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ | Microbiome
Neu J, Walker WA. Некротический энтероколит. N Engl J Med. 2011; 364: 255–64.
CAS Статья PubMed PubMed Central Google ученый
Лин П.В., Столл Б.Дж. Некротизирующий энтероколит. Ланцет. 2006; 368: 1271–83.
Артикул PubMed Google ученый
Фанарофф А.А., Столл Б.Дж., Райт Л.Л., Карло В.А., Эренкранц Р.А., Старк А.Р., Бауэр С.Р., Донован Э.Ф., Коронес С.Б., Лапток А.Р. и др. Тенденции неонатальной заболеваемости и смертности новорожденных с очень низкой массой тела при рождении. Am J Obstet Gynecol. 2007; 196: 147. е141-148.
Артикул PubMed Google ученый
Лимонс Дж. А., Бауэр С. Р., О В., Короне С. Б., Папил Л. А., Столл Б. Дж., Вертер Дж., Темпроса М., Райт Л. Л., Эренкранц Р. А. и др. Результаты исследования очень низкой массы тела при рождении, проведенного сетью неонатальных исследований Национального института здоровья ребенка и человеческого развития, с января 1995 г. по декабрь 1996 г.Сеть неонатальных исследований NICHD. Педиатрия. 2001; 107: E1.
CAS Статья PubMed Google ученый
Holman RC, Stoll BJ, Curns AT, Yorita KL, Steiner CA, Schonberger LB. Госпитализации новорожденных с некротизирующим энтероколитом в США. Педиатр Перинат Эпидемиол. 2006. 20: 498–506.
Артикул PubMed Google ученый
Столл Б.Дж., Хансен Н.И., Адамс-Чапман И., Фанаров А.А., Хинтц С.Р., Вор Б., Хиггинс Р.Д.Нарушение нервного развития и роста у младенцев с крайне низкой массой тела при рождении с неонатальной инфекцией. ДЖАМА. 2004; 292: 2357–65.
CAS Статья PubMed Google ученый
Claud EC, Walker WA. Бактериальная колонизация, пробиотики и некротический энтероколит. J Clin Gastroenterol. 2008; 42 Приложение 2: S46–52.
Артикул PubMed Google ученый
Nanthakumar NN, Fusunyan RD, Sanderson I, Walker WA. Воспаление в развивающемся кишечнике человека: возможный патофизиологический вклад в некротический энтероколит. Proc Natl Acad Sci U S. A. 2000; 97: 6043–8.
CAS Статья PubMed PubMed Central Google ученый
Nanthakumar N, Meng D, Goldstein AM, Zhu W., Lu L, Uauy R, Llanos A, Claud EC, Walker WA. Механизм чрезмерного воспаления кишечника при некротическом энтероколите: незрелый врожденный иммунный ответ.PLoS One. 2011; 6: e17776.
CAS Статья PubMed PubMed Central Google ученый
Carlisle EM, Morowitz MJ. Микробиом кишечника и некротический энтероколит. Curr Opin Pediatr. 2013; 25: 382–7.
CAS Статья PubMed Google ученый
Ван Й., Хёниг Д.Д., Малин К.Дж., Камар С., Петроф Е.О., Сан Дж., Антонопулос Д.А., Чанг Э.Б., Клауд Э.С.Анализ фекальной микробиоты недоношенных новорожденных с некротическим энтероколитом и без него на основе гена 16S рРНК. ISME J. 2009; 3: 944–54.
CAS Статья PubMed PubMed Central Google ученый
Афрази А., Содхи С.П., Ричардсон В., Нил М., Гуд М., Сиггерс Р., Хакам Диджей. Новые взгляды на патогенез и лечение некротического энтероколита: толл-подобные рецепторы и не только. Pediatr Res. 2011; 69: 183–8.
CAS Статья PubMed PubMed Central Google ученый
Musemeche CA, Kosloske AM, Bartow SA, Umland ET. Сравнительное влияние ишемии, бактерий и субстрата на патогенез кишечного некроза. J Pediatr Surg. 1986; 21: 536–8.
CAS Статья PubMed Google ученый
Коттен С.М., Тейлор С., Столл Б., Голдберг Р.Н., Хансен Н.И., Санчес П.Дж., Амбалаванан Н., Бенджамин-младший, Д.К. Увеличенная продолжительность первоначального эмпирического лечения антибиотиками связана с повышенным уровнем некротического энтероколита и смерти младенцев с крайне низкой массой тела при рождении.Педиатрия. 2009; 123: 58–66.
Артикул PubMed PubMed Central Google ученый
Александр В.Н., Нортруп В., Биззарро М.Дж. Воздействие антибиотиков в отделении интенсивной терапии новорожденных и риск некротического энтероколита. J Pediatr. 2011; 159: 392–7.
Артикул PubMed PubMed Central Google ученый
Моровиц М.Дж., Поройко В., Каплан М., Алверди Дж., Лю Д.К.Новое определение роли кишечных микробов в патогенезе некротического энтероколита. Педиатрия. 2010; 125: 777–85.
Артикул PubMed Google ученый
Содхи С.П., Нил М.Д., Сиггерс Р., Шо С., Ма К., Бранка М.Ф., Приндл-младший Т., Руссо А.М., Афрази А., Гуд М. и др. Толл-подобный рецептор 4 кишечного эпителия регулирует развитие бокаловидных клеток и необходим для некротического энтероколита у мышей. Гастроэнтерология. 2012; 143: 708–18.e701-705.
CAS Статья PubMed PubMed Central Google ученый
Лу П, Соди С.П., Хакам Диджей. Толл-подобные рецепторы регуляции развития кишечника и воспаления в патогенезе некротического энтероколита. Патофизиология. 2014; 21: 81–93.
CAS Статья PubMed Google ученый
Геверс Д., Найт Р., Петросино Дж. Ф., Хуанг К., Макгуайр А. Л., Биррен Б. В., Нельсон К. Э., Уайт О., Мете Б. А., Хаттенхауэр К.Проект «Микробиом человека»: общественный ресурс, посвященный здоровому микробиому человека. PLoS Biol. 2012; 10: e1001377.
CAS Статья PubMed PubMed Central Google ученый
Проект микробиома человека C. Структура, функции и разнообразие здорового микробиома человека. Природа. 2012; 486: 207–14.
Артикул Google ученый
Sze MA, Schloss PD.Ищем сигнал в шуме: возвращаемся к ожирению и микробиому. mBio. 2016; 7 (4): e01018–16. DOI: 10.1128 / mBio.01018-16.
Белл М.Дж., Тернберг Д.Л., Фейгин Р.Д., Китинг Дж. П., Маршалл Р., Бартон Л., Браттон Т. Некротический энтероколит новорожденных, терапевтические решения, основанные на клинической стадии. Ann Surg. 1978; 187: 1–7.
CAS Статья PubMed PubMed Central Google ученый
Мохер Д., Либерати А., Тецлафф Дж., Альтман Д.Г., Группа П.Предпочтительные элементы отчетности для систематических обзоров и метаанализов: заявление PRISMA. BMJ. 2009; 339: b2535.
Артикул PubMed PubMed Central Google ученый
Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, Moher D, Becker BJ, Sipe TA, Thacker SB. Метаанализ наблюдательных исследований в эпидемиологии: предложение для отчетности. Метаанализ обсервационных исследований в группе эпидемиологии (MOOSE).ДЖАМА. 2000; 283: 2008–12.
CAS Статья PubMed Google ученый
Lozupone CA, Stombaugh J, Gonzalez A, Ackermann G, Wendel D, Vazquez-Baeza Y, Jansson JK, Gordon JI, Knight R. Мета-анализ исследований микробиоты человека. Genome Res. 2013; 23: 1704–14.
CAS Статья PubMed PubMed Central Google ученый
Вишванатан М., Беркман Н.Д., Драйден Д.М., Хартлинг Л.Оценка риска предвзятости и противоречия в наблюдательных исследованиях вмешательств или воздействий: дальнейшее развитие банка статей RTI. Отчет о методах исследования. (Подготовлено Центром доказательной практики RTI – UNC по контракту № 290-2007-10056-I). Публикация AHRQ № 13-EHC106-EF. Роквилл: Агентство медицинских исследований и качества; 2013. www.effectivehealthcare.ahrq.gov/reports/final.cfm. По состоянию на 27 июня 2015 г.
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нат методы. 2010; 7: 335–6.
CAS Статья PubMed PubMed Central Google ученый
Макдональд Д., Прайс М.Н., Гудрич Дж., Навроски Е.П., ДеСантис Т.З., Пробст А., Андерсен Г.Л., Найт Р., Хугенгольц П. Улучшенная таксономия Грингенса с явными рангами для экологического и эволюционного анализа бактерий и архей. ISME J. 2012; 6: 610–8.
CAS Статья PubMed Google ученый
Эдгар RC. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика. 2010; 26: 2460–1.
CAS Статья PubMed Google ученый
Мшвилдадзе М., Ной Дж., Шустер Дж., Териак Д., Ли Н., Май В. Микробная экология кишечника у недоношенных новорожденных, оцененная с помощью некультуральных методов. J Pediatr. 2010; 156: 20–5.
Артикул PubMed PubMed Central Google ученый
Mai V, Young CM, Ukhanova M, Wang X, Sun Y, Casella G, Theriaque D, Li N, Sharma R, Hudak M, Neu J. Фекальная микробиота недоношенных детей до некротического энтероколита. PLoS One. 2011; 6: e20647.
CAS Статья PubMed PubMed Central Google ученый
МакМёртри В.Е., Гупта Р.В., Тран Л., Бланшар Э., Пенн Д., Тейлор К.М., Феррис М.Дж. Бактериальное разнообразие и численность клостридий уменьшаются с увеличением тяжести некротического энтероколита.Микробиом. 2015; 3: 11.
Артикул PubMed PubMed Central Google ученый
Морроу А.Л., Лагомарчино А.Дж., Шиблер К.Р., Тафт Д.Х., Ю З., Ван Б., Алтай М., Вагнер М., Геверс Д., Уорд Д.В. и др. Ранние микробные и метаболомные признаки предсказывают более позднее начало некротического энтероколита у недоношенных детей. Микробиом. 2013; 1:13.
Артикул PubMed PubMed Central Google ученый
Normann E, Fahlen A, Engstrand L, Lilja HE. Профили кишечных микробов у крайне недоношенных детей с некротическим энтероколитом и без него. Acta Paediatr. 2013; 102: 129–36.
Артикул PubMed Google ученый
Сим К., Шоу А.Г., Рэнделл П., Кокс М.Дж., МакКлюр З.Э., Ли М.С., Хаддад М., Лэнгфорд П.Р., Куксон В.О., Моффатт М.Ф., Кролл Дж.С. Дисбактериоз, предвосхищающий некротический энтероколит у очень недоношенных детей. Clin Infect Dis.2015; 60: 389–97.
CAS Статья PubMed Google ученый
Torrazza RM, Ukhanova M, Wang X, Sharma R, Hudak ML, Neu J, Mai V. Микробная экология кишечника и факторы окружающей среды, влияющие на некротический энтероколит. PLoS One. 2013; 8: e83304.
Артикул PubMed PubMed Central Google ученый
Чжоу Й., Шан Дж., Содергрен Е., Вайншток Дж., Уокер В. А., Грегори К. Э.Продольный анализ кишечного микробиома недоношенных детей до некротического энтероколита: исследование случай-контроль. PLoS One. 2015; 10: e0118632.
Артикул PubMed PubMed Central Google ученый
Уорнер Б.Б., Дейч Э., Чжоу Ю., Холл-Мур С., Вайншток Г.М., Содергрен Э., Шейх Н., Хоффманн Д.А., Линнеман Л.А., Хамвас А. и др. Дисбактериоз кишечных бактерий и некротический энтероколит у младенцев с очень низкой массой тела при рождении: проспективное исследование случай-контроль.Ланцет. 2016; 387 (10031): 1928–36.
de la Cochetiere MF, Piloquet H, des Robert C., Darmaun D, Galmiche JP, Roze JC. Ранняя кишечная бактериальная колонизация и некротический энтероколит у недоношенных детей: предполагаемая роль Clostridium. Pediatr Res. 2004; 56: 366–70.
Артикул PubMed Google ученый
Стюарт С.Дж., Маррс Е.К., Магорриан С., Нельсон А., Ланьон С., Перри Дж. Д., Эмблтон Н. Д., Каммингс С. П., Беррингтон Дж. Э..Микробиота кишечника недоношенных: изменения, связанные с некротическим энтероколитом и инфекцией. Acta Paediatr. 2012; 101: 1121–7.
CAS Статья PubMed Google ученый
Йи У.Х., Сораишам А.С., Шах В.С., Азиз К., Юн В., Ли С.К. Частота и время проявления некротического энтероколита у недоношенных детей. Педиатрия. 2012; 129: e298–304.
Артикул PubMed Google ученый
Gonzalez-Rivera R, Culverhouse RC, Hamvas A, Tarr PI, Warner BB. Возраст начала некротического энтероколита: применение модели инкубационного периода Сартвелла. J Perinatol. 2011; 31: 519–23.
CAS Статья PubMed PubMed Central Google ученый
Llanos AR, Moss ME, Pinzon MC, Dye T, Sinkin RA, Kendig JW. Эпидемиология неонатального некротического энтероколита: популяционное исследование. Педиатр Перинат Эпидемиол.2002; 16: 342–9.
Артикул PubMed Google ученый
Ла Роса П.С., Уорнер Б.Б., Чжоу Й., Вайншток Г.М., Содергрен Э., Холл-Мур С.М., Стивенс Х.Дж., Беннетт мл. В.Е., Шейх Н., Линнеман Л.А. и др. Наблюдаемое развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci U S. A. 2014; 111: 12522–7.
Артикул PubMed PubMed Central Google ученый
Соди К., Ричардсон В., Грибар С., Хакам Д. Д.. Разработка животных моделей для изучения некротического энтероколита. Dis Model Mech. 2008; 1: 94–8.
Артикул PubMed PubMed Central Google ученый
Содхи С.П., Ши XH, Ричардсон В.М., Грант З.С., Шапиро Р.А., Приндл-младший Т., Бранка М., Руссо А., Грибар С.К., Ма С., Хакэм Д. Toll-подобный рецептор-4 подавляет пролиферацию энтероцитов за счет нарушения передачи сигналов бета-катенина при некротическом энтероколите.Гастроэнтерология. 2010. 138: 185–96.
CAS Статья PubMed Google ученый
Джиллинг Т., Саймон Д., Лу Дж., Мэн Ф.Дж., Ли Д., Ши Р., Томсон Р.Б., Солиман А., Ардити М., Каплан М.С. Роль бактерий и TLR4 в моделях некротического энтероколита у крыс и мышей. J Immunol. 2006; 177: 3273–82.
CAS Статья PubMed PubMed Central Google ученый
Уорд Д.В., Шольц М., Зольфо М., Тафт Д.Х., Шиблер К.Р., Тетт А., Сегата Н., Морроу А.Л. Метагеномное секвенирование с разрешением на уровне штаммов указывает на участие уропатогенной E. coli в некротическом энтероколите и смертности недоношенных детей. Cell Rep. 2016; 14: 2912–24.
CAS Статья PubMed PubMed Central Google ученый
Моровиц М.Дж., Денеф В.Дж., Костелло Е.К., Томас Б.К., Поройко В., Релман Д.А., Банфилд Дж.Ф. Геномный анализ микробной колонизации кишечника у недоношенного ребенка с выделением штаммов.Proc Natl Acad Sci U S. A. 2011; 108: 1128–33.
CAS Статья PubMed Google ученый
Zeissig S, Blumberg RS. Жизнь в начале: нарушение микробиоты антибиотиками в раннем возрасте и его роль в здоровье и болезнях. Nat Immunol. 2014; 15: 307–10.
CAS Статья PubMed Google ученый
Гибсон М.К., Ван Б., Ахмади С., Бернхэм, Калифорния, Тарр П.И., Уорнер Б.Б., Дантас Г.Динамика развития микробиоты кишечника недоношенных новорожденных и резистома к антибиотикам. Nat Microbiol. 2016; 1: 16024.
Артикул PubMed PubMed Central Google ученый
Барб Дж.Дж., Олер А.Дж., Ким Х.С., Чалмерс Н., Уоллен Г.Р., Кода А, Мансон П.Дж., Эймс, штат Нью-Джерси. Разработка аналитического конвейера, характеризующего несколько гипервариабельных областей 16S рРНК с использованием фиктивных образцов. PLoS One. 2016; 11: e0148047.
Артикул PubMed PubMed Central Google ученый
Zheng W, Tsompana M, Ruscitto A, Sharma A, Genco R, Sun Y, Buck MJ. Точный и эффективный экспериментальный подход к характеристике сложной микробиоты полости рта. Микробиом. 2015; 3: 48.
Артикул PubMed PubMed Central Google ученый
Кумар П.С., Брукер М.Р., Дауд С.Е., Камерленго Т. Выбор целевой области является критическим детерминантом отпечатков пальцев сообщества, генерируемых пиросеквенированием 16S. PLoS One.2011; 6: e20956.
CAS Статья PubMed PubMed Central Google ученый
Taft DH, Ambalavanan N, Schibler KR, Yu Z, Newburg DS, Ward DV, Morrow AL. Микробиота кишечника недоношенных детей различается со временем и между больницами. Микробиом. 2014; 2: 36.
Артикул PubMed PubMed Central Google ученый
Torrazza RM, Neu J.Измененный микробиом кишечника и некротический энтероколит. Clin Perinatol. 2013; 40: 93–108.
Артикул PubMed PubMed Central Google ученый
Schwiertz A, Gruhl B, Lobnitz M, Michel P, Radke M, Blaut M. Развитие бактериального состава кишечника у госпитализированных недоношенных детей по сравнению с доношенными младенцами, находящимися на грудном вскармливании. Pediatr Res. 2003; 54: 393–9.
Артикул PubMed Google ученый
Bjorkstrom MV, Hall L, Soderlund S, Hakansson EG, Hakansson S, Domellof M. Кишечная флора у младенцев с очень низкой массой тела при рождении. Acta Paediatr. 2009. 98: 1762–7.
Артикул PubMed Google ученый
Latuga MS, Stuebe A, Seed PC. Обзор источника и функции микробиоты в грудном молоке. Semin Reprod Med. 2014; 32: 68–73.
Артикул PubMed Google ученый
Шарон I, Моровиц MJ, Томас BC, Костелло EK, Relman DA, Banfield JF. Анализ геномики сообщества временных рядов показывает быстрые изменения видов, штаммов и фагов бактерий во время колонизации кишечника младенца. Genome Res. 2013; 23: 111–20.
CAS Статья PubMed PubMed Central Google ученый
Гришин А., Папийон С., Белл Б., Ван Дж., Форд Х. Роль кишечной микробиоты в патогенезе некротического энтероколита.Semin Pediatr Surg. 2013; 22: 69–75.
Артикул PubMed PubMed Central Google ученый
Равех-Садка Т., Томас BC, Сингх А., Файрек Б., Брукс Б., Кастель С.Дж., Шарон И., Бейкер Р., Гуд М., Моровиц М.Дж., Банфилд Дж.Ф. Кишечные бактерии редко являются общими для госпитализированных недоношенных детей, независимо от развития некротического энтероколита. Элиф. 2015; 4.
Миллар М.Р., Линтон С.Дж., Кейд А, Глэнси Д., Холл М, Джалал Х.Применение ПЦР гена 16S рРНК для изучения флоры кишечника недоношенных детей с некротическим энтероколитом и без него. J Clin Microbiol. 1996; 34 (10): 2506–10.
Smith B, Bodé S, Skov TH, Mirsepasi H, Greisen G, Krogfelt KA. Исследование ранней микрофлоры кишечника у недоношенных детей с / без некротического энтероколита двумя разными методами. Pediatr Res. 2012. 71 (1): 115–20.
Границы | Дисбиоз желудочно-кишечного микробиома у новорожденных мышей изменяет передачу сигналов периферических CD8 + Т-клеточных рецепторов
Введение
Экспериментальные исследования продолжают предлагать надежные доказательства того, что желудочно-кишечный микробиом (ЖКТ) оказывает большое влияние на анатомическое и клеточное развитие и функции иммунной системы (1–3).Колонизация кишечника специфическими бактериями стабилизирует популяции иммунных регуляторных клеток, участвующих в поддержании здоровья. Например, было показано, что баланс Th2 / Th3 (4), Th27 (5), Treg (6) и iNKT слизистой оболочки (7) требует GIM для своего нормального развития и функционирования. Таким образом, нарушение естественного процесса колонизации кишечника, происходящего в GIM младенца, может иметь как немедленные, так и долгосрочные иммунные последствия. Агрессивные стандарты гигиены, использования антибиотиков и недоедание вызывают значительные краткосрочные и долгосрочные нарушения сборки и созревания ГИМ младенца (8, 9).Сейчас мы понимаем, что иммунные эффекты дисбиоза GIM не могут быть реализованы в краткосрочной перспективе. Появляются новые высококачественные исследования, которые связывают использование антибиотиков в раннем возрасте с повышенным риском развития аллергических и аутоиммунных заболеваний в более позднем возрасте (10–14). Однако соответствующее влияние дисбактериоза GIM на конкретные параметры функции Т-лимфоцитов ребенка не изучалось.
ГИМ младенцев особенно уязвима из-за присущей ей нестабильности и меньшего видового разнообразия по сравнению с детьми старшего возраста и взрослыми (15, 16).Антибиотики являются наиболее часто назначаемыми лекарствами беременным женщинам и детям и, таким образом, являются основной причиной дисбактериоза кишечника. До 40% беременных женщин лечатся антибиотиками в перинатальный период (17, 18), и до 75% детей лечились хотя бы одним курсом антибиотиков в возрасте до 2 лет (19, 20). Наиболее распространенное лечение антибиотиками беременных женщин — это во время родов профилактика антибиотиками (IAP) во время родов для предотвращения перинатальной болезни, вызванной стрептококками группы B (GBS) у младенцев.Пенициллин, ампициллин, ванкомицин или клиндамицин — распространенные антибиотики, используемые для лечения матерей, колонизированных СГБ, во время родов (21). В нескольких исследованиях подробно описано долгосрочное влияние даже коротких курсов антибиотиков на плотность, сложность и стабильность GIM (22, 23). Влияние антибиотиков, принимаемых матерью во время родов на GIM младенца, подробно описано в нескольких исследованиях с использованием методов культивирования и некультурирования (24–27). Насколько нам известно, ни в одном исследовании не оценивалось, как IAP-индуцированный дисбиоз у новорожденных GIM может изменять функцию отдельных подгрупп адаптивного клеточного иммунитета после рождения.
Младенцы характеризуются отчетливым GIM. Следовательно, функциональное поведение и фенотип детских иммунных эффекторов не может регулироваться GIM таким же образом, как это было продемонстрировано у взрослых. Младенческие Т-клетки ограничены в своей способности регулировать гамма-интерферон (IFN-γ), важный медиатор в борьбе с вирусными и другими внутриклеточными патогенными инфекциями. Как было продемонстрировано на мышах и людях, детские Т-клетки способны продуцировать IFN-γ в ответ на инфекцию, но это может быть искажено по времени (слишком рано) и по величине (слишком слабо) по сравнению со взрослыми Т-клетками (28).Эти различия в развитии могут модулироваться внутренними или внешними механизмами и включают эпигенетическое гиперметилирование промотора IFN-γ (29), повышенный порог активации Т-клеточного рецептора (TCR), регулируемый miRNA (30), ингибирование Treg (31), перекос в сторону врожденный функциональный профиль (32), недостаточное содействие со стороны младенческих антигенпрезентирующих клеток (33) или метаболитов GIM (34, 35).
Мы продемонстрировали, что детеныши мышей с дисбиозом GIM, вызванным лечением матери антибиотиками (MAT) в последние дни беременности, вызывают повышенную предрасположенность к смерти в результате системной вирусной инфекции (36).Мы наблюдаем, что эффекторные Т-клетки CD8 + от новорожденных мышей MAT последовательно демонстрируют неспособность поддерживать продукцию IFN-γ in vivo, после инфицирования вирусом осповакцины и in vitro, , при стимуляции TCR. Цели этого исследования заключались в дальнейшей оценке внутренней функциональной способности MAT CD8 + Т-клеток и оценке активации проксимальных и дистальных сигнальных молекул после вовлечения TCR. Мы также определили, достаточно ли переноса Т-клеток MAT CD8 + в недисбиотическую среду хозяина или стимуляции липополисахаридом (ЛПС) для восстановления сигнальной активации и ответа на IFN-γ Т-клеток MAT CD8 + .
Материалы и методы
Мыши
Все исследования на животных проводились в соответствии с протоколом на животных, утвержденным Комитетом по использованию и уходу за животными Медицинского центра Колумбийского университета. От шести до восьми недель C57BL / 6J, OT-I CD45.1, Rag1KO (B6.129S7- Rag1 tm1Mom / J), MyD88KO [B6.129P2 (SLJ) — Myd88 tm1.1Def / J] и TLR4KO (B6.B10ScN- Tlr4 lps-del / JthJ) мышей содержали в течение по крайней мере 7 дней до разведения и содержали в условиях BSL-1 и BSL-2, свободных от конкретных патогенов. условия содержания животных в помещениях Медицинского центра Колумбийского университета.Пары были созданы в гареме по две самки и один самец в клетке. Беременных самок отделяли от самцов и помещали отдельно на 17 день после спаривания. Мышам, переведенным из одного помещения в другое, давали возможность акклиматизироваться в течение ≥1 недели до начала экспериментов. Мыши OT-I CD45.1 были получены путем скрещивания мышей OT-I [C57BL / 6-Tg (TcrαTcrβ) 1100Mjb / J] и CD45.1 (B6.SJL- Ptprc a Pepc b / BoyJ). уже более 10 поколений. Фенотип мышей OT-I CD45.1 подтвержден методом проточной цитометрии с использованием антител, специфичных к CD45.1 (клон A20), CD8α (клон 53-6.7), TCR Vα2 (клон B20.1) и TCR V5.1 (клон MR9-4), все от BioLegend (Сан-Диего, Калифорния, США). Все родительские штаммы были получены из лаборатории Джексона (Бар-Харбор, штат Мэн, США). Во всех экспериментах использовали однопометников женского и мужского пола до отъема.
Лечение матерей антибиотиками
Беременным матерям разрешалось пить воду, обработанную антибиотиками, содержащую смесь ампициллина (AuroMedics), стрептомицина (X-Gen Pharmaceuticals) и клиндамицина (Aurobindo Pharma) в стерильной воде (каждая в дозе 1 мг / мл) ad libitum 3–5 дней до рождения помета и на время экспериментов.Воду, обработанную антибиотиками, заменяли каждые 3 дня. Ранее мы определили, что с помощью этого коктейля требуется всего 3 дня для значительного изменения микробиома (данные не показаны) и что обновление раствора антибиотика каждые 3 дня поддерживает устойчивое истощение микробиоты у взрослых мышей.
Изоляция Т-клеток и
Анализы активации in vitroДля экспериментов in vitro по стимуляции, LPS и переносу OT-I, общее количество CD8 + Т-клеток было очищено из объединенных селезенок 15-дневного контроля (CTRL) и однопометного сверстника MAT C57BL / 6J, MyD88KO, совпадает с полом. TLR4KO и OT-I мышей, соответственно, с использованием набора для выделения CD8 мыши MojoSort (BioLegend) плюс биотин анти-CD71 (клон RI7217), биотин анти-CD45R / B220 (клон RA3-6B2) и биотин анти-TER119 (клон TER119) с последующей отрицательной селекцией MACS (Miltenyi Biotec).CD8 + чистота Т-клеток обычно давала 98%. Чтобы оценить влияние обработки ЛПС на продукцию цитокинов CD8 + Т-лимфоцитов, Т-клетки CD8 + стимулировали связанными с планшетом анти-CD3 (1 мкг / мл; клон 145-2C11) и растворимым анти-CD28 (2 мкг). / мл; клон 37,51) с или без Escherichia coli 055: LPS, производный от B5 (1 мкг / мл; InvivoGen) в течение 72 часов. Для анализов передачи сигналов TCR общие Т-клетки были обогащены из индивидуально обработанных селезенок 15-дневных мышей CTRL и MAT C57BL / 6J из одного помета с использованием биотина против CD71 (клон RI7217), биотина против CD45R / B220 (клон RA3-6B2 ) и биотиновое антитело против TER119 (клон TER119) с последующей отрицательной селекцией MACS (Miltenyi Biotec).Для создания эффекторных Т-клеток для анализа передачи сигналов TCR, общие Т-клетки (2 × 10 5 клеток / 200 мкл) стимулировали связанными с планшетом анти-CD3 (1 мкг / мл; клон 145-2C11) и растворимым анти-CD28 ( 2 мкг / мл; клон 37,51) в RPMI-10 (RPMI 1640 с добавлением 10% FBS, 20 мМ HEPES, 2 мМ l-глутамина, 0,1 мМ 2-меркаптоэтанола, 50 мкг / мл сульфата гентамицина, 50 Ед / мл пенициллина, и 50 мкг / мл стрептомицина) в 96-луночных планшетах с плоским дном и инкубировали при 37 ° C с 5% CO 2 в течение 24, 48 и 72 часов.В некоторых анализах передачи сигналов TCR использовали очищенные Т-клетки CD8 + , как указано. Все антитела были от BioLegend.
Эксперименты по переносу адоптивных клеток OT-I
Control и MAT OT-I CD8 + Т-клетки, объединенные от однопометников (1,5 × 10 5 /100 мкл PBS), были перенесены в совпадающие по возрасту и полу реципиенты CTRL Rag1KO путем внутрибрюшинной (внутрибрюшинной) инъекции. Через 24 часа после переноса адоптивных клеток OT-I мышей-реципиентов инфицировали i.p.с 1 × 10 4 БОЕ рекомбинантного овальбумина осповакцины (Vac-OVA) с помощью i.p. инъекция. Ежедневно наблюдали за мышами на предмет потери веса и появления болезни. Через восемь дней после заражения мышей умерщвляли ингаляцией CO 2 . Клетки перитонеального экссудата (PEC) аспирировали после промывания брюшины 1 мл стерильного PBS. Селезенки и брыжеечные лимфатические узлы (MLN) механически разрушали для получения суспензий единичных клеток, а затем обрабатывали буфером ACK для лизиса эритроцитов.Для обнаружения цитокинов клетки культивировали в течение 5 ч в RPMI-10 с пептидом SIINFEKL (5 мкМ; пептид Новой Англии) в присутствии брефельдина А и монензина (BioLegend).
In vivo Лечение LPS и инфекция Vac-OVAПятнадцатидневных мышей CTRL и MAT C57BL / 6J были инфицированы Vac-OVA (1 × 10 4 БОЕ внутрибрюшинно) и перорально обработаны E. coli 0111: LPS, полученный из B4 (50 мкг орогастрального; InvivoGen), начиная со дня заражения и продолжая через день в течение 10 дней.Ежедневно наблюдали за мышами на предмет потери веса и появления болезни. Через одиннадцать дней после заражения мышей умерщвляли ингаляцией CO 2 . Селезенки механически разрушали для получения суспензий единичных клеток, а затем обрабатывали буфером ACK для лизиса эритроцитов. Для обнаружения цитокинов спленоциты культивировали в течение 5 ч в RPMI-10 с пептидом SIINFEKL (5 мкМ; пептид Новой Англии), форбол 12-миристат 13-ацетат (PMA) (10 нг / мл) и иономицином (1 мкг / мл) в присутствии брефельдина А и монензина (BioLegend).
Проточная цитометрия
Одноклеточные суспензии лимфоцитов, выделенных из селезенки, MLN или PEC неинфицированных и инфицированных мышей, окрашивали оптимальными концентрациями следующих антител и реагентов: CD3ε (клон 145-2C11), CD8α (клон 53-6.7), CD25. (клон PC61), CD44 (клон IM7), CD62L (клон MEL-14), CD69 (клон h2.2F3), TNF-α (клон MP6-XT22), IFN-γ (клон XMG1.2), pTyr (клон pY20), ZAP-70 (клон 1E7.2), фосфорилированный ZAP-70 (pZAP-70) Tyr319 (клон n3kobu5; eBioscience), Erk2 (клон REA186; Miltenyi Biotec), фосфо-Erk-1/2 (pErk1 / 2 ) Thr202 / Tyr 204 (клон 4B11B69), c-Rel (клон REA397; Miltenyi Biotec), Ki-67 (клон B56; BD Biosciences), аннексин V и 7-аминоактиномицин D (7-AAD).Все антитела и реагенты были от BioLegend, если не указано иное. Мертвые клетки исключались из анализа окрашиванием Zombie Aqua (BioLegend). Клетки анализировали на проточном цитометре Fortessa (Becton Dickinson) с использованием программного обеспечения CellQuest ™. Данные анализировали с помощью программного обеспечения для анализа FlowJo v10 (TreeStar).
Анализ сигналов TCR с помощью проточной цитометрии
CTRL и MAT Т-клеток младенцев (5 × 10 5 клеток / 50 мкл), которые были свежевыделены (нестимулированы) или стимулированы анти-CD3 / анти-CD28 в течение 24, 48 и 72 ч, инкубировались с растворимыми растворами или без них. анти-CD3 (10 мкг / мл; клон 145-2C11; BioLegend) и растворимый анти-CD28 (10 мкг / мл; клон 37.51, BioLegend) в холодном RPMI 1640 с добавлением 0,5% FBS в 96-луночных круглодонных планшетах при 4 ° C в течение 15 мин, промытых холодной средой, инкубированных с растворимым козьим антихомячьим IgG или без него (20 мкг / мл; Jackson ImmunoResearch Лаборатории) при 4 ° C в течение 15 мин, промывали холодной средой, затем ресуспендировали в 50 мкл среды и инкубировали на водяной бане при 37 ° C в течение 2 мин. После сшивания CD3 / CD28 клетки немедленно фиксировали 50 мкл предварительно нагретого буфера Cytofix (BD Biosciences) для окрашивания Erk2 и pErk1 / 2 или буфера фиксации IC (eBioscience) для ZAP-70, pZAP-70, pTyr и c. -Rel окрашивание, инкубировали при 37 ° C в течение 10 мин и промывали буфером FACS (HBSS, содержащий 1% FBS и 0.1% азид натрия) перед окрашиванием антителами к CD8α, CD44 и CD62L при 4 ° C в течение 30 мин. Для внутриклеточного окрашивания Erk2 и pErk1 / 2 клетки пермеабилизировали предварительно охлажденным буфером Phosflow Perm III (BD Biosciences). Для внутриклеточного окрашивания ZAP-70, pZAP-70, pTyr и c-Rel клетки пермеабилизировали с помощью буфера Perm Wash (BioLegend). Клетки инкубировали с внутриклеточными антителами при 4 ° C в течение ночи, промывали буфером Perm Wash, а затем буфером FACS перед анализом. Анализ выполняли с привязкой к наивным (CD44 — ) или эффекторным (CD44 + ) CD8 + Т-клеткам, как указано.
Статистический анализ
Статистический анализ выполнялся с помощью GraphPad Prism 7.0. Данные были проанализированы с помощью однофакторного дисперсионного анализа с последующим тестом Холма-Сидака или непарного двустороннего критерия Стьюдента t , как указано. Во всех анализах значения с p <0,05 считались статистически значимыми.
Результаты
MAT Effector CD8
+ Т-клетки демонстрируют меньше полифункциональных цитокиновых ответов, чем клетки CTRLНедавно мы сообщили, что у маленьких мышей, матери которых лечили антибиотиками (MAT) в последние дни беременности и во время кормления грудью, значительно изменился состав GIM, повысилась восприимчивость к системной вирусной инфекции, изменились популяции клеток врожденного иммунитета и снизился эффекторный CD8. + Т-клеточных ответов по сравнению с младенцами CTRL (36).В частности, эффекторные Т-клетки MAT CD8 + не способны поддерживать продукцию IFN-γ in vivo, , после инфицирования вирусом осповакцины, и , in vitro, , при стимуляции TCR и CD28 (36). Эти данные привели нас к гипотезе о том, что дисфункция, наблюдаемая в MAT CD8 + Т-лимфоцитах, была вызвана внутренними клеточными дефектами.
Чтобы выяснить судьбу MAT и CTRL-антиген-специфических Т-клеток CD8 + , мы адоптивно перенесли овальбумин-специфические антиген-специфические CD8 + Т-клетки в хозяина с нормальным GIM до заражения системной вирусной инфекцией.Мыши Rag1KO не поддерживают эндогенные B- или T-клетки, хотя подмножества врожденных иммунных клеток сохраняются (37), что позволяет оценить распространение и функцию перенесенных овальбумин-специфических Т-клеток OT-I в ответ на инфекцию. В этих экспериментах 1,5 × 10 5 селезеночных OT-I CD8 + Т-клеток, выделенных из дня жизни (dol) 15 конгенных (CD45.1) мышей MAT и CTRL, были адоптивно перенесены в детей, соответствующих возрасту и полу. CTRL Rag1KO мышей. В течение 24 часов, прежде чем может произойти значительная гомеостатическая пролиферация перенесенных клеток (38), мышей инфицировали Vac-OVA (1 × 10 4 БОЕ i.п.). В день инфицирования (doi) 8, который соответствует пику системного адаптивного иммунного ответа против осповакцины, мы выделили лимфоциты из очага инфекции в брюшине и из лимфоидных тканей, дренирующих системный дренаж (39). Мы обнаружили эквивалентные проценты MAT и CTRL OT-I CD8 + Т-клеток (CD45.1 + TCRVβ5 + ) в PEC, MLN и селезенке мышей-реципиентов (рисунок 1A). Эквивалентные проценты эффекторных Т-клеток MAT и CTRL OT-I (CD44 + CD62L —) были обнаружены в месте инфекции (PEC) и в селезенке.Однако значительно сниженный процент эффекторов MAT OT-I был обнаружен в MLN мышей-реципиентов (рис. 1B). Затем мы проанализировали экспрессию маркера активации CD69 в эффекторных Т-клетках MAT и CTRL OT-I, распределенных в селезенке, MLN и PEC мышей-реципиентов. Мы обнаружили аналогичные проценты CD69 + MAT и CTRL OT-I эффекторных Т-клеток на каждом сайте (рис. 1C). Тем не менее, исходя из уровней экспрессии CD69, эффекторы MAT OT-I были менее активированы, чем эффекторы CTRL, но только в MLN (рис. 1D).Наконец, мы оценили способность Т-клеток MAT и CTRL OT-I, выделенных из селезенки, MLN и PEC мышей-реципиентов CTRL Rag1KO, инфицированных Vac-OVA, продуцировать эффекторные цитокины IFN-γ и TNF-α в ответ на Ограниченный MHC классом I OVA-пептид SIINFEKL. Полифункциональные эффекторы Т-клеток CD8 + образуются после инфицирования вирусом осповакцины (40), а также связаны с лучшим CTRL вирусных инфекций (41, 42). Как MAT, так и CTRL OT-I эффекторные Т-клетки имели одинаковый процент IFN-γ- и TNF-α-продуцирующих клеток в месте инфекции (PEC) (рис. 1E).В то время как эффекторы MAT OT-I проявляли устойчивые ответы IFN-γ в периферических лимфоидных органах, эффекторные T-клетки CTRL OT-I, выделенные в периферических лимфоидных тканях (селезенке и MLN), характеризовались высокой частотой IFN-γ и TNF-α, двойными. продуцирующие клетки (селезенка 58% и MLN 61%). Эффекторные Т-клетки MAT OT-I имели низкую частоту этой двойной продуцирующей подгруппы (селезенка 39% и MLN 30%) и заметно более высокую частоту клеток, не продуцирующих цитокины (селезенка 19% и MLN 20%; Рисунок 1E). Эти результаты показывают, что Ag-специфические CD8 + Т-клетки, полученные от мышей MAT, несмотря на первоначальное праймирование в среде нормальной микробиоты при оптимальных условиях активации, в целом поддерживают дифференциальный фенотип от CTRL Ag-специфических CD8 + Т-клеток, демонстрируя пониженную полифункциональность. противовирусные цитокиновые ответы.Такое поведение согласуется с гипотезой о том, что существуют внутренние различия в Т-клетках MAT CD8 + младенцев (36), возможно, запечатленные в результате их развития в среде, обедненной GIM.
Фиг. 1. Эффекторные Т-клетки CD8 + для лечения материнскими антибиотиками (MAT) проявляют меньше полифункциональных цитокиновых ответов, чем контрольные (CTRL) эффекторные клетки . Конгенные (CD454.1) OT-I CD8 + Т-клетки, выделенные из селезенки в день жизни 15 новорожденных мышей CTRL и MAT были адоптивно перенесены в соответствующих по возрасту и полу реципиентных мышей CTRL Rag1KO за 24 часа до инфицирования вирусом осповакцины-OVA (1 × 10 4 БОЕ внутрибрюшинно).Лимфоциты, выделенные из селезенки, брыжеечных лимфатических узлов (MLN) и клеток перитонеального экссудата (PEC) мышей-реципиентов CTRL Rag1KO, анализировали на (A) процентное содержание CD45.1 и Т-клеточного рецептора (TCR) Vβ5 + клеток от общего количества лимфоцитов, (B) процент CD44 + и CD62L — клеток (T эффекторные клетки, Teff) OT-I CD8 + Т-клеток, (C) процент CD69 + клетки OT-I Teff клеток, (D) медианная интенсивность флуоресценции (MFI) CD69 клеток OT-I Teff и (E) процент интерферона гамма (IFN-γ) — и TNF-α-экспрессирующих Клетки OT-I Teff после стимуляции in vitro пептидом SIINFEKL (5 мкМ).DN, дважды отрицательный по экспрессии IFN-γ и TNF-α. Показаны сопоставленные данные двух независимых экспериментов (CTRL, n = 7; MAT, n = 10). Данные на панелях (A – C) представлены как среднее + SEM. * p <0,05, непарный двусторонний тест Стьюдента t -тест.
Наивные MAT CD8
+ Т-клетки демонстрируют измененную передачу сигналов TCRМы ранее наблюдали, что MAT и CTRL эффекторные CD8 + Т-клетки, генерирующие in vitro после стимуляции TCR и CD28, имели аналогичную частоту IFN-γ-продуцирующих клеток через 24 часа после стимуляции, но эффекторные клетки MAT не смогли поддерживать IFN. Продукция -γ через 72 часа после стимуляции (36).Включение TCR и CD28 инициирует внутриклеточные сигнальные пути, которые приводят к активации факторов транскрипции, которые способствуют активации, пролиферации, дифференцировке, продукции цитокинов и выживанию Т-клеток (43). Митоген-активируемая протеинкиназа (MAPK) и сигнальные пути ядерного фактора-κB (NF-κB) имеют решающее значение для продукции IFN-γ Т-клетками (44–49). Мы предположили, что нарушение продукции IFN-γ в эффекторных Т-клетках MAT CD8 + является результатом измененной передачи сигналов, опосредованной TCR.Соответственно, мы проанализировали экспрессию и активацию проксимальных и дистальных белков, участвующих в передаче сигналов TCR, включая альфа-цепь CD8 (CD8α), бета-цепь TCR (TCRβ), проксимальную протеинтирозинкиназу ZAP-70, MAPKs Erk1 / 2, и член семейства факторов транскрипции NF-κB, c-Rel. Мы предположили, что внутренние дефекты клеток в MAT CD8 + Т-лимфоциты могут возникать в наивных клетках или позже, во время их эффекторной стадии. Было описано, что TCR-опосредованные сигнальные ответы различаются между наивными, эффекторными и субпопуляциями CD8 + Т-клеток памяти (50, 51).Таким образом, мы обогатили общие Т-клетки из селезенки неинфицированных мышей dol 15 MAT и CTRL для анализа передачи сигналов, опосредованной TCR, у наивных и in vitro, генерированных эффекторных Т-клеток CD8, + , с использованием проточной цитометрии.
Сначала мы проанализировали экспрессию CD8α и TCRβ в MAT и CTRL-наивных CD8 + Т-клетках. Мы отметили эквивалентную экспрессию этих белков клеточной поверхности в обеих группах (Рисунки 2A, B). Затем мы проанализировали экспрессию проксимальной сигнальной молекулы TCR ZAP-70.Несмотря на сниженные уровни экспрессии белка в MAT-наивных CD8 + Т-клетках (фиг. 2C), как MAT, так и CTRL-клетки проявляли эквивалентные уровни экспрессии pZAP-70 после перекрестного связывания TCR и CD28 (фигура 2D). Более того, стимуляция H 2 O 2 , которая обходит стимуляцию TCR и индуцирует фосфорилирование тирозина ZAP-70 (52), привела к эквивалентной активации ZAP-70 в MAT и CTRL-наивных CD8 + Т-клетках (Рисунок 2D) . Однако нестимулированные MAT наивные CD8 + Т-клетки демонстрировали повышенное соотношение pZAP-70 / ZAP-70 по сравнению с CTRL (рис. 2E).В совокупности эти результаты показали, что проксимальная TCR-опосредованная сигнальная способность не нарушена в MAT-наивных CD8 + Т-клетках и что ZAP-70 может быть гиперфосфорилирован в этих клетках.
Фигура 2. Лечение материнскими антибиотиками (MAT) и контрольные (CTRL) наивные CD8 + Т-клетки демонстрируют эквивалентную передачу сигналов, опосредованную проксимальным Т-клеточным рецептором (TCR) . Общее количество Т-лимфоцитов, обогащенных селезенками дня жизни 15 CTRL и MAT, мышей-младенцев анализировали на экспрессию (A) CD8α (CTRL, n = 7; MAT, n = 5), (B) TCRβ (CTRL, n = 13; MAT, n = 13), (C) ZAP-70 (CTRL, n = 11, MAT, n = 8) и (D ) фосфо-ЗАП-70 (pZAP-70) (CTRL, n = 6; MAT, n = 3) гейтирование наивных (CD44 —) CD8 + Т-клеток с помощью проточной цитометрии.Чтобы проанализировать экспрессию pZAP-70 (D) , Т-клетки не стимулировали (-) или стимулировали (+) анти-CD3 / анти-CD28 или H 2 O 2 в течение 2 минут при 37 ° C. . (E) Соотношение pZAP-70 / ZAP-70 в нестимулированных наивных CD8 + Т-клетках (CTRL, n = 6; MAT, n = 3). Показаны характерные графики (CTRL, белый; MAT, черный; пунктирная линия, отрицательный контроль окрашивания) и анализ средней интенсивности флуоресценции (MFI). Данные представляют два независимых эксперимента и представлены как среднее + стандартная ошибка среднего.** p <0,01, непарный двусторонний тест Стьюдента t -тест.
Затем мы оценили дистальные сигнальные компоненты пути передачи сигналов TCR, в частности, сосредоточив внимание на пути MAPK, регулируемом с помощью Erk1 / 2, поскольку его активация является критической для активации и дифференцировки Т-клеток (53). MAT и CTRL-наивные Т-клетки CD8 + показали аналогичные уровни экспрессии Erk2 (фиг. 3A) и после перекрестного связывания TCR / CD28, равные проценты (фиг. 3B) и уровни экспрессии pErk1 / 2 (фиг. 3C).Чтобы определить, была ли передача сигналов протеинкиназы C (PKC) выше пути Erk1 / 2 MAPK эквивалентна в MAT и CTRL-наивных Т-клетках CD8 + , мы обошли передачу сигналов TCR, активируя Т-клетки комбинацией сложного эфира форбола PMA. и ионофор кальция иономицин. PMA индуцирует аутофосфорилирование PKC, имитируя естественный лиганд диацилглицерин, и иономицин действует в синергии с PMA (54). Мы определили, что у наивных MAT CD8 + Т-клетки имели пониженную частоту и уровни экспрессии pErk1 / 2 при стимуляции PMA и иономицином, что позволяет предположить, что активация PKC и мобилизация Ca 2+ может быть в некоторой степени нарушена в этих клетках (Рисунки 3B). , В).Наконец, мы проанализировали экспрессию c-Rel, компонента пути передачи сигнала NF-κB, в MAT и CTRL-наивных Т-клетках CD8 + . Уровни его экспрессии были значительно снижены в клетках MAT по сравнению с CTRL (рис. 3D). В совокупности наши результаты демонстрируют, что хотя MAT и CTRL-наивные CD8 + Т-клетки демонстрируют эквивалентную проксимальную TCR-опосредованную передачу сигналов, дистальные и зависимые от кальция события передачи сигналов могут быть скомпрометированы.
Рисунок 3.Передача сигналов, опосредованная дистальными Т-клеточными рецепторами, нарушается при лечении материнскими антибиотиками (MAT) наивных CD8 + Т-клеток . Суммарные Т-клетки, обогащенные из селезенок контрольной группы 15-го дня жизни (CTRL) и новорожденных мышей MAT, анализировали на предмет (A) экспрессии Erk2 (CTRL, n = 5; MAT, n = 4), (B) процента фосфо-Erk-1/2 (pErk1 / 2) положительных клеток (CTRL, n = 5; MAT, n = 4), (C) экспрессия pErk1 / 2 (CTRL , n = 5; MAT, n = 4) и (D) экспрессия c-Rel (CTRL, n = 6; MAT, n = 3), гейтирование наивно (CD44 — ) CD8 + Т-клетки методом проточной цитометрии.Для анализа экспрессии pErk1 / 2 (B, C) Т-клетки оставляли нестимулированными (-) или стимулировали (+) анти-CD3 / анти-CD28 или форбол 12-миристат 13-ацетат (PMA) / иономицин в течение 2 дней. мин при 37 ° C. Показаны характерные графики (CTRL, белый; MAT, черный; пунктирная линия, отрицательный контроль окрашивания) и анализ средней интенсивности флуоресценции (MFI) или процента. Данные являются репрезентативными для двух независимых экспериментов, представлены как среднее значение + стандартная ошибка среднего и были проанализированы с помощью однофакторного дисперсионного анализа с использованием посттеста Холма – Сидака (B, C) или непарного двустороннего теста Стьюдента t -теста (D) .* p <0,05, ** p <0,01.
Эффектор MAT CD8
+ Т-клетки не поддерживают фосфорилирование Erk1 / 2Чтобы создать эффекторные Т-клетки CD8 + , мы очистили Т-клетки CD8 + из объединенных селезенок мышей dol 15 CTRL и MAT, совпадающих по полу, и стимулировали Т-клетки CD8 + анти-CD3 и анти-CD3. -CD28 до 72 часов. На этом этапе Т-клетки CD8 + приобрели эффекторный статус, основанный на экспрессии маркеров активации и дифференцировки клеточной поверхности, пролиферации и продукции цитокинов (рис. 4).И MAT, и CTRL CD8 + Т-клетки продемонстрировали эквивалентную пролиферацию и дифференцировку на основе экспрессии Ki-67 и CD44 (фиг.4A). Однако, несмотря на идентичные частоты эффекторных клеток CD25 + (рис. 4B), значительно сниженный процент эффекторных клеток MAT продуцировал IFN-γ по сравнению с эффекторами CTRL (рис. 4C), что согласуется с нашими предыдущими выводами. Это не было связано с различиями в выживаемости клеток, поскольку как MAT, так и CTRL эффекторные Т-клетки CD8 + проявляли идентичное процентное содержание аннексин V и 7-AAD-положительных клеток (фиг. 4D).
Рис. 4. Лечебные антибиотики матери (MAT) и контрольные (CTRL) эффекторные CD8 + Т-клетки пролиферируют и активируют одинаково, но эффекторы MAT производят меньше гамма-интерферона (IFN-γ) . CD8 + Т-клетки, очищенные из объединенных селезенок дня жизни 15 Мышей CTRL и MAT стимулировали анти-CD3 / анти-CD28 в течение 72 часов и анализировали на (A) процентное содержание Ki-67 и CD44 + клеток, (B) процентов CD25 + клеток эффекторных Т-клеток (CD44 + CD62L — , Teff) (CTRL, n = 6; MAT, n = 10), (C) процента IFN-γ + клеток Teff (CTRL, n = 11; MAT, n = 13) и (D) процента клеток Teff, положительных по 7-аминоактиномицину D и аннексину V. методом проточной цитометрии.Данные являются репрезентативными для трех независимых экспериментов, представлены как среднее значение + стандартная ошибка среднего и были проанализированы с помощью непарного двустороннего теста Стьюдента t -тест (B, C) . ** p <0,01.
Таким образом, чтобы определить, в какой момент времени во время дифференцировки эффекторных Т-клеток, у MAT CD8 + Т-клетки нарушена их способность эффективно передавать сигналы через TCR для поддержания продукции IFN-γ, мы проанализировали общее фосфорилирование тирозина белка ( pTyr), экспрессия ZAP-70 и экспрессия / активация Erk-1/2 через 24, 48 и 72 часа после стимуляции.В этих анализах мы обогащали общее количество Т-клеток из селезенки мышей dol 15 CTRL и MAT и стимулировали Т-клетки анти-CD3 и анти-CD28 в указанные моменты времени. Затем был проведен анализ по эффекторным (CD44 + ) CD8 + Т-клеткам. Анализ фосфорилирования тирозина общего белка, индуцированного TCR, показал, что MAT и CTRL эффекторные Т-клетки CD8 + экспрессируют аналогичные уровни фосфорилированных тирозином белков через 24 часа после стимуляции. Однако в течение последующих 48 часов эти уровни были заметно снижены в эффекторных Т-клетках MAT CD8 + по сравнению с эффекторами CTRL, что указывает на то, что TCR-опосредованные сигнальные события в MAT CD8 + Т-клетках не поддерживаются во время более поздние эффекторные стадии (рис. 5А).
Фигура 5. Эффектор антибиотика для матери (MAT) CD8 + Т-клетки не поддерживают фосфорилирование общего тирозина . Общие Т-клетки, обогащенные из селезенки контрольной группы 15-го дня жизни (CTRL) и мышей MAT, стимулировали анти-CD3 / анти-CD28 в течение 24, 48 и 72 часов и анализировали на предмет экспрессии общего белка (A) фосфорилирование тирозина (pTyr) (CTRL, n = 6; MAT, n = 5), (B) экспрессия ZAP-70 (CTRL, n = 7; MAT, n = 6) и (C) процента ZAP-70 и интерферон-гамма (IFN-γ) положительных клеток, блокирующих эффекторные (CD44 + ) CD8 + Т-клетки с помощью проточной цитометрии.Показаны характерные графики (CTRL, белый; MAT, черный) и анализ средней интенсивности флуоресценции (MFI). Данные представляют два независимых эксперимента и представлены как среднее + стандартная ошибка среднего. * p <0,05, ** p <0,01, *** p <0,001, односторонний дисперсионный анализ с посттестом Холма – Сидака.
Экспрессия ZAP-70 в Т-клетках увеличивается после продолжительной антигенной стимуляции, а повышенные уровни белка ZAP-70 в активированных Т-клетках CD4 + были связаны с приобретением эффекторных функций (т.е.е., продукция IFN-γ) (55). Поэтому мы проанализировали экспрессию ZAP-70 в эффекторных клетках MAT и CTRL CD8 + через 48 и 72 часа после стимуляции. Хотя экспрессия ZAP-70 была снижена в эффекторных Т-клетках MAT CD8 + через 48 часов после стимуляции, его экспрессия была эквивалентно повышена как в MAT, так и в CTRL эффекторных Т-клетках CD8 + к 72 часам (фиг. 5B). Следовательно, снижение продукции IFN-γ в эффекторных Т-клетках MAT CD8 + через 72 часа после стимуляции не было связано с нарушением экспрессии ZAP-70 (фиг. 5C).
Учитывая сходство экспрессии ZAP-70, мы исследовали дистальные сигнальные молекулы, необходимые для транскрипции генов цитокинов в эффекторных Т-клетках. Мы сосредоточили наш анализ на сигнальном пути Erk-1/2 и Erk2, учитывая его роль в активации Т-клеток и транскрипции IFN-γ (46, 47). Через 24 часа после стимуляции мы обнаружили сходную частоту и уровни экспрессии Erk2 в MAT и CTRL эффекторных Т-клетках CD8 + (Фигуры 6A, B). Кроме того, мы определили, что эффекторные Т-клетки MAT и CTRL CD8 + демонстрируют эквивалентные проценты и уровни экспрессии pErk1 / 2 после перекрестного связывания TCR и CD28 (Фигуры 6C, D).Однако уже через 48 и 2 часа после стимуляции эффекторные Т-клетки MAT CD8 + демонстрировали значительно сниженную частоту и уровни экспрессии pErk1 / 2 по сравнению с эффекторными клетками CTRL (Фигуры 6C, D). Хотя процент Erk2-экспрессирующих MAT и CTRL CD8 + Т-клеток оставался эквивалентным через 48 и 72 часа после стимуляции (фиг. 6A), эффекторные клетки MAT экспрессировали значительно меньшие количества Erk2 в эти моменты времени (фиг. 6B). Более тщательный анализ показал, что это происходит из-за бимодальной экспрессии Erk2 в эффекторных клетках MAT.Как показано на фиг. 6Е, большинство эффекторных Т-клеток MAT CD8 + экспрессировали от промежуточных до низких уровней Erk2, тогда как большинство эффекторов CTRL экспрессировали высокие уровни этого белка через 48 часов после стимуляции. Более того, в то время как и Erk2 lo — и Erk2 hi -экспрессирующие CTRL эффекторные CD8 + Т-клетки фосфорилировали Erk-1/2, только Erk2 hi -экспрессирующие MAT эффекторные CD8 + Т-клетки имели фосфорилированные Erk-клетки. -1/2 через 48 часов после стимуляции (рис. 6E).Кроме того, через 72 часа после стимуляции как Erk2 lo -, так и Erk hi , экспрессирующие MAT эффекторные Т-клетки CD8 + , не имели фосфорилированных Erk-1/2, в то время как эффекторные CTRL CD8 + Т-клетки сохраняли экспрессию Erk2 и устойчивое фосфорилирование Erk-1/2 (рисунок S1 в дополнительном материале). Более того, мы наблюдали точный паттерн экспрессии Erk2 и pErk1 / 2 в эффекторных Т-клетках MAT CD8 + , генерированных при стимуляции очищенных Т-клеток CD8 + анти-CD3 и анти-CD28 в течение 72 часов (рисунок S2 в дополнительном материале). ).Этот результат предполагает дифференциально регулируемый контроль ответной реакции на передачу сигналов (56) в эффекторных Т-клетках MAT CD8 + , что может способствовать отсутствию устойчивой активации Erk-1/2 (57).
Фигура 6. Эффекторная терапия материнскими антибиотиками (MAT) CD8 + Т-клетки не поддерживают фосфорилирование Erk-1/2 . Общее количество Т-клеток, обогащенных селезенками контрольной группы 15-го дня жизни (CTRL) и мышей MAT, стимулировали анти-CD3 / анти-CD28 в течение 24, 48 и 72 часов и анализировали на (A) процентное содержание Erk2 + клеток (CTRL, n = 7; MAT, n = 6), (B) экспрессия Erk2 (CTRL, n = 7; MAT, n = 6), (C ) процентов фосфо-Erk-1/2 (pErk1 / 2) -положительных клеток (CTRL, n = 7; MAT, n = 6) и (D) экспрессия pErk1 / 2 gating на эффектор (CD44 + ) CD8 + Т-клетки (Teff). (E) Процент CD8 + Teff-клеток, экспрессирующих низкие или высокие уровни Erk2 (Erk2 lo и Erk2 hi , соответственно) и стробирующий анализ их соответствующих популяций, экспрессирующих pErk1 / 2, через 48 ч после стимуляция. Данные представляют два независимых эксперимента и представлены как среднее + стандартная ошибка среднего. * p <0,05, **** p <0,0001, односторонний дисперсионный анализ с посттестом Холма – Сидака.
ОбработкаLPS увеличивает продукцию IFN-γ в эффекторных клетках MAT CD8
+ In vivo и In VitroБыло показано, что лечение LPS может восстанавливать нарушенную продукцию IFN-γ Т-клетками на модели взрослых мышей с антибиотико-опосредованным дисбактериозом вируса гриппа A (58).Таким образом, мы решили оценить, может ли обработка ЛПС in vivo , в качестве заместителя для колонизации грамотрицательными бактериями, отсутствующими у мышей MAT (36), увеличивать продукцию цитокинов, опосредованную Т-клетками, и спасать новорожденных мышей MAT от смерти после системная вирусная инфекция. Мышей-младенцев Dol 15 MAT и CTRL инфицировали Vac-OVA (1 × 10 4 БОЕ внутрибрюшинно) и лечили ЛПС из E.coli (50 мкг og), начиная с дня заражения и продолжая каждый второй. день в течение 10 дней.В doi 11 мы проанализировали цитокиновый ответ селезенки MAT и CTRL эффекторных Т-клеток CD8 + и наблюдали, что обработка LPS увеличивала продукцию IFN-γ и TNF-α в эффекторных Т-клетках MAT CD8 + до уровней CTRL, тогда как у него умеренный эффект в ячейках CTRL (рис. 7A). Более того, лечение LPS значительно увеличивало выживаемость младенцев MAT, в то время как необработанные животные погибали на пике вирусной инфекции, 60% мышей MAT, получавших LPS, выживали при системной инфекции вирусом осповакцины (фигура 7B).Мы также оценили влияние обработки LPS на продукцию IFN-γ и TNF-α из MAT селезенки эффекторными CD8 + Т-клетками, генерировавшими in vitro . Обогащенные MACS CD8 + Т-клетки селезенки стимулировали анти-CD3 / CD28 в отсутствие или в присутствии ЛПС E. coli 055: B5 (1 мкг / мл) в течение 72 часов. Чистота Т-клеток CD8 + в этих культурах составляла до 97% (рисунок S3 в дополнительном материале). По сравнению с CTRL эффекторными Т-клетками CD8 + эффекторы MAT, культивированные в отсутствие LPS, снова продемонстрировали пониженный процент клеток, продуцирующих IFN-γ и TNF-α.Включение LPS во время стимуляции эффекторов MAT, происходящих из селезенки, привело к усилению продукции IFN-γ и неизменной продукции TNF-α (фигура 7C). Эффект LPS, по-видимому, был специфическим, поскольку мы также выполнили те же анализы с использованием CD8 + Т-клеток, очищенных из объединенных селезенок dol 15 MAT и CTRL TLR4KO и MyD88KO мышей. Мы наблюдали, что эффекторы MAT TLR4KO и MyD88KO, стимулированные в отсутствие LPS, демонстрируют меньшее количество клеток, продуцирующих IFN-γ и TNF-α, чем CTRL, а добавление LPS во время стимуляции TCR не усиливает профили продукции цитокинов ни в CTRL, ни в CTRL. Полученные из MAT CD8 + Т-клетки (фиг. 8).Эти результаты предполагают, что при определенных обстоятельствах дисбиоза GIM лечение LPS может представлять собой эффективное вмешательство для восстановления функции Т-клеток CD8 + и повышения устойчивости к вирусным инфекциям.
Фигура 7. Обработка липополисахаридом (LPS) усиливает продукцию гамма-интерферона (IFN-γ) в эффекторных CD8 + клеток in vivo и in vitro материнских антибиотиков. Контрольных (CTRL) и MAT младенцев мышей инфицировали в день жизни (dol) 15 овальбумином осповакцины (Vac-OVA, 1 × 10 4 БОЕ внутрибрюшинно) и обрабатывали ЛПС, полученным из Escherichia coli (50 мкг о.ж.) через день в течение 10 дней (Vac-OVA + LPS). (A) На 11 день инфицирования лимфоциты выделяли из селезенок мышей CTRL и MAT и стимулировали in vitro пептидом SIINFEKL, форбол 12-миристат 13-ацетатом и иономицином в течение 5 часов для анализа процентное соотношение продуцирующих IFN-γ и TNF-α CD8 + T эффекторных клеток (CD44 + CD62L —, Teff) по данным проточной цитометрии (CTRL Vac-OVA, n = 3; CTRL Vac-OVA + LPS, n = 7; MAT Vac-OVA, n = 2; MAT Vac-OVA + LPS, n = 3). (B) Кривая выживаемости новорожденных мышей CTRL и MAT после инфекции Vac-OVA и лечения LPS (CTRL Vac-OVA, n = 5; CTRL Vac-OVA + LPS, n = 5; MAT Vac-OVA , n = 2; MAT Vac-OVA + LPS, n = 11). Сравнение кривых выживаемости проводили с помощью логрангового критерия (Мантела – Кокса). Данные представляют два эксперимента по заражению. (C) Объединенные CD8 + Т-клетки, выделенные из селезенки неинфицированных dol 15 CTRL ( n = 3) и MAT ( n = 6) новорожденных мышей стимулировали анти-CD3 / анти-CD28 с помощью или без ЛПС Escherichia coli (1 мкг / мл) в течение 72 часов и анализировали на процентное содержание IFN-γ и TNF-α-продуцирующих клеток Teff с помощью проточной цитометрии.Данные представляют из трех независимых экспериментов.
Фигура 8. Производство контрольных цитокинов (CTRL) и лечение материнскими антибиотиками (MAT) TLR4KO и MyD88KO эффекторные CD8 + Т-клетки в ответ на липополисахарид (LPS) . Объединенные CD8 + Т-клетки, выделенные из селезенки неинфицированного дня жизни 15 CTRL TLR4KO ( n = 2), MAT TLR4KO ( n = 5), CTRL MyD88KO ( n = 5) и MAT MyD88KO ( n = 4) детенышей мышей стимулировали анти-CD3 и анти-CD28 с или без ЛПС, полученного из Escherichia coli (1 мкг / мл), в течение 72 часов.Анализ процентного содержания интерферона гамма (IFN-γ) и TNF-α-продуцирующих эффекторных CD8 + Т-клеток (CD44 + CD62L —) проводили с помощью проточной цитометрии. DN, дважды отрицательный по экспрессии IFN-γ и TNF-α. Данные представляют два независимых эксперимента.
Обсуждение
Цель нашего исследования — понять, как микробиом желудочно-кишечного тракта (ЖКТ) влияет на адаптивный противовирусный иммунитет в младенчестве. Мы обнаружили, что CD8 + Т-клетки от младенцев, рожденных от матерей, леченных антибиотиками (MAT), демонстрируют заметно сниженные ответы IFN-γ в отличие от мышей CTRL того же возраста, которые развиваются с нормальным GIM.MAT CD8 + Т-клеточные ответы подавлялись как in vivo, после сублетальной вирусной инфекции, так и in vitro, после стимуляции TCR / CD28. Эксперименты in vitro показали, что детские CD8 + Т-клетки MAT поддерживают внутреннюю клеточную дисфункцию при удалении из среды их хозяина. Эта внутренняя дисфункция не была полностью восстановлена после переноса 15-дневных Т-клеток MAT в соответствующую по возрасту недисбиотическую среду хозяина или после обработки E.coli — производный LPS. В совокупности наши результаты демонстрируют, что системные Т-клетки, которые развиваются у мышей с GIM-дисбиозом, демонстрируют дисфункцию Т-клеток из-за измененной экспрессии и активации ключевых сигнальных белков TCR, что ставит под угрозу устойчивую продукцию цитокинов Т-клетками.
Наши результаты предполагают, что дисбиотическая среда, присутствующая в младенческих мышах MAT, импринтирует их периферические Т-клетки CD8 + и подавляет внутреннюю чувствительность, хотя точный механизм, опосредующий этот эффект, еще не ясен.В то время как младенческие Т-клетки могут генерировать ответы, подобные взрослым, при определенных обстоятельствах (59), новые исследования неонатальных Т-клеток из нормальной среды микробиоты хозяина подтверждают, что внутренние свойства отличают их реактивность на ТКО от ювенильных и взрослых Т-клеток (60, 61). Т-клетки CD4 + , происходящие из пуповинной крови человека, были обнаружены с дефицитом TCR-ассоциированных сигнальных молекул, включая низкую экспрессию Lck, неэффективное фосфорилирование Lck и снижение экспрессии TCR-ассоциированного белка ниже по течению (62, 63).Кроме того, неонатальные CD8 + Т-клетки человека, полученные из пуповинной крови, по-видимому, нуждаются в IL-12 для обеспечения «третьего сигнала» после стимуляции CD3 и CD28 для достижения максимальной экспансии, пролиферации, продукции IL-2 и дифференцировки в IFN. -γ-продуцирующие эффекторные клетки (64). Для достижения максимального фосфорилирования проксимальных сигнальных молекул и сигнальных молекул TCR более поздней стадии требуется устойчивая передача сигналов IL-12 в течение по крайней мере 72 часов. Таким образом, проксимальные и дистальные сигнальные события могут не действовать согласованно в детских Т-клетках, модифицируя их реакцию на TCR-зависимую передачу сигналов для активации и дифференцировки.Мы аналогичным образом отметили различия в проксимальной экспрессии и последующем устойчивом фосфорилировании в MAT CD8 + Т-клетках. Обнаружение дифференциальной экспрессии Erk1 / 2 в эффекторных Т-клетках MAT CD8 + было неожиданным, однако более низкая экспрессия Erk1 / 2 коррелировала со сниженной и плохо устойчивой активацией в этих клетках. Мы предполагаем, что эта дифференциальная экспрессия может быть связана с альтернативными вариантами сплайсинга или другими внутренними факторами, регулирующими посттрансляционную стабильность белка Erk1 / 2 (65) в эффекторных Т-клетках MAT CD8 + .Будущие эксперименты будут направлены на оценку этих возможностей. В целом, наши результаты указывают на потребность в численно плотном и разнообразном GIM для обеспечения полной эффекторной функции детских CD8 + Т-клеток.
В дополнение к различиям в передаче сигналов Т-клетками, младенцы также характеризуются отчетливым GIM (66). Следовательно, функциональное поведение и фенотип адаптивных Т-клеточных ответов младенцев, регулируемых GIM, могут не быть эквивалентными взрослым. У взрослых мышей истощение микробиоты антибиотиками подавляло активацию инфламмасом и экспрессию генов противовирусной защиты в клетках врожденного иммунитета, что приводило к слабым гриппоспецифическим или LCMV-специфическим ответам Т-клеток (67, 68).Однако наши результаты показывают, что дисбактериоз детского GIM напрямую влияет на младенческие CD8 + Т-клетки, что еще больше ставит под угрозу и без того сниженную способность младенческих Т-клеток генерировать достаточные ответы, управляемые IFN-γ (28).
Мы наблюдали повышенное соотношение pZAP-70 / ZAP-70 в нестимулированных MAT, наивных CD8 + Т-клеток по сравнению с CTRL-клетками. Есть преимущество, что измененный GIM может влиять на базовую активацию системных Т-клеток. Хуанг и др. установили модель мыши с ограниченной флорой, в которой мышей поддерживают с ограниченной микробиотой, определяемой шестью непатогенными видами Clostridium .Они наблюдали, что взрослые селезеночные наивные CD4 + Т-клетки проявляли гиперреактивность TCR, которая была связана с повышенным фосфорилированием сигнальных молекул ZAP-70, Lck и LAT, а также повышенной активацией, вызванной гибелью клеток (69). Возможно, что изменения в TCR-опосредованной передаче сигналов в MAT T-клетках включают гиперфосфорилированные базальные уровни критических проксимальных и промежуточных сигнальных белков для компенсации нижестоящих дефицитов. Так же, как Хуанг и др., Мы аналогичным образом предполагаем, что пониженная микробная среда у мышей MAT либо подавляет исходное состояние, необходимое для функционального гомеостаза Т-клеток, либо циркулирующие метаболиты микробиома регулируют дифференциальную чувствительность Т-клеток CD8 + .Снижение плотности или разнообразия видов, продуцирующих иммунорегулирующие метаболиты, может, таким образом, влиять на нормальные паттерны транскрипции и регуляции сигналов в периферических детских Т-клетках, зависящих от этих продуктов.
Множество механизмов, с помощью которых продукты, полученные из микробиоты, опосредуют иммунные эффекты, еще предстоит полностью охарактеризовать (70, 71). Согласно недавнему исследованию, способность вырабатывать воспалительные цитокины лимфоцитами периферической крови человека была связана с GIM и конкретными микробными метаболическими путями (72).Кроме того, показано, что два хорошо описанных примера факторов микробного происхождения регулируют Т-клетки in vivo . ПСА, продуцируемый Bacteroides fragilis , задействует TLR2, экспрессируемый на Т-клетках, чтобы способствовать дифференцировке Treg в периферических лимфоидных тканях (73). Бутират короткоцепочечных жирных кислот служит источником энергии для эпителиальных клеток толстой кишки, но также опосредует гомеостаз и функцию иммунной системы, связываясь с GPR43, экспрессируемым на множестве врожденных и адаптивных иммунных клеток, в частности на Treg (74).Бутират также способен управлять эпигенетической модификацией генов, воздействуя на HDAC (35). Учитывая важность эпигенетических механизмов, участвующих в регуляции развития и функции детских Т-клеток (32, 75), интересно предположить, насколько они проницаемы для циркулирующих бактериальных метаболитов, происходящих из детского GIM. Прямое действие ЛПС на обогащенные или очищенные человеческие и мышиные Т-клетки in vitro было описано ранее (76). Однако мы не можем полностью исключить, что in vitro эффекты LPS CD8 + Т-клеток в нашем анализе были опосредованы через , загрязняющие врожденные эффекторы, поскольку мы не использовали сортированные очищенные клетки.Тем не менее, LPS успешно использовался в качестве адъюванта для усиления вирусных и вакциноспецифических ответов in vivo (58, 77), и мы действительно наблюдали положительный эффект LPS бактериального происхождения на усиление функции MAT Т-клеток и MAT у младенцев. выживаемость мышей после вирусной инфекции. Частичный ответ, наблюдаемый у мышей, может указывать на то, что лечение было проведено слишком поздно, чтобы полностью восстановить функциональные ответы MAT, и что существуют определенные возрастные окна, когда должен присутствовать нормальный GIM, чтобы поддерживать развитие и функцию нормального иммунитета.
Младенчество и детство — это период, отмеченный повышенной исходной восприимчивостью к вирусным инфекциям, а также период жизни, когда вводится большинство вакцин. Таким образом, оценка того, как дисбиоз GIM в этот период жизни может изменять Т-клеточный иммунитет, имеет решающее значение для нашего понимания иммунитета младенцев в целом и для разработки стратегий, которые могут защитить или усилить Т-клеточный иммунитет CD8 + . Наши результаты предполагают, что GIM младенца импринтирует функцию Т-лимфоцитов CD8 + в течение этого периода жизни и может иметь долгосрочные последствия.Наш текущий и будущий анализ этой модели включает (1) определение длительного воздействия дисбиоза GIM на функцию Т-лимфоцитов, особенно в генерации долговременной памяти, (2) стратегии тестирования, которые можно использовать для коррекции дисфункции, (3) и оценка роли микробных метаболитов GIM младенческого происхождения в регуляции противовирусного иммунитета Т-клеток CD8 + .
Взносы авторов
GG-P и EL-S разработали и провели эксперименты, проанализировали и интерпретировали данные, подготовили рисунки и написали рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Исследование, описанное в этой публикации, было проведено в CCTI Flow Cytometry Core.
Финансирование
Эта работа была поддержана Премией Гарольда Амоса в области развития факультетов от Фонда Роберта Вуда Джонсона (грант № 71107) и Премией факультета Колумбийского университета за разнообразие.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и интерпретации данных или в принятии решения о представлении работы для публикации.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу https://www.frontiersin.org/article/10.3389/fimmu.2017.00265/full#supplementary-material.
Сокращения
ГИМ, микробиом желудочно-кишечного тракта; TCR, рецептор Т-клеток; ERK, киназа, регулируемая внеклеточными сигналами; ЛПС, липополисахарид; TLR, толл-подобный рецептор; PMA, форбол 12-миристат 13-ацетат.
Список литературы
2. Макферсон А.Дж., Харрис Н.Л. Взаимодействие между комменсальными кишечными бактериями и иммунной системой. Nat Rev Immunol (2004) 4 (6): 478–85. DOI: 10.1038 / nri1373
CrossRef Полный текст | Google Scholar
3. Zhang Z, Li J, Zheng W., Zhao G, Zhang H, Wang X и др. Увеличение и поддержание объема периферических лимфоидов контролируются микробиотой кишечника через дендритные клетки RALDH +. Иммунитет (2016) 44 (2): 330–42. DOI: 10.1016 / j.immuni.2016.01.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Иванов И.И., Атараши К., Манель Н., Броди Э.Л., Шима Т., Караоз У и др. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Cell (2009) 139 (3): 485–98. DOI: 10.1016 / j.cell.2009.09.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Атараси К., Тануэ Т., Шима Т., Имаока А., Кувахара Т., Момосе И. и др. Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium . Наука (2011) 331 (6015): 337–41. DOI: 10.1126 / science.1198469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Zeissig S, Blumberg RS. Комменсальная микробиота и NKT-клетки в контроле воспалительных заболеваний слизистых оболочек. Curr Opin Immunol (2013) 25 (6): 690–6. DOI: 10.1016 / j.coi.2013.09.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Хансен С.Х., Нильсен Д.С., Кверка М., Закостельска З., Климесова К., Худкович Т. и др.Паттерны ранней колонизации кишечника формируют будущие иммунные ответы хозяина. PLoS One (2012) 7 (3): e34043. DOI: 10.1371 / journal.pone.0034043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука (2012) 336 (6080): 489–93. DOI: 10.1126 / science.1219328
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Рассел С.Л., Голд М.Дж., Хартманн М., Виллинг Б.П., Торсон Л., Влодарска М. и др. Изменения микробиоты в раннем возрасте, вызванные приемом антибиотиков, повышают восприимчивость к аллергической астме. EMBO Rep (2012) 13 (5): 440–7. DOI: 10.1038 / embor.2012.32
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Shaw SY, Blanchard JF, Bernstein CN. Связь между применением антибиотиков на первом году жизни и воспалительным заболеванием кишечника у детей. Am J Gastroenterol (2010) 105 (12): 2687–92.DOI: 10.1038 / ajg.2010.398
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Метсала Дж., Лундквист А., Вирта Л. Дж., Кайла М., Гисслер М., Виртанен С. М.. Пренатальное и послеродовое воздействие антибиотиков и риск астмы в детстве. Clin Exp Allergy (2015) 45 (1): 137–45. DOI: 10.1111 / cea.12356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, et al.Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. Sci Transl Med (2015) 7 (307): 307ra152. DOI: 10.1126 / scitranslmed.aab2271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ливанос А.Е., Грейнер Т.У., Вангаи П., Патмасири В., Стюарт Д., МакРитчи С. и др. Опосредованное антибиотиками нарушение микробиома кишечника ускоряет развитие диабета 1 типа у мышей. Nat Microbiol (2016) 1: 16140. DOI: 10,1038 / нмикробиол.2016.140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Кениг Дж. Э., Спор А., Скалфон Н., Фрикер А. Д., Стомбо Дж., Найт Р. и др. Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc Natl Acad Sci U S A (2011) 108 (Дополнение 1): 4578–85. DOI: 10.1073 / pnas.1000081107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Backhed F, Roswall J, Peng Y, Feng Q, Jia H, Kovatcheva-Datchary P, et al.Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин (2015) 17 (5): 690–703. DOI: 10.1016 / j.chom.2015.04.004
CrossRef Полный текст | Google Scholar
17. Норгаард М., Эренштейн В., Нильсен РБ, Баккетейг Л.С., Соренсен Х.Т. Использование антибиотиков матерями, госпитализация по поводу инфекции во время беременности и риск детской эпилепсии: популяционное когортное исследование. PLoS One (2012) 7 (1): e30850. DOI: 10,1371 / журнал.pone.0030850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Broe A, Pottegard A, Lamont RF, Jorgensen JS, Damkier P. Увеличение использования антибиотиков во время беременности в период 2000-2010 гг .: распространенность, время, категория и демография. BJOG (2014) 121 (8): 988–96. DOI: 10.1111 / 1471-0528.12806
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Хикс Л.А., Барточес М.Г., Робертс Р.М., Суда К.Дж., Ханклер Р.Дж., Тейлор Т.Х. мл. И др.Различия в назначении антибиотиков в амбулаторных условиях в США в зависимости от географии, популяции пациентов и специализации провайдера в 2011 году. Clin Infect Dis (2015) 60 (9): 1308–16. DOI: 10.1093 / cid / civ076
CrossRef Полный текст | Google Scholar
21. Верани Дж. Р., Макги Л., Шраг С. Дж.; Отдел бактериальных болезней NCfI, Респираторные заболевания CfDC, Профилактика. Профилактика перинатального стрептококкового заболевания группы B — пересмотренное руководство CDC, 2010. MMWR Recomm Rep (2010) 59 (RR – 10): 1–36.
Google Scholar
22. Zeissig S, Blumberg RS. Жизнь в начале: нарушение микробиоты антибиотиками в раннем возрасте и его роль в здоровье и болезнях. Nat Immunol (2014) 15 (4): 307–10. DOI: 10.1038 / ni.2847
CrossRef Полный текст | Google Scholar
23. Вангай П., Уорд Т., Гербер Дж. С., Найтс Д. Антибиотики, детский дисбактериоз и болезни. Клеточный микроб-хозяин (2015) 17 (5): 553–64. DOI: 10.1016 / j.chom.2015.04.006
CrossRef Полный текст | Google Scholar
24.Алоизио I, Квальяриелло А., Де Фанти С., Луизелли Д., Де Филиппо С., Альбанезе Д. и др. Оценка воздействия антибиотикопрофилактики во время родов на микробиоту кишечника новорожденных с использованием подхода секвенирования, нацеленного на мульти-гипервариабельные участки 16S рДНК. Appl Microbiol Biotechnol (2016) 100 (12): 5537–46. DOI: 10.1007 / s00253-016-7410-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Азад М.Б., Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др.Влияние антибиотиков во время родов, метода родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. BJOG (2016) 123 (6): 983–93. DOI: 10.1111 / 1471-0528.13601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Корвалья Л., Тонти Дж., Мартини С., Ацети А, Маццола Дж., Алоизио I и др. Влияние интранатальной антибиотикопрофилактики стрептококка группы B на микробиоту кишечника в первый месяц жизни. J Pediatr Gastroenterol Nutr (2016) 62 (2): 304–8. DOI: 10.1097 / MPG.0000000000000928
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Jaureguy F, Carton M, Panel P, Foucaud P, Butel MJ, Doucet-Populaire F. Влияние пенициллиновой профилактики во время родов на бактериальную колонизацию кишечника у младенцев. J Clin Microbiol (2004) 42 (11): 5184–8. DOI: 10.1128 / JCM.42.11.5184-5188.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Смит Н.Л., Виссинк Э., Ван Дж., Пинелло Дж.Ф., Давенпорт М.П., Гримсон А. и др. Быстрая пролиферация и дифференцировка нарушают развитие CD8 + Т-клеток памяти в раннем возрасте. J Immunol (2014) 193 (1): 177–84. DOI: 10.4049 / jimmunol.1400553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Winders BR, Schwartz RH, Bruniquel D. Отдельная область промотора IFN-гамма мыши гипометилируется в результате раннего развития Т-клеток посредством дифференцировки зрелых наивных клеток и клеток Th2, но гиперметилируется в клетках Th3. J Immunol (2004) 173 (12): 7377–84. DOI: 10.4049 / jimmunol.173.12.7377
CrossRef Полный текст | Google Scholar
31. Том Дж. Дж., Бикхэм К. Л., Омура Ю., Кубота М., Мацуока Н., Гордон С. и др. Компартментализация дифференцировки и регуляторной функции Т-клеток человека в слизистой и лимфоидных тканях. Nat Med (2016) 22 (1): 72–7. DOI: 10,1038 / нм. 4008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Галиндо-Альбарран А.О., Лопес-Порталес, Огайо, Гутьеррес-Рейна Д.Й., Родригес-Хорхе О, Санчес-Вильянуэва Дж. А., Рамирес-Плиего О. и др.CD8 + Т-клетки новорожденных человека склонны к врожденному иммунному ответу. Cell Rep (2016) 17 (8): 2151–60. DOI: 10.1016 / j.celrep.2016.10.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Апхэм Дж. У., Рейт А, Роу Дж., Кусел М., Хитрый П. Д., Холт П. Г.. Незрелость дендритных клеток в младенчестве ограничивает способность экспрессировать вакцино-специфическую Т-клеточную память. Infect Immun (2006) 74 (2): 1106–12. DOI: 10.1128 / IAI.74.2.1106-1112.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Гомес де Агуэро М., Ганал-Вонарбург С.К., фюрер Т., Рупп С., Учимура Ю., Ли Х и др. Материнская микробиота способствует раннему постнатальному развитию врожденного иммунитета. Наука (2016) 351 (6279): 1296–302. DOI: 10.1126 / science.aad2571
CrossRef Полный текст | Google Scholar
35. Пак Дж., Ким М., Кан С.Г., Джаннаш А.Х., Купер Б., Паттерсон Дж. И др. Короткоцепочечные жирные кислоты индуцируют как эффекторные, так и регуляторные Т-клетки путем подавления гистондеацетилаз и регуляции пути mTOR-S6K. Mucosal Immunol (2015) 8 (1): 80–93. DOI: 10,1038 / mi.2014.44
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Гонсалес-Перес Г., Хикс А.Л., Текиели Т.М., Раденс С.М., Уильямс Б.Л., Ламуз-Смит Е.С. Лечение матери антибиотиками влияет на развитие кишечного микробиома новорожденных и противовирусный иммунитет. J Immunol (2016) 196 (9): 3768–79. DOI: 10.4049 / jimmunol.1502322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Zecher D, van Rooijen N, Rothstein DM, Shlomchik WD, Lakkis FG. Врожденная реакция на несамостоятельную аллогенную реакцию со стороны моноцитов. J Immunol (2009) 183 (12): 7810–6. DOI: 10.4049 / jimmunol.04
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Моисей К.Т., Торстенсон К.М., Джеймсон С.К., Хоруц А. Конкуренция за собственные лиганды сдерживает гомеостатическую пролиферацию наивных Т-лимфоцитов CD4. Proc Natl Acad Sci U S. A (2003) 100 (3): 1185–90. DOI: 10.1073 / PNAS.0334572100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Xiao Z, Curtsinger JM, Prlic M, Jameson SC, Mescher MF. Т-клеточный ответ CD8 на вирус коровьей оспы демонстрирует сайт-зависимую гетерогенность функциональных ответов. Int Immunol (2007) 19 (6): 733–43. DOI: 10.1093 / intimm / dxm039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Hersperger AR, Siciliano NA, Eisenlohr LC. Сравнимая полифункциональность мышиных Т-клеток, специфичных для вируса эктромелии и вируса коровьей оспы, несмотря на заметно разную репликацию и патогенность in vivo. J Virol (2012) 86 (13): 7298–309. DOI: 10.1128 / JVI.00038-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Harari A, Dutoit V, Cellerai C, Bart PA, Du Pasquier RA, Pantaleo G. Функциональные признаки защитного противовирусного Т-клеточного иммунитета при вирусных инфекциях человека. Immunol Rev (2006) 211: 236–54. DOI: 10.1111 / j.0105-2896.2006.00395.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Браунли Р.Дж., Замойская Р.Сигнальные сети рецепторов Т-клеток: разветвленные, разнообразные и ограниченные. Nat Rev Immunol (2013) 13 (4): 257–69. DOI: 10.1038 / nri3403
CrossRef Полный текст | Google Scholar
44. Ринкон М., Энслен Х., Рейнго Дж., Рехт М., Заптон Т., Су М.С. и др. Экспрессия гамма-интерферона эффекторными Т-клетками Th2, опосредованная сигнальным путем киназы p38 MAP. EMBO J (1998) 17 (10): 2817–29. DOI: 10.1093 / emboj / 17.10.2817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Merritt C, Enslen H, Diehl N, Conze D, Davis RJ, Rincon M. Активация митоген-активируемой протеинкиназы p38 in vivo селективно индуцирует апоптоз CD8 (+), но не CD4 (+) Т-клеток. Mol Cell Biol (2000) 20 (3): 936–46. DOI: 10.1128 / MCB.20.3.936-946.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Эгертон М., Фицпатрик Д. Р., Келсо А. Активация пути киназы, регулируемого внеклеточными сигналами, по-разному необходима для стимулированного TCR продукции шести цитокинов в первичных Т-лимфоцитах. Int Immunol (1998) 10 (2): 223–9. DOI: 10.1093 / intimm / 10.2.223
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Dumont FJ, Staruch MJ, Fischer P, DaSilva C., Camacho R. Ингибирование активации Т-клеток фармакологическим нарушением киназы MEK1 / ERK MAP или сигнальных путей кальциневрина приводит к дифференциальной модуляции продукции цитокинов. J Immunol (1998) 160 (6): 2579–89.
PubMed Аннотация | Google Scholar
48.Corn RA, Aronica MA, Zhang F, Tong Y, Stanley SA, Kim SR, et al. Внутренняя потребность Т-клеток в индукции NF-каппа B в постдифференцированной продукции IFN-гамма и клональной экспансии в ответе Th2. J Immunol (2003) 171 (4): 1816–24. DOI: 10.4049 / jimmunol.171.4.1816
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Сика А., Дорман Л., Виджиано В., Чиппителли М., Гош П., Райс Н. и др. Взаимодействие NF-kappaB и NFAT с промотором гамма-интерферона. J Biol Chem (1997) 272 (48): 30412-20. DOI: 10.1074 / jbc.272.48.30412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Mehlhop-Williams ER, Bevan MJ. Память CD8 + Т-клетки предъявляют повышенные требования к порогу антигена для пролиферации воспоминаний. J Exp Med (2014) 211 (2): 345–56. DOI: 10.1084 / jem.20131271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Керш Э.Н., Кеч С.М., Онами Т.М., Моран М., Уэрри Э.Дж., Мичели М.К. и др.Трансдукция сигнала TCR в антиген-специфических Т-клетках памяти CD8. J Immunol (2003) 170 (11): 5455–63. DOI: 10.4049 / jimmunol.170.11.5455
CrossRef Полный текст | Google Scholar
52. Schieven GL, Mittler RS, Nadler SG, Kirihara JM, Bolen JB, Kanner SB, et al. Участие тирозинкиназы ZAP-70, CD45 и Т-клеточного рецептора в УФ- и Н-индуцированной передаче сигнала Т-клеток. J Biol Chem (1994) 269 (32): 20718–26.
PubMed Аннотация | Google Scholar
53.Адачи К., Дэвис ММ. Лигирование рецепторов Т-клеток индуцирует различные пути передачи сигналов в наивных Т-клетках по сравнению с Т-клетками, испытавшими антиген. Proc Natl Acad Sci U S A (2011) 108 (4): 1549–54. DOI: 10.1073 / pnas.1017340108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Chatila T, Silverman L, Miller R, Geha R. Механизмы активации Т-клеток ионофором кальция иономицином. J Immunol (1989) 143 (4): 1283–9.
Google Scholar
56.Birtwistle MR, Rauch J, Kiyatkin A, Aksamitiene E, Dobrzynski M, Hoek JB, et al. Возникновение бимодальных ответов клеточной популяции в результате взаимодействия аналоговой одноклеточной передачи сигналов и шума экспрессии белка. BMC Syst Biol (2012) 6: 109. DOI: 10.1186 / 1752-0509-6-109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Краус И., Бесонг Агбо Д., Отто М., Вильтфанг Дж., Клафки Х. Обнаружение и дифференциация треонин- и тирозин-монофосфорилированных форм ERK1 / 2 с помощью капиллярного изоэлектрического фокусирующего иммуноанализа. Научный журнал (2015) 5: 12767. DOI: 10.1038 / srep12767
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Ичинохе Т., Панг И.К., Кумамото Ю., Пипер Д.Р., Хо Дж. Х., Мюррей Т.С. и др. Микробиота регулирует иммунную защиту от инфекции, вызванной вирусом гриппа А. Proc Natl Acad Sci U S A (2011) 108 (13): 5354–9. DOI: 10.1073 / pnas.1019378108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Марчант А., Аппей В., Ван дер Санде М., Дульфи Н., Лиснард С., Кидд М. и др.Ответ зрелых CD8 (+) Т-лимфоцитов на вирусную инфекцию во время жизни плода. J Clin Invest (2003) 111 (11): 1747–55. DOI: 10.1172 / JCI17470
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Баша С., Сурендран Н., Пичичеро М. Иммунные ответы у новорожденных. Expert Rev Clin Immunol (2014) 10 (9): 1171–84. DOI: 10.1586 / 1744666X.2014.942288
CrossRef Полный текст | Google Scholar
62. Мисиа С., Ди Бальдассар А., Сабатино Дж., Бонвини Е., Рана Р. А., Витале М. и др.Неэффективная активация фосфолипазы C и пониженная экспрессия Lck характеризуют дефект передачи сигналов Т-лимфоцитов пуповины. J Immunol (1999) 163 (5): 2416–24.
PubMed Аннотация | Google Scholar
63. Мисиа С., Ди Бальдассарре А., Катальди А., Рана Р. А., Ди Пьетро Р., Боско Д. и др. Иммуноцитохимическая локализация изоферментов фосфолипазы C в пуповинной крови и Т-лимфоцитах взрослых. J. Histochem Cytochem (1999) 47 (7): 929–36. DOI: 10.1177 / 0022155490710
CrossRef Полный текст | Google Scholar
65.Раман М., Чен В., Кобб М.Х. Дифференциальное регулирование и свойства МАПК. Онкоген (2007) 26 (22): 3100–12. DOI: 10.1038 / sj.onc.1210392
CrossRef Полный текст | Google Scholar
66. Яцуненко Т., Рей Ф.Е., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М. и др. Микробиом кишечника человека в зависимости от возраста и географии. Nature (2012) 486 (7402): 222–7. DOI: 10.1038 / nature11053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67.Ichinohe T, Lee HK, Ogura Y, Flavell R, Iwasaki A. Распознавание вируса гриппа инфламмасомами необходимо для адаптивных иммунных ответов. J Exp Med (2009) 206 (1): 79–87. DOI: 10.1084 / jem.20081667
CrossRef Полный текст | Google Scholar
68. Abt MC, Osborne LC, Монтичелли Л.А., Деринг Т.А., Аленгхат Т., Зонненберг Г.Ф. и др. Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета. Иммунитет (2012) 37 (1): 158–70. DOI: 10.1016 / j.иммунитет.2012.04.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Хуанг Т., Вэй Б., Веласкес П., Борнеман Дж., Браун Дж. Комменсальная микробиота изменяет численность и реакцию TCR наивных CD4 + Т-лимфоцитов селезенки. Clin Immunol (2005) 117 (3): 221–30. DOI: 10.1016 / j.clim.2005.09.012
CrossRef Полный текст | Google Scholar
70. Фонг Ф.Л., Кирьявайнен П.В., Эль-Незами Х. Иммуномодуляция растворимых факторов, полученных из Lactobacillus rhamnosus GG (LGG), на антигенпрезентирующих клетках здоровых доноров крови. Научный журнал (2016) 6: 22845. DOI: 10.1038 / srep22845
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Кеперт И., Фонсека Дж., Мюллер С., Милгер К., Хохвинд К., Кострик М. и др. d-триптофан из пробиотических бактерий влияет на микробиом кишечника и аллергические заболевания дыхательных путей. J Allergy Clin Immunol (2016). DOI: 10.1016 / j.jaci.2016.09.003
CrossRef Полный текст | Google Scholar
72. Ширмер М., Смикенс С.П., Вламакис Х., Джегер М., Оостинг М., Франзоса Е.А. и др.Связь микробиома кишечника человека с производительностью воспалительных цитокинов. Ячейка (2016) 167 (4): 1125–1136.e8. DOI: 10.1016 / j.cell.2016.10.020
CrossRef Полный текст | Google Scholar
73. Мазманян С.К., Лю СН, Цианабос А.О., Каспер Д.Л. Иммуномодулирующая молекула симбиотических бактерий направляет созревание иммунной системы хозяина. Cell (2005) 122 (1): 107–18. DOI: 10.1016 / j.cell.2005.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74.Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P и др. Метаболиты, продуцируемые комменсальными бактериями, способствуют образованию периферических регуляторных Т-клеток. Nature (2013) 504 (7480): 451–5. DOI: 10.1038 / nature12726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Wissink EM, Smith NL, Spektor R, Rudd BD, Grimson A. МикроРНК и их мишени по-разному регулируются в CD8 + Т-клетках взрослых и новорожденных мышей. Генетика (2015) 201 (3): 1017–30.DOI: 10.1534 / genetics.115.179176
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Занин-Жоров А., Тал-Лапидот Г., Кахалон Л., Коэн-Сфади М., Певзнер-Фишер М., Лидер О. и др. Передний край: Т-клетки врожденно реагируют на липополисахариды посредством передачи сигналов TLR4. J Immunol (2007) 179 (1): 41–4. DOI: 10.4049 / jimmunol.179.1.41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Цуй В., Джоши Н.С., Лю Ю., Мэн Х., Кляйнштейн С.Х., Кеч С.М.Лиганды TLR4, липополисахарид и монофосфориллипид А, по-разному регулируют эффекторную дифференцировку CD8 + Т-клеток и дифференцировку Т-клеток памяти. J Immunol (2014) 192 (9): 4221–32. DOI: 10.4049 / jimmunol.1302569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Проблемы с концепцией дисбактериоза кишечной микробиоты — Брюссов — 2020 — Микробная биотехнология
Введение
«Микробиота человека находится в центре внимания одной из самых динамичных областей исследований нашего времени» — этим предложением начинается недавний обзор Cell по микробиому кишечника человека (Schmidt et al., 2018). Если посмотреть на освещение исследований микробиома в журналах Nature, Science, Cell и родственных им журналах, это суждение отнюдь не является преувеличением. Иногда целые выпуски содержат статьи о микробиомах, например, выпуск журнала Nature от 30 мая 2019 г., в котором представлены последние результаты Проекта интегративного микробиома человека (HMP) (Проктор и Консорциум исследовательской сети Integrative HMP (iHMP), 2019 г.
).Один из трех подпроектов HMP касается микробиоты кишечника при воспалительном заболевании кишечника (ВЗК), где впечатляющий набор мультиомных технологий был применен к почти 3000 образцам стула, биопсии и крови, повторно взятым в течение одного года у 132 пациентов (Lloyd -Цена и др. ., 2019). Индивидуальные вариации составили большую часть наблюдаемых различий, в то время как статус болезни объяснил только меньшую часть. В ходе последующего наблюдения у некоторых пациентов наблюдались «дисбиотические» отклонения микробиома кишечника, но они были слабо связаны с активностью заболевания. Таким образом, эти отклонения кишечной микробиоты представляют собой потенциально случайные события. Таксономические сдвиги в сторону аэротолерантных провоспалительных кладов бактерий подтвердили наблюдения из предыдущих отчетов. Новыми являются наблюдения за большей экспрессией генов клостридиями и сокращением неклассифицированных видов Subdoligranulum при ВЗК.Авторы подчеркнули, что неясно, могут ли данные мультиомного микробиома предсказывать события болезни до их возникновения. Причинно-следственный анализ требует разработки интервенционных исследований. Эти данные представляют собой каталог новых взаимосвязей между мультиомными функциями, которые позволяют проводить исследования в будущем, но исследования микробиома остаются, таким образом, в значительной степени описательными.
По словам координатора этого проекта, прогресс в исследованиях микробиома воодушевил промышленность (Proctor and the Integrative HMP (iHMP) Research Network Consortium, 2019; Proctor, 2019).Финансовые показатели полезны для того, чтобы представить микробиологам перспективу микробиомного предприятия. За последнее десятилетие государственный сектор потратил на исследования в области микробиома более 1,7 миллиарда долларов США. Рыночная стоимость продуктов и вмешательств на основе микробиома (диагностических и терапевтических) в настоящее время оценивается во всем мире между 275 и 400 миллионами долларов США и, как ожидается, как минимум утроится в течение следующих лет (Proctor and the Integrative HMP (iHMP) Research Network Консорциум, 2019; Проктор, 2019).Для сравнения, в 2017 году мировой рынок пробиотиков составил 40 миллиардов долларов США (Reid et al ., 2019). По-видимому, существуют трудности с переводом фундаментальных исследований микробиома в продукты питания, питание, здоровье или фармацевтические продукты. Заметным исключением является трансплантация фекалий для лечения рецидивирующих инфекций, вызванных Clostridium difficile (CDI). Однако, несмотря на четкие данные о его эффективности (Tariq et al ., 2019), его превращение в коммерческий продукт наталкивается на нормативные препятствия (Vyas et al ., 2015; Verbeke et al ., 2017), а FDA недавно выпустило предупреждение о безопасности его использования (https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/important-safety- предупреждение относительно использования-фекальной-микробиоты-трансплантации и-серьезного-неблагоприятного риска). Кроме того, основная концепция этого подхода предшествовала исследованию микробиома (de Vos, 2013), и определенные бактериальные штаммы для рецидивирующей ИКД (Tvede and Rask-Madsen, 1989; Tvede et al ., 2015) все еще нуждаются в разработке в зарегистрированные продукты.
Проблема определений
Проблемы, с которыми сталкиваются продукты, полученные из микробиома, для промышленного применения многочисленны. Может показаться удивительным, что одним из препятствий является вопрос о фундаментальном научном определении, вопрос, который не следует сбрасывать со счетов как имеющий чисто семантическую важность. Почти 2000 лет назад отец-основатель медицины подчеркнул важность четких научных терминов при написании: «Прежде всего, однако, мы должны четко различать и четко объяснять различные термины, которые мы собираемся использовать, и то, к чему мы их применяем; и это окажется не просто объяснением терминов, но в то же время демонстрацией воздействия природы »(Гален, 191 г. н.э.).В области пробиотиков давно обсуждается, что представляет собой пробиотик, и были организованы консенсусные конференции, чтобы найти определение. Одно только четкое определение не решает научных вопросов. Фактически, научные общества рекомендовали лишь несколько пробиотиков для ограниченного числа медицинских применений (Brüssow, 2019). Однако отсутствие четкого определения терминов рискует затмить обсуждение.
В области микробиома используется всеобъемлющий термин «дисбиоз» и его коррекция до состояния «эубиоза» с помощью целевых вмешательств.Отличие от области пробиотиков состоит в том, что ни одна консенсусная конференция еще не выработала определение «дисбактериоза», и во многих исследовательских работах по микробиомам этот термин используется даже без определения или спецификации ad hoc . Это пренебрежение свидетельствует не только об отсутствии научной строгости, но и может фактически помешать прогрессу в области микробиома от описательной к трансляционной науке. В последние годы неоднократно высказывалась критика неопределенного использования термина «дисбактериоз».В коротком комментарии: «Дисбиоз — это не ответ», Олесен и Альм (2016) отклонили дисбактериоз как главную организационную концепцию в науке о микробиоме, утверждая, что она основана на донаучных представлениях о микробном дисбалансе и в некоторой степени напоминает гуморальную теорию микробиома. человеческое здоровье. По мнению этих авторов, неоднозначность определения позволяет наблюдать дисбактериоз в составе микробиоты, фактически не достигая чего-либо полезного с научной точки зрения. В качестве примера они приводят диагностические сигнатуры микробиома для воспалительного заболевания кишечника (ВЗК), которые не превосходят более простой тест, основанный на измерении фекального кальпротектина.Кроме того, диагностика дисбактериоза не позволяет сказать, является ли он причиной или следствием заболевания. Подробная историческая оценка термина «дисбактериоз» и его текущего и неправильного использования предоставлена Hooks and O’Malley (2017). При просмотре литературы по микробиоте они обнаружили «дисбаланс микробиоты» как наиболее частую характеристику дисбактериоза, при этом дисбаланс определяется как потеря гомеостаза, который сам по себе не определяется или определяется очень редко, что приводит к круглому определению в большинстве случаев. Приложения.Это расплывчатое определение привело, по мнению авторов, к общему определению, не имеющему научной ценности, что помешало области микробиома перейти от науки, ориентированной на ассоциации, к объяснительной науке.
Подходы к определению дисбактериоза
Леви и др. . (2017) выделили три типа дисбактериоза, определяемые как «расцвет патобионтов, потеря комменсалов или потеря разнообразия», в то время как Vangay et al .(2015) выделили четыре типа дисбактериоза, а именно «потерю ключевых таксонов, потерю разнообразия, сдвиги в метаболической способности или расцвет патогенов». Патобионты определяются здесь как представители комменсальной микробиоты, которые могут вызывать патологию (Chow and Mazmanian, 2010). Краеугольный камень определяется тем, что он оказывает непропорционально большое влияние на его естественную среду по сравнению с его численностью. Многие определения пытались связать дисбактериоз с заболеванием, например «дисбиоз — это любое изменение в составе постоянных комменсальных сообществ по сравнению с сообществом здоровых людей» (Petersen and Round, 2014).Согласно Hooks и O’Malley (2017), это определение указывало на главную методологическую проблему в данной области: при поиске изменений микробиоты у больных людей по сравнению со здоровыми субъектами в исследованиях случай-контроль, дисбиотическое состояние негласно подтверждается как вызывающее заболевание. , что является классическим круговым заключением. Или в более мягкой форме критики: Bäckhed et al . (2012) заявили, что «имеющихся данных недостаточно, чтобы различать дисбактериоз как причину или следствие заболевания».
Фундаментальная критика наивного использования термина «дисбактериоз» была сформулирована Levy et al . (2017), которые отметили, что недостаточно сравнивать больных людей с контрольной группой, благополучной по болезни; особенно это требует сравнения различных проявлений одного и того же заболевания. Этот запрос обеспечит более тесный уровень ассоциации, однако полностью не решит проблему причины или следствия. Эти авторы также призвали к функциональной, а не к таксономической интерпретации дисбиотической микробиоты и подняли вопрос о высокой контекстной зависимости наблюдений, например, с иммунной системой хозяина, действующей на микробиом, и микробиомом, действующим на иммунную систему хозяина.Эти авторы выступают с радикальным предложением о том, что определение конфигурации дисбиотической микробиоты должно соответствовать критериям постулатов Коха для определения болезнетворного микробного агента, здесь расширенного для болезнетворного микробиома.
При исследовании связи между детским дисбактериозом и заболеванием Vangay et al . (2015) упомянули важные смешивающие факторы, которые необходимо учитывать в таких анализах микробиоты и болезней, такие как временное созревание кишечной микробиоты и зависимость состава микробиоты от типа родоразрешения (кесарево сечение vs.вагинально) (Chu et al. , 2017), на диете (грудное вскармливание или из бутылочки) и при предшествующем применении антибиотиков. Подробное описание кишечной микробиоты младенцев с учетом этих факторов было предоставлено для здоровых младенцев из Швеции (Bäckhed et al ., 2015) и США (Baumann-Dudenhoeffer et al ., 2018). В единственном исследовании случай-контроль была задокументирована связь микробиоты с заболеванием, а именно недоедание у детей из Бангладеш, с возрастным развитием микробиоты с использованием машинного обучения на данных последовательности 16S РНК, что привело к «индексу относительной зрелости микробиоты».Авторы обнаружили относительную незрелость микробиоты у детей с недостаточным питанием (Subramanian et al ., 2014). Хотя это наблюдение представляет исследовательский интерес, оно имеет ограниченное практическое значение, поскольку это состояние можно легко оценить с помощью антропометрии и визуальной диагностики.
Проблема разнообразия
Утрата разнообразия использовалась в качестве критерия дисбактериоза во многих определениях, что свидетельствует о снижении микробных услуг для хозяина и, следовательно, о меньшем «здоровье» микробиоты.Однако авторы, рассматривающие микробиоту кишечника человека с точки зрения современной экологической теории, пришли к более тонким оценкам (Coyte et al ., 2015). Несомненно, высокое видовое разнообразие является характерной чертой кишечной микробиоты. Хотя ожидается, что усиление сотрудничества в таком сложном сообществе будет способствовать общей метаболической эффективности, хозяин сталкивается с компромиссом, поскольку это происходит за счет снижения экологической стабильности, поскольку большое количество видов имеет тенденцию дестабилизировать систему.Поэтому Джонсон и Бернет (2016) призвали с осторожностью относиться к наивному применению аргумента разнообразия. Например, у детей, находящихся на искусственном вскармливании, постоянно наблюдается более разнообразная кишечная микробиота, чем у детей, вскармливаемых грудью (например, см. Simeoni et al ., 2016), при этом эта разница не приводит к большему здоровью детей, находящихся на искусственном вскармливании, по сравнению с младенцами, вскармливаемыми грудью. В этом контексте часто цитируют другой пример: африканская популяция охотников-собирателей (хадза) показала более высокую таксономичность (Schnorr et al ., 2014) и функциональное разнообразие (Smits et al ., 2017) микробиоты кишечника по сравнению с субъектами из промышленно развитых стран. Сделать вывод о том, что совокупность кишечной микробиоты хадза связана с лучшим «здоровьем кишечника», чем у людей из промышленно развитых стран, на основе аргумента разнообразия без эпидемиологических данных или медицинских обследований было бы более или менее простым постулатом. Этот вывод основан на теоретических концепциях, подобных концепции мутуалистического суперорганизма, где микробы квалифицируются как «старые друзья», которые вместе эволюционировали во время эволюции гоминидов и пришли в упадок с адаптацией к более современным системам производства продуктов питания.Однако до тех пор, пока эти данные не подтверждаются фактическими показателями работоспособности, их следует интерпретировать с осторожностью. На самом деле, в хадзах отсутствовали бифидобактерии (Schnorr et al. ., 2014), которые, как принято считать, влияют на здоровье кишечной микробиоты и являются общим наследием эволюции гоминидов (Moeller et al., 2016). Если отсутствие бифидобактерий не является техническим артефактом (например, вопрос выделения ДНК, использования праймеров, как в нескольких исследованиях, в которых не сообщалось о бифидобактериях), это действительно может указывать на нездоровую микробиоту кишечника, особенно в дополнение к обнаружению трепонемы в стуле хадзы, которые обычно считаются вредными для здоровья.Действительно, у шести процентов хадза трепонемы также были обнаружены в образцах сыворотки, что вызывает дополнительные сомнения в отношении их общего состояния здоровья. Хотя у нас есть данные, которые показывают, как изменения в составе микробиоты происходят в генетически однородной популяции, переходящей на разные системы производства продуктов питания, у нас все еще нет данных о том, как эти изменения влияют на физиологию и здоровье человека в соответствии с этим градиентом (Jha et al ., 2018).
Данные хадза подчеркивают другой аспект, а именно важность сезонной изменчивости кишечной микробиоты в примитивных обществах (Smits et al ., 2017), что ставит под угрозу надежды связать констелляцию кишечной микробиоты со здоровьем, если также не предвидеть сезонных изменений здоровья или двух разных созвездий здоровой кишечной микробиоты в разных экологических условиях. Есть даже данные, хотя и разработанные на очень небольшом количестве людей, демонстрирующие суточные изменения в составе кишечной микробиоты и более подробно описанные на мышах (Thaiss et al ., 2014). В случае подтверждения такая изменчивость констелляции кишечной микробиоты потребует протоколов со стандартизованным временем отбора проб стула (сезоны, часы дня), чтобы поддерживать сравнения между исследованиями и позволять делать обобщения.
Кроме того, Shade (2017) призывает к сдержанности в использовании измерения разнообразия для оценки здоровья: само по себе разнообразие имеет ограниченную ценность, поскольку для его интерпретации требуется много контекста. Несоответствие между различными индексами разнообразия сообществ давно признано в области экологии, что затрудняет сравнение между исследованиями. Таким образом, разнообразие микробиоты — это ни хорошо, ни плохо. Это легко демонстрируется микробиотой влагалища человека, где повышенное микробное разнообразие явно связано с пагубными эффектами (бактериальный вагиноз у афроамериканских женщин, даже с неблагоприятными исходами родов); Fettweis et al ., 2019). Зависимость генетического фона хозяина от ассоциаций микробиоты и здоровья хорошо продемонстрирована в исследованиях влагалищной микробиоты афроамериканских и белых женщин из США (Callahan et al ., 2017). В случае вагинальной микробиоты аргумент о совместной эволюции микробиоты с родословной гоминид неприменим, поскольку вагинальная микробиота, в которой доминирует Lactobacillus , встречается только у людей, а не у обезьян (Miller et al . , 2016).
Недостаточные исследования и метаанализы
Многие исследования микробиоты, диагностирующие дисбактериоз в исследованиях «случай – контроль», статистически недостаточны, учитывая только небольшие размеры выборки людей: <20 субъектов на группу не является чем-то необычным в этой области.Чтобы учесть эти ограничения, Дювалье (2018) выступает за метаанализ в области дисбактериоза. Метаанализ может увеличить статистическую мощность многих небольших исследований, обнаруживая истинные сигналы на фоне ложных срабатываний. Основным преимуществом метаанализа является выявление последовательных наблюдений в независимых исследованиях или опровержение ложных ассоциаций. Предлагается тестовый пример ассоциации кишечной микробиоты с ожирением.
Первоначальные исследования сообщили о различиях в разнообразии кишечных микробов и различиях в соотношении Bacteroidetes / Firmicutes (B / F) среди людей с ожирением и без него.Пионерское исследование было проведено с небольшим количеством участников (12 человек с ожирением и 5 худых), показавшее, что соотношение B / F увеличивалось со временем на диете с ограничением калорий (Ley et al ., 2006). Последующее исследование близнецов с участием 154 человек подтвердило, что ожирение связано с изменениями на уровне филумов микробиоты кишечника (уменьшение количества Bacteroidetes и увеличение количества актинобактерий), уменьшением разнообразия бактерий и изменением экспрессии бактериальных генов (Turnbaugh et al ., 2009). Наряду с аналогичными изменениями микробиоты, наблюдаемыми у тучных и худых мышей, демонстрация того, что « тучная » микробиота обладает повышенной способностью извлекать энергию из рациона, и демонстрация того, что эта черта передается стерильным мышам (Turnbaugh et al . , 2006), связь ожирения и микробиоты стала демонстрацией выраженных изменений микробной экологии кишечника в масштабе всего отдела, связанных с патологией хозяина. Однако метаанализ, включающий 10 исследований случай-контроль и около 2800 субъектов (около трети из которых страдали ожирением), не выявил значительных различий в соотношении B / F между группами худых и страдающих ожирением, а только незначительные различия в разнообразии микробиоты (Sze и Schloss, 2016).Finucane и др. . (2014) использовали интеллектуальный анализ базы данных в US Human Microbiome Project (HMP) и европейском наборе данных MetaHIT и не обнаружили связи между соотношением B / F и индексом массы тела (BMI) или составом микробиома на уровне филумов и BMI. Различия между исследованиями в относительной численности Bacteroidetes и Firmicutes в их анализе была больше, чем различия внутри исследования между худыми и тучными людьми. Напротив, Falony et al . (2016) обнаружили связь, хотя и небольшую, между составом микробиома и ИМТ при анализе микробиома кишечника у 1106 субъектов из проекта Flemish Gut Flora Project (FGFP).Однако, основываясь на своих данных, они подсчитали, что для обнаружения изменений состава микробиоты потребуется 865 худых и 865 страдающих ожирением добровольцев с уровнем значимости P <5% и мощностью 80%. Ни одного исследования ожирения такого масштаба еще не проводилось.
Безусловно, было бы желательно, чтобы в будущих исследованиях ассоциации микробиома и заболевания проводились расчеты мощности с реалистично ожидаемыми величинами эффекта в опубликованных результатах, как это обычно делается в протоколах клинических испытаний.Такие подходы в сочетании с метаанализом помогут отличить истинные ассоциации от ложных, что позволит сосредоточиться на многообещающих ассоциациях микробиота-болезнь, которые ведут поле от шумихи к надежде (McKenney & Pamer 2015), с метаанализом фекального переноса в C. difficile. Примером может служить инфекция (Tariq et al ., 2019).
Классификация исследований дисбактериоза
Гилберт и др. . (2016) выделили три категории ассоциаций микробиоты и болезней: предсказуемые ассоциации (например,грамм. синдром раздраженного кишечника, синдром воспалительного кишечника), интригующие ассоциации (например, ожирение, сердечно-сосудистые заболевания, рак толстой кишки, ревматоидный артрит) и неожиданные ассоциации (например, большая депрессия, болезнь Паркинсона, аутизм), которые также могут представлять градиенты вероятности причинного участия микробиоты при заболеваниях или время, необходимое для перевода данных исследований в клиническую практику. Дювале и др. . (2017) использовали метааналитический подход к исследованиям случай – контроль для различных типов заболеваний, что привело к интересным выводам.Они отнесли изменения микробиоты к отдельным категориям. Одна категория характеризуется обогащением небольшого числа потенциальных патогенов, таких как Fusobacterium, Porphyromonas, Peptostreptococcus, Parvimonas и Enterobacter , как было выявлено в трех из четырех исследований колоректального рака (Wang et al ., 2011; Chen ., 2011; Chen ., 2011; Chen . et al ., 2012; Zeller et al ., 2014; Baxter et al ., 2016). Эти исследования предлагают использование конкретных противомикробных препаратов в качестве терапевтических подходов (например,грамм. бактериоцины или бактериофаги). Другая категория соответствовала заболеваниям, связанным с истощением связанных со здоровьем бактерий. Например, пять родов из семейств Ruminococcaceae и Lachnospiraceae постоянно истощались у пациентов с ВЗК. Эти исследования предлагают пробиотические подходы, чтобы восполнить недостающие бактерии в сообществе. Некоторые заболевания характеризовались значительными изменениями состава микробиоты, наиболее ярким примером которых является диарея C. difficile , свидетельствующая о трансплантации фекалий, подтвержденная многочисленными клиническими исследованиями.Некоторые ассоциации микробиоты с болезнями, вероятно, были вызваны смешивающими факторами, такими как связанные с ВИЧ изменения микробиоты под влиянием сексуальной практики или ассоциации ожирения и микробиоты под влиянием эффектов диеты. Некоторые бактерии, по-видимому, неспецифически связаны с несколькими заболеваниями: Escherichia / Shigella / Salmonella , вызванными лечением антибиотиками, независимо от основного типа инфекции.
Эубиоз
Относительно неуловимый характер термина «дисбиоз» является зеркальным отражением также плохо охарактеризованного противоположного термина «эубиоз».Для эубиоза не было дано точного определения, кроме «сбалансированной» микробиоты или микробиоты, обнаруженной у здоровых людей. Четкое определение эубиотической микробиоты особенно важно для исследований методом случай-контроль. Если здоровая эубиотическая микробиота четко определена как семантически, так и по составу микробиоты, потребуются только данные о микробиоте от небольшого числа контрольных субъектов. Этот эффект предлагается на основе «принципа Анны Карениной», согласно которому люди с дисбиотиками различаются по составу микробного сообщества больше, чем здоровые люди (Zaneveld et al ., 2017). Своеобразное название этого принципа — игра слов по книге Льва Толстого, которая начинается с предложения: «Все счастливые семьи похожи друг на друга, каждая несчастная семья несчастлива по-своему». Подтверждение этому принципу было обнаружено у океанских кораллов, у которых дисбиотические кораллы, то есть стрессированные кораллы, имеют более изменчивый и нестабильный микробиом, чем здоровые (Ahmed et al ., 2019). Хотя микробиота влагалища человека, кажется, согласна с этим принципом, далеко не ясно, применим ли этот принцип к здоровой микробиоте кишечника человека (Brüssow, 2016).
Если состав кишечной микробиоты здоровых субъектов сильно различается, большое количество субъектов необходимо в исследованиях случай-контроль, чтобы прийти к значительным выводам. Оценка необходимого количества может быть получена из крупных исследований микробиома среднестатистических людей из Бельгии (Falony et al., 2016) или Нидерландов (Zhernakova et al., 2016). Перепись микробов выявила около 800 родов бактерий. Тем не менее, богатство западной кишечной микробиоты все еще недостаточно изучено, и авторы подсчитали, что для достижения насыщения потребуется 40 000 субъектов.Бельгийское исследование выявило 20 основных таксонов (присутствующих в 95% проб), и основные таксоны также принадлежали к наиболее многочисленным таксонам. Различия между индивидуумами на самом деле были значительными, но в основном это были изменения в численности основных таксонов, таких как Ruminococcaceae, Bacteroides и Prevotella , всех организмов, которые ранее предлагались в качестве идентификаторов энтеротипов (Arumugam et al., 2011) . В дополнение к этим трем основным группам кишечных бактерий был описан длинный хвост бактерий с низкой численностью, который внес существенный вклад в функциональную диверсификацию здоровой кишечной микробиоты (Arumugam et al., 2011). Около 70 факторов от субъектов показали значительную связь с составом микробиоты, и почти половина из них также была идентифицирована в голландской когорте как значимые коварианты (Falony et al., 2016). Однако эти факторы объясняют лишь 1–15% вариаций численности рода, что позволяет предположить, что неизвестные эффекты, биотические взаимодействия и даже случайные процессы имеют большое влияние на здоровую микробиоту кишечника. Сильный стохастический элемент также проявлялся в существенных еженедельных изменениях кишечной микробиоты у здоровых детей (Sarker et al ., 2017a) и ежедневные вариации у здоровых взрослых из Бангладеш (Sarker et al ., 2012; McCallin et al ., 2013). Если это подтвердится исследованиями, проведенными в других географических регионах (высокая вариабельность кишечной микробиоты в Бангладеш может отражать низкий уровень гигиены окружающей среды и пищевых продуктов), будет сложно отличить маркеры дисбиотического микробиома от небольшого числа контрольных групп, особенно если это влияет на изменения численности в основные таксоны, такие как соотношение B / F, которое показало непрерывную вариацию также у европейских субъектов, как продемонстрировало исследование пожилых людей из Ирландии (Claesson et al ., 2011).
Смешивающие факторы
Лекарства для повседневных условий жизни оказали наибольшее влияние на состав микробиоты в бельгийских исследованиях FGFP и голландских LifeLines DEEP (Falony et al., 2016; Жернакова et al., 2016). Это наблюдение неудивительно с учетом воздействия неантибиотических препаратов на комменсальные бактерии: 24% из 1000 распространенных лекарств подавляли рост бактерий in vitro (Maier et al ., 2018). Сильное влияние лекарств как мешающего фактора показано в исследованиях, изучающих связь дисбактериоза кишечной микробиоты с диабетом 2 типа (T2D). Китайское исследование описало умеренный дисбактериоз кишечной микробиоты в исследовании «случай – контроль», в котором только 4% кишечных микробных генов были связаны с T2D. Функциональная аннотация указывает на уменьшение количества бактерий, продуцирующих бутират, и увеличение количества факультативных патогенов (Qin et al., 2012). Датское исследование показало, что у женщин с СД2 увеличилось количество четырех видов Lactobacillus и уменьшилось количество пяти видов Clostridium .Классификаторы микробов ( Lactobacillus, Akkermansia ) различались между китайскими и датскими когортами T2D, указывая на популяционные эффекты (Karlsson et al., 2013). В третьем исследовании пациенты с СД2 стратифицировались в зависимости от приема метформина (Forslund et al., 2015). У пациентов, не получавших метформин, снижение продуцентов бутирата было связано с увеличением количества Lactobacillus с заболеванием. Однако у пациентов с СД2, получавших метформин, те же авторы связали значительное увеличение Escherichia с заболеванием, что могло бы объяснить как терапевтические, так и побочные эффекты (диарея, вздутие живота) этого наиболее широко используемого противодиабетического препарата.Следовательно, исследования «случай – контроль» должны быть стратифицированы для лекарств, чтобы обеспечить надежные ассоциации микробиоты и болезни. В противном случае изменения микробиоты могут быть просто следствием лечения болезни.
Подходы с несколькими омиксами…
Из-за значительной индивидуальной вариабельности и влияния сопутствующих факторов на микробиоту кишечника, другие авторы исследовали более сложные подходы для дифференциации здоровой микробиоты от дисбиотической.Один из вариантов — изучить временную изменчивость с помощью математических подходов теоретической экологии. Двумерное пространство параметров закона Тейлора позволило определить пространство здоровой микробиоты, из которого можно было дифференцировать субъектов, принимающих антибиотики, пациентов с ожирением и пациентов с синдромом раздраженного кишечника (СРК) (Marti et al., 2017). Гилберт и др. . (2016) рекомендуют исследования временных рядов для ассоциативных исследований микробиома, чтобы связать изменения микробиоты с заболеванием.Они выступают за создание типа системы глобального позиционирования микробов (GPS), объединяющей данные о микробиоме, геноме хозяина и подтипах болезни, полученные с помощью нескольких подходов omics. Таким образом, они предлагают проследить путь микробиома субъектов и пациентов из группы риска с помощью графика принципиального координатного анализа (PCoA). Такие графики могут быть полезны в диагностике при выявлении пациентов из группы риска до того, как заболевание проявится, а также позволят отслеживать влияние терапевтических вмешательств по изменениям положения графиков.В таком анализе сюжета предполагается, что диетические вмешательства, считающиеся мягкими, вызывают небольшие сдвиги в позиции сюжета, в то время как сильные (например, антибиотики) вмешательства вызывают большие сдвиги, а вмешательства, меняющие правила игры (например, трансплантация фекалий), могут привести к «телепортации» пациента. микробиоты в здоровую зону на этих участках.
Тенденция в анализе здорового кишечного микробиома и его дисбиотических изменений явно направлена на использование инструментов все большей аналитической сложности.Одна из последних разработок заимствована из статистических подходов, разработанных для работы с взаимодействующими системами, казалось бы, непреодолимой сложности, которые первоначально применялись для анализа финансовых рынков (Raman et al ., 2019). Крупный международный консорциум во главе с J.I. Гордон, пионер исследований микробиоты-ожирения и микробиоты-недоедания, провел статистический ковариационный анализ с образцами стула из когорты рожденных в Бангладеш, который выявил «экогруппу» из 15 различных бактериальных таксонов, которые дают краткое описание развития микробиоты в здоровые дети, что также применимо для детей из Индии и Перу.Первичный главный компонент описывает 80% дисперсии данных. Анализ экогруппы позволил четко дифференцировать здоровых детей от детей с тяжелой недостаточностью питания (SAM) и более слабую дифференциацию детей с умеренным недоеданием (MAM) от здоровых детей из контрольной группы. Традиционная терапия повторным кормлением вызвала заметные сдвиги в пространстве анализа основных компонентов (PCA) состава микробиоты, не достигнув положения PCA здоровых контролей. Аспекты микробно-микробного взаимодействия могут быть воспроизведены на модели гнотобиотического поросенка.
… и их ограничения
Подходы, которые создают микробный GPS, увлекательны, но все еще далеки от воплощения в клинической практике. Чувствительность и специфичность тестов на микробиоту для диагностики заболеваний все еще относительно неясны. Также неизвестно, являются ли изменения микробиоты достаточно мелкозернистыми, чтобы позволить диагностически значимую дифференциацию болезни. Более того, большинство исследований микробиоты кишечника было проведено по логистическим причинам с образцами стула.Состав микробиоты образцов фекалий отличается от состава образцов слизистой оболочки (Eckburg et al ., 2005). Очевидно, что микробиота слизистой оболочки из-за ее более тесной связи с пораженными тканями кишечника с большей вероятностью повлияет на исход заболевания, если микробиота является движущей силой исследуемого заболевания. Фекальная микробиота, напротив, представляет собой смесь бактерий слизистых оболочек и отдельной неприлипающей микробиоты просвета, которая с меньшей вероятностью отражает процесс заболевания. Таким образом, фекальная микробиота потенциально является лишь отдаленным зеркалом патологических событий, и поэтому мы не должны ожидать тесных корреляций с заболеваниями кишечника, даже если они существуют для микробиоты слизистой оболочки.
Комплексное комплексное вмешательство
Консорциум под руководством Гордона расширил свой экотипический анализ (Raman et al ., 2019) на исследование диетических вмешательств, чтобы поддержать гипотезу о том, что развитие здоровой микробиоты причинно связано со здоровым ростом (Gehrig et al ., 2019) . В своей формулировке это звучит немного похоже на круговой вывод. Их исходное наблюдение состоит в том, что у истощенных детей из Бангладеш наблюдается задержка созревания кишечной микробиоты по сравнению с детьми контрольной группы (Subramanian et al ., 2014). Они разработали пищевые компоненты из Бангладеш на основе экспериментов по микробной инокуляции на мышах-гнотобиотах и поросятах, которые повлияли на переход от недоедания к здоровой кишечной микробиоте, связанной с биомаркерами здоровья и роста экспериментальных животных. На основе этого предварительного отбора они провели рандомизированное двойное слепое исследование с четырьмя различными режимами кормления у умеренно истощенных детей с MAM (14-17 детей в группе). Вмешательство привело к статистически значимому, но клинически небольшому увеличению веса (Z-баллы веса к росту улучшились с -2.От 2 до -1,9) во всех четырех группах. Состав микробиоты детей MAM, который уже был близок к составу здоровой контрольной группы, показал сдвиг в сторону состава здоровой кишечной микробиоты в группе дополнительного питания 2 (MDCF2), ориентированной на микробиоту, которую кормили нутом, соевой и арахисовой мукой. плюс бананы. Параллельно с этим авторы наблюдали изменение протеома плазмы, «дискриминирующего здоровый рост», полученное в результате сравнения SAM, MAM и здоровых детей. Данные следует интерпретировать с осторожностью, поскольку вмешательство проводилось у детей с умеренным недоеданием, у которых при зачислении в исследование уже был обнаружен состав кишечной микробиоты, близкий к здоровым детям.Кроме того, эффект набора веса был умеренным, а конечными точками были биомаркеры, а не клиническая оценка. Одним из значительных изменений, затронутых MDCF2, было уменьшение Bifidobacterium longum . Этот вывод противоречит здравому смыслу, поскольку бифидобактерии связаны с грудным вскармливанием (Simeoni et al ., 2016), обычно считающимся желательным детским питанием, а бифидобактерии являются ведущими кандидатами на пробиотики в педиатрии (Brüssow, 2019), а также связанные со здоровьем виды кишечника у пожилых ( Брюссов, 2013).Еще неизвестно, окажет ли это разработанное микробиотой диетическое вмешательство желаемый эффект роста в будущих клинических испытаниях. Причинная связь между дисбиотической микробиотой кишечника и недоеданием, хотя и наводит на размышления, не доказана. Для доказательства может потребоваться подход, разработанный в соответствии с постулатами Коха для патогенов, связанных с болезнью.
Модифицированный постулат Коха для ассоциаций микробиома и здоровья
Исследователи из Института Сэнгера предложили постулаты для связанных со здоровьем микробных комменсалов (Neville et al ., 2018). Их первый постулат требует, чтобы связанный со здоровьем комменсал регулярно выявлялся у здоровых хозяев и реже — у больных хозяев. Это очень похоже на обычно применяемый критерий дисбактериоза в исследованиях «случай – контроль», но отличается по важным моментам. Поскольку микробиота человека сильно варьируется, авторы запрашивают большие наборы данных для выявления надежных сигналов для выполнения этого постулата. Кроме того, для этого первого постулата необходима идентификация с высоким разрешением на уровне деформации.Идентификации на уровне вида, не говоря уже о роде или даже на более высоких таксономических уровнях, недостаточно. Выполнение их второго постулата требует чистой культуральной изоляции идентифицированного комменсала. Такая просьба казалась нереальной. Однако выделение более 1000 таксономически идентифицированных штаммов бактерий из одного стула взрослого человека методом ограниченного разведения (Goodman et al ., 2011) продемонстрировало, что такой подход осуществим, хотя и трудоемок.Ученые Сангера продемонстрировали, что 234 изолята, представляющих 134 вида и соответствующих 90% численности каловых бактерий на уровне видов, можно культивировать даже при использовании одной среды (Browne et al ., 2016). Их третий постулат гласит, что комменсальный штамм (-ы) облегчает течение болезни при введении новому хозяину. Модель in vivo должна быть биологически релевантной моделью позвоночных. Для этой демонстрации обычно используются мыши, где смеси комменсалов (Lawley et al ., 2012) и даже отдельные комменсальные штаммы (Buffie et al ., 2015) показали профилактическую и терапевтическую активность против инфекций C. difficile или Salmonella enterica (Brugiroux et al ., 2016). Что касается исходного третьего постулата Коха, этот критерий представляет собой трудоемкий, но необходимый подход, который усложняется биологическими сложностями модели мыши, которая может ограничивать распространение на условия человеческого существования и, следовательно, трансляционные исследования (Arrieta et al ., 2016). Четвертый постулат требует, чтобы комменсальный штамм мог быть обнаружен после его введения хозяину, состояние здоровья которого улучшилось. Поскольку это обнаружение может быть выполнено с помощью ПЦР, этот критерий кажется вполне выполнимым, но существуют предостережения, поскольку комменсалы могут не сохраняться, чтобы опосредовать терапевтический эффект, если они подавляют воспалительные процессы или повышают барьерные функции кишечника и впоследствии становятся ненужными (Li et al. al ., 2016), как это предполагается для некоторых пробиотиков.
При применении постулатов типа Коха к связи комменсал – здоровье и, в более широком смысле, к связи дисбактериоз – болезнь, можно понять, насколько мы все еще далеки от четкого определения этой области, за исключением возможного исключения комменсалов и C. difficile инфекция. Однако в этой области очевидного клинического преимущества трансплантации фекалий мы находимся, за исключением подхода, предшествовавшего эре микробиома (Tvede and Rask-Madsen, 1989; Tvede et al ., 2015), еще не на уровне вмешательства с микробными элементами, определенными на уровне штамма.
О догадках и опровержениях
Концепция эубиоза связана с другой концепцией — холобионта или гологенома (коллективный геном хозяина и микробиома). Сторонники этой концепции утверждают, что все животные и растения устанавливают симбиотические отношения с микроорганизмами, которые передаются от поколения к поколению и влияют на приспособленность холобионта в его среде, что приводит к появлению типа суперорганизма и новой единицы отбора в эволюции (Зильбер- Розенберг и Розенберг, 2008).Эта концепция, по-видимому, влияет на многих микробиологов, которые молчаливо полагают, что нарушение со стороны микробиома (дисбиоз) должно приводить к потере приспособленности холобионта и, в выраженных случаях, к нарушениям здоровья животного-хозяина. Эволюционные биологи довольно скептически относятся к этой концепции, не в последнюю очередь потому, что она вводит ламарковские элементы в дарвиновскую эволюцию. Моран и Слоан (2015) утверждали, что гипотеза о том, что специфические для хозяина составы микробных сообществ эволюционировали в пользу хозяина, не должна приниматься в качестве нулевой гипотезы для объяснения особенностей ассоциаций хозяин-симбионт.Хотя это может иметь место, например, в случае кораллов (которые, однако, демонстрируют гораздо более тесные отношения между животными и микробами), этот случай нельзя обобщать. Конфликты между хозяевами и ассоциированными с ними микробами обычны даже при самом близком вообразимом взаимодействии хозяин-микроб (митохондрии), приводящем к цитоядерным конфликтам. Кроме того, многие другие ситуации в кишечнике будут отражать микробно-микробные конфликты, не влияя на хозяина. Эти невидимые межмикробные конфликты могут свидетельствовать о сильном влиянии случайных процессов на состав микробиома кишечника человека (Falony et al., 2016, Жернакова и др., 2016). Вместо того, чтобы предвидеть без дополнительных доказательств пагубные последствия микробного дисбиоза для здоровья человека, хотя они отражают только внутреннюю микробную конкуренцию, мы должны искать случаи, которые соответствуют модифицированным постулатам Коха для микробных комменсалов, которые опосредуют здоровье человека. В противном случае понятие дисбактериоза, как и холобионта, рискует вызвать больше путаницы, чем ясности. Философ Поппер (2002) утверждал, что приобретение знаний и, следовательно, научные исследования состоят из диалектического процесса предположений, с одной стороны, и опровержений, с другой.В области микробиома существует множество предположений, создающих впечатление, что мы находимся на пороге «Новой биологии». Вместо того, чтобы создавать все больше и больше захватывающих гипотез в этой области, мы должны не только искать их обоснование на твердой концептуальной основе с модифицированными постулатами типа Коха, мы также должны активно искать опровержения рабочих гипотез микробиома. Опровержение, основанное на построении знаний, в настоящее время недооценивается в научном сообществе. Влиятельные журналы и грантовые агентства больше ищут стимулирующие новые предположения, чем их приземленные опровержения.Однако этот неравный рейтинг двух ветвей построения знания приводит к серьезному недоиспользованию ветки опровержения для продвижения знаний.
Опыт с диареей
Вместо того, чтобы закончить это скорее теоретическим взглядом, я кратко расскажу о нашем собственном опыте в области дисбактериоза — здоровья и болезней. Когда мы пытались лечить детей, страдающих диареей, вызванной E. coli , колифагами (фаговая терапия) в Бангладеш, мы обнаружили, что фекальный микробиом пациентов демонстрирует выраженный дисбактериоз с повышенным содержанием стрептококков по сравнению с местными здоровыми детьми из контрольной группы (Sarker et al. al ., 2016). Титры E. coli не были заметными и не коррелировали с количественными параметрами диареи, в то время как стрептококки в кале имели. По мере выздоровления от диареи количество стрептококков уменьшилось, и фекальная микробиота приблизилась к таковой у детей контрольной группы. Таким образом, было заманчиво связать увеличение количества фекальных стрептококков с диареей. Однако стрептококки принадлежали к двум комменсальным группам ( S. salivarius и S. bovis комплекс видов), и последовательности генома из изолятов стула не показали факторов вирулентности (Sarker et al ., 2016). В последующих исследованиях мы обнаружили такое же увеличение количества фекальных стрептококков у пациентов с диареей независимо от этиологии диареи, даже включая пациентов с ротавирусом, четко определенным детским возбудителем диареи (Kieser et al ., 2018). При корректировке количества бактерий в стуле и объемов стула количественно определенный выход стрептококка был лишь незначительно увеличен по сравнению с контрольными детьми. Увеличение относительной численности всегда должно корректироваться на общее количество бактерий: тривиальный, но необходимый контроль (Vandeputte et al ., 2017), которым пренебрегают во многих исследованиях микробиома. Увеличение численности стрептококков и его очевидная связь с диареей может быть просто следствием устранения типичной микробиоты толстой кишки патологией водянистой диареи (очищение), что приводит к относительному преобладанию фекальных стрептококков, которые действительно являются комменсалами тонкой кишки и кишечника. возможно, опорожнение кишечника влияет на него в меньшей степени, поскольку перистальтический кровоток в тонком кишечнике в любом случае высок (Brüssow, 2016). В двух других особых группах пациентов с диареей (истощенные дети с острой диареей, дети с постоянной диареей) мы наблюдали еще один дисбиоз фекальной микробиоты (Kieser et al ., 2017, Султана, представлено). На этот раз мы наблюдали увеличение количества E. coli на , подтвержденное как увеличением численности, так и абсолютным увеличением титра по сравнению с детьми контрольной группы. Хотя E. coli может быть патогеном для этих форм диареи (Sarker et al ., 2017b), секвенирование метагенома не показало увеличения специфического для диареи гена вирулентности в стуле пациентов. Основываясь на клинических данных и данных, полученных на моделях мышей (Faber et al ., 2016), более вероятно, что их увеличение является следствием лечения антибиотиками.Во всех этих случаях связь диареи и дисбактериоза с большей вероятностью представляет собой следствие, а не причину диареи. Кроме того, наблюдение, что дисбактериоз улучшается после выздоровления от диареи, не является сильным аргументом в пользу причинной связи.
Острая диарея представляет собой интересный тестовый пример для исследования микробиома, поскольку болезнь непродолжительна и проходит самостоятельно. Он представляет собой естественное нарушение физиологического равновесия кишечной микробиоты, и его нарушение патологическим процессом, а восстановление нового равновесия обещает понять механизмы взаимодействия микробов и микробов в кишечнике.
Outlook
Медицинские вмешательства, такие как лечение антибиотиками или очистка кишечника при подготовке к колоноскопии, представляют интересные исследовательские возможности для анализа микробиома, поскольку все зарегистрированные субъекты являются информативными, а биологические образцы можно легко получить до, во время и после вмешательств (Fukuyama et al ., 2017) . Эти данные могут дополнить выводы исследований острой диареи.
Критический тест на причинное влияние дисбактериоза на заболевание может быть предоставлен только в проспективных исследованиях, в которых состав микробиоты регулярно устанавливается для всех участников до того, как возникнут заболевания.Такие подходы являются трудоемкими и дорогостоящими даже при заболеваниях, которые возникают с большой частотой, например, диарее у детей из развивающихся стран. Если предполагаемый дисбактериоз, вызывающий заболевание, затем наблюдается у субъектов до того, как у них разовьется явное заболевание, но не у детей соответствующего возраста и среды, у которых не развивается указанное заболевание, можно разумно предположить причинную роль. Для окончательного доказательства все еще потребуются доказательства механизма действия дисбактериоза. В настоящее время мы проводим когортное исследование в Бангладеш с участием почти 300 детей, которые проходят клиническое наблюдение в течение двухлетнего периода наблюдения в сочетании с регулярным отбором образцов микробиоты.Необходимы продольные исследования и исследования, которые соответствуют «комменсальным постулатам Коха», чтобы поставить связь дисбактериоза кишечной микробиоты со здоровьем и болезнями человека на прочную научную основу. Подобные утверждения могут звучать как научный ригуризм, поскольку требуют многих лет дальнейших исследований. Тем не менее, мы должны знать, что необходимо для доказательства в области дисбактериоза / микробиома, чтобы не поддаться соблазну сделать преждевременные выводы и тем самым создать нереалистичные надежды на перевод исследований микробиома в улучшение здоровья человека.
Клинические интервенционные испытания, наконец, стали решающим критерием практической ценности исследований микробиома. Успех фекальной трансплантации при инфекции C. difficile является признаком надежды (Tariq et al ., 2019), но нам нужно расшифровать, как это работает механически, как для получения промышленного продукта, так и для понимания того, почему фекальная трансплантация хуже работает при других гастроэнтерологических заболеваниях (Imdad et al ., 2018).
Благодарности
Я благодарю доктора Шону МакКаллин за критическое прочтение рукописи.
Восстановление кишечных микробов, отсутствующих при дисбиозе в раннем возрасте, может снизить риск колита у генетически предрасположенных мышей
Новое исследование Чикагского университета установило, что восстановление одного вида микробов — Bacteroides sp. CL1-UC (Bc) — в микробиом кишечника в ключевой момент времени развития может предотвратить колит, вызванный антибиотиками, в модели этого состояния на мышах.Результаты, опубликованные 7 июня в Gastroenterology , имеют большое значение для людей, страдающих воспалительными заболеваниями кишечника (ВЗК), и подчеркивают влияние воздействия раннего детства на здоровье на протяжении всей жизни.
Предыдущие исследования на людях показали, что воздействие антибиотиков в раннем возрасте может исказить микробиом кишечника, вызывая дисбактериоз или дисбаланс микробных популяций в кишечнике, что коррелирует с повышенным риском развития ВЗК у детей.
«Мы знаем, что виды микробов, с которыми вы сталкиваетесь в раннем возрасте, на самом деле определяют, как развивается ваша иммунная система», — сказал старший автор Юджин Чанг, доктор медицины, профессор медицины Мартина Бойера в Калифорнийском университете в Чикаго. «Наша иммунная система учится распознавать самих себя и триллионы микробов в нашем кишечнике — они тоже« мы », поэтому наша иммунная система должна научиться терпеть эти организмы так же, как она терпит наши собственные клетки. Раннее воздействие антибиотиков может уничтожить некоторые организмы, которые необходимы для обучения иммунной системы развитию иммунной толерантности.”
Из-за проблем, связанных с проведением таких исследований на людях, исследователи решили использовать общую модель для изучения колита: мышей, у которых отсутствует ген, известный как IL-10 (IL-10 — / — ). «Эта модель мыши была признана генетически восприимчивой к ВЗК, и мы знаем, что микробиом кишечника играет решающую роль в развитии колита в этой модели», — сказал первый автор Джун Миёси, доктор медицинских наук, старший доцент кафедры Кафедра гастроэнтерологии и гепатологии Медицинского факультета Университета Киорин, а также бывший научный сотрудник Университета Чикаго.
Хотя у этих мышей очень редко развивается спонтанный колит без какого-либо вмешательства в чистую среду, если их матери подвергаются воздействию антибиотиков во время беременности и кормления грудью, нарушенный микробиом может передаваться щенкам в раннем возрасте. Около 30% щенков с нарушенным микробиомом, передающимся по вертикали, заболевают колитом.
Исследователи использовали метод, известный как метагеномное секвенирование с дробовиком, для скрининга фекальных микробиомов мышей IL-10 — / — , у которых был индуцированный антибиотиками дисбактериоз, наряду с необработанной контрольной группой, и идентифицировали конкретные виды микробов, которые могли бы различать две группы. .Это привело их к членам бактериального филума Bacteroides.
Одним из ключей к пониманию важности этого типа было то, что Bacteroides было очень много в микробиомах нелеченых мышей, но полностью отсутствовало у мышей, подвергшихся воздействию антибиотиков. Более того, исследователи никогда не встречали Bacteroides у пролеченных мышей, у которых не развился колит, но они часто находили Bacteroides в кишечнике мышей, у которых действительно возникло это заболевание.
«Эти бактерии были уничтожены ранним воздействием антибиотиков и были необходимы для обучения иммунной системы развитию иммунной толерантности», — сказал Чанг. «Когда эти мыши позже приобрели бактерии, их иммунная система никогда не замечала этого. Он считался чужеродным, а не собственным, и их иммунная система реагировала на это ».
Пытаясь определить, может ли возвращение важного Bacteroides обратно в микробиом исправить дисбактериоз, исследователи оттачивали особенно многочисленный вид, известный как Bacteroides sp.CL1-UC (Bc). Они попытались добавить Bc обратно в микробиомы мышей с дисбактериозом в двух временных точках: примерно в младенчестве (трехнедельный возраст) и во взрослом возрасте (11-недельный возраст).
Внедрение Bc молодым мышам во время критического окна развития иммунной системы исправило их дисбиоз и предотвратило колит, но добавление Bc обратно взрослым мышам не могло исправить дисбиоз и даже усугубило их колит.
«Это показывает, что вы не можете просто восстановить недостающие бактерии в любой момент времени, это должно быть в определенное время в начале жизни, чтобы иметь положительный эффект», — сказал Чанг.«У молодых животных мы знаем, что иммунная система развивается, она наивна, ее нужно обучать, и ее нужно обучать, подвергаясь воздействию определенных видов микробов. В некотором смысле это похоже на аллергию на арахис — раннее воздействие антигена может привести к толерантности иммунной системы, чтобы помочь избежать аллергии на арахис, но это должно произойти в очень ограниченном промежутке времени ».
Исследователи были удивлены, узнав, что восстановления одного микроба было достаточно для коррекции пожизненного дисбактериоза, и заявили, что это подчеркнуло, как относительно небольшие изменения могут иметь огромное влияние на систему.«Это похоже на высокие деревья тропических лесов Амазонки, — сказал Чанг. «Вам нужны высокие деревья, потому что без них экосистема, расположенная ниже, не сможет развиваться должным образом. Но если у вас есть эти деревья, остальная часть экосистемы будет процветать ».
Результаты также идут вразрез с популярными теориями происхождения ВЗК. «Существует заблуждение, что колит вызывается классическим возбудителем, таким как сальмонелла, и ученые потратили годы на поиск виновника», — сказал Чанг. «Но наши данные указывают на то, что эти заболевания вызываются нашими собственными комменсальными микробами.Они присутствуют в нормальном здоровом микробиоме, но при подходящих обстоятельствах и возможности могут трансформироваться в микробы, способствующие развитию болезней ».
Хотя это раннее исследование было доказательством концепции, если результаты применимы к людям, волновые эффекты, вероятно, будут далеко идущими. «Это показывает, что мы, вероятно, должны переосмыслить наш подход к такого рода сложным иммунным расстройствам», — сказал Чанг. «Мы видим, что риск развивается в раннем возрасте — даже in utero — и поэтому это имеет значение для таких практик, как кесарево сечение и кормление смесью, которые могут воздействовать на микробы, которым подвергается младенец.Для меня это говорит о том, что нам, врачам, нужно думать не о том, что непосредственно предшествует этим заболеваниям, а о том, что происходит в раннем возрасте. Вот где нам нужно вмешаться для этих пациентов ».
Исследование «Восстановление микробов в раннем возрасте снижает риск колита, вызванного дисбактериозом кишечника, вызванным антибиотиками, у мышей IL-10 — / — », при поддержке Национального института диабета, болезней органов пищеварения и почек (P30 DK42086, RC2DK122394). , R37 DK47722 и K01 DK111785), Чикагский исследовательский фонд GI и Исследовательский фонд Дэвида и Эллен Хоринг.Исследование стало возможным благодаря многопрофильной группе исследователей, включая Кэндис Чам, Аки Сакатани, Карен Янг, Юэ Шан, Меган Кеннеди, Эвана Кифла и Махмуда Юсефа из Чикагского университета; Савако Миёси из Медицинского факультета Университета Чикаго и Киорин; Том О. Дельмон из Калифорнийского университета в Чикаго и Парижский университет Сакле; Сонни Т. Ли из Университета штата Чикаго и Канзаса; А. Мурат Эрен из Калифорнийского университета в Чикаго и Морской биологической лаборатории; Ванесса Леоне из Калифорнийского университета в Чикаго и Университета Висконсин-Мэдисон; Шон Кроссон из Университета штата Мичиган; Митчелл Согин из Морской биологической лаборатории; и Дионисий А.Антонопулос из Аргоннской национальной лаборатории.
Дисбактериоз кишечника — Педиатрия | Nutricia
По материалам Peterson and Round, 2014. 1
Что вызывает дисбактериоз кишечной микробиоты у младенцев? Ранний период жизни — критический период для развития микробиома кишечника, поэтому кишечник младенца особенно уязвим для дисбактериоза. Есть несколько факторов, которые влияют на состав кишечного микробиома у младенцев, в том числе: 1,4-6
- Срок беременности
- Материнское окружение
- Способ родов (вагинальные или кесарево)
- Питание (грудное или искусственное вскармливание)
- Использование антибиотиков
- Диета
- Загрязнение воздуха
- Генетика
Генетические факторы и изменения в факторах окружающей среды могут изменить состав микробиома кишечника, что приведет к дисбактериозу. 1 Какая связь между дисбактериозом кишечной микробиоты и аллергией? Сообщалось о дисбактериозе кишечной микробиоты у младенцев с аллергическими состояниями, такими как аллергия на белок коровьего молока (CMPA). У здоровых младенцев, находящихся на грудном вскармливании, в кишечнике обычно преобладает группа полезных бактерий, известных как бифидобактерии. Эти бактерии сначала передаются от матери во время родов и с грудным молоком. 7–9 У младенцев с аллергическими заболеваниями факторы окружающей среды могут влиять на состав микробиоты кишечника.Младенцы с АБКМ часто имеют более низкие уровни бифидобактерий в микробиоте кишечника по сравнению со здоровыми младенцами, находящимися на грудном вскармливании. 9 В настоящее время считается, что дисбактериоз кишечника потенциально может привести к развитию аллергии и другим последствиям для здоровья в более позднем возрасте. 1
Может ли дисбактериоз кишечной микробиоты повлиять на развитие иммунной системы? Ранний период жизни — критический период как для развития иммунной системы, так и для микробиоты кишечника. Иммунная система развивается быстро в течение первых 1000 дней жизни, и хорошо известно, что между иммунной системой и кишечной микробиотой возникает перекрестное взаимодействие.Таким образом, дисбактериоз кишечной микробиоты может повлиять на развитие иммунной системы, что может привести к аллергии, такой как CMPA, и другим последствиям для здоровья, таким как астма, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 4,15–17
Может ли дисбактериоз кишечной микробиоты приводить к аллергическим заболеваниям, таким как аллергия на белок коровьего молока, у младенцев? Считается, что дисбактериоз кишечной микробиоты играет роль в развитии пищевой аллергии, такой как аллергия на белок коровьего молока (CMPA), в раннем возрасте.Несколько исследований показали, что дисбактериоз кишечника у младенцев может задерживать развитие оральной толерантности — процесса, при котором подавляется иммунный ответ на пищевой белок. Нарушение пероральной переносимости может привести к развитию пищевой аллергии. 16 Дисбактериоз кишечника в молодом возрасте также был связан с развитием ряда заболеваний, включая астму, метаболический синдром, сердечно-сосудистые заболевания и ожирение. 17
Можем ли мы вернуть баланс к здоровой микробиоте кишечника? Грудное молоко содержит как пребиотики природного происхождения, такие как олигосахариды грудного молока (HMO), так и полезные бактерии (пробиотики).Оба эти элемента помогают поддерживать здоровую микробиоту кишечника и поддерживать развитие иммунной системы. 16,17 Если грудное вскармливание невозможно, добавление уникальной комбинации пребиотиков и пробиотиков, известных как синбиотики, к детской смеси, восстанавливает баланс кишечного микробиома и способствует пероральной переносимости, потенциально снижая риск аллергических заболеваний. . 20,23,24
Почему стоит рассмотреть уникальную смесь синбиотиков при аллергии на белок коровьего молока? Растущее количество клинических данных свидетельствует о том, что уникальная смесь синбиотиков может иметь положительный эффект у детей грудного возраста, находящихся в группе риска или живущих с пищевой аллергией, таких как АБКМ. 12,23,24 Признавая потенциальные преимущества пре- и пробиотиков, Группа рекомендаций Всемирной организации по аллергии предлагает рассмотреть вопрос о добавлении пре- и пробиотиков для младенцев с риском аллергии, если они не находятся на исключительно грудном вскармливании. 21,22 В настоящее время большинство детских смесей, содержащих пробиотики, включают виды Bifidobacterium и / или молочнокислые бактерии, такие как Lactobacillus, 25 , которые обычно считаются безопасными и разрешенными для использования в пищевых продуктах в соответствии с пищевыми стандартами Австралии и Новой Зеландии. Нормативные документы.В последнее десятилетие различные пребиотические смеси галактоолигосахаридов (GOS) и фруктоолигосахаридов (FOS) были изучены на предмет их положительного воздействия на младенцев с риском пищевой аллергии или живущих с ней. Клинические исследования пребиотических смесей для грудных детей, состоящих из короткоцепочечной (sc) GOS и длинноцепочечной (lc) FOS, scGOS / lcFOS в соотношении 9: 1, напоминающих олигосахаридные компоненты грудного молока как по количеству, так и по разнообразию, показали преимущества, связанные с регулированием микробиоты кишечника и иммунной системы, снижением частоты инфекций и размягчением стула. 25 Отобранные продукты Nutricia для лечения аллергии на белок коровьего молока содержат уникальную запатентованную смесь синбиотиков пребиотиков (включая scGOS / lcFOS (9: 1)) и пробиотиков (Bifidobacterium breve M16V), вдохновленных компонентами грудного молока. .
Связь между кишечной микробиотой и патогенезом ревматоидного артрита
Характеристики и понимание кишечной микробиоты в последнее время расширились, что представляет собой широкую область исследований, особенно в области аутоиммунных заболеваний.Микробиота кишечника является основным источником микробов, которые могут оказывать как полезные, так и патогенные эффекты на здоровье человека. Роль кишечного микробиома как медиатора воспаления выяснилась совсем недавно. Было обнаружено, что микробиота различается у субъектов с ранним ревматоидным артритом по сравнению с контрольной группой, и это открытие привело к этому исследованию как возможный аутоиммунный процесс. Исследования кишечной микробиоты показали, что ревматоидный артрит характеризуется увеличением и / или уменьшением бактериальных групп по сравнению с контролем.В этом обзоре мы представляем доказательства связи дисбактериоза кишечника с аутоиммунными механизмами, участвующими в развитии ревматоидного артрита.
1. Введение
Ревматоидный артрит (РА) — это системное, воспалительное и хроническое заболевание, характеризующееся стойким иммунным ответом, который приводит к воспалению и разрушению суставов. Эти этиопатогенные механизмы сложны и включают взаимодействие между врожденным и приобретенным иммунным ответом, включая антигенпрезентирующие клетки (APC), образование аутореактивных Т-клеток и выработку аутоантител, направленных против их собственных клеточных структур, таких как ревматоидный фактор (RF) и антицитруллинированные белковые антитела (ACPA).Эти антитела часто присутствуют в крови задолго до появления каких-либо признаков воспаления суставов, что позволяет предположить, что запуск аутоиммунитета может происходить на разных участках суставов, например, в желудочно-кишечном тракте или дыхательных путях [1]. Эпидемиологические исследования предполагают, что ревматоидный артрит является результатом сложных взаимодействий между генами, экологическими и гормональными факторами и иммунной системой [2, 3].
Существует генетическая предрасположенность к ревматоидному артриту, обусловленная тенденцией к семейной агрегации, конкордантностью между монозиготными близнецами и ассоциацией с некоторыми антигенами гистосовместимости [4, 5].Оценки наследственности предполагают 60–70% генетических факторов риска, ответственных за развитие ревматоидного артрита [6]. Исследования генов-кандидатов или полногеномных ассоциаций выявили различные локусы риска, связанные с этиологией ревматоидного артрита. В настоящее время при этом заболевании около 100 описанных генов связаны с восприимчивостью, защитой, тяжестью, активностью и ответом на лечение [6]. Полиморфизм лейкоцитарного антигена человека (HLA) является наиболее важным генетическим фактором риска. HLA — важная часть иммунной системы, запускающая Т-клетки иммунной системы для выработки антител.Ассоциации РА с аллелями HLA-DRB1 наблюдались во всех расовых и этнических популяциях [7, 8]. Общий эпитоп (SE), мотив последовательности из 5 аминокислот в положениях 70–74 цепи HLA – DR β , является наиболее значимым генетическим фактором риска ревматоидного артрита [9]. Некоторые аллели SE, такие как HLA-DRB10401, по-видимому, представляют более высокий риск, чем другие; кроме того, наличие двух аллелей SE и, в частности, HLA-DRB10401 / 0404 создает высокий риск развития заболевания, а также влияет на тяжесть заболевания [10].Аллели SE связаны с ACPA-положительным ревматоидным артритом, но относительно слабо связаны с ACPA-отрицательным ревматоидным артритом [8]. Аллели SE могут вносить вклад в генетическую предрасположенность к ревматоидному артриту, вызывая иммунную дисрегуляцию (контролирующую как специфичность, так и количество продукции ACPA) или преждевременное старение иммунитета [10].
У генетически предрасположенных людей последующие триггеры окружающей среды могут вызывать развитие ревматоидного артрита. Бактериальные и вирусные компоненты являются привлекательным источником антигенов, способных вызывать ревматоидный артрит, и поэтому наиболее исследованы как потенциальные возбудители [3].Однако на сегодняшний день нет убедительных доказательств причинной связи микроорганизма с ревматоидным артритом.
В последние годы характеристики и понимание этой кишечной микробиоты расширились и составляют широкую область исследований, особенно в области аутоиммунных заболеваний. Микробиота кишечника является основным источником микробов, которые могут оказывать как полезные, так и патогенные эффекты на здоровье человека [11]. Вдохновленный исследованиями, которые показывают изменения в составе кишечной микробиоты при аутоиммунных заболеваниях, таких как ревматоидный артрит, возобновился интерес к изучению микроорганизмов как потенциальных кандидатов в развитии аутоиммунитета [11–14].
Результаты, подтверждающие идею о том, что начало аутоиммунитета может быть связано с желудочно-кишечным трактом, заключаются в следующем: (1) микробный состав у субъектов с ранним ревматоидным артритом отличается от контрольной группы, с уменьшением количества определенных бактерий, принадлежащих к семейству Bifidobacterium и Bacteroides [15, 16], и заметное увеличение количества видов, принадлежащих к роду Prevotella [17]. (2) В моделях на мышах парентеральная инъекция фрагментов клеточной стенки различных кишечных бактерий является артритогенной [17], и в этой модели артрит не развивается при разведении в стерильных условиях; в противном случае он проявляется при интродукции кишечных бактерий [18].(3) Было показано, что диета влияет на уровень воспалительной активности [19]. (4) Некоторые препараты, используемые для лечения ревматоидного артрита, обладают антимикробным действием (хлорохин, сульфасалазин, миноциклин и рокситромицин) [20–23]. (5) Измененный микробиом был частично восстановлен до нормального состояния у пациентов, показавших клиническое улучшение после назначения модифицирующих течение заболевания противоревматических препаратов [5, 18]. Таким образом, различия в составе кишечной микробиоты и функции иммунной системы могут определять, у каких пациентов развивается болезнь.
В настоящее время прилагаются большие усилия для изучения субъектов с ревматоидным артритом на доклинической стадии. Осведомленность о механизмах, запускающих аутоиммунный процесс, а также о механизмах, участвующих в переходе от доклинической фазы к клинической, может помочь разработать стратегии вмешательства, которые позволят предотвратить или лечить этот процесс на очень ранних стадиях заболевания. Некоторые публикации предполагают, что раннее лечение ревматоидного артрита приводит к лучшим долгосрочным результатам и, возможно, к увеличению частоты ремиссии без лекарств [24].Концепция профилактики — это новая область исследований в области ревматологии, в которой изменения микробиоты могут быть новым способом модуляции болезни.
2. Иммунопатогенез ревматоидного артрита
Понимание сложных молекулярных процессов, которые играют роль в патогенезе ревматоидного артрита, по-прежнему остается сложной задачей. Восприимчивые люди под влиянием генетических факторов и факторов окружающей среды с потерей иммунологической толерантности к аутоантигенам запускают аутоиммунные явления и образование аутоантител [25].Это отсутствие иммунологической толерантности представляет собой первый шаг к аутоиммунитету. Нарушение регуляции иммунной системы характеризуется наличием аутоантител и аутореактивных Т-клеток. Несоответствующее образование аутореактивных В-клеток — наиболее очевидное изменение иммунной системы у этих пациентов; их обнаруживают задолго до появления болезни. Наиболее важными являются RF и ACPA, которые распознают разные белки в цитруллинированной форме [26]. Наряду с повышенной продукцией аутоантител уровень провоспалительных цитокинов повышен в синовиальной оболочке сустава пациентов с ревматоидным артритом.Суставы пациентов с РА представляют собой сложные ткани, в которые вовлечены врожденные и адаптивные иммунные клетки наряду с резидентными клетками суставов, такими как синовиоциты и хондроциты [27].
Было идентифицировано несколько типов клеток, которые вносят вклад в патогенный контекст ревматоидного артрита. В ревматоидном синовиуме дендритные клетки обнаруживаются в основном в лимфоцитарных агрегатах и периферических сосудах, что позволяет предположить, что они происходят из периферической крови. Аллели MHC экспрессируются APC, которые обрабатывают внеклеточные пептиды до CD4 + Т-клеток, управляя секрецией провоспалительных цитокинов, которые стимулируют В-клетки продуцировать антитела [25].У пациентов с этим заболеванием наблюдается нарушение функции циркулирующих регуляторных Т-клеток (Treg) и увеличение количества Т-хелперных 17 (Th27) клеток в плазме и синовиальной жидкости [28]. Произведенный из макрофагов и дендритных клеток трансформирующий фактор роста β и интерлейкин-1 β , 6, 21 и 23 обеспечивают среду, которая поддерживает дифференцировку Th27 и подавляет дифференцировку регуляторных Т-клеток, тем самым смещая гомеостаз Т-клеток в сторону воспаления. [29].
Посттрансляционные модификации (ПТМ) имеют решающее значение для функции и антигенности белков.Три ПТМ, в первую очередь участвующих в ревматоидном артрите, — это гликозилирование, карбамилирование и цитруллинирование [25]. Цитруллинирование является результатом превращения аргинина в цитруллин ферментом пептидиларгининдеиминазой (PAD), и это основная критическая посттранскрипционная модификация, связанная с распознаванием аутоантигена при ревматоидном артрите [25]. Цитруллин может изменять структуру белка и генерировать новые эпитопы, связанные с производством ACPA. ACPA, присутствующие у пациентов с ревматоидным артритом, демонстрируют различную тонкую специфичность и степень перекрестной реактивности с различными цитруллинированными и / или посттрансляционно модифицированными пептидами / белками, включая фибриноген, фибронектин, α -енолазу, коллаген типа II и гистоны [30].
Таблица 1 суммирует соответствующие аспекты развития этого заболевания. Доклинический ревматоидный артрит включает период, в течение которого аутоиммунитет выявляется до начала воспаления и / или повреждения клинически очевидной ткани, генетические факторы и факторы риска окружающей среды взаимодействуют, вероятно, последовательно, чтобы инициировать и распространять развитие аутоиммунитета, что в конечном итоге приводит к обнаружению воспаление и поражение тканей [24, 31]. Причастен ли какой-либо другой фактор риска к возникновению и / или распространению заболевания, он до сих пор неизвестен.
| |||||||||||||||||||||||||||||||||||||||||||
Реакция ACPAs может быть важна для перехода от доклинической фазы к клинической стадии ревматоидного артрита.Анализ репертуара ACPA до постановки диагноза у пациентов с ревматоидным артритом показал, что этот иммунный ответ начинается очень ограниченным образом и распространяется до нескольких месяцев или даже лет (распространение эпитопа, от одного первоначально распознанного эпитопа к реактивности на множество различных эпитопов) до постановки диагноза. ревматоидного артрита [10, 24, 32, 33]. Распространение эпитопа в сторону большего количества цитруллинированных антигенов совместимо с возможностью того, что один антиген (но не всегда один и тот же) ответственен за запуск иммунного ответа [16, 32].Соколове и др. [33] сообщили, что ранее идентифицированные аутоантитела были нацелены против различных лигандов врожденного иммунного ответа, включая цитруллинированные гистоны, фибриноген и бигликан. Со временем титры ACPA и разнообразие эпитопов ACPA увеличиваются, особенно до начала артрита. ACPA могут быть изотипами IgG, IgA или IgM с измененным статусом гликозилирования, что обеспечивает усиление связывания Fc-рецептора и цитруллинированного антигена [34]. Сами по себе ACPA могут быть патогенными, активируя макрофаги или остеокласты посредством образования иммунных комплексов и взаимодействия с Fc-рецептором, или, возможно, связывая цитруллинированный виментин мембраной, способствуя, таким образом, потере костной массы [34].
С момента первоначального описания антител как цитруллинированных антигенов в субпопуляции пациентов с ревматоидным артритом стало ясно, что цитруллинированные эпитопы большого числа аутоантигенов, а также антигены, полученные из микроорганизмов, могут распознаваться высокоспецифичными антителами против ревматоидного артрита [ 30]. Изменения в определенных участках слизистой оболочки предполагают, что микробные факторы могут влиять на иммунный ответ слизистой оболочки, что также играет важную роль в раннем патогенезе ревматоидного артрита [35].Изменения композиционного разнообразия и уровней численности микробиоты, то есть дисбактериоз, могут запускать несколько типов аутоиммунных и воспалительных заболеваний из-за дисбаланса субпопуляций Т-клеток, таких как Th2, Th3, Th27 и Treg [27].
Дисбиоз в одном или нескольких участках слизистой оболочки приводит к иммунным изменениям и нарушению самотолерантности к цитруллинированным аутоантигенам [35]. Поверхности слизистых оболочек тела, такие как дыхательные пути и желудочно-кишечный тракт, выполняют сложные задачи, поскольку они должны (1) оставаться толерантными к безвредным экологическим, пищевым и микробным антигенам для обеспечения функции органов и (2) создавать эффективные иммунные ответы против вторжения патогенов [36].Ткани легких и кишечника содержат иммунологические клетки, способные инициировать иммунный ответ; привлекательная возможность состоит в том, что запуск Т-клеточного иммунитета к цитруллинированным аутоантигенам может происходить в слизистых оболочках после презентации неоантигенов APC [1, 31]. В участке слизистой оболочки могут существовать возможные роли цитруллинированных микробных антигенов и молекулярной мимикрии, сигналов Toll-подобных рецепторов (TLR) и других активаторов врожденного иммунитета и сигналов опасности [35]. Бактериальная флора, ассоциированная со слизистой оболочкой, курение или частицы окружающей среды (кремнеземная пыль) действуют на иммунные клетки (нейтрофилы, дендритные клетки и макрофаги) в качестве молекулярных структур, связанных с патогенами, и повреждают их, что приводит к возникновению воспаления, увеличению количества циркулирующих цитокинов и хемокинов вместе с производство аутоантигенов.Цитруллинированные антигены процессируются и представляются APC Т-клеткам, которые активируются и, в свою очередь, активируют В-клетки, что приводит к продукции аутоантител [31]. Аутоантигены при ревматоидном артрите не являются тканеспецифичными или органоспецифичными, но содержат большой набор посттрансляционных модифицированных белков [31]. Курение и другие стимулы могут инициировать цитруллинирование за счет активации PAD, образования лимфоидных структур, которые могут усиливать презентацию антигена, а также продукцию Т- и В-клеток [31].Возможные механизмы, с помощью которых сигаретный дым (CS) способствует ревматоидному артриту, включают высвобождение внутриклеточных белков из активированных или поврежденных реактивными окислительными веществами клеток, усиление аутореактивной функции B-клеток и изменение (а) многих клеточных сигнальных путей, участвующих в клеточной активации, (b ) антиген-презентирующие клетки, нарушенные сигаретным дымом, (в) регуляторные функции Т-клеток и (г) активация Т-клеток антигенами, обнаруженными в сигаретном дыме [37].
3. Микробиота и иммунная система
Воздействие микробов в желудочно-кишечном тракте и дыхательных путях является ключевыми детерминантами общего иммунного тонуса на этих слизистых барьерах и представляет собой главную цель для будущих стратегий вмешательства [36].Кишечник — это проход для различных антигенов окружающей среды в виде пищи или инфекционных агентов. Кишечная микробиота — фактор, влияющий на метаболический гомеостаз и иммунную систему [5]; это место замечательного взаимодействия между микроорганизмами и человеческим телом. Микроорганизмы устанавливают симбиотические отношения с эпителиальной и лимфоидной тканью [12, 25]. Кишечные бактерии синтезируют и изменяют множество соединений, влияющих на физиологию и иммунитет. Однако не все взаимодействия хозяина и микробиоты способствуют укреплению здоровья, особенно виды резидентных бактерий, по-видимому, активируют иммунную систему, что приводит к воспалительным заболеваниям [38, 39].Разнообразная и сбалансированная микробиота необходима для развития соответствующего иммунного ответа [40].
Преимущества, обеспечиваемые кишечной микробиотой хозяину, зависят от сложных взаимодействий с клетками хозяина [41]. Исследования на стерильных животных и гнотобиотических животных, колонизированных определенными бактериями, предоставили прямые доказательства решающей роли микробиоты в развитии и поддержании иммунной системы хозяина [41] и сохранении ее функций, таких как созревание лимфоидной ткани кишечника, секреция иммуноглобулина А. и производство важных антимикробных пептидов [42].У мышей axenic наблюдали скудный рост лимфоидной ткани и изменения в Т-клетках и субпопуляциях развития В-лимфоцитов; в некоторых случаях у этих мышей не развивались заболевания, характерные для обычных субъектов, вероятно, из-за дефектов адаптивной иммунной системы в отсутствие микробиоты, а не из-за отсутствия микроорганизмов как таковых. Консервированные молекулярные паттерны, выраженные на поверхности симбиотических бактерий или секретируемые в кишечнике, могут взаимодействовать с рецепторами распознавания паттернов (PRR), которые экспрессируются на эпителиальных и лимфоидных клетках или внутри них, чтобы инициировать трансдукцию и транскрипцию сигналов от набора молекул. которые опосредуют защиту хозяина или метаболическую активность в кишечнике [40].
Было показано, что кишечная комменсальная микробиота модулирует Т-клеточные и Treg-ответы, которые необходимы для эффективной защиты хозяина от патогенов, в то же время обходя аутоиммунные реакции и другие иммунопатологические последствия [43]. В качестве первой линии защиты хозяина от патогенов врожденные иммунные ответы полагаются на семейство рецепторов, известных как PRR, включая TLR и рецепторы, подобные домену олигомеризации, связывающим нуклеотиды (NLR). TLR являются ключевыми рецепторами врожденного иммунитета для восприятия патоген-ассоциированных молекулярных паттернов (PAMP), которые представляют собой специфическую патогенную «молекулярную сигнатуру».«После обнаружения микробных PAMPs, TLR позволяют инициировать воспалительные реакции и в конечном итоге устранять патогенных захватчиков [43]. Компоненты грамположительных и грамотрицательных бактерий взаимодействуют с TLR, опосредуя как врожденный, так и адаптивный иммунитет, а также другие клеточные функции слизистого барьера [40]. Эпителиальные клетки имеют TLR на своей клеточной мембране, которые позволяют распознавать PAMP и активировать опосредованную белком MyD88 передачу сигналов, которая заканчивается индукцией воспалительного ответа и выработкой провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNF- α ), интерлейкин-6 или интерлейкин-1 β .Клетки врожденного иммунного ответа собственной пластинки постоянно исследуют содержимое просвета кишечника на предмет чужеродных антигенов и составляют еще один защитный механизм [28]. Поскольку комменсальные бактерии различаются по своей способности стимулировать рецепторы врожденного иммунитета (TLR и NLR), характер высвобождаемых химических медиаторов значительно варьируется, определяя провоспалительные или противовоспалительные реакции. Липополисахарид грамотрицательных бактерий связывается с TLR-4, тогда как пептидогликан и другие компоненты клеточной стенки грамположительных бактерий передают сигнал через путь TLR-2, вызывая иммунный ответ [11].Грамположительные анаэробные бактерии содержат большее количество полисахаридов и пептидогликанов, которые могут действовать как антигенные раздражители.
После взаимодействия с антигеном дендритные клетки играют важную роль в дифференцировке незрелых лимфоцитов CD4 + в клетки Th2, Th27 или Th3. На дифференцировку Т-хелперных клеток, по-видимому, сильно влияет кишечная микробиота [11, 16, 42]. Дендритные клетки действуют как APC, отображая заряженные пептиды в своих молекулах MHC класса II.Презентация этих молекул В-клеткам или рецепторам Т-клеток сенсибилизирует эти клетки, чтобы инициировать адаптивный иммунный ответ [28]. При ревматоидном артрите дендритные клетки могут участвовать в поддержании воспалительного процесса, регулируя антигенную презентацию, и тогда презентация антигена или артритогенных антигенов будет ненормально продлена, что может способствовать сохранению воспаления. Макрофаги и дендритные клетки постоянно обнаруживают антигены просвета кишечника и оценивают наличие вредоносных антигенов.Антигены представлены молекулами MHC II и взаимодействуют с В-клетками или рецепторами Т-клеток, чтобы вызвать адаптивные иммунные ответы. В зависимости от микробного антигена затем создается специфическая цитозиновая среда, чтобы влиять на специфический тип дифференцировки Т-хелперных клеток. В то время как Т-хелперные клетки (Th2) типа 1 развиваются в ответ на внутриклеточные патогены и продуцируют интерферон, как Т-хелперные клетки (Th3) типа 2 (Th3), так и клетки Th27 стимулируются внеклеточными микроорганизмами. Клетки Th27 вносят вклад в защиту от внеклеточных патогенов за счет продукции IL-17 и IL-22, которые вызывают изменение класса иммуноглобулинов в B-лимфоцитах и продукцию Reg3g эпителиальными клетками соответственно [14].Иммунный ответ, генерируемый эффекторными Т-клетками, регулируется субпопуляцией, известной как регуляторные Treg-клетки. Кишечные Treg-клетки играют важную роль в поддержании иммунной толерантности к диетическим антигенам и кишечной микробиоте [44]. Treg-клетки сохраняют толерантность к аутоантигенам и устраняют аутоиммунитет. CD4 + CD25 + Treg-клетки представляют собой супрессивные клетки, которые экспрессируют фактор транскрипции Foxp3, и незаменимы для поддержания иммунной самотолерантности и гомеостаза путем подавления аберрантного или чрезмерного иммунного ответа. Lactobacillus и Bifidobacterium infantis оказывают противовоспалительное действие за счет индукции CD4 + CD25 + FoxP3 + Treg-клеток [11]. Bacteroides fragilis полисахарид A действует как иммуномодулятор и стимулирует CD4 + Treg-клетки посредством интерлейкин-2-зависимого механизма с образованием IL-10 [11].
Принимая во внимание тот факт, что дендритные клетки играют фундаментальную роль в генерации иммунного ответа, было высказано предположение, что комменсальные бактерии влияют на функцию и дифференцировку дендритных клеток, модулируя таким образом иммунный ответ [11, 23].Таким образом, дисбактериоз кишечника может вызывать артрит, влияя на дифференциацию подгрупп Т-клеток. Он также влияет на степень экспрессии Toll-подобных рецепторов антигенпрезентирующих клеток и может вносить вклад в дисбаланс соотношения Th27 / Treg-клеток. С развитием клеток Th27, активацией местных воспалительных каскадов с повреждением тканей и у предрасположенных людей этот местный иммунный ответ может привести к системному аутоиммунитету с самореактивными клетками Th27.
Микробиота оказывает наиболее заметное влияние со стороны окружающей среды на дифференцировку клеток Th27.В последнее время большое внимание уделяется сегментированным нитчатым бактериям (SFB) из-за их способности индуцировать продукцию и активацию клеток Th27 в кишечнике с секрецией интерлейкина-17 [23, 27]. SFB включают группу грамположительных бактерий, связанных с Clostridia, которые плотно прилегают к бляшкам Пейера в тонком кишечнике и могут стимулировать иммунный ответ, индуцируя секрецию IgA и активируя B-клетки. Эти бактерии необходимы для развития аутоиммунитета на мышиной модели артрита K / BxN [45], а использование антибиотиков предотвращает развитие артрита [13, 30, 31].Исследования на мышах показали, что индукция клеток T , FH и Th27 предшествует началу артрита, что указывает на роль обоих типов клеток. Моноколонизация с помощью SFB усиливает продукцию аутоантител и ускоряет прогрессирование заболевания за счет генерации клеток Th27, хотя клеточно-зависимый процесс T FH , индуцированный микробиотой, также может спровоцировать заболевание [44]. Teng et al. [46] продемонстрировали, что SFB запускают аутоиммунный артрит, индуцируя дифференцировку и миграцию T-фолликулярных вспомогательных клеток кишечника (T FH ) в системные лимфоидные участки, что приводит к увеличению продукции аутоантител и обострению артрита.Напротив, Block et al. [45, 47] подтвердили роль микробиоты кишечника в дифференцировке клеток T FH и формировании зародышевого центра. Истощение кишечной микробиоты у мышей антибиотиками снижает количество клеток T FH и уровни продукции антител. Они пришли к выводу, что кишечная микробиота регулирует развитие артрита через T FH независимо от клеток Th27.
4. Дисбактериоз при ревматоидном артрите
Важность кишечного микробиома в аутоиммунитетах, связанных с ревматоидным артритом, была связана как с моделями мышей, так и с заболеваниями человека.Изменения микробиоты связаны с риском и тяжестью заболевания. С ним связаны три участка, в основном легкие, слизистая оболочка рта и желудочно-кишечный тракт. Тем не менее, еще предстоит проверить место (а) инициации первоначального иммунного ответа. В то время как точные механизмы, которые увеличивают риск, полностью не поняты для каждого из них, вполне вероятно, что местный тканевой стресс приводит к посттрансляционной модификации пептидов с последующим образованием антител, выступающих в качестве общего механизма [48].
Нарушения дыхательных путей и цитруллинирование легочной ткани обнаруживаются как у пациентов с ревматоидным артритом, так и у лиц из группы риска. Это позволяет предположить, что легкое является возможным местом генерации аутоиммунитета [49]. Доказательства ранней роли адаптивного иммунитета и иммунной активации в легких этих пациентов получены из протеомного исследования, в котором были описаны два общих цитруллинированных пептида виментина в бронхиальной ткани у пациентов с ранним ревматоидным артритом и синовиальной ткани пациентов с установленным заболеванием. некоторые ключи к разгадке иммунного процесса, инициированного в легких [25].Слизистая оболочка легких как причина аутоиммунного процесса основана на следующих наблюдениях: ACPA представлены в мокроте ACPA-положительных пациентов без артрита; есть микроскопические и макроскопические изменения в легких при раннем ревматоидном артрите и у нелеченных ACPA-положительных пациентов; легочные изменения были продемонстрированы при компьютерной томографии с высоким разрешением у субъектов без заболевания, но с положительным ACPA; образцы легочной биопсии от пациентов с положительным ACPA и установленной AR предполагают, что ACPA продуцируются локально.Однако точные молекулярные механизмы, которые могут быть ответственны за запуск иммунитета в слизистой оболочке легких, относительно не изучены. Известно, что воздействие на легкие вредных агентов, включая дым, может вызвать повышенную экспрессию и активацию PAD [1]. Было высказано предположение, что цитруллинированные белки могут стать аутоантигеном и тем самым вызвать ответ иммунной системы у людей с генетической предрасположенностью к ревматоидному артриту.
Курение и пародонтит способствуют цитруллинированию белка и выработке ACPA [50].Внимание к деснам основано на заболевании пародонта, которое чаще встречается у пациентов с ревматоидным артритом или связано с его активностью. Было высказано предположение, что пародонтальные патогены вызывают системное воспаление или распространяются на пораженные ткани. Действительно, повышенный специфический IgG к патогенам пародонта, включая Prevotella intermedia и Porphyromonas gingivalis , был зарегистрирован при РА [51]. Присутствие P. intermedia и P. gingivalis в поддесневой зубной бляшке, а также в синовиальной жидкости подтверждает роль микробиоты в инициировании или поддержании хронического воспаления [52].Поперечные исследования выявили корреляцию между RA и более высокими титрами сывороточных антител против предполагаемых патогенов пародонта, таких как P. gingivalis , Prevotella melaninogenica и Tannerella forsythia [53]. Оральная инокуляция P. gingivalis и Prevotella nigrescens усугубляла тяжесть артрита в экспериментальной мышиной модели, направляя иммунный путь в сторону продукции IL-17 и генерации ответа Th27 [54].Эффекты двух бактерий расходились в том, что P. nigrescens , в отличие от P. gingivalis , подавляло защитные для суставов цитокины типа 2, включая IL-4. P. gingivalis экспрессирует фермент с амидезиминазной активностью, который превращает С-концевой аргинин в цитруллин, аналогичный тому, который участвует в этиологии ревматоидного артрита. Цитруллинирование бактериальных и человеческих белков с помощью PAD может выявить скрытые эпитопы, что приведет к потере толерантности у генетически предрасположенных лиц.Считается, что возникающий иммунный ответ вместе с эндогенным цитруллинированием продуцирует ACPA [4]. Тот факт, что курение тесно связано с наличием пародонтита и инфекции P. gingivalis , дает косвенные доказательства в пользу этой гипотезы. Однако недавние эпидемиологические данные не продемонстрировали четкой взаимосвязи между пародонтитом и ревматоидным артритом [1].
Недавно микробиота кишечника была предложена в качестве незаменимого фактора окружающей среды в прогрессировании ревматоидного артрита [5, 18, 27, 55–57].Беннике и др. [43] идентифицировали 21 цитруллинированный пептид в ткани толстой кишки как пациентов с ревматоидным артритом, так и контрольной группы, которые ранее были обнаружены в ткани легких и синовиальной жидкости пациентов с РА. Три цитруллинированных белка (цитруллинированный виментин, фибриноген-альфа и актин) являются известными мишенями для ACPA, что подтверждает, что слизистая оболочка толстой кишки может быть потенциальным местом нарушения иммунной толерантности к цитруллинированным эпитопам. Цитруллинированный виментин был обнаружен с повышенным содержанием в ткани толстой кишки этих пациентов по сравнению с контрольной группой, что может указывать на то, что первоначальный запуск ревматоидного артрита не ограничивается только конкретным местом в организме, но может иметь место во многих других местах [43].Таким образом, это исследование поддерживает гипотезу о том, что слизистая оболочка толстой кишки может служить местом нарушения иммунной толерантности к цитруллинированным белкам, вызывая выработку ACPA у пациентов с ослабленной иммунной системой.
5. Кишечная микробиота при ревматоидном артрите
Потенциальная роль кишечной микробиоты в этиопатогенезе ревматоидного артрита подтверждается исследованиями на животных моделях, исследованиями кишечной микробиомы и косвенно влиянием диеты и пробиотиков на степень воспалительного процесса. деятельность.Патофизиологические механизмы, с помощью которых микробиота кишечника связана с артритом, вероятно, многофакторны; предлагаемые механизмы включают активацию антигенпрезентирующих клеток посредством воздействия на TLR или NLR, способность производить цитруллинизацию пептидов посредством ферментативного действия, антигенную мимикрию, изменения проницаемости слизистой оболочки кишечника, контроль иммунной системы хозяина (запуск дифференциации Т-клеток) и усиление воспаления слизистой оболочки, опосредованного Т-хелперами 17.
Несмотря на существование моделей на животных, хорошо известно, что не существует модели на животных, которая полностью представляла бы ревматоидный артрит [58].Однако мышиные модели артрита показали, что они вызывают эрозивный полиартрит при внутрибрюшинной инъекции фрагментов клеточной стенки Streptococcus pyogenes , Lactobacillus casei и Eubacterium aerofaciens [59–61]. Артритогенность бактериальных структур зависит от видов бактерий, и, что примечательно, даже бактерии из нормальной кишечной микробиоты вызывают экспериментальный артрит у животных [17]. У мышей-гнотобиотиков не развивается артрит, и введения SFB достаточно для реинтеграции клеток Th27 из собственной пластинки, увеличения выработки аутоантител и быстрого развития деструктивного артрита [62].Лечение антибиотиками предотвращает и подавляет фенотип, аналогичный ревматоидному артриту на нескольких моделях мышей [4, 18, 28], а у генетически предрасположенных мышей дисбиоз увеличивает чувствительность к артриту за счет активации аутореактивных Т-клеток в кишечнике [63].
Роль кишечной микробиоты в патогенезе артрита была продемонстрирована индукцией / обострением артрита на экспериментальных моделях на мышах [55, 64–66]. Исследования на мышах-гнотобиотах показали, что нарушения в кишечной микробиоте могут вызывать выработку провоспалительных цитокинов, интерлейкина-17 и повышение уровня клеток Th27 даже во внекишечных тканях [11].Затем клетки Th27 мигрируют в периферическую лимфоидную ткань и секретируют IL-17, который, в свою очередь, действует непосредственно на B-клетки и индуцирует системную дифференцировку B-клеток и продукцию антител [67]. В конечном итоге это может привести к развитию аутоиммунного заболевания за счет распознавания молекулярных паттернов кишечной микробиоты [67]. Мыши с нокаутом по антагонисту рецептора IL-1 (IL-1Ra), у которых спонтанно развивается аутоиммунный Т-клеточный артрит, не заболевают при выращивании в среде, свободной от микробов. Однако колонизация пригородной Lactobacillus bifidus вызывает быстрое начало заболевания, тяжесть и заболеваемость, сравнимые с артритом, наблюдаемым у мышей. L. bifidus запускает артрит в этой модели, способствуя дисбалансу гомеостаза Treg-Th27 клеток и опосредованному через передачу сигналов Toll-подобного рецептора (TLR2-TLR4) [28, 65]. Лю и др. [64] обнаружили, что род Lactobacillus был значительно более распространен у мышей, чувствительных к коллаген-индуцированному артриту (CIA-) до начала артрита, чем у устойчивых к CIA мышей. Примечательно, что стерилизованные мыши с микробиотой от чувствительных к CIA мышей показали более высокую частоту индукции артрита, чем мыши с микробиотой от устойчивых к CIA мышей.Моноколонизация свободных от микробов мышей K / BxN с помощью SFB была достаточной для стимулирования продукции аутоантител и патогенных клеток Th27, а также для запуска артрита [66]. Системный дефицит стерильных животных отражает потерю клеток Th27 из собственной пластинки кишечника. Введение одного вида резидентных кишечных нитчатых бактерий восстановило компартмент клеток Th27 в собственной пластинке; производство аутоантител и артрит возникли быстро. Таким образом, единственный комменсальный микроб, благодаря своей способности стимулировать конкретную субпопуляцию Т-хелперных клеток, может привести к аутоиммунному заболеванию [66].Эти результаты свидетельствуют о том, что комменсальные бактерии могут вызывать аутоиммунный артрит, вызывая ответ Th27 в кишечнике. Следовательно, состав микробиоты кишечника играет ключевую роль в балансе между воспалительными Th-клетками и супрессивными Treg-клетками для поддержания иммунной толерантности в здоровых условиях [27].
Взаимодействие между генетическими факторами хозяина, такими как MHC и кишечная микробиота, и его влияние на развитие ревматоидного артрита трудно изучать на людях из-за высокой вариабельности генетических факторов и диеты [11].Исследования, проведенные Gomez et al. [68] представили первую демонстрацию того, что гены HLA и кишечная среда взаимодействуют, чтобы влиять на восприимчивость к артриту. Это исследование показало различия в фекальном микробиоме трансгенных мышей HLA-DRB10401, чувствительных к ревматоидному артриту, по сравнению с мышами DRB10402, устойчивыми к развитию ревматоидного артрита. В частности, самки мышей DRB10401 имели микробный состав, значительно отличающийся от самок DRB10402, и это приводило к увеличению кишечной проницаемости и транскриптам цитокинов типа Th27 у мышей DRB10401.Анализ показал, что кишечная флора мышей, чувствительных к артриту, имела большее количество Clostridium sp. Бактерии DRB10402, устойчивые к артриту, пополнились семействами Porphyromonadaceae и Bifidobacteriaceae [68]. Последний организм связан с противовоспалительным ответом иммунной системы слизистой оболочки кишечника за счет подавления пролиферации Т-клеток и продукции провоспалительных цитокинов, а также за счет ингибирования ядерного фактора kB.Результаты показывают разницу в микробном составе кишечника между двумя штаммами, предполагая, что гены MHC могут прямо или косвенно участвовать в определении микробного состава кишечника и взаимодействия между кишечными комменсалами [13, 18]. Кроме того, они продемонстрировали, что дисбактериоза недостаточно, поскольку он требует генетической предрасположенности хозяина из-за невозможности индукции воспалительного ответа у диких животных даже с проартритогенной кишечной флорой [13, 28].
В течение последних десятилетий было проведено несколько исследований, пытающихся связать воспаление слизистой оболочки кишечника и суставов. Eerola et al. [69] сообщили, что фекальный профиль жирных кислот бактериальных клеток значительно отличался у субъектов с ревматоидным артритом, в основном анаэробными бактериями, по сравнению с контрольной группой. Они поддерживают идею о том, что ревматоидный артрит представляет собой состояние хронического воспаления, которое может быть мотивировано или усугублено чрезмерным ростом патогенных бактерий или отсутствием обычных иммуномодулирующих бактерий [5, 16, 18, 57, 70].Ваахтовуо и др. [16] также описали различия в фекальном разнообразии у лиц с ревматоидным артритом по сравнению с пациентами с фибромиалгией, характеризующимися более низкими бунди-бактериями, Bacteroides-Porphyromonas-Prevotella , подгруппа Bacteroides fragilis и группа Eubacterium cocterium rectaleco у пациентов с ревматоидным артритом [6]. С другой стороны, Newkirk et al. [71] выявили различия в типах колонизации патогеном E. coli среди субъектов с ревматоидным артритом, RF-положительные пациенты чаще колонизировались E.coli , филогенетическая группа D, тогда как RF-отрицательные пациенты чаще были колонизированы E. coli , филогенетическая группа B2, и у этих людей также были более низкие оценки суставов и маркеры воспаления, но более высокие ответы антител IgA к E. coli .
Наблюдение за различиями микробиоты кишечника у субъектов с ранним ревматоидным артритом по сравнению с контрольной группой возобновило интерес к изучению кишечной микробиоты как возможного места происхождения аутоиммунных процессов; исследования микробиоты кишечника показывают, что ревматоидный артрит характеризуется увеличением и / или уменьшением бактериальных групп по сравнению с контролем [5, 18, 55–57].Высокопроизводительное секвенирование образцов стула в 5 исследованиях пациентов с РА показало дисбактериоз кишечника [5, 18, 55, 57, 63], а в 2 исследованиях сообщалось о чрезмерном расширении Prevotella sp. у пациентов с ранним РА, особенно P. copri (Таблица 2) . Различия между бактериями, о которых сообщалось в исследованиях, могут зависеть от временного течения заболевания (т. Е. Раннего по сравнению с установленным), субъектов, включенных в контрольные группы (здоровые или родственники первой степени), полученного лечения и географического положения, поскольку исследования не показывают такой же закономерности.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MLGs: группы метагеномных связей. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Toivanen et al. [57] сравнили фекальную микробиоту 25 пациентов с ранним RA с микробиотой пациентов с невоспалительной болью, используя олигонуклеотидный зонд против 16S РНК. У пациентов с ранним РА было значительно меньше бактерий, принадлежащих к полу: Bacteroides sp., Prevotella sp. И Porphyromonas sp. В другом исследовании Scher et al. [18] сообщили, что люди с ранним РА более склонны содержать Prevotella copri по сравнению с контрольной группой.Кроме того, они продемонстрировали, что пероральное введение P. copri увеличивало местный воспалительный ответ на мышиной модели колита. Следовательно, P. copri может изменять кишечную проницаемость. Такое увеличение может привести к проникновению бактерий и / или их компонентов по всему телу; это один из предложенных механизмов, связывающих дисбактериоз с патогенезом артрита. Интересно, что относительная численность P. copri показала отрицательную корреляцию с наличием общего эпитопа, что позволяет предположить, что состав микробиома кишечника человека также может частично зависеть от генома хозяина, и предполагает наличие дисбактериоза до появления клинических проявлений. фенотип.
В соответствии с этими результатами Maeda et al. [63] наблюдали, что P. copri было в изобилии в кишечной микробиоте у японских пациентов с ранним РА, не получавших медикаментозного лечения. Они определили, что P. copri per se обладает высокой способностью индуцировать цитокины, связанные с клетками Th27, такие как IL-6 и IL-23. Увеличенная Prevotella sp. изобилие связано с усиленным Т-хелпером 17-опосредованного воспаления слизистой оболочки, что соответствует отмеченной способности Prevotella sp.в управлении иммунным ответом Th27 in vitro [51]. В другом исследовании Pianta et al. [72] определили, что подгруппы пациентов с ревматоидным артритом имеют дифференциальную иммунную реактивность IgG или IgA с P. copri. Как у пациентов с впервые начавшимся ревматоидным артритом, так и у пациентов с хроническим артритом подгруппа имела ответы антител IgA либо на Pc-p27, либо на весь организм, которые коррелировали с ответами цитокинов Th27 и частыми ACPA. Во второй подгруппе присутствовали антитела IgG P. copri , которые были связаны с ДНК Prevotella в синовиальной жидкости, P.copri -специфические ответы Th2 и менее частые ACPA. Пациенты с РА имели IgA, IgG или не имели специфических антител, что указывает на то, что у каждого отдельного пациента могут развиваться разные иммунные ответы на P. copri , что, в свою очередь, может иметь последствия для риска и исходов заболевания.
Молекулярная мимикрия из-за сходства последовательностей чужеродных и собственных пептидов является одним из таких механизмов, которые, как известно, приводят к перекрестной активации аутореактивных Т- или В-клеток, происходящих от патогенов.Эти Т- и В-клетки могут перекрестно реагировать с эпитопами хозяина, что приводит к аутоиммунитету [67]. В недавней работе Pianta et al. [73] описали два белка, происходящие из общих типов кишечных бактерий, которые могут вызывать иммунные ответы у пациентов с РА. N -Ацетилглюкозамин-6-сульфатаза (GNS) и филамин A (FLNA) были идентифицированы как аутоантигены, которые вызывают ответ как Т-, так и В-клеток, более чем у 50% пациентов с РА, но не у здоровых людей из контрольной группы или пациентов с другие ревматические заболевания.Представленный HLA-DR пептид GNS имеет выраженную гомологию последовательностей с эпитопами сульфатазных белков Prevotella sp. и Parabacteroides sp., тогда как представленный HLA-DR пептид FLNA имеет гомологию с эпитопами из белков Prevotella sp. и Butyricimonas sp., другой кишечный комменсал. Ответы Т-клеток на соответствующие микробные и собственные пептиды сильно коррелировали. Это исследование предоставляет доказательства того, что эпитопы Т-клеток родственного отряда кишечных микробов, в частности, Prevotella sp., могут перекрестно реагировать с аутоэпитопами высокоэкспрессированных белков в суставах, особенно у пациентов с аллелями SE.
Кроме того, Prevotella sp. может быть не единственным видом, участвующим в воспалительном заболевании. Zhang et al. [5] использовали метагеномную технологию секвенирования для анализа образцов фекалий, зубов и слюны у большой группы пациентов с РА, а также у здоровых людей. Анализ дифференциально представленных групп метагеномного сцепления выявил значительные различия микробиома между пациентами с РА и здоровыми людьми в контрольной группе не только в фекалиях, но также в образцах слюны и зубов.Они продемонстрировали, что грамположительные бактерии обогащают микробиоту по сравнению с небольшим количеством грамотрицательных бактерий, и, кроме того, что дисбактериоз связан с маркерами воспаления и клинической активностью ревматоидного артрита. Кроме того, они также обнаружили изменения в окислительно-восстановительной среде, транспорте и метаболизме железа, серы и цинка в микробиоте пациентов с РА, что указывает на то, что измененный микробиом может играть важную роль в патогенезе РА. Примечательно, что измененный микробиом был частично восстановлен до нормального состояния (микробиом здорового контроля) у пациентов, у которых отмечалось клиническое улучшение после назначения модифицирующих болезнь противоревматических препаратов.Примечательно, что P. copri у индивидуумов, пораженных RA, продемонстрировал тенденцию к увеличению относительной численности в первый год, что согласуется с его увеличением в раннем RA. Многие виды Prevotella были обогащены слюной субъектов с ревматоидным артритом по сравнению с контрольной группой. Заметным исключением был Prevotella intermedia , который был обогащен в контрольной группе. Однако в образцах зубного налета картина была совсем другой, и большинство Prevotella sp. присутствовали в более высоких пропорциях у здоровых субъектов.
Chen et al. [55] сообщили, что бактерии, принадлежащие к типу Actinobacteria , играют значительную роль в патогенезе ревматоидного артрита, Collinsella sp. и Eggerthella sp. предсказал его присутствие, и дисбактериоз в кишечном микробиоме частично восстанавливается после лечения модифицирующими болезнь противоревматическими препаратами, аналогично результатам, полученным в предыдущем исследовании. Потенциальная ассоциация P. copri , о которой сообщалось ранее, с впервые возникшим нелеченным RA и DR4 не наблюдалась в этой когорте пациентов с RA (в отличие от предыдущих исследований, все пациенты в настоящем исследовании в настоящее время находились на схеме лечения).Они показали, что снижение микробного разнообразия кишечника у пациентов с РА связано с продолжительностью заболевания после корректировки различных препаратов, используемых для лечения. Collinsella sp. может способствовать развитию ревматоидного артрита посредством молекулярной мимикрии, поскольку он представляет последовательности, общие с DRB10401. Роль RA-ассоциированных бактерий Collinsella sp. был подтвержден с использованием линии эпителиальных клеток человека и гуманизированной мышиной модели артрита. Collinsella sp.повышенная тяжесть заболевания на гуманизированной модели мыши. Один из механизмов, с помощью которого Collinsella вносит вклад в патогенез заболевания, заключается в увеличении проницаемости кишечника, о чем свидетельствует более низкая экспрессия белков плотных контактов. Кроме того, Collinsella влияет на продукцию IL-17A эпителием [55].
Хотя исследования пациентов с ревматоидным артритом показывают корреляцию между Prevotella sp. в своем патогенезе другие исследования предполагают, что он может считаться полезным бактериальным видом, а не патогенным [74, 75].Коллекции культур в настоящее время включают около 40 различных видов Prevotella , большинство из которых представляют собой пероральные изоляты, а три из них обнаружены в кишечнике (обычно более многочисленны P. copri ). Существенно различающиеся репертуары геномных генов штаммов в пределах Prevotella sp. и между хозяевами, вероятно, лежат в основе некоторых различий, наблюдаемых в ответах на уровне рода на диету и состояние здоровья у разных людей [75]. Недавнее комплексное исследование, сравнивающее несколько видов бактерий, предполагает, что принадлежность к определенному типу не предсказывает иммунологические свойства, подчеркивая важность характеристики свойств на уровне видов.Marietta et al. [76] оценили способность 2 видов Prevotella sp. для профилактики и лечения артрита у мышей HLA-DQ8. Было показано, что способность модулировать иммунный ответ у штаммов Prevotella различалась. Лечение P. histicola подавляло развитие артрита путем модуляции иммунного ответа (регуляция дендритных клеток и генерация Treg-клеток), что приводило к подавлению ответов Th27 и снижению воспалительных цитокинов (IL-2, IL-17 и некроз опухолей). фактор).Напротив, введение P. melaninogenica не показало значительных изменений в уровнях цитокинов, предотвращающих развитие артрита. Способность P. histicola модулировать была подтверждена с использованием модели мышей DBA / 1, демонстрирующей, что у мышей, получавших P. histicola , развился более умеренный артрит по сравнению с контролем. Понятно, что единственный штамм Prevotella sp. могут действовать в зависимости от контекста, что было истолковано как положительное или отрицательное.Это может объяснить, почему Prevotella sp. изобилует здоровой микробиотой и предполагает, что только определенные штаммы могут проявлять патогенные свойства.
У пациентов с впервые возникшим РА, изобилие Prevotella в кишечнике происходило за счет Bacteroides fragilis , организма, который важен для функции Treg [18, 72]. Фактически, высокие уровни P. copri и подобных видов связаны с низким уровнем полезных микробов, которые, как полагают, подавляют иммунную систему и метаболизируют витамины в формах, всасываемых в кровоток [17].При обсуждении возможных механизмов, посредством которых диета может влиять на ревматоидный артрит, следует учитывать влияние кишечной флоры [77–79]. Диета, богатая белками и животными жирами, связана с присутствием Bacteroides sp. в то время как диета, богатая углеводами, связана с присутствием Prevotella sp. [80]. Исследования показали, что средиземноморская или веганская диета снижает воспалительную активность, улучшает физическую функцию и улучшает жизненный тонус [19]. Однако в некоторых других исследованиях обнаруживаются преимущества без достижения значительного улучшения сводных индексов для измерения активности заболевания [81, 82].Тем не менее, в этих исследованиях не было определено, действительно ли улучшение при ревматоидном артрите было связано с изменением состава кишечной флоры.
Пробиотики — это живые организмы, которые могут принести пользу здоровью хозяина. Пробиотики в основном проявляют свои положительные эффекты с помощью следующих трех методов: антимикробное действие, повышение целостности слизистого барьера и иммуномодуляция [83]. Исследования [84–86], оценивающие взаимосвязь между добавлением пробиотиков и уровнем активности РА, не показали убедительных результатов (Таблица 3).Улучшения в пробиотических вмешательствах не были достаточно очевидными, чтобы продемонстрировать эффективность лечения пациентов с РА, из-за ограниченного количества исследований. Необходимо провести более продуманное исследование, чтобы определить лучшие виды, облегчающие РА, и оптимизировать метод приема и дозы пробиотиков [83].
| ||||||||||||||||||||||||||||||||
| CRP: C-реактивный белок; DAS28: показатель активности заболевания — 28; ИЛ: интерлейкин; СОЭ: скорость оседания эритроцитов; ACR: Американский колледж ревматологии. | ||||||||||||||||||||||||||||||||
Наконец, доказательства того, что кишечная микробиота стимулирует развитие артрита, получены на экспериментальных моделях на мышах. У людей эта ассоциация основана на различиях между микробиомом в группах сравнения, которые не обязательно отражают его причинную связь. Результаты на людях позволяют предположить, что дисбактериоз является значимым этиологическим агентом, способствующим прогрессированию ревматоидного артрита или, что более важно, воспаление, вызванное некоторыми микроорганизмами, такими как P. copri , вероятно, может способствовать поддержанию артрита.Для того чтобы предсказать роль кишечной микробиоты в патогенезе ревматоидного артрита, все же необходимо точное представление о потенциале этого вида, его экологии и взаимодействии с другими микробами и / или хозяевами. Кроме того, хотя слизистая оболочка кишечника, вероятно, имеет самый высокий потенциал для взаимодействия хозяина и микроба, все слизистые оболочки имеют резидентную микробиоту и динамически реагируют на ее присутствие с помощью иммунной модуляции. Грамотрицательные бактерии могут вызвать инфекции в любой части тела; Среди наиболее распространенных типов — оральный, стоматологический, плевропульмонарный, интраабдоминальный, слизистые оболочки половых органов, кожа и мягкие ткани.Другими словами, это не означает, что все пациенты с ревматоидным артритом должны иметь дисбактериоз в одном месте.
6. Микробиота как возможный механизм профилактики ревматоидного артрита
Текущие исследовательские проекты сосредоточены на профилактике с помощью биологических препаратов, которые ингибируют образование антител или активируют Т-клетки [87]. Недавние открытия показали, что дисбактериоз кишечника является большим шагом вперед в нашем понимании ревматоидного артрита. Тем не менее, нет исследований, демонстрирующих антиген или антигены, запускающие аутоиммунный процесс.Логические признаки указывают на дисбактериоз слизистой оболочки как привлекательное место для выяснения путей аутоиммунитета, особенно механизмов, которые вызывают потерю иммунной толерантности, и конкретных механизмов, с помощью которых человек эволюционирует от доклинического к клиническому заболеванию.
Было показано, что микробиота кишечника играет роль в ревматоидном артрите, хотя механизм этой связи остается неясным. Понимание этих механизмов имеет решающее значение для повышения эффективности лечения и индивидуального ведения пациентов [67].Пластичность микробиома может позволить специфические или систематические манипуляции с определенной кишечной микробиотой, связанной с болезнями хозяина [88], предполагая, что в будущем эта манипуляция может изменить терапевтические стратегии у субъектов с ревматоидным артритом.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Авторы благодарят Глорию Меркадо за ее полезные комментарии во время подготовки этой рукописи.
Evolve BioSystems объявляет об инвестициях Cargill и Manna Tree в пробиотики для здоровья кишечника младенцев
Новый капитал будет использован, чтобы помочь компании продолжить коммерциализацию пробиотиков следующего поколения, способных восполнить широко распространенный дефицит микробиома кишечника младенцев.
«Мы очень рады объявить о наших новых инвесторах, поскольку мы продолжаем наши поиски решения проблемы кризиса здоровья новорожденных», — сказал Тимоти Браун, генеральный директор Evolve BioSystems.
«Наше исследование показало, что более чем у 90% младенцев в США отсутствуют критические бактерии, Bifidobacterium longum subsp.Infantis (B. infantis), который широко задокументирован как ключевой компонент микробиома кишечника младенца. Объявленная сегодня финансовая поддержка, которая включает сильную постоянную поддержку со стороны наших прежних инвесторов, поможет продолжить нашу миссию по созданию более здорового будущего для наших детей в младенчестве и за его пределами ».
Evolve BioSystems производит Evivo, запатентованный пробиотик, доказавший свою полезность. детский дисбактериоз кишечника, или недостаточность кишечника новорожденного. Evivo состоит из активированного B.Infantis EVC001, исследования которого показали, что он способствует критическому развитию пищеварительной и иммунной систем младенцев.
Evivo восстанавливает эту недостающую бактерию в микробиоме кишечника младенца, уменьшая количество потенциально патогенных бактерий на 80%, а также значительно уменьшая воспаление кишечника. Эти патогены связаны с более высоким риском как краткосрочных, так и долгосрочных проблем со здоровьем, включая колики, опрелости, экзему, астму, аллергию и диабет 1 типа.
«Evivo, инновационный детский пробиотик Evolve BioSystem, доказал, что он оказывает сильное влияние на развивающийся кишечник младенца и определяет долгосрочную траекторию его здоровья.Этот раунд финансирования будет продолжать повышать осведомленность потребителей и практикующих врачей, поддерживая при этом дальнейшие исследования и разработки. Мы гордимся тем, что сотрудничаем с такими новаторами, как Тим и вся команда Evolve, которые находятся в авангарде продуктов питания и биотехнологий », — сказала Габриэль« Элли »Рубинштейн, соучредитель и генеральный директор Manna Tree.
« Это важное вложение. лежит в основе нашей миссии Manna Tree — инвестирования в здоровье человека ».
Польза Evivo для здоровья подтверждена многочисленными клиническими исследованиями и рецензируемыми публикациями.Инвестиции Manna Tree и Cargill последовали за последним прорывом в исследовании Evolve — исследованием микробиома США, недавно опубликованным в Scientific Reports. Исследование показывает, что девять из десяти младенцев в США страдают от кишечной недостаточности новорожденных, что увеличивает риск для здоровья и развития младенцев в раннем возрасте. Это крупнейшее на сегодняшний день исследование, в котором оцениваются широко распространенные уровни потенциальных патогенных бактерий у младенцев в США и значительный дефицит B. infantis .
«Evivo от Evolve BioSystem может стать отличным пробиотиком для младенцев, и мы рады работать с ними, чтобы увеличить его влияние», — сказал Чак Варта, президент подразделения технологий здравоохранения Cargill.
«Наша цель — помочь людям жить более здоровыми днями с самого начала. Вместе мы можем использовать наш соответствующий опыт и знания в области питания, пищеварения и иммунитета, чтобы предложить нашим клиентам ингредиенты нового поколения.

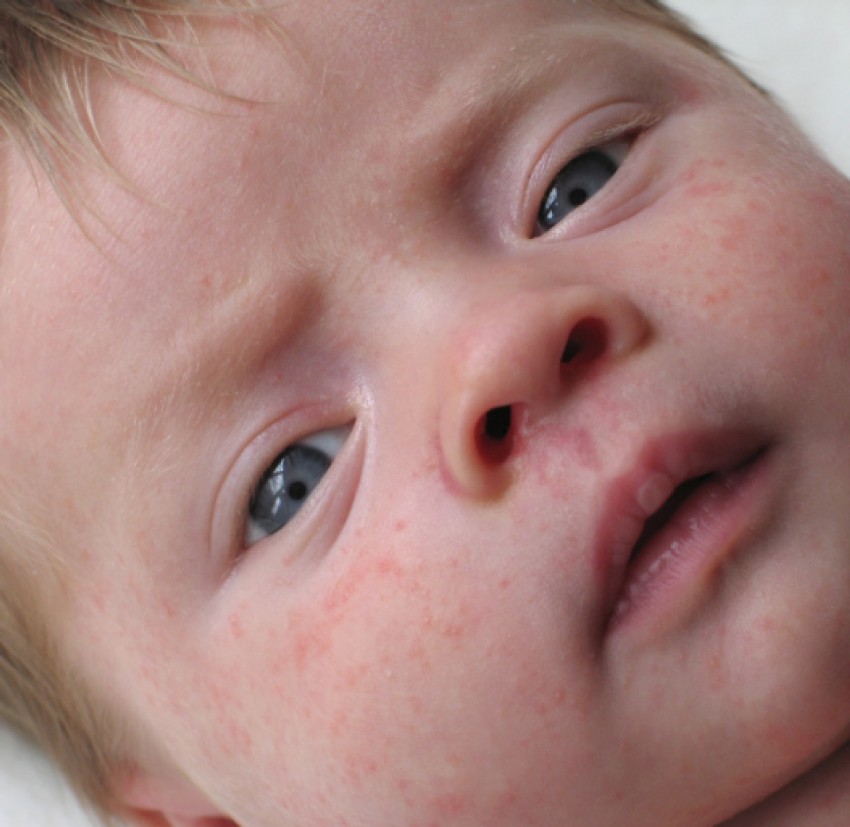

 Такие, как эмоциональное возбуждение и физическое напряжение.
Такие, как эмоциональное возбуждение и физическое напряжение.



 Чаще всего этот процесс — не самостоятельная болезнь, а реакция на нарушение работы какой-то из систем организма.
Чаще всего этот процесс — не самостоятельная болезнь, а реакция на нарушение работы какой-то из систем организма. Сальмонелла, шигелла не должны появляться в фекалиях малыша.
Сальмонелла, шигелла не должны появляться в фекалиях малыша.
 В этом случае инфицирование ребенка происходит в тот момент, когда он проходит по родовым путям. Если мама больна кандидозом, то малыш часто имеет признаки данной инфекции сразу после рождения. В этой ситуации неблагоприятные симптомы болезни можно обнаружить уже у грудничка.
В этом случае инфицирование ребенка происходит в тот момент, когда он проходит по родовым путям. Если мама больна кандидозом, то малыш часто имеет признаки данной инфекции сразу после рождения. В этой ситуации неблагоприятные симптомы болезни можно обнаружить уже у грудничка. Любая инфекция, в том числе и грибковая, легко вызывает у них инфицирование и появление неблагоприятных симптомов.
Любая инфекция, в том числе и грибковая, легко вызывает у них инфицирование и появление неблагоприятных симптомов. После тяжелых и частых простуд организм ребенка резко ослабевает. У таких деток, как правило, усиливается рост грибковой флоры, что приводит к появлению признаков кандидоза.
После тяжелых и частых простуд организм ребенка резко ослабевает. У таких деток, как правило, усиливается рост грибковой флоры, что приводит к появлению признаков кандидоза. Поселяясь во рту, грибки вызывают различные многочисленные повреждения. К ним относятся: хейлит, стоматит, гингивит, глассит. По статистике, кандидоз ротовой полости чаще всего встречается у грудничков и школьников. Новорожденные малыши могут заразиться от матери во время проведения грудных вскармливаний.
Поселяясь во рту, грибки вызывают различные многочисленные повреждения. К ним относятся: хейлит, стоматит, гингивит, глассит. По статистике, кандидоз ротовой полости чаще всего встречается у грудничков и школьников. Новорожденные малыши могут заразиться от матери во время проведения грудных вскармливаний. Провоцирующей причиной в этом случае часто становится дисбактериоз или хронические заболевания желудочно-кишечного тракта. Длительные запоры способствуют формированию у малыша также анальных форм кандидоза. Лечением таких форм молочницы занимается детский гастроэнтеролог.
Провоцирующей причиной в этом случае часто становится дисбактериоз или хронические заболевания желудочно-кишечного тракта. Длительные запоры способствуют формированию у малыша также анальных форм кандидоза. Лечением таких форм молочницы занимается детский гастроэнтеролог. Является самой распространенной формой. Локализация — в паху. У девочек при данной форме кандидоза появляются творожистые выделения из влагалища. Многие острые формы молочницы при этом могут переходить в хронические.
Является самой распространенной формой. Локализация — в паху. У девочек при данной форме кандидоза появляются творожистые выделения из влагалища. Многие острые формы молочницы при этом могут переходить в хронические. Такая избирательная особенность вызвана особенностью их анатомического и физиологического строения. Это также обуславливает многообразие различных клинических вариантов болезни.
Такая избирательная особенность вызвана особенностью их анатомического и физиологического строения. Это также обуславливает многообразие различных клинических вариантов болезни. Он может в небольшом количестве или существенно покрывать поврежденные участки. При прикасании к налету — он начинает крошиться и ломаться. При попытках его снятия на слизистых оболочках остаются эрозированные участки, которые могут кровоточить. Цвет налета -чаще белый или с сероватым оттенком.
Он может в небольшом количестве или существенно покрывать поврежденные участки. При прикасании к налету — он начинает крошиться и ломаться. При попытках его снятия на слизистых оболочках остаются эрозированные участки, которые могут кровоточить. Цвет налета -чаще белый или с сероватым оттенком. Встречаются при кандидозном хейлите. Этот симптом можно заметить и в домашних условиях. Во внешних уголках рта у ребенка появляются глубокие бороздки. Во время приема пищи они могут травмироваться и кровоточить.
Встречаются при кандидозном хейлите. Этот симптом можно заметить и в домашних условиях. Во внешних уголках рта у ребенка появляются глубокие бороздки. Во время приема пищи они могут травмироваться и кровоточить.
 Этот метод позволяет точно выявлять наличие грибка в различном биологическом материале. Для проведения данного теста потребуется предварительный забор налета.
Этот метод позволяет точно выявлять наличие грибка в различном биологическом материале. Для проведения данного теста потребуется предварительный забор налета. Чрезмерные психоэмоциональные нагрузки лучше исключить. Регулярное закаливание также улучшает показатели иммунитета.
Чрезмерные психоэмоциональные нагрузки лучше исключить. Регулярное закаливание также улучшает показатели иммунитета.