гемопоэз, формирование тканевого иммунитета, участие в процессе свертывания крови, формирование памяти иммунитета
В статье, где рассказывалось о строении, происхождении и значении моноцитов, упоминалась их главная функция – способность к фагоцитозу. Действительно, основная миссия этих клеток в организме состоит в том, что они играют роль фагоцитов. Количество моноцитов в крови таково, что они постоянно «мониторят» все части кровеносного русла на предмет наличия в нем источников угрозы – любых чужеродных и вредоносных частиц, от которых нужно избавиться. Зафиксировав их наличие, они тут же атакуют найденные объекты и «пожирают» их.
Казалось бы, при такой значительной функции не стоит ожидать от моноцитов наличия еще каких-то ценных «опций». Однако они есть: кроме фагоцитоза, функции моноцитов заключаются в следующем…
Участие в гемопоэзе:
Гемопоэз – это процесс образования клеток крови. К ним относятся эритроциты, тромбоциты, а также многочисленные виды лейкоцитов, среди которых и описываемые клетки.
Все компоненты крови исходят из стволовых клеток красного костного мозга; они подвергаются воздействию тех или иных соединений, перемещаются в различные органы и образования, делятся, созревают, и в результате формируются известные разновидности форменных элементов крови. Однако эти элементы не просто являются конечным продуктом гемопоэза – они и сами оказывают заметное воздействие на его протекание.
Так, известно, что моноциты продуцируют определенные вещества, действующие на костный мозг и определяющие активность процесса образования им подобных. Уровень моноцитов сохраняется на постоянных значениях во многом благодаря тому, что эти клетки сами поддерживают свое «поголовье».
Кроме того, продукты синтеза моноцитов влияют на формирование лейкоцитов, исходящих из одного с ними ростка. Речь идет о нейтрофилах, базофилах и эозинофилах.
Формирование тканевого иммунитета:
Моноциты у детей и взрослых – эффективные защитники кровеносного русла. Они активно уничтожают вредоносные объекты, проникшие в кровь. Кроме того, действие моноцитов «многоразовое»: в отличие от многих других фагоцитов, они не гибнут после первой же встречи с агрессором, а продолжают поглощать вредные частицы достаточно долгое время.
Правда, понятие «долгое» в их отношении достаточно условно, потому что, хоть уровень моноцитов в крови постоянный, эти клетки там все время обновляются и сменяют друг друга. Они циркулируют в кровотоке несколько десятков часов, а затем выходят в ткани, где превращаются в макрофаги.
Макрофаги — это долгоживущая разновидность фагоцитов, которые формируют тканевой иммунитет и являются самым важным его звеном, отвечающим за быструю реакцию защиты от бактерий и других чужеродных элементов.
Участники работы других звеньев иммунитета:
Иммунную систему формируют не только разные виды лейкоцитов.
Так, в крови человека существует ряд защитных систем, состоящих из растворенных в ней соединений. Они играют роль в обеззараживании, обездвиживании, обезвреживании вредоносных агентов, делая это несколько иными способами, нежели иммунные клетки.
В производстве некоторых таких веществ принимают участие моноциты. Например, моноциты у детей и взрослых выделяют некоторые белки системы комплемента – защитного комплекса протеинов плазмы, которые усиливают и направляют некоторые реакции иммунитета, повышая эффективность его работы.
Участие в процессах свертывания крови:
Функция моноцитов, помимо прочего, заключается еще и в том, что эти клетки выделяют такие вещества как активаторы плазминогена, тромбоксаны, тромбопластины – соединения, участвующие в свертывании крови. В зависимости от того, какая именно реакция требуется организму – разжижение крови или ее сгущение – моноциты синтезируют определенные соединения.
Формирование памяти иммунитета:
Большое количество моноцитов, встретившись с агрессорами и уничтожив их, выделяют цитокины. Это вещества, которые являются носителями информации о ликвидированной угрозе и о том, как с ней справиться. Они представляют собой своеобразные носители информации, на которых на понятном организму языке записаны полезные инструкции о работе иммунитета. Передаваясь лимфоцитам, цитокины обучают их правильной реакции в ответ на поступление в организм вредоносных частиц. Это помогает иммунитету защищать здоровье человека, а также создавать и поддерживать банк иммунной памяти.
Моноциты – клетки с незаменимыми функциями, поэтому очень важно вести такой образ жизни, чтобы поддерживать их нормальное количество и функцию. Надо правильно питаться, беречься от болезней, отказаться от вредных привычек и т.д. Кроме того, есть препарат, который способен помочь в обеспечении полноценной работы моноцитарно-макрофагальной системы иммунитета. Он называется Трансфер Фактор и содержит цитокины.
Дополнительные порции цитокинов, которые человек получает с препаратом, позволяют стабилизировать работу иммунитета, усилить ее, исправить возникшие ошибки. Это помогает моноцитам в осуществлении их функций, в борьбе с имеющимися заболеваниями и оказывает общее благоприятное воздействие на здоровье людей, принимающих Трансфер Фактор.
О чем расскажут клетки крови? — Статья педиатра Детской поликлиники Литфонда
В крови содержатся различные типы клеток, выполняющих совершенно разные функции – от переноса кислорода до выработки защитного иммунитета. Для того, чтобы понимать, изменения формулы крови при различных заболеваниях, необходимо знать, какие функции выполняет каждый тип клеток.
Некоторые из этих клеток никогда в норме не покидают кровеносное русло, другие же для исполнения своего предназначения выходят в другие ткани организма, в которых обнаруживается воспаление или повреждение.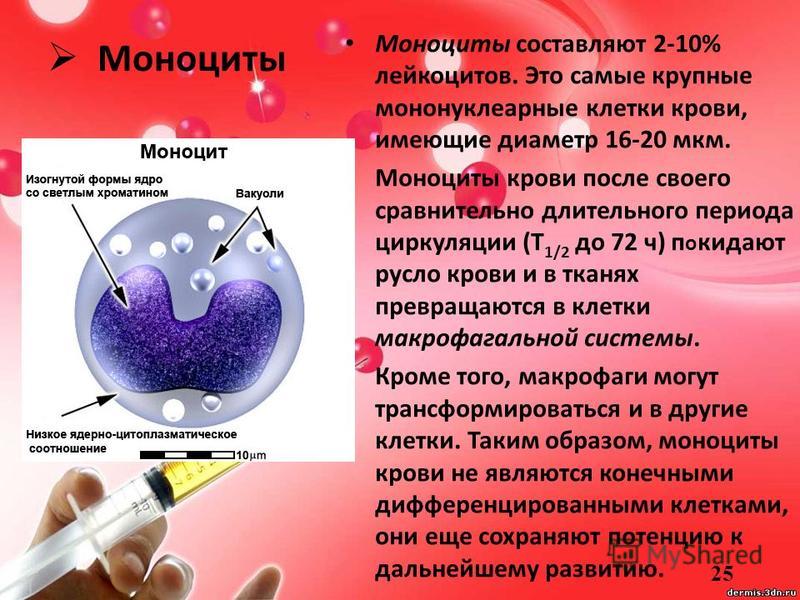
Клетки крови можно разделить на красные и белые – эритроциты и лейкоциты. Эритроциты всю свою жизнь – около 120 дней – циркулируют по кровеносным сосудам и переносят кислород и углекислый газ. Эритроциты составляют основную массу клеток крови. В процессе своего созревания они узко специализируются для выполнения своей самой главной функции – снабжение тканей организма кислородом и удаление углекислого газа.
Для этого они теряют все «лишние» клеточные элементы, приобретают специальную вогнутую форму, позволяющую им проникать в самые мелкие и изогнутые капилляры, и заполняют свою цитоплазму молекулами гемоглобина, способного обратимо связывать кислород. При различных заболеваниях может изменяться как форма, размер, количество эритроцитов, так и уровень гемоглобина. Для постановки правильного диагноза иногда приходится проводить дополнительные тесты, позволяющие выявить нарушения в строении мембраны эритроцита или наличие патологических форм гемоглобина.
Лейкоциты – белые клетки крови – борются с инфекциями и переваривают остатки разрушенных клеток, выходя для этого через стенки небольших кровеносных сосудов в ткани. Лейкоциты делятся на три главные группы: гранулоциты, моноциты и лимфоциты.
Среди гранулоцитов есть нейтрофилы, эозинофилы и базофилы. Внутри гранулоцитов содержатся многочисленные пузырьки и гранулы с биологически-активным содержимым. Нейтрофилы захватывают, убивают и переваривают микроорганизмы бактерии. Базофилы выделяют гистамин, который вовлечен в реакции воспалительного ответа. Эозинофилы участвуют в разрушении паразитов и в аллергических реакциях.
Моноциты, вместе с нейтрофилами, являются главными «санитарами организма», так как их основная функция – удаление обломков старых, отживших, свое клеток, и инородных элементов. Для этого моноциты, выходя из кровеносного русла, становятся макрофагами, которые значительно больше по размерам и дольше живут, чем нейтрофилы.
Лимфоциты являются главными клетками, опосредующими иммунный ответ. Они представлены двумя главными классами:
- B-лимфоциты производят антитела,
- T-лимфоциты убивают клетки, инфицированные вирусом, и регулируют активность других лейкоцитов.
Кроме того, существуют лимфоциты – естественные (природные) киллеры, способные убивать опухолевые клетки.
Тромбоциты содержаться в крови в большом количестве. По своей сути, они не являются обычными целыми клетками, а представляют собой мелкие клеточные фрагменты, отделившиеся от гигантских клеток мегакариоцитов. Мегакариоциты не циркулируют в крови, а находятся в костном мозге, где от них и отделяются «клеточные пластинки» – тромбоциты. Тромбоциты способны прилипать к внутренней поверхности поврежденного сосуда, выступая в качестве организатора заплатки, помогая восстановить целостность сосудистой стенки в процессе свертывания крови.
Образование и созревание большинства клеток крови (гемопоэз) происходит у взрослого человека в костном мозге, где из уникальной стволовой клетки образуется все разнообразие кровяных клеток.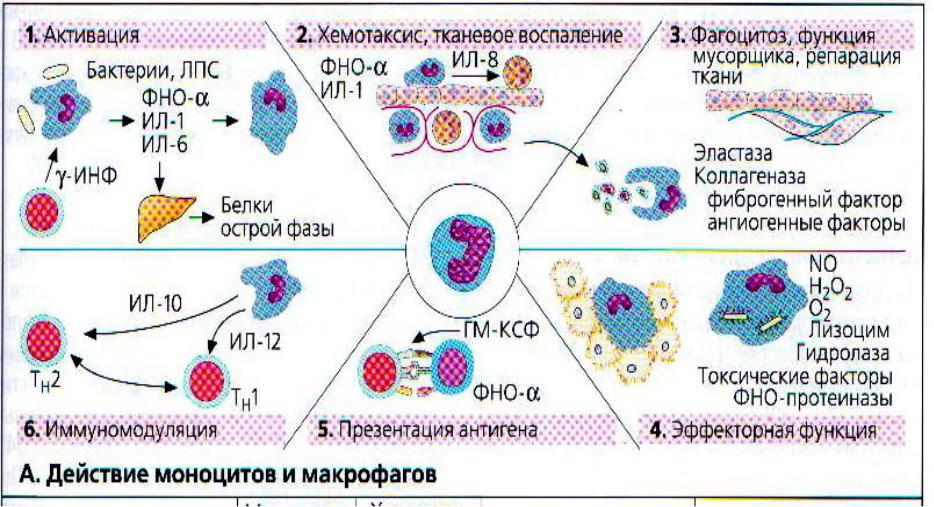 Костный мозг в норме расположен в крупных костях скелета человека, таких как бедренная, тазовая кости, грудина и некоторые др. Однако клетки лимфоидной природы созревают вне костного мозга – в органах иммунной системы, которыми являются некоторые участки слизистой кишечника, тимус, миндалины, селезенка и лимфоузлы. Количество клеток каждого вида образуется в строгом соответствии с потребностями организма, для чего существует сложный контроль. Поэтому, изменения в формуле анализа крови имеют огромное диагностическое значение. Опытный доктор, анализируя количественные и качественные сдвиги в анализе периферической крови, способен понять, среди каких патологических состояний следует проводить диагностический поиск.
Костный мозг в норме расположен в крупных костях скелета человека, таких как бедренная, тазовая кости, грудина и некоторые др. Однако клетки лимфоидной природы созревают вне костного мозга – в органах иммунной системы, которыми являются некоторые участки слизистой кишечника, тимус, миндалины, селезенка и лимфоузлы. Количество клеток каждого вида образуется в строгом соответствии с потребностями организма, для чего существует сложный контроль. Поэтому, изменения в формуле анализа крови имеют огромное диагностическое значение. Опытный доктор, анализируя количественные и качественные сдвиги в анализе периферической крови, способен понять, среди каких патологических состояний следует проводить диагностический поиск.
Запись на прием педиатра по телефону +7(495)150-60-03
Наши врачи Записаться на прием Уважаемые пациенты! Для Вашего удобства и оперативного предоставления всей
необходимой для Вас информации, просим оставить Вашу заявку в часы работы
клиники.
Возврат к списку
Иммунологический «ликбез»
Не последнюю роль в отказе от иммунных препаратов играет и то, что большинством врачей иммунология воспринимается как сложнейшая, не подлежащая восприятию «китайская грамота». Каждый из нас неоднократно изучал учебник иммунологии, и каждый раз – как первый, начиная с полнейшей «стерильности», отсеивал мелкие, потребные только специалистам детали, отбивающие охоту продолжать изучение у любого самого прилежного читателя, но занимающие десятки страниц текста. Поэтому позволим себе начать с азов и представить адаптированный вариант «учения об иммунитете»; он поможет в дальнейшем разобраться с механизмом действия иммунных препаратов без каких-либо ограничений.
Организм человека имеет несколько барьеров, препятствующих проникновению инфекционного агента, распознающих его и уничтожающих. Факторы защиты постоянно взаимодействуют и подразделяются на конституциональные, или врожденные, и индуцированные, или приобретенные.
Конституциональные факторы объединяет неспецифичность действия, и, в свою очередь, они подразделяются на механические барьеры (кожа и слизистые), физико-химические (секреты желез кожи и слизистых) и иммунобиологические (гуморальные и клеточные). Реакции неспецифического иммунитета не обладают памятью, не направлены против определенного агента. Их основная роль – защита от любого агента. Это первая линия защиты, вторая – иммунная система, представляющая собой совокупность органов, тканей и клеток, обеспечивающих генетическое и структурное постоянство организма. Задача первой линии защиты – не допустить проникновение болезнетворного агента, а если он проник – вывести. Активацию факторов иммунобиологической резистентности организма вызывают бактериальные продукты, многие цитокины и антитела, компоненты комплимента. Главную роль играют фаготирующие клетки и система комплимента.
Фаготирующие клетки поглощают, разрушают чужеродный агент и выводят его из организма. Фагоциты представляют собой гранулоциты крови (нейтрофилы, эозинофилы и базофилы) и моноциты, которые циркулируют 1-2 дня в крови, затем мигрируют в ткани и становятся макрофагами.
Фагоциты представляют собой гранулоциты крови (нейтрофилы, эозинофилы и базофилы) и моноциты, которые циркулируют 1-2 дня в крови, затем мигрируют в ткани и становятся макрофагами.
Основные функции системы комплимента, состоящей из 26 сывороточных белков, – стимуляция фагоцитоза, нарушение целостности клеточных стенок микроорганизмов, воспроизводство медиаторов воспаления. Поочередно компоненты комплимента взаимодействуют с антигеном или комплексом антиген-антитело, образуя на мембране микроба повреждающий комплекс, разрушающий его.
Фагоцитоз – процесс поглощения и переваривания микроорганизмов, чужеродных частиц и клеток, состоит из четырех последовательных стадий: хемотаксис (процесс передвижения фагоцита к максимальной концентрации активирующих стимулов), адгезия (приклеивание к чужеродному агенту), поглощение и уничтожение.
К другим факторам неспецифической резистентности относятся интерфероны, естественные антитела и факторы, выделяющиеся при разрушении клеток, проявляющие бактерицидное действие (лейкины, плакины). Принципы структурного постоянства основаны на способности распознавания «свой – чужой», для чего на поверхности клеток имеются рецепторы, составляющие главный комплекс гистосовместимости – МНС. При изменении рецепторов иммунная система реагирует на клетку как на чужака. Оптимальное функционирование системы обеспечивают механизмы взаимодействия лимфоидных клеток и макрофагов, как непосредственно, так и с помощью посредников – медиаторов. Макрофаги, поглотившие и расщепившие чужеродный агент, представляют его лимфоцитам и выделяют цитокины, то есть передают информацию на вторую линию защиты [12].
Принципы структурного постоянства основаны на способности распознавания «свой – чужой», для чего на поверхности клеток имеются рецепторы, составляющие главный комплекс гистосовместимости – МНС. При изменении рецепторов иммунная система реагирует на клетку как на чужака. Оптимальное функционирование системы обеспечивают механизмы взаимодействия лимфоидных клеток и макрофагов, как непосредственно, так и с помощью посредников – медиаторов. Макрофаги, поглотившие и расщепившие чужеродный агент, представляют его лимфоцитам и выделяют цитокины, то есть передают информацию на вторую линию защиты [12].
Цитокины – это 18 белков межклеточного взаимодействия, вырабатываемые различными клетками. Многие цитокины оказывают сходное действие, в то же время каждый из них способен действовать на разные типы клеток. Каждый цитокин выполняет множество функций. Важно то, что цитокины осуществляют взаимодействие между клетками, они же регулируют пролиферацию, дифференцировку, активацию клеток иммунной системы и развитие иммунного ответа [13,55].
Ко второй линии защиты принадлежат органы иммунной системы и клетки, ими вырабатываемые, – лимфоциты. В центральных органах иммунной системы (костный мозг и тимус) осуществляется лимфопоэз, в периферических (селезенка, лимфоузлы, лимфоидная ткань) зрелые лимфоциты взаимодействуют между собой, антигенами и вспомогательными клетками. Лимфоциты, распознающие свои и чужеродные антигены, имеют одинаковую морфологию, но разные функции, поверхностно-клеточные маркеры, индивидуальное развитие (по клонам) и судьбу: Т-лимфоциты, В-лимфоциты и естественные киллеры (NK-клетки). Взаимодействие иммунокомпетентных клеток с другими регулируют медиаторы иммунного ответа – цитокины.
Т-лимфоцит происходит из предшественника, тот, в свою очередь, – из стволовой клетки. Созревание Т-лимфоцита завершается в детстве, далее популяция поддерживается только за счет пролиферации зрелых форм. В-лимфоциты, моноциты и гранулоциты созревают на протяжении всей жизни человека в костном мозге из стволовой клетки.
Т-лимфоциты выполняют различные функции, по этому признаку их подразделяют на субпопуляции, каждая из которых имеет свои специфические поверхностные белковые молекулы: Т-хелперы, Т-супрессоры, Т-киллеры (цитотоксические Т-лимфоциты – ЦТЛ), Т-клетки памяти. Т-хелперы распознают антигены, взаимодействуют с макрофагами и В-лимфоцитами. Т-супрессоры регулируют интенсивность иммунного ответа, предотвращая развитие аутоиммунных реакций. Т-киллеры, или ЦТЛ, лизируют клетки-мишени. Т-лимфоциты осуществляют свои функции, секретируя различные факторы (цитокины и хемокины). А представляют антиген лимфоцитам макрофаги и дендритные клетки.
В-лимфоциты имеют две субпопуляции: предшественники антителообразующих клеток, которые после антигенной стимуляции дифференцируются в плазматические клетки (синтезирующие антитела), и В-клетки памяти. На поверхности В-лимфоцита находятся рецепторы, распознающие антиген, – иммуноглобулины, состоящие из нескольких цепей и подразделяющиеся по виду цепей на пять классов.
Естественные киллеры, или NK-клетки, представляют собой большие зернистые лимфоциты, уничтожающие опухолевые клетки и клетки, поврежденные вирусами, бактериями и простейшими. Эти клетки неспособны к фагоцитозу, поэтому уничтожают инородный агент другим способом. NK-клетки выделяют встраивающиеся в поверхностную мембрану клетки-мишени порфирины, что выравнивает ионный состав цитоплазмы и внешней среды и приводит к гибели клетки. Активность NK-клеток регулируют цитокины. Активация лимфоцитов – многоступенчатый процесс, развивающийся в следующем направлении: получение сигнала, его внутриклеточная передача, пролиферация, дифференцировка и реализация функций лимфоцитов [14].
Иммунные реакции традиционно, хотя и весьма условно, разделяют на гуморальные (реализуются циркулирующими в средах организма антителами, произведенными плазматическими клетками) и клеточные (реализуются при непосредственном контакте иммунокомпетентных клеток путем выделения цитокинов и хемокинов) [13].
В норме реакция на чужеродный агент проходит четыре стадии:
- миграция лейкоцитов к месту внедрения;
- специфическое, посредством Т- и В-лимфоцитов, и неспецифическое, посредством макрофагов, связывание антигена и активация комплемента;
- накопление в месте внедрения антигена специфических и неспецифических клеток-эффекторов, их активация комплементом, цитокинами, кининами и метаболитами;
- фагоцитоз макрофагами и нейтрофилами или лизис Т-лимфоцитами и NK-клетками [14].
Мещерякова Н.Г.
Факты о крови и клетках крови
Эта информация поможет вам узнать о различных компонентах крови и их функциях.
Ваша кровь разносит кислород и питательные элементы ко всем клеткам организма. Кроме того, клетки крови противостоят инфекциям и останавливают кровотечение.
Большинство клеток крови вырабатываются в костном мозге. Их образование и замещение происходит непрерывно. Время существования клетки крови до ее замещения называется продолжительностью жизни клетки.
Кровь состоит из четырех компонентов: эритроцитов, лейкоцитов, тромбоцитов и плазмы.
Компоненты крови
Эритроциты (красные кровяные тельца)
Красные кровяные тельца несут кислород из легких к тканям организма. Также они несут углекислый газ обратно в легкие.
Эритроциты составляют почти половину от общего объема крови. Продолжительность жизни этих клеток — около 120 дней.
Лейкоциты (белые кровяные тельца)
Лейкоциты противостоят инфекциям и являются важным элементом иммунной системы. Они составляют очень малую часть от общего объема крови (менее 1 %).
Существует три типа лейкоцитов: гранулоциты, моноциты и лимфоциты. Каждый тип играет важную роль.
- Гранулоциты бывают 3 типов:
- Нейтрофилы помогают противостоять бактериальным и грибковым инфекциям.
- Базофилы принимают участие в иммунной реакции организма. Их точная функция изучена недостаточно.
- Эозинофилы помогают бороться с инфекциями, возбудителями которых являются паразиты.

- Моноциты разрушают и выводят из организма чужеродные микроорганизмы и отмирающие клетки.
- Лимфоциты формируют иммунную систему.
Продолжительность жизни лейкоцитов варьируется в широких пределах — от часов до нескольких лет.
Тромбоциты
Тромбоциты — это небольшие фрагменты клеток. Их основной функцией является остановка кровотечения. Они составляют очень малую часть от общего объема крови (менее 1 %). Продолжительность жизни тромбоцитов — около 9–12 дней.
Плазма
Плазма — это бледно-желтая жидкая часть крови, в которой содержатся все клетки крови. Она составляет чуть больше половины от общего объема крови.
Плазма помогает разносить воду, питательные элементы, минеральные вещества, лекарства и гормоны по всему организму. Также она переносит отходы к почкам. Затем почки фильтруют кровь, очищая ее от этих отходов. Плазма состоит из воды, белка, липидов (жиров). Она несет воду, жирорастворительные питательные элементы и другие вещества к различным органам и от них.
Нейтрофилы и моноциты при повреждении сосудистого эндотелия как звенья единой патогенетической цепи в развитии хронической болезни почек и атеросклероза
В клинике внутренних болезней в настоящее время используется такой показатель поражения сердечно-сосудистой системы, как наличие микроальбуминурии. Кардиологам не от хорошей жизни приходится вводить в обиход чисто нефрологический термин — слишком мало количественных методов определения поражения сосудов на ранних стадиях заболевания. Наши почки фильтруют весь объем крови около 30 раз в день, повторно абсорбируя > 95 % фильтрата, для того чтобы произвести всего 1–2 литра мочи. Почки также регулируют множество других функций организма, а их архитектоника такова, что все уникальные пространственные связи сосудов этого органа подвергаются большим нагрузкам и испытаниям, чем другие органы человека. Безусловно, при хронической болезни почек (ХБП) помимо традиционных имеется множество дополнительных факторов риска атеросклероза, включающих альбуминурию, дисбаланс электролитов, воспаление, увеличенный окислительный стресс и нарушения в системе L-аргинин/оксид азота (NO) [7, 11, 22]. Пациенты с ХБП чаще умирают от ишемической болезни сердца (ИБС), чем в общей популяции. Kidney Disease Outcomes Quality Initiative (2003) признает, что ХБП является фактором риска ИБС [31]. Вместе с тем в последнее время особое внимание исследователей стало привлекать состояние сосудистого эндотелия, клетки которого, будучи монослоем, занимают огромную площадь. Было установлено, что выполнять свои многочисленные функции эти клетки могут только при условии целостности эндотелиального слоя [5, 36].
Пациенты с ХБП чаще умирают от ишемической болезни сердца (ИБС), чем в общей популяции. Kidney Disease Outcomes Quality Initiative (2003) признает, что ХБП является фактором риска ИБС [31]. Вместе с тем в последнее время особое внимание исследователей стало привлекать состояние сосудистого эндотелия, клетки которого, будучи монослоем, занимают огромную площадь. Было установлено, что выполнять свои многочисленные функции эти клетки могут только при условии целостности эндотелиального слоя [5, 36].
Пронализировав результаты обследования 517 больных в возрасте 35–65 лет (240 мужчин и 277 женщин), находившихся на лечении в Институте терапии, из которых у 171 больных был диагностирован хронический гломерулонефрит (ХГН), у 179 больных — диабетическая нефропатия (ДН), у 167 больных — гипертоническая болезнь (ГБ, группа сравнения), а также учитывая работы M. Mayranpaa et al. (2006), мы высказали предположение о возможном участии нейтрофилов и ICAM в отслоении клеток эндотелия, приводящего к появлению эрозий как в капиллярах клубочков, так и в магистральных сосудах [5, 10, 33] (рис. 1).
1).
Больные были разделены на 3 основные группы: I группа — 131 пациент с микроальбуминурией, II группа — 74 больных с протеинурией и III группа — 312 больных без наличия белка в моче. Все группы были сопоставимы по возрасту и полу. В исследование не включали больных с повышенным уровнем креатинина в плазме крови, наличием нестабильной стенокардии, системными заболеваниями соединительной ткани и лиц, переживших острые сосудистые катастрофы менее 1 года назад. При этом среди больных с нормоальбуминурией лица с наличием стабильной стенокардии, клинических и инструментальных данных о поражениях периферических и церебральных сосудов, перенесенном инфаркте миокарда или ишемическом инсульте составили 18 %, среди больных с микроальбуминурией — 37 %, с протеинурией — 41 %.
С учетом работы K. Daub et al. (2006) была высказана гипотеза о том, что тромбоциты, которые в норме рекрутируют эндотелиальные клетки-предшественники (ЭКП) CD-34 в зону отслоения и апоптоза эндотелия для его замещения, при их активации под воздействием оксидантного стресса вызывают трансформацию этих клеток в пенистые [23]. Связь этих показателей с выраженностью альбуминурии может свидетельствовать о нарушении процессов репарации эндотелия капилляров клубочков с сохраняющимися на неопределенное время участками десквамации в местах предполагаемого отслоения CD146 клеток-aноикис (греч. «бездомный») — клеток эндотелия, подвергшихся апоптозу и какое-то время циркулирующих в крови (рис. 2).
Связь этих показателей с выраженностью альбуминурии может свидетельствовать о нарушении процессов репарации эндотелия капилляров клубочков с сохраняющимися на неопределенное время участками десквамации в местах предполагаемого отслоения CD146 клеток-aноикис (греч. «бездомный») — клеток эндотелия, подвергшихся апоптозу и какое-то время циркулирующих в крови (рис. 2).
Вместе с тем эндотелиальные клетки являются одной из главных клеточных составляющих кровеносных сосудов, и одно из наиболее важных их свойств — функция привратника, контролирующего инфильтрацию белков и клеток крови в стенку сосудов [30]. Эти уникальные характеристики достигаются благодаря специализированной трансцеллюлярной системе везикулярного транспорта и скоординированному открытию и закрытию межклеточных соединений (МКС). Установлено, что межклеточные соединения являются не только местами прикреплений между эндотелиальными клетками — они могут функционировать как сигнальные структуры, сообщающие клетке о ее положении, границах роста, апоптозе, и регулировать сосудистый гомеостаз в целом [25].
МКС образуются с помощью трансмембранных адгезивных белков, таких как VE-cadherin в AJs и claudin-5 в TJs [19], которые обеспечивают связь между клетками в виде застежек-молний по краям клеток. Внутри клеток адгезивные белки МКС сцеплены с актиновым цитоскелетом, и это взаимодействие стабилизирует монослой эндотелиальных клеток. Благодаря своим цитоплазматическим хвостам адгезивные белки МКС связаны с цитоскелетом и сигнальными белками, что делает возможным закрепление адгезивных белков на актиновых микрофиламентах и перенос сигналов внутрь клетки [26]. Недавние исследования показали, что эти структуры играют центральную роль в стабилизации эндотелия в покоящемся состоянии — переключение этих клеток со сливного, покоящегося состояния в состояние миграции и пролиферации, например во время образования новых сосудов, сопровождается модуляцией организации и системы передачи сигналов МКС [24]. Специализированная трансцеллюлярная система пузырьков включает органеллы эндотелиальных клеток, известные как vesiculo-vacuolar органеллы — рециркулирующие везикулы (РВ), которые участвуют в трансэндотелиальном прохождении растворимых макромолекул. Эти системы поддерживают интегральность эндотелия и защищают сосуды от любого неконтролируемого увеличения проницаемости, воспаления или тромботических реакций. Изменение баланса NOS в плазме крови у обследованных нами больных может свидетельствовать о нарушении NO-образующей функции эндотелия у больных ХБП в связи с уменьшением содержания eNOS; при этом уменьшение NO-опосредованных противосвертывающих свойств может вносить вклад в прилипание и агрегацию клеток крови в пределах поврежденного эндотелия [12]. Ранее мы показали, что у больных ХБП в связи с оксидантным стрессом нарушается выделение NO из его депо в S-нитрозотиолах [16]. В последнее время появились данные, свидетельствующие о том, что еще одним источником депонированного NO является нитрит, поэтому выявленное нами снижение содержания нитрита при альбуминурии может также свидетельствовать о снижении выработки NO клетками поврежденного эндотелия [15].
Эти системы поддерживают интегральность эндотелия и защищают сосуды от любого неконтролируемого увеличения проницаемости, воспаления или тромботических реакций. Изменение баланса NOS в плазме крови у обследованных нами больных может свидетельствовать о нарушении NO-образующей функции эндотелия у больных ХБП в связи с уменьшением содержания eNOS; при этом уменьшение NO-опосредованных противосвертывающих свойств может вносить вклад в прилипание и агрегацию клеток крови в пределах поврежденного эндотелия [12]. Ранее мы показали, что у больных ХБП в связи с оксидантным стрессом нарушается выделение NO из его депо в S-нитрозотиолах [16]. В последнее время появились данные, свидетельствующие о том, что еще одним источником депонированного NO является нитрит, поэтому выявленное нами снижение содержания нитрита при альбуминурии может также свидетельствовать о снижении выработки NO клетками поврежденного эндотелия [15].
Полученные нами результаты, свидетельствующие о нарушении функции капилляров почек, было трудно экстраполировать на механизмы развития атеросклероза в магистральных сосудах, хотя общие биологические закономерности нарушения целостности эндотелия как в капиллярах почек, так и в более крупных сосудах прослеживаются, о чем говорит увеличение процента пациентов с верифицированным атеросклерозом среди больных с более выраженной альбуминурией.
Вместе с тем в предыдущей работе мы не смогли ответить на два главных вопроса:
1. Каким образом активированные нейтрофилы могут разрушить столь мощные адгезивные связи МКС?
2. Какова роль моноцитов-макрофагов в повреждении эндотелия, остается ли их основная роль прежней («чистильщик» в образовавшихся эрозиях и разрывах атеросклеротической бляшки)?
Сосудистый эндотелиальный кадгерин (VE-кадгерин) — строго эндотелиальная определенная молекула адгезии, расположенная в соединениях между эндотелиальными клетками. По аналогии с ролью E-кадгерина как главного определяющего фактора для целостности контактов эпителиоцита VE-кадгерин имеет жизненное значение для поддержания и контролирования контактов эндотелиальных клеток. Механизмы, которые регулируют VE-кадгерин-опосредованную адгезию, важны для контроля за сосудистой проницаемостью и транссудацией лейкоцитов. В дополнение к своим адгезивным функциям VE-кадгерин регулирует различные клеточные процессы, такие как пролиферация клеток, их апоптоз, и модулирует сосудистые функции рецепторов эндотелиального фактора роста [25].
Есть основания предполагать, что VE-кадгерин, являющийся главным адгезивным механизмом целостности эндотелиальных контактов, должен быть локально ослаблен, чтобы позволить лейкоциту преодолеть такой барьер. Первоначально полагали, что прикрепление нейтрофилов к человеческому эндотелиальныму монослою приводит к деградации компонентов комплексного соединения VE-кадгерин/катенин с помощью механизмов в пределах эндотелиальных клеток. Однако расширение этих исследований показало, что наблюдаемые эффекты были связаны с протеазами, выделявшимися во время приготовлений к анализу. Когда дизайн эксперимента был изменен и взаимодействия лейкоцитов с эндотелиальными монослоями были проанализированы в потоке крови, было установлено, что окрашивание комплексного соединения VE-кадгерин/катенин отсутствовало в местах эндотелиальных контактов, где произошла трансмиграция лейкоцитов [37]. Эти результаты были подтверждены видеомикроскопией и инфицированными вирус-эндотелиальными клетками VE-кадгерин-GFP или антителами, маркированными как VE-кадгерин и PECAM-1 [42]. Было сделано заключение, что VE-кадгерин может отодвигаться в сторону, как занавес, позволяя лейкоцитам проходить через соединение. Альтернативным объяснением был бы эндоцитоз. В любом случае, вероятно, что адгезивные связи VE-кадгерина открываются прежде, чем молекулы VE-кадгерина удаляются из сайтов переселения клеток. Как это регулируется полностью, еще неизвестно. Несколько публикаций сообщают о корреляциях между изменениями адгезивной стабильности VE-кадгерина и изменениями тирозинфосфориляции VE-кадгерина бета-катениновым комплексом. Увеличение слияния эндотелиальных клеток коррелировало с увеличивающейся тирозинфосфориляцией VE-кадгерина и Β-катенина, но не α-катенина [18]. Сообщалось, что нейтрофилы, стимулируемые C5a, усиливали эндотелиальную проницаемость клетки для белка и это коррелировало с увеличенной тирозинфосфориляцией VE-кадгерина и β-катенина; предполагалось, что фосфориляция тирозина самого VE-кадгерина могла бы повлиять на функции VE-кадгерина. Основываясь на исследованиях проницаемости инфицированных вирусом клеток CHO, экспрессирующих видоизмененные формы VE-кадгерина с остатками тирозина, замещенными или глутаматом, или фенилаланином, предположили участие остатков тирозина 731 и 658 в регулировании адгезивной функции VE-кадгерина [37]. Однако клетки CHO, экспрессирующие эти мутанты, связывались также с иммобилизированным VE-кадгерином-Fc как клетки CHO, экспрессирующие невидоизмененный VE-кадгерин [41]. Интригует то, что чрезмерная экспрессия мутантов при замене тирозина/фенилаланина в VE-кадгерине или тирозина 731 и 658 в эндотелиальных клетках первичной человеческой пупочной вены (HUVECs) ингибировала трансэндотелиальную миграцию лейкоцитов. Было впервые предположено, что фосфориляция специфических остатков включается в транссудацию лейкоцитов.
Опубликованные недавно работы позволяют подтвердить высказанную ранее гипотезу. Так, в работе Michael J. Allingham et al. (2007) показано, что фосфориляция белков тирозина адгезивных соединений, таких как сосудистый эндотелиальный кадгерин (VE-кадгерин) и бета-катенин, коррелирует с разрушением МКС [19]. Используя человеческие лейкоциты и эндотелиальные клетки, они продемонстрировали, что адгезия ICAM-1 приводит к активации двух киназ тирозина, Src и Pyk2, то есть участие ICAM-1 индуцирует фосфориляцию VE-кадгерина на тирозинах 658 и 731, которые относятся к p120-катенина и бета-катенина связывающим участкам соответственно. Pilar Alcaide et al. (2008) установили, что ингибирование эндотелиального Src с PP2 или SU6656 блокирует переселение нейтрофилов на 71,1 ± 3,8 и 48,6 ± 3,8 % соответственно, тогда как ингибирование эндотелиального Pyk2 также заканчивается сниженным переселением нейтрофила на 25,5 ± 6,0 % [18]. Очень похожие результаты показали P. Turowsky et al. (2008) для VE-кадгерина мыши, хотя в этом сообщении было проанализировано несколько больше мутантов тирозина VE-кадгерина, и только в точке Y731F мутантной формы VE-кадгерина диапедез лейкоцитов был ингибирован [42]. Различные факторы, как известно, усиливают сосудистую проницаемость и влияют на фосфориляцию комплексного соединения VE-кадгерин — катенин. Рецептор белкового типа тирозинфосфатаза RPTP-µ не ограничен эндотелиальными клетками и влияет на функцию различных кадгеринов. Он связывается непосредственно с эндоплазматическим хвостом VE-кадгерина и подавляет его экспрессию в человеческих эндотелиальных клетках, усиливая их проницаемость для белка. [34]. Наши клинические результаты [10, 14 ] демонстрируют, что увеличение ICAM-1 клетками белой крови — нейтрофилами и моноцитами [2, 13] — приводит к увеличению альбуминурии, следствием чего вполне может быть фосфориляция тирозина VE-кадгерина в МКС клубочковых капилляров (рис. 3).
Таким образом, рекрутированные к участку повреждения эндотелия воспалительные клетки выделяют цитокины и другие провоспалительные медиаторы, которые вызывают изменения в эндотелиальных клетках локальных кровеносных сосудов, а те, в свою очередь, способствуют конверсии ткани в воспаленное состояние. В частности, ФНО-a, IL-1 и IL-6 вызывают ряд морфологических и молекулярных изменений, которые все вместе приводят к увеличенной миграции лейкоцитов и потоку плазмы к поврежденному участку [3, 6]. В большинстве случаев нейтрофилы, как клетки врожденного иммунитета, прибывают очень быстро, сопровождаемые более поздним втеканием моноцитов. Нейтрофилы поступают в воспаленный участок, вооруженные батареей эффекторных механизмов, которые могут нанести ущерб тканям сосудов. Помимо того, что они обладают гранулами, загруженными протеазами, способными к разложению фагоцитированного материала, они также производят кислородные радикалы и реактивные разновидности азота (RNS), которые денатурируют белки, разрывают липиды и повреждают ДНК [8, 35]. После поступления в зону воспаления нейтрофилы фагоцитируют любые доступные микроорганизмы и направляют содержание их гранул к этим фагосомам [9]. Если нейтрофилы обнаруживают ФНО-α, но непосредственно не сталкиваются ни с какими микробными частицами после поступления в ткани, они выделяют содержимое своих гранул во внеклеточное пространство, чтобы создать неблагоприятную среду для близлежащих повреждающих агентов. Содержание этих гранул производит значительное разрушение организменных тканей и клеток. Например, эластаза, катепсин G и протеиназа 3 являются широкоспецифичными сывороточными протеазами, которые могут разрушать компоненты внеклеточного матрикса и клетки хозяина, приводящие к расплавлению ткани [10, 33]. Эта токсичность служит для удержания повреждения в критической ранней фазе, прежде чем сработает полный иммунный ответ. Все действия нейтрофилов, однако, заканчиваются одним и тем же исходом: их гибелью путем апоптоза и удалением макрофагами. Как было упомянуто ранее, моноциты-макрофаги поступают в зону воспаления после нейтрофилов, по команде тех же самых сигналов. В дополнение к клиренсу апоптотических нейтрофилов макрофаги также вносят вклад в разложение и поглощение детрита, используя протеазы, пептиды, кислородные радикалы и RNS. Следовательно, ассоциация «кадгерин — катенин» — все еще главная цель многих исследований по определению механизма, с помощью которого целостность эндотелия нарушается при различных васкулопатиях. По-видимому, различные внутриклеточные сигнальные молекулы, фосфориляция тирозина и сывороточные остатки катенина или кадгеринов играют роль в регулировании VE-кадгерина. Подобно интегринам, кадгерины также известны как передатчики сигналов снаружи внутрь — термин, который описывает функции рецептора молекул адгезии клеток. VE-кадгерин был описан как фактор контактного торможения роста клетки, который, таким образом, противодействовал пролиферации клетки под воздействием VEGFR-2; вместе с тем он поддерживал антиапоптотические эффекты, стимулированные VEGFR-2 [40].
И еще одна, совсем свежая, работа из Голландии, возможно, поможет уточнить вопрос о роли моноцитов-макрофагов в развитии атеросклероза. В октябре 2008 года Jakub Rohlena et al. опубликовали работу, в которой они показали на уровне всего генома те гены, которые специфично стимулируются в эндотелии атеросклеротических бляшек человеческих артерий [28]. Поскольку полученные данные свидетельствовали о том, что мРНК CD81 значительно и специфично стимулируется в эндотелии, лежащем над ранней атеромой, они изучили функциональные последствия стимуляции CD81. Иммуногистохимический анализ в независимом наборе донорских артерий подтвердил в эндотелии ранних человеческих атеросклеротических поражений расширенную экспрессию CD81, которая носила определенную зависимость от оксидантного стресса. Авторы установили, что увеличенный уровень эндотелиальной CD81 связан с увеличенным прилипанием моноцитов к преобразованным эндотелиальным клеткам, приближаясь к уровням, обычно достигаемым только после стимуляции фактором некроза опухоли. Влияние CD81 зависело и от внутриклеточной молекулы адгезии-1 (ICAM-1), и от сосудистой молекулы адгезии клеток-1 (VCAM-1), поскольку адгезия уменьшалась в присутствии смеси антител anti-ICAM-1 и anti-VCAM-1. Проточная цитометрия показала, что увеличение уровня CD81 не увеличивало экспрессию ICAM-1 и VCAM-1. Вместо этого, как показала конфокальная и электронная микроскопия, молекулы адгезии были сконцентрированы в мембранные грозди. CD81 также был расположен вместе с ICAM-1 и VCAM-1 в адгезивном кольце, окружающем связанные моноциты. Авторы сделали заключение, что у эндотелиального CD81, активированного в ранней человеческой атероме, есть потенциал для того, чтобы играть важную роль в начальных стадиях формирования атеросклеротической бляшки, увеличивая адгезию моноцитов при уже имеющейся воспалительной реакции в эндотелии.
Таким образом, учитывая собственные результаты и данные литературы, можно сделать вывод, что в местах стенки сосудов, подвергшихся воздействию ФНО-α, IL-1 и IL-6, скапливаются ICAM-1 и VCAM-1, ослабляющие VE-кадгериновые связи и способствующие проникновению нейтрофилов, которые вместе с тучными клетками выделяют протезы, вызывая воспаление и аноикис клеток эндотелия. В эндотелии, лежащем над ранней атеромой, экспрессируются мРНК и белок CD81, которые приводят к усиленному прилипанию моноцитов и развитию атеромы (рис. 4). Эти данные подчеркивают вторичную роль моноцитов в развитии ранних атеросклеротических изменений при сердечно-сосудистых заболеваниях, что требует усиления противовоспалительных мероприятий, направленных на клетки врожденного иммунитета и адгезивные соединения.
Перспективные методы коррекции репарации и регенерации эндотелия
Классический вопрос «Кто виноват?» предполагает следующий вопрос: «Что делать?». Учитывая тот факт, что практически у всех больных с ХБП выявляется оксидантный стресс со снижением глутатионпероксидазы (у наших больных — на 19 %) и уменьшением биодоступности оксида азота — окислительный стресс и воспаление неразрывно связаны, одно порождает другое с формированием замкнутой цепи. Окислительный стресс стимулирует рецепторы клеток, которые, в свою очередь, индуцируют продукцию провоспалительных цитокинов и экспрессию адгезивных молекул: E-селектина, межклеточной адгезивной молекулы-1 (ICAM-1) и сосудистой адгезивной молекулы-1 (VCAM-1). Эти события приводят к активации лейкоцитов, инфильтрации ткани этими клетками (то есть развитию воспаления), продукции кислородных радикалов лейкоцитами и резидентными клетками (например, макрофагами, сосудистыми гладкомышечными клетками, эндотелиальными клетками и фибробластами). Окислительный стресс вызывает воспаление, которое, в свою очередь, усиливает окислительный стресс; следовательно, стратегия на уменьшение окислительного стресса и воспаления является одной из основ лечения ХБП и атеросклероза. Ранее полагали, что лечение окислительного стресса заключается в назначении антиоксидантов, способных к нейтрализации кислородных радикалов. Поэтому неудивительно, что результаты клинических испытаний антиоксидантов были неоднозначными. Несколько небольших исследований показали снижение артериального давления после назначения витаминов С и E [9, 38], но, по данным больших клинических испытаний, лечение антиоксидантами не приводило к заметному кардиопротекторному эффекту. Определенные надежды возлагаются на проходящий сейчас клинические испытания отечественный препарат корвитин/кверитин.
По-видимому, необходимо принимать во внимание несколько факторов, которые могли бы объяснить отсутствие эффективности или неблагоприятные побочные эффекты при приеме антиоксидантов. Во-первых, окислительный стресс при АГ, почечных и сердечно-сосудистых заболеваниях в связи с недостатком в организме антиоксидантов обусловлен прежде всего локальной продукцией избыточных кислородных радикалов, и назначение антиоксидантов не может оказать существенного влияния на окислительный стресс in situ. Во-вторых, антиоксиданты часто не могут проникать во внутриклеточное пространство, в котором эти кислородные радикалы синтезируются. Например, эффективность водорастворимых и жирорастворимых антиоксидантов в уменьшении окислительных реакций будет в значительной степени ограничена биохимическими свойствами мембран тех отделов клеточного пространства, где происходят соответствующие реакции. В-третьих, скорость взаимодействия между такими мощными эндогенными оксидантами, как хлорноватистая кислота или пероксинитрит (ONOO–), и молекулами-мишенями часто превышает способность антиоксидантной системы предотвращать взаимодействия. Эти очень реактивные оксиданты производятся активированными фагоцитами и являются необходимым компонентом врожденного иммунитета против внедрившихся микроорганизмов. Поэтому их биохимические действия против структурных компонентов инфекционных организмов беспрепятственно пропускаются антиоксидантной системой. По-видимому, по этой же причине окислительный стресс, вызванный неинфекционным воспалением, может быть устойчивым к терапии антиоксидантами [15, 27]. Поэтому прежде всего необходимы специфические мероприятия, направленные на коррекцию этих состояний у отдельно взятого пациента. Употребление свежих плодов и овощей, которые содержат много природных антиоксидантов в почти совершенных соотношениях, является самой надежной и самой эффективной стратегией для поддержания антиоксидантного баланса. Кроме того, регулярная физическая нагрузка стимулирует продукцию антиоксидантных ферментов, увеличивает продукцию NO, повышает чувствительность к инсулину, улучшает эндотелиальную функцию и липидный профиль с увеличением плазменных уровней липопротеидов высокой плотности [26]. Таким образом, диета и модификация образа жизни — необходимые компоненты любой стратегии по коррекции окислительного стресса и воспаления у больных ХБП и при ее осложнениях.
Нарушение функции эндотелия присутствует при всех хронических болезнях почек и сердечно-сосудистых заболеваниях. Лечение основной болезни при некоторых условиях может восстановить функцию эндотелия — у больных с хронической почечной недостаточностью пересадка почки восстанавливает и азотовыделительную функцию, и функцию эндотелия. Из фармакологических средств наиболее эффективными считаются блокаторы рецепторов ангиотензина и ингибиторы АПФ. Механизмы, посредством которых блокада ренин-ангиотензиновой системы может улучшить эндотелиальную функцию, также включают редуцирование окислительного стресса и воспаления [7]. При сахарном диабете стимуляторы γ-рецепторов активированных пролифераторов пероксисом (например, глитазоны) и активаторы α-рецепторов активированных пролифераторов пероксисом (например, фибраты) оказывают противовоспалительное и антиоксидантное воздействие и положительно влияют на эндотелиальную функцию [31]; уменьшение уровней гомоцистеина при назначении фолиевой кислоты может улучшить функцию эндотелия; миметики тетрагидробиоптерина могут улучшить эндотелиальную функцию путем увеличения биодоступности NO [21]. Недавно было показано, что ацетилсалициловая кислота может уменьшить окислительный стресс и улучшить эндотелиальную функцию. Доказано положительное влияние на эндотелиальную функцию статинов, которое может быть обусловлено как снижением содержания липидов, так и их противовоспалительным эффектом с уменьшением содержания ICAM, VCAM и увеличением экспрессии eNOS в эндотелиальных клетках [1, 4, 17]. Потенциальная защитная роль антагонистов рецептора альдостерона исследуется только в последние годы. Этот интерес связан с неожиданно положительными результатами Randomized Aldacton Evaluation Study, в котором участвовали пациенты с тяжелой хронической сердечной недостаточностью, показавшими уменьшение летальности на 30 % при назначении антагониста рецепторов альдостерона, спиронолактона, в дополнение к стандартному лечению ингибиторами АПФ. Спиронолактон в сочетании с ингибиторами АПФ снижал артериальное давление у больных сахарным диабетом, нормализуя NO-опосредованную релаксацию сосудов путем изменения баланса между NO и формированиями супероксидного аниона.
Дифференциация ЭКП и их созревание в определенных органах зависят от локальных межклеточных и клеточно-матричных взаимодействий, активации факторов роста. Установлено, что количество ЭКП в периферической крови может быть увеличено в ответ на фармакологические вмешательства, например при назначении статинов или блокаторов ангиотензиновых рецепторов [29]. В работе F. Deschaseaux et al. (2007) были представлены данные, которые показали, что количество CD34-клеток было значительно больше в статин-позитивных группах, чем в статин-отрицательных [24]. Эти результаты доказывают, что длительное лечение статинами на ранних стадиях атерогенеза оказывает воздействие на формирование в кровотоке эндотелиальных клеток-предшественников с CD34-фенотипом.
Мощным стимулятором функциональной активности и пролиферации ЭКП является также рекомбинантный человеческий эритропоэтин (rhEPO) или его аналог дарбепоэтин [21]. Выраженная стимуляция ЭКП in vitro и in vivo отмечалась даже при небольших терапевтических дозах rhEPO при лечении почечной анемии. Установлено положительное влияние на функциональные свойства эндотелия донаторов L-аргинина, агонистов пролифератора пероксисом и ω-3-ненасыщенных жирных кислот [15, 17, 39]. Вместе с тем до настоящего времени все еще нет единой точки зрения о возможности применения различных комбинаций стволовых ЭКП in vivo, нет четких критериев степени их активности, необходимы дальнейшие исследования по изучению эффективности терапевтических мероприятий, направленных на улучшение функции ЭКП.
Заключение
Исследования последних лет показали значительную роль VE-кадгерина как доминирующей молекулы адгезии, ответственной за поддержание и контроль контактов эндотелиальных клеток при многих заболеваниях сердечно-сосудистой системы; его роль в морфогенезе системы кровеносных сосудов сделала VE-кадгерин главной целью исследования среди молекул адгезии в сосудистой сети. Большие успехи были достигнуты в идентификации его сигнальных партнеров и факторов, которые влияют на его функцию. На основании наших результатов и данных литературы напрашивается ряд важных вопросов, на которые предстоит ответить в ближайшем будущем:
1. Как фосфориляция комплексного соединения «кадгерин — катенин» (например, при воздействии ICAM,VCAM и других воспалительных факторов) влияет на изменения прочности МКС-соединений в зависимости от нозологической формы и стадии заболевания?
2. Какие фармакологические препараты и до какой степени могут регулировать VE-кадгериновый барьер? Смогут ли они эффективно повлиять на процесс транссудации форменных элементов крови и своевременную замену перенесших аноикис клеток эндотелия при ХБП и атеросклерозе?
Исходя из высказанных предположений и приведенных фактов, необходимо сделать следующий вывод: поскольку количество пациентов с инфарктом миокарда, инсультом и требующих лечения с использованием диализа неуклонно увеличивается, разработка новых методов диагностики и лечения, которые обеспечат улучшение состояния больных без диализа и коронарного шунтирования, станет не только главным достижением исследователей, но и потребностью общества.
Работа была озвучена 16 октября 2008 г. в докладе на II Национальном конгрессе врачей внутренней медицины «Міждисциплінарний підхід до впровадження сучасних рекомендацій з діагностики та лікування захворювань внутрішніх органів в клінічну практику» (Киев, Украина)
Bibliography1. Волков B.I., Яковлева Л.М., Бондар Т.М., Ченчик Т.О., Калашник Д.М. Дозозалежний вплив симвастатину на активність запального процесу у хворих на гострий коронарний синдром без підйому сегмента ST // Укр. кард. журнал. — 2006. — № 6. — С. 24-27.
2. Кондаков И.К., Гальчинская В.Ю., Топчий И.И., Семенових П.С., Шитова А.Б. Особенности популяционного состава лейкоцитов у больных диабетической нефропатией // Кровообіг та гемостаз. — 2006. — № 1–2. — C. 28-31.
3. Крутиков Е.С., Топчий И.И. Динамика показателей цитокинового звена иммунитета у больных, получающих хроническую гемодиализную терапию // Врачебная практика. — 2007. — № 4. — С. 68-71.
4. Синяченко О.В., Игнатенко Г.А., Мухин И.В., Грушина М.В. Сравнительная эффективность ингибиторов ГМГ-КоА редуктазы у больных хроническим гломерулонефритом без нефротического синдрома // Укр. журн. нефрології та діалізу. — 2007. — № 3. — C. 40-44.
5. Топчий И.И. Функциональные свойства макрофагов при хронической болезни почек и методы их коррекции // Врачебная практика. — 2007. — № 1. — С. 85-94.
6. Топчий И.И. Взаимодействие оксида азота, калликреин-кининовой и плазминоген-плазминовой систем как терапевтическая мишень для лечения и профилактики фиброза при хронической болезни почек // Укр. журн. нефрології та діалізу. — 2007. — № 2. — С. 2-8.
7. Топчий И.И. Окислительный стресс, повышение содержания асимметричного диметиларгинина и разобщенность NO-синтаз как факторы развития артериальной гипертензии при хронической болезни почек // Укр. тер. журн. — 2007. — № 3. — С. 8-15.
8. Топчий И.И. Эпителиально-мезенхимальная трансформация — фактор развития фиброза при хронической болезни почек у больных сахарным диабетом II типа — результат дефицита eNOS и механического стресса? // Внутрішня медицина. — 2007. — № 6 — C. 49-56.
9. Топчий И.И. Альтернативные механизмы развития артериальной гипертензии при хронической болезни почек и возможные направления их коррекции // Мистецтво лікування. — 2008. — № 2. — С. 65-70.
10. Топчий И.И. Взаимодействие макрофагов, тромбоцитов и клеток эндотелия как зеркало эволюции наших представлений об атерогенезе в кардионефрологии // Український терапевтичний журнал. — 2008. — № 1. — С. 9-18.
11. Топчий И.И., Горбач Т.В., Бондарь Т.Н. Взаимосвязь изменений антиоксидантной системы и метаболизма оксида азота у больных хронической болезнью почек с артериальной гипертензией // Серце і судини. — 2006. — № 1. — С. 89-94.
12. Топчий И.И., Горбач Т.В., Кириенко А.Н., Денисенко В.П. Влияние ω-3 ненасыщенных жирных кислот на показатели антиоксидантной системы, гемодинамику и метаболизм оксида азота у больных диабетической нефропатией с артериальной гипертензией // Кровообіг та гемостаз. — 2007. — № 3. — C. 68-72.
13. Топчий И.И., Кордеро Г.А., Шабалтас Н.Л., Кириленко А.Н., Панченко Г.Ю. Озонотерапия в комплексном лечении больных с диабетичсекой нефропатией // Експериментальна і клінічна медицина. — 2005. — № 1. — С. 69-73.
14. Топчий И.И., Тверетинов А.Б., Щербань Т.Д., Кордеро Г.А., Оксененко С.В. Влияние ренопротекторной гипотензивной терапии и ω-3 полиненасыщенных жирных кислот на воспалительный компонент диабетической нефропатии // Укр. тер. журн. — 2007. — № 2. — С. 40-46.
15. Топчій І.І., Тверетінов О.Б., Денисенко В.П., Кірієнко О.М., Бондар Т.М., Горбач Т.В. Вплив лікування на активність NO-синтаз та вміст стабільних метаболітів оксиду азоту у хворих на діабетичну нефропатию // Медицина сьогодні і завтра. — 2007. — № 2. — С. 98-102.
16. Топчий И.И., Шабалтас Н.Л., Василенко О.А. Влияние L-аргинина, S-нитрозоглутатиона и препаратов — донаторов оксида азота на функциональные свойства тромбоцитов у больных хроническим гломерулонефритом и гипертонической болезнью // Врач. практика. — 2001. — № 2. — С. 25-29.
17. Топчий И.И., Шабалтас Н.Л. Влияние препаратов — донаторов оксида азота на функциональные свойства тромбоцитов и уровень стабильных метаболитов NO у больных хроническим гломерулонефритом и гипертонической болезнью // Медицина сегодня и завтра. — 2002. — № 1. — С. 86-89.
18. Alcaide Pilar, Gail Newton, Scott Auerbach et al. p120-Catenin regulates leukocyte transmigration through an effect on VE-cadherin phosphorylation // Blood. — October 2008. — Vol. 112, № 7. — Р. 2770-2779.
19. Michael J. Allingham, Jaap D. van Buul, Keith Burridge. ICAM-1-Mediated, Src- and Pyk2-Dependent Vascular Endothelial Cadherin Tyrosine Phosphorylation Is Required for Leukocyte Transendothelial Migration? // The Journal of Immunology. — 2007. — Vol. 179. — P. 4053-4064.
20. Bahlmann F.H., De Groot K., Mueller O. Stimulation of endothelial progenitor cells. New putative therapeutic effects of angiotensin II receptor antagonists // Hypertension. — 2005. — Vol. 45. — P. 526-529.
21. Bahlmann F.H., De Groot K., Spandau J. Erythropoietin regulates endothelial progenitor cells // Blood. — 2004. — Vol. 103. — P. 921-926.
22. Boos C.J., Lane D.A., Karpha M., Beevers D.G., Haynes R. et al. Circulating endothelial cells, arterial stiffness, and cardiovascular risk stratification in Hypertension // Chest. — 2007. — Vol. 132. — P. 1540-1547.
23. Daub K., Langer H., Seizer P., Stellos K., May A.E. et al. Platelets induce differentiation of human CD34+ progenitor cells into foam cells and endothelial cells // The FASEB Journal. — 2006. — Vol. 20. — P. 2559-2561.
24. Deschaseaux F., Selmani Z., Falcoz P.-E., Mersin N., Meneveau N. Two types of circulating endothelial progenitor cells in patients receiving long term therapy by HMG-CoA reductase inhibitors // European Journal of Pharmacology. — 2007. — Vol. 562. — P. 111-118.
25. Erdbruegger U., Grossheim M., Hertel B. Diagnostic role of endothelial microparticles in vasculitis // Rheumatology Advance Access. — 2008 October 16.
26. Eiselein L., Wilson D.W., Lame M.W., Rutledge J.C. Lipolysis products from triglyceride-rich lipoproteins increase endothelial permeability, perturb zonula occludens-1 and F-actin, and induce apoptosis // Am. J. Physiol. Heart Circ. Physiol. — 2007. — Vol. 292. — P. 2745-2753.
27. Hill J.M., Zalos G., Hlacox J.P. et al. Circulating endothelial progenitor cells vascular function and cardiovascular risk // N. Engl. J. Med. — 2003. — Vol. 348. — P. 593-600.
28. Jakub Rohlena, Oscar L. Volger Jaap D. van Buul, Liesbeth H.P. Hekking et al. Endothelial CD81 is a marker of early human atherosclerotic plaques and facilitates monocyte adhesion // Cardiovascular Research Advance Access first published online on September 18, 2008. This version [Corrected Proof] published online on October 1, 2008 Cardiovascular Research, doi:10.1093/cvr/cvn 256.
29. Galchinskaya V., Semenovykh P., Topchiy I., Kondakov I., Shitova A. CD95 (Fas) expression disturbances in patients with diabetic nephropathy // The XLV ERA-EDTA Congress (Stockholm, Sweden — May 10–13 2008). Book of Abstracts. — MP147.
30. Langer H., May A.E., Daub K., Heinzmann U., Lang P., Schumm M., Vestweber D., Massberg S., Schonberger T., Pfisterer I. et al Adherent platelets recruit and induce differentiation of murine embryonic endothelial progenitor cells to mature endothelial cells in vitro // Circ. Res. — 2005. — Vol. 98. — P. 2-10.
31. Li A.C., Binder C.J., Gutierrez A., Brown K.K., Plotkin C.R. et al. Differential inhibition of macrophage foam-cell formation and atherosclerosis in mice by PPAR alpha, beta/delta, and gamma // J. Clin. Invest. — 2004. — Vol. 114. — P. 1564-1576.
32. Malyszko J., Malyszko J.S., Kozminski P., Pawlak K., Mysliwiec M. Adipokines, linking adipocytes and vascular function in hemodialyzed patients may also be possibly related to CD146, a novel adhesion molecule // Clin. Appl. Thromb. Hemost. — 2007. — Vol. 26. — P. 17-23.
33. Mayranpaa M.I., Heikkila H.M., Lindstedt K.A., Walls A.F., Kovanen P.T. Desquamation of human coronary artery endothelium by human mast cell proteases: implications for plaque erosion // Coronary Artery Disease. — 2006. — Vol. 17. — P. 611-621.
34. Peltier J., Bellocq A., Perez J. Calpain activation and secretion promote glomerular injury in experimental glomerulonephritis: evidence from calpastatin-transgenic mice // J. Am. Soc. Nephrol. — 2006. — Vol. 17, № 12. — P. 3415-3423.
35. Roberts C.K. Oxidative stress and dysregulation of NAD(P)H oxidase and antioxidant enzymes in diet-induced metabolic syndrome // Metabolism. — 2006. — Vol. 55. — P. 928-934.
36. Schmidt-Lucke C., Rossig L., Fichtlscherer S., Vasa M., Britten M. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair // Circulation. — 2005. — Vol. 111. — P. 2981-2987.
37. Serban Doinita, Leng Jie, Cheresh David. H-Ras Regulates Angiogenesis and Vascular Permeability by Activation of Distinct Downstream Effectors // Circulation Research. — 2008. — Vol. 102. — P. 1350.
38. Tian N. Antioxidant treatment prevents renal damage and dysfunction and reduces arterial pressure in salt-sensitive hypertension // J. Hypertens. — 2005. — Vol. 45. — P. 934-939.
39. Werner N., Kosiol S., Schiegl T., Ahlers P., Walenta K. et al. Circulating endothelial progenitor cells and cardiovascular outcomes // N. Engl. J. Med. — 2005. —Vol. 353. — P. 999-1007.
40. Xu Q. The impact of progenitor cells in atherosclerosis // Nat. Clin. Pract. Cardiovasc. Med. — 2006. — Vol. 3. — P. 94-101.
41. Potter M.D., Barbero S., Cheresh D.A. Tyrosine phosphorylation of VE-cadherin prevents binding of p120- and beta-catenin and maintains the cellular mesenchymal state // J. Biol. Chem. — 2005. — Vol. 280. — P. 31906-31912.
42. Turowski P., Martinelli R., Crawford R. et al. Phosphorylation of vascular endothelial cadherin controls lymphocyte emigration // J. Cell Sci. — 2008, in press.
Гистология, моноциты — StatPearls — NCBI Bookshelf
Введение
Моноциты — это белые кровяные тельца, происходящие из костного мозга. Моноциты являются частью врожденного иммунного ответа и регулируют клеточный гомеостаз, особенно в условиях инфекции и воспаления. [1] На их долю приходится примерно 5% циркулирующих ядерных клеток в нормальной крови взрослого человека [2]. Период полувыведения циркулирующих моноцитов составляет примерно от одного до трех дней. [3] Моноцитопения, снижение количества циркулирующих моноцитов, часто встречается при миелодиспластических синдромах.[4] В то время как моноцитоз, увеличение количества циркулирующих моноцитов, является обычным явлением в периферической крови, особенно в связи с инфекцией, травмой, приемом лекарств, аутоиммунным заболеванием и некоторыми злокачественными новообразованиями. [1] Когда моноцитоз является стойким и необъяснимым, диагноз хронического миеломоноцитарного лейкоза заслуживает исследования [5].
Проблемы, вызывающие озабоченность
При подозрении на миелоидное новообразование с моноцитарной дифференцировкой сложно и важно точно классифицировать моноциты как зрелые или незрелые.Не существует однозначного теста для выявления незрелых моноцитов. Проточная цитометрия идентифицирует молекулы на поверхности таких клеток, известные как маркеры кластера дифференцировки (CD). Такие маркеры могут предоставить информацию, помогающую оценить приблизительную популяцию зрелых и незрелых моноцитов. [6] Наряду с проточной цитометрией, морфология клетки требует оценки из-за атипичной экспрессии маркеров CD во время опухолевого роста. [5] При хроническом миеломоноцитарном лейкозе наблюдается стойкий моноцитоз периферической крови с примерно удвоенным количеством моноцитов в нормальной циркуляции.[5] В костном мозге должно быть менее 20% бластов (незрелых клеток), чтобы врач мог поставить диагноз хронического миеломоноцитарного лейкоза. [7]
Структура
Моноциты — самые крупные белые кровяные клетки, их диаметр составляет от 12 до 20 мкм, что примерно в два раза больше красных кровяных телец [2]. Моноциты обычно легко идентифицировать в периферической крови по их относительно большому размеру и извилистым двулопастным ядрам, часто описываемым как почковидные. [8]
Функция
Моноциты — важнейший компонент врожденной иммунной системы.[9] Моноцит — это тип лейкоцита, который дифференцируется на популяции макрофагов и дендритных клеток для регулирования клеточного гомеостаза, особенно в условиях инфекции и воспаления. [1] Моноциты выполняют две разные роли; они регулярно патрулируют организм на предмет микробных клеток и организуют иммунный ответ во время инфекции и воспаления. [1] Моноциты имеют на своей поверхности толл-подобные рецепторы, которые взаимодействуют с PAMPS (патоген-ассоциированными молекулярными структурами), обнаруженными на вторгающихся микробных клетках.[10] В ответ на такие стимулы моноциты мигрируют из костного мозга в кровоток и инфильтрируют ткани в течение 12–24 часов. [11]
Чтобы проникнуть в пораженные участки, моноциты должны сначала прикрепиться к эндотелию, а затем свободно катиться по сосудистой поверхности. Затем моноцит прочно прикрепляется к эндотелию и, наконец, проходит через эндотелиальные клетки посредством процесса, известного как диапедез. Затем моноциты могут проникать через базальную мембрану эндотелия и мигрировать в область воспаления.[12] Этот процесс происходит за счет взаимодействия молекул как на поверхности моноцитов, так и на поверхности эндотелиальных клеток. [13] Факторы роста и цитокины определяют подтип моноцитов. [14] Моноциты функционируют как фагоциты и антигенпрезентирующие клетки периферической крови, поглощая и удаляя микроорганизмы, инородный материал, а также мертвые или поврежденные клетки. [1] Антигенпрезентирующие клетки включают макрофаги, дендритные клетки, В-лимфоциты и активированные эндотелиальные клетки. [15]
Макрофаги могут далее дифференцироваться в специализированные макрофаги в зависимости от их местоположения.[16] К ним относятся гистиоциты в соединительной ткани, клетки микроглии в головном мозге, остеокласты в кости, мезангиальные клетки в почках и альвеолярные макрофаги в легких. [17] Моноциты могут продуцировать цитокины, которые привлекают дополнительные клетки и белки к пораженному участку, вызывая значительный иммунный ответ. [1] Типы выделяемых цитокинов зависят от функции. [18] Чтобы восстановить гомеостаз, моноциты могут способствовать ремоделированию и заживлению с помощью противовоспалительных цитокинов.[18]
Препарат ткани
Гистологическая характеристика моноцитов состоит из трех основных этапов. Эти шаги включают получение и подготовку образца цельной крови, проточную цитометрию и гейтирование моноцитов. Процесс подготовки цельной крови — это многоступенчатая химическая процедура, которая включает лизис клеток, маркировку клеток и, в конечном итоге, получение концентрированного образца для использования в исследовании. Затем проточная цитометрия образца позволяет охарактеризовать моноциты в зависимости от обрабатываемых ими маркеров.Гейтинг моноцитов — это визуальное средство, с помощью которого можно систематизировать собранные данные, чтобы показать процентное содержание каждой подгруппы моноцитов. [19]
Гистохимия и цитохимия
Кластер маркеров дифференцировки (CD) — это специфические молекулы, обнаруженные на поверхности клетки, которые дифференцируют клетки друг от друга, а также от окружающей ткани. Маркеры CD специфичны для подтипа моноцитов и типа ответа, вызываемого иммунной системой. [6] Общие маркеры CD включают CD4, CD11b, CD14, CD16 и CD33.[20]
Микроскопический свет
Одиночное двудольчатое ядро имеет зрелый хроматин, а цитоплазма от умеренной до обильной и часто имеет нерегулярные базофильные края. При окрашивании неспецифическими эстеразами ядро становится бледно-фиолетовым, а обильная цитоплазма окрашивается от бледно-серого до синего цвета с многочисленными красновато-синими цитоплазматическими гранулами. [2]
Электронная микроскопия
Электронная микроскопия показывает, что моноциты имеют одно ядро и обильную цитоплазму с разбросанными гранулами, а также органеллами.Такие органеллы включают многочисленные митохондрии, аппарат Гольджи, микровезикулы, микротрубочки и микрофиламенты. [21]
Патофизиология
Роль моноцитов многогранна и связана с различными типами заболеваний, инфекционных процессов и воспалений. Моноцитоз и моноцитопения являются факторами, определяющими множество гематологических заболеваний, таких как лейкемии и миелодиспластические синдромы. [22] Моноцитоз присутствует при многочисленных воспалительных и иммунных нарушениях, таких как заболевания соединительной ткани, такие как ревматоидный артрит, системная красная волчанка и саркоидоз.[23] [24] [25] Моноциты играют решающую роль в иммунном ответе на острые инфекционные и воспалительные процессы, такие как микобактериальные инфекции и вирус ветряной оспы. [26] [27] Моноцитоз также возникает при инфаркте миокарда и часто связан с сывороточной креатининкиназой и степенью инфаркта. [28] Моноциты могут удалять мусор и способствовать ремоделированию после инфаркта миокарда. [29]
Клиническая значимость
Моноциты являются важным компонентом врожденной иммунной системы.Они являются источником многих других жизненно важных элементов иммунной системы, таких как макрофаги и дендритные клетки. Моноциты играют роль как в воспалительных, так и в противовоспалительных процессах, происходящих во время иммунного ответа. Моноциты и их изобилие или недостаток могут предоставить важные идентификационные ключи для диагностики нескольких гематологических нарушений, а также воспалительных и иммунных нарушений.
Рисунок
Базофил (в центре) с соседними нейтрофилом и моноцитом.Предоставлено Дэвидом Линчем, MD
Ссылки
- 1.
- Yáñez A, Coetzee SG, Olsson A, Muench DE, Berman BP, Hazelett DJ, Salomonis N, Grimes HL, Goodridge HS. Предшественники гранулоцитов-моноцитов и предшественники моноцит-дендритных клеток независимо продуцируют функционально отличные моноциты. Иммунитет. 2017 21 ноября; 47 (5): 890-902.e4. [Бесплатная статья PMC: PMC5726802] [PubMed: 29166589]
- 2.
- Prinyakupt J, Pluempitiwiriyawej C. Сегментация лейкоцитов и сравнение морфологии клеток с помощью линейных и простых байесовских классификаторов.Биомед Рус Онлайн. 2015 30 июня; 14:63. [Бесплатная статья PMC: PMC4485641] [PubMed: 26123131]
- 3.
- Патель А.А., Чжан Й., Фуллертон Дж. Н., Болен Л., Ронгво А., Майни А. А., Бигли В., Флавелл Р. А., Гилрой, Аскит Б., Д. Д. Макаллан. , Йона С. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и системном воспалении. J Exp Med. 2017 г. 03 июля; 214 (7): 1913-1923. [Бесплатная статья PMC: PMC5502436] [PubMed: 28606987]
- 4.
- Саид Л., Патнаик М. М., Бегна К. Х., Аль-Кали А., Литцов М. Р., Хансон Калифорния, Кеттерлинг Р. П., Поррата Л. Ф., Парданани А., Гангат Н., Теффери А.Прогностическая значимость лимфоцитопении, моноцитопении и соотношения лимфоцитов и моноцитов при первичных миелодиспластических синдромах: опыт единого центра у 889 пациентов. Рак крови J. 31 марта 2017 г .; 7 (3): e550. [Бесплатная статья PMC: PMC5380913] [PubMed: 28362440]
- 5.
- Itzykson R, Fenaux P, Bowen D, Cross NCP, Cortes J, De Witte T., Germing U, Onida F, Padron E, Platzbecker U, Santini V, Sanz GF, Solary E, Van de Loosdrecht A, Malcovati L. Диагностика и лечение хронических миеломоноцитарных лейкозов у взрослых: рекомендации Европейской гематологической ассоциации и European LeukemiaNet.Полусфера. 2018 декабрь; 2 (6): e150. [Бесплатная статья PMC: PMC6745959] [PubMed: 31723789]
- 6.
- Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS, Kim C, McSkimming C, Taylor AM, Nguyen AT, McNamara CA , Хедрик СС. Гетерогенность моноцитов человека, выявленная методом многомерной масс-цитометрии. Артериосклер Thromb Vasc Biol. 2019 Янв; 39 (1): 25-36. [Бесплатная статья PMC: PMC6697379] [PubMed: 30580568]
- 7.
- Цыганов Э., Мастио Дж., Чен Э, Габрилович Д.И.Пластичность клеток-супрессоров миелоидного происхождения при раке. Curr Opin Immunol. 2018 Апрель; 51: 76-82. [Бесплатная статья PMC: PMC5943174] [PubMed: 29547768]
- 8.
- Скиннер Б.М., Джонсон Э. Ядерные морфологии: их разнообразие и функциональная значимость. Хромосома. 2017 Март; 126 (2): 195-212. [Бесплатная статья PMC: PMC5371643] [PubMed: 27631793]
- 9.
- Auffray C, Sieweke MH, Geissmann F. Моноциты крови: развитие, гетерогенность и взаимосвязь с дендритными клетками. Анну Рев Иммунол.2009; 27: 669-92. [PubMed: 19132917]
- 10.
- Santoni G, Cardinali C, Morelli MB, Santoni M, Nabissi M, Amantini C. Распознавание молекулярных паттернов, связанных с опасностями и патогенами, рецепторами распознавания образов и ионными каналами переходного рецептора потенциальная семья запускает активацию инфламмасом в иммунных клетках и сенсорных нейронах. J Нейровоспаление. 2015 3 февраля; 12:21. [Бесплатная статья PMC: PMC4322456] [PubMed: 25644504]
- 11.
- Issekutz AC, Issekutz TB.Количественное определение и кинетика миграции моноцитов крови к острым воспалительным реакциям, а также IL-1 альфа, фактор некроза опухоли альфа и IFN-гамма. J Immunol. 1993 15 августа; 151 (4): 2105-15. [PubMed: 8345197]
- 12.
- Maslin CL, Kedzierska K, Webster NL, Muller WA, Crowe SM. Трансэндотелиальная миграция моноцитов: основные молекулярные механизмы и последствия инфекции ВИЧ-1. Curr HIV Res. 2005 Октябрь; 3 (4): 303-17. [PubMed: 16250878]
- 13.
- Хендерсон Р. Б., Хоббс Дж. А., Мэтис М., Хогг Н.Быстрое рекрутирование воспалительных моноцитов не зависит от миграции нейтрофилов. Кровь. 01 июля 2003 г .; 102 (1): 328-35. [PubMed: 12623845]
- 14.
- Бойетт Л. Б., Маседо К., Хади К., Элинофф Б. Д., Уолтерс Д. Т., Рамасвами Б., Чаласани Г., Табоас Д. М., Лаккис Ф. Г., Метес Д. М.. Фенотип, функция и потенциал дифференцировки субпопуляций моноцитов человека. PLoS One. 2017; 12 (4): e0176460. [Бесплатная статья PMC: PMC5406034] [PubMed: 28445506]
- 15.
- Jakubzick CV, Randolph GJ, Henson PM.Дифференцировка моноцитов и антигенпрезентирующие функции. Nat Rev Immunol. 2017 июн; 17 (6): 349-362. [PubMed: 28436425]
- 16.
- Варол С., Йона С., Юнг С. Происхождение и зависящие от тканевого контекста судьбы моноцитов крови. Immunol Cell Biol. 2009 Янв; 87 (1): 30-8. [PubMed: 1 16]
- 17,
- Schultze JL. Ремоделирование хроматина при активации моноцитов и макрофагов. Adv Protein Chem Struct Biol. 2017; 106: 1-15. [PubMed: 28057208]
- 18.
- Ян Дж., Чжан Л., Ю Ц., Ян Х. Ф., Ван Х.Дифференциация моноцитов и макрофагов: воспалительные моноциты кровообращения как биомаркеры воспалительных заболеваний. Biomark Res. 2014 7 января; 2 (1): 1. [Бесплатная статья PMC: PMC3892095] [PubMed: 24398220]
- 19.
- Маримуту Р., Фрэнсис Х., Дервиш С., Ли SCH, Медбери Х., Уильямс Х. Характеристика субпопуляций человеческих моноцитов с помощью анализа цитометрии всего кровотока. J Vis Exp. 17 октября 2018 г .; (140) [Бесплатная статья PMC: PMC6235554] [PubMed: 30394370]
- 20.
- Stansfield BK, Ingram DA.Клиническое значение неоднородности моноцитов. Clin Transl Med. 2015; 4: 5. [Бесплатная статья PMC: PMC4384980] [PubMed: 25852821]
- 21.
- Пум Ф, Афонюшкин Т., Реш Ю., Обермайер Г., Роде М., Пенц Т., Шустер М., Вагнер Г., Рендейро А.Ф., Мелки И., Каун С. , Войта Дж., Бок С., Джилма Б., Макман Н., Бойлард Е., Биндер С.Дж. Митохондрии представляют собой субпопуляцию внеклеточных везикул, высвобождаемых активированными моноцитами, и индуцируют ответы IFN и TNF типа I в эндотелиальных клетках. Circ Res. 2019 21 июня; 125 (1): 43-52.[PubMed: 31219742]
- 22.
- Olingy CE, Dinh HQ, Hedrick CC. Гетерогенность и функции моноцитов при раке. J Leukoc Biol. 2019 август; 106 (2): 309-322. [Бесплатная статья PMC: PMC6658332] [PubMed: 30776148]
- 23.
- Roberts CA, Дикинсон AK, Taams LS. Взаимодействие между моноцитами / макрофагами и субпопуляциями CD4 (+) Т-клеток при ревматоидном артрите. Фронт Иммунол. 2015; 6: 571. [Бесплатная статья PMC: PMC4652039] [PubMed: 26635790]
- 24.
- Burbano C, Villar-Vesga J, Orejuela J, Muñoz C, Vanegas A, Vásquez G, Rojas M, Castaño D.Возможное участие микрочастиц, полученных из тромбоцитов, и микрочастиц, образующих иммунные комплексы, во время активации моноцитов у пациентов с системной красной волчанкой. Фронт Иммунол. 2018; 9: 322. [Бесплатная статья PMC: PMC5837989] [PubMed: 29545790]
- 25.
- Fraser SD, Sadofsky LR, Kaye PM, Hart SP. Сниженная экспрессия моноцитов CD200R связана с повышенной продукцией провоспалительных цитокинов при саркоидозе. Научный доклад, 8 декабря 2016 г .; 6: 38689. [Бесплатная статья PMC: PMC5144133] [PubMed: 27929051]
- 26.
- Delcroix M, Heydari K, Dodge R, Riley LW. Проточно-цитометрический анализ субпопуляций человеческих моноцитов, пораженных Mycobacterium bovis BCG, до образования гранулемы. Pathog Dis. 1 ноября 2018 г .; 76 (8) [Бесплатная статья PMC: PMC6276273] [PubMed: 30445573]
- 27.
- Кеннеди Дж. Дж., Стейн М., Слобедман Б., Абендрот А. Инфекция и функциональная модуляция человеческих моноцитов и макрофагов ветряной оспой. Опоясывающий лишай. J Virol. 1 февраля 2019 г .; 93 (3) [Бесплатная статья PMC: PMC6340020] [PubMed: 30404793]
- 28.
- Nahrendorf M, Pittet MJ, Swirski FK. Моноциты: главные действующие лица воспаления инфаркта и восстановления после инфаркта миокарда. Тираж. 8 июня 2010 г .; 121 (22): 2437-45. [Бесплатная статья PMC: PMC2892474] [PubMed: 20530020]
- 29.
- Датта П., Нахрендорф М. Моноциты при инфаркте миокарда. Артериосклер Thromb Vasc Biol. 2015 Май; 35 (5): 1066-70. [Бесплатная статья PMC: PMC4409536] [PubMed: 25792449]
Гистология, моноциты — StatPearls — Книжная полка NCBI
Введение
Моноциты — это белые кровяные тельца, которые происходят из костного мозга.Моноциты являются частью врожденного иммунного ответа и регулируют клеточный гомеостаз, особенно в условиях инфекции и воспаления. [1] На их долю приходится примерно 5% циркулирующих ядерных клеток в нормальной крови взрослого человека [2]. Период полувыведения циркулирующих моноцитов составляет примерно от одного до трех дней. [3] Моноцитопения, снижение количества циркулирующих моноцитов, часто встречается при миелодиспластических синдромах. [4] В то время как моноцитоз, увеличение количества циркулирующих моноцитов, является частым явлением в периферической крови, особенно в связи с инфекцией, травмой, приемом лекарств, аутоиммунным заболеванием и некоторыми злокачественными новообразованиями.[1] Когда моноцитоз является стойким и необъяснимым, диагноз хронического миеломоноцитарного лейкоза заслуживает исследования. [5]
Проблемы, вызывающие озабоченность
При подозрении на миелоидное новообразование с моноцитарной дифференцировкой сложно и важно точно классифицировать моноциты как зрелые или незрелые. Не существует однозначного теста для выявления незрелых моноцитов. Проточная цитометрия идентифицирует молекулы на поверхности таких клеток, известные как маркеры кластера дифференцировки (CD).Такие маркеры могут предоставить информацию, помогающую оценить приблизительную популяцию зрелых и незрелых моноцитов. [6] Наряду с проточной цитометрией, морфология клетки требует оценки из-за атипичной экспрессии маркеров CD во время опухолевого роста. [5] При хроническом миеломоноцитарном лейкозе наблюдается стойкий моноцитоз периферической крови с примерно удвоенным количеством моноцитов в нормальной циркуляции [5]. В костном мозге должно быть менее 20% бластов (незрелых клеток), чтобы врач мог поставить диагноз хронического миеломоноцитарного лейкоза.[7]
Структура
Моноциты — самые крупные белые кровяные тельца, их диаметр составляет от 12 до 20 мкм, что примерно в два раза больше красных кровяных телец. [2] Моноциты обычно легко идентифицировать в периферической крови по их относительно большому размеру и извилистым двулопастным ядрам, часто описываемым как почковидные. [8]
Функция
Моноциты являются важным компонентом врожденной иммунной системы. [9] Моноцит — это тип лейкоцита, который дифференцируется на популяции макрофагов и дендритных клеток для регулирования клеточного гомеостаза, особенно в условиях инфекции и воспаления.[1] Моноциты выполняют две разные роли; они регулярно патрулируют организм на предмет микробных клеток и организуют иммунный ответ во время инфекции и воспаления. [1] Моноциты имеют на своей поверхности толл-подобные рецепторы, которые взаимодействуют с PAMPS (патоген-ассоциированными молекулярными структурами), обнаруженными во вторжающихся микробных клетках. [10] В ответ на такие стимулы моноциты мигрируют из костного мозга в кровоток и инфильтрируют ткани в течение 12–24 часов [11].
Чтобы проникнуть в пораженные участки, моноциты должны сначала прикрепиться к эндотелию, а затем свободно катиться по сосудистой поверхности.Затем моноцит прочно прикрепляется к эндотелию и, наконец, проходит через эндотелиальные клетки посредством процесса, известного как диапедез. Затем моноциты могут проникать через базальную мембрану эндотелия и мигрировать в область воспаления. [12] Этот процесс происходит за счет взаимодействия молекул как на поверхности моноцитов, так и на поверхности эндотелиальных клеток [13]. Факторы роста и цитокины определяют подтип моноцитов. [14] Моноциты функционируют как фагоциты и антигенпрезентирующие клетки периферической крови, поглощая и удаляя микроорганизмы, инородный материал, а также мертвые или поврежденные клетки.[1] Антигенпрезентирующие клетки включают макрофаги, дендритные клетки, В-лимфоциты и активированные эндотелиальные клетки. [15]
Макрофаги могут далее дифференцироваться в специализированные макрофаги в зависимости от их местоположения. [16] К ним относятся гистиоциты в соединительной ткани, клетки микроглии в головном мозге, остеокласты в кости, мезангиальные клетки в почках и альвеолярные макрофаги в легких [17]. Моноциты могут продуцировать цитокины, которые привлекают дополнительные клетки и белки в пораженную область, вызывая значительный иммунный ответ.[1] Типы выделяемых цитокинов зависят от функции. [18] Чтобы восстановить гомеостаз, моноциты могут способствовать ремоделированию и заживлению с помощью противовоспалительных цитокинов. [18]
Препарат ткани
Гистологическая характеристика моноцитов состоит из трех основных этапов. Эти шаги включают получение и подготовку образца цельной крови, проточную цитометрию и гейтирование моноцитов. Процесс подготовки цельной крови — это многоступенчатая химическая процедура, которая включает лизис клеток, маркировку клеток и, в конечном итоге, получение концентрированного образца для использования в исследовании.Затем проточная цитометрия образца позволяет охарактеризовать моноциты в зависимости от обрабатываемых ими маркеров. Гейтинг моноцитов — это визуальное средство, с помощью которого можно систематизировать собранные данные, чтобы показать процентное содержание каждой подгруппы моноцитов. [19]
Гистохимия и цитохимия
Кластер маркеров дифференцировки (CD) — это специфические молекулы, обнаруженные на поверхности клетки, которые дифференцируют клетки друг от друга, а также от окружающей ткани. Маркеры CD специфичны для подтипа моноцитов и типа ответа, вызываемого иммунной системой.[6] Общие маркеры CD включают CD4, CD11b, CD14, CD16 и CD33. [20]
Осветитель для микроскопии
Одиночное двудольчатое ядро имеет зрелый хроматин, а цитоплазма от умеренной до обильной и часто имеет нерегулярные базофильные края. При окрашивании неспецифическими эстеразами ядро становится бледно-фиолетовым, а обильная цитоплазма окрашивается от бледно-серого до синего цвета с многочисленными красновато-синими цитоплазматическими гранулами. [2]
Электронная микроскопия
Электронная микроскопия показывает, что моноциты имеют одно ядро и обильную цитоплазму с разбросанными гранулами, а также органеллами.Такие органеллы включают многочисленные митохондрии, аппарат Гольджи, микровезикулы, микротрубочки и микрофиламенты. [21]
Патофизиология
Роль моноцитов многогранна и связана с различными типами заболеваний, инфекционных процессов и воспалений. Моноцитоз и моноцитопения являются факторами, определяющими множество гематологических заболеваний, таких как лейкемии и миелодиспластические синдромы. [22] Моноцитоз присутствует при многочисленных воспалительных и иммунных нарушениях, таких как заболевания соединительной ткани, такие как ревматоидный артрит, системная красная волчанка и саркоидоз.[23] [24] [25] Моноциты играют решающую роль в иммунном ответе на острые инфекционные и воспалительные процессы, такие как микобактериальные инфекции и вирус ветряной оспы. [26] [27] Моноцитоз также возникает при инфаркте миокарда и часто связан с сывороточной креатининкиназой и степенью инфаркта. [28] Моноциты могут удалять мусор и способствовать ремоделированию после инфаркта миокарда. [29]
Клиническая значимость
Моноциты являются важным компонентом врожденной иммунной системы.Они являются источником многих других жизненно важных элементов иммунной системы, таких как макрофаги и дендритные клетки. Моноциты играют роль как в воспалительных, так и в противовоспалительных процессах, происходящих во время иммунного ответа. Моноциты и их изобилие или недостаток могут предоставить важные идентификационные ключи для диагностики нескольких гематологических нарушений, а также воспалительных и иммунных нарушений.
Рисунок
Базофил (в центре) с соседними нейтрофилом и моноцитом.Предоставлено Дэвидом Линчем, MD
Ссылки
- 1.
- Yáñez A, Coetzee SG, Olsson A, Muench DE, Berman BP, Hazelett DJ, Salomonis N, Grimes HL, Goodridge HS. Предшественники гранулоцитов-моноцитов и предшественники моноцит-дендритных клеток независимо продуцируют функционально отличные моноциты. Иммунитет. 2017 21 ноября; 47 (5): 890-902.e4. [Бесплатная статья PMC: PMC5726802] [PubMed: 29166589]
- 2.
- Prinyakupt J, Pluempitiwiriyawej C. Сегментация лейкоцитов и сравнение морфологии клеток с помощью линейных и простых байесовских классификаторов.Биомед Рус Онлайн. 2015 30 июня; 14:63. [Бесплатная статья PMC: PMC4485641] [PubMed: 26123131]
- 3.
- Патель А.А., Чжан Й., Фуллертон Дж. Н., Болен Л., Ронгво А., Майни А. А., Бигли В., Флавелл Р. А., Гилрой, Аскит Б., Д. Д. Макаллан. , Йона С. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и системном воспалении. J Exp Med. 2017 г. 03 июля; 214 (7): 1913-1923. [Бесплатная статья PMC: PMC5502436] [PubMed: 28606987]
- 4.
- Саид Л., Патнаик М. М., Бегна К. Х., Аль-Кали А., Литцов М. Р., Хансон Калифорния, Кеттерлинг Р. П., Поррата Л. Ф., Парданани А., Гангат Н., Теффери А.Прогностическая значимость лимфоцитопении, моноцитопении и соотношения лимфоцитов и моноцитов при первичных миелодиспластических синдромах: опыт единого центра у 889 пациентов. Рак крови J. 31 марта 2017 г .; 7 (3): e550. [Бесплатная статья PMC: PMC5380913] [PubMed: 28362440]
- 5.
- Itzykson R, Fenaux P, Bowen D, Cross NCP, Cortes J, De Witte T., Germing U, Onida F, Padron E, Platzbecker U, Santini V, Sanz GF, Solary E, Van de Loosdrecht A, Malcovati L. Диагностика и лечение хронических миеломоноцитарных лейкозов у взрослых: рекомендации Европейской гематологической ассоциации и European LeukemiaNet.Полусфера. 2018 декабрь; 2 (6): e150. [Бесплатная статья PMC: PMC6745959] [PubMed: 31723789]
- 6.
- Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS, Kim C, McSkimming C, Taylor AM, Nguyen AT, McNamara CA , Хедрик СС. Гетерогенность моноцитов человека, выявленная методом многомерной масс-цитометрии. Артериосклер Thromb Vasc Biol. 2019 Янв; 39 (1): 25-36. [Бесплатная статья PMC: PMC6697379] [PubMed: 30580568]
- 7.
- Цыганов Э., Мастио Дж., Чен Э, Габрилович Д.И.Пластичность клеток-супрессоров миелоидного происхождения при раке. Curr Opin Immunol. 2018 Апрель; 51: 76-82. [Бесплатная статья PMC: PMC5943174] [PubMed: 29547768]
- 8.
- Скиннер Б.М., Джонсон Э. Ядерные морфологии: их разнообразие и функциональная значимость. Хромосома. 2017 Март; 126 (2): 195-212. [Бесплатная статья PMC: PMC5371643] [PubMed: 27631793]
- 9.
- Auffray C, Sieweke MH, Geissmann F. Моноциты крови: развитие, гетерогенность и взаимосвязь с дендритными клетками. Анну Рев Иммунол.2009; 27: 669-92. [PubMed: 19132917]
- 10.
- Santoni G, Cardinali C, Morelli MB, Santoni M, Nabissi M, Amantini C. Распознавание молекулярных паттернов, связанных с опасностями и патогенами, рецепторами распознавания образов и ионными каналами переходного рецептора потенциальная семья запускает активацию инфламмасом в иммунных клетках и сенсорных нейронах. J Нейровоспаление. 2015 3 февраля; 12:21. [Бесплатная статья PMC: PMC4322456] [PubMed: 25644504]
- 11.
- Issekutz AC, Issekutz TB.Количественное определение и кинетика миграции моноцитов крови к острым воспалительным реакциям, а также IL-1 альфа, фактор некроза опухоли альфа и IFN-гамма. J Immunol. 1993 15 августа; 151 (4): 2105-15. [PubMed: 8345197]
- 12.
- Maslin CL, Kedzierska K, Webster NL, Muller WA, Crowe SM. Трансэндотелиальная миграция моноцитов: основные молекулярные механизмы и последствия инфекции ВИЧ-1. Curr HIV Res. 2005 Октябрь; 3 (4): 303-17. [PubMed: 16250878]
- 13.
- Хендерсон Р. Б., Хоббс Дж. А., Мэтис М., Хогг Н.Быстрое рекрутирование воспалительных моноцитов не зависит от миграции нейтрофилов. Кровь. 01 июля 2003 г .; 102 (1): 328-35. [PubMed: 12623845]
- 14.
- Бойетт Л. Б., Маседо К., Хади К., Элинофф Б. Д., Уолтерс Д. Т., Рамасвами Б., Чаласани Г., Табоас Д. М., Лаккис Ф. Г., Метес Д. М.. Фенотип, функция и потенциал дифференцировки субпопуляций моноцитов человека. PLoS One. 2017; 12 (4): e0176460. [Бесплатная статья PMC: PMC5406034] [PubMed: 28445506]
- 15.
- Jakubzick CV, Randolph GJ, Henson PM.Дифференцировка моноцитов и антигенпрезентирующие функции. Nat Rev Immunol. 2017 июн; 17 (6): 349-362. [PubMed: 28436425]
- 16.
- Варол С., Йона С., Юнг С. Происхождение и зависящие от тканевого контекста судьбы моноцитов крови. Immunol Cell Biol. 2009 Янв; 87 (1): 30-8. [PubMed: 1 16]
- 17,
- Schultze JL. Ремоделирование хроматина при активации моноцитов и макрофагов. Adv Protein Chem Struct Biol. 2017; 106: 1-15. [PubMed: 28057208]
- 18.
- Ян Дж., Чжан Л., Ю Ц., Ян Х. Ф., Ван Х.Дифференциация моноцитов и макрофагов: воспалительные моноциты кровообращения как биомаркеры воспалительных заболеваний. Biomark Res. 2014 7 января; 2 (1): 1. [Бесплатная статья PMC: PMC3892095] [PubMed: 24398220]
- 19.
- Маримуту Р., Фрэнсис Х., Дервиш С., Ли SCH, Медбери Х., Уильямс Х. Характеристика субпопуляций человеческих моноцитов с помощью анализа цитометрии всего кровотока. J Vis Exp. 17 октября 2018 г .; (140) [Бесплатная статья PMC: PMC6235554] [PubMed: 30394370]
- 20.
- Stansfield BK, Ingram DA.Клиническое значение неоднородности моноцитов. Clin Transl Med. 2015; 4: 5. [Бесплатная статья PMC: PMC4384980] [PubMed: 25852821]
- 21.
- Пум Ф, Афонюшкин Т., Реш Ю., Обермайер Г., Роде М., Пенц Т., Шустер М., Вагнер Г., Рендейро А.Ф., Мелки И., Каун С. , Войта Дж., Бок С., Джилма Б., Макман Н., Бойлард Е., Биндер С.Дж. Митохондрии представляют собой субпопуляцию внеклеточных везикул, высвобождаемых активированными моноцитами, и индуцируют ответы IFN и TNF типа I в эндотелиальных клетках. Circ Res. 2019 21 июня; 125 (1): 43-52.[PubMed: 31219742]
- 22.
- Olingy CE, Dinh HQ, Hedrick CC. Гетерогенность и функции моноцитов при раке. J Leukoc Biol. 2019 август; 106 (2): 309-322. [Бесплатная статья PMC: PMC6658332] [PubMed: 30776148]
- 23.
- Roberts CA, Дикинсон AK, Taams LS. Взаимодействие между моноцитами / макрофагами и субпопуляциями CD4 (+) Т-клеток при ревматоидном артрите. Фронт Иммунол. 2015; 6: 571. [Бесплатная статья PMC: PMC4652039] [PubMed: 26635790]
- 24.
- Burbano C, Villar-Vesga J, Orejuela J, Muñoz C, Vanegas A, Vásquez G, Rojas M, Castaño D.Возможное участие микрочастиц, полученных из тромбоцитов, и микрочастиц, образующих иммунные комплексы, во время активации моноцитов у пациентов с системной красной волчанкой. Фронт Иммунол. 2018; 9: 322. [Бесплатная статья PMC: PMC5837989] [PubMed: 29545790]
- 25.
- Fraser SD, Sadofsky LR, Kaye PM, Hart SP. Сниженная экспрессия моноцитов CD200R связана с повышенной продукцией провоспалительных цитокинов при саркоидозе. Научный доклад, 8 декабря 2016 г .; 6: 38689. [Бесплатная статья PMC: PMC5144133] [PubMed: 27929051]
- 26.
- Delcroix M, Heydari K, Dodge R, Riley LW. Проточно-цитометрический анализ субпопуляций человеческих моноцитов, пораженных Mycobacterium bovis BCG, до образования гранулемы. Pathog Dis. 1 ноября 2018 г .; 76 (8) [Бесплатная статья PMC: PMC6276273] [PubMed: 30445573]
- 27.
- Кеннеди Дж. Дж., Стейн М., Слобедман Б., Абендрот А. Инфекция и функциональная модуляция человеческих моноцитов и макрофагов ветряной оспой. Опоясывающий лишай. J Virol. 1 февраля 2019 г .; 93 (3) [Бесплатная статья PMC: PMC6340020] [PubMed: 30404793]
- 28.
- Nahrendorf M, Pittet MJ, Swirski FK. Моноциты: главные действующие лица воспаления инфаркта и восстановления после инфаркта миокарда. Тираж. 8 июня 2010 г .; 121 (22): 2437-45. [Бесплатная статья PMC: PMC2892474] [PubMed: 20530020]
- 29.
- Датта П., Нахрендорф М. Моноциты при инфаркте миокарда. Артериосклер Thromb Vasc Biol. 2015 Май; 35 (5): 1066-70. [Бесплатная статья PMC: PMC4409536] [PubMed: 25792449]
Гистология, моноциты — StatPearls — Книжная полка NCBI
Введение
Моноциты — это белые кровяные тельца, которые происходят из костного мозга.Моноциты являются частью врожденного иммунного ответа и регулируют клеточный гомеостаз, особенно в условиях инфекции и воспаления. [1] На их долю приходится примерно 5% циркулирующих ядерных клеток в нормальной крови взрослого человека [2]. Период полувыведения циркулирующих моноцитов составляет примерно от одного до трех дней. [3] Моноцитопения, снижение количества циркулирующих моноцитов, часто встречается при миелодиспластических синдромах. [4] В то время как моноцитоз, увеличение количества циркулирующих моноцитов, является частым явлением в периферической крови, особенно в связи с инфекцией, травмой, приемом лекарств, аутоиммунным заболеванием и некоторыми злокачественными новообразованиями.[1] Когда моноцитоз является стойким и необъяснимым, диагноз хронического миеломоноцитарного лейкоза заслуживает исследования. [5]
Проблемы, вызывающие озабоченность
При подозрении на миелоидное новообразование с моноцитарной дифференцировкой сложно и важно точно классифицировать моноциты как зрелые или незрелые. Не существует однозначного теста для выявления незрелых моноцитов. Проточная цитометрия идентифицирует молекулы на поверхности таких клеток, известные как маркеры кластера дифференцировки (CD).Такие маркеры могут предоставить информацию, помогающую оценить приблизительную популяцию зрелых и незрелых моноцитов. [6] Наряду с проточной цитометрией, морфология клетки требует оценки из-за атипичной экспрессии маркеров CD во время опухолевого роста. [5] При хроническом миеломоноцитарном лейкозе наблюдается стойкий моноцитоз периферической крови с примерно удвоенным количеством моноцитов в нормальной циркуляции [5]. В костном мозге должно быть менее 20% бластов (незрелых клеток), чтобы врач мог поставить диагноз хронического миеломоноцитарного лейкоза.[7]
Структура
Моноциты — самые крупные белые кровяные тельца, их диаметр составляет от 12 до 20 мкм, что примерно в два раза больше красных кровяных телец. [2] Моноциты обычно легко идентифицировать в периферической крови по их относительно большому размеру и извилистым двулопастным ядрам, часто описываемым как почковидные. [8]
Функция
Моноциты являются важным компонентом врожденной иммунной системы. [9] Моноцит — это тип лейкоцита, который дифференцируется на популяции макрофагов и дендритных клеток для регулирования клеточного гомеостаза, особенно в условиях инфекции и воспаления.[1] Моноциты выполняют две разные роли; они регулярно патрулируют организм на предмет микробных клеток и организуют иммунный ответ во время инфекции и воспаления. [1] Моноциты имеют на своей поверхности толл-подобные рецепторы, которые взаимодействуют с PAMPS (патоген-ассоциированными молекулярными структурами), обнаруженными во вторжающихся микробных клетках. [10] В ответ на такие стимулы моноциты мигрируют из костного мозга в кровоток и инфильтрируют ткани в течение 12–24 часов [11].
Чтобы проникнуть в пораженные участки, моноциты должны сначала прикрепиться к эндотелию, а затем свободно катиться по сосудистой поверхности.Затем моноцит прочно прикрепляется к эндотелию и, наконец, проходит через эндотелиальные клетки посредством процесса, известного как диапедез. Затем моноциты могут проникать через базальную мембрану эндотелия и мигрировать в область воспаления. [12] Этот процесс происходит за счет взаимодействия молекул как на поверхности моноцитов, так и на поверхности эндотелиальных клеток [13]. Факторы роста и цитокины определяют подтип моноцитов. [14] Моноциты функционируют как фагоциты и антигенпрезентирующие клетки периферической крови, поглощая и удаляя микроорганизмы, инородный материал, а также мертвые или поврежденные клетки.[1] Антигенпрезентирующие клетки включают макрофаги, дендритные клетки, В-лимфоциты и активированные эндотелиальные клетки. [15]
Макрофаги могут далее дифференцироваться в специализированные макрофаги в зависимости от их местоположения. [16] К ним относятся гистиоциты в соединительной ткани, клетки микроглии в головном мозге, остеокласты в кости, мезангиальные клетки в почках и альвеолярные макрофаги в легких [17]. Моноциты могут продуцировать цитокины, которые привлекают дополнительные клетки и белки в пораженную область, вызывая значительный иммунный ответ.[1] Типы выделяемых цитокинов зависят от функции. [18] Чтобы восстановить гомеостаз, моноциты могут способствовать ремоделированию и заживлению с помощью противовоспалительных цитокинов. [18]
Препарат ткани
Гистологическая характеристика моноцитов состоит из трех основных этапов. Эти шаги включают получение и подготовку образца цельной крови, проточную цитометрию и гейтирование моноцитов. Процесс подготовки цельной крови — это многоступенчатая химическая процедура, которая включает лизис клеток, маркировку клеток и, в конечном итоге, получение концентрированного образца для использования в исследовании.Затем проточная цитометрия образца позволяет охарактеризовать моноциты в зависимости от обрабатываемых ими маркеров. Гейтинг моноцитов — это визуальное средство, с помощью которого можно систематизировать собранные данные, чтобы показать процентное содержание каждой подгруппы моноцитов. [19]
Гистохимия и цитохимия
Кластер маркеров дифференцировки (CD) — это специфические молекулы, обнаруженные на поверхности клетки, которые дифференцируют клетки друг от друга, а также от окружающей ткани. Маркеры CD специфичны для подтипа моноцитов и типа ответа, вызываемого иммунной системой.[6] Общие маркеры CD включают CD4, CD11b, CD14, CD16 и CD33. [20]
Осветитель для микроскопии
Одиночное двудольчатое ядро имеет зрелый хроматин, а цитоплазма от умеренной до обильной и часто имеет нерегулярные базофильные края. При окрашивании неспецифическими эстеразами ядро становится бледно-фиолетовым, а обильная цитоплазма окрашивается от бледно-серого до синего цвета с многочисленными красновато-синими цитоплазматическими гранулами. [2]
Электронная микроскопия
Электронная микроскопия показывает, что моноциты имеют одно ядро и обильную цитоплазму с разбросанными гранулами, а также органеллами.Такие органеллы включают многочисленные митохондрии, аппарат Гольджи, микровезикулы, микротрубочки и микрофиламенты. [21]
Патофизиология
Роль моноцитов многогранна и связана с различными типами заболеваний, инфекционных процессов и воспалений. Моноцитоз и моноцитопения являются факторами, определяющими множество гематологических заболеваний, таких как лейкемии и миелодиспластические синдромы. [22] Моноцитоз присутствует при многочисленных воспалительных и иммунных нарушениях, таких как заболевания соединительной ткани, такие как ревматоидный артрит, системная красная волчанка и саркоидоз.[23] [24] [25] Моноциты играют решающую роль в иммунном ответе на острые инфекционные и воспалительные процессы, такие как микобактериальные инфекции и вирус ветряной оспы. [26] [27] Моноцитоз также возникает при инфаркте миокарда и часто связан с сывороточной креатининкиназой и степенью инфаркта. [28] Моноциты могут удалять мусор и способствовать ремоделированию после инфаркта миокарда. [29]
Клиническая значимость
Моноциты являются важным компонентом врожденной иммунной системы.Они являются источником многих других жизненно важных элементов иммунной системы, таких как макрофаги и дендритные клетки. Моноциты играют роль как в воспалительных, так и в противовоспалительных процессах, происходящих во время иммунного ответа. Моноциты и их изобилие или недостаток могут предоставить важные идентификационные ключи для диагностики нескольких гематологических нарушений, а также воспалительных и иммунных нарушений.
Рисунок
Базофил (в центре) с соседними нейтрофилом и моноцитом.Предоставлено Дэвидом Линчем, MD
Ссылки
- 1.
- Yáñez A, Coetzee SG, Olsson A, Muench DE, Berman BP, Hazelett DJ, Salomonis N, Grimes HL, Goodridge HS. Предшественники гранулоцитов-моноцитов и предшественники моноцит-дендритных клеток независимо продуцируют функционально отличные моноциты. Иммунитет. 2017 21 ноября; 47 (5): 890-902.e4. [Бесплатная статья PMC: PMC5726802] [PubMed: 29166589]
- 2.
- Prinyakupt J, Pluempitiwiriyawej C. Сегментация лейкоцитов и сравнение морфологии клеток с помощью линейных и простых байесовских классификаторов.Биомед Рус Онлайн. 2015 30 июня; 14:63. [Бесплатная статья PMC: PMC4485641] [PubMed: 26123131]
- 3.
- Патель А.А., Чжан Й., Фуллертон Дж. Н., Болен Л., Ронгво А., Майни А. А., Бигли В., Флавелл Р. А., Гилрой, Аскит Б., Д. Д. Макаллан. , Йона С. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и системном воспалении. J Exp Med. 2017 г. 03 июля; 214 (7): 1913-1923. [Бесплатная статья PMC: PMC5502436] [PubMed: 28606987]
- 4.
- Саид Л., Патнаик М. М., Бегна К. Х., Аль-Кали А., Литцов М. Р., Хансон Калифорния, Кеттерлинг Р. П., Поррата Л. Ф., Парданани А., Гангат Н., Теффери А.Прогностическая значимость лимфоцитопении, моноцитопении и соотношения лимфоцитов и моноцитов при первичных миелодиспластических синдромах: опыт единого центра у 889 пациентов. Рак крови J. 31 марта 2017 г .; 7 (3): e550. [Бесплатная статья PMC: PMC5380913] [PubMed: 28362440]
- 5.
- Itzykson R, Fenaux P, Bowen D, Cross NCP, Cortes J, De Witte T., Germing U, Onida F, Padron E, Platzbecker U, Santini V, Sanz GF, Solary E, Van de Loosdrecht A, Malcovati L. Диагностика и лечение хронических миеломоноцитарных лейкозов у взрослых: рекомендации Европейской гематологической ассоциации и European LeukemiaNet.Полусфера. 2018 декабрь; 2 (6): e150. [Бесплатная статья PMC: PMC6745959] [PubMed: 31723789]
- 6.
- Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS, Kim C, McSkimming C, Taylor AM, Nguyen AT, McNamara CA , Хедрик СС. Гетерогенность моноцитов человека, выявленная методом многомерной масс-цитометрии. Артериосклер Thromb Vasc Biol. 2019 Янв; 39 (1): 25-36. [Бесплатная статья PMC: PMC6697379] [PubMed: 30580568]
- 7.
- Цыганов Э., Мастио Дж., Чен Э, Габрилович Д.И.Пластичность клеток-супрессоров миелоидного происхождения при раке. Curr Opin Immunol. 2018 Апрель; 51: 76-82. [Бесплатная статья PMC: PMC5943174] [PubMed: 29547768]
- 8.
- Скиннер Б.М., Джонсон Э. Ядерные морфологии: их разнообразие и функциональная значимость. Хромосома. 2017 Март; 126 (2): 195-212. [Бесплатная статья PMC: PMC5371643] [PubMed: 27631793]
- 9.
- Auffray C, Sieweke MH, Geissmann F. Моноциты крови: развитие, гетерогенность и взаимосвязь с дендритными клетками. Анну Рев Иммунол.2009; 27: 669-92. [PubMed: 19132917]
- 10.
- Santoni G, Cardinali C, Morelli MB, Santoni M, Nabissi M, Amantini C. Распознавание молекулярных паттернов, связанных с опасностями и патогенами, рецепторами распознавания образов и ионными каналами переходного рецептора потенциальная семья запускает активацию инфламмасом в иммунных клетках и сенсорных нейронах. J Нейровоспаление. 2015 3 февраля; 12:21. [Бесплатная статья PMC: PMC4322456] [PubMed: 25644504]
- 11.
- Issekutz AC, Issekutz TB.Количественное определение и кинетика миграции моноцитов крови к острым воспалительным реакциям, а также IL-1 альфа, фактор некроза опухоли альфа и IFN-гамма. J Immunol. 1993 15 августа; 151 (4): 2105-15. [PubMed: 8345197]
- 12.
- Maslin CL, Kedzierska K, Webster NL, Muller WA, Crowe SM. Трансэндотелиальная миграция моноцитов: основные молекулярные механизмы и последствия инфекции ВИЧ-1. Curr HIV Res. 2005 Октябрь; 3 (4): 303-17. [PubMed: 16250878]
- 13.
- Хендерсон Р. Б., Хоббс Дж. А., Мэтис М., Хогг Н.Быстрое рекрутирование воспалительных моноцитов не зависит от миграции нейтрофилов. Кровь. 01 июля 2003 г .; 102 (1): 328-35. [PubMed: 12623845]
- 14.
- Бойетт Л. Б., Маседо К., Хади К., Элинофф Б. Д., Уолтерс Д. Т., Рамасвами Б., Чаласани Г., Табоас Д. М., Лаккис Ф. Г., Метес Д. М.. Фенотип, функция и потенциал дифференцировки субпопуляций моноцитов человека. PLoS One. 2017; 12 (4): e0176460. [Бесплатная статья PMC: PMC5406034] [PubMed: 28445506]
- 15.
- Jakubzick CV, Randolph GJ, Henson PM.Дифференцировка моноцитов и антигенпрезентирующие функции. Nat Rev Immunol. 2017 июн; 17 (6): 349-362. [PubMed: 28436425]
- 16.
- Варол С., Йона С., Юнг С. Происхождение и зависящие от тканевого контекста судьбы моноцитов крови. Immunol Cell Biol. 2009 Янв; 87 (1): 30-8. [PubMed: 1 16]
- 17,
- Schultze JL. Ремоделирование хроматина при активации моноцитов и макрофагов. Adv Protein Chem Struct Biol. 2017; 106: 1-15. [PubMed: 28057208]
- 18.
- Ян Дж., Чжан Л., Ю Ц., Ян Х. Ф., Ван Х.Дифференциация моноцитов и макрофагов: воспалительные моноциты кровообращения как биомаркеры воспалительных заболеваний. Biomark Res. 2014 7 января; 2 (1): 1. [Бесплатная статья PMC: PMC3892095] [PubMed: 24398220]
- 19.
- Маримуту Р., Фрэнсис Х., Дервиш С., Ли SCH, Медбери Х., Уильямс Х. Характеристика субпопуляций человеческих моноцитов с помощью анализа цитометрии всего кровотока. J Vis Exp. 17 октября 2018 г .; (140) [Бесплатная статья PMC: PMC6235554] [PubMed: 30394370]
- 20.
- Stansfield BK, Ingram DA.Клиническое значение неоднородности моноцитов. Clin Transl Med. 2015; 4: 5. [Бесплатная статья PMC: PMC4384980] [PubMed: 25852821]
- 21.
- Пум Ф, Афонюшкин Т., Реш Ю., Обермайер Г., Роде М., Пенц Т., Шустер М., Вагнер Г., Рендейро А.Ф., Мелки И., Каун С. , Войта Дж., Бок С., Джилма Б., Макман Н., Бойлард Е., Биндер С.Дж. Митохондрии представляют собой субпопуляцию внеклеточных везикул, высвобождаемых активированными моноцитами, и индуцируют ответы IFN и TNF типа I в эндотелиальных клетках. Circ Res. 2019 21 июня; 125 (1): 43-52.[PubMed: 31219742]
- 22.
- Olingy CE, Dinh HQ, Hedrick CC. Гетерогенность и функции моноцитов при раке. J Leukoc Biol. 2019 август; 106 (2): 309-322. [Бесплатная статья PMC: PMC6658332] [PubMed: 30776148]
- 23.
- Roberts CA, Дикинсон AK, Taams LS. Взаимодействие между моноцитами / макрофагами и субпопуляциями CD4 (+) Т-клеток при ревматоидном артрите. Фронт Иммунол. 2015; 6: 571. [Бесплатная статья PMC: PMC4652039] [PubMed: 26635790]
- 24.
- Burbano C, Villar-Vesga J, Orejuela J, Muñoz C, Vanegas A, Vásquez G, Rojas M, Castaño D.Возможное участие микрочастиц, полученных из тромбоцитов, и микрочастиц, образующих иммунные комплексы, во время активации моноцитов у пациентов с системной красной волчанкой. Фронт Иммунол. 2018; 9: 322. [Бесплатная статья PMC: PMC5837989] [PubMed: 29545790]
- 25.
- Fraser SD, Sadofsky LR, Kaye PM, Hart SP. Сниженная экспрессия моноцитов CD200R связана с повышенной продукцией провоспалительных цитокинов при саркоидозе. Научный доклад, 8 декабря 2016 г .; 6: 38689. [Бесплатная статья PMC: PMC5144133] [PubMed: 27929051]
- 26.
- Delcroix M, Heydari K, Dodge R, Riley LW. Проточно-цитометрический анализ субпопуляций человеческих моноцитов, пораженных Mycobacterium bovis BCG, до образования гранулемы. Pathog Dis. 1 ноября 2018 г .; 76 (8) [Бесплатная статья PMC: PMC6276273] [PubMed: 30445573]
- 27.
- Кеннеди Дж. Дж., Стейн М., Слобедман Б., Абендрот А. Инфекция и функциональная модуляция человеческих моноцитов и макрофагов ветряной оспой. Опоясывающий лишай. J Virol. 1 февраля 2019 г .; 93 (3) [Бесплатная статья PMC: PMC6340020] [PubMed: 30404793]
- 28.
- Nahrendorf M, Pittet MJ, Swirski FK. Моноциты: главные действующие лица воспаления инфаркта и восстановления после инфаркта миокарда. Тираж. 8 июня 2010 г .; 121 (22): 2437-45. [Бесплатная статья PMC: PMC2892474] [PubMed: 20530020]
- 29.
- Датта П., Нахрендорф М. Моноциты при инфаркте миокарда. Артериосклер Thromb Vasc Biol. 2015 Май; 35 (5): 1066-70. [Бесплатная статья PMC: PMC4409536] [PubMed: 25792449]
Гистология, моноциты — StatPearls — Книжная полка NCBI
Введение
Моноциты — это белые кровяные тельца, которые происходят из костного мозга.Моноциты являются частью врожденного иммунного ответа и регулируют клеточный гомеостаз, особенно в условиях инфекции и воспаления. [1] На их долю приходится примерно 5% циркулирующих ядерных клеток в нормальной крови взрослого человека [2]. Период полувыведения циркулирующих моноцитов составляет примерно от одного до трех дней. [3] Моноцитопения, снижение количества циркулирующих моноцитов, часто встречается при миелодиспластических синдромах. [4] В то время как моноцитоз, увеличение количества циркулирующих моноцитов, является частым явлением в периферической крови, особенно в связи с инфекцией, травмой, приемом лекарств, аутоиммунным заболеванием и некоторыми злокачественными новообразованиями.[1] Когда моноцитоз является стойким и необъяснимым, диагноз хронического миеломоноцитарного лейкоза заслуживает исследования. [5]
Проблемы, вызывающие озабоченность
При подозрении на миелоидное новообразование с моноцитарной дифференцировкой сложно и важно точно классифицировать моноциты как зрелые или незрелые. Не существует однозначного теста для выявления незрелых моноцитов. Проточная цитометрия идентифицирует молекулы на поверхности таких клеток, известные как маркеры кластера дифференцировки (CD).Такие маркеры могут предоставить информацию, помогающую оценить приблизительную популяцию зрелых и незрелых моноцитов. [6] Наряду с проточной цитометрией, морфология клетки требует оценки из-за атипичной экспрессии маркеров CD во время опухолевого роста. [5] При хроническом миеломоноцитарном лейкозе наблюдается стойкий моноцитоз периферической крови с примерно удвоенным количеством моноцитов в нормальной циркуляции [5]. В костном мозге должно быть менее 20% бластов (незрелых клеток), чтобы врач мог поставить диагноз хронического миеломоноцитарного лейкоза.[7]
Структура
Моноциты — самые крупные белые кровяные тельца, их диаметр составляет от 12 до 20 мкм, что примерно в два раза больше красных кровяных телец. [2] Моноциты обычно легко идентифицировать в периферической крови по их относительно большому размеру и извилистым двулопастным ядрам, часто описываемым как почковидные. [8]
Функция
Моноциты являются важным компонентом врожденной иммунной системы. [9] Моноцит — это тип лейкоцита, который дифференцируется на популяции макрофагов и дендритных клеток для регулирования клеточного гомеостаза, особенно в условиях инфекции и воспаления.[1] Моноциты выполняют две разные роли; они регулярно патрулируют организм на предмет микробных клеток и организуют иммунный ответ во время инфекции и воспаления. [1] Моноциты имеют на своей поверхности толл-подобные рецепторы, которые взаимодействуют с PAMPS (патоген-ассоциированными молекулярными структурами), обнаруженными во вторжающихся микробных клетках. [10] В ответ на такие стимулы моноциты мигрируют из костного мозга в кровоток и инфильтрируют ткани в течение 12–24 часов [11].
Чтобы проникнуть в пораженные участки, моноциты должны сначала прикрепиться к эндотелию, а затем свободно катиться по сосудистой поверхности.Затем моноцит прочно прикрепляется к эндотелию и, наконец, проходит через эндотелиальные клетки посредством процесса, известного как диапедез. Затем моноциты могут проникать через базальную мембрану эндотелия и мигрировать в область воспаления. [12] Этот процесс происходит за счет взаимодействия молекул как на поверхности моноцитов, так и на поверхности эндотелиальных клеток [13]. Факторы роста и цитокины определяют подтип моноцитов. [14] Моноциты функционируют как фагоциты и антигенпрезентирующие клетки периферической крови, поглощая и удаляя микроорганизмы, инородный материал, а также мертвые или поврежденные клетки.[1] Антигенпрезентирующие клетки включают макрофаги, дендритные клетки, В-лимфоциты и активированные эндотелиальные клетки. [15]
Макрофаги могут далее дифференцироваться в специализированные макрофаги в зависимости от их местоположения. [16] К ним относятся гистиоциты в соединительной ткани, клетки микроглии в головном мозге, остеокласты в кости, мезангиальные клетки в почках и альвеолярные макрофаги в легких [17]. Моноциты могут продуцировать цитокины, которые привлекают дополнительные клетки и белки в пораженную область, вызывая значительный иммунный ответ.[1] Типы выделяемых цитокинов зависят от функции. [18] Чтобы восстановить гомеостаз, моноциты могут способствовать ремоделированию и заживлению с помощью противовоспалительных цитокинов. [18]
Препарат ткани
Гистологическая характеристика моноцитов состоит из трех основных этапов. Эти шаги включают получение и подготовку образца цельной крови, проточную цитометрию и гейтирование моноцитов. Процесс подготовки цельной крови — это многоступенчатая химическая процедура, которая включает лизис клеток, маркировку клеток и, в конечном итоге, получение концентрированного образца для использования в исследовании.Затем проточная цитометрия образца позволяет охарактеризовать моноциты в зависимости от обрабатываемых ими маркеров. Гейтинг моноцитов — это визуальное средство, с помощью которого можно систематизировать собранные данные, чтобы показать процентное содержание каждой подгруппы моноцитов. [19]
Гистохимия и цитохимия
Кластер маркеров дифференцировки (CD) — это специфические молекулы, обнаруженные на поверхности клетки, которые дифференцируют клетки друг от друга, а также от окружающей ткани. Маркеры CD специфичны для подтипа моноцитов и типа ответа, вызываемого иммунной системой.[6] Общие маркеры CD включают CD4, CD11b, CD14, CD16 и CD33. [20]
Осветитель для микроскопии
Одиночное двудольчатое ядро имеет зрелый хроматин, а цитоплазма от умеренной до обильной и часто имеет нерегулярные базофильные края. При окрашивании неспецифическими эстеразами ядро становится бледно-фиолетовым, а обильная цитоплазма окрашивается от бледно-серого до синего цвета с многочисленными красновато-синими цитоплазматическими гранулами. [2]
Электронная микроскопия
Электронная микроскопия показывает, что моноциты имеют одно ядро и обильную цитоплазму с разбросанными гранулами, а также органеллами.Такие органеллы включают многочисленные митохондрии, аппарат Гольджи, микровезикулы, микротрубочки и микрофиламенты. [21]
Патофизиология
Роль моноцитов многогранна и связана с различными типами заболеваний, инфекционных процессов и воспалений. Моноцитоз и моноцитопения являются факторами, определяющими множество гематологических заболеваний, таких как лейкемии и миелодиспластические синдромы. [22] Моноцитоз присутствует при многочисленных воспалительных и иммунных нарушениях, таких как заболевания соединительной ткани, такие как ревматоидный артрит, системная красная волчанка и саркоидоз.[23] [24] [25] Моноциты играют решающую роль в иммунном ответе на острые инфекционные и воспалительные процессы, такие как микобактериальные инфекции и вирус ветряной оспы. [26] [27] Моноцитоз также возникает при инфаркте миокарда и часто связан с сывороточной креатининкиназой и степенью инфаркта. [28] Моноциты могут удалять мусор и способствовать ремоделированию после инфаркта миокарда. [29]
Клиническая значимость
Моноциты являются важным компонентом врожденной иммунной системы.Они являются источником многих других жизненно важных элементов иммунной системы, таких как макрофаги и дендритные клетки. Моноциты играют роль как в воспалительных, так и в противовоспалительных процессах, происходящих во время иммунного ответа. Моноциты и их изобилие или недостаток могут предоставить важные идентификационные ключи для диагностики нескольких гематологических нарушений, а также воспалительных и иммунных нарушений.
Рисунок
Базофил (в центре) с соседними нейтрофилом и моноцитом.Предоставлено Дэвидом Линчем, MD
Ссылки
- 1.
- Yáñez A, Coetzee SG, Olsson A, Muench DE, Berman BP, Hazelett DJ, Salomonis N, Grimes HL, Goodridge HS. Предшественники гранулоцитов-моноцитов и предшественники моноцит-дендритных клеток независимо продуцируют функционально отличные моноциты. Иммунитет. 2017 21 ноября; 47 (5): 890-902.e4. [Бесплатная статья PMC: PMC5726802] [PubMed: 29166589]
- 2.
- Prinyakupt J, Pluempitiwiriyawej C. Сегментация лейкоцитов и сравнение морфологии клеток с помощью линейных и простых байесовских классификаторов.Биомед Рус Онлайн. 2015 30 июня; 14:63. [Бесплатная статья PMC: PMC4485641] [PubMed: 26123131]
- 3.
- Патель А.А., Чжан Й., Фуллертон Дж. Н., Болен Л., Ронгво А., Майни А. А., Бигли В., Флавелл Р. А., Гилрой, Аскит Б., Д. Д. Макаллан. , Йона С. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и системном воспалении. J Exp Med. 2017 г. 03 июля; 214 (7): 1913-1923. [Бесплатная статья PMC: PMC5502436] [PubMed: 28606987]
- 4.
- Саид Л., Патнаик М. М., Бегна К. Х., Аль-Кали А., Литцов М. Р., Хансон Калифорния, Кеттерлинг Р. П., Поррата Л. Ф., Парданани А., Гангат Н., Теффери А.Прогностическая значимость лимфоцитопении, моноцитопении и соотношения лимфоцитов и моноцитов при первичных миелодиспластических синдромах: опыт единого центра у 889 пациентов. Рак крови J. 31 марта 2017 г .; 7 (3): e550. [Бесплатная статья PMC: PMC5380913] [PubMed: 28362440]
- 5.
- Itzykson R, Fenaux P, Bowen D, Cross NCP, Cortes J, De Witte T., Germing U, Onida F, Padron E, Platzbecker U, Santini V, Sanz GF, Solary E, Van de Loosdrecht A, Malcovati L. Диагностика и лечение хронических миеломоноцитарных лейкозов у взрослых: рекомендации Европейской гематологической ассоциации и European LeukemiaNet.Полусфера. 2018 декабрь; 2 (6): e150. [Бесплатная статья PMC: PMC6745959] [PubMed: 31723789]
- 6.
- Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS, Kim C, McSkimming C, Taylor AM, Nguyen AT, McNamara CA , Хедрик СС. Гетерогенность моноцитов человека, выявленная методом многомерной масс-цитометрии. Артериосклер Thromb Vasc Biol. 2019 Янв; 39 (1): 25-36. [Бесплатная статья PMC: PMC6697379] [PubMed: 30580568]
- 7.
- Цыганов Э., Мастио Дж., Чен Э, Габрилович Д.И.Пластичность клеток-супрессоров миелоидного происхождения при раке. Curr Opin Immunol. 2018 Апрель; 51: 76-82. [Бесплатная статья PMC: PMC5943174] [PubMed: 29547768]
- 8.
- Скиннер Б.М., Джонсон Э. Ядерные морфологии: их разнообразие и функциональная значимость. Хромосома. 2017 Март; 126 (2): 195-212. [Бесплатная статья PMC: PMC5371643] [PubMed: 27631793]
- 9.
- Auffray C, Sieweke MH, Geissmann F. Моноциты крови: развитие, гетерогенность и взаимосвязь с дендритными клетками. Анну Рев Иммунол.2009; 27: 669-92. [PubMed: 19132917]
- 10.
- Santoni G, Cardinali C, Morelli MB, Santoni M, Nabissi M, Amantini C. Распознавание молекулярных паттернов, связанных с опасностями и патогенами, рецепторами распознавания образов и ионными каналами переходного рецептора потенциальная семья запускает активацию инфламмасом в иммунных клетках и сенсорных нейронах. J Нейровоспаление. 2015 3 февраля; 12:21. [Бесплатная статья PMC: PMC4322456] [PubMed: 25644504]
- 11.
- Issekutz AC, Issekutz TB.Количественное определение и кинетика миграции моноцитов крови к острым воспалительным реакциям, а также IL-1 альфа, фактор некроза опухоли альфа и IFN-гамма. J Immunol. 1993 15 августа; 151 (4): 2105-15. [PubMed: 8345197]
- 12.
- Maslin CL, Kedzierska K, Webster NL, Muller WA, Crowe SM. Трансэндотелиальная миграция моноцитов: основные молекулярные механизмы и последствия инфекции ВИЧ-1. Curr HIV Res. 2005 Октябрь; 3 (4): 303-17. [PubMed: 16250878]
- 13.
- Хендерсон Р. Б., Хоббс Дж. А., Мэтис М., Хогг Н.Быстрое рекрутирование воспалительных моноцитов не зависит от миграции нейтрофилов. Кровь. 01 июля 2003 г .; 102 (1): 328-35. [PubMed: 12623845]
- 14.
- Бойетт Л. Б., Маседо К., Хади К., Элинофф Б. Д., Уолтерс Д. Т., Рамасвами Б., Чаласани Г., Табоас Д. М., Лаккис Ф. Г., Метес Д. М.. Фенотип, функция и потенциал дифференцировки субпопуляций моноцитов человека. PLoS One. 2017; 12 (4): e0176460. [Бесплатная статья PMC: PMC5406034] [PubMed: 28445506]
- 15.
- Jakubzick CV, Randolph GJ, Henson PM.Дифференцировка моноцитов и антигенпрезентирующие функции. Nat Rev Immunol. 2017 июн; 17 (6): 349-362. [PubMed: 28436425]
- 16.
- Варол С., Йона С., Юнг С. Происхождение и зависящие от тканевого контекста судьбы моноцитов крови. Immunol Cell Biol. 2009 Янв; 87 (1): 30-8. [PubMed: 1 16]
- 17,
- Schultze JL. Ремоделирование хроматина при активации моноцитов и макрофагов. Adv Protein Chem Struct Biol. 2017; 106: 1-15. [PubMed: 28057208]
- 18.
- Ян Дж., Чжан Л., Ю Ц., Ян Х. Ф., Ван Х.Дифференциация моноцитов и макрофагов: воспалительные моноциты кровообращения как биомаркеры воспалительных заболеваний. Biomark Res. 2014 7 января; 2 (1): 1. [Бесплатная статья PMC: PMC3892095] [PubMed: 24398220]
- 19.
- Маримуту Р., Фрэнсис Х., Дервиш С., Ли SCH, Медбери Х., Уильямс Х. Характеристика субпопуляций человеческих моноцитов с помощью анализа цитометрии всего кровотока. J Vis Exp. 17 октября 2018 г .; (140) [Бесплатная статья PMC: PMC6235554] [PubMed: 30394370]
- 20.
- Stansfield BK, Ingram DA.Клиническое значение неоднородности моноцитов. Clin Transl Med. 2015; 4: 5. [Бесплатная статья PMC: PMC4384980] [PubMed: 25852821]
- 21.
- Пум Ф, Афонюшкин Т., Реш Ю., Обермайер Г., Роде М., Пенц Т., Шустер М., Вагнер Г., Рендейро А.Ф., Мелки И., Каун С. , Войта Дж., Бок С., Джилма Б., Макман Н., Бойлард Е., Биндер С.Дж. Митохондрии представляют собой субпопуляцию внеклеточных везикул, высвобождаемых активированными моноцитами, и индуцируют ответы IFN и TNF типа I в эндотелиальных клетках. Circ Res. 2019 21 июня; 125 (1): 43-52.[PubMed: 31219742]
- 22.
- Olingy CE, Dinh HQ, Hedrick CC. Гетерогенность и функции моноцитов при раке. J Leukoc Biol. 2019 август; 106 (2): 309-322. [Бесплатная статья PMC: PMC6658332] [PubMed: 30776148]
- 23.
- Roberts CA, Дикинсон AK, Taams LS. Взаимодействие между моноцитами / макрофагами и субпопуляциями CD4 (+) Т-клеток при ревматоидном артрите. Фронт Иммунол. 2015; 6: 571. [Бесплатная статья PMC: PMC4652039] [PubMed: 26635790]
- 24.
- Burbano C, Villar-Vesga J, Orejuela J, Muñoz C, Vanegas A, Vásquez G, Rojas M, Castaño D.Возможное участие микрочастиц, полученных из тромбоцитов, и микрочастиц, образующих иммунные комплексы, во время активации моноцитов у пациентов с системной красной волчанкой. Фронт Иммунол. 2018; 9: 322. [Бесплатная статья PMC: PMC5837989] [PubMed: 29545790]
- 25.
- Fraser SD, Sadofsky LR, Kaye PM, Hart SP. Сниженная экспрессия моноцитов CD200R связана с повышенной продукцией провоспалительных цитокинов при саркоидозе. Научный доклад, 8 декабря 2016 г .; 6: 38689. [Бесплатная статья PMC: PMC5144133] [PubMed: 27929051]
- 26.
- Delcroix M, Heydari K, Dodge R, Riley LW. Проточно-цитометрический анализ субпопуляций человеческих моноцитов, пораженных Mycobacterium bovis BCG, до образования гранулемы. Pathog Dis. 1 ноября 2018 г .; 76 (8) [Бесплатная статья PMC: PMC6276273] [PubMed: 30445573]
- 27.
- Кеннеди Дж. Дж., Стейн М., Слобедман Б., Абендрот А. Инфекция и функциональная модуляция человеческих моноцитов и макрофагов ветряной оспой. Опоясывающий лишай. J Virol. 1 февраля 2019 г .; 93 (3) [Бесплатная статья PMC: PMC6340020] [PubMed: 30404793]
- 28.
- Nahrendorf M, Pittet MJ, Swirski FK. Моноциты: главные действующие лица воспаления инфаркта и восстановления после инфаркта миокарда. Тираж. 8 июня 2010 г .; 121 (22): 2437-45. [Бесплатная статья PMC: PMC2892474] [PubMed: 20530020]
- 29.
- Датта П., Нахрендорф М. Моноциты при инфаркте миокарда. Артериосклер Thromb Vasc Biol. 2015 Май; 35 (5): 1066-70. [Бесплатная статья PMC: PMC4409536] [PubMed: 25792449]
Гистология, моноциты — StatPearls — Книжная полка NCBI
Введение
Моноциты — это белые кровяные тельца, которые происходят из костного мозга.Моноциты являются частью врожденного иммунного ответа и регулируют клеточный гомеостаз, особенно в условиях инфекции и воспаления. [1] На их долю приходится примерно 5% циркулирующих ядерных клеток в нормальной крови взрослого человека [2]. Период полувыведения циркулирующих моноцитов составляет примерно от одного до трех дней. [3] Моноцитопения, снижение количества циркулирующих моноцитов, часто встречается при миелодиспластических синдромах. [4] В то время как моноцитоз, увеличение количества циркулирующих моноцитов, является частым явлением в периферической крови, особенно в связи с инфекцией, травмой, приемом лекарств, аутоиммунным заболеванием и некоторыми злокачественными новообразованиями.[1] Когда моноцитоз является стойким и необъяснимым, диагноз хронического миеломоноцитарного лейкоза заслуживает исследования. [5]
Проблемы, вызывающие озабоченность
При подозрении на миелоидное новообразование с моноцитарной дифференцировкой сложно и важно точно классифицировать моноциты как зрелые или незрелые. Не существует однозначного теста для выявления незрелых моноцитов. Проточная цитометрия идентифицирует молекулы на поверхности таких клеток, известные как маркеры кластера дифференцировки (CD).Такие маркеры могут предоставить информацию, помогающую оценить приблизительную популяцию зрелых и незрелых моноцитов. [6] Наряду с проточной цитометрией, морфология клетки требует оценки из-за атипичной экспрессии маркеров CD во время опухолевого роста. [5] При хроническом миеломоноцитарном лейкозе наблюдается стойкий моноцитоз периферической крови с примерно удвоенным количеством моноцитов в нормальной циркуляции [5]. В костном мозге должно быть менее 20% бластов (незрелых клеток), чтобы врач мог поставить диагноз хронического миеломоноцитарного лейкоза.[7]
Структура
Моноциты — самые крупные белые кровяные тельца, их диаметр составляет от 12 до 20 мкм, что примерно в два раза больше красных кровяных телец. [2] Моноциты обычно легко идентифицировать в периферической крови по их относительно большому размеру и извилистым двулопастным ядрам, часто описываемым как почковидные. [8]
Функция
Моноциты являются важным компонентом врожденной иммунной системы. [9] Моноцит — это тип лейкоцита, который дифференцируется на популяции макрофагов и дендритных клеток для регулирования клеточного гомеостаза, особенно в условиях инфекции и воспаления.[1] Моноциты выполняют две разные роли; они регулярно патрулируют организм на предмет микробных клеток и организуют иммунный ответ во время инфекции и воспаления. [1] Моноциты имеют на своей поверхности толл-подобные рецепторы, которые взаимодействуют с PAMPS (патоген-ассоциированными молекулярными структурами), обнаруженными во вторжающихся микробных клетках. [10] В ответ на такие стимулы моноциты мигрируют из костного мозга в кровоток и инфильтрируют ткани в течение 12–24 часов [11].
Чтобы проникнуть в пораженные участки, моноциты должны сначала прикрепиться к эндотелию, а затем свободно катиться по сосудистой поверхности.Затем моноцит прочно прикрепляется к эндотелию и, наконец, проходит через эндотелиальные клетки посредством процесса, известного как диапедез. Затем моноциты могут проникать через базальную мембрану эндотелия и мигрировать в область воспаления. [12] Этот процесс происходит за счет взаимодействия молекул как на поверхности моноцитов, так и на поверхности эндотелиальных клеток [13]. Факторы роста и цитокины определяют подтип моноцитов. [14] Моноциты функционируют как фагоциты и антигенпрезентирующие клетки периферической крови, поглощая и удаляя микроорганизмы, инородный материал, а также мертвые или поврежденные клетки.[1] Антигенпрезентирующие клетки включают макрофаги, дендритные клетки, В-лимфоциты и активированные эндотелиальные клетки. [15]
Макрофаги могут далее дифференцироваться в специализированные макрофаги в зависимости от их местоположения. [16] К ним относятся гистиоциты в соединительной ткани, клетки микроглии в головном мозге, остеокласты в кости, мезангиальные клетки в почках и альвеолярные макрофаги в легких [17]. Моноциты могут продуцировать цитокины, которые привлекают дополнительные клетки и белки в пораженную область, вызывая значительный иммунный ответ.[1] Типы выделяемых цитокинов зависят от функции. [18] Чтобы восстановить гомеостаз, моноциты могут способствовать ремоделированию и заживлению с помощью противовоспалительных цитокинов. [18]
Препарат ткани
Гистологическая характеристика моноцитов состоит из трех основных этапов. Эти шаги включают получение и подготовку образца цельной крови, проточную цитометрию и гейтирование моноцитов. Процесс подготовки цельной крови — это многоступенчатая химическая процедура, которая включает лизис клеток, маркировку клеток и, в конечном итоге, получение концентрированного образца для использования в исследовании.Затем проточная цитометрия образца позволяет охарактеризовать моноциты в зависимости от обрабатываемых ими маркеров. Гейтинг моноцитов — это визуальное средство, с помощью которого можно систематизировать собранные данные, чтобы показать процентное содержание каждой подгруппы моноцитов. [19]
Гистохимия и цитохимия
Кластер маркеров дифференцировки (CD) — это специфические молекулы, обнаруженные на поверхности клетки, которые дифференцируют клетки друг от друга, а также от окружающей ткани. Маркеры CD специфичны для подтипа моноцитов и типа ответа, вызываемого иммунной системой.[6] Общие маркеры CD включают CD4, CD11b, CD14, CD16 и CD33. [20]
Осветитель для микроскопии
Одиночное двудольчатое ядро имеет зрелый хроматин, а цитоплазма от умеренной до обильной и часто имеет нерегулярные базофильные края. При окрашивании неспецифическими эстеразами ядро становится бледно-фиолетовым, а обильная цитоплазма окрашивается от бледно-серого до синего цвета с многочисленными красновато-синими цитоплазматическими гранулами. [2]
Электронная микроскопия
Электронная микроскопия показывает, что моноциты имеют одно ядро и обильную цитоплазму с разбросанными гранулами, а также органеллами.Такие органеллы включают многочисленные митохондрии, аппарат Гольджи, микровезикулы, микротрубочки и микрофиламенты. [21]
Патофизиология
Роль моноцитов многогранна и связана с различными типами заболеваний, инфекционных процессов и воспалений. Моноцитоз и моноцитопения являются факторами, определяющими множество гематологических заболеваний, таких как лейкемии и миелодиспластические синдромы. [22] Моноцитоз присутствует при многочисленных воспалительных и иммунных нарушениях, таких как заболевания соединительной ткани, такие как ревматоидный артрит, системная красная волчанка и саркоидоз.[23] [24] [25] Моноциты играют решающую роль в иммунном ответе на острые инфекционные и воспалительные процессы, такие как микобактериальные инфекции и вирус ветряной оспы. [26] [27] Моноцитоз также возникает при инфаркте миокарда и часто связан с сывороточной креатининкиназой и степенью инфаркта. [28] Моноциты могут удалять мусор и способствовать ремоделированию после инфаркта миокарда. [29]
Клиническая значимость
Моноциты являются важным компонентом врожденной иммунной системы.Они являются источником многих других жизненно важных элементов иммунной системы, таких как макрофаги и дендритные клетки. Моноциты играют роль как в воспалительных, так и в противовоспалительных процессах, происходящих во время иммунного ответа. Моноциты и их изобилие или недостаток могут предоставить важные идентификационные ключи для диагностики нескольких гематологических нарушений, а также воспалительных и иммунных нарушений.
Рисунок
Базофил (в центре) с соседними нейтрофилом и моноцитом.Предоставлено Дэвидом Линчем, MD
Ссылки
- 1.
- Yáñez A, Coetzee SG, Olsson A, Muench DE, Berman BP, Hazelett DJ, Salomonis N, Grimes HL, Goodridge HS. Предшественники гранулоцитов-моноцитов и предшественники моноцит-дендритных клеток независимо продуцируют функционально отличные моноциты. Иммунитет. 2017 21 ноября; 47 (5): 890-902.e4. [Бесплатная статья PMC: PMC5726802] [PubMed: 29166589]
- 2.
- Prinyakupt J, Pluempitiwiriyawej C. Сегментация лейкоцитов и сравнение морфологии клеток с помощью линейных и простых байесовских классификаторов.Биомед Рус Онлайн. 2015 30 июня; 14:63. [Бесплатная статья PMC: PMC4485641] [PubMed: 26123131]
- 3.
- Патель А.А., Чжан Й., Фуллертон Дж. Н., Болен Л., Ронгво А., Майни А. А., Бигли В., Флавелл Р. А., Гилрой, Аскит Б., Д. Д. Макаллан. , Йона С. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и системном воспалении. J Exp Med. 2017 г. 03 июля; 214 (7): 1913-1923. [Бесплатная статья PMC: PMC5502436] [PubMed: 28606987]
- 4.
- Саид Л., Патнаик М. М., Бегна К. Х., Аль-Кали А., Литцов М. Р., Хансон Калифорния, Кеттерлинг Р. П., Поррата Л. Ф., Парданани А., Гангат Н., Теффери А.Прогностическая значимость лимфоцитопении, моноцитопении и соотношения лимфоцитов и моноцитов при первичных миелодиспластических синдромах: опыт единого центра у 889 пациентов. Рак крови J. 31 марта 2017 г .; 7 (3): e550. [Бесплатная статья PMC: PMC5380913] [PubMed: 28362440]
- 5.
- Itzykson R, Fenaux P, Bowen D, Cross NCP, Cortes J, De Witte T., Germing U, Onida F, Padron E, Platzbecker U, Santini V, Sanz GF, Solary E, Van de Loosdrecht A, Malcovati L. Диагностика и лечение хронических миеломоноцитарных лейкозов у взрослых: рекомендации Европейской гематологической ассоциации и European LeukemiaNet.Полусфера. 2018 декабрь; 2 (6): e150. [Бесплатная статья PMC: PMC6745959] [PubMed: 31723789]
- 6.
- Hamers AAJ, Dinh HQ, Thomas GD, Marcovecchio P, Blatchley A, Nakao CS, Kim C, McSkimming C, Taylor AM, Nguyen AT, McNamara CA , Хедрик СС. Гетерогенность моноцитов человека, выявленная методом многомерной масс-цитометрии. Артериосклер Thromb Vasc Biol. 2019 Янв; 39 (1): 25-36. [Бесплатная статья PMC: PMC6697379] [PubMed: 30580568]
- 7.
- Цыганов Э., Мастио Дж., Чен Э, Габрилович Д.И.Пластичность клеток-супрессоров миелоидного происхождения при раке. Curr Opin Immunol. 2018 Апрель; 51: 76-82. [Бесплатная статья PMC: PMC5943174] [PubMed: 29547768]
- 8.
- Скиннер Б.М., Джонсон Э. Ядерные морфологии: их разнообразие и функциональная значимость. Хромосома. 2017 Март; 126 (2): 195-212. [Бесплатная статья PMC: PMC5371643] [PubMed: 27631793]
- 9.
- Auffray C, Sieweke MH, Geissmann F. Моноциты крови: развитие, гетерогенность и взаимосвязь с дендритными клетками. Анну Рев Иммунол.2009; 27: 669-92. [PubMed: 19132917]
- 10.
- Santoni G, Cardinali C, Morelli MB, Santoni M, Nabissi M, Amantini C. Распознавание молекулярных паттернов, связанных с опасностями и патогенами, рецепторами распознавания образов и ионными каналами переходного рецептора потенциальная семья запускает активацию инфламмасом в иммунных клетках и сенсорных нейронах. J Нейровоспаление. 2015 3 февраля; 12:21. [Бесплатная статья PMC: PMC4322456] [PubMed: 25644504]
- 11.
- Issekutz AC, Issekutz TB.Количественное определение и кинетика миграции моноцитов крови к острым воспалительным реакциям, а также IL-1 альфа, фактор некроза опухоли альфа и IFN-гамма. J Immunol. 1993 15 августа; 151 (4): 2105-15. [PubMed: 8345197]
- 12.
- Maslin CL, Kedzierska K, Webster NL, Muller WA, Crowe SM. Трансэндотелиальная миграция моноцитов: основные молекулярные механизмы и последствия инфекции ВИЧ-1. Curr HIV Res. 2005 Октябрь; 3 (4): 303-17. [PubMed: 16250878]
- 13.
- Хендерсон Р. Б., Хоббс Дж. А., Мэтис М., Хогг Н.Быстрое рекрутирование воспалительных моноцитов не зависит от миграции нейтрофилов. Кровь. 01 июля 2003 г .; 102 (1): 328-35. [PubMed: 12623845]
- 14.
- Бойетт Л. Б., Маседо К., Хади К., Элинофф Б. Д., Уолтерс Д. Т., Рамасвами Б., Чаласани Г., Табоас Д. М., Лаккис Ф. Г., Метес Д. М.. Фенотип, функция и потенциал дифференцировки субпопуляций моноцитов человека. PLoS One. 2017; 12 (4): e0176460. [Бесплатная статья PMC: PMC5406034] [PubMed: 28445506]
- 15.
- Jakubzick CV, Randolph GJ, Henson PM.Дифференцировка моноцитов и антигенпрезентирующие функции. Nat Rev Immunol. 2017 июн; 17 (6): 349-362. [PubMed: 28436425]
- 16.
- Варол С., Йона С., Юнг С. Происхождение и зависящие от тканевого контекста судьбы моноцитов крови. Immunol Cell Biol. 2009 Янв; 87 (1): 30-8. [PubMed: 1 16]
- 17,
- Schultze JL. Ремоделирование хроматина при активации моноцитов и макрофагов. Adv Protein Chem Struct Biol. 2017; 106: 1-15. [PubMed: 28057208]
- 18.
- Ян Дж., Чжан Л., Ю Ц., Ян Х. Ф., Ван Х.Дифференциация моноцитов и макрофагов: воспалительные моноциты кровообращения как биомаркеры воспалительных заболеваний. Biomark Res. 2014 7 января; 2 (1): 1. [Бесплатная статья PMC: PMC3892095] [PubMed: 24398220]
- 19.
- Маримуту Р., Фрэнсис Х., Дервиш С., Ли SCH, Медбери Х., Уильямс Х. Характеристика субпопуляций человеческих моноцитов с помощью анализа цитометрии всего кровотока. J Vis Exp. 17 октября 2018 г .; (140) [Бесплатная статья PMC: PMC6235554] [PubMed: 30394370]
- 20.
- Stansfield BK, Ingram DA.Клиническое значение неоднородности моноцитов. Clin Transl Med. 2015; 4: 5. [Бесплатная статья PMC: PMC4384980] [PubMed: 25852821]
- 21.
- Пум Ф, Афонюшкин Т., Реш Ю., Обермайер Г., Роде М., Пенц Т., Шустер М., Вагнер Г., Рендейро А.Ф., Мелки И., Каун С. , Войта Дж., Бок С., Джилма Б., Макман Н., Бойлард Е., Биндер С.Дж. Митохондрии представляют собой субпопуляцию внеклеточных везикул, высвобождаемых активированными моноцитами, и индуцируют ответы IFN и TNF типа I в эндотелиальных клетках. Circ Res. 2019 21 июня; 125 (1): 43-52.[PubMed: 31219742]
- 22.
- Olingy CE, Dinh HQ, Hedrick CC. Гетерогенность и функции моноцитов при раке. J Leukoc Biol. 2019 август; 106 (2): 309-322. [Бесплатная статья PMC: PMC6658332] [PubMed: 30776148]
- 23.
- Roberts CA, Дикинсон AK, Taams LS. Взаимодействие между моноцитами / макрофагами и субпопуляциями CD4 (+) Т-клеток при ревматоидном артрите. Фронт Иммунол. 2015; 6: 571. [Бесплатная статья PMC: PMC4652039] [PubMed: 26635790]
- 24.
- Burbano C, Villar-Vesga J, Orejuela J, Muñoz C, Vanegas A, Vásquez G, Rojas M, Castaño D.Возможное участие микрочастиц, полученных из тромбоцитов, и микрочастиц, образующих иммунные комплексы, во время активации моноцитов у пациентов с системной красной волчанкой. Фронт Иммунол. 2018; 9: 322. [Бесплатная статья PMC: PMC5837989] [PubMed: 29545790]
- 25.
- Fraser SD, Sadofsky LR, Kaye PM, Hart SP. Сниженная экспрессия моноцитов CD200R связана с повышенной продукцией провоспалительных цитокинов при саркоидозе. Научный доклад, 8 декабря 2016 г .; 6: 38689. [Бесплатная статья PMC: PMC5144133] [PubMed: 27929051]
- 26.
- Delcroix M, Heydari K, Dodge R, Riley LW. Проточно-цитометрический анализ субпопуляций человеческих моноцитов, пораженных Mycobacterium bovis BCG, до образования гранулемы. Pathog Dis. 1 ноября 2018 г .; 76 (8) [Бесплатная статья PMC: PMC6276273] [PubMed: 30445573]
- 27.
- Кеннеди Дж. Дж., Стейн М., Слобедман Б., Абендрот А. Инфекция и функциональная модуляция человеческих моноцитов и макрофагов ветряной оспой. Опоясывающий лишай. J Virol. 1 февраля 2019 г .; 93 (3) [Бесплатная статья PMC: PMC6340020] [PubMed: 30404793]
- 28.
- Nahrendorf M, Pittet MJ, Swirski FK. Моноциты: главные действующие лица воспаления инфаркта и восстановления после инфаркта миокарда. Тираж. 8 июня 2010 г .; 121 (22): 2437-45. [Бесплатная статья PMC: PMC2892474] [PubMed: 20530020]
- 29.
- Датта П., Нахрендорф М. Моноциты при инфаркте миокарда. Артериосклер Thromb Vasc Biol. 2015 Май; 35 (5): 1066-70. [Бесплатная статья PMC: PMC4409536] [PubMed: 25792449]
Незрелость в сочетании с функциональным нарушением
Хорошо известно, что система врожденного иммунитета, включающая вклад моноцитов и макрофагов, может нарушаться у плодов и недоношенных новорожденных.Моноциты способны дифференцироваться в дендритные клетки (ДК) или в макрофаги слизистой оболочки во время определенных инфекций и вырабатывать медиаторы воспаления, такие как TNF- α (фактор некроза опухоли альфа), оксид азота и активные формы кислорода. Плоды, а также новорожденные подвержены инфекциям в результате дефектного механизма в вышеупомянутой мононуклеарной системе. Функция моноцитов у плодов и недоношенных новорожденных зависит от фагоцитарной и окислительной способности макрофагов и их способности к антиген-адгезии.Функциональные, а не анатомические нарушения, вероятно, являются основной причиной, в то время как нарушение выработки цитокинов, таких как TNF- α , IL-6 (интерлейкин 6), IL-1 β (интерлейкин 1 бета) и G-CSF. (Гранулоцитарный колониестимулирующий фактор). Недостаточная продукция вышеупомянутых медиаторов воспаления и феномен непереносимости эндотоксина, который возникает при попадании любого антигена в недоношенный новорожденный, подвергают недоношенных новорожденных более высокому риску инфекций.Здесь представлены существующие данные исследований, которые, однако, недостаточны и фрагментарны, что объясняет тот факт, что точная патофизиология этих нарушений еще полностью не выяснена.
1. Введение
Моноциты и макрофаги, относящиеся к лейкоцитам, играют ключевую роль в системе врожденного иммунитета [1–3]. Их происхождение лежит в общем миелоидном предшественнике, в то время как они оба играют важную роль в врожденном иммунитете. Макрофаги, которые образуются из моноцитов после воздействия на них определенных раздражителей, циркулируют в кровотоке; они недолговечны, так как подвергаются спонтанному апоптозу [4, 5].Однако в ответ на дифференцирующие факторы некоторые моноциты мигрируют и заселяют ткани, тем самым избегая своей апоптотической судьбы и становясь макрофагами, которые имеют более длительную продолжительность жизни и обнаруживаются почти в каждом органе тела. Обладая фагоцитарными клетками в лимфоидной и нелимфоидной ткани, они обладают способностью распознавать широкий спектр патогенов и являются эффективными фагоцитами, а также индуцируют продукцию воспалительных цитокинов [6–8].
Моноциты обладают потенциалом дифференцироваться в дендритные клетки (ДК) или тканевые макрофаги, хотя многие ДК и тканевые макрофаги не происходят из моноцитов в стабильном состоянии [4].При определенных обстоятельствах моноциты действительно дифференцируются в ДК во время инфекции, которые продуцируют медиаторы воспаления, такие как TNF- α , оксид азота (NO –) и активные формы кислорода, как при инфекции Listeria monocytogenes [7, 9]. Тем не менее, в других условиях моноциты дифференцируются в макрофаги слизистой оболочки с другим поверхностным фенотипом и способностью продуцировать медиаторы воспаления, как это происходит при инфекции Toxoplasma gondii [10].Моноциты и их предшественники могут активировать или подавлять иммунный ответ, в зависимости от местных и системных сигналов и патогена [4].
Моноциты рано приобретают способность к дифференцировке и продукции медиаторов воспаления [7, 11]. Тем не менее, есть свидетельства незрелости врожденной иммунной системы у плодов человека, включая ее фундаментальный компонент — систему мононуклеарных фагоцитов. Считается, что эта незрелость имеет функциональное происхождение, поскольку у плода присутствуют различные типы клеток, участвующие в врожденном иммунитете, хотя их «достоинства» иммунитета находятся под вопросом [12].Новорожденные предрасположены к тяжелым бактериальным инфекциям, и смертность от инфекций высока, несмотря на своевременную антибактериальную терапию: это явление особенно распространено среди недоношенных новорожденных [13]. Поскольку производство фагоцитов и их правильное функционирование имеют решающее значение для эффективного бактерицидного иммунного механизма, дефектное функционирование мононуклеарной системы может объяснить уязвимость новорожденных к инфекциям [14].
2. Функция моноцитов у плода и недоношенных новорожденных
Имеется немного исследований иммунной системы плода и новорожденного, а знания о фагоцитарной и окислительной способности макрофагов или экспрессии их молекул адгезии скудны [15–19].Тем не менее было установлено, что различные функции врожденной иммунной системы плода существенно отличаются от функций, наблюдаемых у доношенных новорожденных или взрослых [11, 20]. Описано значительное снижение фагоцитарной активности моноцитов плода, что резко контрастирует с повышенным образованием продуктов реактивного кислорода. Более того, значительное количество фетальных моноцитов способны продуцировать провоспалительные цитокины в ответ на воспалительную стимуляцию [11]. Однако была отмечена разница в характере продукции цитокинов по сравнению с таковой у более зрелых особей; другими словами, наблюдалось заметное уменьшение количества IL-6 и моноцитов, положительных по фактору некроза опухоли.В отличие от ответов доношенных детей, ответы на TNF-, α и IL-6 у недоношенных детей (с гестационным возрастом (GA) <30 недель) были серьезно нарушены из-за уменьшения доли цитокин-продуцирующих моноцитов. Аналогичным образом, ответы недоношенных моноцитов на цельную пуповинную кровь, стимулированную живыми стрептококками группы B (GBS), были почти всегда менее устойчивыми, чем у доношенных новорожденных [12].
Было обнаружено, что у новорожденных экспрессия нескольких молекул адгезии, участвующих в миграции моноцитов, значительно нарушена, что приводит к снижению иммунного ответа новорожденных.Более того, качественные нарушения функции фагоцитов были продемонстрированы у недоношенных новорожденных [21]. Тот факт, что новорожденные, особенно родившиеся преждевременно, вырабатывают сравнительно низкие количества G-CSF после воспалительной стимуляции, предполагает, что это может частично объяснять их недостаточную регуляцию как продукции нейтрофилов, так и их функции во время инфекции [22].
Что касается влияния недоношенности на фагоцитоз моноцитов, то данные очень ограничены. Тем не менее, исследования недоношенных нейтрофилов и альвеолярных макрофагов недоношенных кроликов документально подтвердили снижение поглощения бактериями [23, 24], в то время как другие бактериальные стимулы показали, что моноциты недоношенных новорожденных обладают присущей гестационным возрастом недостаточностью способности распознавать и реагировать. в ГБС [12, 25].Между тем, хорошо известно, что у недоношенных новорожденных наблюдается снижение секреции TNF- α , бактерицидная функция и экспрессия рецепторов адгезии в моноцитах [7, 11, 12] (Рисунок 1).
Пониженная функция моноцитов, возможно, может объяснить эквивалентность содержания ДНК между недоношенными и доношенными моноцитами, что продемонстрировано с помощью анализа ДНК [12, 21]. Помимо содержания ДНК, эквивалентность была также показана между секрецией цитокинов IL-1 β и IL-6 прикрепленными моноцитами как у недоношенных, так и у доношенных новорожденных.То же явление наблюдается в отношении продукции и дегрануляции супероксид-аниона (), которые эквивалентны или повышены в свежевыделенных моноцитах недоношенных новорожденных по сравнению с доношенными новорожденными. Приведенные выше наблюдения убедительно указывают на присутствие и полную функциональность основных клеточных компонентов бактерицидного ответа в моноцитах недоношенных новорожденных [21]. Более того, помещенные в культуру моноциты показывают, что процессы присоединения и дифференцировки вызывают изменения в синтезе белка и клеточном метаболизме, посредством которых модификации, в свою очередь, модулируют бактерицидную активность.Таким образом, сниженная продукция и дегрануляция, наблюдаемые в преждевременно прикрепившихся моноцитах, по-видимому, связаны с регуляторными процессами, а не с дефектными или отсутствующими компонентами бактерицидного ответа [21]. С другой стороны, можно также предположить, что небольшие модификации имеют место в способности моноцитов недоношенных новорожденных к прилипанию, что может оказывать влияние на сигнальные пути, регулирующие секрецию TNF- α . В этой связи следует отметить, что продукция IL-1 β и IL-6 не изменялась в недоношенных клетках, что предполагает функционирование регуляторных регуляторов, отличных от таковых TNF- α [12].
3. Дефицит моноцитов у недоношенных новорожденных: функциональный, структурный или и то, и другое?
Были поставлены два основных вопроса исследования: это проблема анатомии, то есть есть ли структурный дефект в моноцитах недоношенных, или это связано с функциональным нарушением? Немногочисленные доступные наблюдения за недоношенными детьми имеют тенденцию указывать на второе объяснение, не предоставляя четкого объяснения. Результаты, касающиеся целостности фагоцитарного механизма моноцитов, указывают на наличие и общую функциональность основных клеточных компонентов бактерицидной активности в моноцитах недоношенных новорожденных.Уменьшение количества клеток, если оно присутствует, вероятно, может объяснить снижение функции моноцитов. Следовательно, анатомическое нарушение может быть исключено, а функциональное нарушение, по крайней мере, внутреннее, находится под вопросом. Когда исследуется секреция IL-1 β , ответ IL-1 β на липополисахарид (LPS) остается неизменным в моноцитах новорожденного человека, в то время как повышенная нестимулированная активность этих моноцитов после неонатальных осложнений также была зарегистрирована [18 ].
Предполагая, что дефицит моноцитов у недоношенных новорожденных может быть анатомической проблемой врожденной иммунной системы, это могло произойти в результате аллельных мутаций в одном локусе гена Toll-подобного рецептора 4 (TLR4), поскольку это единственный путь, обслуживающий LPS.В этом отношении примечательно, что эти мутации гена TLR4 ответственны за устойчивость к эндотоксинам. Способность хозяина реагировать на антигены изменяется по мере изменения последовательности гена, что означает, что различия в ответе ЛПС у людей связаны с общими мутациями в конкретном гене, этот эффект также подтверждается генетическими данными [26, 27]. . Более того, в некоторых популяциях недоношенных новорожденных высокого риска генотипы TLR4 могут влиять на тяжесть БЛД (бипариетальный диаметр плода) [28].
В отношении IL-6 данные несколько противоречивы, поскольку эквивалентное соответствие между секрецией цитокинов IL-1 β и IL-6 прикрепленными моноцитами у недоношенных, с одной стороны, и доношенных новорожденных, с другой стороны, определено [17]. Тем не менее, индуцированные уровни IL-6 были значительно ниже у недоношенных новорожденных, особенно у рожденных до 30 недель беременности. Ни низкие уровни сывороточного иммуноглобулина G, сопровождающиеся низкими уровнями комплемента в сыворотке у недоношенных новорожденных, ни немного сниженное количество моноцитов не могут служить достаточным объяснением, поскольку уровень IL-6, индуцированный LPS (стимуляция LPS, по-видимому, не требует процесса опсонизации), оставался ниже. когда новорожденные были менее 30 недель гестационного возраста [12].Однако различия в количестве моноцитов сами по себе недостаточно велики, чтобы объяснить заметные различия в уровнях IL-6, продуцируемых недоношенными и доношенными новорожденными. Таким образом, можно предположить, что у недоношенных новорожденных изначально нарушены функции моноцитов [12]. Синтез IL-6 и G-CSF среди других цитокинов у недоношенных и доношенных новорожденных в модели опсонизации эндотоксина ex vivo культуры пуповинной крови, по-видимому, связан с незрелостью [29].
Подавленная продукция IL-6, наряду со сниженной выработкой перекиси водорода, считается типичной для так называемой непереносимости эндотоксина [30].Клетки новорожденных способны адекватно реагировать на презентацию антигена, прямую микробицидную активность и окислительный взрыв. В этом контексте могут быть допустимы обычно смертельные дозы эндотоксина, если организм ранее подвергался воздействию сублетальных доз эндотоксина. В клинических условиях такое состояние иммунной толерантности делает организм уязвимым для внутрибольничных инфекций: проявление вялотекущих и стойких хориоамнионитов у новорожденных, скорее всего, является проявлением этого состояния высокого риска [13, 31].
Опубликованные на сегодняшний день исследования имеют некоторые ограничения, отчасти из-за присущих им трудностей изучения важной части иммунной системы отдельно от всей системы. В этом контексте использование изолированных мононуклеарных клеток часто приводит к неспецифической стимуляции этих клеток для выработки различных цитокинов. С другой стороны, стало очевидно, что идеальная платформа для оценки клеточного ответа на стимулирующие агенты in vitro может быть предоставлена с помощью культур с использованием цельной крови или плаценты и миометрия человека и изучения их взаимодействия с иммунной системой во время родов [32]. .Трудности в изучении врожденной иммунной системы новорожденных человека также связаны с тем фактом, что высвобождение цитокинов и медиаторов воспаления может происходить и в других непатологических ситуациях, таких как беременность и роды, а не только при инфекциях [32]. В целом, вышеуказанные результаты, полученные на людях, убедительно указывают на то, что то же самое может происходить и у недоношенных новорожденных, и для изучения этой гипотезы требуются дальнейшие исследования.
Однако исследования in vitro могут неадекватно описывать процессы in vivo, поскольку в реальных условиях моноциты in vivo действуют как часть всей иммунной системы.Более того, действительно происходят многоуровневые взаимодействия с другими компонентами иммунной системы, и исследования in vitro можно рассматривать как чрезмерное упрощение.
4. Выводы
В заключение, хотя точно установлено, что моноциты играют центральную роль в врожденном иммунитете и признана их дефектная функция у недоношенных новорожденных, пока существует скудная информация о патофизиологических механизмах, которые объясняют это функциональное нарушение. . Наибольшая степень поражения чаще всего встречается у новорожденных, родившихся на сроке примерно 30 недель гестации.Этот дефектный ответ на патогены наряду с непереносимостью эндотоксина может подвергнуть новорожденных риску внутрибольничной инфекции. Дальнейшие исследования должны быть сосредоточены на производстве определенных молекул, таких как цитокины и другие медиаторы воспаления, а также на их взаимодействии с другими компонентами иммунной системы. Путем точной идентификации механизма недостаточного ответа иммунной системы у недоношенных новорожденных, возможно, в будущем удастся успешно бороться с инфекцией у этих пациентов, достигнув быстрой активации врожденных иммунных механизмов, а также, если это возможно, ускорения созревания моноцитов.
Что такое моноциты? — Определение, функции и анализ крови — Видео и стенограмма урока
Функции моноцитов
Моноциты выполняют несколько функций, чтобы помочь вам предотвратить болезни и инфекции. Чтобы помочь вам запомнить, что они делают, обратите внимание, что каждая функция начинается с буквы «M».
Моноциты Munch
Моноциты обладают способностью превращаться в другую клеточную форму, называемую макрофагами , прежде чем столкнуться с микробами. Они действительно могут потреблять или жевать вредные бактерии, грибки и вирусы.Затем ферменты в теле моноцита убивают и расщепляют микробы на части.
Моноциты Mount
Моноциты помогают другим лейкоцитам определять тип микробов, проникших в организм. После поглощения микробов моноциты берут части этих микробов, называемые антигенами, и устанавливают их вне своего тела, как флаги. Другие белые кровяные тельца видят антигены и вырабатывают антитела, предназначенные для уничтожения этих конкретных типов микробов.
Monocytes Mend
Моноциты помогают вылечить поврежденные ткани, останавливая процесс воспаления.Они удаляют мертвые клетки из очагов инфекции, что заживляет раны. Также было показано, что они влияют на формирование некоторых органов, таких как сердце и мозг, помогая компонентам, скрепляющим ткани.
Моноциты в анализах крови
Врачи могут многое сказать о том, что происходит с человеком, по тому, был ли у него повышенный или пониженный уровень моноцитов в крови. Повышенные уровни моноцитов наблюдаются, когда люди страдают инфекциями, воспалительными заболеваниями или некоторыми видами рака.Это отражает потребность организма в большом количестве моноцитов для борьбы с микробами. Низкий уровень моноцитов обычно указывает на состояние, подавляющее ответ иммунной системы, или на неспособность организма производить достаточно моноцитов, чтобы остановить подавляющее количество микробов.
Стресс может повышать или понижать уровень моноцитов в крови. Хороший стресс, например, упражнения или положительный опыт, способствует выработке моноцитов в организме. Плохой стресс, такой как воздействие сигаретного дыма и чувство депрессии, может снизить уровень моноцитов, вырабатываемых организмом, что делает человека более восприимчивым к болезням.
Краткое содержание урока
Моноциты — самые крупные белые кровяные тельца иммунной системы. Моноциты защищают нас от бактерий, грибков и вирусов. Моноциты функционируют, превращаясь в макрофаги и поедая чужеродный материал, устанавливая части микробов снаружи самих себя, чтобы другие белые кровяные тельца могли видеть их и вырабатывать антитела, и восстанавливая поврежденные ткани, удаляя мертвые клетки из мест инфекции.
Было также показано, что моноциты влияют на формирование некоторых органов.Изучая повышенный или пониженный уровень моноцитов в анализе крови, врачи могут определить, есть ли у человека воспаление, инфекции, рак или повышенный уровень стресса.

