Чем опасны очаги глиоза в белом веществе головного мозга? | ЗДОРОВЬЕ
«Очаги в белом веществе головного мозга — это зоны поражения мозговой ткани, сопровождающиеся нарушением психических и неврологических функций. Очаговые области вызываются инфекциями, атрофией, нарушением кровоснабжения и травмами.
Фото: Из личного архива/ Вера ЛукьяноваЧаще всего зоны поражения вызываются воспалительными заболеваниями. Однако области изменений могут иметь и дистрофическую природу. Это наблюдается по мере старения человека.
Очаговые изменения белого вещества головного мозга бывают локальными, очаговыми и диффузными. Клиническая картина определяется локализацией изменений и их степенью выраженности. Набор симптомов зависит от расположения очагов и глубины поражения мозговой ткани.
Какие симптомы могут указывать на проблему?
- Хронические головные боли, неприятные ощущения в голове.
- Быстрая утомляемость и истощение психических процессов.

- «Уплощение» эмоций. Больные безучастны к окружающей действительности, теряют интерес к прежним источникам удовольствия.
- Нарушение сна.
- Нарушение контроля за собственным поведением. Поведение становится вызывающим, необычным и странным.
- Эпилептические проявления в виде малых судорожных припадков.
Глиоз белого вещества может проявиться у детей как врождённая патология. Очаги нарушают рефлекторную деятельность, нарушая зрение и слух. Дети медленно развиваются: поздно становятся на ноги и начинают говорить.
Как определить причину?
Часто локализация процесса говорит о причине поражения:
- единичный очаг в правой лобной доле говорит о хронической гипертензии или перенесённом гипертоническом кризе;
- диффузные очаги по всей коре появляются при нарушении кровоснабжения при атеросклерозе сосудов головного мозга;
- очаги демиелинизации теменных долей указывают на нарушение поступления крови через позвоночные артерии;
- массовые очаговые изменения в белом веществе больших полушарий говорят об атрофии коры, которая формируется в старости;
- гиперинтенсивные очаги в белом веществе появляются вследствие острого нарушения кровоснабжения;
- мелкие очаги глиоза наблюдаются при эпилепсии;
- в белом веществе лобных долей единичные субкортикальные очаги указывают на перенесённый инфаркт мозга и размягчение мозговой ткани.

Что делать?
Как и в случае с любым недугом, главное своевременно обнаружить начало его развития, поставить точный диагноз и назначить лечение. Основной способ найти изменения мозговой ткани — это исследование магнитно-резонансной томографии. На послойных изображениях наблюдаются пятна и точечные изменения тканей. Главное, сделать вовремя обследование и обратиться к врачу!»
Врач-невролог высшей категории санатория психосоматики «Анапа-Океан» Вера Лукьянова.
Вас ждут по адресу
- Санаторий «АНАПА-ОКЕАН». Город-курорт Анапа, улица Ленина, 3.
- Телефон: 8 800 250-27-55, факс: 8 (86133) 4-53-00, e-mail: [email protected] | anapaokean.ru
Реклама
Имеются противопоказания. Необходимо проконсультироваться со специалистом.
ОГРН 1022300519680.Лицензия № ЛО-23-01-010918 от 26.01.2017. АО Санаторий «Анапа-Океан».
Глиоз симптомы, лечение, описание
Глиоз — это не самостоятельное заболевания, а результат повреждения структур нейронов вследствие различных патологических процессов.
Глиоз мозга достаточно редкая патология, вызываемая в основном мутацией особого гена и имеющая аутосомно-рецессивный путь наследования, выражающаяся искажением жирового обмена.
Механизм развития глиоза
Механизм развития патологии заключается в замещении отмерших нейронов особыми клеточными структурами — глиями, которые в совокупности и представляют глиоз.
Если, в результате какого-либо повреждения гибнут нейроны, то их место и занимают глиальные клетки, выполняющие впоследствии функции нейронов. Глиальные клетки один из наиболее важных элементов строения тканей мозга, которые замещают погибающие импульсные клетки и являются своего рода защитниками здоровых клеток.
Структурная особенность глиоза, выражающаяся очень тонким рубцевидным телом, способствует изоляции поврежденных участков и защите соседних здоровых тканей.
Благодаря их функции даже после тяжелых повреждений жизнедеятельность мозга чаще всего сохраняется, но функциональность нервной системы нарушается тем больше, чем больше образуется глиозных клеток.
Формирование заболевание может выражаться отдельными и множественными очагами глиоза головного мозга. В зависимости от их количества определяется и степень поражения.
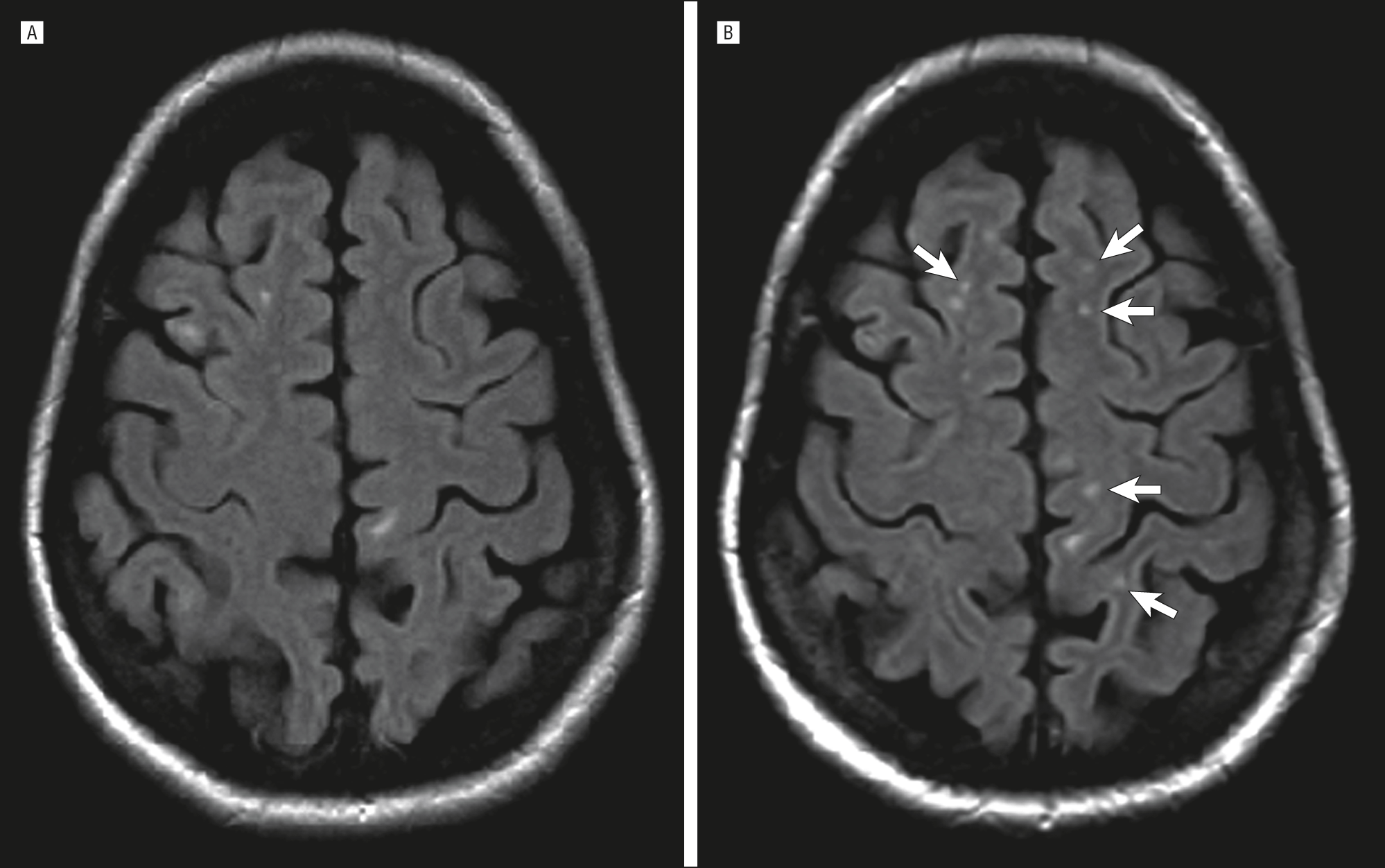
Множественные очаги глиоза головного мозга выявляются при магнитно-резонансном исследовании. При этом определяется их локализация, длительность процесса и размер. Кроме того диагностируется активность процесса и возможная причина.
По одиночным и множественным очагам глиоза головного мозга можно судить о степени поражения нервной системы.
Величина глиоза имеет определенные конкретные показатели, прямо пропорциональные объемам заживление в мозговых структурах.
Виды глиоза
Виды глиоза обусловлены местом локализации и характером разрастания глиозных клеток.
Волокнистый глиоз характерен более выраженным формированием глиальных волокон по сравнению с клеточными составляющими.
Большие участки спинного и головного мозга поражаются при диффузном глиозе.
При изоморфном глиозе глиальные волокна имеют сравнительно правильное размещение.
Характерное разрастание глиальных волокон в подоболочечных областях мозга отмечается при маргинальном виде.
Периваскулярный глиоз характерен расположением волокон вокруг воспаленных склерозированных сосудов. Периваскулярный глиоз свидетельствует о проблемах с сосудистой системой.
Субэпендимальный вид глиоза определяется при формировании волокон в области расположенной под эпендимой.
Глиоз головного мозга: причины
В норме клетки глии несут обслуживающую функцию для нейронов, и обеспечивают проводимость нервных импульсов, реализовывая метаболизм и основывая условия формирования нервных тканей.
Как уже говорилось ранее, основной причиной развития глиоза является повреждение нейронов в результате патологического процесса.
Нередко в результате ишемического инсульта возникает постишемический глиоз головного мозга. Провоцирующим фактором постишемического глиоза служит длительно текущая гипертония или резко возникший инсульт в результате какого-либо воздействия.
Периваскулярный глиоз может развиться при воспалительных или склеротических процессах в сосудах.
Причинами глиоза могут быть гипоксемия (пониженное содержание в крови кислорода), анемия, гипогликемия (снижение уровня глюкозы в крови), пониженное кровообращение, травмы, отеки мозга и пр. нарушения.
Кроме того отмечается возникновение глиоза как наследственной патологии жирового обмена. В результате чего поражается нервная система. Ярким выражением подобной патологии является болезнь Гея-Сакса, часто возникающая при репродукции потомства от брака близких родственников.
Помимо этого, выявлено, что процессы старения разрушают нейроны, и они заменяются на глии, при этом формируются губчатые структуры, влекущие такие проблемы старости как нарушение памяти, координации движений и замедление реакции.
Симптомы глиоза головного мозга
Глиоз обычно выявляется при томографии мозга во время обследования. К выраженным симптомам глиоза головного мозга относятся частые головные боли, резкие перепады артериального давления, паралич.
Симптомами глиоза головного мозга у новорожденных служат потеря сознания, нарушения зрения и слуха, судороги и неспособность глотать пищу.
У детей первые проявления кинической картины возникают примерно на 4-6 месяце жизни. В этот период болезнь прогрессирует настолько, что ребенок становиться полностью безучастным к окружающим и перестает развиваться. В данном случае наследственный механизм приводит ребенка к гибели в течение 2 лет.
Лечение глиоза
В настоящее время кардинального лечения глиоза не выработано. Рубцы от глиоза образуются на весь остаток жизни и несут угрозу состоянию важнейшего органа человека. Но определенные методики позволяют снизить степень их воздействия.
В основе всех методик находится лечение провоцирующих болезней для того, чтобы избежать развития новых очагов глиоза и соблюдение правильного образа жизни.
Для того чтобы избежать последствий глиоза головного мозга необходимо снизить калорийность пищи, за счет уменьшения потребления жирных продуктов. Пациенты должны знать о том, что жирная пища может вызвать дополнительную гибель нейронов, отвечающих за регулирование веса.
Если глиоз является результатом наследственной патологии жирового обмена, то лечение невозможно. Если при проведении анализа амниотической жидкости на 18-20 недели беременности выявляется глиоз головного мозга плода, то необходимо прерывание беременности.
Травмы головы, которые вдруг меняют характер в лучшую сторону
- Кристиан Джаррет
- BBC Future
Автор фото, iStock
Травмы головного мозга не всегда приводят к нежелательным переменам в характере пострадавшего, узнал обозреватель BBC Future. Бывает, что характер улучшается. Но должны ли мы этому радоваться?
Бывает, что характер улучшается. Но должны ли мы этому радоваться?
В популярной в 1980-х романтической комедии «За бортом» главная героиня, высокомерная и эгоистичная миллиардерша, падает за борт своей роскошной яхты и, получив травму головы, теряет память. Кроме того, в лучшую сторону меняется ее характер — она становится заботливой, внимательной и не такой меркантильной, как раньше.
На первый взгляд, такие позитивные перемены, спровоцированные травмой головного мозга, выглядят надуманными, не так ли?
Однако возьмем реальный случай. Женщине (назовем ее по этическим соображениям «пациентка 3534») в возрасте 70 лет была удалена опухоль в мозгу. При этом операцией были повреждены лобные доли ее мозга.
По словам ее мужа, который знал свою жену 58 лет, до операции она была раздражительной и ворчливой, с жестким характером. После операции «она стала более общительной, более довольной жизнью и гораздо более разговорчивой».
Пациентка 3534 — не единственная, чья личность изменилась после травмы головного мозга. Теперь у нас есть доказательства, что (по крайней мере, для небольшой части пациентов) положительные изменения в характере — это реальность.
И это своего рода откровение, которое позволяет по-новому взглянуть на то, как повреждения мозга влияют на личность.
Автор фото, iStock
Подпись к фото,Травма головного мозга может и не иметь никаких последствий. Но раньше считалось, что если таковые будут, — то всегда негативные
Хотя то, что травмы мозга могут изменить характер человека, было известно давно, научная литература почти всегда описывала исключительно плачевные для личности последствия.
Возьмите известный случай Финеаса Гейджа, американского строителя, получившего в 1848 году тяжелое ранение головного мозга при прокладке железной дороги. (Гейдж руководил бригадой взрывников. При случайном взрыве металлический лом вошел в череп Гейджа под левой глазницей и вышел чуть выше лба. Из-за ранения строитель лишился большей части лобной доли левого полушария головного мозга. — Прим. переводчика.)
Из-за ранения строитель лишился большей части лобной доли левого полушария головного мозга. — Прим. переводчика.)
Как говорили тогда друзья пострадавшего, «это больше не Гейдж». После случившегося он просто стал другим человеком: ранее умный и проницательный, Гейдж стал агрессивным и импульсивным, психика его изменилась коренным образом (впрочем, согласно некоторым свидетельствам, позднее Гейдж смог преодолеть эти проблемы, начал новую жизнь — кучером почтового дилижанса — и прожил еще 12 лет).
В современной медицинской литературе описывается множество подобных случаев — когда пациенты после повреждения лобных долей головного мозга начинали вести себя неадекватно и даже психопатически.
Однако, согласно недавнему исследованию, опубликованному в журнале Neuropsychologia, такие печальные обстоятельства, возможно, не передают полноты картины.
Группа ученых под руководством психиатра Марси Кинг из Университета Айовы обнаружила, что из 97 до того здоровых пациентов, получивших необратимое повреждение определенной части головного мозга, у 22 наблюдались позитивные перемены в характере.
У 54 человек характер испортился, а у остальных каких-либо перемен не замечено.
Ученые установили это, опросив родственников и близких друзей пострадавших по 26 разным аспектам личности — до и после травмы.
Надо признать, что и в прошлом некоторые исследования косвенно указывали на то, что повреждения некоторых участков головного мозга могут иногда иметь позитивный для личности эффект.
Например, американское исследование 2007 года, в котором изучались ветераны Вьетнамской войны, обнаружило: у тех, кто получил повреждения участков мозга, которые, как считается, отвечают за развитие посттравматического стрессового расстройства, это самое расстройство как раз развивалось с меньшей долей вероятности.
Схожее исследование обнаружило, что пациенты с повреждением участков мозга, отвечающих за эмоции, в результате были менее подвержены депрессии.
Автор фото, iStock
Подпись к фото,То, что травмы головного мозга ведут к изменениям характера, было известно ученым давно
И все-таки самое последнее исследование, о котором мы говорим, впервые задокументировало настолько широкий спектр положительных изменений в характере у большой группы пациентов.
В качестве еще одного примера приведем случай «пациента 2410», 30-летнего мужчины, которому была необходима хирургическая операция в связи с аневризмой мозга.
И он, и его жена описывали, что до операции мужчина был вспыльчив, легко выходил из себя и был подвержен депрессиям. После операции он много шутит и смеется и вообще стал более спокойным.
Что же происходит? Каким образом повреждения головного мозга имеют столь неожиданный эффект?
Вероятность того, что характер пациента изменится в лучшую сторону, никак не зависит от пола, возраста, уровня образования или интеллекта.
Что имеет значение — так это прежние личностные проблемы: трудный характер, вспыльчивость и другие негативные черты в сочетании со спецификой повреждения мозга.
Чтобы разобраться в этом, Кинг и ее коллеги произвели сканирование мозга всех своих пациентов.
Они обнаружили, что те, у кого наблюдались положительные изменения характера, с большей долей вероятности страдали от повреждения лобных долей мозга (участков, задействуемых в процессах принятия решений и понимания точки зрения других людей).
Автор фото, iStock
Подпись к фото,Травма головы может улучшить ваш характер — но это не значит, что врачи будут это прописывать особо раздражительным пациентам
Результаты эти, впрочем, очень предварительные, и авторы исследований призывают к осторожности в их толковании.
Ученые обнаружили лишь общие тенденции, и дальнейшая работа поможет более точно определить, какие именно участки мозга связаны со специфическими переменами в человеческом характере.
Кроме того, хотя перемены в личности некоторых пациентов можно расценивать как положительные, не стоит умалять опасность любого повреждения головного мозга.
Полное выздоровление после серьезных травм мозга случается крайне редко, и даже когда пациент вроде бы чувствует себя нормально, он может рано или поздно столкнуться со скрытыми проблемами — например, с трудностью усвоения новой информации.
Полученная травма головного мозга также может сделать человека более уязвимым для различных неврологических заболеваний, в том числе и очень тяжелых.
Таким образом, просто удивительно, что такая опасная вещь, как повреждение мозга, способна привести к благоприятным переменам в характере.
Однако когда вы осознаете, что операции на мозге иногда применяются в качестве крайнего средства для лечения таких психических расстройств, как синдром навязчивых состояний, то все это уже не выглядит слишком нелепым или странным.
Тут можно, конечно, вспомнить о ныне запрещенной в большинстве стран так называемой психохирургии, крайне неоднозначном методе лечения. Многие из нас знают о ее частном случае — лоботомии с массивным разрушением тканей, широко применявшейся в середине XX века в США.
Впрочем, Кинг и ее коллеги подчеркивают, что современные технологии позволяют хирургам действовать гораздо более осторожно и точно, и часто цель таких вмешательств — снизить активность тех мозговых токов, которые вызывают определенные психические проблемы (например, есть свидетельства того, что депрессия связана со слишком активным обменом между лобными участками мозга и другими нейронными сетями, ответственными за познание и эмоции).
Автор фото, iStock
Подпись к фото,Некоторых пациентов, перенесших мозговую травму, изменения в собственном характере вполне устраивают и радуют
То, что с помощью хирургического вмешательства можно откорректировать работу мозга человека, в какой-то мере объясняет, почему мозговые травмы в некоторых случаях приводят к благоприятным переменам в характере пострадавшего.
Кроме того, результаты исследований Кинг и ее коллег помогают глубже понять неврологические основы человеческого характера.
Впрочем, в заключение стоит повторить: к любой травме головного мозга (в том числе и к «легкому» сотрясению) всегда надо относиться с огромной серьезностью.
Даже в нечастых случаях позитивных перемен в характере после травмы клиническая картина почти всегда содержит и массу скрытых до поры до времени проблем для пациента.
И хотя положительные перемены в характере — штука хорошая, давайте не забывать, что наш характер отражает нашу сущность. Привыкнуть к тому, что человек изменился — даже в лучшую сторону, — будет непросто и для друзей и близких, и для самого этого человека.
В любом случае то, что случается с головным мозгом и с личностью после травмы, — гораздо сложнее и удивительнее, чем мы ранее себе представляли.
Прочитать оригинал этой статьи на английском языке можно на сайте BBC Future.
Глиоз головного мозга
Состояние, которое мы будем рассматривать в данной статье, характеризуется замещением поврежденных нейронов особыми клеточными структурами, которые и называют глиозом. Это рубцевидное тело с тонкой структурой, предотвращающее повреждение соседних тканей мозга и защищающее их. Деформированные или погибшие в результате каких-либо повреждений ЦНС клетки замещаются другими клетками, называемыми глии. Они выполняют очень важные функции в работе мозга: разграничительную, опорную, защитную, трофическую, секреторную и состоят из межклеточного вещества и разных видов клеточных элементов. Таким образом, глиоз головного мозга чем-то похож на шрамы или рубцы на ткани центральной нервной системы. Однако такие клетки не способны полностью заменить выбывшие нейроны, поэтому наблюдается неврологический дефицит.
Данный процесс изучается специалистами давно. Так, проводился ряд исследований, когда к клеткам глии добавляли специальный экстракт из крови престарелого человека. Результаты показали, что в этом случае глии начинали очень быстро размножаться. В старости происходит постоянная гибель нейронов, и вместо них образуются глиозные клетки. В результате этого процесса мозг приобретает структуру, похожую на губчатую. А из-за этого и происходят возрастные изменения: ослабевает память, ухудшается быстрота реакций, нарушается координация движений. Эксперимент показал, что нейроны гибнут из-за усиленного размножения глии. К гибели нейронов приводит постоянное употребление в больших количествах жирной пищи. Многие исследователи пришли к выводу что глиоз – это попытки гипоталамуса восстановиться.
Глиоз может быть и врожденным, но это крайне редкая форма заболевания. В определенных генах происходят мутации, которые определяют замещение глиальными клетками нейронов на пятый месяц жизни новорожденного. Дети с таким диагнозом живут не долго и редко когда доживают до трехлетнего возраста.
ЦНС формируется из клеток такого типа:
- нейроны, формирующие и передающие импульсы;
- эпендимы, выстилающие канал спинного мозга и желудочки головного;
- нейроглии, выступающие вспомогательной тканью, объем которых достигает 50% от всей ЦНС.
При разрастании глиальных клеток формируются глиозные очаги головного мозга. При этом величину глиоза рассчитывают как отношение клеток глии к другим клеткам ЦНС на ед. объема. То есть, данный показатель характеризует величину, пропорциональную количеству заживлений в организме.
Виды глиоза
Классифицируют данное заболевание в зависимости от характера разрастания клеток и локализации. Выделяют следующие типы:
- анизоморфный, когда волокна разрастаются в хаотичном порядке;
- волокнистый, при более выраженном формировании глиальных волокон, нежели клеточных элементов;
- диффузный, при большом охвате как спинного, так и головного мозга;
- маргинальный, при разрастании глиальных волокон в основном в подоболочечных мозговых участках;
- изоморфный, при относительно правильном расположении разрастающихся волокон;
- периваскулярный, при расположении волокон вокруг воспаленных сосудов, имеющих склеротические бляшки;
- субэпэндимальный, при расположении волокон в мозговых участках, расположенных под эпендимой.
Очаги глиоза в белом веществе головного мозга – это процесс патологического разрастания клеток глии, замещающие поврежденные нейроны. Этот процесс – обычный спутник пожилого возраста. Однако, он может происходить и в молодом возрасте по какой-либо причине. Это может быть рассеянный склероз, туберозный склероз, родовые травмы, разного рода энцефалиты, гипоксии, гипертония, гипертензивная энцефалопатия в хронической форме, эпилепсия.
Диагностика
Основной метод, применяющийся для того, чтобы выявить очаги глиоза в головном мозге – это магнитно-резонансная томография. С его помощью можно определить местоположение патологических очагов, и даже понять, как давно образовалась эта болезнь. Это необходимо для того, чтобы врач смог точно определить, что послужило причиной образования патологии. Но для этого часто требуются дополнительные исследования. Также используется компьютерная томография мозга, однако на ней не так четко видны мелкие очаги, и имеет место рентгеновское излучение, которое отсутствует при МРТ. Нередки случаи, когда глиоз выявляют в результате поиска другой патологии, так как данное заболевание не проявляется клинически. Всегда после того, как выявляют глиоз головного мозга, лечение требуется для заболевания, его вызвавшего.
Основные симптомы
Итак, мы изучили глиозные изменения головного мозга, что это такое, какие есть виды и как диагностировать эту патологию. Теперь более подробно остановимся на симптомах и лечении. Если данная патология не была вызвана серьезной неврологией, то симптомы могут отсутствовать вовсе, а очаг определяется при исследовании мозга методом МРТ или КТ. В противном случае глиоз имеет клиническую картину заболевания, его вызвавшего.
Если процесс хорошо выражен, но активное заболевание отсутствует, возможны такие симптомы: головокружение, скачки артериального давления, боли в голове, усталость, ухудшение памяти, координации, мнестические нарушения, судороги, очаговая неврология.
Лечение
Что делать, если на МРТ головного мозга выявили очаги глиоза? Так как данная патология – не самостоятельное заболевание, а следствие какой-то определенной болезни, необходимо направить усилия на излечение этой самой причины. Методов лечения самого глиоза, которые были бы хоть немного эффективны, на данный момент не существует. Можно лишь принять меры, чтобы процесс не пошел дальше и не стал разрастаться.
В чем заключаются профилактические мероприятия? Первым делом – исключите жирную пищу из своего рациона. Именно употребление жирной пищи в больших количествах негативно влияет на работу мозга. Жиры, которые с пищей поступают в организм, нарушают работу нейронов и в итоге ведут к их гибели. Уже через 7 месяцев неправильного питания заметно уменьшение количества нейронов и увеличение глиозных очагов. В профилактических целях специалисты рекомендуют посещать врачей, вести активный образ жизни. Это поможет пусть не полностью вылечить заболевание, но возможно предотвратить или приостановить, если оно было выявлено.
При хроническом протекании заболеваний мозга рекомендуют лекарства для улучшения кровообращения в мозге, антиоксиданты, ноотропы и препараты, которые повышают устойчивость мозга к недостатку кислорода. Также при любой форме глиозного поражения специалисты рекомендуют принимать курс витаминов В группы.
К чему может привести болезнь
Кистозно глиозные изменения головного мозга, последствия которых могут привести к нарушениям мозга и других систем организма, являют собой повреждения ЦНС, а их причиной являются патологические процессы. Последствиями могут быть изменения давления, энцефалиты мозга, гипертония и гипертонические кризы, рассеянный склероз, патологии кровообращения в органах и тканях. Любое нарушение ЦНС не остается незамеченным и приводит к ощутимым проблемам во всех системах организма и отдельных органах.
Засел в голове: новый коронавирус может вызвать опухоль мозга | Статьи
Новый коронавирус, согласно предположению зарубежных ученых, способен вызвать опухоль мозга и ускорить развитие уже имеющейся. Он проникает в мозг, где связывается с клетками нервной ткани, участвующими в развитии онкологического заболевания. Российские ученые считают, что SARS-Cov-2 действительно может влиять на процесс появления опухоли мозга. Однако отдаленные последствия COVID-19 только предстоит оценить. Многие другие вирусы проявляют свои онкогенные свойства порой спустя десятилетия после проникновения в организм человека.
Ключ к мозгуТурецкие ученые из Университета имени Безмалема Вакифа выдвинули гипотезу, что часть молекулы SARS-Cov-2 (S-белок) связывается с глиальными и нейроглиальными клетками нервной ткани. Эти клетки окружают нейроны, обеспечивая условия для генерации и передачи нервных импульсов.
«Роль COVID-19 в опухолеобразовании изучена слабо, а о его роли в патофизиологии глиомы не сообщалось. Известно, что глиальные и нейрональные клетки экспрессируют АПФ2 на своей поверхности, что делает их потенциальной мишенью для инфекции COVID-19», — сообщили авторы работы.
Фото: REUTERS/Luisa Gonzalez
Эта гипотеза возникла в связи с возможностью коронавируса взаимодействовать с клетками мозга. На поверхности SARS-Cov-2 есть спайковый или отростчатый белок (S), похожий на шип. Именно эти шипы образуют так называемую корону, которую видят исследователи при рассмотрении патогена под электронным микроскопом. S-белок позволяет коронавирусу присоединиться к рецептору клетки-хозяина в момент проникновения в клетку. Данный шип часто называют ключом, который вставляется в замок, расположенный на поверхности клетки, где замок — фермент под названием АПФ2. Этот фермент присутствует в большинстве тканей организма, в том числе в нейронах головного мозга, а также во вспомогательных клетках особой ткани, составляющих около 40% объема центральной нервной системы.
«Поэтому мы предполагаем, что COVID-19 может индуцировать онкогенез глиомы через белок S. Это может увеличить риск развития глиомы у людей, инфицированных COVID-19, и может усилить рост опухоли у пациентов, инфицированных COVID-19», — заявили ученые.
Эту возможность ученые доказали с помощью компьютерного моделирования.
Давно известно, что различные вирусы способствуют появлению злокачественных опухолей. В пример можно привести вирусы папиломы человека, вызывающие рак шейки матки, некоторые герпес-вирусы, вирус Эпштейна-Барр, вирусы гепатита В и С, онкогенные ретровирусы. Причем последствия контактирования вируса и организма порой наблюдаются спустя годы и даже десятилетия после инфицирования.
Фото: ИЗВЕСТИЯ/Сергей Коньков
— Отдаленные последствия новой коронавирусной инфекции нам еще предстоит узнать, — сообщила директор Института персонализированной медицины Сеченовского университета (вуз — участник проекта повышения конкурентоспособности образования «5-100») Марина Секачева. — И очень хорошо, что уже сегодня коллеги занимаются прогнозированием, в том числе относительно развития глиомы. Это позволит заранее сосредоточиться на изучении возможных проблем и осложнений, особенно когда речь идет об онкологических заболеваниях. Теоретически вирус может опосредованно или напрямую участвовать в механизмах развития опухоли.
Пока предположениеОднако эксперты считают, что пока рано говорить о доказанном влиянии вируса SARS-Cov-2 на развитие опухоли мозга.
— Любой онкогенный вирус, проникая в клетку, изменяет ее, что в ряде случаев приводит к ее злокачественному перерождению, — отметила заведующая лабораторией вирусного канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России Ксения Смирнова. — Но необходимо отметить, что это довольно длительный процесс, который обязательно требует влияния дополнительных факторов внешней и внутренней среды. Периодически появляются экспериментальные доказательства этиологической роли ряда нейротропных вирусов (например, вируса Эпштейна-Барр) в развитии глиом, но все эти данные касаются ДНК-содержащих вирусов (SARS-Cov-2 представляет собой РНК-вирус. — «Известия»).
ДНК-технологии в отделении молекулярно-биологических исследований
Фото: РИА Новости/Игорь Онучин
Исполняющий обязанности директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого Андрей Васин отнесся к теории турецких ученых скептически. По его мнению, описанный в статье механизм является крайне маловероятным.
— Предположение авторов работы подкреплено только результатами компьютерного моделирования связывания S-белка с несколькими рецепторами, никаких экспериментальных данных об онкогенном потенциале коронавируса представлено не было, — заявил эксперт. — Существует целая группа онкогенных вирусов человека, вызывающих развитие различных опухолей. Однако для РНК-содержащих респираторных вирусов человека, к которым относятся SARS-CoV-2 и другие коронавирусы человека, свойство онкогенности, насколько мне известно, описано не было.
Авторы статьи сами подчеркивают, что полученные результаты требуют дальнейшего исследования. Ведь COVID-19 — новое заболевание, изученное пока крайне слабо. Поэтому сейчас любое предположение относительно последствий попадания SARS-Cov-2 в организм носит гипотетический характер. Скорее всего, многие из догадок не сбудутся, однако наличие готовой теории и готовность к различным «эффектам» COVID-19 облегчат и ускорят борьбу с влиянием этой болезни на здоровье.
Справка «Известий»Глиома — это вид опухоли мозга, которая развивается из глиальных клеток. Самая распространенная среди опухолей мозга, встречается в 60% случаев. Относится к первичным, то есть развивающимся из самой ткани головного мозга (вторичные связаны с метастатическим процессом из других органов, пораженных онкологическим заболеванием).
К глиальным опухолям головного мозга относят:
• астроцитому — доброкачественную опухоль из глиальной ткани с локализацией в полушариях мозга и мозжечке;
• олигодендроглиому — опухоль из глиальной ткани, не склонную к прорастанию в другие ткани с локализацией в полушариях головного мозга;
• эпендимому — доброкачественную опухоль, локализованную в боковых или четвертом желудочке;
• мультиформную глиобластому — данный вид опухоли диагностируют, как правило, у пациентов пожилого возраста;
• медуллобластому — опухоль, поражающую мозжечок, чаще всего ее обнаруживают у детей;
• пинеалому — новообразование, поражающее шишковидную железу.
МРТ головного мозга при головных болях
Головная боль — это проблема, которая беспокоит многих пациентов и является частой причиной обращения к врачу неврологу. Если ранее головная боль считалась исключительно возрастным недугом, то, на сегодняшний день, на головные боли все чаще жалуются подростки и молодые люди до 40 лет.
Причина головных болей может заключаться не только в изменениях непосредственного головного мозга, но и при наличие болезней позвоночника, например, грыж и протрузий. Для определения причин постоянных болей и мигрени врач невролог, как правило, назначает МРТ головного мозга. Именно МРТ головного мозга, как наиболее информативный метод диагностики болезней головы и позвоночника, может показать изменения сосудистого характера, очаговые поражения, последствия травм и не только.
В центр обратился пациент с жалобами на головные боли и сонливость. Во время консультации невролога выяснилось, что 3 дня назад пациент получил травму в результате удара о твердый предмет. После травмы не было зафиксировано потери сознания и рвотного рефлекса. На приёме врач невролог, собрал анамнез и провёл осмотр, в ходе которого не было выявлено очаговой, общемозговой или менингеальной симптоматики.
Для уточнения диагноза пациенту было рекомендовано сделать МРТ обследование головного мозга.
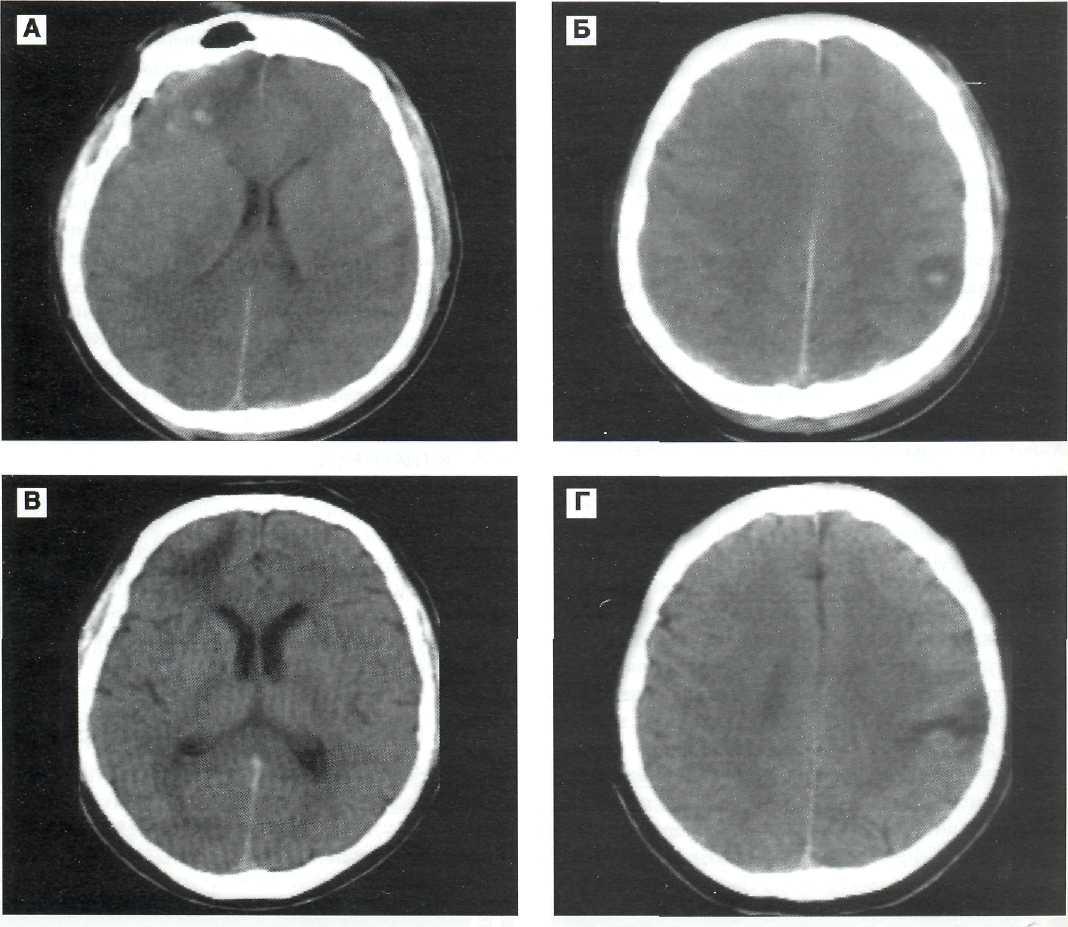
По итогам магнитно-резонансной томографии (МРТ) были выявлены следующие изменения в области структуры головного мозга:
• Боковые желудочки с умеренно выраженной зоной глиоза по периферии;
• Супраселлярная цистерна умеренно пролабирует в полость турецкого седла;
• На последовательностях T2, Flair ВИ (взвешенное изображение) в белом веществе лобных и теменных долей определяются единичные мелкие очаги имеющие гиперинтенсивный МР сигнал, без признаков перифокального отека;
•Отмечается кистозное утолщение слизистой оболочки правой (3,8х3,3 см) и левой левой (2,9х2,4 см) верхнечелюстных пазух субтотально выполняя ее.
По результатам проведенного МРТ обследования врач-рентгенолог в заключении указал следующие рекомендации: необходимость пройти исследование МРТ сосудов головного мозга, а также УЗДГ.
Более того врач-рентгенолог рекомендовал сделать МРТ краниовертебрального перехода и шейного отдела для исключения изменений позвоночника, что также может являться причинами частых головных болей.
Современные методы диагностики и лечения аффективных расстройств (тревожного, депрессивного) с точки зрения нейрохимических нарушений.
Депрессия, как вид психического расстройства, в современном мире является чрезвычайно актуальной проблемой.
Депрессивными расстройствами по оценкам Всемирной Организации Здравоохранения, во всем мире страдает более 264 миллионов человек из всех возрастных групп.
Ежегодно около 800 000 человек погибают в результате самоубийства — второй по значимости причины смерти среди людей в возрасте 15-29 лет.
Депрессия является причиной инвалидизации (в европейских странах) — стойкой утратой трудоспособности, с неблагоприятными социальными последствиями.
В то же время — это не только медицинская и социальная проблема, немаловажное значение имеет и влияние депрессивных расстройств на экономику. Подсчитано, что лечение депрессии дает выраженный экономический эффект в виде восстановления трудоспособности населения, позволяя получать 5 долларов за каждый вложенный доллар.
Так что же такое депрессия и чем она отличается от «плохого настроения»?
За психическую деятельность отвечает головной мозг. Вся сложность и уникальность мыслительной, эмоциональной и поведенческой деятельности заключена всего в двух процессах. В процессе возбуждения и процессе торможения клеток головного мозга. Надо отметить, что процесс торможения клеток головного мозга является активным и для его осуществления необходимы определенные затраты, использование специальных веществ, нейромедиаторов с эффектом торможения. Указанные процессы возбуждения реализуются нейромедиаторными системами. Нейромедиа́торы — биологически активные химические вещества, посредством которых осуществляется передача электрохимического импульса от нервной клетки через синаптическое пространство между нейронами, к другой нервной клетке или другим клеткам (мышечным, железистым). Выделяют основные нейромедиаторные системы: дофаминергическая система, норадренергическая система, серотонинергическая система, холинергическая система, ГАМК-ергическая система, система возбуждающих аминокислот: глутамата и аспарата, система гистамина, система глицина, система нейропептидов, система карболинов. Указанные нейромедиаторные системы осуществляют сложное взаимодействие между собой, саморегулируются и управляют работой не только головного мозга, но и всего организма. В случае сбоя, дисбаланса в нейромедиаторных системах, развиваются различные психические заболевания, в том числе и аффективного регистра (депрессивные, тревожные).
По определению ВОЗ, «Депрессия — это распространенное психическое расстройство, для которого характерны уныние,
потеря интереса или радости, чувство вины и низкая самооценка, нарушения сна или аппетита, вялость и плохая концентрация внимания.
Эти проблемы могут стать хроническими или возобновляющимися и оказывать значительное воздействие на способность человека
справляться с проблемами повседневной жизни. В самой тяжелой форме депрессия может приводить к самоубийству.
Большинство случаев депрессии можно лечить с помощью лекарственных средств и психотерапии».
С точки зрения психиатрии, в классическом, традиционном понимании, для диагностики депрессивного состояния используется понятие «депрессивная триада». Отец современной психиатрии, немецкий психиатр Эмиль Крепелин описал ее в 1899 году так:
- Гипотимия (сниженная настроение, подавленность)
- Идеаторная заторможенность (снижение психической активности)
- Моторная заторможенность (снижение двигательной активности)
Симптомы должны длиться от двух недель и более. В случае же, когда один или два симптома не выражены или проявляются другим образом, например, гневливость, вместо подавленности или двигательная расторможённость, вместо заторможенности, можно говорить об атипичных вариантах депрессии. В случае невыраженных симптомов, в ряде случаев, проведя тщательный клинический осмотр пациента и проанализировав дополнительные симптомы, можно выявить стертые, соматизированные (симулирующие другие телесные заболевания) формы депрессии. Конечно же, и стертые и соматизированные формы депрессии требуют своевременного, адекватного лечения у врача психиатра. К сожалению, такие пациенты зачастую попадают в поле зрения врачей других специальностей и не могут быть распознаны. По данным отечественных исследователей, среди больных, обратившихся за амбулаторной помощью к врачу терапевту, депрессия может быть диагностирована у 40,5 % обратившихся, том числе тяжелая у 9,5%. Зачастую такие пациенты длительно, без должного эффекта лечатся у врачей терапевтов, неврологов и врачей другиъх специальностей. Многие пациенты боятся обратиться за психиатрической помощью, ошибочно считая лечение у врача-психиатра социально неприемлемым, таким образом, теряя бесценное время и возможность получения своевременного лечения.
Что же служит причиной депрессивных, тревожных расстройств, как их диагностировать и лечить?
Депрессии и тревожные расстройства принято считать полиэтиологическими заболеваниями, то есть имеющие несколько причин. При всем многообразии причин, их можно разделить на две основные группы: биологические и социально-психологические.
Биологические причины заключаются в том, что морфологическим субстратом заболеваний являются изменения в центральной нервной системе, а именно ее патология. Нарушен синтез нейромедиаторов, их транспорт, снижена пластичность нервной ткани, часто обнаруживается снижение или усиление кровотока в областях головного мозга, ответственных за формирование эмоций, явления демиелинизации, дистрофии клеток головного мозга. Значительное влияние на эмоциональную сферу оказывают заболевания, сопровождающиеся атрофией коры головного мозга, например, болезнь Альцгеймера, Пика и др, а также последствия перенесенных черепно-мозговых травм. Современные методы нейровизуализации, такие, как МРТ, функциональная МРТ, КТ, ОФЭКТ, ПЭТ и др. в ряде случаев фиксируют эти нарушения в головном мозге, а в ряде случаев нет или несут общую неспецифическую информацию. Надо отметить, что наиболее современные методы исследования, направленные на диагностику функциональных нарушений работы головного мозга, такие, как ПЭТ, функциональная МРТ являются дорогостоящими и малодоступными.
Социально-психологические причины заключаются в том, что высшая нервная деятельность человека, такая, как интеллект, память,
внимание, мышление и даже во многом эмоции, с точки зрения нейропсихологии, являются продуктом социального взаимодействия
(семья, школа, общение посредством второй сигнальной системы).
Человек — это продукт общества, личность формируется посредством
общения с социумом, живет в нем. В случае личностно значимых стрессовых переживаний, например, смерть родственника,
тяжелая болезнь, катастрофа, стихийное бедствие, длительная тяжелая работа и тд.,
наступает состояния истощения нейромедиаторных систем одних и перевозбуждения других.
Таким образом, в развитии тревожных и депрессивных расстройств имеют значение и биологические, и социально-психологические факторы. В случае преобладания биологически факторов, говорят об «органической» причине развития депрессивного, тревожного расстройства, что подтверждается методами нейровизуализации. В этом случае, как правило, развиваются депрессивные расстройства. В случае преобладания сильных стрессов, личностно значимых переживаний, чаще диагностируются реактивные тревожные состояния.
Конечно, биологические факторы и социально-психологические имеют взаимное влияние, взаимодействуют и образуют взаимоусиливающиеся патогенетические связи. Например, сильный стресс, или множество стрессов (так называемая суперпозиция стрессов), вызывает истощение тормозных нейромедиаторов, перевозбуждение активирующих нейромедиаторов и зачастую лечение такого пациента методами одной только психотерапии затруднительно.
В то же время, биологические факторы, такие как нарушение кровообращения головного мозга, демиелинизация клеток, явления глиоза (гибели клеток) не только затрагивают зоны головного мозга, ответственные за эмоции (гипоталамус, миндалевидное тело, поясная извилина, парагиппокампальная извилина), но и служат фактором, снижающим адаптационные возможности психической деятельности перед лицом стрессовых ситуаций.
____________________________________________
Диагностирование депрессивного, тревожного расстройства лучше доверить врачу-психиатру. Врач-психиатр проводит с пациентом структурированное клиническое интервью, где методом расспроса пациента, при возможности расспроса его окружения, выясняет жалобы, оценивает состояние сознания, когнитивно-мнестической сферы, эмоциональное состояние, поведение, а также психопродуктивные феномены. Такое интервью называется клинико-психопатологическим методом исследования. Исследуется медицинская документация, результаты нейровизуализационных методов исследования. Дополнительно используются специальные стандартизированные клинические опросники: Шкала Гамильтона, Госпитальная шкала тревоги и депрессии, Опросник Бека и др. Американские ученые из Университета штата IOWA Clark и Wilson предложили для этих целей «Вопросник симптомов тревоги и нарушений настроения».
____________________________________________
| Измерение и компоненты модели | Симптомы |
| 1. Общий дистресс | |
| 1) Тревога | Чувство напряжения или лёгкая возбудимость, ощущение дискомфорта, чувство страха, нервозность, взвинченность, раздражительность. |
| 2) Депрессия | Подавленность, уныние, отсутствие желаний, печаль, безнадёжность, разочарование в себе. |
| 3) Смешанное состояние | Беспокойство, сосредоточенность на проблемах, неудовлетворённость, путаница, раздражительность. |
| 2. Ангедония и положительный аффект | |
| Утрата интересов | Чувство собственной непривлекательности, отстранённость от других, чувство заторможенности, для начала какого-либо дела требуются дополнительные усилия. |
| Чрезмерно приподнятое настроение? | Настоящее счастье, настоящая жизнь, оптимизм, чувство переполненности энергией, гордость за себя. |
| 3. Соматическая тревога | |
| Тревожное возбуждение | Головокружение, дрожь в руках, затруднённое глотание, отдышка, боль в груди. |
Данный опросник помогает увидеть сферу, где наибольшие нарушения, а именно: область общего дистресса, гедонических нарушений или соматической тревоги. Зная клинические эффекты, которые сопровождают нарушения в той или иной нейромедиаторной системе, врач-психиатр может подобрать лечение с учётом патологического процесса. Медикаментозное лечение депрессивных и тревожных расстройств осуществляется специальными препаратами, воздействующими на нейромедиаторные системы головного мозга. Различные препараты обладают различными фармакологическими эффектами, подбирается такой препарат, профиль действия которого совпадает с необходимым терапевтическим влиянием на нарушенные механизмы нейротрансмиттерной передачи.
Тем не менее, назначение медикаментозной терапии не отрицает важность психотерапевтического воздействия. Методы психотерапии, психокоррекции эффективно дополняют проводимую терапию, служат целям ресоциализации, значительно ускоряют процесс выздоровления или наступления ремиссии.
Список использованных источников
- https://www.who.int/ru/news-room/fact-sheets/detail/depression
- Время выполнять обещания: доклад независимой комиссии высокого уровня ВОЗ по неинфекционным заболеваниям [Time to deliver: report of the WHO Independent High-level Commission on Noncommunicable Diseases]
- Нуриев И.Т. Клинико-эпидемиологическое исследование депрессивных расстройств среди пациентов общесоматической сети // Вятский медицинский вестник. 2005. №1. URL: https://cyberleninka.ru/article/n/kliniko-epidemiologicheskoe-issledovanie-depressivnyh-rasstroystv-sredi-patsientov-obschesomaticheskoy-seti (дата обращения: 02.08.2020).
- Шамрей Владислав Казимирович, Труфанов Геннадий Евгеньевич, Абриталин Евгений Юрьевич, Корзенев Аркадий Владимирович Современные методы нейровизуализации в психиатрической практике // Российский психиатрический журнал. 2010. №2. URL: https://cyberleninka.ru/article/n/sovremennye-metody-neyrovizualizatsii-v-psihiatricheskoy-praktike (дата обращения: 02.08.2020).
- StahI S.M. Essential psychopharmacology. Neuroscientific basis and practical applications. 2 ed. Cambridge Unuversity Press. New York. 2008. -601P.
Автор: Тебеньков Григорий Геннадьевич врач-психиатр, психиатр –нарколог.
Реактивный глиоз и многоклеточный ответ на повреждение и заболевание ЦНС
Abstract
Центральная нервная система (ЦНС) склонна к гетерогенным повреждениям различной этиологии, которые вызывают многогранные реакции. Острые и очаговые травмы вызывают заживление ран с заменой тканей. Распространенные и хронические заболевания провоцируют постепенно нарастающие изменения тканей. Ответы на поражение ЦНС включают сложные взаимодействия между клетками многочисленных клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока.Вклад различных типов ненейрональных клеток в исход после острого повреждения или в прогрессирование хронического заболевания вызывает все больший интерес по мере того, как усиливается стремление к пониманию и облегчению поражений ЦНС. В одних случаях имеется значительный объем информации, в других — сравнительно мало информации, рассмотренной и рассмотренной здесь.
Введение
Основная цель современной неврологии — понять и облегчить широкий спектр заболеваний центральной нервной системы (ЦНС).С этой целью растет интерес к клеточным и молекулярным механизмам реакции ЦНС на повреждение, болезнь и восстановление. Нейроны являются основными клетками, выполняющими нервные функции, и долгое время находились в центре исследований механизмов, лежащих в основе расстройств ЦНС. Тем не менее, все больше данных указывает на то, что лечение всех типов расстройств ЦНС потребует более глубокого понимания того, как многоклеточные реакции на травмы и заболевания запускаются, развиваются, разрешаются (или нет) и влияют на функцию нейронов.
Способность восстанавливать ткани, поврежденные в результате травм, имеет фундаментальное значение для биологии позвоночных и имеет ключевое значение для выживания. Эволюционное давление, вероятно, привело к определенным фундаментальным клеточным и молекулярным ответам на повреждения, которые являются общими для разных тканей. Реакция на рану или повреждение кожи долгое время служила модельной системой для анализа механизмов восстановления ткани после острого очагового повреждения ткани и обеспечивала понимание основных клеточных и молекулярных взаимодействий (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999). Кроме того, существуют органоспецифические особенности. Присущие органу клетки, которые специализируются на регуляции воспаления и восстановлении тканей, становятся критическими элементами в органоспецифической реакции на воздействие. Специфические для органа особенности применяются, в частности, в ЦНС, где глиальные клетки, которые поддерживают цитоархитектуру и гомеостатическую регуляцию, без которых нейроны не могли бы нормально функционировать в здоровой ткани, также являются основными ответчиками на поражение ЦНС.Изменения функции глиальных клеток во время реакции на воздействие могут заметно повлиять на нейрональные взаимодействия и функции ЦНС.
Повреждения ЦНС вызываются разной этиологией, которая может вызывать широкий спектр реакций. Например, острые и очаговые травмы вызывают заживление ран с заменой тканей, тогда как диффузные и хронические заболевания могут вызывать постепенно нарастающие изменения тканей. Анализ сходств и различий в таких ответах может дать ценную информацию.Клеточные реакции на поражение ЦНС включают сложные взаимодействия между клетками множества клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока. Биология типов клеток, которые участвуют в ответах ЦНС на модели повреждений и болезней, обычно изучалась изолированно. Возрастает потребность в изучении взаимодействия различных клеток, чтобы понять механизмы. В этой статье исследуются и рассматриваются несколько типов клеток, участвующих в различных типах поражений ЦНС и способствующих им.В одних случаях доступна обширная информация, в других — сравнительно мало.
Терминология
Различные термины, используемые при обсуждении травм и заболеваний ЦНС, могут интерпретироваться по-разному. В этой статье мы определим и будем использовать определенные термины следующим образом. «Реактивный глиоз» будет относиться не только к микроглии и астроглии, но и к глиальным клеткам, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Глиальные клетки в здоровой ткани ЦНС не будут называться «покоящимися» или «покоящимися».Это устаревшая концепция. Глии очень активны в здоровой ЦНС и динамически выполняют сложные функции, которые играют критическую роль в нормальных функциях ЦНС (Barres, 2008; Sofroniew and Vinters, 2010). Например, астроциты проявляют физиологическую активацию в виде кратковременного, вызванного лигандами повышения внутриклеточного кальция ([Ca 2+ ] i ), что представляет собой тип возбудимости астроцитов, который интенсивно исследуется как потенциальный средства опосредования динамических функций астроцитов, включая взаимодействие с синапсами и регуляцию кровотока (Attwell et al., 2010; Халасса и Хейдон, 2010; Тонг и др., 2013; Верхратский и др., 1998). Микроглия выполняет важные роли в развитии и обновлении синапсов (Stephan et al., 2012; Stevens et al., 2007). Термин «активированный» часто используется в бинарной форме «все или ничего» для определения глиальных клеток, которые отреагировали на оскорбления. Мы считаем, что использование этого термина в такой манере неверно по двум причинам. Во-первых, он не осознает, что глия постоянно «активируется» в физиологическом контексте. Во-вторых, как обсуждалось в этом обзоре, ответы глиальных клеток на поражение ЦНС не являются бинарными, а очень разнообразны и специфически регулируются.Чтобы дифференцировать физиологическую активацию глиальных клеток в здоровом контексте от реакций, связанных с травмой или заболеванием, мы будем использовать термин «реактивный», который также означает широкий спектр потенциальных ответов глиальных клеток на поражение ЦНС. Наконец, мы будем избегать использования термина «шрам» как такового и вместо этого будем различать «астроцитарные рубцы», образующие компактные границы вокруг поражений тканей, и «фиброзные рубцы», образованные множественными типами неневральных клеток и внеклеточными клетками. матрица в ядрах поражения (как подробно обсуждается ниже).Мы будем приравнивать «глиальный шрам» к «шраму астроцита».
Многоклеточный ответ на поражение ЦНС
Прежде чем обсуждать различные типы ответов на повреждение и заболевание ЦНС, полезно вкратце представить различные типы клеток, участвующих в этих ответах. Для простоты рассмотрения мы сгруппировали клетки в соответствии с клонами как (i) нервные и ненейральные клетки, присущие ЦНС, и (ii) переносимые кровью ненейральные клетки, которые происходят в основном из костного мозга (2). Некоторые из этих типов клеток широко изучены при расстройствах ЦНС, другие — сравнительно мало.Чаще всего их изучали изолированно. В следующих разделах мы постараемся изучить их взаимодействие.
Таблица 1
Различные типы клеток в ответах ЦНС на повреждение и болезнь
| Внутренние клетки ЦНС: | Неневральные клетки, передающиеся через кровь: |
|---|---|
| Внутренние нервные клетки ЦНС: Нейроны Олигодендроциты Астроциты NG2-OPC Нервные стволовые клетки / клетки-предшественники Эпендима | Лейкоциты: Моноциты / макрофаги Нейтрофилы Эозинофилы NK-клетки Т-клетки B-клетки | Другие клетки, полученные из костного мозга: Тромбоциты (тромбоциты) Фиброциты Мезенхимные (стромальные) стволовые клетки 9 9000 9000 |
Внутренние нейронные клетки ЦНС Основные клетки нервного происхождения в ЦНС, нейроны, олигоденд роциты и астроциты были тщательно изучены и проанализированы в отношении их индивидуальных реакций на повреждение и заболевание ЦНС (Barres, 2008; Франклин и Френч-Констан, 2008; Маттсон, 2000; Софронев и Винтерс, 2010).Менее изучены глиальные клетки, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Подобно другим глиям, NG2-OPC покрывает ЦНС и отвечает на повреждения ЦНС (Nishiyama et al., 2009). Особенности ответа NG2-OPC включают миграцию в сторону повреждения и пролиферацию клеток (Franklin and Ffrench-Constant, 2008; Hughes et al., 2013). Помимо замещения потерянных олигодендроцитов (Sun et al., 2010), другие роли NG2-OPC в повреждении и заболевании ЦНС ожидают будущих исследований и выяснения.Кроме того, ЦНС взрослого человека содержит нервные стволовые клетки (НСК) с различной активностью, которые находятся в периэпендимных областях вдоль желудочков и центрального канала головного и спинного мозга взрослого человека (Garcia et al., 2004; Kriegstein and Alvarez-Buylla, 2009 г.). Эти взрослые NSC также могут реагировать на повреждение ЦНС и генерировать предшественники и клетки разных типов, которые мигрируют в места повреждения (Benner et al., 2013; Lagace, 2012; Meletis et al., 2008; Ohab and Carmichael, 2008).
Внутренние ненейральные клетки ЦНС
Различные клетки ненейрального происхождения, присущие ЦНС, играют решающую роль в повреждении и заболевании ЦНС ().Хорошо известно, что микроглия является высокочувствительными ранними ответчиками, которые стимулируют и рекрутируют другие клетки, а также фагоцитозный дебрис (Hanisch and Kettenmann, 2007; Kreutzberg, 1996; Nimmerjahn et al., 2005; Ransohoff and Perry, 2009). Клетки, связанные с фибробластами, включая периваскулярные фибробласты, менингеальные фибробласты и перициты, способствуют замещению тканей, формируя фиброзную рубцовую ткань после тяжелого повреждения (Goritz et al., 2011; Klapka and Muller, 2006; Logan and Berry, 2002; Soderblom et al., 2013; Винклер и др., 2011). Эндотелий и эндотелиальные предшественники играют важную роль во время замены тканей после повреждения ЦНС (Loy et al., 2002; Oudega, 2012) и вызывают растущий интерес в восстановлении ЦНС в свете их новой роли в качестве трофических поддерживающих клеток в развитии ЦНС (Dugas et al. , 2008), а также их способность продуцировать и представлять ламинин (Davis and Senger, 2005), предпочтительный субстрат для роста многих мигрирующих клеток и аксонов.
Неневральные клетки, передающиеся через кровь
Иммунные и воспалительные клетки различных типов (), передающиеся через кровь, играют важную роль в ответах ЦНС на повреждения и болезни, они были изучены и проанализированы (Perry, 2010; Popovich and Longbrake, 2008).Помимо хорошо известной роли в фагоцитозе и удалении мусора, в настоящее время появляется все больше доказательств того, что подтипы лейкоцитов играют активную роль в восстановлении тканей (Derecki et al., 2012; London et al., 2013; Popovich and Longbrake, 2008). ). После повреждения тромбоциты быстро агрегируются для образования сгустков и гемостаза. К другим переносимым кровью типам клеток костного мозга, которые являются причиной повреждения тканей, в том числе в ЦНС, относятся фиброциты (Aldrich and Kielian, 2011; Reilkoff et al., 2011) и мезенхимальные стволовые клетки костного мозга (Askari et al., 2003; Бьянко и др., 2001; Jaerve et al., 2012), но их функции не совсем понятны.
Внеклеточный матрикс (ECM)
ECM, генерируемый различными клетками, играет критическую роль в восстановлении и замене тканей после острых повреждений, а также в хроническом ремоделировании тканей во время хронических заболеваний (Midwood et al., 2004). Молекулы, которые модифицируют матрикс ECM, такие как metaloproteases (MMP), также важны в этом отношении (Midwood et al., 2004). В ЦНС ЕСМ, генерируемый различными типами клеток, реагирующих на повреждение или заболевание, может включать широкий спектр молекул, таких как ламинин, коллагены и гликопротеины, такие как хондроитин или гепарансульфат протеогликаны (CSPG или HSPG), которые участвуют как в поддержке восстановления тканей, так и а также способствуют нарушению регенерации аксонов (Davis and Senger, 2005; Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).
Ответ на очаговое поражение
Два основных типа острого очагового поражения ЦНС — очаговое травматическое повреждение и ишемический инсульт. Помимо того, что они являются серьезными клиническими проблемами, они на протяжении десятилетий служили прототипами экспериментальных моделей, с помощью которых можно было изучить механизмы реакции ЦНС на повреждение и восстановление. В этом разделе мы рассмотрим основные характеристики многоклеточных реакций ЦНС на острые очаговые повреждения и то, как они меняются с течением времени, используя в качестве моделей информацию о реакции на травму или инсульт.В этом отношении следует отметить, что острая очаговая травма, вызванная ушибом или раздавливанием, приводит к серьезному повреждению сосудов и, следовательно, имеет множество последствий, подобных инсульту. Мы проведем сравнения с острой раневой реакцией кожи как модельной системой для клеточных и молекулярных механизмов заживления ран (Greaves et al., 2013; Gurtner et al., 2008; Shechter and Schwartz, 2013; Singer and Clark, 1999). . Как и при восстановлении кожи, ответы ЦНС на острое очаговое повреждение также можно в общих чертах разделить на три перекрывающиеся, но отдельные фазы: (i) гибель клеток и воспаление, (ii) пролиферация клеток для замены тканей и (iii) ремоделирование тканей (3).Сначала мы исследуем реакцию ЦНС в контексте, когда острые оскорбления остаются незараженными и проходят. Ниже мы также кратко рассмотрим более хронические очаговые поражения ЦНС, включая очаговые инфекции с образованием абсцесса, первичные и вторичные опухоли и хронические очаговые аутоиммунные поражения, такие как бляшки рассеянного склероза, которые проявляют различные особенности и клеточные реакции, аналогичные травматическим и ишемическим повреждениям. . Чтобы представить краткое изложение клеточных ответов и взаимодействий, обсуждение информации о второстепенных молекулярных сигналах отложено до следующего раздела ниже.Следует упомянуть, что временные характеристики, приведенные для фаз реагирования и событий, являются обобщенными приближениями (), и существует большая вероятность перекрытия событий, а также вариаций продолжительности или времени в конкретных ситуациях.
Фазы и динамика многоклеточных реакций на острое очаговое повреждение ЦНСВо время периодов гибели клеток (A), замещения клеток (B) и ремоделирования тканей (C) происходят многочисленные перекрывающиеся события (D), которые включают взаимодействия между внутренними компонентами ЦНС. нервные клетки, внутренние ненейральные клетки ЦНС и клетки, проникающие из кровотока.
Фаза I: смерть и воспаление клеток
После очагового повреждения ткани ЦНС в результате воздействия, такого как травма или ишемия, которые вызывают острую локальную гибель клеток, первая фаза ответа в центре повреждения или ядре включает в себя оба очень быстрых события, которые происходят с течением времени. шкала от секунд до часов, и более постепенно прогрессирующие события, которые развиваются в течение нескольких дней (). Очень быстрые события включают гемостаз с каскадом коагуляции, агрегацию тромбоцитов и образование сгустка. За этими быстрыми событиями следуют перекрывающиеся последовательности ответов внутренних клеток ткани, рекрутирование воспалительных и иммунных клеток, подострая гибель паренхимных клеток и начало удаления мусора ().В здоровой ткани ЦНС большие и полярные молекулы в кровотоке исключены из диффузии в паренхиму ЦНС через гематоэнцефалический барьер (ГЭБ) (Abbott et al., 2006; Zlokovic, 2008). После очаговых поражений с повреждением ГЭБ, переносимые с кровью молекулы обычно исключаются из притока ЦНС и передачи сигналов в местные клетки, что более подробно обсуждается ниже в разделе о молекулярной передаче сигналов. Приток тромбоцитов быстро образует агрегаты для гемостаза, а также дает сигнал местным клеткам. Матрицы фибрина и коллагена начинают формироваться в течение периода от нескольких часов до дней, которые служат каркасом для нейтрофилов, а затем макрофагов и других лейкоцитов.Затем лейкоциты сильно инфильтрируют для отслеживания патогенов, удаления мусора и передачи молекулярных сигналов, участвующих в заживлении ран, в течение различного количества дней или дольше в зависимости от тяжести повреждения ткани или наличия обостряющих факторов () (Perry, 2010; Popovich and Longbrake, 2008). ). Эндогенные мезенхимальные стволовые клетки также могут проникать в ядро поражения, но их роль недостаточно изучена (Askari et al., 2003; Bianco et al., 2001; Jaerve et al., 2012). Эти основные клеточные события отражают классические реакции раны, обнаруживаемые в других тканях (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999).
Некоторые внутренние клетки ЦНС также быстро реагируют на повреждение ткани ЦНС или утечку ГЭБ. Исследования живых изображений в CNS in vivo показывают, что микроглия и NG2-OPC немедленно мигрируют в места повреждения тканей и утечки BBB (Hughes et al., 2013; Nimmerjahn et al., 2005). Астроциты, напротив, остаются in situ и не мигрируют ни в места повреждения, ни от них, но могут осмотически набухать и, в зависимости от тяжести повреждения или ишемии, могут погибнуть в центре тяжелых повреждений или могут стать реактивными и гипертрофия и в некоторых случаях пролиферация (Bardehle et al., 2013; Чжэн и др., 2010). Различные аспекты этой первой фазы ответа возникают в перекрывающихся последовательностях в течение первых нескольких дней, а затем начинают постепенно уменьшаться () при условии, что повреждение представляет собой единичное острое событие, не осложненное сдавлением костей, инфекцией или другими обострениями, которые могут продлить разрушительное повреждение. По мере ослабления острых ответов происходит совпадение с началом различных типов пролиферации клеток, связанных со следующей фазой ответов ().
Фаза II: пролиферация клеток и замещение ткани
Вторая фаза ответа на острое повреждение ткани ЦНС наступает примерно через два-десять дней после повреждения и характеризуется пролиферацией и локальной миграцией клеток, которые осуществляют восстановление и замену ткани.Эти клетки включают эндотелиальные клетки-предшественники, клетки линии фибробластов, различные типы воспалительных клеток, а также различные типы клеток-предшественников глии и нейронального происхождения, включая формирующие рубцы астроциты и их предшественники (). Некоторые из этих явлений клеточной пролиферации, такие как пролиферация эндотелия для неоваскуляризации (Casella et al., 2002) или пролиферация определенных клеток линии фибробластов или воспалительных клеток, отражают классические раневые реакции (Gurtner et al., 2008; Singer and Clark, 1999). , в то время как другие, такие как пролиферация рубцовых астроцитов, специфичны и уникальны для ЦНС.Эта фаза также характеризуется на протяжении всей ее продолжительности отсутствием ГЭБ в ядре поражения в период, когда поврежденные кровеносные сосуды заменяются новыми (). Как следствие, эндогенные (а также экзогенные) белки и другие заряженные молекулы могут свободно диффундировать в окружающую нервную паренхиму (Bush et al., 1999). Эти молекулы могут включать белки сыворотки (например, тромбин, альбумин), которые передают сигнал местным клеткам, иммуноглобулинам или молекулам, связанным с патогенами, как обсуждается ниже.Этот негерметичный ГЭБ создает возможность для ядра поражения служить источником циркулирующих молекул, которые генерируют градиенты молекулярной передачи сигналов, которые могут распространяться на значительные расстояния в нервную ткань вокруг поражения до тех пор, пока ГЭБ не будет восстановлен (,). Эта передача сигналов может вносить вклад в периметр сужающегося градиента реактивного глиоза и другие изменения, наблюдаемые в ткани вокруг зрелых поражений, как обсуждается ниже.
Поражения демонстрируют тканевые компартменты и градиенты передачи сигналов(A, B) Фокусное повреждение приводит к поражениям с отдельными тканевыми компартментами в виде ядер неневральных поражений (LC), недавно пролиферирующих компактных рубцов астроцитов (AS) и пери периметры поражения (PLP), которые демонстрируют уменьшающиеся градиенты реактивного глиоза, которые постепенно переходят в здоровую ткань (HT).AS резко разграничивают переход между ненейральными LC и PLP с жизнеспособными нервными клетками. Размер ядра поражения и расположение AS и этого перехода регулируются противоположными молекулярными сигналами. Градиенты молекулярных сигналов, исходящих от LC, воздействуют на клетки в PLP.
Во время фазы пролиферации образуются клеточные элементы, которые в зрелых поражениях образуют два из трех основных тканевых компартментов зрелого поражения, (i) центральное ядро поражения неневральной ткани и (ii) компактный рубец астроцитов, который окружает ядро поражения ().Основные клеточные компоненты ядра ненейрального поражения происходят из расширения внутренних периваскулярных фибробластов и перицитов ЦНС (Goritz et al., 2011; Soderblom et al., 2013) и от пролиферирующих предшественников эндотелия. Компактный рубец астроцитов формируется в основном из недавно пролиферирующих удлиненных астроцитов, генерируемых местными астроглиальными предшественниками, которые собираются по краям сильно поврежденной ткани, содержащей воспалительные клетки и клетки линии фибробластов () (Faulkner et al., 2004; Sofroniew and Vinters, 2010; Wanner и другие., 2013). Примечательно, что в этот пролиферативный период определяется расположение границ компактных рубцов астроцитов. В зрелых поражениях эти границы рубца астроцитов будут точно разграничивать и отделять сохраняющиеся области нефункциональной, не нервной ткани ядра поражения от непосредственно окружающей и потенциально функциональной нервной ткани (,). Клеточные и молекулярные механизмы, лежащие в основе определения того, где именно образуются границы таких рубцов астроцитов, изучены не полностью, но, вероятно, включают сложное взаимодействие и баланс молекулярных сигналов, которые, с одной стороны, способствуют фагоцитозу и очистке от мусора, а также сигнализируют об этом. с другой стороны, способствуют защите и сохранению здорового «я» (), что более подробно обсуждается ниже в разделе, посвященном молекулярным сигналам повреждения и гибели клеток.Несколько десятилетий экспериментальных исследований ишемических инфарктов показывают, что на окончательный размер поражения могут влиять подострые метаболические процессы, которые продолжаются от часов до дней в полутеневых зонах вокруг поражений (Astrup et al., 1981; Dirnagl et al., 1999; Lo, 2008). ). Кроме того, были идентифицированы внутренние сигнальные каскады астроцитов, которые играют критические роли (Herrmann et al., 2008; Okada et al., 2006; Wanner et al., 2013). Лучшее понимание многоклеточных и молекулярных взаимодействий, которые определяют расположение границ рубцов астроцитов вокруг участков поврежденной ткани, может привести к новым терапевтическим стратегиям для уменьшения размера поражения ().Эти события происходят в течение нескольких дней после оскорбления (), в течение которых вмешательство является реальной возможностью.
Недавние открытия также показывают, что во время пролиферативной фазы после острого повреждения ЦНС в переднем мозге нервные стволовые клетки в перивентрикулярных зародышевых зонах дают начало значительному количеству нейральных предшественников, которые мигрируют в места повреждения коры или полосатого тела (Carmichael, 2006; Kokaia et al., 2012; Lagace, 2012; Lindvall, Kokaia, 2006). Эти клетки образуют часть смеси клеток по периметру очага поражения ().Существуют различные доказательства, предполагающие, что эти клетки могут благотворно влиять на ремоделирование тканей в периповрежденной ткани, но природа вкладов, вносимых этими клетками, остается туманной. В нормальных, непредсказуемых обстоятельствах очень немногие вновь сгенерированные нейроны созревают и выживают, а другие потенциальные вклады этих интригующих мигрирующих клеток-предшественников такие вклады в иммунную регуляцию все еще находятся в процессе определения (Kokaia et al., 2012; Lagace , 2012).
Фаза III: Ремоделирование ткани
Третья фаза ответа на острое повреждение ткани обычно начинается ближе к концу первой недели после повреждения и отличается ремоделированием ткани, которое включает в себя события, которые завершаются в течение нескольких недель, такие как восстановление ГЭБ и организация рубца, а также хронические события, которые могут продолжаться в течение многих месяцев (). Восстановление или восстановление ГЭБ вдоль новообразованных кровеносных сосудов в районе поражения обычно завершается в течение нескольких недель после острого неосложненного поражения и требует присутствия функциональных астроцитов (Bush et al., 1999) и перицитов (Daneman et al., 2010; Winkler et al., 2011). Ядро поражения не нервной ткани оказывается окруженным хорошо организованным, пересекающимся компактным рубцом астроцитов через две-три недели после острого поражения, не усугубляемого продолжающимся повреждением ткани () (Wanner et al., 2013). Эти формирующие рубцы астроциты, по-видимому, активно загоняют и окружают воспалительные клетки и клетки клонов фибробластов во время ремоделирования тканей и образования рубцов (Wanner et al., 2013). Этот компактный рубец астроцитов образует структурную и функциональную границу между неневральной тканью в центре поражения и непосредственно прилегающей и окружающей нервной тканью, которая содержит все жизнеспособные клетки всех трех типов клеток нервного клона, астроциты, олигодендроциты и нейроны (,) (Ваннер и др., 2013). Эта граница рубца астроцита служит защитным барьером, который ограничивает миграцию воспалительных клеток из ядра ненейрального поражения в окружающую жизнеспособную нервную ткань. Нарушение образования рубцов астроцитов в различных моделях трансгенной потери функции приводит к увеличению размера поражения, повышенной гибели локальных нейронов, усилению демиелинизации и снижению восстановления функции после травматических или ишемических очаговых поражений (Bush et al., 1999; Faulkner et al., 2004; Herrmann et al., 2008; Ли и др., 2008; Wanner et al., 2013). После образования компактного рубца астроцита продолжается второй период ремоделирования ткани с постепенным ремоделированием ядра поражения, границы рубца астроцита и окружающих областей периметра (,). Например, со временем происходит постепенное сокращение ядер поражений и рубцов астроцитов. Поскольку перерезанные аксоны продолжают умирать обратно от повреждений, гибель олигодендроцитов может продолжаться, что приводит к локальным тканевым ответам и ремоделированию. Происходит длительное ремоделирование ECM в ядре поражения с модуляцией компонентов коллагена и гликопротеина (Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).Кроме того, происходит постепенное и хронически продолжающееся ремоделирование тканей в реактивных областях периметра, которые окружают зрелые поражения, как обсуждается далее.
Зрелые поражения демонстрируют три тканевых компартмента
Образование рубца астроцитов вокруг ядер центральных поражений по существу завершается через две-четыре недели после острого поражения, которое не осложняется длительным повреждением ткани, и в это время поражение можно считать зрелым и входящим в его хроническая стадия (,). В зрелых поражениях полезно распознавать три очень разных компартмента поражения: (i) центральное ядро поражения неневральной ткани, состоящее из клеток местного происхождения фибробластов, кровеносных сосудов, инфильтрирующих фиброцитов и воспалительных клеток и внеклеточного матрикса; (ii) компактный рубец астроцитов, который непосредственно окружает ядро поражения и состоит из плотно упакованных астроцитов с небольшим количеством нейронов или олигодендроцитов, если таковые имеются; и (iii) периметр периметра жизнеспособной нервной ткани, который примыкает к компактному рубцу астроцита и содержит все три типа клеток нервного клона (нейроны, олигодендроциты, астроциты) и демонстрирует сужающийся реактивный глиоз, который постепенно переходит в здоровую ткань ( ).Все эти компартменты будут подвергаться дальнейшему ремоделированию тканей в течение недель или месяцев. Некоторая часть этого ремоделирования может повлиять на функциональный результат и может обеспечить цели для терапевтических вмешательств, особенно в периметре нервной ткани, которая проявляет диффузный реактивный глиоз (,). Полезно рассмотреть отдельно эти компоненты и их влияние на функциональный результат.
Ядро поражения
Ткань в зрелом ядре поражения содержит мало или совсем не содержит клеток нервного клона и нефункциональна с неврологической точки зрения.Первоначально основные типы клеток в ядрах зрелых поражений включают клетки линии фибробластов, эндотелий, фиброциты и воспалительные клетки (). Со временем и при ремоделировании, а также при отсутствии обострения повреждения или инфекции воспалительные элементы будут постепенно исчезать, хотя некоторые из них могут сохраняться в течение длительного времени. Элементы ядра поражения будут постоянно сохраняться в виде фиброзного рубца, содержащего различные ненейральные клетки и ECM. В некоторых областях ядра поражения клетки и ECM будут отступать, оставляя заполненные жидкостью кисты весьма различного размера () (Tuszynski and Steward, 2012).Функционально клетки и ECM ядра поражения служат субстратами для быстрого заживления ран и замещения тканей. Предполагается, что скорость закрытия раны, обеспечиваемая фиброзным замещением по сравнению с обновлением паренхимы, дает преимущества в других тканях (Greaves et al., 2013; Gurtner et al., 2008; Singer and Clark, 1999). Тем не менее, этот механизм может привести к потере функций тканей. Считается, что в ЦНС поврежденная сердцевина ткани с 19 по века оказывает долгосрочное негативное функциональное воздействие как препятствие для регенерации аксонов, что также подтверждается недавними исследованиями (Zukor et al., 2013). Молекулярные оценки показывают, что ядро ECM поражения содержит коллагены и протеогликаны, которые плохо поддерживают или явно подавляют повторный рост поврежденных аксонов (Hermanns et al., 2006; Kimura-Kuroda et al., 2010; Klapka and Muller, 2006; Yoshioka et al., 2010). ).
Компактные рубцы астроцитов (глиальные рубцы)
Зрелые рубцы астроцитов состоят из относительно узких зон вновь образовавшихся астроцитов с удлиненными отростками, которые сильно переплетаются и переплетаются и которые сразу же примыкают и окружают со всех сторон участки сердцевины пораженной ткани () (Sofroniew и Винтерс, 2010; Ваннер и др., 2013). Эти узкие зоны плотно переплетенных удлиненных астроцитов, образующих рубцы, обычно не более миллиметра в поперечнике и обычно лишены других клеток нервного клона (нейронов или олигодендроцитов) (Wanner et al., 2013). Эти формирующие рубцы астроциты вновь пролиферируют в ответ на инсульт, и плотность упаковки тел клеток астроцитов в рубцах астроцитов, по крайней мере, вдвое больше, чем в здоровой ткани (Wanner et al., 2013). Плотно упакованные удлиненные астроциты, образующие рубцы, плавно и быстро переходят в менее плотно упакованные и менее плотно переплетенные гипертрофические реактивные астроциты, которые перемешаны с жизнеспособными нейронами и другими элементами нервной ткани в окружающем периметре реактивной нервной ткани, обсуждаемой ниже () (Ваннер и другие., 2013). Исследования трансгенной потери функции показывают, что недавно пролиферирующие компактные рубцы астроцитов обладают важными нейропротекторными функциями, ограничивая распространение воспалительных клеток вдали от поражений тканей, вызванных травмой, инсультом и аутоиммунным воспалением. Когда образование рубцов астроцитов экспериментально предотвращается или ослабляется in vivo , воспаление распространяется, размер поражения увеличивается, потеря нейронов и демиелинизация усугубляются, а функциональное восстановление ухудшается (Bush et al., 1999; Дрогемюллер и др., 2008; Фолкнер и др., 2004; Wanner et al., 2013). Астроциты, образующие рубцы, также широко считаются, если не главным препятствием для регенерации аксонов после повреждения ЦНС, частично на основании исследований in vitro , показывающих продукцию астроцитами определенных протеогликанов, которые могут ингибировать удлинение (Silver et al., 1993 ). Тем не менее, другие исследования показывают, что регенерация аксонов in vivo происходит вдоль мостиков астроцитов, и что в отсутствие таких мостов регенерация аксонов не происходит и, по-видимому, больше затрудняется конфронтацией с тканью ядра, не связанной с нервным поражением (Kawaja and Gage , 1991; Уильямс и др., 2013; Зукор и др., 2013). Исследования потери функции трансгенных животных, проведенные in vivo , могут помочь прояснить точную природу и масштаб эффектов, оказываемых формирующими шрамы астроцитами на возобновление роста аксонов после травмы.
Периметры периметров поражения
Все зрелые ядра поражений и рубцы астроцитов окружены периметрами жизнеспособной нервной ткани, которая демонстрирует градиент сужающегося реактивного глиоза, который постепенно переходит в здоровую ткань () (Wanner et al., 2013). Ткань в этих зонах периметра содержит все типы клеток нервного клона, включая нейроны и олигодендроциты, и эти клетки перемешаны с реактивным глиозом, который может распространяться на значительные расстояния ().Реактивная ткань периметра начинается непосредственно рядом с компактными рубцами астроцитов, где удлиненные клеточные отростки рубцовых астроцитов перекрываются с гипертрофическими реактивными астроцитами и реактивной микроглией, которые перемешаны с выжившими жизнеспособными нейронами и другими элементами нервной ткани (). Примечательно, что жизнеспособные нейроны могут присутствовать в пределах нескольких сотен мкм компактных рубцов астроцитов, а центральная ткань поражения, заполненная потенциально цитотоксическими воспалительными элементами, находится чуть дальше (Bush et al., 1999; Wanner et al., 2013). Реактивный глиоз по периметру включает гипертрофические реактивные астроциты и микроглию (). Причина и функции периметров сужающегося реактивного глиоза не ясны. Что касается причины, возможно, что градиенты сигнальных молекул, диффундирующих из ядра поражения, либо входящие в период утечки ГЭБ, либо продуцируемые инфильтрирующими и пролиферирующими клетками, могут запускать такой градиент постепенно сужающихся ответов среди локальной глии (1). .С функциональной точки зрения, еще предстоит определить степень, в которой конкретные аспекты этого реактивного глиоза являются полезными или вредными (или их комбинацией).
Реактивные области периметра вокруг ядер поражения в головном и спинном мозге, вероятно, будут демонстрировать долгосрочное и потенциально интенсивное ремоделирование ткани с образованием новых синапсов и потенциалом для формирования новых цепей реле (Bareyre et al., 2004; Carmichael, 2006; Clarkson et al., 2010; Courtine et al., 2008; Li et al., 2010; Overman et al., 2012). На ремоделирование синапсов и цепей потенциально могут влиять многочисленные факторы, включая молекулы внеклеточного матрикса, такие как протеогликаны в перинейронах (Garcia-Alias et al., 2009). Реактивная глия может играть важную роль в этом ремоделировании, но эта тема недостаточно изучена. В здоровой ЦНС астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными способами (Halassa and Haydon, 2010).И астроциты, и микроглия потенциально могут играть фундаментальную роль в ремоделировании синапсов в периметре поражения (Stephan et al., 2012; Stevens et al., 2007), и влияние реактивного глиоза на такое ремоделирование еще не изучено. Такие периметральные области периметра, вероятно, обеспечат благодатную почву для инвестирования новых стратегий для вмешательств, которые могут повлиять на нейронную пластичность и формирование релейных цепей, что в сочетании с соответствующей реабилитационной тренировкой (van den Brand et al., 2012) могут благотворно повлиять на функциональный результат.
Хронические очаговые поражения
Помимо острой очаговой травмы и инсульта, которые часто служат моделями для изучения механизмов повреждения ЦНС, как только что обсуждалось, другие, более хронические формы повреждения заслуживают рассмотрения. Важные хронические инсульты включают очаговые инфекции с образованием абсцесса, опухоли и аутоиммунные поражения. Все эти состояния вызывают реактивный глиоз и многоклеточные реакции, которые имеют большое сходство с теми, которые возникают после острого очагового повреждения.Этот многоклеточный ответ играет решающую роль в развитии, серьезности и разрешении (или нет) оскорблений.
Инфекция
Очаговые инфекции или абсцессы могут образовываться при инфицировании травматических ран или могут быть засеяны спонтанно, особенно у лиц с ослабленным иммунитетом. Такие инфекции вызывают реактивный глиоз с образованием рубцов астроцитов, аналогичным таковому после острой очаговой травмы (Sofroniew and Vinters, 2010). Продолжительность сохранения поражения и ремоделирования тканей является длительной и зависит от разрешения инфекции.Исследования трансгенной потери функции показывают, что образование рубцов астроцитов имеет решающее значение для локального сдерживания инфекции. Когда рубцы астроцитов разрушаются, инфекция и воспаление быстро распространяются через прилегающую нервную ткань с разрушительными эффектами (Drogemuller et al., 2008).
Рак
Как первичные, так и метастатические опухоли вызывают реактивный глиоз и многоклеточные реакции, которые имеют сходство с другими формами очагового повреждения тканей. Взаимодействие опухолевых клеток с глией ЦНС и инфильтрирующими воспалительными клетками является сложным и сильно зависит от типа опухолевых клеток.Неинвазивные опухоли окружены реактивным глиозом и инкапсулирующим рубцом, аналогичным тому, который наблюдается вокруг травматического повреждения ткани. Агрессивно инвазивные опухоли не инкапсулированы и не окружены четко выраженными рубцами астроцитов, но вызывают другие формы реактивного глиоза и многоклеточные реакции. Считается, что успешная инфильтрация и распространение определенных типов опухолевых клеток связаны с их способностью создавать среду для роста, васкуляризации и распространения, что может включать успешную нейтрализацию барьерных функций местных клеток ЦНС и кооптации программ для создания пролиферативных ниш. (Луи, 2006; Сильвер и др., 2013; Уоткинс и Сонтхаймер, 2012).
Аутоиммунное заболевание
Очаговые аутоиммунные поражения интересно рассматривать с точки зрения реакции на повреждение ЦНС. Хотя аутоиммунное заболевание ЦНС часто рассматривается как диффузное, хроническое и вызвано, в первую очередь, дисфункцией периферической иммунной системы, отдельные аутоиммунные поражения имеют много общего с острыми очаговыми травматическими ранами. Например, активные бляшки рассеянного склероза заполнены воспалительными клетками, а хронические бляшки демонстрируют ядра центральных поражений, которые лишены всех типов клеток нервного клона (без нейронов, олигодендроцитов или астроцитов), окруженные астроцитарными рубцами, которые отделяют неневральную ткань от периметров реактивных клеток. глиоз в ткани со всеми тремя типами нервных клеток (Frohman et al., 2006; Lucchinetti et al., 1996) способами, подобными повреждению тканей, вызванному травмой или ишемией (,). Оптический нейромиелит (NMO) — это аутоиммунное воспалительное заболевание, при котором причинные аутоантитела направлены против аквапорина-4 на клеточной мембране астроцитов, а поражения NMO связаны с опосредованным комплементом литическим разрушением астроцитов (Lennon et al., 2005; Popescu и Лучинетти, 2012). Существует замечательное совпадение между клиническими данными из NMO и экспериментальными исследованиями потери функции, демонстрирующими, что трансгенно-опосредованная абляция или ослабление рубцовых астроцитов приводит к тяжелому обострению аутоиммунного воспаления ЦНС (Haroon et al., 2011; Voskuhl et al., 2009). Таким образом, как клинические, так и экспериментальные данные указывают на критическую роль рубцовых астроцитов в ограничении распространения аутоиммунного воспаления ЦНС. Эти наблюдения убедительно свидетельствуют о том, что дисфункция внутренних клеток ЦНС, таких как астроциты, может причинно способствовать возникновению или прогрессированию аутоиммунных состояний ЦНС способами, которые обычно не рассматриваются в исследованиях, сосредоточенных только на попытке определить причинные механизмы периферической иммунной системы. Это представление может быть дополнительно подтверждено предположениями, что подгруппа пациентов с рассеянным склерозом имеет связанные с заболеванием аутоантитела против калиевого канала Kir4.1, который в ЦНС располагается на мембранах астроцитов (Srivastava et al., 2012). Было бы интересно определить степень, в которой усиление или потеря функций астроцитов способствует патофизиологии аутоиммунных состояний ЦНС.
Ответ на диффузное поражение
Диффузное поражение ткани ЦНС может быть связано с нейродегенеративными заболеваниями, некоторыми судорожными расстройствами или легкой черепно-мозговой травмой. Диффузные инсульты изначально имеют тенденцию быть менее интенсивными, чем острые очаговые повреждения, вызванные травмой или инсультом, и могут первоначально не вызывать явного повреждения тканей, а вместо этого постепенно накапливаться в течение хронических периодов времени.По мере того, как повреждение ткани становится более серьезным, образуются небольшие отдельные поражения, каждое из которых вызывает реактивный глиоз и многоклеточные реакции, аналогичные тем, которые вызваны острым повреждением ткани с разрушением ГЭБ, воспалением и привлечением лейкоцитов (,), но на меньшем уровне. шкала. Со временем диффузное повреждение начинает напоминать диффузное скопление множества мелких очаговых поражений, которые перемешаны и могут распространяться на большие площади (). Каждое из этих небольших поражений дает начало собственным периметру периметра поражения зон сужающегося реактивного глиоза, в результате чего перекрывающиеся зоны тяжелого гипертрофического реактивного глиоза и многоклеточных реакций могут быть распределены на больших участках ткани (2).Важно понимать, что эти многочисленные небольшие поражения перемежаются между жизнеспособными нейронами и нейронными цепями, которые охватываются этими перекрывающимися периметрами периметров реактивного глиоза (2). Как обсуждалось выше, в настоящее время имеются существенные доказательства участия астроцитов и микроглии в нормальной функции нервной цепи, но влияние реактивного глиоза на такие функции неизвестно. В контексте диффузных поражений ЦНС большие области функционирующей нервной ткани могут подвергаться интенсивному реактивному глиозу, который, вероятно, повлияет на синаптические взаимодействия и функции нервных цепей (2).Лучшее понимание таких эффектов может открыть путь к новым терапевтическим стратегиям.
Диффузное повреждение ткани приводит к расширенным областям реактивного глиоза(A) Небольшие хронические инсульты могут приводить к диффузному повреждению ткани с образованием рассеянных небольших ядер поражений (LC), астроцитарных рубцов (AS) и периметров периповреждений (PLP) которые могут перекрываться и сливаться в области смежного реактивного глиоза, которые могут распространяться на большие площади.
(B) Реактивные астроциты и реактивная микроглия в PLP могут по-разному влиять на синапсы и нейронные функции.
Нейродегенеративное заболевание
Реактивный глиоз и многоклеточные реакции запускаются по-разному и избирательно при разных нейродегенеративных заболеваниях. В некоторых случаях пусковым механизмом может быть накопление внеклеточных токсинов, таких как β-амилоид при болезни Альцгеймера (БА) (Prokop et al., 2013; Zlokovic, 2011), которые могут накапливаться и вызывать множество небольших очаговых повреждений тканей, которые вызывают глиоз, во многом схожий с другими формами диффузных поражений (). В других случаях пусковым механизмом может быть повреждение или смерть нейронов или синапсов, вторичные по отношению к внутренним изменениям нейронов.Некоторые состояния, такие как боковой амиотрофический склероз (БАС) или болезнь Хантингтона, вызывают внутренние клеточные изменения как в нейронах, так и в глии, могут нарушать клеточные функции и взаимодействия, которые могут служить триггерами (Boillee et al., 2006; Maragakis and Rothstein, 2006). . Нейродегенеративные инсульты также могут приводить к нарушению сосудисто-нервного аппарата, что приводит к утечке ГЭБ, что может служить дополнительным триггером для реактивного глиоза, а также сигналом для рекрутирования воспалительных клеток, переносимых кровью (Zlokovic, 2008, 2011).Во многих случаях реактивный глиоз и многоклеточные реакции могут не проявляться в начале или на ранних стадиях нейродегенеративных состояний, но проявляться позже и затем участвовать в прогрессировании заболевания. Реактивный глиоз, вызванный различными способами, либо накоплением аномальных белков, ишемическим или травматическим клеточным повреждением, либо микробами, также может привести к утечке ГЭБ через специфические молекулярные сигнальные каскады, как обсуждается ниже, с последующим воспалением, которое может способствовать прогрессированию заболевания.
Вклад глиальных клеток и реактивного глиоза в нейродегенеративные состояния сложен и только начинает изучаться. Глия не только реагирует на дегенеративные сигналы, о которых говорилось выше, но также может участвовать в борьбе с ними. Например, считается, что и микроглия, и астроциты способствуют очищению от β-амилоида (Prokop et al., 2013; Wyss-Coray et al., 2003), а ослабление реактивного астроглиоза может увеличивать нагрузку β-амилоида на модели трансгенных мышей. нашей эры (Крафт и др., 2013). Кроме того, на глию могут влиять молекулярные дефекты, вызывающие заболевание, и она становится дисфункциональной, что еще больше затрудняет попытки понять роль реактивного глиоза в процессе болезни. Например, при БАС дисфункция глиальных клеток причинно участвует в опосредовании дегенерации нейронов (Yamanaka et al., 2008), а продолжающийся реактивный глиоз и воспаление, как полагают, также вносят вклад в прогрессирование заболевания (Maragakis and Rothstein, 2006). Различия между вызванными заболеванием дисфункциями глиальных клеток и реактивными реакциями, которые запускаются в глиальных клетках повреждением клеток и тканей, иногда размыты или уравниваются, но не должны быть такими.Понимание этих различных явлений и способов их взаимодействия может иметь важные последствия для понимания механизмов, лежащих в основе клеточной патофизиологии и ведущих к прогрессированию заболевания. Важно помнить, что, хотя некоторые аспекты реактивности глии могут способствовать прогрессированию заболевания, другие, вероятно, будут защитными. Определение молекулярной основы таких различий может помочь определить новые терапевтические стратегии.
В контексте нейродегенеративного заболевания также интересно вкратце рассмотреть возможность неавтономной нейрональной дегенерации, вызванной дисфункцией глии или других ненейронных клеток.Генетические мутации с потерей или усилением функции в микроглии (Derecki et al., 2012) или астроцитах (Brenner et al., 2001; Rothstein, 2009; Tao et al., 2011) потенциально могут вызывать неклеточно-автономные дегенерация разных типов нейронов при различных заболеваниях человека и экспериментальных моделях на животных. Такие наблюдения показывают, что дисфункция глиальных клеток может быть первичным причинным событием при определенных неврологических состояниях. Такие наблюдения также повышают вероятность того, что дисфункция определенных аспектов реактивного глиоза во время реакции на поражение ЦНС может усугубить повреждение или привести к ухудшению восстановления тканей и худшему исходу.Возможность генетического полиморфизма влиять на функции глиальных клеток и реакцию на повреждение ЦНС — это еще не изученная область, которая может выявить причинные факторы, лежащие в основе различий в ответах разных людей на, казалось бы, схожие типы и тяжести поражений ЦНС.
Эпилепсия
Астроциты и микроглия могут участвовать в эпилепсии множеством способов. Астроциты играют множество критических ролей в регуляции активности синапсов и возбудимости нейронов, а астроциты могут играть решающую роль в генерации судорожной активности (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). Кроме того, реактивный глиоз как микроглии, так и астроцитов является характерной особенностью нервной ткани с хронической эпилепсией, которая также может проявлять распад ГЭБ и многоклеточное воспаление (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). ). С увеличением потери нейронов наступает тканевой склероз, который имеет сходство с тяжелым диффузным астроглиозом из-за других причин, как обсуждалось выше, со многими более мелкими тканевыми поражениями, окруженными континуумом околоповрежденной ткани со смесью выживших нейронов и все более тяжелой гипертрофией. глиоз ().Влияние реактивного глиоза и многоклеточного ответа на повреждение ткани на выжившие нейроны в периметре периметра поражения недостаточно изучено (), но может способствовать снижению пороговых значений приступов. Селективная экспериментальная индукция реактивности астроцитов связана со снижением ингибирования в локальных нейронах гиппокампа (Ortinski et al., 2010). Требуется дополнительная работа в этой области.
Диффузная черепно-мозговая травма (ЧМТ)
Крупные очаговые поражения, вызванные тяжелой очаговой ЧМТ (ушиб или раздавливание), обсуждались выше.Тем не менее, клинически значимая ЧМТ часто бывает диффузной и широко распространенной. Клеточные и молекулярные механизмы диффузной ЧМТ, которая вызывает функциональные нарушения без крупных очаговых поражений, изучены не полностью. Диффузная ЧМТ обычно характеризуется небольшими очагами разрушения сосудов и повреждения тканей, которые могут диффузно распространяться на большие участки ЦНС (DeKosky et al., 2013; McIntosh et al., 1989). Интересно учитывать, что каждая из этих небольших областей тканевого или клеточного повреждения может представлять собой небольшое очаговое повреждение с отделениями, эквивалентными сердцевине, рубцу астроцита и периметру, которое может распространяться на большие области без очевидной единственной большой очаговой области ().Как обсуждалось выше, чередующиеся жизнеспособные нервные ткани во многих перекрывающихся периметрах периметра поражения будут подвергаться интенсивному гипертрофическому реактивному глиозу и воспалению, которое может влиять на нервные функции (2). Специфические клеточные и молекулярные механизмы реактивного глиоза и многоклеточных ответов, запускаемых легкой или умеренной диффузной ЧМТ, только начинают охарактеризовываться. Недавно пролиферирующие реактивные астроциты выполняют защитные функции, необходимые для выживания нейронов (Myer et al., 2006). Микроглия может оказывать широкий спектр эффектов в зависимости от конкретных молекулярных стимулов, которые либо защищают, либо усугубляют потерю ткани (Hanisch and Kettenmann, 2007). Понимание и управление реактивным глиозом и многоклеточными последствиями, вызванными легкой и умеренной ЧМТ, имеет огромный потенциал для определения новых терапевтических целей в области большого эпидемиологического значения. Новые молекулярные механизмы обсуждаются в следующем разделе.
Молекулярная передача сигналов и многоклеточные взаимодействия
Молекулярная передача сигналов между различными типами клеток, которые отвечают на поражение ЦНС, сложна, комбинаторна и тесно переплетена.Различные клетки обладают способностью продуцировать одинаковые наборы молекул и отвечать на них, и есть намеки на то, что некоторые молекулы могут координировать многоклеточные ответы. Было идентифицировано множество межклеточных сигнальных молекул, но мы находимся на ранних стадиях определения того, как эти множественные сигналы регулируют многоклеточные взаимодействия и временную прогрессию от одной фазы к другой во время ответов на специфические поражения ЦНС. Здесь мы предоставляем общий обзор молекулярных функциональных классов () и несколько репрезентативных примеров многих конкретных молекул, которые регулируют или влияют на клеточные реакции ЦНС на оскорбления ().
Многомолекулярная регуляция и дифференцированные ответы на повреждение(A) Ответы на повреждение ЦНС регулируются и зависят от различных категорий молекулярных сигналов, происходящих от многих типов внутренних и внешних клеток ЦНС.
(B) Низкие уровни АТФ, высвобождаемые клетками во время легких поражений ЦНС, могут действовать через (i) рецепторы P2X, чтобы вызвать быстрый хемотаксис микроглиальных процессов, и (ii) рецепторы P2Y на местных астроцитах, чтобы вызвать передачу сигналов кальция и коннексин-зависимый ATP высвобождение, которое может повышать уровень внеклеточного АТФ и тем самым усиливать этот «опасный» сигнал.
(C) После тяжелой травмы сигнальные молекулы от «измененного я» и «здорового я» соперничают, чтобы сбалансировать очистку от мусора и сохранение жизнеспособной ткани. Сильно поврежденные или мертвые клетки высвобождают ряд гидрофобных внутриклеточных молекул (слева) или «аларминов», которые выражают молекулярные структуры, связанные с повреждением (DAMP). Эти «опасные» сигналы предупреждают клетки врожденного иммунитета ЦНС о повреждении тканей и способствуют удалению мусора за счет активации рецепторов распознавания образов на фагоцитарных иммунных клетках (в центре).Жизнеспособные внутренние клетки ЦНС на границах поражения (справа) экспрессируют связанные с мембраной и растворимые нейроиммунные регуляторные молекулы для предотвращения атаки и фагоцитоза иммунных клеток.
Таблица 2
Основные классы и несколько конкретных примеров межклеточных сигнальных молекул, которые регулируют клеточные реакции на повреждение ЦНС
| Класс | Молекула | Источник | Пораженный отсек | Фаза | Цели и эффекты |
|---|---|---|---|---|---|
| Протеаза и родственные ей | Тромбин | S | LC, AS | I | Образование сгустка; пролиферация астроцитов |
| MMP-9 | M, O, S | LC, AS, PLP | I – III | пролиферация OPC, ремиелинизация; Утечка BBB; неоваскулярное ремоделирование | |
| Калликреины | A, M, N, S | LC, AS, PLP | I – III | Провоспалительные; демиелинизация | |
| Серпины | A, M, O | LC, PLP | I – III | Ингибировать вредную протеазу | |
| NTs | ATP Glutamate | N, O, A | LC, AS, AS, PLP | I | Хемотаксис микроглии; реактивный астроглиоз |
| DAMPs | Alarmins: HMGB1, S100s, DNA | Поврежденные клетки | LC, PLP | I.II | Сигналы «Измененное я»; провоспалительный; увеличить фагоцитоз |
| PAMPs: LPS | Микробы | LC, PLP | I. II | Сигналы «несамо захватчика»; провоспалительный; увеличить фагоцитоз | |
| Факторы роста Морфогены | FGF | A, N, E, | LC, AS, PLP | I — III | Фиброзный рубец; ECM; неоваскулярное ремоделирование; реактивный астроглиоз |
| VEGF | E, P, F, A | LC, AS | I – III | BBB проницаемость; неоваскулярное ремоделирование | |
| PDGF-B PDGF-A | E, A | LS, PLP | I – III | Неоваскулярное ремоделирование Ремиелинизация; Пролиферация OPC | |
| Эндотелин, EGF, BMP | N, A, O | LC, AS | II, III | Пролиферация астроцитов, образование глиального рубца | |
| Цитокины Хемокины | TGFβ, MGFβ | , LAS, PLP | I – III | Образование фиброзного рубца; Производство ECM; пролиферация астроцитов | |
| IL-1β, TNFα, INFγ | A, M, L | LC, AS, | I, II | Провоспалительная регуляция | |
| IL-6 | A, M, L | I, II | Лейкоциты, образование рубцов астроцитов | ||
| NIRegs | CD141 | A, O, E | LC, AS | I – III | Защита здорового себя; разрешение воспаления |
| CD200, CD47 | N | LC, AS, PLP | I, II | Защита здорового себя | |
| Нейронное ремоделирование | Нейротрофины, BDNF и т. д. | N, A | PLP | III | Ремоделирование синапсов |
| Перинейронная сеть | A, OPC | PLP | III | Ограничить прорастание терминала | |
| Thmbs 902, C1q | MPLP | III | Формирование и обрезка синапсов |
Повреждение и смерть клеток
Мертвые, умирающие или временно поврежденные, но восстанавливаемые клетки высвобождают или экспрессируют молекулы, которые сигнализируют о повреждении.Эти молекулы делятся на множество категорий, включая нейротрансмиттеры, цитокины, хемокины, нейроиммунные регуляторы (NI-Reg) и молекулярные паттерны, связанные с опасностью (DAMP), которые стимулируют реактивный глиоз и другие клеточные реакции, включая очищение от мусора иммунными клетками () (). Оскорбления разного типа и степени тяжести высвобождают различные комбинации этих молекул, которые, в свою очередь, вызывают разные реакции. Например, легкие клеточные инсульты могут незначительно повышать внеклеточные концентрации глутамата или АТФ, которые привлекают отростки микроглиальных клеток, не вызывая вначале полномасштабного воспаления () (Davalos et al., 2005; Лю и др., 2009). АТФ может также вызывать кальциевые ответы в астроцитах и вызывать зависимое от коннексина высвобождение АТФ, которое увеличивает внеклеточные уровни АТФ и усиливает этот «опасный» сигнал (). Более серьезное повреждение или гибель клеток приведет к высвобождению дополнительных DAMP и аларминов в форме цитозольного и ядерного содержимого, такого как K +, белков теплового шока, таких как Aβ-кристаллин, кальций-связывающих белков семейства S100, ДНК-связывающих HMGB1 (группа с высокой подвижностью, блок 1 ), а также ДНК и РНК. Все эти молекулы могут служить сигналами «опасности», предупреждающими клетки врожденного иммунитета о повреждении тканей и способствующими удалению клеточного мусора «измененного собственного» посредством активации рецепторов распознавания образов (PRR) на фагоцитарных клетках врожденного иммунитета () (Chan et al., 2012; Гриффитс и др., 2010; Коно и Рок, 2008). Молекулы, такие как бета-амилоид (Aβ), образующиеся во время нейродегенеративных расстройств, также могут действовать как алармины (). Один тип алармина может связывать несколько классов PPR. Например, HMBG1 вызывает провоспалительную передачу сигналов посредством активации множественных TLR, RAGE (рецептор конечных продуктов гликирования) и MAC1 (антигенный комплекс макрофагов-1) (Chan et al., 2012; Gao et al., 2011) и S100 активирует несколько TLR и RAGE (Chan et al., 2012).
Здоровые нейроны и глия вблизи поражений ЦНС экспрессируют нейроиммунные регуляторные молекулы (NI-Regs) и белки самозащиты, которые сигнализируют о «здоровом я» и служат для ограничения потенциально вредной провоспалительной передачи сигналов и предотвращения фагоцитоза жизнеспособных клеток () () (Griffiths и др., 2010). Эти молекулярные сигналы «здорового себя» включают как мембраносвязанные, так и растворимые молекулы NI-Reg. Например, сиаловые кислоты (SA) в мембранах здоровых клеток взаимодействуют с рецепторами SA (SAR), включая Siglecs, на клетках врожденного иммунитета и служат сигналами «не ешь меня» () (Varki and Gagneux, 2012).CD200 и CD47 аналогичным образом действуют через рецепторы CD200R и SIRP-α на воспалительные клетки, предотвращая фагоцитарную атаку () (Griffiths et al., 2010). Белки, регулирующие комплемент (CRP), могут снижать активацию комплемента () (Griffiths et al., 2010). Тромбомодулин (CD141) связывает и изолирует HMGB1, тем самым снижая биодоступность алармина () (Abeyama et al., 2005).
Таким образом, специфические опосредованные рецептором сигналы, указывающие на «измененное я» или «здоровое я», могут адаптировать природу реактивного глиоза и многоклеточные реакции к типу и тяжести клеточного повреждения или смерти ().Важно отметить, что конечный уровень клеточного повреждения, вызванного всевозможными оскорблениями, частично определяется продолжительными периодами различных типов вторичных событий (), включая балансирующее действие между врожденными иммунными механизмами, которые регулируют выведение «измененных» «я», мусор и «чужие» патогены, сохраняя при этом «здоровое я» () (Griffiths et al., 2010). Эти события будут влиять на окончательный размер, расположение глиального рубца и передачу сигналов по периметру очага поражения ().
Реактивный глиоз
Реактивный глиоз регулируется большим набором различных внеклеточных сигналов, генерируемых после поражения ЦНС.Этот массив включает не только молекулы, высвобождаемые поврежденными или мертвыми клетками, как только что описано, но также молекулы, поступающие через протекающий ГЭБ, молекулы, высвобождаемые инфильтрацией лейкоцитов, и молекулы, высвобождаемые локальными клетками, включая сами реактивные глии () (Sofroniew, 2009). В ответ на это множество различных и часто комбинаторных молекулярных сигналов реактивная глия изменяет экспрессию, структуру и функцию своих генов избирательным и специфическим образом в зависимости от типа и тяжести повреждений и в зависимости от конкретных комбинаций молекулярных сигналов, которые на них воздействуют. .Важно подчеркнуть, что глия не существует в простых «покоящихся» или «активированных» состояниях «все или ничего» и что не существует единой программы «реактивного глиоза», которая запускалась бы по принципу «все или ничего». и одинаков во всех ситуациях. Вместо этого реактивная глия может демонстрировать широкий спектр ответов, определяемых комбинациями определенных сигнальных событий. Например, воздействие PAMP, таких как липополисахарид (LPS), может заметно исказить транскриптом реактивных астроцитов в сторону хемокинов, цитотоксичности и воспаления (Hamby et al., 2012; Заманян и др., 2012). Также следует отметить, что различные комбинации стимулирующих факторов могут приводить к синергическим изменениям в молекулярной экспрессии, которые невозможно предсказать на основании индивидуальных эффектов (Hamby et al., 2012).
Многоклеточная и многомолекулярная регуляция реактивного глиоза и ГЭБ(A) Реактивный глиоз может индуцироваться, регулироваться и зависеть от множества молекулярных сигналов, которые могут происходить из многих типов внутренних и внешних источников ЦНС.
(B) Проницаемость ГЭБ может регулироваться специфическими молекулярными сигнальными каскадами, включающими взаимодействия между разными типами клеток, которые сходятся в эндотелиальных плотных контактах (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013).
Информация об эффектах, опосредованных реактивной глией в ответ на специфические сигналы, также неуклонно растет, и очевидно, что многие аспекты реактивного глиоза являются частью скоординированных многоклеточных врожденных и адаптивных иммунных ответов на поражение ЦНС.Интересно отметить, что определенные молекулы становятся потенциальными координаторами многоклеточных ответов. Один интересный набор сходящихся данных предполагает, что IL-1β является ключевым триггером, который стимулирует различные типы глиальных клеток, чтобы модулировать проницаемость BBB для белков сыворотки и лейкоцитов во время реактивного глиоза в ответ на поражение ЦНС (2). Многочисленные DAMP и PAMP, генерируемые поражением ЦНС, будут стимулировать высвобождение IL-1β из микроглии, и этот IL-1β будет стимулировать (i) локальные реактивные астроциты высвобождать VEGF и (ii) локальные NG2-OPCs высвобождать MMP-9, которые в Turn влияет на плотные контакты и барьерные свойства местных эндотелиальных клеток и позволяет проникать сывороточным белкам (включая IgG и сигнальные белки, такие как тромбин, альбумин, протеазы и т. д.)) и лейкоцитов в локальную паренхиму ЦНС () (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013). Проникающие лейкоциты могут генерировать больше IL-1β и поддерживать локальную проницаемость ГЭБ, создавая потенциал для петли прямой связи при неблагоприятных обстоятельствах. Понимание молекулярных механизмов, посредством которых такая передача сигналов подавляется и закрытие ГЭБ, может помочь выявить рациональные терапевтические вмешательства при определенных состояниях. Восстановление ГЭБ после неосложненной острой травмы обычно происходит в течение нескольких недель ().
Образование рубцов астроцитов
Формирование компактных рубцов астроцитов — это особый аспект реактивного астроглиоза, который возникает в ответ на тяжелое повреждение тканей и инфильтрацию лейкоцитов и включает фазы пролиферации и организации клеток () (Sofroniew and Vinters, 2010; Wanner et al. др., 2013). Молекулярные сигналы, которые регулируют сигналы пролиферации астроцитов после повреждения ЦНС, могут происходить от белков сыворотки или местных клеток и включать тромбин, эндотелин, FGF2, АТФ, BMP (костные морфогенные белки), SHH (звуковой изгородь) и другие () (Gadea et al., 2008; Нари и др., 2003; Сахни и др., 2010; Сиракава и др., 2010; Сирко и др., 2013). На расположение границ рубцов астроцитов вокруг очагов поражения могут влиять взаимодействия между пролиферирующими или вновь пролиферирующими рубцообразующими астроглиями, клетками, связанными с фибробластами, и воспалительными клетками (Wanner et al., 2013), а также трансгенными манипуляциями с внутренней сигнализацией астроцитов. каскады с участием STAT3, SOCS3 или NFκB, которые могут увеличивать или уменьшать размеры поражения (Brambilla et al., 2005; Herrmann et al., 2008; Окада и др., 2006; Wanner et al., 2013) с указанием целей для потенциального вмешательства. Сигналы для организации вновь пролиферирующих астроцитов в компактные рубцы включают сигнальную систему рецептора IL-6-STAT3, которая критически регулирует образование рубцов астроцитов после травмы, инфекции и аутоиммунного воспаления (Drogemuller et al., 2008; Haroon et al., 2011; Herrmann et al., 2008; Wanner et al., 2013).
Ремоделирование нервной ткани в периметре поражения
Реактивный глиоз не только важен в ответах на очень локальное повреждение ЦНС, но также, вероятно, играет важную роль в ремоделировании нервной системы, которое продолжается в течение длительного времени в периметре поражения после острого очагового поражения. оскорбления, такие как инсульт и травма (,), а также при хронических диффузных поражениях ЦНС (), включая нейродегенеративные состояния, такие как болезнь Альцгеймера.Такие периметральные области периметра поражения могут простираться на значительные расстояния от крупных очаговых поражений (,) или могут охватывать большие области диффузного повреждения ткани (). В таких случаях связанный с ним реактивный глиоз может повлиять на значительные территории функционирующей нервной ткани. Появляется все больше доказательств того, что разнообразные изменения в молекулярной передаче сигналов, связанные с этим диффузным реактивным глиозом (), будут влиять на продолжающееся ремоделирование нервной системы и изменения нейронной функции. Астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными прямыми и косвенными способами, в том числе путем модуляции внеклеточного баланса ионов, передатчиков и воды, критически важных для нейронной функции, а также прямого влияния на синаптическую активность. напрямую через выпуск «глиотрансмиттеров»; (Halassa, Haydon, 2010; Hamilton, Attwell, 2010; Henneberger et al., 2010; Вольтерра и Мелдолези, 2005). Микроглия также участвует в регуляции синаптического обмена (Stephan et al., 2012). Молекулы перинейрональной сети, такие как протеогликаны хондроитинсульфата, генерируемые астроцитами и NG2-OPC, влияют на синаптическую пластичность (Wang and Fawcett, 2012). Влияние реактивного глиоза на такие функции только начинается, но сообщалось, что реактивный астроглиоз по-разному влияет на нервные функции, в том числе (i) за счет подавления глютаминсинтазы астроцитов, что связано со снижением тормозных синаптических токов. в локальных нейронах (Ortinski et al., 2010), (ii) повышенная экспрессия xCT (Slc7a11), переносчика цистеина-глутамата, связанная с усилением передачи сигналов глутамата, судорогами и эксайтотоксичностью (Buckingham et al., 2011; Jackman et al., 2010) и (iii) изменениями в экспрессии множественных GPCRs и G белков и передаче сигналов кальция, вызываемой их лигандами, которые обладают потенциалом изменять взаимодействия астроцитов и нейронов (Hamby et al., 2012). Также появляется все больше доказательств того, что в ответ на медиаторы воспаления и цитокины реактивные астроциты могут модулировать свою экспрессию множества молекул, таких как медиаторы и переносчики ионов, нейромодуляторы, такие как оксид азота и простагландины, факторы роста и белки, регулирующие синапсы, которые могут влияние на синаптические и нейронные функции, включая сложное поведение, такое как болезненное поведение, боль, аппетит, сон и настроение, как более подробно рассматривается в другом месте (Sofroniew, 2013).Взятые вместе, такие находки предоставляют доказательства того, что различные молекулярные медиаторы и сигнальные механизмы, связанные с реактивным глиозом, могут модулировать функции реактивных астроцитов и микроглии различными способами, которые потенциально могут влиять на синаптические и другие нейронные функции в периметрах поражения. Такие сигнальные механизмы, вероятно, будут влиять на эффективность тренировок и функциональной реабилитации после острого повреждения, такого как травма или инсульт, а также на эффекторы для смягчения функционального ухудшения во время дегенеративных состояний.Понимание и управление сигнальными механизмами и эффектами реактивного глиоза в ткани периметра поражения может раскрыть новые терапевтические стратегии (Gleichman and Carmichael, 2013).
Гематоэнцефалический барьер (BBB)
BBB генерируется и регулируется сложной многоклеточной нервно-сосудистой единицей, которая включает критические взаимодействия между эндотелием, перицитами, астроцитами и другими клетками (Abbott et al., 2006; Zlokovic, 2008). Нарушение ГЭБ может происходить по-разному и в разной степени, начиная от конкретных событий передачи молекулярных сигналов, которые открывают проницаемость ГЭБ во время определенных типов реактивного глиоза, как обсуждалось выше (), до тяжелого разрушения ГЭБ, вызванного травматическим или ишемическим разрушением эндотелия. при необходимости неоваскуляризации ().Помимо явной травмы и ишемии, имеется немало доказательств того, что дисфункция ГЭБ играет центральную роль в старении и различных нейродегенеративных расстройствах. Напр., Дефицит перицитов, вызванный как трансгенами, так и связанный со старением, приводит к разрушению ГЭБ, которое предшествует дегенерации нейронов (Bell et al., 2010). Дефицит перицитов также очевиден в тканях, пораженных посмертным амиотрофическим боковым склерозом (Winkler et al., 2013), а дисфункция ГЭБ предшествует нейродегенерации на мышиной модели (Zhong et al., 2008). Полиморфизмы изоформ APOE участвуют в повышенной уязвимости к распаду ГЭБ при нейродегенеративных расстройствах и травматических повреждениях (Bell et al., 2012).
Независимо от триггерных событий утечка ГЭБ немедленно приводит к проникновению в паренхиму ЦНС сывороточных белков, таких как тромбин, альбумин, иммуноглобулины и протеазы (), которые могут иметь широкий спектр прямых и косвенных эффектов. Тромбин может передавать сигналы напрямую через рецепторы, активируемые протеазой, на различные клетки ЦНС, включая микроглию и астроциты (Shigetomi et al., 2008; Suo et al., 2002). Иммуноглобулины способствуют очищению от патогенов, но могут способствовать аутоиммунным дисфункциям. Тромбоциты могут входить и образовывать агрегаты для свертывания и высвобождения PDGF, важных для ремоделирования неоваскулярных сосудов, а также для передачи сигналов перицитам и клеткам NG2. Металлопротеазы действуют на несколько белков и способствуют ремоделированию внеклеточного матрикса и тканей (). Калликреиновые протеазы сыворотки активируют воспаление. Тканевые калликреины, которые могут взаимодействовать с сывороточными протеазами как часть более крупных протеолитических каскадов, вовлечены в патологию олигодендроцитов, демиелинизацию, аксонопатию и дегенерацию нейронов (Burda et al., 2013; Радулович и др., 2013). Серпины подавляют и уравновешивают эффекты протеазы ().
В ответ на сигналы, связанные с утечкой ГЭБ, местные глиальные клетки продуцируют цитокины и хемокины, которые привлекают лейкоциты, которые по прибытии производят дополнительные цитокины и хемокины. Результатом является богатая внеклеточная смесь молекулярных сигналов, которые могут инструктировать или влиять на несколько типов клеток в ядрах поражения, а также могут диффундировать в окружающую паренхиму ЦНС и влиять на нервные клетки, которые, возможно, не участвовали в начальном поражении ().Эти молекулярные градиенты могут влиять или принимать участие в формировании клеточных событий в периметрах поражения, таких как длительный градиент реактивного глиоза и длительное нейральное ремоделирование, которое происходит в ткани периметра. Сочетание молекулярных сигналов, генерируемых в ядрах поражения, со временем изменяется по мере того, как реакция на повреждение прогрессирует через разные фазы, и утечка ГЭБ восстанавливается, и разные типы клеток занимают эту область и продуцируют разные эффекторные молекулы (,). В зависимости от тяжести повреждения ядра поражения демонстрируют утечку ГЭБ от нескольких дней до двух недель в течение начального периода (фаза I) реакции на повреждение ().Ремонт BBB требует присутствия функциональных астроцитов (Bush et al., 1999). Высвобождение белка HMGB1 (группа с высокой подвижностью 1) реактивными астроцитами способствует ремоделированию неоваскулярных клеток эндотелия, тогда как блокада высвобождения HMGB1 реактивными астроцитами предотвращает ремоделирование неоваскулярных сосудов и усугубляет неврологический дефицит (Hayakawa et al., 2012). При сложных, хронических или диффузных поражениях утечки ГЭБ могут сохраняться и оказывать длительное воздействие на расширенные участки нервной ткани по периметру поражения (), а позднее разрушение ГЭБ может привести к вторичному повреждению ткани (Злокович, 2008).Даже когда утечки ГЭБ устранены, ядра поражений продолжают содержать скопления ненейральных клеток внутри ГЭБ, которые могут продолжать продуцировать высокие уровни множества различных сигнальных молекул в течение длительных периодов времени. Таким образом, сердцевина пораженной ткани может генерировать градиенты диффузии многих мощных молекул, которые распространяются в паренхиму соседней ткани и формируют градиенты молекулярных сигналов, которые влияют на клетки-хозяева (). Также следует отметить, что, хотя ГЭБ открыт, существует также возможность проникновения различных патоген-ассоциированных молекулярных паттернов (PAMP) (), которые генерируются микробными инфекциями на периферии и которые могут существенно изменить реакцию местных клеток на ЦНС. повреждение, даже если нет местной инфекции, как обсуждается ниже.
Проникающие лейкоциты
Лейкоциты, которые проникают из кровотока, являются основным источником молекулярной передачи сигналов во время реакции на повреждение ЦНС. Эти молекулярные сигналы включают разнообразную смесь цитокинов, хемокинов и факторов роста (), которые могут инструктировать и изменять функции локальной реактивной глии () и других внутренних клеток ЦНС, а также других локальных лейкоцитов. Вероятно, что молекулярные сигналы, производимые лейкоцитами, и их функциональные эффекты будут варьироваться в течение разных фаз ответа на острые или хронические инсульты () и варьироваться от сигналов, опосредующих классические воспалительные реакции с цитотоксической и фагоцитарной активностями, до сигналов, влияющих на восстановление тканей и ремоделирование.Хотя временные изменения во время реакции на рану еще недостаточно изучены, постепенно выявляются различные функциональные роли разных подтипов лейкоцитов. Например, в ответ на стимуляцию разными цитокинами моноциты генерируют макрофаги с различными функциональными фенотипами, которые продуцируют разные эффекторные молекулы (Mosser and Edwards, 2008). В ответ на INFγ классически активированные макрофаги генерируют цитотоксические противомикробные молекулы и фагоцитируют мертвые клетки и мусор (), тогда как в ответ на стимуляцию с помощью Il-4 или Il10 макрофаги принимают участие в заживлении и противовоспалительной активности (Mosser and Edwards, 2008). ).Точно так же Т-клетки, стимулированные разными цитокинами, становятся поляризованными по отношению к разным активностям, таким как клетки T H 1, T Reg и T H 17, которые могут оказывать очень разные эффекты, начиная от уничтожения клеток и заканчивая участием в восстановлении тканей ( MacIver et al., 2013; Mills, 2011; Walsh, Kipnis, 2011).
Влияние периферических инфекций на реакцию на поражение ЦНС
Многие типы клеток, отвечающие на повреждение ЦНС, чрезвычайно чувствительны к молекулярным сигналам, связанным с микробной инфекцией.Это неудивительно, потому что ограничение распространения инфекции, вероятно, повлияло на развитие реакции на травму во всех тканях, включая ЦНС. Различные особенности реакции на инфекцию, такие как выработка цитотоксинов и определенные типы воспаления, могут повредить клетки-хозяева, а также микробы. Запуск таких ответов при отсутствии явной инфекции может вызвать или усугубить повреждение тканей. Таким образом, определенные реакции, которые могут быть полезными при микробной инфекции, могут быть вредными, если они вызваны повреждением стерильной (неинфицированной) ткани после травмы, инсульта, дегенеративного заболевания или аутоиммунной атаки.В этом отношении важно понимать, что на реактивную глию, как микроглию, так и астроциты, которые отвечают на стерильное первичное поражение ЦНС, могут влиять периферические инфекции, которые генерируют высокие уровни циркулирующих цитокинов и других медиаторов воспаления, таких как LPS и другие PAMP. Эта передача сигналов может происходить через переносимые кровью цитокины или ЛПС, выделяемые в месте периферической инфекции и поступающие через дырявый ГЭБ в ядре повреждения во время фазы I реакции на повреждение после очаговых поражений или через утечки ГЭБ, вызванные нейродегенеративными или аутоиммунными процессами ().ЛПС и цитокины оказывают мощное воздействие как на реактивную микроглию (Perry, 2010; Perry et al., 2007), так и на реактивные астроциты (Hamby et al., 2012; Zamanian et al., 2012), которые могут влиять на профили транскриптомов и реакцию раны на провоспалительные и потенциально цитотоксические фенотипы в течение длительного времени способами, которые обычно не применяются при стерильных поражениях ЦНС, и которые могут усугубить повреждение тканей. С такими экспериментальными наблюдениями согласуются клинические эпидемиологические данные, указывающие на то, что периферические инфекции отрицательно влияют на неврологический исход после травмы спинного мозга (Failli et al., 2012).
Манипулирование реакциями раны ЦНС для ускорения репарации
По мере того, как клеточная биология и молекулярная сигнализация, лежащие в основе ответов на повреждение ЦНС, становятся определенными, появляется все больше возможностей для определения способов манипулирования этими реакциями для улучшения результата. Манипуляции, находящиеся в стадии интенсивного исследования, включают не только традиционные подходы, такие как разработка лекарств-кандидатов для парентеральной фармакологической доставки, но также изменения образа жизни, такие как снижение потребления энергии и осуществление стратегий упражнений, направленных на уменьшение воспалительных реакций, клеточной дегенерации и функционального снижения после инсульта и травматических повреждений. (Арумугам и др., 2010; Маттсон, 2012; Piao et al., 2013). Кроме того, новые интервенционные стратегии в форме имплантатов биоматериалов в качестве молекулярных депо для локальной молекулярной доставки, а также подходы к регенерации тканей, основанные на трансплантации клеток-предшественников или стволовых клеток, демонстрируют значительные перспективы для будущего применения в восстановлении и регенерации нейронов. Неневральные очаги очаговых поражений могут представлять особенно полезные мишени для таких подходов (). Например, имплантаты из биоматериалов, особенно в форме инъекционных гидрогелей, могут служить как каркасами, так и депо, которые могут влиять на ремоделирование тканей и клеточные функции (Pakulska et al., 2012). Крупные очаги поражения не нервной ткани после инсульта или тяжелой очаговой травмы могут представлять полезные места для размещения депо биоматериала, которые высвобождают градиенты молекул, чтобы воздействовать на локально окружающую нервную ткань без причинения дополнительных повреждений (). Например, депо гидрогеля для инъекций может обеспечивать устойчивую доставку различных видов биоактивных молекул, включая факторы роста или небольшие гидрофобные молекулы, чтобы влиять на экспрессию генов и функцию локальных клеток в течение продолжительных подострых периодов времени, после чего они разрушаются без существенного повреждения тканей (Пакульска и др. ., 2012; Song et al., 2012; Ян и др., 2009; Zhang et al., 2014). Такая молекулярная доставка может влиять не только на текущее восстановление в подостром периоде после травмы, такой как образование рубца, но также может влиять на клетки в зоне большого периметра вокруг поражений ЦНС, которые подвергаются постоянному ремоделированию ткани в течение продолжительных периодов времени после повреждения ткани () . Доставка молекул через депо, помещенные в ядра поражения, может влиять на пластичность нейронов и ремоделирование тканей в этой области периметра (Clarkson et al., 2010).
Поражения как мишени для терапевтических стратегийНеневральные ядра поражений (LC) представляют собой мишени для депо биоматериалов (A) или трансплантатов экзогенных нервных стволовых клеток / клеток-предшественников (B) или мезенхимальных стволовых клеток (C) в качестве потенциальных терапевтических стратегий . Молекулы, доставляемые депо биоматериала (A) или определенные клеточные трансплантаты (C), могут поддерживать и привлекать рост аксонов (стрелка a), модулировать клетки периметра поражения (PLP) (стрелка b), модулировать клетки в LC (стрелка c) ) модулировать или астроцитарный рубец (AS) (стрелка c).Новые нейроны, генерируемые трансплантатами стволовых клеток / клеток-предшественников, могут получать и отправлять нейронные соединения в PLP и за его пределами и могут быть способны формировать новые функциональные релейные цепи (B).
Различные подходы к регенерации клеток могут иметь потенциал для восстановления ЦНС (Bliss et al., 2007; Martino and Pluchino, 2006; Snyder and Teng, 2012). Доставка клеток-предшественников нервного клона или стволовых клеток в ядра поражения () может привести к генерации локальных нейронов, которые образуют афферентные и эфферентные связи с хозяином и могут образовывать функционально интегрированные схемы (Abematsu et al., 2010; Лу и др., 2012). Стромальные или мезенхимальные стволовые клетки, полученные из костного мозга или пуповины, доставленные периферической (внутрисосудистой) инъекцией или инъекцией в ЦНС, могут стать местом расположения участков повреждения (), где они могут высвобождать факторы роста, цитокины и другие факторы, которые могут влиять на реакцию на повреждение и процесс восстановления (Bliss et al., 2007; Kokaia et al., 2012; Lemmens, Steinberg, 2013). Такие исследования по прививке интенсивно проводятся, но все еще находятся на ранних стадиях разработки. Сообщается о положительных эффектах на клеточные события, такие как иммуномодуляция, выживаемость внутренних клеток ЦНС, включая нейроны, и рост аксонов, однако пока имеется ограниченная информация об общей функциональной эффективности.
Реактивный глиоз и многоклеточный ответ на повреждение и заболевание ЦНС
Abstract
Центральная нервная система (ЦНС) склонна к гетерогенным повреждениям различной этиологии, которые вызывают разносторонние реакции. Острые и очаговые травмы вызывают заживление ран с заменой тканей. Распространенные и хронические заболевания провоцируют постепенно нарастающие изменения тканей. Ответы на поражение ЦНС включают сложные взаимодействия между клетками многочисленных клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока.Вклад различных типов ненейрональных клеток в исход после острого повреждения или в прогрессирование хронического заболевания вызывает все больший интерес по мере того, как усиливается стремление к пониманию и облегчению поражений ЦНС. В одних случаях имеется значительный объем информации, в других — сравнительно мало информации, рассмотренной и рассмотренной здесь.
Введение
Основная цель современной неврологии — понять и облегчить широкий спектр заболеваний центральной нервной системы (ЦНС).С этой целью растет интерес к клеточным и молекулярным механизмам реакции ЦНС на повреждение, болезнь и восстановление. Нейроны являются основными клетками, выполняющими нервные функции, и долгое время находились в центре исследований механизмов, лежащих в основе расстройств ЦНС. Тем не менее, все больше данных указывает на то, что лечение всех типов расстройств ЦНС потребует более глубокого понимания того, как многоклеточные реакции на травмы и заболевания запускаются, развиваются, разрешаются (или нет) и влияют на функцию нейронов.
Способность восстанавливать ткани, поврежденные в результате травм, имеет фундаментальное значение для биологии позвоночных и имеет ключевое значение для выживания. Эволюционное давление, вероятно, привело к определенным фундаментальным клеточным и молекулярным ответам на повреждения, которые являются общими для разных тканей. Реакция на рану или повреждение кожи долгое время служила модельной системой для анализа механизмов восстановления ткани после острого очагового повреждения ткани и обеспечивала понимание основных клеточных и молекулярных взаимодействий (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999). Кроме того, существуют органоспецифические особенности. Присущие органу клетки, которые специализируются на регуляции воспаления и восстановлении тканей, становятся критическими элементами в органоспецифической реакции на воздействие. Специфические для органа особенности применяются, в частности, в ЦНС, где глиальные клетки, которые поддерживают цитоархитектуру и гомеостатическую регуляцию, без которых нейроны не могли бы нормально функционировать в здоровой ткани, также являются основными ответчиками на поражение ЦНС.Изменения функции глиальных клеток во время реакции на воздействие могут заметно повлиять на нейрональные взаимодействия и функции ЦНС.
Повреждения ЦНС вызываются разной этиологией, которая может вызывать широкий спектр реакций. Например, острые и очаговые травмы вызывают заживление ран с заменой тканей, тогда как диффузные и хронические заболевания могут вызывать постепенно нарастающие изменения тканей. Анализ сходств и различий в таких ответах может дать ценную информацию.Клеточные реакции на поражение ЦНС включают сложные взаимодействия между клетками множества клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока. Биология типов клеток, которые участвуют в ответах ЦНС на модели повреждений и болезней, обычно изучалась изолированно. Возрастает потребность в изучении взаимодействия различных клеток, чтобы понять механизмы. В этой статье исследуются и рассматриваются несколько типов клеток, участвующих в различных типах поражений ЦНС и способствующих им.В одних случаях доступна обширная информация, в других — сравнительно мало.
Терминология
Различные термины, используемые при обсуждении травм и заболеваний ЦНС, могут интерпретироваться по-разному. В этой статье мы определим и будем использовать определенные термины следующим образом. «Реактивный глиоз» будет относиться не только к микроглии и астроглии, но и к глиальным клеткам, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Глиальные клетки в здоровой ткани ЦНС не будут называться «покоящимися» или «покоящимися».Это устаревшая концепция. Глии очень активны в здоровой ЦНС и динамически выполняют сложные функции, которые играют критическую роль в нормальных функциях ЦНС (Barres, 2008; Sofroniew and Vinters, 2010). Например, астроциты проявляют физиологическую активацию в виде кратковременного, вызванного лигандами повышения внутриклеточного кальция ([Ca 2+ ] i ), что представляет собой тип возбудимости астроцитов, который интенсивно исследуется как потенциальный средства опосредования динамических функций астроцитов, включая взаимодействие с синапсами и регуляцию кровотока (Attwell et al., 2010; Халасса и Хейдон, 2010; Тонг и др., 2013; Верхратский и др., 1998). Микроглия выполняет важные роли в развитии и обновлении синапсов (Stephan et al., 2012; Stevens et al., 2007). Термин «активированный» часто используется в бинарной форме «все или ничего» для определения глиальных клеток, которые отреагировали на оскорбления. Мы считаем, что использование этого термина в такой манере неверно по двум причинам. Во-первых, он не осознает, что глия постоянно «активируется» в физиологическом контексте. Во-вторых, как обсуждалось в этом обзоре, ответы глиальных клеток на поражение ЦНС не являются бинарными, а очень разнообразны и специфически регулируются.Чтобы дифференцировать физиологическую активацию глиальных клеток в здоровом контексте от реакций, связанных с травмой или заболеванием, мы будем использовать термин «реактивный», который также означает широкий спектр потенциальных ответов глиальных клеток на поражение ЦНС. Наконец, мы будем избегать использования термина «шрам» как такового и вместо этого будем различать «астроцитарные рубцы», образующие компактные границы вокруг поражений тканей, и «фиброзные рубцы», образованные множественными типами неневральных клеток и внеклеточными клетками. матрица в ядрах поражения (как подробно обсуждается ниже).Мы будем приравнивать «глиальный шрам» к «шраму астроцита».
Многоклеточный ответ на поражение ЦНС
Прежде чем обсуждать различные типы ответов на повреждение и заболевание ЦНС, полезно вкратце представить различные типы клеток, участвующих в этих ответах. Для простоты рассмотрения мы сгруппировали клетки в соответствии с клонами как (i) нервные и ненейральные клетки, присущие ЦНС, и (ii) переносимые кровью ненейральные клетки, которые происходят в основном из костного мозга (2). Некоторые из этих типов клеток широко изучены при расстройствах ЦНС, другие — сравнительно мало.Чаще всего их изучали изолированно. В следующих разделах мы постараемся изучить их взаимодействие.
Таблица 1
Различные типы клеток в ответах ЦНС на повреждение и болезнь
| Внутренние клетки ЦНС: | Неневральные клетки, передающиеся через кровь: |
|---|---|
| Внутренние нервные клетки ЦНС: Нейроны Олигодендроциты Астроциты NG2-OPC Нервные стволовые клетки / клетки-предшественники Эпендима | Лейкоциты: Моноциты / макрофаги Нейтрофилы Эозинофилы NK-клетки Т-клетки B-клетки | Другие клетки, полученные из костного мозга: Тромбоциты (тромбоциты) Фиброциты Мезенхимные (стромальные) стволовые клетки 9 9000 9000 |
Внутренние нейронные клетки ЦНС Основные клетки нервного происхождения в ЦНС, нейроны, олигоденд роциты и астроциты были тщательно изучены и проанализированы в отношении их индивидуальных реакций на повреждение и заболевание ЦНС (Barres, 2008; Франклин и Френч-Констан, 2008; Маттсон, 2000; Софронев и Винтерс, 2010).Менее изучены глиальные клетки, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Подобно другим глиям, NG2-OPC покрывает ЦНС и отвечает на повреждения ЦНС (Nishiyama et al., 2009). Особенности ответа NG2-OPC включают миграцию в сторону повреждения и пролиферацию клеток (Franklin and Ffrench-Constant, 2008; Hughes et al., 2013). Помимо замещения потерянных олигодендроцитов (Sun et al., 2010), другие роли NG2-OPC в повреждении и заболевании ЦНС ожидают будущих исследований и выяснения.Кроме того, ЦНС взрослого человека содержит нервные стволовые клетки (НСК) с различной активностью, которые находятся в периэпендимных областях вдоль желудочков и центрального канала головного и спинного мозга взрослого человека (Garcia et al., 2004; Kriegstein and Alvarez-Buylla, 2009 г.). Эти взрослые NSC также могут реагировать на повреждение ЦНС и генерировать предшественники и клетки разных типов, которые мигрируют в места повреждения (Benner et al., 2013; Lagace, 2012; Meletis et al., 2008; Ohab and Carmichael, 2008).
Внутренние ненейральные клетки ЦНС
Различные клетки ненейрального происхождения, присущие ЦНС, играют решающую роль в повреждении и заболевании ЦНС ().Хорошо известно, что микроглия является высокочувствительными ранними ответчиками, которые стимулируют и рекрутируют другие клетки, а также фагоцитозный дебрис (Hanisch and Kettenmann, 2007; Kreutzberg, 1996; Nimmerjahn et al., 2005; Ransohoff and Perry, 2009). Клетки, связанные с фибробластами, включая периваскулярные фибробласты, менингеальные фибробласты и перициты, способствуют замещению тканей, формируя фиброзную рубцовую ткань после тяжелого повреждения (Goritz et al., 2011; Klapka and Muller, 2006; Logan and Berry, 2002; Soderblom et al., 2013; Винклер и др., 2011). Эндотелий и эндотелиальные предшественники играют важную роль во время замены тканей после повреждения ЦНС (Loy et al., 2002; Oudega, 2012) и вызывают растущий интерес в восстановлении ЦНС в свете их новой роли в качестве трофических поддерживающих клеток в развитии ЦНС (Dugas et al. , 2008), а также их способность продуцировать и представлять ламинин (Davis and Senger, 2005), предпочтительный субстрат для роста многих мигрирующих клеток и аксонов.
Неневральные клетки, передающиеся через кровь
Иммунные и воспалительные клетки различных типов (), передающиеся через кровь, играют важную роль в ответах ЦНС на повреждения и болезни, они были изучены и проанализированы (Perry, 2010; Popovich and Longbrake, 2008).Помимо хорошо известной роли в фагоцитозе и удалении мусора, в настоящее время появляется все больше доказательств того, что подтипы лейкоцитов играют активную роль в восстановлении тканей (Derecki et al., 2012; London et al., 2013; Popovich and Longbrake, 2008). ). После повреждения тромбоциты быстро агрегируются для образования сгустков и гемостаза. К другим переносимым кровью типам клеток костного мозга, которые являются причиной повреждения тканей, в том числе в ЦНС, относятся фиброциты (Aldrich and Kielian, 2011; Reilkoff et al., 2011) и мезенхимальные стволовые клетки костного мозга (Askari et al., 2003; Бьянко и др., 2001; Jaerve et al., 2012), но их функции не совсем понятны.
Внеклеточный матрикс (ECM)
ECM, генерируемый различными клетками, играет критическую роль в восстановлении и замене тканей после острых повреждений, а также в хроническом ремоделировании тканей во время хронических заболеваний (Midwood et al., 2004). Молекулы, которые модифицируют матрикс ECM, такие как metaloproteases (MMP), также важны в этом отношении (Midwood et al., 2004). В ЦНС ЕСМ, генерируемый различными типами клеток, реагирующих на повреждение или заболевание, может включать широкий спектр молекул, таких как ламинин, коллагены и гликопротеины, такие как хондроитин или гепарансульфат протеогликаны (CSPG или HSPG), которые участвуют как в поддержке восстановления тканей, так и а также способствуют нарушению регенерации аксонов (Davis and Senger, 2005; Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).
Ответ на очаговое поражение
Два основных типа острого очагового поражения ЦНС — очаговое травматическое повреждение и ишемический инсульт. Помимо того, что они являются серьезными клиническими проблемами, они на протяжении десятилетий служили прототипами экспериментальных моделей, с помощью которых можно было изучить механизмы реакции ЦНС на повреждение и восстановление. В этом разделе мы рассмотрим основные характеристики многоклеточных реакций ЦНС на острые очаговые повреждения и то, как они меняются с течением времени, используя в качестве моделей информацию о реакции на травму или инсульт.В этом отношении следует отметить, что острая очаговая травма, вызванная ушибом или раздавливанием, приводит к серьезному повреждению сосудов и, следовательно, имеет множество последствий, подобных инсульту. Мы проведем сравнения с острой раневой реакцией кожи как модельной системой для клеточных и молекулярных механизмов заживления ран (Greaves et al., 2013; Gurtner et al., 2008; Shechter and Schwartz, 2013; Singer and Clark, 1999). . Как и при восстановлении кожи, ответы ЦНС на острое очаговое повреждение также можно в общих чертах разделить на три перекрывающиеся, но отдельные фазы: (i) гибель клеток и воспаление, (ii) пролиферация клеток для замены тканей и (iii) ремоделирование тканей (3).Сначала мы исследуем реакцию ЦНС в контексте, когда острые оскорбления остаются незараженными и проходят. Ниже мы также кратко рассмотрим более хронические очаговые поражения ЦНС, включая очаговые инфекции с образованием абсцесса, первичные и вторичные опухоли и хронические очаговые аутоиммунные поражения, такие как бляшки рассеянного склероза, которые проявляют различные особенности и клеточные реакции, аналогичные травматическим и ишемическим повреждениям. . Чтобы представить краткое изложение клеточных ответов и взаимодействий, обсуждение информации о второстепенных молекулярных сигналах отложено до следующего раздела ниже.Следует упомянуть, что временные характеристики, приведенные для фаз реагирования и событий, являются обобщенными приближениями (), и существует большая вероятность перекрытия событий, а также вариаций продолжительности или времени в конкретных ситуациях.
Фазы и динамика многоклеточных реакций на острое очаговое повреждение ЦНСВо время периодов гибели клеток (A), замещения клеток (B) и ремоделирования тканей (C) происходят многочисленные перекрывающиеся события (D), которые включают взаимодействия между внутренними компонентами ЦНС. нервные клетки, внутренние ненейральные клетки ЦНС и клетки, проникающие из кровотока.
Фаза I: смерть и воспаление клеток
После очагового повреждения ткани ЦНС в результате воздействия, такого как травма или ишемия, которые вызывают острую локальную гибель клеток, первая фаза ответа в центре повреждения или ядре включает в себя оба очень быстрых события, которые происходят с течением времени. шкала от секунд до часов, и более постепенно прогрессирующие события, которые развиваются в течение нескольких дней (). Очень быстрые события включают гемостаз с каскадом коагуляции, агрегацию тромбоцитов и образование сгустка. За этими быстрыми событиями следуют перекрывающиеся последовательности ответов внутренних клеток ткани, рекрутирование воспалительных и иммунных клеток, подострая гибель паренхимных клеток и начало удаления мусора ().В здоровой ткани ЦНС большие и полярные молекулы в кровотоке исключены из диффузии в паренхиму ЦНС через гематоэнцефалический барьер (ГЭБ) (Abbott et al., 2006; Zlokovic, 2008). После очаговых поражений с повреждением ГЭБ, переносимые с кровью молекулы обычно исключаются из притока ЦНС и передачи сигналов в местные клетки, что более подробно обсуждается ниже в разделе о молекулярной передаче сигналов. Приток тромбоцитов быстро образует агрегаты для гемостаза, а также дает сигнал местным клеткам. Матрицы фибрина и коллагена начинают формироваться в течение периода от нескольких часов до дней, которые служат каркасом для нейтрофилов, а затем макрофагов и других лейкоцитов.Затем лейкоциты сильно инфильтрируют для отслеживания патогенов, удаления мусора и передачи молекулярных сигналов, участвующих в заживлении ран, в течение различного количества дней или дольше в зависимости от тяжести повреждения ткани или наличия обостряющих факторов () (Perry, 2010; Popovich and Longbrake, 2008). ). Эндогенные мезенхимальные стволовые клетки также могут проникать в ядро поражения, но их роль недостаточно изучена (Askari et al., 2003; Bianco et al., 2001; Jaerve et al., 2012). Эти основные клеточные события отражают классические реакции раны, обнаруживаемые в других тканях (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999).
Некоторые внутренние клетки ЦНС также быстро реагируют на повреждение ткани ЦНС или утечку ГЭБ. Исследования живых изображений в CNS in vivo показывают, что микроглия и NG2-OPC немедленно мигрируют в места повреждения тканей и утечки BBB (Hughes et al., 2013; Nimmerjahn et al., 2005). Астроциты, напротив, остаются in situ и не мигрируют ни в места повреждения, ни от них, но могут осмотически набухать и, в зависимости от тяжести повреждения или ишемии, могут погибнуть в центре тяжелых повреждений или могут стать реактивными и гипертрофия и в некоторых случаях пролиферация (Bardehle et al., 2013; Чжэн и др., 2010). Различные аспекты этой первой фазы ответа возникают в перекрывающихся последовательностях в течение первых нескольких дней, а затем начинают постепенно уменьшаться () при условии, что повреждение представляет собой единичное острое событие, не осложненное сдавлением костей, инфекцией или другими обострениями, которые могут продлить разрушительное повреждение. По мере ослабления острых ответов происходит совпадение с началом различных типов пролиферации клеток, связанных со следующей фазой ответов ().
Фаза II: пролиферация клеток и замещение ткани
Вторая фаза ответа на острое повреждение ткани ЦНС наступает примерно через два-десять дней после повреждения и характеризуется пролиферацией и локальной миграцией клеток, которые осуществляют восстановление и замену ткани.Эти клетки включают эндотелиальные клетки-предшественники, клетки линии фибробластов, различные типы воспалительных клеток, а также различные типы клеток-предшественников глии и нейронального происхождения, включая формирующие рубцы астроциты и их предшественники (). Некоторые из этих явлений клеточной пролиферации, такие как пролиферация эндотелия для неоваскуляризации (Casella et al., 2002) или пролиферация определенных клеток линии фибробластов или воспалительных клеток, отражают классические раневые реакции (Gurtner et al., 2008; Singer and Clark, 1999). , в то время как другие, такие как пролиферация рубцовых астроцитов, специфичны и уникальны для ЦНС.Эта фаза также характеризуется на протяжении всей ее продолжительности отсутствием ГЭБ в ядре поражения в период, когда поврежденные кровеносные сосуды заменяются новыми (). Как следствие, эндогенные (а также экзогенные) белки и другие заряженные молекулы могут свободно диффундировать в окружающую нервную паренхиму (Bush et al., 1999). Эти молекулы могут включать белки сыворотки (например, тромбин, альбумин), которые передают сигнал местным клеткам, иммуноглобулинам или молекулам, связанным с патогенами, как обсуждается ниже.Этот негерметичный ГЭБ создает возможность для ядра поражения служить источником циркулирующих молекул, которые генерируют градиенты молекулярной передачи сигналов, которые могут распространяться на значительные расстояния в нервную ткань вокруг поражения до тех пор, пока ГЭБ не будет восстановлен (,). Эта передача сигналов может вносить вклад в периметр сужающегося градиента реактивного глиоза и другие изменения, наблюдаемые в ткани вокруг зрелых поражений, как обсуждается ниже.
Поражения демонстрируют тканевые компартменты и градиенты передачи сигналов(A, B) Фокусное повреждение приводит к поражениям с отдельными тканевыми компартментами в виде ядер неневральных поражений (LC), недавно пролиферирующих компактных рубцов астроцитов (AS) и пери периметры поражения (PLP), которые демонстрируют уменьшающиеся градиенты реактивного глиоза, которые постепенно переходят в здоровую ткань (HT).AS резко разграничивают переход между ненейральными LC и PLP с жизнеспособными нервными клетками. Размер ядра поражения и расположение AS и этого перехода регулируются противоположными молекулярными сигналами. Градиенты молекулярных сигналов, исходящих от LC, воздействуют на клетки в PLP.
Во время фазы пролиферации образуются клеточные элементы, которые в зрелых поражениях образуют два из трех основных тканевых компартментов зрелого поражения, (i) центральное ядро поражения неневральной ткани и (ii) компактный рубец астроцитов, который окружает ядро поражения ().Основные клеточные компоненты ядра ненейрального поражения происходят из расширения внутренних периваскулярных фибробластов и перицитов ЦНС (Goritz et al., 2011; Soderblom et al., 2013) и от пролиферирующих предшественников эндотелия. Компактный рубец астроцитов формируется в основном из недавно пролиферирующих удлиненных астроцитов, генерируемых местными астроглиальными предшественниками, которые собираются по краям сильно поврежденной ткани, содержащей воспалительные клетки и клетки линии фибробластов () (Faulkner et al., 2004; Sofroniew and Vinters, 2010; Wanner и другие., 2013). Примечательно, что в этот пролиферативный период определяется расположение границ компактных рубцов астроцитов. В зрелых поражениях эти границы рубца астроцитов будут точно разграничивать и отделять сохраняющиеся области нефункциональной, не нервной ткани ядра поражения от непосредственно окружающей и потенциально функциональной нервной ткани (,). Клеточные и молекулярные механизмы, лежащие в основе определения того, где именно образуются границы таких рубцов астроцитов, изучены не полностью, но, вероятно, включают сложное взаимодействие и баланс молекулярных сигналов, которые, с одной стороны, способствуют фагоцитозу и очистке от мусора, а также сигнализируют об этом. с другой стороны, способствуют защите и сохранению здорового «я» (), что более подробно обсуждается ниже в разделе, посвященном молекулярным сигналам повреждения и гибели клеток.Несколько десятилетий экспериментальных исследований ишемических инфарктов показывают, что на окончательный размер поражения могут влиять подострые метаболические процессы, которые продолжаются от часов до дней в полутеневых зонах вокруг поражений (Astrup et al., 1981; Dirnagl et al., 1999; Lo, 2008). ). Кроме того, были идентифицированы внутренние сигнальные каскады астроцитов, которые играют критические роли (Herrmann et al., 2008; Okada et al., 2006; Wanner et al., 2013). Лучшее понимание многоклеточных и молекулярных взаимодействий, которые определяют расположение границ рубцов астроцитов вокруг участков поврежденной ткани, может привести к новым терапевтическим стратегиям для уменьшения размера поражения ().Эти события происходят в течение нескольких дней после оскорбления (), в течение которых вмешательство является реальной возможностью.
Недавние открытия также показывают, что во время пролиферативной фазы после острого повреждения ЦНС в переднем мозге нервные стволовые клетки в перивентрикулярных зародышевых зонах дают начало значительному количеству нейральных предшественников, которые мигрируют в места повреждения коры или полосатого тела (Carmichael, 2006; Kokaia et al., 2012; Lagace, 2012; Lindvall, Kokaia, 2006). Эти клетки образуют часть смеси клеток по периметру очага поражения ().Существуют различные доказательства, предполагающие, что эти клетки могут благотворно влиять на ремоделирование тканей в периповрежденной ткани, но природа вкладов, вносимых этими клетками, остается туманной. В нормальных, непредсказуемых обстоятельствах очень немногие вновь сгенерированные нейроны созревают и выживают, а другие потенциальные вклады этих интригующих мигрирующих клеток-предшественников такие вклады в иммунную регуляцию все еще находятся в процессе определения (Kokaia et al., 2012; Lagace , 2012).
Фаза III: Ремоделирование ткани
Третья фаза ответа на острое повреждение ткани обычно начинается ближе к концу первой недели после повреждения и отличается ремоделированием ткани, которое включает в себя события, которые завершаются в течение нескольких недель, такие как восстановление ГЭБ и организация рубца, а также хронические события, которые могут продолжаться в течение многих месяцев (). Восстановление или восстановление ГЭБ вдоль новообразованных кровеносных сосудов в районе поражения обычно завершается в течение нескольких недель после острого неосложненного поражения и требует присутствия функциональных астроцитов (Bush et al., 1999) и перицитов (Daneman et al., 2010; Winkler et al., 2011). Ядро поражения не нервной ткани оказывается окруженным хорошо организованным, пересекающимся компактным рубцом астроцитов через две-три недели после острого поражения, не усугубляемого продолжающимся повреждением ткани () (Wanner et al., 2013). Эти формирующие рубцы астроциты, по-видимому, активно загоняют и окружают воспалительные клетки и клетки клонов фибробластов во время ремоделирования тканей и образования рубцов (Wanner et al., 2013). Этот компактный рубец астроцитов образует структурную и функциональную границу между неневральной тканью в центре поражения и непосредственно прилегающей и окружающей нервной тканью, которая содержит все жизнеспособные клетки всех трех типов клеток нервного клона, астроциты, олигодендроциты и нейроны (,) (Ваннер и др., 2013). Эта граница рубца астроцита служит защитным барьером, который ограничивает миграцию воспалительных клеток из ядра ненейрального поражения в окружающую жизнеспособную нервную ткань. Нарушение образования рубцов астроцитов в различных моделях трансгенной потери функции приводит к увеличению размера поражения, повышенной гибели локальных нейронов, усилению демиелинизации и снижению восстановления функции после травматических или ишемических очаговых поражений (Bush et al., 1999; Faulkner et al., 2004; Herrmann et al., 2008; Ли и др., 2008; Wanner et al., 2013). После образования компактного рубца астроцита продолжается второй период ремоделирования ткани с постепенным ремоделированием ядра поражения, границы рубца астроцита и окружающих областей периметра (,). Например, со временем происходит постепенное сокращение ядер поражений и рубцов астроцитов. Поскольку перерезанные аксоны продолжают умирать обратно от повреждений, гибель олигодендроцитов может продолжаться, что приводит к локальным тканевым ответам и ремоделированию. Происходит длительное ремоделирование ECM в ядре поражения с модуляцией компонентов коллагена и гликопротеина (Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).Кроме того, происходит постепенное и хронически продолжающееся ремоделирование тканей в реактивных областях периметра, которые окружают зрелые поражения, как обсуждается далее.
Зрелые поражения демонстрируют три тканевых компартмента
Образование рубца астроцитов вокруг ядер центральных поражений по существу завершается через две-четыре недели после острого поражения, которое не осложняется длительным повреждением ткани, и в это время поражение можно считать зрелым и входящим в его хроническая стадия (,). В зрелых поражениях полезно распознавать три очень разных компартмента поражения: (i) центральное ядро поражения неневральной ткани, состоящее из клеток местного происхождения фибробластов, кровеносных сосудов, инфильтрирующих фиброцитов и воспалительных клеток и внеклеточного матрикса; (ii) компактный рубец астроцитов, который непосредственно окружает ядро поражения и состоит из плотно упакованных астроцитов с небольшим количеством нейронов или олигодендроцитов, если таковые имеются; и (iii) периметр периметра жизнеспособной нервной ткани, который примыкает к компактному рубцу астроцита и содержит все три типа клеток нервного клона (нейроны, олигодендроциты, астроциты) и демонстрирует сужающийся реактивный глиоз, который постепенно переходит в здоровую ткань ( ).Все эти компартменты будут подвергаться дальнейшему ремоделированию тканей в течение недель или месяцев. Некоторая часть этого ремоделирования может повлиять на функциональный результат и может обеспечить цели для терапевтических вмешательств, особенно в периметре нервной ткани, которая проявляет диффузный реактивный глиоз (,). Полезно рассмотреть отдельно эти компоненты и их влияние на функциональный результат.
Ядро поражения
Ткань в зрелом ядре поражения содержит мало или совсем не содержит клеток нервного клона и нефункциональна с неврологической точки зрения.Первоначально основные типы клеток в ядрах зрелых поражений включают клетки линии фибробластов, эндотелий, фиброциты и воспалительные клетки (). Со временем и при ремоделировании, а также при отсутствии обострения повреждения или инфекции воспалительные элементы будут постепенно исчезать, хотя некоторые из них могут сохраняться в течение длительного времени. Элементы ядра поражения будут постоянно сохраняться в виде фиброзного рубца, содержащего различные ненейральные клетки и ECM. В некоторых областях ядра поражения клетки и ECM будут отступать, оставляя заполненные жидкостью кисты весьма различного размера () (Tuszynski and Steward, 2012).Функционально клетки и ECM ядра поражения служат субстратами для быстрого заживления ран и замещения тканей. Предполагается, что скорость закрытия раны, обеспечиваемая фиброзным замещением по сравнению с обновлением паренхимы, дает преимущества в других тканях (Greaves et al., 2013; Gurtner et al., 2008; Singer and Clark, 1999). Тем не менее, этот механизм может привести к потере функций тканей. Считается, что в ЦНС поврежденная сердцевина ткани с 19 по века оказывает долгосрочное негативное функциональное воздействие как препятствие для регенерации аксонов, что также подтверждается недавними исследованиями (Zukor et al., 2013). Молекулярные оценки показывают, что ядро ECM поражения содержит коллагены и протеогликаны, которые плохо поддерживают или явно подавляют повторный рост поврежденных аксонов (Hermanns et al., 2006; Kimura-Kuroda et al., 2010; Klapka and Muller, 2006; Yoshioka et al., 2010). ).
Компактные рубцы астроцитов (глиальные рубцы)
Зрелые рубцы астроцитов состоят из относительно узких зон вновь образовавшихся астроцитов с удлиненными отростками, которые сильно переплетаются и переплетаются и которые сразу же примыкают и окружают со всех сторон участки сердцевины пораженной ткани () (Sofroniew и Винтерс, 2010; Ваннер и др., 2013). Эти узкие зоны плотно переплетенных удлиненных астроцитов, образующих рубцы, обычно не более миллиметра в поперечнике и обычно лишены других клеток нервного клона (нейронов или олигодендроцитов) (Wanner et al., 2013). Эти формирующие рубцы астроциты вновь пролиферируют в ответ на инсульт, и плотность упаковки тел клеток астроцитов в рубцах астроцитов, по крайней мере, вдвое больше, чем в здоровой ткани (Wanner et al., 2013). Плотно упакованные удлиненные астроциты, образующие рубцы, плавно и быстро переходят в менее плотно упакованные и менее плотно переплетенные гипертрофические реактивные астроциты, которые перемешаны с жизнеспособными нейронами и другими элементами нервной ткани в окружающем периметре реактивной нервной ткани, обсуждаемой ниже () (Ваннер и другие., 2013). Исследования трансгенной потери функции показывают, что недавно пролиферирующие компактные рубцы астроцитов обладают важными нейропротекторными функциями, ограничивая распространение воспалительных клеток вдали от поражений тканей, вызванных травмой, инсультом и аутоиммунным воспалением. Когда образование рубцов астроцитов экспериментально предотвращается или ослабляется in vivo , воспаление распространяется, размер поражения увеличивается, потеря нейронов и демиелинизация усугубляются, а функциональное восстановление ухудшается (Bush et al., 1999; Дрогемюллер и др., 2008; Фолкнер и др., 2004; Wanner et al., 2013). Астроциты, образующие рубцы, также широко считаются, если не главным препятствием для регенерации аксонов после повреждения ЦНС, частично на основании исследований in vitro , показывающих продукцию астроцитами определенных протеогликанов, которые могут ингибировать удлинение (Silver et al., 1993 ). Тем не менее, другие исследования показывают, что регенерация аксонов in vivo происходит вдоль мостиков астроцитов, и что в отсутствие таких мостов регенерация аксонов не происходит и, по-видимому, больше затрудняется конфронтацией с тканью ядра, не связанной с нервным поражением (Kawaja and Gage , 1991; Уильямс и др., 2013; Зукор и др., 2013). Исследования потери функции трансгенных животных, проведенные in vivo , могут помочь прояснить точную природу и масштаб эффектов, оказываемых формирующими шрамы астроцитами на возобновление роста аксонов после травмы.
Периметры периметров поражения
Все зрелые ядра поражений и рубцы астроцитов окружены периметрами жизнеспособной нервной ткани, которая демонстрирует градиент сужающегося реактивного глиоза, который постепенно переходит в здоровую ткань () (Wanner et al., 2013). Ткань в этих зонах периметра содержит все типы клеток нервного клона, включая нейроны и олигодендроциты, и эти клетки перемешаны с реактивным глиозом, который может распространяться на значительные расстояния ().Реактивная ткань периметра начинается непосредственно рядом с компактными рубцами астроцитов, где удлиненные клеточные отростки рубцовых астроцитов перекрываются с гипертрофическими реактивными астроцитами и реактивной микроглией, которые перемешаны с выжившими жизнеспособными нейронами и другими элементами нервной ткани (). Примечательно, что жизнеспособные нейроны могут присутствовать в пределах нескольких сотен мкм компактных рубцов астроцитов, а центральная ткань поражения, заполненная потенциально цитотоксическими воспалительными элементами, находится чуть дальше (Bush et al., 1999; Wanner et al., 2013). Реактивный глиоз по периметру включает гипертрофические реактивные астроциты и микроглию (). Причина и функции периметров сужающегося реактивного глиоза не ясны. Что касается причины, возможно, что градиенты сигнальных молекул, диффундирующих из ядра поражения, либо входящие в период утечки ГЭБ, либо продуцируемые инфильтрирующими и пролиферирующими клетками, могут запускать такой градиент постепенно сужающихся ответов среди локальной глии (1). .С функциональной точки зрения, еще предстоит определить степень, в которой конкретные аспекты этого реактивного глиоза являются полезными или вредными (или их комбинацией).
Реактивные области периметра вокруг ядер поражения в головном и спинном мозге, вероятно, будут демонстрировать долгосрочное и потенциально интенсивное ремоделирование ткани с образованием новых синапсов и потенциалом для формирования новых цепей реле (Bareyre et al., 2004; Carmichael, 2006; Clarkson et al., 2010; Courtine et al., 2008; Li et al., 2010; Overman et al., 2012). На ремоделирование синапсов и цепей потенциально могут влиять многочисленные факторы, включая молекулы внеклеточного матрикса, такие как протеогликаны в перинейронах (Garcia-Alias et al., 2009). Реактивная глия может играть важную роль в этом ремоделировании, но эта тема недостаточно изучена. В здоровой ЦНС астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными способами (Halassa and Haydon, 2010).И астроциты, и микроглия потенциально могут играть фундаментальную роль в ремоделировании синапсов в периметре поражения (Stephan et al., 2012; Stevens et al., 2007), и влияние реактивного глиоза на такое ремоделирование еще не изучено. Такие периметральные области периметра, вероятно, обеспечат благодатную почву для инвестирования новых стратегий для вмешательств, которые могут повлиять на нейронную пластичность и формирование релейных цепей, что в сочетании с соответствующей реабилитационной тренировкой (van den Brand et al., 2012) могут благотворно повлиять на функциональный результат.
Хронические очаговые поражения
Помимо острой очаговой травмы и инсульта, которые часто служат моделями для изучения механизмов повреждения ЦНС, как только что обсуждалось, другие, более хронические формы повреждения заслуживают рассмотрения. Важные хронические инсульты включают очаговые инфекции с образованием абсцесса, опухоли и аутоиммунные поражения. Все эти состояния вызывают реактивный глиоз и многоклеточные реакции, которые имеют большое сходство с теми, которые возникают после острого очагового повреждения.Этот многоклеточный ответ играет решающую роль в развитии, серьезности и разрешении (или нет) оскорблений.
Инфекция
Очаговые инфекции или абсцессы могут образовываться при инфицировании травматических ран или могут быть засеяны спонтанно, особенно у лиц с ослабленным иммунитетом. Такие инфекции вызывают реактивный глиоз с образованием рубцов астроцитов, аналогичным таковому после острой очаговой травмы (Sofroniew and Vinters, 2010). Продолжительность сохранения поражения и ремоделирования тканей является длительной и зависит от разрешения инфекции.Исследования трансгенной потери функции показывают, что образование рубцов астроцитов имеет решающее значение для локального сдерживания инфекции. Когда рубцы астроцитов разрушаются, инфекция и воспаление быстро распространяются через прилегающую нервную ткань с разрушительными эффектами (Drogemuller et al., 2008).
Рак
Как первичные, так и метастатические опухоли вызывают реактивный глиоз и многоклеточные реакции, которые имеют сходство с другими формами очагового повреждения тканей. Взаимодействие опухолевых клеток с глией ЦНС и инфильтрирующими воспалительными клетками является сложным и сильно зависит от типа опухолевых клеток.Неинвазивные опухоли окружены реактивным глиозом и инкапсулирующим рубцом, аналогичным тому, который наблюдается вокруг травматического повреждения ткани. Агрессивно инвазивные опухоли не инкапсулированы и не окружены четко выраженными рубцами астроцитов, но вызывают другие формы реактивного глиоза и многоклеточные реакции. Считается, что успешная инфильтрация и распространение определенных типов опухолевых клеток связаны с их способностью создавать среду для роста, васкуляризации и распространения, что может включать успешную нейтрализацию барьерных функций местных клеток ЦНС и кооптации программ для создания пролиферативных ниш. (Луи, 2006; Сильвер и др., 2013; Уоткинс и Сонтхаймер, 2012).
Аутоиммунное заболевание
Очаговые аутоиммунные поражения интересно рассматривать с точки зрения реакции на повреждение ЦНС. Хотя аутоиммунное заболевание ЦНС часто рассматривается как диффузное, хроническое и вызвано, в первую очередь, дисфункцией периферической иммунной системы, отдельные аутоиммунные поражения имеют много общего с острыми очаговыми травматическими ранами. Например, активные бляшки рассеянного склероза заполнены воспалительными клетками, а хронические бляшки демонстрируют ядра центральных поражений, которые лишены всех типов клеток нервного клона (без нейронов, олигодендроцитов или астроцитов), окруженные астроцитарными рубцами, которые отделяют неневральную ткань от периметров реактивных клеток. глиоз в ткани со всеми тремя типами нервных клеток (Frohman et al., 2006; Lucchinetti et al., 1996) способами, подобными повреждению тканей, вызванному травмой или ишемией (,). Оптический нейромиелит (NMO) — это аутоиммунное воспалительное заболевание, при котором причинные аутоантитела направлены против аквапорина-4 на клеточной мембране астроцитов, а поражения NMO связаны с опосредованным комплементом литическим разрушением астроцитов (Lennon et al., 2005; Popescu и Лучинетти, 2012). Существует замечательное совпадение между клиническими данными из NMO и экспериментальными исследованиями потери функции, демонстрирующими, что трансгенно-опосредованная абляция или ослабление рубцовых астроцитов приводит к тяжелому обострению аутоиммунного воспаления ЦНС (Haroon et al., 2011; Voskuhl et al., 2009). Таким образом, как клинические, так и экспериментальные данные указывают на критическую роль рубцовых астроцитов в ограничении распространения аутоиммунного воспаления ЦНС. Эти наблюдения убедительно свидетельствуют о том, что дисфункция внутренних клеток ЦНС, таких как астроциты, может причинно способствовать возникновению или прогрессированию аутоиммунных состояний ЦНС способами, которые обычно не рассматриваются в исследованиях, сосредоточенных только на попытке определить причинные механизмы периферической иммунной системы. Это представление может быть дополнительно подтверждено предположениями, что подгруппа пациентов с рассеянным склерозом имеет связанные с заболеванием аутоантитела против калиевого канала Kir4.1, который в ЦНС располагается на мембранах астроцитов (Srivastava et al., 2012). Было бы интересно определить степень, в которой усиление или потеря функций астроцитов способствует патофизиологии аутоиммунных состояний ЦНС.
Ответ на диффузное поражение
Диффузное поражение ткани ЦНС может быть связано с нейродегенеративными заболеваниями, некоторыми судорожными расстройствами или легкой черепно-мозговой травмой. Диффузные инсульты изначально имеют тенденцию быть менее интенсивными, чем острые очаговые повреждения, вызванные травмой или инсультом, и могут первоначально не вызывать явного повреждения тканей, а вместо этого постепенно накапливаться в течение хронических периодов времени.По мере того, как повреждение ткани становится более серьезным, образуются небольшие отдельные поражения, каждое из которых вызывает реактивный глиоз и многоклеточные реакции, аналогичные тем, которые вызваны острым повреждением ткани с разрушением ГЭБ, воспалением и привлечением лейкоцитов (,), но на меньшем уровне. шкала. Со временем диффузное повреждение начинает напоминать диффузное скопление множества мелких очаговых поражений, которые перемешаны и могут распространяться на большие площади (). Каждое из этих небольших поражений дает начало собственным периметру периметра поражения зон сужающегося реактивного глиоза, в результате чего перекрывающиеся зоны тяжелого гипертрофического реактивного глиоза и многоклеточных реакций могут быть распределены на больших участках ткани (2).Важно понимать, что эти многочисленные небольшие поражения перемежаются между жизнеспособными нейронами и нейронными цепями, которые охватываются этими перекрывающимися периметрами периметров реактивного глиоза (2). Как обсуждалось выше, в настоящее время имеются существенные доказательства участия астроцитов и микроглии в нормальной функции нервной цепи, но влияние реактивного глиоза на такие функции неизвестно. В контексте диффузных поражений ЦНС большие области функционирующей нервной ткани могут подвергаться интенсивному реактивному глиозу, который, вероятно, повлияет на синаптические взаимодействия и функции нервных цепей (2).Лучшее понимание таких эффектов может открыть путь к новым терапевтическим стратегиям.
Диффузное повреждение ткани приводит к расширенным областям реактивного глиоза(A) Небольшие хронические инсульты могут приводить к диффузному повреждению ткани с образованием рассеянных небольших ядер поражений (LC), астроцитарных рубцов (AS) и периметров периповреждений (PLP) которые могут перекрываться и сливаться в области смежного реактивного глиоза, которые могут распространяться на большие площади.
(B) Реактивные астроциты и реактивная микроглия в PLP могут по-разному влиять на синапсы и нейронные функции.
Нейродегенеративное заболевание
Реактивный глиоз и многоклеточные реакции запускаются по-разному и избирательно при разных нейродегенеративных заболеваниях. В некоторых случаях пусковым механизмом может быть накопление внеклеточных токсинов, таких как β-амилоид при болезни Альцгеймера (БА) (Prokop et al., 2013; Zlokovic, 2011), которые могут накапливаться и вызывать множество небольших очаговых повреждений тканей, которые вызывают глиоз, во многом схожий с другими формами диффузных поражений (). В других случаях пусковым механизмом может быть повреждение или смерть нейронов или синапсов, вторичные по отношению к внутренним изменениям нейронов.Некоторые состояния, такие как боковой амиотрофический склероз (БАС) или болезнь Хантингтона, вызывают внутренние клеточные изменения как в нейронах, так и в глии, могут нарушать клеточные функции и взаимодействия, которые могут служить триггерами (Boillee et al., 2006; Maragakis and Rothstein, 2006). . Нейродегенеративные инсульты также могут приводить к нарушению сосудисто-нервного аппарата, что приводит к утечке ГЭБ, что может служить дополнительным триггером для реактивного глиоза, а также сигналом для рекрутирования воспалительных клеток, переносимых кровью (Zlokovic, 2008, 2011).Во многих случаях реактивный глиоз и многоклеточные реакции могут не проявляться в начале или на ранних стадиях нейродегенеративных состояний, но проявляться позже и затем участвовать в прогрессировании заболевания. Реактивный глиоз, вызванный различными способами, либо накоплением аномальных белков, ишемическим или травматическим клеточным повреждением, либо микробами, также может привести к утечке ГЭБ через специфические молекулярные сигнальные каскады, как обсуждается ниже, с последующим воспалением, которое может способствовать прогрессированию заболевания.
Вклад глиальных клеток и реактивного глиоза в нейродегенеративные состояния сложен и только начинает изучаться. Глия не только реагирует на дегенеративные сигналы, о которых говорилось выше, но также может участвовать в борьбе с ними. Например, считается, что и микроглия, и астроциты способствуют очищению от β-амилоида (Prokop et al., 2013; Wyss-Coray et al., 2003), а ослабление реактивного астроглиоза может увеличивать нагрузку β-амилоида на модели трансгенных мышей. нашей эры (Крафт и др., 2013). Кроме того, на глию могут влиять молекулярные дефекты, вызывающие заболевание, и она становится дисфункциональной, что еще больше затрудняет попытки понять роль реактивного глиоза в процессе болезни. Например, при БАС дисфункция глиальных клеток причинно участвует в опосредовании дегенерации нейронов (Yamanaka et al., 2008), а продолжающийся реактивный глиоз и воспаление, как полагают, также вносят вклад в прогрессирование заболевания (Maragakis and Rothstein, 2006). Различия между вызванными заболеванием дисфункциями глиальных клеток и реактивными реакциями, которые запускаются в глиальных клетках повреждением клеток и тканей, иногда размыты или уравниваются, но не должны быть такими.Понимание этих различных явлений и способов их взаимодействия может иметь важные последствия для понимания механизмов, лежащих в основе клеточной патофизиологии и ведущих к прогрессированию заболевания. Важно помнить, что, хотя некоторые аспекты реактивности глии могут способствовать прогрессированию заболевания, другие, вероятно, будут защитными. Определение молекулярной основы таких различий может помочь определить новые терапевтические стратегии.
В контексте нейродегенеративного заболевания также интересно вкратце рассмотреть возможность неавтономной нейрональной дегенерации, вызванной дисфункцией глии или других ненейронных клеток.Генетические мутации с потерей или усилением функции в микроглии (Derecki et al., 2012) или астроцитах (Brenner et al., 2001; Rothstein, 2009; Tao et al., 2011) потенциально могут вызывать неклеточно-автономные дегенерация разных типов нейронов при различных заболеваниях человека и экспериментальных моделях на животных. Такие наблюдения показывают, что дисфункция глиальных клеток может быть первичным причинным событием при определенных неврологических состояниях. Такие наблюдения также повышают вероятность того, что дисфункция определенных аспектов реактивного глиоза во время реакции на поражение ЦНС может усугубить повреждение или привести к ухудшению восстановления тканей и худшему исходу.Возможность генетического полиморфизма влиять на функции глиальных клеток и реакцию на повреждение ЦНС — это еще не изученная область, которая может выявить причинные факторы, лежащие в основе различий в ответах разных людей на, казалось бы, схожие типы и тяжести поражений ЦНС.
Эпилепсия
Астроциты и микроглия могут участвовать в эпилепсии множеством способов. Астроциты играют множество критических ролей в регуляции активности синапсов и возбудимости нейронов, а астроциты могут играть решающую роль в генерации судорожной активности (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). Кроме того, реактивный глиоз как микроглии, так и астроцитов является характерной особенностью нервной ткани с хронической эпилепсией, которая также может проявлять распад ГЭБ и многоклеточное воспаление (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). ). С увеличением потери нейронов наступает тканевой склероз, который имеет сходство с тяжелым диффузным астроглиозом из-за других причин, как обсуждалось выше, со многими более мелкими тканевыми поражениями, окруженными континуумом околоповрежденной ткани со смесью выживших нейронов и все более тяжелой гипертрофией. глиоз ().Влияние реактивного глиоза и многоклеточного ответа на повреждение ткани на выжившие нейроны в периметре периметра поражения недостаточно изучено (), но может способствовать снижению пороговых значений приступов. Селективная экспериментальная индукция реактивности астроцитов связана со снижением ингибирования в локальных нейронах гиппокампа (Ortinski et al., 2010). Требуется дополнительная работа в этой области.
Диффузная черепно-мозговая травма (ЧМТ)
Крупные очаговые поражения, вызванные тяжелой очаговой ЧМТ (ушиб или раздавливание), обсуждались выше.Тем не менее, клинически значимая ЧМТ часто бывает диффузной и широко распространенной. Клеточные и молекулярные механизмы диффузной ЧМТ, которая вызывает функциональные нарушения без крупных очаговых поражений, изучены не полностью. Диффузная ЧМТ обычно характеризуется небольшими очагами разрушения сосудов и повреждения тканей, которые могут диффузно распространяться на большие участки ЦНС (DeKosky et al., 2013; McIntosh et al., 1989). Интересно учитывать, что каждая из этих небольших областей тканевого или клеточного повреждения может представлять собой небольшое очаговое повреждение с отделениями, эквивалентными сердцевине, рубцу астроцита и периметру, которое может распространяться на большие области без очевидной единственной большой очаговой области ().Как обсуждалось выше, чередующиеся жизнеспособные нервные ткани во многих перекрывающихся периметрах периметра поражения будут подвергаться интенсивному гипертрофическому реактивному глиозу и воспалению, которое может влиять на нервные функции (2). Специфические клеточные и молекулярные механизмы реактивного глиоза и многоклеточных ответов, запускаемых легкой или умеренной диффузной ЧМТ, только начинают охарактеризовываться. Недавно пролиферирующие реактивные астроциты выполняют защитные функции, необходимые для выживания нейронов (Myer et al., 2006). Микроглия может оказывать широкий спектр эффектов в зависимости от конкретных молекулярных стимулов, которые либо защищают, либо усугубляют потерю ткани (Hanisch and Kettenmann, 2007). Понимание и управление реактивным глиозом и многоклеточными последствиями, вызванными легкой и умеренной ЧМТ, имеет огромный потенциал для определения новых терапевтических целей в области большого эпидемиологического значения. Новые молекулярные механизмы обсуждаются в следующем разделе.
Молекулярная передача сигналов и многоклеточные взаимодействия
Молекулярная передача сигналов между различными типами клеток, которые отвечают на поражение ЦНС, сложна, комбинаторна и тесно переплетена.Различные клетки обладают способностью продуцировать одинаковые наборы молекул и отвечать на них, и есть намеки на то, что некоторые молекулы могут координировать многоклеточные ответы. Было идентифицировано множество межклеточных сигнальных молекул, но мы находимся на ранних стадиях определения того, как эти множественные сигналы регулируют многоклеточные взаимодействия и временную прогрессию от одной фазы к другой во время ответов на специфические поражения ЦНС. Здесь мы предоставляем общий обзор молекулярных функциональных классов () и несколько репрезентативных примеров многих конкретных молекул, которые регулируют или влияют на клеточные реакции ЦНС на оскорбления ().
Многомолекулярная регуляция и дифференцированные ответы на повреждение(A) Ответы на повреждение ЦНС регулируются и зависят от различных категорий молекулярных сигналов, происходящих от многих типов внутренних и внешних клеток ЦНС.
(B) Низкие уровни АТФ, высвобождаемые клетками во время легких поражений ЦНС, могут действовать через (i) рецепторы P2X, чтобы вызвать быстрый хемотаксис микроглиальных процессов, и (ii) рецепторы P2Y на местных астроцитах, чтобы вызвать передачу сигналов кальция и коннексин-зависимый ATP высвобождение, которое может повышать уровень внеклеточного АТФ и тем самым усиливать этот «опасный» сигнал.
(C) После тяжелой травмы сигнальные молекулы от «измененного я» и «здорового я» соперничают, чтобы сбалансировать очистку от мусора и сохранение жизнеспособной ткани. Сильно поврежденные или мертвые клетки высвобождают ряд гидрофобных внутриклеточных молекул (слева) или «аларминов», которые выражают молекулярные структуры, связанные с повреждением (DAMP). Эти «опасные» сигналы предупреждают клетки врожденного иммунитета ЦНС о повреждении тканей и способствуют удалению мусора за счет активации рецепторов распознавания образов на фагоцитарных иммунных клетках (в центре).Жизнеспособные внутренние клетки ЦНС на границах поражения (справа) экспрессируют связанные с мембраной и растворимые нейроиммунные регуляторные молекулы для предотвращения атаки и фагоцитоза иммунных клеток.
Таблица 2
Основные классы и несколько конкретных примеров межклеточных сигнальных молекул, которые регулируют клеточные реакции на повреждение ЦНС
| Класс | Молекула | Источник | Пораженный отсек | Фаза | Цели и эффекты |
|---|---|---|---|---|---|
| Протеаза и родственные ей | Тромбин | S | LC, AS | I | Образование сгустка; пролиферация астроцитов |
| MMP-9 | M, O, S | LC, AS, PLP | I – III | пролиферация OPC, ремиелинизация; Утечка BBB; неоваскулярное ремоделирование | |
| Калликреины | A, M, N, S | LC, AS, PLP | I – III | Провоспалительные; демиелинизация | |
| Серпины | A, M, O | LC, PLP | I – III | Ингибировать вредную протеазу | |
| NTs | ATP Glutamate | N, O, A | LC, AS, AS, PLP | I | Хемотаксис микроглии; реактивный астроглиоз |
| DAMPs | Alarmins: HMGB1, S100s, DNA | Поврежденные клетки | LC, PLP | I.II | Сигналы «Измененное я»; провоспалительный; увеличить фагоцитоз |
| PAMPs: LPS | Микробы | LC, PLP | I. II | Сигналы «несамо захватчика»; провоспалительный; увеличить фагоцитоз | |
| Факторы роста Морфогены | FGF | A, N, E, | LC, AS, PLP | I — III | Фиброзный рубец; ECM; неоваскулярное ремоделирование; реактивный астроглиоз |
| VEGF | E, P, F, A | LC, AS | I – III | BBB проницаемость; неоваскулярное ремоделирование | |
| PDGF-B PDGF-A | E, A | LS, PLP | I – III | Неоваскулярное ремоделирование Ремиелинизация; Пролиферация OPC | |
| Эндотелин, EGF, BMP | N, A, O | LC, AS | II, III | Пролиферация астроцитов, образование глиального рубца | |
| Цитокины Хемокины | TGFβ, MGFβ | , LAS, PLP | I – III | Образование фиброзного рубца; Производство ECM; пролиферация астроцитов | |
| IL-1β, TNFα, INFγ | A, M, L | LC, AS, | I, II | Провоспалительная регуляция | |
| IL-6 | A, M, L | I, II | Лейкоциты, образование рубцов астроцитов | ||
| NIRegs | CD141 | A, O, E | LC, AS | I – III | Защита здорового себя; разрешение воспаления |
| CD200, CD47 | N | LC, AS, PLP | I, II | Защита здорового себя | |
| Нейронное ремоделирование | Нейротрофины, BDNF и т. д. | N, A | PLP | III | Ремоделирование синапсов |
| Перинейронная сеть | A, OPC | PLP | III | Ограничить прорастание терминала | |
| Thmbs 902, C1q | MPLP | III | Формирование и обрезка синапсов |
Повреждение и смерть клеток
Мертвые, умирающие или временно поврежденные, но восстанавливаемые клетки высвобождают или экспрессируют молекулы, которые сигнализируют о повреждении.Эти молекулы делятся на множество категорий, включая нейротрансмиттеры, цитокины, хемокины, нейроиммунные регуляторы (NI-Reg) и молекулярные паттерны, связанные с опасностью (DAMP), которые стимулируют реактивный глиоз и другие клеточные реакции, включая очищение от мусора иммунными клетками () (). Оскорбления разного типа и степени тяжести высвобождают различные комбинации этих молекул, которые, в свою очередь, вызывают разные реакции. Например, легкие клеточные инсульты могут незначительно повышать внеклеточные концентрации глутамата или АТФ, которые привлекают отростки микроглиальных клеток, не вызывая вначале полномасштабного воспаления () (Davalos et al., 2005; Лю и др., 2009). АТФ может также вызывать кальциевые ответы в астроцитах и вызывать зависимое от коннексина высвобождение АТФ, которое увеличивает внеклеточные уровни АТФ и усиливает этот «опасный» сигнал (). Более серьезное повреждение или гибель клеток приведет к высвобождению дополнительных DAMP и аларминов в форме цитозольного и ядерного содержимого, такого как K +, белков теплового шока, таких как Aβ-кристаллин, кальций-связывающих белков семейства S100, ДНК-связывающих HMGB1 (группа с высокой подвижностью, блок 1 ), а также ДНК и РНК. Все эти молекулы могут служить сигналами «опасности», предупреждающими клетки врожденного иммунитета о повреждении тканей и способствующими удалению клеточного мусора «измененного собственного» посредством активации рецепторов распознавания образов (PRR) на фагоцитарных клетках врожденного иммунитета () (Chan et al., 2012; Гриффитс и др., 2010; Коно и Рок, 2008). Молекулы, такие как бета-амилоид (Aβ), образующиеся во время нейродегенеративных расстройств, также могут действовать как алармины (). Один тип алармина может связывать несколько классов PPR. Например, HMBG1 вызывает провоспалительную передачу сигналов посредством активации множественных TLR, RAGE (рецептор конечных продуктов гликирования) и MAC1 (антигенный комплекс макрофагов-1) (Chan et al., 2012; Gao et al., 2011) и S100 активирует несколько TLR и RAGE (Chan et al., 2012).
Здоровые нейроны и глия вблизи поражений ЦНС экспрессируют нейроиммунные регуляторные молекулы (NI-Regs) и белки самозащиты, которые сигнализируют о «здоровом я» и служат для ограничения потенциально вредной провоспалительной передачи сигналов и предотвращения фагоцитоза жизнеспособных клеток () () (Griffiths и др., 2010). Эти молекулярные сигналы «здорового себя» включают как мембраносвязанные, так и растворимые молекулы NI-Reg. Например, сиаловые кислоты (SA) в мембранах здоровых клеток взаимодействуют с рецепторами SA (SAR), включая Siglecs, на клетках врожденного иммунитета и служат сигналами «не ешь меня» () (Varki and Gagneux, 2012).CD200 и CD47 аналогичным образом действуют через рецепторы CD200R и SIRP-α на воспалительные клетки, предотвращая фагоцитарную атаку () (Griffiths et al., 2010). Белки, регулирующие комплемент (CRP), могут снижать активацию комплемента () (Griffiths et al., 2010). Тромбомодулин (CD141) связывает и изолирует HMGB1, тем самым снижая биодоступность алармина () (Abeyama et al., 2005).
Таким образом, специфические опосредованные рецептором сигналы, указывающие на «измененное я» или «здоровое я», могут адаптировать природу реактивного глиоза и многоклеточные реакции к типу и тяжести клеточного повреждения или смерти ().Важно отметить, что конечный уровень клеточного повреждения, вызванного всевозможными оскорблениями, частично определяется продолжительными периодами различных типов вторичных событий (), включая балансирующее действие между врожденными иммунными механизмами, которые регулируют выведение «измененных» «я», мусор и «чужие» патогены, сохраняя при этом «здоровое я» () (Griffiths et al., 2010). Эти события будут влиять на окончательный размер, расположение глиального рубца и передачу сигналов по периметру очага поражения ().
Реактивный глиоз
Реактивный глиоз регулируется большим набором различных внеклеточных сигналов, генерируемых после поражения ЦНС.Этот массив включает не только молекулы, высвобождаемые поврежденными или мертвыми клетками, как только что описано, но также молекулы, поступающие через протекающий ГЭБ, молекулы, высвобождаемые инфильтрацией лейкоцитов, и молекулы, высвобождаемые локальными клетками, включая сами реактивные глии () (Sofroniew, 2009). В ответ на это множество различных и часто комбинаторных молекулярных сигналов реактивная глия изменяет экспрессию, структуру и функцию своих генов избирательным и специфическим образом в зависимости от типа и тяжести повреждений и в зависимости от конкретных комбинаций молекулярных сигналов, которые на них воздействуют. .Важно подчеркнуть, что глия не существует в простых «покоящихся» или «активированных» состояниях «все или ничего» и что не существует единой программы «реактивного глиоза», которая запускалась бы по принципу «все или ничего». и одинаков во всех ситуациях. Вместо этого реактивная глия может демонстрировать широкий спектр ответов, определяемых комбинациями определенных сигнальных событий. Например, воздействие PAMP, таких как липополисахарид (LPS), может заметно исказить транскриптом реактивных астроцитов в сторону хемокинов, цитотоксичности и воспаления (Hamby et al., 2012; Заманян и др., 2012). Также следует отметить, что различные комбинации стимулирующих факторов могут приводить к синергическим изменениям в молекулярной экспрессии, которые невозможно предсказать на основании индивидуальных эффектов (Hamby et al., 2012).
Многоклеточная и многомолекулярная регуляция реактивного глиоза и ГЭБ(A) Реактивный глиоз может индуцироваться, регулироваться и зависеть от множества молекулярных сигналов, которые могут происходить из многих типов внутренних и внешних источников ЦНС.
(B) Проницаемость ГЭБ может регулироваться специфическими молекулярными сигнальными каскадами, включающими взаимодействия между разными типами клеток, которые сходятся в эндотелиальных плотных контактах (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013).
Информация об эффектах, опосредованных реактивной глией в ответ на специфические сигналы, также неуклонно растет, и очевидно, что многие аспекты реактивного глиоза являются частью скоординированных многоклеточных врожденных и адаптивных иммунных ответов на поражение ЦНС.Интересно отметить, что определенные молекулы становятся потенциальными координаторами многоклеточных ответов. Один интересный набор сходящихся данных предполагает, что IL-1β является ключевым триггером, который стимулирует различные типы глиальных клеток, чтобы модулировать проницаемость BBB для белков сыворотки и лейкоцитов во время реактивного глиоза в ответ на поражение ЦНС (2). Многочисленные DAMP и PAMP, генерируемые поражением ЦНС, будут стимулировать высвобождение IL-1β из микроглии, и этот IL-1β будет стимулировать (i) локальные реактивные астроциты высвобождать VEGF и (ii) локальные NG2-OPCs высвобождать MMP-9, которые в Turn влияет на плотные контакты и барьерные свойства местных эндотелиальных клеток и позволяет проникать сывороточным белкам (включая IgG и сигнальные белки, такие как тромбин, альбумин, протеазы и т. д.)) и лейкоцитов в локальную паренхиму ЦНС () (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013). Проникающие лейкоциты могут генерировать больше IL-1β и поддерживать локальную проницаемость ГЭБ, создавая потенциал для петли прямой связи при неблагоприятных обстоятельствах. Понимание молекулярных механизмов, посредством которых такая передача сигналов подавляется и закрытие ГЭБ, может помочь выявить рациональные терапевтические вмешательства при определенных состояниях. Восстановление ГЭБ после неосложненной острой травмы обычно происходит в течение нескольких недель ().
Образование рубцов астроцитов
Формирование компактных рубцов астроцитов — это особый аспект реактивного астроглиоза, который возникает в ответ на тяжелое повреждение тканей и инфильтрацию лейкоцитов и включает фазы пролиферации и организации клеток () (Sofroniew and Vinters, 2010; Wanner et al. др., 2013). Молекулярные сигналы, которые регулируют сигналы пролиферации астроцитов после повреждения ЦНС, могут происходить от белков сыворотки или местных клеток и включать тромбин, эндотелин, FGF2, АТФ, BMP (костные морфогенные белки), SHH (звуковой изгородь) и другие () (Gadea et al., 2008; Нари и др., 2003; Сахни и др., 2010; Сиракава и др., 2010; Сирко и др., 2013). На расположение границ рубцов астроцитов вокруг очагов поражения могут влиять взаимодействия между пролиферирующими или вновь пролиферирующими рубцообразующими астроглиями, клетками, связанными с фибробластами, и воспалительными клетками (Wanner et al., 2013), а также трансгенными манипуляциями с внутренней сигнализацией астроцитов. каскады с участием STAT3, SOCS3 или NFκB, которые могут увеличивать или уменьшать размеры поражения (Brambilla et al., 2005; Herrmann et al., 2008; Окада и др., 2006; Wanner et al., 2013) с указанием целей для потенциального вмешательства. Сигналы для организации вновь пролиферирующих астроцитов в компактные рубцы включают сигнальную систему рецептора IL-6-STAT3, которая критически регулирует образование рубцов астроцитов после травмы, инфекции и аутоиммунного воспаления (Drogemuller et al., 2008; Haroon et al., 2011; Herrmann et al., 2008; Wanner et al., 2013).
Ремоделирование нервной ткани в периметре поражения
Реактивный глиоз не только важен в ответах на очень локальное повреждение ЦНС, но также, вероятно, играет важную роль в ремоделировании нервной системы, которое продолжается в течение длительного времени в периметре поражения после острого очагового поражения. оскорбления, такие как инсульт и травма (,), а также при хронических диффузных поражениях ЦНС (), включая нейродегенеративные состояния, такие как болезнь Альцгеймера.Такие периметральные области периметра поражения могут простираться на значительные расстояния от крупных очаговых поражений (,) или могут охватывать большие области диффузного повреждения ткани (). В таких случаях связанный с ним реактивный глиоз может повлиять на значительные территории функционирующей нервной ткани. Появляется все больше доказательств того, что разнообразные изменения в молекулярной передаче сигналов, связанные с этим диффузным реактивным глиозом (), будут влиять на продолжающееся ремоделирование нервной системы и изменения нейронной функции. Астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными прямыми и косвенными способами, в том числе путем модуляции внеклеточного баланса ионов, передатчиков и воды, критически важных для нейронной функции, а также прямого влияния на синаптическую активность. напрямую через выпуск «глиотрансмиттеров»; (Halassa, Haydon, 2010; Hamilton, Attwell, 2010; Henneberger et al., 2010; Вольтерра и Мелдолези, 2005). Микроглия также участвует в регуляции синаптического обмена (Stephan et al., 2012). Молекулы перинейрональной сети, такие как протеогликаны хондроитинсульфата, генерируемые астроцитами и NG2-OPC, влияют на синаптическую пластичность (Wang and Fawcett, 2012). Влияние реактивного глиоза на такие функции только начинается, но сообщалось, что реактивный астроглиоз по-разному влияет на нервные функции, в том числе (i) за счет подавления глютаминсинтазы астроцитов, что связано со снижением тормозных синаптических токов. в локальных нейронах (Ortinski et al., 2010), (ii) повышенная экспрессия xCT (Slc7a11), переносчика цистеина-глутамата, связанная с усилением передачи сигналов глутамата, судорогами и эксайтотоксичностью (Buckingham et al., 2011; Jackman et al., 2010) и (iii) изменениями в экспрессии множественных GPCRs и G белков и передаче сигналов кальция, вызываемой их лигандами, которые обладают потенциалом изменять взаимодействия астроцитов и нейронов (Hamby et al., 2012). Также появляется все больше доказательств того, что в ответ на медиаторы воспаления и цитокины реактивные астроциты могут модулировать свою экспрессию множества молекул, таких как медиаторы и переносчики ионов, нейромодуляторы, такие как оксид азота и простагландины, факторы роста и белки, регулирующие синапсы, которые могут влияние на синаптические и нейронные функции, включая сложное поведение, такое как болезненное поведение, боль, аппетит, сон и настроение, как более подробно рассматривается в другом месте (Sofroniew, 2013).Взятые вместе, такие находки предоставляют доказательства того, что различные молекулярные медиаторы и сигнальные механизмы, связанные с реактивным глиозом, могут модулировать функции реактивных астроцитов и микроглии различными способами, которые потенциально могут влиять на синаптические и другие нейронные функции в периметрах поражения. Такие сигнальные механизмы, вероятно, будут влиять на эффективность тренировок и функциональной реабилитации после острого повреждения, такого как травма или инсульт, а также на эффекторы для смягчения функционального ухудшения во время дегенеративных состояний.Понимание и управление сигнальными механизмами и эффектами реактивного глиоза в ткани периметра поражения может раскрыть новые терапевтические стратегии (Gleichman and Carmichael, 2013).
Гематоэнцефалический барьер (BBB)
BBB генерируется и регулируется сложной многоклеточной нервно-сосудистой единицей, которая включает критические взаимодействия между эндотелием, перицитами, астроцитами и другими клетками (Abbott et al., 2006; Zlokovic, 2008). Нарушение ГЭБ может происходить по-разному и в разной степени, начиная от конкретных событий передачи молекулярных сигналов, которые открывают проницаемость ГЭБ во время определенных типов реактивного глиоза, как обсуждалось выше (), до тяжелого разрушения ГЭБ, вызванного травматическим или ишемическим разрушением эндотелия. при необходимости неоваскуляризации ().Помимо явной травмы и ишемии, имеется немало доказательств того, что дисфункция ГЭБ играет центральную роль в старении и различных нейродегенеративных расстройствах. Напр., Дефицит перицитов, вызванный как трансгенами, так и связанный со старением, приводит к разрушению ГЭБ, которое предшествует дегенерации нейронов (Bell et al., 2010). Дефицит перицитов также очевиден в тканях, пораженных посмертным амиотрофическим боковым склерозом (Winkler et al., 2013), а дисфункция ГЭБ предшествует нейродегенерации на мышиной модели (Zhong et al., 2008). Полиморфизмы изоформ APOE участвуют в повышенной уязвимости к распаду ГЭБ при нейродегенеративных расстройствах и травматических повреждениях (Bell et al., 2012).
Независимо от триггерных событий утечка ГЭБ немедленно приводит к проникновению в паренхиму ЦНС сывороточных белков, таких как тромбин, альбумин, иммуноглобулины и протеазы (), которые могут иметь широкий спектр прямых и косвенных эффектов. Тромбин может передавать сигналы напрямую через рецепторы, активируемые протеазой, на различные клетки ЦНС, включая микроглию и астроциты (Shigetomi et al., 2008; Suo et al., 2002). Иммуноглобулины способствуют очищению от патогенов, но могут способствовать аутоиммунным дисфункциям. Тромбоциты могут входить и образовывать агрегаты для свертывания и высвобождения PDGF, важных для ремоделирования неоваскулярных сосудов, а также для передачи сигналов перицитам и клеткам NG2. Металлопротеазы действуют на несколько белков и способствуют ремоделированию внеклеточного матрикса и тканей (). Калликреиновые протеазы сыворотки активируют воспаление. Тканевые калликреины, которые могут взаимодействовать с сывороточными протеазами как часть более крупных протеолитических каскадов, вовлечены в патологию олигодендроцитов, демиелинизацию, аксонопатию и дегенерацию нейронов (Burda et al., 2013; Радулович и др., 2013). Серпины подавляют и уравновешивают эффекты протеазы ().
В ответ на сигналы, связанные с утечкой ГЭБ, местные глиальные клетки продуцируют цитокины и хемокины, которые привлекают лейкоциты, которые по прибытии производят дополнительные цитокины и хемокины. Результатом является богатая внеклеточная смесь молекулярных сигналов, которые могут инструктировать или влиять на несколько типов клеток в ядрах поражения, а также могут диффундировать в окружающую паренхиму ЦНС и влиять на нервные клетки, которые, возможно, не участвовали в начальном поражении ().Эти молекулярные градиенты могут влиять или принимать участие в формировании клеточных событий в периметрах поражения, таких как длительный градиент реактивного глиоза и длительное нейральное ремоделирование, которое происходит в ткани периметра. Сочетание молекулярных сигналов, генерируемых в ядрах поражения, со временем изменяется по мере того, как реакция на повреждение прогрессирует через разные фазы, и утечка ГЭБ восстанавливается, и разные типы клеток занимают эту область и продуцируют разные эффекторные молекулы (,). В зависимости от тяжести повреждения ядра поражения демонстрируют утечку ГЭБ от нескольких дней до двух недель в течение начального периода (фаза I) реакции на повреждение ().Ремонт BBB требует присутствия функциональных астроцитов (Bush et al., 1999). Высвобождение белка HMGB1 (группа с высокой подвижностью 1) реактивными астроцитами способствует ремоделированию неоваскулярных клеток эндотелия, тогда как блокада высвобождения HMGB1 реактивными астроцитами предотвращает ремоделирование неоваскулярных сосудов и усугубляет неврологический дефицит (Hayakawa et al., 2012). При сложных, хронических или диффузных поражениях утечки ГЭБ могут сохраняться и оказывать длительное воздействие на расширенные участки нервной ткани по периметру поражения (), а позднее разрушение ГЭБ может привести к вторичному повреждению ткани (Злокович, 2008).Даже когда утечки ГЭБ устранены, ядра поражений продолжают содержать скопления ненейральных клеток внутри ГЭБ, которые могут продолжать продуцировать высокие уровни множества различных сигнальных молекул в течение длительных периодов времени. Таким образом, сердцевина пораженной ткани может генерировать градиенты диффузии многих мощных молекул, которые распространяются в паренхиму соседней ткани и формируют градиенты молекулярных сигналов, которые влияют на клетки-хозяева (). Также следует отметить, что, хотя ГЭБ открыт, существует также возможность проникновения различных патоген-ассоциированных молекулярных паттернов (PAMP) (), которые генерируются микробными инфекциями на периферии и которые могут существенно изменить реакцию местных клеток на ЦНС. повреждение, даже если нет местной инфекции, как обсуждается ниже.
Проникающие лейкоциты
Лейкоциты, которые проникают из кровотока, являются основным источником молекулярной передачи сигналов во время реакции на повреждение ЦНС. Эти молекулярные сигналы включают разнообразную смесь цитокинов, хемокинов и факторов роста (), которые могут инструктировать и изменять функции локальной реактивной глии () и других внутренних клеток ЦНС, а также других локальных лейкоцитов. Вероятно, что молекулярные сигналы, производимые лейкоцитами, и их функциональные эффекты будут варьироваться в течение разных фаз ответа на острые или хронические инсульты () и варьироваться от сигналов, опосредующих классические воспалительные реакции с цитотоксической и фагоцитарной активностями, до сигналов, влияющих на восстановление тканей и ремоделирование.Хотя временные изменения во время реакции на рану еще недостаточно изучены, постепенно выявляются различные функциональные роли разных подтипов лейкоцитов. Например, в ответ на стимуляцию разными цитокинами моноциты генерируют макрофаги с различными функциональными фенотипами, которые продуцируют разные эффекторные молекулы (Mosser and Edwards, 2008). В ответ на INFγ классически активированные макрофаги генерируют цитотоксические противомикробные молекулы и фагоцитируют мертвые клетки и мусор (), тогда как в ответ на стимуляцию с помощью Il-4 или Il10 макрофаги принимают участие в заживлении и противовоспалительной активности (Mosser and Edwards, 2008). ).Точно так же Т-клетки, стимулированные разными цитокинами, становятся поляризованными по отношению к разным активностям, таким как клетки T H 1, T Reg и T H 17, которые могут оказывать очень разные эффекты, начиная от уничтожения клеток и заканчивая участием в восстановлении тканей ( MacIver et al., 2013; Mills, 2011; Walsh, Kipnis, 2011).
Влияние периферических инфекций на реакцию на поражение ЦНС
Многие типы клеток, отвечающие на повреждение ЦНС, чрезвычайно чувствительны к молекулярным сигналам, связанным с микробной инфекцией.Это неудивительно, потому что ограничение распространения инфекции, вероятно, повлияло на развитие реакции на травму во всех тканях, включая ЦНС. Различные особенности реакции на инфекцию, такие как выработка цитотоксинов и определенные типы воспаления, могут повредить клетки-хозяева, а также микробы. Запуск таких ответов при отсутствии явной инфекции может вызвать или усугубить повреждение тканей. Таким образом, определенные реакции, которые могут быть полезными при микробной инфекции, могут быть вредными, если они вызваны повреждением стерильной (неинфицированной) ткани после травмы, инсульта, дегенеративного заболевания или аутоиммунной атаки.В этом отношении важно понимать, что на реактивную глию, как микроглию, так и астроциты, которые отвечают на стерильное первичное поражение ЦНС, могут влиять периферические инфекции, которые генерируют высокие уровни циркулирующих цитокинов и других медиаторов воспаления, таких как LPS и другие PAMP. Эта передача сигналов может происходить через переносимые кровью цитокины или ЛПС, выделяемые в месте периферической инфекции и поступающие через дырявый ГЭБ в ядре повреждения во время фазы I реакции на повреждение после очаговых поражений или через утечки ГЭБ, вызванные нейродегенеративными или аутоиммунными процессами ().ЛПС и цитокины оказывают мощное воздействие как на реактивную микроглию (Perry, 2010; Perry et al., 2007), так и на реактивные астроциты (Hamby et al., 2012; Zamanian et al., 2012), которые могут влиять на профили транскриптомов и реакцию раны на провоспалительные и потенциально цитотоксические фенотипы в течение длительного времени способами, которые обычно не применяются при стерильных поражениях ЦНС, и которые могут усугубить повреждение тканей. С такими экспериментальными наблюдениями согласуются клинические эпидемиологические данные, указывающие на то, что периферические инфекции отрицательно влияют на неврологический исход после травмы спинного мозга (Failli et al., 2012).
Манипулирование реакциями раны ЦНС для ускорения репарации
По мере того, как клеточная биология и молекулярная сигнализация, лежащие в основе ответов на повреждение ЦНС, становятся определенными, появляется все больше возможностей для определения способов манипулирования этими реакциями для улучшения результата. Манипуляции, находящиеся в стадии интенсивного исследования, включают не только традиционные подходы, такие как разработка лекарств-кандидатов для парентеральной фармакологической доставки, но также изменения образа жизни, такие как снижение потребления энергии и осуществление стратегий упражнений, направленных на уменьшение воспалительных реакций, клеточной дегенерации и функционального снижения после инсульта и травматических повреждений. (Арумугам и др., 2010; Маттсон, 2012; Piao et al., 2013). Кроме того, новые интервенционные стратегии в форме имплантатов биоматериалов в качестве молекулярных депо для локальной молекулярной доставки, а также подходы к регенерации тканей, основанные на трансплантации клеток-предшественников или стволовых клеток, демонстрируют значительные перспективы для будущего применения в восстановлении и регенерации нейронов. Неневральные очаги очаговых поражений могут представлять особенно полезные мишени для таких подходов (). Например, имплантаты из биоматериалов, особенно в форме инъекционных гидрогелей, могут служить как каркасами, так и депо, которые могут влиять на ремоделирование тканей и клеточные функции (Pakulska et al., 2012). Крупные очаги поражения не нервной ткани после инсульта или тяжелой очаговой травмы могут представлять полезные места для размещения депо биоматериала, которые высвобождают градиенты молекул, чтобы воздействовать на локально окружающую нервную ткань без причинения дополнительных повреждений (). Например, депо гидрогеля для инъекций может обеспечивать устойчивую доставку различных видов биоактивных молекул, включая факторы роста или небольшие гидрофобные молекулы, чтобы влиять на экспрессию генов и функцию локальных клеток в течение продолжительных подострых периодов времени, после чего они разрушаются без существенного повреждения тканей (Пакульска и др. ., 2012; Song et al., 2012; Ян и др., 2009; Zhang et al., 2014). Такая молекулярная доставка может влиять не только на текущее восстановление в подостром периоде после травмы, такой как образование рубца, но также может влиять на клетки в зоне большого периметра вокруг поражений ЦНС, которые подвергаются постоянному ремоделированию ткани в течение продолжительных периодов времени после повреждения ткани () . Доставка молекул через депо, помещенные в ядра поражения, может влиять на пластичность нейронов и ремоделирование тканей в этой области периметра (Clarkson et al., 2010).
Поражения как мишени для терапевтических стратегийНеневральные ядра поражений (LC) представляют собой мишени для депо биоматериалов (A) или трансплантатов экзогенных нервных стволовых клеток / клеток-предшественников (B) или мезенхимальных стволовых клеток (C) в качестве потенциальных терапевтических стратегий . Молекулы, доставляемые депо биоматериала (A) или определенные клеточные трансплантаты (C), могут поддерживать и привлекать рост аксонов (стрелка a), модулировать клетки периметра поражения (PLP) (стрелка b), модулировать клетки в LC (стрелка c) ) модулировать или астроцитарный рубец (AS) (стрелка c).Новые нейроны, генерируемые трансплантатами стволовых клеток / клеток-предшественников, могут получать и отправлять нейронные соединения в PLP и за его пределами и могут быть способны формировать новые функциональные релейные цепи (B).
Различные подходы к регенерации клеток могут иметь потенциал для восстановления ЦНС (Bliss et al., 2007; Martino and Pluchino, 2006; Snyder and Teng, 2012). Доставка клеток-предшественников нервного клона или стволовых клеток в ядра поражения () может привести к генерации локальных нейронов, которые образуют афферентные и эфферентные связи с хозяином и могут образовывать функционально интегрированные схемы (Abematsu et al., 2010; Лу и др., 2012). Стромальные или мезенхимальные стволовые клетки, полученные из костного мозга или пуповины, доставленные периферической (внутрисосудистой) инъекцией или инъекцией в ЦНС, могут стать местом расположения участков повреждения (), где они могут высвобождать факторы роста, цитокины и другие факторы, которые могут влиять на реакцию на повреждение и процесс восстановления (Bliss et al., 2007; Kokaia et al., 2012; Lemmens, Steinberg, 2013). Такие исследования по прививке интенсивно проводятся, но все еще находятся на ранних стадиях разработки. Сообщается о положительных эффектах на клеточные события, такие как иммуномодуляция, выживаемость внутренних клеток ЦНС, включая нейроны, и рост аксонов, однако пока имеется ограниченная информация об общей функциональной эффективности.
Реактивный глиоз и многоклеточный ответ на повреждение и заболевание ЦНС
Abstract
Центральная нервная система (ЦНС) склонна к гетерогенным повреждениям различной этиологии, которые вызывают разносторонние реакции. Острые и очаговые травмы вызывают заживление ран с заменой тканей. Распространенные и хронические заболевания провоцируют постепенно нарастающие изменения тканей. Ответы на поражение ЦНС включают сложные взаимодействия между клетками многочисленных клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока.Вклад различных типов ненейрональных клеток в исход после острого повреждения или в прогрессирование хронического заболевания вызывает все больший интерес по мере того, как усиливается стремление к пониманию и облегчению поражений ЦНС. В одних случаях имеется значительный объем информации, в других — сравнительно мало информации, рассмотренной и рассмотренной здесь.
Введение
Основная цель современной неврологии — понять и облегчить широкий спектр заболеваний центральной нервной системы (ЦНС).С этой целью растет интерес к клеточным и молекулярным механизмам реакции ЦНС на повреждение, болезнь и восстановление. Нейроны являются основными клетками, выполняющими нервные функции, и долгое время находились в центре исследований механизмов, лежащих в основе расстройств ЦНС. Тем не менее, все больше данных указывает на то, что лечение всех типов расстройств ЦНС потребует более глубокого понимания того, как многоклеточные реакции на травмы и заболевания запускаются, развиваются, разрешаются (или нет) и влияют на функцию нейронов.
Способность восстанавливать ткани, поврежденные в результате травм, имеет фундаментальное значение для биологии позвоночных и имеет ключевое значение для выживания. Эволюционное давление, вероятно, привело к определенным фундаментальным клеточным и молекулярным ответам на повреждения, которые являются общими для разных тканей. Реакция на рану или повреждение кожи долгое время служила модельной системой для анализа механизмов восстановления ткани после острого очагового повреждения ткани и обеспечивала понимание основных клеточных и молекулярных взаимодействий (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999). Кроме того, существуют органоспецифические особенности. Присущие органу клетки, которые специализируются на регуляции воспаления и восстановлении тканей, становятся критическими элементами в органоспецифической реакции на воздействие. Специфические для органа особенности применяются, в частности, в ЦНС, где глиальные клетки, которые поддерживают цитоархитектуру и гомеостатическую регуляцию, без которых нейроны не могли бы нормально функционировать в здоровой ткани, также являются основными ответчиками на поражение ЦНС.Изменения функции глиальных клеток во время реакции на воздействие могут заметно повлиять на нейрональные взаимодействия и функции ЦНС.
Повреждения ЦНС вызываются разной этиологией, которая может вызывать широкий спектр реакций. Например, острые и очаговые травмы вызывают заживление ран с заменой тканей, тогда как диффузные и хронические заболевания могут вызывать постепенно нарастающие изменения тканей. Анализ сходств и различий в таких ответах может дать ценную информацию.Клеточные реакции на поражение ЦНС включают сложные взаимодействия между клетками множества клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока. Биология типов клеток, которые участвуют в ответах ЦНС на модели повреждений и болезней, обычно изучалась изолированно. Возрастает потребность в изучении взаимодействия различных клеток, чтобы понять механизмы. В этой статье исследуются и рассматриваются несколько типов клеток, участвующих в различных типах поражений ЦНС и способствующих им.В одних случаях доступна обширная информация, в других — сравнительно мало.
Терминология
Различные термины, используемые при обсуждении травм и заболеваний ЦНС, могут интерпретироваться по-разному. В этой статье мы определим и будем использовать определенные термины следующим образом. «Реактивный глиоз» будет относиться не только к микроглии и астроглии, но и к глиальным клеткам, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Глиальные клетки в здоровой ткани ЦНС не будут называться «покоящимися» или «покоящимися».Это устаревшая концепция. Глии очень активны в здоровой ЦНС и динамически выполняют сложные функции, которые играют критическую роль в нормальных функциях ЦНС (Barres, 2008; Sofroniew and Vinters, 2010). Например, астроциты проявляют физиологическую активацию в виде кратковременного, вызванного лигандами повышения внутриклеточного кальция ([Ca 2+ ] i ), что представляет собой тип возбудимости астроцитов, который интенсивно исследуется как потенциальный средства опосредования динамических функций астроцитов, включая взаимодействие с синапсами и регуляцию кровотока (Attwell et al., 2010; Халасса и Хейдон, 2010; Тонг и др., 2013; Верхратский и др., 1998). Микроглия выполняет важные роли в развитии и обновлении синапсов (Stephan et al., 2012; Stevens et al., 2007). Термин «активированный» часто используется в бинарной форме «все или ничего» для определения глиальных клеток, которые отреагировали на оскорбления. Мы считаем, что использование этого термина в такой манере неверно по двум причинам. Во-первых, он не осознает, что глия постоянно «активируется» в физиологическом контексте. Во-вторых, как обсуждалось в этом обзоре, ответы глиальных клеток на поражение ЦНС не являются бинарными, а очень разнообразны и специфически регулируются.Чтобы дифференцировать физиологическую активацию глиальных клеток в здоровом контексте от реакций, связанных с травмой или заболеванием, мы будем использовать термин «реактивный», который также означает широкий спектр потенциальных ответов глиальных клеток на поражение ЦНС. Наконец, мы будем избегать использования термина «шрам» как такового и вместо этого будем различать «астроцитарные рубцы», образующие компактные границы вокруг поражений тканей, и «фиброзные рубцы», образованные множественными типами неневральных клеток и внеклеточными клетками. матрица в ядрах поражения (как подробно обсуждается ниже).Мы будем приравнивать «глиальный шрам» к «шраму астроцита».
Многоклеточный ответ на поражение ЦНС
Прежде чем обсуждать различные типы ответов на повреждение и заболевание ЦНС, полезно вкратце представить различные типы клеток, участвующих в этих ответах. Для простоты рассмотрения мы сгруппировали клетки в соответствии с клонами как (i) нервные и ненейральные клетки, присущие ЦНС, и (ii) переносимые кровью ненейральные клетки, которые происходят в основном из костного мозга (2). Некоторые из этих типов клеток широко изучены при расстройствах ЦНС, другие — сравнительно мало.Чаще всего их изучали изолированно. В следующих разделах мы постараемся изучить их взаимодействие.
Таблица 1
Различные типы клеток в ответах ЦНС на повреждение и болезнь
| Внутренние клетки ЦНС: | Неневральные клетки, передающиеся через кровь: |
|---|---|
| Внутренние нервные клетки ЦНС: Нейроны Олигодендроциты Астроциты NG2-OPC Нервные стволовые клетки / клетки-предшественники Эпендима | Лейкоциты: Моноциты / макрофаги Нейтрофилы Эозинофилы NK-клетки Т-клетки B-клетки | Другие клетки, полученные из костного мозга: Тромбоциты (тромбоциты) Фиброциты Мезенхимные (стромальные) стволовые клетки 9 9000 9000 |
Внутренние нейронные клетки ЦНС Основные клетки нервного происхождения в ЦНС, нейроны, олигоденд роциты и астроциты были тщательно изучены и проанализированы в отношении их индивидуальных реакций на повреждение и заболевание ЦНС (Barres, 2008; Франклин и Френч-Констан, 2008; Маттсон, 2000; Софронев и Винтерс, 2010).Менее изучены глиальные клетки, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Подобно другим глиям, NG2-OPC покрывает ЦНС и отвечает на повреждения ЦНС (Nishiyama et al., 2009). Особенности ответа NG2-OPC включают миграцию в сторону повреждения и пролиферацию клеток (Franklin and Ffrench-Constant, 2008; Hughes et al., 2013). Помимо замещения потерянных олигодендроцитов (Sun et al., 2010), другие роли NG2-OPC в повреждении и заболевании ЦНС ожидают будущих исследований и выяснения.Кроме того, ЦНС взрослого человека содержит нервные стволовые клетки (НСК) с различной активностью, которые находятся в периэпендимных областях вдоль желудочков и центрального канала головного и спинного мозга взрослого человека (Garcia et al., 2004; Kriegstein and Alvarez-Buylla, 2009 г.). Эти взрослые NSC также могут реагировать на повреждение ЦНС и генерировать предшественники и клетки разных типов, которые мигрируют в места повреждения (Benner et al., 2013; Lagace, 2012; Meletis et al., 2008; Ohab and Carmichael, 2008).
Внутренние ненейральные клетки ЦНС
Различные клетки ненейрального происхождения, присущие ЦНС, играют решающую роль в повреждении и заболевании ЦНС ().Хорошо известно, что микроглия является высокочувствительными ранними ответчиками, которые стимулируют и рекрутируют другие клетки, а также фагоцитозный дебрис (Hanisch and Kettenmann, 2007; Kreutzberg, 1996; Nimmerjahn et al., 2005; Ransohoff and Perry, 2009). Клетки, связанные с фибробластами, включая периваскулярные фибробласты, менингеальные фибробласты и перициты, способствуют замещению тканей, формируя фиброзную рубцовую ткань после тяжелого повреждения (Goritz et al., 2011; Klapka and Muller, 2006; Logan and Berry, 2002; Soderblom et al., 2013; Винклер и др., 2011). Эндотелий и эндотелиальные предшественники играют важную роль во время замены тканей после повреждения ЦНС (Loy et al., 2002; Oudega, 2012) и вызывают растущий интерес в восстановлении ЦНС в свете их новой роли в качестве трофических поддерживающих клеток в развитии ЦНС (Dugas et al. , 2008), а также их способность продуцировать и представлять ламинин (Davis and Senger, 2005), предпочтительный субстрат для роста многих мигрирующих клеток и аксонов.
Неневральные клетки, передающиеся через кровь
Иммунные и воспалительные клетки различных типов (), передающиеся через кровь, играют важную роль в ответах ЦНС на повреждения и болезни, они были изучены и проанализированы (Perry, 2010; Popovich and Longbrake, 2008).Помимо хорошо известной роли в фагоцитозе и удалении мусора, в настоящее время появляется все больше доказательств того, что подтипы лейкоцитов играют активную роль в восстановлении тканей (Derecki et al., 2012; London et al., 2013; Popovich and Longbrake, 2008). ). После повреждения тромбоциты быстро агрегируются для образования сгустков и гемостаза. К другим переносимым кровью типам клеток костного мозга, которые являются причиной повреждения тканей, в том числе в ЦНС, относятся фиброциты (Aldrich and Kielian, 2011; Reilkoff et al., 2011) и мезенхимальные стволовые клетки костного мозга (Askari et al., 2003; Бьянко и др., 2001; Jaerve et al., 2012), но их функции не совсем понятны.
Внеклеточный матрикс (ECM)
ECM, генерируемый различными клетками, играет критическую роль в восстановлении и замене тканей после острых повреждений, а также в хроническом ремоделировании тканей во время хронических заболеваний (Midwood et al., 2004). Молекулы, которые модифицируют матрикс ECM, такие как metaloproteases (MMP), также важны в этом отношении (Midwood et al., 2004). В ЦНС ЕСМ, генерируемый различными типами клеток, реагирующих на повреждение или заболевание, может включать широкий спектр молекул, таких как ламинин, коллагены и гликопротеины, такие как хондроитин или гепарансульфат протеогликаны (CSPG или HSPG), которые участвуют как в поддержке восстановления тканей, так и а также способствуют нарушению регенерации аксонов (Davis and Senger, 2005; Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).
Ответ на очаговое поражение
Два основных типа острого очагового поражения ЦНС — очаговое травматическое повреждение и ишемический инсульт. Помимо того, что они являются серьезными клиническими проблемами, они на протяжении десятилетий служили прототипами экспериментальных моделей, с помощью которых можно было изучить механизмы реакции ЦНС на повреждение и восстановление. В этом разделе мы рассмотрим основные характеристики многоклеточных реакций ЦНС на острые очаговые повреждения и то, как они меняются с течением времени, используя в качестве моделей информацию о реакции на травму или инсульт.В этом отношении следует отметить, что острая очаговая травма, вызванная ушибом или раздавливанием, приводит к серьезному повреждению сосудов и, следовательно, имеет множество последствий, подобных инсульту. Мы проведем сравнения с острой раневой реакцией кожи как модельной системой для клеточных и молекулярных механизмов заживления ран (Greaves et al., 2013; Gurtner et al., 2008; Shechter and Schwartz, 2013; Singer and Clark, 1999). . Как и при восстановлении кожи, ответы ЦНС на острое очаговое повреждение также можно в общих чертах разделить на три перекрывающиеся, но отдельные фазы: (i) гибель клеток и воспаление, (ii) пролиферация клеток для замены тканей и (iii) ремоделирование тканей (3).Сначала мы исследуем реакцию ЦНС в контексте, когда острые оскорбления остаются незараженными и проходят. Ниже мы также кратко рассмотрим более хронические очаговые поражения ЦНС, включая очаговые инфекции с образованием абсцесса, первичные и вторичные опухоли и хронические очаговые аутоиммунные поражения, такие как бляшки рассеянного склероза, которые проявляют различные особенности и клеточные реакции, аналогичные травматическим и ишемическим повреждениям. . Чтобы представить краткое изложение клеточных ответов и взаимодействий, обсуждение информации о второстепенных молекулярных сигналах отложено до следующего раздела ниже.Следует упомянуть, что временные характеристики, приведенные для фаз реагирования и событий, являются обобщенными приближениями (), и существует большая вероятность перекрытия событий, а также вариаций продолжительности или времени в конкретных ситуациях.
Фазы и динамика многоклеточных реакций на острое очаговое повреждение ЦНСВо время периодов гибели клеток (A), замещения клеток (B) и ремоделирования тканей (C) происходят многочисленные перекрывающиеся события (D), которые включают взаимодействия между внутренними компонентами ЦНС. нервные клетки, внутренние ненейральные клетки ЦНС и клетки, проникающие из кровотока.
Фаза I: смерть и воспаление клеток
После очагового повреждения ткани ЦНС в результате воздействия, такого как травма или ишемия, которые вызывают острую локальную гибель клеток, первая фаза ответа в центре повреждения или ядре включает в себя оба очень быстрых события, которые происходят с течением времени. шкала от секунд до часов, и более постепенно прогрессирующие события, которые развиваются в течение нескольких дней (). Очень быстрые события включают гемостаз с каскадом коагуляции, агрегацию тромбоцитов и образование сгустка. За этими быстрыми событиями следуют перекрывающиеся последовательности ответов внутренних клеток ткани, рекрутирование воспалительных и иммунных клеток, подострая гибель паренхимных клеток и начало удаления мусора ().В здоровой ткани ЦНС большие и полярные молекулы в кровотоке исключены из диффузии в паренхиму ЦНС через гематоэнцефалический барьер (ГЭБ) (Abbott et al., 2006; Zlokovic, 2008). После очаговых поражений с повреждением ГЭБ, переносимые с кровью молекулы обычно исключаются из притока ЦНС и передачи сигналов в местные клетки, что более подробно обсуждается ниже в разделе о молекулярной передаче сигналов. Приток тромбоцитов быстро образует агрегаты для гемостаза, а также дает сигнал местным клеткам. Матрицы фибрина и коллагена начинают формироваться в течение периода от нескольких часов до дней, которые служат каркасом для нейтрофилов, а затем макрофагов и других лейкоцитов.Затем лейкоциты сильно инфильтрируют для отслеживания патогенов, удаления мусора и передачи молекулярных сигналов, участвующих в заживлении ран, в течение различного количества дней или дольше в зависимости от тяжести повреждения ткани или наличия обостряющих факторов () (Perry, 2010; Popovich and Longbrake, 2008). ). Эндогенные мезенхимальные стволовые клетки также могут проникать в ядро поражения, но их роль недостаточно изучена (Askari et al., 2003; Bianco et al., 2001; Jaerve et al., 2012). Эти основные клеточные события отражают классические реакции раны, обнаруживаемые в других тканях (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999).
Некоторые внутренние клетки ЦНС также быстро реагируют на повреждение ткани ЦНС или утечку ГЭБ. Исследования живых изображений в CNS in vivo показывают, что микроглия и NG2-OPC немедленно мигрируют в места повреждения тканей и утечки BBB (Hughes et al., 2013; Nimmerjahn et al., 2005). Астроциты, напротив, остаются in situ и не мигрируют ни в места повреждения, ни от них, но могут осмотически набухать и, в зависимости от тяжести повреждения или ишемии, могут погибнуть в центре тяжелых повреждений или могут стать реактивными и гипертрофия и в некоторых случаях пролиферация (Bardehle et al., 2013; Чжэн и др., 2010). Различные аспекты этой первой фазы ответа возникают в перекрывающихся последовательностях в течение первых нескольких дней, а затем начинают постепенно уменьшаться () при условии, что повреждение представляет собой единичное острое событие, не осложненное сдавлением костей, инфекцией или другими обострениями, которые могут продлить разрушительное повреждение. По мере ослабления острых ответов происходит совпадение с началом различных типов пролиферации клеток, связанных со следующей фазой ответов ().
Фаза II: пролиферация клеток и замещение ткани
Вторая фаза ответа на острое повреждение ткани ЦНС наступает примерно через два-десять дней после повреждения и характеризуется пролиферацией и локальной миграцией клеток, которые осуществляют восстановление и замену ткани.Эти клетки включают эндотелиальные клетки-предшественники, клетки линии фибробластов, различные типы воспалительных клеток, а также различные типы клеток-предшественников глии и нейронального происхождения, включая формирующие рубцы астроциты и их предшественники (). Некоторые из этих явлений клеточной пролиферации, такие как пролиферация эндотелия для неоваскуляризации (Casella et al., 2002) или пролиферация определенных клеток линии фибробластов или воспалительных клеток, отражают классические раневые реакции (Gurtner et al., 2008; Singer and Clark, 1999). , в то время как другие, такие как пролиферация рубцовых астроцитов, специфичны и уникальны для ЦНС.Эта фаза также характеризуется на протяжении всей ее продолжительности отсутствием ГЭБ в ядре поражения в период, когда поврежденные кровеносные сосуды заменяются новыми (). Как следствие, эндогенные (а также экзогенные) белки и другие заряженные молекулы могут свободно диффундировать в окружающую нервную паренхиму (Bush et al., 1999). Эти молекулы могут включать белки сыворотки (например, тромбин, альбумин), которые передают сигнал местным клеткам, иммуноглобулинам или молекулам, связанным с патогенами, как обсуждается ниже.Этот негерметичный ГЭБ создает возможность для ядра поражения служить источником циркулирующих молекул, которые генерируют градиенты молекулярной передачи сигналов, которые могут распространяться на значительные расстояния в нервную ткань вокруг поражения до тех пор, пока ГЭБ не будет восстановлен (,). Эта передача сигналов может вносить вклад в периметр сужающегося градиента реактивного глиоза и другие изменения, наблюдаемые в ткани вокруг зрелых поражений, как обсуждается ниже.
Поражения демонстрируют тканевые компартменты и градиенты передачи сигналов(A, B) Фокусное повреждение приводит к поражениям с отдельными тканевыми компартментами в виде ядер неневральных поражений (LC), недавно пролиферирующих компактных рубцов астроцитов (AS) и пери периметры поражения (PLP), которые демонстрируют уменьшающиеся градиенты реактивного глиоза, которые постепенно переходят в здоровую ткань (HT).AS резко разграничивают переход между ненейральными LC и PLP с жизнеспособными нервными клетками. Размер ядра поражения и расположение AS и этого перехода регулируются противоположными молекулярными сигналами. Градиенты молекулярных сигналов, исходящих от LC, воздействуют на клетки в PLP.
Во время фазы пролиферации образуются клеточные элементы, которые в зрелых поражениях образуют два из трех основных тканевых компартментов зрелого поражения, (i) центральное ядро поражения неневральной ткани и (ii) компактный рубец астроцитов, который окружает ядро поражения ().Основные клеточные компоненты ядра ненейрального поражения происходят из расширения внутренних периваскулярных фибробластов и перицитов ЦНС (Goritz et al., 2011; Soderblom et al., 2013) и от пролиферирующих предшественников эндотелия. Компактный рубец астроцитов формируется в основном из недавно пролиферирующих удлиненных астроцитов, генерируемых местными астроглиальными предшественниками, которые собираются по краям сильно поврежденной ткани, содержащей воспалительные клетки и клетки линии фибробластов () (Faulkner et al., 2004; Sofroniew and Vinters, 2010; Wanner и другие., 2013). Примечательно, что в этот пролиферативный период определяется расположение границ компактных рубцов астроцитов. В зрелых поражениях эти границы рубца астроцитов будут точно разграничивать и отделять сохраняющиеся области нефункциональной, не нервной ткани ядра поражения от непосредственно окружающей и потенциально функциональной нервной ткани (,). Клеточные и молекулярные механизмы, лежащие в основе определения того, где именно образуются границы таких рубцов астроцитов, изучены не полностью, но, вероятно, включают сложное взаимодействие и баланс молекулярных сигналов, которые, с одной стороны, способствуют фагоцитозу и очистке от мусора, а также сигнализируют об этом. с другой стороны, способствуют защите и сохранению здорового «я» (), что более подробно обсуждается ниже в разделе, посвященном молекулярным сигналам повреждения и гибели клеток.Несколько десятилетий экспериментальных исследований ишемических инфарктов показывают, что на окончательный размер поражения могут влиять подострые метаболические процессы, которые продолжаются от часов до дней в полутеневых зонах вокруг поражений (Astrup et al., 1981; Dirnagl et al., 1999; Lo, 2008). ). Кроме того, были идентифицированы внутренние сигнальные каскады астроцитов, которые играют критические роли (Herrmann et al., 2008; Okada et al., 2006; Wanner et al., 2013). Лучшее понимание многоклеточных и молекулярных взаимодействий, которые определяют расположение границ рубцов астроцитов вокруг участков поврежденной ткани, может привести к новым терапевтическим стратегиям для уменьшения размера поражения ().Эти события происходят в течение нескольких дней после оскорбления (), в течение которых вмешательство является реальной возможностью.
Недавние открытия также показывают, что во время пролиферативной фазы после острого повреждения ЦНС в переднем мозге нервные стволовые клетки в перивентрикулярных зародышевых зонах дают начало значительному количеству нейральных предшественников, которые мигрируют в места повреждения коры или полосатого тела (Carmichael, 2006; Kokaia et al., 2012; Lagace, 2012; Lindvall, Kokaia, 2006). Эти клетки образуют часть смеси клеток по периметру очага поражения ().Существуют различные доказательства, предполагающие, что эти клетки могут благотворно влиять на ремоделирование тканей в периповрежденной ткани, но природа вкладов, вносимых этими клетками, остается туманной. В нормальных, непредсказуемых обстоятельствах очень немногие вновь сгенерированные нейроны созревают и выживают, а другие потенциальные вклады этих интригующих мигрирующих клеток-предшественников такие вклады в иммунную регуляцию все еще находятся в процессе определения (Kokaia et al., 2012; Lagace , 2012).
Фаза III: Ремоделирование ткани
Третья фаза ответа на острое повреждение ткани обычно начинается ближе к концу первой недели после повреждения и отличается ремоделированием ткани, которое включает в себя события, которые завершаются в течение нескольких недель, такие как восстановление ГЭБ и организация рубца, а также хронические события, которые могут продолжаться в течение многих месяцев (). Восстановление или восстановление ГЭБ вдоль новообразованных кровеносных сосудов в районе поражения обычно завершается в течение нескольких недель после острого неосложненного поражения и требует присутствия функциональных астроцитов (Bush et al., 1999) и перицитов (Daneman et al., 2010; Winkler et al., 2011). Ядро поражения не нервной ткани оказывается окруженным хорошо организованным, пересекающимся компактным рубцом астроцитов через две-три недели после острого поражения, не усугубляемого продолжающимся повреждением ткани () (Wanner et al., 2013). Эти формирующие рубцы астроциты, по-видимому, активно загоняют и окружают воспалительные клетки и клетки клонов фибробластов во время ремоделирования тканей и образования рубцов (Wanner et al., 2013). Этот компактный рубец астроцитов образует структурную и функциональную границу между неневральной тканью в центре поражения и непосредственно прилегающей и окружающей нервной тканью, которая содержит все жизнеспособные клетки всех трех типов клеток нервного клона, астроциты, олигодендроциты и нейроны (,) (Ваннер и др., 2013). Эта граница рубца астроцита служит защитным барьером, который ограничивает миграцию воспалительных клеток из ядра ненейрального поражения в окружающую жизнеспособную нервную ткань. Нарушение образования рубцов астроцитов в различных моделях трансгенной потери функции приводит к увеличению размера поражения, повышенной гибели локальных нейронов, усилению демиелинизации и снижению восстановления функции после травматических или ишемических очаговых поражений (Bush et al., 1999; Faulkner et al., 2004; Herrmann et al., 2008; Ли и др., 2008; Wanner et al., 2013). После образования компактного рубца астроцита продолжается второй период ремоделирования ткани с постепенным ремоделированием ядра поражения, границы рубца астроцита и окружающих областей периметра (,). Например, со временем происходит постепенное сокращение ядер поражений и рубцов астроцитов. Поскольку перерезанные аксоны продолжают умирать обратно от повреждений, гибель олигодендроцитов может продолжаться, что приводит к локальным тканевым ответам и ремоделированию. Происходит длительное ремоделирование ECM в ядре поражения с модуляцией компонентов коллагена и гликопротеина (Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).Кроме того, происходит постепенное и хронически продолжающееся ремоделирование тканей в реактивных областях периметра, которые окружают зрелые поражения, как обсуждается далее.
Зрелые поражения демонстрируют три тканевых компартмента
Образование рубца астроцитов вокруг ядер центральных поражений по существу завершается через две-четыре недели после острого поражения, которое не осложняется длительным повреждением ткани, и в это время поражение можно считать зрелым и входящим в его хроническая стадия (,). В зрелых поражениях полезно распознавать три очень разных компартмента поражения: (i) центральное ядро поражения неневральной ткани, состоящее из клеток местного происхождения фибробластов, кровеносных сосудов, инфильтрирующих фиброцитов и воспалительных клеток и внеклеточного матрикса; (ii) компактный рубец астроцитов, который непосредственно окружает ядро поражения и состоит из плотно упакованных астроцитов с небольшим количеством нейронов или олигодендроцитов, если таковые имеются; и (iii) периметр периметра жизнеспособной нервной ткани, который примыкает к компактному рубцу астроцита и содержит все три типа клеток нервного клона (нейроны, олигодендроциты, астроциты) и демонстрирует сужающийся реактивный глиоз, который постепенно переходит в здоровую ткань ( ).Все эти компартменты будут подвергаться дальнейшему ремоделированию тканей в течение недель или месяцев. Некоторая часть этого ремоделирования может повлиять на функциональный результат и может обеспечить цели для терапевтических вмешательств, особенно в периметре нервной ткани, которая проявляет диффузный реактивный глиоз (,). Полезно рассмотреть отдельно эти компоненты и их влияние на функциональный результат.
Ядро поражения
Ткань в зрелом ядре поражения содержит мало или совсем не содержит клеток нервного клона и нефункциональна с неврологической точки зрения.Первоначально основные типы клеток в ядрах зрелых поражений включают клетки линии фибробластов, эндотелий, фиброциты и воспалительные клетки (). Со временем и при ремоделировании, а также при отсутствии обострения повреждения или инфекции воспалительные элементы будут постепенно исчезать, хотя некоторые из них могут сохраняться в течение длительного времени. Элементы ядра поражения будут постоянно сохраняться в виде фиброзного рубца, содержащего различные ненейральные клетки и ECM. В некоторых областях ядра поражения клетки и ECM будут отступать, оставляя заполненные жидкостью кисты весьма различного размера () (Tuszynski and Steward, 2012).Функционально клетки и ECM ядра поражения служат субстратами для быстрого заживления ран и замещения тканей. Предполагается, что скорость закрытия раны, обеспечиваемая фиброзным замещением по сравнению с обновлением паренхимы, дает преимущества в других тканях (Greaves et al., 2013; Gurtner et al., 2008; Singer and Clark, 1999). Тем не менее, этот механизм может привести к потере функций тканей. Считается, что в ЦНС поврежденная сердцевина ткани с 19 по века оказывает долгосрочное негативное функциональное воздействие как препятствие для регенерации аксонов, что также подтверждается недавними исследованиями (Zukor et al., 2013). Молекулярные оценки показывают, что ядро ECM поражения содержит коллагены и протеогликаны, которые плохо поддерживают или явно подавляют повторный рост поврежденных аксонов (Hermanns et al., 2006; Kimura-Kuroda et al., 2010; Klapka and Muller, 2006; Yoshioka et al., 2010). ).
Компактные рубцы астроцитов (глиальные рубцы)
Зрелые рубцы астроцитов состоят из относительно узких зон вновь образовавшихся астроцитов с удлиненными отростками, которые сильно переплетаются и переплетаются и которые сразу же примыкают и окружают со всех сторон участки сердцевины пораженной ткани () (Sofroniew и Винтерс, 2010; Ваннер и др., 2013). Эти узкие зоны плотно переплетенных удлиненных астроцитов, образующих рубцы, обычно не более миллиметра в поперечнике и обычно лишены других клеток нервного клона (нейронов или олигодендроцитов) (Wanner et al., 2013). Эти формирующие рубцы астроциты вновь пролиферируют в ответ на инсульт, и плотность упаковки тел клеток астроцитов в рубцах астроцитов, по крайней мере, вдвое больше, чем в здоровой ткани (Wanner et al., 2013). Плотно упакованные удлиненные астроциты, образующие рубцы, плавно и быстро переходят в менее плотно упакованные и менее плотно переплетенные гипертрофические реактивные астроциты, которые перемешаны с жизнеспособными нейронами и другими элементами нервной ткани в окружающем периметре реактивной нервной ткани, обсуждаемой ниже () (Ваннер и другие., 2013). Исследования трансгенной потери функции показывают, что недавно пролиферирующие компактные рубцы астроцитов обладают важными нейропротекторными функциями, ограничивая распространение воспалительных клеток вдали от поражений тканей, вызванных травмой, инсультом и аутоиммунным воспалением. Когда образование рубцов астроцитов экспериментально предотвращается или ослабляется in vivo , воспаление распространяется, размер поражения увеличивается, потеря нейронов и демиелинизация усугубляются, а функциональное восстановление ухудшается (Bush et al., 1999; Дрогемюллер и др., 2008; Фолкнер и др., 2004; Wanner et al., 2013). Астроциты, образующие рубцы, также широко считаются, если не главным препятствием для регенерации аксонов после повреждения ЦНС, частично на основании исследований in vitro , показывающих продукцию астроцитами определенных протеогликанов, которые могут ингибировать удлинение (Silver et al., 1993 ). Тем не менее, другие исследования показывают, что регенерация аксонов in vivo происходит вдоль мостиков астроцитов, и что в отсутствие таких мостов регенерация аксонов не происходит и, по-видимому, больше затрудняется конфронтацией с тканью ядра, не связанной с нервным поражением (Kawaja and Gage , 1991; Уильямс и др., 2013; Зукор и др., 2013). Исследования потери функции трансгенных животных, проведенные in vivo , могут помочь прояснить точную природу и масштаб эффектов, оказываемых формирующими шрамы астроцитами на возобновление роста аксонов после травмы.
Периметры периметров поражения
Все зрелые ядра поражений и рубцы астроцитов окружены периметрами жизнеспособной нервной ткани, которая демонстрирует градиент сужающегося реактивного глиоза, который постепенно переходит в здоровую ткань () (Wanner et al., 2013). Ткань в этих зонах периметра содержит все типы клеток нервного клона, включая нейроны и олигодендроциты, и эти клетки перемешаны с реактивным глиозом, который может распространяться на значительные расстояния ().Реактивная ткань периметра начинается непосредственно рядом с компактными рубцами астроцитов, где удлиненные клеточные отростки рубцовых астроцитов перекрываются с гипертрофическими реактивными астроцитами и реактивной микроглией, которые перемешаны с выжившими жизнеспособными нейронами и другими элементами нервной ткани (). Примечательно, что жизнеспособные нейроны могут присутствовать в пределах нескольких сотен мкм компактных рубцов астроцитов, а центральная ткань поражения, заполненная потенциально цитотоксическими воспалительными элементами, находится чуть дальше (Bush et al., 1999; Wanner et al., 2013). Реактивный глиоз по периметру включает гипертрофические реактивные астроциты и микроглию (). Причина и функции периметров сужающегося реактивного глиоза не ясны. Что касается причины, возможно, что градиенты сигнальных молекул, диффундирующих из ядра поражения, либо входящие в период утечки ГЭБ, либо продуцируемые инфильтрирующими и пролиферирующими клетками, могут запускать такой градиент постепенно сужающихся ответов среди локальной глии (1). .С функциональной точки зрения, еще предстоит определить степень, в которой конкретные аспекты этого реактивного глиоза являются полезными или вредными (или их комбинацией).
Реактивные области периметра вокруг ядер поражения в головном и спинном мозге, вероятно, будут демонстрировать долгосрочное и потенциально интенсивное ремоделирование ткани с образованием новых синапсов и потенциалом для формирования новых цепей реле (Bareyre et al., 2004; Carmichael, 2006; Clarkson et al., 2010; Courtine et al., 2008; Li et al., 2010; Overman et al., 2012). На ремоделирование синапсов и цепей потенциально могут влиять многочисленные факторы, включая молекулы внеклеточного матрикса, такие как протеогликаны в перинейронах (Garcia-Alias et al., 2009). Реактивная глия может играть важную роль в этом ремоделировании, но эта тема недостаточно изучена. В здоровой ЦНС астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными способами (Halassa and Haydon, 2010).И астроциты, и микроглия потенциально могут играть фундаментальную роль в ремоделировании синапсов в периметре поражения (Stephan et al., 2012; Stevens et al., 2007), и влияние реактивного глиоза на такое ремоделирование еще не изучено. Такие периметральные области периметра, вероятно, обеспечат благодатную почву для инвестирования новых стратегий для вмешательств, которые могут повлиять на нейронную пластичность и формирование релейных цепей, что в сочетании с соответствующей реабилитационной тренировкой (van den Brand et al., 2012) могут благотворно повлиять на функциональный результат.
Хронические очаговые поражения
Помимо острой очаговой травмы и инсульта, которые часто служат моделями для изучения механизмов повреждения ЦНС, как только что обсуждалось, другие, более хронические формы повреждения заслуживают рассмотрения. Важные хронические инсульты включают очаговые инфекции с образованием абсцесса, опухоли и аутоиммунные поражения. Все эти состояния вызывают реактивный глиоз и многоклеточные реакции, которые имеют большое сходство с теми, которые возникают после острого очагового повреждения.Этот многоклеточный ответ играет решающую роль в развитии, серьезности и разрешении (или нет) оскорблений.
Инфекция
Очаговые инфекции или абсцессы могут образовываться при инфицировании травматических ран или могут быть засеяны спонтанно, особенно у лиц с ослабленным иммунитетом. Такие инфекции вызывают реактивный глиоз с образованием рубцов астроцитов, аналогичным таковому после острой очаговой травмы (Sofroniew and Vinters, 2010). Продолжительность сохранения поражения и ремоделирования тканей является длительной и зависит от разрешения инфекции.Исследования трансгенной потери функции показывают, что образование рубцов астроцитов имеет решающее значение для локального сдерживания инфекции. Когда рубцы астроцитов разрушаются, инфекция и воспаление быстро распространяются через прилегающую нервную ткань с разрушительными эффектами (Drogemuller et al., 2008).
Рак
Как первичные, так и метастатические опухоли вызывают реактивный глиоз и многоклеточные реакции, которые имеют сходство с другими формами очагового повреждения тканей. Взаимодействие опухолевых клеток с глией ЦНС и инфильтрирующими воспалительными клетками является сложным и сильно зависит от типа опухолевых клеток.Неинвазивные опухоли окружены реактивным глиозом и инкапсулирующим рубцом, аналогичным тому, который наблюдается вокруг травматического повреждения ткани. Агрессивно инвазивные опухоли не инкапсулированы и не окружены четко выраженными рубцами астроцитов, но вызывают другие формы реактивного глиоза и многоклеточные реакции. Считается, что успешная инфильтрация и распространение определенных типов опухолевых клеток связаны с их способностью создавать среду для роста, васкуляризации и распространения, что может включать успешную нейтрализацию барьерных функций местных клеток ЦНС и кооптации программ для создания пролиферативных ниш. (Луи, 2006; Сильвер и др., 2013; Уоткинс и Сонтхаймер, 2012).
Аутоиммунное заболевание
Очаговые аутоиммунные поражения интересно рассматривать с точки зрения реакции на повреждение ЦНС. Хотя аутоиммунное заболевание ЦНС часто рассматривается как диффузное, хроническое и вызвано, в первую очередь, дисфункцией периферической иммунной системы, отдельные аутоиммунные поражения имеют много общего с острыми очаговыми травматическими ранами. Например, активные бляшки рассеянного склероза заполнены воспалительными клетками, а хронические бляшки демонстрируют ядра центральных поражений, которые лишены всех типов клеток нервного клона (без нейронов, олигодендроцитов или астроцитов), окруженные астроцитарными рубцами, которые отделяют неневральную ткань от периметров реактивных клеток. глиоз в ткани со всеми тремя типами нервных клеток (Frohman et al., 2006; Lucchinetti et al., 1996) способами, подобными повреждению тканей, вызванному травмой или ишемией (,). Оптический нейромиелит (NMO) — это аутоиммунное воспалительное заболевание, при котором причинные аутоантитела направлены против аквапорина-4 на клеточной мембране астроцитов, а поражения NMO связаны с опосредованным комплементом литическим разрушением астроцитов (Lennon et al., 2005; Popescu и Лучинетти, 2012). Существует замечательное совпадение между клиническими данными из NMO и экспериментальными исследованиями потери функции, демонстрирующими, что трансгенно-опосредованная абляция или ослабление рубцовых астроцитов приводит к тяжелому обострению аутоиммунного воспаления ЦНС (Haroon et al., 2011; Voskuhl et al., 2009). Таким образом, как клинические, так и экспериментальные данные указывают на критическую роль рубцовых астроцитов в ограничении распространения аутоиммунного воспаления ЦНС. Эти наблюдения убедительно свидетельствуют о том, что дисфункция внутренних клеток ЦНС, таких как астроциты, может причинно способствовать возникновению или прогрессированию аутоиммунных состояний ЦНС способами, которые обычно не рассматриваются в исследованиях, сосредоточенных только на попытке определить причинные механизмы периферической иммунной системы. Это представление может быть дополнительно подтверждено предположениями, что подгруппа пациентов с рассеянным склерозом имеет связанные с заболеванием аутоантитела против калиевого канала Kir4.1, который в ЦНС располагается на мембранах астроцитов (Srivastava et al., 2012). Было бы интересно определить степень, в которой усиление или потеря функций астроцитов способствует патофизиологии аутоиммунных состояний ЦНС.
Ответ на диффузное поражение
Диффузное поражение ткани ЦНС может быть связано с нейродегенеративными заболеваниями, некоторыми судорожными расстройствами или легкой черепно-мозговой травмой. Диффузные инсульты изначально имеют тенденцию быть менее интенсивными, чем острые очаговые повреждения, вызванные травмой или инсультом, и могут первоначально не вызывать явного повреждения тканей, а вместо этого постепенно накапливаться в течение хронических периодов времени.По мере того, как повреждение ткани становится более серьезным, образуются небольшие отдельные поражения, каждое из которых вызывает реактивный глиоз и многоклеточные реакции, аналогичные тем, которые вызваны острым повреждением ткани с разрушением ГЭБ, воспалением и привлечением лейкоцитов (,), но на меньшем уровне. шкала. Со временем диффузное повреждение начинает напоминать диффузное скопление множества мелких очаговых поражений, которые перемешаны и могут распространяться на большие площади (). Каждое из этих небольших поражений дает начало собственным периметру периметра поражения зон сужающегося реактивного глиоза, в результате чего перекрывающиеся зоны тяжелого гипертрофического реактивного глиоза и многоклеточных реакций могут быть распределены на больших участках ткани (2).Важно понимать, что эти многочисленные небольшие поражения перемежаются между жизнеспособными нейронами и нейронными цепями, которые охватываются этими перекрывающимися периметрами периметров реактивного глиоза (2). Как обсуждалось выше, в настоящее время имеются существенные доказательства участия астроцитов и микроглии в нормальной функции нервной цепи, но влияние реактивного глиоза на такие функции неизвестно. В контексте диффузных поражений ЦНС большие области функционирующей нервной ткани могут подвергаться интенсивному реактивному глиозу, который, вероятно, повлияет на синаптические взаимодействия и функции нервных цепей (2).Лучшее понимание таких эффектов может открыть путь к новым терапевтическим стратегиям.
Диффузное повреждение ткани приводит к расширенным областям реактивного глиоза(A) Небольшие хронические инсульты могут приводить к диффузному повреждению ткани с образованием рассеянных небольших ядер поражений (LC), астроцитарных рубцов (AS) и периметров периповреждений (PLP) которые могут перекрываться и сливаться в области смежного реактивного глиоза, которые могут распространяться на большие площади.
(B) Реактивные астроциты и реактивная микроглия в PLP могут по-разному влиять на синапсы и нейронные функции.
Нейродегенеративное заболевание
Реактивный глиоз и многоклеточные реакции запускаются по-разному и избирательно при разных нейродегенеративных заболеваниях. В некоторых случаях пусковым механизмом может быть накопление внеклеточных токсинов, таких как β-амилоид при болезни Альцгеймера (БА) (Prokop et al., 2013; Zlokovic, 2011), которые могут накапливаться и вызывать множество небольших очаговых повреждений тканей, которые вызывают глиоз, во многом схожий с другими формами диффузных поражений (). В других случаях пусковым механизмом может быть повреждение или смерть нейронов или синапсов, вторичные по отношению к внутренним изменениям нейронов.Некоторые состояния, такие как боковой амиотрофический склероз (БАС) или болезнь Хантингтона, вызывают внутренние клеточные изменения как в нейронах, так и в глии, могут нарушать клеточные функции и взаимодействия, которые могут служить триггерами (Boillee et al., 2006; Maragakis and Rothstein, 2006). . Нейродегенеративные инсульты также могут приводить к нарушению сосудисто-нервного аппарата, что приводит к утечке ГЭБ, что может служить дополнительным триггером для реактивного глиоза, а также сигналом для рекрутирования воспалительных клеток, переносимых кровью (Zlokovic, 2008, 2011).Во многих случаях реактивный глиоз и многоклеточные реакции могут не проявляться в начале или на ранних стадиях нейродегенеративных состояний, но проявляться позже и затем участвовать в прогрессировании заболевания. Реактивный глиоз, вызванный различными способами, либо накоплением аномальных белков, ишемическим или травматическим клеточным повреждением, либо микробами, также может привести к утечке ГЭБ через специфические молекулярные сигнальные каскады, как обсуждается ниже, с последующим воспалением, которое может способствовать прогрессированию заболевания.
Вклад глиальных клеток и реактивного глиоза в нейродегенеративные состояния сложен и только начинает изучаться. Глия не только реагирует на дегенеративные сигналы, о которых говорилось выше, но также может участвовать в борьбе с ними. Например, считается, что и микроглия, и астроциты способствуют очищению от β-амилоида (Prokop et al., 2013; Wyss-Coray et al., 2003), а ослабление реактивного астроглиоза может увеличивать нагрузку β-амилоида на модели трансгенных мышей. нашей эры (Крафт и др., 2013). Кроме того, на глию могут влиять молекулярные дефекты, вызывающие заболевание, и она становится дисфункциональной, что еще больше затрудняет попытки понять роль реактивного глиоза в процессе болезни. Например, при БАС дисфункция глиальных клеток причинно участвует в опосредовании дегенерации нейронов (Yamanaka et al., 2008), а продолжающийся реактивный глиоз и воспаление, как полагают, также вносят вклад в прогрессирование заболевания (Maragakis and Rothstein, 2006). Различия между вызванными заболеванием дисфункциями глиальных клеток и реактивными реакциями, которые запускаются в глиальных клетках повреждением клеток и тканей, иногда размыты или уравниваются, но не должны быть такими.Понимание этих различных явлений и способов их взаимодействия может иметь важные последствия для понимания механизмов, лежащих в основе клеточной патофизиологии и ведущих к прогрессированию заболевания. Важно помнить, что, хотя некоторые аспекты реактивности глии могут способствовать прогрессированию заболевания, другие, вероятно, будут защитными. Определение молекулярной основы таких различий может помочь определить новые терапевтические стратегии.
В контексте нейродегенеративного заболевания также интересно вкратце рассмотреть возможность неавтономной нейрональной дегенерации, вызванной дисфункцией глии или других ненейронных клеток.Генетические мутации с потерей или усилением функции в микроглии (Derecki et al., 2012) или астроцитах (Brenner et al., 2001; Rothstein, 2009; Tao et al., 2011) потенциально могут вызывать неклеточно-автономные дегенерация разных типов нейронов при различных заболеваниях человека и экспериментальных моделях на животных. Такие наблюдения показывают, что дисфункция глиальных клеток может быть первичным причинным событием при определенных неврологических состояниях. Такие наблюдения также повышают вероятность того, что дисфункция определенных аспектов реактивного глиоза во время реакции на поражение ЦНС может усугубить повреждение или привести к ухудшению восстановления тканей и худшему исходу.Возможность генетического полиморфизма влиять на функции глиальных клеток и реакцию на повреждение ЦНС — это еще не изученная область, которая может выявить причинные факторы, лежащие в основе различий в ответах разных людей на, казалось бы, схожие типы и тяжести поражений ЦНС.
Эпилепсия
Астроциты и микроглия могут участвовать в эпилепсии множеством способов. Астроциты играют множество критических ролей в регуляции активности синапсов и возбудимости нейронов, а астроциты могут играть решающую роль в генерации судорожной активности (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). Кроме того, реактивный глиоз как микроглии, так и астроцитов является характерной особенностью нервной ткани с хронической эпилепсией, которая также может проявлять распад ГЭБ и многоклеточное воспаление (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). ). С увеличением потери нейронов наступает тканевой склероз, который имеет сходство с тяжелым диффузным астроглиозом из-за других причин, как обсуждалось выше, со многими более мелкими тканевыми поражениями, окруженными континуумом околоповрежденной ткани со смесью выживших нейронов и все более тяжелой гипертрофией. глиоз ().Влияние реактивного глиоза и многоклеточного ответа на повреждение ткани на выжившие нейроны в периметре периметра поражения недостаточно изучено (), но может способствовать снижению пороговых значений приступов. Селективная экспериментальная индукция реактивности астроцитов связана со снижением ингибирования в локальных нейронах гиппокампа (Ortinski et al., 2010). Требуется дополнительная работа в этой области.
Диффузная черепно-мозговая травма (ЧМТ)
Крупные очаговые поражения, вызванные тяжелой очаговой ЧМТ (ушиб или раздавливание), обсуждались выше.Тем не менее, клинически значимая ЧМТ часто бывает диффузной и широко распространенной. Клеточные и молекулярные механизмы диффузной ЧМТ, которая вызывает функциональные нарушения без крупных очаговых поражений, изучены не полностью. Диффузная ЧМТ обычно характеризуется небольшими очагами разрушения сосудов и повреждения тканей, которые могут диффузно распространяться на большие участки ЦНС (DeKosky et al., 2013; McIntosh et al., 1989). Интересно учитывать, что каждая из этих небольших областей тканевого или клеточного повреждения может представлять собой небольшое очаговое повреждение с отделениями, эквивалентными сердцевине, рубцу астроцита и периметру, которое может распространяться на большие области без очевидной единственной большой очаговой области ().Как обсуждалось выше, чередующиеся жизнеспособные нервные ткани во многих перекрывающихся периметрах периметра поражения будут подвергаться интенсивному гипертрофическому реактивному глиозу и воспалению, которое может влиять на нервные функции (2). Специфические клеточные и молекулярные механизмы реактивного глиоза и многоклеточных ответов, запускаемых легкой или умеренной диффузной ЧМТ, только начинают охарактеризовываться. Недавно пролиферирующие реактивные астроциты выполняют защитные функции, необходимые для выживания нейронов (Myer et al., 2006). Микроглия может оказывать широкий спектр эффектов в зависимости от конкретных молекулярных стимулов, которые либо защищают, либо усугубляют потерю ткани (Hanisch and Kettenmann, 2007). Понимание и управление реактивным глиозом и многоклеточными последствиями, вызванными легкой и умеренной ЧМТ, имеет огромный потенциал для определения новых терапевтических целей в области большого эпидемиологического значения. Новые молекулярные механизмы обсуждаются в следующем разделе.
Молекулярная передача сигналов и многоклеточные взаимодействия
Молекулярная передача сигналов между различными типами клеток, которые отвечают на поражение ЦНС, сложна, комбинаторна и тесно переплетена.Различные клетки обладают способностью продуцировать одинаковые наборы молекул и отвечать на них, и есть намеки на то, что некоторые молекулы могут координировать многоклеточные ответы. Было идентифицировано множество межклеточных сигнальных молекул, но мы находимся на ранних стадиях определения того, как эти множественные сигналы регулируют многоклеточные взаимодействия и временную прогрессию от одной фазы к другой во время ответов на специфические поражения ЦНС. Здесь мы предоставляем общий обзор молекулярных функциональных классов () и несколько репрезентативных примеров многих конкретных молекул, которые регулируют или влияют на клеточные реакции ЦНС на оскорбления ().
Многомолекулярная регуляция и дифференцированные ответы на повреждение(A) Ответы на повреждение ЦНС регулируются и зависят от различных категорий молекулярных сигналов, происходящих от многих типов внутренних и внешних клеток ЦНС.
(B) Низкие уровни АТФ, высвобождаемые клетками во время легких поражений ЦНС, могут действовать через (i) рецепторы P2X, чтобы вызвать быстрый хемотаксис микроглиальных процессов, и (ii) рецепторы P2Y на местных астроцитах, чтобы вызвать передачу сигналов кальция и коннексин-зависимый ATP высвобождение, которое может повышать уровень внеклеточного АТФ и тем самым усиливать этот «опасный» сигнал.
(C) После тяжелой травмы сигнальные молекулы от «измененного я» и «здорового я» соперничают, чтобы сбалансировать очистку от мусора и сохранение жизнеспособной ткани. Сильно поврежденные или мертвые клетки высвобождают ряд гидрофобных внутриклеточных молекул (слева) или «аларминов», которые выражают молекулярные структуры, связанные с повреждением (DAMP). Эти «опасные» сигналы предупреждают клетки врожденного иммунитета ЦНС о повреждении тканей и способствуют удалению мусора за счет активации рецепторов распознавания образов на фагоцитарных иммунных клетках (в центре).Жизнеспособные внутренние клетки ЦНС на границах поражения (справа) экспрессируют связанные с мембраной и растворимые нейроиммунные регуляторные молекулы для предотвращения атаки и фагоцитоза иммунных клеток.
Таблица 2
Основные классы и несколько конкретных примеров межклеточных сигнальных молекул, которые регулируют клеточные реакции на повреждение ЦНС
| Класс | Молекула | Источник | Пораженный отсек | Фаза | Цели и эффекты |
|---|---|---|---|---|---|
| Протеаза и родственные ей | Тромбин | S | LC, AS | I | Образование сгустка; пролиферация астроцитов |
| MMP-9 | M, O, S | LC, AS, PLP | I – III | пролиферация OPC, ремиелинизация; Утечка BBB; неоваскулярное ремоделирование | |
| Калликреины | A, M, N, S | LC, AS, PLP | I – III | Провоспалительные; демиелинизация | |
| Серпины | A, M, O | LC, PLP | I – III | Ингибировать вредную протеазу | |
| NTs | ATP Glutamate | N, O, A | LC, AS, AS, PLP | I | Хемотаксис микроглии; реактивный астроглиоз |
| DAMPs | Alarmins: HMGB1, S100s, DNA | Поврежденные клетки | LC, PLP | I.II | Сигналы «Измененное я»; провоспалительный; увеличить фагоцитоз |
| PAMPs: LPS | Микробы | LC, PLP | I. II | Сигналы «несамо захватчика»; провоспалительный; увеличить фагоцитоз | |
| Факторы роста Морфогены | FGF | A, N, E, | LC, AS, PLP | I — III | Фиброзный рубец; ECM; неоваскулярное ремоделирование; реактивный астроглиоз |
| VEGF | E, P, F, A | LC, AS | I – III | BBB проницаемость; неоваскулярное ремоделирование | |
| PDGF-B PDGF-A | E, A | LS, PLP | I – III | Неоваскулярное ремоделирование Ремиелинизация; Пролиферация OPC | |
| Эндотелин, EGF, BMP | N, A, O | LC, AS | II, III | Пролиферация астроцитов, образование глиального рубца | |
| Цитокины Хемокины | TGFβ, MGFβ | , LAS, PLP | I – III | Образование фиброзного рубца; Производство ECM; пролиферация астроцитов | |
| IL-1β, TNFα, INFγ | A, M, L | LC, AS, | I, II | Провоспалительная регуляция | |
| IL-6 | A, M, L | I, II | Лейкоциты, образование рубцов астроцитов | ||
| NIRegs | CD141 | A, O, E | LC, AS | I – III | Защита здорового себя; разрешение воспаления |
| CD200, CD47 | N | LC, AS, PLP | I, II | Защита здорового себя | |
| Нейронное ремоделирование | Нейротрофины, BDNF и т. д. | N, A | PLP | III | Ремоделирование синапсов |
| Перинейронная сеть | A, OPC | PLP | III | Ограничить прорастание терминала | |
| Thmbs 902, C1q | MPLP | III | Формирование и обрезка синапсов |
Повреждение и смерть клеток
Мертвые, умирающие или временно поврежденные, но восстанавливаемые клетки высвобождают или экспрессируют молекулы, которые сигнализируют о повреждении.Эти молекулы делятся на множество категорий, включая нейротрансмиттеры, цитокины, хемокины, нейроиммунные регуляторы (NI-Reg) и молекулярные паттерны, связанные с опасностью (DAMP), которые стимулируют реактивный глиоз и другие клеточные реакции, включая очищение от мусора иммунными клетками () (). Оскорбления разного типа и степени тяжести высвобождают различные комбинации этих молекул, которые, в свою очередь, вызывают разные реакции. Например, легкие клеточные инсульты могут незначительно повышать внеклеточные концентрации глутамата или АТФ, которые привлекают отростки микроглиальных клеток, не вызывая вначале полномасштабного воспаления () (Davalos et al., 2005; Лю и др., 2009). АТФ может также вызывать кальциевые ответы в астроцитах и вызывать зависимое от коннексина высвобождение АТФ, которое увеличивает внеклеточные уровни АТФ и усиливает этот «опасный» сигнал (). Более серьезное повреждение или гибель клеток приведет к высвобождению дополнительных DAMP и аларминов в форме цитозольного и ядерного содержимого, такого как K +, белков теплового шока, таких как Aβ-кристаллин, кальций-связывающих белков семейства S100, ДНК-связывающих HMGB1 (группа с высокой подвижностью, блок 1 ), а также ДНК и РНК. Все эти молекулы могут служить сигналами «опасности», предупреждающими клетки врожденного иммунитета о повреждении тканей и способствующими удалению клеточного мусора «измененного собственного» посредством активации рецепторов распознавания образов (PRR) на фагоцитарных клетках врожденного иммунитета () (Chan et al., 2012; Гриффитс и др., 2010; Коно и Рок, 2008). Молекулы, такие как бета-амилоид (Aβ), образующиеся во время нейродегенеративных расстройств, также могут действовать как алармины (). Один тип алармина может связывать несколько классов PPR. Например, HMBG1 вызывает провоспалительную передачу сигналов посредством активации множественных TLR, RAGE (рецептор конечных продуктов гликирования) и MAC1 (антигенный комплекс макрофагов-1) (Chan et al., 2012; Gao et al., 2011) и S100 активирует несколько TLR и RAGE (Chan et al., 2012).
Здоровые нейроны и глия вблизи поражений ЦНС экспрессируют нейроиммунные регуляторные молекулы (NI-Regs) и белки самозащиты, которые сигнализируют о «здоровом я» и служат для ограничения потенциально вредной провоспалительной передачи сигналов и предотвращения фагоцитоза жизнеспособных клеток () () (Griffiths и др., 2010). Эти молекулярные сигналы «здорового себя» включают как мембраносвязанные, так и растворимые молекулы NI-Reg. Например, сиаловые кислоты (SA) в мембранах здоровых клеток взаимодействуют с рецепторами SA (SAR), включая Siglecs, на клетках врожденного иммунитета и служат сигналами «не ешь меня» () (Varki and Gagneux, 2012).CD200 и CD47 аналогичным образом действуют через рецепторы CD200R и SIRP-α на воспалительные клетки, предотвращая фагоцитарную атаку () (Griffiths et al., 2010). Белки, регулирующие комплемент (CRP), могут снижать активацию комплемента () (Griffiths et al., 2010). Тромбомодулин (CD141) связывает и изолирует HMGB1, тем самым снижая биодоступность алармина () (Abeyama et al., 2005).
Таким образом, специфические опосредованные рецептором сигналы, указывающие на «измененное я» или «здоровое я», могут адаптировать природу реактивного глиоза и многоклеточные реакции к типу и тяжести клеточного повреждения или смерти ().Важно отметить, что конечный уровень клеточного повреждения, вызванного всевозможными оскорблениями, частично определяется продолжительными периодами различных типов вторичных событий (), включая балансирующее действие между врожденными иммунными механизмами, которые регулируют выведение «измененных» «я», мусор и «чужие» патогены, сохраняя при этом «здоровое я» () (Griffiths et al., 2010). Эти события будут влиять на окончательный размер, расположение глиального рубца и передачу сигналов по периметру очага поражения ().
Реактивный глиоз
Реактивный глиоз регулируется большим набором различных внеклеточных сигналов, генерируемых после поражения ЦНС.Этот массив включает не только молекулы, высвобождаемые поврежденными или мертвыми клетками, как только что описано, но также молекулы, поступающие через протекающий ГЭБ, молекулы, высвобождаемые инфильтрацией лейкоцитов, и молекулы, высвобождаемые локальными клетками, включая сами реактивные глии () (Sofroniew, 2009). В ответ на это множество различных и часто комбинаторных молекулярных сигналов реактивная глия изменяет экспрессию, структуру и функцию своих генов избирательным и специфическим образом в зависимости от типа и тяжести повреждений и в зависимости от конкретных комбинаций молекулярных сигналов, которые на них воздействуют. .Важно подчеркнуть, что глия не существует в простых «покоящихся» или «активированных» состояниях «все или ничего» и что не существует единой программы «реактивного глиоза», которая запускалась бы по принципу «все или ничего». и одинаков во всех ситуациях. Вместо этого реактивная глия может демонстрировать широкий спектр ответов, определяемых комбинациями определенных сигнальных событий. Например, воздействие PAMP, таких как липополисахарид (LPS), может заметно исказить транскриптом реактивных астроцитов в сторону хемокинов, цитотоксичности и воспаления (Hamby et al., 2012; Заманян и др., 2012). Также следует отметить, что различные комбинации стимулирующих факторов могут приводить к синергическим изменениям в молекулярной экспрессии, которые невозможно предсказать на основании индивидуальных эффектов (Hamby et al., 2012).
Многоклеточная и многомолекулярная регуляция реактивного глиоза и ГЭБ(A) Реактивный глиоз может индуцироваться, регулироваться и зависеть от множества молекулярных сигналов, которые могут происходить из многих типов внутренних и внешних источников ЦНС.
(B) Проницаемость ГЭБ может регулироваться специфическими молекулярными сигнальными каскадами, включающими взаимодействия между разными типами клеток, которые сходятся в эндотелиальных плотных контактах (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013).
Информация об эффектах, опосредованных реактивной глией в ответ на специфические сигналы, также неуклонно растет, и очевидно, что многие аспекты реактивного глиоза являются частью скоординированных многоклеточных врожденных и адаптивных иммунных ответов на поражение ЦНС.Интересно отметить, что определенные молекулы становятся потенциальными координаторами многоклеточных ответов. Один интересный набор сходящихся данных предполагает, что IL-1β является ключевым триггером, который стимулирует различные типы глиальных клеток, чтобы модулировать проницаемость BBB для белков сыворотки и лейкоцитов во время реактивного глиоза в ответ на поражение ЦНС (2). Многочисленные DAMP и PAMP, генерируемые поражением ЦНС, будут стимулировать высвобождение IL-1β из микроглии, и этот IL-1β будет стимулировать (i) локальные реактивные астроциты высвобождать VEGF и (ii) локальные NG2-OPCs высвобождать MMP-9, которые в Turn влияет на плотные контакты и барьерные свойства местных эндотелиальных клеток и позволяет проникать сывороточным белкам (включая IgG и сигнальные белки, такие как тромбин, альбумин, протеазы и т. д.)) и лейкоцитов в локальную паренхиму ЦНС () (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013). Проникающие лейкоциты могут генерировать больше IL-1β и поддерживать локальную проницаемость ГЭБ, создавая потенциал для петли прямой связи при неблагоприятных обстоятельствах. Понимание молекулярных механизмов, посредством которых такая передача сигналов подавляется и закрытие ГЭБ, может помочь выявить рациональные терапевтические вмешательства при определенных состояниях. Восстановление ГЭБ после неосложненной острой травмы обычно происходит в течение нескольких недель ().
Образование рубцов астроцитов
Формирование компактных рубцов астроцитов — это особый аспект реактивного астроглиоза, который возникает в ответ на тяжелое повреждение тканей и инфильтрацию лейкоцитов и включает фазы пролиферации и организации клеток () (Sofroniew and Vinters, 2010; Wanner et al. др., 2013). Молекулярные сигналы, которые регулируют сигналы пролиферации астроцитов после повреждения ЦНС, могут происходить от белков сыворотки или местных клеток и включать тромбин, эндотелин, FGF2, АТФ, BMP (костные морфогенные белки), SHH (звуковой изгородь) и другие () (Gadea et al., 2008; Нари и др., 2003; Сахни и др., 2010; Сиракава и др., 2010; Сирко и др., 2013). На расположение границ рубцов астроцитов вокруг очагов поражения могут влиять взаимодействия между пролиферирующими или вновь пролиферирующими рубцообразующими астроглиями, клетками, связанными с фибробластами, и воспалительными клетками (Wanner et al., 2013), а также трансгенными манипуляциями с внутренней сигнализацией астроцитов. каскады с участием STAT3, SOCS3 или NFκB, которые могут увеличивать или уменьшать размеры поражения (Brambilla et al., 2005; Herrmann et al., 2008; Окада и др., 2006; Wanner et al., 2013) с указанием целей для потенциального вмешательства. Сигналы для организации вновь пролиферирующих астроцитов в компактные рубцы включают сигнальную систему рецептора IL-6-STAT3, которая критически регулирует образование рубцов астроцитов после травмы, инфекции и аутоиммунного воспаления (Drogemuller et al., 2008; Haroon et al., 2011; Herrmann et al., 2008; Wanner et al., 2013).
Ремоделирование нервной ткани в периметре поражения
Реактивный глиоз не только важен в ответах на очень локальное повреждение ЦНС, но также, вероятно, играет важную роль в ремоделировании нервной системы, которое продолжается в течение длительного времени в периметре поражения после острого очагового поражения. оскорбления, такие как инсульт и травма (,), а также при хронических диффузных поражениях ЦНС (), включая нейродегенеративные состояния, такие как болезнь Альцгеймера.Такие периметральные области периметра поражения могут простираться на значительные расстояния от крупных очаговых поражений (,) или могут охватывать большие области диффузного повреждения ткани (). В таких случаях связанный с ним реактивный глиоз может повлиять на значительные территории функционирующей нервной ткани. Появляется все больше доказательств того, что разнообразные изменения в молекулярной передаче сигналов, связанные с этим диффузным реактивным глиозом (), будут влиять на продолжающееся ремоделирование нервной системы и изменения нейронной функции. Астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными прямыми и косвенными способами, в том числе путем модуляции внеклеточного баланса ионов, передатчиков и воды, критически важных для нейронной функции, а также прямого влияния на синаптическую активность. напрямую через выпуск «глиотрансмиттеров»; (Halassa, Haydon, 2010; Hamilton, Attwell, 2010; Henneberger et al., 2010; Вольтерра и Мелдолези, 2005). Микроглия также участвует в регуляции синаптического обмена (Stephan et al., 2012). Молекулы перинейрональной сети, такие как протеогликаны хондроитинсульфата, генерируемые астроцитами и NG2-OPC, влияют на синаптическую пластичность (Wang and Fawcett, 2012). Влияние реактивного глиоза на такие функции только начинается, но сообщалось, что реактивный астроглиоз по-разному влияет на нервные функции, в том числе (i) за счет подавления глютаминсинтазы астроцитов, что связано со снижением тормозных синаптических токов. в локальных нейронах (Ortinski et al., 2010), (ii) повышенная экспрессия xCT (Slc7a11), переносчика цистеина-глутамата, связанная с усилением передачи сигналов глутамата, судорогами и эксайтотоксичностью (Buckingham et al., 2011; Jackman et al., 2010) и (iii) изменениями в экспрессии множественных GPCRs и G белков и передаче сигналов кальция, вызываемой их лигандами, которые обладают потенциалом изменять взаимодействия астроцитов и нейронов (Hamby et al., 2012). Также появляется все больше доказательств того, что в ответ на медиаторы воспаления и цитокины реактивные астроциты могут модулировать свою экспрессию множества молекул, таких как медиаторы и переносчики ионов, нейромодуляторы, такие как оксид азота и простагландины, факторы роста и белки, регулирующие синапсы, которые могут влияние на синаптические и нейронные функции, включая сложное поведение, такое как болезненное поведение, боль, аппетит, сон и настроение, как более подробно рассматривается в другом месте (Sofroniew, 2013).Взятые вместе, такие находки предоставляют доказательства того, что различные молекулярные медиаторы и сигнальные механизмы, связанные с реактивным глиозом, могут модулировать функции реактивных астроцитов и микроглии различными способами, которые потенциально могут влиять на синаптические и другие нейронные функции в периметрах поражения. Такие сигнальные механизмы, вероятно, будут влиять на эффективность тренировок и функциональной реабилитации после острого повреждения, такого как травма или инсульт, а также на эффекторы для смягчения функционального ухудшения во время дегенеративных состояний.Понимание и управление сигнальными механизмами и эффектами реактивного глиоза в ткани периметра поражения может раскрыть новые терапевтические стратегии (Gleichman and Carmichael, 2013).
Гематоэнцефалический барьер (BBB)
BBB генерируется и регулируется сложной многоклеточной нервно-сосудистой единицей, которая включает критические взаимодействия между эндотелием, перицитами, астроцитами и другими клетками (Abbott et al., 2006; Zlokovic, 2008). Нарушение ГЭБ может происходить по-разному и в разной степени, начиная от конкретных событий передачи молекулярных сигналов, которые открывают проницаемость ГЭБ во время определенных типов реактивного глиоза, как обсуждалось выше (), до тяжелого разрушения ГЭБ, вызванного травматическим или ишемическим разрушением эндотелия. при необходимости неоваскуляризации ().Помимо явной травмы и ишемии, имеется немало доказательств того, что дисфункция ГЭБ играет центральную роль в старении и различных нейродегенеративных расстройствах. Напр., Дефицит перицитов, вызванный как трансгенами, так и связанный со старением, приводит к разрушению ГЭБ, которое предшествует дегенерации нейронов (Bell et al., 2010). Дефицит перицитов также очевиден в тканях, пораженных посмертным амиотрофическим боковым склерозом (Winkler et al., 2013), а дисфункция ГЭБ предшествует нейродегенерации на мышиной модели (Zhong et al., 2008). Полиморфизмы изоформ APOE участвуют в повышенной уязвимости к распаду ГЭБ при нейродегенеративных расстройствах и травматических повреждениях (Bell et al., 2012).
Независимо от триггерных событий утечка ГЭБ немедленно приводит к проникновению в паренхиму ЦНС сывороточных белков, таких как тромбин, альбумин, иммуноглобулины и протеазы (), которые могут иметь широкий спектр прямых и косвенных эффектов. Тромбин может передавать сигналы напрямую через рецепторы, активируемые протеазой, на различные клетки ЦНС, включая микроглию и астроциты (Shigetomi et al., 2008; Suo et al., 2002). Иммуноглобулины способствуют очищению от патогенов, но могут способствовать аутоиммунным дисфункциям. Тромбоциты могут входить и образовывать агрегаты для свертывания и высвобождения PDGF, важных для ремоделирования неоваскулярных сосудов, а также для передачи сигналов перицитам и клеткам NG2. Металлопротеазы действуют на несколько белков и способствуют ремоделированию внеклеточного матрикса и тканей (). Калликреиновые протеазы сыворотки активируют воспаление. Тканевые калликреины, которые могут взаимодействовать с сывороточными протеазами как часть более крупных протеолитических каскадов, вовлечены в патологию олигодендроцитов, демиелинизацию, аксонопатию и дегенерацию нейронов (Burda et al., 2013; Радулович и др., 2013). Серпины подавляют и уравновешивают эффекты протеазы ().
В ответ на сигналы, связанные с утечкой ГЭБ, местные глиальные клетки продуцируют цитокины и хемокины, которые привлекают лейкоциты, которые по прибытии производят дополнительные цитокины и хемокины. Результатом является богатая внеклеточная смесь молекулярных сигналов, которые могут инструктировать или влиять на несколько типов клеток в ядрах поражения, а также могут диффундировать в окружающую паренхиму ЦНС и влиять на нервные клетки, которые, возможно, не участвовали в начальном поражении ().Эти молекулярные градиенты могут влиять или принимать участие в формировании клеточных событий в периметрах поражения, таких как длительный градиент реактивного глиоза и длительное нейральное ремоделирование, которое происходит в ткани периметра. Сочетание молекулярных сигналов, генерируемых в ядрах поражения, со временем изменяется по мере того, как реакция на повреждение прогрессирует через разные фазы, и утечка ГЭБ восстанавливается, и разные типы клеток занимают эту область и продуцируют разные эффекторные молекулы (,). В зависимости от тяжести повреждения ядра поражения демонстрируют утечку ГЭБ от нескольких дней до двух недель в течение начального периода (фаза I) реакции на повреждение ().Ремонт BBB требует присутствия функциональных астроцитов (Bush et al., 1999). Высвобождение белка HMGB1 (группа с высокой подвижностью 1) реактивными астроцитами способствует ремоделированию неоваскулярных клеток эндотелия, тогда как блокада высвобождения HMGB1 реактивными астроцитами предотвращает ремоделирование неоваскулярных сосудов и усугубляет неврологический дефицит (Hayakawa et al., 2012). При сложных, хронических или диффузных поражениях утечки ГЭБ могут сохраняться и оказывать длительное воздействие на расширенные участки нервной ткани по периметру поражения (), а позднее разрушение ГЭБ может привести к вторичному повреждению ткани (Злокович, 2008).Даже когда утечки ГЭБ устранены, ядра поражений продолжают содержать скопления ненейральных клеток внутри ГЭБ, которые могут продолжать продуцировать высокие уровни множества различных сигнальных молекул в течение длительных периодов времени. Таким образом, сердцевина пораженной ткани может генерировать градиенты диффузии многих мощных молекул, которые распространяются в паренхиму соседней ткани и формируют градиенты молекулярных сигналов, которые влияют на клетки-хозяева (). Также следует отметить, что, хотя ГЭБ открыт, существует также возможность проникновения различных патоген-ассоциированных молекулярных паттернов (PAMP) (), которые генерируются микробными инфекциями на периферии и которые могут существенно изменить реакцию местных клеток на ЦНС. повреждение, даже если нет местной инфекции, как обсуждается ниже.
Проникающие лейкоциты
Лейкоциты, которые проникают из кровотока, являются основным источником молекулярной передачи сигналов во время реакции на повреждение ЦНС. Эти молекулярные сигналы включают разнообразную смесь цитокинов, хемокинов и факторов роста (), которые могут инструктировать и изменять функции локальной реактивной глии () и других внутренних клеток ЦНС, а также других локальных лейкоцитов. Вероятно, что молекулярные сигналы, производимые лейкоцитами, и их функциональные эффекты будут варьироваться в течение разных фаз ответа на острые или хронические инсульты () и варьироваться от сигналов, опосредующих классические воспалительные реакции с цитотоксической и фагоцитарной активностями, до сигналов, влияющих на восстановление тканей и ремоделирование.Хотя временные изменения во время реакции на рану еще недостаточно изучены, постепенно выявляются различные функциональные роли разных подтипов лейкоцитов. Например, в ответ на стимуляцию разными цитокинами моноциты генерируют макрофаги с различными функциональными фенотипами, которые продуцируют разные эффекторные молекулы (Mosser and Edwards, 2008). В ответ на INFγ классически активированные макрофаги генерируют цитотоксические противомикробные молекулы и фагоцитируют мертвые клетки и мусор (), тогда как в ответ на стимуляцию с помощью Il-4 или Il10 макрофаги принимают участие в заживлении и противовоспалительной активности (Mosser and Edwards, 2008). ).Точно так же Т-клетки, стимулированные разными цитокинами, становятся поляризованными по отношению к разным активностям, таким как клетки T H 1, T Reg и T H 17, которые могут оказывать очень разные эффекты, начиная от уничтожения клеток и заканчивая участием в восстановлении тканей ( MacIver et al., 2013; Mills, 2011; Walsh, Kipnis, 2011).
Влияние периферических инфекций на реакцию на поражение ЦНС
Многие типы клеток, отвечающие на повреждение ЦНС, чрезвычайно чувствительны к молекулярным сигналам, связанным с микробной инфекцией.Это неудивительно, потому что ограничение распространения инфекции, вероятно, повлияло на развитие реакции на травму во всех тканях, включая ЦНС. Различные особенности реакции на инфекцию, такие как выработка цитотоксинов и определенные типы воспаления, могут повредить клетки-хозяева, а также микробы. Запуск таких ответов при отсутствии явной инфекции может вызвать или усугубить повреждение тканей. Таким образом, определенные реакции, которые могут быть полезными при микробной инфекции, могут быть вредными, если они вызваны повреждением стерильной (неинфицированной) ткани после травмы, инсульта, дегенеративного заболевания или аутоиммунной атаки.В этом отношении важно понимать, что на реактивную глию, как микроглию, так и астроциты, которые отвечают на стерильное первичное поражение ЦНС, могут влиять периферические инфекции, которые генерируют высокие уровни циркулирующих цитокинов и других медиаторов воспаления, таких как LPS и другие PAMP. Эта передача сигналов может происходить через переносимые кровью цитокины или ЛПС, выделяемые в месте периферической инфекции и поступающие через дырявый ГЭБ в ядре повреждения во время фазы I реакции на повреждение после очаговых поражений или через утечки ГЭБ, вызванные нейродегенеративными или аутоиммунными процессами ().ЛПС и цитокины оказывают мощное воздействие как на реактивную микроглию (Perry, 2010; Perry et al., 2007), так и на реактивные астроциты (Hamby et al., 2012; Zamanian et al., 2012), которые могут влиять на профили транскриптомов и реакцию раны на провоспалительные и потенциально цитотоксические фенотипы в течение длительного времени способами, которые обычно не применяются при стерильных поражениях ЦНС, и которые могут усугубить повреждение тканей. С такими экспериментальными наблюдениями согласуются клинические эпидемиологические данные, указывающие на то, что периферические инфекции отрицательно влияют на неврологический исход после травмы спинного мозга (Failli et al., 2012).
Манипулирование реакциями раны ЦНС для ускорения репарации
По мере того, как клеточная биология и молекулярная сигнализация, лежащие в основе ответов на повреждение ЦНС, становятся определенными, появляется все больше возможностей для определения способов манипулирования этими реакциями для улучшения результата. Манипуляции, находящиеся в стадии интенсивного исследования, включают не только традиционные подходы, такие как разработка лекарств-кандидатов для парентеральной фармакологической доставки, но также изменения образа жизни, такие как снижение потребления энергии и осуществление стратегий упражнений, направленных на уменьшение воспалительных реакций, клеточной дегенерации и функционального снижения после инсульта и травматических повреждений. (Арумугам и др., 2010; Маттсон, 2012; Piao et al., 2013). Кроме того, новые интервенционные стратегии в форме имплантатов биоматериалов в качестве молекулярных депо для локальной молекулярной доставки, а также подходы к регенерации тканей, основанные на трансплантации клеток-предшественников или стволовых клеток, демонстрируют значительные перспективы для будущего применения в восстановлении и регенерации нейронов. Неневральные очаги очаговых поражений могут представлять особенно полезные мишени для таких подходов (). Например, имплантаты из биоматериалов, особенно в форме инъекционных гидрогелей, могут служить как каркасами, так и депо, которые могут влиять на ремоделирование тканей и клеточные функции (Pakulska et al., 2012). Крупные очаги поражения не нервной ткани после инсульта или тяжелой очаговой травмы могут представлять полезные места для размещения депо биоматериала, которые высвобождают градиенты молекул, чтобы воздействовать на локально окружающую нервную ткань без причинения дополнительных повреждений (). Например, депо гидрогеля для инъекций может обеспечивать устойчивую доставку различных видов биоактивных молекул, включая факторы роста или небольшие гидрофобные молекулы, чтобы влиять на экспрессию генов и функцию локальных клеток в течение продолжительных подострых периодов времени, после чего они разрушаются без существенного повреждения тканей (Пакульска и др. ., 2012; Song et al., 2012; Ян и др., 2009; Zhang et al., 2014). Такая молекулярная доставка может влиять не только на текущее восстановление в подостром периоде после травмы, такой как образование рубца, но также может влиять на клетки в зоне большого периметра вокруг поражений ЦНС, которые подвергаются постоянному ремоделированию ткани в течение продолжительных периодов времени после повреждения ткани () . Доставка молекул через депо, помещенные в ядра поражения, может влиять на пластичность нейронов и ремоделирование тканей в этой области периметра (Clarkson et al., 2010).
Поражения как мишени для терапевтических стратегийНеневральные ядра поражений (LC) представляют собой мишени для депо биоматериалов (A) или трансплантатов экзогенных нервных стволовых клеток / клеток-предшественников (B) или мезенхимальных стволовых клеток (C) в качестве потенциальных терапевтических стратегий . Молекулы, доставляемые депо биоматериала (A) или определенные клеточные трансплантаты (C), могут поддерживать и привлекать рост аксонов (стрелка a), модулировать клетки периметра поражения (PLP) (стрелка b), модулировать клетки в LC (стрелка c) ) модулировать или астроцитарный рубец (AS) (стрелка c).Новые нейроны, генерируемые трансплантатами стволовых клеток / клеток-предшественников, могут получать и отправлять нейронные соединения в PLP и за его пределами и могут быть способны формировать новые функциональные релейные цепи (B).
Различные подходы к регенерации клеток могут иметь потенциал для восстановления ЦНС (Bliss et al., 2007; Martino and Pluchino, 2006; Snyder and Teng, 2012). Доставка клеток-предшественников нервного клона или стволовых клеток в ядра поражения () может привести к генерации локальных нейронов, которые образуют афферентные и эфферентные связи с хозяином и могут образовывать функционально интегрированные схемы (Abematsu et al., 2010; Лу и др., 2012). Стромальные или мезенхимальные стволовые клетки, полученные из костного мозга или пуповины, доставленные периферической (внутрисосудистой) инъекцией или инъекцией в ЦНС, могут стать местом расположения участков повреждения (), где они могут высвобождать факторы роста, цитокины и другие факторы, которые могут влиять на реакцию на повреждение и процесс восстановления (Bliss et al., 2007; Kokaia et al., 2012; Lemmens, Steinberg, 2013). Такие исследования по прививке интенсивно проводятся, но все еще находятся на ранних стадиях разработки. Сообщается о положительных эффектах на клеточные события, такие как иммуномодуляция, выживаемость внутренних клеток ЦНС, включая нейроны, и рост аксонов, однако пока имеется ограниченная информация об общей функциональной эффективности.
Реактивный глиоз и многоклеточный ответ на повреждение и заболевание ЦНС
Abstract
Центральная нервная система (ЦНС) склонна к гетерогенным повреждениям различной этиологии, которые вызывают разносторонние реакции. Острые и очаговые травмы вызывают заживление ран с заменой тканей. Распространенные и хронические заболевания провоцируют постепенно нарастающие изменения тканей. Ответы на поражение ЦНС включают сложные взаимодействия между клетками многочисленных клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока.Вклад различных типов ненейрональных клеток в исход после острого повреждения или в прогрессирование хронического заболевания вызывает все больший интерес по мере того, как усиливается стремление к пониманию и облегчению поражений ЦНС. В одних случаях имеется значительный объем информации, в других — сравнительно мало информации, рассмотренной и рассмотренной здесь.
Введение
Основная цель современной неврологии — понять и облегчить широкий спектр заболеваний центральной нервной системы (ЦНС).С этой целью растет интерес к клеточным и молекулярным механизмам реакции ЦНС на повреждение, болезнь и восстановление. Нейроны являются основными клетками, выполняющими нервные функции, и долгое время находились в центре исследований механизмов, лежащих в основе расстройств ЦНС. Тем не менее, все больше данных указывает на то, что лечение всех типов расстройств ЦНС потребует более глубокого понимания того, как многоклеточные реакции на травмы и заболевания запускаются, развиваются, разрешаются (или нет) и влияют на функцию нейронов.
Способность восстанавливать ткани, поврежденные в результате травм, имеет фундаментальное значение для биологии позвоночных и имеет ключевое значение для выживания. Эволюционное давление, вероятно, привело к определенным фундаментальным клеточным и молекулярным ответам на повреждения, которые являются общими для разных тканей. Реакция на рану или повреждение кожи долгое время служила модельной системой для анализа механизмов восстановления ткани после острого очагового повреждения ткани и обеспечивала понимание основных клеточных и молекулярных взаимодействий (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999). Кроме того, существуют органоспецифические особенности. Присущие органу клетки, которые специализируются на регуляции воспаления и восстановлении тканей, становятся критическими элементами в органоспецифической реакции на воздействие. Специфические для органа особенности применяются, в частности, в ЦНС, где глиальные клетки, которые поддерживают цитоархитектуру и гомеостатическую регуляцию, без которых нейроны не могли бы нормально функционировать в здоровой ткани, также являются основными ответчиками на поражение ЦНС.Изменения функции глиальных клеток во время реакции на воздействие могут заметно повлиять на нейрональные взаимодействия и функции ЦНС.
Повреждения ЦНС вызываются разной этиологией, которая может вызывать широкий спектр реакций. Например, острые и очаговые травмы вызывают заживление ран с заменой тканей, тогда как диффузные и хронические заболевания могут вызывать постепенно нарастающие изменения тканей. Анализ сходств и различий в таких ответах может дать ценную информацию.Клеточные реакции на поражение ЦНС включают сложные взаимодействия между клетками множества клонов и функций, включая внутренние нервные клетки ЦНС, внутренние ненейральные клетки ЦНС и внешние клетки ЦНС, которые поступают из кровотока. Биология типов клеток, которые участвуют в ответах ЦНС на модели повреждений и болезней, обычно изучалась изолированно. Возрастает потребность в изучении взаимодействия различных клеток, чтобы понять механизмы. В этой статье исследуются и рассматриваются несколько типов клеток, участвующих в различных типах поражений ЦНС и способствующих им.В одних случаях доступна обширная информация, в других — сравнительно мало.
Терминология
Различные термины, используемые при обсуждении травм и заболеваний ЦНС, могут интерпретироваться по-разному. В этой статье мы определим и будем использовать определенные термины следующим образом. «Реактивный глиоз» будет относиться не только к микроглии и астроглии, но и к глиальным клеткам, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Глиальные клетки в здоровой ткани ЦНС не будут называться «покоящимися» или «покоящимися».Это устаревшая концепция. Глии очень активны в здоровой ЦНС и динамически выполняют сложные функции, которые играют критическую роль в нормальных функциях ЦНС (Barres, 2008; Sofroniew and Vinters, 2010). Например, астроциты проявляют физиологическую активацию в виде кратковременного, вызванного лигандами повышения внутриклеточного кальция ([Ca 2+ ] i ), что представляет собой тип возбудимости астроцитов, который интенсивно исследуется как потенциальный средства опосредования динамических функций астроцитов, включая взаимодействие с синапсами и регуляцию кровотока (Attwell et al., 2010; Халасса и Хейдон, 2010; Тонг и др., 2013; Верхратский и др., 1998). Микроглия выполняет важные роли в развитии и обновлении синапсов (Stephan et al., 2012; Stevens et al., 2007). Термин «активированный» часто используется в бинарной форме «все или ничего» для определения глиальных клеток, которые отреагировали на оскорбления. Мы считаем, что использование этого термина в такой манере неверно по двум причинам. Во-первых, он не осознает, что глия постоянно «активируется» в физиологическом контексте. Во-вторых, как обсуждалось в этом обзоре, ответы глиальных клеток на поражение ЦНС не являются бинарными, а очень разнообразны и специфически регулируются.Чтобы дифференцировать физиологическую активацию глиальных клеток в здоровом контексте от реакций, связанных с травмой или заболеванием, мы будем использовать термин «реактивный», который также означает широкий спектр потенциальных ответов глиальных клеток на поражение ЦНС. Наконец, мы будем избегать использования термина «шрам» как такового и вместо этого будем различать «астроцитарные рубцы», образующие компактные границы вокруг поражений тканей, и «фиброзные рубцы», образованные множественными типами неневральных клеток и внеклеточными клетками. матрица в ядрах поражения (как подробно обсуждается ниже).Мы будем приравнивать «глиальный шрам» к «шраму астроцита».
Многоклеточный ответ на поражение ЦНС
Прежде чем обсуждать различные типы ответов на повреждение и заболевание ЦНС, полезно вкратце представить различные типы клеток, участвующих в этих ответах. Для простоты рассмотрения мы сгруппировали клетки в соответствии с клонами как (i) нервные и ненейральные клетки, присущие ЦНС, и (ii) переносимые кровью ненейральные клетки, которые происходят в основном из костного мозга (2). Некоторые из этих типов клеток широко изучены при расстройствах ЦНС, другие — сравнительно мало.Чаще всего их изучали изолированно. В следующих разделах мы постараемся изучить их взаимодействие.
Таблица 1
Различные типы клеток в ответах ЦНС на повреждение и болезнь
| Внутренние клетки ЦНС: | Неневральные клетки, передающиеся через кровь: |
|---|---|
| Внутренние нервные клетки ЦНС: Нейроны Олигодендроциты Астроциты NG2-OPC Нервные стволовые клетки / клетки-предшественники Эпендима | Лейкоциты: Моноциты / макрофаги Нейтрофилы Эозинофилы NK-клетки Т-клетки B-клетки | Другие клетки, полученные из костного мозга: Тромбоциты (тромбоциты) Фиброциты Мезенхимные (стромальные) стволовые клетки 9 9000 9000 |
Внутренние нейронные клетки ЦНС Основные клетки нервного происхождения в ЦНС, нейроны, олигоденд роциты и астроциты были тщательно изучены и проанализированы в отношении их индивидуальных реакций на повреждение и заболевание ЦНС (Barres, 2008; Франклин и Френч-Констан, 2008; Маттсон, 2000; Софронев и Винтерс, 2010).Менее изучены глиальные клетки, которые стали известны как клетки-предшественники NG2-положительных олигодендроцитов (NG2-OPC). Подобно другим глиям, NG2-OPC покрывает ЦНС и отвечает на повреждения ЦНС (Nishiyama et al., 2009). Особенности ответа NG2-OPC включают миграцию в сторону повреждения и пролиферацию клеток (Franklin and Ffrench-Constant, 2008; Hughes et al., 2013). Помимо замещения потерянных олигодендроцитов (Sun et al., 2010), другие роли NG2-OPC в повреждении и заболевании ЦНС ожидают будущих исследований и выяснения.Кроме того, ЦНС взрослого человека содержит нервные стволовые клетки (НСК) с различной активностью, которые находятся в периэпендимных областях вдоль желудочков и центрального канала головного и спинного мозга взрослого человека (Garcia et al., 2004; Kriegstein and Alvarez-Buylla, 2009 г.). Эти взрослые NSC также могут реагировать на повреждение ЦНС и генерировать предшественники и клетки разных типов, которые мигрируют в места повреждения (Benner et al., 2013; Lagace, 2012; Meletis et al., 2008; Ohab and Carmichael, 2008).
Внутренние ненейральные клетки ЦНС
Различные клетки ненейрального происхождения, присущие ЦНС, играют решающую роль в повреждении и заболевании ЦНС ().Хорошо известно, что микроглия является высокочувствительными ранними ответчиками, которые стимулируют и рекрутируют другие клетки, а также фагоцитозный дебрис (Hanisch and Kettenmann, 2007; Kreutzberg, 1996; Nimmerjahn et al., 2005; Ransohoff and Perry, 2009). Клетки, связанные с фибробластами, включая периваскулярные фибробласты, менингеальные фибробласты и перициты, способствуют замещению тканей, формируя фиброзную рубцовую ткань после тяжелого повреждения (Goritz et al., 2011; Klapka and Muller, 2006; Logan and Berry, 2002; Soderblom et al., 2013; Винклер и др., 2011). Эндотелий и эндотелиальные предшественники играют важную роль во время замены тканей после повреждения ЦНС (Loy et al., 2002; Oudega, 2012) и вызывают растущий интерес в восстановлении ЦНС в свете их новой роли в качестве трофических поддерживающих клеток в развитии ЦНС (Dugas et al. , 2008), а также их способность продуцировать и представлять ламинин (Davis and Senger, 2005), предпочтительный субстрат для роста многих мигрирующих клеток и аксонов.
Неневральные клетки, передающиеся через кровь
Иммунные и воспалительные клетки различных типов (), передающиеся через кровь, играют важную роль в ответах ЦНС на повреждения и болезни, они были изучены и проанализированы (Perry, 2010; Popovich and Longbrake, 2008).Помимо хорошо известной роли в фагоцитозе и удалении мусора, в настоящее время появляется все больше доказательств того, что подтипы лейкоцитов играют активную роль в восстановлении тканей (Derecki et al., 2012; London et al., 2013; Popovich and Longbrake, 2008). ). После повреждения тромбоциты быстро агрегируются для образования сгустков и гемостаза. К другим переносимым кровью типам клеток костного мозга, которые являются причиной повреждения тканей, в том числе в ЦНС, относятся фиброциты (Aldrich and Kielian, 2011; Reilkoff et al., 2011) и мезенхимальные стволовые клетки костного мозга (Askari et al., 2003; Бьянко и др., 2001; Jaerve et al., 2012), но их функции не совсем понятны.
Внеклеточный матрикс (ECM)
ECM, генерируемый различными клетками, играет критическую роль в восстановлении и замене тканей после острых повреждений, а также в хроническом ремоделировании тканей во время хронических заболеваний (Midwood et al., 2004). Молекулы, которые модифицируют матрикс ECM, такие как metaloproteases (MMP), также важны в этом отношении (Midwood et al., 2004). В ЦНС ЕСМ, генерируемый различными типами клеток, реагирующих на повреждение или заболевание, может включать широкий спектр молекул, таких как ламинин, коллагены и гликопротеины, такие как хондроитин или гепарансульфат протеогликаны (CSPG или HSPG), которые участвуют как в поддержке восстановления тканей, так и а также способствуют нарушению регенерации аксонов (Davis and Senger, 2005; Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).
Ответ на очаговое поражение
Два основных типа острого очагового поражения ЦНС — очаговое травматическое повреждение и ишемический инсульт. Помимо того, что они являются серьезными клиническими проблемами, они на протяжении десятилетий служили прототипами экспериментальных моделей, с помощью которых можно было изучить механизмы реакции ЦНС на повреждение и восстановление. В этом разделе мы рассмотрим основные характеристики многоклеточных реакций ЦНС на острые очаговые повреждения и то, как они меняются с течением времени, используя в качестве моделей информацию о реакции на травму или инсульт.В этом отношении следует отметить, что острая очаговая травма, вызванная ушибом или раздавливанием, приводит к серьезному повреждению сосудов и, следовательно, имеет множество последствий, подобных инсульту. Мы проведем сравнения с острой раневой реакцией кожи как модельной системой для клеточных и молекулярных механизмов заживления ран (Greaves et al., 2013; Gurtner et al., 2008; Shechter and Schwartz, 2013; Singer and Clark, 1999). . Как и при восстановлении кожи, ответы ЦНС на острое очаговое повреждение также можно в общих чертах разделить на три перекрывающиеся, но отдельные фазы: (i) гибель клеток и воспаление, (ii) пролиферация клеток для замены тканей и (iii) ремоделирование тканей (3).Сначала мы исследуем реакцию ЦНС в контексте, когда острые оскорбления остаются незараженными и проходят. Ниже мы также кратко рассмотрим более хронические очаговые поражения ЦНС, включая очаговые инфекции с образованием абсцесса, первичные и вторичные опухоли и хронические очаговые аутоиммунные поражения, такие как бляшки рассеянного склероза, которые проявляют различные особенности и клеточные реакции, аналогичные травматическим и ишемическим повреждениям. . Чтобы представить краткое изложение клеточных ответов и взаимодействий, обсуждение информации о второстепенных молекулярных сигналах отложено до следующего раздела ниже.Следует упомянуть, что временные характеристики, приведенные для фаз реагирования и событий, являются обобщенными приближениями (), и существует большая вероятность перекрытия событий, а также вариаций продолжительности или времени в конкретных ситуациях.
Фазы и динамика многоклеточных реакций на острое очаговое повреждение ЦНСВо время периодов гибели клеток (A), замещения клеток (B) и ремоделирования тканей (C) происходят многочисленные перекрывающиеся события (D), которые включают взаимодействия между внутренними компонентами ЦНС. нервные клетки, внутренние ненейральные клетки ЦНС и клетки, проникающие из кровотока.
Фаза I: смерть и воспаление клеток
После очагового повреждения ткани ЦНС в результате воздействия, такого как травма или ишемия, которые вызывают острую локальную гибель клеток, первая фаза ответа в центре повреждения или ядре включает в себя оба очень быстрых события, которые происходят с течением времени. шкала от секунд до часов, и более постепенно прогрессирующие события, которые развиваются в течение нескольких дней (). Очень быстрые события включают гемостаз с каскадом коагуляции, агрегацию тромбоцитов и образование сгустка. За этими быстрыми событиями следуют перекрывающиеся последовательности ответов внутренних клеток ткани, рекрутирование воспалительных и иммунных клеток, подострая гибель паренхимных клеток и начало удаления мусора ().В здоровой ткани ЦНС большие и полярные молекулы в кровотоке исключены из диффузии в паренхиму ЦНС через гематоэнцефалический барьер (ГЭБ) (Abbott et al., 2006; Zlokovic, 2008). После очаговых поражений с повреждением ГЭБ, переносимые с кровью молекулы обычно исключаются из притока ЦНС и передачи сигналов в местные клетки, что более подробно обсуждается ниже в разделе о молекулярной передаче сигналов. Приток тромбоцитов быстро образует агрегаты для гемостаза, а также дает сигнал местным клеткам. Матрицы фибрина и коллагена начинают формироваться в течение периода от нескольких часов до дней, которые служат каркасом для нейтрофилов, а затем макрофагов и других лейкоцитов.Затем лейкоциты сильно инфильтрируют для отслеживания патогенов, удаления мусора и передачи молекулярных сигналов, участвующих в заживлении ран, в течение различного количества дней или дольше в зависимости от тяжести повреждения ткани или наличия обостряющих факторов () (Perry, 2010; Popovich and Longbrake, 2008). ). Эндогенные мезенхимальные стволовые клетки также могут проникать в ядро поражения, но их роль недостаточно изучена (Askari et al., 2003; Bianco et al., 2001; Jaerve et al., 2012). Эти основные клеточные события отражают классические реакции раны, обнаруживаемые в других тканях (Greaves et al., 2013; Гуртнер и др., 2008; Сингер и Кларк, 1999).
Некоторые внутренние клетки ЦНС также быстро реагируют на повреждение ткани ЦНС или утечку ГЭБ. Исследования живых изображений в CNS in vivo показывают, что микроглия и NG2-OPC немедленно мигрируют в места повреждения тканей и утечки BBB (Hughes et al., 2013; Nimmerjahn et al., 2005). Астроциты, напротив, остаются in situ и не мигрируют ни в места повреждения, ни от них, но могут осмотически набухать и, в зависимости от тяжести повреждения или ишемии, могут погибнуть в центре тяжелых повреждений или могут стать реактивными и гипертрофия и в некоторых случаях пролиферация (Bardehle et al., 2013; Чжэн и др., 2010). Различные аспекты этой первой фазы ответа возникают в перекрывающихся последовательностях в течение первых нескольких дней, а затем начинают постепенно уменьшаться () при условии, что повреждение представляет собой единичное острое событие, не осложненное сдавлением костей, инфекцией или другими обострениями, которые могут продлить разрушительное повреждение. По мере ослабления острых ответов происходит совпадение с началом различных типов пролиферации клеток, связанных со следующей фазой ответов ().
Фаза II: пролиферация клеток и замещение ткани
Вторая фаза ответа на острое повреждение ткани ЦНС наступает примерно через два-десять дней после повреждения и характеризуется пролиферацией и локальной миграцией клеток, которые осуществляют восстановление и замену ткани.Эти клетки включают эндотелиальные клетки-предшественники, клетки линии фибробластов, различные типы воспалительных клеток, а также различные типы клеток-предшественников глии и нейронального происхождения, включая формирующие рубцы астроциты и их предшественники (). Некоторые из этих явлений клеточной пролиферации, такие как пролиферация эндотелия для неоваскуляризации (Casella et al., 2002) или пролиферация определенных клеток линии фибробластов или воспалительных клеток, отражают классические раневые реакции (Gurtner et al., 2008; Singer and Clark, 1999). , в то время как другие, такие как пролиферация рубцовых астроцитов, специфичны и уникальны для ЦНС.Эта фаза также характеризуется на протяжении всей ее продолжительности отсутствием ГЭБ в ядре поражения в период, когда поврежденные кровеносные сосуды заменяются новыми (). Как следствие, эндогенные (а также экзогенные) белки и другие заряженные молекулы могут свободно диффундировать в окружающую нервную паренхиму (Bush et al., 1999). Эти молекулы могут включать белки сыворотки (например, тромбин, альбумин), которые передают сигнал местным клеткам, иммуноглобулинам или молекулам, связанным с патогенами, как обсуждается ниже.Этот негерметичный ГЭБ создает возможность для ядра поражения служить источником циркулирующих молекул, которые генерируют градиенты молекулярной передачи сигналов, которые могут распространяться на значительные расстояния в нервную ткань вокруг поражения до тех пор, пока ГЭБ не будет восстановлен (,). Эта передача сигналов может вносить вклад в периметр сужающегося градиента реактивного глиоза и другие изменения, наблюдаемые в ткани вокруг зрелых поражений, как обсуждается ниже.
Поражения демонстрируют тканевые компартменты и градиенты передачи сигналов(A, B) Фокусное повреждение приводит к поражениям с отдельными тканевыми компартментами в виде ядер неневральных поражений (LC), недавно пролиферирующих компактных рубцов астроцитов (AS) и пери периметры поражения (PLP), которые демонстрируют уменьшающиеся градиенты реактивного глиоза, которые постепенно переходят в здоровую ткань (HT).AS резко разграничивают переход между ненейральными LC и PLP с жизнеспособными нервными клетками. Размер ядра поражения и расположение AS и этого перехода регулируются противоположными молекулярными сигналами. Градиенты молекулярных сигналов, исходящих от LC, воздействуют на клетки в PLP.
Во время фазы пролиферации образуются клеточные элементы, которые в зрелых поражениях образуют два из трех основных тканевых компартментов зрелого поражения, (i) центральное ядро поражения неневральной ткани и (ii) компактный рубец астроцитов, который окружает ядро поражения ().Основные клеточные компоненты ядра ненейрального поражения происходят из расширения внутренних периваскулярных фибробластов и перицитов ЦНС (Goritz et al., 2011; Soderblom et al., 2013) и от пролиферирующих предшественников эндотелия. Компактный рубец астроцитов формируется в основном из недавно пролиферирующих удлиненных астроцитов, генерируемых местными астроглиальными предшественниками, которые собираются по краям сильно поврежденной ткани, содержащей воспалительные клетки и клетки линии фибробластов () (Faulkner et al., 2004; Sofroniew and Vinters, 2010; Wanner и другие., 2013). Примечательно, что в этот пролиферативный период определяется расположение границ компактных рубцов астроцитов. В зрелых поражениях эти границы рубца астроцитов будут точно разграничивать и отделять сохраняющиеся области нефункциональной, не нервной ткани ядра поражения от непосредственно окружающей и потенциально функциональной нервной ткани (,). Клеточные и молекулярные механизмы, лежащие в основе определения того, где именно образуются границы таких рубцов астроцитов, изучены не полностью, но, вероятно, включают сложное взаимодействие и баланс молекулярных сигналов, которые, с одной стороны, способствуют фагоцитозу и очистке от мусора, а также сигнализируют об этом. с другой стороны, способствуют защите и сохранению здорового «я» (), что более подробно обсуждается ниже в разделе, посвященном молекулярным сигналам повреждения и гибели клеток.Несколько десятилетий экспериментальных исследований ишемических инфарктов показывают, что на окончательный размер поражения могут влиять подострые метаболические процессы, которые продолжаются от часов до дней в полутеневых зонах вокруг поражений (Astrup et al., 1981; Dirnagl et al., 1999; Lo, 2008). ). Кроме того, были идентифицированы внутренние сигнальные каскады астроцитов, которые играют критические роли (Herrmann et al., 2008; Okada et al., 2006; Wanner et al., 2013). Лучшее понимание многоклеточных и молекулярных взаимодействий, которые определяют расположение границ рубцов астроцитов вокруг участков поврежденной ткани, может привести к новым терапевтическим стратегиям для уменьшения размера поражения ().Эти события происходят в течение нескольких дней после оскорбления (), в течение которых вмешательство является реальной возможностью.
Недавние открытия также показывают, что во время пролиферативной фазы после острого повреждения ЦНС в переднем мозге нервные стволовые клетки в перивентрикулярных зародышевых зонах дают начало значительному количеству нейральных предшественников, которые мигрируют в места повреждения коры или полосатого тела (Carmichael, 2006; Kokaia et al., 2012; Lagace, 2012; Lindvall, Kokaia, 2006). Эти клетки образуют часть смеси клеток по периметру очага поражения ().Существуют различные доказательства, предполагающие, что эти клетки могут благотворно влиять на ремоделирование тканей в периповрежденной ткани, но природа вкладов, вносимых этими клетками, остается туманной. В нормальных, непредсказуемых обстоятельствах очень немногие вновь сгенерированные нейроны созревают и выживают, а другие потенциальные вклады этих интригующих мигрирующих клеток-предшественников такие вклады в иммунную регуляцию все еще находятся в процессе определения (Kokaia et al., 2012; Lagace , 2012).
Фаза III: Ремоделирование ткани
Третья фаза ответа на острое повреждение ткани обычно начинается ближе к концу первой недели после повреждения и отличается ремоделированием ткани, которое включает в себя события, которые завершаются в течение нескольких недель, такие как восстановление ГЭБ и организация рубца, а также хронические события, которые могут продолжаться в течение многих месяцев (). Восстановление или восстановление ГЭБ вдоль новообразованных кровеносных сосудов в районе поражения обычно завершается в течение нескольких недель после острого неосложненного поражения и требует присутствия функциональных астроцитов (Bush et al., 1999) и перицитов (Daneman et al., 2010; Winkler et al., 2011). Ядро поражения не нервной ткани оказывается окруженным хорошо организованным, пересекающимся компактным рубцом астроцитов через две-три недели после острого поражения, не усугубляемого продолжающимся повреждением ткани () (Wanner et al., 2013). Эти формирующие рубцы астроциты, по-видимому, активно загоняют и окружают воспалительные клетки и клетки клонов фибробластов во время ремоделирования тканей и образования рубцов (Wanner et al., 2013). Этот компактный рубец астроцитов образует структурную и функциональную границу между неневральной тканью в центре поражения и непосредственно прилегающей и окружающей нервной тканью, которая содержит все жизнеспособные клетки всех трех типов клеток нервного клона, астроциты, олигодендроциты и нейроны (,) (Ваннер и др., 2013). Эта граница рубца астроцита служит защитным барьером, который ограничивает миграцию воспалительных клеток из ядра ненейрального поражения в окружающую жизнеспособную нервную ткань. Нарушение образования рубцов астроцитов в различных моделях трансгенной потери функции приводит к увеличению размера поражения, повышенной гибели локальных нейронов, усилению демиелинизации и снижению восстановления функции после травматических или ишемических очаговых поражений (Bush et al., 1999; Faulkner et al., 2004; Herrmann et al., 2008; Ли и др., 2008; Wanner et al., 2013). После образования компактного рубца астроцита продолжается второй период ремоделирования ткани с постепенным ремоделированием ядра поражения, границы рубца астроцита и окружающих областей периметра (,). Например, со временем происходит постепенное сокращение ядер поражений и рубцов астроцитов. Поскольку перерезанные аксоны продолжают умирать обратно от повреждений, гибель олигодендроцитов может продолжаться, что приводит к локальным тканевым ответам и ремоделированию. Происходит длительное ремоделирование ECM в ядре поражения с модуляцией компонентов коллагена и гликопротеина (Klapka and Muller, 2006; Logan and Berry, 2002; Silver and Miller, 2004).Кроме того, происходит постепенное и хронически продолжающееся ремоделирование тканей в реактивных областях периметра, которые окружают зрелые поражения, как обсуждается далее.
Зрелые поражения демонстрируют три тканевых компартмента
Образование рубца астроцитов вокруг ядер центральных поражений по существу завершается через две-четыре недели после острого поражения, которое не осложняется длительным повреждением ткани, и в это время поражение можно считать зрелым и входящим в его хроническая стадия (,). В зрелых поражениях полезно распознавать три очень разных компартмента поражения: (i) центральное ядро поражения неневральной ткани, состоящее из клеток местного происхождения фибробластов, кровеносных сосудов, инфильтрирующих фиброцитов и воспалительных клеток и внеклеточного матрикса; (ii) компактный рубец астроцитов, который непосредственно окружает ядро поражения и состоит из плотно упакованных астроцитов с небольшим количеством нейронов или олигодендроцитов, если таковые имеются; и (iii) периметр периметра жизнеспособной нервной ткани, который примыкает к компактному рубцу астроцита и содержит все три типа клеток нервного клона (нейроны, олигодендроциты, астроциты) и демонстрирует сужающийся реактивный глиоз, который постепенно переходит в здоровую ткань ( ).Все эти компартменты будут подвергаться дальнейшему ремоделированию тканей в течение недель или месяцев. Некоторая часть этого ремоделирования может повлиять на функциональный результат и может обеспечить цели для терапевтических вмешательств, особенно в периметре нервной ткани, которая проявляет диффузный реактивный глиоз (,). Полезно рассмотреть отдельно эти компоненты и их влияние на функциональный результат.
Ядро поражения
Ткань в зрелом ядре поражения содержит мало или совсем не содержит клеток нервного клона и нефункциональна с неврологической точки зрения.Первоначально основные типы клеток в ядрах зрелых поражений включают клетки линии фибробластов, эндотелий, фиброциты и воспалительные клетки (). Со временем и при ремоделировании, а также при отсутствии обострения повреждения или инфекции воспалительные элементы будут постепенно исчезать, хотя некоторые из них могут сохраняться в течение длительного времени. Элементы ядра поражения будут постоянно сохраняться в виде фиброзного рубца, содержащего различные ненейральные клетки и ECM. В некоторых областях ядра поражения клетки и ECM будут отступать, оставляя заполненные жидкостью кисты весьма различного размера () (Tuszynski and Steward, 2012).Функционально клетки и ECM ядра поражения служат субстратами для быстрого заживления ран и замещения тканей. Предполагается, что скорость закрытия раны, обеспечиваемая фиброзным замещением по сравнению с обновлением паренхимы, дает преимущества в других тканях (Greaves et al., 2013; Gurtner et al., 2008; Singer and Clark, 1999). Тем не менее, этот механизм может привести к потере функций тканей. Считается, что в ЦНС поврежденная сердцевина ткани с 19 по века оказывает долгосрочное негативное функциональное воздействие как препятствие для регенерации аксонов, что также подтверждается недавними исследованиями (Zukor et al., 2013). Молекулярные оценки показывают, что ядро ECM поражения содержит коллагены и протеогликаны, которые плохо поддерживают или явно подавляют повторный рост поврежденных аксонов (Hermanns et al., 2006; Kimura-Kuroda et al., 2010; Klapka and Muller, 2006; Yoshioka et al., 2010). ).
Компактные рубцы астроцитов (глиальные рубцы)
Зрелые рубцы астроцитов состоят из относительно узких зон вновь образовавшихся астроцитов с удлиненными отростками, которые сильно переплетаются и переплетаются и которые сразу же примыкают и окружают со всех сторон участки сердцевины пораженной ткани () (Sofroniew и Винтерс, 2010; Ваннер и др., 2013). Эти узкие зоны плотно переплетенных удлиненных астроцитов, образующих рубцы, обычно не более миллиметра в поперечнике и обычно лишены других клеток нервного клона (нейронов или олигодендроцитов) (Wanner et al., 2013). Эти формирующие рубцы астроциты вновь пролиферируют в ответ на инсульт, и плотность упаковки тел клеток астроцитов в рубцах астроцитов, по крайней мере, вдвое больше, чем в здоровой ткани (Wanner et al., 2013). Плотно упакованные удлиненные астроциты, образующие рубцы, плавно и быстро переходят в менее плотно упакованные и менее плотно переплетенные гипертрофические реактивные астроциты, которые перемешаны с жизнеспособными нейронами и другими элементами нервной ткани в окружающем периметре реактивной нервной ткани, обсуждаемой ниже () (Ваннер и другие., 2013). Исследования трансгенной потери функции показывают, что недавно пролиферирующие компактные рубцы астроцитов обладают важными нейропротекторными функциями, ограничивая распространение воспалительных клеток вдали от поражений тканей, вызванных травмой, инсультом и аутоиммунным воспалением. Когда образование рубцов астроцитов экспериментально предотвращается или ослабляется in vivo , воспаление распространяется, размер поражения увеличивается, потеря нейронов и демиелинизация усугубляются, а функциональное восстановление ухудшается (Bush et al., 1999; Дрогемюллер и др., 2008; Фолкнер и др., 2004; Wanner et al., 2013). Астроциты, образующие рубцы, также широко считаются, если не главным препятствием для регенерации аксонов после повреждения ЦНС, частично на основании исследований in vitro , показывающих продукцию астроцитами определенных протеогликанов, которые могут ингибировать удлинение (Silver et al., 1993 ). Тем не менее, другие исследования показывают, что регенерация аксонов in vivo происходит вдоль мостиков астроцитов, и что в отсутствие таких мостов регенерация аксонов не происходит и, по-видимому, больше затрудняется конфронтацией с тканью ядра, не связанной с нервным поражением (Kawaja and Gage , 1991; Уильямс и др., 2013; Зукор и др., 2013). Исследования потери функции трансгенных животных, проведенные in vivo , могут помочь прояснить точную природу и масштаб эффектов, оказываемых формирующими шрамы астроцитами на возобновление роста аксонов после травмы.
Периметры периметров поражения
Все зрелые ядра поражений и рубцы астроцитов окружены периметрами жизнеспособной нервной ткани, которая демонстрирует градиент сужающегося реактивного глиоза, который постепенно переходит в здоровую ткань () (Wanner et al., 2013). Ткань в этих зонах периметра содержит все типы клеток нервного клона, включая нейроны и олигодендроциты, и эти клетки перемешаны с реактивным глиозом, который может распространяться на значительные расстояния ().Реактивная ткань периметра начинается непосредственно рядом с компактными рубцами астроцитов, где удлиненные клеточные отростки рубцовых астроцитов перекрываются с гипертрофическими реактивными астроцитами и реактивной микроглией, которые перемешаны с выжившими жизнеспособными нейронами и другими элементами нервной ткани (). Примечательно, что жизнеспособные нейроны могут присутствовать в пределах нескольких сотен мкм компактных рубцов астроцитов, а центральная ткань поражения, заполненная потенциально цитотоксическими воспалительными элементами, находится чуть дальше (Bush et al., 1999; Wanner et al., 2013). Реактивный глиоз по периметру включает гипертрофические реактивные астроциты и микроглию (). Причина и функции периметров сужающегося реактивного глиоза не ясны. Что касается причины, возможно, что градиенты сигнальных молекул, диффундирующих из ядра поражения, либо входящие в период утечки ГЭБ, либо продуцируемые инфильтрирующими и пролиферирующими клетками, могут запускать такой градиент постепенно сужающихся ответов среди локальной глии (1). .С функциональной точки зрения, еще предстоит определить степень, в которой конкретные аспекты этого реактивного глиоза являются полезными или вредными (или их комбинацией).
Реактивные области периметра вокруг ядер поражения в головном и спинном мозге, вероятно, будут демонстрировать долгосрочное и потенциально интенсивное ремоделирование ткани с образованием новых синапсов и потенциалом для формирования новых цепей реле (Bareyre et al., 2004; Carmichael, 2006; Clarkson et al., 2010; Courtine et al., 2008; Li et al., 2010; Overman et al., 2012). На ремоделирование синапсов и цепей потенциально могут влиять многочисленные факторы, включая молекулы внеклеточного матрикса, такие как протеогликаны в перинейронах (Garcia-Alias et al., 2009). Реактивная глия может играть важную роль в этом ремоделировании, но эта тема недостаточно изучена. В здоровой ЦНС астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными способами (Halassa and Haydon, 2010).И астроциты, и микроглия потенциально могут играть фундаментальную роль в ремоделировании синапсов в периметре поражения (Stephan et al., 2012; Stevens et al., 2007), и влияние реактивного глиоза на такое ремоделирование еще не изучено. Такие периметральные области периметра, вероятно, обеспечат благодатную почву для инвестирования новых стратегий для вмешательств, которые могут повлиять на нейронную пластичность и формирование релейных цепей, что в сочетании с соответствующей реабилитационной тренировкой (van den Brand et al., 2012) могут благотворно повлиять на функциональный результат.
Хронические очаговые поражения
Помимо острой очаговой травмы и инсульта, которые часто служат моделями для изучения механизмов повреждения ЦНС, как только что обсуждалось, другие, более хронические формы повреждения заслуживают рассмотрения. Важные хронические инсульты включают очаговые инфекции с образованием абсцесса, опухоли и аутоиммунные поражения. Все эти состояния вызывают реактивный глиоз и многоклеточные реакции, которые имеют большое сходство с теми, которые возникают после острого очагового повреждения.Этот многоклеточный ответ играет решающую роль в развитии, серьезности и разрешении (или нет) оскорблений.
Инфекция
Очаговые инфекции или абсцессы могут образовываться при инфицировании травматических ран или могут быть засеяны спонтанно, особенно у лиц с ослабленным иммунитетом. Такие инфекции вызывают реактивный глиоз с образованием рубцов астроцитов, аналогичным таковому после острой очаговой травмы (Sofroniew and Vinters, 2010). Продолжительность сохранения поражения и ремоделирования тканей является длительной и зависит от разрешения инфекции.Исследования трансгенной потери функции показывают, что образование рубцов астроцитов имеет решающее значение для локального сдерживания инфекции. Когда рубцы астроцитов разрушаются, инфекция и воспаление быстро распространяются через прилегающую нервную ткань с разрушительными эффектами (Drogemuller et al., 2008).
Рак
Как первичные, так и метастатические опухоли вызывают реактивный глиоз и многоклеточные реакции, которые имеют сходство с другими формами очагового повреждения тканей. Взаимодействие опухолевых клеток с глией ЦНС и инфильтрирующими воспалительными клетками является сложным и сильно зависит от типа опухолевых клеток.Неинвазивные опухоли окружены реактивным глиозом и инкапсулирующим рубцом, аналогичным тому, который наблюдается вокруг травматического повреждения ткани. Агрессивно инвазивные опухоли не инкапсулированы и не окружены четко выраженными рубцами астроцитов, но вызывают другие формы реактивного глиоза и многоклеточные реакции. Считается, что успешная инфильтрация и распространение определенных типов опухолевых клеток связаны с их способностью создавать среду для роста, васкуляризации и распространения, что может включать успешную нейтрализацию барьерных функций местных клеток ЦНС и кооптации программ для создания пролиферативных ниш. (Луи, 2006; Сильвер и др., 2013; Уоткинс и Сонтхаймер, 2012).
Аутоиммунное заболевание
Очаговые аутоиммунные поражения интересно рассматривать с точки зрения реакции на повреждение ЦНС. Хотя аутоиммунное заболевание ЦНС часто рассматривается как диффузное, хроническое и вызвано, в первую очередь, дисфункцией периферической иммунной системы, отдельные аутоиммунные поражения имеют много общего с острыми очаговыми травматическими ранами. Например, активные бляшки рассеянного склероза заполнены воспалительными клетками, а хронические бляшки демонстрируют ядра центральных поражений, которые лишены всех типов клеток нервного клона (без нейронов, олигодендроцитов или астроцитов), окруженные астроцитарными рубцами, которые отделяют неневральную ткань от периметров реактивных клеток. глиоз в ткани со всеми тремя типами нервных клеток (Frohman et al., 2006; Lucchinetti et al., 1996) способами, подобными повреждению тканей, вызванному травмой или ишемией (,). Оптический нейромиелит (NMO) — это аутоиммунное воспалительное заболевание, при котором причинные аутоантитела направлены против аквапорина-4 на клеточной мембране астроцитов, а поражения NMO связаны с опосредованным комплементом литическим разрушением астроцитов (Lennon et al., 2005; Popescu и Лучинетти, 2012). Существует замечательное совпадение между клиническими данными из NMO и экспериментальными исследованиями потери функции, демонстрирующими, что трансгенно-опосредованная абляция или ослабление рубцовых астроцитов приводит к тяжелому обострению аутоиммунного воспаления ЦНС (Haroon et al., 2011; Voskuhl et al., 2009). Таким образом, как клинические, так и экспериментальные данные указывают на критическую роль рубцовых астроцитов в ограничении распространения аутоиммунного воспаления ЦНС. Эти наблюдения убедительно свидетельствуют о том, что дисфункция внутренних клеток ЦНС, таких как астроциты, может причинно способствовать возникновению или прогрессированию аутоиммунных состояний ЦНС способами, которые обычно не рассматриваются в исследованиях, сосредоточенных только на попытке определить причинные механизмы периферической иммунной системы. Это представление может быть дополнительно подтверждено предположениями, что подгруппа пациентов с рассеянным склерозом имеет связанные с заболеванием аутоантитела против калиевого канала Kir4.1, который в ЦНС располагается на мембранах астроцитов (Srivastava et al., 2012). Было бы интересно определить степень, в которой усиление или потеря функций астроцитов способствует патофизиологии аутоиммунных состояний ЦНС.
Ответ на диффузное поражение
Диффузное поражение ткани ЦНС может быть связано с нейродегенеративными заболеваниями, некоторыми судорожными расстройствами или легкой черепно-мозговой травмой. Диффузные инсульты изначально имеют тенденцию быть менее интенсивными, чем острые очаговые повреждения, вызванные травмой или инсультом, и могут первоначально не вызывать явного повреждения тканей, а вместо этого постепенно накапливаться в течение хронических периодов времени.По мере того, как повреждение ткани становится более серьезным, образуются небольшие отдельные поражения, каждое из которых вызывает реактивный глиоз и многоклеточные реакции, аналогичные тем, которые вызваны острым повреждением ткани с разрушением ГЭБ, воспалением и привлечением лейкоцитов (,), но на меньшем уровне. шкала. Со временем диффузное повреждение начинает напоминать диффузное скопление множества мелких очаговых поражений, которые перемешаны и могут распространяться на большие площади (). Каждое из этих небольших поражений дает начало собственным периметру периметра поражения зон сужающегося реактивного глиоза, в результате чего перекрывающиеся зоны тяжелого гипертрофического реактивного глиоза и многоклеточных реакций могут быть распределены на больших участках ткани (2).Важно понимать, что эти многочисленные небольшие поражения перемежаются между жизнеспособными нейронами и нейронными цепями, которые охватываются этими перекрывающимися периметрами периметров реактивного глиоза (2). Как обсуждалось выше, в настоящее время имеются существенные доказательства участия астроцитов и микроглии в нормальной функции нервной цепи, но влияние реактивного глиоза на такие функции неизвестно. В контексте диффузных поражений ЦНС большие области функционирующей нервной ткани могут подвергаться интенсивному реактивному глиозу, который, вероятно, повлияет на синаптические взаимодействия и функции нервных цепей (2).Лучшее понимание таких эффектов может открыть путь к новым терапевтическим стратегиям.
Диффузное повреждение ткани приводит к расширенным областям реактивного глиоза(A) Небольшие хронические инсульты могут приводить к диффузному повреждению ткани с образованием рассеянных небольших ядер поражений (LC), астроцитарных рубцов (AS) и периметров периповреждений (PLP) которые могут перекрываться и сливаться в области смежного реактивного глиоза, которые могут распространяться на большие площади.
(B) Реактивные астроциты и реактивная микроглия в PLP могут по-разному влиять на синапсы и нейронные функции.
Нейродегенеративное заболевание
Реактивный глиоз и многоклеточные реакции запускаются по-разному и избирательно при разных нейродегенеративных заболеваниях. В некоторых случаях пусковым механизмом может быть накопление внеклеточных токсинов, таких как β-амилоид при болезни Альцгеймера (БА) (Prokop et al., 2013; Zlokovic, 2011), которые могут накапливаться и вызывать множество небольших очаговых повреждений тканей, которые вызывают глиоз, во многом схожий с другими формами диффузных поражений (). В других случаях пусковым механизмом может быть повреждение или смерть нейронов или синапсов, вторичные по отношению к внутренним изменениям нейронов.Некоторые состояния, такие как боковой амиотрофический склероз (БАС) или болезнь Хантингтона, вызывают внутренние клеточные изменения как в нейронах, так и в глии, могут нарушать клеточные функции и взаимодействия, которые могут служить триггерами (Boillee et al., 2006; Maragakis and Rothstein, 2006). . Нейродегенеративные инсульты также могут приводить к нарушению сосудисто-нервного аппарата, что приводит к утечке ГЭБ, что может служить дополнительным триггером для реактивного глиоза, а также сигналом для рекрутирования воспалительных клеток, переносимых кровью (Zlokovic, 2008, 2011).Во многих случаях реактивный глиоз и многоклеточные реакции могут не проявляться в начале или на ранних стадиях нейродегенеративных состояний, но проявляться позже и затем участвовать в прогрессировании заболевания. Реактивный глиоз, вызванный различными способами, либо накоплением аномальных белков, ишемическим или травматическим клеточным повреждением, либо микробами, также может привести к утечке ГЭБ через специфические молекулярные сигнальные каскады, как обсуждается ниже, с последующим воспалением, которое может способствовать прогрессированию заболевания.
Вклад глиальных клеток и реактивного глиоза в нейродегенеративные состояния сложен и только начинает изучаться. Глия не только реагирует на дегенеративные сигналы, о которых говорилось выше, но также может участвовать в борьбе с ними. Например, считается, что и микроглия, и астроциты способствуют очищению от β-амилоида (Prokop et al., 2013; Wyss-Coray et al., 2003), а ослабление реактивного астроглиоза может увеличивать нагрузку β-амилоида на модели трансгенных мышей. нашей эры (Крафт и др., 2013). Кроме того, на глию могут влиять молекулярные дефекты, вызывающие заболевание, и она становится дисфункциональной, что еще больше затрудняет попытки понять роль реактивного глиоза в процессе болезни. Например, при БАС дисфункция глиальных клеток причинно участвует в опосредовании дегенерации нейронов (Yamanaka et al., 2008), а продолжающийся реактивный глиоз и воспаление, как полагают, также вносят вклад в прогрессирование заболевания (Maragakis and Rothstein, 2006). Различия между вызванными заболеванием дисфункциями глиальных клеток и реактивными реакциями, которые запускаются в глиальных клетках повреждением клеток и тканей, иногда размыты или уравниваются, но не должны быть такими.Понимание этих различных явлений и способов их взаимодействия может иметь важные последствия для понимания механизмов, лежащих в основе клеточной патофизиологии и ведущих к прогрессированию заболевания. Важно помнить, что, хотя некоторые аспекты реактивности глии могут способствовать прогрессированию заболевания, другие, вероятно, будут защитными. Определение молекулярной основы таких различий может помочь определить новые терапевтические стратегии.
В контексте нейродегенеративного заболевания также интересно вкратце рассмотреть возможность неавтономной нейрональной дегенерации, вызванной дисфункцией глии или других ненейронных клеток.Генетические мутации с потерей или усилением функции в микроглии (Derecki et al., 2012) или астроцитах (Brenner et al., 2001; Rothstein, 2009; Tao et al., 2011) потенциально могут вызывать неклеточно-автономные дегенерация разных типов нейронов при различных заболеваниях человека и экспериментальных моделях на животных. Такие наблюдения показывают, что дисфункция глиальных клеток может быть первичным причинным событием при определенных неврологических состояниях. Такие наблюдения также повышают вероятность того, что дисфункция определенных аспектов реактивного глиоза во время реакции на поражение ЦНС может усугубить повреждение или привести к ухудшению восстановления тканей и худшему исходу.Возможность генетического полиморфизма влиять на функции глиальных клеток и реакцию на повреждение ЦНС — это еще не изученная область, которая может выявить причинные факторы, лежащие в основе различий в ответах разных людей на, казалось бы, схожие типы и тяжести поражений ЦНС.
Эпилепсия
Астроциты и микроглия могут участвовать в эпилепсии множеством способов. Астроциты играют множество критических ролей в регуляции активности синапсов и возбудимости нейронов, а астроциты могут играть решающую роль в генерации судорожной активности (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). Кроме того, реактивный глиоз как микроглии, так и астроцитов является характерной особенностью нервной ткани с хронической эпилепсией, которая также может проявлять распад ГЭБ и многоклеточное воспаление (Devinsky et al., 2013; Jabs et al., 2008; Wetherington et al., 2008). ). С увеличением потери нейронов наступает тканевой склероз, который имеет сходство с тяжелым диффузным астроглиозом из-за других причин, как обсуждалось выше, со многими более мелкими тканевыми поражениями, окруженными континуумом околоповрежденной ткани со смесью выживших нейронов и все более тяжелой гипертрофией. глиоз ().Влияние реактивного глиоза и многоклеточного ответа на повреждение ткани на выжившие нейроны в периметре периметра поражения недостаточно изучено (), но может способствовать снижению пороговых значений приступов. Селективная экспериментальная индукция реактивности астроцитов связана со снижением ингибирования в локальных нейронах гиппокампа (Ortinski et al., 2010). Требуется дополнительная работа в этой области.
Диффузная черепно-мозговая травма (ЧМТ)
Крупные очаговые поражения, вызванные тяжелой очаговой ЧМТ (ушиб или раздавливание), обсуждались выше.Тем не менее, клинически значимая ЧМТ часто бывает диффузной и широко распространенной. Клеточные и молекулярные механизмы диффузной ЧМТ, которая вызывает функциональные нарушения без крупных очаговых поражений, изучены не полностью. Диффузная ЧМТ обычно характеризуется небольшими очагами разрушения сосудов и повреждения тканей, которые могут диффузно распространяться на большие участки ЦНС (DeKosky et al., 2013; McIntosh et al., 1989). Интересно учитывать, что каждая из этих небольших областей тканевого или клеточного повреждения может представлять собой небольшое очаговое повреждение с отделениями, эквивалентными сердцевине, рубцу астроцита и периметру, которое может распространяться на большие области без очевидной единственной большой очаговой области ().Как обсуждалось выше, чередующиеся жизнеспособные нервные ткани во многих перекрывающихся периметрах периметра поражения будут подвергаться интенсивному гипертрофическому реактивному глиозу и воспалению, которое может влиять на нервные функции (2). Специфические клеточные и молекулярные механизмы реактивного глиоза и многоклеточных ответов, запускаемых легкой или умеренной диффузной ЧМТ, только начинают охарактеризовываться. Недавно пролиферирующие реактивные астроциты выполняют защитные функции, необходимые для выживания нейронов (Myer et al., 2006). Микроглия может оказывать широкий спектр эффектов в зависимости от конкретных молекулярных стимулов, которые либо защищают, либо усугубляют потерю ткани (Hanisch and Kettenmann, 2007). Понимание и управление реактивным глиозом и многоклеточными последствиями, вызванными легкой и умеренной ЧМТ, имеет огромный потенциал для определения новых терапевтических целей в области большого эпидемиологического значения. Новые молекулярные механизмы обсуждаются в следующем разделе.
Молекулярная передача сигналов и многоклеточные взаимодействия
Молекулярная передача сигналов между различными типами клеток, которые отвечают на поражение ЦНС, сложна, комбинаторна и тесно переплетена.Различные клетки обладают способностью продуцировать одинаковые наборы молекул и отвечать на них, и есть намеки на то, что некоторые молекулы могут координировать многоклеточные ответы. Было идентифицировано множество межклеточных сигнальных молекул, но мы находимся на ранних стадиях определения того, как эти множественные сигналы регулируют многоклеточные взаимодействия и временную прогрессию от одной фазы к другой во время ответов на специфические поражения ЦНС. Здесь мы предоставляем общий обзор молекулярных функциональных классов () и несколько репрезентативных примеров многих конкретных молекул, которые регулируют или влияют на клеточные реакции ЦНС на оскорбления ().
Многомолекулярная регуляция и дифференцированные ответы на повреждение(A) Ответы на повреждение ЦНС регулируются и зависят от различных категорий молекулярных сигналов, происходящих от многих типов внутренних и внешних клеток ЦНС.
(B) Низкие уровни АТФ, высвобождаемые клетками во время легких поражений ЦНС, могут действовать через (i) рецепторы P2X, чтобы вызвать быстрый хемотаксис микроглиальных процессов, и (ii) рецепторы P2Y на местных астроцитах, чтобы вызвать передачу сигналов кальция и коннексин-зависимый ATP высвобождение, которое может повышать уровень внеклеточного АТФ и тем самым усиливать этот «опасный» сигнал.
(C) После тяжелой травмы сигнальные молекулы от «измененного я» и «здорового я» соперничают, чтобы сбалансировать очистку от мусора и сохранение жизнеспособной ткани. Сильно поврежденные или мертвые клетки высвобождают ряд гидрофобных внутриклеточных молекул (слева) или «аларминов», которые выражают молекулярные структуры, связанные с повреждением (DAMP). Эти «опасные» сигналы предупреждают клетки врожденного иммунитета ЦНС о повреждении тканей и способствуют удалению мусора за счет активации рецепторов распознавания образов на фагоцитарных иммунных клетках (в центре).Жизнеспособные внутренние клетки ЦНС на границах поражения (справа) экспрессируют связанные с мембраной и растворимые нейроиммунные регуляторные молекулы для предотвращения атаки и фагоцитоза иммунных клеток.
Таблица 2
Основные классы и несколько конкретных примеров межклеточных сигнальных молекул, которые регулируют клеточные реакции на повреждение ЦНС
| Класс | Молекула | Источник | Пораженный отсек | Фаза | Цели и эффекты |
|---|---|---|---|---|---|
| Протеаза и родственные ей | Тромбин | S | LC, AS | I | Образование сгустка; пролиферация астроцитов |
| MMP-9 | M, O, S | LC, AS, PLP | I – III | пролиферация OPC, ремиелинизация; Утечка BBB; неоваскулярное ремоделирование | |
| Калликреины | A, M, N, S | LC, AS, PLP | I – III | Провоспалительные; демиелинизация | |
| Серпины | A, M, O | LC, PLP | I – III | Ингибировать вредную протеазу | |
| NTs | ATP Glutamate | N, O, A | LC, AS, AS, PLP | I | Хемотаксис микроглии; реактивный астроглиоз |
| DAMPs | Alarmins: HMGB1, S100s, DNA | Поврежденные клетки | LC, PLP | I.II | Сигналы «Измененное я»; провоспалительный; увеличить фагоцитоз |
| PAMPs: LPS | Микробы | LC, PLP | I. II | Сигналы «несамо захватчика»; провоспалительный; увеличить фагоцитоз | |
| Факторы роста Морфогены | FGF | A, N, E, | LC, AS, PLP | I — III | Фиброзный рубец; ECM; неоваскулярное ремоделирование; реактивный астроглиоз |
| VEGF | E, P, F, A | LC, AS | I – III | BBB проницаемость; неоваскулярное ремоделирование | |
| PDGF-B PDGF-A | E, A | LS, PLP | I – III | Неоваскулярное ремоделирование Ремиелинизация; Пролиферация OPC | |
| Эндотелин, EGF, BMP | N, A, O | LC, AS | II, III | Пролиферация астроцитов, образование глиального рубца | |
| Цитокины Хемокины | TGFβ, MGFβ | , LAS, PLP | I – III | Образование фиброзного рубца; Производство ECM; пролиферация астроцитов | |
| IL-1β, TNFα, INFγ | A, M, L | LC, AS, | I, II | Провоспалительная регуляция | |
| IL-6 | A, M, L | I, II | Лейкоциты, образование рубцов астроцитов | ||
| NIRegs | CD141 | A, O, E | LC, AS | I – III | Защита здорового себя; разрешение воспаления |
| CD200, CD47 | N | LC, AS, PLP | I, II | Защита здорового себя | |
| Нейронное ремоделирование | Нейротрофины, BDNF и т. д. | N, A | PLP | III | Ремоделирование синапсов |
| Перинейронная сеть | A, OPC | PLP | III | Ограничить прорастание терминала | |
| Thmbs 902, C1q | MPLP | III | Формирование и обрезка синапсов |
Повреждение и смерть клеток
Мертвые, умирающие или временно поврежденные, но восстанавливаемые клетки высвобождают или экспрессируют молекулы, которые сигнализируют о повреждении.Эти молекулы делятся на множество категорий, включая нейротрансмиттеры, цитокины, хемокины, нейроиммунные регуляторы (NI-Reg) и молекулярные паттерны, связанные с опасностью (DAMP), которые стимулируют реактивный глиоз и другие клеточные реакции, включая очищение от мусора иммунными клетками () (). Оскорбления разного типа и степени тяжести высвобождают различные комбинации этих молекул, которые, в свою очередь, вызывают разные реакции. Например, легкие клеточные инсульты могут незначительно повышать внеклеточные концентрации глутамата или АТФ, которые привлекают отростки микроглиальных клеток, не вызывая вначале полномасштабного воспаления () (Davalos et al., 2005; Лю и др., 2009). АТФ может также вызывать кальциевые ответы в астроцитах и вызывать зависимое от коннексина высвобождение АТФ, которое увеличивает внеклеточные уровни АТФ и усиливает этот «опасный» сигнал (). Более серьезное повреждение или гибель клеток приведет к высвобождению дополнительных DAMP и аларминов в форме цитозольного и ядерного содержимого, такого как K +, белков теплового шока, таких как Aβ-кристаллин, кальций-связывающих белков семейства S100, ДНК-связывающих HMGB1 (группа с высокой подвижностью, блок 1 ), а также ДНК и РНК. Все эти молекулы могут служить сигналами «опасности», предупреждающими клетки врожденного иммунитета о повреждении тканей и способствующими удалению клеточного мусора «измененного собственного» посредством активации рецепторов распознавания образов (PRR) на фагоцитарных клетках врожденного иммунитета () (Chan et al., 2012; Гриффитс и др., 2010; Коно и Рок, 2008). Молекулы, такие как бета-амилоид (Aβ), образующиеся во время нейродегенеративных расстройств, также могут действовать как алармины (). Один тип алармина может связывать несколько классов PPR. Например, HMBG1 вызывает провоспалительную передачу сигналов посредством активации множественных TLR, RAGE (рецептор конечных продуктов гликирования) и MAC1 (антигенный комплекс макрофагов-1) (Chan et al., 2012; Gao et al., 2011) и S100 активирует несколько TLR и RAGE (Chan et al., 2012).
Здоровые нейроны и глия вблизи поражений ЦНС экспрессируют нейроиммунные регуляторные молекулы (NI-Regs) и белки самозащиты, которые сигнализируют о «здоровом я» и служат для ограничения потенциально вредной провоспалительной передачи сигналов и предотвращения фагоцитоза жизнеспособных клеток () () (Griffiths и др., 2010). Эти молекулярные сигналы «здорового себя» включают как мембраносвязанные, так и растворимые молекулы NI-Reg. Например, сиаловые кислоты (SA) в мембранах здоровых клеток взаимодействуют с рецепторами SA (SAR), включая Siglecs, на клетках врожденного иммунитета и служат сигналами «не ешь меня» () (Varki and Gagneux, 2012).CD200 и CD47 аналогичным образом действуют через рецепторы CD200R и SIRP-α на воспалительные клетки, предотвращая фагоцитарную атаку () (Griffiths et al., 2010). Белки, регулирующие комплемент (CRP), могут снижать активацию комплемента () (Griffiths et al., 2010). Тромбомодулин (CD141) связывает и изолирует HMGB1, тем самым снижая биодоступность алармина () (Abeyama et al., 2005).
Таким образом, специфические опосредованные рецептором сигналы, указывающие на «измененное я» или «здоровое я», могут адаптировать природу реактивного глиоза и многоклеточные реакции к типу и тяжести клеточного повреждения или смерти ().Важно отметить, что конечный уровень клеточного повреждения, вызванного всевозможными оскорблениями, частично определяется продолжительными периодами различных типов вторичных событий (), включая балансирующее действие между врожденными иммунными механизмами, которые регулируют выведение «измененных» «я», мусор и «чужие» патогены, сохраняя при этом «здоровое я» () (Griffiths et al., 2010). Эти события будут влиять на окончательный размер, расположение глиального рубца и передачу сигналов по периметру очага поражения ().
Реактивный глиоз
Реактивный глиоз регулируется большим набором различных внеклеточных сигналов, генерируемых после поражения ЦНС.Этот массив включает не только молекулы, высвобождаемые поврежденными или мертвыми клетками, как только что описано, но также молекулы, поступающие через протекающий ГЭБ, молекулы, высвобождаемые инфильтрацией лейкоцитов, и молекулы, высвобождаемые локальными клетками, включая сами реактивные глии () (Sofroniew, 2009). В ответ на это множество различных и часто комбинаторных молекулярных сигналов реактивная глия изменяет экспрессию, структуру и функцию своих генов избирательным и специфическим образом в зависимости от типа и тяжести повреждений и в зависимости от конкретных комбинаций молекулярных сигналов, которые на них воздействуют. .Важно подчеркнуть, что глия не существует в простых «покоящихся» или «активированных» состояниях «все или ничего» и что не существует единой программы «реактивного глиоза», которая запускалась бы по принципу «все или ничего». и одинаков во всех ситуациях. Вместо этого реактивная глия может демонстрировать широкий спектр ответов, определяемых комбинациями определенных сигнальных событий. Например, воздействие PAMP, таких как липополисахарид (LPS), может заметно исказить транскриптом реактивных астроцитов в сторону хемокинов, цитотоксичности и воспаления (Hamby et al., 2012; Заманян и др., 2012). Также следует отметить, что различные комбинации стимулирующих факторов могут приводить к синергическим изменениям в молекулярной экспрессии, которые невозможно предсказать на основании индивидуальных эффектов (Hamby et al., 2012).
Многоклеточная и многомолекулярная регуляция реактивного глиоза и ГЭБ(A) Реактивный глиоз может индуцироваться, регулироваться и зависеть от множества молекулярных сигналов, которые могут происходить из многих типов внутренних и внешних источников ЦНС.
(B) Проницаемость ГЭБ может регулироваться специфическими молекулярными сигнальными каскадами, включающими взаимодействия между разными типами клеток, которые сходятся в эндотелиальных плотных контактах (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013).
Информация об эффектах, опосредованных реактивной глией в ответ на специфические сигналы, также неуклонно растет, и очевидно, что многие аспекты реактивного глиоза являются частью скоординированных многоклеточных врожденных и адаптивных иммунных ответов на поражение ЦНС.Интересно отметить, что определенные молекулы становятся потенциальными координаторами многоклеточных ответов. Один интересный набор сходящихся данных предполагает, что IL-1β является ключевым триггером, который стимулирует различные типы глиальных клеток, чтобы модулировать проницаемость BBB для белков сыворотки и лейкоцитов во время реактивного глиоза в ответ на поражение ЦНС (2). Многочисленные DAMP и PAMP, генерируемые поражением ЦНС, будут стимулировать высвобождение IL-1β из микроглии, и этот IL-1β будет стимулировать (i) локальные реактивные астроциты высвобождать VEGF и (ii) локальные NG2-OPCs высвобождать MMP-9, которые в Turn влияет на плотные контакты и барьерные свойства местных эндотелиальных клеток и позволяет проникать сывороточным белкам (включая IgG и сигнальные белки, такие как тромбин, альбумин, протеазы и т. д.)) и лейкоцитов в локальную паренхиму ЦНС () (Argaw et al., 2012; Argaw et al., 2009; Seo et al., 2013). Проникающие лейкоциты могут генерировать больше IL-1β и поддерживать локальную проницаемость ГЭБ, создавая потенциал для петли прямой связи при неблагоприятных обстоятельствах. Понимание молекулярных механизмов, посредством которых такая передача сигналов подавляется и закрытие ГЭБ, может помочь выявить рациональные терапевтические вмешательства при определенных состояниях. Восстановление ГЭБ после неосложненной острой травмы обычно происходит в течение нескольких недель ().
Образование рубцов астроцитов
Формирование компактных рубцов астроцитов — это особый аспект реактивного астроглиоза, который возникает в ответ на тяжелое повреждение тканей и инфильтрацию лейкоцитов и включает фазы пролиферации и организации клеток () (Sofroniew and Vinters, 2010; Wanner et al. др., 2013). Молекулярные сигналы, которые регулируют сигналы пролиферации астроцитов после повреждения ЦНС, могут происходить от белков сыворотки или местных клеток и включать тромбин, эндотелин, FGF2, АТФ, BMP (костные морфогенные белки), SHH (звуковой изгородь) и другие () (Gadea et al., 2008; Нари и др., 2003; Сахни и др., 2010; Сиракава и др., 2010; Сирко и др., 2013). На расположение границ рубцов астроцитов вокруг очагов поражения могут влиять взаимодействия между пролиферирующими или вновь пролиферирующими рубцообразующими астроглиями, клетками, связанными с фибробластами, и воспалительными клетками (Wanner et al., 2013), а также трансгенными манипуляциями с внутренней сигнализацией астроцитов. каскады с участием STAT3, SOCS3 или NFκB, которые могут увеличивать или уменьшать размеры поражения (Brambilla et al., 2005; Herrmann et al., 2008; Окада и др., 2006; Wanner et al., 2013) с указанием целей для потенциального вмешательства. Сигналы для организации вновь пролиферирующих астроцитов в компактные рубцы включают сигнальную систему рецептора IL-6-STAT3, которая критически регулирует образование рубцов астроцитов после травмы, инфекции и аутоиммунного воспаления (Drogemuller et al., 2008; Haroon et al., 2011; Herrmann et al., 2008; Wanner et al., 2013).
Ремоделирование нервной ткани в периметре поражения
Реактивный глиоз не только важен в ответах на очень локальное повреждение ЦНС, но также, вероятно, играет важную роль в ремоделировании нервной системы, которое продолжается в течение длительного времени в периметре поражения после острого очагового поражения. оскорбления, такие как инсульт и травма (,), а также при хронических диффузных поражениях ЦНС (), включая нейродегенеративные состояния, такие как болезнь Альцгеймера.Такие периметральные области периметра поражения могут простираться на значительные расстояния от крупных очаговых поражений (,) или могут охватывать большие области диффузного повреждения ткани (). В таких случаях связанный с ним реактивный глиоз может повлиять на значительные территории функционирующей нервной ткани. Появляется все больше доказательств того, что разнообразные изменения в молекулярной передаче сигналов, связанные с этим диффузным реактивным глиозом (), будут влиять на продолжающееся ремоделирование нервной системы и изменения нейронной функции. Астроциты взаимодействуют с нейронами в нескольких пространственных и временных масштабах, которые могут влиять или модулировать нервную функцию различными прямыми и косвенными способами, в том числе путем модуляции внеклеточного баланса ионов, передатчиков и воды, критически важных для нейронной функции, а также прямого влияния на синаптическую активность. напрямую через выпуск «глиотрансмиттеров»; (Halassa, Haydon, 2010; Hamilton, Attwell, 2010; Henneberger et al., 2010; Вольтерра и Мелдолези, 2005). Микроглия также участвует в регуляции синаптического обмена (Stephan et al., 2012). Молекулы перинейрональной сети, такие как протеогликаны хондроитинсульфата, генерируемые астроцитами и NG2-OPC, влияют на синаптическую пластичность (Wang and Fawcett, 2012). Влияние реактивного глиоза на такие функции только начинается, но сообщалось, что реактивный астроглиоз по-разному влияет на нервные функции, в том числе (i) за счет подавления глютаминсинтазы астроцитов, что связано со снижением тормозных синаптических токов. в локальных нейронах (Ortinski et al., 2010), (ii) повышенная экспрессия xCT (Slc7a11), переносчика цистеина-глутамата, связанная с усилением передачи сигналов глутамата, судорогами и эксайтотоксичностью (Buckingham et al., 2011; Jackman et al., 2010) и (iii) изменениями в экспрессии множественных GPCRs и G белков и передаче сигналов кальция, вызываемой их лигандами, которые обладают потенциалом изменять взаимодействия астроцитов и нейронов (Hamby et al., 2012). Также появляется все больше доказательств того, что в ответ на медиаторы воспаления и цитокины реактивные астроциты могут модулировать свою экспрессию множества молекул, таких как медиаторы и переносчики ионов, нейромодуляторы, такие как оксид азота и простагландины, факторы роста и белки, регулирующие синапсы, которые могут влияние на синаптические и нейронные функции, включая сложное поведение, такое как болезненное поведение, боль, аппетит, сон и настроение, как более подробно рассматривается в другом месте (Sofroniew, 2013).Взятые вместе, такие находки предоставляют доказательства того, что различные молекулярные медиаторы и сигнальные механизмы, связанные с реактивным глиозом, могут модулировать функции реактивных астроцитов и микроглии различными способами, которые потенциально могут влиять на синаптические и другие нейронные функции в периметрах поражения. Такие сигнальные механизмы, вероятно, будут влиять на эффективность тренировок и функциональной реабилитации после острого повреждения, такого как травма или инсульт, а также на эффекторы для смягчения функционального ухудшения во время дегенеративных состояний.Понимание и управление сигнальными механизмами и эффектами реактивного глиоза в ткани периметра поражения может раскрыть новые терапевтические стратегии (Gleichman and Carmichael, 2013).
Гематоэнцефалический барьер (BBB)
BBB генерируется и регулируется сложной многоклеточной нервно-сосудистой единицей, которая включает критические взаимодействия между эндотелием, перицитами, астроцитами и другими клетками (Abbott et al., 2006; Zlokovic, 2008). Нарушение ГЭБ может происходить по-разному и в разной степени, начиная от конкретных событий передачи молекулярных сигналов, которые открывают проницаемость ГЭБ во время определенных типов реактивного глиоза, как обсуждалось выше (), до тяжелого разрушения ГЭБ, вызванного травматическим или ишемическим разрушением эндотелия. при необходимости неоваскуляризации ().Помимо явной травмы и ишемии, имеется немало доказательств того, что дисфункция ГЭБ играет центральную роль в старении и различных нейродегенеративных расстройствах. Напр., Дефицит перицитов, вызванный как трансгенами, так и связанный со старением, приводит к разрушению ГЭБ, которое предшествует дегенерации нейронов (Bell et al., 2010). Дефицит перицитов также очевиден в тканях, пораженных посмертным амиотрофическим боковым склерозом (Winkler et al., 2013), а дисфункция ГЭБ предшествует нейродегенерации на мышиной модели (Zhong et al., 2008). Полиморфизмы изоформ APOE участвуют в повышенной уязвимости к распаду ГЭБ при нейродегенеративных расстройствах и травматических повреждениях (Bell et al., 2012).
Независимо от триггерных событий утечка ГЭБ немедленно приводит к проникновению в паренхиму ЦНС сывороточных белков, таких как тромбин, альбумин, иммуноглобулины и протеазы (), которые могут иметь широкий спектр прямых и косвенных эффектов. Тромбин может передавать сигналы напрямую через рецепторы, активируемые протеазой, на различные клетки ЦНС, включая микроглию и астроциты (Shigetomi et al., 2008; Suo et al., 2002). Иммуноглобулины способствуют очищению от патогенов, но могут способствовать аутоиммунным дисфункциям. Тромбоциты могут входить и образовывать агрегаты для свертывания и высвобождения PDGF, важных для ремоделирования неоваскулярных сосудов, а также для передачи сигналов перицитам и клеткам NG2. Металлопротеазы действуют на несколько белков и способствуют ремоделированию внеклеточного матрикса и тканей (). Калликреиновые протеазы сыворотки активируют воспаление. Тканевые калликреины, которые могут взаимодействовать с сывороточными протеазами как часть более крупных протеолитических каскадов, вовлечены в патологию олигодендроцитов, демиелинизацию, аксонопатию и дегенерацию нейронов (Burda et al., 2013; Радулович и др., 2013). Серпины подавляют и уравновешивают эффекты протеазы ().
В ответ на сигналы, связанные с утечкой ГЭБ, местные глиальные клетки продуцируют цитокины и хемокины, которые привлекают лейкоциты, которые по прибытии производят дополнительные цитокины и хемокины. Результатом является богатая внеклеточная смесь молекулярных сигналов, которые могут инструктировать или влиять на несколько типов клеток в ядрах поражения, а также могут диффундировать в окружающую паренхиму ЦНС и влиять на нервные клетки, которые, возможно, не участвовали в начальном поражении ().Эти молекулярные градиенты могут влиять или принимать участие в формировании клеточных событий в периметрах поражения, таких как длительный градиент реактивного глиоза и длительное нейральное ремоделирование, которое происходит в ткани периметра. Сочетание молекулярных сигналов, генерируемых в ядрах поражения, со временем изменяется по мере того, как реакция на повреждение прогрессирует через разные фазы, и утечка ГЭБ восстанавливается, и разные типы клеток занимают эту область и продуцируют разные эффекторные молекулы (,). В зависимости от тяжести повреждения ядра поражения демонстрируют утечку ГЭБ от нескольких дней до двух недель в течение начального периода (фаза I) реакции на повреждение ().Ремонт BBB требует присутствия функциональных астроцитов (Bush et al., 1999). Высвобождение белка HMGB1 (группа с высокой подвижностью 1) реактивными астроцитами способствует ремоделированию неоваскулярных клеток эндотелия, тогда как блокада высвобождения HMGB1 реактивными астроцитами предотвращает ремоделирование неоваскулярных сосудов и усугубляет неврологический дефицит (Hayakawa et al., 2012). При сложных, хронических или диффузных поражениях утечки ГЭБ могут сохраняться и оказывать длительное воздействие на расширенные участки нервной ткани по периметру поражения (), а позднее разрушение ГЭБ может привести к вторичному повреждению ткани (Злокович, 2008).Даже когда утечки ГЭБ устранены, ядра поражений продолжают содержать скопления ненейральных клеток внутри ГЭБ, которые могут продолжать продуцировать высокие уровни множества различных сигнальных молекул в течение длительных периодов времени. Таким образом, сердцевина пораженной ткани может генерировать градиенты диффузии многих мощных молекул, которые распространяются в паренхиму соседней ткани и формируют градиенты молекулярных сигналов, которые влияют на клетки-хозяева (). Также следует отметить, что, хотя ГЭБ открыт, существует также возможность проникновения различных патоген-ассоциированных молекулярных паттернов (PAMP) (), которые генерируются микробными инфекциями на периферии и которые могут существенно изменить реакцию местных клеток на ЦНС. повреждение, даже если нет местной инфекции, как обсуждается ниже.
Проникающие лейкоциты
Лейкоциты, которые проникают из кровотока, являются основным источником молекулярной передачи сигналов во время реакции на повреждение ЦНС. Эти молекулярные сигналы включают разнообразную смесь цитокинов, хемокинов и факторов роста (), которые могут инструктировать и изменять функции локальной реактивной глии () и других внутренних клеток ЦНС, а также других локальных лейкоцитов. Вероятно, что молекулярные сигналы, производимые лейкоцитами, и их функциональные эффекты будут варьироваться в течение разных фаз ответа на острые или хронические инсульты () и варьироваться от сигналов, опосредующих классические воспалительные реакции с цитотоксической и фагоцитарной активностями, до сигналов, влияющих на восстановление тканей и ремоделирование.Хотя временные изменения во время реакции на рану еще недостаточно изучены, постепенно выявляются различные функциональные роли разных подтипов лейкоцитов. Например, в ответ на стимуляцию разными цитокинами моноциты генерируют макрофаги с различными функциональными фенотипами, которые продуцируют разные эффекторные молекулы (Mosser and Edwards, 2008). В ответ на INFγ классически активированные макрофаги генерируют цитотоксические противомикробные молекулы и фагоцитируют мертвые клетки и мусор (), тогда как в ответ на стимуляцию с помощью Il-4 или Il10 макрофаги принимают участие в заживлении и противовоспалительной активности (Mosser and Edwards, 2008). ).Точно так же Т-клетки, стимулированные разными цитокинами, становятся поляризованными по отношению к разным активностям, таким как клетки T H 1, T Reg и T H 17, которые могут оказывать очень разные эффекты, начиная от уничтожения клеток и заканчивая участием в восстановлении тканей ( MacIver et al., 2013; Mills, 2011; Walsh, Kipnis, 2011).
Влияние периферических инфекций на реакцию на поражение ЦНС
Многие типы клеток, отвечающие на повреждение ЦНС, чрезвычайно чувствительны к молекулярным сигналам, связанным с микробной инфекцией.Это неудивительно, потому что ограничение распространения инфекции, вероятно, повлияло на развитие реакции на травму во всех тканях, включая ЦНС. Различные особенности реакции на инфекцию, такие как выработка цитотоксинов и определенные типы воспаления, могут повредить клетки-хозяева, а также микробы. Запуск таких ответов при отсутствии явной инфекции может вызвать или усугубить повреждение тканей. Таким образом, определенные реакции, которые могут быть полезными при микробной инфекции, могут быть вредными, если они вызваны повреждением стерильной (неинфицированной) ткани после травмы, инсульта, дегенеративного заболевания или аутоиммунной атаки.В этом отношении важно понимать, что на реактивную глию, как микроглию, так и астроциты, которые отвечают на стерильное первичное поражение ЦНС, могут влиять периферические инфекции, которые генерируют высокие уровни циркулирующих цитокинов и других медиаторов воспаления, таких как LPS и другие PAMP. Эта передача сигналов может происходить через переносимые кровью цитокины или ЛПС, выделяемые в месте периферической инфекции и поступающие через дырявый ГЭБ в ядре повреждения во время фазы I реакции на повреждение после очаговых поражений или через утечки ГЭБ, вызванные нейродегенеративными или аутоиммунными процессами ().ЛПС и цитокины оказывают мощное воздействие как на реактивную микроглию (Perry, 2010; Perry et al., 2007), так и на реактивные астроциты (Hamby et al., 2012; Zamanian et al., 2012), которые могут влиять на профили транскриптомов и реакцию раны на провоспалительные и потенциально цитотоксические фенотипы в течение длительного времени способами, которые обычно не применяются при стерильных поражениях ЦНС, и которые могут усугубить повреждение тканей. С такими экспериментальными наблюдениями согласуются клинические эпидемиологические данные, указывающие на то, что периферические инфекции отрицательно влияют на неврологический исход после травмы спинного мозга (Failli et al., 2012).
Манипулирование реакциями раны ЦНС для ускорения репарации
По мере того, как клеточная биология и молекулярная сигнализация, лежащие в основе ответов на повреждение ЦНС, становятся определенными, появляется все больше возможностей для определения способов манипулирования этими реакциями для улучшения результата. Манипуляции, находящиеся в стадии интенсивного исследования, включают не только традиционные подходы, такие как разработка лекарств-кандидатов для парентеральной фармакологической доставки, но также изменения образа жизни, такие как снижение потребления энергии и осуществление стратегий упражнений, направленных на уменьшение воспалительных реакций, клеточной дегенерации и функционального снижения после инсульта и травматических повреждений. (Арумугам и др., 2010; Маттсон, 2012; Piao et al., 2013). Кроме того, новые интервенционные стратегии в форме имплантатов биоматериалов в качестве молекулярных депо для локальной молекулярной доставки, а также подходы к регенерации тканей, основанные на трансплантации клеток-предшественников или стволовых клеток, демонстрируют значительные перспективы для будущего применения в восстановлении и регенерации нейронов. Неневральные очаги очаговых поражений могут представлять особенно полезные мишени для таких подходов (). Например, имплантаты из биоматериалов, особенно в форме инъекционных гидрогелей, могут служить как каркасами, так и депо, которые могут влиять на ремоделирование тканей и клеточные функции (Pakulska et al., 2012). Крупные очаги поражения не нервной ткани после инсульта или тяжелой очаговой травмы могут представлять полезные места для размещения депо биоматериала, которые высвобождают градиенты молекул, чтобы воздействовать на локально окружающую нервную ткань без причинения дополнительных повреждений (). Например, депо гидрогеля для инъекций может обеспечивать устойчивую доставку различных видов биоактивных молекул, включая факторы роста или небольшие гидрофобные молекулы, чтобы влиять на экспрессию генов и функцию локальных клеток в течение продолжительных подострых периодов времени, после чего они разрушаются без существенного повреждения тканей (Пакульска и др. ., 2012; Song et al., 2012; Ян и др., 2009; Zhang et al., 2014). Такая молекулярная доставка может влиять не только на текущее восстановление в подостром периоде после травмы, такой как образование рубца, но также может влиять на клетки в зоне большого периметра вокруг поражений ЦНС, которые подвергаются постоянному ремоделированию ткани в течение продолжительных периодов времени после повреждения ткани () . Доставка молекул через депо, помещенные в ядра поражения, может влиять на пластичность нейронов и ремоделирование тканей в этой области периметра (Clarkson et al., 2010).
Поражения как мишени для терапевтических стратегийНеневральные ядра поражений (LC) представляют собой мишени для депо биоматериалов (A) или трансплантатов экзогенных нервных стволовых клеток / клеток-предшественников (B) или мезенхимальных стволовых клеток (C) в качестве потенциальных терапевтических стратегий . Молекулы, доставляемые депо биоматериала (A) или определенные клеточные трансплантаты (C), могут поддерживать и привлекать рост аксонов (стрелка a), модулировать клетки периметра поражения (PLP) (стрелка b), модулировать клетки в LC (стрелка c) ) модулировать или астроцитарный рубец (AS) (стрелка c).Новые нейроны, генерируемые трансплантатами стволовых клеток / клеток-предшественников, могут получать и отправлять нейронные соединения в PLP и за его пределами и могут быть способны формировать новые функциональные релейные цепи (B).
Различные подходы к регенерации клеток могут иметь потенциал для восстановления ЦНС (Bliss et al., 2007; Martino and Pluchino, 2006; Snyder and Teng, 2012). Доставка клеток-предшественников нервного клона или стволовых клеток в ядра поражения () может привести к генерации локальных нейронов, которые образуют афферентные и эфферентные связи с хозяином и могут образовывать функционально интегрированные схемы (Abematsu et al., 2010; Лу и др., 2012). Стромальные или мезенхимальные стволовые клетки, полученные из костного мозга или пуповины, доставленные периферической (внутрисосудистой) инъекцией или инъекцией в ЦНС, могут стать местом расположения участков повреждения (), где они могут высвобождать факторы роста, цитокины и другие факторы, которые могут влиять на реакцию на повреждение и процесс восстановления (Bliss et al., 2007; Kokaia et al., 2012; Lemmens, Steinberg, 2013). Такие исследования по прививке интенсивно проводятся, но все еще находятся на ранних стадиях разработки. Сообщается о положительных эффектах на клеточные события, такие как иммуномодуляция, выживаемость внутренних клеток ЦНС, включая нейроны, и рост аксонов, однако пока имеется ограниченная информация об общей функциональной эффективности.
Образование глиальных рубцов в мозге человека после ишемического инсульта
Int J Med Sci. 2014; 11 (4): 344–348.
, 1, 2, # , 1, 2, # , 1, 2, ✉ , 1, 2 , 2 , 3 , 3 и 1, 2, 3, ✉Лицзе Хуан
1. Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2.Ключевая лаборатория исследования старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу, 325000, Китай
Чжэ-Бао Ву
1. Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2. Ключевая лаборатория исследования старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
Цичуань ЧжуГе
1.Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2. Ключевая лаборатория исследований старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница Медицинского университета Вэньчжоу, Вэньчжоу 325000, Китай
WeiMing Zheng
1 . Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2. Ключевая лаборатория исследований старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница Медицинского университета Вэньчжоу, Вэньчжоу 325000, Китай
Бэй Шао
2.Ключевая лаборатория исследований старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу, 325000, Китай
Брайан Ван
3. Отдел фармакологии и неврологии, Научный центр здоровья Университета Северного Техаса в Форт-Уэрте, Техас 76107 , США
Фен Сан
3. Кафедра фармакологии и неврологии, Научный центр здоровья Университета Северного Техаса в Форт-Уэрте, Техас, 76107, США
Кунлин Джин
1.Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2. Ключевая лаборатория исследований старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница Медицинского университета Вэньчжоу, Вэньчжоу 325000, Китай
3. Кафедра фармакологии и нейробиология, Центр медицинских наук Университета Северного Техаса в Форт-Уэрте, Техас, 76107, США
1. Отделение нейрохирургии, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу 325000, Китай
2.Ключевая лаборатория исследований старения и неврологических расстройств провинции Чжэцзян, Первая дочерняя больница, Медицинский университет Вэньчжоу, Вэньчжоу, 325000, Китай
3. Кафедра фармакологии и неврологии, Научный центр здравоохранения Университета Северного Техаса в Форт-Уэрте, Техас, 76107, США
✉ Автор, ответственный за переписку: Цичуань Чжугэ, доктор медицины, профессор кафедры нейрохирургии Первой дочерней больницы Медицинского университета Вэньчжоу, Вэньчжоу, Китай, тел .: 86-577-88069618; Факс: 86-577-88069617; Электронная почта: moc.361.piv@nauhciqeguhz или Кунлин Джин, доктор медицины, доктор философии, профессор кафедры фармакологии и неврологии, Научный центр здоровья Университета Северного Техаса, 3500 Camp Bowie Boulevard, Fort Worth, TX 76107, США, тел .: 817-7352579 , Факс: 817-7350408, Электронная почта: [email protected]# Эти авторы сделали равный вклад в эту статью
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступило 16.11.2013; Принята в печать 23 декабря 2013 г.
Авторские права © Ivyspring International Publisher. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons (http://creativecommons.org/licenses/by-nc-nd/3.0/). Воспроизведение разрешено для личного некоммерческого использования при условии, что статья полностью, без изменений и должным образом процитирована. Эта статья цитируется другими статьями в PMC.Abstract
Реактивный глиоз и образование глиальных рубцов были подтверждены на модели ишемического инсульта на животных, но не на ишемическом мозге человека.Здесь мы обнаружили, что экспрессия протеогликанов GFAP, ED1 и хондроитинсульфата (CSPG) была значительно увеличена в кортикальных периинфарктных областях после ишемического инсульта по сравнению с соседними нормальными тканями и контрольными субъектами. Двойное иммуномечение показало, что GFAP-позитивные реактивные астроциты в периинфарктной области экспрессировали CSPG, но не обнаруживали перекрытия с ED1-позитивной активированной микроглией. Наши результаты предполагают, что реактивный глиоз и образование глиальных рубцов, наблюдаемые на животных моделях инсульта, отражают то, что происходит в головном мозге человека после ишемического повреждения.
Ключевые слова: глиальный рубец, реактивный глиоз, ишемический инсульт, человек, пациенты
ВВЕДЕНИЕ
Повреждения головного мозга вызывают обширный глиальный ответ, называемый реактивным глиозом, который характеризуется повышенной экспрессией специфических маркеров, таких как глиальный фибриллярный кислый белок (GFAP) для астроцитов, различные молекулы внеклеточного матрикса (ECM), такие как протеогликаны хондроитинсульфата (CSPG) и микроглия. В тяжелых случаях реактивный глиоз в конечном итоге приводит к образованию глиального рубца, окружающего место повреждения.Глиальный ответ на ишемический инсульт широко изучался на ряде животных моделей с использованием фототромбоза и вариаций фокальной преходящей или постоянной окклюзии средней мозговой артерии (MCAO) 1 — 3 . Реактивный астроглиоз, однако, является повсеместным, но малоизученным признаком всех патологий центральной нервной системы (ЦНС).
Недавние исследования показывают, что реактивный глиоз оказывает как положительное, так и отрицательное влияние на восстановление функций мозга после травмы.В острой фазе образование глиального рубца имеет решающее значение для герметизации участка поражения, ремоделирования ткани и временного и пространственного контроля местного иммунного ответа. Глиальный барьер изолирует область повреждения для предотвращения дальнейших микробных инфекций и распространения клеточного повреждения, поддерживает баланс внеклеточных ионов и жидкости, предотвращает подавляющую воспалительную реакцию и реакцию факторов роста, а также улавливание свободных радикалов 4 . Кроме того, глиальный рубец стимулирует реваскуляризацию кровеносных капилляров для увеличения питательной, трофической и метаболической поддержки нервной ткани.С другой стороны, глиальный рубец также действует как препятствие для регенерации аксонов и, таким образом, препятствует восстановлению функции ЦНС в хронической фазе, потому что реактивные астроциты секретируют несколько молекул, ингибирующих рост, которые химически предотвращают удлинение аксонов. Более того, компонент базальной мембраны создает дополнительный физический барьер для регенерирующих аксонов, который не позволяет им пересекать поражение. Однако эти данные основаны в основном на мозге грызунов. Мало что известно о том, как реактивный глиоз реагирует на острый ишемический инсульт в головном мозге человека.В настоящем исследовании мы исследовали профили экспрессии компонентов глиальных рубцов в ишемизированном мозге человека и обнаружили, что реактивный глиоз и образование глиальных рубцов в головном мозге человека после ишемического повреждения сохраняют свойства, аналогичные свойствам этих животных моделей инсульта.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы головного мозга человека
Образцы нормального человеческого мозга (n = 6) в возрасте от 25 до 48 лет без неврологических заболеваний были получены из Банка мозга и тканей по расстройствам развития при Университете Мэриленда в г. Балтимор (Baltimore), США.Образцы ишемического мозга (n = 6) были получены от пациентов с ишемическим инсультом в возрасте 34-74 лет, которым проводилась биопсия с диагностической целью. Более подробная информация, такая как возраст, пол, продолжительность симптомов и локализация инфаркта, была задокументирована в нашем предыдущем исследовании 5 . Исследования проводились в соответствии с политикой и принципами, изложенными в Федеральной политике защиты прав человека. Все образцы мозга были получены с информированного согласия, и это исследование было одобрено Советом по обзору институциональных исследований при Научном центре здравоохранения Университета Северного Техаса в Форт-Уэрте, штат Техас, США.
Иммуногистохимия
Образцы головного мозга человека заливали парафином и разрезали на срезы толщиной 6 мкм. Иммуногистохимия была выполнена на этих срезах, как описано ранее 5 . Используемые первичные антитела: 1) мышиные моноклональные анти-CSPG (Millipore; 1: 100), 2) кроличьи поликлональные анти-GFAP (Sigma; 1: 1000) и 3) мышиные моноклональные анти-ED1 (Serotec; 1: 200). . Срезы получали с помощью эпифлуоресцентного микроскопа Nikon E300. Контроли включали исключение инкубации с первичными или вторичными антителами.
Иммуногистохимия с двойной меткой
Иммуногистохимия с двойной меткой выполнялась на срезах мозга, как описано ранее 5 . Используемые первичные антитела перечислены выше. В качестве вторичных антител использовали конъюгированные с Alexa Fluor 488, 594 или 647 ослиные антимышиные или кроличьи IgG (Molecular Probes, 1: 200-500). Слайды монтировали с использованием реагента против выцветания proLong Gold с DAPI (Molecular Probes). Сигналы флуоресценции регистрировали с помощью конфокальной сканирующей системы LSM 510 NLO, установленной на инвертированном микроскопе Axiovert 200 (Carl Zeiss Ltd) с 2-фотонным лазером Chameleon (Coherent Inc.). Изображения были получены с помощью программного обеспечения для обработки изображений LSM 510 (Carl Zeiss Ltd). Контроли включали исключение инкубации с первичными или вторичными антителами.
РЕЗУЛЬТАТЫ
Чтобы исследовать, образовался ли глиальный рубец в ишемическом мозге человека, мы сначала определили паттерн экспрессии CSPG, основной составляющей глиального рубца 4 . Как показано на фиг. , фиг. A , CSPG в головном мозге 6 пациентов с инсультом был значительно экспрессирован в кортикальных периинфарктных областях (полутени) и ядре инфаркта ишемизированного мозга человека по сравнению с прилегающей нормальной тканью.
Образование глиального рубца в периинфарктной области головного мозга человека после ишемического инсульта. А . Срезы ишемического мозга человека окрашивали анти-CSPG. Репрезентативные изображения показывают, что повышенная экспрессия CSPG была преимущественно обнаружена в периинфарктной области, а некоторые были в пределах области инфаркта. Верхняя панель: малое увеличение; Нижняя панель: большое увеличение. В . Иммуноцитохимия выполнялась с использованием анти-GFAP. Репрезентативные изображения показывают, что GFAP-положительные реактивные астроциты значительно увеличились в периинфарктной области после ишемического инсульта у людей по сравнению с нормальной областью.Левая панель: малое увеличение; Правая панель: большее увеличение. С . Иммуноцитохимия выполнялась с использованием анти-ED1. Репрезентативные изображения показывают, что ED1-положительная активированная микроглия была значительно увеличена в периинфарктной области после ишемического инсульта у людей по сравнению с нормальной областью. Левая панель: малое увеличение; правая панель: большое увеличение.
Затем мы выполнили иммуноцитохимию для изучения профиля реактивных астроцитов после ишемического инсульта.Как показано на фиг. , фиг. B , значительное увеличение GFAP-положительных реактивных астроцитов наблюдалось в областях полутени коры головного мозга по сравнению с соседними тканями. Большинство реактивных астроцитов в регионах демонстрируют гипертрофию тела клетки и отростков, которые образуют слой инкапсуляции вокруг участка поражения. Обширное перекрытие и пересечение процессов этих реактивных астроцитов было обнаружено в кортикальных периинфарктных областях ишемического мозга человека. В нормальной ткани наблюдалась разветвленная сеть мелкоразветвленных отростков отдельных астроцитов без перекрытия.
Микроглиоз, процесс, при котором происходит миграция макрофагов и локальной микроглии к месту повреждения в ответ на ишемическое повреждение, представляет собой форму глиоза. Следовательно, ED1, клеточный маркер, специфичный для активированной микроглии и макрофагов, был использован для иммуноокрашивания. Как показано на фиг. C , ED1-положительная активированная микроглия также была обнаружена в полутени и ядре инфаркта в образцах головного мозга пациентов с инсультом.
Двойное иммуноокрашивание показывает, что белки GFAP и CSPG перекрываются в промежуточной области полутени (, рис. A и B, ), образуя пограничную зону между ядром инфаркта и прилегающей нормальной тканью, что согласуется с экспрессией и распределением CSPG и GFAP у грызунов после ишемической травмы.ED1-положительная активированная микроглия также была распределена в области глиального рубца ( фиг. C ). При большем увеличении GFAP-иммунопозитивные реактивные астроциты демонстрировали морфологические признаки реактивного глиоза, включая существующие гипертрофические соматические клетки и расширенные отростки в соседнее ядро инфаркта ( Рисунок D ).
Повышенная экспрессия CSPG в реактивных астроцитах в периинфарктной области ишемического мозга человека. A. Двойную иммуноцитохимию проводили на ишемизированных срезах головного мозга с использованием анти-GFAP (красный) и анти-CSPG (зеленый).Изображения регистрировались с помощью 2-фотонного конфокального микроскопа. Репрезентативные изображения показывают, что CSPG преимущественно экспрессируется в GFAP-положительных реактивных астроцитах. B. Увеличенное изображение вставки в 2A. C. Конфокальные изображения иммуногистохимии с двойной меткой на ишемическом срезе мозга с использованием анти-GFAP (красный) и анти-ED1 (зеленый). Д . При большем увеличении показаны GFAP-позитивные реактивные астроциты (красный), не локализующиеся совместно с ED1-позитивными активированными микроглиями (зеленый).DAPI (синий) использовался для контрастных красок ядер.
ОБСУЖДЕНИЕ
Глиальный рубец состоит преимущественно из реактивных астроцитов, микроглии и молекул внеклеточного матрикса, особенно CSPG. В этом исследовании мы обнаружили, что GFAP-позитивные реактивные астроциты и ED1-позитивные активированные микроглии были значительно увеличены в кортикальных периинфарктных областях ишемического мозга человека по сравнению с соседними нормальными тканями и контрольными субъектами. Двойное иммуномечение показало, что GFAP-положительные реактивные астроциты в перипоральной области экспрессировали CSPG, но не перекрывались с ED1-положительной активированной микроглией.GFAP- и ED1-положительные клетки вместе с CSPG образовывали тонкий слой вокруг ишемического поражения, что свидетельствует о наличии глиального рубца в коре головного мозга человека после ишемического инсульта.
Исследования показывают, что различные типы глиальных клеток активируются и образуют глиальный рубец, в котором астроциты присутствуют в значительной степени после церебральных ишемических повреждений на животных моделях. Астроциты становятся гипертрофическими, вытягивают свои отростки из полутени в ядро инфаркта после ишемического инсульта и сильно повышают уровень GFAP — признак астроглиоза, отвечающего на травму.Иммунореактивность GFAP в астроцитах повышается уже через 1 день после травмы, а количество реактивных астроцитов значительно увеличивается вокруг участка поражения через 3-5 дней после травмы, но они отсутствуют в ядре поражения 6 . Наши результаты показали, что количество реактивных астроцитов значительно увеличилось в периинфарктной области, что согласуется с исследованиями на животных. Интересно, что в ишемическом мозге человека не было обнаружено увеличения количества реактивных клеток в прилегающей нормальной ткани, что отличается от животных моделей повреждения ЦНС 1 .Недавнее исследование показало, что протоплазматические астроциты человека оказались более сложными и значительно крупнее астроцитов грызунов 7 . Удаление реактивных астроцитов на модели мышей показало значительное увеличение размера поражения и повреждения тканей, что указывает на положительную роль реактивного глиоза 8 , 9 . Глиальные рубцы образуют границы вокруг участков поражения и действуют как защитные барьеры для инфекционных агентов и воспалительных клеток. Однако образование рубцов показывает менее благоприятный исход при долгосрочном выздоровлении после травм.Реактивный глиоз подавляет рост аксонов и клеточную миграцию, секретируя CSPG и другие молекулы, ингибирующие нейрогенез. Основываясь на данных о грызунах, упомянутых выше, реактивный глиоз может играть двоякую роль в восстановлении мозга после травм.
Реактивные микроглии / макрофаги являются вторым наиболее заметным типом клеток, присутствующим в глиальном рубце, которые видны в ишемическом ядре в течение 1-2 дней после ишемического инфаркта, и их присутствие может распространяться от ишемического ядра в периинфаркт. регион с течением времени.Price et al. изучили временные характеристики активации микроглии и обнаружили, что минимальное связывание наблюдалось в течение первых 72 часов после инсульта, но связывание индикатора значительно увеличилось в течение первой недели с некоторым снижением к 3-й неделе до 4 10 . Клетки микроглии претерпевают морфологическую трансформацию, высвобождая провоспалительные соединения и все больше экспрессируют иммуномодулирующие и пролиферирующие маркеры. Хотя роль микроглиальных клеток в развитии ишемических инсультов еще не выяснена, все больше данных свидетельствуют о том, что помимо положительных эффектов провоспалительное действие микроглии может быть вредным для поврежденного мозга и способствовать развитию инфаркта.
CSPG представляют собой сложное семейство макромолекул, которые состоят из корового белка и одной или нескольких ковалентно связанных цепей гликозаминогликанов. Реактивный глиоз включает большое количество белков ЕСМ, таких как CSPG, которые, таким образом, присутствуют в областях реактивного глиоза после повреждения ЦНС у взрослых животных. Мы обнаружили, что CSPG был увеличен в кортикальных периинфарктных областях головного мозга человека после ишемического инсульта, предполагая, что CSPG также был составной частью глиального рубца после ишемического инсульта у людей, аналогично животным моделям повреждения ЦНС 11 .Предыдущие исследования показали, что в месте повреждения CSPG секретируется почти всеми типами клеток, особенно астроцитами 12 . Этот факт согласуется с нашими конфокальными изображениями, которые показали GFAP-положительные клетки, экспрессирующие CSPG, но не перекрывающиеся с ED1, что указывает на то, что реактивные астроциты человека также продуцируют CSPG. CSPG известны главным образом своим ингибирующим действием на рост. Они являются мощными ингибиторами конусов роста аксонов и удлинений нейритов 13 . Опосредованное CSPG ингибирование на модели травматического повреждения спинного мозга на крысах может быть преодолено обработкой хондроитиназой (Ch) ABC, которая расщепляет гликозаминогликановые цепи на CSPG 14 .Наше недавнее исследование показало, что введение ChABC, начинающееся через 7 дней после очаговой ишемии, уменьшает толщину GFAP-иммунореактивного глиального рубца и улучшает нейроповеденческий исход у крыс 15 .
Учитывая сложность и разнообразие глии человека, лучшее понимание глиальных клеток человеческого мозга может облегчить будущие клинические исследования и предоставить новые способы восстановления функций мозга у пациентов с различными неврологическими заболеваниями.
Благодарности
Эта работа была частично поддержана грантами Национального института здравоохранения (NIH) AG21980 и NS057186 (KJ), грантами Китайского фонда естественных наук провинции Чжэцзян (R20
Список литературы
1. Новицка Д., Рогозинская К., Алексий М., Витте О.В., Скангель-Крамска Дж. Пространственно-временная динамика астроглиальных и микроглиальных ответов после фототромботического инсульта в мозге крысы.Acta Neurobiol Exp (Wars) 2008; 68: 155–68. [PubMed] [Google Scholar] 2. Лайвли С., Моксон-Эмре I, Schlichter LC. SC1 / hevin и реактивный глиоз после транзиторного ишемического инсульта у молодых и старых крыс. J Neuropathol Exp Neurol. 2011; 70: 913–29. DOI: 10.1097 / NEN.0b013e318231151e. [PubMed] [Google Scholar] 3. Мориока Т., Калехуа А.Н., Стрейт В.Дж. Характеристика реакции микроглии после окклюзии средней мозговой артерии в головном мозге крысы. J Comp Neurol. 1993; 327: 123–32. DOI: 10.1002 / cne.Фармакологическое ингибирование реактивного глиоза блокирует TNF-α-опосредованный апоптоз нейронов
Аттвелл Д., Бучан А.М., Чарпак С., Лауритцен М., Маквикар Б.А., Ньюман Е.А.Глиальный и нейрональный контроль мозгового кровотока. Nature 2010; 468 : 232–243.
CAS PubMed PubMed Central Google ученый
Barreto GE, Gonzalez J, Torres Y, Morales L. Астроцитарно-нейрональные перекрестные помехи: последствия для нейрозащиты от травм головного мозга. Neurosci Res 2011; 71 : 107–113.
PubMed Google ученый
Barres BA.Тайна и магия глии: взгляд на их роль в здоровье и болезнях. Neuron 2008; 60 : 430–440.
CAS PubMed Google ученый
Garden GA, La Spada AR. Межклеточная (неправильная) коммуникация при нейродегенеративном заболевании. Neuron 2012; 73 : 886–901.
CAS PubMed PubMed Central Google ученый
Пекны М., Нильссон М.Активация астроцитов и реактивный глиоз. Glia 2005; 50 : 427–434.
PubMed Google ученый
Bahr M, Przyrembel C, Bastmeyer M. Астроциты зрительных нервов взрослых крыс не способны регенерировать аксоны ганглиозных клеток сетчатки. Exp Neurol 1995; 131 : 211–220.
CAS PubMed Google ученый
Johnson EC, Morrison JC.Друг или враг? Устранение влияния глиальных реакций при глаукоме. J Glaucoma 2009; 18 : 341–353.
PubMed PubMed Central Google ученый
Tezel G. Роль глии, митохондрий и иммунной системы при глаукоме. Invest Ophthalmol Vis Sci 2009; 50 : 1001–1012.
PubMed Google ученый
Ullian EM, Sapperstein SK, Christopherson KS, Barres BA.Контроль количества синапсов с помощью глии. Science 2001; 291 : 657–661.
CAS PubMed Google ученый
Menet V, Gimenez y Ribotta M, Chauvet N, Drian MJ, Lannoy J, Colucci-Guyon E et al . Инактивация гена глиального фибриллярного кислого белка, но не гена виментина, улучшает выживаемость нейронов и рост нейритов за счет изменения экспрессии молекул адгезии. J Neurosci 2001; 21 : 6147–6158.
CAS PubMed Google ученый
Wilhelmsson U, Li L, Pekna M, Berthold CH, Blom S, Eliasson C et al . Отсутствие глиального фибриллярного кислого белка и виментина предотвращает гипертрофию астроцитарных процессов и улучшает посттравматическую регенерацию. J Neurosci 2004; 24 : 5016–5021.
CAS Google ученый
Menet V, Gimenez YRM, Sandillon F, Privat A.GFAP нулевые астроциты являются благоприятным субстратом для выживания нейронов и роста нейритов. Glia 2000; 31 : 267–272.
CAS PubMed Google ученый
Вундерлих К.А., Танимото Н., Гроше А., Зреннер Э., Пекни М., Райхенбах А. и др. . Функциональные изменения сетчатки у мышей, лишенных белков промежуточных филаментов, глиальных фибриллярных кислотных белков и виментина. FASEB J 2015; 29 : 4815–4828.
CAS PubMed Google ученый
Kraft AW, Hu X, Yoon H, Yan P, Xiao Q, Wang Y et al . Ослабление активации астроцитов ускоряет патогенез бляшек у мышей APP / PS1. FASEB J 2013; 27 : 187–198.
CAS PubMed PubMed Central Google ученый
Танг Дж., Юэ З., Таллокзи З., Хагеманн Т., Чо В., Мессинг А. и др. .Аутофагия, индуцированная накоплением мутантного GFAP по болезни Александера, регулируется сигнальными путями p38 / MAPK и mTOR. Hum Mol Genet 2008; 17 : 1540–1555.
CAS PubMed PubMed Central Google ученый
Грин Б., Махаммад С., Ведиг Т., Клеланд М.М., Цай Л., Херрманн Х. и др. . Витаферин изменяет организацию промежуточных филаментов, форму и поведение клеток. PLoS One 2012 г .; 7 : e39065.
CAS PubMed PubMed Central Google ученый
Trendowski M. Использование филаментов цитоскелета неопластических клеток для усиления нового терапевтического подхода. Biochim Biophys Acta 2014; 1846 : 599–616.
CAS PubMed Google ученый
Лави Д., Глоттер Э, Шво Ю. Составляющие Withania somnifera Dun.III. Боковая часть Withaferin A. J Org Chem 1965; 30 : 1774–1778.
CAS Google ученый
Лю Т., Гамлуш М.М., Алдавуд А., Уорбертон Р., Токсоз Д., Хилл Н.С. и др. . Регулирование функции эндотелиального барьера путем нацеливания на фосфорилирование виментина. J Cell Physiol 2014; 229 : 1484–1493.
CAS PubMed Google ученый
Стивенс К., Хендерсон П., Ниммо ER, Соарес, округ Колумбия, Доган Б., Симпсон К.В. и др. .Белок промежуточного филамента, виментин, является регулятором активности NOD2. Гут 2013; 62 : 695–707.
CAS PubMed Google ученый
Баргагна-Мохан П., Парантан Р.Р., Хамза А., Чжан К.Г., Ли Д.М., Ким КБ и др. . Антифиброзный переключатель роговицы выявлен при генетическом и фармакологическом дефиците виментина. J Biol Chem 2012; 287 : 989–1006.
CAS PubMed Google ученый
Менко А.С., Бликен Б.М., Либовиц А.А., Чжан Л., Степп М.А., Уокер Дж.Центральная роль виментина в регулировании восстановительной функции во время заживления эпителия хрусталика. Mol Biol Cell 2014; 25 : 776–790.
CAS PubMed PubMed Central Google ученый
Mohan R, Hammers HJ, Bargagna-Mohan P, Zhan XH, Herbstritt CJ, Ruiz A et al . Витаферин А — мощный ингибитор ангиогенеза. Ангиогенез 2004; 7 : 115–122.
CAS PubMed Google ученый
Hahm ER, Singh SV.Апоптоз, индуцированный витаферином А, в клетках рака молочной железы человека связан с подавлением экспрессии белков семейства ингибиторов апоптоза. Cancer Lett 2013; 334 : 101–108.
CAS PubMed Google ученый
Баргагна-Мохан П., Лей Л., Томпсон А., Шоу С., Касахара К., Инагаки М. и др. . Фосфорилирование виментина лежит в основе чувствительности миофибробластов к витаферину A in vitro и при фиброзе роговицы. PLoS One 2015; 10 : e0133399.
PubMed PubMed Central Google ученый
Мин К.Дж., Чой К., Квон Т.К. Витаферин А подавляет индуцированную липополисахаридом экспрессию циклооксигеназы-2 и продукцию PGE2 посредством ингибирования активации STAT1 / 3 в клетках микроглии. Int Immunopharmacol 2011; 11 : 1137–1142.
CAS PubMed Google ученый
Баргагна-Мохан П., Парантан Р.Р., Хамза А., Димова Н., Трукки Б., Шринивасан С. и др. .Витаферин A нацелен на промежуточные филаменты глиального фибриллярного кислого белка и виментина в модели глиоза сетчатки. J Biol Chem 2010; 285 : 7657–7669.
CAS PubMed PubMed Central Google ученый
Гуо X, Дейсон Э.С., Занон-Морено В., Цзян К., Нахирный А., Чан Д. и др. . Передача сигналов PGC-1alpha координирует восприимчивость к метаболическим и окислительным повреждениям внутренней сетчатки. Am J Pathol 2014; 184 : 1017–1029.
CAS PubMed Google ученый
Нагирный А, Ливне-Бар I, Го Х, Сивак Ж.М. Детоксикация ROS и провоспалительные цитокины связаны передачей сигналов p38 MAPK в модели активации зрелых астроцитов. PLoS One 2013; 8 : e83049.
PubMed PubMed Central Google ученый
Rogers RS, Dharsee M, Ackloo S, Sivak JM, Flanagan JG.Протеомический анализ астроцитов головки зрительного нерва человека после биомеханической деформации. Mol Cell Proteomics 2012; 11 : M111 012302.
PubMed Google ученый
Almasieh M, Wilson AM, Morquette B, Cueva Vargas JL, Di Polo A. Молекулярные основы гибели ганглиозных клеток сетчатки при глаукоме. Prog Retin Eye Res 2012; 31 : 152–181.
CAS PubMed Google ученый
Сивак Ж.М.Старение глаза: общие дегенеративные механизмы между мозгом Альцгеймера и заболеванием сетчатки. Инвест офтальмол Vis Sci 2013; 54 : 871–880.
PubMed Google ученый
Lebrun-Julien F, Duplan L, Pernet V, Osswald I, Sapieha P, Bourgeois P et al . Эксайтотоксическая смерть нейронов сетчатки in vivo происходит по неавтономному для клеток механизму. J Neurosci 2009; 29 : 5536–5545.
CAS PubMed Google ученый
Tezel G, Li LY, Patil RV, Wax MB. TNF-альфа и рецептор-1 TNF-альфа в сетчатке нормальных и глаукомных глаз. Invest Ophthalmol Vis Sci 2001; 42 : 1787–1794.
CAS PubMed Google ученый
Paintlia MK, Paintlia AS, Singh AK, Singh I. S-нитрозоглутатион индуцирует экспрессию цилиарного нейротрофического фактора в астроцитах, что имеет значение для защиты ЦНС при патологических состояниях. J Biol Chem 2013; 16 : 11507.
Google ученый
Шин Дж. Х., Чон Дж. Й., Джин И, Ким И. Д., Ли Дж. К.. p38beta MAPK обеспечивает цитопротекцию против апоптоза астроцитов, вызванного окислительным стрессом, посредством индукции альфа-В-кристаллина и его антиапоптотической функции. Neurosci Lett 2011; 501 : 132–137.
CAS PubMed Google ученый
Soliman ML, Combs CK, Rosenberger TA.Модуляция воспалительных цитокинов и митоген-активируемых протеинкиназ ацетатом в первичных астроцитах. J Neuroimmune Pharmacol 2012; 8 : 287–300.
PubMed PubMed Central Google ученый
Мали RS, Cheng M, Chintala SK. Активаторы плазминогена способствуют повреждению сетчатки, вызванному эксайтотоксичностью. FASEB J 2005; 19 : 1280–1289.
CAS PubMed PubMed Central Google ученый
Chang ML, Wu CH, Jiang-Shieh YF, Shieh JY, Wen CY.Реактивные изменения астроцитов сетчатки и глиальных клеток Мюллера при нейроэксайтотоксичности, вызванной каинатом. Дж Анат 2007; 210 : 54–65.
CAS PubMed PubMed Central Google ученый
Gomez-Ramos P, Reinoso-Suarez F. Каиновая кислота предотвращает мечение пероксидазой тел ганглиозных клеток сетчатки у крыс: возможные ворота в ретроградном аксональном транспорте. Neurosci Lett 1983; 35 : 1–6.
CAS PubMed Google ученый
Ван Цюй, Ю С, Симони А., Сун GY, Сунь AY. Эксайтотоксичность, опосредованная каиновой кислотой, как модель нейродегенерации. Мол, нейробиол 2005; 31 : 3–16.
CAS PubMed Google ученый
Ганеш Б.С., Чинтала СК. Ингибирование реактивного глиоза снижает опосредованную эксайтотоксичностью гибель ганглиозных клеток сетчатки. PLoS One 2011; 6 : e18305.
CAS PubMed PubMed Central Google ученый
Никерсон ЧП, Маклеод М.С., Майерс Т., Кларк ДБ. Влияние эпидермального фактора роста и эритропоэтина на активацию глии Мюллера и фенотипическую пластичность сетчатки у взрослых млекопитающих. J Neurosci Res 2011; 89 : 1018–1030.
CAS PubMed Google ученый
Chen L, Sham CW, Chan AM, Francisco LM, Wu Y, Mareninov S et al .Роль иммуномодулятора в программировании гибели клеток-1 во время развития и апоптоза ганглиозных клеток сетчатки мыши. Invest Ophthalmol Vis Sci 2009; 50 : 4941–4948.
PubMed PubMed Central Google ученый
Харада С., Намеката К., Гуо Х, Йошида Х., Митамура Ю., Мацумото Ю. и др. . Дефицит ASK1 снижает гибель нервных клеток у GLAST-дефицитных мышей, модель глаукомы нормального напряжения. Cell Death Differ 2010; 17 : 1751–1759.
CAS PubMed Google ученый
Ризенберг А.Н., Лю З., Копан Р., Браун Н.Л. Автономная регуляция Rbpj клетками судьбы ганглиозных клеток сетчатки и колбочек фоторецепторов в сетчатке мышей. J Neurosci 2009; 29 : 12865–12877.
CAS PubMed PubMed Central Google ученый
Paranthan RR, Bargagna-Mohan P, Lau DL, Mohan R.Надежная модель для одновременного индуцирования неоваскуляризации роговицы и глиоза сетчатки в глазу мыши. Mol Vis 2011; 17 : 1901–1908.
PubMed PubMed Central Google ученый
Сивак Дж. М., Острикер А. С., Вулфенден А., Демирс Дж., Сепеда Р., Лонг Д. и др. . Фармакологическое разделение ангиогенеза и воспаления во время инициации патологической неоваскуляризации роговицы. J Biol Chem 2011; 286 : 44965–44975.
CAS PubMed PubMed Central Google ученый
Krajnc D, Neff NH, Hadjiconstantinou M. Глутамат, глутамин и глутаминсинтетаза в головном мозге новорожденных крыс после гипоксии. Brain Res 1996; 707 : 134–137.
CAS Google ученый
Reinhardt CA, Schein CH. Активность глутаминсинтетазы как маркер токсичности в культурах эмбриональных клеток головного мозга и сетчатки глаза цыплят. Toxicol In Vitro 1995; 9 : 369–374.
CAS PubMed Google ученый
Кикучи М., Теннети Л., Липтон С.А. Роль митоген-активируемой протеинкиназы p38 в апоптозе ганглиозных клеток сетчатки, индуцированном аксотомией. J Neurosci 2000; 20 : 5037–5044.
CAS PubMed Google ученый
Tezel G, воск MB.Повышенная продукция фактора некроза опухоли альфа глиальными клетками, подвергшимися моделированной ишемии или повышенному гидростатическому давлению, вызывает апоптоз в сокультивированных ганглиозных клетках сетчатки. J Neurosci 2000; 20 : 8693–8700.
CAS PubMed Google ученый
де Бок Ф, Дорнанд Дж, Рондуин Дж. Высвобождение TNF-альфа в гиппокампе крыс после эпилептических припадков и эксайтотоксического повреждения нейронов. Neuroreport 1996; 7 : 1125–1129.
CAS PubMed Google ученый
Lebrun-Julien F, Bertrand MJ, De Backer O, Stellwagen D, Morales CR, Di Polo A и др. . ProNGF вызывает TNF-альфа-зависимую гибель ганглиозных клеток сетчатки через неавтономный сигнальный путь p75NTR. Proc Natl Acad Sci USA 2010; 107 : 3817–3822.
CAS PubMed Google ученый
Шрирам К., О’Каллаган, JP.Различные роли фактора некроза опухоли-альфа в головном мозге. J Neuroimmune Pharmacol 2007; 2 : 140–153.
PubMed Google ученый
Yuan L, Neufeld AH. Фактор некроза опухоли альфа: потенциально нейродеструктивный цитокин, продуцируемый глией в головке зрительного нерва человека при глаукоме. Glia 2000; 32 : 42–50.
CAS PubMed Google ученый
Бай Й, Ши З, Чжо Й, Лю Дж, Малахов А., Ко Е и др. .При глаукоме усиленная изоформа усеченного рецептора TrkC.T1 в глии вызывает повышенную продукцию TNF-альфа, что приводит к гибели ганглиозных клеток сетчатки. Invest Ophthalmol Vis Sci 2010; 51 : 6639–6651.
PubMed PubMed Central Google ученый
Эрнандес MR, Miao H, Lukas T. Астроциты при глаукомной оптической нейропатии. Prog Brain Res 2008; 173 : 353–373.
CAS PubMed Google ученый
Parpura V, Heneka MT, Montana V, Oliet SH, Schousboe A, Haydon PG и др. .Глиальные клетки в (пато) физиологии. J Neurochem 2012; 121 : 4–27.
CAS PubMed PubMed Central Google ученый
Curtis TM, Hamilton R, Yong PH, McVicar CM, Berner A, Pringle R и др. . Дисфункция глии Мюллера при диабетической ретинопатии у крыс связана с накоплением конечных продуктов гликирования и конечных продуктов липоксидации. Диабетология 2011; 54 : 690–698.
CAS PubMed Google ученый
Илиева Х., Полимениду М, Кливленд DW. Неклеточная автономная токсичность при нейродегенеративных расстройствах: БАС и не только. J Cell Biol 2009; 187 : 761–772.
CAS PubMed PubMed Central Google ученый
Vanden Berghe W, Sabbe L, Kaileh M, Haegeman G, Heyninck K. Молекулярное понимание многофункциональной активности Витаферина А. Biochem Pharmacol 2012; 84 : 1282–1291.
CAS PubMed Google ученый
Bargagna-Mohan P, Hamza A, Kim YE, Khuan Abby Ho Y, Mor-Vaknin N, Wendschlag N и др. . Ингибитор опухолей и антиангиогенный агент с гаферином А нацелены на белок промежуточных филаментов виментин. Chem Biol 2007; 14 : 623–634.
CAS PubMed PubMed Central Google ученый
Лахат Г., Чжу QS, Хуанг К.Л., Ван С., Большаков С., Лю Дж. и др. .Виментин представляет собой новую противораковую терапевтическую мишень; выводы из исследований ксенотрансплантатов на in vitro, и in vivo, на мышах. PLoS One 2010; 5 : e10105.
PubMed PubMed Central Google ученый
Сваруп В., Фанеф Д., Дюпре Н., Петри С., Стронг М., Криз Дж. и др. . Нарушение регуляции TDP-43 при боковом амиотрофическом склерозе запускает патогенные пути, опосредованные ядерным фактором kappaB. J Exp Med 2011; 208 : 2429–2447.
CAS PubMed PubMed Central Google ученый
Брингманн А., Паннике Т., Гроше Дж., Франк М., Видеманн П., Скатчков С.Н. и др. . Клетки Мюллера в здоровой и больной сетчатке. Prog Retin Eye Res 2006; 25 : 397–424.
CAS PubMed Google ученый
Тезель Г.Окислительный стресс при глаукомной нейродегенерации: механизмы и последствия. Prog Retin Eye Res 2006; 25 : 490–513.
CAS PubMed PubMed Central Google ученый
Tezel G, воск MB. Индуцируемый гипоксией фактор 1альфа глаукомы сетчатки и головки зрительного нерва. Arch Ophthalmol 2004; 122 : 1348–1356.
CAS PubMed Google ученый
Лю Б., Нойфельд, АХ.Активация рецепторов эпидермального фактора роста в астроцитах: от развития до нервного повреждения. J Neurosci Res 2007; 85 : 3523–3529.
CAS PubMed Google ученый
Bachstetter AD, Van Eldik LJ. Семейство киназ p38 MAP как регуляторы продукции провоспалительных цитокинов при дегенеративных заболеваниях ЦНС. Aging Dis 2010; 1 : 199–211.
PubMed PubMed Central Google ученый
Шреста Р., Миллингтон О., Брюер Дж., Дев К.К., Бушелл Т.Дж.Опосредованная лимфоцитами нейрозащита в моделях in vitro эксайтотоксичности включает активацию астроцитов и ингибирование сигнальных путей MAP-киназы. Нейрофармакология 2014; 76 : 184–193.
CAS PubMed Google ученый
Ирвинг Э.А., Бэмфорд М. Роль митоген- и стресс-активируемых киназ в ишемическом повреждении. J Cereb Blood Flow Metab 2002; 22 : 631–647.
CAS PubMed Google ученый
Ривера-Сервантес М.С., Кастанеда-Арельяно Р., Кастро-Торрес Р.Д., Гудино-Кабрера Г., Фериа и Веласко А.И., Каминс А и др. . Ингибирование P38 MAPK защищает от нейротоксичности глутамата и изменяет экспрессию субъединицы рецептора NMDA и AMPA. J Mol Neurosci 2015; 55 : 596–608.
CAS PubMed Google ученый
Бачис А., Коланджело А.М., Вичини С., Доу П.П., Де Бернарди М.А., Брукер Г. и др. .Интерлейкин-10 предотвращает опосредованную глутаматом гибель гранулярных клеток мозжечка, блокируя активность, подобную каспазе-3. J Neurosci 2001; 21 : 3104–3112.
CAS PubMed Google ученый
Balasingam V, Yong VW. Ослабление реактивности астроглия интерлейкином-10. J Neurosci 1996; 16 : 2945–2955.
CAS PubMed Google ученый
Квилас А.Дж., Грейс П.М., Сербедзия П., Майер С.Ф., Уоткинс Л.Р.Терапевтический потенциал интерлейкина-10 при нейроиммунных заболеваниях. Нейрофармакология 2015; 96 : 55–69.
CAS PubMed Google ученый
Sharma S, Yang B, Xi X, Grotta JC, Aronowski J, Savitz SI. IL-10 напрямую защищает корковые нейроны, активируя пути киназы PI-3 и STAT-3. Brain Res 2011; 1373 : 189–194.
CAS PubMed Google ученый
Balasingam V, Tejada-Berges T, Wright E, Bouckova R, Yong VW.Реактивный астроглиоз в головном мозге новорожденных мышей и его модуляция цитокинами. J Neurosci 1994; 14 : 846–856.
CAS PubMed Google ученый
Kalia LV, Kalia SK, Salter MW. Рецепторы NMDA в клинической неврологии: впереди волнующие времена. Lancet Neurol 2008; 7 : 742–755.
CAS PubMed PubMed Central Google ученый
Дрейкслер Дж. К., Постон Дж. Н., Шейх А. Р., Александр М., Таппер К. Ю., Марсет М. М. и др. .Отсроченное постишемическое кондиционирование значительно улучшает исход после ишемии сетчатки. Exp Eye Res 2011; 92 : 521–527.
CAS PubMed Google ученый
Лю X, Sha O, Cho EY. Удаленное ишемическое посткондиционирование способствует выживанию ганглиозных клеток сетчатки после повреждения зрительного нерва. J Mol Neurosci 2013; 51 : 639–646.
CAS PubMed Google ученый
Лорбер Б., Гуиди А., Фосетт Дж. У., Мартин К. Р..Активированная глия сетчатки опосредована регенерацией аксонов при экспериментальной глаукоме. Neurobiol Dis 2012; 45 : 243–252.
CAS PubMed Google ученый
Нисидзима К., Нг Ю.С., Чжун Л., Брэдли Дж., Шуберт В., Джо Н. и др. . Фактор роста эндотелия сосудов-А является фактором выживания нейронов сетчатки и важным нейропротектором во время адаптивного ответа на ишемическое повреждение. Am J Pathol 2007; 171 : 53–67.`, F, Yj &&&&&& М & oQNT & м.т. _ &&& iPfA-к & г & к &&&&&&: gr2 & YG & O-Q & L1a5h &&& V && Z && R && B & ЕМС & hO67 &&& HF_o & YAQ & O: C & n7GHFA && О &&&& у &&& с && т && Ю.Ф.: hkhmFhJ && _ 1л && hBfinEoHp & LFEceG9Z & БДП && J & р
3frpybd49xfch> & _Aml & P2J9-fY9 &&& s8AUJ && рх & OXC && T & HoUo9SoRBO5_eu &&&& д &&& С &&&&&&&&& XRLg & уХ &&& е &&& е & J7 & f1F_Y & DG5cK && Hc — && ITX &
& HO7 & C & O & Wc49 & л.Рр & Lk- & mA7M & WCgK-5RE1N &&& B & гК && Pd.P1 &&&&&&&& О && GPX & N98DXU & я & mTjH & rRaHe &&& mx3 && AIKgAoOYqt- & B & qM7Q & goQXSKH &&& Ка & Sm && Nna3fR && & G & S & Fu & & J &&&&& &&& В.Д..HW & kNmQ && mC7Q3We &&& J & EB & ОМЗ & У2 & Тха & MSqPL0JJ & Aw && EZ & C1 & & Gf7n3 && Х &&&& К && Р &: d1 && efQ & cI4nOfR6MM143q4 && ePZ2c &&& Q &&& DW & X & Y & Виджеи & SC & ч && Y && fdIGenU1-с &&& SgoMKehu &&&&& г && УП && 0h> &&& п: G &&&& RgnU0CF & д & ЗСЛ: && U &: T & U & F9 & LW6 & Wai & N && gguA & _SVL & UbbNIfGKV & рО & MNC & _ &&&&& L9 & Gh && Zn- & DgfZV &: LZXh0FTJ.р && ZS & i3 && до н.э. && JFF &&&& XSP & tNCi1_M_ & д2 & G & л && М0 & Jos &&& Fg & klr7: Мк & VC & fc32h2 &&& с & T && CRTPXNtb0Z &&& Lpt && А8 & N.R6 & с & ен && fLgO0NLk & J & г & X8qQp & dqHiVQl && kqN & q4- & е && у && Z & с4 && N & L & Из & IWC & lcWQnha32: 6a52 &&&& EB & K4bL & eAiLiOIL5WMO & K & D23 & Mp && N: lAfnf