Фенотип антигенов эритроцитов и индекс сенсибилизации у доноров компонентов крови и пациентов г. Астаны
Ж.К. Буркитбаев, Р.Б. Меирбекова, Е.Н. Курганская, Л.Л. Карп, Р.З. Магзумова
Научно-производственный центр трансфузиологии, г. Астана, Казахстан
Трансфузиология №2, 2013
Резюме
В результате проведенного исследования установлено большое разнообразие фенотипов в системе Резус, а также достаточно высокая степень сенсибилизации у реципиентов и высокий индекс сенсибилизации населения города Астаны.
Ключевые слова: антигенный состав эритроцитов.
Введение
Исследование распространенности у доноров основных клинически значимых антигенов эритроцитов, определение индекса аллоиммунизации является непременным условием адекватной профилактики посттрансфузионных реакций и осложнений гемолитического типа. Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16].
Цель и задачи исследования
Целью работы явилось изучение частоты встречаемости антигенов эритроцитов и определение уровня сенсибилизации населения г. Астаны.
Материал и методы исследования
Материалом исследования служили 119882 образцов крови доноров и 6313 реципиентов за период 2010–2012 гг. Возраст доноров колебался от 18 до 60 лет. Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-Rh2(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США).
Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-Rh2(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США).

Результаты и обсуждения
Нами было проанализировано распределение групп крови системы АВО у доноров и реципиентов (таблица 1).
Полученные данные свидетельствуют о том, что распределение групп крови по системе АВО у доноров и пациентов сходны. Преобладающими являются O и А группы крови. Выявленная нами частота встречаемости антигена А2 в группе крови А и АВ составляет для доноров 0,32%, а для пациентов 3,2%. Выявленное нами соотношение Rh(D)-положительных и Rh(D)-отрицательных лиц среди пациентов составило 94,39 и 5,6% соответственно. Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Полученные нами данные выявили значительно больший процент антигена D вариантного у пациентов. Возможно, это является результатом ослабления антигена D при заболеваниях. Изучение антигенного состава эритроцитов кадровых доноров и пациентов показало, что наиболее распространенным фенотипом среди Rh(D)-положительных лиц является фенотип CCDee-, далее следуют фенотипы CcDee-, CcDEe- и ccDEe- (табл.
Наибольшую опасность представляют в трансфузионном отношении гомозиготные сочетания антигенов системы Резус (СС, сc, ЕЕ и ее), которые встречаются у 86% резус-положительных (D+). Всем донорам и реципиентам независимо от групповой и резус- принадлежности предварительно проводился скрининг на наличие антиэритроцитарных антител. При оценке антиэритроцитарных антител у 13,3% пациентов обнаружены иммунные антитела различной специфичности. В связи с тем, что среди контингента обследованных в лаборатории лиц превалировали беременные, входившие в группу риска по аллоиммунизации, а также больные получившие многократные трансфузии, – индекс сенсибилизации у пациентов оказался высоким. Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции.
Проблема гемолитической болезни новорожденных (ГБН) для города Астана актуальна. Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
Центр крови ФМБА России
08 ноября
Почему массовая сдача крови во время громких терактов приводит впоследствии к нехватке крови? Можно ли быть донором, если у вас есть татуировки? Сколько можно заработать на сдаче крови и другие интересные вопросы Зожник задал Ярославу Николаевичу Глазову, врачу-трансфузиологу, заведующему отделением заготовки и фракционирования крови Центра крови ФМБА России.
СКОЛЬКО КРОВИ В ЧЕЛОВЕКЕ
Расскажите для начала, сколько всего крови в человеке и сколько ее можно сдать в качестве донора?
В зависимости от пола, возраста и телосложения объем циркулирующей крови (ОЦК) на 1 кг массы тела колеблется от 50 до 80 мл на килограмм веса. ОЦК можно посчитать по формуле: масса тела * 77. Например, если человек весит 56 кг, то его объем крови будет равен 4,31 л. При этом сдать в качестве донора можно не более 12% этого объема.
Но вообще стандартный объем заготовки крови — 450 мл, без учета крови, взятой для анализов — еще до 40 мл.
СРОК ХРАНЕНИЯ
А что происходит с кровью, которую сдают доноры? Мы слышали, что довольно значительная часть ее просто утилизируется, грубо говоря, выливается в унитаз. В каких случаях так происходит?
Обычно, говоря о донорстве, чаще всего имеют в виду процедуру сдачи цельной крови. Во время этой непродолжительной и не вызывающей даже незначительного дискомфорта процедуры из кровеносного русла донора извлекают в специальный пластиковый контейнер около 450 мл крови.
При этом у донора сверх этого отдельно забирают около 30-40 мл, чтобы позже провести обследования в специальных лабораториях и определить ее принадлежность к определенной группе крови и резус-фактор, биохимические показатели, а также маркеры вируса иммунодефицита (ВИЧ), гепатита В и С и сифилиса.
Сразу после сдачи крови ее разделяют на компоненты — эритроциты, тромбоциты и плазму.
ВРЕД МАССОВОЙ СДАЧИ КРОВИ
Сейчас часто бывает, что после терактов или бедствий разворачиваются различные пункты приема крови, кто-то зарабатывает политические очки на этом. Люди же думают, что их кровь напрямую будет переливаться жертвам. Есть ли смысл идти и становиться донором в таких ситуациях?
На случай чрезвычайных ситуаций в учреждениях службы крови постоянно поддерживается неснижаемый запас компонентов крови. При необходимости резервы немедленно обеспечат потребность для лечения весьма большого количества пострадавших. Именно резерв — ранее заготовленные от регулярных доноров компоненты крови, протестированные в полном объеме и готовые к переливанию ‑ расходуется в первую очередь при ликвидации последствий чрезвычайных ситуаций.
В период катастроф обычно происходит массовый приток доноров. Такой наплыв несет опасность создания запасов невостребованной крови. Самое досадное, что краткосрочная донорская активность не улучшает ситуацию с повседневной нехваткой компонентов крови,а иногда даже ухудшает.
РЕДКАЯ КРОВЬ
Правда ли, что бывают особо редкие виды крови, содержащие некий уникальный набор элементов и что такая кровь особенно востребована? Есть ли нехватка какого-то конкретного вида крови (группа/резус, что-то еще)?
Вся кровь разделяется по принципу групповой принадлежности (группы крови системы АВО), основанной на 4-х комбинациях эритроцитарных антигенов А и В — I (O), II (A), III (B) и IV(AB), а также по резус-фактору — антиген, который находится на поверхности эритроцитов. Около 85% людей имеют этот самый резус-фактор и являются резус-положительными (Rh+). Остальные 15% являются резус-отрицательными (Rh-).
Существуют так называемые редкие фенотипы — определенный набор буквенных показателей. Но ни в коем случае нельзя говорить о какой-то особой востребованности данного фенотипа. Ведь если фенотип редкий, соответственно и людей с таким фенотипом мало и крови им надо также мало.
Но ни в коем случае нельзя говорить о какой-то особой востребованности данного фенотипа. Ведь если фенотип редкий, соответственно и людей с таким фенотипом мало и крови им надо также мало.
Специалисты, работающие в учреждениях переливания крови, сходятся во мнении, что считать IV группу крови с Rh+ и Rh редкой — неправильно. Каждый день потребность клиник в компонентах крови определенной группы меняется. В какой-то момент «редкой» может стать и I, и II группы крови, если количество запросов на компоненты данной группы, поступающих от ЛПУ, будет превышать возможности учреждения переливания крови.
С полной версией интервью Вы можете ознакомиться в блоге ЗОЖНИК.
Источник: блог ЗОЖНИКОпределение фенотипа резус-фактора и антигена К системы Келл
Исследование включает в себя определение наличия на исследуемых эритроцитах наиболее клинически значимых антигенов системы Rh (C, E, c, e) и Kell (K).
Наличие или отсутствие определенных белков на мембране эритроцитов (фенотип антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни. Люди, у которых отсутствует какой-либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, которая содержит эритроциты, несущие соответствующий антиген, и гемолитическая болезнь новорождённых вследствие прохождения через плаценту материнских IgG-антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии.
Люди, у которых отсутствует какой-либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, которая содержит эритроциты, несущие соответствующий антиген, и гемолитическая болезнь новорождённых вследствие прохождения через плаценту материнских IgG-антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии.
Когда назначается исследование?
- Обследования перед планирующимися гемотрансфузиями в целях снижения частоты трансфузионных реакций.
- Дополнительные обследования во время беременности в целях оценки статуса по системе Rh и Kell.
- Диагностика, оценка риска возникновения гемолитической болезни новорождённых и решение о своевременном адекватном лечении данной патологии.
- Обследование всех доноров крови в соответствии с приказом МЗ РФ № 183н от 02.04.2013 г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
Стоимость исследования
Фенотипы групп крови по системе АВО и смертность у пациентов с COVID-19, находящихся в критическом состоянии
Оригинал: Вritish Journal of Haematology
Автор: Rebecca Karp Leaf et al.
Опубликовано: 01 июля 2020, Вritish Journal of Haematology, (onlinelibrary.wiley.com)
Перевод: Серафима Кокорина, Фонд профилактики рака
Данные о взаимосвязи между группой крови и исходом коронавирусной инфекции (COVID-19) ограничены. Cогласно исследованиям из Китая [3] и Европы [4], пациенты с I (О) группой крови могут быть защищены от коронавирусной инфекции, в то время как пациенты со II (A) группой крови могут иметь более высокий риск. Данные о схожей вспышке в 2003 году [5]- коронавирусной инфекции, вызывающей тяжёлый острый респираторный синдром (SARS-CoV-1), показывают, что медицинские работники с I (О) группой крови были менее подвержены заболеванию. Эксперименты in vitro показали, что взаимодействие между шиповидным белком SARS-CoV-1 и ангиотензин-превращающим ферментом-2 (АПФ-2), который необходим для проникновения вируса в клетку, может нарушаться анти-А антителами [6].
Для исследования взаимосвязи между фенотипом по системе ABО и смертностью среди критически больных пациентов с COVID-19 мы использовали критерий хи-квадрат. Мы сопоставили распределение фенотипов крови по системе АВО с 28-дневной госпитальной смертностью, стратифицированной по расовым/этническим категориям. Пациенты, выписанные живыми из больницы до 28 дней, считались живыми в течение 28 дней. Обоснованность этого предположения была подтверждена на рандомной выборке из 50 пациентов, выписанных до 28 дней — все они оставались живы в течение 28 дней согласно электронным медицинским данным или телефонной проверке. Статистический анализ был выполнен с помощью GraphPad Prism 7 (GraphPad, Inc., San Diego, CA) и Microsoft Excel 2016 (Microsoft Corp., Redmond, WA).
Мы сопоставили распределение фенотипов крови по системе АВО с 28-дневной госпитальной смертностью, стратифицированной по расовым/этническим категориям. Пациенты, выписанные живыми из больницы до 28 дней, считались живыми в течение 28 дней. Обоснованность этого предположения была подтверждена на рандомной выборке из 50 пациентов, выписанных до 28 дней — все они оставались живы в течение 28 дней согласно электронным медицинским данным или телефонной проверке. Статистический анализ был выполнен с помощью GraphPad Prism 7 (GraphPad, Inc., San Diego, CA) и Microsoft Excel 2016 (Microsoft Corp., Redmond, WA).
Среди 3239 пациентов с COVID-19 в критическом состоянии 2033 (62.8%) имели известный фенотип по ABO и были включены в текущее исследование. Средний возраст пациентов — 62 года (межквартильный размах 52-71), 1297 (63,8%) из них — мужчины.
Наблюдаемая и ожидаемая встречаемость фенотипов ABO у белых, темнокожих и латиноамериканских пациентов показаны на Рисунке 1. Среди белых пациентов наблюдаемое распределение фенотипов ABO отличалось от ожидаемого (Рисунок 1A).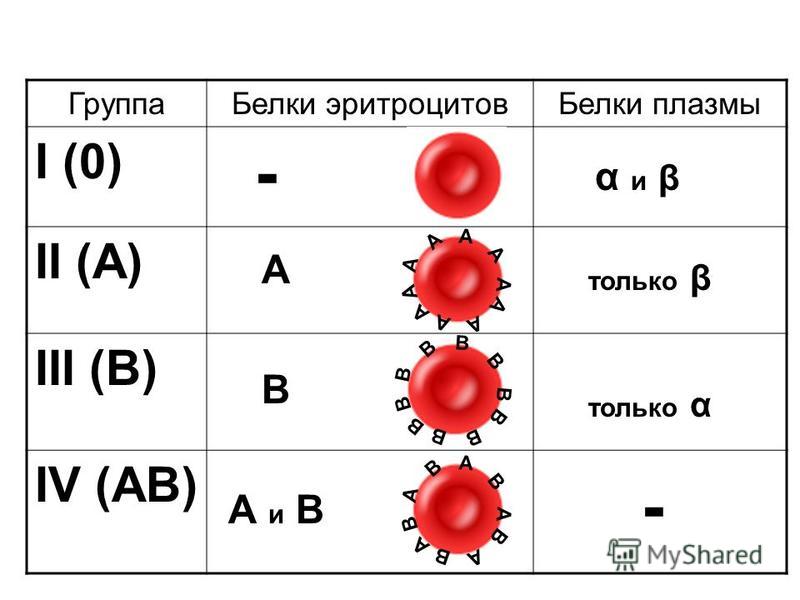 Разница была обусловлена большим количеством пациентов со II (А) группой крови (45.1% наблюдаемых против 39.8% ожидаемых) и меньшим числом пациентов с I (О) группой крови (37.8% наблюдаемых против 45.2% ожидаемых). Среди темнокожих (Рисунок 1B) и латиноамериканских пациентов (Рисунок 1C) наблюдаемая и ожидаемая встречаемость фенотипов по ABO оказались идентичны.
Разница была обусловлена большим количеством пациентов со II (А) группой крови (45.1% наблюдаемых против 39.8% ожидаемых) и меньшим числом пациентов с I (О) группой крови (37.8% наблюдаемых против 45.2% ожидаемых). Среди темнокожих (Рисунок 1B) и латиноамериканских пациентов (Рисунок 1C) наблюдаемая и ожидаемая встречаемость фенотипов по ABO оказались идентичны.
799 из 2033 пациентов (39.3%) умерли в течение 28 дней. Уровень смертности был одинаковым у всех фенотипов ABO во всех расовых/этнических категориях (Рисунок 1D-F). При рассмотрении фенотипов по резус-фактору результаты качественно не изменились.
В этом крупном национальном исследовании пациентов с COVID-19 в критическом состоянии мы обнаружили значительные различия между наблюдаемым и ожидаемым распределением фенотипов ABO среди белых пациентов со II (А) и I (О) группами крови, которые были представлены в избытке и в недостатке соответственно. Мы не нашли подобных различий среди темнокожих и латиноамериканских пациентов. Также не была обнаружена связь между фенотипом ABO и 28-дневной смертностью среди какой-либо из трёх исследуемых расовых/этнических категорий.
Также не была обнаружена связь между фенотипом ABO и 28-дневной смертностью среди какой-либо из трёх исследуемых расовых/этнических категорий.
Полученные нами данные о более высокой, чем ожидалось, частоте встречаемости II (А) группы крови и более низкой, чем ожидалось, частоте встречаемости I (О) группы крови, по крайней мере, среди белых пациентов, согласуются с другими отчётами. Например, Ellinghaus и соавторы в недавнем полигеномном поиске ассоциаций приблизительно у 2000 пациентов в Италии и Испании идентифицировали 2 генных кластера, расширенных у пациентов с COVID-19. Первый кластер содержал гены, отвечающие за функционирование АПФ-2 и иммунный ответ, в то время как второй кластер включал гены, определяющие группу крови по системе ABO. В мета-анализе двух различных исследований «случай-контроль» авторы обнаружили, что II (А) группа крови связана с более высоким риском тяжёлого течения COVID-19, а I (О) группа крови даёт защиту от него.4Аналогично исследователи из Китая и США сообщают, что у пациентов со II (А) группой крови повышен риск развития COVID-19, а пациенты с I (О) группой крови имеют меньший риск [3].
Механизмы данной защиты всё ещё изучаются. В соответствии с одной из теорий, нейтрализуюшие анти-А антитела защищают лёгочный эпителий от проникновения вируса, как предполагалось в случае с SARS-CoV-1 [6]; но в этом случае как I (О), так и III (В) группы крови должны реже встречаться в нашей когорте. С другой стороны, известно, что индивидуумы с I (О) группой крови имеют более низкий риск тромбозов и сердечно-сосудистых заболеваний, что связано с изменением активности гликозилтрансферазы и увеличенным клиренсом фактора фон Виллебранда. Таким образом, у пациентов с I (О) группой крови может быть меньше вероятность развития микрососудистых тромбозов и эндотелиальной дисфункции, связанных с COVID-19 [8].
закрыть менюИсточники
- Anstee DJ. The relationship between blood groups and disease. Blood 2010;115:4635-43.
- Cooling L. Blood Groups in Infection and Host Susceptibility. Clin Microbiol Rev 2015;28:801-70.
- Zhao J YY, Huang H, Li D, Gu D, Lu X, Zhang Z, Liu L, Liu T, Liu Y, He Y, Sun B, Wei M, Yang G, Wang X, Zhang L, Zhou X, Xing M, Wang PG.
 Relationship between the ABO Blood Group and the COVID-19 Susceptibility. MedRxiv (Preprint) 2020.
Relationship between the ABO Blood Group and the COVID-19 Susceptibility. MedRxiv (Preprint) 2020. - Ellinghaus D, Degenhardt F, Bujanda L, et al. Genomewide Association Study of Severe Covid- 19 with Respiratory Failure. N Engl J Med 2020.
- Cheng Y, Cheng G, Chui CH, et al. ABO blood group and susceptibility to severe acute respiratory syndrome. JAMA 2005;293:1450-1.
- Guillon P, Clement M, Sebille V, et al. Inhibition of the interaction between the SARS-CoV spike protein and its cellular receptor by anti-histo-blood group antibodies. Glycobiology 2008;18:1085-93.
- Garratty G, Glynn SA, McEntire R, Retrovirus Epidemiology Donor S. ABO and Rh(D) phenotype frequencies of different racial/ethnic groups in the United States. Transfusion 2004;44:703-6.
Анализы на Группа крови + Резус-фактор, цены в лаборатории KDL
Комплексное лабораторное исследование, направленное на выявление индивидуальных антигенов на мембране эритроцитов по системе AB0 (группа крови) и резус-фактору (Rh), генетически наследуемых от родителей.
Общая информация.
На мембране эритроцитов известны более 290 антигенов, составляющих 29 групп крови. Наибольшее значение в медицинской практике имеют система АВ0 и резус-фактор.
Система АВ0 – основная система классификации групп крови, включает наиболее иммуногенные антигены (часто вызывающие реакцию) А и В, расположенные на поверхности эритроцитов и антитела альфа и бета в плазме крови. Сочетание антигенов и антител явилось основой классификации групп крови АВ0:
- 0 (I) – нулевая, или первая группа. Не содержит антигенов А и В, в плазме присутствуют аглютинины (антитела) альфа и бета
- А (II) – есть антиген А на поверхности эритроцита, в плазме аглютинин бета
- В (III) – есть антиген В, в плазме аглютинин альфа
- АВ (IV) – на мембране эритроцита содержатся оба антигена — А и В, в плазме антител нет.
Резус-фактор – сложная система, насчитывающая до 40 антигенов, но главным среди них являются антигены типа D. Термин «положительный резус-фактор» относится только к антигену D (85% населения). Отсутствие антигена D на мембране эритроцита говорит о резус-отрицательном факторе.
Термин «положительный резус-фактор» относится только к антигену D (85% населения). Отсутствие антигена D на мембране эритроцита говорит о резус-отрицательном факторе.
Когда назначается группа крови и резус-фактор?
- Донорам и пациентам перед процедурой переливания крови
- Перед госпитализацией в стационар хирургического профиля (есть вероятность необходимости переливания крови)
- При постановке на учёт по беременности. Резус-отрицательный фактор и 0 (I) группа крови у женщины требуют дополнительных исследований в течение беременности и в родах с целью профилактики гемолитической болезни плода и новорожденного
- При диагностика гемолитической болезни новорожденных
Как выполняется исследование?
Гелевая технология, гелевые карты DiaMed AG, Швейцария.
Преимущества гелевой технологии:
При определении группы крови и резус-фактора иногда могут встречаться случаи выявления ослабленных антигенов, распознаваемые с помощью современных гелевых систем. Их определение имеет важное значение при переливании крови
- Слабый антиген А2 в системе АВ0 (встречается чаще других) может приводить к ложному определению группы крови. Если его не выявить, возможно ошибочное отнесение носителя А2 (II) к группе 0 (I) или носителя А2В (IV) — к группе В (III). Гелевые системы распознают ослабленные антигены А2.
- Ослабленный антиген D. Таким пациентам при переливании крови требуется резус-отрицательная кровь, а в качестве донора их считают резус-положительными для избежания конфликта.
Что означают результаты теста?
Определяется принадлежность к группе крови и резус-фактору.
Обнаружение слабых вариантов групповых антигенов или генов резус-фактора сопровождается соответствующим комментарием, в этом случае требуется фенотипирование крови (индивидуальный подбор) в центрах переливания крови.
Сроки выполнения теста.
1-2 дня.
СЛУЧАЙ ВОЗНИКНОВЕНИЯ ТРАНСФУЗИОННОЙ ХИМЕРЫ И ВЫРАБОТКИ АНТИЭРИТРОЦИТАРНЫХ АНТИТЕЛ У РЕБЕНКА / 2-й номер / 2015 год
- Номера
- 2015 год
- 2-й номер
- СЛУЧАЙ ВОЗНИКНОВЕНИЯ ТРАНСФУЗИОННОЙ…
УДК 615.38
© Коллектив авторов, 2015
Поступила 01.06.2015 г.
М.С. АГАНДЕЕВА, Н.Ю. БАЛАНДИНА,
Л.М. ЯКОВЛЕВА, А.В. ЦАРЕВА
СЛУЧАЙ ВОЗНИКНОВЕНИЯ ТРАНСФУЗИОННОЙ ХИМЕРЫ И ВЫРАБОТКИ АНТИЭРИТРОЦИТАРНЫХ АНТИТЕЛ У РЕБЕНКА
Институт усовершенствования врачей,
Республиканская станция переливания крови, Чебоксары
Рассмотрен случай возникновения трансфузионной химеры в педиатрической практике в результате переливания эритроцитной массы без учета фенотипов донора и реципиента. Кратко освещены сведения об иммунологической безопасности трансфузионной терапии, кровяных химерах, минорных антигенах.
Ключевые слова: кровяные химеры, антигены эритроцитов, иммунные антиэритроцитарные антитела, иммунологическая безопасность трансфузионной терапии.
Введение. Обеспечение максимальной терапевтической эффективности компонентов донорской крови и предупреждение возможных осложнений при их применении актуальны и практически важны. К настоящему времени достаточно подробно изучена антигенная структура эритроцитов и антиэритроцитарных антител человека, что позволило разработать оптимальные методы предупреждения несовместимости крови донора и реципиента, основанные на иммунологическом подборе [3, 4, 5]. Однако до настоящего времени в большинстве медицинских учреждений Чувашии существует практика применения компонентов крови, совместимых только по группе АВ0 и Rh-принадлежности больного и донора, без учета других антигенных систем. Это нередко приводит к ряду негативных последствий трансфузионной терапии, среди которых можно выделить возникновение трансфузионных химер и аллоиммунизацию реципиента.
Кровяными химерами называют одновременное пребывание в кровяном русле двух или нескольких популяций эритроцитов, отличающихся по антигенному составу [1, 2, 3]. Установление группы крови, резус-фактора и определение антигенов других систем при кровяных химерах крайне затруднено, поскольку в некоторых случаях до 50% эритроцитов, находящихся в циркуляции, имеют один антигенный состав, а 50% — другой [1].
Различают истинные и трансфузионные кровяные химеры. Истинные (постоянные) химеры имеют различный генез и сохраняются на протяжении всей жизни. Они встречаются у гетерозиготных разногруппных близнецов, имевших в период внутриутробного развития межплацентарные анастомозы и, как следствие, обмен стволовыми гемопоэтическими клетками. Кроме того, истинный химеризм наблюдается после трансплантации аллогенного костного мозга, отличающегося по антигенному составу и продуцирующего эритроциты иного фенотипа [1, 3]. Трансплантационные химеры характеризуются большой продолжительностью их циркуляции, вариабельностью и многообразием форм. Иногда происходит полная замена антигенов эритроцитов реципиента на антигены эритроцитов донора костного мозга и соответственно изменение антительного состава сыворотки реципиента. Такие химеры характеризуются различным соотношением химеричных эритроцитов, естественных и иммунных антител, появившихся вследствие взаимодействия организмов хозяина и трансплантата [1, 3].
Реже истинный химеризм возникает при таких хромосомных нарушениях, как трисомия и полисомия (наличие трех или более гомологичных хромосом вместо двух). При этой патологии третья хромосома обусловливает появление эритроцитов с антигенами другой группы, чем две первые [1, 2].
Трансфузионные (транзиторные) химеры возникают в результате переливания совместимых, но отличающихся по антигенному составу эритроцитов, например, эритроцитов группы 0(I) реципиентам, имеющим группу крови А(II). В этом случае в кровеносном русле одновременно циркулируют эритроциты групп 0(I) и А(II) [1, 2, 3]. Такая химера носит транзиторный характер. Через некоторое время после прекращения трансфузии, по мере элиминации перелитых эритроцитов, она исчезает. Но в ряде случаев даже кратковременная циркуляция чужеродных эритроцитов в кровеносном русле больного способна вызвать иммунный ответ в виде выработки аллоантител, что является крайне опасным при выполнении повторных трансфузий, т. к. может привести к развитию посттрансфузионных гемолитических осложнений. Кроме того, если реципиентом явилась девочка или женщина фертильного возраста, данные аллоантитела могут в дальнейшем послужить причиной гемолитической болезни новорожденного [1, 2, 3, 4].
Материалы и методы. Диагностику кровяных химер традиционно проводят методом дифференциальной агглютинации эритроцитов. Он заключается в избирательной агглютинации антисыворотками отдельно эритроцитов донора и отдельно эритроцитов реципиента. Более информативным является метод агглютинации в геле, где можно четко видеть двойную популяцию эритроцитов. При кровяной химере в одной и той же пробирке гелевой карты наблюдается одновременно положительный результат в верхней части и отрицательный результат в нижней, тогда как в норме результат должен быть или только положительным, или только отрицательным [1].
В нашем случае исследование выполнялось гелевой технологией «Scangel» на иммуногематологическом анализаторе «Hemos SP II» с применением диагностических карт и моноклональных реагентов производства «Bio-Rad laboratories» США — Франция. В работе использовались данные о донорах, полученные из автоматизированной информационной системы трансфузиологии «АИСТ», внедренной в БУ «Республиканская станция переливания крови» Минздравсоцразвития Чувашии в 2009 году.
Приводим собственное наблюдение. Больной М., 2007 г.р., находился на стационарном лечении с 07.02.2011 г. по 22.04.2011 г. Клинический диагноз: Болезнь Гиршпрунга, ректосигмоидная форма. Субкомпенсированная стадия. Осложнение: мочевой перитонит.
Проведенные операции: 16.02.2011 г. — трансанальная резекция ректосигмоидного отдела толстой кишки, лапароскопическая мобилизация брыжейки, 23.03.2011 г. — диагностическая лапароскопия, лапаротомия, разъединение спаек, субтотальная резекция большого сальника, санация и дренирование брюшной полости, 28.03.2011 г. — уретеростомия слева, 04.04.2011 г. — релапаротомия, цистостомия, уретеро- уретероанастомоз слева «конец-в-конец».
Послеоперацинный период протекал тяжело, с выраженными признаками динамической кишечной непроходимости (рвота застойным содержимым из желудка, отсутствие перистальтики, отсутствие стула, вздутие и болезненность при пальпации живота), явлениями интоксикации (гипертермия, вялость, лейкоцитоз — 20,1×109/л), геморрагическим синдромом (геморрагическое содержимое из желудочного зонда), умеренно выраженной анемией (Hb 85-106 г/л). Кроме того, был диагностирован мочевой перитонит, вызванный интраоперационным повреждением левого мочеточника. Больной получал адекватную антибактериальную и антигрибковую терапию, препараты для парентерального питания, пробиотики, препараты для стимуляции кишечника, габриглобин, глюкозо-солевые растворы. Интраоперационно и в послеоперационном периоде больному проводилась трансфузионная терапия. Процедура выполнялась согласно «Инструкции по применению компонентов крови», утвержденной приказом № 363 Министерства здравоохранения РФ 25.11.2002 г. Было проведено предварительное (в отделении — прямой реакцией) и подтверждающее (в лаборатории — перекрестным способом) определение группы крови АВ0 и резус-принадлежности больной. Была установлена группа крови — А(II)Rh+ . Бланк с результатом исследования имеется в истории болезни, данные о группе крови вынесены на титульный лист. С гемостатической целью (с 16.02.2011 г. по 27.02.1011 г.) шестикратно была перелита карантинизированная свежезамороженная плазма группы А(II)Rh+ в общем объёме 900 мл. Реакций и осложнений, связанных с переливанием плазмы, не было. С заместительной целью дважды (25.02.2011 г. и 22.03.2011 г.) была перелита эритроцитная масса группы А(II)Rh+ в общем объёме 240 мл. Применение эритроцитной массы было обоснованным, гемотрансфузионные карты заполнены правильно, в полном объеме. Согласно записям в гемотрансфузионных картах, перед каждым переливанием проводилась перепроверка группы крови и резус-принадлежности больного и донора, выполнялись пробы на индивидуальную совместимость (холодовая, с 33% раствором полиглюкина, биологическая), симптомов, указывающих на реакцию и осложнение в посттрансфузионном периоде, не отмечалось.
04.04.2011 г. врач, выполнявший третью трансфузию эритроцитной массы, при постановке пробы на индивидуальную совместимость с 33% раствором полиглюкина выявил положительную реакцию, свидетельствующую о несовместимости данной дозы эритроцитов донора и сыворотки реципиента. От проведения трансфузии отказались, гемоконтейнер с эритроцитной массой и пробирка с образцом крови больного М. были незамедлительно доставлены в клинико-диагностическую лабораторию БУ «Республиканская станция переливания крови» для выяснения причин несовместимости. Согласно стандартной операционной процедуре СОП — ИНСТР — 0300 — 018 — 01 «Порядок проведения иммуногематологических исследований при возникновении посттрансфузионных осложнений» нами были выполнены следующие основные операции:
- Перепроверка группы АВ0 и Rh-принадлежности крови реципиента (в образце крови, взятом до трансфузии) и крови донора (из контейнера).
- Определение (фенотипирование) минорных клинически значимых антигенов (С, с, Е, е, Kell) на эритроцитах реципиента. Оценка совместимости фенотипа больного с фенотипом донора. Выявление несоответствия антигенного профиля эритроцитов донора и реципиента, что позволило целенаправленно вести поиск аллоантител в сыворотке реципиента, ставших причиной несовместимости.
- Скрининг иммунных антител в сыворотке реципиента.
- Постановка пробы на индивидуальную совместимость данной дозы крови донора и сыворотки реципиента непрямым антиглобулиновым тестом Кумбса.
Результаты. Было установлено следующее: группа крови больного М. А(II)Rh+ соответствует результату, полученному в медицинской организации. Группа крови донора также А(II)Rh+. При проведении фенотипирования антигенов эритроцитов больного в гелевой карте «Scangel» выявлена кровяная трансфузионная химера (рисунок).
Результат определения фенотипа больного М. в гелевой карте
На фотографии гелевой карты отчетливо видно, что эритроциты больного содержат антигены С и е (эритроциты расположены в верхней части первой и четвертой микропробирок с гелем — реакция положительная), не содержат антигена К (эритроциты расположены в виде компактного осадка на дне пятой микропробирки с гелем — реакция отрицательная). Во второй и третьей микропробирках эритроциты разделились на две фракции. Некоторое количество клеток расположено в верхней части. Это клетки, содержащие антигены Е и с (реакция положительная). Другая фракция собралась в виде компактного осадка на дне. Это клетки, не содержащие антигены Е и с (реакция отрицательная). Данная картина говорит о наличии трансфузионной химеры, т.е. об одновременном пребывании в кровеносном русле больного Е+ (положительных) и Е — (отрицательных) эритроцитов, с+ (положительных) и с — (отрицательных) эритроцитов.
Таким образом, фенотип больного М. не полностью идентифицирован и выглядит так: С+ с±? Е±? е +К —, кровяная трансфузионная химера по антигенам с и Е. При исследовании сыворотки крови больного М. на наличие иммунных аллоантител установлено наличие неполных анти-Е антител класса Ig G. При уточнении фенотипов доноров, эритроцитная масса которых была перелита данному реципиенту, по данным автоматизированной информационной системы трансфузиологии «АИСТ» установлено следующее: 25.02.2011 г. трансфузия эритроцитной массы группы А(II)Rh+, фенотип С+с — Е — е +К — ; 22.03.2011 г. трансфузия эритроцитной массы группы А(II)Rh+, фенотип С+с — Е + е+ К —. При исследовании эритроцитной массы из гемоконтейнера, не совместимой с сывороткой больного М. и не перелитой ему 04.04.2011г., установлено следующее: группа А(II)Rh+, фенотип С+с — Е+ е +К —.
Выводы:
- Кровь больного М. и всех доноров идентична по группе АВ0: А(II)Rh+
- Кровь больного М. имеет фенотип С+с +Е — е+ К —. Это логическое заключение сделано нами на основании того, что:
- все перелитые донорские эритроциты не имеют антигена с, следовательно, именно они расположены в нижней части третьей гелевой микропробирки, в верхней же её части расположены собственные эритроциты больного М.;
- у больного обнаружены иммунные анти-Е антитела, следовательно, именно его эритроциты не имеют антигена Е и поэтому расположены в нижней части второй гелевой микропробирки, в верхней же её части обнаруживаются эритроциты донора, имеющего антиген Е, перелитые 22.03.2011 г. и вызвавшие иммунный ответ в виде выработки анти-Е антител.
Становится очевидным, что наличие в сыворотке больного иммунных анти-Е антител обусловило несовместимость при попытке переливания 04.04.2011г. эритроцитной массы фенотипа С+с — Е+ е +К -, т.к. анти-Е антитела вступили в реакцию конглютинации с эритроцитами донора, имеющими антиген Е.
Трансфузионная терапия в случае обнаружения кровяной химеры имеет определенные особенности. В связи с большой вариабельностью эритроцитарного химеризма программу лечения необходимо подбирать индивидуально для каждого больного. При выработке у реципиента антител рекомендуется проводить лечебный плазмаферез с целью их удаления. При необходимости повторной трансфузии таким больным индивидуально подбираются эритроциты, не содержащие антигены, по отношению к которым у реципиента присутствуют аллоантитела.
Заключение. Учитывая вышесказанное, становится очевидной необходимость определять при проведении трансфузионной терапии не только группу крови системы АВ0 и Rh — принадлежность больного и донора, но и совместимость их фенотипов в соответствии с приказом Министерства здравоохранения Российской Федерации (Минздрав России) от 2 апреля 2013 г. N 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов». Особенно это касается реципиентов, которым необходимы частые трансфузии, девочек, женщин детородного возраста, а также пациентов, имеющих в анамнезе посттрансфузионные осложнения. Это поможет в значительной степени минимизировать риск возникновения посттрансфузионных осложнений гемолитического типа и гемолитической болезни новорожденного.
CПИСОК ЛИТЕРАТУРЫ
- Донсков С.И. Групповые антигены эритроцитов. Концепция совместимости: руководство для иммуносерологов и трансфузиологов / С.И. Донсков, В.А. Мороков, И.В. Дубинкин. — Москва, 2008. — 184 с.
- Донсков С.И. Группы крови человека: руководство по иммуносерологии / С.И. Донсков, В.А. Мороков. — М.: ИП Скороходов В.А., 2011. — 1016 с.
- Донсков С.И. Группы крови системы Rhesus. Теория и практика / С.И. Донсков — М.: ВИНИТИ РАН, 2005. — 400 с.
- Донсков С.И. Новая тактика гемотрансфузионной терапии — от совместимости к идентичности: руководство для специалистов производственной и клинической трансфузиологии / С.И. Донсков, Б.М. Уртаев, И.В. Дубинкин. — М., 2014. — 270 с.
- Жибурт Е.Б. Правила и аудит переливания крови: руководство для врачей / Е.Б. Жибурт, Е.А. Шестаков. — М.: РАЕН, 2010. — 347 с.
СВЕДЕНИЯ ОБ АВТОРАХ:
Агандеева Мария Сергеевна
соискатель кафедры педиатрии АУ Чувашии «Институт усовершенствования врачей» Минздравсоцразвития Чувашии
Баландина Наталья Юрьевна
врач клинической лабораторной диагностики высшей квалификационной категории
Яковлева Любовь Михайловна
главный врач БУ «Республиканская станция переливания крови» Минздравсоцразвития Чувашии, главный внештатный специалист гематолог-трансфузиолог, кандидат медицинских наук
Царёва Алевтина Валерьевна
заместитель главного врача по медицинской части, эксперт по трансфузиологии Минздравсоцразвития Чувашии, врач-трансфузиолог высшей квалификационной категории
Адрес для переписки:
428017, Чувашская Республика, г. Чебоксары, ул. Пирогова, д. 9
Тел.: +7 (8352) 453705
Е-mail: [email protected]
INFORMATION ABOUT THE AUTHORS:
Maria Sergeevna Agandeeva
external PhD student of pediatrics department at AI of Chuvashia «Postgraduate Doctors’ Training Institute» Health Care and Social Development Ministry of Chuvashia
Natalia Yuryevna Balandina
physician of clinical laboratory diagnostics of the highest qualification category
Lubov Mihailovna Yakovleva
chief doctor of BI «The Republican Blood Donor Center» Health Care and Social Development Ministry of Chuvashia, Ph.D.
Alevtina Valeryevna Tsareva
deputy chief doctor for medical work, an expert on blood transfusion at Health Care and Social Development Ministry of Chuvashia, transfusiologist of the highest qualification category
Correspondence address:
Pirogov str., 9, Cheboksary, the Chuvash Republic, 428017
Tel.: +7 (8352) 453705
Е-mail: [email protected]
M.S. AGANDEEVA, N.Y. BALANDINA,
L.M. YAKOVLEVA, A.V. TSAREVA
CASE OF TRANSFUSION CHIMERA AND DEVELOPMENT OF ANTIERYTHROCYTE ANTIBODIES IN CHILD
Postgraduate Doctors’ Training Institute,
the Republican Blood Donor Center, Cheboksary
The article deals with a case of transfusion chimera in pediatric practice as a result of red cells transfusion without considering phenotypes of a donor and recipient. It has been presented information about the immunologic safety of transfusion therapy, blood chimeras minor antigens.
Keywords: blood chimeras, antigens of red blood cells, immune anti-erythrocytic antibodies, immunological safety of transfusion therapy.
Резус-фактор и беременность
Резус-фактор и беременность
Одним из осложнений при беременности является так называемый резус-конфликт между матерью и плодом. Этот конфликт обусловлен тем, что организм резус отрицательной (Rh-) беременной женщины отторгает резус положительный (Rh+) эмбрион за счет недопонимания со стороны иммунной системы матери. Для того, чтобы оценить риск развития резус-конфликта и понять методы его профилактики, необходимо разобраться в том, как работает наша иммунная система, что такое группа крови и как устроен резус-фактор.
Иммунная система – это главный защитник организма от проникших в него вирусов, микробов и даже паразитов. Основной механизм ее действия основан на умении распознавать клетки: чужие и те, что относятся к оберегаемому организму. Для этого клетки нашего организма приучены сигнализировать о своем состоянии с помощью специальных молекул, находящихся на поверхности клетки. Иммунные клетки проверяют, соответствует ли набор поверхностных молекул набору, свойственному этому конкретному организму. Если находятся какие-то несоответствия, клетка признается зараженной или поломанной и уничтожается специальными агентами иммунной системы. Фрагмент чужеродной молекулы – антиген – предоставляется особым клеткам, которые способны «разработать» специальный белок-антитело, связывающийся со своим антигеном (той самой несоответствующей метке на поверхности подозрительной клетки), где бы он ни находился, и уже напрямую сигнализирующий клеткам иммунной системы об атаке без этапов распознавания. Такая реакция будет формироваться на любой белок, который в этом организме не синтезируется, даже если у других организмов этого вида он есть. Хорошим примером является именно резус-фактор, и в этой статье мы подробно разберем этот аспект.
Когда в поликлинике вы сдаете анализ на группу крови, в результате вы получаете информацию о вашей группе крови I, II, III, IV и статусе резус-фактора. Однако это характеристики только двух систем групп крови из более чем 30ти известных на сегодняшний день для человека, к тому же – неполные. Система группы крови основывается на ограниченном списке генов и их аллельных состояний и правилах взаимоисключения. Например, в систему AB0 входят гены A1, A2, B, 0. Гены типа A1, A2, B кодируют два разных фермента, которые способствуют формированию двух разных антигенов на поверхности эритроцитов. В плазме крови могут находится два типа антител к этим антигенам – α и β. Так как α вызывает иммунную реакцию по отношению к А-антигенам, то α и А не могут находиться одновременно в одном организме – это правило взаимоисключения. Аналогичное правило существует для антигена B и антител β. Таким образом, существует всего 4 возможных варианта группы крови системы AB0 у человека: 0 (на мембране эритроцитов нет ни антигена А, ни В, но в плазме есть антитела α, β), A, B, AB. Соответственно при переливании крови нужно следить, чтобы не смешивались соответствующие антигены с антителами: А с α, а B с β.
Группа крови системы резус (Rh0) состоит из 54 антигенов, а резус-фактор – это лишь один из них. Его выделяют за высокое клиническое значение при пересадке органов, переливании крови и риске развития гемолитической болезни новорожденных при резус-конфликте во время беременности. Резус-фактор, он же антиген D, формируется в результате взаимодействия специального белка в мембране эритроцитов с небольшими молекулами. Этот белок кодируется геном RHD. Так называемый отрицательный резус вызван отсутствием этого самого гена: нет гена – значит нет белка, основы для формирования комплекса антигена D. Среди европейцев примерно 85% имеют ген RHD и, соответственно, резус-положительный фенотип. При этом 50% несут только одну копию гена RHD, а 35% — две. Эти данные позволяют оценить, что примерно 9% беременностей могут проходить в условиях, когда мать Rh-, а плод – Rh+. В отличие от системы AB0 в норме в Rh- организме нет постоянно циркулирующих в крови антител, вызывающих неправильную реакцию иммунной системы на Rh+ клетки. Поэтому для формирования реакции резус-отрицательного организма на клетки с антигеном D необходима иммунизация, то есть первичная реакция распознавания чужого антигена, передачи информации специальной клетке, формирующей антитело, и синтез этого антитела. Таким образом получается, что, хотя антиген D является составляющей иммунной системы в норме, иммунная система людей без гена RHD с этим антигеном не знакома. При знакомстве она не признает его за своего, потому что в ее списке, с которым она сверяется при проверке клеток на предмет «свой-чужой», такого антигена просто нет. Распознавание Rh+ клеток как «чужих» вызывает иммунную реакцию посредством синтеза антител. Именно этот процесс называется иммунизацией: теперь Rh- организм знает антиген D, этот антиген стоит у него в списке вредоносных (все «чужие» по умолчанию распознаются как опасные) и для него готово специфическое оружие – специальные антитела. Чем чаще в организм будут проникать Rh+ клетки, тем больше антител против них будет циркулировать в крови Rh- организма. Первичная иммунизация может произойти по разным сценариям, в том числе при переливании крови и при беременности резус-отрицательной женщины резус-положительным плодом.
Оценка риска развития и превентивные способы предотвращения возникновения резус-конфликта, особенности диагностики гетерозиготного носительства делеции гена RHD и разбор сложных случаев будут представлены в следующей статье на нашем сайте.
Основные генетические термины и понятия
Автор: Жикривецкая Светлана
биолог-исследователь
Группа крови Hh — группы крови и антигены красных кровяных телец
Группа крови Hh содержит один антиген, H-антиген, который находится практически на все эритроциты и является строительным блоком для производства антигенов внутри ABO группа крови.
Дефицит антигенаH известен как «фенотип Бомбея» (h / h, также известный как Oh) и встречается у 1 из 10 000 человек в Индии и у 1 из миллиона человек в Европе. Отсутствие H-дефицита не оказывает вредного воздействия, но если переливание крови когда-либо необходимо, люди с этой группой крови могут получать кровь только от других доноров, которые также H дефицитный.(Переливание «нормальной» крови группы O может вызвать тяжелое реакция переливания.)
Поскольку антиген H является предшественником антигенов группы крови ABO, если он не продуцируются, антигены группы крови ABO также не продуцируются. Это может ввести в заблуждение в случаях установления отцовства, факт, который использовался в сюжетных линиях мыльных опер!
В шоу «Общая больница» под сомнением был отец ребенка Моники. Моника имела группа крови A (генотип АО) и ее ребенок имели группу крови O (генотип OO).Поскольку ребенок должен унаследовать аллель O от отца, отец может иметь генотип АО, БО или ОО. Другими словами, отец ребенка мог иметь группу крови А или В или O, что исключает муж Моники Алан (тип AB) и подразумевает Рика (тип O).
Однако Алан — отец! Это возможно, потому что и он, и Моника — носители. неполного дефицита H (H / h). Их h / h ребенок не может производить кровь ABO группы антигенов, и поэтому, несмотря на наследование аллеля A или B от Алана, ребенок В эритроцитах отсутствуют антигены A и B, как в группе крови O.
Кратко
Антигены группы крови Hh
Вид в собственном окне
| Количество антигенов | 1: антиген H |
| Антигенная специфичность | Углеводы Специфичность антигена H определяется последовательностью олигосахаридов. Более в частности, минимальным требованием к H-антигенности является терминальный дисахарид фукоза-галактоза, где фукоза имеет альфа- (1-2) — связь. |
| Антиген-несущие молекулы | Гликопротеины и гликолипиды неизвестного происхождения
функция H-антиген присоединен к олигосахариду цепочки, которые выступают над поверхностью RBC. Эти цепочки прикреплены к белкам и липидам, которые лежат в мембране эритроцитов. |
| Молекулярная основа | Ген FUT1 косвенно кодирует антиген H, экспрессируемый на
РБК. FUT1 кодирует фукозилтрансферазу, которая катализирует заключительную стадию синтеза H антиген. Ген FUT2 косвенно кодирует растворимую форму антиген H, который содержится в выделениях организма. |
| Частота H-антигена | Присутствует на 99,9% эритроцитов всего
популяции Дефицит H встречается редко: он встречается в 1 из 8 000 в Тайване, 1 из 10 000 в Индии и 1 на миллион в Европа (1). |
| Частота фенотипа H | Группа крови O: 45% у кавказцев, 49% у чернокожих, 43% у
Азиаты и 55% мексиканцев Частота H-антиген эквивалентен частоте группы крови O, в которой антиген H остается неизменным (1). |
Антитела, продуцируемые против антигена H
Вид в собственном окне
| Anti-H тип | IgM встречается чаще, чем IgG Anti-H естественно возникает у людей с дефицитом антигена H. |
| Анти-H реактивность | Способен к гемолизу Anti-H может активировать каскад комплемента, который лизирует эритроциты, пока они еще находятся в кровообращение (внутрисосудистый гемолиз). |
| Реакция на переливание крови | Да, может вызвать острую гемолитическую трансфузию. реакция |
| Гемолитическая болезнь новорожденных | Возможная ГБН могла возникнуть у матерей с Фенотип Бомбея (Oh, h / h) |
Общая информация
История
В Бомбее, Индия, у человека была обнаружена интересная группа крови. это отреагировало на другие группы крови невиданным ранее образом.Сыворотка от этого человека содержали антитела, которые реагировали со всеми эритроцитами нормального Фенотипы ABO (т.е. группы O, A, B и AB). Эритроциты человека, по-видимому, отсутствуют все антигены группы крови ABO плюс дополнительный антиген, который был ранее неизвестно.
В 1952 г. вышла статья о «новом характере группы крови, связанной с кровью АВО. группа »(2). новый признак группы крови — антиген H, и он является строительным блоком для антигены группы крови АВО.
Названо в честь города, в котором он был впервые обнаружен, «фенотип Бомбея». описывает людей, в эритроцитах которых отсутствует антиген H. Потому что A и B антигены не могут образовываться без предшественника H-антигена, в их эритроцитах также отсутствуют эти антигены. В результате эти люди вырабатывают анти-H, анти-A и анти-B, и поэтому их можно переливать только с эритроцитами, в которых также отсутствуют H, A, и антигены B, то есть они могут получать кровь только от другого человека с Бомбейский фенотип. Из-за редкости этой группы крови это обычно означает с использованием донорской крови от подходящего родственника.
Базовая биохимия
Биосинтез антигена H и антигенов A и B включает ряд ферменты (гликозилтрансферазы), переносящие моносахариды. Образующиеся антигены олигосахаридные цепи, которые прикреплены к липидам и белкам, которые закреплен в мембране эритроцитов.
Антиген H продуцируется специфической фукозилтрансферазой. В зависимости от человека Группа крови ABO, антиген H превращается в антиген A, антиген B или оба.Если у человека группа крови O, антиген H остается неизменным. Следовательно, антиген H присутствует в наибольших количествах в группе крови O и в наименьшем количества в группе крови AB.
Две области генома кодируют два фермента с очень похожим субстратом особенности — локус H (FUT1) и локус Se (FUT2).
Локус H содержит ген FUT1, который экспрессируется в эритроцитах. Хотя бы один должна присутствовать функционирующая копия FUT1 (H / H или H / h), чтобы антиген H был производится на эритроцитах.Если обе копии FUT1 неактивны (ч / ч), фенотип Бомбея полученные результаты.
Локус Se содержит ген FUT2, который экспрессируется в секреторных железах. Лица, которые являются «секретарями» (Se / Se или Se / se), содержат по крайней мере одну копию функционирующий фермент. Они производят растворимую форму H-антигена, содержащуюся в слюне. и другие физиологические жидкости. «Несекреторы» (se / se) не продуцируют растворимый H-антиген. Фермент, кодируемый FUT2, также участвует в синтезе антигенов Группа крови Льюиса.
Общие фенотипы H
Два общих фенотипа H — это «секреторный» и «несекреторный».
Секреторный (общий)
H антиген экспрессируется на эритроцитах.
H-антиген экспрессируется в слюне.
Анти-H не вырабатывается.
Генотип: H / H или H / h; Se / Se или Se / se
Несекретор (общий)
H-антиген присутствует на эритроцитах.
Антиген H в слюне отсутствует.
Анти-H не вырабатывается.
Генотип: H / H или H / h; se / se
Необычные фенотипы H
Фенотип Бомбея и фенотип пара-Бомбея встречаются относительно редко. В Индии, где впервые был обнаружен дефицит H, частота обоих фенотипов в совокупности — 1 из 10 000 (1). ЧАС дефицит немного чаще встречается на Тайване, им страдает 1 человек из 8000 (1). Относительно большое количество H-дефицитные особи были обнаружены на острове Реюньон, небольшом французском Остров в 800 км к востоку от Мадагаскара в Индийском океане (3).И классический фенотип Бомбея, и новый Вариантный тип частичной недостаточности Н наблюдали у островитян (4). В Европе 1 на миллион человек являются H-дефицитными (1).
Парабомбейский фенотип
H-антиген слабо экспрессируется на эритроцитах.
H-антиген может присутствовать или отсутствовать в слюне.
Сыворотка содержит анти-H.
Генотип: (H), Se / Se или Se / se или se / se
Экспрессия антигена H
Антиген H имеет такое же широкое тканевое распределение, что и антигены A и B.Аналогичным образом, у людей, которые являются «секреторами», растворимая форма H-антигена является обнаруживается в слюне и всех жидкостях, кроме спинномозговой.
Функция антигена H
Функция антигена H, помимо того, что он является промежуточным субстратом в синтез антигенов группы крови ABO неизвестен, хотя может быть вовлечен в адгезии клеток (5). Человек который отсутствие H-антигена, не оказывает вредного воздействия, и будучи H-дефицитным проблема только в том случае, если им понадобится переливание крови, потому что они требуется кровь с дефицитом H.
Клиническое значение антител к H
Реакции при переливании
Если пациенты с анти-H в крови получают переливание крови, содержит антиген H (например, группа крови O), они подвержены риску острая гемолитическая трансфузионная реакция.
Гемолитическая болезнь новорожденных
Теоретически выработка анти-H матерью во время беременности может вызвать гемолитическая болезнь у плода, который не унаследовал фенотип Бомбея от матери.На практике случаи ГБН, вызванной таким образом, не описаны, возможно из-за редкости фенотипа Бомбея.
Молекулярная информация
Локус группы крови H (содержащий FUT1) и секреторный локус (содержащий FUT2) расположены на хромосоме 19 в q.13.3. FUT1 и FUT2 тесно связаны связаны, будучи всего в 35 кб друг от друга. Поскольку они очень гомологичны, они, вероятно, быть результатом дупликации гена общего предка.
Локус H содержит четыре экзона, которые охватывают более 8 т.п.н. геномной ДНК.Оба Фенотипы Бомбея и пара-Бомбея являются результатом точечных мутаций в гене FUT1. (6, 7).
Классический фенотип Бомбея вызван мутацией Tyr316Ter в кодирующей области из FUT1 (1, 8). Мутация вводит стоп-кодон, в результате чего получается усеченный фермент, в котором не хватает 50 аминокислот на С-конце, делая фермент неактивным. У кавказцев Бомбей фенотип может быть вызван рядом мутаций (9, 10). Точно так же был произведен ряд мутаций. сообщается, что они лежат в основе пара-Бомбейского фенотипа (11).
Ссылки
- 1.
Reid ME и Lomas-Francis C. Группа крови Книга фактов об антигенах. Второе изд. 2004, Нью-Йорк: Elsevier Academic Нажмите.
- 2.
- Bhende YM, Deshpande CK, Bhatia HM, Sanger R, Race RR, Morgan WT, Watkins WM. «Новый» персонаж группы крови, относящийся к системе ABO. Ланцет. 1952; 1: 903–4. [PubMed: 14918471]
- 3.
- 4.
- Фернандес-Матеос П., Кайло А., Генри С., Косташ М., Эльмгрен А., Свенссон Л., Ларсон Г., Самуэльссон Б. Э., Ориол Р., Молликоне Р.Точечные мутации и делеции, ответственные за Bombay H нуль и Реюньон H слабые группы крови. Vox Sang. 1998. 75: 37–46. [PubMed: 9745152]
- 5.
- Zhu K, Amin MA, Kim MJ, Katschke K. J., Jr, Park CC, Koch AE. Новая функция для аналога глюкозы группы крови H антиген как медиатор лейкоцитарно-эндотелиальной адгезии через молекула внутриклеточной адгезии 1. J Biol Chem. 2003. 278: 21869–77. [PubMed: 12672794]
- 6.
- Келли Р.Дж., Эрнст Л.К., Ларсен Р.Д., Брайант Дж. Г., Робинсон Дж. С., Лоу Дж. Б..Молекулярная основа дефицита группы крови H в Бомбее (О) и парабомбейские люди. Proc Natl Acad Sci U S. A. 1994; 91: 5843–7. [Бесплатная статья PMC: PMC44093] [PubMed: 76]
- 7.
- Канеко М., Нисихара С., Шинья Н., Кудо Т., Ивасаки Х., Сено Т., Окубо Ю., Наримацу Х. Широкий спектр точечных мутаций в гене H Бомбея и парабомбейские особи, которые инактивируют фермент H. Кровь. 1997; 90: 839–49. [PubMed: 9226185]
- 8.
- Koda Y, Soejima M, Johnson PH, Smart E, Kimura H.Миссенс-мутация FUT1 и делеция FUT2 являются отвечает за индийский Бомбейский фенотип системы группы крови ABO. Biochem Biophys Res Commun. 1997. 238: 21–5. [PubMed: 9299444]
- 9.
- Wagner FF, Flegel WA. Полиморфизм аллеля h и популяционная частота спорадические нефункциональные аллели. Переливание. 1997; 37: 284–90. [PubMed:01]
- 10.
- Вагнер Т., Вадон М., Штаудахер Э., Шмарда А., Гасснер С., Хельмберг В., Ланцер Г., Флегель В.А., Вагнер Ф.Ф.Новый аллель h, обнаруженный в Европе, имеет миссенс-мутацию. Мотив альфа (1,2) -фукозилтрансферазы II. Переливание. 2001; 41: 31–8. [PubMed: 11161242]
- 11.
- Yu LC, Yang YH, Broadberry RE, Chen YH, Lin M. Неоднородность группы крови человека H ген альфа (1,2) фукозилтрансферазы среди парабомбейцев. Vox Sang. 1997; 72: 36-40. [PubMed:99]
Группа крови Hh — группы крови и антигены эритроцитов
Группа крови Hh содержит один антиген, H-антиген, который находится практически на все эритроциты и является строительным блоком для производства антигенов внутри ABO группа крови.
Дефицит антигенаH известен как «фенотип Бомбея» (h / h, также известный как Oh) и встречается у 1 из 10 000 человек в Индии и у 1 из миллиона человек в Европе. Отсутствие H-дефицита не оказывает вредного воздействия, но если переливание крови когда-либо необходимо, люди с этой группой крови могут получать кровь только от других доноров, которые также H дефицитный. (Переливание «нормальной» крови группы O может вызвать тяжелое реакция переливания.)
Поскольку антиген H является предшественником антигенов группы крови ABO, если он не продуцируются, антигены группы крови ABO также не продуцируются.Это может ввести в заблуждение в случаях установления отцовства, факт, который использовался в сюжетных линиях мыльных опер!
В шоу «Общая больница» под сомнением был отец ребенка Моники. Моника имела группа крови A (генотип АО) и ее ребенок имели группу крови O (генотип OO). Поскольку ребенок должен унаследовать аллель O от отца, отец может иметь генотип АО, БО или ОО. Другими словами, отец ребенка мог иметь группу крови А или В или O, что исключает муж Моники Алан (тип AB) и подразумевает Рика (тип O).
Однако Алан — отец! Это возможно, потому что и он, и Моника — носители. неполного дефицита H (H / h). Их h / h ребенок не может производить кровь ABO группы антигенов, и поэтому, несмотря на наследование аллеля A или B от Алана, ребенок Отсутствие в эритроцитах антигенов А и В, как в группе крови О.
Кратко
Антигены группы крови Hh
Вид в собственном окне
| Количество антигенов | 1: антиген H |
| Антигенная специфичность | Углеводы Специфичность антигена H определяется последовательностью олигосахаридов.Более в частности, минимальным требованием к H-антигенности является терминальный дисахарид фукоза-галактоза, где фукоза имеет альфа- (1-2) — связь. |
| Антиген-несущие молекулы | Гликопротеины и гликолипиды неизвестного происхождения
функция H-антиген присоединен к олигосахариду цепочки, которые выступают над поверхностью RBC. Эти цепочки прикреплены к белкам и липидам, которые лежат в мембране эритроцитов. |
| Молекулярная основа | Ген FUT1 косвенно кодирует антиген H, экспрессируемый на
РБК. FUT1 кодирует фукозилтрансферазу, которая катализирует заключительную стадию синтеза H антиген. Ген FUT2 косвенно кодирует растворимую форму антиген H, который содержится в выделениях организма. |
| Частота H-антигена | Присутствует на 99,9% эритроцитов всего
популяции Дефицит H встречается редко: он встречается в 1 из 8 000 в Тайване, 1 из 10 000 в Индии и 1 на миллион в Европа (1). |
| Частота фенотипа H | Группа крови O: 45% у кавказцев, 49% у чернокожих, 43% у
Азиаты и 55% мексиканцев Частота H-антиген эквивалентен частоте группы крови O, в которой антиген H остается неизменным (1). |
Антитела, продуцируемые против антигена H
Вид в собственном окне
| Anti-H тип | IgM встречается чаще, чем IgG Anti-H естественно возникает у людей с дефицитом антигена H. |
| Анти-H реактивность | Способен к гемолизу Anti-H может активировать каскад комплемента, который лизирует эритроциты, пока они еще находятся в кровообращение (внутрисосудистый гемолиз). |
| Реакция на переливание крови | Да, может вызвать острую гемолитическую трансфузию. реакция |
| Гемолитическая болезнь новорожденных | Возможная ГБН могла возникнуть у матерей с Фенотип Бомбея (Oh, h / h) |
Общая информация
История
В Бомбее, Индия, у человека была обнаружена интересная группа крови. это отреагировало на другие группы крови невиданным ранее образом.Сыворотка от этого человека содержали антитела, которые реагировали со всеми эритроцитами нормального Фенотипы ABO (т.е. группы O, A, B и AB). Эритроциты человека, по-видимому, отсутствуют все антигены группы крови ABO плюс дополнительный антиген, который был ранее неизвестно.
В 1952 г. вышла статья о «новом характере группы крови, связанной с кровью АВО. группа »(2). новый признак группы крови — антиген H, и он является строительным блоком для антигены группы крови АВО.
Названо в честь города, в котором он был впервые обнаружен, «фенотип Бомбея». описывает людей, в эритроцитах которых отсутствует антиген H. Потому что A и B антигены не могут образовываться без предшественника H-антигена, в их эритроцитах также отсутствуют эти антигены. В результате эти люди вырабатывают анти-H, анти-A и анти-B, и поэтому их можно переливать только с эритроцитами, в которых также отсутствуют H, A, и антигены B, то есть они могут получать кровь только от другого человека с Бомбейский фенотип. Из-за редкости этой группы крови это обычно означает с использованием донорской крови от подходящего родственника.
Базовая биохимия
Биосинтез антигена H и антигенов A и B включает ряд ферменты (гликозилтрансферазы), переносящие моносахариды. Образующиеся антигены олигосахаридные цепи, которые прикреплены к липидам и белкам, которые закреплен в мембране эритроцитов.
Антиген H продуцируется специфической фукозилтрансферазой. В зависимости от человека Группа крови ABO, антиген H превращается в антиген A, антиген B или оба.Если у человека группа крови O, антиген H остается неизменным. Следовательно, антиген H присутствует в наибольших количествах в группе крови O и в наименьшем количества в группе крови AB.
Две области генома кодируют два фермента с очень похожим субстратом особенности — локус H (FUT1) и локус Se (FUT2).
Локус H содержит ген FUT1, который экспрессируется в эритроцитах. Хотя бы один должна присутствовать функционирующая копия FUT1 (H / H или H / h), чтобы антиген H был производится на эритроцитах.Если обе копии FUT1 неактивны (ч / ч), фенотип Бомбея полученные результаты.
Локус Se содержит ген FUT2, который экспрессируется в секреторных железах. Лица, которые являются «секретарями» (Se / Se или Se / se), содержат по крайней мере одну копию функционирующий фермент. Они производят растворимую форму H-антигена, содержащуюся в слюне. и другие физиологические жидкости. «Несекреторы» (se / se) не продуцируют растворимый H-антиген. Фермент, кодируемый FUT2, также участвует в синтезе антигенов Группа крови Льюиса.
Общие фенотипы H
Два общих фенотипа H — это «секреторный» и «несекреторный».
Секреторный (общий)
H антиген экспрессируется на эритроцитах.
H-антиген экспрессируется в слюне.
Анти-H не вырабатывается.
Генотип: H / H или H / h; Se / Se или Se / se
Несекретор (общий)
H-антиген присутствует на эритроцитах.
Антиген H в слюне отсутствует.
Анти-H не вырабатывается.
Генотип: H / H или H / h; se / se
Необычные фенотипы H
Фенотип Бомбея и фенотип пара-Бомбея встречаются относительно редко. В Индии, где впервые был обнаружен дефицит H, частота обоих фенотипов в совокупности — 1 из 10 000 (1). ЧАС дефицит немного чаще встречается на Тайване, им страдает 1 человек из 8000 (1). Относительно большое количество H-дефицитные особи были обнаружены на острове Реюньон, небольшом французском Остров в 800 км к востоку от Мадагаскара в Индийском океане (3).И классический фенотип Бомбея, и новый Вариантный тип частичной недостаточности Н наблюдали у островитян (4). В Европе 1 на миллион человек являются H-дефицитными (1).
Парабомбейский фенотип
H-антиген слабо экспрессируется на эритроцитах.
H-антиген может присутствовать или отсутствовать в слюне.
Сыворотка содержит анти-H.
Генотип: (H), Se / Se или Se / se или se / se
Экспрессия антигена H
Антиген H имеет такое же широкое тканевое распределение, что и антигены A и B.Аналогичным образом, у людей, которые являются «секреторами», растворимая форма H-антигена является обнаруживается в слюне и всех жидкостях, кроме спинномозговой.
Функция антигена H
Функция антигена H, помимо того, что он является промежуточным субстратом в синтез антигенов группы крови ABO неизвестен, хотя может быть вовлечен в адгезии клеток (5). Человек который отсутствие H-антигена, не оказывает вредного воздействия, и будучи H-дефицитным проблема только в том случае, если им понадобится переливание крови, потому что они требуется кровь с дефицитом H.
Клиническое значение антител к H
Реакции при переливании
Если пациенты с анти-H в крови получают переливание крови, содержит антиген H (например, группа крови O), они подвержены риску острая гемолитическая трансфузионная реакция.
Гемолитическая болезнь новорожденных
Теоретически выработка анти-H матерью во время беременности может вызвать гемолитическая болезнь у плода, который не унаследовал фенотип Бомбея от матери.На практике случаи ГБН, вызванной таким образом, не описаны, возможно из-за редкости фенотипа Бомбея.
Молекулярная информация
Локус группы крови H (содержащий FUT1) и секреторный локус (содержащий FUT2) расположены на хромосоме 19 в q.13.3. FUT1 и FUT2 тесно связаны связаны, будучи всего в 35 кб друг от друга. Поскольку они очень гомологичны, они, вероятно, быть результатом дупликации гена общего предка.
Локус H содержит четыре экзона, которые охватывают более 8 т.п.н. геномной ДНК.Оба Фенотипы Бомбея и пара-Бомбея являются результатом точечных мутаций в гене FUT1. (6, 7).
Классический фенотип Бомбея вызван мутацией Tyr316Ter в кодирующей области из FUT1 (1, 8). Мутация вводит стоп-кодон, в результате чего получается усеченный фермент, в котором не хватает 50 аминокислот на С-конце, делая фермент неактивным. У кавказцев Бомбей фенотип может быть вызван рядом мутаций (9, 10). Точно так же был произведен ряд мутаций. сообщается, что они лежат в основе пара-Бомбейского фенотипа (11).
Ссылки
- 1.
Reid ME и Lomas-Francis C. Группа крови Книга фактов об антигенах. Второе изд. 2004, Нью-Йорк: Elsevier Academic Нажмите.
- 2.
- Bhende YM, Deshpande CK, Bhatia HM, Sanger R, Race RR, Morgan WT, Watkins WM. «Новый» персонаж группы крови, относящийся к системе ABO. Ланцет. 1952; 1: 903–4. [PubMed: 14918471]
- 3.
- 4.
- Фернандес-Матеос П., Кайло А., Генри С., Косташ М., Эльмгрен А., Свенссон Л., Ларсон Г., Самуэльссон Б. Э., Ориол Р., Молликоне Р.Точечные мутации и делеции, ответственные за Bombay H нуль и Реюньон H слабые группы крови. Vox Sang. 1998. 75: 37–46. [PubMed: 9745152]
- 5.
- Zhu K, Amin MA, Kim MJ, Katschke K. J., Jr, Park CC, Koch AE. Новая функция для аналога глюкозы группы крови H антиген как медиатор лейкоцитарно-эндотелиальной адгезии через молекула внутриклеточной адгезии 1. J Biol Chem. 2003. 278: 21869–77. [PubMed: 12672794]
- 6.
- Келли Р.Дж., Эрнст Л.К., Ларсен Р.Д., Брайант Дж. Г., Робинсон Дж. С., Лоу Дж. Б..Молекулярная основа дефицита группы крови H в Бомбее (О) и парабомбейские люди. Proc Natl Acad Sci U S. A. 1994; 91: 5843–7. [Бесплатная статья PMC: PMC44093] [PubMed: 76]
- 7.
- Канеко М., Нисихара С., Шинья Н., Кудо Т., Ивасаки Х., Сено Т., Окубо Ю., Наримацу Х. Широкий спектр точечных мутаций в гене H Бомбея и парабомбейские особи, которые инактивируют фермент H. Кровь. 1997; 90: 839–49. [PubMed: 9226185]
- 8.
- Koda Y, Soejima M, Johnson PH, Smart E, Kimura H.Миссенс-мутация FUT1 и делеция FUT2 являются отвечает за индийский Бомбейский фенотип системы группы крови ABO. Biochem Biophys Res Commun. 1997. 238: 21–5. [PubMed: 9299444]
- 9.
- Wagner FF, Flegel WA. Полиморфизм аллеля h и популяционная частота спорадические нефункциональные аллели. Переливание. 1997; 37: 284–90. [PubMed:01]
- 10.
- Вагнер Т., Вадон М., Штаудахер Э., Шмарда А., Гасснер С., Хельмберг В., Ланцер Г., Флегель В.А., Вагнер Ф.Ф.Новый аллель h, обнаруженный в Европе, имеет миссенс-мутацию. Мотив альфа (1,2) -фукозилтрансферазы II. Переливание. 2001; 41: 31–8. [PubMed: 11161242]
- 11.
- Yu LC, Yang YH, Broadberry RE, Chen YH, Lin M. Неоднородность группы крови человека H ген альфа (1,2) фукозилтрансферазы среди парабомбейцев. Vox Sang. 1997; 72: 36-40. [PubMed:99]
Частоты фенотипа систем основных групп крови (Rh, Kell, Kidd, Du
Введение
Основная функция любого банка крови — своевременно предоставлять пациентам безопасную и совместимую кровь или компоненты крови. 1 Однако эта цель может быть сложной, если пациенты были идентифицированы с помощью аллоантител при отсутствии местной базы данных фенотипов доноров. Международное общество переливания крови идентифицировало 346 антигенов групп крови, 308 из которых были отнесены к 36 системам групп крови, а остальные 38 антигенов были сгруппированы в коллекции, низкочастотные серии (700), высокочастотные серии (901) и коллекционная серия (200). 2 Фенотипы группы крови по-разному распределяются среди разных популяций и этнических групп, что было зарегистрировано в популяциях африканцев, европеоидов, китайцев и индийцев.Однако сообщения о фенотипах групп крови в Саудовской Аравии ограничиваются системами групп крови ABO и RhD. 3–7 Нет данных о распределении фенотипов различных групп крови в восточном регионе Саудовской Аравии. Саудовская Аравия — большая многонациональная страна с разнообразным этническим происхождением, особенно на Востоке и Западе из-за ее близости к морю, что привело к долгой истории иммиграции.
Восточный регион Саудовской Аравии имеет высокую распространенность гемоглобинопатий по сравнению с другими регионами королевства — 111.4 случая серповидно-клеточной болезни (SCD) на 1000 человек и 23,7 случая талассемии на 1000 человек при серповидно-клеточной анемии. 8 В результате пациенты с гемоглобинопатией нуждаются в многократных переливаниях крови, что составляет основную часть их режима лечения. Следовательно, обеспечение фенотипически подобранных эритроцитов может быть проблематичным в отсутствие местной базы данных доноров.
Целью этого исследования было определение частот основных антигенов групп крови в восточном регионе Саудовской Аравии с использованием гелевого метода и обеспечение основы для начала разработки базы данных для добровольцев-доноров крови, чтобы обеспечить предоставление антиген-отрицательной крови. пациентам с аллоантителами.Это поможет сократить время выполнения фенотипирования и перекрестного сопоставления и рентабельно использовать ресурсы банка крови.
Материалы и методы
Размер выборки и критерии включения
Размер выборки был рассчитан, как описано Faul et al., С использованием программного обеспечения G * Power3.1. 9 Вкратце, с использованием программного обеспечения G * Power 3.1 размер выборки был оценен в 87 выборок. Это предполагает значительный уровень 5% и мощность 80%. Этот размер выборки можно использовать для обнаружения существенной разницы, если предполагаемая распространенность (альтернатива) отличается от нулевого значения 0.4290 на сумму 0,15. В этом исследовании размер выборки был округлен до 100 случаев.
Критерии включения доноров
Все участники были саудовскими добровольцами-донорами крови, соответствующими национальным руководящим принципам переливания крови в Саудовской Аравии, включая возраст, историю болезни и критерии инфекции.
Сбор образцов и приготовление суспензии эритроцитов
От каждого донора брали образец 5 мл крови с антикоагулянтом EDTA. Готовили упакованные эритроциты от каждого донора.5% суспензия в ID-разбавителе-1 (Bromlin, DiaMed GmBH, Cressier, Швейцария) была приготовлена для антигенных профилей I и II, а 0,8% суспензия в ID-разбавителе-2 (физиологический раствор с низкой ионной силой (LISS), DiaMed GmBH, Cressier, Швейцария) получали для антигенного профиля III.
Типирование расширенного антигена красных клеток
Для подгрупп Rh + K (C, c, E, e и K) профиль антигена-I ID-карты (P 1 , Le a , Le b , Lu a , Lu b ) и профиль антигена ID-карты-II (k, Kp a , Kp b , Jk a , Jk b ), 5% суспензии эритроцитов в ID-Diluent-1 (Bromlin) было используется для фенотипирования в соответствии с инструкциями производителя (DiaMed GmBH).Вкратце, 12,5 мкл 5% суспензии эритроцитов вносили пипеткой во все 6 микропробирок, содержащих специфические тестируемые антисыворотки. Все карты центрифугировали в течение 10 мин при 85 × g с использованием ID-Centrifuge.
Для профиля антигена III ID-карты (M, N, S, s, Fy a , Fy b ) для типирования антигена в соответствии с инструкциями производителя (DiaMed GmBH) использовали 0,8% суспензию эритроцитов. Вкратце, 50 мкл 0,8% суспензии эритроцитов пипеткой вносили во все 6 микропробирок, а затем 50 мкл сыворотки для ID-теста добавляли в соответствующие микропробирки.ID-карты инкубировали в течение 10 минут при комнатной температуре, затем центрифугировали в течение 10 минут при 85 × g в ID-Centrifuge.
Интерпретация результатов
Положительно
Агглютинированные клетки образуют линию на поверхности микропробирки или диффундируют по всему гелю. Результаты были оценены от 4+ до 1+ в зависимости от диффузии клеток, что указывает на присутствие соответствующего антигена.
отрицательный
Накопление эритроцитов в виде компактной кнопки на дне микропробирки указывает на отсутствие соответствующего антигена.
Статистический анализ
Статистический пакет для социальных наук (SPSS для Windows версии 19. Армонк, штат Нью-Йорк, США) был использован для проведения мета-анализа для сравнения результатов этого исследования с результатами других популяций. Все результаты были стандартизированы в процентах. Для определения отношения шансов (OR) использовалась бинарная логистическая регрессия, где эталонной категорией были результаты нашего исследования. Значение P считалось значимым, если оно было <0,05.
Результаты
Сто образцов донорской крови были типированы на антигены основных систем групп крови (резус, Келл, Кидд, Даффи, MNS, P, Льюис и лютеранский).Для системы групп крови Rh все образцы были типизированы на D, C, E, c и e. Из них 80% доноров были RhD-положительными, а 20% — RhD-отрицательными. В таблице 1 показана частота встречаемости антигенов резус-фактора. E-антиген показал самую высокую частоту 97%, за ним следовали c-антиген и D-антиген (86% и 80% соответственно).
Таблица 1 Распределение резус-антигенов у доноров крови в Восточном регионе Саудовской Аравии по сравнению с другими популяциями |
Кроме того, в таблице 1 показана двумерная связь между выборкой исследования и результатами из других популяций (т. Е. Индейцев, европеоидов, африканцев и китайцев).Результаты указывают на статистически значимое различие антигенов D, C и c между населением Саудовской Аравии и другими популяциями. У китайского населения шансы иметь антиген D в 24,8 раза выше, чем у саудовцев, а антиген C в 5,6 раза выше, чем у саудовского населения. В то время как африканцы имели в 7,9 раз больше шансов иметь антиген c по сравнению с саудовцами.
Таблица 2 показывает распространенность фенотипов резус-фактора, выявленных в этом исследовании, по сравнению с другими популяциями, DCCee, например, был значительно выше как в китайском, так и в индийском населении по сравнению с саудовским населением (OR = 4.3 и 4.8 соответственно). Кроме того, вероятность наличия фенотипа Dccee у африканского населения в 7,9 раз выше, чем у саудовского населения. Все RhD-отрицательные доноры экспрессировали обычно ассоциированные антигены c и e, что видно в таблице 2. Слабый антиген D не наблюдался ни у одного из доноров в этом исследовании.
Таблица 2 Распространенность резус-фенотипов, выявленных в этом исследовании, по сравнению с другими популяциями |
Частота антигенов и фенотипы групп крови других основных групп крови также были проверены в этом исследовании.Некоторые антигены эритроцитов в текущем исследовании значительно отличаются от других популяций (например, индийских, кавказских, африканских и китайских) (Таблица 3). Например, s-антиген в 21,6 раза выше у населения Китая по сравнению с населением Саудовской Аравии. населению Саудовской Аравии. В то время как вероятность наличия Antigen Fy b составляет 17.В 3 раза выше у кавказцев по сравнению с исследуемой популяцией.
Таблица 3 Распространенность антигенов эритроцитов в текущем исследовании и других популяциях |
При оценке процента групп крови Келла, Кидда и Даффи в текущем исследовании и другом исследовании было обнаружено, что существуют значительные различия (Таблица 4), а именно: K-k +, K + k +, Jk. (a + b-), Jk (a-b +), Fy (a + b-), Fy (a-b +), Fy (a + b +), Fy (ab-).Вероятность наличия фенотипа Fy (a + b-) в популяции Китая в 25,6 раза выше по сравнению с популяцией Саудовской Аравии, в то время как вероятность наличия фенотипа в популяции Индии в 3,8 раза выше по сравнению с исследуемой популяцией. Кроме того, шансы фенотипа Fy (a + b +) в популяциях Индии и Кавказа значительно отличаются от популяций Саудовской Аравии (OR = 14,3 и 18,3 соответственно). As, Fy a и Fy b были обнаружены у 22% населения в нашем исследовании (Таблица 3).Интересно, что это привело к обнаружению редкого фенотипа Fy (a-b -) у 61% доноров в исследовании (Таблица 4).
Таблица 4 Процент фенотипов групп крови Келла, Кидда и Даффи в текущем исследовании и других популяциях |
Что касается системы групп крови MNS, M + N-S + s + и M + N + S-s + были среди наиболее распространенных фенотипов с частотой 24% и 21% соответственно, тогда как M-N + S + s + и M-N + S + s- были наименее распространенными фенотипами системы групп крови MNS с частотой 3% (Таблица 5).
Таблица 5 Процент фенотипов группы крови Льюиса, Лютерана и ПНВ в текущем исследовании и других популяциях |
Наконец, для систем групп холодной крови Lewis, Lutheran и P; 49% доноров были Le (a-b +) и 97% — Lu (a-b +). Редкие Lu (a + b +) и Lu (a-b-) были обнаружены в этом исследовании с частотой 2% и 1% соответственно (Таблица 5). Редкий фенотип Le (a + b +) наблюдался у 3% доноров.Антиген P1 наблюдался у 85% доноров в этом исследовании (таблица 3).
Обсуждение / Заключение
В настоящем исследовании мы определили частоту фенотипов основных групп крови (Rh, Kell, Kidd, Duffy, MNS, P, Lewis и Lutheran) среди доноров крови в восточном регионе Саудовской Аравии с использованием гелевого метода. Исследование показало, что частота фенотипов этих групп крови различается между центральным регионом Саудовской Аравии и другими популяциями.
Поскольку в восточном регионе Саудовской Аравии наиболее высока распространенность ВСС и талассемии, местные банки крови сталкиваются с проблемой предоставления антиген-отрицательных донорских единиц для таких пациентов, которым в рамках терапевтического режима требуются частые переливания эритроцитов. 8 Следовательно, определение частоты антигена у местной популяции доноров имеет важное значение для облегчения рутинной практики банка крови, своевременно предоставляющей кровь пациентам, при одновременном предотвращении аллоиммунизации в будущем. 10
О частотах антигенов в основных системах групп крови широко сообщалось среди населения Кавказа, Африки, Индии и Китая. 11–14 Однако информация о частотах антигенов в Саудовской Аравии ограничена системами групп крови ABO и Rh. 3–5,7 Насколько нам известно, это первое исследование, в котором сообщается о расширенном антигенном фенотипировании основных систем групп крови в Саудовской Аравии, особенно в Восточном регионе.
Заболеваемость антигеном D варьируется в разных популяциях; в нашем исследовании было обнаружено, что антиген D присутствует у 80% населения, что сопоставимо с таковым в популяции европеоидной расы. Однако антиген D был высоко экспрессирован в китайском и африканском населении со значительной разницей по сравнению с результатами нашего исследования с отношением шансов (OR) 2.9 и 24, а также значимое значение p <0,05 и <0,001 соответственно (Таблица 1). Точно так же частота встречаемости антигена С и С была сопоставима с популяцией европеоидной расы. Частота встречаемости антигена C в нашем исследовании была обнаружена у 59% доноров, что было значительно меньше, чем у индейцев и китайцев (p <0,001), но выше, чем у африканцев (p <0,001) (Таблица 1 ). 13,14 Аналогичное исследование было проведено Nomani et al. На донорах крови в центральном регионе Саудовской Аравии, где антиген D был обнаружен на уровне 91.3% по сравнению с 80% в нашем исследовании. 15 Точно так же с антигеном C, который был обнаружен в 59% в нашем исследовании по сравнению с 69,2% в Центральном регионе. Эти результаты подчеркивают различия в экспрессии антигенов в различных регионах Саудовской Аравии, что доказывает, что Саудовская Аравия имеет разнообразное этническое происхождение. В целом, антиген и фенотипическая экспрессия системы групп крови резус в этом исследовании оказались ближе к таковым у европеоидной популяции, чем у любой другой популяции.
В системе групп крови Kell наши результаты показали, что 8% наших доноров экспрессировали антиген K, что было сопоставимо с таковым в кавказской и индийской популяциях. 13,14 Антиген k (целлано) был обнаружен у 100% наших доноров, что также было сопоставимо со значениями, зарегистрированными во всех других популяциях. 12–14
Антигены группы крови Даффи действуют как рецепторы малярийных паразитов, в частности Plasmodium vivax . Инфекции малярии, вызванные P.vivax поражает около 80 миллионов человек во всем мире. 16 Лица с нулевым фенотипом Даффи Fy (a-b-) устойчивы к малярийным инфекциям, вызываемым P. vivax , поскольку у них отсутствует рецептор, который позволяет паразитам вторгаться в эритроциты. Нулевой фенотип распространен среди африканского населения, живущего в эндемичных для малярии районах, с распространенностью примерно 68%, в то время как в других популяциях, таких как индийцы, китайцы и европейцы, этот фенотип встречается редко. 12–14 Неожиданно в нашем исследовании этот нулевой фенотип показал распространенность 61%, что сходно с африканской популяцией, а также с общими фенотипами системы групп крови Даффи (Таблица 4). Однако исследование, проведенное в центральном регионе Саудовской Аравии, обнаружило Fy (a-b-) только у 36% их доноров, что было ниже значения, найденного в нашем исследовании. 15 Это открытие в дополнение к различиям в экспрессии антигена Rh указывает на то, что частоты фенотипов в разных регионах Саудовской Аравии различаются в зависимости от региона, что подчеркивает важность документирования фенотипов групп крови на национальном уровне, чтобы минимизировать поиск антиген-отрицательной крови при необходимости.
Система групп холодной крови Льюис был наиболее распространенным фенотипом, обнаруженным в нашем исследовании, при этом Le (a-b +) показал распространенность 49%, что близко к значению, наблюдаемому в африканской популяции (55%). Нулевой Le (ab-) был обнаружен у 19% наших доноров, показывая аналогичную частоту как в индийском, китайском, так и в африканском населении и значительно, чем в европеоидной популяции, которая составила 6% (p <0,05). . 12–14 Для лютеранской системы групп крови наиболее частым обнаруженным фенотипом был Lu (a-b +) с частотой 97%; это значение аналогично таковым во всех других популяциях.
Фенотипы M + N-S + s + и M + N + S-s + из системы групп крови MNS были обнаружены у наших доноров с частотой 24% и 21% соответственно; однако они не были наиболее распространенными фенотипами MNS, наблюдаемыми в других популяциях. 12–14
Как было замечено в этом исследовании, частота основных групп крови в восточном регионе Саудовской Аравии отличается от таковой не только в других исследованных популяциях, но и в центральном регионе Саудовской Аравии. Основным ограничением этого исследования является отсутствие национального реестра доноров крови, из-за чего частота этих фенотипов не может быть распространена на население Саудовской Аравии в целом, но остается ограниченной для восточного региона.
Еще одним серьезным ограничением является небольшой размер выборки, но результаты этого исследования могут быть использованы в качестве основы для создания местных реестров по всей стране, а не только в Восточном регионе. Понимание частот основных систем групп крови, отличных от систем ABO и Rh, необходимо для всех банков крови для планового тестирования и чрезвычайных ситуаций. Данные могут быть использованы, чтобы помочь банкам крови подготовить внутренние расширенные панели для идентификации антител для обнаружения неожиданных множественных антител, когда коммерческие наборы для идентификации антител не дают окончательных результатов.
Заявление об этике
Доноры предоставили письменное информированное согласие на участие в исследовании, и протокол исследования был одобрен институциональным наблюдательным советом Университета имама Абдулрахмана бин Фейсала (IRB-PGS-2018-03-141). Исследование соответствует Хельсинкской декларации.
Благодарность
Авторы хотели бы поблагодарить профессора Сулеймана Баха из Колледжа общественного здравоохранения Университета имама Абдулрахмана бин Фейсала, Даммам, Саудовская Аравия, за его консультацию по расчету размера выборки.Г-жа Нада Аль-Захрани, куратор банка крови из больницы Короля Фахда Университета, за предоставление нам данных о резус-фенотипе доноров.
Авторские взносы
Все авторы участвовали в анализе данных, составлении и редактировании статьи, окончательно одобрили версию, которая будет опубликована, и согласны нести ответственность за все аспекты работы.
Финансирование
Это исследование финансировалось отделом исследований и аспирантуры Университета имама Абдулрахмана бин Фейсала (2018-302-CAMS).
Раскрытие
Авторы не заявляют о конфликте интересов.
Список литературы
1. Эшфорд П. Руководство по процедурам совместимости перед переливанием. Трансфус Мед . 1997; 7 (2): 171. DOI: 10.1046 / j.1365-3148.1997.d01-22.x
2. Сторри Дж. Р., Кастильо Л., Чен К. и др. Рабочая группа Международного общества переливания крови по иммуногенетике и терминологии эритроцитов: отчет о заседаниях в Сеуле и Лондоне. ISBT Sci Ser .2016; 11: 118–122. DOI: 10.1111 / voxs.12280
3. Башаври Л.А., Аль-Мулхим А.А., Ахмад М.С., Ахмед М.А. Частота групп крови ABO в восточном регионе Саудовской Аравии. Саудовская медицина J . 2001. 22 (11): 1008–1012.
4. Сархан МАА, Салех К.А., Бин-Даджем С.М. Распределение групп крови ABO и резус-фактора в Юго-Западной Саудовской Аравии. Саудовская медицина J . 2009. 30 (1): 116–119.
5. АльБилали А., Аль-Фраиди О., Аль-Харби Х. и др. Распределение групп крови ABO и резус-фактора среди регулярных доноров в Аль-Мадина Аль-Монавара, Саудовская Аравия, 2016 г. Int J Adv Res . 2017; 14 (3): 7850–7863. DOI: 10.21474 / ijar01 / 3092
6. Алсухайбани Е.С., Кизилбаш Н.А., Малик С. Гетерогенность и разнообразие генов групп крови ABO и Rh в избранных популяциях Саудовской Аравии. Genet Mol Res . 2015; 14: 7850–7863. DOI: 10.4238 / 2015. 14 июля, 11
7. Абдулла С.М. Частота групп крови ABO и Rh в Джазанской области Саудовской Аравии. Пак Дж. Медицина . 2010. 26 (4): 818–821.
8. Алсаид Э.С., Фархат Г.Н., Ассири А.М. и др.Распространение нарушений гемоглобинопатии в Саудовской Аравии на основе данных программы добрачного скрининга и генетического консультирования, 2011–2015 гг. J Epidemiol Glob Health . 2018; 7 (приложение 1): S41–7. DOI: 10.1016 / j.jegh.2017.12.001
9. Фаул Ф., Эрдфельдер Э., Ланг А. Г., Бюхнер А. Г. * Power 3: гибкая программа статистического анализа мощности для социальных, поведенческих и биомедицинских наук. Методы определения поведения . 2007. 39 (2): 175–191. DOI: 10.3758 / BF03193146
10.Kacker S, Ness PM, Shirey RS, Savage WJ, King KE, Tobian AAR. Будущее снижения риска аллоиммунизации эритроцитов. Переливание крови . 2015; 55 (1): 222–224. DOI: 10.1111 / trf.12866
11. Кахар М., Патель Р. Частоты фенотипов систем групп крови (Rh, Kell, Kidd, Duffy, MNS, P, Lewis и Lutheran) у доноров крови из южного Гуджарата, Индия. Азиатский журнал J Transfus Sci . 2014. 8 (1): 51–55. DOI: 10.4103 / 0973-6247.126693
12. Yu Y, Ma C, Sun X, et al. Частоты антигенов и фенотипов основных групп крови эритроцитов у китайского населения хань из материкового Китая. Инт Дж. Иммуногенет . 2016; 43 (4): 226–235. DOI: 10.1111 / iji.12277
13. Такрал Б., Салуджа К., Шарма Р.Р., Марваха Н. Частоты фенотипов систем групп крови (резус, Келл, Кидд, Даффи, MNS, P, Льюис и лютеранец) у доноров крови из Северной Индии. Transfus Apher Sci . 2010. 43 (1): 17–22. DOI: 10.1016 / j.transci.2010.05.006
14. Рейд М.Э., Ломас-Фрэнсис К., Олссон М.Л. Книга фактов об антигенах группы крови . 3-е изд. Нью-Йорк: Academic Press; 2012. doi: 10.1016 / C2011-0-69689-9
15. LNomani SN, FS. Резюме Презентации ежегодного собрания AABB Филадельфия, Пенсильвания, 25–28 октября 2014 г. В: Transfusion. Vol 54; 2014: 15A – 268A. DOI: 10.1111 / trf.12845
16. Langhi DM, Bordin JO. Группа крови Даффи и малярия. Гематология . 2006. 11 (5): 389–398. DOI: 10.1080 / 10245330500469841
Генетика группы крови
Генетика группы крови Группы крови ABO и Rh в ЛюдиРанние эксперименты с переливанием крови человека часто приводили к смерти пациента по неизвестным причинам.В 1901 году было обнаружено, что существует три * группы крови: A, B и O, и что смешивание крови разных типов вызывает иммунный ответ, который приводит к слипанию.
* Тип AB встречается редко и был обнаружен позже.
ABO Группа крови : красные кровяные тельца человека будут содержать белки типа A или B, или обоих, или ни одного. Организм вырабатывает антитела, которые атакуют любой чужеродный тип. Аллели типов I A и I B преобладают над типом i .
Генотип | Группа крови | Белки крови | Антитела крови | Можно пожертвовать | Можно получить от |
я | Тип O | Нет | Anti-A и Anti-B | A, B, AB, O | O |
Я А Я А | Тип A | А | Anti-B | A, AB | А, О |
я А я | Тип A | А | Anti-B | A, AB | А, О |
I B I B | Тип B | В | Анти-А | B, AB | B, O |
I B i | Тип B | В | Анти-А | B, AB | B, O |
I A I B | Тип AB | А и В | Нет | AB | A, B, AB, O |
Резус-фактор : резус-фактор, вторая по важности система групп крови после системы групп крови АВО, впервые был обнаружен у обезьян-резесов.Резус-фактор наследуется независимо от группы крови АВО. Генотипы по резус-фактору: + / +, +/- и — / -. Люди с + / + или +/- обладают антигеном Rh (D) и имеют положительный результат теста. Люди с — / — не обладают антигеном Rh (D) и имеют отрицательный результат теста. Около 15% американцев имеют отрицательный резус-фактор.
Генотип | Фенотип | Белки крови | Антитела крови | Можно пожертвовать | Можно получить от |
+ / + | Rh + | Белки Rh (D) | Нет | Rh + | Rh + или Rh- |
| +/- | Rh + | белков Rh (D) | Нет | Rh + | Rh + или Rh- |
— / — | Rh- | Нет | Анти-Rh (D) | Rh + или Rh- | Rh- |
Сенсибилизация по резус-фактору : Один интересный медицинский сценарий связан с резус-отрицательной матерью, которая вынашивает ребенка с положительным резус-фактором.(Ребенок от резус-положительного отца и резус-отрицательной матери может быть +/- или — / -.) Если ребенок +/-, первая беременность вызывает резус-сенсибилизацию у матери, потому что она подвергается воздействию чужеродных белков и вырабатывает антитела против них. Дальнейшая беременность может быть все более сложной, поскольку материнские антитела атакуют ребенка.
| ABO Тип | Комбинированный% | Rh-фактор | % в Население США |
| О | 44 год | + | 37.4 |
| — | 6,6 | ||
| А | 42 | + | 35,7 |
| — | 6.3 | ||
| B | 10 | + | 8.5 |
| — | 1.5 | ||
| AB | 4 | + | 3,4 |
| — | 0,6 |
Источник данных
Доноры и реципиенты : Поскольку красные кровяные тельца людей с отрицательной группой крови O не содержат белков, которые может быть отклонен, отрицательный тип O упоминается как универсальный донор .Поскольку красные кровяные тельца с положительным типом AB содержат все возможные антигены (белки), ни один из них не будет считается иностранным, поэтому положительный результат типа AB — это универсальный получатель . Поскольку плазма (жидкая часть крови, из которой красные и белые тельца были удалены центрифугированием) положительных людей типа AB не содержит антител, плазма положительных доноров типа AB является универсальной. В чрезвычайной ситуации, когда нет времени делать анализ группы крови, знание того, кто является универсальным донором, может спасти жизни.
Расовые различия : Различия в частоте групп крови в различные популяции людей предположительно связаны с историческими изоляция небольших популяций, что привело к генетическому дрейфу. Не имея каких-либо научных достоинств, расовая сегрегация крови оставалась политикой американского Красного Креста до 1950 года, несмотря на протесты известного афроамериканского врача и исследователя переливания крови доктора Чарльза Дрю. Для хорошего чтения о заблуждениях о расе и человеке различия читайте Р.С. Левонтин или Стивен Джей Гулд.
Проблемы генетики группы крови
Иммуногенетика эритроцитов и терминология групп крови
Разработать и поддерживать руководящие принципы по номенклатуре антигенов группы крови и аллелей для использования в трансфузионной медицине и смежных науках.
Термин «группа крови» обычно относится к индивидуальной комбинации поверхностных антигенов эритроцитов (эритроцитов). Антигены — это специфические участки на различных белках, гликопротеинах или гликолипидах, которые образуют части мембраны эритроцитов, с которыми может взаимодействовать иммунная система.Эти белки выполняют множество функций, таких как мембранные переносчики (Диего, Кидд), рецепторы и молекулы адгезии (Даффи, Лютеран), гликопротеины, регулирующие комплемент (Cromer, Knops), ферменты (Yt, Kell, Dombrock), структурные компоненты (Diego, Gerbich ) или компоненты гликокаликса (MNS).
Антигены определяются как антитела, которые возникают либо «естественным образом» из-за встречаемости антигенов, повсеместно встречающихся в окружающей среде, либо образуются в результате активной иммунизации чужеродными антигенами эритроцитов после воздействия эритроцитов человека от другого человека.Именно наличие и отсутствие из-за наследственной изменчивости поверхностных антигенов эритроцитов определяет группу крови человека.
Системы групп крови официально определены как «системы одного или нескольких антигенов, управляемые одним геном или комплексом из двух или более тесно связанных гомологичных генов». Каждая система генетически отделена от любой другой системы группы крови. Для распознавания системы групп крови и ее антигенов необходимо идентифицировать лежащую в основе генетическую вариацию, секвенировать и подтвердить, что она влияет на фенотип.
Рабочая группа Международного общества переливания крови (ISBT) по иммуногенетике эритроцитов и терминологии групп крови (ISBT WP) ведет официальный учет всех признанных в настоящее время систем групп крови. В настоящее время существует 43 признанных системы групп крови, содержащих 345 антигенов эритроцитов (июнь 2021 г.). 43 системы генетически определены 48 генами. Для получения дополнительной информации перейдите по следующим ссылкам:
Системы групп крови
Антигены в системах
Таблицы аллелей групп крови (прокрутите вниз до сеанса терминологии группы крови)
ISBT также поддерживает три категории для антигенов, которые еще не были связаны с системами групп крови.Коллекции (серия 200) были разработаны для группирования антигенов, которые являются биохимически, генетически или серологически подобными, если генетическая основа еще не обнаружена. Есть также два антигенных ряда; Серия 700 содержит антигены, которые не входят ни в одну систему или коллекцию, частота которых составляет <1% среди всех этнических популяций человека, а серия 901 Series содержит антигены, которые имеют частоту> 99% среди популяций разных этнических групп. происхождение.
Аберрантный фенотип ABO B с нерегулярным анти-B, вызванный парабомбейской мутацией FUT1 — FullText — Transfusion Medicine and Hemotherapy 2020, Vol. 47, № 1
Абстрактные
Справочная информация: Стандартное типирование группы крови по системе ABO для тестирования перед переливанием у пациента мужского пола из Австрии дальневосточного происхождения показало противоречивые результаты с явно слабым фенотипом группы крови B и нерегулярным анти-B. Материалы и методы: Фенотипирование ABH и перекрестное сопоставление проводили стандартными серологическими методами, а уровни экспрессии H определяли с помощью проточной цитометрии.Было выполнено секвенирование гена ABO , включая регуляторные области, а также анализ FUT1 (H), FUT2 (Secretor) и FUT3 (Lewis). Результаты: В то время как типирование моноклонального антигена ABO показало группу крови O, наблюдались слабые реакции агглютинации с использованием поликлональных человеческих анти-B и анти-AB. При обратном типировании при комнатной температуре плазма реагировала с эритроцитами A1 и A2 и отрицательно с клетками B и O, тогда как при 4 ° C была обнаружена анти-B реактивность.Непрямое перекрестное соответствие антиглобулинов в плазме пациента было положительным с эритроцитами группы B и отрицательным с эритроцитами группы O. Анализ секвенирования показал наличие аллеля ABO * B.01 (B114) и гомозиготность по мутации FUT1 c.551_552delAG. Проточная цитометрия показала следовые количества H-антигена в эритроцитах пациента. Заключение: Хотя функциональный аллель B был обнаружен, анализ генов FUT1 и FUT2 выявил присутствие редкого парабомбейского генотипа O h B .Интересно, что в плазме пациента не было обнаружено анти-H, но нерегулярные анти-B, ответственные за положительное перекрестное соответствие с эритроцитами группы B. Несмотря на то, что он очень редок и не регистрируется для европейской популяции, наличие H-дефицитного фенотипа следует учитывать при обследовании лиц с необычной группой крови ABO.
© 2019 S. Karger AG, Базель
Введение
Синтез антигенов групп крови A и B зависит от присутствия предшественников H углеводных структур.Экспрессия H-антигена в эритроцитах (эритроцитах) регулируется фукозилтрансферазой 1, продуктом гена FUT1 , тогда как фукозилтрансфераза 2, кодируемая геном FUT2 , регулирует экспрессию растворимых антигенов ABH в секретах. Мутации в гене FUT1 могут приводить к снижению или отсутствию продукции H-антигена в эритроцитах, в то время как нефункциональные аллели FUT2 при гомозиготности приводят к несекреторному фенотипу. Неактивность обеих, фукозилтрансферазы 1 и 2, характеризует фенотип Бомбея (O h ).При парабомбейских фенотипах ABH-антигены дефицитны по секреторам или частично дефицитны как по секреторам, так и по несекреторам [1, 2].
Генетические полиморфизмы FUT1 и FUT2 этнически и географически специфичны. Аллели FUT1 редки и встречаются спорадически, тогда как ген FUT2 является высокополиморфным и распределяется популяционно-специфическим образом [3-7]. Варианты фукозилтрансфераз 1 и 2 могут быть причиной несовпадения результатов серологического определения группы крови по системе АВО.Здесь мы сообщаем об аберрантном фенотипе B с нерегулярным анти-B, вызванном деструктивной мутацией в FUT1 мужчины австрийского пациента дальневосточного происхождения.
Материалы и методы
Серологический анализ крови по АВО и Льюису проводили с использованием методов гелевой матрицы (система MicroTyping, Bio-Rad, Вена, Австрия). Наличие антигена H тестировали с использованием двух моноклональных анти-H (MIMA134, предоставленных G. Halverson, New York Blood Center, New York, NY; 10934C11, BAG, Lich, Germany) в гелевой матрице (Bio-Rad).Кроме того, экспрессию H-антигена анализировали проточной цитометрией с использованием анти-H, конъюгированного с флуоресцеинизотиоцианатом (BRIC198, Международная справочная лаборатория группы крови, Бристоль, Великобритания; FACSCanto II, Becton Dickinson, Гейдельберг, Германия). Поликлональные анти-A или анти-B (Biotest, Dreieich, Германия) адсорбировались на эритроцитах пациента с последующей кислотной элюцией (DiaCidel, DiaMed). Элюаты тестировали против эритроцитов A1, A2, B и O. Перекрестное сопоставление плазмы пациента с эритроцитами группы O и B проводили в картах античеловеческого глобулина и нейтрального геля (Bio-Rad) при 37 ° C и комнатной температуре соответственно.Скрининг на антитела к эритроцитам и прямой тест на человеческий глобулин (DAT) проводили, как описано [8]. Анализы аллель-специфического секвенирования гена ABO и его регуляторных областей, а также генов FUT1 , FUT2 и FUT3 проводили, как описано ранее [6, 9].
Результаты
Тестирование эритроцитов пациента с помощью моноклональных реагентов для типирования ABO показало группу крови O. Напротив, при использовании поликлональных реагентов после предварительной обработки эритроцитов бромелином слабые реакции агглютинации наблюдались с анти-B и анти-AB (- / + и +++ соответственно; рис.1А и Б). При обратном типировании группы крови при комнатной температуре сыворотка была сильно реактивной с эритроцитами A1, ++ реактивной с A2 и отрицательной с B и O клетками. Однако обратное типирование при 4 ° C показало присутствие анти-B (++) (рис. 1C и D). Плазма пациента показала отрицательный результат скрининга на антитела, а его эритроциты были отрицательными в DAT.
Рис. 1.
АВО прямого и обратного набора. Типирование антигена ABO с использованием моноклональных реагентов ( A ) показало в целом отрицательные результаты, в отличие от положительных реакций с поликлональными реагентами ( B ), усиленными предварительной обработкой бромелином эритроцитов (слегка положительные и +++ с анти-B и анти- AB соответственно).Обратное типирование ABO плазмы пациента в нейтральном геле показало реактивность с клетками A1 и A2 при комнатной температуре (RT; ° C, ) и дополнительно с B-клетками при 4 ° C ( D ).
Исследования адсорбции-элюции с эритроцитами пациента показали отрицательные результаты с анти-A, но положительные реакции с анти-B, что подтвердило слабый фенотип B. Перекрестное соответствие плазмы пациента было положительным с двумя из трех образцов эритроцитов группы B в обоих: фазе антиглобулина человека при 37 ° C и фазе физиологического раствора при комнатной температуре.Перекрестное соответствие было в целом отрицательным с эритроцитами группы O (данные не показаны). Антиген H не был обнаружен при типировании гемагглютинации эритроцитов (рис. 2А). Проточная цитометрия показала следовые количества H-антигена на эритроцитах пациента, даже меньше, чем на контрольных клетках A1 (рис. 2B).
Рис. 2.
ЭкспрессияH антигена. Серологическое типирование антигена H в эритроцитах пациента (патент) с использованием моноклональных анти-H (HIMA134) в нейтральных гелевых картах было отрицательным ( A ). Идентичные результаты были получены с другим анти-H (10934C11; не показано).Проточный цитометрический анализ с использованием анти-H, конъюгированного с флуорохромом (BRIC198), выявил минимальные количества H-антигенов в эритроцитах пациента ( B ). Для сравнения показаны контрольные эритроциты A1, B и O.
Посредством анализа секвенирования были идентифицированы аллели ABO * O.01.01 и вариант ABO * B.01 (B114) . Генотип FUT1 показал гомозиготность по аллелю FUT1 * 01N.06 , содержащему нуклеотидную делецию одного из трех повторов AG (c.551_552delAG, p.Glu184Valfs * 85) в кодирующей области гена [10]. FUT2 был гомозиготным по функциональному аллелю Se357 (c.357C> T, p.Asn119Asn119) [11], что указывало на секреторный статус. В соответствии с фенотипом Le (ab-) пациента, секвенирование FUT3 выявило гомозиготность для неактивных аллелей Льюиса на основании наличия c.59T> G (p.Leu20Arg) и c.1067T> A (p.I356K) [12, 13].
Обсуждение
Наличие функционального аллеля B в генотипе не отражает аберрантный фенотип группы крови ABO исследуемого пациента.Однако обнаруженный вариант последовательности в гене FUT1 кодирует мутацию, ранее обнаруженную у нескольких человек на Тайване. Поскольку делеция приводит к сдвигу рамки считывания, создавая преждевременный стоп-кодон в кодирующей области, нефункциональные ферменты α (1,2) фукозилтрансферазы могут экспрессироваться [10]. Присутствуют функциональные аллели FUT2, указывающие на H-дефицитный секретор типа O h B -secretor.
Минимальное присутствие H-антигенов в эритроцитах пациента было обнаружено только с помощью анализа проточной цитометрии, который, как известно, более чувствителен, чем серологическое типирование путем прямой агглютинации.Из-за секреторного статуса пациента растворимый антиген H, синтезируемый FUT2, а также обнаруженные антигены B могут адсорбироваться на эритроцитах, описанных как фенотип O h B [14, 15].
Подобно людям с фенотипом Бомбея, пара-Бомбейцы могут вырабатывать антитела против антигенов H [16, 17]. Однако в сыворотке нашего пациента анти-H не наблюдалось.
Интересно, что анти-B был обнаружен в плазме пациента при 4 ° C, что позволяет предположить наличие нерегулярного анти-B, ответственного за положительное перекрестное совпадение с эритроцитами группы B.
О предыдущих переливаниях крови не известно, и, к сожалению, данные семейного анамнеза недоступны.
Когда показано переливание, эритроциты группы O кажутся совместимыми для этого пациента. Донорская кровь того же фенотипа — за исключением семейных доноров — чрезвычайно редка в Европе и в данном случае не подходила. В случае развития алло-анти H стратегия переливания должна быть пересмотрена.
Сообщалось о присутствии анти-H в H-дефицитных секреторах [16, 17]; однако, поскольку пара-Бомбейцы обычно сохраняют некоторые H-антигены в своих эритроцитах, в их плазме может наблюдаться только слабая анти-H-активность или ее отсутствие.
Пара-Бомбейский фенотип немного чаще встречается на Тайване с частотой около 1 из 8000 человек [18], но не зарегистрирован среди австрийского населения. Поскольку антисыворотка против H обычно не применяется для типирования ABO, случаи пара-Бомбейского фенотипа останутся неустановленными. Несмотря на то, что это происходит очень редко, особенно при обследовании лиц дальневосточного происхождения с необычной группой крови ABO, следует учитывать наличие H-дефицитного фенотипа. При таких фенотипах особое внимание следует уделять потенциальным отклоняющимся результатам обратного типирования, чтобы гарантировать безопасность переливания.
Благодарности
Авторы благодарят Аню Штойссер за ее техническую помощь.
Заявление об этике
Пациент дал информированное согласие. Никакого этического одобрения не требовалось.
Заявление о раскрытии информации
Авторы не заявляют о конфликте интересов.
Источники финансирования
Исследование не получало финансирования.
Вклад авторов
Ева Мария Мацхольд написала рукопись, концептуально разработанную Гюнтером Ф.Кёрмёци и Томас Вагнер. Марлиз Шенбахер, Ева Мария Мацхольд и Гюнтер Ф. Кёрмёци провели лабораторные испытания и собрали данные. Камилла Дрекслер критически отредактировала работу и подготовила рисунки. Все авторы одобрили рукопись для подачи.
Интернет-ресурсы
http://www.isbtweb.org/fileadmin/user_upload/Working_parties/WP_on_Red_Cell_Immunogenetics_and/018_H_Alleles_v5.1_170221.pdf. Доступ к URL-адресу 5 апреля 2018 г.
Список литературы
- Ларсен Р.Д., Эрнст Л.К., Наир Р.П., Лоу Дж.Б.Молекулярное клонирование, последовательность и экспрессия кДНК GDP-L-фукоза: бета-D-галактозид 2-альфа-L-фукозилтрансферазы человека, которая может образовывать антиген H группы крови. Proc Natl Acad Sci USA. 1990 сентябрь; 87 (17): 6674–8.
- Келли Р.Дж., Рукье С., Джорджи Д., Леннон Г.Г., Лоу Дж. Б.. Последовательность и экспрессия кандидата в ген альфа (1,2) фукозилтрансферазы секреторной группы крови человека (FUT2).Гомозиготность по инактивирующей ферменты нонсенс-мутации обычно коррелирует с несекреторным фенотипом. J Biol Chem. 1995 Март; 270 (9): 4640–9.
- Вагнер Ф. Ф., Флегель В. А.. Полиморфизм аллеля h и популяционная частота спорадических нефункциональных аллелей. Переливание.1997 Март; 37 (3): 284–90.
- Koda Y, Soejima M, Kimura H. Полиморфизмы фукозилтрансфераз. Leg Med (Токио). 2001 Март; 3 (1): 2–14.
- Панг Х., Кода Й., Соедзима М., Фудзитани Н., Огаки Т., Сайто А. и др.Полиморфизм локуса ABO-Secretor человека (FUT2) в четырех популяциях в Азии: указание на отдельные азиатские субпопуляции. Энн Хам Жене. 2001 сентябрь; 65 (Pt 5): 429–37.
- Мацхольд Э.М., Хельмберг В., Вагнер Т., Дрекслер С., Ульрих С., Винклер А. и др. Идентификация 14 новых аллелей в локусах фукозилтрансферазы 1, 2 и 3 у доноров крови Штирии, Австрия.Переливание. 2009 Октябрь; 49 (10): 2097–108.
- Сторри Дж. Р., Йоханнессон Дж., Пул Дж., Стриндберг Дж., Родригес М. Дж., Яхалом В. и др. Идентификация шести новых аллелей в локусах FUT1 и FUT2 у этнически разнородных людей с фенотипами Бомбея и Пара-Бомбея. Переливание. 2006 декабрь; 46 (12): 2149–55.
- Гасснер К., Утц I, Шеннах Х, Рамони А., Штайнер Х, Шольц С. и др. Новые аллели RHD со слабой гемагглютинацией и генетическим разнообразием экзона 9: слабые типы D 45.1, 75 и 76. Переливание. 2013 ноя; 53 (11 приложение 2): 2954–9.
- Мацхольд Э.М., Дрекслер С., Штаудахер Э., Глок Б., Вагнер Т.Новый вариант аллеля B в локусе гена ABO, характеризующийся вставкой 27 нуклеотидов на основе дупликации, идентифицированный у иракского мужчины со слабым фенотипом подгруппы B. Переливание. 2018 Май; 58 (5): 1318–9.
- Yu LC, Yang YH, Broadberry RE, Chen YH, Lin M. Гетерогенность гена альфа (1,2) фукозилтрансферазы H группы крови человека среди парабомбейцев.Vox Sang. 1997. 72 (1): 36–40.
- Yu LC, Yang YH, Broadberry RE, Chen YH, Chan YS, Lin M. Корреляция миссенс-мутации в гене альфа 1,2-фукозилтрансферазы Secretor человека с фенотипом Льюиса (a + b +): потенциальная молекулярная основа для слабый секреторный аллель (Sew).Biochem J. 1995 Dec; 312 (Pt 2): 329–32.
- Молликон Р., Регуин И., Келли Р. Дж., Флетчер А., Ватт Дж., Чатфилд С. и др. Молекулярная основа дефицита гена альфа (1,3 / 1,4) -фукозилтрансферазы Льюиса (FUT3) обнаружена в индонезийских родословных, отрицательных по Льюису. J Biol Chem. 1994 август; 269 (33): 20987–94.
- Кода Й., Кимура Х., Мекада Е. Анализ генов фукозилтрансферазы Льюиса из слизистой оболочки желудка человека у Льюис-положительных и отрицательных людей. Кровь. 1993 ноябрь; 82 (9): 2915–9.
- Дзежкова-Бородей В., Мейнхард В., Несторович С., Пирог Я.Успешное элюирование анти-A и некоторых анти-H реагентов из двух образцов крови «Бомбей» (O A H) и исследование изоагглютининов в их сыворотках. Arch Immunol Ther Exp (Warsz). 1972: 20 (6): 841–9.
- Rodier L, Lopez M, Liberge G, Badet J, Gerbal A, Salmon C. Анти-h абсорбируется красными кровяными тельцами Oh (Бомбей) и элюируется из них.Биомедицина. Июль 1974 г., 21 (7): 312–6.
- Yan L, Zhu F, Xu X, Hong X, Lv Q. Молекулярная основа парабомбейских фенотипов у китайцев, включая новый нефункциональный аллель FUT1. Переливание. 2005 Май; 45 (5): 725–30.
- Мак К.Х., Лубенко А., Гринвелл П., Воак Д., Ян К.Ф., Пул Дж.Серологические характеристики H-дефицитных фенотипов китайцев в Гонконге. Переливание. 1996 ноябрь-декабрь; 36 (11-12): 994-9.
- Chen DP, Tseng CP, Wang W.T., Peng CT, Tsao KC, Wu TL, et al. Два преобладающих аллеля h в парабомбейских гаплотипах у 250 000 тайваньцев. Ann Clin Lab Sci.2004. 34 (3): 314–8.
Автор Контакты
Günther Körmöczi, MD, MME
Отделение серологии группы крови и трансфузионной медицины
Венский медицинский университет
Währinger Gürtel 18–20, AT – 1090 Вена (Австрия)
E-Mail [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 19 декабря 2018 г.
Принято: 19 марта 2019 г.
Опубликовано онлайн: 29 апреля 2019 г.
Дата выпуска: февраль 2020 г.
Количество страниц для печати: 4
Количество рисунков: 2
Количество столов: 0
ISSN: 1660-3796 (печатный)
eISSN: 1660-3818 (онлайн)
Для дополнительной информации: https: // www.karger.com/TMH
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
режимов наследования | BioNinja
Понимание:
• Доминантные аллели маскируют эффект рецессивных аллелей, но совмещенные аллели имеют совместные эффекты
Генный состав (т.е. комбинация аллелей) для определенного признака обозначается как генотип
- Генотип конкретного гена обычно будет либо гомозиготным, либо гетерозиготным
Наблюдаемые характеристики конкретного признака (то есть физическое выражение) упоминаются как фенотип
- Фенотип определяется как генотипом , так и влиянием окружающей среды
Полное доминирование
Большинство признаков следуют классическому доминантному / рецессивному паттерну наследования, при котором один аллель выражается поверх другой
- Доминантный аллель будет маскировать рецессивный аллель в гетерозиготном состоянии
- Гомозиготные доминантные и гетерозиготные формы будут фенотипически неразличимы
- Рецессивный аллель будет экспрессироваться в фенотипе только в гомозиготном состоянии358358 9000 представляющие аллели , соглашение состоит в том, чтобы использовать доминантный аллель с заглавной буквы и использовать строчные буквы для рецессивного аллеля
- Примером этого способа наследования является цвет шерсти мыши — черная шерсть (BB или Bb) преобладает над коричневой шерстью (bb)
Complete Dominance (Цвет шерсти мыши)
Ко-доминантностьКо-доминантность возникает, когда пары аллелей оба экспрессируются одинаково в фенотипе гетерозиготного человека
- Следовательно, гетерозиготы имеют измененный фенотип, поскольку аллели имеют совместное действие
При представлении аллелей принято использовать надстрочные индексы для различных ко-доминантных аллелей (рецессивный еще нижний регистр)- Примером совместного доминирования является оперение у кур — черное (C B ) и белое (C ). W ) перья образуют пятнистую шерсть (C B C W )
Совместное доминирование (куриное оперение)
Заявка:
• Наследование групп крови ABO
Эритроциты человека можно разделить на разные группы крови на основе структуры поверхностного гликопротеина (антигена)- Группы крови ABO контролируются одним геном с множественными аллелями (A, B, O)
Все аллели A, B и O продуцируют основной антиген на поверхности красных кровяных телец- Аллели A и B являются ко-доминантными , и каждый из них модифицирует структуру антигена для получения различные варианты
- Аллель O является рецессивным и не изменяет основную антигенную структуру
При представлении аллелей группы крови буква I используется для обозначения различных антигенных форм (изоантигенов)- Аллель А = I A ; Аллель B = I B ; Аллель O = i (рецессивный)
Генотипы для разных групп крови можно резюмировать следующим образом:
Поскольку люди вырабатывают антитела против чужеродных антигенов, переливание крови несовместимо между некоторыми группами крови- Группы крови AB могут получать кровь любого другого типа (поскольку они уже имеют оба антигенных варианта в своих клетках)
- Группы крови не могут получать кровь B или кровь AB (поскольку изоантиген, продуцируемый аллелем B, является чужеродным)
- Группы крови B не могут получать кровь A или кровь AB (поскольку изоантиген, продуцируемый аллелем A, является чужеродным)
- группы крови O могут получать только переливания крови от другого донора крови O (оба антигенных варианта являются чужеродными)
Сводка групп крови ABO
Последствия переливания несовместимой крови
.

 Relationship between the ABO Blood Group and the COVID-19 Susceptibility. MedRxiv (Preprint) 2020.
Relationship between the ABO Blood Group and the COVID-19 Susceptibility. MedRxiv (Preprint) 2020.