Хлорид магния, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ХЛОРИД МАГНИЯ ШЕСТИВОДНЫЙ СИНТЕТИЧЕСКИЙ ВЫСОКОЙ ЧИСТОТЫ — НИИТОНХ и БТ
Планируемая дата промышленного производства – I квартал 2022 года
Выполнена научно-исследовательская работа по созданию инновационной технологии (2018 г.)
Ведется монтаж опытно-промышленной линии синтеза магния хлористого шестиводнго. Работы по организации выпуска продукции выполняются в соответствии с Планом мероприятий по импортозамещению в отрасли химической промышленности
Российской Федерации
(шифр продукта в отраслевом плане по импортозамещению Д13Х98)
ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Массовая доля 6-водного хлористого магния не менее 99%
Массовая доля нерастворимых в воде веществ не более 0,005%
Массовая доля кислот в пересчете на соляную кислоту не более 0,002%
Массовая доля щелочей в пересчете на окись магния не более 0,0005%
Массовая доля общего азота не более 0,005%
Массовая доля сульфатов не более 0,003%
Массовая доля фосфатов не более 0,0005%
Массовая доля бария не более 0,002%
Массовая доля железа не более 0,001%
Массовая доля кальция не более 0,02%
Массовая доля мышьяка не более 0,00002%
Массовая доля тяжелых металлов не более 0,0002%
ОБЛАСТИ ПРИМЕНЕНИЯ
В фармакологии, как компонент следующих лекарственных препаратов: Неогемодез, Гемодез-н, Гемодез-8000, Красгемодез, Красгемодез-8000, Лактасол, Сорбилакт, Натрия фумарат сложный, Рингера-ацетат, Магния окись, Магния хлорид, Мафусол, Реосорбилакт, Квинтасоль, Изонидез.
Парфюмерно-косметическая промышленность: основное применение в косметике – регулятор вязкости, входит в состав гелей для душа, шампуней, бальзамов-ополаскивателей, зубных паст.
Пищевая промышленность: используется в качестве пищевой добавки Е 511 как стабилизатор цвета, загуститель и эмульгатор.
Химическая промышленность: используется для получения магнийсодержащих соединений, в том числе оксида и гидроксида магния, и синтетического гидротальцита.
Магния хлорид свойства — Справочник химика 21
Опыт 9. Свойства гидроксида магния. К 3—4 каплям раствора соли магния прилить по каплям раствор щелочи до выпадения осадка. Полученный гидроксид магния разделить на три пробирки. Содержимое одной из них обработать разбавленной соляной кислотой, второй — концентрированным раствором хлорида аммония, третьей — раствором щелочи (последнюю пробирку с осадком сохранить). В каких случаях растворяется осадок Составить уравнения реакций (если они пойдут) [c. 68]
68]
Магнезиальная коррозия. Всякая растворимая соль магния, содержащаяся в воде, взаимодействует с гидроксидом кальция с образованием нерастворимого гидроксида магния, не обладающего вяжущими свойствами, а также растворимой соли кальция. Исключение составляет уже рассмотренная соль М 504, которая, помимо малорастворимой Mg(0H)2, образует и малорастворимую соль — сульфат кальция. Так, хлорид магния взаимодействует с гидроксидом кальция по реакции [c.370]
Широко известна замазка под названием цемент Сореля, которую приготовляют размешиванием 60%-ного раствора хлорида магния с окисью магния до получения густой массы. Смесь быстро затвердевает, так как образуется твердый оксихлорид магния. Аналогичными свойствами обладает смесь раствора хлорида цинка с окисью цинка. [c.45]
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ХЛОРИДА МАГНИЯ В СИСТЕМЕ ХЛОРИД МАГНИЯ — ХЛОРИД КАЛИЯ [c.123]
Под жесткостью воды понимают свойство природной воды, определяемое присутствием в ней в основном растворенных солей кальция и магния. Жесткость воды подразделяется на карбонатную (присутствие гидрокарбонатов магния и кальция) и некарбонатную присутствие солей сильных кислот — хлоридов или сульфатов кальция и магния). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость. [c.250]
Жесткость воды подразделяется на карбонатную (присутствие гидрокарбонатов магния и кальция) и некарбонатную присутствие солей сильных кислот — хлоридов или сульфатов кальция и магния). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость. [c.250]
Качества природной воды характеризуются физическими и химическими свойствами, а также бактериальным загрязнением. К физическим свойствам относят температуру, мутность (или прозрачность), цветность, вкус и запах. Химические свойства зависят от содержания в воде химических веществ. Химический состав воды определяют ее жесткость, щелочность, окисляемость, активная реакция, содержание железа, магния, хлоридов, сульфитов и др. [c.263]
Окись магния присутствует преимущественно в виде мелких частиц. Во время хлорирования она превращается в основной хлорид магния, обладающий свойством закупоривать фильтровальную ткань, вследствие чего резко ухудшаются условия фильтрования. [c. 38]
38]
Свойства некоторых рассольных и для сравнения других применяемых в химической промышленности хладоносителей приведены в табл. 19.1. Основным показателем, определяющим температурный интервал, в пределах которого возможно использование вещества в качестве хладоносителя, является температура его замерзания. Для обеспечения положительных температур охлаждаемых объектов обычно применяют воду, обладающую наилучшей совокупностью теплофизических свойств, а для умеренного холода — концентрированные водные растворы солей (рассолы), главным образом хлориды кальция, натрия, магния или их смеси. [c.300]
Электролит для получения магния должен обладать высокой электропроводностью (выше, чем у магния), большой плотностью, малой вязкостью, высоким поверхностным натяжением на границах расплав— воздух и металл — электролит. При выборе электролита можно пользоваться диаграммами зависимости физикохимических свойств электролита от его состава (рис.
 XVI-5). Для улучшения этих свойств к электролиту добавляют хлориды натрия, кальция, калия и бария в таких количествах, чтобы содержание хлорида магния составляло не более 18%. [c.513]
XVI-5). Для улучшения этих свойств к электролиту добавляют хлориды натрия, кальция, калия и бария в таких количествах, чтобы содержание хлорида магния составляло не более 18%. [c.513]Опыт 1. Получение и свойства гидроксида магния. Налейте в две пробирки по 3—4 капли раствора хлорида или сульфата магния, по 1—2 капли разбавленного раствора гидроксида натрия или калия и отметьте происшедшие изменения. [c.90]
Проведение опыта. В бокал налить раствор хлорида магния и добавить к нему раствор щелочи. Выпадает осадок гидроокиси магния. Жидкость с осадком разлить в три бокала. В первый бокал добавить раствор щелочи растворение осадка не происходит во второй и третий — прилить соответственно соляную кислоту и избыток насыщенного раствора хлорида аммония. Осадки растворяются. Гидроокись магния проявляет только основные свойства, поэтому растворяется в кислотах. Мд(0Н)2 взаимодействует также с насыщенным раствором хлорида аммония, так как при этом образуется соединение ЫНз-НгО, легко разлагающееся с выделением газообразного аммиака. [c.102]
[c.102]
Магний в промышленных условиях был получен впервые электролизом расплавленного хлорида магния, к которому для снижения температуры плавления электролита и улучшения его физико-химических свойств добавлялись хлориды калия и натрия. Этот способ до настоящего времени сохранил свое значение в производстве магния. [c.287]
Основным компонентом электролитов для получения магния является хлорид магния, имеющий температуру плавления 718 °С. Для снижения температуры плавления электролита в его состав вводят хлориды калия, натрия, кальция. В зависимости от состава различают калиевый, натриево-калиевый, натриево-кальциевый и натриевый электролиты, составы и свойства которых приведены в табл. 5.4. [c.236]
Не менее серьезные проблемы возникают при проведении технологических процессов по переработке нефти. Хотя при первичной подготовке нефти проводятся обессоливание и обезвоживание, хлориды и вода все же попадают в нефть. При дальнейшей переработке нефти вследствие гидролиза хлорида магния и кальция, попадающих в нефть из пластовой воды, в системе появляется хлористый водород, характеризующийся сильными агрессивными свойствами. [c.41]
При дальнейшей переработке нефти вследствие гидролиза хлорида магния и кальция, попадающих в нефть из пластовой воды, в системе появляется хлористый водород, характеризующийся сильными агрессивными свойствами. [c.41]
ЖЕСТКОСТЬ воды — свойство природной воды, обусловленное присутствием в ней растворенных солей кальция и магния. Жесткость воды подразделяется ка карбонатную (временную), обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную (постоянную), обусловленную концентрацией всех других растворенных в воде солей кальция и магния (хлоридов, сульфатов и др.). Суммарное содержание всех солей кальция и магния называется общей жесткостью, которую определяют комплексонометричоским титрованием. Ж. в. можно снизить известковым, содовым, фосфатным, натронным или ионообменным способами, карбонатную Ж. в. — также кипячением. В СССР Ж. в. выражают в миллиграмм-эквивалентах на литр, в некоторых других странах — в т. наз. градусах жесткости. По общепринятой классификации очень мягкая вода в среднем содержит О—1,5 мг-экв/л a или Mg + мягкая [c. 96]
96]
Повторите оба предыдущих опыта, взяв в качестве исходного раствора хлорид магния. Сравните свойства карбонатов кальция и магния (ПPмg Oз =2,1 10 ). [c.249]
Предложен еще один вариант комплексометрического определения сульфата, основанный на первоначальном осаждении сульфата свинца. Этот осадок обладает значительно лучшими свойствами, чем BaS04, а его относительно высокую растворимость можно уменьшить, добавляя этанол. Для проведения определения анализируемый образец, содержащий 5—350 мкг сульфата, обрабатывают известным избытком раствора нитрата свинца в среде, содержащей уксусную кислоту и 25—30% этанола [85]. После фильтрования осадка фильтрат титруют стандартным раствором ЭДТА, используя комплексное соединение медь(П)—ПАН[1-(2-пиридилазо)-2-нафтол] в качестве индикатора. Определению сульфатов описанным методом не мешают ионы калия, натрия, аммония, магния, хлорида, а также СОг однако кальций и фосфат соосаждаются на сульфате свинца и мешают определению сульфатов. [c.535]
[c.535]
При введении оксида магния (дополнительно к оксиду цинка) сшивание замедляется, предельная степень сшивания уменьшается, но комплекс свойств резин улучшается. Роль оксида магния состоит в подавлении реакций сшивания, активируемых хлоридом цинка. Связывая в хлорид магния хлорид водорода, получающийся при вулканизации и термическом дегпдрохлорировании каучука, оксид магния способствует уменьшению концентрации хлорида цинка. Кроме того, на поверхности дисперсных частиц оксида магния адсорбируется и тем самым выводится из реакционной зоны хлорид цинка, который образуется при вулканизации на поверхности частиц ZnO и диффундирует в объем каучуковой матрицы. В результате уменьшается вероятность образования поперечных связей С—С (эти реакции активируются хлоридом цинка) и преобладающими становятся поперечные связи С—О—С, образующиеся в результате гетерогенной реакции. Физико-механические свойства вулканизатов при этом улучшаются. [c.329]
В качестве хладоагента применяется рассол (водный раствор солей — хлорида кальция, хлорида натрия или хлорида магния, — обладающих свойством в зависимости от концентрации понижать температуру замёрзания (или охлаждения) воды.
 [c.178]
[c.178] На рис. 74 можно видеть, что кривыеД0° для многих хлоридов пересекаются друг с другом, следовательно, взаимная их устойчивость меняется с изменением температуры. Это необходимо учитывать при анализе хлорирования многокомпонентного сырья, когда хлориды одних металлов могут быть хлорирующими агентами по отношению к другим металлам или окислам. На том же рисунке видно, что при данной температуре металл способен вытесняться из хлорида другими металлами (восстанавливаться) тем легче, чем выше егоДО°, и, наоборот чем ниже лежит кривая AG° образования хлорида, тем сильнее восстановительные свойства данного металла. Металлические титан, цирконий и гафний получают восстановлением их тетрахлоридов магнием или натрием. Кривые Д0°, Mg и Na l лежат значительно ниже кривых указанных тетрахлоридов, поэтому реакции восстановления протекают практически нацело. Выше 2000° в качестве восстановителя может быть использован водород, так как в этой области кривая для реакции (40) лежит ниже кривых для тетрахлоридов [c. 259]
259]
Щелочные металлы в природе. Получение и свойства щелочных металлов. Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калнй принадлежат к распространенным элементам содержание каждого из них в земной коре равно приблизительно 2% (масс.). Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида илн двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются соликамские месторождения в СССР, стассфуртские в ГДР и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богаз-Гол Каспийского моря, где эта соль в зимние месяцы толстым слое. м осаждается на дне. [c.562]
м осаждается на дне. [c.562]
Катионы 3-й аналитической группы осаждаются в щелочной среде сульфидом аммония при pH 9 в присутствии буферного раствора — смеси гидроокиси и хлорида аммония. 3-ю группу делят на две подгруппы 1) подгруппу катионов, образующих гидроокиси, и 2) подгруппу катионов, образующих сульфиды. Гидроокиси металлов получаются из сульфидов в том случае, когда растворимость гидроокиси меньше, чем растворимость сульфида данного металла. В подгруппе катионов, образующих гидроокиси, ясно заметно влияние диагонального направления в системе Менделеева. По диагоналям расположены элементы, выделяющиеся в этих условиях в виде гидроокисей а) бериллия, алюминия, титана, ниобия б) скандия, циркония, тантала, урана (VI) в) иттрия, гафния, лантана, тория вследствие сходства в свойствах с лантаном и актинием вместе с гидроокисями указанных металлов выпадают также все лантаноиды и актиноиды. Может выпасть и гидроокись магния в отсутствие иона ЫН . Выпадение в этой же подгруппе гидроокиси хрома, Сг(ОН)з, объясняется существованием электронной конфигурации. .. ёЧзК По этой же причине медь с электронной конфигурацией. .. За 1″451 попадает не в 3-ю, а в 4-ю аналитическую группу, образуя сульфид Сы5, не растворимый в кислой среде. Появление внешнего подуровня наблюдается через четыре элемента калий 5, кальций скандий s титан s ванадий хром 5 марганец s железо s кобальт 5% никель 5% медь цинк 5 Поведение ионов ванадия и марганца отличается от поведения хрома, поведение никеля и цинка — от поведения меди. [c.28]
.. ёЧзК По этой же причине медь с электронной конфигурацией. .. За 1″451 попадает не в 3-ю, а в 4-ю аналитическую группу, образуя сульфид Сы5, не растворимый в кислой среде. Появление внешнего подуровня наблюдается через четыре элемента калий 5, кальций скандий s титан s ванадий хром 5 марганец s железо s кобальт 5% никель 5% медь цинк 5 Поведение ионов ванадия и марганца отличается от поведения хрома, поведение никеля и цинка — от поведения меди. [c.28]
Исследовано влияние количества и свойств растворенных солей на разделение суспензий глинистых сланцев [220]. Опыты проведены с применением анионоактнвного, катионоактивного и неионогенного флокулянтов в присутствии хлоридов натрия, кальция и магния, карбонатов натрия, кальция и магния, сульфатов натрия, магния, железа и алюминия при концентрации 100—5000 ч. на 1 млн. Установлено, что эффективность действия флокулянтов зависит от концентрации и валентности ионов солей, причем влияние этих факторов на каждый флокулянт различно. [c.196]
[c.196]
Исследованы псевдоаморфные осадки гидроокиси магния, полученные прилипанием раствора едкого кали к раствору хлорида магния и раствора хлорида магния к раствору едкого кали [235]. При одинаковых размерах первичных и вторичных частиц осадок, полученный по первому способу, состоял из плотных и прочных пластинок с резко очерченными краями, а осадок, полученный по второму способу, — из студенистых образований, легко меняющих форму при механическом воздействии и приближающихся по структуре к частицам гидроокисей железа и алюминия. Такое различие в свойствах осадков объясняется следующим образом. При приливании раствора едкого кали к раствору хлорида магния двухвалентные ионы магния в большей степени уменьшают толщину двойного электрического слоя у поверхности первичных частиц, гидроокиси магния, чем одновалентные ионы калия при обратном порядке смешения растворов. Значительное уменьшение двойногс электрического слоя приводит к более тесному соприкосновеник> первичных частиц при образовании вторичных. [c.207]
[c.207]
Приведите электронные формулы атома магния и кальциа 2.. Как изменяются основные свойства гидроксидов элементов главной подгруппы второй группы периодичес]сой системы Чем это можно объяснить фЗ. Почему гидроксид магния растворяется в соляной кислоте и в растворе хлорида аммонил ф4. Почему карбонаты кальция и магния растворяются в прирсдной воде Составьте уравнения соответствующих реакций. фЗ. Чем обусловливается общая, «временная и постоянная жесткость воды фи. Что принимается за единицу измерения жесткости воды в СССР ф7. На титрование 100 мл воды в присутствии метилового оранжевого затрачено 3,4 мл 0,0988 н. раствора серной кислоты. Вычислите жесткость воды в мэкв/л. ф8. Жесткость воды равна 2,9 мэкв/л. Какое, количество соды нужно прибавить к 1 м такой в( ды для устранения жесткости ф9. Составьте уравнение реакции, происходящей при отвердении гашеной извести. ф10. Как получают негашеную известь В чем заключается процесс гашения навести Выразите происходящие реакции уравнениями. ф11. Почему нельзя осадить полностью гидроксид магния действием гидроксида аммония ф12. Составите уравнения следующих реакций [c.171]
ф11. Почему нельзя осадить полностью гидроксид магния действием гидроксида аммония ф12. Составите уравнения следующих реакций [c.171]
При улавливании аэрозоля окиси магния на головной электрод подавали положительный заряд. При перемене полюсов к. п. д. аппарата несколько снижался, т. е. больший эффект достигался в случае положительного заряда короны. То же наблюдалось для табачного дыма. Однако этот вывод нельзя распространить на другие аэрозоли, так как их физико-химические свойства могут оказать существенное влияние на степень улавливания. Действительно, при улавливании, например, хлорида аммония оптимальные результаты получены при отрицательном заряде короны. В случае улавливания шамотной, апатитовой и других пылей знак заряда коронирующего электрода заметного влияния не оказывал. [c.194]
Жесткостью называется свойство воды, обусловленное присутствием в ней солей кальция и магния. В зависимости от природы анионов различают временную (устранимую, карбонатную) жесткость, зависящую от наличия в воде бикарбонат-ионов НСОз, Жв, и постоянную (некарбонатную) жесткость, вызываемую присутствием хлорид-ионов СГ, нитрат-ионов ЫОз и сульфат-ионов 804 2, Жц. Сумма временной и постоянной жесткости называется общей жесткостью воды [c.73]
Сумма временной и постоянной жесткости называется общей жесткостью воды [c.73]
Признаком молекулярной решетки может служить между прочими свойствами и значение эквивалентной электрической проводимости расплавленной соли. У молекулярных соединений оно сравнительно очень мало. Так, для хлоридов бериллия (молекулярный тип решетки) и хлорида магния (ионный тип) имеем, соответственно, 0,086 и 28,8 Ом см2, для хлорида алюминия (молекулярный тип) и хлорида скандия (ионный тип) — 15-10 и 15 Ом см2. Типичные ионные соединения (например, хлорид натрия) имеют эквивалентную проводимость порядка 100 (для Na l). [c.282]
Кроме снижения температуры плавления, солевые добавки к Mg l2 существенно улучшают физико-химические свойства электролита. Добавка хлоридов калия и натрия повышает удельную электропроводность электролита, которая для указанных выше составов при 700 С составляет от 1,30 до 1,90 ом — см-К Для хлоридов калия, натрия и магния, а также для карналлита в табл. 42 приведены значения удельной электропроводности в зависимости от температуры. [c.291]
42 приведены значения удельной электропроводности в зависимости от температуры. [c.291]
Полученный электролизом или термическими способами магний-сырец содержит ряд примесей, отрицательно влияющих на его коррозионную стойкость и механические свойства. Эти примеси можно зазделить на металлические и неметаллические. К металлическим относятся На, К, Са и Ре, попадающие в магний при определенных условиях либо при электролизе, либо путем восстановления их соединений в исходной шихте металлическим магнием. Основными неметаллическими примесями в электролитическом магнии являются хлориды всех компонентов расплава, захватываемые магнием при извлечении его из ванны. Кроме того, в магнии-сырце встречаются примеси окиси магния, нитриды и карбиды. Термический магний не содержит хлоридов, но в нем встречаются окислы магния, кальция и железа и нитриды магния. Общее количество примесей в магнии-сырце может достигать нескольких процентов. Такой металл непригоден для употребления и подлежит рафинированию.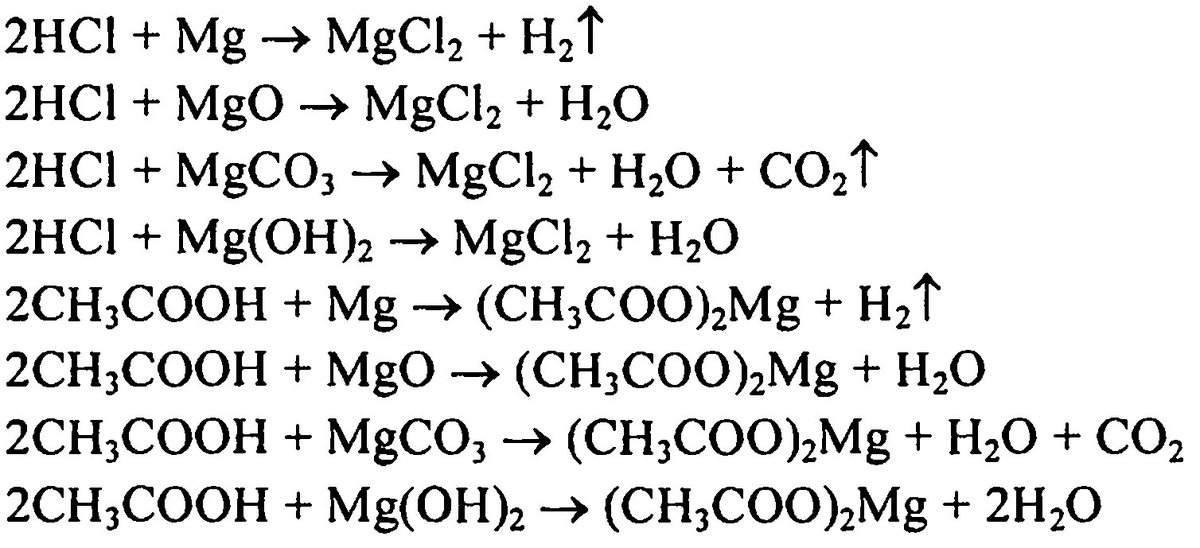 По ГОСТ 804—49 магний марки МГ-Гдолжен содержать 99,91% Mg и не более 0,09% суммы примесей, в том числе не более 0,04% Ре 0,03% 51 0,005% СЬ 0,01% На 0,005% К 0,01% Си и 0,001% N1. По тому же ГОСТ для марки МГ-2 общее количество примесей в магнии допускается не более 0,15%. [c.300]
По ГОСТ 804—49 магний марки МГ-Гдолжен содержать 99,91% Mg и не более 0,09% суммы примесей, в том числе не более 0,04% Ре 0,03% 51 0,005% СЬ 0,01% На 0,005% К 0,01% Си и 0,001% N1. По тому же ГОСТ для марки МГ-2 общее количество примесей в магнии допускается не более 0,15%. [c.300]
Получение и свойства. Строение кристаллических решеток. Получают эти металлы обычно электролизом расплавленных хлоридов, магний — также восстановлением оксида MgO углем в электрических печах и другими способами. Барий чаще всего получают алюминотермическим способом. Бериллий, магний и при высокой температуре кальций образуют кристаллы с гексагональной плотной упаковкой, а стронций и при низкой температуре кальций имеют кубическую гранецентрированную решетку. Для бария характерна объемноцентриро-ванная упаковка. Это различие решеток играет некоторую роль в нарушении закономерности различий плотности, температур плавления и других физических свойств. Атомы их, кроме бериллия, теряют два электрона, превращаясь в ионыЭ . Но их восстановительная способность слабее, чем у щелочных металлов. [c.275]
Но их восстановительная способность слабее, чем у щелочных металлов. [c.275]
Магний — важная часть легких сплавов, отвечающих составам [в 7о(масс,)] 89—91 А1 и 9—11 —магналий] до 10,5 А1, 4,5 2п, 17 Мп и до 83 Mg —электрон. Эти сплавы обладают хорошими механическими и антикоррозионными свойствами, немагнитны и не искрят при ударах и трении. Они нашли применение в самолетостроении и в производстве наземного транспорта. Магний используют для получения металлов из трудновос-станавливаемых оксидов и хлоридов. Способность магния гореть на воздухе ослепительно ярким пламенем изобилующим лучами коротких длин волн, используется в пиротехнике и при фотосъемках. Из соединений маг- [c.426]
Магний — главный антистрессовый макроэлемент!
Мурзаева Ирина Юрьевна
Эндокринолог, Врач превентивной медицины
Не так давно я стала увлекаться проблемами нарушений важнейших микро(макро)элементов в организме человека, а началось все с поиска причин аутоиммунного тиреоидита и причин его распространенности, с учебника по нарушению микроэлементов при АИТ, затем тема стала расширяться в поиске причин «массового выпадения волос», в том числе у детей, поиска причин частых ОРВИ у детей … дальше — больше. Оказалось, нарушение микроэлементного состава тела человека — огромная наука и не один ученый России этим занимается, но тема эта мало освещена и мало литературы, где с ней можно ознакомиться :!:Но, кто ищет — тот всегда найдет.
Сегодня начинаем разговор о важнейших для человека микроэлементах и макроэлементах.
Магний — минерал, который сейчас активно обсуждается и рекламируется … «магний от стресса», «магний от раздражительности», «магний от аритмии», «магний от судорог» «магний при гипертонусе матки при беременности» и т.д. МагнеВ6 и Магнелис, пожалуй, самые знаменитые препараты магния. Но это только вершина айсберга, магний не так прост … )
Магний участвует более чем в 300 ферментных процессах в организме, магний, наряду с натрием и калием, является — жизненно-необходимым макроэлементом (даже не микроэлементом 🙂 ).
В организме всего 24 гр магния (это немного), но без него не возможно ни проведение нервного импульса по нервным волокнам, ни сокращение сердца, ни сокращение мышц, ни регулировка артериального давления, без него нарушается свертывание крови, нарушается аппетит, может быть тошнота и рвота и др нарушения. Про магний написана отдельная книга, это серьезная научная работа, объемом 800 стр под названием «Магний и болезни цивилизации». Я не буду в этой статье освещать все важнейшие «точки приложения» магния в организме, как нибудь позже, лучше я расскажу о его практическом применении …
Магний — минерал , который сложно «накопить» в организме , расходуется он крайне быстро , и чем больше стрессов , тем сильнее выражен дефицит магния … Но не все препараты магния могут успешно восполнить его дефицит …. Для его всасывания и для лучшего эффекта в той или иной ситуации, важно понимать с чем магний «соединен» . Объясняю подробнее … Для того чтобы поступить в организм , магний должен быть «в составе » соли или какого либо органического соединения , и вот от характера «этого проводника -соли или органики «будет зависеть эффект магния и усваиваемость.
Теперь об усвоении магния : магний может существовать в следующих 15 формах —
магния цитрат , магния малат, глицинат и биглицинат магния ,магния треонат,магния карбонат, магния лактат , магния таурат,хлорид магния ,магния оротат. магния сульфат, магния хелат, оксид магния , глутамат и аспартат магния.
А теперь расшифровываю :
Магния цитрат— магниевая соль лимонной кислоты , самая усваиваемая форма магния , используется в большинстве известных препаратов — магнеВ6 и магнелис , магний цитрат солгар и др , используется чаще как спазмолитик , снимает спазмы ЖКТ , то есть облегчает запоры и нарушение желчеотделения , хорош в гастроэнтерологии .
Магния малат — магниевая соль яблочной кислоты ,хорошо облегчает гипомагниевые судороги мышц , снимает утомление и интоксикацию алюминием в организме.
Магния треонат — в соединении с треоновой кислотой , в исследованиях улучшает долгосрочную и краткосрочную память , лучше , чем магния цитрат
Магния таурат — халатная форма магния , очень биодоступна , хорошо использовать при инсулиновой и лептинорезистентсноти , то есть снижает тягу с перееданию сладкого и «ночной жор».
Оксид магния —может использоваться только в случае снижения повышенной кислотности желудка , в других случаях вызывает выраженную осмотическую диарею.Поэтому хорош при запорах.
Хлорид магния — используется в основной как соль для ванн с успокаивающим эффектом на нервную систему , но об этом позже .
Магния оротат — соединение магния с оротовой кислотой , обладает преимущественным эффектом на сердечную мышцу , используется при нарушениях ритма и ВПС по типу пролапса митрального клапана .
Магния сульфат — соединён с серной кислотой , используется в соли для ванн ( в таком виде практически незаменим) ,в «знаменитых» в/ в инъекциях , в основном для купирования гипертонических кризов .
Аспартат и глутамат магния — лучше не использовать , относят к классу эндотоксинов .
Глицинат и бисглицинат магния—хорошая форма магния, в смеси с глицином , хорошо подходит при синдроме хронической усталости и тазовой боли , хорошо тем , что не вызывает слабительный эффект .
Магния лактат — искусственно синтезированная, недорогая форма магния , имеет общеукрепляющий эффект , как вспомогательное вещество используется в большинстве препаратов магния как составная часть.
Магния карбонат — также используется при повышенной кислотности желудка, нейтрализует действие НПВС , хорош при ГэРБ, нельзя при фенилкетонурии .
Магния хелат — это форма магния , погружённого в аминокислоту , что облегчает биодоступность. Усваиваемость хелата и соответственно магния из него — 90% , он не меняет кислотности желудка , в отличие от форм , соединённых с кислотами— поэтому подходит всем , но соответственно менее эффективен при запоре и др дискинезиях ЖКТ, но редко встречается в розничной продаже и это дорогая форма магния .
Магний находится в тесной взаимосвязи с кальцием, витаминами К2 и D3. Баланс этих четырёх элементов поможет сохранить здоровье без осложнений.
Только для функции ЩЖ магний имеет менее значимое влияние , чем селен , йод и железо , например.
Теперь о моей любимой форме магния …… Если вам не хочется глотать таблетки , слабительный эффект вам не нужен , а нервы «на пределе и вы не можете уснуть» , было бы не плохо провести программу Антистресс или Детоксикации—Ваш идеальный вариант- Ванны с английской солью, а, проще говоря, ванны с сульфатом магния 0,5- 1 кг соли на 1 ванну и уже в течение первых 15 минут «вы начнете заспать в ванной».
Ниже привожу опросники, по которым вы можете определить нехватку магния у взрослого человека и ребенка.
ФАРМАЦЕВТИЧЕСКАЯ ПРОДУКЦИЯ (натрия ацетат, натрия хлорид, калия хлорид, натрия ацетат, натрия хлорид, калия хлорид; метамизол натрия; желатина полісукцинат + натрия ацетата тригидрат + натрия хлорид + калия хлорид + кальция хлорида дигидрат + магния хлорида гексагидрат + натрия гидроксид; гидроксиэтилкрахмал; декстроза; эуфиллин; калия хлорид; кальция глюконат; левофлоксацин; магния сульфат;маннитол; метронідазо; натрия гидрокарбонат; сальбутамола сульфат; прокаїна гидрохлорид; декстран+натрия хлорид; сорбитол, натрия лактат, натрия хлорид, кальция хлорида дигидрат, калия хлорид, магния хлорида гексагидрат; натрия хлорид, калия хлорид, кальция хлорида дигидрат;натрия хлорид, калия хлорид, кальция хлорида дигидрат, натрия лактат;калия хлорид + кальция хлорид + магния хлорид + натрия лактат + натрия хлорид + сорбитол; аргініна гидрохлорид; натрия хлорид, калия хлорид, натрия гидрокарбонат; цитиколина натрия) UA-2017-03-06-002119-b: 211 282.00 грн
Шановний Користувач електронного майданчика «Zakupki UA»,
для використання електронного майданчика «Zakupki UA» з метою участі у якості учасника у закупівлях у відповідності до законодавства у сфері публічних закупівель, кожен Користувач, крім реєстрації/авторизації на електронному майданчику «Zakupki UA», має:
- прийняти (акцептувати) Пропозицію ТОВАРИСТВА З ОБМЕЖЕНОЮ ВІДПОВІДАЛЬНІСТЮ «ЗАКУПІВЛІ ЮА» укласти Договір про надання послуг (приєднатися до Договору) шляхом здійснення оплати з власного поточного (розрахункового) рахунку за наданим Оператором рахунком, відповідно до умов Договору;
- пройти ідентифікацію та отримати від Оператора доступ до електронної системи закупівель.
Користувачі мають змогу ознайомитись з чинними редакціями Регламенту електронного майданчика «Zakupki UA» і Тарифів електронного майданчика «Zakupki UA» за посиланнями: https://zakupki.com.ua/reglament і https://zakupki.com.ua/pricing.
З повагою,
Служба підтримки Zakupki UA
[email protected]
%d0%bc%d0%b0%d0%b3%d0%bd%d0%b8%d1%8f%20%d1%85%d0%bb%d0%be%d1%80%d0%b8%d0%b4 — с русского на все языки
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАнглийскийНемецкийНорвежскийКитайскийИвритФранцузскийУкраинскийИтальянскийПортугальскийВенгерскийТурецкийПольскийДатскийЛатинскийИспанскийСловенскийГреческийЛатышскийФинскийПерсидскийНидерландскийШведскийЯпонскийЭстонскийТаджикскийАрабскийКазахскийТатарскийЧеченскийКарачаевскийСловацкийБелорусскийЧешскийАрмянскийАзербайджанскийУзбекскийШорскийРусскийЭсперантоКрымскотатарскийСуахилиЛитовскийТайскийОсетинскийАдыгейскийЯкутскийАйнский языкЦерковнославянский (Старославянский)ИсландскийИндонезийскийАварскийМонгольскийИдишИнгушскийЭрзянскийКорейскийИжорскийМарийскийМокшанскийУдмурдскийВодскийВепсскийАлтайскийЧувашскийКумыкскийТуркменскийУйгурскийУрумскийЭвенкийскийБашкирскийБаскский
Соль для ванн хлорида магния гексагидрат — Группа PCC
Чтобы связаться с нами при помощи выше излагаемого вопросника, заполните пожалуйста данные, указанные в анкете. Предоставление данных является добровольным, но если Вы этого не сделаете, у Вас не будет возможности отправить нам сообщение таким образом.
Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящаяся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша). Вы можете связаться с нашим инспектором по защите персональных данных при помощи электронной почты: hide_email_a address=»[email protected]».
Мы обрабатываем Ваши данные для общения с Вами и чтобы отвечать на Ваши вопросы. Основанием для обработки Ваших данных является реализация законодательно обоснованной заинтересованности администратора или законодательно обоснованная заинтересованность третьей стороны (обратная связь с Вами, маркетинг наш или наших партнеров, в частностиКомпании PCC, на который Вы можете не выразить своего согласия), либо обработка Вашего запроса перед заключением потенциального договора в зависимости от содержания Вашего сообщения.
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Экспериментальное определение константы растворимости гидрата гидроксида хлорида магния (Mg3Cl (OH) 5 · 4h3O, фаза 5) при комнатной температуре и ее значение для изоляции ядерных отходов в геологических хранилищах в солевых формациях
В данном исследовании константа растворимости гидрата гидроксида хлорида магния, Mg 3 Cl (OH) 5 · 4H 2 O, обозначенная как фаза 5, определяется из серии экспериментов по растворимости в растворах MgCl 2 –NaCl.Константа растворимости в логарифмических единицах при 25 ° C для следующей реакции Mg3Cl (OH) 5 · 4h3O + 5H + = 3Mg2 ++ 9h3O (l) + Cl- рассчитывается как 43,21 ± 0,33 (2 σ ) на основе модель теории специфического взаимодействия (SIT) для экстраполяции на бесконечное разбавление. Свободная энергия Гиббса и энтальпия образования для фазы 5 при 25 ° C получены как -3384 ± 2 (2 σ ) кДж моль -1 и -3896 ± 6 (2 σ ) кДж моль -1. соответственно.
MgO (объемный чистый MgO, соответствующий минеральному периклазу) — единственный инженерный барьер, сертифицированный Агентством по охране окружающей среды (EPA) для размещения на экспериментальной установке по изоляции отходов (WIPP) в США, и Mg (OH) 2 Инженерный барьер на основе (объемный чистый Mg (OH) 2 , соответствующий бруситу) будет использоваться в хранилище Asse в Германии.Фаза 5 и аналогичная фаза, фаза 3 (Mg 2 Cl (OH) 3 · 4H 2 O), могла бы сыграть значительную роль в влиянии на геохимические условия в геологических хранилищах ядерных отходов в соляных формациях, где MgO или брусит используются в качестве инженерных барьеров. Основываясь на нашей константе растворимости для фазы 5 в сочетании с литературным значением для фазы 3, мы прогнозируем, что состав для инвариантной точки фазы 5 и фазы 3 будет m Mg = 1.70 и pmH = 8.94 в двойной системе Mg – Cl. Недавние базовые расчеты оценки производительности приложения для повторной сертификации WIPP показывают, что фаза 5, вместо фазы 3, действительно является стабильной фазой, когда WIPP Generic Weep Brine (GWB), рассол с преобладанием Na-Mg-Cl, связанный с формацией Саладо, уравновешивается с фазами источника актинидов, бруситом, карбонатами магния, галитом и ангидритом. Таким образом, этап 5 важен для WIPP и потенциально важен для других хранилищ в соляных формациях.
Термодинамические свойства гидрата гидроксида хлорида магния (Mg3Cl (OH) 5: 4h3O, фаза 5) и его значение для изоляции ядерных отходов в геологических хранилищах в соляных формациях
Абстрактные
MgO (объемный чистый MgO, соответствующий минеральному периклазу) — единственный инженерный барьер, сертифицированный Агентством по охране окружающей среды для размещения на экспериментальной установке по изоляции отходов (WIPP) в США, а также инженерный барьер на основе Mg (OH) 2 ( объемный чистый Mg (OH) 2, соответствующий бруситу) должен использоваться в хранилище Asse в Германии.И WIPP, и Asse расположены в соляных образованиях. WIPP — это геологическое хранилище Министерства энергетики США, используемое для постоянного захоронения трансурановых отходов оборонного назначения (отходы TRU). Хранилище находится на 655 м ниже поверхности и расположено в формации Саладо, пермском соляном пласте, в основном состоящем из галита и меньшего количества полигалита, ангидрита, гипса, магнезита, глин и кварца. WIPP Generic Weep Brine (GWB), рассол с преобладанием Na-Mg-Cl, связан с формацией Саладо.Предыдущим поставщиком MgO для WIPP была компания Premier Chemicals, а текущим поставщиком — Martin Marietta Materials. Экспериментальные исследования Premier MgO и Martin Marietta MgO с GWB в SNL указывают на образование гидрата гидроксида хлорида магния, Mg3Cl (OH) 5: 4h3O, называемого фазой 5. Однако эта важная фаза отсутствует в существующей термодинамической базе данных. В этом исследовании константа растворимости фазы 5 определяется из серии экспериментов по растворимости в растворах MgCl2-NaCl.Константа растворимости при 25 oC для следующей реакции, Mg3Cl (OH) 5: 4h3O + 5H + = 3Mg2 + + 9h3O (l) + Cl-, рекомендуется как 43,21 ± 0,33 (2σ) на основе модели специфической теории взаимодействия (SIT) для экстраполяция на бесконечное разбавление. Значение log K, полученное с помощью уравнений Питцера, идентично приведенному выше значению в пределах указанной неопределенности. Свободная энергия Гиббса и энтальпия образования для фазы 5 при 25 ° C получены как -3384 ± 2 (2σ) кДж моль-1 и -3896 ± 6 (2σ) кДж моль-1, соответственно. Стандартные энтропия и теплоемкость фазы 5 при 25 oC оцениваются как 393 ± 20 Дж · моль-1 · K-1 и 374 ± 19 Дж · моль-1 · K-1 соответственно.Фаза 5 и аналогичная ей фаза 3 (Mg2Cl (OH) 3: 4h3O) могут играть важную роль в влиянии на геохимические условия в геологических хранилищах ядерных отходов в солевых формациях, где MgO или брусит используются в качестве искусственных барьеров, когда Рассолы с преобладанием Na-Mg-Cl реагируют с MgO или бруситом. Основываясь на нашей константе растворимости для фазы 5 в сочетании с литературным значением для фазы 3, мы прогнозируем, что состав для инвариантной точки фазы 5 и фазы 3 будет mMg = 1.70 и pmH = 8.93 в двойной системе Mg-Cl. Недавние расчеты исходных условий PA по заявке на повторную сертификацию WIPP показывают, что фаза 5 вместо фазы 3 действительно является стабильной фазой, когда GWB уравновешивается с фазами, являющимися источниками актинидов, бруситом, карбонатами магния, галитом и ангидритом. 1. Это исследование финансируется программами WIPP, администрируемыми Министерством энергетики США. 2. Sandia — это многопрограммная лаборатория, управляемая Sandia Corporation, входящей в состав компании Lockheed Martin, для Национального управления ядерной безопасности Министерства энергетики США по контракту DE-AC04-94AL85000.
Хлорид магния | Encyclopedia.com
ОБЗОР
Хлорид магния (mag-NEE-zee-um KLOR-ide) представляет собой белое кристаллическое твердое вещество, которое сильно расплывается. Он поглощает влагу из воздуха, превращаясь в гидратированную форму, гексагидрат хлорида магния (MgCl 2 · 6H 2 O). Расплывающееся вещество — это вещество, которое поглощает влагу из воздуха, часто до такой степени, что растворяется в собственной гидратационной воде. Хлорид магния является важным промышленным химическим веществом, используемым в производстве магния, текстиля и бумаги, а также цементов; в холодильной и противопожарной защите; и как средство против обледенения.
КЛЮЧЕВЫЕ ФАКТЫ
ДРУГИЕ НАИМЕНОВАНИЯ:
Дихлорид магния
ФОРМУЛА:
MgCl 2
ЭЛЕМЕНТЫ:
Магний, хлор
ТИП СОЕДИНЕНИЯ:
Неорганическая соль; бинарная соль
СОСТОЯНИЕ:
Твердый
МОЛЕКУЛЯРНЫЙ ВЕС:
95,21 г / моль
ТОЧКА ПЛАВЛЕНИЯ:
714 ° C (1320 ° F)
ТОЧКА КИПЕНИЯ:
1412 ° C (2574 ° F)
РАСТВОРИМОСТЬ:
Растворим в воде; умеренно растворим в этиловом спирте
КАК ЭТО ПРОИЗВОДИТСЯ
Хлорид магния извлекается из морской воды или рассола, в состав которого он входит, и из минералов, таких как карналлит (KCl · MgCl 2 · H 2 O) и бишофит (MgCl 2 · 6H 2 O).Обычная процедура заключается в обработке морской воды, рассола или минерала известью (CaO), кальцинированным доломитом (CaO · MgO) или едким натром (гидроксид натрия; NaOH) для получения гидроксида магния [Mg (OH) 2 ], который затем обрабатывают соляной кислотой (HCl) для извлечения хлорида магния, который обычно получают в виде кристаллического гексагидрата. Чистое соединение также получают путем нагревания двойной соли, хлорида магния-аммония (MgCl 2 · NH 4 Cl · 6H 2 O), которая сначала теряет гидратную воду с образованием безводной двойной соли (MgCl ). 2 · NH 4 Cl).При дальнейшем нагревании хлорид аммония возгоняется, оставляя чистый безводный хлорид магния.
ОБЫЧНОЕ ИСПОЛЬЗОВАНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Хлорид магния чаще всего применяется в производстве металлического магния. Металл получают путем электролиза расплавленного хлорида магния в процессе, разработанном американским химиком и изобретателем Гербертом Генри Доу (1866–1930) в 1916 году. Процесс Доу по-прежнему является основным методом производства металлического магния.Другие коммерческие и промышленные применения хлорида магния включают:
- При производстве дезинфицирующих средств;
- При огнестойкости стальных балок, деревянных панелей и других материалов;
- В составе огнетушителей;
- При производстве так называемого цемента Сорель используется смесь хлорида магния и оксида магния, также известная как оксихлоридный цемент;
- В качестве связующего для борьбы с пылью на грунтовых дорогах;
- В качестве средства для борьбы с обледенением;
- Для удаления взвешенных частиц в водоочистных сооружениях и очистных сооружениях;
- Для обработки хлопчатобумажных и шерстяных тканей;
- При переработке сахарной свеклы;
- Для охлаждения бурового инструмента; и
- При производстве бумаги и керамических материалов.
Интересные факты
- Тофу традиционно готовят путем обработки соевого молока хлоридом магния или сульфатом кальция.
Слова, которые нужно знать
- БЕЗВОДНЫЙ
- Соединение, в котором отсутствует гидратная вода.
- DELIQUESCENT
- Описание вещества, которое впитывает влагу из воздуха, часто до такой степени, что растворяется в собственной гидратационной воде.
- ГИДРАТ
- Химическое соединение, образующееся, когда одна или несколько молекул воды физически добавляются к молекуле другого вещества.
- СУБЛИМАЦИЯ
- Процесс, при котором твердое тело превращается непосредственно в газ без предварительного плавления.
- УВЛАЖНЯЮЩАЯ ВОДА
- Вода, которая каким-либо физическим образом соединяется с компаундом.
Хлорид магния вызывает раздражение кожи, носа и глаз, хотя эта опасность обычно беспокоит только тех, кто работает с чистым соединением. Он также токсичен при приеме внутрь. Проглатывание соединения может вызвать тошноту, рвоту и диарею.Вдыхание паров хлорида магния может раздражать легкие и дыхательные пути, вызывая состояние, известное как лихорадка от паров металлов, напоминающая грипп.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
«Хлорид магния». ChemicalLand21.com. http://www.chemicalland21.com/arokorhi/industrialchem/inorganic/MAGNESIUM%20CHLORIDE.htm (по состоянию на 14 октября 2005 г.).
«Хлорид магния». Дж. Т. Бейкер. http://www.jtbaker.com/msds/englishhtml/m0156.htm (по состоянию на 14 октября 2005 г.).
См. Также Гидроксид магния
Последние достижения в синтезе наноструктурированного гидроксида магния
В этом обзоре освещаются синтетические пути получения наноструктурированного гидроксида магния и уделяется внимание тому, как эти различные препаративные подходы могут производить наночастицы Mg (OH) 2 наночастиц с контролируемым размером и морфологией.Нанокристаллы Mg (OH) 2 со стержневой, игольчатой, полой трубчатой или пластинчатой морфологией могут быть синтезированы путем модификации химических и физических параметров эксперимента, таких как выбор предшественника магния, растворителя и температуры или с использованием модификаторов поверхностей и шаблонов. Методы, основанные на гидротермальной / сольвотермической обработке, микроволновом нагреве и (со) осаждении, являются доминирующими в производстве Mg (OH) 2 в наномасштабе, но сейчас появляются и другие подходы к дизайну материалов.Bulk Mg (OH) 2 широко изучается на протяжении десятилетий и находит применение в широком диапазоне приложений. Кроме того, гидроксид также может служить предшественником других коммерчески важных материалов, таких как MgO. Наноструктурирование материала оказалось чрезвычайно полезным для изменения некоторых из его наиболее важных свойств — не в последнюю очередь для улучшения характеристик Mg (OH) 2 как нетоксичного антипирена — но в равной степени это открывает новые возможности для прикладных исследований.Мы оцениваем здесь последние усилия по разработке новых путей синтеза нано-Mg (OH) 2 , чтобы понять механизмы роста кристаллитов и приспособить микроструктуру к конкретным свойствам и областям применения.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?терапевтических применений магния — Американский семейный врач
2. Алаймо К., Макдауэлл, Массачусетс, Брифель РР, и другие.Диетическое потребление витаминов, минералов и клетчатки людьми в возрасте 2 месяцев и старше в Соединенных Штатах: Третье национальное обследование здоровья и питания, фаза 1, 1988–91 Adv Data . 1994; (258): 1-28.
3. Marier JR. Содержание магния в продуктах питания в современном мире. Магний . 1986; 5 (1): 1–8.
4. Томас Д. Исследование истощения минеральных веществ в пищевых продуктах, доступных нам как нации, в период с 1940 по 1991 год. Nutr Health . 2003. 17 (2): 85–115.
5. LaValle JB. Скрытые нарушения метаболического синдрома: вызванное лекарствами истощение питательных веществ как путь к ускоренной патофизиологии метаболического синдрома. Альтернативная медицина здравоохранения . 2006. 12 (2): 26–31.
6. Герреро-Ромеро Ф, Родригес-Моран М. Гипомагниемия связана с низким уровнем холестерина ЛПВП в сыворотке крови независимо от уровня глюкозы в сыворотке. J Осложнения диабета . 2000. 14 (5): 272–276.
7. Gropper SS, Смит JL, Groff JL. Магний. Продвинутое питание и метаболизм человека . 4-е изд., Бельмонт, Калифорния:: Издательство Уодсворта; 2005
8. Совет по пищевым продуктам и питанию, Институт медицины. Нормы потребления кальция, фосфора, магния, витамина D и фторида с пищей . Вашингтон, округ Колумбия: Национальная академия прессы; 1997.
9. Elin RJ. Магний: пятый, но забытый электролит. Ам Дж. Клин Патол . 1994. 102 (5): 616–622.
10. Такая Дж., Хигашино Х, Кобаяши Ю. Внутриклеточный магний и инсулинорезистентность. Magnes Res . 2004. 17 (2): 126–136.
11. Ньюхаус Ай Джей, Finstad EW. Влияние добавок магния на физическую работоспособность. Clin J Sport Med . 2000. 10 (3): 195–200.
12. Бол. Volpe SL. Магний и упражнения. Crit Rev Food Sci Nutr .2002. 42 (6): 533–563.
13. Грубый РК, Shils ME. Магний. В: Shils ME, Шике М, Росс AC, Кабальеро Б, Кузинс Р.Дж. , ред. Современное питание в условиях здоровья и болезней . 10-е изд. Филадельфия, Пенсильвания: Lippincott Williams & amp; Уилкинс; 2005: 223–248.
14. Чубанов В, Гудерманн Т, Schlingmann KP. Существенная роль TRPM6 в эпителиальном транспорте магния и гомеостазе магния в организме. Арка Пфлюгерса . 2005. 451 (1): 228–234.
15. Paolisso G, Барбагалло М. Гипертония, сахарный диабет и инсулинорезистентность: роль внутриклеточного магния. Am J Hypertens . 1997. 10 (3): 346–355.
16. Барбагалло М, Домингес Л.Дж., Галиото А, и другие. Роль магния в действии инсулина, диабете и кардиометаболическом синдроме X. Mol Aspect Med . 2003. 24 (1–3): 39–52.
17. Суарес А, Пулидо Н, Касла А, Казанова Б, Арриета Ф.Дж., Ровира А. Нарушение тирозинкиназной активности мышечных рецепторов инсулина крыс с гипомагниемией. Диабетология . 1995. 38 (11): 1262–1270.
18. Ю. Ю., Ли СК, Ян С.Д. Влияние концентраций Mg2 + на фосфорилирование / активацию киназы фосфорилазы b cAMP / Ca (2 +) — независимой, зависимой от аутофосфорилирования протеинкиназой. J Protein Chem . 1995. 14 (8): 747–752.
19. Арнер П., Pollare T, Лителл H, Ливингстон Дж. Н. Дефектная тирозинкиназа рецептора инсулина в скелетных мышцах человека при ожирении и сахарном диабете 2 типа (инсулинозависимый). Диабетология . 1987. 30 (6): 437–440.
20. Witlin AG, Сибай БМ. Терапия сульфатом магния при преэклампсии и эклампсии. Акушерский гинекол . 1998. 92 (5): 883–889.
21. Дулей Л., Хендерсон-Смарт Д. Сульфат магния против фенитоина при эклампсии. Кокрановская база данных Syst Rev . 2003; (4): CD000128.
22. Дулей Л., Гюльмезоглу AM. Сульфат магния против литического коктейля при эклампсии. Кокрановская база данных Syst Rev . 2001; (1): CD002960.
23. Белфорт М.А., Энтони Дж, Сааде Г.Р., Аллен Дж. К. Младший, для исследовательской группы нимодипина. Сравнение сульфата магния и нимодипина для профилактики эклампсии. N Engl J Med . 2003. 348 (4): 304–311.
24. Дулей Л., Гюльмезоглу А.М., Хендерсон-Смарт Диджей. Сульфат магния и другие противосудорожные препараты для женщин с преэклампсией. Кокрановская база данных Syst Rev . 2003; (2): CD000025.
25. Альтман Д., Карроли Дж., Дулей Л., и другие. Польза от сульфата магния для женщин с преэклампсией и их младенцев? The Magpie Trial: рандомизированное плацебо-контролируемое исследование. Ланцет . 2002; 359 (9321): 1877–1890.
26. Банай С, Цивони Д. Медикаментозная терапия при пуантах. Дж Кардиоваск Электрофизиол . 1993. 4 (2): 206–210.
27. Оналан О, Кристалл E, Даула А, Лау С, Кристалл А, Лашевский И. Метаанализ терапии магнием для неотложной помощи при быстрой фибрилляции предсердий. Ам Дж. Кардиол . 2007. 99 (12): 1726–1732.
28.Башир Ы, Снеддон Дж. Ф., Стонтон HA, и другие. Эффект долгосрочной пероральной замены хлорида магния при застойной сердечной недостаточности, вторичной по отношению к ишемической болезни сердца. Ам Дж. Кардиол . 1993. 72 (15): 1156–1162.
29. Rowe BH, Bretzlaff JA, Бурдон С, Бота ГВ, Камарго Калифорния младший Сульфат магния для лечения обострений острой астмы в отделении неотложной помощи. Кокрановская база данных Syst Rev .2000; (2): CD001490.
30. Чеук Д.К., ТЦ Чау, Ли SL. Метаанализ внутривенного введения сульфата магния для лечения острой астмы. Арч Дис Детский . 2005. 90 (1): 74–77.
31. Фогарти А, Льюис С.А., Scrivener SL, и другие. Пероральные добавки магния и витамина С при астме: рандомизированное плацебо-контролируемое исследование в параллельных группах. Clin Exp Allergy . 2003. 33 (10): 1355–1359.
32.Блиц М, Блиц S, Бизели Р, и другие. Ингаляция сульфата магния при лечении острой астмы. Кокрановская база данных Syst Rev . 2005 (4): CD003898.
33. Маускоп А, Альтура БТ, Cracco RQ, Altura BM. Внутривенный сульфат магния снимает кластерные головные боли у пациентов с низким уровнем ионизированного магния в сыворотке крови. Головная боль . 1995. 35 (10): 597–600.
34. Маускоп А, Альтура БТ, Altura BM.Уровни ионизированного магния в сыворотке и соотношение ионизированного кальция / ионизированного магния в сыворотке крови у женщин с менструальной мигренью. Головная боль . 2002. 42 (4): 242–248.
35. Peikert A, Вилимциг С, Кёне-Волланд Р. Профилактика мигрени пероральным приемом магния: результаты проспективного многоцентрового плацебо-контролируемого двойного слепого рандомизированного исследования. Цефалгия . 1996. 16 (4): 257–263.
36. Pfaffenrath V, Уэссели П., Мейер С, и другие.Магний в профилактике мигрени — двойное слепое плацебо-контролируемое исследование. Цефалгия . 1996. 16 (6): 436–440.
37. Бигал М.Э., Бордини CA, Теппер С.Ю., Speciali JG. Внутривенное введение сульфата магния в остром лечении мигрени без ауры и мигрени с аурой. Рандомизированное двойное слепое плацебо-контролируемое исследование. Цефалгия . 2002. 22 (5): 345–353.
38. Holtmeier W, Хольтманн Г, Каспары ВФ, Weingärtner U.Лечение по требованию острой изжоги антацидным гидротальцитом по сравнению с фамотидином и плацебо: рандомизированное двойное слепое перекрестное исследование. Дж Клин Гастроэнтерол . 2007. 41 (6): 564–570.
39. DeVault KR. Лечение симптомов перемежающегося рефлюкса: не всем подходит один размер [редакционная статья]. Дж Клин Гастроэнтерол . 2007. 41 (6): 546–547.
40. Рамкумар Д, Рао СС. Эффективность и безопасность традиционных методов лечения хронических запоров: систематический обзор. Ам Дж. Гастроэнтерол . 2005; 100 (4): 936–971.
41. Andrews CN, Bharucha AE. Обзор: веские доказательства поддерживают использование полиэтиленгликоля и тегасерода при запорах. ACP J Club . 2005; 143 (2): 47.
42. Стендиг-Линдберг Г, Теппер Р, Лейхтер И. Плотность трабекулярной кости в двухлетнем контролируемом исследовании перорального применения магния при остеопорсе. Magnes Res . 1993. 6 (2): 155–163.
43. Такер К.Л., Ханнан М.Т., Чен Х, Капплс Лос-Анджелес, Уилсон П.В., Кильский DP.Потребление калия, магния, фруктов и овощей связано с большей минеральной плотностью костей у пожилых мужчин и женщин. Ам Дж. Клин Нутр . 1999. 69 (4): 727–736.
44. He K, Лю К, Давиглус М.Л., и другие. Потребление магния и частота метаболического синдрома среди молодых людей. Тираж . 2006. 113 (13): 1675–1682.
45. Герреро-Ромеро Ф, Родригес-Моран М. Гипомагниемия, окислительный стресс, воспаление и метаболический синдром. Diabetes Metab Res Rev. . 2006. 22 (6): 471–476.
46. Молодой Г.Л., Джуэлл Д. Вмешательства при судорогах ног при беременности. Кокрановская база данных Syst Rev . 2002; (1): CD000121.
47. Проктор М.Л., Мерфи PA. Травяные и диетические методы лечения первичной и вторичной дисменореи. Кокрановская база данных Syst Rev . 2001; (3): CD002124.
48. Gums JG. Магний при сердечно-сосудистых и других заболеваниях. Am J Health Syst Pharm . 2004. 61 (15): 1569–1576.
49. Martindale W, Парфит К. , eds Martindale: The Complete Drug Reference . 32-е изд. Лондон: Pharmaceutical Press; 1999.
50. Шилс М.Е., Олсон Дж. Современное питание в условиях здоровья и болезней . 8-е изд., Филадельфия, Пенсильвания: Lea & amp; Фебигер; 1994.
51. МакКевой Г.К. , изд. Информация о лекарствах AHFS . Bethesda, штат Мэриленд.: Американское общество фармацевтов систем здравоохранения; 1998.
52. ConsumerLab.com. Мультивитаминные / мультиминеральные добавки. http://www.consumerlab.com/results/multivit.asp. По состоянию на 13 января 2009 г.
53. Национальный центр дополнительной и альтернативной медицины. Магний и астма — клинические испытания. http://clinicaltrials.gov/ct2/show/NCT00029510?term=%28NCCAM%29+%5BSPONSOR%5D+%28magnesium%29+%5BTREATMENT%5D&rank=1. По состоянию на 13 января 2009 г.
% PDF-1.4 % 1667 0 объект > эндобдж xref 1667 110 0000000016 00000 н. 0000002556 00000 н. 0000002773 00000 н. 0000003903 00000 н. 0000004360 00000 н. 0000004447 00000 н. 0000004554 00000 н. 0000004683 00000 п. 0000004832 00000 н. 0000004893 00000 н. 0000004954 00000 н. 0000005069 00000 н. 0000005203 00000 н. 0000005319 00000 п. 0000005478 00000 н. 0000005539 00000 н. 0000005688 00000 п. 0000005749 00000 н. 0000005924 00000 н. 0000005985 00000 н. 0000006134 00000 н. 0000006195 00000 н. 0000006256 00000 н. 0000006409 00000 п. 0000006587 00000 н. 0000006648 00000 н. 0000006817 00000 н. 0000006878 00000 н. 0000007041 00000 н. 0000007102 00000 п. 0000007261 00000 н. 0000007322 00000 н. 0000007464 00000 н. 0000007526 00000 н. 0000007587 00000 н. 0000007731 00000 н. 0000007803 00000 н. 0000007946 00000 н. 0000008099 00000 н. 0000008160 00000 н. 0000008221 00000 н. 0000008384 00000 н. 0000008561 00000 н. 0000008622 00000 н. 0000008683 00000 н. 0000008833 00000 н. 0000008894 00000 н. 0000008955 00000 н. 0000009079 00000 н. 0000009140 00000 н. 0000009261 00000 п. 0000009323 00000 п. 0000009444 00000 н. 0000009505 00000 н. 0000009647 00000 н. 0000009708 00000 н. 0000009823 00000 н. 0000009884 00000 н. 0000010022 00000 п. 0000010083 00000 п. 0000010204 00000 п. 0000010265 00000 п. 0000010370 00000 п. 0000010431 00000 п. 0000010550 00000 п. 0000010611 00000 п. 0000010720 00000 п. 0000010781 00000 п. 0000010890 00000 п. 0000010951 00000 п. 0000011011 00000 п. 0000011071 00000 п. 0000011412 00000 п. 0000014797 00000 п. 0000015149 00000 п. 0000015691 00000 п. 0000015722 00000 п. 0000015902 00000 н. 0000015957 00000 п. 0000016667 00000 п. 0000016690 00000 п. 0000016905 00000 н. 0000017218 00000 п. 0000023284 00000 н. 0000023701 00000 п. 0000023770 00000 п. 0000024032 00000 п. 0000024782 00000 п. 0000025310 00000 п. 0000025816 00000 п. 0000026562 00000 п. 0000027376 00000 п. 0000027885 00000 п. 0000028226 00000 п. 0000028593 00000 п. 0000028801 00000 п. 0000028995 00000 п. 0000029018 00000 н. 0000032585 00000 п. 0000039384 00000 п. 0000039810 00000 п. 0000040494 00000 п. 0000040614 00000 п. 0000041040 00000 п. 0000041724 00000 п. 0000041855 00000 п. 0000042281 00000 п. 0000042965 00000 п. 0000002909 00000 н. 0000003880 00000 н. трейлер ] >> startxref 0 %% EOF 1668 0 объект > >> эндобдж 1669 0 объект > эндобдж 1775 0 объект > транслировать HTMhSY͏} yF + UhU! L22SV $%.) \ t. (7E ŝ $ Ֆ ԍ ;; 9 \
| [1] SORREL S. На новом магниевом цементе [J]. C. R. Acad. Sci., 1867, 65: 102-104. [2] 乌 志明, 马培华. 、 镁 资源 与 镁质 材料 概述 [J]. 研究, 2007, 15 (4): 65-72. WU Z M, MA P H. Краткое изложение магния, ресурсов магния и магниевых материалов [J]. Journal of Salt Lake Research, 2007, 15 (4): 65-72. [3] 宋彭生, 李 武, 孙 柏, 等. 盐湖 资源 开发 利用 进展 [J]. 化学 学报, 2011, 27 (5): 801-815. ПЕСНЯ P S, LI W, SUN B и др.Последние разработки по комплексному использованию ресурсов соленых озер [J]. Китайский журнал неорганической химии, 2011 г., 27 (5): 801-815. [4] 王欣荣.浅谈 电 石渣 的 综合利用 [J].中国 氯碱, 2003 (8): 36-39. WANG X R. Краткое введение в комплексную утилизацию карбидного шлака [J]. China Cholr-Alkali, 2003 (8): 36-39. [5] РАБАДЖИЕВА Д., ИВАНОВА К., БАЛАРЕВ К. и др. Производство гидроксида магния из остаточного природного рассола при извлечении соли из морской воды [J]. Российский журнал прикладной химии, 1997, 70 (3): 358-363. [6] 张月琴, 叶 旭 初, 张林 进.改进 石灰 卤水 法制 备 Mg (OH) 2 [Дж].工业 大学 学报: 的, 2008,30 (6): 54-58. ZHANG Y Q, YE X C, ZHANG L J. Получение гидроксида магния с помощью усовершенствованного способа рассола и извести [J]. Журнал Нанкинского технологического университета: издание по естествознанию, 2008 г., 30 (6): 54-58. [7] 宋长友, 崔江丽, 罗 胜 铁, 等.石灰 — 卤水 法制 备 高 纯氢 氧化镁 的 研究 [J].工程师, 2010 (1): 66-67. ПЕСНЯ C Y, CUI J L, LUO S T и др. Получение гидроксида магния высокой чистоты известково-рассольным методом [J]. Химическая инженерия, 2010 (1): 66-67. [8] ТУРЕК М., ГНОТ У.Осаждение гидроксида магния из рассола [J]. Исследования в области промышленной и инженерной химии, 1995, 34 (1): 244-250. [9] БУСТЕР ДЖ. Л, СЭНДВИК А. В., РЕЙТЕР М. А. Превращение фторида магния в гидроксид магния [Дж]. Minerals Engineering, 2003, 16 (3): 273-281. [10] 蔺 力.氢氧 化 钙 法制 备 超细 氢 氧化镁 阻燃剂 研究 [D].北京: 北京 化工 大学, 2008. ЛИН Л. Исследование новой технологии производства антипирена на основе гидроксида магния [Д]. Пекин: Пекинский химико-технологический университет, 2008 г. [11] 李阳, 姜丽娜, 李洪玲, 等.利用 电 石渣 和 氯化镁 制氢 氧化镁 工艺 研究 [J].工业, 2011,43 (9): 55-56. LI Y, JIANG L N, LI H L и др. Исследование получения гидроксида магния с использованием карбидного шлака и хлорида магния [J]. Неорганическая химическая промышленность, 2011,43 (9): 55-56. [12] 中国科学院 青海 盐湖 研究所 分析 室.卤水 与 盐 的 分析 方法 [M].第 2 Версия.北京:, 1998. Учреждение Солт-Лейк в Цинхае, Китайская академия наук. Методы анализа рассолов и солей [M]. 2-е издание. Пекин: Издательство китайской науки, 1998. [13] МУЛЛИН Дж. Кристаллизация [М]. 4 версия北京: 世界 图书, 2015.МУЛЛИН Дж. Кристаллизация [М]. 4-е издание. Пекин: Пекинская всемирная издательская корпорация, 2015. [14] ЙОРЕО Дж. Дж. Д, ВЕКИЛОВ П. Г. Принципы зарождения и роста кристаллов [Дж]. Обзоры в Минералогии и геохимии, 2003,54 (1): 57-93. [15] Юань Цзянь, Лу Зи, Чжан П. и др. Изучение кинетики синтеза и кристаллизации гидроксида магния [J]. Химия и физика материалов, 2015, 162: 734-742 [16] Справочник Дина по химии Дж. А. Ланге [M]. Макгроу-Хилл, 1999: 687-688. Leave a Reply
|
