Посев кала на микрофлору и определение чувствительности к антибиотикам (расширенный спектр)
В кале здоровых лиц могут выявляться, по меньшей мере, 15 групп микроорганизмов — бифидобактерий, лактобактерий, бактероидов, энтерококков, эубактерий, фузобактерий, пептострептококков, клостридий, различные типы E.coli, других условно-патогенных энтеробактерий, S.aureus, сапрофитного и эпидермального стафилококков, Candida spp., неферментатирующих бактерий. Обнаружение в кале даже патогенных микроорганизмов не всегда свидетельствует о наличии заболевания и может быть связано с бактерионосительством. Оценка результатов обязательно должна проводиться с учетом клинической картины Определение чувствительности к антибактериальным препаратам (АБП). Основной целью определения чувствительности микроорганизмов к АБП является прогнозирование их эффективности при лечении инфекций у конкретных пациентов. Определение чувствительности также проводят при наблюдении за распространением резистентности среди микроорганизмов.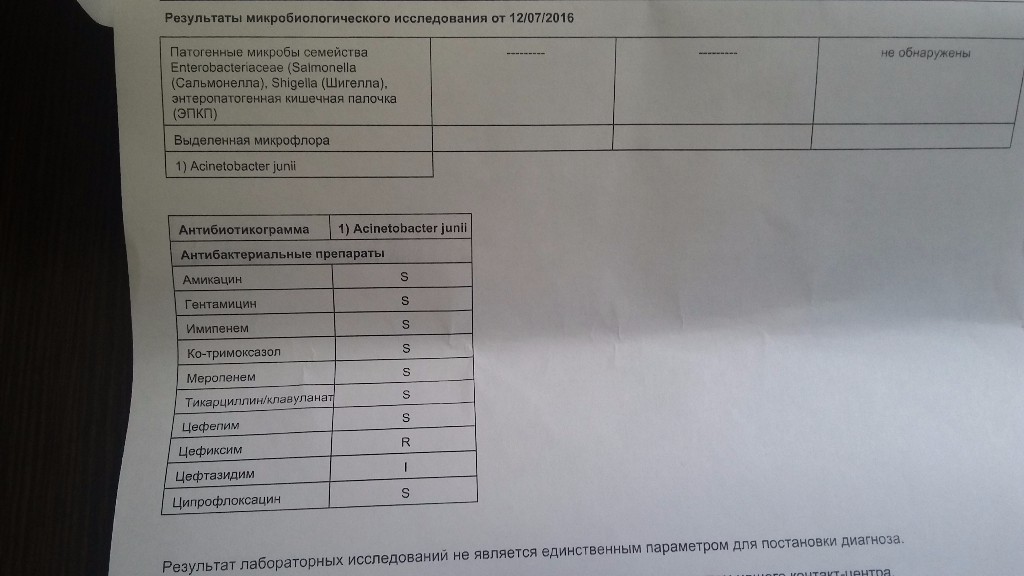
Материал для исследования берется до начала антибактериальной терапии или в интервалах между курсами лечения, но не ранее двух недель после ее окончания. За 3-4 дня до процедуры посева кала на микрофлору отменить прием любых слабительных препаратов, исключить прием алкоголя и бактерийных препаратов. В судно или на дно унитаза, без воды, помещают стерильную бумагу или проглаженный плотный лист бумаги. Совершается акт дефекации, при этом исключается попадание в кал мочи. Сразу после акта дефекации посредством специальной ложечки, вмонтированной в крышку стерильного пластикового контейнера отбирается проба кала.
Показания к исследованию: острые и хронические кишечные инфекции различной этиологии, дисбактериоз.
Представленные данные не могут быть использованы пациентом для самодиагностики и самолечения. Правильный диагноз ставит только лечащий врач на основании результатов лабораторных исследований, клинической картины заболевания и инструментального обследования. В соответствии с поставленным диагнозом лечащий врач назначает лечение.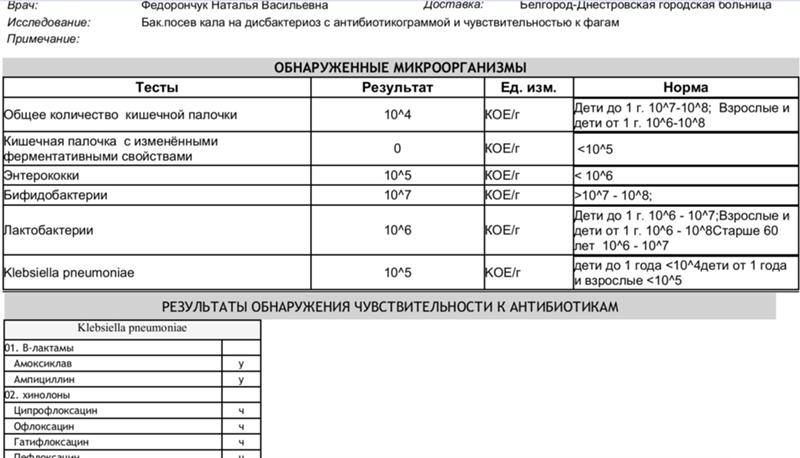
энтеробактерии, стафилококки, нефер-ментирующие бактерии) с определением чувствительности к бак-териофагам
Код услуги
77010200Описание
Кал на условно-патогенную микрофлору. Цель исследования.изучение флоры толстой кишки , обнаружение в кале условно — патогенной микрофлоры : энтеробактерий (кишечной палочки с нормальной и измененной ферментативной активностью, клебсиелл, энтеробактер, цитробактер, протеев, морганелл, гафний, сераций), стафилококков, неферментирующей флоры, синегнойной палочки. Определение чувствительности выделенной условно-патогенной микрофлоры к бактериофагам. Исследуемый материал.Кал. Показания к исследованю. Длительно протекающие кишечные расстройства. Затянувшийся период реконвалесценции после ОКИ. Дисфункция кишечнника у лиц , длительноо подвергающихся воздействию вредных факторов ( излучение, химиотерапия, гормональная терапия). Наличие системной воспалительной реакции или бактериемии. Частые респираторные инфекции. Аллергические заболевания.

Подготовка
Кал для исследования отбирается из средней порции в количестве 1-2 г (2 ложечки) в специальный стерильный контейнер. При запорах можно использовать слабительные средства только растительного происхождения (сена,слабительный чай,чернослив,свекла).Кал должен быть нормальной консистенции.Нельзя использовать клизму.Доставка в течение 2 часов, кроме воскресенья.Анализ кала на микрофлору в Москве
Данный тип анализов играет важную роль при постановке диагноза. В кишечнике человека обитает большое количество самых разнообразных микроорганизмов, которые могут как принести пользу своему симбионту, так и стать причиной многих серьезных заболеваний.
Некоторые виды бактерий незаменимы при всасывании витаминов К, Д, С, фолиевой кислоты и группы В. В то же время полезная микрофлора при определенных условиях сдерживает рост численности патогенных микроорганизмов. При нарушении баланса объем колоний полезных микроорганизмов значительно снижается, и освободившаяся ниша занимается патогенными видами бактерий.
Что показывает анализ
Анализ кала на микрофлору кишечника позволяет определить количественные взаимоотношения между разными видами микроорганизмов. В ходе исследования определяется наличие организмов, относящихся к трем группам:
- Патогенным видам;
- Условно—патогенным видам;
- Полезным.
К полезным относят лактобациллы, бифидобактерии, бактероиды и энтерококки. К условно—патогенным причисляют клебсиеллу, протеи, стафилококки, цитробактер, энтеробактер и грибы рода Кандид.
Показания к анализу
Данный вид диагностики назначается:
- При проблемах, со стулом которые выражаются запорами и диареей;
- При обнаружении в кале следов крови и слизи;
- При повышенном газообразовании;
- При появлении болей в области живота;
- При частых аллергических реакциях и ухудшении состояния кожи;
- При частых простудных заболеваниях.

При желании, пациент может самостоятельно сдать анализ кала на микрофлору для профилактики.
Подготовка к процедуре
Исследование кала на флору требует определенной подготовки:
- Забор материала проводится только после прекращения приема лекарственных препаратов, особенно антибиотиков. Разрешено сдавать кал в том случае, если после приема лекарства прошло не менее семи дней;
- Обязательным является соблюдение диеты. Из рациона полностью исключаются продукты, способствующие образованию запоров;
- Накануне обследования не рекомендуется использовать ректальные свечи и принимать слабительное;
- В лабораторию материал должен быть доставлен в чистом и стерильном контейнере;
- В анализ не должна попасть моча и выделения из половых органов. Для этого перед сбором кала необходимо провести гигиенические процедуры;
- Для полноценного анализа достаточно всего десяти граммов фекалий.

Возможно хранение кала в холодильнике, но в течение непродолжительного времени, причем температура не должна опускаться ниже шести и повышаться выше восьми градусов Цельсия. В лабораторию контейнер доставляется в течение трех часов.
Причины ложных результатов
Ложный результат может быть получен:
- При нарушении стерильности контейнера;
- При приеме антибиотиков и препаратов со схожим способом действия на организм;
- При нарушении временных рамок сдачи материала;
- Анализ кала нельзя сдавать женщинам во время менструации, так как кровь попадая в материал способна изменить итоговые значения.
При получении ложных результатов, врач назначает сдачу анализа повторно.
Как проводится анализ
При проведении анализа производится посев имеющихся микроорганизмов в специально подобранную среду, обеспечивающую рост численности колонии. Далее определяется принадлежность микроорганизма, его количественное значение, а в случае с патогенными микроорганизмами и уровень вирулентности.
Нормы и расшифровка результата
Для врача имеет значение не только присутствие в кишечнике определенных видов микроорганизмов, но и их количественное содержание и активность.
Бифидобактерии. Всегда присутствуют в кале здоровых людей. В возрасте от 18 до 60 лет в фекалиях должно содержаться до 109—1010 бифидобактерий. В более пожилом возрасте норма составляет 108—109.
Снижение концентрации этого типа микроорганизмов в кишечнике происходит:
- После длительного приема антибиотиков
- При серьезных проблемах в работе пищеварительной системы.
- При длительном стрессовом воздействии на организм
- При значительном снижении уровня иммунитета.
Лактобактерии. Норма содержания в кале здорового человека составляет от 107 до 108. У пожилых пациентов этот уровень показателей изменяется и составляет от 106 до 107. Уменьшение их числа происходит по тем же причинам что и бифидобактерий. Уменьшение числа их колоний приводит к росту патогенной флоры.
Уменьшение их числа происходит по тем же причинам что и бифидобактерий. Уменьшение числа их колоний приводит к росту патогенной флоры.
Кишечные палочки. В норме их концентрация в фекалиях составляет от 107 до 108. От возраста этот показатель не зависит. Кишечные палочки в первую очередь начинают погибать при приеме антибиотиков. Их количество даже при минимальной дозе резко сокращается.
Бактероиды. Норма 109—1010 . При вступлении в пожилой возраст данное значение изменяется и составляет 1010— 1011. Уменьшение их числа происходит на фоне самых различных ограничений в питании.
Энтерококки. Норма 107 до 108. У людей старше 60 лет происходит снижение их количества норма в этом случае равняется от 106 до 107. Снижение уровня этого типа микроорганизмов происходит по причине перебоев в работе поджелудочной железы и длительных по времени стрессов.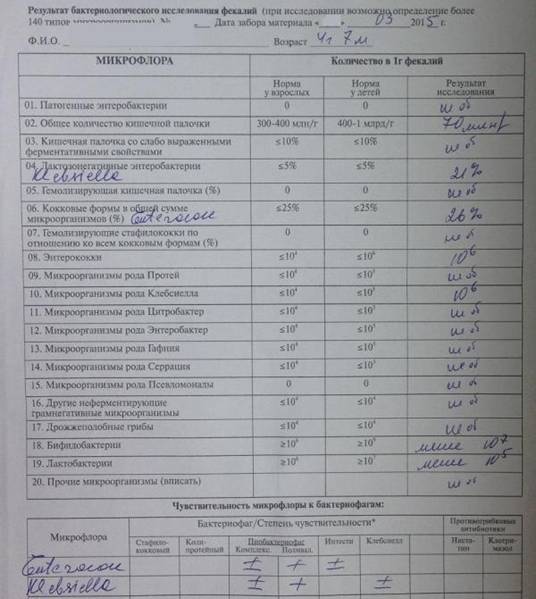
Содержание условно—патогенных микроорганизмов не должно превышать 104 степени. Этот уровень данного вида бактерий совсем не связан с возрастом пациента.
Патогенные микроорганизмы должны полностью отсутствовать в образце кала.
Изменение соотношения микроорганизмов в сторону преобладания патогенной флоры требует немедленной коррекции. В этом случае полезные бактерии вводятся в организм искусственным путем при помощи медикаментозной терапии.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Дисбактериоз. Исследование микробиоценоза кишечника с определением чувствительности к бактериофагам
При микробиологическом исследовании кала на дисбактериоз выдается количественная оценка всех выделенных микроорганизмов в единицах измерения КОЕ/грамм с указанием референсных значений для каждого микроорганизма и результатами оценки чувствительности к фагам.
Исследование на дисбактериоз кишечника с определением чувствительности к бактериофагам включает в себя определение следующих микроорганизмов:
| Микроорганизмы |
|---|
| Бифидобактерии |
| Лактобактерии |
| Клостридии |
| Escherichia coli типичные |
| Escherichia coli лактозонегативные |
| Escherichia coli гемолитические |
| Условно-патогенные энтеробактерии: |
| Klebsiella spp. |
| Citrobacter spp. |
| Enterobacter spp. |
| Hafnia spp. |
| Serratia spp. |
| Proteus spp. |
| Morganella spp. |
| Providencia spp. |
Raoultella spp.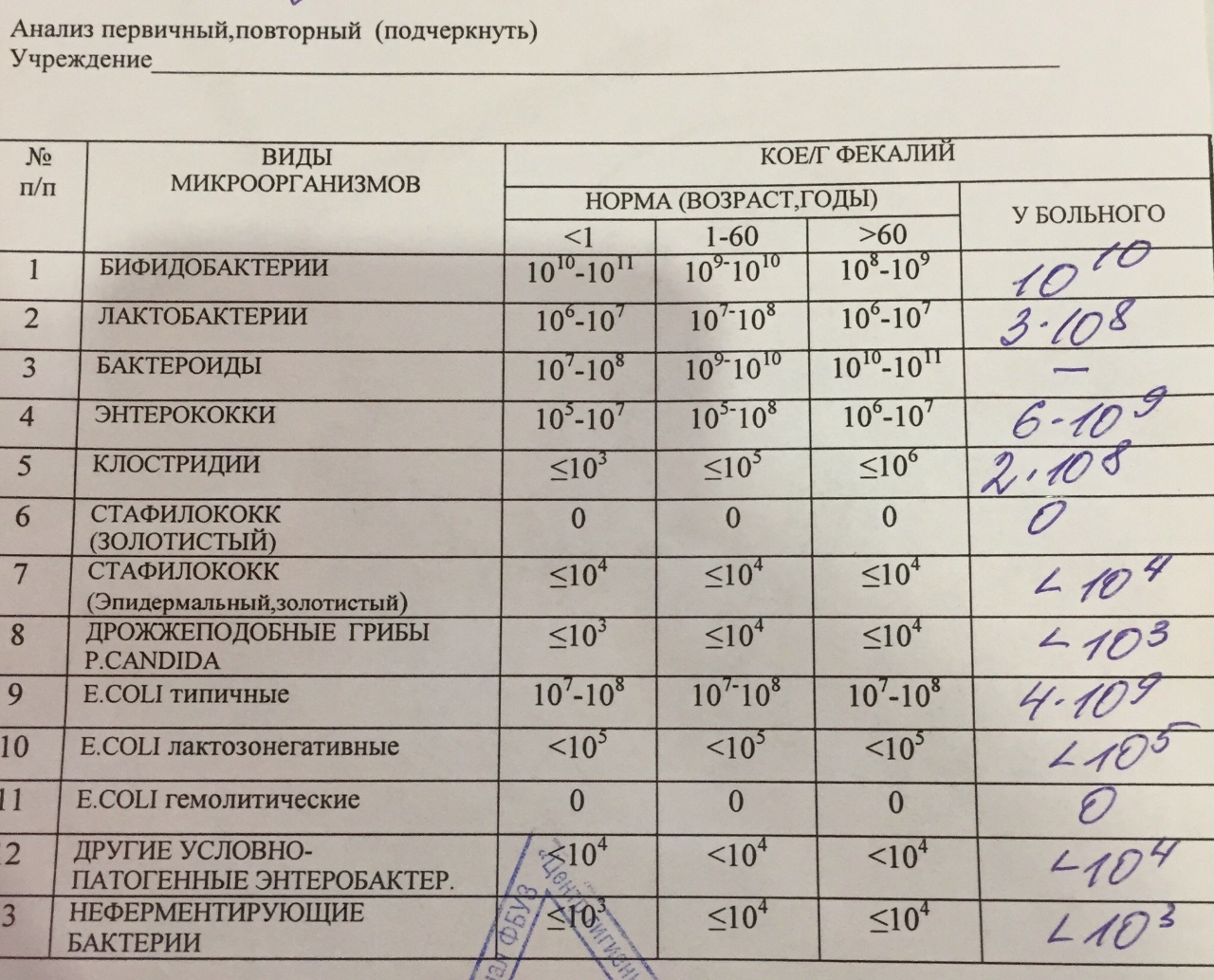
|
| Неферментирующие бактерии: |
| Pseudomonas spp. |
| Acinetobacter spp. |
| Другие неферментирующие бактерии |
| Патогенные микроорганизмы |
| Энтерококки |
| Стафилококк золотистый |
| Staphylococcus saprophyticus, Staphylococcus epidermidis |
| Дрожжеподобные грибы рода Candida |
Интерпретация проводится врачом с учетом клинических проявлений.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Кал на патогенную и условно-патогенную микрофлору
Взятие проб кала должно осуществляться на ранних этапах болезни, пока патогенные микробы содержатся в материале в большом количестве.
Для сбора кала пациенту выдается контейнер с крышкой и ложечкой.
Если пациент собирает кал дома, ему нужно выдать Памятку , где изложены правила сбора и предупредить о том, что материал должен быть доставлен в лабораторию, как можно быстрее:
Кал, полученный после клизмы, а также после приема бария (при рентгеновском обследовании) для исследования непригоден. До сбора анализа помочитесь в унитаз. Далее путем естественной дефекации в унитаз или подкладное судно собирают испражнения. Не рекомендуется собирать кал из унитаза. Собирают кал на чистую поверхность, в качестве которой может быть использован чистый новый лист (пакет) из полиэтилена или бумаги (этот способ является предпочтительным). При использовании судна, его предварительно хорошо промывают с мылом и губкой, ополаскивают многократно водопроводной водой, а потом обдают кипятком и остужают. Кал забирается ложечкой в стерильный контейнер с завинчивающейся крышкой в количестве 1-3 г. (1 ложка). Материал предпочтительно брать из участков, где обнаруживается слизь и/или кровь. Завинтить емкость крышкой и немедленно доставить кал в лабораторию.
При использовании судна, его предварительно хорошо промывают с мылом и губкой, ополаскивают многократно водопроводной водой, а потом обдают кипятком и остужают. Кал забирается ложечкой в стерильный контейнер с завинчивающейся крышкой в количестве 1-3 г. (1 ложка). Материал предпочтительно брать из участков, где обнаруживается слизь и/или кровь. Завинтить емкость крышкой и немедленно доставить кал в лабораторию.
На контейнере необходимо указать Вашу фамилию, инициалы, дату рождения, дату и время сбора материала, запись должна быть сделана разборчивым почерком.
Если кал собирается в условиях медицинского центра и доставка не может быть осуществлена в кратчайший срок, для сохранности материала используют транспортную систему со средой Кэрри Блэйр. Тампон погружают в фекалии поочередно в нескольких местах, после чего он погружается в пробирку с транспортной средой.
При исследовании на рота- и аденовирус кал доставляется в контейнере.
Транспортная среда: Транспортная среда Кэрри Блэйрили стерильный контейнер для кала (Для рота-аденовирусов – стерильный контейнер для кала)
Температура хранения забранного биоматериала: 2-8 °С
Максимальный срок доставки в лабораторию при соблюдении температурного режима:
Транспортная среда Кэрри Блэйр: 24 часа.
Стерильный контейнер для кала: 3 часа.
Комплексные исследования микрофлоры ЖКТ
Комплексные исследования микрофлоры ЖКТ
Для того, чтобы узнать, как сдавать анализы, нажмите курсором на иконку в графе «Как сдавать» напротив необходимого анализа
Отдельно оплачиваются
Забор крови из вены 275-00
Взятия материала для исследования (нос, зев, глаза, ухо, ) 270-00
Взятие материала для исследования (урогинекологический) 415-00
Комплексные исследования микрофлоры кишечника
| Исследование | Цена | Как сдавать |
|---|---|---|
|
Комплексное (биохимическое и микробиологическое) исследование микрофлоры кишечника с определением чувствительности к бактериофагам и противогрибковым препаратам (Концентрации в копрофильтрате летучих жирных кислот: Уксусной, пропионовой, масляной, валериановой, капроновой и их изомеров) |
2920-00 | Как сдавать |
|
Комплексное (биохимическое и микробиологическое) исследование микрофлоры кишечника с определением чувствительности к антибиотикам, бактериофагам и противогрибковым препаратам (Концентрации в копрофильтрате летучих жирных кислот: Уксусной, пропионовой, масляной, валериановой, капроновой и их изомеров) |
3325-00 | Как сдавать |
Комплексные исследования микрофлоры ротоглотки.
| Исследование | Цена | Как сдавать |
|---|---|---|
|
Биохимическое исследование микрофлоры ротоглотки (слюна) (Концентрации в слюне летучих жирных кислот: Уксусной, пропионовой, масляной, валериановой, капроновой и их изомеров) |
795-00 | Как сдавать |
Комплексный анализ микрофлоры кишечника — общая информация.
По оценкам Минздрава РФ за 2010 г. причиной смертности населения в 56,6% случаев являются ишемическая болезнь сердца и цереброваскулярных заболеваний. Эти смертельные заболевания развиваются по многим причинам, одной из которых является сахарный диабет. Сахарный диабет бывает врожденный и приобретенный. Развитие приобретенного сахарного диабета начинается с неправильного питания и прочих синдромов, которые объединяются под термином дисбиоз. Причиной масштабного распространения дисбиозов признано неправильное питание, стрессы, агрессивное влияние окружающей среды, нерациональное использование антибиотиков и гормонов как для лечения, так и в промышленном производстве мяса говядины и птицы. «Золотым стандартом» диагностики дисбактериозов признан бактериологический посев кала с определением баланса между нормальными и условно-болезнетворными бактериями.
«Золотым стандартом» диагностики дисбактериозов признан бактериологический посев кала с определением баланса между нормальными и условно-болезнетворными бактериями.
С июня 2003 года в России действует отраслевой стандарт ОСТ «Протокол ведения больных. Дисбактериоз кишечника», в котором заданы критерии и определены границы состояния микробиоценоза с разными степенями дисбактериоза. Намеченные в ОСТе критерии определяют «степень микробного воспаления» кишечника. Таким образом, бактериологический анализ кала указывает факт «микробного воспаления», но не указывает причину, которая его вызывает. Для поиска причины дисбиоза врачи назначают дополнительные исследования, как правило, это копрологический анализ и прочие исследования в зависимости от диагноза. Для того чтобы составить полное представление о причинах и степени дисбактериоза мы предлагаем комплексный анализ микрофлоры кишечника.
Комплексный анализ микрофлоры кишечника включает в себя:
- копрологического исследование кала (визуальное определение степени переваривания пищи и наличия гастродуоденита, холецистита, панкреатита или глистной инвазии)
- бактериологический анализ кала с учетом чувствительности бактерий к антибиотикам и бактериофагам, а так же концентрации летучих жирных кислот, которые характеризуют микробные взаимоотношения в кишечнике.

Определение концентрации летучих жирных кислот сравнительно недавно стало применяться для характеристики микробных взаимоотношений в кишечнике. Известно, что бактериологический анализ определяет далеко не все (не более 1%) бактерии, населяющие наш кишечник. Большая часть наших микробов не растет на предлагаемых средах и требует безвоздушной среды и многих других условий для роста. Однако, мы можем определять продукты жизнедеятельности микробов, чтобы определить активность и тип брожения (гнилостное или бродильное), полноту переваривания субстрата, и долю анаэробной микрофлоры.
Комплексный анализ микрофлоры кишечника включает следующие блоки:
- макроскопическое исследование кала, его органолептические характеристики;
- микроскопическое исследование кала, полуколичественное определение растительных мышечных волокон, степени их переваренности, жиров, жирных кислот и их солей, а так же кристаллов; наличие йодофильной микрофлоры, грибов, паразитов, простейших;
- бактериологическое исследование кала с определением энтеробактерий, бацилл, грибов и их резистентности к антимикробным препаратам, антимикотикам, бактериофагам;
- определение концентраций ЛЖК методом ГЖХ прямым вводом подкисленного супернатанта фекалий в испаритель ГЖ хроматографа с последующим разделением на капиллярной колонке с детекцией компонентов смеси на пламенно-ионизационном детекторе.

Сочетание копрологического и микробиологического исследования с высокой долей вероятности указывает на имеющиеся нарушения ферментации на различных уровнях ЖКТ и позволяет дать клиническое заключение.
Алгоритм определяет 8 копрологических синдромов: норма; ахилия; ахолия; энтеральный синдром; бродильная диспепсия; гнилостная диспепсия; замедленная эвакуация; колит. Также определяется тип субстрата, переваривание которого нарушено: креаторея; амилорея; стеаторея.
Микробиологический анализ кала позволяет определить тип микробиологических нарушений в организме по количеству и соотношению микроорганизмов индигенной и транзиторной микрофлоры.
Для оценки степени микробиологических нарушений использованы критерии соотношения количества микроорганизмов, изложенные в Приказе Минздрава РФ ? 231 от 9 июля 2003 г.
Рассчитывается общий уровень летучих жирных кислот, уровни и доли в общем пуле (спектры) уксусной (С2), пропионовой (С3), масляной (С4), изомасляной (iC4), валериановой (С5), изовалериановой (iC5), капроновой (С6), изокапроновой (iC6) кислот, а также значение структурного индекса (СИ), индекса изокислот (ИИ).
Значение СИ используется как показатель инфраструктуры микробиоценоза, соотношения популяций анаэробных и факультативно-анаэробных микроорганизмов, поскольку источником уксусной кислоты является почти вся индигенная кишечная микрофлора, а более восстановленных метаболитов (все ЛЖК за исключением уксусной) — только строгие анаэробы.
Значение ИИ используется как показатель преобладающего типа микроорганизмов сахаролиты-протеолиты. Увеличение значение ИИ ¾ увеличение суммарной концентрации изокислот, продуктов микробного переваривания аминокислот (белков), то есть увеличение доли протеолитической микрофлоры в микробном сообществе.
Суммарный уровень ЛЖК, характеризует возможность кишечной микрофлоры переваривать субстрат. Величина суммарного уровня так же зависит от скорости всасывания продуктов метаболизма. Так как кишечный микробиоценоз закрытая саморегулирующаяся система, суммарная концентрация ЛЖК в кале имеет большой разброс значений. Однако, его значения не снижаются ниже определённого уровня.
В составе ЛЖК выделяются основные – уксусная, пропионовая, масляная кислоты и сопутствующие, валериановая, капроновая и их изомеры. Уксусная и пропионовая кислоты всасываются в кровь, достигнув печени, значительная часть ЛЖК сжигается в пероксисомах гепатоцитов. В крови, оттекающей от печени, концентрация ЛЖК существенно меньше и окончательной метаболизации кислоты подвергаются в клетках периферических тканей. Концентрация масляной кислоты в стуле человека меняется от 11 до 25 ммоль/г.
Диапазон соотношений основных ЛЖК уксусной: пропионовой:масляной от 48:29:23 до 70:15:15 при среднем значении 60:20:20. Определить общую продукцию ЛЖК сложно, так как 95% ЛЖК быстро абсорбируются и метаболизируются организмом, поэтому концентрации меняются в широких пределах в зависимости от скорости транзита содежимого кишечника. Большая часть масляной кислоты метаболизируется кишечным эпителием, в портальной вене отмечается концентрация масляной кислоты от 1,3 до 14,4 ммоль/г; в сыворотке венозной крови — 0,5-3,3 ммоль/г. Концентрации ЛЖК в сыворотке крови уксусной кислоты составляют 98-143, пропионовой — 3,8-5,4 ммоль/г.
Концентрации ЛЖК в сыворотке крови уксусной кислоты составляют 98-143, пропионовой — 3,8-5,4 ммоль/г.
Результаты анализов, содержащие данные о нарушении ферментативного и микробного пищеварения, позволяют найти причину имеющегося у пациента заболевания или синдрома. Заключение по результатам анализа содержит данные о наличии копрологического синдрома или нарушения переваривания, всасывания, скорости транзита содержимого в ЖКТ. Отмечается степень микробиологического нарушения микробиоты кишечника и метаболические нарушения по типу дефицита метаболитов, в особенности масляной кислоты, соотношения ЛЖК – доли уксусной кислоты и структурный индекс, даётся характеристика протеолитической активности микрофлоры кишечника
Гастродоуденит — диагностика.
При помощи комплексного анализа микрофлоры кишечника можно установить высокую вероятность наличия гастродоуденита.
При подозрении на гастродоуденит наиболее распространёнными является ряд признаков, свидетельствующий о возможности его наличия.
Микроскопия водной эмульсии кала указывает на большое количество оксалатов, непереваренного и переваренного крахмала, наличие в мазках нормальной и патогенной иодофильной микрофлоры, солей жирных кислот. Использование алгоритма определения недостаточности ферментативного пищеварения укажет на наличие гастрогенного синдрома
Бактериологический анализ кала показывает достаточное количество нормальной микрофлоры и отсутствие или незначительное количество условно-патогенной микрофлоры. Значения концентраций микроорганизмов не выходят за пределы нормальных значений.
Хроматографическое исследование концентраций ЛЖК в кале показывает снижение общего уровня ЛЖК, особенно уксусной кислоты, снижение индекса изокислот ниже референсных значений.
Синдром мальабсорбции.
При комплексном анализе микрофлоры кишечника выявляется следующий набор параметров.
Микроскопия водной эмульсии кала указывает на наличие большого количество нейтрального жира, непереваренного крахмала, иодофильной микрофлоры и мышечных волокон увеличивается рН.
При бактериологическом анализе кала наблюдается снижение бифидобактерий и общее количество Escherichia coli, что соответствует 1 степени микробиологических нарушений.
Хроматографическое исследование концентраций ЛЖК в кале показывает снижение общего уровня ЛЖК, особенно масляной кислоты (может снижаться до значений ниже 0,1 ммоль/г), снижение индекса изокислот ниже референсных значений.
Панкреатит.
В результатах комплексного анализа микрофлоры кишечника при подозрении на панкреатит отмечаются следующие характерные параметры.
Микроскопия водной эмульсии кала указывает на наличие нейтрального жира, жирных кислот и их солей увеличение показателя рН, могут быть повышенные значения лейкоцитов. При применении алгоритма исследования недостаточности ферментативного пищеварения определяется синдром панкреатической недостаточности.
Бактериологический анализ кала указывает на 2 степень микробиологических нарушений с наиболее вероятным присутствием в значительных количествах Staphylococcus aureus и Escherichia coli Hly+ (гемолизирующей).
Хроматографическое исследование концентраций ЛЖК в кале показывает снижение ниже референсных значений значений структурного индекса, индекса изокислот, снижение доли уксусной кислоты в соотношении уксусная: пропионовая:масляная кислоты
Синдром избыточного бактериального роста в тонкой кишке.
В основе развития синдрома избыточного бактериального роста в тонкой кишке лежит повышенное заселение тонкой кишки фекальной микрофлорой, например Escherichia coli, облигатными анаэробами (бактероидами и клостридиями в концентрации более 105 КОЕ/мл аспирата из тощей кишки).
При наличии синдрома избыточного бактериального роста в тощей кишке при комплексном анализе микрофлоры кишечника выявляются следующие параметры.
Микроскопия водной эмульсии кала указывает на наличие в кале нейтрального жира, жирных кислот, иодофильной микрофлоры. Для синдрома избыточного роста характерны нарушения, которые могут определяться по алгоритмам недостаточности ферментного пищеварения как нарушение всасывания или ускоренный транзит в зависимости от стадии развития синдрома.
При бактериологическом анализе кала наблюдается бурный рост одного вида условно-патогенных микроорганизмов (лактозонегативной или гемолизирующей Escherichia coli, Staphylococcus aureus) на фоне сниженного количества остальных условно-патогенных микроорганизмов.
Хроматографическое исследование концентраций ЛЖК в кале показывает снижение значений структурного индекса и индекса изокислот.
Подозрение на паразитарную инвазию
При подозрении на паразитарную инвазию отмечается наличие кристалов Шарко-Лейдена при микроскопическом исследовании водной эмульсии кала, снижение общего количества Escherichia coli и бифидобактерий при бактериологическом анализе кала и снижение концентраций общего количества ЛЖК в кале при сохранении соотношений уксусная:пропионовая:масляная кислоты в границах референсных значений
Подготовка к комплексному анализу микрофлоры кишечника.
Необходимо купить стерильный контейнер в аптеке или подготовить стеклянную банку (например, из-под детского питания) и крышку следующим образом: промыть без использования дезинфицирующих средств и прокипятить в течение 20 минут. Стул должен быть без клизм и слабительных средств. Кал не должен собираться с тканевой поверхности. В банку поместить около 1 чайной ложки кала. Образец кала доставить в течение
Стул должен быть без клизм и слабительных средств. Кал не должен собираться с тканевой поверхности. В банку поместить около 1 чайной ложки кала. Образец кала доставить в течение
Центр лабораторных технологий АБВ — Исследование микробиоценоза кишечника (дисбактериоз) с расширенной антибиотикограммой
Микробиологическое исследование, которое позволяет оценить состав микрофлоры кишечника – концентрацию и соотношение «полезных», условно-патогенных и патогенных микроорганизмов в кале, определить чувствительность выявленных микроорганизмов к антибиотикам. К нормальной микрофлоре кишечника («полезные» бактерии) относятся лактобактерии, бифидобактерии, энтерококки, кишечные палочки (типичные), анаэробная флора (бактероиды). Условно-патогенная флора – это энтеробактерии, неферментирующие бактерии, стафилококки, анаэробные бактерии (клостридии), грибы. Патогенными микроорганизмами являются сальмонеллы, шигеллы, патогенные эшерихии. При выявлении патогенных и/или условно-патогенных микроорганизмов будет определена их чувствительность к антимикробным препаратам (антибиотикам). При обнаружении микроорганизмов, составляющих нормальную микрофлору, чувствительность к антибиотикам не определяется, т.к. это не имеет диагностического значения. Биоматериал, используемый для исследования: кал после естественной дефекации. Сбор образца: в стерильный контейнер с ложкой. Правила отбора: до начала антибактериальной терапии. Сбор фекалий необходимо производить стерильно из горшка, судна, с пеленки, памперса, из фекальной массы, не соприкасающейся со стенками горшка (судна) или тканью пеленки в количестве 0,5-1,0 г. Хранение и транспортировка: материал необходимо доставить в лабораторию не позднее чем через 2 часа после взятия пробы. В промежутке между взятием пробы и до посева оптимальным является хранение материала при температуре +40 С. Факторы, влияющие на показатель: 1. Прием антибиотиков. 2. Неправильный сбор и хранение биоматериала. 3. Прием слабительных препаратов, введение ректальных свечей, масел, прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.
При обнаружении микроорганизмов, составляющих нормальную микрофлору, чувствительность к антибиотикам не определяется, т.к. это не имеет диагностического значения. Биоматериал, используемый для исследования: кал после естественной дефекации. Сбор образца: в стерильный контейнер с ложкой. Правила отбора: до начала антибактериальной терапии. Сбор фекалий необходимо производить стерильно из горшка, судна, с пеленки, памперса, из фекальной массы, не соприкасающейся со стенками горшка (судна) или тканью пеленки в количестве 0,5-1,0 г. Хранение и транспортировка: материал необходимо доставить в лабораторию не позднее чем через 2 часа после взятия пробы. В промежутке между взятием пробы и до посева оптимальным является хранение материала при температуре +40 С. Факторы, влияющие на показатель: 1. Прием антибиотиков. 2. Неправильный сбор и хранение биоматериала. 3. Прием слабительных препаратов, введение ректальных свечей, масел, прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др. ), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала. 4. Возраст. Показания: 1. Дисбиоз кишечника у новорожденных, детей грудного и раннего возраста, детей дошкольного и школьного возраста, лиц пожилого возраста. 2. Нарушение пищеварительной функции желудочно-кишечного тракта при наличии ферментативной недостаточности, несбалансированном питании, стрессах. 3. Дисбиоз кишечника после лечения антибиотиками, гормональными, нестероидными противовоспалительными препаратами; проведения химио- и лучевой терапии.
), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала. 4. Возраст. Показания: 1. Дисбиоз кишечника у новорожденных, детей грудного и раннего возраста, детей дошкольного и школьного возраста, лиц пожилого возраста. 2. Нарушение пищеварительной функции желудочно-кишечного тракта при наличии ферментативной недостаточности, несбалансированном питании, стрессах. 3. Дисбиоз кишечника после лечения антибиотиками, гормональными, нестероидными противовоспалительными препаратами; проведения химио- и лучевой терапии.
Микрофлора кала — обзор
Диета
Грудное вскармливание: В фекальной микробиоте младенцев, находящихся на грудном вскармливании, преобладают Bifidobacterium , за которыми следуют Streptococcus , Staphylococcus , 000 и 000 Lactobacus . Грудное молоко содержит лактозу в качестве основного источника углеводов и различные олигосахариды, которые, как считается, способствуют росту определенных видов бактерий, особенно Bifidobacterium . Другие бактерии, которые, как сообщается, были обнаружены в грудном молоке, — это Streptococcus , Staphylococcus и Lactobacillus . Грудное молоко также содержит антимикробные факторы (например, лизоцим, лактоферрин), что объясняет более низкий рост факультативных анаэробов у младенцев, находящихся на грудном вскармливании.
Другие бактерии, которые, как сообщается, были обнаружены в грудном молоке, — это Streptococcus , Staphylococcus и Lactobacillus . Грудное молоко также содержит антимикробные факторы (например, лизоцим, лактоферрин), что объясняет более низкий рост факультативных анаэробов у младенцев, находящихся на грудном вскармливании.
Более разнообразная фекальная микробиота младенцев на искусственном вскармливании включает Enterobacteriaceae и более высокую численность и распространенность факультативных анаэробов, таких как Bacteroides и Clostridium , по сравнению с младенцами на грудном вскармливании. Bifidobacterium также присутствовал в кишечной микробиоте младенцев на искусственном вскармливании, но в меньшем количестве и меньшей частоте.
Продольный анализ показал, что группа Lactobacilli – Enterococci выше у младенцев на грудном вскармливании в течение четырех временных точек в возрасте до 1 года. На уровне видов грудное вскармливание повлияло на распространенность Clostridium leptum , C. difficile , C. perfringens и Bifidobacterium в фекальной микробиоте младенцев, тогда как у младенцев, вскармливаемых смесью, преобладали Bacteroides и . Clostridium coccoides .
difficile , C. perfringens и Bifidobacterium в фекальной микробиоте младенцев, тогда как у младенцев, вскармливаемых смесью, преобладали Bacteroides и . Clostridium coccoides .
Факторы питания: Исследования образцов фекалий из нескольких стран продемонстрировали кластеризацию кишечной микробиоты по трем различным энтеротипам. Эти паттерны в основном отличались обогащением Bacteroides , Prevotella и Ruminococcus и не были связаны с национальностью, возрастом, полом и индексом массы тела.
Bacteriodetes и Actinobacteria были положительно связаны с жиром, но отрицательно с клетчаткой, а обратная связь наблюдалась для Firmicutes и Proteobacteria.Используя те же данные, исследователь показал, что долгосрочные диетические эффекты позволили объединить микробиоту кишечника в Bacteroides (энтеротип 1), который связан с животным белком и насыщенными жирами, и Prevotella (энтеротип 2), который связан с углеводами.
Другое исследование показало, что Actinobacteria и Bacteroidetes более преобладали у детей Буркина-Фасо с преимущественно вегетарианской диетой с высоким содержанием клетчатки, крахмала и растительных углеводов, но с низким содержанием жиров и животного белка.Было обнаружено, что Firmicutes и Proteobacteria более распространены у европейских детей, которые придерживаются типичной западной диеты с высоким содержанием животного белка, сахара, крахмала и жира, но с низким содержанием клетчатки. Prevotella , Xylanibacter (Bacteroidetes) и Treponema (Spirochaetes) присутствовали только у детей Буркина-Фасо. Используя метод иерархической кластеризации с полной связью, микробиота кишечника была сгруппирована в три кластера: группа Буркина-Фасо, европейская группа и подгруппа всех детей на грудном вскармливании из обеих стран.Эти результаты предполагают, что структура питания является важной переменной, которая преобладает над другими переменными окружающей среды, такими как санитария, гигиена, география и климат.
Микрофлора фекалий — обзор
Фекальное загрязнение поверхностных вод
Микробное заражение фекальными бактериями, вызванное изменениями окружающей среды и антропогенной деятельностью, считается серьезной проблемой для поверхностных вод во всем мире. Воздействие человека на микробиологическое качество воды является значительным, и деятельность человека, такая как урбанизация и индустриализация, в сочетании с ростом населения, сильно влияет на водную среду.Обширная индустриализация и сельское хозяйство привели к увеличению загрязнения и гидроморфологическим изменениям в озерах и реках (Joshi et al., 2016).
Патогены, передающиеся через воду и потенциально способные заразить людей, можно разделить на категории бактерий, простейших и вирусов. Микробное загрязнение водоемов обычно определяется путем измерения концентраций FIB, а не патогенов (ВОЗ, 2008), потому что обнаружение разновидностей патогенов очень сложно, требует много времени и дорого.Кроме того, хотя FIB, как правило, не являются патогенными, их присутствие в водоемах указывает на возможное присутствие других патогенных микроорганизмов (Burres, 2009, стр. 576–678). Патогены реагируют на изменение климата так же, как и FIB, и, следовательно, это наиболее распространенный метод. Фекальные колиформные бактерии, E. coli и энтерококки, наиболее широко используются в качестве индикаторов фекального загрязнения источников воды (Ouattara et al., 2013). Индикаторы полезны при оценке риска для здоровья, независимо от того, являются ли определенные патогены патогенными или нет.Определить конкретные источники фекального загрязнения в озерах и реках невозможно с помощью FIB, например, E. coli . Оценка качества воды с использованием только FIB может ввести в заблуждение менеджеров по качеству воды. Кишечные вирусы, которые играют важную роль в болезнях, передающихся через воду, должны быть включены в мониторинг микробного качества воды, которые в настоящее время редко исследуются из-за сложности обнаружения и количественной оценки различных вирусных патогенов. Маркеры отслеживания микробных источников, такие как маркеры, специфичные для человека, представляют собой более совершенный инструмент для определения воздействия неточечных источников загрязнения человеческими фекалиями.
576–678). Патогены реагируют на изменение климата так же, как и FIB, и, следовательно, это наиболее распространенный метод. Фекальные колиформные бактерии, E. coli и энтерококки, наиболее широко используются в качестве индикаторов фекального загрязнения источников воды (Ouattara et al., 2013). Индикаторы полезны при оценке риска для здоровья, независимо от того, являются ли определенные патогены патогенными или нет.Определить конкретные источники фекального загрязнения в озерах и реках невозможно с помощью FIB, например, E. coli . Оценка качества воды с использованием только FIB может ввести в заблуждение менеджеров по качеству воды. Кишечные вирусы, которые играют важную роль в болезнях, передающихся через воду, должны быть включены в мониторинг микробного качества воды, которые в настоящее время редко исследуются из-за сложности обнаружения и количественной оценки различных вирусных патогенов. Маркеры отслеживания микробных источников, такие как маркеры, специфичные для человека, представляют собой более совершенный инструмент для определения воздействия неточечных источников загрязнения человеческими фекалиями. Достижения в отслеживании источников позволяют менеджерам водного хозяйства отслеживать происхождение неточечного загрязнения точнее, чем когда-либо ранее (Labbate et al., 2016). Из-за трудностей и затрат, связанных с тестированием патогенов, FIB, происходящий из фекалий человека и животных, использовался в большинстве исследований в качестве заместителя патогенов (Burres, 2009, стр. 576–678). Однако FIB часто не отражает присутствие патогенов в пробах воды (Ouattara et al., 2013). Следовательно, для оценки микробного качества воды необходимо прямое обнаружение конкретных патогенов.Другие методы моделирования судьбы и переноса микробного загрязнения в водоеме используют компьютерные модели, которые учитывают гидродинамические ситуации и процесс отмирания микроорганизмов в водной среде (Sokolova, Pettersson, Bergstedt, & Херманссон, 2013). Знания о концентрации бактерий и других вредных микроорганизмов и их источниках необходимы для оценки рисков для здоровья человека, связанных с потреблением загрязненной воды.
Достижения в отслеживании источников позволяют менеджерам водного хозяйства отслеживать происхождение неточечного загрязнения точнее, чем когда-либо ранее (Labbate et al., 2016). Из-за трудностей и затрат, связанных с тестированием патогенов, FIB, происходящий из фекалий человека и животных, использовался в большинстве исследований в качестве заместителя патогенов (Burres, 2009, стр. 576–678). Однако FIB часто не отражает присутствие патогенов в пробах воды (Ouattara et al., 2013). Следовательно, для оценки микробного качества воды необходимо прямое обнаружение конкретных патогенов.Другие методы моделирования судьбы и переноса микробного загрязнения в водоеме используют компьютерные модели, которые учитывают гидродинамические ситуации и процесс отмирания микроорганизмов в водной среде (Sokolova, Pettersson, Bergstedt, & Херманссон, 2013). Знания о концентрации бактерий и других вредных микроорганизмов и их источниках необходимы для оценки рисков для здоровья человека, связанных с потреблением загрязненной воды. Увеличивая базу знаний о связи между экологическими и социально-экономическими факторами и микробной динамикой / разнообразием, риски для здоровья вполне могут быть уменьшены. Вмешательство человека, такое как надлежащие методы управления озерами, контроль источников загрязнения и очистка сточных вод перед сбросом в озера и водохранилища, может улучшить качество воды в озерах. Риски для здоровья человека, вызванные потреблением загрязненной воды, можно свести к минимуму за счет уменьшения попадания загрязняющих веществ в окружающую среду и уменьшения воздействия загрязненных вод.
Увеличивая базу знаний о связи между экологическими и социально-экономическими факторами и микробной динамикой / разнообразием, риски для здоровья вполне могут быть уменьшены. Вмешательство человека, такое как надлежащие методы управления озерами, контроль источников загрязнения и очистка сточных вод перед сбросом в озера и водохранилища, может улучшить качество воды в озерах. Риски для здоровья человека, вызванные потреблением загрязненной воды, можно свести к минимуму за счет уменьшения попадания загрязняющих веществ в окружающую среду и уменьшения воздействия загрязненных вод.
Определить источник патогенов сложно (Dickerson, Crozier, Hagedorn, & Hassall, 2007; Malakoff, 2002). Однако есть потенциал для использования относительно нового подхода, такого как отслеживание микробных источников (MST), для отслеживания происхождения фекальных колиформ (Dickerson et al., 2007; Ma, Li, & Zhang, 2014). В прошлом метод MST использовался для анализа устойчивости к антибиотикам для оценки воздействия крупного рогатого скота на качество воды в масштабе водораздела (Grave, Hagedorn, Brooks, Hagedorn, & Martin, 2007). Для отслеживания источников патогенов авторы предположили, что полезны библиотеки происхождения хозяина, основанные на фенотипическом методе. Однако многие методы MST основаны на предположении, что некоторые штаммы бактерий обнаруживаются только в пределах одного вида или группы животных. Это предположение является спорным, когда речь идет об обычных фекальных бактериях E . coli (Малакофф, 2002). Таким образом, следует соблюдать осторожность при использовании E . coli для отслеживания источника (Гордон, 2001). Кроме того, затраты на разработку библиотек, реализацию обширных программ выборки, необходимые для проверки метода MST, и расчет неопределенностей, связанных с этим методом, являются законными проблемами, которые требуют внимания перед использованием метода MST в масштабе водораздела.
Для отслеживания источников патогенов авторы предположили, что полезны библиотеки происхождения хозяина, основанные на фенотипическом методе. Однако многие методы MST основаны на предположении, что некоторые штаммы бактерий обнаруживаются только в пределах одного вида или группы животных. Это предположение является спорным, когда речь идет об обычных фекальных бактериях E . coli (Малакофф, 2002). Таким образом, следует соблюдать осторожность при использовании E . coli для отслеживания источника (Гордон, 2001). Кроме того, затраты на разработку библиотек, реализацию обширных программ выборки, необходимые для проверки метода MST, и расчет неопределенностей, связанных с этим методом, являются законными проблемами, которые требуют внимания перед использованием метода MST в масштабе водораздела.
Какие бактерии находятся в моих фекалиях? Смотря куда смотреть …
Это гостевой пост от моего друга и бывшего коллеги Тами Либерман. Она работает постдоком в лаборатории Кишони на факультете системной биологии Гарвардской медицинской школы, и вы следите за ней в твиттере @conTAMInatedsci.
Как недавно получивший докторскую степень я изучаю эволюцию бактерий во время инфекции. Я хочу лучше понять, как они приобретают устойчивость к антибиотикам и к чему еще они могут адаптироваться, пытаясь выжить внутри нас.Очень весело думать о невидимых эволюционных процессах, происходящих внутри людей.
Мне также нравится думать о нескольких фунтах бактерий внутри и на моем теле — какие бактерии там живут, как они туда попали и что это значит для моего здоровья. И, конечно же, как мой микробиом может развиваться. Возможно, вы также думали о невидимых экосистемах на вас.
Итак, когда две разные кампании на Indiegogo предложили мне возможность изучить состав моего микробиома, я был продан.23 года назад я профилировал мой геном, и это был следующий шаг.
Но одновременно я был осторожен, потому что профилирование микробиома беспорядочно (и я говорю не только о сборе образцов). Например, несколько лет назад появилась история о том, что каждый наш кишечник принадлежит к одному из трех канонических типов, называемых «энтеротипами». С тех пор понятие дискретных энтеротипов стало предметом пристального внимания. Проблема в том, что исследовать микробиом сложно. Технологии профилирования ДНК и методы анализа несовершенны и все еще развиваются.Золотого стандарта не существует, потому что мы не знаем, как вырастить большинство кишечных бактерий в лаборатории, чтобы проверить, действительно ли они там есть. Более того, наш микробиом — это движущаяся цель, меняющаяся с возрастом и диетой. Что же тогда я действительно могу узнать из снимка?
С тех пор понятие дискретных энтеротипов стало предметом пристального внимания. Проблема в том, что исследовать микробиом сложно. Технологии профилирования ДНК и методы анализа несовершенны и все еще развиваются.Золотого стандарта не существует, потому что мы не знаем, как вырастить большинство кишечных бактерий в лаборатории, чтобы проверить, действительно ли они там есть. Более того, наш микробиом — это движущаяся цель, меняющаяся с возрастом и диетой. Что же тогда я действительно могу узнать из снимка?
«Эксперимент»
Я решил посмотреть, сколько информации о моей экосистеме я действительно мог бы собрать из одного мазка. Я купил два набора для взятия проб кишечника от American Gut и один от uBiome. Я хотел задать два вопроса: (1) Насколько различаются результаты двух поставщиков услуг? и (2) насколько изменчивы внутри человека, даже в пределах одной кормы?
Однажды октябрьским утром в четверг, получив наборы, я, наконец, был готов принять очень особенный какашку (только в том смысле, что я собирался узнать о ней много нового). Оба поставщика попросили меня протереть грязную туалетную бумагу, и я немного изменил это, чтобы соответствовать моему сравнению. Я использовал два разных куска туалетной бумаги, чтобы взять два очень маленьких куска табурета из одного бревна. Я приложил все усилия, чтобы гомогенизировать каждый образец, натирая туалетную бумагу о себя. Затем я взял один мазок дважды — по одному для каждого врача, а другой — для американского кишечника. Я отправил образцы, зарегистрировал комплекты в Интернете, неохотно заполнил целую кучу опросов по питанию и здоровью (для каждого собственного исследования) и ждал еще несколько месяцев, чтобы получить свои результаты.
Оба поставщика попросили меня протереть грязную туалетную бумагу, и я немного изменил это, чтобы соответствовать моему сравнению. Я использовал два разных куска туалетной бумаги, чтобы взять два очень маленьких куска табурета из одного бревна. Я приложил все усилия, чтобы гомогенизировать каждый образец, натирая туалетную бумагу о себя. Затем я взял один мазок дважды — по одному для каждого врача, а другой — для американского кишечника. Я отправил образцы, зарегистрировал комплекты в Интернете, неохотно заполнил целую кучу опросов по питанию и здоровью (для каждого собственного исследования) и ждал еще несколько месяцев, чтобы получить свои результаты.
uBiome против американского кишечника
Мои результаты uBiome прибыли в марте. Затем, несколько недель назад, по совпадению, когда я был на своей первой конференции по микробиому, пришли мои результаты по американскому кишечнику. Я был в восторге.
Первоначально я ожидал, что между поставщиками будет значительное количество разногласий. Действительно положительным моментом является то, что результаты American Gut и uBiome, взятые из Образца 1, по существу совпадают. Все бактерии, обнаруженные американским кишечником с частотой выше 5%, также были обнаружены uBiome с аналогичной частотой, и обратное также верно.Я ожидал найти больше различий (как нашел другой пользователь). Поскольку эти поставщики предположительно используют несколько разные методы подготовки и анализа ДНК, я нашел эти результаты как неожиданными, так и обнадеживающими.
Действительно положительным моментом является то, что результаты American Gut и uBiome, взятые из Образца 1, по существу совпадают. Все бактерии, обнаруженные американским кишечником с частотой выше 5%, также были обнаружены uBiome с аналогичной частотой, и обратное также верно.Я ожидал найти больше различий (как нашел другой пользователь). Поскольку эти поставщики предположительно используют несколько разные методы подготовки и анализа ДНК, я нашел эти результаты как неожиданными, так и обнадеживающими.
Самая большая разница между двумя поставщиками заключалась в способе представления данных. American Gut предоставляет таблицу и PDF-файл с некоторыми трудно интерпретируемыми графиками. Важно отметить, что American Gut сравнивает вас только с различными средними показателями людей, без какого-либо упоминания «диапазона», которого я ожидал бы от здоровых людей (рис. 2).Что еще хуже, они показывают несколько столбцов, которые представляют средние значения для разных популяций, и они очень похожи друг на друга (потому что они усредняют большие, похожие группы населения). В отличие от этих столбиков, мой микробиом выглядит как выброс — когда, как мы увидим ниже, он находится в пределах нормальных отклонений кишечника здоровых людей.
В отличие от этих столбиков, мой микробиом выглядит как выброс — когда, как мы увидим ниже, он находится в пределах нормальных отклонений кишечника здоровых людей.
uBiome имеет несколько графиков с той же проблемой, но также имеет очень информативные интерактивные графики, которые позволяют избежать этой проблемы и показывают, где ваши результаты попадают в диапазон нормальных вариаций.Как видно на Рисунке 3, от 50% до 76% Firmicutes находится в пределах нормы. Интерактивный веб-сайт uBiome, который все еще находится в стадии бета-тестирования, очень прост в навигации и позволяет проводить несколько очень интересных типов исследований, о которых я не буду здесь вдаваться.
Изменчивость во время стула
Настоящая неожиданность произошла при сравнении двух областей одного и того же стула. Посмотрите, сколько Firmicutes содержится во втором тампоне, который я отправил в American Gut! Количество Firmicutes увеличивается с 64% в образце 1 до 76% в образце 2.
Считается, что Firmicutes связаны с ожирением. Означает ли это, что я должен попытаться изменить свой микробиом и уменьшить количество Firmicutes, чтобы похудеть? Вероятно, нет — потому что я сомневаюсь (по причинам, о которых я расскажу ниже), что этот мазок дает значимые результаты.
Чтобы понять, почему эти два образца различались по количеству Firmicutes, мы можем увеличить масштаб. Гистограммы, которые я показывал до сих пор, классифицируют бактерии на уровне филума (на один таксономический шаг точнее, чем царство), но по типу используемых данных оба поставщика могут классифицировать бактерии до уровня семейства и / или рода.Я загрузил подробные таблицы численности из American Gut и быстро построил график, используя самую низкую классификацию, предусмотренную для каждой идентифицированной бактерии. Бактерии с одинаковой численностью в двух образцах попадут на диагональную линию; чем дальше от этой линии, тем больше различаются два образца. Члены Firmicutes phlyum показаны красным цветом на рис. 5:
5:
. Хотя большая часть численности мало различается между образцами, есть два огромных выброса (выделены синим цветом), которые объясняют различия, видимые на гистограммах (рис. 4).Второй образец — это 15% Lactobacillus (член Firmicutes), в то время как первый образец практически ничего не показал (по результатам от обоих поставщиков). Во вторых образцах не было Prevotella, тогда как uBiome и American Gut согласились, что в первом образце было около 12% Prevotella!
Что означает эта изменчивость?
Эта вариация внутри стула, особенно у Преветоллы (0% против 12%), представляет собой довольно серьезную проблему. Несколько недавних исследований были сосредоточены на Преветолле как на выдающемся иногда члене нашего микробиома.С разной степенью тщательности эти исследования связали Prevotella как детерминант энтеротипов, обогащенный определенными культурами, и коррелировали с ревматоидным артритом и предикторами сердечных заболеваний.
Я не тестировал это, но держу пари, что могу попросить одного или трех микробиологов взглянуть на результаты образца 1 и рассказать мне, как это изобилие Prevotella отражает мою диету. Джефф Лич недавно написал в блоге длинное сообщение о микробиоме, в котором основное внимание уделялось Prevotella и связано различное количество Prevotella между ним и его друзьями с дифференцированным потреблением цельнозерновых продуктов.Майкл Поллан недавно написал статью на NYTimes, в которой оплакивал потерю Prevotella после курса антибиотиков. Исчезли бы эти микробные сигнатуры, на которых сосредоточили внимание Лич, Поллан и другие, если бы они взяли второй мазок?
Вывод из этой вариабельности стула заключается в том, что нам нужно противостоять побуждению интерпретировать наши личные данные микробиома. Обратите внимание, что я сказал «интерпретировать», а не «переоценивать». Многие люди делают достойную работу, принимая учебу с недоверием.Однако нам необходимо применить это сомнение к самим данным, имея в виду пространственную неоднородность и другие источники изменчивости. Это особенно важно, так как люди используют эти результаты для самых разных целей, в том числе для мониторинга собственных трансплантаций фекалий в домашних условиях. Мы просто не можем получить хорошее представление о микробиоме человека из одного образца.
Это случайная неоднородность или систематическая биогеография?
Некоторые эксперты, с которыми я разговаривал на недавнем микробиомном собрании, не были удивлены тем, что я обнаружил вариабельность стула.Они сказали мне, что очевидно, что мы не можем многому научиться из одного образца (если бы это не было «очевидным», я мог бы попытаться написать рукопись вместо сообщения в блоге…). В конце концов, наш микробиом реагирует на то, что мы едим, а то, что я ел на завтрак, отличается от того, что я ел на ужин.
Чтобы обойти этот и другие источники изменчивости, исследователи сравнивают множество людей при проведении сравнительных исследований (например, ожирение и худощавость) и с течением времени берут много образцов у одного человека.
Но что, если эти различия могут быть не случайными колебаниями в пространстве, а вместо этого систематические различия отражают биогеографию стула? Вероятно, существует систематическая реакция микробиоты на влажность, время и местоположение в толстой кишке. Некоторые исследования намекают, что такая биогеография существует. Тем не менее, насколько мне известно, систематических исследований микробного сообщества в образце стула не проводилось, хотя есть этот забавный анализ распределения яиц нематодового червя по стулу.
Если есть важные пространственные различия в стуле, взятие большого количества образцов у человека с течением времени может не усреднить эту вариацию. Фекалии того, кто постоянно какает перед завтраком, могут микробиологически отличаться от того, кто какает в полдень. Две группы (например, здоровые люди и люди с глютеновой болезнью) могут иметь систематические различия в форме, длине или консистенции стула (щелкните по нему!). Их микробиомы могут быть практически одинаковыми, но при этом существенно отличаться!
Я надеюсь, что исследователи кишечного микробиома включат вариабельность стула в свой (длинный) список возможных смешивающих факторов.
Ну, корма
Важно помнить, что в этом «эксперименте» была небольшая выборка. Возможно, что два моих образца показали крайние вариации в стуле, и что большинство людей будут демонстрировать большую стабильность в своих фекалиях.
Но мне кажется, что в области микробиома существует консенсус в отношении того, что существует слишком много внутриличностных и межличностных вариаций, чтобы сделать значимые выводы из единственного образца.
Тем не менее, провайдеры скрывают понятие изменчивости.Они действительно включают предупреждения о том, что эти тесты не являются диагностическими (возможно, то, что должен был сделать 23andme), но не содержат никаких заявлений о том, что сами данные могут не отражать ваш микробиом. Сообщения от American Gut скрывают межличностную изменчивость. Учитывая стремительный рост нашего микробиома и людей, выполняющих опасные операции по пересадке фекалий в домашних условиях, отказ от вариабельности образцов должен быть громким и четким.
Подробнее об исследованиях Тами по эволюции бактерий во время инфекции можно прочитать здесь и здесь.
Анализ стула: культура бактерий (для родителей)
Что это такое
Образец стула (кала) может предоставить врачам ценную информацию о том, что происходит, когда у ребенка проблемы с желудком, кишечником или другой частью желудочно-кишечной (ЖКТ) системы. Посев кала помогает врачу определить наличие бактериальной инфекции в кишечнике.
Техник помещает небольшие образцы стула в стерильные пластиковые чашки с питательными веществами, которые способствуют росту определенных бактерий.Целевые бактерии будут расти только в том случае, если они уже находятся в образце стула. Если образуются бактериальные колонии, технический специалист оценивает их с помощью микроскопа и химических тестов для идентификации организма.
Почему это сделано
Врач может запросить посев кала на наличие болезнетворных бактерий, таких как:
Иногда обнаруживаются и другие бактерии.
Посев кала может быть заказан, если у вашего ребенка диарея в течение нескольких дней или диарея с кровью, особенно если в вашем районе произошла вспышка пищевого происхождения, ваш ребенок недавно ел недоваренное мясо или яйца или непастеризованное молоко, или ваш ребенок ел. недавно побывал в определенных местах за пределами США.
с.
Препарат
В отличие от большинства других лабораторных тестов, образец стула обычно собирают родители дома, а не медицинские работники в больнице или клинике. Никакой специальной подготовки не требуется, но сообщите своему врачу, если ваш ребенок недавно принимал антибиотики.
Процедура
Врач или больничная лаборатория обычно предоставляют письменные инструкции о том, как взять образец стула. Если инструкции не предоставлены, вот советы по сбору образца стула у вашего ребенка:
- Обязательно наденьте защитные перчатки и после этого вымойте руки и руки ребенка.
- Многие дети с диареей, особенно маленькие, не всегда могут заранее сообщить родителям о приближении дефекации. Поэтому для сбора образца стула используется пластиковая крышка в форме шляпы. Это улавливающее устройство можно быстро разместить над унитазом или под попкой вашего ребенка для сбора пробы. Использование улавливающего устройства может предотвратить загрязнение стула туалетной водой. Другой способ собрать образец стула — это накинуть на сиденье унитаза неплотно полиэтиленовую пленку.Затем поместите образец стула в чистый герметичный контейнер, прежде чем отнести его в лабораторию.
- Пластиковую пленку также можно использовать для выстилки подгузника младенца или малыша, который еще не пользуется туалетом. Повязку следует размещать так, чтобы моча попадала в подгузник, а не в подгузник.
- Ваш ребенок не должен мочиться в контейнер. Если возможно, попросите ребенка опорожнить мочевой пузырь перед дефекацией, чтобы образец кала не разбавлялся мочой.
- Стульчик следует поместить в чистые сухие пластиковые банки с завинчивающейся крышкой.Вашего ребенка могут попросить сдать образец стула один или несколько раз. Для достижения наилучших результатов стул следует доставить в лабораторию в течение нескольких часов.
п.
Чего ожидать
Когда образец поступает в лабораторию, техник наносит мазок стула на стимулирующее рост вещество внутри стерильных чашек. Каждая из этих пластин хранится при температуре, обеспечивающей самый быстрый рост целевых бактерий.
Если колонии бактерий не образуются, тест отрицательный, что означает отсутствие признаков бактериальной инфекции.Но если бактериальные колонии все же образуются, технический специалист исследует их под микроскопом и может выполнить химические тесты, чтобы идентифицировать их более конкретно.
Получение результатов
Как правило, результат посева кала сообщается в течение 24-48 часов.
Риски
Сбор образцов стула не представляет никакого риска.
Помощь вашему ребенку
Взять образец стула безболезненно. Скажите ребенку, что сбор стула не повредит, но это нужно делать осторожно.Достаточно взрослый ребенок может самостоятельно собрать образец, чтобы избежать затруднений. Расскажите ребенку, как это делать правильно.
Если у вас есть вопросы
Если у вас есть вопросы о посеве стула, поговорите со своим врачом.
груд древних фекалий свидетельствуют о «исчезновении» кишечных бактерий человека | Наука
Каждый прием пищи, которую вы едите, переваривается с помощью множества бактерий, обитающих в вашем кишечнике. Когда вы закончите переваривание, эти бактерии также станут частью того, что выводится из организма.Теперь 1000-летние груды высохших фекалий дают представление о том, как миллиардные бактериальные экосистемы в кишечнике человека были изменены санитарией, обработанными пищевыми продуктами и антибиотиками.
В исследовании, опубликованном сегодня в журнале Nature , исследователи проанализировали древнюю ДНК из копролитов или консервированных фекалий, найденных за каменными убежищами в Юте и Мексике. По словам биолога из Стэнфордского университета Джастина Зонненбурга, эти данные дают ученым возможность впервые хорошенько взглянуть на сообщества древних кишечных бактерий.«Эти палеофекалии — эквивалент машины времени».
Они предполагают, что за последнее тысячелетие кишечник человека пережил «событие вымирания», потеряв десятки видов и стал значительно менее разнообразным, говорит ведущий автор и микробиолог Гарвардской медицинской школы Александр Костич. «Это вещи, которые мы не вернем».
Предыдущие исследования использовали кишечные бактерии сегодняшних охотников-собирателей и пастухов в качестве заместителя древнего микробиома. Их микробное разнообразие намного превышает разнообразие людей в индустриальных обществах, и исследователи связывают низкое разнообразие с более высокими показателями «болезней цивилизации», включая диабет, ожирение и аллергии.Но было неясно, сколько общего у сегодняшних непромышленных людей с древними людьми. «Мы действительно хотели иметь возможность вернуться в прошлое и увидеть, когда произошли эти изменения [в современном микробиоме кишечника] и что их вызывает», — говорит генетик Гарвардского университета Кристина Уоринер, соавтор статьи. «Это сама еда? Это переработка, антибиотики, санитария?»
Международная группа исследователей проанализировала восемь древних копролитов, сохранившихся благодаря сухости и стабильным температурам в трех каменных убежищах в Мексике и на юго-западе США.Исследователи датировали образцы, некоторые из которых были выкопаны почти 100 лет назад и хранились в музее, с помощью радиоуглерода между 0 и 1000 гг. более длинные нити ДНК, чем в предыдущих анализах палеофекалий.
Более ранние попытки проанализировать древний микробиом кишечника были сорваны из-за проблемы отделения ДНК древних кишечных бактерий от ДНК микробов, вторгшихся из окружающей почвы, говорит Марша Вибово, доктор философии.D. студентка Гарвардского диабетического центра Джослина, которая проанализировала ДНК. Она выделила древние виды кишечника, сосредоточив внимание на ДНК, поврежденной временем, и на последовательностях бактерий, которые, как известно, связаны с кишечником млекопитающих. Однако некоторая часть древней ДНК была незнакомой и, очевидно, представляла собой невиданные ранее виды вымерших бактерий.
Копролиты дали 181 геном, которые были древними и, вероятно, произошли из кишечника человека. Многие из них напоминали те, которые сегодня обнаруживаются в непромышленных образцах кишечника, включая виды, связанные с диетами с высоким содержанием клетчатки.Кусочки пищи в образцах подтвердили, что в рацион древних людей входили кукуруза и бобы, типичные для первых фермеров Северной Америки. Образцы с одного места в штате Юта предлагают более эклектичную, богатую клетчаткой «голодную диету», включая опунцию, рисовые травы и кузнечики.
Но древние микробиомы также отличались от своих современных собратьев, например, не имея маркеров устойчивости к антибиотикам. И они были заметно более разнообразными, включая десятки неизвестных видов. «Только в этих восьми образцах из относительно ограниченной географии и временного периода мы обнаружили 38% новых видов», — говорит Костич.
Бактерии Treponema , например, практически неизвестны в промышленно развитом кишечном микробиоме и лишь изредка появляются у людей, ведущих непромышленный образ жизни сегодня. Но «они присутствуют в каждой палеофекалии на всех географических участках», — говорит Костич. «Это говорит о том, что все влияет не только на диету». Он надеется, что будущие эксперименты с копролитами из других периодов времени позволят определить, когда произошли самые большие сдвиги и что их вызвало.
Полученные данные перекликаются с другим исследованием гораздо более старых образцов, опубликованным Уоринером и его коллегами на этой неделе, в котором сообщается о ДНК ранее не идентифицированных микробов на зубах неандертальцев и ранних современных людей.
Новые данные из старых кормов показывают, что сегодня ни один человек на планете не избежал изменений в своем микробиоме. «Непромышленные группы населения, включая их микробиомы, не должны рассматриваться как прокси для наших предков», — говорит генетик Массачусетского технологического института Мэтью Груссен.
Результаты также показывают, что мы потеряли много помощников микробов в недавнем прошлом, и наши тела, возможно, не успели адаптироваться. «Это исследование дает нам золотой стандарт для проверки того, какие виды мы потеряли», — говорит Зонненбург.
Поскольку фекалии не считаются человеческими останками в соответствии с законодательством США, говорит Уоринер, на раннем этапе этики исследования почти не обсуждались. Но когда группа обратилась к нескольким десяткам племен на юго-западе, некоторые сказали, что образцы были связью с их предками, и были расстроены, что с ними не посоветовались раньше.В настоящее время исследование включает в себя этическое заявление, впервые для статьи о палеофеках.
Калифорнийский университет в Сан-Диего, генетик Кеолу Фокс говорит, что команда не зашла достаточно далеко. По его словам, понимание древнего кишечника может когда-нибудь послужить основой для коммерческих усилий по изменению современного микробиома. Это поднимает сложные вопросы о том, кому принадлежат такие данные. «Это предположительно отходы, но они содержат ДНК и профили микробного разнообразия. Может быть, эти корма в буквальном смысле слова золото», — говорит Фокс. «Мы попадаем в совершенно новую серую зону.«
Применение градиента плотности для выделения фекального микробного компонента стула и его потенциальное использование
В течение последних нескольких лет растущий интерес к пониманию состава микробиоты кишечника человека привел к более глубоким знаниям о том, как эти микробные популяции могут быть изменены в рамках определенных заболеваний, особенно с аутоиммунными или воспалительными компонентами. Микробиота кишечника начинает рассматриваться как динамичный орган человеческого тела и, как таковой, может быть трансплантирована в терапевтических целях.Во всех описанных путях и способах введения FMT фекальный материал (свежий или замороженный) разбавляется физиологическим раствором или лиофилизируется, как правило, в неконтролируемой атмосфере.
Отделение микробов от фекалий с использованием методологий, основанных на градиенте плотности, не является новой концепцией, поскольку она используется для отделения бактерий от почвы с 1970-х годов. Первые протоколы разделения состояли из повторяющихся стадий смешивания-центрифугирования в различных буферах и солевых растворах 36,37 .Позже было предложено разделение бактерий центрифугированием на модифицированных градиентах сахарозы 38 или пропусканием через катионообменную смолу (Jacobsen and Rasmussen, 1992) 39 . Основным ограничением этих протоколов является то, что они отнимают много времени и поэтому их трудно внедрить в рутинный анализ; это ограничение преодолевается с помощью смолы Nycodenz 25 , хотя данные о жизнеспособности бактерий не приводятся. В рамках FMT отделение микробиоты желудочно-кишечного тракта от остального фекального материала дает преимущество уменьшения гигиенических проблем из-за непривлекательного характера фекалий.
В этой работе были отобраны восемь образцов кала из предыдущей исследовательской работы, посвященной дисбактериозу кишечника в рамках SLE 17 . Эти образцы различались в отношении бактериального разнообразия, что отражалось в различных значениях отношения Firmicutes к Bacteroidetes (FBR, ниже у пациентов с СКВ по сравнению со здоровым контролем; HC4 = 8,6, HC32 = 8,8, HC33 = 4,5, SLE2 = 1,6, SLE12 = 1,0, SLE13 = 1,6, SLE21 = 1,2, SLE22 = 0,3). Интересно, что изменения FBR наблюдались при некоторых заболеваниях человека, таких как болезнь Крона, диабет 2 типа или ожирение.Обоснование этого выбора состояло в том, чтобы оценить, может ли наш метод экстракции влиять на образцы с различными FBR.
В нашем подходе гомогенизированное разведение фекалий загружали поверх 80% -ного раствора Nycodenz® (рис. 1А) и центрифугировали при 10000 × g. Это отличалось от подхода Rooijers et al. 40 , которые следовали методологии Murayama et al. 41 , с разными препаратами градиента Nycodenz® и разными значениями относительной центрифужной силы.Микробиоту отделяли от остального фекального материала за один этап центрифугирования. Как видно на фиг. 1B, два слоя, соответствующие микробной биомассе, наблюдались в верхней части слоя нерастворимых обломков. Этот мусор облегчил задачу восстановления микроорганизмов после удаления верхней фазы растворимого мусора, поскольку он создавал физический барьер, предотвращающий смешивание ресуспендированной микробиоты с нижним слоем Nycodenz®. Различные слои были подвергнуты контрастной фазовой микроскопии, и подавляющее большинство микроорганизмов было обнаружено в вышеупомянутых двух слоях (рис.1С).
Подход, использованный для оценки эффективности процедуры экстракции Nycodenz®, показал, что жизнеспособность фекальной микробиоты, отделенной с помощью градиента плотности, сохранялась в большей степени по сравнению со свежей фекальной микробиотой (Дополнение, рис. 1). В среднем в микробиоте, восстановленной после обработки Nycodenz®, 66,9% бактерий были все еще живы, со значениями в диапазоне от 71,3 до 60,6% (66,9 ± 5,6) среди трех проанализированных образцов фекалий, в то время как в свежих фекалиях жизнеспособность оценивалась как диапазон между 85.6–49,9% (68,6 ± 17,9). Это дает представление о высокой эффективности предложенной методологии концентрации и изоляции жизнеспособной микробиоты, независимо от изменений в фекалиях с точки зрения влажности и содержания клетчатки. Концентрации живых бактерий в трех образцах, проанализированных методом проточной цитометрии, варьировались от 3,2 × 10 9 до 7,2 × 10 9 (5,2 ± 2,0 × 10 9 ) бактерий / грамм сухого вещества фекалий в исходных образцах свежие фекалии и между 5,7 × 10 9 и 9.0 × 10 9 (7,0 ± 1,8 × 10 9 ) на грамм фекалий после экстракции градиентом плотности. Это означает, что все жизнеспособные бактерии извлекаются из фекального материала с выходом около 10 10 жизнеспособных бактерий на два грамма образца фекалий. Не было обнаружено значительных различий в средних концентрациях до и после лечения. Таким образом, наши результаты показали минимальную вариабельность жизнеспособной микробиоты, восстановленной у разных отдельных доноров, и отсутствие влияния протокола изоляции на целостность фекальных бактерий.
Анализ фракций микробиоты, экстрагированных с использованием градиента плотности, привел к общему снижению разнообразия по сравнению с результатами, полученными для ДНК, экстрагированной непосредственно из фекалий. Это было верно, когда рассчитывались индексы альфа-разнообразия, учитывающие только видовое богатство (Chao 1, Observed Species), но обратное наблюдалось при использовании индекса Шеннона, который учитывает однородность видов (Shannon) (рис. 2) . Никаких различий в альфа-разнообразии с помощью индекса Симпсона не обнаружено.В целом это означает, что, хотя количество извлеченных OTU меньше после экстракции Nycodenz®, пропорции между ними не обязательно менялись в процессе экстракции. Следует проявлять осторожность в том смысле, что уменьшение альфа-разнообразия может повлиять на эффективность FMT, поскольку могут быть потеряны точные бактериальные группы, важные для баланса дисбактериоза. Таким образом, необходимы дальнейшие исследования, чтобы определить, может ли снижение количества OTU / видов отчасти быть вызвано воздействием кислорода во время манипуляции с разделением микробиоты в градиенте плотности.Возможно, что определенные типы микробов, более чувствительные к кислороду, могут быть защищены, если экстракция фекальной микробиоты проводится в строгих анаэробных условиях. Также будет интересно выяснить, полезны ли градиенты Nycodenz® для избирательного удаления нежелательных молекул / микроорганизмов из фекалий, таких как токсины, прионы и вирусы.
Рисунок 2Различные индексы альфа-разнообразия, полученные из образцов стула до (темно-серый) или после (светло-серый) разделения микробиоты по градиенту плотности.
Столбцы представляют собой среднее значение ± стандартное отклонение. (* р <0,05; *** р <0,001).
Чтобы узнать, могут ли различия, наблюдаемые в микробном разнообразии между образцами, с экстракцией Nycodenz® или без нее, использоваться для целей кластеризации, образцы были упорядочены с использованием таксономического состава на уровне типа или семейства с использованием различных методологий: Основные компоненты Анализ (PCA), анализ главных координат (PCoA) и анализ соответствия (CA) (рис.3). При непредвзятом использовании, то есть без предоставления информации об источнике различных микробных профилей, все методы упорядочивания могли сгруппировать образцы в отдельные группы (фекалии против извлеченной микробиоты) (рис. 3). Отсутствие эффекта от метода экстракции было подтверждено статистически, a posteriori , с использованием непараметрических тестов, таких как One-way ANOSIM и One-way PERMANOVA. В обоих случаях образцы сначала классифицировались по их происхождению, а их сходство измерялось в соответствии с евклидовыми расстояниями.Полученные p-значения не подтверждают классификацию образцов на две группы (фекалии против извлеченной микробиоты; односторонний ANOSIM; p-значение 0,733; одностороннее PERMANOVA; p-значение 0,353).
Рисунок 3Для определения того, были ли микробные популяции получены непосредственно из гомогенизированных образцов стула (черные точки) или из отдельной фекальной микробиоты (серые квадраты), сгруппированных в зависимости от их состава, использовались различные непредвзятые методики многомерного упорядочения. .
Эллипсы обозначают предполагаемый регион, в котором ожидается падение 95% населенных пунктов. Анализы проводились на уровне типа и семьи. PCA: анализ главных компонентов; PCoA, анализ главных координат; CA, Анализ корреспонденции.
Для дальнейшего изучения влияния разделения микробов с помощью градиента плотности на профилирование гена 16S РНК была построена матрица сходства с использованием относительной численности семейств путем расчета расстояний Жаккара, метода, уже использовавшегося в других метагеномных исследованиях 42 .Образцы были сгруппированы с использованием этих расстояний между образцами в соответствии с методом простого связывания или с помощью алгоритма объединения соседей и соответствующих полученных дендрограмм (рис. 4). В обоих случаях образцы, из которых ДНК была извлечена после отделения микробиоты, сгруппировались с соответствующими образцами фекалий, за исключением образцов LS12 и HD33. В этих образцах влияние экстракции микробиоты на метагеномные профили было выше, при этом в некоторых группах наблюдались резкие изменения на уровне типа или семейства (Дополнение.Рис.2). Эти результаты подтвердили, что, как правило, микробные сообщества, извлеченные с использованием процедуры центрифугирования в градиенте плотности, являются репрезентативными для тех, которые присутствовали в исходном образце стула.
Рисунок 4Дендрограммы, показывающие сходство образцов в соответствии с расстояниями Жаккара; ( A ) кластеризация посредством простого связывания; ( B ) кластеризация с использованием объединения с соседями с поддержкой ветвей (10 000 повторений). Суффиксы NEW и OLD обозначают образцы, из которых микробиота экстрагировалась или не экстрагировалась в градиенте плотности, соответственно, до экстракции ДНК.
Разделение микроорганизмов с использованием градиента плотности Nicodenz® впервые было введено Линдалом и Баккеном для выделения бактерий из почвы. 43 . Этот метод также успешно применялся в других биологических системах, например, при описании кишечного метагенома красного пальмового долгоносика ( Rhynchophorus ferrugineus ) 44 или при оценке экспрессии генов в матрицах молочных продуктов 45 . Отделение бактерий от определенных матричных соединений может быть очень полезным для последующих задач молекулярной биологии, поскольку на этом этапе удаляются многие компоненты, ингибирующие ПЦР, такие как гуминовые соединения или окрашенные вещества, мешающие протоколам блот-гибридизации 46 .
В нашей работе было показано, что применение этой методологии не влияет на глобальную изменчивость извлеченной микробиоты, и разнообразие бактерий, извлеченных непосредственно из почвы или следуя градиенту Nycodenz®, существенно не отличалось, за исключением γ-Proteobacteria. 25 . Однако некоторые таксономические группы показали значительные различия в зависимости от экстракции градиента, когда все образцы были сгруппированы и проанализированы (Таблица 1). В целом профили гена 16S рРНК из образцов, в которых микробиота была экстрагирована в градиенте Nycodenz®, характеризовались более высокой относительной численностью филума Firmicutes, что связано с более высоким выходом порядка Clostridiales (Дополнение.Рис.3). Несколько групп, образующих подразделения Beta, Delta и Epsilon типа Proteobacteria, также показали значительные различия в зависимости от лечения, хотя и в меньшей степени.
Таблица 1 Таксоны, показывающие статистические различия в их относительной численности при сравнении прямой экстракции ДНК из фекалий или после разделения микробиоты в градиенте плотности.В целом методология, представленная в этой работе, предлагает простой и понятный метод извлечения и отделения фекальной микробиоты от остальных компонентов стула, что позволяет дальнейшие улучшения, такие как выполнение этого процесса в контролируемых атмосферных условиях.Кроме того, эта стадия экстракции может устранить некоторые нежелательные соединения фекалий, но это заслуживает дальнейших исследований. Наш подход может быть использован для получения репрезентативной кишечной микробиоты, свободной от каловых масс, для длительного хранения. Это также может быть полезным в качестве первого шага для сохранения микробных сообществ в целом и может быть использовано в ближайшем будущем при разработке продуктов / носителей на основе микробиоты для FMT и новых биотерапевтических методов восстановления кишечника. Однако необходимы дальнейшие улучшения этого метода, так как, например, экстракция Nycodenz® и некоторых представителей этого рода, таких как C.scindens может иметь отношение к лечению CDI 47 . Кроме того, необходимы эксперименты на животных, чтобы показать, что микробиота, извлеченная с помощью этого метода, эффективно приживается в организме хозяина.
Интересно, что этот протокол может быть расширен, позволяя обрабатывать большие количества фекалий с помощью центробежных устройств с большей емкостью. Например, 430 граммов фекального материала можно обработать с помощью качающихся роторов (до 30 000 × г ) с распределением 4 ведер по 1000 мл с ожидаемым выходом 10 12 жизнеспособных бактерий.
Подводя итог, получение репрезентативной микробиоты из фекалий здорового донора с использованием градиента плотности Nycodenz®, описанного в этой работе, позволило бы сконцентрировать кишечную микробиоту и отделить ее от остальных компонентов стула, сохраняя при этом высокую жизнеспособность. уровни. С одной стороны, Nycodenz® — безопасная молекула с точки зрения токсичности для человека, которая может быть легко удалена из образцов в процессе выделения микробиоты. По сравнению с другими молекулами, используемыми для выделения в градиенте плотности, рентгеновское плотное соединение Nycodenz® демонстрирует преимущества, такие как не ингибирующий эффект на активность большинства ферментов, совместимость с анализами определения белка и, что важно для этой цели. этой статьи, он показывает низкую токсичность для людей 41 .С другой стороны, градиент плотности позволяет восстановить репрезентативную и жизнеспособную фекальную микробиоту и подавить нежелательные микроорганизмы / соединения, а также облегчить тестирование образцов на наличие опасных агентов. Это могло бы позволить разработку последующих приложений, таких как терапевтические стратегии на основе микробиоты для микробного восстановления кишечника, как в рамках данного заболевания, так и для других приложений.
5.11 Фекальные бактерии | Мониторинг и оценка
Что такое фекальные бактерии и почему они важны?
Члены двух групп бактерий, колиформ и фекальных стрептококков, используются в качестве индикаторов возможного загрязнения сточных вод, поскольку они обычно обнаруживаются в фекалиях людей и животных.Хотя сами по себе они, как правило, не вредны, они указывают на возможное присутствие патогенных (вызывающих болезни) бактерий, вирусов и простейших, которые также обитают в пищеварительной системе человека и животных. Таким образом, их присутствие в ручьях предполагает, что здесь также могут присутствовать патогенные микроорганизмы и что плавание и употребление в пищу моллюсков может быть опасным для здоровья. Поскольку проведение прямого тестирования на наличие большого количества различных патогенов является трудным, трудоемким и дорогостоящим процессом, воду обычно проверяют на наличие колиформных бактерий и фекальных стрептококков.Источники фекального загрязнения поверхностных вод включают очистные сооружения сточных вод, локальные септические системы, навоз домашних и диких животных и ливневые стоки.
Помимо возможного риска для здоровья, связанного с повышенным уровнем фекальных бактерий, они также могут вызывать мутную воду, неприятный запах и повышенную потребность в кислороде. (См. Раздел о растворенном кислороде.)
Типы бактерий-индикаторов и что они могут вам сказать
Наиболее часто тестируемыми индикаторами фекальных бактерий являются общие колиформные бактерии, фекальные колиформные бактерии, Escherichia coli , фекальные стрептококки и энтерококки.Все, кроме E. coli , состоят из ряда видов бактерий, которые имеют общие характеристики, такие как форма, среда обитания или поведение; E. coli — единственный вид в группе фекальных колиформ.
Общие колиформные бактерии — это группа бактерий, широко распространенных в природе. Все члены общей группы колиформных бактерий могут встречаться в человеческих фекалиях, но некоторые могут также присутствовать в навозе животных, почве, затопленной древесине и в других местах за пределами человеческого тела. Таким образом, полезность общих колиформных бактерий в качестве индикатора фекального загрязнения зависит от степени, в которой обнаруженные виды бактерий являются фекальными и человеческими по происхождению.Для рекреационных вод больше не рекомендуется использовать общие колиформные бактерии в качестве индикатора. Для питьевой воды общие колиформные бактерии по-прежнему являются стандартным тестом, поскольку их присутствие указывает на загрязнение водоснабжения из внешнего источника.
Фекальные колиформные бактерии, подмножество общих колиформных бактерий, имеют более фекальное происхождение. Однако даже в эту группу входит род Klebsiella , виды которого не обязательно фекального происхождения. Клебсиелла обычно ассоциируется с отходами текстильных и целлюлозно-бумажных комбинатов.Поэтому, если эти источники попадают в ваш ручей, вы можете рассмотреть возможность мониторинга большего количества фекальных и специфических для человека бактерий. Для рекреационных вод эта группа была основным индикатором бактерий до относительно недавнего времени, когда EPA начало рекомендовать E. coli и энтерококки как лучшие индикаторы риска для здоровья от контакта с водой. Фекальные колиформные бактерии все еще используются во многих штатах в качестве индикаторных бактерий.
E. coli — это вид фекальных колиформных бактерий, специфичных для фекального материала людей и других теплокровных животных.EPA рекомендует кишечную палочку как лучший индикатор риска для здоровья от контакта с водой в рекреационных водах; некоторые штаты изменили свои стандарты качества воды и соответственно проводят мониторинг.
Фекальные стрептококки обычно встречаются в пищеварительной системе человека и других теплокровных животных. В прошлом фекальные стрептококки отслеживались вместе с фекальными колиформными бактериями и рассчитывалось соотношение фекальных колиформ к стрептококкам. Это соотношение использовалось для определения того, было ли загрязнение человеческого или нечеловеческого происхождения.Однако это больше не рекомендуется как надежный тест.
Энтерококки представляют собой подгруппу фекальных стрептококков. Энтерококки отличаются своей способностью выживать в соленой воде, и в этом отношении они более точно имитируют многие патогены, чем другие индикаторы. Энтерококки обычно более специфичны для человека, чем более крупная группа фекальных стрептококков. EPA рекомендует энтерококки как лучший индикатор риска для здоровья в соленой воде, используемой для отдыха, а также как полезный индикатор в пресной воде.
Какие бактерии следует контролировать?
Какие бактерии вы проверяете, зависит от того, что вы хотите знать. Хотите знать, опасно ли купание в ручье для здоровья? Хотите знать, соответствует ли ваш ручей государственным стандартам качества воды?
Исследования, проведенные Агентством по охране окружающей среды для определения корреляции между различными бактериальными показателями и возникновением заболеваний пищеварительной системы на пляжах для купания, показывают, что лучшими индикаторами риска для здоровья от контакта с пресной водой в рекреационных целях являются E.coli и энтерококки. Для соленой воды лучше всего подходят энтерококки. Интересно, что фекальные колиформные группы как группа были определены как плохой индикатор риска заболевания пищеварительной системы. Однако многие штаты продолжают использовать фекальные колиформные бактерии в качестве основного индикатора риска для здоровья.
Если в вашем штате все еще используются общие или фекальные колиформные бактерии в качестве индикаторных бактерий и вы хотите знать, соответствует ли вода государственным стандартам качества воды, вам следует контролировать фекальные колиформные бактерии. Однако, если вы хотите узнать о риске для здоровья от контакта с водой в рекреационных целях, результаты исследований Агентства по охране окружающей среды показывают, что вам следует подумать о переходе на E.coli или метод энтерококков для тестирования пресной воды. В любом случае лучше всего проконсультироваться с отделом качества воды экологического агентства вашего штата, особенно если вы ожидаете, что они будут использовать ваши данные.
Отбор проб и оборудованиеБактерии трудно отбирать и анализировать по многим причинам. Уровни естественных бактерий в ручьях могут значительно различаться; состояние бактерий сильно коррелирует с осадками, поэтому сравнение данных о бактериях в влажную и сухую погоду может быть проблемой; многие аналитические методы имеют низкий уровень точности, но могут быть довольно сложными; и для сбора и обработки образцов требуются абсолютно стерильные условия.
При отборе проб на бактерии в первую очередь следует принять решение о том, какой тип и размер емкости для проб вы будете использовать. После того, как вы приняли это решение, будет использоваться одна и та же простая процедура сбора, независимо от типа отслеживаемых бактерий. Процедуры сбора описаны ниже в разделе «Как отбирать образцы».
При мониторинге бактерий критически важно, чтобы все емкости и поверхности, с которыми будет соприкасаться проба, были стерильными. ЕРА допускает контейнеры из пластика или стекла Pyrex.Однако, если контейнеры будут использоваться повторно, их необходимо стерилизовать с помощью тепла и давления. Контейнеры можно стерилизовать с помощью автоклава, который представляет собой машину, которая стерилизует контейнеры паром под давлением. При использовании автоклава материал контейнера должен выдерживать высокие температуры и давление. Пластиковые контейнеры из полиэтилена высокой плотности или полипропилена могут быть предпочтительнее стеклянных с практической точки зрения, поскольку они лучше выдерживают разрушение. В любом случае обязательно ознакомьтесь со спецификациями производителя, чтобы узнать, выдержит ли емкость 15 минут в автоклаве при температуре 121 ° C без плавления.(При работе с автоклавом рекомендуется соблюдать крайнюю осторожность.) Одноразовые стерильные пластиковые пакеты Whirl-pak® используются в ряде программ. Размер контейнера будет зависеть от количества образца, необходимого для выбранного вами метода анализа бактерий, и количества, необходимого для других анализов.
Существует два основных метода анализа проб воды на наличие бактерий:
- Метод мембранной фильтрации включает фильтрацию нескольких порций пробы разного размера с использованием фильтров со стандартным диаметром и размером пор, размещение каждого фильтра на селективной питательной среде в чашке Петри, инкубацию чашек при заданной температуре в течение заданного времени. период, а затем подсчет колоний, выросших на фильтре.Этот метод различается для разных типов бактерий (варианты могут включать, например, тип питательной среды, количество и типы инкубаций и т. Д.).
- Метод ферментации с несколькими пробирками включает добавление определенного количества пробы в пробирки, содержащие питательный бульон, инкубацию пробирок при указанной температуре в течение определенного периода времени, а затем поиск газа и / или мутности, которые производят бактерии. . Наличие или отсутствие газа в каждой трубке используется для расчета индекса, известного как наиболее вероятное число (MPN).
Учитывая сложность процедур анализа и необходимого оборудования, полевой анализ бактерий не рекомендуется. Бактерии могут быть проанализированы добровольцем в хорошо оборудованной лаборатории или отправлены в сертифицированную государством лабораторию для анализа. Если вы отправляете образец бактерий в частную лабораторию, убедитесь, что он сертифицирован государством для анализа бактерий. Рассмотрим государственные лаборатории качества воды, лаборатории университетов и колледжей, частные лаборатории, лаборатории очистных сооружений и больницы.Возможно, вам придется заплатить этим лабораториям за анализ.
В данном руководстве не рассматриваются лабораторные методы, поскольку обычно отслеживаются несколько типов бактерий, и методы для каждого типа различны. Для получения дополнительной информации о лабораторных методах см. Ссылки в конце этого раздела. Если вы решите анализировать образцы в собственной лаборатории, обязательно выполните программу обеспечения качества / контроля качества. Конкретные процедуры рекомендуются в разделе ниже.
Как собирать образцыПроцедуры сбора и анализа проб на бактерии состоят из следующих задач:
ЗАДАЧА 1 Подготовить контейнеры для проб
Если для отбора проб используются предварительно стерилизованные одноразовые пакеты Whirl-pak® с заводской запечаткой, подготовка не требуется.Любые повторно используемые контейнеры для проб (и вся стеклянная посуда, используемая в этой процедуре) необходимо промыть и стерилизовать при 121 ° C в течение 15 минут в автоклаве перед повторным использованием для отбора проб.
ЗАДАНИЕ 2 Подготовиться перед выездом на место отбора проб
См. Раздел 2.3 — Меры безопасности для получения подробной информации о подтверждении данных и времени отбора проб, подборе оборудования, рассмотрении соображений безопасности, а также проверке погоды и направлений. Кроме того, для отбора проб на колиформы вы должны проверить свое оборудование следующим образом:
- Пакеты Whirl-pak® запечатаны на заводе и стерилизованы.Убедитесь, что пломба не снята.
- Бутылки должны иметь на крышке ленту, печать или маркировку, указывающую на то, что они были стерилизованы. Если какая-либо из бутылей с пробами не пронумерована, спросите координатора лаборатории, как их пронумеровать. Если контейнеры для проб не должны быть помечены номером участка, не нумеруйте их самостоятельно.
ЗАДАЧА 3 Собрать образец
См. Задание 2 в главе 5 — Условия качества воды для получения подробной информации о взятии пробы с использованием бутылок с завинчивающейся крышкой или пакетов Whirl-pak®.Не забывайте тщательно мыть руки после взятия проб, которые могут содержать фекальные загрязнения. Кроме того, не прикасайтесь к глазам, ушам, носу или рту, пока не помоете руки.
Рекомендуемые процедуры обеспечения / контроля качества на местах включают:
- Полевые заготовки. Их следует собирать на 10% участков для отбора проб вместе с обычными пробами. Стерильную воду в стерилизованных контейнерах следует отправлять с отобранными пробоотборниками.В заранее определенном месте для пробы пробоотборник заполняет обычный контейнер для проб этой стерильной водой. Он помечен как обычный образец, но со специальным обозначением (например, «B»), указывающим, что это пустое поле. Затем он анализируется с помощью обычных образцов. Лабораторный анализ должен дать нулевое количество бактерий для всех бланков. Бланки используются для выявления ошибок или загрязнения при сборе и анализе проб.
- Дубликаты внутренних полей. Их следует собирать на 10% участков отбора проб вместе с обычными пробами.Дубликат поля — это дублированный образец потока, собранный в одно и то же время и в том же месте одним и тем же пробоотборником или другим пробоотборником. Он помечен как обычный образец, но со специальным обозначением (например, «D»), указывающим, что это дубликат. Затем он анализируется с помощью обычных образцов. Лабораторный анализ должен привести к сопоставимому количеству бактерий на 100 мл для дубликатов и обычных образцов, собранных в одном и том же месте. Дубликаты используются для оценки точности отбора проб и лабораторных анализов.
- Дубликаты внешнего поля. Дубликат внешнего поля — это дублированный образец потока, собранный и обработанный независимым (например, профессиональным) сборщиком образцов или группой в том же месте в то же время, что и образцы обычного потока. Он используется для оценки точности отбора проб и лабораторных анализов.
ЗАДАЧА 4 Верните листы полевых данных и образцы в лабораторию или в пункт выдачи
Образцы на бактерии должны быть проанализированы в течение 6 часов после сбора. Храните образцы на льду и как можно скорее отнесите их в лабораторию или в пункт сдачи.
ЗАДАНИЕ 5 Проанализировать образцы в лаборатории
В данном руководстве не рассматривается лабораторный анализ проб воды. Лабораторные методы описаны в приведенных ниже ссылках (APHA, 1992; River Watch Network, 1991; USEPA, 1985). Однако лаборатория, с которой вы работаете, должна выполнять следующие рекомендуемые лабораторные процедуры обеспечения / контроля качества:
- Отрицательные пластинки образуются, когда забуференная промывочная вода (вода, используемая для ополаскивания стенок фильтрующей воронки во время фильтрации) была отфильтрована таким же образом, как и проба.Он отличается от пустого поля тем, что он содержит реагенты, используемые в промывочной воде. После инкубации на фильтре не должно быть роста бактерий. Он используется для обнаружения лабораторного бактериального заражения образца. Положительные пластины
- образуются, когда вода, о которой известно, что она содержит бактерии (например, поступающая из очистных сооружений), фильтруется так же, как и образец. После инкубации на фильтре должно быть много бактерий. Положительные пластины используются для обнаружения процедурных ошибок или наличия загрязняющих веществ в лабораторных анализах, которые могут препятствовать росту бактерий.
- Лабораторные копии. Лабораторная копия — это образец, который делится на подвыборки в лаборатории. Затем каждая подвыборка фильтруется и анализируется. Лабораторные реплики используются для получения оптимального количества колоний бактерий на фильтрах для целей подсчета. Обычно подвыборки объемом 100, 10 и 1 миллилитр (мл) фильтруют для получения колоний бактерий на фильтре, которые можно надежно и точно подсчитать (обычно от 20 до 80 колоний). Чашка с подсчетом от 20 до 80 колоний выбирается для отчета о результатах, и количество пересчитывается в количество колоний на 100 мл.
- Knowns. В воду с реагентом добавляется заранее определенное количество обезвоженных бактерий, что должно привести к известному результату с допустимой погрешностью.
- Анализ повторяющихся проб вне лаборатории. Дубликаты внутренних или внешних полей могут быть проанализированы в независимой лаборатории. Результаты должны быть сопоставимы с результатами, полученными в проектной лаборатории.
Список литературы
APHA. 1992. Стандартные методы исследования воды и сточных вод. 18 -е изд. Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия.
Hogeboom, T. Микробиолог, Лаборатория охраны окружающей среды штата Вермонт, Уотербери, штат Вирджиния. Личное общение.
Сеть речного дозора. 1991. Процедура мембранного фильтрования Escherichia coli ( E. coli ) (адаптирована из метода USEPA 1103.1, 1985). Монтпилиер, VT. Октябрь.
USEPA. 1985. Методы определения Escherichia coli и энтерококков в воде с помощью процедуры мембранного фильтра (Метод № 1103.1). EPA 600 / 4-85-076. Агентство по охране окружающей среды США, Лаборатория экологического мониторинга и поддержки, Цинциннати, Огайо.
USEPA. 1986. Бактериологические критерии качества окружающей воды для морских и пресных рекреационных вод. EPA 440 / 5-84-002. Агентство по охране окружающей среды США, Управление исследований и разработок, Цинциннати, Огайо.




