Лейкоцитарная формула (с микроскопией мазка крови при выявлении патологических изменений)
Лейкоцитарная формула – процентное соотношение различных форм лейкоцитов в сыворотке крови и подсчет их числа в единице объема. При наличии атипичных форм клеток проводится исследование крови под микроскопом. В отличие от эритроцитов, популяция которых является однородной, лейкоциты делятся на 5 типов, отличающихся по внешнему виду и выполняемым функциям: нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы.
Синонимы русские
Cоотношение различных форм лейкоцитов в крови, дифференцированный подсчет лейкоцитов, лейкоцитограмма, лейкограмма, формула крови, подсчет лейкоцитарной формулы.
Синонимы английские
Leukocyte differential count, Peripheral differential, WBC differential.
Метод исследования
Проточная цитофлуориметрия.
Единицы измерения
*10^9/л (10 в ст. 9/л).
9/л).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за сутки перед сдачей крови.
- Не принимать пищу за 2-3 часа до исследования (можно пить чистую негазированную воду).
- Исключить физическое и эмоциональное перенапряжение и не курить за 30 минут до исследования.
Общая информация об исследовании
Лейкоциты, как и другие клетки крови, образуются в костном мозге. Основная их функция – борьба с инфекцией, а также ответ на повреждение тканей.
В отличие от эритроцитов, популяция которых является однородной, лейкоциты делятся на 5 типов, отличающихся по внешнему виду и выполняемым функциям: нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы.
Лейкоциты образуются из стволовых клеток костного мозга. Они живут недолго, поэтому происходит их постоянное обновление. Продукция лейкоцитов в костном мозге возрастает в ответ на любое повреждение тканей, это часть нормального воспалительного ответа. Разные типы лейкоцитов имеют несколько разные функции, однако они способны к координированным взаимодействиям путем «общения» с использованием определенных веществ – цитокинов.
Продукция лейкоцитов в костном мозге возрастает в ответ на любое повреждение тканей, это часть нормального воспалительного ответа. Разные типы лейкоцитов имеют несколько разные функции, однако они способны к координированным взаимодействиям путем «общения» с использованием определенных веществ – цитокинов.
Долгое время лейкоцитарную формулу высчитывали вручную, однако современные анализаторы позволяют гораздо точнее проводить исследование в автоматическом режиме (врач смотрит 100-200 клеток, анализатор – несколько тысяч). Если анализатором определяются атипичные формы клеток либо выявляются значительные отклонения от референсных значений, то лейкоцитарная формула дополняется микроскопическим исследованием мазка крови, который позволяет диагностировать некоторые заболевания, такие как, например, инфекционный мононуклеоз, определить степень тяжести инфекционного процесса, описать тип выявленных атипичных клеток при лейкозе.
Нейтрофилы – наиболее многочисленные из лейкоцитов – первыми начинают бороться с инфекцией и первыми появляются в месте повреждения тканей. Нейтрофилы имеют ядро, разделенное на несколько сегментов, поэтому их еще называют сегментоядерными нейтрофилами или полиморфноядерными лейкоцитами. Эти названия, однако, относятся только к зрелым нейтрофилам. Созревающие формы (юные, палочкоядерные) содержат цельное ядро.
Нейтрофилы имеют ядро, разделенное на несколько сегментов, поэтому их еще называют сегментоядерными нейтрофилами или полиморфноядерными лейкоцитами. Эти названия, однако, относятся только к зрелым нейтрофилам. Созревающие формы (юные, палочкоядерные) содержат цельное ядро.
В очаге инфекции нейтрофилы окружают бактерии и ликвидируют их путем фагоцитоза.
Лимфоциты – одно из важнейших звеньев иммунной системы, они имеют большое значение в уничтожении вирусов и борьбе с хронической инфекцией. Существует два вида лимфоцитов – Т и В (в лейкоцитарной формуле подсчета видов лейкоцитов по отдельности нет). B-лимфоциты вырабатывают антитела – специальные белки, которые связываются с чужеродными белками (антигенами), находящимися на поверхности вирусов, бактерий, грибов, простейших. Окруженные антителами клетки, содержащие антигены, доступны для нейтрофилов и моноцитов, которые убивают их. Т-лимфоциты способны разрушать зараженные клетки и препятствовать распространению инфекции. Также они распознают и уничтожают раковые клетки.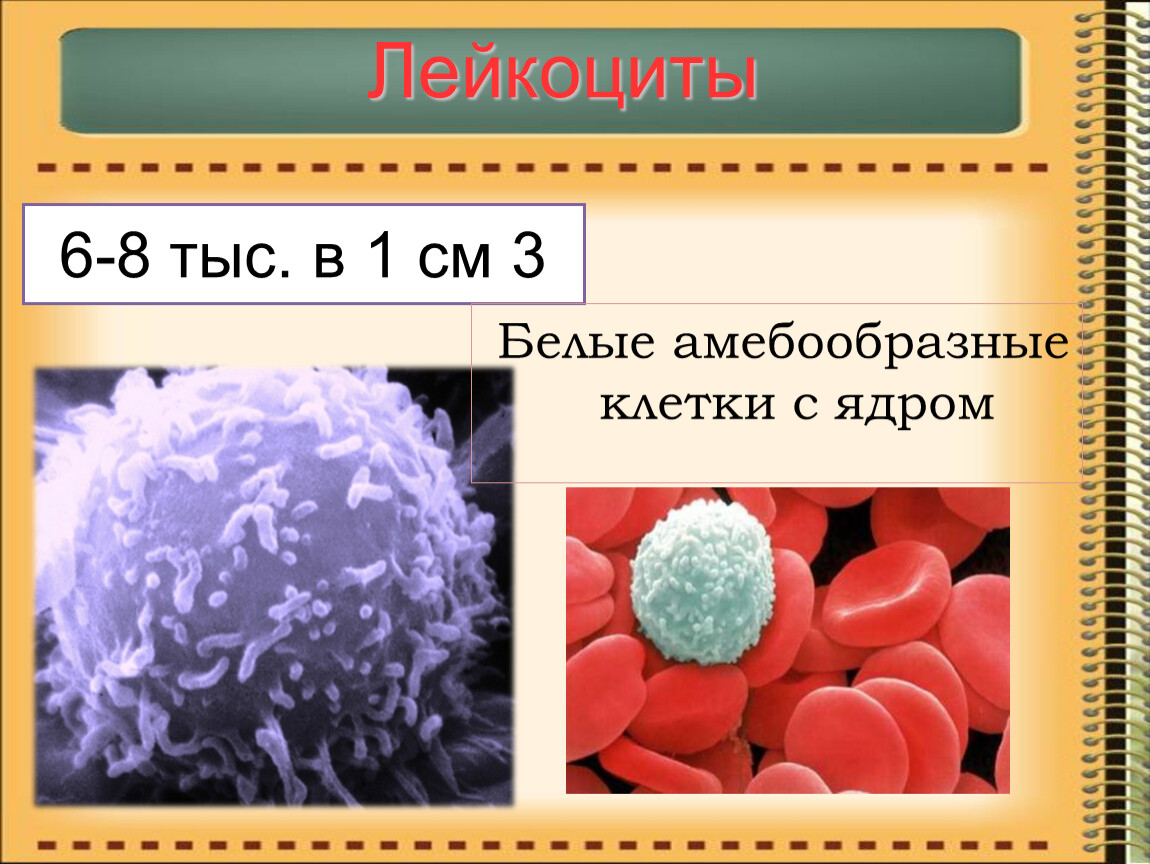
Моноцитов в организме не очень много, однако они осуществляют крайне важную функцию. После непродолжительной циркуляции в кровяном русле (20-40 часов) они перемещаются в ткани, где превращаются в макрофаги. Макрофаги способны уничтожать клетки, так же как нейтрофилы, и держать на своей поверхности чужеродные белки, на которые реагируют лимфоциты. Они играют роль в поддержании воспаления при некоторых хронических воспалительных заболеваниях, таких как ревматоидный артрит.
Эозинофилов в крови содержится небольшое количество, они тоже способны к фагоцитозу, однако в основном играют другую роль – борются с паразитами, а также принимают активное участие в аллергических реакциях.
Базофилов в крови также немного. Они перемещаются в ткани, где превращаются в тучные клетки. Когда они активируются, из них выделяется гистамин, обусловливающий симптомы аллергии (зуд, жжение, покраснение).
Для чего используется исследование?
- Для оценки способности организма противостоять инфекции.

- Для определения степени выраженности аллергии, а также наличия в организме паразитов.
- Для выявления неблагоприятного воздействия некоторых лекарственных препаратов.
- Для оценки иммунного ответа на вирусные инфекции.
- Для дифференциальной диагностики лейкозов и для оценки эффективности их лечения.
- Для контроля за воздействием на организм химиотерапии.
Когда назначается исследование?
- Совместно с общим анализом крови при плановых медицинских осмотрах, подготовке к хирургическому вмешательству.
- При инфекционном заболевании (или подозрении на него).
- Если есть подозрение на воспаление, аллергическое заболевание или заражение паразитами.
- При назначении некоторых лекарственных препаратов.
- При лейкозах.
- При контроле за различными заболеваниями.
Что означают результаты?
Лейкоцитарная формула обычно интерпретируется в зависимости от общего количества лейкоцитов. 9/л
9/л
Нейтрофилы, %
|
Возраст |
Референсные значения |
|
Меньше 1 года |
16 — 45 % |
|
1-2 года |
28 — 48 % |
|
2-4 года |
32 — 55 % |
|
4-6 лет |
32 — 58 % |
|
6-8 лет |
38 — 60 % |
|
8-10 лет |
41 — 60 % |
|
10-16 лет |
43 — 60 % |
|
Больше 16 лет |
47 — 72 % |
Чаще всего уровень нейтрофилов повышен при острых бактериальных и грибковых инфекциях. Иногда в ответ на инфекцию продукция нейтрофилов увеличивается столь значительно, что в кровяное русло выходят незрелые формы нейтрофилов, увеличивается количество палочкоядерных. Это называется сдвигом лейкоцитарной формулы влево и свидетельствует об активности ответа костного мозга на инфекцию.
Иногда в ответ на инфекцию продукция нейтрофилов увеличивается столь значительно, что в кровяное русло выходят незрелые формы нейтрофилов, увеличивается количество палочкоядерных. Это называется сдвигом лейкоцитарной формулы влево и свидетельствует об активности ответа костного мозга на инфекцию.
Другие причины повышения уровня нейтрофилов:
- системные воспалительные заболевания, панкреатит, инфаркт миокарда, ожоги (как реакция на повреждение тканей),
- онкологические заболевания костного мозга.
Количество нейтрофилов может уменьшаться при:
- массивных бактериальных инфекциях и сепсисе, в случаях когда костный мозг не успевает воспроизводить достаточно нейтрофилов,
- вирусных инфекциях (гриппе, кори, гепатите В),
- онкологических заболеваниях костного мозга и метастазах других опухолей в костный мозг.
 9/л
9/л
Лимфоциты, %
Возраст
Референсные значения
Меньше 1 года
45 — 75 %
1-2 года
37 — 60 %
2-4 года
33 — 55 %
4-6 лет
33 — 50 %
6-8 лет
30 — 50 %
8-10 лет
30 — 46 %
10-16 лет
30 — 45 %
Больше 16 лет
19 — 37 %
Причины повышенного уровня лимфоцитов:
- инфекционный мононуклеоз и другие вирусные инфекции (цитомегаловирус, краснуха, ветряная оспа, токсоплазмоз),
- некоторые бактериальные инфекции (туберкулез, коклюш),
- онкологические заболевания костного мозга (хронический лимфолейкоз) и лимфоузлов (неходжкинская лимфома).
 9/л
9/л
Моноциты, %
Возраст
Референсные значения
Меньше 1 года
4 — 10 %
1 — 2 года
3 — 10 %
Больше 2 лет
3 — 12 %
Причины повышения уровня моноцитов:
- острые бактериальные инфекции,
- туберкулез,
- подострый бактериальный эндокардит,
- сифилис,
- онкологические заболевания костного мозга и лимфоузлов,
- рак желудка, молочных желез, яичников,
- заболевания соединительной ткани,
- саркоидоз.
 9/л
9/л
Эозинофилы, %
Возраст
Референсные значения
Меньше 1 года
1 — 6 %
1 — 2 года
1 — 7 %
2 — 4 года
1 — 6 %
Больше 4 лет
1 — 5 %
Наиболее распространенные причины повышения уровня эозинофилов:
- аллергические заболевания (бронхиальная астма, сенная лихорадка, пищевая аллергия, экзема),
- заражение паразитическими червями,
- аллергическая реакция на лекарственные препараты (антибиотики, аллопуринол, гепарин, пропранолол и др.
 9/л.
9/л.Базофилы, %: 0 — 1,2 %.
Увеличение содержания базофилов встречается редко: при онкологических заболеваниях костного мозга и лимфоузлов, истинной полицитемии, аллергических заболеваниях.
Уменьшаться количество базофилов может при острой фазе инфекции, гипертиреозе, длительной терапии кортикостероидами (преднизолоном).
Скачать пример результатаТакже рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, педиатр, хирург, инфекционист, гематолог, гинеколог, уролог.
Лейкоциты (WBC — white blood cells)
Клетки гранулоцитарного, моноцитарного и лимфоидного рядов. Основная функция лейкоцитов – защита организма от чужеродных агентов путем реализации фагоцитарной и бактерицидной активности, участия в гуморальном и клеточном иммунитете. Лейкоцитарный состав крови рассматривается как показатель состояния организма при различных патологических состояниях.
 Увеличение количества лейкоцитов в периферической крови выше референсных значений называют лейкоцитозом, снижение — лейкопенией.
Увеличение количества лейкоцитов в периферической крови выше референсных значений называют лейкоцитозом, снижение — лейкопенией.
Референсные значения (вариант нормы)
Лейкоциты (WBC — white blood cells) — 109 клеток /л
Возраст Мужчины Женщины <1 года 6,0 — 17,5 1 – 2 года 6,0 — 17,0 2 — 4 года 5,5 — 15,5 4 — 6 лет 5,0 — 14,5 6 — 10 лет 4,5 — 13,5 10 — 16 лет 4,5 — 13,0 > 16 лет 4,5 — 11,0 Повышение уровня (лейкоцитоз) Понижение уровня (лейкопения) - Острые инфекции, особенно если их возбудителями являются кокки
- Ревматическая атака
- Интоксикации
- Злокачественные новообразования
- Травмы, ожоги
- Острые кровотечения
- Оперативные вмешательства
- Инфаркты внутренних органов
- Миело- и лимфолейкоз
- Применение адреналина и стероидных гормонов
- Физиологический лейкоцитоз: боль, холодная или горячая ванна, физическая нагрузка, эмоциональное напряжение, менструация, период родов
- Некоторые вирусные и бактериальные инфекции (корь, малярия, краснуха, инфекционный мононуклеоз, милиарный туберкулез, СПИД)
- Сепсис
- Заболевания костного мозга
- Воздействие ионизирующего излучения
- Спленомегалия
- Острые лейкозы
- Миелофиброз
- Миелодиспластические синдромы
- Плазмоцитома
- Болезнь Аддисона – Бирмера
- Анафилактический шок
- Заболевания соединительной ткани
- Прием сульфаниламидов, левомицетина, анальгетиков, НПВС, тиреостатиков, цитостатиков
Шкала оценки тяжести состояния для пациентов с COVID-19
Как рассчитать уровень тяжести состояния: каждый из 9 показателей (см.
 таблицу) нужно
сравнить с порогом. Показатели делятся на 2 категории: для которых балл начисляется за
превышение порога (АЧТВ, СРБ, Д-димер, глюкоза, мочевина и общие лейкоциты) и те, у
которых балл начисляется за уменьшение ниже порога (гемоглобин, лимфоциты, общий белок).
Далее начисленные баллы суммируются.
таблицу) нужно
сравнить с порогом. Показатели делятся на 2 категории: для которых балл начисляется за
превышение порога (АЧТВ, СРБ, Д-димер, глюкоза, мочевина и общие лейкоциты) и те, у
которых балл начисляется за уменьшение ниже порога (гемоглобин, лимфоциты, общий белок).
Далее начисленные баллы суммируются.Показатель Порог Балл APTT (АЧТВ) > 42 sec 4 CRP (С-реактивный белок) > 146 mg/L 3 D-dimer (Д-димер) > 2149 mg/L 4 Glucose (Глюкоза) > 9 mmol/L 4 Hemoglobin (Гемоглобин) 3 Lymphocytes (Лимфоциты) 3 Total protein (Общий белок) 6 Urea (Мочевина) > 11 mmol/L 5 WBC (Общие лейкоциты) > 13,5*10^9/L 4 Итого: максимум 36 баллов
Например, у пациента АЧТВ 45 сек, СРБ 180, Д-димер: 1000, глюкоза: 8, гемоглобин 110, лимфоциты: 0.
 8, общий белок: 60, мочевина 10, общие лейкоциты: 15.
8, общий белок: 60, мочевина 10, общие лейкоциты: 15.Как видно, критическое значение наблюдается у: АЧТВ (4 балла), СРБ (3 балла), гемоглобин (3 балла), общий белок (6 баллов), общие лейкоциты (4 балла). Таким образом суммарный балл составляет 4+3+3+6+4 = 20 баллов.
Далее суммарный балл можно сопоставить с рассчитанными диапазонами и вынести вердикт о градации риска.
Подробнее о методике расчета: https://www.medrxiv.org/content/10.1101/2021.02.09.21249859v3
Для удобства оценки предлагаем автоматический калькулятор.
Для корректного расчета необходимо заполнить все поля. Десятичные дроби необходимо вводить с точкой в качестве разделителя целой и дробной частей.
Важно!
В шкале не учитывается информация о сатурации кислородом! Даже низкий балл при дыхательной недостаточности (SpO2
Результаты шкалы не предназначены для самостоятельного применения пациентом и должны оцениваться ТОЛЬКО врачом-специалистом с учетом результатов комплексного клинико-лабораторного обследования.

Анализ секрета простаты | Медицинская клиника «МЕДЭКСПЕРТ»
Показатели
Норма
Расшифровка отклонений:
Количество
от 0,5 до 2 мл
Может наблюдаться как уменьшение объема (простатит), так и увеличение (при застойных явлениях)
Цвет
Белесоватый
Воспаление в предстательной железе может придавать секрету интенсивно белый и желтый цвет. Примесь крови дает различные оттенки красного.
Запах
Специфический запах спермина
Неспецифический запах
Плотность
1022
х < 1022 > х
Реакция (рН)
Слабо кислая или нейтральная (рН = 6,4-7,0)
Обычно при остром простатите или обострении хронического простатита pH сдвигается в кислую сторону.
 При хроническом П. вне обострения – реакция может быть щелочной.
При хроническом П. вне обострения – реакция может быть щелочной.Лейкоциты
0-10 в п/зр (увеличение — 280)
0-5 в п/зр (увел. — 400)
300 клеток/мкл (при использовании счетной камеры)Повышение количества лейкоцитов выше нормы свидетельствует о наличии воспалительного процесса. Следует помнить о том, что лейкоциты могут примешиваться в секрет при прохождении через уретру.
Эритроциты
Единичные или отсутствуют
Могут появляться при простатите и раке простаты
Эпителиальные клетки
1-2 в п/зр
Повышение свидетельствует о наличии воспалительного компонента.
Макрофаги
Отсутствуют либо единичные
Их количество увеличивается при хроническом воспалительном процессе либо при застойных явлениях
Гигантские клетки
Отсутствуют
Появляются на фоне хронического воспаления в железе и застоя
Амилоидные тельца
Отсутствуют
Их появление свидетельствует о застойных явлениях
Лецитиновые зерна
Много (10млн/мл)
Количество уменьшается при простатите
Кристаллы Беттхера
Единичные
Особого диагностического значения не имеют
Симптом папоротника
Положительный
Отрицательный
Гонококк
Не обнаружен
Гонорея
Трихомонада
Не обнаружена
Трихомониаз
Грибки
Не обнаружен
Выявляются при простатите
Флора (бактерии)
Единичная
При бактериальном простатите выявляется в большом количестве (обильно)
Лабораторная диагностика туберкулеза — сдать анализы в СЗЦДМ
Туберкулез — инфекционная болезнь, возбудителем которой является микобактерия. Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет.
Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет. Патология проявляется длительным кашлем, субфебрильной температурой, которая может удерживаться в течении нескольких месяцев, ночным потоотделением, лимфаденопатией. Современные схемы лечения позволяют избавиться от болезни. Однако, для этого необходима своевременная постановка диагноза. Первое время туберкулез может не вызывать клиническую симптоматику, поэтому диагностика должна быть профилактической и регулярной. Ранняя терапия позволяет избавиться от осложнений, среди которых выраженные структурные нарушения дыхательной системы и вторичное распространение инфекции.
Современные методы диагностики туберкулезаРазличают следующие методы диагностики патологии:
-
бактериологический анализ мочи;
-
общий анализ мочи;
-
биохимическое исследование крови;
-
T-SPOT.
 TB;
TB;
-
микробиологические методы диагностики;
-
исследование свертывающей системы;
-
микроскопический анализ мокроты;
-
лучевые методы диагностики.
Перейти к анализам
Рассмотрим эти методы подробнее.Бактериологический анализ мочи
Показан при внелегочной форме туберкулеза. Этот метод диагностики крайне важен, ведь туберкулез мочеполовой системы часто вызывает осложнения и долгое время не вызывает симптомов. Именно туберкулез может долго маскироваться под воспалительный процесс или мочекаменную болезнь. Поэтому, длительная патология данных органов, которая сложно поддается лечению, является показанием к диагностике. Также, анализ мочи показан при туберкулезе для исключения вовлечения в процесс мочеполовой системы.

Для того, чтобы определить наличие возбудителя в моче, проводится бактериоскопия или посев на среду.
Для обнаружения микобактерии проводится специальное окрашивание, при котором возбудитель приобретает другой оттенок, отличный от здоровых клеток.
Другой метод заключается в посеве образца мочи на питательную среду. Если наблюдается рост культуры микобактерий, это говорит о наличии в организме возбудителя.
Общий анализ мочи
В общем анализе мочи наблюдаются характерные изменения при туберкулезе. Это появление капель гноя, наличие или следы белка и более кислая реакция. Также появляются видоизмененные лейкоциты, бактерии, эритроциты.
Биохимический анализ крови
На некоторых стадиях болезни выявляются изменения в биохимическом исследовании крови. При неактивной форме никаких изменений в данных анализах нет, хотя они могут появляться при сопутствующей патологии.

Острая форма туберкулеза приводит к снижению альбумино-глобулинового коэффициента. Если патология привела к осложнениям в виде поражения печени, повышается уровень трансаминаз, разных фракций билирубина. Эти показатели входят в обязательное обследование пациента с туберкулезом. Пациент сдает этот анализ в динамике, для оценки состояния.
Ухудшение работы почек может отражаться в повышении креатинина, изменениях скорости клубочковой фильтрации.
Биохимический анализ крови не имеет специфической диагностической ценности, однако является важным компонентом оценки качества лечения и состояния пациента.
К иммунологическим методам диагностики относится методика T-SPOT.TB. Основа способа заключается в изучении реакции Т-лимфоцитов. Процедура имеет высокую чувствительность и довольно информативен. Ложные результаты исключены даже тогда, когда остальные методики нечувствительны к результату. Метод применяется в сомнительных случаях, например после прививок, у пациентов с аутоиммунной патологией, у медработников. Данный способ позволяет оценить наличие возбудителя количественно, но не дает информации о фазе процесса.
Особое место данная диагностика занимает у носителей ВИЧ. Дело в том, что вирус поражает именно лимфоциты. Несмотря на это диагностика по методу T-SPOT.TB дает точные результаты.
Высокая точность теста объясняется также тем, что тест-система чувствительна к компонентам возбудителя, но именно к тем, которых нет ни в вакцине БЦЖ, ни в других микроорганизмах, которые имеют сходные компоненты. Суть метода заключается в количественном определении в крови эффекторных Т-клеток (CD4 и CD8), вырабатывающих ИФН-ɣ (гамма-интерферон), который продуцируется в ответ на стимуляцию специально подобранными антигенами ESAT-6 и CFP10. Речь идет об одном из фрагментов генома микобактерии. Примечательно, что высокая специфичность наблюдается и в латентную, и в активную фазу.
Особенной подготовки к сдаче анализов не требуется — достаточно ограничить прием пищи за два часа до процедуры. Проводится забор венозной крови. Это необходимо проводить в соответствующих условиях, с соблюдением правил асептики и антисептики.
Положительный результат теста говорит о том, что в организме присутствует микобактерия, а отрицательный — об обратном.
Микробиологические методы диагностики
Применяются для прямого обнаружения возбудителя туберкулеза в биологических тканях организма. Применяются различные методики.
Окраска по Цилю-Нельсену заключается в том, что мазок с препаратом обрабатывается специфическим красителем. Микобактерии приобретают характерный оттенок, что говорит о том, что реакция произошла. Так можно подтвердить или исключить наличие возбудителя в материале. Метод экономичный и сравнительно быстрый. Однако, он чувствителен только при высокой концентрации микроорганизмов в образце.
Люминесцентная микроскопия дает более высокое разрешение и улучшает методику окраски. Требуется применение флуорохромов — специфических веществ, которые “подсвечивают” микобактерии и делают их более видимыми под микроскопом.
Полимеразно-цепная реакция позволяет осуществить воспроизведение ДНК бактерии из её фрагментов, которые содержатся в тканях. Это быстрый и информативный метод диагностики, который имеет высокую специфичность и чувствительность.
Культуральный метод заключается в выращивании культуры из микобактерий. Для этого берется фрагмент биоматериала и сеется на питательную среду. Потом оценивается штамм, который вырос на среде и подтверждается или исключается диагноз. Используется специфическая среда, на которой с большей вероятностью вырастет необходимая среда. Выращенные колонии можно использовать для определения чувствительности к антибиотикам.
ВАСТЕС460 — это современный метод диагностики, в ходе которого используется радиометрическая система и меченый СО2. Бактерия поглощает элемент-индикатор и её можно обнаружить в исследуемом материале.
Исследование свертывающей системы крови
Коагулограмма часто используется в фтизиатрии, так как у пациентов с туберкулезом постепенно возникает кровохаркание или легочные кровотечения. Это приводит к изменению показателей гемостаза. Анализ может меняться и после хирургического лечения болезни.
Контроль коагулограммы основан на анализе таких показателей, как АЧТВ, фибриноген, время кровотечения, время свертывания. Эти показатели могут колебаться в разные стороны, в зависимости от объема кровопотери. Если она незначительна — коагуляционная система стимулируется и показатели повышаются. Потеря большого объема крови приводит к снижению в организме факторов свертывания и соответствующим изменениям коагулограммы.
Микроскопический анализ мокроты
Анализ мокроты — обязательное исследование при туберкулезе. При этой патологии мокроты выделяется в небольшом количестве, имеет вкрапления крови, гноя, слизи. На ранних стадиях, кровь может не появляться. Кавернозная форма болезни приводит к появлению в материале так называемых рисовых телец. Также, наблюдаются вкрапления кристаллов, эластичных волокон, холестерина. Повышается белок в общем составе мокроты. Если произошел распад — мокрота содержит кальций, волокна различного происхождения, холестерин и, собственно, туберкулезные микобактерии.
Проводится также бактериология мокроты. Применяется специфический метод окраски, который позволяет определить наличие микобактерии. Посевы на питательные среды также имеют диагностическую ценность.
Бактериоскопия мокроты подразумевает её изучение под необходимым увеличением микроскопа. При высокой концентрации микроорганизмов методика довольно специфична и чувствительна. Мокрота изучается 3 раза для того, чтобы получить наиболее точный результат.
Лучевые методы диагностики
Лучевые методы позволяют визуализировать изменения в организме, к которым привела микобактерия. Это и скрининговый метод диагностики, и способ оценки тяжести и степени патологии. Также, лучевая диагностика — метод динамической оценки пациента. Различают такие лучевые методики в диагностике туберкулеза:
- флюорография;
- рентгенография;
- томография;
- рентгеноконтрастные исследования.
Флюорография используется для скрининговой диагностики, которая требует подтверждения при подозрительных результатах. Неспецифический метод, который используется для профилактического осмотра. Цифровая методика позволяет оценивать изображение на экране с использованием увеличения и приближения картинки. Метод прост, быстрый и экономичный.
Рентгенография является более точной методикой и позволяет полноценно обследовать структуры грудной клетки. на снимке можно обнаружить признаки функциональной недостаточности различных органов, проследить топография новообразования, диагностировать каверну, ателектаз, абсцесс или нарушение целостности плевральной полости. Выполняется в двух проекциях для более точных результатов. Иногда используется прицельное проведение диагностики.
Томография является наиболее точной методикой визуализации структур грудной клетки. Это формирование послойных изображений органов и структур. Можно определить распространение и локализацию очага болезни, увидеть, какие ткани он поразил и насколько глубоко проник.
Методики с использованием контраста применяются для получения изображения бронхиального дерева (бронхография). Можно обнаружить полостные изменения, нарушения дренажной функции, структурные изменения и наличие фистул. также применяется ангиопульмонография. контраст вводится в сосудистое русло и позволяет оценить легочной кровоток. особенно это важно при кровохарканьи и кровотечениях.
Применяются радионуклидные методы, сцинтиграфия. Они применяются для оценки функциональной активности или нарушений.
Ультразвуковая методика применяется для оценки деятельности сердца, диагностики состояния плевральных синусов, лимфатических узлов.
Сбор материала и подготовка к исследованиямДля анализа мочи на туберкулез применяется утренняя порция. необходимо провести туалет наружных половых органов и не касаться ими резервуара для сбора материала. Контейнер должен быть стерильным и сухим. Собранный биоматериал необходимо как можно скорее доставить в лабораторию, не допускать его высыхания и нагревания. За сутки до сдачи анализа необходимо отказаться от таких продуктов, как черника, морковь, свекла и других ярких овощей и фруктов. Также следует ограничить прием диуретиков, витаминов, ацетилсалициловой кислоты. Женщинам следует помнить, что анализы мочи не сдают во время менструаций. Сдается средняя, промежуточная порция мочи.
Сдача крови происходит натощак, так как прием пищи может исказить результаты исследования. Стоит проконсультироваться с лечащим врачом на предмет отмены некоторых препаратов. Накануне не следует употреьоять кофе, алкоголь, табак. Сбор крови происходит в стерильных условиях, с соблюдением правил забора материала. Для некоторых исследований необходима капиллярная, а для некоторых — венозная кровь.
Мокрота собирается натощак, с соблюдением основных правил. Материал необходимо откашлять, чтобы в посуду не попала слизь изо рта или носоглотки. Используется специальная плевательница из темного стекла, с плотной крышкой. Мокрота не должна обветриваться или высыхать.
К инструментальным методам исследования не требуется особая подготовка. Исключение — применение контрастного вещества. Перед его использованием необходимо оценить функцию почек. Большинство рентгеноконтрастных веществ выводится именно эти органом и врач должен быть уверен в том, что выделительная система выдержит эту нагрузку.
Нормы и выявляемые отклоненияВ норме, в организме не должно быть микобактерий. Их наличие расценивается как положительный результат диагностики туберкулеза. Негативный результат говорит о том, что у пациента нет данной патологии. Некоторые методы неспецифичны и не обладают высокой диагностической ценностью. Они используются для оценки общего состояния. Бактериологические методики более специфичны и их положительные результаты можно считать подтверждением диагноза. Отрицательный результат является поводом для повторных анализов, если есть клинические признаки болезни.
Сроки готовности результатов диагностики туберкулезаОбщий и биохимический анализ крови, мокроты и мочи может быть готов в течении нескольких часов. Как правило, результаты сообщаются на следующий день.
Бактериологический метод с окраской занимает около 24 часов.
Посевы занимают больше времени — до нескольких недель.
Результат лучевых методов диагностики зависит от скорости описания снимка. Чаще всего, это занимает около суток.обзор 3939 случаев COVID-19 из Китая
Оригинал: The Journal of Leukocyte Biology
Авторы: Wang et al.
Опубликовано: 13 июня 2020, The Journal of Leukocyte Biology
Перевод: Наталия Шахгильдян, Фонд профилактики рака
Аннотация
Согласно последним клиническим данным, смертельные исходы у пациентов с инфекцией, вызванной SARS-CoV-2, наступают из-за значительных альвеолярных повреждений и полиорганной недостаточности. Данные состояния ассоциированы с гиперпродукцией цитокинов, известной как “цитокиновый шторм” или “синдром высвобождения цитокинов”. COVID-19 легкого и тяжелого течения приводит к изменению циркулирующих лейкоцитов и секреции цитокинов, в особенности интерлейкина 6 (ИЛ-6), интерлейкина 1 β (ИЛ-1β), интерлейкина 10 (ИЛ-10), фактора некроза опухоли (ФНО), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), ИФНγ-индуцируемого белка 10 (IP-10), интерлейкина 17, моноцитарного хемотаксического белка 3 (МХБ-3) и антагониста рецептора интерлейкина 1 (ИЛ-1РА). Поэтому неудивительно, что терапия COVID-19, направленная на регуляцию иммунного ответа и цитокинового шторма, стала предметом изучения в недавних клинических исследованиях.
В данной работе анализируются данные 3939 пациентов с COVID-19 из Китая и приводятся новые сведения об иммунопатологических процессах. Кроме того, рассматриваются клинические исследования, изучающие ингибирование провоспалительных цитокинов; перенос иммуносупрессивных мезенхимальных стволовых клеток; терапию на основе плазмы доноров-реконвалесцентов, а также иммуномодулирующую терапию и китайские традиционные подходы к терапии. При изучении активности лейкоцитов и цитокинов при COVID-19 особое внимание уделяется тому, как изменяется их количество в процессе развития болезни, образованию нейтрофильных внеклеточных ловушек (“нетоз”), макрофагальному и Т-клеточному ответам и другим процесам. В работе также предполагаются возможные влияния данных процессов на органы и системы (развитие коагулопатии и др.). Особенности взаимодействия вируса и организма хозяина описываются для более глубокого изучения биологии лейкоцитов и механизмов развития болезни в целом и/или органных повреждений при нерегулируемом цитокиновом ответе. Лучшее понимание механизмов, влияющих на интенсивность цитокинового шторма, позволит разработать более точные терапевтические подходы для лечения болезни на разных стадиях.
Полезная информация — «Скандинавия» Казань
Памятка пациентам при обращении в клинику на оперативное лечение под анестезией.
Ваше здоровье:
- Состояние здоровья играет важную роль в том, как будет протекать наркоз, а также насколько комфортным будет пробуждение от наркоза. Перед наркозом важно пройти комплексное обследование организма, включающее консультацию врача терапевта, выполнение ряда анализов и инструментальных методов исследований. Если имеются какие-либо хронические заболевания, то с помощью лечащего врача необходимо достичь стойкой ремиссии этих болезней.
- Проведение плановой анестезии возможно на фоне стабильного состояния здоровья, в день операции должны отсутствовать признаки ОРВИ.
- Наиболее важная роль при проведении анестезии возлагается на сердце и легкие, поэтому перед наркозом работоспособность этих органов должна быть максимально приближена к удовлетворительной — это значит, что простуда, обструктивный бронхит, астма, гипертония, стенокардия, сердечная недостаточность должны быть пролечены и находиться в стадии компенсации.
- Исключите курение сигарет за 6 недель до предполагаемого оперативного вмешательства. Это позволит значительно снизить риск дыхательных осложнений после операции. Если вы не смогли бросить курить, то постарайтесь хотя бы не курить в день операции.
- Если Вы имеете шатающиеся зубы или коронки, то пройдите лечение у стоматолога, так как эти зубы могут быть потеряны, когда анестезиолог будет обеспечивать проходимость дыхательных путей (располагая в ротовой полости специально предназначенные для этого приспособления).
- Не забудьте взять в больницу все принимаемые Вами лекарства.
Перед операцией необходимо сдать анализы, затем по результатам лабораторного обследования пройти консультацию терапевта и анестезиолога. Анализы сдаются натощак (нельзя есть и пить, накануне необходимо воздержаться от жирной и соленой пищи).
План обязательного обследования больных, подлежащих оперативному вмешательству под анестезией (анализы должны быть сданы не ранее, чем за 10 дней до операции):
- Общий анализ крови + Лейкоформула + тромбоциты.
- Время свертывания и длительность кровотечения.
- Группа крови и резус фактор.
- Глюкоза крови.
- Биохимический анализ крови: АЛТ, АСТ, общий билирубин, креатинин, мочевина, общий белок.
- Коагулограмма (ПТИ, Фибриноген, АЧТВ, Тромбиновое время).
- Общий анализ мочи.
- ВИЧ (3 месяца), Гепатиты В и С (1 месяц), RW (2 недели).
- Флюорография или Ro-графия грудной клетки.
- ЭКГ с расшифровкой.
- Заключение терапевта.
При наличии сопутствующих патологий необходима консультация узкого специалиста.
При поступлении в стационар в день операции — приходить на голодный желудок (с вечера разрешается легкий ужин, утром нельзя есть и пить). Очень важно при подготовке к анестезии, чтобы Ваш желудок был пустой, так как даже минимальное количество находящейся в желудке пищи или воды могут значительно снизить безопасность анестезии, предоставляя реальную угрозу для жизни.
Вечером в день до операции примите гигиенический душ. Ванна (душ) очистят кожу от невидимых загрязнений, что позволит уменьшить риск инфекции во время операции.
Перед операцией извлеките из ротовой полости все съемные предметы, если таковые имеются (зубные протезы, пирсинг). Все эти предметы после введения в наркоз могут вызвать проблемы с Вашим дыханием.
Подготавливаясь к наркозу также снимите контактные линзы, слуховой аппарат.
Ногти на руках должны быть свободны от маникюрного лака, который может быть причиной затрудненного считывания информации о дыхании, получаемой при помощи специального прибора, подключаемого при проведении наркоза к одному из пальцев руки.
Если Ваш анестезиолог разрешил оставить утренний прием какого-либо лекарства (которое Вы постоянно принимали до операции), то оптимальнее всего проглотить таблетки, не запивая их жидкостью. Если трудно поступить таким образом, то запейте таблетки минимальным глотком воды, сместив при этом прием лекарственных препаратов на максимально раннее утреннее время.
СвязываниеДНК с лейкоцитами человека. Доказательства опосредованной рецепторами ассоциации, интернализации и деградации ДНК
Предыдущие исследования показали, что белые кровяные тельца содержат ДНК на своих внешних мембранах. В этом исследовании мы намеревались определить, связывается ли экзогенная ДНК с клетками способом, совместимым с лигандным рецепторным объединением. Очищенные популяции лейкоцитов; нейтрофилы (полиморфно-ядерные лейкоциты, PMN), адгезивные мононуклеарные клетки (ADMC), розеточные лимфоциты (E + клетки) и некрозирующие лимфоциты (E-клетки) инкубировали с радиоактивно меченной ДНК фага лямбда в возрастающих концентрациях.Связывание [3H] ДНК было насыщаемым процессом и ингибировалось избытком холодной ДНК и предварительной трипсинизацией клеток. Скоростное центрифугирование с зональной плотностью очищенных препаратов клеточных мембран подтвердило, что ДНК связывалась с внешней поверхностью клетки. Константа диссоциации для всех четырех типов клеток составляла приблизительно 10 (-9) М и от 0,81 · 10 (3) до 2,6 · 10 (3) молекул ДНК фага лямбда, связанных с каждой клеткой, в зависимости от типа клетки. Связывание не ингибировалось конкурентно РНК, полидезоксиадениловая кислота-полидезокситимидиловая кислота (поли [d (A).d (T)]) или мононуклеотидов. Додецилсульфат натрия (SDS) в полиакриламидном геле, разделенные электрофорезом (PAGE) белки из PMN, ADMC, E + и E- клеток, подвергали электрофоретическому блоттингу на нитроцеллюлозных листах; зонд меченной биотином ДНК показал, что один вид ДНК-связывающей молекулы мигрирует в положении, соответствующем молекулярной массе 30 000. Изотопные и иммунофлуоресцентные исследования показывают, что ДНК интернализуется и разлагается до олигонуклеотидов; этот процесс ингибируется циклогексимидом.Эти результаты подтверждают представление о том, что существует общий сайт связывания ДНК на лейкоцитах, что стехиометрия ассоциации совместима с лигандными рецепторными отношениями, и что этот очевидный рецептор отвечает за эндоцитоз и деградацию экзогенной ДНК.
Нарушение продукции интерлейкина-6 лейкоцитами брюшины у пациентов с эндометриозом
Цели: Изучить способность лейкоцитов брюшины продуцировать интерлейкин-6 (IL-6) in vitro и определить, присутствует ли IL-6 в перитонеальной жидкости (PF) in vivo.
Дизайн: Лейкоциты брюшины оценивали на предмет спонтанной и стимулированной продукции IL-6. Интерлейкин-6 в ПФ также определялся количественно.
Параметр: Лейкоциты были выделены из ПФ, полученного во время диагностической лапароскопии по поводу боли и бесплодия, или у женщин, перенесших двустороннюю перевязку маточных труб.
Пациенты: В исследуемую популяцию вошли 24 женщины. Экспериментальные группы состояли из женщин, перенесших перевязку маточных труб (n = 6), пациентов с поствоспалительными спаечными процессами таза, не связанными с эндометриозом (n = 6), и женщин с минимальным или легким эндометриозом (n = 6) или умеренным или тяжелым заболеванием (n = 6). ).
Результаты: Лейкоциты брюшины от нормальных контрольных женщин и пациентов с тяжелым эндометриозом спонтанно продуцировали низкие уровни IL-6.Напротив, клетки женщин с легкой формой заболевания или спаек спонтанно высвобождали в два-четыре раза более высокие уровни этого цитокина. Лейкоциты брюшины от пациентов с легким и тяжелым эндометриозом были невосприимчивы к дополнительному высвобождению цитокинов непосредственно в ответ на стимуляцию эндотоксином. Биоактивный ИЛ-6 присутствовал в ПФ всех групп пациентов, тогда как иммунореактивный ИЛ-6 не был обнаружен в этой жидкости.
Выводы: Эти данные демонстрируют, что ИЛ-6 присутствовал в ПФ всех групп пациентов.Однако способность лейкоцитов брюшины продуцировать IL-6 in vitro различалась в зависимости от стадии заболевания. Мы предполагаем, что измененная лейкоцитарного ИЛ-6, в естественных условиях может внести свой вклад в патофизиологии эндометриоза.
лейкоцитов | Безграничная анатомия и физиология
Типы лейкоцитов
Различные типы белых кровяных телец (лейкоцитов) включают нейтрофилы, базофилы, эозинофилы, лимфоциты, моноциты и макрофаги.
Цели обучения
Различают два основных типа лейкоцитов (лейкоцитов): гранулоциты и агранулоциты
Основные выводы
Ключевые моменты
- Двумя основными типами лейкоцитов являются гранулоциты и мононуклеарные лейкоциты (агранулоциты).
- Лейкоциты возникают из гемопоэтических стволовых клеток костного мозга.
- Лейкоциты участвуют в распознавании патогенов, фагоцитозе (попадании частиц в организм), разрушении патогенов, опосредовании воспаления и презентации антигена.
- Гранулоциты включают нейтрофилы, базофилы, эозинофилы и тучные клетки. Их гранулы содержат ферменты, которые повреждают или переваривают патогены и высвобождают медиаторы воспаления в кровоток.
- Мононуклеарные лейкоциты включают лимфоциты, моноциты, макрофаги и дендритные клетки. Эта группа участвует как в функции врожденной, так и в адаптивной иммунной системе.
Ключевые термины
- эндоцитозировано : Поглощено во время процесса, при котором плазматическая мембрана клетки загибается внутрь, чтобы проглотить материал.
- антиген : Вещество, обычно чужеродное, которое вызывает иммунный ответ.
- патоген : Любой организм или вещество, особенно микроорганизм, способный вызывать заболевание. Примеры включают бактерии, вирусы, простейшие или грибы. Микроорганизмы не считаются патогенными до тех пор, пока популяция не станет достаточно большой, чтобы вызвать болезнь.
Лейкоциты (лейкоциты) или лейкоциты — это клетки иммунной системы, которые защищают организм от инфекционных заболеваний и инородных материалов.Есть несколько разных типов лейкоцитов. У них есть общие черты, но они различаются по форме и функциям. Лейкоциты продуцируются в костном мозге гемопоэтическими стволовыми клетками, которые дифференцируются в лимфоидные или миелоидные клетки-предшественники. Основной отличительной чертой является наличие гранул; лейкоциты часто характеризуются как гранулоциты или агранулоциты.
Гранулоциты
Гранулоциты, также известные как полиморфноядерные (PMN) лейкоциты, характеризуются окрашенными гранулами в их цитоплазме под микроскопом.Эти гранулы представляют собой мембраносвязанные ферменты, которые действуют в первую очередь при переваривании эндоцитозированных частиц. Они также могут вызывать апоптоз, опосредованный гранулами, посредством высвобождения перфоринов, гранзимов и протеаз. Ядро содержит несколько долей (полиморфноядерных) в отличие от одной округлой доли. Гранулоциты содержат толл-подобные рецепторы, которые позволяют им распознавать молекулярные паттерны, связанные с патогенами (PAMPS). Все категории, кроме нейтрофилов, содержат рецепторы IgE, которые участвуют в аллергических реакциях.Есть четыре типа гранулоцитов:
Гранулоциты : нейтрофил, эозинофил и базофил слева направо.
- Нейтрофилы защищают от бактериальной или грибковой инфекции и других очень мелких воспалительных процессов. Обычно они первыми реагируют на микробную инфекцию. Их активность и гибель в большом количестве от дегрануляции образуют гнойный некроз (гной).
- Эозинофилы в первую очередь борются с паразитарными инфекциями.Они также являются преобладающими воспалительными клетками при аллергических реакциях.
- Базофилы в основном отвечают за кратковременную воспалительную реакцию (особенно при аллергии или раздражении), выделяя химический гистамин, который вызывает расширение сосудов, возникающее при воспалении.
- Тучные клетки функционируют аналогично базофилам в том, что они часто опосредуют воспаление, но чаще встречаются и возникают из другой гемопоэтической линии.
Мононуклеарные лейкоциты
Мононуклеарные (MN) лейкоциты характеризуются одним круглым ядром в цитоплазме.Некоторые лейкоциты MN содержат гранулы, а другие нет, но члены этой группы иногда считаются агранулоцитами по соглашению об именах. Лейкоциты MN содержат лизосомы, небольшие пузырьки, содержащие пищеварительные ферменты, которые расщепляют инородные тела, которые эндоцитируются клеткой во время фагоцитоза. Ячейки включают:
- Лимфоциты трех типов. В-лимфоциты вырабатывают антитела в рамках гуморального иммунного ответа. Т-лимфоциты участвуют в клеточном иммунном ответе.NK-клетки — это цитотоксические клетки, которые участвуют во врожденном иммунном ответе, убивая инфицированные вирусом и опухолевые клетки и опосредуя лихорадку и длительное воспаление. B- и T-лимфоциты содержат рецепторы антигена MHC, и их активность антиген-специфична. Другие лейкоциты атакуют любой патоген, но не могут различать разные типы патогенов.
- Моноциты — это большие лейкоциты, которые дифференцируются в макрофаги и дендритные клетки в различных условиях, выполняя схожие функции в фагоцитозе и презентации антигена (процесс, посредством которого молекулярные компоненты представляются лимфоцитам для стимуляции адаптивного иммунного ответа).Моноциты и их потомство содержат толл-подобные рецепторы и гранулы.
- Макрофаги — это моноциты, которые мигрировали из кровотока во внутренние ткани организма. Они уничтожают остатки некротических клеток и инородный материал, включая вирусы и бактерии, и могут представлять антигены наивным лимфоцитам. Обычно они прибывают к месту воспаления через один-три дня после первоначальной реакции нейтрофилов, чтобы очистить мертвые нейтрофилы, клеточный мусор и оставшиеся патогены.
- Дендритные клетки — это моноциты, которые мигрировали в клетки, которые находятся в контакте с внешней средой, такой как кожа, кишечник или респираторный эпителий. Их название происходит от разветвленных выступов, называемых дендритами, которые увеличивают площадь их поверхности. Они фагоцитируют патогены и представляют антигены наивным лимфоцитам.
Макрофаг : макрофаг фагоцитирует две более мелкие частицы, возможно, патогены
Функция WBC
Каждый тип лейкоцитов (WBC) выполняет определенную функцию по защите организма от инфекций.
Цели обучения
Опишите функции лейкоцитов (лейкоцитов)
Основные выводы
Ключевые моменты
- Функции лейкоцитов часто возникают в кровотоке и могут представлять либо врожденную, либо адаптивную иммунную систему.
- Функции врожденной иммунной системы неспецифичны и включают фагоцитоз, воспаление и дегрануляцию.
- Функции адаптивной иммунной системы являются антигенспецифическими и включают презентацию антигена, а также клеточно-опосредованную и опосредованную гуморальностью активность.
- По сравнению с функциями врожденной иммунной системы, функции адаптивной иммунной системы запускаются дольше, но работают намного быстрее. У них есть компонент памяти, чтобы предотвратить повторное заражение одним и тем же патогеном.
Ключевые термины
- макрофаг : лейкоцит, который фагоцитирует остатки некротических клеток и инородный материал, включая вирусы, бактерии и чернила для татуировок. Он представляет лимфоцитам чужеродные антигены на молекулах MHC II. Часть врожденной иммунной системы.
- Воспаление : Функция врожденной иммунной системы в ответ на патоген или травму. Химические медиаторы заставляют кровеносные сосуды расширяться и становиться более проницаемыми, что притягивает нейтрофилы в эту область.
- цитотоксический : любой механизм, который может вызвать гибель клетки (обычно без фагоцитоза), такой как дегрануляция или опосредованный клетками апоптоз.
Лейкоциты (белые кровяные тельца) выполняют ряд функций, которые в первую очередь связаны с защитой организма от патогенов (чужеродных захватчиков).Большая активность лейкоцитов происходит в кровотоке, но не ограничивается этой областью. Многие лейкоциты способны выполнять свои функции в тканях или органах во время нормального транспорта и в ответ на травму. Функции лейкоцитов можно классифицировать как врожденные или адаптивные на основании нескольких характеристик.
Функции врожденной иммунной системы
Под врожденной иммунной системой понимается способность организма предотвращать проникновение патогенов и уничтожать патогены, которые попадают в организм.Его функции — быстрые реакции, которые подавляют патоген, как только он обнаруживается в организме. Функции врожденной иммунной системы, связанные с лейкоцитами, включают:
- Фагоцитоз возбудителей болезней. Этот процесс выполняется в основном нейтрофилами, макрофагами и дендритными клетками, но большинство других лейкоцитов также могут это делать. Он включает связывание рецептора Fc с хвостом патогена. Возбудитель поглощается лейкоцитами и разрушается ферментами и свободными радикалами.
- Воспаление.Этот процесс осуществляется в основном тучными клетками, эозинофилами, базофилами и NK-клетками. Когда патоген обнаружен или эндотелиальные клетки сосудов высвобождают стрессовые цитокины из-за повреждения, такого как порез, лейкоциты выделяют множество воспалительных цитокинов, таких как гистамин или TNF-альфа. Они вызывают расширение сосудов, увеличивают проницаемость сосудов и способствуют перемещению нейтрофилов к месту воспаления.
- Дегрануляция. Этот процесс осуществляется гранулоцитами, такими как нейтрофилы.Когда встречаются патогены, у патогена может быть индуцирован гранулярно-зависимый апоптоз (механизм цитотоксичности) путем высвобождения перфоринов, гранзимов и протеаз из их гранул.
Нейтрофилы, фагоцитирующие бактерии : Здесь изображены нейтрофилы, фагоцитирующие и полностью поглощающие бактерии.
Функции адаптивной иммунной системы
Адаптивная иммунная система специфична для каждого патогена на основе антигенов, молекулярных компонентов патогенов, используемых лейкоцитами для распознавания этого специфического патогена.По сравнению с врожденной иммунной системой, функции адаптивного иммунитета работают намного быстрее и имеют компонент памяти, который предотвращает повторное заражение тем же патогеном. Однако обычно проходит больше времени, прежде чем адпативная иммунная система начинает работать. К адаптивным иммунным функциям лейкоцитов относятся:
- Представление антигена. Этот процесс в основном осуществляется макрофагами и дендритными клетками. После фагоцитоза белковые компоненты (антигены) патогена экспрессируются на молекулах MHC лейкоцитов и представляются наивным Т-клеткам (и В-клеткам) в лимфатических узлах.Затем Т-клетки запускают адаптивный иммунный ответ, быстро пролиферируя и дифференцируясь.
- Клеточно-опосредованная активность. Этот процесс выполняется Т-клетками. Патогены, несущие антиген Т-клетки, уничтожаются за счет цитотоксического апоптоза и протеазной активности.
- Гуморальная деятельность. Этот процесс осуществляется В-клетками, которые секретируют антиген-специфические антитела. Антитела связываются с патогенами, чтобы опсонизировать (маркировать) их, чтобы фагоциты поглотили, нейтрализовали или запустили каскад комплемента, в котором белки образуют комплекс, атакующий мембрану, для лизирования патогена.
- Активность ячейки памяти. После презентации антигена создаются В- и Т-клетки памяти. Они быстро производят новые Т-клетки или антитела, если тот же патоген будет обнаружен в будущем. Это предотвращает повторное заражение организма этим патогеном.
Образование WBC
Кроветворение относится к образованию компонентов клеток крови. Это необходимо для функции позвоночных.
Цели обучения
Опишите образование лейкоцитов (лейкоцитов или лейкоцитов)
Основные выводы
Ключевые моменты
- Гематопоэтические стволовые клетки самообновляются и находятся в мозговом веществе кости (костном мозге).
- Все клетки крови делятся на две основные линии, продуцируемые лимфоидными клетками-предшественниками или миелоидными клетками-предшественниками, в зависимости от типа линии.
- Лимфоидные клетки-предшественники дифференцируются в В-, Т-клетки и NK-клетки.
- Миелоидные клетки-предшественники дифференцируются в миелоциты (гранулоциты и моноциты) или не лейкоциты, такие как эритороциты и мегакариоциты (которые продуцируют тромбоциты).
- До рождения большая часть клеток крови формируется в печени или селезенке, которые имеют тенденцию увеличиваться при использовании для кроветворения.У взрослых большая часть кроветворения происходит в костном мозге.
Ключевые термины
- миелоцит : большая клетка, обнаруженная в костном мозге, которая становится гранулоцитом или моноцитом при созревании.
- дифференциация : постепенные изменения, которые происходят, когда тип клетки или ткани превращается в другой тип. Клетки обычно становятся более специализированными, чем больше они дифференцируются, и считаются окончательно дифференцированными, когда они не могут дальше дифференцироваться (а часто и делиться).
- мегакариоцит : большая клетка в костном мозге, ответственная за производство тромбоцитов.
Гематопоэз относится к образованию клеточных компонентов крови, включая как белые, так и эритроциты. Все клеточные компоненты крови происходят из гемопоэтических стволовых клеток, расположенных в костном мозге. У здорового взрослого человека ежедневно вырабатывается примерно 10 11 –10 12 новых клеток крови для поддержания равновесного уровня в периферическом кровообращении.
Гематопоэз лейкоцитов
Гематопоэтические стволовые клетки (HSC) находятся в костном мозге и обладают уникальной способностью давать начало всем зрелым типам клеток крови путем дифференцировки в другие клетки-предшественники. ГСК самообновляются. Когда они размножаются, по крайней мере, некоторые дочерние клетки остаются HSC, поэтому пул стволовых клеток не истощается со временем. Дочерние клетки — это миелоидные и лимфоидные клетки-предшественники, которые не могут самообновляться, а дифференцируются в различные миелоидные лейкоциты и лимфоциты соответственно.Это один из жизненно важных процессов в организме.
Лейкоцитарные линии
Две разные линии лейкоцитов и две нелейкоцитарные линии возникают из потомства HSC. После этого разделения дифференцировки подтипы в конечном итоге дифференцируются на лейкоциты, дифференцированные на терминалах, которые обычно не делятся независимо.
- Линия лимфоцитов происходит из общих лимфоидных клеток-предшественников, которые, в свою очередь, становятся лимфобластами перед дифференцировкой в Т-клетки, В-клетки и NK-клетки.
- Миелоциты являются ответвлением обычных миелоидных клеток-предшественников, которые также дифференцируются на эритропоэтические и магакариотические предшественники. Эта разнообразная группа подразделяется на гранулоциты и моноциты. Моноциты далее дифференцируются в макрофаги или дендритные клетки при достижении определенных тканей.
- Мегакариоциты (клетки, производящие тромбоциты) и эритроциты (красные кровяные тельца) формально не считаются лейкоцитами, а возникают из общих миелоидных клеток-предшественников, которые производят другие клеточные компоненты крови.
Гематопоэз у человека : На этой диаграмме показан гематопоэз в том виде, в каком он происходит у человека.
Сайты гемопоэза в пре- и постнатальный периоды
В развивающихся эмбрионах кроветворение происходит в виде скоплений клеток крови в желточном мешке, называемых островками крови. Однако большая часть кровоснабжения поступает от матери через плаценту. По мере развития кроветворение происходит в основном в селезенке, печени и лимфатических узлах.
Когда костный мозг развивается, он в конечном итоге берет на себя задачу формирования большей части клеток крови для всего организма. Однако созревание, активация и некоторая пролиферация лимфоидных клеток происходит в лимфоидных органах (селезенке, тимусе и лимфатических узлах). У детей кроветворение происходит в костном мозге длинных костей, таких как бедренная и большеберцовая кость. У взрослых это происходит в основном в области таза, черепа, позвонков и грудины.
В некоторых случаях печень, тимус и селезенка могут возобновить свою кроветворную функцию при необходимости.Это называется экстрамедуллярным кроветворением. Это может привести к гипертрофии этих органов и их значительному увеличению. Во время внутриутробного развития печень функционирует как главный орган кроветворения, поскольку кости и костный мозг развиваются позже. Следовательно, в процессе развития печень увеличивается по сравнению с ее зрелыми пропорциями.
Визуализирующая цитометрия лейкоцитов человека с микроскопией третьего поколения гармоник
Получение достоверных изображений ГТГ изолированных лейкоцитов
Чтобы получить достоверные изображения ГТГ лейкоцитов для in vivo, визуализирующая проточная цитометрия, лейкоциты должны быть изолированы с наименьшими затратами. нарушение их физиологических свойств сразу после забора крови.Стимуляция окружающей среды может вызывать изменения размера, морфологии и зернистости клеток. Следовательно, необходимо исследовать последствия каждой ручной операции. Сразу после забора крови первым потенциальным стимулом является антикоагулянт. В нашей методике цельная кровь собиралась с помощью пробирок, покрытых этилендиаминтетрауксусной кислотой (ЭДТА). По сравнению с гематологическим исследованием с использованием стандартного красителя Лю (рис. S1 a ), в мазке крови можно четко идентифицировать срезы THG эритроцитов (эритроцитов), полиморфноядерных нейтрофилов, моноцитов, меньших лимфоцитов и рассеянных тромбоцитов (рис.1). Их ядерная морфология (темные контрасты) и размер напоминают те, что были под пятном Лю. Напротив, мы обнаружили, что большинство лейкоцитов, собранных с помощью пробирок с гепарином, были деформированы и не подходили для дальнейшего исследования (рис. S2).
Рис. 1Изображение среза мазка цельной крови через THG через 1 час после забора крови.
Различные типы лейкоцитов можно различить по размеру, интенсивности ТГГ и морфологии ядра. Поле зрения: 73 × 73 мкм.
Второй фактор, который может изменить морфологию клеток, — это контакт лейкоцитов с поверхностью контейнера.Когда лейкоциты оседают, они могут прилипать к поверхности контейнера и образовывать гранулы из-за стресса со стороны окружающей среды. Мы наблюдали, что лейкоциты оседали более 4 часов при комнатной температуре, а их изображения ГТГ демонстрировали неправильную форму и яркие гранулы (рис. S3). Чтобы избежать этого эффекта, мы сделали ГТГ-изображения лейкоцитов сразу после их загрузки в счетную камеру и закончили измерение в течение одного часа.
Третий фактор — это процедура выделения лейкоцитов.Чтобы собрать определенные типы лейкоцитов для последующего анализа, мы сначала использовали градиентное центрифугирование с Histopaque-1119 и -1077. Гранулоциты и агранулоциты можно разделить из-за их разницы в плавучей плотности. Как подтверждено окрашиванием Лю, почти все лейкоциты в полосе гранулоцитов были нейтрофилами, и их морфология THG существенно не изменилась (рис. S1 b ). Аналогичным образом не изменилась морфология моноцитов и лимфоцитов в полосе агранулоцитов (рис.S1 c ). Однако на поверхности клеток были прикреплены тромбоциты, что может повлиять на анализ при визуализирующей цитометрии. Чтобы повысить чистоту выделения, мы дополнительно отсортировали клетки с помощью проточного цитометра. При стробировании с прямым и боковым рассеянием три основных типа лейкоцитов были отсортированы и изолированы. Морфология ТГГ моноцитов и лимфоцитов после этого процесса существенно не изменилась, в то время как большая часть гранулоцитов каким-то образом была искажена (рис. 2). В результате достоверные изображения нейтрофилов ГТГ должны быть изолированы от полосы гранулоцитов градиента центрифугирования Histopaque.Для выделения моноцитов и лимфоцитов мы дополнительно добавили иммунофлуоресцентную метку с антителом против FITC в процесс сортировки. Очевидно, что на морфологию клеток не влияла ни положительная маркировка клеток-мишеней, ни отрицательная маркировка других клеток, не являющихся мишенями (рис. 3). Морфологические изменения произошли только в гранулоцитах. Наконец, для получения достоверных изображений лимфоцитов и моноцитов с помощью ГТГ следует использовать клетки, очищенные с помощью проточной цитометрии с отрицательной маркировкой. После обеспечения наименее разрушительного метода выделения лейкоцитов мы взяли кровь у трех добровольцев, чтобы измерить достоверные изображения ГТГ различных лейкоцитов.Для уменьшения статистической ошибки визуализировали более 30 клеток для каждого типа лейкоцитов.
Рисунок 2Изображения срезов THG (пурпурный) различных лейкоцитов, выделенных с помощью центрифугирования в градиенте Histopaque (верхний ряд) и с помощью проточной цитометрии (нижний ряд).
Шкала: 5 мкм. L: лимфоцит; М: моноцит; P: тромбоцит.
Рис. 3THG срезы изображений (пурпурный) различных лейкоцитов в мазке крови, положительно-меченых и отрицательно-меченых клеток.
Клетки-мишени излучают флуоресценцию FITC (зеленый) в группе с положительной меткой, но им не хватает флуоресценции в группе с отрицательной окраской. Масштабные линейки: 5 мкм.
Дифференциация изолированных лейкоцитов с изображениями THG
После сегментации на границе клетки мы проанализировали среднюю интенсивность THG внутри клетки и размер клетки как дифференцируемые особенности. Размер ячейки был приблизительно равен количеству пикселей, заключенных внутри границы ячейки в плоскости сечения. Средняя интенсивность THG была рассчитана по этим замкнутым пикселям.Применяя гистограмму лейкоцитов того же добровольца (рис. 4), мы обнаружили, что интенсивность ГТГ гранулярных нейтрофилов (серые столбцы, 84,2 ± 6,1) была явно выше, чем у агранулярных моноцитов (светло-пурпурные столбцы, 53,3 ± 9,1) или лимфоциты (зеленые столбцы, 43,7 ± 7,5). Учитывая диапазон популяции 5–95% (усы на прямоугольной диаграмме на рис. 4b), для дифференциации был определен пороговый уровень 70 (пунктирная линия на рис. 4a, b). Этот результат подтвердил, что интенсивность ГТГ может отражать гранулярность лейкоцитов человека и служить важным признаком дифференциации лейкоцитов.При анализе размера (рис. 4c) лимфоциты, очевидно, имеют меньшее количество заключенных пикселей (зеленые столбцы, 2387 ± 267), чем нейтрофилы (серые столбцы, 3618 ± 269) и моноциты (светло-пурпурные столбцы, 3976 ± 398). Порог размера в 2956 пикселей позволяет четко отличить лимфоциты от двух других типов клеток (рис. 4d). Помещая все точки данных на график разброса интенсивности / размера ГТГ, становится очевидным, что три основных типа лейкоцитов можно отличить друг от друга (рис. 4e). Чтобы сделать последовательную и надежную дифференциацию, мы применили алгоритм кластеризации k-средних 20 к точкам данных всех лейкоцитов.Три рассчитанных центроида [(84,4,3632), (53,3,3965), (43,5,2410)] хорошо согласуются со средними значениями нейтрофилов (84,2,3618), моноцитов (53,3,3976) и лимфоцитов (43,7,2387). ). Анализируя достоверные изображения лейкоцитов ГТГ, чувствительность и специфичность дифференциации превышают 96% и 99% соответственно (временная точка T1 добровольца V1 в таблице S1).
Рисунок 4( a , c ) Гистограммы, ( b , d ) прямоугольные диаграммы и ( e , f ) диаграммы разброса ( a , b ) средняя интенсивность ГТГ и ( c , d ) размер лейкоцитов.Нейтрофилы (серые), моноциты (светло-пурпурный) и лимфоциты (зеленые) были собраны из одной и той же пробирки с кровью, взятой у одного и того же добровольца. На прямоугольной диаграмме диапазон прямоугольников охватывает среднее значение ± стандартное отклонение, а усы охватывают от 5% до 95% данных. Три группы данных, K1 (черный открытый квадрат), K2 (открытый красный кружок) и K3 (открытый оливковый треугольник), были сгруппированы с помощью кластерного анализа k-средних. Neu: нейтрофилы; Моно: моноциты; Lym: лимфоциты.
У того же добровольца мы также взяли образцы его периферической крови в двух других временных точках, Т2 и Т3, разделенных несколькими днями.Интенсивность ТГГ нейтрофилов была относительно ниже, но все же выше, чем у лейкоцитов без значительных цитоплазматических гранул (рис. S4a и S4 b ). Лимфоциты отличались от двух других типов лейкоцитов по их размеру (рис. S4 d ). Три разделяемых кластера все еще можно распознать на диаграммах рассеяния (рис. S4 f и S4 g ). Соответствующие чувствительность дифференцировки и специфичность для всех типов лейкоцитов составляли 93–98% и 97–100% соответственно (Таблица S1).Следовательно, для здорового добровольца момент забора крови не повлияет на чувствительность и специфичность дифференциации. То же самое и со вторым добровольцем (рис. S5 и таблица S1). Только во второй временной точке некоторые нейтрофилы небольшого размера (рис. S5 b ) снизили чувствительность обнаружения до 80%. Чтобы понять индивидуальные вариации дифференцировки лейкоцитов, мы дополнительно набрали третьего добровольца и провели волонтер-зависимый анализ (рис. 5).
Рисунок 5( a , c ) Гистограммы, ( b , d ) прямоугольные диаграммы и ( e , f ) диаграммы разброса ( a , b ) средняя интенсивность ГТГ и ( c , d ) размер лейкоцитов.Нейтрофилы (серые), моноциты (светло-пурпурный) и лимфоциты (зеленые) были собраны у трех разных добровольцев, V1, V2 и V3. На прямоугольной диаграмме прямоугольный диапазон охватывает среднее значение ± стандартное отклонение, а усы покрывают от 5% до 95% данных. Три группы данных, K1 (черный открытый квадрат), K2 (открытый красный кружок) и K3 (открытый оливковый треугольник), были сгруппированы с помощью кластерного анализа k-средних. Neu: нейтрофилы; Моно: моноциты; Lym: лимфоциты.
Мы обнаружили, что при рассмотрении распределения 5–95% не существует универсального порога интенсивности или размера ТГГ для дифференцировки лейкоцитов (рис.5б, г). Типы лейкоцитов необходимо дифференцировать на двумерных графиках разброса интенсивности / размера ГТГ (рис. 5e – g). После применения алгоритма кластеризации k-средних средняя чувствительность / специфичность дифференциации нашего метода цитометрии визуализации THG составила 96% / 99%, 98% / 97% и 97% / 99% для нейтрофилов, моноцитов и лимфоцитов. соответственно. Интересно, что соединив все точки данных от трех добровольцев, мы обнаружили, что прямоугольные диаграммы интенсивности и размера ГТГ могут иметь четкие пороговые значения 63 и 3050 соответственно (рис.S6). На комбинированной диаграмме рассеяния характерные черты трех кластеров остались. Чувствительность дифференциации и специфичность алгоритма кластеризации k-средних для каждого типа лейкоцитов были выше 95% и 97% соответственно. Эти статистические результаты поддерживают интеграцию двух функций визуализации THG и базового алгоритма кластеризации k-средних, чтобы отличить три основных подтипа лейкоцитов от любого здорового человека в любой момент времени отбора проб. Прежде чем закрыть этот раздел, мы упоминаем, что текстурные особенности изображений ячеек могут быть включены для дальнейшего различения различных типов ячеек.Например, в предположении инвариантности вращения элементов текстуры, элемент текстуры определяется матрицей совместной встречаемости для пар соседних горизонтальных пикселей. Предварительное исследование показывает, что особенности текстуры, такие как корреляция, могут повысить общую точность кластеризации (см. Рис. S8). Чтобы в полной мере использовать эти функции, мы могли бы применить современную технику машинного обучения для дальнейшего изучения лежащей в основе нелинейной структуры. Систематическое изучение этих особенностей и нелинейных методов выходит за рамки данной статьи, и результаты будут сообщены в будущей работе.
Подсчет лейкоцитов в цельной крови с помощью изображений THG
Доказав концепцию изолированных лейкоцитов, мы продвигаемся вперед, чтобы проверить возможности нашего метода в клиническом сценарии; то есть идентификация, дифференциация и подсчет лейкоцитов в цельной крови. Мы набрали пять добровольцев и взяли у них кровь в пробирку объемом 6 мл. Половина крови была отправлена в отделение лабораторной медицины NTUH для проведения общего анализа крови (CBC) с дифференциалом лейкоцитов. Другую половину разбавляли в 10 раз фосфатно-солевым буфером (PBS), а затем загружали в самодельную счетную камеру для визуализации THG.Затем загруженная камера была установлена на платформе микроскопа. Перемещая фокальную плоскость изображения ГТГ в область камеры, мы могли наблюдать клетки крови, зажатые между покровными стеклами. Чтобы получить достаточно большое количество лейкоцитов, мы сканировали в поперечном направлении через область 2 × 2 мм 2 в каждой камере. Поскольку поверхность раздела жидкое стекло имеет сильный сигнал THG, когда мы перемещаем объектив по направлению к камере, мы можем четко идентифицировать эти две границы раздела этих материалов в счетной камере и измерить осевое расстояние между ними.Как показано на рис. 1, лейкоциты можно легко идентифицировать, потому что красные кровяные тельца имеют гораздо более сильный сигнал THG, а тромбоциты имеют гораздо меньший размер. Учитывая площадь сканирования и толщину камеры, мы рассчитали объем крови при визуализации, а затем числовую плотность лейкоцитов. Плотность лейкоцитов у пяти добровольцев находится в физиологическом диапазоне 4000–11000 на микролитр. При применении порога, определенного на рис. 5, процент нейтрофилов, моноцитов и лимфоцитов у здоровых добровольцев составлял приблизительно 52–70%, 3–14% и 22–34% соответственно (таблица 1).Процентное соотношение типов лейкоцитов при подсчете было близко к результатам общего анализа крови и показало хорошую корреляцию (r = 0,8863, p <0,05). Что касается абсолютной плотности всех лейкоцитов, было изменение на 20%, что могло быть вызвано испарением PBS или сжатием пространства между двумя покровными стеклами с течением времени, что в некоторых случаях приводило к более высокой плотности клеток. Мы думаем, что эти ошибки можно значительно уменьшить, заменив этот держатель образца надежными счетными камерами, предназначенными для объективов с коротким рабочим расстоянием.
Таблица 1 Число подсчетов (N), процент и плотность клеток по данным микроскопии THG по сравнению с тестом CBC.Подсчет лейкоцитов из
in vivo изображений THGВ качестве проверки осуществимости мы взяли изображений in vivo THG циркулирующих клеток крови (видео 1) в области сосочков дермы [зеленый цвет на рис. , в)] под кожей человека. Сосочек окружен базальными клетками и эпидермальными клетками с сильным контрастом THG [пурпурный цвет на рис. 6 (b, c)]. Внутри сосочка имеется капиллярная петля (обозначенная белыми стрелками) в этой плоскости сечения.Мы сделали видеоизображения in vivo THG на этом капилляре в течение 15 минут и проанализировали каждую текущую клетку крови. Согласно морфодинамике 9 , размерам и интенсивности ТГГ клеток крови мы идентифицировали 40 лейкоцитов (рис. S9). Анализируя их среднюю интенсивность ГТГ и площадь поперечного сечения, мы обнаружили из диаграммы рассеяния [Рис. 6 (d)], что лейкоциты все еще можно дифференцировать, установив порог интенсивности THG (пунктирная линия) и размера (сплошная линия) на 84 и 2880 соответственно.Клетки можно разделить на 26 ячеек с высокой интенсивностью THG, 3 ячейки с большей площадью поперечного сечения и 11 ячеек с меньшими размерами и площадями. Приписав их нейтрофилам, моноцитам и лимфоцитам, соответственно, мы обнаружили, что процентная доля населения каждого типа (Neu: 65%; Mono: 7,5%; Lym: 27,5%) хорошо согласуется с результатами клинического анализа крови здорового добровольца (Neu: 64,2%; Mono: 6,2%; Lym: 29,6%) на ту же дату. Для определения специфичности и чувствительности нашего метода потребуются дополнительные клинические испытания.
Рисунок 6( a ) SHG, ( b ) THG и ( c ) объединенные изображения капилляра (обозначенного белой стрелкой) в области дермального сосочка под кожей человека. Сосочек окружен базальными клетками с сильным контрастом THG. ( d ) График разброса средней интенсивности THG и размера изображений поперечного сечения лейкоцитов, полученных в капилляре человека (см. Фиг. S9).
Передача сигналов MyD88 нейронами индуцирует хемокины, которые привлекают защитные лейкоциты к инфицированной вирусом ЦНС
Защита от энцефалита
Вирусный энцефалит вызывается инфицированием ЦНС нейротропными вирусами и может привести к длительным неврологическим осложнениям или смерти.Ghita et al. изучал роль гена 88 первичного ответа миелоидной дифференцировки адаптера передачи сигналов врожденного иммунитета (MyD88) на мышиной модели инфекции ЦНС вируса везикулярного стоматита (VSV). MyD88 представляет собой сигнальный адаптер для передачи сигналов рецептора TLR и IL-1. Здесь они заметили, что MyD88 необходим для рекрутирования лейкоцитов в ЦНС, особенно Т-лимфоцитов CD8, и имеет решающее значение для защиты от смерти. Передача сигналов MyD88 в нейронах была необходима для продукции хемокинов и рекрутирования лейкоцитов в ЦНС, и вместе эти данные дают представление о врожденных иммунных механизмах, участвующих в защите от вирусного энцефалита.
Abstract
Вирусный энцефалит инициирует серию иммунологических событий в головном мозге, которые могут привести к повреждению мозга и смерти. Астроциты экспрессируют IFN-β в ответ на нейротропную инфекцию, тогда как активированная микроглия продуцирует провоспалительные цитокины и накапливается в местах инфицирования. Здесь мы наблюдали, что инфекция вируса нейротропного везикулярного стоматита (VSV) вызывает рекрутирование лейкоцитов в центральную нервную систему (ЦНС), что требует MyD88, адаптера Toll-подобного рецептора и передачи сигналов рецептора интерлейкина-1.Проникающие лейкоциты, и в частности Т-клетки CD8 + , защищают ЦНС от летальной инфекции VSV. Восстановление MyD88, особенно в нейронах, восстановило продукцию хемокинов в обонятельной луковице, а также рекрутирование лейкоцитов в инфицированную ЦНС и увеличило выживаемость. Сравнительный анализ трансатома нейронов и астроцитов подтвердил, что нейроны являются критическим источником хемокинов, которые регулируют инфильтрацию лейкоцитов в инфицированный мозг и влияют на выживаемость.
- Copyright © 2021 Авторы, некоторые права защищены; эксклюзивный лицензиат Американской ассоциации содействия развитию науки. Отсутствие претензий к оригинальным работам правительства США
Экстравазация лейкоцитов по сравнению с опухолевыми клетками | Клеточная коммуникация и передача сигналов
- 1.
Пэджет С. Распределение вторичных новообразований при раке груди. Ланцет. 1889, 133 (3421): 571-573. 10.1016 / S0140-6736 (00) 49915-0.
Google Scholar
- 2.
Balkwill F, Mantovani A: Воспаление и рак: назад к Вирхову ?. Ланцет. 2001, 357 (9255): 539-545. 10.1016 / S0140-6736 (00) 04046-0.
CAS PubMed Google Scholar
- 3.
Muller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T., Murphy E, Yuan W, Wagner SN, Barrera JL, Mohar A, Verastegui E, Zlotnik A: участие хемокиновые рецепторы при метастазировании рака груди. Природа. 2001, 410 (6824): 50-56. 10.1038/35065016.
CAS PubMed Google Scholar
- 4.
Энтшладен Ф., Дрелл Т.Л., Ланг К., Джозеф Дж., Заенкер К.С.: Миграция, инвазия и метастазирование опухолевых клеток: навигация с помощью нейротрансмиттеров. Ланцет Онкол. 2004, 5 (4): 254-258. 10.1016 / S1470-2045 (04) 01431-7.
CAS PubMed Google Scholar
- 5.
Iadocicco K, Monteiro LH, Chaui-Berlinck JG: Теоретическая модель для оценки константы маргинальности лейкоцитов.BMC Physiol. 2002, 2 (3):
- 6.
Osada T, Radegran G: Изменения реологического профиля потока в кондуитной бедренной артерии во время ритмичных сокращений мышц бедра у людей. Jpn J Physiol. 2005, 55 (1): 19-28. 10.2170 / jjphysiol.R2074.
PubMed Google Scholar
- 7.
Aird WC: Фенотипическая неоднородность эндотелия: I. Структура, функции и механизмы. Circ Res. 2007, 100 (2): 158-173. 10.1161 / 01.RES.0000255691.76142.4a.
CAS PubMed Google Scholar
- 8.
Wagner JG, Roth RA: Механизмы миграции нейтрофилов с упором на легочную сосудистую сеть. Pharmacol Rev.2000, 52 (3): 349-374.
CAS PubMed Google Scholar
- 9.
Doerschuk CM, Allard MF, Martin BA, MacKenzie A, Autor AP, Hogg JC: Маргинальный пул нейтрофилов в легких кролика.J Appl Physiol. 1987, 63 (5): 1806-1815.
CAS PubMed Google Scholar
- 10.
Doerschuk CM, Beyers N, Coxson HO, Wiggs B, Hogg JC: Сравнение диаметров нейтрофилов и капилляров и их связь с секвестрацией нейтрофилов в легких. J Appl Physiol. 1993, 74 (6): 3040-3045.
CAS PubMed Google Scholar
- 11.
Doerschuk CM, Allard MF, Hogg JC: Кинетика нейтрофилов у кроликов во время инфузии плазмы, активированной зимозаном.J Appl Physiol. 1989, 67 (1): 88-95.
CAS PubMed Google Scholar
- 12.
Дауни Г.П., Уортен Г.С., Хенсон П.М., Хайд Д.М.: Секвестрация и миграция нейтрофилов при локализованном воспалении легких. Локализация капилляров и миграция через межальвеолярную перегородку. Am Rev Respir Dis. 1993, 147 (1): 168-176.
CAS PubMed Google Scholar
- 13.
Aird WC: Фенотипическая неоднородность эндотелия: II.Репрезентативные сосудистые русла. Circ Res. 2007, 100 (2): 174-190. 10.1161 / 01.RES.0000255690.03436.ae.
CAS PubMed Google Scholar
- 14.
Girard JP, Springer TA: Венулы высокого эндотелия (HEV): специализированный эндотелий для миграции лимфоцитов. Иммунол сегодня. 1995, 16 (9): 449-457. 10.1016 / 0167-5699 (95) 80023-9.
CAS PubMed Google Scholar
- 15.
Миясака М., Танака Т.: Транспортировка лимфоцитов через венулы высокого эндотелия: догмы и загадки. Nat Rev Immunol. 2004, 4 (5): 360-370. 10.1038 / nri1354.
CAS PubMed Google Scholar
- 16.
Лю Л., Кубес П: Молекулярные механизмы рекрутирования лейкоцитов: органоспецифические механизмы действия. Thromb Haemost. 2003, 89 (2): 213-220.
CAS PubMed Google Scholar
- 17.
Янг Дж, Розен С.Д., Бенделе П., Хеммерих С. Индукция PNAd и N-ацетилглюкозамин 6-O-сульфотрансфераз 1 и 2 при артрите, индуцированном коллагеном у мышей. BMC Immunol. 2006, 7 (12):
- 18.
Ласки Л.А., Зингер М.С., Доубенко Д., Имаи Ю., Хензель В.Дж., Гримли С., Фенни С., Джиллетт Н., Уотсон С.Р., Розен С.Д.: эндотелиальный лиганд для L-селектина. представляет собой новую муциноподобную молекулу. Клетка. 1992, 69 (6): 927-938. 10.1016 / 0092-8674 (92)
-Г.CAS PubMed Google Scholar
- 19.
Баумхетер С., Зингер М.С., Хензель В., Хеммерих С., Ренц М., Розен С.Д., Ласки Л.А.: Связывание L-селектина с сосудистым сиаломуцином CD34. Наука. 1993, 262 (5132): 436-438. 10.1126 / science.7692600.
CAS PubMed Google Scholar
- 20.
Умемото Э, Танака Т., Канда Х, Джин С., Тохья К., Отани К., Мацутани Т., Мацумото М., Эбисуно Ю., Джанг М. Х., Фукуда М., Хирата Т., Миясака М.: Непмуцин, роман HEV. сиаломуцин опосредует L-селектин-зависимое сворачивание лимфоцитов и способствует адгезии лимфоцитов в потоке.J Exp Med. 2006, 203 (6): 1603-1614. 10.1084 / jem.20052543.
PubMed Central CAS PubMed Google Scholar
- 21.
Hemmerich S, Butcher EC, Rosen SD: Зависимое от сульфатирования распознавание лигандов венул высокого эндотелия (HEV) L-селектином и MECA 79 и моноклональными антителами, блокирующими адгезию. J Exp Med. 1994, 180 (6): 2219-2226. 10.1084 / jem.180.6.2219.
CAS PubMed Google Scholar
- 22.
Кавасима H: Роль сульфатированных гликанов в хоминге лимфоцитов. Биол Фарм Булл. 2006, 29 (12): 2343-2349. 10.1248 / bpb.29.2343.
CAS PubMed Google Scholar
- 23.
Rosen SD: Эндотелиальные лиганды для L-селектина: от рециркуляции лимфоцитов до отторжения аллотрансплантата. Am J Pathol. 1999, 155 (4): 1013-1020.
PubMed Central CAS PubMed Google Scholar
- 24.
Elangbam CS, Qualls CW, Dahlgren RR: Молекулы клеточной адгезии — обновленная информация. Vet Pathol. 1997, 34 (1): 61-73.
CAS PubMed Google Scholar
- 25.
Бартел С.Р., Гавино Дж. Д., Дешени Л., Димитрофф К. Дж.: Нацеливание на селектины и лиганды селектина при воспалении и раке. Эксперт считает, что цели. 2007, 11 (11): 1473-1491. 10.1517 / 14728222.11.11.1473.
PubMed Central CAS PubMed Google Scholar
- 26.
Schweitzer KM, Drager AM, Valk van der P, Thijsen SF, Zevenbergen A, Theijsmeijer AP, Schoot van der CE, Langenhuijsen MM: Конститутивная экспрессия E-селектина и молекулы-1 адгезии сосудистых клеток на эндотелиальных клетках кроветворных тканей. Am J Pathol. 1996, 148 (1): 165-175.
PubMed Central CAS PubMed Google Scholar
- 27.
Sackstein R: Костный мозг сродни коже: HCELL и биология самонаведения гемопоэтических стволовых клеток.J Investigate Dermatol Symp Proc. 2004, 9 (3): 215-223. 10.1111 / j.0022-202X.2004.09301.x.
PubMed Google Scholar
- 28.
Strell C, Lang K, Niggemann B, Zaenker KS, Entschladen F: Поверхностные молекулы, регулирующие скатывание и адгезию к эндотелию нейтрофильных гранулоцитов и клеток карциномы молочной железы MDA-MB-468 и их взаимодействие. Cell Mol Life Sci. 2007, 64 (24): 3306-3316. 10.1007 / s00018-007-7402-6.
CAS PubMed Google Scholar
- 29.
Иванов Д.Б., Филиппова М.П., Ткачук В.А.: Структура и функции классических кадгеринов. Биохимия (Москва). 2001, 66 (10): 1174-1186. 10.1023 / А: 1012445316415.
CAS Google Scholar
- 30.
Christofori G: Смена соседей, изменение поведения: передача сигналов, опосредованная молекулами клеточной адгезии во время прогрессирования опухоли. EMBO J. 2003, 22 (10): 2318-2323. 10.1093 / emboj / cdg228.
PubMed Central CAS PubMed Google Scholar
- 31.
Гарридо-Урбани С., Брэдфилд П.Ф., Ли Б.П., Имхоф Б.А.: Сосудистые и эпителиальные соединения: барьер для миграции лейкоцитов. Biochem Soc Trans. 2008, 36 (Pt 2): 203-211. 10.1042 / BST0360203.
CAS PubMed Google Scholar
- 32.
Su WH, Chen HI, Jen CJ: Дифференциальные движения VE-кадгерина и PECAM-1 во время трансмиграции полиморфно-ядерных лейкоцитов через эндотелий пупочной вены человека. Кровь. 2002, 100 (10): 3597-3603.10.1182 / кровь-2002-01-0303.
CAS PubMed Google Scholar
- 33.
Майлз Флорида, Прюитт Флорида, ван Голен К.Л., Купер К.Р .: Выйти из потока: капиллярная экстравазация при метастазах рака. Clin Exp Metastasis. 2008, 25 (4): 305-324. 10.1007 / s10585-007-9098-2.
CAS PubMed Google Scholar
- 34.
Burdick MM, Chu JT, Godar S, Sackstein R: HCELL является основным лигандом E- и L-селектина, экспрессируемым на клетках карциномы толстой кишки LS174T.J Biol Chem. 2006, 281 (20): 13899-13905. 10.1074 / jbc.M513617200.
CAS PubMed Google Scholar
- 35.
Hanley WD, Napier SL, Burdick MM, Schnaar RL, Sackstein R, Konstantopoulos K: Вариантные изоформы CD44 представляют собой лиганды P- и L-селектина на клетках карциномы толстой кишки. Фасеб Дж. 2006, 20 (2): 337-339.
CAS PubMed Google Scholar
- 36.
Napier SL, Healy ZR, Schnaar RL, Konstantopoulos K: Экспрессия лиганда селектина регулирует начальные сосудистые взаимодействия клеток карциномы толстой кишки: роль CD44v и альтернативных сиалофукозилированных лигандов селектина.J Biol Chem. 2007, 282 (6): 3433-3441. 10.1074 / jbc.M607219200.
CAS PubMed Google Scholar
- 37.
Dimitroff CJ, Descheny L, Trujillo N, Kim R, Nguyen V, Huang W, Pienta KJ, Kutok JL, Rubin MA: Идентификация лигандов E-селектина лейкоцитов, лиганд-1 гликопротеина P-селектина и E -селектиновый лиганд-1 на метастатических опухолевых клетках простаты человека. Cancer Res. 2005, 65 (13): 5750-5760. 10.1158 / 0008-5472.CAN-04-4653.
PubMed Central CAS PubMed Google Scholar
- 38.
Aigner S, Ramos CL, Hafezi-Moghadam A, Lawrence MB, Friederichs J, Altevogt P, Ley K: CD24 опосредует перекатывание клеток карциномы молочной железы на P-селектин. Faseb J. 1998, 12 (12): 1241-1251.
CAS PubMed Google Scholar
- 39.
Thomas SN, Zhu F, Schnaar RL, Alves CS, Konstantopoulos K: Карциноэмбриональный антиген и вариантные изоформы CD44 взаимодействуют, опосредуя адгезию клеток карциномы толстой кишки к E- и L-селектину в сдвиговом потоке.J Biol Chem. 2008, 283 (23): 15647-15655. 10.1074 / jbc.M800543200.
PubMed Central CAS PubMed Google Scholar
- 40.
Qi J, Chen N, Wang J, Siu CH: Трансэндотелиальная миграция клеток меланомы включает адгезию, опосредованную N-кадгерином, и активацию пути передачи сигналов бета-катенина. Mol Biol Cell. 2005, 16 (9): 4386-4397. 10.1091 / mbc.E05-03-0186.
PubMed Central CAS PubMed Google Scholar
- 41.
Borsig L, Wong R, Feramisco J, Nadeau DR, Varki NM, Varki A: Гепарин и рак снова: механистические связи с участием тромбоцитов, P-селектина, муцинов карциномы и метастазов опухоли. Proc Natl Acad Sci USA. 2001, 98 (6): 3352-3357. 10.1073 / pnas.061615598.
PubMed Central CAS PubMed Google Scholar
- 42.
Kim YJ, Borsig L, Han HL, Varki NM, Varki A: Определенные лиганды селектина на муцинах карциномы толстой кишки могут опосредовать патологические взаимодействия между тромбоцитами, лейкоцитами и эндотелием.Am J Pathol. 1999, 155 (2): 461-472.
PubMed Central CAS PubMed Google Scholar
- 43.
Лаубли Х., Стивенсон Дж. Л., Варки А., Варки Н. М., Борсиг Л. Облегчение метастазирования L-селектином включает временную индукцию Fut7-зависимых лигандов в местах остановки опухолевых клеток. Cancer Res. 2006, 66 (3): 1536-1542. 10.1158 / 0008-5472.CAN-05-3121.
PubMed Google Scholar
- 44.
Lustre AD: Хемокины — хемотаксические цитокины, опосредующие воспаление. N Engl J Med. 1998, 338 (7): 436-445. 10.1056 / NEJM199802123380706.
CAS PubMed Google Scholar
- 45.
Баггиолини М., Девальд Б., Мозер Б.: Человеческие хемокины: обновленная информация. Анну Рев Иммунол. 1997, 15: 675-705. 10.1146 / annurev.immunol.15.1.675.
CAS PubMed Google Scholar
- 46.
Танака Ю., Адамс Д.Х., Шоу С.: Протеогликаны на эндотелиальных клетках представляют цитокины, вызывающие адгезию, к лейкоцитам. Иммунол сегодня. 1993, 14 (3): 111-115. 10.1016 / 0167-5699 (93) -4.
CAS PubMed Google Scholar
- 47.
Entschladen F, Lang K, Durchdewald M, Niggemann B, Zaenker KS: Характеристики миграции лейкоцитов. Int J Med Biol Front. 2007, 12 (3/4): 241-256.
Google Scholar
- 48.
МакЭвер Р.П., Чжу Ц .: Уловка для активации интегрина. Nat Immunol. 2007, 8 (10): 1035-1037. 10.1038 / НИ1007-1035.
CAS PubMed Google Scholar
- 49.
Dib K: передача сигналов интегрина BETA 2 в лейкоцитах. Передние биоски. 2000, 5: D438-451. 10.2741 / Патология.
CAS PubMed Google Scholar
- 50.
Fagerholm SC, Hilden TJ, Nurmi SM, Gahmberg CG: специфическое фосфорилирование альфа- и бета-цепей интегрина регулирует активацию LFA-1 через аффинно-зависимые и независимые механизмы.J Cell Biol. 2005, 171 (4): 705-715. 10.1083 / jcb.200504016.
PubMed Central CAS PubMed Google Scholar
- 51.
Лей К., Лауданна С., Цибульский М.И., Нуршар С. Добраться до очага воспаления: обновлен каскад адгезии лейкоцитов. Nat Rev Immunol. 2007, 7 (9): 678-689. 10.1038 / nri2156.
CAS PubMed Google Scholar
- 52.
Кэмпбелл Дж. Дж., О’Коннелл Д. Д., Вурбель Массачусетс: Передний край: Хемокиновый рецептор CCR4 необходим для контролируемого антигеном накопления CD4 Т-клеток в коже в физиологических условиях.J Immunol. 2007, 178 (6): 3358-3362.
PubMed Central CAS PubMed Google Scholar
- 53.
Debes GF, Arnold CN, Young AJ, Krautwald S, Lipp M, Hay JB, Butcher EC: Хемокиновый рецептор CCR7, необходимый для выхода Т-лимфоцитов из периферических тканей. Nat Immunol. 2005, 6 (9): 889-894. 10.1038 / ni1238.
PubMed Central CAS PubMed Google Scholar
- 54.
Broxmeyer HE: хемокины в кроветворении. Curr Opin Hematol. 2008, 15 (1): 49-58.
CAS PubMed Google Scholar
- 55.
Balkwill F: Рак и сеть хемокинов. Нат Рев Рак. 2004, 4 (7): 540-550. 10.1038 / nrc1388.
CAS PubMed Google Scholar
- 56.
Kakinuma T, Hwang ST: хемокины, хемокиновые рецепторы и метастазы рака.J Leukoc Biol. 2006, 79 (4): 639-651. 10.1189 / jlb.1105633.
CAS PubMed Google Scholar
- 57.
Vandercappellen J, Van Damme J, Struyf S: Роль хемокинов CXC и их рецепторов при раке. Cancer Lett. 2008, 267 (2): 226-244. 10.1016 / j.canlet.2008.04.050.
CAS PubMed Google Scholar
- 58.
Cardones AR, Murakami T, Hwang ST: CXCR4 усиливает адгезию опухолевых клеток B16 к эндотелиальным клеткам in vitro и in vivo через бета (1) интегрин.Cancer Res. 2003, 63 (20): 6751-6757.
CAS PubMed Google Scholar
- 59.
Jamieson WL, Shimizu S, D’Ambrosio JA, Meucci O, Fatatis A: CX3CR1 экспрессируется эпителиальными клетками предстательной железы, а андрогены регулируют уровни CX3CL1 / фракталкина в костном мозге: потенциальная роль в раке простаты костей тропизм. Cancer Res. 2008, 68 (6): 1715-1722. 10.1158 / 0008-5472.CAN-07-1315.
PubMed Central CAS PubMed Google Scholar
- 60.
Shulby SA, Dolloff NG, Stearns ME, Meucci O, Fatatis A: Экспрессия CX3CR1-фракталкина регулирует клеточные механизмы, участвующие в адгезии, миграции и выживании клеток рака простаты человека. Cancer Res. 2004, 64 (14): 4693-4698. 10.1158 / 0008-5472.CAN-03-3437.
CAS PubMed Google Scholar
- 61.
Дрелл Т.Л., Джозеф Дж., Ланг К., Ниггеманн Б., Заенкер К.С., Энтшладен Ф .: Влияние нейротрансмиттеров на хемокинез и хемотаксис клеток карциномы молочной железы человека MDA-MB-468.Лечение рака груди Res. 2003, 80 (1): 63-70. 10.1023 / А: 10244
366.CAS PubMed Google Scholar
- 62.
Entschladen F, Palm D, Niggemann B, Zaenker KS: Нервный зуб рака: учитывая перекрестные помехи нейронов внутри опухолей. Semin Cancer Biol. 2008, 18 (3): 171-175. 10.1016 / j.semcancer.2007.12.004.
CAS PubMed Google Scholar
- 63.
Каппер С., Бек Г., Ридель С., Прем К., Хаак М., Вуд ван дер Ф. Дж., Ярд Б. А.: Модуляция продукции хемокинов и экспрессии молекул адгезии в эпителиальных и эндотелиальных клетках почечных канальцев с помощью катехоламинов. Трансплантация. 2002, 74 (2): 253-260. 10.1097 / 00007890-200207270-00017.
CAS PubMed Google Scholar
- 64.
Palm D, Lang K, Niggemann B, Drell TL, Masur K, Zaenker KS, Entschladen F: вызванное норэпинефрином метастазирование клеток рака предстательной железы человека PC-3 у голых мышей BALB / c ингибируется бета-блокаторы.Int J Cancer. 2006, 118 (11): 2744-2749. 10.1002 / ijc.21723.
CAS PubMed Google Scholar
- 65.
Луо Б.Х., Карман К.В., Спрингер Т.А.: Структурные основы регуляции интегрина и передачи сигналов. Анну Рев Иммунол. 2007, 25: 619-647. 10.1146 / annurev.immunol.25.022106.141618.
PubMed Central CAS PubMed Google Scholar
- 66.
Константин Г., Маджид М., Джагулли С., Пиччио Л., Ким Дж. Ю., Бутчер Е.К., Лауданна С. Хемокины вызывают немедленные изменения аффинности и подвижности интегрина бета2: дифференциальная регуляция и роли в остановке лимфоцитов в условиях кровотока.Иммунитет. 2000, 13 (6): 759-769. 10.1016 / S1074-7613 (00) 00074-1.
CAS PubMed Google Scholar
- 67.
Лауданна С., Ким Дж. Ю., Константин Г., Мясник Е: Быстрая активация интегрина лейкоцитов хемокинами. Immunol Rev.2002, 186: 37-46. 10.1034 / j.1600-065X.2002.18604.x.
CAS PubMed Google Scholar
- 68.
Arnaout MA, Mahalingam B, Xiong JP: структура интегрина, аллостерия и двунаправленная передача сигналов.Annu Rev Cell Dev Biol. 2005, 21: 381-410. 10.1146 / annurev.cellbio.21.0
.151217.CAS PubMed Google Scholar
- 69.
Кинаши Т. Внутриклеточная передача сигналов, контролирующая активацию интегрина в лимфоцитах. Nat Rev Immunol. 2005, 5 (7): 546-559. 10.1038 / nri1646.
CAS PubMed Google Scholar
- 70.
Wegener KL, Campbell ID: Трансмембранные и цитоплазматические домены в активации интегрина и белок-белковых взаимодействиях (обзор).Mol Membr Biol. 2008, 25 (5): 376-387. 10.1080 / 09687680802269886.
PubMed Central CAS PubMed Google Scholar
- 71.
Ibbotson GC, Doig C, Kaur J, Gill V, Ostrovsky L, Fairhead T, Kubes P: Функциональный альфа-4-интегрин: недавно идентифицированный путь рекрутирования нейтрофилов у тяжелобольных пациентов с сепсисом. Nat Med. 2001, 7 (4): 465-470. 10.1038 / 86539.
CAS PubMed Google Scholar
- 72.
Цибульский М.И., Гимброне М.А.: Эндотелиальная экспрессия мононуклеарной молекулы адгезии лейкоцитов во время атерогенеза. Наука. 1991, 251 (4995): 788-791. 10.1126 / science.19
.CAS PubMed Google Scholar
- 73.
Cybulsky MI, Iiyama K, Li H, Zhu S, Chen M, Iiyama M, Davis V, Gutierrez-Ramos JC, Connelly PW, Milstone DS: основная роль для VCAM-1, но не для ICAM- 1, при раннем атеросклерозе. J Clin Invest. 2001, 107 (10): 1255-1262.10.1172 / JCI11871.
PubMed Central CAS PubMed Google Scholar
- 74.
Рао Р.М., Ян Л., Гарсия-Кардена Г., Лусцинскас Ф.В.: Эндотелиально-зависимые механизмы рекрутирования лейкоцитов в сосудистую стенку. Circ Res. 2007, 101 (3): 234-247. 10.1161 / CIRCRESAHA.107.151860b.
CAS PubMed Google Scholar
- 75.
Montgomery AM, Becker JC, Siu CH, Lemmon VP, Cheresh DA, Pancook JD, Zhao X, Reisfeld RA: молекула адгезии нервных клеток человека L1 и крысиный гомолог NILE являются лигандами для интегрина альфа v бета 3.J Cell Biol. 1996, 132 (3): 475-485. 10.1083 / jcb.132.3.475.
CAS PubMed Google Scholar
- 76.
Ruppert M, Aigner S, Hubbe M, Yagita H, Altevogt P: Молекула адгезии L1 является клеточным лигандом для VLA-5. J Cell Biol. 1995, 131 (6 Pt 2): 1881-1891. 10.1083 / jcb.131.6.1881.
CAS PubMed Google Scholar
- 77.
Лю Ф.Т., Рабинович Г.А.: Галектины как модуляторы опухолевой прогрессии.Нат Рев Рак. 2005, 5 (1): 29-41. 10.1038 / nrc1527.
CAS PubMed Google Scholar
- 78.
Thijssen VL, Poirier F, Baum LG, Griffioen AW: Галектины в эндотелии опухоли: возможности для комбинированной терапии рака. Кровь. 2007, 110 (8): 2819-2827. 10.1182 / кровь-2007-03-077792.
CAS PubMed Google Scholar
- 79.
Hughes RC: Галектины как модуляторы клеточной адгезии.Биохимия. 2001, 83 (7): 667-676. 10.1016 / S0300-9084 (01) 01289-5.
CAS PubMed Google Scholar
- 80.
Hoyer KK, Pang M, Gui D, Shintaku IP, Kuwabara I, Liu FT, Said JW, Baum LG, Teitell MA: антиапоптотическая роль галектина-3 в диффузных больших B-клеточных лимфомах. Am J Pathol. 2004, 164 (3): 893-902.
PubMed Central CAS PubMed Google Scholar
- 81.
Стиллман Б.Н., Хсу Д.К., Панг М., Брюер К.Ф., Джонсон П., Лю Ф.Т., Баум Л.Г.: Галектин-3 и галектин-1 связывают различные гликопротеиновые рецепторы клеточной поверхности, вызывая гибель Т-клеток. J Immunol. 2006, 176 (2): 778-789.
CAS PubMed Google Scholar
- 82.
Рабинович Г.А., Тоскано М.А., Иларреги Дж. М., Рубинштейн Н.: проливают свет на иммуномодулирующие свойства галектинов: новые регуляторы врожденных и адаптивных иммунных ответов.Glycoconj J. 2004, 19 (7–9): 565-573.
PubMed Google Scholar
- 83.
Клаус Н., Брюль ван ден Ф, Валтрегни Д., Гарнье Ф., Кастроново В. Экспрессия галектина-1 в капиллярных эндотелиальных клетках, ассоциированных с опухолью предстательной железы, повышается клетками карциномы простаты и модулирует гетеротипическую межклеточную адгезию. Ангиогенез. 1999, 3 (4): 317-325. 10.1023 / А: 1026584523789.
CAS PubMed Google Scholar
- 84.
Лотан Р., Беллони П.Н., Тресслер Р.Дж., Лотан Д., Сюй XC, Николсон Г.Л.: Экспрессия галектинов на эндотелиальных клетках микрососудов и их участие в адгезии опухолевых клеток. Glycoconj J. 1994, 11 (5): 462-468. 10.1007 / BF00731282.
CAS PubMed Google Scholar
- 85.
Купер Д., Норлинг Л. В., Перретти М.: Новое понимание ингибирующих эффектов галектина-1 на рекрутирование нейтрофилов в потоке. J Leukoc Biol. 2008, 83 (6): 1459-1466.10.1189 / jlb.1207831.
CAS PubMed Google Scholar
- 86.
La M, Cao TV, Cerchiaro G, Chilton K, Hirabayashi J, Kasai K, Oliani SM, Chernajovsky Y, Perretti M: новая биологическая активность галектина-1: ингибирование взаимодействий лейкоцитов и эндотелиальных клеток в экспериментальное воспаление. Am J Pathol. 2003, 163 (4): 1505-1515.
PubMed Central CAS PubMed Google Scholar
- 87.
Норлинг Л.В., Сампайо А.Л., Купер Д., Перретти М.: Ингибирующий контроль эндотелиального галектина-1 при перемещении лимфоцитов in vitro и in vivo. Фасеб Дж. 2008, 22 (3): 682-690. 10.1096 / fj.07-9268com.
CAS PubMed Google Scholar
- 88.
Рабинович Г.А.: Галектин-1 как потенциальная мишень для рака. Br J Рак. 2005, 92 (7): 1188-1192. 10.1038 / sj.bjc.6602493.
PubMed Central CAS PubMed Google Scholar
- 89.
Ryschich E, Lizdenis P, Ittrich C, Benner A, Stahl S, Hamann A, Schmidt J, Knolle P, Arnold B, Hammerling GJ, Ganss R: Молекулярный фингерпринтинг и аутокринная регуляция роста эндотелиальных клеток на мышиной модели гепатоцеллюлярной карциномы . Cancer Res. 2006, 66 (1): 198-211. 10.1158 / 0008-5472.CAN-05-1636.
CAS PubMed Google Scholar
- 90.
Nieminen J, St-Pierre C, Bhaumik P, Poirier F, Sato S: Роль галектина-3 в привлечении лейкоцитов в мышиной модели легочной инфекции Streptococcus pneumoniae.J Immunol. 2008, 180 (4): 2466-2473.
CAS PubMed Google Scholar
- 91.
Matsumoto R, Matsumoto H, Seki M, Hata M, Asano Y, Kanegasaki S, Stevens RL, Hirashima M: человеческий экалектин, вариант человеческого галектина-9, представляет собой новый хемоаттрактант эозинофилов, продуцируемый Т-лимфоцитами. . J Biol Chem. 1998, 273 (27): 16976-16984. 10.1074 / jbc.273.27.16976.
CAS PubMed Google Scholar
- 92.
Zhu C, Anderson AC, Schubart A, Xiong H, Imitola J, Khoury SJ, Zheng XX, Strom TB, Kuchroo VK: Галектин-9, лиганд Tim-3, негативно регулирует иммунитет Т-хелперов 1 типа. Nat Immunol. 2005, 6 (12): 1245-1252. 10.1038 / ni1271.
CAS PubMed Google Scholar
- 93.
Гарофало А., Чириви Р., Фоглиени С., Пиготт Р., Мортарини Р., Мартин-Падура I, Аничини А., Геринг А. Дж., Санчес-Мадрид Ф, Дежана Е. Вовлечение очень позднего интегрина антигена 4 в меланому в экспериментальных метастазах, усиленных интерлейкином 1.Cancer Res. 1995, 55 (2): 414-419.
CAS PubMed Google Scholar
- 94.
Окахара Х., Ягита Х., Мияке К., Окумура К. Вовлечение антигена очень поздней активации 4 (VLA-4) и молекулы адгезии сосудистых клеток 1 (VCAM-1) в усиление фактора некроза опухоли альфа экспериментальных метастазов . Cancer Res. 1994, 54 (12): 3233-3236.
CAS PubMed Google Scholar
- 95.
Voura EB, Ramjeesingh RA, Montgomery AM, Siu CH: участие интегрина альфа (v) бета (3) и молекулы клеточной адгезии L1 в трансэндотелиальной миграции клеток меланомы. Mol Biol Cell. 2001, 12 (9): 2699-2710.
PubMed Central CAS PubMed Google Scholar
- 96.
Nangia-Makker P, Sarvis R, Visscher DW, Bailey-Penrod J, Raz A, Sarkar FH: ретротранспозоны галектина-3 и L1 в карциномах груди человека. Лечение рака груди Res.1998, 49 (2): 171-183. 10.1023 / А: 1005913810250.
CAS PubMed Google Scholar
- 97.
Глинский В.В., Глинский Г.В., Риттенхаус-Олсон К., Хуфлейт М.Е., Глинский О.В., Дойчер С.Л., Куинн Т.П.: Роль антигена Томсена-Фриденрейха в адгезии клеток рака груди и простаты человека к эндотелию. Cancer Res. 2001, 61 (12): 4851-4857.
CAS PubMed Google Scholar
- 98.
Глинский В.В., Хуфлейт М.Э., Глинский Г.В., Дойчер С.Л., Куинн Т.П.: Влияние антиген-специфического пептида Р-30 Томсена-Фриденрейха на бета-галактозид-опосредованную гомотипическую агрегацию и адгезию к эндотелию карциномы молочной железы человека MDA-MB-435 клетки. Cancer Res. 2000, 60 (10): 2584-2588.
CAS PubMed Google Scholar
- 99.
Халдояниди С.К., Глинский В.В., Сикора Л., Глинский А.Б., Моссин В.В., Куинн Т.П., Глинский Г.В., Шрирамарао П.: Гомо- и гетеротипическая адгезия клеток карциномы груди человека MDA-MB-435 в условиях потока опосредуется в частично за счет взаимодействий Thomsen-Friedenreich антиген-галектин-3.J Biol Chem. 2003, 278 (6): 4127-4134. 10.1074 / jbc.M2095
.
CAS PubMed Google Scholar
- 100.
Fonseca I, Costa Rosa J, Felix A, Therkildsen MH, Mandel U, Soares J: простые углеводные антигены муцинового типа (T, Tn и сиалозил-Tn) при мукоэпидермоидной карциноме слюнных желез. Гистопатология. 1994, 25 (6): 537-543. 10.1111 / j.1365-2559.1994.tb01372.x.
CAS PubMed Google Scholar
- 101.
Springer GF, Desai PR, Ghazizadeh M, Tegtmeyer H: T / Tn аутоантигены панкарциномы: фундаментальные, диагностические и прогностические аспекты. Обнаружение рака Пред. 1995, 19 (2): 173-182.
CAS PubMed Google Scholar
- 102.
Ю. Л., Эндрюс Н., Чжао К., Маккин Д., Уильямс Дж. Ф., Коннор Л. Дж., Герасименко О. В., Хилкенс Дж., Хирабаяши Дж., Касаи К., Родс Дж. М.: Взаимодействие галектина-3 с дисахаридом Томсена-Фриденрейха при раке -ассоциированный MUC1 вызывает повышенную адгезию эндотелия раковых клеток.J Biol Chem. 2007, 282 (1): 773-781. 10.1074 / jbc.M606862200.
CAS PubMed Google Scholar
- 103.
Ю. Л. Онкофетальный углеводный антиген Томсена-Фриденрейха в прогрессировании рака. Glycoconj J. 2007, 24 (8): 411-420. 10.1007 / s10719-007-9034-3.
CAS PubMed Google Scholar
- 104.
Сарафян В., Жадот М., Фойдарт Дж. М., Летессон Дж., Брюле Ван ден Ф, Кастроново В., Ваттио Р., Конинк С. В.: Экспрессия лампы-1 и лампы-2 и их взаимодействия с галектином-3 у человека. опухолевые клетки.Int J Cancer. 1998, 75 (1): 105-111. 10.1002 / (SICI) 1097-0215 (19980105) 75: 1 <105 :: AID-IJC16> 3.0.CO; 2-F.
CAS PubMed Google Scholar
- 105.
Петри Б., Биксель М.Г.: Молекулярные события во время диапедеза лейкоцитов. Фебс Дж. 2006, 273 (19): 4399-4407. 10.1111 / j.1742-4658.2006.05439.x.
CAS PubMed Google Scholar
- 106.
Muller WA: Роль PECAM-1 (CD31) в эмиграции лейкоцитов: исследования in vitro и in vivo.J Leukoc Biol. 1995, 57 (4): 523-528.
CAS PubMed Google Scholar
- 107.
Muller WA, Weigl SA, Deng X, Phillips DM: PECAM-1 необходим для трансэндотелиальной миграции лейкоцитов. J Exp Med. 1993, 178 (2): 449-460. 10.1084 / jem.178.2.449.
CAS PubMed Google Scholar
- 108.
Berman ME, Xie Y, Muller WA: Роль молекулы-1 адгезии тромбоцитов / эндотелиальных клеток (PECAM-1, CD31) в трансэндотелиальной миграции естественных клеток-киллеров и активации интегрина бета 2.J Immunol. 1996, 156 (4): 1515-1524.
CAS PubMed Google Scholar
- 109.
Bird IN, Spragg JH, Ager A, Matthews N: Исследования трансэндотелиальной миграции лимфоцитов: анализ фенотипов мигрировавших клеток в отношении CD31 (PECAM-1), CD45RA и CD45RO. Иммунология. 1993, 80 (4): 553-560.
PubMed Central CAS PubMed Google Scholar
- 110.
Вествебер D: Адгезионные и сигнальные молекулы, контролирующие трансмиграцию лейкоцитов через эндотелий. Immunol Rev.2007, 218: 178-196. 10.1111 / j.1600-065X.2007.00533.x.
CAS PubMed Google Scholar
- 111.
Lou O, Alcaide P, Luscinskas FW, Muller WA: CD99 является ключевым медиатором трансэндотелиальной миграции нейтрофилов. J Immunol. 2007, 178 (2): 1136-1143.
CAS PubMed Google Scholar
- 112.
Bixel MG, Petri B, Khandoga AG, Khandoga A, Wolburg-Buchholz K, Wolburg H, Marz S, Krombach F, Vestweber D: CD99-родственный антиген на эндотелиальных клетках опосредует экстравазацию нейтрофилов, но не лимфоцитов in vivo. Кровь. 2007, 109 (12): 5327-5336. 10.1182 / кровь-2006-08-043109.
CAS PubMed Google Scholar
- 113.
Schenkel AR, Mamdouh Z, Chen X, Liebman RM, Muller WA: CD99 играет важную роль в миграции моноцитов через эндотелиальные соединения.Nat Immunol. 2002, 3 (2): 143-150. 10.1038 / ni749.
CAS PubMed Google Scholar
- 114.
Ebnet K, Suzuki A, Ohno S, Vestweber D: Соединительные молекулы адгезии (JAM): больше молекул с двойными функциями ?. J Cell Sci. 2004, 117 (Pt 1): 19-29. 10.1242 / jcs.00930.
CAS PubMed Google Scholar
- 115.
Martin-Padura I, Lostaglio S, Schneemann M, Williams L, Romano M, Fruscella P, Panzeri C, Stoppacciaro A, Ruco L, Villa A, Simmons D, Dejana E: Соединительная молекула адгезии, роман член суперсемейства иммуноглобулинов, который распределяется по межклеточным соединениям и модулирует трансмиграцию моноцитов.J Cell Biol. 1998, 142 (1): 117-127. 10.1083 / jcb.142.1.117.
PubMed Central CAS PubMed Google Scholar
- 116.
Ostermann G, Weber KS, Zernecke A, Schroder A, Weber C: JAM-1 является лигандом бета (2) интегрина LFA-1, участвующего в трансэндотелиальной миграции лейкоцитов. Nat Immunol. 2002, 3 (2): 151-158. 10.1038 / ni755.
CAS PubMed Google Scholar
- 117.
Engelhardt B, Wolburg H: Мини-обзор: Трансэндотелиальная миграция лейкоцитов: через входную дверь или по сторонам дома ?. Eur J Immunol. 2004, 34 (11): 2955-2963. 10.1002 / eji.200425327.
CAS PubMed Google Scholar
- 118.
Arrate MP, Rodriguez JM, Tran TM, Brock TA, Cunningham SA: Клонирование соединительной адгезионной молекулы 3 человека (JAM3) и ее идентификация в качестве контррецептора JAM2. J Biol Chem.2001, 276 (49): 45826-45832. 10.1074 / jbc.M105972200.
CAS PubMed Google Scholar
- 119.
Leppert D, Waubant E, Galardy R, Bunnett NW, Hauser SL: Т-клеточные желатиназы опосредуют трансмиграцию через базальную мембрану in vitro. J Immunol. 1995, 154 (9): 4379-4389.
CAS PubMed Google Scholar
- 120.
Фридл П., Вейгелин В: Миграция интерстициальных лейкоцитов и иммунная функция.Nat Immunol. 2008, 9 (9): 960-969. 10.1038 / ni.f.212.
CAS PubMed Google Scholar
- 121.
Аль-Мехди А.Б., Тозава К., Фишер А.Б., Шиентаг Л., Ли А., Мушел Р.Дж .: Внутрисосудистое происхождение метастазов от пролиферации прикрепленных к эндотелию опухолевых клеток: новая модель метастазов. Nat Med. 2000, 6 (1): 100-102. 10.1038 / 71429.
CAS PubMed Google Scholar
- 122.
Heyder C, Gloria-Maercker E, Entschladen F, Hatzmann W, Niggemann B, Zanker KS, Dittmar T: визуализация в реальном времени взаимодействий опухолевых клеток / эндотелиальных клеток во время трансмиграции через эндотелиальный барьер. J Cancer Res Clin Oncol. 2002, 128 (10): 533-538. 10.1007 / s00432-002-0377-7.
CAS PubMed Google Scholar
- 123.
Brandt B, Heyder C, Gloria-Maercker E, Hatzmann W, Rotger A, Kemming D, Zanker KS, Entschladen F, Dittmar T: 3D-модель экстравазации — отбор высокоподвижных и метастатических раковых клеток.Semin Cancer Biol. 2005, 15 (5): 387-395. 10.1016 / j.semcancer.2005.06.006.
PubMed Google Scholar
- Нейтрофилы — основное действие против бактериальных и грибковых инфекций.
- Моноциты — основное действие против бактериальных инфекций .
- Эозинофилы — основное действие против паразитарных инфекций.
- Базофилы — отвечают за реакцию на аллергенов.
- Лимфоциты — основное действие против вирусных инфекций.
- Естественные клетки-киллеры
- Т-клетки
- В-клетки
Лейкоциты — лейкоциты — лимфоциты
Лейкоциты, также известные как лейкоциты, представляют собой иммунные клетки, которые циркулируют в крови и лимфатической системе.
Существует 5 основных типов:
Нейтрофилы, эозинофилы и базофилы — это гранулоцитов , поскольку они имеют цитоплазматические гранулы, которые могут переваривать микроорганизмы.
Лимфоциты и моноциты — это агранулоцитов , поскольку в их цитоплазме отсутствуют гранулы.
В этой статье дается общий обзор пяти основных типов лейкоцитов. Более подробная информация доступна в отдельных статьях.
НейтрофилыНейтрофилы представляют собой гранулярных лейкоцитов и развиваются из миелоидных клеток линии в костном мозге. Это самый распространенный тип лейкоцитов, составляющий 40-70% от лейкоцитов периферической крови.Нейтрофилы в первую очередь участвуют в иммунном ответе против бактериальных инфекций, и их присутствие в тканях связано с острым воспалением.
Они имеют диаметр 9–16 мкм и имеют мульти — лопастное ядро . Их цитоплазма содержит гранулы с разрушающимися ферментами, которые высвобождаются во время фагоцитоза. У них короткая продолжительность жизни — 2-3 дня, и они одними из первых реагируют на вторжение микробов.
Рис. 1. Фильм крови, показывающий нейтрофилы с многодольчатыми ядрами [/ caption]Нейтрофилы являются частью врожденной иммунной системы и первыми достигают места заражения.В ответ на повреждение или патогены ткани производят хемокины, которые привлекают нейтрофилы в процессе, называемом хемотаксисом, позволяя нейтрофилам оттачиваться в месте инфекции.
Здесь нейтрофилы фагоцитируют микроорганизмы и впоследствии переваривают их, высвобождая гранулы в фагосому. Нейтрофилы также могут выделять вещества для привлечения моноцитов, которые, попадая в ткань, дифференцируются в макрофаги.
Бактериальные инфекции, стресс, рак (например, лейкемия) и травмы могут вызывать высокое количество нейтрофилов .
Химиотерапия, апластическая анемия, дефицит витамина B12 и рак (например, миелодисплазия) могут вызывать снижение числа нейтрофилов на .
Примечание: некоторые лаборатории могут указывать количество нейтрофилов как PMN (полиморфноядерные нейтрофилы).
Дополнительную информацию о нейтрофилах и их функции можно найти в наших статьях о фагоцитах, фагоцитозе и остром воспалении.
МоноцитыМоноциты принадлежат к линии миелоидных клеток костного мозга.Они в первую очередь участвуют в иммунном ответе против бактериальной инфекции и составляют примерно 5-10% всех циркулирующих лейкоцитов. У них есть бобовидное ядро.
Рис. 2. Срез мазка крови, показывающий моноцит с ядром в форме фасоли [/ caption]Моноциты — это циркулирующих лейкоцитов , которые обычно остаются в крови около 8 часов, прежде чем мигрировать в ткань, где они дифференцируются в макрофаги.
Макрофаги затем образуют основную популяцию фагоцитарных клеток в тканях и имеют гораздо более длительную продолжительность жизни, чем нейтрофилы, — месяцы или даже годы. В некоторых тканях резидентные макрофаги имеют определенные названия, например Клетки Купфера в печени и остеокласты в кости. Они намного крупнее нейтрофилов, имеют диаметр 25-50 мкм и имеют однодолевое круглое ядро.
Макрофаги затем фагоцитируют микроорганизмов и переваривают их, высвобождая гранулы в фагосому.Они также секретируют цитокины, которые модулируют иммунный ответ.
В определенных ситуациях моноциты также могут дифференцироваться в дендритные клетки. Они образуют важное звено между врожденной и адаптивной иммунными системами. Они помогают в активации Т-клеток во время адаптивного иммунного ответа и являются единственным типом клеток, который может активировать наивные Т-клетки.
Дополнительную информацию о моноцитах и их функциях можно найти в наших статьях о фагоцитах и фагоцитозе.
ЭозинофилыЭозинофилы, названные так потому, что они гистологически окрашиваются эозином , представляют собой гранулярные лейкоциты из линии миелоидных клеток в костном мозге.Они составляют 1-3% циркулирующих лейкоцитов. Эозинофилы обычно проводят в периферической крови около часа и в основном присутствуют в тканях.
Они имеют диаметр 12-17 мкм и двудольчатое ядро колбасной формы.
Рис. 3. Пленка крови, показывающая эозинофилы, обратите внимание на высокое поглощение пигмента эозина цитоплазмой [/ caption]Их гранулы содержат такие молекулы, как основной основной белок (MBP), катионный белок и пероксидаза. Эти молекулы токсичны для паразитов.Они также фагоцитируют комплексы антиген-антитело.
У пациентов с паразитарными инфекциями, аллергическими реакциями или некоторыми аутоиммунными заболеваниями (см. Ниже) обычно наблюдается высокое количество эозинофилов.
БазофилыБазофилы — это гранулярных лейкоцитов миелоидного происхождения. Они имеют диаметр 14-16 мкм и двудольчатое S-образное ядро. Базофилы циркулируют в периферической крови и живут примерно 2 недели.
По функциям и внешнему виду они очень похожи на тучные клетки, находящиеся в тканях.
Базофилы содержат гранул гистамина и вызывают местные воспалительные реакции за счет взаимодействия с IgE. Их роль в иммунной системе плохо изучена, но они потенциально опосредуют реакции гиперчувствительности I типа наряду с тучными клетками. Примеры включают астму и анафилаксию.
Пациенты с аллергическими реакциями обычно имеют высокое количество базофилов .
Рис. 4. Срез мазка крови, показывающий базофилы [/ caption] ЛимфоцитыЛимфоциты — это агранулярных лейкоцитов, которые образуются из линии лимфоидных клеток в костном мозге.Они реагируют на вирусных инфекций и представляют собой самые маленькие лейкоциты, диаметром 6-15 мкм. Лимфоциты имеют округлые, плотно окрашенные ядра с разреженной цитоплазмой.
Они циркулируют между тканями, периферической кровью и лимфатической системой. Их продолжительность жизни также варьируется в зависимости от подтипа, на который они дифференцируются.
Есть три основных типа лимфоцитов:
Естественные клетки-киллеры
NK-клетки обеспечивают неспецифический иммунитет против клеток, отображающих чужеродные белки, таких как раковых клеток и вирусных инфицированных клеток.Они составляют менее 5% циркулирующих лейкоцитов.
Хотя они более эффективно действуют вместе с Т-хелперами, они могут независимо обнаруживать и уничтожать патогены как часть врожденной иммунной системы.
NK-клетки могут обнаруживать аномальные клетки и в ответ выделять перфорины. Перфорины — это цитолитические белки, которые встраиваются в плазматическую мембрану. Это создает каналы, которые позволяют внеклеточной жидкости проникать в клетки, вызывая их разрыв (лизис).
Т-клетки
Т-клетки образуются в костном мозге, но созревают в – гимусе.Они являются частью адаптивной иммунной системы и участвуют в клеточном иммунитете.
Активизировавшись, цитотоксические Т-клетки могут напрямую атаковать инфицированные клетки. Кроме того, вспомогательные Т-клетки выполняют множество функций, включая активацию В-клеток и формирование Т-клеток памяти, которые реагируют на повторное заражение.
Дополнительную информацию можно найти в наших статьях о Т-клетках и Т-клеточной памяти.
B-клетки
В-клетки образуются и созревают в одном костном мозге b . Они являются частью адаптивной иммунной системы и участвуют в гуморальном иммунитете, секретируя антитела.После активации В-клетки созревают в плазматических клеток , которые секретируют антитела, и В-клеток памяти .
Дополнительную информацию о B-клетках можно найти здесь.
[старт-клиника]
Клиническая значимость — эозинофильный эзофагит
Эозинофильный эзофагит (ЭО) — хроническое воспалительное заболевание иммунной системы. Эозинофилы проникают в эпителиальную выстилку пищевода и опосредуют аллергическую реакцию на проглоченную пищу. Повышенное количество эозинофилов и активация иммунной системы затем приводят к воспалению и повреждению тканей.ЭО вызывает симптомы, сходные с симптомами гастроэзофагеальной рефлюксной болезни (GORD) , но обычно не реагирует на ингибиторы протонной помпы.
Пациенты обычно обращаются с болями в эпигастрии, дисфагией и обструкцией пищевого болюса. У них также обычно в анамнезе есть аллергические заболевания, такие как астма, риноконъюнктивит и синдром оральной аллергии.
Диагноз ставится по выявлению эозинофильной инфильтрации при биопсии.
Основа лечения — стероидов местного действия. Пациенты пользуются стероидными ингаляторами. Однако дозу распыляют в рот и проглатывают в сухом виде, а не вдыхают.
Рис. 6. Биопсия ткани пациента с эозинофильным эзофагитом, показывающая инфильтраты, содержащие эозинофилы [/ caption][окончание клинической]
.

 9/л
9/л
 9/л
9/л
 9/л
9/л
 9/л.
9/л. Увеличение количества лейкоцитов в периферической крови выше референсных значений называют лейкоцитозом, снижение — лейкопенией.
Увеличение количества лейкоцитов в периферической крови выше референсных значений называют лейкоцитозом, снижение — лейкопенией.
 таблицу) нужно
сравнить с порогом. Показатели делятся на 2 категории: для которых балл начисляется за
превышение порога (АЧТВ, СРБ, Д-димер, глюкоза, мочевина и общие лейкоциты) и те, у
которых балл начисляется за уменьшение ниже порога (гемоглобин, лимфоциты, общий белок).
Далее начисленные баллы суммируются.
таблицу) нужно
сравнить с порогом. Показатели делятся на 2 категории: для которых балл начисляется за
превышение порога (АЧТВ, СРБ, Д-димер, глюкоза, мочевина и общие лейкоциты) и те, у
которых балл начисляется за уменьшение ниже порога (гемоглобин, лимфоциты, общий белок).
Далее начисленные баллы суммируются. 8, общий белок: 60, мочевина 10, общие лейкоциты: 15.
8, общий белок: 60, мочевина 10, общие лейкоциты: 15.
 При хроническом П. вне обострения – реакция может быть щелочной.
При хроническом П. вне обострения – реакция может быть щелочной. Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет.
Чаще всего поражает дыхательную системы, однако может распространяться и в другие ткани и органы. Наиболее распространенный путь передачи — воздушно-капельный. Для того чтобы развилась активная форма болезни, необходимы благоприятные условия, например, сниженный иммунитет.  TB;
TB;

