Признаки Глиоза Головного Мозга (на МРТ)
Полноценное функционирование рефлекторной деятельности человека во многом обусловлено работой нервной системы.
Если нервная система поражена, то организм человека дает сбой – нарушаются все его основные функции: частота и ритм работы сердца, дыхание, координация движений и навыки ходьбы, а также питание.
Если нарушения происходят в мозге, то у человека могут быть утрачены все основные жизненные навыки касательно речи, написания и чтения.
Несмотря на то, что глиоз мозгового вещества не является заболеванием, но данный аномальный процесс способствует возникновению серьезных нарушений в привычной жизни человека.
Глиоз белого вещества мозга – что это?
Данный процесс представляет собой достаточно тяжелое морфофизическое нарушение патологического характера, которое протекает в тканях головного мозга под воздействием определенных экологических факторов, которые носят травмирующий характер.
Этот процесс сопровождается значительным разрастанием рубца, образованного на травмированном участке, на котором погибли нейроны.
Данный рубец в медицине называют нейроглией.
Под этим термином понимают дополнительное тканевое вещество головного мозга, который составляет порядка 30% от общей массы ткани мозга. Основной функцией нейроглии выступает обеспечение защиты мозгового вещества от воздействия патогенных микроорганизмов и различных повреждений. Также нейроглия вырабатывает полезные вещества и принимает участие в обменных процессах.
При получении травмы или инфекционном поражении мозговых клеток объем нейроглии увеличивается. На поврежденном участке мертвых нейронов обычно образуется рубцовая ткань.
Однако нейроглия исключает ее формирование, поскольку сама становится своеобразным биопроводником.
Главная проблема заключается в том, что нейроглия не способна функционировать наподобие естественной нервной ткани.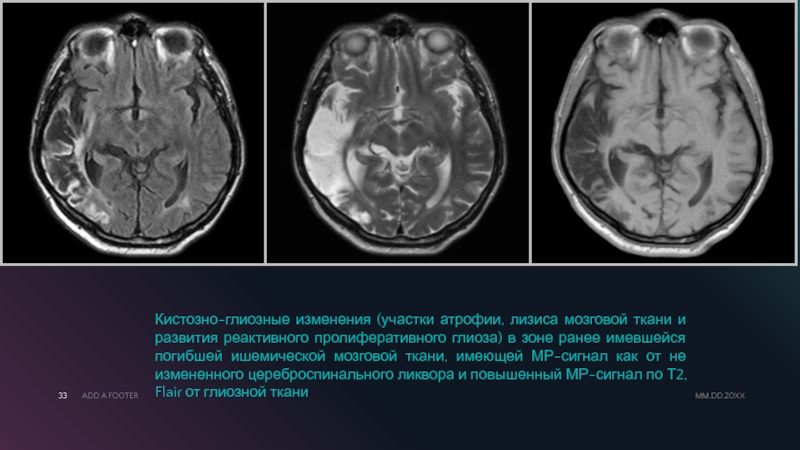 Это в свою очередь вызывает серьезные проблемы со здоровьем.
Это в свою очередь вызывает серьезные проблемы со здоровьем.
Очень четко видны очаги глиоза на МРТ головного мозга.
При повреждениях мозговых тканей наблюдаются следующие симптомы:
- Усталость, которая носит хронический характер. Человек испытывает беспричинные приступы переутомления, даже находясь в состоянии покоя.
- Продолжительные и неутихающие головные боли, которые могут сопровождаться головокружением, тошнотой, боязнью света, рвотой.
- Резкие скачки артериального давления, включая состояния артериальной гипертензии разной степени сложности.
- Эпилептические припадки и судороги. Если присутствует большой очаг поражения, то также могут наблюдаться неврологические симптомы.
- Нарушение координации движения, связанные с расстройствами мозжечка, что приводит к получению травм разной степени тяжести.
- Сбои в работе кратковременной и долговременной памяти.
- Возникновение звуковых и обонятельных галлюцинаций.

- Отсутствие способности ясно излагать свои мысли вслух и в письменной форме, что обусловлено образованием в мозге очага в области, отвечающей за формирование устной и письменной речи.
- Резкие перепады настроения, которые могут сопровождаться повышенной агрессией, депрессивными состояниями, абсолютной апатией ко всему.
Виды заболевания
Поскольку вследствие давления развивающейся нейроглии, некротические клетки постепенно погибают и отмирают.
На фоне этого появляются небольшие участки глиоза разного размера и формы, которые могут располагаться в любой области головного мозга.
Патологический процесс классифицируют по 7 формам:
- Внутрижелудочковая – очаги поражения образуются внутри желудочков мозга, что способствует существенному сокращению их объема, а также объема спинномозговой жидкости.
- Формирование островков поражения, которые образуются вокруг атеросклеротических сосудов, которые под давлением сильно сдавливаются.

- Краевая – предполагает образование единичных очагов поражения, которые концентрируются снаружи тканей мозга (данный тип нейроглии является наиболее простым, поскольку не затрагивает центральную область).
- Волокнистая – глиозные очаги могут заполняются волокнами, которые могут иметь различную длину и размеры.
- Массивная нейроглия – множественные очаги образуются на разных участках мозговой ткани (при сканировании изображение отображается в виде крупного пятнистого поля).
- Внутриоболочечная – измененные области находятся под внутренними оболочками мозга, что значительно усложняет диагностику заболевания.
- Анизоморфная – измененные очаги располагаются хаотично.
Очаги глиоза
В зависимости от того, как очаговые изменения отображаются на пленке при проведении МРТ головного мозга глиоз, их подразделяют на следующие группы:
- Гиподенсные – встречаются достаточно редко, не имеют определенной структуры и крайне сложно поддаются окрашиванию;
- Гиперинтенсивные – характеризуются ярко выраженной структурой, легко окрашиваются в процессе обследования.

В зависимости от числа патологических зон очаги нейроглии также разделяют на:
- единичные – при проведении МРТ головного мозга единичные очаги глиоза очень хорошо видны;
- множественные – также хорошо отображаются при проведении обследования.
Единичные образования
Подобные образования встречаются чаще у разных возрастных групп.
На МРТ головного мозга выявить очаги глиоза можно как у младенцев, так и у пожилых пациентов.
В первом случае формирование измененных очагов может быть связано с последствиями послеродовой травмы, во втором – быть результатом дегенерации тканей мозга вследствие возрастных изменений.
Данный процесс представляет собой естественные возрастные изменения, которые в 60% случаев отображаются при сканировании белого вещества у лиц старше 85 лет.
Как правило, подобные поражения выявляются случайно, поскольку они не приносят дискомфорта. Однако при образовании очагов в левой лобной доле, они нередко провоцируют появление галлюцинаций.
Главной особенностью такого поражения выступает то, что оно не предрасположено к разрастанию и несет существенного риска при развитии и обострении хронических болезней.
Множественные очаги
Такие поражения встречаются намного реже по сравнению с единичным глиозом головного мозга. Данная патология может развиться на фоне различных заболеваний кровеносных сосудов, ЦНС (в частности, белого вещества), а также соединительных тканей.
Обычно причиной подобных поражений выступают атеросклерозы, а также перенесенные инсульты и инфаркты. Также множественные очаги поражений могут возникать вследствие получения черепно-мозговой травмы.
Важно отметить, что при травматизме головного мозга протекает процесс некроза, причем – на разных участках и в разных областях. В результате этого глиозному перерождению намного лучше подвергаются именно субкортикальные очаги отмирания тканей.
При получении незначительных травм головы величина поражений составляет не более нескольких миллиметров. Благодаря этому функции мышления человека остаются практически неизменными.
Если у пациента присутствуют даже мельчайшие структурные изменения, их легко можно выявить с помощью КТ или МРТ обследования.
Признаки глиоза на МРТ головного мозга диагностика, профилактика и лечение.
В ходе МРТ головного мозга врачи могут выявить такое заболевание, как глиоз. О том, что же это такое, каковы признаки глиоза на томографии и как с этим жить, мы поговорим в этой статье. Глиоз головного мозга представляет собой вторичное заболевание, появляющееся по причине возникновения определенных расстройств на клеточном уровне ЦНС. Болезнь носит хронический характер. Максимальным положительным эффектом лечения можно считать стабилизацию состояния без дальнейшего прогрессирования.
КОНСУЛЬТАЦИЯ О ДИАГНОСТИКЕ
Если сомневаетесь, запишитесь на бесплатную консультацию.
Или проконсультируйтесь по телефону
+7 (812) 209-00-79
Клиническая картина появления глиоза Человеческий мозг состоит из следующих клеточных образований: эпендимальный слой, нейроны (нейроцит, нерв и его волокно, неврон), нейроглиальные клетки. Главными веществами головного мозга являются нейроны, распространяющие импульсы по всей нервной системе. Нейронные процессы, включая гибель этих клеток, протекают малозаметно для человека. Достаточно важную функцию выполняют и нейроглии, отвечающие за метаболические процессы, выполнение секреторной, трофической функции. Здоровый мозг содержит глиальные клетки в большом количестве (около 40% от общей мозга) при сохранении всех нейронов. Они защищают мозг от возможных травм, клеточных повреждений и инфекций. Если же по причине заболевания или травмы происходит отмирание нейронов, их место занимают глии.

Ограниченные участки головного мозга, где произошло поражение нейронов, именуются очагами. Это своеобразные пустоты заполняются глиозными образованиями. Развитие болезней клеточного генеза приводит к увеличению массы глии относительной общего количества мозговой ткани. Проблема эта достаточно серьезная, но до определенной стадии человек и врачи вообще могут не замечать появления очагов. Если же имеет место повышение содержания глиозных тканей в головном мозге, можно говорить о прогрессирующем характере болезни. Клинические тесты, направленные на изучение истинных причин развития глиозных нарушений, проводятся медиками регулярно. Есть мнение, что глиоз — это некое состояние мозговых тканей, возникающее под действием множества факторов, носящих чисто наследственный характер. Последние исследования в этой области выявили некоторую зависимость образования участков поражения от возраста больного. Единичные очаги глиоза могут формироваться в любом возрасте, но преимущественно данные процессы происходят у пожилых людей, поэтому выдвинуто предположение, что глиоз — это естественный дегенеративный процесс, говорящий о старении мозговых клеток. Однако полностью патогенез этого явление не изучен.
Есть мнение, что глиоз — это некое состояние мозговых тканей, возникающее под действием множества факторов, носящих чисто наследственный характер. Последние исследования в этой области выявили некоторую зависимость образования участков поражения от возраста больного. Единичные очаги глиоза могут формироваться в любом возрасте, но преимущественно данные процессы происходят у пожилых людей, поэтому выдвинуто предположение, что глиоз — это естественный дегенеративный процесс, говорящий о старении мозговых клеток. Однако полностью патогенез этого явление не изучен.
Разновидности глиоза Классификация глиозной ткани осуществляется с учетом концентрации участков поражения и формы очагов патологии. Выделяют следующие формы глиозов головного мозга:
- Аморфный тип. Отличается беспорядочным разрастанием очагов глиоза в головном мозге с преобладанием клеточной структуры.
- Волокнистый тип. Образование имеет, преимущественно, волокнистую структуру.

- Периваскулярный глиоз. Характеризуется концентрацией глий вокруг склерозированных кровеносных сосудов. Одной из причин глиоза сосудистого можно назвать демиелинизирующие заболевания, например — рассеянный склероз.
- Диффузный тип. Охарактеризован отсутствием очагов поражения. Возникает у пациента в головном, либо спинном мозге. Причина — диффузные поражения нервной системы, например, ишемическая болезнь.
- Субэпендимальный вид. Характеризуется сосредоточением очагов глиоза в субэпендемии.
- Краевой глиоз. Характеризуется концентрацией очагов поражения сразу под оболочкой.
- Очаговый вид. Области повреждения нервных тканей четко очерчены. Возникает по причине протекания воспалительного заболевания, приведшего к отмиранию нейронов.
Важным параметром глиальных образований является размер. Чем больше область разрастания образования, чем менее четко она локализована, тем сильнее возможны поражения нервной системы.

Симптомы глиоза Глиоз головного мозга сопровождается проявлением различных симптомов, поскольку он может быть локализован в различных долях мозгового вещества. В их число входит головные боли, гипертония, нарушенная координация, дезориентация в пространстве, уменьшение остроты зрения, слуха, потеря памяти, человеку тяжело концентрировать внимание. Множественные очаги глиоза приводят к распространению следующих симптомов:
- снижение уровня зрения и слуха;
- проблемы с вниманием на фоне первичной потери памяти;
- нарушения психического поведения;
- перепады артериального давления;
- проблемы с речью и координацией;
- бывает возникает временный паралич.
 Поставить правильный диагноз поможет только процедура МРТ головного мозга.
Поставить правильный диагноз поможет только процедура МРТ головного мозга.
Симптомы глиоза у новорожденных Глиоз головного мозга может носить врожденный характер. У новорожденных малышей он проявляется немного иначе, чем у взрослых. Нервные ткани гибнут по причине врожденных заболеваний центральной нервной системы. Затем на их месте появляются глии. Данное заболевание проявляется следующими симптомами:
- снижение активности головного мозга;
- заторможенность и неспособность младенца фокусироваться и концентрировать внимание;
- признаки гидроцефалии;
- слабый тонус конечностей.
Причины глиоза
Проблема отмирания нервных клеток и последующий глиоз белого вещества может возникать вследствие различных болезней:- демилиезация и рассеянный склероз;
- нарушенный жировой обмен;
- воспалительные заболевания оболочки мозга, включая менингит, энцефалит и туберкулез;
- последствия ЧМТ, отечное состояние мозга;
- ОНМК, инсульт, ишемия;
- частые гипогликемии;
- наследственные факторы;
- дефицит железа в крови.

Роль наследственности при глиозе Сейчас врачи медицинских центров СПб глиоз головного мозга могут предвидеть на генном уровне, поскольку он появляется под влиянием мутирующего гена, отвечающего за синтез гексозоаминидаза. Это фермент, обеспечивающий выработку ганглиозидов, а они уже провоцируют дисфункцию нервных тканей. При условии, что мутирующий ген присутствует и у отца, и у матери, риск возникновения у общего ребенка глиоза головного мозга составляет 25%. Имея такой риск, родителям необходимо получить консультацию генетика при планировании беременности. Также при наличии глиоза головного мозга у одного из детей значительно повышается вероятность проявления заболевания и у следующих общих детей пары. В данном случае достоверные прогнозы развития патологий может дать только квалифицированный врач.
Диагностика глиоза на МРТ Выявляется глиоз на МРТ головного мозга. Магнитно-резонансная томография проводится с использованием специального устройства – томографа. Обследуемый помещается в открытую или закрытую камеру аппарата, где под действием магнитных волн исследуется состояние долей мозга и сосудистого русла. На полученных МРТ снимках врачи четко увидят даже самы маленькие очаги поражения, источник возникновения глиальных клеток, степень распространенности патологии, смогут оценить нарушения в системе сосудов. Помимо МРТ могут проводиться некоторые клинические анализы: анализ крови на содержание железа, генетический анализ крови родителей.
Однако информативность их имеет вторичный характер. Скорее они направлены не на выявление глиоза, а на контроль лечения основной болезни, ставшей толчком его развития. Основным методом диагностики, дающим обширную картину состояния головного мозга, все же является МРТ головы. Для детей, помимо МРТ, допускается проведение нейросонографии, также отображающей обширную картину мест скопления клеток глий, а для младенцев до года результативным также является УЗИ. МРТ показывает следующие клинические проявления глиоза головного мозга:
- геометрию и количество локальных скоплений клеток, замещающих нервную ткань;
- степень поражения вещества головного мозга глиальными очагами;
- состояние близко расположенных тканей и сосудов.
Профилактика глиоза Методик полного излечения глиоза головного мозга пока не разработано. Но врачами проводится успешная терапия, которая тормозит распространение патологических процессов. Основная задача этой терапии – лечении заболеваний, ставших причиной глиоза головного мозга. Ключевыми факторами, влияющими на появление множественных очагов глиоза, стоит назвать и такие проблемы, как высокий холестерин, декомпенсированный диабет, гипертония, мерцательная аритмия. Значительно улучшить качество жизни и предотвратить возникновение проблем с разрастанием глиальных клеток поможет правильное питание. Главным условием правильного питания для мозга является ограничение потребления жиров, провоцирующих заболевание.
Излечить глиоз головного мозга невозможно, но болезнь можно предупредить или же остановить ее дальнейшее развитие. Для этого следует выполнять следующие меры профилактики: правильное питание с максимальным отказом от жирной пищи, как уже упоминалось выше. В данном случае нарушение жирового обмена провоцирует распространение глий. Следует оставить в рационе то количество жиров, которое необходимо для нормальной жизнедеятельности организма.
Здоровый образ жизни. Регулярная физическая активность с приемлемым уровнем нагрузки будет способствовать улучшению все систем организма. Важно не перегружать организм, а просто обеспечить активный образ жизни на свежем воздухе. Постоянные обследования с рекомендуемой частотой. Сюда входит не только МРТ диагностика раз в год пациентам старше 50 лет, но систематический контроль артериального давления, холестерина, глюкозы в крови. Также при появлении симптоматики необходимо посещать невролога и по рекомендации устранять все выявленные проблемы, препятствующие нормальной работе организма.
В некоторых случаях профилактика заболеваний обеспечивается за счет лечения терапевтическими методами в стационарных или амбулаторных условиях, например, сезонные курсы витаминных капельниц или периодические поездки для санаторно-курортного лечения. Важно, начиная с 45 лет, проходить ежегодное полное обследование и выявить все существующие проблемы с головным мозгом до назначения различных терапевтических препаратов. Нельзя применять методы самолечения, поскольку болезнь может приобрести более сложный характер под действием такого лечения. По рекомендации специалиста-невролога можно и нужно лечить первоисточники глиоза головного мозга с помощью лекарственных средств и капельниц, укрепляющих сосуды и улучшающих витаминизацию и кровобращение.
Лечение глиоза Как уже было сказано, очаги поражения нейронов возникают в головном мозге разными путями. В основном причинами являются патологические воспалительные и демиелинизирующие изменения в головном мозге. Глиозные процессы не поддаются полноценному лечению, обратная замена глиозной ткани нейронами невозможна. Также глии не могут выполнять функции нейронов, но они очень важны для нормального течения обменных процессов. Потому проблема редко решается хирургическим путем. Глиозная ткань, которая замещает собой мертвые нейроны, не удаляется без острой необходимости. Но можно устранить причины и некоторые последствия основного заболевания, что позволит улучшить состояние пациента.
При хроническом процессе в нервной ткани специалистами назначается терапевтическое лечение в амбулаторных условиях. Подбираются лекарственные препараты, оказывающие положительное влияние на кровообращение и артериальное давление, системы сосудистого расширения, а также витаминные комплексы. Под действием препаратов замедляется или полностью останавливается развитие глиоза белого вещества. Большое значение имеет соблюдение рекомендаций медицинских специалистов относительно образа жизни и питания. Следует как можно больше времени проводить на свежем воздухе, начинать свой день с легкой зарядки и неплотного завтрака. Острое состояние требует госпитализации пациента. Как правило, для острого сосудистого и иного вида глиоза характерны потери сознания, резкие боли, судорожные припадки, нарастающая дисфункция внутренних органов. Лечение в этом случае допускает хирургическое удаление. Осуществляется шунтирование с последующим удалением образования клеток глии и отводом ликвора, если это необходимо.
Список первоисточников
- Дергунова Н.И. Рентгеновская компьютерная и магнитно-резонансная томография в диагностике глиальных опухолей головного мозга иконтроле эффективности различных методов лечения: Дисканд. мед.наук. СПб, 2004.-215 с.
- Гайдар Б.В., Рамешвили Т.Е., Труфанов Г.Е., Парфенов В.Е. Лучевая диагностика опухолей головного и спинного мозга. — СПб: Фолиант, 2006.-336 с.
- Гайкова, О.Н. «Очаговые изменения головного мозга при дисциркуляторной энцефалопатии (МРТ патоморфологические сопоставления)» / О.Н. Гайкова, М.М. Одинак, Т.Н. Трофимова и др. // Медицинская визуализация. — 2007. — № 1. — С. 89-96.
- Алиханов, А. А. Визуализация эпилептогенных поражений мозга у детей / А. А. Алиханов. М.: Видар-М, 2009. — 270 с.
- Беличенко О.И. Магнитно-резонансная томография’в диагностике цереброваскулярных заболеваний / О.И. Беличенко, С.А. Дадвани, Н.Н. Абрамова. -М. : ВИДАР, 1997. 320 с.
- Верещагин Н.В. Патология головного мозга при атеросклерозе и артериальной гипертонии / Н.В. Верещагин, В.А. Моргунов, Т.С. Гулев-ская. М.: Медицина, 1997 — 288 с.
- Berkseth KE, Rubinow KB, Melhorn SJ, et al. Hypothalamic Gliosis by MRI and Visceral Fat Mass Negatively Correlate with Plasma Testosterone Concentrations in Healthy Men. Obesity (Silver Spring). 2018;26(12):1898-1904.
- Hattingen E, Enkirch SJ, Jurcoane A, et al. Hippocampal «gliosis only» on MR imaging represents a distinct entity in epilepsy patients. Neuroradiology. 2018;60(2):161-168.
-
Гайкова, О.Н. Изменения белого вещества головного мозга при височной эпилепсии: автореф. докт. дис. . д-ра мед. наук / О.Н. Гайкова. СПб: ВМедА, 2001. — 32 с.
Полезная информация
МРТ при беременности
Можно ли делать МРТ при беременности — любая беременная женщина, столкнувшись с необходимостью, спрашивает себя об этом, а также её волнует, как диагностика подействует на малыша. Поэтому важно, отбросив все мифы и предрассудки, понять суть работы магнитно-резонансного томографа, а также разобраться в плюсах и минусах данной диагностической методики. Об этом и пойдет речь в этой статье.
читать далее +
Как подготовиться к МРТ головного мозга?
МРТ (магнитно-резонансная томография) сегодня — это один из самых информативных методов исследования, позволяющий медицинским специалистам заглянуть внутрь организма, не причиняя пациенту никакого вреда. Более того, на сегодняшний день МРТ является “золотым стандартом” для постановки диагноза и лечения заболеваний головного мозга. Если человека беспокоит головная боль и головокружение, шум в ушах, ухудшение памяти, мошки в
читать далее +
Что покажет МРТ головного мозга
МРТ головного мозга – это хорошо апробированный и надежный метод диагностики, который основывается на свойствах магнитного поля и отличается повышенной информативностью и точностью. Суть метода заключается в том, что под воздействием радиомагнитных импульсов в органах человека возникают ответные волновые сигналы, которые с помощью компьютера томографа преобразовываются в изображения в нескольких
читать далее +
Глиоз на МРТ головного мозга
Магнитно-резонансная томография – информативный неинвазивный способ изучения церебральных структур. Диагностика патологических процессов головного мозга при помощи других методов осложняется наличием черепной коробки, выполняющей защитную функцию. Сканирование с использованием индукционного поля позволяет выявить малейшие изменения. Очаги глиоза на МРТ головного мозга обнаруживаются наиболее точно, специалист может определить характер и локализацию процесса.
Различные формы глиоза на снимках МРТ головного мозга
Исследование проводят с помощью томографа, состоящего из передвижного стола и широкого тоннеля. Устройство генерирует магнитное поле, под воздействием которого атомы водорода в молекулах воды выстраиваются особым образом. Чувствительные датчики считывают отклик сканируемых тканей, получая информацию о степени насыщения жидкостью клеток головного мозга.
Компьютерная программа преобразует сигнал в серию послойных изображений, сделанных в аксиальной, сагиттальной и фронтальной проекциях. На основании полученных снимков врач может, при необходимости, реконструировать 3D-модель головного мозга.
Признаки глиозаМозг человека состоит из эпендимальной мембраны, глиальных клеток и нейронов. Последние осуществляют передачу нервных импульсов по всему организму. Патологические процессы, затрагивающие центральную нервную систему (ЦНС), в некоторых случаях приводят к гибели нейронов.
Глиальные клетки в нормальном состоянии выполняют защитную, трофическую и секреторную функции, отвечают за клеточный метаболизм. Составляют 40% от общей массы мозгового вещества. Разрушение нейронов стимулирует процесс заполнения образовавшихся пустот глиями, которые обеспечивают питание клеток нервной ткани. При этом количественное соотношение церебральных элементов меняется.
Процесс замещения нейронов нейроглиальными клетками называется глиозом и считается вторичным заболеванием ЦНС. Причинами патологического явления могут стать возрастные изменения, травмы, демиелинизация и ишемия церебральных структур.
Микроангиопатия головного мозга, очаговые изменения на МРТ (аксиальная проекция)
На ранних этапах глиоз не имеет клинических проявлений, диагностировать отклонение можно при магнитно-резонансном сканировании головного мозга. По мере развития процесса возникают характерные симптомы:
- головная боль;
- парезы, параличи;
- нарушение речи;
- снижение слуха;
- потеря остроты зрения;
- нарушение координации в пространстве;
- потеря памяти;
- снижение концентрации;
- развитие гипертонии.
У новорожденных детей отмечают утрату глотательного рефлекса, нарушения слуха и зрения, симптомы гидроцефалии.
Клиническая картина зависит от вида глиоза, локализации процесса и характера заболевания, вызвавшего гибель нервных клеток. Супратенториальные очаговые изменения (расположенные выше мозжечка) приводят к нарушению двигательной активности, расстройству мелкой моторики.
Очаги глиозаРазрастание ткани происходит вследствие гибели нейронов. Данный процесс может иметь диффузный или очаговый характер, в зависимости от этиологии заболевания. Первый тип характеризуется отсутствием ограниченных патологически измененных участков. Причиной возникновения служат диффузные поражения ЦНС (головного и спинного мозга).
Очаговый глиоз отличается единичными или множественными островками, имеющими четкую границу. Расположение и размер патологических участков зависит от причин, вызвавших гибель нейронов.
Единичные очагиОграниченная зона разрастания глиальных клеток может быть следствием возрастных изменений, хронической гипертонии, локализованного воспалительного процесса. У детей причиной патологии является родовая травма, чаще измененный участок располагается в левой или правой теменной доле.
Единичные очаги не имеют клинических проявлений, диагностировать заболевание можно при ангиографии сосудов головного мозга, МРТ, КТ. В пожилом возрасте гибель нейронов объясняют естественными причинами, лечение в данном случае направлено на замедление процесса.
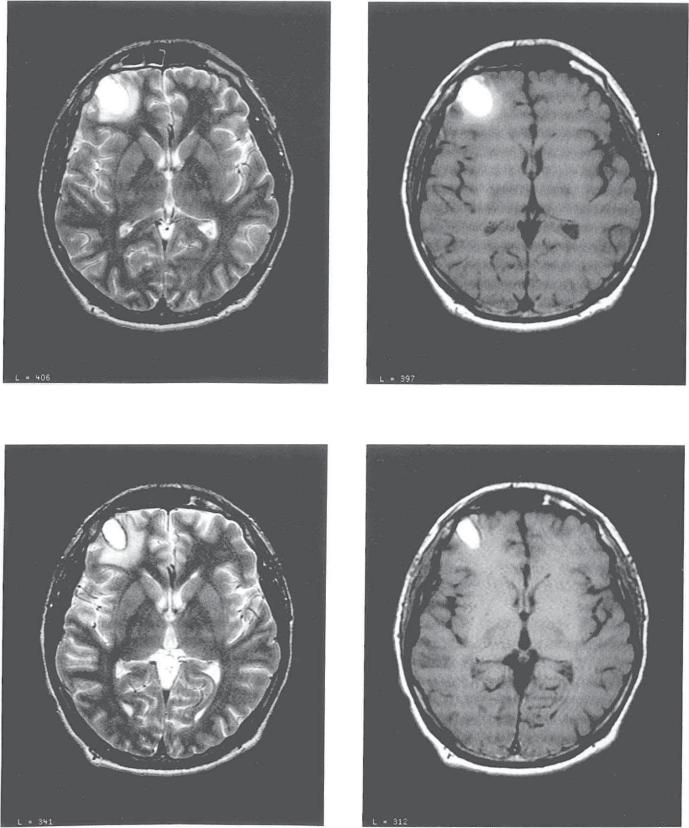
Множественные очагиОстрые и хронические нарушения кровообращения головного мозга, травмы приводят к появлению нескольких островков глиоза. В процессе развития патологии, послужившей причиной гибели нейронов, количество и размеры измененных участков могут увеличиваться.
Множественные очаги глиоза вызывают нарушение деятельности ЦНС, усиливая клинические проявления основного заболевания. Чаще причинами возникновения нескольких (более 3) пораженных участков становятся инсульты, инфаркты, атеросклероз и сдавление сосудов головного мозга.
Множественные очаги глиоза (показаны стрелками) на МРТ
Как выглядит глиоз на МРТ?Магнитно-резонансная томография является наиболее результативным видом диагностики заболеваний головного мозга. Послойные сканы визуализируют малейшие изменения структуры церебрального вещества, позволяя уточнить размеры и локализацию патологического участка.
Единичные очаги глиоза на МРТ головного мозга на Т1-взвешенных изображениях выглядят светлыми пятнами с четкой границей. Изменение цвета говорит о дистрофии белого вещества и патологическом разрастании глиальных клеток.
Преимуществом МРТ является возможность оценить состояние тканей, расположенных вокруг глиозного очага, характер кровоснабжения сканируемой зоны (в том числе и супратенториального пространства). Послойные изображения визуализируют изменения церебральных структур, нарушения функциональности сосудистой системы. МРТ позволяет своевременно диагностировать патологические процессы, вызвавшие гибель нейронов и способствует назначению результативного лечения.
На томограммах при глиозе сосудистого генеза видны нарушения проходимости вен и артерий головного мозга, участки сдавления, сужение просвета кровеносного русла. Метод отражает изменения, характерные для демиелинизирующих, некротических, ишемических, воспалительных процессов.
Магнитно-резонансная томография информативна в отношении патологически измененных участков в лобных долях, позволяет выявить перивентрикулярный глиоз, локализованный в области желудочков головного мозга. Единичные очаги диаметром от 3 мм в супратенториальном пространстве хорошо видны на снимках МРТ.
Результаты МРТ: глиоз головного мозгаПротокол исследования включает в себя описание состояния суб- и супратенториального пространства. На основании результатов МРТ головного мозга врач оценивает:
- расположение срединных структур;
- периваскулярные пространства лобных, теменных долей; области базальных ядер;
- однородность структуры белого вещества;
- локализацию, размер очаговых изменений, наличие перифокальной (краевой) инфильтрации;
- состояние гипофиза, желудочков головного мозга;
- наличие патологических образований;
- функциональность кровеносных сосудов зоны интереса.
При наличии характерных очагов глиоза врач уточняет генез изменений, указывая в заключении основной диагноз.
Очаги глиоза (показаны стрелками) на снимке МРТ головного мозга в аксиальной проекции
При подозрении на любые церебральные патологии пройти МРТ можно в диагностическом центре “Магнит”.
КЛИНИКОДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ МИКРООЧАГОВОГО ПОРАЖЕНИЯ ГОЛОВНОГО МОЗГА СОСУДИСТОГО ГЕНЕЗА У СПЕЦИАЛИСТОВ УПРАВЛЕНЧЕСКОГО ПРОФИЛЯ | Васильев
1. Верещагин Н.В., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. – М. : Медицина, 1997. – 228 с.
2. Врайт К.Б. [и др.]. Корреляционная связь между выраженностью лейкоареоза и уровнем воспалительных биомаркеров повышенного риска развития сосудистых заболеваний // Stroke. – 2010. – № 1. – С. 24–32.
3. Григорьева В.Н., Гусов А.В., Котова О.В. [и др.]. Роль эмоционального напряжения в развитии начальных форм хронической цереброваскулярной недостаточности // Журн. неврологии и психиатрии им. С.С. Корсакова. – 2000. – № 5. – С. 14–18.
4. Гуирауд В. [и др.]. Триггеры ишемического инсульта. Систематический обзор // Stroke. – 2011. – № 1. – С. 73–83.
5. Федина Н.В., Сааркоппель Л.М. Вопросы реабилитации при цереброваскулярной патологии у работников умственного труда // Профессия и здоровье : материалы VI Всерос. конгр. – М., 2007. – С. 145–146.
6. Bots M.L. [et al.]. Cerebral white matter lesions and atherosclerosis in the Rotterdam Study // Lancet. – 1993. – Vol. 341, N 8855. – P. 1232–1237.
7. Brisset M. [et al.]. Large_vessel correlates of cerebral small_vessel disease // Neurology. – 2013. – Vol. 80, N 7. – P. 662–669.
8. Chambless L.E. [et al.]. Carotid wall thickness is predictive of incident clinical stroke: the Atherosclerosis Risk in Communities (ARIC) study // Am. J. Epidemiol. – 2000. – Vol. 151, N 5. – P. 478– 487.
9. Goldstein I.B. [et al.]. Relationship between blood pressure and subcortical lesions in healthy elderly people // Stroke. – 1998. – Vol. 29, N 4. – P. 765–772.
10. Hollander M. [et al.]. Carotid plaques increase the risk of stroke and subtypes of cerebral infarction in asymptomatic elderly: the Rotterdam study // Circulation. – 2002. – Vol. 105, N 24. – P. 2872–2877.
11. Hoshi T., Kitagawa K. Relations of Serum High Sensitivity C_Reactive Protein and Interleukin_6 Levels With Silent Brain Infarction // Stroke. – 2005. – Vol. 36, N 4. – P. 768–772.
12. Kario K. [et al.]. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study // Circulation. – 2003. – Vol. 107, N 10. – P. 1401–1406.
13. Kario K. [et al.]. Stroke prognosis and abnormal nocturnal blood pressure falls in older hypertensives // Hypertension. – 2001. – Vol. 38, N 4. – P. 852–857.
14. Kobayashi S., Okada K. [et al.]. Subcortical silent brain infarction as a risk factor for clinical stroke // Stroke. – 1997. – Vol. 28, N 10. – P. 1932–1939.
15. Maillard P. [et al.]. Effects of systolic blood pressure on white_matter integrity in young adults in the Framingham Heart Study: a cross_sectional study // Lancet Neurol. – 2012. – Vol. 11, N 12. – P. 1039–1047.
16. Musialek P. [et al.]. Multimarker Approach in Discriminating Patients with Symptomatic and Asymptomatic Atherosclerotic Carotid Artery Stenosis // J. Clin. Neurol. – 2013. – Vol. 9, N 3. – P. 165–175.
17. Pico F. [et al.]. Longitudinal study of carotid atherosclerosis and white matter hyperintensities: the EVA_MRI cohort // Cerebrovasc. Dis. – 2002. – Vol. 14, N 2. – P. 109–115.
18. Shrestha I. [et al.]. Association between central systolic blood pressure, white matter lesions in cerebral MRI and carotid atherosclerosis // Hypertens. Res. – 2009. – Vol. 32, N 10. – P. 869–874.
19. Sierra C. [et al.]. Silent cerebral white matter lesions in middle_aged essential hypertensive patients // J. Hypertens. – 2002. – Vol. 20, N 3. – P. 519–524.
20. Touboul P.J. [et al.]. Mannheim Carotid IntimaMedia Thickness and Plaque Consensus (2004–2006– 2011) // Cerebrovasc. Dis. – 2012. – Vol. 34, N 4. – P. 290–296.
21. Vermeer S.E., Longstreth W.T., Koudstaal P.J. Silent brain infarcts: a systematic review // Lancet Neurol. – 2007. – Vol. 6, N 7. – P. 611–619.
Случаи из блогов связанные с головой
В данном разделе описаны выявления заболеваний, связанных с головой. Как показывает практика, мрт диагностика головы на ранних стадиях болезни помогает существенно снизить риск развития заболеваний
25 ИЮЛ Выявление ОНМК в бассейне левых ЗМА и СМА головного мозга с помощью МРТПациентка Н. 85 лет после гипертонического криза (подъем давления до 280 мм.рт.ст.) отмечает частичное нарушение речи, головную боль, нарушение памяти, головокружение, ухудшение зрения на правый глаз. С диагнозом ОНМК (острое нарушение мозгового кровообращения) госпитализирована в стационар, где выполнена МРТ головного мозга.
Подробнее 13 МАЙ Выявление огромной арахноидальной кисты с признаками латеральной и аксиальной дислокации при помощи МРТПациент Х. 73 года, образование высшее, всю жизнь проработал по специальности врачом. Сейчас на пенсии. На протяжении 2-3 лет близкие стали отмечать у него снижение памяти и интеллекта, заторможенность, шаркающую походку, что расценивалось ими как возрастные изменения. Последние два месяца присоединилось состояние оглушенности. Неврологом больной направлен на МРТ головного мозга.
На МР-томограммах в передней и средней черепных ямках слева определяется крупная арахноидальная ликворная киста, которая компремирует левое полушарие, левый боковой желудочек, смещает срединные структуры до 15 мм вправо. Левые лобная, височная, островковая доли уменьшены в объеме, с признаками гипогенезии. Правый боковой желудочек умеренно расширен, охватывающая цистерна и конвекситальные субарахноидальные пространства компремированы.
Подробнее 18 ЯНВ МРТ диагностика острого нарушения мозгового кровообращенияПациентка Ж. 70 лет была доставлена в отделение магнитно-резонансной томографии ФГБУ «ФЦСКЭ им В.А. Алмазова Минздравсоцразвития» с подозрением на острое нарушение мозгового кровообращения.
По данным МРТ головного мозга в левой лобно-теменной области, в бассейне левой средней мозговой артерии определяется зона гиперинтенсивного МР сигнала на Т2 ВИ, FLAIR ИП, DWI соответствующая зоне острого нарушения мозгового кровообращения по ишемическому типу.
Подробнее 06 ДЕК МРТ диагностика S-образной извитости ЛВСАМужчина 56 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется S-образная извитость левой внутренней сонной артерии в экстракраниальных отделах, что наиболее вероятно и обуславливает клиническую симптоматику больного.
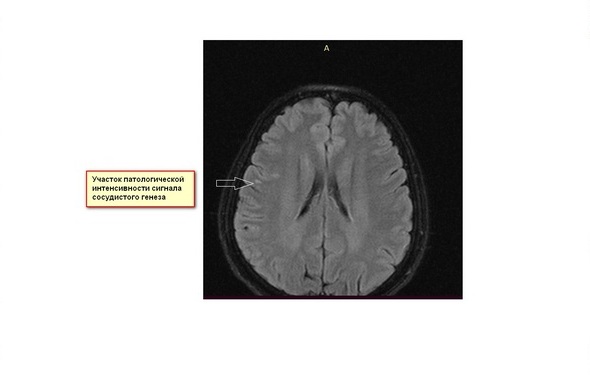
Подробнее 27 НОЯ МРТ диагностика очага глиоза сосудистого генеза у пациента 53 летПациент H. 53 лет обратился к врачу общей практики с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе левой лобной доли, на суправентрикулярном уровне, определяется единичный очаг (наиболее вероятно очаг глиоза сосудистого генеза, менее вероятен демиелинизирующий процесс), размером 12 мм.
Подробнее 16 НОЯ МРТ диагностика головного мозга без патологииПациент Л. 27 лет обратился к врачу общей практики с жалобами на однократный эпизод потери сознания. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ участков патологической интенсивности МР сигнала в веществе головного мозга не выявлено.
Подробнее 15 НОЯ МРТ диагностика асимметрии калибров позвоночных артерий у мужчины 53 летМужчина 53 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется асимметрия калибров позвоночных артерий в сегменте V4 (калибр ППА меньше ЛПА), что наиболее вероятно и обуславливает клиническую симптоматику больного.
Подробнее 02 НОЯ МРТ диагностика асимметрии калибров позвоночных артерий у мужчины 57 летМужчина 57 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется асимметрия калибров позвоночных артерий в сегменте V4 (калибр ЛПА меньше ППА), что наиболее вероятно и обуславливает клиническую симптоматику больного.
Подробнее 29 ОКТ МРТ диагностика арахноидальной кисты левой височной областиПациент К. 15-и лет наблюдается у невролога по поводу эпилепсии. В этом году он решил сделать МРТ головного мозга.
На серии МРТ головного мозга определяется: в полюсе левой височной доли определяется кистозное расширение наружного ликворного пространства, размером 3,8 х 4,8 х 5,2 см, с четкими ровными контурами, с выраженным масс-эффектом, без признаков перифокального отека (наиболее вероятно, арахноидальная киста). Срединные структуры минимально смещены вправо на 0,3 см.
Подробнее 24 ОКТ МРТ диагностика S-образной извитости левой внутренней сонной артерииМужчина 60 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется S-образная извитость левой внутренней сонной артерии в экстракраниальных отделах, что наиболее вероятно и обуславливает клиническую симптоматику больного.
Подробнее 22 ОКТ МРТ диагностика арахноидальной кистыМама ребенка 12 лет обратилась к неврологу с жалобами на впервые возникшие у ребенка судороги, сопровождавшиеся потерей сознания.
После проведенного МРТ было выявлено: что в левой лобной области имеется арахноидальная киста, компремирующая прилежащие отделы головного мозга и вызывающая атрофию от сдавления лобной кости.
Подробнее 19 ОКТ МРТ диагностика асимметрии калибров позвоночных артерий у мужчины 55 летМужчина 55 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется асимметрия калибров позвоночных артерий в сегменте V4 (калибр ППА меньше ЛПА), что наиболее вероятно и обуславливает клиническую симптоматику больного.
Подробнее 18 ОКТ МРТ диагностика атеросклероза сосудов головного мозгаМужчина 45 лет обратился к неврологу с жалобами на периодические головные боли, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется: правая позвоночная артерия не визуализируется. Контуры остальных сосудов головного мозга не ровные, что связано, наиболее вероятно, с атеросклеротическим поражением.
Подробнее 17 ОКТ МРТ диагностика мигрениПациент Г. 30 лет обратился к врачу общей практики с жалобами на однократный эпизод потери сознания. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ участков патологической интенсивности МР сигнала в веществе головного мозга не выявлено.
Подробнее 01 ОКТ МРТ диагностика кистозного образования шишковидной железыПациент М. 34 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, бессонницу. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: очаговые изменения в веществе головного мозга не выявлены. Однако, в проекции шишковидной железы обнаружено кистозное образование с четкими ровными контурами размером 1,2х0,9 см без признаков объемного воздействия на окружающие структуры.
Подробнее 26 СЕН МРТ диагностика рассеянного склероза у пациента 29 летПациент Н. 29 лет обратился к неврологу с жалобами на расстройство зрения, головокружения, шаткость походки, онемение рук. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения демиелинизирующего заболевания.
По данным МРТ головного мозга в белом веществе обеих гемисфер перивентрикулярно, а так же в мозолистом теле определяются множественные очаги «сливного» характера различных формы и размеров (наиболее вероятно очаги демиелинизации).
Подробнее 25 СЕН МРТ диагностика нарушения мозгового кровообращенияПациентка Д. 73 лет была доставлена в отделение магнитно-резонансной томографии ФГБУ «ФЦСКЭ им В.А. Алмазова Минздравсоцразвития» с подозрением на острое нарушение мозгового кровообращения.
По данным МРТ головного мозга в правой лобной доле на уровне базальных ядер определяется зона гиперинтенсивного МР сигнала на Т2 ВИ, FLAIR ИП, DWI соответствующая зоне острого нарушения мозгового кровообращения по ишемическому типу.
Подробнее 24 СЕН МРТ диагностика единичного очага глиоза, размером 3 ммПациент Р. 34 лет обратился к врачу общей практики с жалобами на расстройство сна. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе правой лобной доли, на уровне переднего рога правого бокового желудочка, определяется единичный очаг глиоза сосудистого генеза, размером 3 мм.
Подробнее 17 СЕН МРТ диагностика сосудов головного мозгаМужчина 54 лет обратился к неврологу с жалобами на ежедневные головные боли во второй половине дня, в связи с чем был направлен на МР-ангиографию сосудов головного мозга.
На полученных изображениях сосудов головного мозга в режиме 3D-TOF сужений и патологической извитости сосудов не выявлено. МР сигнал от сосудов головного мозга не изменен.
Подробнее 13 СЕН МРТ диагностика поражений головного мозга и недостаточности мозгового кровообращенияПациент З. 76 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, периодические головокружения. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: в белом веществе обеих гемисфер субкориткально и перивентрикулярно определяются множественные очаги сосудистого характера. Так же отмечается смешанная гидроцефалия заместительного генеза. Диагноз: хроническая недостаточность мозгового кровообращения.
Подробнее 28 АВГ Мрт диагностика головыПациент Г. 27 лет обратился к врачу общей практики с жалобами на головные боли и периодические головокружения. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ участков патологической интенсивности МР сигнала в веществе головного мозга не выявлено.
Подробнее 21 АВГ МРТ диагностика дисциркуляторной энцефалопатииПациент К. 64 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, периодические головокружения. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: в белом веществе обеих гемисфер субкориткально и перивентрикулярно определяются очаги глиоза сосудистого характера. Диагноз: дисциркуляторная энцефалопатиz.
Подробнее 15 АВГ МРТ диагностика кисты шишковидной железыПациент Д. 36 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: очаговые изменения в веществе головного мозга не выявлены. Однако, в проекции шишковидной железы обнаружено кистозное образование с четкими ровными контурами размером 1,2х0,7 см без признаков объемного воздействия на окружающие структуры.
Подробнее 13 АВГ МРТ диагностика единичного очага глиоза в правой лобной долиПациент Ж. 34 лет обратился к врачу общей практики с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе правой лобной доли, субкортикально, определяется единичный очаг глиоза сосудистого генеза, размером 3 мм.
Подробнее 30 ИЮЛ МРТ диагностика гидроцефалии заместительного генезаПациент Ш. 68 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, периодические головокружения, резкое снижение памяти. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: в белом веществе обеих гемисфер субкориткально и перивентрикулярно определяются множественные очаги сосудистого характера.
Подробнее 25 ИЮЛ МРТ диагностика извитости ЛВСАПациентка К 24 лет обратилась к неврологу с жалобами на частые головные боли. Невролог рекомендовал пациентке сделать МРТ сосудов головного мозга.
По данным МРТ сосудов головного мозга определяется: S-образная извитость в экстракраниальном отделе левой внутренней сонной артерии. Так же гипоплазия левой позвоночной артерии.
Подробнее 24 ИЮЛ МРТ диагностика единого очага глиозаПациент Л. 34 лет обратился к врачу общей практики с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе левой лобной доли, на паравентрикулярном уровне, определяется единичный очаг глиоза сосудистого генеза, размером 3 мм.
Подробнее 20 ИЮЛ МРТ диагностика многоочагового поражения головного мозга (ХНМК)Пациент З. 76 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, периодические головокружения, резкое снижение памяти. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: в белом веществе обеих гемисфер субкориткально и перивентрикулярно определяются множественные очаги сосудистого характера. Так же отмечается смешанная гидроцефалия заместительного генеза. Диагноз: хроническая недостаточность мозгового кровообращения.
Подробнее 23 МАЙ МРТ диагностика ликворных кисПациентка К. 50 лет обратилась к неврологу с жалобами на головные боли, расстройство памяти. Из анамнеза известно, что пациентка страдает атеросклерозом брахиоцефальных артерий. После консультации пациентка была направлена на МРТ головного мозга.
При МРТ головного мозга в проекции базальных ядер обеих гемисфер определяются множественные ликворные кисты, обусловленные ранее перенесенными лакунарными инсультами.
Кроме того, при обследовании сосудов было выявлено резкое обеднение кровотока по позвоночным артериям, а также окклюзия средней трети основной артерии. С данными МРТ пациентка была направлена к неврологу с целью подбора необходимой терапии.
Подробнее 21 МАЙ МРТ диагностика менингиомы мозжечкаПациентка 70 лет, обратилась к неврологу с жалобами на головную боль. После неврологического осмотра, пациентка была направлена на МРТ головного мозга. При МРТ головного мозга в левой половине задней черепной ямки выявлено патологическое вне мозговое образование, неоднородной структуры за счет обызвествлений, сдавливающее левое полушарие мозжечка.
Подробнее 21 ИЮН МРТ диагностика субдуральной гематомыПациент К. 28 лет в состоянии алкогольного опьянения был сбит мотоциклом, сознание не терял, от медицинской помощи отказался. После травмы стал отмечать головную боль, интенсивность, частота и длительность которой постепенно нарастали. Иногда она сопровождалась рвотой. Через 2 недели с момента травмы пациент обратился к неврологу, который направил его на МРТ головного мозга.
Подробнее 11 ИЮН Выявление холестеатомы левого мостомозжечкового угла с помощью МРТПациента В. 38 лет беспокоили периодические боли в левой половине лица. Спустя три месяца боли стали постоянными, появилось онемение левой половины лица, больше в области носа и нижней челюсти, которые усиливались при чистке зубов и бритье. За медицинской помощью не обращался. Постепенно присоединились онемение тыльной поверхности и основания большого пальца. Неврологом направлен на МРТ головного мозга.
Подробнее 23 МАЙ Выявление тривентрикулярной гидроцефалии головного мозгаУ пациента Х. 36 лет после тяжелой ЧМТ сохранились грубые атаксические нарушения, незначительно выраженный тетрапарез.
После курсов восстановительной терапии у пациента сохранялась шаткость походки. Постепенно состояние пациента прогрессивно ухудшалось: неустойчивость, шаткость походки усилились, головные боли участились, наросла их интенсивность, снизилась работоспособность, повысилась утомляемость, отмечалось снижение памяти, появилось нарушение функции мочеиспускания. Госпитализирован в плановом порядке, выполнена МРТ головного мозга.
Подробнее 14 ЯНВ МРТ диагностика холестеатомы ЗЧЯВашему вниманию предлагается клинический случай пациента П. 53 года, который после черепно-мозговой травмы стал отмечать снижение слуха на левое ухо. По этому поводу не обследовался, за медицинской помощью не обращался, считая последствием травмы. Постепенно присоединилась головная боль, боль в левой половине лица. Невропатолог направил на МРТ головного мозга.
Подробнее 10 ЯНВ МРТ диагностика опухоли задней черепной ямкиВашему вниманию предлагается клинический случай пациентки Р. 51 год, у которой появилась шаткость походки, постепенно (в течение 3-4 месяцев) присоединилась слабость в ногах. Самостоятельно выполнила МРТ головного мозга.
Подробнее 09 ЯНВ МРТ диагностика демиелинизации белого вещества мозгаВашему вниманию предлагается клинический случай пациентки Ч. 52 года, которая стала отмечать снижение зрение на левый глаз. Самостоятельно выполнила МРТ, выявлено внемозговое конвекситальное образование правой лобной области. С диагностической целью была выполнена селективная церебральная ангиография, после которой появились нарушение речи в виде упрощения, оскудения, сложности в формулировании высказывания, нарушения моторики, вплоть до затруднения и невозможности выполнения целенаправленной деятельности, значительного рассеивания внимания. Отмечались расторможенность, эйфория. Экстренно выполнена повторная МРТ головного мозга.
Подробнее 13 ДЕК МРТ диагностика опухоли височной долиУ пациента Ф.54 года на фоне полного благополучия возникли генерализованные судороги. Обратился к невропатологу, направлен на МРТ головного мозга.
При МРТ исследовании в медио-базальных отделах правой височной доли определяется образование с размытыми контурами, гиперинтнесивного МР-сигнала на Т2 ВИ и Tirm,
Подробнее 11 ДЕК МРТ диагностика краниофарингиомыПациентка В.23 года, на фоне длительных и выраженных головных болей стала отмечать сужения полей зрения, ухудшение остроты зрения. Обратилась к невропатологу, который направил ее на МРТ головного мозга.
На МР-томограммах в хиазмально-селлярной области определяется крупное образование кистозно-солидной структуры, распространяющееся супраселлярно, компремирующая соответствующую цистерну, третий желудочек, колено, передние и средние отделы мозолистого тела.
Подробнее 03 ДЕК МРТ диагностика аденомы гипофизаВашему вниманию представляется клинический случай пациента Г. 62 года, которого полгода беспокоят головные боли и прогрессирующая слабость, сужение полей зрения с обеих сторон. Осмотрен невропатологом и эндокринологом. Назначена МРТ головного мозга.
Подробнее 30 НОЯ МРТ диагностика дисциркулятроной гидроцефалииВашему вниманию предлагается клинический случай пациента С. 68 лет, у которого появилась шаткость походки, усиливающаяся в темноте. Близкие стали отмечать эмоциональную лабильность, ухудшения памяти, расстройство сна. Кроме того, пациента беспокоили головные боли в височно-затылочной области, головокружения, боли в шейном и поясничном отделах. Больной был госпитализирован в неврологический стационар с диагнозом: Дисциркуляторная энцефалопатия смешанного генеза. Выполнена МРТ головного мозга.
Подробнее 29 НОЯ МРТ диагностика конвекситальной менингиомыВашему вниманию предлагается клинический случай пациента М.48 лет, который на протяжении трех лет страдает интенсивными головными болями. Кроме того, стал отмечать появление плотного выроста в левой лобной области. Самостоятельно выполнил МРТ головного мозга.
Подробнее 09 НОЯ МРТ диагностика микроаденомы центрального отдела гипофизаВашему вниманию предлагается клинический случай пациента А, 31 год, которого несколько лет беспокоят головные боли и повышение артериального давления (до высоких цифр: 190/100 мм.рт.ст.), кроме того отмечает появление лишнего веса. По поводу артериальной гипертензии получает лечение у терапевта. Пациент самостоятельно выполнил МРТ головного мозга.
Подробнее 08 НОЯ МРТ диагностика глиомыВашему вниманию предлагается клинический случай пациентки Л. 41 года, у которой в течение последнего месяца появилось ощущение постороннего запаха и отмечалась потеря сознания на 2-3 минуты, периодически головокружение. Появление жалоб ни с чем не связывает, приступы повторялись ежедневно. Пациентка направлена невропатологом на МРТ головного мозга.
Подробнее 06 НОЯ МРТ диагностика центрального понтинного миелинолизаВашему вниманию предлагается клинический случай пациентки Д. 40 лет, страдающей хроническим алкоголизмом, у которой было два судорожных припадка с потерей сознания, появилась слабость в левой ноге. Для исключения органических изменений головного мозга невропатолог направил пациентку на МРТ.
Подробнее 05 НОЯ МРТ диагностика опухоли лобной областиВашему вниманию предлагается клинический случай пациента К., 31 год, который на протяжении нескольких лет отмечает постоянную заложенность носа. По данному поводу не обследовался и не лечился. Постепенно присоединились головные боли, преимущественно в лобной области, которые последние две недели носили интенсивный характер. Невропатологом пациент был направлен на МРТ головного мозга.
Подробнее 23 ОКТ МРТ диагностика рака шейки маткиВашему вниманию предлагается клинический случай пациентки В. 43 года, которую в течение нескольких лет беспокоят периодические тянущие боли в нижних отделах живота. На осмотре у гинеколога не была в течение нескольких лет. Присоединились обильные кровянистые выделения, не связанные с менструальным циклом. Направлена на МРТ малого таза.
Подробнее 15 ОКТ МРТ диагностика менингиомыВашему вниманию представляется клинический случай пациентки Б. 57 лет. Со слов пациентки считает себя больной в течение последних нескольких лет, когда постепенно появились давящие боли в левой лобно-теменной области, которые возникали периодически, плохо купировались медикаментозно. За последний год отмечает ухудшение зрения. Невропатологом рекомендовано МРТ головного мозга.
Подробнее 10 ОКТ МРТ диагностика опухолевого поражения лимфатических узловВашему вниманию предлагается клинический случай пациентки Д. 67 лет, которая стала отмечать эпизоды нехватки воздуха, слабости, повышенную потливость. Пациентку беспокоили приступы значительного падения артериального давления (до 80 и 40 мм.рт.ст.), по поводу одного из них была госпитализирована в стационар. Кроме того, пациентка отметила увеличение размеров шеи слева (в течение трех месяцев), с чем обратилась на консультацию к хирургу. Для уточнения характера изменений была направлена на МРТ мягких тканей шеи.
Подробнее 04 ОКТ МРТ диагностика опухоли мозжечкаПредставляем Вашему вниманию клинический случай пациентки К. 65 лет, которая внезапно почувствовала шум в ушах, на следующий день утром присоединилась шаткость походки, головокружение. С диагнозом острое нарушение мозгового кровообращения в течение 10 дней лечилась у невропатолога по месту жительства, со слабым клиническим эффектом. Для уточнения характера изменений в головном мозге пациентка была направлена на МРТ.
Подробнее 02 ОКТ МРТ диагностика опухоли головного мозгаВашему вниманию предлагается клинический случай пациентки К.56 лет, у которой постепенно развилась выраженная апатия, однократно отмечались судороги. По этому поводу за медицинской помощью не обращалась, не обследовалась. Через несколько недель (на улице) развились генерализованные судороги. Обратилась к невропатологу, направлена на МРТ головного мозга.
Подробнее 04 СЕН МРТ диагностика рассеянного склерозаПациент Н. 29 лет обратился к неврологу с жалобами на расстройство зрения, головокружения, шаткость походки, онемение рук. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения демиелинизирующего заболевания.
По данным МРТ головного мозга в белом веществе обеих гемисфер перивентрикулярно, а так же в мозолистом теле определяются множественные очаги «сливного» характера различных формы и размеров (наиболее вероятно очаги демиелинизации).
Подробнее 03 СЕН МРТ диагностика пролапса тазовых органовВашему вниманию предлагается клинический случай пациентки К, 67 лет, которая наблюдалась у гинеколога по поводу пролапса тазовых органов. От предложенного оперативного лечения неоднократно отказывалась. Пациентку беспокоят практическое постоянное выпадение половых органов с их мацерацией, нарушения мочеиспускания и дефекации, тянущая боль в нижних отделах живота. Лечащим доктором направлена на МРТ малого таза.
Подробнее 14 АВГ Мрт исследование головных болейПациент Е. 32 лет обратился к врачу общей практики с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ участков патологической интенсивности МР сигнала в веществе головного мозга не выявлено.
Подробнее 01 АВГ МРТ диагностика кавернозной ангиомыПациент С. 58 лет обратился к участковому неврологу с жалобами на частые головные боли и головокружения. После консультации пациент был направлен на МРТ головного мозга в ЦМРТ с целью исключения различной патологии.
При МРТ головного мозга в правой лобной доле на уровне базальных ядер было выявлено округлой формы образование с четкими ровными контурами, несколько не однородной структуры, окруженное гипоинтенсивным ободком – кавернозная ангиома.
Подробнее 27 ИЮЛ МРТ диагностика задней трифуркацииПациентка Ц 57 лет была госпитализирована в ФБГУ «ФЦСКЭ им В.А. Алмазова Минздравсоцразвития РФ» для плановой операции на сердце. Перед операцией анестезиологи рекомендовали выполнение МРТ сосудов головного мозга с целью оценки их состояния перед подачей общей анестезии во избежание осложнений ишемического генеза.
Подробнее 16 ИЮЛ МРТ диагностика многоочагового поражения головного мозгаПациент R 70 лет, обратился за консультацией к неврологу в медицинский центр с жалобами на головные боли, периодические головокружения. С целью исключения очагового поражения головного мозга, пациент был направлен на МРТ.
При МРТ головного мозга установлено: в белом веществе обеих гемисфер субкориткально и перивентрикулярно определяются множественные «сливного» характера очаги сосудистого характера. Диагноз: хроническая недостаточность мозгового кровообращения. Так же у пациента определяется смешанная гидроцефалия заместительного генеза.
Подробнее 13 ИЮЛ МРТ диагностика очага глиоза сосудистого генеза у пациента 34 летПациент З. 34 лет обратился к неврологу с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе левой лобной доли на уровне переднего рога левого бокового желудочка, определяется единичный очаг глиоза сосудистого генеза, размером 3 мм.
На основании полученных МРТ данных пациент был направлен на консультацию к неврологу.
Подробнее 06 ИЮЛ МРТ диагностика гидроцефалииПациент Н. 56 лет обратился к врачу общей практики с жалобами на расстройство памяти. Из анамнеза известно, что пациент длительное время работал на химическом заводе. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
Подробнее 05 ИЮЛ МРТ диагностика ретроцеребеллярной кистыУ пациента Р. 28 лет при плановом МРТ исследовании головного мозга по поводу периодических головокружений, было выявлено локальное расширение ретроцеребеллярного пространства – ретроцеребеллярная киста.
На основании данных МРТ обследования, пациент был направлен в медицинский центр к неврологу для определения дальнейшей тактики лечения.
Подробнее 26 ИЮН МРТ диагностика кисты сосудистых сплетенийУ пациента Н. 34 лет при выполнении КТ головного мозга было выявлено расширение задних рогов боковых желудочков мозга. С целью уточнения характера изменений пациентке была назначена МРТ головного мозга. При МРТ головного мозга в проекции задних рогов боковых желудочков мозга, в проекции сосудистых сплетений, определяются кистозные образования, соответствующие кистам сосудистых сплетений.
Подробнее 20 ИЮН МРТ диагностика множественных образований головного мозгаВашему вниманию предлагается клинический случай пациентки К.56 лет, у которой постепенно развилась выраженная апатия, однократно отмечались судороги. По этому поводу за медицинской помощью не обращалась, не обследовалась. Через несколько недель (на улице) развились генерализованные судороги. Обратилась к невропатологу, направлена на МРТ головного мозга.
Подробнее 14 ИЮН МРТ диагностика сосудистой мальформации у новорожденного ребенкаВашему вниманию представляется клинический случай пациентки Д. возрастом 5 суток. Во время кормления мама отметила у новорожденной дочери подергивание ручкой, о чем сообщила педиатру. Других изменений в состоянии ребенка не отмечалось. Для исключения патологии головного мозга выполнена МРТ.
По данным МРТ в левой теменной доле и в области заднего рога левого бокового желудочка определяется связанный с сосудистым сплетением желудочка сосудистый клубок.
Подробнее 11 ИЮН МРТ диагностика единичного очага глиозаПациент И. 28 лет обратился к неврологу с жалобами на головные боли. После неврологического осмотра, пациент был направлен на МРТ головного мозга с целью исключения органической патологии.
По данным МРТ головного мозга в белом веществе левой лобной доли определяется единичный очаг глиоза сосудистого генеза, размером 3 мм. Так же отмечается неравномерное утолщение слизистой оболочки в правой и левой верхне-челюстной пазухе с наличием жидкости.
Подробнее 08 ИЮН МРТ диагностика внутренней гидроцефалииПациентка Ш. 83 лет обратилась к районному неврологу с жалобами на снижение памяти, повышенную утомляемость. Пациентка была направлена на МРТ головного мозга с целью исключения различной патологии.
При МРТ головного мозга установлено: МРТ признаки хронической недостаточности мозгового кровообращения; выраженная открытая внутренняя гидроцефалия, свидетельствующая о признаках атрофических изменений в головном мозге.
Подробнее 06 ИЮН МРТ диагностика астроцитомы головного мозгаПациент Ф. 54 лет обратился в ЦМРТ в целью контроля продолженного роста опухоли, т.к. отмечал ухудшение своего самочувствия в течение последнего месяца.
На серии МРТ томограмм головного мозга после внутривенного контрастирования, на фоне постоперационных глиозно-кистозных изменений, отмечается избирательное усиление интенсивности МР сигнала, что свидетельствует о продолженном росте патологического образования.
Подробнее 05 ИЮН МРТ диагностика хиазмально-селлярной опухолиВашему вниманию предлагается клинический случай пациента Е. 53 года, которого беспокоят головные боли и снижение зрения, больше на левый глаз. С данными жалобами обратился к неврологу. Офтальмолог выявил признаки застойных явлений на глазном дне. Пациент направлен на МРТ головного мозга.
На МР-томограммах в хиазмально-селлярной области визуализируется объемное патологическое образование, с анте-, инфра-, супра- и латероселлярным (влево) ростом, однородной структуры, общими размерами 5,7х3,6х4,0 см.
Подробнее 17 МАЙ МРТ диагностика заболеваний сосудовУ пациентки появилась сильная головная боль с однократной потерей сознания, затем постепенно возникли тошнота, рвота, головокружение. На следующий день выполнена МРТ. При МРТ в сосудистом режиме (а, б, в) было выявлено спонтанное внутричерепное кровоизлияние (1) и его причина – аневризма (2) размерами 3х4х6 мм. Госпитализирована в госпиталь. Выполненная в госпитале рентгеновская ангиография (г) подтвердила причину кровоизлияния — аневризму.
Подробнее 17 МАЙ МРТ диагностика передней трифуркацииМужчина 50 лет обратился к неврологу с жалобами на ежедневные головные боли во второй половине дня, в связи с чем был направлен на МР-ангиографию сосудов головного мозга. На полученных изображениях сосудов головного мозга в режиме 3D-TOF определяется вариант отхождения обеих передних мозговых артерий от правой внутренней сонной артерии (передняя трифуркация) и отсутствие визуализации правой позвоночной артерии, что и обуславливает клиническую симптоматику больного.Пациент был направлен на консультацию к неврологу, где ему была назначена специализированная терапия.
Подробнее 09 МАЙ МРТ диагностика микроаденомы гипофизаВашему вниманию представлен клинический случай пациентки с выявленной по данным МРТ микроаденомой гипофиза.
Пациентка Р. 24 лет с жалобами на нарушения менструального цикла обратилась за консультацией к районному эндокринологу. Врач назначил пациентке анализ крови на гормоны гипофиза. В анализах крови было выявлено повышение уровня пролактина (1000 мкМЕ/мл ). Далее, для уточнения характера изменений в гипофизе, пациентка была направлена на МРТ гипофиза с внутривенным контрастированием.
Подробнее 03 МАЙ МРТ диагностика рассеянного склероза у пациента 22 летВашему вниманию представлен клинический случай пациента Л. 22 лет с жалобами на онемение рук, шаткость походки, расстройства зрения. Пациент решил самостоятельно выполнить МРТ головного мозга. На серии МРТ томограмм головного мозга изменения были не выявлены. Сам пациент успокоился и решил к врачам больше не обращаться. Однако мама пациента заметила некоторые симптомы у сына и отвела его к районному неврологу. Невролог, опираясь на отсутствие изменений в головном мозге, трактовал симптомы как признаки переутомления. Мама пациента решила проконсультировать сына дополнительно в стационаре у другого невролога, который заподозрил демиелинизирующее заболевание и назначил МРТ шейного отдела позвоночника.
ПодробнееВопросы о болезнях
Здраствуйте мне 38 лет в феврале 2018г у меня в глазу лопнул сосуд мне посоветовали сделать МРТ головного мозга .Заключение: МР-признаки неспецифического очага белого вещества (до 5мм) правой лобной доли вероятно сосудистого характера . Пролечилась реамберин , актовегин ,вит в12.Мнения невропатологов расходятся один говорит микроинсульт другой вегетососудистая дистония. Что это на самом деле ,? И можно мне лететь за границу на море? Спасибо.
Здравствуйте, Анна!
Скорее всего очаг сосудистого генеза. Да, вы можете ехать на отдых, лечится.
С уважением, врач-нейрохирург,Кондюков Дмитрий Андреевич.
Добрый день. Подскажите пожалуйста,если вам прислать фото и заключение МРТ головного мозга,мсожете дать консультацыю.
Здравствуйте, Снежана!
Да, Вы можете прислать снимки МРТ на наш электронный адрес для получения дальнейшей консультации.
С уважением, администратор Центра.
Добрый день! Мне 48 лет. В последнее время постоянно очень болит голова с левой стороны, от лба к затылку,бывает кружится,с утра болей сильных нет-начинается к обеду и вечером,Бывает все лицо и уши красные (уши аж горят) и изредка тошнит, бывает закладывает уши (лор сказал что сосудистое)Лечилась курсами сначала таблетки Комбилипен,Трентал,Вестикап, затем Кавинтон- результата нет; Далее невролог выписал-
проделала уколы три укола сразу- сосудорасширяющие- Мексикор и еще какой-то и никотинку.Тоже эффекта нет.Пью таблетки от давления лористу Н, вечером Амлодипин 1/4 или 1/2 таблетки, кардио-магнил и оторвастатин. Есть не большие бляшки на шее 20-25%. На щитовидке два маленьких узелка- просто наблюдение эндокринолог. По результату МРТ (делала 03.02.2018) поставлен диагноз:Объемных образований в веществе головного мозга не выявлено.Расширенное пространство Вихрова-Робена левой гемисферы. Признаки легкой, смешанной, заместительной гидроцефалии. Двухсторонний гайморит (лор выписал только капли от аллергического ренита) МР ангиография артерий головного мозга- заключение задняя неполная трифуркация ЛВСА. Гипоплазия интракраниального сегмента левой позвоночной артерии. МР- ангиография вен головного мозга- заключение МРА данные за физиологическое сужение поперечного синуса, левой гемичферы. Подскажите, куда можно обратиться к врачу-неврологу или нейрохирургу,чтоб подобрали правельно лечение? Дополнительное обследование какое пройти? Нужно ли при обращении делать свежий МРТ?
Здравствуйте, Людмила!
Вам необходима консультация невролога. Вы можете записаться к неврологу в нашем Центре по телефону: 89013704509
мне 78лет.Пчуствовал неустойчивасть походки,невролг отправил на МРТ.вот результат- мр картина очаговых изменений вещества головнога мозга дисциркуляторно-дистрофического характера.наружная заместительная гидроцефалия на фоне умуренно выраженной кортикальной биполушарной и церебеллярной атрофии. невролог назначил уколы-мексидол,актовегини церебролизат.Я не подозреваю невролога в некомпетенции.Я хотел узнать как вести себя при этих симптомах что можно что нельзя,я например парюс в парной-парюс всю жизнь и можно ли применят народные средства в лечении,какую диету соблюдать.Спасибо. PS-работаю на компьюторе.
Здравствуйте, Евгений!
В чем Ваш вопрос?
Добрый день!С моим 19-летним сыном произошел несчастный случай: упал на твердую обивку дивана и пробил голову. В итоге наряд Скорой помощи отвез его в больницу, где был поставлен диагноз:Открытая рана волосистой части головы. Ему был сделан снимок головы. И после просмотра снимка хирург сказал сделать МРТ с контрастом, тк. обнаружены в подкорковых структурах справа и слева зоны размером до 12 мм повышенной плотности(сосудистое сплетение). Что это такое? Жалоб у сына нет, профессионально занимается карате уже 14 лет. Но хирург сказал, что спорт придется забыть. Мы в замешательстве,настолько все серьезно?
Здравствуйте, Ольга!
Вышлите,пожалуйста, снимки МРТ на адрес нашей электронной почты.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
Здравствуйте. В июне 2017 у меня была операция по удалению невриномы 35*22*32 мм до размеров 25*10*28мм. После — гамма нож. В мае этого года прошла мрт. Размеры увеличились до 27*22*26мм, в мму справа определяется неправильной эллипсоидной формы новообразование, с распростронением в просвет внутреннего слухового прохода, негомогенное за счет включений кальция , неправильной формы, с четкими неровными контурами. С признаками компрессии преддверно- улиткового, лицевого, тройничкового нервов, моста и мозжечковой ножки справа с отеком белого в-ва в них и смежных отделах правой гемисферы мозжечка. Образование накапливает контраст(гадовист).Мне 52 года. Что это может быть. На консультацию к нейрохирургу я пойду только через неделю. Спасибо, если ответите.
Здравствуйте, Марина!
Вышлите,пожалуйста, снимки МРТ на адрес нашей электронной почты.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
Здравствуйте! У моего мужа несколько месяцев покалывало правое бедро, чаще всего при поднятии тяжестей. А сейчас рези прекратились, но ооявился синяк, диаметром 4 см и прекратилась чувствительность в том месте. Не подскажите, что это может быть? Он сейчас в рейсе, к врачу обратиться нет возможности
Здравствуйте, Анна!
Вашему мужу нужно срочно показаться врачу. Не видя пациента, да еще по скудному описанию жалоб с чужих слов, неправильно назначать лечение.
С уважением, врач-невролог, Васькова Наталья Львовна.
Добрый день. Мне 27 лет. частичное потеря слуха на правое ухо, начала бегать по врачам, прописали Актовигин, Милдронат (таб) особо не помогло , сурдолог говорит что тугоухость смешанного характера, но сделала МРТ головного мозга и выявлено , что в веществе головного мозга визуализируются единичные очаги глиоза, диаметром до 4 мм без перифокального отека, масс эффекта.- начиталась в инете и страшно осознавать что это не лечиться.. слобость , вялость и сонливость у меня лет таки с 15 и головные боли бывали очень редко. В аварию не попадала, травм головы не было. На данный момент у меня шум в ушах, признаки остеохандроза шейного отдела. Это все связано как то или что ?! очень страшно( Каковы прогноз на жизнь?!(( Заранее спасибо.
Здравствуйте, Инна!
Вам показана очная консультация невролога с результатами проведенного обследования для уточнения диагноза и определения дальнейшей тактики ( дообследования и лечения).
С уважением, врач-невролог, Васькова Наталья Львовна.
мне 21 год. у меня рассеянный склероз. опухоль мозга с правои стороны 10мм на 9мм
Здравствуйте, Николай!
Вышлите, пожалуйста, снимки МРТ на адрес нашей электронной почты.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
Моей дочери 33года, болезнь пришла внезапно, начиная с 27 лет жаловалась на сильные головные боли, боли в суставах, особенно с левой стороны, далее это все превратилось в невыносимое существование, боли головы сопровождались со светочувствительностью, болело за глазами что-то, потом все приступы стали сильнее и превратились надень по нескольку раз. Судороги ее всю выворачивало,теряла сознание и на улице, дома , вечером, днем , на работе. Вызывали скорую, наблюдались в поликлинике, в стационаре разводили руками, она замучилась так что стала весить 42 кг, хотя ее вес стабилен ранее был 54 кг, рост 160см. Ее стало трясти без остановки при любой попытке двигаться, сейчас она инвалид 1 группы. Сначало левая старона болела, ножка не поднималась, потом рука, стал болеть позвоночник, спустя 2 года и правая нога перестала подниматься. Конечно сейчас мы ей помогаем больше питаться, ЛФК, массаж но все четно. МРТ пишут Мелкоочаговая лейкоэнцефалопатия, вероятно, сосудистого генеза. Церебральная атрофия. Диагноз ставят Спастическая наследственная параплегия в сочитании с нарушением тазовых органов, симптоматическая эпилепсия с частыми припадками. В нейрохирургии осмотрели пишут больше данных за насл. лейкодистрафию, синдром спастического тетрапареза, тазовыми нарушениями, эписиндром, нейропатический болевой синдром. Плюс Деменция умеренной степени. Вообщем куча диагнозов, а лечение препарат от эпилепсии и если тянет жилы прописали Бакласан. ей сейчас и не лучше и не хуже, просто парой по 2-3 деня спит и спит и спит. Давление 90/60, говорит что болит то там то тут, восновном позвоночник, копчик, тянет пальцы рцк прям выкручивает как деревянные. То плачет, то бессоница, то не разбудишь. Говорить что тело чувстыует такую усталость что буд то таскала ведра. Под ногами парой и тапок не видит, руки и не могут кнопку нажать такое бессилие. Врачи помочь ничем не могут, а жить надо, все же молодая, ранее она работала, родила дочь. Училась отлично-хорошо и в институте. Что так резко привело ее в такое состояние и она сама не может понять. Может вы можете нам что-то посоветовать в плане реабилитации. Заранее спасибо.
Здравствуйте, Тамара!
К сожалению, наш Центр не занимается лечением и реабилитацией больных с таким диагнозом.
С уважением, врач-невролог, Гуляева Юлия Святославовна.
здравствуйте,мне 37 лет ,начали мучать головные боли в висках,давящие на глаза,боль не проходящая была около месяца,и постоянный шум в ушах,невролог назначил снимок шейных позвонков,узи сосудов головного мозга и ээг,также сказала пока проколоть эмоксипин,боль прошла,но сейчас снова тоже самое,рентген шейного отдела показал остеохондроз 1 степени,узи сосудов всё хорошо,а ээг показало признаки фокальных изменений в левых прередне-средне-задне височных отведениях и правых отведениях с наличием единичных спайк волн,невролог направляет на мрт и под вопросом ставит объемное образование,пока жду очередь мрт и уже не знаю что думать,серьезно ли всё это по результату ЭЭГ судя?
Здравствуйте, Марина!
Вам показана МСКТ головного мозга и очная консультация невролога.
С уважением, врач-невролог, Васькова Наталья Львовна.
Здравствуйте . Девочка 18 лет . 5 месяцев тому назад полная потеря зрения на 20 дней .Потом после резкой боли в глазных яблоках зрение полностью вернулось ,но на данный момент опять повторилось. Девушка проживает в Иракской республике Курдистан . Доктора данной страны разводят руками . Проведены некоторые обследования в том числе МРТ . Обращались в офтальмологические клиники Курдистана.В России результаты обследований посмотрели врачи одной офтальмологической клиники в Краснодаре и посоветовали обратиться к неврологам ,так как в одном из заключений описаны признаки поражения зрительных нервов. Подскажите пожалуйста,какие обследования нужны дополнительно и есть ли возможность посмотреть заключения обследований докторами вашей клиники?Если есть хоть какой нибудь шанс ,готовы приехать в клинику . Заранее спасибо . С уважением ,Виктория .
Здравствуйте, Виктория!
Вышлите, пожалуйста, результаты обследований для уточнения необходимого дообследования. Вам показана очная консультация невролога!
С уважением, врач-невролог, Васькова Наталья Львовна.
Здравствуйте, мне 37 лет. Остеохондроз ставили, и шеи и грудного отдела позвоночника и поясницы, есть протрузии. Были сильные боли в спине,шеи, постоянное головные боли, терял сознание, направили на МРТ головного мозга.
В области основания базальных ядер справа, а также в островковой доле слева, определяются единичные кистовидно расширенные периваскулярные пространства Робина-Вирхова, максимальное размером до 0,9х0,4см.
Подскажите пожалуйста, что это такое, чем опасно и как лечить
Здравствуйте, Евгений!
Вам показана очная консультация невролога.
С уважением, врач-невролог, Васькова Наталья Львовна.
Добрый день. Меня зовут Анна,мне 63 года. По результатам мрт головного мозга дали вот такое заключение: МР-картина множественных патологических очагов головного мозга вторичного генеза. МР-признаки дисциркуляторной энцефалопатии сосудистого генеза. Что это может значить и что нужно делать дальше? Жду вашего ответа. Заранее спасибо.
Добрый день, Анна!
Вышлите, пожалуйста, снимки МРТ на адрес нашей электронной почты.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
мр картина объемного образования селлярной области, структурных изменений мышц правого глазного яблока, лакунарных кист дисциркуляторного характера, очаговых изменений в веществе мозга гидроцефалии.Пациентке 57, перенесла 2 года назад операцию по удалению меланомы на пятке, после проходила курс иммунотерапии, сейчас образовалась увеличен лимфоузел в паху, на данный момент проходит обследование, назначена операция. Беспокоит повышенное давление 200/130, правый глаз двоит изображение, глаз прикрыт-раньше такого не было, нижняя губа перестала чувствовать, по-этому сделали мрт, расшифруйте мрт,
Здравствуйте, Тамара!
Вышлите,пожалуйста, снимки МРТ и КТ на наш электронный адрес.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
Здравствуйте. Меня зовут Ольга, мне 45 лет. Где-то пару недель назад начались сильные головные боли, сначала болело в области лба, глаз. Боль давящая или распирающая,слабость. При поворотах головой головокружение. Температура нормальная. Потом боль появилась под левой челюстью, болело слева и при глотании. Пошла к ЛОРу. Врач сказала, что по ее части ничего не видит. Сделали узи и обнаружили увеличение 2 подчелюстных лимфоузлов слева – 9 мм и 14 мм. Назначили горлоспас и цефадокс на 5 дней Горло перестало болеть и прошла боль под челюстью. Вскоре появился отек под левым глазом и синева, легкое онемение вокруг глаза, возле носа до верхней губы. Пошла к окулисту: макулопатия обеих глаз, больше слева (обнаружили еще год назад). Назначили капли медролгин. Далее: консультация невропатолога. Сказал, что симптомы не дифференцированы: назначил 5 дней уколы олфена, нормовен, серрату. Появилась тошнота. Начала промывать нос, капать, отек уменьшился. Снова пошла к ЛОРу, исключили синусит, снимок показал, что патологий в пазухах нет. Головокружение и тошнота остались, практически каждый день возникает давящая головная боль. Сделали МРТ. Единичные мелкие (d до 3-5 мм) умеренно интенсивные субкортикальные очаги слева в лобной и теменной долях, более вероятно, “сосудистого” характера, достоверно не дифференцирующиеся на Т1-ВИ (хронического ишемического или обусловлены развитием кризовой васкулопатии мелких артериол ?) Легкое локальное “муфтообразное” расширение субарахноидальных пространств зрительных нервов в ретробульбарных сегментах, несколько больше выраженное справа. В заключении – характерно для хронической доброкачественной внутричерепной гипертензии.В остальном супра- и субтенториальные структуры головного мозга без очаговых и диффузных изменений интенсивности МР-сигнала (очень мелкие “шапочки” гиперинтенсивного МР-сигнала во FLAIR-ИП в области передних рогов боковых желудочков – гранулярный эпендимит- норма для лиц старше 40 лет). В остальном головной мозг без МРТ-признаков очаговой и объемной патологии. Признаки гидроцефалии отсутствуют. Другие признакиХВЧГ явно не выражены. Врожденная извитость позвоночных артерий в интракраниальных отделах, гипоплазия правой позвоночной артерии (подтверждено узи-доплерографией). В 2016 году МРТ шейного отдела позвоночника:MR-признаки остеохондроза шейного отдела позвоночника в ПДС С2-С7. Левосторонние парафораминальные протрузии м/п дисков С3/С4, С4/С5, циркулярная протрузия м/п диска С5/С6, левосторонние фораминальные протрузии м/п дисков С6/С7. С7/Th2 с компрессией дурального мешка и корешковых каналов спинномозговых нервов. ОАК – норма, Т4, ТТГ, АТ к ТПО – норма, узловой зоб без увеличение щитовидной железы, в январе делала ФГДС желудка и ретроманоскопию – без патологий. Хотелось бы узнать, что со мной. Заранее благодарю за ответ.
Здравствуйте, Ольга!
Вам необходима очная консультация невролога.
С уважением, врач-невролог, Васькова Наталья Львовна.
Здравствуйте, сделали МРТ, в котором указано, что «На серии МР-томограмм, взвешенных по Т1 и Т2 в аксиальной, корональной и сагиттальной плоскостях, визуализированы суб- и супратенториальные структуры.
Перивентикулярно боковым желудочкам выявляются зоны измененного МР-сигнала, по характеристикам соответствующие серому веществу головного мозга, с наличием мелких узелков до 5 мм, более вероятно, обусловленные очаговой субэпендимальной гетеротопией серого вещества.
Боковые желудочки симметричные, не расширены. III и IV желудочек без особенностей. Субарахноидальное пространство выражено неравномерно, умеренно расширено по конвекситальной поверхности лобных и теменных долей. Отмечается расширение лериваскулярных пространств по ходу пенетрирующих сосудов. В задней черепной ямки выявляется ретроцеребеллярная арахноидальная киста размерами 68x32x42 мм. Базальные цистерны не деформированы.
Срединные структуры не смещены.
Хиазмально-селлярная область и мостомозжечковые углы без особенностей.
Миндалины мозжечка расположены на уровне большого затылочного отверстия.
Околоносовые пазухи пневматизированы. Заключение:МР-признаки субэпендимальной (перивеытрикулярной) гетеротопии
серого вещества. МР-картина ретроцеребеллярной арахноидальной кисты, расширения наружных ликворных пространств» Мучают постоянные головные боли.
Скажите, нужно ли лечение? и если да, то какое? Ответ прошу выслать по адресу [email protected]. Спасибо
Здравствуйте, Ольга!
Вышлите, пожалуйста, снимки МРТ на наш электронный адрес.
С уважением, врач-нейрохирург, Кондюков Дмитрий Андреевич.
добрый день
у меня редкое заболевание таблица Менделеева позвонка врачи наши не хотят прыгать через профессоров природное заболевание не пишут в картах медицины .По факту обновления позвонка кальций при вращается воду и с тикает в кисту позвоночную у меня 12 грыж остеопороз артрит спондилез !!! подскажите есть возможность вылечить это меня беспокоит киста боли на против лопаток оно увеличивается годами позвонки темнеют ребра болят тоже мне 47лет поставили 2 группу инвалидности иногда ног не чувствую прошу Вас помочь
Здравствуйте, Михаил!
Вышлите,пожалуйста, снимки МРТ на наш электронный адрес.
С уважением, врач-невролог, Васькова Наталья Львовна.
множественные очаговые изменения белого вещества головного мозганаружная заместительная гидроцефалия 3 желудочек до 4 мм мне 52 года сильные головные боли зрение падает что это ичем лечить цераксон пантогам глиатилин что лучше не пью не курю
Здравствуйте, Светлана!
Вам показана очная консультация невролога для уточнения причин головных болей и лечения.
С уважением, врач-невролог, Васькова Наталья Львовна.
Здравствуйте. Мне 43 года. С 2015 г. беспокоят боли в шее и голове (затылок и висок справа), ощущение «распирания» в голове, чувство давления на правый глаз. МРТ ШОП от 2015 г.: гемангиома С5, тотально выполняющая тело позвонка. МРТ головного мозга от 20.07.2017: МР-признаки слабого расширения наружных ликворных пространств лобно-теменной области заместительного характера.В 2017 начало снижаться зрение, появились «слепые пятна». Заключение нейроофтальмолога от 18.09.2017 г.: начальная стадия застойного диска зрительного нерва обоих глаз (более выражена слева). Заключение от 16.01.2018 г.: умеренно выраженная стадия застойного диска зрительного нерва обоих глаз (более выражена слева). Отмечается отрицательная динамика по остроте зрения, периметрии и глазному дну по сравнению с офтальмологическим статусом от 18.09.2017 г. В течение месяца принимала цитофлавин и в течение 10 дней — диакарб. Заключение от 13.03.2018: Умеренно выраженная стадия застойного диска зрительного нерва обоих глаз (более выраженная слева). Маятникообразный горизонтальный нистагм OU. Тортиколис вправо. Отмечается положительная динамика по остроте зрения и периметрии по сравнению с офтальмологическим статусом от 16.01.2018
Отмечается быстрая утомляемость, слабость, сонливость, тошнота, красные круги под глазами.
По данным МРТ нет повода для беспокойства.Может ли гемангиома так влиять на зрительные нервы?К какому специалисту обратиться, чтобы выявить причину застойных дисков?
Здравствуйте, Ольга!
Вам показана очная консультация невролога. После осмотра врач сможет определить объем дополнительного обследования ( при необходимости( и лечения.
С уважением, врач-невролог,Васькова Наталья Львовна.
Глиозные изменения головного мозга
Глиоз: причины и механизмы развития
Глиальная ткань – это одна из трех разновидностей тканей головного мозга (наряду с нейрональной и эпендимальной), которая по сути является соединительной тканью, в норме она составляет около 40% объема ГМ. Ее функция –сохранение самой структуры головного мозга, обеспечение поступления питательных веществ к главным клеткам мозга — нейронам, а также физическая защита нейронов и придание им определенного положения. По мере того, как нейроны гибнут в результате естественных или патологических причин, они замещаются глиозной тканью.
Глиозом называется патологическое разрастание глиозной ткани, появление крупных единичных или множественных очагов соединительной ткани (по виду они напоминают рубцы) в структурах головного мозга. Глиозные клетки, хоть и замещают погибшие клетки-нейроны, однако не могут в полной мере выполнять их функции, поэтому в результате недостатка механизмов передачи нервных импульсов развивается неврологическая симптоматика. Появление глиозных очагов приводит к тому, что нарушается нормальное функционирование мозга – у пациента ослабевает внимание и память, нарушаются умственные процессы, речь и движения становятся неуверенными.
Такие нарушения неизбежны в результате естественного старения организма, однако встречаются случаи преждевременного патологического разрастания глиозных очагов в структурах головного мозга людей молодого и среднего возраста. В исключительно редких случаях у человека может наблюдаться врожденное замещение нейронов глиальными клетками.
Природа возникновения глиозных изменений головного мозга может быть разной. К ускоренной гибели нейронов и разрастанию соединительной ткани могут приводить заболевания мозга, такие как эпилепсия, энцефалит, рассеянный склероз, также причинами глиоза могут стать сосудистые нарушения, гипертония, анемия, травмы и отеки головного мозга. Провоцирующими факторами являются: наследственность, пожилой возраст, чрезмерное употребление жирной пищи и неправильный образ жизни в целом.
Диагностика глиозных изменений головного мозга
Наличие небольших одиночных очагов глиоза в головном мозге, как правило, долго никак не проявляет себя, и пациент может долгое время не подозревать о возникновении патологии. Заметить глиозные очаги можно только при проведении обследования головного мозга по другим причинам.
При наличии множественных, крупных глиозных образований появление характерной симптоматики неизбежно. При наличии таких признаков как головные боли, скачки артериального давления, головокружения, повышенная утомляемость, расстройства интеллекта, нарушения речи, слуха, зрения, парез, выраженные психические расстройства и т.п. необходимо обязательно пройти сканирование на магнитно-резонансном томографе.
МРТ является главным инструментом, приоритетным методом, позволяющим определить наличие глиозных изменений в головном мозге, определить их количество, оценить размер и сроки образования, масштаб гибели нейронов.
Соединительная ткань имеет особую структуру, поэтому отличается от других видов мягких тканей особым типом сигнала, поэтому именно мрт позволяет точно установить очаги глиоза в различных структурах мозга. На снимках МРТ они выглядят как участки светлого цвета неправильной формы. В зависимости от вида глиоза они могут быть в виде волокон, островков, пятен, которые располагаются в определенных зонах головного мозга (вдоль сосудов, пораженных атеросклерозом), под оболочками ГМ, на внутренней оболочке желудочков, хаотично или упорядоченно.
Еще одно достоинство магнитно-резонансного сканирования мозга – возможность не только установить сам факт наличия глиозных изменений, но и установить их причину. На снимках будут четко видны зоны мозга с недостаточностью питания вследствие нарушения проходимости сосудов, закупоренных атеросклеротическими бляшками, участки гематомы, воспалительные процессы, новообразования (кисты, опухоли). Метода, позволяющего заменить уже сформировавшуюся соединительную ткань на новые нервные клетки, пока не существует в медицине. Однако, МРТ здесь сыграет важную роль – позволит установить причину развития данного заболевания для того, чтобы устранить провоцирующий фактор и предотвратить усугубление ситуации.
Глиоз — обзор | ScienceDirect Topics
ТРИГГЕРЫ АСТРОЦИТНОГО ГЛИОЗА
Хотя астроцитарный глиоз в ответ на повреждение ЦНС изучается в течение многих лет, конкретные причины и механизмы, приводящие к гипертрофии астроцитов, гиперплазии и увеличению продукции GFAP, остаются неизвестными. Некоторые исследователи предположили, что глиоз астроцитов может быть вызван дегенерацией разорванных трактов аксонов, возможно, вторичной по отношению к дегенерации Валлера или ретроградным изменениям аксонов, основываясь на наблюдениях за распространением иммунореактивности GFAP по путям белого вещества вдали от места травмы до позвоночника. спинной или дорсальный корешок (Barrett et al., 1981, 1984; Murray et al., 1990), или отложенное увеличение мРНК GFAP у мутантных животных с замедленной дегенерацией Валлера (Steward and Trimmer, 1997). Поражение одной стороны головного мозга приводит к глиозу во всем ипсилатеральном полушарии (Berry et al., 1983; Mathewson and Berry, 1985), и иногда глиоз также распространяется на области контралатерального полушария (Amaducci et al., 1981; Ludwin, 1985; Schiffer et al., 1986; Takamiya et al., 1988; Xie et al., 1995; Fitch and Silver, 1997a), предполагая, что аксоны, охватывающие полушария головного мозга, могут вносить вклад в глиальные реакции на сторона, противоположная травме.Различные цитокины и другие молекулы были вовлечены как возможные триггеры глиоза астроцитов, включая IL-1 (Giulian and Lachman, 1985; Giulian et al., 1988; Rostworowski et al., 1997), IL-6 (Chiang et al., 1994; Klein et al., 1997), тромбин (Nishino et al., 1993, 1994), цилиарный нейротрофический фактор (CNTF) (Kahn et al., 1995, 1997; Winter et al., 1995), эндотелин-1 ( Hama et al., 1997) и TNF-альфа (Rostworowski et al., 1997). Такие факторы, которые потенциально играют роль в глиозе астроцитов, могут происходить из самих поврежденных астроцитов, эндогенных сывороточных факторов, активированных микроглиальных клеток или вторгающихся воспалительных клеток с периферии.
Хотя, безусловно, важно идентифицировать молекулы, которые могут играть роль в индуцировании глиоза астроцитов, становится все более очевидным, что использование активации GFAP и клеточной гипертрофии в качестве маркеров функционально «плохого» глиоза (как это было сделано в большинстве исследований) может быть ограниченная выгода. Наблюдения нескольких исследователей предполагают, что глиоз астроцитов может быть гетерогенным (Miller et al., 1986; Hill et al., 1996), особенно в связи с производством ингибирующих молекул (McKeon et al., 1991, 1995; Fitch and Silver, 1997a; Fitch et al., 1999). Хотя некоторые реактивные астроциты, особенно те, которые находятся рядом с эпицентром раны, были связаны с образованием граничных молекул, очевидно, что не все астроциты с морфологическими характеристиками реактивных астроцитов (т. Е. Повышенным GFAP) присутствуют в областях с повышенным уровнем молекул внеклеточного матрикса (McKeon et al., 1991, 1995; Pindzola et al., 1993; Levine, 1994; Davies et al., 1997; Fitch and Silver, 1997a; Fitch et al., 1999). Эти наблюдения предполагают, что, возможно, не все астроциты, которые реагируют на повреждение, играют роль в отказе регенерации ЦНС, и что только те астроциты, которые связаны с тормозными молекулами, вредны для роста аксонов, в то время как те, которые находятся дальше от поражения, могут быть более способствующими прорастанию нейритов , функциональная пластичность и дистанционная регенерация.
Глиальные реакции на черепно-мозговую травму, инсульт, роль глиоза — лабораторные исследования — Nedergaard Lab
URMC / Labs / Nedergaard Lab / Lab Focuses / Глиальные реакции на травматическое повреждение головного мозга, инсульт, роль глиозаОткровенное поражение центральной нервной системы (ЦНС) в форме черепно-мозговой травмы (ЧМТ) или инфаркта мозга (инсульта) подвергает различные клеточные популяции головного и спинного мозга экологической катастрофе.Клеточные мембраны и кровеносные сосуды разрываются, распространяя цитотоксические и воспалительные агенты во внеклеточное пространство и нарушая кровоснабжение, в то время как разрыв гематоэнцефалического барьера приводит к притоку нефильтрованных компонентов крови, вызывающих нарушение нормального клеточного метаболизма. Такие травмы приводят к очень разным функциональным результатам в зависимости от их местоположения и тяжести и часто приводят к непреодолимым физическим и эмоциональным страданиям, когнитивному снижению в случае травм головного мозга и возникновению деменции.Примечательно, что несмотря на то, что большинство популяций нейрональных клеток не регенерируют, травма ЦНС часто сопровождается восстановлением нарушенной сенсорной и моторной функции. Но на клеточном уровне, как наиболее чувствительная ткань организма реагирует на травму и какие факторы способствуют посттравматической нейропластичности?
Ex vivo изображение диффузного микроинфаркта, вызванного инфузией кристаллов холестерина в сонную артерию.
GFAP (синий) указывает на реактивные астроциты, CD68 (красный) указывает на активированную микроглию.
Ключевые проблемы трансляционной нейробиологии — это отсутствие понимания роли, которую глиальные клетки играют в нормальной физиологии, и, как следствие, последствий астроцитарной дисфункции в патофизиологических состояниях. Поскольку сложные когнитивные и исполнительные функции в значительной степени зависят от взаимосвязанной нейронной сети мозга, локальные травмы в одной области часто оказывают глубокое глобальное влияние на функцию. Наш интерес к роли астроцитов после повреждений ЦНС проистекает из того факта, что они представляют собой терапевтические мишени, занимающие первостепенное место: расширяя процессы, которые взаимодействуют с кровеносными сосудами и нейронными синапсами, а также формируют физически связанные сети с другими астроцитами, они эффективно сочетать нутритивную поддержку с передачей и обработкой информации.Более того, появляющиеся данные свидетельствуют о том, что роль астроцитов более активна и динамична, чем считалось ранее. Было показано, что астроциты осуществляют контроль над направлением мозгового кровотока (гиперемия), опосредуют клиренс патологически значимых белков (глимфатическая система) и участвуют в сложных нейроглиальных сигнальных взаимодействиях.
Модель грызунов легкой и средней степени тяжести Hit and Run
с закрытой ЧМТ черепа, показывающая динамику реактивного глиоза.
Реактивные астроциты окрашиваются на GFAP (красный), а активированные микроглии окрашиваются на CD68 (зеленый).
(Изображение и концепция Hit and Run TBI
любезно предоставлены доктором Цзегуангом Реном, доктором медицины. ).
Несмотря на то, что патогенез поражения ЦНС широко распространен, все еще плохо изучен. Эксперименты в нашей и других лабораториях показали, независимо от источника, острые повреждения ЦНС вызывают аналогичный клеточный ответ: астроциты и другие глиальные клетки, такие как микроглия, активируются в процессе, известном как реактивный глиоз
.Хотя этот феномен, впервые описанный почти сто лет назад, характерен для ряда нейропатологий и широко изучен, точная функция глиоза (патологический или защитный), механизмы его возникновения и его временная значимость для терапевтических вмешательств после травмы ДНС остаются спорными.
Работа в нашей лаборатории, а также аналогичные результаты независимых лабораторий показали, что в ответ на травму тканей или нефизиологические изменения внеклеточной среды астроциты увеличиваются, увеличиваются в количестве, высвобождают сигнальные молекулы дальнего действия, такие как АТФ, и повышают экспрессию белки промежуточных филаментов (например,г. GFAP), которые важны для модификации клеточной структуры и астроцитарных сетей. Картина глиоза еще более усложняется результатами экспериментов на животных моделях черепно-мозговой травмы, травмы спинного мозга и инсульта, которые показали противоречивые результаты относительно его природы. Эти исследования показывают, что активация астроцитов представляет собой как защитную реакцию, направленную на уменьшение и прекращение распространения повреждений от первичного повреждения, так и патологический процесс, который вызывает вторичное повреждение и глубокие нарушения здорового функционирования.
Деполяризация AQP4 в реактивных астроцитах
после Hit and Run закрытый череп TBI.
Хотя точная роль глиоза еще не известна, разработка животных моделей травм и болезней в огромной степени помогла в характеристике и интерпретации патологического значения глиальных реакций на повреждения ЦНС. Однако обычно успешное лечение животных не может предсказать человеческие результаты. Одна из основных проблем — отсутствие моделей, которые точно воспроизводят соответствующие клинические особенности патологий ЦНС.Например, многие животные модели ЧМТ — основной причины смерти, связанной с травмами в Соединенных Штатах, — полагаются на фиксацию головы и раскрытие черепа для облегчения прямого коркового повреждения, а также на большие дозы анестезии. По большому счету, эти травмы не воспроизводят один из наименее изученных компонентов распространенных патологий ЧМТ, то есть контрацептурные травмы, которые приводят к повреждению как полушария удара, так и контралатеральной стороны.
В ответ на эти недостатки мы разработали новую модель закрытой черепно-мозговой травмы Hit and Run
, которая воспроизводит клинические признаки ЧМТ, включая контракупные повреждения.Интересно, что мы обнаружили, что умеренные и тяжелые ушибы неповрежденного черепа грызуна привели к широко распространенному астроглиозу (как на ипси-, так и на контрлатеральном полушарии) и значительному нарушению типично поляризованного паттерна экспрессии астроцитарного водного канала аквапорина-4 (AQP4). ).
Схема и трехдневное репрезентативное изображение модели диффузного лакунарного инфаркта у грызунов.
Реактивные астроциты обозначены GFAP (синий), активированная микроглия — CD68 (красный).
Также отсутствуют модели диффузного инсульта, патологии, которая характеризуется снижением когнитивных функций и, как полагают, затрагивает до 30% более широкого пожилого населения. Чтобы лучше понять, мы разработали модель, в которой мы вводили кристаллы холестерина, чтобы вызвать множественные мини-инсульты (диффузные лакунарные инфаркты) у грызунов. В результате неожиданного открытия мы отметили, что в отличие от типичного макро-инфаркта, при котором гибель нейронов в пораженной ткани в значительной степени завершается в течение нескольких часов, микроинфаркт вызывает замедленную гибель нейронов, которая постепенно прогрессирует от ~ 35% через 3 дня до ~ 60% через 28 дней. дней.Подобно нашим выводам из TBI «Hit and Run», этот временной ход совпал с широко распространенным астроглиозом и соответствующими глобальными нарушениями поляризации AQP4. Такие данные предполагают, что специфические для повреждений реакции астроцитов могут быть ключом к пониманию того, как локализованное повреждение ткани может привести к хронической гибели клеток и глобальной дисфункции.
Следовательно, неудивительно, что астроциты играют важную роль в патогенезе различных болезненных состояний, включая первичные и вторичные стадии травматического повреждения или церебрального инфаркта.Текущая работа сосредоточена на выявлении терапевтических окон для изменения степени астроглиоза, вызванного травмой, а также на оценке функциональных последствий нарушения патологически значимого клиренса растворенных веществ через глимфатический путь.
Дополнительная литература
Модель закрытой черепно-мозговой черепно-мозговой травмы (ЧМТ) «Hit & Run» выявляет сложные закономерности посттравматической дисрегуляции AQP4 . Ren Z, Iliff JJ, Yang L, Yang J, Chen X, Chen MJ, Giese RN, Wang B, Shi X, Nedergaard M.J Cereb Blood Flow Metab. 2013 июн; 33 (6): 834-45.
Когнитивный дефицит и отсроченная потеря нейронов на мышиной модели множественных микроинфарктов . Ван М., Илифф Дж., Ляо Ю., Чен М. Дж., Шинсеки М. С., Венкатараман А., Чунг Дж., Ван В., Недергаард М. Дж. Neurosci. 2012 декабря 12; 32 (50): 17948-60.
Астроцитарные полуканалы CX43 и щелевые соединения играют решающую роль в развитии хронической невропатической боли после повреждения спинного мозга . Чен MJ, Кресс Б., Хан X, Молл К., Пэн В., Джи Р. Р., Недергаард М.Глия. 2012 ноя; 60 (11): 1660-70.
Критическая роль коннексина 43 во вторичном распространении травматического повреждения спинного мозга . Хуанг К., Хан Х, Ли Х, Лам Э, Пэн В., Лу Н., Торрес А., Ян М., Гарре Дж. М., Тиан Г. Ф., Беннетт М. В., Недергаард М., Такано Т. Дж. Neurosci. 2012 7 марта; 32 (10): 3333-8.
Сужение перицита после инсульта: решение еще не принято . Vates GE, Takano T, Zlokovic B, Nedergaard M. Nat Med. 2010 сентябрь; 16 (9): 959.
Центральная роль коннексина 43 в прекондиционировании гипоксии .Лин Дж. Х., Лу Н., Кан Н., Такано Т., Ху Ф, Хан Х, Сюй К., Ловатт Д., Торрес А., Виллеке К., Ян Дж., Кан Дж., Недергаард М. Дж. Neurosci. 2008 16 января; 28 (3): 681-95.
Корковая депрессия распространения вызывает гипоксию тканей и совпадает с ней . Takano T, Tian GF, Peng W, Lou N, Lovatt D, Hansen AJ, Kasischke KA, Nedergaard M. Nat Neurosci. 2007 июн; 10 (6): 754-62.
Ангиогенное ингибирование снижает кровоизлияние в зародышевый матрикс . Ballabh P, Xu H, Hu F, Braun A, Smith K, Rivera A, Lou N, Ungvari Z, Goldman SA, Csiszar A, Nedergaard M.Nat Med. 2007 Апрель; 13 (4): 477-85.
Этот проект финансируется Национальным институтом неврологических расстройств и инсульта NIH. ( Неудача клиренса метаболитов в модели мультилакунарных инфарктов
).
Соавторы проекта:
Д-р Энтони Петралья, д-р Зегуанг Рен
«вернуться ко всем проектам
Реактивный глиоз и некроз | Инициатива по опухолям головного мозга | Онкологический центр им. Сильвестра
Когда вы страдаете черепно-мозговой травмой, страдаете от такого состояния, как инсульт или рассеянный склероз, или подвергаетесь облучению мозга, у вас может развиться реактивный глиоз или некроз.
Некроз — гибель клеток. К сожалению, некроз нельзя обратить вспять, но некоторые методы лечения могут остановить распространение некроза на другие клетки.
Глиоз возникает, когда ваше тело создает больше или больше глиальных клеток (клеток, которые поддерживают нервные клетки). Эти новые глиальные клетки могут вызывать рубцы в вашем мозгу, которые влияют на работу вашего тела.
Хотя это не опухоли головного мозга, некроз и глиоз могут вызывать симптомы, похожие на опухоли головного мозга.
Симптомы могут включать:
- Депрессия
- Галлюцинации
- Потеря или ухудшение памяти
- Изменения личности
- Изъятия
- Проблемы с когнитивной функцией
Специалисты Инициативы по опухолям головного мозга предлагают варианты лечения реактивного глиоза и некроза.Используя передовой уход, они работают над уменьшением рубцов от глиоза и остановкой некроза, улучшая работу мозга.
Почему выбирают онкологический центр им. Сильвестра?
Один из 71 онкологических центров США, назначенных NCI. Sylvester — один из двух онкологических центров во Флориде, признанных Национальным институтом рака. Команда заслужила это звание благодаря своей выдающейся работе по проведению исследований в своих лабораториях, лечению пациентов в своих клиниках и больницах и работе с сообществами, нуждающимися в медицинском обслуживании, с помощью инновационных стратегий профилактики.
Новаторское лечение опухолей головного мозга . Эксперты из Онкологического центра Сильвестра и UHealth составляют одну из крупнейших и наиболее полных групп по лечению опухолей головного мозга в Соединенных Штатах. Благодаря многопрофильному сотрудничеству наша команда использует инновационные процедуры, такие как трепанация черепа в сознании, радиохирургия Gamma Knife® и многие другие методы. Мы используем наименее инвазивные нейрохирургические методы как для взрослых, так и для детей, что сокращает время восстановления и существенно улучшает качество вашей жизни.
Специализированные специалисты по опухолям головного мозга . Ваша медицинская бригада состоит из врачей-специалистов и исследователей, занимающихся лечением опухолей головного мозга. В вашу команду могут входить нейрохирурги, нейроонкологи, онкологи-радиологи, невропатологи и другие врачи, которые занимаются исключительно лечением опухолей головного мозга. Их многолетний опыт и знания помогут вам подобрать для вас подходящее лечение.
Инновационные исследования, которые меняют будущее лечения опухолей головного мозга .Как единственный академический медицинский центр в этом районе, мы находимся на переднем крае лечения и исследований опухолей головного мозга. Как пациент, вы также имеете доступ к инновационным исследованиям и последним клиническим испытаниям. Наши текущие трансляционные и клинические исследования привели к появлению многообещающих методов лечения, таких как вакцина с белком теплового шока и таргетных методов лечения, разработанных для вашего конкретного типа опухоли головного мозга.
Международные лидеры в области лечения опухолей головного мозга . Мы играем жизненно важную роль в обществе благодаря нашим новаторским исследованиям и заботе о пациентах во Флориде, Карибском бассейне, Центральной и Южной Америке.Мы превращаем Майами в столицу здравоохранения Северной и Южной Америки. Мы создаем один из ведущих центров по лечению опухолей головного мозга в стране.
Хирургическая экспертиза . Мы проводим тысячи операций по удалению опухолей головного мозга каждый год и лечим больше опухолей головного мозга, чем любой другой медицинский центр во Флориде. Наши опытные нейрохирурги постоянно разрабатывают новые методы лечения. От минимально инвазивных операций на позвоночнике до краниотомии в сознании — мы предлагаем уникальные операции, которых нет больше нигде в регионе.
Консьерж-сервис . Нашим пациентам не нужно во всем разбираться в одиночку. Вам назначен координатор консьержа, который будет помогать вам и вашей семье, пока вы находитесь под нашей опекой. Они свяжут вас с другими поставщиками медицинских услуг, которые могут вам понадобиться, проведут вас через процесс операции и могут ответить на любые вопросы, которые могут возникнуть у вас или вашей семьи.
границ | Глиоз и нейродегенеративные заболевания: роль ПЭТ и МРТ
Введение
Селективная корковая или подкорковая атрофия, гибель и усыхание нейронов характеризуют патологические особенности различных нейродегенеративных заболеваний и нарушений головного мозга (Chi et al., 2018).
Тем не менее, исключительно нейронцентрические подходы к невропатологическим явлениям не вернули новых достижений в профилактике и терапии заболеваний головного мозга (Verkhratsky et al., 2014). Этот пробел обусловлен сложностью нейронных сетей, которую нельзя объяснить только нейрональной активностью, поскольку исследовательские усилия направлены на различные участники центральной нервной системы (ЦНС): глии (Papa et al., 2014).
Глиальные клетки, в основном представленные микроглией и астроцитами, являются ключевыми компонентами для развития и поддержания функций и схем мозга.Клетки микроглии соответствуют резидентным в мозгу макрофагам, играющим важную роль в синаптической обрезке, восстановлении ЦНС и, главным образом, в качестве клеточных медиаторов нейровоспаления, характерного для различных заболеваний мозга (Colonna and Butovsky, 2017). Вместо этого астроциты, первоначально предназначенные для поддержки нейрональной активности, теперь приобрели центральную роль в функции мозга, например, являясь частью концепции трехчастного синапса и глиотрансмиссии, поскольку они влияют на нейронную коммуникацию и пластичность (Pérez-Alvarez and Araque, 2013).
Все больше данных подтверждают роль измененной глиальной функции как основного динамического признака психиатрических и неврологических расстройств (Garden and Campbell, 2016).
По мере того, как фармацевтические усилия начинают сосредотачиваться на конкретных глиальных мишенях, ограничивающим шагом в знаниях является отсутствие валидированных биомаркеров для долгосрочной оценки и мониторинга глиоза, поддерживающих клиническое ведение и потенциально определяющих лучших ответчиков на клеточно-специфические препараты (Garden and Campbell, 2016 ).
Соответственно, за последние 15 лет резко возрос интерес к разработке новых методов исследования активации глии и, в более общем плане, нейровоспаления. Нейровизуализация предлагает широкий спектр неинвазивных или минимально инвазивных методов для характеристики нейровоспалительных процессов.
Среди различных методов визуализации неинвазивные функциональные измерения мозга с использованием позитронно-эмиссионной томографии (ПЭТ) и подробная морфофункциональная информация, полученная с помощью магнитно-резонансной томографии (МРТ), оказались более привлекательными для трансляционных целей, поскольку они используются как в доклинических, так и в клинических условиях.
В этом контексте гибридный сканер ПЭТ / МРТ представляет собой наиболее продвинутый инструмент для молекулярной визуализации, сочетающий функциональную специфичность радиоактивных индикаторов ПЭТ (например, нацеливание на метаболизм, гипоксию, воспаление и специфические мембранные рецепторы) с полученной как с высоким разрешением, так и с многопараметрической информацией. МРТ за один сеанс получения изображений.
Цели этого обзора: обобщить доклинические и клинические исследования с использованием методов ПЭТ и МРТ для изучения влияния глии на заболевания головного мозга; критически рассмотреть основные доказательства, полученные с помощью ПЭТ-глиальных индикаторов при нейродегенеративных расстройствах, и их применимость в клиническом контексте; изучить потенциальную добавленную стоимость гибридного ПЭТ / МРТ для характеристики активации микроглии и астроцитов при неврологических и психических заболеваниях.
Гибридный сканер ПЭТ / МРТ
По сравнению с другими более распространенными и проверенными гибридными методами визуализации, такими как ПЭТ / компьютерная томография (КТ), сканер ПЭТ / МРТ представляет собой первую реальную попытку эффективно интегрировать два метода путем одновременного сбора данных, выходя за рамки серийного ПЭТ / КТ, обеспечивая естественную совместимость. -регистрация мультимодальных изображений (Monti et al., 2017). Интеграция и совместная регистрация мультимодальной информации, достигаемой с помощью различных методов визуализации, необходимы для полного понимания процессов в головном мозге, что представляет собой решающий шаг как для визуальной качественной оценки, так и для многопараметрического количественного анализа.Ретроспективная регистрация сложных диагностических наборов данных, последовательно полученных на разных сканерах, обычно достигается с помощью программного обеспечения с помощью алгоритмов преобразования, основанных на анатомической информации компонента компьютерной томографии ПЭТ / КТ. Несмотря на экономическую эффективность этого подхода по сравнению с гибридными решениями, ретроспективная совместная регистрация может быть особенно сложной и технически сложной для пациентов, не сотрудничающих с пациентом (Monti et al., 2017). Эта проблема решается с помощью гибридных сканеров, которые позволяют одновременно получать изображения, использующие одну и ту же систему координат (Zaidi and Guerra, 2011).
Это нововведение стало возможным после разработки специализированных аппаратных компонентов для каждой модальности, на которые не оказывают взаимного влияния магнитное поле или путь фотонов (Aiello et al., 2018).
В настоящее время интегрированная ПЭТ / МРТ представляет собой наиболее продвинутый инструмент для молекулярной визуализации, открывающий новые возможности для характеристики неврологических и психических расстройств и, возможно, для многостороннего ведения пациентов (Aiello et al., 2015, 2016; Cavaliere et al., 2018а).Действительно, этот инновационный клинический диагностический сканер позволяет комбинировать функциональную специфичность радиоактивных индикаторов ПЭТ (например, нацеливание на метаболизм, гипоксию, воспаление, специфические лиганды или рецепторы) как с высокой разрешающей способностью, так и с многопараметрической информацией, полученной с помощью МРТ, за один сеанс получения изображений ( Herzog et al., 2010; Aiello et al., 2019). Эта одновременность результатов, достигаемых с помощью ПЭТ / МРТ, если они полезны для взаимных технических корректировок, касающихся временного и пространственного кросс-модального выравнивания / синхронизации, открывает все еще обсуждаемые идеи о его клинической ценности для неврологических пациентов, возможно, несовместимых и сильно изменчивых с клинической точки зрения. (Zaidi and Guerra, 2011; Cavaliere et al., 2018б).
Методы визуализациив ядерной медицине, такие как ПЭТ, предлагают уникальную возможность исследовать in vivo мини- или неинвазивно, множество молекулярных механизмов, в зависимости от селективности используемого радиоиндикатора. Эта возможность подтолкнула радиохимиков и фармацевтическую промышленность к тестированию и исследованию новых потенциально инновационных индикаторов, способных конкретно воздействовать на патофизиологические пути, такие как нейровоспаление, глиальные клетки или мембранные рецепторы, чтобы распутать нейродегенеративные явления (Herzog et al., 2010). Однако автономная ПЭТ-визуализация по-прежнему ограничена низким пространственным разрешением, что обязывает ее регистрировать совместно с методами визуализации с более высоким разрешением, такими как КТ и МРТ. По сравнению с КТ, МРТ предоставляет различную количественную информацию (например, диффузию воды и метаболитов, концентрации метаболитов, региональную перфузию и активацию), просто изменяя параметры последовательностей, представляя золотой стандарт для исследования мягких тканей и мозга и предоставляя дополнительную информацию по сравнению с ПЭТ визуализация (Cavaliere et al., 2018b; Марчителли и др., 2018). Более того, более высокое контрастное разрешение, обеспечиваемое MR, может быть более подходящим для сегментации эталонных областей, полезных для нормализации сигнала ПЭТ с целью извлечения количественных параметров поглощения.
В то время как, как и в случае со сканерами ПЭТ / КТ, результаты, полученные с помощью МРТ и ПЭТ, могут быть получены последовательно в два разных периода времени, для высокодинамичных систем, таких как мозг, этот временной промежуток может искажать сравнение интермодальности. Действительно, последовательный подход предполагает, что между двумя сеансами визуализации не произошло никаких существенных изменений в основном состоянии объекта — утверждение, которое может быть неэффективным с физиологической точки зрения (например,g., изменения в когнитивных состояниях или бдительности) и при патологических состояниях (например, психиатрических или неврологических расстройствах) или в результате медицинского вмешательства посредством психологического консультирования, лекарств или электрических / магнитных стимуляций мозга (Aiello et al., 2018; Cavaliere et al. др., 2018б). По этим причинам гибридные сканеры ПЭТ / МРТ позволяют преодолеть эти ограничения, одновременно получая морфологическую, функциональную, молекулярную или метаболическую информацию, полученную с помощью МРТ и ПЭТ, за один снимок.
ПЭТ и МРТ активации микроглии
Нейровоспаление — это динамический флогистический ответ, включающий сложный многоклеточный каскад, включающий активацию как микроглии, так и астроцитов, а также высвобождение различных нейроактивных соединений.
Предыдущие экспериментальные исследования предоставили неопровержимые доказательства ключевого участия связанных с микроглией молекулярных сетей в патофизиологии многих нейродегенеративных и психических заболеваний (Condello et al., 2018). Однако точные механизмы, с помощью которых микроглия влияет на прогрессирование заболевания и изменяют невропатологию, остаются плохо изученными.
Различные фенотипы активации, по-видимому, характеризуют хронические патологии головного мозга, начиная от нейропротекторного и противовоспалительного фенотипа M2, в основном представленного на ранней стадии, до перехода к провоспалительному фенотипу M1, типичному для более поздних стадий и способствующему дисфункции нейронов, травмам. и прогрессирование заболевания (рисунок 1) (Shen et al., 2018).
Рис. 1. Фенотипы микроглии и астроцитов как возможные мишени для in vivo ПЭТ / МРТ.
Таким образом, разработка неинвазивных методов молекулярной визуализации, способных динамически характеризовать пространственно-временной профиль нейровоспалительных биомаркеров, широко привлекает научный и клинический интерес, а также для применения иммуномодулирующих методов лечения как в клинических, так и в доклинических условиях (Narayanaswami et al., 2018).
Позитронно-эмиссионная томография микроглии появилась в последние годы благодаря разработке целенаправленных радиоиндикаторов и, среди них, в основном, транслокаторного белка-18 кДа (TSPO) (Таблица 1) (Рисунок 2).
Таблица 1. Основные радиоактивные индикаторы ПЭТ, используемые для исследования селективной активации микроглии и астроцитов.
Рис. 2. Примеры изображений в ПЭТ и МРТ. На рисунке слева направо показаны аксиальная, сагиттальная и корональная проекции здорового мозга (слева) и AD-спектр (справа) для различных ПЭТ (Shigemoto et al., 2018) и MR контрасты. Сверху в нижний ряд: поглощение микроглиями, выявленное с помощью индикатора ПЭТ 11C-PiB; поглощение астроцитов, выявленное с помощью трассера ПЭТ 18F-THK5351; структурная трехмерная Т1-взвешенная МРТ, используемая в качестве анатомического ориентира для ПЭТ и для выявления кортикальной атрофии и увеличения желудочков; 3D-визуализация, взвешенная по восприимчивости, МРТ, связанная с отложением железа и микроглиозом; Т2-взвешенное МРТ-сканирование, используемое для картирования Т2 и астроглиоза.
Радиолиганд первого поколения [ 11 C] (R) -PK11195 был наиболее широко изучен в клинических исследованиях и различных нейродегенеративных заболеваниях, включая рассеянный склероз (Airas et al., 2018), болезни Крейтцфельда-Якоба (Iaccarino et al., 2018), а также при психических расстройствах, таких как шизофрения (Di Biase et al., 2017). Хотя результаты повышенного поглощения этого индикатора при этих патологиях, ограничения, включая низкое отношение сигнал / шум и высокое неспецифическое связывание, были направлены на синтез TSPO-специфических радиофармпрепаратов второго и третьего поколений, связанных с [ 11 C] или [ 18 F], включая [ 11 C] -PBR28, [ 18 F] -DPA-714, [ 18 F] -PBR06, [ 18 F] -FEPPA и [ 18 F] -GE-180 (все используются в клиническом контексте, за исключением [ 18 F] -DPA-714) (Luo et al., 2018; Singhal et al., 2018; Best et al., 2019). Аналогичным образом, в различных исследованиях сообщалось о селективном поглощении этих индикаторов микроглией на моделях и пациентах с рассеянным склерозом (Hagens et al., 2018; Herranz et al., 2019; Nack et al., 2019), боковом амиотрофическом склерозе (Zürcher et al. , 2015; Datta et al., 2017), болезнь Альцгеймера (Alam et al., 2017; Keller et al., 2018; Focke et al., 2019) и болезнь Лайма у людей (Coughlin et al., 2018), и экспериментальные модели инсульта (Miyajima et al., 2018), с более противоречивыми результатами для психиатрических пациентов, страдающих шизофренией (Di Biase et al., 2017; Hafizi et al., 2017; Ottoy et al., 2018; Selvaraj et al., 2018) и большой депрессией (Li et al., 2018), вероятно, из-за разной стадии заболевания. Интересно, что одно исследование субъектов с фибромиалгией пытается продемонстрировать специфичность индикаторов TSPO для микроглии, учитывая, что высокая экспрессия этой молекулы также была обнаружена в активированных астроцитах (Albrecht et al., 2019).Авторы, используя [ 11 C] PBR28, который связывается с TSPO, и [ 11 C] -DED, как полагают, в первую очередь отражают астроцитарный (но не микроглиальный) сигнал, продемонстрировали, хотя и в образце небольшого размера, селективный кортикальный поглощение микроглиального индикатора, но не астроцитарного (Albrecht et al., 2019).
Тем не менее, на применение индикаторов TSPO влияет значительная вариабельность между субъектами, в основном из-за полиморфизма rs6971, который влияет на связывание TSPO в основном в радиолигандах первого и второго поколений (Hafizi et al., 2017), и, что более важно, они не способны различать фенотип микроглии, различая консервативную и вредную активацию. Более того, хотя TSPO активируется в активированных глиальных клетках, его функция и роль в иммунном ответе все еще неясны. Наконец, учитывая, что основные доказательства получены в результате поглощения TSPO у пациентов с рассеянным склерозом и очень низкого поглощения в мозге у здоровых субъектов, было высказано несколько сомнений относительно проницаемости этих индикаторов через гематоэнцефалический барьер в физиологических условиях (Albert et al., 2019).
По этой причине были идентифицированы другие микроглиальные мишени для конкретных радиоактивных индикаторов на животных моделях, таких как каннабиноидный рецептор типа 2 ([18F] -D8-THC) (Ni et al., 2019; Gifford et al., 2002), рецептор P2X7 ([ 11 C] -GSK1482160) (Han et al., 2017), циклооксигеназа 1 ([ 11 C] -кетопрофен метиловый эфир) (Shukuri et al., 2011), циклооксигеназа -оксигеназа 2 ([ 11 C] -целекоксиб) (Kumar et al., 2018) и макрофагальный колониестимулирующий фактор 1 ([ 11 C] CPPC [5-циано-N- (4- (4 — [ 11 C] метилпиперазин-1-ил) -2- (пиперидин-1-ил) фенил) фуран-2-карбоксамид]) (Horti et al., 2019).
Что касается использования МРТ для идентификации микроглиоза, меньше исследований пытались напрямую охарактеризовать активацию микроглии в определенных областях мозга. Изменения отложения железа, количественно оцененные с помощью количественного картирования восприимчивости в МР, были коррелированы с активированными микроглией / макрофагами на краях некоторых хронических демиелинизированных поражений у пациентов, страдающих рассеянным склерозом (Dal-Bianco et al., 2017; Gillen et al., 2018 ; Hametner et al., 2018). Продвинутые модели диффузии, основанные на дисперсии ориентации нейритов и визуализации плотности (NODDI) в МРТ, оказались чувствительными к плотности микроглии и клеточным изменениям, связанным с активацией микроглии в доклинических условиях (Yi et al., 2019). Наконец, у пациентов с боковым амиотрофическим склерозом метод, основанный на диффузионной спектроскопии, был применен для выявления увеличения преимущественно глиальных метаболитов (неспецифичных для микроглии и астроцитов) tCr (креатин + фосфокреатин) и tCho (холинсодержащих соединений) в первичном моторная кора (Reischauer et al., 2018).
Несмотря на доказанный потенциал как ПЭТ, так и МРТ для визуализации микроглии, очень немногие исследования интегрировали оба метода на людях, и, как правило, большинство используют МРТ, чтобы просто совместить поглощение TSPO с бляшками рассеянного склероза, идентифицированными с помощью МРТ (Colasanti et al. ., 2014; Канг и др., 2018; Unterrainer et al., 2018; Каунцнер и др., 2019). До настоящего времени только три исследования выполняли одновременную ПЭТ / МРТ для изучения активации микроглии при нейродегенеративных заболеваниях. Первый, использующий селективные радиоактивные индикаторы P2X7R у пациентов, страдающих болезнью Паркинсона, не смог выявить значительных различий в поглощении ПЭТ между пациентами и контрольными субъектами (van Weehaeghe et al., 2019). Второй метод, использующий радиоактивный индикатор TSPO второго поколения у пациентов, страдающих рассеянным склерозом, продемонстрировал активацию микроглии как в нормальном мозжечке, так и в сегментированных поражениях (Barletta et al., 2019). Последний сочетает в себе магнитно-резонансную спектроскопию глиальных метаболитов с поглощением TSPO-радиоактивных индикаторов у пациентов с боковым амиотрофическим склерозом, демонстрируя положительную корреляцию между МР- и ПЭТ-биомаркерами нейровоспаления (Ratai et al., 2018) (Рисунок 2).
ПЭТ и МРТ активации астроцитов
Астроциты являются наиболее распространенным типом клеток в головном мозге и участвуют в сложных нейронно-глиальных взаимодействиях для обеспечения синаптического гомеостаза и метаболической поддержки нейронов (Miller, 2018).Что касается микроглиальных клеток, то, по-видимому, активация астроцитов в физиологических и патологических состояниях характеризуется различными фенотипами, начиная от провоспалительного фенотипа A1 до защитного и противовоспалительного фенотипа A2 (рисунок 1) (Miller, 2018).
Ранее рассматривавшиеся только как поддерживающие нейрональные клетки, вклад астроцитов в различные нейродегенеративные и психиатрические заболевания был недавно пересмотрен (Papa et al., 2014).
По сравнению с визуализацией микроглии, радиоактивные индикаторы ПЭТ, специфичные для астроцитарной функции, были только недавно применены для клинических целей, в основном связывая фермент моноаминоксидазу типа B (MAOB), который в высокой степени экспрессируется активированными астроцитами (Таблица 1) (Рисунок 2) (Ishibashi и другие., 2019). Исследования ПЭТ с использованием радиоактивных индикаторов MAOB 11C-DED или [18F] THK5351 у пациентов, страдающих болезнью Альцгеймера, продемонстрировали высокую корреляцию между отложением тау-белка в головном мозге и поглощением астроцитов (Harada et al., 2018), а также между гипометаболизмом глюкозы в корке, обнаруженным с помощью 18F- ПЭТ с фтордезоксиглюкозой [18F] -FDG и продольное снижение астроцитарной функции, обнаруженное с помощью 11C-DED (Carter et al., 2019). Эти результаты согласуются с другой клинической работой, которая демонстрирует увеличение поглощения ФДГ после избирательной активации астроцитарного транспорта глутамата (Zimmer et al., 2017). Специфическое региональное усиление астроцитарной функции было также обнаружено в двух случаях прогрессирующего сопрануклеарного паралича, изученного с помощью ПЭТ [18F] THK5351 (Ishiki et al., 2018).
Что касается использования МРТ для выявления вовлечения астроцитов в неврологические и психические заболевания, несколько исследовательских групп подчеркнули возможность МРТ для достижения этой цели (рис. 2). В нескольких доклинических исследованиях предлагалось использовать магнитно-резонансную спектроскопию для выделения лактата (Blanc et al., 2019) или ацетата (Dehghani et al., 2017) изменения пиков как суррогатные маркеры, специфичные для метаболического гомеостаза астроцитов. Однако сила магнитного поля клинически доступного сканера не способна спектрально разрешить эти метаболиты по окружающим пикам. В другом клиническом исследовании (Alshelh et al., 2018) предполагалось, что региональные изменения времени релаксации Т2 указывают на активацию астроглии у пациентов, страдающих нейропатической болью. Совсем недавно происхождение сигнала, используемого функциональной МРТ для исследования большой группы нейрональных активаций, обсуждалось с учетом доклинических доказательств того, что вызванные астроцитарные волны Ca 2+ могут коррелировать с усилением сигнала мощности ЭЭГ (Wang et al., 2018), вызванные астроцитами BOLD-флуктуации (Takata et al., 2018) и транскраниальный ответ на стимуляцию постоянным током (Monai and Hirase, 2018). Эти результаты делают еще более привлекательным использование гибридного сканера, который может одновременно регистрировать сигнал ПЭТ, фМРТ и ЭЭГ (Mele et al., 2019).
Как бы то ни было, доказательства активации астроцитов, полученные с помощью МРТ, все еще ограничены несколькими группами и часто на ограниченных образцах. В нескольких исследованиях с этой целью последовательно использовались как ПЭТ, так и МРТ, а также использовались результаты МРТ для совместной локализации захвата ПЭТ.В продольном исследовании пациентов с кортикобазальным синдромом было продемонстрировано, что связывание [18F] THK5351 обнаруживает динамический астроглиоз в определенных областях коры головного мозга (Ezura et al., 2019). В случае рассеянного склероза, вместо этого, авторы продемонстрировали совместную регистрацию поглощения [18F] THK5351 с демиелинизирующими бляшками (Ishibashi et al., 2019). В другом исследовании сравнивали пространственные паттерны поглощения [18F] THK5351 и изменения сети фМРТ у пациентов с ранним БА и здоровых людей в контрольной группе, показывая аналогичную картину для предклиния, области, критически важной для прогрессирования болезни Альцгеймера (Yokoi et al., 2018).
Наконец, у пациентов, страдающих семантическим вариантом первичной прогрессирующей афазии, несколько авторов продемонстрировали, что индикаторы MAOB могут быть более чувствительными к детективным нейродегенеративным изменениям по сравнению с МРТ (Kobayashi et al., 2018).
Glial PET Radiotracers: критическая точка зрения
Несмотря на замечательную разработку радиоиндикаторов для множества молекулярных мишеней, вовлеченных в процесс нейровоспаления, лишь некоторые из них успешно использовались на пациентах.
Индикаторы ПЭТ TSPO
Основные проблемы индикаторов TSPO заключаются в том, что они не могут различать про- и противовоспалительные реакции, у них низкое отношение сигнал / шум и высокое неспецифическое связывание, низкая вариабельность динамического ответа при нейродегенеративных патологиях (рис. 2). Кроме того, основная проблема при клиническом использовании этих ПЭТ-индикаторов связана с наличием полиморфизма (SNP) в гене TSPO. Эти проблемы были уменьшены и / или устранены с помощью ПЭТ-индикаторов TSPO второго и третьего поколения, однако до сих пор нет возможной дифференциации между генотипами M1 (нейротоксический) и M2 (нейропротекторный).Более того, даже если была обнаружена трехмерная пентамерная структура TSPO, роль этого рецептора, по-видимому, еще не ясна, поскольку влияние активации рецептора как иммунной реакции неясно. В настоящее время [18F] -GE180 используется в качестве индикатора третьего поколения в клинических испытаниях. Хотя [18F] -GE180 может проходить в ЦНС только в случае разрушения гематоэнцефалического барьера, при низкой проницаемости ГЭБ в здоровом мозге человека, этот радиоактивный индикатор является очень важным агентом визуализации нейровоспаления при различных заболеваниях ЦНС (Albert et al., 2019).
Каннабиноидные рецепторы типа 2 ПЭТ-индикаторы
Из-за высокой плотности мозга этот рецептор был подвергнут in vivo визуализации с использованием методов ПЭТ с использованием радиолигандов, таких как Δ 8 -Тетрагидроканнабинол (Δ 8 -THC), меченный фтором-18. Однако изображения ПЭТ, полученные после инъекции [18F] -Δ 8 -THC у приматов, не показывают конкретную конкретную область церебральной локализации настолько, что кажется, что радиоактивный индикатор широко распространен во всех областях мозга ( Гиффорд и др., 2002). Некоторые из синтетических производных классических каннабиноидов, которые проявляют нано-сродство к рецепторам CB2, могут оказаться успешными кандидатами для in vivo визуализации этих рецепторов, включая производные пиразола и производные аминоалкилиндола. Поскольку уровень экспрессии рецепторов CB2 в здоровом головном мозге низкий, а количество этих рецепторов увеличивается при патологических состояниях, большое количество исследований было сосредоточено на этих рецепторах. На сегодняшний день только радиоактивный индикатор [ 11 C] -NE40 использовался на людях для исследований биораспределения на здоровых пациентах, чтобы проверить поглощение и вымывание (Ahmad et al., 2013). Лиганды CB2 все еще находятся на стадии доклинической оценки, однако они могут представлять собой действительную альтернативу при оценке активации микроглии (Yamagishi et al., 2019).
ПЭТ-индикаторы циклооксигеназы-2
Несмотря на потенциал, который дает изучение увеличения циклооксигеназ (COX1 и COX2) при воспалении, на самом деле было синтезировано и изучено лишь очень небольшое количество радиоактивных индикаторов. Для исследований нейровоспаления обязательно использование селективных радиолигандов для соответствующих изоформ СОХ1 и СОХ2.Преимущество использования [ 11 C] -целекоксиба, безусловно, представлено его способностью преодолевать гематоэнцефалический барьер, даже если он не поврежден (Kumar et al., 2018).
P2X
7 Рецепторные ПЭТ-индикаторы РецепторP2X7 представляет собой аденозинтрифосфатный АТФ-зависимый пуринорецептор, который широко экспрессируется в микроглии и астроцитах. Активация рецептора P2X7 приводит к высвобождению провоспалительных медиаторов, таких как цитокин IL-1β, в головном мозге. Фактически увеличение экспрессии этого рецептора приводит к активации микроглии, более чем его сверхэкспрессия является следствием активации микроглии.В последние годы исследования были сосредоточены на синтезе и изучении лигандов этого рецептора. Самыми многообещающими, безусловно, являются: [ 11 C] -GSK1482160, [ 11 C] -SMW139 и [ 18 F] -JNJ-64413739. Первый [ 11 C] -GSK1482160 был изучен на здоровых пациентах-добровольцах для оценки дозиметрии и биораспределения радиофармацевтического излучения (Green et al., 2018). Первое исследование ПЭТ / МРТ, даже если оно предварительное, на пациентах, страдающих рассеянным склерозом, было проведено в 2019 году с введением [ 11 C] -SMW139 (Hagens et al., 2019). Соединение Янссена [ 18 F] -JNJ-64413739 помечено фтором-18, что, безусловно, представляет собой преимущество с клинической точки зрения, учитывая более длительный период полураспада радиоизотопа (Kolb et al., 2019). [ 18 F] -JNJ-64413739 все еще оценивается на этапе доклинических исследований, и данные о пациентах еще не доступны, однако первые исследования на животных показывают его потенциал в качестве индикатора ПЭТ для нейровоспаления.
Рецептор колониестимулирующего фактора 1 макрофагов (CSF1R) ПЭТ-индикатор
CSF1R представляет собой поверхностный рецептор (рецепторы семейства тирозинкиназ), в основном экспрессируемый микроглией.Недавно был синтезирован и изучен специфический радиолиганд этого рецептора [ 11 C] -CPPC (Horti et al., 2019). Даже если этот лиганд ПЭТ все еще находится на доклинической стадии экспериментов на животных, этот новый класс радиолигандов может быть очень многообещающим для изучения активации ПЭТ / МРТ микроглии.
Моноаминоксидаза-B ПЭТ-индикаторы
Во время нейровоспаления астроциты увеличивают активность MAO-B (аминоксидазы), что приводит к окислительному стрессу из-за образования перекиси водорода (Gulyás et al., 2011). Среди ПЭТ-лигандов MAO-B, изученных и синтезированных на протяжении многих лет, у пациентов были успешно использованы два радиоактивных индикатора, один из которых содержал углерод-11 ([ 11 C] — L -депренил-D2) (Arakawa et al., 2017), другой — фтор-18 ([ 18 F] -THK5351) (Ishibashi et al., 2019). Последний был использован у пациента с ремиттирующим рассеянным склерозом (РС), было замечено, что накопление [ 18 F] -THK5351 соответствовало участкам, идентифицированным на МРТ, где были бляшки РС, в поражениях, подвергающихся астроглиозу.
Бимодальные зонды как перспективы будущего
Хотя к ПЭТ / МРТ часто обращаются как к новому рубежу молекулярной визуализации (Chen and Chen, 2010), очень мало исследований использовали этот метод для визуализации глии и часто ограничивали МРТ структурным эталоном для сигнала ПЭТ. Одно из возможных нововведений в этой области может быть представлено разработкой эффективного и надежного зонда с двумя изображениями ПЭТ / МРТ, что может оказаться сложной задачей для химиков и нейробиологов (Bouziotis et al., 2013; Vecchione et al., 2017), могут помочь выявить убийственные применения ПЭТ / МРТ.
Общей проблемой для новых одно- или мультимодальных зондов для визуализации, которые нацелены на мозг и которую необходимо учитывать, является проницаемость гематоэнцефалического барьера, сложной многоклеточной структуры, которая защищает ЦНС от внешних нейротоксических веществ и которая функционирует обеспечиваются также кончиками астроцитов (Poupot et al., 2018). Возможное решение представлено использованием физиологического переноса, существующего через барьер, например, использование определенных носителей или феномен трансцитоза (Pulgar, 2019).
Среди новых инструментов визуализации различные наночастицы (обычно размером менее 100 нм) широко используются в доклинических условиях в качестве контрастного агента для МРТ в сочетании с индикатором ПЭТ, в основном для онкологической, а в последнее время и сердечно-сосудистой визуализации (Aime et al., 2002; Uppal et al. al., 2011; Lewis et al., 2015; Kirschbaum et al., 2016; Vecchione et al., 2017; Grimaldi et al., 2019). Недавно был описан потенциальный мультимодальный зонд ПЭТ / МРТ для нацеливания на микроглию и нейровоспаление на модели мышей (Tang et al., 2018). Предлагаемая наночастица избирательно связывается с рецептором скавенджера класса A (SR-A), экспрессируемым на активированной микроглии, и покрыта оксидом железа, что позволяет обнаруживать ее с помощью Т2 * -взвешенной МРТ.
Заключение
В этом обзоре обобщены основные биомаркеры ПЭТ и МРТ для активации микроглии и астроцитов. Кроме того, эти исследования также демонстрируют потенциальные преимущества интеграции результатов, достигаемых одновременным использованием сканеров ПЭТ / МРТ, хотя в литературе до сих пор мало используется.В то время как технологические проблемы кажутся преодоленными с помощью новых мощных сканеров, способных in vivo охарактеризовать молекулярные процессы, необходимы дополнительные усилия по идентификации селективных глиальных мишеней и эффективных мультимодальных зондов для визуализации, потенциально полезных для индивидуализированного лечения, нацеленного на активацию глии.
Авторские взносы
CC разработал и написал рукопись. LT, DF и VA написали рукопись и подготовили рисунки / таблицы. MA и MS пересмотрели и одобрили текст.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Ahmad, R., Koole, M., Evens, N., Serdons, K., Verbruggen, A., Bormans, G., et al. (2013). Биораспределение в организме и дозиметрия излучения каннабиноидного лиганда рецептора типа 2 [11C] -NE40 у здоровых субъектов. Мол. Imaging Biol. 15, 384–390. DOI: 10.1007 / s11307-013-0626-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айелло, М., Кавальер, К., Фиоренца, Д., Дугдженто, А., Пассамонти, Л., и Тоски, Н. (2019). Нейровоспаление при нейродегенеративных заболеваниях: текущие исследования мультимодальной визуализации и будущие возможности гибридного ПЭТ / МРТ. Неврология 403, 125–135. DOI: 10.1016 / j.neuroscience.2018.07.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айелло, М., Кавальер, К., Марчителли, Р., д’Альборе, А., Де Вита, Э., и Сальваторе, М. (2018). Гибридный ПЭТ / МРИ Методология. Внутр. Rev. Neurobiol. 141, 97–128. DOI: 10.1016 / bs.irn.2018.07.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Aiello, M., Monti, S., Inglese, M., Forte, E., Cavaliere, C., Catalano, O.A., et al. (2015). Мультимодальная схема для улучшения просмотра ПЭТ / МРТ. Ejnmmi. Phys. 2 (Дополнение 1): A32. DOI: 10.1186 / 2197-7364-2-S1-A32
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эйме, С., Фруллано, Л., и Крич, С. Г. (2002). Компартментализация комплекса гадолиния в полости апоферритина: способ получения контрастных агентов с высокой релаксирующей способностью для магнитно-резонансной томографии. Angewandte Chem. Int. Эд. 41, 1017–1019. DOI: 10.1002 / 1521-3773 (20020315) 41: 6 <1017 :: aid-anie1017> 3.0.co; 2-р
CrossRef Полный текст | Google Scholar
Айрас, Л., Найлунд, М., и Риссанен, Э. (2018). Оценка активации микроглии у пациентов с рассеянным склерозом с помощью позитронно-эмиссионной томографии. Фронт. Neurol. 9: 181. DOI: 10.3389 / fneur.2018.00181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алам М. М., Ли Дж. И Ли С. Ю. (2017). Недавний прогресс в разработке лигандов TSPO PET для визуализации нейровоспаления при неврологических заболеваниях. Nucl. Med. Мол. Imaging 51, 283–296. DOI: 10.1007 / s13139-017-0475-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альберт, Н. Л., Антеррайнер, М., Brendel, M., Kaiser, L., Zweckstetter, M., Cumming, P., et al. (2019). В ответ на: валидность 18F-GE180 в качестве агента визуализации TSPO. Eur, J. Nucl. Med. Мол. Imaging 46, 1208–1211. DOI: 10.1007 / s00259-019-04294-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альбрехт, Д. С., Форсберг, А., Сандстрём, А., Берган, К., Кадетов, Д., Проценко, Э., и др. (2019). Активация глии головного мозга при фибромиалгии — исследование с помощью многоточечной позитронно-эмиссионной томографии. Brain Behav. Иммун. 75, 72–83. DOI: 10.1016 / j.bbi.2018.09.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Alshelh, Z., Di Pietro, F., Mills, E.P., Vickers, E.R., Peck, C.C., Murray, G.M, et al. (2018). Изменение времени релаксации T2 регионарного мозга у лиц с хронической орофациальной нейропатической болью. Neuroimage Clin. 19, 167–173. DOI: 10.1016 / j.nicl.2018.04.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аракава, Р., Стенкрона, П., Такано, А., Наг, С., Майор, Р. С., и Халлдин, К. (2017). Повторный тест на воспроизводимость связывания [11C] -L-депренил-D2 с MAO-B в головном мозге человека. Ejnmmi Res. Декабрь 7:54. DOI: 10.1186 / s13550-017-0301-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барлетта В. Т., Эрранц Э., Треаба К. А., Уэллетт Р., Мендиратта А., Лоджия М. и др. (2019). Доказательства диффузного нейровоспаления мозжечка при рассеянном склерозе с помощью 11C-PBR28 MR-PET. Мульт. Склер. doi: 10.1177 / 1352458519843048 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Бест, Л., Гадери, К., Павезе, Н., Тай, Ю. Ф., и Страфелла, А. П. (2019). Новые и старые радиолиганды TSPO PET для визуализации активации микроглии головного мозга при нейродегенеративных заболеваниях. Curr. Neurol. Neurosci. Реп 19:24. DOI: 10.1007 / s11910-019-0934-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блан, Ж., Roumes, H., Mazuel, L., Massot, P., Raffard, G., Biran, M., et al. (2019). Функциональная магнитно-резонансная спектроскопия при 7 Тл в коре головного мозга крысы во время активации усов. J. Vis. Exp. 8: e58912. DOI: 10.3791 / 58912
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бузиотис, П., Псимадас, Д., Цотакос, Т., Стамопулос, Д., и Цукалас, К. (2013). Наночастицы оксида железа с радиоактивной меткой в качестве двухкомпонентных агентов для ОФЭКТ / МРТ и ПЭТ / МРТ. Curr.Вершина. Med. Chem. 12, 2694–2702. DOI: 10.2174 / 1568026611212230007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Картер С. Ф., Чиотис К., Нордберг А. и Родригес-Виитес Е. (2019). Продольная связь между функцией астроцитов и метаболизмом глюкозы при аутосомно-доминантной болезни Альцгеймера. Eur. J. Nucl. Med. Мол. Imaging 46, 348–356. DOI: 10.1007 / s00259-018-4217-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кавальер, К., Kandeepan, S., Aiello, M., Ribeiro de Paula, D., Marchitelli, R., Fiorenza, S., et al. (2018a). Мультимодальный нейровизуализационный подход к изменчивости функциональной связи при расстройствах сознания: пилотное исследование ПЭТ / МРТ. Фронт. Neurol. 9: 861. DOI: 10.3389 / fneur.2018.00861
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кавальере, К., Лонгарцо, М., Орсини, М., Айелло, М., и Гросси, Д. (2018b). Фронто-височные контуры в музыкальных галлюцинациях: тематическое исследование ПЭТ-МРТ. Фронт. Гм. Neurosci. 12: 385. DOI: 10.3389 / fnhum.2018.00385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коласанти, А., Гуо, К., Мулерт, Н., Джаннетти, П., Онега, М., Ньюбоулд, Р. Д., и др. (2014). Оценка in vivo воспаления белого вещества мозга при рассеянном склерозе с помощью (18) F-PBR111 PET. J. Nucl Med. 55, 1112–1118. DOI: 10.2967 / jnumed.113.135129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колонна, М., и Бутовский О. (2017). Микроглия функционирует в центральной нервной системе во время здоровья и нейродегенерации. Annu. Rev. Immunol. 35, 441–468. DOI: 10.1146 / annurev -munol-051116-052358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конделло, К., Юань, П., и Груцендлер, Дж. (2018). Опосредованная микроглией нейрозащита, трем2 и болезнь Альцгеймера: данные оптической визуализации. Biol. Психиатрия 83, 377–387. DOI: 10.1016 / j.biopsych.2017.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кафлин, Дж. М., Янг, Т., Ребман, А. В., Бехтольд, К. Т., Ду, Ю., Мэтьюз, В. Б. и др. (2018). Визуализация активации глии у пациентов с симптомами болезни Лайма после лечения: пилотное исследование с использованием [11C] DPA-713 PET. J. Нейровоспаление 15: 346. DOI: 10.1186 / s12974-018-1381-1384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даль-Бьянко, А., Грабнер, Г., Кроннерветтер, К., Вебер, М., Хёфтбергер, Р., Бергер, Т. и др. (2017). Медленное расширение очагов рассеянного склероза железного ободка: патология и магнитно-резонансная томография 7 Тл. Acta Neuropathol. 133, 25–42. DOI: 10.1007 / s00401-016-1636-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Датта, Г., Коласанти, А., Калк, Н., Оуэн, Д., Скотт, Г., Рабинер, Э. А. и др. (2017). 11C-PBR28 и 18F-PBR111 обнаруживают воспалительную гетерогенность белого вещества при рассеянном склерозе. Дж.Nucl. Med. 58, 1477–1482. DOI: 10.2967 / jnumed.116.187161
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ди Биасе, М. А., Залески, А., О’Киф, Г., Ласкарис, Л., Бауне, Б. Т., Вейкерт, К. С. и др. (2017). ПЭТ-изображение предполагаемой активации микроглии у лиц с ультравысоким риском психоза, недавно диагностированных и хронически больных шизофренией. Пер. Психиатрия 7: e1225. DOI: 10.1038 / TP.2017.193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эзура, М., Кикучи, А., Исики, А., Окамура, Н., Хасегава, Т., Харада, Р. и др. (2019). Продольные изменения позитронно-эмиссионной томографии 18 F-THK5351 при кортикобазальном синдроме. Eur. J. Neurol. 26, 1205–1211. DOI: 10.1111 / ene.13966
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фокке К., Блюм Т., Зотт Б., Ши Й., Деуссинг М., Петерс Ф. и др. (2019). Ранняя и продольная активация микроглии, но не накопление амилоида, предсказывают когнитивный исход у мышей PS2APP. J. Nucl. Med. 60, 548–554. DOI: 10.2967 / jnumed.118.217703
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиффорд А. Н., Макрияннис А., Волков Н. Д. и Гатли С. Дж. (2002). Визуализация каннабиноидных рецепторов мозга in vivo. Chem.Phys. Липиды 121, 65–72. DOI: 10.1016 / s0009-3084 (02) 00148-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиллен, К. М., Мубарак, М., Нгуен, Т. Д., и Питт, Д.(2018). Значение и обнаружение in vivo железосодержащей микроглии в очагах рассеянного склероза белого вещества. Фронт. Иммунол. 9: 255. DOI: 10.3389 / fimmu.2018.00255
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грин, М., Хатчинс, Г., Флетчер, Дж., Террито, У., Полсон, Х., Трассел, Х. и др. (2018). Распространение радиофармпрепарата [11C] GSK1482160, нацеленного на рецептор P2X7, у нормальных людей. J. Nucl. Med. 59 (Приложение 1): 1009.
Google Scholar
Гримальди, А. М., Форте, Э., Инфанте, Т., Кавальер, К., Сальваторе, М., Кадемартири, Ф. и др. (2019). Перспективы использования контрастных веществ на основе наночастиц для магнитного резонанса сердца при инфаркте миокарда. Наномедицина 17, 329–341. DOI: 10.1016 / j.nano.2019.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуляш, Б., Павлова, Э., Каса, П., Гуля, К., Бакота, Л., и Варшеги, С. (2011).Активированный МАО-B в головном мозге пациентов с болезнью Альцгеймера, продемонстрированный [11C] -L-депренилом с помощью авторадиографии всего полушария. Neurochem. Int. 58, 60–68. DOI: 10.1016 / j.neuint.2010.10.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хафизи, С., Да Силва, Т., Герритсен, К., Кианг, М., Багби, Р. М., Прсе, И. и др. (2017). Визуализация Активация микроглии у лиц с высоким клиническим риском психоза: исследование ПЭТ in vivo с [18F] FEPPA. Нейропсихофармакология 42, 2474–2481.DOI: 10.1038 / npp.2017.111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хагенс, М. Х. Дж., Голла, С. С. В., Янссен, Б., Вугтс, Д. Дж., Бейно, В. и Виндхорст, А. Д. (2019). Маркер рецептора P2X7 [11C] SMW139 как in vivo маркер нейровоспаления при рассеянном склерозе: исследование, проведенное впервые на людях. Eur. J. Nucl. Med. Мол. Imaging 47, 379–389. DOI: 10.1007 / s00259-019-04550-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хагенс, М.Х. Дж., Голла, С. В., Вейбург, М. Т., Якуб, М., Хейтель, Д., Стинвейк, М. Д. и др. (2018). Оценка нейровоспаления при прогрессирующем рассеянном склерозе in vivo: доказательство концепции исследования с [18F] DPA714 PET. J. Нейровоспаление 15: 314. DOI: 10.1186 / s12974-018-1352-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hametner, S., Dal Bianco, A., Trattnig, S., and Lassmann, H. (2018). Связанные с железом изменения в очагах рассеянного склероза и их достоверность для характеристики типов и динамики поражений при рассеянном склерозе с помощью магнитно-резонансной томографии в сверхвысоком поле. Brain Pathol. 28, 743–749. DOI: 10.1111 / bpa.12643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Han, J., Liu, H., Liu, C., Jin, H., Perlmutter, J. S., Egan, T. M., et al. (2017). Фармакологические характеристики радиолиганда, специфичного к рецептору P2X7, [11C] GSK1482160 для нейровоспалительного ответа. Nucl. Med. Commun. 38, 372–382. DOI: 10.1097 / MNM.0000000000000660
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харада, Р., Ishiki, A., Kai, H., Sato, N., Furukawa, K., Furumoto, S., et al. (2018). Корреляция ПЭТ 18F-THK5351 с посмертным бременем тау-белка и астроглиозом при болезни Альцгеймера. J. Nucl. Med. 59, 671–674. DOI: 10.2967 / jnumed.117.197426
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрранц, Э., Луапре, К., Треаба, К. А., Говиндараджан, С. Т., Уэллетт, Р., Мангеат, Г., и др. (2019). Профили кортикального воспаления при рассеянном склерозе с помощью 11C-PBR28 MR-PET и визуализации 7 тесла. MultScler 1: 1352458519867320. DOI: 10.1177 / 1352458519867320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херцог, Х., Петржик, У., Шах, Н. Дж., И Зиемонс, К. (2010). Современное состояние, проблемы и перспективы MR-PET. NeuroImage 49, 2072–2082. DOI: 10.1016 / j.neuroimage.2009.10.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хорти, А.Г., Найк, Р., Фосс, К.А., Минн, И., Мишенева, В., Du, Y., et al. (2019). ПЭТ-визуализация микроглии путем нацеливания на рецептор колониестимулирующего фактора 1 макрофагов (CSF1R). Proc. Natl. Акад. Sci. США 116, 1686–1691. DOI: 10.1073 / pnas.1812155116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Iaccarino, L., Moresco, R.M, Presotto, L., Bugiani, O., Iannaccone, S., Giaccone, G., et al. (2018). ПЭТ in vivo 11C- (R) -PK11195 и исследование патологии in vitro активации микроглии при болезни Крейтцфельда-Якоба. Мол. Neurobiol. 55, 2856–2868. DOI: 10.1007 / s12035-017-0522-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ishibashi, K., Miura, Y., Hirata, K., Toyohara, J., and Ishii, K. (2019). ПЭТ 18F-THK5351 может идентифицировать астроглиоз в бляшках рассеянного склероза. Clin. Nucl. Med. 2019: 24. DOI: 10.1097 / RLU.0000000000002751
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исики, А., Харада, Р., Кай, Х., Сато, Н., Totsune, T., Tomita, N., et al. (2018). Нейровизуализационно-патологические корреляции ПЭТ [18F] THK5351 при прогрессирующем надъядерном параличе. Acta Neuropathol. Commun. 6:53. DOI: 10.1186 / s40478-018-0556-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг Ю., Шлайер Д., Каунцнер У. В., Кусейски А., Котари П. Дж. И Готье С. А. (2018). Сравнение двух различных методов анализа изображений для оценки активации микроглии у пациентов с рассеянным склерозом с использованием (R) — [N-метил-углерод-11] PK11195. PLoS One 13: e0201289. DOI: 10.1371 / journal.pone.0201289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kaunzner, U. W., Kang, Y., Zhang, S., Morris, E., Yao, Y., Pandya, S., et al. (2019). Количественное картирование восприимчивости позволяет идентифицировать воспаление в подгруппе поражений хронического рассеянного склероза. Мозг 142, 133–145. DOI: 10,1093 / мозг / awy296
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келлер, Т., Лопес-Пикон, Ф. Р., Кшичмоник, А., Форсбак, С., Кирьявайнен, А. К., Таккинен, Дж. С. и др. (2018). [18F] F-DPA для обнаружения активированной микроглии на мышиной модели болезни Альцгеймера. Nucl. Med. Биол. 67, 1–9. DOI: 10.1016 / j.nucmedbio.2018.09.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киршбаум К., Соннер Дж. К., Целлер М. В., Деумеландт К., Боде Дж., Шарма Р. и др. (2016). Визуализация наночастиц in vivo клеток врожденного иммунитета может служить маркером тяжести заболевания в модели рассеянного склероза. Proc. Natl. Акад. Sci. США 113, 13227–13232. DOI: 10.1073 / pnas.1609397113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кобаяси, Р., Хаяси, Х., Кавакацу, С., Исики, А., Окамура, Н., Араи, Х., и др. (2018). [18F] THK-5351 ПЭТ-визуализация при ранней стадии семантического варианта первичной прогрессирующей афазии: отчет о двух случаях и обзор литературы. BMC Neurol. 18: 109. DOI: 10.1186 / s12883-018-1115-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кольб, Х.К., Баррет, О., Бхаттачарья, А., Чен, Г., Константинеску, К., и Хуанг, К. (2019). Доклиническая оценка и исследование занятости рецепторов нечеловеческих приматов 18F-JNJ-64413739, радиолиганда ПЭТ для рецепторов P2X7. J. Nucl. Med. 60, 1154–1159. DOI: 10.2967 / jnumed.118.212696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, Дж. С. Д., Бай, Б., Зандериго, Ф., Делорензо, К., Прабхакаран, Дж., Парси, Р. В. и др. (2018). Получение изображений мозга in vivo, оценка биораспределения и дозиметрии излучения [11C] целекоксиба, лиганда COX-2 PET, у нечеловеческих приматов. Молекулы 23: E1929. DOI: 10.3390 / молекулы23081929
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Льюис, К. М., Грейвс, С. А., Эрнандес, Р., Валдовинос, Х. Ф., Барнхарт, Т. Е., Кай, В. и др. (2015). Производство 52Mn для отслеживания с помощью ПЭТ / МРТ стволовых клеток человека, экспрессирующих транспортер 1 двухвалентного металла (DMT1). Theranostics 5, 227–239. DOI: 10.7150 / thno.10185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х., Сагар, А. П., и Кери, С. (2018). Связывание с транслокаторным белком (18 кДа TSPO), маркером микроглии, снижается при большой депрессии во время когнитивно-поведенческой терапии. Прог. Neuropsychopharmacol. Биол. Психиатрия 83, 1–7. DOI: 10.1016 / j.pnpbp.2017.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Луо, С., Конг, X., Ву, Дж. Р., Ван, С. Ю., Тиан, Ю., Чжэн, Г. и др. (2018). Нейровоспаление у крыс с острой печеночной энцефалопатией: визуализация и оценка терапевтической эффективности с использованием микропозитронно-эмиссионной томографии 11C-PK11195 и 18F-DPA-714. Metab. Brain Dis. 33, 1733–1742. DOI: 10.1007 / s11011-018-0282-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marchitelli, R., Aiello, M., Cachia, A., Quarantelli, M., Cavaliere, C., Postiglione, A., et al. (2018). ФДГ-ПЭТ / фМРТ в состоянии одновременного покоя при болезни Альцгеймера: взаимосвязь между метаболизмом глюкозы и внутренней активностью. NeuroImage 176, 246–258. DOI: 10.1016 / j.neuroimage.2018.04.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меле, Г., Кавальер, К., Альфано, В., Орсини, М., Сальваторе, М., и Айелло, М. (2019). Одновременная ЭЭГ-фМРТ для функциональной неврологической оценки. Фронт. Neurol. 10: 848. DOI: 10.3389 / fneur.2019.00848
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миядзима, Н., Ито, М., Рокугава, Т., Иимори, Х., Момосаки, С., Омачи, С., и др. (2018). Обнаружение нейровоспаления до появления избирательной потери нейронов после легкой очаговой ишемии с использованием изображений [18F] DPA-714. EJNMMI Res. 8:43. DOI: 10.1186 / s13550-018-0400-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монай, Х., Хирасе, Х. (2018). Астроциты как мишень транскраниальной стимуляции постоянным током (tDCS) для лечения депрессии. Neurosci. Res. 126, 15–21. DOI: 10.1016 / j.neures.2017.08.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монти, С., Кавальер, К., Ковелло, М., Николай, Э., Сальваторе, М., и Айелло, М.(2017). Оценка преимуществ одновременной регистрации на ПЭТ / МРТ при визуализации головы / шеи. J. Healthcare Eng. 2017: 2634389. DOI: 10.1155 / 2017/2634389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nack, A., Brendel, M., Nedelcu, J., Daerr, M., Nyamoya, S., Beyer, C., et al. (2019). Экспрессия белка-транслокатора и поглощения лиганда [18F] -ge180 в моделях рассеянного склероза на животных. Ячейки 8, E94. DOI: 10.3390 / Cell8020094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нараянасвами, В., Даль, К., Бернар-Готье, В., Джозефсон, Л., Камминг, П., и Васдев, Н. (2018). Новые радиоактивные индикаторы ПЭТ и мишени для визуализации нейровоспаления при нейродегенеративных заболеваниях: перспективы за пределами TSPO. Мол. Imaging 17: 15360121187
. DOI: 10.1177 / 15360121187PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ни, Р., Му, Л., и Аметамей, С. (2019). Позитронно-эмиссионная томография каннабиноидных рецепторов 2 типа для выявления воспаления в центральной нервной системе. Acta Pharmacol. Грех. 40, 351–357. DOI: 10.1038 / s41401-018-0035-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оттой, Дж., Де Пикер, Л., Верхаге, Дж., Делай, С., Вайффелс, Л., Костен, Л. и др. (2018). 18F-PBR111 ПЭТ-визуализация у здоровых людей и больных шизофренией: воспроизводимость повторных тестов и количественная оценка нейровоспаления. J. Nucl. Med. 59, 1267–1274. DOI: 10.2967 / jnumed.117.203315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папа, М., Де Лука, К., Петта, Ф., Альбергина, Л., и Чирилло, Г. (2014). Взаимодействие астроцитов и нейронов в неадаптивной пластичности. Neurosci. Biobehav. Ред. 42, 35–54. DOI: 10.1016 / j.neubiorev.2014.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пульгар В. М. (2019). Трансцитоз через гематоэнцефалический барьер, новые достижения и проблемы. Фронт. Neurosci. 12, 1019.
Google Scholar
Ратаи, Э.М., Альшихо, М.J., Zürcher, N. R., Loggia, M. L., Cebulla, C. L., Cernasov, P., et al. (2018). Интегрированная визуализация [11C] -PBR28 PET, МРТ диффузия и магнитно-резонансная спектроскопия 1H-MRS при боковом амиотрофическом склерозе. Neuroimage Clin. 20, 357–364. DOI: 10.1016 / j.nicl.2018.08.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Reischauer, C., Gutzeit, A., Neuwirth, C., Fuchs, A., Sartoretti-Schefer, S., Weber, M., et al. (2018). Оценка in vivo нейрональных и глиальных изменений при боковом амиотрофическом склерозе с помощью тензорной диффузионной спектроскопии. Neuroimage Clin. 20, 993–1000. DOI: 10.1016 / j.nicl.2018.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сельварадж С., Блумфилд П. С., Цао Б., Веронезе М., Туркхаймер Ф. и Хоус О. Д. (2018). Визуализация TSPO головного мозга и объем серого вещества у пациентов с шизофренией и людей с очень высоким риском психоза: исследование [11C] PBR28. Schizophr Res. 195, 206–214. DOI: 10.1016 / j.schres.2017.08.063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шен З., Бао, X., и Ван, Р. (2018). Клиническая ПЭТ-визуализация активации микроглии: значение для микроглиальной терапии при болезни Альцгеймера. Фронт. Aging Neurosci. 10: 314. DOI: 10.3389 / fnagi.2018.00314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шигемото Ю., Соне Д., Майкуса Н., Окамура О., Фурумото С., Кудо Ю. и др. (2018). Связь отложения тау и амилоид-β белков со структурными изменениями связности у когнитивно нормальных пожилых людей и пациентов с болезнью Альцгеймера. Brain Behav. 8: e01145. DOI: 10.1002 / brb3.1145
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шукури М., Такашима-Хирано М., Токуда К., Такашима Т., Мацумура К., Иноуэ О. и др. (2011). Экспрессия циклооксигеназы-1 in vivo в активированной микроглии и макрофагах во время нейровоспаления, визуализированная с помощью ПЭТ с метиловым эфиром 11C-кетопрофена. J. Nucl. Med. 52, 1094–1101. DOI: 10.2967 / jnumed.110.084046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингхал, Т., О’Коннор, К., Дубей, С., Белэнджер, А. П., Гурвиц, С., Чу, Р. и др. (2018). 18F-PBR06 по сравнению с 11C-PBR28 PET для оценки связывания белка-транслокатора белого вещества при рассеянном склерозе. Clin. Nucl. Med. 43, e289 – e295. DOI: 10.1097 / RLU.0000000000002179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таката Н., Сагиура Ю., Йошида К., Коидзуми М., Хироши Н., Хонда К. и др. (2018). Оптогенетическая активация астроцитов вызывает BOLD fMRI-ответ с потреблением кислорода без модуляции нейрональной активности. Glia. 66, 2013–2023 гг. DOI: 10.1002 / glia.23454
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tang, T., Valenzuela, A., Petit, F., Chow, S., Leung, K., Gorin, F., et al. (2018). In Vivo МРТ функционализированных наночастиц оксида железа при воспалении головного мозга. Contrast Media Mol. Imaging 25: 3476476. DOI: 10.1155 / 2018/3476476
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Unterrainer, M., Mahler, C., Vomacka, L., Lindner, S., Havla, J., Brendel, M., et al. (2018). TSPO PET с [18F] GE-180 чувствительно обнаруживает очаговое нейровоспаление у пациентов с ремиттирующим рассеянным склерозом. Eur. J. Nucl. Med. Мол. Imaging 45, 1423–1431. DOI: 10.1007 / s00259-018-3974-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уппал Р., Катана К., Ай И., Беннер Т., Соренсен А. Г. и Караван П. (2011). Бимодальная визуализация тромба: одновременная визуализация ПЭТ / МРТ с нацеленным на фибрин двойным датчиком ПЭТ / МРТ — технико-экономическое обоснование на модели крысы. Радиология 258, 812–820. DOI: 10.1148 / radiol.10100881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van Weehaeghe, D., Koole, M., Schmidt, M.E., Deman, S., Jacobs, A.H., Souche, E., et al. (2019). [11C] JNJ54173717, новый радиолиганд рецептора P2X7 в качестве маркера нейровоспаления: биораспределение человека, дозиметрия, кинетическое моделирование мозга и количественное определение рецепторов P2X7 мозга у пациентов с болезнью Паркинсона и здоровых добровольцев. Eur.J. Nucl. Med. Мол. Imaging 46, 2051–2064. DOI: 10.1007 / s00259-019-04369-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Веккьоне Д., Айелло М., Кавальер К., Николай Э., Нетти П. А. и Торино Э. (2017). Гибридные наночастицы с ядром и оболочкой, улавливающие Gd-DTPA и 18F-FDG для одновременного получения данных с помощью ПЭТ / МРТ. Наномедицина 12, 2223–2231. DOI: 10.2217 / nnm-2017-0110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Верхратский, А., Парпура, В., Пекна, М., Пекни, М., и Софронев, М. (2014). Глия в патогенезе нейродегенеративных заболеваний. Biochem. Soc. Пер. 42, 1291–1301. DOI: 10.1042 / BST20140107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван М., Хе Ю., Сейновски Т. Дж. И Ю. X. (2018). Сигналы Ca2 + астроцитов, зависящие от состояния мозга, связаны как с положительными, так и с отрицательными сигналами BOLD-fMRI. Proc. Natl. Акад. Sci. США 115, E1647 – E1656.DOI: 10.1073 / pnas.17116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямагиши, С., Ига, Ю., Накамура, М., Такидзава, К., Фукумото, Д., и Какиучи, Т. (2019). Повышенная регуляция каннабиноидного рецептора типа 2, но не TSPO, при нейровоспалении, ускоренном старением, у мышей: исследование позитронно-эмиссионной томографии. J. Нейровоспаление. 10 16: 208. DOI: 10.1186 / s12974-019-1604-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йи, С.Ю., Барнетт, Б. Р., Торрес-Веласкес, М., Чжан, Ю., Херли, С. А., Роули, П. А. и др. (2019). Определение плотности микроглии с помощью количественной мультикомпонентной диффузной МРТ. Фронт. Neurosci. 13:81. DOI: 10.3389 / fnins.2019.00081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йокои Т., Ватанабэ Х., Ямагути Х., Багаринао Э., Масуда М., Имаи К. и др. (2018). Вовлечение предклинья / задней поясной коры имеет важное значение для развития болезни Альцгеймера: ПЭТ (THK5351, PiB) и исследование фМРТ в покое. Фронт. Aging Neurosci. 10: 304. DOI: 10.3389 / fnagi.2018.00304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Циммер, Э. Р., Родитель, М. Дж., Соуза, Д. Г., Леузи, А., Лекрук, К., Ким, Х. И. и др. (2017). [18F] Сигнал FDG PET управляется астроглиальным транспортом глутамата. Nat. Neurosci. 20, 393–395. DOI: 10.1038 / nn.4492
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цюрхер, Н. Р., Лоджия, М. Л., Лоусон, Р., Chonde, D. B., Izquierdo-Garcia, D., Yasek, J. E., et al. (2015). Повышенная активация глии in vivo у пациентов с боковым амиотрофическим склерозом: оценено с помощью [(11) C] -PBR28. Neuroimage Clin. 7, 409–414. DOI: 10.1016 / j.nicl.2015.01.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
границ | Роль глии в нарушении памяти после черепно-мозговой травмы: биомаркеры дисфункции глии
Введение
Принято считать, что нейроны составляют менее 25% клеток мозга, но отвечают за обработку информации и контроль функций организма.Астроциты, которые составляют 30–65% глии и представляют собой наиболее распространенный тип клеток в головном мозге, представляют собой многофункциональные клетки, роль которых включает поддержание осмотического баланса и оптимальных ионных условий для нейронов, обработку информации посредством рециклинга нейротрансмиттеров и гомеостаз метаболитов (Kimelberg, 2005; Buffo et al., 2010; Kimelberg, Nedergaard, 2010). В совокупности эти функции, а также другие, заставляют астроциты косвенно участвовать во всех функциях мозга, включая формирование памяти (Moraga-Amaro et al., 2014). Микроглия составляет приблизительно 10% от общей глии в головном мозге и в основном идентифицируется по их функции как иммунные клетки центральной нервной системы (ЦНС), которые первыми прибывают в место повреждения, чтобы инициировать воспалительный каскад. Однако данные указывают на то, что «покоящаяся» микроглия играет критическую роль в регуляции синаптической и структурной пластичности во время обучения и памяти (Kettenmann et al., 2011, 2013; Scheff et al., 2013). Наконец, олигодендроциты обеспечивают поддержку аксонов за счет производства миелиновой оболочки, которая имеет жизненно важное значение для быстрой передачи импульсов через тракты белого вещества (WM).Эти быстрые взаимодействия между областями мозга необходимы для функций мозга более высокого порядка, таких как формирование памяти. Из-за высокой скорости метаболизма олигодендроциты подвержены молекулярным последствиям повреждения тканей (McTigue and Tripathi, 2008). Гибель олигодендроцитов вызывает демиелинизацию, нарушение аксональной проводимости и, в конечном итоге, гибель аксонов, что способствует ухудшению памяти. В совокупности дисфункция глии вызывает морфологические и функциональные изменения, которые влияют на нейрально-глиальные и глиально-глиальные взаимодействия.Синаптические разъединения, дисбаланс гомеостаза нейротрансмиттеров и потенциальная дегенерация аксонов и гибель нейронов могут в конечном итоге привести к ухудшению памяти. Понимание реакции глии после травмы на молекулярном уровне может дать ключ к уменьшению хронического дефицита памяти.
Вторичная травма и метаболическая дисфункция
Черепно-мозговая травма (ЧМТ) — сложное прогрессирующее состояние, которое состоит из механизмов первичного и вторичного повреждения. Первичное повреждение вызвано прямым механическим повреждением и является инициатором вторичных молекулярных каскадов.Вторичная травма в основном характеризуется метаболическим дисбалансом и нейровоспалением (рис. 1). После первичного инсульта клетки мозга испытывают истощение энергии и потерю гомеостаза кальция, которые являются основными для функции митохондрий. Нарушение митохондрий хорошо задокументировано в острых стадиях ЧМТ (Colicos and Dash, 1996; Xiong et al., 1997; Sullivan et al., 1998, 2005; Singh et al., 2006; Gilmer et al., 2009; Cheng et al. ., 2012). Хотя эти изменения не являются специфическими для глии, они усиливаются активированной глией.Из-за всплеска внеклеточного АТФ, который возникает из-за поврежденных клеток, активируется глия, что приводит к последующему высвобождению кальция из эндоплазматического ретикулума (Locovei et al., 2006). В результате могут происходить изменения экспрессии различных метаботропных рецепторов (Wang et al., 2012), способствующие скачкам внутриклеточного кальция. Повышенный цитозольный кальций уравновешивается митохондриями за счет потенциала митохондриальной мембраны. В конце концов, митохондрии подвергаются перегрузке кальцием, и повреждение усугубляется образованием активных форм кислорода (АФК).Нейроны ограничены в своей антиоксидантной способности и, таким образом, полагаются на астроциты для буферизации ROS (Hamby and Sofroniew, 2010). В противном случае они становятся уязвимыми для необратимых повреждений. Важно отметить, что прооксидантная среда способствует повреждению липидов, белков и нуклеиновых кислот, проявляющемуся в основном в разрушении мембран (Lewén and Hillered, 1998; Miller et al., 2015) и индукции нейровоспаления (Hsieh and Yang, 2013). Исследования были сосредоточены на выяснении роли клеточных сенсоров и ферментов, которые модулируют внутриклеточный кальций и АФК в метаболической дисфункции, связанной со смертью (Lu et al., 2014; Angeloni et al., 2015; Рао и др., 2015). Более того, кальциевые сигналы в глиальной передаче необходимы для обработки информации и нейронно-глиальной координации. Таким образом, нарушение глиально-нейрональной передачи способствует потере памяти (Walker, Tesco, 2013; Croft et al., 2015; Gundersen et al., 2015). Помимо гомеостаза кальция, необходимо учитывать последствия дисбаланса калия при вторичной травме. Астроциты обычно поглощают внеклеточный калий через каналы и Na + / K + / АТФазу, что, в свою очередь, способствует изменениям объема, характерным для ЧМТ (Macaulay and Zeuthen, 2012; Larsen et al., 2014). Нарушения гомеостаза калия, наряду с активацией рецепторов нейромедиаторов, усиливают нейрональные нарушения (D’Ambrosio et al., 1999; Pietrobon and Moskowitz, 2014).
Рис. 1. Иллюстрация вклада глии во вторичные механизмы повреждения, связанные с нейродегенерацией после черепно-мозговой травмы .
Отек, связанный с травмой
Отек мозга вызван водным дисбалансом в ответ на травму. Цитотоксический отек возникает на острой стадии ЧМТ в результате нарушения регуляции метаболизма.Часто наблюдается двухфазный отек, при котором за ранним цитотоксическим отеком следует вазогенный отек, связанный с нарушением гематоэнцефалического барьера (ГЭБ). Глии играют важную роль в регуляции воды и других молекул, пересекающих ГЭБ. Концевые лапы астроцитов напрямую контактируют с сосудами головного мозга и локализованы с белками аквапорина (AQP), которые являются белками пор для прохождения воды (Nielsen et al., 1997). Более того, астроциты очень чувствительны к набуханию из-за экспрессии AQP (Suzuki et al., 2006; Сато и др., 2007; Рао и др., 2011). Экспрессия AQP после травмы предполагает, что устойчивая экспрессия AQP имеет решающее значение для облегчения отека, однако она зависит от местоположения относительно травмы, времени и вариаций в моделях TBI (Kiening et al., 2002; Sun et al., 2003; Zhao и др., 2005). Недавнее исследование показало лишь небольшое уменьшение объема мозга у мышей с нокаутом AQP4 без каких-либо доказательств разницы в нарушении ГЭБ между нокаутом AQP4 и диким типом (Yao et al., 2015). Различные результаты могут быть связаны с различной ролью AQP в ответе на двухфазный отек.Новые теории предполагают, что AQP4 способствует большему потоку через глимфатическую систему, что противоречит образованию отеков, локализованных на концах астроцитов (Thrane et al., 2014). Доказательства также указывают на то, что существует перекрестное взаимодействие между микроглией и астроцитами в регуляции AQP4 посредством путей, опосредованных рецептором распознавания микроглиального паттерна (Laird et al., 2014). Другие исследования направлены на понимание эффекта модуляции AQP на уменьшение нейронального повреждения и когнитивных нарушений, связанных с отеком, вызванным ЧМТ (Tran et al., 2010; Шенак и др., 2012).
Расширение клеточной смерти
Большая часть межклеточной молекулярной буферизации, необходимой для гомеостаза в головном мозге, обеспечивается щелевыми соединениями (GJ), которые состоят из полуканалов коннексина (Сх), которые пересекают плазматическую мембрану, напрямую соединяют соседние клетки. Cx30 и Cx43 экспрессируются астроцитами, тогда как Cx32 экспрессируется только олигодендроцитами (Rash et al., 2001). ЩК необходимы для образования астроцитарных сетей, которые соединяют синапсы и сосуды нейронов (Giaume, 2010; Giaume et al., 2010). Роль Cx43 в повреждении ЦНС обсуждалась как защитная и пагубная для коммуникации GJ (Chew et al., 2010). GJs позволяют переносить ионы, метаболиты и другие небольшие молекулы. Таким образом, поврежденная клетка может распространять свои повреждающие компоненты на соседние здоровые клетки. Хотя это потенциально защищает поврежденные клетки, это также усугубляет распространение травмы. Исследования изучали роль экспрессии Сх43 в увеличении клеточной гибели (Frantseva et al., 2002; Lin et al., 2008; Sun et al., 2014; Ровеньо и др., 2015). Воспалительные цитокины, секретируемые микроглией, активируют Cx43 в астроцитах и могут усиливать опосредованную рецептором N-метил-D-аспартата (NMDA) эксайтотоксичность в окружающих нейронах (Froger et al., 2010). Кроме того, полуканалы Cx являются путем высвобождения АТФ во внеклеточное пространство, что усугубляет метаболическую дисфункцию и воспаление (Cotrina et al., 1998; Frantseva et al., 2002; Davalos et al., 2005; Figiel et al., 2007). ). Также известно, что высвобождение трансмиттеров, включая АТФ и глутамат, может нарушать межклеточную передачу сигналов кальция в астроцитарных сетях, что, в свою очередь, может способствовать нейровоспалению и гибели клеток (Choo et al., 2013; Де Бок и др., 2014). Имеются доказательства того, что экспрессия Cx влияет на функциональные и когнитивные исходы травм (Huang et al., 2012; Sun et al., 2015), а также на прогрессирующую нейродегенерацию (Orellana et al., 2009).
Реактивный глиоз
После оскорбления глия переходит в реактивное состояние. Реактивный глиоз характеризуется специфическими молекулярными и морфологическими изменениями микроглии и астроцитов. После активации микроглия в сочетании с макрофагами и астроцитами секретирует цитокины (интерферон-γ, фактор некроза тканей-α, интерлейкины-1 и 6, а также трансформирующий фактор роста-β (TGF-β)) (Morganti-Kossmann et al., 2001; Ли и др., 2009; Кумар и Лоан, 2012; Aungst et al., 2014; Sajja et al., 2014b). Хотя активация начинается сразу после травмы, она часто сохраняется хронически, что связано с нарушением гомеостаза нейронов и дефицитом памяти (Hanisch and Kettenmann, 2007; Ramlackhansingh et al., 2011; Mannix and Whalen, 2012; Smith et al., 2012; Джонсон и др., 2013). Нейровоспаление связано с АФК и обострением активации астроцитов. Сообщалось о продолжительных нейротрофических эффектах активированной микроглии (Nagamoto-Combs et al., 2007). Это хроническое воспаление имеет пагубные последствия и способствует нейродегенерации и ухудшению памяти (Faden and Loane, 2015). Подходы к молекулярному и генетическому влиянию на снижение активации микроглии привели к снижению нейропатологии (Yi et al., 2008; Dohi et al., 2010) и улучшению когнитивных и функциональных результатов (Erlich et al., 2007; Li et al., 2009). ; Kabadi et al., 2012; Cho et al., 2013).
Реактивность астроцитов или астроглиоз характеризуется тремя признаками: гипертрофией, повышенной экспрессией промежуточных филаментов (глиально-фибриллярный кислый белок (GFAP), нестин и виментин) и повышенной пролиферацией (Baldwin and Scheff, 1996; Sahin Kaya et al., 1999; Vandevord et al., 2008). Астроглиоз зависит от взаимодействия с активированной микроглией (Di Giovanni et al., 2005; Myer et al., 2006). Реактивные астроциты секретируют молекулы для регуляции существующего нейровоспалительного ответа (Panenka et al., 2001; Gorina et al., 2011), являются неотъемлемой частью создания физических барьеров, связанных с ГЭБ, а также способствуют образованию рубцов вокруг поврежденной ткани. Астроцитарный рубец подавляет рост аксонов, поскольку клетки секретируют ингибиторы роста, такие как TGF-β, что влияет на долгосрочные когнитивные результаты.Хотя большинство исследований сосредоточено на модуляции астроглиоза, как защитные, так и тормозящие эффекты оценивались в контексте улучшения выживаемости нейронов и когнитивных способностей с течением времени (Smith et al., 1997; Hoane et al., 2003; Wu et al. , 2010; Madathil et al., 2013).
Глиальный вклад в дефицит памяти
Дисфункция олигодендроцитов из-за воспаления или гибели клеток нарушает нейротрансмиссию из-за дегенерации трактов WM (Smith et al., 1997; Gorina et al., 2011). Доклинические и клинические исследования показали, что нарушение аксонов связано с функциональным нарушением (Lu et al., 2012; MacDonald et al., 2013; Calabrese et al., 2014). В исследовании на приматах, кроме человека, сообщалось о потере целостности WM и гипертрофии астроцитов с повышенным содержанием AQP-4, которые способствовали гибели клеток, связанной с когнитивными нарушениями (Lu et al., 2012). В частности, было показано, что обучение и память связаны с аномальными уровнями мио-инозита, который является маркером астроглиоза (Sajja et al., 2014б). Было обнаружено, что результаты глиоза, направленные на деменцию, такие как тау-маркеры и маркеры метилирования ДНК, активируются после TBI (Bailey et al., 2015; Sajja et al., 2015; Shultz et al., 2015). Другой индикатор, связанный с дефицитом памяти, — это нарушенный гомеостаз дополнительных и внутриклеточных K + каналов в глии (D’Ambrosio et al., 1999). Кроме того, было показано, что блокирование активации глии улучшает когнитивные функции (Homsi et al., 2010; Bedi et al., 2013). Новое исследование показало роль эпендимных клеток в нарушении памяти.Эпендимные клетки представляют собой специализированные глии, выстилающие желудочки ЦНС. Было обнаружено, что потеря эпендимных клеток снижает желудочковый кровоток после ЧМТ, что может негативно повлиять на обмен отходов и питательных веществ в головном мозге (Xiong et al., 2014). Дополнительные исследования, которые помогут расшифровать молекулярные пути между глией и дефицитом памяти, будут иметь жизненно важное значение для разработки лучших клинических инструментов для измерения потери памяти.
Биомаркеры на основе глии
Ответ глии на TBI многогранен, что подтверждает важность этих клеток для восстановления.Однако сложные химические и физические реакции глии очень трудно обнаружить в клинических условиях. Технически сложно диагностировать и изучить участие глии на этапах восстановления после травмы и их вклад в дефицит памяти. Большинство легких случаев ЧМТ имеют нормальные результаты при обычной нейровизуализации [компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ)]. Несмотря на то, что как фундаментальные, так и клинические исследования значительно улучшились, достижения жизненно важны для заполнения пробела в переводе.Появились инновационные технологии, такие как сывороточные биомаркеры и in vivo, магнитно-резонансная спектроскопия ( 1 H-MRS), которые могут обеспечить связь, необходимую для разветвления основной и клинической областей (рис. 2).
Рис. 2. Клинически переводимые биомаркеры черепно-мозговой травмы . Магнитно-резонансная спектроскопия in vivo ( 1 H-MRS) и глиальные биомаркеры сыворотки могут обеспечить связь, необходимую для разветвления областей фундаментальных и клинических исследований.
Биомаркеры сыворотки
Минимально инвазивные методы, такие как сывороточные биомаркеры, могут использоваться для выявления патологий головного мозга. Благодаря технологическим достижениям в протеомике и липидомике поиск точных биомаркеров, отражающих состояние здоровья глии, будет чрезвычайно ценным. GFAP является распространенным астроцитарным маркером, который был обнаружен в сыворотке после TBI как в доклинических, так и в клинических исследованиях (Fraser et al., 2011; Vajtr et al., 2012; Papa et al., 2014; Huang et al., 2015). Значительное накопление GFAP сохранялось в крови до 7 дней после травмы (Svetlov et al., 2009; Boutte ́ et al., 2015). Некоторые предположили, что использование GFAP в качестве биомаркера ЧМТ дает чистую выгоду по сравнению с одним только клиническим скринингом и может помочь избежать дорогостоящего сканирования изображений без ущерба для диагностической чувствительности (McMahon et al., 2015). Кальций-связывающий белок B S100 (S100-β) — еще один биомаркер сыворотки, который клинически используется для помощи в диагностике неврологических расстройств (Bouvier et al., 2012; ДеФазио и др., 2014; Телин и др., 2014). S100-β экспрессируется в основном зрелыми астроцитами и присутствует во внеклеточном пространстве, окружающем глию, помогая регулировать приток / отток кальция из клеток, но также связан с апоптотической средой (Gyorgy et al., 2011; Vajtr et al., 2012 ). Исследования определили S100-β как биомаркер, который потенциально может быть использован при диагностике ЧМТ, однако другие предполагают, что GFAP является лучшим средством оценки ЧМТ без переломов черепа (Papa et al., 2014). Миелин-основной белок (MBP) является специфическим маркером олигодендроцитов и был обнаружен в крови, что указывает на возможное нарушение миелина, что приводит к повреждению аксонов (Gyorgy et al., 2011; Yan et al., 2014; Papa et al., 2015).
Биомаркеры на основе липидов, такие как сфинголипиды, в частности сфингомиелины и церамиды, в последнее время стали активной областью исследований биомаркеров. Сфингомиелин в изобилии присутствует в миелиновой мембране, и аномальные уровни в крови могут представлять собой изменения в состоянии миелина и ассоциации с повреждением олигодендроцитов (Haughey, 2010; Abdullah et al., 2014; Новгородов и др., 2014; Энрикес-Энрикес и др., 2015; Коал и др., 2015). Кроме того, церамид метаболизируется из сфингомиелинов и, наоборот, сфингомиелиназой. Известно, что церамид служит вторичным посредником для внутриклеточной активации уровней каспазы-3 при клеточном апоптозе (Haughey et al., 2010). Следовательно, сочетание изменений уровней церамида и сфингомиелина может предсказать общий липидный статус миелина в головном мозге. Липиды очень чувствительны к изменениям в состоянии мозга, поэтому они предлагают новые диагностические возможности благодаря развитию надежных и чувствительных аналитических методов (Touboul and Gaudin, 2014).
1 H-MRSМРТ — это неинвазивный и широко распространенный метод диагностики для изучения аномалий головного мозга. В то время как МРТ T1, T2 и T2 * может предоставить информацию, относящуюся к грубым анатомическим изменениям, отеку и кровоизлиянию в мозг, 1 H-MRS обеспечивает более подробное химическое понимание функционального статуса и патологического прогноза мозга (Sajja et al., 2012; Kantarci, 2013). Доклинический 1 H-MRS может разрешить ~ 25, а клинический 1 H-MRS примерно ~ 10 метаболитов в зависимости от параметров подавления пика (Moore and Galloway, 2002; Moffett et al., 2007; Софронев и Винтерс, 2010).
N-ацетиласпартат (NAA) представляет собой нейрометаболит, синтезируемый из аспартата и ацетильного кофермента A. NAA или NAA / креатин (Cre) трансрегулируется между олигодендроцитами и нейронами и может дать представление о структурной целостности WM (Charlton et al. ., 2006; Ariyannur et al., 2008; Kantarci, 2013). Исследования показали, что уровни NAA в головном мозге коррелируют с изменением целостности WM после TBI (Pendlebury et al., 2000; Brooks et al., 2001; Shiino et al., 2004).Нарушение гомеостаза нейронов и олигодендроцитов может повлиять на потенциалы аксонов и, в конечном итоге, на нейротрансмиссию, что приведет к изменению когнитивного статуса. Поскольку изменения уровней NAA в богатых WM регионах могут указывать на состояние здоровья олигодендроцитов и его можно измерить как доклиническим, так и клиническим 1 H-MRS, он может стать инновационным средством трансляции.
Реактивные астроциты быстро накапливаются в области повреждения и изменяют свою морфологию, обычно вызывая отек.Это связано с изменениями осмолярности, которые возникают в результате отека или ишемии после ЧМТ (Sofroniew and Vinters, 2010). Мио-инозитол (Ins) — это основной метаболит, поддерживающий осмолярность мозга. Клинические исследования показали, что повышенная регуляция Ins коррелирует с астроглиозом при патофизиологических состояниях, таких как ЧМТ, деменция и глиобластома (Hattingen et al., 2008; Kantarci, 2013; Kierans et al., 2014). Доклинические исследования показали, что 1 H-MRS-разрешенных Ins были связаны с астроглиозом и нарушением когнитивных функций после ЧМТ (Kierans et al., 2014; Sajja et al., 2014a).
Вместе с астроцитами микроглия активно участвует в очистке от мусора, образовавшегося в результате нейровоспаления. Изменения метаболитов, таких как фосфориэтаноламин (PEA), глицерофосфохолин (GPC) и холины (Cho), связаны с микроглией. PEA и GPC участвуют в обновлении клеточных мембран, что указывает на нейровоспаление, и уровни GPC / PEA изменяются в зависимости от статуса активации клеток (Sajja et al., 2012). Таким образом, они указывают на нарушение клеточной активности.
Разрешение 1 пиков H-MRS с более низким отношением сигнал / шум зависит от напряженности поля сканера, времени получения и количества повторений сбора. Хотя многие метаболиты могут быть определены с помощью доклинических МРТ сканеров, только небольшая часть может быть определена с помощью клинического сканера, что ограничивает клиническую трансляцию. Однако NAA, Ins и Cho могут быть решены с помощью клинически доступных МРТ-сканеров. Таким образом, мы подчеркнули потенциальную полезность клинического 1 H-MRS в сочетании с другими методами дифференциальной диагностики.
Заключение
Мы рассмотрели несколько молекул на основе глии, которые дают представление о состоянии здоровья глии после ЧМТ. Существует общее мнение, что панель маркеров предоставит наиболее клинически значимый диагностический инструмент. Таким образом, понимание того, как дисфункция глии после травмы может изменить механизмы синаптической пластичности и ее связь с повышенным риском стойкого дефицита памяти, необходимо для продвижения вперед. Исследователи активно ищут новые цели для малоинвазивных инструментов, которые могут точно и объективно обнаруживать травмы головного мозга.Сочетание сложных инструментов, таких как биомаркеры сыворотки и MRS, обеспечит точный дифференциальный диагноз после TBI. Более того, временная структура этих маркеров может дать прогностические подсказки относительно нейрональной пластичности, ведущей к формированию памяти.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Абдулла, Л., Эванс, Дж. Э., Фергюсон, С., Музон, Б., Монтегю, Х., Рид, Дж. И др. (2014). Липидомный анализ выявляет специфические изменения фосфолипидов через 3 месяца после черепно-мозговой травмы. FASEB J. 28, 5311–5321. DOI: 10.1096 / fj.14-258228
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анжелони, К., Прата, К., Виецели Далла Сега, Ф., Пиперно, Р., и Хрелия, С. (2015). Черепно-мозговая травма и НАДФН-оксидаза: глубокая взаимосвязь. Оксид. Med. Клетка. Longev. 2015, 10. doi: 10.1155 / 2015/370312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арияннур, П. С., Мадхаварао, К. Н., и Намбудири, А. М. (2008). Синтез N-ацетиласпартата в головном мозге: митохондрии против микросом. Brain Res. 1227, 34–41. DOI: 10.1016 / j.brainres.2008.06.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аунгст, С. Л., Кабади, С. В., Томпсон, С. М., Стойка, Б.А., Фаден А. И. (2014). Повторные легкие черепно-мозговые травмы вызывают хроническое нейровоспаление, изменения синаптической пластичности гиппокампа и связанные с ними когнитивные нарушения. J. Cereb. Blood Flow Metab. 34, 1223–1232. DOI: 10.1038 / jcbfm.2014.75
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейли, З. С., Гринтер, М. Б., Де Ла Торре Кампос, Д., и ВандеВорд, П. Дж. (2015). Нейротравма, вызванная взрывом, вызывает зависимые от избыточного давления изменения в равновесии метилирования ДНК. Neurosci. Lett. 604, 119–123. DOI: 10.1016 / j.neulet.2015.07.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болдуин, С. А., и Шефф, С. В. (1996). Изменение промежуточного филамента в астроцитах после легкого ушиба коры. Glia 16, 266–275.
PubMed Аннотация | Google Scholar
Беди, С. С., Хетц, Р., Томас, К., Смит, П., Олсен, А. Б., Уильямс, С., и др. (2013). Внутривенная терапия мультипотентными взрослыми клетками-предшественниками ослабляет активированный ответ микроглии / макрофага и улучшает пространственное обучение после черепно-мозговой травмы. Stem Cells Пер. Med. 2, 953–960. DOI: 10.5966 / sctm.2013-0100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бутте, А.М., Денг-Брайант, Ю., Джонсон, Д., Тортелла, Ф.С., Дэйв, Дж. Р., Шир, Д. А., и др. (2015). Сывороточный глиальный фибриллярный кислый белок предсказывает продукты распада глиального фибриллярного кислого белка ткани и терапевтическую эффективность после проникающего баллистического повреждения мозга. J. Нейротравма . 33, 147–156. DOI: 10,1089 / neu.2014.3672
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бувье, Д., Фурнье, М., Дофин, Дж. Б., Амат, Ф., Угетто, С., Лаббе, А. и др. (2012). Определение S100B в сыворотке крови при лечении легкой черепно-мозговой травмы у детей. Clin. Chem. 58, 1116–1122. DOI: 10.1373 / Clinchem.2011.180828
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брукс, В. М., Фридман, С. Д., Гаспарович, К. (2001). Магнитно-резонансная спектроскопия при черепно-мозговой травме. J. Head Trauma Rehabil. 16, 149–164. DOI: 10.1097 / 00001199-200104000-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Buffo, A., Rolando, C., and Ceruti, S. (2010). Астроциты в поврежденном мозге: молекулярные и клеточные данные об их реактивной реакции и лечебном потенциале. Biochem. Pharmacol. 79, 77–89. DOI: 10.1016 / j.bcp.2009.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калабрезе, Э., Du, F., Garman, R.H., Johnson, G.A., Riccio, C., Tong, L.C., et al. (2014). Визуализация с помощью тензора диффузии выявляет повреждение белого вещества на крысиной модели повторяющегося черепно-мозгового повреждения, вызванного взрывом. J. Neurotrauma 31, 938–950. DOI: 10.1089 / neu.2013.3144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чарльтон Р. А., Баррик Т. Р., Макинтайр Д. Дж., Шен Ю., О’салливан М., Хоу Ф. А. и др. (2006). Повреждение белого вещества при визуализации диффузионного тензора коррелирует с возрастным когнитивным снижением. Неврология 66, 217–222. DOI: 10.1212 / 01.wnl.0000194256.15247.83
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cheng, G., Kong, R.-H., Zhang, L.-M., and Zhang, J.-N. (2012). Митохондрии при черепно-мозговой травме и многопотенциальные терапевтические стратегии, нацеленные на митохондрии. руб. J. Pharmacol. 167, 699–719. DOI: 10.1111 / j.1476-5381.2012.02025.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу, С.С. Л., Джонсон, К. С., Грин, К. Р., Данеш-Мейер, Х. В. (2010). Роль коннексина 43 в повреждении центральной нервной системы. Exp. Neurol. 225, 250–261. DOI: 10.1016 / j.expneurol.2010.07.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чо, Х. Дж., Саджа, В. С., Вандеворд, П. Дж., И Ли, Ю. В. (2013). Взрыв вызывает окислительный стресс, воспаление, потерю нейронов и последующее ухудшение кратковременной памяти у крыс. Неврология 253, 9–20.DOI: 10.1016 / j.neuroscience.2013.08.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу, А. М., Миллер, В. Дж., Чен, Ю. К., Нибли, П., Патель, Т. П., Голетиани, К. и др. (2013). Антагонизм пуринергической передачи сигналов улучшает восстановление после черепно-мозговой травмы. Мозг 136, 65–80. DOI: 10.1093 / brain / aws286
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коликос, М.А., и Дэш, П.К. (1996). Апоптотическая морфология гранулярных клеток зубчатой извилины после экспериментального коркового ударного повреждения у крыс: возможная роль в дефиците пространственной памяти. Brain Res. 739, 120–131. DOI: 10.1016 / S0006-8993 (96) 00824-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cotrina, M. L., Lin, J. H. C., Alves-Rodrigues, A., Liu, S., Li, J., Azmi-Ghadimi, H., et al. (1998). Коннексины регулируют передачу сигналов кальция, контролируя высвобождение АТФ. Proc. Natl. Акад. Sci. США 95, 15735–15740. DOI: 10.1073 / pnas.95.26.15735
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крофт, W., Добсон, К. Л., и Беллами, Т. К. (2015). Пластичность нейрон-глиальной передачи: оснащение глии для долгосрочной интеграции сетевой активности. Neural Plast. 2015, 11. DOI: 10.1155 / 2015/765792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Д’Амброзио, Р., Марис, Д. О., Грейди, М. С., Винн, Х. Р., и Янигро, Д. (1999). Нарушение гомеостаза K (+) и измененные электрофизиологические свойства посттравматической глии гиппокампа. J. Neurosci. 19, 8152–8162.
PubMed Аннотация | Google Scholar
Давалос, Д., Груцендлер, Дж., Янг, Г., Ким, Дж. В., Цзо, Ю., Юнг, С. и др. (2005). АТФ опосредует быстрый ответ микроглии на локальное повреждение головного мозга in vivo . Nat. Neurosci. 8, 752–758. DOI: 10.1038 / nn1472
PubMed Аннотация | CrossRef Полный текст | Google Scholar
De Bock, M., Decrock, E., Wang, N., Bol, M., Vinken, M., Bultynck, G., et al. (2014). Двойное лицо астроглиальной связи Ca2 + на основе коннексина: ключевой игрок в физиологии мозга и главная мишень в патологии. Biochim. Биофиз. Acta 1843, 2211–2232. DOI: 10.1016 / j.bbamcr.2014.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДеФацио, М. В., Раммо, Р. А., Роблес, Дж. Р., Брамлет, Х. М., Дитрих, В. Д. и Баллок, М. Р. (2014). Потенциальная полезность биохимических маркеров, полученных из крови, в качестве индикаторов ранних клинических тенденций после тяжелой черепно-мозговой травмы. World Neurosurg. 81, 151–158. DOI: 10.1016 / j.wneu.2013.01.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ди Джованни, С., Мовсесян В., Ахмед Ф., Чернак И., Шинелли С., Стойка Б. и др. (2005). Ингибирование клеточного цикла обеспечивает нейрозащиту и снижает глиальную пролиферацию и образование рубцов после черепно-мозговой травмы. Proc. Natl. Акад. Sci. США 102, 8333–8338. DOI: 10.1073 / pnas.0500989102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дохи К., Отаки Х., Накамачи Т., Йофу С., Сато К., Миямото К. и др. (2010). Gp91 (phox) (NOX2) в классически активированной микроглии усугубляет черепно-мозговую травму. J. Нейровоспаление 7, 41–41. DOI: 10.1186 / 1742-2094-7-41
CrossRef Полный текст | Google Scholar
Эрлих С., Александрович А., Шохами Э. и Пинкас-Крамарски Р. (2007). Рапамицин — нейропротекторное средство при черепно-мозговой травме. Neurobiol. Дис. 26, 86–93. DOI: 10.1016 / j.nbd.2006.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фаден, А. И., Лоан, Д. Дж. (2015). Хроническая нейродегенерация после черепно-мозговой травмы: болезнь Альцгеймера, хроническая травматическая энцефалопатия или стойкое нейровоспаление? Neurotherapeutics 12, 143–150.DOI: 10.1007 / s13311-014-0319-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фигиль, М., Аллриц, К., Леманн, К., и Энгеле, Дж. (2007). Контроль щелевых соединений экспрессии глиального транспортера глутамата. Мол. Клетка. Neurosci. 35, 130–137. DOI: 10.1016 / j.mcn.2007.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Францева, М.В., Кокаровцева, Л., Наус, К.Г., Карлен, П.Л., МакФабе, Д., и Перес Веласкес, Дж.Л. (2002). Специфические щелевые соединения повышают уязвимость нейронов к травматическим повреждениям головного мозга. J. Neurosci. 22, 644–653.
PubMed Аннотация | Google Scholar
Фрейзер Д. Д., Клоуз Т. Е., Роуз К. Л., Уорд Р., Мель М., Фаррелл К. и др. (2011). При тяжелой черепно-мозговой травме у детей повышается содержание глиального фибриллярного кислого белка в спинномозговой жидкости и сыворотке. Pediatr. Крит. Care Med. 12, 319–324. DOI: 10.1097 / PCC.0b013e3181e8b32d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрогер, Н., Orellana, J.A., Calvo, C.F., Amigou, E., Kozoriz, M.G., Naus, C.C., et al. (2010). Ингибирование индуцированной цитокинами активности полуканала коннексина 43 в астроцитах является нейропротекторным. Мол. Клетка. Neurosci. 45, 37–46. DOI: 10.1016 / j.mcn.2010.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джом, К., Кулакофф, А., Ру, Л., Холкман, Д., и Руах, Н. (2010). Астроглиальные сети: шаг вперед в нейроглиальных и глиоваскулярных взаимодействиях. Nat. Rev. Neurosci. 11, 87–99. DOI: 10.1038 / nrn2757
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гилмер, Л. К., Робертс, К. Н., Джой, К., Салливан, П. Г., и Шефф, С. В. (2009). Ранняя митохондриальная дисфункция после ушиба коры. J. Neurotrauma 26, 1271–1280. DOI: 10.1089 / neu.2008.0857
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Горина Р., Фон-Ньевес М., Маркес-Кисиновский Л., Санталусия, Т., и Планас, А.М. (2011). Активация TLR4 астроцитов вызывает провоспалительную среду посредством взаимодействия между MyD88-зависимой передачей сигналов NFkappaB, MAPK и путями Jak1 / Stat1. Glia 59, 242–255. DOI: 10.1002 / glia.21094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дьерджи А., Линг Г., Винго Д., Уокер Дж., Тонг Л., Паркс С. и др. (2011). Зависимые от времени изменения уровней биомаркеров в сыворотке крови после взрывной черепно-мозговой травмы. J. Neurotrauma 28, 1121–1126. DOI: 10.1089 / neu.2010.1561
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ханиш, У.К., и Кеттенманн, Х. (2007). Микроглия: активные сенсорные и универсальные эффекторные клетки в нормальном и патологическом головном мозге. Nat. Neurosci. 10, 1387–1394. DOI: 10.1038 / nn1997
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаттинген, Э., Рааб, П., Франц, К., Занелла, Ф. Э., Ланферманн, Х., и Пилатус, У. (2008). Мио-инозитол: маркер реактивного астроглиоза при глиальных опухолях? ЯМР Биомед. 21, 233–241. DOI: 10.1002 / nbm.1186
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоги, Н. Дж., Бандару, В. В., Бэ, М., и Маттсон, М. П. (2010). Роль дисфункционального метаболизма сфинголипидов в нейропатогенезе болезни Альцгеймера. Biochim. Биофиз. Acta 1801, 878–886. DOI: 10.1016 / j.bbalip.2010.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энрикес-Энрикес, М.П., Солари, С., Кирога, Т., Ким, Б. И., Декельбаум, Р. Дж., И Воргалл, Т. С. (2015). Низкий уровень сфинголипидов в сыворотке крови у детей с синдромом дефицита внимания с гиперактивностью Фронт. Neurosci. 9: 300. DOI: 10.3389 / fnins.2015.00300
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоан, М. Р., Акстулевич, С. Л., и Топпен, Дж. (2003). Лечение витамином B3 улучшает функциональное восстановление и снижает экспрессию GFAP после черепно-мозговой травмы у крыс. J. Neurotrauma 20, 1189–1199. DOI: 10.1089 / 089771503770802871
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Homsi, S., Piaggio, T., Croci, N., Noble, F., Plotkine, M., Marchand-Leroux, C., et al. (2010). Блокада острой активации микроглии миноциклином способствует нейропротекции и снижает гиперактивность опорно-двигательного аппарата после закрытой травмы головы у мышей: последующее двенадцатинедельное исследование. J. Neurotrauma. 27, 911–921. DOI: 10.1089 / neu.2009.1223
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, К., Хан, X., Ли, X., Лам, Э., Пэн, В., Лу, Н. и др. (2012). Критическая роль коннексина 43 во вторичном распространении травм спинного мозга. J. Neurosci. 32, 3333–3338. DOI: 10.1523 / JNEUROSCI.1216-11.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, X. J., Глушакова, О., Монделло, С., Ван, К., Хейс, Р. Л., и Лайт, Б. Г. (2015). Острые временные профили сывороточных уровней UCH-L1 и GFAP и взаимосвязь с нейрональной и астроглиальной патологией после черепно-мозговой травмы у крыс. J. Neurotrauma 32, 1179–1189. DOI: 10.1089 / neu.2015.3873
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонсон В. Э., Стюарт Дж. Э., Бегби Ф. Д., Трояновски Дж. К., Смит Д. Х. и Стюарт В. (2013). Воспаление и дегенерация белого вещества сохраняются годами после однократной черепно-мозговой травмы. Мозг 136, 28–42. DOI: 10.1093 / мозг / aws322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кабади, С.В., Стойка, Б. А., Бирнс, К. Р., Хэнском, М., Лоан, Д. Дж., И Фаден, А. И. (2012). Селективный ингибитор CDK ограничивает нейровоспаление и прогрессирующую нейродегенерацию после травмы головного мозга. J. Cereb. Blood Flow Metab. 32, 137–149. DOI: 10.1038 / jcbfm.2011.117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кенинг, К. Л., ван Ландегем, Ф. К. Х., Шрайбер, С., Томале, У. У., фон Даймлинг, А., Унтерберг, А. В. и др. (2002). Снижение уровня аквапорина-4 в полушарии связано с развитием отека мозга у крыс после контролируемого повреждения коры. Neurosci. Lett. 324, 105–108. DOI: 10.1016 / S0304-3940 (02) 00180-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киранс, А.С., Киров, И.И., Гонен, О., Хемер, Г., Нисенбаум, Э., Бабб, Дж. С. и др. (2014). Нарушение нейрометаболитов миоинозитола и глутаматного комплекса после легкой черепно-мозговой травмы. Неврология 82, 521–528. DOI: 10.1212 / WNL.0000000000000105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коал, Т., Клавинс, К., Сеппи, Д., Кеммлер, Г., и Хампель, К. (2015). Сфингомиелин SM (d18: 1/18: 0) значительно усиливается в образцах спинномозговой жидкости, дихотомизированных по патологическим уровням амилоида-бета42, тау и фосфо-тау-181. J. Alzheimers. Дис. 44, 1193–1201. DOI: 10.3233 / JAD-142319
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, А., Лоан, Д. Дж. (2012). Нейровоспаление после черепно-мозговой травмы: возможности терапевтического вмешательства. Brain Behav. Иммун. 26, 1191–1201. DOI: 10.1016 / j.bbi.2012.06.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лэрд, М. Д., Шилдс, Дж. С., Сукумари-Рамеш, С., Кимблер, Д. Э., Фесслер, Р. Д., Шакир, Б. и др. (2014). Белок-бокс группы высокой подвижности-1 способствует отеку мозга после черепно-мозговой травмы посредством активации толл-подобного рецептора 4. Glia 62, 26–38. DOI: 10.1002 / glia.22581
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ларсен, Б.R., Assentoft, M., Cotrina, M. L., Hua, S. Z., Nedergaard, M., Kaila, K., et al. (2014). Вклады Na (+) / K (+) — ATPase, NKCC1 и Kir4.1 в клиренс K (+) и объемные реакции гиппокампа. Glia 62, 608–622. DOI: 10.1002 / glia.22629
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Левен А. и Хилеред Л. (1998). Участие активных форм кислорода в разрушении мембранных фосфолипидов и энергетических возмущениях после черепно-мозговой травмы у крысы. J. Neurotrauma 15, 521–530. DOI: 10.1089 / neu.1998.15.521
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Б., Махмуд, А., Лу, Д., Ву, Х., Сюн, Ю., Цюй, С. и др. (2009). Симвастатин ослабляет микроглию, активацию астроцитов и снижает уровень IL-1β после черепно-мозговой травмы. Нейрохирургия 65, 179–186. DOI: 10.1227 / 01.NEU.0000346272.76537.DC
CrossRef Полный текст | Google Scholar
Лин, Дж. Х., Лу, Н., Канг Н., Такано Т., Ху Ф., Хан Х. и др. (2008). Центральная роль коннексина 43 в прекондиционировании гипоксии. J. Neurosci. 28, 681–695. DOI: 10.1523 / JNEUROSCI.3827-07.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Locovei, S., Wang, J., and Dahl, G. (2006). Активация каналов паннексина 1 АТФ через рецепторы P2Y и цитоплазматическим кальцием. FEBS Lett. 580, 239–244. DOI: 10.1016 / j.febslet.2005.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, Дж., Ng, K. C., Ling, G., Wu, J., Poon, D. J., Kan, E. M., et al. (2012). Влияние взрывного воздействия на структуру мозга и познавательные способности Macaca fascicularis. J. Neurotrauma. 229, 1434–1454. DOI: 10.1089 / neu.2010.1591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, X.-Y., Ван, Х.-Д., Сюй, Дж.-Г., Дин, К., и Ли, Т. (2014). Ингибирование НАДФН-оксидазы улучшает неврологический исход при экспериментальной черепно-мозговой травме. Neurochem. Int. 69, 14–19.DOI: 10.1016 / j.neuint.2014.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маколей Н. и Цойтен Т. (2012). Клиренс глиального K (+) и набухание клеток: ключевые роли котранспортеров и насосов. Neurochem. Res. 37, 2299–2309. DOI: 10.1007 / s11064-012-0731-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
MacDonald, C., Johnson, A., Cooper, D., Malone, T., Sorrell, J., Shimony, J., et al. (2013). Аномалии белого вещества мозжечка после первичной взрывной травмы у военнослужащих США. PLOS ONE 8: e55823. DOI: 10.1371 / journal.pone.0055823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мадатил, С. К., Карлсон, С. В., Брелсфоард, Дж. М., Йе, П., Д’Эркол, А. Дж., И Саатман, К. Э. (2013). Специфическая для астроцитов сверхэкспрессия инсулиноподобного фактора роста-1 защищает нейроны гиппокампа и снижает поведенческий дефицит после черепно-мозговой травмы у мышей. PLoS ONE 8: e67204. DOI: 10.1371 / journal.pone.0067204
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакМахон, П.J., Panczykowski, D. M., Yue, J. K., Puccio, A. M., Inoue, T., Sorani, M. D., et al. (2015). Измерение глиального фибриллярного кислого белка и продуктов его распада Биомаркер GFAP-BDP для обнаружения черепно-мозговой травмы по сравнению с компьютерной томографией и магнитно-резонансной томографией. J. Neurotrauma 32, 527–533. DOI: 10.1089 / neu.2014.3635
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер Д. М., Сингх И. Н., Ван Дж. А. и Холл Э.Д. (2015). Активатор Nrf2-ARE карнозиновая кислота снижает митохондриальную дисфункцию, окислительное повреждение и деградацию цитоскелета нейронов после черепно-мозговой травмы у мышей. Exp. Neurol. 264, 103–110. DOI: 10.1016 / j.expneurol.2014.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моффет, Дж. Р., Росс, Б., Арун, П., Мадхаварао, К. Н., и Намбудири, М. А. А. (2007). N-ацетиласпартат в ЦНС: от нейродиагностики к нейробиологии. Прог.Neurobiol. 81, 89–131. DOI: 10.1016 / j.pneurobio.2006.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мур, Г. Дж., И Галлоуэй, М. П. (2002). Магнитно-резонансная спектроскопия: нейрохимия и лечебные эффекты при аффективных расстройствах. Psychopharmacol. Бык. 36, 5–23.
PubMed Аннотация | Google Scholar
Морага-Амаро, Р., Херес-Бараона, Дж. М., Саймон, Ф., и Стеберг, Дж. (2014). Роль астроцитов в памяти и психических расстройствах. J. Physiol. Париж 108, 240–251. DOI: 10.1016 / j.jphysparis.2014.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морганти-Косманн, М. К., Ранкан, М., Отто, В. И., Стахел, П. Ф., и Косманн, Т. (2001). Роль церебрального воспаления после черепно-мозговой травмы: новая концепция. Ударная волна 16, 165–177. DOI: 10.1097 / 00024382-200116030-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Майер, Д.Дж., Гуркофф, Г. Г., Ли, С. М., Ховда, Д. А., и Софронев, М. В. (2006). Существенные защитные роли реактивных астроцитов при черепно-мозговой травме. Мозг 129, 2761–2772. DOI: 10.1093 / brain / awl165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагамото-Комбс, К., МакНил, Д. У., Моркрафт, Р. Дж., И Комбс, К. К. (2007). Затяжной микроглиоз центральной нервной системы макак-резусов после черепно-мозговой травмы. J. Neurotrauma 24, 1719–1742.DOI: 10.1089 / neu.2007.0377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нильсен, С., Нагельхус, Э. А., Амири-Могхаддам, М., Бурк, К., Агре, П., и Оттерсен, О. П. (1997). Специализированные мембранные домены для транспорта воды в глиальных клетках: цитохимия аквапорина-4 с высоким разрешением в головном мозге крысы. J. Neurosci. 17, 171–180.
PubMed Аннотация | Google Scholar
Новгородов С.А., Райли К.Л., Ю.Дж., Борг К.T., Hannun, Y.A., Proia, R.L. и др. (2014). Важные роли нейтральной церамидазы и сфингозина в митохондриальной дисфункции из-за черепно-мозговой травмы. J. Biol. Chem. 289, 13142–13154. DOI: 10.1074 / jbc.M113.530311
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Орельяна, Дж. А., Саез, П. Дж., Шоджи, К. Ф., Шальпер, К. А., Паласиос-Прадо, Н., Веларде, В. и др. (2009). Модуляция полуканалов мозга и каналов щелевых контактов провоспалительными агентами и их возможная роль в нейродегенерации. Антиоксид. Редокс-сигнал. 11, 369–399. DOI: 10.1089 / ars.2008.2130
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паненка, В., Джиджон, Х., Херкс, Л. М., Армстронг, Дж. Н., Фейган, Д., Вей, Т. и др. (2001). Активация P2X7-подобного рецептора в астроцитах увеличивает экспрессию хемоаттрактантного протеина-1 хемокинов моноцитов через митоген-активируемую протеинкиназу. J. Neurosci. 21, 7135–7142.
PubMed Аннотация | Google Scholar
Папа, Л., Робертсон, С. С., Ван, К. К., Брофи, Г. М., Хэнней, Х. Дж., Хитон, С. и др. (2015). Биомаркеры улучшают предикторы клинических исходов смертности после непроникающей тяжелой черепно-мозговой травмы. Neurocrit. Уход 22, 52–64. DOI: 10.1007 / s12028-014-0028-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папа, Л., Сильвестри, С., Брофи, Г. М., Джордано, П., Фальк, Дж. Л., Брага, К. Ф. и др. (2014). GFAP превосходит S100beta в обнаружении травматических внутричерепных поражений на компьютерной томографии у пациентов с травмами с легкой черепно-мозговой травмой и пациентов с экстракраниальными поражениями. J. Neurotrauma 31, 1815–1822. DOI: 10.1089 / neu.2013.3245
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пендлбери, С. Т., Ли, М. А., Бламир, А. М., Стайлз, П., и Мэтьюз, П. М. (2000). Корреляция маркеров магнитно-резонансной томографии повреждения аксонов и демиелинизации при двигательных нарушениях, вторичных по отношению к инсульту и рассеянному склерозу. Magn. Резон. Imaging 18, 369–378. DOI: 10.1016 / S0730-725X (00) 00115-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пьетробон, Д., и Московиц, М.А. (2014). Хаос и волнения вследствие распространяющейся корковой депрессии и распространяющейся деполяризации. Nat. Rev. Neurosci. 15, 379–393. DOI: 10.1038 / nrn3770
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамлакхансинг, А. Ф., Брукс, Д. Дж., Гринвуд, Р. Дж., Бозе, С. К., Туркхаймер, Ф. Э., Киннунен, К. М. и др. (2011). Воспаление после травмы: активация микроглии и черепно-мозговая травма. Ann. Neurol. 70, 374–383.DOI: 10.1002 / ana.22455
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рао, К. В. Р., Редди, П. В. Б., Кертис, К. М., и Норенберг, М. Д. (2011). Экспрессия аквапорина-4 в культивируемых астроцитах после травмы, вызванной жидкостной перкуссией. J. Neurotrauma 28, 371–381. DOI: 10.1089 / neu.2010.1705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рао, В., Чжан, Л., Пэн, К., Хуэй, Х., Ван, К., Су, Н. и др. (2015). Подавление STIM2 улучшает выживаемость нейронов после черепно-мозговой травмы, уменьшая перегрузку кальцием и митохондриальную дисфункцию. Biochim. Биофиз. Acta Mol. Основы дис. 1852, 2402–2413. DOI: 10.1016 / j.bbadis.2015.08.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раш, Дж. Э., Ясумура, Т., Дэвидсон, К. Г., Фурман, К. С., Дудек, Ф. Э., и Надь, Дж. И. (2001). Идентификация клеток, экспрессирующих Cx43, Cx30, Cx26, Cx32 и Cx36 в щелевых соединениях головного и спинного мозга крыс. Cell Commun. Клеи. 8, 315–320. DOI: 10.3109 / 1541
045PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ровеньо, М., Сото, П. А., Саез, П. Дж., Наус, К. К., Саез, Дж. К., и фон Бернхарди, Р. (2015). Полуканалы коннексина 43 опосредуют распространение вторичного клеточного повреждения из зоны травмы в дистальные зоны монослоев астроцитов. Glia 63, 1185–1199. DOI: 10.1002 / glia.22808
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сахин Кая, С., Махмуд, А., Ли, Ю., Явуз, Э., и Чопп, М. (1999). Экспрессия нестина после черепно-мозговой травмы в головном мозге крысы. Brain Res. 840, 153–157. DOI: 10.1016 / S0006-8993 (99) 01757-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саджа В. С., Галлоуэй М. П., Годдусси Ф., Тируталинатан Д., Кепсел А., Хей К. и др. (2012). Нейротравма, вызванная взрывом, приводит к нейрохимическим изменениям и дегенерации нейронов в гиппокампе крысы. ЯМР Биомед. 25, 1331–1339. DOI: 10.1002 / nbm.2805
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саджа, В.С., Хаббард, В. Б., Холл, К. С., Годдусси, Ф., Галлоуэй, М. П., и Вандеворд, П. Дж. (2015). Устойчивый дефицит памяти и нейрональная патология после черепно-мозговой травмы, вызванной взрывом. Sci. Отчет 5: 15075. DOI: 10.1038 / srep15075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саджа В. С., Перрин С. А., Годдусси Ф., Холл С. С., Галлоуэй М. П. и ВандеВорд П. Дж. (2014a). Взрывная нейротравма ухудшает рабочую память и нарушает уровень префронтального мио-инозита у крыс. Мол. Клетка. Neurosci. 59, 119–126. DOI: 10.1016 / j.mcn.2014.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саджа, В. С. С., Эрейфей, Э. С., и ВандеВорд, П. Дж. (2014b). Уязвимость гиппокампа и подострая реакция после разной силы взрыва. Neurosci. Lett. 570, 33–37. DOI: 10.1016 / j.neulet.2014.03.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сато, Ж.-И., Табуноки, Х., Ямамура, Т., Арима, К., и Конно, Х. (2007). Астроциты человека экспрессируют аквапорин-1 и аквапорин-4 in vitro и in vivo . Невропатология 27, 245–256. DOI: 10.1111 / j.1440-1789.2007.00774.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шефф, С. В., Прайс, Д. А., Шмитт, Ф. А., Робертс, К. Н., Икономович, М. Д., и Муфсон, Э. Дж. (2013). Стабильность синапсов в предклинье на ранних этапах прогрессирования болезни Альцгеймера. J. Alzheimers.Дис. 35, 599–609. DOI: 10.3233 / JAD-122353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шенак, М., Кассем, Х., Пенг, К., Шафер, С., Динг, Дж. Й., Фредриксон, В. и др. (2012). Повреждение нейронов и функциональный дефицит улучшаются за счет ингибирования аквапорина и HIF1альфа после черепно-мозговой травмы (TBI). J. Neurol. Sci. 323, 134–140. DOI: 10.1016 / j.jns.2012.08.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шиино, А., Нисида, Ю., Ясуда, Х., Судзуки, М., Мацуда, М., и Инубуши, Т. (2004). Магнитно-резонансное спектроскопическое определение нейрональных и аксональных маркеров в белом веществе предсказывает обратимость дефицита при вторичной гидроцефалии нормального давления. J. Neurol. Нейрохирургия. Психиатр. 75, 1141–1148. DOI: 10.1089 / neu.2013.3110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шульц, С. Р., Райт, Д. К., Чжэн, П., Стучбери, Р., Лю, С. Дж., Сашиндранат, М., и другие. (2015). Селенат натрия снижает уровень гиперфосфорилированного тау-белка и улучшает результаты после черепно-мозговой травмы. Мозг 138, 1297–1313. DOI: 10.1093 / brain / awv053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингх И. Н., Салливан П. Г., Дэн Ю., Мбай Л. Х. и Холл Э. Д. (2006). Динамика посттравматического окислительного повреждения и дисфункции митохондрий на мышиной модели очаговой черепно-мозговой травмы: последствия для нейропротекторной терапии. J. Cereb. Blood Flow Metab. 26, 1407–1418. DOI: 10.1038 / sj.jcbfm.9600297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Smith, D. H., Chen, X.-H., Pierce, J. E. S., Wolf, J. A., Trojanowski, J. Q., Graham, D. I., et al. (1997). Прогрессирующая атрофия и гибель нейронов в течение одного года после травмы головного мозга у крысы. J. Neurotrauma 14, 715–727. DOI: 10.1089 / neu.1997.14.715
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, Дж.А., Дас, А., Рэй, С. К., Баник, Н. Л. (2012). Роль провоспалительных цитокинов, высвобождаемых из микроглии, в нейродегенеративных заболеваниях. Brain Res. Бык. 87, 10–20. DOI: 10.1016 / j.brainresbull.2011.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Салливан П. Г., Келлер Дж. Н., Маттсон М. П. и Шефф С. В. (1998). Черепно-мозговая травма изменяет синаптический гомеостаз: последствия для нарушения митохондриальной и транспортной функции. Дж.Нейротравма 15, 789–798. DOI: 10.1089 / neu.1998.15.789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Салливан П., Рабчевский А., Вальдмайер П. и Спрингер Дж. (2005). Изменение проницаемости митохондрий при травме ЦНС: причина или следствие гибели нейрональных клеток? J. Neurosci. Res. 79, 231–239. DOI: 10.1002 / jnr.20292
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, L., Gao, J., Zhao, M., Cui, J., Li, Y., Ян X. и др. (2015). Новый механизм когнитивного нарушения, заключающийся в том, что астроцитарный p-коннексин 43 способствует аутофагии нейронов посредством активации P2X7R и подавления экспрессии GLT-1 в гиппокампе после черепно-мозговой травмы у крыс. Behav. Brain Res. 291, 315–324. DOI: 10.1016 / j.bbr.2015.05.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, L.Q., Gao, J. L., Cui, C.M., Cui, Y., Jing, X. B., Zhao, M. M., et al. (2014). Астроцитарный р-коннексин 43 регулирует аутофагию нейронов в гиппокампе после черепно-мозговой травмы у крыс. Мол. Med. Rep. 9, 77–82. DOI: 10.3892 / mmr.2013.1787
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сан, М. К., Хани, К. Р., Берк, К., Вонг, Н. Л. и Цуй, Дж. К. (2003). Регулирование аквапорина-4 в модели черепно-мозговой травмы у крыс. J. Neurosurg. 98, 565–569. DOI: 10.3171 / jns.2003.98.3.0565
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сузуки, Р., Окуда, М., Асаи, Дж., Нагашима, Г., Итокава, Х., Мацунага А. и др. (2006). «Астроциты коэкспрессируют аквапорин-1, -4 и фактор роста эндотелия сосудов в ткани отека мозга, связанной с ушибом мозга», в Brain Edema XIII , ред. JT Hoff, RF Keep, G. Xi и Y. Hua ( Вена: Springer), 398–401.
PubMed Аннотация | Google Scholar
Светлов, С. И., Ларнер, С. Ф., Кирк, Д. Р., Аткинсон, Дж., Хейс, Р. Л., и Ван, К. К. (2009). Биомаркеры нейротравмы, вызванной взрывом: профилирование молекулярных и клеточных механизмов повреждения мозга взрывом. J. Neurotrauma 26, 913–921. DOI: 10.1089 / neu.2008.0609
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Телин, Э. П., Нельсон, Д. У., и Белландер, Б. М. (2014). Вторичные пики S100B в сыворотке относятся к последующей радиологической патологии при черепно-мозговой травме. Neurocrit. Уход 20, 217–229. DOI: 10.1007 / s12028-013-9916-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Трейн, А.С., Рангру Трейн, В., и Недергаард, М. (2014). Тонущие звезды: переоценка роли астроцитов в отеке мозга. Trends Neurosci. 37, 620–628. DOI: 10.1016 / j.tins.2014.08.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тран, Н. Д., Ким, С., Винсент, Х. К., Родригес, А., Хинтон, Д. Р., Буллок, М. Р. и др. (2010). Опосредованный аквапорином-1 отек мозга после черепно-мозговой травмы: последствия ацидоза и введения кортикостероидов. J. Neurosurg. 112, 1095–1104. DOI: 10.3171 / 2009.8.JNS081704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вайтр, Д., Бенада, О., Линцер, П., Самал, Ф., Спрингер, Д., Стрейц, П. и др. (2012). Иммуногистохимия и сывороточные значения S-100B, глиального фибриллярного кислого белка и гиперфосфорилированных нейрофиламентов при травмах головного мозга. Soud. Лек. 57, 7–12.
PubMed Аннотация | Google Scholar
Вандеворд, П. Дж., Люнг, Л. Ю., Харди, В., Мейсон, М., Ян, К. Х., и Кинг, А. И. (2008). Повышение активности генов реактивности и выживания в астроцитах после кратковременного воздействия избыточного давления. Neurosci. Lett. 434, 247–252. DOI: 10.1016 / j.neulet.2008.01.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, J.-W., Wang, H.-D., Zhong, W.-Z., Li, N., and Cong, Z.-X. (2012). Экспрессия и распределение клеток метаботропного рецептора глутамата 5 в коре головного мозга крысы после черепно-мозговой травмы. Brain Res. 1464, 73–81. DOI: 10.1016 / j.brainres.2012.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, H., Mahmood, A., Lu, D., Jiang, H., Xiong, Y., Zhou, D., et al. (2010). Ослабление астроглиоза и модуляция рецептора фактора роста эндотелия в липидных рафтах симвастатином после черепно-мозговой травмы. J. Neurosurg. 113, 591–597. DOI: 10.3171 / 2009.9.JNS09859
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюн, Г., Элкинд, Дж. А., Кунду, С., Смит, К. Дж., Антунес, М. Б., Тамаширо, Э. и др. (2014). Потеря эпендимных ресничек, вызванная черепно-мозговой травмой, снижает ток спинномозговой жидкости. J. Нейротравма . 31, 1396–1404. DOI: 10.1089 / neu.2013.3110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Xiong, Y., Gu, Q., Peterson, P.L., Muizelaar, J.P., and Lee, C.P. (1997). Дисфункция митохондрий и нарушение кальция, вызванное черепно-мозговой травмой. Дж.Нейротравма 14, 23–34. DOI: 10.1089 / neu.1997.14.23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, Э. Б., Сатгунасилан, Л., Пол, Э., Бай, Н., Нгуен, П., Агьяпомаа, Д., и др. (2014). Посттравматическая гипоксия связана с длительной выработкой церебральных цитокинов, более высокими уровнями биомаркеров в сыворотке и плохим исходом у пациентов с тяжелой черепно-мозговой травмой. J. Neurotrauma 31, 618–629. DOI: 10.1089 / neu.2013.3087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яо, X., Учида, К., Пападопулос, М. К., Задор, З., Мэнли, Г. Т., и Веркман, А. С. (2015). Незначительное уменьшение отека мозга и улучшение неврологического исхода у мышей с нокаутом по аквапорину-4 после контролируемого коркового повреждения головного мозга. J. Neurotrauma 32, 1458–1464. DOI: 10.1089 / neu.2014.3675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йи Дж. Х., Парк С. У., Брукс Н., Ланг Б. Т. и Вемуганти Р. (2008). Розиглитазон, агонист PPARγ, обладает нейропротективным действием после черепно-мозговой травмы за счет противовоспалительных и антиоксидантных механизмов. Brain Res. 1244, 164–172. DOI: 10.1016 / j.brainres.2008.09.074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Дж., Мур, А. Н., Клифтон, Г. Л., и Дэш, П. К. (2005). Сульфорафан усиливает экспрессию аквапорина-4 и уменьшает отек головного мозга после черепно-мозговой травмы. J. Neurosci. Res. 82, 499–506. DOI: 10.1002 / jnr.20649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Воспаление и глиоз при неврологических заболеваниях — клинические последствия
Hintergrund: Die der Pathogenese von Morbus Parkinson (PD, болезнь Паркинсона) zugrunde liegenden Mechanismen sind bis heute nur unvollständig verstanden.Insbesondere ist unklar, durch welche ursächlichen Faktoren Parkinson ausgelöst wird. Bei der HIV-Infektion treten bei vielen Patienten nerologische Störungen auf (ВИЧ-ассоциированные неврологические расстройства, HAND), die in der klinischen Symptomatik und der Lokalisation der betroffenen Gehirnareale dem Morbus Parkinson ähneln. Möglicherweise könnte eine Fehlregulation der Immunantwort eine Rolle als Auslöser beider Erkrankungen spielen. In dieser Arbeit wurde die Autoimmunantwort von PD- und HAND-Patienten und gesunden Kontrollen gegen verschiedene gehirnhomogenate untersucht, die während der Parkinsonerkrankung in unterschiedlichem Ausmaß geschädigt werden.Das Autoimmun-Signal имеет количественный и значительный аутоантигический идентификатор. Метододен: In dieser Arbeit wurde ein Western-Blot-basiertes Verfahren zum Nachweis von Autoantikörpern gegen Gehirngewebe entwickelt. Dieses Verfahren wurde nach Optimierung mit Plasmaproben von gesunden Kontrollen, PD-Patienten und Patienten mit HIV-Infektion insbesondere an einer Gruppe von 40 Parkinson-Patienten (Durchschnittsalter 65 Jahre, 45% weiblichrevells, Durchschnittsalter 65 Jahre, 45% weiblichrevenschrend 40 alterschontrolschrellschlich) und 40 других 50% weiblich) angewendet und die humorale Autoimmunität gegen verschiedene Gehirnareale untersucht.Dazu wurden die verschiedenen Areale (дорсалер Motornucleus des Glossopharynx- und Vagusnervs (dm), Substantia nigra (SN), переднемедиальный темпоралер Mesocortex (MC), сенсорные ассоциации высокого порядка — и передние предсердные сенсоры (HC), первые oderfelder-сенсоры (HC) , primäre sensorische und motorische Felder (FC)) von post mortem Gehirnen homogenisiert, auf SDS-Gradienten-Gelen elektrophoretisch aufgetrennt und auf Nitrocellulose geblottet. Die Membranen wurden mit den Plasmen inkubiert und gebundene Autoantikörpermunologisch Detektiert.Die Signale wurden qualitativ und количественный ausgewertet. Mit Hilfe einer zweidimensionalen Elektrophorese und anschließender Immunfärbung wurden prominente Autoantigene durch Massenspektroskopie identifiziert. Ergebnisse: Mit dem in dieser Arbeit entwickelten Assay lässt sich die humorale Autoimmunantwort gegen Gehirngewebe semiquantitativ bestimmen. In allen untersuchten Proben konnten verschiedene Autoantikörper gegen unterschiedliche Antigene nachgewiesen werden. Der Gesamt-IgG-Gehalt der Plasmen unterscheidet sich weder zwischen PD-Patienten und gesunden Kontrollen, noch zwischen Männern und Frauen signifikant.Weibliche PD-Patienten zeigen Signifikant stärkere Signale gegen dm als männliche (p = 0,02, U-тест Манна-Уитни), der wiederum in jedem Patienten — unabhängig vom Geschlecht — von den untersuchten Hirnmunäirdlebris signif (p <0,0001, Фридман-ANOVA). В jedem Hirnareal wurden drei Banden besonders häufig erkannt (45, 40 и 37 кДа), jede davon am stärksten im dm (p <0,0001, Friedman-ANOVA). Die Einzelanalysen der Signalintensitäten zeigt, dass PD-Patienten signifikant weniger Autoreaktivität gegen die 45 kDa-Bande in der SN (p = 0.056), im MC (p = 0,0277) и im FC (p = 0,0188) zeigen, als Kontrollen. Weitere Analysen zeigen, dass männliche PD-Patienten hochsignifikant weniger das 45 kDa-Protein im SN (p <0,0001), MC (p = 0,0042) и FC (p = 0,0088) erkennen als Kontrollen, wohingegen bei den weiblichen Kontroll- und PD- Plasmen kein Unterschied festzustellen war. Ein weiteres Protein bei 160 kDa wird signifikant unterschiedlich stark in allen Gehirnarealen erkannt (p <0,0001, Friedman-ANOVA), wobei die stärkste Immunreaktivität gegen FC лучше.Basierend auf dem Nachweis der 45 kDa-Bande aus der SN ergibt sich eine Коэффициент шансов для Merkmal Parkinson von 3,38 (CI 1,11 - 10,30). Bei Männern ist diese Odds Ratio sogar 53,12 (CI 2,79 - 1012), bei Frauen 0,44 (CI 0,09 - 2,09). Die Sensitivität dieses Тесты должны соответствовать Männern bei 1 (CI 0,84 - 1), die Spezifität bei 4,41 (0,31 - 0,78). Die negativ prädiktiven Werte liegen in allen Gruppen über 99,15%. Die Identifizierung der Proteine mittels Massenspektroskopie ergab, dass es sich bei den 37-45 kDa Banden um Isoformen oder posttranslational modifizierte Formen des GFAP (глиальный фибриллярный кислый белок), einem Bestandteil von Neurofilamenten v.а. в Astrozyten handelt. Außerdem wurde Fructose-Bisphosphate Aldolase A und Aspartat-Aminotransferase (митохондриальная изоформа 1 Vorläufer), beides Proteine des Kohlenhydrat-Stoffwechsels und der Glykolyse, als weitere Proteine mit ebenfalls 45 kDaiz. Благодаря определению белка с молекулярной массой 160 кДа, связанной с дигидропиримидиназой-родственным белком 2, GFAP падает ниже Bildung des Zytoskeletts beteiligt. Обсуждение: Autoantikörper gegen Gehirnantigene sind ein Physiologisches Phänomen, das unabhängig von dem Vorliegen einer nerologischen Erkrankung besteht.Gehirnareale, die bei Parkinson besonders stark geschädigt werden, werden von dieser humoralen Аутоиммунный зверобойный болотный вид. Eine vorübergehende Permeabilisierung der Blut-Hirn-Schranke durch Infektion или Trauma könnte den Zutritt der Autoantikörper zum Gehirn erlauben und so autoreaktive Prozesse in Gang setzen und zum Untergang dopaminerger Neuronen. Bei den identifizierten Proteinen handelt es sich um grundlegende Bestandteile eukaryotischer Zellen, был die Hypothese eines Art Beseitigungsmechanismus der Autoantikörper und damit die Aufgabe der Aufrechterhaltung der Homöostase darstel.Bei männlichen PD Patienten wird die 45 kDa Bande Signifikant weniger stark von Auto-IgGs erkannt; dieser Mechanismus könnte somit in den männlichen PD-Patienten vermindert sein. Als Folge wäre die Ablagerung von Zelltrümmern im Gehirn vorstellbar, die dann auch langfristig eine Angriffsfläche für Autoimmunprozesse mit dem Verlust dopaminerger Neuronen bieten könnte.
Региональная нейродегенерация и глиоз усугубляются легкой травмой головного мозга, повторяющейся через 24 часа | Журнал невропатологии и экспериментальной неврологии
Абстрактные
Большинство черепно-мозговых травм (ЧМТ), которые происходят ежегодно, классифицируются как «легкие.«Лица, занимающиеся деятельностью, связанной с повышенным риском, могут перенести множественные легкие формы ЧМТ. Мы оценили острые физиологические и гистопатологические последствия легкой ЧМТ на модели мышей, сравнивая фиктивную травму, одиночный удар или 5 ударов с интервалом между травмами 24 или 48 часов. Одиночный закрытый удар черепа привел к двустороннему глиозу в гиппокампе и энторинальной коре, что было пропорционально глубине удара. Удар по средней линии на глубине чуть выше порога, вызывающего временное бессознательное состояние, приводил к случайным повреждениям аксонов и дегенерированию нейронов, сопровождаемых астроглиозом в энторинальной коре и мозжечке.Легкая ЧМТ, повторяемая каждые 24 часа, привела к двусторонним геморрагическим поражениям в энторинальной коре, а также к значительному увеличению нейродегенерации и активации микроглии, несмотря на уменьшение продолжительности апноэ и бессознательного состояния с последующими воздействиями. Астроглиоз и диффузно распределенное повреждение аксонов также наблюдались с двух сторон в мозжечке и стволе мозга. Когда интервал между легкой ЧМТ был увеличен до 48 часов, патологические последствия были сопоставимы с таковыми при одиночной ЧМТ.Вместе эти данные предполагают, что у мышей мозг остается в группе повышенного риска повреждения в течение 24 часов после легкой ЧМТ, несмотря на снижение острых физиологических реакций на последующие легкие воздействия.
Введение
Приблизительно от 1,7 до 3,8 миллиона человек в Соединенных Штатах ежегодно получают черепно-мозговую травму (ЧМТ) (1, 2), причем подавляющее большинство классифицируется как «легкая» и происходит во время занятий спортом (1, 3). Легкая ЧМТ вызвана травматической или биомеханической силой, которая приводит к изменению функции мозга без невропатологических осложнений, что можно наблюдать с помощью стандартных методов визуализации (4–6).Легкая ЧМТ проявляется множеством признаков и симптомов. Сюда могут входить такие симптомы, как головокружение, головная боль и / или тошнота, и такие признаки, как потеря сознания, потеря памяти, возбуждение и / или двигательный дефицит (4–6). Для многих пациентов отдых с течением времени помогает облегчить симптомы легкой травмы головы в течение нескольких часов или нескольких дней. Однако у 10–15% людей симптомы сохраняются намного дольше (6).
Особое внимание при ЧМТ, связанной со спортом, уделялось облегчению симптомов до того, как спортсмен должен вернуться в игру.Тем не менее, неясно, стихают ли клеточные реакции в мозге в это время или мозг остается в состоянии повышенной уязвимости к последующей травме. Затем люди возвращаются к игре с более высоким риском развития другой легкой ЧМТ, особенно в высококонтактных видах спорта, таких как бокс и футбол (4–6). Кроме того, неврологические и патофизиологические последствия дополнительных ЧМТ могут быть более серьезными, чем последствия, вызванные первой ЧМТ, если мозг не полностью восстановился.
Модели на животных являются важными инструментами для выяснения молекулярных событий, вызванных легкой ЧМТ, исследования клеточной основы постоянной уязвимости и корреляции патологии мозга с нейроповеденческой дисфункцией.Модели позволяют контролировать воспроизводимое воздействие и позволяют систематически варьировать экспериментальные параметры для изучения эффектов повторяющихся ЧМТ легкой степени тяжести.
Исследование ЧМТ основано на различных хорошо зарекомендовавших себя моделях на животных, включая снижение веса (7, 8), травму от перкуссии жидкостью (9, 10), ускорение удара (11, 12) и контролируемое корковое воздействие (13) . Эти модели использовались для описания паттернов глиоза, повреждения аксонов и / или гибели нейронов, а также нарушений памяти и координации движений после единичного повреждения «от умеренного до тяжелого».Многие из этих моделей были модифицированы для изучения легкой ЧМТ и последствий повторных травм (14–20).
Чтобы создать модель легкой ЧМТ, подходящую для изучения повторных травм головы, мы выбрали закрытую модель черепа, как и во многих лабораториях (14, 17, 21–26), чтобы облегчить применение повторных травм. и создать более расплывчатую картину травмы, передав силу оскорбления через большую часть мозга. Мы использовали фиксацию головы, чтобы минимизировать вариативность, вызванную движением головы.Удар выполнялся гибким наконечником, чтобы свести к минимуму перелом черепа, как описано в предыдущих публикациях (17, 18, 27). Хотя во многих повторяющихся исследованиях легкой ЧМТ использовалось латеральное воздействие (15, 21, 24, 28–30), мы выбрали удар по средней линии (14, 16, 22) с целью получения двустороннего повреждения для усиления распределенного характера патологических изменений. . Затем мы охарактеризовали гистологические и физиологические реакции на одиночную ЧМТ легкой степени в зависимости от тяжести травмы и сравнили реакцию на одиночную ЧМТ легкой степени с ответами на ЧМТ легкой степени, повторяемую с 24- или 48-часовым интервалом.Мы подтверждаем, что повреждение аксонов и астроглиоз являются особенностями одной легкой закрытой травмы головы (CHI), но демонстрируют повышенную уязвимость мозга к легкой ЧМТ, повторяющейся с 24-часовым интервалом, что приводит к более обширной нейродегенерации и нейровоспалению, включая повреждение внутри тела. энторинальная кора, мозжечок и ствол мозга.
Материалы и методы
Животные
Самцов мышей C57Bl / 6 в возрасте от двух до трех месяцев были приобретены в Jackson Laboratories (Bar Harbor, ME) для всех экспериментов.По прибытии мышей помещали в группу при контролируемом цикле свет: темнота 14:10 и давали пищу и воду ad libitum. Животноводство и все хирургические процедуры были одобрены Комитетом по институциональному уходу и использованию животных Университета Кентукки и следовали федеральным руководящим принципам, установленным Институтом ресурсов лабораторных животных (США) и Комитетом по уходу и использованию лабораторных животных.
Закрытая травма головы
После индукции анестезии в камере с использованием 3% изофлурана / 3% кислорода в течение 1-2 минут мышей переводили в стереотаксическую рамку с неразрушающимися ушными чашками Zygomar (Kopf Instruments, Tujunga, CA), где анестезию поддерживали с помощью 2.5% изофлурана / 2,5% кислорода доставляется через носовой конус. Хирургический участок кожи головы очищали раствором Бетадина. После инъекции 0,2 мл адреналина 1: 200 000 и 0,5% бупивакаина (Henry Schein Animal Health, Дублин, Огайо) в стерильном физиологическом растворе для местного обезболивания была резецирована кожа головы. Затем мышам вводили легкую ВИГ с использованием пневматически управляемого кортикального ударного устройства (TBI-0310 Impactor; Precision Systems and Instrumentation, Fairfax Station, VA) с гибким силиконовым наконечником диаметром 5 мм, изготовленным по индивидуальному заказу, с твердостью 55. Шор А.Кончик был выровнен по средней линии шва между швами брегмы и лямбда. Устройство было запрограммировано на удар на заданной глубине (0,5–3,0 мм) со скоростью 3,5 м / с с временем пребывания 500 миллисекунд. Мыши с ложными травмами получили анестезию и подверглись той же хирургической процедуре без какого-либо воздействия. Общая продолжительность анестезии для всех животных контролировалась и составляла 10 минут.
Чтобы оценить потерю сознания, вызванную травмой, по сравнению с анестезией наиболее точно, мышей сразу после удара удаляли из стереотаксического устройства и помещали на грелку на спину.Оценивали продолжительность апноэ и время спонтанного перехода в положение лежа (выпрямляющий рефлекс). После восстановления мышей ненадолго реанестезировали, чтобы зашить скальп, и возвращали к грелке для восстановления. Мышам подкожно вводили 1 мл стерильного физиологического раствора для увеличения гидратации, стимулирования нормальной реакции на питание после травмы и поддержания здорового веса. При повторных имитационных травмах и травмах ВМС швы снимали, кожу головы резецировали, а затем выполняли вышеуказанные травмы и процедуры оценки.
Для первоначальной характеристики глубины удара на гистологические и физиологические реакции был нанесен одиночный удар с заданной глубиной 0,5, 1,0, 1,5, 2,0, 2,5 или 3,0 мм (n = 2–3 на глубину удара). Данные апноэ и выпрямляющего рефлекса анализировали отдельно с помощью однофакторного дисперсионного анализа (ANOVA) с последующими апостериорными тестами Ньюмана-Кеулса с использованием программного обеспечения GraphPad Prism 6 (La Jolla, CA). Мышей из этих групп умерщвляли через 48 часов после травмы для анализа астроцитоза и дегенерации нейронов.
Для повторных экспериментов с CHI мышей случайным образом разделили на 3 основные группы: 2,0 мм повторные CHI; 2,0 мм одинарный ЧИ; и фиктивный ОМС (рис. 1). Группа повторных ОМС получила 5 ударов либо с 24-часовым интервалом между травмами (rCHI-24h; n = 9), либо с 48-часовым интервалом (rCHI-48h; n = 8). Эти интервалы были выбраны на основании нескольких исследований, которые предполагают, что интервал уязвимости для повторных легких ЧМТ у грызунов может составлять от 24 до 48 часов (18, 21, 22, 26, 28, 30). На основании предыдущих исследований повторных ЧМТ легкой степени тяжести использовались пять воздействий (22, 23, 26).Мышей rCHI убивали через 24 часа после их последнего удара, чтобы оценить острые последствия повторных CHI с различными интервалами между травмами. Единственная группа ОМС была разделена на 3 подгруппы, чтобы сопоставить время выживания групп rCHI относительно первой и последней травм: 24 часа (одиночные 24 часа; n = 6), 5 дней (одиночные 5 дней; n = 5) и 9. дней (одиночные 9 дней; n = 5). Ложные контрольные мыши для групп rCHI-24h (n = 4) и rCHI-48h (n = 3) были объединены для анализа (n = 7), за исключением рисунка, Дополнительный цифровой контент 1, Дополнительные данные.Одна мышь, отнесенная к группе rCHI-24h, и одна мышь, отнесенная к группе rCHI-48h, умерла до получения 5 CHI. Таким образом, окончательный размер группы составлял 8 для rCHI-24h и 7 для rCHI-48h. Данные апноэ и выпрямляющего рефлекса анализировали с помощью однофакторного дисперсионного анализа с повторными измерениями (группа травм × количество ВМС) с последующими апноэ-тестами Ньюмана-Кеулса с использованием программного обеспечения GraphPad Prism 6.
РИСУНОК 1
Дизайн эксперимента с повторной закрытой травмой головы (rCHI). Синие стрелки — день ОМС; зеленые кресты, смерть.
РИСУНОК 1
Дизайн эксперимента с повторной закрытой травмой головы (rCHI). Синие стрелки — день ОМС; зеленые кресты, смерть.
Обработка тканей
Мышей умерщвляли внутрибрюшинной инъекцией Fatal Plus (130 мг / кг; Henry-Schein Animal Health) перед транскардиальной перфузией холодным гепаринизированным стерильным физиологическим раствором с последующим введением 10% нейтрального забуференного формалина (Fisher Scientific, Атланта, Джорджия). Мышей обезглавливали и головы помещали в формалин на 24 часа.Затем мозг извлекали из черепа и оставляли на дополнительные 24 часа для постфиксации. По истечении этого периода мозг помещали в 30% сахарозу в 1 × трис-буферном физиологическом растворе (TBS) на 24-48 часов для криопротекции ткани. Ткань замораживали в изопентане от -25 ° C до -35 ° C перед тем, как разрезать на коронковые срезы толщиной 40 мкм с помощью скользящего микротома (Dolby-Jamison, Pottstown, PA). Срезы тканей хранили при -20 ° C в криопротекторе (30% глицерин, 30% этиленгликоль в 1 × TBS).
Гистология
Для начальной оценки потери клеток серию из 9 срезов, расположенных с интервалами 400 мкм, окрашивали 2 по Нисслю.5% крезиловый фиолетовый. Дегенерирующие нейроны исследовали с помощью Fluoro-Jade C (FJC), как описано ранее (31). Для каждого животного были отобраны 4 среза с интервалом 400 мкм в пределах каудального гиппокампа и энторинальной коры (от -2,2 до -3,4 мм брегмы) и от 6 до 8 срезов с интервалами 200 мкм в мозжечке и стволе мозга. Срезы первоначально обрабатывали диаминобензидином (Vector Laboratories, Burlingame, CA) в течение 5 минут, промывали в ddH 2 O и наносили на предметные стекла. Обработка диаминобензидином использовалась для подавления эндогенных пероксидаз, устранения любой неспецифической флуоресценции, которая может возникнуть при кровотечении.Ткань обезвоживали, помещая слайды в более теплый (45 ° C) на 30 минут, а затем оставляя их при комнатной температуре на ночь. На следующий день предметные стекла последовательно погружали в 1% NaOH в 80% этаноле, 70% этаноле и ddH 2 O перед тем, как поместить в 0,06% раствор перманганата калия на 10 минут. Ткань промывали ddH 2 O перед инкубацией в 0,0001% растворе FJC (Millipore, Temecula, CA) в 0,1% уксусной кислоте в течение 10 минут. Ткань промывали ddH 2 O, сушили на воздухе, закрывали Cytoseal 60 (Thermo Scientific, Hanover Park, IL) и защищали от света.
Иммуногистохимия
Свободно плавающие срезы тканей использовали для иммуногистохимического анализа. Чтобы маркировать ткань для накопления белка-предшественника амилоида (cAPP) и гиперфосфорилированного тау (PHF-1), извлечение антигена выполняли с использованием 10 ммоль / л лимонной кислоты на водяной бане при 65 ° C в течение 15 минут. Затем ткани давали остыть при комнатной температуре в течение 20 минут перед промывкой 1 × TBS. Для всех тканей, чтобы погасить эндогенные пероксиды, ткань обрабатывали 3% H 2 O 2 в 50/50 метаноле / ddH 2 O в течение 30 минут, покачивая при комнатной температуре.Затем ткань промывали и блокировали в течение 1 часа 5% нормальной лошадиной сывороткой в 1 × TBS / 0,1% Triton X-100 перед инкубацией с первичным антителом в течение ночи при 4 ° C. Были использованы следующие антитела: белок-предшественник амилоида (cAPP, кроличий поликлональный, 1: 2000; Invitrogen / Life Technologies, Карлсбад, Калифорния), антитела против тау-белка pSer396 / 404 (PHF-1, мышиный моноклональный, 1: 500, Peter Дэвис; Институт медицинских исследований имени Файнштейна, Грейт-Нек, Нью-Йорк), антиглиальный фибриллярно-кислотный белок ([GFAP] мышиный моноклональный, 1: 3000; Sigma-Aldrich, St.Louis, MO), антиионизированная кальций-связывающая адаптерная молекула-1 ([Iba-1] кроличий поликлональный, 1: 1000; Wako, Richmond, VA) и анти-MHC II (IA / IE, крысиный моноклональный, 1: 1000; eBiosciences, Сан-Диего, Калифорния). На следующий день срезы ткани, меченные анти-GFAP, -cAPP и -PHF-1, инкубировали в соответствующей конъюгированной с биотином вторичной обмотке в течение 1 часа. Ткань промывали перед инкубацией в комплексе авидин-биотин (Vector Laboratories) в течение 1 часа, а затем обрабатывали диаминобензидином в соответствии с указаниями производителя.Ткани, меченные Iba-1- и I-A / I-E, инкубировали с соответствующими вторичными антителами, конъюгированными с Alexa-488 и Cy-3 соответственно.
Количественная оценка гистологии и иммуногистохимии
Срезы, окрашенные FJC, просматривали при 40-кратном увеличении с использованием микроскопа Olympus AX80 с фильтром TRITC. FJC-положительные клетки в двусторонней энторинальной коре головного мозга подсчитывал человек, не знающий условий повреждения. Для статистического анализа подсчеты суммировали для каждого животного.Качественно исследовали срезы мозжечка и ствола мозга, помеченные FJC.
cAPP-положительные аксоны в 4 срезах на животное, расположенных с интервалом 200 мкм (уровень ∼bregma, от −2,2 до −3,4 мм), просматривали в ярком поле с использованием микроскопа Olympus AX80 с линзой 40x. Набухания аксонов и луковицы подсчитывались ослепленным исследователем. Для статистического анализа подсчеты суммировали для каждого животного.
Иммунореактивность глиального фибриллярного кислого белка наблюдали с использованием микроскопа Olympus BX51 (20 ×) с автоматизированным столиком ASI XY.24-битные RGB-изображения энторинальной коры и гиппокампа были получены с помощью 12-битной камеры Q Imaging. Откалиброванный модуль Stage-Pro программы Image Pro Plus (Media Cybernetics, MD) использовался для сборки изображений в монтаж. Энторинальную кору анализировали в 4 срезах от каждого животного, взятых с интервалом 200 мкм (брегма от -2,8 до -3,4 мм). Астроцитоз в гиппокампе анализировали в 3 срезах от каждого животного, взятых с интервалом 200 мкм (брегма от -2,8 до -3,2 мм). Для количественной оценки иммунореактивности GFAP область интереса была очерчена с использованием анатомических характеристик, как описано в The Mouse Brain in Stereotaxic Coordinates , 4th Edition (Paxinos and Franklin).Гиппокамп очерчивали вдоль дорсального края по альвеусу гиппокампа, а затем над таламусом на вентральной стороне гиппокампа. Чтобы очертить энторинальную кору, в качестве отправной точки использовали ринальную щель. Линия была проведена вентрально по периферии энторинальной коры примерно в 1,5 мм от ринальной щели. Оттуда линия была продлена горизонтально до бокового желудочка, а затем продолжилась дорсально вдоль края бокового желудочка до горизонтали до ринальной щели.Линия продолжалась горизонтально до ринальной щели, чтобы соединиться с исходной точкой. Диапазон был установлен от 0 до 210 для каждого цвета, а минимальная площадь объекта была установлена на уровне 5 пикселей для захвата меченных анти-GFAP астроцитов и устранения фонового шума. Количество GFAP-иммунореактивных астроцитов определяли количественно и определяли среднюю интегральную оптическую плотность (IOD) путем деления общего IOD на количество астроцитов в данной области интереса. Более высокая ИОД соответствовала большей иммунореактивности GFAP.Собранные данные усредняли для каждой области (энторинальной коры, гиппокампа) для каждого животного для статистического анализа. В мозжечке и стволе мозга иммунореактивность GFAP оценивали качественно в серии от 6 до 8 срезов, выбранных с интервалом 200 мкм.
ИммунореактивностьIba-1 наблюдали с использованием флюоресцеин-изотиоцианатного фильтра на микроскопе Olympus BX51 (20 ×) с автоматизированным столиком ASI XY, и получали и монтировали 8-битные полутоновые изображения, как описано ранее. Процент иммунореактивности Iba-1 в энторинальной коре и гиппокампе анализировали, сначала устанавливая диапазон отображения от 0 до 255, чтобы очертить гиппокамп или энторинальную кору, как описано ранее.Затем слепой исследователь выбрал диапазон, в котором была выбрана иммунореактивная микроглия для каждого мозаичного изображения. Процент общей площади, которая содержала меченную Iba-1 микроглией, измеряли и усредняли для энторинальной коры по 8 монтажам на животное и для гиппокампа по 6 монтажам на животное. Ткань, меченная Iba-1, была помечена I-A / I-E (MHC Class II). Иммуномечение I-A / I-E оценивалось качественно.
Односторонний дисперсионный анализ с последующими апостериорными тестами Ньюмана-Кеулса, где это необходимо, выполняли с использованием программного обеспечения GraphPad Prism 6 для определения статистической значимости среди групп для каждого маркера в каждой области.
Результаты
Определение глубины удара
Первоначальная когорта мышей была подвергнута CHI разной глубины воздействия, чтобы охарактеризовать модель CHI и определить параметры повреждения, которые привели к легкой ЧМТ, что оценивалось по дегенерации нейронов, глиозу и острым постконкуссивным физиологическим ответам. Заданные глубины удара по срединному шву черепа мыши 0,5, 1,0 и 1,5 мм не продлевали подавление рефлекса выпрямления после удара (рис.2A), но вызывал постепенное увеличение апноэ с увеличением тяжести травмы (фиг. 2B) по сравнению с одной анестезией у имитационных контрольных животных. Мыши, получившие травму с предписанной глубиной 2,0 мм, имели значительно повышенное подавление рефлекса выпрямления (p <0,05) и продолжительность апноэ (p <0,05) по сравнению с мышами фиктивной контрольной группы и мышами, получавшими CHI при всех других меньших глубинах воздействия. Глубина удара 2,0 мм не привела к перелому черепа. Напротив, удар глубиной 2,5 мм и 3,0 мм приводил к переломам черепа или длительному апноэ, что приводило к смерти 6 из 10 протестированных животных.
РИСУНОК 2
Острые физиологические и гистопатологические последствия однократного удара в зависимости от глубины. Рефлекс выпрямления (A) и апноэ (B) . * p <0,05 по сравнению со всеми другими группами. Столбцы представляют собой среднее значение ± стандартное отклонение. (C – O) Окрашивание фторо-нефритом C (FJC) после имитации (C) , 1,0 мм (G) — , 2,0 мм (K) — и 3,0 мм (O ) — глубин удара. FJC-положительные клетки были обнаружены в зубчатой извилине через 48 часов после 3.Глубина удара 0 мм. Астроциты, меченные глиальным фибриллярным кислым белком (GFAP) в гиппокампе и энторинальной коре после имитации (DF) , 1,0 мм (HJ) — , 2,0 мм (L – N) — и 3,0 мм (P – R) — глубин удара. Легкий астроцитоз был очевиден в каудальном гиппокампе и энторинальной коре после 2,0-мм удара. Удар 3,0 мм усиливал астроцитоз всего гиппокампа и моторной коры. Масштабные линейки = (C, D, G, H, K, L, O, P) 500 мкм; (вставки D, O, P) 100 мкм; (E, F, I, J, M, N, Q, R) 1 мм.
РИСУНОК 2
Острые физиологические и гистопатологические последствия однократного удара в зависимости от глубины. Рефлекс выпрямления (A) и апноэ (B) . * p <0,05 по сравнению со всеми другими группами. Столбцы представляют собой среднее значение ± стандартное отклонение. (C – O) Окрашивание фторо-нефритом C (FJC) после имитации (C) , 1,0 мм (G) — , 2,0 мм (K) — и 3,0 мм (O ) — глубин удара. FJC-положительные клетки были обнаружены в зубчатой извилине через 48 часов после 3.Глубина удара 0 мм. Астроциты, меченные глиальным фибриллярным кислым белком (GFAP) в гиппокампе и энторинальной коре после имитации (DF) , 1,0 мм (HJ) — , 2,0 мм (L – N) — и 3,0 мм (P – R) — глубин удара. Легкий астроцитоз был очевиден в каудальном гиппокампе и энторинальной коре после 2,0-мм удара. Удар 3,0 мм усиливал астроцитоз всего гиппокампа и моторной коры. Масштабные линейки = (C, D, G, H, K, L, O, P) 500 мкм; (вставки D, O, P) 100 мкм; (E, F, I, J, M, N, Q, R) 1 мм.
Через 48 часов после CHI, FJC-положительные клетки наблюдались только в группе воздействия 3,0 мм в зубчатой извилине (рис. 20), что позволяет предположить, что один CHI глубиной менее 3,0 мм не вызывает заметной нейродегенерации головной мозг через 48 часов после удара. Иммуногистохимия глиального фибриллярного кислого белка использовалась для визуализации астроглиальных изменений во всем головном мозге. Глубина удара 0,5 мм (данные не показаны), 1,0 мм (рис. 2H – J), 1,5 мм (данные не показаны) и 2,0 мм (рис. 2L – N) вызвали лишь небольшое увеличение иммунореактивности GFAP в гиппокампе и энторинальная кора.Напротив, гиппокампальный и кортикальный глиоз был более очевиден после CHI при глубине удара 2,5 мм (данные не показаны) или 3,0 мм (рис. 2P – R), особенно в зубчатой извилине и воротах, где также происходила дегенерация нейронов. Основываясь на первоначальной характеристике глубины удара в диапазоне от 0,5 до 3,0 мм, глубина 2,0 мм была выбрана для последующих экспериментов по оценке повторных ОМС на основе наличия острых физиологических реакций (повышенный рефлекс выпрямления и время апноэ) и умеренный глиоз, указывающий на тканевых ответов в отсутствие заметной гибели нейронов.Мозжечок и ствол мозга этой когорты животных не были доступны для оценки.
Снижение острых физиологических реакций при повторных ОМС
Чтобы оценить влияние повторного CHI на острые физиологические реакции и определить, зависят ли апноэ и рефлекс выпрямления от интервала между травмами, реакции сравнивали среди мышей из групп фиктивных, rCHI-24h и rCHI-48h.
Время, необходимое для того, чтобы вызвать ответный рефлекс выпрямления, зависело от обеих групп травмы (p <0.0005) и количество CHI (p <0,0001), при значительном взаимодействии между этими факторами (p <0,05) (рис. 3A). Подавление рефлекса выпрямления в обеих группах rCHI было значительно дольше, чем в группе фиктивной (p <0,001 для rCHI-24h; p <0,005 для rCHI-48h). С течением времени возвращение рефлекторного ответа выпрямления в группе rCHI-24h было значительно более задержанным по сравнению с группой rCHI-48h (p <0,05). Апостериорное тестирование не выявило значительной разницы в рефлексе выпрямления между двумя группами rCHI для любого конкретного CHI (с первого по пятый).В группе rCHI-24h подавление рефлекса выпрямления было значительно продлено после первого и второго CHI (p <0,05 по сравнению с фиктивным). Подавление рефлексов было значительно снижено после четвертого и пятого воздействий по сравнению с реакцией группы rCHI-24h на первоначальное воздействие. Группа rCHI-48h также продемонстрировала значительное увеличение времени восстановления выпрямляющего рефлекса после первого CHI, но не после последующих CHI.
РИСУНОК 3
Рефлекс выпрямления (A) и апноэ (B) после имитации травмы, повторной закрытой травмы головы с интервалом в 24 часа (rCHI-24h) и повторной закрытой травмы головы с интервалом в 48 часов (rCHI -48ч).$ p <0,05 по сравнению с фиктивным; % p <0,05 по сравнению с rCHI-48h; # p <0,05 по сравнению с CHI 1 той же группы. Столбцы, среднее ± SE.
РИСУНОК 3
Рефлекс выпрямления (A) и апноэ (B) после имитации травмы, повторной закрытой травмы головы с интервалом в 24 часа (rCHI-24h) и повторной закрытой травмы головы с интервалом в 48 часов ( рЧИ-48ч). $ p <0,05 по сравнению с фиктивным; % p <0,05 по сравнению с rCHI-48h; # p <0,05 по сравнению с CHI 1 той же группы. Столбцы, среднее ± SE.
Продолжительность апноэ варьировала в зависимости от травмы (p <0.0001) и количество CHI (p <0,005) со значительным взаимодействием между этими факторами (p <0,05) (рис. 3B). Обе группы rCHI-24h и rCHI-48h имели значительное апноэ после первого воздействия по сравнению с фиктивной группой (p <0,0001 и p <0,001, соответственно), но продолжительность апноэ значительно уменьшилась, когда второй удар был нанесен через 48 часов, а не через 24 часа. часов после первого (р <0,05). Обе группы с повторной ЧМТ легкой степени продемонстрировали тенденцию к более короткому апноэ с последовательными воздействиями.По сравнению с апноэ после первого удара, апноэ значительно уменьшилось после третьего, четвертого и пятого ударов для группы rCHI-24h и второго, четвертого и пятого воздействий для группы rCHI-48h, что свидетельствует о компенсаторном механизме в группе rCHI-48h. играть с несколькими легкими ЧМТ.
Легкая ЧМТ, повторяющаяся через 24-часовой, но не 48-часовой интервал, усугубляет острую смерть нейронов в энторинальной коре головного мозга
Несколько гистологических оценок были использованы для оценки воздействия повторных ОМС на мозг и того, повлиял ли временной интервал между воздействиями на эти реакции.Окрашивание по Нисслю не выявило каких-либо явных патологических изменений через 1, 5 или 9 дней после однократного CHI (фиг. 4A). Однако у 5 из 8 мышей в группе rCHI-24h наблюдались геморрагические поражения энторинальной коры через 24 часа после пятого сотрясения мозга (рис. 4С). Частота геморрагических поражений снизилась до 1 из 7 в группе rCHI-48h, и поражения были меньше по сравнению с теми, которые наблюдались у мышей, травмированных с 24-часовым интервалом (рис. 4E).
РИСУНОК 4
Дегенерация нейронов в энторинальной коре после однократной и многократной закрытой травмы головы (ЧИ). (A, C, E) Окрашивание по Нисслю мышей, убитых через 24 часа после однократного CHI (однократный 24 часа; A ), 5 CHI, повторенных с 24-часовым интервалом между травмами (rCHI-24h; C ), и Повторение 5 ВМС с 48-часовым интервалом между травмами (rCHI-48h; E ). Окрашивание по Нисслю показывает геморрагические поражения в энторинальной коре головного мозга группы rCHI-24h. (B, D, F) Окрашивание фтор-нефритом C (FJC) в энторинальной коре мышей за одни 24 часа (B) , rCHI-24h (D) и rCHI-48h (F) групп.p <0,05 по сравнению с однократным приемом 9 дней.
РИСУНОК 4
Дегенерация нейронов в энторинальной коре после однократной и многократной закрытой травмы головы (ЧИ). (A, C, E) Окрашивание по Нисслю мышей, убитых через 24 часа после однократного CHI (однократный 24 часа; A ), 5 CHI, повторенных с 24-часовым интервалом между травмами (rCHI-24h; C ), и Повторение 5 ВМС с 48-часовым интервалом между травмами (rCHI-48h; E ). Окрашивание по Нисслю показывает геморрагические поражения в энторинальной коре головного мозга группы rCHI-24h.p <0,05 по сравнению с однократным приемом 9 дней.
В энторинальной коре однократное воздействие на 2,0 мм привело к появлению небольшого количества FJC-положительных клеток через 24 часа после травмы (рис. 4B), что указывает на дегенерацию нейронов; однако количество дегенерирующих нейронов существенно не отличалось от фиктивных (рис. 4G). В группе rCHI-24h, FJC-положительные клетки были расположены вокруг области кровоизлияния (рис. 4C), а также в энторинальной коре в срезах ткани, которые не содержали поражения. Легкая ЧМТ, повторяемая с 24-часовым интервалом, но не с 48-часовым интервалом, привела к значительному увеличению количества FJC-положительных клеток в энторинальной коре по сравнению с фиктивным повреждением (p <0.05) (рис. 4G). Ни однократный, ни повторный CHI на глубине удара 2,0 мм не приводил к окрашиванию FJC в гиппокампе.
В мозжечке качественная оценка окрашивания FJC выявила небольшое количество двусторонней дегенерации нейронов в клетке Пуркинье и молекулярных слоях наиболее дистальной части латеральной листовой оболочки мозжечка через 24 часа после однократного CHI (рис. 5A), который первоначально был ограничивается окрашиванием нейрональных процессов в молекулярном слое через 9 дней после однократного CHI (не показано).Напротив, сомы дегенерирующих нейронов редко метили у мышей, получавших rCHI с 24-часовыми интервалами. С интервалом между травмами 48 часов у некоторых мышей rCHI было обнаружено FJC-мечение небольшого количества нейронов и отростков в латеральной листовой оболочке мозжечка, аналогичное тому, которое наблюдалось в группах с одиночным CHI.
РИСУНОК 5
Дегенерация нейронов мозжечка и ствола мозга после однократной и многократной закрытой травмы головы (ЧИ). Окрашивание фторо-нефритом C (FJC) мышей, убитых через 24 часа после однократного CHI (однократного 24 часа), показало дегенерирующие нейроны в слое клеток Пуркинье (PC) и некоторое повреждение аксонов в белом веществе (WM) тракта мозжечка (A ) с очень небольшим повреждением ствола мозга (B) .дегенерирующие нейроны; ML, молекулярный слой; GC, слой зернистых клеток. Масштабная линейка = 100 мкм.
РИСУНОК 5
Дегенерация нейронов мозжечка и ствола мозга после однократной и многократной закрытой травмы головы (ЧИ). Окрашивание фторо-нефритом C (FJC) мышей, убитых через 24 часа после однократного CHI (однократного 24 часа), показало дегенерирующие нейроны в слое клеток Пуркинье (PC) и некоторое повреждение аксонов в белом веществе (WM) тракта мозжечка (A ) с очень небольшим повреждением ствола мозга (B) .дегенерирующие нейроны; ML, молекулярный слой; GC, слой зернистых клеток. Масштабная линейка = 100 мкм.
ЧМТ легкой степени вызывают повреждение аксонов
Хотя окрашивание FJC не выявило заметных повреждений аксонов в коре, белом веществе головного мозга или гиппокампе, оно предоставило четкие доказательства повреждения аксонов в мозжечке и стволе мозга через 24 часа после повторных ЧМТ легкой степени тяжести. Легкое повреждение аксонов наблюдалось в боковых трактах белого вещества мозжечка (рис. 5А), но не в стволе мозга (рис.5Б) с одиночным ОМС. Поражение аксонов было более обширным и более диффузно распределенным в группе rCHI-24h, с повреждением аксонов в латеральном (Рис. 5C) и центральном трактах белого вещества в мозжечке и разбросанном по стволу мозга с наибольшей концентрацией вентролатерально (Рис. 5D). Повторный CHI с 48-часовым интервалом привел к тому же распределению аксональных повреждений, что и с 24-часовым интервалом, но степень аксонального повреждения оказалась меньше (рис. 5E, F).
В головном мозге повреждение аксонов было обнаружено по накоплению cAPP в отростках аксонов и небольших луковицах в энторинальной коре через 24 часа после однократного CHI (рис.6А, Г). Количество cAPP-положительных аксонов / луковиц уменьшалось с увеличением продолжительности жизни (5 дней, 9 дней), что указывает на острую, но не затяжную волну аксонального повреждения (фиг. 6G). Когда CHI повторяли с 24-часовыми интервалами, количество меченых аксонов увеличивалось по сравнению с одним CHI, но это не было статистически значимым (рис. 6G). Частота повреждения аксонов также была сходной между группой rCHI-24h (5 из 8 с> 1 опухолью на разрез) и единственной 24-часовой группой (3 из 6). Несмотря на это сходство, луковицы, меченные cAPP, оказались намного крупнее в группе rCHI-24h (рис.6B, E), чем в одиночных группах CHI (рис. 6A, D). Кроме того, в группе rCHI-24h скопления луковиц были расположены рядом с внешней капсулой (рис. 6B, E), тогда как повреждение аксонов в единственной 24-часовой группе располагалось более центрально в пределах энторинальной коры. Когда CHI повторяли с 48-часовыми интервалами, у нескольких мышей наблюдались повреждения аксонов (2 из 7). Хотя среднее количество аксонов, меченных cAPP, было таким же, как в единственной 24-часовой группе, это было вызвано одним животным с необычно большим количеством опухолей.меченные сАРР аксоны; * внешняя капсула; + ринальная трещина. Масштабная линейка = 250 мкм. (G) Количество иммуномеченных набуханий аксонов существенно не различалось в разных группах. Столбцы представляют собой среднее значение ± стандартное отклонение.
РИСУНОК 6
Аксональная травма после повторной закрытой черепно-мозговой травмы (ЧИ). Иммуногистохимическое мечение белка-предшественника амилоида (cAPP) через 24 часа после одного CHI (однократный 24 часа; A, D ), 5 CHI, повторенных с 24-часовыми интервалами (rCHI-24h; B, E ) и 5 CHI повторяется с 48-часовыми интервалами (rCHI-48h; C, F ).меченные сАРР аксоны; * внешняя капсула; + ринальная трещина. Масштабная линейка = 250 мкм. (G) Количество иммуномеченных набуханий аксонов существенно не различалось в разных группах. Столбцы представляют собой среднее значение ± стандартное отклонение.
Астроцитоз усугубляется повторным ОМС через 24-часовой, но не 48-часовой интервал
Глиальные фибриллярные кислые белковые астроциты присутствовали в энторинальной коре головного мозга ложно травмированных животных, но их клеточные тела и отростки не выглядели раздутыми (рис.7А, Г). Вскоре после однократного CHI некоторые астроциты в небольшой области энторинальной коры казались более опухшими по сравнению с таковыми у фиктивных мышей. Хотя количество GFAP-положительных астроцитов через 24 часа не увеличивалось по сравнению с фиктивным повреждением, их количество постепенно увеличивалось в течение 9 дней после однократной ЧМТ легкой степени (p <0,05 по сравнению с однократным 24-часовым; рис. 7G). Единичная ЧМТ легкой степени также привела к замедленному увеличению интенсивности иммунореактивности GFAP в расчете на астроцит через 9 дней после травмы (p <0,05 по сравнению с фиктивной; рис.7G). Когда CHI повторяли с 24-часовыми интервалами, астроциты по всей энторинальной области коры казались реактивными с набухшими клеточными телами и отростками (рис. 7B, E). Число GFAP-положительных астроцитов в энторинальной коре было значительно увеличено у мышей rCHI-24h по сравнению с мышами, оцененными через 24 часа после однократного CHI (p <0,05; рис. 7G), и, по-видимому, увеличилось по сравнению с выживаемостью 5d с одиночным CHI. группы, хотя это не достигло статистической значимости. Интенсивность иммунореактивности GFAP в расчете на один астроцит также увеличивалась в энторинальной коре головного мозга группы rCHI-24h по сравнению с группами одиночного CHI и ложным повреждением (p <0.05; Рис. 7G). Когда интервал между травмами был увеличен до 48 часов, региональная степень реактивного астроцитоза была аналогична той, которая наблюдалась через 9 дней после однократного CHI, но некоторые клеточные тела и отростки выглядели опухшими, как в группе rCHI-24h (рис. 7C, F). . Количество GFAP-положительных астроцитов в энторинальной коре в группе rCHI-48h увеличилось по сравнению с 24 часами после однократного CHI, но не отличалось от 9 дней после однократного CHI (рис. 7G). Иммунореактивность глиального фибриллярного кислого белка для данного астроцита в группе rCHI-48h не изменилась по сравнению с фиктивным и одиночным CHI, что позволяет предположить, что более длительный интервал между повреждениями может защитить от кумулятивных воздействий (рис.7G). Эти данные указывают на аддитивный эффект CHI, повторяемый с 24-часовым, но не 48-часовым интервалом, на астроглиоз в энторинальной коре.
РИСУНОК 7
Астроцитоз в энторинальной коре и гиппокампе после имитации и повторных закрытых травм головы (ЗКИ). Иммуногистохимическое мечение глиального фибриллярного кислого белка (GFAP) после имитации (A, D) , 5 CHI, повторяемых с 24-часовыми интервалами (rCHI-24h; B, E ), или 48-часовые интервалы (rCHI-48h, C, F ).Масштабные линейки = (A – C) 500 мкм; (D – F) 250 мкм. Иммунореактивные астроциты подсчитывали в энторинальной коре (репрезентативная область интереса, обведенная черным) (G) и гиппокампе (H) . Средняя интегральная оптическая плотность GFAP на астроцит была определена количественно в энторинальной коре (G) и гиппокампе (H) . Столбцы представляют собой среднее значение ± стандартное отклонение. * p <0,05 по сравнению со всеми другими группами; $ p <0,05 по сравнению с фиктивным; ! р <0,05 по сравнению с однократным 24 ч; # р <0.05 по сравнению с одиночным 5d и одиночным 9d.
РИСУНОК 7
Астроцитоз в энторинальной коре и гиппокампе после имитации и повторных закрытых травм головы (ЗИ). Иммуногистохимическое мечение глиального фибриллярного кислого белка (GFAP) после имитации (A, D) , 5 CHI, повторяемых с 24-часовыми интервалами (rCHI-24h; B, E ), или 48-часовые интервалы (rCHI-48h, C, F ). Масштабные линейки = (A – C) 500 мкм; (D – F) 250 мкм. Иммунореактивные астроциты подсчитывали в энторинальной коре (репрезентативная область интереса, обведенная черным) (G) и гиппокампе (H) .Средняя интегральная оптическая плотность GFAP на астроцит была определена количественно в энторинальной коре (G) и гиппокампе (H) . Столбцы представляют собой среднее значение ± стандартное отклонение. * p <0,05 по сравнению со всеми другими группами; $ p <0,05 по сравнению с фиктивным; ! р <0,05 по сравнению с однократным 24 ч; # p <0,05 по сравнению с одиночным 5d и одиночным 9d.
В гиппокампе как количество, так и иммунореактивность GFAP на астроцит были выше через 24 часа после однократного CHI, чем через 5 дней и 9 дней, что соответствует острому переходному глиозу (рис.7H). Однако реакция через 24 часа после однократного CHI была эквивалентна фиктивной, что свидетельствует о возможном глиозе, вызванном анестезией, у мышей с фиктивными повреждениями, которые получили 5 воздействий анестезии. Ранее сообщалось об усилении астроцитоза гиппокампа при повторной анестезии (22), но на степень астроцитоза, вызванного анестезией, не влиял интервал между приступами анестезии (рисунок, дополнительный цифровой контент 1, дополнительные данные). Легкая ЧМТ, повторенная с 24-часовым интервалом, не привела к большему количеству GFAP-положительных астроцитов по сравнению с фиктивным или одиночным CHI (рис.7H). Иммунореактивность GFAP в расчете на один астроцит была значительно увеличена в группе rCHI-24h по сравнению с фиктивной, но не в единственной 24-часовой группе (фиг. 7H). Когда CHI повторялся с 48-часовыми интервалами между травмами, астроциты выглядели менее опухшими, чем в группе rCHI-24h, и ни количество GFAP-положительных астроцитов, ни экспрессия GFAP на астроцит не были значительно различаются по сравнению с фиктивной или единственной 24-часовой группой (рис. 7H).
Качественный анализ астроцитоза в мозжечке и стволе мозга выявил закономерности среди групп повреждений, аналогичные описанным для энторинальной коры.Одиночный CHI индуцировал легкий глиоз в молекулярном слое наиболее дистального аспекта латеральной листовой пластинки мозжечка в областях, подобных тем, которые демонстрируют дегенерацию нейронов с FJC. В стволе мозга была отмечена очень низкая реактивность астроцитов. При повторении с 24-часовыми интервалами 5 CHI вызывали повышенный ответ астроцитов с двух сторон в мозжечке, особенно в латеральных слоях (рис. 8B). Отростки астроцитов, распространяющиеся через молекулярный слой, стали утолщенными, а тела клеток в гранулярном слое клеток гипертрофировались (рис.8E). Повторный CHI с 24-часовыми интервалами также приводил к усилению иммуноокрашивания GFAP в сером и белом веществе ствола мозга (рис. 8H, K). Когда интервал был увеличен до 48 часов, 5 CHI вызывали более мягкий астроцитарный ответ в боковом мозжечке (фиг. 8C, F) и стволе мозга (фиг. 6I, L) по сравнению с группой rCHI-24h.
РИСУНОК 8
Астроцитоз в мозжечке и стволе мозга после повторной закрытой травмы головы (ЧИ). Иммуногистохимическое мечение глиального фибриллярного кислого белка (GFAP) после фиктивного CHI указывает на исходный уровень иммуноокрашивания в слое клеток Пуркинье мозжечка (A, D) и в стволе мозга (G, J) .Когда 5 CHI были повторены с 24-часовыми интервалами (rCHI-24h), реактивный астроцитоз наблюдался по всему мозжечку, с наибольшей гипертрофией, происходящей в молекулярном и гранулярном слоях латеральной листовой пластинки мозжечка (B, E) . После 5 CHI, повторенных с 48-часовыми интервалами (rCHI-48h), реактивный астроцитоз не был таким сильным и был сосредоточен в боковой пластине мозжечка (C, F) . Астроглиоз был более выражен в стволе мозга после rCHI с 24-часовыми интервалами (H, K) , чем с 48-часовыми интервалами (I, L) .Масштабные линейки = (A – C, G – I, J – L) 500 мкм; (D – F) 250 мкм.
РИСУНОК 8
Астроцитоз мозжечка и ствола мозга после повторной закрытой травмы головы (ЧИ). Иммуногистохимическое мечение глиального фибриллярного кислого белка (GFAP) после фиктивного CHI указывает на исходный уровень иммуноокрашивания в слое клеток Пуркинье мозжечка (A, D) и в стволе мозга (G, J) . Когда 5 CHI были повторены с 24-часовыми интервалами (rCHI-24h), реактивный астроцитоз наблюдался по всему мозжечку, с наибольшей гипертрофией, происходящей в молекулярном и гранулярном слоях латеральной листовой пластинки мозжечка (B, E) .После 5 CHI, повторенных с 48-часовыми интервалами (rCHI-48h), реактивный астроцитоз не был таким сильным и был сосредоточен в боковой пластине мозжечка (C, F) . Астроглиоз был более выражен в стволе мозга после rCHI с 24-часовыми интервалами (H, K) , чем с 48-часовыми интервалами (I, L) . Масштабные линейки = (A – C, G – I, J – L) 500 мкм; (D – F) 250 мкм.
Микроглия активируется CHI повторно через 24 часа, но не через 48 часов
У здоровой мыши Iba-1 в основном метил небольшие однородные тела клеток микроглии и очень тонкие отростки.Микроглиоз наблюдался как морфологические изменения меченных Iba-1 клеток, такие как набухание тел клеток и увеличение Iba-1-положительных процессов. Микроглиоз, измеренный через процент площади, занятой иммуномечением Iba-1, не увеличивался через 24 часа, 5 дней или 9 дней после однократного CHI по сравнению с фиктивным повреждением энторинальной коры или гиппокампа (фиг. 9E). Однако после rCHI с 24-часовыми интервалами тела микроглиальных клеток и отростки в энторинальной коре выглядели опухшими (рис.9А, В). Процент площади микроглии, меченной Iba-1, был увеличен в энторинальной коре (p <0,0001 по сравнению со всеми другими группами; рис. 9E), но не в гиппокампе (p> 0,05). RCHI, повторяемый с 48-часовыми интервалами, не вызывал значительного микроглиоза (рис. 9B, D) в энторинальной коре или гиппокампе по сравнению с фиктивным повреждением или одиночным CHI (p> 0,05; рис. 9E).
РИСУНОК 9
Микроглиоз после повторных закрытых травм головы (рКИ). Иммуногистохимическое мечение ионизированной кальций-связывающей адаптерной молекулы 1 (Iba-1) после 5 CHI, повторяемых с 24-часовыми интервалами (rCHI-24h; A, C ) и 48-часовыми интервалами (rCHI-48h; B, D ). ). (E) Процент площади иммунной метки Iba-1 был определен количественно в пределах энторинальной коры и гиппокампа. Столбцы представляют собой среднее значение ± стандартное отклонение. * p <0,05 по сравнению со всеми другими группами. (F – I) Инфильтрирующие макрофаги, меченные I-A / I-E в геморрагическом поражении (F, G) , не метят вместе с Iba-1-экспрессирующей микроглией (H, I) . Масштабные линейки = (A, B, F) 500 мкм; (C, D) 250 мкм; (G-I) 125 мкм.
РИСУНОК 9
Микроглиоз после повторных закрытых травм головы (рКИ).Иммуногистохимическое мечение ионизированной кальций-связывающей адаптерной молекулы 1 (Iba-1) после 5 CHI, повторяемых с 24-часовыми интервалами (rCHI-24h; A, C ) и 48-часовыми интервалами (rCHI-48h; B, D ). ). (E) Процент площади иммунной метки Iba-1 был определен количественно в пределах энторинальной коры и гиппокампа. Столбцы представляют собой среднее значение ± стандартное отклонение. * p <0,05 по сравнению со всеми другими группами. (F – I) Инфильтрирующие макрофаги, меченные I-A / I-E в геморрагическом поражении (F, G) , не метят вместе с Iba-1-экспрессирующей микроглией (H, I) .Масштабные линейки = (A, B, F) 500 мкм; (C, D) 250 мкм; (G-I) 125 мкм.
IA / IE (MHC II) использовался в качестве маркера активированной микроглии (32), но мягкий CHI не индуцировал микроглиальную экспрессию MHC II после повреждения, о чем свидетельствует отсутствие коэкспрессии с Iba-1 (рис. 9I). Вместо этого в областях кровотечения I-A / I-E, по-видимому, маркируют макрофаги, которые проникли в мозг из-за разрушения гематоэнцефалического барьера (рис. 9F, G). Клетки, меченные I / A-I / E, также выстилали желудочки во всех группах (данные не показаны).
Повторный ОЗГ не вызывает острого гиперфосфорилирования тау-белка
Иммуногистохимия с PHF-1 не выявила качественного увеличения гиперфосфорилированного тау в коре или гиппокампе в любой группе травмы по сравнению с фиктивным контролем (данные не показаны).
Обсуждение
Многие легкие ЧМТ, возникающие каждый год, можно отнести к таким занятиям, как бокс и футбол, где повышен риск повторных сотрясений мозга.В этом исследовании мы разработали модель легкой ЧМТ на мышах, используя мягкую среднюю линию удара по закрытому черепу. Эта модель вызвала повреждение в первую очередь энторинальной коры и мозжечка с дополнительной патологией в стволе мозга с повторяющимися ударами. Варьируя запрограммированную глубину удара, глубина удара 2,0 мм была выбрана в качестве оптимальной тяжести травмы, вызывающей острые физиологические последствия и легкий глиоз без перелома черепа или явной гибели кортикальных клеток или клеток гиппокампа. Это типично для человеческого состояния, при котором после удара может произойти потеря сознания, но визуальный анализ мозга обычно ничем не примечателен.Затем мы продемонстрировали, что 5 легких ЧМТ с 24-часовыми или 48-часовыми интервалами между травмами привели к подавлению апноэ и выпрямляющего рефлекса, которые уменьшались при последовательных воздействиях. Несмотря на снижение ответа, 5 ВМС, повторенные с 24-часовым интервалом между травмами, усилили глиоз и увеличили дегенерацию нейронов и повреждение аксонов по сравнению с одним ВМС. Когда интервал между травмами головы был увеличен с 24 часов до 48 часов, полученные гистопатологические последствия были аналогичны единичному CHI.
Временная потеря сознания продолжительностью до 30 минут возникает у людей при легкой ЧМТ (33). У мышей рефлекс выпрямления используется более 50 лет для обозначения потери сознания (34). Хотя меньшая глубина удара не оказала существенного влияния на реакцию выпрямляющего рефлекса, одиночный ВМС глубиной 2,0 мм вызывал потерю сознания примерно на 10 минут, в пределах диапазона, представляющего легкую ЧМТ на моделях грызунов (20). Хотя это подавление рефлексов длится дольше, чем в некоторых предыдущих отчетах (2–5 минут), в большинстве этих исследований для оценки сознания использовалась реакция на защемление пальца / хвоста или другой болезненный стимул (15, 27, 30), что может привести к более быстрое возвращение отзывчивости (35).Хотя анестезия подавляет рефлекс выпрямления, мы поддерживали постоянную продолжительность ингаляционной анестезии на протяжении каждой операции.
Продолжительность апноэ постепенно увеличивалась в зависимости от глубины удара. Хотя апноэ не является типичным признаком легкой ЧМТ у людей, реакции апноэ обычны в моделях легкой ЧМТ у грызунов с использованием срединного удара по черепу (12, 22, 36) и значительно дольше, чем реакции апноэ, сообщаемые при боковом повреждении (15, 30). В то время как боковой удар может направлять деформацию ткани по средней линии, а также вниз через более глубокие структуры мозга, удар по средней линии, вероятно, направляет деформацию ткани в сторону ствола мозга, временно воздействуя на нейроны, участвующие в дыхании (37).В средних моделях более тяжелой ЧМТ животным требуется интубация для облегчения дыхательной деятельности (12). Хотя трудно отделить потенциальные эффекты апноэ от последствий механического повреждения, кратковременное апноэ в нашей модели вряд ли внесет значительный вклад в патологические изменения. Повторное апноэ во время обструктивного апноэ во сне было связано с нарушением функции памяти у людей и животных моделей, но только в тяжелых случаях, включающих до 100 эпизодов апноэ каждую ночь, причем каждый эпизод длился от секунд до минут (38).
Во время серии из 5 сотрясений, потеря сознания и апноэ уменьшились с последующим ОЗИ почти до уровня фиктивного контроля. Уменьшение рефлекса выпрямления и апноэ происходило быстрее, когда интервал между травмами был увеличен с 24 часов до 48 часов, что позволяет предположить, что адаптивный или защитный механизм был запущен через 48 часов, а не через 24 часа после CHI. Наши результаты подтверждают исследование Mouzon et al (22), в котором продолжительность апноэ уменьшалась при повторной средней ЧМТ легкой степени у мышей, но они контрастируют с другими исследованиями, демонстрирующими увеличенную или устойчивую продолжительность апноэ или исправляющие рефлекторные реакции при повторных легких ЧМТ (14, 15, 22, 30, 39).Различия в ударном устройстве, характеристиках ударного наконечника, тяжести травмы, месте травмы или анестезии могут способствовать этим несопоставимым наблюдениям. Необходимы дальнейшие исследования, чтобы понять эволюцию и лежащие в основе механизмы подавления восстановительного рефлекса и ответов апноэ при повторных легких ЧМТ, но наши данные поднимают интересный вопрос о том, адаптируются ли люди к повторным сотрясениям с точки зрения их острых физиологических реакций. То есть, в ответ на эквивалентное сотрясение мозга, будут ли у спортсменов, таких как боксеры, получившие много ударов по голове в течение своей карьеры, симптомы, отличные от симптомов людей, не имевших ранее сотрясений мозга? Если симптоматика уменьшается при множественных сотрясениях мозга, серьезность и возможные последствия любой данной травмы головы могут быть недооценены.
Исторически модели легкой ЧМТ вызывали некоторую степень дегенерации нейронов, которая наблюдается сразу после травмы (20), что указывает на временную волну гибели клеток (36). С растущим интересом к повторным сотрясениям, параметры травмы были изменены, чтобы уменьшить или исключить гибель клеток как признак однократной (26, 29) или повторной легкой ЧМТ (26, 28, 40). Однако во многих из этих исследований для оценки гибели клеток использовались относительно нечувствительные меры, такие как окрашивание по Нисслю. В нашей модели после сингла 2.0 мм средней линии CHI, явной потери клеток не наблюдалось с помощью окрашивания по Нисслю, но небольшое количество острой дегенерации нейронов в энторинальной коре и слое клеток Пуркинье мозжечка было обнаружено с помощью FJC. Когда CHI повторяли с 24-часовым интервалом между повреждениями, количество тел нейронов, меченных FJC, увеличивалось, и в энторинальной коре развивалось геморрагическое поражение. Сообщалось об ухудшении потери клеток, истончении кортикального слоя или развитии поражения при повторной ЧМТ по сравнению с единичной (15, 22, 29), но эти наблюдения были качественными или полуколичественными и не использовали нейрон-специфические маркеры для острого заболевания. перерождение.Longhi и др. (27) отметили, что острая корковая нейродегенерация была качественно эквивалентна после одного и двух ВМС с трехдневным интервалом. Мы исследовали более короткие интервалы и предоставили количественные данные, чтобы продемонстрировать, что удлинение интервала между травмами с 24 часов до 48 часов предотвращает обострение гибели нейронов в энторинальной коре, указывая на то, что первоначальная клеточная дисфункция была обратимой в течение 48 часов после травмы. Насколько нам известно, это первый отчет, в котором количественно оценивается влияние повторяющихся легких ЧМТ и вариаций временного интервала на накопление дегенерирующих нейронов.Следовательно, мы предлагаем модель, в которой множественные повреждения могут преобразовать сублетальное повреждение нейронов в дегенерацию нейронов, что является важной платформой для исследования уязвимости нейронов и аксонов к легкой ЧМТ. Интересно, что в мозжечке не наблюдалось повышенной острой гибели клеток, что может указывать на уникальные механизмы повреждения или на ускоренную дегенерацию, которая не была зафиксирована с помощью окрашивания FJC. Дальнейшая оценка долгосрочного повреждения нейронов, включая количество стереологических клеток, необходима для понимания степени гибели нейронов в энторинальной коре и мозжечке.
Аксональное повреждение является частым признаком легкой диффузной ЧМТ, которая обычно усугубляется повторными травмами (16, 18, 29, 30, 39). В настоящем исследовании одиночный ВМС вызвал легкое повреждение аксонов в энторинальной коре и мозжечке, распределение, уникальное для других моделей легкой ЧМТ, которые чаще всего сообщают о повреждении подкорковых путей белого вещества (18, 27, 29, 30, 36). Непонятно, почему удар по средней линии не привел к повреждению аксонов подкоркового белого вещества, обнаруженному с помощью иммуноокрашивания APP или окрашивания FJC, но в будущих исследованиях будут использоваться альтернативные методы обнаружения, такие как окрашивание серебром, которое может быть более чувствительным, или обнаруживать альтернативные фенотипы повреждения аксонов ( 28).Черепно-мозговая травма, повторяющаяся с интервалом в 24 часа, не увеличивала значимо количество APP-положительных аксонов в энторинальной коре, но набухание аксонов выглядело больше, что может указывать на функциональные различия. Хотя сообщалось, что размер набухания аксонов коррелирует со временем выживания (41), более крупные набухания в группе rCHI-24h нельзя приписывать исключительно более длительному выживанию, поскольку эквивалентные набухания не наблюдались в группах одиночных CHI с одинаковым временем выживания.Напротив, rCHI с интервалом в 24 часа приводила к заметному усилению повреждения аксонов мозжечка и появлению диффузного повреждения аксонов в стволе мозга. О развитии аксонального повреждения после повторной, но ни одной легкой ЧМТ не сообщалось в стволе мозга (16, 22) и таламусе (29) в других моделях средней линии ВМС, и это может указывать на то, что одна легкая ЧМТ вызывает дисфункцию аксонов, которая перерастает только в АРР. -положительная патология с повторной травмой. Когда легкая ЧМТ повторялась с 48-часовыми интервалами между травмами, повреждение аксонов в энторинальной коре было таким же, как у мышей, обследованных через 9 дней после однократной ВМС, а дегенерирующие аксоны в мозжечке и стволе мозга наблюдались реже, чем в rCHI-24h. группа.Эти данные предполагают, что более длительные интервалы между легкой ЧМТ защищают от обострения аксонального повреждения, как было показано Fujita et al (16). В совокупности наши данные подтверждают гипотезу о том, что повторные легкие ЧМТ в течение определенного периода времени могут вызвать и / или ускорить повреждение аксонов.
Хотя клеточные механизмы временной уязвимости нейронов к повторной легкой ЧМТ не совсем понятны, динамические изменения проницаемости клеточных мембран, высвобождения глутамата, регуляции кальция и митохондриальной функции могут играть роль.Снижение метаболизма глюкозы в мозге также считается основной причиной уязвимости ко второй ЧМТ (42). Взаимодействие между нейронами и реактивной глией после травмы еще больше затрудняет идентификацию причинных клеточных механизмов.
При травматическом событии астроциты становятся реактивными и запускают защитные механизмы восстановления, чтобы ограничить повреждение тканей, восстанавливая любой разрыв гематоэнцефалического барьера (43) и способствуя синаптогенезу (44). Единичный CHI размером 2,0 мм или меньше приводил к очень легкому прогрессирующему астроглиозу, как и в других моделях одиночного CHI на грызунах (22, 45).Когда легкая ЧМТ повторялась с 24-часовыми интервалами между травмами, астроцитоз усиливался в энторинальной коре, мозжечке и стволе мозга, подтверждая предыдущие сообщения об увеличении астроглиоза при повторной по сравнению с одиночной легкой ЧМТ (21, 22). Однако остается неясным, является ли обострение астроцитоза нейропротективным или пагубным для окружающих нейронов. Астроциты ответственны за обратный захват глутамата из синаптической щели, но после ушиба транспортеры глутамата подавляются, что усиливает эксайтотоксичность в синаптической щели (46).В будущих исследованиях будет изучаться стойкость глиального ответа после повторного CHI и его связь с начальным и продолжающимся повреждением нейронов.
Подобно астроцитозу, микроглиальная реактивность была отмечена у грызунов после однократной и повторной ЧМТ легкой степени, прежде всего в коре головного мозга ниже места удара, мозолистом теле и гиппокампе сразу после травмы (15, 22, 28) и в течение длительного периода после травмы. 2 месяца (15) и 12 месяцев (47). В этом исследовании реактивность микроглии не была очевидна в течение 9-дневного периода после однократного CHI или сразу после rCHI с 48-часовым интервалом; однако rCHI с интервалом в 24 часа значительно увеличивал микроглиоз энторинальной коры.Напротив, Mouzon et al (22) продемонстрировали, что 5 легких ЧМТ с 48-часовыми интервалами увеличивали микроглиоз в коре и мозолистом теле в течение 24 часов после окончательной травмы. Однако парадигма травмы, используемая Музоном и соавторами, индуцировала микроглиоз после однократной легкой ЧМТ, тогда как наша модель вызывала микроглиоз только при повторных сотрясениях мозга, что позволяет предположить, что наш одиночный ВМС может представлять собой более легкую начальную травму. Активация микроглии наблюдалась в энторинальной коре головного мозга одновременно с повреждением аксонов и дегенерацией нейронов.При активации микроглия высвобождает множество цитокинов и хемокинов, которые сигнализируют о начале воспалительного каскада. В зависимости от уровней этих различных сигнальных молекул после травмы в микроглии могут развиваться фенотипы, способствующие либо гибели клеток, либо восстановлению тканей (48). Необходимо дальнейшее исследование экспрессии цитокинов / хемокинов в микроглии между повторными повреждениями и хронически после повторных ЧМТ легкой степени, чтобы понять, помогает ли микроглия или противодействует восстановлению нейронов после повторных травматических повреждений.
Комбинация нейроглиальных ответов в гиппокампе, энторинальной коре, мозжечке и стволе мозга в нашей модели CHI является отличительной; Большинство моделей умеренной ЧМТ вызывают повреждение клеток сенсорной и моторной коры вблизи места удара, мозолистого тела и / или гиппокампа. Энторинальная кора вместе с гиппокампом участвует в цепи памяти. Было показано, что двусторонние электролитические поражения энторинальной коры вызывают дефицит памяти и обучения (49).Таким образом, в нашей модели повторной легкой ЧМТ двусторонняя нейродегенерация энторинальной коры в сочетании с глиозом гиппокампа может облегчить исследование посттравматического дефицита памяти. Двустороннее повреждение мозжечка и аксонов ствола мозга может иметь функциональные последствия для сложной координации движений и баланса. Таким образом, будущая работа должна определить, приводят ли повторные ОМС с этой моделью к поведенческой дисфункции. Настоящее исследование ограничивалось оценкой острых физиологических и гистопатологических изменений.Поскольку считается, что повторные ЧМТ легкой степени являются фактором риска или причиной нейродегенеративных заболеваний, таких как болезнь Альцгеймера и хроническая травматическая энцефалопатия (50), важно изучить долгосрочные гистологические последствия повторных ЧМТ легкой степени в этой модели.
В заключение, по сравнению с одной легкой ЧМТ, легкая ЧМТ, повторяемая с 24-часовым интервалом, приводила к большей дегенерации нейронов, повреждению аксонов, астроглиозу и микроглиозу во всех каудальных областях мозга мыши.Эти повышенные тканевые реакции не были просто вызваны большим количеством ударов, потому что 5 сотрясений, вызванных с 48-часовыми интервалами, не увеличивали гибель нейронов или глиоз по сравнению с одной травмой. Необходимы дополнительные исследования для выявления клеточных и молекулярных факторов, влияющих на временную уязвимость к повторным легким ЧМТ. Усиленные невропатологические изменения, связанные с повторными травмами головы, были очевидны, несмотря на снижение острых физиологических реакций на последовательные воздействия.Эти данные подтверждают необходимость дополнить симптоматический анализ легкой ЧМТ оценкой патологии головного мозга с использованием изображений, биомаркеров или других технологий.
Благодарность
PHF-1 был щедрым подарком доктора Питера Дэвиса.
Список литературы
1..
Эпидемиология и последствия черепно-мозговой травмы: краткий обзор
.J Центр реабилитации после травм головы
2006
;21
:375
—78
2..
Травматическая травма головного мозга в США: посещения отделений неотложной помощи, госпитализации и смерти 2002–2006 гг.
.Атланта, Джорджия
:Национальный центр профилактики и контроля травм
;2010
3..
Эпидемиология легкой неосложненной травмы головного мозга
.J Trauma
1988
;28
:1637
—43
4.и другие. .
Заявление о позиции Американского медицинского общества спортивной медицины: Сотрясение мозга при спорте
.Br J Sports Med
2013
;47
:15
—26
5.и другие. .
Резюме обновленного научно обоснованного руководства: Оценка и лечение сотрясения мозга в спорте: Отчет Подкомитета по разработке рекомендаций Американской академии неврологии
.Неврология
2013
;80
:2250
—57
6.и другие. .
Заявление о консенсусе по сотрясению мозга в спорте: 4-я Международная конференция по сотрясению мозга в спорте, Цюрих, ноябрь 2012 г.
.Br J Sports Med
2013
;47
:250
—58
7.и другие. .
Экспериментальная закрытая черепно-мозговая травма у крыс: механические, патофизиологические и неврологические свойства
.Crit Care Med
1988
;16
:258
—65
8.и другие. .
Экспериментальная модель закрытой черепно-мозговой травмы у мышей: патофизиология, гистопатология и когнитивные нарушения
.J Neurotrauma
1996
;13
:557
—68
9.и другие. .
Черепно-мозговая травма у крысы: характеристика модели срединной жидкостной перкуссии
.Cent Nerv Syst Trauma
1987
;4
:119
—34
10.и другие. .
Модель экспериментального черепно-мозгового повреждения крысы методом жидкостной перкуссии
.J Neurosurgery
1987
;67
:110
—19
11..
Новая модель диффузной черепно-мозговой травмы у крыс
.Часть II: Морфологическая характеристика. J Neurosurgery
1994
;80
:301
—13
12.и другие. .
Новая модель диффузной черепно-мозговой травмы у крыс
.Часть I: Патофизиология и биомеханика.J Neurosurg
1994
;80
:291
—300
13..
Контролируемое корковое воздействие: новая экспериментальная модель черепно-мозговой травмы
.J Neurotrauma
1988
;5
:1
—15
14.и другие. .
Множественные эпизоды легкой черепно-мозговой травмы приводят к ухудшению когнитивных функций у мышей
.Acad Emerg Med
2004
;11
:809
—19
15.и другие. .
Повторяющееся у крысы легкое перкуссионное поражение головного мозга боковой жидкостью вызывает кумулятивные долгосрочные нарушения поведения, нейровоспаление и потерю коры головного мозга на животной модели повторного сотрясения мозга
.J Нейротравма
2012
;29
:281
—94
16..
Повторяющиеся черепно-мозговые травмы, зависящие от интенсивности и интервалов, могут вызывать как аксональные, так и микрососудистые повреждения
.J Нейротравма
2012
;29
:2172
—80
17..
Визуализация тензора диффузии выявляет аксональное повреждение в модели повторяющейся черепно-мозговой травмы закрытого черепа на мышах
.Neurosci Lett
2012
;513
:160
—65
18.и другие. .
Легкая травма головы, повышающая уязвимость мозга ко второму сотрясающему удару
.J Neurosurgery
2001
;95
:859
—70
19.и другие. .
Анализ функциональных путей, измененных после легкой черепно-мозговой травмы
.J Нейротравма
2013
;30
:752
—64
20.и другие. .
Проблемы разработки моделей легкой черепно-мозговой травмы на грызунах
.J Нейротравма
2013
;30
:688
—701
21.и другие. .
Долгосрочные когнитивные нарушения и патологические изменения на мышиной модели повторяющейся легкой черепно-мозговой травмы
.Передний Neurol
2014
;5
:12
22.и другие. .
Повторяющиеся легкие черепно-мозговые травмы на мышиной модели вызывают дефицит обучения и памяти, сопровождаемый гистологическими изменениями
.J Нейротравма
2012
;29
:2761
—73
23.и другие. .
Мышиная модель повторяющейся легкой черепно-мозговой травмы человека
.J Neurosci Methods
2012
;203
:41
—49
24.и другие. .
Легкая черепно-мозговая травма детеныша мыши вызывает сильную дегенерацию аксонов белого вещества, которая предшествует апоптотической гибели кортикальных и таламических нейронов
.Exp Neurol
2008
;211
:551
—60
25..
Повреждение мозга средней линии у неполовозрелой крысы вызывает стойкий когнитивный дефицит, биополушарное повреждение аксонов и нейродегенерацию
.Exp Neurol
2008
;213
:84
—92
26.и другие. .
Увеличение времени восстановления между травмами улучшает когнитивные результаты после повторяющихся легких сотрясений мозга у мышей
.Нейрохирургия
2012
;71
:885
—91
27.и другие. .
Временное окно уязвимости к повторяющимся экспериментальным сотрясениям головного мозга
.Нейрохирургия
2005
;56
:364
—74
28.и другие. .
Повторяющиеся черепно-мозговые травмы с закрытым черепом у мышей вызывают стойкое мультифокальное повреждение аксонов и реактивность микроглии
.J Neuropathol Exp Neurol
2011
;70
:551
—67
29..
Фундаментальная наука: Повторяющаяся легкая неконтузивная травма головного мозга у неполовозрелых крыс усугубляет травматическое повреждение аксонов и активацию аксонального кальпаина: предварительный отчет
.J Нейротравма
2007
;24
:15
—27
30.и другие. .
Повторные черепно-мозговые травмы у молодых крыс связаны с повышенным повреждением аксонов и когнитивными нарушениями
.Dev Neurosci
2010
;32
:510
—18
31.и другие. .
Скорость нейродегенерации в модели контролируемого кортикального воздействия на мышей зависит от формы кончика ударника: значение для механистических и терапевтических исследований
.Journal of Neurotrauma
2011
:28
;2245
—62
32.и другие. .
Палочковидная микроглия встречается только в глазах с лазерно-индуцированной глазной гипертензией, но отсутствует в микроглиальных изменениях контралатерального необработанного глаза
.PloS One
2013
;8
:e83733
33.CDC
.Отчет для Конгресса о легкой травме головного мозга в Соединенных Штатах: шаги по предотвращению серьезной проблемы общественного здравоохранения
.Профилактика CfDCa
(ред.)Центры по контролю и профилактике заболеваний
,Атланта, Джорджия
;2003
:1
—47
34..
Предлагаемый общий механизм действия общих и местных анестетиков на центральную нервную систему
.Br J Pharmacol Chemother
1963
;21
:1
—9
35.и другие. .
Измененная реакция на пропофол, но не на кетамин, у мышей с дефицитом 65-килодальтонной изоформы глутаматдекарбоксилазы
.J Pharmacol Exp Ther
2009
;329
:592
—99
36.и другие. .
Сотрясение мозга мыши приводит к острым когнитивным нарушениям и стойкому нарушению функции аксонов
.J Нейротравма
2011
;28
:547
—63
37.и другие. .
Биомеханические аспекты жидкостной перкуссионной модели черепно-мозговой травмы
.J Neurotrauma
1992
;9
:311
—22
38..
Соединение фенотипов черепно-мозговой травмы и дисфункции при обструктивном апноэ сна
.Передний Neurol
2012
;3
:139
39.и другие. .
Повторная черепно-мозговая травма влияет на комплексную когнитивную функцию у поросят
.J Нейротравма
2009
;26
:1111
—21
40.и другие. .
Повторные легкие травмы головного мозга приводят к когнитивным нарушениям у мышей B6C3F1
.J Neurotrauma
2002
;19
:427
—38
41..
Корреляция времени выживания с размером аксонов при диффузном повреждении аксонов
.Acta Neuropathologica
1999
;98
:197
—202
42.и другие. .
Повторная легкая черепно-мозговая травма: механизмы церебральной уязвимости
.J Нейротравма
2013
;30
:30
—38
43.и другие. .
Инфильтрация лейкоцитов, дегенерация нейронов и рост нейритов после удаления рубцовых реактивных астроцитов у взрослых трансгенных мышей
.Neuron
1999
;23
:297
—308
44.и другие. .
Индуцированный астроцитами синаптогенез опосредуется трансформацией передачи сигналов фактора роста бета посредством модуляции уровней D-серина в нейронах коры головного мозга
.J Biol Chem
2012
;287
:41432
—45
45.и другие. .
Посттравматическая гипоксия усугубляет повреждение ткани мозга: анализ аксонального повреждения и глиальных реакций
.J Нейротравма
2010
;27
:1997
—2010
46.и другие. .
Черепно-мозговая травма снижает регуляцию белков глиального транспортера глутамата (GLT-1 и GLAST) в головном мозге крысы
.J Neurochem
1998
;70
:2020
—27
47.и другие. .
Хронические невропатологические и нейроповеденческие изменения в модели повторяющейся легкой черепно-мозговой травмы
.Ann Neurol
2014
;75
:241
—54
48..
Участие про- и противовоспалительных цитокинов и хемокинов в патофизиологии черепно-мозговой травмы
.Neurotherapeutics
2010
;7
:22
—30
49.и другие. .
Доказательства восстановления пространственного обучения после поражения энторинальной коры у мышей
.Brain Res
1997
;758
:187
—200
50..
Военная черепно-мозговая травма и нейродегенерация
.Альцхейм Демент
2014
;10
:S242
—53
Дополнительная информация
Дополнительные данные
Заметки автора
Авторские права © 2014 Американской ассоциации невропатологов, Inc.