детей без пробы Манту можно изолировать от остальных — судебные истории в Т—Ж
Две мамы не сделали своим детям пробы Манту. В ответ на отказ школа решила не учить этих детей в обычном классе, а изолировать их от остальных учеников. В итоге детям без обследования на туберкулез в виде специальной подкожной пробы пришлось ходить на уроки отдельно от одноклассников. Мамы посчитали, что это вредит психическому здоровью детей и нарушает их права.
Екатерина Мирошкина
экономист
Профиль автораРешение об изоляции школа приняла на основании письма Минздрава, в котором установили такой порядок: нет пробы Манту — учитесь отдельно. Мамы пошли в Верховный суд, чтобы признать это письмо недействительным. А заодно и клинические рекомендации по профилактике туберкулеза. Мамы хотели, чтобы их дети без обследований ходили в школу как все остальные — без изоляции, отдельных уроков и требований вводить какие-то препараты.
Источник:
Решение ВС № АКПИ19-115
Что Минздрав сказал школам по поводу детей без пробы Манту?
В 2017 году Минздрав разослал школам и вузам письмо по поводу приема и обучения непривитых детей. В этом письме было такое:
В этом письме было такое:
- Если ребенка направили на консультацию в тубдиспансер, а через месяц родители не принесли справку, что он здоров, то его вообще нельзя допускать в школу, сад или вуз.
- Если родители отказались от пробы Манту или «Диаскинтеста», их детей можно допустить в школу. Но только при наличии заключения от фтизиатра, что туберкулеза нет.
- Дети без обследований должны учиться отдельно. Они не могут посещать коллектив наравне со всеми.
- Фтизиатр только выдает справку, но не может указывать школе, допускать ребенка к занятиям в общем классе или нет.
- Решение о допуске к занятиям принимает руководство учебного заведения.
Это письмо Минздрав написал на основе клинических рекомендаций. И хотя они пока необязательные, но детей без пробы Манту школа решила учить отдельно. Их фактически изолировали от остальных, а мамам такой расклад не понравился.
Оспаривать письма и разные нормативные документы положено в Верховном суде, куда родители и отправились.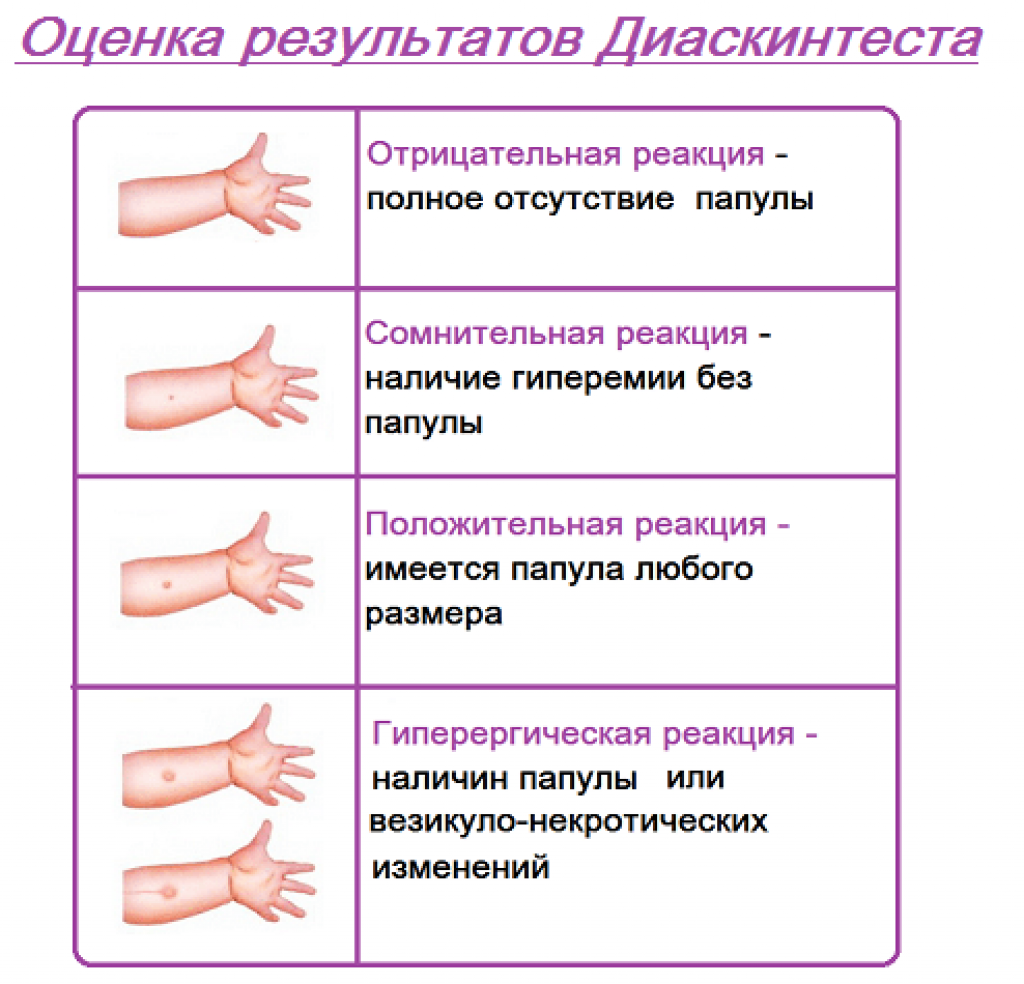 Это суд не с конкретной школой, а для оспаривания нормативного акта. Если бы все получилось, решение было бы актуально вообще для всех мам, детей и учебных заведений.
Это суд не с конкретной школой, а для оспаривания нормативного акта. Если бы все получилось, решение было бы актуально вообще для всех мам, детей и учебных заведений.
Что сказал суд?
Верховный суд сказал, что детей без обследования на туберкулез можно изолировать от обследованных. Тут нет нарушения прав. Их тоже будут учить, но в какой-то другой форме, например отдельно или на дому. То есть на этом этапе мамы проиграли.
Вот какие аргументы привел суд:
- Клинические рекомендации основаны на научных доказательствах.
- На их основе Минздрав составил письмо для учебных заведений.
- Письмо и рекомендации о профилактике туберкулеза — это не нормативный документ. Они необязательные. Это всего лишь советы школам, что делать с непривитыми детьми.
- Родители имеют право отказаться от любых прививок, проб и обследований. От пробы Манту тоже.
- Детей и взрослых положено обследовать на наличие активной формы туберкулеза. Это нужно, чтобы не было эпидемий и вовремя выявлялись случаи заболеваний.
 Такое требование санитарного законодательства нужно выполнять.
Такое требование санитарного законодательства нужно выполнять. - Детей обследуют с помощью иммунодиагностики — им вводят препараты с учетом возраста и потом смотрят на реакцию.
- Чтобы доказать, что нет активной формы туберкулеза, можно использовать другие виды диагностики — без введения ребенку каких-то препаратов. Например, рентген или специальный анализ крови.
- Школа должна делать так, чтобы все дети могли реализовать право на доступное и безопасное образование. Нельзя рисковать здоровьем одних детей ради прав и желаний других детей или их родителей.
- Если есть дети, по которым непонятно, что они точно здоровы, они не могут учиться вместе с обследованными.
Нарушения прав детей без пробы Манту здесь нет: детей не исключили из школы, а предложили им такую форму обучения, чтобы никто не рисковал. Как именно учить детей без обследования — это решает школа.
Профилактических прививок это тоже касается?
Профилактические прививки — это когда ребенку вводят вакцину, чтобы он не заболел чем-то опасным: корью, столбняком или коклюшем.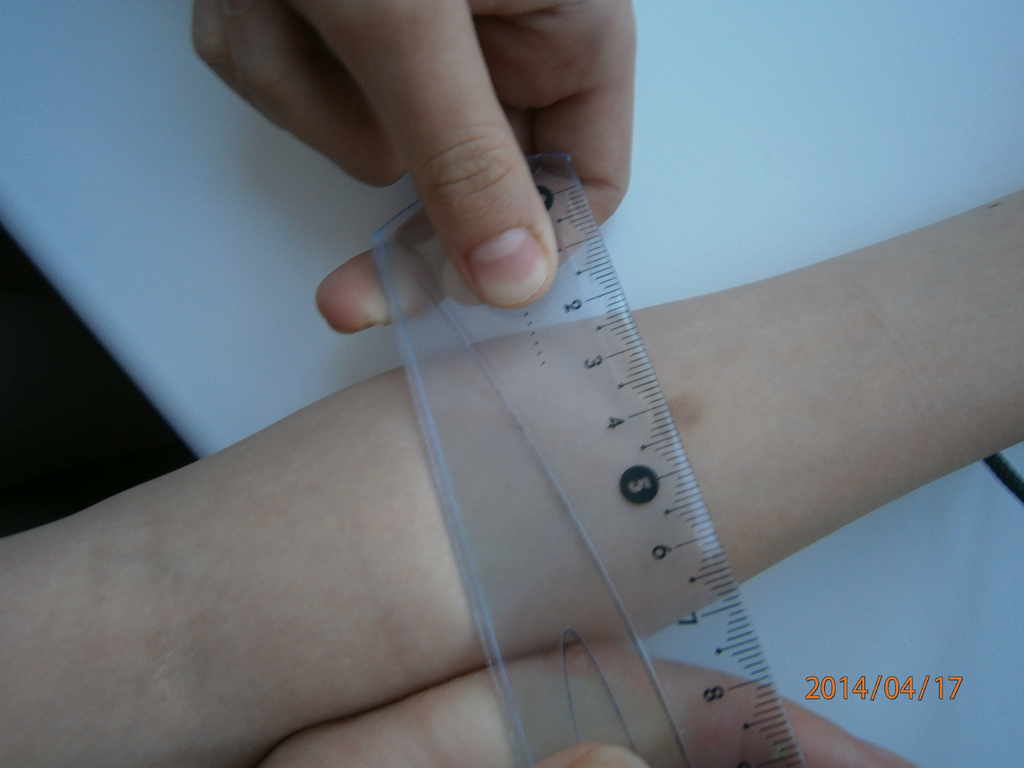 От таких прививок можно отказаться. Если ребенок заболеет, это будет ответственность родителей, а не школы или детского сада.
От таких прививок можно отказаться. Если ребенок заболеет, это будет ответственность родителей, а не школы или детского сада.
Проба Манту — это тест, который показывает, что ребенок не болеет туберкулезом. То есть он никого не заразит в школе или детском лагере.
Поэтому требования к этим процедурам разные. Школа не может отказаться учить ребенка без прививки от кори или столбняка. Если у других детей есть прививки от этих болезней, то рискуют не они, а непривитый ребенок. А вот без пробы Манту в школу хоть и примут, но могут изолировать. А в детские сады обычно вообще не принимают, потому что в школе есть обучение на дому, а садика на дому быть не может. Пока это работает так.
Не хочу делать ребенку пробу Манту. Как избежать изоляции в школе?
Используйте другие методы обследований.
 Подходящий вариант подскажет врач.
Подходящий вариант подскажет врач.Получите справку от фтизиатра. Эта справка подтвердит, что ребенок никого не заразит. Ее могут выдать на основании других видов диагностики, а не только пробы Манту. Иногда проба показывает реакцию, а рентген подтверждает, что болезни нет.
Предъявите справку в школе или детском саду. Это не значит, что ребенка точно не изолируют, но часто такого подтверждения достаточно. Справка — это не допуск к учебе вместе с обследованными детьми. Школа имеет право решать, изолировать ребенка или нет. Если будет эпидемия, спросят с директора. Помогите ему подстраховаться документами.
При отказе жалуйтесь в прокуратуру. Здесь важны нюансы: вы вообще отказались от всех видов обследования или получили справку, а ребенка все равно не принимают в садик или перевели на обучение на дому. Еще можно пойти в суд, но шансов мало: обычно суды говорят, что не допускать ребенка в сад или школу без обследований на туберкулез — это законно.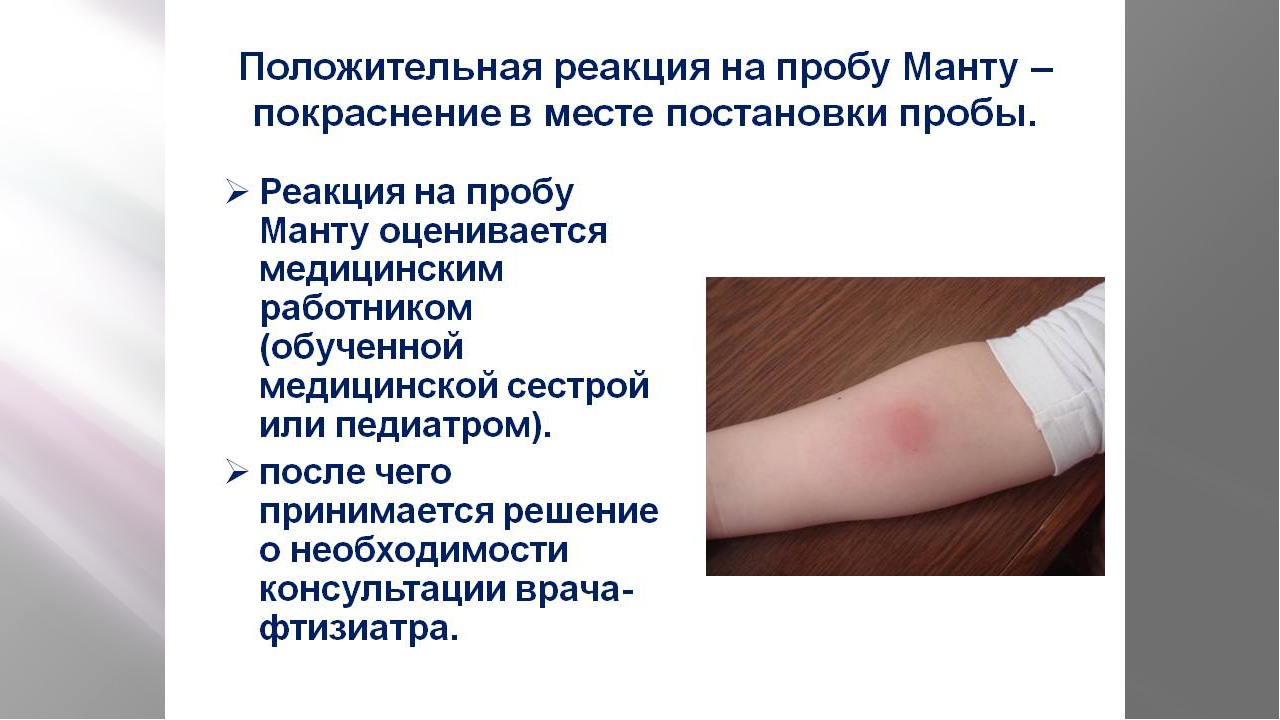
Манту заменят на Диаскинтест
15 сентября 2016
Доказавшие за многие годы свою эффективность пробы на раннее обнаружение опасной для общества болезни — туберкулеза — уходят в прошлое. Осенью 2016 года в России вступают в силу новые правила диагностики туберкулеза, в соответствии с которыми вместо пробы Манту будет использоваться Диаскинтест (ДСТ) для всех групп населения за исключением дошкольников. В настоящее время Министерство здравоохранения России выставило на общественное обсуждение проект приказа об изменении схемы диагностики туберкулеза у детей и подростков. Документ пока собирает преимущественно негативные отзывы.
В соответствии с документом «Об утверждении порядка и сроков проведения профилактических медицинских осмотров граждан в целях выявления туберкулеза», проба на реакцию Манту (иммунодиагностика с применением аллергена бактерий с 2 туберкулиновыми единицами очищенного туберкулина в стандартном разведении) будет проводиться только детям до 7 лет.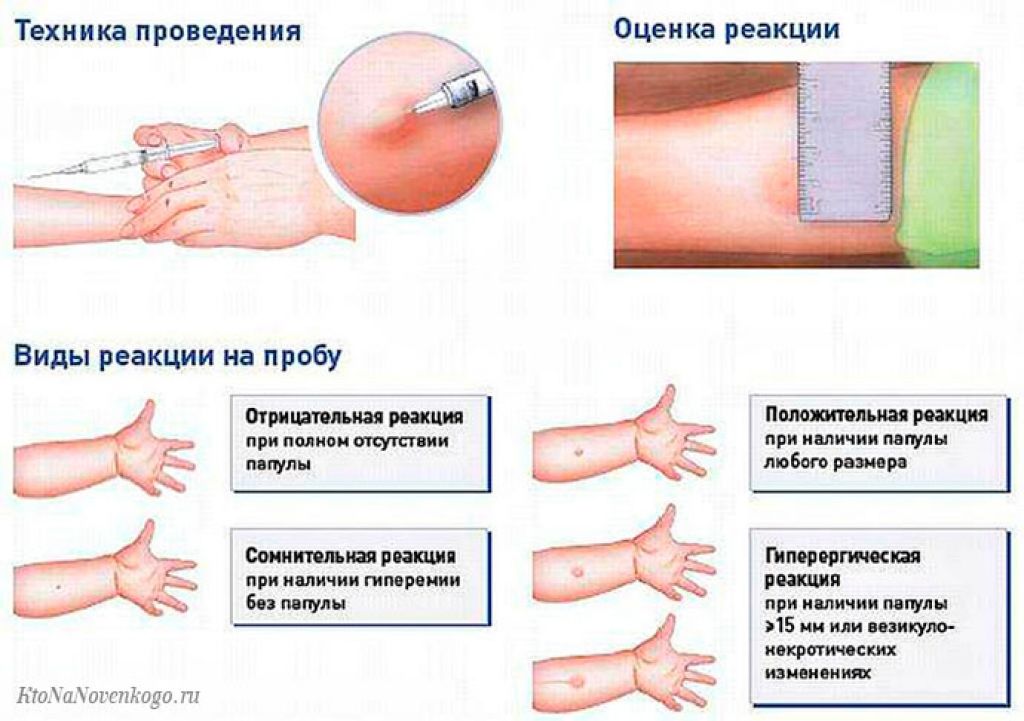
Школьникам с 8 до 14 лет диагностику туберкулеза предлагается проводить с помощью Диаскинтеста (иммунодиагностика с применением аллергена туберкулезного рекомбинантного в стандартном разведении). Для подростков в возрасте 15-17 лет схема диагностики туберкулеза включает Диаскинтест и флюорографию.
Сейчас приказ, опубликованный на Едином портале раскрытия информации, собрал больше голосов «против», чем «за». Многие фтизиатры сомневаются в эффективности изменения схемы диагностики.
По мнению главного научного сотрудника отдела организации противотуберкулезной помощи НИИ фтизиопульмонологии Первого МГМУ имени Сеченова Маргариты Шиловой, Диаскинтест не подходит для массовой диагностики. Он выявляет туберкулез лишь в 50% случаев, и имеет ряд других недостатков. Замена им реакции Манту может привести к тому, что тысячи диагнозов не будут поставлены вовремя, считает она.
Препарат Диаскинтест – оригинальная разработка российской фармацевтической компании «Генериум». В декабре 2015 года производитель по предложению Росздравнадзора приостанавливал производство и реализацию одной из серий препарата в связи с проверкой, начатой после смерти шестилетней девочки, которая получила инъекцию в противотуберкулезном диспансере в Смоленске. 2 июня 2016 года продажа этой серии была возобновлена.
В декабре 2015 года производитель по предложению Росздравнадзора приостанавливал производство и реализацию одной из серий препарата в связи с проверкой, начатой после смерти шестилетней девочки, которая получила инъекцию в противотуберкулезном диспансере в Смоленске. 2 июня 2016 года продажа этой серии была возобновлена.
фото с сайта: news.sputnik.ru
Новость с сайта vladmedicina.ru
Диаскинтест в практике педиатра, Л.И.Венюкова Врач фтизиатр противотуберкулезного диспансера
Многие годы главным способом выявить туберкулез или предрасположенность к нему считалась проба Манту. В последнее время всё чаще используется новая альтернатива – диаскинтест.
Диаскинтест (далее ДСТ) – современный проверенный препарат на основе двух составляющих. В фармакологическом плане — это рекомбинантный белок, в молекулярную структуру которого встроены два антигена, связанные между собой. Эти антигены специфические и отсутствуют у всех вирусных агентов кроме туберкулеза.
Вакциной Диаскинтест не является, только пробой для диагностики. Он считается экспресс-тестом на туберкулез и применяется внутрикожно.
ДСТ используется с целью:
— Диагностика туберкулеза с нетуберкулезными заболевания и побочными реакциями на БЦЖ-вакцинацию;
— дифференциальной диагностики поствакциальной и инфекционной аллергии;
— выявление латентной туберкулезной инфекции с высоким риском развития активного туберкулеза, определения показаний для химиопрофилактики.
Согласно приказа МЗ РБ от 02.10.15г. №977 «Об утверждении Инструкции о порядке проведения иммунодиагностики и химиопрофилактики туберкулеза среди детского населения» для раннего выявления туберкулезной инфекции ДСТ следует проводит:
1. Ежегодно детям в возрасте от 8 до 17 лет из группы риска:
— ВИЧ-инфицированные;
— признанные находящимися в социально опасном положении, а также проживающие в общежитии, из семьи беженцев, мигрантов;
— с иммуносупрессией, готовящиеся к трансплантации органов;
— из детских интернатных учреждений с круглосуточным пребыванием;
— дети – инвалиды;
— поступающие в социально – педагогические учреждения , специальные учебно – воспитательные учреждения при отсутствии медицинской документации или отсутствии в медицинской документации информации о проведении туберкулинодиагностики и вакцинации БЦЖ.
2. Детям с подозрением на туберкулёз по клинико – лабораторным и / или рентгенологическим признакам.
3. Детям направленным к фтизиатру по результатам пробы Манту.
Техника введения ДСТ
Инъекция делается тонкой иглой, в среднюю треть предплечья, внутрикожно, исключительно медицинским работником, имеющим допуск. Отметим, что интервал между пробой ДСТ и профилактическими прививками должен быть не меньше месяца.
Противопоказания
— Острые и хронические (в период обострения) инфекционные заболевания, за исключением случаев, подозрительных на туберкулез;
— соматические и другие заболевания в период обострения;
— распространенные кожные заболевания;
— аллергические состояния;
— эпилепсия;
— беременность, лактация, обострения соматических заболеваний;
— нельзя делать пробы в детских учреждениях в период карантина.
Несмотря на все эти противопоказания, надо помнить, что ДСТ – генетически измененные штаммы кишечной палочки и никогда сам туберкулез вызвать не смогут.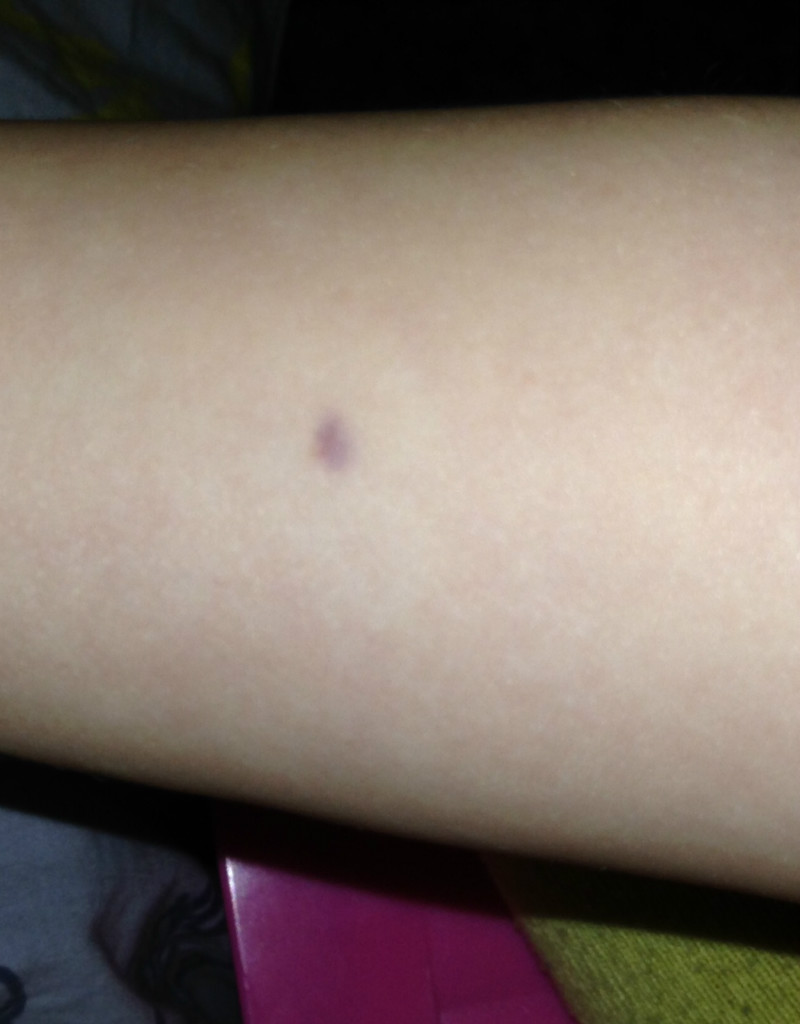 Место пробы мочить нельзя, иначе данные исказятся из-за посторонних аллергенов и тест придется повторять.
Место пробы мочить нельзя, иначе данные исказятся из-за посторонних аллергенов и тест придется повторять.
Чтение пробы ДСТ должно проводиться только врачом. Делается это спустя 72 часа после укола. Оценивается диаметр красного пятна и уплотнения на месте инъекции.
Результаты
Отрицательные – при полном отсутствии инфильтрата и гиперемии, наличие «уколочной реакции» или «синяка» размером 2 – 4 мм;
Сомнительные – при наличии гиперемии любого размера без инфильтрата;
Положительные – при наличии инфильтрата любого размера;
Гиперергические — на месте укола образуется уплотнение от 15 мм. Также могут возникать пузырьки, язвочки. Возможно увеличение лимфоузлов в подмышечной впадине или локтевой яме.
Отрицательная реакция на ДСТ характерна для:
— не инфицированных МБТ;
— инфицированных МБТ с неактивной туберкулёзной инфекцией;
— у детей с нетуберкулёзными заболеваниями и серьёзными побочными реакциями на БЦЖ
Реакция ДСТ может быть отрицательной у детей:
— больных туберкулезом с выраженными иммунопатологическими нарушениями, обусловленными тяжёлым течением туберкулёзного процесса
— на ранних стадиях периода первичного инфицирования МБТ и на ранних стадиях туберкулеза;
— с иммунодефицитным состоянием (ВИЧ-инфекция и др. )
)
При наличии характерных клинико-лабораторных и/или рентгенологических признаков туберкулеза и отрицательной реакции на ДСТ проводятся дальнейшие мероприятия по диагностике туберкулёза.
Все дети с сомнительной и положительной реакцией на ДСТ направляются на консультацию к фтизиатру. В течение двух недель им проводится рентгенография органов грудной клетки (по показаниям КТ), лабораторные исследования (общий анализ крови, мочи) и выдаётся заключение. Наблюдение фтизиатром осуществляется в соответствии с VI группой диспансерного учёта.
Отличия от пробы Манту:
В чем-то пробы Манту и ДСТ схожи (внутрикожная инъекция и активное вещество препарата), но имеются существенные различия. В препарате для пробы Манту есть туберкулин, добытый из возбудителей туберкулеза.
ДСТ в стандартном разведении представляет собой рекомбинантный белок, продуцируемый генетически модифицированной культурой EscherichiacoliBL21(DE3)/pCFP-ESAT, разведенный в стерильном изотоническом фосфатном буферном растворе, с консервантом (фенол). Содержит два антигена, присутствующие в вирулентных штаммах микобактерий туберкулеза и отсутствующие в вакцинном штамме БЦЖ.
Содержит два антигена, присутствующие в вирулентных штаммах микобактерий туберкулеза и отсутствующие в вакцинном штамме БЦЖ.
ДСТ показывает лишь то, что организму знаком специфический белок возбудителей туберкулеза. По статистике проба Манту даёт правильный результат в 70 % случаев, а Диаскинтест – в 98 %. Препарат также способен следить за эффективностью лечения туберкулеза.
Если соблюдать все прямые противопоказания, проба не причинит организму никакого вреда. Но, как и у многих медицинских препаратов, в результате его применения возможны побочные эффекты: легкое повышение температуры, головная боль, слабость и усталость.
Л.И.Венюкова
Врач фтизиатр
противотуберкулезного диспансера
Прямое тестирование микобактерий туберкулеза на лекарственную чувствительность для быстрого выявления множественной лекарственной устойчивости с использованием системы Bactec MGIT 960: многоцентровое исследование
J Clin Microbiol. 2012 фев; 50 (2): 435–440.
2012 фев; 50 (2): 435–440.
Salman Siddiqi
a Becton Dickinson, Sparks, Maryland, USA
Altaf Ahmed
b Indus Hospital, Karachi, Пакистан
Sunil Asif
bПакистан
Дигамбер Бехера
c Институт туберкулеза и респираторных заболеваний LRS, Нью-Дели, Индия
Мона Джавид
b Госпиталь Инда, Карачи, Пакистан
Жасмин Джани
d BD Diagnostic Systems Гургаон, Индия
Арора Джиоти
c Институт туберкулеза и респираторных заболеваний LRS, Нью-Дели, Индия
Радхика Махатре
e P.Национальный госпиталь Д. Хиндуджи и медицинский исследовательский центр, Мумбаи, Индия
Девананд Махто
d BD Diagnostic Systems, Гургаон, Индия
Эльвира Рихтер
f Национальный справочный центр микобактерий, Борстел, Германия
Камилла Родригес
e PD Hinduja National Hospital and Medical Research Center, Mumbai, India
Potharaju Visalakshi
c LRS Институт туберкулеза и респираторных заболеваний, Нью-Дели, Индия
Sabine Rüsch-Gerdes
f Национальный справочный центр по микобактериям Bors , Германия
a Бектон Дикинсон, Спаркс, Мэриленд, США
b Больница Инда, Карачи, Пакистан
c Институт туберкулеза и респираторных заболеваний LRS, Нью-Дели, Индия
d Диагностика B Systems, Гургаон, Индия
e P. Национальный госпиталь Д. Хиндуджа и медицинский исследовательский центр, Мумбаи, Индия
Национальный госпиталь Д. Хиндуджа и медицинский исследовательский центр, Мумбаи, Индия
f Национальный справочный центр по микобактериям, Борстел, Германия
Автор, ответственный за переписку.Поступило 29 сентября 2011 г .; Изменения запрошены 26 октября 2011 г .; Принято 29 ноября 2011 г.
Copyright © 2012, Американское общество микробиологии. Все права защищены. Эту статью цитировали в других статьях в PMC.Реферат
Обычное непрямое тестирование лекарственной чувствительности Mycobacterium tuberculosis с жидкой средой хорошо зарекомендовало себя и предлагает быстрые и надежные результаты.Это многоцентровое исследование было проведено для оценки возможности успешного проведения теста на лекарственную чувствительность (ТЛЧ) непосредственно на обработанных образцах с положительным мазком (прямое ТЛЧ) и может ли этот подход обеспечить значительную экономию времени. Образцы мокроты переваривали, обеззараживали и концентрировали в соответствии с рутинной лабораторной процедурой и инокулировали в Bactec MGIT 960, а также в среду Левенштейна-Йенсена (LJ) для первичного выделения. Все обработанные образцы, которые дали положительный мазок на кислотоустойчивые бактерии (КУБ), были использованы для настройки прямого ТЛЧ к изониазиду (INH) и рифампицину (RIF).После добавления противомикробной смеси полимиксина B, амфотерицина B, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) пробирки вводили в прибор MGIT 960, используя 21-дневный протокол (протокол пиразинамида Bactec 960 [PZA]). Результаты, полученные с помощью прямого ТЛЧ, сравнивались с результатами, полученными с помощью косвенного ТЛЧ, чтобы установить точность и экономию времени с помощью этого подхода. Из 360 образцов мокроты с положительным мазком на КУБ, подготовленных для прямого ТЛЧ в четырех центрах в трех разных странах, 307 (85%) образцов дали результаты, подлежащие регистрации.Среднее время отчетности для прямого перехода на летнее время составило 11 дней (диапазон от 10 до 12 дней). Средняя экономия времени с помощью прямого ТЛЧ по сравнению с непрямым ТЛЧ, которое включает время для выделения культуры и проведения ТЛЧ, составила 8 дней (диапазон от 6 до 9 дней).
Все обработанные образцы, которые дали положительный мазок на кислотоустойчивые бактерии (КУБ), были использованы для настройки прямого ТЛЧ к изониазиду (INH) и рифампицину (RIF).После добавления противомикробной смеси полимиксина B, амфотерицина B, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) пробирки вводили в прибор MGIT 960, используя 21-дневный протокол (протокол пиразинамида Bactec 960 [PZA]). Результаты, полученные с помощью прямого ТЛЧ, сравнивались с результатами, полученными с помощью косвенного ТЛЧ, чтобы установить точность и экономию времени с помощью этого подхода. Из 360 образцов мокроты с положительным мазком на КУБ, подготовленных для прямого ТЛЧ в четырех центрах в трех разных странах, 307 (85%) образцов дали результаты, подлежащие регистрации.Среднее время отчетности для прямого перехода на летнее время составило 11 дней (диапазон от 10 до 12 дней). Средняя экономия времени с помощью прямого ТЛЧ по сравнению с непрямым ТЛЧ, которое включает время для выделения культуры и проведения ТЛЧ, составила 8 дней (диапазон от 6 до 9 дней). Когда результаты прямого ТЛЧ сравнивали с результатами непрямого ТЛЧ, было выявлено соответствие 95,1% с INH и 96,1% с рифампицином. Эти результаты показывают, что прямое ТЛЧ с помощью системы Bactec MGIT 960 обеспечивает дополнительную экономию времени и является быстрым методом надежного выявления случаев множественной лекарственной устойчивости (МЛУ).
Когда результаты прямого ТЛЧ сравнивали с результатами непрямого ТЛЧ, было выявлено соответствие 95,1% с INH и 96,1% с рифампицином. Эти результаты показывают, что прямое ТЛЧ с помощью системы Bactec MGIT 960 обеспечивает дополнительную экономию времени и является быстрым методом надежного выявления случаев множественной лекарственной устойчивости (МЛУ).
ВВЕДЕНИЕ
По данным ВОЗ, лекарственная устойчивость туберкулеза (ТБ) является глобальной проблемой (30). Устойчивость к изониазиду (INH) и рифампицину (RIF), определяемая как множественная лекарственная устойчивость (MDR), растет во многих странах (3, 4, 31). Если эти случаи не лечить должным образом, у них может развиться устойчивость к другим лекарствам, таким как фторхинолоны и инъекционные аминогликозиды, определяемые как широкая лекарственная устойчивость (ШЛУ), и они могут, в свою очередь, инфицировать других лекарственно-устойчивым штаммом (5, 10 , 22).Для лучшего ведения случаев лекарственной устойчивости чрезвычайно важно раннее выявление устойчивости, чтобы можно было назначить эффективное лечение. Экспресс-тестирование лекарственной чувствительности играет важную роль в выявлении и борьбе с МЛУ / ШЛУ ТБ (23, 31).
Экспресс-тестирование лекарственной чувствительности играет важную роль в выявлении и борьбе с МЛУ / ШЛУ ТБ (23, 31).
Тестирование лекарственной чувствительности (ТЛЧ) Mycobacterium tuberculosis обычно проводится после выделения культуры из клинического образца. Это занимает много времени, сначала для выделения культуры, а затем для проведения теста на лекарственную чувствительность (непрямое ТЛЧ).Если бы ТЛЧ можно было настроить одновременно с инокулированием обработанного образца в твердой или жидкой среде (прямое ТЛЧ), это могло бы значительно сэкономить время для обнаружения лекарственной устойчивости.
Прямое ТЛЧ в обычной твердой среде хорошо зарекомендовало себя (9, 14, 15). Единственный недостаток — получение результатов на твердой среде занимает много времени, так как скорость роста на такой среде ниже. С введением жидкой среды Bactec 12B (Becton Dickinson Diagnostic Systems, Sparks, MD) время на сообщение результатов было значительно сокращено (13, 19, 24, 25).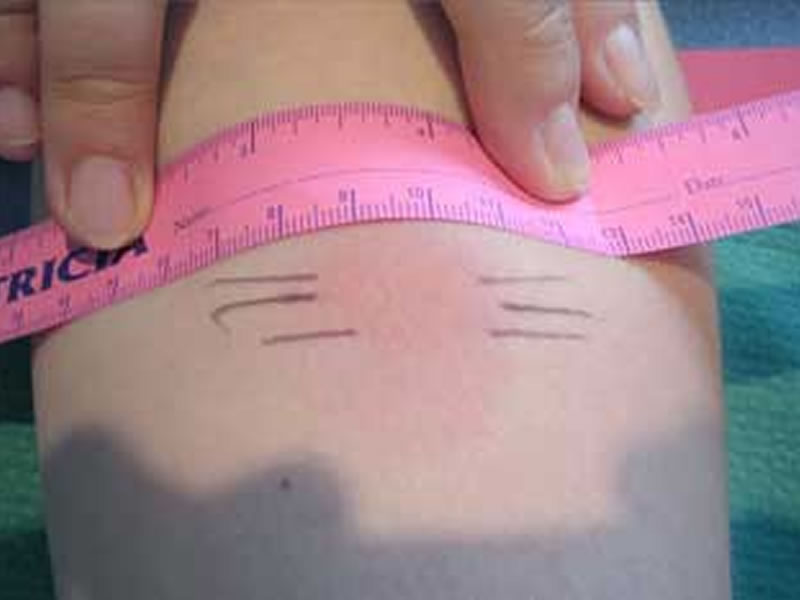 В 1993 г. CDC рекомендовал использовать жидкую среду на основании ее лучших характеристик и более ранних результатов (27). Прямое ТЛЧ с жидкой системой Bactec 460 было успешно опробовано (16). Однако использование радиометрического метода Bactec 460 постепенно прекращается из-за проблем, связанных с захоронением радиоактивных отходов. Эта система заменяется нерадиометрической системой Bactec MGIT 960 (Becton Dickinson Diagnostic Systems, Sparks, MD). Непрямая ТЛЧ хорошо известна в этой жидкой системе (1, 2, 6–8, 12, 20).В 2001 г. было опубликовано небольшое исследование с использованием ручной системы BBL MGIT по прямому ТЛЧ к INH и RIF с отличными результатами (11). В 2007 г. ВОЗ опубликовала политическое заявление с рекомендациями по использованию жидкой среды для стран с низким и средним уровнем доходов (32).
В 1993 г. CDC рекомендовал использовать жидкую среду на основании ее лучших характеристик и более ранних результатов (27). Прямое ТЛЧ с жидкой системой Bactec 460 было успешно опробовано (16). Однако использование радиометрического метода Bactec 460 постепенно прекращается из-за проблем, связанных с захоронением радиоактивных отходов. Эта система заменяется нерадиометрической системой Bactec MGIT 960 (Becton Dickinson Diagnostic Systems, Sparks, MD). Непрямая ТЛЧ хорошо известна в этой жидкой системе (1, 2, 6–8, 12, 20).В 2001 г. было опубликовано небольшое исследование с использованием ручной системы BBL MGIT по прямому ТЛЧ к INH и RIF с отличными результатами (11). В 2007 г. ВОЗ опубликовала политическое заявление с рекомендациями по использованию жидкой среды для стран с низким и средним уровнем доходов (32).
Это многоцентровое исследование было разработано, чтобы установить прямую выполнимость ТЛЧ в четырех различных клинических лабораториях с разными группами пациентов и параметрами тестов. Основная цель этого исследования заключалась в создании стандартного протокола для прямого ТЛЧ с использованием автоматизированной системы Bactec MGIT 960.Результаты сравнивались с косвенными результатами ТЛЧ, чтобы установить точность, а также экономию времени при использовании этого подхода.
Основная цель этого исследования заключалась в создании стандартного протокола для прямого ТЛЧ с использованием автоматизированной системы Bactec MGIT 960.Результаты сравнивались с косвенными результатами ТЛЧ, чтобы установить точность, а также экономию времени при использовании этого подхода.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования.
Это исследование проводилось в четырех разных центрах в трех странах: (i) участок 1, P.D. Национальная больница и медицинский исследовательский центр Хиндуджа, больница третичного уровня, Мумбаи, Индия; (ii) участок 2, Институт туберкулеза и болезней легких LRS, специализированная противотуберкулезная больница и национальная справочная лаборатория (NRL), Нью-Дели, Индия; (iii) участок 3, больница Инда, благотворительная больница общего профиля, специализирующаяся на туберкулезе, особенно лечении МЛУ, Карачи, Пакистан; (iv) участок 4, Национальный справочный центр микобактерий, национальный центр (с доступом к клиническим образцам из районов с высокой эндемичностью по МЛУ в других странах), Борстель, Германия.
Образцы.
В это исследование были включены только образцы мокроты от пациентов с серьезным подозрением на туберкулез, а также от пациентов с хроническими заболеваниями, особенно от тех, у которых предполагается наличие МЛУ-ТБ. В исследование были включены образцы, которые оказались положительными по мазку на кислотоустойчивые бактерии (КУБ) независимо от степени положительного результата мазка. Образцы мокроты доставлялись в лабораторию с минимальной задержкой и охлаждались, если обработка не проводилась немедленно.
Обработка образцов.
Все образцы были обработаны в соответствии со стандартным методом NALC-NaOH для разложения, обеззараживания и концентрирования (14, 26). Концентрированный осадок ресуспендировали примерно в 2-3 мл фосфатного буфера (pH 6,8) и тщательно перемешивали. Был приготовлен мазок для кислотостойкого окрашивания, и культуральные среды были засеяны в соответствии с лабораторной стандартной процедурой первичного выделения. Было обеспечено, чтобы для прямого ТЛЧ оставалось чуть более 1 мл суспензии.
Мазки AFB.
Все мазки окрашивали методами Циля-Нильсена и / или флуорохромами. Оценка мазков проводилась в соответствии с рекомендациями ВОЗ (28) и основывалась на количестве AFB, обнаруженных во время обследования. Мазки были оценены как скудные (от 1 до 9 AFB / 100 полей), 1+ (от 10 до 99/100 полей), 2+ (от 1 до 10 AFB / поле) или 3+ (более 10 AFB / поле). Две лаборатории не имели категории «скудные» в своей системе оценок (эти мазки были включены в категорию 1+).
Посев питательных сред для первичного выделения.
Все четыре предприятия использовали систему Bactec MGIT 960 для жидкости, а для твердой среды использовали один уклон Левенштейна-Йенсена (LJ). Эти среды были засеяны в соответствии с установленной стандартной операционной процедурой (СОП) отдельной лаборатории. Для среды MGIT соблюдались стандартные рекомендуемые процедуры (рекомендации производителя и руководство MGIT от FIND [26]). После подготовки мазков и посевов для посева оставшуюся часть образца немедленно охлаждали до температуры от 2 ° C до 8 ° C и использовали для настройки прямого ТЛЧ, как только были получены результаты мазка.
Прямая процедура перехода на летнее время.
Было три основных различия в процедуре прямого ТЛЧ по сравнению со стандартной процедурой непрямого ТЛЧ для MGIT 960: (i) прямое ТЛЧ было протоколом от 4 до 21 дня, в то время как непрямое ТЛЧ было протоколом от 4 до 13 дней. ; (ii) контроль был разбавлен 1:10 при прямом ТЛЧ, тогда как при непрямом ТЛЧ он был разбавлен 1: 100; (iii) при прямом ТЛЧ к контролю добавляли противомикробную смесь полимиксина B, амфотерицина B, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) (Becton Dickinson Diagnostic Systems, Sparks, MD), а также в лекарственное средство — содержащие пробирки MGIT для подавления загрязнения.
Все среды и другие реагенты были такими же, как те, которые использовались в рутинной непрямой ТЛЧ: среда MGIT (7 мл пробирки MGIT со штрих-кодом), добавка SIRE для ТЛЧ и лиофилизированные препараты Bactec MGIT INH и RIF (Becton Dickinson Системы диагностики, Искры, МД).
Перед установкой прямого ТЛЧ лиофилизированный PANTA восстанавливали с использованием 15 мл добавки SIRE (не добавки для роста) (Becton Dickinson Diagnostic Systems, Sparks, MD) и хорошо перемешивали до полного растворения.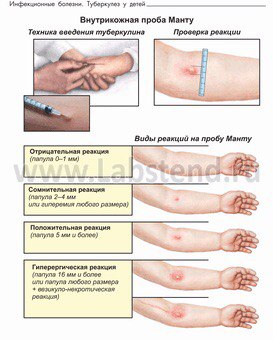 Флаконы с лекарственными препаратами (лиофилизированные препараты, такие же, как те, которые используются в непрямом ТЛЧ MGIT) с INH и RIF восстанавливали 4 мл стерильной деионизированной (DI) воды и хорошо перемешивали. Для каждого образца были подготовлены наборы из четырех пробирок MGIT для проведения прямого ТЛЧ. Две пробирки были помечены как «контроль роста» (GC), одна для INH, а другая для RIF. Третья пробирка была маркирована «INH», а четвертая — «RIF».
Флаконы с лекарственными препаратами (лиофилизированные препараты, такие же, как те, которые используются в непрямом ТЛЧ MGIT) с INH и RIF восстанавливали 4 мл стерильной деионизированной (DI) воды и хорошо перемешивали. Для каждого образца были подготовлены наборы из четырех пробирок MGIT для проведения прямого ТЛЧ. Две пробирки были помечены как «контроль роста» (GC), одна для INH, а другая для RIF. Третья пробирка была маркирована «INH», а четвертая — «RIF».
После растворения 0,8 мл смеси добавок PANTA-SIRE добавляли в каждую из четырех промаркированных пробирок MGIT.Следующим шагом было добавление лекарств. В пробирку с INH-меткой добавляли 0,1 мл восстановленного лиофилизированного лекарственного средства INH (конечная концентрация 0,1 мкг / мл). Аналогичным образом 0,1 мл восстановленного RIF добавляли в пробирку с меткой RIF (1,0 мкг / мл). Эти концентрации были такими же, как и при непрямой процедуре ТЛЧ (вкладыш в упаковке [26]). После перемешивания среды 0,5 мл хорошо перемешанного восстановленного осадка вносили в каждую из двух пробирок, содержащих лекарственное средство.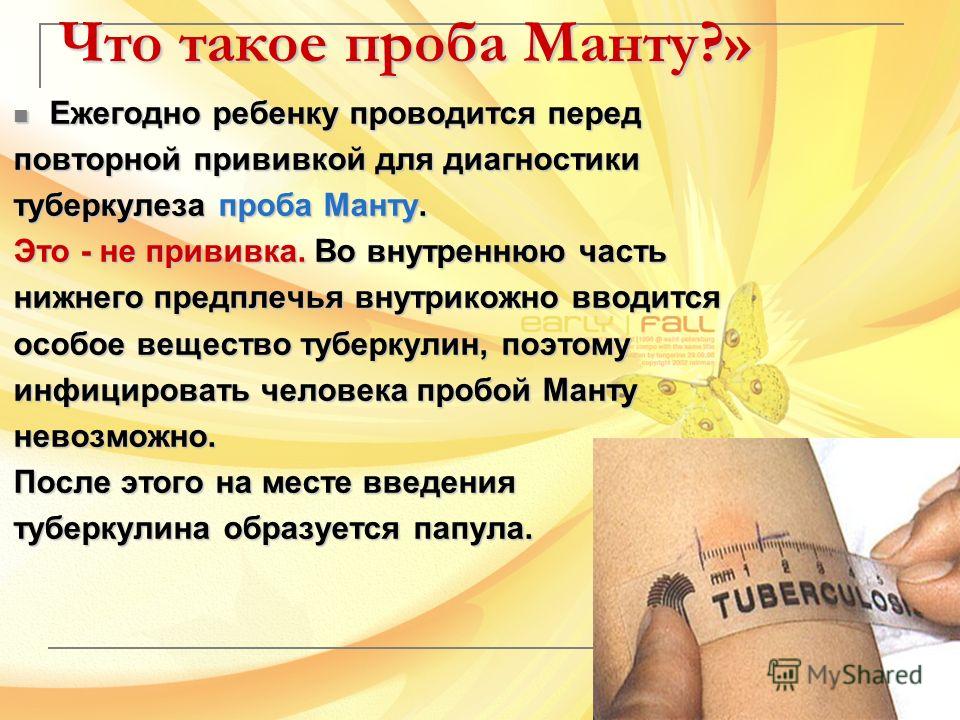 Для контроля ресуспендированный осадок разбавляли 1:10 путем добавления 0.2 мл хорошо перемешанного осадка в 1,8 мл стерильного физиологического раствора или воды. После тщательного перемешивания в каждую из двух пробирок для ГХ вносили по 0,5 мл. Пробирки снова перемешивали, несколько раз переворачивая.
Для контроля ресуспендированный осадок разбавляли 1:10 путем добавления 0.2 мл хорошо перемешанного осадка в 1,8 мл стерильного физиологического раствора или воды. После тщательного перемешивания в каждую из двух пробирок для ГХ вносили по 0,5 мл. Пробирки снова перемешивали, несколько раз переворачивая.
Для прямого перехода на летнее время использовался расширенный протокол, который обычно используется для непрямой настройки летнего времени PZA, поскольку прямое летнее время требует 21-дневного протокола для завершения теста (18, 26). Использовались два двухтрубных держателя набора DST. Пробирки с контролем роста и INH помещали в один набор носителей (GC и INH), а пробирки с контролем роста и RIF помещали в другой набор носителей (GC и RIF).Эти держатели набора были введены в прибор как тест PZA. Первой трубкой в держателе набора всегда была контрольная.
На одном сайте применялся другой подход к работе с 21-дневным протоколом. Во втором варианте прямого перехода на летнее время процедуры были такими же, за исключением того, что использовался только один сборщик мусора. Пробирки для ГХ и INH помещали в один держатель с двумя пробирками и вводили как PZA DST. Пробирку RIF вводили как обычную пробирку для роста (42-дневный протокол) и помещали рядом с держателем набора INH.
Пробирки для ГХ и INH помещали в один держатель с двумя пробирками и вводили как PZA DST. Пробирку RIF вводили как обычную пробирку для роста (42-дневный протокол) и помещали рядом с держателем набора INH.
Техника безопасности.
На всех четырех площадках есть хорошо оборудованные лаборатории BSL III. При обработке образцов, посевах и ТЛЧ соблюдались стандартные меры безопасности (29).
Интерпретация результатов прямого тестирования лекарственной чувствительности.
Когда ГХ достиг значения 400 единиц роста (GU) или более, прибор показал, что тест завершен, набор чувствительности был удален после сканирования, и был напечатан отчет об инвентаризации. Результаты чувствительности для INH и RIF (в первом варианте) интерпретировались прибором как «S» или «R.В то время, когда значение GU GC составляло 400 или более, и если значение GU трубки с лекарством было меньше 100, результат теста сообщался как «чувствительный», в то время как если значение GU трубки с лекарством было 100 или Более того, результат был интерпретирован как «стойкий». Были получены и записаны значения GU обоих наборов DST. В случае, если значение GU для контроля не достигало 400 в течение 21 дня, прибор показывал ошибку X200, указывающую на недостаточный рост. С другой стороны, если GU достигло 400 раньше, чем на 4-й день, прибор выдает ошибку X400, указывая на контаминацию или чрезмерную инокуляцию.
Были получены и записаны значения GU обоих наборов DST. В случае, если значение GU для контроля не достигало 400 в течение 21 дня, прибор показывал ошибку X200, указывающую на недостаточный рост. С другой стороны, если GU достигло 400 раньше, чем на 4-й день, прибор выдает ошибку X400, указывая на контаминацию или чрезмерную инокуляцию.
Во втором варианте пробирки ГХ и INH извлекались, когда прибор показывал, что тест завершен и результаты получены. Были получены значения GU набора INH. Поскольку пробирка RIF инкубировалась в системе отдельно как обычная пробирка для роста, прибор не интерпретировал результаты. На этом этапе значение GU трубки RIF также было получено путем распечатки отчета об инвентаризации прибора. Результаты были интерпретированы вручную в соответствии с указанными выше критериями.
Для расчета времени, необходимого для получения прямых результатов DST, было записано время, которое потребовалось прибору для завершения теста DST. Поскольку прибор показывает время в часах, любое время, равное половине дня или более, принималось за полный день.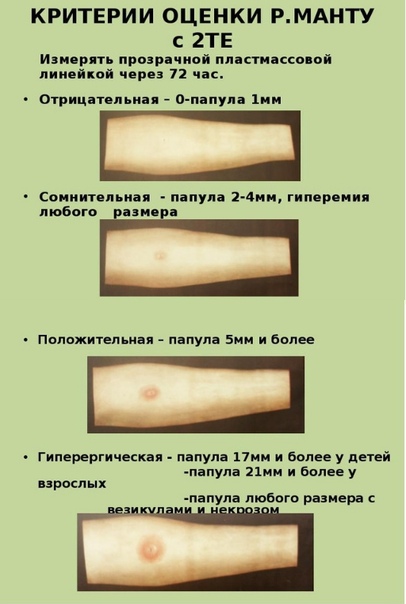
Эталонный метод: непрямое тестирование лекарственной чувствительности.
Следили за первичными изоляционными трубками образцов, включенных в исследование. После того, как инокулированный образец оказался положительным по культуре в MGIT и подтвердил наличие чистой культуры M.tuberculosis , непрямое ТЛЧ было установлено в соответствии с процедурами, рекомендованными производителем для системы MGIT 960. Результаты непрямого ТЛЧ и время, необходимое для завершения теста, извлекались из прибора и записывались.
Для расчета времени, необходимого для регистрации непрямых результатов ТЛЧ для образца, для получения общего времени было добавлено время получения положительной культуры плюс время получения косвенных результатов ТЛЧ. Поскольку косвенное летнее время устанавливается через 1–5 дней после того, как прибор дает положительный сигнал, к общему времени было добавлено дополнительно 2 дня.Иногда ТЛЧ не устанавливали в течение 5 дней после получения положительного результата посева в MGIT, и требовалось субкультивирование. На этот раз документально не зафиксировано. Время, необходимое для непрямого ТЛЧ, сравнивали со временем, требуемым для прямого ТЛЧ того же образца. Разница считалась экономией времени.
На этот раз документально не зафиксировано. Время, необходимое для непрямого ТЛЧ, сравнивали со временем, требуемым для прямого ТЛЧ того же образца. Разница считалась экономией времени.
На участке 4 рутинное непрямое ТЛЧ также проводилось на среде LJ, но результаты не были включены в этот анализ.
Идентификация выделенных микобактерий.
Метод MGIT 960 DST рекомендуется для M.tuberculosis , и поэтому изолированные микобактерии из образцов с положительной культурой были идентифицированы с использованием стандартного метода, используемого в лабораториях для идентификации M. tuberculosis . В это исследование были включены только те культуры, которые подтверждены как M. tuberculosis . Прямые результаты ТЛЧ для тех образцов, которые были заражены или в которых была микобактерия, отличная от M. tuberculosis , были исключены.
Проверка несоответствия.
Образцы, показавшие несовпадающие результаты между прямым и косвенным методами, были повторно протестированы путем повторения косвенного метода. Если результаты второго тестирования были такими же, как и первые косвенные результаты, результаты прямой восприимчивости считались несоответствующими. Если результаты повторного тестирования не соответствовали предыдущим косвенным результатам и соответствовали прямым результатам, то результаты считались правильными.
Если результаты второго тестирования были такими же, как и первые косвенные результаты, результаты прямой восприимчивости считались несоответствующими. Если результаты повторного тестирования не соответствовали предыдущим косвенным результатам и соответствовали прямым результатам, то результаты считались правильными.
Контроль качества.
M. tuberculosis штамм h47Rv (ATCC 27294) использовали для тестирования контроля качества (QC) при ТЛЧ. Этот штамм вводили каждый раз, когда устанавливали партию ТЛЧ, или как каждый 6-й изолят в прогоне.Если наблюдалась какая-либо устойчивость в штамме QC, все остальные результаты в этой партии считались недействительными.
РЕЗУЛЬТАТЫ
Из 360 обработанных образцов 307 (85%) результатов ТЛЧ подлежали регистрации (). Большинство из тех, о которых не сообщалось, были те, в которых контроль не достиг необходимого порога (ошибка X200), в то время как некоторые были загрязнены (ошибка X400). На участке 1 обработано 126 образцов мокроты и получено 113 результатов (90%), на участке 2 обработано 122 образца и получено 103 результата (84%), на участке 3 обработано 74 образца и получено 58 результатов (84%), а на участке 4 — 33 результата, подлежащих регистрации.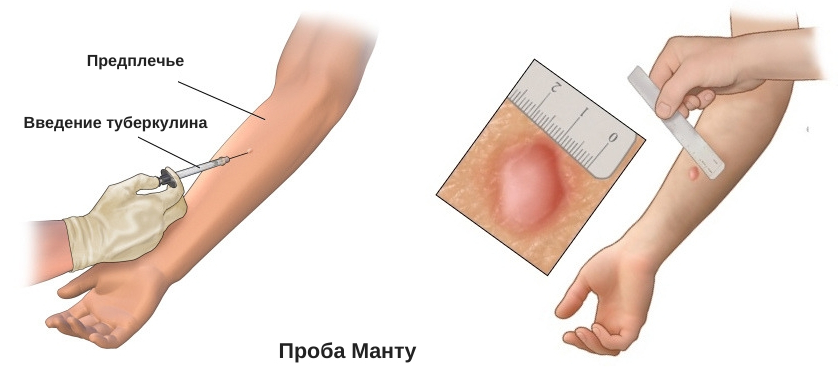 из 38 обработанных образцов (87%).Образцы, которые были отрицательными для посева, были загрязнены или имели нетуберкулезные микобактерии (NTM), были исключены для расчета результатов, подлежащих регистрации. Всего было 15 образцов, которые имели контаминацию, 8 были идентифицированы как NTM, 19 имели ошибку X200 и 5 имели ошибку X400.
из 38 обработанных образцов (87%).Образцы, которые были отрицательными для посева, были загрязнены или имели нетуберкулезные микобактерии (NTM), были исключены для расчета результатов, подлежащих регистрации. Всего было 15 образцов, которые имели контаминацию, 8 были идентифицированы как NTM, 19 имели ошибку X200 и 5 имели ошибку X400.
Таблица 1
Общий итог испытаний
| Участок a | Число настроенных испытаний | Число отчетных результатов |
|---|---|---|
| 126 | ||
| 126 | 113||
| 2 | 122 | 103 |
| 3 | 74 | 58 |
| 4 | 38 | 33 |
| Всего |
Время представления результатов положительных культур было проанализировано в соответствии со степенью положительности мазка на КУБ (). Большинство образцов были 2–3+ положительными мазками на всех участках. Время до обнаружения положительного результата посева существенно не различалось для разных классов мазков. В целом, посевы были положительными в среднем через 8 дней с диапазоном от 8 до 10 дней.
Большинство образцов были 2–3+ положительными мазками на всех участках. Время до обнаружения положительного результата посева существенно не различалось для разных классов мазков. В целом, посевы были положительными в среднем через 8 дней с диапазоном от 8 до 10 дней.
Таблица 2
Время обнаружения MGIT-положительных культур
| Оценка мазка по участкам | Количество образцов, получивших положительный результат через несколько дней: | Общее количество образцов оказались положительными | Среднее время обнаружения (кол.дней) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3–7 | 8–14 | 15–21 | > 21 | ||||||||
| Участок 1 | 902 | 4 | 6 | 1 | 0 | 11 | 9 | ||||
| 1+ | 14 | 7 | 3 | 0 | 24 | ||||||
| 9 902 | 14 | 1 | 0 | 29 | 8 | ||||||
| 3+ | 45 | 3 | 1 | 0 | 49 | 6 | 6 | 0 | 113 | 8 | |
| Сайт 2 | Скудный | 0 | 0 | 0 | 0 | 0 | 0 | ||||
| 1+ | 10 | 18 | 4 | 0 | + | 17 | 11 | 2 | 0 | 30 | 8 |
| 3+ | 35 | 6 | 0 | 0 | 41 | 35 | 6 | 0 | 103 | 8 | |
| Сайт 3 | |||||||||||
| 0 | 0 | ||||||||||
| 1+ | 8 | 15 | 3 | 0 | 26 | 10 9026 4 | |||||
| 2+ | 4 | 1 | 1 | 0 | 6 | 8 | |||||
| 3+ | 21 | 3 | 1 | 1 | 1 | 1 | |||||
| Итого | 33 | 19 | 5 | 1 | 58 | 8 | |||||
| Участок 4 | 9026 4 | 1 | 0 | 6 | 12 | ||||||
| 1+ | 1 | 6 | 0 | 1 | 8 | 12 | |||||
| 1 | 0 | 6 | 11 | ||||||||
| 3+ | 10 | 3 | 0 | 0 | 13 | 7 9 0264 | |||||
| Всего | 14 | 16 | 2 | 1 | 33 | 10 | |||||
Время до завершения прямого ТЛЧ обработанных образцов было рассчитано в соответствии с категориями положительных мазков (). Не было значительной разницы между временем получения прямых результатов ТЛЧ в разных категориях с положительным мазком. Большинство результатов были готовы в течение 8–14 дней, при этом в среднем 10 дней на участке 1, 11 дней на участках 2 и 3 и 12 дней на участке 4.
Не было значительной разницы между временем получения прямых результатов ТЛЧ в разных категориях с положительным мазком. Большинство результатов были готовы в течение 8–14 дней, при этом в среднем 10 дней на участке 1, 11 дней на участках 2 и 3 и 12 дней на участке 4.
Таблица 3
Время сообщить о прямой чувствительности к лекарствам результаты обработанных образцов
| Мазок (кол-во образцов) | Кол-во тестов через дни: | Среднее время обнаружения (кол-во образцов)дней) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 3–7 | 8–14 | 15–21 | |||||||
| Скудный (11) | 1 | 7 | 3 | 12 | 1 9024 + ) | 0 | 20 | 4 | 12 |
| 2+ (29) | 2 | 21 | 6 | 11 | |||||
| 3+ (49) 902 902 | 0 | 8 | |||||||
| Среднее время обнаружения всего | 10 | ||||||||
| Участок 2 | |||||||||
| 0 | 0 | ||||||||
| 1+ (32) | 3 | 21 | 8 | 13 | |||||
| 2+ (30) | 3 | 23 | 4 | 3 11||||||
| 3+ (41) | 17 | 21 | 3 | 9 | |||||
| Среднее время обнаружения всего | 11 | ||||||||
| Скудный | 0 | 0 | 0 | 0 | |||||
| 1+ (26) | 3 | 13 1024 902 | 2 | 4 | 0 | 9 | |||
| 3+ (26) | 8 | 16 | 2 | 10 | |||||
| Среднее время до обнаружения всего | 11 | ||||||||
| Участок 4 | |||||||||
| Скудный (6) | 0 | 4 | 90 263 215 | ||||||
| 1+ (8) | 0 | 3 | 5 | 14 | |||||
| 2+ (6) | 0 | 6 | |||||||
| 0 | 3+ (13) | 1 | 11 | 1 | 10 | ||||
| Среднее время обнаружения всего | 12 | ||||||||
 Среднее время для сообщения о непрямом ТЛЧ от изолированной культуры варьировалось от 6 дней (участок 4) до 10 дней (участок 2).
Среднее время для сообщения о непрямом ТЛЧ от изолированной культуры варьировалось от 6 дней (участок 4) до 10 дней (участок 2).Таблица 4
Время представить результаты испытаний на непрямую чувствительность из изолированных культур a
| Участок | Количество тестов с отчетными результатами через несколько дней: | Среднее время для отчета ( кол-во дней) | ||||
|---|---|---|---|---|---|---|
| 4–7 | 8–13 | |||||
| 1 | 27 | 86 | 8 | |||
| 2 | 872646 | 3 | 18 | 40 | 9 | |
| 4 | 30 | 3 | 6 | |||
Общее время, необходимое с момента обработки образца до момента получения косвенных результатов ТЛЧ входит в.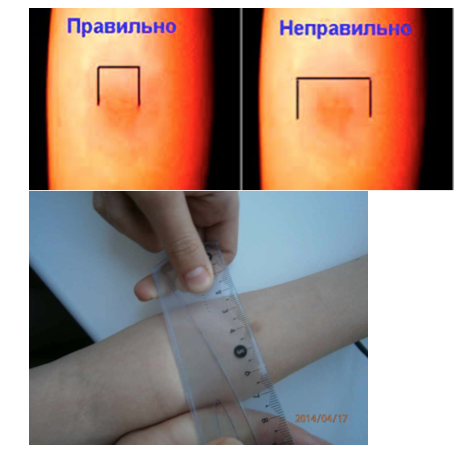 Он составлял от 18 до 20 дней.
Он составлял от 18 до 20 дней.
Таблица 6
Экономия времени за счет тестирования прямой чувствительности на обработанных образцах
| Участок | Среднее время для отчета (дни) | Экономия времени (кол-во дней) | |
|---|---|---|---|
| Косвенная a | Прямой | ||
| 1 | 18 | 10 | 8 |
| 2 | 20 | 11 | 9|
| 11 | 9|||
| 4 | 18 | 12 | 6 |
| Все сайты | 19 | 11 | 8 |
Были проанализированы противоречивые результаты всех прямых тестов DST доступный (). Из 113 образцов, представленных центром 1, было 5 образцов, которые показали противоречивые результаты между прямыми и непрямыми методами для INH (4,4%): три результата были зарегистрированы как ложноустойчивые, а два результата — как ложно восприимчивые. Для RIF было три несоответствующих результата (2,7%), два из которых были ложно восприимчивыми, а один — ложно устойчивым к RIF. На участке 2 из 103 образцов три показали противоречивые результаты по INH (2,9%), причем все они были ложно чувствительными. Также для RIF было всего три несовпадающих результата (2.9%): два ложноустойчивых и один ложноустойчивый. В сайте 3 из 58 тестов на INH (10,3%) были получены несовпадающие результаты, четыре из которых были ложно-устойчивыми, а два — ложно-чувствительными. Для RIF было пять несовпадающих результатов (8,6%), два из которых были ложно-устойчивыми, а три — ложно-чувствительными. В центре 4 из 33 тестов было только одно (3,0%) ложноустойчивое к INH и одно (3,0%) ложно-чувствительное к RIF.
Из 113 образцов, представленных центром 1, было 5 образцов, которые показали противоречивые результаты между прямыми и непрямыми методами для INH (4,4%): три результата были зарегистрированы как ложноустойчивые, а два результата — как ложно восприимчивые. Для RIF было три несоответствующих результата (2,7%), два из которых были ложно восприимчивыми, а один — ложно устойчивым к RIF. На участке 2 из 103 образцов три показали противоречивые результаты по INH (2,9%), причем все они были ложно чувствительными. Также для RIF было всего три несовпадающих результата (2.9%): два ложноустойчивых и один ложноустойчивый. В сайте 3 из 58 тестов на INH (10,3%) были получены несовпадающие результаты, четыре из которых были ложно-устойчивыми, а два — ложно-чувствительными. Для RIF было пять несовпадающих результатов (8,6%), два из которых были ложно-устойчивыми, а три — ложно-чувствительными. В центре 4 из 33 тестов было только одно (3,0%) ложноустойчивое к INH и одно (3,0%) ложно-чувствительное к RIF. Таким образом, общее расхождение результатов для INH и 3,9% для RIF по всем сайтам составило 4,9%.
Таким образом, общее расхождение результатов для INH и 3,9% для RIF по всем сайтам составило 4,9%.
Таблица 5
Несоответствие результатов прямого и косвенного методов ТЛЧ
| Участок (общее кол.испытаний) | Кол-во (%) образцов | |||||
|---|---|---|---|---|---|---|
| INH | RIF | |||||
| Ложь S | Ложь R | Всего | Ложь S | Ложь R | ||
| 1 (113) | 2 (1,8) | 3 (2,7) | 2 (1,8) | 1 (0,9) | ||
| 2 (103) | 3 (2,9) | 0 | 1 (1) | 2 (1. 9) 9) | ||
| 3 (58) | 2 (3,4) | 4 (7) | 3 (5,2) | 2 (3,4) | ||
| 4 (33) | 01 (3) | 1 (3) | 0 | |||
| Всего (307) | 7 (2,3) | 8 (2,6) | 15 (4,9) | 7 ( 2.5) | 5 (1.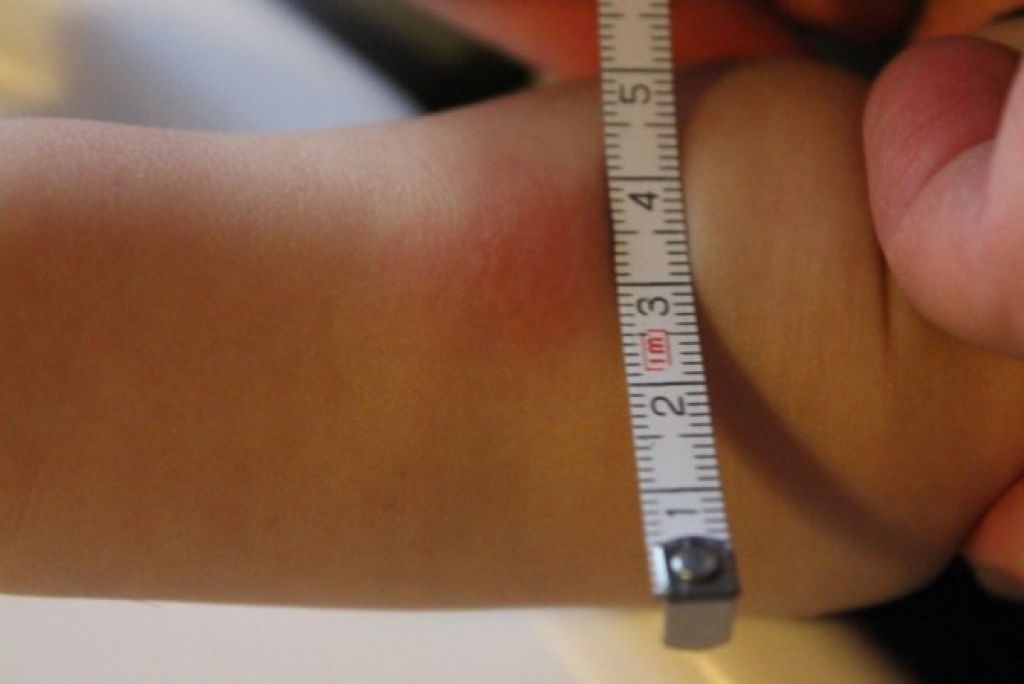 6) 6) | 12 (3.9) |
Результаты экономии времени за счет прямого перехода на летнее время приведены в.Общая экономия времени составила 8 дней, от 6 до 9 дней для всех сайтов.
Для контроля качества был настроен h47Rv вместе с прямыми и косвенными партиями DST. Ни в одном учреждении не было ни одного случая, когда h47 Rv не давал ожидаемых результатов.
ОБСУЖДЕНИЕ
Результаты, полученные с помощью обычных методов непрямого тестирования чувствительности, особенно с твердой средой, становятся доступными слишком поздно, чтобы повлиять на своевременное решение о ведении пациента. Следовательно, необходимы более быстрые тесты на чувствительность к туберкулезу, непосредственно применяемые к клиническим образцам.Некоторые из некоммерчески доступных прямых тестов включают анализ нитратредуктазы (NRA) и анализ чувствительности к лекарствам под микроскопом (MODS). Эти тесты были разработаны как «внутренние» анализы с целью преодоления высокой стоимости коммерчески доступных методов. В NRA добавление реагента NRA требует регулярного открытия пробирок, что создает значительный риск образования аэрозоля. Чтение планшетов MODS необходимо выполнять ежедневно, это трудоемко и требует много времени (34).Коммерчески доступные молекулярные анализы, такие как Genotype MTBDR Plus (Hain Lifescience, Нерен, Германия), можно применять непосредственно к образцам с положительным мазком, и они требуют меньше времени на обработку, что позволяет сэкономить несколько недель. Однако ни один из установленных молекулярных тестов не нацелен на все возможные гены, участвующие в устойчивости, и, таким образом, различная доля устойчивых штаммов может не быть обнаружена (17, 33). Жидкая культура признана золотым стандартом и является наиболее быстрой для фенотипической ТЛЧ. Это исследование было направлено на установление экономии времени при использовании прямого подхода к ТЛЧ по сравнению с рутинным непрямым подходом в жидкой среде, поэтому молекулярное тестирование не было включено в исследование.
В NRA добавление реагента NRA требует регулярного открытия пробирок, что создает значительный риск образования аэрозоля. Чтение планшетов MODS необходимо выполнять ежедневно, это трудоемко и требует много времени (34).Коммерчески доступные молекулярные анализы, такие как Genotype MTBDR Plus (Hain Lifescience, Нерен, Германия), можно применять непосредственно к образцам с положительным мазком, и они требуют меньше времени на обработку, что позволяет сэкономить несколько недель. Однако ни один из установленных молекулярных тестов не нацелен на все возможные гены, участвующие в устойчивости, и, таким образом, различная доля устойчивых штаммов может не быть обнаружена (17, 33). Жидкая культура признана золотым стандартом и является наиболее быстрой для фенотипической ТЛЧ. Это исследование было направлено на установление экономии времени при использовании прямого подхода к ТЛЧ по сравнению с рутинным непрямым подходом в жидкой среде, поэтому молекулярное тестирование не было включено в исследование.
Жидкая культура предлагает более чувствительный и быстрый метод выделения M. tuberculosis и проведения тестов на чувствительность к различным противотуберкулезным препаратам первого и второго ряда (13, 21). Однако большинство исследований ТЛЧ проводилось обычным непрямым методом с использованием изолированных культур. Это первое крупномасштабное многоцентровое исследование, посвященное оценке прямой чувствительности M. tuberculosis на клинических образцах с использованием автоматизированной системы жидких культур MGIT 960.
Поскольку туберкулез с множественной лекарственной устойчивостью является одной из основных проблем в программе борьбы с туберкулезом, а результаты ТЛЧ играют важную роль в борьбе с туберкулезом, мы сосредоточились на прямом ТЛЧ только к двум препаратам: изониазиду и рифу. Это не означает, что этот подход применим только к этим двум противомикробным препаратам. Ожидается, что это исследование может стать руководством для быстрого прямого ТЛЧ на основе бульонов к другим противотуберкулезным препаратам первого и второго ряда, что особенно поможет, если у пациента есть подозрение на устойчивость к этим препаратам.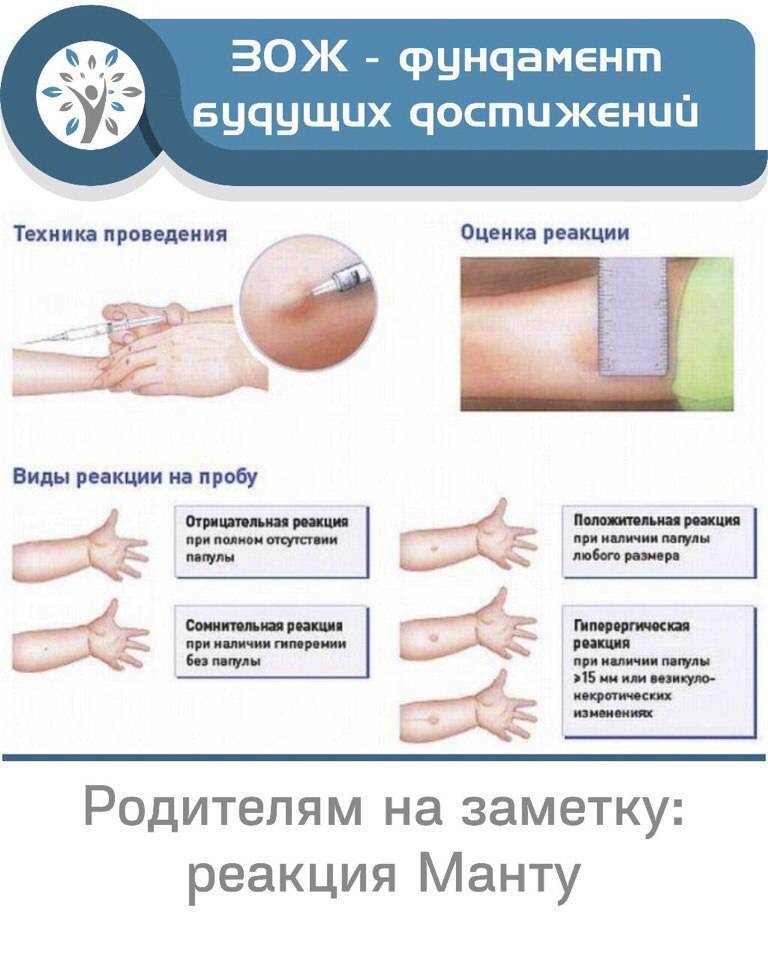
Одной из основных проблем было выполнение прямого перехода на летнее время. Ранее было установлено, что для прямого ТЛЧ с использованием жидкой среды продолжительность протокола теста должна быть увеличена с 14 дней до 21 дня, поскольку M. tuberculosis , присутствующий в клиническом образце, не растет так быстро, как в клиническом образце. изолированная культура (16). В предлагаемом протоколе прямое ТЛЧ проводится для образца с положительным мазком AFB с любой степенью положительного мазка при любой процедуре окрашивания; таким образом, в некоторых случаях количество бактерий, присутствующих в посевном материале, невелико, и для достижения необходимого уровня роста или GU может потребоваться более 14 дней.Процедура непрямого ТЛЧ MGIT 960 разработана с протоколом от 4 до 13 дней, за исключением ТЛЧ PZA, которое представляет собой тест от 4 до 21 дня. Однако тест PZA разработан только для двухтрубной системы. Мы попробовали несколько различных подходов к рабочему процессу, чтобы добиться результатов с 21-дневным протоколом.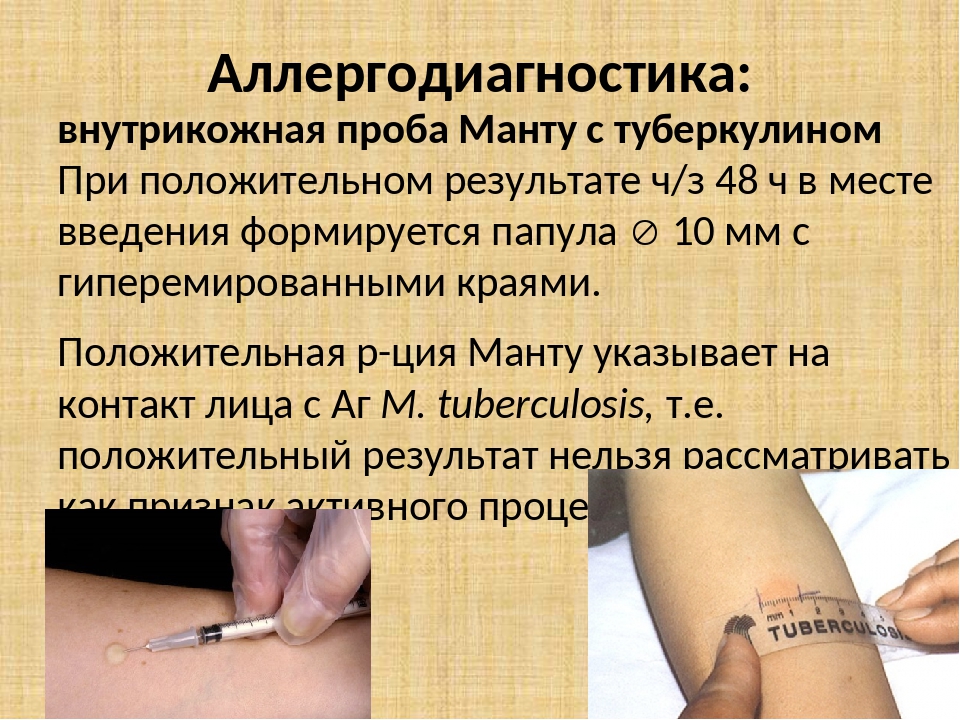 Первый подход заключался в том, чтобы установить для каждого препарата свой собственный контроль, а затем ввести его в прибор в держателе набора из двух пробирок в качестве теста PZA. Это простая, понятная и предпочтительная процедура, и прибор автоматически интерпретирует результаты.Однако некоторые исследователи считали этот подход дорогостоящим, поскольку для каждого препарата необходим контроль, что означает необходимость в большем количестве пробирок MGIT. Чтобы снизить стоимость, мы придумали другой подход, при котором первый препарат, в данном случае контроль роста и INH, вводится в прибор с протоколом PZA. Другая пробирка с лекарственным средством, а именно RIF, вводится в прибор как пробирка для роста, а не пробирка DST. Пробирка помещается в тот же ящик рядом с пробирками INH DST. Когда набор INH готов (GU контроля достигает 400 или более), прибор отмечает его как завершенный и интерпретирует результаты как «S» или «R.В это время значения GU для пробирки RIF извлекаются путем запроса инвентарных значений GU для инкубируемых пробирок в приборе, а затем записывается значение GU для пробирки RIF.
Первый подход заключался в том, чтобы установить для каждого препарата свой собственный контроль, а затем ввести его в прибор в держателе набора из двух пробирок в качестве теста PZA. Это простая, понятная и предпочтительная процедура, и прибор автоматически интерпретирует результаты.Однако некоторые исследователи считали этот подход дорогостоящим, поскольку для каждого препарата необходим контроль, что означает необходимость в большем количестве пробирок MGIT. Чтобы снизить стоимость, мы придумали другой подход, при котором первый препарат, в данном случае контроль роста и INH, вводится в прибор с протоколом PZA. Другая пробирка с лекарственным средством, а именно RIF, вводится в прибор как пробирка для роста, а не пробирка DST. Пробирка помещается в тот же ящик рядом с пробирками INH DST. Когда набор INH готов (GU контроля достигает 400 или более), прибор отмечает его как завершенный и интерпретирует результаты как «S» или «R.В это время значения GU для пробирки RIF извлекаются путем запроса инвентарных значений GU для инкубируемых пробирок в приборе, а затем записывается значение GU для пробирки RIF.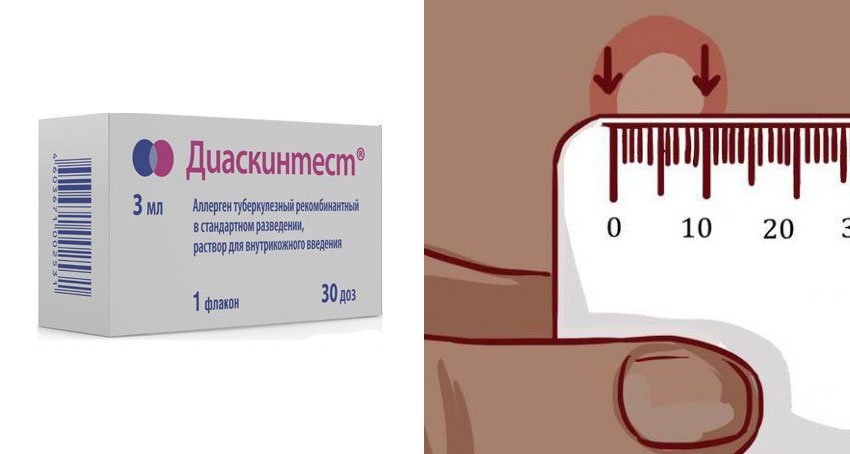 Это делается путем печати отчета об инвентаризации без сканирования трубки из прибора перед печатью, поскольку значения GU могут быть потеряны. В случае, если сложно разместить одну пробирку в выдвижном ящике, есть еще одна возможность поместить эту пробирку RIF в держатель для двух пробирок DST, поместив сначала пустую пробирку со средой MGIT в качестве контроля роста, а затем пробирку RIF.Этот установленный носитель вводится в прибор как PZA DST и помещается рядом с установленным INH. Поскольку управление не инокулируется, эта установленная несущая должна быть удалена одновременно с установленной несущей INH. Значения GU извлекаются и записываются перед сканированием этого второго набора носителей; в противном случае значения GU будут потеряны. Интерпретация RIF DST выполняется вручную на основе формулы, приведенной в предыдущем разделе. Незасеянную пробирку для контроля роста можно использовать снова и снова. Вышеописанная процедура может применяться для любого и любого количества лекарств, которое необходимо.
Это делается путем печати отчета об инвентаризации без сканирования трубки из прибора перед печатью, поскольку значения GU могут быть потеряны. В случае, если сложно разместить одну пробирку в выдвижном ящике, есть еще одна возможность поместить эту пробирку RIF в держатель для двух пробирок DST, поместив сначала пустую пробирку со средой MGIT в качестве контроля роста, а затем пробирку RIF.Этот установленный носитель вводится в прибор как PZA DST и помещается рядом с установленным INH. Поскольку управление не инокулируется, эта установленная несущая должна быть удалена одновременно с установленной несущей INH. Значения GU извлекаются и записываются перед сканированием этого второго набора носителей; в противном случае значения GU будут потеряны. Интерпретация RIF DST выполняется вручную на основе формулы, приведенной в предыдущем разделе. Незасеянную пробирку для контроля роста можно использовать снова и снова. Вышеописанная процедура может применяться для любого и любого количества лекарств, которое необходимо.
Это исследование проводилось в хорошо зарекомендовавших себя лабораториях. Показатель положительного результата посева образцов с положительным мазком был очень высоким (более 95%), с приемлемыми показателями контаминации (от 4 до 8%) и очень низкой распространенностью НТМ. Общий показатель успешности ТЛЧ к препаратам с положительным мазком составил 85%. Это означает, что только от 10 до 15% от общего числа настроек DST было невозможно интерпретировать из-за нескольких причин, таких как загрязнение или наличие NTM (ошибки X400) или отсутствие роста или недостаточный рост в контроле (ошибки X200).Некоторые из них, несмотря на положительный результат мазка на КУБ (даже 3+), либо не вырастали в пробирке для первичной изоляции и были отрицательными на культуре, либо роста было недостаточно для интерпретации прямых результатов ТЛЧ (ошибка X200). Информация об успешности прямого DST важна для оценки рентабельности прямого DST.
Наиболее важным аспектом наших выводов является экономия времени за счет прямого перехода на летнее время. Время для сообщения о непрямом ТЛЧ Bactec MGIT от положительных культур варьировалось от 6 до 10 дней, что согласуется со многими более ранними сообщениями (1, 2, 7, 20).Это время для отчета варьируется в зависимости от многих факторов, включая изменчивость стандартной процедуры, выполняемой в лаборатории, популяцию пациентов и распространенность лекарственной устойчивости. Известно, что изолятам, устойчивым к лекарствам, обычно требуется больше времени для роста, чем изолятам, чувствительным к лекарствам. Общее время для отчета о непрямом ТЛЧ рассчитывалось как время, необходимое для выделения культуры, время, необходимое для настройки ТЛЧ, и время, необходимое для получения результатов теста на чувствительность от положительной культуры. С другой стороны, время для отчета о прямом ТЛЧ было временем для достижения результатов ТЛЧ после инокуляции обработанного образца.Экономия времени за счет прямого перехода на летнее время составила в целом 8 дней и не сильно варьировалась от сайта к сайту.
Время для сообщения о непрямом ТЛЧ Bactec MGIT от положительных культур варьировалось от 6 до 10 дней, что согласуется со многими более ранними сообщениями (1, 2, 7, 20).Это время для отчета варьируется в зависимости от многих факторов, включая изменчивость стандартной процедуры, выполняемой в лаборатории, популяцию пациентов и распространенность лекарственной устойчивости. Известно, что изолятам, устойчивым к лекарствам, обычно требуется больше времени для роста, чем изолятам, чувствительным к лекарствам. Общее время для отчета о непрямом ТЛЧ рассчитывалось как время, необходимое для выделения культуры, время, необходимое для настройки ТЛЧ, и время, необходимое для получения результатов теста на чувствительность от положительной культуры. С другой стороны, время для отчета о прямом ТЛЧ было временем для достижения результатов ТЛЧ после инокуляции обработанного образца.Экономия времени за счет прямого перехода на летнее время составила в целом 8 дней и не сильно варьировалась от сайта к сайту. Эта экономия времени очень важна, так как в случае МЛУ на счету каждый день. Результаты показывают, что прямое ТЛЧ дополнительно сокращает время, необходимое для сообщения результатов о чувствительности. После прямого ТЛЧ в среднем сайты 1 и 4 сообщали о прямых результатах ТЛЧ через 2 дня положительных результатов посева, а сайты 2 и 3 сообщали после трех дней положительных результатов посева. Эти сайты обрабатывают большое количество случаев МЛУ, и, таким образом, среди всех изученных нами случаев хорошо представлены случаи лекарственной устойчивости.
Эта экономия времени очень важна, так как в случае МЛУ на счету каждый день. Результаты показывают, что прямое ТЛЧ дополнительно сокращает время, необходимое для сообщения результатов о чувствительности. После прямого ТЛЧ в среднем сайты 1 и 4 сообщали о прямых результатах ТЛЧ через 2 дня положительных результатов посева, а сайты 2 и 3 сообщали после трех дней положительных результатов посева. Эти сайты обрабатывают большое количество случаев МЛУ, и, таким образом, среди всех изученных нами случаев хорошо представлены случаи лекарственной устойчивости.
Другой целью данного исследования была оценка точности результатов, полученных прямым методом. В этом расчете косвенное ТЛЧ считалось золотым стандартом, и в случае противоречивых результатов непрямое ТЛЧ было повторено. В целом, среди четырех сайтов только 4,9% результатов были противоречивыми в случае INH и 3,9% в случае RIF, с 2,3% ложной чувствительностью (очень большая ошибка) для INH и 2,5% для рифампицина. Ложная резистентность (основная ошибка) составила 2,6% для INH и 1,6% для рифампицина. На одном сайте разногласия были выше, чем на трех других. Не было четкой картины противоречивых результатов, поскольку при использовании INH и RIF наблюдались как ложная резистентность, так и ложная восприимчивость.
На одном сайте разногласия были выше, чем на трех других. Не было четкой картины противоречивых результатов, поскольку при использовании INH и RIF наблюдались как ложная резистентность, так и ложная восприимчивость.
Таким образом, это многоцентровое исследование установило стандартный протокол для определения прямой чувствительности с помощью автоматизированной системы Bactec MGIT. О результатах ТЛЧ можно сообщить через 2–3 дня после получения положительных результатов посева. Такая значительная экономия времени может оказать большую помощь в назначении эффективного лечения, особенно в случаях МЛУ.Если стоимость вызывает беспокойство, а распространенность монорезистентности к RIF не является обычным явлением, только RIF может быть протестирован и может считаться суррогатным маркером для MDR. Прямое ТЛЧ является надежным тестом, поскольку результаты, полученные с помощью прямого ТЛЧ, на 95–96% совпадают с результатами, полученными косвенным методом.
БЛАГОДАРНОСТИ
Мы благодарим Кирстен Отт (Национальный справочный центр микобактерий, Борстель, Германия) за ценный вклад в это исследование. Мы благодарим Becton Dickinson за предоставленные реагенты.
Мы благодарим Becton Dickinson за предоставленные реагенты.
Салман Сиддики имеет консалтинговое соглашение с BD и рядом других организаций, занимающихся диагностикой ТБ. Остальные авторы не сообщают о конфликте интересов.
Сноски
Опубликованы досрочно 7 декабря 2011 г.
ССЫЛКИ
1. Аджерс-Коскела К, Катила МЛ. 2003. Тестирование чувствительности с помощью ручной пробирки с индикатором роста микобактерий (MGIT) и системы MGIT 960 обеспечивает быструю и надежную проверку туберкулеза с множественной устойчивостью.J. Clin. Microbiol. 41: 1235–1239 [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Ардито Ф. и др. 2001. Оценка автоматизированной системы индикатора роста микобактерий BACTEC (MGIT 960) для определения лекарственной чувствительности Mycobacterium tuberculosis. J. Clin. Microbiol. 39: 4440–4444 [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Азиз М.А. и др. 2006. Эпидемиология противотуберкулезной лекарственной устойчивости (глобальный проект по надзору за противотуберкулезной лекарственной устойчивостью): обновленный анализ. Ланцет 368: 2142–2154 [PubMed] [Google Scholar] 4.
Балабанова Ю., и др. 2005. Туберкулез с множественной лекарственной устойчивостью в России: клиническая характеристика, анализ лекарственной устойчивости второго ряда и разработка стандартизированной терапии. Евро. J. Clin. Microbiol. Заразить. Дис. 24: 136–139 [PubMed] [Google Scholar] 5.
Банерджи Р., Шектер Г.Ф., Флад Дж., Порко ТЦ. 2008. Туберкулез с широкой лекарственной устойчивостью: новые штаммы, новые вызовы. Эксперт Rev. Anti Infect. Ther. 6: 713–724 [PubMed] [Google Scholar] 6.
Bastian I, Rigouts L, Palomino JC, Portaels F.2001. Тестирование Mycobacterium tuberculosis на чувствительность к канамицину с использованием индикаторной трубки Mycobacterium Growth Indicator Tube и колориметрического метода. Противомикробный. Агенты Chemother. 45: 1934–1936 [Бесплатная статья PMC] [PubMed] [Google Scholar] 7.
Bemer P, Palicova F, Rüsch-Gerdes S, Drugeon HB, Pfyffer GE. 2002. Многоцентровая оценка полностью автоматизированной системы BACTEC Mycobacteria Growth Indicator Tube 960 для тестирования чувствительности Mycobacterium tuberculosis.
Ланцет 368: 2142–2154 [PubMed] [Google Scholar] 4.
Балабанова Ю., и др. 2005. Туберкулез с множественной лекарственной устойчивостью в России: клиническая характеристика, анализ лекарственной устойчивости второго ряда и разработка стандартизированной терапии. Евро. J. Clin. Microbiol. Заразить. Дис. 24: 136–139 [PubMed] [Google Scholar] 5.
Банерджи Р., Шектер Г.Ф., Флад Дж., Порко ТЦ. 2008. Туберкулез с широкой лекарственной устойчивостью: новые штаммы, новые вызовы. Эксперт Rev. Anti Infect. Ther. 6: 713–724 [PubMed] [Google Scholar] 6.
Bastian I, Rigouts L, Palomino JC, Portaels F.2001. Тестирование Mycobacterium tuberculosis на чувствительность к канамицину с использованием индикаторной трубки Mycobacterium Growth Indicator Tube и колориметрического метода. Противомикробный. Агенты Chemother. 45: 1934–1936 [Бесплатная статья PMC] [PubMed] [Google Scholar] 7.
Bemer P, Palicova F, Rüsch-Gerdes S, Drugeon HB, Pfyffer GE. 2002. Многоцентровая оценка полностью автоматизированной системы BACTEC Mycobacteria Growth Indicator Tube 960 для тестирования чувствительности Mycobacterium tuberculosis. J. Clin. Microbiol. 40: 150–154 [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Cambau E, et al. 2000. Пробирка индикатора роста микобактерий в сравнении с методом пропорции на среде Левенштейна-Йенсена для определения чувствительности Mycobacterium tuberculosis к антибиотикам. Евро. J. Clin. Microbiol. Заразить. Дис. 19: 938–942 [PubMed] [Google Scholar] 9.
CLSI
2007. Тестирование чувствительности микобактерий, нокардий и аэробных актиномицетов: утвержденные стандарты, второе издание, том 26, № 23. Документ CLSI M24-2. Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания [Google Scholar] 10.Ганди Н.Р. и др. 2006. Обширный туберкулез с лекарственной устойчивостью как причина смерти пациентов с сочетанной инфекцией туберкулеза и ВИЧ в сельской местности Южной Африки. Lancet 368: 1575–1580 [PubMed] [Google Scholar] 11.
Голубьева В. и др. 2001. Оценка пробирки индикатора роста микобактерий для прямого и непрямого определения лекарственной чувствительности Mycobacterium tuberculosis в образцах респираторных органов в сибирской тюремной больнице.
J. Clin. Microbiol. 40: 150–154 [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Cambau E, et al. 2000. Пробирка индикатора роста микобактерий в сравнении с методом пропорции на среде Левенштейна-Йенсена для определения чувствительности Mycobacterium tuberculosis к антибиотикам. Евро. J. Clin. Microbiol. Заразить. Дис. 19: 938–942 [PubMed] [Google Scholar] 9.
CLSI
2007. Тестирование чувствительности микобактерий, нокардий и аэробных актиномицетов: утвержденные стандарты, второе издание, том 26, № 23. Документ CLSI M24-2. Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания [Google Scholar] 10.Ганди Н.Р. и др. 2006. Обширный туберкулез с лекарственной устойчивостью как причина смерти пациентов с сочетанной инфекцией туберкулеза и ВИЧ в сельской местности Южной Африки. Lancet 368: 1575–1580 [PubMed] [Google Scholar] 11.
Голубьева В. и др. 2001. Оценка пробирки индикатора роста микобактерий для прямого и непрямого определения лекарственной чувствительности Mycobacterium tuberculosis в образцах респираторных органов в сибирской тюремной больнице. J. Clin. Microbiol. 39: 1501–1505 [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Idigoras P, et al. 2000. Сравнение автоматической нерадиометрической системы BACTEC MGIT 960 с твердыми средами Левенштейна-Йенсена, Колецоса и Миддлбрука 7h21 для выделения микобактерий. Евро. J. Clin. Microbiol. Заразить. Дис. 19: 350–354 [PubMed] [Google Scholar] 13.
Кам К.М. и др. 2010. Определение критических концентраций противотуберкулезных препаратов второго ряда с клинической и микробиологической значимостью. Int. J. Tuberc. Lung Dis. 14: 282–288 [PubMed] [Google Scholar] 14.
Kent PT, Kubica GP.1985. Микробиология общественного здравоохранения, руководство для лаборатории уровня III. Центры по контролю заболеваний, Отдел лабораторного обучения и консультаций, Атланта, Джорджия [Google Scholar] 15.
Kim SJ. 2005. Тестирование лекарственной чувствительности при туберкулезе: методы и надежность результатов. Евро. Респир. J. 25: 564–569 [PubMed] [Google Scholar] 16.
Либонати Дж. П., Стагер CE, Дэвис Дж.
J. Clin. Microbiol. 39: 1501–1505 [Бесплатная статья PMC] [PubMed] [Google Scholar] 12.Idigoras P, et al. 2000. Сравнение автоматической нерадиометрической системы BACTEC MGIT 960 с твердыми средами Левенштейна-Йенсена, Колецоса и Миддлбрука 7h21 для выделения микобактерий. Евро. J. Clin. Microbiol. Заразить. Дис. 19: 350–354 [PubMed] [Google Scholar] 13.
Кам К.М. и др. 2010. Определение критических концентраций противотуберкулезных препаратов второго ряда с клинической и микробиологической значимостью. Int. J. Tuberc. Lung Dis. 14: 282–288 [PubMed] [Google Scholar] 14.
Kent PT, Kubica GP.1985. Микробиология общественного здравоохранения, руководство для лаборатории уровня III. Центры по контролю заболеваний, Отдел лабораторного обучения и консультаций, Атланта, Джорджия [Google Scholar] 15.
Kim SJ. 2005. Тестирование лекарственной чувствительности при туберкулезе: методы и надежность результатов. Евро. Респир. J. 25: 564–569 [PubMed] [Google Scholar] 16.
Либонати Дж. П., Стагер CE, Дэвис Дж.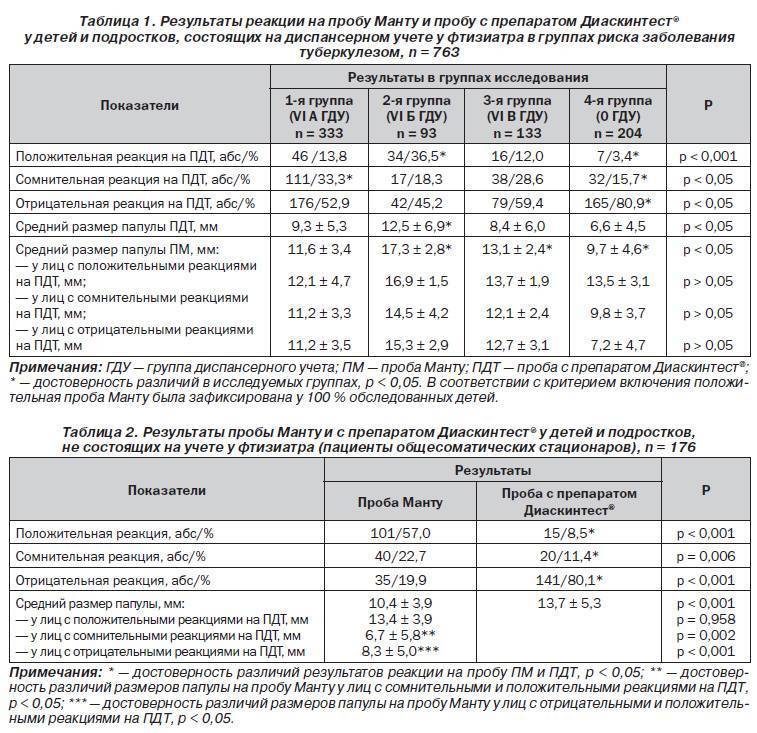 Р., Сиддики Ш. 1988. Прямое определение чувствительности Mycobacterium tuberculosis к противомикробным препаратам радиометрическим методом. Диаг. Microbiol.Заразить. Дис. 10: 41–48 [PubMed] [Google Scholar] 17.
Линг Д.И., Цверлинг А.А., Пай М. 2008. Анализ генотипа MTBDR для диагностики туберкулеза с множественной лекарственной устойчивостью; метаанализ. Евро. Респир. 32: 1165–1174 [PubMed] [Google Scholar] 18.
Pfyffer GE, Palicova F, Rüsch-Gerdes S. 2002. Тестирование чувствительности Mycobacterium tuberculosis к пиразинамиду с помощью нерадиометрической системы BACTEC MGIT 960. J. Clin. Microbiol. 40: 1670–1674 [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.
Робертс Г.Д. и др.1983. Оценка радиометрического метода BACTEC для выявления микобактерий и определение лекарственной чувствительности Mycobacterium tuberculosis из кислотоустойчивых образцов с положительным мазком. J. Clin. Microbiol. 18: 689–696 [Бесплатная статья PMC] [PubMed] [Google Scholar] 20.
Rüsch-Gerdes S, et al. 1999.
Р., Сиддики Ш. 1988. Прямое определение чувствительности Mycobacterium tuberculosis к противомикробным препаратам радиометрическим методом. Диаг. Microbiol.Заразить. Дис. 10: 41–48 [PubMed] [Google Scholar] 17.
Линг Д.И., Цверлинг А.А., Пай М. 2008. Анализ генотипа MTBDR для диагностики туберкулеза с множественной лекарственной устойчивостью; метаанализ. Евро. Респир. 32: 1165–1174 [PubMed] [Google Scholar] 18.
Pfyffer GE, Palicova F, Rüsch-Gerdes S. 2002. Тестирование чувствительности Mycobacterium tuberculosis к пиразинамиду с помощью нерадиометрической системы BACTEC MGIT 960. J. Clin. Microbiol. 40: 1670–1674 [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.
Робертс Г.Д. и др.1983. Оценка радиометрического метода BACTEC для выявления микобактерий и определение лекарственной чувствительности Mycobacterium tuberculosis из кислотоустойчивых образцов с положительным мазком. J. Clin. Microbiol. 18: 689–696 [Бесплатная статья PMC] [PubMed] [Google Scholar] 20.
Rüsch-Gerdes S, et al. 1999. Многоцентровая оценка пробирки с индикатором роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. J. Clin. Microbiol. 37: 45–48 [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Rüsch-Gerdes S, Pfyffer GE, Casal M, Chadwick M., Siddiqi S. 2006. Многоцентровая лабораторная валидация методики BACTEC MGIT 960 для проверки чувствительности Mycobacterium tuberculosis к классическим препаратам второго ряда и новым противомикробным препаратам. J. Clin. Microbiol. 44: 688–692 [Бесплатная статья PMC] [PubMed] [Google Scholar] 23.
Shinnick TM, Lademarco MF, Ridderhof JC. 2005. Национальный план надежных лабораторных услуг по туберкулезу с использованием системного подхода. Рекомендации CDC и Целевой группы Ассоциации лабораторий общественного здравоохранения по лабораторным службам туберкулеза.MMWR Recomm. Реп. 54: 1–12 [PubMed] [Google Scholar] 24.
Siddiqi SH, Hawkins JE, Laszlo A. 1985. Межлабораторное тестирование лекарственной чувствительности Mycobacterium tuberculosis с помощью радиометрической процедуры и двух традиционных методов.
Многоцентровая оценка пробирки с индикатором роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. J. Clin. Microbiol. 37: 45–48 [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Rüsch-Gerdes S, Pfyffer GE, Casal M, Chadwick M., Siddiqi S. 2006. Многоцентровая лабораторная валидация методики BACTEC MGIT 960 для проверки чувствительности Mycobacterium tuberculosis к классическим препаратам второго ряда и новым противомикробным препаратам. J. Clin. Microbiol. 44: 688–692 [Бесплатная статья PMC] [PubMed] [Google Scholar] 23.
Shinnick TM, Lademarco MF, Ridderhof JC. 2005. Национальный план надежных лабораторных услуг по туберкулезу с использованием системного подхода. Рекомендации CDC и Целевой группы Ассоциации лабораторий общественного здравоохранения по лабораторным службам туберкулеза.MMWR Recomm. Реп. 54: 1–12 [PubMed] [Google Scholar] 24.
Siddiqi SH, Hawkins JE, Laszlo A. 1985. Межлабораторное тестирование лекарственной чувствительности Mycobacterium tuberculosis с помощью радиометрической процедуры и двух традиционных методов.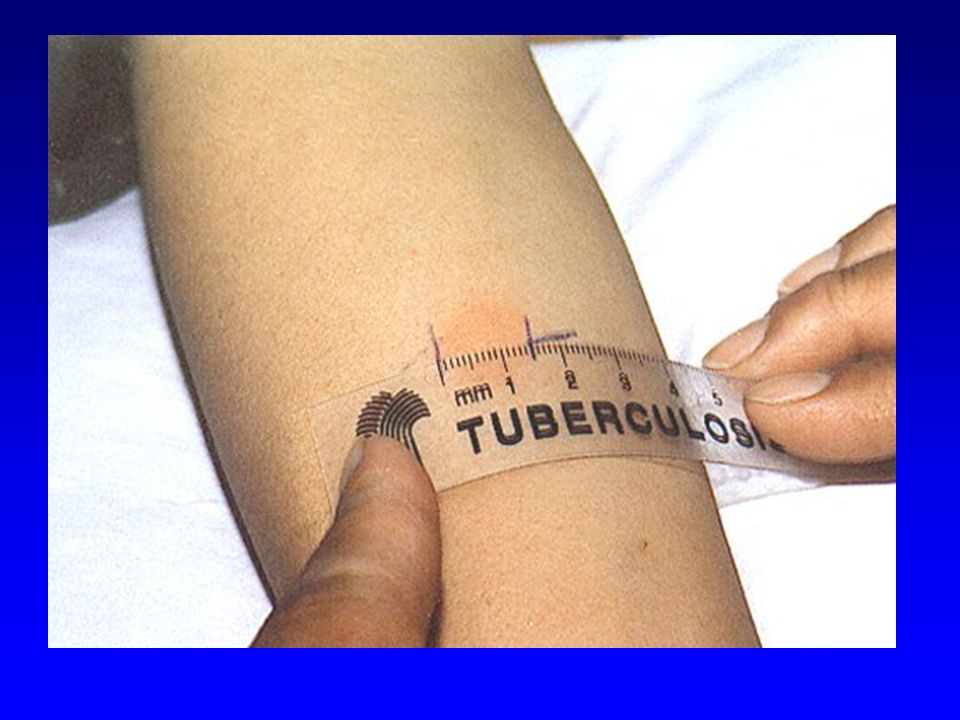 J. Clin. Microbiol. 22: 919–923 [Бесплатная статья PMC] [PubMed] [Google Scholar] 25.
Сиддики С.Х., Либонати Дж. П., Миддлбрук Г. 1981. Оценка быстрого радиометрического метода для определения лекарственной чувствительности Mycobacterium tuberculosis. J. Clin. Microbiol. 13: 908–912 [Бесплатная статья PMC] [PubMed] [Google Scholar] 26.Сиддики С.Х., Рюш-Гердес С. 2006. Руководство по процедурам MGIT. Фонд инновационных новых диагностических средств (FIND), Женева, Швейцария [Google Scholar] 28.
Всемирная организация здравоохранения
1998. Лабораторная серия по борьбе с туберкулезом. Часть II, микроскопия. WHO / TB / 98.258. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 29.
Всемирная организация здравоохранения
2004. Руководство по биобезопасности в лабораториях, 3-е изд. WHO / CDS / CSR / LYO / 2004.11; Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 30.
Всемирная организация здравоохранения
2004 г.Устойчивость к противотуберкулезным препаратам в мире.
J. Clin. Microbiol. 22: 919–923 [Бесплатная статья PMC] [PubMed] [Google Scholar] 25.
Сиддики С.Х., Либонати Дж. П., Миддлбрук Г. 1981. Оценка быстрого радиометрического метода для определения лекарственной чувствительности Mycobacterium tuberculosis. J. Clin. Microbiol. 13: 908–912 [Бесплатная статья PMC] [PubMed] [Google Scholar] 26.Сиддики С.Х., Рюш-Гердес С. 2006. Руководство по процедурам MGIT. Фонд инновационных новых диагностических средств (FIND), Женева, Швейцария [Google Scholar] 28.
Всемирная организация здравоохранения
1998. Лабораторная серия по борьбе с туберкулезом. Часть II, микроскопия. WHO / TB / 98.258. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 29.
Всемирная организация здравоохранения
2004. Руководство по биобезопасности в лабораториях, 3-е изд. WHO / CDS / CSR / LYO / 2004.11; Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 30.
Всемирная организация здравоохранения
2004 г.Устойчивость к противотуберкулезным препаратам в мире. № отчета 3. Глобальный проект ВОЗ / IUATLD по надзору за лекарственной устойчивостью к туберкулезу. WHO / HTM / TB / 2004. 343. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 31.
Всемирная организация здравоохранения
2006. Руководство по программному лечению туберкулеза с лекарственной устойчивостью. WHO / HTM / TB / 2006.361. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 32.
Всемирная организация здравоохранения
2007. Использование жидкой культуры туберкулеза и тестов на лекарственную чувствительность (ТЛЧ) в странах с низким и средним уровнем дохода.Сводный отчет заседания экспертной группы по использованию жидких питательных сред. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 33.
Всемирная организация здравоохранения
2008. Заявление о политике. Тесты молекулярных зондов для быстрого скрининга пациентов с риском туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ). Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 34.
№ отчета 3. Глобальный проект ВОЗ / IUATLD по надзору за лекарственной устойчивостью к туберкулезу. WHO / HTM / TB / 2004. 343. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 31.
Всемирная организация здравоохранения
2006. Руководство по программному лечению туберкулеза с лекарственной устойчивостью. WHO / HTM / TB / 2006.361. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 32.
Всемирная организация здравоохранения
2007. Использование жидкой культуры туберкулеза и тестов на лекарственную чувствительность (ТЛЧ) в странах с низким и средним уровнем дохода.Сводный отчет заседания экспертной группы по использованию жидких питательных сред. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 33.
Всемирная организация здравоохранения
2008. Заявление о политике. Тесты молекулярных зондов для быстрого скрининга пациентов с риском туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ). Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar] 34. Всемирная организация здравоохранения
2010. Заявление о политике. Некоммерческий посев и тестирование лекарственной чувствительности для быстрого скрининга пациентов с риском МЛУ-ТБ.Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]
Всемирная организация здравоохранения
2010. Заявление о политике. Некоммерческий посев и тестирование лекарственной чувствительности для быстрого скрининга пациентов с риском МЛУ-ТБ.Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]Frontiers | Клиническая проверка системы QMAC-DST для тестирования лекарственной чувствительности Mycobacterium tuberculosis к препаратам первого и второго ряда
Введение
Туберкулез — серьезная глобальная проблема здравоохранения, и появление Mycobacterium tuberculosis (МЛУ-ТБ) и широкой лекарственной устойчивости M. tuberculosis ТБ (ШЛУ-ТБ) представляет собой угрозу для усилий общественного здравоохранения по борьбе с туберкулезом. .Поэтому Центры по контролю и профилактике заболеваний [CDC] (2006) и Всемирная организация здравоохранения [ВОЗ] (2015) рекомендуют быстрое тестирование лекарственной чувствительности (ТЛЧ) для выявления МЛУ-ТБ и ШЛУ-ТБ. В настоящее время молекулярные методы обнаружения лекарственно-устойчивого МТБ широко доступны в клинических лабораториях благодаря быстрой и надежной работе.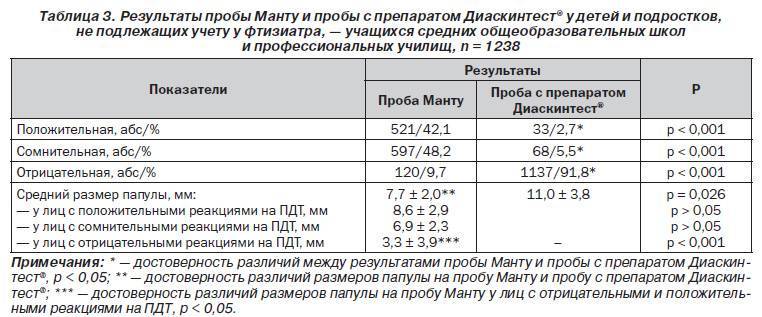 Однако они лишь дополняют фенотипическое ТЛЧ, поскольку ограничиваются обнаружением устойчивости к нескольким основным лекарственным средствам, молекулярные механизмы которых хорошо установлены (Boehme et al., 2010, 2011; Ханрахан и др., 2012). Два надежных фенотипических метода ТЛЧ, основанные на агаровой среде Левенштейна-Йенсена (LJ-DST) или жидкой среде, такой как BACTEC MGIT 960 (BD Biosciences, Сан-Хосе, Калифорния, США), были одобрены Всемирной организацией здравоохранения [ВОЗ] ( 2015) (Rodrigues et al., 2008; Boehme et al., 2010, 2011; Hanrahan et al., 2012). LJ-DST — это золотой стандарт для большинства противотуберкулезных препаратов, но среднее время обработки составляет 4 недели. Метод DST на основе MGIT (MGIT-DST) обеспечивает 7-дневное время обработки, что намного быстрее, чем LJ-DST (Kim, 2005), но является трудоемким и стандартизированным только для стрептомицина, изониазида, рифампицина и этамбутол (SIRE).QMAC-DST (QuantaMatrix, Сеул, Корея) был разработан на основе технологии микрожидкостных чипов для мониторинга микроскопического роста колоний MTB (Choi et al.
Однако они лишь дополняют фенотипическое ТЛЧ, поскольку ограничиваются обнаружением устойчивости к нескольким основным лекарственным средствам, молекулярные механизмы которых хорошо установлены (Boehme et al., 2010, 2011; Ханрахан и др., 2012). Два надежных фенотипических метода ТЛЧ, основанные на агаровой среде Левенштейна-Йенсена (LJ-DST) или жидкой среде, такой как BACTEC MGIT 960 (BD Biosciences, Сан-Хосе, Калифорния, США), были одобрены Всемирной организацией здравоохранения [ВОЗ] ( 2015) (Rodrigues et al., 2008; Boehme et al., 2010, 2011; Hanrahan et al., 2012). LJ-DST — это золотой стандарт для большинства противотуберкулезных препаратов, но среднее время обработки составляет 4 недели. Метод DST на основе MGIT (MGIT-DST) обеспечивает 7-дневное время обработки, что намного быстрее, чем LJ-DST (Kim, 2005), но является трудоемким и стандартизированным только для стрептомицина, изониазида, рифампицина и этамбутол (SIRE).QMAC-DST (QuantaMatrix, Сеул, Корея) был разработан на основе технологии микрожидкостных чипов для мониторинга микроскопического роста колоний MTB (Choi et al. , 2016). Он обладает высокой гибкостью в отношении типов и концентраций тестируемых лекарств, отсутствием эффектов инокулята в широком диапазоне 10 3 –10 8 клеток / мл, отличной воспроизводимостью при использовании лиофилизированных лекарств и быстрым сроком обработки в течение 7 дней ( Юнг и др., 2018). Для коммерциализации панель QMAC-DST адаптировала критические концентрации (CC) с автоматическим считыванием посредством количественной оценки микроскопического роста, в отличие от оригинальной конструкции (Jung et al., 2018; Таблица 1). Целью этого исследования было сравнение эффективности системы QMAC-DST с двумя одобренными ВОЗ методами ТЛЧ: LJ-DST и MGIT-DST.
, 2016). Он обладает высокой гибкостью в отношении типов и концентраций тестируемых лекарств, отсутствием эффектов инокулята в широком диапазоне 10 3 –10 8 клеток / мл, отличной воспроизводимостью при использовании лиофилизированных лекарств и быстрым сроком обработки в течение 7 дней ( Юнг и др., 2018). Для коммерциализации панель QMAC-DST адаптировала критические концентрации (CC) с автоматическим считыванием посредством количественной оценки микроскопического роста, в отличие от оригинальной конструкции (Jung et al., 2018; Таблица 1). Целью этого исследования было сравнение эффективности системы QMAC-DST с двумя одобренными ВОЗ методами ТЛЧ: LJ-DST и MGIT-DST.
Таблица 1. Сравнение трех тестов на лекарственную чувствительность с использованием среды Левенштейна-Йенсена, QMAC-DST и BACTEC MGIT 960.
Материалы и методы
Бактериальные изоляты
клинических изолятов МТБ были последовательно собраны в Медицинском центре Асан в течение 12 месяцев с января по декабрь 2015 г. и хранились при 4 ± 2 ° C до дальнейшего тестирования.Все изоляты, использованные в этом исследовании, были идентифицированы как MTB с помощью ПЦР в реальном времени AdvanSure TM TB / NTM (LG Chem, Сеул, Корея) и были отправлены на эталонное ТЛЧ, которое было проанализировано Корейским институтом туберкулеза (Осонг). , Корея). Для исследования было собрано до 200 изолятов с обогащением изолятов, устойчивых к лекарствам. Были включены все лекарственно-устойчивые изоляты, а остальные изоляты культивировали с чувствительными изолятами. Исследуемые изоляты пересевали на среду L-J для подтверждения жизнеспособности и чистоты этого исследования.Это исследование было одобрено Экспертным советом медицинского центра Асан (2015-1346). Кроме того, письменное согласие было отменено для пациента, от которого был получен изолят, в соответствии с рекомендациями протокола валидации метода испытаний in vitro с анонимизацией.
и хранились при 4 ± 2 ° C до дальнейшего тестирования.Все изоляты, использованные в этом исследовании, были идентифицированы как MTB с помощью ПЦР в реальном времени AdvanSure TM TB / NTM (LG Chem, Сеул, Корея) и были отправлены на эталонное ТЛЧ, которое было проанализировано Корейским институтом туберкулеза (Осонг). , Корея). Для исследования было собрано до 200 изолятов с обогащением изолятов, устойчивых к лекарствам. Были включены все лекарственно-устойчивые изоляты, а остальные изоляты культивировали с чувствительными изолятами. Исследуемые изоляты пересевали на среду L-J для подтверждения жизнеспособности и чистоты этого исследования.Это исследование было одобрено Экспертным советом медицинского центра Асан (2015-1346). Кроме того, письменное согласие было отменено для пациента, от которого был получен изолят, в соответствии с рекомендациями протокола валидации метода испытаний in vitro с анонимизацией.
QMAC-DST
Всего 178 клинических изолятов M.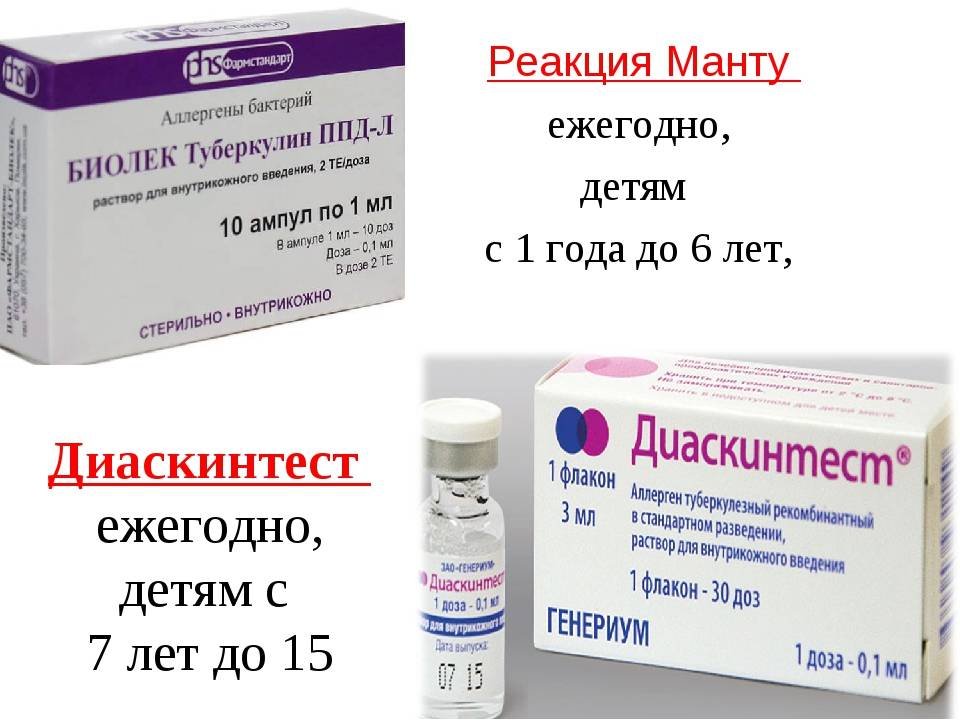 tuberculosis были подвергнуты тесту QMAC-DST против 13 противомикробных препаратов. Контрольный изолят, h47Rv (ATCC 27294), был включен в каждый тестовый прогон в качестве контроля.Забуференный фосфатом физиологический раствор (PBS, pH 6,8) использовали для суспендирования клеток из колоний, выращенных на среде L-J, для приготовления мутной суспензии. Раствор агарозы (900 мкл, 0,5%; агароза Seakem ® LE, Lonza, Rockland, ME, США) готовили в микроволновой печи и помещали в тепловой блок при 37 ° C. Суспензию клеток смешивали с раствором агарозы в соотношении объемов 1: 3 после охлаждения в течение 3 мин (рис. 1; Jung et al., 2018).
tuberculosis были подвергнуты тесту QMAC-DST против 13 противомикробных препаратов. Контрольный изолят, h47Rv (ATCC 27294), был включен в каждый тестовый прогон в качестве контроля.Забуференный фосфатом физиологический раствор (PBS, pH 6,8) использовали для суспендирования клеток из колоний, выращенных на среде L-J, для приготовления мутной суспензии. Раствор агарозы (900 мкл, 0,5%; агароза Seakem ® LE, Lonza, Rockland, ME, США) готовили в микроволновой печи и помещали в тепловой блок при 37 ° C. Суспензию клеток смешивали с раствором агарозы в соотношении объемов 1: 3 после охлаждения в течение 3 мин (рис. 1; Jung et al., 2018).
Рис. 1. Система QMAC-DST для автоматизированного покадрового построения изображений CAT-чипов с использованием программного обеспечения для обработки изображений. (A) Схематическое изображение CAT-чипа с 24 интегральными реакционными цепями, который состоит из перекрестного канала для заполнения залитых агарозой клеток Mycobacterium tuberculosis и лунки, содержащей каждое лиофилизированное противотуберкулезное лекарство. (B) После добавления бульона 7H9, содержащего 10% OADC, 0,5% агарозная пробка, заполняющая поперечный канал, позволила растворенному лекарству немедленно достичь целевой концентрации и обеспечить контакт лекарств со встроенными клетками Mycobacterium tuberculosis в цепи . (C) Для каждой схемы были взяты два поля для покадровых изображений в фиксированных положениях около центра левого плеча поперечного канала в дни 1, 2, 5 и 7 инкубации. Кумулятивный рост колоний на каждом поле измеряли для определения устойчивых (рост клеток) или восприимчивых (отсутствие роста) клеток в цепи с использованием программного обеспечения для анализа изображений.
(B) После добавления бульона 7H9, содержащего 10% OADC, 0,5% агарозная пробка, заполняющая поперечный канал, позволила растворенному лекарству немедленно достичь целевой концентрации и обеспечить контакт лекарств со встроенными клетками Mycobacterium tuberculosis в цепи . (C) Для каждой схемы были взяты два поля для покадровых изображений в фиксированных положениях около центра левого плеча поперечного канала в дни 1, 2, 5 и 7 инкубации. Кумулятивный рост колоний на каждом поле измеряли для определения устойчивых (рост клеток) или восприимчивых (отсутствие роста) клеток в цепи с использованием программного обеспечения для анализа изображений.
Все 13 протестированных противомикробных препаратов, включая изониазид, рифампицин, стрептомицин, этамбутол, амикацин, капреомицин, этионамид, канамицин, левофлоксацин, моксифлоксацин, офлоксацин, пара- -аминосалициловая кислота (СТАС), были приобретены у АС-аминосалициловой кислоты (СТАС), и .Луис, Миссури, США). Жидкая питательная среда представляла собой бульон Миддлбрука 7H9 (BBL, BD Biosciences, Балтимор, Мэриленд, США) с добавлением 10% олеиновой кислоты, альбумина, декстрозы и каталазы (BD Biosciences). Чип кросс-агарозного канала для туберкулеза (CAT) состоял из CC каждого лекарства. СС были основаны на бульоне Миддлбрука 7H9, который был создан для системы MGIT 960 (Всемирная организация здравоохранения [ВОЗ], 2009), за исключением стрептомицина, амикацина и ПАСК, которые были скорректированы в соответствии с предыдущим исследованием (Jung et al. ., 2018). КК составляли 0,1, 1,0, 2,0, 5,0, 2,0, 2,5, 2,5, 1,5, 0,5, 2,0, 0,5, 4,0 и 5,0 мкг / мл для изониазида, рифампицина, стрептомицина, этамбутола, амикацина, капреомицина, канамицина, левофлоксацина, моксифлоксацина. , офлоксацин, пара -аминосалициловая кислота (ПАСК), рифабутин и этионамид, соответственно (Woodley, 1986; Kam et al., 2010; Jung et al., 2018). Суспензию клеток МТБ инокулировали, как описано ранее (Jung et al., 2018).
Жидкая питательная среда представляла собой бульон Миддлбрука 7H9 (BBL, BD Biosciences, Балтимор, Мэриленд, США) с добавлением 10% олеиновой кислоты, альбумина, декстрозы и каталазы (BD Biosciences). Чип кросс-агарозного канала для туберкулеза (CAT) состоял из CC каждого лекарства. СС были основаны на бульоне Миддлбрука 7H9, который был создан для системы MGIT 960 (Всемирная организация здравоохранения [ВОЗ], 2009), за исключением стрептомицина, амикацина и ПАСК, которые были скорректированы в соответствии с предыдущим исследованием (Jung et al. ., 2018). КК составляли 0,1, 1,0, 2,0, 5,0, 2,0, 2,5, 2,5, 1,5, 0,5, 2,0, 0,5, 4,0 и 5,0 мкг / мл для изониазида, рифампицина, стрептомицина, этамбутола, амикацина, капреомицина, канамицина, левофлоксацина, моксифлоксацина. , офлоксацин, пара -аминосалициловая кислота (ПАСК), рифабутин и этионамид, соответственно (Woodley, 1986; Kam et al., 2010; Jung et al., 2018). Суспензию клеток МТБ инокулировали, как описано ранее (Jung et al., 2018). Чип CAT инкубировали при 37 ° C, и покадровые изображения автоматически регистрировались на 1, 2, 5 и 7 дней инкубации с использованием QDST TM (QuantaMatrix).Рост колоний отдельных клеток отслеживали каждый день в 20-кратном поле с помощью инвертированного оптического микроскопа, который всегда был выровнен по одному и тому же локусу по метке фокуса, выгравированной на дне чипа (Рисунок 1; Choi et al., 2014, 2016). Значение бинаризации изображений, захваченных из полей, вычислялось как сумма черной области (совокупная площадь колоний) после черно-белого преобразования (бинаризации). Число бинаризации каждой комбинации лекарственное средство-изолят интерпретировали как восприимчивость (S) и устойчивость (R) с использованием пороговых значений программы QMAC-DST.Для каждой скважины интерпретация восприимчивости дублировалась показаниями двух отдельных полей и принималась, когда обе интерпретации совпадали. Результаты сравнивали с результатами LJ-DST, проведенного Корейским институтом туберкулеза.
Чип CAT инкубировали при 37 ° C, и покадровые изображения автоматически регистрировались на 1, 2, 5 и 7 дней инкубации с использованием QDST TM (QuantaMatrix).Рост колоний отдельных клеток отслеживали каждый день в 20-кратном поле с помощью инвертированного оптического микроскопа, который всегда был выровнен по одному и тому же локусу по метке фокуса, выгравированной на дне чипа (Рисунок 1; Choi et al., 2014, 2016). Значение бинаризации изображений, захваченных из полей, вычислялось как сумма черной области (совокупная площадь колоний) после черно-белого преобразования (бинаризации). Число бинаризации каждой комбинации лекарственное средство-изолят интерпретировали как восприимчивость (S) и устойчивость (R) с использованием пороговых значений программы QMAC-DST.Для каждой скважины интерпретация восприимчивости дублировалась показаниями двух отдельных полей и принималась, когда обе интерпретации совпадали. Результаты сравнивали с результатами LJ-DST, проведенного Корейским институтом туберкулеза. Категориальное согласие и частота ошибок были получены для каждой комбинации лекарственное средство-изолят (Институт клинических лабораторных стандартов [CLSI], 2016). Чтобы устранить несоответствия между каждым методом, все репрезентативные изоляты были подвергнуты повторному тестированию и определению устойчивых мутаций.
Категориальное согласие и частота ошибок были получены для каждой комбинации лекарственное средство-изолят (Институт клинических лабораторных стандартов [CLSI], 2016). Чтобы устранить несоответствия между каждым методом, все репрезентативные изоляты были подвергнуты повторному тестированию и определению устойчивых мутаций.
Пробирка индикатора роста микобактерий (MGIT) Тест на лекарственную чувствительность
MGIT-DST был проведен с тем же набором изолятов через несколько месяцев после завершения QMAC-DST с использованием набора BACTEC MGIT 960 SIRE в соответствии с инструкциями производителя. Вкратце, в каждую пробирку MGIT добавляли 800 мкл добавки OADC и 100 мкл лекарств. Несколько колоний на среде L-J собирали и суспендировали в PBS путем встряхивания с получением гомогенной суспензии McFarland 0,5. Из этой суспензии было приготовлено разведение 1: 5 с использованием PBS, из которых 500 мкл образцов были засеяны в каждую пробирку, содержащую лекарство, и пробирку для контроля роста (Siddiqi et al. , 2012; Адами и др., 2017). Препараты использовались в конечных концентрациях, рекомендованных производителем: 1,0 мкг / мл стрептомицина, 0,1 мкг / мл изониазида, 1,0 мкг / мл рифампицина и 5,0 мкг / мл этамбутола (Piersimoni et al., 2006). Данные MGIT-DST были доступны для 156 изолятов, за исключением тех, которые были заражены или не смогли расти. Основная ошибка (ME), очень большая ошибка (vME) и коэффициент согласования между тремя методами (LJ-DST, MGIT-DST, QMAC-DST) были рассчитаны для каждого препарата (Таблица 3; Институт клинических лабораторных стандартов [CLSI] , 2016).
, 2012; Адами и др., 2017). Препараты использовались в конечных концентрациях, рекомендованных производителем: 1,0 мкг / мл стрептомицина, 0,1 мкг / мл изониазида, 1,0 мкг / мл рифампицина и 5,0 мкг / мл этамбутола (Piersimoni et al., 2006). Данные MGIT-DST были доступны для 156 изолятов, за исключением тех, которые были заражены или не смогли расти. Основная ошибка (ME), очень большая ошибка (vME) и коэффициент согласования между тремя методами (LJ-DST, MGIT-DST, QMAC-DST) были рассчитаны для каждого препарата (Таблица 3; Институт клинических лабораторных стандартов [CLSI] , 2016).
Разрешение расхождений с помощью метода молекулярной диагностики
Для изолятов, показывающих противоречивые результаты, был проведен QMAP Dual-ID (Quantamatrix, Сеул, Республика Корея) для выявления мутаций, устойчивых к рифампину. В этом исследовании использовались пять зондов дикого типа, представляющих последовательность дикого типа горячей точки 81 п.н. (кодон 509-534), и пять зондов мутантного типа (513CCA, 516TAC, 516GTC, 526TAC, 531TTG) (Wang et al. , 2017c).
, 2017c).
ПЦР выполняли с использованием 10 мкл смеси Taq HS Perfect Mix (TaKaRa Bio INC., Kusatsu, Shiga, Japan), 2 мкл смеси биотинилированных праймеров, 2–3 мкл образца ДНК и дистиллированная вода до конечного объема 20 мкл. Условия термоциклирования ПЦР были следующими: предварительная денатурация в течение 5 минут при 94 ° C, затем 40 циклов по 30 с при 94 ° C, 30 с при 65 ° C и окончательное удлинение в течение 10 минут при 72 ° C. Биотинилированные продукты ПЦР денатурировали при 25 ° C в течение 5 мин в денатурирующем растворе. Добавьте 45 мкл предоставленного раствора для гибридизации и микродиски с зондом в прилагаемый стеклянный планшет MatriPlate (Brooks, Chelmsford, MA, США).Передача 1200 об / мин за 30 мин. Микродиски трижды промывали 100 мкл промывочного буфера, инкубировали с 50 мкл окрашивающего буфера (конъюгат стрептавидин R-фикоэритрин, ProZyme, Сан-Леандро, Калифорния, США) при 35 ° C в течение 10 мин и трижды промывали. Результаты были обнаружены как средние значения интенсивности флуоресценции с использованием изображений флуоресцентной микроскопии в сканере QMAP2.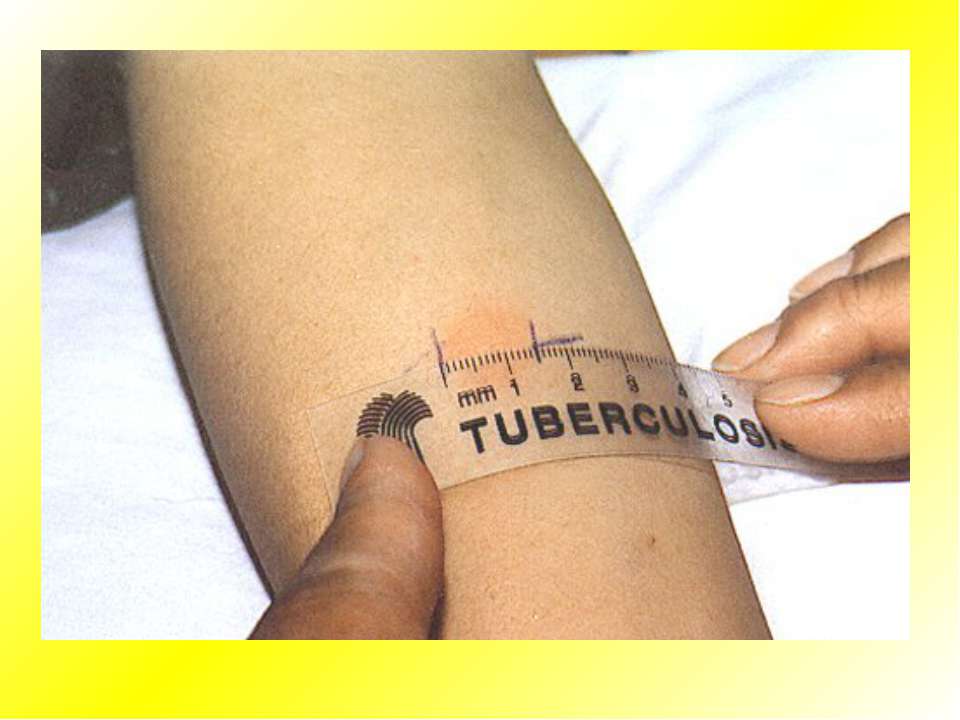 0 (QuantaMatrix) (Wang et al., 2017a, b, c).
0 (QuantaMatrix) (Wang et al., 2017a, b, c).
Результаты
Сравнение QMAC-DST и MGIT-DST с LJ-DST
Результаты согласования QMAC-DST и MGIT-DST показаны в таблице 1.Общая степень соответствия QMAC-DST и LJ-DST для 13 препаратов составила 97,8%, а MGIT-DST для препаратов первого ряда — 95,5%. Все препараты показали степень согласия более 90%, за исключением PAS. VME QMAC-DST составлял 25% среди PAS-устойчивых изолятов, потому что было обнаружено одно несоответствие среди четырех устойчивых изолятов.
Сравнение трех методов для основных лекарственных средств
Несоответствующие результаты для основных лекарственных средств между каждым методом показаны в таблице 2. Рифампицин показал наименьшую общую степень соответствия между QMAC-DST и эталонным методом.
Таблица 2. Несогласованные результаты трех тестов на лекарственную чувствительность с использованием QMAC-DST, среды Левенштейна-Йенсена и BACTEC MGIT 960 для препаратов первого ряда.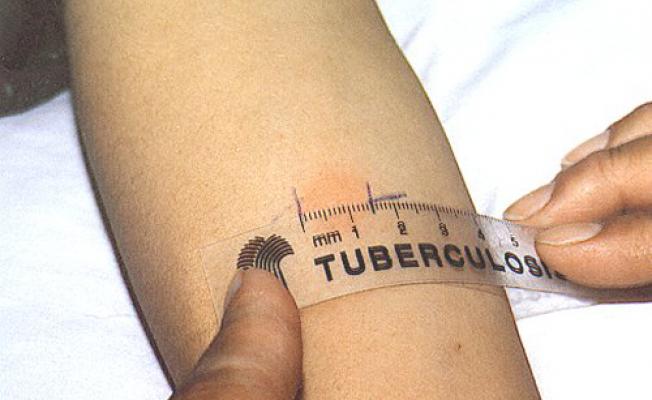
По сравнению с LJ-DST были рассчитаны показатели ME и vME, а также общие показатели согласованности QMAC-DST и MGIT DST (таблица 3). QMAC-DST показал ME в 2 (1,7%) для изониазида, 10 (7,3%) для рифампицина, 1 (0,7%) для этамбутола и 6 (4,2%) для стрептомицина, в результате чего общая ME составила 3,5%, но не vME.Таким образом, QMAC-DST показал наименьшее согласие для рифампицина — 93,6%. MGIT-DST показал низкий ME 2,2%, но vME наблюдалась у 3 (15,8%) для рифампицина, 7 (70%) для этамбутола и 2 (14,3%) для стрептомицина, что привело к общему vME 19,8% ( Таблица 3). Среди четырех протестированных препаратов MGIT-DST показал наименьшее согласие для этамбутола на уровне 93,6% из-за встречаемости ME у 3 (2,1%) и vME у 7 (70,0%). Частота соответствия QMAC-DST и MGIT-DST составила 94,2% для изониазида, 91,0% для рифампицина, 93,0% для этамбутола и 95.5% для стрептомицина. Общая степень соответствия между методами была следующей: 95,5% (MGIT по сравнению с методом LJ), 97% (QMAC по сравнению с методом LJ) и 93,4% (QMAC по сравнению с MGIT).
Таблица 3. Очень серьезная ошибка, основная ошибка и категориальное согласие теста на лекарственную чувствительность с использованием QMAC-DST и BACTEC MGIT 960 по сравнению с тестированием лекарственной чувствительности с использованием среды Левенштейна-Йенсена.
Анализ ME случаев рифампицина в QMAC-DST
Восемь из десяти изолятов, показывающих ME в DST для рифампицина, были подтверждены как устойчивые мутации с помощью метода QMAP Dual ID, которые все были устойчивы как к LJ-DST, так и к MGIT-DST (таблица 4).Чтобы изучить механизм ME рифампицином, мы проанализировали изображения случаев ME по сравнению с изолятами, которые были правильно интерпретированы как чувствительные или устойчивые (рис. 2A). Рост колоний в этих случаях ME был меньше, чем в устойчивых случаях, но явно больше, чем в случае истинно чувствительных результатов. Значение бинаризации, обозначающее совокупную площадь колоний в этих случаях ME, показало промежуточные значения между восприимчивыми и устойчивыми считываниями, которые в среднем составляли только половину устойчивых считываний (рис. 2В).
Таблица 4. Согласование результатов тестирования лекарственной чувствительности с использованием QMAC-DST и тестирования лекарственной чувствительности с использованием BACTEC MGIT 960.
Рис. 2. Анализ изображений QMAC-DST изолятов, показывающий основную ошибку ТЛЧ к рифампину по сравнению с устойчивыми и чувствительными изолятами. (A) Рост колоний в случаях серьезных ошибок был выше, чем в восприимчивых случаях, но явно меньше, чем в устойчивых случаях. (B) Значение бинаризации обозначает совокупную площадь колоний.Значение основных случаев ошибок было промежуточным между устойчивыми и восприимчивыми случаями на пятый и седьмой день инкубации.
Обсуждение
В этом исследовании QMAC-DST показал высокий уровень согласия 97,8% по сравнению с методом золотого стандарта. Все препараты, кроме PAS, показали степень соответствия более 90% как для чувствительных, так и для резистентных изолятов. Технология микрожидкостных чипов, применяемая в QMAC-DST, эффективна и удобна с точки зрения скорости и выбора тестируемых лекарств, поскольку она адаптировала ту же технологию, что и известные системы быстрого автоматизированного тестирования чувствительности к противомикробным препаратам для бактериальных патогенов, QMAC-dRAST (QuantaMatrix) ( Kim et al., 2018). Таким образом, по сравнению с другими методами быстрого культивирования, такими как MGIT, QMAC-DST имел преимущество в высокой пропускной способности, менее трудоемких процедурах и широкой доступности различных препаратов первого и второго ряда за один запуск, аналогично QMAC- ДРАСТ. Несколько фенотипических методов ТЛЧ, отличных от MGIT-ТЛЧ, были разработаны в кратчайшие сроки. Планшет Sensititre MYCOTB MIC (Trek Diagnostic Systems, Кливленд, Огайо, США), метод определения лекарственной чувствительности под микроскопом, колориметрический окислительно-восстановительный метод ТЛЧ (Woods et al., 2015) и технологии амплификации фага (Albay et al., 2003) в настоящее время доступны в клинических лабораториях. Однако они часто ограничиваются препаратами первого ряда, трудоемкими, малопроизводительными или имеют проблемы с безопасностью. Sensititre MYCOTB с использованием 96-луночных микротитровальных планшетов имеет преимущество в измерении реальной МИК и охвате препаратов первого и второго ряда как QMAC-DST, но для окончательного считывания требуется 3-недельная инкубация (Lee et al., 2019). Более того, высокая степень соответствия эталонному методу означает превосходные характеристики в сочетании с его эффективностью, что делает QMAC-DST идеальной фенотипической системой ТЛЧ в клинических лабораториях, особенно в странах с высокой распространенностью ТБ, таких как Корея.
Ни один vME, обнаруженный в QMAC-DST, не показал большого преимущества в диагностической производительности. Для PAS выявление выбросов ME требует дальнейшей оценки с большим количеством устойчивых к PAS изолятов, потому что были включены только четыре устойчивых изолята, а один из них был пропущен в это исследование. Для сравнения, MGIT-DST показал более низкое согласие, чем QMAC-DST, и значительную vME. Общая степень соответствия MGIT-DST и LJ-DST составила 95,5%, что немного ниже, чем ранее сообщаемые значения 96–97% (Tukvadze et al., 2012; Lawson et al., 2013). Этот более низкий уровень согласия может быть связан с более низкими показателями устойчивости тестируемых изолятов в этом исследовании по сравнению с таковыми в предыдущем исследовании. Поскольку в этом исследовании оценивали только 10 изолятов, устойчивых к этамбутолу, vME MGIT-DST достиг 70%, когда MGIT-DST пропустил семь изолятов. Устойчивость к этамбутолу трудно точно определить с помощью любого фенотипического метода, поскольку диапазоны минимальных ингибирующих концентраций чувствительных к этамбутолу и устойчивых к этамбутолу изолятов близки друг к другу.Поэтому рекомендуемые ВОЗ эталонные методы основаны на различных концентрациях в диапазоне 2,0–7,5 мкг / мл (Rüsch-Gerdes et al., 1999; Said et al., 2012). В метаанализе объединенное среднее значение, основанное на высокой концентрации этамбутола, равной 5 мкг / мл, как в этом исследовании, показало наивысшее соответствие с молекулярным ТЛЧ (Cheng et al., 2014). В этом исследовании и MGIT-DST, и QMAC-DST использовали 5 мкг / мл этамбутола. Напротив, LJ-DST использовала 2 мкг / мл этамбутола. Таким образом, причина большой разницы между MGIT-DST и QMAC-DST остается неясной.Сравнение MGIT-DST и LJ-DST показало, что все препараты первого ряда показали высокие показатели конкордантности, превышающие 95% у чувствительных изолятов, но относительно низкие показатели конкордантности у резистентных изолятов. VME MGIT-DST для изониазида и рифампина составлял 10,5% и 15,8% соответственно. Поскольку эти два препарата показали очень низкий vME с MGIT-DST в предыдущих исследованиях (Piersimoni et al., 2006; Hwang et al., 2014; Zhao et al., 2014), относительно небольшое количество устойчивых изолятов было принято в качестве единственного причина высокого vME (Said et al., 2012; Чжао и др., 2014). Более высокая корреляция QMAC-DST с LJ-DST, чем MGIT-DST, может быть объяснена его адаптацией к тем же критическим концентрациям, что и LJ-DST. Поскольку vME является наиболее серьезной ошибкой, этот низкий уровень vME QMAC-DST требует диагностического использования.
Сравнение QMAC-DST и LJ-DST выявило высокие показатели конкордантности, превышающие 95%, за исключением рифампина, у чувствительных изолятов и 100%, за исключением этамбутола, рифабутина и PAS, у устойчивых изолятов. При ТЛЧ к рифампицину было обнаружено большое количество ложных показаний резистентности.Анализ изображений показал, что устойчивость была завышена из-за ошибочного определения роста в лунках с рифампицином. Рифампицин является суррогатным маркером для выявления МЛУ при использовании в качестве резистентного и основного лекарства от туберкулеза. Следовательно, ТЛЧ к рифампину имеет решающее значение (Pang et al., 2014), особенно в Корее, где недавняя распространенность устойчивости к рифампину составляет 5,7% (Lee et al., 2015). Поскольку результаты QMAC-DST были получены путем наблюдения за ростом отдельных клеток с использованием микроскопических методов, установка пороговых значений для распознавания роста может быть затруднена, когда только часть клетки растет как естественная вариация каждого изолята (Ahmad et al., 2016). Однако большая часть ложной резистентности была обнаружена в лунках с рифампицином, и предполагалось, что субингибирующий эффект рифампицина играет роль. Рифампицин является бактерицидным препаратом, который останавливает синтез белка, ингибируя ДНК-зависимую РНК-полимеразу, однако рифампицин также может активировать транскрипцию гена промотора, чувствительного к кворуму, при субингибирующих концентрациях (Acar and Goldstein, 1996). Более того, паттерны активации различались в жидкой среде по сравнению с твердой средой (Goh et al., 2002). Следовательно, воздействие условий, таких как погруженные в агар бактерии, погруженные в жидкую среду (т.е., QMAC), характеристики роста МТБ остаются неясными. Следовательно, контрольная точка QMAC-DST была дополнительно оптимизирована для рифампицина на основе этого исследования, и, таким образом, все ME были успешно скорректированы.
Ограничением этого исследования было то, что оно не содержало достаточного количества устойчивых изолятов ко всем лекарствам. Устойчивость к препаратам второго ряда все еще очень низка, в основном менее 3% в Корее (Lee et al., 2015). Еще одно ограничение заключается в том, что пиразинамид (PZA), препарат первой линии, не был включен в панель QMAC-DST.Поскольку (PZA) требует других значений pH, в отличие от других препаратов, в настоящее время он находится в стадии разработки для добавления в панель QMAC-DST.
Заключение
В заключение, QMAC-DST — это быстрая и точная альтернатива традиционному DST. Кроме того, QMAC-DST очень ценен в случаях неудачного лечения или в анамнезе пациентов с МЛУ-ТБ, поскольку с его помощью можно тестировать различные препараты первого и второго ряда. Эта полностью автоматизированная высокопроизводительная система DST особенно подходит для лабораторий с большим объемом работ.
Взносы авторов
M-NK и SHK в равной степени внесли свой вклад в обработку этого исследования в качестве авторов-корреспондентов. С.Л. провел эксперименты и написал эту рукопись. DC, YC, EJ, SYK, HK, HJK, JC, HS и BJ способствовали проведению экспериментов и анализу данных. GK внесла свой вклад в анализ данных секвенирования. E-GK внесла свой вклад в разработку и производство микросхемы DST.
Финансирование
Это исследование было поддержано грантом Корейского проекта исследований и разработок в области технологий здравоохранения Корейского института развития индустрии здравоохранения (KHIDI), финансируемого Министерством здравоохранения и социального обеспечения Южной Кореи (номер гранта: HI16C1567).
Заявление о конфликте интересов
SL, EJ, SYK, HK, HJK, GK, BJ, E-GK и SHK работали в компании QuantaMatrix, Inc., которая занимается разработкой и коммерциализацией технологии DST и имеет долю в QuantaMatrix, Inc.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
Акар, Дж. Ф., и Гольдштейн, Ф.W. (1996). «Тестирование чувствительности диска», в Антибиотики в лабораторной медицине , изд. В. Лориан (Балтимор, Мэриленд: Уильямс и Уилкинс), 419–420. DOI: 10.1016 / j.diagmicrobio.2016.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Адами, А.Г., Галло, Дж. Ф., Пинхата, Дж. М., Мартинс, М. К., Джампалья, К. М., и де Оливейра, Р. С. (2017). Модифицированный протокол тестирования лекарственной чувствительности культур MGIT Mycobacterium tuberculosis с помощью MGIT 960. Диагн. Microbiol. Заразить. Дис. 87, 108–111. DOI: 10/1016 / j.diagmicrobio.2016.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахмад, С., Мокаддас, Э., Аль-Мутаири, Н., Элдин, Х. С., и Мохаммади, С. (2016). Несоответствие фенотипических и молекулярных методов тестирования лекарственной чувствительности изолятов Mycobacterium tuberculosis в стране с низкой заболеваемостью ТБ. PLoS One 11: e0153563. DOI: 10,1371 / журнал.pone.0153563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Албай А., Киса О., Байлан О. и Доганчи Л. (2003). Оценка теста FASTPlaqueTB для экспресс-диагностики туберкулеза. Диагн. Microbiol. Заразить. Дис. 46, 211–215. DOI: 10.1016 / S0732-8893 (03) 00048-48
CrossRef Полный текст | Google Scholar
Boehme, C.C., Nabeta, P., Hillemann, D., Nicol, M.P., Shanai, S., Krapp, F., et al. (2010). Быстрое молекулярное определение туберкулеза и устойчивости к рифампину. N. Engl. J. Med. 363, 1005–1015. DOI: 10.1056 / NEJMoa0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беме, К. К., Николь, М. П., Набета, П., Майкл, Дж. С., Готуццо, Э., Тахирли, Р. и др. (2011). Осуществимость, диагностическая точность и эффективность децентрализованного использования теста Xpert MTB / RIF для диагностики туберкулеза и множественной лекарственной устойчивости: многоцентровое исследование внедрения. Ланцет 377, 1495–1505. DOI: 10.1016 / S0140-6736 (11) 60438-60438
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Центры по контролю и профилактике заболеваний [CDC] (2006).Появление Mycobacterium tuberculosis с обширной устойчивостью к препаратам второго ряда — во всем мире. 2000-2004 гг. MMWR Morb. Смертный. Wkly. Rep. 55, 301–305.
PubMed Аннотация | Google Scholar
Ченг, С., Цуй, З., Ли, Ю. и Ху, З. (2014). Диагностическая точность метода молекулярной лекарственной чувствительности для противотуберкулезного препарата этамбутол: систематический обзор и метаанализ. J. Clin. Microbiol. 52, 2913–2924. DOI: 10.1128 / JCM.00560-514.
CrossRef Полный текст | Google Scholar
Choi, J., Kim, E. K., Yoo, J., Lee, M., Lee, S., Joo, S., et al. (2014). Экспресс-тест на чувствительность к противомикробным препаратам на основе морфологического анализа отдельных клеток. Sci. Пер. Med. 6: 174. DOI: 10.1126 / scitranslmed.3009650
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чой, Дж., Ю, Дж., Ким, К. Дж., Ким, Э. Г., Пак, К. О., Ким, Х. и др. (2016). Экспресс-тест на лекарственную чувствительность Mycobacterium tuberculosis с использованием микроскопической покадровой визуализации в агарозной матрице. Прил. Microbiol. Biotechnol. 100, 2355–2365. DOI: 10.1007 / s00253-015-7210-7210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Институт стандартов клинических лабораторий [CLSI] (2016). «Утвержденное руководство M23-A4» в «Разработка критериев чувствительности in vitro и параметров контроля качества» , 4-е изд., Изд. А. Мэтью (Уэйн, Пенсильвания: Институт стандартов клинической лаборатории). DOI: 10.1073 / pnas.252607699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гох, Э.Б., Йим, Г., Цуй, В., МакКлюр, Дж., Суретт, М. Г., Дэвис, Дж. И др. (2002). Транскрипционная модуляция экспрессии бактериальных генов субингибирующими концентрациями антибиотиков. Proc. Natl. Акад. Sci. США 99, 17025–17030. DOI: 10.1073 / pnas.252607699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ханрахан, К. Ф., Дорман, С. Э., Эразм, Л., Коорнхоф, Х., Кутзи, Г., Голуб, Дж. Э. и др. (2012). Влияние расширенного тестирования на туберкулез с множественной лекарственной устойчивостью с использованием генотипа MTBDRplus в Южной Африке: обсервационное когортное исследование. PLoS One 7: e49898. DOI: 10.1371 / journal.pone.0049898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hwang, S.M., Hwang, K.C., Hong, Y.J., Lee, H.R., Kim, T.S., Park, K.U., et al. (2014). Улучшение тестирования чувствительности к противотуберкулезным препаратам с использованием жидких сред. Ann. Clin. Лаборатория. Sci. 44, 123–130. DOI: 10.1038 / s41598-018-26419-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юнг, Ю. Г., Ким, Х., Ли, С., Ким, С., Джо, Э., Ким, Э. Г. и др. (2018). Система быстрого культивирования, не подверженная влиянию инокулята, повышает надежность и удобство тестирования лекарственной чувствительности Mycobacterium tuberculosis . Sci. Реп. 8: 8651. DOI: 10.1038 / s41598-018-26419-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кам, К. М., Слуцкий, А., Ип, К. В., Буллед, Н., Сунг, К. Дж., Зигнол, М., и др. (2010). Определение критических концентраций противотуберкулезных препаратов второго ряда, имеющих клиническое и микробиологическое значение. Внутр. J. Tuberc. Lung Dis. 14, 282–288. DOI: 10.5145 / ACM.2018.21.1.12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kim, H., Jeong, H.Y., Han, S.K., Han, S.H., Choi, J., Jin, B., et al. (2018). Клиническая оценка QMAC-dRAST для прямого и быстрого теста на чувствительность к противомикробным препаратам с грамположительными кокками из бутылочек с положительными культурами крови. Ann. Clin. Microbiol. 21, 12–19. DOI: 10.5145 / ACM.2018.21.1.12
CrossRef Полный текст | Google Scholar
Лоусон, Л., Эменйону, Н., Абдуррахман, С. Т., Лоусон, Дж. О., Узоевулу, Г. Н., Согаолу, О. М., и др. (2013). Сравнение лекарственной чувствительности Mycobacterium tuberculosis с использованием твердой и жидкой культур в Нигерии. BMC Res. Примечания 6: 215. DOI: 10.1186 / 1756-0500-6-215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х. Ю., Ли, Дж., Ли, Ю. С., Ким, М. Ю., Ли, Х. К., Ли, Ю. М. и др. (2015). Структура лекарственной устойчивости штаммов Mycobacterium tuberculosis от пациентов с легочным и внелегочным туберкулезом в период с 2006 по 2013 год в корейском медицинском центре третичного уровня. Кореец J. Intern. Med. 30, 325–334. DOI: 10.3904 / kjim.2015.30.3.325
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж., Армстронг, Д. Т., Ссенгуба, В., Парк, Дж. А., Ю., Ю., Мумба, Ф. и др. (2019). Планшет Sensititre MYCOTB MIC для тестирования чувствительности Mycobacterium tuberculosis к препаратам первого и второго ряда. Антимикробный. Агенты Chemother. 58, 11–18. DOI: 10.1128 / AAC.01209-1213
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Панг, Ю., Ruan, Y.Z., Zhao, J., Chen, C., Xu, C.H., Su, W., et al. (2014). Диагностическая дилемма: результаты лечения больных туберкулезом с непостоянной чувствительностью к рифампицину. Внутр. J. Tuberc. Lung Dis. 18, 357–362. DOI: 10.5588 / ijtld.13.0459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пирсимони К., Оливьери А., Бенаккио Л. и Скарпаро К. (2006). Современные перспективы тестирования лекарственной чувствительности комплекса Mycobacterium tuberculosis : автоматизированные нерадиометрические системы. J. Clin. Microbiol. 44, 20–28.
PubMed Аннотация | Google Scholar
Родригес, К., Джани, Дж., Шенаи, С., Таккар, П., Сиддики, С., и Мехта, А. (2008). Тестирование лекарственной чувствительности Mycobacterium tuberculosis к препаратам второго ряда с использованием системы bactec MGIT 960. Внутр. J. Tuberc. Lung Dis. 12, 1449–1455.
PubMed Аннотация | Google Scholar
Рюш-Гердес, С., Домель, К., Нарди, Г., Гисмондо, М. Р., Велшер, Х.М. и Пфиффер Г. Э. (1999). Многоцентровая оценка пробирки с индикатором роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. J. Clin. Microbiol. 37, 45–48. DOI: 10.1186 / 1471-2334-12-369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саид, Х. М., Кок, М. М., Исмаил, Н. А., Баба, К., Омар, С. В., Осман, А. Г. и др. (2012). Сравнение системы BACTEC MGIT 960 и метода пропорции агара для тестирования чувствительности штаммов туберкулеза с множественной лекарственной устойчивостью в условиях высокой нагрузки в Южной Африке. BMC Infect. Дис. 12: 369. DOI: 10.1186 / 1471-2334-12-369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сиддики С., Ахмед А., Асиф С., Бехера Д., Джавид М., Джоти А. и др. (2012). Прямое тестирование лекарственной чувствительности Mycobacterium tuberculosis для быстрого выявления множественной лекарственной устойчивости с помощью системы Bactec MGIT 960: многоцентровое исследование. J. Clin. Microbiol. 50, 435–440. DOI: 10.1371 / journal.pone.0031563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Туквадзе, Н., Кемпкер, Р. Р., Каландадзе, И., Курбатова, Э., Леонард, М. К., Апсиндзелашвили, Р. и др. (2012). Использование молекулярного диагностического теста у подозреваемых на туберкулез с положительным мазком AFB значительно сокращает время до выявления туберкулеза с множественной лекарственной устойчивостью. PLoS One 7: e31563. DOI: 10.1371 / journal.pone.0031563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Х. Ю., Ээ, Ю., Ким, С., и Ли, Х. (2017a). Производительность системы мультиплексной аналитической платформы Quantamatrix для дифференциации и идентификации видов Mycobacterium . J. Med. Microbiol. 66, 777–787. DOI: 10.1099 / jmm.0.000495
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Х. Ю., Ээ, Ю., Ким, С., и Ли, Х. (2017b). Система мультиплексной аналитической платформы Quantamatrix для прямого обнаружения бактерий и детерминант устойчивости к антибиотикам в бутылях с положительными культурами крови. Clin. Microbiol. Заразить. 23: 333. DOI: 10.1016 / j.cmi.2016.12.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Х.Y., Uh, Y., Kim, S., Shim, T. S., and Lee, H. (2017c). Оценка системы платформы мультиплексного анализа Quantamatrix для одновременного обнаружения Mycobacterium tuberculosis и гена устойчивости к рифампицину с использованием культивированных микобактерий. Внутр. J. Infect. Дис. 61, 107–113. DOI: 10.1016 / j.ijid.2017.06.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вудли, К. Л. (1986). Оценка концентраций стрептомицина и этамбутола для тестирования чувствительности Mycobacterium tuberculosis с помощью радиометрических и обычных процедур. J. Clin. Microbiol. 23, 385–386.
PubMed Аннотация | Google Scholar
Вудс, Г. Л., Лин, С. Ю. Г., Десмонд, Э. П. (2015). «Методы испытаний на чувствительность: Mycobacteria , Nocardia и другие актиномицеты» в Руководстве по клинической микробиологии , 11-е изд., Изд. Дж. Х. Йоргенсен (Вашингтон, округ Колумбия: ASM Press).
Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2009 г.). Руководство по надзору за лекарственной устойчивостью туберкулеза, 4-е изд.Женева: ВОЗ.
Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2015 г.). Глобальный отчет о туберкулезе. Женева: Всемирная организация здравоохранения.
Google Scholar
Zhao, P., Fang, F., Yu, Q., Guo, J., Zhang, J.H., Qu, J., et al. (2014). Оценка системы BACTEC MGIT 960 для тестирования чувствительности Mycobacterium tuberculosis к препаратам первого ряда в Китае. PLoS One 9: e99659. DOI: 10.1371 / journal.pone.0099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ПРОЦЕДУРЫ ОТБОРА ОБРАЗЦОВ НА ТБ — Служба здравоохранения и социального обеспечения штата Делавэр
Mycobacterium tuberculosis , организм, ответственный за туберкулез (ТБ), является основной проблемой общественного здравоохранения в Соединенных Штатах.Однако с увеличением числа бездомных, употребления инъекционных наркотиков и появлением ВИЧ-инфицированных пациентов во многих районах страны произошло значительное увеличение как туберкулезных, так и нетуберкулезных микобактериальных заболеваний (НТМ).
DE Public Health Lab обслуживает штат Делавэр в качестве справочного центра для выявления и / или тестирования чувствительности M. tuberculosis и другие изоляты микобактерий.Быстрые методы, рекомендованные CDC для сокращения времени обработки диагнозов ТБ, а также специальные методы идентификации, необходимые для нетуберкулезных видов Mycobacterium, могут оказаться неприменимыми в местных лабораториях.
ПРЕДЛАГАЕМЫЕ ИСПЫТАНИЯ
- Мазок на кислотоустойчивые бактерии (AFB)
- Культура для AFB
- Идентификация AFB
- Тестирование чувствительности к противомикробным препаратам
- Особые запросы и обработка справок
СБОР, ОБРАЩЕНИЕ И ОТПРАВКА ОБРАЗЦОВ
- Получите расходные материалы, заказав отдельные компоненты со склада этой лаборатории.Расходные материалы можно получить, связавшись с заказы в лабораторию, по факсу или по электронной почте [email protected].
- Заполните форму заявки на тестирование, включая информацию о пациенте или запрос онлайн. через нашу Систему управления лабораторной информацией (LIMS). Образцы и формы должны быть размещены в специально отведенном месте на каждом участке. для курьера лаборатории, чтобы забрать.
- Возьмите образец в соответствии с указаниями, приведенными ниже.
- Пометьте каждый контейнер уникальным идентификатором пациента, именем и датой получения в соответствии с формой заявки. Убедитесь, что крышка плотно закрыта контейнером и упакована отдельно.
- Поместите образец и форму заявки, если необходимо, в пакет для биологически опасных материалов для транспортировки в лабораторию.Убедитесь, что образец запечатан. внутри двойного мешка, а форма вставляется во внешний карман, отделенный от самого образца. Доставка в лабораторию курьерской службой. ДЕЛАТЬ НЕ по почте.
МАТЧА (ОТХРАННАЯ)
Необходимо предоставить три образца, полученные ранним утром в разные дни.Достаточно объема от 5 до 10 мл, и нет преимущество в сборе большего объема. Образец должен содержать недавно выделившийся материал из бронхиального дерева с минимальным содержание слюны.
МАТЧА (ВЫВЕДЕННАЯ)
Если у пациента возникают трудности с получением образца мокроты, следует рассмотреть возможность индукции.Производство мокроты может быть вызвано вдыхание теплого аэрозоля стерильного 5-10% хлорида натрия в воде, производимого небулайзером.
Образец должен иметь четкую пометку «INDUCED» на бланке запроса, так как распыленная мокрота имеет водянистую консистенцию и может быть ошибочно принимают за слюну.
ПРОМЫВАНИЕ ЖЕЛУДКА
Эту процедуру можно использовать, когда не удается получить мокроту.Эта техника требует профессионального внимания и должна покушение в больнице. Промывание желудка проводят рано утром перед едой и не менее чем через 8 часов после того, как пациент ел или принимал пероральные препараты. Требуется образец объемом 5-10 мл, который необходимо нейтрализовать 100 мг карбоната натрия.
МОЧА
Образец из середины ручья следует собирать рано утром.Отправьте образец целиком. Для получить положительный образец. Из-за загрязнения и порчи образцы мочи за 24 часа НЕ принимаются. Хранить образец в холодильнике до транспортировки.
КРОВЬ
Образцы следует собирать в изоляторные пробирки, которые можно получить по запросу в комнате с наборами этой лаборатории.Проверьте срок годности до кровь. Храните пробирки при комнатной температуре. Транспортировать в тот же день сбора.
ЖИДКОСТИ
Биологические жидкости (спинномозговые, плевральные, перикардиальные, синовиальные, асцитические, кровь, гной и костный мозг) должны собираться в асептических условиях и отправляться в стерильные контейнеры. Хранить в холодильнике до транспортировки.
ТКАНЬ
Любую ткань для культивирования необходимо собрать в асептических условиях в стерильный контейнер без фиксаторов и консервантов. Если образец может высушите, добавьте стерильный физиологический раствор, чтобы он оставался влажным. Не помещайте образец ткани для культивирования в формалин. Хранить в холодильнике до транспортировки.
ИЗОЛЯЦИИ ИЛИ КУЛЬТУРЫ ДЛЯ ИДЕНТИФИКАЦИИ И / ИЛИ УСТОЙЧИВОСТИ
Изоляты должны быть представлены в виде чистых свежих субкультур на средах Миддлбрука 7h20 или Левенштейна-Йенсена, когда это возможно, но жидкие патентованные бульоны 7H9 приемлемы (т.е. MGIT или флакон BacT / Alert MP). Включите предварительную идентификацию в форму заявки на тестирование. Если направление в CDC является вероятным или специально запрошенным, образец должен сопровождаться заполненной черточкой CDC.
ИСПЫТАНИЯ
Эта лаборатория использует систему Bactec MGIT 960 TB для обнаружения AFB в образцах и проведения тестов на чувствительность.
Прямая идентификация из прямых образцов (т. Е. Из легких), а также из выращенных культур (бульон или выращенные изоляты) выполняется с помощью лабораторно разработанного теста (LDT) с использованием полимеразной цепной реакции в реальном времени (qPCR).
Обычная восприимчивость применима только к M. tuberculosis complex (Mtbc).
Первичное тестирование лекарственной чувствительности (ТЛЧ): изониазид, рифампицин, этамбутол, пиразинамид проводится в DPHL (при необходимости).Панели вторичных препаратов или быстрое первичное ТЛЧ направляются в лабораторию по изучению микробных заболеваний CA (MDL) или CDC, когда это необходимо или требуется.
Тесты, требующие дополнительных специализированных методов, могут быть отнесены к CDC или CA MDL.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
В соответствии с рекомендациями CDC по уменьшению распространения M.tuberculosis, эта лаборатория предоставляет следующие результаты AFB:
- Флуоресцентное кислотостойкое окрашивание исходного образца: 24–72 часа с момента поступления в лабораторию.
- Идентификация M. tuberculosis в культуре: как можно скорее, но в течение 14–21 дней с момента получения образца.
- Результаты восприимчивости для M.tuberculosis : как можно скорее, но в течение 15–30 дней с момента получения образца.
ПРИМЕЧАНИЕ. Все положительные результаты будут считаться в тот же день обнаружения.
ОТКАЗ
Образцы будут отклонены, если они:
- Без надписи — все образцы ДОЛЖНЫ иметь уникальный идентификатор пациента.
- Дата получения не указана
- Недостаточно количества — Образец не получен, образец в контейнере или образец недостаточен для проведения испытания.
- Мокроты, содержащие
- Моча с
- Damaged — Образец протек или сломался во время транспортировки.
- Too Old — образцы старше 3 дней являются ненадежными образцами для тестирования.
- Загрязненный — Изоляты или субкультуры будут отклонены, если невозможно выделить тестовый организм.
Вернуться на страницу «Выполненные тесты»
Вернуться на страницу Лаборатории общественного здравоохранения Делавэра
Обратите внимание: некоторые файлы, доступные на этой странице, находятся в формате Adobe PDF, для которого требуется Adobe Acrobat Reader.Бесплатную копию Adobe Acrobat Reader можно загрузить прямо с Adobe. Если вы используете вспомогательную технологию и не можете читать Adobe PDF, просмотрите соответствующую текстовую версию (если она доступна) или посетите страницу Adobe Accessibility Tools.
Реагент для кожных тестов с определенным молекулярным уровнем для диагностики туберкулеза крупного рогатого скота, совместимый с вакцинацией против болезни Джона
Выбор антигенов для включения в MDT
Для выбора дополнительных антигенов, которые могут быть добавлены к трем антигенам DST ESAT-6, CFP -10 и Rv3615c, мы подготовили список кандидатов в антигены (таблица 1).Эти белки были выбраны потому, что в ранее опубликованных и неопубликованных исследованиях, проведенных в нашей лаборатории, они показали многообещающую способность распознавать специфический у инфицированного крупного рогатого скота, но не у наивного крупного рогатого скота или у тех, кто сенсибилизирован микобактериями окружающей среды. Однако они не продемонстрировали полезности DIVA, поскольку вакцинированные БЦЖ животные действительно распознавали эти белки. Восемнадцать белков были перечислены и получены либо в виде рекомбинантных белков, либо в виде набора перекрывающихся 20-членных пептидов. Для уменьшения пула кандидатов антигены применяли в IGRA с использованием криоконсервированных мононуклеарных клеток периферической крови (PBMC) крупного рогатого скота, естественно инфицированных M.bovis , или от животных, свободных от bTB (по 14 животных). Рекомбинантный ESAT-6, CFP-10 и Rv3615c также были включены в этот скрининг. Как и ожидалось при тестировании образцов из беспородных популяций, для антигенов наблюдался широкий диапазон ответов (Таблица 1). Критериями отбора для включения антигена в реагент MDT было то, что они не вызывали ответов у неинфицированных животных, но стимулировали статистически значимо более сильные ответы в PBMC от инфицированных животных по сравнению с неинфицированными контрольными животными.Четыре из 18 протестированных антигенов соответствовали этим критериям (Rv1789, Rv3478, Rv3616c и Rv3810 выделены жирным шрифтом в таблице 1). Кроме того, ответы на ESAT-6, CFP-10 и Rv3615c также были сильнее в PBMC от инфицированных животных по сравнению с неинфицированными контролями. В дополнение к четырем новым антигенам мы также включили в MDT ранее описанный антиген, Rv3020c 13,14 . Таким образом, состав MDT, который нужно было использовать в кожном тесте in vivo и в IGRA in vitro, описанных в следующих абзацах, был следующим: Rv1789, Rv3020c, Rv3478, Rv3615c, Rv3616c, Rv3810, Rv3874 (CFP-10) и Rv3875. (ESAT-6).Этот прототип MDT был составлен в виде коктейля из 7 рекомбинантных белков (Rv1789, Rv3020c, Rv3478, Rv3615c, Rv3810, Rv3874 и Rv3875) и одного набора перекрывающихся синтетических пептидов, представляющих Rv3616c (дополнительная таблица 2). Ответы, индуцированные MDT, сравнивали с коктейлем DST рекомбинантных белков ESAT-6, CFP-10 и Rv3615c.
Таблица 1 Сводная информация об антигенах и ответах на IFN-γ PBMC.Реакция кожных тестов на MDT
На следующем этапе этого проекта мы провели кожные тесты с реагентом MDT в четырех группах животных: экспериментально M.bovis инфицированный крупный рогатый скот (n = 22), естественно M. bovis инфицированных животных (n = 21), наивный контроль (n = 30) и группа телят, вакцинированных против JD с использованием вакцины Gudair (n = 29). MDT, DST, PPD-B и PPD-A вводились в порядке латинского квадрата. Результаты показаны на фиг.1. Как и ожидалось, сильные ответы PPD-B наблюдались в обеих группах из инфицированных M. bovis животных, что приводило к ответу CCT с сильным смещением по PPD-B (PPD-B минус PPD-A) ( Рисунок 1). Экспериментально инфицированные телята показали значительно более сильную реакцию кожи на MDT, чем на DST ( p <0.0001), а ответы на ТЛЧ также были значительно ниже по сравнению с КСТ ( p = 0,0060). Значительно повышенная реактивность MDT по сравнению с DST была подтверждена при тестировании естественно инфицированного крупного рогатого скота (рис. 1, p = 0,0012). Интересно, что MDT также вызывал значительно более выраженные реакции, чем определено с CCT (рис. 1, p <0,0001). Специфичность как ДСТ, так и МДТ была подтверждена их невосприимчивостью к наивному КРС (рис. 1). Эффективная сенсибилизация к антигенам MAP после вакцинации Gudair была продемонстрирована сильными реакциями кожной пробы, наблюдаемыми после PPD-A, что также привело к сильно смещенным ответам CCT на PPD-A (рис.1). С другой стороны, DST и MDT вызвали отсутствие или очень слабые реакции кожных проб у животных, вакцинированных Gudair, что еще больше подчеркивает их специфичность (рис. 1). Таким образом, мы смогли продемонстрировать в этой серии экспериментов, что MDT вызывал реакции кожных тестов с повышенной силой сигнала по сравнению с DST со сравнительно высокой специфичностью.
Рисунок 1Сравнение реакций кожных проб, вызванных MDT и DST, у крупного рогатого скота. Реакции кожных проб на реагенты PPD, DST и MDT измеряли через 72 часа после инъекции у крупного рогатого скота, экспериментально инфицированного M.bovis ( n = 22), крупный рогатый скот, естественно инфицированный M. bovis (n = 21), наивный контроль ( n = 30) и вакцинированный Gudair (n = 29). Результаты выражаются как разница в толщине кожи между показаниями до и после кожного теста. Каждый символ представляет отдельное животное, а горизонтальные линии представляют собой групповые медианы. ** p <0,01, **** p <0,0001, тест Фридмана с тестом множественных сравнений Данна.
Чтобы оценить, трансформируется ли повышенный уровень сигнала, наблюдаемый с помощью MDT, в повышенную чувствительность при более надежных пороговых значениях по сравнению с DST, мы применили диапазон значений отсечки, чтобы свести в таблицу относительную чувствительность и специфичность DST и MDT, и сравнили эти значения к соответствующим значениям, полученным с CCT и SCT.Как показано в таблице 2, мы оценили влияние различных пороговых значений ТЛЧ и МДТ на чувствительность и специфичность в диапазоне от ≥ 2 мм (граница, обычно применяемая к ТЛЧ) до ≥ 5 мм. При всех примененных пороговых значениях MDT проявлял большую чувствительность у экспериментально и естественно инфицированных животных по сравнению с DST, причем эта улучшенная чувствительность становилась статистически значимой при пороговом значении ≥ 5 мм (с относительной чувствительностью 100% и 73%). для MDT и DST соответственно у экспериментально инфицированного крупного рогатого скота и 71% и 29% соответственно у естественно инфицированного крупного рогатого скота, p <0.05 и p <0,01, таблица 2). В обеих группах инфицированного крупного рогатого скота чувствительность к MDT при всех примененных порогах соответствовала чувствительности SCT с перекрывающимся 95% доверительным интервалом (таблица 2). Напротив, чувствительность к MDT при всех примененных пороговых значениях была выше по сравнению с CCT при интерпретации пороговых значений> 4 мм и> 2 мм в обеих группах инфицированных животных (таблица 2). Более того, при сравнении с CCT, интерпретируемой при пороговом значении B> A, эквивалентная чувствительность MDT при всех примененных пороговых значениях наблюдалась у экспериментально инфицированного крупного рогатого скота.Аналогичные результаты наблюдались у естественно инфицированного крупного рогатого скота, за исключением того, что несколько более низкая чувствительность к MDT наблюдалась при более высоких пороговых значениях (≥ 4 и ≥ 5 мм) по сравнению с интерпретацией CCT B> A, хотя они не были достичь статистической значимости. Относительная чувствительность ТЛЧ при порогах ≥ 2 и ≥ 3 мм также соответствовала ЧМТ при пороге> 4 мм у экспериментально инфицированных животных, причем пороговая чувствительность ТЛЧ ≥ 2 мм соответствовала относительной чувствительности для ЧМТ на > 2 мм интерпретации и лишь немного ниже, чем CCT при интерпретации B> A, в этой группе животных.В группе естественно инфицированного крупного рогатого скота ТЛЧ при граничных значениях до ≥ 4 мм выполнялось так же, если не лучше, чем ТЛЧ, интерпретированное при граничных значениях> 4 и> 2 мм, с ТЛЧ ≥ 2 мм. отсечка почти соответствует относительной чувствительности для CCT с использованием интерпретации B> A.
Таблица 2 Сравнение результатов кожных проб при определенных пороговых значениях.Значения относительной специфичности в тех же самых точках отсечения, описанных выше, сравнивались после рассмотрения результатов, полученных на неопытном и вакцинированном Гудаиром скоте (Таблица 2).У неопытных контрольных животных не наблюдалось ложноположительных ответов на ТЛЧ и МДТ при любом примененном пороговом значении, а также при применении ТГК и КСТ при любых критериях интерпретации (100% специфичность, таблица 2). В то время как низкие положительные ответы (2 мм) наблюдались у животных, вакцинированных 3/29 Gudair после инъекции ТЛЧ, повышение порогового значения ТЛЧ до ≥ 3 мм восстановило специфичность в этой группе до 100% (Таблица 2). Точно так же инъекция MDT вызвала низкие кожные реакции у 4/29 и 1/29 животных в точках отсечения ≥ 2 и ≥ 3 мм соответственно, в то время как 100% специфичность восстанавливалась путем применения точки отсечения MDT ≥ 4 мм (Таблица 2).Как и ожидалось на основании ответов CCT, связанных с высоким уровнем PPD-A, все вакцинированные Gudair животные дали отрицательный результат CCT при всех интерпретациях. Однако специфичность SCT была серьезно нарушена в вакцинах Gudair, из которых 79% дали положительный результат (специфичность 21%, таблица 2). В заключение мы продемонстрировали, что MDT позволяет более надежно устанавливать точки отсечки, чем это возможно для DST. Это позволило нам сопоставить показатели SCT во всех группах животных (при использовании порогового значения ≥ 4 мм для MDT) и, по крайней мере, соответствовать и, возможно, превзойти показатели CCT при применении этого отсечения MDT.Кроме того, MDT не снижает специфичность вакцинированных Gudair животных, как это наблюдалось для SCT, и, предположительно, также преодолевает маскирующий эффект вакцинированных Gudair или инфицированных MAP животных, которые также инфицированы M. bovis , который возникает при использовании CCT. у таких дважды инфицированных животных из-за высоких ответов PPD-A.
Применение MDT в IGRA
IGRA — это ценный дополнительный тест для наблюдения, применяемый наряду с кожными тестами для максимального выявления инфицированных животных.Поэтому было актуально исследовать производительность MDT в этом тестовом формате. Образцы были получены от тех же животных, что описаны выше (22 экспериментально инфицированных, 21 естественно инфицированный крупный рогатый скот, 29 телят, вакцинированных Gudair, и увеличенная группа из 59 наивных животных). Образцы крови были взяты перед инъекцией антигена для кожной пробы и стимулированы in vitro с помощью MDT, DST, PPD-A и PPD-B. В пилотном эксперименте мы определили, что DST и MDT работают оптимально с точки зрения чувствительности и специфичности при концентрации анализа 0.1 мкг / мл. PPD-A и PPD-B использовались в концентрациях, которые они применяют в рутинной программе эпиднадзора Великобритании (250 и 300 МЕ / мл, соответственно). Результаты этого анализа показаны на рис. 2. Как и в случае реакции кожных проб, представленных в предыдущем абзаце, MDT индуцировал значительно более высокие уровни IFN-γ у экспериментально и естественно инфицированного крупного рогатого скота по сравнению со стимуляцией DST (рис. 2). p = 0,0020 и p <0,0001 соответственно). Традиционная интерпретация IGRA основана на пороговом значении, рассчитанном путем вычитания IFN-γ, индуцированного PPD-A, из IFN-γ, индуцированного стимуляцией PPD-B (B – A).Обнадеживает тот факт, что хотя ответы, вызванные ТЛЧ у обеих категорий инфицированного крупного рогатого скота, были значительно ниже, чем значения В – А (рис. 2, p <0,0001 для экспериментально и естественно инфицированных животных), индуцированный МДТ IFN- γ-ответы существенно не различались, что еще раз подтверждает, что MDT является более мощным индуктором IFN-γ у инфицированных животных, чем DST (рис. 2). Как неинфицированные контрольные животные, так и вакцинированные Gudair показали сильные ответы PPD-A, которые привели к ответам B-A, смещенным к PPD-A (рис.2). Напротив, ни DST, ни MDT-стимулированные образцы от вакцинированных Gudair или неинфицированных контрольных животных не приводили к ответам IFN-γ выше фона культур без антигена (фиг. 2).
Рисунок 2Количественная оценка MDT и DST, индуцированной продукции IFN-γ in vitro. Образцы крови крупного рогатого скота, экспериментально зараженного M. bovis ( n = 22), крупного рогатого скота, естественно инфицированного M. bovis (n = 21), контрольных животных ( n = 59) и вакцинированных Гудаиром (n = 29) стимулировали in vitro реагентами PPD, DST и MDT, а продукцию IFN-γ измеряли с помощью ELISA.Каждый символ представляет отдельное животное, а горизонтальные линии представляют собой групповые медианы. ** p <0,01, *** p <0,001, **** p <0,0001, тест Фридмана с тестом множественных сравнений Данна.
Затем мы интерпретировали эти данные, используя в качестве порогового значения оптической плотности антиген минус нулевой антиген IFN-γ при 450 нм> 0,1. Это пороговое значение, используемое в рутинных контрольных тестах GB IGRA как для ответов B – A, так и для ответов ESAT-6 / CFP-10.Результаты этого анализа по четырем группам животных в отношении относительной чувствительности и специфичности показаны в Таблице 3. Параллельно с результатами кожных тестов, MDT смог выявить как естественным, так и экспериментальным путем инфицированных M. bovis крупного рогатого скота с высокой относительной чувствительностью. (100% животных в обеих группах, таблица 3) соответствует показателям B – A в этих когортах. Напротив, ТЛЧ обнаружила значительно меньшую долю инфицированных животных (63% и 68% экспериментально или естественно инфицированных животных соответственно, различия в обеих группах были значительными с p <0.05, тест Макнемара, таблица 3). И ТЛЧ, и МДТ показали высокую специфичность (97–100%), сравнимую со специфичностью, наблюдаемой для PPD птиц и крупного рогатого скота (B – A) в двух неинфицированных группах (неинфицированный контроль и вакцинация Gudair, таблица 3). Таким образом, эти данные также демонстрируют превосходную эффективность антигенов MDT при применении в IGRA. Кроме того, эти данные также ясно демонстрируют, что тестирование IGRA на основе MDT можно использовать без вмешательства вакцинации Gudair, чтобы служить в качестве вспомогательного теста к тестированию на коже с целью максимального выявления животных bTB во время очистки стада.
Таблица 3 Результаты тестов IGRA a для реагентов DST и MDT.Кожный тест на определенный антиген для диагностики туберкулеза крупного рогатого скота
ВВЕДЕНИЕ
Туберкулез, вызванный Mycobacterium tuberculosis var. туберкулез — одно из самых смертоносных инфекционных заболеваний в мире, уносящее до трех человеческих жизней каждую минуту ( 1 — 3 ). Близкородственный M. tuberculosis var. bovis ( M. bovis ) является основной причиной туберкулеза у самых разных животных-хозяев, включая крупный рогатый скот [туберкулез крупного рогатого скота (bTB)], и значительно ограничивает продуктивность животноводства ( 4 , 5 ).bTB представляет собой серьезную зоонозную угрозу и, по оценкам, является причиной примерно 10% от общего числа случаев туберкулеза среди людей во всем мире ( 6 — 8 ). В то время как bTB хорошо контролируется в большинстве стран с высоким уровнем дохода за счет реализации строгих стратегий тестирования и отбраковки, это заболевание остается эндемическим в большинстве стран с низким и средним уровнем доходов, где национальные программы борьбы еще не реализованы по социально-экономическим причинам, и, следовательно, продолжает вносить серьезные потери в продуктивность животноводства наряду с заболеваемостью и смертностью людей ( 9 — 12 ).На основе подхода, первоначально разработанного более века назад, текущий стандарт диагностики bTB у животных измеряет клеточно-опосредованный иммунный ответ после внутрикожной кожной пробы с плохо определенным и сильно вариабельным антигеном туберкулиновой кожной пробы (TST) ( 13 , 14 ). Совсем недавно тест высвобождения интерферона-γ (IFN-γ) in vitro (IGRA) был введен в качестве вспомогательного теста для повышения общей чувствительности обнаружения bTB-инфицированных животных ( 15 , 16 ).Плохо стандартизированные стимулирующие антигены в TST [«очищенное производное белка» (PPD)] представляют собой экстракты, полученные из убитых нагреванием культур определенных штаммов микобактерий, выращенных на глицериновом бульоне ( 17 , 18 ). Например, бычий PPD (PPD-B) получают из экстракта культуры штамма M. bovis AN5, тогда как птичий PPD (PPD-A) представляет собой аналогично полученный экстракт из M. avium subsp. avium D4ER ( 19 ). В регионах с высоким уровнем воздействия микобактерий окружающей среды разница в усилении реакции уплотнения кожи между PPD-B и PPD-A устанавливается с помощью единого внутрикожного сравнительного цервикального туберкулинового теста (SICCT) для повышения специфичности теста, но, как известно, снижает чувствительность анализа ( 13 ).Кроме того, помимо плохой стандартизации PPD, наличие перекрестно-реактивных антигенов между патогенными и вакцинными штаммами в неочищенном препарате цельноклеточного антигена делает TST на основе PPD неспособным отличить инфицированных от бациллы Кальметта-Герена (БЦЖ). –Вакцинированные животные (DIVA), что ограничивает возможности для разработки программ контроля на основе вакцинации БЦЖ ( 20 — 23 ). Следовательно, существует общепризнанная и срочная потребность в разработке определенных диагностических тестов bTB на основе антигенов с возможностями DIVA для использования вместе с будущими (основанными на вакцинации) программами контроля в регионах, где традиционные стратегии тестирования и отбраковки неосуществимы по социально-экономическим причинам ( 24 ).За последние два десятилетия сравнительный анализ генома и транскриптома выявил несколько специфических антигенов M. bovis с функцией DIVA, включая ESAT-6, CFP-10 и Rv3615c, которые присутствуют в полевых штаммах M. bovis , но являются либо отсутствует, либо не является иммуногенным в широко используемом вакцинном штамме БЦЖ ( 25 , 26 ). При использовании в комбинации эти антигены показали себя многообещающими как для выявления инфицированных животных, так и для дифференциации их от животных, вакцинированных БЦЖ, тем самым открывая путь для разработки столь необходимого кожного теста на определенные антигены (DST) с возможностью DIVA ( 27 ). ).Основываясь на этой многообещающей более ранней работе, целью настоящего исследования было разработать и оценить пептидный коктейль минимальной сложности в качестве определенного антигена для кожных тестов с возможностью DIVA, который мог бы служить надежным, простым в производстве и пригодным для использования целевой тест для диагностики bTB. Наконец, значительным преимуществом реагентов на основе пептидов является возможность их использования в регулирующих условиях, например в Индии, где генетически модифицированные или рекомбинантные белки с синтетическими метками либо не разрешены, либо сталкиваются с высоким порогом утверждения.Наши исследования показывают, что это ТЛЧ на основе пептидов не только имеет равные или превосходящие рабочие характеристики по сравнению с существующим стандартным тестом для наблюдения за туберкулином, но также устраняет многие ограничения существующих тестов, позволяя при этом разрабатывать и внедрять критически необходимые программы вакцинации для ускорения контроля над bTB. в условиях высокой распространенности среди людей и bTB, где это больше всего необходимо.
ОБСУЖДЕНИЕ
Сравнительный геномный, транскриптомный и протеомный анализы выявили несколько многообещающих M.bovis с функцией DIVA, включая высокоиммуногенные белки ESAT-6, CFP-10 и Rv3615c, которые присутствуют в M. bovis , но отсутствуют или не являются иммуногенными во всех штаммах вакцины БЦЖ ( 26 , 27 , 31 — 34 ). Эти белки, используемые в комбинации с определенными антигенами, показали большие перспективы для выявления животных, инфицированных M. bovis , и для дифференциации их от животных, вакцинированных БЦЖ, как при кожных пробах, так и в лабораторных анализах.Расширяя эти данные с помощью ТЛЧ на основе рекомбинантных белков, результаты текущего исследования показывают, что гибридный белок, содержащий эти три антигена, был способен вызывать специфические реакции кожных проб для выявления инфицированного крупного рогатого скота (рис. 1). Тем не менее, реагенты на основе пептидов могут иметь потенциал для использования даже в регионах с высокими регуляторными барьерами для использования in vivo продуктов рекомбинантного происхождения у сельскохозяйственных животных, и наша работа, описанная здесь с использованием синтетических пептидов, была предпринята для преодоления ограничений на использование рекомбинантных белков в такой регуляторной среде.ТЛЧ на основе синтетических пептидов для диагностики bTB недавно показало себя многообещающим в качестве альтернативы рекомбинантным белкам ( 27 , 31 , 32 , 35 ). Однако эти пептидные коктейли состояли из больших и сложных наборов коротких перекрывающихся 16-20-мерных пептидов с ограниченным коммерческим использованием в качестве реагента для кожных тестов из-за проблем со стоимостью, связанных с производством и обеспечением качества сложных пептидных смесей. Чтобы решить эти проблемы, наши текущие исследования показывают, что менее сложный коктейль из 40-мерных перекрывающихся пептидов (PCL) превосходит рекомбинантный слитый белок в IGRA и эквивалентен в индукции кожных реакций у инфицированных животных, сохраняя при этом высокую специфичность у наивных животных. или вакцинированные БЦЖ животные.Мы попытались уменьшить сложность пептидного коктейля путем картирования иммунодоминантных пептидов в пределах PCL, а также более короткого набора перекрывающихся пептидов с использованием анализов ELISpot (рис. 2). Полученные данные свидетельствуют о том, что, хотя большинство пептидов PCL были хорошо узнаваемы, меньшая подгруппа оказалась плохо антигенной по причинам, которые не до конца понятны, но могут включать стерические затруднения при подборе пептидов в канавке связывания MHC или несоответствующий процессинг ( 36 , 37 ).Например, CL1 оказался плохо распознаваемым в анализах ELISpot, в то время как короткий пептид CS2, последовательность которого расположена в CL1, распознавался беспорядочно (рис. 2). Напротив, ряд длинных пептидов, таких как CL3 и CL4 на С-конце CFP-10, вызывал гораздо более сильный ответ, чем короткие пептиды CS6 на CS10, которые покрывают тот же участок последовательности. Эти наблюдения подчеркивают возможность оптимизации и уточнения состава коктейля путем включения комбинаций иммунодоминантных длинных и коротких пептидов, которые вместе вызывали как широкие, так и беспорядочные реакции.Чтобы изучить эту возможность, была разработана усовершенствованная комбинация пептидных антигенов (PC-1, таблица S1) и оценена in vitro и в исследованиях на животных. Результаты показали аналогичную реакцию на IFN-γ in vitro как PC-1, так и PCL у реакторного крупного рогатого скота (рис. 3). Поскольку исследования, проводимые в контролируемых экспериментальных условиях, часто переоценивают эффективность диагностических тестов по сравнению с полевыми исследованиями, мы затем попытались оценить эффективность пептидных коктейлей в полевых условиях в эндемичных по bTB регионах.Результаты показывают, что нет существенной разницы в доле животных, у которых в кожных пробах были получены положительные результаты на PC-1 и PCL (фиг. 4B). Вместе эти данные предоставляют убедительные доказательства возможности снижения сложности пептидного коктейля даже при дальнейшем улучшении и оптимизации рабочих характеристик за счет выбора оптимальной комбинации доминирующих длинных и коротких пептидов для включения в качестве определенного антигена кожной пробы. В условиях эндемичных стран относительная чувствительность пептидных коктейлей PCL и PC-1 была оценена в группе из 25 естественно инфицированных реакторных кроссбредных животных в Эфиопии.Результаты подтверждают, что относительная диагностическая чувствительность синтетических пептидных коктейлей (PCL и PC-1) существенно не отличалась от чувствительности одиночного интрадермального теста (SIT) (PPD-B) (фиг. 4B). Напротив, на уровне 48% относительная чувствительность ответа PPD (BA) была на 40% ниже, чем наблюдаемая для одного PPD-B, что позволяет предположить, что у этих животных относительная чувствительность широко используемой и Всемирной организации здравоохранения животных / Метод SICCT, предписанный Office International des Epizooties (OIE), для эндемичных регионов был значительным ( P = 0.005; Точный Фишер; двусторонний) ниже, чем у СИТ. Хотя это открытие не совсем неожиданно, учитывая вероятное высокое бремя микобактерий окружающей среды в Эфиопии и других странах, в которых bTB остается эндемичным, он подчеркивает основную дилемму кожных тестов на основе туберкулина в эндемичных по bTB странах с высоким или неизвестным бременем микобактерий окружающей среды. : Использование одного PPD-B, как и в случае с SIT, часто приводит к высокому уровню ложноположительных результатов из-за сенсибилизации микобактериями окружающей среды, и, наоборот, сравнительный тест (SICCT) имеет потенциал для высокого уровня ложноотрицательных результатов из-за на маскировку ответов PPD-B у животных, сенсибилизированных микобактериями окружающей среды ( 13 , 29 ).Напротив, при использовании определенных антигенов ТЛЧ может устранить многие ограничения традиционных тестов на основе туберкулина, а также дает возможность получить диагностическую чувствительность, эквивалентную таковой у SIT, и специфичность, равную или превышающую SICCT, все в пределах Результаты этого и других исследований ( 27 , 35 ) показывают, что использование определенных антигенов обеспечивает значительно меньшую амплитуду кожных реакций у реакторных животных (в данном исследовании: 8 ± 1.5 мм с PCL по сравнению со средним значением 19,5 ± 3,5 мм с PPD-B) без снижения чувствительности. Кроме того, поскольку ТЛЧ устраняет необходимость введения PPD-A для повышения специфичности теста, животные, которые подвергаются воздействию микобактерий окружающей среды, у которых отсутствуют или не экспрессируются антигены ТЛЧ, остаются инертными, обеспечивая значительное техническое преимущество, а также пользу для благополучия животных, когда с учетом регулярного наблюдения за животными в регионах с высокой подверженностью микобактериям окружающей среды.В то время как ТЛЧ демонстрирует большие перспективы в качестве теста, пригодного для использования в повседневном наблюдении и диагностике животных, инфицированных bTB, учитывая несоответствие между различными тестами, используемыми для диагностики bTB в полевых условиях (рис. 4 и рис. S4). , для будущих исследований будет важно установить истинный статус инфекции у животных в полевых реакторах, чтобы получить надежные оценки чувствительности или специфичности теста. Например, хотя весь крупный рогатый скот, включенный в наш эксперимент в Эфиопии, предположительно имел M.bovis — инфицированные животные, поскольку они были частью сильно инфицированного стада и, по крайней мере, были сильно подвержены воздействию M. bovis в своей среде, их истинный статус инфекции остается неизвестным без проведения тщательного патологоанатомического исследования, что является проблемой даже в странах с высоким уровнем дохода. Из-за отсутствия точного эталонного прижизненного теста на инфекцию неудивительно, что испытания по валидации диагностики туберкулеза трудно проводить в полевых условиях, особенно в условиях эндемичных стран ( 38 , 39 ).Для решения этой проблемы потребуются крупномасштабные программы эпиднадзора в условиях эндемичных стран в сочетании с мощными статистическими подходами, включая оценку максимального правдоподобия и байесовские выводы для точных оценок эффективности ТЛЧ или ТКП. Мы отмечаем, что хотя 2-миллиметровое пороговое значение для ТЛЧ, примененное в текущем исследовании, было установлено с использованием анализа ROC, его необходимо будет пересмотреть по мере появления дополнительных данных полевых испытаний с ТЛЧ, чтобы обеспечить оптимальный баланс между чувствительностью и специфичностью в соответствующих географических регионах. чтобы наилучшим образом удовлетворить местные потребности.Важной задачей, остающейся в области диагностики bTB, является повышение эффективности туберкулиновых тестов. Наше текущее исследование предоставляет убедительные доказательства того, что определенное ТЛЧ на основе пептидов может представлять собой многообещающую альтернативу традиционным туберкулиновым тестам для диагностики bTB в полевых условиях и, кроме того, дает возможность отличать инфицированных от вакцинированных БЦЖ животных, тем самым преодолевая серьезное препятствие для реализация программ вакцинации крупного рогатого скота БЦЖ как ключевого компонента борьбы с болезнями в странах с низким и средним уровнем доходов.
Обнадеживающие результаты предварительных испытаний безопасности (не показаны) с DST в Bos taurus ssp. indicus кроссбредный крупный рогатый скот в условиях надлежащей лабораторной практики (GLP) в Индии с повторными экспериментами и экспериментами по передозировке предполагает, что ТЛЧ является безопасным. Необходимы дальнейшие усилия для оценки характеристик ТЛЧ в более крупных когортах инфицированных, контрольных животных и животных, вакцинированных БЦЖ, в полевых условиях, чтобы соответствовать стандартам МЭБ для валидации анализов, а также обеспечить научную основу для внедрения ТЛЧ в национальных БТБ. программы наблюдения и контроля и крайне необходимые инструменты для ускорения контроля над bTB в 21 веке.
МАТЕРИАЛЫ И МЕТОДЫ
Антигены и пептиды
Коммерческие препараты бычьего туберкулина (PPD-B) и птичьего туберкулина (PPD-A, Thermo Fisher Scientific) использовали для стимуляции PBMC в конечной концентрации 300 и 250 МЕ / мл. соответственно, согласно инструкции к набору. Два набора пептидов [PCL, 40-мерная длина с перекрытием 20-остатков; PCS (пептидный коктейль — короткий), от 16 до 20 меров с перекрытием от 8 до 12 остатков] были химически синтезированы до минимальной чистоты 98 и 85% соответственно.Идентичность подтверждали масс-спектрометрией (аминокислотные последовательности см. В таблице S1). Слитый рекомбинантный белок, меченный гистидином, ESAT-6, CFP-10 и Rv3615c, экспрессируемый в Escherichia coli , очищали с помощью аффинной хроматографии на никеле (Lionex Ltd., Брауншвейг, Германия).
Животные
Для экспериментов in vitro, проведенных в Агентстве по охране здоровья животных и растений (APHA), использовались архивные PBMC от следующих групп крупного рогатого скота ( B. taurus ): (i) естественно M.bovis — инфицированный крупный рогатый скот, происходящий из британских стад, о которых известно, что у него bTB (естественная инфекция была подтверждена посмертным и / или культурным анализом), (ii) неинфицированный контрольный скот, происходящий из британских стад в зоне низкого риска, которые официально были свободны от туберкулеза более чем 5 лет, и (iii) вакцины БЦЖ, состоящие из контрольного крупного рогатого скота, как описано в (ii), которые впоследствии были вакцинированы BCG Danish Statens Serum Institut (SSI) (эквивалентно пяти дозам для человека). Использовали PBMC через 8 недель после вакцинации.Для тестирования пептидных коктейлей in vivo использовали следующие группы крупного рогатого скота: (i) экспериментально M. bovis — зараженный крупный рогатый скот, состоящий из телят-самцов, экспериментально инфицированных приблизительно 10 000 колониеобразующих единиц полевого штамма M. bovis (AF2122 / 97) эндобронхиальным путем (кожные пробы были выполнены через 5 недель после заражения, и инфекция была подтверждена патологоанатомическим анализом и / или анализом культуры) и (ii) неинфицированный контрольный рогатый скот, как описано выше.Наконец, чтобы определить характеристики ТЛЧ в условиях эндемичных стран, in vivo чувствительность к пептидным коктейлям была также оценена у 25 взрослых помесей крупного рогатого скота (Holstein Friesian X Zebu) в Эфиопии. Первоначально этот скот был набран в Национальном исследовательском центре молочного животноводства Holeta Эфиопского института сельскохозяйственных исследований, поскольку он был положительным на bTB и дал сильные положительные отзывы как на SICCT, так и на IGRA. Все эксперименты с крупным рогатым скотом проводились в соответствии с протоколами этики и биобезопасности животных, утвержденными Наблюдательным советом Института патобиологии Аклилу Лемма (ссылка №ALIPB IBR / 007/2011/2018). Процедуры на животных для исследований, проводимых в APHA, были одобрены Комитетом по надзору за благополучием и этикой животных APHA, а в Эфиопии — Комитетом по надзору за этикой Университета Аддис-Абебы.
Процедуры кожных тестов
PPD-A и PPD-B вводили в объеме 0,1 мл в соответствии с рекомендациями производителя, в то время как пептиды вводили в виде коктейля, содержащего 10 мкг каждого пептида (конечный объем 0,1 мл) на основе ранее установленные эксперименты по титрованию дозы, проведенные на коже крупного рогатого скота ( 27 ).Толщина кожи измерялась одним и тем же оператором до и через 72 часа после введения, а разница в толщине кожи (в миллиметрах) между показаниями до и после кожного теста регистрировалась в соответствии с предписаниями МЭБ ( 19 ).Стимуляция РВМС in vitro
Приготовление РВМС выполняли по методу «наложения» с использованием пробирок без фритты и криоконсервированных. Размораживание криоконсервированных клеток проводили как можно быстрее на водяной бане при 37 ° C.После оттаивания соответствующий объем полной среды [RPMI 1640, содержащий 2 мМ GlutaMax, 25 мМ Hepes, 0,1 мМ NEAA (заменимые аминокислоты), 5 × 10 -5 M β-меркаптоэтанол, пенициллин (100 Ед / мл), стрептомицин. (100 мкг / мл) (Gibco Life Technologies, UK) и 10% фетальной телячьей сыворотки (Sigma-Aldrich, UK)] добавляли по каплям и центрифугировали при 350 g в течение 10 минут в комнате. температура. Супернатант осторожно сливали, осадок клеток осторожно разрыхляли, после чего ресуспендировали в соответствующем объеме свежей полной среды в зависимости от концентрации, необходимой для анализа.Клетки подсчитывали с помощью гемоцитометра и инкубировали с антигенами для стимуляции in vitro. Для ELISpot / FluoroSpot после инкубационного периода ~ 20 часов пятна проявляли, как описано ниже. Для BOVIGAM период инкубации составлял от 3 до 5 дней, после чего планшеты центрифугировали при 350 g в течение 10 минут при комнатной температуре и осторожно собирали супернатант.
ИФН-γ иммуноферментный анализ
Концентрации IFN-γ в супернатантах культур PBMC определяли с использованием имеющихся в продаже наборов на основе иммуноферментного анализа BOVIGAM (Thermo Fisher Scientific, США).Первоначально результаты выражали как оптическую плотность при 450 нм (OD 450 ) для культур, стимулированных антигеном, минус OD 450 для культур без антигена (т.е. ΔOD 450 ). Результаты кривых титрования дозы антигена позволили рассчитать значения AUC с использованием программного обеспечения Prism 7 (GraphPad Software, La Jolla, CA).
IFN-γ ELISpot / FluoroSpot assay
Стимуляцию PBMC для этих анализов выполняли, как описано ранее ( 40 ).Продукция IFN-γ PBMC детектировалась с использованием (i) вторичного биотинилированного антитела с последующей инкубацией со стрептавидин-связанной пероксидазой хрена (Bovine IFN-γ ELISpot kit; Mabtech, Stockholm, Sweden), с визуализацией с использованием набора AEC для хромогена. (Sigma, Сент-Луис, Миссури) и пятнообразующие единицы, подсчитанные с использованием считывающего устройства AID ELISPOT и программного обеспечения ELISpot 4.0 (Autoimmun Diagnostika, Германия), или (ii) вторичного BAM-конъюгированного антитела против бычьего IFN-γ (клон MT307 , Mabtech) с последующей инкубацией с меченным флуорофором антителом против BAM-490 (Mabtech) с визуализацией с использованием усилителя флуоресценции (Mabtech).Пятнообразующие единицы подсчитывали с использованием системы считывания ELISpot / FluoroSpot (iSpot Spectrum, AID, Германия) с версией программного обеспечения 7.0. Средний ответ, вызванный у отдельного животного на конкретный белок, рассчитывали как способ нормализации для каждого животного. Статистическую разницу между этими средними ответами и индивидуальными пептидными ответами у всех животных определяли с использованием баллов /. Оценка Z помогла определить SD исходных оценок отдельных пептидов (количество IFN-γ-положительных пятен) на основе среднего ответа на животное, и результаты были сопоставлены, как показано на рис.2. Например, считыватель ELISPOT подсчитал 99, 74, 268 и 296 точек для EL1, EL2, EL3 и EL4, соответственно, для животного №. 1 (средний ответ, вызванный животным № 1 для ESAT-6, составляет 184,25). Z оказались равными -2,4, -10,9, 7,2 и 3,2 для EL1, EL2, EL3 и EL4 соответственно. Схематическое изображение подхода представлено на рис. S4 и показывает, что чем больше z-оценка, тем сильнее индивидуальный пептидный ответ по сравнению со средним ответом, вызываемым животным.Статистический анализ
Все статистические анализы были выполнены с использованием Prism 7 (GraphPad Software, La Jolla, CA).
Благодарности
Мы благодарим ветеринарный персонал APHA, Великобритания, и Университета Аддис-Абебы, Эфиопия, за отличную техническую поддержку. Финансирование: Это исследование было поддержано грантом (OPP1176950) Фонда Билла и Мелинды Гейтс и Министерства международного развития Великобритании. Мы также благодарим Департамент окружающей среды, продовольствия и сельских районов (DEFRA) Великобритании за использование зараженного крупного рогатого скота в рамках проекта SE3304.R.G.H. и H.M.V. поддерживаются правительством Уэльса и проектом 80761-AU185 Европейского фонда регионального развития Ser Cymru II. В.К. является старшим советником и оплачиваемым консультантом Фонда Билла и Мелинды Гейтс, агентства, финансирующего это исследование. Однако финансирующее агентство не играло никакой роли в разработке, проведении, анализе, интерпретации или написании этого исследования. Вклад авторов: S.Sr., G.J., N.J., H.M.V. и V.K. разработал исследование; S.Sr., G.J., M.V., S.St., T.H., A.Z., A.F., G.A. и L.E. провели эксперименты; S.Sr., G.J., D.B., N.J., G.G., R.G.H., H.M.V. и V.K. проанализировали данные; S.Sr. подготовил документ; S.Sr., G.J., D.B., N.J., G.G., H.M.V. и V.K. способствовал написанию. Конкурирующие интересы: APHA (работодатель HMV, GJ, S.St. и RGH) имеет три патента (номера патентов WO / 2009/060184, WO / 2011/135369 и WO / 2012/010875) на использование Rv3615c в диагностических тестах на bTB. Кроме того, APHA (H.M.V. и G.J.) и Penn State (S.Sr. и V.K.) находятся в процессе регистрации защиты интеллектуальной собственности для DST. Авторы не заявляют о других конкурирующих интересах. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в статье и / или дополнительных материалах. Дополнительные данные, относящиеся к этой статье, могут быть запрошены у авторов.
Экспресс-тест на чувствительность к противомикробным препаратам при сепсисе I QuantaMatrix — решение для туберкулеза
QDST TM , экспресс-тест на лекарственную чувствительность от туберкулезаQDST — это система быстрого фенотипического тестирования лекарственной чувствительности на туберкулез.Система предоставляет результаты теста на чувствительность для 15 лекарств, включая препараты первого и второго ряда, всего за неделю, что может позволить лабораториям сократить время обработки на 3-5 недель по сравнению с традиционными методами тестирования.
- Восприимчивость к туберкулезу через 7 дней
- Произвольный доступ с объемом выборки 120
- Инкубация для культуры туберкулеза
- Полностью автоматизированная оптическая визуализация для мониторинга роста бактерий
- Технология анализа изображений на основе алгоритмов
- Результаты S / R на основе критической концентрации
Решения QuantaMatrix для микробной диагностики являются первыми решениями, разработанными в Корее и получившими высшие награды, включая сертификат New Excellent Technology (NET) и сертификат новых медицинских технологий.
Результаты теста на лекарственную чувствительность
в неделюQDST предоставляет результаты теста на лекарственную чувствительность от туберкулеза всего за 7 дней. По сравнению с обычными методами тестирования, которые занимают от 4 до 6 недель, QDST значительно сокращает время получения результатов.
* ТЛЧ: Тест на лекарственную чувствительность к Mycobacterium tuberculosis QDST с жидкой культурой 1 неделя DST QDST с твердой культурой 1 неделя DST СОХРАНИТЬ 5 НЕДЕЛЬ Традиционное летнее время с твердой культурой 6-недельное летнее время 0 1 2 3 4 5 6 7 8 9 10недель
Поддержка принятия решения о лечении
QMAC-DST TM Панель PLUS включает LNZ и Cs, чтобы помочь клиницистам назначить оптимальное лечение пациентам с лекарственно-устойчивым туберкулезом.Между тем, доступны лунки с несколькими концентрациями для INH, RIF, EMB и Cs. В дополнение к критической концентрации предоставляются высокие и низкие концентрации резистентности, что способствует принятию более обоснованных решений о лечении.
Преимущества
- 1 неделя
Время обращения
для TB DST - 3-х уровневая система безопасности
Защитите пользователей
- 120 образцов
с произвольным доступом
Набор QMAC-DST TM PLUS включает панель QMAC-DST TM PLUS вместе с герметиком панели.Панель включает 4 первичных и 11 вторичных противотуберкулезных препаратов с разными концентрациями. В дополнение к агарозе, которая иммобилизует бактерии ТБ, крышка панели и герметик панели служат для обеспечения безопасности пользователя.
3-х уровневая
система безопасностиБезопасность пользователя имеет первостепенное значение, поскольку туберкулез переносится воздушно-капельным путем. Панель QMAC-DST TM PLUS имеет три уровня безопасности, как показано ниже, для предотвращения утечки образцов во время процесса тестирования.
- Уровень 1
Иммобилизация бактерий ТБ в слое агарозы
- Уровень 2
Закройте панель герметиком
для предотвращения утечки образца - Уровень 3
Зафиксируйте панель крышкой панели
Дополнительные аксессуары для QMAC-DST
TM PLUS kit- 7H9 Бульон без OADC
Смешайте бульон 7H9 с OADC
Загрузите жидкую среду после инокуляции бактерий ТБ
- QM Агароза
Устранение бактерий туберкулеза
- Трубка для борта QM
Бактерии туберкулеза для предварительной обработки
- ШАГ 1
Приготовьте смесь культивированных бактерий туберкулеза и агарозы для иммобилизации.
- ШАГ 2
Нанесите смесь и среду на панель QDST c, содержащую предварительно загруженные и высушенные антибиотики.
- ШАГ 3
Подготовленная панель автоматически загружается в 120 пластинчатых загрузчиков в QDST.
- ШАГ 4
Наблюдение роста бактерий и устойчивости к препарату в течение 7 дней с помощью полностью автоматизированной оптической визуализации.
- ШАГ 5
Результаты восприимчивости сообщаются с использованием собственного алгоритма и базы данных на основе критической концентрации.
QDST TM программное обеспечение использует собственный алгоритм и набор баз данных для выполнения расширенного тестирования лекарственной чувствительности.Полностью автоматизированная покадровая съемка позволяет с высокой точностью измерять и рассчитывать рост микроколоний.
- Легко и просто использовать
15-дюймовый сенсорный экран для удобства
- Отображение изображений
Изображения роста клеток проиллюстрированы рядом с контрольным изображением для параллельного сравнения
- Собственный алгоритм
Определение S / R получено через собственный алгоритм
Расхождений в тесте на лекарственную чувствительность для больных туберкулезом, полученных в результате смешанной инфекции и системы тестирования
Чтобы найти потенциальные причины расхождений в тесте на лекарственную чувствительность (ТЛЧ) M.tuberculosis , двадцать парных изолятов со спорной лекарственной чувствительностью к изониазиду (INH) были отобраны в соответствии с тестированием MGIT960 и методами пропорции Левенштейна-Йенсена (LJ). Их МИК были снова подтверждены методом микроразбавления бульона и методом пропорции LJ. Результаты сполиготипирования показали, что из всех 20 парных штаммов 11 парных изолятов принадлежали к генотипу Beijing, а 6 парных изолятов принадлежали к SIT1634, и что каждый из оставшихся 3 парных изолятов имел два генотипа, а именно SIT1 и SIT1634.Эти 3 парных изолята с разными внутрипарными сполиготипами были дополнительно подтверждены как смешанная инфекция по результатам того, что эти три пары изолятов с разными 12 локусными внутрипарными типами MIRU и одна пара несли разные пары оснований в кодоне 315 (AGC по сравнению с AAC). Всего мутации в гене katG были идентифицированы в 13 парных изолятах. Не было обнаружено мутаций в регуляторных последовательностях и открытых рамках считывания (ORF) генов inhA и ahpC ни в одном из протестированных изолятов.Эти результаты показали, что различные тест-системы и смешанная инфекция с конкретными генотипами штаммов M. tuberculosis способствовали расхождению в чувствительности к лекарствам.
1. Введение
Проведение тестирования лекарственной чувствительности (ТЛЧ) для измерения лекарственной устойчивости важно не только до лечения, но и в ходе терапии для выявления приобретенной устойчивости, особенно в регионах с высокой заболеваемостью МЛУ-ТБ [1]. Обычные методы ТЛЧ основаны на средах на основе яиц (Левенштейн-Йенсен; LJ) или агара (Миддлбрук), но это трудоемкие и длительные процедуры, требующие от 3 до 8 недель для получения результатов [2].За последнее десятилетие для быстрого обнаружения микобактерий и улучшения их роста был введен ряд новых методов ТЛЧ, в том числе пробирка с индикатором роста микобактерий (MGIT) [3], тест [4] и методы Alamar blue [5]. ставки [6, 7].
Метод BACTEC MGIT960 был оценен во многих странах, и была оценена его степень соответствия с традиционными методами ТЛЧ к M. tuberculosis [8–10]. Мета-анализ опубликованных результатов выявил высокую точность и прогностическую ценность, связанные с использованием BACTEC MGIT960 [11].Однако по-прежнему существуют расхождения в результатах ТЛЧ, полученных для различных противотуберкулезных препаратов, между BACTEC MGIT960 и другими методами ТЛЧ. Расхождения в восприимчивости к INH между методами определения пропорции MGIT960 и L-J, например, варьировались от 0% до 1% [9]; однако сообщалось о нескольких исследованиях, посвященных возможным механизмам, лежащим в основе расхождений между системой MGIT960 и методами пропорции LJ.
Расхождения могут возникать по многим причинам, например, из-за использования разных систем ТЛЧ, смешанного заражения разными M.tuberculosis и, что не менее важно, заражение. В этом исследовании было отобрано 20 парных изолятов со спорной лекарственной чувствительностью к INH в соответствии с тестированием MGIT960 и методами определения соотношения L-J. Название «парные изоляты» относится к двум изолятам, полученным отдельно от культур после ТЛЧ с помощью методов MGIT960 и определения соотношения L-J из одной и той же мокроты пациента. Причины несоответствий ТЛЧ были проанализированы с помощью методов сполиготипирования и генотипирования VNTR, а также мутаций, связанных с лекарственной устойчивостью, испытанных в генах, связанных с устойчивостью к INH.
2. Материалы и методы
2.1. Штаммы и антибиотики
Всего в 2006 г. в больнице Тяньцзинь Хайхэ из 1412 изолятов было собрано 20 парных изолятов M. tuberculosis с несоответствиями по ТЛЧ (рис. 1). «Парные изоляты» были получены из культуры, полученной методом MGIT960 и метода пропорции L-J, соответственно, о котором говорилось выше. Между тем, 96 случайно выбранных изолятов, чьи результаты MGIT960 и ТЛЧ в агаровой пропорции совпадали, также были собраны из той же больницы.Было установлено, что 20 парных изолятов M. tuberculosis чувствительны к INH с использованием стандартного метода определения доли LJ (1 μ г / мл) [12], но устойчивы к INH с использованием метода BACTEC MGIT960 (0,1 μ г / мл). мл, Becton Dickinson Microbiology Systems, MD, США) [9]. M. tuberculosis h47Rv (ATCC 27294), полученный из Китайской национальной справочной лаборатории, использовали в качестве контроля.
2.2. Определение МИК INH с помощью микроразведения в бульоне Миддлбрука 7H9 и разведения в L-J агарном агаре
Резазурин использовали в качестве индикатора для тестирования МИК INH в методе микроразведения в бульоне Миддлбрука 7H9 [13].Вкратце, 100 мкл л бульона Миддлбрука 7H9, содержащего 0,05% Tween 80 и 10% OADC (Sigma, США), распределяли в лунки 96-луночного планшета для культивирования клеток (Corning Coast). Концентрации INH в среде Миддлбрука 7H9 были следующими: 0,1, 0,2, 0,4, 0,8, 1,0, 1,2, 1,6 и 1,8 мг / л. Извлеченные изоляты собирали с наклонных участков LJ и гомогенизировали. Мутность доводили до стандарта МакФарланда номер 1 (приблизительно 1 × 10 7 КОЕ / мл), суспензию разбавляли 1:10 и добавляли 100 мкл л раствора в каждую лунку, содержащую 100 мкл л. соответствующего разведения INH.Конечная концентрация посевного материала составляла 5 × 10 4 КОЕ / мл. Планшеты закрывали и инкубировали при 37 ° C в течение одной недели. Затем в каждую лунку добавляли двадцать пять микролитров 0,02% раствора резазурина (Sigma Chem. Co., США) и планшеты инкубировали в течение дополнительных 2 дней. Изменение цвета с синего на розовый указывает на рост бактерий, и МИК считалась минимальной концентрацией INH, которая предотвращала изменение цвета в присутствии резазурина.
Определение MIC INH с использованием метода пропорции L-J следовало протоколу Китайской противотуберкулезной ассоциации [12].Концентрации INH, используемые в среде L-J, составляли 2,0, 1,8, 1,6, 1,2, 1,0, 0,8, 0,6, 0,4 и 0,2 мг / л. Около 10 5 КОЕ инокулировали на скошенной среде, содержащей INH, и результаты регистрировали через 5-6 недель.
2.3. Выделение геномной ДНК, полимеразная цепная реакция (ПЦР) и анализ последовательности
Колонии сначала удаляли со скошенных участков путем соскабливания, ресуспендировали в 500 мкл л ТЕ (10 мМ Трис, 1 мМ ЭДТА (pH 8,0)). и убивают нагреванием при 80 ° C в течение 30 мин.Метод экстракции ДНК, праймеры (от CyberSyn Co., Пекин, Китай) и условия ПЦР были такими, как описано ранее [14]. Праймеры были сконструированы для амплификации гена katG , включая область вокруг кодона 315, регуляторную область inhA , ORF inhA и области oxyR-ahpC (Таблица 1) [15, 16]. Обе нити были секвенированы для подтверждения. Мутации были идентифицированы путем сравнения BLAST с M. tuberculosis h47Rv в качестве эталона (номер GenBank NC_000962.3).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.4. Молекулярное типирование с помощью сполиготипирования и 12-локусного метода MIRU
Сполиготипирование выполняли с помощью коммерческого набора (Isogen Bioscience BV, Маарссен, Нидерланды) в соответствии с инструкциями производителя. Амплификацию участков прямого варианта для сполиготипирования выполняли по существу, как описано ранее [17]. Интерпретация паттернов сполиготипа и присвоение восьмеричных кодов были основаны на базе данных SITVIT2 (Институт Пастера, Гваделупа, Паррис, Франция), которая является обновленной версией ранее выпущенной базы данных SpolDB4 (http: // www.pasteur-guadeloupe.fr:8081/SITVITDemo/tsSpoligo.jsp), как описано ранее [18].
Число тандемных повторов (TR) в каждом локусе в изолятах определяли на основе числа полных повторов в продукте ПЦР, размер которого оценивался по гелю [19]. Анализы полимеразной цепной реакции для 12 выбранных локусов повторяли и сравнивали в гелях и между гелями для обеспечения согласованной оценки размера и количества TR-копий [20].
3. Результаты
3.1. Анализ генотипирования
Анализ генотипа может определить не только то, является ли инфекция результатом передачи данного изолята туберкулеза, но также то, затрагивает ли инфекция более одного штамма M.туберкулез . Результаты нашего анализа генотипирования показали, что 10 парных изолятов относятся к Spoligotype International Type SIT1 (генотип Beijing, 000000000003771), а 6 парных изолятов относятся к Spoligotype International Type SIT1634 (MANU2, 777777777723771) (Таблица 2), сполиготипу, который не был обнаружен. в 96 случайно выбранных клинических изолятах (таблица 3). Три парных изолята представляли собой смеси сполиготипов SIT1 и SIT1634, а одна пара — смесь сполиготипов SIT1 и SIT269 (генотип Пекин, 000000000000771).По сравнению с нашим набором из 96 случайно выбранных изолятов из Тяньцзиня, присутствовали только генотипы Beijing и MANU, а процент генотипа MANU был чрезвычайно высоким (20 парных изолятов: 15/40, 37,5%; 96 случайных клинических изолятов: 3/96. , 3,125%).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Примечание. Порядок 24 локусов MIRU: 2, 20, 4, 10, 16 26, 27, 31, 39 и 40. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
Результаты, полученные с использованием метода MIRU с 12 локусами для 20 пар изолятов [19], показали .Как сполиготипирование, так и паттерны MIRU различались у изолятов, названных по отдельности как 6, 12 и 18 пар. Изоляты, названные 7 парами, имели разные сполиготипы, но один и тот же тип MIRU (таблица 2).
3.2. МИК тестируемых штаммов
Для выявления различий между методами определения доли жидкого Миддлбрука 7H9 и LJ в ТЛЧ мы протестировали МИК каждого из 16 парных изолятов, устойчивых к INH, и 4 пар изолятов, которые состояли из разных генотипов, используя оба метода Миддлбрука. Методы микроразведения бульона 7H9 и пропорции LJ.МИК всех 24 тестируемых изолятов были определены как более 0,1 μ г / мл (от 0,1 до 0,6 μ г / мл) с использованием метода микроразбавления бульона Миддлбрука 7H9 и более 0,3 μ г / мл ( От 0,4 до 1,8 мкм г / мл) с использованием метода пропорции LJ (Таблица 4). МИК 5 пар тестируемых изолятов с использованием метода пропорции L-J были выше, чем 1 мкл г / мл, пороговая концентрация для определения чувствительности к лекарству в методе определения пропорции L-J агара в этом исследовании (таблица 4).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Примечание: katG 315 — преобладающая мутация. Дикий тип — AGC. * 16 изолятов с последовательным генотипом в паре и 4 пары изолятов ( жирным шрифтом ) с разными генотипами в паре. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3. Анализ последовательности предполагаемых генов-мишеней INH
Мутации в гене katG были идентифицированы в 13 парных изолятах, из которых каждый из 12 парных изолятов нес одинаковые мутации и одна пара, которая показала расхождение DST по методам соотношения MGIT960 и LJ несли разные пары оснований в кодоне 315 (AGC по сравнению с AAC).Мутация AGC315AAC была обнаружена в 4 парных изолятах, а 9 парных изолятов несли мутацию AGC315ACC. Мутации AGC315AAC и AGC 315ACC не были связаны со специфичностью к генотипам Beijing или MANU2 среди тестируемых изолятов. Семь парных изолятов не содержали мутаций в гене katG , и никаких мутаций не было обнаружено в регуляторных последовательностях и открытых рамках считывания (ORF) генов inhA и ahpC ни в одном из протестированных изолятов (Таблица 4).
4. Обсуждение
Были разработаны и используются в повседневной клинической практике различные методы ТЛЧ, такие как обычные методы LJ и автоматизированный MB / BacT (Organon Teknika, Turnhout, Бельгия), ESPII (Difco Laboratories, Детройт, Мичиган) , Системы BACTEC 9000MB (Becton Dickenson Microbiology System, Sparks, MD) и BACTEC MGIT 960 (BBL Becton Dickinson Microbiology Systems, Cockeysville, MD) [5, 21–23]. На результаты ТЛЧ будут влиять многие этапы протокола, включая культуру и методы ТЛЧ.В этом исследовании мы проанализировали несоответствие теста на лекарственную чувствительность методами MGIT и L-J для изолятов, собранных из культуры с помощью MGIT и L-J, соответственно.
За исключением среднего времени для представления результатов ТЛЧ, показатели положительности комплексной культуры M. tuberculosis также сильно различались в MGIT и LJ [24], что указывает на возможное предпочтение посева в некоторой степени. Время обнаружения, точность и производительность также зависят от различных методов DST.Исследования показали, что причины разной производительности этих методов в основном связаны с разными системами DST [23, 25]. Наиболее очевидное различие — это концентрации препарата, используемые для ТЛЧ. В системе MGIT чувствительные штаммы были чувствительны к INH менее 0,1 μ г / мл, в то время как концентрация INH составляла 1 μ г / мл в системе LJ в этом исследовании [12, 26, 27] . Из всех 20 парных случаев в 15 случаях MIC находился на границе между методами MGIT и DST, что было обычной причиной разногласий.
Многие отчеты показали, что существует хорошее соответствие между DST на LJ и MGIT для INH в DST [25–27]. В этом исследовании мы по-прежнему обнаружили, что 20 парных изолятов с одинаковыми генотипами индивидуально показали несоответствие в чувствительности к лекарственным препаратам к INH в соответствии с тестированием MGIT960 и методами определения соотношения L-J. Лоусон и др. продемонстрировали, что существует значительная степень согласия между двумя методами со схожими характеристиками ТЛЧ к INH и рифампицину, но более частое обнаружение устойчивости к стрептомицину и менее частое обнаружение этамбутола с L-J, чем MGIT-960.Однако различия не были статистически значимыми [25]. Многоцентровая оценка показала, что расхождения в восприимчивости к INH между методами определения соотношения MGIT960 и L-J варьировались от 0% до 1% [9].
Смешанная инфекция с разными генотипами M. tuberculosis у одного и того же пациента также повлияла на результаты ТЛЧ даже при использовании одних и тех же систем тестирования [28, 29]. В этом исследовании гетерогенные генотипы были обнаружены в изолятах от каждого из 4 пациентов. Три пациента были инфицированы разными красителями генотипами Spoligotype International Type SIT1634 (Manu2) и Beijing, а 1 пациент был инфицирован штаммами с двумя разными генотипами Beijing.А также наш тест на мутации предполагаемых генов-мишеней INH, katG , inhA, и ahpC дополнительно подтвердил одного пациента (номер 18) со смешанной инфекцией гетерогенных генотипов (Таблица 4).
Некоторые микобактериальные характеристики могут быть связаны с определенными генотипами. Хорошо известным, но спорным примером является то, что штаммы семейства Beijing M. tuberculosis часто связаны с рецидивом [30], лекарственной устойчивостью [31] и повышенной способностью вызывать болезнь, передаваемую в определенных географических условиях [ 32, 33].Изоляты с определенными генотипами, такими как Spoligotype International Type SIT1634 (Manu2) в этом исследовании, показали более высокую степень устойчивости в системе MGIT960, чем в системе L-J. В этом исследовании мы обнаружили, что процент штаммов генотипа «MANU» был заметно увеличен в парных изолятах, результаты ТЛЧ которых показали расхождения (37,5%) по сравнению с случайно выбранными клиническими изолятами (3,125%). О необычно высокой доле штаммов, принадлежащих к кладе «Manu» (27,15%), также сообщили Helal et al.[18]. Интересно, что штаммы Manu2 (SIT1634) редко были зарегистрированы в Тяньцзине или даже в Китае в целом [34, 35] или в базе данных SPOLDB4 (за исключением этого исследования, 1 из Индии и 2 из США).
В этом исследовании все 40 изолятов были определены как устойчивые с помощью MGIT и чувствительные с помощью LJ, из которых 27 изолятов были обнаружены с мутациями в katG315 и 13 изолятов не имели мутаций в katG315 (Таблица 4 ). Эти результаты мутаций, обнаруженных в генах, нацеленных на INH, подтверждают, что результат ТЛЧ, полученный MGIT, был более точным, чем результат теста LJ, и мы также обнаружили, что MIC некоторых изолятов методом агара LJ были очень выше, чем результаты теста на агар LJ. первая казнь в клинике, которая в какой-то степени указала на необходимость улучшения операции пропорциональным методом на LJ агаре.
5. Заключение
Наше исследование подтвердило, что расхождения в ТЛЧ клинических изолятов M. tuberculosis действительно существуют для INH. Одна из причин расхождения — это разные тестовые системы между системой BACTEC MGIT960 и традиционным методом определения пропорции LJ. Смешанное инфицирование штаммами с генотипами MANU2 и Beijing также может способствовать несоответствию лекарств.

 Такое требование санитарного законодательства нужно выполнять.
Такое требование санитарного законодательства нужно выполнять.