о чем обычно не говорят гинекологи пациенткам – Медицинский центр «МедЛена»
Дисплазия шейки матки – сложности лечения, или «о чем обычно не говорят гинекологи своим пациенткам»!
Современные реалии таковы, что все большему количеству женщин в мире ставится диагноз «дисплазия шейки матки». А известно ли Вам, что это предраковое заболевание и, если не лечить, то всё может закончится раком шейки матки. Подводные камни «дисплазии шейки матки» — это бессимптомное течение.
Что является причиной возникновения «дисплазии шейки матки»? Природа заболевания в 95% случаев– вирус папилломы человека. Но не спешите винить мужа или своего полового партнера! Этот вирус мог поселиться в вашем организме еще в детстве, или после первого полового контакта, или даже после бассейна. Его агрессивность зависит от напряженности вашего иммунитета. Важно знать, что от ВПЧ не спасают презервативы и единственный способ профилактики – это здоровый образ жизни, сильный иммунитет и прививка ВПЧ-вакциной от рака шейки матки желательно до начала половой жизни.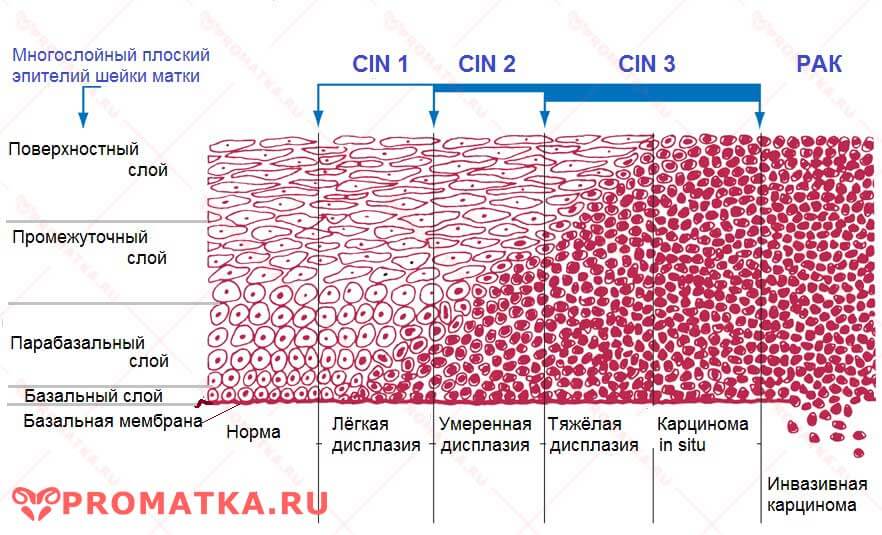
Но, ваш случай уже другой и диагноз «дисплазия шейки матки» уже в медицинской карточке. Давайте разберемся, что же делать дальше… Как лечиться…
Следует знать, что диагноз «дисплазия шейки матки» нельзя установить просто по осмотру на гинекологическом кресле. Если Вам не брали цитологический мазок, не делали кольпоскопию с биопсией, и советуют сделать «криодеструкцию», то задумайтесь. Такое лечение небезопасно.
Также следует отметить, что не существует специфической медикаментозной терапии ВПЧ-инфекции и дисплазии шейки матки. Единственный общепризнанный метод лечения в медицинском мире – это удаление пораженного участка ткани в шейке матки. Провоцирующим фактором к персистенции ВПЧ-инфекции в организме женщины являются частые вагинальные инфекции или гормональные нарушения. Поэтому на первом этапе лечения обязательно необходимо исключить эти патологические состояния, а потом уже принимать решение об оперативной тактике в зависимости от степени поражения шейки матки.
Провоцирующим фактором к персистенции ВПЧ-инфекции в организме женщины являются частые вагинальные инфекции или гормональные нарушения. Поэтому на первом этапе лечения обязательно необходимо исключить эти патологические состояния, а потом уже принимать решение об оперативной тактике в зависимости от степени поражения шейки матки.
- При выявлении дисплазии шейки матки легкой степени – CIN I никаких «прижиганий» выполнять не рекомендовано. Необходимо провести обследование на инфекции, передающиеся половым путем (хламидиоз, трихомониаз, микоплазмоз, гонорея), на наличие бактериального вагиноза (уреаплазмоз, гарднереллез и др.). При выявлении инфекционно-воспалительного фактора проводится соответствующее антимикробно-противовоспалительное лечение и коррекция влагалищного биоценоза. Далее – активное наблюдение за
 А дальше принимается решение о применении электроэксцизионных методик лечения. Раньше, гинекологи активно выполняли «криодеструкцию», но сейчас этот метод крайне не рекомендован, т.к. после него существует высокий риск рецидива и быстрого перехода дисплазии шейки матки в более тяжелую степень.
А дальше принимается решение о применении электроэксцизионных методик лечения. Раньше, гинекологи активно выполняли «криодеструкцию», но сейчас этот метод крайне не рекомендован, т.к. после него существует высокий риск рецидива и быстрого перехода дисплазии шейки матки в более тяжелую степень. - Если вам поставили диагноз «
- Если гинеколог установил диагноз «дисплазия тяжелой степени – CIN III», не рискуйте жизнью, направляйтесь к онкогинекологу.

И помните, что в первый год после любого лечения дисплазии шейки матки обязательно наблюдение у гинеколога каждые 3 месяца.
МЦ «МедЛена» специализируется на диагностике и лечении патологии шейки матки. У нас принимают профессиональные гинекологи и онкогинекологи, что гарантирует для вас квалифицированную консультацию
причины, симптомы, диагностика и методы лечения на сайте «Альфа-Центр Здоровья»
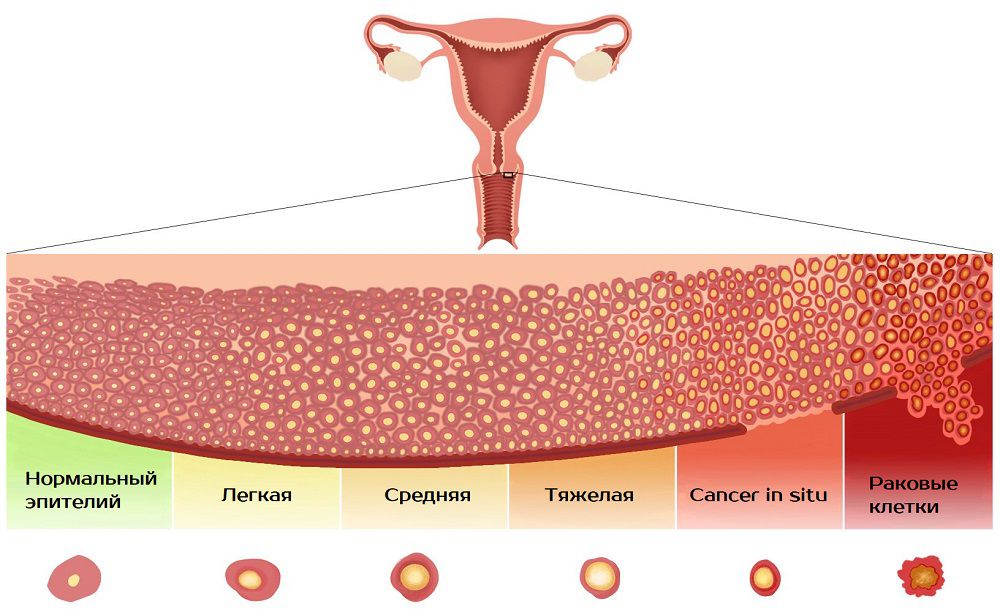
Это структурные изменения клеток эпителия на шейке матки. Признаки дисплазии шейки матки чаще обнаруживают после 35 лет, однако риск есть в любом возрасте. Заболевания опасно появлением злокачественных новообразований, поэтому иногда встречается упоминание как предраковое состояние.
Признаки дисплазии шейки матки чаще обнаруживают после 35 лет, однако риск есть в любом возрасте. Заболевания опасно появлением злокачественных новообразований, поэтому иногда встречается упоминание как предраковое состояние.
Причины и симптомы дисплазии шейки матки
Основная причина – инфицирование папилломавирусом человека (ВПЧ), а точнее двумя из его двухсот видов (16 и 18 типы), опасными появлением онкологических новообразований. Инфицирование происходит через незащищенный половой контакт. Риски столкнуться с симптомами дисплазии шейки матки увеличиваются при:
- незащищенных контактах с несколькими партнерами;
- низком иммунитете;
- травмах, гинекологических инфекциях;
- ранних родах (до 17), при 3-х и более беременностях;
- гормональных нарушениях;
- хронических болезнях, неправильном питании;
- курении.
Признаки дисплазии шейки матки могут не проявляться годами. Состояние прогрессирует, а женщина без визита к гинекологу не подозревает об опасности.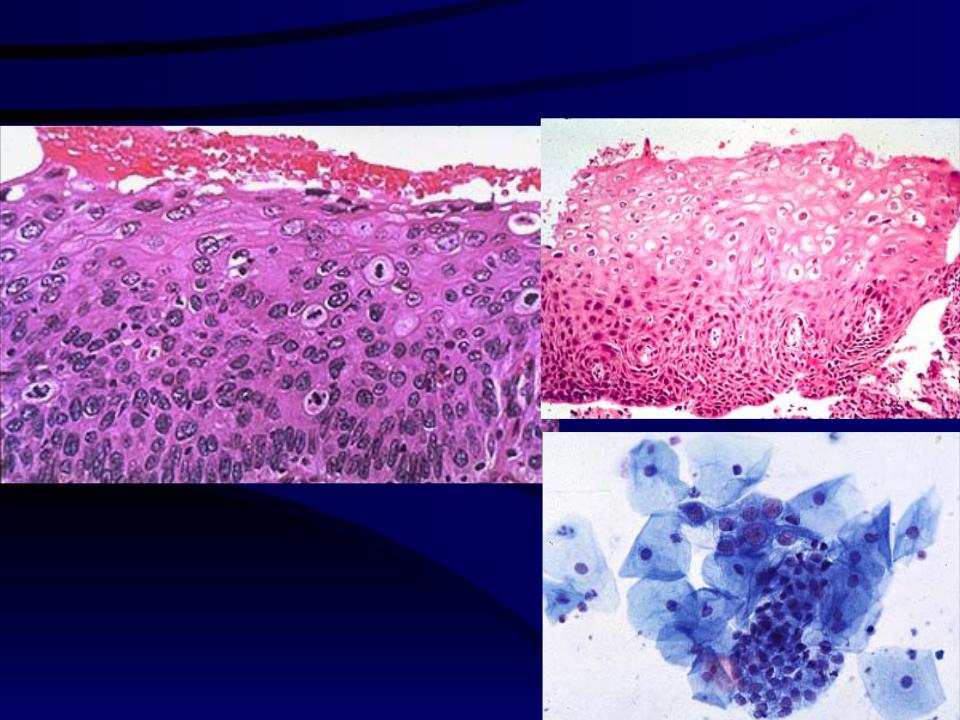
- тянущие боли, дискомфорт в нижней частей живота;
- выделения;
- субфебрильная температура тела;
- жалобы на ухудшение самочувствия.
Степень заболевания классифицируется по количеству измененных клеток в эпителии:
- слабая – менее трети эпителиального слоя содержат патологию;
- средняя – поражена половина глубины слизистой;
- тяжелая – процесс затронул 2/3 слоя эпителия или больше.
Как лечить дисплазию шейки матки
Подтвердить диагноз можно после:
- гинекологического осмотра с кольпоскопией;
- лабораторных анализов – ПАП-мазка (исследование количества клеток под микроскопом), теста на онкомаркеры;
- УЗИ.
Методика лечения дисплазии шейки матки учитывает стадию развития изменений, возраст пациента, другие факторы. На первой степени рекомендована периодическая (2-3 раза в год) проверка динамики изменений. В 70% случаев в молодом возрасте все нормализуется само. При этом лечат выявленные болезни репродуктивной системы, укрепляют иммунитет. На второй и третьей стадиях ожидать, что все пройдет само не стоит, поэтому переходят к решительным действиям. Терапия проводится хирургическими методами:
В 70% случаев в молодом возрасте все нормализуется само. При этом лечат выявленные болезни репродуктивной системы, укрепляют иммунитет. На второй и третьей стадиях ожидать, что все пройдет само не стоит, поэтому переходят к решительным действиям. Терапия проводится хирургическими методами:
- прижиганием током;
- лазерной деструкцией;
- криохирургией;
- радиоволновой терапией.
В крайних случаях удаляют часть шейки матки или ее целиком. Основные осложнения – травматичность, риск образования рубцов, что опасно невынашиванием беременности и плохим раскрытием шейки в родах.
Народных методов, которыми лечат дисплазию шейки матки, с доказанной эффективностью нет. Тампоны, спринцевания дополнительно травмируют слизистую и могут усугубить ее состояние.
Лечение дисплазии шейки матки предусматривает профилактические меры, чтобы предотвратить рецидивы. Это вакцинация от ВПЧ, предохранение при случайных связях, ежегодное посещение гинеколога, укрепление иммунитета.
N87.2 Резко выраженная дисплазия шейки матки, не классифицированная в других рубриках
Медицинский портал SIBMEDA («Сибмеда») — специализированное рекламное средство массовой информации, зарегистрированное по темам «Медицина», «Здоровье», «Здоровый образ жизни», «Красота», предназначенное, в первую очередь, для медицинских и фармацевтических работников. Имеются противопоказания! Проконсультируйтесь со специалистом.Редакция портала не несет ответственности за точность и достоверность высказанных на станицах портала мнений, советов, утверждений и другой «частной» информации. В случае неправильной их трактовки и самостоятельного применения ответственность возлагается на посетителя.
 Администрация портала также не несет ответственности за содержание и достоверность рекламных материалов, а также за возможный вред от использования рекламируемых товаров.
Администрация портала также не несет ответственности за содержание и достоверность рекламных материалов, а также за возможный вред от использования рекламируемых товаров.В материалах, размещенных на портале «Сибмеда», могут встречаться технические, грамматические ошибки, опечатки и некоторые другие погрешности.
Если в тексте замечены неточности или некорректные формулировки – сообщите в редакцию.
Копирование текстовых и фотоматериалов возможно с активной ссылкой на источник и при согласии редакции. Редактирование материалов и рерайт текстов возможен только при ссылке на первоисточник.
Все материалы на сайте защищены авторскими правами и являются собственностью правообладателей. В случае нарушения права нарушители будут преследоваться согласно законам РФ.
Свидетельство о регистрации СМИ ЭЛ №ФС 77-62529 от 27.07.2015 выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций.
Учредитель – общество с ограниченной ответственностью «Сибмеда». Главный редактор – Заиграева Е. Ю. Тел.: (383) 209 3 206, [email protected]
Главный редактор – Заиграева Е. Ю. Тел.: (383) 209 3 206, [email protected]
Портал корректно отображается в браузерах Mozilla Firefox версия 22 и выше, Google Chrome, Safari версия 4 и выше, Opera версия 12 и выше, MSIE версия 8 и выше.
Дисплазия шейки матки 3 степени отзывы
Пациентка: К, 26 лет, г Москва. Диагноз: CIN II-III шейки матки. История заболевания: В мае 2015 года обратилась к гинекологу по страховке по поводу болей в период менструации. При обследовании выявлена ВПЧ инфекция, эрозия шейки матки. Рекомендовано обследование. В течение 3 месяцев принимает изопренозин по схеме. 15.10.2015 года проведена биопсия шейки матки, выскабливание цервикального канала. Гистологическое заключение от 15.10.2015 года. 1) Фрагменты ткани шейки матки с койлоцитозом экзоцервикса, на фоне которого отмечается очаговая диспллазия эпителия умеренной и тяжелой степени. Наряду с этим, отмечается эктопия цервикального цилиндрического эпителия; 2) Среди полей слизи определяются обрывки цервикального цилиндрического эпителия.
Заключение: цервикальная интраэпителиальная неоплазия II-III степени. Эктопия цервикального цилиндрического эпителия. ДНК-вирусное носительство (папилломавирус). Пересмотр препратов в онкоцентре им. Блохина, номер анализа 41102 от 06.11.2015 года. 1- мелкие фрагменты ткани шейки матки из зон эктопии, выстланные ветвящимися криптами эндоцервикального эпителия и из зоны эпидермизированной эктопии с явлениями легкой и умеренной койлоцитарной дисплазии плоского эпителия. 2-слизь, мелкие обрывки слизистой эндоцервикса. Гинекологический анамнез: менструации с 13 лет, регулярные, безболезненные, умеренные. Половая жизнь с 19 лет. Промискуитет не выражен. Беременностей не было. Предохранение презервативом. Диагноз: CIN II-III шейки матки.
Заключение: у пациентки имеется цервиекальная интраэпителиальная неоплазии средней и тяжелой степени. Ранее была проведена биопсия шейки матки, но из одного участка. При кольпоскопии определяются резко выраженные вирусные поражения плоского эпителия в зоне трансформации. Показано проведение лечения в объеме фотодинамической терапии шейки матки. О существующих других методах лечения информирована, также могут быть проведены. Однако с целью сохранения репродуктивной функции и эффективности терапии, наиболее приоритетным остается метод фотодинамической терапии. Планируется проведение ФДТ начиная с 07 дня очередного менструального цикла. Лечение дисплазии шейки матки методом фотодинамической терапии
Показано проведение лечения в объеме фотодинамической терапии шейки матки. О существующих других методах лечения информирована, также могут быть проведены. Однако с целью сохранения репродуктивной функции и эффективности терапии, наиболее приоритетным остается метод фотодинамической терапии. Планируется проведение ФДТ начиная с 07 дня очередного менструального цикла. Лечение дисплазии шейки матки методом фотодинамической терапии
Заключение цитологического исследования:
Здоровая шейка матки:
Аномальный мазок Папаниколау? Что нужно знать о дисплазии шейки матки Онкологический центр
Итак, вы пережили дискомфорт и неловкость во время теста Папаниколау, и вам неожиданно позвонил врач: ваш тест Папаниколау был ненормальным. Что теперь?
Недавно мы поговорили с Кэтлин Шмелер, доктором медицины, соруководителем организации MD Anderson’s HPV-Related Cancers Moon Shot ™, чтобы узнать, что вам следует знать.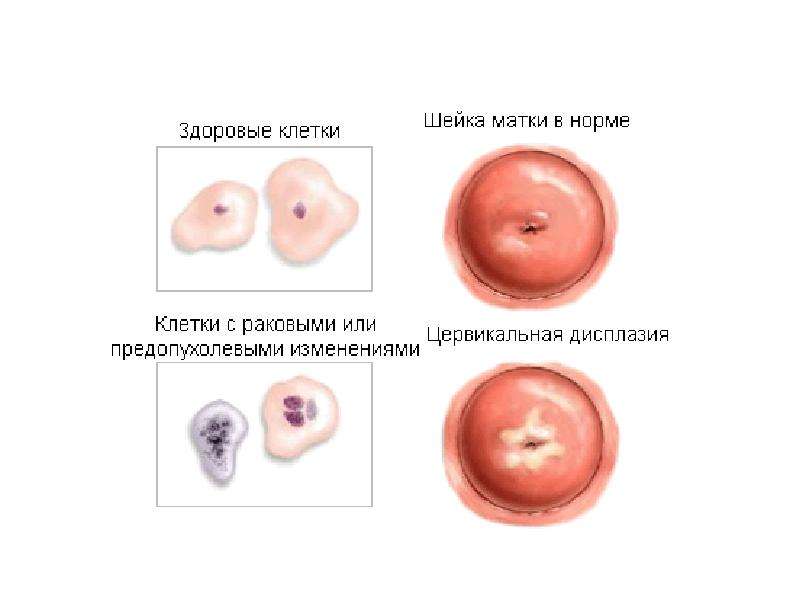 Вот что она сказала.
Вот что она сказала.
Что означает, когда мой врач говорит, что у меня ненормальный тест Папаниколау?
Неправильный результат мазка Папаниколау означает, что в шейке матки есть клетки, которые не выглядят нормально под микроскопом.Это довольно распространенное состояние известно как дисплазия шейки матки или преинвазивное заболевание шейки матки.
Означает ли отклонение от нормы мазка Папаниколау у меня рак шейки матки?
Аномальный мазок Папаниколау не означает, что у вас рак или у вас будет рак в будущем. В большинстве случаев у женщин с отклонениями в мазке Папаниколау не развивается рак шейки матки. Но у некоторых есть предраковое заболевание, которое поддается лечению.
Что вызывает отклонение от нормы мазка Папаниколау?
Аномальные клеточные изменения шейки матки часто вызываются вирусом папилломы человека (ВПЧ).Обычно инфекции ВПЧ проходят сами по себе. Но некоторые штаммы ВПЧ могут вызывать дисплазию высокой степени и несколько типов рака, включая рак шейки матки.
Иногда аномальные клетки вызываются дрожжевой или бактериальной инфекцией, обе из которых хорошо поддаются лечению. Или, если вы уже пережили менопаузу, эти клеточные изменения могут быть результатом возраста.
Ослабленная иммунная система и ВИЧ также могут повысить вероятность отклонения Пап-теста от нормы.
Но большинство женщин с отклонениями в результатах мазка Папаниколау совершенно здоровы.
В чем разница между дисплазией шейки матки низкой и высокой степени?
Низкая степень дисплазии шейки матки обычно проходит сама по себе. Но если у вас дисплазия шейки матки высокой степени, клетки более аномальны, и их нужно лечить, потому что они могут превратиться в рак.
Что мне нужно делать теперь, когда у меня ненормальный тест Папаниколау?
Когда мы видим женщину, у которой в клинике кольпоскопии доктора медицины Андерсона были отклонения от нормы мазка Папаниколау, мы обычно делаем тазовый осмотр с кольпоскопией и биопсией шейки матки.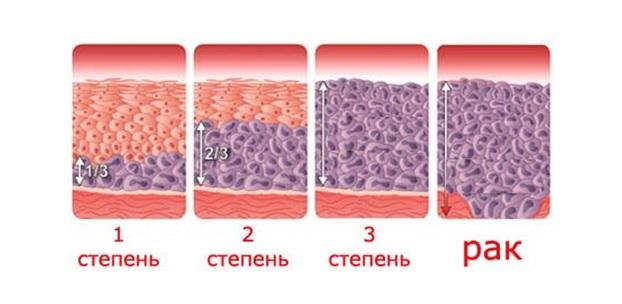 Кольпоскопия — это процедура, при которой врач внимательно осматривает шейку матки с помощью специального инструмента, называемого кольпоскопом.
Кольпоскопия — это процедура, при которой врач внимательно осматривает шейку матки с помощью специального инструмента, называемого кольпоскопом.
Если у вас диагностирована дисплазия высокой степени, врачу может потребоваться процедура электрохирургического удаления петли (LEEP). Эта процедура удаляет аномальные клетки из шейки матки с помощью проволочной петли, нагретой электрическим током.
К какому врачу мне нужно обратиться?
Обязательно обратитесь к гинекологу или гинекологу-онкологу, который сделал много кольпоскопий.Это лучший способ убедиться, что вы получите правильный диагноз и лечение с первого раза.
Что происходит во время кольпоскопии?
Во время кольпоскопии мы наносим уксусную кислоту на шейку матки, чтобы было легче увидеть аномальные участки с помощью кольпоскопа. Его можно проводить в клинике и не требуется анестезия. Если во время кольпоскопии мы увидим что-то ненормальное, мы сделаем биопсию этих участков.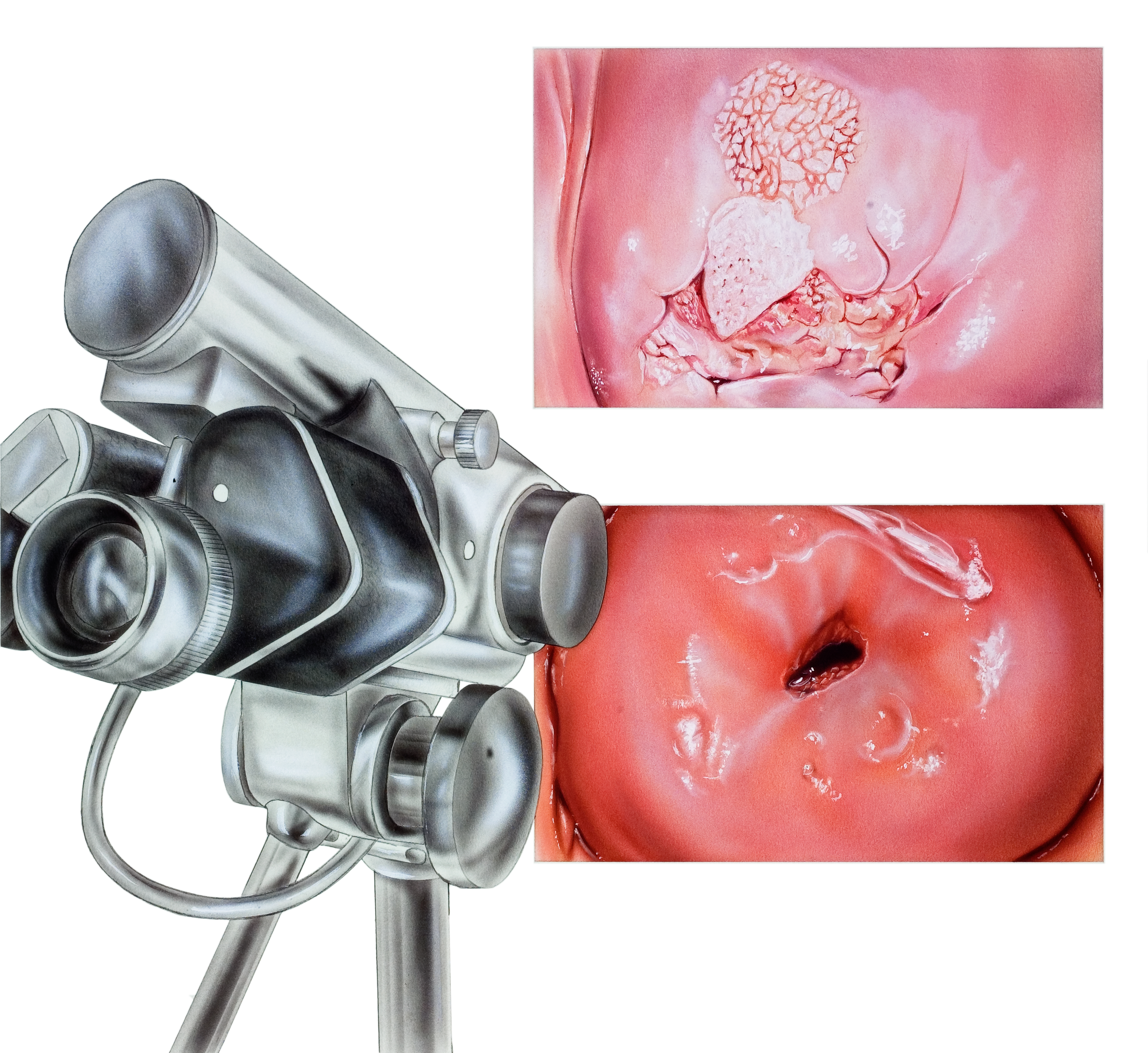
Обычно на получение результатов биопсии уходит около недели.
Что делать, если результаты моей биопсии не соответствуют норме?
Если мы увидим значительные изменения клеток, мы удалим аномальную ткань. Обычно мы делаем это в клинике с помощью LEEP.
Но если мы опасаемся, что у пациента может быть рак, мы делаем биопсию конуса в операционной. Это более обширная биопсия, при которой конусообразный клин аномальной ткани удаляется выше в цервикальном канале. Поскольку до этой области труднее добраться, эта процедура требует общей анестезии.
Какой вид последующего ухода мне понадобится после кольпоскопии?
Если дисплазия шейки матки незначительная или нормальная, вам нужно будет обратиться к врачу через год. Если он качественный, вы будете записаны на прием гораздо раньше — всего через четыре недели после курса LEEP — а затем через год, в зависимости от результатов, назначите контрольный прием.
Конечно, если вы заметили какие-либо изменения в своем теле до следующего приема, обратитесь к врачу раньше.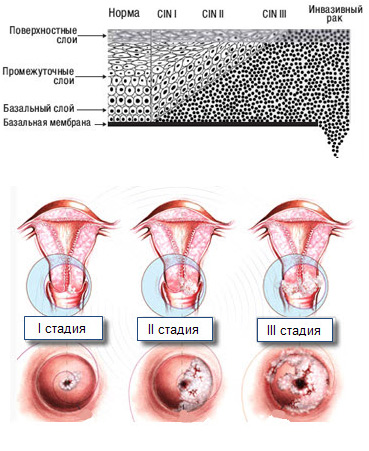
Что еще вы хотите, чтобы женщины знали о ненормальных результатах мазка Папаниколау?
Обязательно обратитесь за медицинской помощью, если обнаружите, что результаты вашего мазка Папаниколау не соответствуют норме.Таким образом, ваш врач сможет наблюдать за вами и составить план лечения, чтобы гарантировать, что аномальные клетки не превратятся в рак. И если эти клетки действительно превращаются в рак, ваш врач может поймать рак на ранней стадии, когда он наиболее поддается лечению.
Клиника кольпоскопии Андерсона предлагает диагностику и лечение дисплазии шейки матки. Запишитесь на прием онлайн или позвонив по телефону 1-877-632-6789.
Дисплазия шейки матки: это рак?
Недавно мне сделали мазок Папаниколау, и мой врач сказал, что результаты показали дисплазию шейки матки.Что это обозначает? Это рак?
Ответ от Шеннон К. Лафлин-Томмазо, доктор медицины Нет.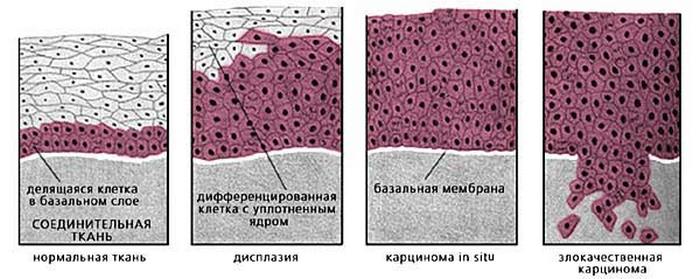 Дисплазия шейки матки — это не рак. Термин указывает на то, что на поверхности шейки матки были обнаружены аномальные клетки.
Дисплазия шейки матки — это не рак. Термин указывает на то, что на поверхности шейки матки были обнаружены аномальные клетки.
Дисплазия шейки матки может варьироваться от легкой до тяжелой, в зависимости от внешнего вида аномальных клеток. В протоколе мазка Папаниколау это будет указано как плоскоклеточное интраэпителиальное поражение (SIL) низкой или высокой степени или иногда как атипичные плоскоклеточные или железистые клетки. Дисплазия могла пройти сама по себе.В редких случаях это могло перерасти в рак.
Тесты для определения степени дисплазии шейки матки
После обнаружения отклонений по мазку Папаниколау ваш врач может порекомендовать дополнительные тесты, в том числе:
- Тест на вирус папилломы человека (ВПЧ)
- Кольпоскопия
Кольпоскопия — это исследование шейки матки, влагалища и вульвы с помощью увеличительного прибора. Во время кольпоскопии ваш врач может определить, где растут аномальные клетки и степень аномалии. Образец клеток (биопсия) может быть взят для анализа. Результаты биопсии могут указывать на интраэпителиальную неоплазию шейки матки (другой термин для обозначения дисплазии), которая классифицируется как CIN I, II или III.
Образец клеток (биопсия) может быть взят для анализа. Результаты биопсии могут указывать на интраэпителиальную неоплазию шейки матки (другой термин для обозначения дисплазии), которая классифицируется как CIN I, II или III.
Лечение дисплазии шейки матки и последующее наблюдение
Часто при легкой дисплазии (CIN I) лечение не требуется. В большинстве случаев легкая дисплазия проходит сама по себе и не становится злокачественной. Ваш врач может порекомендовать последующее наблюдение через год, чтобы проверить наличие дополнительных изменений.
Если у вас тяжелая дисплазия (CIN II или III), ваш врач может порекомендовать лечение, например хирургическое вмешательство или другие процедуры для удаления аномальных клеток.
Независимо от того, есть ли у вас дисплазия легкой или тяжелой степени, вполне вероятно, что ваш врач порекомендует через год пройти тест Папаниколау и HPV , чтобы контролировать ваше состояние и проверять наличие рецидивов дисплазии. Если на этом приеме у вас были отрицательные результаты мазка Папаниколау и теста на ВПЧ , ваш врач может порекомендовать возобновлять мазок Папаниколау и тест на ВПЧ каждые три-пять лет, в зависимости от возрастных рекомендаций.
Если на этом приеме у вас были отрицательные результаты мазка Папаниколау и теста на ВПЧ , ваш врач может порекомендовать возобновлять мазок Папаниколау и тест на ВПЧ каждые три-пять лет, в зависимости от возрастных рекомендаций.
с
Шеннон К. Лафлин-Томмазо, М.Д.
- Инфекция ВПЧ: как она вызывает рак шейки матки?
- Мазок Папаниколау: нужен ли он мне, если я девственница?
- Ферри ФФ. Дисплазия шейки матки. В: Клинический советник Ферри, 2017. Филадельфия, Пенсильвания: Эльзевьер; 2017. https://www.clinicalkey.com. Проверено 4 января 2017 г.
- Hoffman BL, et al. Преинвазивные поражения нижних отделов половых путей. В: Гинекология Вильямса. 3-е изд. Нью-Йорк, штат Нью-Йорк: образование McGraw-Hill; 2016 г.http://accessmedicine.mhmedical.com. Проверено 4 января 2017 г.
- AskMayoExpert.
 Скрининг рака шейки матки. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2016.
Скрининг рака шейки матки. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2016. - Американский колледж акушеров и гинекологов (ACOG) Комитет по практическим бюллетеням — акушерство. Практический бюллетень ACOG № 140: Ведение патологических результатов скрининговых тестов на рак шейки матки и предшественников рака шейки матки. Акушерство и гинекология. 2013; 122: 1338.
- Мазок Папаниколау и ВПЧ.Национальный институт рака. http://www.cancer.gov/cancertopics/factsheet/detection/Pap-HPV-testing. По состоянию на 7 апреля 2017 г.
.
Эффекты типа вируса папилломы человека и фенотипа HLA
Стойкая инфекция с высоким риском или онкогенный тип вируса папилломы человека (ВПЧ) необходима, но недостаточна для развития большинства плоскоклеточных карцином шейки матки и их предшественников, цервикальных интраэпителиальных неоплазия (CIN; исх. 1). Поражения CIN1, CIN2 и CIN3 представляют собой спектр заболеваний. Поражения низкой степени злокачественности, или CIN1, представляют собой хроническую инфекцию ВПЧ, при которой ДНК ВПЧ является эписомальной и происходит выработка и выделение интактных вирионов. У иммунокомпетентных женщин многие поражения низкой степени или CIN1, тем не менее, в конечном итоге регрессируют без вмешательства (1, 2). Зарегистрированные показатели регресса достигают 58% в течение 24 месяцев (3). Очень небольшой процент (~ 2%) прогрессирует до поражений высокой степени.
1). Поражения CIN1, CIN2 и CIN3 представляют собой спектр заболеваний. Поражения низкой степени злокачественности, или CIN1, представляют собой хроническую инфекцию ВПЧ, при которой ДНК ВПЧ является эписомальной и происходит выработка и выделение интактных вирионов. У иммунокомпетентных женщин многие поражения низкой степени или CIN1, тем не менее, в конечном итоге регрессируют без вмешательства (1, 2). Зарегистрированные показатели регресса достигают 58% в течение 24 месяцев (3). Очень небольшой процент (~ 2%) прогрессирует до поражений высокой степени.
Напротив, считается, что большинство поражений высокой степени или CIN2 / 3 с большей вероятностью сохранятся, чем регрессируют.Однако сообщаемые показатели спонтанной регрессии варьируют от 6% до 50%, в зависимости от диагностических критериев и продолжительности наблюдения (4). Риск прогрессирования инвазивного рака через 24 месяца у женщин с поражениями высокой степени составляет от ~ 1% до 2%.
Механизмы, с помощью которых разрешаются внутриэпителиальные поражения, связанные с ВПЧ, недостаточно изучены.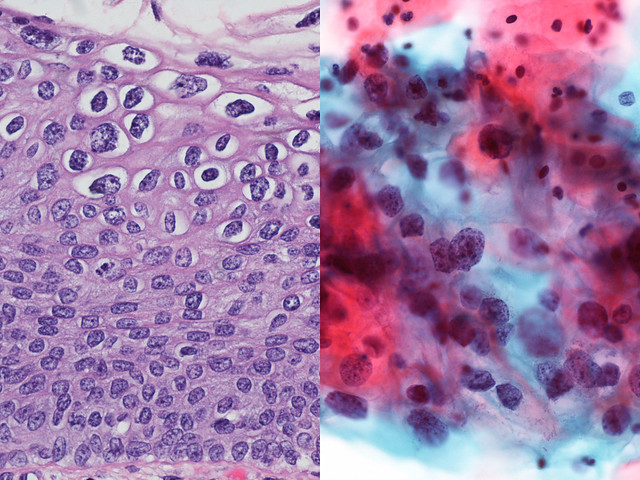 В качестве прелюдии к интервенционным клиническим испытаниям у женщин с подтвержденным биопсией CIN2 / 3 мы провели проспективное наблюдательное когортное исследование, в котором оценивали известные, поддающиеся количественной оценке прогностические переменные у иммунокомпетентных женщин с подтвержденным биопсией CIN2 / 3 в течение периода наблюдения перед рутинным терапевтическим удалением.Наша цель состояла в том, чтобы оценить скорость спонтанного регресса после диагностической биопсии у иммунокомпетентных женщин и изучить клинические, иммунологические и вирусологические различия между женщинами, у которых болезнь регрессировала, и женщинами, у которых болезнь не регрессировала. Тщательная характеристика поражений, которые могут регрессировать без вмешательства, имеет решающее значение для разработки интервенционных исследований в этой популяции пациентов.
В качестве прелюдии к интервенционным клиническим испытаниям у женщин с подтвержденным биопсией CIN2 / 3 мы провели проспективное наблюдательное когортное исследование, в котором оценивали известные, поддающиеся количественной оценке прогностические переменные у иммунокомпетентных женщин с подтвержденным биопсией CIN2 / 3 в течение периода наблюдения перед рутинным терапевтическим удалением.Наша цель состояла в том, чтобы оценить скорость спонтанного регресса после диагностической биопсии у иммунокомпетентных женщин и изучить клинические, иммунологические и вирусологические различия между женщинами, у которых болезнь регрессировала, и женщинами, у которых болезнь не регрессировала. Тщательная характеристика поражений, которые могут регрессировать без вмешательства, имеет решающее значение для разработки интервенционных исследований в этой популяции пациентов.
Материалы и методы
Дизайн исследования
Мы проспективно пригласили женщин, которые были направлены в Службу кольпоскопии Джонса Хопкинса для оценки мазка Папаниколау (Пап) высокого качества, для участия в протоколе обсервационного исследования перед стандартной терапевтической хирургической резекцией. гистологически подтвержденные поражения шейки матки высокой степени.Обращались ко всем женщинам, направленным для оценки мазка Папаниколау высокой степени, за исключением (а) беременных, (б) иммунодефицитных или (в) известных случаев злоупотребления активными веществами, что исключает соблюдение режима последующего наблюдения. Пациенты, оцениваемые в этом анализе, имели CIN2 / 3, подтвержденную кольпоскопически направленной биопсией, и имели видимые поражения после диагностической биопсии. Мы выбрали гистологический диагноз CIN2 / 3 в качестве нашего критерия входа в отличие от цитологического диагноза, потому что воспроизводимость гистологических диагнозов CIN2 / 3 значительно более надежна, чем воспроизводимость цитологических диагнозов поражений высокой степени (5, 6).
гистологически подтвержденные поражения шейки матки высокой степени.Обращались ко всем женщинам, направленным для оценки мазка Папаниколау высокой степени, за исключением (а) беременных, (б) иммунодефицитных или (в) известных случаев злоупотребления активными веществами, что исключает соблюдение режима последующего наблюдения. Пациенты, оцениваемые в этом анализе, имели CIN2 / 3, подтвержденную кольпоскопически направленной биопсией, и имели видимые поражения после диагностической биопсии. Мы выбрали гистологический диагноз CIN2 / 3 в качестве нашего критерия входа в отличие от цитологического диагноза, потому что воспроизводимость гистологических диагнозов CIN2 / 3 значительно более надежна, чем воспроизводимость цитологических диагнозов поражений высокой степени (5, 6).
Испытуемым задавали стандартные вопросы о демографических и поведенческих факторах, включая сообщенное начало половой жизни, количество партнеров на протяжении всей жизни, историю болезней, передаваемых половым путем, курение табака и использование противозачаточных средств. Первичным результатом этого анализа было сохранение CIN2 / 3 по сравнению с регрессией, определяемой как CIN1 или меньше, при резекции через 15 недель.
Первичным результатом этого анализа было сохранение CIN2 / 3 по сравнению с регрессией, определяемой как CIN1 или меньше, при резекции через 15 недель.
Субъекты прошли однократный интервальный визуальный кольпоскопический осмотр на 8 неделе. Во время этого визита был взят мазок из шейки матки для типирования на ВПЧ.Во время терапевтического иссечения конуса зоны трансформации на 15 неделе был взят третий мазок из шейки матки для типирования ВПЧ и были получены кольпографы.
В период с марта 2000 г. по июнь 2004 г. в общей сложности 187 субъектов, направленных на оценку мазка Папаниколау высокого качества, были набраны для отбора на участие в исследовании. Среди женщин, подписавших согласие на скрининг, 65 из 187 (34,8%) не имели подтвержденного биопсией CIN2 / 3. Эта цифра соответствует положительной прогностической ценности цитологических скрининговых диагнозов, обнаруженной в крупных исследованиях (5, 6).Общие диагнозы у женщин с высокой степенью направленности по Папаниколау, у которых не было подтвержденных биопсией поражений, включали низкоуровневые поражения, атрофию и атипичную незрелую метаплазию. Другие причины отказа от участия в исследовании включали интервальную беременность ( n = 3), диагноз аденокарциномы in situ при биопсии ( n = 2), несоблюдение режима лечения ( n = 16) и интервальный инфаркт миокарда ( n = 1). ).
Другие причины отказа от участия в исследовании включали интервальную беременность ( n = 3), диагноз аденокарциномы in situ при биопсии ( n = 2), несоблюдение режима лечения ( n = 16) и интервальный инфаркт миокарда ( n = 1). ).
На сегодняшний день в общей сложности 100 женщин с подтвержденным биопсией CIN2 / 3 завершили последующее наблюдение с резекцией конечной точки.Все кольпоскопические исследования проводил один гинеколог (C.L.T.). Диагностическая биопсия была взята из наиболее аномальных участков при первом посещении, а мазок из шейки матки был взят для типирования ВПЧ. Кольпоскопия проводилась путем помещения двустворчатого зеркала во влагалище и непосредственной визуализации шейки матки. Промывка разбавленной уксусной кислотой (1%) была нанесена на шейку матки, а зеленый светофильтр использовался для выявления ацетобелых поражений и аномальных сосудистых паттернов. Была проведена однократная пункционная биопсия наиболее аномальной области.Кольпоскопия была проведена повторно непосредственно перед терапевтической резекцией ткани. Гистологические образцы считывались в обычном порядке. Гистологическая оценка дисплазии была основана на стандартных критериях CIN1, CIN2 и CIN3. Весь гистологический материал был повторно рассмотрен вторым патологоанатомом-гинекологом, при этом личность пациента и история болезни не указывались. Типирование ВПЧ было обнаружено в образцах мазков из шейки матки с помощью ПЦР и блоттинга с обратной линией (7). HLA-типирование было выполнено на лимфоцитах периферической крови в лаборатории иммуногенетики Джона Хопкинса.Аллели HLA идентифицировали гибридизацией специфичных для последовательности олигонуклеотидных зондов с геномной ДНК человека, выделенной из цельной крови. Типирование на основе последовательностей с высоким разрешением было выполнено для экзонов 2, 3 и 4 локуса HLA-A; Локус HLA-B 2, 3 и 4; и локусы Cw 2 и 3. Типирование с промежуточным разрешением было выполнено для локусов HLA класса II DRB1 и DQB1 .
Типирование вируса папилломы человека: обработка образца
Аликвоты по сто микролитров исходного образца мазка в стандартной транспортной среде Digene были удалены и добавлены к 10 мкл 10-кратного буфера для переваривания [1 моль / л Трис-HCl (pH 7.5), 0,5 моль / л ЭДТА, 1% лаурет-12 и 4 мг / мл протеиназы К]. После встряхивания образец + буфер для разложения инкубировали при 65 ° C в течение 1 часа. После тепловой инактивации протеазы при 95 ° C в течение 10 минут гидролизат смешивали с холодным раствором для осаждения (0,825 моль / л ацетата аммония и 83,5% этанола), и ДНК осаждали в течение ночи при -30 ° C. ДНК осаждали при 15000 об / мин в течение 30 минут при 4 ° C, супернатант удаляли и осадок сушили в течение 30 минут при 42 ° C. Образцы ресуспендировали в 50 мкл LoTE [1 ммоль / л Трис + 0.5 ммоль / л ЭДТА (pH 7,5)]. Контроли экстракции были включены в каждую партию обработки от 30 до 40 образцов. Они включали контроль высокой экстракции, состоящий из 1,25 × 10 5 клеток SiHa и 1,0 × 10 6 клеток K562 на мл стандартной транспортной среды; контроль с низкой экстракцией, состоящий из 5,0 × 10 3 клеток SiHa и 1,0 × 10 6 клеток K562 на мл стандартной транспортной среды; и отрицательный контроль экстракции, состоящий из 1,0 × 10 6 клеток на мл стандартной транспортной среды.Аликвоту 100 мкл каждого контроля экстракции обрабатывали с каждой партией.
Генотипирование вируса папилломы человека
Аликвоту 5 мкл каждого образца ДНК амплифицировали с использованием консенсусных праймеров PGMY09 / 11 L1, а определение генотипа 27 распространенных генитальных типов ВПЧ проводили с помощью блот-гибридизации с обратной линией, как описано ранее (7, 8) . Реагенты PGMY / linear array были любезно подарены компанией Roche Molecular Systems, Inc. (Плезантон, Калифорния).
Количественное определение HPV16
Все анализы были выполнены с использованием системы определения последовательности ABI 5700.HPV16 был количественно определен с использованием методов Taqman PCR, как описано ранее (9). По существу, 2,5 мкл экстрагированной ДНК, контрольной ДНК или воды (без контроля матрицы) добавляли к 47,5 мкл мастер-смеси, содержащей 1 × буфер для ПЦР [10 ммоль / л Трис-HCl (pH 8,0) + 50 ммоль / л KCl. ]; По 200 мкмоль / л каждого dATP, dGTP, dCTP и dTTP; Зонд Такмана 0,1 мкмоль / л; 0,2 мкмоль / л каждого праймера; 4 ммоль / л MgCl 2 ; и 5 единиц ДНК-полимеразы AmpliTaq Gold. Образцы амплифицировали с использованием следующего теплового профиля: 50 ° C в течение 2 минут, 95 ° C в течение 12 минут и 50 циклов при 95 ° C в течение 15 секунд и 55 ° C в течение 30 секунд.После амплификации используется программное обеспечение для обнаружения ABI 5700 Sequence Detection System путем ручного выбора порога на основе наблюдаемых кривых роста.
Мы также стремились контролировать вариабельность выборки путем нормализации вирусной нагрузки HPV16 по общему количеству обработанной ДНК человека. Используя аликвоту каждого образца объемом 2,5 мкл, мы также амплифицировали с использованием методов ПЦР в реальном времени Taqman эндогенный ретровирус человека (ERV-3), который предположительно присутствует в двух копиях на диплоидную клетку (10). Вкратце, 2,5 мкл образца ДНК были добавлены к 47.5 мкл мастер-микса, содержащего 1 × буфер для ПЦР [10 ммоль / л Трис-HCl (pH 8,0) + 50 ммоль / л KCl]; По 200 мкмоль / л каждого dATP, dGTP, dCTP и dTTP; Зонд Такмана 0,25 мкмоль / л; 0,4 мкмоль / л каждого праймера; 4 ммоль / л MgCl 2 ; и 5 единиц ДНК-полимеразы AmpliTaq Gold. Образцы амплифицировали с использованием следующего теплового профиля: 95 ° C в течение 10 минут и 50 циклов: 95 ° C в течение 15 секунд и 60 ° C в течение 30 секунд.
Тесты HPV16 и ERV-3 количественно определяли неизвестные образцы на основе кривой внешнего стандарта, амплифицированной в каждом анализе.Для HPV16 эта стандартная кривая была построена из серии разведений плазмиды HPV16 на фоне 50 нг / мкл плацентарной ДНК человека. Для ERV-3 очищенную ДНК человека из диплоидной линии клеток легких человека CCD-18Lu (ATCC CCL 205) серийно разводили до фона 50 нг / мкл ДНК спермы лосося (Invitrogen, San Diego, CA). Наклон и пересечение логарифмически линейного графика стандартного количества копий и C t использовались для оценки неизвестного количества копий на основе измеренного C t для каждого неизвестного.Нормализованная вирусная нагрузка представлена как общее количество копий HPV16 на 1000 эквивалентов клеток (ERV-3 копии / 2 для учета диплоидного генома).
Этот протокол был одобрен Наблюдательным советом больницы Джонса Хопкинса. Информированное согласие было получено от каждого пациента. Эти расследования были проведены в соответствии с принципами, закрепленными в Хельсинкской декларации.
Статистические методы
Первичным статистическим результатом исследования была спонтанная регрессия поражений, определяемая как CIN1 или меньше, через 15 недель.Мы сравнили характеристики женщин, у которых наблюдался спонтанный регресс поражений в течение периода исследования, с женщинами, у которых было хроническое заболевание. Результат CIN при резекции был взят как дихотомическая переменная. Его одномерная связь с другими категориальными факторами (например, типированием ВПЧ) оценивалась в таблицах сопряженных обстоятельств, с помощью оценочных отношений шансов (OR) и по статистике χ 2 . Непрерывно распределенные предикторы у пациентов, которые регрессировали, по сравнению с пациентами, которые не регрессировали (например, возраст), сравнивались с использованием средних и тестов t .Чтобы учесть влияние нескольких предикторов одновременно на результат, использовались модели многомерной логистической регрессии. Во всех случаях результатом было регресс поражения по сравнению с сохранением. Все модели включали время, измеренное от постановки диагноза до хирургической резекции в месяцах в качестве предиктора. Чтобы проверить связь переменных-предикторов с результатом, для построения модели использовалась пошаговая процедура обратного исключения. Все переменные-кандидаты были введены в модель, и статистически незначимые (и / или клинически слабые) факторы были удалены из модели по одному с повторной оценкой OR, доверительных интервалов (CI) и значений P на каждом этапе.Все пропорции даны с точным биномиальным доверительным интервалом 95%.
Результаты
Характеристики пациентов
Субъекты были набраны в среднем через 1 месяц после направления на основании их индексного патологического диагноза мазка Папаниколау при их первоначальном обращении к специалисту для кольпоскопической оценки патологического мазка Папаниколау. Клинические характеристики 100 пациентов с полным набором тканей для диагностической биопсии / терапевтической резекции показаны на. Средний возраст составлял 29,7 года (медиана — 26.5 лет; диапазон, 18-67 лет). Средняя четность составила 1,76 (диапазон 0-11). Среднее количество зарегистрированных сексуальных партнеров на протяжении всей жизни составило 8,1 (диапазон от 1 до 50). Этническое распределение включало 26 (26%) афроамериканцев, трех (3%) латиноамериканцев, 67 (67%) белых и четырех (4%) азиатов. Сообщенный анамнез текущего курения табака был получен от 42 (42%). Средний интервал от биопсии до резекции составил 123,8 дня (медиана — 110,0 дней). Эта когорта отражает этническое и демографическое распределение женщин с ВПЧ нижних отделов половых путей, обращенных в наше учреждение.
Таблица 1
Клинические характеристики женщин с CIN2 / 3
| Средний возраст (лет) 30,1 года; диапазон, 18-67 лет (%) | ||||
| <25 | 25 (25) | |||
| 25-34 | 53 (53) | |||
| > 35 | 22 (22) | |||
| Среднее время до резекции | 123,8 дн | |||
| Этническая принадлежность (%) | ||||
| Афроамериканец | 26 (26) | |||
| Латиноамериканец | 3 (3) | 503 (3) | 50 Белый 67 (67)||
| Азиатский | 4 (4) | |||
| Сообщенное количество партнеров | 8.1 (1-50) | |||
| Курение табака (%) | ||||
| Текущее | ||||
| Бывшее | 2 (2) | |||
| Никогда | ||||
| 9024 Использование гормональных контрацептивов (%) | 52 (52) |
Гистологические результаты
Мы сравнили клинические, гистологические и вирусологические характеристики в этой когорте из 100 женщин (). Общая частота спонтанной гистологической регрессии, определяемая как CIN1 или меньше во время конизации, составляла 28%.Не было значительной разницы в возрасте, времени до резекции или использовании гормональных контрацептивов у женщин, у которых болезнь регрессировала по сравнению с теми, у которых болезнь не регрессировала. В настоящее время потребление табака было немного, но не значительно выше среди женщин с хроническим заболеванием, чем среди женщин, у которых болезнь регрессировала.
Таблица 2
Характеристики пациента: спонтанная регрессия в сравнении с персистирующим заболеванием
| Характеристики пациента | Устойчивое заболевание (%) | Регрессивное заболевание (%) | P |
|---|---|---|---|
| 72 (72) | 28 (28) | ||
| Текущее употребление табака ( n = 42) | 26/42 (61.9) | 16/42 (38,1) | 0,21 |
| Гормональные противозачаточные ( n = 52) | 39/52 (75) | 13/52 (25) | 0,95 |
| Возраст> 25 ( n = 75) | 58/75 (77,3) | 17/75 (22,7) | 0,06 |
| HLA * A201, да ( n = 30) | 23/30 (76,7) | 7/30 (23,3) | 0,41 |
Тип вируса папилломы человека
Распространенность ВПЧ в этой когорте составляла 100% и 98% для типов высокого риска (16, 18, 26, 31 , 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и W13b).ВПЧ16 обнаружен у 68%. Либо HPV16, либо другие типы, связанные с HPV16 (31, 33, 35, 52 и 58), были обнаружены у 81 из 100 (81%).
В подгруппе когорты, у которой была инфекция ВПЧ16 на момент включения в исследование ( n = 52), мы обнаружили, что коинфекция с другими типами на момент включения в исследование была обычным явлением (33%). Мы также обнаружили, что новые инфекции в течение периода наблюдения были обычным явлением (32,7%), и что очищение типов ВПЧ в течение периода наблюдения также было обычным явлением (38,5%; данные не показаны).
Количественное определение вирусной нагрузки HPV16 у этих пациентов в продольных образцах позволило предположить пороговый эффект.Пациенты, у которых количественная вирусная нагрузка упала ниже 1000 копий на 1000 эквивалентов клеток к 15-й неделе посещения, в целом, излечили свои поражения. Напротив, пациенты, у которых вирусная нагрузка увеличилась за период наблюдения, особенно до высоких уровней, не очистили свои поражения (; количественная вирусная нагрузка ВПЧ16 с течением времени).
Серийные мазки из шейки матки были получены от пациентов с поражениями, связанными с ВПЧ16. Посещение 1, скрининговое посещение; визит 2, неделя 8; визит 3, неделя 15 (лечебная резекция зоны трансформации).С помощью количественной ПЦР и праймеров для HPV16E6 и нормализации до ERV-3 были оценены серийные цервикальные мазки. Количественная вирусная нагрузка ВПЧ16 на шейку матки с течением времени у пациентов, чьи поражения спонтанно разрешились в течение 15-недельного окна наблюдения ( вверху ). Пациенты, у которых поражения не регрессировали ( снизу ).
В окне наблюдения исследования спонтанная регрессия произошла у 9 из 44 (20,5%) женщин с единичной инфекцией ВПЧ16 (). Напротив, у женщин, инфицированных типами, отличными от типа 16, скорость спонтанного регресса составляла 12 из 33 (36.4%). У женщин, инфицированных как HPV16, так и хотя бы одним другим типом HPV, спонтанная регрессия произошла у 7 из 24 (29,2%). В целом эффект однотипной инфекции, вызванной одним ВПЧ16, привел к 3-кратному снижению вероятности регресса заболевания в течение периода исследования по сравнению с женщинами, у которых были поражения, не связанные с ВПЧ16 (ОШ, 0,34; 95% ДИ, 0,117-0,997. ; P = 0,05;).
Таблица 3
Паттерны ВПЧ-инфекции: спонтанная регрессия в сравнении с персистирующим заболеванием
| Персистент (%) | Регресс (%) | P | |
|---|---|---|---|
| = 44) | 35/44 (79.5) | 9/44 (20,5) | 0,05 |
| ВПЧ16 плюс другие ( n = 24) | 17/24 (70,8) | 7/24 (29,2) | 0,08 |
| Другой ВПЧ, не ВПЧ16 ( n = 32) | 19/32 (59,4) | 13/32 (40,6) | 0,08 |
| Не ВПЧ16, не связанный с ВПЧ16 (13/32) | 5 / 13 (38,5) | 8/13 (61,5) | |
| Всего ( n = 100) | 72/100 (72) | 28/100 (28) |
Таблица 4
Многопараметрическая логистическая регрессия для разрешения поражения
| Переменная | Расчетное ОШ (95% ДИ) | P | ||||
|---|---|---|---|---|---|---|
| Месяцы | 0.99 (0,84-1,16) | 0,86 | ||||
| HPV16 | 0,34 (0,12-0,99) | 0,05 | ||||
| месяцев | 0,99 (0,84-1,16) | 0,86 | 0000 0,12-1,01)0,05 | |||
| HLA * A201 | 0,71 (0,25-1,99) | 0,52 | ||||
| месяцев | 1,01 (0,86-1,19) | 0,87 | 0,87 | 0,06-0.73) | 0,01 | |
| HLA * A201 | 0,90 (0,03-29,44) | 0,95 | ||||
| Non-HPV16 × HLA * A201 | 0,03 (<0,001-125,03 9034 905 |

 А дальше принимается решение о применении электроэксцизионных методик лечения. Раньше, гинекологи активно выполняли «криодеструкцию», но сейчас этот метод крайне не рекомендован, т.к. после него существует высокий риск рецидива и быстрого перехода дисплазии шейки матки в более тяжелую степень.
А дальше принимается решение о применении электроэксцизионных методик лечения. Раньше, гинекологи активно выполняли «криодеструкцию», но сейчас этот метод крайне не рекомендован, т.к. после него существует высокий риск рецидива и быстрого перехода дисплазии шейки матки в более тяжелую степень.
 Скрининг рака шейки матки. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2016.
Скрининг рака шейки матки. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2016.